JP2009528828A - 消化器多核体ウイルス感染症の治療のための組み換えポリクローナル抗体 - Google Patents
消化器多核体ウイルス感染症の治療のための組み換えポリクローナル抗体 Download PDFInfo
- Publication number
- JP2009528828A JP2009528828A JP2008557594A JP2008557594A JP2009528828A JP 2009528828 A JP2009528828 A JP 2009528828A JP 2008557594 A JP2008557594 A JP 2008557594A JP 2008557594 A JP2008557594 A JP 2008557594A JP 2009528828 A JP2009528828 A JP 2009528828A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- rsv
- less
- protein
- antibodies
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 238000011282 treatment Methods 0.000 title claims description 23
- 230000001079 digestive effect Effects 0.000 title abstract description 6
- 230000009385 viral infection Effects 0.000 title description 2
- 238000000034 method Methods 0.000 claims abstract description 81
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 77
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 50
- 206010061603 Respiratory syncytial virus infection Diseases 0.000 claims abstract description 38
- 241000700605 Viruses Species 0.000 claims abstract description 37
- 238000010494 dissociation reaction Methods 0.000 claims abstract description 7
- 230000005593 dissociations Effects 0.000 claims abstract description 7
- 210000004027 cell Anatomy 0.000 claims description 276
- 239000000203 mixture Substances 0.000 claims description 125
- 108091007433 antigens Proteins 0.000 claims description 120
- 102000036639 antigens Human genes 0.000 claims description 120
- 239000000427 antigen Substances 0.000 claims description 117
- 230000027455 binding Effects 0.000 claims description 74
- 108091006027 G proteins Proteins 0.000 claims description 66
- 108091000058 GTP-Binding Proteins 0.000 claims description 66
- 150000007523 nucleic acids Chemical group 0.000 claims description 63
- 102000030782 GTP binding Human genes 0.000 claims description 60
- 230000009257 reactivity Effects 0.000 claims description 54
- 239000012634 fragment Substances 0.000 claims description 52
- 235000018102 proteins Nutrition 0.000 claims description 49
- 239000013598 vector Substances 0.000 claims description 46
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 41
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 40
- 108010068327 4-hydroxyphenylpyruvate dioxygenase Proteins 0.000 claims description 35
- 230000000890 antigenic effect Effects 0.000 claims description 35
- 235000001014 amino acid Nutrition 0.000 claims description 29
- 230000003472 neutralizing effect Effects 0.000 claims description 27
- 150000001413 amino acids Chemical class 0.000 claims description 24
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 23
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 23
- 238000004458 analytical method Methods 0.000 claims description 23
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 20
- 239000008194 pharmaceutical composition Substances 0.000 claims description 18
- 230000002265 prevention Effects 0.000 claims description 18
- 210000004180 plasmocyte Anatomy 0.000 claims description 15
- 235000018417 cysteine Nutrition 0.000 claims description 14
- 101710132601 Capsid protein Proteins 0.000 claims description 13
- 101710094648 Coat protein Proteins 0.000 claims description 13
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 claims description 13
- 101710125418 Major capsid protein Proteins 0.000 claims description 13
- 101710141454 Nucleoprotein Proteins 0.000 claims description 13
- 101710083689 Probable capsid protein Proteins 0.000 claims description 13
- 230000028996 humoral immune response Effects 0.000 claims description 13
- 238000003757 reverse transcription PCR Methods 0.000 claims description 13
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 claims description 12
- 241000124008 Mammalia Species 0.000 claims description 11
- 210000004698 lymphocyte Anatomy 0.000 claims description 11
- 238000007857 nested PCR Methods 0.000 claims description 11
- 239000013612 plasmid Substances 0.000 claims description 11
- 239000004480 active ingredient Substances 0.000 claims description 10
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 10
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 9
- 238000002360 preparation method Methods 0.000 claims description 9
- 230000010076 replication Effects 0.000 claims description 8
- 208000024891 symptom Diseases 0.000 claims description 8
- 238000002955 isolation Methods 0.000 claims description 7
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 claims description 7
- 108010076504 Protein Sorting Signals Proteins 0.000 claims description 6
- 230000005030 transcription termination Effects 0.000 claims description 6
- 230000037396 body weight Effects 0.000 claims description 5
- 230000003405 preventing effect Effects 0.000 claims description 5
- 230000006798 recombination Effects 0.000 claims description 5
- 238000005215 recombination Methods 0.000 claims description 5
- 108091026890 Coding region Proteins 0.000 claims description 4
- 239000003085 diluting agent Substances 0.000 claims description 3
- 239000003981 vehicle Substances 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 2
- 230000001737 promoting effect Effects 0.000 claims description 2
- 239000011248 coating agent Substances 0.000 claims 1
- 238000000576 coating method Methods 0.000 claims 1
- 102100040396 Transcobalamin-1 Human genes 0.000 abstract 1
- 101710124861 Transcobalamin-1 Proteins 0.000 abstract 1
- 108010088716 attachment protein G Proteins 0.000 abstract 1
- 238000012216 screening Methods 0.000 description 40
- 239000013604 expression vector Substances 0.000 description 33
- 229960000402 palivizumab Drugs 0.000 description 32
- 238000003556 assay Methods 0.000 description 28
- 238000006386 neutralization reaction Methods 0.000 description 27
- 241000699670 Mus sp. Species 0.000 description 21
- 239000000047 product Substances 0.000 description 21
- 230000000694 effects Effects 0.000 description 20
- 108090000765 processed proteins & peptides Proteins 0.000 description 20
- 241000588724 Escherichia coli Species 0.000 description 19
- 108060003951 Immunoglobulin Proteins 0.000 description 17
- 102000018358 immunoglobulin Human genes 0.000 description 17
- 238000000338 in vitro Methods 0.000 description 17
- 210000004072 lung Anatomy 0.000 description 17
- 208000015181 infectious disease Diseases 0.000 description 16
- 102000004196 processed proteins & peptides Human genes 0.000 description 16
- 238000002965 ELISA Methods 0.000 description 15
- 239000000872 buffer Substances 0.000 description 15
- 230000004927 fusion Effects 0.000 description 15
- 238000012360 testing method Methods 0.000 description 15
- 102000018120 Recombinases Human genes 0.000 description 14
- 108010091086 Recombinases Proteins 0.000 description 14
- 239000002609 medium Substances 0.000 description 14
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 13
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 13
- 230000000295 complement effect Effects 0.000 description 13
- 230000005764 inhibitory process Effects 0.000 description 13
- 210000002966 serum Anatomy 0.000 description 13
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 12
- 230000001965 increasing effect Effects 0.000 description 12
- 210000003720 plasmablast Anatomy 0.000 description 12
- 230000009467 reduction Effects 0.000 description 12
- 230000003612 virological effect Effects 0.000 description 12
- 108020004414 DNA Proteins 0.000 description 11
- 239000006228 supernatant Substances 0.000 description 11
- 101710160621 Fusion glycoprotein F0 Proteins 0.000 description 10
- 241001465754 Metazoa Species 0.000 description 10
- 239000011324 bead Substances 0.000 description 10
- 210000004369 blood Anatomy 0.000 description 10
- 239000008280 blood Substances 0.000 description 10
- 238000012512 characterization method Methods 0.000 description 10
- 238000010790 dilution Methods 0.000 description 10
- 239000012895 dilution Substances 0.000 description 10
- 230000028993 immune response Effects 0.000 description 10
- 108020004707 nucleic acids Proteins 0.000 description 10
- 102000039446 nucleic acids Human genes 0.000 description 10
- 239000002245 particle Substances 0.000 description 10
- 238000001890 transfection Methods 0.000 description 10
- 241000283973 Oryctolagus cuniculus Species 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 238000003117 fluorescence-linked immunosorbent assay Methods 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 238000011534 incubation Methods 0.000 description 9
- 230000006698 induction Effects 0.000 description 9
- 230000010354 integration Effects 0.000 description 9
- 238000002156 mixing Methods 0.000 description 9
- 230000035772 mutation Effects 0.000 description 9
- 230000003389 potentiating effect Effects 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- 238000005406 washing Methods 0.000 description 9
- 102000019034 Chemokines Human genes 0.000 description 8
- 108010012236 Chemokines Proteins 0.000 description 8
- 102000004127 Cytokines Human genes 0.000 description 8
- 108090000695 Cytokines Proteins 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 238000013411 master cell bank Methods 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- 238000011160 research Methods 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 7
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 7
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 7
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 7
- 208000019693 Lung disease Diseases 0.000 description 7
- 241000699666 Mus <mouse, genus> Species 0.000 description 7
- 230000003321 amplification Effects 0.000 description 7
- 238000013507 mapping Methods 0.000 description 7
- 238000003199 nucleic acid amplification method Methods 0.000 description 7
- 239000000523 sample Substances 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 101710120037 Toxin CcdB Proteins 0.000 description 6
- 230000001684 chronic effect Effects 0.000 description 6
- 238000010367 cloning Methods 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Chemical compound O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 6
- 230000012010 growth Effects 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 6
- 230000008569 process Effects 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 5
- 101000854520 Homo sapiens Fractalkine Proteins 0.000 description 5
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 5
- 101150117115 V gene Proteins 0.000 description 5
- 239000003708 ampul Substances 0.000 description 5
- 230000014102 antigen processing and presentation of exogenous peptide antigen via MHC class I Effects 0.000 description 5
- 230000002457 bidirectional effect Effects 0.000 description 5
- 210000001185 bone marrow Anatomy 0.000 description 5
- 238000004113 cell culture Methods 0.000 description 5
- 239000003795 chemical substances by application Substances 0.000 description 5
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 238000003018 immunoassay Methods 0.000 description 5
- 230000016784 immunoglobulin production Effects 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 150000002605 large molecules Chemical class 0.000 description 5
- 229920002521 macromolecule Polymers 0.000 description 5
- 210000004962 mammalian cell Anatomy 0.000 description 5
- 229920001184 polypeptide Polymers 0.000 description 5
- 108091008146 restriction endonucleases Proteins 0.000 description 5
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- 102000006734 Beta-Globulins Human genes 0.000 description 4
- 108010087504 Beta-Globulins Proteins 0.000 description 4
- 241000282693 Cercopithecidae Species 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 108010010803 Gelatin Proteins 0.000 description 4
- 229920001213 Polysorbate 20 Polymers 0.000 description 4
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 4
- 238000002835 absorbance Methods 0.000 description 4
- 230000006978 adaptation Effects 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 238000012937 correction Methods 0.000 description 4
- 229910003460 diamond Inorganic materials 0.000 description 4
- 239000010432 diamond Substances 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- 239000012894 fetal calf serum Substances 0.000 description 4
- 239000008273 gelatin Substances 0.000 description 4
- 229920000159 gelatin Polymers 0.000 description 4
- 235000019322 gelatine Nutrition 0.000 description 4
- 235000011852 gelatine desserts Nutrition 0.000 description 4
- 230000028709 inflammatory response Effects 0.000 description 4
- 239000002054 inoculum Substances 0.000 description 4
- 230000004807 localization Effects 0.000 description 4
- 238000002823 phage display Methods 0.000 description 4
- 229940068196 placebo Drugs 0.000 description 4
- 239000000902 placebo Substances 0.000 description 4
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 4
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 4
- 230000000069 prophylactic effect Effects 0.000 description 4
- 230000008439 repair process Effects 0.000 description 4
- 239000012679 serum free medium Substances 0.000 description 4
- 230000002195 synergetic effect Effects 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 230000032258 transport Effects 0.000 description 4
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 3
- OXEUETBFKVCRNP-UHFFFAOYSA-N 9-ethyl-3-carbazolamine Chemical compound NC1=CC=C2N(CC)C3=CC=CC=C3C2=C1 OXEUETBFKVCRNP-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 241000283707 Capra Species 0.000 description 3
- 108020004705 Codon Proteins 0.000 description 3
- 208000002330 Congenital Heart Defects Diseases 0.000 description 3
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 3
- 102100020997 Fractalkine Human genes 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 241000711920 Human orthopneumovirus Species 0.000 description 3
- 108090000978 Interleukin-4 Proteins 0.000 description 3
- 108090001007 Interleukin-8 Proteins 0.000 description 3
- 108010063738 Interleukins Proteins 0.000 description 3
- 102000015696 Interleukins Human genes 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 230000004988 N-glycosylation Effects 0.000 description 3
- 229930193140 Neomycin Natural products 0.000 description 3
- 239000004793 Polystyrene Substances 0.000 description 3
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 3
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 3
- 241000144282 Sigmodon Species 0.000 description 3
- 241000144290 Sigmodon hispidus Species 0.000 description 3
- 230000010530 Virus Neutralization Effects 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 230000002744 anti-aggregatory effect Effects 0.000 description 3
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 230000024203 complement activation Effects 0.000 description 3
- 208000028831 congenital heart disease Diseases 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 3
- 150000001945 cysteines Chemical class 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 230000008030 elimination Effects 0.000 description 3
- 238000003379 elimination reaction Methods 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 230000002163 immunogen Effects 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000013642 negative control Substances 0.000 description 3
- 229960004927 neomycin Drugs 0.000 description 3
- WEXRUCMBJFQVBZ-UHFFFAOYSA-N pentobarbital Chemical compound CCCC(C)C1(CC)C(=O)NC(=O)NC1=O WEXRUCMBJFQVBZ-UHFFFAOYSA-N 0.000 description 3
- 229920002223 polystyrene Polymers 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 238000012163 sequencing technique Methods 0.000 description 3
- 238000001542 size-exclusion chromatography Methods 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 238000010200 validation analysis Methods 0.000 description 3
- 239000011534 wash buffer Substances 0.000 description 3
- 206010002091 Anaesthesia Diseases 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 206010006448 Bronchiolitis Diseases 0.000 description 2
- 102100032367 C-C motif chemokine 5 Human genes 0.000 description 2
- 108010078239 Chemokine CX3CL1 Proteins 0.000 description 2
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 108010046276 FLP recombinase Proteins 0.000 description 2
- 102000013818 Fractalkine Human genes 0.000 description 2
- 241000233866 Fungi Species 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 206010061598 Immunodeficiency Diseases 0.000 description 2
- 102100034343 Integrase Human genes 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 108010002616 Interleukin-5 Proteins 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- 102000009571 Macrophage Inflammatory Proteins Human genes 0.000 description 2
- 108010009474 Macrophage Inflammatory Proteins Proteins 0.000 description 2
- 101710151805 Mitochondrial intermediate peptidase 1 Proteins 0.000 description 2
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-dimethylformamide Substances CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 2
- 206010057249 Phagocytosis Diseases 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 230000001464 adherent effect Effects 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 229960000723 ampicillin Drugs 0.000 description 2
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- 230000000840 anti-viral effect Effects 0.000 description 2
- 210000000628 antibody-producing cell Anatomy 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 239000002131 composite material Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 241001493065 dsRNA viruses Species 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 210000003979 eosinophil Anatomy 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 230000001747 exhibiting effect Effects 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 230000009368 gene silencing by RNA Effects 0.000 description 2
- 102000057105 human CX3CL1 Human genes 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- 230000008348 humoral response Effects 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 229940079322 interferon Drugs 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 238000012933 kinetic analysis Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 229920001542 oligosaccharide Polymers 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- 229960001412 pentobarbital Drugs 0.000 description 2
- 230000008782 phagocytosis Effects 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 230000004481 post-translational protein modification Effects 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 238000011552 rat model Methods 0.000 description 2
- 238000003259 recombinant expression Methods 0.000 description 2
- 230000036387 respiratory rate Effects 0.000 description 2
- 238000010839 reverse transcription Methods 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 239000004576 sand Substances 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000013207 serial dilution Methods 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 102000003390 tumor necrosis factor Human genes 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- 229960005486 vaccine Drugs 0.000 description 2
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 1
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 1
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 1
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 1
- 101710098275 C-X-C motif chemokine 10 Proteins 0.000 description 1
- 108010081635 CX3C Chemokines Proteins 0.000 description 1
- 102000004325 CX3C Chemokines Human genes 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 108010055166 Chemokine CCL5 Proteins 0.000 description 1
- 108010014419 Chemokine CXCL1 Proteins 0.000 description 1
- 102000016950 Chemokine CXCL1 Human genes 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 241001115388 Coronella Species 0.000 description 1
- 101150031350 Cxcl2 gene Proteins 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 230000004544 DNA amplification Effects 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 102000007260 Deoxyribonuclease I Human genes 0.000 description 1
- 108010008532 Deoxyribonuclease I Proteins 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 238000009007 Diagnostic Kit Methods 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 206010015719 Exsanguination Diseases 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 101000797762 Homo sapiens C-C motif chemokine 5 Proteins 0.000 description 1
- 101001069921 Homo sapiens Growth-regulated alpha protein Proteins 0.000 description 1
- 108010058683 Immobilized Proteins Proteins 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 108010061833 Integrases Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 239000012515 MabSelect SuRe Substances 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 241000204031 Mycoplasma Species 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 241000711504 Paramyxoviridae Species 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000007079 Peptide Fragments Human genes 0.000 description 1
- 108010033276 Peptide Fragments Proteins 0.000 description 1
- 241000711902 Pneumovirus Species 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- IWUCXVSUMQZMFG-AFCXAGJDSA-N Ribavirin Chemical compound N1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 IWUCXVSUMQZMFG-AFCXAGJDSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 101150107578 SH gene Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 101710200413 Small hydrophobic protein Proteins 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 241000701955 Streptomyces virus phiC31 Species 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108010022394 Threonine synthase Proteins 0.000 description 1
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 108020000999 Viral RNA Proteins 0.000 description 1
- 241000212749 Zesius chrysomallus Species 0.000 description 1
- 238000011481 absorbance measurement Methods 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 239000011543 agarose gel Substances 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 238000002820 assay format Methods 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 239000002771 cell marker Substances 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000022261 cerebral cortex tangential migration using cell-cell interactions Effects 0.000 description 1
- 238000010516 chain-walking reaction Methods 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229940112822 chewing gum Drugs 0.000 description 1
- 235000015218 chewing gum Nutrition 0.000 description 1
- 239000003593 chromogenic compound Substances 0.000 description 1
- 238000012411 cloning technique Methods 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 238000012136 culture method Methods 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000000120 cytopathologic effect Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 108010068047 endodeoxyribonuclease AscI Proteins 0.000 description 1
- 108010015866 endodeoxyribonuclease NheI Proteins 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000001976 enzyme digestion Methods 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 210000002288 golgi apparatus Anatomy 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000005802 health problem Effects 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 102000055297 human CXCL1 Human genes 0.000 description 1
- 230000000521 hyperimmunizing effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000010324 immunological assay Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 238000013383 initial experiment Methods 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 238000012792 lyophilization process Methods 0.000 description 1
- 238000007403 mPCR Methods 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 239000011325 microbead Substances 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 239000008196 pharmacological composition Substances 0.000 description 1
- 238000013492 plasmid preparation Methods 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000011176 pooling Methods 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 238000002818 protein evolution Methods 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 239000011535 reaction buffer Substances 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 208000023504 respiratory system disease Diseases 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229960000329 ribavirin Drugs 0.000 description 1
- HZCAHMRRMINHDJ-DBRKOABJSA-N ribavirin Natural products O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1N=CN=C1 HZCAHMRRMINHDJ-DBRKOABJSA-N 0.000 description 1
- 239000003161 ribonuclease inhibitor Substances 0.000 description 1
- 238000002702 ribosome display Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000009738 saturating Methods 0.000 description 1
- 238000007790 scraping Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 239000013049 sediment Substances 0.000 description 1
- 238000005204 segregation Methods 0.000 description 1
- 239000004017 serum-free culture medium Substances 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 235000020183 skimmed milk Nutrition 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- YEENEYXBHNNNGV-XEHWZWQGSA-M sodium;3-acetamido-5-[acetyl(methyl)amino]-2,4,6-triiodobenzoate;(2r,3r,4s,5s,6r)-2-[(2r,3s,4s,5r)-3,4-dihydroxy-2,5-bis(hydroxymethyl)oxolan-2-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound [Na+].CC(=O)N(C)C1=C(I)C(NC(C)=O)=C(I)C(C([O-])=O)=C1I.O[C@H]1[C@H](O)[C@@H](CO)O[C@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 YEENEYXBHNNNGV-XEHWZWQGSA-M 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 238000004114 suspension culture Methods 0.000 description 1
- 229940036185 synagis Drugs 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 108091007466 transmembrane glycoproteins Proteins 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 230000035899 viability Effects 0.000 description 1
- 230000007502 viral entry Effects 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 238000003989 weak cation exchange chromatography Methods 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/08—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses
- C07K16/10—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from viruses from RNA viruses
- C07K16/1027—Paramyxoviridae, e.g. respiratory syncytial virus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/42—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum viral
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/18011—Paramyxoviridae
- C12N2760/18511—Pneumovirus, e.g. human respiratory syncytial virus
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Virology (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Animal Behavior & Ethology (AREA)
- Molecular Biology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pulmonology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- General Chemical & Material Sciences (AREA)
- Communicable Diseases (AREA)
- Epidemiology (AREA)
- Cell Biology (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Biotechnology (AREA)
- Developmental Biology & Embryology (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
消化器多核体ウイルス(RSV)を標的とする新規ポリクローナル抗体、およびRSVと反応する新規な高親和性抗体が開示される。前記ポリクローナル抗体は、RSVタンパク質RおよびRSVタンパク質Gの両方と反応する抗体分子を含んでもよく、好ましくは、前記ポリクローナル抗体は、これらのタンパク質の様々なエピトープを標的とする。本発明の単一の抗体分子は、ピコモル範囲で低い解離定数を提供する親和性を示すことが示される。本発明の抗体を産生する方法ならびにRSV感染のためのそれらの使用方法もまた開示される。
Description
本発明は、消化器多核体ウイルス感染症に関連した1つまたはそれ以上の症状の予防、治療または改善のための組み換えポリクローナル抗体に関する。本発明はまた、抗−RSV組み換えポリクローナル抗体(抗−RSV rpAb)を産生するポリクローナル発現細胞株に関する。さらに、本出願は、抗−RSV rpAbを含む診断上および薬理学的組成物ならびにRSV感染に関連する1つまたはそれ以上の症状の予防、治療または改善における使用を記載する。
消化器多核体ウイルス(RSV)は、幼児および小さな子供における下部呼吸器疾患の主な要因である。慢性肺疾患または先天性心臓疾患のごとく根本的な健康問題を抱える未成熟な幼児および子供は、RSV感染後の細気管支炎および肺炎などの重篤な病気に対して最も高いリスクを有する。最近、RSVはまた、免疫不全の成人、特に骨髄移植被提供者、高齢者および肺疾患にかかっている人などの一定のリスクの高い成人において重要な病変として認識されてきた。
ヒトRSVは、パラミクソウイルス科ニューモウイルス属サブファミリーのメンバーであり、AおよびBサブタイプとして存在する。RSVは、外被性非分割型のマイナス鎖RNAウイルスである。ウイルスゲノムは、少なくとも11種のタンパク質をコードし、そのうちの3種が外被関連タンパク質、F(融合糖たんぱく質)、G(受容体−結合糖タンパク質)、およびSH(小疎水性タンパク質)である。外被タンパク質は、ウイルス表面上に存在し、ある程度まで感染した細胞の表面上にも存在する。Fタンパク質は、ウイルスと細胞膜の融合を促進し、それによりウイルスRNAの細胞質への侵入を可能にする。Fタンパク質は、2つのジスルフィド結合サブユニット、F1とF2からなり、574個のアミノ酸の不活性型N−グルコシル化前駆体のタンパク質分解性切断により産生される。Gタンパク質は、(ウイルス株に依存する)289〜299個のアミノ酸のII型膜貫通糖タンパク質である。前駆形態は32kDaであり、N−およびO−連結オリゴ糖の付加により80〜90kDaのタンパク質に成熟する。RSV Gタンパク質は、ビリオンの標的細胞への結合に関連する。Gタンパク質の膜−結合形態に加えて、短縮型の可溶性形態もまた産生される。この機能はウイルスと感染細胞から離れている免疫応答を再指令することが示唆される。さらに、Gタンパク質は、リンパ球の取り込みと同様に、ケモカインの修飾やサイトカインの発現のごとく多くの炎症性効果に関連することが示されている。SHタンパク質は64〜65個のアミノ酸のタンパク質であり、精製されたRSV粒子の表面上に極めて低い量で存在するが、RSV感染細胞の表面上で豊富に発現される。SHタンパク質の機能は解明されていないが、ゴルジ複合体を介するウイルスタンパク質の輸送を補助しうる可能性がある(Rixon et al 2004, J.Gen.Virol.85:1153-1165)。GおよびFタンパク質の機能を阻害することは、RSV感染の予防に関係すると考えられている。
RSV感染の予防と治療はこの数十年間大きく注目を浴びており、ワクチンの開発、抗ウイルス化合物(治療用に承認されたリバビリン)、アンチセンス薬物、RNA干渉(RNAi)技術および免疫グロブリンやモノクローナル抗体のごとき抗体産物を含む(Maggon and Barik, 2004, Rev.med.Virol.14:149-168で全て総説される)。これらの方法のなかで、静脈注射用免疫グロブリン、RSV−IVIG、およびモノクローナル抗体、パリビズマブはリスクの高い子供のRSV予防用に承認されている。
しかしながら、RSV−IVIG(RespiGam)のごとき免疫グロブリン産物は、大量の注射を必要とする低い特異的活性のごとくいくつかの欠点を有することが知られ、前もっての集中的な治療のため静脈投与が限られる子供には困難である。さらに、バッチ間の変動が伴う問題とともに、血清由来の免疫グロブリン産物からのウイルス疾患の伝染のリスクもまた存在する。したがって、正常なドナーの約8%のみがRSVを中和するのに十分高い抗体力価を示すことから、高力価RSV免疫グロブリン産生の要請に見合う十分なドナーを得ることは困難である。
Fタンパク質またはGタンパク質に対するモノクローナル抗体は、インビトロにおける中和効果およびインビボにおける予防効果を有することが示されてきた(例えば、Beeler and Coelingh 1989.J.Viro l63:2941-50; Garcia-Barreno et al 1989.J.Virol 63:925-32; Taylor et al 1984.Immunology 52: 137-142; Walsh et al 1984, Infection and Immunity 43:756-758; US 5,842,307およびUS 6,818,216)。今日、モノクローナル抗体パリビズマブはRSV−IVIGの使用から完全に取って代わった。中和アッセイは、パリビズマブおよびRSV−IVIGが、RSVサブタイプBに対して対等に作用する一方、パリビズマブがサブタイプAに対してより有効に作用することを示す(Johnson et al 1997.J.Infect.Dis1 76:1215-24)。しかしながら、パリビズマブおよびNumaxのごとく産物により示されるようなモノクローナル抗体の優れた中和および予防効果にもかかわらず、これらにはまた、RSVウイルスの性質による一定の欠点が付随しうる。
RSVには、2つの別個の抗原グループまたはサブタイプ、AおよびBが存在する。ほとんどのRSVタンパク質は、2つのサブグループ間で高度に保存され、Fタンパク質は91%のアミノ酸相同性を示す。しかしながら、Gタンパク質は、AおよびBサブグループ間で53%のみのアミノ酸相同性を有する広範な配列可変性を示す(Sullender 2000. Clin.Microbiol.Rev 13:1-15)。ほとんどのタンパク質はまた、Gタンパク質を除いて、アミノ酸レベルにおいて、サブグループA内で20%およびサブグループB内で9%まで相違するサブグループ内で限られた変動を示す。AおよびBのウイルスサブタイプは、異なる年の間で変化する相対頻度を伴って、多くのRSV伝染病で共循環する。それゆえ、モノクローナル抗体は、両方のサブタイプならびにサブタイプ内の変化を中和することができるように慎重に選択されなければならない。
2つのRSVサブタイプとサブタイプ内の多様性の問題点に加えて、ヒトRSVは、ほとんどのRNAウイルスと同様に、選択圧の下で急速な変異を行う能力を有する。mAbを用いるインビトロにおけるRSVエスケープ変異体の選択がよく知られている(例えば、Garcia-Barreno et al 1989.J.Virol 63:925-32)。重要なことに、最近、パリビズマブはインビボと同様にインビトロでもエスケープ変異体を選択し、その単離された変異体のいくつかはコットンラットにおけるパリビズマブ予防に完全に耐性であることが知見された(Zhao and Sullender 2005 J.Virol 79:3962-8およびZhao et al 2004.J.Infect.Dis 190:1941-6)。さらに、内在的にパリビズマブに耐性である野生型RSV株も存在し得、それは、パリビズマブの起源であるマウス抗体がある臨床分離株を中和することに失敗することにより示された(Beeler and Coelingh 1989.J.Virol 63:2941-50)。その上、1つの明らかに耐性なウイルスもまた、免疫応答性コットンラットにおけるパリビズマブ予防後に同定された(Johnson et al 1997.J.Infect.Dis 176:1215-24)。それゆえ、一定条件下において、エスケープ変異体が存在するか、または治療の結果として時間とともに発生しうることから、単独の単一特異性の抗体の使用は、RSV疾患の治療に適切または十分であり得ない。
RSV−IVIGおよびパリビズマブの有用性に関するさらなる検討事項は、有効な治療に必要とされる用量である。RSV感染症のコットンラットモデルにおいて、肺のRSV複製を100倍まで減少させるのに30μg/ml以上の血清濃度が必要であることが示されている。RSV−IVIGにおいては、静脈に投与される月に750mg総タンパク質/kgの用量が、リスクの高い子供におけるRSV入院の頻度を減少させるのに有効である一方、パリビズマブにおいては、月に15mg/kgの筋肉内用量が有効であることが証明された。しかしながら、複数回にわたる静脈内または筋肉内の大用量の投与は、患者にとって不便であり、RSV感染症に対するリスクのある成人の広範なグループの予防および治療のためのこれらの産物の幅広い使用を妨げる。
したがって、ドナーの利用可能性に依存せず、サブタイプAおよびBを網羅する1種またはそれ以上のRSV抗原ならびにウイルス変異により生じるいずれかのエスケープ変異体に対して免疫特異的に結合し、高度に強力であり、改善された薬物動態学的プロファイルを有し、それゆえに総体として改善された治療プロファイルを示し、それによりより低頻度の投与および/またはより低用量の投与で足りる、抗体産物が必要である。
(貢献の開示)
それゆえ、本発明の目的は、極めて強力な代替的な抗−RSV免疫グロブリン産物であって、組み換えで産生され、消化器多核体ウイルスのサブタイプAおよびBに対して、ならびにエスケープ変異体の可能性を制限する主要な表面抗原のうちの少なくとも1つにおける複数のエピトープに対して、反応性を示す抗−RSV免疫グロブリン産物を提供することである。
それゆえ、本発明の目的は、極めて強力な代替的な抗−RSV免疫グロブリン産物であって、組み換えで産生され、消化器多核体ウイルスのサブタイプAおよびBに対して、ならびにエスケープ変異体の可能性を制限する主要な表面抗原のうちの少なくとも1つにおける複数のエピトープに対して、反応性を示す抗−RSV免疫グロブリン産物を提供することである。
本発明はまた、新規のヒト抗−RSV抗体分子ならびにそれらの誘導体を提供することを目的とし、この抗体分子または誘導体は、既存のモノクローナル抗−RSV抗体および抗体誘導体を超えた改善された性質を示す。
(本発明の説明)
RSVにおける複数のエピトープを標的とするポリクローナル抗体組成物の使用は、エスケープ変異体の発生を最小限にすることが期待され、多様性をもって自然界で循環するウイルスに対する保護をも提供することができる。血清由来のRSV−IVIGとは対照に、本発明のポリクローナル抗体は、非RSV抗原に結合する抗体分子を含まない。
RSVにおける複数のエピトープを標的とするポリクローナル抗体組成物の使用は、エスケープ変異体の発生を最小限にすることが期待され、多様性をもって自然界で循環するウイルスに対する保護をも提供することができる。血清由来のRSV−IVIGとは対照に、本発明のポリクローナル抗体は、非RSV抗原に結合する抗体分子を含まない。
本発明は、ポリクローナル抗−RSV抗体を提供する。好ましくは、ポリクローナル抗−RSV抗体は、自然には抗体を産生しない細胞から得られる。かかる抗体は、組み換えポリクローナル抗体(rpAb)と呼ばれる。本発明の抗−RSV rpAbは、FまたはGタンパク質における複数のエピトープに対して指向性がある。特に、GおよびFタンパク質の両方における複数のエピトープにして指向性がある抗−RSVrpAbが好ましい。好ましくは、保存されたグループ、潜在的にサブタイプ−特異的グループおよび株−特異的グループに属するGタンパク質エピトープは、抗−RSV rpAbにより網羅される。さらに、第3の外被タンパク質、小分子疎水性(SH)タンパク質に対して反応性を有する抗体は、本発明の抗−RSV rpAbの望ましい構成要素である。
さらに、本発明は、活性成分が抗−RSVポリクローナル抗体である医薬組成物、ならびにRSV感染症の予防、改善または治療のためのかかる組成物の使用を提供する。
本発明は、RSVによる感染によって上昇された液性免疫応答を反映するための方法であって、かかる誘発した個体から元々のVHおよびVL遺伝子のペアーを単離し、次いでこの元々のペアーを維持する抗体を産生することによる方法をさらに提供する。
(定義)
用語「抗体」は、血清の機能的な構成要素を記載し、多くの場合、分子のコレクション(抗体または免疫グロブリン)としてまたは1分子(抗体分子または免疫グロブリン分子)としてのどちらかで呼ばれる。抗体分子は、特異的な抗原性決定基(抗原または抗原性エピトープ)に結合または反応することができ、順に免疫学的なエフェクター機構の誘導を導きうる。個々の抗体分子は通常、単一特異性とされ、抗体分子の組成物は、モノクローナル(すなわち、同一の抗体分子からなる)またはポリクローナル(すなわち、同一の抗原におけるか、または別個の異なる抗原における同一または異なるエピトープと反応する異なる抗体分子からなる)であってもよい。各抗体分子は、その対応する抗原に特異的に結合することを可能にする固有の構造を有し、全ての自然の抗体分子は、2つの同一の軽鎖および2つの同一の重鎖の同一の全体基本構造を有する。抗体はまた、免疫グロブリンとして総称される。本明細書で用いられるような用語、抗体は、最も広い意味で用いられ、インタクト(intact)な抗体、キメラ化、ヒト化、完全なヒトのおよび単一鎖の抗体、ならびにFab、FvフラグメントまたはscFvフラグメントのごとき抗体の結合フラグメント、ならびに二量体IgA分子または五価IgGのごとき多量体型を網羅する。いくつかの例では、本出願は、用語「合成もしくは半合成抗体アナログ」を用い、それは、特に(RSV抗原への特異的な結合を示すことより)抗体の性質を示す天然に存在しない分子を意味し、天然に存在する抗体に由来するCDRを含み、−かかるアナログは、例えば、scFvフラグメント、二重特異性抗体などにより表されるが、例えば、本明細書で開示される抗−RSV抗体分子に由来するCDR(例、当該技術分野で周知の移植技術による)を含むように改良される表面上天然に存在する抗体−例えば、かかる抗体アナログは、別の動物種の抗体分子に取り込まれている、あるいは同一種由来の異なる抗体アイソタイプもしくはクラスに取り込まれている、本明細書に開示されるCDRを含みうる。
用語「抗体」は、血清の機能的な構成要素を記載し、多くの場合、分子のコレクション(抗体または免疫グロブリン)としてまたは1分子(抗体分子または免疫グロブリン分子)としてのどちらかで呼ばれる。抗体分子は、特異的な抗原性決定基(抗原または抗原性エピトープ)に結合または反応することができ、順に免疫学的なエフェクター機構の誘導を導きうる。個々の抗体分子は通常、単一特異性とされ、抗体分子の組成物は、モノクローナル(すなわち、同一の抗体分子からなる)またはポリクローナル(すなわち、同一の抗原におけるか、または別個の異なる抗原における同一または異なるエピトープと反応する異なる抗体分子からなる)であってもよい。各抗体分子は、その対応する抗原に特異的に結合することを可能にする固有の構造を有し、全ての自然の抗体分子は、2つの同一の軽鎖および2つの同一の重鎖の同一の全体基本構造を有する。抗体はまた、免疫グロブリンとして総称される。本明細書で用いられるような用語、抗体は、最も広い意味で用いられ、インタクト(intact)な抗体、キメラ化、ヒト化、完全なヒトのおよび単一鎖の抗体、ならびにFab、FvフラグメントまたはscFvフラグメントのごとき抗体の結合フラグメント、ならびに二量体IgA分子または五価IgGのごとき多量体型を網羅する。いくつかの例では、本出願は、用語「合成もしくは半合成抗体アナログ」を用い、それは、特に(RSV抗原への特異的な結合を示すことより)抗体の性質を示す天然に存在しない分子を意味し、天然に存在する抗体に由来するCDRを含み、−かかるアナログは、例えば、scFvフラグメント、二重特異性抗体などにより表されるが、例えば、本明細書で開示される抗−RSV抗体分子に由来するCDR(例、当該技術分野で周知の移植技術による)を含むように改良される表面上天然に存在する抗体−例えば、かかる抗体アナログは、別の動物種の抗体分子に取り込まれている、あるいは同一種由来の異なる抗体アイソタイプもしくはクラスに取り込まれている、本明細書に開示されるCDRを含みうる。
用語「抗−RSV組み換えポリクローナル抗体」または「抗−RSV rpAb」は、組み換えで産生される多様な抗体分子の組成物であって、各メンバーが消化器多核体ウイルスにおける少なくとも1つのエピトープに結合することができ、全体としてのポリクローナル抗体がRSVを中和することができる抗体分子の組成物を記載する。好ましいのは、抗−RSV rpAb組成物は、RSVサブタイプAおよびBの両方を中和する。さらにより好ましいのは、抗−RSV rpAbは、GおよびFタンパク質に対する結合反応性をさらに含む。好ましいのは、組成物は、単一のポリクローナルを生成する細胞株から産生される。
用語「同種VHおよびVLをコードするペアー(pairs)」は、同一細胞内に含まれるか、または由来するVHおよびVLをコードする配列の元々のペアーを記載する。したがって、同種VHおよびVLのペアーは、かかる細胞が由来するドナーに元々存在するVHおよびVLのペアーを表す。用語「VHおよびVLをコードするペアーから発現される抗体」は、抗体または抗体フラグメントが、VHおよびVLをコードする配列を含むベクター、プラスミドまたは類似物から産生されることを示す。同種のVHおよびVLをコードするペアーが、完全な抗体として、またはそれらの安定なフラグメントとして発現される場合、それらは、それらが由来する細胞で元々発現される抗体の結合親和性および特異性を維持する。同種ペアーのライブラリーはまた、同種ペアーのレパートリーまたはコレクションとも称され、個別に保存されるか、またはプールされうる。
用語「組み換えポリクローナル抗体の別個のメンバー」は、可変領域内の1つまたはそれ以上の鎖を含む組み換えポリクローナル抗体組成物の個々の抗体分子を表し、他のポリクローナルタンパク質の個々のメンバーと比較してアミノ酸配列の相違により特徴付けられる。これらの鎖は、特に、CDR1、CDR2およびCDR3領域に局在される。
用語「エピトープ」は、一般に、動物、好ましくは、哺乳動物、最も好ましくは、ヒトにおける抗原性または免疫原性活性を有する大型分子の一部または大型分子の部分(例、抗原または抗原部位)を記載するのに用いられる。免疫原性活性を有するエピトープは、動物における抗体応答を誘導する大型分子の一部である。抗原性活性を有するエピトープは、当該技術分野でよく知られる方法のいずれかにより、例えば、本明細書に記載される免疫アッセイにより調べられるように、抗体が免疫特異的に結合する大型分子の一部である。抗原性エピトープは、必ずしも免疫原性である必要はない。抗原は、抗体または抗体フラグメントが免疫特異的に結合する物質、例えば、毒素、ウイルス、細菌、タンパク質またはDNAである。抗原または抗原部位は、それらが非常に小さくない限り、多くの場合、1つより多くのエピトープを有し、免疫応答を活性化することができる。同一の抗原における異なるエピトープに結合する抗体は、それらがエピトープの局在に依存して、結合する抗原の活性を変化させる効果を示すことができる。抗原の活性部位におけるエピトープに結合する抗体は、抗原の機能を完全に妨害しうる一方、異なるエピトープに結合する別の抗体は、単独で抗原の活性に全くまたはほとんど効果を示し得ない。しかしながら、かかる抗体は、さらに補体を活性化し、それにより抗原の排除が起き、次いで同一の抗原の異なるエピトープに結合する1つまたはそれ以上の抗体と結合される場合に相乗効果を生じうる。本発明では、大型分子のエピトープの一部は、好ましくはRSVポリペプチドの一部である。本発明の抗原は、好ましくは、抗体または抗体フラグメントが免疫特異的に結合する、RSV関連タンパク質、ポリペプチドまたはそれらのフラグメントである。RSV関連抗原はまた、抗体または抗体フラグメントが免疫特異的に結合する、RSVポリペプチドまたはそのフラグメントのアナログまたは誘導体であってもよい。
例えば、DNA、RNAまたはタンパク質の配列に関連して用いられる用語「完全なヒト」は、98から100%のヒト配列を記載する。
用語「免疫グロブリン」は、一般に、血液または血清中で見出される抗体の混合物の総称として用いられるが、他の起源に由来する抗体の混合物を表すのに用いられてもよい。
用語「液性免疫応答を反映する」は、ポリクローナル抗体に関して用いられる場合、個々の抗体メンバーをコードする核酸配列が、抗−RSV特異的抗体を産生する血漿細胞の発生頻度の上昇を伴うドナーに由来する抗体組成物を意味する。かかるドナーは、RSV感染から回復したものであるか、RSVに感染した個体と密接な関係を示すものであるか、あるいはRSVワクチン接種を受けたもののいずれかであってもよい(RSVワクチンの例は、例えば、Maggon and Barik, 2004, Rev.med.Virol.14:149-168を参照)。感染または誘発によってドナー内で上昇した抗体の親和性および特異性を反映させるために、可変重鎖(VH)および可変軽鎖(VL)をコードする配列は、それらが単離される時に、ドナー内に元々存在する遺伝子のペアーまたは組合せ(同種のペアー)で維持されるべきである。ドナーにおける液性免疫応答の多様性を反映するため、RSVに結合する抗体をコードする全ての配列は、スクリーニング手順に基づいて選択される。単離された配列は、可変領域、特に、CDR領域の多様性に関して、またはVHおよびVLファミリーに関しても解析される。これらの解析に基づいて、RSVに結合する抗体の全体の多様性を表す同種ペアーの集団が選択される。かかるポリクローナル抗体は、典型的に、少なくとも5、10、20、30、40、50、100、1000または104個の別個のメンバーを有する。
組成物は、その投与が受容する患者により耐性化されうる場合、「薬理学的に許容される」と言われる−同じことを、組成物の一部である賦形剤、ビヒクル、担体および希釈剤に適用する。
用語「ポリクローナル抗体」は、同一または異なる抗原における数種の特異的な抗原性決定基/エピトープと結合するか、または反応することができる異なる(多様な)抗体分子の組成物であって、組成物中のそれぞれ個々の抗体が特定のエピトープと反応することができる組成物を記載する。通常、ポリクローナル抗体の可変性は、いわゆるポリクローナル抗体の可変領域、特にCDR1、CDR2およびCDR3領域に位置される。本発明では、ポリクローナル抗体は、ポリクローナル細胞株からワンポットで産生されるか、または異なるポリクローナル抗体の混合物のどちらかであってもよい。モノクローナル抗体の混合物は、それらが個々のバッチ内で産生され、必ずしも、例えば、翻訳後修飾の相違を生じる同一の細胞株に由来しないことから、ほとんどポリクローナル抗体とは考えられていない。しかしながら、モノクローナル抗体の混合物が、本発明のポリクローナル抗体として同一の抗原/エピトープの範囲(coverage)を提供する場合、ポリクローナル抗体の等価物として考えられる。ポリクローナル抗体のメンバーが抗原/抗原部位/エピトープに対して特異的に結合するか、または特異的な反応性を有すると記載する場合、本明細書では、結合定数が100nM以下、好ましくは10nM以下、さらにより好ましくは1nM以下であることを意味する。
用語「組み換え抗体」は、発現ベクターでトランスフェクトされた細胞または細胞株から発現される抗体分子または数種類の分子を記載するのに用いられ、この発現ベクターは、自然界ではその細胞に付随していない抗体のコーディング配列を含む。組み換え抗体組成物中の抗体分子が多様であるか、または相違する場合、用語「組み換えポリクローナル抗体」または「rpAb」は、ポリクローナル抗体の定義に従って適用する。
用語「組み換えポリクローナル細胞株」または「ポリクローナル細胞株」は、変異型の核酸配列のレパートリー(例、抗体をコードする核酸配列のレパートリー)でトランスフェクトされるタンパク質の混合物/集団を発現する細胞を意味し、変異型の核酸配列は、自然界ではトランスフェクトされた細胞に付随していない。好ましいのは、トランスフェクションは、組み換えポリクローナル細胞株を一緒に構成する個々の細胞が各々、目的の単一で別個の核酸配列の転写活性コピーを保持し、目的の組み換えポリクローナル抗体の1つのメンバーをコードするように行われる。さらにより好ましいのは、別個の核酸配列の単一コピーのみがゲノム中の特異的な部位に組み込まれる。組み換えポリクローナル細胞株を構成する細胞は、目的の別個の核酸配列の組み込まれるコピーを保持する能力について、例えば、抗生物質選択により選択される。かかるポリクローナル細胞株を構成することができる細胞は、例えば、細菌、真菌、酵母、昆虫細胞、植物細胞または哺乳動物細胞のごとき真核細胞、特に、CHO細胞、COS細胞、BHK細胞、骨髄腫細胞(例、Sp2/0細胞、NS0)、NIH 3T3、YB2/0のごとき不死化哺乳動物細胞株、ならびに、Hela細胞、HEK293細胞、またはPER.C6のごとき不死化ヒト細胞でありうる。
用語「VHおよびVLのペアーをコードする配列」または「VHおよびVLをコードする配列のペアー」は、各分子が、可変重鎖および可変軽鎖の発現をコードする配列を含む核酸分子を示し、これらは、適切なプロモーターおよび/またはIRES領域が存在し、配列に作動可能に連結される場合、核酸分子に由来する一組として発現されうる。核酸分子はまた、重鎖および/または軽鎖の定常領域の一部または完全な定常領域をコードし、適切なプロモーターおよび/またはIRES領域が存在し、配列に作動可能に連結される場合に、Fabフラグメント、全長抗体または他の抗体フラグメントが発現されてもよい。
組み換えポリクローナル抗体は、投与される量が生理学的に有意である、例えば、動物またはヒトにおけるRSV感染を予防するか、または弱毒化する場合に、「治療上有効な量」で投与されることとされる。
(図面の説明)
図1:(A)プロトタイプ株、Long(サブタイプA)および18537(サブタイプB)由来の全体のGタンパク質のアミノ酸配列の並列比較。シグナル/膜貫通領域を点線で囲う。Cane et al1991 J.Gen.Virol. 72:2091-2096により同定されるようなアミノ酸101〜133および208〜299の間の2つの可変領域を下線で特定する。Gタンパク質の中心フラグメントはE.coliで融合タンパク質として発現され、黒色で囲う。2つのアミノ酸配列を、配列番号:711(サブタイプA)および配列番号:712(サブタイプB)に記載する。(B)(A)に示される中心フラグメントの並列比較。13−aa保存領域およびGタンパク質システインリッチドメイン(GCRR)の局在を角括弧で示す。(両サブタイプ間で同一の)GCRRにおけるジスルフィド架橋を四角角括弧で示す。2つのアミノ酸配列を配列番号:713(サブタイプA)および配列番号:714(サブタイプB)に記載する。
図1:(A)プロトタイプ株、Long(サブタイプA)および18537(サブタイプB)由来の全体のGタンパク質のアミノ酸配列の並列比較。シグナル/膜貫通領域を点線で囲う。Cane et al1991 J.Gen.Virol. 72:2091-2096により同定されるようなアミノ酸101〜133および208〜299の間の2つの可変領域を下線で特定する。Gタンパク質の中心フラグメントはE.coliで融合タンパク質として発現され、黒色で囲う。2つのアミノ酸配列を、配列番号:711(サブタイプA)および配列番号:712(サブタイプB)に記載する。(B)(A)に示される中心フラグメントの並列比較。13−aa保存領域およびGタンパク質システインリッチドメイン(GCRR)の局在を角括弧で示す。(両サブタイプ間で同一の)GCRRにおけるジスルフィド架橋を四角角括弧で示す。2つのアミノ酸配列を配列番号:713(サブタイプA)および配列番号:714(サブタイプB)に記載する。
図2:多重重複伸長RT−PCR(A)およびクローン化工程(B)の模式的概要。(A)VHおよびVK遺伝子ファミリー各々に特異的な2組のプライマー、CH+VH1−8およびVK1−6+CK1を第一のPCR工程に用いた。VHまたはVKプライマー間の相同領域は重複するPCR産物を生じる。第2工程において、この産物をネスティドPCRで増幅させる。プライマーはまた、クローン化を容易にする制限酵素の認識部位を含む。(B)作成した同種の連結VHおよびVKをコードするペアーをプールし、隣接するXhoIおよびNotI制限部位の使用により哺乳動物IgG発現ベクターに挿入した。次いで、全長抗体の発現を促進するために、二方向性プロモーターを連結VHおよびVKをコードする配列間のAscI−NheI制限酵素部位に挿入する。用いられるPCRプライマーを平行矢印により示す。CH1:重鎖定常領域1、CL:定常領域、LC:軽鎖;Ab:抗体;P1−P2:二方向性プロモーター。
図3:哺乳動物全長抗体発現ベクター00−VP−530の模式図。ベクターは以下の構成要素を含む:AmpおよびAmp pro=アンピシリン耐性遺伝子およびそのプロモーター。pUC開始点=pUC複製開始点。P1=軽鎖の発現を促進する哺乳動物プロモーター。P2=重鎖の発現を促進する哺乳動物プロモーター。リーダーIGHV=ゲノムヒト重鎖リーダー。VH=重鎖可変領域をコードする配列。IgG1=ゲノム免疫グロブリンアイソタイプG1重鎖定常領域をコードする配列。ウサギβ−グロブリンA=ウサギベータ−グロブリンポリA配列。カッパリーダー=マウスカッパリーダーをコードする配列。LC=軽鎖をコードする配列の配列。SV40 term=サルウイルス40転写終結配列。FRT=Flp認識標的部位。Neo=ネオマイシン耐性遺伝子。SV40polyA=サルウイルス40ポリAシグナル配列。
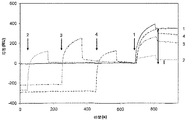
図4:ビアコア(Biacore)解析を用いてクローン801から得られた抗体(Ab801)のエピトープ特異性の特徴付け。抗体801結合を、3つの抗体、9c5(2)、133−h(3)およびパリビズマブ(4)であって、各々、抗原部位F1、CおよびIIに結合する抗体を用いて、タンパク質Fへの結合に関する対競合(pair−wise competition)でテストした。対照の細胞は、競合しないAb801(1)のタンパク質Fへの結合を示す。4つの抗体の注入時間を矢印により示す。応答を相対的共鳴単位(RU)で示す。長い両方向矢印は競合しない応答の大きさを示し、短い両方向矢印は9c5で阻害された応答の大きさを示す。
図5:図は、RSVサブタイプAおよびB株のインビトロ中和の結果である。抗−F抗体混合物の希釈物を、RSV long(グラフA)およびRSV B1(グラフB)株を中和する能力についてテストした。クローン810、818、819、825および827から得られた抗体混合物、抗−F(I)を三角形(▲)として示し、クローン735、800、810、818、819、825、827、863、880、884および894から得られた抗体混合物、抗−F(II)を四角形(■)として示す。パリビズマブをダイヤモンンド(◆)として示し、アイソタイプに適合する陰性コントロール(抗−アカゲザルD)抗体を円(●)として示す。吸光度を490nmで測定し、RSV複製と相関関係にある。
図6:図は、インビトロRSV融合阻害アッセイの結果である。抗体混合物の希釈物を、RSV B1株を中和する能力についてテストした。クローン810、818、819、825、827、796、838841、856および888から得られる抗体混合物、抗−F(I)Gを白抜きの四角形(□)として示し、735、800、810、818、819、825、827、863、880、884、894、793、796、838、841、856および888から得られる抗体混合物、抗−F(II)Gを、白抜きの三角形(△)として示す。パリビズマブをダイアモンド(◆)として示す。吸光度を490nmで測定し、RSV複製と相関関係にある。
図7:図は、活性な補体の存在下でPRNTにより測定されるごとく抗−G抗体クローンの組み合わせによるRSVのインビトロ中和からの結果である。(表8に記載される)個々の抗体組成物の希釈物を、ウサギ補体の存在下におけるRSV株Longとインキュベートし、その後、HEp−2細胞を感染させた。インキュベーション24時間後、感染の程度を、RSV特異的血小板の免疫検出を用いて検出した。抗−RSV rpAb13を白抜き三角形(△)として、抗−RSV rpAb35を三角形(▲)として、抗−RSV rpAb36を四角形(■)として、抗−RSV rpAb41を円(●)として、ならびに抗−RSV rpAb45を白抜き四角形(□)として示す。データをコントロール±SDと比較して%感染として表す。
(発明の詳細な説明)
標的抗原およびポリクローナル抗体組成物
本発明のポリクローナル抗体は、同一の組成物中に多くの別個の抗体分子を含む。各分子は、RSV関連抗原に結合する能力に基づいて選択される。本発明のポリクローナル抗体は、ポリクローナル抗体組成物を構成する別個の抗体分子の集められた(compiled)結合反応性に相当する結合反応性を含む。
標的抗原およびポリクローナル抗体組成物
本発明のポリクローナル抗体は、同一の組成物中に多くの別個の抗体分子を含む。各分子は、RSV関連抗原に結合する能力に基づいて選択される。本発明のポリクローナル抗体は、ポリクローナル抗体組成物を構成する別個の抗体分子の集められた(compiled)結合反応性に相当する結合反応性を含む。
本発明の抗−RSVポリクローナル抗体は、好ましくは、GおよびFタンパク質の両方に対する収集された結合反応性、より好ましくは、エスケープ変異体の発生のリスクを最小限にし、最も高い可能性のある中和能力を達成する複数のエピトープに対する集められた結合反応性を含む。中和抗体により認識される少なくとも5つの主要な抗原部位は、Fタンパク質において同定されている(Lopez et al 1998.J.Virol 72:6922-8)。全ての抗原部位はF1鎖にマップされ、部位I、II、IV、VおよびVIを含み、部位IおよびIIは各々、BおよびAとも呼ばれうる。部位IIは、N−末端分節のプロテアーゼ耐性領域に位置し、ならびに部位IV、VおよびVIは、タンパク質のシステインリッチ領域のC末端に位置する。部位Iは、このシステインクラスターの中央に位置する。Fタンパク質上のさらなる抗原部位は、アミノ酸位置241および242を含むエピトープF2が位置する部位Cである。さらに、F1と呼ばれる抗原部位に結合するモノクローナル抗体が存在し、F1はF1a、F1bおよびF1cと呼ばれるエピトープを含む。現在、この抗原部位は、Fタンパク質上の特定の部位にマップされていない。これらの部位/エピトープの大半は、広く中和抗体を生じるが、抗原部位Iに特異的ないくつかの抗体は、サブタイプA特異的であることが示されている。部位Iに結合する抗体はまた、ウイルス中和における限界効果を示す。パリビズマブにより認識されるエピトープは、アミノ酸位置272における選択されたエスケープ変異体の局在により判断されるような抗原部位IIに位置する(Zhao et al 2004 J.Infect.Dis190:1941-6)。さらに、エピトープの3種のタイプがGタンパク質上で同定された:i)全てのRSV株に存在する保存されたエピトープ、ii)同一のサブタイプに属する全てのウイルスに存在するグループ特異的なエピトープ、ならびにiii)同一のサブタイプに属する株のサブセットのみに存在する株特異的または可変性エピトープ。保存されたおよびグループ特異的なエピトープは、4つのシステイン(アミノ酸残基173、176、182および186)のクラスターならびに全てのヒトRSV単離体(isolate)間で同一配列の短いアミノ酸断片(残基164−176)を含むGタンパク質の中央部分にマップされている。システインクラスターは、位置173−183および176−182の間のジスルフィド結合により保持され、アミノ酸残基171−187の範囲であるGタンパク質システインリッチ領域(GCRR)の中央部を構成し、それによりGCRRは、13個のアミノ酸保存領域と重複する。G糖タンパク質は、保護的免疫と疾病病因の両方の誘導に役割を果たすようである。例えば、マウスにおける研究は、G糖タンパク質が、IL−4、IL−5、IL−13および肺好酸球の産生により特徴付けられるTh2 CD4+ T細胞応答を調節することを示した。好酸球の補充と活性は、IL−4およびIL−5のごとき数種の因子により促進される。さらに、マウスの急性感染期間におけるRSV Gタンパク質の発現は、Th1サイトカイン発現の減少(例、IL−2およびガンマインターフェロン)、ケモカインmRNA発現の変化(例、MIP−1アルファ、MIP−1ベータ、MIP−2、IP−10、MCP−1)、ならびに感染した肺へのNK細胞輸送の減少により特徴付けられる改善された自然免疫応答に関連していた。特に、GCRRは、自然炎症反応を調節し、それにより可能性としてRSVクリアランスを遅延させることに重要な役割を果たすことが示された(Polack et al.,2005 PNAS 102:8996-9001)。GCRRは、アミノ酸位置182から186にCX3Cモチーフを含む。RSVに感染されたマウスにおける呼吸速度の減少は、CX3Cモチーフに対する抗体が呼吸速度の減少を無効にすることから、このモチーフに関連することが示された(Tripp et al.2003.J.Virol.77:6580-6584およびUS 2004/0009177 (appl.no.10/420,387))。株特異的エピトープは、Gタンパク質の外部ドメインにおけるシステインクラスターの可変領域N末端にマップされるが、好ましいのは、Gポリペプチドの可変C末端の3番目に位置される(Martinez et al.1997.J.Gen.Virol.78:2419-29)。図1は、Long株(サブタイプA)および18537株(サブタイプB)由来のGタンパク質の並列比較を表し、これはGタンパク質の多様な領域を示す。一般的に、モノクローナル抗−Gタンパク質抗体は、RSV中和における限界的効果を有する。しかしながら、モノクローナル抗−G抗体の混合物がインビトロならびにインビボにおけるRSVの中和を高めることが報告されてきた(Walsh et al 1989.J.Gen.Virol 70:2953-61およびMartinez and Melero 1998 J.Gen.Virol.79:2215-20)。モノクローナル抗−G抗体を結合する最も大きな効果は、ウイルスの画分がまだ中和に耐性であっても、抗体が異なるエピトープに結合する時に明確に発揮される。さらに、異なるエピトープ特異性を有する2つの異なる抗−F抗体の組合せならびに1つの抗−Fと1つの抗−G特異的抗体の組合せは、RSVにおけるインビトロ中和効果の上昇を示した(Anderson et al 1988 J.Virol.62: 4232-4238)。モノクローナル抗体を混合することにより得られるいくつかの有利な点は、例えば、活性部位の阻害によるアンタゴニスト効果のごときモノクローナル抗体の個々の特性のためと考えられる。その他の効果は、今のところ理解されていない理由による相乗作用が考えられる。
RSV中和のメカニズムは複雑であり、完全に理解されていない。多くの異なるエピトープ、FおよびGタンパク質のみで同定された、保存されたサブタイプ特異的ならびに株特異的エピトープ、ならびにエスケープ変異体の潜在的な作成は、RSV感染の予防に役割を果たしうる全ての中和メカニズムを定めるのに広範囲な抗体特異性が必要であることを示唆する。それゆえ、合理的な方法において、サブタイプAおよびBの両方のRSV株、ならびにエスケープ変異体および今日知られるRSV株から生じる新しい株によるRSV感染を予防することができるモノクローナル抗体の混合物を選択することは非常に困難である。
本発明の態様は、多くの多様性および広範な抗−RSV特異性を有するポリクローナル抗−RSV抗体を提供する。本発明のポリクローナル抗−RSV抗体は、産生時における利用可能なドナーに依存せず、バッチ間の変動は、ドナー由来の抗−RSV免疫グロブリン産物(例、RSV IVIG)で観察されるものよりかなり小さい。本発明のポリクローナル抗−RSV抗体では、全ての個々の抗体メンバーは、RSV関連抗原に結合することができ、前記ポリクローナル抗体はRSVサブタイプAおよびBを中和することができる。ポリクローナル抗体の各々別個の抗体は、ポリクローナル抗体の他のメンバーのいずれかによっても結合されないエピトープに結合することが好ましい。本発明のポリクローナル抗−RSVは、多価の手段でRSV抗原に結合し、それは通常、結果として、相乗的な中和、マクロファージによる感染細胞の食作用の改善および感染細胞に対する抗体依存性細胞障害(ADCC)の改良ならびに補体活性の上昇を生じる。さらに、本発明のポリクローナル抗体は、RSV IVIGの場合である非結合タンパク質により「希釈」されず、この場合、有効であるために750mgの合計タンパク質/kgの用量が必要とされる。750mgの合計タンパク質内におけるRSV特異的抗体の割合は知られていないが、最大で1%より大きくなることはなく、恐らく1%より小さいと考えられる。したがって、パリビズマブのインビトロにおける効力がRSV IVIGの効力より25−30倍高いとされた場合(Johnson et al 1997 J.Infect.Dis.176:1215-24)、これはRSV IVIGの特異的活性の減少により相殺される。それゆえ、RSV−IVIGに含まれる免疫グロブリン分子のわずか1%がRSVに特異的である場合、RSV−IVIGポリクローナル抗体の活性のある用量は、モノクローナル抗体パリビズマブの活性のある用量より低い、わずか7.5mg/kgである。
これらの理由により、本発明の組み換えポリクローナルRSV−特異的抗体は、モノクローナル抗体より有意に高い能力であることが期待され、それゆえに、パリビズマブおよびRSV IVIGの有効な用量と比較して、より少ない用量の本発明のポリクローナル抗体で投与することが可能である。したがって、本発明のポリクローナル抗−RSV抗体はまた、リスクの高い患者、特に骨髄移植の被提供者、高齢者および慢性肺疾患にかかっている個体の予防および治療に適すると考えられる。本発明のポリクローナル抗−RSV抗体のさらなる有利な点は、個々の抗体メンバーの濃度がモノクローナル抗体の濃度より有意に低く(用いられる濃度が同一であったとしても)、したがって個々の抗体が治療上、個々の免疫系により外部物質として認識される可能性が低くなり、1つの個々の抗体が患者内の免疫応答により排除されるとしても、残存する抗体メンバーが無傷であることから、ポリクローナル抗−RSV抗体の中和能力またはクリアランス速度に影響することはないようである。
本発明の具体例は、RSVサブタイプAおよびBを中和することができる組み換えポリクローナル抗−RSV抗体であり、前記ポリクローナル抗体は、少なくとも1つのRSV外被タンパク質における少なくとも3つの異なるエピトープに一緒に特異的に結合する別個の抗体メンバーを含む。好ましいのは、Fタンパク質は、少なくとも3つの別個の抗体メンバーにより特異的に結合され、前記エピトープは、好ましくは異なる抗原部位に位置する。
本発明のさらなる具体例は、RSVサブタイプAおよびBを中和することができる組み換えポリクローナル抗−RSV抗体であり、前記ポリクローナル抗体は、少なくとも2つのRSV外被タンパク質に対する特異的反応性を一緒に提供する別個の抗体メンバーを含む。2つの外被タンパク質は、RSV Gタンパク質、すなわち、RSV Fタンパク質およびRSV SHタンパク質から選択することができる。好ましくは、本発明のポリクローナル抗−RSV抗体は、抗−Gおよび抗−F反応性を含む。かかるポリクローナル抗体の抗−Gおよび抗−F反応性は、好ましくは、少なくとも2つの別個の抗−G抗体および少なくとも1つの別個の抗−F抗体からなる。好ましいのは、少なくとも3つの別個の抗体は、異なるエピトープに結合し、それにより少なくとも3つの異なるエピトープを網羅し、同時に抗体は、同様にRSVサブタイプAおよびサブタイプB株を中和することができる。より好ましい本発明のポリクローナル抗−RSV抗体の抗−Gおよび抗−F反応性は、以下に記載される抗−Gおよび抗−F反応性のいずれかの組合せからなる。最も好ましい本発明のポリクローナル抗−RSV抗体は、以下で言及される全ての抗原部位/エピトープに対する抗−Gおよび抗−F反応性からなる。本発明のポリクローナル抗−RSV抗体に可能な最も広い特異性を得るために、1つまたはそれ以上の好ましい全ての抗原部位は、1つより多くの別個の抗体により網羅されることが望ましい。したがって、同一抗原または抗原部位における数種のエピトープが、本発明のポリクローナル抗体の別個のメンバーにより結合されることが好ましい。
本発明のポリクローナル抗−RSV抗体の抗−G反応性に関して、この反応性は、好ましくは、保存されたエピトープに対する指向性である。より好ましい抗−G反応性は、G−タンパク質上の保存されたエピトープに特異的に結合することができる第1の抗−G抗体、およびGタンパク質システインリッチ領域(GCRR)に特異的に結合することができる第2の抗−G抗体からなる。ポリクローナル抗−RSV抗体は、好ましくは、少なくとも2つの別個の抗−Gタンパク質を含み、少なくとも1つの第1の抗体は、Gタンパク質上の保存されたエピトープに特異的に結合することができ、少なくとも1つの第2の抗体は、サブタイプAまたはBのどちらかを認識する異なる保存されたエピトープまたはグループ特異的エピトープに特異的に結合することができる。好ましくは、ポリクローナル抗体は、少なくとも3つの別個の抗−G抗体を含み、第1の抗体は、G−タンパク質上の保存されたエピトープに特異的に結合することができ、第2の抗体は、サブタイプAのGタンパク質に特異的に結合することができ、第3の抗体は、サブタイプBのGタンパク質に特異的に結合することができる。Gタンパク質システインリッチ領域(GCRR)は、保存されたエピトープが位置する上流13アミノ酸領域およびグループ特異的エピトープが位置する領域と一部重複する。それゆえ、保存されたエピトープに特異的に結合することができる抗体ならびにグループ特異的な抗体は、それらが認識するエピトープがGCRRに位置する場合にGCRRに結合してもよい。好ましくは、保存されたエピトープまたは株特異的なエピトープへの結合により特徴付けられる別個の抗体のうちの少なくとも1つもまた、GCRRを認識する。GCRRのCX3Cモチーフに結合する抗体は、ウイルス中和の観点から特に好ましい。しかしながら、CX3XCモチーフに結合する抗体はまた、フラクタルカインおよび他のヒトCX3Cケモカインのごとく多くの他の関連しないヒト抗原に結合し、それゆえ、望ましくない副作用を産生することから、交差反応(例、実施例における一定の抗体について示されるように)についてかかる抗体をテストし、次いで適するモデル系で同一の抗体をテストする合理的方法が存在する。いずれにしても、副作用が存在しないか、ごく軽微であるか、または少なくとも許容されるかが確実性の程度で立証されうる前に、臨床試験において、本発明の抗体のごとき所定の医薬品をテストすることが必ず必要である。保存されたおよびグループ特異的な抗−G反応性に加えて、株特異的なエピトープに対して指向性のあるさらなる抗−G反応性もまた、本発明のポリクローナル抗−RSV抗体に含まれてもよい。ほとんどの多くの株特異的エピトープに対して指向性のある株特異的抗−G反応性は、5年以内にRSV感染を生じるウイルス株に存在することが好ましい。本発明では、株特異的エピトープは、限られた数のRSV株に存在するのみのエピトープとして理解される。グループ特異的および/または株特異的抗−G抗体の添加は、本発明の抗−RSV抗体に対してさらなる多様性を提供することができ、Gタンパク質の保存領域に対する反応性を有する抗体と結合される時に相乗作用を誘導しうる。好ましくは、本発明の抗−G抗体は、直接RSVを中和し、ウイルスの細胞への進入を阻害し、細胞移動を防止し、炎症反応を抑制し、および/または多核体形成を予防する。
本発明のポリクローナル抗−RSV抗体の抗−F反応性に関して、この反応性は、好ましくは、1つまたはそれ以上の抗原部位I、II、IV、V、VI、CまたはF1における少なくとも1つのエピトープに対して指向性がある。本発明のさらなる具体例では、少なくとも2つ、3つ、4つ、5つ、6つまたは全てのこれらの抗原部位/エピトープは、本発明のポリクローナル抗−RSV抗体における別個の抗体により網羅される。好ましくは、本発明の抗−F抗体は、直接RSVを中和し、および/またはウイルスの細胞への進入を阻害し、および/または多核体形成を予防する。
本発明のポリクローナル抗−RSV抗体組成物では、組成物は、Fタンパク質における全ての抗原部位を対して指向性のある結合反応性を含まず、抗原部位IIのエピトープに特異的に結合する少なくとも1つの別個の抗−F抗体が存在することが好ましい。より好ましいのは、部位II特異的な抗−F抗体は、抗体パリビズマブとして同一のエピトープまたは抗原部位に結合する。部位II−特異的な抗体に加えて、1つまたはそれ以上の別個の部位IV−特異的な抗−F抗体が望ましく、かかる抗体は、好ましくはRSVF2−5として同一のエピトープに結合する。
サブタイプ−特異的な抗−F抗体はまた、当該技術分野で知られている。しかし、Fタンパク質が2つのサブタイプAおよびB間で91%のアミノ酸相同性を示すことから、サブタイプ−特異的な抗−F抗体は、抗−G抗体におけるよりもより少ない。しかしながら、かかる株−特異的な抗−F抗体は、可能な限り広範な特異性を得ることを付与し、それゆえに本発明のポリクローナル抗−RSV抗体の望ましい構成要素である。
上で言及されたRSV GおよびFタンパク質抗原に加えて、RSウイルスは、第3の外被タンパク質である小分子疎水性(SH)タンパク質を発現する。SHタンパク質由来のペプチドに対して上昇した過免疫血清は、インビトロでRSVを中和することができないことが示されてきた(Akerlind-Stopner et al 1993 J.Med.Virol.40:112-120)。しかしながら、タンパク質は主に感染した細胞で発現されることから、SHタンパク質に対する抗体は、融合の阻害における効果を示し、RSV感染に対するインビボにおける保護に関連する可能性が考えられる。このことは、SH遺伝子を欠失するRSV株が上気道において10倍低い効率で複製するという事実により支持される(Bukreyev et al 1997 J.Virol.71:8973-82)。
本発明のさらなる具体例は、RSVサブタイプAおよびBを中和し、抗−SH反応性、および抗−Gもしくは抗−F反応性を含むことができるポリクローナル抗−RSV抗体である。SHタンパク質のアミノ酸41から64/65(サブタイプA/B)までの範囲のC−末端は、細胞表面上に露出される。したがって、この領域に局在するエピトープに対する抗−SH反応性が望ましい。SHタンパク質のC末端は、サブタイプAおよびBと異なり、それゆえに本発明のポリクローナル抗体におけるサブタイプAおよびBの両方に対する抗−SH反応性を含むことが望ましい。このSH反応性は、少なくとも2つの別個の抗−SH抗体により提供することができ、第1の抗体は、SHサブタイプAに特異的に結合することができ、第2の抗体は、SHサブタイプBに特異的に結合することができる。
本発明の一の具体例では、ポリクローナル抗−RSV抗体は、SHサブタイプAおよび/またはBに対する特異的反応性ならびにGタンパク質に対する特異的反応性を含む。Gタンパク質に対する反応性は、上に記載の反応性のいずれかからなりうる。
代替的な具体例では、SHサブタイプAおよび/またはBに対する特異的な反応性は、上に記載される抗−F反応性のいずれかと組み合わされてポリクローナル抗−RSV抗体が構成されうる。
本発明の好ましい具体例では、ポリクローナル抗−RSV抗体は、外被タンパク質、F、GおよびSHの3つ全てに対する反応性を含む。
本発明のポリクローナル抗−RSV抗体に含まれる反応性は、組合せがRSVサブタイプAおよびBを中和することができる限り、表1に記載される抗原/抗原部位および/またはエピトープに対する特異的な結合反応性を有する別個の抗体のいずれか可能な組合せを構成してもよい。好ましくは、組合せは、少なくとも2つのRSV外被タンパク質に対する反応性を含む。
好ましくは、本発明によるポリクローナル抗体の個々の別個な抗体メンバーは、それら自身で中和および/または抗−炎症特性を有する。しかしながら、これらの特定の特性を持たない抗体もまた、例えば、補体活性を介して、RSVクリアランスに役割を果たしうる。
表1:RSV関連抗原、抗原部位およびエピトープのまとめ
表1:RSV関連抗原、抗原部位およびエピトープのまとめ
好ましくは、本発明のポリクローナル抗体は、抗体分子を自然に発現しないポリクローナル細胞株(組み換えポリクローナル抗体発現とも呼ばれる)由来の単一のバッチまたは数個のバッチとして産生される。モノクローナル抗体を混合することと比較して、組み換えポリクローナル抗体を産生することの有利な点の1つは、(単一のモノクローナル抗体を産生するのと同様のコストで)同時に無制限数の別個の抗体分子を産生する能力である。それゆえ、有意に最終産物のコストを増加させることなく、大量のRSV関連の抗原に対する反応性を有する抗体を含むことが可能である。特に、生物学では完全に理解されていないRSVと同様に複雑な標的に関しては、RSV単独に対して中和または保護することが示されていない個々の抗体は、他の抗体と結合される時に相乗作用を誘導しうる。それゆえ、ポリクローナル抗体組成物中に上に記載されるものに加えて、別個の抗体を含むことは有利な点であり得、わずかな判断基準は、個々の抗体がRSV関連抗原に結合する(例えば、RSV感染細胞への結合により評価される)ことである。好ましくは、上に記載される全てのポリクローナル抗−RSV抗体組成物は、組み換えポリクローナル抗−RSV抗体(抗−RSV rpAb)組成物である。
関連抗原として実証されていないが、その可能性のあるRSV標的抗原に結合する潜在的に関連のある抗原を獲得するための1つの方法は、RSVに感染されたドナーの免疫応答(完全な免疫応答)により上昇した個々の抗体からなるポリクローナル抗体組成物を作成することである。RSVに対して完全な免疫応答を示す抗体を得ることに加えて、RSV感染の保護、中和、および/または排除に特に関連する可能性のある抗原に結合する抗体に対する陽性選択が行われうる。さらに、RSVの保護、中和および/または排除に関連すると考えられる特定の抗原、抗原部位またはエピトープに対する抗体がドナーの完全な免疫応答において同定されない場合、かかる抗体は、特定の抗原(選択された免疫応答)を有するドナーの免疫付与/ワクチン接種により上昇されてもよい。一般的に、中和は、血小板の減少、マイクロ中和試験または融合阻害アッセイのごときインビトロ中和アッセイにより評価される(例、Johnson et al 1997 J.Infect.Dis 176:1215-24)。したがって、これらのアッセイのうちの1つにおいて有意な効果を示す抗体または抗体組成物は、陰性コントロールと比較した時に中和すると考えられる。保護は、一般的に、例えばコットンラットモデル(例、Johnson et al 1997 J.Infect.Dis 176:1215-24)またはマウスモデル(例、Taylor et al 1984 Immunology 52, 137-142およびMejias, et al 2005 Antimicrob Agents Chemother 49: 4700-4707)におけるインビトロ誘発実験により測定される。インビボ誘発実験は、抗体がウイルス誘発前に投与される予防様式において、または抗体がウイルス誘発後に投与される治療として実施するか、あるいは両方の組合せとして実施することができる。
本発明のポリクローナル抗体組成物は、RSV抗原に結合することができる抗体からなり得、このRSV抗原は必ずしも知られていないか、または必ずしも外被タンパク質ではない(抗体は感染細胞に結合するが、選択された抗原または抗原部位には結合しない)が、抗体は、例えば、RSV感染にかかっているか、またはRSV感染から回復する1つまたはそれ以上のドナーに由来する別個の抗体をコードする核酸配列を得ることにより、RSV感染後の完全な免疫応答から獲得される。第二に、同一の完全な免疫応答に由来する抗体は、特定の抗原、抗原部位および/またはエピトープに結合する能力に基づいて選択され、本発明のポリクローナル抗体に含まれうる。第三に、特定のRSV関連抗原で免疫付与/ワクチン接種され、それによりこれらのドナーで「選択された」免疫応答が上昇された1つまたはそれ以上のドナーから獲得されたVHおよびVLペアーからコードされる別個の抗体は、本発明のポリクローナル抗体組成物に含まれうる。したがって、本発明で言及される技術のいずれかに由来する抗体は、単一のポリクローナル抗体に結合されてもよい。好ましくは、本発明の抗体をコードする核酸は、ヒトドナーから得られ、産生された抗体は、完全なヒト抗体である。
本発明のポリクローナル抗体組成物の背景にある動機は:仮に、RSVに感染したドナーが抗原に対する液性免疫応答を上げる場合、これらの抗体は、少なくともある程度まで、ウイルスのクリアランスに貢献し、それによりポリクローナル抗体産物中の包含にふさわしいようである。
本発明のさらなる態様は、抗−RSV rpAbを産生することであって、別個の抗体メンバーの組成物は、RSV外被抗原に対する多様性、親和性および特異性に関して液性免疫応答を反映する。好ましくは、液性応答の反映は以下のうちの1つまたはそれ以上が満たされることを確認することにより立証される。i)かかる抗−RSV rpAb中の個々の抗体メンバーのVHおよびVL領域をコードする核酸配列が、例えばRSV感染後にRSVに対する液性免疫応答を上げたドナーに由来すること;ii)VHおよびVLをコードする配列が、ドナーに存在するVHおよびVLをコードする配列の元々のペアーが維持されるようなドナーから単離されること;iii)rpAbの個々のメンバーをコードするVHおよびVLのペアーが、CDR領域が可能な限り多様であるように選択されること;あるいはiv)抗−RSV rpAbの個々のメンバーの特異性が、抗体組成物が哺乳動物における有意な抗体応答を導く抗原に一緒に結合するように選択されること。好ましくは、抗体組成物は、前記ドナーに由来する血清サンプル中で有意な抗体力価を生じる抗原、抗原部位および/またはエピトープに一緒に結合する。かかる抗原、抗原部位および/またはエピトープは、上記表1にまとめられるが、上に記載されるような未知の抗原、抗原部位および/またはエピトープならびに非外被抗原を構成してもよい。好ましくは、ドナーはヒトであり、ポリクローナル抗体は完全なヒト抗体である。
本発明は、RSV関連抗原に対して結合特異性を有する全長の抗体、Fabフラグメントまたはその他の抗体フラグメントとして表すことができる一連のVHおよびVLペアーを同定した。特異的なVHおよびVLペアーは、実施例2における表5のクローン数により同定される。表5で同定されるようなVHおよびVLペアーを含む抗体は、好ましくは完全なヒト抗体である。しかしながら、望ましくは、キメラ化抗体もまた産生されてもよい。
本発明の好ましい抗−RSV組み換えポリクローナル抗体は、表5に記載されるVHおよびVLペアーのグループから選択される重鎖および軽鎖CDR1、CDR2およびCDR3領域を含む別個のメンバーからなる。好ましくは、CDR領域は、表5に示されるペアーで維持され、望ましいフレームワークに組み込まれる。
代替的に、第1クローンの重鎖由来のCDR領域(CDRH)は、第2クローンの軽鎖由来のCDR領域(CDRL)と結合される(VHおよびVLペアーの組み換え(scrambling))。CDR領域はまた、例えば、第1クローン由来のCDRL1領域を第2クローン由来のCDRL2およびCDRL3領域と結合することにより、軽鎖または重鎖内で組み換えられてもよい。かかる組み換えは、好ましくは同一抗原に結合するクローン間で行われる。本発明のCDR領域はまた、例えば、点変異による親和性成熟を受けてもよい。
可変重鎖および可変軽鎖をコードするペアーの単離および選択
抗−RSV組み換えポリクローナル抗体組成物を作成するプロセスは、適する起源に由来する可変重鎖(VH)および可変軽鎖(VL)をコードし、それによりVHおよびVLをコードするペアーのレパートリーを作成する配列の単離に関する。一般的に、VHおよびVLをコードする配列を得るための適する起源は、RSVに感染されたか、またはRSV感染から回復した動物またはヒトに由来するか、あるいはRSV株またはかかる株に由来するタンパク質もしくはDNAで免疫付与/ワクチン接種された動物またはヒトに由来する血液、脾臓または骨髄サンプルのごとき細胞画分を含むリンパ球である。好ましくは、画分を含むリンパ球は、ヒトまたはヒト免疫グロブリン遺伝子を有するトランスジェニック動物から採集される。細胞画分を含む採集されたリンパ球は、さらに特定のリンパ球集団、例えば、Bリンパ球系列に由来する細胞を得るために濃縮されてもよい。好ましくは、濃縮は、例えばB細胞、形質芽細胞および/または血漿細胞に対して系列特異的細胞表面マーカータンパク質の特性を利用する、磁気ビーズ細胞分離装置(MACS)および/または蛍光標示式細胞分取器(FACS)を用いて行われる。好ましくは、細胞画分を含むリンパ球は、B細胞、形質芽細胞および/または血漿細胞に関して濃縮される。さらにより好ましくは、高いCD38発現および中間体CD19および/またはCD45発現を有する細胞が血液から単離される。これらの細胞は時々、循環血漿細胞、初期血漿細胞または形質芽細胞と呼ばれる。簡潔にするため、本発明では、それらは他の用語が同じ意味で用いられるとしても単に血漿細胞と呼ぶ。
抗−RSV組み換えポリクローナル抗体組成物を作成するプロセスは、適する起源に由来する可変重鎖(VH)および可変軽鎖(VL)をコードし、それによりVHおよびVLをコードするペアーのレパートリーを作成する配列の単離に関する。一般的に、VHおよびVLをコードする配列を得るための適する起源は、RSVに感染されたか、またはRSV感染から回復した動物またはヒトに由来するか、あるいはRSV株またはかかる株に由来するタンパク質もしくはDNAで免疫付与/ワクチン接種された動物またはヒトに由来する血液、脾臓または骨髄サンプルのごとき細胞画分を含むリンパ球である。好ましくは、画分を含むリンパ球は、ヒトまたはヒト免疫グロブリン遺伝子を有するトランスジェニック動物から採集される。細胞画分を含む採集されたリンパ球は、さらに特定のリンパ球集団、例えば、Bリンパ球系列に由来する細胞を得るために濃縮されてもよい。好ましくは、濃縮は、例えばB細胞、形質芽細胞および/または血漿細胞に対して系列特異的細胞表面マーカータンパク質の特性を利用する、磁気ビーズ細胞分離装置(MACS)および/または蛍光標示式細胞分取器(FACS)を用いて行われる。好ましくは、細胞画分を含むリンパ球は、B細胞、形質芽細胞および/または血漿細胞に関して濃縮される。さらにより好ましくは、高いCD38発現および中間体CD19および/またはCD45発現を有する細胞が血液から単離される。これらの細胞は時々、循環血漿細胞、初期血漿細胞または形質芽細胞と呼ばれる。簡潔にするため、本発明では、それらは他の用語が同じ意味で用いられるとしても単に血漿細胞と呼ぶ。
VHおよびVLをコードする配列の単離は、VHおよびVLをコードする配列がランダムにベクターに結合してVHおよびVLをコードする配列ペアーの組合せライブラリーを作成する従来の方法において行うことができる。しかしながら、本発明では、RSV感染による液性免疫応答で産生される抗体の多様性、親和性および特異性を反映することが好ましい。このことは、ドナーに元々存在するVHおよびVLペアーの維持に関連し、それにより配列が単離されるドナーから産生された抗体に元々存在するVHおよびVLペアーに相当する可変重鎖(VH)および可変軽鎖(VL)をコードする各配列ペアーのレパートリーを生じる。これはVHおよびVLをコードする配列の同種ペアーとも呼ばれ、この抗体は同種抗体と称される。好ましくは、本発明のVHおよびVLをコードするペアー、組合せまたは同種は、ヒトドナーから得られ、それゆえ配列は完全にヒトのものである。
VHおよびVLをコードする配列の同種ペアーを作成するためのいくつかの異なる方法が存在する。1つの方法は、リンパ球含有細胞画分から分離される単一細胞に由来するVHおよびVLをコードする配列の増幅と単離に関する。VHおよびVLをコードする配列は、別々に増幅され、第二工程で組み合わされてもよく、あるいは、それらは増幅中に組み合わされてもよい(Coronella et al 2000 Nucleic Acids Res 28: E85; Babcook et al 1996 PNAS 93: 7843-7848およびWO 05/042774)。第2の方法は、細胞内(in−cell)増幅ならびにVHおよびVLをコードする配列の組合せに関する(Embleton et al 1992 Nucleic Acids Res 20: 3831-3837; Chapal et al 1997. BioTechniques 23: 518-524)。第3の方法は、溶血プラークアッセイをVHおよびVLのcDNAクローニングと組み合わせる選択リンパ球抗体法(SLAM)である(Babcook et al 1996 PNAS 93:7843-7848)。ドナーにおけるVHおよびVL配列ペアーの多様性を擬似するVHおよびVLをコードする配列のペアーのレパートリーを得るために、VHおよびVLペアーの組み換え(ランダムな組合せ)ができる限り生じないハイスループット法が好ましく、例えば(本明細書に援用される)WO 05/042774に記載される。
本発明の好ましい具体例では、VHおよびVLをコードするペアーのレパートリーは、メンバーのペアーがRSV感染から生じる液性免疫応答に関連する遺伝子のペアーを反映し、工程i)RSVに感染したか、またはRSV感染から回復したドナーに由来するリンパ球含有細胞画分を提供し;ii)任意選択的に、前記細胞画分からB細胞または血漿細胞を濃縮し、;iii)前記細胞画分各々に由来する細胞を複数の容器に分配することを含む、単離された単一細胞の集団を得;iv)前記単離された単一細胞に由来する鋳型を用いて、多重重複伸長RT−PCR法において増幅し、VHおよびVLをコードするペアーの連結を生じさせ、次いでv)任意選択的に、連結されたVHおよびVLをコードするペアーのネスティド(nested)PCRを行うことを含む方法にしたがって作成される。好ましくは、単離された同種VHおよびVLをコードするペアーは、以下に記載されるようにスクリーニングの手法にかけられる。
一度VHおよびVL配列のペアーが作成されると、RSV関連抗原に対する結合反応性を有するVHおよびVLペアーをコードする配列を同定するスクリーニング手法が行われる。好ましくは、RSV関連抗原はRSV外被タンパク質、特にRSV Gタンパク質、RSV Fタンパク質およびRSV SHタンパク質である。VHおよびVL配列のペアーが組み合わされる場合、スクリーニングの前に、RSVに結合する抗体フラグメントをコードするVHおよびVLペアーを濃縮するためにファージディスプレイ法を適用することができる。
RSVによる感染により液性免疫応答時に産生される抗体の多様性、親和性および特異性を反映するために、本発明は、出来る限り最も広範な多様性を得るため、同種ペアーのためのスクリーニング手法を発展させた。スクリーニングのために、同種VHおよびVLをコードするペアーのレパートリーは、適する宿主細胞にトランスフェクトされる細菌または哺乳動物のどちらかのスクリーニングベクターを用いて、抗体フラグメント(例、scFvもしくはFab)または全長抗体としてのどちらかで個々に発現される。Fab/抗体のレパートリーは、1つまたはそれ以上のRSV株のウイルス粒子に対する反応性について選択される。好ましくは、少なくとも2つの株、サブタイプAのうちの1つおよびサブタイプBのうちの1つが用いられる。サブタイプA株は、例えば、Long(ATCC VR−26)、A2(ATCC VR−1540)または最近のLong様サブタイプA分離株である。サブタイプB株は、例えば、18537(ATCC VR−1580)、B1(ATCC VR−1400)、9320(ATCC VR−955)または最近の18537様分離株である。同時に、Fab/抗体のレパートリーは、組み換えGタンパク質、組み換えFタンパク質およびRSV抗原に由来するペプチドのごとく選択された抗原に対して選択される。抗原ペプチドは、例えば、Gタンパク質保存領域(アミノ酸164−176)およびGタンパク質のシステインコア領域(サブタイプAならびにサブタイプB株のアミノ酸171−187)、ならびにSHタンパク質の細胞外領域(サブタイプAのアミノ酸42−64およびサブタイプBの42−65)から選択されうる。好ましくは、スクリーニング中のビーズまたはプレートにおける固定を容易にするために、ペプチドがビオチン化される。代替的な固定の方法が用いられてもよい。抗原は、RSVの生物学の知見および期待される中和および/または保護効果に基づいて選択され、これらの抗原に結合することができる可能性のある抗体が提供できる。このスクリーニング手法は、同様にして組み合わせファージディスプレイライブラリーに適用されうる。スクリーニングに用いられる組み換えGおよび/またはFタンパク質は、細菌、昆虫細胞、哺乳動物細胞または別の適切な発現系において発現されうる。Gおよび/またはFタンパク質は、(膜貫通領域のない)可溶性タンパク質として発現されるか、または3番目のタンパク質に融合されるかのどちらかで安定性が上昇されてもよい。Gおよび/またはFタンパク質が融合タグと一緒に発現される場合、融合の相手方は、スクリーニング前に切り離されてもよい。好ましくは、サブタイプAおよびサブタイプBの両方の典型例であるGおよび/またはFタンパク質は、スクリーニングのために発現され、用いられる。加えて、株特異的Gタンパク質もスクリーニングのために発現され、用いられる。上に記載される一次スクリーニングに加えて、選択された配列が擬陽性をコードしていないことを確実にするため、二次スクリーニングが実施されてもよい。二次スクリーニングでは、一次スクリーニングで同定したVHおよびVLペアーに結合する全てのRSV/抗原が、ウイルス株および選択された抗原の両方に対して再度選択される。一般的に、免疫学的アッセイは、本発明で実施されるスクリーニングに適する。かかるアッセイは当該技術分野においてよく知られ、例えば、ELISPOTS、ELISA、FLISA、膜アッセイ(例、ウェスタンブロット)、フィルターを用いる解析、およびFACSを構成する。前記アッセイは、前の濃縮工程がなくてもVHおよびVLペアーをコードする配列から産生されるポリペプチドを利用して行うことができる。VHおよびVLをコードするペアーのレパートリーが同種ペアーである事象では、例えば、ファージディスプレイによる濃縮は、スクリーニングの前には必要とされない。しかしながら、組み合わせライブラリーのスクリーニングでは、免疫アッセイは、好ましくは、ファージディスプレイ、リボソームディスプレイ、細菌表面ディスプレイ、酵母ディスプレイ、真核生物ウイルスディスプレイ、RNAディスプレイまたはコバレント(covalent)ディスプレイのごとき濃縮方法と組み合わせてまたは濃縮方法の後に行われる(Fitz Gerald, K.,2000. Drug Discov.Today 5, 253-258にて総説される)。
スクリーニングで選択された配列をコードするVHおよびVLペアーは、一般的に、配列決定(sequencing)にかけられ、可変領域の多様性に関して解析される。特に、CDR領域における多様性が興味深いが、VHおよびVLファミリーの発現もまた興味深い。これらの解析に基づいて、1つまたはそれ以上のドナーから単離されたRSV結合抗体の全体の多様性を表すVHおよびVLペアーをコードする配列が選択される。好ましくは、全てのCDR領域(CDRH1、CDRH2、CDRH3ならびにCDRL1、CDRL2およびCDRL3)に相違を持つ配列が選択される。異なるVHおよびVLファミリーに属する1つまたはそれ以上の同一または非常に類似したCDR領域を持つ配列が存在する場合、これらも選択される。好ましくは、少なくとも可変重鎖のCDR3領域(CDRH3)は、選択された配列のペアー間で異なる。潜在的に、VHおよびVL配列ペアーの選択は、単にCDRH3領域の可変性に基づくことができる。プライミングおよび配列の増幅中に、可変領域のフレームワーク領域、特に最初のフレームワーク領域において変異が生じうる。好ましくは、最初のフレームワーク領域で起きるエラーは、例えば、配列が完全なヒトであるようなドナーの配列に完全にまたは少なくとも98%対応することを確実にするために修復される。
VHおよびVLペアーをコードする選択された配列のコレクションの全体の多様性が、RSV感染に対する液性反応における遺伝子レベルで見られる多様性をよく表すことが確実である場合、選択されたVHおよびVLをコードするペアーのコレクションから発現される抗体の全体の特異性もまた、RSV感染ドナーで産生される抗体の特異性を表すことが期待される。選択されたVHおよびVLをコードするペアーのコレクションから発現される抗体の特異性が、感染したドナーで上昇された抗体の特異性を表すかどうかの指標は、ウイルス株ならびにドナー血液のうちの選択された抗原に対する抗体力価を、選択されたVHおよびVLをコードするペアーのコレクションから発現される抗体の特異性と比較することにより得ることができる。加えて、選択されたVHおよびVLをコードするペアーのコレクションから発現される抗体の特異性がさらに解析されうる。特異性の程度は、検出することができる結合反応性に対する異なる抗原の数に相関する。本発明のさらなる具体例では、選択されたVHおよびVLをコードするペアーのコレクションから発現される個々の抗体の特異性は、エピトープマッピングにより解析される。
エピトープマッピングは、多くの方法により行われてもよく、それらは必ずしも相互に排斥しない。抗体クローンのエピトープ特異性をマップする1つの方法は、標的抗原の一次構造に由来する各種大きさのペプチドへの結合性を評価することである。かかるペプチドは、直鎖状および立体構造の両方であってもよく、ELISA、FLISAおよび表面プラズモン共鳴法(SPR、Biacore)を含む多くのアッセイ形式で用いられてもよい。
さらに、ペプチドは、例えば、標的抗原の細胞外領域または保存領域を表す利用可能な配列および構造データを用いて合理的に選択されてもよく、あるいは、ペプチドは、抗原の選択された部分または全てを表す重複するペプチドのパネルとして設計されてもよい(Meloen RH, Puijk WC, Schaaper WMM. Epitope mapping by PEPSCAN. In: Immunology Methods Manual. Ed Iwan Lefkovits 1997, Academic Press, pp 982-988)。
1つまたはそれ以上のかかるペプチドを有する抗体クローンの特異的な反応性は、一般的にエピトープ特異性の指標である。しかしながら、ペプチドは、多くの場合、立体構造の欠如のため、および抗体とタンパク質で比較されるような抗体とタンパク質抗原間の相互作用の一般的に大きな埋もれた表面積のため、タンパク質性抗原に対して高まった抗体により認識されるエピトープの模倣性に乏しい。エピトープマッピングの第2の方法は、タンパク質抗原において直接的に特異性を定めることが可能であり、従来のよく定められた抗体を用いてマスクする選択的エピトープによるものである。ブロッキング後に抗原に対して2番目に結合する抗体の結合性の減少は、共有または重複エピトープの一般的な指標である。選択的なマスクによるエピトープマッピングは、多くの免疫アッセイにより行われてもよく、当該技術分野でよく知られるELISAおよびBiacoreを含むが、これらだけに限定されない(例、Ditzel et al. 1997 J.Mol.Biol. 267:684-695; Aldaz-Carroll et al.2005.J.Virol. 79: 6260-6271)。抗−ウイルス抗体のエピトープ特異性を調べるためのさらに別の可能な方法は、抗体の存在下におけるウイルスエスケープ変異体の選択である。かかるエスケープ変異体からの目的遺伝子の配列決定は、一般に、抗体による認識に重要であって、エピトープ(の一部)を構成する抗原におけるアミノ酸を明らかにする。
好ましくは、本発明の抗−RSV rpAbに含まれる個々のメンバーは、抗体組成物の特異性が共同で、RSVサブタイプAとBの両方、およびRSV関連抗原タンパク質FとG、ならびに好ましくはGを網羅するように選択される。
選択されたVHおよびVLをコードするペアーに由来する組み換えポリクローナル抗体の産生
本発明のポリクローナル抗体は、1また数個のバイオリアクターまたはそれらの等価物中でポリクローナル発現細胞株から産生される。この方法の後に、抗−RSV rpAbは、そのプロセスの間に抗−RSV rpAbを構成する個々のメンバーを分離することなく、単一の調製物としてリアクターから精製することができる。ポリクローナル抗体が1つ以上のバイオリアクターで産生される場合、各バイオリアクターからの上澄み液は、精製前にプールされうるか、あるいは精製された抗−RSV rpAbは、各バイオリアクターから各々精製された上澄み液から得られた抗体をプールすることにより得られうる。
本発明のポリクローナル抗体は、1また数個のバイオリアクターまたはそれらの等価物中でポリクローナル発現細胞株から産生される。この方法の後に、抗−RSV rpAbは、そのプロセスの間に抗−RSV rpAbを構成する個々のメンバーを分離することなく、単一の調製物としてリアクターから精製することができる。ポリクローナル抗体が1つ以上のバイオリアクターで産生される場合、各バイオリアクターからの上澄み液は、精製前にプールされうるか、あるいは精製された抗−RSV rpAbは、各バイオリアクターから各々精製された上澄み液から得られた抗体をプールすることにより得られうる。
組み換えポリクローナル抗体を産生する1つの方法は、WO 2004/061104およびWO 2006/007850 (PCT/DK2005/000501)に記載される(これらの文献は出典明示により本明細書に援用する)。本明細書に記載される方法は、抗体をコードする配列の各宿主細胞のゲノムへの部位特異的な組み込みを基にし、VHおよびVLタンパク質鎖が、生成期間に元々のペアーで維持されることを確実にする。さらに、部位特異的な組み込みは、位置効果を最小限にし、それゆえ、ポリクローナル細胞株における個々の細胞の増殖と発現の特性がきわめて類似することが期待される。一般に、前記方法は以下に関する:i)1つまたはそれ以上のリコンビナーゼ認識部位を有する宿主細胞;ii)宿主細胞に適合する少なくとも1つのリコンビナーゼ認識部位を有する発現ベクター;iii)全長抗体または抗体フラグメントがベクターから発現されうるように、選択されたVHおよびVLをコードするペアーをスクリーニングベクターから発現ベクターに移すことによる発現ベクターコレクションの作成(かかる移行は、必ずしもスクリーニングベクターが発現ベクターと同一である必要はない);iv)発現ベクターおよび宿主細胞のゲノム中のリコンビナーゼ認識部位をベクター中の認識部位と結合させることが可能なリコンビナーゼをコードするベクターのコレクションによる宿主細胞のトランスフェクション;v)トランスフェクトされた宿主細胞かららポリクローナル細胞株を得ること/作成すること、次いでvi)前記ポリクローナル細胞株からポリクローナル抗体を発現させ、収集すること。
好ましくは、CHO細胞、COS細胞、BHK細胞、骨髄腫細胞(例、Sp2/0またはNS0細胞)のごとき哺乳動物細胞、NIH3T3のごとき線維芽細胞、ならびにHeLa細胞、HEK293細胞、またはPER.C6のごとき不死化ヒト細胞が用いられる。しかしながら、植物細胞、昆虫細胞、酵母細胞、真菌、E.coliなどのごとく非哺乳動物の真核または原核細胞もまた用いられうる。適する宿主細胞は、そのゲノム中に1つまたはそれ以上の適するリコンビナーゼ認識部位を含む。宿主細胞はまた、組み込み体を選択することができるために、組み込み部位に作動可能に連結される選択様式を含むべきである(すなわち、組み込み部位中に抗−RSV Ab発現ベクターまたは発現ベクターフラグメントの組み込まれたコピーを有している細胞)。ゲノム中の予定された位置にFRT部位を有する細胞の調製物は、例えば、US 5,677,177に記載された。好ましくは、宿主細胞は単一の組み込み部位のみを有し、その部位は組み込み体の高発現を可能にする部位(いわゆるホットスポット)に位置される。
適する発現ベクターは、宿主細胞のリコンビナーゼ認識部位に適合する組み換え認識部位を含む。好ましくは、リコンビナーゼ認識部位は、宿主細胞の構築に用いられる選択遺伝子とは異なる適切な選択遺伝子に連結される。選択遺伝子は、当該技術分野においてよく知られ、グルタミン合成酵素遺伝子(GS)、ジヒドロ葉酸還元酵素遺伝子(DHFR)、およびネオマイシンを含み、GSまたはDHFRは、挿入されたVHおよびVL配列の遺伝子増幅に用いられてもよい。ベクターはまた、ベクターの完全な組み込みの代わりに、抗体をコードする配列のリコンビナーゼ介在カセット交換(Recombinase−mediated cassete exchange;RMCE)を可能にする2つの異なるリコンビナーゼ認識部位を含んでもよい。RMCEは、Langer et al 2002. Nucleic Acids Res. 30, 3067-3077; Schlake and Bode 1994. Biochemistry 33, 12746-12751およびBelteki et al 2003. Nat.biotech. 21, 321-324に記載される。適するリコンビナーゼ認識部位は当該技術分野でよく知られ、FRT、loxおよびattP/attB部位を含む。好ましくは、組み込みベクターは、アイソタイプをコードするベクターであり、定常領域(好ましくはイントロンを含む)は、スクリーニングベクターからのVHおよびVLをコードするペアーの移行前のベクターに存在する(あるいは、スクリーニングが全長抗体において行われる場合、定常領域はスクリーニングベクター中にすでに存在する)。ベクターに存在する定常領域は、全体の重鎖定常領域(CH1からCH3またはCH4まで)であるか、抗体のFc部分をコードする定常領域(CH2からCH3またはCH4まで)のどちらかであり得る。軽鎖カッパまたはラムダ定常領域はまた、移行前に存在してもよい。定常領域数の選択は、存在するとしても用いられるスクリーニングおよび移行システムに依存する。重鎖の定常領域は、アイソタイプIgG1、IgG2、IgG3、IgG4、IgA1、IgA2、IgM、IgDおよびIgEから選択することができる。好ましいアイソタイプは、IgG1および/またはIgG3である。さらに、抗−RSV抗体をコードする核酸の部位特異的な組み込みのための発現ベクターは、VHおよびVL鎖の各々の高レベル発現を指示する適切なプロモーターまたはその等価な配列を含む。図3は、発現ベクターを設計するための1つの可能な方法を示すが、他の多くの設計も可能である。
スクリーニングベクターからの選択されたVHおよびVLをコードするペアーの移行は、各発現ベクター分子が1つのVHおよびVLをコードするペアーを含むように、慣用的な制限酵素切断およびライゲーションにより行うことができる。好ましくは、VHおよびVLをコードするペアーは各々移行されるが、任意選択的に、まとめて移行されてもよい。全ての選択されたVHおよびVLをコードするペアーが発現ベクターに移行されると、発現ベクターのコレクションまたはライブラリーが得られる。移行の代替的な方法は、任意選択で用いられてもよい。スクリーニングベクターが発現ベクターと同一である場合、発現ベクターのライブラリーは、スクリーニング中に選択されたVHおよびVL配列ペアーからなり、それらはスクリーニング/発現ベクター中に配置される。
核酸配列を宿主細胞にトランスフェクトする方法は当該技術分野において周知である。部位特異的な組み込みを確実にするために、適切なリコンビナーゼが宿主細胞にも提供されるべきである。これは、好ましくはリコンビナーゼをコードするプラスミドの共トランスフェクションにより達成される。適切なリコンビナーゼは、例えば、Flp、CreまたはファージΦC31インテグラーゼであり、対応するリコンビナーゼ認識部位を有する宿主細胞/ベクターシステムと一緒に用いられる。宿主細胞は、まとめてトランスフェクトされ得、それは、発現ベクターのライブラリーが1回の単一反応で細胞株にトランスフェクトされ、それによりポリクローナル細胞株を得ることを意味する。代替的に、発現ベクターのコレクションは、宿主細胞に個別にトランスフェクトされ、それにより個々の細胞株のコレクションを作成することができる(各細胞株は特定の特異性を有する抗体を産生する)。次いで、トランスフェクションにより作成された細胞株(各々またはポリクローナル)は、トランスフェクション前にまだこれらの特性を示さなかった場合、部位特異的な組み込み体について選択され、懸濁液および血清を含まない培地で増殖させるのに用いられる。トランスフェクションが個別に実施された場合、個々の細胞株は、それらの増殖特性および抗体産生に関してさらに解析される。好ましくは、同様の増殖速度および抗体発現レベルを有する細胞株は、ポリクローナル細胞株の作成について選択される。次に、ポリクローナル細胞株は、個々の細胞株を所定の割合で混合することにより作成される。一般に、ポリクローナルマスター細胞バンク(pMCB)、ポリクローナルリサーチ細胞バンク(pRCB)および/またはポリクローナルワーキング細胞バンク(pWCB)がポリクローナル細胞株から構築される。ポリクローナル細胞株は、個々の細胞株を所定の割合で混合することにより作成される。ポリクローナル細胞株は、アンプルに分配され、それによりポリクローナルリサーチ細胞バンク(pRCB)またはマスター細胞バンク(pMCB)を作成し、ポリクローナルワーキング細胞バンク(pWCB)は、リサーチまたはマスター細胞バンクから細胞を増殖させることにより作成することができる。リサーチ細胞バンクは、主として概念研究の証拠のためのものであり、ポリクローナル細胞株は、マスター細胞バンクにおけるポリクローナル細胞株ほど多くの個々の抗体を含み得ない。通常、pMCBは、産生のためにpWCBを構築するためにさらに増殖させられる。pWCBが使い果たされると、pMCBからのアンプルが増殖させられて新しいpWCBを構築することができる。
本発明の一の具体例は、本発明の組み換えポリクローナル抗−RSV抗体を発現することができるポリクローナル細胞株である。
本発明のさらなる具体例は、各々個別の細胞が単一のVHおよびVLをコードするペアーを発現することができるポリクローナル細胞株であって、前記ポリクローナル細胞株が、全体としてVHおよびVLをコードするペアーのコレクションを発現することができ、各VHおよびVLのペアーが抗−RSV抗体をコードする。好ましくは、VHおよびVLをコードするペアーのコレクションは、本発明の方法により作成される同種ペアーである。
本発明の組み換えポリクローナル抗体は、抗体の十分な発現が可能な期間、適切な培地中でpWCBからの1つのアンプルを培養することにより発現され、このポリクローナル細胞株は安定した状態を保つ(期間(window)はおよそ15日と50日の間である)。流加または灌流のごとき培養方法が用いられてもよい。組み換えポリクローナル抗体は、培地から得られ、慣用的な精製技術により精製される。イオン交換クロマトグラフィー、疎水性相互作用およびゲルろ過のごとく後の精製工程と一緒にしたアフィニティークロマトグラフィーがIgGの精製によく用いられる。精製後、ポリクローナル抗体組成物中の全ての個々のメンバーの存在が、例えば、イオン交換クロマトグラフィーにより試験される。ポリクローナル抗体組成物の特徴付けは、WO 2006/007853(PCT/DK2005/000504)(出典明示により本明細書に援用する)に詳細に記載される。
組み換え宿主において抗体の混合物を発現させる代替的な方法は、WO 04/009618に記載される。この方法は、単一の細胞株に由来する同一の軽鎖に結合した異なる重鎖を有する抗体を生成する。この方法は、抗−RSV rpAbが組み合わせライブリーから産生される場合に適用してもよい。
治療用組成物
本発明の別の態様は、活性成分として抗−RSV rpAbもしくは抗−RSV組み換えポリクローナルFabまたは別の抗−RSV組み換えポリクローナル抗体フラグメントを含む医薬組成物である。好ましくは、かかる組成物の活性成分は、本発明に記載されるような抗−RSV組み換えポリクローナル抗体である。かかる組成物は、RSV感染の予防および/または治療を目的とされる。好ましくは、医薬組成物は、ヒト、家畜、またはペットに投与される。
本発明の別の態様は、活性成分として抗−RSV rpAbもしくは抗−RSV組み換えポリクローナルFabまたは別の抗−RSV組み換えポリクローナル抗体フラグメントを含む医薬組成物である。好ましくは、かかる組成物の活性成分は、本発明に記載されるような抗−RSV組み換えポリクローナル抗体である。かかる組成物は、RSV感染の予防および/または治療を目的とされる。好ましくは、医薬組成物は、ヒト、家畜、またはペットに投与される。
医薬組成物は、医薬上許容される賦形剤をさらに含む。
抗−RSV rpAbまたはそのポリクローナルフラグメントは、単一用量形態において、医薬上許容される希釈剤、担体、または賦形剤内で投与されてもよい。慣用的な医薬上の実施が用いられることにより、RSVに感染した患者、またはRSVに感染するリスクの高いであろう患者に投与するのに適切な製剤または組成物が提供されてもよい。好ましい具体例では、投与は予防である。別の好ましい具体例では、投与は治療であり、RSV感染に関連する症状の発症後に投与されることを意味する。適切な投与経路が用いられてもよく、例えば、投与は、非経口、静脈内、動脈内、皮下、筋肉内、腹腔内、鼻腔内、エアロゾル、座剤、または経口投与であってもよい。例えば、医薬製剤は、液状溶液または懸濁液の形態であってもよく、経口投与用には、製剤は、錠剤、カプセル、チューインガムまたはペースト状の形態であってもよく、鼻腔内用には、粉末、点鼻剤、またはエアロゾルの形態であってもよい。
本発明の医薬組成物は、例えば、従来の溶解、凍結乾燥、混合、顆粒化または調合プロセスを用いて、それ自体周知な手法で調製される。医薬組成物は、慣用的な製薬の実施に従って製剤化されてもよい(例えば、Remington: The Science and Practice of Pharmacy (20th ed.), ed. A.R.Gennaro, 2000, Lippincott Williams & Wilkins, Philadelphia, PAおよびEncyclopedia of Pharmaceutical Technology, eds.J.Swarbrick and J.C.Boylan, 1988-1999, Marcel Dekker, New York, NYを参照。)。
好ましくは、活性成分の溶液もしくは懸濁液、特に等張水溶液もしくは懸濁液は、本発明の医薬組成物を調製するのに用いられる。活性成分のみまたは担体、例えば、マンニトールと一緒になった活性成分を含む凍結乾燥された組成物の場合、かかる溶液もしくは懸濁液は、可能であるならば、使用前に産生されてもよい。医薬組成物は、滅菌されていてもよく、ならびに/あるいは賦形剤、例えば、保存剤、安定化剤、湿潤剤および/または乳化剤、可溶化剤、浸透圧を調節する塩および/または緩衝液を含んでいてもよく、例えば、慣用的な溶解または凍結乾燥プロセスを用いて、それ自身よく知られる手法で調製される。前記溶液もしくは懸濁液は、カルボキシメチルセルロースナトリウム、カルボキシメチルセルロース、デキストラン、ポリビニルピロリドンまたはゼラチンのごとき粘度増加物質を含んでもよい。
注入組成物は、滅菌状態下で慣用的な手法において調製される;同じく、組成物をアンプルまたはバイアルに導入し、容器を密閉することに適用する。
経口投与のための医薬組成物は、活性成分を液体担体と一緒にすることにより、望ましくは生じた混合物を顆粒化し、次いで、所望または必要であるならば、適切な賦形剤を錠剤、ピル、またはカプセルへ添加した後、混合物を処理することにより得ることができ、セラック、糖またはその両方でコートされていてもよい。それらはまた、活性成分を一定量で拡散し、または解離されうるプラスティック担体に取り込まれることも可能である。
医薬組成物は、約1%から約95%まで、好ましくは約20%から約90%までの活性成分を含む。本発明による医薬組成物は、例えば、アンプル、バイアル、座薬、錠剤、ピル、またはカプセルの形態のごとき単一用量の形態であってもよい。製剤は、治療上または予防上有効量(例、病態を予防、排除、または軽減する量)でヒトの個体に投与されることにより、病気または状態に対する治療が提供されうる。投与される治療剤の好ましい用量は、RSV感染の重症度、各患者の総体的な健康状態、化合物賦形剤の剤形、およびその投与経路のごとき変動するものに依存すると考えられる。
本発明による組成物の治療上の使用
本発明による医薬組成物は、哺乳動物における病気の治療、改善または予防に用いられてもよい。本願の医薬組成物で治療または予防することができる状態は、RSVに感染した患者の治療、またはRSVに感染するリスクのある患者、特にRSVに感染する高いリスクを有する患者の予防、および治療を含む。高いリスクの患者は、例えば、幼児および小さい子供である。特に、慢性肺疾患または先天性心疾患のごとき問題を抱える未熟な幼児および子供は、RSV感染後に細気管支炎および肺炎のごとき深刻な病気に対して最も高いリスクを有する。また、免疫不全の成人、特に骨髄移植被提供者、高齢者および慢性肺疾患にかかっている患者のごとき高いリスクの成人は、好ましくは、本発明による医薬組成物による予防または治療上の処置を受けることができる。
本発明による医薬組成物は、哺乳動物における病気の治療、改善または予防に用いられてもよい。本願の医薬組成物で治療または予防することができる状態は、RSVに感染した患者の治療、またはRSVに感染するリスクのある患者、特にRSVに感染する高いリスクを有する患者の予防、および治療を含む。高いリスクの患者は、例えば、幼児および小さい子供である。特に、慢性肺疾患または先天性心疾患のごとき問題を抱える未熟な幼児および子供は、RSV感染後に細気管支炎および肺炎のごとき深刻な病気に対して最も高いリスクを有する。また、免疫不全の成人、特に骨髄移植被提供者、高齢者および慢性肺疾患にかかっている患者のごとき高いリスクの成人は、好ましくは、本発明による医薬組成物による予防または治療上の処置を受けることができる。
本発明の一の具体例は、哺乳動物におけるRSV感染に関連した1つまたはそれ以上の症状を予防、治療または改善する方法であって、前記哺乳動物に本発明の抗−RSV組み換えポリクローナル抗体の有効量を投与することを含む。
本発明のさらなる具体例は、哺乳動物におけるRSV感染に関連した1つまたはそれ以上の症状の治療、改善または予防のための組成物の調製のための本発明の抗−RSV組み換えポリクローナル抗体の使用である。
好ましくは、上記具体例における哺乳動物は、ヒト、家畜またはペットである。
さらなる具体例では、RSV感染に関連した1つまたはそれ以上の症状を予防、治療または改善する方法を受けさせる哺乳動物は、好ましくは40kgを超える体重を有する。
対象がヒトである具体例では、好ましくは、未成熟な幼児、慢性肺疾患または先天性心疾患にかかっている子供である。代替的な具体例では、ヒトは、免疫不全の成人、特に骨髄移植被提供者、高齢者または慢性肺疾患にかかっている個体である。
診断上の使用
本発明の別の具体例は、診断用キットを目的とする。本発明によるキットは、本発明に従って調製される抗−RSV rpAbを含み、このタンパク質は、検出可能な標識で標識されていてもよく、または非標識検出用に標識されていなくてもよい。キットは、RSVで感染された個体を同定するのに用いられてもよい。
本発明の別の具体例は、診断用キットを目的とする。本発明によるキットは、本発明に従って調製される抗−RSV rpAbを含み、このタンパク質は、検出可能な標識で標識されていてもよく、または非標識検出用に標識されていなくてもよい。キットは、RSVで感染された個体を同定するのに用いられてもよい。
本発明の抗体分子およびそれに関連した態様
本明細書で開示される新規な抗体分子がそれら自体の権利において技術常識に貢献すると信じられることは特筆されるべきである。したがって、本発明はまた、本明細書で開示される抗体分子のいずれか1つならびにこれらの抗体のフラグメントおよびアナログに関連し、前記フラグメントまたはアナログは、少なくとも本明細書で開示される抗体のCDRを含む。
本明細書で開示される新規な抗体分子がそれら自体の権利において技術常識に貢献すると信じられることは特筆されるべきである。したがって、本発明はまた、本明細書で開示される抗体分子のいずれか1つならびにこれらの抗体のフラグメントおよびアナログに関連し、前記フラグメントまたはアナログは、少なくとも本明細書で開示される抗体のCDRを含む。
例えば、ヒトのドナーから単離された完全なヒト抗体分子のいずれかは、抗原結合部位としては、公知の従来技術のモノクローナル抗体を超えた極めて高い改善された動力学的特性を示す結合部位を含むことが本発明者らにより見出された。それゆえ、本願の開示におけるポリクローナル抗体組成物に多くの着目がなされたとしても、本明細書で説明されるポリクローナル抗体の利用に関する全ての対象物はまた、本明細書で開示される単一の抗体分子のうちのいずれか1つに関連する。−すなわち、本発明のポリクローナル抗体組成物に関連する製剤化、用量、投与などに関する全ての開示は、本明細書で開示される個々の抗体分子、抗体フラグメントおよび抗体アナログ、好ましくはフレームワーク配列に準用する。
したがって、本発明はまた、本明細書中の表5に記載される抗体分子から選択される単離ヒトRSV−抗体分子、あるいは前記単離抗体分子に特異的に結合するフラグメントまたは合成もしくは半合成抗体アナログであって、前記結合するフラグメントまたはアナログは、少なくとも前記単離抗体分子の相補性決定領域(CDR)を含むものに関連する。多くの場合、元々のヒト抗体の可変領域に由来するフレームワーク領域は、抗体の抗原特異性がCDRおよびフレームワーク領域の3D構成によることが知られることから、フラグメントまたはアナログにも含まれる。
用語「単離された抗体分子」は、天然の夾雑物から単離され、同一のアミノ酸配列(すなわち、同一の可変領域および定常領域)を示す別個の抗体コレクションを表すことが意図される。
典型的に、抗体分子、フラグメントまたはアナログは、表8に記載される抗体に由来するか、あるいは、配列番号:1−44のうちの1つに含まれる重鎖CDRアミノ酸配列および配列番号:1−44から選択されるアミノ酸配列より88高い配列番号:を有する付随の軽鎖CDRアミノ酸配列を含む。このことは、抗体分子、フラグメントまたはアナログが上に記載される44個のクローン以外の同一物から見出される可変領域の同種のペアーを含むことを意味する。
上に記載されるように、多くの本抗体分子は、非常に高い親和性を示し、本発明はまた、ヒト抗体に由来するFab中のCDRに同一のCDRを含む、単離された抗体分子、抗体フラグメントまたは合成もしくは半合成抗体アナログに関連し、前記Fabは、物質輸送時の制限を避けるために極めて低い密度でセンサー表面上に固定された組み換えRSV Gタンパク質を用いて、Biacore3000において表面プラズモン共鳴分析を実施して測定した場合、500nMまたはそれ以下のRSV Gタンパク質の解離定数KDを示す。単離された抗体分子、抗体フラグメントまたは合成もしくは半合成抗体は、典型的に、400nMまたはそれ以下、例えば、300nMまたはそれ以下、200nMまたはそれ以下、100nMまたはそれ以下、1nMまたはそれ以下、900pMまたはそれ以下、800pMまたはそれ以下、700pMまたはそれ以下、600pMまたはそれ以下、500pMまたはそれ以下、400pMまたはそれ以下、300pMまたはそれ以下、200pMまたはそれ以下、100pMまたはそれ以下、90pMまたはそれ以下、および80pMまたはそれ以下のごときより低いKDを示す。
本発明の別の具体例は、ヒト抗体に由来するFab中の抗原結合部位に同一の抗原結合部位を含む、単離された抗体分子、抗体フラグメントまたは合成もしくは半合成抗体アナログに関連し、前記Fabは、物質輸送時の制限を避けるために極めて低い密度でセンサー表面上に固定された組み換えRSV Gタンパク質を用いて、Biocore3000において表面プラズモン共鳴分析を実施して測定した場合、500nMまたはそれ以下のRSV Fタンパク質の解離定数KDを示す。この単離された抗体、抗体フラグメントまたは合成もしくは半合成抗体は、典型的に、400nMまたはそれ以下、例えば、300nMまたはそれ以下、200nMまたはそれ以下、100nMまたはそれ以下、1nMまたはそれ以下、900pMまたはそれ以下、800pMまたはそれ以下、700pMまたはそれ以下、600pMまたはそれ以下、500pMまたはそれ以下、400pMまたはそれ以下、300pMまたはそれ以下、200pMまたはそれ以下、100pMまたはそれ以下、90pMまたはそれ以下、80pMまたはそれ以下、70pMまたはそれ以下、60pMまたはそれ以下、50pMまたはそれ以下、40pMまたはそれ以下、30pMまたはそれ以下、25pMまたはそれ以下、20pMまたはそれ以下、15pMまたはそれ以下、10pMまたはそれ以下、9pMまたはそれ以下、8pMまたはそれ以下、7pMまたはそれ以下、6pMまたはそれ以下、および5pMまたはそれ以下のごときKDを示す。
特に有用な抗体分子または特異的に結合するフラグメントまたは合成もしくは半合成の抗体アナログは、クローン番号810、818、819、824、825、827、858または894で産生されるヒト抗体のCDRを含む。
上に記載されるように、本発明のこれらの有用な抗体分子は、本発明のポリクローナル製剤と同一の方法および同一の適用で製剤化されてもよい。したがって、本発明は、医薬上許容される担体、賦形剤、ビヒクルまたは希釈剤と混合した、このセクションで記載される抗体分子、特異的に結合するフラグメントまたは合成もしくは半合成の抗体アナログを含む抗体組成物に関する。組成物は、1つ以上の結合特異性を含んでもよく、例えば、2つの本発明の別個の抗体分子ならびに/あるいは本発明の特異的に結合するフラグメントおよび/または合成もしくは半合成の抗体アナログを含んでもよい。組成物は、少なくとも3つの別個の抗体分子および/または抗体フラグメントおよび/または合成もしくは半合成抗体アナログ、特に本発明の結合フラグメントまたは合成もしくは半合成の抗体アナログを含んでもよく、それゆえに4、5、6、7、9、10、11、12、13、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29または30個の別個の抗体分子および/またはフラグメントおよび/または合成もしくは半合成抗体アナログを含む組成物を構成してもよい。
特に目的とする組成物は、少なくとも1つのRSV Fタンパク質に結合する本発明の抗体分子、フラグメントまたはアナログ、ならびに少なくとも1つのRSV Gタンパク質に結合する本発明の抗体分子、フラグメントまたはアナログを含む。
本発明の一部はまた、核酸フラグメントのごとく、本発明の抗体分子のうちの少なくとも1つの定義されたCDRのアミノ酸をコードする単離された核酸フラグメントであって、それは、少なくとも表5に記載されるクローンのうちの1つにより産生される抗体のCDRをコードする。核酸フラグメントは、典型的にはDNAであるが、RNAでもありうる。
別の具体例は、配列番号:1−44のうちのいずれか1つに記載される重鎖アミノ酸配列のCDR配列をコードする、単離された核酸フラグメントであるか、あるいは、配列番号:89−132のうちのいずれか1つに記載される軽鎖アミノ酸配列のCDR配列をコードする、単離された核酸フラグメントである。本発明の好ましい核酸フラグメントは、配列番号:1−44のうちのいずれか1つに記載される重鎖アミノ酸配列のCDR配列をコードし、配列番号:1−44から選択されるアミノ酸配列より88高い配列番号:を有する付随する軽鎖CDRアミノ酸配列に記載される。このことは当然、核酸フラグメントが上で記載される44個のクローン由来の同一物中に見出される可変領域の同種のペアーをコードすることを意味する。それゆえ、核酸フラグメントは、配列番号:45−88および/または133−176に含まれるコーディング配列を含んでもよい。
利便的に、核酸フラグメントがベクターに導入されても、本発明の一部となる。かかるベクターは、自律的に複製することができてもよく、典型的には、プラスミド、ファージ、コスミド、ミニ染色体、およびウイルスからなる群から選択される。
本発明のベクターが発現ベクターである場合では、それは、好ましくは以下に概略を示す(参考.図3の典型的なベクター):
−5’→3’方向および作動可能な連結において、上記に示される第1の核酸フラグメントの発現を促進するための少なくとも1つのプロモーターであって、それは、いずれかの必須なフレームワーク領域、任意選択でリーダーペプチドをコードする核酸配列、前記第1の核酸フラグメント、任意選択で抗体の定常領域をコードする核酸配列、ならびに任意選択で第1の転写終結領域をコードする核酸配列と一緒に少なくとも1つの軽鎖CDRをコードし、ならびに/あるいは
−5’→3’方向および作動可能な連結において、本発明の第2の核酸フラグメントの発現を促進するための少なくとも1つのプロモーターであって、それは、いずれかの必須なフレームワーク領域、任意選択でリーダーペプチドをコードする核酸配列、前記第2の核酸フラグメント、任意選択で抗体の定常領域をコードする核酸配列、ならびに任意選択で第2の転写終結領域をコードする核酸配列と一緒に少なくとも1つの重鎖CDRをコードする。
−5’→3’方向および作動可能な連結において、上記に示される第1の核酸フラグメントの発現を促進するための少なくとも1つのプロモーターであって、それは、いずれかの必須なフレームワーク領域、任意選択でリーダーペプチドをコードする核酸配列、前記第1の核酸フラグメント、任意選択で抗体の定常領域をコードする核酸配列、ならびに任意選択で第1の転写終結領域をコードする核酸配列と一緒に少なくとも1つの軽鎖CDRをコードし、ならびに/あるいは
−5’→3’方向および作動可能な連結において、本発明の第2の核酸フラグメントの発現を促進するための少なくとも1つのプロモーターであって、それは、いずれかの必須なフレームワーク領域、任意選択でリーダーペプチドをコードする核酸配列、前記第2の核酸フラグメント、任意選択で抗体の定常領域をコードする核酸配列、ならびに任意選択で第2の転写終結領域をコードする核酸配列と一緒に少なくとも1つの重鎖CDRをコードする。
かかるベクターは、安定に宿主細胞を形質転換することに用いることができ、次いで組み換え発現産物を得るために培養されうる場合に特に有用である。したがって、好ましいベクターは、宿主細胞に導入される時に、宿主細胞ゲノムに組み込まれるものである。
したがって、本発明はまた、このセクションに記載される発明のベクターを保有する形質転換された細胞、ならびにこのベクターを保有し、このセクションに記載される本発明の核酸フラグメントを発現する安定な細胞株に関連する。形質転換された細胞および細胞株の両方は、必要に応じて、その表面上の組み換え発現産物(すなわち、本発明の抗体分子、抗体フラグメントまたはアナログ)を分泌するか、または保有する。
この実施例は、本発明を例示するために適用された方法を集めたものである。
a.ドナー血液由来のラムダ−陰性の形質芽細胞の分別
末梢血単核細胞(PBMC)を、製造業者の説明書に従ってLymphoprep(Axis Shield)および勾配遠心分離を用いて、ドナーから採集した血液から単離した。単離したPBMCを、−150℃でFCS;10%DMSO中で凍結保存するか、または直接使用した。B細胞画分を抗−CD19抗体で標識し、磁気細胞分離(MACS)を用いてPBMC画分から単離した。PBMC(1×106細胞)を抗−CD19−FITC抱合抗体(BD Pharmingen)と4℃で20分間インキュベートした。細胞をMACS緩衝液(Miltenyi Biotec)で2回洗浄し、再懸濁させた。抗−FITC MicroBeads(Miltenyi Biotec)を、標識した細胞と混合し、4℃で15分間インキュベートした。細胞−ビーズ懸濁液をLS MACSカラム(Miltenyi Biotec)にアプライする前に洗浄の手順を繰り返した。CD19陽性細胞画分を、製造業者の説明書に従ってカラムから溶離し、FCS−10% DMSO中で保存するか、または直接単一細胞を分別した。
末梢血単核細胞(PBMC)を、製造業者の説明書に従ってLymphoprep(Axis Shield)および勾配遠心分離を用いて、ドナーから採集した血液から単離した。単離したPBMCを、−150℃でFCS;10%DMSO中で凍結保存するか、または直接使用した。B細胞画分を抗−CD19抗体で標識し、磁気細胞分離(MACS)を用いてPBMC画分から単離した。PBMC(1×106細胞)を抗−CD19−FITC抱合抗体(BD Pharmingen)と4℃で20分間インキュベートした。細胞をMACS緩衝液(Miltenyi Biotec)で2回洗浄し、再懸濁させた。抗−FITC MicroBeads(Miltenyi Biotec)を、標識した細胞と混合し、4℃で15分間インキュベートした。細胞−ビーズ懸濁液をLS MACSカラム(Miltenyi Biotec)にアプライする前に洗浄の手順を繰り返した。CD19陽性細胞画分を、製造業者の説明書に従ってカラムから溶離し、FCS−10% DMSO中で保存するか、または直接単一細胞を分別した。
形質芽細胞を、CD19、CD38、およびCD45細胞表面タンパク質の発現プロファイルに基づいた蛍光表示式細胞分取器(FACS)により、CD19+B細胞画分から選択した。CD19は、血漿細胞前駆体上でも発現されるB−細胞マーカーである一方、CD38は、形質芽細胞および血漿細胞上で強く発現される。形質芽細胞は、明らかに残りのCD19+細胞よりいくらか低いCD19およびCD45の発現を示し、このことは別々の集団への分離を可能にする。細胞をFACS緩衝液(PBS;1%BSA)で洗浄し、抗−CD19−FITC、抗−CD38−APC、抗−ラムダ−PE(BD Pharmingen)で20分間染色した。PCRの鋳型として供給できない細胞を排除させるためにラムダ軽鎖染色を含めた(セクションcを参照)。染色された細胞をFACS緩衝液で洗浄し、再懸濁させた。
FACS中の細胞の流速を約200イベント/秒に設定し、細胞濃度を5×105/mlにして高い血漿細胞レスキューを得た。以下のゲート設定を用いた。各ゲートは作成者の設定(daughter of the former)である。
ゲート1:FSC/SSCゲート。最も高いFSCを示すリンパ球集団を選択し、それにより生存細胞の分別を確実にした。
ゲート2:SSCh/SSCw。このゲートは単一細胞の分別を確実にした。
ゲート3:形質芽細胞を表すイベントをCD38高/CD19中間としてCD38/CD19ドットプロットで表した。
ゲート4:セクションcで記載されるPCR法のみがカッパ軽鎖を増幅するため、ラムダ−陰性イベントをラムダ/CD19ドットプロットで表した。
ゲート3の代替としてまたはゲート3に加えて、形質芽細胞をCD45/CD38ドットプロット中のCD38高およびCD45中間として同定した。これは、抗−CD45−PerCPによる細胞の染色を必要とする。
これらの4つの基準を満たした得られた集団を、分別緩衝液を含む96−ウェルPCRプレートに単一細胞に分別した(セクションcを参照)。前記細胞を含むプレートを−80℃で保存した。
b.ELISpot
ELISotを用いることにより、得られた細胞サンプル、すなわち、PBMC、MACS−精製CD19+細胞、またはFACSで分別した形質芽細胞の集団において、抗−RSV抗体を発現する形質芽細胞の割合を評価した。ニトロセルロース表面を伴う96−ウェルプレート(Millipore)を25μg/mlの不活性化RSV Long粒子(HyTest)溶液でコートした。ウェルをRPMI、2% 粉乳とのインキュベーションによりブロックし、4℃で約5時間静置し、続いて37℃で1時間インキュベートした。プレートを洗浄し、細胞サンプルをRPMI培地中で各ウェルに添加し、続いて一般的な組織培養条件で24時間インキュベートした。分泌されたRSV−特異的な抗体は、抗体産生細胞周辺の固定化されたウイルス粒子に結合する。細胞をPBS;0.01% Tween20で3回およびPBSで3回洗浄することにより取り除いた。HRP−抱合抗−ヒトIgG(H+L)(CalTaq)およびHRP−抱合抗−ヒトIgA(Serotec)を加え、固定化された抗体と37℃で1時間反応させた。洗浄の手順を繰り返し、発色基質(N,N−DMF(ジ−メチルホルムアミド)中に可溶化された3−アミノ−9−エチルカルバゾール)を添加した。発色をH2Oの添加により4分後に停止させた。赤色スポットを抗原−特異的抗体−分泌細胞が局在する部位として同定した。
ELISotを用いることにより、得られた細胞サンプル、すなわち、PBMC、MACS−精製CD19+細胞、またはFACSで分別した形質芽細胞の集団において、抗−RSV抗体を発現する形質芽細胞の割合を評価した。ニトロセルロース表面を伴う96−ウェルプレート(Millipore)を25μg/mlの不活性化RSV Long粒子(HyTest)溶液でコートした。ウェルをRPMI、2% 粉乳とのインキュベーションによりブロックし、4℃で約5時間静置し、続いて37℃で1時間インキュベートした。プレートを洗浄し、細胞サンプルをRPMI培地中で各ウェルに添加し、続いて一般的な組織培養条件で24時間インキュベートした。分泌されたRSV−特異的な抗体は、抗体産生細胞周辺の固定化されたウイルス粒子に結合する。細胞をPBS;0.01% Tween20で3回およびPBSで3回洗浄することにより取り除いた。HRP−抱合抗−ヒトIgG(H+L)(CalTaq)およびHRP−抱合抗−ヒトIgA(Serotec)を加え、固定化された抗体と37℃で1時間反応させた。洗浄の手順を繰り返し、発色基質(N,N−DMF(ジ−メチルホルムアミド)中に可溶化された3−アミノ−9−エチルカルバゾール)を添加した。発色をH2Oの添加により4分後に停止させた。赤色スポットを抗原−特異的抗体−分泌細胞が局在する部位として同定した。
c.同種VHおよびVLペアーの連結
VHおよびVLをコードする配列の連結を、セクションaに記載されるように得られた単一細胞上で行い、VHおよびVLをコードする配列の同種のペアーを容易にした。手法は、一工程(one−step)の多重重複伸長RT−PCRに続いてネスティドPCRに基づく二工程(two step)PCR法を利用した。本実施例で用いられるプライマーミックスは、カッパ軽鎖のみを増幅する。しかしながら、ラムダ軽鎖を増幅することができるプライマーを任意選択で多重プライマーミックスおよびネスティドPCRプライマーミックスに添加することができた。ラムダプライマーを添加する場合、セクションaにおける分取の手法は、ラムダ陽性細胞が排除されないように用いられるべきである。同種VHおよびVL配列の連結のための原理を図2に示す。
VHおよびVLをコードする配列の連結を、セクションaに記載されるように得られた単一細胞上で行い、VHおよびVLをコードする配列の同種のペアーを容易にした。手法は、一工程(one−step)の多重重複伸長RT−PCRに続いてネスティドPCRに基づく二工程(two step)PCR法を利用した。本実施例で用いられるプライマーミックスは、カッパ軽鎖のみを増幅する。しかしながら、ラムダ軽鎖を増幅することができるプライマーを任意選択で多重プライマーミックスおよびネスティドPCRプライマーミックスに添加することができた。ラムダプライマーを添加する場合、セクションaにおける分取の手法は、ラムダ陽性細胞が排除されないように用いられるべきである。同種VHおよびVL配列の連結のための原理を図2に示す。
セクションaで産生された96−ウェルPCRプレートを融解させ、分取した細胞を多重重複伸長RT−PCRの鋳型として供給した。単一細胞分取前に各ウェルに添加した分取緩衝液は、反応緩衝液(OneStep RT−PCR緩衝液;Qiagen)、RT−PCR用プライマー(表2を参照)およびRNase阻害剤(RNasin、Promega)を含有した。これにOneStep RT−PCR酵素ミックス(25×希釈率;Qiagen)およびdNTP(各200μM)を補充して20μlの反応体積で所定の最終濃度を得た。
プレートを55℃で30分間インキュベートして各細胞からのRNA逆転写を可能にした。RT後、プレートを以下のPCRサイクルにかけた:94℃で10分、35×(94℃で40秒、60℃で40秒、72℃で5分)、72℃で10分。
24個の96−ウェルプレート用のPeel Seal Baketを備えるH20BITサーマルサイクラー(ABgene)でPCR反応を実施してハイスループットを容易にした。PCRプレートをサイクリング後に−20℃で保存した。
ネスティドPCR工程では、96−ウェルプレートの各ウェル(20−μl反応物)に以下の混合物を調製して所定の最終濃度を得た:1×FastStart緩衝液(Roche)、dNTPミックス(各200μM)、ネスティドプライマーミックス(表3を参照)、Phusion DNAポリメラーゼ(0.08U;Finnzymes)およびFastStart High Fidelity Enzyme Blend(0.8U;Roche)。ネスティドPCRの鋳型として、1μlを多重重複伸長PCR反応物から移した。ネスティドPCRプレートを以下のPCRサイクルにかけた:35×(95℃で30秒、60℃で30秒、72℃で90秒)、72℃で10分。
無作為に選択した反応物を1%アガロースゲル上で解析して約1070bpの重複伸長フラグメントの存在を確認した。
さらにPCRフラグメントを処理するまでプレートを−20℃で保存した。
d.同種VHおよびVLをコードするペアーのスクリーニングベクターへの挿入
RSV粒子または抗原に対して結合特異性を有する抗体を同定するために、セクションcに記載されるように得られたVHおよびVLをコードする配列を全長抗体として発現させた。このことは、VHおよびVLをコードするペアーのレパートリーの発現ベクターへの挿入および宿主細胞への形質転換に関連した。
RSV粒子または抗原に対して結合特異性を有する抗体を同定するために、セクションcに記載されるように得られたVHおよびVLをコードする配列を全長抗体として発現させた。このことは、VHおよびVLをコードするペアーのレパートリーの発現ベクターへの挿入および宿主細胞への形質転換に関連した。
連結されたVHおよびVLをコードするペアーを含む発現ベクターのレパートリーを作成するために、二工程クローニング法を採用した。統計的に、発現ベクターのレパートリーがスクリーニングレパートリーの作成に用いられる同種ペアーのVHおよびVLPCR産物の数より10倍多い組み換えプラスミドを含む場合、全てユニークな遺伝子ペアーが表される可能性は99%である。それゆえ、400個の重複伸長V−遺伝子フラグメントがセクションcで得られた場合、少なくとも4000個のクローンのレパートリーがスクリーニングにより作成された。
簡単に説明すると、セクションcにおけるネスティドPCRからの連結されたVHおよびVLをコードするペアーのレパートリーを、(他のドナーに由来するペアーを混合することなく)プールした。PCRフラグメントを、PCR産物の末端に導入された認識部位においてXhoIおよびNotI DNAエンドヌクレアーゼを用いて切断した。一般的なライゲーションの方法により、切断および精製されたフラグメントをXhoI/NotIで消化した哺乳動物IgG発現ベクター(図3)に結合させた。ライゲーション混合物をE.coliにエレクトロポレートし、適切な抗生物質を含む2×YTプレートに添加し、37℃で一晩インキュベートした。増幅されたベクターのレパートリーを、一般的なDNA精製方法(Qiagen)を用いて、プレートから回収した細胞から精製した。プロモーター−リーダーフラグメントの挿入のために、AscIおよびNheIエンドヌクレアーゼを用いる切断によりプラスミドを調製した。これらの酵素の制限部位は、VHおよびVLをコードする遺伝子のペアー間に局在した。ベクターの精製後に、AscI−NheIで消化された二方向性哺乳動物プロモーター−リーダーフラグメントを、一般的なライゲーション法によりAscIおよびNheI制限部位に挿入した。結合されたベクターをE.coli中で増幅させ、一般的な方法を用いてプラスミドを精製した。作成されたスクリーニングベクターのレパートリーを慣用的な手法によりE.coliに形質転換させた。得られたコロニーを384−ウェルマスタープレートに集め、保存した。アレイしたコロニー数は、インプットしたPCR産物の数を少なくとも3倍超え、それによりセクションcで得られた全てのユニークなV−遺伝子ペアーの存在について95%の可能性が与えられた。
e.スクリーニング
セクションdで集められた細菌コロニーを、同様の384−ウェルプレート中の培地に播種し、一晩培養した。トランスフェクション用のDNAを細胞培養プレートの各ウェルから調製した。トランスフェクション前日に、384−ウェルプレートに20μl培地中で3000細胞/ウェルにおいてCHO−Flp−In細胞(Invitrogen)を播種した。細胞を、製造業者の説明書に従ってFugene6(Roche)を用いてDNAとともにトランスフェクトさせた。2−3日間の培養後、スクリーニングに用いるため、全長抗体を含む上澄み液を収集し、保存した。
セクションdで集められた細菌コロニーを、同様の384−ウェルプレート中の培地に播種し、一晩培養した。トランスフェクション用のDNAを細胞培養プレートの各ウェルから調製した。トランスフェクション前日に、384−ウェルプレートに20μl培地中で3000細胞/ウェルにおいてCHO−Flp−In細胞(Invitrogen)を播種した。細胞を、製造業者の説明書に従ってFugene6(Roche)を用いてDNAとともにトランスフェクトさせた。2−3日間の培養後、スクリーニングに用いるため、全長抗体を含む上澄み液を収集し、保存した。
Applied Biosystems 8200 FMAT(登録商標)システム、ホモジニアス(homogeneous)ビーズに基づいた可溶化キャプチャーFLISA(蛍光連結免疫吸着アッセイ)を用いてスクリーニングを行った(Swartzman et al1999, AnalBiochem271:143-151)。RSV抗原に由来するウイルス粒子、組み換えGタンパク質およびビオチン化ペプチドを含む多くの抗原をスクリーニングに使用した。ペプチドは、Gタンパク質の保存領域(アミノ酸164−176)とシステインコア領域(アミノ酸171−187、株Longおよび18537)およびSH−タンパク質の細胞外領域(A2株のアミノ酸42−64および18537株の42−65)に由来した。不活性化されたRSV株Longのウイルス粒子(HyTest)を、300μlのウイルスストック(タンパク質濃度:200μg/ml)と一緒に300μlの5% w/vビーズ(直径6.79μm、Spherotech Inc.)をインキュベートすることによりポリスチレンビーズ上に固定化させた。可溶性組み換えGタンパク質(18537株の配列のアミノ酸66−292)を同様に直接ポリスチレンビーズ上に固定化させた一方、ビオチン化されたペプチドを、前コートされたストレプトアビジンポリスチレンビーズ(直径6.0−8.0μm、Gerlinde Kisker)上で飽和濃度において補促させた。コート混合物を一晩インキュベートし、PBSで2回洗浄した。ビーズを、1%ウシ血清アルブミン(PBS/BSA)および5μlヤギ−抗−ヒトIgG Alexa647抱合体(Molecular probes)を含む50mlのPBSで再懸濁した。再懸濁したコート混合物の10μlに、FMAT適合性の384−ウェルプレート中で20μlの抗体を含む上澄み液を添加し、約12時間インキュベートし、その後、各ウェル中のビーズ表面における蛍光を測定した。蛍光の強度がバックグラウンド基準を超えた少なくとも6つの標準偏差である場合、蛍光イベント(event)が陽性であると判断した。
最初の当たりで生じたクローンを元々のマスタープレートから取り出し、新しいプレートに収集した。これらのクローンからDNAを単離し、V−遺伝子のDNA配列決定を行った。この配列を並列比較し、全てのユニークなクローンを選択した。
選択されたクローンをさらに検証した。簡単に説明すると、2×106個のフリースタイル(Freestyle)293細胞(Invitrogen)を、製造業者の説明書に従って、2mlのフリースタイル培地(Invitrogen)中において、選択されたクローン由来の1.7μg DNAおよび0.3μgのpAdVAntageプラスミド(Promega)でトランスフェクトした。2日後、上澄み液を、IgG発現について、ならびに一次スクリーニングに用いられる異なる抗原および組み換え精製Fタンパク質とE.coli産生のGタンパク質フラグメント(18537株配列のアミノ酸127−203)との反応性について、FLISAおよび/またはELISAによりテストした。抗体上澄み液を連続希釈でテストすることにより、抗原反応性によるクローンのランキングを可能にした。
f.クローン修復
セクションcに記載されるような多重PCR法を用いると、高い相同性により、一定頻度のV−遺伝子ファミリー内および間のクロスプライミングが予想される。クロスプライミングは、免疫グロブリンフレームワーク中に天然に存在しないアミノ酸を導入し、いくつかの潜在的な結果、例えば、構造変化および免疫原性の増加をもたらし、それらは全て治療活性の減少を招く。
セクションcに記載されるような多重PCR法を用いると、高い相同性により、一定頻度のV−遺伝子ファミリー内および間のクロスプライミングが予想される。クロスプライミングは、免疫グロブリンフレームワーク中に天然に存在しないアミノ酸を導入し、いくつかの潜在的な結果、例えば、構造変化および免疫原性の増加をもたらし、それらは全て治療活性の減少を招く。
これらの欠点を解消し、選択されたクローンが自然の液性免疫応答を反映することを確実にするために、かかるクロスプライミング変異をクローン修復(clone repair)と呼ばれるプロセスで修復した。
クローン修復手順の第一工程では、VH配列を、目的クローンの起源であるVH−遺伝子に対応する配列を含むプライマーセットでPCR増幅し、それによりクロスプライミングにより導入された変異のいずれかを修正した。PCRフラグメントをXhoIおよびAscIで消化し、慣用的なライゲーション手法を用いて、XhoI/AscIで消化された哺乳動物発現ベクター(図3)に結合させた。結合したベクターをE.coli中で増幅させ、一般的な方法によりプラスミドを精製した。VH配列の配列を決定して修正を確認し、ベクターをNheI/NotIで消化して軽鎖の挿入用に調製した。
第二工程では、完全な軽鎖を、目的クローンの起源であるVL−遺伝子に対応する配列を含むプライマーセットでPCR増幅し、それによりクロスプライミングにより導入された変異のいずれかを修正した。PCRフラグメントをNheI/NotIで消化し、上記で調製されたベクターを含むVHに結合させた。ライゲーション産物をE.coliで増幅させ、一般的な方法により精製した。次いで、軽鎖の配列を決定して修正を確認した。
選択されたクローンのカッパ定常領域が、セクションcに記載の遺伝子増幅中に導入された変異を含んだ場合、未変異の定常領域により置換された。これは、(定常領域を除いて増幅された)修復VL−遺伝子を、(別々のPCRで得られた)修正配列を伴う定常領域に繋ぐ重複PCRにおいて行った。全体の配列を増幅し、上に記載されるごときベクターを含むVHにクローン化し、修復された軽鎖の配列を決定して修正を確認した。
g.ポリクローナル細胞株の作成
組み換えポリクローナル抗体を産生するポリクローナル発現細胞株の作成は、単一のVHおよびVL遺伝子配列に由来するユニークな抗体を各々発現する個々の発現細胞株の作成に関する複数−工程手順である。ポリクローナル細胞株は、個々の細胞株を混合し、混合物をアンプルに分配し、それによりポリクローナルリサーチ細胞バンク(pRCB)またはマスター細胞バンク(pMCB)を作成することにより得られ、ポリクローナルワーキング細胞バンク(pWCB)は、リサーチまたはマスター細胞バンクから細胞を増殖させることにより作成されうる。一般的に、pRCB由来のポリクローナル細胞株は、pWCBを作成することなく直接用いられる。
組み換えポリクローナル抗体を産生するポリクローナル発現細胞株の作成は、単一のVHおよびVL遺伝子配列に由来するユニークな抗体を各々発現する個々の発現細胞株の作成に関する複数−工程手順である。ポリクローナル細胞株は、個々の細胞株を混合し、混合物をアンプルに分配し、それによりポリクローナルリサーチ細胞バンク(pRCB)またはマスター細胞バンク(pMCB)を作成することにより得られ、ポリクローナルワーキング細胞バンク(pWCB)は、リサーチまたはマスター細胞バンクから細胞を増殖させることにより作成されうる。一般的に、pRCB由来のポリクローナル細胞株は、pWCBを作成することなく直接用いられる。
ポリクローナル細胞株を作成するプロセスにおける各工程を以下に記載する。
g−1 哺乳動物細胞株のトランスフェクションおよび選択
Flp−In CHO細胞株(Invitrogen)を開始細胞株として用いた。より均一な細胞株を得るために、親のFlp−In CHO細胞株を、希釈を制限してサブクローン化し、いくつかのクローンを選択し、増殖させた。増殖の具合に基づいて、1つのクローン、CHO−Flp−In(019)を開始細胞株として選択した。CHO−Flp−In(019)細胞を10%ウシ胎児血清(FCS)を含むHAM−F12中で接着細胞として培養した。
Flp−In CHO細胞株(Invitrogen)を開始細胞株として用いた。より均一な細胞株を得るために、親のFlp−In CHO細胞株を、希釈を制限してサブクローン化し、いくつかのクローンを選択し、増殖させた。増殖の具合に基づいて、1つのクローン、CHO−Flp−In(019)を開始細胞株として選択した。CHO−Flp−In(019)細胞を10%ウシ胎児血清(FCS)を含むHAM−F12中で接着細胞として培養した。
セクションfで得た選択および修復されたVHおよびVLをコードするペアーを各々含む各プラスミド調製物を、Fugene6(Roche)を用いて、T175フラスコ中の〜19×106個のCHO−Flp−In(019)細胞(より詳細については、WO 04/061104を参照)に、Flpリコンビナーゼをコードするプラスミドで共トランスフェクトした。細胞を24時間後にトリプシン処理し、2−layer(1260cm2)cell factory(Nunc)に移した。トランスフェクション48時間後に添加した500μg/mlのジェネティシンの存在下で培養することにより、組み換え細胞株を選択した。約2週間後にクローンが現れた。クローンを数え、細胞をトリプシン処理し、その後、RSV特異的な抗体のうちの1つを発現するクローンのプールとして培養した。
g−2 血清を含まない懸濁培養への適応
接着した抗−RSV抗体を発現する細胞培養物各々をトリプシン処理し、遠心分離し、適切な無血清培地(Excell302、JRH Biosciences;500μg/ml ジェネティシン、抗凝集剤(1:250)および4mM L−グルタミン)中に1.15×106細胞/mlの入った別々の振蘯フラスコ(250ml)に移した。増殖と細胞形態を数週間にわたって経過観察した。4−6週間後、細胞株は通常、30時間より少ない倍加時間を有する良好かつ安定な増殖状態を示し、次いで用いた各細胞株を複数のアンプルに凍結保存した。
接着した抗−RSV抗体を発現する細胞培養物各々をトリプシン処理し、遠心分離し、適切な無血清培地(Excell302、JRH Biosciences;500μg/ml ジェネティシン、抗凝集剤(1:250)および4mM L−グルタミン)中に1.15×106細胞/mlの入った別々の振蘯フラスコ(250ml)に移した。増殖と細胞形態を数週間にわたって経過観察した。4−6週間後、細胞株は通常、30時間より少ない倍加時間を有する良好かつ安定な増殖状態を示し、次いで用いた各細胞株を複数のアンプルに凍結保存した。
適応中に発現された各抗体を、セクションi)に記載される方法を用いて上澄み液から精製した。精製された抗体を以下に記載されるごとく抗原特異性および生化学的特性の特徴付けに用いた。
g−3 細胞株の特徴付け
全ての各細胞株を抗体産生および増殖に関して特徴付けを行った。これを以下のアッセイで行った:
全ての各細胞株を抗体産生および増殖に関して特徴付けを行った。これを以下のアッセイで行った:
産生:
各発現細胞株の組み換え抗体の産生を、カッパ特異的ELISAによる適応期間後に続けた。ELISAプレートを、炭酸緩衝液、pH9.6中のヤギ−抗−ヒトFc精製抗体(Serotec)で一晩コートした。プレートを洗浄緩衝液(PBS;0.05% Tween20)で6回洗浄し、2% スキムミルクを含む洗浄緩衝液中で1時間のインキュベーションによりブロックした。細胞培地の上澄み液を添加し、さらに1時間インキュベートした。プレートを洗浄緩衝液で6回洗浄し、二次抗体(ヤギ−抗−ヒトカッパHRP、Serotec)を添加し、インキュベーションを繰り返した。激しい洗浄後、ELISAをTMB基質液で発色させ、H2SO4の添加により反応を止めた。プレートを450nmで読み取った。
各発現細胞株の組み換え抗体の産生を、カッパ特異的ELISAによる適応期間後に続けた。ELISAプレートを、炭酸緩衝液、pH9.6中のヤギ−抗−ヒトFc精製抗体(Serotec)で一晩コートした。プレートを洗浄緩衝液(PBS;0.05% Tween20)で6回洗浄し、2% スキムミルクを含む洗浄緩衝液中で1時間のインキュベーションによりブロックした。細胞培地の上澄み液を添加し、さらに1時間インキュベートした。プレートを洗浄緩衝液で6回洗浄し、二次抗体(ヤギ−抗−ヒトカッパHRP、Serotec)を添加し、インキュベーションを繰り返した。激しい洗浄後、ELISAをTMB基質液で発色させ、H2SO4の添加により反応を止めた。プレートを450nmで読み取った。
さらに、細胞内染色を用いることにより、一般的な発現レベルならびに組み換え抗体の発現に関する細胞集団の均一性(homogeneity)を調べた。5×105個の細胞を、CellFix(BD-Biosciences)中で20分間のインキュベーションによる固定の前に、冷FACS緩衝液(PBS;2% FCS)で洗浄した。細胞をペレット状にし、氷冷メタノールで10分間透過処理し、FACS緩衝液で2回洗浄した。懸濁液に、蛍光タグをつけた抗体(ヤギF(ab’)2フラグメント、抗−ヒトIgG(H+L)−PE、Beckman Coulter)を添加した。20分後、氷上で細胞を洗浄し、FACS緩衝液で再懸濁し、次いでFACS解析を行った。
増殖:
細胞懸濁液のアリコットを1週間に2から3回取り、細胞数、細胞の大きさおよび生存率をVi−Cell XR(Cell viability analyzer、Beckman Coulter)解析により調べた。細胞培養の倍加時間をVi−Cell測定からの細胞数を用いて算出した。
細胞懸濁液のアリコットを1週間に2から3回取り、細胞数、細胞の大きさおよび生存率をVi−Cell XR(Cell viability analyzer、Beckman Coulter)解析により調べた。細胞培養の倍加時間をVi−Cell測定からの細胞数を用いて算出した。
g−4 各抗体の抗原特異性の特徴付け
よく特徴付けられた特性を有する抗−RSV rpAbの作成を行うために、各々発現される抗体の抗原およびエピトープ特異性を測定した。すでにセクションeに記載されるように、スクリーニング中に同定された抗体を、単一のRSV抗原(組み換えGタンパク質、組み換えまたは精製Fタンパク質)またはそのペプチドフラグメント(タンパク質G、サブタイプAおよびBの保存領域およびシステインコアモチーフ、ならびにSHタンパク質、サブタイプAおよびBの細胞外ドメイン)に対するそれらの結合特性をFLISA、ELISAおよび表面プラズモン共鳴(SPR;Biacore)により測定することで確認した。エピトープ特異性を、よく特徴付けられた市販の抗体であって、そのうちのいくつかが表4に示される抗体との競合によるELISAにおいて調べた。必ずしも表4に示された全ての抗体を、本発明の各々の抗体の特徴付けに用いておらず、それらが結合する抗原、抗原部位および/またはエピトープに関して特徴付けられた潜在的な他の抗体または抗体フラグメントもまた用いられてもよい。簡単に説明すると、エピトープのブロッキングに用いられる抗体または抗体フラグメントを、過剰量、すなわち、実験的に調べられたように75%の最大結合を与える濃度の100倍(Ditzel et al., J.Mol.Biol.1997, 267:684-695)の固定化抗体(RSV Long粒子、HyTest)とインキュベートした。洗浄後、各抗体クローンを、様々な濃度でブロックした抗原とインキュベートし、いずれかの結合したヒトIgGを、一般的なELISAプロトコルに従ってヤギ−抗−ヒトHRP抱合体(Serotec)を用いて検出した。エピトープ特異性を、ブロッキングおよびプロービング(probing)の両方の(実験的に調べられた)飽和濃度を用いるBiacoreにおいて、異なる抗体クローン間の対(pair−wise)競合によりさらに特徴付けした。直接アミンカップリング(Biacore)により固定化された精製FまたはGタンパク質を抗原として用いた。ELISA−およびBiacore−の両方に基づいたエピトープマッピングでは、エピトープブロッキング後の減少した結合を競合させていない結合と比較した。
よく特徴付けられた特性を有する抗−RSV rpAbの作成を行うために、各々発現される抗体の抗原およびエピトープ特異性を測定した。すでにセクションeに記載されるように、スクリーニング中に同定された抗体を、単一のRSV抗原(組み換えGタンパク質、組み換えまたは精製Fタンパク質)またはそのペプチドフラグメント(タンパク質G、サブタイプAおよびBの保存領域およびシステインコアモチーフ、ならびにSHタンパク質、サブタイプAおよびBの細胞外ドメイン)に対するそれらの結合特性をFLISA、ELISAおよび表面プラズモン共鳴(SPR;Biacore)により測定することで確認した。エピトープ特異性を、よく特徴付けられた市販の抗体であって、そのうちのいくつかが表4に示される抗体との競合によるELISAにおいて調べた。必ずしも表4に示された全ての抗体を、本発明の各々の抗体の特徴付けに用いておらず、それらが結合する抗原、抗原部位および/またはエピトープに関して特徴付けられた潜在的な他の抗体または抗体フラグメントもまた用いられてもよい。簡単に説明すると、エピトープのブロッキングに用いられる抗体または抗体フラグメントを、過剰量、すなわち、実験的に調べられたように75%の最大結合を与える濃度の100倍(Ditzel et al., J.Mol.Biol.1997, 267:684-695)の固定化抗体(RSV Long粒子、HyTest)とインキュベートした。洗浄後、各抗体クローンを、様々な濃度でブロックした抗原とインキュベートし、いずれかの結合したヒトIgGを、一般的なELISAプロトコルに従ってヤギ−抗−ヒトHRP抱合体(Serotec)を用いて検出した。エピトープ特異性を、ブロッキングおよびプロービング(probing)の両方の(実験的に調べられた)飽和濃度を用いるBiacoreにおいて、異なる抗体クローン間の対(pair−wise)競合によりさらに特徴付けした。直接アミンカップリング(Biacore)により固定化された精製FまたはGタンパク質を抗原として用いた。ELISA−およびBiacore−の両方に基づいたエピトープマッピングでは、エピトープブロッキング後の減少した結合を競合させていない結合と比較した。
欄「抗原」は、Mab/Fabにより結合されるRSV関連抗原を示し、サブタイプ特異性が知られている場合、これは()で示される。欄「エピトープ(aa)」は、MAb/Fabにより認識されるエピトープ名を示し、さらに、()では、RSVエスケープ変異体を生じるアミノ酸の位置、または結合が示されたペプチド/タンパク質が示される。表4に示す参考文献(Ref.)の番号は、
1. Anderson et al., J.Clin.Microbiol.1986, 23:475-480.
2. Anderson et al., J.Virol.1988, 62:1232-4238.
3. Beeler & van Wyke Coelingh, J.Virol.1989, 63:2941-2950.
4. Cowe et al., JID 1998, 177:1073-1076.
5. Sominina et al., Vestn Ross Akad Med Nauk 1995, 9:49-54.
6. Collins et al., Fields Virology, p1313-1351.
7. Crowe et al., Virology 1998, 252:373-375.
8. Zhao & Sullender, J.Virol.2004, 79:3962-3968.
9. Sullender, Virology 1995, 209:70-79.
10. Morgan et al., J.Gen.Virol.1987, 68:2781-2788.
11. McGill et al., J.Immunol.Methods 2005, 297:143-152.
12. Arbiza et al., J.Gen.Virol.1992, 73:2225-2234.
13. Lopez et al., J.Virol.1998, 72:6922-6928.
14. Walsh et al., J.Gen.Virol.1989, 70:2953-2961.
15. Walsh et al., J.Gen.Virol.1998, 79:479-487.
に対応する。
1. Anderson et al., J.Clin.Microbiol.1986, 23:475-480.
2. Anderson et al., J.Virol.1988, 62:1232-4238.
3. Beeler & van Wyke Coelingh, J.Virol.1989, 63:2941-2950.
4. Cowe et al., JID 1998, 177:1073-1076.
5. Sominina et al., Vestn Ross Akad Med Nauk 1995, 9:49-54.
6. Collins et al., Fields Virology, p1313-1351.
7. Crowe et al., Virology 1998, 252:373-375.
8. Zhao & Sullender, J.Virol.2004, 79:3962-3968.
9. Sullender, Virology 1995, 209:70-79.
10. Morgan et al., J.Gen.Virol.1987, 68:2781-2788.
11. McGill et al., J.Immunol.Methods 2005, 297:143-152.
12. Arbiza et al., J.Gen.Virol.1992, 73:2225-2234.
13. Lopez et al., J.Virol.1998, 72:6922-6928.
14. Walsh et al., J.Gen.Virol.1989, 70:2953-2961.
15. Walsh et al., J.Gen.Virol.1998, 79:479-487.
に対応する。
さらに、抗体クローンを、異なるRSV株(LongおよびB1)で感染させた咽頭上皮HEp−2細胞(ATCC CLL−23)への結合に関してもFACSにより特徴付けした。簡単に説明すると、HEp−2細胞を、無血清培地中で0.1pfu/細胞の割合においてRSV Long(ATCC番号VR−26)株またはRSV B1(ATCC番号VR−1400)株のどちらかで24時間(Long株)または48時間(B1株)感染させた。剥離および洗浄後、細胞を96−ウェルプレートに分注し、各抗−RSV抗体の希釈液(4pM−200μM)において37℃で1時間インキュベートした。細胞を1%ホルムアルデヒドで固定し、細胞表面結合抗体をヤギF(ab)2抗−ヒトIgG−PE抱合体(Beckman Coulter)との4℃で30分間のインキュベーションにより検出した。モック(mock)感染HEp−2細胞に対する結合を同様に解析した。タンパク質G特異的として選択されたクローンもまた、組み換えヒトフラクタルキン(CX3CL1;R&D systems)との交差反応性についてELISAによりテストした。抗−ヒトCX3CL1/フラクタルキンモノクローナル抗体(R&D systems)を陽性コントロールとして用いた。
g−5 各抗体の結合反応速度の特徴付け
本発明の抗体の動力学的解析を、物質移動の制限を避けるために極めて低い密度でセンサー表面上に固定された組み換え抗原を用いて、Biacore 3000(スウェーデン、ウプサラのBiacore AB)で表面プラズモン共鳴分析を用いて行った。ImmunoPure Fab調製キット(Pierce)を用いて各抗体クローンから調製されたFabフラグメントを用いて解析を行った。簡単に説明すると、合計200共鳴単位(RU)の組み換えタンパク質Fまたは合計50RUの組み換えタンパク質Gを、製造業者の説明書に従ってアミンカップリングキット(Biacore)を用いてCM5チップ表面に抱合させた。Fabフラグメントを連続希釈でチップ表面上に注入し、固定化タンパク質を有するチップ上でテストされる時に25を超えるRU最大値を生じることのない最適化濃度で開始した。結合速度定数(ka)および解離定数(kd)を、BIAevaluation 4.1ソフトウェア(BIAcore)における所定の1:1(Langmuir)結合および解離モデルを用いて全体的に評価した。
本発明の抗体の動力学的解析を、物質移動の制限を避けるために極めて低い密度でセンサー表面上に固定された組み換え抗原を用いて、Biacore 3000(スウェーデン、ウプサラのBiacore AB)で表面プラズモン共鳴分析を用いて行った。ImmunoPure Fab調製キット(Pierce)を用いて各抗体クローンから調製されたFabフラグメントを用いて解析を行った。簡単に説明すると、合計200共鳴単位(RU)の組み換えタンパク質Fまたは合計50RUの組み換えタンパク質Gを、製造業者の説明書に従ってアミンカップリングキット(Biacore)を用いてCM5チップ表面に抱合させた。Fabフラグメントを連続希釈でチップ表面上に注入し、固定化タンパク質を有するチップ上でテストされる時に25を超えるRU最大値を生じることのない最適化濃度で開始した。結合速度定数(ka)および解離定数(kd)を、BIAevaluation 4.1ソフトウェア(BIAcore)における所定の1:1(Langmuir)結合および解離モデルを用いて全体的に評価した。
Fabフラグメントにおける動力学的解析を行うことにより、実際に得られたデータがRSVタンパク質に対する結合親和性を反映することを確認した。完全な抗体を用いた場合、データは結合親和性を反映し、容易に抗体の結合特性と抗原との正確な形の意味のある測定に置き換えることができないであろう。
g−6 各抗体の生化学的特性の特徴付け
不均一性(heterogeneity)は、抗体および組み換えタンパク質における共通の現象である。抗体の修飾は、典型的には、例えば、N−糖鎖付加、タンパク質分解フラグメント化、およびN−とC−末端不均一性のごとき翻訳後修飾が発現中に起き、大きさまたは帯電の不均一性を生じる。加えて、メチオニン酸化および脱アミド化のごとき修飾は、後の短期または長期保存中に生じうる。これらのパラメーターは、治療抗体でよく定められていることが必要となるため、それらは、ポリクローナル細胞株の作成前に解析された。
不均一性(heterogeneity)は、抗体および組み換えタンパク質における共通の現象である。抗体の修飾は、典型的には、例えば、N−糖鎖付加、タンパク質分解フラグメント化、およびN−とC−末端不均一性のごとき翻訳後修飾が発現中に起き、大きさまたは帯電の不均一性を生じる。加えて、メチオニン酸化および脱アミド化のごとき修飾は、後の短期または長期保存中に生じうる。これらのパラメーターは、治療抗体でよく定められていることが必要となるため、それらは、ポリクローナル細胞株の作成前に解析された。
精製された各抗体の特徴付け(セクションiを参照)に用いられる方法は、SDS−PAGE(還元と非還元状態)、弱陽イオン交換クロマトグラフィー(IEX)、サイズ排除クロマトグラフィー(SEC)、およびRP−HPLC(還元と非還元状態)を含んだ。還元と非還元状態下におけるSDS−PAGE解析およびSECは、精製された抗体が微量のフラグメント化および凝集化された形態を伴い、実質的に無傷であることを示した。精製された抗体のIEXプロファイル解析は、単一のピークを示すプロファイルまたは複数のピークを示すクロマトグラフを結果として生じ、これらはこれらの特定の抗体における帯電の不均一性を示す。IEX解析における複数のピークおよび/またはSDSゲルにおける軽もしくは重鎖の異常な移動、あるいは異常なRP−HPLCプロファイルを生じる抗体調製物を、N−末端の配列決定により無傷なN−末端について、およびオリゴ糖プロファイルの相違により引き起こされる不均一性について詳細に解析した。さらに、選択された抗体を、酵素処理およびその後のSDS−PAGE解析を用いて、可変鎖におけるN−糖鎖付加部位の存在について解析した。
g−7 抗−RSV組み換えポリクローナル抗体産生のためのポリクローナル細胞株の樹立
樹立された発現細胞株のコレクションから、サブセットを選択して混合し、ポリクローナル細胞株およびポリクローナルリサーチ/マスター細胞バンク(pRCB/pMCB)を作成する。選択パラメーターを、ポリクローナル細胞株から産生されるポリクローナル抗体の使用、ならびに各細胞株の能力に従って定めることができる。一般的に以下のパラメーターを考慮する:
・細胞株の性質;ポリクローナル細胞株の安定性を最適化すること、21〜30時間の倍加時間を有する各細胞株および1pg/細胞/日を超える抗体産生が好ましい。
・反応性;抗−RSV rpAbが反応性を示す抗原/抗原部位およびエピトープを慎重に考慮する。
・タンパク質化学;明確な生化学的性質を示す好ましい抗体が最終的な抗−RSV rpAbに含まれる。
樹立された発現細胞株のコレクションから、サブセットを選択して混合し、ポリクローナル細胞株およびポリクローナルリサーチ/マスター細胞バンク(pRCB/pMCB)を作成する。選択パラメーターを、ポリクローナル細胞株から産生されるポリクローナル抗体の使用、ならびに各細胞株の能力に従って定めることができる。一般的に以下のパラメーターを考慮する:
・細胞株の性質;ポリクローナル細胞株の安定性を最適化すること、21〜30時間の倍加時間を有する各細胞株および1pg/細胞/日を超える抗体産生が好ましい。
・反応性;抗−RSV rpAbが反応性を示す抗原/抗原部位およびエピトープを慎重に考慮する。
・タンパク質化学;明確な生化学的性質を示す好ましい抗体が最終的な抗−RSV rpAbに含まれる。
組み換え抗−RSV抗体を発現する選択された各細胞株を、振蘯フラスコにおける無血清培地中において37℃で融解し、増殖させて21−34時間の倍加時間の集団を示す各クローンの少なくとも4×108個の細胞とした。生存率は、好ましくは93%から96%までの範囲である。ポリクローナル細胞株を、各細胞株から2×106個の細胞を混合することにより調製する。ポリクローナル細胞株を、5.6×107個の細胞を含有する凍結アンプルに分け、凍結保存する。ポリクローナル細胞株を有するこのバイアルのコレクションをポリクローナルリサーチ/マスター細胞バンク(pRCB/pMCB)と名付け、ポリクローナルワーキング細胞バンク(pWCB)は、pRCB/pMCBから1つのアンプルを増殖させることにより、pRCB/pMCBのアンプルと同じ細胞密度を有する約200個のアンプルのポリクローナルワーキング細胞バンク(pWCB)を作出するために十分量の細胞とすることにより作成することができる。前記細胞バンクに由来する細胞をマイコプラズマおよび無菌性についてテストする。
h.組み換えポリクローナル抗−RSV抗体の発現
組み換えポリクローナル抗−RSV抗体のバッチを5リットルのバイオリアクター(ドイツ、メルズンゲンのB.Braun Biotech International)で産生する。簡単に説明すると、pRCBまたはpWCBに由来するバイアルを融解し、振蘯フラスコ(Corning)中で増殖させる。播種した列の細胞を、G418および抗凝集剤を含むExCell302培地中で37℃、5%CO2で培養する。このバイオリアクターに、G418および抗凝集剤を含まない3lのExCell302培地中に懸濁させて0.6×106細胞/mlで播種する。細胞数/生存細胞をCASYまたはViCell計数により毎日モニターする。50時間で2000mlのExCell302培地を補充し、92時間後に37℃から32℃に温度を下げる。細胞培養上澄み液を164時間後に回収し、セクションiに記載されるごとく精製にかける。
組み換えポリクローナル抗−RSV抗体のバッチを5リットルのバイオリアクター(ドイツ、メルズンゲンのB.Braun Biotech International)で産生する。簡単に説明すると、pRCBまたはpWCBに由来するバイアルを融解し、振蘯フラスコ(Corning)中で増殖させる。播種した列の細胞を、G418および抗凝集剤を含むExCell302培地中で37℃、5%CO2で培養する。このバイオリアクターに、G418および抗凝集剤を含まない3lのExCell302培地中に懸濁させて0.6×106細胞/mlで播種する。細胞数/生存細胞をCASYまたはViCell計数により毎日モニターする。50時間で2000mlのExCell302培地を補充し、92時間後に37℃から32℃に温度を下げる。細胞培養上澄み液を164時間後に回収し、セクションiに記載されるごとく精製にかける。
i.各抗−RSV抗体およびポリクローナル抗−RSV抗体の精製
セクションg.g−2およびhに記載されるように発現される抗体、全てのIgG1アイソタイプを、MabSelect SuReカラム(プロテイン−A)を用いてアフィニティー精製した。各抗体が固定化されたプロテイン−AにpH7.4で相互作用し、一方で夾雑するタンパク質をカラムから洗浄した。次いで、結合した抗体を、pHを2.7まで下げることによりカラムから溶出した。280nmの吸光度測定から調べられた抗体を含む画分をプールし、G−25カラムを用いて5mM 酢酸ナトリウム、150mM NaCl、pH5で緩衝液交換し、−20℃で保存した。
セクションg.g−2およびhに記載されるように発現される抗体、全てのIgG1アイソタイプを、MabSelect SuReカラム(プロテイン−A)を用いてアフィニティー精製した。各抗体が固定化されたプロテイン−AにpH7.4で相互作用し、一方で夾雑するタンパク質をカラムから洗浄した。次いで、結合した抗体を、pHを2.7まで下げることによりカラムから溶出した。280nmの吸光度測定から調べられた抗体を含む画分をプールし、G−25カラムを用いて5mM 酢酸ナトリウム、150mM NaCl、pH5で緩衝液交換し、−20℃で保存した。
j.インビトロ中和アッセイ
j−1 インビトロ使用のための活性なRSVの調製
ヒト咽頭上皮HEp−2細胞(ATCC CLL−23)を1×107細胞/フラスコで175cm2フラスコに播種した。細胞を、RSV Long(ATCC番号 VR−26)、RSV B1(ATCC番号 VR−1400)またはRSV B Wash/18537(Advanced Biotechnologies Inc.)のうちのいずれかで0.1pfu/細胞の割合において3ml無血清培地中に感染させた。細胞を、37℃;5%CO2で2時間感染させ、続いて37mlの完全MEM培地を添加した。細胞変性効果が観察されるまで細胞をインキュベートした。細胞を掻き取ることにより剥がし、培地と細胞を20秒間超音波処理し、一定分量にし、液体窒素で凍結させ、−80℃で保存した。
j−1 インビトロ使用のための活性なRSVの調製
ヒト咽頭上皮HEp−2細胞(ATCC CLL−23)を1×107細胞/フラスコで175cm2フラスコに播種した。細胞を、RSV Long(ATCC番号 VR−26)、RSV B1(ATCC番号 VR−1400)またはRSV B Wash/18537(Advanced Biotechnologies Inc.)のうちのいずれかで0.1pfu/細胞の割合において3ml無血清培地中に感染させた。細胞を、37℃;5%CO2で2時間感染させ、続いて37mlの完全MEM培地を添加した。細胞変性効果が観察されるまで細胞をインキュベートした。細胞を掻き取ることにより剥がし、培地と細胞を20秒間超音波処理し、一定分量にし、液体窒素で凍結させ、−80℃で保存した。
j−2 プラーク減少中和試験(PRNT)
HEp−2細胞を2×104細胞/ウェルで96−ウェル培養プレート中に播種し、37℃;5%CO2で一晩インキュベートした。試験物質を無血清MEM中に希釈させ、補体(ウサギに由来する補体血清、Sigma)の非存在または存在下において37℃で30分間前インキュベートした。この混合物をHEp−2細胞の単層にアプライし、37℃;5%CO2で24時間インキュベートした。細胞を80%アセトン;20%PBSで20分間固定した。洗浄後、ビオチン化されたヤギ抗−RSV抗体(AbD Serotec)を、1%BSAを含有するPBS中に添加し(1:200)、室温で1時間インキュベートした。洗浄後、HRP−アビジンを添加し、30分間インキュベートした。プラークを3−アミノ−9−エチルカルバゾール(AEC)基質との25分間(RSV Long)および45分間(RSV B1)のインキュベートにより発達させた。プラークをBioreader(Bio−Sys GmbH)でカウントした。力価の比較ができるように適用可能な場合には、EC50値(プラーク数の50%の減少を引き起こすのに必要とされる有効濃度)を算出した。
HEp−2細胞を2×104細胞/ウェルで96−ウェル培養プレート中に播種し、37℃;5%CO2で一晩インキュベートした。試験物質を無血清MEM中に希釈させ、補体(ウサギに由来する補体血清、Sigma)の非存在または存在下において37℃で30分間前インキュベートした。この混合物をHEp−2細胞の単層にアプライし、37℃;5%CO2で24時間インキュベートした。細胞を80%アセトン;20%PBSで20分間固定した。洗浄後、ビオチン化されたヤギ抗−RSV抗体(AbD Serotec)を、1%BSAを含有するPBS中に添加し(1:200)、室温で1時間インキュベートした。洗浄後、HRP−アビジンを添加し、30分間インキュベートした。プラークを3−アミノ−9−エチルカルバゾール(AEC)基質との25分間(RSV Long)および45分間(RSV B1)のインキュベートにより発達させた。プラークをBioreader(Bio−Sys GmbH)でカウントした。力価の比較ができるように適用可能な場合には、EC50値(プラーク数の50%の減少を引き起こすのに必要とされる有効濃度)を算出した。
j−3 融合阻害アッセイ
融合阻害アッセイを、基本的に、RSVをテスト物質の添加前に感染させることを除いてプラーク減少中和アッセイと同様に行った。実際には、ウイルスを無血清培地中でHEp−2細胞の単層に1.5時間添加した。
融合阻害アッセイを、基本的に、RSVをテスト物質の添加前に感染させることを除いてプラーク減少中和アッセイと同様に行った。実際には、ウイルスを無血清培地中でHEp−2細胞の単層に1.5時間添加した。
上澄み液を除去し、試験物質を補体(ウサギ由来の補体血清、Sigma)の存在するまたは存在しない完全MEM培地に添加した。プレートを一晩インキュベートし、プラーク減少中和アッセイに関して上に記載されるように処理した。
j−4 マイクロ中和アッセイ
セクションj−2およびj−3に記載されるPRNTおよび融合阻害アッセイに加えて、RSVタンパク質の検出に基づくマイクロ中和アッセイをRSV中和および融合阻害の測定に用いた。
セクションj−2およびj−3に記載されるPRNTおよび融合阻害アッセイに加えて、RSVタンパク質の検出に基づくマイクロ中和アッセイをRSV中和および融合阻害の測定に用いた。
中和テストでは、試験物質を無血清MEMで希釈し、RSVで96ウェル培養プレート中において室温で30分間前インキュベートした。トリプシン処理したHEp−2細胞を1.5×104細胞/ウェルで添加し、37℃;5%CO2で2−3日間インキュベートした。細胞を洗浄し、80%アセトン;20%PBSにおいて4℃で15分間固定し、乾燥させた。
次いで、プレートを0.5%ゼラチン含有のPBS中において室温で30分間ブロックし、0.5%ゼラチンおよび0.5%Tween−20含有のPBS中で1:200に希釈したRSVタンパク質に対するマウスモノクローナル抗体(NCL−RSV3、Novocastra)のプールにおいて室温で2時間染色した。洗浄後、0.5%ゼラチンおよび0.5%Tween−20含有のPBSで1:1000に希釈したポリクローナルウサギ抗−マウス免疫グロブリンHRP−抱合体(P0260;DakoCytomation)を添加し、室温で2時間インキュベートした。プレートを洗浄し、オルト−フェニレンジアミンの添加により発色させた。H2SO4の添加により反応を止め、プレートをELISAプレートリーダーで490nmを読み取った。
融合阻害アッセイを、ウイルスが細胞に添加され、完全MEMで希釈された試験物質が添加される前に37℃;5%CO2で1.5時間インキュベートすることを除いて、基本的にマイクロ中和試験と同様に行った。プレートを37℃;5%CO2で2−3日間インキュベートし、上に記載のとおりに発色させた。
k.インビボ保護アッセイ
k−1 マウス誘発モデル
7−8週齢の雌BALB/cマウスに、0.2ml抗体調製物を研究−1日目に腹腔内に接種した。プラセボ処理マウスを同様に0.1mlPBS緩衝液で腹腔内に接種した。研究0日目に、マウスに吸入イソフルオランを用いて麻酔をかけ、50μl中の10−6〜10−7pfuのRSV株A2または細胞溶解物(偽の接種菌液)で鼻腔内に接種した。麻酔から完全に回復させて真っ直ぐに立たせると同時に、マウスに30秒接種菌液を吸引させた。
k−1 マウス誘発モデル
7−8週齢の雌BALB/cマウスに、0.2ml抗体調製物を研究−1日目に腹腔内に接種した。プラセボ処理マウスを同様に0.1mlPBS緩衝液で腹腔内に接種した。研究0日目に、マウスに吸入イソフルオランを用いて麻酔をかけ、50μl中の10−6〜10−7pfuのRSV株A2または細胞溶解物(偽の接種菌液)で鼻腔内に接種した。麻酔から完全に回復させて真っ直ぐに立たせると同時に、マウスに30秒接種菌液を吸引させた。
誘発5日後、マウスを過剰量のペントバルビタールナトリウムで屠殺した。屠殺後、血清を調製するために腋窩脈管からの放血により血液を得た。肺を取り除き、滅菌した砂を用いて2.5ml緩衝液中でホモジェナイズした。肺のホモジェナイズ物を遠心分離して砂と細胞破片を沈降させ、上澄み液を一定分量採取し、−70℃で保存した。
ウイルス負荷を、逆転写酵素(RT−)PCRを用いる肺サンプル中のRSV RNAコピー数の定量化により調べた。製造業者の説明書に従って、抽出システムを自動化したMagNA Pure LC Total Nucleic Acidキット(Roche Diagnostics)を用いて、肺のホモジェナイズサンプルからRNAを抽出した。Whileyら(J. Clinical Microbiol.2002, 40: 4418-22)により開示されるgごとくRSVサブタイプAのN遺伝子に特異的なプライマーおよびフルオロフォア標識プローブによるLightCycle機器および試薬(Roche Diagnostics)を用いて、single−tubeリアル−タイムRT−PCRにより、RSV RNAの検出を行った。公知のRSV RNAコピー数を有するサンプルを同様に解析することにより標準曲線を作成した。
肺組織サンプルにおける異なるサイトカインおよびケモカインのレベルを、齧歯類のmulti−analyte profile(MAP)を用いるRules−Based Medicine(テキサス州、オースティン)で市販される複数の免疫アッセイにより調べた。
k−2 コットンラット誘発モデル
6−8週齢の雌コットンラット(Sigmodon hispidus)に、0.5mlの抗体調製物またはプラセボ(PBS)を研究−1日目に腹腔内に接種する。24時間後、イソフルオランで早急に麻酔にかけ、10−6−10−7pfuのRSV株A2またはコントロール培地(偽の接種菌液)の鼻腔内誘発を与える。総体積100μlの接種菌液を投与し、両方の鼻腔に均等に分布させる。鼻腔内誘発の完了後、各ラットを最低30秒間真っ直ぐに立たせてから接種菌液を完全に吸気させる。誘発5日後、ペントバルビタールの致死性腹腔内注射により屠殺し、心臓穿刺により放血させる。血清サンプルを採取し、−80℃で凍結し、各ラットを肺および鼻腔組織を除去するために無菌条件下で解剖する。組織サンプルをホモジェナイズし、上澄み液を−80℃において一定分量で保存した。
6−8週齢の雌コットンラット(Sigmodon hispidus)に、0.5mlの抗体調製物またはプラセボ(PBS)を研究−1日目に腹腔内に接種する。24時間後、イソフルオランで早急に麻酔にかけ、10−6−10−7pfuのRSV株A2またはコントロール培地(偽の接種菌液)の鼻腔内誘発を与える。総体積100μlの接種菌液を投与し、両方の鼻腔に均等に分布させる。鼻腔内誘発の完了後、各ラットを最低30秒間真っ直ぐに立たせてから接種菌液を完全に吸気させる。誘発5日後、ペントバルビタールの致死性腹腔内注射により屠殺し、心臓穿刺により放血させる。血清サンプルを採取し、−80℃で凍結し、各ラットを肺および鼻腔組織を除去するために無菌条件下で解剖する。組織サンプルをホモジェナイズし、上澄み液を−80℃において一定分量で保存した。
組織サンプルにおけるウイルス負荷を、Vam Eldenらの方法(J Clin Microbiol2003, 41(9):4378-4381)に基づくTaq−Manリアル−タイムアッセイによりRSV RNAコピー数を定量化することで調べる。簡単に説明すると、製造業者の説明書に従ってRNeasy(Qiagen)法を用いて、肺のホモジェナイズしたサンプルからRNAを抽出する。抽出されたRNAをcDNAに逆転写させ、次いで、RSVサブタイプAのN遺伝子に特異的なプライマーおよび標識プローブとともにSuperscript III Platinum One Step Quantitative RT−PCR system(Invitrogen)を用いてPCRにより増幅する。公知のRSV濃度を有するサンプルを同様に解析して標準曲線を作成する。
本実施例では、抗−RSV特異性を有する全長抗体として発現される同種VHおよびVLペアーを含むクローンの単離、スクリーニング、選択および保存を例示した。
ドナー
合計89人のドナーを、RSVの季節に従業者およびビィドゥビェ病院(デンマーク)の小児科に入院した子供の両親の中から採用した。18mlの最初の血液サンプルを採血し、CD19+B細胞を精製し(実施例1、セクションa)、ELISpotを用いて抗−RSV抗体の存在について検査し(実施例1、セクションb)、血漿細胞の発生頻度をFACS解析により調べた。
合計89人のドナーを、RSVの季節に従業者およびビィドゥビェ病院(デンマーク)の小児科に入院した子供の両親の中から採用した。18mlの最初の血液サンプルを採血し、CD19+B細胞を精製し(実施例1、セクションa)、ELISpotを用いて抗−RSV抗体の存在について検査し(実施例1、セクションb)、血漿細胞の発生頻度をFACS解析により調べた。
最初の血液サンプルのスクリーニング時に11人のドナーが陽性と見出され、これらのうちの10人から450mlの2回目の血液サンプルを採血した。形質芽細胞を実施例1のセクションaに従って単一細胞に分別した。ELISpotをCD19陽性B細胞の画分について行った。
2回目の供血では、合計血漿細胞集団のうちの0.2および0.6%間のRSV特異的な血漿細胞(IgG+およびIgA+)のELISpot頻度を有する4人のドナーを同定した。これらの頻度を、同種VHおよびVLペアーのレパートリーの連結を促進するのに十分高いと考えた。
同種VHおよびVLをコードするペアーの単離
抗体のレパートリーをコードする核酸を、5人のドナーに由来する単一細胞に分別された血漿細胞から多重重複伸長RT−PCR(実施例1、セクションc)により単離した。多重重複伸長RT−PCRは、重鎖可変領域遺伝子フラグメント(VH)および全長軽鎖(LC)の間に物理的連結を作出する。VH増幅用に1つおよびLC増幅用に1つである2つのプライマーセットを用いることにより、全てのVH−遺伝子ファミリーとカッパ軽鎖の抗体遺伝子を増幅するためにプロトコルを設計した。逆転写および多重重複伸長PCRに続いて、連結された配列をネスティドプライマーのセットによる2番目のPCR増幅にかけた。
抗体のレパートリーをコードする核酸を、5人のドナーに由来する単一細胞に分別された血漿細胞から多重重複伸長RT−PCR(実施例1、セクションc)により単離した。多重重複伸長RT−PCRは、重鎖可変領域遺伝子フラグメント(VH)および全長軽鎖(LC)の間に物理的連結を作出する。VH増幅用に1つおよびLC増幅用に1つである2つのプライマーセットを用いることにより、全てのVH−遺伝子ファミリーとカッパ軽鎖の抗体遺伝子を増幅するためにプロトコルを設計した。逆転写および多重重複伸長PCRに続いて、連結された配列をネスティドプライマーのセットによる2番目のPCR増幅にかけた。
各々のドナーについて個別に処理し、多重重複RT−PCRにより1480から2450個の重複産物を作成した。各ドナーからの同種の連結したVHおよびVLをコードするペアーの作成したコレクションをプールし、実施例1のセクションd)に記載されるごとき哺乳動物IgG発現ベクター(図3)に組み込んだ。作成したレパートリーをE.coliに形質転換させ、20個の384−ウェルプレート中で一元管理し、保存した。レパートリーは、ドナーあたり1×106および3.6×106個の間のクローンで構成した。
スクリーニング
IgG抗体を含む上澄み液を、マスタープレートに由来する細菌クローンから調製したDNAで一過的にトランスフェクトしたCHO細胞から得た。上澄み液を実施例1、セクションeに記載されるごとく選択した。約600個の一次ヒット物を配列決定し、並列比較した。大部分は2つまたはそれ以上のメンバーのクラスターに収まったが、いわゆるシングルトンとして単離されたわずかなクローンも存在した。各クラスターおよびシングルトンに由来する代表的なクローンを、実施例1、セクションe)に記載されるごとき検証研究にかけた。多くの一次ヒット物を、不対システイン、潜在的なPCRエラーである保存されていない変異、多重コドンの挿入および/または欠失、ならびに切断のごとき望まれていない配列の特徴のため、さらなる特徴付けから排斥した。
IgG抗体を含む上澄み液を、マスタープレートに由来する細菌クローンから調製したDNAで一過的にトランスフェクトしたCHO細胞から得た。上澄み液を実施例1、セクションeに記載されるごとく選択した。約600個の一次ヒット物を配列決定し、並列比較した。大部分は2つまたはそれ以上のメンバーのクラスターに収まったが、いわゆるシングルトンとして単離されたわずかなクローンも存在した。各クラスターおよびシングルトンに由来する代表的なクローンを、実施例1、セクションe)に記載されるごとき検証研究にかけた。多くの一次ヒット物を、不対システイン、潜在的なPCRエラーである保存されていない変異、多重コドンの挿入および/または欠失、ならびに切断のごとき望まれていない配列の特徴のため、さらなる特徴付けから排斥した。
合計85個のユニークなクローンが検証を通過した。これらを表5にまとめる。各クローン番号は、特定のVHおよびVLペアーを特定する。IGHVおよびIGKV遺伝子ファミリーは、各クローンについて示され、選択されたクローンのフレームワーク領域(FR)を特定する。各クローンから発現される抗体の相補性決定領域(CDR)のアミノ酸配列が示され、CDRH1、CDRH2、CDRH3は、重鎖のCDR領域1、2および3を示し、CDRL1、CDRL2およびCDRL3は、軽鎖のCDR領域1、2および3を示す。
完全な可変重鎖および軽鎖配列は、表5の情報から定めることができる。
表5の各欄についてのさらなる詳細を以下に記載する。
IGHVおよびIGKV遺伝子ファミリー名を公式のHUGO/IMGT命名法(IMGT; Lefranc & Lefranc, 2001, The Immunoglobulin FactsBook, Academic Press)に従って割り当てた。番号付けと並列比較は、Chothia(Al-Lazikani et al.1997 J.Mol.Biol. 273:927-48)による。クローン809はCDRH1の5’に対して2個のコドンの挿入を有し、伸長されたCDRループに翻訳されうる。クローン831はCDRH1の位置31に1個のコドンの欠失を有する。
欄「Ag」は、ELISA、FLISAおよび/またはBiacoreにより調べられるごとく、命名されたクローンから産生される抗体により認識されるRSV関連抗原を示す。「+」は、クローンがRSV粒子および/またはRSV感染細胞に結合するが、抗原が同定されていないことを示す。
欄「エピトープ」は、命名されたクローンから産生される抗体により認識される抗原部位またはエピトープを示す(表4および下記を参照)。「U」は、エピトープが知られていないことを示す。UCIおよびUCIIは、未知のクラスターIおよびIIを意味する。これらのクラスターに属する抗体は、類似の反応プロファイルを示すが、いまだ特定のエピトープに割り当てられていない。いくつかの抗体は、A&Cのごとく複合的なエピトープを認識する。()に示されるエピトープはELISAのみで同定されている。
CDRH1と名付けられた欄における上段から下段までのアミノ酸配列は、配列番号:201−285と同じ順番で記載される。
CDRH2と名付けられた欄における上段から下段までのアミノ酸配列は、配列番号:286−370と同じ順番で記載される。
CDRH3と名付けられた欄における上段から下段までのアミノ酸配列は、配列番号:371−455と同じ順番で記載される。
CDRL1と名付けられた欄における上段から下段までのアミノ酸配列は、配列番号:456−540と同じ順番で記載される。
CDRL2と名付けられた欄における上段から下段までのアミノ酸配列は、配列番号:541−625と同じ順番で記載される。
CDRL3と名付けられた欄における上段から下段までのアミノ酸配列は、配列番号:626−710と同じ順番で記載される。
抗原特異性の特徴付け
検証期間に、クローンの抗原特異性を、ウイルス粒子、可溶性GおよびFタンパク質ならびにGタンパク質のフラグメントに対する結合性によりある程度まで調べた。
検証期間に、クローンの抗原特異性を、ウイルス粒子、可溶性GおよびFタンパク質ならびにGタンパク質のフラグメントに対する結合性によりある程度まで調べた。
抗−F反応性を有するクローンにおいては、さらに、抗原部位、可能ならば各クローンにより結合されるエピトープを調べるために、クローンから発現される各抗体の特異性を測定した(実施例1、セクションg−4を参照)。図4は、Biacore解析を用いて、クローン801から得られた抗体のエピトープ特異性の特徴付けを示す。解析は、タンパク質Fが、抗体801のBiacore細胞への注入前に133−1hまたはパリビズマブ(抗原部位CおよびII各々)により阻害される場合、高い抗体801結合性が検出できることを示す。競合した801抗体の結合性は、競合しない801抗体の結合性と比較してわずかに減少する。しかしながら、この減少は非常に低いため、結合部位の直接競合より立体構造の障害による可能性が高い。抗体801のBiacore細胞への注入前の9c5抗体(抗原部位F1)を有するタンパク質Fの阻害は、Fタンパク質への抗体801結合性のほぼ完全な阻害を示す。それゆえ、抗体801はF1部位、またはそれに非常に近い部位でタンパク質Fに結合することとなる。
抗−G反応性を有するクローンにおいては、さらに、各抗体がGタンパク質の中心ドメイン、保存領域、またはGCRRに結合するかどうか、また、エピトープが保存またはサブタイプ特異的であるかを調べるために、クローンから発現される各抗体の特異性を測定した。このことは、以下のGタンパク質フラグメントを用いるELISAおよび/またはFLISAにより行った:
G(B):(DG44CHO細胞で発現される)RSV株18537に由来する残基66−292
G(B)フラグメント:(E.coliで発現される)RSV株18537に由来する残基127−203
GCRR A:(選択的に形成されたシステイン架橋を伴って合成される)RSV株Longに由来する残基171−187
GCRR B:(選択的に形成されたシステイン架橋を伴って合成される)RSV株18537に由来する残基171−187
G保存:残基164−176
G(B):(DG44CHO細胞で発現される)RSV株18537に由来する残基66−292
G(B)フラグメント:(E.coliで発現される)RSV株18537に由来する残基127−203
GCRR A:(選択的に形成されたシステイン架橋を伴って合成される)RSV株Longに由来する残基171−187
GCRR B:(選択的に形成されたシステイン架橋を伴って合成される)RSV株18537に由来する残基171−187
G保存:残基164−176
さらなるエピトープ解析を、実施例1、セクションg−4に記載されるごとき競合アッセイにより抗−G反応性クローンにおいても行った。
さらに、実施例1、セクションeに記載されるごときスクリーニング手法で同定されたクローンのうちの1つは、SH特異的な抗体を産生する。加えて、多くのクローンは、1つまたはそれ以上の試験されたRSV株に結合するが、抗原は調べられなかった。
全ての検証されたクローンにおける抗原特異性に関するデータを表5にまとめる。検証されたクローンはいずれもヒト咽頭上皮細胞に結合せず、試験されたG−特異的クローン(793、816、835、841、853、855、856、および888)のいずれもまたヒトフラクタルカイン(CX3CL1)に結合しなかった。
結合反応速度の特徴付け
組み換えRSV抗原に関する結合親和性を、番号付けした抗体クローンにおける表面プラズモン共鳴により調べた。全長抗体の酵素切断により調製されたFabフラグメントで解析を行った。ピコモルからナノモル範囲におけるKD値を有する多くの高親和性抗体クローンについてのデータを表6に表す。市販されているパリビズマブ(Synagis)から得たFabフラグメントを対照として同様に解析した。
組み換えRSV抗原に関する結合親和性を、番号付けした抗体クローンにおける表面プラズモン共鳴により調べた。全長抗体の酵素切断により調製されたFabフラグメントで解析を行った。ピコモルからナノモル範囲におけるKD値を有する多くの高親和性抗体クローンについてのデータを表6に表す。市販されているパリビズマブ(Synagis)から得たFabフラグメントを対照として同様に解析した。
表5におけるクローン番号735、736、744、793、795、796、799、800、801、804、810、811、812、814、816、817、818、819、824、825、827、828、829、830、831、835、838、841、853、855、856、857、858、859、861、863、868、870、871、880、881、884、885、886、888、894および955に対応する47個のユニークな同種VHおよびVLをコードするペアーのサブセットを、単一のVHおよびVL遺伝子配列からユニークな抗体をそれぞれ発現する安定な個々の発現細胞株の作成のために選択した。44個の選択されたクローン(上記に同定された828、885、および955を除く)の全配列(DNAおよび推定アミノ酸)を配列番号:1−176に示す。
44個のクローンを、配列番号:1−44に記載される以下のVH配列を産生することにより特徴付けする:
クローン番号735:
QVQLQESGPGLVKPSETLSLTCTVSNGAIGDYDWSWIRQSPGKGLEWIGNINYRGNTNYNPSLKSRVTMSLRTSTMQFSLKLSSATAADTAVYYCARDVGYGGGQYFAMDVWSPGTTVTVSS
QVQLQESGPGLVKPSETLSLTCTVSNGAIGDYDWSWIRQSPGKGLEWIGNINYRGNTNYNPSLKSRVTMSLRTSTMQFSLKLSSATAADTAVYYCARDVGYGGGQYFAMDVWSPGTTVTVSS
クローン番号736:
QVQLVESGGGVVQPGGSLRLSCTASGFTFSTYGMHWVRQAPGKGLEWVAFIRYDGSTQDYVDSVKGRFTISRDNSKNMVYVQMNSLRVEDTAVYYCAKDMDYYGSRSYSVTYYYGMDVWGQGTTVTVSS
QVQLVESGGGVVQPGGSLRLSCTASGFTFSTYGMHWVRQAPGKGLEWVAFIRYDGSTQDYVDSVKGRFTISRDNSKNMVYVQMNSLRVEDTAVYYCAKDMDYYGSRSYSVTYYYGMDVWGQGTTVTVSS
クローン番号744:
QVQLVQSGAEVKKPGASVKVSCKASGYTFSGYYMHWVRQAPGQGLEWMGWINTSSGGTNYAQKFQGRVTMTRDTSISTAHMELRRLRSDDTAVYYCAREDGTMGTNSWYGWFDPWGQGTLVTVSS
QVQLVQSGAEVKKPGASVKVSCKASGYTFSGYYMHWVRQAPGQGLEWMGWINTSSGGTNYAQKFQGRVTMTRDTSISTAHMELRRLRSDDTAVYYCAREDGTMGTNSWYGWFDPWGQGTLVTVSS
クローン番号793:
QVQLVESGGGLVKPGGSLRLSCAASGFPFGDYYMSWIRQAPGKGLEWVAYINRGGTTIYYADSVKGRFTISRDNAKNSLFLQMNSLRAGDTALYYCARGLILALPTATVELGAFDIWGQGTMVTVSS
QVQLVESGGGLVKPGGSLRLSCAASGFPFGDYYMSWIRQAPGKGLEWVAYINRGGTTIYYADSVKGRFTISRDNAKNSLFLQMNSLRAGDTALYYCARGLILALPTATVELGAFDIWGQGTMVTVSS
クローン番号795:
QVQLQESGPGLVKPSQTLSLTCTVSGASISSGDYYWSWIRQSPRKGLEWIGYIFHSGTTYYNPSLKSRAVISLDTSKNQFSLRLTSVTAADTAVYYCARDVDDFPVWGMNRYLALWGRGTLVTVSS
QVQLQESGPGLVKPSQTLSLTCTVSGASISSGDYYWSWIRQSPRKGLEWIGYIFHSGTTYYNPSLKSRAVISLDTSKNQFSLRLTSVTAADTAVYYCARDVDDFPVWGMNRYLALWGRGTLVTVSS
クローン番号796:
QVQLVESGGGVVQPGRSLRLSCAASGFSFSHFGMHWVRQVPGKGLEWVAIISYDGNNVHYADSVKGRFTISRDNSKNTLFLQMNSLRDDDTGVYYCAKDDVATDLAAYYYFDVWGRGTLVTVSS
QVQLVESGGGVVQPGRSLRLSCAASGFSFSHFGMHWVRQVPGKGLEWVAIISYDGNNVHYADSVKGRFTISRDNSKNTLFLQMNSLRDDDTGVYYCAKDDVATDLAAYYYFDVWGRGTLVTVSS
クローン番号799:
QVQLVESGGGVVQPGRSLKLSCEASGFNFNNYGMHWVRQAPGKGLEWVAVISYDGRNKYFADSVKGRFIISRDDSRNTVFLQMNSLRVEDTAVYYCARGSVQVWLHLGLFDNWGQGTLVTVSS
QVQLVESGGGVVQPGRSLKLSCEASGFNFNNYGMHWVRQAPGKGLEWVAVISYDGRNKYFADSVKGRFIISRDDSRNTVFLQMNSLRVEDTAVYYCARGSVQVWLHLGLFDNWGQGTLVTVSS
クローン番号800:
QVQLVESGGAVVQPGRSLRLSCEVSGFSFSDYGMNWVRQGPGKGLEWVAVIWHDGSNKNYLDSVKGRFTVSRDNSKNTLFLQMNSLRAEDTAVYYCARTPYEFWSGYYFDFWGQGTLVTVSS
QVQLVESGGAVVQPGRSLRLSCEVSGFSFSDYGMNWVRQGPGKGLEWVAVIWHDGSNKNYLDSVKGRFTVSRDNSKNTLFLQMNSLRAEDTAVYYCARTPYEFWSGYYFDFWGQGTLVTVSS
クローン番号801:
QVQLVESGGGVVQPGRSLRLSCAASGFPFNSYAMHWVRQAPGKGLEWVAVIYYEGSNEYYADSVKGRFTISRDNSKNTLYLQMDSLRAEDTAVYYCARKWLGMDFWGQGTLVTVSS
QVQLVESGGGVVQPGRSLRLSCAASGFPFNSYAMHWVRQAPGKGLEWVAVIYYEGSNEYYADSVKGRFTISRDNSKNTLYLQMDSLRAEDTAVYYCARKWLGMDFWGQGTLVTVSS
クローン番号804:
EVQLVESGGGLVRPGGSLRLSCSASGFTFSNYAMHWVRQAPGKRLEYVSATSTDGGSTYYADSLKGTFTISRDNSKNTLYLQMSSLSTEDTAIYYCARRFWGFGNFFDYWGRGTLVTVSS
EVQLVESGGGLVRPGGSLRLSCSASGFTFSNYAMHWVRQAPGKRLEYVSATSTDGGSTYYADSLKGTFTISRDNSKNTLYLQMSSLSTEDTAIYYCARRFWGFGNFFDYWGRGTLVTVSS
クローン番号810:
QVQLVQSGAEVKKSGSSVKVSCRASGGTFGNYAINWVRQAPGQGLEWVGRIIPVFDTTNYAQKFQGRVTITADRSTNTAIMQLSSLRPQDTAMYYCLRGSTRGWDTDGFDIWGQGTMVTVSS
QVQLVQSGAEVKKSGSSVKVSCRASGGTFGNYAINWVRQAPGQGLEWVGRIIPVFDTTNYAQKFQGRVTITADRSTNTAIMQLSSLRPQDTAMYYCLRGSTRGWDTDGFDIWGQGTMVTVSS
クローン番号811:
QVQLVQSGAVVETPGASVKVSCKASGYIFGNYYIHWVRQAPGQGLEWMAVINPNGGSTTSAQKFQDRITVTRDTSTTTVYLEVDNLRSEDTATYYCARQRSVTGGFDAWLLIPDASNTWGQGTMVTVSS
QVQLVQSGAVVETPGASVKVSCKASGYIFGNYYIHWVRQAPGQGLEWMAVINPNGGSTTSAQKFQDRITVTRDTSTTTVYLEVDNLRSEDTATYYCARQRSVTGGFDAWLLIPDASNTWGQGTMVTVSS
クローン番号812:
QVQLVQSGAEMKKPGSSVKVSCKASGGSFSSYSISWVRQAPGRGLEWVGMILPISGTTNYAQTFQGRVIISADTSTSTAYMELTSLTSEDTAVYFCARVFREFSTSTLDPYYFDYWGQGTLVTVSS
QVQLVQSGAEMKKPGSSVKVSCKASGGSFSSYSISWVRQAPGRGLEWVGMILPISGTTNYAQTFQGRVIISADTSTSTAYMELTSLTSEDTAVYFCARVFREFSTSTLDPYYFDYWGQGTLVTVSS
クローン番号814:
QVQLVESGGGVVQPGKSVRLSCVGSGFRLMDYAMHWVRQAPGKGLDWVAVISYDGANEYYAESVKGRFTVSRDNSDNTLYLQMKSLRAEDTAVYFCARAGRSSMNEEVIMYFDNWGLGTLVTVSS
QVQLVESGGGVVQPGKSVRLSCVGSGFRLMDYAMHWVRQAPGKGLDWVAVISYDGANEYYAESVKGRFTVSRDNSDNTLYLQMKSLRAEDTAVYFCARAGRSSMNEEVIMYFDNWGLGTLVTVSS
クローン番号816:
EVQLLESGGGLVQPGGSLRLSCVASGFTFSTYAMTWVRQAPGKGLEWVSVIRASGDSEIYADSVRGRFTISRDNSKNTVFLQMDSLRVEDTAVYFCANIGQRRYCSGDHCYGHFDYWGQGTLVTVSS
EVQLLESGGGLVQPGGSLRLSCVASGFTFSTYAMTWVRQAPGKGLEWVSVIRASGDSEIYADSVRGRFTISRDNSKNTVFLQMDSLRVEDTAVYFCANIGQRRYCSGDHCYGHFDYWGQGTLVTVSS
クローン番号817:
QVQLVESGGGVVQPGRSLRLSCAASGFGFNTHGMHWVRQAPGKGLEWLSIISLDGIKTHYADSVKGRFTISRDNSKNTVFLQLSGLRPEDTAVYYCAKDHIGGTNAYFEWTVPFDGWGQGTLVTVSS
QVQLVESGGGVVQPGRSLRLSCAASGFGFNTHGMHWVRQAPGKGLEWLSIISLDGIKTHYADSVKGRFTISRDNSKNTVFLQLSGLRPEDTAVYYCAKDHIGGTNAYFEWTVPFDGWGQGTLVTVSS
クローン番号818:
QVTLRESGPAVVKPTETLTLTCAFSGFSLNAGRVGVSWIRQPPGQAPEWLARIDWDDDKAFRTSLKTRLSISKDSSKNQVVLTLSNMDPADTATYYCARTQVFASGGYYLYYLDHWGQGTLVTVSS
QVTLRESGPAVVKPTETLTLTCAFSGFSLNAGRVGVSWIRQPPGQAPEWLARIDWDDDKAFRTSLKTRLSISKDSSKNQVVLTLSNMDPADTATYYCARTQVFASGGYYLYYLDHWGQGTLVTVSS
クローン番号819:
QVQLQESGPGLVKPSQTLSLTCTVSSGAISGADYYWSWIRQPPGKGLEWVGFIYDSGSTYYNPSLRSRVTISIDTSKKQFSLKLTSVTAADTAVYYCARDLGYGGNSYSHSYYYGLDVWGRGTTVTVSS
QVQLQESGPGLVKPSQTLSLTCTVSSGAISGADYYWSWIRQPPGKGLEWVGFIYDSGSTYYNPSLRSRVTISIDTSKKQFSLKLTSVTAADTAVYYCARDLGYGGNSYSHSYYYGLDVWGRGTTVTVSS
クローン番号824:
QVQLQESGPGLVKPSETLSLTCTVSGGSIGNYYWGWIRQPPGKGLEWIGHIYFGGNTNYNPSLQSRVTISVDTSRNQFSLKLNSVTAADTAVYYCARDSSNWPAGYEDWGQGTLVTVSS
QVQLQESGPGLVKPSETLSLTCTVSGGSIGNYYWGWIRQPPGKGLEWIGHIYFGGNTNYNPSLQSRVTISVDTSRNQFSLKLNSVTAADTAVYYCARDSSNWPAGYEDWGQGTLVTVSS
クローン番号825:
QVQLVQSGAEVKKPGASVKVSCKVSGYTFTSNGLSWVRQAPGQGFEWLGWISASSGNKKYAPKFQGRVTLTTDISTSTAYMELRSLRSDDTAVYYCAKDGGTYVPYSDAFDFWGQGTMVTVSS
QVQLVQSGAEVKKPGASVKVSCKVSGYTFTSNGLSWVRQAPGQGFEWLGWISASSGNKKYAPKFQGRVTLTTDISTSTAYMELRSLRSDDTAVYYCAKDGGTYVPYSDAFDFWGQGTMVTVSS
クローン番号827:
QVQLVQSGAEVKKPGASVKVSCRVSGHTFTALSKHWMRQGPGGGLEWMGFFDPEDGDTGYAQKFQGRVTMTEDTATGTAYMELSSLTSDDTAVYYCATVAAAGNFDNWGQGTLVTVSS
QVQLVQSGAEVKKPGASVKVSCRVSGHTFTALSKHWMRQGPGGGLEWMGFFDPEDGDTGYAQKFQGRVTMTEDTATGTAYMELSSLTSDDTAVYYCATVAAAGNFDNWGQGTLVTVSS
クローン番号829:
QVTLKESGPALVKATQTLTLTCTFSGFSLSRNRMSVSWIRQPPGKALEWLARIDWDDDKFYNTSLQTRLTISKDTSKNQVVLTMTNMDPVDTATYYCARTGIYDSSGYYLYYFDYWGQGTLVTVSS
QVTLKESGPALVKATQTLTLTCTFSGFSLSRNRMSVSWIRQPPGKALEWLARIDWDDDKFYNTSLQTRLTISKDTSKNQVVLTMTNMDPVDTATYYCARTGIYDSSGYYLYYFDYWGQGTLVTVSS
クローン番号830:
QVQLVQSGAEVKVPGASVKVSCKASGYTFTTYGVSWVRQAPGQGLEWMGWISAYNGNTYYLQKLQGRVTMTTDTSTSTAYMELRGLRSDDTAMYYCARDRVGGSSSEVLSRAKNYGLDVWGQGTTVTVSS
QVQLVQSGAEVKVPGASVKVSCKASGYTFTTYGVSWVRQAPGQGLEWMGWISAYNGNTYYLQKLQGRVTMTTDTSTSTAYMELRGLRSDDTAMYYCARDRVGGSSSEVLSRAKNYGLDVWGQGTTVTVSS
クローン番号831:
QVQLVQSGAEVKKPGASVKVSCKASANIFTYAMHWVRQAPGQRLEWMGWINVGNGQTKYSQRFQGRVTITRDTSATTAYMELSTLRSEDTAVYYCARRASQYGEVYGNYFDYWGQGTLVTVSS
QVQLVQSGAEVKKPGASVKVSCKASANIFTYAMHWVRQAPGQRLEWMGWINVGNGQTKYSQRFQGRVTITRDTSATTAYMELSTLRSEDTAVYYCARRASQYGEVYGNYFDYWGQGTLVTVSS
クローン番号835:
QVQLVQSGAEVKRPGASVKVSCKASGYTFISYGFSWVRQAPGQGLEWMGWSSVYNGDTNYAQKFHGRVNMTTDTSTNTAYMELRGLRSDDTAVYFCARDRNVVLLPAAPFGGMDVWGQGTMVTVSS
QVQLVQSGAEVKRPGASVKVSCKASGYTFISYGFSWVRQAPGQGLEWMGWSSVYNGDTNYAQKFHGRVNMTTDTSTNTAYMELRGLRSDDTAVYFCARDRNVVLLPAAPFGGMDVWGQGTMVTVSS
クローン番号838:
QVQLVESGGGVVQPGTSLRLSCAASGFTFSTFGMHWVRQAPGKGLEWVAVISYDGNKKYYADSVKGRFTISRDNSKNTLYLQVNSLRVEDTAVYYCAAQTPYFNESSGLVPDWGQGTLVTVSS
QVQLVESGGGVVQPGTSLRLSCAASGFTFSTFGMHWVRQAPGKGLEWVAVISYDGNKKYYADSVKGRFTISRDNSKNTLYLQVNSLRVEDTAVYYCAAQTPYFNESSGLVPDWGQGTLVTVSS
クローン番号841:
QVQLVQSGAEVKKPGASVKVSCKASGYTFISFGISWVRQAPGQGLEWMGWISAYNGNTDYAQRLQDRVTMTRDTATSTAYLELRSLKSDDTAVYYCTRDESMLRGVTEGFGPIDYWGQGTLVTVSS
QVQLVQSGAEVKKPGASVKVSCKASGYTFISFGISWVRQAPGQGLEWMGWISAYNGNTDYAQRLQDRVTMTRDTATSTAYLELRSLKSDDTAVYYCTRDESMLRGVTEGFGPIDYWGQGTLVTVSS
クローン番号853:
EVQLVQSGAEVKKPGQSLKISCKTSGYIFTNYWIGWVRQRPGKGLEWMGVIFPADSDARYSPSFQGQVTISADKSIGTAYLQWSSLKASDTAIYYCARPKYYFDSSGQFSEMYYFDFWGQGTLVTVSS
EVQLVQSGAEVKKPGQSLKISCKTSGYIFTNYWIGWVRQRPGKGLEWMGVIFPADSDARYSPSFQGQVTISADKSIGTAYLQWSSLKASDTAIYYCARPKYYFDSSGQFSEMYYFDFWGQGTLVTVSS
クローン番号855:
QVQLVQSGPEVKKPGASVKVSCKASGYVLTNYAFSWVRQAPGQGLEWLGWISGSNGNTYYAEKFQGRVTMTTDTSTSTAYMELRSLRSDDTAVYFCARDLLRSTYFDYWGQGTLVTVSS
QVQLVQSGPEVKKPGASVKVSCKASGYVLTNYAFSWVRQAPGQGLEWLGWISGSNGNTYYAEKFQGRVTMTTDTSTSTAYMELRSLRSDDTAVYFCARDLLRSTYFDYWGQGTLVTVSS
クローン番号856:
QVQLVQSGAEVKKPGASVKVSCKASGYTFSNYGFSWVRQAPGRGLEWMGWISAYNGNTYYAQNLQGRVTMTTDTSTTTAYMVLRSLRSDDTAMYYCARDGNTAGVDMWSRDGFDIWGQGTMVTVSS
QVQLVQSGAEVKKPGASVKVSCKASGYTFSNYGFSWVRQAPGRGLEWMGWISAYNGNTYYAQNLQGRVTMTTDTSTTTAYMVLRSLRSDDTAMYYCARDGNTAGVDMWSRDGFDIWGQGTMVTVSS
クローン番号857:
EVQLLESGGGLVQPGGPLRLSCVASGFSFSSYAMNWIRLAPGKGLEWVSGISGSGGSTYYGDSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKEPWIDIVVASVISPYYYDGMDVWGQGTTVTVSS
EVQLLESGGGLVQPGGPLRLSCVASGFSFSSYAMNWIRLAPGKGLEWVSGISGSGGSTYYGDSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKEPWIDIVVASVISPYYYDGMDVWGQGTTVTVSS
クローン番号858:
QVQLVQSGAEVKKPGSSVKVSCKASGGSFDGYTISWLRQAPGQGLEWMGRVVPTLGFPNYAQKFQGRVTVTADRSTNTAYLELSRLTSEDTAVYYCARMNLGSHSGRPGFDMWGQGTLVTVSS
QVQLVQSGAEVKKPGSSVKVSCKASGGSFDGYTISWLRQAPGQGLEWMGRVVPTLGFPNYAQKFQGRVTVTADRSTNTAYLELSRLTSEDTAVYYCARMNLGSHSGRPGFDMWGQGTLVTVSS
クローン番号859:
QVQLVESGGGVVQPGRSLRLSCAVSGSSFSKYGIHWVRQAPGKGLEWVAVISYDGSKKYFTDSVKGRFTIARDNSQNTVFLQMNSLRAEDTAVYYCATGGGVNVTSWSDVEHSSSLGYWGLGTLVTVSS
QVQLVESGGGVVQPGRSLRLSCAVSGSSFSKYGIHWVRQAPGKGLEWVAVISYDGSKKYFTDSVKGRFTIARDNSQNTVFLQMNSLRAEDTAVYYCATGGGVNVTSWSDVEHSSSLGYWGLGTLVTVSS
クローン番号861:
QVQLVESGGGVVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAFIWNDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCVKDEVYDSSGYYLYYFDSWGQGTLVTVSS
QVQLVESGGGVVQPGGSLRLSCAASGFTFSSYGMHWVRQAPGKGLEWVAFIWNDGSNKYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCVKDEVYDSSGYYLYYFDSWGQGTLVTVSS
クローン番号863:
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYTMSWVRQAPGKGLEWVSSISASTVLTYYADSVKGRFTISRDNSKNTLYLQMSSLRAEDTAVYYCAKDYDFWSGYPGGQYWFFDLWGRGTLVTVSS
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYTMSWVRQAPGKGLEWVSSISASTVLTYYADSVKGRFTISRDNSKNTLYLQMSSLRAEDTAVYYCAKDYDFWSGYPGGQYWFFDLWGRGTLVTVSS
クローン番号868:
QVQLQESGPGLVTPSETLSVTCTVSNYSIDNAYYWGWIRQPPGKGLEWIGSIHHSGSAYYNSSLKSRATISIDTSKNQFSLNLRSVTAADTAVYYCARDTILTFGEPHWFDPWGQGTLVTVSS
QVQLQESGPGLVTPSETLSVTCTVSNYSIDNAYYWGWIRQPPGKGLEWIGSIHHSGSAYYNSSLKSRATISIDTSKNQFSLNLRSVTAADTAVYYCARDTILTFGEPHWFDPWGQGTLVTVSS
クローン番号870:
QVQLQESGPGLVKPSETLSLTCTVSGDSISNYYWSWIRQPPGKGLEWIGEISNTWSTNYNPSLKSRVTISLDMPKNQLSLKLSSVTAADTAVYYCARGLFYDSGGYYLFYFQHWGQGTLVTVSS
QVQLQESGPGLVKPSETLSLTCTVSGDSISNYYWSWIRQPPGKGLEWIGEISNTWSTNYNPSLKSRVTISLDMPKNQLSLKLSSVTAADTAVYYCARGLFYDSGGYYLFYFQHWGQGTLVTVSS
クローン番号871:
QVQLVESGGGVVQPGRSLRVSCAASGFTFSNYGMHWVRQAPGKGLEWVAVIWYDDSNKQYGDSVKGRFTISRDNSKSTLYLQMDRLRVEDTAVYYCARASEYSISWRHRGVLDYWGQGTLVTVSS
QVQLVESGGGVVQPGRSLRVSCAASGFTFSNYGMHWVRQAPGKGLEWVAVIWYDDSNKQYGDSVKGRFTISRDNSKSTLYLQMDRLRVEDTAVYYCARASEYSISWRHRGVLDYWGQGTLVTVSS
クローン番号880:
QITLKESGPTLVRPTQTLTLTCTFSGFSLSTSKLGVGWIRQPPGKALEWLALVDWDDDRRYRPSLKSRLTVTKDTSKNQVVLTMTNMDPVDTATYYCAHSAYYTSSGYYLQYFHHWGPGTLVTVSS
QITLKESGPTLVRPTQTLTLTCTFSGFSLSTSKLGVGWIRQPPGKALEWLALVDWDDDRRYRPSLKSRLTVTKDTSKNQVVLTMTNMDPVDTATYYCAHSAYYTSSGYYLQYFHHWGPGTLVTVSS
クローン番号881:
EVQLVESGGGVVQPGGSLRLSCEVSGFTFNSYEMTWVRQAPGKGLEWVSHIGNSGSMIYYADSVKGRFTISRDNAKNSLYLQMNSLRVEDTAVYYCARSDYYDSSGYYLLYLDSWGHGTLVTVSS
EVQLVESGGGVVQPGGSLRLSCEVSGFTFNSYEMTWVRQAPGKGLEWVSHIGNSGSMIYYADSVKGRFTISRDNAKNSLYLQMNSLRVEDTAVYYCARSDYYDSSGYYLLYLDSWGHGTLVTVSS
クローン番号884:
QVQLVQSGAEVRKPGASVKVSCKASGHTFINFAMHWVRQAPGQGLEWMGYINAVNGNTQYSQKFQGRVTFTRDTSANTAYMELSSLRSEDTAVYYCARNNGGSAIIFYYWGQGTLVTVSS
QVQLVQSGAEVRKPGASVKVSCKASGHTFINFAMHWVRQAPGQGLEWMGYINAVNGNTQYSQKFQGRVTFTRDTSANTAYMELSSLRSEDTAVYYCARNNGGSAIIFYYWGQGTLVTVSS
クローン番号886:
QVQLVESGGGVVQPGRSLRLSCAASGFSFSSYGMHWVRQAPGKGLEWVAVISNDGSNKYYADSVKGRFTISRDNSKKTMYLQMNSLRAEDTAVYFCAKTTDQRLLVDWFDPWGQGTLVTVSS
QVQLVESGGGVVQPGRSLRLSCAASGFSFSSYGMHWVRQAPGKGLEWVAVISNDGSNKYYADSVKGRFTISRDNSKKTMYLQMNSLRAEDTAVYFCAKTTDQRLLVDWFDPWGQGTLVTVSS
クローン番号888:
QLQLQESGPGLVKPSETLSLTCTASGGSINSSNFYWGWIRQPPGKGLEWIGSIFYSGTTYYNPSLKSRVTISVDTSKNQFSLKLSPVTAADTAVYHCARHGFRYCNNGVCSINLDAFDIWGQGTMVTVSS
QLQLQESGPGLVKPSETLSLTCTASGGSINSSNFYWGWIRQPPGKGLEWIGSIFYSGTTYYNPSLKSRVTISVDTSKNQFSLKLSPVTAADTAVYHCARHGFRYCNNGVCSINLDAFDIWGQGTMVTVSS
クローン番号894:
QVQLVESGGGVVQPGKSLRLSCAASGFRFSDYGMHWVRQAPSKGLEWVAVIWHDGSNIRYADSVRGRFSISRDNSKNTLYLQMNSMRADDTAFYYCARVPFQIWSGLYFDHWGQGTLVTVSS
QVQLVESGGGVVQPGKSLRLSCAASGFRFSDYGMHWVRQAPSKGLEWVAVIWHDGSNIRYADSVRGRFSISRDNSKNTLYLQMNSMRADDTAFYYCARVPFQIWSGLYFDHWGQGTLVTVSS
これらのVHアミノ酸配列は、以下の核酸配列によりコードされるクローンに存在し、それらはまた、配列番号:45−88として記載される:
クローン番号735:
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctcacgtgcactgtgtctaatggcgccatcggcgactacgactggagctggattcgtcagtccccagggaagggactggagtggattgggaacataaattacagagggaacaccaactacaacccctccctcaagagtcgagtcaccatgtccctacgcacgtccacgatgcagttctccctgaagctgagctctgcgaccgctgcggacacggccgtctattactgtgcgagagatgtaggctacggtggcgggcagtatttcgcgatggacgtctggagcccagggaccacggtcaccgtctcgagt
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctcacgtgcactgtgtctaatggcgccatcggcgactacgactggagctggattcgtcagtccccagggaagggactggagtggattgggaacataaattacagagggaacaccaactacaacccctccctcaagagtcgagtcaccatgtccctacgcacgtccacgatgcagttctccctgaagctgagctctgcgaccgctgcggacacggccgtctattactgtgcgagagatgtaggctacggtggcgggcagtatttcgcgatggacgtctggagcccagggaccacggtcaccgtctcgagt
クローン番号736:
caggtgcagctggtggagtctgggggaggcgtggtccagcctggggggtccctgagactctcctgtacagcgtctggattcaccttcagtacctatggcatgcactgggtccgccaggctcccggcaaggggctggaatgggtggcatttatacggtatgatggaagtactcaagactatgtagactccgtgaagggccgattcaccatctccagagacaattccaagaatatggtgtatgtgcagatgaacagcctgagagttgaggacacggctgtctattactgtgcgaaagacatggattactatggttcgcggagttattctgtcacctactactacggaatggacgtctggggccaagggaccacggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctggggggtccctgagactctcctgtacagcgtctggattcaccttcagtacctatggcatgcactgggtccgccaggctcccggcaaggggctggaatgggtggcatttatacggtatgatggaagtactcaagactatgtagactccgtgaagggccgattcaccatctccagagacaattccaagaatatggtgtatgtgcagatgaacagcctgagagttgaggacacggctgtctattactgtgcgaaagacatggattactatggttcgcggagttattctgtcacctactactacggaatggacgtctggggccaagggaccacggtcaccgtctcgagt
クローン番号744:
caggtgcagctggtgcagtctggggctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggatacaccttcagcggctattatatgcactgggtgcgacaggcccctggacaagggcttgagtggatgggatggatcaacactagcagtggtggcacaaactatgcgcagaagtttcagggcagggtcaccatgaccagggacacgtccatcagcacagcccacatggaactgaggaggctgagatctgacgacacggccgtgtattattgtgcgagagaggacggcaccatgggtactaatagttggtatggctggttcgacccctggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtgcagtctggggctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggatacaccttcagcggctattatatgcactgggtgcgacaggcccctggacaagggcttgagtggatgggatggatcaacactagcagtggtggcacaaactatgcgcagaagtttcagggcagggtcaccatgaccagggacacgtccatcagcacagcccacatggaactgaggaggctgagatctgacgacacggccgtgtattattgtgcgagagaggacggcaccatgggtactaatagttggtatggctggttcgacccctggggccagggaaccctggtcaccgtctcgagt
クローン番号793:
caggtgcagctggtggagtctgggggaggcttggtcaagcctggggggtccctgagactctcctgtgcggcctctggattccccttcggtgactactacatgagctggatccgccaggctccagggaagggactggagtgggttgcatacattaatagaggtggcactaccatatactacgcagactctgtgaagggccgattcaccatctccagggacaacgccaagaactccctgtttctgcaaatgaacagcctgagagccggggacacggccctctattactgtgcgagagggctaattctagcactaccgactgctacggttgagttaggagcttttgatatctggggccaagggacaatggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcttggtcaagcctggggggtccctgagactctcctgtgcggcctctggattccccttcggtgactactacatgagctggatccgccaggctccagggaagggactggagtgggttgcatacattaatagaggtggcactaccatatactacgcagactctgtgaagggccgattcaccatctccagggacaacgccaagaactccctgtttctgcaaatgaacagcctgagagccggggacacggccctctattactgtgcgagagggctaattctagcactaccgactgctacggttgagttaggagcttttgatatctggggccaagggacaatggtcaccgtctcgagt
クローン番号795:
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcacagaccctgtccctcacctgcactgtctctggtgcctccatcagcagtggtgattattactggagttggatccgtcagtctccaaggaagggcctggagtggattgggtacatcttccacagtgggaccacgtactacaacccgtccctcaagagtcgagctgtcatctcactggacacgtccaagaaccaattctccctgaggctgacgtctgtgactgccgcagacacggccgtctattattgtgccagagatgtcgacgattttcccgtttggggtatgaatcgatatcttgccctctggggccggggaaccctggtcaccgtctcgagt
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcacagaccctgtccctcacctgcactgtctctggtgcctccatcagcagtggtgattattactggagttggatccgtcagtctccaaggaagggcctggagtggattgggtacatcttccacagtgggaccacgtactacaacccgtccctcaagagtcgagctgtcatctcactggacacgtccaagaaccaattctccctgaggctgacgtctgtgactgccgcagacacggccgtctattattgtgccagagatgtcgacgattttcccgtttggggtatgaatcgatatcttgccctctggggccggggaaccctggtcaccgtctcgagt
クローン番号796:
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcctgtgcagcctctggattcagcttcagtcactttggcatgcactgggtccgccaggttccaggcaaggggctggagtgggtggcaattatatcatatgatgggaataatgtacactatgccgactccgtaaagggccgattcaccatctccagagacaattccaagaacacgctgtttctgcaaatgaacagcctgagagatgacgacacgggtgtgtattactgtgcgaaggacgacgtggcgacagatttggctgcctactactacttcgatgtctggggccgtggcaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcctgtgcagcctctggattcagcttcagtcactttggcatgcactgggtccgccaggttccaggcaaggggctggagtgggtggcaattatatcatatgatgggaataatgtacactatgccgactccgtaaagggccgattcaccatctccagagacaattccaagaacacgctgtttctgcaaatgaacagcctgagagatgacgacacgggtgtgtattactgtgcgaaggacgacgtggcgacagatttggctgcctactactacttcgatgtctggggccgtggcaccctggtcaccgtctcgagt
クローン番号799:
caggtgcagctggtggagtctgggggcggcgtggtccagcctgggaggtccctgaaactctcttgtgaagcctctggattcaacttcaataattatggcatgcactgggtccgccaggcaccaggcaaggggctggagtgggtggcagttatttcatatgacggaagaaataagtattttgctgactccgtgaagggccgattcatcatctccagagacgattccaggaacacagtgtttctgcaaatgaacagcctgcgagttgaagatacggccgtctattactgtgcgagaggcagcgtacaagtctggctacatttgggactttttgacaactggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggcggcgtggtccagcctgggaggtccctgaaactctcttgtgaagcctctggattcaacttcaataattatggcatgcactgggtccgccaggcaccaggcaaggggctggagtgggtggcagttatttcatatgacggaagaaataagtattttgctgactccgtgaagggccgattcatcatctccagagacgattccaggaacacagtgtttctgcaaatgaacagcctgcgagttgaagatacggccgtctattactgtgcgagaggcagcgtacaagtctggctacatttgggactttttgacaactggggccagggaaccctggtcaccgtctcgagt
クローン番号800:
caggtgcagctggtggagtctgggggagccgtggtccagcctgggaggtccctgagactctcctgtgaagtgtctggattcagtttcagtgactatggcatgaactgggtccgccagggtccaggcaaggggctggagtgggtggcagttatatggcatgacggaagtaataaaaattatctagactccgtgaagggccgattcaccgtctccagagacaattccaagaacacattgtttctgcaaatgaacagcctgagagccgaagacacggctgtatattactgtgcgaggacgccttacgagttttggagtggctattactttgacttctggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggagccgtggtccagcctgggaggtccctgagactctcctgtgaagtgtctggattcagtttcagtgactatggcatgaactgggtccgccagggtccaggcaaggggctggagtgggtggcagttatatggcatgacggaagtaataaaaattatctagactccgtgaagggccgattcaccgtctccagagacaattccaagaacacattgtttctgcaaatgaacagcctgagagccgaagacacggctgtatattactgtgcgaggacgccttacgagttttggagtggctattactttgacttctggggccagggaaccctggtcaccgtctcgagt
クローン番号801:
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcctgtgcagcgtctggattccccttcaatagctatgccatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagtgatatattatgaagggagtaatgaatattatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacactctgtatttgcaaatggatagcctgagagccgaggacacggctgtctattactgtgcgaggaagtggctggggatggacttctggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcctgtgcagcgtctggattccccttcaatagctatgccatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagtgatatattatgaagggagtaatgaatattatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacactctgtatttgcaaatggatagcctgagagccgaggacacggctgtctattactgtgcgaggaagtggctggggatggacttctggggccagggaaccctggtcaccgtctcgagt
クローン番号804:
gaggtgcagctggtggagtctgggggaggcttggtccggcctggggggtccctgagactctcctgttcagcctctggattcaccttcagtaactatgctatgcactgggtccgccaggctccagggaagagactggaatatgtttcagctactagtactgatggggggagcacatactacgcagactccctaaagggcacattcaccatctccagagacaattccaagaacacactgtatcttcaaatgagcagtctcagtactgaggacacggctatttattactgcgcccgccgattctggggatttggaaacttttttgactactggggccggggaaccctggtcaccgtctcgagt
gaggtgcagctggtggagtctgggggaggcttggtccggcctggggggtccctgagactctcctgttcagcctctggattcaccttcagtaactatgctatgcactgggtccgccaggctccagggaagagactggaatatgtttcagctactagtactgatggggggagcacatactacgcagactccctaaagggcacattcaccatctccagagacaattccaagaacacactgtatcttcaaatgagcagtctcagtactgaggacacggctatttattactgcgcccgccgattctggggatttggaaacttttttgactactggggccggggaaccctggtcaccgtctcgagt
クローン番号810:
caggtgcagctggtgcagtctggggctgaggtgaagaagtccgggtcctcggtgaaggtctcctgcagggcttctggaggcaccttcggcaattatgctatcaactgggtgcgacaggcccctggacaagggcttgagtgggtgggaaggatcatccctgtctttgatacaacaaactacgcacagaagttccagggcagagtcacgattaccgcggacagatccacaaacacagccatcatgcaactgagcagtctgcgacctcaggacacggccatgtattattgtttgagaggttccacccgtggctgggatactgatggttttgatatctggggccaagggacaatggtcaccgtctcgagt
caggtgcagctggtgcagtctggggctgaggtgaagaagtccgggtcctcggtgaaggtctcctgcagggcttctggaggcaccttcggcaattatgctatcaactgggtgcgacaggcccctggacaagggcttgagtgggtgggaaggatcatccctgtctttgatacaacaaactacgcacagaagttccagggcagagtcacgattaccgcggacagatccacaaacacagccatcatgcaactgagcagtctgcgacctcaggacacggccatgtattattgtttgagaggttccacccgtggctgggatactgatggttttgatatctggggccaagggacaatggtcaccgtctcgagt
クローン番号811:
caggttcagctggtgcagtctggggctgtcgtggagacgcctggggcctcagtgaaggtctcctgcaaggcatctggatacatcttcggcaactactatatccactgggtgcggcaggcccctggacaagggcttgagtggatggcagttatcaatcccaatggtggtagcacaacttccgcacagaagttccaagacagaatcaccgtgaccagggacacgtccacgaccactgtctatttggaggttgacaacctgagatctgaggacacggccacatattattgtgcgagacagagatctgtaacagggggctttgacgcgtggcttttaatcccagatgcttctaatacctggggccaggggacaatggtcaccgtctcgagt
caggttcagctggtgcagtctggggctgtcgtggagacgcctggggcctcagtgaaggtctcctgcaaggcatctggatacatcttcggcaactactatatccactgggtgcggcaggcccctggacaagggcttgagtggatggcagttatcaatcccaatggtggtagcacaacttccgcacagaagttccaagacagaatcaccgtgaccagggacacgtccacgaccactgtctatttggaggttgacaacctgagatctgaggacacggccacatattattgtgcgagacagagatctgtaacagggggctttgacgcgtggcttttaatcccagatgcttctaatacctggggccaggggacaatggtcaccgtctcgagt
クローン番号812:
caggtgcagctggtgcagtctggggctgagatgaagaagcctgggtcctcggtgaaggtctcctgcaaggcttctggaggctccttcagcagctattctatcagctgggtgcgacaggcccctggacgagggcttgagtgggtgggaatgatcctgcctatctctggtacaacaaactacgcacagacatttcagggcagagtcatcattagcgcggacacatccacgagcacagcctacatggagctgaccagcctcacatctgaagacacggccgtgtatttctgtgcgagagtctttagagaatttagcacctcgacccttgacccctactactttgactactggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtgcagtctggggctgagatgaagaagcctgggtcctcggtgaaggtctcctgcaaggcttctggaggctccttcagcagctattctatcagctgggtgcgacaggcccctggacgagggcttgagtgggtgggaatgatcctgcctatctctggtacaacaaactacgcacagacatttcagggcagagtcatcattagcgcggacacatccacgagcacagcctacatggagctgaccagcctcacatctgaagacacggccgtgtatttctgtgcgagagtctttagagaatttagcacctcgacccttgacccctactactttgactactggggccagggaaccctggtcaccgtctcgagt
クローン番号814:
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaagtccgtgagactctcctgtgtaggctctggcttcaggctcatggactatgctatgcactgggtccgccaggctccaggcaagggactggattgggtggcagttatttcatatgatggagccaatgaatactacgcagagtccgtgaagggccgattcaccgtctccagagacaattcagacaacactctgtatctacaaatgaagagcctgagagctgaggacacggctgtgtatttctgtgcgagagcgggccgttcctctatgaatgaagaagttattatgtactttgacaactggggcctgggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaagtccgtgagactctcctgtgtaggctctggcttcaggctcatggactatgctatgcactgggtccgccaggctccaggcaagggactggattgggtggcagttatttcatatgatggagccaatgaatactacgcagagtccgtgaagggccgattcaccgtctccagagacaattcagacaacactctgtatctacaaatgaagagcctgagagctgaggacacggctgtgtatttctgtgcgagagcgggccgttcctctatgaatgaagaagttattatgtactttgacaactggggcctgggaaccctggtcaccgtctcgagt
クローン番号816:
gaggtgcagctgttggagtctgggggaggcttggtccagcctggggggtccctgagactctcctgtgtagcctccggattcacctttagtacctacgccatgacctgggtccgccaggctccagggaaggggctggagtgggtctcagtcattcgtgctagtggtgatagtgaaatctacgcagactccgtgaggggccggttcaccatctccagagacaattccaagaacacggtgtttctgcaaatggacagcctgagagtcgaggacacggccgtatatttctgtgcgaatataggccagcgtcggtattgtagtggtgatcactgctacggacactttgactactggggccagggaaccctggtcaccgtctcgagt
gaggtgcagctgttggagtctgggggaggcttggtccagcctggggggtccctgagactctcctgtgtagcctccggattcacctttagtacctacgccatgacctgggtccgccaggctccagggaaggggctggagtgggtctcagtcattcgtgctagtggtgatagtgaaatctacgcagactccgtgaggggccggttcaccatctccagagacaattccaagaacacggtgtttctgcaaatggacagcctgagagtcgaggacacggccgtatatttctgtgcgaatataggccagcgtcggtattgtagtggtgatcactgctacggacactttgactactggggccagggaaccctggtcaccgtctcgagt
クローン番号817:
caggtgcagctggtggagtctgggggaggcgtggtccaacctgggaggtccctgagactctcctgtgcagcctctggattcggcttcaacacccatggcatgcactgggtccgccaggctccaggcaaggggctggagtggctgtcaattatctcacttgatgggattaagacccactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacggtgtttctacaattgagtggcctgagacctgaagacacggctgtatattactgtgcgaaagatcatattggggggacgaacgcatattttgaatggacagtcccgtttgacggctggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccaacctgggaggtccctgagactctcctgtgcagcctctggattcggcttcaacacccatggcatgcactgggtccgccaggctccaggcaaggggctggagtggctgtcaattatctcacttgatgggattaagacccactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacggtgtttctacaattgagtggcctgagacctgaagacacggctgtatattactgtgcgaaagatcatattggggggacgaacgcatattttgaatggacagtcccgtttgacggctggggccagggaaccctggtcaccgtctcgagt
クローン番号818:
caggtcaccttgagggagtctggtccagcggtggtgaagcccacagaaacgctcactctgacctgcgccttctctgggttctcactcaacgccggtagagtgggtgtgagttggatccgtcagcccccagggcaggccccggaatggcttgcacgcattgattgggatgatgataaagcgttccgcacatctctgaagaccagactcagcatctccaaggactcctccaaaaaccaggtggtccttacactgagcaacatggaccctgcggacacagccacatattactgtgcccggacacaggtcttcgcaagtggaggctactacttgtactaccttgaccactggggccagggaaccctggtcaccgtctcgagt
caggtcaccttgagggagtctggtccagcggtggtgaagcccacagaaacgctcactctgacctgcgccttctctgggttctcactcaacgccggtagagtgggtgtgagttggatccgtcagcccccagggcaggccccggaatggcttgcacgcattgattgggatgatgataaagcgttccgcacatctctgaagaccagactcagcatctccaaggactcctccaaaaaccaggtggtccttacactgagcaacatggaccctgcggacacagccacatattactgtgcccggacacaggtcttcgcaagtggaggctactacttgtactaccttgaccactggggccagggaaccctggtcaccgtctcgagt
クローン番号819:
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcacagaccctgtccctcacctgcactgtctctagtggcgccatcagtggtgctgattactactggagttggatccgccagcccccagggaagggcctggagtgggttgggttcatctatgacagtgggagcacctactacaacccgtccctcaggagtcgagtgaccatatcaatagacacgtccaagaagcagttctccctgaagctgacctctgtgactgccgcagacacggccgtgtattactgtgccagagatctaggctacggtggtaactcttactcccactcctactactacggtttggacgtctggggccgagggaccacggtcaccgtctcgagt
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcacagaccctgtccctcacctgcactgtctctagtggcgccatcagtggtgctgattactactggagttggatccgccagcccccagggaagggcctggagtgggttgggttcatctatgacagtgggagcacctactacaacccgtccctcaggagtcgagtgaccatatcaatagacacgtccaagaagcagttctccctgaagctgacctctgtgactgccgcagacacggccgtgtattactgtgccagagatctaggctacggtggtaactcttactcccactcctactactacggtttggacgtctggggccgagggaccacggtcaccgtctcgagt
クローン番号824:
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctcacctgcactgtctctggtggctccatcggaaattactactggggctggatccggcagcccccagggaagggacttgagtggattgggcatatctacttcggtggcaacaccaactacaacccttccctccagagtcgagtcaccatttcagtcgacacgtccaggaaccagttctccctgaagttgaactctgtgaccgccgcggacacggccgtgtattactgtgcgagggatagcagcaactggcccgcaggctatgaggactggggccagggaaccctggtcaccgtctcgagt
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccctgtccctcacctgcactgtctctggtggctccatcggaaattactactggggctggatccggcagcccccagggaagggacttgagtggattgggcatatctacttcggtggcaacaccaactacaacccttccctccagagtcgagtcaccatttcagtcgacacgtccaggaaccagttctccctgaagttgaactctgtgaccgccgcggacacggccgtgtattactgtgcgagggatagcagcaactggcccgcaggctatgaggactggggccagggaaccctggtcaccgtctcgagt
クローン番号825:
caggttcagctggtgcagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggtttctggttacacctttaccagtaatggtctcagctgggtgcgacaggcccctggacaagggtttgagtggctgggatggatcagcgctagtagtggaaacaaaaagtatgccccgaaattccagggaagagtcaccttgaccacagacatttccacgagcacagcctacatggaactgaggagtctgagatctgacgatacggccgtatattactgtgcgaaagatgggggcacctacgtgccctattctgatgcctttgatttctggggccaggggacaatggtcaccgtctcgagt
caggttcagctggtgcagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggtttctggttacacctttaccagtaatggtctcagctgggtgcgacaggcccctggacaagggtttgagtggctgggatggatcagcgctagtagtggaaacaaaaagtatgccccgaaattccagggaagagtcaccttgaccacagacatttccacgagcacagcctacatggaactgaggagtctgagatctgacgatacggccgtatattactgtgcgaaagatgggggcacctacgtgccctattctgatgcctttgatttctggggccaggggacaatggtcaccgtctcgagt
クローン番号827:
caggtccagctggtacagtctggggctgaggtgaagaagcctggggcctcagtgaaggtctcctgcagggtttccggacacactttcactgcattatccaaacactggatgcgacagggtcctggaggagggcttgagtggatgggattttttgatcctgaagatggtgacacaggctacgcacagaagttccagggcagagtcaccatgaccgaggacacagccacaggcacagcctacatggagctgagcagcctgacatctgacgacacggccgtatattattgtgcaacagtagcggcagctggaaactttgacaactggggccagggaaccctggtcaccgtctcgagt
caggtccagctggtacagtctggggctgaggtgaagaagcctggggcctcagtgaaggtctcctgcagggtttccggacacactttcactgcattatccaaacactggatgcgacagggtcctggaggagggcttgagtggatgggattttttgatcctgaagatggtgacacaggctacgcacagaagttccagggcagagtcaccatgaccgaggacacagccacaggcacagcctacatggagctgagcagcctgacatctgacgacacggccgtatattattgtgcaacagtagcggcagctggaaactttgacaactggggccagggaaccctggtcaccgtctcgagt
クローン番号829:
caggtcaccttgaaggagtctggtcctgcgctggtgaaagccacacagaccctgacactgacctgcaccttctctgggttttcactcagtaggaatagaatgagtgtgagctggatccgtcagcccccagggaaggccctggagtggcttgcacgcattgattgggatgatgataaattctacaacacatctctgcagaccaggctcaccatctccaaggacacctccaaaaaccaggtggtccttacaatgaccaacatggaccctgtggacacagccacctattactgcgcacggactgggatatatgatagtagtggttattacctctactactttgactactggggccagggaaccctggtcaccgtctcgagt
caggtcaccttgaaggagtctggtcctgcgctggtgaaagccacacagaccctgacactgacctgcaccttctctgggttttcactcagtaggaatagaatgagtgtgagctggatccgtcagcccccagggaaggccctggagtggcttgcacgcattgattgggatgatgataaattctacaacacatctctgcagaccaggctcaccatctccaaggacacctccaaaaaccaggtggtccttacaatgaccaacatggaccctgtggacacagccacctattactgcgcacggactgggatatatgatagtagtggttattacctctactactttgactactggggccagggaaccctggtcaccgtctcgagt
クローン番号830:
caggtgcagctggtgcagtctggagctgaggtgaaggtgcctggggcctcagtgaaggtctcctgcaaggcttctggttacacctttaccacttacggtgtcagctgggtgcggcaggcccctggacaagggcttgagtggatgggttggatcagcgcttacaatggtaacacatactatctacagaagctccagggcagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgcggggcctgaggtctgacgacacggccatgtattactgtgcgagagatcgtgttgggggcagctcgtccgaggttctatcgcgggccaaaaactacggtttggacgtctggggccaagggaccacggtcaccgtctcgagt
caggtgcagctggtgcagtctggagctgaggtgaaggtgcctggggcctcagtgaaggtctcctgcaaggcttctggttacacctttaccacttacggtgtcagctgggtgcggcaggcccctggacaagggcttgagtggatgggttggatcagcgcttacaatggtaacacatactatctacagaagctccagggcagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgcggggcctgaggtctgacgacacggccatgtattactgtgcgagagatcgtgttgggggcagctcgtccgaggttctatcgcgggccaaaaactacggtttggacgtctggggccaagggaccacggtcaccgtctcgagt
クローン番号831:
caggttcagctggtgcagtctggggctgaggtgaagaagcctggggcctcagttaaggtttcctgcaaggcttctgcaaacatcttcacttatgcaatgcattgggtgcgccaggcccccggacaaaggcttgagtggatgggatggatcaacgttggcaatggtcagacaaaatattcacagaggttccagggcagagtcaccattaccagggacacgtccgcgactacagcctacatggagctgagcaccctgagatctgaggacacggctgtgtattactgtgcgaggcgtgcgagccaatatggggaggtctatggcaactactttgactactggggccagggaaccctggtcaccgtctcgagt
caggttcagctggtgcagtctggggctgaggtgaagaagcctggggcctcagttaaggtttcctgcaaggcttctgcaaacatcttcacttatgcaatgcattgggtgcgccaggcccccggacaaaggcttgagtggatgggatggatcaacgttggcaatggtcagacaaaatattcacagaggttccagggcagagtcaccattaccagggacacgtccgcgactacagcctacatggagctgagcaccctgagatctgaggacacggctgtgtattactgtgcgaggcgtgcgagccaatatggggaggtctatggcaactactttgactactggggccagggaaccctggtcaccgtctcgagt
クローン番号835:
caggtgcagctggtgcagtctggagctgaggtgaagaggcctggggcctcagtgaaggtctcctgcaaggcttcaggttacacctttatcagctatggtttcagctgggtgcgacaggcccctggacaagggcttgagtggatgggatggagcagcgtttacaatggtgacacaaactatgcacagaagttccacggcagagtcaacatgacgactgacacatcgacgaacacggcctacatggaactcaggggcctgagatctgacgacacggccgtgtatttctgtgcgagggatcgcaatgttgttctacttccagctgctccttttggaggtatggacgtctggggccaagggacaatggtcaccgtctcgagt
caggtgcagctggtgcagtctggagctgaggtgaagaggcctggggcctcagtgaaggtctcctgcaaggcttcaggttacacctttatcagctatggtttcagctgggtgcgacaggcccctggacaagggcttgagtggatgggatggagcagcgtttacaatggtgacacaaactatgcacagaagttccacggcagagtcaacatgacgactgacacatcgacgaacacggcctacatggaactcaggggcctgagatctgacgacacggccgtgtatttctgtgcgagggatcgcaatgttgttctacttccagctgctccttttggaggtatggacgtctggggccaagggacaatggtcaccgtctcgagt
クローン番号838:
caggtgcagctggtggagtctgggggaggcgtggtccagccggggacttccctgagactctcctgtgcagcctctggattcaccttcagtacgtttggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatcatatgatggaaataagaaatactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacgctgtatctgcaagtgaacagcctgagagtcgaggacacggctgtgtattactgtgcggcccaaactccatatttcaatgagagcagtgggttagtgccggactggggccagggcaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagccggggacttccctgagactctcctgtgcagcctctggattcaccttcagtacgtttggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatcatatgatggaaataagaaatactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacgctgtatctgcaagtgaacagcctgagagtcgaggacacggctgtgtattactgtgcggcccaaactccatatttcaatgagagcagtgggttagtgccggactggggccagggcaccctggtcaccgtctcgagt
クローン番号841:
caggtgcagctggtgcagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggttacacctttatcagttttggcatcagctgggtgcgacaggcccctggacaaggacttgagtggatgggatggatcagcgcttacaatggtaacacagactatgcacagaggctccaggacagagtcaccatgactagagacacagccacgagcacagcctacttggagctgaggagcctgaaatctgacgacacggccgtgtactattgcactagagacgagtcgatgcttcggggagttactgaaggattcggacccattgactactggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtgcagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggttacacctttatcagttttggcatcagctgggtgcgacaggcccctggacaaggacttgagtggatgggatggatcagcgcttacaatggtaacacagactatgcacagaggctccaggacagagtcaccatgactagagacacagccacgagcacagcctacttggagctgaggagcctgaaatctgacgacacggccgtgtactattgcactagagacgagtcgatgcttcggggagttactgaaggattcggacccattgactactggggccagggaaccctggtcaccgtctcgagt
クローン番号853:
gaagtgcagctggtgcagtctggagcagaggtgaaaaagccggggcagtctctgaagatctcctgtaagacttctggatacatctttaccaactactggatcggctgggtgcgccagaggcccgggaaaggcctggagtggatgggggtcatctttcctgctgactctgatgccagatacagcccgtcgttccaaggccaggtcaccatctcagccgacaagtccatcggtactgcctacctgcagtggagtagcctgaaggcctcggacaccgccatatattactgtgcgagaccgaaatattactttgatagtagtgggcaattctccgagatgtactactttgacttctggggccagggaaccctggtcaccgtctcgagt
gaagtgcagctggtgcagtctggagcagaggtgaaaaagccggggcagtctctgaagatctcctgtaagacttctggatacatctttaccaactactggatcggctgggtgcgccagaggcccgggaaaggcctggagtggatgggggtcatctttcctgctgactctgatgccagatacagcccgtcgttccaaggccaggtcaccatctcagccgacaagtccatcggtactgcctacctgcagtggagtagcctgaaggcctcggacaccgccatatattactgtgcgagaccgaaatattactttgatagtagtgggcaattctccgagatgtactactttgacttctggggccagggaaccctggtcaccgtctcgagt
クローン番号855:
caggttcagctggtgcagtctggacctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggttatgtgttgaccaactatgccttcagctgggtgcggcaggcccctggacaagggcttgagtggctgggatggatcagcggctccaatggtaacacatactatgcagagaagttccagggccgagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagtctgagatctgacgacacggccgtttatttctgtgcgagagatcttctgcggtccacttactttgactactggggccagggaaccctggtcaccgtctcgagt
caggttcagctggtgcagtctggacctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggttatgtgttgaccaactatgccttcagctgggtgcggcaggcccctggacaagggcttgagtggctgggatggatcagcggctccaatggtaacacatactatgcagagaagttccagggccgagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagtctgagatctgacgacacggccgtttatttctgtgcgagagatcttctgcggtccacttactttgactactggggccagggaaccctggtcaccgtctcgagt
クローン番号856:
caggtgcagctggtgcagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggttacaccttttccaactacggtttcagctgggtgcgacaggcccctggacgagggcttgagtggatgggatggatcagcgcttacaatggtaacacatactatgcacagaacctccagggcagagtcaccatgaccacagacacatccacgaccacagcctacatggtactgaggagcctgagatctgacgacacggccatgtattactgtgcgagagatggaaatacagcaggggttgatatgtggtcgcgtgatggttttgatatctggggccaggggacaatggtcaccgtctcgagt
caggtgcagctggtgcagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttctggttacaccttttccaactacggtttcagctgggtgcgacaggcccctggacgagggcttgagtggatgggatggatcagcgcttacaatggtaacacatactatgcacagaacctccagggcagagtcaccatgaccacagacacatccacgaccacagcctacatggtactgaggagcctgagatctgacgacacggccatgtattactgtgcgagagatggaaatacagcaggggttgatatgtggtcgcgtgatggttttgatatctggggccaggggacaatggtcaccgtctcgagt
クローン番号857:
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggcccctgaggctctcctgtgtagcctctggattcagctttagcagctatgccatgaactggatccgcctggctccagggaaggggctggagtgggtctcaggtattagtggtagcggtggtagcacttactacggagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtatctgcaaatgaacagcctgagagccgaggacacggccgtatattactgtgcgaaagagccgtggatcgatatagtagtggcatctgttatatccccctactactacgacggaatggacgtctggggccaagggaccacggtcaccgtctcgagt
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggcccctgaggctctcctgtgtagcctctggattcagctttagcagctatgccatgaactggatccgcctggctccagggaaggggctggagtgggtctcaggtattagtggtagcggtggtagcacttactacggagactccgtgaagggccggttcaccatctccagagacaattccaagaacacgctgtatctgcaaatgaacagcctgagagccgaggacacggccgtatattactgtgcgaaagagccgtggatcgatatagtagtggcatctgttatatccccctactactacgacggaatggacgtctggggccaagggaccacggtcaccgtctcgagt
クローン番号858:
caggttcagctggtgcagtctggggctgaggtgaagaagcctgggtcctcggtgaaggtctcctgcaaggcctctggaggatccttcgacggctacactatcagctggctgcgacaggcccctggacaggggcttgagtggatgggaagggtcgtccctacacttggttttccaaactacgcacagaagttccaaggcagagtcaccgttaccgcggacagatccaccaacacagcctacttggaattgagcagactgacatctgaagacacggccgtatattactgtgcgaggatgaatctcggatcgcatagcgggcgccccgggttcgacatgtggggccaaggaaccctggtcaccgtctcgagt
caggttcagctggtgcagtctggggctgaggtgaagaagcctgggtcctcggtgaaggtctcctgcaaggcctctggaggatccttcgacggctacactatcagctggctgcgacaggcccctggacaggggcttgagtggatgggaagggtcgtccctacacttggttttccaaactacgcacagaagttccaaggcagagtcaccgttaccgcggacagatccaccaacacagcctacttggaattgagcagactgacatctgaagacacggccgtatattactgtgcgaggatgaatctcggatcgcatagcgggcgccccgggttcgacatgtggggccaaggaaccctggtcaccgtctcgagt
クローン番号859:
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccttgagactctcctgtgcagtgtctggatccagcttcagtaaatatggcatacactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatcgtatgatggaagtaaaaagtatttcacagactccgtgaagggccgattcaccatcgccagagacaattcccagaacacggtttttctgcaaatgaacagcctgagagccgaggacacggctgtctattactgtgcgacaggagggggtgttaatgtcacctcgtggtccgacgtagagcactcgtcgtccttaggctactggggcctgggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccttgagactctcctgtgcagtgtctggatccagcttcagtaaatatggcatacactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatcgtatgatggaagtaaaaagtatttcacagactccgtgaagggccgattcaccatcgccagagacaattcccagaacacggtttttctgcaaatgaacagcctgagagccgaggacacggctgtctattactgtgcgacaggagggggtgttaatgtcacctcgtggtccgacgtagagcactcgtcgtccttaggctactggggcctgggaaccctggtcaccgtctcgagt
クローン番号861:
caggtgcagctggtggagtctgggggaggcgtggtccagcctggggggtccctgagactctcctgtgcagcgtctggattcaccttcagtagctatggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcatttatatggaatgatggaagtaataaatactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacgctgtatctgcaaatgaacagcctgagagctgaggacacggctgtgtattactgtgtgaaagatgaggtctatgatagtagtggttattacctgtactactttgactcttggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctggggggtccctgagactctcctgtgcagcgtctggattcaccttcagtagctatggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcatttatatggaatgatggaagtaataaatactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaacacgctgtatctgcaaatgaacagcctgagagctgaggacacggctgtgtattactgtgtgaaagatgaggtctatgatagtagtggttattacctgtactactttgactcttggggccagggaaccctggtcaccgtctcgagt
クローン番号863:
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgagactctcctgtgcagcctctggattcacgtttagctcctataccatgagctgggtccgccaggctccagggaaggggctggagtgggtctcaagtattagtgctagtactgttctcacatactacgcagactccgtgaagggccgcttcaccatctccagagacaattccaagaacacgctgtatctgcaaatgagtagcctgagagccgaggacacggccgtatattactgtgcgaaagattacgatttttggagtggctatcccgggggacagtactggttcttcgatctctggggccgtggcaccctggtcaccgtctcgagt
gaggtgcagctgttggagtctgggggaggcttggtacagcctggggggtccctgagactctcctgtgcagcctctggattcacgtttagctcctataccatgagctgggtccgccaggctccagggaaggggctggagtgggtctcaagtattagtgctagtactgttctcacatactacgcagactccgtgaagggccgcttcaccatctccagagacaattccaagaacacgctgtatctgcaaatgagtagcctgagagccgaggacacggccgtatattactgtgcgaaagattacgatttttggagtggctatcccgggggacagtactggttcttcgatctctggggccgtggcaccctggtcaccgtctcgagt
クローン番号868:
caggtgcagctgcaggagtcgggcccaggactggtgacgccttcggagaccctgtccgtcacttgcactgtctctaattattccatcgacaatgcttactactggggctggatccggcagcccccagggaagggtctggagtggataggcagtatccatcatagtgggagcgcctactacaattcgtccctcaagagtcgagccaccatatctatagacacgtccaagaaccaattctcgttgaacctgaggtctgtgaccgccgcagacacggccgtatattactgtgcgcgcgataccatcctcacgttcggggagccccactggttcgacccctggggccagggaaccctggtcaccgtctcgagt
caggtgcagctgcaggagtcgggcccaggactggtgacgccttcggagaccctgtccgtcacttgcactgtctctaattattccatcgacaatgcttactactggggctggatccggcagcccccagggaagggtctggagtggataggcagtatccatcatagtgggagcgcctactacaattcgtccctcaagagtcgagccaccatatctatagacacgtccaagaaccaattctcgttgaacctgaggtctgtgaccgccgcagacacggccgtatattactgtgcgcgcgataccatcctcacgttcggggagccccactggttcgacccctggggccagggaaccctggtcaccgtctcgagt
クローン番号870:
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccttgtccctcacctgcactgtctcaggtgactccatcagtaattactactggagttggatccggcagcccccagggaagggactggagtggattggagaaatatctaacacttggagcaccaattacaacccctccctcaagagtcgagtcaccatatctctagacatgcccaagaaccagttgtccctgaagctgagctctgtgaccgctgcggacacggccgtatattactgtgcgagagggcttttctatgacagtggtggttactacttgttttacttccaacactggggccagggcaccctggtcaccgtctcgagt
caggtgcagctgcaggagtcgggcccaggactggtgaagccttcggagaccttgtccctcacctgcactgtctcaggtgactccatcagtaattactactggagttggatccggcagcccccagggaagggactggagtggattggagaaatatctaacacttggagcaccaattacaacccctccctcaagagtcgagtcaccatatctctagacatgcccaagaaccagttgtccctgaagctgagctctgtgaccgctgcggacacggccgtatattactgtgcgagagggcttttctatgacagtggtggttactacttgttttacttccaacactggggccagggcaccctggtcaccgtctcgagt
クローン番号871:
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagagtctcctgtgcagcgtctggattcaccttcagtaactatggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatggtatgatgacagtaataaacagtatggagactccgtgaagggccgattcaccatctccagagacaattccaagagtacgctgtatctgcaaatggacagactgagagtcgaggacacggctgtgtattattgtgcgagagcctccgagtatagtatcagctggcgacacaggggggtccttgactactggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagagtctcctgtgcagcgtctggattcaccttcagtaactatggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatggtatgatgacagtaataaacagtatggagactccgtgaagggccgattcaccatctccagagacaattccaagagtacgctgtatctgcaaatggacagactgagagtcgaggacacggctgtgtattattgtgcgagagcctccgagtatagtatcagctggcgacacaggggggtccttgactactggggccagggaaccctggtcaccgtctcgagt
クローン番号880:
cagatcaccttgaaggagtctggtcctacgctggtgagacccacacagaccctcacactgacctgcaccttctctgggttctcactcagcactagtaaactgggtgtgggctggatccgtcagcccccaggaaaggccctggagtggcttgcactcgttgattgggatgatgataggcgctacaggccatctttgaagagcaggctcaccgtcaccaaggacacctccaaaaaccaggtggtccttacaatgaccaacatggaccctgtggacacagccacatattactgtgcacacagtgcctactatactagtagtggttattaccttcaatacttccatcactggggcccgggcaccctggtcaccgtctcgagt
cagatcaccttgaaggagtctggtcctacgctggtgagacccacacagaccctcacactgacctgcaccttctctgggttctcactcagcactagtaaactgggtgtgggctggatccgtcagcccccaggaaaggccctggagtggcttgcactcgttgattgggatgatgataggcgctacaggccatctttgaagagcaggctcaccgtcaccaaggacacctccaaaaaccaggtggtccttacaatgaccaacatggaccctgtggacacagccacatattactgtgcacacagtgcctactatactagtagtggttattaccttcaatacttccatcactggggcccgggcaccctggtcaccgtctcgagt
クローン番号881:
gaggtgcagctggtggagtctgggggaggcgtggtacagcctggaggctccctgagactctcctgtgaagtctccggattcaccttcaatagttatgaaatgacctgggtccgccaggccccagggaaggggctggagtgggtttcacacattggtaatagtggttctatgatatactacgctgactctgtgaagggccgattcaccatctccagagacaacgccaagaactcactatatctgcaaatgaacagcctgagagtcgaggacacggctgtttattactgtgcgaggtcagattactatgatagtagtggttattatctcctctacttagactcctggggccatggaaccctggtcaccgtctcgagt
gaggtgcagctggtggagtctgggggaggcgtggtacagcctggaggctccctgagactctcctgtgaagtctccggattcaccttcaatagttatgaaatgacctgggtccgccaggccccagggaaggggctggagtgggtttcacacattggtaatagtggttctatgatatactacgctgactctgtgaagggccgattcaccatctccagagacaacgccaagaactcactatatctgcaaatgaacagcctgagagtcgaggacacggctgtttattactgtgcgaggtcagattactatgatagtagtggttattatctcctctacttagactcctggggccatggaaccctggtcaccgtctcgagt
クローン番号884:
caggtgcagctggtgcagtctggggctgaggtgaggaagcctggggcctcagtgaaggtttcctgcaaggcttctggacatactttcattaactttgctatgcattgggtgcgccaggcccccggacaggggcttgagtggatgggatacatcaacgctgtcaatggtaacacacagtattcacagaagttccagggcagagtcacctttacgagggacacatccgcgaacacagcctacatggagctgagcagcctgagatctgaagacacggctgtgtattactgtgcgagaaacaatgggggctctgctatcattttttactactggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtgcagtctggggctgaggtgaggaagcctggggcctcagtgaaggtttcctgcaaggcttctggacatactttcattaactttgctatgcattgggtgcgccaggcccccggacaggggcttgagtggatgggatacatcaacgctgtcaatggtaacacacagtattcacagaagttccagggcagagtcacctttacgagggacacatccgcgaacacagcctacatggagctgagcagcctgagatctgaagacacggctgtgtattactgtgcgagaaacaatgggggctctgctatcattttttactactggggccagggaaccctggtcaccgtctcgagt
クローン番号886:
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcctgtgcagcctctggattcagcttcagtagctatggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatcaaatgatggaagtaataaatactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaaaacgatgtatctgcaaatgaacagcctgagagctgaggacacggctgtgtatttctgtgcgaagacaacagaccagcggctattagtggactggttcgacccctggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtggtccagcctgggaggtccctgagactctcctgtgcagcctctggattcagcttcagtagctatggcatgcactgggtccgccaggctccaggcaaggggctggagtgggtggcagttatatcaaatgatggaagtaataaatactatgcagactccgtgaagggccgattcaccatctccagagacaattccaagaaaacgatgtatctgcaaatgaacagcctgagagctgaggacacggctgtgtatttctgtgcgaagacaacagaccagcggctattagtggactggttcgacccctggggccagggaaccctggtcaccgtctcgagt
クローン番号888:
cagctgcagctgcaggagtcgggcccaggactggtgaagccatcggagaccctgtccctcacctgcactgcctctggtggctccatcaacagtagtaatttctactggggctggatccgccagcccccagggaaggggctggagtggattgggagtatcttttatagtgggaccacctactacaacccgtccctcaagagtcgagtcaccatatccgtagacacgtccaagaaccagttctccctgaagctgagccctgtgaccgccgcagacacggctgtctatcactgtgcgagacatggcttccggtattgtaataatggtgtatgctctataaatctcgatgcttttgatatctggggccaagggacaatggtcaccgtctcgagt
cagctgcagctgcaggagtcgggcccaggactggtgaagccatcggagaccctgtccctcacctgcactgcctctggtggctccatcaacagtagtaatttctactggggctggatccgccagcccccagggaaggggctggagtggattgggagtatcttttatagtgggaccacctactacaacccgtccctcaagagtcgagtcaccatatccgtagacacgtccaagaaccagttctccctgaagctgagccctgtgaccgccgcagacacggctgtctatcactgtgcgagacatggcttccggtattgtaataatggtgtatgctctataaatctcgatgcttttgatatctggggccaagggacaatggtcaccgtctcgagt
クローン番号894:
caggtgcagctggtggagtctgggggaggcgtcgtccagcctggaaagtccctgagactctcctgtgcagcgtctggattcagattcagtgactacggcatgcactgggtccggcaggctccaagcaaggggctggagtgggtggcagttatctggcatgacggaagtaatataaggtatgcagactccgtgaggggccgattttccatctccagagacaattccaagaacacgctgtatttgcaaatgaacagcatgagagccgacgacacggctttttattattgtgcgagagtcccgttccagatttggagtggtctttattttgaccactggggccagggaaccctggtcaccgtctcgagt
caggtgcagctggtggagtctgggggaggcgtcgtccagcctggaaagtccctgagactctcctgtgcagcgtctggattcagattcagtgactacggcatgcactgggtccggcaggctccaagcaaggggctggagtgggtggcagttatctggcatgacggaagtaatataaggtatgcagactccgtgaggggccgattttccatctccagagacaattccaagaacacgctgtatttgcaaatgaacagcatgagagccgacgacacggctttttattattgtgcgagagtcccgttccagatttggagtggtctttattttgaccactggggccagggaaccctggtcaccgtctcgagt
同一のクローンにおいて、軽鎖の完全なアミノ酸配列(すわなち、定常領域および可変領域を含む軽鎖)は以下のアミノ酸配列を有し、それらはまた、配列番号:89−132として記載される:
クローン番号735:
EIVLTQSPATLSLSPGERATLSCRASQSVNSHLAWYQQKPGQAPRLLIYNTFNRVTGIPARFSGSGSGTDFTLTISSLATEDFGVYYCQQRSNWPPALTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPATLSLSPGERATLSCRASQSVNSHLAWYQQKPGQAPRLLIYNTFNRVTGIPARFSGSGSGTDFTLTISSLATEDFGVYYCQQRSNWPPALTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号736:
DIQMTQSPSSLSASVGDRVTFTCRASQRISNHLNWYQQKPGKAPKLLIFGASTLQSGAPSRFSGSGSGTDFTLTITNVQPDDFATYYCQQSYRTPPINFGQGTRLDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTFTCRASQRISNHLNWYQQKPGKAPKLLIFGASTLQSGAPSRFSGSGSGTDFTLTITNVQPDDFATYYCQQSYRTPPINFGQGTRLDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号744:
EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIYGASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYDSSLSTWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIYGASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYDSSLSTWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号793:
DIQMTQSPSSLSASVGDRVTITCRASQSITGYLNWYQQKPGKAPKLLIYATSTLQSEVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYNTLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCRASQSITGYLNWYQQKPGKAPKLLIYATSTLQSEVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYNTLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号795:
EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIHGASTGATGTPDRFSGSGSGTDFTLTISTLEPEDFAVYYCQQYGRTPYTFGQGTKLENKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIHGASTGATGTPDRFSGSGSGTDFTLTISTLEPEDFAVYYCQQYGRTPYTFGQGTKLENKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号796:
DIVMTQTPLSLSVTPGQPASISCRSSQSLLRSDGKTFLYWYLQKPGQSPQPLMYEVSSRFSGVPDRFSGSGSGADFTLNISRVETEDVGIYYCMQGLKIRRTFGPGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQTPLSLSVTPGQPASISCRSSQSLLRSDGKTFLYWYLQKPGQSPQPLMYEVSSRFSGVPDRFSGSGSGADFTLNISRVETEDVGIYYCMQGLKIRRTFGPGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号799:
DIQMTQSPSTLSASVGDRVTFSCRASQSVSSWVAWYQQKPGKAPKLLISEASNLESGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQYHSYSGYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSTLSASVGDRVTFSCRASQSVSSWVAWYQQKPGKAPKLLISEASNLESGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQYHSYSGYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号800:
AIQLTQSPSSLSASVGDRVTLTCRASQGITDSLAWYQQKPGKAPKVLLYAASRLESGVPSRFSGRGSGTDFTLTISSLQPEDFATYYCQQYSKSPATFGPGTKVEIRRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
AIQLTQSPSSLSASVGDRVTLTCRASQGITDSLAWYQQKPGKAPKVLLYAASRLESGVPSRFSGRGSGTDFTLTISSLQPEDFATYYCQQYSKSPATFGPGTKVEIRRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号801:
DIVMTQSPLSLPVTPGEPASISCRSSQSLLNSNGFNYVDWYLQKPGQSPQLLIYLGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQALETPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQSPLSLPVTPGEPASISCRSSQSLLNSNGFNYVDWYLQKPGQSPQLLIYLGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQALETPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号804:
EIVLTQSPGTLSLSPGGRATLSCRASQSVSSGYLAWYQQKPGQAPRLLIYGASGRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYFGSPYTFGQGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPGTLSLSPGGRATLSCRASQSVSSGYLAWYQQKPGQAPRLLIYGASGRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYFGSPYTFGQGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号810:
NIQMTQSPSAMSASVGDRVTITCRASQGISNYLVWFQQKPGKVPKRLIYAASSLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQHNISPYTFGQGTKLETKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
NIQMTQSPSAMSASVGDRVTITCRASQGISNYLVWFQQKPGKVPKRLIYAASSLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCLQHNISPYTFGQGTKLETKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号811:
DIVMTQSPDSLAVSLGERATINCRSSETVLYTSKNQSYLAWYQQKARQPPKLLLYWASTRESGVPARFSGSGSGTDFTLAISSLQAEDVAVYYCQQFFRSPFTFGPGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQSPDSLAVSLGERATINCRSSETVLYTSKNQSYLAWYQQKARQPPKLLLYWASTRESGVPARFSGSGSGTDFTLAISSLQAEDVAVYYCQQFFRSPFTFGPGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号812:
EIVLTQSPGTLSLSPGERVTLSCRASQSVSSSYIAWYQQKPGQAPRLVIYAASRRATGVPDRFSGSGSATDFTLTISRLEPEDLAVYYCQHYGNSLFTFGPGTKVDVKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPGTLSLSPGERVTLSCRASQSVSSSYIAWYQQKPGQAPRLVIYAASRRATGVPDRFSGSGSATDFTLTISRLEPEDLAVYYCQHYGNSLFTFGPGTKVDVKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号814:
DIQMTQSPSTLSASVGDRVTITCRASQSIGSRLAWYQQQPGKAPKFLIYDASSLESGVPSRFSGSGSGTEFTLTISSLQPEDLATYYCQQYNRDSPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSTLSASVGDRVTITCRASQSIGSRLAWYQQQPGKAPKFLIYDASSLESGVPSRFSGSGSGTEFTLTISSLQPEDLATYYCQQYNRDSPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号816:
DIVMTQSPLSLPVTPGEPASISCRSSQSLLHSDGRYYVDWYLQKPGQSPHLLIYLASNRASGVPDRFTGSGSGTDFTLKISRVEAEDVGVYYCMQGLHTPWTFGQGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQSPLSLPVTPGEPASISCRSSQSLLHSDGRYYVDWYLQKPGQSPHLLIYLASNRASGVPDRFTGSGSGTDFTLKISRVEAEDVGVYYCMQGLHTPWTFGQGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号817:
EIVMTQSPATLSASPGERATLSCWASQTIGGNLAWYQQKPGQAPRLLIYGASTRATGVPARFSGSGSGTEFTLAISSLQSEDFAVYYCQQYKNWYTFGQGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVMTQSPATLSASPGERATLSCWASQTIGGNLAWYQQKPGQAPRLLIYGASTRATGVPARFSGSGSGTEFTLAISSLQSEDFAVYYCQQYKNWYTFGQGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号818:
DIQMTQSPSSLSASVGDRVTITCRASQTIASYVNWYQQKPGRAPSLLIYAASNLQSGVPPRFSGSGSGTDFTLTISGLQPDDFATYYCQQSYSYRALTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCRASQTIASYVNWYQQKPGRAPSLLIYAASNLQSGVPPRFSGSGSGTDFTLTISGLQPDDFATYYCQQSYSYRALTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号819:
EIVLTQSPATLSLSPGERATLSCRASQSVSSSLAWYQQTPGQAPRLLIYDASYRVTGIPARFSGSGSGIDFTLTISSLEPEDFAVYYCQQRSNWPPGLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPATLSLSPGERATLSCRASQSVSSSLAWYQQTPGQAPRLLIYDASYRVTGIPARFSGSGSGIDFTLTISSLEPEDFAVYYCQQRSNWPPGLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号824:
AIQLTQSPSSLSASVGDTVTVTCRPSQDISSALAWYQQKPGKPPKLLIYGASTLDYGVPLRFSGTASGTHFTLTISSLQPEDFATYYCQQFNTYPFTFGPGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
AIQLTQSPSSLSASVGDTVTVTCRPSQDISSALAWYQQKPGKPPKLLIYGASTLDYGVPLRFSGTASGTHFTLTISSLQPEDFATYYCQQFNTYPFTFGPGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号825:
DIVMTQSPDSLAVSLGERATINCKSSQSVLYNSNNKNYLAWYQQKPGQPPKLLIHLASTREYGVPDRFSGSGSGTDFALIISSLQAEDVAVYYCQQYYQTPLTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQSPDSLAVSLGERATINCKSSQSVLYNSNNKNYLAWYQQKPGQPPKLLIHLASTREYGVPDRFSGSGSGTDFALIISSLQAEDVAVYYCQQYYQTPLTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号827:
DIQMTQSPSSLAASVGDRVTITCRASQFISSYLHWYQQRPGKAPKLLMYAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYTNPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLAASVGDRVTITCRASQFISSYLHWYQQRPGKAPKLLMYAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYTNPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号829:
DIQMTQSPSSLSASVGDRVTITCRASQSIASYLNWYQQKPGKAPKLLIYAASSLHSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQHSYSTRFTFGPGTKVDVKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCRASQSIASYLNWYQQKPGKAPKLLIYAASSLHSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQHSYSTRFTFGPGTKVDVKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号830:
DIQMTQSPSTLSASVGDRVTITCRASQSVTSELAWYQQKPGKAPNFLIYKASSLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYNSFPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSTLSASVGDRVTITCRASQSVTSELAWYQQKPGKAPNFLIYKASSLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYNSFPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号831:
DIQMTQSPSTLSASVGDRLTITCRASQNIYNWLAWYQQKPGKAPKLLIYDASTLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYNSLSPTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSTLSASVGDRLTITCRASQNIYNWLAWYQQKPGKAPKLLIYDASTLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYNSLSPTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号835:
DIQLTQSPSFLSASLEDRVTITCRASQGISSYLAWYQQKPGKAPKLLLDAASTLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQLNSYPRTFGQGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQLTQSPSFLSASLEDRVTITCRASQGISSYLAWYQQKPGKAPKLLLDAASTLQSGVPSRFSGSGSGTEFTLTISSLQPEDFATYYCQQLNSYPRTFGQGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号838:
DIQMTQSPSSLSASVGDRVSITCRASQGISNYLAWYQQKPGKVPKLLIYAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQKYNSAPQTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVSITCRASQGISNYLAWYQQKPGKVPKLLIYAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQKYNSAPQTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号841:
DIVMTQSPDSLAVSLGERATINCRSSQSVLYSSNNKNYLAWYQQKPGQPPKLLVYWASTRASGVPDRFSGSGSGTDFTLTLSSLQAEDVAVYYCQQFHSTPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQSPDSLAVSLGERATINCRSSQSVLYSSNNKNYLAWYQQKPGQPPKLLVYWASTRASGVPDRFSGSGSGTDFTLTLSSLQAEDVAVYYCQQFHSTPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号853:
EIVLTQSPGTLSLSPGERATLSCRASQSVSSNYLAWYQQKPGQAPRLLIYGASSRAAGMPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGNSPLTFGGGTEVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPGTLSLSPGERATLSCRASQSVSSNYLAWYQQKPGQAPRLLIYGASSRAAGMPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGNSPLTFGGGTEVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号855:
DIQMTQSPSSVSASVGDRVTITCRASQAISNWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISGLQPEDFATYYCQQADTFPFTFGPGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSVSASVGDRVTITCRASQAISNWLAWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISGLQPEDFATYYCQQADTFPFTFGPGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号856:
DIVMTQTPLSLPVTPGEPASISCRSSQSLLDSNDGNTYLDWYLQKPGQSPQLLIYTFSYRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQRIEFPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQTPLSLPVTPGEPASISCRSSQSLLDSNDGNTYLDWYLQKPGQSPQLLIYTFSYRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQRIEFPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号857:
DIVMTQSPLSLPVTPGEPASISCRSSQSLLHRNEYNYLDWYLQKPGQSPQLLIYWGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQTLQTPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQSPLSLPVTPGEPASISCRSSQSLLHRNEYNYLDWYLQKPGQSPQLLIYWGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQTLQTPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号858:
DIQMTQSPSSVSASVGDRVTITCQASQDISNYLNWYQQKPGKAPKLLIFDATKLETGVPTRFIGSGSGTDFTVTITSLQPEDVATYYCQHFANLPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSVSASVGDRVTITCQASQDISNYLNWYQQKPGKAPKLLIFDATKLETGVPTRFIGSGSGTDFTVTITSLQPEDVATYYCQHFANLPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号859:
DIQMTQSPSSLSASVGDRVTITCRASQGIRNYLAWYQQKPGKVPKLLVFAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQRYNSAPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCRASQGIRNYLAWYQQKPGKVPKLLVFAASTLQSGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQRYNSAPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号861:
DIQMTQSPSSLSASVGDRVTITCRASQIIASYLNWYQQKPGRAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYSTPIFTFGPGTKVNIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCRASQIIASYLNWYQQKPGRAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYSTPIFTFGPGTKVNIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号863:
EIVLTQSPATLSLSPGERATLSCRTSQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSDWLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVLTQSPATLSLSPGERATLSCRTSQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSDWLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号868:
EIVMTQSPATLSVSPGERATLSCRASQSIKNNLAWYQVKPGQAPRLLTSGASARATGIPGRFSGSGSGTDFTLTISSLQSEDIAVYYCQEYNNWPLLTFGGGTKVEIQRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVMTQSPATLSVSPGERATLSCRASQSIKNNLAWYQVKPGQAPRLLTSGASARATGIPGRFSGSGSGTDFTLTISSLQSEDIAVYYCQEYNNWPLLTFGGGTKVEIQRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号870:
DIQMTQSPPSLSASVGDRVTITCRASQRIASYLNWYQQKPGRAPKLLIFAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDYATYYCQQSYSTPIYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPPSLSASVGDRVTITCRASQRIASYLNWYQQKPGRAPKLLIFAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDYATYYCQQSYSTPIYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号871:
DIQMTQSPSSLSASVGDRVTITCQASQGISNYLNWYQQKPGKAPKLLIFDASNLESEVPSRFSGRGSGTDFTFSISSLQPEDIATYFCQQYDNFPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCQASQGISNYLNWYQQKPGKAPKLLIFDASNLESEVPSRFSGRGSGTDFTFSISSLQPEDIATYFCQQYDNFPYTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号880:
DIQMTQSPSSLAASVGDRVTITCRASQTIASYVNWYQQKPGKAPNLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFASYFCQQSYSFPYTFGQGTKLDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLAASVGDRVTITCRASQTIASYVNWYQQKPGKAPNLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFASYFCQQSYSFPYTFGQGTKLDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号881:
DIQMTQSPSSLSASVGDRVTITCRASQTIASYVNWYQQKPGKAPKLLIYAASNLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYSVPRLTFGGGTKVDITRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCRASQTIASYVNWYQQKPGKAPKLLIYAASNLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQSYSVPRLTFGGGTKVDITRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号884:
DIQMTQSPSSLSASVGDRVTITCRSSQTISVFLNWYQQKPGKAPKLLIYAASSLHSAVPSRFSGSGSGTDFTLTISSLQPEDSATYYCQESFSSSTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIQMTQSPSSLSASVGDRVTITCRSSQTISVFLNWYQQKPGKAPKLLIYAASSLHSAVPSRFSGSGSGTDFTLTISSLQPEDSATYYCQESFSSSTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号886:
EIVMTQSPATLSVSPGETATLSCRASQSVSSNLAWYQHKPGQAPRLLIHSASTRATGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYNMWPPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVMTQSPATLSVSPGETATLSCRASQSVSSNLAWYQHKPGQAPRLLIHSASTRATGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYNMWPPWTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号888:
DIVMTQSPLSLPVTPGAPASISCRSSQSLLRTNGYNYLDWYLQKPGQSPQLLIYLGSIRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQSLQTSITFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
DIVMTQSPLSLPVTPGAPASISCRSSQSLLRTNGYNYLDWYLQKPGQSPQLLIYLGSIRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCMQSLQTSITFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
クローン番号894:
EIVMTQSPATLSVSPGERATLSCRASQSVGNNLAWYQQRPGQAPRLLIYGASTRATGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYDKWPETFGQGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
EIVMTQSPATLSVSPGERATLSCRASQSVGNNLAWYQQRPGQAPRLLIYGASTRATGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQYDKWPETFGQGTKVDIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
これらのクローンにおいて核酸フラグメントをコードする軽鎖は、以下の核酸配列を有し、それらはまた、配列番号:133−176として提供される:
クローン番号735:
gaaattgtgttgacacagtctccagccaccctgtccttgtctccaggagaaagagccaccctctcctgcagggccagtcagagtgttaacagccacttagcctggtaccaacagaaacctggccaggctcccaggctcctcatctataatacattcaatagggtcactggcatcccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagccttgcgactgaagattttggcgtttattactgtcagcagcgtagcaactggcctcccgccctcactttcggcggagggaccaaagtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacacagtctccagccaccctgtccttgtctccaggagaaagagccaccctctcctgcagggccagtcagagtgttaacagccacttagcctggtaccaacagaaacctggccaggctcccaggctcctcatctataatacattcaatagggtcactggcatcccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagccttgcgactgaagattttggcgtttattactgtcagcagcgtagcaactggcctcccgccctcactttcggcggagggaccaaagtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号736:
gacatccagatgacccagtctccatcctccctgtctgcatctgtgggagacagagtcaccttcacttgccgggccagtcagaggattagcaaccatttaaattggtatcaacaaaagccagggaaagcccctaaactcctgatctttggtgcatccactcttcaaagtggggccccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcactaatgtacaacctgacgattttgcaacttactactgtcaacagagttacagaactcccccgatcaacttcggccaagggacacgcctggacattaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtgggagacagagtcaccttcacttgccgggccagtcagaggattagcaaccatttaaattggtatcaacaaaagccagggaaagcccctaaactcctgatctttggtgcatccactcttcaaagtggggccccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcactaatgtacaacctgacgattttgcaacttactactgtcaacagagttacagaactcccccgatcaacttcggccaagggacacgcctggacattaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号744:
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagcagctacttagcctggtatcagcagaaacctggccaggctcccaggctcctcatctatggtgcatccagcagggccactggcatcccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagactggagcctgaagattttgcagtgtattactgtcagcagtatgatagctcactttctacgtggacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagcagctacttagcctggtatcagcagaaacctggccaggctcccaggctcctcatctatggtgcatccagcagggccactggcatcccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagactggagcctgaagattttgcagtgtattactgtcagcagtatgatagctcactttctacgtggacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号793:
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattaccggctatttaaattggtatcagcagaaaccagggaaagcccctaaactcctgatctatgctacatccactttgcaaagtgaggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtcttcaacctgaagattttgcaacttactactgtcaacagagttataataccctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattaccggctatttaaattggtatcagcagaaaccagggaaagcccctaaactcctgatctatgctacatccactttgcaaagtgaggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtcttcaacctgaagattttgcaacttactactgtcaacagagttataataccctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号795:
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagcagctacttagcctggtatcagcagaaacctggccaggctcccaggctcctcatacatggcgcatccaccggggccactggcaccccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagtacactggagcctgaagattttgcagtgtattactgtcagcaatatggtaggacaccgtacacttttggccaggggaccaagctggagaacaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagcagctacttagcctggtatcagcagaaacctggccaggctcccaggctcctcatacatggcgcatccaccggggccactggcaccccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagtacactggagcctgaagattttgcagtgtattactgtcagcaatatggtaggacaccgtacacttttggccaggggaccaagctggagaacaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号796:
gatattgtgatgacccagactccactctctctgtccgtcacccctggacagccggcctccatctcctgcaggtctagtcagagcctcctgcgaagtgatggaaagacgtttttgtattggtatctgcagaagccaggccagtctccccaacccctaatgtatgaggtgtccagccggttctctggagtgccagataggttcagtggcagcgggtcaggggcagatttcacactgaacatcagccgggtggagactgaggatgttgggatctattactgcatgcaaggtttgaaaattcgtcggacgtttggcccagggaccaaggtcgaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gatattgtgatgacccagactccactctctctgtccgtcacccctggacagccggcctccatctcctgcaggtctagtcagagcctcctgcgaagtgatggaaagacgtttttgtattggtatctgcagaagccaggccagtctccccaacccctaatgtatgaggtgtccagccggttctctggagtgccagataggttcagtggcagcgggtcaggggcagatttcacactgaacatcagccgggtggagactgaggatgttgggatctattactgcatgcaaggtttgaaaattcgtcggacgtttggcccagggaccaaggtcgaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号799:
gacatccagatgacccagtctccttccaccctgtctgcatctgtaggagacagagtcaccttctcttgccgggccagtcagagtgttagtagttgggtggcctggtatcagcagaaaccaggaaaagcccctaagctcctgatctctgaggcctccaatttggaaagtggggtcccatcccggttcagcggcagtggatccgggacagaattcactctcaccatcagcagcctgcagcctgaagattttgcaacttattactgccaacagtatcatagttactctgggtacacttttggccaggggaccaagttggaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccttccaccctgtctgcatctgtaggagacagagtcaccttctcttgccgggccagtcagagtgttagtagttgggtggcctggtatcagcagaaaccaggaaaagcccctaagctcctgatctctgaggcctccaatttggaaagtggggtcccatcccggttcagcggcagtggatccgggacagaattcactctcaccatcagcagcctgcagcctgaagattttgcaacttattactgccaacagtatcatagttactctgggtacacttttggccaggggaccaagttggaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号800:
gccatccagttgacccagtctccatcgtccctgtctgcatctgtaggcgacagagtcaccctcacttgccgggcgagtcagggcattaccgattctttagcctggtatcagcagaaaccagggaaagcccctaaggtcctgctctatgctgcttccagattggaaagtggggtcccatccaggttcagtggccgtggatctgggacggatttcactctcaccatcagcagcctgcagcctgaagactttgcaacttattactgtcaacagtattctaagtcccctgcgacgttcggcccagggaccaaggtggaaatcagacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gccatccagttgacccagtctccatcgtccctgtctgcatctgtaggcgacagagtcaccctcacttgccgggcgagtcagggcattaccgattctttagcctggtatcagcagaaaccagggaaagcccctaaggtcctgctctatgctgcttccagattggaaagtggggtcccatccaggttcagtggccgtggatctgggacggatttcactctcaccatcagcagcctgcagcctgaagactttgcaacttattactgtcaacagtattctaagtcccctgcgacgttcggcccagggaccaaggtggaaatcagacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号801:
gatattgtgatgacccagtctccactctccctgcccgtcacccctggagagccggcctccatctcctgcaggtctagtcagagcctcctaaatagtaatggattcaactatgtggattggtacctgcagaagccagggcagtctccacaactcctgatctatttgggttctaatcgggcctccggggtccctgacaggttcagtggcagtggatcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggggtttattactgcatgcaagctctagaaactccgctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gatattgtgatgacccagtctccactctccctgcccgtcacccctggagagccggcctccatctcctgcaggtctagtcagagcctcctaaatagtaatggattcaactatgtggattggtacctgcagaagccagggcagtctccacaactcctgatctatttgggttctaatcgggcctccggggtccctgacaggttcagtggcagtggatcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggggtttattactgcatgcaagctctagaaactccgctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号804:
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccagggggaagagccaccctctcctgcagggccagtcagagtgttagcagcggctacttagcctggtaccagcagaaacctggccaggctcccaggctcctcatctatggtgcatccggcagggccactggcatcccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagactggagcctgaagattttgcagtgtattactgtcagcagtattttggctcaccgtacacttttggccaggggaccaagctggagctcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccagggggaagagccaccctctcctgcagggccagtcagagtgttagcagcggctacttagcctggtaccagcagaaacctggccaggctcccaggctcctcatctatggtgcatccggcagggccactggcatcccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagactggagcctgaagattttgcagtgtattactgtcagcagtattttggctcaccgtacacttttggccaggggaccaagctggagctcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号810:
aacatccagatgacccagtctccatctgccatgtctgcatctgtaggagacagagtcaccatcacttgtcgggcgagtcagggcattagtaattatttagtctggtttcagcagaaaccagggaaagtccctaagcgcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagcggcagtggatctgggacagaattcactctcacaatcagcagcctgcagcctgaagattttgcaacttattactgtctacagcataatatttccccttacacttttggccaggggaccaagctggagaccaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
aacatccagatgacccagtctccatctgccatgtctgcatctgtaggagacagagtcaccatcacttgtcgggcgagtcagggcattagtaattatttagtctggtttcagcagaaaccagggaaagtccctaagcgcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagcggcagtggatctgggacagaattcactctcacaatcagcagcctgcagcctgaagattttgcaacttattactgtctacagcataatatttccccttacacttttggccaggggaccaagctggagaccaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号811:
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgcaggtccagtgagactgttttatacacctctaaaaatcagagctacttagcttggtaccagcagaaagcacgacagcctcctaaactactcctttactgggcatctacccgggaatccggggtccctgcccgattcagtggcagcggatctgggacagatttcactctcgccatcagcagcctgcaggctgaagatgtggcagtttattactgtcagcaattttttaggagtcctttcactttcggccccgggaccagactggagattaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgcaggtccagtgagactgttttatacacctctaaaaatcagagctacttagcttggtaccagcagaaagcacgacagcctcctaaactactcctttactgggcatctacccgggaatccggggtccctgcccgattcagtggcagcggatctgggacagatttcactctcgccatcagcagcctgcaggctgaagatgtggcagtttattactgtcagcaattttttaggagtcctttcactttcggccccgggaccagactggagattaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号812:
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagttaccctctcttgcagggccagtcagagtgttagcagcagttacatagcctggtaccagcagaagcctggccaggctcccaggctcgtcatctatgctgcatcccgcagggccactggcgtcccagacaggttcagtggcagtgggtctgcgacagacttcactctcaccatcagtagactggagcctgaagatcttgcagtgtattactgtcagcactatggtaactcactattcactttcggccctgggaccaaggtggatgtcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagttaccctctcttgcagggccagtcagagtgttagcagcagttacatagcctggtaccagcagaagcctggccaggctcccaggctcgtcatctatgctgcatcccgcagggccactggcgtcccagacaggttcagtggcagtgggtctgcgacagacttcactctcaccatcagtagactggagcctgaagatcttgcagtgtattactgtcagcactatggtaactcactattcactttcggccctgggaccaaggtggatgtcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号814:
gacatccagatgacccagtctccctccaccctgtctgcatctgtcggagacagagtcaccatcacttgccgggccagtcagagtattggtagccggttggcctggtatcagcagcaaccagggaaagcccctaaattcctgatctatgatgcctccagtttggaaagtggggtcccatcaaggttcagcggcagtggatcagggacagaattcactctcaccatcagcagcctgcagccggaggatcttgcaacttattactgccaacagtacaatagagattctccgtggacgttcggccaagggaccaaggtggaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccctccaccctgtctgcatctgtcggagacagagtcaccatcacttgccgggccagtcagagtattggtagccggttggcctggtatcagcagcaaccagggaaagcccctaaattcctgatctatgatgcctccagtttggaaagtggggtcccatcaaggttcagcggcagtggatcagggacagaattcactctcaccatcagcagcctgcagccggaggatcttgcaacttattactgccaacagtacaatagagattctccgtggacgttcggccaagggaccaaggtggaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号816:
gatattgtgatgacccagtctccactctccctgcccgtcaccccaggagagccggcctccatctcctgcaggtctagtcagagcctcctgcatagtgatggacgctactatgtggattggtacctgcagaagccagggcagtctccacacctcctgatctatttggcttctaatcgggcctccggggtccctgacaggttcactggcagtggatcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggcgtttattactgcatgcaaggtctacacactccttggacgttcggccaggggaccaaggtggacatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gatattgtgatgacccagtctccactctccctgcccgtcaccccaggagagccggcctccatctcctgcaggtctagtcagagcctcctgcatagtgatggacgctactatgtggattggtacctgcagaagccagggcagtctccacacctcctgatctatttggcttctaatcgggcctccggggtccctgacaggttcactggcagtggatcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggcgtttattactgcatgcaaggtctacacactccttggacgttcggccaggggaccaaggtggacatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号817:
gaaattgtaatgacacagtctccagccaccctgtctgcgtccccaggggaaagagccaccctctcctgttgggccagtcagactattggaggcaacttagcctggtaccagcagaaacctggccaggctcccaggctcctcatctatggtgcatccaccagggccactggtgtcccagccaggttcagtggcagtgggtctgggacagagttcactctcgccatcagcagcctgcagtctgaagattttgcagtttattactgtcagcagtataaaaactggtacacttttggccaggggaccaagctggagctcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtaatgacacagtctccagccaccctgtctgcgtccccaggggaaagagccaccctctcctgttgggccagtcagactattggaggcaacttagcctggtaccagcagaaacctggccaggctcccaggctcctcatctatggtgcatccaccagggccactggtgtcccagccaggttcagtggcagtgggtctgggacagagttcactctcgccatcagcagcctgcagtctgaagattttgcagtttattactgtcagcagtataaaaactggtacacttttggccaggggaccaagctggagctcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号818:
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagaccattgccagttacgtaaattggtaccaacaaaaaccagggagagcccctagtctcctgatctatgctgcatctaacttgcagagtggggtcccaccaaggttcagtggcagtggatctgggacagacttcactctcaccatcagcggtctgcaacctgacgattttgcaacttattactgtcaacagagttacagttatcgagcgctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagaccattgccagttacgtaaattggtaccaacaaaaaccagggagagcccctagtctcctgatctatgctgcatctaacttgcagagtggggtcccaccaaggttcagtggcagtggatctgggacagacttcactctcaccatcagcggtctgcaacctgacgattttgcaacttattactgtcaacagagttacagttatcgagcgctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号819:
gaaattgtgttgacacagtctccagccaccctgtcgttgtccccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagctccttagcctggtaccaacagacacctggccaggctcccaggcttctcatctatgatgcgtcctacagggtcactggcatcccagccaggttcagtggcagtgggtctgggatagacttcactctcaccatcagcagcctagagcctgaagattttgcagtttactattgtcagcagcgtagcaactggcctccggggctcactttcggcggggggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacacagtctccagccaccctgtcgttgtccccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagctccttagcctggtaccaacagacacctggccaggctcccaggcttctcatctatgatgcgtcctacagggtcactggcatcccagccaggttcagtggcagtgggtctgggatagacttcactctcaccatcagcagcctagagcctgaagattttgcagtttactattgtcagcagcgtagcaactggcctccggggctcactttcggcggggggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号824:
gccatccagttgacccagtctccatcctccctgtctgcatctgttggagacacagtcaccgtcacttgccggccaagtcaggacattagcagtgctttagcctggtatcagcagaaaccagggaaacctcctaagctcctgatctatggtgcctccactttggattatggggtcccattaaggttcagcggcactgcatctgggacacatttcactctcaccatcagcagcctgcaacctgaagattttgcaacttattactgtcaacagtttaatacttacccattcactttcggccctgggaccaaagtggatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gccatccagttgacccagtctccatcctccctgtctgcatctgttggagacacagtcaccgtcacttgccggccaagtcaggacattagcagtgctttagcctggtatcagcagaaaccagggaaacctcctaagctcctgatctatggtgcctccactttggattatggggtcccattaaggttcagcggcactgcatctgggacacatttcactctcaccatcagcagcctgcaacctgaagattttgcaacttattactgtcaacagtttaatacttacccattcactttcggccctgggaccaaagtggatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号825:
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgcaagtccagccagagtgttttatacaactccaacaataagaactacttagcctggtatcagcagaaaccaggacagcctcctaagctcctcattcacttggcatctacccgggaatacggggtccctgaccgattcagtggcagcgggtctgggacagatttcgctctcatcatcagcagcctgcaggctgaagatgtggcagtttattactgtcaacaatattatcaaactcctctaacttttggccaggggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgcaagtccagccagagtgttttatacaactccaacaataagaactacttagcctggtatcagcagaaaccaggacagcctcctaagctcctcattcacttggcatctacccgggaatacggggtccctgaccgattcagtggcagcgggtctgggacagatttcgctctcatcatcagcagcctgcaggctgaagatgtggcagtttattactgtcaacaatattatcaaactcctctaacttttggccaggggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号827:
gacatccagatgacccagtctccatcctccctggctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagttcattagcagctatttacattggtatcagcaaagaccaggcaaggcccctaaactcctgatgtatgctgcctccactttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacagagttacactaacccatacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctggctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagttcattagcagctatttacattggtatcagcaaagaccaggcaaggcccctaaactcctgatgtatgctgcctccactttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacagagttacactaacccatacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号829:
gacatccagatgacccagtctccatcctccctatctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattgccagctatttaaattggtatcagcagaaaccagggaaagcccccaaactcctgatctatgctgcatccagtttgcatagtggggtcccatcaagattcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacacagttacagtactcgattcactttcggccctgggaccaaagtggatgtcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctatctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagagcattgccagctatttaaattggtatcagcagaaaccagggaaagcccccaaactcctgatctatgctgcatccagtttgcatagtggggtcccatcaagattcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacacagttacagtactcgattcactttcggccctgggaccaaagtggatgtcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号830:
gacatccagatgacccagtctccttcgaccctgtctgcatctgtaggagacagagtcaccatcacttgccgggccagtcagagtgttactagtgagttggcctggtatcagcagaaaccagggaaagcccctaacttcctgatctataaggcgtctagtttagaaagtggggtcccatcaaggttcagcggcagtggatctgggacagaattcactctcaccatcagcagcctgcagcctgatgattttgcaacttattactgccaacagtataatagttttccgtacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccttcgaccctgtctgcatctgtaggagacagagtcaccatcacttgccgggccagtcagagtgttactagtgagttggcctggtatcagcagaaaccagggaaagcccctaacttcctgatctataaggcgtctagtttagaaagtggggtcccatcaaggttcagcggcagtggatctgggacagaattcactctcaccatcagcagcctgcagcctgatgattttgcaacttattactgccaacagtataatagttttccgtacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号831:
gacatccagatgacccagtctccttccaccctgtctgcatctgtaggcgacagactcaccatcacttgccgggccagtcagaatatttataactggttggcctggtatcagcagaaaccagggaaagcccctaaactcctgatctatgacgcctccactttggaaagtggggtcccatcaaggttcagcggcagtggatctgggacagagttcactctcaccatcagcagcctgcagcctgatgattttgcgacttattactgccaacaatataatagtttgtctccgacgttcggccaagggaccaaggtggaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccttccaccctgtctgcatctgtaggcgacagactcaccatcacttgccgggccagtcagaatatttataactggttggcctggtatcagcagaaaccagggaaagcccctaaactcctgatctatgacgcctccactttggaaagtggggtcccatcaaggttcagcggcagtggatctgggacagagttcactctcaccatcagcagcctgcagcctgatgattttgcgacttattactgccaacaatataatagtttgtctccgacgttcggccaagggaccaaggtggaaatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号835:
gacatccagttgacccagtctccatccttcctgtctgcatctttagaagacagagtcactatcacttgccgggccagtcagggcattagcagttatttagcctggtatcagcaaaaaccagggaaagcccctaagctcctgctcgatgctgcatccactttgcaaagtggggtcccatcaaggttcagcggcagtggatctgggacagagttcactctcacaatcagcagcctgcagcctgaagattttgcaacttattactgtcaacagcttaatagttaccctcggacgttcggccaagggaccaaggtggacatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagttgacccagtctccatccttcctgtctgcatctttagaagacagagtcactatcacttgccgggccagtcagggcattagcagttatttagcctggtatcagcaaaaaccagggaaagcccctaagctcctgctcgatgctgcatccactttgcaaagtggggtcccatcaaggttcagcggcagtggatctgggacagagttcactctcacaatcagcagcctgcagcctgaagattttgcaacttattactgtcaacagcttaatagttaccctcggacgttcggccaagggaccaaggtggacatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号838:
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcagcatcacttgccgggcgagtcagggcattagcaattatttagcctggtatcagcagaaaccagggaaggttcctaagctcctgatctatgctgcatccactttgcaatcaggggtcccatctcggttcagtggcagtggatctgggacagatttcactctcaccatcagcagcctgcagcctgaggatgttgcaacttattactgtcaaaagtataacagtgcccctcaaacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcagcatcacttgccgggcgagtcagggcattagcaattatttagcctggtatcagcagaaaccagggaaggttcctaagctcctgatctatgctgcatccactttgcaatcaggggtcccatctcggttcagtggcagtggatctgggacagatttcactctcaccatcagcagcctgcagcctgaggatgttgcaacttattactgtcaaaagtataacagtgcccctcaaacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号841:
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgcaggtccagccagagtgttttatacagctccaacaataagaactacttagcttggtaccagcagaaaccaggacagcctcctaagctgctcgtttactgggcatcaacccgggcatccggggtccctgaccgattcagtggcagcgggtctgggacagatttcactctcaccctcagcagcctgcaggctgaagatgtggcagtttattactgtcagcagtttcatagtactcctcggacgttcggccaagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatcgtgatgacccagtctccagactccctggctgtgtctctgggcgagagggccaccatcaactgcaggtccagccagagtgttttatacagctccaacaataagaactacttagcttggtaccagcagaaaccaggacagcctcctaagctgctcgtttactgggcatcaacccgggcatccggggtccctgaccgattcagtggcagcgggtctgggacagatttcactctcaccctcagcagcctgcaggctgaagatgtggcagtttattactgtcagcagtttcatagtactcctcggacgttcggccaagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号853:
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagcaactacttagcctggtaccagcagaaacctggccaggctcccaggctcctcatctatggtgcatccagcagggccgctggcatgccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagactggagcctgaagattttgcagtgtattactgtcagcagtatggtaactcaccgctcactttcggcggagggaccgaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacgcagtctccaggcaccctgtctttgtctccaggggaaagagccaccctctcctgcagggccagtcagagtgttagcagcaactacttagcctggtaccagcagaaacctggccaggctcccaggctcctcatctatggtgcatccagcagggccgctggcatgccagacaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagactggagcctgaagattttgcagtgtattactgtcagcagtatggtaactcaccgctcactttcggcggagggaccgaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号855:
gacatccagatgacccagtctccatcttctgtgtctgcatctgtaggagacagagtcaccatcacttgtcgggcgagtcaggctattagtaactggttagcctggtatcagcagaaaccaggaaaagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaagattcagcggcagtggatctgggacagatttcactctcactatcagcggcctgcagcctgaggattttgcaacttactattgtcaacaggctgacactttccctttcactttcggccctgggaccaaagtggatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcttctgtgtctgcatctgtaggagacagagtcaccatcacttgtcgggcgagtcaggctattagtaactggttagcctggtatcagcagaaaccaggaaaagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaagattcagcggcagtggatctgggacagatttcactctcactatcagcggcctgcagcctgaggattttgcaacttactattgtcaacaggctgacactttccctttcactttcggccctgggaccaaagtggatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号856:
gatattgtgatgacccagactccactctccctgcccgtcacccctggagagccggcctccatctcctgcaggtctagtcagagcctcttggatagtaatgatggaaacacctatttggactggtacctgcagaagccagggcagtctccacagctcctgatttatacattttcctatcgggcctctggagtcccagacaggttcagtggcagtgggtctggcactgatttcacactgaaaatcagcagggtggaggccgaggatgttggagtttattactgcatgcaacgtatcgagtttccgtacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gatattgtgatgacccagactccactctccctgcccgtcacccctggagagccggcctccatctcctgcaggtctagtcagagcctcttggatagtaatgatggaaacacctatttggactggtacctgcagaagccagggcagtctccacagctcctgatttatacattttcctatcgggcctctggagtcccagacaggttcagtggcagtgggtctggcactgatttcacactgaaaatcagcagggtggaggccgaggatgttggagtttattactgcatgcaacgtatcgagtttccgtacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号857:
gatattgtgatgacccagtctccactctccctgcccgtcacccctggagagccggcctccatctcctgcaggtctagtcagagcctcctgcatagaaatgagtacaactatttggattggtacttgcagaagccagggcagtctccacagctcctgatctattggggttctaatcgggcctccggggtccctgacaggttcagtggcagtggatcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggggtttattactgcatgcaaactctacaaactcctcggacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gatattgtgatgacccagtctccactctccctgcccgtcacccctggagagccggcctccatctcctgcaggtctagtcagagcctcctgcatagaaatgagtacaactatttggattggtacttgcagaagccagggcagtctccacagctcctgatctattggggttctaatcgggcctccggggtccctgacaggttcagtggcagtggatcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggggtttattactgcatgcaaactctacaaactcctcggacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号858:
gacatccagatgacccagtctccatcctccgtgtctgcatctgtgggagacagagtcaccatcacttgccaggcgagtcaagacattagcaactatttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatcttcgatgcaaccaaattggagacaggggtcccaacaaggttcattggaagtggatctgggacagattttactgtcaccatcaccagcctgcagcctgaagatgttgcaacatattactgtcaacactttgctaatctcccatacacttttggccaggggaccaagctggagatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccgtgtctgcatctgtgggagacagagtcaccatcacttgccaggcgagtcaagacattagcaactatttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatcttcgatgcaaccaaattggagacaggggtcccaacaaggttcattggaagtggatctgggacagattttactgtcaccatcaccagcctgcagcctgaagatgttgcaacatattactgtcaacactttgctaatctcccatacacttttggccaggggaccaagctggagatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号859:
gacatccagatgacccagtctccatcttccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcgagtcagggcattaggaattatttagcctggtatcagcagaaaccagggaaagttcctaagctcctggtctttgctgcatccactttgcaatcaggggtcccatctcggttcagtggcagtggatctgggacagatttcactctcaccatcagcagcctgcagcctgaggatgttgcaacttattactgtcaaaggtataacagtgccccgctcactttcggcggagggacgaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcttccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcgagtcagggcattaggaattatttagcctggtatcagcagaaaccagggaaagttcctaagctcctggtctttgctgcatccactttgcaatcaggggtcccatctcggttcagtggcagtggatctgggacagatttcactctcaccatcagcagcctgcagcctgaggatgttgcaacttattactgtcaaaggtataacagtgccccgctcactttcggcggagggacgaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号861:
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagatcattgccagctatttaaattggtatcagcagaaaccaggcagagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacagagttacagtacccccatattcactttcggccctgggaccaaggtgaatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagatcattgccagctatttaaattggtatcagcagaaaccaggcagagcccctaagctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacagagttacagtacccccatattcactttcggccctgggaccaaggtgaatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号863:
gaaattgtgttgacacagtctccagccaccctgtctttgtctccaggggaaagagccaccctctcctgcaggaccagtcagagtgttagcagctacttagcctggtaccaacagaaacctggccaggctcccaggctcctcatctatgatgcttccaatagggccactggcatcccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagcctagagcctgaagattttgcagtttattactgtcagcagcgtagtgactggctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtgttgacacagtctccagccaccctgtctttgtctccaggggaaagagccaccctctcctgcaggaccagtcagagtgttagcagctacttagcctggtaccaacagaaacctggccaggctcccaggctcctcatctatgatgcttccaatagggccactggcatcccagccaggttcagtggcagtgggtctgggacagacttcactctcaccatcagcagcctagagcctgaagattttgcagtttattactgtcagcagcgtagtgactggctcactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号868:
gaaattgtaatgacacagtctccagccaccctgtctgtgtctccaggggaaagagccaccctctcctgcagggccagtcagagtattaaaaacaacttggcctggtaccaggtgaaacctggccaggctcccaggctcctcacctctggtgcatccgccagggccactggaattccaggcaggttcagtggcagtgggtctgggactgacttcactctcaccatcagcagcctccagtctgaagatattgcagtttattactgtcaggagtataataattggcccctgctcactttcggcggagggaccaaggtggagatccaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtaatgacacagtctccagccaccctgtctgtgtctccaggggaaagagccaccctctcctgcagggccagtcagagtattaaaaacaacttggcctggtaccaggtgaaacctggccaggctcccaggctcctcacctctggtgcatccgccagggccactggaattccaggcaggttcagtggcagtgggtctgggactgacttcactctcaccatcagcagcctccagtctgaagatattgcagtttattactgtcaggagtataataattggcccctgctcactttcggcggagggaccaaggtggagatccaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号870:
gacatccagatgacccagtctcctccctccctgtctgcatctgtgggagacagagtcaccatcacttgccgggcaagtcagaggattgccagctatttaaattggtatcagcagaaaccagggagagcccctaagctcctgatctttgctgcatccagtttacaaagtggggtcccatcaaggttcagtggcagtggatctgggacagacttcactctcaccatcagtagtctgcaacctgaagattatgcgacttactactgtcaacagagttacagtactcccatctacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctcctccctccctgtctgcatctgtgggagacagagtcaccatcacttgccgggcaagtcagaggattgccagctatttaaattggtatcagcagaaaccagggagagcccctaagctcctgatctttgctgcatccagtttacaaagtggggtcccatcaaggttcagtggcagtggatctgggacagacttcactctcaccatcagtagtctgcaacctgaagattatgcgacttactactgtcaacagagttacagtactcccatctacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号871:
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccaggcgagtcagggcattagcaactatttaaattggtatcaacagaaaccagggaaagcccctaagctcctgatcttcgatgcatccaatttggaatcagaggtcccatcaaggttcagtggacgtggatctgggacagattttactttctccatcagcagcctgcagcctgaagatattgcaacatatttctgtcaacagtatgataatttcccgtacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccaggcgagtcagggcattagcaactatttaaattggtatcaacagaaaccagggaaagcccctaagctcctgatcttcgatgcatccaatttggaatcagaggtcccatcaaggttcagtggacgtggatctgggacagattttactttctccatcagcagcctgcagcctgaagatattgcaacatatttctgtcaacagtatgataatttcccgtacacttttggccaggggaccaagctggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号880:
gacatccagatgacccagtctccatcctccctggctgcatctgtaggagacagagtcaccatcacctgccgggcaagtcagacgattgccagttatgtaaattggtatcaacagaaaccagggaaagcccctaatctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcatcttacttctgtcaacagagttacagtttcccgtacacttttggccaggggaccaagctggatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctggctgcatctgtaggagacagagtcaccatcacctgccgggcaagtcagacgattgccagttatgtaaattggtatcaacagaaaccagggaaagcccctaatctcctgatctatgctgcatccagtttgcaaagtggggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcatcttacttctgtcaacagagttacagtttcccgtacacttttggccaggggaccaagctggatatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号881:
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagaccattgccagctatgtaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgctgcatccaatttgcaaagtggggtcccttcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacagagttacagtgtccctcggctcactttcggcggagggaccaaggtggacatcacacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccgggcaagtcagaccattgccagctatgtaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgctgcatccaatttgcaaagtggggtcccttcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattttgcaacttactactgtcaacagagttacagtgtccctcggctcactttcggcggagggaccaaggtggacatcacacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号884:
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccggtcaagtcagaccattagcgtctttttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgccgcatccagtttgcacagtgcggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattctgcaacttactactgtcaagagagtttcagtagctcaactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gacatccagatgacccagtctccatcctccctgtctgcatctgtaggagacagagtcaccatcacttgccggtcaagtcagaccattagcgtctttttaaattggtatcagcagaaaccagggaaagcccctaagctcctgatctatgccgcatccagtttgcacagtgcggtcccatcaaggttcagtggcagtggatctgggacagatttcactctcaccatcagcagtctgcaacctgaagattctgcaacttactactgtcaagagagtttcagtagctcaactttcggcggagggaccaaggtggagatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号886:
gaaattgtaatgacacagtctccagccaccctgtctgtgtctccaggggaaacagccaccctctcctgcagggccagtcagagtgttagcagcaacttagcctggtaccaacataaacctggccaggctcccaggctcctcatccatagtgcatccaccagggccactgggatcccagccaggttcagtggcagtgggtctgggacagagttcactctcaccataagcagcctgcagtctgaagattttgcagtttattactgtcagcagtataatatgtggcctccctggacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtaatgacacagtctccagccaccctgtctgtgtctccaggggaaacagccaccctctcctgcagggccagtcagagtgttagcagcaacttagcctggtaccaacataaacctggccaggctcccaggctcctcatccatagtgcatccaccagggccactgggatcccagccaggttcagtggcagtgggtctgggacagagttcactctcaccataagcagcctgcagtctgaagattttgcagtttattactgtcagcagtataatatgtggcctccctggacgttcggccaagggaccaaggtggaaatcaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号888:
gatattgtgatgacccagtctccactctccctgcccgtcacccctggagcgccggcctccatctcctgcaggtctagtcagagcctcctgcgtactaatggatacaactatttggattggtacctgcagaagccagggcagtctccacagctcctgatctatttgggttctattcgggcctccggggtccctgacaggttcagtggcagtggctcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggggtttattactgcatgcaatctctacaaacttcgatcaccttcggccaagggacacgactggagattaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gatattgtgatgacccagtctccactctccctgcccgtcacccctggagcgccggcctccatctcctgcaggtctagtcagagcctcctgcgtactaatggatacaactatttggattggtacctgcagaagccagggcagtctccacagctcctgatctatttgggttctattcgggcctccggggtccctgacaggttcagtggcagtggctcaggcacagattttacactgaaaatcagcagagtggaggctgaggatgttggggtttattactgcatgcaatctctacaaacttcgatcaccttcggccaagggacacgactggagattaaacgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
クローン番号894:
gaaattgtaatgacacagtctccagccaccctgtctgtgtctccgggggaaagagccaccctctcctgcagggctagtcagagtgttggcaacaacttagcctggtaccagcagagacctggccaggctcccagactcctcatctatggtgcgtccaccagggccactggtatcccagccaggttcagtggcagtgggtctgggacagagttcactctcaccatcagcagcctgcagtctgaggattttgcagtttattactgtcagcagtatgataagtggcctgagacgttcggccaggggaccaaggtggacatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
gaaattgtaatgacacagtctccagccaccctgtctgtgtctccgggggaaagagccaccctctcctgcagggctagtcagagtgttggcaacaacttagcctggtaccagcagagacctggccaggctcccagactcctcatctatggtgcgtccaccagggccactggtatcccagccaggttcagtggcagtgggtctgggacagagttcactctcaccatcagcagcctgcagtctgaggattttgcagtttattactgtcagcagtatgataagtggcctgagacgttcggccaggggaccaaggtggacatcaagcgaactgtggctgcaccatctgtcttcatcttcccgccatctgatgagcagttgaaatctggaactgcctctgttgtgtgcctgctgaataacttctatcccagagaggccaaagtacagtggaaggtggataacgccctccaatcgggtaactcccaggagagtgtcacagagcaggacagcaaggacagcacctacagcctcagcagcaccctgacgctgagcaaagcagactacgagaaacacaaagtctacgcctgcgaagtcacccatcagggcctgagctcgcccgtcacaaagagcttcaacaggggagagtgt
上記で考察された44個のクローンの全てにおいて、コードされた抗体は、同一の定常IgG重鎖を含み、それらは、以下のアミノ酸配列を有する(配列番号178):
SASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
SASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
この配列において、エクソンは二重下線により示される。さらに、最初のSerをコードするヌクレオチドagt(ボルド体下線)は、IgG発現ベクターにおいて、可変重鎖部位をコードするXhoIで消化されたPCR産物のXhoIで消化された発現ベクターへの導入の結果として作成される。
上に記載されるVHおよびVLをコードするペアーは、ELISAおよび/またはFLISAにおける様々な抗原およびペプチドに対する結合特異性、エピトープマッピング、抗原多様性、ならびに配列多様性により選択された。誤りが見つかった場合、選択された同種V−遺伝子ペアーをクローン修復(実施例1、セクションf)にかけた。各々の発現構築物を、CHO−FlpIn受容細胞株(Invitrogen)へのFlp−リコンビナーゼを発現するプラスミドを用いて共トランスフェクトし、次いで、組み込み体の抗生物質選択を行った。トランスフェクション、選択、および無血清培地への適応を、実施例1、セクションg−1およびg−2に記載されるごとく行った。
各抗体を産生する細胞株の細胞バンクを作成するために、安定的にトランスフェクトされ、無血清の懸濁培地が適応された個々の発現細胞株を複数のアンプルで凍結保存した。
インビトロ中和実験を、単一抗体クローンおよび精製された抗体の組み合わせの両方で行った。以下に記載される全ての抗体混合物は、本発明の各抗−RSV抗体の多くからなり、それらを等量の異なる抗体を用いた混合物中に混合させた。
単一抗体のテスト
最初に、各抗体の中和活性を、実施例1、セクションj−2で上に記載されるごとく、RSVサブタイプAおよびB株に対する補体の存在下におけるPRNTで調べた。多くの精製抗体のEC50値を表7に示す。興味深いことに、ほとんどの抗−F抗体が各々ウイルス中和活性を示した一方、EC50は抗−RSVタンパク質G抗体の大半で測定されなかった。このことは、これらの抗体が各々、ウイルスを中和することができないことを示す。空欄は、まだ解析を行っていないことを示す。NDは、EC50値が非常に低いか、もしくは中和活性を欠失しているため、PRNTで測定できなかったことを示す。
最初に、各抗体の中和活性を、実施例1、セクションj−2で上に記載されるごとく、RSVサブタイプAおよびB株に対する補体の存在下におけるPRNTで調べた。多くの精製抗体のEC50値を表7に示す。興味深いことに、ほとんどの抗−F抗体が各々ウイルス中和活性を示した一方、EC50は抗−RSVタンパク質G抗体の大半で測定されなかった。このことは、これらの抗体が各々、ウイルスを中和することができないことを示す。空欄は、まだ解析を行っていないことを示す。NDは、EC50値が非常に低いか、もしくは中和活性を欠失しているため、PRNTで測定できなかったことを示す。
抗−F抗体の混合物
サブタイプAおよびBのRSV株を中和する抗−RSVタンパク質F抗体の混合物の能力を、パリビズマブ(抗−F抗体についても)を用いて得られた中和効果と比較した。中和能力を、実施例1、セクションjに記載されるごとくマイクロ中和試験またはPRNTを用いて測定した。最初の実験では、5個および11個の異なる抗−F抗体を含む2つの抗体混合物、抗−F(I)および抗−F(II)を各々、マイクロ中和試験を用いてパリビズマブと比較した。抗−F(I)は、クローン810、818、819、825および827から得られる抗体からなる。抗体810および819は、抗原部位A/IIに結合し、抗体818は、部位B/IまたはF1に、抗体825は、部位AおよびCと重複する複合エピトープに結合し、ならびに抗体827は、別の複合エピトープに結合する(表5を参照)。抗−F(II)は、クローン735、800、810、818、819、825、827、863、880、884および894から得られる抗体からなる。抗−F(II)は、所定の抗原部位のいずれかに対する複数の結合部位を含む:抗体810、819および863はA/IIに結合し、抗体800および818はF1(またはB/I)に結合し、抗体827および825は、上に記載される複合エピトープに、抗体735および894は、未知のクラスター(UC)Iに属し、抗体880は、UCIIに、ならびに884は、別のいまだ未知のエピトープに結合する(表5を参照)。図5に示されるごとく、組成物抗−F(I)およびF(II)の両方は、両サブタイプのRSV株の中和に関してパリビズマブよりより強力である。
サブタイプAおよびBのRSV株を中和する抗−RSVタンパク質F抗体の混合物の能力を、パリビズマブ(抗−F抗体についても)を用いて得られた中和効果と比較した。中和能力を、実施例1、セクションjに記載されるごとくマイクロ中和試験またはPRNTを用いて測定した。最初の実験では、5個および11個の異なる抗−F抗体を含む2つの抗体混合物、抗−F(I)および抗−F(II)を各々、マイクロ中和試験を用いてパリビズマブと比較した。抗−F(I)は、クローン810、818、819、825および827から得られる抗体からなる。抗体810および819は、抗原部位A/IIに結合し、抗体818は、部位B/IまたはF1に、抗体825は、部位AおよびCと重複する複合エピトープに結合し、ならびに抗体827は、別の複合エピトープに結合する(表5を参照)。抗−F(II)は、クローン735、800、810、818、819、825、827、863、880、884および894から得られる抗体からなる。抗−F(II)は、所定の抗原部位のいずれかに対する複数の結合部位を含む:抗体810、819および863はA/IIに結合し、抗体800および818はF1(またはB/I)に結合し、抗体827および825は、上に記載される複合エピトープに、抗体735および894は、未知のクラスター(UC)Iに属し、抗体880は、UCIIに、ならびに884は、別のいまだ未知のエピトープに結合する(表5を参照)。図5に示されるごとく、組成物抗−F(I)およびF(II)の両方は、両サブタイプのRSV株の中和に関してパリビズマブよりより強力である。
図5はまた、5個の抗体(抗−F(I))の組み合わせが11個の抗体(抗−F(II))の組み合わせより強力であることが示唆されることを示す。抗−F(I)混合物は、これまで明確にされてきた異なるエピトープ特異性のうちで最も強力な個々の中和抗体のいくつかを含む。抗−F(II)混合物は、同一の5個の極めて強力な抗体を含むが、それはまた、所定のエピトープのいくつかに対するさらなる結合部位を含み、含まれた抗体はまた、それら自身におけるより広い範囲の中和活性を示す。それゆえ、極めて強力な抗体の活性は、Fタンパク質における中和エピトープへの結合による競合のため、抗−F(II)組み合わせで希釈される可能性がある。しかしながら、各々の抗体に関連する中和効果以外の効果、例えば、食作用の増加、抗体依存性細胞障害活性(ADCC)の上昇、抗炎症効果、補体活性、およびエスケープ変異体が作成される可能性の低下が可能性として存在することから、インビボを考慮に入れると、この結果は、5個の抗体混合物がインビボで用いられる際に11個の抗体混合物よりも良好であるという指標として解釈されるべきではない。
この最初の実験および補体の存在下で極めて強力であるF−特異的な抗体クローンの多くの組み合わせが同定されたことから、インビトロアッセイおよびクローンの組み合わせの両方が精査された。さらなる抗−F抗体組成物のEC50値(プラーク数の50%減少を引き起こすのに必要とされる有効濃度)として表される中和能力を表8に記載する。組成物中のクローンの正確な数によらず、F−特異的抗体のテストされた組み合わせの大半は、RSV株サブタイプAの中和に関してパリビズマブよりも強力である。
抗−G抗体の混合物
サブタイプAのRSV株を中和する抗−G抗体混合物の能力を、実施例1、セクションj−2に記載されるように、PRNTを用いてテストした。テストした抗−G抗体組成物からのEC50値を表8に記載する。2つの抗−G抗体の組成物のほとんどは、個々の抗−G抗体と比較してウイルスを中和する能力の顕著な上昇を示さなかった。2または3つの抗−G抗体のうちのいくつかの組み合わせは、濃度にかかわらず、決して100%のウイルス中和率には到達しなかった。しかしながら、さらなる抗−G抗体を組成物に添加すると能力が上昇し、それは、可能性として抗−G抗体間における相乗的な中和効果を示唆する。図7は、複数のG−特異的なクローンを組み合わせた際の能力の上昇の一例を示す。
サブタイプAのRSV株を中和する抗−G抗体混合物の能力を、実施例1、セクションj−2に記載されるように、PRNTを用いてテストした。テストした抗−G抗体組成物からのEC50値を表8に記載する。2つの抗−G抗体の組成物のほとんどは、個々の抗−G抗体と比較してウイルスを中和する能力の顕著な上昇を示さなかった。2または3つの抗−G抗体のうちのいくつかの組み合わせは、濃度にかかわらず、決して100%のウイルス中和率には到達しなかった。しかしながら、さらなる抗−G抗体を組成物に添加すると能力が上昇し、それは、可能性として抗−G抗体間における相乗的な中和効果を示唆する。図7は、複数のG−特異的なクローンを組み合わせた際の能力の上昇の一例を示す。
抗−Fおよび抗−G抗体の混合物
RSVサブタイプB株を中和する抗−RSVタンパク質Fおよびタンパク質G抗体混合物の能力を、パリビズマブを用いて得られる中和効果と比較した。実施例1、セクションj−4に記載ごときマイクロ中和融合阻害アッセイまたはプラーク減少中和アッセイ(実施例1、セクションj−2)のどちらかを用いて中和能力を測定した。
RSVサブタイプB株を中和する抗−RSVタンパク質Fおよびタンパク質G抗体混合物の能力を、パリビズマブを用いて得られる中和効果と比較した。実施例1、セクションj−4に記載ごときマイクロ中和融合阻害アッセイまたはプラーク減少中和アッセイ(実施例1、セクションj−2)のどちらかを用いて中和能力を測定した。
最初に、2つの抗体混合物、抗−F(I)Gおよび抗−F(II)Gの中和活性をマイクロ中和融合阻害アッセイで測定した。これらの混合物の各々は、上に記載される組成物抗−F(I)および抗−F(II)の抗−F抗体ならびにクローン793、796、838、841、856および888から得られる抗−G抗体を含み、ここで、抗体793、796、838はGタンパク質の保存領域に結合し、841、956はRSVサブタイプAのGCRRに結合し、および888は両方のサブタイプのGCRRに結合する(表5を参照)。図6に示されるように、両組成物抗−F(I)GおよびF(II)Gは、RSV B1株の中和に関してパリビズマブよりも強力である。さらに、2つの混合物の中和活性はおよそ同等である。それゆえ、抗−F抗体を多くのタンパク質G−特異的クローンと組み合わせると、2つの抗−F抗体混合物間で以前観察された能力の差異は減少するように思われる。このことは、RSVにおける広い範囲の抗原およびエピトープを認識する抗体を組み合わせると、一般的に中和活性が増加することを示唆しうる。
その後、抗−Fおよび抗−G抗体の両方の多くの異なる組み合わせを、補体の存在または非存在下におけるPRNTを用いてテストした。活性な補体の存在下でこのアッセイにより得られるEC50値を表8に表す。抗−Fおよび抗−G抗体の両方を含む全てのテストされた組成物はRSVサブタイプAを中和し、これらの大半はパリビズマブよりより強力である。
結果はまた、本発明の抗体クローニング技術を用いてヒトドナーから自然に高い親和性を有する抗体を繰り返し得られうることを示す。
RSV感染マウス肺におけるウイルス負荷の減少
RSV感染に対する本発明の精製抗体の組み合わせのインビボ保護能力を、実施例1、セクションk−1に記載されるように、BALB/cマウスモデルにおいて示した(Taylor et al. 1984. Immunology 52, 137-142; Mejias, et al. 2005. Antimicrob. Agents Chemother. 49: 4700-4707)。表9において、本発明の異なる抗体クローンの等量からなる3つの異なる抗−RSV rpAbを用いる実験からのデータを、同一の実験の未感染コントロールマウスおよびプラセボ(PBS)処理マウスからのデータと比較して表す。各処理群は5匹ずつのマウスを含み、このモデルにおいてウイルス複製のだいたいのピークである感染5日後にサンプルを得た。表9に示されるように、予防的に投与されると、rpAb組み合わせは、少なくとも投与量の順にウイルス負荷を有効に減少させる。コピー数を平均±標準偏差として表す。2つの処理群では、コピー数はこのアッセイの検出限界点またはそれ以下、すなわち、3.8log10RNAコピー/mlであった。
RSV感染に対する本発明の精製抗体の組み合わせのインビボ保護能力を、実施例1、セクションk−1に記載されるように、BALB/cマウスモデルにおいて示した(Taylor et al. 1984. Immunology 52, 137-142; Mejias, et al. 2005. Antimicrob. Agents Chemother. 49: 4700-4707)。表9において、本発明の異なる抗体クローンの等量からなる3つの異なる抗−RSV rpAbを用いる実験からのデータを、同一の実験の未感染コントロールマウスおよびプラセボ(PBS)処理マウスからのデータと比較して表す。各処理群は5匹ずつのマウスを含み、このモデルにおいてウイルス複製のだいたいのピークである感染5日後にサンプルを得た。表9に示されるように、予防的に投与されると、rpAb組み合わせは、少なくとも投与量の順にウイルス負荷を有効に減少させる。コピー数を平均±標準偏差として表す。2つの処理群では、コピー数はこのアッセイの検出限界点またはそれ以下、すなわち、3.8log10RNAコピー/mlであった。
RSV感染マウスに由来する肺サンプルにおけるサイトカインおよびケモカインレベル
試験的なマウス予防研究に由来する肺サンプルを市販されている複合的な免疫アッセイを用いて解析することにより、実施例1、セクションk−1に記載されるように、RSV感染およびrpAb 18による抗体予防後における異なるサイトカインおよびケモカインのレベルを調べた(表8)。未感染および未処理マウスからのサンプルについても、BALB/cマウスの基準データを得るために解析した。感染5日後に全てのサンプルを得た。データを平均±標準偏差として表す。
試験的なマウス予防研究に由来する肺サンプルを市販されている複合的な免疫アッセイを用いて解析することにより、実施例1、セクションk−1に記載されるように、RSV感染およびrpAb 18による抗体予防後における異なるサイトカインおよびケモカインのレベルを調べた(表8)。未感染および未処理マウスからのサンプルについても、BALB/cマウスの基準データを得るために解析した。感染5日後に全てのサンプルを得た。データを平均±標準偏差として表す。
解析では、ヒトとマウスの両方において、RSV感染、次いで炎症応答の重要なマーカーとして示される多くのサイトカインおよびケモカインは、インターフェロン(IFN)−γ、インターロイキン(IL)−1β、IL−4、IL−6、IL−8(KC/GROα)、IL−10、マクロファージ炎症タンパク質(MIP)−1α、発現および分泌標準T細胞活性調整(RANTES、CCL5)および腫瘍壊死因子(TNF)−αを含み、それらサイトカインおよびケモカイン数のレベルがプラセボ処理マウスの肺で上昇する一方、約50mg/kgのrpAbで処理したマウスの肺は、未感染のコントロールマウスとほぼ同一のレベルであることが示された。同様の結果を他の抗−RSV rpAbの組み合わせで得た。マウスはIL−8の自明なホモログを有していないが、KCと呼ばれるヒトGROαに機能的な相同性(IL−8と同様な機能)を有することは注目すべきである。
炎症応答の動力学および抗体予防の用量応答効果は調査中である。
Claims (50)
- RSVサブタイプAおよびBを中和することができる抗−RSV組み換えポリクローナル抗体であって、前記ポリクローナル抗体が、少なくとも1種のRSV外被タンパク質における少なくとも3種の異なるエピトープに一緒に特異的に結合する別個の抗体メンバーを含む、抗−RSV組み換えポリクローナル抗体。
- 前記ポリクローナル抗体が、少なくとも2種のRSV外被タンパク質に対する特異的な反応性を一緒に提供する別個の抗体メンバーを含む、請求項1記載の抗−RSV組み換えポリクローナル抗体。
- RSV外被タンパク質が、RSV Gタンパク質、RSV Fタンパク質およびRSV SHタンパク質から選択される、請求項1または2記載の抗−RSV組み換えポリクローナル抗体。
- 抗−外被タンパク質の反応性が抗−Gおよび抗−F反応性であり、前記反応性が少なくとも2種の別個の抗−G抗体および少なくとも1種の別個の抗−F抗体により提供される、請求項1から3のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体。
- 第1の抗−G抗体が、G−タンパク質における保存されたエピトープに特異的に結合でき、第2の抗−G抗体が、G−タンパク質システインリッチドメイン(GCRR)に特異的に結合でき、ならびにF−反応性が、抗原部位I、II、IV、V、VI、C、またはF1のうちの少なくとも1つに対して指向性である、請求項4記載の抗−RSV組み換えポリクローナル抗体。
- 少なくとも抗−G反応性の一部がCX3Cモチーフに対して指向性である、請求項4または5記載の抗−RSV組み換えポリクローナル抗体。
- 抗−G反応性が、さらに少なくとも1種の株特異的なエピトープに対して指向性である、請求項4から6のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体。
- 抗−F反応性が、少なくとも抗原部位IIおよび抗原部位IVに対して指向性である、請求項4から7のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体。
- 抗−外被タンパク質の反応性が、請求項4から8に対して、または関して指向性であって、さらにSHタンパク質に対して指向性である、請求項1から8のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体。
- 別個の抗体メンバーの組成物が、ドナーにおけるRSV外被抗原に対する多様性、親和性および特異性に関する液性免疫応答を反映する、請求項1から9のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体。
- 請求項1から10のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体であって、別個の抗体が、RSVに対する液性免疫応答を上げた一人またはそれ以上のヒトドナーから得られた核酸配列によりコードされ、前記ポリクローナル抗体が、十分にヒト抗体であるポリクローナル抗体。
- 別個の抗体メンバーが、ドナーに元々存在するVHおよびVLのペアーから構成される、請求項10または11記載の抗−RSV組み換えポリクローナル抗体。
- 別個のメンバーが各々、表5に示されるVHおよびVLのペアーの群から選択されるCDR1、CDR2およびCDR3領域を含む、請求項1から12のうちのいずれか記載の抗−RSV組み換えポリクローナル抗体。
- 請求項1から13のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体および医薬上許容される賦形剤を活性成分として含む、医薬組成物。
- 哺乳動物においてRSV感染に関連する1つまたはそれ以上の症状を予防、治療または改善する方法であって、前記哺乳動物に請求項1から13のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体または請求項14記載の医薬組成物の有効量を投与することを含む方法。
- 有効量が、体重kgあたり抗体100mgまたはそれ以下であり、例えば、体重kgあたり抗体90mgまたはそれ以下、80mgまたはそれ以下、70mgまたはそれ以下、60mgまたはそれ以下、50mgまたはそれ以下、40mgまたはそれ以下、30mgまたはそれ以下、20mgまたはそれ以下、10mgまたはそれ以下、9mgまたはそれ以下、8mgまたはそれ以下、7mgまたはそれ以下、6mgまたはそれ以下、5mgまたはそれ以下、4mgまたはそれ以下、3mgまたはそれ以下、2mgまたはそれ以下、1mgまたはそれ以下、0.9mgまたはそれ以下、0.8mgまたはそれ以下、0.7mgまたはそれ以下、0.6mgまたはそれ以下、0.5mgまたはそれ以下、0.4mgまたはそれ以下、0.3mgまたはそれ以下、0.2mgまたはそれ以下および0.1mgまたはそれ以下である、請求項15記載の方法。
- 有効量が、少なくとも体重kgあたり抗体0.01mgであり、例えば、少なくとも0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8mgである、請求項15記載の方法。
- 有効量が、体重kgあたり抗体0.1〜20mgの間である、請求項15記載の方法。
- 抗体が、年間あたり少なくとも1回投与され、例えば、年間あたり1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19回で投与される、請求項15〜18のうちのいずれか1項に記載の方法。
- 抗体が、RSV感染を誘引するリスクの高い年の間に一定間隔で投与される、請求項19記載の方法。
- 一定間隔が、1週間、2週間、1ヶ月間、または2ヶ月間である、請求項20記載の方法。
- 哺乳動物におけるRSV感染に関連した1つまたはそれ以上の症状の治療、改善または予防のための組成物の調製のための請求項1から13のうちのいずれか1項記載の抗−RSV組み換えポリクローナル抗体または請求項14記載の医薬組成物の使用。
- VHおよびVLをコードするペアー(pairs)のレパートリーを作成する方法であって、メンバーが、RSV感染から生じる液性免疫応答に関連する遺伝子のペアーを反映するものであって、
a.RSVに感染したドナーまたはRSV感染から回復したドナーからリンパ球を含む細胞画分を提供し;
b.任意選択的に、前記細胞画分からB細胞または血漿細胞を濃縮し;
c.前記細胞画分由来の細胞を複数の容器に個々に分配することを含む、単離された単一細胞の集団を得て;次いで
d.前記単離された単一細胞に由来する鋳型を用いて、重複伸長(overlap extension)RT−PCR法において、増幅させ、VHおよびVLをコードするペアーの連結を生じさせ;
e.任意選択的に、連結したVHおよびVLをコードするペアーのネスティド(nested)PCRを実施すること:
を含む方法。 - 請求項1から13のうちのいずれか1項記載の組み換えポリクローナル抗−RSV抗体を発現することができる、ポリクローナル細胞株。
- 個々の細胞が各々、単一のVHおよびVLをコードするペアーを発現することができ、全体としてポリクローナル細胞株がVHおよびVLをコードするペアーのコレクションを発現することができ、各VHおよびVLをコードするペアーが、抗−RSV抗体をコードする、ポリクローナル細胞株。
- 前記VHおよびVLをコードするペアーのコレクションが、請求項23の方法により作成される、請求項25記載のポリクローナル細胞株。
- 本明細書の表5に記載される抗体分子、あるいは前記抗体分子の特異的に結合するフラグメントまたは合成もしくは半合成抗体アナログから選択される単離ヒト抗RSV−抗体分子であって、前記結合するフラグメントまたはアナログが、少なくとも前記単離抗体分子の相補性決定領域(CDR)を含む単離ヒト抗RSV−抗体分子。
- 表8に記載された抗体に由来するか、あるいは配列番号:1〜44のうちの1つに含まれる重鎖CDRアミノ酸配列および配列番号:1〜44から選択されるアミノ酸配列より88高い配列番号を有する付随の軽鎖CDRアミノ酸配列を含む、請求項27記載の抗体分子、フラグメントまたはアナログ。
- ヒト抗体由来のFabにおけるCDRと同一であるCDRを含み、前記Fabは、物質輸送時の制限を避けるために非常に低い密度でセンサー表面上に固定された組み換えRSV Gタンパク質を用いて、Biacore3000において表面プラズモン共鳴分析を実施して測定する場合、500nMまたはそれ以下のRSV Gタンパク質に対する解離定数KDを示す、単離された抗体分子、抗体フラグメントまたは合成もしくは半合成抗体アナログ。
- KDが、400nMまたはそれ以下であり、例えば、300nMまたはそれ以下、200nMまたはそれ以下、100nMまたはそれ以下、1nMまたはそれ以下であり、900pMまたはそれ以下、800pMまたはそれ以下、700pMまたはそれ以下、600pMまたはそれ以下、500pMまたはそれ以下、400pMまたはそれ以下、300pMまたはそれ以下、200pMまたはそれ以下、100pMまたはそれ以下、90pMまたはそれ以下、および80pMまたはそれ以下である、請求項29記載の単離された抗体分子、抗体フラグメントまたは合成もしくは半合成抗体アナログ。
- ヒト抗体由来のFabにおける抗原結合部位に同一である抗原結合部位を含み、前記Fabは、物質輸送時の制限を避けるために非常に低い密度でセンサー表面上に固定された組み換えRSV Gタンパク質を用いて、Biacore3000において表面プラズモン共鳴分析を実施して測定する場合、500nMまたはそれ以下のRSV Fタンパク質に対する解離定数KDを示す、単離された抗体分子、抗体フラグメントまたは合成もしくは半合成抗体アナログ。
- KDが、400nMまたはそれ以下であり、例えば、300nMまたはそれ以下、200nMまたはそれ以下、100nMまたはそれ以下、1nMまたはそれ以下であり、900pMまたはそれ以下、800pMまたはそれ以下、700pMまたはそれ以下、600pMまたはそれ以下、500pMまたはそれ以下、400pMまたはそれ以下、300pMまたはそれ以下、200pMまたはそれ以下、100pMまたはそれ以下、90pMまたはそれ以下、80pMまたはそれ以下、70pMまたはそれ以下、60pMまたはそれ以下、50pMまたはそれ以下、40pMまたはそれ以下、30pMまたはそれ以下、25pMまたはそれ以下、20pMまたはそれ以下、15pMまたはそれ以下、10pMまたはそれ以下、9pMまたはそれ以下、8pMまたはそれ以下、7pMまたはそれ以下、6pMまたはそれ以下、および5pMまたはそれ以下である、請求項31記載の単離された抗体分子、抗体フラグメントまたは合成もしくは半合成抗体アナログ。
- クローン番号810、818、819、824、825、827、858または894で産生されるヒト抗体のCDRを含む、請求項27〜32のうちのいずれか1項記載の抗体分子あるいは特異的に結合するフラグメントまたは合成もしくは半合成抗体アナログ。
- 医薬上許容される担体、賦形剤、ビヒクルまたは希釈液との混合において、請求項27〜33のうちのいずれか1項記載の抗体分子あるいは特異的に結合するフラグメントまたは合成もしくは半合成抗体アナログを含む抗体組成物。
- 請求項27〜33のうちのいずれか1項記載の2種の別個の抗体分子および/または特異的に結合するフラグメントおよび/または合成もしくは半合成抗体アナログを含む、請求項34記載の組成物。
- 請求項27〜33のうちのいずれか1項記載の少なくとも3種の別個の抗体分子および/または特異的に結合するフラグメントおよび/または合成もしくは半合成抗体アナログを含み、かかる組成物が、4、5、6、7、9、10、11、12、13、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29または30種の別個の抗体分子および/またはフラグメントおよび/または合成もしくは半合成抗体アナログを含む、請求項34記載の組成物。
- RSV Fタンパク質に結合する少なくとも1種の抗体分子、フラグメントまたはアナログを含み、RSV Gタンパク質に結合する少なくとも1種の抗体分子、フラグメントまたはアナログを含む、請求項34〜36のうちのいずれか1項記載の組成物。
- 請求項27〜33のうちのいずれか1項で定義される少なくとも1種のCDRのアミノ酸配列をコードする、単離核酸フラグメント。
- 少なくとも表5に記載されたクローンのうちの1つにより産生される抗体のCDRをコードする、単離核酸フラグメント。
- 配列番号:1〜44のうちのいずれか1つに記載される重鎖アミノ酸配列のCDR配列をコードする、単離核酸フラグメント。
- 配列番号:89〜132のうちのいずれか1つに記載される軽鎖アミノ酸配列のCDR配列をコードする、単離核酸フラグメント。
- 配列番号:1〜44のうちのいずれか1つに記載される重鎖アミノ酸配列のCDR配列および配列番号:1〜44から選択されるアミノ酸配列より88高い配列番号を有する付随の軽鎖CDRアミノ酸配列をコードする、単離核酸フラグメント。
- 配列番号:45〜88および/または133〜176に含まれるコーディング配列を含む、請求項38〜42のうちのいずれか1項記載の核酸フラグメント。
- 請求項38〜43のうちのいずれか1項に記載の核酸フラグメントを含む、ベクター。
- 自律的に複製することができる、請求項44記載のベクター。
- プラスミド、ファージ、コスミド、ミニ染色体、およびウイルスからなる群から選択される、請求項44または45記載のベクター。
- 5’→3’方向および作動可能な連結において、請求項38〜43のうちのいずれか1項に記載の第1の核酸フラグメントの発現を促進するための少なくとも1つのプロモーターであって、必須なフレームワーク領域、任意選択でリーダーペプチドをコードする核酸配列、前記第1の核酸フラグメント、任意選択で定常領域をコードする核酸配列、および任意選択で第1の転写終結領域をコードする核酸配列と一緒に少なくとも1つの軽鎖CDRをコードし、ならびに/あるいは
5’→3’方向および作動可能な連結において、請求項38〜43のうちのいずれか1項に記載の第2の核酸フラグメントの発現を促進するための少なくとも1つのプロモーターであって、必須なフレームワーク領域、任意選択でリーダーペプチドをコードする核酸配列、前記第2の核酸フラグメント、任意選択で定常領域をコードする核酸配列、および任意選択で第2の転写終結領域をコードする核酸配列と一緒に少なくとも1つの重鎖CDRをコードするもの
を含む、請求項44〜46のうちのいずれか1項記載のベクター。 - 宿主細胞に導入される時に宿主細胞のゲノムに組み込まれる、請求項44〜47のうちのいずれか1項記載のベクター。
- 請求項44〜48のうちのいずれか1項のベクターを有する、形質転換細胞。
- 請求項44〜48のうちのいずれか1項記載のベクターを有し、請求項38〜43のうちのいずれか1項記載の核酸フラグメントを発現し、ならびに任意選択的にその表面上でその組み換え発現産物を分泌または保有する安定な細胞株。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DKPA200600324 | 2006-03-06 | ||
| US87471606P | 2006-12-14 | 2006-12-14 | |
| PCT/DK2007/000113 WO2007101441A1 (en) | 2006-03-06 | 2007-03-06 | Recombinant polyclonal antibody for treatment of respiratory syncytial virus infections |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009528828A true JP2009528828A (ja) | 2009-08-13 |
| JP2009528828A5 JP2009528828A5 (ja) | 2011-04-28 |
Family
ID=38230163
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008557594A Withdrawn JP2009528828A (ja) | 2006-03-06 | 2007-03-06 | 消化器多核体ウイルス感染症の治療のための組み換えポリクローナル抗体 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20100040606A1 (ja) |
| EP (1) | EP2004686A1 (ja) |
| JP (1) | JP2009528828A (ja) |
| KR (1) | KR20080113223A (ja) |
| CN (1) | CN101395182A (ja) |
| AU (1) | AU2007222798A1 (ja) |
| BR (1) | BRPI0708636A2 (ja) |
| CA (1) | CA2638833A1 (ja) |
| IL (1) | IL193386A0 (ja) |
| MX (1) | MX2008011280A (ja) |
| WO (1) | WO2007101441A1 (ja) |
| ZA (1) | ZA200806362B (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013539357A (ja) * | 2010-07-09 | 2013-10-24 | クルセル ホランド ベー ヴェー | 抗ヒト呼吸器多核体ウイルス(rsv)抗体および使用の方法 |
| JP2016512554A (ja) * | 2013-03-14 | 2016-04-28 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | 呼吸器合胞体ウイルスfタンパク質に対するヒト抗体及びその使用方法 |
Families Citing this family (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2273202T3 (es) | 2003-01-07 | 2007-05-01 | Symphogen A/S | Procedimiento para producir proteinas policlonales recombinantes. |
| US8288109B2 (en) | 2004-07-20 | 2012-10-16 | Symphogen A/S | Procedure for structural characterization of a recombinant polyclonal protein or a polyclonal cell line |
| AU2006322445B2 (en) | 2005-12-05 | 2011-05-12 | Symphogen A/S | Anti-orthopoxvirus recombinant polyclonal antibody |
| WO2007147265A1 (en) * | 2006-06-23 | 2007-12-27 | Alethia Biotherapeutics Inc. | Polynucleotides and polypeptide sequences involved in cancer |
| PT2121920E (pt) | 2007-03-01 | 2011-10-03 | Symphogen As | Método de clonagem de anticorpos cognatos |
| AU2008221118B2 (en) | 2007-03-01 | 2013-10-03 | Les Laboratoires Servier | Recombinant anti-epidermal growth factor receptor antibody compositions |
| WO2008106980A2 (en) * | 2007-03-06 | 2008-09-12 | Symphogen A/S | Recombinant antibodies for treatment of respiratory syncytial virus infections |
| JP2008289483A (ja) * | 2007-05-25 | 2008-12-04 | Symphogen As | 真核生物系において発現可能な形質転換体のスクリーニング |
| PL2152872T3 (pl) | 2007-05-25 | 2011-03-31 | Symphogen As | Sposób wytwarzania rekombinowanego białka poliklonalnego |
| EP2185590A2 (en) * | 2007-09-07 | 2010-05-19 | Symphogen A/S | Methods for recombinant manufacturing of anti-rsv antibodies |
| BRPI0817257A2 (pt) * | 2007-09-24 | 2015-06-16 | Univ Vanderbilt | Anticorpos moniclonais para vírus sincital respiratório e usos dos mesmos |
| RU2526517C2 (ru) | 2007-10-25 | 2014-08-20 | Треллис Байосайенс,Инк. | Антитела против g-белка распираторно-синцитиального вируса (rsv) |
| MX2011001927A (es) | 2008-08-29 | 2011-04-21 | Symphogen As | Composiciones de anticuerpo recombinante anti-receptor de factor de crecimiento epidermico. |
| US20110224094A1 (en) * | 2008-10-06 | 2011-09-15 | Symphogen A/S | Method for identifying and selecting drug candidates for combinatorial drug products |
| WO2010060186A1 (en) | 2008-11-03 | 2010-06-03 | Alethia Biotherapeutics Inc. | Antibodies that specifically block the biological activity of a tumor antigen |
| US8691510B2 (en) * | 2008-11-07 | 2014-04-08 | Sequenta, Inc. | Sequence analysis of complex amplicons |
| US8748103B2 (en) * | 2008-11-07 | 2014-06-10 | Sequenta, Inc. | Monitoring health and disease status using clonotype profiles |
| US9506119B2 (en) | 2008-11-07 | 2016-11-29 | Adaptive Biotechnologies Corp. | Method of sequence determination using sequence tags |
| EP3699296A1 (en) | 2008-11-07 | 2020-08-26 | Adaptive Biotechnologies Corporation | Methods of monitoring conditions by sequence analysis |
| US9528160B2 (en) | 2008-11-07 | 2016-12-27 | Adaptive Biotechnolgies Corp. | Rare clonotypes and uses thereof |
| US8628927B2 (en) | 2008-11-07 | 2014-01-14 | Sequenta, Inc. | Monitoring health and disease status using clonotype profiles |
| US9365901B2 (en) | 2008-11-07 | 2016-06-14 | Adaptive Biotechnologies Corp. | Monitoring immunoglobulin heavy chain evolution in B-cell acute lymphoblastic leukemia |
| EP2387627B1 (en) | 2009-01-15 | 2016-03-30 | Adaptive Biotechnologies Corporation | Adaptive immunity profiling and methods for generation of monoclonal antibodies |
| EP3409792B1 (en) | 2009-06-25 | 2023-09-20 | Fred Hutchinson Cancer Center | Method of measuring adaptive immunity |
| KR101425405B1 (ko) * | 2009-07-17 | 2014-08-01 | 한림대학교 산학협력단 | 리포좀에 포집된 올리고뉴클레오타이드 및 에피토프를 포함하는 면역증강용 조성물 |
| BR112012007815A2 (pt) | 2009-10-09 | 2018-03-20 | Symphogen As | quantificação multiplex de proteínas recombinantes em uma mistura por peptídeos de assinatura e espectrometria de massa. |
| US9043160B1 (en) | 2009-11-09 | 2015-05-26 | Sequenta, Inc. | Method of determining clonotypes and clonotype profiles |
| GB2498163B (en) * | 2010-10-08 | 2015-07-01 | Harvard College | High-throughput immune sequencing |
| EP2663334A4 (en) * | 2011-01-10 | 2016-01-13 | Univ Emory | ANTIBODIES AGAINST INFLUENZA |
| ES2615387T3 (es) | 2011-03-31 | 2017-06-06 | Alethia Biotherapeutics Inc. | Anticuerpos contra el antígeno 1 asociado al riñón y fragmentos de unión al antígeno de estos |
| US10385475B2 (en) | 2011-09-12 | 2019-08-20 | Adaptive Biotechnologies Corp. | Random array sequencing of low-complexity libraries |
| EP2768982A4 (en) | 2011-10-21 | 2015-06-03 | Adaptive Biotechnologies Corp | QUANTIFICATION OF ADAPTIVE IMMUNOCELL GENOMES IN A COMPLEX MIX OF CELLS |
| ES2867924T3 (es) | 2011-12-09 | 2021-10-21 | Adaptive Biotechnologies Corp | Diagnóstico de tumores malignos linfoides y detección de enfermedad residual mínima |
| US9499865B2 (en) | 2011-12-13 | 2016-11-22 | Adaptive Biotechnologies Corp. | Detection and measurement of tissue-infiltrating lymphocytes |
| RS58918B1 (sr) | 2012-01-09 | 2019-08-30 | Adc Therapeutics Sa | Agensi za tretman trostruko negativnog raka dojke |
| WO2013119419A1 (en) * | 2012-02-08 | 2013-08-15 | North Carolina State University | Treatment of allergic diseases with recombinant antibodies |
| WO2013134162A2 (en) | 2012-03-05 | 2013-09-12 | Sequenta, Inc. | Determining paired immune receptor chains from frequency matched subunits |
| PT2831276T (pt) | 2012-05-08 | 2016-07-26 | Adaptive Biotechnologies Corp | Composições e método para medição e calibração do viés de amplificação em reações pcr multiplex |
| PL2887959T3 (pl) * | 2012-08-23 | 2019-04-30 | Agensys Inc | Koniugaty leków i przeciwciał (adc), które wiążą białka 158p1d7 |
| EP2904111B1 (en) | 2012-10-01 | 2017-12-06 | Adaptive Biotechnologies Corporation | Immunocompetence assessment by adaptive immune receptor diversity and clonality characterization |
| US10150996B2 (en) | 2012-10-19 | 2018-12-11 | Adaptive Biotechnologies Corp. | Quantification of adaptive immune cell genomes in a complex mixture of cells |
| DK2917360T3 (da) | 2012-11-06 | 2020-03-30 | Medimmune Llc | Antistoffer mod S. aureus-overflade-determinanter |
| GB2584364A (en) | 2013-03-15 | 2020-12-02 | Abvitro Llc | Single cell bar-coding for antibody discovery |
| CN103196731A (zh) * | 2013-04-18 | 2013-07-10 | 王刚平 | 用于鉴别乳腺肌上皮病变的多重染色试剂及其检测方法 |
| US9708657B2 (en) | 2013-07-01 | 2017-07-18 | Adaptive Biotechnologies Corp. | Method for generating clonotype profiles using sequence tags |
| US20170292149A1 (en) | 2014-03-05 | 2017-10-12 | Adaptive Biotechnologies Corporation | Methods using randomer-containing synthetic molecules |
| US10066265B2 (en) | 2014-04-01 | 2018-09-04 | Adaptive Biotechnologies Corp. | Determining antigen-specific t-cells |
| US10590483B2 (en) | 2014-09-15 | 2020-03-17 | Abvitro Llc | High-throughput nucleotide library sequencing |
| BR112017006598A2 (pt) * | 2014-09-30 | 2018-04-17 | Neurimmune Holding Ag | anticorpo de repetições antidipeptídeo derivado de ser humano (dprs) |
| EP3207055A1 (en) * | 2014-10-15 | 2017-08-23 | Xenothera | Composition with reduced immunogenicity |
| WO2016069886A1 (en) | 2014-10-29 | 2016-05-06 | Adaptive Biotechnologies Corporation | Highly-multiplexed simultaneous detection of nucleic acids encoding paired adaptive immune receptor heterodimers from many samples |
| US10246701B2 (en) | 2014-11-14 | 2019-04-02 | Adaptive Biotechnologies Corp. | Multiplexed digital quantitation of rearranged lymphoid receptors in a complex mixture |
| EP3498866A1 (en) | 2014-11-25 | 2019-06-19 | Adaptive Biotechnologies Corp. | Characterization of adaptive immune response to vaccination or infection using immune repertoire sequencing |
| WO2016138122A1 (en) | 2015-02-24 | 2016-09-01 | Adaptive Biotechnologies Corp. | Methods for diagnosing infectious disease and determining hla status using immune repertoire sequencing |
| EP3277294B1 (en) | 2015-04-01 | 2024-05-15 | Adaptive Biotechnologies Corp. | Method of identifying human compatible t cell receptors specific for an antigenic target |
| WO2018052789A1 (en) * | 2016-09-08 | 2018-03-22 | Pcm Targetech, Llc | Monoclonal antibodies specific to the plexin-semaphorin-integrin (psi) domain of ron for drug delivery and its application in cancer therapy |
| US10428325B1 (en) | 2016-09-21 | 2019-10-01 | Adaptive Biotechnologies Corporation | Identification of antigen-specific B cell receptors |
| JP7127859B2 (ja) | 2016-11-09 | 2022-08-30 | ノース カロライナ ステート ユニバーシティ | キメラタンパク質を用いたアレルギー疾患の治療 |
| US11254980B1 (en) | 2017-11-29 | 2022-02-22 | Adaptive Biotechnologies Corporation | Methods of profiling targeted polynucleotides while mitigating sequencing depth requirements |
| WO2019165019A1 (en) * | 2018-02-21 | 2019-08-29 | Vanderbilt University | Antibodies to human respiratory syncytial virus protein f pre-fusion conformation and methods of use therefor |
| WO2019183437A1 (en) | 2018-03-23 | 2019-09-26 | North Carolina State University | Methods and compositions for antibody to high affinity receptor for ige |
| AU2019389806A1 (en) * | 2018-11-30 | 2021-07-22 | Csl Behring Ag | Methods and compositions for preventing or treating acute exacerbations with polyclonal immunoglobulin |
| BR112021021725A2 (pt) * | 2019-04-30 | 2021-12-28 | Gigagen Inc | Proteínas policlonais recombinantes e métodos de uso das mesmas |
| KR20230135087A (ko) * | 2021-01-29 | 2023-09-22 | 암젠 인크 | 항-mcl1 항체를 투여하여 암을 모니터링하기 위한 물질및 방법 |
| CN113249333B (zh) * | 2021-03-16 | 2023-06-02 | 贵州省人民医院 | 一种分泌抗呼吸道合胞病毒单克隆抗体的杂交瘤细胞株rsvn4c3 |
Family Cites Families (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4767610A (en) * | 1984-10-19 | 1988-08-30 | The Regents Of The University Of California | Method for detecting abnormal cell masses in animals |
| US5639853A (en) * | 1987-09-29 | 1997-06-17 | Praxis Biologics, Inc. | Respiratory syncytial virus vaccines |
| DE69130708T2 (de) * | 1990-07-19 | 1999-05-27 | The United States Of America As Represented By The Secretary, United States Department Of Commerce, Springfield, Va. | Verbesserte immunotherapeutische methode zur verhinderung oder behandlung viraler krankheiten der atemwege |
| US5344640A (en) * | 1991-10-22 | 1994-09-06 | Mallinckrodt Medical, Inc. | Preparation of apatite particles for medical diagnostic imaging |
| US5824307A (en) * | 1991-12-23 | 1998-10-20 | Medimmune, Inc. | Human-murine chimeric antibodies against respiratory syncytial virus |
| ES2191016T3 (es) * | 1992-09-16 | 2003-09-01 | Scripps Research Inst | Anticuerpos monoclonales neutralizantes humanos para el virus respiratorio sincitial. |
| FR2718452B1 (fr) * | 1994-04-06 | 1996-06-28 | Pf Medicament | Elément d'immunogène, agent immunogène, composition pharmaceutique et procédé de préparation. |
| DE69509103T2 (de) * | 1994-08-25 | 1999-09-30 | Pepscan Systems B.V., Lelystad | Antigene peptide abgeleitet vom g-protein des rsv (respiratorisches synzytialvirus) für die typen- und subtypen spezifische diagnose einer rsv-infektionen |
| US5922344A (en) * | 1995-02-10 | 1999-07-13 | Abbott Laboratories | Product for prevention of respiratory virus infection and method of use |
| US5811524A (en) * | 1995-06-07 | 1998-09-22 | Idec Pharmaceuticals Corporation | Neutralizing high affinity human monoclonal antibodies specific to RSV F-protein and methods for their manufacture and therapeutic use thereof |
| US20020141990A1 (en) * | 1996-11-01 | 2002-10-03 | Smithkline Beecham Corporation | Anti-RSV human monoclonal antibodies |
| US6699478B1 (en) * | 1997-09-19 | 2004-03-02 | Wyeth Holdings Corporation | Enhanced immune response to attachment (G) protein of Respiratory Syncytial Virus |
| AU785038B2 (en) * | 2000-01-27 | 2006-08-31 | Applied Molecular Evolution, Inc. | Ultra high affinity neutralizing antibodies |
| AU4002001A (en) * | 2000-03-01 | 2001-09-12 | Med Immune Inc | High potency recombinant antibodies and method for producing them |
| US20050175986A1 (en) * | 2000-05-09 | 2005-08-11 | Smit Kline Beecham Corporation | Human monoclonal antibody |
| AU2002224416A1 (en) * | 2000-10-18 | 2002-04-29 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Health And Human Services, Centers For Disease Control And Prevention | Compositions and methods for modulating RSV infection and immunity |
| US6818216B2 (en) * | 2000-11-28 | 2004-11-16 | Medimmune, Inc. | Anti-RSV antibodies |
| EP1534327A4 (en) * | 2002-07-25 | 2006-08-23 | Medimmune Inc | METHODS OF TREATING AND PREVENTING RSV, HMPV, AND PIV USING ANTI-RSV, ANTI-MPVH, ANTI-PIV ANTIBODIES |
| ES2273202T3 (es) * | 2003-01-07 | 2007-05-01 | Symphogen A/S | Procedimiento para producir proteinas policlonales recombinantes. |
| US20060275766A1 (en) * | 2003-01-07 | 2006-12-07 | Haurum John S | Method for manufacturing recombinant polyclonal proteins |
| US6821450B2 (en) * | 2003-01-21 | 2004-11-23 | Hewlett-Packard Development Company, L.P. | Substrate and method of forming substrate for fluid ejection device |
| CA2520671C (en) * | 2003-03-28 | 2014-03-18 | Medimmune Vaccines, Inc. | Compositions and methods involving respiratory syncytial virus subgroup b strain 9320 |
| US7070786B2 (en) * | 2003-06-06 | 2006-07-04 | Centocor, Inc. | RSV proteins, antibodies, compositions, methods and uses |
| TWI333977B (en) * | 2003-09-18 | 2010-12-01 | Symphogen As | Method for linking sequences of interest |
| CA2580921C (en) * | 2004-09-21 | 2016-04-12 | Medimmune, Inc. | Antibodies against and methods for producing vaccines for respiratory syncytial virus |
| AU2006322445B2 (en) * | 2005-12-05 | 2011-05-12 | Symphogen A/S | Anti-orthopoxvirus recombinant polyclonal antibody |
| WO2008106980A2 (en) * | 2007-03-06 | 2008-09-12 | Symphogen A/S | Recombinant antibodies for treatment of respiratory syncytial virus infections |
| WO2009048769A2 (en) * | 2007-10-10 | 2009-04-16 | Kirin Pharma Kabushiki Kaisha | Vaccinia virus h3l and b5r specific monoclonal antibodies and methods of making and using same |
-
2007
- 2007-03-06 JP JP2008557594A patent/JP2009528828A/ja not_active Withdrawn
- 2007-03-06 CA CA002638833A patent/CA2638833A1/en not_active Abandoned
- 2007-03-06 KR KR1020087024416A patent/KR20080113223A/ko not_active Application Discontinuation
- 2007-03-06 WO PCT/DK2007/000113 patent/WO2007101441A1/en active Application Filing
- 2007-03-06 BR BRPI0708636-9A patent/BRPI0708636A2/pt not_active IP Right Cessation
- 2007-03-06 CN CNA2007800077783A patent/CN101395182A/zh active Pending
- 2007-03-06 AU AU2007222798A patent/AU2007222798A1/en not_active Abandoned
- 2007-03-06 US US11/792,927 patent/US20100040606A1/en not_active Abandoned
- 2007-03-06 EP EP07711256A patent/EP2004686A1/en not_active Withdrawn
- 2007-03-06 MX MX2008011280A patent/MX2008011280A/es not_active Application Discontinuation
-
2008
- 2008-07-22 ZA ZA200806362A patent/ZA200806362B/xx unknown
- 2008-08-12 IL IL193386A patent/IL193386A0/en unknown
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2013539357A (ja) * | 2010-07-09 | 2013-10-24 | クルセル ホランド ベー ヴェー | 抗ヒト呼吸器多核体ウイルス(rsv)抗体および使用の方法 |
| JP2015198658A (ja) * | 2010-07-09 | 2015-11-12 | クルセル ホランド ベー ヴェー | 抗呼吸器多核体ウイルス(抗rsv)抗体、その抗原結合断片、それらの使用、多価抗体、製薬上組成物、rsv感染を検出する方法、および核酸 |
| JP2016512554A (ja) * | 2013-03-14 | 2016-04-28 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | 呼吸器合胞体ウイルスfタンパク質に対するヒト抗体及びその使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN101395182A (zh) | 2009-03-25 |
| CA2638833A1 (en) | 2007-09-13 |
| MX2008011280A (es) | 2008-09-12 |
| BRPI0708636A2 (pt) | 2011-06-07 |
| AU2007222798A1 (en) | 2007-09-13 |
| IL193386A0 (en) | 2011-08-01 |
| ZA200806362B (en) | 2009-05-27 |
| KR20080113223A (ko) | 2008-12-29 |
| WO2007101441A1 (en) | 2007-09-13 |
| US20100040606A1 (en) | 2010-02-18 |
| EP2004686A1 (en) | 2008-12-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7879329B2 (en) | Recombinant antibodies for treatment of respiratory syncytial virus infections | |
| JP2009528828A (ja) | 消化器多核体ウイルス感染症の治療のための組み換えポリクローナル抗体 | |
| TWI627964B (zh) | 抗-人類呼吸道融合性病毒(rsv)抗體及其使用方法 | |
| CA2703667C (en) | Anti-rsv g protein antibodies | |
| US10196438B2 (en) | Human antibodies binding to RSV G protein | |
| CA2908921C (en) | Human antibodies binding to rsv g protein | |
| US11370829B2 (en) | Antibodies that potently neutralize RSV and uses thereof | |
| CA2223033A1 (en) | High affinity human monoclonal antibodies specific for rsv f-protein | |
| KR20140135259A (ko) | Rsv, mpv 및 pvm를 중화하는 항체 및 이의 용도 | |
| US20240262894A1 (en) | Antibody against respiratory syncytial virus and use thereof | |
| TW200837079A (en) | Recombinant polyclonal antibody for treatment of respiratory syncytial virus infections |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100305 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100305 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20120222 |