JP2009517009A - エリスロポエチンポリペプチド及びそれらの使用 - Google Patents
エリスロポエチンポリペプチド及びそれらの使用 Download PDFInfo
- Publication number
- JP2009517009A JP2009517009A JP2008541750A JP2008541750A JP2009517009A JP 2009517009 A JP2009517009 A JP 2009517009A JP 2008541750 A JP2008541750 A JP 2008541750A JP 2008541750 A JP2008541750 A JP 2008541750A JP 2009517009 A JP2009517009 A JP 2009517009A
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- seq
- amino acid
- amino acids
- epo
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/475—Growth factors; Growth regulators
- C07K14/505—Erythropoietin [EPO]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Biochemistry (AREA)
- Diabetes (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Hematology (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Psychology (AREA)
- Vascular Medicine (AREA)
- Psychiatry (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Description
エキソン1:ヌクレオチド601からヌクレオチド794まで(782位での開始コドンを含む)。
エキソン2:ヌクレオチド1359からヌクレオチド1504まで。
エキソン3:ヌクレオチド1763からヌクレオチド1849まで。
エキソン4:ヌクレオチド2465からヌクレオチド2644まで。
エキソン5:ヌクレオチド2779からヌクレオチド3499まで(2763位での終止コドンを含む)。
本発明の発明者は、組織保護活性(特に神経栄養活性)を有するEPOのドメイン、及び組織保護活性(特に神経栄養活性)を有するが、血液栄養活性を欠くEPO変異体を同定している。EPOのこれら短い変種及び同定されたEPO変異体は、価値ある医薬品を提示する。
第1の態様において、本発明は、単離エリスロポエチンの変異ポリペプチドにあり、前記変異ポリペプチドは、配列番号3のアミノ酸56(システイン)から193(アルギニン)までのうちの少なくとも1つ、好ましくは少なくとも2つ、より好ましくは少なくとも3つ、さらにより好ましくは少なくとも4つ、さらにより好ましくは少なくとも5つ、さらにより好ましくは少なくとも6つ、さらにより好ましくは少なくとも7つ、さらにより好ましくは少なくとも8つ、さらにより好ましくは少なくとも9つ、さらにより好ましくは少なくとも10、さらにより好ましくは少なくとも11、さらにより好ましくは少なくとも12、さらにより好ましくは少なくとも13、さらにより好ましくは少なくとも14、さらにより好ましくは少なくとも15、さらにより好ましくは少なくとも16、さらにより好ましくは少なくとも17、さらにより好ましくは少なくとも18、さらにより好ましくは少なくとも19、さらにより好ましくは少なくとも20、さらにより好ましくは少なくとも21、さらにより好ましくは少なくとも22、さらにより好ましくは少なくとも23、さらにより好ましくは少なくとも24、さらにより好ましくは少なくとも25、さらにより好ましくは少なくとも26、さらにより好ましくは少なくとも27、さらにより好ましくは少なくとも28、さらにより好ましくは少なくとも29、さらにより好ましくは少なくとも30、さらにより好ましくは少なくとも31、さらにより好ましくは少なくとも32、さらにより好ましくは少なくとも33、さらにより好ましくは少なくとも34、さらにより好ましくは少なくとも35、さらにより好ましくは少なくとも36、さらにより好ましくは少なくとも37、さらにより好ましくは少なくとも38、さらにより好ましくは少なくとも39、さらにより好ましくは少なくとも40、さらにより好ましくは少なくとも41、さらにより好ましくは少なくとも42、さらにより好ましくは少なくとも43、さらにより好ましくは少なくとも44、さらにより好ましくは少なくとも45、さらにより好ましくは少なくとも46、さらにより好ましくは少なくとも47、さらにより好ましくは少なくとも48、さらにより好ましくは少なくとも49、さらにより好ましくは少なくとも50、さらにより好ましくは少なくとも51、さらにより好ましくは少なくとも52、さらにより好ましくは少なくとも53、さらにより好ましくは少なくとも54、さらにより好ましくは少なくとも55、さらにより好ましくは少なくとも56、さらにより好ましくは少なくとも57、さらにより好ましくは少なくとも58、さらにより好ましくは少なくとも59、さらにより好ましくは少なくとも60、さらにより好ましくは少なくとも61、さらにより好ましくは少なくとも62、さらにより好ましくは少なくとも63、さらにより好ましくは少なくとも64、さらにより好ましくは少なくとも65、さらにより好ましくは少なくとも66、さらにより好ましくは少なくとも67、さらにより好ましくは少なくとも68、さらにより好ましくは少なくとも69、さらにより好ましくは少なくとも70、さらにより好ましくは少なくとも71、さらにより好ましくは少なくとも72、さらにより好ましくは少なくとも73、さらにより好ましくは少なくとも74、さらにより好ましくは少なくとも75、さらにより好ましくは少なくとも76、さらにより好ましくは少なくとも77、さらにより好ましくは少なくとも78、さらにより好ましくは少なくとも79、さらにより好ましくは少なくとも80、さらにより好ましくは少なくとも81、さらにより好ましくは少なくとも82、さらにより好ましくは少なくとも83、さらにより好ましくは少なくとも84、さらにより好ましくは少なくとも85、さらにより好ましくは少なくとも86、さらにより好ましくは少なくとも87、さらにより好ましくは少なくとも88、さらにより好ましくは少なくとも89、さらにより好ましくは少なくとも90、さらにより好ましくは少なくとも91、さらにより好ましくは少なくとも92、さらにより好ましくは少なくとも93、さらにより好ましくは少なくとも94、さらにより好ましくは少なくとも95、さらにより好ましくは少なくとも96、さらにより好ましくは少なくとも97、さらにより好ましくは少なくとも98、さらにより好ましくは少なくとも99、さらにより好ましくは少なくとも100、さらにより好ましくは少なくとも101、さらにより好ましくは少なくとも102、さらにより好ましくは少なくとも103、さらにより好ましくは少なくとも104、さらにより好ましくは少なくとも105、さらにより好ましくは少なくとも106、さらにより好ましくは少なくとも107、さらにより好ましくは少なくとも108、さらにより好ましくは少なくとも109、さらにより好ましくは少なくとも110、さらにより好ましくは少なくとも111、さらにより好ましくは少なくとも112、さらにより好ましくは少なくとも113、さらにより好ましくは少なくとも114、さらにより好ましくは少なくとも115、さらにより好ましくは少なくとも116、さらにより好ましくは少なくとも117、さらにより好ましくは少なくとも118、さらにより好ましくは少なくとも119、さらにより好ましくは少なくとも120、さらにより好ましくは少なくとも121、さらにより好ましくは少なくとも122、さらにより好ましくは少なくとも123、さらにより好ましくは少なくとも124、さらにより好ましくは少なくとも125、さらにより好ましくは少なくとも126、さらにより好ましくは少なくとも127、さらにより好ましくは少なくとも128、さらにより好ましくは少なくとも129、さらにより好ましくは少なくとも130、さらにより好ましくは少なくとも131、さらにより好ましくは少なくとも132、さらにより好ましくは少なくとも133、さらにより好ましくは少なくとも134、さらにより好ましくは少なくとも135、さらにより好ましくは少なくとも136、さらにより好ましくは少なくとも137、及びさらにより好ましくは少なくとも138のアミノ酸の欠失により配列番号3に示された配列とはまったく異なるポリペプチドからなる。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短ポリペプチドとは異なる。好ましい実施形態において、変異ポリペプチドは、G104S及びS147Cからなる群において選択される1つ又は2つの変異により本明細書における上記のEPO短ポリペプチドの配列とは異なる。アミノ酸配列の修飾のために本明細書に使用される表記は、示された位置の野生型アミノ酸がそれぞれの番号の直後のアミノ酸に変わることを意味する。所与のナンバリングは、配列番号3におけるアミノ酸のナンバリングに関連する。したがって例えば、E40Q変異は、配列番号3の40位のアミノ酸E(グルタミン酸)のアミノ酸Q(グルタミン)への変異に相当する。しかしながら、1つ以上のこれら変異部位は、EPOwtと比較して、EPO短ポリペプチドに欠いているアミノ酸数に依って存在しないと考えられる。別の実施形態において、EPO短ポリペプチドの変異体は、
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短ポリペプチドとは異なる。さらに別の実施形態において、EPO短ポリペプチドの変異体は、
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短ポリペプチドとは異なる。さらに別の実施形態において、EPO短ポリペプチドの変異体は、
からなる群において選択される1つの組換え変異により本明細書において上記のEPO短ポリペプチドの配列とは異なる。好ましい実施形態において、C34Sからなる変異により本明細書において上記のEPO短ポリペプチドの配列とは異なる。しかしながら、1つ以上のこれら変異部位は、EPOwtと比較して、EPO短ポリペプチドに欠いているアミノ酸数に依って存在しないと考えられる。好ましい実施形態において、本明細書において上記のEPO短ポリペプチドの変異体は、N末端シグナルペプチドを欠く成熟ペプチドである。さらに特に、本明細書において上記のペプチドは、配列番号3のアミノ酸1から27までからなるシグナルペプチドを欠く。したがって、特定の態様において、本発明は、変異C34S(配列番号15のアミノ酸28から55まで)によりEPOvmとは異なるアミノ酸配列からなるポリペプチドにある。
から選択される修飾により修飾された、本明細書において上記のEPO短ポリペプチド、又はEPO短ポリペプチドの変異体を含むか、又はそれらからなる。
さらなる態様において、本発明は、配列番号3のアミノ酸54(トレオニン)から82(グルタミン酸)までのうちの少なくとも1つ、好ましくは少なくとも2つ、より好ましくは少なくとも3つ、さらにより好ましくは少なくとも4つ、さらにより好ましくは少なくとも5つ、さらにより好ましくは少なくとも6つ、さらにより好ましくは少なくとも7つ、さらにより好ましくは少なくとも8つ、さらにより好ましくは少なくとも9つ、さらにより好ましくは少なくとも10、さらにより好ましくは少なくとも11、さらにより好ましくは少なくとも12、さらにより好ましくは少なくとも13、さらにより好ましくは少なくとも14、さらにより好ましくは少なくとも15、さらにより好ましくは少なくとも16、さらにより好ましくは少なくとも17、さらにより好ましくは少なくとも18、さらにより好ましくは少なくとも19、さらにより好ましくは少なくとも20、さらにより好ましくは少なくとも21、さらにより好ましくは少なくとも22、さらにより好ましくは少なくとも23、さらにより好ましくは少なくとも24、さらにより好ましくは少なくとも25、さらにより好ましくは少なくとも26、さらにより好ましくは少なくとも27、さらにより好ましくは少なくとも28、さらにより好ましくは少なくとも29のアミノ酸の欠失により配列番号3に示された配列とは異なるEPOポリペプチドからなる単離ポリペプチドにある。これらのEPOポリペプチドは、以後「EPO短1」と命名される。別の態様において、本発明は、EPO短1ポリペプチドを含む単離ポリペプチドにある。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短1ポリペプチドとは異なる。好ましい実施形態において、変異ポリペプチドは、G104S及びS147Cからなる群において選択される1つ又は2つの変異により本明細書における上記のEPO短1ポリペプチドの配列とは異なる。別の実施形態において、EPO短1ポリペプチドの変異体は、
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短1ポリペプチドとは異なる。さらに別の実施形態において、EPO短1ポリペプチドの変異体は、
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短1ポリペプチドとは異なる。さらに別の実施形態において、EPO短1ポリペプチドの変異体は、
からなる群において選択される1つの組換え変異により本明細書において上記のEPO短1ポリペプチドとは異なる。好ましい実施形態において、C34Sからなる変異により本明細書において上記のEPO短1ポリペプチドの配列とは異なる。アミノ酸配列の修飾のために本明細書に用いられる表記は、指定された位置での野生型アミノ酸は、それぞれの番号直後のアミノ酸に変えられることを意味する。所与のナンバリングは、配列番号3におけるアミノ酸のナンバリングに関連する。したがって例えば、E40Q変異は、配列番号3の40位におけるアミノ酸E(グルタミン酸)のアミノ酸Q(グルタミン)への変異に相当する。しかしながら、このナンバリングは、EPO短1ポリペプチドの各々に関して53位後のアミノ酸(トレオニン)に関して異なり、EPOwtと比較して、EPO短1に欠いているアミノ酸数に依ることは明白である。変異を受ける対応のアミノ酸(複数可)は、EPOwtと比較して特定のEPO短1ペプチドに欠いているアミノ酸数を配列番号3におけるアミノ酸位置数から差し引くことにより(例えば、ポリペプチドEPO短1がアミノ酸54から82(29のアミノ酸)を欠く場合、G104S変異は、この特定のポリペプチドに関してG75Sに相当する)容易に同定される。
から選択される修飾により修飾された、本明細書において上記のEPO短1ポリペプチド、又はEPO短1ポリペプチドの変異体を含むか、又はそれらからなる。
さらなる態様において、本発明は、配列番号3のアミノ酸54(トレオニン)から142(グルタミン)までのうちの少なくとも1つ、好ましくは少なくとも2つ、より好ましくは少なくとも3つ、さらにより好ましくは少なくとも4つ、さらにより好ましくは少なくとも5つ、さらにより好ましくは少なくとも6つ、さらにより好ましくは少なくとも7つ、さらにより好ましくは少なくとも8つ、さらにより好ましくは少なくとも9つ、さらにより好ましくは少なくとも10、さらにより好ましくは少なくとも11、さらにより好ましくは少なくとも12、さらにより好ましくは少なくとも13、さらにより好ましくは少なくとも14、さらにより好ましくは少なくとも15、さらにより好ましくは少なくとも16、さらにより好ましくは少なくとも17、さらにより好ましくは少なくとも18、さらにより好ましくは少なくとも19、さらにより好ましくは少なくとも20、さらにより好ましくは少なくとも21、さらにより好ましくは少なくとも22、さらにより好ましくは少なくとも23、さらにより好ましくは少なくとも24、さらにより好ましくは少なくとも25、さらにより好ましくは少なくとも26、さらにより好ましくは少なくとも27、さらにより好ましくは少なくとも28、さらにより好ましくは少なくとも29、さらにより好ましくは少なくとも30、さらにより好ましくは少なくとも31、さらにより好ましくは少なくとも32、さらにより好ましくは少なくとも33、さらにより好ましくは少なくとも34、さらにより好ましくは少なくとも35、さらにより好ましくは少なくとも36、さらにより好ましくは少なくとも37、さらにより好ましくは少なくとも38、さらにより好ましくは少なくとも39、さらにより好ましくは少なくとも40、さらにより好ましくは少なくとも41、さらにより好ましくは少なくとも42、さらにより好ましくは少なくとも43、さらにより好ましくは少なくとも44、さらにより好ましくは少なくとも45、さらにより好ましくは少なくとも46、さらにより好ましくは少なくとも47、さらにより好ましくは少なくとも48、さらにより好ましくは少なくとも49、さらにより好ましくは少なくとも50、さらにより好ましくは少なくとも51、さらにより好ましくは少なくとも52、さらにより好ましくは少なくとも53、さらにより好ましくは少なくとも54、さらにより好ましくは少なくとも55、さらにより好ましくは少なくとも56、さらにより好ましくは少なくとも57、さらにより好ましくは少なくとも58、さらにより好ましくは少なくとも59、さらにより好ましくは少なくとも60、さらにより好ましくは少なくとも61、さらにより好ましくは少なくとも62、さらにより好ましくは少なくとも63、さらにより好ましくは少なくとも64、さらにより好ましくは少なくとも65、さらにより好ましくは少なくとも66、さらにより好ましくは少なくとも67、さらにより好ましくは少なくとも68、さらにより好ましくは少なくとも69、さらにより好ましくは少なくとも70、さらにより好ましくは少なくとも71、さらにより好ましくは少なくとも72、さらにより好ましくは少なくとも73、さらにより好ましくは少なくとも74、さらにより好ましくは少なくとも75、さらにより好ましくは少なくとも76、さらにより好ましくは少なくとも77、さらにより好ましくは少なくとも78、さらにより好ましくは少なくとも79、さらにより好ましくは少なくとも80、さらにより好ましくは少なくとも81、さらにより好ましくは少なくとも82、さらにより好ましくは少なくとも83、さらにより好ましくは少なくとも84、さらにより好ましくは少なくとも85、さらにより好ましくは少なくとも86、さらにより好ましくは少なくとも87、さらにより好ましくは少なくとも88、さらにより好ましくは少なくとも89のアミノ酸の欠失により配列番号3に示された配列とは異なるEPOポリペプチドからなる単離ポリペプチドにある。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短2ポリペプチドとは異なる。好ましい実施形態において、変異ポリペプチドは、G104S及びS147Cからなる群において選択される1つ又は2つの変異により本明細書における上記のEPO短2ポリペプチドの配列とは異なる。別の実施形態において、EPO短2ポリペプチドの変異体は、
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短2ポリペプチドとは異なる。さらに別の実施形態において、EPO短2ポリペプチドの変異体は、
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により本明細書において上記のEPO短2ポリペプチドとは異なる。さらに別の実施形態において、EPO短2ポリペプチドの変異体は、
からなる群において選択される1つの組換え変異により本明細書において上記のEPO短2ポリペプチドとは異なる。好ましい実施形態において、EPO短2ポリペプチドの変異体は、C34Sからなる変異により本明細書において上記のEPO短2ポリペプチドの配列とは異なる。アミノ酸配列の修飾のために本明細書に用いられる表記は、指定された位置での野生型アミノ酸は、それぞれの番号直後のアミノ酸に変えられることを意味する。所与のナンバリングは、配列番号3におけるアミノ酸のナンバリングに関連する。したがって例えば、E40Q変異は、配列番号3の40位におけるアミノ酸E(グルタミン酸)のアミノ酸Q(グルタミン)への変異に相当する。しかしながら、このナンバリングは、EPO短2ポリペプチドの各々に関して53位後のアミノ酸(トレオニン)に関して異なり、EPOwtと比較して、EPO短2に欠いているアミノ酸数に依ることは明白である。変異を受ける対応のアミノ酸(複数可)は、EPOwtと比較して特定のEPO短2ペプチドに欠いているアミノ酸数を配列番号3におけるミノ酸位置数から差し引くことにより(例えば、ポリペプチドEPO短2がアミノ酸54から142(89のアミノ酸)を欠く場合、S147C変異は、この特定のポリペプチドに関してS58Cに相当する)容易に同定される。
から選択される修飾により修飾された、本明細書において上記のEPO短2ポリペプチド、又はEPO短2ポリペプチドの変異体を含むか、又はそれらからなる。
さらなる態様において、本発明は、配列番号8に示された配列を含むか、又はそれからなる単離ポリペプチドにある。配列番号8に示された配列を有するポリペプチドは、初めて本明細書に開示されたEPOの新規な転写変異体のC末端部分に相当し、エキソン4Aの3’末端によりコード化される。前記エキソン4Aは、野生型EPOをコードするエキソン4と比較して3’末端がより長い(図3及び6を参照)。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により配列番号9に示された配列とは異なる。別の実施形態において、EPOv3変異ポリペプチドは、D70N及びG104Sからなる群において選択される1つ又は2つの変異により配列番号9に示された配列とは異なる。さらに別の実施形態において、EPOv3変異ポリペプチドは、
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により配列番号9に示された配列とは異なる。さらに別の実施形態において、EPOv3変異ポリペプチドは、K72D/S127E、A57N/H59T、R130E/L135S、N51K/N65K/N110K、及びY42A/N51Kからなる群において選択される変異の組合せの1つにより配列番号9に示された配列とは異なる。好ましい実施形態において、EPOv3変異ポリペプチドは、C34Sからなる変異により配列番号9に示された配列とは異なる。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により配列番号9に示された配列とは異なるポリペプチド;又はD70N及びG104Sからなる群において選択される少なくとも1つ及び2つの変異により配列番号9に示された配列とは異なるポリペプチド;又は
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により配列番号9に示された配列とは異なるポリペプチド;又は
からなる群において選択される変異の組合せの1つにより配列番号9に示された配列とは異なるポリペプチド;又はC34Sからなる変異により配列番号9に示された配列とは異なるポリペプチド)とは異なる。1つ以上のオリゴ糖基によるタンパク質のグリコシル化は、ポリペプチド骨格に沿って特定の位置に生じ、タンパク質安定性、分泌、細胞下局在化、及び生物活性などのタンパク質の物理的性質に影響を及ぼす。グリコシル化は、通常、2つのタイプがある。O−結合オリゴ糖類は、セリン又はトレオニン残基に結合し、N−結合オリゴ糖類は、アスパラギン残基に結合する。N−結合及びO−結合オリゴ糖類の双方に見られる1タイプのオリゴ糖は、9つ以上の炭素原子を含有するアミノ糖類のファミリーであるN−アセチルノイラミン酸(シアル酸)である。シアル酸は負電荷を有し、糖タンパク質に酸性を付与することから、シアル酸は、通常、N−結合及びO−結合オリゴ糖類上の双方の末端残基である。N−結合グリコシル化部位:EPOwtmの24位、38位及び83位におけるアスパラギン残基は、EPOv3mに保持される(一方、O−結合グリコシル化部位:EPOwtmの126位に配置されるセリン残基は、EPOv3mに存在しない)。特定の実施形態において、本発明のEPOv3変異体は、シアル酸結合に対する部位数の増加をもたらすアミノ酸配列の1つ以上の変化を有する類似体を含む。これらの糖タンパク質類似体は、グリコシル化に利用できる部位を増加させるか、又は変化させるアミノ酸残基の付加、欠失、又は置換を有する部位特異的変異誘発により作出できる。特定の実施形態において、ヒトエリスロポエチンに見られるものよりも大きなシアル酸レベルを有するEPOv3変異体は、生物活性に必要な第二級又は第三級立体配座を摂動しないグリコシル化部位を付加することにより作出される。特定の実施形態において、本発明のEPOv3変異体はまた、通常、N−結合又はO−結合部位に密接した1つ以上のアミノ酸の置換を含むグリコシル化部位に炭水化物結合の増加レベルを有する類似体を含む。特定の実施形態において、本発明のEPOv3変異体はまた、エリスロポエチンのカルボキシ末端から伸長する1つ以上のアミノ酸を有し、少なくとも1つの追加の炭水化物部位を提供する類似体を含む。特定の実施形態において、本発明のEPOv3変異体はまた、グリコシル化用に少なくとも1つの部位の転移を含むアミノ酸配列を有する類似体を含む。このようなグリコシル化部位の転移は、EPOv3において(又は
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又はD70N及びG104Sからなる群において選択される少なくとも1つ及び2つの変異により;又は
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又は
からなる群において選択される変異の組合せの1つにより;又はC34Sからなる変異により、配列番号9に示された配列とは異なるポリペプチドにおいて)1つ以上のグリコシル化部位の欠失及び1つ以上の非天然グリコシル化部位の付加を含む。エリスロポエチン上の炭水化物鎖数の増加、したがって、1エリスロポエチン分子当たりのシアル酸数を増加させることにより、安定性の増加、より大きな耐タンパク分解性、免疫原性の減少、血清中半減期の増加、生物活性の増加など、有利な性質を付与できる。追加のグリコシル化部位を有するエリスロポエチン類似体は、欧州特許出願第640,619号、PCT出願WO0024893及びWO0181405に、さらに詳細に開示されている。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又はD70N及びG104Sからなる群において選択される少なくとも1つ及び2つの変異により;又は
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又は
からなる群において選択される変異の組合せの1つにより;又はC34Sからなる変異により、このような配列とは異なるアミノ酸配列)を含むか、又はこれらからなる。別の実施形態において、このようなEPOv3変異体は、少なくとも2つの追加グリコシル化部位、又は少なくとも3つの追加グリコシル化部位、或いは少なくとも4つの追加グリコシル化部位を含む。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又はD70N及びG104Sからなる群において選択される1つ又は2つの変異により;又は
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又は
からなる群において選択される変異の組合せの1つにより;又はC34Sからなる変異により、配列番号9とは異なるアミノ酸配列)を含むか、又はこれらからなり、以下の:
から選択される修飾により修飾される。
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又はD70N及びG104Sからなる群において選択される1つ又は2つの変異により;又は
からなる群において選択される少なくとも1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により;又は
からなる群において選択される変異の組合せの1つにより;又はC34Sからなる変異により、配列番号9のアミノ酸配列)を含むか、又はこれらからなり、以下の:
から選択される修飾により修飾される。
上記又は下記のEPOポリヌクレオチド、変異体及び類似体のいずれも、少なくともいくつかの生物活性を保持することが好ましい。より好ましくは、前記生物活性は、以下の項目の少なくとも1つである:EPORに対する結合、EPOR発現細胞におけるJAK2のチロシンリン酸化の誘導、EPOR発現細胞の増殖刺激、哺乳動物、特にヒトにおける赤血球細胞の産生刺激、哺乳動物起源、特にヒト起源のインビトロ及び/又はインビボでの赤血球細胞の増殖及び/又は終末成熟の誘導、哺乳動物(特にヒトにおける)における血管作動性作用(血管収縮又は血管拡張)特に高血圧の誘導、哺乳動物、特にヒトにおけるヘマトクリットの増加、活性化過剰血小板、凝血原活性、血小板の産生増加、哺乳動物、特にヒトにおけるインビトロ及び/又はインビボでの神経保護活性、哺乳動物、特にヒトにおけるインビトロ及び/又はインビボでの神経栄養活性、哺乳動物、特にヒトにおけるインビトロ及び/又はインビボでの神経細胞の生存の増強、哺乳動物、特にヒトにおけるインビトロ及び/又はインビボでの心保護活性、哺乳動物、特にヒトにおけるインビトロ及び/又はインビボでの心筋細胞の生存の増強、哺乳動物起源、特にヒト起源のインビトロ及び/又はインビボでの癌細胞(好ましくは、腎、前立腺、卵巣又は乳房に由来する細胞、又はリンパ腫細胞(特に濾胞性リンパ腫、皮膚T細胞リンパ腫、ホジキンリンパ腫又は非ホジキンリンパ腫)、又は白血病細胞(特に慢性リンパ球性リンパ腫又は慢性骨髄性リンパ腫)、又は多発性骨髄腫細胞、又は中枢神経系に影響を及ぼす腫瘍細胞(特に神経膠芽腫又は神経芽腫))の増殖刺激、インビトロ及び/又はインビボ抗ウィルス活性(特にB型又はC型肝炎或いはHIVに対して)。
本発明はまた、追加のアミノ酸ドメインに作動可能に結合した、上記に開示されたポリペプチド(特にEPO短ポリペプチド又はその変異体、EPO短1ポリペプチド又はその変異体、EPO短2ポリペプチド又はその変異体、EPOv3ポリペプチド又はその変異体)を含む融合タンパク質に関する。追加のアミノ酸ドメインは、本明細書の上記のポリペプチドの配列から上流(N末端)又は下流(C末端)に配置され得る。この追加のドメインは、例えば、融合タンパク質の安定性、ターゲティング又は生物学的利用能の増加を提供する機能性領域を含むことができ;精製又は産生を容易にし、又は分子に追加の生物活性を付与する。このような追加のアミノ酸配列の特定の例としては、米国特許第6,193,972号に記載されたGST配列、Hisタグ配列、多量体化ドメイン、免疫グロブリン分子の定常領域又はヒト絨毛膜性生殖腺刺激ホルモン(hCG)などのヘテロ二量体タンパク質ホルモンを含む。用語の「作動可能に結合した」とは、ポリペプチド及び追加のアミノ酸ドメインは、直接的又はスペーサー残基を介してペプチド結合により結合することを示す。この様式で、融合タンパク質は、下記のとおり、同じものをコードする核酸分子の宿主細胞における直接発現により組換え的に産生できる。また、必要ならば、融合タンパク質に含まれた追加のアミノ酸配列は、産生/精製過程の終末、又はインビボで例えば、適切なエンド−/エキソ−ペプチダーゼの手段により除去できる。例えば、融合タンパク質に含まれたスペーサー配列は、インビボ又はインビトロのいずれかで追加のアミノ酸ドメインから所望のポリペプチド変異体の酵素的開裂により分離するために使用できるエンドペプチダーゼ(カスパーゼなど)に対する認識部位を含むことができる。
A.本発明のポリペプチド、タンパク質及び融合タンパク質をコードする核酸及びベクター類:
本発明のさらなる目的は、上記に定義されたポリペプチド、タンパク質及び融合タンパク質をコードする単離核酸分子である。これに関して、用語「核酸分子」は、限定はしないが、デオキシリボ核酸(例えば、DNA、cDNA、gDNA、合成DNAなど)、リボ核酸(例えば、RNA、mRNAなど)及びペプチド核酸(PNA)など、すべて異なるタイプの核酸を包含する。好ましい実施形態において、核酸分子は、二本鎖DNA分子又はcDNA分子などのDNA分子である。用語の「単離」とは、通常、天然源に結合する少なくとも1種の不純物の核酸分子から同定及び分離された核酸分子を意味する。単離核酸分子は、天然に見られる形態又は設定以外のものである。したがって、単離核酸分子は、天然細胞に存在する特異的核酸分子と区別される。
からなる群又は相補鎖又はその縮重鎖、又は
のポリペプチドをコードする核酸、又はその相補鎖を含むか、又はそれらからなる単離核酸分子にある。縮重配列とは、参照ヌクレオチド配列として同じアミノ酸配列をコードするが、遺伝子コード縮重の結果、異なるヌクレオチド配列を含むヌクレオチド配列を称す。好ましい実施形態において、核酸分子は、二本鎖DNA分子又はcDNA分子などのDNA分子である。
本発明のさらなる態様は組換え宿主細胞であり、前記細胞は、上記に定義された核酸分子又はベクターを含む。宿主細胞は、原核細胞又は真核細胞であり得る。原核細胞の例としては、大腸菌(E.coli)などの細菌を含む。真核細胞の例としては、任意の一次的細胞培養又は確立された細胞系(例えば、3T3、ベロ、HEK293、TN5など)を含む酵母細胞、植物細胞、哺乳動物細胞及び昆虫細胞である。グリコシル化タンパク質の発現に好適な宿主細胞は、多細胞生物に由来する。無脊椎動物細胞の例としては、ショウジョウバエ(Drosophila)S2及びスポドプテラ(Spodoptera)Sf9などの昆虫細胞、並びに植物細胞が挙げられる。有用な哺乳動物宿主細胞系の例としては、チャイニーズハムスター卵巣(CHO)細胞及びCOS細胞が挙げられる。さらに具体的な例としては、SV40(COS−7、ATCC CRL 1651)により変換されたサル腎臓CV1系;ヒト胎仔腎臓系(懸濁培地中の増殖用にサブクローン化された293又は293細胞、Grahamら、J.Gen Virol.、36:59頁(1977));チャイニーズハムスター卵巣細胞/−DHFR(CHO、Urlaub及びChasin、Proc.Natl.Acad.Sci.USA、77:4216頁(1980));マウスセルトリ細胞(TM4、Mather、Biol.Reprod.、23:243〜251頁(1980));ヒト肺細胞(W138、ATCC CCL 75);ヒト肝細胞(Hep G2、HB 8065);及びマウス乳房腫瘍(MMT 060562、ATCC CCL51)が挙げられる。本発明の特に好ましい哺乳動物細胞はCHO細胞である。
本発明のポリペプチド及び融合タンパク質は、組換えテクノロジー、化学合成、クローニング、連結又はそれらの組合せによるなど、それ自体当業界に知られている任意の技法により産生できる。特定の実施形態において、ポリペプチド又は融合タンパク質は、組換えテクノロジー、例えば、好適な宿主細胞における対応する核酸の発現により産生される。したがって、本発明の別の目的は、本発明のEPOポリペプチド、変異体又は類似体(特にEPO短ポリペプチド又はその変異体、EPO短1ポリペプチド又はその変異体、EPO短2ポリペプチド又はその変異体、EPOv3ポリペプチド又はその変異体)を産生する方法であり、該方法は、核酸分子の発現を可能にする条件下、本発明の組換え宿主細胞を培養すること、及び産生されたポリペプチドを回収することを含む。産生されたポリペプチドは、グリコシル化されていてもされてなくてもよく、又は使用される宿主細胞タイプに依って他の翻訳後の修飾を含有してもよい。多数の書籍及びレビュー、例えば、オックスフォード大学プレスにより出版された「実用的アプローチ(A Practical Approach)」シリーズにおけるいくつかのタイトル(「DNAクローニング2:発現系(DNA Cloning 2:Expression Systems)」、1995年;「DNAクローニング4:哺乳動物系(DNA Cloning 4:Mammalian Systems)」、1996年;「タンパク質発現(Protein Expression)」、1999年;「タンパク質精製技法(Protein Purification Techniques)」、2001年)などで、ベクター及び原核細胞又は真核細胞を用いた組換えタンパク質をクローン化する方法及び産生する方法を教示している。
本発明のポリペプチド又は融合タンパク質(特にEPO短ポリペプチド又はその変異体、EPO短1ポリペプチド又はその変異体、EPO短2ポリペプチド又はその変異体、EPOv3ポリペプチド又はその変異体)は、共有結合又はそうでなく、直接的又はカップリング剤若しくはリンカーの使用により、細胞毒性剤、標識(例えば、ビオチン、蛍光標識)、薬物又は他の治療剤から選択できる異種部分による活性な結合体又は複合体の形態であり得る。有用な結合体又は複合体は、例えば、EPO受容体との相互作用の検出(放射性又は蛍光標識、ビオチン)、サンプル中のEPO受容体発現細胞の検出(放射性又は蛍光標識、ビオチン)、治療効力(細胞毒性剤、薬物又は他の治療剤)を可能にするために、それら自体当業界に知られている分子及び方法を用いて作出できる。細胞毒性剤としては、化学療法剤、毒素(例えば、細菌、真菌、植物、又は動物起源の酵素活性毒素、又はそれらの断片)、又は放射性同位元素(即ち、放射性結合体)が挙げられる。使用できる酵素活性毒素及びそれらの断片としては、ジフテリアA鎖、ジフテリア毒素の非結合活性断片、外毒素A鎖(緑膿菌(Pseudomonas aeruginosa)に由来)、リシンA鎖、アブリンA鎖、モデッシンA鎖、アルファ−サルシン、アレウリテスフォルジ(Aleurites fordii)タンパク質、ジアンチン(dianthin)タンパク質、フィトラカアメリカーナ(Phytolaca americana)タンパク質(PAPI、PAPII、及びPAP−S)、モモルジカカランチア(momordica charantia)阻害剤、クルシン、クロチン、サポナリアオフィシナリス(saponaria officinalis)阻害剤、ゲロニン、ミトゲリン、レストリクトシン、フェノマイシン、エノマイシン、及びトリコテセン類が挙げられる。種々の放射性核種は、放射性結合タンパク質の製造に利用できる。例としては、212Bi、131I、131In、90Y、及び186Reが挙げられる。
本発明の組成物及び方法に使用するためのいくつかの薬物候補は、任意の上記又は下記のポリペプチドに選択的に結合する抗体、抗体断片又はそれらの誘導体である。
げっ歯類、霊長類及びウマなど、種々の種からポリクローナル抗体を調製する方法は、例えば、Vaitukaitisら(J Clin Endocrinol Metab.33(1971)988頁)に記載されている。ポリクローナル抗体は、例えば、1回以上の免疫剤、及び所望ならば、アジュバントの注射により哺乳動物において増加させることができる。典型的には、免疫剤及び/又はアジュバントは、複数回の皮下又は腹腔内注射により哺乳動物に注入される。
抗体は、代わりにモノクローナル抗体であってもよい。本明細書に用いられる用語「モノクローナル抗体」とは、実質的に均一な抗体集団から得られた抗体のことであり、即ち、該集団を含む個々の抗体は、少量で存在し得る天然変異の可能性を除いて同一である。モノクローナル抗体は高特異的であり、単一の抗原部位に対して向けられる。モディファイヤー「モノクローナル」は、実質的に均一な抗体集団から得られる抗体の特徴を示し、任意の特定の方法により抗体の産生を必要とするものと解すべきではない。
本発明の抗体は、さらにヒト化抗体又はヒト抗体を含むことができる。非ヒト(例えば、マウス)抗体のヒト化形態は、キメラ免疫グロブリン、免疫グロブリン鎖又は非ヒト免疫グロブリンに由来する最少配列を含有するその断片(Fv、Fab、Fab’、F(ab’)2又は抗体の他の抗原結合部分配列など)である。ヒト化抗体は、ヒト免疫グロブリン(レシピエント抗体)を含み、レシピエントの相補決定領域(CDR)からの残基は、所望の特異性、親和力及び能力を有するマウス、ラット又はウサギなど、非ヒト種(ドナー抗体)のCDRからの残基により置換される。いくつかの場合、ヒト免疫グロブリンのFvフレームワーク残基は、対応する非ヒト残基により置換される。
本発明はまた、直接的又はカップリング剤或いはリンカーの使用を介して、共有結合又は非共有結合の細胞毒性剤、標識、薬物又は他の治療剤などの異種部分に結合した抗体を含む免疫結合体に関する。細胞毒性剤としては、化学療法剤、毒素(例えば、細菌、真菌、植物、又は動物起源の酵素活性毒素、又はその断片)、又は放射線同位元素(即ち放射性結合)が挙げられる。
本発明はまた、無処置抗体、好ましくは抗原結合又は無処置抗体の可変性領域の一部を含む「抗体断片」に関する。抗体断片の例としては、Fab、Fab’、F(ab’)2、及びFv断片;ジア体;線状抗体(Zapataら、Protein Eng.、8(10):1057〜1062頁[1995]);単鎖抗体分子;モノボディ;及び抗体断片から形成された多特異的抗体が挙げられる。
本発明の抗体及び抗体断片は、種々の有用性を有する。例えば、抗体は、本明細書に上記された本発明の任意のEPOポリペプチド又は変異体を検出、投薬、精製又は中和に使用できる。特定の態様において、本発明はこのように、サンプル中の上記に定義された本発明のEPOポリペプチド又は変異体を検出又は投薬する方法にあり、この方法は、このようなサンプルを、上記に開示された抗体、その断片又は誘導体と接触させること、及び免疫複合体の形成を判定するか、又はその(関連する)量を投薬することを含む。サンプルは、例えば、場合によっては、任意選択で希釈及び/又は処理された血液、血漿、血清などの任意の生体液であり得る。抗体、その断片又は誘導体を懸濁液中にあるか、又は支持体上に固定できる。免疫複合体の存在又は量は、例えば、レポーター抗体、標識抗体などを用いて、例えば、ELISA、RIAなどにより、それ自体当業界に知られている任意の技法により測定できる。特定の実施形態において、抗体、その断片又は誘導体は、本明細書の上記のEPOv及び/又はEPO短ポリペプチド及び/又は前記ポリペプチドの変異体及び/又は類似体に選択的に結合する。別の特定の実施形態において、抗体、その断片又は誘導体は、本明細書の上記のEPOv1及び/又はEPO短1ポリペプチド及び/又は前記ポリペプチドの変異体及び/又は類似体に選択的に結合する。別の特定の実施形態において、抗体、その断片又は誘導体は、本明細書の上記のEPOv2及び/又はEPO短2ポリペプチド及び/又は前記ポリペプチドの変異体及び/又は類似体に選択的に結合する。別の実施形態において、抗体、その断片又は誘導体は、本明細書の上記の配列番号8及び/又は配列番号9のポリペプチド及び/又は前記ポリペプチドの変異体に選択的に結合する。
EPOは種々の生理学的作用に関与してきた。特に、EPOは、赤血球細胞(赤血球)の産生刺激に関与してきた。組換えヒトEPO(rHuEPO)は現在、慢性腎不全に関連した貧血を有する患者、ジドブジンを用いた治療による貧血を有するAIDS患者、化学療法剤を用いて治療されている患者における非骨髄性悪性疾患、外科手術中の患者、及び自己血液供与の処置に用いられている。
本発明のさらなる態様は、サンプル中、本発明のEPOポリペプチド又は変異体又は類似体をコードする核酸、好ましくは、RNA又はcDNAを検出又は投与する組成物及び方法に関する。このような組成物としては、例えば、本明細書における上記のEPOポリペプチド又は変異体又は類似体をコードする核酸を特異的に認識する任意の特異的核酸プローブ又はプライマーが挙げられる。
ヒト遺伝子EPOのエキソン1、2、4及び5によってコードされたEPOの転写変異体のクローニング
エキソン1、2、4及び5によってコードされたEPO転写変異体(EPOv1)が、EPOのヒト遺伝子において予想された(図4を参照)。我々の予想により、4つのエキソンにまたがっている492bpに対応する、164のアミノ酸(配列番号4)においてコードされたEPOv1タンパク質が導かれる。この予想には、開始メチオニン、シグナル配列及び停止コドンが含まれた(図4)。
逆転写及びクローニングの技法を用い、EPOv1を、RNAのプールからクローン化した。用いられたRNAのプールは、種々の組織からのRNAの混合物である。用いられた混合物は、以下のとおりである:ヒト膵臓のポリA RNA(Clontech;カタログ照会番号:636119)、ヒト骨格筋のポリA RNA(Clontech;カタログ照会番号:636120)、ヒト小腸のポリA RNA(Clontech;カタログ照会番号:636125)、ヒト精巣のポリA RNA(Clontech;カタログ照会番号:636115)、ヒト肝臓のポリA RNA(Clontech;カタログ照会番号:636101)、ヒト脳(全体)のポリA RNA(Clontech;カタログ照会番号:636102)及びヒト正常脂肪の総RNA(Invitrogen組織コレクション、(ロットA5040004)、InVitrogen、カールスバッド、カリフォルニア州、米国)。
A)第1鎖cDNAの合成:
該cDNAの合成には、ClontechからのSMART(商標)RACEcDNA Amplification Kit(マウンテンビュー、カリフォルニア州、カタログ照会番号:634914)を、製造元の推奨に従って使用した。用いられたプロトコルは以下のとおりであった:
1−混合物調製
− 0.5μlのRNAプール(上記参照)
− 1μlの3’SMART CDSPrimerIIA(10μM)
− 1μlのSMARTIIAオリゴヌクレオチド(10μm)
− 2.5μlの脱イオン化H2O
2−内容物を混合し、該管をマイクロ遠心分離機内で簡単に回転させる
3−72℃で2分間インキュベートする
4−該管を氷上で2分間冷却する
5−各反応管に以下のものを加える
− 2μlの5×第1鎖緩衝液
− 1μlのDTT(20mM)
− 1μlの50×dNTP(10mM)
− 1μlのPowerScript Reverse Transcriptase
6−該管を42℃で1時間インキュベートする
7−190μlのTE 1×(pH7.5)を加える
8−72℃で7分間インキュベートする
9−−20℃で保存する
Clontech(マウンテンビュー、カリフォルニア州、カタログ照会番号:639119)からのAdvantage−GC 2 PCR Kit & Polymerase Mixを用いたPCRを実施した。用いられたプロトコルは以下のとおりであった:
1−混合物調製
− 29μlのH2O
− 10μlの5×GC×2PCR緩衝液
− 5μlのGC Melt(5M)
− 2μlの入れ子ユニバーサルプライマーA 10mM
− 1μlの50×dNTP(各10mM)
− 1μlのAdvantage−GC Pol.Mix
2−ステップA)で得られた産物2μlを加える
3−PCR反応:
94℃ 1分間 1サイクル
94℃ 15秒間 )
65℃ 5秒間 )20サイクル
68℃ 12分間 )
68℃ 12分間 1サイクル
4−使用された管:0.4ng/μl
Gatewayクローニング法(Invitrogenから商品として入手できるGateway PCRクローニングシステム)の第1段階は、本明細書上記でテンプレートとして作出されたcDNAを用いて、5’末端にattB1組換え部位及びKozak配列が隣接し、3’末端にインフレーム6ヒスチジン(6His)タグをコードする配列、停止コドン及びattB2組換え部位(Gateway適合性cDNA)が隣接したEPOv1のORFを作出する2ステップのPCR反応を含む。
プライマーとして、RecF1(TGAGGGACCCCGGCCAGGCGCGGAG(配列番号16))及びRecR1(ATGCCCAGGTGGACACACCTGGTCA(配列番号17))、マトリックスとして、本明細書上記のステップB)で得られた産物並びに以下の条件を用いて、第1のPCRを実施した。
1−混合物調製
− 5μlの本明細書上記ステップB)で得られた産物
− 45μlのH2O
− 5μlの緩衝液「TaqPlus(登録商標)Precision」10×、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
− 0.4μlのdNTP 25mM、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:10297−018)
− 各10μMで1μlのプライマー、RecF1及びRecR1(上記参照)
− 0.25μlのTaqPlus(登録商標)Precision、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
− 2.5μlのDMSO 100%
2−PCR反応:
94℃ 1分間 1サイクル
94℃ 40秒間 )
45℃ 40秒間 )3サイクル
72℃ 1分間 )
94℃ 40秒間 )
55℃ 40秒間 )9サイクル
72℃ 1分間 )
72℃ 5分間
4℃ 終了
プライマーとして、cloF1(GGGGACAAGTTTGTACAAAAAAGCAGGCTTCGCCACCATGGGGGTGCACGAATGTCC(配列番号18))及びcloR1(GGGGACCACTTTGTACAAGAAAGCTGGGTTTCAATGGTGATGGTGATGGTGTCTGTCCCCTGTCCTGCAGG(配列番号19))、マトリックスとして、本明細書上記のステップA)で得られた産物並びに以下の条件を用いて、第2のPCRを実施した:
1−混合物調製
− 10μlの本明細書上記ステップA)で得られた産物
− 31.5μlのH2O
− 4μlの緩衝液「TaqPlus(登録商標)Precision」10×、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
− 0.32μlのdNTP 25mM、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:10297−018)
− 各10μMで4μlのプライマー、cloF1及びcloR1(上記参照)
− 0.2μlのTaqPlus(登録商標)Precision、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
2−PCR反応
94℃ 1分間 1サイクル
94℃ 40秒間 )
45℃ 40秒間 )3サイクル
72℃ 1分間 )
94℃ 1分間
94℃ 40秒間 )
50℃ 40秒間 )3サイクル
72℃ 1分間 )
94℃ 40秒間 )
55℃ 40秒間 )7サイクル
72℃ 1分間 )
72℃ 5分間
4℃ 終了
Gatewayクローニング法の第2段階(BP組換えによるGatewayエントリークローニング、Invitrogen)は、GatewayエントリーベクターpDONR(商標)201へのGateway修飾PCR産物(即ち、上記ステップB)で得られたPCR産物)のサブクローニングを含む。
1−混合物調製
− 1μlの本明細書上記ステップB)で得られた産物
− 4μlのTE10.1
− 1μlのベクターpDONR201(300ng/μl)、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:11798−014)
− 2μlの緩衝BP反応液5×、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:11789−013)
− 2μlのBPクロナーゼ酵素、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:11789−013)
2−25℃で1時間インキュベートする
3−1μlのプロテイナーゼKを加える(Merck KGaA(ダルムスタット、ドイツ国、カタログ照会番号:1.24568)
4−37℃で10分間インキュベートする
5−4℃で保存する
本明細書上記のステップC)で得られた反応産物を用い、電気穿孔により、大腸菌DH10B細胞を形質転換した。
1−混合物組成:
− 1μlの本明細書上記ステップC)で得られたBP−反応産物
− 30μlのElectroMax DH10B細胞、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:18290−015)
該混合物を冷却した0.1cmの電気穿孔キュベットに移し、製造元のプロトコルに従って、該細胞を電気穿孔した。
− 電気穿孔直後に、500μlのSOC培地を加えた。
2−攪拌下、37℃で1時間インキュベートする
3−LBアガープレート上に30μlを塗布する(+50μg/mlのカナマイシン)
4−37℃で一晩インキュベートする
150μlのLB培養物+カナマイシンを接種するために、96のクローンを取り出して用い、37℃で20時間インキュベートした。pDONR特異的プライマー(正プライマー、5’−TCGCGTTAACGCTAGCATGGATCTC−3’(配列番号32);逆プライマー、5’−GTAACATCAGAGATTTTGAGACAC−3’(配列番号33))によるPCRのために、各培養物2マイクロリットルを用いた。
PCR条件:
PCR混合物:
2μlの培養物
10×PCR緩衝液2μl
20mMのdNTP0.2μl
10μMのpDONR正プライマー1μl
10μMのpDONR逆プライマー1μl
Taq DNAポリメラーゼ(5U/μl)0.1μl
ddH2Oを20μlまで加える
PCRプログラム
95℃で2分間
95℃で30秒間)
56℃で30秒間}35サイクル
72℃で60秒間)
EPOv1(His−タグ化)の発現
ヒト細胞、例えば、エプスタインバーウィルス核抗原を発現するヒト胚腎臓293細胞(HEK293−EBNA、Invitrogen)に、このような細胞にEPOv1の発現を可能にさせる発現ベクター(pEAK12d_EPOv1−HIS)をトランスフェクトした。EPOv1を発現する細胞を増殖させ、該培養培地から該組換えタンパク質を抽出した。
エプスタインバーウィルス核抗原を発現するヒト胚腎臓293細胞(HEK293−EBNA、Invitrogen)を、Ex−細胞VPRO無血清培地(シードストック、維持培地、JRH)中、懸濁してルーチンに維持した。トランスフェクション前に、50mlのFEME1%FBSに、500μgのEPOv1コードプラスミドDNA(pEAK12d_EPOv1−HIS)及び10μgのレポーター遺伝子プラスミドを加えた。次いで、1mlのPEI(1mg/ml Polysciences、米国)を加えた。攪拌後、該混合物を室温で10分間インキュベートした。該細胞接種物をトランスフェクション混合溶液と再懸濁し、1%FBS(Invitrogen)を添加した200mlのFEME(19mMのHEPES、5g/Lのグルコース、7.5mMのL−グルタミン、4ml/LのITS−XにDMEM/ハムのF−12、1:1を補足)(すべてInvitrogen−Life Technologies)培地に加え、好適な容器中、1×106細胞/mlの細胞密度にする。該培養物を、5%CO2大気、及び少なくとも70%の相対湿度のインキュベーター中、37℃で90分間、さらにインキュベートした。最後に、該容量に、4ml/LのITS−Xを補足した250mlの化学的に規定された無血清FreeStyle293(Invitrogen)培地をつぎ足した。トランスフェクションのため、該トランスフェクトした培養物を、同一条件でさらに6日間インキュベートした。採集日に、定性的蛍光試験(Axiovert 10 Zeiss)によって、陽性トランスフェクションの確認を行った。上澄み液(500ml)を、遠心分離し(1800×g、4℃、6〜10分間)、0.22umのフィルターユニット(Millipore、500mlフィルターユニット)を通して滅菌ろ過し、IMAC(Immobilised Metal Affinity Chromatography)クロマトグラフィーにより精製した。該上澄み液の1つのアリコート(500μl)を、6His−タグ化タンパク質のQC用に保持した。
C末端6Hisタグを有するEPOv1組換えタンパク質を含有する500mlの培養培地サンプルを、1容量の冷緩衝液A(50mMのNaH2PO4;600mMのNaCl;8.7%(w/v)のグリセロール、pH7.5)で希釈し、1000mlの最終容量にした。該サンプルを、0.22mmの滅菌フィルター(Millipore、500mlフィルターユニット)を通してろ過し、1リットルの滅菌角形培地瓶(Nalgene)中、4℃で保持した。自動サンプル充填器(Labomatic)に接続したVISIONワークスステーション(Applied Biosystems)上、4℃で精製を行った。精製操作は、2つの連続的ステップ、Niイオンを充填したPoros 20MC(Applied Biosystems)カラム(10×50mm、3.93ml)上での金属アフィニティークロマトグラフィー、引き続いて、Sephadex G−25培地(Amersham Pharmacia)ゲルろ過カラム(1.0×15cm)上での緩衝液交換を含んだ。第1のクロマトグラフィーステップでは、金属アフィニティーカラムを、30カラム容量のEDTA液(100mMのEDTA;1MのNaCl;pH8.0)で再生し、15カラム容量の100mM NiSO4溶液を用いた洗浄によってNiイオンによる再荷電を行い、10カラム容量の緩衝液A、続いて7カラム容量の緩衝液B(50mMのNaH2PO4;600mMのNaCl;8.7%(w/v)のグリセロール、400mM;イミダゾール、pH7.5)により洗浄し、最後に、15mMのイミダゾールを含有する15カラム容量の緩衝液Aによって平衡化した。該サンプルをLabomaticサンプル充填器により、200mlのサンプルループ内に移し、引き続き、20ml/分の流速で、Ni金属アフィニティーカラム上に充填した。該Niカラム上にサンプル全体(1000ml)を移すために、該充填操作を5回繰り返した。引き続いて、12カラム容量の緩衝液A、続いて、20mMのイミダゾールを含有する28カラム容量の緩衝液Aによって該カラムを洗浄した。20mMのイミダゾール洗浄の間に、緩く結合した混入タンパク質をカラムから溶出させた。最後に、組換えEPOv1 Hisタグ化タンパク質を、2ml/分の流速で10カラム容量の緩衝液Bにより溶出させ、溶出した該タンパク質を、2.7mlのフラクション中に採集した。第2のクロマトグラフィーステップでは、Sephadex G−25ゲルろ過カラムを、2mlの緩衝液D(1.137MのNaCl;2.7mMのKCl;1.5mMのKH2PO4;8mMのNa2HPO4;pH7.2)で再生し、引き続き、4カラム容量の緩衝液C(137mMのNaCl;2.7mMのKCl;1.5mMのKH2PO4;8mMのNa2HPO4;20%(w/v)のグリセロール;pH7.4)で平衡化した。該Niカラムから、積分サンプル充填器を通して、ピークフラクションをVISION上に自動的に溶出させ、Sephadex G−25カラム上に充填し、該タンパク質を、2ml/分の流速で緩衝液Cにより溶出させた。脱塩サンプルを、2.7mlのフラクション中に採集した。該フラクションを、0.22mmの滅菌遠心分離フィルター(Millipore)を通してろ過し、分割し、凍結し、−80℃で保存した。サンプルのアリコートを、クーマシーブルー染色及び抗His抗体を用いたウェスタンブロットによりSDS−PAGE(4〜12%のNuPAGEゲル;Novex)上で分析した。レベルLPSエンドトキシンの判定用にさらなるアリコートを採取した。
ヒト遺伝子EPO(EPOv2)のエキソン1、2、及び5によってコードされたEPOの変異体のクローニング
実施例1に記載された方法を用いて、EPOのヒト遺伝子のエキソン1、2、及び5を含有し、EPOv2をコードする配列(図5を参照)を同定し、クローン化した。得られた発現プラスミド、pEAK12d_EPOv2−HISの配列は、配列番号21で示される。
EPOv2(Hisタグ化)の発現
EPOv2タンパク質は、3つのエキソンにまたがる312bpに対応する、104のアミノ酸長(配列番号6)である。該配列は、開始メチオニン、シグナル配列及び停止コドンを含有する(図5)。
ヒト遺伝子EPOのエキソン1、2、3及びより長いエキソン4(本明細書においてエキソン4Aと称される)によってコードされるEPOの転写変異体のクローニング
坐骨神経圧潰におけるEPOv1及びEPOv2の効果を試験することにより、本試験における野生型タンパク質で見られた活性と同様な活性を双方とも有することが判明した(実施例11及び図9参照)。該変異タンパク質は、2つのドメイン、即ち、エキソン2及びエキソン5によってコードされたドメインを、完全長分子と共有する。坐骨神経圧潰モデルにおいて保護を与える該タンパク質の領域をより正確に規定する目的で、変異タンパク質EPOv3の活性を調べた。この変異体は、エキソン5を欠いており、下記のとおりクローン化された。
逆転写及びクローニング技法を用いてRNAのプールからEPOv3をクローン化した。用いられたRNAのプールは、種々の組織からのRNAの混合物である。用いられた混合物は、以下のとおりであった:ヒト膵臓のポリA RNA(Clontech;カタログ照会番号:636119)、ヒト骨格筋のポリA RNA(Clontech;カタログ照会番号:636120)、ヒト小腸のポリA RNA(Clontech;カタログ照会番号:636125)、ヒト精巣のポリA RNA(Clontech;カタログ照会番号:636115)、ヒト肝臓のポリA RNA(Clontech;カタログ照会番号:636101)、ヒト脳(全体)のポリA RNA(Clontech;カタログ照会番号:636102)及びヒト正常脂肪の総RNA(Invitrogen組織コレクション、(ロットA5040004)、InVitrogen、カールスバッド、カリフォルニア州、米国)。
A)第1鎖cDNAの合成:
cDNA合成のために、Clontech(マウンテンビュー、カリフォルニア州、カタログ照会番号:634914)からのSMART(商標)RACEcDNA Amplification Kitを、製造元の推奨に従って用いた。用いられたプロトコルは、以下のとおりであった:
1−混合物調製
− 0.5μlのRNAプール(上記参照)
− 1μlの3’SMART CDSプライマーIIA(10μM)
− 1μlのSMARTIIAオリゴヌクレオチド(10μm)
− 2.5μlの脱イオン化H2O
2−内容物を混合し、該管をマイクロ遠心管中で簡単に回転させる
3−72℃で2分間インキュベートする
4−該管を氷上で2分間冷やす
5−各反応管に以下のものを加える:
− 2μlの5×第1鎖緩衝液
− 1μlのDTT(20mM)
− 1μlの50×dNTP(10mM)
− 1μlのPowerScript逆転写酵素
6−該管を42℃で1時間インキュベートする
7−190μlのTE1X(pH7.5)を加える
8−72℃で7分間インキュベートする
9−−20℃で保存する
Clontech(マウンテンビュー、カリフォルニア州、カタログ照会番号:639119)からのAdvantage−GC 2PCRキット & Polymerase Mixを用いたPCRを実施した。用いられたプロトコルは、以下のとおりである:
1−混合物調製
− 29μlのH2O
− 10μlの5×GCX 2 PCR緩衝液
− 5μlのGC溶融液(5M)
− 2μlの入れ子ユニバーサルプライマー10mM
− 1μlの50×dNTP(各10mM)
− 1μlのAdvantage−GC Pol.Mix
2−ステップA)で得られた産物の2μlを加える
3−PCR反応:
94℃ 1分間 1サイクル
94℃ 15秒間 )
65℃ 5秒間 )20サイクル
68℃ 12分間 )
68℃ 12分間 1サイクル
4−使用する管:0.4ng/μl
Gatewayクローニング法(Invitrogenから商品として入手できるGateway PCRクローニングシステム)の第1段階は、テンプレートとして本明細書上記で作製したcDNAを用いて、5’末端にattB1組換え部位及びKozak配列が隣接し、3’末端にインフレーム6ヒスチジン(6His)タグをコードする配列、停止コドン及びattB2組換え部位(Gateway適合性cDNA)が隣接したEPOv3のORFを作出する2ステップのPCR反応を含む。
プライマーとして、RecF1(TGAGGGACCCCGGCCAGGCGCGGAG(配列番号16))及びRecR1(ATGCCCAGGTGGACACACCTGGTCA(配列番号17))、マトリックスとして、本明細書上記ステップB)で得られた産物及び以下の条件を用いる第1のPCRを実施した:
1−混合物調製
− 5μlの本明細書上記ステップB)で得られた産物
− 45μlのH2O
− 5μlの緩衝液「TaqPlus(登録商標)Precision」10×、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
− 0.4μlのdNTP 25mM、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:10297−018)
− 各10μMのプライマー1μl、RecF3及びRecR3(上記参照)
− 0.25μlのTaqPlus(登録商標)Precision、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
− 2.5μlのDMSO 100%
2−PCR反応:
94℃ 1分間 1サイクル
94℃ 40秒間 )
45℃ 40秒間 )3サイクル
72℃ 1分間 )
94℃ 40秒間 )
55℃ 40秒間 )9サイクル
72℃ 1分間 )
72℃ 5分間
4℃ 終了
プライマーとして、cloF1(GGGGACAAGTTTGTACAAAAAAGCAGGCTTCGCCACCATGGGGGTGCACGAATGTCC(配列番号18))及びcloR3(GGGGACCACTTTGTACAAGAAAGCTGGGTTTCAATGGTGATGGTGATGGTGCAGAAAGGGCAAGCAGAAGT(配列番号22))、マトリックスとして、本明細書上記ステップA)で得られた産物及び以下の条件を用いて、第2のPCRを実施した:
1−混合物調製
− 本明細書上記ステップA)で得られた産物10μl
− 31.5μlのH2O
− 4μlの緩衝液「TaqPlus(登録商標)Precision」10×、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
− 0.32μlのdNTP 25mM、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:10297−018)
− 各10μMのプライマー4μl、cloF3及びcloR3(上記参照)
− 0.2μlのTaqPlus(登録商標)Precision、Stratagene(ラジョーラ、カリフォルニア州、カタログ照会番号:600211)
2−PCR反応:
94℃ 1分間 1サイクル
94℃ 40秒間 )
45℃ 40秒間 )3サイクル
72℃ 1分間 )
94℃ 1分間 )
94℃ 40秒間 )
50℃ 40秒間 )3サイクル
72℃ 1分間 )
94℃ 40秒間 )
55℃ 40秒間 )7サイクル
72℃ 1分間 )
72℃ 5分間
4℃ 終了
Gatewayクローニング法(BP組換えによるGatewayエントリークローニング、Invitrogen)の第2段階は、GatewayエントリーベクターpDONR(商標)201内へのGateway修飾PCR産物(即ち、本明細書上記ステップB)で得たPCR産物)のサブクローニングを含む。
1−混合物調製
− 本明細書上記ステップB)で得られた産物1μl
− 4μlのTE10.1
− 1μlのベクターpDONR201(300ng/μl)、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:11798−014)
− 2μlの緩衝BP反応液5×、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:11789−013)
− 2μlのBPクロナーゼ酵素、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:11789−013)
2−25℃で1時間インキュベートする
3−1μlのプロテイナーゼKを加える
4−37℃で10分間インキュベートする
5−4℃で保存する
本明細書上記のステップC)で得られた反応産物を用いて、電気穿孔により、大腸菌DH10B細胞を形質転換した。
1−混合物組成
− 本明細書上記ステップC)で得られたBP反応産物1μl
− 30μlのElectroMax DH10B細胞、Invitrogen(カールスバッド、カリフォルニア州、カタログ照会番号:18290−015)
該混合物を0.1cmの冷電気穿孔キュベットに移し、製造元のプロトコルに従って該細胞を電気穿孔した。
− 電気穿孔直後に、500μlのSOC培地を加えた
2−攪拌下、37℃で1時間、インキュベートする
3−LB寒天プレート上に30μlを塗布する(+50μg/mlのカナマイシン)
4−37℃で一晩インキュベートする
EPOv3(Hisタグ化)の発現
ヒト細胞、例えば、エプスタインバーウィルス核抗原を発現するヒト胚腎臓293細胞(HEK293−EBNA、Invitrogen)に、このような細胞にEPOv3の発現を可能にする発現ベクター(pEAK12d_EPOv3−HIS)をトランスフェクトする。EPOv3を発現する該細胞を増殖させ、該組換えタンパク質を培養培地から抽出する。
エプスタインバーウィルス核抗原を発現するヒト胚腎臓293細胞(HEK293−EBNA、Invitrogen)を、Ex−cell VPRO無血清培地(シードストック、維持培地、JRH)中、懸濁してルーチンに維持する。トランスフェクション前に、50mlのFEME1%FBSに、500μgのEPOコードプラスミドDNA(pEAK12d_EPOv3−HIS)及び10μgのレポーター遺伝子プラスミドを加える。次いで、1mlのPEI(1mg/ml Polysciences、米国)を加える。攪拌後、該混合物を室温で10分間インキュベートする。該細胞接種物をトランスフェクション混合溶液と再懸濁し、1%FBS(Invitrogen)を添加した200mlのFEME(19mMのHEPES、5g/Lのグルコース、7.5mMのL−グルタミン、4ml/LのITS−XにDMEM/ハムのF−12、1:1を補足)(すべてInvitrogen−Life Technologies)培地に加え、好適な容器中、1×106細胞/mlの細胞密度にする。該培養物を、5%CO2大気、及び少なくとも70%の相対湿度のインキュベーター中、37℃で90分間、さらにインキュベートする。最後に、該容量に、4ml/LのITS−Xを補足した250mlの化学的に規定された無血清FreeStyle293(Invitrogen)培地をつぎ足す。トランスフェクションのため、該トランスフェクトした培養物を、同一条件でさらに6日間インキュベートする。採集日に、定性的蛍光試験(Axiovert 10 Zeiss)によって、陽性トランスフェクションの確認を行う。上澄み液(500ml)を、遠心分離し(1800×g、4℃、6〜10分間)、0.22umのフィルターユニット(Millipore、500mlフィルターユニット)を通して滅菌ろ過し、IMAC(Immobilised Metal Affinity Chromatography)クロマトグラフィーにより精製する。該上澄み液の1つのアリコート(500μl)を、6His−タグ化タンパク質のQC用に保持する。
C末端6Hisタグを有するEPOv3組換えタンパク質を含有する500mlの培養培地サンプルを、1容量の冷緩衝液A(50mMのNaH2PO4;600mMのNaCl;8.7%(w/v)のグリセロール、pH7.5)で希釈し、1000mlの最終容量にする。該サンプルを、0.22mmの滅菌フィルター(Millipore、500mlフィルターユニット)を通してろ過し、1リットルの滅菌角形培地瓶(Nalgene)中、4℃で保持する。自動サンプル充填器(Labomatic)に接続したVISIONワークスステーション(Applied Biosystems)上、4℃で精製を行う。精製操作は、2つの連続的ステップ、Niイオンを充填したPoros 20MC(Applied Biosystems)カラム(10×50mm、3.93ml)上での金属アフィニティークロマトグラフィー、引き続いて、Sephadex G−25培地(Amersham Pharmacia)ゲルろ過カラム(1.0×15cm)上での緩衝液交換を含む。第1のクロマトグラフィーステップでは、金属アフィニティーカラムを、30カラム容量のEDTA液(100mMのEDTA;1MのNaCl;pH8.0)で再生し、15カラム容量の100mM NiSO4溶液を用いた洗浄によってNiイオンによる再荷電を行い、10カラム容量の緩衝液A、続いて7カラム容量の緩衝液B(50mMのNaH2PO4;600mMのNaCl;8.7%(w/v)のグリセロール、400mM;イミダゾール、pH7.5)により洗浄し、最後に、15mMのイミダゾールを含有する15カラム容量の緩衝液Aによって平衡化する。該サンプルをLabomaticサンプル充填器により、200mlのサンプルループ内に移し、引き続き、20ml/分の流速で、Ni金属アフィニティーカラム上に充填する。該Niカラム上にサンプル全体(1000ml)を移すために、該充填操作を5回繰り返す。引き続いて、12カラム容量の緩衝液A、続いて、20mMのイミダゾールを含有する28カラム容量の緩衝液Aによって該カラムを洗浄する。20mMのイミダゾール洗浄の間に、緩く結合した混入タンパク質をカラムから溶出させる。最後に、組換えEPOv3 Hisタグ化タンパク質を、2ml/分の流速で10カラム容量の緩衝液Bにより溶出させ、溶出した該タンパク質を、2.7mlのフラクション中に採集した。第2のクロマトグラフィーステップでは、Sephadex G−25ゲルろ過カラムを、2mlの緩衝液D(1.137MのNaCl;2.7mMのKCl;1.5mMのKH2PO4;8mMのNa2HPO4;pH7.2)で再生し、引き続き、4カラム容量の緩衝液C(137mMのNaCl;2.7mMのKCl;1.5mMのKH2PO4;8mMのNa2HPO4;20%(w/v)のグリセロール;pH7.4)で平衡化した。該Niカラムから、積分サンプル充填器を通して、ピークフラクションをVISION上に自動的に溶出させ、Sephadex G−25カラム上に充填し、該タンパク質を、2ml/分の流速で緩衝液Cにより溶出させた。脱塩サンプルを、2.7mlのフラクション中に採集した。該フラクションを、0.22mmの滅菌遠心分離フィルター(Millipore)を通してろ過し、分割し、凍結し、−80℃で保存した。サンプルのアリコートを、クーマシーブルー染色及び抗His抗体を用いたウェスタンブロットによりSDS−PAGE(4〜12%のNuPAGEゲル;Novex)上で分析した。
ヒトEPO変異体の組織分布
予測されたEPOv1、EPOv2及びEPOv3 mRNAの発現パターンを、RT−PCR解析によって判定する。該変異体の組織発現を判定するために、種々の特異的プライマーを用いて、種々の組織のcDNAテンプレートを増幅する。
ヒト遺伝子EPO(本明細書において、EPOv及びその成熟形態においてEPOvmと称する)のエキソン1、2、及びエキソン3の最初の2つのアミノ酸によってコードされたEPOの切断変異体のクローニング
配列番号12で示された配列を作出するために、オリゴヌクレオチド特異的欠失変異誘発を実施した。以下のPCR反応を実施するために、4種のオリゴヌクレオチドプライマー、AS671からAS674(表1を参照)を用いた。1及び2のPCR反応において、テンプレートDNAは、pDEST12.2発現ベクターにクローン化された完全長野生型エリスロポエチンcDNA(Invitrogen、カタログ番号11808011)であった。反応1では、図8に示された配列のN末端部分を増幅するために、プライマーAS671及びAS674が用いられ;反応2では、図8に示された配列のC末端部分を増幅するために、プライマーAS672及びAS673が用いられた。双方の場合とも、反応混合物は、1×PCR緩衝液、0.2mMの各dNTP、0.5mMの各PCRプライマー、50ngのテンプレートDNAを含有するように設定し、反応は、5UのPfuTurbo(Stratagene)の添加により開始させた。サイクリング条件は、95℃2分間(1サイクル);95℃15秒間、50℃30秒間、72℃70秒間(25サイクル);75℃7分間(1サイクル)であった。PCRの効率及び収率を推定するために、0.8%アガロースゲル中電気泳動により、各PCR反応物のアリコートを分析した。第3のPCR反応において、反応1及び2の等モル量の重複産物を共に混合し、PCRプライマーAS671及びAS672の存在下、増幅して、完全長の0.9kb断片を作出した。反応1及び2に関し、PCR反応条件は上記のとおりであった。精製PCR反応物のアリコートを、製造元により供給された酵素緩衝液を用い、37℃で2時間、NdeI(New England Biolabs)により消化した。並行して、適切な量のpDEST12.2発現ベクターを、NdeIにより消化した。消化されたベクター及び挿入体を各々、0.8%アガロースゲル上で分離し、対応する断片を切除し、Wizard Cleanup System(Promega)を用い、製造元により提供されたプロトコルに従って精製した。精製したベクターDNA及びPCR産物を、1:3のモル比で混合し、2.5容量のエタノールの添加により、−20℃で一晩沈殿させた。沈殿したDNAを、遠心分離により回収し、70%エタノール中で洗浄し、減圧乾燥し、Rapid Ligation Kit(Roche Diagnostics)を用い、製造元によって供給されたプロトコルに従って、最終容量10μlにおいて結合させた。
Biorobot 8000ロボットシステム(Qiagen)又はWizard Plus SV Miniprepsキット(Promega、カタログ番号:1460)を用い、製造元の指示に従って、5mlの培養物からミニプレッププラスミドDNAを調製した。プラスミドDNAを、80μlの滅菌水中に溶出させた。Eppendorf BO光度計又はSpectramax190光度計(Molecular Devices)を用いて、DNA濃度を測定した。
成熟タンパク質の7位における遊離システイン残基がセリンに置換されているヒト遺伝子EPO(本明細書において、その成熟形態において、EPOvC34S及びEPOvmC34Sと称される)のエキソン1、2、及びエキソン3の最初の2つのアミノ酸によってコードされた、EPOの切断変異体のクローニング
完全長エリスロポエチンを切断してEPOvm変異体を作出した1つの結果は、完全長分子において通常は対になっている、成熟タンパク質の7位(EPOvの34位)におけるシステイン残基が、遊離のままであり、したがって、分子間対合に利用し得ることである。したがって、この小型ペプチド断片の凝集の問題が生じる可能性を回避するために、オリゴヌクレオチド特異的変異誘発により、誘導体C34Sが構築された。
Biorobot 8000ロボットシステム(Qiagen)又はWizard Plus SV Miniprepsキット(Promega、カタログ番号:1460)を用い、製造元の指示に従って、5mlの培養物からミニプレッププラスミドDNAを調製した。プラスミドDNAを、80μlの滅菌水中に溶出させた。Eppendorf BO光度計又はSpectramax190光度計(Molecular Devices)を用いて、DNA濃度を測定した。
本発明のEPOポリペプチド及び変異体の生物活性
本発明のポリペプチドの生物活性は、当業界にそれ自体知られているいくつかの生物学的アッセイを用いて検証できる。
EPO受容体へのEPO結合のスキャッチャード解析は、例えば、Nagao Mら、Blood.1993年;81(10):2503〜10頁におけるものなど、当業界に十分記載されている。
JAK2のチロシンリン酸化を試験するための種々の試験が当業界に記載されており、これらの技法は当業者に知られている。例えば、エリスロポエチン受容体発現細胞における本発明のポリペプチドによるJAK2のチロシンリン酸化の誘導は、Cell.1993年;74(2):227〜36頁におけるWitthuhn BAらによって開示されている試験によって試験することができる。
10.3.1 ヒトエリスロポエチン細胞系TF−1を用いた細胞ベースの増殖アッセイ:
この目的のため、試験すべき少量のポリペプチドを、例えば、実施例2、4又は6に記載された方法に従って作出する。次いで、エリスロポエチン受容体を発現し、増殖のためにIL−3、GM−CSF又はEPOに依存性である(Hammerling,U.ら、J.Pharma.Biomed.Anal.12:1455〜69頁(1996))ヒトエリスロポエチン細胞系TF−1を用いて、該タンパク質を、生物学的応答を誘発するその能力に関して試験する。この因子依存性細胞系を用いた細胞ベースの増殖アッセイを、エリスロポエチンのインビトロ生物活性測定のための工業標準として用いる(Kitamura,T.ら、J:Cell Physiol.140:323(1989))。このアッセイは極めて鋭敏であり、極めて少量の生物活性タンパク質を検出することができる。このアッセイのさらなる利点は、純粋なタンパク質を得るために大規模な精製法を使用せずに、本発明の修飾エリスロポエチン分子を発現する細胞培養物からの未精製の上澄み液を、生物活性の試験に使用できることである。類似タンパク質各々の活性を野生型タンパク質の活性と比較して、市販のELISAキットを用いて必要な定量化を行うことができる。
Ba/F3−EpoR細胞の増殖を測定することにより、本発明のポリペプチドの生物活性を評価できる。この目的のために、ヒトEPO受容体(EpoR)の全コード配列に対応するDNA断片をPCRによって得て、チミジンキナーゼ(tk)−ネオマーカーを含有する発現ベクターにクローン化する。制限酵素による消化によって線形化した後、該ベクター構築体を、Ba/F3(末梢血から確立したIL−3依存性マウスプロB細胞系;Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH(DSMZ、ブラウンシュバイク、ドイツ国)で参照番号ACC300でアクセス可能)内に導入する。2mg/mlのG418中、EpoR構築体を発現するネオマイシン耐性細胞を選択し、限界希釈により個々のクローンを得る。Ba/F3−EpoR細胞の増殖刺激を測定する生物学的アッセイにおいて、EpoRを発現するクローンを、組換えヒトEPO(rhEPO)(Amgen)又は試験される本発明のポリペプチドに対するそれらの応答に関して解析する。rhEPO及び試験される本発明のポリペプチドそれぞれに応答してのBa/F3−EpoR細胞の増殖刺激を、細胞DNA内への[3H]−チミジンの組込みの程度によって測定する。細胞は始め、16時間、IL−3飢餓とし、引き続き、rhEPO又は試験される本発明のポリペプチドを含有する培地中、25,000細胞/ウェルの密度で、96ウェルプレート内に接種する。22時間のインキュベーション後、[3H]−チミジン/ウェルの1μCiを該ウェルに加え、該細胞をさらに6時間インキュベートしてから採集する。例えば、Top Count Counter(Packard Instruments)を用いて、40μlのシンチレーション液(例えば、icroscint 20)の存在下、細胞組込み放射活性を判定する。Ba/F3−EpoR細胞内トリチウム化チミジンの組込み刺激における本発明のポリペプチドの効率を、rhEpoによる刺激の効率と比較できる。
Liら(Li X、Gnias SL、Campana WM.Glia.第51巻(4):254〜65頁)は、シュワン細胞がEpo受容体を発現することを示している。本明細書下記のとおり、BrdU組込みの判定により、本発明のポリペプチドの生物活性を評価できる。
シュワン細胞を、Hiraiwaら(Hiraiwa Mら、1997年、Proc Natl Acad Sci USA 94:4778〜4781頁)及びCampanaら(Campana WMら、1998年、FASEB J 12:307〜314頁)によって記載されたとおり1日齢のSDラットの坐骨神経から単離する。シュワン細胞をさらに、抗フィブロネクチン抗体及びウサギ補体を用いて、線維芽細胞から分離する。これにより、S−100免疫蛍光によって評価できるとおり、およそ99%純粋なシュワン細胞培養物が生じる。10%ウシ胎仔血清(FBS)、100U/mlのペニシリン、100mg/mlのストレプトマイシン、21mg/mlのウシ下垂体抽出物及び4mMのホルスコリン(完全培地)を含有するDMEM中で一次シュワン細胞を維持し、加湿5.0%CO2下、37℃でインキュベートする。該培養物を確立後、シュワン細胞を3〜4回継代することにより増殖させる。
シュワン細胞を、完全培地中、96ウェルプレート内に、1ウェル当たり5,000細胞で塗布する。細胞を一晩付着させてから、洗浄し、引き続き、rhEpo又は試験される本発明のポリペプチドと共に、又はそれなしで、DMEM中、1%FBSと共に、37℃で24時間培養する。増殖対照として、完全培地(ウシ下垂体抽出物、BPEを含有)を用いる。次いで、Cell Proliferation ELISA キット(Roche Applied Science、インジアナポリス、インジアナ州)を用い、S期の間のDNA合成の指標として、BrdU組込みを測定する。24時間のrhEpo又は試験される本発明のポリペプチド処理時間の最後の20時間、BrdUを加える。
正常赤血球マウスバイオアッセイは当業界に知られており(Pharm.Europa Spec.Issue Erythropoietin Brp Bio、1997年(2))、方法は、Ph.Eur.BRPのエリスロポエチンのモノグラフにおいて知られている。7〜15週齢の正常な健康マウスに、BSA−PBS溶液中、0.2mlの被験ポリペプチド又は対照としての緩衝液を、皮下投与する。6日間にわたって、尾部静脈の穿刺により血液を採取し、0.15μモルのアクリジンオレンジ染色液の1ml中に1μlの血液が存在するように、希釈する。染色時間は3分から10分である。赤色蛍光ヒストグラムの解析により、フローサイトメーターにおいて、マイクロ蛍光定量的に網状赤血球のカウントを実施する。網状赤血球カウントは、絶対数によって与えられる(分析される30,000個の血球当たり)。
本発明のポリペプチドの生物活性は、ヒト骨髄細胞からの赤血球コロニーの産生を刺激する本発明のポリペプチドの能力を測定することによって評価できる。
本発明のポリペプチドの生物活性は、骨髄細胞の培養液中の未成熟及び成熟赤血球細胞の形成を刺激する本発明のポリペプチドの能力を測定することによって評価することができる。CF、50ng/mlのキットリガンド(KL)及び50ng/mLのrhEpo(Amgen)又は本発明の被験ポリペプチドの存在下、IMDM/10%FCS中、上記のとおり単離した20,000個のCD34+細胞を培養する。培養細胞の7〜10インチのプレートを血球計数器によりカウントし、引き続き、赤血球細胞表面マーカーCD36、CD71及びグリコホリンAの発現に関してアッセイする。その結果により、骨髄培養液中の未成熟及び成熟赤血球細胞の形成を刺激する本発明のポリペプチドの能力を判定することが可能となる。
本発明のポリペプチドの生物活性は、本発明のポリペプチドで処置した哺乳動物の血圧を、非処置対象と比較して測定することによって試験することができる。このような哺乳動物は、例えば、マウス、ラット、ウサギ、イヌ、ウシ又はサル(例えば、チンパンジー)であり得る。これらの哺乳動物の血圧を測定する種々の方法は当業者によく知られている。
本発明のポリペプチドの生物活性は、本発明のポリペプチドで処置した哺乳動物のヘマトクリットレベルを、非処置対象と比較して測定することによって試験することができる。このような哺乳動物は、例えば、マウス、ラット、ウサギ、イヌ、ウシ又はサル(例えば、チンパンジー)であり得る。
10.9.1 神経保護活性のインビボ試験:
本発明のポリペプチドの神経保護活性は、例えば、大脳中央動脈閉鎖モデルにおいて試験できる。体重250gのオスSDラットを、Morishita,E.ら、1997年、Neuroscience 76、105〜116頁に記載されているとおり、60分の可逆的虚血により生じた極めて広い境界域内の狭いコア損傷部からなる中央脳動脈閉鎖に供する。該動物は、閉鎖の時点で、本発明の被験ポリペプチド、陽性対照としての組換え野生型ヒトEPO(rhEPO)(5,000ユニット/kg体重)又は陰性対照としての生理食塩水のいずれかを、腹腔内注射により投与される。製造元のプロトコル(In Situ Cell Death Detection Kit、Roche Diagnostics)に従って、該脳を24時間後に取り出し、連続切片とし(厚さ50nm)、メタノール中3%H2O2中で10分間ブロックし、4℃で0.1%トリトンX−100/クエン酸ナトリウム中で2分間透過化処理し、TUNEL反応混合物によって処理する。展開後に陽性ニューロンを同定する(ジアミノベンジジン中30分、脱水、及びカバーガラス化)。陰性対照として、末端トランスフェラーゼを除外する。
脱髄性疾患、例えば、本明細書上記で特定した多発性硬化症(MS)又はギラン−バレ症候群の治療における本発明のポリペプチドの有用性は、例えば、本発明後記の方法に従って、動物試験法において実証することができる。多発性硬化症の最も広く使用されている動物モデルは、ヒト疾患と共有された組織病理学的及び臨床的特徴に基づいた実験的自己免疫性脳脊髄炎(EAE)である。
本発明のポリペプチドの神経保護活性は、例えば、Siren ALら(Proc Natl Acad Sci USA.2001年、98(7):4044〜9頁)によって記載された培養物中に一次運動神経を用いることによって、インビトロで試験できる。15日齢のSDラット胚から脊髄を得る。前角をトリプシン処理し、4%BSAクッションにより、300×gで10分間遠心分離する。細胞(混合神経膠培養物を表す)を、ポリ−DL−オルニチン及びラミニンでプレコートした24mmのウェルプレートに、2,000細胞/cm2の密度で接種する。運動神経を、免疫パニングによりさらに精製し(Mettling,C.ら、1995年、J.Neurosci.15、3128〜3137頁によって記載されているとおり)、細胞を、ポリ−DL−オルニチン及びラミニンでプレコートし、完全培養培地(Neurobasaly/B27(2%)/0.5mMのL−グルタミン/2%ウマ血清/25μMの2−メルカプトエタノール/25μMのグルタメート/1%ペニシリン及びストレプトマイシン/1ng/mlのBDNF)を含有する24mmのウェルプレートに、低密度(20,000細胞/cm2)で接種する。この培地(グルタメートなし)を、4日目と6日目、培養液に再添加する。48時間の血清/BDNF欠乏により、又は48時間のカイニン酸(混合ニューロン/グリア培養物では5μM;精製培養物では50μM)とのインキュベーションにより、培養物において、6日目に細胞死を誘導する。本発明の被験ポリペプチド、又は陽性対照としてのrhEPO(10ユニット/ml)又は陰性対照としての媒体を、細胞死誘導の72時間前に、該培養物に添加し、処置を48時間継続する。次いで、該培地を廃棄し、細胞を、PBS中、4%(容量/容量)パラホルムアルデヒドにより40分間固定し、0.2%トリトンX−100により透過化処理し、PBS中、10%(容量/容量)FCSによりブロックし、非リン酸化神経フィラメントに対する抗体(SMI−32;1:9,000)と共に一晩インキュベートし、ジアミノベンジジンによるアビジン−ビオチン法を用いることによって可視化する。運動神経の生存度を、カバーガラスの4つの側面にわたってSMI−32陽性細胞をカウントすることによって、形態学的に評価する。H33258を用いることによって(Galli,G & Fratelli,M.(1993)Exp.Cell Res.204、54〜60頁に記載されているとおり)アポトーシス体の染色を行う。
インビトロ及びインビボ双方でのポリペプチドの心臓保護活性を試験するための種々の試験が当業界に記載されており、これらの技法は当業者に知られている。このような技法の例は、本明細書下記に、及び参照として組み込まれている引用文献に記載されている。
本発明のポリペプチドの心臓保護活性は、例えば、以下のモデルにおいて試験することができる。記載されているとおり(Fiordaliso,F.ら、(2001)Diabetes 50、2363〜2375頁及びLeri,A.ら、(1998)J.Clin.Invest.101、1326〜1342頁)、3カ月齢のオスSDラットから左心室の心筋細胞を単離する。簡単に述べると、抱水クロラール麻酔下(300mg/kg体重)、心臓を切除し、コラゲナーゼにより心筋細胞を分離する。心筋細胞(98〜99%純粋)を、0.5μg/cm2のラミニンでコーティングしたペトリ皿に、1cm2当たり2×104細胞の密度で塗布する。非必須アミノ酸、トランスフェリン(10μg/ml)、BSA(0.1%)、及び抗生物質を有する修飾イーグル培地(MEM)からなる無血清培地中で、細胞をインキュベートする。非結合心筋細胞を除去するために、この培地を塗布30分後、新たな培地に交換する。窒素を継続的にフラッシュさせた気密チャンバー内に曝すことにより、低酸素条件を作り出し、28時間維持する。この操作により、該培地中の酸素圧は5mmHg(約=通常の3%;1mmHg=133Pa)に低下する。低酸素状態は28時間維持される。本発明の被験ポリペプチド又は陽性対照としてのrhEPO(100ng/ml)、Hepes(20mM)、又は双方を、低酸素誘導の30分前に該培地に加える。長時間低酸素により生じたアシドーシスを補正するためにHepesが用いられる。
オスSDラット(約250g)を、抱水クロラール(150mg/kg、腹腔内)及びジエチルエーテルで麻酔し、気管内カニューレにより人工呼吸にかける(1分当たり61呼吸、1回呼吸量1.2ml/100gの体重)。第5肋間空間における15mmの開口部を通して、心臓を外部に出した後、左前下降冠状動脈(LAD)を、5−S絹縫合糸に結さつする。2つの縫合糸上にプレインノットを結び、30分後にそれを除去して、再潅流を開始させる。胸部を陰圧下で閉鎖し、継続的な心電図モニタリング下で、ラットを人工呼吸器から外す。心室転位症及び心筋の白化の発現により虚血が確認される。通常の潮紅により再潅流の成功が示される。偽操作のラットは、同一の外科手術操作を受けるが、LADの結さつは行わない。虚血の誘導(処置前)前、又は再潅流時(処置後)のいずれかに、本発明の被験ポリペプチド又は陽性対照としてのrhEPO(5,000ユニット/kg体重)を腹腔内投与する。各動物が、試験完了まで、本発明の被験ポリペプチド又はrhEPOの追加用量を毎日投与される。
癌細胞の増殖を刺激するポリペプチドの能力を試験するためのインビトロ及びインビボモデルは、当業界によく知られている。例えば、試験される癌に由来する1つ以上の細胞系の増殖を、当業界によく知られた種々の技法を用いて、インビトロで測定することができる。このような技法としては、例えば、[3H]−チミジンの組込み、MTT細胞増殖アッセイ、細胞数のカウントが挙げられる。
本発明のEPOv1、EPOv2、EPOv3及びEPOvの神経保護活性
Epo変異体の神経保護効果を、「Fast Track(高速追跡)」によるタンパク質送達後、マウス坐骨神経圧潰モデルを用いて試験した。EPOv1、EPOv2、EPOv3及びEPOvをコードするcDNAを、発現ベクターpDEST12.12内にクローン化又はサブクローン化した。Fast Track操作において、発現ベクターpDEST12.12内にクローン化したcDNAを、レシピエントマウスの筋肉内に電気穿孔し、コードされたタンパク質を、該筋肉の細胞によって発現させ、宿主マウスの循環内に分泌させる。これらの実験において、各cDNAを6匹のマウスに電気穿孔し、観察結果の統計的有意性を提供した。電気穿孔後、赤血球容量(ヘマトクリット)及びひ腹筋における複合筋活動電位(CMAP)測定値に及ぼす効果をモニターした。
原Fast Trackプロトコルにおいて、cDNAの電気穿孔部位として、ひ腹筋を用いた。しかし、坐骨神経圧潰モデルにおいて、ひ腹筋を用いた電気筋運動記録読取り(EMG)も実施されるため、電気生理学的読取りを妨害しないように、他の電気穿孔部位を試験した。これらの試験の結果、前肢上部の筋肉を選択して、本明細書に記載の実験に用いた。神経圧潰の4日前の0日目に、6匹のメスC57BL/6マウス(Elevage Janvier)の群を、イソフラン(イソフランBaxter、照会番号:ZDG9623)により麻酔し、右前肢への最初の電気穿孔を、以下のとおり実施した:0.9%NaCl、6mg/mlのL−グルタメート(Sigma、照会番号:P4761)中、cDNAを2mg/mlで調製した。電気穿孔前に、25μlのヒアルラニダーゼ(100U/ml)を、20分後に25μl(50mg)のcDNAを筋肉内に注射した。超音波検査ゲルを適用し、筋肉を、ElectroSquarePorator BTX(照会番号:ECM830)の2つの円形電極(直径0.5mm)間に保持した。75ボルトの電場を20ミリ秒加え、これを、各パルス間1秒の間隔で10回繰り返した。
メスマウス(C57BL/6マウス、Elevage Janvier)を、イソフルランで麻酔し、体温をチェックした。コッヒャー鉗子を用いて右坐骨神経を圧潰した(2×30秒)。圧潰の7日後及び14日後、電気筋運動記録パラメーター、即ち、振幅、潜伏時間及び持続時間を、Medtronicの装置(Keypointモデル)を用いて評価した。過最大強度(12.8mA)での坐骨神経の単一0.2ミリ秒刺激後に、複合筋活動電位(CMAP)を、ひ腹筋において測定した。振幅(mV)は、活性運動単位数に関連し、軸索変性により影響される。潜伏時間(ミリ秒)は、運動神経伝導及び神経筋伝達速度に関連し、脱髄に影響される。持続時間(1つの脱分極/再分極サイクルに必要な時間)は、電導の定性的指数であり、やはり脱髄によって影響される。
エリスロポエチン及びEPO変異体によって最も改善され易いCMAPパラメーターは潜伏時間である。図9に示された実験で、すべてのEPO変異体は、潜伏時間において、野生型タンパク質の活性に比較して、統計的に有意な改善を示す。他方、ベクター単独も、非関連タンパク質IL4の発現も、潜伏時間に正の効果を示さない。興味深いことに、すべての変異体に共通のエリスロポエチンのN末端の28個のアミノ酸だけを発現するEpovは、野生型タンパク質と同様に活性であり、すべての神経保護活性がこの配列(図7及び配列番号13を参照)内に包含されていることを示唆している。
ヘマトクリット濃度に及ぼす本発明のEPOv1、EPOv2、EPOv3及びEPOvの効果
実施例11に記載されたFast Trackプロトコルに従って処置されたマウスのヘマトクリット濃度を測定した。
血液サンプルをヘパリン化ガラス毛細管に移し、CritSpin遠心分離管中、16000rpmで120秒間遠心分離する。ヘマトクリット読取りは、サンプルの総容量のパーセンテージとして表される沈降赤血球容量として行われる。
図10に示された結果から、野生型エリスロポエチンのみが造血経路を活性化でき、一方、Epo変異体(EPOv1、EPOv2、EPOv3及びEPOv)のいずれも赤血球カウントに影響を及ぼさないことが結論付けられる。
ヒト赤白血病細胞系TF−1を用いた細胞ベースの増殖アッセイ:
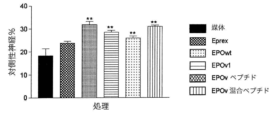
TF−1(ATCC#CRL−2003)は、生存及び増殖のために、GM−CSFなどのサイトカインの存在に依存することが知られている赤白血病細胞系である。TF−1細胞増殖に及ぼすエリスロポエチンの効果を調べるために試験を行った。図11において、rEPOwtm(実施例2と同様のプロトコルに従って得られた、Hisタグ化した組換え野生型EPO)及びrEPOvlm(実施例2に記載されたとおりに得られた、Hisタグ化した組換えEPOvlm)の効果を、市販製品、Eprexの活性と比較した。その結果は、1ng/mlでのGM−CSFは、およそ20時間の培養倍増時間で細胞増殖を支持することができる一方、市販のエリスロポエチン(Eprex1000)は、0.2U/ml(1.7ng/ml)以上の濃度でTF−1細胞の用量依存的生存を示すが、増殖は示さないこと(上枠)を示している。組換えEPOwtm−6Hisタンパク質は、Eprex(中央の枠)の活性と同一の活性を示す。他方、EPOvlmは、170ng/mlで部分的保護を示すが、より低用量(下枠)では保護を示さない。この赤血球細胞系においてアッセイされたEPOvlmの活性は、完全長EPOwtmの活性のおよそ1%であることが結論付けられる。この活性低下は、ヘマトクリットアッセイにおいて活性の減少を示すインビボデータ(図10)と一致する。
本発明のEPOv1及びEPOvの神経保護活性
坐骨神経圧潰の回復に及ぼすEPOwt及びEPO変異タンパク質の皮下注射の効果を試験した。
図12に示されているとおり、精製EPOv1及びEPOvの注射は双方とも、潜伏時間パラメーターに関して、野生型タンパク質と同等の活性を示すが、媒体だけの注射後には効果が見られなかった。Fast Track実験で先に判明したとおり、持続時間及び振幅に及ぼす効果の明白さはより少ない。
圧潰後の坐骨神経のMBP含量に及ぼすEPOwt及びEPO変異タンパク質の効果
CMAPに及ぼすEPO及びEPO変異体の観察された主な効果は、髄鞘形成の程度に大きく影響される潜伏時間に対するものであるため、電気生理学的読取りと、髄鞘の再生において生じる生化学的変化との関連付けに努めた。これを行うために、坐骨神経におけるミエリン塩基性タンパク質(MBP)の濃度を判定するための新規な方法が開発された。坐骨神経切開後、圧潰部位はより厚い瘢痕組織として容易に確認できるが、MBP測定のために、それを回避することにした。したがって、各動物に関して、圧潰部位と遠位の圧潰神経のおよそ2mmのセクションを、対側神経の対応するセクションと共に除去した。切開した神経セクションを、ドライアイス上に保持した96ウェルの丸底細胞培養皿に移した。抽出のため、20μlの10%SDSを加え、該プレートを、4×10秒パルスを用いレベル5に出力を設定したX2020マイクロタイタープレート超音波処理器(Misonix社)において超音波処理した。次いで、180μlのTrizol(Invitrogen)を添加し、室温で1時間インキュベーションすることによって、各サンプルを抽出した。該マイクロタイタープレートを、出力設定7で上記のとおり再超音波処理し、各ウェルの内容物を、エッペンドルフ管に移した。該管に50μlのクロロホルムを添加後、激しくボルテックスし、14Krpmで10m、遠心分離することによって相を分離させた。ペレット化した不溶物質を乱すことなく、下部の有機相を慎重に除去し、5容量のアセトンを加え、室温で1時間インキュベーションすることによって該タンパク質を沈殿させる。沈殿したタンパク質を、遠心分離によって採集し、70%エタノール中で洗浄し、減圧下遠心分離により簡単に乾燥させた。ペレットは、0.2%SDS、140mMのNaCl、50mMのトリス pH8.0中、4℃で一晩、続いて95℃で10mインキュベートすることによって可溶化した。次いで、50μlの2%NP40、1%デオキシコレート、140mMのNaCl、50mMのトリス pH8.0をさらに添加して、MBP Elisaに用いるトリプルディタージャント緩衝液を再構成した。
BCAタンパク質アッセイ(Pierce)を用い、製造元により推奨された操作に従って、各サンプル中のタンパク質濃度を判定した。すべてのサンプルを同一のタンパク質濃度に希釈し、各サンプルの連続希釈のMBP含量を、酵素結合免疫吸着アッセイ(ELISA)によって判定した。Elisaのために、96ウェルプレート(Nunc Immunoplate、#439545)を、PBS中1:5000に希釈した抗MBPモノクローナル抗体(Mab382、Chemicon)で一晩コーティングした。プレートを空にし、PBS中、0.1%BSA(Sigma、A9647)でブロックした。Triple Detergent緩衝液(1%NP40、0.5%ジオキシコレート、0.1%SDS、140mMのNaCl、50mMのトリス pH8.0)中、神経抽出物の連続希釈液を、コーティングしたウェルに加え、ロッカープラットホーム上、室温で2時間インキュベートした。検量標品として、精製マウスMBP(Invitrogen、13228−010)の連続希釈液をプレート中に入れた。インキュベーション後、該ウェルを、0.5%ツウィーン20を含有するPBSで3回洗浄し、検出抗体、PBS0.1%BSA中1:300に希釈したウサギ抗MBPポリクローナル抗体(Zymed 18−0038)を加え、ロッカープラットホーム上で2時間インキュベートした。該検出抗体を除去し、ウェルを、上記のとおり、PBS、ツウィーン20中、再度洗浄した。PBS 0.1%BSA中、1:10,000に希釈したビオチン化ヤギ抗ウサギポリクローナル(Vector、BA−1000)を1時間加え、ウェルを上記のとおり洗浄し、1:8000に希釈したストレプトアビジン−HRP(Amersham、RPN1051V)を加えた。1時間後、ウェルを、上記のとおり、PBS、ツウィーン20中、3回洗浄し、Sigmafast OPD(Sigma、P9187)と共に、室温で30分間インキュベーションすることにより、シグナルを展開させた。この時間の最後に、等容量の2M H2SO4の添加により反応を停止させ、該プレートを492nmにおいて読み取った。
上記のとおり判定された坐骨神経のMBP含量は、各群内の標準偏差の小ささにより判断して再現性が高かった。正常な媒体処置坐骨神経においては、MBPは総抽出タンパク質のおよそ5%であるが、圧潰された媒体処置坐骨神経の遠位セクションでは、圧潰16日後、MBPは、総抽出タンパク質のおよそ1%である。EPOwtm、EPOvlm又はEPOvm C34Sで処置された群はすべて、媒体処置群に比較して、圧潰神経におけるMBPの濃度の増加を示す。本発明に記載されたEPOwt及びEPO変異体は、MBP産生を刺激することができ、これは恐らく、坐骨神経圧潰後のミエリン再生の改善を反映していると思われる。このように、CMAP読取りにより判定されるEPOwt及びEPO変異体の電気生理学的結果は、MBPの増加に関連しており、したがって、恐らくミエリン含量に関連していると思われる。
Claims (43)
- 哺乳動物において実質的にヘマトクリットレベルを増加させることなく、前記哺乳動物、特にヒトにおける組織保護活性を有する単離エリスロポエチン変異ポリペプチド。
- a)アミノ酸56から193までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
b)アミノ酸1から27までの欠失及びアミノ酸56から193までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
c)配列番号13に示された配列を含むポリペプチド又は;
d)配列番号13のアミノ酸28から55に示された配列を含むポリペプチド又は;
e)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドを含むポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
f)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドを含むポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
g)84位、96位、113位、115位、116位又は141位に少なくとも1つの追加N−結合グリコシル化部位を含むことにより、a)、b)、c)、d)、e)又はf)とはまったく異なるポリペプチドを含むポリペプチドであって、前記位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド
からなる群から選択される請求項1に記載の単離ポリペプチド。 - a)アミノ酸56から193までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドからなるポリペプチド又は;
b)アミノ酸1から27までの欠失及びアミノ酸56から193までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドからなるポリペプチド又は;
c)配列番号13に示された配列からなるポリペプチド又は;
d)配列番号13のアミノ酸28から55に示された配列からなるポリペプチド又は;
e)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドからなるポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
f)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドからなるポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
g)84位、96位、113位、115位、116位又は141位に少なくとも1つの追加のN−結合グリコシル化部位を含むことにより、a)、b)、c)、d)、e)又はf)とはまったく異なるポリペプチドからなるポリペプチドであって、前記位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
h)a)、b)、c)、d)、e)、f)又はg)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドを含むポリペプチド又は;
i)a)、b)、c)、d)、e)、f)又はg)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドからなるポリペプチド
からなる群から選択される請求項1に記載の単離ポリペプチド。 - a)配列番号3のアミノ酸54(トレオニン)から82(グルタミン酸)までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
b)配列番号3のアミノ酸54(トレオニン)から82(グルタミン酸)までの少なくとも1つの欠失及びアミノ酸1から27までの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
c)配列番号4に示された配列を含むポリペプチド又は;
d)配列番号4のアミノ酸28から164に示された配列を含むポリペプチド又は;
e)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドを含むポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
f)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドを含むポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
g)84位、96位、113位、115位、116位又は141位に少なくとも1つの追加のN−結合グリコシル化部位を含むことにより、a)、b)、c)、d)、e)又はf)とはまったく異なるポリペプチドを含むポリペプチドであって、前記位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド
からなる群から選択される請求項1に記載の単離ポリペプチド。 - a)配列番号3のアミノ酸54(トレオニン)から82(グルタミン酸)までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
b)配列番号3のアミノ酸54(トレオニン)から82(グルタミン酸)までの少なくとも1つの欠失及びアミノ酸1から27までの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
c)配列番号4に示された配列からなるポリペプチド又は;
d)配列番号4のアミノ酸28から164に示された配列からなるポリペプチド又は;
e)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とは異なるポリペプチドからなるポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
f)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドからなるポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
g)84位、96位、113位、115位、116位又は141位に少なくとも1つの追加のN−結合グリコシル化部位を含むことにより、a)、b)、c)、d)、又はe)とは異なるポリペプチドからなるポリペプチドであって、前記位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
h)a)、b)、c)、d)、e)、f)又はg)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドを含むポリペプチド又は;
i)a)、b)、c)、d)、e)、f)又はg)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドからなるポリペプチド
からなる群から選択される請求項1に記載のポリペプチド。 - a)配列番号3のアミノ酸54(トレオニン)から142(グルタミン)までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
b)配列番号3のアミノ酸54(トレオニン)から142(グルタミン)までの少なくとも1つの欠失及びアミノ酸1から27までの欠失により、配列番号3に示された配列とは異なるポリペプチドを含むポリペプチド又は;
c)配列番号6に示された配列を含むポリペプチド又は;
d)配列番号6のアミノ酸28から104に示された配列を含むポリペプチド又は;
e)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドを含むポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
f)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドを含むポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
g)84位、96位、113位、115位、116位又は141位に少なくとも1つの追加のN−結合グリコシル化部位を含むことにより、a)、b)、c)、d)、e)又はf)とはまったく異なるポリペプチドを含むポリペプチドであって、前記位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド
からなる群から選択される請求項1に記載の単離ポリペプチド。 - a)配列番号3のアミノ酸54(トレオニン)から142(グルタミン)までの少なくとも1つの欠失により、配列番号3に示された配列とは異なるポリペプチドからなるポリペプチド又は;
b)配列番号3のアミノ酸54(トレオニン)から142(グルタミン)までの少なくとも1つの欠失及びアミノ酸1から27までの欠失により、配列番号3に示された配列とは異なるポリペプチドからなるポリペプチド又は;
c)配列番号6に示された配列からなるポリペプチド又は;
d)配列番号6のアミノ酸28から104に示された配列からなるポリペプチド又は;
e)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とは異なるポリペプチドを含むポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
f)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)、b)、c)又はd)とはまったく異なるポリペプチドからなるポリペプチドであって、前記変異の位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド又は;
g)84位、96位、113位、115位、116位又は141位に少なくとも1つの追加のN−結合グリコシル化部位を含むことにより、a)、b)、c)、d)、e)又はf)とは異なるポリペプチドを含むポリペプチドであって、前記位置が、配列番号3のアミノ酸の位置に関して規定されるポリペプチド;
h)a)、b)、c)、d)、e)、f)又はg)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドを含むポリペプチド又は;
i)a)、b)、c)、d)、e)、f)又はg)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドからなるポリペプチド
からなる群から選択される請求項1に記載のポリペプチド。 - a)配列番号8に示された配列を含むポリペプチド又は;
b)配列番号8と少なくとも75%のアミノ酸配列同一性を有する配列を含むポリペプチド
からなる群から選択される単離ポリペプチド。 - a)配列番号9に示された配列を含むポリペプチド又は;
b)配列番号9のアミノ酸28から154に示された配列を含むポリペプチド又は;
c)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)又はb)とはまったく異なるポリペプチドを含むポリペプチド又は;
d)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)又はb)とはまったく異なるポリペプチドを含むポリペプチド又は;
e)57位、78位、79位、80位、82位、84位、96位、113位、115位、116位又は141位に少なくとも1つの追加のN結合グリコシル化部位を含むことにより、a)、b)、c)又はd)とはまったく異なるポリペプチドを含むポリペプチド;
f)a)、b)、c)、d)又はe)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドを含むポリペプチド
からなる群から選択される請求項1に記載のポリペプチド。 - a)配列番号8からなるポリペプチド又は;
b)配列番号8と少なくとも75%のアミノ酸配列同一性を有するポリペプチドからなるポリペプチド
からなる群から選択される請求項8に記載のポリペプチド。 - a)配列番号9からなるポリペプチド又は;
b)配列番号9のアミノ酸28から154に示された配列からなるポリペプチド又は;
c)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)又はb)とは異なるポリペプチドからなるポリペプチド又は;
d)
からなる群から選択される1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ又は10の変異により、a)又はb)とはまったく異なるポリペプチドからなるポリペプチド又は;
e)57位、78位、79位、80位、82位、84位、96位、113位、115位、116位又は141位に少なくとも1つの追加のN−結合グリコシル化部位を含むことにより、a)、b)、c)又はd)とは異なるポリペプチドからなるポリペプチド;
f)a)、b)、c)、d)又はe)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドを含むポリペプチド又は;
g)a)、b)、c)、d)又はe)のポリペプチドと少なくとも80%のアミノ酸配列同一性を有するポリペプチドからなるポリペプチド
からなる群から選択される請求項1に記載のポリペプチド。 - 追加のアミノ酸ドメインに作動可能に結合した請求項1から11までのいずれか一項に記載のポリペプチドを含む融合タンパク質。
- 前記ポリペプチドが、GST配列、Hisタグ配列、多量体化ドメイン、免疫グロブリン分子の定常領域又はヒト柔毛膜性生殖腺刺激ホルモン(hCG)などのヘテロ二量体タンパク質ホルモンに作動可能に結合した請求項12に記載の融合タンパク質。
- 請求項1から13までのいずれか一項に記載のポリペプチドをコードする単離核酸分子。
- cDNA分子である請求項14に記載の単離核酸分子。
- 請求項14から16までのいずれか一項に記載の核酸分子を含むベクター。
- 請求項14から16までのいずれか一項に記載の核酸分子又は請求項17に記載のベクターを含む組換え宿主細胞。
- 原核細胞又は真核細胞である請求項18に記載の宿主細胞。
- 請求項1から13までのいずれか一項に記載のポリペプチドを産生する方法であって、請求項18又は19に記載の組換え宿主細胞を核酸分子の発現を可能にする条件下で培養すること、及び産生されたポリペプチドを回収することを含む方法。
- 活性な結合体又は複合体の形態である請求項1から13までのいずれか一項に記載のポリペプチド。
- ペグ化された請求項21に記載のポリペプチド。
- 請求項1から13までのいずれか一項に記載のポリペプチドに選択的に結合する抗体、又はその断片若しくは誘導体。
- モノクローナル抗体、又はその断片若しくは誘導体である請求項23に記載の抗体。
- ヒト若しくはヒト化抗体、又はその断片若しくは誘導体である請求項23又は24に記載の抗体。
- 非相同部分に結合した請求項23から25までのいずれか一項に記載の抗体を含む免疫結合体。
- 薬剤として使用するための、請求項1から13まで又は請求項21若しくは22のいずれか一項に記載のポリペプチド。
- 請求項1から13まで又は請求項21若しくは22のいずれか一項に記載のポリペプチド、請求項14から16までのいずれか一項に記載の核酸分子、請求項17に記載のベクター、又は請求項18又は19に記載の細胞、及び薬学的に許容できる担体、賦形剤、又は安定化剤を含む医薬組成物。
- 患者の障害症状、EPO発現又は活性の調節不全を含む障害を治療、予防又は改善する方法であって、請求項28に記載の医薬組成物を患者に投与することを含む方法。
- 前記障害が、貧血、慢性腎不全患者の高血圧、小児透析患者、ヘマトクリット濃度不足に関連する疾患又は病態、化学療法治療に関係した障害、癌、循環器病、一次的神経系症状又は精神医学的症状を有する中枢神経系(CNS)疾患又は末梢神経系疾患からなる群から選択される患者の障害症状を治療、予防又は改善する方法であって、請求項1から13まで又は請求項21若しくは22のいずれか一項に記載のポリペプチド、又は請求項28に記載の医薬組成物の治療有効量を患者に投与することを含む方法。
- 患者の障害、即ち貧血、慢性腎不全患者の高血圧、小児透析患者、ヘマトクリット濃度不足に関連する疾患又は病態、化学療法治療に関係した障害、癌、循環器病、一次的神経系症状又は精神医学的症状を有する中枢神経系(CNS)疾患又は末梢神経系疾患からなる群から選択される障害を治療するための薬剤の製造における、請求項1から13まで又は請求項21若しくは22のいずれか一項に記載のポリペプチド、又は請求項28に記載の医薬組成物の使用。
- 前記障害が、貧血、癌、アルツハイマー病、パーキンソン病、リー病、筋萎縮性側索硬化症、多発性硬化症、虚血性再灌流傷害、心筋梗塞からなる群から選択される請求項30又は31に記載の方法又は使用。
- 前記障害が、慢性腎不全(CRF)に関連する貧血、ジドブジン治療HIV感染患者の貧血、化学療法又は放射線療法に対する癌患者の貧血、非骨髄性癌の進行に関連する貧血、ウィルス性感染(HIVなど)に関連する貧血及び慢性疾患の貧血からなる群から選択される貧血であるか、又は腎臓、前立腺、卵巣又は乳房の腺癌、リンパ腫、白血病、多発性骨髄腫、中枢神経系に影響を及ぼす腫瘍からなる群から選択される癌である請求項32に記載の方法又は使用。
- 薬剤として使用するための、請求項23から25までのいずれか一項に記載の抗体、又はその断片若しくは誘導体。
- 請求項23から25までのいずれか一項に記載の抗体、又はその断片若しくは誘導体、及び薬学的に許容できる担体、賦形剤、又は安定化剤を含む医薬組成物。
- 対象における癌の症状を治療、予防又は改善する方法であって、請求項23から25までのいずれか一項に記載の抗体、又はその断片若しくは誘導体の治療有効量を患者に投与することを含む方法。
- 癌を治療するための薬剤の製造における、請求項23から25までのいずれか一項に記載の抗体、又はその断片若しくは誘導体の使用。
- 請求項14から16までのいずれか一項に記載の核酸又はその相補鎖に選択的にハイブリダイズする核酸プローブ。
- 請求項1から13までのいずれか一項に記載のEPOポリペプチドをコードする核酸分子の少なくとも1つの特有の断片を増幅させるために使用できる核酸プライマー。
- 神経圧潰後、少なくとも約0.02msの複合性筋活動電位(CMAP)潜伏時間の減少を誘導する請求項1から13まで又は請求項21若しくは22のいずれか一項に記載のポリペプチド。
- ミエリン塩基性タンパク質(MBP)の産生を、好ましくは、少なくとも約5%刺激する請求項1から13まで、又は請求項21若しくは22、又は請求項40のいずれか一項に記載のポリペプチド。
- 野生型EPOの血液栄養活性の50%未満を保持する請求項1から13まで又は請求項21若しくは22、又は請求項40若しくは41のいずれか一項に記載のポリペプチド。
- ベースラインのヘマトクリット濃度と比較して、ヘマトクリット濃度を約10%未満増加させる請求項1から13まで、又は請求項21若しくは22、又は請求項40から42までのいずれか一項に記載のポリペプチド。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP05111262 | 2005-11-24 | ||
| EP05111265 | 2005-11-24 | ||
| US75370605P | 2005-12-22 | 2005-12-22 | |
| US75366805P | 2005-12-22 | 2005-12-22 | |
| PCT/EP2006/068859 WO2007060213A2 (en) | 2005-11-24 | 2006-11-23 | Erythropoietin polypeptides and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009517009A true JP2009517009A (ja) | 2009-04-30 |
| JP2009517009A5 JP2009517009A5 (ja) | 2010-02-04 |
Family
ID=37807876
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008541750A Pending JP2009517009A (ja) | 2005-11-24 | 2006-11-23 | エリスロポエチンポリペプチド及びそれらの使用 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20080260746A1 (ja) |
| EP (1) | EP1966237A2 (ja) |
| JP (1) | JP2009517009A (ja) |
| AU (1) | AU2006316450A1 (ja) |
| CA (1) | CA2621705A1 (ja) |
| IL (1) | IL191426A (ja) |
| WO (1) | WO2007060213A2 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4484115B2 (ja) * | 2004-02-09 | 2010-06-16 | パイオニア株式会社 | 光学素子、光ピックアップ及び情報記録再生装置 |
| US7625564B2 (en) | 2006-01-27 | 2009-12-01 | Novagen Holding Corporation | Recombinant human EPO-Fc fusion proteins with prolonged half-life and enhanced erythropoietic activity in vivo |
| US20100115638A1 (en) * | 2006-12-19 | 2010-05-06 | Amina Abina | Method for inhibiting the expression of endogenous erythropoietin (epo) |
| AU2008261212A1 (en) * | 2007-06-15 | 2008-12-18 | University Of Zurich | Treatment for Alzheimer' s disease |
| BRPI0814465B1 (pt) | 2007-07-26 | 2021-11-23 | Novagen Holding Corporation | Proteína de fusão, dímero, método para produzir uma proteína de fusão, linhagem de célula, usos de uma proteína de fusão e de uma composição farmacêutica e composição farmacêutica |
| US9732132B2 (en) * | 2011-01-14 | 2017-08-15 | Vanderbilt University | Therapeutic compositions and methods for disorders associated with neuronal degeneration |
| CN102816853A (zh) * | 2012-08-30 | 2012-12-12 | 山东百福基因科技有限公司 | 运动机能相关基因epo荧光检测试剂盒及检测方法 |
| US9365646B2 (en) | 2012-12-05 | 2016-06-14 | Novartis Ag | Compositions and methods for antibodies targeting EPO |
| EP3334842B1 (en) | 2015-08-12 | 2022-03-02 | Novartis AG | Methods of treating ophthalmic disorders |
| CN110475786A (zh) * | 2017-02-27 | 2019-11-19 | 大邱庆北科学技术院 | 红细胞生成素衍生肽通过其对预防细胞损伤的作用的用途 |
| WO2022159414A1 (en) | 2021-01-22 | 2022-07-28 | University Of Rochester | Erythropoietin for gastroinfestinal dysfunction |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS60500558A (ja) * | 1983-02-04 | 1985-04-25 | キリン−アムジェン、インコ−ポレ−テッド | Atcc hb8209 及びそのエリスロポエチンに対するモノクロ−ナル抗体 |
| JPH10101574A (ja) * | 1996-08-06 | 1998-04-21 | Snow Brand Milk Prod Co Ltd | 増殖性臓器疾患治療・改善剤 |
| WO2004003176A2 (en) * | 2002-07-01 | 2004-01-08 | The Kenneth S. Warren Institute, Inc. | Recombinant tissue protective cytokines and encoding nucleic acids thereof for protection, restoration, and enhancement of responsive cells, tissues, and organs |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ210501A (en) * | 1983-12-13 | 1991-08-27 | Kirin Amgen Inc | Erythropoietin produced by procaryotic or eucaryotic expression of an exogenous dna sequence |
| DE3923963A1 (de) * | 1989-07-20 | 1991-01-31 | Behringwerke Ag | Muteine des menschlichen erythropoetins, ihre herstellung und ihre verwendung |
| CN1234073A (zh) * | 1996-10-25 | 1999-11-03 | G·D·瑟尔公司 | 环状变更的促红细胞生成素受体激动剂 |
| US7033774B2 (en) * | 1997-04-21 | 2006-04-25 | Glycozyme, Inc. | Determination of recombinant glycosylated proteins and peptides in biological fluids |
| US20040229779A1 (en) * | 1999-05-14 | 2004-11-18 | Ramesh Kekuda | Therapeutic polypeptides, nucleic acids encoding same, and methods of use |
| US6974684B2 (en) * | 2001-08-08 | 2005-12-13 | Curagen Corporation | Therapeutic polypeptides, nucleic acids encoding same, and methods of use |
| DK1463751T3 (da) * | 2001-12-21 | 2013-08-26 | Human Genome Sciences Inc | Albuminfusionsproteiner. |
| AU2003304034A1 (en) * | 2002-08-09 | 2004-11-01 | Curagen Corporation | Therapeutic polypeptides, nucleic acids encoding same, and methods of use |
| US7846466B2 (en) * | 2004-06-10 | 2010-12-07 | Northwestern University | Biodegradable scaffolds and uses thereof |
-
2006
- 2006-11-23 JP JP2008541750A patent/JP2009517009A/ja active Pending
- 2006-11-23 CA CA002621705A patent/CA2621705A1/en not_active Abandoned
- 2006-11-23 EP EP06830107A patent/EP1966237A2/en not_active Withdrawn
- 2006-11-23 US US12/094,869 patent/US20080260746A1/en not_active Abandoned
- 2006-11-23 AU AU2006316450A patent/AU2006316450A1/en not_active Abandoned
- 2006-11-23 WO PCT/EP2006/068859 patent/WO2007060213A2/en active Application Filing
-
2008
- 2008-05-14 IL IL191426A patent/IL191426A/en not_active IP Right Cessation
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS60500558A (ja) * | 1983-02-04 | 1985-04-25 | キリン−アムジェン、インコ−ポレ−テッド | Atcc hb8209 及びそのエリスロポエチンに対するモノクロ−ナル抗体 |
| JPH10101574A (ja) * | 1996-08-06 | 1998-04-21 | Snow Brand Milk Prod Co Ltd | 増殖性臓器疾患治療・改善剤 |
| WO2004003176A2 (en) * | 2002-07-01 | 2004-01-08 | The Kenneth S. Warren Institute, Inc. | Recombinant tissue protective cytokines and encoding nucleic acids thereof for protection, restoration, and enhancement of responsive cells, tissues, and organs |
Non-Patent Citations (3)
| Title |
|---|
| JPN6012011068; Science (2004) vol.305, no.5681, p.239-242 * |
| JPN6012011069; J. Biol. Chem. (1993) vol.268, no.21, p.15983-15993 * |
| JPN6012011070; Nat. Rev. Neurosci. (Jun 2005) vol.6, no.6, p.484-494 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2621705A1 (en) | 2007-05-31 |
| AU2006316450A1 (en) | 2007-05-31 |
| WO2007060213A3 (en) | 2008-08-14 |
| EP1966237A2 (en) | 2008-09-10 |
| IL191426A (en) | 2012-05-31 |
| US20080260746A1 (en) | 2008-10-23 |
| WO2007060213A2 (en) | 2007-05-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2009517009A (ja) | エリスロポエチンポリペプチド及びそれらの使用 | |
| CN101175768B (zh) | 促红细胞生成素变体 | |
| JP5558213B2 (ja) | 貧血の予防および治療用の方法および組成物 | |
| JP5858442B2 (ja) | Robo1−Fc融合タンパク質および腫瘍を治療するためのこの使用 | |
| KR101626153B1 (ko) | 조직 보호 펩티드 및 이의 용도 | |
| JP2012530493A (ja) | キメラポリペプチドおよびその使用 | |
| JP2003530874A (ja) | 貧血の予防及び治療用の方法及び組成物 | |
| BRPI1011404B1 (pt) | Polipeptídeos mutantes fgf21, polipeptídeo de fusão, multímero, composição farmacêutica, ácido nucleico isolado, vetor e célula hospedeira | |
| JP2016521688A (ja) | 肝細胞増殖因子に結合する設計アンキリン反復タンパク質 | |
| JPH10113186A (ja) | トロンボポエチンをコードする遺伝子 | |
| NZ543192A (en) | Tissue protective cytokine receptor complex, assays for identifying tissue protective compounds and uses thereof | |
| JP2012525847A (ja) | Fgf21変異体およびその使用 | |
| BR122020010972B1 (pt) | polipeptídeo isolado e de fusão, sua composição farmacêutica e multímero | |
| US20190106470A1 (en) | Erythropoietin variants | |
| JP2018535964A (ja) | 線維芽細胞増殖因子(fgf)1アナログによるステロイド誘導性高血糖の処置 | |
| EP2655408B1 (en) | Robo1-fc fusion protein for use in the treatment of hepatocarcinoma | |
| JPH04506513A (ja) | 巨核球増殖促進活性 | |
| JP2003511030A (ja) | 成長因子ポリペプチドおよび成長因子ポリペプチドをコードする核酸 | |
| KR20010043090A (ko) | 신규인 폴리펩티드, 그 폴리펩티드를 코드화하는 cDNA및 그 용도 | |
| JP2002543784A (ja) | 新規なチンパンジーエリスロポエチン(chepo)ポリペプチドおよびこれをコードする核酸 | |
| HUT75656A (en) | Protein having tpo activity | |
| JP2002335972A (ja) | インスリン受容体関連受容体結合蛋白質及びその利用 | |
| EP3539561A1 (en) | Therapeutic agent for cerebral infarction | |
| US20020192704A1 (en) | Insulin receptor-related receptor binding protein and utilization of the same | |
| TW201307393A (zh) | 用於治療肝癌之Robo1-Fc融合蛋白 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20091120 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091208 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120302 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120518 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120525 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20120702 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20120709 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120801 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121102 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130419 |