JP2005531528A - チオトロピウム塩を含有する吸入用エアロゾル製剤 - Google Patents
チオトロピウム塩を含有する吸入用エアロゾル製剤 Download PDFInfo
- Publication number
- JP2005531528A JP2005531528A JP2003581759A JP2003581759A JP2005531528A JP 2005531528 A JP2005531528 A JP 2005531528A JP 2003581759 A JP2003581759 A JP 2003581759A JP 2003581759 A JP2003581759 A JP 2003581759A JP 2005531528 A JP2005531528 A JP 2005531528A
- Authority
- JP
- Japan
- Prior art keywords
- formulation
- tiotropium
- pharmaceutical
- inhaler
- pharmaceutical formulation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0078—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a nebulizer such as a jet nebulizer, ultrasonic nebulizer, e.g. in the form of aqueous drug solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/439—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom the ring forming part of a bridged ring system, e.g. quinuclidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5386—1,4-Oxazines, e.g. morpholine spiro-condensed or forming part of bridged ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pulmonology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Dispersion Chemistry (AREA)
- Otolaryngology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Cosmetics (AREA)
- Nozzles (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
本発明は、吸入によって投与されることができるこれらの化合物の液体活性物質製剤に関し、本発明の液体製剤は高い品質基準を満たす必要がある。
肺において活性物質の最適分配を達成するために、適した吸入器を用いて投与される噴霧剤ガスを含まない液体製剤を使用することは意味がある。数秒以内に治療目的で必要な投与量の、少量の液体製剤を噴霧して、吸入治療に適したエアロゾルとすることができる前記吸入器は特に好ましい。本発明の範囲内で、好ましいネブライザーは100マイクロリットル未満、好ましくは50マイクロリットル未満、最も好ましくは20マイクロリットル未満の量の活性物質溶液を、好ましくは一吹き又は二吹きで噴霧して20ミクロン未満、好ましくは10ミクロン未満の平均粒子サイズを有するエアロゾルを形成できるものであり、それ故エアロゾルの吸入可能な部分はすでに治療上有効な量に相当する。
吸入用液体医薬組成物の計量された量の噴霧剤ガスを含まない投与のためのこの種の装置は、例えば国際特許出願WO91/14468 “Atomizing Device and Methods”及びWO97/12687(図6a及び6b並びに明細書を参照)に詳細に記載されている。この種のネブライザーにおいて、医薬溶液は500バールまでの高圧で、肺に向かうことになっているエアロゾルに変換される(噴霧される)。参照により、上記文献の全内容は、本明細書の範囲内に組み込まれる。
溶液を噴霧するために、特別のノズルが、例えばWO94/07607又はWO99/16530に開示されるように使用される(これらは、参照により本明細書に組み込まれる)。
WO98/27959は、添加剤としてエデト酸(editic acid)の二ナトリウム塩(又は四酢酸エチレンジアミン二ナトリウム二水和物若しくはエデト酸ナトリウム)を含む上述の吸入器用の溶液製剤を開示する。上述の吸入器を用いて吸入可能なエアロゾルに変換される水溶液製剤について、明細書には、噴霧異常の発生を減らすために、50mg/100mlのエデト酸ナトリウムの最少濃度が示されている。実施例には、pHが3.2又は3.4の臭化チオトロピウムを含む製剤が記載されている。この製剤中の活性物質は水に溶解している。エデト酸ナトリウムの比率もまた50mg/100mlである。
この種の製剤は、従来技術から公知の臭化チオトロピウムを含む製剤と比較して、RespimatTM吸入器によって噴霧されるときに、エデト酸ナトリウムの量が製剤100g当たり5〜20mgであれば、与えられる組成物の散乱の減少を示すことも分かった。本発明の製剤の噴霧品質は非常によい。このように生成されたエアロゾルは吸入による投与にとって非常によい特性を有する。さらに、本発明の製剤は安定性に優れ、患者に対するエデト酸ナトリウムの負荷を軽減する。
したがって、本発明の目的は、上述の吸入器を用いて溶液の最適な噴霧を達成するために必要な高い基準を満たす薬剤的に許容されるチオトロピウム塩を含む活性物質水溶液製剤を提供することである。本発明の活性物質製剤は十分に高い医薬品質でなければならない。すなわち、数年、好ましくは少なくとも1年、より好ましくは2年の保存期間にわたって薬剤的に安定でなければならない。
別の目的は、吸入器を用いて圧力をかけて噴霧される、噴霧剤を含まないチオトロピウム塩含有溶液製剤を提供することであり、生成されるエアロゾルによって与えられる組成物は再生可能な特定の範囲内に含まれる。
さらに別の目的は、溶媒として水を含む溶液製剤としてチオトロピウム塩を有する吸入可能な製剤を提供することであり、この製剤は安定で、患者に対する化学物質の負荷を最小に低減する。
本発明の範囲内で、臭化チオトロピウムは塩として好ましい。本発明の範囲内で臭化チオトロピウムへの言及は、常に可能なすべての臭化チオトロピウムのアモルファス及び結晶変態への言及であると解釈されるべきである。これらは、例えばその結晶構造中に溶媒分子を含んでもよい。臭化チオトロピウムの結晶変態の中で、水を含むもの(水和物)は本発明によれば好ましい。臭化チオトロピウム一水和物を使用することは、本発明の範囲内で特に好ましい。好ましくは、製剤は、チオトロピウム又は薬剤的に許容されるその塩を含まない他の活性物質を含まない。
本発明の製剤において、チオトロピウム塩は水に溶解する。他の溶媒は使用されない。特に、製剤は噴霧剤ガスを含まない。
最終医薬製剤のチオトロピウムの比率をベースとするチオトロピウム塩の濃度は、要求される治療効果に依存する。チオトロピウムに応答する病気のほとんどについて、チオトロピウムの濃度は製剤100g当たり0.01〜0.06gである。製剤の密度は1.00g/cm3であるため、100gの製剤は100mlの容量に相当する。本明細書の範囲内で、表現「100ml当たり」又は「/100ml」は、いずれの場合にも、特に明記しない限り製剤100ml当たりを意味する。0.015g/100ml〜0.055g/100mlの量が好ましく、0.02g/100ml〜0.05g/100mlの量がより好ましい。最も好ましくは、製剤100ml当たり0.023±0.001g〜0.045±0.001gの量である。
本発明の製剤のpHは2.7〜3.1であり、好ましくは2.8〜3.05であり、より好ましくは2.80〜3.0であり、最も好ましくは2.9である。
薬理学的に許容される酸の添加によって、pHは調整される。この目的のために好ましい無機酸の例としては、塩酸、臭化水素酸、硝酸、硫酸及び/又は燐酸が挙げられる。特に適した有機酸の例は、アスコルビン酸、クエン酸、リンゴ酸、酒石酸、マレイン酸、コハク酸、フマル酸、酢酸、ギ酸及び/又はプロピオン酸等である。好ましい無機酸は塩酸及び硫酸である。また、活性物質と酸付加塩を形成する酸を使用することは可能である。有機酸の中で、アスコルビン酸、フマル酸及びクエン酸が好ましく、クエン酸は最も好ましい。所望により、特にそのアシドーシス性に加えて他の特性を有する酸、例えば香料添加剤又は酸化防止剤として作用するもの、例えばクエン酸又はアスコルビン酸のような酸の場合に、上記酸の混合物を使用してもよい。
上記酸の中で、塩酸及びクエン酸は特に好ましいものとして記載される。
本発明によれば、この製剤はエデト酸(EDTA)又はその公知の塩の1つ、例えばナトリウムEDTA又は二ナトリウムEDTA二水和物(エデト酸ナトリウム)を安定剤又は錯化剤として含む。好ましくは、エデト酸ナトリウムが使用される。
エデト酸ナトリウムをベースとする含有量は、製剤100ml当たり5〜20mgであり、好ましくは製剤100ml当たり5〜15mgであり、より好ましくは製剤100ml当たり8〜12mgであり、最も好ましくは製剤100ml当たり10mgである。
エデト酸の異なる塩又は該酸自体を使用する場合、同等量の錯化剤が使用される。
また、エデト酸ナトリウムに関する記述は、EDTA又はその塩よりも好ましくはないが、匹敵する、錯化剤特性を有する他の可能な添加剤であって、例えばニトリロ三酢酸及びその塩のようなそれらに代えて使用できる添加剤に対して同様に適用する。
他の薬理学的に許容されるアジュバントは、本発明の製剤に添加してもよい。
本明細書において、アジュバント及び添加剤とは、薬理学的に許容され、かつ、治療上有効な任意の物質を意味し、活性物質ではないが、活性物質製剤の品質を向上させるために、薬理学的に適した溶媒中で活性物質と一緒に製剤化することができる物質である。好ましくは、これらの物質は、所望の治療との関連で、薬理効果を持たず、又は明らかな若しくは少なくとも望ましくない薬理効果を持たない。アジュバント及び添加剤としては、例えば他の安定剤、錯化剤、最終医薬製剤の貯蔵寿命を延ばす酸化防止剤及び/又は防腐剤、香料添加剤、ビタミン及び/又は技術的に公知の他の添加剤が挙げられる。また、添加剤としては、例えば塩化ナトリウムのような薬理学的に許容される塩が挙げられる。
好ましい賦形剤としては、例えばpHを調整するために使用されていないことを条件としてアスコルビン酸のような酸化防止剤、ビタミンA、ビタミンE、トコフェロール及び同様のビタミン又は人体で生じるプロビタミンが挙げられる。
防腐剤は、病原菌を含む汚染物質から製剤を保護するために添加できる。適した防腐剤は従来技術で公知のものであり、特に従来技術で公知の濃度の塩化ベンザルコニウム又は安息香酸若しくは安息香酸ナトリウムのようなベンゾアートである。好ましくは、塩化ベンザルコニウムは本発明の製剤に添加される。塩化ベンザルコニウムの量は、製剤100ml当たり5〜20mgであり、好ましくは製剤100ml当たり5〜15mgであり、より好ましくは製剤100ml当たり8〜12mgであり、最も好ましくは製剤100ml当たり10mgである。
好ましい製剤は、溶媒用水及びチオトロピウム塩に加えて、塩化ベンザルコニウム、エデト酸ナトリウム及びpHを調整するための酸、好ましくは塩酸のみを含む。
結晶性臭化チオトロピウム一水和物は、以下により詳細に説明される方法を用いて得ることができる。本発明の結晶性一水和物を調製するために、EP 418 716 A1に開示される方法によって得られる臭化チオトロピウムは、例えば最初に水に溶解し、加熱し、活性炭で精製する必要があり、活性炭の除去後臭化チオトロピウム一水和物はゆっくりと冷却しながらゆっくりと結晶化される。
以下の手順は好ましい。
適切な大きさの反応容器で、溶媒を臭化チオトロピウム(例えば、EP 418 716 A1に開示される方法で得られた)と混合する。
加えられた臭化チオトロピウム1モル当たり0.4〜1.5kg、好ましくは0.6〜1kg、最も好ましくは約0.8kgの水を溶媒として使用する。
得られる混合物を撹拌しながら、好ましくは50℃よりも高い温度、最も好ましくは60℃よりも高い温度に加熱する。選択できる最大温度は使用した溶媒(水)の沸点によって決定される。好ましくは、混合物は80〜90℃の範囲に加熱される。
活性炭(乾燥又は水で湿らせたもの)をこの溶液に添加する。好ましくは、10〜50g、より好ましくは15〜35g、最も好ましくは約25gの活性炭を使用する臭化チオトロピウム1モル当たりに添加する。必要に応じて、臭化チオトロピウムを含む溶液に添加する前に、活性炭を水に懸濁する。添加した臭化チオトロピウム1モル当たり70〜200g、好ましくは100〜160g、より好ましくは約135gの水を使用して、活性炭を懸濁する。予め活性炭を水に懸濁する場合には、臭化チオトロピウムを含む溶液に添加する前に同量の水で再度濯ぐのがよい。
次いで、濾液を、好ましくは20〜25℃の温度にゆっくり冷却する。冷却は、好ましくは10〜30分で1〜10℃、好ましくは10〜30分で2〜8℃、より好ましくは10〜20分で3〜5℃、最も好ましくは20分で3〜5℃の冷却速度で行われる。必要に応じて、20〜25℃への冷却後、さらに20℃未満に、より好ましくは10〜15℃に冷却してもよい。
冷却完了後、20分〜3時間、好ましくは40分〜2時間、より好ましくは約1時間撹拌を続けて結晶化を完了する。
次いで、得られる結晶を濾過又は吸引濾過によって分離し、溶媒を除去する。得られる結晶をさらに洗浄工程に供する必要が認められる場合には、洗浄溶媒として水又はアセトンを使用するのがよい。添加した臭化チオトロピウム1モル当たり0.1〜1.0L、好ましくは0.2〜0.5L、より好ましくは約0.3Lの溶媒を使用して、得られる臭化チオトロピウム一水和物結晶を洗浄する。必要に応じて、洗浄工程を繰り返してもよい。得られる生成物は、含水率が2.5〜4.0%になるまで、減圧して、又は循環熱風を用いて乾燥される。
したがって、一局面によれば、本発明は、上述の手順によって得ることができる結晶性臭化チオトロピウム一水和物を用いて上述のタイプの溶液の調製に関する。
本発明のチオトロピウム塩を含む医薬製剤は、好ましくは上述の種類の吸入器で使用されて、本発明の噴霧剤を含まないエアロゾルを生成する。ここで、上述の特許文献は参照により本明細書に組み込まれることを再度明確に付言しておく。
好ましいアトマイザーは上部ハウジング部分、ポンプハウジング、ノズル、ロッキングクランプ、スプリングハウジング、スプリング及び貯蔵容器から本質的になり、
- 上部ハウジング部分に固定され、ノズル又はノズルアレンジメントを有するノズル本体を一方の端部に有するポンプハウジング、
- バルブ本体を有する中空ピストン、
- 中空本体が固定され、かつ、上部ハウジング部分に位置するパワーテイクオフフランジ、
- 上部ハウジング部分に位置するロッキングクランピング機構、
- その中に位置するスプリングを有するスプリングハウジング(ロータリーベアリングによって上部ハウジング部分に回転できるように取りつけられている)、
- 軸方向にスプリングハウジング上に取りつけられた下部ハウジング部分によって特徴付けられる。
バルブ本体は、好ましくはノズル本体に面した中空ピストンの端部に取りつけられる。
ノズル本体のノズルは、好ましくはミクロ構造化される(mircostructured)(すなわち、マイクロ技術(microengineering)によって生成される)。ミクロ構造化ノズル本体は、例えばWO99/16530に開示され、特に図1及び関連する記載は、参照により本明細書に組み込まれるものとする。ノズル本体は、例えば一緒にしっかりと固定された2枚のガラス及び/又はシリコンからなり、その少なくとも1枚は、ノズル入り口端部とノズル出口端部を繋ぐ1つ以上のミクロ構造化チャネルを有する。ノズル出口端部に、深さが2〜10ミクロンで幅が5〜15ミクロン、好ましくは深さが4.5〜6.5ミクロンで幅が7〜9ミクロンの少なくとも1つの円形又は非円形開口部がある。複数個、好ましくは2個のノズル開口部がある場合、ノズル本体におけるノズルの噴霧の方向は、互いに平行であってもよく、又はノズル開口部の方向において、互いに対して傾斜していてもよい。出口端部に少なくとも2個のノズル開口部を有するノズル本体の場合、噴霧の方向は、20〜160°、好ましくは60〜150°、最も好ましくは80〜100°の角度で互いに対して傾斜していてもよい。ノズル開口部は、好ましくは10〜200ミクロン、より好ましくは10〜100ミクロン、さらにより好ましくは30〜70ミクロンの間隔で配置される。50ミクロンの間隔が最も好ましい。したがって、噴霧の方向はノズル開口部の領域に集まる。
ロッキングクランピング機構は、力学的エネルギーを蓄えるためのスプリング、好ましくは円筒状圧縮コイルバネを含む。このスプリングは、スプリング部材としてパワーテイクオフフランジに作用し、スプリング部材の移動はロッキング部材の位置によって決定される。パワーテイクオフフランジの移動は、上部停止及び下部停止によって正確に制限される。スプリングは、好ましくはステッピングアップギア、例えばヘリカルスライディングギアを介して、上部ハウジング部分が下部ハウジング部分のスプリングハウジングに対して回転される場合に生成される外部トルクによって伸ばされる。この場合、上部ハウジング部分とパワーテイクオフフランジは、シングル又はマルチスピードスプラインギアを含む。
かみ合うロッキング面を有するロッキング部材は、パワーテイクオフフランジのまわりに環状に配置される。それは、例えば本質的に伸縮自在に変形可能であるプラスチック又は金属のリングからなる。このリングは、アトマイザーの軸に垂直な面に配置される。スプリングのロック後、ロッキング部材のロッキング表面は、パワーテイクオフフランジの軌道にスライドし、スプリングが解放されないようにする。ロッキング部材は、ボタンによって作動する。作動ボタンはロッキング部材と連結又は結合している。ロッキングクランピング機構を作動させるために、作動ボタンを環状面に平行に、好ましくはアトマイザーに移動させ、変形可能なリングは、これによって環状面で変形される。ロッキングクランピング機構の構造の詳細はWO97/20590に開示される。
アトマイザーが作動される場合、ハウジングの上部部分は下部部分に対して回転され、下部部分はそれとともにスプリングハウジングを受け取る。一方、スプリングはヘリカルスライディングギアによって圧縮及び偏向され、クランピング機構は自動的にかみ合う。回転角は、好ましくは360°の自然数分数、例えば180℃である。スプリングが伸ばされると同時に、上部ハウジング部分のパワーテイクオフ部材は所定量進み、中空ピストンはポンプハウジングのシリンダー内部に後退し、その結果として、貯蔵容器から一部の流体をノズルの前の高圧チャンバーに吸引する。
必要に応じて、噴霧される流体を含む複数個の交換可能な貯蔵容器は、次ぎから次ぎへとアトマイザーに挿入され、そして使用される。貯蔵容器は本発明の水性エアロゾル製剤を含む。
噴霧プロセスは作動ボタンを徐々に押すことによって開始される。次いで、クランピング機構はパワーテイクオフ部材の道を開く。偏向されたスプリングはピストンをポンプハウジングのシリンダーに押し込む。流体はスプレーの形態でアトマイザーのノズルから出てくる。
この構造のより詳細な説明はPCT出願WO97/12683及びWO97/20590に開示され、それらは参照により本明細書に組み込まれる。
アトマイザー(ネブライザー)の部材は、その機能に適した材料から作られる。アトマイザーのハウジング及び機能が許せば同様に他の部分は、好ましくはプラスチックから、例えば射出成形によって作られる。医療用途で、生理学的に許容される材料が使用される。
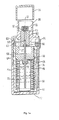
図1aは張力を受けているスプリングを有するアトマイザーの縦断面図を示し、図1bは解放されたスプリングを有するアトマイザーの縦断面図を示す。
上部ハウジング部分(51)はポンプハウジング(52)を含み、その端部にアトマイザーノズル用のホルダー(53)が取りつけられる。ホルダーには、ノズル本体(54)及びフィルター(55)がある。ロッキングクランピング機構のパワーテイクオフフランジ(56)に固定された中空ピストン(57)はポンプハウジングのシリンダーに部分的に突出している。その端部に、中空ピストンはバルブ本体(58)を有する。中空ピストンはガスケット(59)によって密封される。停止(60)は上部ハウジング部分の内部にあり、パワーテイクオフフランジは、スプリングが解放される場合にそこで停止する。停止(61)はパワーテイクオフフランジ上に位置し、パワーテイクオフフランジは、スプリングが張力を受けている場合にそこで停止する。スプリングに張力をかけた後、ロッキング部材(62)は上部ハウジング部分の停止(61)と支持体(63)の間にスライドする。作動ボタン(64)はロッキング部材に連結される。上部ハウジング部材は、マウスピース(65)で終わり、取り外し可能な保護キャップ(66)によって閉鎖される。
圧縮バネ(68)を有するスプリングハウジング(67)はスナップ式ラグ(69)及び回転ベアリングによって上部ハウジング部分に回転できるように固定される。下部ハウジング部分(70)はスプリングハウジングを押す。噴霧される流体(72)用の取り外し可能な貯蔵容器(71)はスプリングハウジングの内部にある。貯蔵容器はストッパー(73)によって閉鎖され、それによって中空ピストンは貯蔵容器に突出し、その端部を流体(活性物質溶液を供給する)中に沈める。
機械的なカウンター用スピンドル(74)は、スプリングハウジングの外側に取りつけられる。ドライブピニオン(75)は上部ハウジング部分に面するスピンドルの端部に位置する。スライダー(76)はスピンドル上にある。
上述のネブライザーは本発明のエアロゾル製剤を噴霧して吸入に適したエアロゾルを生成するのに適している。
本発明の製剤は上記方法(RespimatRT)を用いて噴霧される場合、吸入器の全作動(一吹き)の少なくとも97%、好ましくは少なくとも98%で噴霧された質量は、所望の量の25%以下、好ましくは20%以下の許容範囲で所定の量に一致すべきである。好ましくは5〜30mg、より好ましくは5〜20mgの製剤は一吹き当たりの所定量として投与される。
しかしながら、本発明の製剤は、上述の吸入器以外の吸入器、例えばジェットストリーム吸入器を用いて噴霧してもよい。
I.臭化チオトロピウム一水和物の合成例
15.0kgの臭化チオトロピウムを適した反応容器の25.7kgの水に添加した。混合物を80〜90℃に加熱し、溶液が透明になるまで一定温度で撹拌した。水で湿らせた活性炭(0.8kg)を4.4kgの水に懸濁し、臭化チオトロピウムを含む水溶液にこの混合物を添加し、4.3kgの水で濯いだ。こうして得られた混合物を少なくとも15分間80〜90℃で撹拌し、次いで加熱したフィルターを通して、70℃の外部温度に予め加熱した装置にろ過した。フィルターは8.6kgの水で濯いだ。装置の内容物を20分で3〜5℃の速度で20〜25℃の温度に冷却した。冷水を用いて装置をさらに10〜15℃に冷却し、さらに少なくとも1時間撹拌して結晶化を完了させた。吸引ろ過乾燥機を用いて結晶を分離し、分離した結晶スラリーを9Lの冷水(10〜15℃)及び冷アセトン(10〜15℃)で洗浄した。得られた結晶を25℃で2時間窒素流で乾燥した。収率:13.4kgの臭化チオトロピウム一水和物(理論の86%)
例13〜24:
9mgのエデト酸ナトリウムを含む以外、例1〜12と同様である。
例25〜36:
11mgのエデト酸ナトリウムを含む以外、例1〜12と同様である。
例37〜48:
9mgの塩化ベンザルコニウムを含む以外、例1〜12と同様である。
例49〜60:
11mgの塩化ベンザルコニウムを含む以外、例1〜12と同様である。
他の例において、塩化ベンザルコニウムの量は8又は12mgである。他の例において、エデト酸ナトリウムの量は8又は12mgである。
例の中でも、例1〜4が最も好ましい。
Claims (28)
- 以下からなる医薬製剤:
100mlの製剤当たり0.01g〜0.06gのチオトロピウムに基づく濃度で、活性物質として1種以上のチオトロピウム塩、ここで、チオトロピウム塩は完全に溶解した状態で医薬製剤中に存在する、
唯一の溶媒として水、
pHを2.7〜3.1、好ましくは2.8〜3.05に調整するための酸、
薬理学的に許容される防腐剤、
薬理学的に許容される錯化剤及び/又は安定剤(必要により1種以上の薬理学的に許容される賦形剤及び添加剤を含んでいてもよい)。 - チオトロピウム塩がHBr、HCl、HI、硫酸モノメチル、メタンスルホン酸及び/又はp−トルエンスルホン酸との塩である、請求項1記載の医薬製剤。
- 活性物質が臭化チオトロピウム単独である、請求項1記載の医薬製剤。
- 活性物質が臭化チオトロピウム一水和物単独である、請求項1記載の医薬製剤。
- エデト酸又はその薬理学的に許容される塩を錯化剤として使用する請求項1〜4のいずれか1項記載の医薬製剤。
- エデト酸ナトリウムを錯化剤として使用する請求項1〜4のいずれか1項記載の医薬製剤。
- エデト酸ナトリウムが100mlの製剤当たり5mg〜20mg、好ましくは8mg〜12mgの量で存在する、請求項6記載の医薬製剤。
- pHが2.8〜3.0、好ましくは2.9である、請求項1〜7のいずれか1項記載の医薬製剤。
- pHが無機酸、好ましくは塩酸で調整される、請求項1〜7のいずれか1項記載の医薬製剤。
- チオトロピウムに基づく濃度が100mlの製剤当たり0.02g〜0.05g、好ましくは0.023±0.001g〜0.045±0.001gである、請求項1〜9のいずれか1項記載の医薬製剤。
- 製剤が防腐剤として塩化ベンザルコニウムを含む、請求項1〜10のいずれか1項記載の医薬製剤。
- 製剤が水、チオトロピウム塩、塩化ベンザルコニウム、エデト酸ナトリウム、塩酸以外に賦形剤及び添加剤を含まない(必要により、塩化ナトリウムを含んでもよい)、請求項1〜11のいずれか1項記載の医薬製剤。
- 100mlの製剤が、0.057gの臭化チオトロピウム一水和物、10mgの無水塩化ベンザルコニウム、10mgのエデト酸ナトリウムを100mlの水及びpHを2.9に調整するのに十分な1N塩酸に溶解することによって調製される、請求項1〜12のいずれか1項記載の医薬製剤。
- 100mlの製剤が、0.028gの臭化チオトロピウム一水和物、10mgの無水塩化ベンザルコニウム、10mgのエデト酸ナトリウムを100mlの水及びpHを2.9に調整するのに十分な1N塩酸に溶解することによって調製される、請求項1〜12のいずれか1項記載の医薬製剤。
- 100mlの製剤が、チオトロピウムに基づく量が0.045gであるチオトロピウム塩、10mgの無水塩化ベンザルコニウム、10mgのエデト酸ナトリウムを100mlの水及びpHを2.9に調整するのに十分な1N塩酸に溶解することによって調製される、請求項1〜12のいずれか1項記載の医薬製剤。
- 100mlの製剤が、チオトロピウムに基づく量が0.023gであるチオトロピウム塩、10mgの無水塩化ベンザルコニウム、10mgのエデト酸ナトリウムを100mlの水及びpHを2.9に調整するのに十分な1N塩酸に溶解することによって調製される、請求項1〜12のいずれか1項記載の医薬製剤。
- 吸入によって投与される薬剤として使用される請求項1〜16のいずれか1項記載の医薬製剤。
- WO91/14468に記載の吸入器又はWO97/12687の図6a及び6bに記載の吸入器で噴霧するための請求項1〜17のいずれか1項記載の医薬製剤の使用。
- 所定量の医薬製剤を100〜600バールの圧力を適用して、2〜10ミクロン深さ及び5〜15ミクロン幅の少なくとも1つのノズル開口部を有するノズルを通して噴霧して吸入可能なエアロゾルを生成する吸入器で噴霧するための請求項1〜17のいずれか1項記載の医薬製剤の使用。
- ノズル開口部の最小数がノズル開口部の方向に互いに20〜160°の角度で傾いている少なくとも2つのノズル開口部である、請求項19記載の使用。
- 所定量が10〜50マイクロリットルである、請求項19又は20記載の使用。
- 吸入器が9〜15cm長さ及び2〜4cm幅である、請求項19〜21のいずれか1項記載の使用。
- 噴霧される製剤の質量が、吸入器の全作動の少なくとも97%で、25%の許容範囲を有する5〜30mgである、請求項19〜22のいずれか1項記載の使用。
- 噴霧される製剤の質量が、吸入器の全作動の少なくとも97%で、20%の許容範囲を有する5〜30mgである、請求項23記載の使用。
- 噴霧される質量が吸入器の全作動の少なくとも98%で達成される、請求項23又は24記載の使用。
- 特に、喘息及び/又はCOPDを治療するための薬剤としての請求項1〜17のいずれか1項記載の医薬製剤の使用。
- 特に、請求項18〜25のいずれか1項記載の吸入器において、請求項1〜17のいずれか1項記載の医薬製剤を使用する喘息及び/又はCOPDの治療方法。
- 個々の成分を一緒に混合することによって請求項1〜17のいずれか1項記載の医薬製剤を調製する方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10216036A DE10216036A1 (de) | 2002-04-11 | 2002-04-11 | Aerosolformulierung für die Inhalation enthaltend ein Tiotropiumsalz |
| PCT/EP2003/003438 WO2003084519A2 (de) | 2002-04-11 | 2003-04-02 | Aerosolformulierung für die inhalation enthaltend ein tiotropiumsalz |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005531528A true JP2005531528A (ja) | 2005-10-20 |
| JP2005531528A5 JP2005531528A5 (ja) | 2006-05-25 |
Family
ID=28458728
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003581759A Pending JP2005531528A (ja) | 2002-04-11 | 2003-04-02 | チオトロピウム塩を含有する吸入用エアロゾル製剤 |
Country Status (33)
| Country | Link |
|---|---|
| EP (2) | EP1496876B1 (ja) |
| JP (1) | JP2005531528A (ja) |
| KR (1) | KR100997219B1 (ja) |
| CN (1) | CN1309378C (ja) |
| AR (1) | AR039286A1 (ja) |
| AT (1) | ATE389391T1 (ja) |
| AU (1) | AU2003222791B2 (ja) |
| BR (1) | BR0309080A (ja) |
| CA (1) | CA2473815C (ja) |
| CO (1) | CO5611150A2 (ja) |
| CY (1) | CY1108133T1 (ja) |
| DE (2) | DE10216036A1 (ja) |
| DK (1) | DK1496876T3 (ja) |
| EA (1) | EA007228B1 (ja) |
| EC (1) | ECSP045358A (ja) |
| ES (1) | ES2303897T3 (ja) |
| HK (1) | HK1078793A1 (ja) |
| HR (1) | HRP20040932B1 (ja) |
| ME (1) | ME00359B (ja) |
| MX (1) | MXPA04009818A (ja) |
| MY (1) | MY137249A (ja) |
| NO (1) | NO334915B1 (ja) |
| PE (1) | PE20030970A1 (ja) |
| PL (1) | PL371204A1 (ja) |
| PT (1) | PT1496876E (ja) |
| RS (1) | RS50923B (ja) |
| SA (1) | SA03240192B1 (ja) |
| SI (1) | SI1496876T1 (ja) |
| TW (1) | TWI344851B (ja) |
| UA (1) | UA78994C2 (ja) |
| UY (1) | UY27754A1 (ja) |
| WO (1) | WO2003084519A2 (ja) |
| ZA (1) | ZA200405721B (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019535714A (ja) * | 2016-11-16 | 2019-12-12 | グレンマーク・スペシャルティー・エスエー | 噴霧チオトロピウム |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT1682541E (pt) | 2003-11-03 | 2010-04-14 | Boehringer Ingelheim Int | Processo para a preparação de sais de tiotrópio |
| JP2009504604A (ja) * | 2005-08-06 | 2009-02-05 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 重症持続型喘息の治療におけるチオトロピウム塩の使用 |
| US20070088030A1 (en) | 2005-10-10 | 2007-04-19 | Barbara Niklaus-Humke | Aerosol formulations for the inhalation of beta-agonists |
| EP1905440A1 (de) * | 2006-09-06 | 2008-04-02 | Boehringer Ingelheim Pharma GmbH & Co. KG | Verwendung einer pharmazeutischen Zusammensetzung enthaltend ein Anticholinergikum zur Abtötung von Mikroorganismen und zur Behandlung von Atemwegsinfektionen |
| EP2044967A1 (de) * | 2007-10-01 | 2009-04-08 | Boehringer Ingelheim Pharma GmbH & Co. KG | Zerstäuber |
| WO2013127738A1 (de) | 2012-02-28 | 2013-09-06 | Boehringer Ingelheim International Gmbh | Neue treibgashaltige tiotropium-formulierung |
| RU2493827C1 (ru) * | 2012-10-03 | 2013-09-27 | Шолекс Девелопмент Гмбх | Стабильный комбинированный раствор фенотерола гидробромида и ипратропия бромида |
| WO2015065223A1 (ru) * | 2013-10-28 | 2015-05-07 | Шолекс Девелопмент Гмбх | Стабильный раствор фенотерола гидробромида |
| WO2015065219A1 (ru) * | 2013-10-28 | 2015-05-07 | Шолекс Девелопмент Гмбх | Раствор ипратропия бромида |
| GB201507686D0 (en) * | 2015-05-05 | 2015-06-17 | Norton Healthcare Ltd | A stable tiotropium nebuliser solution |
| US20210290568A1 (en) * | 2020-03-19 | 2021-09-23 | Cai Gu Huang | Inhalable formulation of a solution containing levalbuterol tartrate |
| CN114259481A (zh) * | 2021-11-26 | 2022-04-01 | 南京华盖制药有限公司 | 一种奥达特罗复方吸入溶液 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000023037A1 (de) * | 1998-10-17 | 2000-04-27 | Boehringer Ingelheim Pharma Kg | Zweikammer-kartusche für vernebler |
| JP2001507343A (ja) * | 1996-12-20 | 2001-06-05 | ベーリンガー インゲルハイム ファルマ コマンディトゲゼルシャフト | 噴射剤フリーエアゾール製造用新規水性医薬製剤 |
| JP4344135B2 (ja) * | 2000-10-31 | 2009-10-14 | ベーリンガー インゲルハイム ファルマ ゲゼルシャフト ミット ベシュレンクテル ハフツング ウント コンパニー コマンディトゲゼルシャフト | チオトロピウム塩を含有する吸入液組成物 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3931041C2 (de) | 1989-09-16 | 2000-04-06 | Boehringer Ingelheim Kg | Ester von Thienylcarbonsäuren mit Aminoalkoholen, ihre Quaternierungsprodukte, Verfahren zu ihrer Herstellung und diese enthaltende Arzneimittel |
| SG45171A1 (en) | 1990-03-21 | 1998-01-16 | Boehringer Ingelheim Int | Atomising devices and methods |
| IL107120A (en) | 1992-09-29 | 1997-09-30 | Boehringer Ingelheim Int | Atomising nozzle and filter and spray generating device |
| DE19536903C2 (de) | 1995-10-04 | 1998-09-10 | Boehringer Ingelheim Int | Vorrichtung zum Haltern eines fluidischen Bauteils |
| DE19536902A1 (de) | 1995-10-04 | 1997-04-10 | Boehringer Ingelheim Int | Vorrichtung zur Hochdruckerzeugung in einem Fluid in Miniaturausführung |
| DE19545226C1 (de) | 1995-12-05 | 1997-06-19 | Boehringer Ingelheim Int | Sperrspannwerk für einen federbetätigten Abtrieb |
| DE19742439C1 (de) | 1997-09-26 | 1998-10-22 | Boehringer Ingelheim Int | Mikrostrukturiertes Filter |
-
2002
- 2002-04-11 DE DE10216036A patent/DE10216036A1/de not_active Withdrawn
-
2003
- 2003-02-04 UA UA20041109194A patent/UA78994C2/uk unknown
- 2003-04-02 PT PT03718724T patent/PT1496876E/pt unknown
- 2003-04-02 EP EP03718724A patent/EP1496876B1/de not_active Expired - Lifetime
- 2003-04-02 MX MXPA04009818A patent/MXPA04009818A/es active IP Right Grant
- 2003-04-02 AT AT03718724T patent/ATE389391T1/de active
- 2003-04-02 DK DK03718724T patent/DK1496876T3/da active
- 2003-04-02 WO PCT/EP2003/003438 patent/WO2003084519A2/de active IP Right Grant
- 2003-04-02 DE DE50309414T patent/DE50309414D1/de not_active Expired - Lifetime
- 2003-04-02 ME MEP-2008-543A patent/ME00359B/me unknown
- 2003-04-02 EP EP08152138A patent/EP1949892A1/de not_active Withdrawn
- 2003-04-02 PL PL03371204A patent/PL371204A1/xx not_active Application Discontinuation
- 2003-04-02 RS YUP-879/04A patent/RS50923B/sr unknown
- 2003-04-02 ES ES03718724T patent/ES2303897T3/es not_active Expired - Lifetime
- 2003-04-02 SI SI200331206T patent/SI1496876T1/sl unknown
- 2003-04-02 JP JP2003581759A patent/JP2005531528A/ja active Pending
- 2003-04-02 AU AU2003222791A patent/AU2003222791B2/en not_active Expired
- 2003-04-02 CA CA2473815A patent/CA2473815C/en not_active Expired - Fee Related
- 2003-04-02 CN CNB038082330A patent/CN1309378C/zh not_active Ceased
- 2003-04-02 KR KR1020047016052A patent/KR100997219B1/ko active IP Right Grant
- 2003-04-02 EA EA200401305A patent/EA007228B1/ru not_active IP Right Cessation
- 2003-04-02 BR BR0309080-9A patent/BR0309080A/pt active Pending
- 2003-04-09 MY MYPI20031314A patent/MY137249A/en unknown
- 2003-04-09 PE PE2003000359A patent/PE20030970A1/es not_active Application Discontinuation
- 2003-04-09 UY UY27754A patent/UY27754A1/es not_active Application Discontinuation
- 2003-04-10 TW TW092108240A patent/TWI344851B/zh not_active IP Right Cessation
- 2003-04-11 AR ARP030101267A patent/AR039286A1/es active Pending
- 2003-07-07 SA SA03240192A patent/SA03240192B1/ar unknown
-
2004
- 2004-07-19 ZA ZA200405721A patent/ZA200405721B/en unknown
- 2004-09-23 NO NO20044001A patent/NO334915B1/no not_active IP Right Cessation
- 2004-10-07 HR HRP20040932AA patent/HRP20040932B1/hr not_active IP Right Cessation
- 2004-10-08 CO CO04100971A patent/CO5611150A2/es active IP Right Grant
- 2004-10-11 EC EC2004005358A patent/ECSP045358A/es unknown
-
2005
- 2005-12-01 HK HK05110950A patent/HK1078793A1/xx not_active IP Right Cessation
-
2008
- 2008-06-11 CY CY20081100623T patent/CY1108133T1/el unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001507343A (ja) * | 1996-12-20 | 2001-06-05 | ベーリンガー インゲルハイム ファルマ コマンディトゲゼルシャフト | 噴射剤フリーエアゾール製造用新規水性医薬製剤 |
| WO2000023037A1 (de) * | 1998-10-17 | 2000-04-27 | Boehringer Ingelheim Pharma Kg | Zweikammer-kartusche für vernebler |
| JP4344135B2 (ja) * | 2000-10-31 | 2009-10-14 | ベーリンガー インゲルハイム ファルマ ゲゼルシャフト ミット ベシュレンクテル ハフツング ウント コンパニー コマンディトゲゼルシャフト | チオトロピウム塩を含有する吸入液組成物 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019535714A (ja) * | 2016-11-16 | 2019-12-12 | グレンマーク・スペシャルティー・エスエー | 噴霧チオトロピウム |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20040019073A1 (en) | Aerosol formulation for inhalation containing a tiotropium salt | |
| JP5314243B2 (ja) | 抗コリン作用薬を含有する吸入用エアロゾル製剤 | |
| KR100940752B1 (ko) | 티오트로퓸 염 및 살메테롤 염에 기초한 신규한 의약 조성물 | |
| US20040132761A1 (en) | Inhalable formulation of a solution containing a tiotropium salt | |
| JP4537652B2 (ja) | 抗コリン作用薬及びシクレソニドをベースとする新規薬剤組成物 | |
| AU2003298473B2 (en) | Aerosol formulation for inhalation containing an anticholinergic agent | |
| JP2008509197A (ja) | 抗コリン作用薬を含む吸入用のエアロゾル製剤 | |
| CA2629082A1 (en) | Aerosol formulation for inhalation containing an anticholinergic agent | |
| CA2629074A1 (en) | Aerosol formulation for inhalation containing an anticholinergic agent | |
| CA2628947A1 (en) | Aerosol formulation for inhalation containing an anticholinergic agent | |
| CA2629070A1 (en) | Aerosol formulation for inhalation containing an anticholinergic agent | |
| CA2629073A1 (en) | Aerosol formulation for inhalation containing an anticholinergic agent | |
| JP2004512359A (ja) | 抗コリン作用薬及びコルチコステロイドをベースとする新規医薬組成物 | |
| JP2005531528A (ja) | チオトロピウム塩を含有する吸入用エアロゾル製剤 | |
| JP4344135B2 (ja) | チオトロピウム塩を含有する吸入液組成物 | |
| PL211227B1 (pl) | Kompozycja farmaceutyczna zawierająca środek przeciwcholinergiczny i steroid oraz zastosowanie kompozycji | |
| NZ536282A (en) | Aerosol formulation for inhalation comprising a tiotropium salt |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060403 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060403 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091130 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100223 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100302 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20101012 |