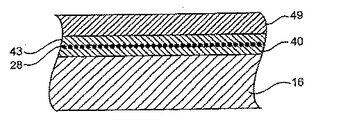
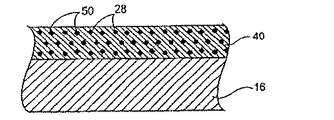
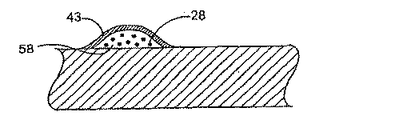
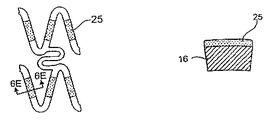
JP2005507708A - 移植された人工器官からの変更可能に制御された物質の送達のための装置および方法 - Google Patents
移植された人工器官からの変更可能に制御された物質の送達のための装置および方法 Download PDFInfo
- Publication number
- JP2005507708A JP2005507708A JP2003539571A JP2003539571A JP2005507708A JP 2005507708 A JP2005507708 A JP 2005507708A JP 2003539571 A JP2003539571 A JP 2003539571A JP 2003539571 A JP2003539571 A JP 2003539571A JP 2005507708 A JP2005507708 A JP 2005507708A
- Authority
- JP
- Japan
- Prior art keywords
- control element
- therapeutic
- scaffold
- rate control
- source
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000000034 method Methods 0.000 title claims description 63
- 229940125368 controlled substance Drugs 0.000 title abstract 2
- 239000000599 controlled substance Substances 0.000 title abstract 2
- 239000000463 material Substances 0.000 claims abstract description 87
- 239000000126 substance Substances 0.000 claims abstract description 42
- 239000003814 drug Substances 0.000 claims description 255
- 230000001225 therapeutic effect Effects 0.000 claims description 251
- 229940079593 drug Drugs 0.000 claims description 165
- 239000003795 chemical substances by application Substances 0.000 claims description 151
- 229940124597 therapeutic agent Drugs 0.000 claims description 88
- 238000000576 coating method Methods 0.000 claims description 66
- 239000011159 matrix material Substances 0.000 claims description 61
- 239000011248 coating agent Substances 0.000 claims description 56
- 229920000642 polymer Polymers 0.000 claims description 50
- 229920000052 poly(p-xylylene) Polymers 0.000 claims description 49
- -1 polyethylene Polymers 0.000 claims description 33
- 229920001577 copolymer Polymers 0.000 claims description 25
- 239000011148 porous material Substances 0.000 claims description 23
- VRBFTYUMFJWSJY-UHFFFAOYSA-N 28804-46-8 Chemical compound ClC1CC(C=C2)=CC=C2C(Cl)CC2=CC=C1C=C2 VRBFTYUMFJWSJY-UHFFFAOYSA-N 0.000 claims description 21
- 238000010438 heat treatment Methods 0.000 claims description 19
- 229910052751 metal Inorganic materials 0.000 claims description 18
- 239000002184 metal Substances 0.000 claims description 18
- 210000001124 body fluid Anatomy 0.000 claims description 15
- 230000008859 change Effects 0.000 claims description 13
- 238000004519 manufacturing process Methods 0.000 claims description 13
- 230000002829 reductive effect Effects 0.000 claims description 13
- 229920002635 polyurethane Polymers 0.000 claims description 12
- 239000004814 polyurethane Substances 0.000 claims description 12
- 238000002844 melting Methods 0.000 claims description 11
- 230000008018 melting Effects 0.000 claims description 11
- 229910045601 alloy Inorganic materials 0.000 claims description 9
- 239000000956 alloy Substances 0.000 claims description 9
- 239000010839 body fluid Substances 0.000 claims description 7
- 230000009477 glass transition Effects 0.000 claims description 7
- 238000002513 implantation Methods 0.000 claims description 7
- 229920002678 cellulose Polymers 0.000 claims description 6
- 239000001913 cellulose Substances 0.000 claims description 6
- 230000004907 flux Effects 0.000 claims description 6
- 239000007769 metal material Substances 0.000 claims description 6
- 229920002379 silicone rubber Polymers 0.000 claims description 6
- 239000004945 silicone rubber Substances 0.000 claims description 6
- 239000004698 Polyethylene Substances 0.000 claims description 5
- 238000013270 controlled release Methods 0.000 claims description 5
- 229920000573 polyethylene Polymers 0.000 claims description 5
- 230000006835 compression Effects 0.000 claims description 3
- 238000007906 compression Methods 0.000 claims description 3
- 230000001747 exhibiting effect Effects 0.000 claims description 3
- 230000002459 sustained effect Effects 0.000 claims description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 2
- 239000001301 oxygen Substances 0.000 claims description 2
- 229910052760 oxygen Inorganic materials 0.000 claims description 2
- 238000005452 bending Methods 0.000 claims 5
- 210000004204 blood vessel Anatomy 0.000 abstract description 16
- 210000001519 tissue Anatomy 0.000 description 57
- 150000001875 compounds Chemical class 0.000 description 51
- 239000010410 layer Substances 0.000 description 50
- 229940126585 therapeutic drug Drugs 0.000 description 45
- 238000000151 deposition Methods 0.000 description 41
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 38
- 230000008021 deposition Effects 0.000 description 37
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 36
- 229960000951 mycophenolic acid Drugs 0.000 description 36
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 33
- 239000002904 solvent Substances 0.000 description 26
- 238000011282 treatment Methods 0.000 description 20
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 18
- 238000002399 angioplasty Methods 0.000 description 18
- 208000037803 restenosis Diseases 0.000 description 18
- 239000007789 gas Substances 0.000 description 17
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 15
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 15
- 229940098773 bovine serum albumin Drugs 0.000 description 15
- 229910052799 carbon Inorganic materials 0.000 description 15
- 230000004888 barrier function Effects 0.000 description 14
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 13
- UODXSCCNACAPCE-UHFFFAOYSA-N draft:flumetramide Chemical compound C1=CC(C(F)(F)F)=CC=C1C1OCC(=O)NC1 UODXSCCNACAPCE-UHFFFAOYSA-N 0.000 description 13
- 229910001220 stainless steel Inorganic materials 0.000 description 13
- 239000010935 stainless steel Substances 0.000 description 13
- 230000015572 biosynthetic process Effects 0.000 description 12
- 229920006217 cellulose acetate butyrate Polymers 0.000 description 12
- 230000000694 effects Effects 0.000 description 11
- 230000001965 increasing effect Effects 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 10
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 10
- 239000008280 blood Substances 0.000 description 9
- 210000004369 blood Anatomy 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 239000010408 film Substances 0.000 description 9
- 239000003112 inhibitor Substances 0.000 description 9
- 150000002739 metals Chemical class 0.000 description 9
- 239000000178 monomer Substances 0.000 description 9
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 8
- 125000000539 amino acid group Chemical group 0.000 description 8
- 239000002246 antineoplastic agent Substances 0.000 description 8
- 230000015556 catabolic process Effects 0.000 description 8
- RRGUKTPIGVIEKM-UHFFFAOYSA-N cilostazol Chemical compound C=1C=C2NC(=O)CCC2=CC=1OCCCCC1=NN=NN1C1CCCCC1 RRGUKTPIGVIEKM-UHFFFAOYSA-N 0.000 description 8
- 238000006731 degradation reaction Methods 0.000 description 8
- 239000000017 hydrogel Substances 0.000 description 8
- 229920001296 polysiloxane Polymers 0.000 description 8
- 238000002604 ultrasonography Methods 0.000 description 8
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 7
- 238000009792 diffusion process Methods 0.000 description 7
- 230000007062 hydrolysis Effects 0.000 description 7
- 238000006460 hydrolysis reaction Methods 0.000 description 7
- 230000002209 hydrophobic effect Effects 0.000 description 7
- 210000000056 organ Anatomy 0.000 description 7
- 239000002243 precursor Substances 0.000 description 7
- 230000008569 process Effects 0.000 description 7
- 238000000859 sublimation Methods 0.000 description 7
- 230000008022 sublimation Effects 0.000 description 7
- VHRSUDSXCMQTMA-PJHHCJLFSA-N 6alpha-methylprednisolone Chemical compound C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)CO)CC[C@H]21 VHRSUDSXCMQTMA-PJHHCJLFSA-N 0.000 description 6
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 6
- 229920002732 Polyanhydride Polymers 0.000 description 6
- 239000002202 Polyethylene glycol Substances 0.000 description 6
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 6
- DFBIRQPKNDILPW-CIVMWXNOSA-N Triptolide Chemical compound O=C1OCC([C@@H]2C3)=C1CC[C@]2(C)[C@]12O[C@H]1[C@@H]1O[C@]1(C(C)C)[C@@H](O)[C@]21[C@H]3O1 DFBIRQPKNDILPW-CIVMWXNOSA-N 0.000 description 6
- 150000001413 amino acids Chemical class 0.000 description 6
- 210000004027 cell Anatomy 0.000 description 6
- 238000005886 esterification reaction Methods 0.000 description 6
- 229920000578 graft copolymer Polymers 0.000 description 6
- 206010020718 hyperplasia Diseases 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- 229960004584 methylprednisolone Drugs 0.000 description 6
- 229920001223 polyethylene glycol Polymers 0.000 description 6
- 238000000197 pyrolysis Methods 0.000 description 6
- 229910000077 silane Inorganic materials 0.000 description 6
- 239000007921 spray Substances 0.000 description 6
- 238000005507 spraying Methods 0.000 description 6
- YKUJZZHGTWVWHA-UHFFFAOYSA-N triptolide Natural products COC12CC3OC3(C(C)C)C(O)C14OC4CC5C6=C(CCC25C)C(=O)OC6 YKUJZZHGTWVWHA-UHFFFAOYSA-N 0.000 description 6
- 238000009834 vaporization Methods 0.000 description 6
- 230000008016 vaporization Effects 0.000 description 6
- JVTAAEKCZFNVCJ-REOHCLBHSA-N L-lactic acid Chemical compound C[C@H](O)C(O)=O JVTAAEKCZFNVCJ-REOHCLBHSA-N 0.000 description 5
- 210000001367 artery Anatomy 0.000 description 5
- 238000009835 boiling Methods 0.000 description 5
- 239000000919 ceramic Substances 0.000 description 5
- 238000005336 cracking Methods 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 238000012377 drug delivery Methods 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 210000002966 serum Anatomy 0.000 description 5
- 238000001771 vacuum deposition Methods 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 239000005552 B01AC04 - Clopidogrel Substances 0.000 description 4
- 108010056764 Eptifibatide Proteins 0.000 description 4
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 4
- WOBHKFSMXKNTIM-UHFFFAOYSA-N Hydroxyethyl methacrylate Chemical compound CC(=C)C(=O)OCCO WOBHKFSMXKNTIM-UHFFFAOYSA-N 0.000 description 4
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 4
- 229920002873 Polyethylenimine Polymers 0.000 description 4
- REFJWTPEDVJJIY-UHFFFAOYSA-N Quercetin Chemical compound C=1C(O)=CC(O)=C(C(C=2O)=O)C=1OC=2C1=CC=C(O)C(O)=C1 REFJWTPEDVJJIY-UHFFFAOYSA-N 0.000 description 4
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 4
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 4
- 239000001361 adipic acid Substances 0.000 description 4
- 235000011037 adipic acid Nutrition 0.000 description 4
- 230000003474 anti-emetic effect Effects 0.000 description 4
- 239000003146 anticoagulant agent Substances 0.000 description 4
- 229940125683 antiemetic agent Drugs 0.000 description 4
- 239000002111 antiemetic agent Substances 0.000 description 4
- 229920002988 biodegradable polymer Polymers 0.000 description 4
- 239000004621 biodegradable polymer Substances 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 229960004588 cilostazol Drugs 0.000 description 4
- GKTWGGQPFAXNFI-HNNXBMFYSA-N clopidogrel Chemical compound C1([C@H](N2CC=3C=CSC=3CC2)C(=O)OC)=CC=CC=C1Cl GKTWGGQPFAXNFI-HNNXBMFYSA-N 0.000 description 4
- 229960003957 dexamethasone Drugs 0.000 description 4
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 4
- 238000010828 elution Methods 0.000 description 4
- CZKPOZZJODAYPZ-LROMGURASA-N eptifibatide Chemical compound N1C(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CCCCNC(=N)N)NC(=O)CCSSC[C@@H](C(N)=O)NC(=O)[C@@H]2CCCN2C(=O)[C@@H]1CC1=CNC2=CC=CC=C12 CZKPOZZJODAYPZ-LROMGURASA-N 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 229920000669 heparin Polymers 0.000 description 4
- 229960002897 heparin Drugs 0.000 description 4
- 229920001519 homopolymer Polymers 0.000 description 4
- 239000006249 magnetic particle Substances 0.000 description 4
- 230000000873 masking effect Effects 0.000 description 4
- 239000002207 metabolite Substances 0.000 description 4
- 229910001092 metal group alloy Inorganic materials 0.000 description 4
- 229960000485 methotrexate Drugs 0.000 description 4
- RTGDFNSFWBGLEC-SYZQJQIISA-N mycophenolate mofetil Chemical compound COC1=C(C)C=2COC(=O)C=2C(O)=C1C\C=C(/C)CCC(=O)OCCN1CCOCC1 RTGDFNSFWBGLEC-SYZQJQIISA-N 0.000 description 4
- 229960004866 mycophenolate mofetil Drugs 0.000 description 4
- 229910001000 nickel titanium Inorganic materials 0.000 description 4
- HLXZNVUGXRDIFK-UHFFFAOYSA-N nickel titanium Chemical compound [Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ti].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni].[Ni] HLXZNVUGXRDIFK-UHFFFAOYSA-N 0.000 description 4
- 229940095638 pletal Drugs 0.000 description 4
- 229920001610 polycaprolactone Polymers 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 4
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 4
- 210000000329 smooth muscle myocyte Anatomy 0.000 description 4
- QJJXYPPXXYFBGM-SHYZHZOCSA-N tacrolimus Natural products CO[C@H]1C[C@H](CC[C@@H]1O)C=C(C)[C@H]2OC(=O)[C@H]3CCCCN3C(=O)C(=O)[C@@]4(O)O[C@@H]([C@H](C[C@H]4C)OC)[C@@H](C[C@H](C)CC(=C[C@@H](CC=C)C(=O)C[C@H](O)[C@H]2C)C)OC QJJXYPPXXYFBGM-SHYZHZOCSA-N 0.000 description 4
- PHWBOXQYWZNQIN-UHFFFAOYSA-N ticlopidine Chemical compound ClC1=CC=CC=C1CN1CC(C=CS2)=C2CC1 PHWBOXQYWZNQIN-UHFFFAOYSA-N 0.000 description 4
- 239000006200 vaporizer Substances 0.000 description 4
- 230000002792 vascular Effects 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 108010088751 Albumins Proteins 0.000 description 3
- 102000009027 Albumins Human genes 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 3
- 102000008186 Collagen Human genes 0.000 description 3
- 108010035532 Collagen Proteins 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 102000009123 Fibrin Human genes 0.000 description 3
- 108010073385 Fibrin Proteins 0.000 description 3
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000004677 Nylon Substances 0.000 description 3
- 229920001710 Polyorthoester Polymers 0.000 description 3
- 201000004681 Psoriasis Diseases 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 description 3
- 230000000975 bioactive effect Effects 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 229940127089 cytotoxic agent Drugs 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000003111 delayed effect Effects 0.000 description 3
- 239000000539 dimer Substances 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 238000010894 electron beam technology Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 229950003499 fibrin Drugs 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 208000014674 injury Diseases 0.000 description 3
- 238000013152 interventional procedure Methods 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- 229920001778 nylon Polymers 0.000 description 3
- NRNFFDZCBYOZJY-UHFFFAOYSA-N p-quinodimethane Chemical group C=C1C=CC(=C)C=C1 NRNFFDZCBYOZJY-UHFFFAOYSA-N 0.000 description 3
- 229920001432 poly(L-lactide) Polymers 0.000 description 3
- 239000004632 polycaprolactone Substances 0.000 description 3
- 239000004417 polycarbonate Substances 0.000 description 3
- 229920000515 polycarbonate Polymers 0.000 description 3
- 239000004810 polytetrafluoroethylene Substances 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 230000008961 swelling Effects 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- QDLHCMPXEPAAMD-QAIWCSMKSA-N wortmannin Chemical compound C1([C@]2(C)C3=C(C4=O)OC=C3C(=O)O[C@@H]2COC)=C4[C@@H]2CCC(=O)[C@@]2(C)C[C@H]1OC(C)=O QDLHCMPXEPAAMD-QAIWCSMKSA-N 0.000 description 3
- QDLHCMPXEPAAMD-UHFFFAOYSA-N wortmannin Natural products COCC1OC(=O)C2=COC(C3=O)=C2C1(C)C1=C3C2CCC(=O)C2(C)CC1OC(C)=O QDLHCMPXEPAAMD-UHFFFAOYSA-N 0.000 description 3
- XMQUEQJCYRFIQS-YFKPBYRVSA-N (2s)-2-amino-5-ethoxy-5-oxopentanoic acid Chemical compound CCOC(=O)CC[C@H](N)C(O)=O XMQUEQJCYRFIQS-YFKPBYRVSA-N 0.000 description 2
- RFFLAFLAYFXFSW-UHFFFAOYSA-N 1,2-dichlorobenzene Chemical compound ClC1=CC=CC=C1Cl RFFLAFLAYFXFSW-UHFFFAOYSA-N 0.000 description 2
- QXOGPTXQGKQSJT-UHFFFAOYSA-N 1-amino-4-[4-(3,4-dimethylphenyl)sulfanylanilino]-9,10-dioxoanthracene-2-sulfonic acid Chemical compound Cc1ccc(Sc2ccc(Nc3cc(c(N)c4C(=O)c5ccccc5C(=O)c34)S(O)(=O)=O)cc2)cc1C QXOGPTXQGKQSJT-UHFFFAOYSA-N 0.000 description 2
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 2
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 2
- XDLMVUHYZWKMMD-UHFFFAOYSA-N 3-trimethoxysilylpropyl 2-methylprop-2-enoate Chemical group CO[Si](OC)(OC)CCCOC(=O)C(C)=C XDLMVUHYZWKMMD-UHFFFAOYSA-N 0.000 description 2
- SJZRECIVHVDYJC-UHFFFAOYSA-N 4-hydroxybutyric acid Chemical compound OCCCC(O)=O SJZRECIVHVDYJC-UHFFFAOYSA-N 0.000 description 2
- BSYNRYMUTXBXSQ-FOQJRBATSA-N 59096-14-9 Chemical compound CC(=O)OC1=CC=CC=C1[14C](O)=O BSYNRYMUTXBXSQ-FOQJRBATSA-N 0.000 description 2
- KKJUPNGICOCCDW-UHFFFAOYSA-N 7-N,N-Dimethylamino-1,2,3,4,5-pentathiocyclooctane Chemical compound CN(C)C1CSSSSSC1 KKJUPNGICOCCDW-UHFFFAOYSA-N 0.000 description 2
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 2
- 239000005528 B01AC05 - Ticlopidine Substances 0.000 description 2
- SOGAXMICEFXMKE-UHFFFAOYSA-N Butylmethacrylate Chemical compound CCCCOC(=O)C(C)=C SOGAXMICEFXMKE-UHFFFAOYSA-N 0.000 description 2
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 2
- 229940127291 Calcium channel antagonist Drugs 0.000 description 2
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 2
- 229920002567 Chondroitin Polymers 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 2
- 108010036949 Cyclosporine Proteins 0.000 description 2
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 2
- 239000005977 Ethylene Substances 0.000 description 2
- 229920000219 Ethylene vinyl alcohol Polymers 0.000 description 2
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- 229940123457 Free radical scavenger Drugs 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 229930186217 Glycolipid Natural products 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 229920002683 Glycosaminoglycan Polymers 0.000 description 2
- HZQDCMWJEBCWBR-UUOKFMHZSA-N Mizoribine Chemical compound OC1=C(C(=O)N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 HZQDCMWJEBCWBR-UUOKFMHZSA-N 0.000 description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 2
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical class O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 2
- 208000031481 Pathologic Constriction Diseases 0.000 description 2
- 229920000954 Polyglycolide Polymers 0.000 description 2
- ZVOLCUVKHLEPEV-UHFFFAOYSA-N Quercetagetin Natural products C1=C(O)C(O)=CC=C1C1=C(O)C(=O)C2=C(O)C(O)=C(O)C=C2O1 ZVOLCUVKHLEPEV-UHFFFAOYSA-N 0.000 description 2
- HWTZYBCRDDUBJY-UHFFFAOYSA-N Rhynchosin Natural products C1=C(O)C(O)=CC=C1C1=C(O)C(=O)C2=CC(O)=C(O)C=C2O1 HWTZYBCRDDUBJY-UHFFFAOYSA-N 0.000 description 2
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 2
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 2
- 229910000767 Tm alloy Inorganic materials 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 229960000446 abciximab Drugs 0.000 description 2
- 229960001138 acetylsalicylic acid Drugs 0.000 description 2
- 229960005305 adenosine Drugs 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 229920003232 aliphatic polyester Polymers 0.000 description 2
- 239000004037 angiogenesis inhibitor Substances 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 230000001772 anti-angiogenic effect Effects 0.000 description 2
- 230000003510 anti-fibrotic effect Effects 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 229940124599 anti-inflammatory drug Drugs 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 230000002095 anti-migrative effect Effects 0.000 description 2
- 230000000702 anti-platelet effect Effects 0.000 description 2
- 230000001028 anti-proliverative effect Effects 0.000 description 2
- 229940127090 anticoagulant agent Drugs 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- 229940127218 antiplatelet drug Drugs 0.000 description 2
- 229960004676 antithrombotic agent Drugs 0.000 description 2
- 239000003443 antiviral agent Substances 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- ZDQSOHOQTUFQEM-PKUCKEGBSA-N ascomycin Chemical compound C/C([C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@]2(O)O[C@@H]([C@H](C[C@H]2C)OC)[C@@H](OC)C[C@@H](C)C\C(C)=C/[C@H](C(C[C@H](O)[C@H]1C)=O)CC)=C\[C@@H]1CC[C@@H](O)[C@H](OC)C1 ZDQSOHOQTUFQEM-PKUCKEGBSA-N 0.000 description 2
- ZDQSOHOQTUFQEM-XCXYXIJFSA-N ascomycin Natural products CC[C@H]1C=C(C)C[C@@H](C)C[C@@H](OC)[C@H]2O[C@@](O)([C@@H](C)C[C@H]2OC)C(=O)C(=O)N3CCCC[C@@H]3C(=O)O[C@H]([C@H](C)[C@@H](O)CC1=O)C(=C[C@@H]4CC[C@@H](O)[C@H](C4)OC)C ZDQSOHOQTUFQEM-XCXYXIJFSA-N 0.000 description 2
- 229960002170 azathioprine Drugs 0.000 description 2
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- QZVNQOLPLYWLHQ-ZEQKJWHPSA-N benidipine Chemical compound C1([C@H]2C(=C(C)NC(C)=C2C(=O)OC)C(=O)O[C@H]2CN(CC=3C=CC=CC=3)CCC2)=CC=CC([N+]([O-])=O)=C1 QZVNQOLPLYWLHQ-ZEQKJWHPSA-N 0.000 description 2
- 229960004916 benidipine Drugs 0.000 description 2
- XKXHCNPAFAXVRZ-UHFFFAOYSA-N benzylazanium;chloride Chemical compound [Cl-].[NH3+]CC1=CC=CC=C1 XKXHCNPAFAXVRZ-UHFFFAOYSA-N 0.000 description 2
- 230000003115 biocidal effect Effects 0.000 description 2
- 239000000560 biocompatible material Substances 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- MYXPLUNESFFVPY-UHFFFAOYSA-N butanoic acid;methyl 2-methylprop-2-enoate Chemical compound CCCC(O)=O.COC(=O)C(C)=C MYXPLUNESFFVPY-UHFFFAOYSA-N 0.000 description 2
- 229940127093 camptothecin Drugs 0.000 description 2
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 2
- 230000000747 cardiac effect Effects 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- DLGJWSVWTWEWBJ-HGGSSLSASA-N chondroitin Chemical compound CC(O)=N[C@@H]1[C@H](O)O[C@H](CO)[C@H](O)[C@@H]1OC1[C@H](O)[C@H](O)C=C(C(O)=O)O1 DLGJWSVWTWEWBJ-HGGSSLSASA-N 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 239000011651 chromium Substances 0.000 description 2
- 229960001265 ciclosporin Drugs 0.000 description 2
- 229960003009 clopidogrel Drugs 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 210000004351 coronary vessel Anatomy 0.000 description 2
- 230000007797 corrosion Effects 0.000 description 2
- 238000005260 corrosion Methods 0.000 description 2
- 239000007822 coupling agent Substances 0.000 description 2
- 229960004397 cyclophosphamide Drugs 0.000 description 2
- 229930182912 cyclosporin Natural products 0.000 description 2
- 229960002806 daclizumab Drugs 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- 230000000593 degrading effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- VILAVOFMIJHSJA-UHFFFAOYSA-N dicarbon monoxide Chemical compound [C]=C=O VILAVOFMIJHSJA-UHFFFAOYSA-N 0.000 description 2
- 229960002768 dipyridamole Drugs 0.000 description 2
- IZEKFCXSFNUWAM-UHFFFAOYSA-N dipyridamole Chemical compound C=12N=C(N(CCO)CCO)N=C(N3CCCCC3)C2=NC(N(CCO)CCO)=NC=1N1CCCCC1 IZEKFCXSFNUWAM-UHFFFAOYSA-N 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 2
- 238000006056 electrooxidation reaction Methods 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 229960004468 eptifibatide Drugs 0.000 description 2
- 229960005167 everolimus Drugs 0.000 description 2
- 239000003527 fibrinolytic agent Substances 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 229960005277 gemcitabine Drugs 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 229910052737 gold Inorganic materials 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 239000013003 healing agent Substances 0.000 description 2
- ZSIAUFGUXNUGDI-UHFFFAOYSA-N hexan-1-ol Chemical compound CCCCCCO ZSIAUFGUXNUGDI-UHFFFAOYSA-N 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 229960003444 immunosuppressant agent Drugs 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- 239000007943 implant Substances 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 229940056984 integrilin Drugs 0.000 description 2
- MWDZOUNAPSSOEL-UHFFFAOYSA-N kaempferol Natural products OC1=C(C(=O)c2cc(O)cc(O)c2O1)c3ccc(O)cc3 MWDZOUNAPSSOEL-UHFFFAOYSA-N 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- 238000013147 laser angioplasty Methods 0.000 description 2
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 2
- 230000000394 mitotic effect Effects 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 229950000844 mizoribine Drugs 0.000 description 2
- 239000002105 nanoparticle Substances 0.000 description 2
- 239000005445 natural material Substances 0.000 description 2
- 239000002840 nitric oxide donor Substances 0.000 description 2
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 2
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 2
- 229920001542 oligosaccharide Polymers 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- TZMFJUDUGYTVRY-UHFFFAOYSA-N pentane-2,3-dione Chemical compound CCC(=O)C(C)=O TZMFJUDUGYTVRY-UHFFFAOYSA-N 0.000 description 2
- YHHSONZFOIEMCP-UHFFFAOYSA-O phosphocholine Chemical compound C[N+](C)(C)CCOP(O)(O)=O YHHSONZFOIEMCP-UHFFFAOYSA-O 0.000 description 2
- 239000002570 phosphodiesterase III inhibitor Substances 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 229950004354 phosphorylcholine Drugs 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 239000000106 platelet aggregation inhibitor Substances 0.000 description 2
- 229940020573 plavix Drugs 0.000 description 2
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 2
- 229920000218 poly(hydroxyvalerate) Polymers 0.000 description 2
- 229920000747 poly(lactic acid) Polymers 0.000 description 2
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 2
- 239000002745 poly(ortho ester) Substances 0.000 description 2
- 229920002463 poly(p-dioxanone) polymer Polymers 0.000 description 2
- 229920002627 poly(phosphazenes) Polymers 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 229920002721 polycyanoacrylate Polymers 0.000 description 2
- 239000000622 polydioxanone Substances 0.000 description 2
- 229920006149 polyester-amide block copolymer Polymers 0.000 description 2
- 230000000379 polymerizing effect Effects 0.000 description 2
- 239000004926 polymethyl methacrylate Substances 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 229920000915 polyvinyl chloride Polymers 0.000 description 2
- 239000004800 polyvinyl chloride Substances 0.000 description 2
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 2
- 229960004618 prednisone Drugs 0.000 description 2
- 238000002203 pretreatment Methods 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 239000002599 prostaglandin synthase inhibitor Substances 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 229960001285 quercetin Drugs 0.000 description 2
- 235000005875 quercetin Nutrition 0.000 description 2
- 239000002516 radical scavenger Substances 0.000 description 2
- 230000003439 radiotherapeutic effect Effects 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 239000012048 reactive intermediate Substances 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 229960002477 riboflavin Drugs 0.000 description 2
- 235000019192 riboflavin Nutrition 0.000 description 2
- 239000002151 riboflavin Substances 0.000 description 2
- 229960004889 salicylic acid Drugs 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 230000036262 stenosis Effects 0.000 description 2
- 208000037804 stenosis Diseases 0.000 description 2
- 230000002966 stenotic effect Effects 0.000 description 2
- FIAFUQMPZJWCLV-UHFFFAOYSA-N suramin Chemical compound OS(=O)(=O)C1=CC(S(O)(=O)=O)=C2C(NC(=O)C3=CC=C(C(=C3)NC(=O)C=3C=C(NC(=O)NC=4C=C(C=CC=4)C(=O)NC=4C(=CC=C(C=4)C(=O)NC=4C5=C(C=C(C=C5C(=CC=4)S(O)(=O)=O)S(O)(=O)=O)S(O)(=O)=O)C)C=CC=3)C)=CC=C(S(O)(=O)=O)C2=C1 FIAFUQMPZJWCLV-UHFFFAOYSA-N 0.000 description 2
- 229960005314 suramin Drugs 0.000 description 2
- 229960001967 tacrolimus Drugs 0.000 description 2
- 229960003433 thalidomide Drugs 0.000 description 2
- 229960000103 thrombolytic agent Drugs 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 229940028869 ticlid Drugs 0.000 description 2
- 229960005001 ticlopidine Drugs 0.000 description 2
- 229910052719 titanium Inorganic materials 0.000 description 2
- 239000010936 titanium Substances 0.000 description 2
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 2
- 229960000303 topotecan Drugs 0.000 description 2
- NZHGWWWHIYHZNX-CSKARUKUSA-N tranilast Chemical compound C1=C(OC)C(OC)=CC=C1\C=C\C(=O)NC1=CC=CC=C1C(O)=O NZHGWWWHIYHZNX-CSKARUKUSA-N 0.000 description 2
- 229960005342 tranilast Drugs 0.000 description 2
- 238000007740 vapor deposition Methods 0.000 description 2
- 229940124549 vasodilator Drugs 0.000 description 2
- 239000003071 vasodilator agent Substances 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- PAPBSGBWRJIAAV-UHFFFAOYSA-N ε-Caprolactone Chemical compound O=C1CCCCCO1 PAPBSGBWRJIAAV-UHFFFAOYSA-N 0.000 description 2
- BOSAWIQFTJIYIS-UHFFFAOYSA-N 1,1,1-trichloro-2,2,2-trifluoroethane Chemical compound FC(F)(F)C(Cl)(Cl)Cl BOSAWIQFTJIYIS-UHFFFAOYSA-N 0.000 description 1
- ICGQLNMKJVHCIR-UHFFFAOYSA-N 1,3,2-dioxazetidin-4-one Chemical compound O=C1ONO1 ICGQLNMKJVHCIR-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- VUQPJRPDRDVQMN-UHFFFAOYSA-N 1-chlorooctadecane Chemical compound CCCCCCCCCCCCCCCCCCCl VUQPJRPDRDVQMN-UHFFFAOYSA-N 0.000 description 1
- OOLUVSIJOMLOCB-UHFFFAOYSA-N 1633-22-3 Chemical compound C1CC(C=C2)=CC=C2CCC2=CC=C1C=C2 OOLUVSIJOMLOCB-UHFFFAOYSA-N 0.000 description 1
- DSUFPYCILZXJFF-UHFFFAOYSA-N 4-[[4-[[4-(pentoxycarbonylamino)cyclohexyl]methyl]cyclohexyl]carbamoyloxy]butyl n-[4-[[4-(butoxycarbonylamino)cyclohexyl]methyl]cyclohexyl]carbamate Chemical compound C1CC(NC(=O)OCCCCC)CCC1CC1CCC(NC(=O)OCCCCOC(=O)NC2CCC(CC3CCC(CC3)NC(=O)OCCCC)CC2)CC1 DSUFPYCILZXJFF-UHFFFAOYSA-N 0.000 description 1
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 1
- 229920000049 Carbon (fiber) Polymers 0.000 description 1
- 241000258920 Chilopoda Species 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 206010016717 Fistula Diseases 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000000521 Immunophilins Human genes 0.000 description 1
- 108010016648 Immunophilins Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- NHTMVDHEPJAVLT-UHFFFAOYSA-N Isooctane Chemical compound CC(C)CC(C)(C)C NHTMVDHEPJAVLT-UHFFFAOYSA-N 0.000 description 1
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004695 Polyether sulfone Substances 0.000 description 1
- 229920000331 Polyhydroxybutyrate Polymers 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 206010047163 Vasospasm Diseases 0.000 description 1
- FJWGYAHXMCUOOM-QHOUIDNNSA-N [(2s,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6s)-4,5-dinitrooxy-2-(nitrooxymethyl)-6-[(2r,3r,4s,5r,6s)-4,5,6-trinitrooxy-2-(nitrooxymethyl)oxan-3-yl]oxyoxan-3-yl]oxy-3,5-dinitrooxy-6-(nitrooxymethyl)oxan-4-yl] nitrate Chemical compound O([C@@H]1O[C@@H]([C@H]([C@H](O[N+]([O-])=O)[C@H]1O[N+]([O-])=O)O[C@H]1[C@@H]([C@@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)[C@@H](CO[N+]([O-])=O)O1)O[N+]([O-])=O)CO[N+](=O)[O-])[C@@H]1[C@@H](CO[N+]([O-])=O)O[C@@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)[C@H]1O[N+]([O-])=O FJWGYAHXMCUOOM-QHOUIDNNSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 239000002318 adhesion promoter Substances 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 210000000709 aorta Anatomy 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000003143 atherosclerotic effect Effects 0.000 description 1
- 238000000418 atomic force spectrum Methods 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- KVNRLNFWIYMESJ-UHFFFAOYSA-N butyronitrile Chemical compound CCCC#N KVNRLNFWIYMESJ-UHFFFAOYSA-N 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000004917 carbon fiber Substances 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 239000007806 chemical reaction intermediate Substances 0.000 description 1
- 230000004087 circulation Effects 0.000 description 1
- 238000004581 coalescence Methods 0.000 description 1
- 239000004035 construction material Substances 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 238000002788 crimping Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- JVSWJIKNEAIKJW-UHFFFAOYSA-N dimethyl-hexane Natural products CCCCCC(C)C JVSWJIKNEAIKJW-UHFFFAOYSA-N 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000005553 drilling Methods 0.000 description 1
- 239000013013 elastic material Substances 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 210000003722 extracellular fluid Anatomy 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 229960000556 fingolimod Drugs 0.000 description 1
- KKGQTZUTZRNORY-UHFFFAOYSA-N fingolimod Chemical compound CCCCCCCCC1=CC=C(CCC(N)(CO)CO)C=C1 KKGQTZUTZRNORY-UHFFFAOYSA-N 0.000 description 1
- 230000003890 fistula Effects 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 210000004907 gland Anatomy 0.000 description 1
- 229930182480 glucuronide Natural products 0.000 description 1
- 150000008134 glucuronides Chemical class 0.000 description 1
- 229960002706 gusperimus Drugs 0.000 description 1
- 210000003709 heart valve Anatomy 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- RNYJXPUAFDFIQJ-UHFFFAOYSA-N hydron;octadecan-1-amine;chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCCCC[NH3+] RNYJXPUAFDFIQJ-UHFFFAOYSA-N 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000005468 ion implantation Methods 0.000 description 1
- 238000010884 ion-beam technique Methods 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 238000002595 magnetic resonance imaging Methods 0.000 description 1
- 230000005285 magnetism related processes and functions Effects 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- IDINUJSAMVOPCM-INIZCTEOSA-N n-[(1s)-2-[4-(3-aminopropylamino)butylamino]-1-hydroxy-2-oxoethyl]-7-(diaminomethylideneamino)heptanamide Chemical compound NCCCNCCCCNC(=O)[C@H](O)NC(=O)CCCCCCN=C(N)N IDINUJSAMVOPCM-INIZCTEOSA-N 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- 210000005170 neoplastic cell Anatomy 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000000399 orthopedic effect Effects 0.000 description 1
- 239000003002 pH adjusting agent Substances 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- 238000005192 partition Methods 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- QQBPIHBUCMDKFG-UHFFFAOYSA-N phenazopyridine hydrochloride Chemical compound Cl.NC1=NC(N)=CC=C1N=NC1=CC=CC=C1 QQBPIHBUCMDKFG-UHFFFAOYSA-N 0.000 description 1
- 238000009832 plasma treatment Methods 0.000 description 1
- 230000010118 platelet activation Effects 0.000 description 1
- 239000005015 poly(hydroxybutyrate) Substances 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920006393 polyether sulfone Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000007781 pre-processing Methods 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 238000006748 scratching Methods 0.000 description 1
- 230000002393 scratching effect Effects 0.000 description 1
- 229910001285 shape-memory alloy Inorganic materials 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000000344 soap Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000007779 soft material Substances 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 238000000935 solvent evaporation Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000003746 surface roughness Effects 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 238000005979 thermal decomposition reaction Methods 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 230000001732 thrombotic effect Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 229940070710 valerate Drugs 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
- A61F2/91—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
- A61F2/91—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes
- A61F2/915—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes with bands having a meander structure, adjacent bands being connected to each other
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/14—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L31/16—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/95—Instruments specially adapted for placement or removal of stents or stent-grafts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
- A61F2/91—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes
- A61F2/915—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes with bands having a meander structure, adjacent bands being connected to each other
- A61F2002/91533—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes with bands having a meander structure, adjacent bands being connected to each other characterised by the phase between adjacent bands
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
- A61F2/91—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes
- A61F2/915—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes with bands having a meander structure, adjacent bands being connected to each other
- A61F2002/9155—Adjacent bands being connected to each other
- A61F2002/91558—Adjacent bands being connected to each other connected peak to peak
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2/00—Filters implantable into blood vessels; Prostheses, i.e. artificial substitutes or replacements for parts of the body; Appliances for connecting them with the body; Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/82—Devices providing patency to, or preventing collapsing of, tubular structures of the body, e.g. stents
- A61F2/86—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure
- A61F2/90—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure
- A61F2/91—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes
- A61F2/915—Stents in a form characterised by the wire-like elements; Stents in the form characterised by a net-like or mesh-like structure characterised by a net-like or mesh-like structure made from perforated sheets or tubes, e.g. perforated by laser cuts or etched holes with bands having a meander structure, adjacent bands being connected to each other
- A61F2002/9155—Adjacent bands being connected to each other
- A61F2002/91583—Adjacent bands being connected to each other by a bridge, whereby at least one of its ends is connected along the length of a strut between two consecutive apices within a band
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2230/00—Geometry of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2230/0002—Two-dimensional shapes, e.g. cross-sections
- A61F2230/0028—Shapes in the form of latin or greek characters
- A61F2230/0054—V-shaped
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
- A61F2250/0068—Means for introducing or releasing pharmaceutical products into the body the pharmaceutical product being in a reservoir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/416—Anti-neoplastic or anti-proliferative or anti-restenosis or anti-angiogenic agents, e.g. paclitaxel, sirolimus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/60—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a special physical form
- A61L2300/602—Type of release, e.g. controlled, sustained, slow
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Chemical & Material Sciences (AREA)
- Transplantation (AREA)
- Vascular Medicine (AREA)
- Heart & Thoracic Surgery (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Cardiology (AREA)
- Epidemiology (AREA)
- Surgery (AREA)
- Dermatology (AREA)
- Materials For Medical Uses (AREA)
- Prostheses (AREA)
- Medicinal Preparation (AREA)
Abstract
Description
【0001】
関連出願の相互参照
本出願は、2001年12月14日に出願された非仮出願の米国特許出願第10/017,500号(代理人ドケット番号(Attorney Docket No.):20460-001000US);および2001年11月1日に出願された第10/002,595号(代理人ドケット番号20460-001600)の利益を主張する。これらの出願は、本出願の譲受人に帰属する。これらの出願の完全な開示は、参照として本明細書に組み入れられる。
【0002】
発明の背景
発明の分野
本発明は概して、医療用具および方法に関する。より詳細には、本発明は、再狭窄の減少または阻害のための血管ステントおよび移植片などの管腔の人工器官を提供する。
【0003】
本発明は概して、医療用具および方法に関する。より詳細には、本発明は、再狭窄の減少または阻害のための血管ステントおよび移植片などの管腔の人工器官を提供する。
【0004】
患者の血管の狭窄したアテローム硬化領域を治療して十分な血流を回復するために、多くの経皮的な血管内の手技が開発されている。これらの治療で最も成功を収めたものは、経皮経管的血管形成術(PTA)である。PTAでは、通常、膨張されるバルーンの形態で膨張可能な遠心端を有するカテーテルを、狭窄部位の血管に配置する。膨張可能な末端が膨張し、血管を拡大して、疾病領域を越えて十分な血流を回復する。狭窄領域を解放するためのその他の手技は、方向性関節切除術(directional arthrectomy)、回転性関節切除術(rotational arthrectomy)、レーザ血管形成術、ステント術などを含む。これらの手技は、広く受け入れられているが(単独でまたは組み合わせて、特にステント術と組み合わせたPTA)、これらは重大な不利な点をもったままである。狭窄領域を開放するためのPTAおよびその他の既知の手技に特に共通する不利な点は、再狭窄が頻発することである。
【0005】
再狭窄は、最初に好結果の血管形成術をした後に、動脈が再び狭小化することをいう。再狭窄は、全ての血管形成術患者の約50%までを苦しめ、管腔開放血管形成術の手技の際の血管壁に対する傷害の結果である。一部の患者では、傷害により、血管形成術による外傷を受けた領域において、「過形成」と称される平滑筋細胞増殖によって特徴づけられる回復反応を開始する。この平滑筋細胞の増殖は、血管形成術によって開放された管腔を数週〜数ヶ月以内に再び狭小化し、このために、再狭窄を軽減するために繰り返しPTAまたはその他の手技を必要とする。
【0006】
過形成を治療し、再狭窄を減少するために、多くの戦略が提唱されている。以前に提唱された戦略は、血管形成術の間のバルーン膨張を延長すること、加温したバルーンによる血管の治療、血管形成術に続く照射による血管の治療、領域におけるステント術、およびその他の手技を含む。これらの提案により、様々なレベルの成功が享受されているが、これらの手技のどれもが、実質的にまたは完全に、全ての再狭窄および過形成の発生を回避することに完全に成功するとは証明されていない。
【0007】
上述した治療の代わりに、または付属的に、再狭窄の阻害のためのPTA後に治療薬を投与することも提唱されている。治療的な処置は、通常カテーテルを介してまたはステントから、治療能力がある薬剤を押し出すか、または放出することを必要とする。多大な見込みを有するものの、再狭窄の阻害のための治療薬の送達は、完全に成功しているというわけではなかった。
【0008】
上述した治療の代わりに、または付属的に、再狭窄の阻害のためのPTA後に治療薬を投与することも提唱されている。治療的な処置は、通常カテーテルを介してまたはステントから、薬物を押し出すか、または放出することを必要とする。多大な見込みを有するものの、再狭窄の阻害のための治療薬の送達は、完全に成功しているというわけではなかった。
【0009】
したがって、血管形成術およびその他の介入性の治療に続くであろう再狭窄および過形成を減少、阻害、または治療するための改善された装置並びに方法を提供することは、意義ある進歩であると考えられる。本発明は、これらの少なくともいくつかのおよびその他の要求を満たす。
【0010】
背景技術の説明
再狭窄の防止のための局部的な薬物送達は、Lincoffら、(1994) Circulation 90: 2070-2084に記載されている。本発明に使用される例示的な管腔の人工器官の完全な記述は、同時係属中の2000年5月4日に出願された出願第09/565,560号(この開示の全体が、参照として本明細書に組み入れられる)に記載されている。移植可能なおよびその他の装置から活性物質を放出するための方法および装置は、米国特許第6,096,070号;第5,824,049号;第5,624,411号;第5,609,629号;第5,569,463号;第5,447,724号;および第5,464,650号に記載されている。血管内における薬物送達のためのステントの使用は、PCT公開国際公開公報第01/01957号、並びに米国特許第6,099,561号;第6,071,305号;第6,063,101号;第5,997,468号;第5,980,551号;第5,980,566号;第5,972,027号;第5,968,092号;第5,951,586号;第5,893,840号;第5,891,108号;第5,851,231号;第5,843,172号;第5,837,008号;第5,769,883号;第5,735,811号;第5,700,286号;第5,679,400号;第5,649,977号;第5,637,113号;第5,591,227号;第5,551,954号;第5,545,208号;第5,500,013号;第5,464,450号;第5,419,760号;第5,411,550号;第5,342,348号;第5,286,254号;および第5,163,952号に記載されている。生体分解性材料は、米国特許第6,051,276号;第5,879,808号;第5,876,452号;第5,656,297号;第5,543,158号;第5,484,584号;第5,176,907号;第4,894,231号;第4,897,268号;第4,883,666号;第4,832,686号;および第3,976,071号に記載されている。速度を制限する障壁としてのヒドロシロシロキサン(hydrocylosiloxane)の使用は、米国特許第5,463,010号に記載されている。ステントの被覆方法については、米国特許第5,356,433号に記載されている。移植可能な装置の生体適合性を増強する被覆は、米国特許第5,463,010号;第5,112,457号;および第5,067,491号に記載されている。薬物の送達、被覆、およびその他の用途のための多孔性並びに非多孔性材料は、米国特許第5,488,015号;第5,470,802号;第5,428,123号;第5,288,504号;第5,270,047号;第5,243,756号;第5,130,889号;第4,788,063号;第3,993,072号;および第3,854,480号に記載されている。エネルギーに基づいた装置は、米国特許第6,031,375号;第5,928,145号;第5,735,811号;第5,728,062号;第5,725,494号;第5,409,000号;第5,368,557号;第5,000,185号;および第4,936,281号に記載されている。磁気プロセス(その幾つかは薬物送達システムにおいて使用されている)は、米国特許第5,427,767号;第5,225,282号;第5,206,159号;第5,069,216号;第4,904,479号;第4,871,716号;第4,501,726号;第4,357,259号;第4,345,588号;および4,335,094号に記載されている。
【0011】
本出願の開示は、以下の出願の開示に関連する:第09/782,927号(代理人ドケット番号20460-000920);第09/783,254号(代理人ドケット番号20460-000930);および第09/782,804号(代理人ドケット番号20460-000940)。
【0012】
上記の各々の参照の完全な開示は、参照として本明細書に組み入れられる。
【発明の開示】
【0013】
発明の簡単な概要
本発明は、感受性の高い組織部位の調製または治療のための改善された装置、並びにこれを製作し使用する方法に向けられる。特に、本発明は、身体上の、特に身体内の装置に向けられる。一つの態様において、本装置および方法は、血管内介入に続くであろう再狭窄および/または過形成の形成または進行を減少する。ある態様において、本装置は、感受性の高い組織部位に対して治療能力がある薬剤を提供する。好ましくは、治療能力がある薬剤は、身体に装置を導入することにより、感受性の高い組織部位に対して、直ちにまたは遅延期間の後に利用できるようになるような様式で、治療能力がある薬剤に提供される。
【0014】
本明細書において使用されるものとして、「感受性の高い組織部位」は、負傷しているか、または障害(例えば、疾患、医学的症状)の結果として負傷する可能性があるか、または血管内介入などの介入性手技の間もしくは後に負傷する可能性がある組織部位をいう。「血管内介入」の用語は、血管、通常は冠動脈などの動脈における、狭窄の、再狭窄の、または血栓の症状を少なくとも部分的に回復するために行われるであろう種々の矯正手技を含む。通常、矯正手技は、バルーン血管形成術を含むと考えられる。また、矯正手技は、方向性粥腫切除(directional atherectomy)、回転性粥腫切除(rotational therectomy)、レーザ血管形成術、ステント術等を含み得、処置された血管の管腔が拡大されて、治療前に存在した狭窄の症状を少なくとも部分的に軽減する。感受性の高い組織部位は、身体内の管腔、器官、または局在性腫瘍に関連した組織を含みうる。本明細書において使用されるものとして、「身体内」の用語は、身体内の、体内管腔または内部身体組織および/もしくは器官をいう。体内管腔は、患者の血管のいずれの血管であってもよく、静脈、動脈、大動脈、特に冠状動脈および末梢動脈を含み、並びに以前に移植された移植片、シャント、瘻孔などを含む。また、本発明は、過剰の新生物細胞増殖を受けた胆管などのその他の体内管腔に適用されてもよいことが認識されるであろう。身体内部の組織および器官の例は、種々の器官、神経、腺、管などを含む。ある態様において、本装置は、血管のステントまたは移植片などの管腔の人工器官を含む。もう一つの態様において、本装置は、心臓ペースメーカーのリードもしくはリードチップ、心臓除細動器のリードもしくはリードチップ、心臓弁、縫合糸、もしくは針、ペースメーカー、整形用の装置、器具、インプラントもしくは代替品、または上記のいずれかの一部を含んでいてもよい。
【0015】
本明細書において使用されるものとして、「治療能力がある薬剤」の用語は、治療下において身体(例えば、ヒト被験者)に導入される際に治療的である、または被検者の身体に入った後(もしくは、場合によっては、身体の表面にさらされたとき)に、例えば、天然のもしくは非天然の物質との反応または条件によって治療的となる、少なくとも1つの化合物を含む。天然の条件の例は、pH(例えば、酸度)、化学物質、温度、塩分、伝導度、体内管腔/器官の収縮性または膨張性の変化、および本装置を通過して流れるまたは接触する体液の拍動性質を含み;非天然の条件は、磁界および超音波などのものを含む。本出願において、任意の治療能力がある薬剤またはその他の化合物の化学名は、化合物自体、およびプロドラッグ(体内で化合物の活性型に変換される前駆体物質)、および/またはその薬学的誘導体、類似体、もしくはその代謝産物(化合物が体内で直接、または、その他の薬剤もしくは条件(例えば、酵素的、化学的、エネルギー的)、もしくは環境(例えば、pH)の導入によって変化する生理活性化合物)をいうために使用される。
【0016】
ある態様において、本装置は、構造体および構造体に結合された少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源を含む。一つの態様において、本装置は、構造体の少なくとも一部に隣接して配置され、または形成された速度制御エレメントをさらに含む。治療能力がある薬剤は、身体に本装置を導入することにより、直ちにまたは遅延期間の後に、感受性の高い組織部位に利用できるようになるような様式で、構造体および速度制御エレメントのいずれかまたは両方に、少なくとも一部が結合されている。本明細書において使用されるものとして、「結合される」の用語は、直接または間接的に、繋がれ(coupled to)、連結され(connected to)、上に配置され(disposed on)、内部に配置され(disposed within)、付着され(attached to)、接着され(adhered to)、密着され(bonded to)、隣接し(adjacent to)、閉じこめられ(entrapped in)、そしてその類似の構成などの、いずれかの結合の形態をいう。
【0017】
ある態様において、本装置は、身体内の標的部位(例えば、体の器官または管腔)を含む身体内に移植可能である。身体内の標的部位は、感受性の高い組織部位を含んでもよく、または代替的に、感受性の高い組織部位に血液を供給する動脈などの供給部位であってもよい。
【0018】
一つの態様において、構造体は、膨張可能な構造体であってもよい。もう一つの態様において、構造体は、実質的に一定の大きさもしくは直径を有してもよく、または代わりに、適用および使用に依存して、縮小可能な構造体であってもよい。膨張可能な構造体は、ステントの形態(これは、さらに管腔の開存性を維持する)であっても、または移植片の形態(これは、さらに管腔壁の強度を保護もしくは増強する)であってもよい。本装置は、少なくとも一部に、足場、好ましくは少なくとも一部が開放性の格子から形成されたものを含んでいてもよい。選択的に、足場は、少なくとも実質的に閉鎖された表面を含む。膨張可能な構造体は、放射状に膨張可能であってもよい。構造体は、自己膨張性であっても、またはバルーンなどの別の物によって膨張可能であってもよい。ある態様において、構造体は、少なくとも1つの表面、通常、組織に面した表面を含む。もう一つの態様において、構造体は、組織に面した表面、もう1つの表面、通常は管腔の表面、および2つのエッジ面を含む。ある態様において、構造体は、2つの表面、通常、組織面および管腔表面の間に配置された内部を有していてもよい。ある態様において、構造体は、膨張もしくは収縮による種々の機械的応力もしくは歪力プロフィールを有する部分、または体を流れる体液(例えば、血液もしくはその他の体液)の実質的にダイレクトライン内の領域を含む。例として、身体内に移植されたときに、構造体の異なる部分が装置の膨張の間に異なる応力特性を示してもよい。一つの態様において、構造体は、お互いに関して機械的応力または歪力プロフィールが相対的に低い部分および相対的に高い部分を含む。「異なる機械的プロフィールを有する」の用語は、本明細書において、構造体または人工器官のこの特性をいうために使用される。ある態様において、装置は、軸方向に異なる被覆プロフィールを含み、その結果、人工器官が異なるプロフィールの治療能力がある薬剤および/または速度制御エレメントを含み、体液の直接の流れの中にあることにより多くの乱流に供される。
【0019】
供与源は、構造体の少なくとも一部に隣接して配置または形成されうる。供与源は、膨張可能な構造体のいずれかもしくは両方の表面の少なくとも一部に隣接して、2つの表面の間に配置された構造体の内部において、エッジのいずれかもしくは両方に隣接して、またはこれらのいずれかを組合せて、配置または形成されてもよい。構造体および速度制御エレメントのいずれかもしくは両方と治療能力がある薬剤の結合は、連続しているか、または別々のセグメントであってもよい。一つの態様において、供与源は、構造体および/または速度制御エレメントの一部のみ、好ましくは、低い機械的な応力プロフィールを有する領域に隣接して配置または形成される。
【0020】
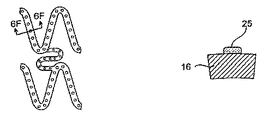
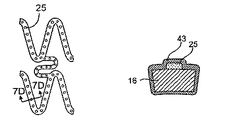
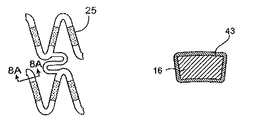
膨張可能な構造体は、金属、重合体、またはその組み合わせなどの任意の適した材料から形成されてもよい。一つの態様において、膨張可能な構造体は、重合体材料、金属材料、またはその組み合わせからなる群より選択される、少なくとも部分的に生体分解性の材料から形成されてもよい。少なくとも部分的に生体分解性の材料は、好ましくは時間とともに分解する。重合体材料の例には、構造体が分解する前に血管を回復することができるように遅延性分解される、ポリ-L-乳酸が含まれる。金属材料の例としては、ステンレス鋼などの身体中で分解可能な金属または合金が含まれる。本発明に使用される典型的なステントは、同時係属出願第09/565560号に記載されており、この完全な開示は、参照として本明細書に組み入れられる。
【0021】
ある態様において、装置は概して、近位のおよび遠位の末端、並びに組織および管腔に面した表面を有する円柱形のフレームを含むステントである。本装置は通常、環を含む複数の放射状に膨張可能なユニットセグメントをさらに含む。環は、好ましくは曲がりくねった形状を有する。ある態様において、ユニットセグメントは、好ましくは、例えば膨張の結果として示されるであろう、異なる機械的プロフィールを有するセグメントを含む。ある態様において、いくつかの環は、膨張リンクを介して少なくとも1つの軸方向に隣接した環でつながれていてもよい。リンクは、好ましくはS字形の形状を有し、より好ましくは、S字形状はその長さに沿って相対的に平滑なプロフィールを有し、膨張によるキンクを最小化または減少させる。同様に、リンクは、これらの長さに沿って異なる機械的プロフィールを有するセグメントを含んでいてもよい。例えば、ジョイントおよび/またはリンクは、これらの長さに沿って、相対的に低い機械的プロフィール部分を有し、ベンド、ポイント、交点、ジョイント、または乱流にさらされる領域において相対的に高い機械的プロフィール部分を有していてもよい。好ましくは、供与源は、構造体の表面に面する組織に隣接して配置される。好ましくは、本部分は、相対的に低い機械的プロフィールを有する構造体の領域である。
【0022】
一つの態様において、供与源および/または速度制御エレメントは、構造体の一部のみに独立して配置され、好ましくは、本部分は、相対的に低い機械的プロフィールを有する。もう一つの態様において、供与源は、相対的に低い機械的プロフィール領域に配置されてもよく、一方、速度制御エレメントは、低い機械的プロフィール領域、または低いおよび高い機械的プロフィール領域のいずれかにわたって配置される。
【0023】
治療能力がある薬剤は、上記の通りの1つまたは複数の方法で、構造体(例えば、膨張可能な構造体)および速度制御エレメントのいずれかまたは両方と結合されていてもよい。治療能力がある薬剤は、膨張可能な構造体に隣接して(例えば、上にまたは中に)配置されてもよい。代わりにまたはさらに、治療能力がある薬剤は、所望の実行(例えば、放出速度)を提供するパターンで、速度制御エレメントに隣接して(例えば、上にまたは中に)、または構造体と速度制御エレメントとの間の界面に配置されてもよい。もう一つの態様において、装置は、治療能力がある薬剤を含む外層を含む。ある態様において、治療能力がある薬剤の外層は、身体に装置を導入することにより治療能力がある薬剤のビュラス(bulous)放出を提供する。一つの態様において、供与源は、例えば、治療能力がある薬剤、および治療的な能力がある別の薬剤または効力を与える化合物などの別の化合物として、複数の化合物を含んでいてもよい。複数の化合物の各々は、供与源において、同じかまたは異なる領域にあってもよい。
【0024】
速度制御エレメントは、非分解性の材料、部分的に分解性の材料、実質的に分解性の材料、またはこれらの組み合わせから形成されていてもよい。材料は、合成のもしくは天然の;非重合体の、重合体の、セラミックの、もしくは金属の;またはこれらの組み合わせであってもよい。速度制御エレメントは、多孔性、マイクロ多孔性、ナノ多孔性、もしくは非多孔性の形態、またはこれらの任意の組み合わせを有していてもよい。好ましくは、装置が多孔性速度制御エレメントを含むときは、非多孔性の速度制御エレメントの少なくとも1つの層が、供与源と多孔性速度制御エレメントとの間に配置される。
【0025】
好ましい態様において、速度制御エレメントは、非多孔性材料、通常は非多孔性の共形(conformal)材料から形成される。適した非多孔性材料の例は、プラズマ沈着させた重合体;スパッターさせ、気化させ、電気メッキした金属および/または合金;グロー放電被覆;ポリエチレン;ポリウレタン;シリコーンゴム;セルロース;およびパリレンC、N、D、F、またはその組み合わせ、通常パリレンCを含むパリレンを含むが、これらに限定されない。ある態様において、装置は、少なくとも部分的に、治療能力がある薬剤に結合するように構成されている、もう一つの速度制御エレメント層を含む。ある態様において、ウシ血清アルブミン(BSA)が非多孔性の速度制御エレメント(例えば、パリレン)に隣接して配置され、その結果、治療能力がある薬剤(例えば、ミコフェノール酸)が非多孔性の速度制御エレメントから拡散または溶出する際に、治療能力がある薬剤はBSAと結合し、治療能力がある薬剤の放出をさらに遅延または制御する。治療能力がある薬剤と結合できるもう一つの速度制御エレメントのその他の例は、ポリエチレンイミンなどの四級アンモニウム化合物を含む。一つの態様において、ヒドロゲル化合物は、治療能力がある薬剤および速度制御エレメントのいずれかもしくは両者の下に、またはマトリックスに配置される。体液がヒドロゲル化合物と接触すると、ヒドロゲル化合物が膨張して、速度制御エレメントを介して例えば速度制御エレメント層の分断を引き起こすことによって、治療能力がある薬剤の流れまたは拡散の特性に変化を引き起こす。
【0026】
本明細書で定義されるものとして、「多孔性材料」は、開放性のセル構造体を有する重合体材料または構造体をいう。このような材料は、マクロ多孔性、マイクロ多孔性(例えば、約1〜約100ミクロンの範囲のサイズのセル/孔サイズを有する)、ナノ多孔性(例えば、ナノメートル範囲のセル/孔サイズを有し、重合体を形成する重合体鎖の実際の長さよりも長い)として分類することができる。このような多孔性材料の典型的な鎖長は、約2〜約100オングストローム(Å)の範囲である。本明細書において使用されるものとして、「非多孔性材料」は、孔を有していないか、または材料の通常の自由体積より小さな孔サイズを有する被覆を含む材料をいう。自由体積は、分節状の運動に到達できる材料における分子間の間隔に関連する。ある態様において、速度制御エレメントは、速度制御エレメント分子の体積と同等または2倍よりも小さな自由体積を有する。
【0027】
分子レベルにおいて、全てではないにしても、ほとんどの固体および/または非多孔性の重合体は、鎖運動が可能な何らかの自由体積を少なくとも有する。自由体積の間隔の大きさは通常、分子鎖長のフラクションのオーダーであり、従って用語は非多孔性である。温度が増大すると、鎖運動および自由体積も増大する。
【0028】
ある態様において、速度制御エレメント(供与源を被覆する外層としておよび/またはマトリックス材料として)による供与源からの治療能力がある薬剤の放出の速度は、治療能力がある薬剤分子の「分配係数」および拡散率、並びに速度制御エレメントの厚さによる影響を受ける。
【0029】
同じ非多孔性の重合体速度制御エレメントにおいても、異なる治療能力がある薬剤の溶解度は、非常に異なる。治療能力がある薬剤−重合体速度制御エレメントの溶解度は、以下のいずれかの1つまたは複数を含むいくつかの因子に依存する:治療能力がある薬剤および非多孔性の重合体速度制御エレメントの化学構造の差、治療能力がある薬剤および速度制御エレメントにおける官能基の存在および特徴、水素結合、イオン結合、または二者間のその他の結合、分子量、治療能力がある薬剤および非多孔性の重合体速度制御エレメントの立体化学配位、結晶性/無定形の状態、系の温度、重合体速度制御エレメントにおける治療能力がある薬剤の溶質の活量係数、治療能力がある薬剤の結晶が重合体速度制御エレメントに溶解または可溶化されるときに吸収されるモル融解熱。
【0030】
非多孔性の重合体速度制御エレメントを介した治療能力がある薬剤の拡散は、分子エネルギー(例えば、振動、回旋、並進)、および分子間の引力/反発(同じ材料の部分の間または2つの異なる材料の間のもの)などの多くの因子に依存する。重合体および治療能力がある薬剤および/または速度制御エレメントの高次構造は、鎖長、分子構造、結晶化度、および架橋度を含む種々の因子に依存する。
【0031】
ある態様において、速度制御エレメントが非多孔性材料から形成されている場合、身体内における構造体の膨張により、速度制御エレメントは、速度制御エレメント上または内において、少なくとも部分的に分断領域を形成してもよい。分断部により、供与源への溶出媒体(例えば、血液などの体液、水、血清、組織、間質液)の輸送、または供与源からの標的とされた身体内の部位への治療能力がある薬剤の輸送のいずれかもしくは両方が可能である。供与源への体液の輸送は、標的とされた身体内の部位へ戻る治療能力がある薬剤の輸送を助ける。一つの態様において、液体の流れの直接のライン内にある装置の少なくとも一部において、移植された装置に分断部が形成されていてもよい。
【0032】
例として、時間とともに少なくとも部分的に分解する金属材料は、速度制御エレメント;並びに大きい分子量、極性もしくは非極性の官能基、電気的電荷、立体障害基、疎水性、親水性、または両親媒性の部分を有する非重合体として使用してもよい。装置は、複数の速度制御エレメントであって、それぞれが同じまたは異なる化学的および物理的なプロフィールおよび特性を有し、それぞれが類似のまたは異なる位置において存在し、かつ治療能力がある薬剤を含まないか、同じか、または異なった治療能力がある薬剤を含む速度制御エレメントを含んでもよいことが、理解されるはずである。もう一つの態様において、装置は、緩徐なまたは迅速な放出を可能にするために厚さを変えられる、供与原および速度制御エレメントの両方を有する領域(例えば、装置の遠位および近位の末端)を含んでいてもよい。
【0033】
適した非分解性またはゆっくりと分解する速度制御エレメント材料は、ポリウレタン、ポリエチレンイミン、酢酸酪酸セルロース、エチレンビニルアルコール共重合体、シリコーン、ポリテトラフルオロエチレン(polytetrafluorethylene:PTFE)、パリレン、パリラスト(parylast)、ポリ(メチルメタクリレートブチレート)、ポリ-N-ブチルメタクリレート、ポリ(メチルメタクリレート)、ポリ2-ヒドロキシメタクリル酸エチル、ポリエチレングリコールメタクリレート、ポリ塩化ビニル、ポリ(ジメチルシロキサン)、ポリ(テトラフルオロエチレン)、ポリ(エチレンオキシド)、ポリエチレンビニルアセテート、ポリカーボネート、ポリアクリルアミドゲル、N-ビニル-2-ピロリドン、無水マレイン酸、ナイロン、ステアリル塩化アンモニウムおよびベンジル塩化アンモニウムを含む四級アンモニウム化合物、酢酸酪酸セルロース(CAB)、並びにその他の合成または天然の重合体物質を含むものなど;その混合物、共重合体、並びにこれらの組み合わせを含むが、これらに限定されない。ある態様において、速度制御エレメントは、シリコーン、ポリテトラフルオロエチレン、パリラスト(parylast)、ポリウレタン、パリレン、酢酸酪酸セルロースからなる群より選択される材料、その混合物、共重合体、およびその組み合わせから形成される。
【0034】
適した生体分解性の速度制御エレメント材料は、ポリ(乳酸)、ポリ(グリコール酸)および共重合体、ポリジオキサノン、ポリ(グルタミン酸エチル)、ポリ(ヒドロキシ酪酸)、ポリヒドロキシバレレートおよび共重合体、ポリカプロラクトン、ポリ酸無水物、ポリ(オルトエステル);ポリ(イミノカーボネート)、ポリエステルアミド、ポリエステルアミン、ポリシアノアクリレート、ポリホスファゼン(polyphosphazene)、共重合体、およびその他の脂肪族ポリエステル、またはポリ-L-乳酸およびポリ-e-カプロラクトンの共重合体を含むその適した共重合体;その混合物、共重合体、並びにこれらの組み合わせを含むが、これらに限定されない。適した材料のその他の例は、米国特許第5,610,241号に開示され、Leeらに対して発行された重合体を含み、これはその全体が参照として本明細書に組み入れられる。Leeは、生体分解性のバックボーン、および反応性のアミノ酸基および/または保護アミノ酸基を有する側鎖を有するグラフト重合体を開示している。グラフト重合体は、カルボニル基およびカルボニル基の炭素に対するアルファ炭素を有し、カルボニル炭素に対するアルファ炭素にH原子を有し、かつバックボーンカルボニル基に対するバックボーンアルファ炭素において、その側鎖アミノ酸ペンダント基が反応性のアミノ酸基および/または保護アミノ酸基を含むペンダント基のカルボニル部分で鎖アミノ酸ペンダント基に接合された生体分解性のホモ重合体または共重合体バックボーンから本質的に成る、生体分解性のホモ重合体または共重合体の開始材料から得られる。
【0035】
グラフト重合体は、その他の保護された反応基を有するアミノ酸ハロゲン化物を、カルボニル基の炭素に対するアルファ炭素にカルボアニオンを含む生体分解性の重合体と反応させ、次いで保護基を脱保護することによって調製される。
【0036】
適した天然の材料は、フィブリン、アルブミン、コラーゲン、ゼラチン、グリコサミノグリカン類、オリゴ糖&ポリ糖類、コンドロイチン、リン脂質類、ホスホリルコリン、糖脂質、タンパク質、アミノ酸、セルロース、およびこれらの混合物、共重合体、または組み合わせを含む。ある態様において、速度制御エレメントは、ウシ血清アルブミン(BSA)を含む。
【0037】
その他の適した材料は、チタン、クロム、ニチノール、金、ステンレス鋼、金属合金、セラミック、またはこれらの組み合わせ;および、速度制御エレメント材料(例えば、非重合体化合物)と治療能力がある薬剤の相互作用(例えば、化学反応、高分子量、立体障害、疎水性、親水性、両親媒性、加熱)の結果として治療能力がある薬剤を放出しうるその他の化合物を含む。例としては、電気化学的腐食経路によって腐食を促進するような異なる電気化学的能力を有する2つ以上の金属または金属合金の組み合わせを使用してもよい。
【0038】
分解性材料は、バルク分解または加水分解によって分解してもよい。ある態様において、速度制御エレメントは、その全体が、または好ましくは表面の分解もしくは加水分解によって、分解または加水分解し、その際、速度制御エレメントの表面は時間とともに分解または加水分解するが、大きさの完全性(bulk integrity)は維持されている。もう一つの態様において、疎水性の速度制御エレメントは、所望の放出速度で治療能力がある薬剤を放出する傾向があるので好ましい。非分解性の速度制御エレメントは、拡散によって治療能力がある薬剤を放出しうる。
【0039】
ある態様において、例えば治療能力がある薬剤が重合体材料である場合、治療能力がある薬剤は、速度制御エレメントである。ある態様において、治療能力がある薬剤は、単独でまたはマトリックス材料と結合してマトリックスを形成する。本明細書に使用されるものとして、「マトリックス」の用語は、治療能力がある薬剤と速度制御エレメントおよび/またはその他の化合物との間の結合をいう。ある態様において、マトリックスは、速度制御エレメントと治療能力がある薬剤および/またはその他の化合物/類との間に形成されたマトリックス界面を含む。ある態様において、速度制御エレメントは、同じまたは異なる材料から形成された多くの隣接する層を含んでいてもよい。治療能力がある薬剤は、1つまたは複数の速度制御エレメント層に隣接して存在していてもよい。加えておよび/または代わりに、治療能力がある薬剤は、1つまたは複数の速度制御エレメント層を有するマトリックスおよび/またはマトリックス界面を形成してもよい。
【0040】
治療能力がある薬剤は、免疫抑制薬、抗炎症剤、抗増殖剤、抗遊走剤、抗線維症剤、アポトーシス誘発剤、カルシウム拮抗薬、抗腫瘍剤、抗癌剤、抗体、抗血栓剤、抗血小板剤、IIb/IIIa剤、抗ウイルス薬、およびこれらの組み合わせからなる群より選択されてもよい。
【0041】
治療能力がある薬剤の具体的な例としては:ミコフェノール酸、ミコフェノール酸モフェチル、ミゾリビン、メチルプレドニゾロン、デキサメサゾン、セルチカン(Certican)(商標)、ラパマイシン、トリプトリド(商標)、メトトレキセート(商標)、ベニジピン(商標)、アスコマイシン(Ascomycin)(商標)、ワートマニン(商標)、LY294002、カンプトセシン(商標)、トポテカン(Topotecan)(商標)、ヒドロキシ尿素、タクロリムス(商標)(FK506)、シクロホスファミド、シクロスポリン、ダクリズマブ(daclizumab)、アザチオプリン、プレドニゾン、ゲムシタビン(Gemcitabine)(商標)、シロスタゾール(Pletal(商標))、トラニラスト、ケルセチン、スラミン;これらの代謝産物、誘導体、および組み合わせを含む。
【0042】
ある態様において、治療能力がある薬剤の供与源は、重合体の構造体上のサブユニットとして治療能力がある薬剤部分を含む重合体材料である。治療能力がある薬剤部分は、重合され、適切な結合(例えば、エチレン結合)を介してお互いに結合し、治療能力がある薬剤の重合体を形成する。治療能力がある薬剤の重合体は、一旦血液などの組織または体液と接触すると、治療能力がある薬剤の重合体のサブユニットが分離する。または、治療能力がある薬剤は、治療能力がある薬剤の重合体が、好ましくは表面の分解またはは加水分解を介して分解または加水分解して、好ましくは時間経過に従って感受性の高い組織部位に対して治療能力がある薬剤を利用可能とするように、放出されてもよい。治療能力がある薬剤を重合するための方法および化合物の例は、Kathryn Uhrichによる、表題「Polyanhydrides With Therapeutically Useful Degradation Products」の特許出願、国際公開公報第99/12990号(ラトガーズ大学に帰属する)に記載されており、この完全な開示は参照として本明細書に組み入れられる。治療能力がある薬剤および反応に適した成分ユニットの例には、酸触媒されるエステル化反応におけるアジピン酸および/またはサリチル酸を伴うミコフェノール酸;酸触媒されるエステル化反応におけるアスピリンおよび/またはアジピン酸を伴うミコフェノール酸、酸その他のNSAIDを伴うミコフェノール酸、および/または触媒されるエステル化反応におけるアジピン酸を含む。ある態様において、治療能力がある薬剤の重合体は、重合体のおよび/または金属のバックボーンを伴っていてもよい。
【0043】
本発明の装置は、1つもしくは複数の相が、同じかまたは異なる実行(例えば、放出)プロフィールを有する1つもしくは複数の相において、治療能力がある薬剤を放出するか、または利用可能にするように配置してもよい。治療能力がある薬剤は、持続性、断続性、または連続性で;1つまたは複数の相および/または送達速度で;1つまたは複数の平滑筋細胞増殖、炎症、免疫応答、高血圧、または同様のものの活性化の補完のいずれかを減少するために有効であろう量で、組織が利用できるように作製されてもよい。少なくとも1つの治療能力がある薬剤のいずれか1つが、増殖/再狭窄の活性を妨げることもしくは減少すること、血栓形成を減少することもしくは阻害すること、血小板活性化を減少することもしくは抑制すること、血管攣縮を減少することもしくは妨げること等を含む1つまたは複数の機能を実行してもよい。
【0044】
放出速度を、速度制御エレメントの大きさ、量、位置、弾性(すなわち、速度制御エレメント重合体は、装置の屈曲の際に伸びるまたは弛緩するため)、および治療能力がある薬剤の疎水性によってさらに制御してもよい。例としては、ミコフェノール酸(MPA)よりも疎水性の治療能力がある薬剤のメチプレドニソロン(methyprednisolone:MP)は、周囲の身体内の部位または回避培地内にミコフェノール酸よりも遅い速度で放出される。
【0045】
組織が利用できるようにした治療能力がある薬剤の総量は、部分的には、所望の治療結果のレベルおよび量に依存する。治療能力がある薬剤は、1つまたは複数の相であって、それぞれがその他の相と同様のまたは異なる放出の速度および期間を有する相において利用できるようにされてもよい。放出速度は、予め定義されていてもよい。ある態様において、放出の速度は、感受性の高い組織部位に対して持続可能なレベルの治療能力がある薬剤を提供するであろう。もう一つの態様において、放出の速度は、実質的に一定である。速度は、減少させてもよく、および/または時間とともに増大してもよく、これは、選択的に、実質的に放出しない期間を含んでいてもよい。放出速度は、複数の速度を含んでもよい。ある態様において、複数の放出速度は、実質的に一定である、減少する、増大する、実質的に放出しない、からなる群より選択される少なくとも2つの速度を含む。
【0046】
利用可能にされたまたは放出された治療能力がある薬剤の総量は、典型的には約0.1μg〜約10g、一般に約0.1μg〜約10mg、好ましくは約1μg〜約10mg、より好ましくは約1μg〜約2mg、10μg〜の約2mg、または約50μg〜約1mgの範囲の量であると考えられる。
【0047】
ある態様において、治療能力がある薬剤は、本装置の移植時間から測定して、約1日〜約200日;約1日〜約45日;または約7日〜約21日の範囲の時間で放出されてもよい。
【0048】
ある態様において、1日あたりの治療能力がある薬剤の放出速度は、約0.001マイクログラム(μg)〜約1000μg、通常約0.001μg〜約200μg、通常約0.5μg〜約200μg、および典型的には、約1μg〜約60μgの範囲で変動してもよい。
【0049】
一つの態様において、速度制御エレメントは、標的とされた組織部位へ速度制御エレメントを横切る(または、マトリックスによる場合には、通る)治療能力がある薬剤のフラックス(flux)密度が、約1.71x10-14μg/(cm2s)〜約1.71x10-8μg/(cm2s)、通常約1.71x10-14μg/(cm2s)〜約1 3.43x10-9μg/(cm2s)、通常約8.57x10-12μg/(cm2s)〜約3.43x10-9μg/(cm2s)、および典型的には約1.71x10-11μg/(cm2s)〜約1.03x10-9μg/(cm2s)の範囲であるような、物理的および/または化学的特性(例えば、厚さなどの物理的な大きさおよび重合体の化学構造などの化学的性質)の特性を有するように構成される。所望の屈曲(flex)密度は、治療能力がある薬剤と速度制御エレメントとの間の総界面積、速度制御エレメントを横切る(または、マトリックスによる場合には、通る)治療能力がある薬剤の拡散係数による影響を受ける。したがって、薬物の性質、および所望の治療的な用量(例えば、総フラックス(μg/日))、および装置のデザイン(例えば、治療能力がある薬剤を含む装置の総面積)、種々の特性(例えば、物理的および/または化学的)に依存して、所望の結果を生じさせるように構成されてもよい。
【0050】
治療能力がある薬剤は、最初の相および1つまたは複数の次の相において利用できるようにしてもよい。治療能力がある薬剤は、異なる相において送達される場合は、初期の送達速度は、典型的には約0〜約99%の次の放出速度、通常約0%〜約90%、好ましくは約0%〜75%であると考えられる。ある態様において、最初の相における物質の哺乳類の組織中濃度は、典型的には約0.001ナノグラム(ng)/mgの組織〜約100μg/mgの組織;約1ng/mgの組織〜約100μg/mgの組織;約1ng/mgの組織〜約10μg/mgの組織の範囲内であると考えられる。次の相における物質の哺乳類の組織中濃度は、典型的には約0.001ng/mgの組織〜約600μg/mgの組織、好ましくは約1ng/mgの組織〜約10μg/mgの組織の範囲内であると考えられる。
【0051】
最初の相の間の送達速度は、典型的には1日につき約0.001ng〜約50μg、通常1日につき約0.1μg〜約30μg、より好ましくは、1日につき約1μg〜1日につき約20μgの範囲であると考えられる。次の相の送達速度は、1日につき約0.01μg〜1日につき約200μg、通常1日につき約1μg〜1日につき約100μgの範囲であってよい。一つの態様において、治療能力がある薬剤は、プログラムされた方法および/または制御された方法で、効率および/または効能が増大されて、感受性の高い組織部位において利用できるようにされる。さらに、本発明は、血管壁の内皮化(endothelialization)に対する障害の制限または減少をもたらす。
【0052】
最初の、次の、およびその他のさらなる相の期間は変化させてもよい。例えば、治療能力がある薬剤の放出は、最初の装置の移植から遅らせてもよい。典型的には、遅れは、処置された部位において十分なセルラライゼーション(cellularization)または内皮化(endothelialization)を生じさせるために十分な長さである。典型的には、最初の相の期間は、本装置の少なくとも一部において、初期のセルラライゼーション(cellularization)または内皮化(endothelialization)をさせるために十分に長い時間である。典型的には、最初の相の期間は、遅延相または放出相であるかにかかわらず、通常約12週未満、さらに通常約1時間〜約8週、より好ましくは約12時間〜約4週、約12時間〜約2週、約1日〜約2週、または約1日〜約1週である。
【0053】
また、次の1つまたは複数の相の期間は、典型的には、約4時間〜約24週、約1日〜約12週、約2日〜約8週、より好ましくは約3日〜約50日の範囲で変更してもよい。ある態様において、特定期間は、血管の環境に関する。1つ以上の相が、同様のもしくは異なる放出の期間、量、および/または速度を含んでいてもよい。例えば、1つのシナリオにおいて、遅延性の最初の相、続く第1の次の放出の速度の相、および第2の次の放出の速度の第2の次の相などがあってもよい。
【0054】
本装置が、複数の化合物(例えば、第1の治療能力がある薬剤、およびもう一つの治療能力がある薬剤または可能にする化合物などのもう一つの化合物)を含む供与源を含む場合、複数の化合物が、同じ層または存在するならば異なる層から、異なる時間および/または速度で放出されてもよい。複数の化合物のそれぞれは、別の介入性手技とは独立して、同時またはその後に利用できるように作製されてもよく、お互いに同時または経時的であってもよい。例えば、第1の治療能力がある薬剤(例えば、トリプトリド(商標))は、介入性手技の時から、2日〜3月の期間内に放出される第2の治療能力がある薬剤(例えば、ミコフェノール酸)と共に、1日〜45日の期間内に放出されてもよい。
【0055】
さらに、本装置の生体適合性を与えるまたは増強するために、供与源および/または本装置の最外層全体に、生体適合性の(例えば、血液適合性を持つ)層を形成してもよい。生体適合性層として使用するために適した生体適合物質は、ポリエチレングリコール(PEG)、ポリエチレンオキシド(PEO)、ヒドロゲル、シリコーン、ポリウレタン、ヘパリンの被覆を含むが、これらに限定されない。
【0056】
ある態様において、本装置は、もう一つの治療能力がある薬剤などのもう一つの化合物、または治療能力がある薬剤の放出および効力のいずれかもしくは両方を可能とするおよび/または増強するもう一つの化合物を更に含む。もう一つの治療能力がある薬剤は、第1の治療能力がある薬剤と同じまたは異なる様式の膨張可能な構造体を伴ってもよい。
【0057】
もう一つの治療能力がある薬剤は、治療能力がある薬剤によって生じ得る可能性がある反応および副生成物を代償するなどの様式で、治療能力がある薬剤と相乗作用して作用してもよい。例えば、治療能力がある薬剤は、所望の内皮細胞の生成を減少させてもよく、従って、適した治療的な能力があるもう一つの薬剤を含むことにより、より多くの内皮化(endothelialization)が達成されてもよい。
【0058】
もう一つの治療能力がある薬剤は、抗癌剤;化学療法薬;血栓溶解剤;血管拡張剤;抗微生物または抗生物有糸分裂阻害剤;成長因子アンタゴニスト;フリーラジカルスカベンジャ;生物学的な薬剤;放射線療法剤;放射線不透過剤;放射標識された薬剤;ヘパリンおよびその誘導体などの血液凝固阻止剤;サリドマイド(商標)などの抗血管形成治療能力がある薬剤;血管形成治療能力がある薬剤;PDGF-Bおよび/またはEGF阻害剤;乾癬治療能力がある薬剤を含む抗炎症薬;リボフラビン;チアゾフリン;ザフリン(zafurin);アセチルサリチル酸などのシクロオキシゲナーゼ阻害剤、クロピドグレル(例えば、プラビックス(Plavix)(商標))およびチクロピジン(例えば、チクリド(Ticlid)(商標))などのADP阻害剤、シロスタゾール(例えば、プレタール(Pletal)(商標))などのホスホジエステラーゼIII阻害剤、アブシキシマブ(abciximab)(例えば、レオプロ(Rheopro)(商標))などの糖タンパク質IIb/IIIa薬を含む抗血小板剤;エプチフィバチド(eptifibatide)(例えば、インテグリリン(Integrilin)(商標))、およびジピリダモールなどのアデノシン再取り込み阻害剤;抗酸化剤、酸化窒素ドナーを含む治癒剤および/または促進剤;制吐剤;制嘔吐剤;これらの誘導体および組み合わせからなる群より選択される少なくとも1つの化合物を含んでいてもよい。もう一つの治療薬は、同じまたは異なる速度および相において、治療能力がある薬剤の前に、同時に、または後に放出されてもよい。
【0059】
ある態様において、もう一つの化合物は、外部のエネルギー形態または天然の状態に応答して、治療能力がある薬剤の放出に影響を及ぼすことができる化合物を含む。応答可能な化合物は、治療能力がある薬剤、速度制御エレメント、膨張可能な構造体、またはこれらの組み合わせと結合していてもよい。第2の可能にする化合物は、治療能力がある薬剤に結合された磁性粒子から形成されていてもよい。エネルギー源は、移植の後に人工器官において磁界を向けて、治療能力がある薬剤の放出を生じさせるための磁気供与源であってもよい。
【0060】
本発明の装置を製造するための方法のある態様において、移植可能な構造体は、治療能力がある薬剤の供与源を提供する。治療能力がある薬剤が被覆された構造体は、通常、治療能力がある薬剤の融点とほぼ同じ温度かそれ未満の温度にしばらくの間加熱される。また、加熱工程の期間に依存して、より低いまたはより高い温度が使用されてもよい。ある態様において、加熱は、治療能力がある薬剤の結晶化度の変化を助け、従って、速度制御エレメント下により一様な表面を提供する。別の態様では、治療能力がある薬剤で被覆された構造体は、速度制御エレメントが構造体上に提供された後にも加熱される。
【0061】
もう一つの態様において、治療能力がある薬剤/速度制御エレメントで被覆された構造体は、速度制御エレメントのガラス転移温度(Tg)とほぼ同じ温度またはそれ未満の温度に加熱される。また、より高いまたはより低い温度を、加熱工程の期間に適切に適応させて使用してもよい。一つの態様において、加熱は、減圧下および/または酸素の不存在下で行われる。この温度への被覆された装置の加熱では、装置の残留応力の減少を補助することにより、速度制御エレメント被覆における望ましくない分断部を形成する可能性が減少される。一部の態様において、装置が身体内に移植される前および/または後に分断部が存在するように、意図して装置に設計されてもよい。また、熱以外のその他のエネルギーの形態、例えば超音波または振動エネルギーを、残留応力を減少させる際に使用してもよい。
【0062】
本発明は、移植可能な足場であって、これと結合した少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源を有し、かつ足場が移植されたときに放出されるように構成された移植可能な足場を含む身体内の装置をさらに提供する。非多孔性材料を含む速度制御エレメントは、供与源の少なくとも一部を被覆する。好ましくは、非多孔性材料は、パリレンを含み、より好ましくは本質的にパリレンからなり、そして多くの場合パリレンからなる。しかし、その他の非多孔性材料は、プラズマ沈着された重合体、スパッターされた材料、蒸着された材料、電気メッキを施された金属、電気メッキを施された合金、グロー放電被覆、ポリエチレン、ポリウレタン、シリコーンゴム、セルロースなどにも使用が見出されるであろう。通常、非多孔層は、移植された領域、典型的には血管における条件にさらされたときに、少なくとも部分的に多孔性になる。または、速度制御メンバーは、分断されてもよく、例えば、移植されたときに、ひびが入るかまたは穴を形成してもよい。多くの場合、治療能力がある薬剤は、速度制御エレメントに存在し、通常、供与源のものと同じ物質である。
【0063】
発明の詳細な説明
図1A-1Cおよび横断面図面の図2A-2Nは、本発明の特徴を具体化する人工器官13などの装置10を図示しており、かつ感受性の高い組織部位22、および治療能力がある薬剤28を含む膨張可能な構造体16に隣接する供与源25を含む体内管腔19などの、一般に身体内に移植可能な膨張可能な構造体16を含む。装置10は、示したとおり、体内管腔19に配置されている。図に示された供与源25は、膨張可能な構造体の表面に隣接して配置されているが、隣接するという語が、典型的な図または記述によって限定されることが企図されないことは認識されるべきである。
【0064】
本明細書において使用されるものとして、「治療能力がある薬剤」の用語は、治療下において身体(例えば、ヒト被験者)に導入される際に治療的であるか、または被検者の身体に入った後(または、場合によっては、身体の表面にさらされたとき)に、例えば天然のもしくは非天然の物質との反応もしくは条件によって治療的となるかのいずれかである、少なくとも1つの化合物を含む。天然の条件の例は、pH(例えば、酸度)、化学薬品、温度、塩分、伝導度、体内管腔/器官の収縮性もしくは膨張性の変化、および装置を通って流れるもしくは接触する体液の拍動性質を含み;非天然の条件は、磁界および超音波などのものを含む。本出願において、任意の治療能力がある薬剤またはその他の化合物の化学名は、化合物自体、およびプロドラッグ(体内で化合物の活性型に変換される前駆体物質)、および/またはその薬学的誘導体、類似体、もしくは代謝産物(化合物が体内で直接、その他の薬剤もしくは条件(例えば、酵素的、化学的、エネルギー的)、または環境(例えば、pH)の導入によって変化する生理活性化合物)をいうために使用される。
【0065】
膨張可能な構造体は、金属、重合体、またはその組み合わせなどの任意の適した材料から形成されてもよい。一つの態様において、膨張可能な構造体は、少なくとも部分的に、重合体材料、金属材料、またはその組み合わせからなる群より選択される生体分解性の材料から形成されてもよい。少なくとも部分的に生体分解性の材料は、好ましくは時間とともに分解する。重合体材料の例は、ポリ-L-乳酸を含み、構造体が分解する前に血管を回復することができるように遅延性分解される。金属材料の例は、ステンレス鋼などの、身体中で分解可能な金属または合金を含む。
【0066】
治療能力がある薬剤は、免疫抑制薬、抗炎症剤、抗増殖剤、抗遊走剤、抗線維症剤、アポトーシス誘発剤、カルシウム拮抗薬、抗腫瘍剤、抗癌剤、抗体、抗血栓剤、抗血小板剤、IIb/IIIa剤、抗ウイルス薬、およびこれらの組み合わせからなる群より選択されてもよい。
【0067】
治療能力がある薬剤の具体的な例としては:ミコフェノール酸、ミコフェノール酸モフェチル、ミゾリビン、メチルプレドニゾロン、デキサメサゾン、セルチカン(Certican)(商標)、ラパマイシン、トリプトリド(商標)、メトトレキセート(商標)、ベニジピン(商標)、アスコマイシン(Ascomycin)(商標)、ワートマニン(商標)、LY294002、カンプトセシン(商標)、トポテカン(Topotecan)(商標)、ヒドロキシ尿素、タクロリムス(商標)(FK506)、シクロホスファミド、シクロスポリン、ダクリズマブ(daclizumab)、アザチオプリン、プレドニゾン、ゲムシタビン(Gemcitabine)(商標)、シロスタゾール(Pletal(商標))、トラニラスト、ケルセチン、スラミン;これらの代謝産物、誘導体、および組み合わせを含む。
【0068】
ある態様において、治療能力がある薬剤の供与源は、重合体の構造体上のサブユニットとして治療能力がある薬剤部分を含む重合体材料である。治療能力がある薬剤部分は、重合され、適切な結合(例えばエチレン結合)を介してお互いに結合し、治療能力がある薬剤の重合体を形成する。治療能力がある薬剤の重合体は、一旦組織または血液などの体液と接触すると、治療能力がある薬剤の重合体のサブユニットが分離する。または、治療能力がある薬剤は、治療能力がある薬剤の重合体が、好ましくは表面の分解または加水分解を介して分解または加水分解して、好ましくは時間経過に従って感受性の高い組織部位が治療能力がある薬剤を利用可能なように放出されてもよい。治療能力がある薬剤を重合するための方法および化合物の例は、Kathryn Uhrichによる、表題「Polyanhydrides With Therapeutically Useful Degradation Products」の特許出願、国際公開公報第99/12990号(ラトガーズ大学に帰属する)に記載されており、この完全な開示は参照として本明細書に組み入れられる。治療能力がある薬剤および反応に適した成分ユニットの例には、酸触媒されるエステル化反応におけるアジピン酸および/またはサリチル酸を伴うミコフェノール酸;酸触媒されるエステル化反応におけるアスピリンおよび/またはアジピン酸を伴うミコフェノール酸、酸その他のNSAIDを伴うミコフェノール酸、および/または触媒されるエステル化反応におけるアジピン酸を含む。ある態様において、治療能力がある薬剤の重合体は、重合体のおよび/または金属のバックボーンを伴っていてもよい。
【0069】
膨張可能な構造体16は、いずれの限定も企図せずに示したとおり、組織に面する表面31および管腔に面する表面34、並びに選択的に図2Bに示したとおりの管腔を含み得る内部37を有する。以下の描写は、説明の目的のみのためのものであり、必ずしも実際の人工器官13の形、大きさ、配置、または分布を反映するというわけではないことはいうまでもない。人工器官は、多くのステントの場合と同様に、連続性の構造体または断続性の構造体を有してもよい(例えば、ステントの横断面が、膨張可能な構造体を形成する基質をもっぱら含むというわけではなく、例えば一部のステントは、スクリーンまたはメッシュ様の横断面を有する)。供与源は、図1Bに示したとおり管腔に面する表面;および図1Cに示したとおりの組織に面する表面;のいずれかもしくは両方の少なくとも一部に隣接して、膨張可能な構造体の内部またはその任意の組み合わせの内部に配置または形成されてもよい。
【0070】
1つまたは複数の配置において、治療能力がある薬剤を治療能力がある薬剤に利用可能にするための供与源25は、膨張可能な構造体を伴う。図2Aおよび2Bで示す供与源は、例えば、マトリックス40が膨張可能な構造体16および治療能力がある薬剤28によって形成されるときに、または治療能力がある薬剤28が膨張可能な構造体16の内部(または、場合によっては膨張可能な構造体16の外側)37に配置されるときに、膨張可能な構造体16内にある。ある態様において、供与源25は、典型的には、約1オングストローム(A)〜約50ミクロン(μm)、約100オングストローム〜約20ミクロン、通常約100オングストローム〜約10ミクロン、通常約5000オングストローム〜約5ミクロン、および名目上約7500オングストローム〜約2ミクロンの範囲の厚さを有する。
【0071】
ここで、図2Cを参照して、本装置は、速度制御エレメント43をさらに含む。速度制御エレメントは、マトリックス40または膨張可能な構造体の内部37からの治療能力がある薬剤28の放出を制御するために、膨張可能な構造体16の少なくとも一部にわたって形成されていてもよい。供与源は、治療能力がある薬剤が、治療能力がある薬剤の重合体であるときには、速度制御エレメント自体であってもよい。
【0072】
ある態様において、供与源は、治療能力がある薬剤およびマトリックス形成材料を含むマトリックスを含んでもよい。例として、供与源は、ミコフェノール酸およびアルブミン(例えば、ウシ血清アルブミンすなわちBSA)を含むマトリックスを含んでいてもよい。例えば、例えばBSAに対して親和性を有する治療能力がある薬剤のマトリックス材料が存在すると、感受性の高い組織部位に対するミコフェノール酸の溶出する(従って、放出する)速度を減少させる。
【0073】
速度制御エレメントは、非分解性の材料、部分的に分解性の材料、実質的に分解性の材料、またはこれらの組み合わせから形成されていてもよい。材料は、合成もしくは天然の;非重合体、重合体、セラミック、もしくは金属の;またはこれらの組み合わせであってもよい。速度制御エレメントは、多孔性、マイクロ多孔性、ナノ多孔性、もしくは非多孔性の形態、またはこれらの任意の組み合わせを有していてもよい。好ましくは、装置が多孔性速度制御エレメントを含むときは、非多孔性の速度制御エレメントの少なくとも1つの層が、供与源と多孔性速度制御エレメントの間に配置される。
【0074】
好ましい態様において、速度制御エレメントは、非多孔性の材料、通常は非多孔性の共形材料から形成される。適した非多孔性材料の例は:プラズマ沈着された重合体;スパッターされ、蒸着され、電気メッキを施された金属および/または合金;グロー放電被覆;ポリエチレン;ポリウレタン;シリコーンゴム;セルロース;およびパリレンC、N、D、F、またはその組み合わせ、通常パリレンCを含むパリレンを含むが、これらに限定されない。
【0075】
適した非分解性またはゆっくりと分解する速度制御エレメント材料は、ポリウレタン、ポリエチレンイミン、酢酸酪酸セルロース、エチレンビニルアルコール共重合体、シリコーン、ポリテトラフルオロエチレン(polytetrafluorethylene:PTFE)、パリレン、パリラスト(parylast)、ポリ(メチルメタクリレートブチレート)、ポリ-n-ブチルメタクリレート、ポリ(メチルメタクリレート)、ポリ2-ヒドロキシメタクリル酸エチル、ポリエチレングリコールメタクリルレート、ポリ塩化ビニル、ポリ(ジメチルシロキサン)、ポリ(テトラフルオロエチレン)、ポリ(エチレンオキサイド)、ポリエチレンビニルアセテート、ポリカーボネート、ポリアクリルアミドゲル、N-ビニル-2-ピロリドン、無水マレイン酸、ナイロン、ステアリル塩化アンモニウムおよびベンジル塩化アンモニウムを含む四級アンモニウム化合物、酢酸酪酸セルロース(CAB)、並びにその他の合成または天然の重合体物質を含むものなど;その混合物、共重合体、並びにこれらの組み合わせ含むが、これらに限定されない。ある態様において、速度制御エレメントは、シリコーン、ポリテトラフルオロエチレン、パリラスト、ポリウレタン、パリレン、酢酸酪酸セルロースからなる群より選択される材料;その混合物、共重合体、並びにこれらの組み合わせより形成される。
【0076】
適した生体分解性の速度制御エレメント材料は、ポリ(乳酸)、ポリ(グリコール酸)および共重合体、ポリジオキサノン、ポリ(グルタミン酸エチル)、ポリ(ヒドロキシ酪酸)、ポリヒドロキシバレレートおよび共重合体、ポリカプロラクトン、ポリ酸無水物、ポリ(オルトエステル);ポリ(イミノカーボネート)、ポリエステルアミド、ポリエステルアミン、ポリシアノアクリレート、ポリホスファゼン(polyphosphazenes)、共重合体、およびその他の脂肪族ポリエステル、またはポリ-L-乳酸およびポリ-e-カプロラクトンの共重合体を含む適した共重合体;その混合物、共重合体、並びにこれらの組み合わせを含むが、これらに限定されない。適した材料のその他の例は、米国特許第5,610,241号に開示され、Leeらに対して発行された重合体を含み、これはその全体が参照として本明細書に組み入れられる。Leeは、生体分解性のバックボーン、ならびに反応性のアミノ酸基および/または保護アミノ酸基を有する側鎖を有するグラフト重合体を開示している。グラフト重合体は、カルボニル基およびカルボニル基の炭素に対するアルファ炭素を有し、カルボニル炭素に対するアルファ炭素にH原子を有し、かつバックボーンカルボニル基に対するバックボーンアルファ炭素において、その側鎖アミノ酸ペンダント基が反応性のアミノ酸基(類)および/または保護アミノ酸基を含むペンダント基のカルボニル部分で鎖アミノ酸ペンダント基に接合された生体分解性のホモ重合体または共重合体バックボーンから本質的に成る、生体分解性のホモ重合体または共重合体の開始材料から得られる。
【0077】
グラフト重合体は、その他の保護された反応基を有するアミノ酸ハロゲン化物を、カルボニル基の炭素に対するアルファ炭素にカルボアニオンを含む生体分解性の重合体と反応させ、次いで保護基を脱保護することによって調製される。
【0078】
適した天然の材料は、フィブリン、アルブミン、コラーゲン、ゼラチン、グリコサミノグリカン類、オリゴ糖およびポリ糖類、コンドロイチン、リン脂質類、ホスホリルコリン、糖脂質、タンパク質、アミノ酸、セルロース、およびこれらの混合物、共重合体、または組み合わせを含む。ある態様において、速度制御エレメントは、ウシ血清アルブミン(BSA)を含む。
【0079】
その他の適した材料は、チタン、クロム、ニチノール、金、ステンレス鋼、金属合金、セラミック、またはこれらの組み合わせ;および速度制御エレメント材料(例えば、非重合体化合物)と治療能力がある薬剤の相互作用(例えば、化学反応、高分子量、立体障害、疎水性、親水性、両親媒性、加熱)の結果として治療能力がある薬剤を放出しうるその他の化合物を含む。例としては、電気化学的腐食経路によって腐食を促進するような異なる電気化学的能力を有する2つ以上の金属または金属合金の組み合わせを使用してもよい。
【0080】
分解性材料は、バルク分解または加水分解によって分解してもよい。ある態様において、速度制御エレメントは、全体の分解もしくは加水分解、または好ましくは表面の分解もしくは加水分解によって、分解もしくは加水分解され、その際速度制御エレメントの表面は時間とともに分解または加水分解されるが、大きさの完全性は維持される。もう一つの態様において、疎水性の速度制御エレメントは、所望の放出速度で治療能力がある薬剤を放出する傾向があるので好ましい。非分解性の速度制御エレメントは、拡散によって治療能力がある薬剤を放出しうる。
【0081】
図2Dは、膨張可能な構造体における組織または管腔に面した表面の1つと速度制御エレメント43との間に配置された、治療能力がある薬剤28を有する態様の特徴を図示する。
【0082】
図2Eに示すように、供与源25は、膨張可能な構造体16の組織または管腔に面した表面の1つの少なくとも一部に形成された速度制御エレメント43を含み、治療能力がある薬剤28と共にマトリックス40を形成する。先に説明したように、治療能力がある薬剤28は、例えば、治療能力がある薬剤の重合体がマトリックスを形成する場合のように、それ自体が速度制御エレメントとして作用してもよい。
【0083】
マトリックスは、図2Fおよび2Gに示すように、速度制御エレメント43と膨張可能な構造体16との間に形成されて、その間にマトリックス界面46を形成してもよく、および/または治療能力がある薬剤28と速度制御エレメント43との間に形成されてもよい。マトリックス界面は、2つの層(例えば、速度制御エレメントおよび治療能力がある薬剤)の物理的な配置の結果として形成されてもよい。代わりにおよび/またはさらに、マトリックス界面は、治療能力がある薬剤と重合体、オリゴマー、カップリング剤、または小分子との間の化学反応の結果として形成されてもよい。マトリックス界面は、好ましくは、さらに、感受性の高い組織部位に対する治療能力がある薬剤の放出の制御をもたらす。
【0084】
ある態様において、図2Hに示した特徴の、人工器官13の最も外側の層は、最も外側の層とその他の層との間で形成されたマトリックス界面46の有無にかかわらず、治療能力がある薬剤から形成されてもよい。治療能力がある薬剤28は、大部分の図に離散粒子として示したが、平滑な層または粒子の層、例えば図2Hに示したとおりのマトリックス界面46の一部として形成されてもよい。
【0085】
別の態様において、図2Iに示した特徴の、第2の速度制御エレメント49の少なくとも1つの層は、マトリックス40全体に形成され、感受性の高い組織部位に対する治療能力がある薬剤28の放出速度にさらに影響を及ぼす。第2の速度制御エレメント49は、第1の速度制御エレメント43を形成するものと同じまたは異なる材料のものであってもよい。
【0086】
ここで、図2Jおよび2Kを参照し、供与源は、複数の化合物、例えば第1の治療能力がある薬剤28、および治療的な能力があるもう一つの薬剤50または可能とする化合物61(図2N)などのもう一つの化合物50を含んでいてもよい。複数の化合物のそれぞれは、供与源の同じまたは異なる領域にあってもよい。例えば、図2Kに示すように、第1の治療能力がある薬剤28は、マトリックス40に存在してもよく、一方、第2の治療能力がある薬剤50は、第2の治療能力がある薬剤50および第2の速度制御エレメント55によって形成される第2のマトリックス52にあってもよい。速度制御エレメント43および55は、同じまたは異なる材料から形成されてもよい。
【0087】
もう一つの治療能力がある薬剤は、抗癌剤;化学療法薬;血栓溶解剤;血管拡張剤;抗微生物または抗生物有糸分裂阻害剤;成長因子アンタゴニスト;フリーラジカルスカベンジャ;生物学的な薬剤;放射線療法剤;放射線不透過剤;放射標識された薬剤;ヘパリンおよびその誘導体などの血液凝固阻止剤;サリドマイド(商標)などの抗血管形成治療能力がある薬剤;血管形成治療能力がある薬剤;PDGF-Bおよび/またはEGF阻害剤;乾癬治療能力がある薬剤を含む抗炎症薬;リボフラビン;チアゾフリン;ザフリン(zafurin);アセチルサリチル酸などのシクロオキシゲナーゼ阻害剤、クロピドグレル(例えば、プラビックス(Plavix)(商標))およびチクロピジン(例えば、チクリド(Ticlid)(商標))などのADP阻害剤、シロスタゾール(例えば、プレタール(Pletal)(商標))などのホスホジエステラーゼIII阻害剤、アブシキシマブ(abciximab)(例えば、レオプロ(Rheopro)(商標))などの糖タンパク質IIb/IIIa薬を含む抗血小板剤;エプチフィバチド(eptifibatide)(例えば、インテグリリン(Integrilin)(商標))、およびジピリダモールなどのアデノシン再取り込み阻害剤;抗酸化剤、酸化窒素ドナーを含む治癒剤および/または促進剤;制吐剤;制嘔吐剤;これらの誘導体および組み合わせからなる群より選択される少なくとも1つの化合物を含んでいてもよい。もう一つの治療薬は、同じまたは異なる速度および相において、治療能力がある薬剤の前に、同時に、または後に放出されてもよい。
【0088】
もう一つの態様において、図2Lおよび2Mに示した特徴の、治療能力がある薬剤28は、貯蔵所58内の膨張可能な構造体16内または上に配置される。速度制御エレメント43は、治療能力がある薬剤の放出に影響を及ぼすために、貯蔵所58および/または治療能力がある薬剤28に隣接して配置されてもよい。前に述べたとおり、典型的な図および記述により「隣接する」の用語を限定することは意図されない。
【0089】
更なる態様において、図2Nに示した特徴の、もう一つの化合物は、外部のエネルギー形態または天然の条件に応答可能にして、治療能力がある薬剤の放出に影響を及ぼすことを可能にする化合物61を含む。応答可能な化合物は、治療能力がある薬剤、速度制御エレメント、膨張可能な構造体、またはこれらの組み合わせと結合していてもよい。図2Nに示すように、応答可能な化合物は、治療能力がある薬剤と結合される。可能にする化合物61は、治療能力がある薬剤28に結合された磁性粒子から形成されてもよい。エネルギー源は、治療能力がある薬剤28の放出を生じさせるために、移植の後に人工器官13において磁界を向けるための磁気供与源であってもよい。磁性粒子61は、磁気ビーズから形成されてもよく、典型的には約1nm〜約100nmの範囲の大きさを有すると考えられる。磁気供与源は、典型的には約0.01T〜約2Tの範囲の強度で人工器官13をその磁界にさらし、これが磁性粒子61を活性化することにより、人工器官からの治療能力がある薬剤の放出を生じると考えられる。もう一つの可能にする化合物は、上記の通りに、人工器官13のその他の配置に存在してもよい。
【0090】
その他の適切な外部エネルギー源は、これらがもう一つの化合物を必要とするか否か、またはこれらの性能が、もう一つの化合物の有無によって影響を受けないかにかかわらず、超音波、磁気共鳴映像法、磁界、高周波、温度変化、電磁、X線、照射、熱、ガンマ、振動、マイクロ波、またはこれらの組み合わせを含む。
【0091】
例として、超音波外のエネルギー源は、20kHz〜100MHzの範囲、好ましくは0.1MHz〜20MHzの範囲の振動数、および0.05W/cm2〜10W/cm2の範囲、好ましくは0.5W/cm2〜5W/cm2の範囲の強度レベルを有して使用されてもよい。超音波エネルギーは、1mm〜30cmの範囲、好ましくは1cm〜20cmの範囲の距離から人工器官13において誘導される。超音波は、5秒〜30分の範囲、好ましくは1分〜15分の範囲の時間で連続的に適用またはパルスしてもよい。この期間中の人工器官13の温度は、36℃〜48℃の範囲であると考えられる。人工器官13の多孔率を増大するために、超音波を使用してもよく、これにより、人工器官13から治療能力がある薬剤28を放出することができる。また、その他のエネルギー源、例えば加熱もしくは振動も、人工器官もしくはその部分の多孔率を増大するために、または同じものの配置を変えるために使用してもよい。
【0092】
さらに、本装置の生体適合性を与えるまたは増強するために、供与源および/または本装置の最外層全体に、生体適合性の(例えば、血液適合性を持つ)層を形成してもよい。生体適合性層として使用するために適した生体適合材料は、ポリエチレングリコール(PEG)、ポリエチレンオキシド(PEO)、ヒドロゲル、シリコーン、ポリウレタン、ヘパリンの被覆を含むが、これらに限定されない。
【0093】
膨張可能な構造体の大きさは、その用途に依存する。典型的には、膨張可能な構造体は、血管に適用するためには、約5mm〜約100mmの範囲の長さを有し、通常約8mm〜約50mmであると考えられる。膨張されない配置で血管に適用するための円柱状に成形された膨張可能な構造体の直径は、通常は、約0.5mm〜約10mm、さらに通常では、約0.8mm〜約8mmの範囲で変動し;膨張された配置における直径は、約1.0mm〜約100mm、好ましくは約2.0mm〜約30mmの範囲で変動する。膨張可能な構造体は、通常約0.025mm〜2.0mm、好ましくは約0.05mm〜約0.5mmの範囲の厚さを有する。
【0094】
環状セグメント、および膨張可能な構造体16などのその他の構造体の成分は、体内管腔ステントおよび移植片のために使用される従来の材料から形成されてもよく、典型的には、300シリーズステンレス鋼などの可鍛性の金属もしくは合金から、または超弾性合金および形状記憶合金、例えば、Nitinol(商標)合金、バネステンレス鋼などの弾力性のある金属;セラミックもしくは重合体材料などの金属性をもたない材料、またはこれらの組み合わせから形成される。重合体材料は、速度制御エレメントのために選択する材料に関して記載したものなどの、実質的に非分解性の重合体材料を含んでいてもよい。または、重合体材料は、生体分解性の速度制御エレメント材料を有する参照に記載されているものなどの、生体分解性のまたは実質的に生体分解性の重合体であってもよい。膨張可能な構成体材料が、速度制御エレメント材料から形成されている場合、膨張可能な構造体は、人工器官および治療能力がある薬剤の直接的供与源として機能するであろう。本発明の本体またはユニットセグメントのためのさらなる構造体は、米国特許第5,195,417号;第5,102,417号;および第4,776,337号に図示されており、これらの完全な開示は、参照として本明細書に組み入れられる。
【0095】
構造体として使用するためのその他の適した材料は、以下のものを含む:炭素もしくは炭素繊維、酢酸セルロース、硝酸セルロース、シリコーン、ポリエチレンテレフタラート(terphthalate)、ポリウレタン、ポリアミド、ポリエステル、ポリオルトエステル、ポリ無水物、ポリエーテルスルホン、ポリカーボネート、ポリテトラフルオロエチレン、もしくは生体適合性の別の重合体材料、またはこれらの混合物もしくは共重合体、ポリ無水物、ポリカプロラクトン、ポリヒドロキシブチラートバリラート、もしくは生体分解性の別の重合体、またはこれらの混合物もしくは共重合体;タンパク質、細胞外基質成分、コラーゲン、フィブリン、もしくは生物学的な別の薬剤、または上に一覧を挙げた、分解性の、非分解性の、金属の、もしくはその他の任意の適した混合物。ある態様において、装置は、治療能力がある薬剤の重合体などの、重合体の供与源と共に生体分解性の構造体を含んでいてもよい。
【0096】
膨張可能な構造体16は、ステント70または移植片であってもよい。膨張可能な構造体がステントである場合、膨張可能な構造体16は、図3に示すとおり、通常少なくとも2つの放射状に膨張可能な、通常、円柱状の環状セグメント73を含む。典型的には、膨張可能な構造体16は、少なくとも4、しばしば、5、6、7、8、10、またはより多くの環状セグメントを有するであろう。環状セグメントの少なくともいくつかは、互いに隣接するが、その他のものは、その他の非環構造体によって分離されていてもよい。典型的なステント構造体の記述は、網羅的であることは企図されず、本発明に有用なステントのデザインのその他のバリエーションが当業者に既知であることが認識されるはずである。
【0097】
図3をもう一度参照し、本発明に使用される典型的なステント70(同時係属米国特許出願第08/968319号において更に詳細に記載され、本発明の譲受人に帰属する、ステントの特徴を具体化しており、この開示はその全体が参照として本明細書に組み入れられる)は、4〜50個の環状セグメント73(8つで図示されている)を含む。環状セグメント73のそれぞれは、少なくとも1つのS字形のリンク76によって隣接した環状セグメントに結合されている。環状セグメント73のそれぞれは、複数、例えば6支柱/ヒンジ・ユニットを含み、環状セグメント73のそれぞれにおけるそれぞれの6個のヒンジ/支柱構造体のうち2個は、S字形のリンク76によって隣接した環状セグメントに結合される。図3で示したとおりのステント70は、ステント70が崩壊したか、または膨張されない配置にあることを示す。
【0098】
「放射状に膨張可能な」の用語は、本明細書に使用されるものとして、小さな直径配置から、放射状に膨張された、通常は円柱形の配置に変化することができ、これは膨張可能な構造体16が所望の標的部位に移植されたときに達成される部分を含む。膨張可能な構造体16は、最小限に弾力的、例えば可鍛性があり、したがって標的部位においてこれを膨張させかつセットするために、内力の適用が必要であってもよい。典型的には、膨張力は、血管における手技のための血管形成術カテーテルのバルーンなどのバルーンによって提供することができる。膨張可能な構造体16は、好ましくは、特にステントの柔軟性および圧着性を増強するために有効である連続したユニットセグメントの間で、S字形のリンクを提供する。
【0099】
または、膨張可能な構造体16は、自己膨張することもできる。本発明の装置に使用される構造体は、膨張可能な構造体16(自己膨張する構造体など)を含み、調節されたステンレス鋼などの弾性材料、またはNitinol(商標)合金などの超弾性合金を利用して、これが、圧迫がないときにその望まれる放射状に膨張された直径を有するように、すなわち放射状に圧迫する外筒の力から解放されるように、本体部分を形成することによって提供される。体内管腔にアンカーされたままにするために、膨張可能な構造体16は、管腔によって部分的に圧迫されたままである。自己膨張する膨張可能な構造体16は、例えば膨張可能な構造体16を外筒またはチューブ内に配置して、標的部位で外筒を除去することにより、これを放射状に圧迫された配置でトラックし送達することができる。
【0100】
ここで図3並びに図4Aおよび4Bを参照し、本発明の特徴を含む典型的なステント70は、一般に近位のおよび遠位の末端82および85を有する円柱形フレーム79、組織および管腔に面する表面88および91、環73を含む放射状に膨張可能な複数のユニットセグメントを含むことが示されている。ユニットセグメントは、好ましくは、異なる機械的プロフィールを有する部分を含み、例えば膨張の結果として示されるであろう。例えば、部分は、ベンド、ポイント、交点、ジョイント、または乱流にさらされる領域において相対的に高い機械的プロフィールの部分のその全長と、相対的に低い機械的プロフィールの部分を含んでもよい。足場の膨張により、相対的に低い機械的プロフィールを示す領域は、典型的には実質的に曲がること、屈曲すること、伸張すること、または圧迫することはなく、通常は約5%未満である。いくつかの環73は、示したように、膨張リンク76を介して少なくとも1つの軸方向に隣接した環でつながれており、好ましくはS字形の形を有し、より好ましくはS形態は、その長さに沿って相対的に平滑なプロフィールを有し、膨張によるキンクを最小化させ、または減少させる。好ましくは、環73は、示したように、S字型の形を有する。同様に、リンクは、これらの長さに沿って異なる機械的プロフィールを有する部分を含んでいてもよい。例えば、リンクまたはジョイントは、これらの長さに沿って、相対的に低い機械的プロフィールの部分を有し、ベンド、ポイント、交点、ジョイント、または乱流にさらされる領域において相対的に高い機械的プロフィールの部分(すなわち、体を通る液体(例えば、血液またはその他の体液)の流れの実質的に直接のラインの領域)を含んでいてもよい。
【0101】
図5Aおよび5Bに示したとおりの態様において、治療能力がある薬剤は、高いおよび低い応力の領域94および97の両方において、構造体の組織に面する表面および管腔に面する表面の少なくとも1つの表面のすべてに隣接して配置する。図6Aから6Fに示したとおり、供与源は、組織もしくは管腔に面する表面のうちの少なくとも1つの全てに、または円柱形のフレームの部分のみに、通常は相対的に低い機械的プロフィール97を有する環および/または関節の73および76の部分のみに配置されてもよい。治療能力がある薬剤は、別々の部分に、相対的に大きな領域部分を有する部分(例えば、図6A)、好ましくは相対的に低い機械的プロフィールを有する領域に適用されてもよい。代わりにまたはさらに、治療能力がある薬剤は、より小さな表面積に(例えば、図6B)、好ましくは構造体の外面に沿って、環および/またはリンク(図6D、6F)の側面および/または縁から離れて存在してもよい。
【0102】
供与源は、これに含まれる治療能力がある薬剤の量を変化させてもよい。供与源が複数のセグメントに存在するときに、例えば、別々の部分に存在するときに、それぞれの供与源は、同じか、または異なる量において、同じか、または異なる治療能力がある薬剤を含んでもよく、並びに同じか、または異なる相および/または速度において、感受性の高い組織部位に治療能力がある薬剤を利用可能としてもよい。供与源は、例えば治療能力がある薬剤が治療能力がある薬剤の重合体であるときは、治療能力がある薬剤であってもよく、または例えば、同じか、もしくは異なるマトリックス形成材料と共に、1つもしくは複数の治療能力がある薬剤としてのマトリックスを含んでいてもよい。供与源は、構造体において、もしくは構造体内で、またはこれらを組み合わせて、マトリックス界面の一部として、層、マトリックスとして存在してもよい。供与源は、単層、またはお互いにすぐ隣接するか、もしくはもう一つの層(例えば、もう一つの供与源または速度制御エレメント層)によって分離された複数の層として存在してもよい。
【0103】
図7Aから7Dに示した態様の特徴において、ステントは、構造体の少なくとも一部に隣接して(例えば、全体に)配置された速度制御エレメント43をさらに含む。速度制御エレメントは、組織または管腔に面する表面のうちの少なくとも1つの構造体(例えば、図7A)または供与源25を含むステントの領域のみ(例えば、図7B)に隣接して配置されていてもよい。速度制御エレメントは、構造体の領域の全てではなく一部のみに配置されるとき、装置は、完全に速度制御エレメントで覆われている構造体と比較して、有利には相対的に高い柔軟性を示す可能性がある。別の態様において、速度制御エレメントは、相対的に高い応力プロフィールを有する構造体における領域のみに配置されてもよい。この後者の態様は、全体の皮膜の厚さがより厚いか、または速度制御エレメントが構造体全体にわたって適用された装置が要求されるときに、特に有効でもよい。図に示したとおり速度制御エレメントは、構造体の全ての外周を被覆しているが、速度制御エレメントは、管腔および組織に面する表面の一方または両方および/または装置の末端の構造体の一部のみを被覆してもよいことが理解されるはずである。加えて、速度制御エレメントおよび/または治療能力がある薬剤は、構造体における種々の位置で、例えば体流の直接的流れの側面において、異なる厚さを有していてもよい。
【0104】
図8Aから8Dに示したもう一つの態様の特徴において、装置は、治療能力がある薬剤の有無にかかわらず、隣接する治療能力がある薬剤を含むセグメントおよびそうでないものの両方に配置された速度制御エレメント43を有するセグメントを含む。好ましくは、セグメントは、相対的に低い機械的プロフィールの領域に隣接して配置された治療能力がある薬剤を含み、相対的に高い機械的プロフィールの領域は、治療能力がある薬剤を含まない。速度制御エレメントは、異なる厚さを有する部分を含む。
【0105】
好ましくは、治療能力がある薬剤(供与源、例えば貯蔵所)を含む装置のセグメントに隣接して配置された速度制御エレメントの厚さは、装置のその他のセグメントの厚さよりも相対的に薄い。この可変の速度制御エレメントの厚さプロフィールにより、より高い応力領域におけるクラッキングまたはピンホール形成の可能性の低下をもたらすと共に、相対的に全体に薄い厚さを維持する。治療能力がある薬剤が存在しない場合であっても、これらのセグメントのクラックおよび/またはピンホール形成の形成を最小にすることにより、抑制できない急速な、治療能力がある薬剤の放出の可能性を最小にする。
【0106】
非多孔性の速度制御層などの速度制御エレメント層の厚さは、約50オングストローム(A)〜約50ミクロン(μm)、約100オングストローム〜約20ミクロン、通常約100オングストローム〜約10ミクロン、通常約5000オングストローム〜約5ミクロン、および名目上7500オングストローム〜約2ミクロンの範囲で変動し得る。
【0107】
いかなる限定も企図しないが、非多孔性の速度制御層は、膨張により相対的に高い機械的プロフィールを受ける構造体の部分全体に適用されたときに、膨張によるピンホールのクラッキングおよび/または形成に対する感受性が高いと考えられている。クラッキングおよび/またはピンホール形成により、速度制御層に間隙を生じる。間隙は、次に、溶出培地の供与源への輸送を助け、これにより、身体上に治療能力がある薬剤をより急速に放出させる。必要および所望の効果に依存して、長期間にわたって治療能力がある薬剤を放出することが必要なときは、この効果を減少することまたは最小にすることが要求されるであろう。治療能力がある薬剤供与源は、相対的により高い機械的プロフィールを示すステントのセグメントの全てまたは一部のみがなくてもよい。
【0108】
治療能力がある薬剤を伴うおよび伴わない装置セグメントを有する態様において、速度制御エレメントの厚さは、好ましくは約100オングストローム〜約5ミクロンの範囲であり;好ましくは、治療能力がある薬剤を含む装置セグメントにおいて約100オングストローム〜約1ミクロンの範囲であり、および好ましくは、治療能力がある薬剤を含まない装置セグメント(例えば、高応力領域)において約0.5〜約5ミクロンの範囲である。または、速度制御エレメントの厚さは、好ましくは約0.5ミクロン〜約5ミクロンの範囲であり;好ましくは、治療能力がある薬剤を含む装置セグメントにおいて、約1ミクロン〜約5ミクロンの範囲であり、および好ましくは、治療能力がある薬剤を含まない装置セグメント(例えば、高応力領域)において約0.5〜約5ミクロンの範囲である。好ましくは、速度制御エレメントが、パリレン、より好ましくはパリレンCを含む場合、速度制御エレメントの応力領域の厚さは、約0.5ミクロン〜約10ミクロンの範囲である。
【0109】
もう一つの態様において、本装置は、放出速度をより遅く、または速くするための供与源および速度制御エレメントのいずれかまたは両方の変更可能な厚さを有する領域(例えば、装置の遠位および近位の末端)を含む。
【0110】
図6Aおよび6Bに示したものなどの態様において、供与源が、相対的に高い機械的プロフィールを有する領域に存在しないときは、非多孔性の速度制御エレメント層の厚さは、好ましくは、約50オングストローム〜5ミクロンの範囲である。
【0111】
もう一つの態様において、図9A〜9Dに示したとおり、本装置は、以下に記載したものと同様の方法によって作成され、かつ使用される、治療能力がある薬剤の貯蔵所に、開口部またはオリフィス100を含み、標的とされた皮質内部位に対する治療能力がある薬剤の放出を制御することができる。
【0112】
開口部100は、治療能力がある薬剤の供与源の上に直接か、もしくはそこから分かれ出るかのいずれかまたは両方(例えば、それぞれ図9Bおよび9Cに示したもの)で、速度制御エレメント(例えば、パリレンなどの非多孔性の速度制御エレメント)に配置されてもよい。
【0113】
開口部は、所望の放出速度に依存して、速度制御エレメント層の完全な厚みに連続した深さを、または完全な深さよりも短いものを有していてもよい。治療的な能力のある薬剤の所望の放出速度を実現するために、単一の装置は、同じか、または異なった開口部、大きさ、位置、パターン、および深さを含んでいてもよい。開口部は、約1オングストローム〜約100ミクロン、通常約1オングストローム〜約8ミクロンの開口の範囲であってもよい。
【0114】
ある態様において、図9Dに示したとおり、供与源および速度制御エレメントは、構造体表面に隆起する少なくとも一部を有する。隆起した部分103は、キャピラリー様の機能を可能にする開口部(表面またはより実質的に深いもの)を含んでいてもよい。隆起部分は、有利には、標的とされた皮質内部位の組織と比較的よく接触して、組織に対する治療能力がある薬剤のより直接の放出を可能にし、かつ血流内へは少なくすることにより、治療能力がある薬剤の洗い流しを最小にすると考えられる。
【0115】
各供与源(例えば、貯蔵所)内の治療能力がある薬剤の量およびタイプは、同じか、または異なっていてもよい。ある例では、縁効果を最小に、または減少させるために、治療能力がある薬剤は、装置の末端においてより多くの量で存在する。
【0116】
少なくとも一つの開口部を含む態様は、治療能力がある薬剤の放出速度を制御可能に、2μg/日よりも多く、好ましくは約5μg/日よりも多く、およびより好ましくは約10μg/日よりも多く増大させる際に特に役立ち;開口部を有さない場合の速度は、50μg/日未満、好ましくは5μg/日未満、より好ましくは2μg/日未満でよい。
【0117】
本発明にしたがって、速度制御エレメントに開口部を含む装置を使用する場合、治療能力がある薬剤の放出速度に優れた一貫性が達成されるであろう。典型的には、速度制御エレメントは、装置間の放出速度に相対的に高い程度の差異を生じる。このような差異をもたらす要因の例は、ロット間(例えば、構造、分子量、向き、結晶化度、ガラス転移温度、多孔度、水分含量)で変動するであろうポリマーの物理的および化学的パラメータを含むが、これらに限定されない。さらに、治療能力がある薬剤は、重合体速度制御エレメントを介して浸透し、治療能力がある薬剤の相分離および膨潤、そして速度制御エレメントは、速度制御エレメントの多孔度の変化を生じ、これにより治療能力がある薬剤の放出特性を変化させる。
【0118】
開口部および穴は、物理的に穴を開ける道具(例えば、針、ワイヤー、薄壁または鋭利な縁のチューブ、異なった横断面および鋭利な縁を有するチューブ、傾斜のあるチューブ、ピック);速度制御エレメント上の的確な位置にまたはランダムに、1つもしくは複数の穴またはオリフィスを作製するためのレーザ、電子ビーム、またはイオンビーム照射、イオン打ち込みなどを含むビーム;本装置の被覆および/または使用に適用する際に針穴が作製されるように、速度制御エレメントの薄層を適用することによって針穴またはオリフィスの形成を誘導することを含む(しかしこれらに限定されない)、種々の道具および方法を使用して作製してもよい。
【0119】
オリフィスを作製する方法のある態様において、図10A〜10Dに示したとおり、短い直径のワイヤー、プラスチック、またはろう(例えば、ミツバチろう)、ビーズ、チューブ、または同様の物体106が、速度制御エレメントを適用する前に穴/オリフィスの所望の位置に付着される。被覆過程において、本物体は、構造体に沿って等角に被覆されて、構造体に固定されていくと考えられる。次いで、本物体を部分的に(図10C)もしくは完全に(図10D)切断または除去し(例えば、切断用具)、結果としてもはや被覆されていない構造体の一部を曝露する。本物体は、微小石けん、油、界面活性剤の水溶液、または被覆後にこれを除去してその場所にオリフィスを残すことが望まれる場合はその他の放出剤で被覆することができる。
【0120】
もう一つの態様において、図11Aおよび11Bに示したとおり、装置70□は、装置の移植および/またはその後に標的とされる身体内部位の環境にさらされる間に膨張した結果として作製される計画的に分断される領域109を含む。
【0121】
例として、疎水性の治療能力がある薬剤の層が相対的に高い機械的プロフィールを有する装置領域に適用される場合、特に、高濃度の治療能力がある薬剤の場合、治療能力がある薬剤および/または隣接して(例えば、治療能力がある薬剤層の外面に)配置された速度制御エレメント層は、装置が膨張し、または標的とされた身体内部位の環境に曝露される間に、ひびが入り、分断し、および/または針穴ができてもよい。その結果、治療能力がある薬剤は、この分断された領域においてより高速に放出される。装置は、使用することにより熟成され、速度制御エレメントのプロフィールが変化(例えば、分断領域の大きさの変化、治療能力がある薬剤へのおよび治療能力がある薬剤からの溶出液の移動の結果としての多孔度の増大)するかもしれない。
【0122】
さらにもう一つの態様において、治療能力がある薬剤は、約90%よりも少ない、通常約50%よりも少ない結晶化度を有する。より低い結晶化度は、所望の結晶化度をもたらすために十分な時間、通常は約1分〜約24時間、典型的には約30分〜約2時間の間、治療能力がある薬剤で被覆された装置の任意の態様を(速度制御エレメントの適用前もしくは適用後に)より高温に、通常はおよそまたは治療能力がある薬剤の融点以上に加熱することにより達成されるであろう。治療能力がある薬剤が融解すると、より非晶質となることにより脆性が低くなる。治療能力がある薬剤の非晶質(または準非晶質)性は、針穴の作製または望まれない速度制御エレメント層の妨害を減少し、したがってより徐放性となる。
【0123】
速度制御エレメントの有無にかかわらず、治療能力がある薬剤を被覆された装置の加熱は、治療能力がある薬剤および/または速度制御エレメントを分子再構成することにより、装置の残留応力を変化する、例えば減少するために役立つであろう。
【0124】
ある態様において、治療能力がある薬剤/速度制御エレメントで被覆された装置は、速度制御エレメントの残留応力を変化させる、通常、約10%未満に、通常は約5%未満に、典型的には1%未満に、普通は約0.5%未満に減少させるために、十分な時間で温度に加熱する。典型的には、装置は、およそまたはTgより高い温度に、通常はTgと速度制御エレメントの融点の間に加熱される。期間は、通常は約1分〜約24時間、典型的には約30分〜約2時間の範囲である。
【0125】
また、速度制御エレメントおよび/または治療能力がある薬剤のための被覆された装置の残留応力は、速度制御エレメントのTgまたは治療能力がある薬剤の融点以下の温度に、それぞれ長期間装置を加熱することなどの手段により、および超音波、磁力、もしくは振動を含むその他のエネルギーの供与源を使用して減少させてもよい。
【0126】
ある態様において、装置は、治療能力がある薬剤と少なくとも部分的に結合するように配置されている別の速度制御エレメント層を含む。ある態様において、ウシ血清アルブミン(BSA)が非多孔性の速度制御エレメント(例えば、パリレン)に隣接して配置され、その結果、治療能力がある薬剤(例えば、ミコフェノール酸)が非多孔性の速度制御エレメントから拡散または溶出し、治療能力がある薬剤はBSAと結合し、治療能力がある薬剤の放出をさらに遅らせまたは制御する。治療能力がある薬剤と結合することができる別の速度制御エレメントのその他の例は、ポリエチレンイミンなどの四級アンモニウム化合物を含む。一つの態様において、ヒドロゲル化合物は、治療能力がある薬剤および速度制御エレメントのいずれかもしくは両方の下に、またはマトリックスに配置される。体液がヒドロゲル化合物と接触して、ヒドロゲル化合物が膨潤して速度制御エレメントを介して、例えば速度制御エレメント層の分断を引き起こすことにより、治療能力がある薬剤の拡散特性に変化を引き起こす。
【0127】
膨張可能な構造には、治療能力がある薬剤を人工器官に被覆すること、噴霧すること、浸漬すること、沈着させること、または塗布することによって、治療能力がある薬剤および/または任意の別の化合物を組み入れてもよい。通常、治療能力がある薬剤は、これを適用する前に溶液に溶解されている。適切な溶媒は、水性溶媒(例えばpH緩衝液、pH調節剤、有機塩、および無機塩を含む水)、アルコール(例えば、メタノール、エタノール、プロタノール、イソプロパノール、ヘキサノール、およびグリセロール)、ニトリル(例えば、アセトニトリル、ベンゾニトリル、およびブチロニトリル)、アミド(例えば、ホルムアミドおよびN-ジメチルホルムアミド)、ケトン、エステル、エーテル、DMSO、気体(例えばCO2)などを含む。次いで、治療能力がある薬剤の構造物を乾燥させる。または、治療能力がある薬剤を、まず治療能力がある薬剤とマトリックス材料を単独で、もしくは溶媒と組み合わせて混合することまたは溶解することによってマトリックス中に調製した後、構造体にこれを組み入れてもよい。
【0128】
本発明の装置を作成する方法の例において、裸のまたは被覆されていないステントを、まず従来の方法を使用して製造および/または加工し(例えば、デスケルし、電解研磨し、不動態化し)、その後に治療能力がある薬剤を組み入れる。例えば、裸のステントを、シラン、プラズマ沈着被覆、プラズマ処理、冠状放電などのカップリング剤、および/またはその後の工程において、裸のステントに対する速度制御エレメントの接着を促進および/または増強するためのその他の手段で任意に処理される。
【0129】
裸の構造(例えば人工器官)または被覆された治療能力がある薬剤の構造体は、蒸着チャンバまたはプラズマ沈着被覆チャンバに置いてもよい。固体または液体の形態の治療能力がある薬剤は、同じチャンバ内の容器またはディッシュ内の構造体下に直接置くこともできる。容器を同時にまたは周期的に所望の温度(すなわち、治療能力がある薬剤の沸点または昇華温度)に加熱し、一方で速度制御エレメント(例えば、パリレン)またはプラズマ沈着を生じる。チャンバは真空であるので、気体の治療能力がある薬剤は、照準線により、構造体を被覆すると考えられる。ディッシュの配置(丸、四角、矩形、深さ、穴を伴う被覆)、治療能力がある薬剤の量/分布、穿孔処理した遮蔽物/フェンス、およびその他の要因により、ステント上に直接もしくは間接的に分散または沈着された治療能力がある薬剤の厚さ、分布、および均一性を制御すると考えられる。または、構造体に、または上に、治療能力がある薬剤および/または速度制御エレメントを選択的に適用するために、ナノサイズの沈着技術を使用してもよい。
【0130】
例えば、本明細書には、構造体上にまたは内に、速度制御エレメントおよび/または治療能力がある薬剤を適用するためのより詳細なプロセスが記載されている。短い直径の心棒112またはその他の手段をステント内に挿入する。次いで、心棒−ステント構造体を沈着チャンバ内に置く。好ましくは、例えば図12に示したように、心棒−ステント構造体をチャンバ内部の回転性の装置上に取り外しがきくように付着させ、より安定した被覆を得てもよい。沈着チャンバをシールする。速度制御エレメント材料またはその前駆体(例えば、パリレンCのその二量体形態)を、充填扉を介して周囲温度の気化器ゾーンに充填する。次いで、扉をシールする。充填される速度制御エレメントまたはその前駆体の量は、所望のまたは必要とされる被覆の厚さ、基質の全表面積、沈着チャンバの大きさ、および速度制御エレメントのタイプ(例えば、パリレンN、C、D、またはF)に依存する。例示的な態様において、充填される速度制御エレメント前駆体(例えば、パリレンCのその二量体形態)は、約3グラムであった。次いで、シールされた系を真空ポンプで、例えば約-4〜約100mTorr、通常は約4〜約15mTorrの定常状態のベース圧力にする。
【0131】
一旦系のベース圧力に達したら、次いで、気化器ゾーンを適切な温度、例えば約70〜約200℃(例えば80℃)に加熱する。チャンバ内の圧力を維持するために、気化器ヒータをチャンバ圧力調節器によってオン/オフを繰り返す。圧力がチャンバ圧の設定点に達すると、チャンバ圧力が行き過ぎるのを防止するために、気化器ヒータの力が弱められる。次いで、気化器ヒータを圧力設定点であるチャンバ圧力の温度に維持し、固体の速度制御エレメントまたはその前駆体(例えば、パリレン二量体)の段階的な気化および/または昇華を助ける。
【0132】
真空ポンプを操作すると、前駆体の気体が熱分解ゾーンを通って下流に流れる。高温の熱分解炉では、二量体の気体を速度制御エレメント(例えば、パリレン単量体)の気体の形態に切断する。反応性の単量体の気体は、熱分解ゾーンに存在し、沈着が生じる構造体(例えば、人工器官構造体)を含む沈着チャンバに入る。単量体は、被覆に利用できる沈着チャンバ内の周囲温度の表面の全てまたは実質的に全てに対して沈着し重合体化すると考えられる。
【0133】
単量体の気体が沈着チャンバ内に流れると、さらなる気体により、チャンバ内の圧力の上昇が生じる。典型的には、所望の上昇は、パリレンCのベース圧力以上の約10〜約40mTorrの範囲である。沈着チャンバ内における速度制御エレメント(例えば、非多孔性のパリレンフィルム)の成長速度は、単量体の気体の分圧に比例する。二量体が気化する速度を制御することにより、沈着チャンバ内において所望の圧力を維持するために、フィードバック制御系を使用してもよい。
【0134】
速度制御エレメント単量体のガス(例えば、パリレンC単量体の気体)を構造体表面に沈着すると同時におよび/またはその後に、治療能力がある薬剤を含むディッシュを治療能力がある薬剤の沸点または昇華温度以上に加熱して、ガス状の治療能力がある薬剤を生じさせて、真空チャンバ内で上向きに流れさせる。構造体は、治療能力がある薬剤との照準線内にあるので、構造体を治療能力がある薬剤で被覆することもできる。したがって、治療能力がある薬剤をマトリックス(例えば、速度制御エレメントを伴う治療能力がある薬剤)の一部として、または別々の層として被覆してもよい。後者の場合、治療能力がある薬剤をまず構造体に被覆し、続いて速度制御エレメントを被覆してもよく、または逆であってもよい。もちろん、別々の層により、これらの間にマトリクス界面を形成してもよい。
【0135】
真空ポンプに付随したガスの流れの動力学のために、沈着チャンバ内に流れ、かつ構造体に沈着しないあらゆる速度制御エレメントおよび治療能力がある薬剤は、冷却トラップを通って真空ポンプの方へ流れる傾向があると考えられる。
【0136】
二量体および/または治療能力がある薬剤が完全に蒸発したときに、沈着チャンバ内の圧力は減少し、ベース圧力に達すると考えられる。この点において、沈着サイクルが完了し、系を大気圧に戻して、被覆されたステントを取り出すことができる。
【0137】
パリレン(例えば、パリレンC)を構造体に適用するためのプロセスのパラメータは、例示的な態様において、以下の通りである。パリレンプロセスのパラメータは:約80℃の気化(昇華)温度、約650℃の熱分解温度、約15mTorr以下のベース圧力(真空)、ベース圧力より上の約20mTorrの設定点の圧力(真空)である。治療能力がある薬剤の蒸発パラメータは:蒸発前のディッシュ温度は、沸点または昇華温度以下であり、蒸発の間のディッシュ温度は、沸点または昇華温度以上であり、約15mTorr以下のベース圧力(真空)、およびベース圧力より上の約20mTorrの設定点の圧力(真空)である。
【0138】
本発明の装置を作成する方法の例示的な態様において、図13Aに示したように、好ましくはステントの内径に近い外径を有する心棒112をステントのフレーム内に配置する。より良好に心棒にステントを維持するために、心棒からステントがはずれるのを防止するためにステントを心棒上に十分に圧着してもよい。心棒は、固体材料から形成されたかまたは閉じた外面を有するものである場合、選択的に、次の被覆工程の間において、円柱状のフレームの内部表面(すなわち、ステントの管腔表面)を遮蔽するためのマスクとして用いうる。
【0139】
選択的に、ステントの内径よりも十分に小さな外径を有する心棒および/または十分な開口部の管腔構造体(好ましくは、ステント上に所望の被覆パターンを作製するように設計されたパターン)が形成されたものは、被覆過程の間にステントの管腔表面を被覆するために使用してもよい。
【0140】
選択的に、概して円柱状の膨張した形状を有し、かつこの好ましくはシリコーンゴム、ナイロンなどの材料から形成された膨張可能なバルーン115を心棒として使用してもよい。バルーンのその膨張された配置は、好ましくは、ステントの内径と同じ外径を有する。心棒としてバルーンを使用することにより、被覆の完了後にステントからの除去が容易になる。
【0141】
図13Bに示したとおり、バルーンは、一連の長軸方向に離れた大きな直径の領域(ムカデ形状など)を含むように形成されてもよい。大きな直径の領域は、ステントが相対的に高い機械的プロフィールである管腔表面と接触し、したがって被覆過程の間に相対的に高い応力の領域をマスクするように、十分に離れている。
【0142】
もう一つの選択的な態様において、バルーンは、軟質ゴムなどの軟質材料から形成された外部管材料を含む。バルーンを支材とリンク間の空間に配置して、この縁をマスクし、こうしてリングの縁(例えば、厚さ)をマスクすると共に、ステントの組織に面する表面のみを被覆させる。
【0143】
本発明の装置を作成する方法のもう一つの態様において、相対的に高い機械的プロフィールの領域におけるステントの被覆を避けるまたは最小にするために、シリコーンゴムワッシャー(または、望まれるならば、その他の形状のその他の材料のもの)などの図13Cおよび13Dに示した一つまたは複数のワッシャーを、ステントの組織に面する表面の相対的に高い機械的プロフィールの領域全体に配置し、このようにして被覆プロセスの間に領域をマスクする。速度制御エレメントの適用後に、図13Bに示したものなどのワッシャーを、裂け目121を横切って避けさせて装置から容易に除去させてもよい。ワッシャーは、ステントの内径と実質的に同じか、わずかに大きいか、またはより好ましくは、より小さな内径を有していてもよい。好ましくは、ワッシャーは、ステントの相対的に高い機械的プロフィールの領域の幅よりも大きな幅を有していてもよい。
【0144】
さらにもう一つの態様において、構造体は、プラスチックまたは金属チューブなどのもう一つの材料に対してネガティブイメージを作製することによってマスクしてもよい。チューブは、2つの半分に切り開くこともできる。次いで、切り開かれたチューブをステント上に固定する。ステントの外側表面のみが曝露される。側面および管腔表面は曝露されない。治療能力がある薬剤をステント上に噴霧するときは、治療能力がある薬剤は、ステントの外側表面上にのみ存在する。これにより、図6B、6D、または同様の態様を生じるであろう。
【0145】
相対的に高い機械的プロフィールを有する構造体領域などの所望の部分をマスクするために、ステント構造体を平板、曲面版、チューブ、または図14Bなどの曝露された開口部もしくはスロットを有するその他の表面124などの種々の方法により、図14Aに示したようにマスクして、その結果、開口部および/またはスロットは所望の領域(例えば、低い機械的プロフィールの領域)を被覆にさらすが、その他の領域(例えば、高い機械的強度の領域)をマスクし得るであろう。または、図14Cに示したとおり、高い応力の領域におけるステントの組織に面する表面を被覆するために、柔軟なテープ127を使用してもよい。
【0146】
もう一つの態様において、ステントは、被覆の際にマスクされないか、または最小限にマスクされているかのいずれかである。望まれるならば、被覆が望まれない領域は、微細チップの紙ヤスリ、高圧空気ノズル、適切な溶媒(例えば、メタノール、エタノールイソプロパノールアセトン、水)を含む高圧噴霧ノズル、低い力のレーザ、電子ビームなどを適用することによって除去してもよい。または、治療能力がある薬剤および/または速度制御エレメントを構造体にまたは上に選択的に適用するために、非常に細かい噴霧ノズルまたはナノサイズの沈着手段を使用してもよい。
【0147】
次いで、図15A〜15Bに示したように、ステントを治療能力がある薬剤の供与源に曝露する。治療能力がある薬剤28は、好ましくは、適切な溶媒(類)および/またはマトリックスに溶解または混合して、噴霧などの方法によって適用される。好ましくは、ステントは、ステントが供与源(溶媒および/またはマトリクス材料に溶解された治療能力がある薬剤)で均一に配置され得るように、回転性の装置に除去可能に固定される。好ましくは、供与源を適用する装置の幅は、ステントの全長に供与源を適用するために、十分に長くする。治療能力がある薬剤を適切なマトリックス材料に溶解し、次いで好ましくは、ステント(マスクされたものまたは他のもの)に噴霧する。
【0148】
または、ステントは、粉末被覆などのその他の技術を使用して供与源で被覆されてもよいが、ステントは、真空沈着チャンバまたはプラズマ沈着/グロー放電チャンバ内にあり、パルスレーザー支援沈着技術で、高真空のチャンバにおいて気化されている治療能力がある薬剤で真空沈着し、その後にステント上に沈着する。被覆の完了後に、マスクをステントから取り除く。必要または望まれる場合には、過剰な治療能力がある薬剤を以前に記載したとおりに被覆されたステントから取り除いてもよい。
【0149】
治療能力がある薬剤および/またはマトリックス被覆の厚さは、噴霧の期間および心棒の回転速度によって制御してもよい。治療能力がある薬剤および/またはマトリックス被覆の厚さは、典型的には、約1オングストローム(Å)〜約50ミクロン(μm)、約100オングストローム〜約20ミクロン、一般には約100オングストローム〜約10ミクロン、通常は約5000オングストローム〜約5ミクロン、名目上約7500オンクストローム〜約2ミクロンの範囲である。一旦ステントが治療能力がある薬剤および/またはマトリックスで被覆されれば、溶媒の蒸発を完全にするために、ステントを真空、乾燥器、真空乾燥器に配置してもよい。
【0150】
非多孔性パリレン被覆は、清澄な透明であり、フィルム様の質感を有する。溶媒に対して抵抗性であり、以下のものなどの有機溶媒中にフィルムの厚さの約3%より多くは膨潤しないと考えられる:アルコール(例えば、イソプロパノール、エタノール、メタノール)、ケトン(アセトンおよび2,3-ペンタンジオン)、脂肪族炭化水素(イソオクタン)、芳香族炭化水素(キシレン、トルエン)、塩素化されたオレフィン(トリクロロメチレン)塩素化された芳香族(クロロベンゼンおよびO-ジクロロベンゼン)、複素環式の塩(ピリデン)、並びにフッ素化された溶媒(トリクロロトリフルオロエタン)。加えて、膨潤後、ひとたび溶剤が真空乾燥によって除去されるならば、非多孔性のパリレンの膨張は、完全に可逆的となる。
【0151】
部分的に速度制御エレメントで被覆された装置を作製するためのプロセスの態様において、プロセスには、上記考察した生産工程の任意の1つまたは複数を含んでもよい。例として、構造体は、蒸着被覆以外(すなわち、非多孔性のパリレン)または非多孔性のプラズマ沈着もしくはグロー放電被覆以外の手段による、非多孔性の重合体での被覆であってもよい。または、応力を加えられた領域における蒸着またはプラズマ沈着/グロー放電被覆の一部は、レーザ、電子光線、またはその他の手段で除去されてもよく;速度制御エレメントが望ましくない場合は、領域をマスキングする。もう一つの態様において、治療能力がある薬剤を適用した後、応力を加えられた領域(治療能力がある薬剤をほとんど伴わないか、または全くない)は、速度制御エレメントでステントを被覆する前にマスキングしてもよい。マスクは、被覆の後に除去される。
【0152】
被覆の真空蒸着の間にパリレン反応中間体のモノ(p-キシリレン)が、またはステントの応力を加えられた領域に対するプラズマ沈着/グロー放電被覆の間にプラズマフリーラジカルが流れることを妨げるために、ステントの所望の領域をフェンス(冷却または加熱)で保護してもよい。
【0153】
被覆の真空蒸着の間にパリレン反応中間体のモノ(p-キシリレン)が、またはステントの応力を加えられた領域に対するプラズマ沈着/グロー放電被覆の間にプラズマフリーラジカルが濃縮にステントが抵抗性となるように、被加熱フィルム、ワイヤー等をステントの所望の領域と接触させてもよい。
【0154】
もう一つの態様において、被覆の真空蒸着またはプラズマ沈着/グロー放電被覆の間に、被加熱流体の流れを輸送する1つまたは複数のチューブを、ステントの所望の領域と接触させてもよい。これらの保護されたステントの領域は、加熱されて、被覆の真空蒸着の間にパリレン反応中間体のモノ(p-キシリレン)が、またはステントの応力を加えられた領域に対するプラズマ沈着/グロー放電被覆の間にプラズマフリーラジカルが濃縮に抵抗性となる。
【0155】
非接触の供与源(例えば、対流熱源、赤外線、紫外線等)は、ステントの所望の領域に直接、またはフィルム、ワイヤー、チューブなどが、ステントの所望の領域と接触していてもよい。
【0156】
非多孔性のパリレンで被覆されていないステントまたは速度制御エレメントを被覆するプラズマ沈着/グロー放電の領域は、非多孔性重合体の速度制御エレメントを有するステントの領域をマスキングして、次いで上記の通りにマスクを取った領域に対して治療能力がある薬剤を適用することによって、治療能力がある薬剤で被覆することができる。
【0157】
必要に応じて、非多孔性の速度制御エレメントは、ステント、治療能力がある薬剤、および速度制御エレメント(例えば、非多孔性の速度制御エレメント)を、1つもしくは複数の溶剤中に配置することによって、治療能力がある薬剤(類)もしくは小さな非活性分子で浸潤させることができ、これは、しばらくの間、例えば、約1秒〜約1週間、通常約1時間〜約72時間、およびしばしば約2時間〜約24時間の範囲で、非多孔性の速度制御エレメントへおよび非多孔性の速度制御エレメントを通して、膨張するかまたは伝達することができる。溶剤(類)は、治療能力がある薬剤もしくは非生理活性の分子の供与源が、治療能力がある薬剤の貯蔵所から、または外部の供給源、または両方からのものであるかどうかに依存して、溶剤(類)に溶解された治療能力がある薬剤もしくは非生理活性の分子を含んでいても、または含んでいなくてもよい。腫脹の間の溶剤(類)の温度は、室温から溶剤(類)の沸点以下の高温度の範囲で変動させることができる。
【0158】
治療能力がある薬剤の貯蔵所および非多孔性の速度制御エレメントを有するステントは、非多孔性の速度制御エレメントが損傷を受けないと考えられる温度以下に、または治療能力がある薬剤が有意に分解しないと考えられる温度以下で、しばらくの間、通常約1秒〜約1週間、しばしば約1時間〜約72時間、および名目上約2時間〜約24時間加熱される。
【0159】
治療能力がある薬剤の貯蔵所および非多孔性の速度制御エレメントを有するステントは、1つまたは複数の蒸発溶剤(これは、好ましくは有機物である)としばらくの間、通常約1秒〜約1週間、しばしば約1時間〜約72時間、および名目上約2時間〜約24時間接触することができる。次いで、被覆された治療能力がある薬剤ステントをPTCAカテーテルのバルーン上に圧着し、標的とされた身体内の部位に配置する。
【0160】
作製の方法のもう一つの態様において、膨張可能な構造体は、装置の膨張の間のクラックおよび/またはピンホールの形成を最小にするために、メタクリルオキシプロピル-トリメトキシシラン(A-174)またはその他のシラン結合剤などのシラン処理によって最初に前処理される。例えば、装置を作製する方法において、膨張可能な治療能力がある薬剤で被覆された構造体は、約100:100:2の比を有するメタノール:水:シランの溶液に、しばらくの間、好ましくは15分間浸漬させる。次いで、構造体を除去して約10分間乾燥させ、次いでIPAでリンスする。次いで、処理された構造体を、速度制御エレメントを更に含めるために、上記の通りに処理する。シラン処理は、ステンレス鋼などの構成体材料に対する非多孔性のパリレンなどの速度制御エレメントの接着の促進を助ける。または、接着の促進を助けるために、非多孔性のプラズマ沈着/グロー放電被覆(例えば、メタン、C2F2、キシレン、シラン調光器(dimmer))を構造体表面に適用することもできる。接着促進物質による構造体の前処理により、例えば構造体の高応力領域において、速度制御エレメントを相対的に薄い厚さで適用するのを助ける。前処理は、その他の任意の態様で提供されてもよい。例として、前処理は、治療能力がある薬剤の供与源の全体に適用されてもよい(例えば、貯蔵所)。しかし、より弱い強度の速度制御エレメント-構造体接着プロフィールが望ましい場合、前処理は必要ではないであろう。
【0161】
または、隣接する治療能力がある薬剤の供与源を被覆する速度制御エレメントは、より厚くされるが、装置において応力を加えられた領域では、安定でしかも被覆の厚さがより薄くされることが望ましいであろう。速度制御エレメントのより厚い被覆により、標的とされた身体内の部位に対し、治療能力がある薬剤の放出速度の計画的な減少を生じる。ある態様において、治療能力がある薬剤を含まない装置セグメント、好ましくはより高い応力の領域の速度制御エレメントの被覆は、クラックおよび/またはピンホールの形成を最小にするのを助けるために相対的により厚い厚さを含む。
【0162】
速度制御エレメントの変更可能なまたは選択的な被覆を達成するために、以前に記載したものと同様のプロセスを利用してもよい。制御された被覆を成し遂げるために、速度制御エレメント単量体の気体(例えば、パリレン)の流速などの因子を減少してもよく、および/またはその位置を制御していてもよい。
【0163】
ある態様において、速度制御エレメントの沈着を制御可能に制限するために、取り外し可能な物理的フェンス(例えば、プレートに溝をつけた治療能力がある薬剤の貯蔵所と同じ幅を有する、ワイヤー、バー、チューブ)を、これに沈着されたより薄い厚さの速度制御エレメントを有することが望まれる領域に隣接して配置してもよい(例えば、ステント治療能力がある薬剤の貯蔵所)。
【0164】
または、速度制御エレメント単量体の気体と所望の薄い領域の材料の反応を最小にする、および/または減少させるために、低温加熱(例えば、室温以上)により、所望の薄い領域を目標としてもよい。このような加熱供与源の例は、赤外、紫外、加熱コイル、加熱エレメント、または所望の領域を目標として異なった量の加熱を発生することができるわずかな光の供与源のいずれかを含む。
【0165】
もう一つの態様において、噴霧被覆などの適切な方法を使用する場合、より少量の速度制御エレメントを計画的に適用してもよい。
【0166】
例として、以下の典型的な方法のいずれかを使用して、多孔性パリレンC層などの、多孔性速度制御エレメントが得られるであろう。
【0167】
多孔性パリレンまたはプラズマ沈着/グロー放電フィルムなどの、多孔性速度制御エレメントを有する装置を作製するための態様において、沈着の温度は、実質的に速度制御エレメント物質のガラス移行温度未満であってもよい。例として、速度制御エレメントとしてのパリレンCについては、ガラス移行温度(Tg)は、約80〜100℃である。析出温度が増大すると、フィルムの結晶化度も増大する。より高温にすることにより、被覆が基質の表面に配置された後に起こりうる再配列および分子運動が可能となる。重合体の鎖は、高次構造的により高次となる。析出温度が減少するほど、フィルムの結晶化度は減少し、アモルファス様になる。温度がさらに減少すると、例えば、-40℃〜液体窒素温度(-196℃)近くに減少すると、速度制御エレメントフィルムは、ますますアモルファス様および多孔性様になる。多孔性フィルムは、205℃の窒素ガス中で約2時間などの長さの期間、適切な温度において薄膜をアニールすることにより、標的とされた速度に変化させるか、または通常非多孔性の形態に変化させてもよい点に留意する必要がある。
【0168】
多孔性速度制御エレメント、多孔性パリレンC層を有する装置を作製するためのもう一つの態様において、以下のパラメータのいずれか1つまたは複数の組み合わせを使用してもよい:約20℃〜約200℃、好ましくは約40℃〜約60℃の気化(昇華)温度;約400℃〜約900℃、好ましくは約500℃〜約650℃、および多孔性パリレンCについては、約750℃以上の熱分解温度;約-4〜約200mTorr、好ましくは約100mTorr以上のベース圧力(減圧);ベース圧力より上の約0〜約200mTorrの圧力(減圧)設定点;約-196℃〜約0℃、好ましくは約-50℃以下、より好ましくは、約-100℃のステント温度。例として、より高いベース圧力およびまたは圧力設定点で多孔性パリレンC速度制御エレメント層を作製するための典型的な態様において、パラメータは、次のようなセットであった:140℃の気化温度、690℃の熱分解温度、120mTorrのベース圧力、135mTorrの圧力設定点、室温のステント温度。例として、より低い熱分解温度およびまたは気化温度で多孔性パリレンC速度制御エレメント層を作製するための典型的な態様において、パラメータは、次のようなセットであった:60℃の気化温度、650℃の熱分解温度、15mTorrのベース圧力、20mTorrの圧力設定点、および室温のステント温度。
【0169】
もう一つの典型的な態様において、多孔性速度制御エレメントは、また、非多孔性の被覆を作製するために上記した方法を使用するが、パラメータを多孔性速度制御エレメントを作製するためのパラメータに関して記載されているものに変更し、さらに次のように生産工程の1つまたは複数をさらに修飾することによって得てもよい:被覆チャンバへの入口をブロックすることにより、パリレンまたはプラズマ沈着/グロー放電リアクティブ単量体のステント充填チャンバへのガスの流れを減少させること;沈着の速度を減少させるために、ステント周辺にフェンスを配置すること;パリレン調光器に不純物を添加すること;被覆の間に、気体をチャンバに導入すること;パリレン被覆の間に、同時に被覆の中でプラズマ沈着すること;熱に不安定な基でプラズマ被覆させること;処理後の温度以上において気体を放出すること;パリレン被覆の間に、同時に被覆中でプラズマ沈着すること;体内で見出される溶剤または酵素に暴露されたときに、分解に対して感受性の高い基でプラズマ被覆をすること。
【0170】
ここで、図16を参照し、所定の時間以上にわたった治療能力がある薬剤の放出の典型的な態様のグラフ図を示してある。本発明の図16において示した所定の速度パターンは、最初の相の間の送達速度をなくすか、いくらか低下させて利用できる治療能力がある薬剤を作製することによって、感受性の高い組織部位に対する治療能力がある薬剤の送達の効果を改善する。一旦、次の相に達すると、治療能力がある薬剤の送達速度は、実質的に高くてもよい。このように、治療能力がある薬剤の放出を遅延する時間は、初期の細胞の沈着または増殖(過形成)の少なくとも部分的な形成において、再狭窄(または場合によっては、その他の標的とされた症状)に影響を与えるようにプログラムすることができる。本発明は、治療能力がある薬剤の放出のタイミングを、少なくとも初期のセルラライゼーション(cellularization)の後で生じるようにすることによって、さらに治療能力がある薬剤の洗い流しを減少することができる。さらに、所定の速度パターンにより、治療能力がある薬剤のローディングおよび/または濃度を減少してもよい。所定の速度パターンによって、効率治療能力がある薬剤の洗い流しを最小にすること、およびその放出の効果を増大させることにより、血管壁の内皮化(endothelialization)に対する障害がなくなるように制限または減少がもたらされるであろう。
【0171】
実施例
実施例1−100%のエタノールまたはメタノール溶媒中の25mg/mlの治療的な能力がある薬剤の溶液を、約3.0mm×14mmの大きさを有するステンレス鋼Duraflex(商標)ステントに吹き付けた。ステントを乾燥してエタノールを蒸発させ、ステント表面に治療能力がある薬剤を残したままにした。75:25のPLLA/PCL共重合体(Polysciencesによって商業的に販売されている)は、1,4ジオキサン(Aldrich Chemicalsによって商業的に販売されている)中に調製した。治療能力がある薬剤で被覆されたステントを200rpmで回転する心棒に載せ、ステントがほぼ10〜30秒の時間回転されるように、スプレーガン(Binks Manufacturingによって商業的に販売されている)を使用して、被覆ステント上へ共重合体溶液の微細な噴霧を施した。次いで、ステントを25〜35℃の乾燥器に24時間置いて、溶剤の蒸着を完了させた。
【0172】
実施例2−ステンレス鋼Duraflexステント(3.0×18mm)は、SSチューブからレーザカットした。治療能力がある薬剤を受けるステントの表面積は、ステントの表面の粗さを増すことによって増大させた。ステントの表面積および体積は、ステント支柱のリンクに沿って、幅10nm深さ5nmに溝をつくることによって、さらに増大させることができる。溝は、ステントの放射状の強度を損なわないように、膨張の間に低い応力をステント領域に与えて作製した。薬物は、イソプロピルアルコール、エタノール、またはメタノールなどの低い表面張力の溶媒中に調製した治療能力がある薬剤溶液に、ステントを液浸または吹付けることによって、ステント上およびステント溝に載せた。次いで、ステントを乾燥して、ステント表面上、および治療能力がある薬剤のために貯蔵所として役立つ溝に、治療能力がある薬剤を残したままにした。次いで、速度制御の障壁として役立つように、パリレンをステントに減圧で沈着させた。薬物は、1日〜45日の範囲の期間にわたってステントから溶出された。
【0173】
実施例3−治療能力がある薬剤をメタノールに溶解し、次いでステント上へ吹き付けた。ステントは、ステントから溶剤を蒸発して乾燥したままにして、治療能力がある薬剤をステント上に残した。マトリックスまたは障害(シリコーン、ポリウレタン、ポリテトラフルオロエチレン(polytetrafluorethylene)、パリラスト(parylast)、パリレン)を、治療能力がある薬剤を被覆するステントに吹き付けるか、または沈着させた。治療能力がある薬剤の量を約100マイクログラムから2ミリグラムに変化し、1日〜45日の放出速度であった。
【0174】
実施例4−マトリックス重合体および治療能力がある薬剤を含むマトリックス溶液を、実施例2にて記述したように、ステント上に被覆した。次いで、ステントを速度制御障壁(および/または速度制御障壁として作用するような薬物を伴わないマトリックス材料)の上塗り被覆で被覆または吹き付けた。または、治療能力がある薬剤は、速度制御障壁を介してステント上に被覆し、次いで上塗り被覆(もう一つの障壁またはマトリックス)で被覆してもよい。上塗り被覆を使用することにより、さらに、放出速度の制御、生体適合性の改善、および/またはステントの送達もしくは膨張による引掻きおよびクラッキングに対する耐性が提供される。
【0175】
実施例5−治療能力がある薬剤は、第2の治療能力がある薬剤(細胞毒薬、細胞静止剤、または乾癬薬)と組み合わせてもよい。一方の薬剤は、第1の被覆内に、または結合され、一方で、他方の薬剤は、第2の被覆内に、または結合される。治療能力がある薬剤は、血管内に移植後の最初の1〜3週に放出されるが、第2の治療能力がある薬剤は、より長い期間放出され、または放出され続ける。
【0176】
実施例6−異なる被覆に個々に含まれている多くの治療能力がある薬剤を組み合わせて、マトリックスとして使用することができる。被覆は、同時におよび/または経時的に多くの薬剤を放出してもよい。薬剤は、新規のヌクレオチド合成の阻害剤の治療能力がある薬剤クラスから、または副腎皮質ステロイド、イムノフィリン結合薬、デオキシスペルグアリン、FTY720、タンパク質薬、もしくはペプチドのクラスから選択されてもよい。これはまた、ステントに結合される上記のクラスからの薬剤の任意の組み合わせに対して、その他の細胞毒薬を添加して適用することができる。
【0177】
実施例7−治療能力がある薬剤、ミコフェノール酸、およびマトリックス重合体のCAB(酢酸酪酸セルロース)を含むマトリックスは;70%〜80%重量のミコフェノール酸を添加して、15mg/mlの濃度で治療能力がある薬剤をアセトンに溶解し、15mg/mlの濃度のCABをアセトンに溶解し、その後に、ミコフェノール酸およびCABの溶液をマトリックス溶液部分に3:1で混合することによって調製した。治療能力がある薬剤の量は、約0.1マイクログラム〜約2mg、好ましくは、600マイクログラムの範囲で変化させた。次いで、マトリックス溶液を、それぞれのステントを回転すると共に、アトマイザ噴霧器(EFD manufacturer)でこれらを吹き付けることによって、2つのステントセット(セットAおよびB)の上に被覆した。それぞれのステントを乾燥させた。次いで、1つのマトリックス被覆ステントを、実施例2に記述したものと同様の方法を使用して、速度制御障壁(約1.1μm)としてのパリレンで被覆した。オリフィスは、レーザ光線または針に表面を供することにより、セットBのステントの上面(パリレン速度制御障壁)に作製した。オリフィスの大きさは、直径約0.1μm〜約100μmの範囲である。セットBステントのオリフィスは、直径約10μmであった。オリフィスは、次のオリフィスから、約0.003〜約2インチ離すことができる(ステント支柱パターンに沿って痕跡する曲線の距離として測定される)。
【0178】
ミコフェノール酸を充填したステントを、ブタ血清の溶出溶液に配置して、1〜7日間熟成させた。血清からの試料を規則的な時間間隔で採取し、HPLCによって解析した。図17Aおよび17B(それぞれ、ステントセットAおよびBに対応する)に示したデータから分かるように、ステントセットAは、ミコフェノール酸について直線的放出速度を示したが、ステントセットBは、最初の相において、比較的遅い直線的放出速度を示し、続いて次の相において比較的迅速な放出速度を示した。
【0179】
実施例8−2つのステントのセット、セットAおよびBは、それぞれ実施例2の記載に従って、250および300□gのミコフェノール酸で被覆した。次いで、セットAを速度制御障壁として1.7ミクロンのパリレンで被覆した。セットBを、まずミコフェノール酸で被覆し、次に速度限定マトリックス材料としてメチルプレドニゾロンで被覆し、およびその後に、1.3ミクロンのパリレンで被覆した。次いで、被覆したステントを、実施例7にて説明したように、インビトロ解離試験に供し、溶出されたミコフェノール酸の量を測定した。図18Aおよび18Bに示したデータ(それぞれ、ステントセットAおよびBに対応する)から分かるように、両セットは、最初の相において比較的速いミコフェノール酸の直線的放出を示し、次の相において比較的遅い放出を示した。これは、より疎水性のメチルプレドニゾロンは、より水溶性のミコフェノール酸に対する速度制御エレメントとして作用し、パリレン被覆と共にミコフェノール酸の放出速度を制御し得ることを示唆するであろう。これは、疾患領域が、初めに大量の薬物の大量瞬時投与を必要とし、次いで持続的により遅い放出を必要とするときに、有効である。
【0180】
実施例9−本発明の治療能力がある薬剤の、細胞培養に対する効果を評価するために、下記の一覧を示したとおりの治療能力がある薬剤の5セットの試料を、濃度を変化させて調製し、標準的な手技にしたがって、ブタ平滑筋細胞培養の異なる群に添加した。セットA、B、C、D、およびEは、それぞれ治療能力がある薬剤セット:ミコフェノール酸及びデキサメサゾン;ミコフェノール酸及びトリプトリド;ワートマニンおよびメトトレキセート;トリプトリド;ミコフェノール酸モフェチル;に対応する。濃度(0.003、0.031、0.31、1.6、および3.1マイクロモル濃度)を変化させた異なる試料について、チミジン取り込み量を測定した。図19A-9E(それぞれ、セットA〜Eに対応する)に示したデータから分かるように、種々のセットについてのIC50(細胞の50%が増殖を妨げられる濃度として定義される)は、異なる濃度で存在した。さらに留意され得るものとして、ミコフェノール酸モフェチル(参照E)は、生体条件(例えば、血液などの身体の流体に供する)の非存在下で有効ではないであろう。
【0181】
実施例10−治療能力がある薬剤のもう1つの群において、濃度(0.003、0.031、0.31、1.6、3.1、31、および156マイクロモル濃度)を変化させた試料について、チミジン取り込み量を測定した。図20A-10Bに示したデータから分かるように、それぞれミコフェノール酸およびメチルプレドニゾロンに対応して、これらの治療能力がある薬剤のIC50は、1.0マイクロモル濃度であった。
【0182】
実施例11−種々の治療能力がある薬剤の効果を評価するために、実施例9および10に記載されているものと同様の方法を使用して、細胞培養を、治療的な能力がある一部の薬剤に供した。図21A-21Bに示したデータから分かるように、それぞれトリプトリド(T)、デキサメサゾン(D)、メトトレキセート(M);およびミコフェノール酸(MA);に対応し、治療能力がある薬剤は、有意な細胞死を引き起こさなかった。加えて、IC50濃度において、大部分の細胞がこれまでに50%増殖して生きていたことが分かる。
【0183】
実施例12−治療能力がある薬剤のミコフェノール酸は、治療能力がある薬剤をアセトンに溶解して15mg/mlの濃度に調製した。治療能力がある薬剤の量は、約0.1μg〜約2mg、好ましくは600μgの範囲で変化させた。次いで、薬液を、実施例8にて説明したとおりに、それぞれのステントを回転すると共に、アトマイザ噴霧器(EFD manufacturer)でこれらを吹き付けることによって、ステント上または全体に被覆した。ステントを乾燥させた。次いで、ステントをPTCAカテーテルの三つ折りのバルーン全体に配置して、その上に圧着した。圧着後、薬物は、無処理のまま、ステントに付着させた。シミュレートしたTecoflex血管に対するステントの膨張では、薬物のクラッキングを示さなかった。シミュレートした血管に対してステントを配置する前に、ステント上に流体の流れを曝しても、ステントからの薬物の解離は生じなかった。
【0184】
実施例13−ある態様において、速度制御エレメントの外面に隣接してBSAを配置すると、ミコフェノール酸(MPA)は、ミコフェノール酸単独よりも安定して、BSAに結合してMPA-BSA複合体を形成し、したがって、そのグルクロニド誘導体(これは、生物学的に不活性である)へのミコフェノール酸の代謝を減少した。MPA-BSAは、ミコフェノール酸単独と比較して、および以下の表に示したように、半減時間を増大させる(液体クロマトグラフィなどのアッセイ方法によって測定される)。
【0185】
実施例14−約3.5mm×18mmの大きさを有する一連のステンレス鋼Duraflex(商標)ステントを、100%のメタノール溶媒中の15mg/mlの治療能力がある薬剤の溶液を使用して、約600μgの治療能力がある薬剤を吹き付けた。ステントを乾燥し、溶媒を蒸発させてステント表面に治療能力がある薬剤を残したままにした。次いで、パリレンCを、速度制御障壁として役立つように、ステントに減圧して沈着させた。異なる速度制御エレメントの厚さを有するステントを作製するために、パリレンの量/厚さを多様にした。被覆したステントを37℃においてブタの血清中においた。治療能力がある薬剤は、ステントから全期間にわたって溶出され、溶出される量をHPLCを使用して測定した。図22から分かるように、速度制御エレメントの厚さが増大すると、ステントの溶出速度が減少した。
【0186】
実施例15−約3.5mm×18mmの大きさを有する一連のステンレス鋼Duraflex(商標)ステントを、70%のアセトン:30%のメタノール溶媒中の15mg/mlのメチルプレドニゾロンの溶液を使用して、約700mgの治療能力がある薬剤を吹き付けた。ステントを乾燥して、エタノールを蒸発させてステント表面に治療能力がある薬剤を残したままにした。次いで、パリレンCを、速度制御障壁として役立つように厚さを変えてステントに減圧して沈着させた。次いで、約1.1ミクロンの厚さの速度制御エレメント層を有する一連のステントをさらに処理して、図9Bの態様と同様の速度制御エレメント層に約0.0005インチのわずかな直径を有する開口部を以下の配置で含めた:全ての支柱に対して1つの開口部、その他の全ての支柱に対して1つの開口部、全ての支柱に対して3つの開口部、および全ての支柱に対して制御された分断部(例えば、図9C)。被覆したステントを37℃においてブタの血清中においた。治療能力がある薬剤は、ステントから全期間にわたって溶出され、溶出される量をHPLCを使用して測定した。図23A(開口部または分断部あり)および23B(開口部または分断部なし)から分かるように、溶出される治療能力がある薬剤の量は、溶出期間の増大にともなって(開口部有無にかかわらず)両シリーズについて増大し、開口部の数が増大すると溶出される量が増大する。
【0187】
実施例16−約3.5mm×18mmの大きさを有する一連のステンレスDuraflex(商標)ステントを、図14Cにテープに関して記載されている態様にしたがって、まずステントの高応力領域にマスキングした。次いで、治療能力がある薬剤として100%のメタノール溶媒中の15mg/mlのミコフェノール酸の溶液を使用して、600μgの治療能力がある薬剤をステントに吹き付けた。ステントを乾燥して、溶媒を蒸発させ、ステントのより低い応力の領域に治療能力がある薬剤を残したままにした。マスクを除去し、次いでパリレンCを約1.1ミクロンの名目上の厚さを有する速度制御障壁として役立つように、ステントに減圧して沈着させた。治療能力がある薬剤は、長期間にわたってステントから溶出された。図24から分かるように、低応力の領域(マスキングを使用して)のみにおいて治療能力がある薬剤で被覆されたステントは、高いおよび低い応力の領域の両方における治療能力がある薬剤で被覆されたものよりも少量で溶出され、治療能力がある薬剤をより徐放性にすることができる。
【0188】
実施例17−約3.5mm×18mmの大きさを有する一連のステンレス鋼Duraflex(商標)ステントを、治療能力がある薬剤として100%のメタノール溶媒中の15mg/mlのミコフェノール酸の溶液を使用して、300μgの治療能力がある薬剤を吹き付けた。ステントを乾燥して、溶媒を蒸発させ、ステントのより低い応力の領域に治療能力がある薬剤を残したままにした。次いで、パリレンCを約2〜8ミクロンの名目上の厚さを有する速度制御障壁として役立つように、ステントに減圧して沈着させた。次いで、治療能力がある薬剤/速度制御エレメントで被覆したステントを2つの群に分割し、第2の群を約1時間約145℃でさらに加熱する。治療能力がある薬剤は、長期間にわたってステントから溶出された。図25から分かるように、装置を最終的に被覆した後で加熱されていたステント(グループB)は、同じ期間にわたって低下した量の治療能力がある薬剤が放出される。
【0189】
特定の好ましい態様および方法が本明細書に開示されているが、このような態様および方法の変更および修飾が、真に本発明の精神および範囲から逸脱することなくなされてもよいことは、前述の開示から当業者には明らかである。したがって、上記の記述は、添付の請求の範囲によって定義される本発明の範囲を限定するものとされるべきでない。
【図面の簡単な説明】
【0190】
(図1A〜図1C)本発明の特徴を具体化した、体内管腔に移植された装置の断面図である。
(図2A〜図2N)線2-2に沿った図1A〜1Cの送達人工器官の種々の態様の断面図である。
(図3)本発明の装置として使用するための典型的なステントの概略図である。
(図4A〜図4B)異なる機械的プロフィールを有する領域を示す図3のステントの一部が膨張された図の概略図である。
(図5A〜図8D)図4Aのステントの異なる態様の概略図である。
(図9A〜図9D)速度制御エレメントに開口部を有する図4Aのステントの態様の概略図である。
(図10A〜図10D)図9のステントを作製するための方法の種々の態様の概略図である。
(図11A〜図11B)計画的に分断される領域を有する図4Aのステントの態様の概略図である。
(図12)回転心棒に配置された図4Aのステントを作製する方法の態様の概略図である。
(図13A〜図13D)図4Aのステントを作製するための装置および方法の種々の態様の概略図である。
(図14A〜図14C)図4Aのステントを作製するためのマスキング装置および方法のもう一つの態様の概略図である。
(図15A〜図15B)図4Aのステントを作製するための噴霧装置および方法の概略図である。
(図16)所定の時間にわたる治療能力がある薬剤の放出のグラフ図である。
(図17A〜図21B)種々の治療能力がある薬剤の性能のグラフ図である。
(図22)種々の厚さの速度制御エレメントを有するステントの性能のグラフ図である。
(図23A〜図23B)治療能力がある薬剤の放出速度に対する速度制御エレメントの開口部の効果を示すステントの種々の態様のグラフ図である。
(図24)治療能力がある薬剤の被覆の間のマスキングの効果を示す図4Aのステントのグラフ図である。
(図25)治療能力がある薬剤の放出におけるステントの加熱の効果を示す図4Aのステントのグラフ図である。
Claims (112)
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場と結合され、かつ制御された速度で患者の体内に治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;並びに、
供与源の少なくとも一部を被覆し、かつ少なくとも1つの治療能力がある薬剤を含み、かつ速度制御エレメント層からの治療的な少なくとも1つの治療能力がある薬剤の初期の相対的に迅速な放出、および供与源からの少なくとも1つの治療能力がある薬剤の徐放性の制御された放出を提供する、速度制御エレメント層。 - 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場と結合された少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置され、かつ初速度およびその後の初速度よりも相対的に遅い速度で、患者の体内で治療能力がある薬剤の放出を制御するように構成された、速度制御エレメント。 - 速度制御エレメントが供与源を被覆する、請求項1または2記載の装置。
- 速度制御エレメントが供与源の一部のみを被覆する、請求項1または2記載の装置。
- 供与源が貯蔵所を含む、請求項1または2記載の装置。
- 貯蔵所が膨張可能な構造体の上に少なくとも部分的に配置されている、請求項5記載の装置。
- 足場が、組織に面するおよび管腔に面する表面を含む、請求項1または2記載の装置。
- 貯蔵所が、管腔に面する表面に隣接して配置されている、請求項7記載の装置。
- 貯蔵所が、組織に面する表面に隣接して配置されている、請求項7記載の装置。
- 以下のものを含む、患者の体内における身体内使用のための装置:
足場の膨張の間に異なる機械的プロフィールを示す複数の領域を有し、かつ相対的に低いおよび相対的に高い機械的プロフィールを含む、放射状に膨張可能な移植可能な足場;並びに、
複数のセグメントを含み、かつ足場の少なくとも一部に隣接して配置された、少なくとも1つの治療能力がある薬剤の供与源。 - セグメントが相対的に低い機械的プロフィールの領域に隣接して配置されている、請求項10記載の装置。
- セグメントが相対的に高い機械的プロフィールの領域に隣接して配置されている、請求項10記載の装置。
- セグメントが、足場の膨張による実質的な屈曲、撓曲、伸張、または圧縮を受けない領域のみに隣接して配置されている、請求項10記載の装置。
- セグメントが、足場の膨張による約5%を超える屈曲、撓曲、伸張、または圧縮を受けない領域のみに隣接して配置されている、請求項10記載の装置。
- セグメントが、足場の膨張による実質的な屈曲、撓曲、伸張、圧縮を受ける領域のみに隣接して配置されている、請求項10記載の装置。
- 相対的に高い機械的プロフィールを示す領域が、体内を通って流れている体液の直接の流れの中に存在するように構成される、請求項10記載の装置。
- 足場に隣接して配置された速度制御エレメントをさらに含む、請求項10、13、または16記載の装置。
- 速度制御エレメントが供与源の少なくとも一部に隣接して配置されている、請求項17記載の装置。
- 速度制御エレメントが非多孔性材料から形成されている、請求項17記載の装置。
- 速度制御エレメントが変更可能な厚みを有する、請求項18記載の装置。
- 速度制御エレメントが、相対的に高い機械的プロフィールを有する足場領域に隣接したより大きな厚みを有する、請求項20記載の装置。
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場の少なくとも一部と結合され、かつ患者の体内で治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置され、かつ供与源へまたは供与源からの材料輸送ができるように十分に大きな少なくとも1つの分断部を含む、速度制御エレメント。 - 少なくとも1つの分断部が開口部である、請求項22記載の装置。
- 少なくとも1つの分断部が予め形成されている、請求項22または23記載の装置。
- 少なくとも1つの分断部が患者の体内で形成される、請求項22または23記載の装置。
- 輸送が、供与源への天然の体液の、または供与源からの治療能力がある薬剤の、少なくとも1つの輸送を含む、請求項22または23記載の装置。
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場の少なくとも一部と結合され、かつ患者の体内で治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置され、かつ機械的な応力または歪力の適用により機械的に変化するように構成された、速度制御エレメント。 - 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場の少なくとも一部と結合し、かつ患者の体内で治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置され、かつ患者の体に移植されることにより機械的変化を受ける、速度制御エレメント。 - 機械的変化が機械的破断のうちの1つである、請求項27または28記載の装置。
- 機械的変化が表面特性の変化のうちの1つである、請求項27または28記載の装置。
- 機械的変化が多孔率の変化のうちの1つである、請求項27または28記載の装置。
- 機械的応力または歪力が足場の屈曲によって適用される、請求項27記載の装置。
- 機械的な応力または歪力が足場の膨張によって適用される、請求項27記載の装置。
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場の少なくとも一部と結合され、かつ患者の体内で治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置された膨張可能な速度制御エレメント。 - 速度制御エレメントが身体内の環境に暴露されることにより膨張する、請求項34記載の装置。
- 速度制御エレメントが供与源から治療能力がある薬剤を放出するように構成されている、請求項35記載の装置。
- ステントを含む、請求項1、10、22、または27のいずれか一項記載の装置。
- ステントが金属材料を含む、請求項37記載の装置。
- ステントが重合体材料を含む、請求項37記載の装置。
- ステントが分解性材料を含む、請求項39記載の装置。
- ステントが非分解性材料を含む、請求項39記載の装置。
- バルーン膨張可能である、請求項37記載の装置。
- 自己膨張可能である、請求項37記載の装置。
- 供与源がマトリックスを含む、請求項37記載の装置。
- マトリックスが、マトリックス材料を含む、請求項44記載の装置。
- 速度制御エレメントが非多孔性材料から形成される、請求項1、10、22、27、または37のいずれか一項記載の装置。
- 速度制御エレメントの多孔率が患者の体に移植することによって変化する、請求項46記載の装置。
- 速度制御エレメントが多孔性材料から形成される、請求項1、10、22、27、または37記載の装置。
- 速度制御エレメントがパリレン重合体または共重合体を含む、請求項46または47記載の装置。
- パリレンがパリレンCを含む、請求項48記載の装置。
- 速度制御エレメントが足場の膨張によって少なくとも部分的に多孔性になる、請求項46記載の装置。
- 患者の体において膨張されていない状態の装置からの治療能力がある薬剤の放出速度が、膨張された状態のものとは異なる、請求項46または48記載の装置。
- 以下のものを含む、管腔の人工器官:
体の管腔内に移植可能である足場;
足場の表面の少なくとも一部にわたって配置された、物質を含有する貯蔵所;および、
物質を含有する貯蔵所の少なくとも一部を被覆する速度制御エレメント層であって、その中に散在された物質を有し、かつ速度制御エレメント層からの物質の初期の迅速な放出、並びに貯蔵所からの物質の徐放性の制御された放出を提供する、速度制御エレメント層。 - 以下のものを含む、管腔の人工器官:
体の管腔に移植可能である足場であって、放射状に膨張可能であり、かつ放射状の膨張の間に、より大きなおよびより小さな機械的な応力または歪力を受ける領域を有する、足場;および、
より小さい応力もしくは歪力を受ける領域にわたって優先的に配置されている個々の部分を含む、物質を含有する貯蔵所または層。 - 物質を含有する層が、足場が膨張されるときに実質的に屈曲、伸張、または圧縮しない足場の部分のみに配置される、請求項54記載の管腔の人工器官。
- 足場の少なくとも一部にわたって形成された速度制御エレメント層をさらに含む、請求項54記載の管腔の人工器官。
- 速度制御エレメント層が、より大きな機械的プロフィールの領域にわたってより厚い、請求項56記載の管腔の人工器官。
- 以下のものを含む、管腔の人工器官:
体の管腔内に移植可能である足場;
足場の表面の少なくとも一部にわたって配置された、物質を含有する貯蔵所;および、
物質を含有する貯蔵所の少なくとも一部を被覆する速度制御エレメント層であって、物質を含有する貯蔵所に体液を輸送すること、および/または貯蔵所から物質を放出することができるように十分に大きな少なくとも1つの予め形成された開口部を有する、速度制御エレメント層。 - 以下のものを含む、管腔の人工器官:
体の管腔内に移植可能である足場;
足場の表面の少なくとも一部にわたって配置された、物質を含有する貯蔵所、および、
物質を含有する貯蔵所の少なくとも一部を被覆する速度制御エレメント層であって、足場を実質的に屈曲、膨張、伸張、または圧縮させることによって応力をかけたときに、破砕するように構成されている、速度制御エレメント層。 - 以下のものを含む、管腔の人工器官:
体の管腔内に移植可能である足場;
足場の表面の少なくとも一部にわたって配置された、物質を含有する貯蔵所;および、
物質を含有する貯蔵所の少なくとも一部を被覆する速度制御エレメント層であって、管腔の環境に暴露されたときに、貯蔵所から物質を放出させることができるように膨張するよう構成されている、速度制御エレメント層。 - 以下のものを含む、管腔の人工器官:
体の管腔内に移植可能である足場;
足場の表面の少なくとも一部にわたって配置された、物質を含有する貯蔵所;および、
足場の表面の少なくとも一部にわたって配置され、かつ物質を含有する貯蔵所の全てよりも少なく被覆する、速度制御エレメント。 - 金属ステントを含む、請求項53〜61のいずれか一項記載の管腔の人工器官。
- 金属ステントがバルーン膨張可能である、請求項62記載の管腔の人工器官。
- 金属ステントが自己膨張する、請求項62記載の管腔の人工器官。
- 物質を含有する貯蔵所が、マトリックス材料に散在する物質を含むマトリックス層を含む、請求項53〜61のいずれか一項記載の管腔の人工器官。
- 物質およびマトリックス材料が足場に蒸着された、請求項65記載の管腔の人工器官。
- 物質を含有する層が本質的に物質の均一な層からなる、請求項53〜61のいずれか一項記載の管腔の人工器官。
- 物質が足場に蒸着された、請求項67記載の管腔の人工器官。
- 足場が、4つの直交表面を定義する矩形の横断切片を有する構造エレメントを含み、薬物が、全ての表面よりも少なく配置されている、請求項53〜61のいずれか一項記載の管腔の人工器官。
- 速度制御エレメントが多孔性である、請求項53〜61のいずれか一項記載の管腔の人工器官。
- 速度制御エレメントが非多孔性である、請求項53〜61のいずれか一項記載の管腔の人工器官。
- 足場の少なくとも一部および物質を含有する層の少なくとも一部にわたる基層をさらに含む、請求項53〜61のいずれか一項記載の管腔の人工器官。
- 速度制御エレメント層がパリレン重合体または共重合体を含む、請求項53〜61のいずれか一項記載の管腔の人工器官。
- パリレンが足場またはその部分上に蒸着された、請求項73記載の管腔の人工器官。
- パリレンがパリレンCを含む、請求項73記載の管腔の人工器官。
- パリレンが非多孔性である、請求項73記載の管腔の人工器官。
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
約90%未満の結晶化度を有し、かつ足場と結合され、かつ患者の体内で治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置され、かつ患者の体に対する治療能力がある薬剤の放出を制御するように構成されている、速度制御エレメント。 - 治療能力がある薬剤が約50%未満の結晶化度を有する、請求項77記載の装置。
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場と結合され、患者の体内で標的とされた組織部位において治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置され、かつ約1.71×10-14μg/(cm2s)〜約1.71×10-8μg/(cm2s)のフラックス密度の治療能力がある薬剤を実現するように構成されている、速度制御エレメント。 - フラックス密度が約1.71×10-14μg/(cm2s)〜約3.43×10-9μg/(cm2s)の範囲である、請求項79記載の装置。
- フラックス密度が約8.57×10-12μg/(cm2s)〜約3.43×10-9μg/(cm2s)の範囲である、請求項79記載の装置。
- フラックス密度が約1.71×10-11μg/(cm2s)〜約1.03×10-9μg/(cm2s)の範囲である、請求項79記載の装置。
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場と結合され、患者の体内で標的とされた組織部位において治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部に隣接して配置され、かつ患者の体内で治療能力がある薬剤の放出を制御するように構成されている、速度制御エレメント、
装置は、約10%未満の膨張されていない状態の残留応力を有する。 - 残留応力が約5%未満である、請求項83記載の装置。
- 残留応力が約1%未満である、請求項83記載の装置。
- 残留応力が約0.5%未満である、請求項83に記載の装置。
- 以下の工程を含む、身体内使用のための装置を製造するための方法:
第1の残留応力を有し、かつ足場を含む、移植可能な構造体、および、
足場と結合され、かつ患者の体内で標的とされた組織部位において治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源、
を提供する工程と;
構造体残留応力を第2の残留応力に変更する工程と;
速度制御エレメントを供与源の少なくとも一部に隣接して配置し、かつ患者の体において治療能力がある薬剤の放出を制御するように構成する工程。 - 変更する工程が残留応力を減らす工程を含む、請求項87記載の方法。
- 変更する工程がしばらくの間構造体を超音波エネルギーにさらす工程を含む、請求項87記載の方法。
- 変更する工程がしばらくの間構造体を振動エネルギーにさらす工程を含む、請求項87記載の方法。
- 変更する工程がしばらくの間構造体を第1の温度に加熱する工程を含む、請求項87記載の方法。
- 第1の温度が治療能力がある薬剤の融点未満である、請求項91記載の方法。
- 第1の温度が治療能力がある薬剤の融点とほぼ同じである、請求項91記載の方法。
- 少なくとも1つの治療能力がある薬剤が、複数の治療能力がある薬剤を含み、第1の温度が、最も低い融点を有する治療能力がある薬剤の融点とほぼ同じである、請求項91記載の方法。
- 第1の温度が治療能力がある薬剤の融点を超える、請求項91記載の方法。
- 少なくとも1つの治療能力がある薬剤が、複数の治療能力がある薬剤を含み、第1の温度が、最も低い融点を有する治療能力がある薬剤の融点を超える、請求項91記載の方法。
- 変更する工程が配置する工程の前に行われる、請求項87、88、89、90、91、92、93、または95に記載の方法。
- 変更する工程が、配置した後に行われる、請求項87、88、89、90、91、92、93、または95に記載の方法。
- 変更する工程がしばらくの間構造体を第2の温度に加熱する工程を含み、かつ配置する工程の後で行われる、請求項87記載の方法。
- 第2の温度への構造体の加熱が減圧下で行われる、請求項99記載の方法。
- 第2の温度への構造体の加熱が酸素の非存在下で行われる、請求項99記載の方法。
- 第2の温度が速度制御エレメントのガラス転移温度未満である、請求項98記載の方法。
- 第1の温度がほぼ速度制御エレメントのガラス転移温度である、請求項98記載の方法。
- 第1の温度が速度制御エレメントのガラス転移温度を超える、請求項98記載の方法。
- 変更する工程が請求項91および99の工程を含む、請求項87記載の方法。
- 以下のものを含む、患者の体内における身体内使用のための装置:
移植可能な足場;
足場と結合され、かつ患者の体内で治療能力がある薬剤を放出するように構成された、少なくとも1つの治療能力がある薬剤の少なくとも1つの供与源;および、
供与源の少なくとも一部を被覆し、かつ非多孔性材料から形成されている、速度制御エレメント層。 - 非多孔性材料がパリレンを含む、請求項106記載の装置。
- 患者の体における条件に暴露されたときに、非多孔性材料が少なくとも部分的に多孔性になる、請求項106記載の装置。
- 患者の体における条件に暴露されたときに、速度制御エレメントが分断される、請求項106記載の装置。
- 速度制御エレメントが治療能力がある薬剤を含む、請求項106記載の装置。
- 速度制御エレメントの治療能力がある薬剤が、供与源の治療能力がある薬剤と同じである、請求項110記載の装置。
- 非多孔性材料が、プラズマ沈着された重合体、スパッターされた材料、蒸着された材料、電気メッキを施された金属、電気メッキを施された合金、グロー放電被覆、ポリエチレン、ポリウレタン、シリコーンゴム、セルロース、およびパリレンからなる群より選択される、請求項106記載の装置。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/002,595 US20020082679A1 (en) | 2000-12-22 | 2001-11-01 | Delivery or therapeutic capable agents |
| US10/017,500 US7077859B2 (en) | 2000-12-22 | 2001-12-14 | Apparatus and methods for variably controlled substance delivery from implanted prostheses |
| PCT/US2002/034350 WO2003037223A1 (en) | 2001-11-01 | 2002-10-25 | Apparatus and methods for variably controlled substance delivery from implanted prostheses |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005507708A true JP2005507708A (ja) | 2005-03-24 |
| JP2005507708A5 JP2005507708A5 (ja) | 2006-01-05 |
Family
ID=26670600
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003539571A Pending JP2005507708A (ja) | 2001-11-01 | 2002-10-25 | 移植された人工器官からの変更可能に制御された物質の送達のための装置および方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (3) | US7077859B2 (ja) |
| EP (1) | EP1448116A4 (ja) |
| JP (1) | JP2005507708A (ja) |
| WO (1) | WO2003037223A1 (ja) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008522747A (ja) * | 2004-12-08 | 2008-07-03 | クック・インコーポレイテッド | 造影剤でコーティングされた医療機器 |
| JP2010503483A (ja) * | 2006-09-18 | 2010-02-04 | ボストン サイエンティフィック リミテッド | 医療装置 |
| JP2012501219A (ja) * | 2008-08-27 | 2012-01-19 | ボストン サイエンティフィック サイムド,インコーポレイテッド | 治療薬送達のための無機コーティングを有する医療用デバイス |
| JP2014176740A (ja) * | 2005-04-05 | 2014-09-25 | Elixir Medical Corp | 分解性の移植可能な医療装置 |
| JP2018526050A (ja) * | 2015-07-11 | 2018-09-13 | カーディアック ペースメイカーズ, インコーポレイテッド | 抗菌性材料によるポリマーコーティングおよび製造方法 |
| JP2019502520A (ja) * | 2016-01-04 | 2019-01-31 | ジュロックス ピーティーワイ リミテッドJurox Pty Ltd | 薬剤放出デバイス及び使用 |
| US10933246B2 (en) | 2015-06-18 | 2021-03-02 | Cardiac Pacemakers, Inc. | Infection fighting bioresorbable polymer device for medical implants |
Families Citing this family (416)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7846202B2 (en) * | 1995-06-07 | 2010-12-07 | Cook Incorporated | Coated implantable medical device |
| US6776792B1 (en) | 1997-04-24 | 2004-08-17 | Advanced Cardiovascular Systems Inc. | Coated endovascular stent |
| US7208011B2 (en) | 2001-08-20 | 2007-04-24 | Conor Medsystems, Inc. | Implantable medical device with drug filled holes |
| US20040254635A1 (en) * | 1998-03-30 | 2004-12-16 | Shanley John F. | Expandable medical device for delivery of beneficial agent |
| US7208010B2 (en) * | 2000-10-16 | 2007-04-24 | Conor Medsystems, Inc. | Expandable medical device for delivery of beneficial agent |
| US6241762B1 (en) | 1998-03-30 | 2001-06-05 | Conor Medsystems, Inc. | Expandable medical device with ductile hinges |
| US7713297B2 (en) | 1998-04-11 | 2010-05-11 | Boston Scientific Scimed, Inc. | Drug-releasing stent with ceramic-containing layer |
| US20020099438A1 (en) | 1998-04-15 | 2002-07-25 | Furst Joseph G. | Irradiated stent coating |
| US20030040790A1 (en) | 1998-04-15 | 2003-02-27 | Furst Joseph G. | Stent coating |
| US20020188037A1 (en) * | 1999-04-15 | 2002-12-12 | Chudzik Stephen J. | Method and system for providing bioactive agent release coating |
| CA2320259C (en) * | 1998-04-27 | 2006-01-24 | Surmodics, Inc. | Bioactive agent release coating |
| US7967855B2 (en) * | 1998-07-27 | 2011-06-28 | Icon Interventional Systems, Inc. | Coated medical device |
| US8070796B2 (en) | 1998-07-27 | 2011-12-06 | Icon Interventional Systems, Inc. | Thrombosis inhibiting graft |
| US8382821B2 (en) | 1998-12-03 | 2013-02-26 | Medinol Ltd. | Helical hybrid stent |
| US20040267349A1 (en) * | 2003-06-27 | 2004-12-30 | Kobi Richter | Amorphous metal alloy medical devices |
| US20060178727A1 (en) * | 1998-12-03 | 2006-08-10 | Jacob Richter | Hybrid amorphous metal alloy stent |
| US20070219642A1 (en) * | 1998-12-03 | 2007-09-20 | Jacob Richter | Hybrid stent having a fiber or wire backbone |
| US20070032853A1 (en) | 2002-03-27 | 2007-02-08 | Hossainy Syed F | 40-O-(2-hydroxy)ethyl-rapamycin coated stent |
| US7807211B2 (en) | 1999-09-03 | 2010-10-05 | Advanced Cardiovascular Systems, Inc. | Thermal treatment of an implantable medical device |
| US7682647B2 (en) | 1999-09-03 | 2010-03-23 | Advanced Cardiovascular Systems, Inc. | Thermal treatment of a drug eluting implantable medical device |
| US7736687B2 (en) | 2006-01-31 | 2010-06-15 | Advance Bio Prosthetic Surfaces, Ltd. | Methods of making medical devices |
| US6451373B1 (en) | 2000-08-04 | 2002-09-17 | Advanced Cardiovascular Systems, Inc. | Method of forming a therapeutic coating onto a surface of an implantable prosthesis |
| US6953560B1 (en) | 2000-09-28 | 2005-10-11 | Advanced Cardiovascular Systems, Inc. | Barriers for polymer-coated implantable medical devices and methods for making the same |
| US20020111590A1 (en) * | 2000-09-29 | 2002-08-15 | Davila Luis A. | Medical devices, drug coatings and methods for maintaining the drug coatings thereon |
| EP1935380B1 (en) | 2000-10-16 | 2010-05-12 | Conor Medsystems, Inc. | Expandable medical device for delivery of beneficial agent |
| US6783793B1 (en) | 2000-10-26 | 2004-08-31 | Advanced Cardiovascular Systems, Inc. | Selective coating of medical devices |
| US7807210B1 (en) | 2000-10-31 | 2010-10-05 | Advanced Cardiovascular Systems, Inc. | Hemocompatible polymers on hydrophobic porous polymers |
| US9107605B2 (en) * | 2000-11-17 | 2015-08-18 | Advanced Bio Prosthetic Surfaces, Ltd., A Wholly Owned Subsidiary Of Palmaz Scientific, Inc. | Device for in vivo delivery of bioactive agents and method of manufacture thereof |
| US6663662B2 (en) | 2000-12-28 | 2003-12-16 | Advanced Cardiovascular Systems, Inc. | Diffusion barrier layer for implantable devices |
| US8632845B2 (en) * | 2000-12-28 | 2014-01-21 | Abbott Cardiovascular Systems Inc. | Method of drying bioabsorbable coating over stents |
| GB0100761D0 (en) | 2001-01-11 | 2001-02-21 | Biocompatibles Ltd | Drug delivery from stents |
| US20040204756A1 (en) * | 2004-02-11 | 2004-10-14 | Diaz Stephen Hunter | Absorbent article with improved liquid acquisition capacity |
| CA2435306C (en) | 2001-02-16 | 2010-12-21 | Stephan Wnendt | Implants with fk506 |
| US20050278014A9 (en) * | 2001-03-07 | 2005-12-15 | Wolfgang Daum | Stent and method for drug delivery from stents |
| US6780424B2 (en) | 2001-03-30 | 2004-08-24 | Charles David Claude | Controlled morphologies in polymer drug for release of drugs from polymer films |
| US7431710B2 (en) | 2002-04-08 | 2008-10-07 | Glaukos Corporation | Ocular implants with anchors and methods thereof |
| US6764505B1 (en) | 2001-04-12 | 2004-07-20 | Advanced Cardiovascular Systems, Inc. | Variable surface area stent |
| US6743462B1 (en) | 2001-05-31 | 2004-06-01 | Advanced Cardiovascular Systems, Inc. | Apparatus and method for coating implantable devices |
| US7727221B2 (en) | 2001-06-27 | 2010-06-01 | Cardiac Pacemakers Inc. | Method and device for electrochemical formation of therapeutic species in vivo |
| US6695920B1 (en) | 2001-06-27 | 2004-02-24 | Advanced Cardiovascular Systems, Inc. | Mandrel for supporting a stent and a method of using the mandrel to coat a stent |
| US8741378B1 (en) | 2001-06-27 | 2014-06-03 | Advanced Cardiovascular Systems, Inc. | Methods of coating an implantable device |
| US20040249443A1 (en) * | 2001-08-20 | 2004-12-09 | Shanley John F. | Expandable medical device for treating cardiac arrhythmias |
| US7056338B2 (en) | 2003-03-28 | 2006-06-06 | Conor Medsystems, Inc. | Therapeutic agent delivery device with controlled therapeutic agent release rates |
| US8303651B1 (en) | 2001-09-07 | 2012-11-06 | Advanced Cardiovascular Systems, Inc. | Polymeric coating for reducing the rate of release of a therapeutic substance from a stent |
| US7285304B1 (en) | 2003-06-25 | 2007-10-23 | Advanced Cardiovascular Systems, Inc. | Fluid treatment of a polymeric coating on an implantable medical device |
| US6753071B1 (en) | 2001-09-27 | 2004-06-22 | Advanced Cardiovascular Systems, Inc. | Rate-reducing membrane for release of an agent |
| US7223282B1 (en) | 2001-09-27 | 2007-05-29 | Advanced Cardiovascular Systems, Inc. | Remote activation of an implantable device |
| US8740973B2 (en) * | 2001-10-26 | 2014-06-03 | Icon Medical Corp. | Polymer biodegradable medical device |
| US7682387B2 (en) * | 2002-04-24 | 2010-03-23 | Biosensors International Group, Ltd. | Drug-delivery endovascular stent and method for treating restenosis |
| US6939376B2 (en) | 2001-11-05 | 2005-09-06 | Sun Biomedical, Ltd. | Drug-delivery endovascular stent and method for treating restenosis |
| US7014654B2 (en) * | 2001-11-30 | 2006-03-21 | Scimed Life Systems, Inc. | Stent designed for the delivery of therapeutic substance or other agents |
| US6709514B1 (en) | 2001-12-28 | 2004-03-23 | Advanced Cardiovascular Systems, Inc. | Rotary coating apparatus for coating implantable medical devices |
| US7326245B2 (en) * | 2002-01-31 | 2008-02-05 | Boston Scientific Scimed, Inc. | Medical device for delivering biologically active material |
| US7445629B2 (en) * | 2002-01-31 | 2008-11-04 | Boston Scientific Scimed, Inc. | Medical device for delivering biologically active material |
| WO2003070084A2 (en) * | 2002-02-19 | 2003-08-28 | Bioarttis, Inc. | Artificial vessel scaffold and artificial organs therefrom |
| US20040024450A1 (en) * | 2002-04-24 | 2004-02-05 | Sun Biomedical, Ltd. | Drug-delivery endovascular stent and method for treating restenosis |
| US7083822B2 (en) * | 2002-04-26 | 2006-08-01 | Medtronic Vascular, Inc. | Overlapping coated stents |
| US7097850B2 (en) | 2002-06-18 | 2006-08-29 | Surmodics, Inc. | Bioactive agent release coating and controlled humidity method |
| US7217426B1 (en) | 2002-06-21 | 2007-05-15 | Advanced Cardiovascular Systems, Inc. | Coatings containing polycationic peptides for cardiovascular therapy |
| US6994867B1 (en) | 2002-06-21 | 2006-02-07 | Advanced Cardiovascular Systems, Inc. | Biocompatible carrier containing L-arginine |
| US8506617B1 (en) | 2002-06-21 | 2013-08-13 | Advanced Cardiovascular Systems, Inc. | Micronized peptide coated stent |
| US7794743B2 (en) | 2002-06-21 | 2010-09-14 | Advanced Cardiovascular Systems, Inc. | Polycationic peptide coatings and methods of making the same |
| US7056523B1 (en) | 2002-06-21 | 2006-06-06 | Advanced Cardiovascular Systems, Inc. | Implantable medical devices incorporating chemically conjugated polymers and oligomers of L-arginine |
| US7011842B1 (en) | 2002-06-21 | 2006-03-14 | Advanced Cardiovascular Systems, Inc. | Polycationic peptide coatings and methods of making the same |
| US7070798B1 (en) | 2002-06-21 | 2006-07-04 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable medical devices incorporating chemically-bound polymers and oligomers of L-arginine |
| US7033602B1 (en) | 2002-06-21 | 2006-04-25 | Advanced Cardiovascular Systems, Inc. | Polycationic peptide coatings and methods of coating implantable medical devices |
| AU2003280437A1 (en) * | 2002-06-27 | 2004-01-19 | Microport Medical (Shanghai) Co., Ltd. | Drug eluting stent |
| US20040002755A1 (en) * | 2002-06-28 | 2004-01-01 | Fischell David R. | Method and apparatus for treating vulnerable coronary plaques using drug-eluting stents |
| AU2003250913A1 (en) * | 2002-07-08 | 2004-01-23 | Abbott Laboratories Vascular Enterprises Limited | Drug eluting stent and methods of manufacture |
| US8016881B2 (en) * | 2002-07-31 | 2011-09-13 | Icon Interventional Systems, Inc. | Sutures and surgical staples for anastamoses, wound closures, and surgical closures |
| US7087263B2 (en) | 2002-10-09 | 2006-08-08 | Advanced Cardiovascular Systems, Inc. | Rare limiting barriers for implantable medical devices |
| AU2003290676A1 (en) * | 2002-11-07 | 2004-06-03 | Abbott Laboratories | Prosthesis with multiple drugs in discrete unmixed droplets |
| US8524148B2 (en) | 2002-11-07 | 2013-09-03 | Abbott Laboratories | Method of integrating therapeutic agent into a bioerodible medical device |
| US8221495B2 (en) * | 2002-11-07 | 2012-07-17 | Abbott Laboratories | Integration of therapeutic agent into a bioerodible medical device |
| JP2006505364A (ja) * | 2002-11-08 | 2006-02-16 | コナー メドシステムズ, インコーポレイテッド | 血管新生因子の局所供給を用いる、慢性全梗塞を処置するための拡張可能な医療装置および方法 |
| KR20130032407A (ko) * | 2002-11-08 | 2013-04-01 | 코너 메드시스템즈, 엘엘씨 | 허혈성 상해 후에 조직 손상을 감소시키기 위한 방법 및 장치 |
| US7169178B1 (en) | 2002-11-12 | 2007-01-30 | Advanced Cardiovascular Systems, Inc. | Stent with drug coating |
| US6896965B1 (en) | 2002-11-12 | 2005-05-24 | Advanced Cardiovascular Systems, Inc. | Rate limiting barriers for implantable devices |
| US9770349B2 (en) * | 2002-11-13 | 2017-09-26 | University Of Virginia Patent Foundation | Nanoporous stents with enhanced cellular adhesion and reduced neointimal formation |
| US6923829B2 (en) * | 2002-11-25 | 2005-08-02 | Advanced Bio Prosthetic Surfaces, Ltd. | Implantable expandable medical devices having regions of differential mechanical properties and methods of making same |
| US6982004B1 (en) | 2002-11-26 | 2006-01-03 | Advanced Cardiovascular Systems, Inc. | Electrostatic loading of drugs on implantable medical devices |
| US7758880B2 (en) | 2002-12-11 | 2010-07-20 | Advanced Cardiovascular Systems, Inc. | Biocompatible polyacrylate compositions for medical applications |
| US7776926B1 (en) | 2002-12-11 | 2010-08-17 | Advanced Cardiovascular Systems, Inc. | Biocompatible coating for implantable medical devices |
| US7074276B1 (en) | 2002-12-12 | 2006-07-11 | Advanced Cardiovascular Systems, Inc. | Clamp mandrel fixture and a method of using the same to minimize coating defects |
| US7094256B1 (en) | 2002-12-16 | 2006-08-22 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable medical device containing polycationic peptides |
| US20060002968A1 (en) | 2004-06-30 | 2006-01-05 | Gordon Stewart | Anti-proliferative and anti-inflammatory agent combination for treatment of vascular disorders |
| US8435550B2 (en) | 2002-12-16 | 2013-05-07 | Abbot Cardiovascular Systems Inc. | Anti-proliferative and anti-inflammatory agent combination for treatment of vascular disorders with an implantable medical device |
| US7758881B2 (en) | 2004-06-30 | 2010-07-20 | Advanced Cardiovascular Systems, Inc. | Anti-proliferative and anti-inflammatory agent combination for treatment of vascular disorders with an implantable medical device |
| US20070239251A1 (en) * | 2002-12-31 | 2007-10-11 | Abbott Cardiovascular Systems Inc. | Flexible stent |
| JP2006517850A (ja) * | 2003-02-18 | 2006-08-03 | メドトロニック・インコーポレーテッド | 閉塞抵抗性水頭症シャント |
| US20090093875A1 (en) | 2007-05-01 | 2009-04-09 | Abbott Laboratories | Drug eluting stents with prolonged local elution profiles with high local concentrations and low systemic concentrations |
| US6926919B1 (en) | 2003-02-26 | 2005-08-09 | Advanced Cardiovascular Systems, Inc. | Method for fabricating a coating for a medical device |
| US7563483B2 (en) | 2003-02-26 | 2009-07-21 | Advanced Cardiovascular Systems Inc. | Methods for fabricating a coating for implantable medical devices |
| US7063884B2 (en) | 2003-02-26 | 2006-06-20 | Advanced Cardiovascular Systems, Inc. | Stent coating |
| WO2004084764A2 (en) | 2003-03-19 | 2004-10-07 | Advanced Bio Prosthetic Surfaces, Ltd. | Endoluminal stent having mid-interconnecting members |
| EP2289571B1 (en) | 2003-03-28 | 2016-08-03 | Innovational Holdings, LLC | Implantable medical device with beneficial agent concentration gradient |
| US20050010170A1 (en) * | 2004-02-11 | 2005-01-13 | Shanley John F | Implantable medical device with beneficial agent concentration gradient |
| US20040236399A1 (en) * | 2003-04-22 | 2004-11-25 | Medtronic Vascular, Inc. | Stent with improved surface adhesion |
| US7482034B2 (en) * | 2003-04-24 | 2009-01-27 | Boston Scientific Scimed, Inc. | Expandable mask stent coating method |
| US20040230298A1 (en) * | 2003-04-25 | 2004-11-18 | Medtronic Vascular, Inc. | Drug-polymer coated stent with polysulfone and styrenic block copolymer |
| US8246974B2 (en) * | 2003-05-02 | 2012-08-21 | Surmodics, Inc. | Medical devices and methods for producing the same |
| WO2004098565A2 (en) * | 2003-05-02 | 2004-11-18 | Surmodics, Inc. | Implantable controlled release bioactive agent delivery device |
| US7279174B2 (en) | 2003-05-08 | 2007-10-09 | Advanced Cardiovascular Systems, Inc. | Stent coatings comprising hydrophilic additives |
| DE10329260A1 (de) * | 2003-06-23 | 2005-01-13 | Biotronik Meß- und Therapiegeräte GmbH & Co. Ingenieurbüro Berlin | Stent mit einem Beschichtungssystem |
| US20050118344A1 (en) | 2003-12-01 | 2005-06-02 | Pacetti Stephen D. | Temperature controlled crimping |
| US9039755B2 (en) | 2003-06-27 | 2015-05-26 | Medinol Ltd. | Helical hybrid stent |
| US9155639B2 (en) | 2009-04-22 | 2015-10-13 | Medinol Ltd. | Helical hybrid stent |
| US7056591B1 (en) | 2003-07-30 | 2006-06-06 | Advanced Cardiovascular Systems, Inc. | Hydrophobic biologically absorbable coatings for drug delivery devices and methods for fabricating the same |
| US7785512B1 (en) | 2003-07-31 | 2010-08-31 | Advanced Cardiovascular Systems, Inc. | Method and system of controlled temperature mixing and molding of polymers with active agents for implantable medical devices |
| US20050033417A1 (en) * | 2003-07-31 | 2005-02-10 | John Borges | Coating for controlled release of a therapeutic agent |
| US7431959B1 (en) | 2003-07-31 | 2008-10-07 | Advanced Cardiovascular Systems Inc. | Method and system for irradiation of a drug eluting implantable medical device |
| US7488343B2 (en) * | 2003-09-16 | 2009-02-10 | Boston Scientific Scimed, Inc. | Medical devices |
| US7441513B1 (en) | 2003-09-26 | 2008-10-28 | Advanced Cardiovascular Systems, Inc. | Plasma-generated coating apparatus for medical devices and a method of coating deposition |
| US7318932B2 (en) | 2003-09-30 | 2008-01-15 | Advanced Cardiovascular Systems, Inc. | Coatings for drug delivery devices comprising hydrolitically stable adducts of poly(ethylene-co-vinyl alcohol) and methods for fabricating the same |
| US7953499B2 (en) * | 2003-09-30 | 2011-05-31 | Cardiac Pacemakers, Inc. | Drug-eluting electrode |
| US6996952B2 (en) * | 2003-09-30 | 2006-02-14 | Codman & Shurtleff, Inc. | Method for improving stability and effectivity of a drug-device combination product |
| US7198675B2 (en) | 2003-09-30 | 2007-04-03 | Advanced Cardiovascular Systems | Stent mandrel fixture and method for selectively coating surfaces of a stent |
| US20050087520A1 (en) * | 2003-10-28 | 2005-04-28 | Lixiao Wang | Method and apparatus for selective ablation of coatings from medical devices |
| US7329413B1 (en) | 2003-11-06 | 2008-02-12 | Advanced Cardiovascular Systems, Inc. | Coatings for drug delivery devices having gradient of hydration and methods for fabricating thereof |
| US20050100577A1 (en) * | 2003-11-10 | 2005-05-12 | Parker Theodore L. | Expandable medical device with beneficial agent matrix formed by a multi solvent system |
| US7261946B2 (en) | 2003-11-14 | 2007-08-28 | Advanced Cardiovascular Systems, Inc. | Block copolymers of acrylates and methacrylates with fluoroalkenes |
| US9114198B2 (en) | 2003-11-19 | 2015-08-25 | Advanced Cardiovascular Systems, Inc. | Biologically beneficial coatings for implantable devices containing fluorinated polymers and methods for fabricating the same |
| US8192752B2 (en) | 2003-11-21 | 2012-06-05 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable devices including biologically erodable polyesters and methods for fabricating the same |
| US7560492B1 (en) | 2003-11-25 | 2009-07-14 | Advanced Cardiovascular Systems, Inc. | Polysulfone block copolymers as drug-eluting coating material |
| US8465453B2 (en) * | 2003-12-03 | 2013-06-18 | Mayo Foundation For Medical Education And Research | Kits, apparatus and methods for magnetically coating medical devices with living cells |
| US20090118817A1 (en) * | 2005-06-16 | 2009-05-07 | Mayo Foundation For Medical Education And Research | Magnetic Medical Apparatus, Kits, and Methods |
| US7220816B2 (en) | 2003-12-16 | 2007-05-22 | Advanced Cardiovascular Systems, Inc. | Biologically absorbable coatings for implantable devices based on poly(ester amides) and methods for fabricating the same |
| CA2490447A1 (en) * | 2003-12-17 | 2005-06-17 | Cordis Neurovascular, Inc. | Activatable bioactive implantable medical device and method of use |
| US20050137677A1 (en) * | 2003-12-17 | 2005-06-23 | Rush Scott L. | Endovascular graft with differentiable porosity along its length |
| US7435788B2 (en) | 2003-12-19 | 2008-10-14 | Advanced Cardiovascular Systems, Inc. | Biobeneficial polyamide/polyethylene glycol polymers for use with drug eluting stents |
| DE10361940A1 (de) * | 2003-12-24 | 2005-07-28 | Restate Patent Ag | Degradationssteuerung biodegradierbarer Implantate durch Beschichtung |
| US7563324B1 (en) | 2003-12-29 | 2009-07-21 | Advanced Cardiovascular Systems Inc. | System and method for coating an implantable medical device |
| US7211108B2 (en) * | 2004-01-23 | 2007-05-01 | Icon Medical Corp. | Vascular grafts with amphiphilic block copolymer coatings |
| US8137397B2 (en) * | 2004-02-26 | 2012-03-20 | Boston Scientific Scimed, Inc. | Medical devices |
| US8915957B2 (en) * | 2004-03-11 | 2014-12-23 | Alcatel Lucent | Drug delivery stent |
| US8685431B2 (en) | 2004-03-16 | 2014-04-01 | Advanced Cardiovascular Systems, Inc. | Biologically absorbable coatings for implantable devices based on copolymers having ester bonds and methods for fabricating the same |
| US20050222671A1 (en) * | 2004-03-31 | 2005-10-06 | Schaeffer Darin G | Partially biodegradable stent |
| US8778014B1 (en) | 2004-03-31 | 2014-07-15 | Advanced Cardiovascular Systems, Inc. | Coatings for preventing balloon damage to polymer coated stents |
| JP2007532197A (ja) | 2004-04-06 | 2007-11-15 | サーモディクス,インコーポレイティド | 生物活性物質のための被覆組成物 |
| US20060083772A1 (en) * | 2004-04-06 | 2006-04-20 | Dewitt David M | Coating compositions for bioactive agents |
| US8349001B2 (en) * | 2004-04-07 | 2013-01-08 | Medtronic, Inc. | Pharmacological delivery implement for use with cardiac repair devices |
| US7553377B1 (en) | 2004-04-27 | 2009-06-30 | Advanced Cardiovascular Systems, Inc. | Apparatus and method for electrostatic coating of an abluminal stent surface |
| JP2007534389A (ja) * | 2004-04-29 | 2007-11-29 | キューブ・メディカル・アクティーゼルスカブ | 血管形成に用いるバルーン |
| US7820732B2 (en) | 2004-04-30 | 2010-10-26 | Advanced Cardiovascular Systems, Inc. | Methods for modulating thermal and mechanical properties of coatings on implantable devices |
| US8293890B2 (en) | 2004-04-30 | 2012-10-23 | Advanced Cardiovascular Systems, Inc. | Hyaluronic acid based copolymers |
| US20060246109A1 (en) * | 2005-04-29 | 2006-11-02 | Hossainy Syed F | Concentration gradient profiles for control of agent release rates from polymer matrices |
| US20050288481A1 (en) * | 2004-04-30 | 2005-12-29 | Desnoyer Jessica R | Design of poly(ester amides) for the control of agent-release from polymeric compositions |
| US9561309B2 (en) | 2004-05-27 | 2017-02-07 | Advanced Cardiovascular Systems, Inc. | Antifouling heparin coatings |
| WO2005118016A1 (en) * | 2004-05-27 | 2005-12-15 | Medtronic, Inc. | Medical device comprising a biologically active agent |
| US20050281858A1 (en) * | 2004-06-18 | 2005-12-22 | Kloke Tim M | Devices, articles, coatings, and methods for controlled active agent release |
| US7563780B1 (en) | 2004-06-18 | 2009-07-21 | Advanced Cardiovascular Systems, Inc. | Heparin prodrugs and drug delivery stents formed therefrom |
| US20050287287A1 (en) * | 2004-06-24 | 2005-12-29 | Parker Theodore L | Methods and systems for loading an implantable medical device with beneficial agent |
| US20050287184A1 (en) | 2004-06-29 | 2005-12-29 | Hossainy Syed F A | Drug-delivery stent formulations for restenosis and vulnerable plaque |
| USD516723S1 (en) | 2004-07-06 | 2006-03-07 | Conor Medsystems, Inc. | Stent wall structure |
| DE602005016194D1 (de) * | 2004-07-27 | 2009-10-08 | Cordis Corp | Verfahren zur Beschichtung von Stents |
| US8357391B2 (en) | 2004-07-30 | 2013-01-22 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable devices comprising poly (hydroxy-alkanoates) and diacid linkages |
| US7494665B1 (en) | 2004-07-30 | 2009-02-24 | Advanced Cardiovascular Systems, Inc. | Polymers containing siloxane monomers |
| US7311980B1 (en) | 2004-08-02 | 2007-12-25 | Advanced Cardiovascular Systems, Inc. | Polyactive/polylactic acid coatings for an implantable device |
| US20060025852A1 (en) * | 2004-08-02 | 2006-02-02 | Armstrong Joseph R | Bioabsorbable self-expanding endolumenal devices |
| US8980300B2 (en) | 2004-08-05 | 2015-03-17 | Advanced Cardiovascular Systems, Inc. | Plasticizers for coating compositions |
| US20060034884A1 (en) * | 2004-08-10 | 2006-02-16 | Stenzel Eric B | Coated medical device having an increased coating surface area |
| US7648727B2 (en) | 2004-08-26 | 2010-01-19 | Advanced Cardiovascular Systems, Inc. | Methods for manufacturing a coated stent-balloon assembly |
| US7244443B2 (en) | 2004-08-31 | 2007-07-17 | Advanced Cardiovascular Systems, Inc. | Polymers of fluorinated monomers and hydrophilic monomers |
| US20060054604A1 (en) * | 2004-09-10 | 2006-03-16 | Saunders Richard J | Laser process to produce drug delivery channel in metal stents |
| US8750983B2 (en) | 2004-09-20 | 2014-06-10 | P Tech, Llc | Therapeutic system |
| US8110211B2 (en) | 2004-09-22 | 2012-02-07 | Advanced Cardiovascular Systems, Inc. | Medicated coatings for implantable medical devices including polyacrylates |
| US7901451B2 (en) | 2004-09-24 | 2011-03-08 | Biosensors International Group, Ltd. | Drug-delivery endovascular stent and method for treating restenosis |
| US9011831B2 (en) * | 2004-09-30 | 2015-04-21 | Advanced Cardiovascular Systems, Inc. | Methacrylate copolymers for medical devices |
| WO2006039675A2 (en) * | 2004-10-01 | 2006-04-13 | Children's Medical Center Corporation | Apparatus and method for nanomanipulation of biomolecules and living cells |
| US7166680B2 (en) | 2004-10-06 | 2007-01-23 | Advanced Cardiovascular Systems, Inc. | Blends of poly(ester amide) polymers |
| US8603634B2 (en) | 2004-10-27 | 2013-12-10 | Abbott Cardiovascular Systems Inc. | End-capped poly(ester amide) copolymers |
| US7390497B2 (en) | 2004-10-29 | 2008-06-24 | Advanced Cardiovascular Systems, Inc. | Poly(ester amide) filler blends for modulation of coating properties |
| US7481835B1 (en) | 2004-10-29 | 2009-01-27 | Advanced Cardiovascular Systems, Inc. | Encapsulated covered stent |
| US7214759B2 (en) | 2004-11-24 | 2007-05-08 | Advanced Cardiovascular Systems, Inc. | Biologically absorbable coatings for implantable devices based on polyesters and methods for fabricating the same |
| US7588642B1 (en) | 2004-11-29 | 2009-09-15 | Advanced Cardiovascular Systems, Inc. | Abluminal stent coating apparatus and method using a brush assembly |
| US8609123B2 (en) | 2004-11-29 | 2013-12-17 | Advanced Cardiovascular Systems, Inc. | Derivatized poly(ester amide) as a biobeneficial coating |
| US7892592B1 (en) * | 2004-11-30 | 2011-02-22 | Advanced Cardiovascular Systems, Inc. | Coating abluminal surfaces of stents and other implantable medical devices |
| EP1827551A1 (en) | 2004-12-06 | 2007-09-05 | SurModics, Inc. | Multifunctional medical articles |
| US20060127443A1 (en) * | 2004-12-09 | 2006-06-15 | Helmus Michael N | Medical devices having vapor deposited nanoporous coatings for controlled therapeutic agent delivery |
| US20060129215A1 (en) * | 2004-12-09 | 2006-06-15 | Helmus Michael N | Medical devices having nanostructured regions for controlled tissue biocompatibility and drug delivery |
| US7632307B2 (en) | 2004-12-16 | 2009-12-15 | Advanced Cardiovascular Systems, Inc. | Abluminal, multilayer coating constructs for drug-delivery stents |
| US7604818B2 (en) | 2004-12-22 | 2009-10-20 | Advanced Cardiovascular Systems, Inc. | Polymers of fluorinated monomers and hydrocarbon monomers |
| US7419504B2 (en) | 2004-12-27 | 2008-09-02 | Advanced Cardiovascular Systems, Inc. | Poly(ester amide) block copolymers |
| US8007775B2 (en) | 2004-12-30 | 2011-08-30 | Advanced Cardiovascular Systems, Inc. | Polymers containing poly(hydroxyalkanoates) and agents for use with medical articles and methods of fabricating the same |
| US7202325B2 (en) | 2005-01-14 | 2007-04-10 | Advanced Cardiovascular Systems, Inc. | Poly(hydroxyalkanoate-co-ester amides) and agents for use with medical articles |
| US8221824B2 (en) | 2005-02-03 | 2012-07-17 | Boston Scientific Scimed, Inc. | Deforming surface of drug eluting coating to alter drug release profile of a medical device |
| US20060178696A1 (en) * | 2005-02-04 | 2006-08-10 | Porter Stephen C | Macroporous materials for use in aneurysms |
| US8323348B2 (en) * | 2005-02-22 | 2012-12-04 | Taiyen Biotech Co., Ltd. | Bone implants |
| JP5335244B2 (ja) * | 2005-03-03 | 2013-11-06 | アイコン メディカル コーポレーション | 改良された金属合金を用いた医療用部材 |
| WO2006110197A2 (en) * | 2005-03-03 | 2006-10-19 | Icon Medical Corp. | Polymer biodegradable medical device |
| US7540995B2 (en) * | 2005-03-03 | 2009-06-02 | Icon Medical Corp. | Process for forming an improved metal alloy stent |
| US20060264914A1 (en) * | 2005-03-03 | 2006-11-23 | Icon Medical Corp. | Metal alloys for medical devices |
| US20060201601A1 (en) * | 2005-03-03 | 2006-09-14 | Icon Interventional Systems, Inc. | Flexible markers |
| US8323333B2 (en) * | 2005-03-03 | 2012-12-04 | Icon Medical Corp. | Fragile structure protective coating |
| US9107899B2 (en) | 2005-03-03 | 2015-08-18 | Icon Medical Corporation | Metal alloys for medical devices |
| DE102005010705B3 (de) * | 2005-03-09 | 2006-08-03 | Heinz Kurz Gmbh Medizintechnik | Gehörknöchelchenprothese |
| US20060206187A1 (en) * | 2005-03-09 | 2006-09-14 | Cook Incorporated | Stent delivery system |
| US7700659B2 (en) | 2005-03-24 | 2010-04-20 | Advanced Cardiovascular Systems, Inc. | Implantable devices formed of non-fouling methacrylate or acrylate polymers |
| US9381279B2 (en) | 2005-03-24 | 2016-07-05 | Abbott Cardiovascular Systems Inc. | Implantable devices formed on non-fouling methacrylate or acrylate polymers |
| US20060235499A1 (en) * | 2005-04-14 | 2006-10-19 | Cardiac Pacemakers, Inc. | Coated lead fixation electrode |
| US7795467B1 (en) | 2005-04-26 | 2010-09-14 | Advanced Cardiovascular Systems, Inc. | Bioabsorbable, biobeneficial polyurethanes for use in medical devices |
| US7477946B2 (en) * | 2005-04-26 | 2009-01-13 | Cardiac Pacemakers, Inc. | Fixation device for coronary venous lead |
| US8175724B2 (en) * | 2005-04-26 | 2012-05-08 | Cardiac Pacemakers, Inc. | Vascular fixation device |
| US8778375B2 (en) | 2005-04-29 | 2014-07-15 | Advanced Cardiovascular Systems, Inc. | Amorphous poly(D,L-lactide) coating |
| US7637941B1 (en) | 2005-05-11 | 2009-12-29 | Advanced Cardiovascular Systems, Inc. | Endothelial cell binding coatings for rapid encapsulation of bioerodable stents |
| CA2843097C (en) * | 2005-05-24 | 2015-10-27 | Inspire M.D Ltd. | Stent apparatuses for treatment via body lumens and methods of use |
| US20060276910A1 (en) * | 2005-06-01 | 2006-12-07 | Jan Weber | Endoprostheses |
| US7622070B2 (en) | 2005-06-20 | 2009-11-24 | Advanced Cardiovascular Systems, Inc. | Method of manufacturing an implantable polymeric medical device |
| US7823533B2 (en) | 2005-06-30 | 2010-11-02 | Advanced Cardiovascular Systems, Inc. | Stent fixture and method for reducing coating defects |
| US20070038176A1 (en) * | 2005-07-05 | 2007-02-15 | Jan Weber | Medical devices with machined layers for controlled communications with underlying regions |
| US8021676B2 (en) | 2005-07-08 | 2011-09-20 | Advanced Cardiovascular Systems, Inc. | Functionalized chemically inert polymers for coatings |
| DE102005032604A1 (de) * | 2005-07-13 | 2007-01-18 | Gfe Medizintechnik Gmbh | Resorbierbares, in den Körper einsetzbares medizinisches Element, insbesondere resorbierbares Implantat |
| US8394446B2 (en) * | 2005-07-25 | 2013-03-12 | Abbott Cardiovascular Systems Inc. | Methods of providing antioxidants to implantable medical devices |
| US7785647B2 (en) * | 2005-07-25 | 2010-08-31 | Advanced Cardiovascular Systems, Inc. | Methods of providing antioxidants to a drug containing product |
| US7735449B1 (en) | 2005-07-28 | 2010-06-15 | Advanced Cardiovascular Systems, Inc. | Stent fixture having rounded support structures and method for use thereof |
| US7658880B2 (en) | 2005-07-29 | 2010-02-09 | Advanced Cardiovascular Systems, Inc. | Polymeric stent polishing method and apparatus |
| US20070055352A1 (en) * | 2005-09-07 | 2007-03-08 | Wendy Naimark | Stent with pockets for containing a therapeutic agent |
| US20070061006A1 (en) * | 2005-09-14 | 2007-03-15 | Nathan Desatnik | Methods of making shape memory films by chemical vapor deposition and shape memory devices made thereby |
| ATE536140T1 (de) * | 2005-09-30 | 2011-12-15 | Cook Medical Technologies Llc | Beschichtete gefässverschlussvorrichtung |
| US20070141106A1 (en) * | 2005-10-19 | 2007-06-21 | Bonutti Peter M | Drug eluting implant |
| WO2007065016A2 (en) * | 2005-12-02 | 2007-06-07 | Au Jessie L S | Methods and compositions to improve activity and reduce toxicity of stents |
| US7976891B1 (en) | 2005-12-16 | 2011-07-12 | Advanced Cardiovascular Systems, Inc. | Abluminal stent coating apparatus and method of using focused acoustic energy |
| US7591841B2 (en) | 2005-12-16 | 2009-09-22 | Advanced Cardiovascular Systems, Inc. | Implantable devices for accelerated healing |
| US7638156B1 (en) | 2005-12-19 | 2009-12-29 | Advanced Cardiovascular Systems, Inc. | Apparatus and method for selectively coating a medical article |
| US7867547B2 (en) | 2005-12-19 | 2011-01-11 | Advanced Cardiovascular Systems, Inc. | Selectively coating luminal surfaces of stents |
| US8840660B2 (en) | 2006-01-05 | 2014-09-23 | Boston Scientific Scimed, Inc. | Bioerodible endoprostheses and methods of making the same |
| US8089029B2 (en) | 2006-02-01 | 2012-01-03 | Boston Scientific Scimed, Inc. | Bioabsorbable metal medical device and method of manufacture |
| US9526814B2 (en) | 2006-02-16 | 2016-12-27 | Boston Scientific Scimed, Inc. | Medical balloons and methods of making the same |
| US20070196428A1 (en) | 2006-02-17 | 2007-08-23 | Thierry Glauser | Nitric oxide generating medical devices |
| US7910152B2 (en) * | 2006-02-28 | 2011-03-22 | Advanced Cardiovascular Systems, Inc. | Poly(ester amide)-based drug delivery systems with controlled release rate and morphology |
| US7601383B2 (en) | 2006-02-28 | 2009-10-13 | Advanced Cardiovascular Systems, Inc. | Coating construct containing poly (vinyl alcohol) |
| US7713637B2 (en) | 2006-03-03 | 2010-05-11 | Advanced Cardiovascular Systems, Inc. | Coating containing PEGylated hyaluronic acid and a PEGylated non-hyaluronic acid polymer |
| US8257419B2 (en) * | 2006-03-10 | 2012-09-04 | Cordis Corporation | Apparatus for treating a bifurcated region of a conduit |
| US20070224235A1 (en) | 2006-03-24 | 2007-09-27 | Barron Tenney | Medical devices having nanoporous coatings for controlled therapeutic agent delivery |
| US8187620B2 (en) | 2006-03-27 | 2012-05-29 | Boston Scientific Scimed, Inc. | Medical devices comprising a porous metal oxide or metal material and a polymer coating for delivering therapeutic agents |
| US8048150B2 (en) | 2006-04-12 | 2011-11-01 | Boston Scientific Scimed, Inc. | Endoprosthesis having a fiber meshwork disposed thereon |
| US7751883B2 (en) * | 2006-04-25 | 2010-07-06 | Eugenio Picano | System and method for promoting coronary angiogenesis |
| US20070258903A1 (en) * | 2006-05-02 | 2007-11-08 | Kleiner Lothar W | Methods, compositions and devices for treating lesioned sites using bioabsorbable carriers |
| US20070259116A1 (en) * | 2006-05-02 | 2007-11-08 | Boston Scientific Scimed, Inc. | Partially coated workpiece and method of making same |
| US20080051335A1 (en) * | 2006-05-02 | 2008-02-28 | Kleiner Lothar W | Methods, compositions and devices for treating lesioned sites using bioabsorbable carriers |
| US20070259101A1 (en) * | 2006-05-02 | 2007-11-08 | Kleiner Lothar W | Microporous coating on medical devices |
| US7985441B1 (en) | 2006-05-04 | 2011-07-26 | Yiwen Tang | Purification of polymers for coating applications |
| US8003156B2 (en) | 2006-05-04 | 2011-08-23 | Advanced Cardiovascular Systems, Inc. | Rotatable support elements for stents |
| US8304012B2 (en) | 2006-05-04 | 2012-11-06 | Advanced Cardiovascular Systems, Inc. | Method for drying a stent |
| WO2007133479A2 (en) * | 2006-05-10 | 2007-11-22 | Cook Incorporated | Delivery of elastin-stabilizing compound within a body lumen |
| US20070270942A1 (en) * | 2006-05-19 | 2007-11-22 | Medtronic Vascular, Inc. | Galvanic Corrosion Methods and Devices for Fixation of Stent Grafts |
| US7775178B2 (en) | 2006-05-26 | 2010-08-17 | Advanced Cardiovascular Systems, Inc. | Stent coating apparatus and method |
| US9561351B2 (en) | 2006-05-31 | 2017-02-07 | Advanced Cardiovascular Systems, Inc. | Drug delivery spiral coil construct |
| US8568764B2 (en) | 2006-05-31 | 2013-10-29 | Advanced Cardiovascular Systems, Inc. | Methods of forming coating layers for medical devices utilizing flash vaporization |
| US8703167B2 (en) | 2006-06-05 | 2014-04-22 | Advanced Cardiovascular Systems, Inc. | Coatings for implantable medical devices for controlled release of a hydrophilic drug and a hydrophobic drug |
| US8778376B2 (en) | 2006-06-09 | 2014-07-15 | Advanced Cardiovascular Systems, Inc. | Copolymer comprising elastin pentapeptide block and hydrophilic block, and medical device and method of treating |
| US11039942B2 (en) | 2006-06-13 | 2021-06-22 | Sino Medical Sciences Technology Inc. | Drug eluting stent and method of use of the same for enabling restoration of functional endothelial cell layers |
| US9884142B2 (en) * | 2006-06-13 | 2018-02-06 | Alchimedics | Drug eluting stent with a biodegradable release layer attached with an electro-grafted primer coating |
| US20080095918A1 (en) * | 2006-06-14 | 2008-04-24 | Kleiner Lothar W | Coating construct with enhanced interfacial compatibility |
| US8603530B2 (en) | 2006-06-14 | 2013-12-10 | Abbott Cardiovascular Systems Inc. | Nanoshell therapy |
| US8114150B2 (en) | 2006-06-14 | 2012-02-14 | Advanced Cardiovascular Systems, Inc. | RGD peptide attached to bioabsorbable stents |
| US8048448B2 (en) | 2006-06-15 | 2011-11-01 | Abbott Cardiovascular Systems Inc. | Nanoshells for drug delivery |
| US8246973B2 (en) | 2006-06-21 | 2012-08-21 | Advanced Cardiovascular Systems, Inc. | Freeze-thaw method for modifying stent coating |
| US8017237B2 (en) | 2006-06-23 | 2011-09-13 | Abbott Cardiovascular Systems, Inc. | Nanoshells on polymers |
| US8815275B2 (en) * | 2006-06-28 | 2014-08-26 | Boston Scientific Scimed, Inc. | Coatings for medical devices comprising a therapeutic agent and a metallic material |
| EP2032091A2 (en) | 2006-06-29 | 2009-03-11 | Boston Scientific Limited | Medical devices with selective coating |
| US8956640B2 (en) * | 2006-06-29 | 2015-02-17 | Advanced Cardiovascular Systems, Inc. | Block copolymers including a methoxyethyl methacrylate midblock |
| US9265865B2 (en) * | 2006-06-30 | 2016-02-23 | Boston Scientific Scimed, Inc. | Stent having time-release indicator |
| US20080008736A1 (en) * | 2006-07-06 | 2008-01-10 | Thierry Glauser | Random copolymers of methacrylates and acrylates |
| US9028859B2 (en) | 2006-07-07 | 2015-05-12 | Advanced Cardiovascular Systems, Inc. | Phase-separated block copolymer coatings for implantable medical devices |
| WO2008013803A2 (en) * | 2006-07-24 | 2008-01-31 | Massachusetts Institute Of Technology | Endovascular devices with axial perturbations |
| US9265866B2 (en) * | 2006-08-01 | 2016-02-23 | Abbott Cardiovascular Systems Inc. | Composite polymeric and metallic stent with radiopacity |
| US8052743B2 (en) * | 2006-08-02 | 2011-11-08 | Boston Scientific Scimed, Inc. | Endoprosthesis with three-dimensional disintegration control |
| DE102006038242A1 (de) * | 2006-08-07 | 2008-02-14 | Biotronik Vi Patent Ag | Stent mit einer Struktur aus einem biokorrodierbaren metallischen Werkstoff |
| US8703169B1 (en) | 2006-08-15 | 2014-04-22 | Abbott Cardiovascular Systems Inc. | Implantable device having a coating comprising carrageenan and a biostable polymer |
| US9248121B2 (en) * | 2006-08-21 | 2016-02-02 | Abbott Laboratories | Medical devices for controlled drug release |
| WO2008033711A2 (en) | 2006-09-14 | 2008-03-20 | Boston Scientific Limited | Medical devices with drug-eluting coating |
| JP2010503489A (ja) | 2006-09-15 | 2010-02-04 | ボストン サイエンティフィック リミテッド | 生体内分解性内部人工器官およびその製造方法 |
| US8052744B2 (en) | 2006-09-15 | 2011-11-08 | Boston Scientific Scimed, Inc. | Medical devices and methods of making the same |
| JP2010503481A (ja) * | 2006-09-15 | 2010-02-04 | ボストン サイエンティフィック リミテッド | 医療器具 |
| EP2121068B1 (en) | 2006-09-15 | 2010-12-08 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis with biostable inorganic layers |
| EP2076296A2 (en) | 2006-09-15 | 2009-07-08 | Boston Scientific Scimed, Inc. | Endoprosthesis with adjustable surface features |
| JP2010503494A (ja) | 2006-09-15 | 2010-02-04 | ボストン サイエンティフィック リミテッド | 生分解性内部人工器官およびその製造方法 |
| CA2663762A1 (en) | 2006-09-18 | 2008-03-27 | Boston Scientific Limited | Endoprostheses |
| US7963942B2 (en) | 2006-09-20 | 2011-06-21 | Boston Scientific Scimed, Inc. | Medical balloons with modified surfaces |
| US20080075753A1 (en) * | 2006-09-25 | 2008-03-27 | Chappa Ralph A | Multi-layered coatings and methods for controlling elution of active agents |
| US8067055B2 (en) * | 2006-10-20 | 2011-11-29 | Biosensors International Group, Ltd. | Drug-delivery endovascular stent and method of use |
| US20080097591A1 (en) | 2006-10-20 | 2008-04-24 | Biosensors International Group | Drug-delivery endovascular stent and method of use |
| US20080103584A1 (en) * | 2006-10-25 | 2008-05-01 | Biosensors International Group | Temporal Intraluminal Stent, Methods of Making and Using |
| US20080294236A1 (en) * | 2007-05-23 | 2008-11-27 | Boston Scientific Scimed, Inc. | Endoprosthesis with Select Ceramic and Polymer Coatings |
| US7981150B2 (en) | 2006-11-09 | 2011-07-19 | Boston Scientific Scimed, Inc. | Endoprosthesis with coatings |
| US8414525B2 (en) | 2006-11-20 | 2013-04-09 | Lutonix, Inc. | Drug releasing coatings for medical devices |
| US8430055B2 (en) | 2008-08-29 | 2013-04-30 | Lutonix, Inc. | Methods and apparatuses for coating balloon catheters |
| US20080276935A1 (en) | 2006-11-20 | 2008-11-13 | Lixiao Wang | Treatment of asthma and chronic obstructive pulmonary disease with anti-proliferate and anti-inflammatory drugs |
| US8414910B2 (en) | 2006-11-20 | 2013-04-09 | Lutonix, Inc. | Drug releasing coatings for medical devices |
| US8414526B2 (en) | 2006-11-20 | 2013-04-09 | Lutonix, Inc. | Medical device rapid drug releasing coatings comprising oils, fatty acids, and/or lipids |
| US8425459B2 (en) | 2006-11-20 | 2013-04-23 | Lutonix, Inc. | Medical device rapid drug releasing coatings comprising a therapeutic agent and a contrast agent |
| US9700704B2 (en) | 2006-11-20 | 2017-07-11 | Lutonix, Inc. | Drug releasing coatings for balloon catheters |
| US8998846B2 (en) | 2006-11-20 | 2015-04-07 | Lutonix, Inc. | Drug releasing coatings for balloon catheters |
| US9737640B2 (en) | 2006-11-20 | 2017-08-22 | Lutonix, Inc. | Drug releasing coatings for medical devices |
| US8414909B2 (en) | 2006-11-20 | 2013-04-09 | Lutonix, Inc. | Drug releasing coatings for medical devices |
| US20080118541A1 (en) * | 2006-11-21 | 2008-05-22 | Abbott Laboratories | Use of a terpolymer of tetrafluoroethylene, hexafluoropropylene, and vinylidene fluoride in drug eluting coatings on medical devices |
| WO2008064058A2 (en) | 2006-11-21 | 2008-05-29 | Abbott Laboratories | Use of a terpolymer of tetrafluoroethylene, hexafluoropropylene, and vinylidene fluoride in drug eluting coatings |
| US7713541B1 (en) | 2006-11-21 | 2010-05-11 | Abbott Cardiovascular Systems Inc. | Zwitterionic terpolymers, method of making and use on medical devices |
| WO2008062414A2 (en) | 2006-11-22 | 2008-05-29 | Inspiremd Ltd. | Optimized stent jacket |
| US8597673B2 (en) | 2006-12-13 | 2013-12-03 | Advanced Cardiovascular Systems, Inc. | Coating of fast absorption or dissolution |
| US8017141B2 (en) * | 2006-12-15 | 2011-09-13 | Advanced Cardiovascular Systems, Inc. | Coatings of acrylamide-based copolymers |
| WO2008083190A2 (en) | 2006-12-28 | 2008-07-10 | Boston Scientific Limited | Bioerodible endoprostheses and methods of making same |
| US8114466B2 (en) | 2007-01-03 | 2012-02-14 | Boston Scientific Scimed, Inc. | Methods of applying coating to the inside surface of a stent |
| US8221496B2 (en) * | 2007-02-01 | 2012-07-17 | Cordis Corporation | Antithrombotic and anti-restenotic drug eluting stent |
| WO2008097511A2 (en) | 2007-02-07 | 2008-08-14 | Cook Incorporated | Medical device coatings for releasing a therapeutic agent at multiple rates |
| US8070797B2 (en) | 2007-03-01 | 2011-12-06 | Boston Scientific Scimed, Inc. | Medical device with a porous surface for delivery of a therapeutic agent |
| US8431149B2 (en) | 2007-03-01 | 2013-04-30 | Boston Scientific Scimed, Inc. | Coated medical devices for abluminal drug delivery |
| US8974514B2 (en) | 2007-03-13 | 2015-03-10 | Abbott Cardiovascular Systems Inc. | Intravascular stent with integrated link and ring strut |
| US8000810B2 (en) * | 2007-03-20 | 2011-08-16 | Cardiac Pacemakers, Inc. | Systems and methods for transvenous lead implantation |
| US8303639B2 (en) * | 2007-03-22 | 2012-11-06 | Medtronic Vascular, Inc. | Releasable polymer on drug elution stent and method |
| US8067054B2 (en) | 2007-04-05 | 2011-11-29 | Boston Scientific Scimed, Inc. | Stents with ceramic drug reservoir layer and methods of making and using the same |
| US20080249599A1 (en) * | 2007-04-05 | 2008-10-09 | Medtronic Vascular, Inc. | Stent With Therapeutic Agent Delivery Structures in Low Strain Regions |
| US20080286332A1 (en) | 2007-05-14 | 2008-11-20 | Pacetti Stephen D | Implantable medical devices with a topcoat layer of phosphoryl choline acrylate polymer for reduced thrombosis, and improved mechanical properties |
| US8147769B1 (en) | 2007-05-16 | 2012-04-03 | Abbott Cardiovascular Systems Inc. | Stent and delivery system with reduced chemical degradation |
| US7976915B2 (en) | 2007-05-23 | 2011-07-12 | Boston Scientific Scimed, Inc. | Endoprosthesis with select ceramic morphology |
| US7967788B2 (en) | 2007-05-25 | 2011-06-28 | Iq Medical Devices, Llc | Catheter with variable attachment means |
| US9056155B1 (en) | 2007-05-29 | 2015-06-16 | Abbott Cardiovascular Systems Inc. | Coatings having an elastic primer layer |
| EP2195070A4 (en) * | 2007-05-30 | 2011-10-26 | Critical Care Innovations Inc | METHOD AND DEVICE FOR SELECTIVELY TREATING INTERSTITIAL TISSUE |
| US8048441B2 (en) | 2007-06-25 | 2011-11-01 | Abbott Cardiovascular Systems, Inc. | Nanobead releasing medical devices |
| US8109904B1 (en) | 2007-06-25 | 2012-02-07 | Abbott Cardiovascular Systems Inc. | Drug delivery medical devices |
| US7942926B2 (en) | 2007-07-11 | 2011-05-17 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US8002823B2 (en) | 2007-07-11 | 2011-08-23 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| JP2010533563A (ja) | 2007-07-19 | 2010-10-28 | ボストン サイエンティフィック リミテッド | 吸着抑制表面を有する内部人工器官 |
| US7931683B2 (en) | 2007-07-27 | 2011-04-26 | Boston Scientific Scimed, Inc. | Articles having ceramic coated surfaces |
| US8815273B2 (en) | 2007-07-27 | 2014-08-26 | Boston Scientific Scimed, Inc. | Drug eluting medical devices having porous layers |
| US8221822B2 (en) | 2007-07-31 | 2012-07-17 | Boston Scientific Scimed, Inc. | Medical device coating by laser cladding |
| WO2009020520A1 (en) | 2007-08-03 | 2009-02-12 | Boston Scientific Scimed, Inc. | Coating for medical device having increased surface area |
| US8052745B2 (en) | 2007-09-13 | 2011-11-08 | Boston Scientific Scimed, Inc. | Endoprosthesis |
| KR100930167B1 (ko) * | 2007-09-19 | 2009-12-07 | 삼성전기주식회사 | 초광각 광학계 |
| EP3025685B1 (en) | 2007-10-19 | 2019-07-17 | CeloNova Biosciences, Inc. | Implantable and lumen-supporting stents |
| US8142490B2 (en) * | 2007-10-24 | 2012-03-27 | Cordis Corporation | Stent segments axially connected by thin film |
| US20090118821A1 (en) * | 2007-11-02 | 2009-05-07 | Boston Scientific Scimed, Inc. | Endoprosthesis with porous reservoir and non-polymer diffusion layer |
| US7938855B2 (en) | 2007-11-02 | 2011-05-10 | Boston Scientific Scimed, Inc. | Deformable underlayer for stent |
| US20090118812A1 (en) * | 2007-11-02 | 2009-05-07 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US8216632B2 (en) | 2007-11-02 | 2012-07-10 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US8029554B2 (en) | 2007-11-02 | 2011-10-04 | Boston Scientific Scimed, Inc. | Stent with embedded material |
| WO2009076592A2 (en) * | 2007-12-12 | 2009-06-18 | Boston Scientific Scimed, Inc. | Medical devices having porous component for controlled diffusion |
| US7722661B2 (en) | 2007-12-19 | 2010-05-25 | Boston Scientific Scimed, Inc. | Stent |
| US20090192583A1 (en) * | 2008-01-28 | 2009-07-30 | Medtronic Vascular, Inc. | Ordered Coatings for Drug Eluting Stents and Medical Devices |
| US20090226598A1 (en) * | 2008-02-11 | 2009-09-10 | Boston Scientific Scimed, Inc. | Substrate Coating Apparatus Having a Solvent Vapor Emitter |
| US8920491B2 (en) | 2008-04-22 | 2014-12-30 | Boston Scientific Scimed, Inc. | Medical devices having a coating of inorganic material |
| US8932346B2 (en) | 2008-04-24 | 2015-01-13 | Boston Scientific Scimed, Inc. | Medical devices having inorganic particle layers |
| WO2009135008A2 (en) * | 2008-05-01 | 2009-11-05 | Boston Scientific Scimed, Inc. | Drug-loaded medical devices and methods for manufacturing drug-loaded medical devices |
| US7998192B2 (en) | 2008-05-09 | 2011-08-16 | Boston Scientific Scimed, Inc. | Endoprostheses |
| US8236046B2 (en) | 2008-06-10 | 2012-08-07 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis |
| WO2009155328A2 (en) | 2008-06-18 | 2009-12-23 | Boston Scientific Scimed, Inc. | Endoprosthesis coating |
| US20100010618A1 (en) * | 2008-07-08 | 2010-01-14 | Boston Scientific Scimed, Inc. | Overlapping Stent |
| DE102008040356A1 (de) * | 2008-07-11 | 2010-01-14 | Biotronik Vi Patent Ag | Stent mit biodegradierbaren Stentstreben und Wirkstoffdepots |
| US7985252B2 (en) | 2008-07-30 | 2011-07-26 | Boston Scientific Scimed, Inc. | Bioerodible endoprosthesis |
| US8382824B2 (en) | 2008-10-03 | 2013-02-26 | Boston Scientific Scimed, Inc. | Medical implant having NANO-crystal grains with barrier layers of metal nitrides or fluorides |
| US8231980B2 (en) | 2008-12-03 | 2012-07-31 | Boston Scientific Scimed, Inc. | Medical implants including iridium oxide |
| US20100152027A1 (en) * | 2008-12-15 | 2010-06-17 | Chevron U.S.A., Inc. | Ionic liquid catalyst having a high molar ratio of aluminum to nitrogen |
| US20100161039A1 (en) * | 2008-12-23 | 2010-06-24 | Vipul Dave | Adhesion promoting temporary mask for coated surfaces |
| AU2015200101B2 (en) * | 2008-12-23 | 2016-09-15 | Cardinal Health 529, Llc | Adhesion promoting temporary mask for coated surfaces |
| EP2393628B1 (en) * | 2009-02-03 | 2017-06-21 | Abbott Cardiovascular Systems Inc. | Improved laser cutting system |
| US8872062B2 (en) * | 2009-02-03 | 2014-10-28 | Abbott Cardiovascular Systems Inc. | Laser cutting process for forming stents |
| WO2010091100A1 (en) | 2009-02-03 | 2010-08-12 | Abbott Cardiovascular Systems Inc. | Multiple beam laser system for forming stents |
| US8267992B2 (en) | 2009-03-02 | 2012-09-18 | Boston Scientific Scimed, Inc. | Self-buffering medical implants |
| US8071156B2 (en) | 2009-03-04 | 2011-12-06 | Boston Scientific Scimed, Inc. | Endoprostheses |
| US20100247600A1 (en) * | 2009-03-24 | 2010-09-30 | Warsaw Orthopedic, Inc. | Therapeutic drug eluting implant cover and method of making the same |
| DE102009001895A1 (de) * | 2009-03-26 | 2010-09-30 | Biotronik Vi Patent Ag | Medizinisches Implantat zur Medikamentenfreisetzung mit poröser Oberfläche |
| US9078712B2 (en) | 2009-04-15 | 2015-07-14 | Warsaw Orthopedic, Inc. | Preformed drug-eluting device to be affixed to an anterior spinal plate |
| US9414864B2 (en) | 2009-04-15 | 2016-08-16 | Warsaw Orthopedic, Inc. | Anterior spinal plate with preformed drug-eluting device affixed thereto |
| US8287937B2 (en) | 2009-04-24 | 2012-10-16 | Boston Scientific Scimed, Inc. | Endoprosthese |
| EP3412260B1 (en) * | 2009-05-18 | 2020-08-26 | Dose Medical Corporation | Drug eluting ocular implant |
| US10206813B2 (en) | 2009-05-18 | 2019-02-19 | Dose Medical Corporation | Implants with controlled drug delivery features and methods of using same |
| WO2010151269A1 (en) | 2009-06-26 | 2010-12-29 | Biotic Laboratories, Inc. | Para-xylylene based multilayer drug elution devices |
| US20110034992A1 (en) * | 2009-08-04 | 2011-02-10 | Papp John E | Stent and Method of Coating Same |
| KR101084275B1 (ko) * | 2009-09-22 | 2011-11-16 | 삼성모바일디스플레이주식회사 | 소스 가스 공급 유닛, 이를 구비하는 증착 장치 및 방법 |
| TWI564427B (zh) * | 2009-12-18 | 2017-01-01 | 財團法人工業技術研究院 | 聚對二甲苯薄膜的形成方法 |
| US8398916B2 (en) | 2010-03-04 | 2013-03-19 | Icon Medical Corp. | Method for forming a tubular medical device |
| WO2011119573A1 (en) | 2010-03-23 | 2011-09-29 | Boston Scientific Scimed, Inc. | Surface treated bioerodible metal endoprostheses |
| US8685433B2 (en) | 2010-03-31 | 2014-04-01 | Abbott Cardiovascular Systems Inc. | Absorbable coating for implantable device |
| US9072618B2 (en) * | 2010-05-06 | 2015-07-07 | Biotronik Ag | Biocorrodable implant in which corrosion may be triggered or accelerated after implantation by means of an external stimulus |
| US8920490B2 (en) * | 2010-05-13 | 2014-12-30 | Boston Scientific Scimed, Inc. | Endoprostheses |
| US8389041B2 (en) | 2010-06-17 | 2013-03-05 | Abbott Cardiovascular Systems, Inc. | Systems and methods for rotating and coating an implantable device |
| US10112257B1 (en) | 2010-07-09 | 2018-10-30 | General Lasertronics Corporation | Coating ablating apparatus with coating removal detection |
| ES2725549T3 (es) | 2010-07-12 | 2019-09-24 | Univ Southern California | Sustrato biocompatible para facilitar las interconexiones entre células madre y tejidos diana y métodos para implantarlo |
| EP2407184A3 (de) | 2010-07-16 | 2014-10-29 | Biotronik AG | Abluminal beschichtete Wirkstoff-freisetzende Stents mit einer formschlüssigen Schutzschicht |
| US8556511B2 (en) | 2010-09-08 | 2013-10-15 | Abbott Cardiovascular Systems, Inc. | Fluid bearing to support stent tubing during laser cutting |
| US9668915B2 (en) | 2010-11-24 | 2017-06-06 | Dose Medical Corporation | Drug eluting ocular implant |
| US10098765B2 (en) * | 2010-12-15 | 2018-10-16 | Biotronik Ag | Implant and method for producing the same |
| US8877489B2 (en) | 2011-12-05 | 2014-11-04 | California Institute Of Technology | Ultrathin parylene-C semipermeable membranes for biomedical applications |
| WO2012149468A2 (en) | 2011-04-29 | 2012-11-01 | University Of Southern California | Instruments and methods for the implantation of cell-seeded substrates |
| US10245178B1 (en) | 2011-06-07 | 2019-04-02 | Glaukos Corporation | Anterior chamber drug-eluting ocular implant |
| US20130072869A1 (en) * | 2011-09-15 | 2013-03-21 | The Johns Hopkins University | Intra-Gastric Timed-Release Drug Delivery System |
| US8685106B2 (en) | 2011-11-15 | 2014-04-01 | Abraham Lin | Method of a pharmaceutical delivery system for use within a joint replacement |
| US9248013B2 (en) | 2011-12-05 | 2016-02-02 | California Institute Of Technology | 3-Dimensional parylene scaffold cage |
| US9895771B2 (en) | 2012-02-28 | 2018-02-20 | General Lasertronics Corporation | Laser ablation for the environmentally beneficial removal of surface coatings |
| US9827401B2 (en) | 2012-06-01 | 2017-11-28 | Surmodics, Inc. | Apparatus and methods for coating medical devices |
| MX388762B (es) | 2012-06-01 | 2025-03-20 | Surmodics Inc | Aparato y método para recubrir catéteres con globo. |
| DE102012025143A1 (de) * | 2012-11-07 | 2014-05-08 | Heraeus Medical Gmbh | Verfahren zur Wirkstofffreisetzung und Wirkstofffreisetzungssysteme |
| AU2014225788B2 (en) | 2013-03-05 | 2018-03-29 | Baylor College Of Medicine | Engager cells for immunotherapy |
| US10517759B2 (en) | 2013-03-15 | 2019-12-31 | Glaukos Corporation | Glaucoma stent and methods thereof for glaucoma treatment |
| US9545301B2 (en) | 2013-03-15 | 2017-01-17 | Covidien Lp | Coated medical devices and methods of making and using same |
| US9320592B2 (en) | 2013-03-15 | 2016-04-26 | Covidien Lp | Coated medical devices and methods of making and using same |
| CN105188791B (zh) | 2013-05-06 | 2018-01-12 | 雅培心血管系统公司 | 填充有治疗剂制剂的中空支架 |
| EP3034048B1 (en) | 2013-09-27 | 2019-06-19 | Terumo Kabushiki Kaisha | Stent production method |
| US9668890B2 (en) | 2013-11-22 | 2017-06-06 | Covidien Lp | Anti-thrombogenic medical devices and methods |
| US10086597B2 (en) * | 2014-01-21 | 2018-10-02 | General Lasertronics Corporation | Laser film debonding method |
| HK1216509A1 (zh) | 2014-02-04 | 2016-11-18 | Abbott Cardiovascular Systems, Inc. | 具有基於novolimus和丙交酯的塗層使得novolimus與塗層具有最小鍵合量的藥物遞送支架或支撐件 |
| BR102014003817B1 (pt) * | 2014-02-19 | 2023-09-26 | Fundação Universidade Federal De São Carlos | Processo de recobrimento descontínuo utilizando um biomaterial bioabsorvível e bioativo aplicado sobre substratos sólidos, recobrimento descontínuo e seu uso |
| US20150342875A1 (en) | 2014-05-29 | 2015-12-03 | Dose Medical Corporation | Implants with controlled drug delivery features and methods of using same |
| BR112016030273A2 (pt) | 2014-06-24 | 2017-08-22 | Icon Medical Corp | Dispositivo médico e método para formar o referido dispositivo |
| ES2940478T3 (es) | 2014-06-26 | 2023-05-08 | Taris Biomedical Llc | Dispositivos de administración de fármacos intravesicales y métodos que incluyen sistemas de matriz de polímero-fármaco elásticos |
| US9789228B2 (en) | 2014-12-11 | 2017-10-17 | Covidien Lp | Antimicrobial coatings for medical devices and processes for preparing such coatings |
| US11925578B2 (en) | 2015-09-02 | 2024-03-12 | Glaukos Corporation | Drug delivery implants with bi-directional delivery capacity |
| WO2017053885A1 (en) | 2015-09-25 | 2017-03-30 | Glaukos Corporation | Punctal implants with controlled drug delivery features and methods of using same |
| WO2017151548A1 (en) | 2016-03-04 | 2017-09-08 | Mirus Llc | Stent device for spinal fusion |
| CA3022830A1 (en) | 2016-04-20 | 2017-10-26 | Harold Alexander Heitzmann | Bioresorbable ocular drug delivery device |
| WO2020112816A1 (en) | 2018-11-29 | 2020-06-04 | Surmodics, Inc. | Apparatus and methods for coating medical devices |
| EP3714913A1 (en) * | 2019-03-29 | 2020-09-30 | Picosun Oy | Color coding |
| US12011377B2 (en) * | 2019-03-29 | 2024-06-18 | Picosun Oy | Medical device with improved coating |
| US11819590B2 (en) | 2019-05-13 | 2023-11-21 | Surmodics, Inc. | Apparatus and methods for coating medical devices |
| CN110584851A (zh) * | 2019-09-21 | 2019-12-20 | 山东百多安医疗器械有限公司 | 一种超声控释刻槽可降解微球载药支架及其制备方法 |
Family Cites Families (124)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US377020A (en) * | 1888-01-31 | Key-fastener | ||
| GB1173942A (en) | 1967-06-06 | 1969-12-10 | Bellon Labor Sa Roger | New 2,3-Dihydro-1,4-Benzoxazines |
| US3854480A (en) | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US3705948A (en) | 1971-03-08 | 1972-12-12 | Nippon Musical Instruments Mfg | System for controlling tone-modifying circuits by muscular voltage in electronic musical instrument |
| US3868454A (en) | 1972-08-14 | 1975-02-25 | Lilly Co Eli | Psoriasis treatment with mycophenolic acid derivatives |
| US3777020A (en) | 1972-08-14 | 1973-12-04 | Lilly Co Eli | Psoriasis treatment with mycophenolic acid |
| US3880995A (en) | 1973-05-14 | 1975-04-29 | Lilly Co Eli | Treatment of arthritis with mycophenolic acid and derivatives |
| US3903071A (en) | 1973-05-22 | 1975-09-02 | Lilly Co Eli | Mycophenolic acid derivatives |
| US3976071A (en) | 1974-01-07 | 1976-08-24 | Dynatech Corporation | Methods of improving control of release rates and products useful in same |
| US3993749A (en) | 1974-04-12 | 1976-11-23 | Ayerst Mckenna And Harrison Ltd. | Rapamycin and process of preparation |
| US3993072A (en) | 1974-08-28 | 1976-11-23 | Alza Corporation | Microporous drug delivery device |
| US4115197A (en) | 1977-03-21 | 1978-09-19 | Eli Lilly And Company | Procedure for obtaining penicillium species mutants with improved ability to synthesize mycophenolic acid |
| US4357259A (en) | 1977-08-01 | 1982-11-02 | Northwestern University | Method of incorporating water-soluble heat-sensitive therapeutic agents in albumin microspheres |
| US4335094A (en) | 1979-01-26 | 1982-06-15 | Mosbach Klaus H | Magnetic polymer particles |
| US4345588A (en) | 1979-04-23 | 1982-08-24 | Northwestern University | Method of delivering a therapeutic agent to a target capillary bed |
| US4234684A (en) | 1979-12-11 | 1980-11-18 | Eli Lilly And Company | Method of preparing mycophenolic acid glucoside |
| JPS57171968A (en) | 1981-04-17 | 1982-10-22 | Kyowa Hakko Kogyo Co Ltd | 1,4-dihydropyridine derivative |
| WO1983001738A1 (en) | 1981-11-12 | 1983-05-26 | SCHRÖDER, Ulf | Intravascularly administrable, magnetically responsive nanosphere or manoparticle, a process for the production thereof, and the use thereof |
| JPS58223437A (ja) | 1982-06-18 | 1983-12-26 | Tdk Corp | 分散性を改良した無機粉末 |
| US4894366A (en) | 1984-12-03 | 1990-01-16 | Fujisawa Pharmaceutical Company, Ltd. | Tricyclo compounds, a process for their production and a pharmaceutical composition containing the same |
| IL72684A (en) | 1984-08-14 | 1989-02-28 | Israel State | Pharmaceutical compositions for controlled transdermal delivery of cholinergic or anticholinergic basic drugs |
| US5206159A (en) | 1984-11-01 | 1993-04-27 | Miles Inc., As Legal Successor By Merger With Technicon Instruments Corp. | Polymer particles containing colloidal iron oxide granules for use as a magnetically responsive reagent carrier |
| GB8601100D0 (en) | 1986-01-17 | 1986-02-19 | Cosmas Damian Ltd | Drug delivery system |
| US4871716A (en) | 1986-02-04 | 1989-10-03 | University Of Florida | Magnetically responsive, hydrophilic microspheres for incorporation of therapeutic substances and methods of preparation thereof |
| US5000185A (en) | 1986-02-28 | 1991-03-19 | Cardiovascular Imaging Systems, Inc. | Method for intravascular two-dimensional ultrasonography and recanalization |
| US4832686A (en) | 1986-06-24 | 1989-05-23 | Anderson Mark E | Method for administering interleukin-2 |
| US5069216A (en) | 1986-07-03 | 1991-12-03 | Advanced Magnetics Inc. | Silanized biodegradable super paramagnetic metal oxides as contrast agents for imaging the gastrointestinal tract |
| US4883666A (en) | 1987-04-29 | 1989-11-28 | Massachusetts Institute Of Technology | Controlled drug delivery system for treatment of neural disorders |
| US4894231A (en) | 1987-07-28 | 1990-01-16 | Biomeasure, Inc. | Therapeutic agent delivery system |
| US4897268A (en) | 1987-08-03 | 1990-01-30 | Southern Research Institute | Drug delivery system and method of making the same |
| US4921723A (en) | 1987-10-16 | 1990-05-01 | The Curators Of The University Of Missouri | Process for applying a composite insulative coating to a substrate |
| WO1990002546A1 (en) | 1988-09-09 | 1990-03-22 | The Ronald T. Dodge Company | Pharmaceuticals microencapsulated by vapor deposited polymers and method |
| US5024671A (en) | 1988-09-19 | 1991-06-18 | Baxter International Inc. | Microporous vascular graft |
| US4936281A (en) | 1989-04-13 | 1990-06-26 | Everest Medical Corporation | Ultrasonically enhanced RF ablation catheter |
| WO1990013332A1 (en) | 1989-05-11 | 1990-11-15 | Cedars-Sinai Medical Center | Stent with sustained drug delivery |
| US5067491A (en) | 1989-12-08 | 1991-11-26 | Becton, Dickinson And Company | Barrier coating on blood contacting devices |
| US6004346A (en) | 1990-02-28 | 1999-12-21 | Medtronic, Inc. | Intralumenal drug eluting prosthesis |
| US5545208A (en) | 1990-02-28 | 1996-08-13 | Medtronic, Inc. | Intralumenal drug eluting prosthesis |
| AU7998091A (en) | 1990-05-17 | 1991-12-10 | Harbor Medical Devices, Inc. | Medical device polymer |
| EP0533816B1 (en) | 1990-06-15 | 1995-06-14 | Cortrak Medical, Inc. | Drug delivery apparatus |
| US5112457A (en) | 1990-07-23 | 1992-05-12 | Case Western Reserve University | Process for producing hydroxylated plasma-polymerized films and the use of the films for enhancing the compatiblity of biomedical implants |
| US5163952A (en) | 1990-09-14 | 1992-11-17 | Michael Froix | Expandable polymeric stent with memory and delivery apparatus and method |
| US5484584A (en) | 1990-10-02 | 1996-01-16 | Board Of Regents, The University Of Texas System | Therapeutic and diagnostic use of modified polymeric microcapsules |
| US5893840A (en) | 1991-01-04 | 1999-04-13 | Medtronic, Inc. | Releasable microcapsules on balloon catheters |
| US5368557A (en) | 1991-01-11 | 1994-11-29 | Baxter International Inc. | Ultrasonic ablation catheter device having multiple ultrasound transmission members |
| DE4117782C2 (de) | 1991-05-28 | 1997-07-17 | Diagnostikforschung Inst | Nanokristalline magnetische Eisenoxid-Partikel, Verfahren zu ihrer Herstellung sowie diagnostische und/oder therapeutische Mittel |
| US5243756A (en) | 1991-06-28 | 1993-09-14 | Digital Equipment Corporation | Integrated circuit protection by liquid encapsulation |
| US5130889A (en) | 1991-06-28 | 1992-07-14 | Digital Equipment Corporation | Integrated circuit protection by liquid encapsulation |
| US5356433A (en) | 1991-08-13 | 1994-10-18 | Cordis Corporation | Biocompatible metal surfaces |
| US5176907A (en) | 1991-08-13 | 1993-01-05 | The Johns Hopkins University School Of Medicine | Biocompatible and biodegradable poly (phosphoester-urethanes) |
| US5411550A (en) | 1991-09-16 | 1995-05-02 | Atrium Medical Corporation | Implantable prosthetic device for the delivery of a bioactive material |
| WO1993006792A1 (en) | 1991-10-04 | 1993-04-15 | Scimed Life Systems, Inc. | Biodegradable drug delivery vascular stent |
| US5464450A (en) | 1991-10-04 | 1995-11-07 | Scimed Lifesystems Inc. | Biodegradable drug delivery vascular stent |
| US5500013A (en) | 1991-10-04 | 1996-03-19 | Scimed Life Systems, Inc. | Biodegradable drug delivery vascular stent |
| US5270047A (en) | 1991-11-21 | 1993-12-14 | Kauffman Raymond F | Local delivery of dipyridamole for the treatment of proliferative diseases |
| US5225282A (en) | 1991-12-13 | 1993-07-06 | Molecular Bioquest, Inc. | Biodegradable magnetic microcluster comprising non-magnetic metal or metal oxide particles coated with a functionalized polymer |
| US5516781A (en) | 1992-01-09 | 1996-05-14 | American Home Products Corporation | Method of treating restenosis with rapamycin |
| US5876452A (en) | 1992-02-14 | 1999-03-02 | Board Of Regents, University Of Texas System | Biodegradable implant |
| US5656297A (en) | 1992-03-12 | 1997-08-12 | Alkermes Controlled Therapeutics, Incorporated | Modulated release from biocompatible polymers |
| US5599352A (en) | 1992-03-19 | 1997-02-04 | Medtronic, Inc. | Method of making a drug eluting stent |
| JP3857306B2 (ja) | 1992-04-24 | 2006-12-13 | ザ ポリマー テクノロジー グループ,インコーポレイティド | 所定分子量レンジの分子を透過させるためのコポリマー及びそれらの非細孔性,半透過性膜並びにその使用 |
| US5283257A (en) | 1992-07-10 | 1994-02-01 | The Board Of Trustees Of The Leland Stanford Junior University | Method of treating hyperproliferative vascular disease |
| US5342348A (en) | 1992-12-04 | 1994-08-30 | Kaplan Aaron V | Method and device for treating and enlarging body lumens |
| US5355832A (en) | 1992-12-15 | 1994-10-18 | Advanced Surface Technology, Inc. | Polymerization reactor |
| US5419760A (en) | 1993-01-08 | 1995-05-30 | Pdt Systems, Inc. | Medicament dispensing stent for prevention of restenosis of a blood vessel |
| US5474563A (en) | 1993-03-25 | 1995-12-12 | Myler; Richard | Cardiovascular stent and retrieval apparatus |
| US5464650A (en) | 1993-04-26 | 1995-11-07 | Medtronic, Inc. | Intravascular stent and method |
| US5543158A (en) | 1993-07-23 | 1996-08-06 | Massachusetts Institute Of Technology | Biodegradable injectable nanoparticles |
| US5409000A (en) | 1993-09-14 | 1995-04-25 | Cardiac Pathways Corporation | Endocardial mapping and ablation system utilizing separately controlled steerable ablation catheter with ultrasonic imaging capabilities and method |
| US5463010A (en) | 1993-11-12 | 1995-10-31 | Surface Engineering Technologies, Division Of Innerdyne, Inc. | Hydrocyclosiloxane membrane prepared by plasma polymerization process |
| US5470802A (en) | 1994-05-20 | 1995-11-28 | Texas Instruments Incorporated | Method of making a semiconductor device using a low dielectric constant material |
| US5488015A (en) | 1994-05-20 | 1996-01-30 | Texas Instruments Incorporated | Method of making an interconnect structure with an integrated low density dielectric |
| US5891108A (en) | 1994-09-12 | 1999-04-06 | Cordis Corporation | Drug delivery stent |
| US5649977A (en) | 1994-09-22 | 1997-07-22 | Advanced Cardiovascular Systems, Inc. | Metal reinforced polymer stent |
| EP0715480B1 (en) * | 1994-11-29 | 2005-09-14 | Nec Corporation | Mobile telephone device having steal prevention function |
| US5637113A (en) | 1994-12-13 | 1997-06-10 | Advanced Cardiovascular Systems, Inc. | Polymer film for wrapping a stent structure |
| US6099562A (en) * | 1996-06-13 | 2000-08-08 | Schneider (Usa) Inc. | Drug coating with topcoat |
| CA2178541C (en) | 1995-06-07 | 2009-11-24 | Neal E. Fearnot | Implantable medical device |
| US6774278B1 (en) * | 1995-06-07 | 2004-08-10 | Cook Incorporated | Coated implantable medical device |
| US5609629A (en) | 1995-06-07 | 1997-03-11 | Med Institute, Inc. | Coated implantable medical device |
| US5879808A (en) | 1995-10-27 | 1999-03-09 | Alpha Metals, Inc. | Parylene polymer layers |
| US5735811A (en) | 1995-11-30 | 1998-04-07 | Pharmasonics, Inc. | Apparatus and methods for ultrasonically enhanced fluid delivery |
| US5728062A (en) | 1995-11-30 | 1998-03-17 | Pharmasonics, Inc. | Apparatus and methods for vibratory intraluminal therapy employing magnetostrictive transducers |
| US5725494A (en) | 1995-11-30 | 1998-03-10 | Pharmasonics, Inc. | Apparatus and methods for ultrasonically enhanced intraluminal therapy |
| US5958510A (en) | 1996-01-08 | 1999-09-28 | Applied Materials, Inc. | Method and apparatus for forming a thin polymer layer on an integrated circuit structure |
| US5868780A (en) | 1996-03-22 | 1999-02-09 | Lashinski; Robert D. | Stents for supporting lumens in living tissue |
| US5928145A (en) | 1996-04-25 | 1999-07-27 | The Johns Hopkins University | Method of magnetic resonance imaging and spectroscopic analysis and associated apparatus employing a loopless antenna |
| US5951586A (en) | 1996-05-15 | 1999-09-14 | Medtronic, Inc. | Intraluminal stent |
| US5769884A (en) | 1996-06-27 | 1998-06-23 | Cordis Corporation | Controlled porosity endovascular implant |
| US6099561A (en) | 1996-10-21 | 2000-08-08 | Inflow Dynamics, Inc. | Vascular and endoluminal stents with improved coatings |
| ZA9710342B (en) * | 1996-11-25 | 1998-06-10 | Alza Corp | Directional drug delivery stent and method of use. |
| US5980551A (en) | 1997-02-07 | 1999-11-09 | Endovasc Ltd., Inc. | Composition and method for making a biodegradable drug delivery stent |
| AU737252B2 (en) * | 1997-02-20 | 2001-08-16 | Cook Medical Technologies Llc | Coated implantable medical device |
| US6051276A (en) | 1997-03-14 | 2000-04-18 | Alpha Metals, Inc. | Internally heated pyrolysis zone |
| US5843172A (en) | 1997-04-15 | 1998-12-01 | Advanced Cardiovascular Systems, Inc. | Porous medicated stent |
| US6240616B1 (en) * | 1997-04-15 | 2001-06-05 | Advanced Cardiovascular Systems, Inc. | Method of manufacturing a medicated porous metal prosthesis |
| US6273913B1 (en) | 1997-04-18 | 2001-08-14 | Cordis Corporation | Modified stent useful for delivery of drugs along stent strut |
| US5972027A (en) | 1997-09-30 | 1999-10-26 | Scimed Life Systems, Inc | Porous stent drug delivery system |
| US6273908B1 (en) | 1997-10-24 | 2001-08-14 | Robert Ndondo-Lay | Stents |
| US6031375A (en) | 1997-11-26 | 2000-02-29 | The Johns Hopkins University | Method of magnetic resonance analysis employing cylindrical coordinates and an associated apparatus |
| US5980566A (en) | 1998-04-11 | 1999-11-09 | Alt; Eckhard | Vascular and endoluminal stents with iridium oxide coating |
| US20010029351A1 (en) | 1998-04-16 | 2001-10-11 | Robert Falotico | Drug combinations and delivery devices for the prevention and treatment of vascular disease |
| US6086952A (en) | 1998-06-15 | 2000-07-11 | Applied Materials, Inc. | Chemical vapor deposition of a copolymer of p-xylylene and a multivinyl silicon/oxygen comonomer |
| US6153252A (en) | 1998-06-30 | 2000-11-28 | Ethicon, Inc. | Process for coating stents |
| JP4898991B2 (ja) | 1998-08-20 | 2012-03-21 | クック メディカル テクノロジーズ エルエルシー | 被覆付植込式医療装置 |
| US6063101A (en) | 1998-11-20 | 2000-05-16 | Precision Vascular Systems, Inc. | Stent apparatus and method |
| JP5140220B2 (ja) | 1999-05-27 | 2013-02-06 | バイオコンパテイブルズ・ユーケイ・リミテツド | 局所的な薬剤送達 |
| US6107052A (en) | 1999-06-09 | 2000-08-22 | Roche Diagnostics Corporation | Enzymatic measurement of mycophenolic acid |
| US6443211B1 (en) * | 1999-08-31 | 2002-09-03 | Cummins Inc. | Mettallurgical bonding of inserts having multi-layered coatings within metal castings |
| US6287628B1 (en) | 1999-09-03 | 2001-09-11 | Advanced Cardiovascular Systems, Inc. | Porous prosthesis and a method of depositing substances into the pores |
| US6613082B2 (en) * | 2000-03-13 | 2003-09-02 | Jun Yang | Stent having cover with drug delivery capability |
| US6379382B1 (en) * | 2000-03-13 | 2002-04-30 | Jun Yang | Stent having cover with drug delivery capability |
| US20020007213A1 (en) | 2000-05-19 | 2002-01-17 | Robert Falotico | Drug/drug delivery systems for the prevention and treatment of vascular disease |
| US20020007214A1 (en) | 2000-05-19 | 2002-01-17 | Robert Falotico | Drug/drug delivery systems for the prevention and treatment of vascular disease |
| US20020005206A1 (en) | 2000-05-19 | 2002-01-17 | Robert Falotico | Antiproliferative drug and delivery device |
| US6776796B2 (en) | 2000-05-12 | 2004-08-17 | Cordis Corportation | Antiinflammatory drug and delivery device |
| US20020007215A1 (en) | 2000-05-19 | 2002-01-17 | Robert Falotico | Drug/drug delivery systems for the prevention and treatment of vascular disease |
| US6395326B1 (en) | 2000-05-31 | 2002-05-28 | Advanced Cardiovascular Systems, Inc. | Apparatus and method for depositing a coating onto a surface of a prosthesis |
| US7018405B2 (en) | 2000-12-22 | 2006-03-28 | Avantec Vascular Corporation | Intravascular delivery of methylprednisolone |
| US20020082678A1 (en) | 2000-12-22 | 2002-06-27 | Motasim Sirhan | Intravascular delivery of mizoribine |
| US6471980B2 (en) * | 2000-12-22 | 2002-10-29 | Avantec Vascular Corporation | Intravascular delivery of mycophenolic acid |
| US6663662B2 (en) * | 2000-12-28 | 2003-12-16 | Advanced Cardiovascular Systems, Inc. | Diffusion barrier layer for implantable devices |
| JP2003100968A (ja) * | 2001-09-21 | 2003-04-04 | Toyota Industries Corp | 放熱材及びその製造方法 |
| EP1465624A1 (en) * | 2002-01-10 | 2004-10-13 | Novartis AG | Drug delivery systems for the prevention and treatment of vascular diseases comprising rapamycin and derivatives thereof |
-
2001
- 2001-12-14 US US10/017,500 patent/US7077859B2/en not_active Expired - Fee Related
-
2002
- 2002-10-25 WO PCT/US2002/034350 patent/WO2003037223A1/en active Application Filing
- 2002-10-25 EP EP02780532A patent/EP1448116A4/en not_active Withdrawn
- 2002-10-25 JP JP2003539571A patent/JP2005507708A/ja active Pending
-
2004
- 2004-12-09 US US11/009,461 patent/US20050107869A1/en not_active Abandoned
- 2004-12-10 US US11/009,657 patent/US20050131532A1/en not_active Abandoned
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008522747A (ja) * | 2004-12-08 | 2008-07-03 | クック・インコーポレイテッド | 造影剤でコーティングされた医療機器 |
| JP2014176740A (ja) * | 2005-04-05 | 2014-09-25 | Elixir Medical Corp | 分解性の移植可能な医療装置 |
| JP2010503483A (ja) * | 2006-09-18 | 2010-02-04 | ボストン サイエンティフィック リミテッド | 医療装置 |
| JP2012501219A (ja) * | 2008-08-27 | 2012-01-19 | ボストン サイエンティフィック サイムド,インコーポレイテッド | 治療薬送達のための無機コーティングを有する医療用デバイス |
| US10933246B2 (en) | 2015-06-18 | 2021-03-02 | Cardiac Pacemakers, Inc. | Infection fighting bioresorbable polymer device for medical implants |
| JP2018526050A (ja) * | 2015-07-11 | 2018-09-13 | カーディアック ペースメイカーズ, インコーポレイテッド | 抗菌性材料によるポリマーコーティングおよび製造方法 |
| JP2019502520A (ja) * | 2016-01-04 | 2019-01-31 | ジュロックス ピーティーワイ リミテッドJurox Pty Ltd | 薬剤放出デバイス及び使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20050131532A1 (en) | 2005-06-16 |
| US20030083646A1 (en) | 2003-05-01 |
| US20050107869A1 (en) | 2005-05-19 |
| WO2003037223A1 (en) | 2003-05-08 |
| EP1448116A4 (en) | 2005-04-27 |
| EP1448116A1 (en) | 2004-08-25 |
| US7077859B2 (en) | 2006-07-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7077859B2 (en) | Apparatus and methods for variably controlled substance delivery from implanted prostheses | |
| US6939375B2 (en) | Apparatus and methods for controlled substance delivery from implanted prostheses | |
| US9770349B2 (en) | Nanoporous stents with enhanced cellular adhesion and reduced neointimal formation | |
| US6589546B2 (en) | Polymeric coatings for controlled delivery of active agents | |
| US8449602B2 (en) | Methods for using a stent having nanoporous layers | |
| JP2006500996A (ja) | 溶出性生体適合性移植可能医療器具を介してマイトマイシンを送達するための装置および方法 | |
| JP2008509742A (ja) | ナノ多孔質層を備える医療用デバイスおよびそれを作製するための方法 | |
| JP5602432B2 (ja) | 経皮的冠動脈インターベンション用の多剤溶出冠動脈ステント | |
| US7018405B2 (en) | Intravascular delivery of methylprednisolone | |
| WO2007143433A1 (en) | Nanoporous stents with enhanced cellular adhesion and reduced neointimal formation | |
| US20070142898A1 (en) | Intravascular delivery of mizoribine | |
| CN101631514A (zh) | 用于经皮冠状动脉介入的多药物洗脱冠状动脉支架 | |
| JP5102029B2 (ja) | 金属性医薬品放出医療用デバイスおよびその作成方法 | |
| US8114153B2 (en) | Endoprostheses | |
| JP2005046611A (ja) | 薬剤含有ポリマーが塗布されたステント用のエネルギーで活性化された接着剤層 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050928 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050928 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080616 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20080815 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080905 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20081009 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20081020 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20081020 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081209 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090508 |