JP2005298632A - 試薬の安定性を改善する方法 - Google Patents
試薬の安定性を改善する方法 Download PDFInfo
- Publication number
- JP2005298632A JP2005298632A JP2004115338A JP2004115338A JP2005298632A JP 2005298632 A JP2005298632 A JP 2005298632A JP 2004115338 A JP2004115338 A JP 2004115338A JP 2004115338 A JP2004115338 A JP 2004115338A JP 2005298632 A JP2005298632 A JP 2005298632A
- Authority
- JP
- Japan
- Prior art keywords
- dye
- glycated
- buffer
- composition
- reagent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 238000000034 method Methods 0.000 title claims abstract description 43
- 239000003153 chemical reaction reagent Substances 0.000 title abstract description 40
- 239000000203 mixture Substances 0.000 claims abstract description 57
- 239000000872 buffer Substances 0.000 claims abstract description 49
- RLFWWDJHLFCNIJ-UHFFFAOYSA-N 4-aminoantipyrine Chemical group CN1C(C)=C(N)C(=O)N1C1=CC=CC=C1 RLFWWDJHLFCNIJ-UHFFFAOYSA-N 0.000 claims description 48
- 108091005996 glycated proteins Proteins 0.000 claims description 43
- 102000004190 Enzymes Human genes 0.000 claims description 37
- 108090000790 Enzymes Proteins 0.000 claims description 37
- DUHQIGLHYXLKAE-UHFFFAOYSA-N 3,3-dimethylglutaric acid Chemical group OC(=O)CC(C)(C)CC(O)=O DUHQIGLHYXLKAE-UHFFFAOYSA-N 0.000 claims description 13
- 239000006172 buffering agent Substances 0.000 claims description 10
- 239000007788 liquid Substances 0.000 claims description 10
- 238000005259 measurement Methods 0.000 abstract description 19
- 230000006641 stabilisation Effects 0.000 abstract description 14
- 238000011105 stabilization Methods 0.000 abstract description 14
- 239000000049 pigment Substances 0.000 abstract description 13
- 108090000623 proteins and genes Proteins 0.000 abstract description 9
- 102000004169 proteins and genes Human genes 0.000 abstract description 8
- 230000006866 deterioration Effects 0.000 abstract description 6
- 239000000975 dye Substances 0.000 description 71
- 108091005804 Peptidases Proteins 0.000 description 26
- 239000004365 Protease Substances 0.000 description 26
- 150000001413 amino acids Chemical class 0.000 description 25
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 17
- 230000035945 sensitivity Effects 0.000 description 16
- 239000000126 substance Substances 0.000 description 15
- 239000012263 liquid product Substances 0.000 description 14
- 102000017011 Glycated Hemoglobin A Human genes 0.000 description 13
- 108091005995 glycated hemoglobin Proteins 0.000 description 12
- 230000000694 effects Effects 0.000 description 11
- 108010004903 glycosylated serum albumin Proteins 0.000 description 11
- -1 tetrazolium compound Chemical class 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- 102000035195 Peptidases Human genes 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 239000012085 test solution Substances 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 7
- 238000002835 absorbance Methods 0.000 description 7
- 230000002797 proteolythic effect Effects 0.000 description 7
- 102000001554 Hemoglobins Human genes 0.000 description 6
- 108010054147 Hemoglobins Proteins 0.000 description 6
- DBXNUXBLKRLWFA-UHFFFAOYSA-N N-(2-acetamido)-2-aminoethanesulfonic acid Chemical compound NC(=O)CNCCS(O)(=O)=O DBXNUXBLKRLWFA-UHFFFAOYSA-N 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 239000003381 stabilizer Substances 0.000 description 6
- 230000000087 stabilizing effect Effects 0.000 description 6
- SEQKRHFRPICQDD-UHFFFAOYSA-N N-tris(hydroxymethyl)methylglycine Chemical compound OCC(CO)(CO)[NH2+]CC([O-])=O SEQKRHFRPICQDD-UHFFFAOYSA-N 0.000 description 5
- 102000003992 Peroxidases Human genes 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- FTOAOBMCPZCFFF-UHFFFAOYSA-N 5,5-diethylbarbituric acid Chemical compound CCC1(CC)C(=O)NC(=O)NC1=O FTOAOBMCPZCFFF-UHFFFAOYSA-N 0.000 description 4
- 239000007991 ACES buffer Substances 0.000 description 4
- 108010088751 Albumins Proteins 0.000 description 4
- 102000009027 Albumins Human genes 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- 241000193830 Bacillus <bacterium> Species 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 239000007997 Tricine buffer Substances 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 239000000306 component Substances 0.000 description 4
- OGGXGZAMXPVRFZ-UHFFFAOYSA-N dimethylarsinic acid Chemical compound C[As](C)(O)=O OGGXGZAMXPVRFZ-UHFFFAOYSA-N 0.000 description 4
- 239000000852 hydrogen donor Substances 0.000 description 4
- 108040007629 peroxidase activity proteins Proteins 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- SXGZJKUKBWWHRA-UHFFFAOYSA-N 2-(N-morpholiniumyl)ethanesulfonate Chemical compound [O-]S(=O)(=O)CC[NH+]1CCOCC1 SXGZJKUKBWWHRA-UHFFFAOYSA-N 0.000 description 3
- DVLFYONBTKHTER-UHFFFAOYSA-N 3-(N-morpholino)propanesulfonic acid Chemical compound OS(=O)(=O)CCCN1CCOCC1 DVLFYONBTKHTER-UHFFFAOYSA-N 0.000 description 3
- ZTQGWROHRVYSPW-UHFFFAOYSA-N 3-(n-ethyl-3-methylanilino)-2-hydroxypropane-1-sulfonic acid Chemical compound OS(=O)(=O)CC(O)CN(CC)C1=CC=CC(C)=C1 ZTQGWROHRVYSPW-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 241000228212 Aspergillus Species 0.000 description 3
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 3
- OWXMKDGYPWMGEB-UHFFFAOYSA-N HEPPS Chemical compound OCCN1CCN(CCCS(O)(=O)=O)CC1 OWXMKDGYPWMGEB-UHFFFAOYSA-N 0.000 description 3
- GIZQLVPDAOBAFN-UHFFFAOYSA-N HEPPSO Chemical compound OCCN1CCN(CC(O)CS(O)(=O)=O)CC1 GIZQLVPDAOBAFN-UHFFFAOYSA-N 0.000 description 3
- FSVCELGFZIQNCK-UHFFFAOYSA-N N,N-bis(2-hydroxyethyl)glycine Chemical compound OCCN(CCO)CC(O)=O FSVCELGFZIQNCK-UHFFFAOYSA-N 0.000 description 3
- MKWKNSIESPFAQN-UHFFFAOYSA-N N-cyclohexyl-2-aminoethanesulfonic acid Chemical compound OS(=O)(=O)CCNC1CCCCC1 MKWKNSIESPFAQN-UHFFFAOYSA-N 0.000 description 3
- 241000187747 Streptomyces Species 0.000 description 3
- 239000002253 acid Substances 0.000 description 3
- OWMVSZAMULFTJU-UHFFFAOYSA-N bis-tris Chemical compound OCCN(CCO)C(CO)(CO)CO OWMVSZAMULFTJU-UHFFFAOYSA-N 0.000 description 3
- 239000005515 coenzyme Substances 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 238000006911 enzymatic reaction Methods 0.000 description 3
- IXZISFNWUWKBOM-ARQDHWQXSA-N fructosamine Chemical compound NC[C@@]1(O)OC[C@@H](O)[C@@H](O)[C@@H]1O IXZISFNWUWKBOM-ARQDHWQXSA-N 0.000 description 3
- 238000000691 measurement method Methods 0.000 description 3
- 244000005700 microbiome Species 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- HDARHUHTZKLJET-UHFFFAOYSA-M sodium;3-(n-ethyl-3,5-dimethoxyanilino)-2-hydroxypropane-1-sulfonate Chemical compound [Na+].[O-]S(=O)(=O)CC(O)CN(CC)C1=CC(OC)=CC(OC)=C1 HDARHUHTZKLJET-UHFFFAOYSA-M 0.000 description 3
- IRQRBVOQGUPTLG-UHFFFAOYSA-M sodium;3-(n-ethyl-3-methylanilino)-2-hydroxypropane-1-sulfonate Chemical compound [Na+].[O-]S(=O)(=O)CC(O)CN(CC)C1=CC=CC(C)=C1 IRQRBVOQGUPTLG-UHFFFAOYSA-M 0.000 description 3
- 239000000600 sorbitol Substances 0.000 description 3
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 3
- PHOLIFLKGONSGY-CSKARUKUSA-N (e)-(3-methyl-1,3-benzothiazol-2-ylidene)hydrazine Chemical compound C1=CC=C2S\C(=N\N)N(C)C2=C1 PHOLIFLKGONSGY-CSKARUKUSA-N 0.000 description 2
- QZTKDVCDBIDYMD-UHFFFAOYSA-N 2,2'-[(2-amino-2-oxoethyl)imino]diacetic acid Chemical compound NC(=O)CN(CC(O)=O)CC(O)=O QZTKDVCDBIDYMD-UHFFFAOYSA-N 0.000 description 2
- DIZBQMTZXOUFTD-UHFFFAOYSA-N 2-(furan-2-yl)-3h-benzimidazole-5-carboxylic acid Chemical compound N1C2=CC(C(=O)O)=CC=C2N=C1C1=CC=CO1 DIZBQMTZXOUFTD-UHFFFAOYSA-N 0.000 description 2
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 2
- UXFQFBNBSPQBJW-UHFFFAOYSA-N 2-amino-2-methylpropane-1,3-diol Chemical compound OCC(N)(C)CO UXFQFBNBSPQBJW-UHFFFAOYSA-N 0.000 description 2
- LVQFQZZGTZFUNF-UHFFFAOYSA-N 2-hydroxy-3-[4-(2-hydroxy-3-sulfonatopropyl)piperazine-1,4-diium-1-yl]propane-1-sulfonate Chemical compound OS(=O)(=O)CC(O)CN1CCN(CC(O)CS(O)(=O)=O)CC1 LVQFQZZGTZFUNF-UHFFFAOYSA-N 0.000 description 2
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 2
- NUFBIAUZAMHTSP-UHFFFAOYSA-N 3-(n-morpholino)-2-hydroxypropanesulfonic acid Chemical compound OS(=O)(=O)CC(O)CN1CCOCC1 NUFBIAUZAMHTSP-UHFFFAOYSA-N 0.000 description 2
- RZQXOGQSPBYUKH-UHFFFAOYSA-N 3-[[1,3-dihydroxy-2-(hydroxymethyl)propan-2-yl]azaniumyl]-2-hydroxypropane-1-sulfonate Chemical compound OCC(CO)(CO)NCC(O)CS(O)(=O)=O RZQXOGQSPBYUKH-UHFFFAOYSA-N 0.000 description 2
- XCBLFURAFHFFJF-UHFFFAOYSA-N 3-[bis(2-hydroxyethyl)azaniumyl]-2-hydroxypropane-1-sulfonate Chemical compound OCCN(CCO)CC(O)CS(O)(=O)=O XCBLFURAFHFFJF-UHFFFAOYSA-N 0.000 description 2
- DBOOMZAMPJBDOE-UHFFFAOYSA-N 4-[2-(2,4-dinitrophenyl)-3-(4-iodophenyl)-1h-tetrazol-5-yl]benzene-1,3-disulfonic acid Chemical compound OS(=O)(=O)C1=CC(S(=O)(=O)O)=CC=C1C1=NN(C=2C=CC(I)=CC=2)N(C=2C(=CC(=CC=2)[N+]([O-])=O)[N+]([O-])=O)N1 DBOOMZAMPJBDOE-UHFFFAOYSA-N 0.000 description 2
- 108700016232 Arg(2)-Sar(4)- dermorphin (1-4) Proteins 0.000 description 2
- 108010024957 Ascorbate Oxidase Proteins 0.000 description 2
- PJWWRFATQTVXHA-UHFFFAOYSA-N Cyclohexylaminopropanesulfonic acid Chemical compound OS(=O)(=O)CCCNC1CCCCC1 PJWWRFATQTVXHA-UHFFFAOYSA-N 0.000 description 2
- 241000223218 Fusarium Species 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 239000007995 HEPES buffer Substances 0.000 description 2
- 102000004316 Oxidoreductases Human genes 0.000 description 2
- 108090000854 Oxidoreductases Proteins 0.000 description 2
- 241000228143 Penicillium Species 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- UZMAPBJVXOGOFT-UHFFFAOYSA-N Syringetin Natural products COC1=C(O)C(OC)=CC(C2=C(C(=O)C3=C(O)C=C(O)C=C3O2)O)=C1 UZMAPBJVXOGOFT-UHFFFAOYSA-N 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 229960002319 barbital Drugs 0.000 description 2
- 239000007998 bicine buffer Substances 0.000 description 2
- 239000012496 blank sample Substances 0.000 description 2
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 2
- 239000004327 boric acid Substances 0.000 description 2
- 229950004243 cacodylic acid Drugs 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 2
- KCFYHBSOLOXZIF-UHFFFAOYSA-N dihydrochrysin Natural products COC1=C(O)C(OC)=CC(C2OC3=CC(O)=CC(O)=C3C(=O)C2)=C1 KCFYHBSOLOXZIF-UHFFFAOYSA-N 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 230000009982 effect on human Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 230000036252 glycation Effects 0.000 description 2
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 125000003831 tetrazolyl group Chemical group 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- JEQHVKBNRPNQDY-UTINFBMNSA-N (2s)-3-methyl-2-[[(3s,4r,5r)-3,4,5,6-tetrahydroxy-2-oxohexyl]amino]butanoic acid Chemical compound CC(C)[C@@H](C(O)=O)NCC(=O)[C@@H](O)[C@H](O)[C@H](O)CO JEQHVKBNRPNQDY-UTINFBMNSA-N 0.000 description 1
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 1
- FJHSYRJUYUOHNA-UHFFFAOYSA-N 2-[[5,5-bis(dimethylamino)-2-phenylcyclohexa-1,3-dien-1-yl]carbamoylamino]acetic acid Chemical compound C1=CC(N(C)C)(N(C)C)CC(NC(=O)NCC(O)=O)=C1C1=CC=CC=C1 FJHSYRJUYUOHNA-UHFFFAOYSA-N 0.000 description 1
- AJTVSSFTXWNIRG-UHFFFAOYSA-N 2-[bis(2-hydroxyethyl)amino]ethanesulfonic acid Chemical compound OCC[NH+](CCO)CCS([O-])(=O)=O AJTVSSFTXWNIRG-UHFFFAOYSA-N 0.000 description 1
- BGFTWECWAICPDG-UHFFFAOYSA-N 2-[bis(4-chlorophenyl)methyl]-4-n-[3-[bis(4-chlorophenyl)methyl]-4-(dimethylamino)phenyl]-1-n,1-n-dimethylbenzene-1,4-diamine Chemical compound C1=C(C(C=2C=CC(Cl)=CC=2)C=2C=CC(Cl)=CC=2)C(N(C)C)=CC=C1NC(C=1)=CC=C(N(C)C)C=1C(C=1C=CC(Cl)=CC=1)C1=CC=C(Cl)C=C1 BGFTWECWAICPDG-UHFFFAOYSA-N 0.000 description 1
- DOHFRZUBXPXYLG-UHFFFAOYSA-N 2-[bis[4-(diethylamino)phenyl]methyl]benzenesulfonic acid Chemical compound C1=CC(N(CC)CC)=CC=C1C(C=1C(=CC=CC=1)S(O)(=O)=O)C1=CC=C(N(CC)CC)C=C1 DOHFRZUBXPXYLG-UHFFFAOYSA-N 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- HSXUNHYXJWDLDK-UHFFFAOYSA-N 2-hydroxypropane-1-sulfonic acid Chemical compound CC(O)CS(O)(=O)=O HSXUNHYXJWDLDK-UHFFFAOYSA-N 0.000 description 1
- HSTOKWSFWGCZMH-UHFFFAOYSA-N 3,3'-diaminobenzidine Chemical compound C1=C(N)C(N)=CC=C1C1=CC=C(N)C(N)=C1 HSTOKWSFWGCZMH-UHFFFAOYSA-N 0.000 description 1
- UVKSMKOQDVSNBN-UHFFFAOYSA-N 3-(3,5-dimethoxyanilino)-2-hydroxypropane-1-sulfonic acid;sodium Chemical compound [Na].COC1=CC(NCC(O)CS(O)(=O)=O)=CC(OC)=C1 UVKSMKOQDVSNBN-UHFFFAOYSA-N 0.000 description 1
- INEWUCPYEUEQTN-UHFFFAOYSA-N 3-(cyclohexylamino)-2-hydroxy-1-propanesulfonic acid Chemical compound OS(=O)(=O)CC(O)CNC1CCCCC1 INEWUCPYEUEQTN-UHFFFAOYSA-N 0.000 description 1
- YVJOXDNYWSKTEH-UHFFFAOYSA-N 3-(n-ethyl-3,5-dimethoxyanilino)propane-1-sulfonic acid;sodium Chemical compound [Na].OS(=O)(=O)CCCN(CC)C1=CC(OC)=CC(OC)=C1 YVJOXDNYWSKTEH-UHFFFAOYSA-N 0.000 description 1
- SYLPAUVHGVHMLB-UHFFFAOYSA-N 3-(n-ethyl-3-methoxyanilino)-2-hydroxypropane-1-sulfonic acid;sodium Chemical compound [Na].OS(=O)(=O)CC(O)CN(CC)C1=CC=CC(OC)=C1 SYLPAUVHGVHMLB-UHFFFAOYSA-N 0.000 description 1
- MTNXOASMPXNWDT-UHFFFAOYSA-N 3-(n-ethylanilino)propane-1-sulfonic acid;sodium Chemical compound [Na].OS(=O)(=O)CCCN(CC)C1=CC=CC=C1 MTNXOASMPXNWDT-UHFFFAOYSA-N 0.000 description 1
- GZNAFYJQMXPVSY-UHFFFAOYSA-N 3-[4-(4-amino-3,5-dimethylphenyl)-2,6-dimethylanilino]propane-1-sulfonic acid Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(NCCCS(O)(=O)=O)=C(C)C=2)=C1 GZNAFYJQMXPVSY-UHFFFAOYSA-N 0.000 description 1
- OJMHBBPQGMQVRY-UHFFFAOYSA-N 3-anilinopropane-1-sulfonic acid;sodium Chemical compound [Na].OS(=O)(=O)CCCNC1=CC=CC=C1 OJMHBBPQGMQVRY-UHFFFAOYSA-N 0.000 description 1
- DVYSLVUKWUHBQL-UHFFFAOYSA-N 4-[2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-1h-tetrazol-5-yl]benzene-1,3-disulfonic acid Chemical compound COC1=CC([N+]([O-])=O)=CC=C1N1N(C=2C=CC(=CC=2)[N+]([O-])=O)N=C(C=2C(=CC(=CC=2)S(O)(=O)=O)S(O)(=O)=O)N1 DVYSLVUKWUHBQL-UHFFFAOYSA-N 0.000 description 1
- PAJSIAXXSFQVPJ-UHFFFAOYSA-N 4-[2-(4-iodophenyl)-3-(4-nitrophenyl)-1h-tetrazol-5-yl]benzene-1,3-disulfonic acid Chemical compound OS(=O)(=O)C1=CC(S(=O)(=O)O)=CC=C1C1=NN(C=2C=CC(=CC=2)[N+]([O-])=O)N(C=2C=CC(I)=CC=2)N1 PAJSIAXXSFQVPJ-UHFFFAOYSA-N 0.000 description 1
- CNHVXRAZMXBDIT-UHFFFAOYSA-N 4-[3-methyl-n-(4-sulfobutyl)anilino]butane-1-sulfonic acid Chemical compound CC1=CC=CC(N(CCCCS(O)(=O)=O)CCCCS(O)(=O)=O)=C1 CNHVXRAZMXBDIT-UHFFFAOYSA-N 0.000 description 1
- NHQAUSOKYWFWHO-UHFFFAOYSA-N 4-aminobutane-2-sulfonic acid Chemical compound OS(=O)(=O)C(C)CCN NHQAUSOKYWFWHO-UHFFFAOYSA-N 0.000 description 1
- 125000004203 4-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- UHPMCKVQTMMPCG-UHFFFAOYSA-N 5,8-dihydroxy-2-methoxy-6-methyl-7-(2-oxopropyl)naphthalene-1,4-dione Chemical compound CC1=C(CC(C)=O)C(O)=C2C(=O)C(OC)=CC(=O)C2=C1O UHPMCKVQTMMPCG-UHFFFAOYSA-N 0.000 description 1
- 241000590020 Achromobacter Species 0.000 description 1
- 241001019659 Acremonium <Plectosphaerellaceae> Species 0.000 description 1
- 238000008941 Albumin Reagent Methods 0.000 description 1
- 108060006004 Ascorbate peroxidase Proteins 0.000 description 1
- 208000000659 Autoimmune lymphoproliferative syndrome Diseases 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 102100031974 CMP-N-acetylneuraminate-beta-galactosamide-alpha-2,3-sialyltransferase 4 Human genes 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 241000193403 Clostridium Species 0.000 description 1
- 241000186216 Corynebacterium Species 0.000 description 1
- 241000235035 Debaryomyces Species 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 108010014663 Glycated Hemoglobin A Proteins 0.000 description 1
- 241001191009 Gymnomyza Species 0.000 description 1
- 101000703754 Homo sapiens CMP-N-acetylneuraminate-beta-galactosamide-alpha-2,3-sialyltransferase 4 Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 241000863031 Lysobacter Species 0.000 description 1
- 229910021380 Manganese Chloride Inorganic materials 0.000 description 1
- GLFNIEUTAYBVOC-UHFFFAOYSA-L Manganese chloride Chemical compound Cl[Mn]Cl GLFNIEUTAYBVOC-UHFFFAOYSA-L 0.000 description 1
- 102000005741 Metalloproteases Human genes 0.000 description 1
- 108010006035 Metalloproteases Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241000235527 Rhizopus Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 241000191940 Staphylococcus Species 0.000 description 1
- 108090000787 Subtilisin Proteins 0.000 description 1
- 241000589596 Thermus Species 0.000 description 1
- 241001495012 Tritirachium <Pucciniomycotina> Species 0.000 description 1
- CAEYKANWBGXIDQ-UHFFFAOYSA-N [Na].S(=O)(=O)(O)CCCNC1=CC(=CC(=C1)OC)OC Chemical compound [Na].S(=O)(=O)(O)CCCNC1=CC(=CC(=C1)OC)OC CAEYKANWBGXIDQ-UHFFFAOYSA-N 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 150000001448 anilines Chemical class 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 208000022379 autosomal dominant Opitz G/BBB syndrome Diseases 0.000 description 1
- OHDRQQURAXLVGJ-HLVWOLMTSA-N azane;(2e)-3-ethyl-2-[(e)-(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S/1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C\1=N/N=C1/SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-HLVWOLMTSA-N 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 239000012503 blood component Substances 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- GVPFVAHMJGGAJG-UHFFFAOYSA-L cobalt dichloride Chemical compound [Cl-].[Cl-].[Co+2] GVPFVAHMJGGAJG-UHFFFAOYSA-L 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 238000001585 disappearance potential spectroscopy Methods 0.000 description 1
- BTWUORFYKAZQHW-UHFFFAOYSA-L disodium;2-hydroxy-3-[4-[4-[(2-hydroxy-3-sulfonatopropyl)amino]-3-methylphenyl]-2-methylanilino]propane-1-sulfonate Chemical compound [Na+].[Na+].C1=C(NCC(O)CS([O-])(=O)=O)C(C)=CC(C=2C=C(C)C(NCC(O)CS([O-])(=O)=O)=CC=2)=C1 BTWUORFYKAZQHW-UHFFFAOYSA-L 0.000 description 1
- DPXDJGUFSPAFJZ-UHFFFAOYSA-L disodium;4-[3-methyl-n-(4-sulfonatobutyl)anilino]butane-1-sulfonate Chemical compound [Na+].[Na+].CC1=CC=CC(N(CCCCS([O-])(=O)=O)CCCCS([O-])(=O)=O)=C1 DPXDJGUFSPAFJZ-UHFFFAOYSA-L 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000003366 endpoint assay Methods 0.000 description 1
- 210000003743 erythrocyte Anatomy 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical compound CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229920006130 high-performance polyamide Polymers 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 229940098895 maleic acid Drugs 0.000 description 1
- 239000011565 manganese chloride Substances 0.000 description 1
- 235000002867 manganese chloride Nutrition 0.000 description 1
- 229940099607 manganese chloride Drugs 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- FSVCQIDHPKZJSO-UHFFFAOYSA-L nitro blue tetrazolium dichloride Chemical compound [Cl-].[Cl-].COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC(=CC=2)[N+]([O-])=O)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=C([N+]([O-])=O)C=C1 FSVCQIDHPKZJSO-UHFFFAOYSA-L 0.000 description 1
- ODUCDPQEXGNKDN-UHFFFAOYSA-N nitroxyl Chemical compound O=N ODUCDPQEXGNKDN-UHFFFAOYSA-N 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 229950000688 phenothiazine Drugs 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000005057 refrigeration Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- SVLRFMQGKVFRTB-UHFFFAOYSA-M sodium;3-(3,5-dimethoxyanilino)-2-hydroxypropane-1-sulfonate Chemical compound [Na+].COC1=CC(NCC(O)CS([O-])(=O)=O)=CC(OC)=C1 SVLRFMQGKVFRTB-UHFFFAOYSA-M 0.000 description 1
- HLXGRHNZZSMNRX-UHFFFAOYSA-M sodium;3-(n-ethyl-3,5-dimethylanilino)-2-hydroxypropane-1-sulfonate Chemical compound [Na+].[O-]S(=O)(=O)CC(O)CN(CC)C1=CC(C)=CC(C)=C1 HLXGRHNZZSMNRX-UHFFFAOYSA-M 0.000 description 1
- CJUDSKIRZCSXJA-UHFFFAOYSA-M sodium;3-(n-ethyl-3-methoxyanilino)-2-hydroxypropane-1-sulfonate Chemical compound [Na+].[O-]S(=O)(=O)CC(O)CN(CC)C1=CC=CC(OC)=C1 CJUDSKIRZCSXJA-UHFFFAOYSA-M 0.000 description 1
- MWFOPMKUGZLPQA-UHFFFAOYSA-M sodium;3-(n-ethyl-3-methoxyanilino)propane-1-sulfonate Chemical compound [Na+].[O-]S(=O)(=O)CCCN(CC)C1=CC=CC(OC)=C1 MWFOPMKUGZLPQA-UHFFFAOYSA-M 0.000 description 1
- JUJBNYBVVQSIOU-UHFFFAOYSA-M sodium;4-[2-(4-iodophenyl)-3-(4-nitrophenyl)tetrazol-2-ium-5-yl]benzene-1,3-disulfonate Chemical compound [Na+].C1=CC([N+](=O)[O-])=CC=C1N1[N+](C=2C=CC(I)=CC=2)=NC(C=2C(=CC(=CC=2)S([O-])(=O)=O)S([O-])(=O)=O)=N1 JUJBNYBVVQSIOU-UHFFFAOYSA-M 0.000 description 1
- 239000010421 standard material Substances 0.000 description 1
- MUUHXGOJWVMBDY-UHFFFAOYSA-L tetrazolium blue Chemical compound [Cl-].[Cl-].COC1=CC(C=2C=C(OC)C(=CC=2)[N+]=2N(N=C(N=2)C=2C=CC=CC=2)C=2C=CC=CC=2)=CC=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 MUUHXGOJWVMBDY-UHFFFAOYSA-L 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 150000004992 toluidines Chemical class 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
Images
Landscapes
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
【解決手段】 色素のモル数を1とした場合に、緩衝剤のモル数を50以上とするにより色素の劣化を防止する。
【効果】 色素のモル数を1とした場合に、緩衝剤のモル数を50以上とすることによる試薬の色素の安定化方法、組成物及び糖化タンパク質測定方法及び測定用組成物を提供することが可能になり、特に臨床検査に有用な色素の安定化方法及び組成物、あるいは糖化タンパク質測定方法及び定量組成物を提供する事が可能になる。
【選択図】 選択図なし
Description
精度が高く、簡便かつ安価な糖化タンパク質の定量法としては酵素法(特許文献1〜6、非特許文献1)が挙げられる。但し糖化タンパク質測定用の液状組成物についての報告は少なく、特許文献7に酵素類、特にプロテアーゼおよび糖化アミノ酸に作用する酵素の安定化について記載があるのみである。
一方、一般に良く使用されている発色系色素、特にトリンダー型の色素は、色素単独の溶液においては安定であるから、これまで糖化タンパク質測定試薬中でこれらの発色色素が不安定になることは知られていなかった。そのため、当然、糖化タンパク質測定試薬中で不安定になった色素の安定化についての報告もなかった。
さらに特許文献8にはヘモグロビンA1cを測定する場合のフルクトシルアミン酸化酵素のフルクトシルバリン特異性を上げる目的で電解質200mM以上と共存させることを特徴とするキットについて記載があり、活性の検出方法としてパーオキシダーゼ〜4アミノアンチピリン系について記述がある。しかし特許文献8は試薬及び色素の安定化に関係なく、特に液体状態での安定性については記載がない。さらにプロテアーゼとの組み合わせについても詳細な記載がない。色素のモル数を1とした場合の、緩衝剤のモル数が50以上であることを特徴とする色素の安定化方法及び組成物についてはこれまで知られていなかった。
そこで安定性に寄与している酵素以外の成分を検討した結果、発色色素、特に4アミノアンチピリンが変性してしまうことにより試薬が劣化してしまうことに原因があることを見出した。4アミノアンチピリンは一般的に液状で安定であるから、糖化タンパク質測定試薬中に含まれる場合など、特殊な環境下において起こる意外な現象であると考えられた。
そこで本発明者は色素の安定化を鋭意検討した結果、通常の安定化剤では安定化作用は小さく、意外なことに緩衝剤の濃度を増やすことにより効果的に色素の安定性が増加することを見出し本発明を成すに至った。また、さらに4アミノアンチピリンの濃度を1.0mM以上にすることでさらに効率的に試薬の安定化が出来ることを見出した。
1)色素と緩衝剤を含有する組成物であって、色素のモル数を1とした場合の、緩衝剤のモル数が50以上であることを特徴とする組成物。
2)さらに酵素を含有することを特徴とする1)に記載の組成物。
3)液状であることを特徴とする1)あるいは2)に記載の組成物。
4)緩衝剤の濃度が100mM以上であることを特徴とする3)の組成物。
5)色素の濃度が1.0mM以上であることを特徴とする3)あるいは4)に記載の組成物。
6)緩衝剤が3,3ジメチルグルタル酸であることを特徴とする1)〜5)いずれかに記載の組成物。
7)色素が4アミノアンチピリンであることを特徴とする1)〜6)いずれかに記載の組成物。
8)酵素、色素および緩衝剤を含有する組成物であって、色素が冷蔵で6ヶ月以上安定であることを特徴とする組成物。
9)色素の安定性を緩衝剤により改善する方法であって、色素のモル数を1とした場合の、緩衝剤のモル数が50以上であることを特徴とする安定性改善方法。
10)酵素の存在下、色素の安定性を緩衝剤により改善する方法であって、色素のモル数を1とした場合の、緩衝剤のモル数が50以上であることを特徴とする安定性改善方法。
11)緩衝剤の濃度が100mM以上であることを特徴とする9)あるいは10)に記載の方法。
12)色素の濃度が1.0mM以上であることを特徴とする9)〜11)いずれかに記載の方法。
13)色素が4アミノアンチピリンである9)〜12)いずれかに記載の方法。
14)緩衝剤が3,3ジメチルグルタル酸である9)〜13)いずれかに記載の方法。
15)1)〜8)いずれかの組成物を用いて糖化タンパク質を測定する方法
本発明に使用しうる色素としては、酵素を用いた糖化タンパク質測定に使用しうる色素であればいかなる物を用いても良いが、例えば還元系の色素、例えば還元型補酵素またはテトラゾリウム化合物等及び酸化系の色素、例えばトリンダー型色素及びロイコ型色素等を用いることが出来、中でもトリンダー型色素及びロイコ型色素が好ましく、さらにはトリンダー型色素がさらに好ましく、トリンダー型色素の中でも、4アミノアンチピリンが最も好ましい。
トリンダー型の色素は水素供与体とカップラーから成る。本願において「色素」といった場合、水素供与体もカップラーもそれぞれ、「色素」の概念に含めるものとする。
カップラーとしては水素供与体と縮合して発色するものであればいかなるものを用いても良いが例えば4アミノアンチピリン若しくは3-メチル-2-ベンゾチアゾリノンヒドラゾン(MBTH)等を用いることが出来る。
テトラゾリウム化合物としてはニトロテトラゾリウムブルー、テトラゾリウムブルー、2-(4-ヨードフェニル)-3-(4-ニトロフェニル)-5-(2,4ジスルフォフェニル)-2H-テトラゾリウム:WST-1、2-(4-ヨードフェニル)-3-(2,4-ジニトロフェニル)-5-(2,4ジスルフォフェニル)-2H-テトラゾリウム:WST-3、2-(2-メトキシ-4-ニトロフェニル)-3-(4-ニトロフェニル)-5-(2,4ジスルフォフェニル)-2H-テトラゾリウム:WSR-8(以上同人化学研究所社製)に代表される各種テトラゾリウム塩を用いることが出来る。
本発明に使用しうる緩衝剤としては、色素が安定になるもの、または酵素及び色素が共存している状態で色素が安定になる緩衝剤であればいかなるものを用いても良い。
緩衝剤の具体的な例としては、例えばグッドの緩衝剤、例えば3-[4-(2-ヒドロキシエチル)-1-ピペラジニル]プロパンスルホン酸(EPPS)、2-[4-(2-ヒドロキシエチル)-1-ピペラジニル]エタンスルホン酸(HEPES)、2-ヒドロキシ-3-[4-(2-ヒドロキシエチル)-1-ピペラジニル]プロパンスルホン酸(HEPPSO)、N-(2-アセトアミド)-2-アミノエタンスルホン酸(ACES)、N-(2-アセトアミド)イミノジ酢酸(ADA)、N,N-ビス(2-ヒドロキシエチル)-2-アミノエタンスルホン酸(BES)、N,N-ビス(2-ヒドロキシエチル)グリシン(Bicine)、ビス(2-ヒドロキシエチル)イミノトリス(ヒドロキシメチル)メタン(Bis-Tris)、N-シクロヘキシル-3-アミノプロパンスルホン酸(CAPS)、N-シクロヘキシル-2-ヒドロキシ-3-アミノプロパンスルホン酸(CAPSO)、N-シクロヘキシル-2-アミノエタンスルホン酸(CHES)、3-[N,N-ビス(2-ヒドロキシエチル)アミノ]-2-ヒドロキシプロパンスルホン酸(DIPSO)、2-モルフィリノエタンスルホン酸(MES)、3-モルフィリノプロパンスルホン酸(MOPS)、2-ヒドロキシ-3-モルフィリノプロパンスルホン酸(MOPSO)、ピペラジン-1,4-ビス(2-エタンスルホン酸(PIPES)、ピペラジン-1,4-ビス(2-ヒドロキシ-3-プロパンスルホン酸)(POPSO)、N-トリス(ヒドロキシメチル)メチル-3-アミノプロパンスルホン酸(TAPS)、2-ハイドロキシ-N-トリス(ヒドロキシメチル)メチル-3-アミノプロパンスルホン酸(TAPSO)、N-トリス(ヒドロキシメチル)メチル-2-アミノプロパンスルホン酸(TES)、N-[トリス(ヒドロキシメチル)メチル]グリシン(Tricine)およびトリスヒドロキシメチルアミノメタン(Tris)、N-(2-アセトアミド)-2-アミノエタンスルホン酸(ACES)、N-(2-アセトアミド)イミノジ酢酸(ADA)等を用いた緩衝剤、またはホウ酸、アンモニア、グリシン、炭酸、酢酸、リン酸、ジエタノールアミン、p-フェノールスルホン酸、2-アミノ-2-メチルプロパン-1,3-ジオール、カコジル酸、クエン酸、マレイン酸、ベロナール及び3,3ジメチルグルタル酸があげられる。
これらの緩衝剤の使用濃度としては、色素が安定になる濃度であればいかなる量を用いても良いが、例えば下限は100mM以上、好ましくは150mM以上であり上限は5.0M以下、好ましくは1.0M以下の濃度で用いればよい。
本発明に使用しうる酵素としては、いかなる酵素を用いても良いが、好ましくは糖化タンパク質の測定に必用な酵素であり、例えばプロテアーゼ、アスコルビン酸オキシダーゼ、糖化アミノ酸に作用する酵素及びパーオキシダーゼ等であり、好ましくはプロテアーゼ、糖化アミノ酸に作用する酵素であり、最も好ましい酵素としてはプロテアーゼである。
本発明に使用しうるプロテアーゼは、被検液に含まれる糖化タンパク質に有効に作用し、かつ当該タンパク質由来の糖化アミノ酸及び/若しくは糖化ペプチドを有効に生成するものであればいかなるものを用いても良いが、例えば動物、植物由来のプロテアーゼ、バチルス(Bacillus)属、アスペルギルス(Aspergillus)、リゾパス(Rhizopus)、ペニシリウム(Penicillium)、ストレプトマイセス(Streptomyces)、スタフィロコッカス(Staphylococcus)、クロストリジウム(Clostridium)、リソバクター(Lysobacter)、グリフォラ(Glifila)、酵母(Yeast)、トリチラチウム(Tritirachium)、サーマス(Thermus)、シュードモナス(Pseudomonus)、アクロモバクター(Achromobacter)等の微生物由来のプロテアーゼ等が挙げられる。バチルス(Bacillus)属の微生物由来のプロテアーゼとしては例えばズブチリシンやメタロプロテアーゼ等がある。
εアミノ基が糖化されたアミノ酸によく作用する糖化アミノ酸に作用する酵素の例としては、ギベレラ(Gibberella)属、アスペルギルス(Aspergillus )属カンジダ(Candida )属、ペニシリウム(Penicillium )属、フサリウム(Fusarium)属、アクレモニウム(Acremonium)属又はデバリオマイゼス(Debaryomyces)属由来の酵素等がある。
αアミノ基が糖化されたアミノ酸によく作用する糖化アミノ酸に作用する酵素の例としては、コリネバクテリウム(Corynebacterium )由来の酵素が挙げられる。
さらに、プロテアーゼと共存させた状態でも充分な活性を有し、かつ安価に製造可能な酵素の例としては、遺伝子組み替え型ケトアミンオキシダーゼ(KAOD;旭化成ファーマ社製;非特許文献1に記載)および加えて糖化バリン反応性を著しく低下させた変異型KAOD(KAOD-V;旭化成ファーマ社製;特許文献2に記載のFOD遺伝子を含有する形質転換微生物JM109・pcmFOD5(FERM BP-7848)が生産するKAOD)が挙げられる。尚糖化アミノ酸に作用する酵素の活性は前記非特許文献1記載の方法で測定した。
本発明の糖化タンパク質の測定方法及び組成物としては本発明の安定性改善方法を用いて糖化タンパク質を測定する方法及び組成物であればいかなる方法及び組成物を用いても良い。さらに、本発明の糖化タンパク質測定用組成物としては、プロテアーゼを含むタンパク質分解試薬と糖化アミノ酸に作用する酵素を含む検出試薬から成る組成物を用いることが出来、どちらかの試薬に色素及び緩衝剤が、色素のモル数を1とした場合の緩衝剤のモル数が50以上になるように含有されているか、若しくはプロテアーゼ、糖化アミノ酸に作用する酵素、色素及び緩衝剤が色素のモル数を1とした場合の緩衝剤のモル数が50以上になるように同時に含まれていれば良い。これらの試薬は液状品及び液状品の凍結物あるいは凍結乾燥品として提供できるが、好ましい剤形は液状品である。液状品としては、例えば色素、緩衝剤を含有する水溶液や、色素、緩衝剤及び酵素を含有する水溶液、等が挙げられる。
例えばプロテアーゼタイプXXIV(シグマ社製)を用いる場合にはpHが7 〜10付近でタンパク質分解活性が強いため、反応のpHは7〜10を選択できる。色素としては4アミノアンチピリンを用いることが出来、使用濃度としては溶液状態で例えば下限濃度0.2mM以上好ましくは0.3mM以上であり、上限濃度1.0M以下、好ましくは0.500mM以下で使用すればよい。また色素を安定化する緩衝液としては3,3ジメチルグルタル酸を使用することが出来、4アミノアンチピリンのモル数を1とした場合の3,3ジメチルグルタル酸の濃度のモル数が50以上となるように使用する。このとき、3,3ジメチルグルタル酸の濃度は、100mM以上の濃度、例えば200mMであることが好ましい。
プロテアーゼの安定化剤としては、公知の安定化剤を用いればよいが、例えばDMSOを安定化剤として添加する場合には、下限濃度は5%以上、好ましくは10%以上であり上限の濃度は50%以下、好ましくは40%以下の濃度で添加すればよい。
本発明に使用しうる糖化アミノ酸定量試薬組成については、使用する糖化アミノ酸に作用する酵素の至適pHを考慮し反応が効率よく進行するようにpHを選択し、次に糖化アミノ酸に作用する酵素量を決定し、最後に糖化アミノ酸に作用する酵素の安定化剤を添加すればよい。
糖化アミノ酸に作用する酵素の安定化剤としては、例えばソルビトールを添加することができ、下限濃度は0.01%以上、好ましくは0.1%以上であり、上限の濃度は30%以下、好ましくは20%以下の濃度で添加すればよい。
さらに本発明に基づく糖化タンパク質を定量する酵素反応組成には、例えば界面活性剤、塩類や防腐剤などを適宜選択して添加しても良い。
界面活性剤としてはポリオキシエチレンアルキルエーテル類、ポリオキシエチレンソルビタン脂肪酸エステル類、ポリビニルアルコール、等の0.01〜10%、好適には0.05〜5%、各種金属塩類、例えば塩化リチウム、塩化ナトリウム、塩化カリウム、塩化マンガン、塩化コバルト、塩化亜鉛、塩化カルシウム等の1mM〜5M、好適には10mM〜1M、各種防腐剤、例えばアジ化ナトリウムの0.01〜10%、好適には0.05〜1%を適宜添加すれば良い。
本発明の測定対象となる被検液は、少なくとも糖化タンパク質を含有する被検液であれば如何なるものを用いても良いが、好ましい被検液としては血液成分、例えば血清、血漿、血球、全血等が挙げられる。また分離された赤血球も、分離の条件によってはグロブリン成分が混入し測定値に影響を与える可能性があることから好ましい被検液として用いることができる。
本発明の糖化タンパク質定量組成物及び方法に於ける測定対象である糖化タンパク質としては、例えば糖化アルブミンまたは糖化ヘモグロビン(ヘモグロビンA1c)が挙げられるが、測定対象となる糖化タンパク質は何らこれらに限定されるものではなく、何れの糖化タンパク質を測定しても良い。
[実施例1]
安定化された糖化アルブミン測定用組成物
R-1 タンパク質分解試薬
150mM 3,3ジメチルグルタル酸(和光純薬社製)
8000U/ml プロテアーゼタイプXXIV(シグマ社製)
2.0mM 4-アミノアンチピリン(和光純薬社製)
20% ジメチルスルホキシド(和光純薬社製)
R-2 糖化アミノ酸検出試薬
150mM トリシン緩衝液(和光純薬社製)pH7.5
3.0mM N-エチル-N-(2-ヒドロキシ-3-スルホプロピル)-m-トルイジン(TOOS、和光純薬社製)
15U/ml KAOD(旭化成ファーマ社製)
20U/ml パーオキシダーゼ(シグマ社製)
5% ソルビトール(和光純薬社製)
安定化された糖化ヘモグロビン測定用組成物
R-1 タンパク質分解試薬
150mM 3,3ジメチルグルタル酸(和光純薬社製)
8000U/ml プロテアーゼタイプXIV(シグマ社製)
2.0mM 4-アミノアンチピリン(和光純薬社製)
2.0mM 2-(4-ヨードフェニル)-3-(2,4-ジニトロフェニル)-5-(2,4ジスルフォフェニル)-2H-テトラゾリウム:WST-3(同仁化学研究所社製)
20% ジメチルスルホキシド(和光純薬社製)
R-2 糖化アミノ酸検出試薬
150mM トリシン緩衝液(和光純薬社製)pH7.5
3.0mM N-エチル-N-(2-ヒドロキシ-3-スルホプロピル)-m-トルイジン(TOOS、和光純薬社製)
15U/ml KAOD(旭化成ファーマ社製)
20U/ml パーオキシダーゼ(シグマ社製)
5% ソルビトール(和光純薬社製)
緩衝剤濃度が試薬の安定性に及ぼす影響
実施例1及び2に記載の糖化タンパク質測定用組成物を冷蔵(約5℃)で1年間保存した。作成直後と冷蔵保存1年後のコントロールの感度を測定した。
<糖化アルブミン測定試薬の反応手順>
37度にインキュベートされたR-1;240μlにコントロール血清(株式会社BML社製)8μlを添加し、37℃で反応を開始し、正確に5分後にR-2;80μlを添加した。R-2添加前及び添加5分後の555nmの吸光度を測定した。また基質溶液の代わりに蒸留水を用いた測定をブランクとし、コントロール基質溶液から得られた吸光度変化からブランク試料の吸光度変化を差し引いた△A0を算出した。
<糖化ヘモグロビン測定試薬の反応手順>
37度にインキュベートされたR-1;240μlにHbA1c測定用実試料標準物質(1次キャリブレーターJDS HbA1c Lot2 福祉・医療技術振興会製)30μlを添加し、37℃で反応を開始し、正確に5分後にR-2;60μlを添加した。R-2添加前及び添加5分後の555nmの吸光度を測定した。また基質溶液の代わりに蒸留水を用いた測定をブランクとし、コントロール基質溶液から得られた吸光度変化からブランク試料の吸光度変化を差し引いた△A0を算出した。
感度変化の測定の結果は、初期の感度を100%とすると、グリコアルブミン試薬、糖化ヘモグロビン測定試薬の感度の残存は冷蔵保存1年後ではそれぞれ85%、77%であった。このことから糖化タンパク質の測定用物組成物が1年間の冷蔵保存で劣化したことが分かる。
さらに、R-1中の劣化の原因を突き止める目的でR-1各成分の添加実験をおこなったところ色素である4アミノアンチピリンの添加の場合のみ感度が回復した。このことからR-1の色素が劣化をしていることが判明した。
緩衝剤濃度が試薬の安定性に及ぼす影響
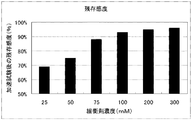
糖化アルブミン測定試薬のR1の緩衝剤3,3ジメチルグルタル酸の濃度を25mM、50mM、75mM、100mM、200mM、300mMに変化させ37℃-1週間試薬を放置し、コントロールの感度を測定した。尚本試薬の37℃-1週間の保存試験は冷蔵保存1年に相当することが知られている。結果を図1に示す。
図1から分かるように100mM以上の緩衝剤を用いることで試薬が飛躍的に安定になることが明白であった。これは試薬中の色素、この場合は4アミノアンチピリンが安定化されていると考えられた。この場合色素には2.0mMの4アミノアンチピリンを用い、緩衝剤濃度は100mM以上が好ましいことから、色素のモル数を1とした場合の、緩衝剤のモル数が50以上であることが好ましいことが明白である。
また色素のモル数を1とした場合の、緩衝剤のモル数が50以上である組成の37℃−1週間の保存後の残存感度が90%以上であり、キャリブレーション後のGA濃度には試験前後で変化なかったことから本安定化方法を用いた組成物は少なくとも冷蔵6ヶ月以上液体状態で、安定であると考えられた。また、本検討と同様の試験を糖化ヘモグロビン組成物に用いたところ同じく色素のモル数を1とした場合の、緩衝剤のモル数が50以上である組成の試薬が飛躍的に安定になった。
4アミノアンチピリン濃度の安定性に及ぼす影響
糖化アルブミン測定試薬の4アミノアチピリン濃度を0.5mM、1.0mM、2.0mM、5.0mMに変化させ37℃-1週間試薬を放置し、コントロールの感度を測定した。結果は残存感度がそれぞれ、80%、93%、94%、95%であり、4アミノアンチピリン濃度1.0mM以上で安定性が高いことが示された。これは試薬劣化の現象が保存時に色素が劣化していくことが原因であることから、最初から4アミノアンチピリンを増量しておけば試薬性能としての劣化が減少するためと考えられた。ただし4アミノアンチピリンを増量だけでは完全に試薬を安定化するには至らなかった。本結果から分かるように色素の安定化を図る場合には色素のモル数を1とした場合の、緩衝剤のモル数が50以上であることに加えて4アミノアンチピリン濃度を1.0mM以上にすると良いことが明白であった。
また、本検討と同様の試験を糖化ヘモグロビン組成物で行ったところ、同じく1.0mM以上の4アミノアンチピリン濃度で安定性がよくなった。
Claims (15)
- 色素と緩衝剤を含有する組成物であって、色素のモル数を1とした場合の、緩衝剤のモル数が50以上であることを特徴とする組成物。
- さらに酵素を含有することを特徴とする請求項1に記載の組成物。
- 液状であることを特徴とする請求項1あるいは2に記載の組成物。
- 緩衝剤の濃度が100mM以上であることを特徴とする請求項3の組成物。
- 色素の濃度が1.0mM以上であることを特徴とする請求項3あるいは4に記載の組成物。
- 緩衝剤が3,3ジメチルグルタル酸であることを特徴とする請求項1〜5いずれかに記載の組成物。
- 色素が4アミノアンチピリンであることを特徴とする請求項1〜6いずれかに記載の組成物。
- 酵素、色素および緩衝剤を含有する組成物であって、色素が冷蔵で6ヶ月以上安定であることを特徴とする組成物。
- 色素の安定性を緩衝剤により改善する方法であって、色素のモル数を1とした場合の、緩衝剤のモル数が50以上とすることを特徴とする安定性改善方法。
- 酵素の存在下、色素の安定性を緩衝剤により改善する方法であって、色素のモル数を1とした場合の、緩衝剤のモル数が50以上とすることを特徴とする安定性改善方法。
- 緩衝剤の濃度が100mM以上であることを特徴とする請求項9あるいは10に記載の方法。
- 色素の濃度が1.0mM以上であることを特徴とする請求項9〜11いずれかに記載の方法。
- 色素が4アミノアンチピリンである請求項9〜12いずれかに記載の方法。
- 緩衝剤が3,3ジメチルグルタル酸である請求項9〜13いずれかに記載の方法。
- 請求項1〜8いずれかの組成物を用いて糖化タンパク質を測定する方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004115338A JP4577873B2 (ja) | 2004-04-09 | 2004-04-09 | 試薬の安定性を改善する方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004115338A JP4577873B2 (ja) | 2004-04-09 | 2004-04-09 | 試薬の安定性を改善する方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005298632A true JP2005298632A (ja) | 2005-10-27 |
| JP4577873B2 JP4577873B2 (ja) | 2010-11-10 |
Family
ID=35330570
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004115338A Expired - Lifetime JP4577873B2 (ja) | 2004-04-09 | 2004-04-09 | 試薬の安定性を改善する方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4577873B2 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018186104A1 (ja) * | 2017-04-04 | 2018-10-11 | オルガノ株式会社 | 尿素の定量方法及び分析装置 |
| JP2021007345A (ja) * | 2019-07-01 | 2021-01-28 | 旭化成ファーマ株式会社 | ジメチルスルホキシドを含む糖化タンパク質測定試薬、糖化タンパク質の測定方法、糖化タンパク質測定試薬の保存方法、及び糖化タンパク質測定試薬の安定化方法 |
Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS63199270A (ja) * | 1986-12-15 | 1988-08-17 | サビオン ダイアグノステイツクス リミテツド | 発色性物質を含有する水性溶液の調整法 |
| JPH02503483A (ja) * | 1988-03-15 | 1990-10-18 | イーストマン コダック カンパニー | 写真要素の安定化方法 |
| JPH07230139A (ja) * | 1994-02-08 | 1995-08-29 | Minnesota Mining & Mfg Co <3M> | 赤外増感色素を含むハロゲン化銀写真エレメント |
| JPH09178755A (ja) * | 1995-10-27 | 1997-07-11 | Kyowa Medex Co Ltd | ビリルビンの定量方法及び定量試薬 |
| JP2643027B2 (ja) * | 1990-11-14 | 1997-08-20 | アクシス リサーチ エイエス | グリカン化血中タンパク質のアッセイ |
| JP2958387B2 (ja) * | 1989-03-10 | 1999-10-06 | バイエルコーポレーション | 酵素試薬組成物及びそれを用いる液体試料中分析対象物の酵素的測定方法 |
| WO2002021142A1 (en) * | 2000-09-07 | 2002-03-14 | Wako Pure Chemical Industries, Ltd. | Method of quantifying total hemoglobin and glycohemoglobin |
| WO2002061119A1 (fr) * | 2001-01-31 | 2002-08-08 | Asahi Kasei Kabushiki Kaisha | Compositions pour analyse de glycoproteines |
| JP2004045395A (ja) * | 2002-05-22 | 2004-02-12 | Sysmex Corp | 免疫測定方法、免疫測定装置、及び免疫測定用試薬 |
| JP2004105157A (ja) * | 2002-09-20 | 2004-04-08 | Pharmafoods Kenkyusho:Kk | 糖類分解酵素阻害飲食組成物 |
| JP2004525644A (ja) * | 2001-04-24 | 2004-08-26 | スリーエム イノベイティブ プロパティズ カンパニー | 生体試料の処理方法および界面活性剤を含む組成物 |
-
2004
- 2004-04-09 JP JP2004115338A patent/JP4577873B2/ja not_active Expired - Lifetime
Patent Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS63199270A (ja) * | 1986-12-15 | 1988-08-17 | サビオン ダイアグノステイツクス リミテツド | 発色性物質を含有する水性溶液の調整法 |
| JPH02503483A (ja) * | 1988-03-15 | 1990-10-18 | イーストマン コダック カンパニー | 写真要素の安定化方法 |
| JP2958387B2 (ja) * | 1989-03-10 | 1999-10-06 | バイエルコーポレーション | 酵素試薬組成物及びそれを用いる液体試料中分析対象物の酵素的測定方法 |
| JP2643027B2 (ja) * | 1990-11-14 | 1997-08-20 | アクシス リサーチ エイエス | グリカン化血中タンパク質のアッセイ |
| JPH07230139A (ja) * | 1994-02-08 | 1995-08-29 | Minnesota Mining & Mfg Co <3M> | 赤外増感色素を含むハロゲン化銀写真エレメント |
| JPH09178755A (ja) * | 1995-10-27 | 1997-07-11 | Kyowa Medex Co Ltd | ビリルビンの定量方法及び定量試薬 |
| WO2002021142A1 (en) * | 2000-09-07 | 2002-03-14 | Wako Pure Chemical Industries, Ltd. | Method of quantifying total hemoglobin and glycohemoglobin |
| WO2002061119A1 (fr) * | 2001-01-31 | 2002-08-08 | Asahi Kasei Kabushiki Kaisha | Compositions pour analyse de glycoproteines |
| JP2004525644A (ja) * | 2001-04-24 | 2004-08-26 | スリーエム イノベイティブ プロパティズ カンパニー | 生体試料の処理方法および界面活性剤を含む組成物 |
| JP2004045395A (ja) * | 2002-05-22 | 2004-02-12 | Sysmex Corp | 免疫測定方法、免疫測定装置、及び免疫測定用試薬 |
| JP2004105157A (ja) * | 2002-09-20 | 2004-04-08 | Pharmafoods Kenkyusho:Kk | 糖類分解酵素阻害飲食組成物 |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018186104A1 (ja) * | 2017-04-04 | 2018-10-11 | オルガノ株式会社 | 尿素の定量方法及び分析装置 |
| JP2018179545A (ja) * | 2017-04-04 | 2018-11-15 | オルガノ株式会社 | 尿素の定量方法及び分析装置 |
| JP2021007345A (ja) * | 2019-07-01 | 2021-01-28 | 旭化成ファーマ株式会社 | ジメチルスルホキシドを含む糖化タンパク質測定試薬、糖化タンパク質の測定方法、糖化タンパク質測定試薬の保存方法、及び糖化タンパク質測定試薬の安定化方法 |
| JP7328808B2 (ja) | 2019-07-01 | 2023-08-17 | 旭化成ファーマ株式会社 | ジメチルスルホキシドを含む糖化タンパク質測定試薬、糖化タンパク質の測定方法、糖化タンパク質測定試薬の保存方法、及び糖化タンパク質測定試薬の安定化方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP4577873B2 (ja) | 2010-11-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101023168B (zh) | 含有蛋白酶反应促进剂和/或色素稳定剂的试剂 | |
| JP5870919B2 (ja) | 糖化ヘモグロビンの測定方法 | |
| CN1625601B (zh) | 利用氧化还原反应的糖化蛋白质的测定方法及测定试剂盒 | |
| US20170058318A1 (en) | Enzymatic determination of hba1c | |
| EP2843045B1 (en) | Method for stabilizing cholesterol oxidase | |
| JP6459268B2 (ja) | 生体成分の測定方法および測定用組成物 | |
| JP4577873B2 (ja) | 試薬の安定性を改善する方法 | |
| CN104321428B (zh) | 抗坏血酸氧化酶的稳定化方法 | |
| JP7226955B2 (ja) | 糖化蛋白質の測定 | |
| JP7328808B2 (ja) | ジメチルスルホキシドを含む糖化タンパク質測定試薬、糖化タンパク質の測定方法、糖化タンパク質測定試薬の保存方法、及び糖化タンパク質測定試薬の安定化方法 | |
| CN1330773C (zh) | 防止n-(羧甲基氨羰基)-4,4′-双(二甲氨基)二苯胺钠盐错误显色的方法、试剂溶液及使用该方法的测量方法 | |
| JP7492513B2 (ja) | フェロシアン化物の酸化還元電位を大きくするプロテアーゼの安定化剤を含む糖化タンパク質測定試薬、糖化タンパク質の測定方法、糖化タンパク質測定試薬の保存方法、及び糖化タンパク質測定試薬の安定化方法 | |
| JP7555739B2 (ja) | 安定化剤を含有する糖化タンパク質測定試薬用の4-アミノアンチピリン含有部分組成物、糖化タンパク質測定試薬、糖化タンパク質の測定方法、糖化タンパク質測定試薬用の4-アミノアンチピリン含有部分組成物の安定化方法、及び糖化タンパク質測定試薬用の4-アミノアンチピリン含有部分組成物の保存方法 | |
| JP2019198321A (ja) | 生体成分測定試薬キットの感度低下抑制方法 | |
| US10989714B2 (en) | Measurement of glycoprotein | |
| JPWO2018221446A1 (ja) | 糖化ヘモグロビンの測定方法 | |
| JP2004113014A (ja) | 糖化アミノ酸の消去方法 | |
| JP2021007341A (ja) | カタラーゼ及びキレート剤を含有する糖化タンパク質測定試薬用の4−アミノアンチピリン含有部分組成物、糖化タンパク質測定試薬、糖化タンパク質の測定方法、糖化タンパク質測定試薬用の4−アミノアンチピリン含有部分組成物の安定化方法、及び糖化タンパク質測定試薬用の4−アミノアンチピリン含有部分組成物の保存方法 | |
| HK1098174A (en) | Reagent containing protease reaction promoter and/or colorant stabilizer | |
| HK1202895B (en) | Method for stabilizing cholesterol oxidase | |
| HK1203555B (en) | Method for stabilizing ascorbic acid oxidase | |
| JP2009247258A (ja) | チラミンオキシダーゼの安定化方法およびその組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20061213 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100208 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100222 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100419 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20100419 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100623 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100729 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100820 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100823 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130903 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 4577873 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| EXPY | Cancellation because of completion of term |