JP2005008564A - フラーレン誘導体の製造方法 - Google Patents
フラーレン誘導体の製造方法 Download PDFInfo
- Publication number
- JP2005008564A JP2005008564A JP2003174682A JP2003174682A JP2005008564A JP 2005008564 A JP2005008564 A JP 2005008564A JP 2003174682 A JP2003174682 A JP 2003174682A JP 2003174682 A JP2003174682 A JP 2003174682A JP 2005008564 A JP2005008564 A JP 2005008564A
- Authority
- JP
- Japan
- Prior art keywords
- fullerene
- reaction mixture
- extraction solvent
- polyhydroxylated
- polyhydroxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- XMWRBQBLMFGWIX-UHFFFAOYSA-N C60 fullerene Chemical class C12=C3C(C4=C56)=C7C8=C5C5=C9C%10=C6C6=C4C1=C1C4=C6C6=C%10C%10=C9C9=C%11C5=C8C5=C8C7=C3C3=C7C2=C1C1=C2C4=C6C4=C%10C6=C9C9=C%11C5=C5C8=C3C3=C7C1=C1C2=C4C6=C2C9=C5C3=C12 XMWRBQBLMFGWIX-UHFFFAOYSA-N 0.000 title claims abstract description 124
- 238000004519 manufacturing process Methods 0.000 title abstract description 14
- 229910003472 fullerene Inorganic materials 0.000 claims abstract description 71
- 239000011541 reaction mixture Substances 0.000 claims abstract description 38
- 239000002904 solvent Substances 0.000 claims abstract description 35
- 238000000605 extraction Methods 0.000 claims abstract description 32
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 claims abstract description 29
- HIFJUMGIHIZEPX-UHFFFAOYSA-N sulfuric acid;sulfur trioxide Chemical compound O=S(=O)=O.OS(O)(=O)=O HIFJUMGIHIZEPX-UHFFFAOYSA-N 0.000 claims abstract description 24
- 239000002244 precipitate Substances 0.000 claims abstract description 17
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims abstract description 15
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 13
- 150000007933 aliphatic carboxylic acids Chemical class 0.000 claims abstract description 8
- 150000004996 alkyl benzenes Chemical class 0.000 claims abstract description 6
- 125000005907 alkyl ester group Chemical group 0.000 claims abstract description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 27
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Natural products CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 11
- 238000000034 method Methods 0.000 claims description 7
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 claims description 6
- 125000003944 tolyl group Chemical group 0.000 claims 1
- 239000004020 conductor Substances 0.000 abstract description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 42
- -1 hydrogen sulfate ester Chemical class 0.000 description 15
- 239000000203 mixture Substances 0.000 description 15
- 230000000052 comparative effect Effects 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 238000005119 centrifugation Methods 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 8
- 230000015572 biosynthetic process Effects 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 239000012299 nitrogen atmosphere Substances 0.000 description 6
- 238000001157 Fourier transform infrared spectrum Methods 0.000 description 5
- 238000007796 conventional method Methods 0.000 description 5
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 5
- 239000007858 starting material Substances 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 239000011261 inert gas Substances 0.000 description 4
- 238000005342 ion exchange Methods 0.000 description 4
- 238000001228 spectrum Methods 0.000 description 4
- 150000001721 carbon Chemical class 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- YNQLUTRBYVCPMQ-UHFFFAOYSA-N Ethylbenzene Chemical compound CCC1=CC=CC=C1 YNQLUTRBYVCPMQ-UHFFFAOYSA-N 0.000 description 2
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 238000000921 elemental analysis Methods 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000007086 side reaction Methods 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- QOSMNYMQXIVWKY-UHFFFAOYSA-N Propyl levulinate Chemical compound CCCOC(=O)CCC(C)=O QOSMNYMQXIVWKY-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical class OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 1
- 235000011054 acetic acid Nutrition 0.000 description 1
- 239000002041 carbon nanotube Substances 0.000 description 1
- 229910021393 carbon nanotube Inorganic materials 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000012776 electronic material Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000000446 fuel Substances 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- 238000009776 industrial production Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 1
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
【課題】プロトン伝導体として有用であるフラーレン誘導体、即ち、ポリ水酸化フラーレンやポリ水酸化フラーレン硫酸水素エステルを低廉に安全に、しかも、大量生産することができる方法を提供する。
【解決手段】フラーレン又はポリ水酸化フラーレンに発煙硫酸を反応させた後、得られた反応混合物を抽出溶媒に接触させて、それぞれシクロ硫酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを上記反応混合物から沈殿として分離させる際に、上記抽出溶媒として、水、炭素原子数1〜3の脂肪族カルボン酸、そのアルキルエステル、ベンゼン又はアルキルベンゼンを用いる。
【選択図】なし
【解決手段】フラーレン又はポリ水酸化フラーレンに発煙硫酸を反応させた後、得られた反応混合物を抽出溶媒に接触させて、それぞれシクロ硫酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを上記反応混合物から沈殿として分離させる際に、上記抽出溶媒として、水、炭素原子数1〜3の脂肪族カルボン酸、そのアルキルエステル、ベンゼン又はアルキルベンゼンを用いる。
【選択図】なし
Description
【0001】
【発明の属する技術分野】
本発明は、プロトン伝導体として有用であるフラーレン誘導体、即ち、シクロ硫酸化フラーレン、ポリ水酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを低廉に安全に、しかも、大量生産することができる方法に関する。
【0002】
【従来の技術】
近年、炭素クラスター、即ち、フラーレンのような炭素原子のみからなる閉殻状の分子やカーボンナノチューブのようなチューブ状の分子からなる炭素原子の集合体がナノテクノロジー(超微細技術)における代表的な材料であるとして、電子材料、医療用途、機械用途等の広い分野への応用が期待されている。
【0003】
特に、最近に至って、炭素クラスターにヒドロキシル基や硫酸水素エステル基のようなプロトン伝導性基を有せしめた炭素クラスター、即ち、ポリ水酸化フラーレンやその硫酸水素エステルの合成が報告されており(非特許文献1及び2参照)、更に、そのような化合物をプロトン伝導体として燃料電池に用いることも提案されている(特許文献1及び2参照)。更に、シクロ硫酸化フラーレンがプロトン伝導性を示すことも見出されている(特許文献3参照)。
【0004】
従来、ポリ水酸化フラーレンは、次のスキーム中の反応式(I)に示すようにして製造されている。即ち、フラーレン(1)に発煙硫酸を反応させて、シクロ硫酸化フラーレン(2)を生成させ、次いで、このシクロ硫酸化フラーレンを含む反応混合物をジエチルエーテル中に少量ずつ加え、沈殿を生成させて、これを遠心分離し、洗浄し、かくして、シクロ硫酸化フラーレン(2)を得、次いで、このシクロ硫酸化フラーレンに水を作用させ、加水分解して、ポリ水酸化フラーレン(3)を生成させ、これを遠心分離して、得ることができる。
【0005】
また、次のスキーム中の反応式(II)に示すように、このポリ水酸化フラーレン(3)に発煙硫酸を作用させ、水酸基を硫酸水素エステル基で置換して、部分エステルであるポリ水酸化フラーレン硫酸水素エステル(4)及び/又は全エステルであるポリ水酸化フラーレン硫酸水素エステル(5)を生成させ、この後、このポリ水酸化フラーレン硫酸水素エステルを含む反応混合物を冷却したジエチルエーテル中に少量ずつ加え、沈殿を生成させて、これを遠心分離し、洗浄することによって、ポリ水酸化フラーレン硫酸水素エステルを得ることができる。ここに、スキーム中、a、b、c、d及びeはそれぞれ1以上の整数である。
【0006】
【化1】
【0007】
このように、従来、ポリ水酸化フラーレンやその硫酸水素エステルを得る場合、フラーレン又はポリ水酸化フラーレンを発煙硫酸で処理した後、得られた反応混合物を沈殿溶媒としてのジエチルエーテル中に加えて、出発物質がフラーレンの場合には、シクロ硫酸化フラーレンを反応混合物から沈殿として分離させるために、また、出発物質がポリ水酸化フラーレンの場合には、目的物であるポリ水酸化フラーレン硫酸水素エステルを反応混合物から沈殿として分離させることが必要である。ここに、本発明においては、便宜上、シクロ硫酸化フラーレンやポリ水酸化フラーレン硫酸水素エステルを反応混合物から沈殿として分離させるために用いる沈殿溶媒を抽出溶媒ということとする。上述した従来の方法においては、抽出溶媒はジエチルエーテルである。また、上述した従来の方法においては、反応混合物から分離したシクロ硫酸化フラーレンやポリ水酸化フラーレン硫酸水素エステルを洗浄する際にも、ジエチルエーテルが用いられている。
【0008】
しかし、ジエチルエーテルは毒性が強く、その使用に際しては、細心の注意が必要とされるし、また、上述したように、得られた反応混合物をジエチルエーテル中に加えた際、反応混合物が発熱するので、ジエチルエーテルが揮散しやすい。従って、ポリ水酸化フラーレンやその硫酸水素エステルの製造において、ジエチルエーテルを抽出溶媒として用いる従来の方法は、環境保護の必要や作業の安全性の要請から高価な設備を要して、設備費用が嵩むと共に、安全性の点からも、工業的な製造には適していない。
【0009】
【特許文献1】WO01/06519A1号公報
【特許文献2】特開2002−063917号公報
【特許文献3】特願2003−32493号明細書
【非特許文献1】L. Y. Chiang et al., J. Chem. Soc., Chem. Commun., 1992, 1791
【非特許文献2】L. Y. Chaing et al., J. Org. Chem., 1994, 59, 3960
【0010】
【発明が解決しようとする課題】
本発明者らは、従来のポリ水酸化フラーレンやその硫酸水素エステルの製造における上述した問題を解決するために鋭意研究した結果、上記抽出溶媒として、ジエチルエーテルに代えて、より低廉で安全に取扱うことができる溶媒を用いることによって、シクロ硫酸化フラーレンやポリ水酸化フラーレン硫酸水素エステルを反応混合物から沈殿として分離させることができることを見出して、本発明に至ったものである。従って、本発明は、プロトン伝導体として有用であるフラーレン誘導体、即ち、シクロ硫酸化フラーレン、ポリ水酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを低廉に安全に、しかも、大量生産することができる方法を提供することを目的とする。
【0011】
【課題を解決するための手段】
本発明によれば、フラーレン又はポリ水酸化フラーレンに発煙硫酸を反応させた後、得られた反応混合物を抽出溶媒に接触させて、それぞれシクロ硫酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを上記反応混合物から沈殿として分離させる際に、上記抽出溶媒として、水、炭素原子数1〜3の脂肪族カルボン酸、そのアルキルエステル、ベンゼン又はアルキルベンゼンを用いることを特徴とするフラーレン誘導体の製造方法が提供される。
【0012】
【発明の実施の形態】
先ず、本発明において、ポリ水酸化フラーレンの製造において、出発物質として用いるフラーレンは、単一の組成を有するものである必要はなく、フラーレンを形成する炭素原子数は、フラーレンを形成し得る整数であればよい。従って、既に知られているように、フラーレンをCn と記載するとき、nは、例えば、60、70、76、78、80、82、84等から選ばれる少なくとも1種であればよい。しかし、本発明によれば、特に、フラーレンとして、炭素原子数が60のフラーレン(C60)、炭素原子数が70のフラーレン(C70)又はこれらの混合物が好ましく用いられる。
【0013】
本発明によるポリ水酸化フラーレンの製造方法によれば、フラーレンを不活性気体雰囲気中、発煙硫酸中に投入して、攪拌する。ここに、不活性気体は、特に限定されるものではないが、通常、窒素が好ましく用いられ、また、発煙硫酸としては60%発煙硫酸が好ましく用いられる。
【0014】
フラーレンを発煙硫酸で処理する際の反応温度は、通常、常温(25℃)から135℃の範囲であり、また、その反応時間は、通常、10時間以上であり、好ましくは、70時間以上である。しかし、120時間を越える必要はない。発煙硫酸は、ポリ水酸化フラーレン1重量部に対して、通常、10重量部以上用いられ、好ましくは、15〜50重量部の範囲で用いられる。
【0015】
本発明によれば、このようにして、フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させて、シクロ硫酸化フラーレンを沈殿として、反応混合物から分離させる。ここに、上記抽出溶媒としては、水、炭素原子数1〜3の脂肪族カルボン酸、そのアルキルエステル、ベンゼン又はアルキルベンゼンが用いられる。
【0016】
ここに、炭素原子数1〜3の脂肪族カルボン酸としては、蟻酸、酢酸又はプロピオン酸を挙げることができ、また、これらの脂肪族カルボン酸のアルキルエステルとしては、例えば、メチルエステル、エチルエステル、プロピルエステル等を挙げることができる。また、アルキルベンゼンとしては、例えば、トルエン、キシレン、エチルベンゼン、メシチレン等を挙げることができる。これらのなかでは、トルエンが好ましく用いられる。
【0017】
本発明によれば、このように、種々の抽出溶媒を用いることができるが、なかでも、抽出溶媒としては、水又は酢酸又はこれらの混合物が好ましく用いられる。
【0018】
本発明において、反応混合物を抽出溶媒に接触させるには、通常、反応混合物に抽出溶媒を加えればよいが、しかし、必要に応じて、反応混合物を抽出溶媒に加えてもよい。また、本発明において、用いる抽出溶媒の量は、生成したシクロ硫酸化フラーレンを反応混合物から沈殿として分離させるに足りる量であれば、特に、限定されるものではないが、通常、得られた反応混合物の容量に対して、2倍以上、好ましくは3倍以上である。しかし、通常、反応混合物に対して、抽出溶媒を10倍量以上用いる必要はなく、好ましくは、5倍量までである。
【0019】
しかし、本発明によれば、望ましくない副反応を抑えて、目的とするシクロ硫酸化フラーレンを収率よく得るためには、反応混合物を抽出溶媒に接触させるに際して、反応混合物の温度を80℃以下に保つことが好ましく、特に、反応混合物の温度を50℃以下、常温までの温度に保つことが好ましい。
【0020】
本発明によれば、このように、フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させることによって、通常、一般式(I)
Cn (OSO3)x
(式中、Cn はシクロ硫酸化フラーレンの母体であるフラーレンを示し、xは5〜30の範囲の数である。)
で表されるシクロ硫酸化フラーレンを沈殿として得ることができる。また、このシクロ硫酸化フラーレンを加水分解することによって、一般式(II)
Cn (OH)x
(式中、Cn はポリ水酸化フラーレンの母体であるフラーレンを示し、xは5〜30の範囲の数である。)
で表されるポリ水酸化フラーレンを得ることができる。
【0021】
次に、本発明によるポリ水酸化フラーレン硫酸水素エステルの製造について説明する。ポリ水酸化フラーレン硫酸水素エステルの製造において、出発物質として用いるポリ水酸化フラーレンも、前述したフラーレンと同様であって、単一の組成を有するものである必要はなく、ポリ水酸化フラーレンの母体を形成するフラーレンの炭素原子数は、フラーレンを形成し得る整数であればよい。従って、既に知られているように、フラーレンをCn と記載するとき、nは、例えば、60、70、76、78、80、82、84等から選ばれる少なくとも1種であればよい。しかし、本発明によれば、特に、ポリ水酸化フラーレンとして、炭素原子数が60のポリ水酸化フラーレン、炭素原子数が70のポリ水酸化フラーレン又はこれらの混合物が好ましく用いられる。
【0022】
更に、ポリ水酸化フラーレン硫酸水素エステルの製造においては、出発物質として用いるポリ水酸化フラーレンは、単一の数のヒドロキシル基を有するフラーレンであってもよいが、また、種々の数のヒドロキシル基を有するものであってもよい。通常、本発明においては、分子中にヒドロキシル基を10〜30の範囲で有し、炭素原子数が60のポリ水酸化フラーレン、炭素原子数が70のポリ水酸化フラーレン又はこれらポリ水酸化フラーレンの混合物が好ましく用いられる。
【0023】
本発明によるポリ水酸化フラーレン硫酸水素エステルの製造においては、ポリ水酸化フラーレンを不活性気体雰囲気中、発煙硫酸中に投入して、攪拌する。ここに、不活性気体は、特に限定されるものではないが、通常、窒素が好ましく用いられ、また、発煙硫酸としては60%発煙硫酸が好ましく用いられる。
【0024】
ポリ水酸化フラーレンを発煙硫酸で処理する際の反応温度は、通常、常温(25℃)から135℃の範囲であり、また、その反応時間は、通常、10時間以上であり、好ましくは、70時間以上である。しかし、120時間を越える必要はない。発煙硫酸は、ポリ水酸化フラーレン1重量部に対して、通常、10重量部以上用いられ、好ましくは、15〜50重量部の範囲で用いられる。
【0025】
本発明によれば、このようにして、ポリ水酸化フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させて、ポリ水酸化フラーレン硫酸水素エステルを沈殿として、反応混合物から分離させる。ここに、本発明によれば、上記抽出溶媒として、前述したものが用いられ、なかでも、水又は酢酸又はこれらの混合物が好ましく用いられる。
【0026】
ポリ水酸化フラーレンからのポリ水酸化フラーレン硫酸水素エステルの製造においても、用いる抽出溶媒の量は、前述したと同様に、特に、限定されるものではないが、通常、得られた反応混合物の容量に対して、2倍以上、好ましくは3倍以上である。しかし、通常、反応混合物に対して、抽出溶媒を10倍量以上用いる必要はなく、好ましくは、5倍量までである。
【0027】
しかし、本発明によれば、望ましくない副反応を抑えて、目的とするポリ水酸化フラーレン硫酸水素エステルを収率よく得るためには、反応混合物を抽出溶媒に接触させるに際して、反応混合物の温度を80℃以下に保つことが好ましく、特に、反応混合物の温度を50℃以下、常温までの温度に保つことが好ましい。
【0028】
本発明によれば、このようにして、ポリ水酸化フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させることによって、通常、一般式(III)
Cn (OH)x−y (OSO3H)y
(式中、Cn はポリ水酸化フラーレン硫酸水素エステルの母体であるフラーレンを示し、xは10〜30の範囲の数であり、yは5〜10の範囲の数である。)で表されるポリ水酸化フラーレン硫酸水素エステルの部分エステルを得ることができる。
【0029】
【実施例】
以下に比較例と共に実施例を挙げて本発明を説明するが、本発明はこれら実施例により何ら限定されるものではない。
【0030】
比較例1
(ポリ水酸化フラーレンの合成)
窒素雰囲気下、フラーレンC60とC70との混合物(重量比C60:C70=0.8:0.2)20gを60%発煙硫酸500gに均一に分散させた後、60℃で72時間攪拌した。得られた反応反応物を冷却したジエチルエーテル中に分散させ、生成した沈殿物を遠心分離にて分別し、ジエチルエーテルとアセトニトリルで洗浄した後、減圧乾燥した。得られた粉末を窒素雰囲気下で乾燥させ、イオン交換水1L中に均一に分散させた後、80℃で10時間攪拌した。遠心分離にて分別し、イオン交換水で洗浄、遠心分離を繰り返した後、減圧乾燥した。
【0031】
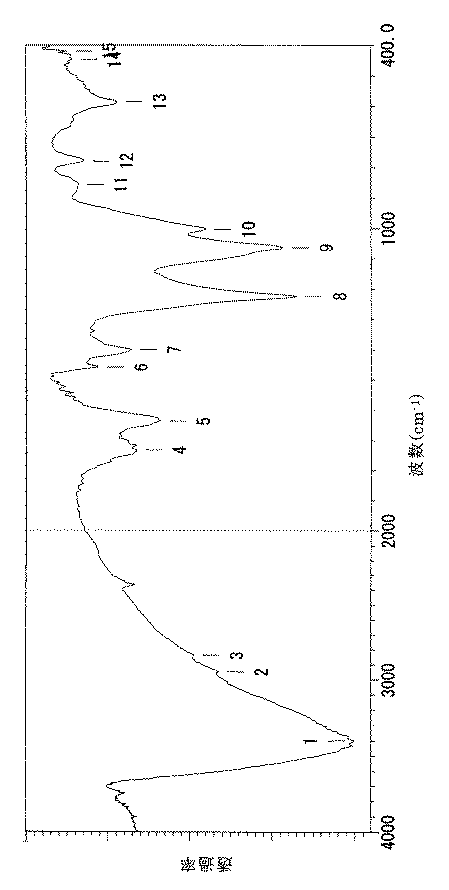
このようにして得られたポリ水酸化フラーレン(試料)のFT−IRを図1に示すように、前記文献(非特許文献1)に記載されているポリ水酸化フラーレン(C60(OH)12) のスペクトルとほぼ一致した。また、元素分析の結果、試料は、C60/C70(OH)15 (C60:C70=0.8:0.2)なる組成を有するものであった。
【0032】
また、上記試料300mgを白金円板で挟み、約1T/cm2 の圧力で直径16mmの円板状ペレットに成形し、このペレットのインピーダンス測定を行って、試料のプロトン伝導率を求めたところ、2.8×10−6S/cmであった。
【0033】
比較例2
(ポリ水酸化フラーレン硫酸水素エステルの合成)
窒素雰囲気下、比較例1で得られたポリ水酸化フラーレン15gを60%発煙硫酸500g中に均一に分散させた後、反応温度25℃で72時間攪拌した。得られた反応混合物を冷却したジエチルエーテル中に分散させ、生成した沈殿物を遠心分離にて分別し、ジエチルエーテルとアセトニトリルで洗浄した後、減圧乾燥した。
【0034】
このようにして得られたポリ水酸化フラーレン硫酸水素エステル(試料)のFT−IRスペクトルを図2に示すように、前記文献(非特許文献2)に記載されているポリ水酸化フラーレン硫酸水素エステルのスペクトルとほぼ一致した。元素分析の結果、試料は、C60/C70(OH)11(OSO3H)4 (C60:C70=0.8:0.2)なる組成を有するものであった。また、比較例1と同様にして、試料のプロトン伝導率を求めたところ、4.9×10−4/cmであった。
【0035】
実施例1
窒素雰囲気下、フラーレンC60とC70との混合物(重量比C60:C70=0.8:0.2)20gを60%発煙硫酸500gに均一に分散させた後、60℃で72時間攪拌した。得られた反応混合物の温度を80℃以下に保ちながら、これに抽出溶媒としてイオン交換水1.5Lを加え、生成した沈殿物を遠心分離にて分別し、更に、イオン交換水で洗浄した後、減圧乾燥した。得られた粉末を窒素雰囲気下で乾燥させ、イオン交換水1L中に均一に分散させた後、80℃で10時間攪拌した。遠心分離にて分別し、イオン交換水で洗浄、遠心分離を繰り返した後、減圧乾燥した。
【0036】
このようにして得られたポリ水酸化フラーレン(試料)のFT−IRを図3に示すように、前記文献(非特許文献1)に記載されているポリ水酸化フラーレン(C60(OH)12) のスペクトルとほぼ一致した。また、比較例1と同様にして、試料のプロトン伝導率を求めたところ、2.5×10−6S/cmであった。
【0037】
実施例2
(ポリ水酸化フラーレン硫酸水素エステルの合成)
窒素雰囲気下、実施例1で得られたポリ水酸化フラーレン15gを60%発煙硫酸500g中に均一に分散させた後、反応温度25℃で72時間攪拌した。得られた反応混合物の温度を80℃以下に保ちながら、これに酢酸1.5Lを加え、生成した沈殿物を遠心分離にて分別し、更に、酢酸で1回、アセトニトリルで2回、それぞれ洗浄した後、減圧乾燥した。
【0038】
このようにして得られたポリ水酸化フラーレン硫酸水素エステル(試料)のFT−IRスペクトルを図4に示すように、前記文献(非特許文献2)に記載されているポリ水酸化フラーレン硫酸水素エステルのスペクトルとほぼ一致した。また、比較例1と同様にして、試料のプロトン伝導率を求めたところ、1.5×10−3/cmであった。
【0039】
実施例3
(ポリ水酸化フラーレン硫酸水素エステルの合成)
実施例2において、抽出溶媒として、酢酸に代えて、酢酸エチルを用いた以外は、実施例1と同様にして、ポリ水酸化フラーレン硫酸水素エステルを得た。比較例1と同様にして、このポリ水酸化フラーレン硫酸水素エステルのプロトン伝導率を求めたところ、1.0×10−3/cmであった。
【0040】
実施例4
(ポリ水酸化フラーレン硫酸水素エステルの合成)
実施例2において、抽出溶媒として、酢酸に代えて、トルエンを用いた以外は、実施例1と同様にして、ポリ水酸化フラーレン硫酸水素エステルを得た。比較例1と同様にして、このポリ水酸化フラーレン硫酸水素エステルのプロトン伝導率を求めたところ、1.2×10−3/cmであった。
【0041】
実施例5
(ポリ水酸化フラーレン硫酸水素エステルの合成)
実施例2において、抽出溶媒として、酢酸に代えて、ベンゼンを用いた以外は、実施例1と同様にして、ポリ水酸化フラーレン硫酸水素エステルを得た。比較例1と同様にして、このポリ水酸化フラーレン硫酸水素エステルのプロトン伝導率を求めたところ、2.6×10−3/cmであった。
【0042】
【発明の効果】
【図面の簡単な説明】
【図1】従来の方法によるポリ水酸化フラーレンのFT−IRスペクトルである。
【図2】従来の方法によるポリ水酸化フラーレン硫酸水素エステルのFT−IRスペクトルである。
【図3】本発明の方法によるポリ水酸化フラーレンのFT−IRスペクトルである。
【図4】本発明の方法によるポリ水酸化フラーレン硫酸水素エステルのFT−IRスペクトルである。
【発明の属する技術分野】
本発明は、プロトン伝導体として有用であるフラーレン誘導体、即ち、シクロ硫酸化フラーレン、ポリ水酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを低廉に安全に、しかも、大量生産することができる方法に関する。
【0002】
【従来の技術】
近年、炭素クラスター、即ち、フラーレンのような炭素原子のみからなる閉殻状の分子やカーボンナノチューブのようなチューブ状の分子からなる炭素原子の集合体がナノテクノロジー(超微細技術)における代表的な材料であるとして、電子材料、医療用途、機械用途等の広い分野への応用が期待されている。
【0003】
特に、最近に至って、炭素クラスターにヒドロキシル基や硫酸水素エステル基のようなプロトン伝導性基を有せしめた炭素クラスター、即ち、ポリ水酸化フラーレンやその硫酸水素エステルの合成が報告されており(非特許文献1及び2参照)、更に、そのような化合物をプロトン伝導体として燃料電池に用いることも提案されている(特許文献1及び2参照)。更に、シクロ硫酸化フラーレンがプロトン伝導性を示すことも見出されている(特許文献3参照)。
【0004】
従来、ポリ水酸化フラーレンは、次のスキーム中の反応式(I)に示すようにして製造されている。即ち、フラーレン(1)に発煙硫酸を反応させて、シクロ硫酸化フラーレン(2)を生成させ、次いで、このシクロ硫酸化フラーレンを含む反応混合物をジエチルエーテル中に少量ずつ加え、沈殿を生成させて、これを遠心分離し、洗浄し、かくして、シクロ硫酸化フラーレン(2)を得、次いで、このシクロ硫酸化フラーレンに水を作用させ、加水分解して、ポリ水酸化フラーレン(3)を生成させ、これを遠心分離して、得ることができる。
【0005】
また、次のスキーム中の反応式(II)に示すように、このポリ水酸化フラーレン(3)に発煙硫酸を作用させ、水酸基を硫酸水素エステル基で置換して、部分エステルであるポリ水酸化フラーレン硫酸水素エステル(4)及び/又は全エステルであるポリ水酸化フラーレン硫酸水素エステル(5)を生成させ、この後、このポリ水酸化フラーレン硫酸水素エステルを含む反応混合物を冷却したジエチルエーテル中に少量ずつ加え、沈殿を生成させて、これを遠心分離し、洗浄することによって、ポリ水酸化フラーレン硫酸水素エステルを得ることができる。ここに、スキーム中、a、b、c、d及びeはそれぞれ1以上の整数である。
【0006】
【化1】
【0007】
このように、従来、ポリ水酸化フラーレンやその硫酸水素エステルを得る場合、フラーレン又はポリ水酸化フラーレンを発煙硫酸で処理した後、得られた反応混合物を沈殿溶媒としてのジエチルエーテル中に加えて、出発物質がフラーレンの場合には、シクロ硫酸化フラーレンを反応混合物から沈殿として分離させるために、また、出発物質がポリ水酸化フラーレンの場合には、目的物であるポリ水酸化フラーレン硫酸水素エステルを反応混合物から沈殿として分離させることが必要である。ここに、本発明においては、便宜上、シクロ硫酸化フラーレンやポリ水酸化フラーレン硫酸水素エステルを反応混合物から沈殿として分離させるために用いる沈殿溶媒を抽出溶媒ということとする。上述した従来の方法においては、抽出溶媒はジエチルエーテルである。また、上述した従来の方法においては、反応混合物から分離したシクロ硫酸化フラーレンやポリ水酸化フラーレン硫酸水素エステルを洗浄する際にも、ジエチルエーテルが用いられている。
【0008】
しかし、ジエチルエーテルは毒性が強く、その使用に際しては、細心の注意が必要とされるし、また、上述したように、得られた反応混合物をジエチルエーテル中に加えた際、反応混合物が発熱するので、ジエチルエーテルが揮散しやすい。従って、ポリ水酸化フラーレンやその硫酸水素エステルの製造において、ジエチルエーテルを抽出溶媒として用いる従来の方法は、環境保護の必要や作業の安全性の要請から高価な設備を要して、設備費用が嵩むと共に、安全性の点からも、工業的な製造には適していない。
【0009】
【特許文献1】WO01/06519A1号公報
【特許文献2】特開2002−063917号公報
【特許文献3】特願2003−32493号明細書
【非特許文献1】L. Y. Chiang et al., J. Chem. Soc., Chem. Commun., 1992, 1791
【非特許文献2】L. Y. Chaing et al., J. Org. Chem., 1994, 59, 3960
【0010】
【発明が解決しようとする課題】
本発明者らは、従来のポリ水酸化フラーレンやその硫酸水素エステルの製造における上述した問題を解決するために鋭意研究した結果、上記抽出溶媒として、ジエチルエーテルに代えて、より低廉で安全に取扱うことができる溶媒を用いることによって、シクロ硫酸化フラーレンやポリ水酸化フラーレン硫酸水素エステルを反応混合物から沈殿として分離させることができることを見出して、本発明に至ったものである。従って、本発明は、プロトン伝導体として有用であるフラーレン誘導体、即ち、シクロ硫酸化フラーレン、ポリ水酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを低廉に安全に、しかも、大量生産することができる方法を提供することを目的とする。
【0011】
【課題を解決するための手段】
本発明によれば、フラーレン又はポリ水酸化フラーレンに発煙硫酸を反応させた後、得られた反応混合物を抽出溶媒に接触させて、それぞれシクロ硫酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを上記反応混合物から沈殿として分離させる際に、上記抽出溶媒として、水、炭素原子数1〜3の脂肪族カルボン酸、そのアルキルエステル、ベンゼン又はアルキルベンゼンを用いることを特徴とするフラーレン誘導体の製造方法が提供される。
【0012】
【発明の実施の形態】
先ず、本発明において、ポリ水酸化フラーレンの製造において、出発物質として用いるフラーレンは、単一の組成を有するものである必要はなく、フラーレンを形成する炭素原子数は、フラーレンを形成し得る整数であればよい。従って、既に知られているように、フラーレンをCn と記載するとき、nは、例えば、60、70、76、78、80、82、84等から選ばれる少なくとも1種であればよい。しかし、本発明によれば、特に、フラーレンとして、炭素原子数が60のフラーレン(C60)、炭素原子数が70のフラーレン(C70)又はこれらの混合物が好ましく用いられる。
【0013】
本発明によるポリ水酸化フラーレンの製造方法によれば、フラーレンを不活性気体雰囲気中、発煙硫酸中に投入して、攪拌する。ここに、不活性気体は、特に限定されるものではないが、通常、窒素が好ましく用いられ、また、発煙硫酸としては60%発煙硫酸が好ましく用いられる。
【0014】
フラーレンを発煙硫酸で処理する際の反応温度は、通常、常温(25℃)から135℃の範囲であり、また、その反応時間は、通常、10時間以上であり、好ましくは、70時間以上である。しかし、120時間を越える必要はない。発煙硫酸は、ポリ水酸化フラーレン1重量部に対して、通常、10重量部以上用いられ、好ましくは、15〜50重量部の範囲で用いられる。
【0015】
本発明によれば、このようにして、フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させて、シクロ硫酸化フラーレンを沈殿として、反応混合物から分離させる。ここに、上記抽出溶媒としては、水、炭素原子数1〜3の脂肪族カルボン酸、そのアルキルエステル、ベンゼン又はアルキルベンゼンが用いられる。
【0016】
ここに、炭素原子数1〜3の脂肪族カルボン酸としては、蟻酸、酢酸又はプロピオン酸を挙げることができ、また、これらの脂肪族カルボン酸のアルキルエステルとしては、例えば、メチルエステル、エチルエステル、プロピルエステル等を挙げることができる。また、アルキルベンゼンとしては、例えば、トルエン、キシレン、エチルベンゼン、メシチレン等を挙げることができる。これらのなかでは、トルエンが好ましく用いられる。
【0017】
本発明によれば、このように、種々の抽出溶媒を用いることができるが、なかでも、抽出溶媒としては、水又は酢酸又はこれらの混合物が好ましく用いられる。
【0018】
本発明において、反応混合物を抽出溶媒に接触させるには、通常、反応混合物に抽出溶媒を加えればよいが、しかし、必要に応じて、反応混合物を抽出溶媒に加えてもよい。また、本発明において、用いる抽出溶媒の量は、生成したシクロ硫酸化フラーレンを反応混合物から沈殿として分離させるに足りる量であれば、特に、限定されるものではないが、通常、得られた反応混合物の容量に対して、2倍以上、好ましくは3倍以上である。しかし、通常、反応混合物に対して、抽出溶媒を10倍量以上用いる必要はなく、好ましくは、5倍量までである。
【0019】
しかし、本発明によれば、望ましくない副反応を抑えて、目的とするシクロ硫酸化フラーレンを収率よく得るためには、反応混合物を抽出溶媒に接触させるに際して、反応混合物の温度を80℃以下に保つことが好ましく、特に、反応混合物の温度を50℃以下、常温までの温度に保つことが好ましい。
【0020】
本発明によれば、このように、フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させることによって、通常、一般式(I)
Cn (OSO3)x
(式中、Cn はシクロ硫酸化フラーレンの母体であるフラーレンを示し、xは5〜30の範囲の数である。)
で表されるシクロ硫酸化フラーレンを沈殿として得ることができる。また、このシクロ硫酸化フラーレンを加水分解することによって、一般式(II)
Cn (OH)x
(式中、Cn はポリ水酸化フラーレンの母体であるフラーレンを示し、xは5〜30の範囲の数である。)
で表されるポリ水酸化フラーレンを得ることができる。
【0021】
次に、本発明によるポリ水酸化フラーレン硫酸水素エステルの製造について説明する。ポリ水酸化フラーレン硫酸水素エステルの製造において、出発物質として用いるポリ水酸化フラーレンも、前述したフラーレンと同様であって、単一の組成を有するものである必要はなく、ポリ水酸化フラーレンの母体を形成するフラーレンの炭素原子数は、フラーレンを形成し得る整数であればよい。従って、既に知られているように、フラーレンをCn と記載するとき、nは、例えば、60、70、76、78、80、82、84等から選ばれる少なくとも1種であればよい。しかし、本発明によれば、特に、ポリ水酸化フラーレンとして、炭素原子数が60のポリ水酸化フラーレン、炭素原子数が70のポリ水酸化フラーレン又はこれらの混合物が好ましく用いられる。
【0022】
更に、ポリ水酸化フラーレン硫酸水素エステルの製造においては、出発物質として用いるポリ水酸化フラーレンは、単一の数のヒドロキシル基を有するフラーレンであってもよいが、また、種々の数のヒドロキシル基を有するものであってもよい。通常、本発明においては、分子中にヒドロキシル基を10〜30の範囲で有し、炭素原子数が60のポリ水酸化フラーレン、炭素原子数が70のポリ水酸化フラーレン又はこれらポリ水酸化フラーレンの混合物が好ましく用いられる。
【0023】
本発明によるポリ水酸化フラーレン硫酸水素エステルの製造においては、ポリ水酸化フラーレンを不活性気体雰囲気中、発煙硫酸中に投入して、攪拌する。ここに、不活性気体は、特に限定されるものではないが、通常、窒素が好ましく用いられ、また、発煙硫酸としては60%発煙硫酸が好ましく用いられる。
【0024】
ポリ水酸化フラーレンを発煙硫酸で処理する際の反応温度は、通常、常温(25℃)から135℃の範囲であり、また、その反応時間は、通常、10時間以上であり、好ましくは、70時間以上である。しかし、120時間を越える必要はない。発煙硫酸は、ポリ水酸化フラーレン1重量部に対して、通常、10重量部以上用いられ、好ましくは、15〜50重量部の範囲で用いられる。
【0025】
本発明によれば、このようにして、ポリ水酸化フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させて、ポリ水酸化フラーレン硫酸水素エステルを沈殿として、反応混合物から分離させる。ここに、本発明によれば、上記抽出溶媒として、前述したものが用いられ、なかでも、水又は酢酸又はこれらの混合物が好ましく用いられる。
【0026】
ポリ水酸化フラーレンからのポリ水酸化フラーレン硫酸水素エステルの製造においても、用いる抽出溶媒の量は、前述したと同様に、特に、限定されるものではないが、通常、得られた反応混合物の容量に対して、2倍以上、好ましくは3倍以上である。しかし、通常、反応混合物に対して、抽出溶媒を10倍量以上用いる必要はなく、好ましくは、5倍量までである。
【0027】
しかし、本発明によれば、望ましくない副反応を抑えて、目的とするポリ水酸化フラーレン硫酸水素エステルを収率よく得るためには、反応混合物を抽出溶媒に接触させるに際して、反応混合物の温度を80℃以下に保つことが好ましく、特に、反応混合物の温度を50℃以下、常温までの温度に保つことが好ましい。
【0028】
本発明によれば、このようにして、ポリ水酸化フラーレンを発煙硫酸で処理した後、得られた反応混合物を抽出溶媒に接触させることによって、通常、一般式(III)
Cn (OH)x−y (OSO3H)y
(式中、Cn はポリ水酸化フラーレン硫酸水素エステルの母体であるフラーレンを示し、xは10〜30の範囲の数であり、yは5〜10の範囲の数である。)で表されるポリ水酸化フラーレン硫酸水素エステルの部分エステルを得ることができる。
【0029】
【実施例】
以下に比較例と共に実施例を挙げて本発明を説明するが、本発明はこれら実施例により何ら限定されるものではない。
【0030】
比較例1
(ポリ水酸化フラーレンの合成)
窒素雰囲気下、フラーレンC60とC70との混合物(重量比C60:C70=0.8:0.2)20gを60%発煙硫酸500gに均一に分散させた後、60℃で72時間攪拌した。得られた反応反応物を冷却したジエチルエーテル中に分散させ、生成した沈殿物を遠心分離にて分別し、ジエチルエーテルとアセトニトリルで洗浄した後、減圧乾燥した。得られた粉末を窒素雰囲気下で乾燥させ、イオン交換水1L中に均一に分散させた後、80℃で10時間攪拌した。遠心分離にて分別し、イオン交換水で洗浄、遠心分離を繰り返した後、減圧乾燥した。
【0031】
このようにして得られたポリ水酸化フラーレン(試料)のFT−IRを図1に示すように、前記文献(非特許文献1)に記載されているポリ水酸化フラーレン(C60(OH)12) のスペクトルとほぼ一致した。また、元素分析の結果、試料は、C60/C70(OH)15 (C60:C70=0.8:0.2)なる組成を有するものであった。
【0032】
また、上記試料300mgを白金円板で挟み、約1T/cm2 の圧力で直径16mmの円板状ペレットに成形し、このペレットのインピーダンス測定を行って、試料のプロトン伝導率を求めたところ、2.8×10−6S/cmであった。
【0033】
比較例2
(ポリ水酸化フラーレン硫酸水素エステルの合成)
窒素雰囲気下、比較例1で得られたポリ水酸化フラーレン15gを60%発煙硫酸500g中に均一に分散させた後、反応温度25℃で72時間攪拌した。得られた反応混合物を冷却したジエチルエーテル中に分散させ、生成した沈殿物を遠心分離にて分別し、ジエチルエーテルとアセトニトリルで洗浄した後、減圧乾燥した。
【0034】
このようにして得られたポリ水酸化フラーレン硫酸水素エステル(試料)のFT−IRスペクトルを図2に示すように、前記文献(非特許文献2)に記載されているポリ水酸化フラーレン硫酸水素エステルのスペクトルとほぼ一致した。元素分析の結果、試料は、C60/C70(OH)11(OSO3H)4 (C60:C70=0.8:0.2)なる組成を有するものであった。また、比較例1と同様にして、試料のプロトン伝導率を求めたところ、4.9×10−4/cmであった。
【0035】
実施例1
窒素雰囲気下、フラーレンC60とC70との混合物(重量比C60:C70=0.8:0.2)20gを60%発煙硫酸500gに均一に分散させた後、60℃で72時間攪拌した。得られた反応混合物の温度を80℃以下に保ちながら、これに抽出溶媒としてイオン交換水1.5Lを加え、生成した沈殿物を遠心分離にて分別し、更に、イオン交換水で洗浄した後、減圧乾燥した。得られた粉末を窒素雰囲気下で乾燥させ、イオン交換水1L中に均一に分散させた後、80℃で10時間攪拌した。遠心分離にて分別し、イオン交換水で洗浄、遠心分離を繰り返した後、減圧乾燥した。
【0036】
このようにして得られたポリ水酸化フラーレン(試料)のFT−IRを図3に示すように、前記文献(非特許文献1)に記載されているポリ水酸化フラーレン(C60(OH)12) のスペクトルとほぼ一致した。また、比較例1と同様にして、試料のプロトン伝導率を求めたところ、2.5×10−6S/cmであった。
【0037】
実施例2
(ポリ水酸化フラーレン硫酸水素エステルの合成)
窒素雰囲気下、実施例1で得られたポリ水酸化フラーレン15gを60%発煙硫酸500g中に均一に分散させた後、反応温度25℃で72時間攪拌した。得られた反応混合物の温度を80℃以下に保ちながら、これに酢酸1.5Lを加え、生成した沈殿物を遠心分離にて分別し、更に、酢酸で1回、アセトニトリルで2回、それぞれ洗浄した後、減圧乾燥した。
【0038】
このようにして得られたポリ水酸化フラーレン硫酸水素エステル(試料)のFT−IRスペクトルを図4に示すように、前記文献(非特許文献2)に記載されているポリ水酸化フラーレン硫酸水素エステルのスペクトルとほぼ一致した。また、比較例1と同様にして、試料のプロトン伝導率を求めたところ、1.5×10−3/cmであった。
【0039】
実施例3
(ポリ水酸化フラーレン硫酸水素エステルの合成)
実施例2において、抽出溶媒として、酢酸に代えて、酢酸エチルを用いた以外は、実施例1と同様にして、ポリ水酸化フラーレン硫酸水素エステルを得た。比較例1と同様にして、このポリ水酸化フラーレン硫酸水素エステルのプロトン伝導率を求めたところ、1.0×10−3/cmであった。
【0040】
実施例4
(ポリ水酸化フラーレン硫酸水素エステルの合成)
実施例2において、抽出溶媒として、酢酸に代えて、トルエンを用いた以外は、実施例1と同様にして、ポリ水酸化フラーレン硫酸水素エステルを得た。比較例1と同様にして、このポリ水酸化フラーレン硫酸水素エステルのプロトン伝導率を求めたところ、1.2×10−3/cmであった。
【0041】
実施例5
(ポリ水酸化フラーレン硫酸水素エステルの合成)
実施例2において、抽出溶媒として、酢酸に代えて、ベンゼンを用いた以外は、実施例1と同様にして、ポリ水酸化フラーレン硫酸水素エステルを得た。比較例1と同様にして、このポリ水酸化フラーレン硫酸水素エステルのプロトン伝導率を求めたところ、2.6×10−3/cmであった。
【0042】
【発明の効果】
【図面の簡単な説明】
【図1】従来の方法によるポリ水酸化フラーレンのFT−IRスペクトルである。
【図2】従来の方法によるポリ水酸化フラーレン硫酸水素エステルのFT−IRスペクトルである。
【図3】本発明の方法によるポリ水酸化フラーレンのFT−IRスペクトルである。
【図4】本発明の方法によるポリ水酸化フラーレン硫酸水素エステルのFT−IRスペクトルである。
Claims (5)
- フラーレン又はポリ水酸化フラーレンに発煙硫酸を反応させた後、得られた反応混合物を抽出溶媒に接触させて、それぞれシクロ硫酸化フラーレン又はポリ水酸化フラーレン硫酸水素エステルを上記反応混合物から沈殿として分離させる際に、上記抽出溶媒として、水、炭素原子数1〜3の脂肪族カルボン酸、そのアルキルエステル、ベンゼン又はアルキルベンゼンを用いることを特徴とするフラーレン誘導体の製造方法。
- 温度80℃以下に保ちながら、反応混合物を抽出溶媒に接触させる請求項1に記載の方法。
- 脂肪族カルボン酸が酢酸である請求項1に記載の方法。
- 脂肪族カルボン酸のアルキルエステルが酢酸エチルである請求項1に記載の方法。
- アルキルベンゼンがトルエンである請求項1に記載の方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003174682A JP2005008564A (ja) | 2003-06-19 | 2003-06-19 | フラーレン誘導体の製造方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003174682A JP2005008564A (ja) | 2003-06-19 | 2003-06-19 | フラーレン誘導体の製造方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005008564A true JP2005008564A (ja) | 2005-01-13 |
Family
ID=34098099
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003174682A Pending JP2005008564A (ja) | 2003-06-19 | 2003-06-19 | フラーレン誘導体の製造方法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005008564A (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006241037A (ja) * | 2005-03-02 | 2006-09-14 | Frontier Carbon Corp | フラーレン誘導体の製造方法 |
| JP2006315970A (ja) * | 2005-05-11 | 2006-11-24 | Sony Corp | イオン解離性機能分子の製造方法及びその原料分子の製造方法 |
| JP2016017063A (ja) * | 2014-07-10 | 2016-02-01 | 国立大学法人大阪大学 | 長鎖アルキルエーテル化フラーレン誘導体およびその製造方法、並びにそれを用いた樹脂組成物 |
-
2003
- 2003-06-19 JP JP2003174682A patent/JP2005008564A/ja active Pending
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006241037A (ja) * | 2005-03-02 | 2006-09-14 | Frontier Carbon Corp | フラーレン誘導体の製造方法 |
| JP2006315970A (ja) * | 2005-05-11 | 2006-11-24 | Sony Corp | イオン解離性機能分子の製造方法及びその原料分子の製造方法 |
| JP2016017063A (ja) * | 2014-07-10 | 2016-02-01 | 国立大学法人大阪大学 | 長鎖アルキルエーテル化フラーレン誘導体およびその製造方法、並びにそれを用いた樹脂組成物 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8410185B2 (en) | Porous polymeric materials for hydrogen storage | |
| WO2017032330A1 (zh) | 不同含氧量的石墨烯量子点的制备方法、石墨烯量子点和荧光材料 | |
| JP3764986B2 (ja) | 可溶性カーボンナノチューブの製造法 | |
| CN106117521B (zh) | 一种碳炔薄膜及其制备方法与应用 | |
| CN108862264A (zh) | 一种石墨烯分散剂及其制备方法、应用 | |
| JP2005220046A (ja) | 両親媒性ヘキサペリヘキサベンゾコロネン誘導体 | |
| CN115874199A (zh) | 以d2o为氘源的官能化氘代烯烃类化合物及其制备方法和应用 | |
| CN104370284A (zh) | 一种可控高取代度羟基功能化石墨烯的制备方法 | |
| JP2005008564A (ja) | フラーレン誘導体の製造方法 | |
| CN116905005A (zh) | 一种通过电化学的方式合成1,3-氟氧化产物的方法 | |
| CN114891188A (zh) | 含有氮氧自由基与二茂铁基团的共轭有机金属聚合物及制备方法与应用、复合热电薄膜 | |
| CN102127424B (zh) | 一种铱金属配合物有机荧光粒子及其制备方法 | |
| WO2011066809A1 (zh) | 寡层石墨及其薄膜的制备方法 | |
| WO2022138636A1 (ja) | 金属錯体又はその付加体、金属錯体又はその付加体を含む触媒及びその製造方法、触媒を含む液状組成物又は電極、電極を備える空気電池又は燃料電池 | |
| JP3934089B2 (ja) | カーボンナノチューブの精製方法 | |
| CN116178244B (zh) | 一种富勒烯吡咯烷衍生物及其制备方法与应用 | |
| CN107602444B (zh) | 合成多样化单取代或双取代[60]富勒烯-1-二氢吡咯衍生物的方法 | |
| JP2001187760A (ja) | 1,1,1,5,5,5−ヘキサフルオロアセチルアセトンの精製方法 | |
| US8841465B2 (en) | Method for selective functionalization of single-walled carbon nanotubes | |
| CN108069421A (zh) | 一种石墨烯吡啶功能化的方法 | |
| KR20190071293A (ko) | 마이크로웨이브를 이용한 그래핀의 제조방법 | |
| CN112250695A (zh) | 一种热电材料及其制备方法与复合热电薄膜 | |
| CN117385378B (zh) | 一种缺电子芳香缩醛的电氧化制备方法和应用 | |
| CN1271146C (zh) | 磺化碳纳米管及其制备方法 | |
| JP2004247057A (ja) | プロトン伝導体とその製造方法 |