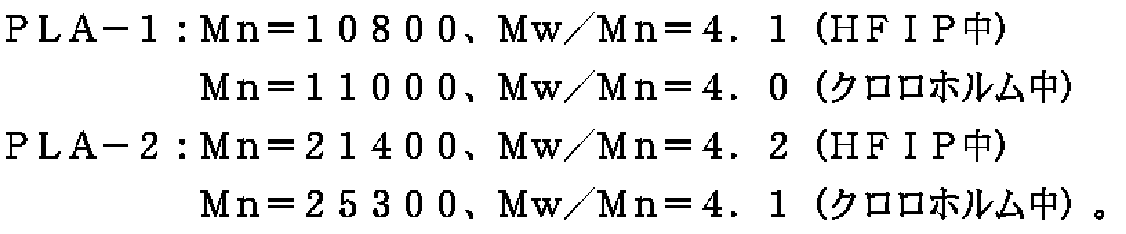JP2004269378A - 多重水素結合性化合物、多重水素結合性架橋体組成物および成形品 - Google Patents
多重水素結合性化合物、多重水素結合性架橋体組成物および成形品 Download PDFInfo
- Publication number
- JP2004269378A JP2004269378A JP2003059585A JP2003059585A JP2004269378A JP 2004269378 A JP2004269378 A JP 2004269378A JP 2003059585 A JP2003059585 A JP 2003059585A JP 2003059585 A JP2003059585 A JP 2003059585A JP 2004269378 A JP2004269378 A JP 2004269378A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- multiple hydrogen
- triazine
- triazine structure
- reaction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- QDCWMPHJELLHBD-UHFFFAOYSA-N CCC1(C)CC(C)(C)CC(C)C1 Chemical compound CCC1(C)CC(C)(C)CC(C)C1 QDCWMPHJELLHBD-UHFFFAOYSA-N 0.000 description 1
- URLKBWYHVLBVBO-UHFFFAOYSA-N Cc1ccc(C)cc1 Chemical compound Cc1ccc(C)cc1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 description 1
Landscapes
- Compositions Of Macromolecular Compounds (AREA)
Abstract
Description
【0001】
【発明の属する技術分野】
本発明は、多重水素結合性化合物、多重水素結合性架橋体組成物および成形品に関するものである。多重水素結合性化合物および多重水素結合性架橋体組成物は熱可逆的に解離・会合を繰り返すことのできる特性を有し、成形温度では、熱可逆結合が解離し、常温では熱可逆結合が会合する物質となる。すなわち本発明は、溶融加工時には低分子量物のような高い流動性、高い溶融加工性を示し、一方冷却後に得られる成形品状態では、会合状態を取り、その結果高分子量体のごとくに、あるいは高度に架橋した熱硬化性樹脂のごとく高い機械特性を兼ね備える二律背反した特性を有する熱可逆性の新規素材に関するものである。
【0002】
【従来の技術】
従来のポリマー合成技術は、主に共有結合からなるポリマー設計に主眼がおかれていた。しかしながら共有結合からなるポリマーは、一旦重合させてしまうと、その結合を熱的、機械的に開裂することは困難であり、そのため共有結合からなるポリマーをリサイクル化するには、大きなエネルギーが必要であり、このことがポリマーのリサイクルを困難にする原因ともなっていた。そのため熱的に可逆性を有する結合の導入により、熱的に非可逆的なポリマーを熱可逆化することは、リサイクル性の向上、加工プロセス時のエネルギーの低減といった地球環境保全の見地から有望な手法となり得る。
【0003】
このような背景のもと、近年、非共有結合と共有結合からなる低分子量物の分子設計研究が活発化している。非特許文献1に記載されているように代表的な非共有結合としては、イオン結合、水素結合などが挙げられるが、非共有結合の中でも特に、複数の水素結合を有する多重水素結合が近年特に注目を浴びている。例えば、多重水素結合成分として、ピリミドン単位を含有する化合物は、低分子量物であっても、有機溶媒中、あるいはバルク状態において、高分子量ポリマー固有の特性、すなわち粘弾性挙動やガラス転移温度を呈すことが報告されている。またピリミドン単位からなる多重水素結合が溶媒中、あるいはバルク状態で自己会合していることが非特許文献2に記載されている。この発見以降、多重水素結合をポリマーに導入するという試みが幾つか行われており、例えばピリミドン単位をポリオレフィンの側鎖に導入すると非極性溶媒中では、ピリミドン単位からなる多重水素結合が強く会合、極性溶媒中では解離することが非特許文献3に記載されている。また特許文献1ではカルボニル基と含窒素5員環状複素環からなる多重水素結合を側鎖に有するポリオレフィンやポリブタジエンが熱可逆性を示し、自動車タイヤに使用されている架橋性ポリマーの代替品として使用できることが開示されている。
【0004】
これらの多重水素結合性化合物は、自己相補型多重水素結合(Self−Complementary Multiple Hydrogen Bond)と呼ばれるものであり、分子中に存在する同一構造を有する多重水素結合が、会合するものである。例えば上記非特許文献2、3を例に挙げると、ピリミドン単位同士が分子間で会合するというものである。
【0005】
一方、自己相補型多重水素結合とは異なる多重水素結合、すなわち相補型多重水素結合(Complementary Multiple HydrogenBond)も報告されている。相補型多重水素結合とは、異なる2種類の多重水素結合成分が、会合構造を形成するものであり、DNAやRNA中の塩基成分のアデニンとチミンの組み合わせ、グアニンとシトシンの組み合わせのように、アデニン単独、チミン単独、グアニン単独、シトシン単独では強い水素結合は形成しないものの、アデニンとチミンの組み合わせ、グアニンとシトシンの組み合わせにより、強い水素結合を形成するものであり、これらは相補型多重水素結合に分類される。例えば、非特許文献4ではメラミン誘導体とシアヌール酸誘導体からなる多重水素結合が開示されている。また非特許文献5ではDNAやRNA中の塩基成分の誘導体である、グアニン誘導体、ジアミノピリジン誘導体とシトシン誘導体からなる多重水素結合が開示されている。また特許文献2〜4には、水素結合性ドナーとして、ピリジン環を分子中に2つ以上含有する水素結合性ドナー成分と、分子中に2つ以上のカルボキシ基を含有するポリエステル樹脂組成物の配合は、カルボキシ基とピリジン環を介し、相補型の水素結合を形成し、その結果、得られるポリエステル樹脂組成物の結晶化速度が速く、弾性率が向上することが報告されている。
【0006】
【非特許文献1】
Reinhout, D. N,“Supramolecular Materials and Technologies”,Vol. 4,1999
【0007】
【非特許文献2】
Rint P. Sijbesma et al,“SCIENCE”,1997, VOL. 278, p1601−1604
【0008】
【非特許文献3】
Lee R. Rieth et al,“Angew. Chem. Int. Ed.”, 2001, 40, No. 11, p2153−2156
【0009】
【特許文献1】
特開2002−80529号公報(第1−8頁)
【0010】
【非特許文献4】
Insung S. Choi et al,“Chem. Mater.”, 1999, 11, p684−690
【0011】
【非特許文献5】
William L. Jorgensen et al.,“J. Am. Chem. Soc.”, 1990, 112, p2008−2010
【0012】
【特許文献2】
特開2002−60601号公報(第1、2、6、7頁)
【0013】
【特許文献3】
特開2002−146169号公報(第1、6、7頁)
【0014】
【特許文献4】
特開2002−201265号公報(第1−4頁)
【0015】
【発明が解決しようとする課題】
しかし、非特許文献2に記載の技術は、もともと液状の低分子量化合物にピリミドン構造からなる自己相補型の多重水素結合を導入すると、ポリマー状態の固体が得られるという学術的知見であり、自己相補型多重水素結合が熱可逆性を示すことを示唆するものではなく、さらに得られたポリマー状固体は、実用樹脂材料として使用できるものではなかった。
【0016】
非特許文献3に記載の技術はポリオレフィンの側鎖にピリミドン構造からなる自己相補型の多重水素結合を導入したポリマーが、極性溶媒中では解離し、非極性溶媒中では会合していることを示したものであり、本文献もまた多重水素結合の熱可逆性を示すものではなかった。
【0017】
一方、特許文献1記載の技術は、非特許文献2、3に記載の自己相補型の多重水素結合とは異なる、カルボニル基と含窒素化合物からなる多重水素結合をポリマー側鎖に導入したものであり、得られたポリマーは、溶融加工時には多重水素結合による架橋が解離し、熱可塑性樹脂と類似の特性を示し、一方、低温では多重水素結合が会合、架橋構造を形成し、熱硬化性樹脂としての特徴を示すことを示したものである。すなわち、リサイクル困難な熱硬化性樹脂にカルボニル基と含窒素化合物からなる多重水素結合を導入することにより、熱硬化性樹脂を熱可逆化することによりリサイクル可能な材料にするという方法である。しかしながら、そこで使用されているカルボニル基と含窒素化合物からなる多重水素結合は、熱可逆的な会合構造だけではなく、実質、カルボニル基と含窒素化合物の分子間交換反応により、共有結合性の架橋が生じるため、熱可逆性は充分といえるものではないという問題があった。
【0018】
また非特許文献4記載の相補型の多重水素結合はメラミンアルキル置換体の合成とシアヌール酸アルキル置換体の構造解析に関する学術的知見であり、該多重水素結合が熱可逆性を示すことを示唆するものでも、熱可逆的なポリマー特性を呈することを示唆するものでもなかった。また非特許文献5では、DNAやRNA中の塩基成分の誘導体である、グアニン誘導体、ジアミノピリジン誘導体とシトシン誘導体からなる多重水素結合の相互作用に関する学術知見であり、本公知例もまた、該多重水素結合が熱可逆性を示すことを示唆するものでも、熱可逆的なポリマー特性を呈することを示唆するものでもなかった。またグアニン誘導体、ジアミノピリジン誘導体など極めて複雑な構造からなる化合物であり、実用性の面でも使用困難な化合物からなる多重水素結合化合物であった。
【0019】
一方特許文献2〜4記載の技術は、多重水素結合とは異なり、カルボキシ基とピリジン環からなる非常に弱い1重の相補型水素結合による分子間相互作用を用いたポリエステル樹脂に関する技術であり、水素結合強度や熱可逆性は不十分であった。
【0020】
本発明の目的は、従来の技術とは全く異なり、極めて単純な構造でかつすでに化学産業の中で高頻度で使用されている化合物から形成される多重水素結合を分子設計し、該多重水素結合を分子中に導入することにより、溶融成形加工温度では多重水素結合が解離することで、低分子量化合物のような良流動性を示し、一方解離温度以下では多重水素結合が会合し、ポリマーと同様の形状、機械特性を有し、かつ滞留安定性・リサイクル性に優れるといった熱可逆的特徴を有する多重水素結合性化合物、多重水素結合性架橋体組成物とその製造方法および成形品を提供することである。
【0021】
【課題を解決するための手段】
本発明者らは、上記の目的を達成すべく鋭意検討した結果、トリアジン環を含有するイソシアネート化合物が自己相補型多重水素結合性を示し、さらにトリアジン環を含有するイソシアネート化合物を導入した分子が熱可逆性のポリマー形状を呈すること、さらに、トリアジン環を含有するイソシアネート化合物を導入した分子とシアヌール酸がさらにより強固な熱可逆的な多重水素結合性架橋体を形成し、解離温度以下では強く会合し、分子量の高いポリマー形態、あるいは架橋構造を呈し、かつ解離温度以上の高い温度領域では分子量の低いポリマー挙動を呈することを見出し、本発明に至ったものである。
【0022】
すなわち、本発明は、
(i)下記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物、
【0023】
【化3】
【0024】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0025】
(ii)下記一般式(2)で表されるトリアジン構造単位を含有する多重水素結合性化合物、
【0026】
【化4】
【0027】
式中mは0〜5の整数、nは2〜10の整数、R2は炭素数1〜6のアルキル基であり、Yは有機基を表す。
【0028】
(iii)(i)記載のトリアジン構造を含有するイソシアネート化合物と、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物とを加熱溶融下あるいは溶液中で配合することを特徴とする(ii)記載のトリアジン構造を含有する多重水素結合性化合物の製造方法、
(iv)(ii)記載のトリアジン構造を含有する多重水素結合性化合物に対し、さらにシアヌール酸を配合してなる多重水素結合性架橋体組成物、
(v)(i)記載のトリアジン構造を含有する多重水素結合性化合物に対し、シアヌール酸を配合してなるトリアジン・シアヌール酸塩含有イソシアネート化合物、
(vi)(v)のトリアジン・シアヌール酸塩含有イソシアネート化合物に対し、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合してなる多重水素結合性架橋体組成物、
(vii)(ii)に記載の多重水素結合性化合物、または(iv)、(vi)いずれかに記載の多重水素結合性架橋体組成物を成形してなる成形品である。
【0029】
【発明の実施の形態】
本発明のトリアジン構造を含有するイソシアネート化合物とは、下記一般式(1)で表されるトリアジン構造とイソシアネート構造を含有する化合物であって、多重水素結合性を示す。その両末端のイソシアネート基の反応性を利用し、分子中に少なくとも1つ以上の水酸基やアミノ基を含有する化合物との反応により、多重水素結合を導入し、かつ熱可逆性を付与できる化合物である。
【0030】
【化5】
【0031】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0032】
mは入手性の面から0〜2の整数が好ましく、特に好ましくは0である。
【0033】
nは熱安定性の面から4以上の整数が好ましく、特に好ましくは6である。
【0034】
R2は炭素数1〜6のアルキル基であり、例えばメチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、ter−ブチル、n−ペンチル、イソペンチル、ネオペンチル、n−ヘキシル、シクロヘキシルなどが挙げられるが、入手性の面からメチルが好ましい。また一般式(1)中のトリアジン構造に結合していない方のイソシアネート基に対するR2のフェニレン基上基の位置はオルト位、メタ位いずれでもよいが、オルト位のものが入手性の面で好ましい。
【0035】
上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物は下記式に示す方法により製造することができる。すなわち下記一般式(3)で表されるトリアジン化合物と下記一般式(4)で表されるジイソシアネートの反応を溶媒中あるいは無溶媒中で反応させることにより、製造することができる。
【0036】
【化6】
【0037】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0038】
m、n、およびR2の好ましい例は、一般式(1)の化合物に関して述べたとおりである。
【0039】
上記反応条件は特に制限はないが、溶媒中で反応させる場合は、上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物を高収率、高純度で得るためには、トリアジン化合物(3)中、アミノ基1モルに対するジイソシアネート化合物(4)のモル比率が2倍モル以上、20倍モル以下が好ましく、より好ましくは3倍モル以上10倍モル以下、特に好ましくは3倍モル以上5倍モル以下である。つまりアミノ基を2つ有するトリアジン化合物、例えばベンゾグアナミンの場合、ジイソシアネート化合物(4)のモル比率が4倍モル以上、40倍モル以下が好ましく、より好ましくは6倍モル以上20倍モル以下、特に好ましくは6倍モル以上10倍モル以下ということである。
【0040】
トリアジン化合物(3)としては、例えばメラミン、2,4−ジアミノ−6−フェニル−1,3,5−トリアジン(ベンゾグアナミン)、2,4−ジアミノ−6−メチル−1,3,5−トリアジン(アセトグアナミン)、2,4−ジアミノ−6−エチル−1,3,5−トリアジン、2,4−ジアミノ−6−プロピル−1,3,5−トリアジン、2,4−ジアミノ−6−ブチル−1,3,5−トリアジン、2,4−ジアミノ−6−ペンチル−1,3,5−トリアジン、2,4−ジアミノ−6−ヘキシル−1,3,5−トリアジンなどが挙げられるが、入手性の面から、メラミン、2,4−ジアミノ−6−フェニル−1,3,5−トリアジン(ベンゾグアナミン)、2,4−ジアミノ−6−メチル−1,3,5−トリアジン(アセトグアナミン)、2,4−ジアミノ−6−エチル−1,3,5−トリアジンが好ましく、特に好ましくはメラミン、2,4−ジアミノ−6−フェニル−1,3,5−トリアジン(ベンゾグアナミン)、2,4−ジアミノ−6−メチル−1,3,5−トリアジン(アセトグアナミン)である。
【0041】
イソシアネート化合物(4)の具体例としては、例えばエチレンジイソシアネート、プロピレンジイソシアネート、ブタンジイソシアネート、ペンタンジイソシアネート、ヘキサメチレンジイソシアネートなどが挙げられるが、入手性および得られるトリアジン構造を含有するイソシアネート化合物の溶解性、融解性の面からヘキサメチレンジイソシアネートが好ましい。
【0042】
この時使用する溶媒としてはジイソシアネート化合物(4)を溶解する溶媒であり、かつジイソシアネート化合物(4)と反応しない溶媒であれば特に制限はない。具体的にはジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、n−メチルピロリドン、アセトン、メチルエチルケトン、ピリジン、テトラヒドロフラン、クロロホルムなどが挙げられる。
【0043】
反応温度は、用いる溶媒の沸点により異なるが、目的物を高収率で得るためには、通常室温から200℃の範囲であり、好ましくは50〜180℃、より好ましくは80〜120℃の範囲である。
【0044】
反応時間は反応温度により異なるが、通常1〜12時間、好ましくは1〜6時間である。
【0045】
なお本製造方法は無溶媒中で行うと、生成した上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物を高収収率、高純度で得られるばかりでなく、反応時間を短縮でき、また洗浄工程が簡略化できるという特徴を付与することができる。無溶媒中で行う場合は、トリアジン化合物(3)とジイソシアネート化合物(4)を均一なスラリー状にする必要があるため、トリアジン化合物(3)中、アミノ基1モルに対するジイソシアネート化合物(4)の比率は、3倍モル以上、20倍モル以下が好ましく、より好ましくは5倍モル以上10倍モル以下、特に好ましくは5倍モル以上7倍モル以下である。
【0046】
この時の反応温度は、通常室温から200℃の範囲であり、好ましくは50〜150℃、より好ましくは50〜120℃の範囲である。
【0047】
また、本反応は溶媒中、あるいは無溶媒中に関わらず、触媒を用いることにより、重合時間を短縮することができる。触媒としては、例えば、錫、亜鉛、鉛、チタン、ビスマス、ジルコニウム、ゲルマニウム、アンチモン、アルミニウムなどの金属及びその誘導体が挙げられる。誘導体としては、金属アルコキシド、カルボン酸塩、炭酸塩、酸化物、ハロゲン化物が好ましい。具体的には、塩化錫、オクチル酸錫、塩化亜鉛、酢酸亜鉛、酸化鉛、炭酸鉛、塩化チタン、アルコキシチタン、酸化ゲルマニウム、酸化ジルコニウムなどが挙げられる。これらの中でも、錫化合物が好ましく、特にオクチル酸錫がより好ましい。
【0048】
触媒の添加量は、特に限定されるものではないが、使用するトリアジン化合物(3)とジイソシアネート化合物(4)の総モル数に対して、0.001〜2モル%が好ましく、特に0.01〜0.5モル%がより好ましい。
【0049】
本反応は溶媒中、無溶媒中に関わらず、通常不均一系で進行するため、沈殿した目的物は濾過した後、過剰のジイソシアネート化合物(4)を溶媒洗浄することにより、一般式(1)で表されるトリアジン構造を有するイソシアネート化合物を高純度で得ることができる。使用する洗浄溶媒は特に限定されるものではないが、ジイソシアネート化合物(4)を溶解し、かつ目的物であるトリアジン構造を含有するイソシアネート化合物を溶解せず、さらにトリアジン構造を含有するイソシアネート化合物と反応しない溶媒であれば特に制限はない。具体的には、ヘキサン、シクロヘキサン、ベンゼン、トルエンなどによって代表される炭化水素溶媒、アセトン、メチルエチルケトンなどのケトン溶媒、ジエチルエーテルなどのエーテル溶媒などが挙げられる。
【0050】
本発明のトリアジン構造を含有するイソシアネート化合物は、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合することにより、下記一般式(2)で表されるトリアジン構造を含有する多重水素結合性化合物を形成することができる。
【0051】
【化7】
【0052】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基であり、Yは有機基を表す。ここでm、nおよびR2については前記一般式(1)におけるm、nおよびR2と同様である。
【0053】
上記一般式中、Yは有機基を示し、後述するように分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物と一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物との付加反応により生成する残基を表している。
【0054】
ここで分子中に少なくとも1つ以上の水酸基を含有する化合物としては、例えばメタノール、エタノール、プロパノール、ブタノールなどの分子中に1つの水酸基を有するアルコール類、エチレングリコール、プロピレングリコール、ブタンジオール、シクロヘキサンジメタノールなどのジオール類、分子中に3つ以上の水酸基を有する多価アルコールのみならず、ポリマー末端やポリマー側鎖に1つ以上の水酸基を有するポリマー、例えばポリエチレングリコール類、ポリプロピレングリコール類、ポリエステル樹脂、ポリカーボネート樹脂、液晶ポリエステル樹脂、ビニルアルコール単位を含有する共重合体、エチレン・ビニルアルコール共重合体などの変性ポリエチレン樹脂、プロピレン・ビニルアルコール共重合体などの変性ポリプロピレン樹脂、2−ヒドロキシエチル(メタ)アクリレート単位を含有するビニル系共重合体、エポキシ樹脂、フェノール樹脂など通常公知のものを幅広く使用することができる。
【0055】
また分子中に少なくとも1つ以上のアミノ基を含有する化合物としては、例えば、エチルアミン、プロピルアミン、ブチルアミン、ペンチルアミン、ヘキシルアミンなどのアミン類、エチレンジアミン、1,3−ペンタンジアミン、1,4−ブタンジアミン、1,5−ペンタンジアミン、1,6−ヘキサメチレンジアミンなどのジアミン類、分子中に3つ以上のアミノ基を含有する多価アミンのみならず、ポリマー末端やポリマー側鎖に1つ以上のアミノ基を有するポリマー、例えば、ポリアミン類、ポリイミン類、ポリアミド樹脂、メラミン樹脂、ポリアクリルアミド、ポリアクリルアミド共重合体、ポリビニルアミン、ポリビニルアミン共重合体、ポリビニルトリアジン、ポリビニルトリアジン共重合体など、通常公知のものを幅広く使用することができる。
【0056】
従って上記一般式Yで表される有機基は、トリアジン構造を含有するイソシアネート化合物と付加反応する上記の分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の水酸基またはアミノ基に結合している有機残基に対応するものである。例えばメタノール、エタノール、プロパノールなどの分子中に1つの水酸基を有するアルコール類とイソシアネートの付加反応物残基、エチレングリコール、プロピレングリコール、ブタンジオール、シクロヘキサンジメタノールなどのジオール類とイソシアネートの付加反応物残基、分子中に3つ以上の水酸基を有する多価アルコールとイソシアネートの付加反応物残基、ポリマー末端やポリマー側鎖に1つ以上の水酸基を有するポリマー、例えばポリエチレングリコール類、ポリプロピレングリコール類、ポリエステル樹脂、ポリカーボネート樹脂、液晶ポリエステル樹脂、ビニルアルコール単位を含有する共重合体、エチレン・ビニルアルコール共重合体などの変性ポリエチレン樹脂、プロピレン・ビニルアルコール共重合体などの変性ポリプロピレン樹脂、2−ヒドロキシエチル(メタ)アクリレート単位を含有するビニル系共重合体、エポキシ樹脂、フェノール樹脂とイソシアネートの付加反応物残基などが例示できる。
【0057】
さらに有機残基Yとしては、例えば、エチルアミン、プロピルアミン、ブチルアミン、ペンチルアミン、ヘキシルアミンなどのアミン類とイソシアネートの付加反応物残基、エチレンジアミン、1,3−ペンタンジアミン、1,4−ブタンジアミン、1,5−ペンタンジアミン、1,6−ヘキサメチレンジアミンなどのジアミン類とイソシアネートの付加反応物残基、分子中に3つ以上のアミノ基を含有する多価アミンとイソシアネートの付加反応物残基のみならず、ポリマー末端やポリマー側鎖に1つ以上のアミノ基を有するポリマー、例えば ポリアミン類、ポリイミン類、ポリアミド樹脂、メラミン樹脂、ポリアクリルアミド、ポリアクリルアミド共重合体、ポリビニルアミン、ポリビニルアミン共重合体、ポリビニルトリアジン、ポリビニルトリアジン共重合体とイソシアネートの付加反応物残基など、種々のものを挙げることができる。
【0058】
上記一般式(2)で表される多重水素結合性化合物は、前述の通り、トリアジン構造を含有するイソシアネート化合物と、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合することにより製造することができる。
【0059】
この時トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の配合比率は、特に制限はないが、未反応の水酸基、アミノ基が残存しないように反応を完結させるためには、トリアジン構造を含有するイソシアネート化合物中のイソシアネート基1モルに対して、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を当モル以上配合することが好ましく、より好ましくは2倍モル以上である。なお未反応の水酸基、アミノ基が残存しても本発明の効果は発揮できるが、未反応の水酸基またはアミノ基が残存しない方が本発明の効果を充分発揮させることができる。
【0060】
加熱溶融下で混合する方法は、通常公知の方法で行うことができる。例えば、トリアジン構造を含有するイソシアネート化合物と、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を予備混合して、またはせずに押出機などに供給して、室温から250℃の温度範囲において充分混練することにより、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の反応が進行し、目的物であるトリアジン構造を含有する多重水素結合性化合物を製造することができる。
【0061】
混練温度はトリアジン構造を含有する多重水素結合性化合物の熱安定性の面から、通常室温から250℃の温度範囲であり、50〜230℃が好ましく、50〜200℃の温度範囲がより好ましい。
【0062】
なお、無溶媒下、溶融状態で混練を行う場合には、反応物を溶融させるために、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の融点、あるいは軟化点以上で反応させることが好ましいが、生成するトリアジン構造を含有する多重水素結合性化合物の分解反応を抑制するという点で、反応物が固まらない程度にできる限り温度を下げて反応を行うことが好ましい。
【0063】
また、溶液中で混練を行う場合には、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物のいずれかを溶解し、かつトリアジン構造を含有するイソシアネート化合物と反応しない溶媒を用いることができる。この時、さらに両成分を溶解する溶媒を用いると、より反応が速やかに進行するが、いずれか一方の成分が溶媒に溶解しなくても、本反応は不均一系でも進行する。しかし、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の両方を溶解し、かつトリアジン構造を含有するイソシアネート化合物と反応しない溶媒中での反応の方が、反応時間が短縮でき、また生成物であるトリアジン構造を含有する多重水素結合性化合物を高純度で生成させることができる。
【0064】
したがってトリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物のいずれかが溶解しない場合は、溶融混練により製造することが好ましい。
【0065】
本反応を溶媒中で行う場合、使用される溶媒としては、たとえば、クロロホルム、塩化メチレン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、ピリジン、ジメチルアセトアミド、N−メチルピロリドンなどを用いることができる。反応後に溶媒を除去する必要がある場合、溶媒を除去する方法としては、特に限定されるものではなく、たとえば室温で溶媒を揮発させる方法、減圧下で溶媒の沸点以上の温度で溶媒を揮発させる方法などを用いることができる。あるいは、生成したトリアジン構造を含有する多重水素結合性化合物を沈殿させうる溶媒中に、投下し、目的物を回収することもできる。
【0066】
反応を溶融混練により行う場合は、例えば“ユニメルト”タイプのスクリューを備えた単軸押出機、二軸、三軸押出機およびニーダタイプの混練機などを用いることができるし、あるいは撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。また、これらの反応器は2種以上組み合わせて使用することができる。反応を溶媒中で行う場合は、撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。
【0067】
本発明のトリアジン構造を含有する多重水素結合性化合物(2)は、下記一般式で表されるように、さらにシアヌール酸(5)と溶融または溶液中で配合することにより、さらにより強固な多重水素結合、すなわちトリアジン単位とシアヌール酸単位を介した、多重水素結合性架橋体組成物を形成することができる。
【0068】
この時、トリアジン構造を含有する多重水素結合性化合物(2)と、一般式(5)で表されるシアヌール酸を溶融または溶液中で配合することにより、両者間で多重水素結合を形成するが、その構造はいくつかの会合状態を呈するため、明確に化学式で表記することは学術的にも困難であるが、実質的に下記一般式(6)で表される構造を有すると推定される。
【0069】
【化8】
【0070】
式中mは0〜5の整数、nは2〜10の整数、R2は炭素数1〜6のアルキル基であり、Yは有機基を表す。
【0071】
すなわち上記一般式(2)で表されるトリアジン構造を含有する多重水素結合性化合物と上記一般式(5)で表されるシアヌール酸の間で、多重水素結合性の熱可逆架橋を形成すると推定されるが、生成物の構造は一般式(6)に限定されるものではなく、一般式(5)で表されるシアヌール酸1モルに対し、トリアジン構造を含有する多重水素結合性化合物(2)の1倍モル以上が配位、会合、または弱く相互作用しているものが存在すれば特に制限はない。また会合していないトリアジン構造を含有する多重水素結合性化合物やシアヌール酸が存在していても、本発明の効果を充分発揮することができるが、理想的にはシアヌール酸1モルに対し、トリアジン構造を含有する多重水素結合性化合物の3倍モル以上が配位、会合、または弱く相互作用したものが存在することが特に好ましい。
【0072】
ここで用いる一般式(2)の化合物に関してm、nおよびR2の好ましい例は、前記の同化合物の説明で述べた好ましい例と同一である。
【0073】
トリアジン構造を含有する多重水素結合性化合物(2)と、一般式(5)で表されるシアヌール酸の配合方法に特に制限はないが、溶媒中で混合する場合は、多重水素結合性化合物100重量部に対するシアヌール酸の配合量は 0.01〜30重量部が好ましく、より好ましくは0.1〜10重量部、特に好ましくは0.2〜5重量部である。
【0074】
この時使用する溶媒としてはトリアジン構造を含有する多重水素結合性化合物を溶解する溶媒であれば特に制限はない。具体的には塩化メチレン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、n−メチルピリミドン、テトラヒドロフラン、クロロホルム、ヘキサフロロイソプロパノールなどが挙げられる。反応温度は、用いる溶媒の沸点により異なるが、目的物を高収率で得るためには、通常室温から200℃の範囲が好ましく、より好ましくは80〜150℃の範囲である。
【0075】
反応時間は反応温度により異なるが、通常1〜60分、好ましくは5〜40分、より好ましくは10〜30分である。
【0076】
なお無溶媒中で行うと、トリアジン構造を含有する多重水素結合性化合物と、一般式(5)で表されるシアヌール酸の配位が効率良く進行し、強い多重水素結合性架橋生成物を形成させることができる。この時、多重水素結合性化合物100重量部に対するシアヌール酸の配合量は0.01〜50重量部が好ましく、より好ましくは0.1〜30重量部、特に好ましくは0.2〜10重量部である。
【0077】
加熱溶融下で混合する方法は、通常公知の方法で行うことができる。例えば、トリアジン構造を含有する多重水素結合性化合物と、シアヌール酸を予備混合して、またはせずに押出機などに供給して、室温℃から280℃の温度範囲において充分混練することにより、トリアジン構造を含有する多重水素結合性化合物とシアヌール酸の配位を進行させることができる。混練温度はトリアジン構造を含有する多重水素結合性化合物の熱安定性の面から、通常室温から280℃の温度範囲であり、好ましくは50〜250℃、より好ましくは50〜230℃である。なお、溶融状態で反応を行う場合には、反応物を溶融させるために、反応物の融点以上、または軟化点温度以上で反応させることが好ましいが、トリアジン構造を含有する多重水素結合性化合物の分解反応を抑制するという点と同時に、反応を促進するという点から、反応物が固まらない程度にできる限り温度を下げて反応を行うことが好ましい。
【0078】
上記の反応を溶融混練により行う場合は、例えば“ユニメルト”タイプのスクリューを備えた単軸押出機、二軸、三軸押出機およびニーダタイプの混練機などを用いることができるし、あるいは撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。また、これらの反応器は2種以上組み合わせて使用することができる。反応を溶媒中で行う場合は、撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることもできる。
【0079】
以上詳細に説明したように、本発明の多重水素結合性架橋体組成物は、トリアジン環を含有するジイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物から得られるトリアジン環を含有する多重水素結合性化合物に、さらにシアヌール酸を配合することにより製造することができる。
【0080】
さらにその他の製造方法として、本発明の多重結合性架橋体組成物は、あらかじめ、トリアジン環を含有するジイソシアネート化合物にシアヌール酸を配合することで、トリアジン・シアヌール酸塩を含有するイソシアネート化合物を製造した後、引き続き、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を溶融または溶液中で混合することにより、多重水素結合性架橋体組成物を製造することもできる。
【0081】
このような方法で用いられるトリアジン・シアヌール酸塩含有イソシアネート化合物とは、下記一般式で表されるようにトリアジン構造を含有するイソシアネート化合物(1)と、一般式(5)で表されるシアヌール酸を溶融または溶液中で配合することにより得られる化合物である。トリアジン構造を含有するイソシアネート化合物と、一般式(5)で表されるシアヌール酸を溶融または溶液中で配合することにより、両者間で水素結合を形成せしめることができるが、その構造は幾つかの会合状態を呈するため、明確に化学式により表記することは学術的にも困難であるけれども、実質的に下記一般式(7)で表される構造を有すると推定される。
【0082】
【化9】
【0083】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0084】
すなわち上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物と一般式(5)で表されるシアヌール酸の間で、多重水素結合を形成すると推定されるが、生成物の構造は一般式(7)に限定されるものではなく、一般式(5)で表されるシアヌール酸1モルに対し、トリアジン構造を含有するイソシアネート化合物が1倍モル以上が配位、会合、または弱く相互作用しているものが存在すれば特に制限はない。また会合していないトリアジン構造を含有するイソシアネート化合物やシアヌール酸が存在していても、本発明の効果を充分発揮することができる。しかしながら理想的にはシアヌール酸1モルに対し、トリアジン構造を含有するイソシアネート化合物の3倍モル以上が配位、会合、または弱く相互作用したものが存在することが特に好ましい。
【0085】
ここで用いる一般式(1)の化合物に関してm、nおよびR2の好ましい例は、前記の同化合物の説明で述べた好ましい例と同一である。
【0086】
上記トリアジン構造を含有するイソシアネート化合物と、一般式(5)で表されるシアヌール酸の配合方法に特に制限はないが、溶媒中で混合する場合は、トリアジン構造を含有するイソシアネート化合物100重量部に対するシアヌール酸の配合量は 0.01〜30重量部が好ましく、より好ましくは0.1〜10重量部、特に好ましくは0.2〜5重量部である。
【0087】
この時使用する溶媒としてはトリアジン構造を含有するイソシアネート化合物を溶解し、かつイソシアネート化合物と反応しない溶媒であれば特に制限はない。具体的にはクロロホルム、塩化メチレン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、n−メチルピロリドン、テトラヒドロフラン、アセトンなどが挙げられる。反応温度は、用いる溶媒の沸点により異なるが、目的物を高収率で得るためには、通常室温から250℃の範囲であり、好ましくは50〜230℃、より好ましくは50〜200℃の範囲である。
【0088】
反応時間は反応温度により異なるが、通常1〜120分、好ましくは10〜60分、より好ましくは10〜30分である。
【0089】
なお本反応を無溶媒中で行うと、トリアジン構造を含有するイソシアネート化合物と、一般式(5)で表されるシアヌール酸の配位が効率良く進行し、高純度、高収率でトリアジン・シアヌール酸塩含有イソシアネート化合物を形成させることができる。この時、トリアジン構造を含有するイソシアネート化合物100重量部に対するシアヌール酸の配合量は0.01〜50重量部が好ましく、より好ましくは0.1〜30重量部、特に好ましくは0.2〜10重量部である。
【0090】
加熱溶融下で混合する方法は、通常公知の方法で行うことができる。例えば、トリアジン構造を含有するイソシアネート化合物と、シアヌール酸を予備混合して、またはせずに押出機などに供給して、室温℃から280℃の温度範囲において充分混練することにより、トリアジン・シアヌール酸塩含有イソシアネート化合物を形成させることができる。混練温度はトリアジン構造を含有するイソシアネート化合物、および生成するトリアジン・シアヌール酸塩含有イソシアネート化合物の融点、軟化温度、熱安定性によるが、通常室温から280℃の温度範囲であり、好ましくは50〜250℃、より好ましくは50〜230℃である。なお、溶融状態で反応を行う場合には、反応物を溶融させるために、反応物の融点、軟化温度以上で反応させることが好ましいが、トリアジン構造を含有するイソシアネート化合物、および生成するトリアジン・シアヌール酸塩含有イソシアネート化合物の分解反応を抑制するという点、および反応を速やかに進行させる点から、反応物が固まらない程度にできる限り温度を下げて反応を行うことが好ましい。
【0091】
上記反応を溶融混練により行う場合は、例えば“ユニメルト”タイプのスクリューを備えた単軸押出機、二軸、三軸押出機およびニーダタイプの混練機などを用いることができるし、あるいは撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。また、これらの反応器は2種以上組み合わせて使用することができる。また上記反応を溶媒中で行う場合は、撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。
【0092】
混練時間は反応温度、反応装置により異なるが、通常1〜120分であり、好ましくは3〜60分、より好ましくは3〜10分である。
【0093】
上記の方法により得られたトリアジン・シアヌール酸塩含有イソシアネート化合物は、さらに前述した分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合することにより、多重水素結合性架橋体組成物を形成することができる。
【0094】
以上に述べた本発明の多重水素結合性架橋体組成物の製造方法をまとめると、下記2通りの製造方法が可能である。すなわち
(1)トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の反応により、多重水素結合性化合物を生成させた後、さらにシアヌール酸を配合することにより製造する方法、
(2)トリアジン構造を含有するイソシアネート化合物とシアヌール酸より、トリアジン・シアヌール酸塩含有イソシアネート化合物をあらかじめ生成させた後、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の反応により製造する方法である。
【0095】
なお、本発明の効果を損なわない範囲であれば、本発明の多重水素結合性架橋体組成物の製造方法は上記2通りの製造方法に限定されるものではなく、例えば、一般式(3)で表されるトリアジン化合物、一般式(4)で表されるジイソシアネート化合物、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物およびシアヌール酸を、途中反応生成物を取り出すことも、精製することもなく、一括添加により製造することもできるし、また各成分を逐次添加して製造することもできる。またトリアジン環を含有するイソシアネート化合物に、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物およびシアヌール酸を、途中生成物を精製、取り出すことなく、一括添加することもできるし、また逐次添加により生成させることも可能である。
【0096】
また、本発明の多重水素結合性化合物、または多重水素結合性架橋体組成物には、本発明の目的を損なわない範囲で、通常の添加剤、例えば紫外線吸収剤、熱安定剤、滑剤、離形剤、染料および顔料を含む着色剤などの1種または2種以上を添加することができる。また通常公知の各種ポリマーを1種または2種以上を配合することもでき、熱可逆性を呈する樹脂組成物として幅広く使用することもできる。
【0097】
また本発明の多重水素結合性化合物、または多重水素結合性架橋体組成物は、さらに充填材を添加することにより熱可逆性を保持したまま、強度、剛性、耐熱性などを大幅に向上させることができる。特に多重水素結合は充填材との接着性に優れるため、強度、剛性、耐熱性の向上効果は極めて大きいことがわかった。
【0098】
本発明の多重水素結合性化合物、または多重水素結合性架橋体組成物は、成形品として広く用いることができる。成形品とは、フィルム、シート、繊維・布、不織布、射出成形品、押出し成形品、真空圧空成形品、ブロー成形品、および他の材料との複合体などである。
【0099】
【実施例】
以下、実施例により本発明を具体的に説明する。ここで、実施例中の部数は、重量部を示す。
【0100】
(1)分子量測定
重量平均分子量は、前述したようにゲルパーミエーションクロマトグラフィー(GPC)により測定した標準ポリメチルメタクリレート換算の重量平均分子量の値である。GPC測定は、検出器にWATERS社示差屈折計WATERS410を用い、ポンプにMODEL510高速液体クロマトグラフィーを用い、カラムにShodex GPC HFIP−806MとShodex GPC HFIP−LGを直列に接続したものを用いて行った。測定条件は、流速0.5mL/minとし、溶媒にヘキサフルオロイソプロパノール(HFIP)またはクロロホルムを用い、試料濃度1mg/mLの溶液を0.1mL注入した。
【0101】
(2)NMR測定
NMR装置として日本電子データム製のJNM−AL400、FT NMR SYSTEM、AL SPECTROMETERを用い、測定物を溶解する重水素化溶媒中、例えば重水素化クロロホルム、重水素化DMSO、重水素化ヘキサフルオロイソプロパノールなどの重水素化溶媒を用い、サンプル濃度0.1〜0.5wt/vol%で測定した。積算時間はスペクトルのS/N比より適宜調整した。
【0102】
(3)溶融粘度測定
溶融粘度測定はキャピログラフ(東洋精機製作所製、1C型)を用い、長さ10.0mm、径1.0mmのキャピラリーを用いた。溶融粘度が低く、正確に粘度を測定できないものについては、溶融開始温度を指標とした。また溶融粘度が測定できるものについては、任意の温度で溶融粘度のずり速度依存性を求めた。バレル(炉体)長さ350mm、径9.55mmに試料を投入して5分間保持し、ずり速度24.32(/s)で測定した時の溶融粘度をもとめた。
【0103】
(4)成形
卓上超小型射出成形機 タッチマンTM−06型(小宮山技研)を用い、シリンダー温度を任意の温度に設定し、金型温度80℃で、厚み2mm、幅10mm、長さ75mmの小型ダンベルを作成した。また 本方法により成形加工可能なものは、成形性○、成形できないものは成形性×と評価した。
【0104】
(5)引張試験
テンシロンUTA−2.5T(オリエンティック製)を用い、ひずみ速度 10mm/min、初期試料長50mm、チャック間距離60mmで測定した。
【0105】
参考例1 ポリブチレンテレフタレート(PBT)の合成
テレフタル酸(40g)と1,4−ブタンジオール(43g)を減圧ラインのついた、試験管重合装置に秤量し、チタンテトラブトキシド(0.021g)の存在下150℃で1時間加熱攪拌し、さらに反応温度を150℃から230℃まで5時間かけて徐々に昇温した。その後1時間かけて徐々に減圧度を上げ、最終的に減圧度を0.1mmHgに到達させた。得られるポリマー分子量は、0.1mmHg下での重合時間を適宜調整し、トルクメーター値より間接的に調製し、下記のように分子量の異なる2種のポリブチレンテレフタレートPBT−1およびPBT−2を得た。
PBT−1:Mn=15100,Mw/Mn=3.2(HFIP中)
PBT−2:Mn=31400、Mw/Mn=3.3(HFIP中)。
【0106】
参考例2 ポリ乳酸(PLA)の合成
L−ラクチド 50g、エチレングリコール(PLA−1の場合は0.08g、PLA−2の場合は0.04g)を撹拌装置のついた反応容器中で、窒素雰囲気下、120℃で均一に溶解させた後、温度を150℃にし、オクチル酸錫 0.2gを加えた後、4時間重合反応させた。重合反応終了後、反応物をクロロホルムに溶解させ、メタノール中で撹拌しながら沈殿させ、モノマーを完全に除去して、下記のように分子量の異なる2種のポリ−L−乳酸PLA−1およびPLA−2を得た(収率85%)。
【0107】
実施例1
ベンゾグアナミン(10g:53.42mmol)に対し、22倍モルのヘキサメチレンジイソシアネート(200g:1.189mol)(ベンゾグアナミン中アミノ基1モルに対し、11倍モル)を加え、100℃まで温度を上げた後、触媒としてチタンテトラブトキシド(0.021g:0.062mmol)を添加し、その後100℃で6時間反応させた。反応は始終不均一系、乳白色であった。6時間後、反応溶液を冷却させ、シクロヘキサン1Lを添加、白色固体を濾過した後、濾過物を脱水したアセトンで再度5回洗浄し、40℃で24時間乾燥して目的物を得た(ベンゾグアナミンに対する収率97%)。得られた化合物の構造と1H NMR(重水素化DMSO中)より測定したスペクトルとその帰属は下記の通りである。
【0108】
【化10】
【0109】
d:9.54ppm(2H)、e:9.26ppm(2H)、a:8.23ppm(2H)、b+c:7.55ppm(3H)、f:3.31ppm(4H)、
g:1.34−1.54ppm(8H)。
【0110】
NMRスペクトルはすべて上記化学式で表されるプロトンに帰属され、かつプロトン強度比は上記化学式のプロトン数と一致した、すなわち目的物であるベンゾグアナミン・ヘキサメチレンジイソシアネートの1:2付加物(BzG−HMDI)が、高収率で得られていることが確認できた。
【0111】
実施例2、実施例3、比較例1
実施例1で得られたBzG−HMDI(42.18g:80.55mmol)に対し3倍モルのエタノール(11.13g:241.65mmol)(EA)を加え、脱水したDMSO 1Lの溶液とした。チタンテトラブトキシド(0.010g:0.031mmol)を添加後、100℃に加熱し、24時間攪拌下反応させた。 反応後、多量のメタノールを添加し、析出物を濾過し、メタノールで5回洗浄後、40℃で24時間乾燥して目的物を得た(エタノールに対する収率92%)。1H NMR(重水素化DMSO中)より測定したスペクトルより、BzG−HMDI由来のピーク(a〜f)が観察され、新たにエタノール由来のピーク(2.0ppm、3.3ppm)が観察されることから、目的の反応が進行していることがわかった。上記によるトリアジン構造を含有するイソシアネート化合物とエタノールとの付加物(2:1)であるトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)の製造例を実施例2とする。
【0112】
つぎに実施例2で得られたトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)100重量部に対し、シアヌール酸1重量部を加え100℃で、ブラベンダーを用い5分間混練し、多重水素結合性架橋体組成物(BzG−HMDI−EA−CA)を調製した(実施例3)。
【0113】
実施例2で得られた、トリアジン構造を含有するイソシアネート化合物とエタノール付加物であるトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)および実施例3で得られた多重水素結合性架橋体組成物(BzG−HMDI−EA−CA)について、卓上超小型射出成形機を用い(シリンダー温度150℃、金型温度23℃)、小型ダンベルを作成し、機械特性をエタノール単独(EA)の場合(比較例1)と比較評価した。一連の結果を表1に示す。なお比較例1のEAは液状であり分子量が低いため、成形・溶融粘度測定は困難であった。
【0114】
比較例1のEAは液体であるため、Tg、Tmは観察されず、また分子量も極めて低く、低分子量側の溶媒ノイズと重なるため、GPCでは分子量を検出することはできなかった。また液状低分子量物であるので成形加工は困難、溶融開始温度の測定も困難であった。
【0115】
一方実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)は、ガラス転移温度−30℃の粘ちょう固体形状であり、また成形可能な材料となった。極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、強く会合し、その結果、高い分子量を示し、トリアジン構造からなる多重水素結合がクロロホルム中で会合状態を呈していることがわかる。またEAは液状であるため溶融粘度測定は困難であったが、実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)は、ポリマー固有の特長である溶融粘度を示し、100℃で溶融するポリマー材料形態をとっていることがわかる。
【0116】
また実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)にシアヌール酸を配合した実施例3の多重水素結合性架橋体組成物(BzG−HMDI−EA−CA)は、極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、多重水素結合単位が強く会合し、その結果高い分子量を示し、さらに実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EG)よりも高い分子量を示し、BzG−HMDI−EAとシアヌール酸間でさらに強い会合状態を取っていることがわかる。成形加工可能であり、実施例2に比べ、さらに引張強度が高くなっていることがわかる。また流動開始温度は180℃と高く、シアヌール酸を介した多重水素結合架橋が形成していることがわかる。
【0117】
実施例4
実施例1で合成したBzG−HMDI(1:2付加物)(10g:19.10mmol)を脱水したDMSO溶媒100mlに溶解させた後、シアヌール酸(4g:31.0mmol)を添加し、室温で1時間攪拌した。多量の脱水したアセトンを添加し、目的物を析出させ、濾過した後、脱水したアセトンで再度5回洗浄し、40℃で24時間乾燥した(BzG−HMDIとシアヌール酸総重量に対する収率93%)。実施例1のBzG−HMDI の1H NMR(重水素化DMSO中)スペクトルとの比較からBzG−HMDI中に認められる9.54ppm(d:2H)、9.26ppm(e:2H)がシアヌール酸の添加により、低磁場側にそれぞれ0.5ppmシフトしていることから、目的とするベンゾグアナミン・シアヌール塩含有イソシアネート化合物を形成していることが確認できた。
【0118】
実施例5
実施例4で合成したベンゾグアナミン・シアヌール酸塩含有イソシアネート化合物10gに対し、10gのEAを添加し、脱水したDMSO500mLの溶液とした。チタンテトラブトキシド(0.010g:0.031mmol)を添加後、100℃に加熱し、24時間攪拌下反応させた。反応後、多量のメタノールを添加し、析出物を濾過し、メタノールで5回洗浄後、40℃で24時間乾燥した(エタノールに対する収率85%)。本合成方法により実施例3とは異なる合成方法により、多重水素結合性架橋体組成物(BzG−HMDI−CA−EA)を調製した。一連の結果を表2に示す。
【0119】
上記結果より、実施例3の多重水素結合架橋組成物(BzG−HMDI−EA−CA)と同様に、極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、強く会合した結果、高い分子量を示し、さらに実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)よりも高い分子量を示し、BzG−HMDI−EAとシアヌール酸間でさらに強い会合状態を取っていることがわかる。成形加工可能であり、実施例2に比べ、さらに引張強度が高くなっていることがわかる。また流動開始温度は170℃と高く、シアヌール酸を介した多重水素結合架橋が形成していることがわかる。
【0120】
実施例6、実施例7、比較例2、比較例3
実施例6では参考例1で調製したPBT−1(Mn=15100,Mw/Mn=3.2(HFIP中))100重量部に対し、実施例1で合成したBzG−HMDI1(1:2付加物)2重量部を230℃で5分間溶融混練し、トリアジン構造を含有する多重水素結合性化合物(TR−PBT)を調製した。
【0121】
さらに実施例7では、参考例1で調製したPBT−1(Mn=15100,Mw/Mn=3.2(HFIP中))100重量部に対し、実施例1で合成したBzG−HMDI1(1:2付加物)2重量部、シアヌール酸2重量部を、ブラベンダーを用い、230℃で5分間溶融混練し、多重水素結合性架橋体組成物(MHBC−PBT)を調製した。
【0122】
参考例1で調製したPBT−1を比較例2とし、同じく参考例1で調製したPBT−2(Mn=31400、Mw/Mn=3.3(HFIP中))を比較例3として、TR−PBT(実施例6)、MHBC−PBT(実施例7)について、250℃、ずり速度24.32(/s)の条件下、溶融粘度の比較を行った。また卓上超小型射出成形機を用い(シリンダー温度250℃、金型温度80℃)、小型ダンベルを作成し、機械特性を評価した。一連の結果を表3に示す。
【0123】
比較例2のPBT−1と実施例6のTR−PBT、比較例3のPBT−2の比較より、TR−PBTはPBT−2に比べ、分子量はほぼ半分であるにも関わらず、PBT−2よりも高い引張強度を示すことがわかる。特に、TR−PBTとほぼ同じ分子量を有するPBT−1は引張強度が低く、かつ破断伸びが小さい一方、TR−PBTは高い引張強度、高い破断伸びを示した。
【0124】
一方溶融粘度はPBT−1とほぼ同等の値を示し、分子量の高いPBT−2よりも流動性に優れることがわかる。すなわちTR−PBTは低分子量体であるPBT−1とほぼ同等の流動性、分子量の高いPBT−2以上の機械特性を示した。
【0125】
同様にさらにシアヌール酸を配合してなる実施例7の多重水素結合性架橋体組成物(MHBC−PBT)も同様に、PBT−2に比べ、分子量はほぼ半分であるにも関わらず、PBT−2よりも高い引張強度を示す。またMHBC−PBTとほぼ同じ分子量を有するPBT−1は引張強度が低く、かつ破断伸びが小さい一方、MHBC−PBTは高い引張強度、高い破断伸びを示した。さらにMHBC−PBT(実施例7)はTR−PBT(実施例6)に比べ、さらに引張強度が高いことがわかる。したがってシアヌール酸による架橋構造を呈しているものと考えられる。
【0126】
次に、実施例6(TR−PBT)について熱可逆性・安定性を評価した。実施例6で成形したサンプルを粉砕後、再度成形に供し、成形2回目、5回目の試験片につき、同様に分子量、溶融粘度、機械特性を評価した。結果を表4に示す。
【0127】
成形2回目、成形5回目ともに分子量変化は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時に多重水素結合が解離し、繰り返し成形加工が可能であり、かつ機械特性は高分子量PBT−2と同等、溶融粘度は低分子量PBT−1とほぼ同等の特性を示すことがわかる。
【0128】
また実施例7(MHBC−PBT)についても同様に、熱可逆性・安定性を評価したところ(表5)、繰り返し成形による分子量低下は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時にトリアジン環とシアヌール酸からなる多重水素結合性架橋が解離し、繰り返し成形加工が可能であることがわかった。
【0129】
実施例8
メラミン(10g:79.29mmol)に対し、20倍モルのヘキサメチレンジイソシアネート(266.7g:1.586mmol)(メラミン中アミノ基1モルに対し、6.7倍モル)を加え、100℃まで温度を上げた後、触媒としてチタンテトラブトキシド(0.021g:0.062mmol)を添加、その後120℃、12時間反応させた。反応は始終不均一系、乳白色であった。12時間後、反応溶液を冷却後、シクロヘキサン1Lを添加、白色固体を濾過した後、濾過物をシクロヘキサンで3回洗浄、脱水したアセトンで1回洗浄後、白色固体を40℃で24時間乾燥して目的物を得た(メラミンに対する収率70%)。得られた化合物の構造と1H NMR(重水素化DMSO中)より測定したスペクトルとその帰属は下記の通りである。
【0130】
【化11】
【0131】
a:10.05ppm(3H)、b:8.87ppm(3H)、c:3.29ppm(12H)、d:1.32−1.55ppm(24H)。
【0132】
NMRスペクトルはすべて上記化学式で表されるプロトンに帰属され、かつプロトン強度比は上記化学式のプロトン数と一致した、すなわち目的物であるメラミン・ヘキサメチレンジイソシアネートの1:3付加物(ML−HMDI)が、得られていることが確認できた。
【0133】
実施例9、10、比較例1
実施例8で調製したML−HMDI(10g:15.85mmol)、エタノール(7.3g:158.5mmol)を秤量し、脱水したDMSO50mLの溶液とした。チタンテトラブトキシド(0.010g:0.031mmol)を添加後、100℃に加熱し、24時間攪拌下反応させた。反応後、多量のメタノールを添加し、析出物を濾過し、メタノールで5回洗浄後、40℃で24時間乾燥して目的物を得た(エチレングリコールに対する収率91%)。1H NMR(重水素化DMSO中)より測定したスペクトルより、ML−HMDI由来のピーク(a〜d)が観察され、新たにエタノール由来のピーク(2.1ppm、3.25ppm)が観察されることから、目的の反応が進行していることがわかった。上記によるトリアジン構造を含有するイソシアネート化合物とエタノール付加物であるトリアジン構造を含有する多重水素結合性化合物(ML−HMDI−EA)の製造例を実施例9とする。
【0134】
つぎに上記トリアジン構造を含有する多重水素結合性化合物(ML−HMDI−EA)100重量部に対し、シアヌール酸1重量部を150℃、ブラベンダーを用い5分間混練し、多重水素結合性架橋体組成物(ML−HMDI−EG−CA)を調製した。上記による多重水素結合性架橋組成物の製造例を実施例10とする。
【0135】
上記の方法により得られた、トリアジン構造を含有するイソシアネート化合物とエチレングリコール付加物であるトリアジン構造を含有する多重水素結合性化合物(ML−HMDI−EG)を実施例9、多重水素結合性架橋体組成物(ML−HMDI−EG−CA)を実施例10、エチレングリコール(EG)を比較例1とし、卓上超小型射出成形機を用い(シリンダー温度150℃、金型温度23℃)、小型ダンベルを作成し、機械特性を評価した。一連の結果を表6に示す。なお比較例1のEGは液状であり分子量が低いため、成形・溶融粘度測定は困難であった。
【0136】
比較例1のEGは液体であるため、Tg、Tmは観察されず、また分子量も極めて低く、低分子量側の溶媒ノイズと重なるため、GPCでは分子量を検出することはできなかった。また液状低分子量物であるので成形加工は困難、溶融開始温度の測定も困難であった。
【0137】
一方実施例9のメラミン構造を含有する多重水素結合性化合物(ML−HMDI−EA)は、ガラス転移温度5℃の固体形状であり、また成形可能な材料となった。融点らしきピークは認められないが、エラスティックな材料ではなく固体粉末である。またGPC測定より、極性溶媒であるHFIP中では多重水素結合が解離しており、EGと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、高い分子量を示し、メラミン構造からなる多重水素結合がクロロホルム中で会合状態を呈していることがわかる。またEGは液状であるため溶融粘度測定は困難であったが、実施例9のメラミン構造を含有する多重水素結合性化合物(ML−HMDI−EA)は、ポリマー固有の特長である溶融粘度を示し、120℃で溶融するポリマー材料形態をとっていることがわかる。
【0138】
また実施例9のメラミン構造含有する多重水素結合性化合物(ML−HMDI−EA)にシアヌール酸を配合した実施例10の多重水素結合性架橋体組成物(ML−HMDI−EA−CA)は、極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、高い分子量を示し、さらに実施例9のメラミン構造を含有する多重水素結合性化合物(ML−HMDI−EA)よりも高い分子量を示し、ML−HMDI−EAとシアヌール酸間でさらに強い会合状態を取っていることがわかる。成形加工可能であり、実施例9に比べ、さらに引張強度が高くなっていることがわかる。また流動開始温度は190℃と高く、シアヌール酸を介した多重水素結合架橋が形成していることがわかる。
【0139】
実施例11、実施例12、比較例4、比較例5
実施例11では参考例2で調製したPLA−1(Mn=10800、Mw/Mn=4.1(HFIP中)、Mn=11000、Mw/Mn=4.0(クロロホルム中))100重量部に対し、実施例8で合成したML−HMDI(1:3付加物)2重量部をブラベンダーを用い、230℃で5分間溶融混練し、メラミン構造を含有するPLA(TR−PLA)を調製した。
【0140】
さらに実施例12では、参考例2で調製したPLA−1(Mn=10800、Mw/Mn=4.1(HFIP中)、Mn=11000、Mw/Mn=4.0(クロロホルム中))100重量部に対し、実施例8で合成したML−HMDI(1:3付加物)2重量部、シアヌール酸2重量部を、ブラベンダーを用い、230℃で5分間溶融混練し、多重水素結合性架橋体組成物(MHBC−PLA)を調製した。参考例2で調製したPLA−1を比較例4、同じく参考例2で調製したPLA−2(Mn=21400、Mw/Mn=4.2(HFIP中)
Mn=25300、Mw/Mn=4.1(クロロホルム中)を比較例5とし、TR−PLA(実施例11)、MHBC−PLA(実施例12)について、210℃、ずり速度24.32(/s)の条件下、溶融粘度測定を行った。また卓上超小型射出成形機を用い(シリンダー温度210℃、金型温度80℃)、小型ダンベルを作成し、一連の結果を表7に示す。
【0141】
PLA−1とTR−PLA、PLA−2の比較より、TR−PLA−1はPLA−2に比べ、分子量はほぼ半分であるにも関わらず、PLA−2とほぼ同等の機械特性を示すことがわかる。特に、メラミン構造を含有するTR−PLAとほぼ同じ分子量を有するPLA−1は、引張強度が低い一方、TR−PLAは高い引張強度を示した。
【0142】
一方TR−PLAの溶融粘度はPLA−1とほぼ同等の値を示し、分子量の高いPLA−2よりも流動性に優れることがわかる。すなわちTR−PLAは低分子量体であるPLA−1とほぼ同等の流動性、分子量の高いPLA−2とほぼ同等の機械特性を示した。
【0143】
また前述したように、クロロホルム中のGPC測定結果より、TR−PLAはクロロホルム中において、高い分子量を示し、TR−PLA中のメラミン構造からなる多重水素結合は非極性溶媒中では2量体以上に会合していることがわかる。固体状態のポリマー挙動は非極性溶媒中挙動に類似しているため、固体状態では多重水素結合が2量体以上に会合、溶融時には解離していることを裏付ける結果となった。
【0144】
同様にさらにシアヌール酸を配合してなる実施例12の多重水素結合性架橋体組成物(MHBC−PLA)も同様に、PLA−2に比べ、分子量はほぼ半分であるにも関わらず、PLA−2よりも高い引張強度を示す。またMHBC−PLAとほぼ同じ分子量を有するPLA−1は引張強度が低く、かつ破断伸びが小さい一方、MHBC−PLAは高い引張強度、高い破断伸びを示した。さらにMHBC−PLA(実施例12)はTR−PLA(実施例11)に比べ、さらに引張強度が高いことがわかる。したがってシアヌール酸による架橋構造を呈しているものと考えられる。
【0145】
次に、実施例11(TR−PLA)について熱可逆性・安定性を評価した。実施例11で成形したサンプルを粉砕後、再度成形に供し、成形2回目、5回目の試験片につき、同様に分子量、溶融粘度、機械特性を評価した。結果を表8に示す。
【0146】
成形2回目、成形5回目ともに分子量変化は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時に多重水素結合が解離し、繰り返し成形加工が可能であり、かつ機械特性は高分子量PLA−2と同等、溶融粘度は低分子量PLA−1とほぼ同等の特性を示すことがわかる。
【0147】
また実施例12(MHBC−PBT)についても同様に、熱可逆性・安定性を評価したところ(表9)、繰り返し成形による分子量低下は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時にメラミン環とシアヌール酸からなる多重水素結合性架橋が解離し、繰り返し成形加工が可能であることがわかった。
【0148】
【表1】
【0149】
【表2】
【0150】
【表3】
【0151】
【表4】
【0152】
【表5】
【0153】
【表6】
【0154】
【表7】
【0155】
【表8】
【0156】
【表9】
【0157】
【発明の効果】
本発明の多重水素結合性化合物および多重水素結合性架橋体組成物は熱可逆的に解離・会合を繰り返すことのできる化合物であり、そのため多重水素結合を含有する化合物は、成形温度では、熱可逆結合が解離し、常温では熱可逆結合が会合する物質となる。その機能により、溶融加工時には低分子量物のような高い流動性、高い溶融加工性を示し、一方冷却後に得られる成形品状態では、会合状態を取り、その結果高分子量体のごとくに、あるいは高度に架橋した熱硬化性樹脂のごとく高い機械特性を兼ね備える二律背反した特性を有する。
【発明の属する技術分野】
本発明は、多重水素結合性化合物、多重水素結合性架橋体組成物および成形品に関するものである。多重水素結合性化合物および多重水素結合性架橋体組成物は熱可逆的に解離・会合を繰り返すことのできる特性を有し、成形温度では、熱可逆結合が解離し、常温では熱可逆結合が会合する物質となる。すなわち本発明は、溶融加工時には低分子量物のような高い流動性、高い溶融加工性を示し、一方冷却後に得られる成形品状態では、会合状態を取り、その結果高分子量体のごとくに、あるいは高度に架橋した熱硬化性樹脂のごとく高い機械特性を兼ね備える二律背反した特性を有する熱可逆性の新規素材に関するものである。
【0002】
【従来の技術】
従来のポリマー合成技術は、主に共有結合からなるポリマー設計に主眼がおかれていた。しかしながら共有結合からなるポリマーは、一旦重合させてしまうと、その結合を熱的、機械的に開裂することは困難であり、そのため共有結合からなるポリマーをリサイクル化するには、大きなエネルギーが必要であり、このことがポリマーのリサイクルを困難にする原因ともなっていた。そのため熱的に可逆性を有する結合の導入により、熱的に非可逆的なポリマーを熱可逆化することは、リサイクル性の向上、加工プロセス時のエネルギーの低減といった地球環境保全の見地から有望な手法となり得る。
【0003】
このような背景のもと、近年、非共有結合と共有結合からなる低分子量物の分子設計研究が活発化している。非特許文献1に記載されているように代表的な非共有結合としては、イオン結合、水素結合などが挙げられるが、非共有結合の中でも特に、複数の水素結合を有する多重水素結合が近年特に注目を浴びている。例えば、多重水素結合成分として、ピリミドン単位を含有する化合物は、低分子量物であっても、有機溶媒中、あるいはバルク状態において、高分子量ポリマー固有の特性、すなわち粘弾性挙動やガラス転移温度を呈すことが報告されている。またピリミドン単位からなる多重水素結合が溶媒中、あるいはバルク状態で自己会合していることが非特許文献2に記載されている。この発見以降、多重水素結合をポリマーに導入するという試みが幾つか行われており、例えばピリミドン単位をポリオレフィンの側鎖に導入すると非極性溶媒中では、ピリミドン単位からなる多重水素結合が強く会合、極性溶媒中では解離することが非特許文献3に記載されている。また特許文献1ではカルボニル基と含窒素5員環状複素環からなる多重水素結合を側鎖に有するポリオレフィンやポリブタジエンが熱可逆性を示し、自動車タイヤに使用されている架橋性ポリマーの代替品として使用できることが開示されている。
【0004】
これらの多重水素結合性化合物は、自己相補型多重水素結合(Self−Complementary Multiple Hydrogen Bond)と呼ばれるものであり、分子中に存在する同一構造を有する多重水素結合が、会合するものである。例えば上記非特許文献2、3を例に挙げると、ピリミドン単位同士が分子間で会合するというものである。
【0005】
一方、自己相補型多重水素結合とは異なる多重水素結合、すなわち相補型多重水素結合(Complementary Multiple HydrogenBond)も報告されている。相補型多重水素結合とは、異なる2種類の多重水素結合成分が、会合構造を形成するものであり、DNAやRNA中の塩基成分のアデニンとチミンの組み合わせ、グアニンとシトシンの組み合わせのように、アデニン単独、チミン単独、グアニン単独、シトシン単独では強い水素結合は形成しないものの、アデニンとチミンの組み合わせ、グアニンとシトシンの組み合わせにより、強い水素結合を形成するものであり、これらは相補型多重水素結合に分類される。例えば、非特許文献4ではメラミン誘導体とシアヌール酸誘導体からなる多重水素結合が開示されている。また非特許文献5ではDNAやRNA中の塩基成分の誘導体である、グアニン誘導体、ジアミノピリジン誘導体とシトシン誘導体からなる多重水素結合が開示されている。また特許文献2〜4には、水素結合性ドナーとして、ピリジン環を分子中に2つ以上含有する水素結合性ドナー成分と、分子中に2つ以上のカルボキシ基を含有するポリエステル樹脂組成物の配合は、カルボキシ基とピリジン環を介し、相補型の水素結合を形成し、その結果、得られるポリエステル樹脂組成物の結晶化速度が速く、弾性率が向上することが報告されている。
【0006】
【非特許文献1】
Reinhout, D. N,“Supramolecular Materials and Technologies”,Vol. 4,1999
【0007】
【非特許文献2】
Rint P. Sijbesma et al,“SCIENCE”,1997, VOL. 278, p1601−1604
【0008】
【非特許文献3】
Lee R. Rieth et al,“Angew. Chem. Int. Ed.”, 2001, 40, No. 11, p2153−2156
【0009】
【特許文献1】
特開2002−80529号公報(第1−8頁)
【0010】
【非特許文献4】
Insung S. Choi et al,“Chem. Mater.”, 1999, 11, p684−690
【0011】
【非特許文献5】
William L. Jorgensen et al.,“J. Am. Chem. Soc.”, 1990, 112, p2008−2010
【0012】
【特許文献2】
特開2002−60601号公報(第1、2、6、7頁)
【0013】
【特許文献3】
特開2002−146169号公報(第1、6、7頁)
【0014】
【特許文献4】
特開2002−201265号公報(第1−4頁)
【0015】
【発明が解決しようとする課題】
しかし、非特許文献2に記載の技術は、もともと液状の低分子量化合物にピリミドン構造からなる自己相補型の多重水素結合を導入すると、ポリマー状態の固体が得られるという学術的知見であり、自己相補型多重水素結合が熱可逆性を示すことを示唆するものではなく、さらに得られたポリマー状固体は、実用樹脂材料として使用できるものではなかった。
【0016】
非特許文献3に記載の技術はポリオレフィンの側鎖にピリミドン構造からなる自己相補型の多重水素結合を導入したポリマーが、極性溶媒中では解離し、非極性溶媒中では会合していることを示したものであり、本文献もまた多重水素結合の熱可逆性を示すものではなかった。
【0017】
一方、特許文献1記載の技術は、非特許文献2、3に記載の自己相補型の多重水素結合とは異なる、カルボニル基と含窒素化合物からなる多重水素結合をポリマー側鎖に導入したものであり、得られたポリマーは、溶融加工時には多重水素結合による架橋が解離し、熱可塑性樹脂と類似の特性を示し、一方、低温では多重水素結合が会合、架橋構造を形成し、熱硬化性樹脂としての特徴を示すことを示したものである。すなわち、リサイクル困難な熱硬化性樹脂にカルボニル基と含窒素化合物からなる多重水素結合を導入することにより、熱硬化性樹脂を熱可逆化することによりリサイクル可能な材料にするという方法である。しかしながら、そこで使用されているカルボニル基と含窒素化合物からなる多重水素結合は、熱可逆的な会合構造だけではなく、実質、カルボニル基と含窒素化合物の分子間交換反応により、共有結合性の架橋が生じるため、熱可逆性は充分といえるものではないという問題があった。
【0018】
また非特許文献4記載の相補型の多重水素結合はメラミンアルキル置換体の合成とシアヌール酸アルキル置換体の構造解析に関する学術的知見であり、該多重水素結合が熱可逆性を示すことを示唆するものでも、熱可逆的なポリマー特性を呈することを示唆するものでもなかった。また非特許文献5では、DNAやRNA中の塩基成分の誘導体である、グアニン誘導体、ジアミノピリジン誘導体とシトシン誘導体からなる多重水素結合の相互作用に関する学術知見であり、本公知例もまた、該多重水素結合が熱可逆性を示すことを示唆するものでも、熱可逆的なポリマー特性を呈することを示唆するものでもなかった。またグアニン誘導体、ジアミノピリジン誘導体など極めて複雑な構造からなる化合物であり、実用性の面でも使用困難な化合物からなる多重水素結合化合物であった。
【0019】
一方特許文献2〜4記載の技術は、多重水素結合とは異なり、カルボキシ基とピリジン環からなる非常に弱い1重の相補型水素結合による分子間相互作用を用いたポリエステル樹脂に関する技術であり、水素結合強度や熱可逆性は不十分であった。
【0020】
本発明の目的は、従来の技術とは全く異なり、極めて単純な構造でかつすでに化学産業の中で高頻度で使用されている化合物から形成される多重水素結合を分子設計し、該多重水素結合を分子中に導入することにより、溶融成形加工温度では多重水素結合が解離することで、低分子量化合物のような良流動性を示し、一方解離温度以下では多重水素結合が会合し、ポリマーと同様の形状、機械特性を有し、かつ滞留安定性・リサイクル性に優れるといった熱可逆的特徴を有する多重水素結合性化合物、多重水素結合性架橋体組成物とその製造方法および成形品を提供することである。
【0021】
【課題を解決するための手段】
本発明者らは、上記の目的を達成すべく鋭意検討した結果、トリアジン環を含有するイソシアネート化合物が自己相補型多重水素結合性を示し、さらにトリアジン環を含有するイソシアネート化合物を導入した分子が熱可逆性のポリマー形状を呈すること、さらに、トリアジン環を含有するイソシアネート化合物を導入した分子とシアヌール酸がさらにより強固な熱可逆的な多重水素結合性架橋体を形成し、解離温度以下では強く会合し、分子量の高いポリマー形態、あるいは架橋構造を呈し、かつ解離温度以上の高い温度領域では分子量の低いポリマー挙動を呈することを見出し、本発明に至ったものである。
【0022】
すなわち、本発明は、
(i)下記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物、
【0023】
【化3】
【0024】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0025】
(ii)下記一般式(2)で表されるトリアジン構造単位を含有する多重水素結合性化合物、
【0026】
【化4】
【0027】
式中mは0〜5の整数、nは2〜10の整数、R2は炭素数1〜6のアルキル基であり、Yは有機基を表す。
【0028】
(iii)(i)記載のトリアジン構造を含有するイソシアネート化合物と、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物とを加熱溶融下あるいは溶液中で配合することを特徴とする(ii)記載のトリアジン構造を含有する多重水素結合性化合物の製造方法、
(iv)(ii)記載のトリアジン構造を含有する多重水素結合性化合物に対し、さらにシアヌール酸を配合してなる多重水素結合性架橋体組成物、
(v)(i)記載のトリアジン構造を含有する多重水素結合性化合物に対し、シアヌール酸を配合してなるトリアジン・シアヌール酸塩含有イソシアネート化合物、
(vi)(v)のトリアジン・シアヌール酸塩含有イソシアネート化合物に対し、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合してなる多重水素結合性架橋体組成物、
(vii)(ii)に記載の多重水素結合性化合物、または(iv)、(vi)いずれかに記載の多重水素結合性架橋体組成物を成形してなる成形品である。
【0029】
【発明の実施の形態】
本発明のトリアジン構造を含有するイソシアネート化合物とは、下記一般式(1)で表されるトリアジン構造とイソシアネート構造を含有する化合物であって、多重水素結合性を示す。その両末端のイソシアネート基の反応性を利用し、分子中に少なくとも1つ以上の水酸基やアミノ基を含有する化合物との反応により、多重水素結合を導入し、かつ熱可逆性を付与できる化合物である。
【0030】
【化5】
【0031】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0032】
mは入手性の面から0〜2の整数が好ましく、特に好ましくは0である。
【0033】
nは熱安定性の面から4以上の整数が好ましく、特に好ましくは6である。
【0034】
R2は炭素数1〜6のアルキル基であり、例えばメチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、ter−ブチル、n−ペンチル、イソペンチル、ネオペンチル、n−ヘキシル、シクロヘキシルなどが挙げられるが、入手性の面からメチルが好ましい。また一般式(1)中のトリアジン構造に結合していない方のイソシアネート基に対するR2のフェニレン基上基の位置はオルト位、メタ位いずれでもよいが、オルト位のものが入手性の面で好ましい。
【0035】
上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物は下記式に示す方法により製造することができる。すなわち下記一般式(3)で表されるトリアジン化合物と下記一般式(4)で表されるジイソシアネートの反応を溶媒中あるいは無溶媒中で反応させることにより、製造することができる。
【0036】
【化6】
【0037】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0038】
m、n、およびR2の好ましい例は、一般式(1)の化合物に関して述べたとおりである。
【0039】
上記反応条件は特に制限はないが、溶媒中で反応させる場合は、上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物を高収率、高純度で得るためには、トリアジン化合物(3)中、アミノ基1モルに対するジイソシアネート化合物(4)のモル比率が2倍モル以上、20倍モル以下が好ましく、より好ましくは3倍モル以上10倍モル以下、特に好ましくは3倍モル以上5倍モル以下である。つまりアミノ基を2つ有するトリアジン化合物、例えばベンゾグアナミンの場合、ジイソシアネート化合物(4)のモル比率が4倍モル以上、40倍モル以下が好ましく、より好ましくは6倍モル以上20倍モル以下、特に好ましくは6倍モル以上10倍モル以下ということである。
【0040】
トリアジン化合物(3)としては、例えばメラミン、2,4−ジアミノ−6−フェニル−1,3,5−トリアジン(ベンゾグアナミン)、2,4−ジアミノ−6−メチル−1,3,5−トリアジン(アセトグアナミン)、2,4−ジアミノ−6−エチル−1,3,5−トリアジン、2,4−ジアミノ−6−プロピル−1,3,5−トリアジン、2,4−ジアミノ−6−ブチル−1,3,5−トリアジン、2,4−ジアミノ−6−ペンチル−1,3,5−トリアジン、2,4−ジアミノ−6−ヘキシル−1,3,5−トリアジンなどが挙げられるが、入手性の面から、メラミン、2,4−ジアミノ−6−フェニル−1,3,5−トリアジン(ベンゾグアナミン)、2,4−ジアミノ−6−メチル−1,3,5−トリアジン(アセトグアナミン)、2,4−ジアミノ−6−エチル−1,3,5−トリアジンが好ましく、特に好ましくはメラミン、2,4−ジアミノ−6−フェニル−1,3,5−トリアジン(ベンゾグアナミン)、2,4−ジアミノ−6−メチル−1,3,5−トリアジン(アセトグアナミン)である。
【0041】
イソシアネート化合物(4)の具体例としては、例えばエチレンジイソシアネート、プロピレンジイソシアネート、ブタンジイソシアネート、ペンタンジイソシアネート、ヘキサメチレンジイソシアネートなどが挙げられるが、入手性および得られるトリアジン構造を含有するイソシアネート化合物の溶解性、融解性の面からヘキサメチレンジイソシアネートが好ましい。
【0042】
この時使用する溶媒としてはジイソシアネート化合物(4)を溶解する溶媒であり、かつジイソシアネート化合物(4)と反応しない溶媒であれば特に制限はない。具体的にはジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、n−メチルピロリドン、アセトン、メチルエチルケトン、ピリジン、テトラヒドロフラン、クロロホルムなどが挙げられる。
【0043】
反応温度は、用いる溶媒の沸点により異なるが、目的物を高収率で得るためには、通常室温から200℃の範囲であり、好ましくは50〜180℃、より好ましくは80〜120℃の範囲である。
【0044】
反応時間は反応温度により異なるが、通常1〜12時間、好ましくは1〜6時間である。
【0045】
なお本製造方法は無溶媒中で行うと、生成した上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物を高収収率、高純度で得られるばかりでなく、反応時間を短縮でき、また洗浄工程が簡略化できるという特徴を付与することができる。無溶媒中で行う場合は、トリアジン化合物(3)とジイソシアネート化合物(4)を均一なスラリー状にする必要があるため、トリアジン化合物(3)中、アミノ基1モルに対するジイソシアネート化合物(4)の比率は、3倍モル以上、20倍モル以下が好ましく、より好ましくは5倍モル以上10倍モル以下、特に好ましくは5倍モル以上7倍モル以下である。
【0046】
この時の反応温度は、通常室温から200℃の範囲であり、好ましくは50〜150℃、より好ましくは50〜120℃の範囲である。
【0047】
また、本反応は溶媒中、あるいは無溶媒中に関わらず、触媒を用いることにより、重合時間を短縮することができる。触媒としては、例えば、錫、亜鉛、鉛、チタン、ビスマス、ジルコニウム、ゲルマニウム、アンチモン、アルミニウムなどの金属及びその誘導体が挙げられる。誘導体としては、金属アルコキシド、カルボン酸塩、炭酸塩、酸化物、ハロゲン化物が好ましい。具体的には、塩化錫、オクチル酸錫、塩化亜鉛、酢酸亜鉛、酸化鉛、炭酸鉛、塩化チタン、アルコキシチタン、酸化ゲルマニウム、酸化ジルコニウムなどが挙げられる。これらの中でも、錫化合物が好ましく、特にオクチル酸錫がより好ましい。
【0048】
触媒の添加量は、特に限定されるものではないが、使用するトリアジン化合物(3)とジイソシアネート化合物(4)の総モル数に対して、0.001〜2モル%が好ましく、特に0.01〜0.5モル%がより好ましい。
【0049】
本反応は溶媒中、無溶媒中に関わらず、通常不均一系で進行するため、沈殿した目的物は濾過した後、過剰のジイソシアネート化合物(4)を溶媒洗浄することにより、一般式(1)で表されるトリアジン構造を有するイソシアネート化合物を高純度で得ることができる。使用する洗浄溶媒は特に限定されるものではないが、ジイソシアネート化合物(4)を溶解し、かつ目的物であるトリアジン構造を含有するイソシアネート化合物を溶解せず、さらにトリアジン構造を含有するイソシアネート化合物と反応しない溶媒であれば特に制限はない。具体的には、ヘキサン、シクロヘキサン、ベンゼン、トルエンなどによって代表される炭化水素溶媒、アセトン、メチルエチルケトンなどのケトン溶媒、ジエチルエーテルなどのエーテル溶媒などが挙げられる。
【0050】
本発明のトリアジン構造を含有するイソシアネート化合物は、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合することにより、下記一般式(2)で表されるトリアジン構造を含有する多重水素結合性化合物を形成することができる。
【0051】
【化7】
【0052】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基であり、Yは有機基を表す。ここでm、nおよびR2については前記一般式(1)におけるm、nおよびR2と同様である。
【0053】
上記一般式中、Yは有機基を示し、後述するように分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物と一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物との付加反応により生成する残基を表している。
【0054】
ここで分子中に少なくとも1つ以上の水酸基を含有する化合物としては、例えばメタノール、エタノール、プロパノール、ブタノールなどの分子中に1つの水酸基を有するアルコール類、エチレングリコール、プロピレングリコール、ブタンジオール、シクロヘキサンジメタノールなどのジオール類、分子中に3つ以上の水酸基を有する多価アルコールのみならず、ポリマー末端やポリマー側鎖に1つ以上の水酸基を有するポリマー、例えばポリエチレングリコール類、ポリプロピレングリコール類、ポリエステル樹脂、ポリカーボネート樹脂、液晶ポリエステル樹脂、ビニルアルコール単位を含有する共重合体、エチレン・ビニルアルコール共重合体などの変性ポリエチレン樹脂、プロピレン・ビニルアルコール共重合体などの変性ポリプロピレン樹脂、2−ヒドロキシエチル(メタ)アクリレート単位を含有するビニル系共重合体、エポキシ樹脂、フェノール樹脂など通常公知のものを幅広く使用することができる。
【0055】
また分子中に少なくとも1つ以上のアミノ基を含有する化合物としては、例えば、エチルアミン、プロピルアミン、ブチルアミン、ペンチルアミン、ヘキシルアミンなどのアミン類、エチレンジアミン、1,3−ペンタンジアミン、1,4−ブタンジアミン、1,5−ペンタンジアミン、1,6−ヘキサメチレンジアミンなどのジアミン類、分子中に3つ以上のアミノ基を含有する多価アミンのみならず、ポリマー末端やポリマー側鎖に1つ以上のアミノ基を有するポリマー、例えば、ポリアミン類、ポリイミン類、ポリアミド樹脂、メラミン樹脂、ポリアクリルアミド、ポリアクリルアミド共重合体、ポリビニルアミン、ポリビニルアミン共重合体、ポリビニルトリアジン、ポリビニルトリアジン共重合体など、通常公知のものを幅広く使用することができる。
【0056】
従って上記一般式Yで表される有機基は、トリアジン構造を含有するイソシアネート化合物と付加反応する上記の分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の水酸基またはアミノ基に結合している有機残基に対応するものである。例えばメタノール、エタノール、プロパノールなどの分子中に1つの水酸基を有するアルコール類とイソシアネートの付加反応物残基、エチレングリコール、プロピレングリコール、ブタンジオール、シクロヘキサンジメタノールなどのジオール類とイソシアネートの付加反応物残基、分子中に3つ以上の水酸基を有する多価アルコールとイソシアネートの付加反応物残基、ポリマー末端やポリマー側鎖に1つ以上の水酸基を有するポリマー、例えばポリエチレングリコール類、ポリプロピレングリコール類、ポリエステル樹脂、ポリカーボネート樹脂、液晶ポリエステル樹脂、ビニルアルコール単位を含有する共重合体、エチレン・ビニルアルコール共重合体などの変性ポリエチレン樹脂、プロピレン・ビニルアルコール共重合体などの変性ポリプロピレン樹脂、2−ヒドロキシエチル(メタ)アクリレート単位を含有するビニル系共重合体、エポキシ樹脂、フェノール樹脂とイソシアネートの付加反応物残基などが例示できる。
【0057】
さらに有機残基Yとしては、例えば、エチルアミン、プロピルアミン、ブチルアミン、ペンチルアミン、ヘキシルアミンなどのアミン類とイソシアネートの付加反応物残基、エチレンジアミン、1,3−ペンタンジアミン、1,4−ブタンジアミン、1,5−ペンタンジアミン、1,6−ヘキサメチレンジアミンなどのジアミン類とイソシアネートの付加反応物残基、分子中に3つ以上のアミノ基を含有する多価アミンとイソシアネートの付加反応物残基のみならず、ポリマー末端やポリマー側鎖に1つ以上のアミノ基を有するポリマー、例えば ポリアミン類、ポリイミン類、ポリアミド樹脂、メラミン樹脂、ポリアクリルアミド、ポリアクリルアミド共重合体、ポリビニルアミン、ポリビニルアミン共重合体、ポリビニルトリアジン、ポリビニルトリアジン共重合体とイソシアネートの付加反応物残基など、種々のものを挙げることができる。
【0058】
上記一般式(2)で表される多重水素結合性化合物は、前述の通り、トリアジン構造を含有するイソシアネート化合物と、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合することにより製造することができる。
【0059】
この時トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の配合比率は、特に制限はないが、未反応の水酸基、アミノ基が残存しないように反応を完結させるためには、トリアジン構造を含有するイソシアネート化合物中のイソシアネート基1モルに対して、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を当モル以上配合することが好ましく、より好ましくは2倍モル以上である。なお未反応の水酸基、アミノ基が残存しても本発明の効果は発揮できるが、未反応の水酸基またはアミノ基が残存しない方が本発明の効果を充分発揮させることができる。
【0060】
加熱溶融下で混合する方法は、通常公知の方法で行うことができる。例えば、トリアジン構造を含有するイソシアネート化合物と、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を予備混合して、またはせずに押出機などに供給して、室温から250℃の温度範囲において充分混練することにより、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の反応が進行し、目的物であるトリアジン構造を含有する多重水素結合性化合物を製造することができる。
【0061】
混練温度はトリアジン構造を含有する多重水素結合性化合物の熱安定性の面から、通常室温から250℃の温度範囲であり、50〜230℃が好ましく、50〜200℃の温度範囲がより好ましい。
【0062】
なお、無溶媒下、溶融状態で混練を行う場合には、反応物を溶融させるために、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の融点、あるいは軟化点以上で反応させることが好ましいが、生成するトリアジン構造を含有する多重水素結合性化合物の分解反応を抑制するという点で、反応物が固まらない程度にできる限り温度を下げて反応を行うことが好ましい。
【0063】
また、溶液中で混練を行う場合には、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物のいずれかを溶解し、かつトリアジン構造を含有するイソシアネート化合物と反応しない溶媒を用いることができる。この時、さらに両成分を溶解する溶媒を用いると、より反応が速やかに進行するが、いずれか一方の成分が溶媒に溶解しなくても、本反応は不均一系でも進行する。しかし、トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の両方を溶解し、かつトリアジン構造を含有するイソシアネート化合物と反応しない溶媒中での反応の方が、反応時間が短縮でき、また生成物であるトリアジン構造を含有する多重水素結合性化合物を高純度で生成させることができる。
【0064】
したがってトリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物のいずれかが溶解しない場合は、溶融混練により製造することが好ましい。
【0065】
本反応を溶媒中で行う場合、使用される溶媒としては、たとえば、クロロホルム、塩化メチレン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、ピリジン、ジメチルアセトアミド、N−メチルピロリドンなどを用いることができる。反応後に溶媒を除去する必要がある場合、溶媒を除去する方法としては、特に限定されるものではなく、たとえば室温で溶媒を揮発させる方法、減圧下で溶媒の沸点以上の温度で溶媒を揮発させる方法などを用いることができる。あるいは、生成したトリアジン構造を含有する多重水素結合性化合物を沈殿させうる溶媒中に、投下し、目的物を回収することもできる。
【0066】
反応を溶融混練により行う場合は、例えば“ユニメルト”タイプのスクリューを備えた単軸押出機、二軸、三軸押出機およびニーダタイプの混練機などを用いることができるし、あるいは撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。また、これらの反応器は2種以上組み合わせて使用することができる。反応を溶媒中で行う場合は、撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。
【0067】
本発明のトリアジン構造を含有する多重水素結合性化合物(2)は、下記一般式で表されるように、さらにシアヌール酸(5)と溶融または溶液中で配合することにより、さらにより強固な多重水素結合、すなわちトリアジン単位とシアヌール酸単位を介した、多重水素結合性架橋体組成物を形成することができる。
【0068】
この時、トリアジン構造を含有する多重水素結合性化合物(2)と、一般式(5)で表されるシアヌール酸を溶融または溶液中で配合することにより、両者間で多重水素結合を形成するが、その構造はいくつかの会合状態を呈するため、明確に化学式で表記することは学術的にも困難であるが、実質的に下記一般式(6)で表される構造を有すると推定される。
【0069】
【化8】
【0070】
式中mは0〜5の整数、nは2〜10の整数、R2は炭素数1〜6のアルキル基であり、Yは有機基を表す。
【0071】
すなわち上記一般式(2)で表されるトリアジン構造を含有する多重水素結合性化合物と上記一般式(5)で表されるシアヌール酸の間で、多重水素結合性の熱可逆架橋を形成すると推定されるが、生成物の構造は一般式(6)に限定されるものではなく、一般式(5)で表されるシアヌール酸1モルに対し、トリアジン構造を含有する多重水素結合性化合物(2)の1倍モル以上が配位、会合、または弱く相互作用しているものが存在すれば特に制限はない。また会合していないトリアジン構造を含有する多重水素結合性化合物やシアヌール酸が存在していても、本発明の効果を充分発揮することができるが、理想的にはシアヌール酸1モルに対し、トリアジン構造を含有する多重水素結合性化合物の3倍モル以上が配位、会合、または弱く相互作用したものが存在することが特に好ましい。
【0072】
ここで用いる一般式(2)の化合物に関してm、nおよびR2の好ましい例は、前記の同化合物の説明で述べた好ましい例と同一である。
【0073】
トリアジン構造を含有する多重水素結合性化合物(2)と、一般式(5)で表されるシアヌール酸の配合方法に特に制限はないが、溶媒中で混合する場合は、多重水素結合性化合物100重量部に対するシアヌール酸の配合量は 0.01〜30重量部が好ましく、より好ましくは0.1〜10重量部、特に好ましくは0.2〜5重量部である。
【0074】
この時使用する溶媒としてはトリアジン構造を含有する多重水素結合性化合物を溶解する溶媒であれば特に制限はない。具体的には塩化メチレン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、n−メチルピリミドン、テトラヒドロフラン、クロロホルム、ヘキサフロロイソプロパノールなどが挙げられる。反応温度は、用いる溶媒の沸点により異なるが、目的物を高収率で得るためには、通常室温から200℃の範囲が好ましく、より好ましくは80〜150℃の範囲である。
【0075】
反応時間は反応温度により異なるが、通常1〜60分、好ましくは5〜40分、より好ましくは10〜30分である。
【0076】
なお無溶媒中で行うと、トリアジン構造を含有する多重水素結合性化合物と、一般式(5)で表されるシアヌール酸の配位が効率良く進行し、強い多重水素結合性架橋生成物を形成させることができる。この時、多重水素結合性化合物100重量部に対するシアヌール酸の配合量は0.01〜50重量部が好ましく、より好ましくは0.1〜30重量部、特に好ましくは0.2〜10重量部である。
【0077】
加熱溶融下で混合する方法は、通常公知の方法で行うことができる。例えば、トリアジン構造を含有する多重水素結合性化合物と、シアヌール酸を予備混合して、またはせずに押出機などに供給して、室温℃から280℃の温度範囲において充分混練することにより、トリアジン構造を含有する多重水素結合性化合物とシアヌール酸の配位を進行させることができる。混練温度はトリアジン構造を含有する多重水素結合性化合物の熱安定性の面から、通常室温から280℃の温度範囲であり、好ましくは50〜250℃、より好ましくは50〜230℃である。なお、溶融状態で反応を行う場合には、反応物を溶融させるために、反応物の融点以上、または軟化点温度以上で反応させることが好ましいが、トリアジン構造を含有する多重水素結合性化合物の分解反応を抑制するという点と同時に、反応を促進するという点から、反応物が固まらない程度にできる限り温度を下げて反応を行うことが好ましい。
【0078】
上記の反応を溶融混練により行う場合は、例えば“ユニメルト”タイプのスクリューを備えた単軸押出機、二軸、三軸押出機およびニーダタイプの混練機などを用いることができるし、あるいは撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。また、これらの反応器は2種以上組み合わせて使用することができる。反応を溶媒中で行う場合は、撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることもできる。
【0079】
以上詳細に説明したように、本発明の多重水素結合性架橋体組成物は、トリアジン環を含有するジイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物から得られるトリアジン環を含有する多重水素結合性化合物に、さらにシアヌール酸を配合することにより製造することができる。
【0080】
さらにその他の製造方法として、本発明の多重結合性架橋体組成物は、あらかじめ、トリアジン環を含有するジイソシアネート化合物にシアヌール酸を配合することで、トリアジン・シアヌール酸塩を含有するイソシアネート化合物を製造した後、引き続き、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を溶融または溶液中で混合することにより、多重水素結合性架橋体組成物を製造することもできる。
【0081】
このような方法で用いられるトリアジン・シアヌール酸塩含有イソシアネート化合物とは、下記一般式で表されるようにトリアジン構造を含有するイソシアネート化合物(1)と、一般式(5)で表されるシアヌール酸を溶融または溶液中で配合することにより得られる化合物である。トリアジン構造を含有するイソシアネート化合物と、一般式(5)で表されるシアヌール酸を溶融または溶液中で配合することにより、両者間で水素結合を形成せしめることができるが、その構造は幾つかの会合状態を呈するため、明確に化学式により表記することは学術的にも困難であるけれども、実質的に下記一般式(7)で表される構造を有すると推定される。
【0082】
【化9】
【0083】
式中mは0〜5の整数、nは2〜10の整数であり、R2は炭素数1〜6のアルキル基を表す。
【0084】
すなわち上記一般式(1)で表されるトリアジン構造を含有するイソシアネート化合物と一般式(5)で表されるシアヌール酸の間で、多重水素結合を形成すると推定されるが、生成物の構造は一般式(7)に限定されるものではなく、一般式(5)で表されるシアヌール酸1モルに対し、トリアジン構造を含有するイソシアネート化合物が1倍モル以上が配位、会合、または弱く相互作用しているものが存在すれば特に制限はない。また会合していないトリアジン構造を含有するイソシアネート化合物やシアヌール酸が存在していても、本発明の効果を充分発揮することができる。しかしながら理想的にはシアヌール酸1モルに対し、トリアジン構造を含有するイソシアネート化合物の3倍モル以上が配位、会合、または弱く相互作用したものが存在することが特に好ましい。
【0085】
ここで用いる一般式(1)の化合物に関してm、nおよびR2の好ましい例は、前記の同化合物の説明で述べた好ましい例と同一である。
【0086】
上記トリアジン構造を含有するイソシアネート化合物と、一般式(5)で表されるシアヌール酸の配合方法に特に制限はないが、溶媒中で混合する場合は、トリアジン構造を含有するイソシアネート化合物100重量部に対するシアヌール酸の配合量は 0.01〜30重量部が好ましく、より好ましくは0.1〜10重量部、特に好ましくは0.2〜5重量部である。
【0087】
この時使用する溶媒としてはトリアジン構造を含有するイソシアネート化合物を溶解し、かつイソシアネート化合物と反応しない溶媒であれば特に制限はない。具体的にはクロロホルム、塩化メチレン、アセトニトリル、ジメチルスルホキシド、ジメチルホルムアミド、ジメチルアセトアミド、n−メチルピロリドン、テトラヒドロフラン、アセトンなどが挙げられる。反応温度は、用いる溶媒の沸点により異なるが、目的物を高収率で得るためには、通常室温から250℃の範囲であり、好ましくは50〜230℃、より好ましくは50〜200℃の範囲である。
【0088】
反応時間は反応温度により異なるが、通常1〜120分、好ましくは10〜60分、より好ましくは10〜30分である。
【0089】
なお本反応を無溶媒中で行うと、トリアジン構造を含有するイソシアネート化合物と、一般式(5)で表されるシアヌール酸の配位が効率良く進行し、高純度、高収率でトリアジン・シアヌール酸塩含有イソシアネート化合物を形成させることができる。この時、トリアジン構造を含有するイソシアネート化合物100重量部に対するシアヌール酸の配合量は0.01〜50重量部が好ましく、より好ましくは0.1〜30重量部、特に好ましくは0.2〜10重量部である。
【0090】
加熱溶融下で混合する方法は、通常公知の方法で行うことができる。例えば、トリアジン構造を含有するイソシアネート化合物と、シアヌール酸を予備混合して、またはせずに押出機などに供給して、室温℃から280℃の温度範囲において充分混練することにより、トリアジン・シアヌール酸塩含有イソシアネート化合物を形成させることができる。混練温度はトリアジン構造を含有するイソシアネート化合物、および生成するトリアジン・シアヌール酸塩含有イソシアネート化合物の融点、軟化温度、熱安定性によるが、通常室温から280℃の温度範囲であり、好ましくは50〜250℃、より好ましくは50〜230℃である。なお、溶融状態で反応を行う場合には、反応物を溶融させるために、反応物の融点、軟化温度以上で反応させることが好ましいが、トリアジン構造を含有するイソシアネート化合物、および生成するトリアジン・シアヌール酸塩含有イソシアネート化合物の分解反応を抑制するという点、および反応を速やかに進行させる点から、反応物が固まらない程度にできる限り温度を下げて反応を行うことが好ましい。
【0091】
上記反応を溶融混練により行う場合は、例えば“ユニメルト”タイプのスクリューを備えた単軸押出機、二軸、三軸押出機およびニーダタイプの混練機などを用いることができるし、あるいは撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。また、これらの反応器は2種以上組み合わせて使用することができる。また上記反応を溶媒中で行う場合は、撹拌槽型反応器、ミキサー型反応器、塔型反応器および押出し機型反応器などを用いることができる。
【0092】
混練時間は反応温度、反応装置により異なるが、通常1〜120分であり、好ましくは3〜60分、より好ましくは3〜10分である。
【0093】
上記の方法により得られたトリアジン・シアヌール酸塩含有イソシアネート化合物は、さらに前述した分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合することにより、多重水素結合性架橋体組成物を形成することができる。
【0094】
以上に述べた本発明の多重水素結合性架橋体組成物の製造方法をまとめると、下記2通りの製造方法が可能である。すなわち
(1)トリアジン構造を含有するイソシアネート化合物と分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の反応により、多重水素結合性化合物を生成させた後、さらにシアヌール酸を配合することにより製造する方法、
(2)トリアジン構造を含有するイソシアネート化合物とシアヌール酸より、トリアジン・シアヌール酸塩含有イソシアネート化合物をあらかじめ生成させた後、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物の反応により製造する方法である。
【0095】
なお、本発明の効果を損なわない範囲であれば、本発明の多重水素結合性架橋体組成物の製造方法は上記2通りの製造方法に限定されるものではなく、例えば、一般式(3)で表されるトリアジン化合物、一般式(4)で表されるジイソシアネート化合物、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物およびシアヌール酸を、途中反応生成物を取り出すことも、精製することもなく、一括添加により製造することもできるし、また各成分を逐次添加して製造することもできる。またトリアジン環を含有するイソシアネート化合物に、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物およびシアヌール酸を、途中生成物を精製、取り出すことなく、一括添加することもできるし、また逐次添加により生成させることも可能である。
【0096】
また、本発明の多重水素結合性化合物、または多重水素結合性架橋体組成物には、本発明の目的を損なわない範囲で、通常の添加剤、例えば紫外線吸収剤、熱安定剤、滑剤、離形剤、染料および顔料を含む着色剤などの1種または2種以上を添加することができる。また通常公知の各種ポリマーを1種または2種以上を配合することもでき、熱可逆性を呈する樹脂組成物として幅広く使用することもできる。
【0097】
また本発明の多重水素結合性化合物、または多重水素結合性架橋体組成物は、さらに充填材を添加することにより熱可逆性を保持したまま、強度、剛性、耐熱性などを大幅に向上させることができる。特に多重水素結合は充填材との接着性に優れるため、強度、剛性、耐熱性の向上効果は極めて大きいことがわかった。
【0098】
本発明の多重水素結合性化合物、または多重水素結合性架橋体組成物は、成形品として広く用いることができる。成形品とは、フィルム、シート、繊維・布、不織布、射出成形品、押出し成形品、真空圧空成形品、ブロー成形品、および他の材料との複合体などである。
【0099】
【実施例】
以下、実施例により本発明を具体的に説明する。ここで、実施例中の部数は、重量部を示す。
【0100】
(1)分子量測定
重量平均分子量は、前述したようにゲルパーミエーションクロマトグラフィー(GPC)により測定した標準ポリメチルメタクリレート換算の重量平均分子量の値である。GPC測定は、検出器にWATERS社示差屈折計WATERS410を用い、ポンプにMODEL510高速液体クロマトグラフィーを用い、カラムにShodex GPC HFIP−806MとShodex GPC HFIP−LGを直列に接続したものを用いて行った。測定条件は、流速0.5mL/minとし、溶媒にヘキサフルオロイソプロパノール(HFIP)またはクロロホルムを用い、試料濃度1mg/mLの溶液を0.1mL注入した。
【0101】
(2)NMR測定
NMR装置として日本電子データム製のJNM−AL400、FT NMR SYSTEM、AL SPECTROMETERを用い、測定物を溶解する重水素化溶媒中、例えば重水素化クロロホルム、重水素化DMSO、重水素化ヘキサフルオロイソプロパノールなどの重水素化溶媒を用い、サンプル濃度0.1〜0.5wt/vol%で測定した。積算時間はスペクトルのS/N比より適宜調整した。
【0102】
(3)溶融粘度測定
溶融粘度測定はキャピログラフ(東洋精機製作所製、1C型)を用い、長さ10.0mm、径1.0mmのキャピラリーを用いた。溶融粘度が低く、正確に粘度を測定できないものについては、溶融開始温度を指標とした。また溶融粘度が測定できるものについては、任意の温度で溶融粘度のずり速度依存性を求めた。バレル(炉体)長さ350mm、径9.55mmに試料を投入して5分間保持し、ずり速度24.32(/s)で測定した時の溶融粘度をもとめた。
【0103】
(4)成形
卓上超小型射出成形機 タッチマンTM−06型(小宮山技研)を用い、シリンダー温度を任意の温度に設定し、金型温度80℃で、厚み2mm、幅10mm、長さ75mmの小型ダンベルを作成した。また 本方法により成形加工可能なものは、成形性○、成形できないものは成形性×と評価した。
【0104】
(5)引張試験
テンシロンUTA−2.5T(オリエンティック製)を用い、ひずみ速度 10mm/min、初期試料長50mm、チャック間距離60mmで測定した。
【0105】
参考例1 ポリブチレンテレフタレート(PBT)の合成
テレフタル酸(40g)と1,4−ブタンジオール(43g)を減圧ラインのついた、試験管重合装置に秤量し、チタンテトラブトキシド(0.021g)の存在下150℃で1時間加熱攪拌し、さらに反応温度を150℃から230℃まで5時間かけて徐々に昇温した。その後1時間かけて徐々に減圧度を上げ、最終的に減圧度を0.1mmHgに到達させた。得られるポリマー分子量は、0.1mmHg下での重合時間を適宜調整し、トルクメーター値より間接的に調製し、下記のように分子量の異なる2種のポリブチレンテレフタレートPBT−1およびPBT−2を得た。
PBT−1:Mn=15100,Mw/Mn=3.2(HFIP中)
PBT−2:Mn=31400、Mw/Mn=3.3(HFIP中)。
【0106】
参考例2 ポリ乳酸(PLA)の合成
L−ラクチド 50g、エチレングリコール(PLA−1の場合は0.08g、PLA−2の場合は0.04g)を撹拌装置のついた反応容器中で、窒素雰囲気下、120℃で均一に溶解させた後、温度を150℃にし、オクチル酸錫 0.2gを加えた後、4時間重合反応させた。重合反応終了後、反応物をクロロホルムに溶解させ、メタノール中で撹拌しながら沈殿させ、モノマーを完全に除去して、下記のように分子量の異なる2種のポリ−L−乳酸PLA−1およびPLA−2を得た(収率85%)。
【0107】
実施例1
ベンゾグアナミン(10g:53.42mmol)に対し、22倍モルのヘキサメチレンジイソシアネート(200g:1.189mol)(ベンゾグアナミン中アミノ基1モルに対し、11倍モル)を加え、100℃まで温度を上げた後、触媒としてチタンテトラブトキシド(0.021g:0.062mmol)を添加し、その後100℃で6時間反応させた。反応は始終不均一系、乳白色であった。6時間後、反応溶液を冷却させ、シクロヘキサン1Lを添加、白色固体を濾過した後、濾過物を脱水したアセトンで再度5回洗浄し、40℃で24時間乾燥して目的物を得た(ベンゾグアナミンに対する収率97%)。得られた化合物の構造と1H NMR(重水素化DMSO中)より測定したスペクトルとその帰属は下記の通りである。
【0108】
【化10】
【0109】
d:9.54ppm(2H)、e:9.26ppm(2H)、a:8.23ppm(2H)、b+c:7.55ppm(3H)、f:3.31ppm(4H)、
g:1.34−1.54ppm(8H)。
【0110】
NMRスペクトルはすべて上記化学式で表されるプロトンに帰属され、かつプロトン強度比は上記化学式のプロトン数と一致した、すなわち目的物であるベンゾグアナミン・ヘキサメチレンジイソシアネートの1:2付加物(BzG−HMDI)が、高収率で得られていることが確認できた。
【0111】
実施例2、実施例3、比較例1
実施例1で得られたBzG−HMDI(42.18g:80.55mmol)に対し3倍モルのエタノール(11.13g:241.65mmol)(EA)を加え、脱水したDMSO 1Lの溶液とした。チタンテトラブトキシド(0.010g:0.031mmol)を添加後、100℃に加熱し、24時間攪拌下反応させた。 反応後、多量のメタノールを添加し、析出物を濾過し、メタノールで5回洗浄後、40℃で24時間乾燥して目的物を得た(エタノールに対する収率92%)。1H NMR(重水素化DMSO中)より測定したスペクトルより、BzG−HMDI由来のピーク(a〜f)が観察され、新たにエタノール由来のピーク(2.0ppm、3.3ppm)が観察されることから、目的の反応が進行していることがわかった。上記によるトリアジン構造を含有するイソシアネート化合物とエタノールとの付加物(2:1)であるトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)の製造例を実施例2とする。
【0112】
つぎに実施例2で得られたトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)100重量部に対し、シアヌール酸1重量部を加え100℃で、ブラベンダーを用い5分間混練し、多重水素結合性架橋体組成物(BzG−HMDI−EA−CA)を調製した(実施例3)。
【0113】
実施例2で得られた、トリアジン構造を含有するイソシアネート化合物とエタノール付加物であるトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)および実施例3で得られた多重水素結合性架橋体組成物(BzG−HMDI−EA−CA)について、卓上超小型射出成形機を用い(シリンダー温度150℃、金型温度23℃)、小型ダンベルを作成し、機械特性をエタノール単独(EA)の場合(比較例1)と比較評価した。一連の結果を表1に示す。なお比較例1のEAは液状であり分子量が低いため、成形・溶融粘度測定は困難であった。
【0114】
比較例1のEAは液体であるため、Tg、Tmは観察されず、また分子量も極めて低く、低分子量側の溶媒ノイズと重なるため、GPCでは分子量を検出することはできなかった。また液状低分子量物であるので成形加工は困難、溶融開始温度の測定も困難であった。
【0115】
一方実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)は、ガラス転移温度−30℃の粘ちょう固体形状であり、また成形可能な材料となった。極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、強く会合し、その結果、高い分子量を示し、トリアジン構造からなる多重水素結合がクロロホルム中で会合状態を呈していることがわかる。またEAは液状であるため溶融粘度測定は困難であったが、実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)は、ポリマー固有の特長である溶融粘度を示し、100℃で溶融するポリマー材料形態をとっていることがわかる。
【0116】
また実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)にシアヌール酸を配合した実施例3の多重水素結合性架橋体組成物(BzG−HMDI−EA−CA)は、極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、多重水素結合単位が強く会合し、その結果高い分子量を示し、さらに実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EG)よりも高い分子量を示し、BzG−HMDI−EAとシアヌール酸間でさらに強い会合状態を取っていることがわかる。成形加工可能であり、実施例2に比べ、さらに引張強度が高くなっていることがわかる。また流動開始温度は180℃と高く、シアヌール酸を介した多重水素結合架橋が形成していることがわかる。
【0117】
実施例4
実施例1で合成したBzG−HMDI(1:2付加物)(10g:19.10mmol)を脱水したDMSO溶媒100mlに溶解させた後、シアヌール酸(4g:31.0mmol)を添加し、室温で1時間攪拌した。多量の脱水したアセトンを添加し、目的物を析出させ、濾過した後、脱水したアセトンで再度5回洗浄し、40℃で24時間乾燥した(BzG−HMDIとシアヌール酸総重量に対する収率93%)。実施例1のBzG−HMDI の1H NMR(重水素化DMSO中)スペクトルとの比較からBzG−HMDI中に認められる9.54ppm(d:2H)、9.26ppm(e:2H)がシアヌール酸の添加により、低磁場側にそれぞれ0.5ppmシフトしていることから、目的とするベンゾグアナミン・シアヌール塩含有イソシアネート化合物を形成していることが確認できた。
【0118】
実施例5
実施例4で合成したベンゾグアナミン・シアヌール酸塩含有イソシアネート化合物10gに対し、10gのEAを添加し、脱水したDMSO500mLの溶液とした。チタンテトラブトキシド(0.010g:0.031mmol)を添加後、100℃に加熱し、24時間攪拌下反応させた。反応後、多量のメタノールを添加し、析出物を濾過し、メタノールで5回洗浄後、40℃で24時間乾燥した(エタノールに対する収率85%)。本合成方法により実施例3とは異なる合成方法により、多重水素結合性架橋体組成物(BzG−HMDI−CA−EA)を調製した。一連の結果を表2に示す。
【0119】
上記結果より、実施例3の多重水素結合架橋組成物(BzG−HMDI−EA−CA)と同様に、極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、強く会合した結果、高い分子量を示し、さらに実施例2のトリアジン構造を含有する多重水素結合性化合物(BzG−HMDI−EA)よりも高い分子量を示し、BzG−HMDI−EAとシアヌール酸間でさらに強い会合状態を取っていることがわかる。成形加工可能であり、実施例2に比べ、さらに引張強度が高くなっていることがわかる。また流動開始温度は170℃と高く、シアヌール酸を介した多重水素結合架橋が形成していることがわかる。
【0120】
実施例6、実施例7、比較例2、比較例3
実施例6では参考例1で調製したPBT−1(Mn=15100,Mw/Mn=3.2(HFIP中))100重量部に対し、実施例1で合成したBzG−HMDI1(1:2付加物)2重量部を230℃で5分間溶融混練し、トリアジン構造を含有する多重水素結合性化合物(TR−PBT)を調製した。
【0121】
さらに実施例7では、参考例1で調製したPBT−1(Mn=15100,Mw/Mn=3.2(HFIP中))100重量部に対し、実施例1で合成したBzG−HMDI1(1:2付加物)2重量部、シアヌール酸2重量部を、ブラベンダーを用い、230℃で5分間溶融混練し、多重水素結合性架橋体組成物(MHBC−PBT)を調製した。
【0122】
参考例1で調製したPBT−1を比較例2とし、同じく参考例1で調製したPBT−2(Mn=31400、Mw/Mn=3.3(HFIP中))を比較例3として、TR−PBT(実施例6)、MHBC−PBT(実施例7)について、250℃、ずり速度24.32(/s)の条件下、溶融粘度の比較を行った。また卓上超小型射出成形機を用い(シリンダー温度250℃、金型温度80℃)、小型ダンベルを作成し、機械特性を評価した。一連の結果を表3に示す。
【0123】
比較例2のPBT−1と実施例6のTR−PBT、比較例3のPBT−2の比較より、TR−PBTはPBT−2に比べ、分子量はほぼ半分であるにも関わらず、PBT−2よりも高い引張強度を示すことがわかる。特に、TR−PBTとほぼ同じ分子量を有するPBT−1は引張強度が低く、かつ破断伸びが小さい一方、TR−PBTは高い引張強度、高い破断伸びを示した。
【0124】
一方溶融粘度はPBT−1とほぼ同等の値を示し、分子量の高いPBT−2よりも流動性に優れることがわかる。すなわちTR−PBTは低分子量体であるPBT−1とほぼ同等の流動性、分子量の高いPBT−2以上の機械特性を示した。
【0125】
同様にさらにシアヌール酸を配合してなる実施例7の多重水素結合性架橋体組成物(MHBC−PBT)も同様に、PBT−2に比べ、分子量はほぼ半分であるにも関わらず、PBT−2よりも高い引張強度を示す。またMHBC−PBTとほぼ同じ分子量を有するPBT−1は引張強度が低く、かつ破断伸びが小さい一方、MHBC−PBTは高い引張強度、高い破断伸びを示した。さらにMHBC−PBT(実施例7)はTR−PBT(実施例6)に比べ、さらに引張強度が高いことがわかる。したがってシアヌール酸による架橋構造を呈しているものと考えられる。
【0126】
次に、実施例6(TR−PBT)について熱可逆性・安定性を評価した。実施例6で成形したサンプルを粉砕後、再度成形に供し、成形2回目、5回目の試験片につき、同様に分子量、溶融粘度、機械特性を評価した。結果を表4に示す。
【0127】
成形2回目、成形5回目ともに分子量変化は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時に多重水素結合が解離し、繰り返し成形加工が可能であり、かつ機械特性は高分子量PBT−2と同等、溶融粘度は低分子量PBT−1とほぼ同等の特性を示すことがわかる。
【0128】
また実施例7(MHBC−PBT)についても同様に、熱可逆性・安定性を評価したところ(表5)、繰り返し成形による分子量低下は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時にトリアジン環とシアヌール酸からなる多重水素結合性架橋が解離し、繰り返し成形加工が可能であることがわかった。
【0129】
実施例8
メラミン(10g:79.29mmol)に対し、20倍モルのヘキサメチレンジイソシアネート(266.7g:1.586mmol)(メラミン中アミノ基1モルに対し、6.7倍モル)を加え、100℃まで温度を上げた後、触媒としてチタンテトラブトキシド(0.021g:0.062mmol)を添加、その後120℃、12時間反応させた。反応は始終不均一系、乳白色であった。12時間後、反応溶液を冷却後、シクロヘキサン1Lを添加、白色固体を濾過した後、濾過物をシクロヘキサンで3回洗浄、脱水したアセトンで1回洗浄後、白色固体を40℃で24時間乾燥して目的物を得た(メラミンに対する収率70%)。得られた化合物の構造と1H NMR(重水素化DMSO中)より測定したスペクトルとその帰属は下記の通りである。
【0130】
【化11】
【0131】
a:10.05ppm(3H)、b:8.87ppm(3H)、c:3.29ppm(12H)、d:1.32−1.55ppm(24H)。
【0132】
NMRスペクトルはすべて上記化学式で表されるプロトンに帰属され、かつプロトン強度比は上記化学式のプロトン数と一致した、すなわち目的物であるメラミン・ヘキサメチレンジイソシアネートの1:3付加物(ML−HMDI)が、得られていることが確認できた。
【0133】
実施例9、10、比較例1
実施例8で調製したML−HMDI(10g:15.85mmol)、エタノール(7.3g:158.5mmol)を秤量し、脱水したDMSO50mLの溶液とした。チタンテトラブトキシド(0.010g:0.031mmol)を添加後、100℃に加熱し、24時間攪拌下反応させた。反応後、多量のメタノールを添加し、析出物を濾過し、メタノールで5回洗浄後、40℃で24時間乾燥して目的物を得た(エチレングリコールに対する収率91%)。1H NMR(重水素化DMSO中)より測定したスペクトルより、ML−HMDI由来のピーク(a〜d)が観察され、新たにエタノール由来のピーク(2.1ppm、3.25ppm)が観察されることから、目的の反応が進行していることがわかった。上記によるトリアジン構造を含有するイソシアネート化合物とエタノール付加物であるトリアジン構造を含有する多重水素結合性化合物(ML−HMDI−EA)の製造例を実施例9とする。
【0134】
つぎに上記トリアジン構造を含有する多重水素結合性化合物(ML−HMDI−EA)100重量部に対し、シアヌール酸1重量部を150℃、ブラベンダーを用い5分間混練し、多重水素結合性架橋体組成物(ML−HMDI−EG−CA)を調製した。上記による多重水素結合性架橋組成物の製造例を実施例10とする。
【0135】
上記の方法により得られた、トリアジン構造を含有するイソシアネート化合物とエチレングリコール付加物であるトリアジン構造を含有する多重水素結合性化合物(ML−HMDI−EG)を実施例9、多重水素結合性架橋体組成物(ML−HMDI−EG−CA)を実施例10、エチレングリコール(EG)を比較例1とし、卓上超小型射出成形機を用い(シリンダー温度150℃、金型温度23℃)、小型ダンベルを作成し、機械特性を評価した。一連の結果を表6に示す。なお比較例1のEGは液状であり分子量が低いため、成形・溶融粘度測定は困難であった。
【0136】
比較例1のEGは液体であるため、Tg、Tmは観察されず、また分子量も極めて低く、低分子量側の溶媒ノイズと重なるため、GPCでは分子量を検出することはできなかった。また液状低分子量物であるので成形加工は困難、溶融開始温度の測定も困難であった。
【0137】
一方実施例9のメラミン構造を含有する多重水素結合性化合物(ML−HMDI−EA)は、ガラス転移温度5℃の固体形状であり、また成形可能な材料となった。融点らしきピークは認められないが、エラスティックな材料ではなく固体粉末である。またGPC測定より、極性溶媒であるHFIP中では多重水素結合が解離しており、EGと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、高い分子量を示し、メラミン構造からなる多重水素結合がクロロホルム中で会合状態を呈していることがわかる。またEGは液状であるため溶融粘度測定は困難であったが、実施例9のメラミン構造を含有する多重水素結合性化合物(ML−HMDI−EA)は、ポリマー固有の特長である溶融粘度を示し、120℃で溶融するポリマー材料形態をとっていることがわかる。
【0138】
また実施例9のメラミン構造含有する多重水素結合性化合物(ML−HMDI−EA)にシアヌール酸を配合した実施例10の多重水素結合性架橋体組成物(ML−HMDI−EA−CA)は、極性溶媒であるHFIP中では多重水素結合が解離しており、EAと同じく分子量を検出することは困難であったが、非極性溶媒であるクロロホルム中では、高い分子量を示し、さらに実施例9のメラミン構造を含有する多重水素結合性化合物(ML−HMDI−EA)よりも高い分子量を示し、ML−HMDI−EAとシアヌール酸間でさらに強い会合状態を取っていることがわかる。成形加工可能であり、実施例9に比べ、さらに引張強度が高くなっていることがわかる。また流動開始温度は190℃と高く、シアヌール酸を介した多重水素結合架橋が形成していることがわかる。
【0139】
実施例11、実施例12、比較例4、比較例5
実施例11では参考例2で調製したPLA−1(Mn=10800、Mw/Mn=4.1(HFIP中)、Mn=11000、Mw/Mn=4.0(クロロホルム中))100重量部に対し、実施例8で合成したML−HMDI(1:3付加物)2重量部をブラベンダーを用い、230℃で5分間溶融混練し、メラミン構造を含有するPLA(TR−PLA)を調製した。
【0140】
さらに実施例12では、参考例2で調製したPLA−1(Mn=10800、Mw/Mn=4.1(HFIP中)、Mn=11000、Mw/Mn=4.0(クロロホルム中))100重量部に対し、実施例8で合成したML−HMDI(1:3付加物)2重量部、シアヌール酸2重量部を、ブラベンダーを用い、230℃で5分間溶融混練し、多重水素結合性架橋体組成物(MHBC−PLA)を調製した。参考例2で調製したPLA−1を比較例4、同じく参考例2で調製したPLA−2(Mn=21400、Mw/Mn=4.2(HFIP中)
Mn=25300、Mw/Mn=4.1(クロロホルム中)を比較例5とし、TR−PLA(実施例11)、MHBC−PLA(実施例12)について、210℃、ずり速度24.32(/s)の条件下、溶融粘度測定を行った。また卓上超小型射出成形機を用い(シリンダー温度210℃、金型温度80℃)、小型ダンベルを作成し、一連の結果を表7に示す。
【0141】
PLA−1とTR−PLA、PLA−2の比較より、TR−PLA−1はPLA−2に比べ、分子量はほぼ半分であるにも関わらず、PLA−2とほぼ同等の機械特性を示すことがわかる。特に、メラミン構造を含有するTR−PLAとほぼ同じ分子量を有するPLA−1は、引張強度が低い一方、TR−PLAは高い引張強度を示した。
【0142】
一方TR−PLAの溶融粘度はPLA−1とほぼ同等の値を示し、分子量の高いPLA−2よりも流動性に優れることがわかる。すなわちTR−PLAは低分子量体であるPLA−1とほぼ同等の流動性、分子量の高いPLA−2とほぼ同等の機械特性を示した。
【0143】
また前述したように、クロロホルム中のGPC測定結果より、TR−PLAはクロロホルム中において、高い分子量を示し、TR−PLA中のメラミン構造からなる多重水素結合は非極性溶媒中では2量体以上に会合していることがわかる。固体状態のポリマー挙動は非極性溶媒中挙動に類似しているため、固体状態では多重水素結合が2量体以上に会合、溶融時には解離していることを裏付ける結果となった。
【0144】
同様にさらにシアヌール酸を配合してなる実施例12の多重水素結合性架橋体組成物(MHBC−PLA)も同様に、PLA−2に比べ、分子量はほぼ半分であるにも関わらず、PLA−2よりも高い引張強度を示す。またMHBC−PLAとほぼ同じ分子量を有するPLA−1は引張強度が低く、かつ破断伸びが小さい一方、MHBC−PLAは高い引張強度、高い破断伸びを示した。さらにMHBC−PLA(実施例12)はTR−PLA(実施例11)に比べ、さらに引張強度が高いことがわかる。したがってシアヌール酸による架橋構造を呈しているものと考えられる。
【0145】
次に、実施例11(TR−PLA)について熱可逆性・安定性を評価した。実施例11で成形したサンプルを粉砕後、再度成形に供し、成形2回目、5回目の試験片につき、同様に分子量、溶融粘度、機械特性を評価した。結果を表8に示す。
【0146】
成形2回目、成形5回目ともに分子量変化は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時に多重水素結合が解離し、繰り返し成形加工が可能であり、かつ機械特性は高分子量PLA−2と同等、溶融粘度は低分子量PLA−1とほぼ同等の特性を示すことがわかる。
【0147】
また実施例12(MHBC−PBT)についても同様に、熱可逆性・安定性を評価したところ(表9)、繰り返し成形による分子量低下は小さく、かつ溶融粘度、機械特性の変化が小さいことがわかる。すなわち、溶融成形時にメラミン環とシアヌール酸からなる多重水素結合性架橋が解離し、繰り返し成形加工が可能であることがわかった。
【0148】
【表1】
【0149】
【表2】
【0150】
【表3】
【0151】
【表4】
【0152】
【表5】
【0153】
【表6】
【0154】
【表7】
【0155】
【表8】
【0156】
【表9】
【0157】
【発明の効果】
本発明の多重水素結合性化合物および多重水素結合性架橋体組成物は熱可逆的に解離・会合を繰り返すことのできる化合物であり、そのため多重水素結合を含有する化合物は、成形温度では、熱可逆結合が解離し、常温では熱可逆結合が会合する物質となる。その機能により、溶融加工時には低分子量物のような高い流動性、高い溶融加工性を示し、一方冷却後に得られる成形品状態では、会合状態を取り、その結果高分子量体のごとくに、あるいは高度に架橋した熱硬化性樹脂のごとく高い機械特性を兼ね備える二律背反した特性を有する。
Claims (8)
- 請求項1記載のトリアジン構造を含有するイソシアネート化合物と、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物とを加熱溶融下あるいは溶液中で配合することを特徴とする請求項2記載のトリアジン構造を含有する多重水素結合性化合物の製造方法。
- 請求項2記載のトリアジン構造を含有する多重水素結合性化合物に対し、さらにシアヌール酸を配合してなる多重水素結合性架橋体組成物。
- 請求項1記載のトリアジン構造を含有するイソシアネート化合物に対し、シアヌール酸を配合してなるトリアジン・シアヌール酸塩含有イソシアネート化合物。
- 請求項5記載のトリアジン・シアヌール酸塩含有イソシアネート化合物に対し、分子中に少なくとも1つ以上の水酸基またはアミノ基を含有する化合物を加熱溶融下あるいは溶液中で配合してなる多重水素結合性架橋体組成物。
- 請求項2記載の多重水素結合性化合物を成形してなる成形品。
- 請求項4または6に記載の多重水素結合性架橋体組成物を成形してなる成形品。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003059585A JP2004269378A (ja) | 2003-03-06 | 2003-03-06 | 多重水素結合性化合物、多重水素結合性架橋体組成物および成形品 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003059585A JP2004269378A (ja) | 2003-03-06 | 2003-03-06 | 多重水素結合性化合物、多重水素結合性架橋体組成物および成形品 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004269378A true JP2004269378A (ja) | 2004-09-30 |
Family
ID=33122358
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003059585A Pending JP2004269378A (ja) | 2003-03-06 | 2003-03-06 | 多重水素結合性化合物、多重水素結合性架橋体組成物および成形品 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2004269378A (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018079613A1 (ja) * | 2016-10-31 | 2018-05-03 | 東レ株式会社 | 相互に少なくとも2つ以上の水素結合を形成する官能基を有する化合物を含む熱可塑性樹脂組成物 |
| CN112708102A (zh) * | 2020-12-17 | 2021-04-27 | 华南理工大学 | 一种基于脲基三嗪结构合成含四重氢键的水性聚氨酯分散体及其制备方法 |
| JP7568298B2 (ja) | 2019-05-15 | 2024-10-16 | エコール ポリテクニーク フェデラル ドゥ ローザンヌ (イーピーエフエル) | シート、フィルム、繊維、及び成形部品の組成物並びに製造方法 |
-
2003
- 2003-03-06 JP JP2003059585A patent/JP2004269378A/ja active Pending
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018079613A1 (ja) * | 2016-10-31 | 2018-05-03 | 東レ株式会社 | 相互に少なくとも2つ以上の水素結合を形成する官能基を有する化合物を含む熱可塑性樹脂組成物 |
| CN109890902A (zh) * | 2016-10-31 | 2019-06-14 | 东丽株式会社 | 包含具有相互形成至少2个以上氢键的官能团的化合物的热塑性树脂组合物 |
| JP7568298B2 (ja) | 2019-05-15 | 2024-10-16 | エコール ポリテクニーク フェデラル ドゥ ローザンヌ (イーピーエフエル) | シート、フィルム、繊維、及び成形部品の組成物並びに製造方法 |
| CN112708102A (zh) * | 2020-12-17 | 2021-04-27 | 华南理工大学 | 一种基于脲基三嗪结构合成含四重氢键的水性聚氨酯分散体及其制备方法 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN105073784A (zh) | 微细纤维素纤维复合体 | |
| JPS6279224A (ja) | ポリヒドロキシエ−テル組成物 | |
| JP2021006556A (ja) | ニトリルオキシド化合物、組成物、ポリオレフィン変性体およびその製造方法、ならびにブロックコポリマーの製造方法 | |
| JP5175421B2 (ja) | ステレオコンプレックスポリ乳酸およびその製造方法 | |
| KR19990028597A (ko) | 폴리에스테르아미드공중합체및그것의제조방법,폴리에스테르아미드단량체및그것의제조방법,그리고폴리에스테르아미드수지조성물 | |
| EP3746497B1 (en) | Hyperbranched polylactide resin compositions | |
| TWI354682B (en) | Process for preparing a melt-processable polyamide | |
| EP0403504A1 (en) | Chain extension of polyethylene terephthalate with polyacyllactams | |
| JP2004250623A (ja) | ポリエステル樹脂、その製造方法および成形品 | |
| JP2004269378A (ja) | 多重水素結合性化合物、多重水素結合性架橋体組成物および成形品 | |
| JP2009019135A (ja) | レーザー溶着用ポリエステル樹脂組成物及びそれを用いた成形品 | |
| EP3385330B1 (en) | Polyalkylene carbonate resin composition, preparation method therefor, molded article formed thereof, and method for manufacturing molded article using same | |
| JP2830329B2 (ja) | 安定化樹脂組成物 | |
| KR102208407B1 (ko) | 폴리에틸렌 카보네이트 수지 조성물 및 이의 제조 방법 | |
| KR0144006B1 (ko) | 급속 결정화 폴리에스테르 조성물 | |
| WO2004083306A1 (ja) | ポリトリメチレンテレフタレート組成物とその製造方法 | |
| JP5190002B2 (ja) | ポリ乳酸ブロック共重合体の製造方法 | |
| KR102498899B1 (ko) | 폴리아미드 수지 및 그의 제조방법 | |
| JP2001048965A (ja) | ビスオキサゾリン化合物含有ポリエステル組成物およびそれを用いた高重合度ポリエステルの製造方法 | |
| JP5223254B2 (ja) | レーザー溶着用ポリエステル樹脂組成物及びそれを用いた成形品 | |
| CN102786676A (zh) | 一种含支化结构的聚酯弹性体及其制备方法 | |
| JP4693784B2 (ja) | アミド結合を含むポリエステル共重合体の製造方法 | |
| JPWO2018079613A1 (ja) | 相互に少なくとも2つ以上の水素結合を形成する官能基を有する化合物を含む熱可塑性樹脂組成物 | |
| JPH10287807A (ja) | ポリエステルアミド樹脂組成物 | |
| JP3181950B2 (ja) | 成形材料の製造方法 |