JP2004123737A - 新規抗体及びその利用法 - Google Patents
新規抗体及びその利用法 Download PDFInfo
- Publication number
- JP2004123737A JP2004123737A JP2003317412A JP2003317412A JP2004123737A JP 2004123737 A JP2004123737 A JP 2004123737A JP 2003317412 A JP2003317412 A JP 2003317412A JP 2003317412 A JP2003317412 A JP 2003317412A JP 2004123737 A JP2004123737 A JP 2004123737A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- pylori
- tyrosine
- phosphorylated
- present
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 208000015181 infectious disease Diseases 0.000 claims abstract description 74
- 238000000034 method Methods 0.000 claims abstract description 74
- 208000005718 Stomach Neoplasms Diseases 0.000 claims abstract description 37
- 206010017758 gastric cancer Diseases 0.000 claims abstract description 37
- 201000011549 stomach cancer Diseases 0.000 claims abstract description 37
- 208000007107 Stomach Ulcer Diseases 0.000 claims abstract description 35
- 201000005917 gastric ulcer Diseases 0.000 claims abstract description 34
- 229960005486 vaccine Drugs 0.000 claims abstract description 14
- 239000003795 chemical substances by application Substances 0.000 claims abstract description 13
- 241000590002 Helicobacter pylori Species 0.000 claims abstract description 12
- 229940037467 helicobacter pylori Drugs 0.000 claims abstract description 12
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 58
- 229920001184 polypeptide Polymers 0.000 claims description 55
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 55
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 claims description 30
- 150000001413 amino acids Chemical class 0.000 claims description 26
- 208000000718 duodenal ulcer Diseases 0.000 claims description 22
- 208000004300 Atrophic Gastritis Diseases 0.000 claims description 21
- 208000036495 Gastritis atrophic Diseases 0.000 claims description 21
- 208000016644 chronic atrophic gastritis Diseases 0.000 claims description 21
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 claims description 18
- 206010061850 Extranodal marginal zone B-cell lymphoma (MALT type) Diseases 0.000 claims description 18
- 201000003791 MALT lymphoma Diseases 0.000 claims description 18
- 235000001014 amino acid Nutrition 0.000 claims description 4
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 4
- 125000003275 alpha amino acid group Chemical group 0.000 claims 3
- 101100476480 Mus musculus S100a8 gene Proteins 0.000 claims 2
- 108090000623 proteins and genes Proteins 0.000 abstract description 103
- 102000004169 proteins and genes Human genes 0.000 abstract description 100
- 201000010099 disease Diseases 0.000 abstract description 70
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 70
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 abstract description 26
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 abstract description 24
- 238000011282 treatment Methods 0.000 abstract description 17
- 101710112752 Cytotoxin Proteins 0.000 abstract description 5
- 231100000599 cytotoxic agent Toxicity 0.000 abstract description 5
- 239000002619 cytotoxin Substances 0.000 abstract description 5
- 235000018102 proteins Nutrition 0.000 description 97
- 210000004027 cell Anatomy 0.000 description 48
- 239000000243 solution Substances 0.000 description 48
- 238000001574 biopsy Methods 0.000 description 31
- 102000036639 antigens Human genes 0.000 description 25
- 108091007433 antigens Proteins 0.000 description 25
- 239000000427 antigen Substances 0.000 description 20
- 230000002496 gastric effect Effects 0.000 description 16
- 238000012744 immunostaining Methods 0.000 description 14
- 210000002966 serum Anatomy 0.000 description 14
- 238000001514 detection method Methods 0.000 description 13
- 210000002919 epithelial cell Anatomy 0.000 description 13
- 238000004519 manufacturing process Methods 0.000 description 13
- 238000002372 labelling Methods 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- 238000001261 affinity purification Methods 0.000 description 10
- 239000002953 phosphate buffered saline Substances 0.000 description 10
- 230000002265 prevention Effects 0.000 description 10
- 210000001519 tissue Anatomy 0.000 description 9
- 125000000539 amino acid group Chemical group 0.000 description 8
- 210000004408 hybridoma Anatomy 0.000 description 8
- 208000007882 Gastritis Diseases 0.000 description 7
- 239000002671 adjuvant Substances 0.000 description 7
- 230000000890 antigenic effect Effects 0.000 description 7
- 230000008878 coupling Effects 0.000 description 7
- 238000010168 coupling process Methods 0.000 description 7
- 238000005859 coupling reaction Methods 0.000 description 7
- 210000000056 organ Anatomy 0.000 description 7
- 239000003814 drug Substances 0.000 description 6
- 238000013399 early diagnosis Methods 0.000 description 6
- 238000007490 hematoxylin and eosin (H&E) staining Methods 0.000 description 6
- 238000011081 inoculation Methods 0.000 description 6
- 241000588747 Klebsiella pneumoniae Species 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 241000283973 Oryctolagus cuniculus Species 0.000 description 5
- 150000001540 azides Chemical class 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 208000023652 chronic gastritis Diseases 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 230000003053 immunization Effects 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 230000026731 phosphorylation Effects 0.000 description 5
- 238000006366 phosphorylation reaction Methods 0.000 description 5
- 102000014914 Carrier Proteins Human genes 0.000 description 4
- 108010078791 Carrier Proteins Proteins 0.000 description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 206010028980 Neoplasm Diseases 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 108010046334 Urease Proteins 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 201000011510 cancer Diseases 0.000 description 4
- 238000003745 diagnosis Methods 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 230000000968 intestinal effect Effects 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 206010019375 Helicobacter infections Diseases 0.000 description 3
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 3
- 102000003992 Peroxidases Human genes 0.000 description 3
- 239000007983 Tris buffer Substances 0.000 description 3
- 229940024606 amino acid Drugs 0.000 description 3
- 239000012472 biological sample Substances 0.000 description 3
- 230000005847 immunogenicity Effects 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000008506 pathogenesis Effects 0.000 description 3
- 230000007918 pathogenicity Effects 0.000 description 3
- 108040007629 peroxidase activity proteins Proteins 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 210000002784 stomach Anatomy 0.000 description 3
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- 206010003694 Atrophy Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- -1 Hydroxysuccinimide ester Chemical class 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- 102000004890 Interleukin-8 Human genes 0.000 description 2
- 108090001007 Interleukin-8 Proteins 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000037444 atrophy Effects 0.000 description 2
- 230000008033 biological extinction Effects 0.000 description 2
- 238000010170 biological method Methods 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 230000002183 duodenal effect Effects 0.000 description 2
- 210000001198 duodenum Anatomy 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 210000003608 fece Anatomy 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 238000011532 immunohistochemical staining Methods 0.000 description 2
- 210000004969 inflammatory cell Anatomy 0.000 description 2
- 229940096397 interleukin-8 Drugs 0.000 description 2
- XKTZWUACRZHVAN-VADRZIEHSA-N interleukin-8 Chemical compound C([C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@@H](NC(C)=O)CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CCSC)C(=O)N1[C@H](CCC1)C(=O)N1[C@H](CCC1)C(=O)N[C@@H](C)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CCC(O)=O)C(=O)N[C@H](CC(O)=O)C(=O)N[C@H](CC=1C=CC(O)=CC=1)C(=O)N[C@H](CO)C(=O)N1[C@H](CCC1)C(N)=O)C1=CC=CC=C1 XKTZWUACRZHVAN-VADRZIEHSA-N 0.000 description 2
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 230000001717 pathogenic effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- OXEUETBFKVCRNP-UHFFFAOYSA-N 9-ethyl-3-carbazolamine Chemical compound NC1=CC=C2N(CC)C3=CC=CC=C3C2=C1 OXEUETBFKVCRNP-UHFFFAOYSA-N 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 238000009010 Bradford assay Methods 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 108700003822 Helicobacter pylori cagA Proteins 0.000 description 1
- 241000238073 Homarus gammarus Species 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- IFQSXNOEEPCSLW-DKWTVANSSA-N L-cysteine hydrochloride Chemical compound Cl.SC[C@H](N)C(O)=O IFQSXNOEEPCSLW-DKWTVANSSA-N 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 102000008300 Mutant Proteins Human genes 0.000 description 1
- 108010021466 Mutant Proteins Proteins 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 208000008469 Peptic Ulcer Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 208000006994 Precancerous Conditions Diseases 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000002238 attenuated effect Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229960002433 cysteine Drugs 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- BGRWYRAHAFMIBJ-UHFFFAOYSA-N diisopropylcarbodiimide Natural products CC(C)NC(=O)NC(C)C BGRWYRAHAFMIBJ-UHFFFAOYSA-N 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 230000008029 eradication Effects 0.000 description 1
- 230000002550 fecal effect Effects 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 108010074605 gamma-Globulins Proteins 0.000 description 1
- 210000001156 gastric mucosa Anatomy 0.000 description 1
- 208000017215 gastric mucosa-associated lymphoid tissue lymphoma Diseases 0.000 description 1
- 108060003552 hemocyanin Proteins 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 230000036732 histological change Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 210000002490 intestinal epithelial cell Anatomy 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 210000003141 lower extremity Anatomy 0.000 description 1
- 201000003265 lymphadenitis Diseases 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 1
- 239000012120 mounting media Substances 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 238000011587 new zealand white rabbit Methods 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 229940092253 ovalbumin Drugs 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 238000002741 site-directed mutagenesis Methods 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- HNKJADCVZUBCPG-UHFFFAOYSA-N thioanisole Chemical compound CSC1=CC=CC=C1 HNKJADCVZUBCPG-UHFFFAOYSA-N 0.000 description 1
- 238000001269 time-of-flight mass spectrometry Methods 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 230000001018 virulence Effects 0.000 description 1
- 230000007923 virulence factor Effects 0.000 description 1
- 239000000304 virulence factor Substances 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Landscapes
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
Abstract
【解決手段】 ヘリコバクター・ピロリ菌が感染している宿主細胞に見出される、チロシンリン酸化されているCagAタンパク質を特異的に認識する抗体を作製した。この抗体を用いることにより、チロシンリン酸化されたCagAタンパク質を高精度で検出することができるため、種々の疾患と密接に関連するH.ピロリ菌の感染を検出可能である。
【選択図】 なし
Description
ライナー・ハス(Rainer Haas)、ブレンダン・バーンズ(Brendan P. Burns)、朝日百百代共著、「Pathogenesis of Helicobacter pylori」、Current Opinion in Gastroenterology、リピンコット・ウイリアムズ アンド ウィルキンス(Lippincott Williams & Wilkins, Inc.)、2001年、第17巻、第1号(suppl 1)、S1-S5 朝日百百代、外11名共著、「Helicobacter pylori CagA Protein Can Be Tyrosine Phosphorylated in Gastric Epithelial Cells」、Journal of Experimental Medicine、ロックフェラー大学出版(Rockefeller University Press)、2000年2月21日、第191巻、第4号、p.593-602 坂本長逸著、「H.pylori感染胃・十二指腸粘膜における組織学的変化とその除菌後におよぼす影響」、Journal of Nippon medicine School、日本医科大学、2002年、第69巻、第1号、p.67-70
本発明者は、以前、胃の上皮細胞に感染したH.ピロリ菌によって、CagAタンパク質が宿主細胞(例えば、ヒトの胃上皮細胞)の細胞質内に注入された後、宿主細胞内のタンパク質チロシンキナーゼ(PTKs)によって、リン酸化されることを明らかにした(上記非特許文献2:Asahi. M., et al. J. Exp. Med. 191, No.4: 2000 593-602)。そして、この現象に着目し、この現象を利用して効率的に、上記疾患と密接に関連するH.ピロリ菌の感染を検出する方法等を開発しようと鋭意努力を重ねた。
(2−1)ポリクローナル抗体の生産方法
本発明に係るポリクローナル抗体を生産する方法は、特に限定されるものではなく、例えば、抗原タンパク質で動物を免疫した後、その動物から血清を採取し、ポリクローナル抗体を得ればよい。なお、「生産」とは、この抗体の生合成に加えて各種人為的な作用を含む、本発明に係る抗体(ポリクローナル抗体、モノクローナル抗体を含む)を得るための全体的な流れを指すものとする。
本発明に係るモノクローナル抗体を生産する方法は、特に限定されるものではなく、例えば、抗原でマウスを免疫した後、そのマウス脾臓リンパ球とマウス由来のミエローマ細胞とを融合させてなる抗体産生ハイブリドーマにより、モノクローナル抗体を得ればよい。なお、本実施の形態における「産生」とは、ハイブリドーマによる抗体の生合成を指すものとする。
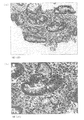
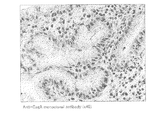
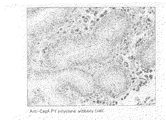
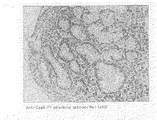
後述する実施例に示すように、本発明に係る抗体を用いて、H.ピロリ菌の感染により引き起こされた胃潰瘍、胃癌のそれぞれの患者から取り出した胃の生検組織の免疫染色を行った結果、萎縮性胃炎を裏付ける腸上皮化性細胞において、チロシンリン酸化されたCagAタンパク質を精度よく検出することができた。
上述したように、本発明に係る抗体は、チロシンリン酸化されたCagAタンパク質を特異的に認識する新規な抗体である。また、本発明者は、H.ピロリ菌が感染したヒトの胃上皮細胞において、チロシン残基がリン酸化されたCagAタンパク質が見出されることを明らかにしており、CagAタンパク質のチロシンリン酸化は、H.ピロリ菌の感染によって引き起こされる種々の疾患と密接に関連していると考えられる。そのため、本発明の抗体は、以下に示すように利用することができる。
本発明に係る抗体は、H.ピロリ菌の宿主細胞への感染を検出するためのH.ピロリ菌の感染検出剤として用いることができる。即ち、本発明に係るH.ピロリ菌の感染検出剤の具体的な組成は、上記抗体を含んでいればよく、特に限定されるものではない。具体的には、使用(検査)対象の生物個体、器官、組織、細胞塊、糞便、あるいは細胞等の種類に応じて、H.ピロリ菌の感染を検出するために、本発明に係る抗体の機能が発揮できるような緩衝液等が含まれていればよい。
また、本発明に係る抗体は、H.ピロリ菌の宿主細胞への感染を検出するための手段として用いることができる。即ち、本発明に係るH.ピロリ菌の感染検出方法は、上記抗体を用いていればよく、その他の構成手段は特に限定されるものではない。
また、本発明に係る抗体は、萎縮性胃炎、胃潰瘍、MALTリンパ腫、および胃癌等のH.ピロリ菌の感染によって引き起こされる種々の疾患の発症または発症危険性を判定するための手段として用いることができる。即ち、本発明に係る上記疾患の発症または発症危険性判定方法(診断方法)は、上記抗体を用いていればよく、その他の構成手段は特に限定されるものではない。
本発明に係る抗体は、さらに、H.ピロリ菌の感染によって引き起こされる種々の疾患の治療に利用できる可能性がある。即ち、上記疾患の原因の一つと考えられるチロシンリン酸化されたCagAタンパク質を標的として、本発明に係る抗体を用いた治療剤または治療方法等を開発することができる。
以下にポリクローナル抗体の作製方法を説明する。
具体的には、以下の方法で行った。まず、配列番号1に示すアミノ酸配列からなるポリペプチドであって、10番目のチロシン残基がリン酸化されている、リン酸化ペプチドを合成した。より詳細には、アミノ酸残基を活性化させるHBTU、あるいはジイソプロピルカルボジイミドを用いた、Fmoc-based化学固相法を利用した。合成したポリペプチドは保護剤(プロテクト)を外し、チオアニソール等からなるスカベンジャーを含んだトリフルオロ酢酸を用いて、レジンベースのポリスチレンからなる固相支持体から切り離した。その後、抽出したポリペプチドは、エーテル内で沈殿させ、5,000rpmにて遠心回収し、エーテルで洗浄した。その後、HPLCにて精製を行った。
上記方法により得られた合成リン酸化ポリペプチドを抗原として、メスのニュージーランド白ウサギ(平均年齢:6ヶ月、平均重量:5-6 lbs)を用いて免疫処理を行った。
以下にアフィニティ精製用カラム作製について説明する。
上記カラムの底部にキャップがされていることを確認した後、15.8mgのL-システイン-HClを2mlのカップリング溶液に添加し、上記ゲルカラムにアプライした。そして、1時間室温にてインキュベートした。その後、10〜15mlの1M NaClにて洗浄し、フィルターをセットした。次いで、10〜15mlの0.5%アザイドNaにて洗浄し、3〜4mlのアザイドNaにてカラム内を満たし、キャップをしっかり閉めて4℃にて保存した。
上記2種類のアフィニティ精製用カラムA、Bを用いて、血清精製を行った。具体的には、まず、配列番号2に示すアミノ酸配列からなるポリペプチドを結合させたアフィニティ精製用カラムAに血清を通した。次いで、前記カラムAからパスしてきた溶液を、配列番号3に示すアミノ酸配列からなるポリペプチドであって、8番目のチロシン残基がリン酸化されているポリペプチドが結合しているアフィニティ精製用カラムBに通した。そして、前記カラムBに結合した抗体を、チロシンリン酸化CagAタンパク質を特異的に認識する抗体として取得した。
IgG精製は以下の手順で行った。まず、カラムを10mlの1×PBS(pH7.3)溶液で洗浄した。次に、上記血清 3mlとPBS 3mlとを2本のIgGカラムにアプライした。カラムを透過した血清をテストチューブに集めた。この血清を再びカラムにかけるという工程を5〜6回繰り返した。
上記実施例1に記載した方法により得たポリクローナル抗体の機能を免疫組織染色法により、以下のように解析した。
Claims (7)
- ヘリコバクター・ピロリ菌が感染している宿主細胞に見出される、チロシンリン酸化されているCagAタンパク質を特異的に認識する抗体。
- 配列番号1に示すアミノ酸配列のうち、1番目のシステイン残基を除く2〜16番目のアミノ酸配列からなるポリペプチドであって、10番目のチロシン残基がリン酸化されているポリペプチドを含むリン酸化CagAタンパク質を特異的に認識する抗体。
- 請求項1または2に記載の抗体を含有するヘリコバクター・ピロリ菌の宿主細胞への感染検出剤。
- 請求項1または2に記載の抗体を用いて、ヘリコバクター・ピロリ菌の宿主細胞への感染を検出する方法。
- 請求項1または2に記載の抗体を用いて、萎縮性胃炎、胃潰瘍、十二指腸潰瘍、MALTリンパ腫、および胃癌のうち、いずれかの疾患の発症または発症危険性を判定する方法。
- 請求項1または2に記載の抗体を用いて、萎縮性胃炎、胃潰瘍、十二指腸潰瘍、MALTリンパ腫、および胃癌のうち、いずれかの疾患を治療する方法。
- 配列番号4に示すアミノ酸配列からなるポリペプチドであって、4番目のチロシン残基がリン酸化されているポリペプチドを含有するワクチン。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003317412A JP2004123737A (ja) | 2002-09-10 | 2003-09-09 | 新規抗体及びその利用法 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002264825 | 2002-09-10 | ||
| JP2003317412A JP2004123737A (ja) | 2002-09-10 | 2003-09-09 | 新規抗体及びその利用法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004123737A true JP2004123737A (ja) | 2004-04-22 |
Family
ID=32301548
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003317412A Pending JP2004123737A (ja) | 2002-09-10 | 2003-09-09 | 新規抗体及びその利用法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2004123737A (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008189648A (ja) * | 2006-04-27 | 2008-08-21 | Toyama Univ | ヘリコバクター・ピロリ菌由来の新規抗原、抗原組成物およびピロリ菌抗体の検出方法。 |
| JP2016528499A (ja) * | 2013-08-13 | 2016-09-15 | テクニシェ ユニバーシタット ミュンヘン | H.ピロリ感染の検出方法 |
| WO2018153991A1 (en) * | 2017-02-24 | 2018-08-30 | Biotome Pty Ltd | Novel peptides and their use in diagnosis |
-
2003
- 2003-09-09 JP JP2003317412A patent/JP2004123737A/ja active Pending
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008189648A (ja) * | 2006-04-27 | 2008-08-21 | Toyama Univ | ヘリコバクター・ピロリ菌由来の新規抗原、抗原組成物およびピロリ菌抗体の検出方法。 |
| JP2016528499A (ja) * | 2013-08-13 | 2016-09-15 | テクニシェ ユニバーシタット ミュンヘン | H.ピロリ感染の検出方法 |
| WO2018153991A1 (en) * | 2017-02-24 | 2018-08-30 | Biotome Pty Ltd | Novel peptides and their use in diagnosis |
| US11401308B2 (en) | 2017-02-24 | 2022-08-02 | Biotome Pty Ltd. | Peptides and their use in diagnosis |
| JP2023049050A (ja) * | 2017-02-24 | 2023-04-07 | バイオトム ピーティーワイ リミテッド | 新規なペプチド及び診断におけるその使用 |
| US12037365B2 (en) | 2017-02-24 | 2024-07-16 | Biotome Pty Ltd. | Peptides and their use in diagnosis |
| US12459976B2 (en) | 2017-02-24 | 2025-11-04 | Biotome Pty Ltd. | Peptides and their use in diagnosis |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7598843B2 (ja) | 腎疾患及び歯周疾患を検出及び診断するための方法及び組成物 | |
| JPH10502366A (ja) | ヘリコバクター・ピロリ抗原タンパク質調製品およびイムノアッセイ | |
| US5866690A (en) | Detection of malignant tumor cells | |
| JP2000502070A (ja) | ヘリコバクター・ピロリによる感染の治療および診断 | |
| Neumann et al. | In vivo deposition of myosin-specific autoantibodies in the hearts of mice with experimental autoimmune myocarditis | |
| JPH04506562A (ja) | 医療目的の人体の乳頭腫ヴィールス(hpv)防止方法 | |
| US12203934B2 (en) | Method of detecting Mycobacterium avium subspecies paratuberculosis infection | |
| BRPI0912982B1 (pt) | método para detectar a presença ou ausência de um ou mais antígenos do nematódeo em uma amostra, polipeptídeo isolado, dispositivo para detectar a presença ou ausência de antígenos do nematódeo a partir de uma amostra, e kit para detectar um ou mais antígenos do nematódeo em uma amostra de mamíferos | |
| PT97150A (pt) | Novos metodos para o diagnostico da tuberculose | |
| CA2109088A1 (en) | Methods to detect and treat diseases caused by bacterial allergens | |
| RU2549698C2 (ru) | Химерный белок боррелии, нуклеиновая кислота, кодирующая такой белок, экспрессирующая кассета, вектор, способ и набор для диагностики лайм-боррелиоза, вакцина для профилактики боррелиоза | |
| EP2913675A2 (en) | GP2 isoforms and their use in autoantibody capture | |
| KR101777254B1 (ko) | En2 단백질을 특이적으로 인식하는 특정 항원으로부터 얻어진 단클론 항체 또는 이를 함유하는 전립선암 진단용 조성물 | |
| KR101062437B1 (ko) | 간흡충 특이 항원을 포함하는 간흡충증 진단 키트 및 상기간흡충 특이 항원의 생산을 위한 단클론 항체 | |
| KR20060129229A (ko) | 표면에 위치한 빈창자캄필로박터 폴리펩티드 | |
| JP2004123737A (ja) | 新規抗体及びその利用法 | |
| CN118126155A (zh) | 一种人nbs1蛋白赖氨酸388位点乳酸化抗原、抗体及其制备方法与应用 | |
| JP2020090477A (ja) | 自己免疫性水疱症の診断 | |
| KR102202082B1 (ko) | 치쿤군야 바이러스의 외피단백질 도메인 ⅱ에 대해 특이적으로 결합하는 단일클론항체, 이를 생산하는 하이브리도마 세포주 및 이의 용도 | |
| JP5565723B2 (ja) | 抗dcdモノクローナル抗体 | |
| KR20090054313A (ko) | 폐흡충 특이 항원의 생산을 위한 단클론 항체 및 폐흡충증신속 진단 키트 | |
| KR101777085B1 (ko) | En2 단백질의 면역원성 단편 펩타이드 또는 이를 특이적으로 인식하는 항체 조성물 | |
| KR102168417B1 (ko) | 디프테리아 독소에 대해 특이적으로 결합하는 단일클론항체, 이를 생산하는 하이브리도마 세포주 및 이의 용도 | |
| KR101779443B1 (ko) | 브루셀라병 진단용 형광면역진단키트 | |
| RU2281511C1 (ru) | Поликлональное антитело, специфически реагирующее с прионным протеином в ткани мозга млекопитающих, и диагностический реагент на его основе |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060907 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20060907 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091006 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091130 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100112 |