ES2868024T3 - Tetrahidrato de ligando H3, su procedimiento de preparación y composiciones farmacéuticas que lo comprenden - Google Patents
Tetrahidrato de ligando H3, su procedimiento de preparación y composiciones farmacéuticas que lo comprenden Download PDFInfo
- Publication number
- ES2868024T3 ES2868024T3 ES18711350T ES18711350T ES2868024T3 ES 2868024 T3 ES2868024 T3 ES 2868024T3 ES 18711350 T ES18711350 T ES 18711350T ES 18711350 T ES18711350 T ES 18711350T ES 2868024 T3 ES2868024 T3 ES 2868024T3
- Authority
- ES
- Spain
- Prior art keywords
- disorders
- tetrahydrate
- compound
- tetrahydrate form
- cognitive
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 150000004685 tetrahydrates Chemical class 0.000 title claims abstract description 56
- 239000008194 pharmaceutical composition Substances 0.000 title claims description 7
- 238000002360 preparation method Methods 0.000 title description 5
- 239000003446 ligand Substances 0.000 title description 4
- 150000001875 compounds Chemical class 0.000 claims abstract description 61
- ACQXFQGMLFJXEI-KRWDZBQOSA-N 4-[4-[3-[(3s)-3-methylpiperidin-1-yl]propoxy]phenyl]-1-oxidopyridin-1-ium Chemical compound C1[C@@H](C)CCCN1CCCOC1=CC=C(C=2C=C[N+]([O-])=CC=2)C=C1 ACQXFQGMLFJXEI-KRWDZBQOSA-N 0.000 claims abstract description 10
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 29
- 208000035475 disorder Diseases 0.000 claims description 23
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 20
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 claims description 10
- 238000000034 method Methods 0.000 claims description 10
- 230000002265 prevention Effects 0.000 claims description 10
- 206010041349 Somnolence Diseases 0.000 claims description 8
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 8
- 208000007590 Disorders of Excessive Somnolence Diseases 0.000 claims description 7
- 239000000843 powder Substances 0.000 claims description 7
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 claims description 6
- 208000018737 Parkinson disease Diseases 0.000 claims description 6
- 230000001149 cognitive effect Effects 0.000 claims description 6
- 208000001797 obstructive sleep apnea Diseases 0.000 claims description 6
- 208000011117 substance-related disease Diseases 0.000 claims description 6
- 238000002844 melting Methods 0.000 claims description 5
- 230000008018 melting Effects 0.000 claims description 5
- 230000036651 mood Effects 0.000 claims description 5
- 201000009032 substance abuse Diseases 0.000 claims description 5
- 231100000736 substance abuse Toxicity 0.000 claims description 5
- 208000007848 Alcoholism Diseases 0.000 claims description 4
- 206010012289 Dementia Diseases 0.000 claims description 4
- 208000013738 Sleep Initiation and Maintenance disease Diseases 0.000 claims description 4
- 206010001584 alcohol abuse Diseases 0.000 claims description 4
- 208000025746 alcohol use disease Diseases 0.000 claims description 4
- 201000003631 narcolepsy Diseases 0.000 claims description 4
- 208000019116 sleep disease Diseases 0.000 claims description 4
- 230000036626 alertness Effects 0.000 claims description 3
- 208000010877 cognitive disease Diseases 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 208000024827 Alzheimer disease Diseases 0.000 claims description 2
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 claims description 2
- 206010003805 Autism Diseases 0.000 claims description 2
- 208000020706 Autistic disease Diseases 0.000 claims description 2
- 208000017164 Chronobiology disease Diseases 0.000 claims description 2
- 241000282412 Homo Species 0.000 claims description 2
- 208000009829 Lewy Body Disease Diseases 0.000 claims description 2
- 201000002832 Lewy body dementia Diseases 0.000 claims description 2
- 208000001145 Metabolic Syndrome Diseases 0.000 claims description 2
- 208000008589 Obesity Diseases 0.000 claims description 2
- 208000006199 Parasomnias Diseases 0.000 claims description 2
- 206010062519 Poor quality sleep Diseases 0.000 claims description 2
- 208000010340 Sleep Deprivation Diseases 0.000 claims description 2
- 206010040981 Sleep attacks Diseases 0.000 claims description 2
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 claims description 2
- 201000004810 Vascular dementia Diseases 0.000 claims description 2
- 208000012886 Vertigo Diseases 0.000 claims description 2
- 206010048010 Withdrawal syndrome Diseases 0.000 claims description 2
- 201000000690 abdominal obesity-metabolic syndrome Diseases 0.000 claims description 2
- 230000006978 adaptation Effects 0.000 claims description 2
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 claims description 2
- 230000002490 cerebral effect Effects 0.000 claims description 2
- 230000007278 cognition impairment Effects 0.000 claims description 2
- 239000012141 concentrate Substances 0.000 claims description 2
- 230000003001 depressive effect Effects 0.000 claims description 2
- 206010012601 diabetes mellitus Diseases 0.000 claims description 2
- 206010015037 epilepsy Diseases 0.000 claims description 2
- 230000002267 hypothalamic effect Effects 0.000 claims description 2
- 210000000987 immune system Anatomy 0.000 claims description 2
- 206010022437 insomnia Diseases 0.000 claims description 2
- 201000003152 motion sickness Diseases 0.000 claims description 2
- 235000020824 obesity Nutrition 0.000 claims description 2
- 230000007170 pathology Effects 0.000 claims description 2
- 230000001817 pituitary effect Effects 0.000 claims description 2
- 230000000506 psychotropic effect Effects 0.000 claims description 2
- 230000029058 respiratory gaseous exchange Effects 0.000 claims description 2
- 230000028327 secretion Effects 0.000 claims description 2
- 231100000889 vertigo Toxicity 0.000 claims description 2
- 238000002425 crystallisation Methods 0.000 claims 2
- 230000008025 crystallization Effects 0.000 claims 2
- 208000032140 Sleepiness Diseases 0.000 claims 1
- 230000001747 exhibiting effect Effects 0.000 claims 1
- 230000037321 sleepiness Effects 0.000 claims 1
- 239000000203 mixture Substances 0.000 description 18
- 238000001035 drying Methods 0.000 description 10
- 239000000047 product Substances 0.000 description 8
- 239000002552 dosage form Substances 0.000 description 7
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- 239000002585 base Substances 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 238000009472 formulation Methods 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 229940079593 drug Drugs 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 238000004448 titration Methods 0.000 description 4
- 239000003981 vehicle Substances 0.000 description 4
- SPOLCPORTSDTGD-HNNXBMFYSA-N 2-[2-[(1s)-1-[3-cyclopropyloxy-4-(difluoromethoxy)phenyl]-2-(1-oxidopyridin-1-ium-3-yl)ethyl]-1,3-thiazol-5-yl]-1,1,1,3,3,3-hexafluoropropan-2-ol Chemical compound S1C(C(O)(C(F)(F)F)C(F)(F)F)=CN=C1[C@H](C=1C=C(OC2CC2)C(OC(F)F)=CC=1)CC1=CC=C[N+]([O-])=C1 SPOLCPORTSDTGD-HNNXBMFYSA-N 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 239000012458 free base Substances 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 150000003891 oxalate salts Chemical class 0.000 description 3
- 238000000634 powder X-ray diffraction Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 238000000354 decomposition reaction Methods 0.000 description 2
- 238000004452 microanalysis Methods 0.000 description 2
- 238000011170 pharmaceutical development Methods 0.000 description 2
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 238000012360 testing method Methods 0.000 description 2
- YFGHCGITMMYXAQ-UHFFFAOYSA-N 2-[(diphenylmethyl)sulfinyl]acetamide Chemical compound C=1C=CC=CC=1C(S(=O)CC(=O)N)C1=CC=CC=C1 YFGHCGITMMYXAQ-UHFFFAOYSA-N 0.000 description 1
- DYPZQMXWIKNBDP-RMRYJAPISA-N 4-[4-[3-[(3S)-3-methylpiperidin-1-yl]propoxy]phenyl]-1-oxidopyridin-1-ium dihydrochloride Chemical compound Cl.Cl.C[C@H]1CCCN(CCCOc2ccc(cc2)-c2cc[n+]([O-])cc2)C1 DYPZQMXWIKNBDP-RMRYJAPISA-N 0.000 description 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- BKRGVLQUQGGVSM-KBXCAEBGSA-N Revanil Chemical compound C1=CC(C=2[C@H](N(C)C[C@H](C=2)NC(=O)N(CC)CC)C2)=C3C2=CNC3=C1 BKRGVLQUQGGVSM-KBXCAEBGSA-N 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 229940035678 anti-parkinson drug Drugs 0.000 description 1
- 239000012296 anti-solvent Substances 0.000 description 1
- 229940124435 antinarcoleptic drug Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 239000000939 antiparkinson agent Substances 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 229960002802 bromocriptine Drugs 0.000 description 1
- OZVBMTJYIDMWIL-AYFBDAFISA-N bromocriptine Chemical compound C1=CC(C=2[C@H](N(C)C[C@@H](C=2)C(=O)N[C@]2(C(=O)N3[C@H](C(N4CCC[C@H]4[C@]3(O)O2)=O)CC(C)C)C(C)C)C2)=C3C2=C(Br)NC3=C1 OZVBMTJYIDMWIL-AYFBDAFISA-N 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- QXDMQSPYEZFLGF-UHFFFAOYSA-L calcium oxalate Chemical compound [Ca+2].[O-]C(=O)C([O-])=O QXDMQSPYEZFLGF-UHFFFAOYSA-L 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000005829 chemical entities Chemical class 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 229940124301 concurrent medication Drugs 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 238000011194 good manufacturing practice Methods 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229960004502 levodopa Drugs 0.000 description 1
- 229960003587 lisuride Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 229960001165 modafinil Drugs 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- -1 ropinorol Chemical compound 0.000 description 1
- 229910001961 silver nitrate Inorganic materials 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- WVSZBAHKLHXQFN-UHFFFAOYSA-N tetrahydrate;dihydrochloride Chemical compound O.O.O.O.Cl.Cl WVSZBAHKLHXQFN-UHFFFAOYSA-N 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/13—Crystalline forms, e.g. polymorphs
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Psychiatry (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Hydrogenated Pyridines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pyridine Compounds (AREA)
Abstract
Forma de tetrahidrato del compuesto de fórmula (A): **(Ver fórmula)** (A): (3S)-4-{4-[3-(3-metilpiperidin-1-il)propoxi]fenil}piridina 1-óxido, diclorhidrato
Description
DESCRIPCIÓN
Tetrahidrato de ligando H3, su procedimiento de preparación y composiciones farmacéuticas que lo comprenden
La invención también se refiere al proceso de preparación de dicha tetrahidrato del compuesto (A), las composiciones farmacéuticas que contienen el mismo, y sus usos terapéuticos.
El compuesto de fórmula (A) es (3S)-4-{4-[3-(3-metilpiperidin-1 -il)propoxi]fenil}piridina 1-óxido, diclorhidrato.
Se describe junto con su forma de base libre, su oxalato y clorhidrato en el documento WO 2006/117609, donde se describen muchos otros ligandos H3 de histamina no de imidazol y sus usos terapéuticos.
Entre los ligandos H3 descritos, se ha encontrado que el (3S)-4-{4-[3-(3-metilpiperidin-1-il) propoxi] fenil} piridina 1-óxido es muy potente. Sin embargo, es líquido y no se favorece para usos farmacéuticos.
La sal de oxalato del mismo no es adecuada, ya sea como candidato a fármaco, ya que las sales de oxalato pueden conducir a depósitos de oxalato de calcio.
La sal de monoclorhidrato del mismo se funde a 74 °C y es probable que se funda durante la compresión en la preparación de pastillas. Por lo tanto, se espera que tampoco sea adecuada para un desarrollo posterior.
Se encontró que la sal de diclorhidrato es demasiado higroscópica para satisfacer los requisitos de estabilidad para los productos farmacéuticos.
Por lo tanto, ninguna de las formas de compuesto (A) es adecuada para usos farmacéuticos. Inesperadamente, se encontró que el tetrahidrato del compuesto (A) era altamente estable y cristalino, con un alto punto de fusión, cumpliendo así los requisitos necesarios para un fármaco candidato.
Según un primer objetivo, la presente invención se refiere, por lo tanto, a la forma de tetrahidrato del compuesto de fórmula (A).
La expresión "tetrahidrato del compuesto (A)" se refiere a la entidad química que comprende una molécula del compuesto (A) y cuatro moléculas de agua.
La "base del compuesto (A)" se refiere al siguiente compuesto:
La forma de tetrahidrato del compuesto (A) puede existir en una forma cristalina.
Según una realización, la presente invención, por tanto, también se refiere a la forma cristalina del tetrahidrato del compuesto (A).
La forma cristalina del tetrahidrato del compuesto (A) está generalmente en forma de un polvo, las características de la cual se mejoran en comparación con la forma de base libre o de otras sales del compuesto (A). El tetrahidrato del compuesto (A) es estable para una humedad relativa que varía de al menos 30% a 70%, que es una propiedad
mejorada en comparación con la naturaleza higroscópica del diclorhidrato anteriormente descrito. El tetrahidrato del compuesto (A) también es estable a temperaturas que varían entre 20 ° C y 40 ° C.
El tetrahidrato del compuesto (A) presenta una o más de las siguientes características: según una realización, la forma de tetrahidrato del compuesto (A) exhibe un pico de fusión alrededor de 191 °C cuando se mide mediante el procedimiento de tubo capilar.
Según otra realización, el análisis por calorimetría diferencial de barrido muestra dos eventos endotérmicos con inicio alrededor de 53 °C y 83 °C, que corresponden a la pérdida de cuatro moléculas de agua; se observa un último evento con un inicio alrededor de los 191 °C.
Según otra realización, el contenido de agua del tetrahidrato del compuesto (A) está comprendido entre 14 y 16%, generalmente aproximadamente 15,3 ± 0,7% en peso.
Según otra realización, la forma de tetrahidrato del compuesto (A) presenta una o más de las líneas del difractograma de rayos X en polvo que se describen a continuación:
Más particularmente, los siguientes picos:
Según un objetivo adicional, la presente invención también se refiere a procedimientos de preparación de la forma
tetrahidrato del compuesto (A). El tetrahidrato del compuesto (A) se puede preparar mediante procedimientos habituales, tales como insolubilización a partir de un disolvente por concentración, adición de un antidisolvente o bajando la temperatura.
Según una realización, el procedimiento de preparación de la forma tetrahidrato del compuesto (A) comprende las siguientes etapas:
- disolver el compuesto (A) en agua;
- concentrar hasta que el sólido se separe; y
- secar el sólido hasta el contenido de agua final deseado, tal como 14-16%, particularmente aproximadamente 15,3 ± 0,7% en peso.
La concentración se puede lograr generalmente mediante evaporación.
Según otra realización, el proceso comprende las siguientes etapas:
- añadir ácido clorhídrico acuoso a la forma básica del compuesto (A);
- añadir acetona y sembrar hasta que el sólido se separe;
- filtrar; y
- secar el sólido hasta el contenido de agua final deseado, tal como 14-16%, particularmente aproximadamente 15,3 ± 0,7% en peso.
El compuesto (A) se puede preparar tal como se describe en el documento WO 2006/117609.
La presente invención también se refiere al tetrahidrato del compuesto (A) para su uso para tratar y/o prevenir en un paciente humano trastornos seleccionados de la enfermedad de Alzheimer; atención; trastornos de la vigilia y la memorización; déficits cognitivos en patologías psiquiátricas; trastornos cognitivos, del estado de ánimo y de la vigilancia, en particular en personas mayores; estados depresivos o asténicos; enfermedad de Parkinson; apnea obstructiva del sueño; demencia con cuerpos de Lewy; demencia vascular; vértigo; cinetosis; obesidad; diabetes y síndrome metabólico; trastornos del sueño; estrés; trastornos psicotrópicos; epilepsia; depresión; narcolepsia con o sin cataplejía; trastornos cognitivos en el autismo; abuso de sustancias, en particular trastornos por abuso de alcohol; prevención de síndromes de abstinencia por abuso de sustancias; fatiga posterior a accidente cerebrovascular; trastornos de atención y vigilancia del trastorno por déficit de atención con hiperactividad (TDAH) en niños o adultos; trastornos de la secreción hipotálamohipofisaria, la circulación cerebral y/o el sistema inmunológico; somnolencia diurna excesiva, tal como somnolencia diurna excesiva y fatiga asociada con la enfermedad de Parkinson, apnea obstructiva del sueño o demencia; y/o para facilitar los trabajos nocturnos o la adaptación al cambio de hora en humanos sanos,
donde dicho uso comprende la administración del tetrahidrato de (A) en un ser humano a una dosis comprendida entre 10 y 90 |jg al día (con respecto a la base del compuesto (A)).
Según una realización, el uso es para el tratamiento y/o prevención de trastornos del sueño, tales como insomnio, trastornos del inicio y el mantenimiento del sueño, la fragmentación del sueño, parasomnias, respiración alterada durante el sueño, trastornos del ritmo circadiano, la narcolepsia con o sin cataplexia, somnolencia diurna excesiva (incluidos "ataques de sueño"), tales como somnolencia diurna excesiva asociada con la enfermedad de Parkinson, apnea obstructiva del sueño o demencia. Otro uso es para el tratamiento y/o prevención de trastornos por abuso de sustancias, en particular el abuso de alcohol. Otro uso es para el tratamiento y/o prevención de trastornos del estado de ánimo, cognitivos y de la vigilancia asociados con el accidente cerebrovascular. Otro uso es para el tratamiento y/o prevención de trastornos cognitivos y de atención en el TDAH.
También se describe en este documento un procedimiento de prevención y/o tratamiento de los trastornos anteriores que comprende la administración del tetrahidrato del compuesto (A) a una dosis de la base comprendida entre 10 y 90 |ig al día (con respecto a la base del compuesto (A)), con un portador o excipiente farmacéuticamente aceptable, a un paciente que lo necesite. Según una realización, la dosis diaria de tetrahidrato de (A) para la administración a un ser humano está comprendida entre 20 y 50 jg al día, preferiblemente de 30 a 45 jg (con respecto a la base del compuesto (A)) al día.
Según otra realización, el procedimiento descrito en el presente documento puede comprender la administración del tetrahidrato del compuesto (A), a una frecuencia comprendida entre una vez cada tres días: una vez cada dos días (qod), una vez al día (qd). Preferiblemente, la administración puede tener lugar por tanto una vez al día.
Se ha de entender que la dosis de la invención es la dosis acumulativa de cada dosis de administración administrada dentro de un día.
La identificación de los sujetos que están en necesidad de tratamiento de enfermedades y afecciones descritas en el presente documento está dentro de la capacidad y conocimiento de un experto en la maeria. Un médico experto en la materia puede identificar fácilmente, mediante el uso de pruebas clínicas, examen físico, pruebas genéticas y antecedentes médicos/familiares, aquellos sujetos que necesitan dicho tratamiento.
Los niveles de dosificación reales del tetrahidrato del compuesto de fórmula (A) de la invención pueden variarse para obtener una cantidad de principio activo que sea eficaz para obtener una respuesta terapéutica deseada para una composición y procedimiento de administración particulares. Por tanto, el nivel de dosificación seleccionado depende del efecto terapéutico deseado, de la vía de administración, de la duración deseada del tratamiento y de otros factores, por ejemplo, el estado del paciente.
Una cantidad terapéuticamente eficaz puede determinarse fácilmente por el médico tratante, como experto en la materia, mediante el uso de técnicas convencionales y observando los resultados obtenidos en circunstancias análogas. Al determinar la cantidad terapéuticamente eficaz, el médico que realiza el diagnóstico considera una serie de factores, que incluyen, pero no se limitan a: la especie del sujeto; su tamaño, edad y salud general; la enfermedad específica involucrada; el grado de afectación o la gravedad de la enfermedad; la respuesta del sujeto individual; el compuesto particular administrado; el modo de administración; la biodisponibilidad característica del preparado administrado; el régimen de dosis seleccionado; el uso de medicación concomitante; y otras circunstancias relevantes.
La cantidad de tetrahidrato del compuesto (A) que se requiere para conseguir el efecto biológico deseado variará dependiendo de una serie de factores, incluyendo la dosificación del fármaco a administrar, el tipo de enfermedad, el estado de enfermedad del paciente y la vía de administración.
En términos generales, es probable que la dosis preferida del fármaco a administrar dependa de variables, tales como el tipo y grado de progresión de la enfermedad o trastorno, el estado de salud general del paciente particular, la eficacia biológica relativa del compuesto seleccionado y la formulación del excipiente del compuesto y su vía de administración. La dosis diaria del tetrahidrato del compuesto (A) será generalmente inferior a 90 |jg al día por paciente.
Según una realización adicional, el procedimiento descrito en el presente documento también comprende la administración de uno o más principios activos, seleccionados entre fármacos anti-Parkinson, tales como levodopa, ropinorol, lisurida, bromocriptina, pramixepole o seleccionado de fármacos antinarcolépticos o supuestamente antinarcolépticos de otra clase, incluido el modafinilo.
El tetrahidrato del compuesto (A) se puede formular en composiciones farmacéuticas mediante mezcla con uno o más excipientes farmacéuticamente aceptables.
Las composiciones pueden administrarse convenientemente en forma de dosificación unitaria y pueden prepararse mediante cualquiera de los procedimientos bien conocidos en la técnica farmacéutica, por ejemplo, tal como se describe en Remington: The Science and Practice of Pharmacy, 20a ed.; Gennaro, AR, Ed.; Lippincott Williams y Wilkins: Filadelfia, PA, 2000.
El tetrahidrato del compuesto (A) se puede administrar mediante diversas vías de administración, tales como por vía oral; parenteral, incluyendo subcutánea, intramuscular, intravenosa; sublingual, tópica; local; intratraqueal; intranasal; transdérmica o rectal, combinándose el principio activo con un excipiente o vehículo farmacéuticamente aceptable en una composición farmacéutica.
Según otro objeto, la presente invención también se refiere a la composición farmacéutica que comprende el tetrahidrato del compuesto (A) y un excipiente o vehículo farmacéuticamente aceptable.
Según una realización, dicha composición es para uso en el tratamiento y/o prevención de los trastornos anteriores.
Según una realización, dicha composición es adecuada para la administración del tetrahidrato del compuesto (A) a una dosis comprendida entre 10 y 90 |ig (con relación a la base del compuesto (A)) al día.
Para la aplicación tópica, las composiciones de la invención pueden formularse como cremas, geles, pomadas o lociones.
En particular, las formulaciones adecuadas para la administración parenteral son estériles e incluyen emulsiones, suspensiones, soluciones acuosas y no acuosas de inyección, que pueden contener agentes de suspensión y agentes espesantes y antioxidantes, tampones, bacteriostáticos y solutos que hacen que la formulación sea isotónica, y tengan un pH adecuadamente ajustado, con la sangre del receptor previsto.
Según la invención, se utiliza ventajosamente la administración oral del compuesto o composición en una formulación apropiada. Las formulaciones que son adecuadas para administrarse por vía oral a un paciente incluyen unidades discretas, tales como cápsulas, tales como cápsulas de gelatina blanda o dura, comprimidos, conteniendo cada una de las cuales una cantidad predeterminada del tetrahidrato del compuesto de fórmula (A). También incluyen polvos o gránulos; soluciones o suspensiones en un líquido acuoso o un líquido no acuoso; o como una emulsión líquida de aceite en agua o una emulsión líquida de agua en aceite.
"Farmacéuticamente" o "farmacéuticamente aceptable" se refieren a entidades moleculares y composiciones que no producen una reacción adversa, alérgica u otra cuando se administra a un animal, o un ser humano, según sea
apropiado.
Tal como se usa en el presente documento, "excipiente, vehículo o portador farmacéuticamente aceptable" incluye, en particular, diluyentes, adyuvantes, excipientes o vehículos. El uso de tales ingredientes para sustancias farmacéuticas activas es bien conocido en la técnica.
En el contexto de la invención, el término "tratar" o "tratamiento", tal como se usa en este documento, significa revertir, aliviar, inhibir el progreso de, o prevenir el trastorno o afección al que se aplica dicho término, o uno o más síntomas de dicho trastorno o afección.
"Cantidad terapéuticamente eficaz" significa una cantidad de un compuesto/medicamento según la presente invención eficaz para producir el efecto terapéutico deseado.
Según la invención, el término "paciente" o "paciente en necesidad del mismo", está destinado a un mamífero humano o no humano afectado o susceptible de ser afectado con los trastornos anteriores. Preferiblemente, el paciente es un ser humano.
El tetrahidrato del compuesto (A) puede administrarse en formas de dosificación unitaria, en donde el término "dosis unitaria" significa una dosis única que se puede administrar a un paciente, y que se puede manipular y envasar fácilmente, permaneciendo como una dosis unitaria físicamente y químicamente estable que comprende el propio compuesto activo o como una composición farmacéuticamente aceptable.
Las formas de dosificación unitarias apropiadas comprenden las formas orales, las formas sublingual, bucal, intratraqueal, intraocular intranasal, las formas por inhalación, las formas tópica, transdérmica, subcutánea, las formas parenterales, las formas rectales y los implantes.
La dosis diaria de entre 10 y 90 |ig (con relación a la base del compuesto (A)) según la presente invención se puede lograr mediante la administración de la mitad de una forma de dosificación unitaria, una forma de dosificación unitaria individual o dos o más formas de dosificación unitaria según la forma de dosificación unitaria comercializada, la dosis diaria a administrar y la frecuencia de administración prescrita por el médico.
FIGURAS
La figura 1 ilustra el difractograma de rayos X (polvo) del compuesto obtenido en el Ejemplo 1 (tetrahidrato del compuesto (A)).
La Figura 2 ilustra el difractograma de rayos X (polvo) del compuesto (A).
Los siguientes ejemplos se proporcionan para realizaciones ilustrativas, no limitantes, de la presente invención. EJEMPLOS
Ejemplo 1: Síntesis de (3S)-4-l4-r3-(3-met¡lp¡per¡d¡n-1-¡l)propox¡lfen¡l}p¡r¡dina 1-óxido. diclorhidrato, tetrahidrato
Se cargan 210 ± 15 g de compuesto (A) y 200 ± 10 g de agua en el recipiente de evaporación. La temperatura del baño en el sistema de evaporación se ajusta a aproximadamente 40 °C y la mezcla se agita hasta que se disuelve todo el precipitado. El agua se evapora hasta que el producto se separa en forma sólida.
El recipiente de evaporación que contiene el producto se transfiere a un secador de vacío en bandeja y el producto se seca a 30 °C. El producto se transfiere del recipiente de evaporación al recipiente de secado real y se continúa el secado a 30 °C hasta que el contenido de agua del producto es del 15,3 ± 0,7 % en peso. Finalmente el producto se muele y se envasa.
Ejemplo 2: Síntesis de (3S)-4-l4-r3-(3-met¡lp¡per¡d¡n-1-¡l)propox¡lfen¡l}p¡r¡dina 1-óxido. diclorhidrato. tetrahidrato
Se disuelven 2,5 kg de (3S)-4-{4-[3-(3-metilpiperidin-1 -il)propoxi]fenil}piridina 1-óxido en una solución de ácido clorhídrico y la temperatura se ajusta a 22-30 °C. Se agrega acetona en el reactor, la mezcla se siembra y se agita. Se añade más acetona a 22-30 °C hasta que la cantidad total añadida es de 20,0 kg. La temperatura de la mezcla se ajusta a 18-24 °C y la mezcla se agita durante 1,0-2,0 h. El producto se aísla mediante filtración y se lava con una mezcla de agua y acetona. El producto se seca bajo un flujo constante de nitrógeno a 20-30 °C, se muele y se envasa.
Ejemplo 3: Difracción de rayos X en polvo
La difracción de rayos X en polvo se registró en (3S)-4-{4-[3-(3-metilpiperidin-1-il)propoxi]fenil}piridina 1-óxido
diclorhidrato, tetrahidrato (Ejemplo 1) en forma de polvo.
- Difractómetros Bruker D5000 Matic Difractometer;
- Ánodo de cobre, voltaje de 40 KV, intensidad de 40 mA
- Configuración 0-0, muestra fija
- Temperatura ambiente
- Intervalo de medición: 3° a 30° (2 theta)
- Incremento de etapa: 0,04°
- Tiempo de medición por etapa: 4s
- Sin referencia interna
- Tratamiento experimental del datos mediante software EVA (v 11.0)
Un difractograma típico de (3S)-4-{4-[3-(3-metilpiperidin-1-il)propoxi]fenil}piridina 1-óxido, diclorhidrato, tetrahidrato se representa en la figura 1, que es claramente diferente de la forma no tetrahidratada de (3S)-4-{4-[3-(3-metilpiperidin-1 -il)propoxi]fenil}piridina 1-óxido, diclorhidrato, mostrada en la Figura 2.
Los picos de caracterización de (3S)-4-{4-[3-(3-metilpiperidin-1-il)propoxi]fenil}piridina 1-óxido, diclorhidrato, tetrahidrato incluyen:
Ejemplo 4: Caracterización de (3S)-4-l4-r3-(3-met¡lp¡per¡d¡n-1-¡l)propox¡lfen¡l}p¡r¡dina 1-óxido, diclorhidrato. tetrahidrato
Microanálisis
La sal de diclorhidrato descrita en el Ejemplo 52 del documento WO 2006/117609 se ha analizado mediante microanálisis. Los resultados se pueden comparar con los valores teóricos para el diclorhidrato anhidro y tetrahidratado:
Los valores medidos se ajustan bien con los teóricos para el diclorhidrato anhidro y son claramente diferentes de los del diclorhidrato tetrahidrato.
El compuesto descrito en el ejemplo 52 del documento WO 2006/117609, por tanto, no está en una forma de tetrahidrato.
Valoración de cloruro
La valoración de cloruro con nitrato de plata se llevó a cabo para el presente ejemplo 1 y el anterior ejemplo 52 del documento WO 2006/117609.
El contenido de cloruro para el presente ejemplo 1 fue de 15,0 % al igual que el valor teórico. El contenido de cloruro para el ejemplo 52 del documento WO 2006/117609 fue del 17,8 % para un valor teórico del 17,75 %.
El ejemplo 1 es diferente de los compuestos descritos previamente en el ejemplo 50 (la base libre y la sal de oxalato que no contienen cloruro) y el ejemplo 52 del documento WO 2006/117609.
Puntos de fusión
La comparación de los puntos de fusión evidencia que el presente Ejemplo 1 es distinto del Ejemplo 51 del documento WO 2006/117609.
Valoración de agua (por Karl Fischer)
La valoración de agua muestra claramente que la nueva fase es un tetrahidrato mientras que el Ejemplo 52 del documento WO 2006/117609 no lo era.
Ejemplo 5: Estabilidad
Estabilidad del ejemplo 52 del documento WO 2006/117609
Los estudios de estabilidad se han realizado según ICH.
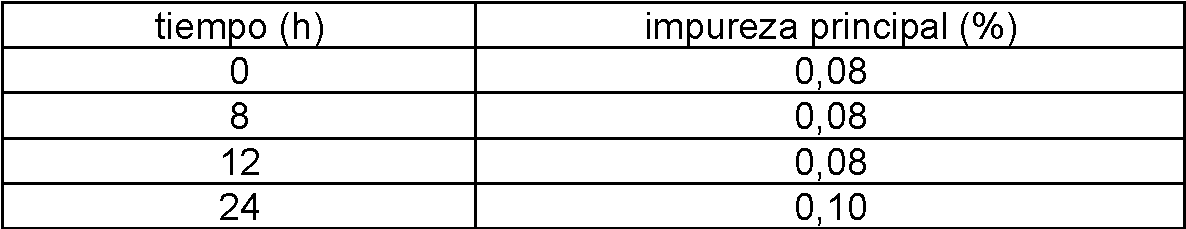
A 40 °C/75 % de humedad relativa, se observa cierta degradación:
Se obtuvieron resultados similares para la muestra de 3 meses a 30 °C/65 % de humedad relativa:
Los estudios de estabilidad muestran de este modo una tendencia a la descomposición del Ejemplo 52. La sustancia permanece dentro de las especificaciones 98,0 - 102,0%, pero la disminución de la pureza es significativa y podría conducir a una vida útil reducida.
Estabilidad del presente ejemplo 1
La estabilidad ha sido evaluada en condiciones ICH.
Los resultados a 40 °C/75 % de humedad relativa se muestran en la siguiente tabla: no se observa degradación:
No hay ninguna variación significativa de la pureza con el tiempo. El diclorhidrato de tetrahidrato es más estable que la fase descrita anteriormente (Ejemplo 52 del documento WO 2006/117609) que perdió un 2 % en seis meses. Además, el análisis de presente Ejemplo 1 por sorción dinámica de vapores y la difracción de rayos X en polvo mostró que la forma de tetrahidrato muestra una buena estabilidad para la humedad relativa del 10 al 90 % a 25 °C.
Ejemplo 6: Higroscopia
Ejemplo 52 del documento WO 2006/117609
Este compuesto es higroscópico. Capta agua durante el tiempo.
Un lote se preparó y se almacenó bajo buenas prácticas de fabricación y se encontró que mostraba cantidades crecientes de contenido de agua con el tiempo:
No se pudo curar mediante secado ya que se encontró que lleva a cierta degradación, tal como se muestra en las tablas siguientes.
El secado no se completó a 60 °C durante 24 horas. El secado a 80 °C o 100 °C permitió la eliminación completa del agua, pero se produjo cierta descomposición.
Secado a 60 °C
Secado a 80 °C
Secado a 100 °C
Presente ejemplo 1
El ejemplo 1 no es higroscópico.
A 40 °C/75 % de humedad relativa, no se observa modificación del contenido de agua:
La forma de tetrahidrato de (3S)-4-{4-[3-(3-metilpiperidin-1 -il)propoxi] fenil}piridina 1-óxido, diclorhidrato es por lo tanto más estable que el (3S)-4-{4-[3-(3-metilpiperidin-1 -il)propoxi]fenil} piridina 1-óxido, diclorhidrato.
El tetrahidrato muestras propiedades mejoradas para el desarrollo farmacéutico y muestra propiedades mejoradas para el desarrollo farmacéutico.
Claims (10)
2. Forma de tetrahidrato, según la reivindicación 1, que presenta un pico de fusión de 191 °C cuando se mide mediante el procedimiento del tubo capilar.
3. Forma de tetrahidrato, según cualquiera de las reivindicaciones 1 ó 2, que comprende un contenido de agua de 15,3 ± 0,7 % en peso.
4. Forma de tetrahidrato, según cualquiera de las reivindicaciones anteriores, que muestra las líneas de difractograma de rayos X en polvo: 2-Theta ° (d en Angstroms) = 9,7 (9,1), 12,5 (7,1), 14,6 (6,1), 15,2 (5,8), 16,5 (5,4), 19,0 (4,7), 19,5 (4,6), 22,0 (4,1), 24,3 (3,7), 24,8 (3,6), 26,2 (3,4), 28,4 (3,1).
5. Proceso de preparación de la forma de tetrahidrato, según cualquiera de las reivindicaciones anteriores, que comprende las siguientes etapas:
- disolver el compuesto (A) en agua;
- concentrar hasta la cristalización;
- filtrar; y
- secar.
6. Proceso de preparación de la forma de tetrahidrato, según cualquiera de las reivindicaciones 1 a 4, que comprende las siguientes etapas:
- disolver el compuesto (A) en agua;
- añadir acetona y bajar la temperatura hasta la cristalización;
- filtrar; y
- secar.
7. Composición farmacéutica que comprende la forma de tetrahidrato, según cualquiera de las reivindicaciones 1 a 4, junto con al menos un excipiente farmacéuticamente aceptable.
8. Forma de tetrahidrato, según cualquiera de las reivindicaciones 1 a 4, para uso para el tratamiento y/o prevención en un paciente humano de la enfermedad de Alzheimer; atención; trastornos de la vigilia y la memorización; déficits cognitivos en patologías psiquiátricas; trastornos del estado de ánimo, de la vigilancia o cognitivos en personas mayores; estados depresivos o asténicos; enfermedad de Parkinson; apnea obstructiva del sueño; demencia con cuerpos de Lewy; demencia vascular; vértigo; cinetosis; obesidad; diabetes y síndrome metabólico; trastornos del sueño; estrés; trastornos psicotrópicos; epilepsia; depresión; narcolepsia con o sin cataplejía; trastornos de la secreción hipotálamohipofisaria, la circulación cerebral y/o el sistema inmunológico; somnolencia diurna excesiva y fatiga asociada con la enfermedad de Parkinson, apnea obstructiva del sueño o demencia y/o para facilitar los trabajos nocturnos o la adaptación al cambio de hora en seres humanos sanos; trastornos por déficit de atención; abuso de sustancias, en particular trastornos por abuso de alcohol; prevención de síndromes de abstinencia por abuso de sustancias; fatiga posterior al accidente cerebrovascular, trastornos del estado de ánimo, cognitivos y de vigilancia; trastornos cognitivos en el autismo; trastornos de atención y vigilancia del trastorno por déficit de atención con hiperactividad (TDAH) en niños o adultos.
9. Forma de tetrahidrato, según cualquiera de las reivindicaciones 1 a 4, para uso en el tratamiento y/o prevención de trastornos del sueño, preferiblemente insomnio, trastornos del inicio y mantenimiento del sueño, fragmentación del sueño, parasomnias, respiración alterada durante el sueño, trastorno del ritmo circadiano, narcolepsia con o sin cataplexia, somnolencia diurna excesiva, incluyendo "ataques de sueño", preferiblemente somnolencia diurna excesiva asociada con la enfermedad de Parkinson, apnea obstructiva del sueño o demencia; trastornos por abuso de sustancias, preferiblemente por abuso de alcohol, trastornos del estado de ánimo, cognitivos y de vigilancia asociados con el accidente cerebrovascular; trastornos cognitivos y de atención en el TDAH.
10. Forma de tetrahidrato para uso, según la reivindicación 8 o 9, en la que dicho uso comprende la administración de
dicho tetrahidrato del compuesto (A) en un ser humano a una dosis comprendida entre 10 y 90 |jg con respecto a la base del compuesto (A) al día.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP17305310.9A EP3378858A1 (en) | 2017-03-21 | 2017-03-21 | Tetrahydrate of h3 ligand, its process of preparation and pharmaceutical compositions comprising the same |
| PCT/EP2018/056999 WO2018172344A1 (en) | 2017-03-21 | 2018-03-20 | Tetrahydrate of h3 ligand, its process of preparation and pharmaceutical compositions comprising the same |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2868024T3 true ES2868024T3 (es) | 2021-10-21 |
Family
ID=58488932
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES18711350T Active ES2868024T3 (es) | 2017-03-21 | 2018-03-20 | Tetrahidrato de ligando H3, su procedimiento de preparación y composiciones farmacéuticas que lo comprenden |
Country Status (22)
| Country | Link |
|---|---|
| US (1) | US11078183B2 (es) |
| EP (2) | EP3378858A1 (es) |
| JP (1) | JP7235671B2 (es) |
| KR (1) | KR102608265B1 (es) |
| CN (1) | CN110891948B (es) |
| AU (1) | AU2018238260B2 (es) |
| CA (1) | CA3056490A1 (es) |
| CY (1) | CY1124114T1 (es) |
| DK (1) | DK3601252T3 (es) |
| ES (1) | ES2868024T3 (es) |
| HR (1) | HRP20210312T1 (es) |
| HU (1) | HUE053710T2 (es) |
| IL (1) | IL269360B2 (es) |
| LT (1) | LT3601252T (es) |
| MA (1) | MA48971B1 (es) |
| MX (1) | MX389167B (es) |
| PL (1) | PL3601252T3 (es) |
| PT (1) | PT3601252T (es) |
| RS (1) | RS61511B1 (es) |
| SM (1) | SMT202100278T1 (es) |
| WO (1) | WO2018172344A1 (es) |
| ZA (1) | ZA201906202B (es) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3378477A1 (en) * | 2017-03-21 | 2018-09-26 | BIOPROJET Pharma | New therapeutical use of h3-ligands |
| EP3598975B1 (en) | 2018-07-27 | 2020-10-21 | Bioprojet | Novel combinations of a h3 antagonist and a noradrenaline reuptake inhibitor, and the therapeutical uses thereof |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101060971B1 (ko) * | 2002-05-14 | 2011-09-01 | 제노바 리미티드 | 안트라닐산 유도체 수화물의 제조 방법 |
| CA2588867A1 (en) | 2004-12-01 | 2006-06-08 | Banyu Pharmaceutical Co., Ltd. | Substituted pyridone derivative |
| EP1717235A3 (en) | 2005-04-29 | 2007-02-28 | Bioprojet | Phenoxypropylpiperidines and -pyrrolidines and their use as histamine H3-receptor ligands |
| CN103958499A (zh) | 2011-12-08 | 2014-07-30 | 大正制药株式会社 | 苯基吡咯衍生物 |
| US20150045553A1 (en) | 2011-12-27 | 2015-02-12 | Taisho Pharmaceutical Co., Ltd | Phenyltriazole derivative |
| EP3378477A1 (en) * | 2017-03-21 | 2018-09-26 | BIOPROJET Pharma | New therapeutical use of h3-ligands |
| EP3598975B1 (en) * | 2018-07-27 | 2020-10-21 | Bioprojet | Novel combinations of a h3 antagonist and a noradrenaline reuptake inhibitor, and the therapeutical uses thereof |
-
2017
- 2017-03-21 EP EP17305310.9A patent/EP3378858A1/en not_active Withdrawn
-
2018
- 2018-03-20 AU AU2018238260A patent/AU2018238260B2/en active Active
- 2018-03-20 PT PT187113501T patent/PT3601252T/pt unknown
- 2018-03-20 WO PCT/EP2018/056999 patent/WO2018172344A1/en not_active Ceased
- 2018-03-20 US US16/496,013 patent/US11078183B2/en active Active
- 2018-03-20 MA MA48971A patent/MA48971B1/fr unknown
- 2018-03-20 ES ES18711350T patent/ES2868024T3/es active Active
- 2018-03-20 MX MX2019011264A patent/MX389167B/es unknown
- 2018-03-20 CA CA3056490A patent/CA3056490A1/en active Pending
- 2018-03-20 LT LTEP18711350.1T patent/LT3601252T/lt unknown
- 2018-03-20 EP EP18711350.1A patent/EP3601252B1/en active Active
- 2018-03-20 DK DK18711350.1T patent/DK3601252T3/da active
- 2018-03-20 CN CN201880028499.3A patent/CN110891948B/zh active Active
- 2018-03-20 PL PL18711350T patent/PL3601252T3/pl unknown
- 2018-03-20 HU HUE18711350A patent/HUE053710T2/hu unknown
- 2018-03-20 SM SM20210278T patent/SMT202100278T1/it unknown
- 2018-03-20 KR KR1020197027549A patent/KR102608265B1/ko active Active
- 2018-03-20 HR HRP20210312TT patent/HRP20210312T1/hr unknown
- 2018-03-20 JP JP2019552006A patent/JP7235671B2/ja active Active
- 2018-03-20 RS RS20210249A patent/RS61511B1/sr unknown
-
2019
- 2019-09-15 IL IL269360A patent/IL269360B2/en unknown
- 2019-09-19 ZA ZA2019/06202A patent/ZA201906202B/en unknown
-
2021
- 2021-03-04 CY CY20211100186T patent/CY1124114T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2956087T3 (es) | Compuestos inhibidores de RIP1 y métodos para preparar y usar los mismos | |
| US10829443B2 (en) | Solvate form of (R)-2-amino-3-phenylpropyl carbamate | |
| ES2940911T3 (es) | Compuestos de 2,4-diamino-pirimidina y su uso como inhibidores de IRAK4 | |
| ES2332009T3 (es) | Formas cristalinas de hidrocloruro de (r)-8-cloro-1-metil-2,3,4,5-tetrahidro-1h-3-benzazepina. | |
| ES2591110T3 (es) | Usos terapéuticos de compuestos que tienen actividad SERT, 5-HT3 y 5-HT1A combinada | |
| ES2971063T3 (es) | Nuevos usos terapéuticos de ligandos H3 | |
| ES2696708T3 (es) | Uso de derivados de bencimidazol-prolina | |
| ES2868024T3 (es) | Tetrahidrato de ligando H3, su procedimiento de preparación y composiciones farmacéuticas que lo comprenden | |
| JP2019504016A (ja) | アルキルジヒドロキノリンスルホンアミド化合物 | |
| ES2587064T3 (es) | Sales fumarato novedosas de un antagonista del receptor de histamina H3 | |
| CA3142963A1 (en) | Use of aminothiol compounds as cerebral nerve or heart protective agent | |
| RU2771753C2 (ru) | Тетрагидрат н3-лиганда, способ его получения и содержащие его фармацевтические композиции | |
| US20230064189A1 (en) | 1h-pyrazolo[3,4-d]pyrimidine compounds useful for the treatment of platinum-resistant cancer | |
| TW201818939A (zh) | 組合trh同功異質體及2-丙基辛酸而成之組成物以及2-丙基辛酸之藥學上所容許之鹽 | |
| BR112019019643B1 (pt) | Forma tetraidrato, processos de preparação da forma tetraidrato, composição farmacêutica e usos da forma tetraidrato | |
| HK40017174B (zh) | H3配体的四水合物、其制备方法和含有它的药物组合物 | |
| HK40017174A (en) | Tetrahydrate of h3 ligand, its process of preparation and pharmaceutical compositions comprising the same | |
| HK40013330B (en) | New therapeutical use of h3-ligands | |
| HK40013330A (en) | New therapeutical use of h3-ligands | |
| NZ791594A (en) | A crystalline 19-nor C3, 3-disubstituted C21-N-pyrazolyl steroid | |
| CN1673209A (zh) | 苯环壬酯的活性代谢产物及其医药用途 |