ES2829285T3 - Administración de AINE y composiciones, métodos y sistemas relacionados - Google Patents
Administración de AINE y composiciones, métodos y sistemas relacionados Download PDFInfo
- Publication number
- ES2829285T3 ES2829285T3 ES14723122T ES14723122T ES2829285T3 ES 2829285 T3 ES2829285 T3 ES 2829285T3 ES 14723122 T ES14723122 T ES 14723122T ES 14723122 T ES14723122 T ES 14723122T ES 2829285 T3 ES2829285 T3 ES 2829285T3
- Authority
- ES
- Spain
- Prior art keywords
- rifaximin
- gastro
- resistant
- diclofenac
- administration
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 title claims abstract description 292
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 title claims abstract description 145
- 239000000203 mixture Substances 0.000 title claims abstract description 125
- 238000000034 method Methods 0.000 title claims abstract description 48
- NZCRJKRKKOLAOJ-XRCRFVBUSA-N rifaximin Chemical compound OC1=C(C(O)=C2C)C3=C4N=C5C=C(C)C=CN5C4=C1NC(=O)\C(C)=C/C=C/[C@H](C)[C@H](O)[C@@H](C)[C@@H](O)[C@@H](C)[C@H](OC(C)=O)[C@H](C)[C@@H](OC)\C=C\O[C@@]1(C)OC2=C3C1=O NZCRJKRKKOLAOJ-XRCRFVBUSA-N 0.000 claims abstract description 582
- 229960003040 rifaximin Drugs 0.000 claims abstract description 560
- 229960001259 diclofenac Drugs 0.000 claims abstract description 206
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 claims abstract description 206
- 230000003115 biocidal effect Effects 0.000 claims abstract description 110
- 229940126409 proton pump inhibitor Drugs 0.000 claims abstract description 99
- 239000000612 proton pump inhibitor Substances 0.000 claims abstract description 98
- 208000037902 enteropathy Diseases 0.000 claims abstract description 63
- 208000028774 intestinal disease Diseases 0.000 claims abstract description 55
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 claims abstract description 11
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 claims abstract description 11
- 229960001680 ibuprofen Drugs 0.000 claims abstract description 11
- 229960002009 naproxen Drugs 0.000 claims abstract description 11
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 claims abstract description 11
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 claims abstract description 5
- 229960000991 ketoprofen Drugs 0.000 claims abstract description 5
- SUBDBMMJDZJVOS-UHFFFAOYSA-N 5-methoxy-2-{[(4-methoxy-3,5-dimethylpyridin-2-yl)methyl]sulfinyl}-1H-benzimidazole Chemical compound N=1C2=CC(OC)=CC=C2NC=1S(=O)CC1=NC=C(C)C(OC)=C1C SUBDBMMJDZJVOS-UHFFFAOYSA-N 0.000 claims description 180
- 229960000381 omeprazole Drugs 0.000 claims description 180
- 239000002253 acid Substances 0.000 claims description 16
- 239000003112 inhibitor Substances 0.000 claims description 15
- 150000003839 salts Chemical class 0.000 claims description 14
- SUBDBMMJDZJVOS-DEOSSOPVSA-N esomeprazole Chemical compound C([S@](=O)C1=NC2=CC=C(C=C2N1)OC)C1=NC=C(C)C(OC)=C1C SUBDBMMJDZJVOS-DEOSSOPVSA-N 0.000 claims description 11
- 229960004770 esomeprazole Drugs 0.000 claims description 10
- 210000004211 gastric acid Anatomy 0.000 claims description 9
- IQPSEEYGBUAQFF-UHFFFAOYSA-N Pantoprazole Chemical compound COC1=CC=NC(CS(=O)C=2NC3=CC=C(OC(F)F)C=C3N=2)=C1OC IQPSEEYGBUAQFF-UHFFFAOYSA-N 0.000 claims description 8
- 229960003174 lansoprazole Drugs 0.000 claims description 8
- MJIHNNLFOKEZEW-UHFFFAOYSA-N lansoprazole Chemical compound CC1=C(OCC(F)(F)F)C=CN=C1CS(=O)C1=NC2=CC=CC=C2N1 MJIHNNLFOKEZEW-UHFFFAOYSA-N 0.000 claims description 8
- 229960005019 pantoprazole Drugs 0.000 claims description 8
- 239000012458 free base Substances 0.000 claims description 7
- 239000004531 microgranule Substances 0.000 claims description 7
- YREYEVIYCVEVJK-UHFFFAOYSA-N rabeprazole Chemical compound COCCCOC1=CC=NC(CS(=O)C=2NC3=CC=CC=C3N=2)=C1C YREYEVIYCVEVJK-UHFFFAOYSA-N 0.000 claims description 6
- PSIREIZGKQBEEO-UHFFFAOYSA-N 2-(1h-benzimidazol-2-ylsulfinylmethyl)-n-methyl-n-(2-methylpropyl)aniline Chemical compound CC(C)CN(C)C1=CC=CC=C1CS(=O)C1=NC2=CC=CC=C2N1 PSIREIZGKQBEEO-UHFFFAOYSA-N 0.000 claims description 3
- ZBFDAUIVDSSISP-UHFFFAOYSA-N 5-methoxy-2-[(4-methoxy-3,5-dimethyl-2-pyridinyl)methylsulfinyl]-1H-imidazo[4,5-b]pyridine Chemical compound N=1C2=NC(OC)=CC=C2NC=1S(=O)CC1=NC=C(C)C(OC)=C1C ZBFDAUIVDSSISP-UHFFFAOYSA-N 0.000 claims description 3
- JWMQOWBYKLZSPY-GYCJOSAFSA-N C([C@H]1[S@](=O)C=2NC3=CC=CC=C3N=2)CCCC2=C1N=CC=C2OC Chemical compound C([C@H]1[S@](=O)C=2NC3=CC=CC=C3N=2)CCCC2=C1N=CC=C2OC JWMQOWBYKLZSPY-GYCJOSAFSA-N 0.000 claims description 3
- HRRXCXABAPSOCP-UHFFFAOYSA-N ilaprazole Chemical compound COC1=CC=NC(CS(=O)C=2NC3=CC(=CC=C3N=2)N2C=CC=C2)=C1C HRRXCXABAPSOCP-UHFFFAOYSA-N 0.000 claims description 3
- 229950008491 ilaprazole Drugs 0.000 claims description 3
- 229950007395 leminoprazole Drugs 0.000 claims description 3
- 229950009573 nepaprazole Drugs 0.000 claims description 3
- 229960004157 rabeprazole Drugs 0.000 claims description 3
- 229950008375 tenatoprazole Drugs 0.000 claims description 3
- BSYNRYMUTXBXSQ-FOQJRBATSA-N 59096-14-9 Chemical compound CC(=O)OC1=CC=CC=C1[14C](O)=O BSYNRYMUTXBXSQ-FOQJRBATSA-N 0.000 claims description 2
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 abstract description 19
- 229960001138 acetylsalicylic acid Drugs 0.000 abstract description 19
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 256
- 229960000905 indomethacin Drugs 0.000 description 128
- 239000008187 granular material Substances 0.000 description 126
- 238000011282 treatment Methods 0.000 description 116
- 241000700159 Rattus Species 0.000 description 86
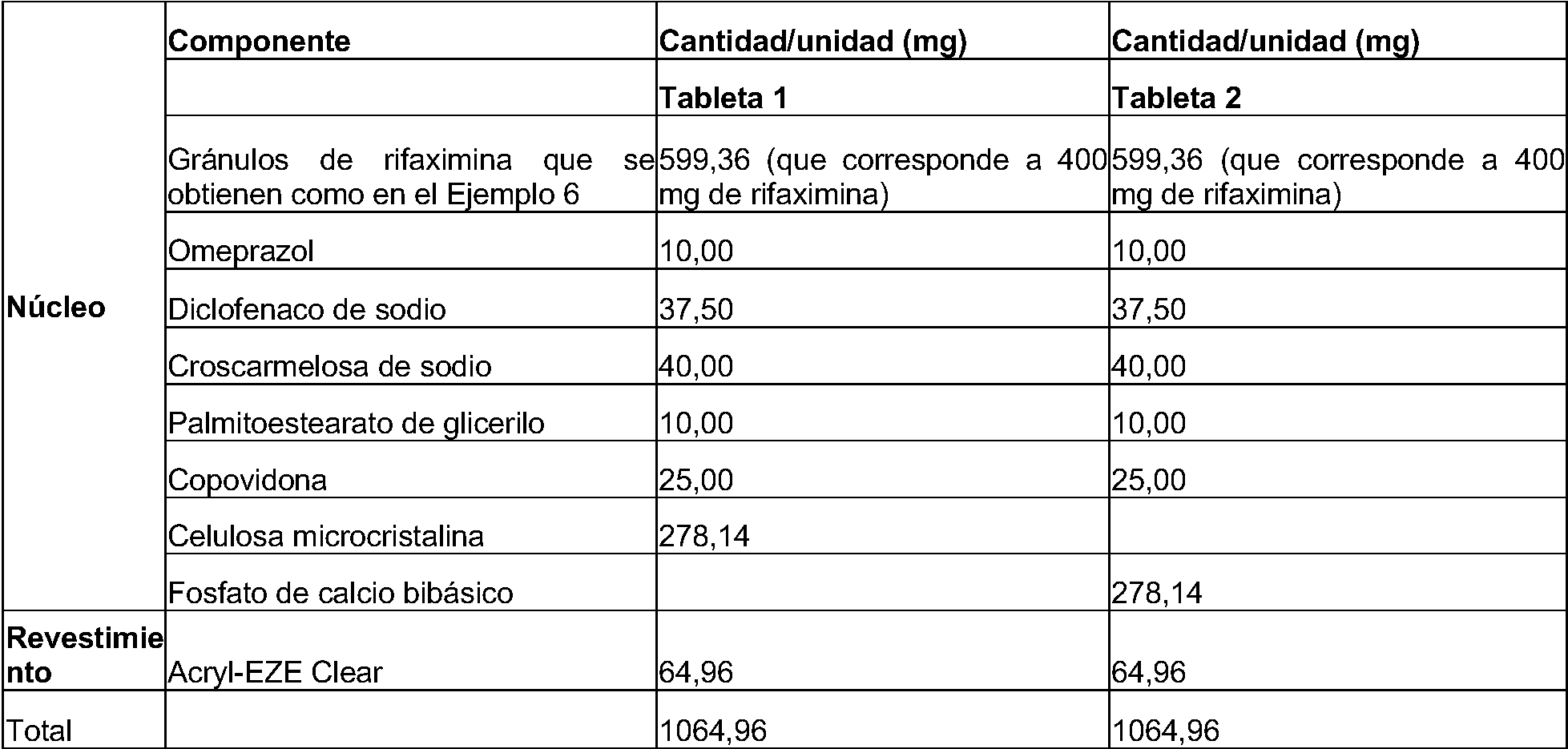
- 239000003826 tablet Substances 0.000 description 84
- 241001465754 Metazoa Species 0.000 description 80
- 230000006378 damage Effects 0.000 description 73
- 230000003902 lesion Effects 0.000 description 69
- 206010061218 Inflammation Diseases 0.000 description 54
- 230000004054 inflammatory process Effects 0.000 description 52
- 210000001519 tissue Anatomy 0.000 description 48
- 230000000694 effects Effects 0.000 description 47
- 239000002775 capsule Substances 0.000 description 46
- 239000003814 drug Substances 0.000 description 46
- 239000000556 agonist Substances 0.000 description 45
- 102000003896 Myeloperoxidases Human genes 0.000 description 43
- 108090000235 Myeloperoxidases Proteins 0.000 description 43
- 208000002193 Pain Diseases 0.000 description 40
- 210000003405 ileum Anatomy 0.000 description 39
- 230000000968 intestinal effect Effects 0.000 description 38
- 238000000576 coating method Methods 0.000 description 36
- 239000011248 coating agent Substances 0.000 description 35
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 34
- 210000001630 jejunum Anatomy 0.000 description 34
- 102000001554 Hemoglobins Human genes 0.000 description 30
- 108010054147 Hemoglobins Proteins 0.000 description 30
- 239000002552 dosage form Substances 0.000 description 28
- 201000010099 disease Diseases 0.000 description 27
- 230000002265 prevention Effects 0.000 description 27
- 208000024172 Cardiovascular disease Diseases 0.000 description 26
- 239000004480 active ingredient Substances 0.000 description 26
- 239000000463 material Substances 0.000 description 26
- 229940124597 therapeutic agent Drugs 0.000 description 26
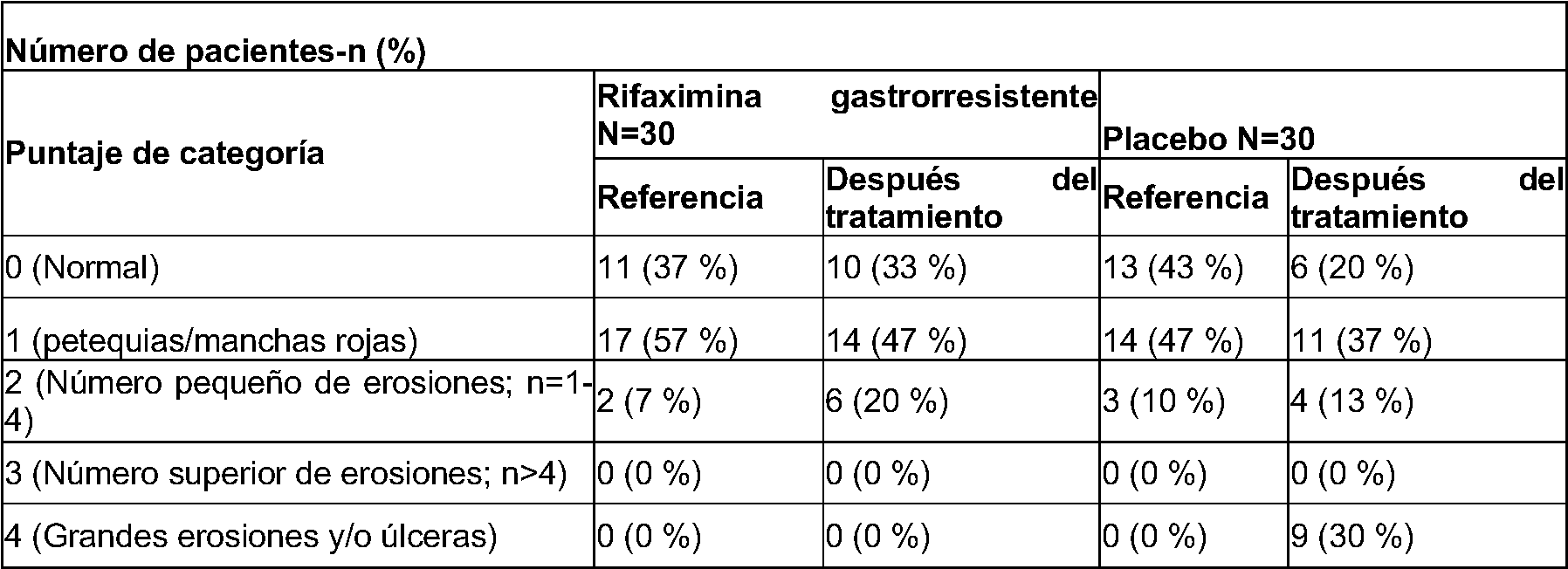
- 229940068196 placebo Drugs 0.000 description 25
- 239000000902 placebo Substances 0.000 description 25
- 239000003242 anti bacterial agent Substances 0.000 description 24
- 210000001035 gastrointestinal tract Anatomy 0.000 description 24
- 238000002360 preparation method Methods 0.000 description 24
- 210000000813 small intestine Anatomy 0.000 description 23
- 238000004458 analytical method Methods 0.000 description 22
- -1 on the conjunctiva) Substances 0.000 description 22
- 230000008569 process Effects 0.000 description 22
- 238000002560 therapeutic procedure Methods 0.000 description 22
- 239000008194 pharmaceutical composition Substances 0.000 description 21
- 230000002411 adverse Effects 0.000 description 20
- 210000004369 blood Anatomy 0.000 description 20
- 239000008280 blood Substances 0.000 description 20
- 239000012530 fluid Substances 0.000 description 20
- 230000002496 gastric effect Effects 0.000 description 20
- 239000000546 pharmaceutical excipient Substances 0.000 description 20
- 208000024891 symptom Diseases 0.000 description 20
- 239000003795 chemical substances by application Substances 0.000 description 19
- 150000001875 compounds Chemical class 0.000 description 19
- 208000014674 injury Diseases 0.000 description 19
- 229920000333 poly(propyleneimine) Polymers 0.000 description 19
- 229920000642 polymer Polymers 0.000 description 19
- 239000000843 powder Substances 0.000 description 19
- 230000000069 prophylactic effect Effects 0.000 description 19
- 239000000725 suspension Substances 0.000 description 19
- 229940079593 drug Drugs 0.000 description 18
- 230000002829 reductive effect Effects 0.000 description 17
- 208000032843 Hemorrhage Diseases 0.000 description 16
- 230000000740 bleeding effect Effects 0.000 description 16
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 16
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 16
- 229920000609 methyl cellulose Polymers 0.000 description 16
- 235000010981 methylcellulose Nutrition 0.000 description 16
- 239000001923 methylcellulose Substances 0.000 description 16
- WSMYVTOQOOLQHP-UHFFFAOYSA-N Malondialdehyde Chemical compound O=CCC=O WSMYVTOQOOLQHP-UHFFFAOYSA-N 0.000 description 15
- 208000027418 Wounds and injury Diseases 0.000 description 15
- 229940118019 malondialdehyde Drugs 0.000 description 15
- 230000009854 mucosal lesion Effects 0.000 description 15
- 239000003981 vehicle Substances 0.000 description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 15
- 238000010521 absorption reaction Methods 0.000 description 14
- 229940088710 antibiotic agent Drugs 0.000 description 14
- 238000010586 diagram Methods 0.000 description 14
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 14
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 14
- 235000010980 cellulose Nutrition 0.000 description 13
- 229920002678 cellulose Polymers 0.000 description 13
- 239000001913 cellulose Substances 0.000 description 13
- 239000003085 diluting agent Substances 0.000 description 13
- 238000009472 formulation Methods 0.000 description 13
- 229940080133 omeprazole 20 mg Drugs 0.000 description 13
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 13
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 12
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 12
- 239000008108 microcrystalline cellulose Substances 0.000 description 12
- 229940016286 microcrystalline cellulose Drugs 0.000 description 12
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 12
- 230000001681 protective effect Effects 0.000 description 12
- 238000012216 screening Methods 0.000 description 12
- 230000008859 change Effects 0.000 description 11
- 230000003628 erosive effect Effects 0.000 description 11
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 11
- 239000008247 solid mixture Substances 0.000 description 11
- 241000282412 Homo Species 0.000 description 10
- 208000025865 Ulcer Diseases 0.000 description 10
- 230000001154 acute effect Effects 0.000 description 10
- 230000001684 chronic effect Effects 0.000 description 10
- 229920001577 copolymer Polymers 0.000 description 10
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 9
- 210000004027 cell Anatomy 0.000 description 9
- 150000002148 esters Chemical class 0.000 description 9
- 238000007431 microscopic evaluation Methods 0.000 description 9
- 230000009467 reduction Effects 0.000 description 9
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 8
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 8
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 230000009885 systemic effect Effects 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 7
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 7
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 7
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 7
- 239000013543 active substance Substances 0.000 description 7
- 150000001408 amides Chemical class 0.000 description 7
- 239000007900 aqueous suspension Substances 0.000 description 7
- 239000011230 binding agent Substances 0.000 description 7
- 239000000227 bioadhesive Substances 0.000 description 7
- 230000007423 decrease Effects 0.000 description 7
- 208000035475 disorder Diseases 0.000 description 7
- 238000011156 evaluation Methods 0.000 description 7
- 239000007903 gelatin capsule Substances 0.000 description 7
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 7
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 7
- 239000010410 layer Substances 0.000 description 7
- 238000007911 parenteral administration Methods 0.000 description 7
- 238000011321 prophylaxis Methods 0.000 description 7
- 230000004044 response Effects 0.000 description 7
- YVOFSHPIJOYKSH-NLYBMVFSSA-M sodium rifomycin sv Chemical compound [Na+].OC1=C(C(O)=C2C)C3=C([O-])C=C1NC(=O)\C(C)=C/C=C/[C@H](C)[C@H](O)[C@@H](C)[C@@H](O)[C@@H](C)[C@H](OC(C)=O)[C@H](C)[C@@H](OC)\C=C\O[C@@]1(C)OC2=C3C1=O YVOFSHPIJOYKSH-NLYBMVFSSA-M 0.000 description 7
- 239000000600 sorbitol Substances 0.000 description 7
- 239000000454 talc Substances 0.000 description 7
- 229910052623 talc Inorganic materials 0.000 description 7
- 235000012222 talc Nutrition 0.000 description 7
- 231100000397 ulcer Toxicity 0.000 description 7
- 108090000695 Cytokines Proteins 0.000 description 6
- 102000004127 Cytokines Human genes 0.000 description 6
- 239000001856 Ethyl cellulose Substances 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 6
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 6
- 208000025747 Rheumatic disease Diseases 0.000 description 6
- 230000009471 action Effects 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 206010003246 arthritis Diseases 0.000 description 6
- 239000001768 carboxy methyl cellulose Substances 0.000 description 6
- 230000034994 death Effects 0.000 description 6
- 231100000517 death Toxicity 0.000 description 6
- 239000007884 disintegrant Substances 0.000 description 6
- 239000003937 drug carrier Substances 0.000 description 6
- 235000019325 ethyl cellulose Nutrition 0.000 description 6
- 229920001249 ethyl cellulose Polymers 0.000 description 6
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 6
- 229940071826 hydroxyethyl cellulose Drugs 0.000 description 6
- 230000006872 improvement Effects 0.000 description 6
- 230000008595 infiltration Effects 0.000 description 6
- 238000001764 infiltration Methods 0.000 description 6
- 230000002401 inhibitory effect Effects 0.000 description 6
- 238000009533 lab test Methods 0.000 description 6
- 238000012153 long-term therapy Methods 0.000 description 6
- 230000007774 longterm Effects 0.000 description 6
- 208000004296 neuralgia Diseases 0.000 description 6
- 208000021722 neuropathic pain Diseases 0.000 description 6
- 206010039073 rheumatoid arthritis Diseases 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- URAYPUMNDPQOKB-UHFFFAOYSA-N triacetin Chemical compound CC(=O)OCC(OC(C)=O)COC(C)=O URAYPUMNDPQOKB-UHFFFAOYSA-N 0.000 description 6
- 241000894006 Bacteria Species 0.000 description 5
- 229920003134 Eudragit® polymer Polymers 0.000 description 5
- 201000005569 Gout Diseases 0.000 description 5
- 208000023178 Musculoskeletal disease Diseases 0.000 description 5
- 206010034464 Periarthritis Diseases 0.000 description 5
- 230000002917 arthritic effect Effects 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 238000011970 concomitant therapy Methods 0.000 description 5
- 230000003247 decreasing effect Effects 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 238000007373 indentation Methods 0.000 description 5
- 210000000936 intestine Anatomy 0.000 description 5
- 229920003145 methacrylic acid copolymer Polymers 0.000 description 5
- 201000008482 osteoarthritis Diseases 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- 239000000651 prodrug Substances 0.000 description 5
- 229940002612 prodrug Drugs 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 239000007909 solid dosage form Substances 0.000 description 5
- 238000012453 sprague-dawley rat model Methods 0.000 description 5
- 239000007921 spray Substances 0.000 description 5
- 238000005507 spraying Methods 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 210000002438 upper gastrointestinal tract Anatomy 0.000 description 5
- 229920002126 Acrylic acid copolymer Polymers 0.000 description 4
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 4
- 229920002785 Croscarmellose sodium Polymers 0.000 description 4
- KCXZNSGUUQJJTR-UHFFFAOYSA-N Di-n-hexyl phthalate Chemical compound CCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCC KCXZNSGUUQJJTR-UHFFFAOYSA-N 0.000 description 4
- 208000027244 Dysbiosis Diseases 0.000 description 4
- 238000002965 ELISA Methods 0.000 description 4
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 4
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 4
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 229930189077 Rifamycin Natural products 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 229920002472 Starch Polymers 0.000 description 4
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 230000006022 acute inflammation Effects 0.000 description 4
- 208000038016 acute inflammation Diseases 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 230000000844 anti-bacterial effect Effects 0.000 description 4
- 230000003110 anti-inflammatory effect Effects 0.000 description 4
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 4
- MYSWGUAQZAJSOK-UHFFFAOYSA-N ciprofloxacin Chemical compound C12=CC(N3CCNCC3)=C(F)C=C2C(=O)C(C(=O)O)=CN1C1CC1 MYSWGUAQZAJSOK-UHFFFAOYSA-N 0.000 description 4
- 238000011260 co-administration Methods 0.000 description 4
- 238000007906 compression Methods 0.000 description 4
- 230000006835 compression Effects 0.000 description 4
- 229940111134 coxibs Drugs 0.000 description 4
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 4
- 238000001035 drying Methods 0.000 description 4
- 230000007140 dysbiosis Effects 0.000 description 4
- 235000003599 food sweetener Nutrition 0.000 description 4
- 210000005095 gastrointestinal system Anatomy 0.000 description 4
- 231100001014 gastrointestinal tract lesion Toxicity 0.000 description 4
- 210000002216 heart Anatomy 0.000 description 4
- 208000019622 heart disease Diseases 0.000 description 4
- 125000001165 hydrophobic group Chemical group 0.000 description 4
- 229920003132 hydroxypropyl methylcellulose phthalate Polymers 0.000 description 4
- 229940031704 hydroxypropyl methylcellulose phthalate Drugs 0.000 description 4
- 208000015181 infectious disease Diseases 0.000 description 4
- 230000002757 inflammatory effect Effects 0.000 description 4
- 230000003903 intestinal lesions Effects 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 210000004877 mucosa Anatomy 0.000 description 4
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 4
- 239000004014 plasticizer Substances 0.000 description 4
- 229940100467 polyvinyl acetate phthalate Drugs 0.000 description 4
- 230000002035 prolonged effect Effects 0.000 description 4
- 229960003292 rifamycin Drugs 0.000 description 4
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 4
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 4
- JGMJQSFLQWGYMQ-UHFFFAOYSA-M sodium;2,6-dichloro-n-phenylaniline;acetate Chemical class [Na+].CC([O-])=O.ClC1=CC=CC(Cl)=C1NC1=CC=CC=C1 JGMJQSFLQWGYMQ-UHFFFAOYSA-M 0.000 description 4
- 235000019698 starch Nutrition 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 239000003765 sweetening agent Substances 0.000 description 4
- 239000007916 tablet composition Substances 0.000 description 4
- 230000008733 trauma Effects 0.000 description 4
- KKJUPNGICOCCDW-UHFFFAOYSA-N 7-N,N-Dimethylamino-1,2,3,4,5-pentathiocyclooctane Chemical compound CN(C)C1CSSSSSC1 KKJUPNGICOCCDW-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 3
- 208000008035 Back Pain Diseases 0.000 description 3
- 206010006811 Bursitis Diseases 0.000 description 3
- 206010011091 Coronary artery thrombosis Diseases 0.000 description 3
- MQIUGAXCHLFZKX-UHFFFAOYSA-N Di-n-octyl phthalate Chemical compound CCCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCC MQIUGAXCHLFZKX-UHFFFAOYSA-N 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- 206010017076 Fracture Diseases 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- UETNIIAIRMUTSM-UHFFFAOYSA-N Jacareubin Natural products CC1(C)OC2=CC3Oc4c(O)c(O)ccc4C(=O)C3C(=C2C=C1)O UETNIIAIRMUTSM-UHFFFAOYSA-N 0.000 description 3
- 208000008930 Low Back Pain Diseases 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical group CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- 229920003091 Methocel™ Polymers 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 3
- 108010057466 NF-kappa B Proteins 0.000 description 3
- 102000003945 NF-kappa B Human genes 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 102100032709 Potassium-transporting ATPase alpha chain 2 Human genes 0.000 description 3
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 3
- 108010083204 Proton Pumps Proteins 0.000 description 3
- 208000008765 Sciatica Diseases 0.000 description 3
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 3
- 208000010040 Sprains and Strains Diseases 0.000 description 3
- 208000007107 Stomach Ulcer Diseases 0.000 description 3
- 208000000491 Tendinopathy Diseases 0.000 description 3
- 206010043255 Tendonitis Diseases 0.000 description 3
- 208000004760 Tenosynovitis Diseases 0.000 description 3
- 208000032109 Transient ischaemic attack Diseases 0.000 description 3
- 208000007814 Unstable Angina Diseases 0.000 description 3
- 108010059993 Vancomycin Proteins 0.000 description 3
- 238000002441 X-ray diffraction Methods 0.000 description 3
- 206010000891 acute myocardial infarction Diseases 0.000 description 3
- 239000003963 antioxidant agent Substances 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 210000004204 blood vessel Anatomy 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 229920002301 cellulose acetate Polymers 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 208000037976 chronic inflammation Diseases 0.000 description 3
- 230000006020 chronic inflammation Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000004040 coloring Methods 0.000 description 3
- 208000002528 coronary thrombosis Diseases 0.000 description 3
- 229960001681 croscarmellose sodium Drugs 0.000 description 3
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 230000002183 duodenal effect Effects 0.000 description 3
- 238000001839 endoscopy Methods 0.000 description 3
- 230000002550 fecal effect Effects 0.000 description 3
- 229910021485 fumed silica Inorganic materials 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- FETSQPAGYOVAQU-UHFFFAOYSA-N glyceryl palmitostearate Chemical compound OCC(O)CO.CCCCCCCCCCCCCCCC(O)=O.CCCCCCCCCCCCCCCCCC(O)=O FETSQPAGYOVAQU-UHFFFAOYSA-N 0.000 description 3
- 229940046813 glyceryl palmitostearate Drugs 0.000 description 3
- 235000013773 glyceryl triacetate Nutrition 0.000 description 3
- 229920001477 hydrophilic polymer Polymers 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 208000037817 intestinal injury Diseases 0.000 description 3
- 210000004347 intestinal mucosa Anatomy 0.000 description 3
- 238000011835 investigation Methods 0.000 description 3
- 210000003750 lower gastrointestinal tract Anatomy 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Substances [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- OJLOPKGSLYJEMD-URPKTTJQSA-N methyl 7-[(1r,2r,3r)-3-hydroxy-2-[(1e)-4-hydroxy-4-methyloct-1-en-1-yl]-5-oxocyclopentyl]heptanoate Chemical compound CCCCC(C)(O)C\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(=O)OC OJLOPKGSLYJEMD-URPKTTJQSA-N 0.000 description 3
- 229960005249 misoprostol Drugs 0.000 description 3
- 208000010125 myocardial infarction Diseases 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- 230000000399 orthopedic effect Effects 0.000 description 3
- 238000004806 packaging method and process Methods 0.000 description 3
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 3
- 239000002985 plastic film Substances 0.000 description 3
- 230000000770 proinflammatory effect Effects 0.000 description 3
- 229960004063 propylene glycol Drugs 0.000 description 3
- 235000013772 propylene glycol Nutrition 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 3
- 208000010110 spontaneous platelet aggregation Diseases 0.000 description 3
- 229960001940 sulfasalazine Drugs 0.000 description 3
- NCEXYHBECQHGNR-QZQOTICOSA-N sulfasalazine Chemical compound C1=C(O)C(C(=O)O)=CC(\N=N\C=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-QZQOTICOSA-N 0.000 description 3
- NCEXYHBECQHGNR-UHFFFAOYSA-N sulfasalazine Natural products C1=C(O)C(C(=O)O)=CC(N=NC=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-UHFFFAOYSA-N 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 238000007910 systemic administration Methods 0.000 description 3
- 201000004415 tendinitis Diseases 0.000 description 3
- 238000011200 topical administration Methods 0.000 description 3
- 201000010875 transient cerebral ischemia Diseases 0.000 description 3
- 208000009174 transverse myelitis Diseases 0.000 description 3
- 229960002622 triacetin Drugs 0.000 description 3
- 206010044652 trigeminal neuralgia Diseases 0.000 description 3
- 238000002562 urinalysis Methods 0.000 description 3
- 229960003165 vancomycin Drugs 0.000 description 3
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 3
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 3
- 238000007631 vascular surgery Methods 0.000 description 3
- JHPBZFOKBAGZBL-UHFFFAOYSA-N (3-hydroxy-2,2,4-trimethylpentyl) 2-methylprop-2-enoate Chemical compound CC(C)C(O)C(C)(C)COC(=O)C(C)=C JHPBZFOKBAGZBL-UHFFFAOYSA-N 0.000 description 2
- BJQHLKABXJIVAM-BGYRXZFFSA-N 1-o-[(2r)-2-ethylhexyl] 2-o-[(2s)-2-ethylhexyl] benzene-1,2-dicarboxylate Chemical compound CCCC[C@H](CC)COC(=O)C1=CC=CC=C1C(=O)OC[C@H](CC)CCCC BJQHLKABXJIVAM-BGYRXZFFSA-N 0.000 description 2
- NHJVRSWLHSJWIN-UHFFFAOYSA-N 2,4,6-trinitrobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O NHJVRSWLHSJWIN-UHFFFAOYSA-N 0.000 description 2
- NBGAYCYFNGPNPV-UHFFFAOYSA-N 2-aminooxybenzoic acid Chemical class NOC1=CC=CC=C1C(O)=O NBGAYCYFNGPNPV-UHFFFAOYSA-N 0.000 description 2
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical class O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- 208000007848 Alcoholism Diseases 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 108010039627 Aprotinin Proteins 0.000 description 2
- 208000035143 Bacterial infection Diseases 0.000 description 2
- 229940122361 Bisphosphonate Drugs 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- 229930186147 Cephalosporin Natural products 0.000 description 2
- 208000017667 Chronic Disease Diseases 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- 208000011231 Crohn disease Diseases 0.000 description 2
- 206010012735 Diarrhoea Diseases 0.000 description 2
- BJQHLKABXJIVAM-UHFFFAOYSA-N Diethylhexyl phthalate Natural products CCCCC(CC)COC(=O)C1=CC=CC=C1C(=O)OCC(CC)CCCC BJQHLKABXJIVAM-UHFFFAOYSA-N 0.000 description 2
- NIQCNGHVCWTJSM-UHFFFAOYSA-N Dimethyl phthalate Chemical compound COC(=O)C1=CC=CC=C1C(=O)OC NIQCNGHVCWTJSM-UHFFFAOYSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 208000005577 Gastroenteritis Diseases 0.000 description 2
- 208000018522 Gastrointestinal disease Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 206010022699 Intestinal stenosis Diseases 0.000 description 2
- GDBQQVLCIARPGH-UHFFFAOYSA-N Leupeptin Natural products CC(C)CC(NC(C)=O)C(=O)NC(CC(C)C)C(=O)NC(C=O)CCCN=C(N)N GDBQQVLCIARPGH-UHFFFAOYSA-N 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- 208000000112 Myalgia Diseases 0.000 description 2
- 229930193140 Neomycin Natural products 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- 229920001800 Shellac Polymers 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- 108020000411 Toll-like receptor Proteins 0.000 description 2
- 102000002689 Toll-like receptor Human genes 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- 229920002494 Zein Polymers 0.000 description 2
- 108010055615 Zein Proteins 0.000 description 2
- 241000212749 Zesius chrysomallus Species 0.000 description 2
- 230000005856 abnormality Effects 0.000 description 2
- GAMPNQJDUFQVQO-UHFFFAOYSA-N acetic acid;phthalic acid Chemical compound CC(O)=O.OC(=O)C1=CC=CC=C1C(O)=O GAMPNQJDUFQVQO-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 206010001584 alcohol abuse Diseases 0.000 description 2
- 208000025746 alcohol use disease Diseases 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 239000000783 alginic acid Substances 0.000 description 2
- 229960001126 alginic acid Drugs 0.000 description 2
- 150000004781 alginic acids Chemical class 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 2
- 229960000723 ampicillin Drugs 0.000 description 2
- 208000007502 anemia Diseases 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002518 antifoaming agent Substances 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 229960004405 aprotinin Drugs 0.000 description 2
- 238000003149 assay kit Methods 0.000 description 2
- 208000022362 bacterial infectious disease Diseases 0.000 description 2
- 230000004888 barrier function Effects 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 125000002619 bicyclic group Chemical group 0.000 description 2
- 238000004166 bioassay Methods 0.000 description 2
- 230000008512 biological response Effects 0.000 description 2
- 229960000074 biopharmaceutical Drugs 0.000 description 2
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 2
- 150000004663 bisphosphonates Chemical class 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 2
- 239000008116 calcium stearate Substances 0.000 description 2
- 235000013539 calcium stearate Nutrition 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 150000001735 carboxylic acids Chemical class 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 229940105329 carboxymethylcellulose Drugs 0.000 description 2
- 229920006217 cellulose acetate butyrate Polymers 0.000 description 2
- 229940106164 cephalexin Drugs 0.000 description 2
- ZAIPMKNFIOOWCQ-UEKVPHQBSA-N cephalexin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)C)C(O)=O)=CC=CC=C1 ZAIPMKNFIOOWCQ-UEKVPHQBSA-N 0.000 description 2
- 229940124587 cephalosporin Drugs 0.000 description 2
- 150000001780 cephalosporins Chemical class 0.000 description 2
- JQXXHWHPUNPDRT-BQVAUQFYSA-N chembl1523493 Chemical compound O([C@](C1=O)(C)O\C=C/[C@@H]([C@H]([C@@H](OC(C)=O)[C@H](C)[C@H](O)[C@H](C)[C@@H](O)[C@@H](C)/C=C\C=C(C)/C(=O)NC=2C(O)=C3C(O)=C4C)C)OC)C4=C1C3=C(O)C=2C=NN1CCN(C)CC1 JQXXHWHPUNPDRT-BQVAUQFYSA-N 0.000 description 2
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 2
- 229960003405 ciprofloxacin Drugs 0.000 description 2
- 229960002227 clindamycin Drugs 0.000 description 2
- KDLRVYVGXIQJDK-AWPVFWJPSA-N clindamycin Chemical compound CN1C[C@H](CCC)C[C@H]1C(=O)N[C@H]([C@H](C)Cl)[C@@H]1[C@H](O)[C@H](O)[C@@H](O)[C@@H](SC)O1 KDLRVYVGXIQJDK-AWPVFWJPSA-N 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 229920001531 copovidone Polymers 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 229940099112 cornstarch Drugs 0.000 description 2
- 208000029078 coronary artery disease Diseases 0.000 description 2
- 229960001193 diclofenac sodium Drugs 0.000 description 2
- FLKPEMZONWLCSK-UHFFFAOYSA-N diethyl phthalate Chemical compound CCOC(=O)C1=CC=CC=C1C(=O)OCC FLKPEMZONWLCSK-UHFFFAOYSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 208000007784 diverticulitis Diseases 0.000 description 2
- 208000000718 duodenal ulcer Diseases 0.000 description 2
- 239000002158 endotoxin Substances 0.000 description 2
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 2
- 235000019441 ethanol Nutrition 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 239000003889 eye drop Substances 0.000 description 2
- 229940012356 eye drops Drugs 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 239000007888 film coating Substances 0.000 description 2
- 238000009501 film coating Methods 0.000 description 2
- 239000000834 fixative Substances 0.000 description 2
- 239000000796 flavoring agent Substances 0.000 description 2
- 239000011888 foil Substances 0.000 description 2
- 201000010603 frozen shoulder Diseases 0.000 description 2
- 201000005917 gastric ulcer Diseases 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 239000001087 glyceryl triacetate Substances 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 229940071676 hydroxypropylcellulose Drugs 0.000 description 2
- 210000003767 ileocecal valve Anatomy 0.000 description 2
- 210000002865 immune cell Anatomy 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000002458 infectious effect Effects 0.000 description 2
- 230000004968 inflammatory condition Effects 0.000 description 2
- 230000008798 inflammatory stress Effects 0.000 description 2
- ZPNFWUPYTFPOJU-LPYSRVMUSA-N iniprol Chemical compound C([C@H]1C(=O)NCC(=O)NCC(=O)N[C@H]2CSSC[C@H]3C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@H](C(N[C@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC=4C=CC=CC=4)C(=O)N[C@@H](CC=4C=CC(O)=CC=4)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=4C=CC=CC=4)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC2=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]2N(CCC2)C(=O)[C@@H](N)CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N2[C@@H](CCC2)C(=O)N2[C@@H](CCC2)C(=O)N[C@@H](CC=2C=CC(O)=CC=2)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N2[C@@H](CCC2)C(=O)N3)C(=O)NCC(=O)NCC(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@H](C(=O)N1)C(C)C)[C@@H](C)O)[C@@H](C)CC)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 ZPNFWUPYTFPOJU-LPYSRVMUSA-N 0.000 description 2
- 208000003243 intestinal obstruction Diseases 0.000 description 2
- 239000004407 iron oxides and hydroxides Substances 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- GDBQQVLCIARPGH-ULQDDVLXSA-N leupeptin Chemical compound CC(C)C[C@H](NC(C)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@H](C=O)CCCN=C(N)N GDBQQVLCIARPGH-ULQDDVLXSA-N 0.000 description 2
- 108010052968 leupeptin Proteins 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000003859 lipid peroxidation Effects 0.000 description 2
- 229920006008 lipopolysaccharide Polymers 0.000 description 2
- 239000006210 lotion Substances 0.000 description 2
- 239000012139 lysis buffer Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 125000005395 methacrylic acid group Chemical group 0.000 description 2
- IWVKTOUOPHGZRX-UHFFFAOYSA-N methyl 2-methylprop-2-enoate;2-methylprop-2-enoic acid Chemical compound CC(=C)C(O)=O.COC(=O)C(C)=C IWVKTOUOPHGZRX-UHFFFAOYSA-N 0.000 description 2
- 229960000282 metronidazole Drugs 0.000 description 2
- VAOCPAMSLUNLGC-UHFFFAOYSA-N metronidazole Chemical compound CC1=NC=C([N+]([O-])=O)N1CCO VAOCPAMSLUNLGC-UHFFFAOYSA-N 0.000 description 2
- 208000013465 muscle pain Diseases 0.000 description 2
- 210000004165 myocardium Anatomy 0.000 description 2
- 229920005615 natural polymer Polymers 0.000 description 2
- 229960004927 neomycin Drugs 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 229940100692 oral suspension Drugs 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 230000036542 oxidative stress Effects 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 239000008188 pellet Substances 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 229940124531 pharmaceutical excipient Drugs 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 230000000704 physical effect Effects 0.000 description 2
- 229920003023 plastic Polymers 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 150000004804 polysaccharides Chemical class 0.000 description 2
- 229920001290 polyvinyl ester Polymers 0.000 description 2
- 239000001253 polyvinylpolypyrrolidone Substances 0.000 description 2
- 235000013809 polyvinylpolypyrrolidone Nutrition 0.000 description 2
- 229920000523 polyvinylpolypyrrolidone Polymers 0.000 description 2
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical group [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 2
- 229920001592 potato starch Polymers 0.000 description 2
- 229940069328 povidone Drugs 0.000 description 2
- 235000013406 prebiotics Nutrition 0.000 description 2
- 230000035935 pregnancy Effects 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 239000006041 probiotic Substances 0.000 description 2
- 235000018291 probiotics Nutrition 0.000 description 2
- 229960003387 progesterone Drugs 0.000 description 2
- 239000000186 progesterone Substances 0.000 description 2
- 230000004224 protection Effects 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 238000010298 pulverizing process Methods 0.000 description 2
- GHBFNMLVSPCDGN-UHFFFAOYSA-N rac-1-monooctanoylglycerol Chemical compound CCCCCCCC(=O)OCC(O)CO GHBFNMLVSPCDGN-UHFFFAOYSA-N 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229960001225 rifampicin Drugs 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 229940113147 shellac Drugs 0.000 description 2
- 239000004208 shellac Substances 0.000 description 2
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 2
- 235000013874 shellac Nutrition 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 201000005671 spondyloarthropathy Diseases 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 150000003431 steroids Chemical class 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 210000002784 stomach Anatomy 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- 238000007395 thrombosis prophylaxis Methods 0.000 description 2
- 239000004408 titanium dioxide Substances 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 230000036269 ulceration Effects 0.000 description 2
- 229940064406 xifaxan Drugs 0.000 description 2
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- SGKRLCUYIXIAHR-AKNGSSGZSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O SGKRLCUYIXIAHR-AKNGSSGZSA-N 0.000 description 1
- MMQXRUYUBYWTDP-KEIGCJKLSA-N (5s,6r,7r)-3-(acetyloxymethyl)-7-[[(2z)-2-(2-amino-1,3-thiazol-4-yl)-2-methoxyiminoacetyl]amino]-5,8-dioxo-5$l^{4}-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound N([C@@H]1C(N2[C@@H]1[S@](CC(COC(C)=O)=C2C(O)=O)=O)=O)C(=O)\C(=N/OC)C1=CSC(N)=N1 MMQXRUYUBYWTDP-KEIGCJKLSA-N 0.000 description 1
- FMZXNVLFJHCSAF-DNVCBOLYSA-N (6R,7R)-3-[(4-carbamoyl-1-pyridin-1-iumyl)methyl]-8-oxo-7-[(1-oxo-2-thiophen-2-ylethyl)amino]-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound C1=CC(C(=O)N)=CC=[N+]1CC1=C(C([O-])=O)N2C(=O)[C@@H](NC(=O)CC=3SC=CC=3)[C@H]2SC1 FMZXNVLFJHCSAF-DNVCBOLYSA-N 0.000 description 1
- RULITNAIJFZYLO-UEKVPHQBSA-N (6r,7r)-7-[[(2r)-2-amino-2-(3-chloro-4-hydroxyphenyl)acetyl]amino]-3-methyl-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)C)C(O)=O)=CC=C(O)C(Cl)=C1 RULITNAIJFZYLO-UEKVPHQBSA-N 0.000 description 1
- SBUCDZYLTRYMFG-PBFPGSCMSA-N (6r,7r)-7-[[(2r)-2-amino-2-(4-hydroxyphenyl)acetyl]amino]-3-[(5-methyl-1,3,4-thiadiazol-2-yl)sulfanylmethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound S1C(C)=NN=C1SCC1=C(C(O)=O)N2C(=O)[C@@H](NC(=O)[C@H](N)C=3C=CC(O)=CC=3)[C@H]2SC1 SBUCDZYLTRYMFG-PBFPGSCMSA-N 0.000 description 1
- ZWTPTPWLMRXLJE-WIYYLYMNSA-N (6r,7r)-7-[[2-(3-chlorophenyl)acetyl]amino]-3-[(4,4-dimethylpiperazin-4-ium-1-carbothioyl)sulfanylmethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate Chemical compound C1C[N+](C)(C)CCN1C(=S)SCC1=C(C([O-])=O)N2C(=O)[C@@H](NC(=O)CC=3C=C(Cl)C=CC=3)[C@H]2SC1 ZWTPTPWLMRXLJE-WIYYLYMNSA-N 0.000 description 1
- GPYKKBAAPVOCIW-HSASPSRMSA-N (6r,7s)-7-[[(2r)-2-amino-2-phenylacetyl]amino]-3-chloro-8-oxo-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid;hydrate Chemical compound O.C1([C@H](C(=O)N[C@@H]2C(N3C(=C(Cl)CC[C@@H]32)C(O)=O)=O)N)=CC=CC=C1 GPYKKBAAPVOCIW-HSASPSRMSA-N 0.000 description 1
- GMVPRGQOIOIIMI-UHFFFAOYSA-N (8R,11R,12R,13E,15S)-11,15-Dihydroxy-9-oxo-13-prostenoic acid Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CCCCCCC(O)=O GMVPRGQOIOIIMI-UHFFFAOYSA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- XUBOMFCQGDBHNK-JTQLQIEISA-N (S)-gatifloxacin Chemical compound FC1=CC(C(C(C(O)=O)=CN2C3CC3)=O)=C2C(OC)=C1N1CCN[C@@H](C)C1 XUBOMFCQGDBHNK-JTQLQIEISA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- QWUWMCYKGHVNAV-UHFFFAOYSA-N 1,2-dihydrostilbene Chemical group C=1C=CC=CC=1CCC1=CC=CC=C1 QWUWMCYKGHVNAV-UHFFFAOYSA-N 0.000 description 1
- BSIMZHVOQZIAOY-SCSAIBSYSA-N 1-carbapenem-3-carboxylic acid Chemical compound OC(=O)C1=CC[C@@H]2CC(=O)N12 BSIMZHVOQZIAOY-SCSAIBSYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 1
- RPZANUYHRMRTTE-UHFFFAOYSA-N 2,3,4-trimethoxy-6-(methoxymethyl)-5-[3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxyoxane;1-[[3,4,5-tris(2-hydroxybutoxy)-6-[4,5,6-tris(2-hydroxybutoxy)-2-(2-hydroxybutoxymethyl)oxan-3-yl]oxyoxan-2-yl]methoxy]butan-2-ol Chemical compound COC1C(OC)C(OC)C(COC)OC1OC1C(OC)C(OC)C(OC)OC1COC.CCC(O)COC1C(OCC(O)CC)C(OCC(O)CC)C(COCC(O)CC)OC1OC1C(OCC(O)CC)C(OCC(O)CC)C(OCC(O)CC)OC1COCC(O)CC RPZANUYHRMRTTE-UHFFFAOYSA-N 0.000 description 1
- KMZHZAAOEWVPSE-UHFFFAOYSA-N 2,3-dihydroxypropyl acetate Chemical compound CC(=O)OCC(O)CO KMZHZAAOEWVPSE-UHFFFAOYSA-N 0.000 description 1
- NGNBDVOYPDDBFK-UHFFFAOYSA-N 2-[2,4-di(pentan-2-yl)phenoxy]acetyl chloride Chemical compound CCCC(C)C1=CC=C(OCC(Cl)=O)C(C(C)CCC)=C1 NGNBDVOYPDDBFK-UHFFFAOYSA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- ZGDLVKWIZHHWIR-UHFFFAOYSA-N 4-[5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridin-2-yl]morpholine Chemical compound O1C(C)(C)C(C)(C)OB1C1=CC=C(N2CCOCC2)N=C1 ZGDLVKWIZHHWIR-UHFFFAOYSA-N 0.000 description 1
- LLQHSBBZNDXTIV-UHFFFAOYSA-N 6-[5-[[4-[2-(2,3-dihydro-1H-inden-2-ylamino)pyrimidin-5-yl]piperazin-1-yl]methyl]-4,5-dihydro-1,2-oxazol-3-yl]-3H-1,3-benzoxazol-2-one Chemical compound C1C(CC2=CC=CC=C12)NC1=NC=C(C=N1)N1CCN(CC1)CC1CC(=NO1)C1=CC2=C(NC(O2)=O)C=C1 LLQHSBBZNDXTIV-UHFFFAOYSA-N 0.000 description 1
- WUWFMDMBOJLQIV-UHFFFAOYSA-N 7-(3-aminopyrrolidin-1-yl)-1-(2,4-difluorophenyl)-6-fluoro-4-oxo-1,4-dihydro-1,8-naphthyridine-3-carboxylic acid Chemical compound C1C(N)CCN1C(C(=C1)F)=NC2=C1C(=O)C(C(O)=O)=CN2C1=CC=C(F)C=C1F WUWFMDMBOJLQIV-UHFFFAOYSA-N 0.000 description 1
- 208000004998 Abdominal Pain Diseases 0.000 description 1
- 206010000087 Abdominal pain upper Diseases 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 208000030090 Acute Disease Diseases 0.000 description 1
- 206010067484 Adverse reaction Diseases 0.000 description 1
- 229910002012 Aerosil® Inorganic materials 0.000 description 1
- 229910002016 Aerosil® 200 Inorganic materials 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 102100036475 Alanine aminotransferase 1 Human genes 0.000 description 1
- 108010082126 Alanine transaminase Proteins 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- MGQLHRYJBWGORO-LLVKDONJSA-N Balofloxacin Chemical compound C1[C@H](NC)CCCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN(C3CC3)C2=C1OC MGQLHRYJBWGORO-LLVKDONJSA-N 0.000 description 1
- SPFYMRJSYKOXGV-UHFFFAOYSA-N Baytril Chemical compound C1CN(CC)CCN1C(C(=C1)F)=CC2=C1C(=O)C(C(O)=O)=CN2C1CC1 SPFYMRJSYKOXGV-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- GOJCZVPJCKEBQV-UHFFFAOYSA-N Butyl phthalyl butylglycolate Chemical compound CCCCOC(=O)COC(=O)C1=CC=CC=C1C(=O)OCCCC GOJCZVPJCKEBQV-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 208000006029 Cardiomegaly Diseases 0.000 description 1
- 208000031229 Cardiomyopathies Diseases 0.000 description 1
- 108010076119 Caseins Proteins 0.000 description 1
- 229920008347 Cellulose acetate propionate Polymers 0.000 description 1
- DQEFEBPAPFSJLV-UHFFFAOYSA-N Cellulose propionate Chemical compound CCC(=O)OCC1OC(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C1OC1C(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C(COC(=O)CC)O1 DQEFEBPAPFSJLV-UHFFFAOYSA-N 0.000 description 1
- PTHCMJGKKRQCBF-UHFFFAOYSA-N Cellulose, microcrystalline Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC)C(CO)O1 PTHCMJGKKRQCBF-UHFFFAOYSA-N 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- HZZVJAQRINQKSD-UHFFFAOYSA-N Clavulanic acid Natural products OC(=O)C1C(=CCO)OC2CC(=O)N21 HZZVJAQRINQKSD-UHFFFAOYSA-N 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- OMFXVFTZEKFJBZ-UHFFFAOYSA-N Corticosterone Natural products O=C1CCC2(C)C3C(O)CC(C)(C(CC4)C(=O)CO)C4C3CCC2=C1 OMFXVFTZEKFJBZ-UHFFFAOYSA-N 0.000 description 1
- 241000938605 Crocodylia Species 0.000 description 1
- IVOMOUWHDPKRLL-KQYNXXCUSA-N Cyclic adenosine monophosphate Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-KQYNXXCUSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- PGIBJVOPLXHHGS-UHFFFAOYSA-N Di-n-decyl phthalate Chemical compound CCCCCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCCCC PGIBJVOPLXHHGS-UHFFFAOYSA-N 0.000 description 1
- PYGXAGIECVVIOZ-UHFFFAOYSA-N Dibutyl decanedioate Chemical compound CCCCOC(=O)CCCCCCCCC(=O)OCCCC PYGXAGIECVVIOZ-UHFFFAOYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical compound [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 1
- 239000001692 EU approved anti-caking agent Substances 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 241000588921 Enterobacteriaceae Species 0.000 description 1
- 229920003163 Eudragit® NE 30 D Polymers 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 241000206672 Gelidium Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- JMBQKKAJIKAWKF-UHFFFAOYSA-N Glutethimide Chemical compound C=1C=CC=CC=1C1(CC)CCC(=O)NC1=O JMBQKKAJIKAWKF-UHFFFAOYSA-N 0.000 description 1
- 239000004348 Glyceryl diacetate Substances 0.000 description 1
- AIJTTZAVMXIJGM-UHFFFAOYSA-N Grepafloxacin Chemical compound C1CNC(C)CN1C(C(=C1C)F)=CC2=C1C(=O)C(C(O)=O)=CN2C1CC1 AIJTTZAVMXIJGM-UHFFFAOYSA-N 0.000 description 1
- 206010018901 Haemoglobinaemia Diseases 0.000 description 1
- 206010019233 Headaches Diseases 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- QIGBRXMKCJKVMJ-UHFFFAOYSA-N Hydroquinone Chemical compound OC1=CC=C(O)C=C1 QIGBRXMKCJKVMJ-UHFFFAOYSA-N 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102100030704 Interleukin-21 Human genes 0.000 description 1
- 108010065637 Interleukin-23 Proteins 0.000 description 1
- 102000013264 Interleukin-23 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 206010022714 Intestinal ulcer Diseases 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- BPFYOAJNDMUVBL-UHFFFAOYSA-N LSM-5799 Chemical compound C1CN(C)CCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN3N(C)COC1=C32 BPFYOAJNDMUVBL-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 235000010643 Leucaena leucocephala Nutrition 0.000 description 1
- 240000007472 Leucaena leucocephala Species 0.000 description 1
- GSDSWSVVBLHKDQ-JTQLQIEISA-N Levofloxacin Chemical compound C([C@@H](N1C2=C(C(C(C(O)=O)=C1)=O)C=C1F)C)OC2=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-JTQLQIEISA-N 0.000 description 1
- SMEROWZSTRWXGI-UHFFFAOYSA-N Lithocholsaeure Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 SMEROWZSTRWXGI-UHFFFAOYSA-N 0.000 description 1
- 206010067125 Liver injury Diseases 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 206010028116 Mucosal inflammation Diseases 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 208000009525 Myocarditis Diseases 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- IGFHQQFPSIBGKE-UHFFFAOYSA-N Nonylphenol Natural products CCCCCCCCCC1=CC=C(O)C=C1 IGFHQQFPSIBGKE-UHFFFAOYSA-N 0.000 description 1
- 108020005497 Nuclear hormone receptor Proteins 0.000 description 1
- 102000007399 Nuclear hormone receptor Human genes 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- UOZODPSAJZTQNH-UHFFFAOYSA-N Paromomycin II Natural products NC1C(O)C(O)C(CN)OC1OC1C(O)C(OC2C(C(N)CC(N)C2O)OC2C(C(O)C(O)C(CO)O2)N)OC1CO UOZODPSAJZTQNH-UHFFFAOYSA-N 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000005764 Peripheral Arterial Disease Diseases 0.000 description 1
- 208000030831 Peripheral arterial occlusive disease Diseases 0.000 description 1
- 229920001283 Polyalkylene terephthalate Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 102000000804 Pregnane X Receptor Human genes 0.000 description 1
- 108010001511 Pregnane X Receptor Proteins 0.000 description 1
- ORNBQBCIOKFOEO-YQUGOWONSA-N Pregnenolone Natural products O=C(C)[C@@H]1[C@@]2(C)[C@H]([C@H]3[C@@H]([C@]4(C)C(=CC3)C[C@@H](O)CC4)CC2)CC1 ORNBQBCIOKFOEO-YQUGOWONSA-N 0.000 description 1
- 206010037549 Purpura Diseases 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- RAFHKEAPVIWLJC-OQQFTUDCSA-N Rifamycin O Natural products COC1C=COC2(C)Oc3c(C)c(O)c4C(=O)C(=CC5(OCC(=O)O5)c4c3C2=O)NC(=O)C(=C/C=C/C(C)C(O)C(C)C(O)C(C)C(OC(=O)C)C1C)C RAFHKEAPVIWLJC-OQQFTUDCSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- YQLJDECYQDRSBI-UHFFFAOYSA-N SR12813 Chemical compound CCOP(=O)(OCC)C(P(=O)(OCC)OCC)=CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 YQLJDECYQDRSBI-UHFFFAOYSA-N 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 238000010161 Student-Newman-Keuls test Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 240000004584 Tamarindus indica Species 0.000 description 1
- 235000004298 Tamarindus indica Nutrition 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 108010053950 Teicoplanin Proteins 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- KRADHMIOFJQKEZ-UHFFFAOYSA-N Tri-2-ethylhexyl trimellitate Chemical compound CCCCC(CC)COC(=O)C1=CC=C(C(=O)OCC(CC)CCCC)C(C(=O)OCC(CC)CCCC)=C1 KRADHMIOFJQKEZ-UHFFFAOYSA-N 0.000 description 1
- DOOTYTYQINUNNV-UHFFFAOYSA-N Triethyl citrate Chemical compound CCOC(=O)CC(O)(C(=O)OCC)CC(=O)OCC DOOTYTYQINUNNV-UHFFFAOYSA-N 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- IVOMOUWHDPKRLL-UHFFFAOYSA-N UNPD107823 Natural products O1C2COP(O)(=O)OC2C(O)C1N1C(N=CN=C2N)=C2N=C1 IVOMOUWHDPKRLL-UHFFFAOYSA-N 0.000 description 1
- 241000289690 Xenarthra Species 0.000 description 1
- 208000019790 abdominal distention Diseases 0.000 description 1
- VJHCJDRQFCCTHL-UHFFFAOYSA-N acetic acid 2,3,4,5,6-pentahydroxyhexanal Chemical compound CC(O)=O.OCC(O)C(O)C(O)C(O)C=O VJHCJDRQFCCTHL-UHFFFAOYSA-N 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 108060000200 adenylate cyclase Proteins 0.000 description 1
- 102000030621 adenylate cyclase Human genes 0.000 description 1
- 230000006838 adverse reaction Effects 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 239000012615 aggregate Substances 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 150000003973 alkyl amines Chemical class 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 229960000711 alprostadil Drugs 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 229960003022 amoxicillin Drugs 0.000 description 1
- LSQZJLSUYDQPKJ-NJBDSQKTSA-N amoxicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=C(O)C=C1 LSQZJLSUYDQPKJ-NJBDSQKTSA-N 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 230000001754 anti-pyretic effect Effects 0.000 description 1
- 238000011203 antimicrobial therapy Methods 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 229940127225 asthma medication Drugs 0.000 description 1
- 230000000923 atherogenic effect Effects 0.000 description 1
- 229940098164 augmentin Drugs 0.000 description 1
- 229960002170 azathioprine Drugs 0.000 description 1
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 1
- WZPBZJONDBGPKJ-VEHQQRBSSA-N aztreonam Chemical compound O=C1N(S([O-])(=O)=O)[C@@H](C)[C@@H]1NC(=O)C(=N/OC(C)(C)C(O)=O)\C1=CSC([NH3+])=N1 WZPBZJONDBGPKJ-VEHQQRBSSA-N 0.000 description 1
- 229960003644 aztreonam Drugs 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 229950000805 balofloxacin Drugs 0.000 description 1
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- 235000012216 bentonite Nutrition 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- SAOKZLXYCUGLFA-UHFFFAOYSA-N bis(2-ethylhexyl) adipate Chemical compound CCCCC(CC)COC(=O)CCCCC(=O)OCC(CC)CCCC SAOKZLXYCUGLFA-UHFFFAOYSA-N 0.000 description 1
- ZDWGXBPVPXVXMQ-UHFFFAOYSA-N bis(2-ethylhexyl) nonanedioate Chemical compound CCCCC(CC)COC(=O)CCCCCCCC(=O)OCC(CC)CCCC ZDWGXBPVPXVXMQ-UHFFFAOYSA-N 0.000 description 1
- 229940106691 bisphenol a Drugs 0.000 description 1
- 208000034158 bleeding Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- PASHVRUKOFIRIK-UHFFFAOYSA-L calcium sulfate dihydrate Chemical compound O.O.[Ca+2].[O-]S([O-])(=O)=O PASHVRUKOFIRIK-UHFFFAOYSA-L 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 210000001736 capillary Anatomy 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 229940063834 carboxymethylcellulose sodium Drugs 0.000 description 1
- 239000011111 cardboard Substances 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- RRYMAQUWDLIUPV-BXKDBHETSA-N cefacetrile Chemical compound S1CC(COC(=O)C)=C(C(O)=O)N2C(=O)[C@@H](NC(=O)CC#N)[C@@H]12 RRYMAQUWDLIUPV-BXKDBHETSA-N 0.000 description 1
- QYIYFLOTGYLRGG-GPCCPHFNSA-N cefaclor Chemical compound C1([C@H](C(=O)N[C@@H]2C(N3C(=C(Cl)CS[C@@H]32)C(O)=O)=O)N)=CC=CC=C1 QYIYFLOTGYLRGG-GPCCPHFNSA-N 0.000 description 1
- 229960005361 cefaclor Drugs 0.000 description 1
- 229960004841 cefadroxil Drugs 0.000 description 1
- NBFNMSULHIODTC-CYJZLJNKSA-N cefadroxil monohydrate Chemical compound O.C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)C)C(O)=O)=CC=C(O)C=C1 NBFNMSULHIODTC-CYJZLJNKSA-N 0.000 description 1
- FUBBGQLTSCSAON-PBFPGSCMSA-N cefaloglycin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@@H]3N(C2=O)C(=C(CS3)COC(=O)C)C(O)=O)=CC=CC=C1 FUBBGQLTSCSAON-PBFPGSCMSA-N 0.000 description 1
- 229950004030 cefaloglycin Drugs 0.000 description 1
- GOFCPYKUMJBHBH-RHSMWYFYSA-N cefaloram Chemical compound N([C@H]1[C@@H]2N(C1=O)C(=C(CS2)COC(=O)C)C(O)=O)C(=O)CC1=CC=CC=C1 GOFCPYKUMJBHBH-RHSMWYFYSA-N 0.000 description 1
- 229950001373 cefaloram Drugs 0.000 description 1
- CZTQZXZIADLWOZ-CRAIPNDOSA-N cefaloridine Chemical compound O=C([C@@H](NC(=O)CC=1SC=CC=1)[C@H]1SC2)N1C(C(=O)[O-])=C2C[N+]1=CC=CC=C1 CZTQZXZIADLWOZ-CRAIPNDOSA-N 0.000 description 1
- 229960000603 cefalotin Drugs 0.000 description 1
- 229950000042 cefaparole Drugs 0.000 description 1
- 229950007281 cefedrolor Drugs 0.000 description 1
- MQLRYUCJDNBWMV-GHXIOONMSA-N cefetamet Chemical compound N([C@@H]1C(N2C(=C(C)CS[C@@H]21)C(O)=O)=O)C(=O)\C(=N/OC)C1=CSC(N)=N1 MQLRYUCJDNBWMV-GHXIOONMSA-N 0.000 description 1
- 229960004041 cefetamet Drugs 0.000 description 1
- JSDXOWVAHXDYCU-VXSYNFHWSA-N cefminox Chemical compound S([C@@H]1[C@@](C(N1C=1C(O)=O)=O)(NC(=O)CSC[C@@H](N)C(O)=O)OC)CC=1CSC1=NN=NN1C JSDXOWVAHXDYCU-VXSYNFHWSA-N 0.000 description 1
- 229960002025 cefminox Drugs 0.000 description 1
- GCFBRXLSHGKWDP-XCGNWRKASA-N cefoperazone Chemical compound O=C1C(=O)N(CC)CCN1C(=O)N[C@H](C=1C=CC(O)=CC=1)C(=O)N[C@@H]1C(=O)N2C(C(O)=O)=C(CSC=3N(N=NN=3)C)CS[C@@H]21 GCFBRXLSHGKWDP-XCGNWRKASA-N 0.000 description 1
- 229960004682 cefoperazone Drugs 0.000 description 1
- 229960005229 ceftiofur Drugs 0.000 description 1
- ZBHXIWJRIFEVQY-IHMPYVIRSA-N ceftiofur Chemical compound S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)\C(=N/OC)C=2N=C(N)SC=2)CC=1CSC(=O)C1=CC=CO1 ZBHXIWJRIFEVQY-IHMPYVIRSA-N 0.000 description 1
- WJXAHFZIHLTPFR-JLRJEBFFSA-N ceftiolene Chemical compound S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)\C(=N/OC)C=2N=C(N)SC=2)CC=1\C=C\SC1=NNC(=O)C(=O)N1CC=O WJXAHFZIHLTPFR-JLRJEBFFSA-N 0.000 description 1
- 229950008880 ceftiolene Drugs 0.000 description 1
- 229950007152 ceftioxide Drugs 0.000 description 1
- NNULBSISHYWZJU-LLKWHZGFSA-N ceftizoxime Chemical compound N([C@@H]1C(N2C(=CCS[C@@H]21)C(O)=O)=O)C(=O)\C(=N/OC)C1=CSC(N)=N1 NNULBSISHYWZJU-LLKWHZGFSA-N 0.000 description 1
- 229960001991 ceftizoxime Drugs 0.000 description 1
- 229960004755 ceftriaxone Drugs 0.000 description 1
- VAAUVRVFOQPIGI-SPQHTLEESA-N ceftriaxone Chemical compound S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)\C(=N/OC)C=2N=C(N)SC=2)CC=1CSC1=NC(=O)C(=O)NN1C VAAUVRVFOQPIGI-SPQHTLEESA-N 0.000 description 1
- 229960001668 cefuroxime Drugs 0.000 description 1
- JFPVXVDWJQMJEE-IZRZKJBUSA-N cefuroxime Chemical compound N([C@@H]1C(N2C(=C(COC(N)=O)CS[C@@H]21)C(O)=O)=O)C(=O)\C(=N/OC)C1=CC=CO1 JFPVXVDWJQMJEE-IZRZKJBUSA-N 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 229920006218 cellulose propionate Polymers 0.000 description 1
- VUFGUVLLDPOSBC-XRZFDKQNSA-M cephalothin sodium Chemical compound [Na+].N([C@H]1[C@@H]2N(C1=O)C(=C(CS2)COC(=O)C)C([O-])=O)C(=O)CC1=CC=CS1 VUFGUVLLDPOSBC-XRZFDKQNSA-M 0.000 description 1
- 208000026106 cerebrovascular disease Diseases 0.000 description 1
- DDTDNCYHLGRFBM-YZEKDTGTSA-N chembl2367892 Chemical compound CC(=O)N[C@H]1[C@@H](O)[C@H](O)[C@H](CO)O[C@H]1O[C@@H]([C@H]1C(N[C@@H](C2=CC(O)=CC(O[C@@H]3[C@H]([C@H](O)[C@H](O)[C@@H](CO)O3)O)=C2C=2C(O)=CC=C(C=2)[C@@H](NC(=O)[C@@H]2NC(=O)[C@@H]3C=4C=C(O)C=C(C=4)OC=4C(O)=CC=C(C=4)[C@@H](N)C(=O)N[C@H](CC=4C=C(Cl)C(O5)=CC=4)C(=O)N3)C(=O)N1)C(O)=O)=O)C(C=C1Cl)=CC=C1OC1=C(O[C@H]3[C@H]([C@@H](O)[C@H](O)[C@H](CO)O3)NC(C)=O)C5=CC2=C1 DDTDNCYHLGRFBM-YZEKDTGTSA-N 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 238000005253 cladding Methods 0.000 description 1
- 229960002626 clarithromycin Drugs 0.000 description 1
- AGOYDEPGAOXOCK-KCBOHYOISA-N clarithromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@](C)([C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)OC)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 AGOYDEPGAOXOCK-KCBOHYOISA-N 0.000 description 1
- 229960004022 clotrimazole Drugs 0.000 description 1
- VNFPBHJOKIVQEB-UHFFFAOYSA-N clotrimazole Chemical compound ClC1=CC=CC=C1C(N1C=NC=C1)(C=1C=CC=CC=1)C1=CC=CC=C1 VNFPBHJOKIVQEB-UHFFFAOYSA-N 0.000 description 1
- 239000011247 coating layer Substances 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000007398 colorimetric assay Methods 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 210000000795 conjunctiva Anatomy 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- OMFXVFTZEKFJBZ-HJTSIMOOSA-N corticosterone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@H](CC4)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OMFXVFTZEKFJBZ-HJTSIMOOSA-N 0.000 description 1
- WZHCOOQXZCIUNC-UHFFFAOYSA-N cyclandelate Chemical compound C1C(C)(C)CC(C)CC1OC(=O)C(O)C1=CC=CC=C1 WZHCOOQXZCIUNC-UHFFFAOYSA-N 0.000 description 1
- 229940095074 cyclic amp Drugs 0.000 description 1
- 239000000850 decongestant Substances 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000001784 detoxification Methods 0.000 description 1
- 229940099371 diacetylated monoglycerides Drugs 0.000 description 1
- PCYQQSKDZQTOQG-NXEZZACHSA-N dibutyl (2r,3r)-2,3-dihydroxybutanedioate Chemical compound CCCCOC(=O)[C@H](O)[C@@H](O)C(=O)OCCCC PCYQQSKDZQTOQG-NXEZZACHSA-N 0.000 description 1
- 229940031954 dibutyl sebacate Drugs 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 229950001733 difloxacin Drugs 0.000 description 1
- NOCJXYPHIIZEHN-UHFFFAOYSA-N difloxacin Chemical compound C1CN(C)CCN1C(C(=C1)F)=CC2=C1C(=O)C(C(O)=O)=CN2C1=CC=C(F)C=C1 NOCJXYPHIIZEHN-UHFFFAOYSA-N 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 230000001079 digestive effect Effects 0.000 description 1
- 208000010643 digestive system disease Diseases 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 1
- FBSAITBEAPNWJG-UHFFFAOYSA-N dimethyl phthalate Natural products CC(=O)OC1=CC=CC=C1OC(C)=O FBSAITBEAPNWJG-UHFFFAOYSA-N 0.000 description 1
- 229960001826 dimethylphthalate Drugs 0.000 description 1
- VJHINFRRDQUWOJ-UHFFFAOYSA-N dioctyl sebacate Chemical compound CCCCC(CC)COC(=O)CCCCCCCCC(=O)OCC(CC)CCCC VJHINFRRDQUWOJ-UHFFFAOYSA-N 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- QQVHEQUEHCEAKS-UHFFFAOYSA-N diundecyl benzene-1,2-dicarboxylate Chemical compound CCCCCCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCCCCC QQVHEQUEHCEAKS-UHFFFAOYSA-N 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 201000006549 dyspepsia Diseases 0.000 description 1
- 239000003221 ear drop Substances 0.000 description 1
- 229940047652 ear drops Drugs 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 239000007938 effervescent tablet Substances 0.000 description 1
- 230000002996 emotional effect Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 206010014665 endocarditis Diseases 0.000 description 1
- 210000001174 endocardium Anatomy 0.000 description 1
- 229940095399 enema Drugs 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229960000740 enrofloxacin Drugs 0.000 description 1
- 101150007166 ensa gene Proteins 0.000 description 1
- 229960000496 esomeprazole sodium Drugs 0.000 description 1
- 229930182833 estradiol Natural products 0.000 description 1
- 229960005309 estradiol Drugs 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- ZANNOFHADGWOLI-UHFFFAOYSA-N ethyl 2-hydroxyacetate Chemical compound CCOC(=O)CO ZANNOFHADGWOLI-UHFFFAOYSA-N 0.000 description 1
- MVPICKVDHDWCJQ-UHFFFAOYSA-N ethyl 3-pyrrolidin-1-ylpropanoate Chemical compound CCOC(=O)CCN1CCCC1 MVPICKVDHDWCJQ-UHFFFAOYSA-N 0.000 description 1
- 229960004667 ethyl cellulose Drugs 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 229940093476 ethylene glycol Drugs 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 229960003306 fleroxacin Drugs 0.000 description 1
- XBJBPGROQZJDOJ-UHFFFAOYSA-N fleroxacin Chemical compound C1CN(C)CCN1C1=C(F)C=C2C(=O)C(C(O)=O)=CN(CCF)C2=C1F XBJBPGROQZJDOJ-UHFFFAOYSA-N 0.000 description 1
- 229940124307 fluoroquinolone Drugs 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000027119 gastric acid secretion Effects 0.000 description 1
- 210000001914 gastric parietal cell Anatomy 0.000 description 1
- 229960003923 gatifloxacin Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960002972 glutethimide Drugs 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940087068 glyceryl caprylate Drugs 0.000 description 1
- 235000019443 glyceryl diacetate Nutrition 0.000 description 1
- 125000003976 glyceryl group Chemical group [H]C([*])([H])C(O[H])([H])C(O[H])([H])[H] 0.000 description 1
- 238000001033 granulometry Methods 0.000 description 1
- 229960000642 grepafloxacin Drugs 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 231100000869 headache Toxicity 0.000 description 1
- 230000035876 healing Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000003709 heart valve Anatomy 0.000 description 1
- 231100000234 hepatic damage Toxicity 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 1
- 238000007327 hydrogenolysis reaction Methods 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- IWBJJCOKGLUQIZ-HQKKAZOISA-N hyperforin Chemical compound OC1=C(CC=C(C)C)C(=O)[C@@]2(CC=C(C)C)C[C@H](CC=C(C)C)[C@](CCC=C(C)C)(C)[C@]1(C(=O)C(C)C)C2=O IWBJJCOKGLUQIZ-HQKKAZOISA-N 0.000 description 1
- QOVWXXKVLJOKNW-UHFFFAOYSA-N hyperforin Natural products CC(C)C(=O)C12CC(CC=C(C)C)(CC(CC=C(C)C)C1CCC=C(C)C)C(=C(CC=C(C)C)C2=O)O QOVWXXKVLJOKNW-UHFFFAOYSA-N 0.000 description 1
- 208000015210 hypertensive heart disease Diseases 0.000 description 1
- 208000009326 ileitis Diseases 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000003960 inflammatory cascade Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 108010074108 interleukin-21 Proteins 0.000 description 1
- 230000003870 intestinal permeability Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- XVQUOJBERHHONY-UHFFFAOYSA-N isometheptene Chemical group CNC(C)CCC=C(C)C XVQUOJBERHHONY-UHFFFAOYSA-N 0.000 description 1
- 235000015110 jellies Nutrition 0.000 description 1
- 239000008274 jelly Substances 0.000 description 1
- 230000009916 joint effect Effects 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 208000017169 kidney disease Diseases 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 229960003376 levofloxacin Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- SMEROWZSTRWXGI-HVATVPOCSA-N lithocholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 SMEROWZSTRWXGI-HVATVPOCSA-N 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000008818 liver damage Effects 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 238000007477 logistic regression Methods 0.000 description 1
- 229960002422 lomefloxacin Drugs 0.000 description 1
- ZEKZLJVOYLTDKK-UHFFFAOYSA-N lomefloxacin Chemical compound FC1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCNC(C)C1 ZEKZLJVOYLTDKK-UHFFFAOYSA-N 0.000 description 1
- 229960001977 loracarbef Drugs 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 239000003120 macrolide antibiotic agent Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- KWORUUGOSLYAGD-UHFFFAOYSA-N magnesium 5-methoxy-2-[(4-methoxy-3,5-dimethyl-2-pyridinyl)methylsulfinyl]benzimidazol-1-ide Chemical compound [Mg+2].N=1C2=CC(OC)=CC=C2[N-]C=1S(=O)CC1=NC=C(C)C(OC)=C1C.N=1C2=CC(OC)=CC=C2[N-]C=1S(=O)CC1=NC=C(C)C(OC)=C1C KWORUUGOSLYAGD-UHFFFAOYSA-N 0.000 description 1
- 159000000003 magnesium salts Chemical group 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 229960002531 marbofloxacin Drugs 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000003340 mental effect Effects 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- KBOPZPXVLCULAV-UHFFFAOYSA-N mesalamine Chemical compound NC1=CC=C(O)C(C(O)=O)=C1 KBOPZPXVLCULAV-UHFFFAOYSA-N 0.000 description 1
- 229960004963 mesalazine Drugs 0.000 description 1
- 229940117841 methacrylic acid copolymer Drugs 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- PMRYVIKBURPHAH-UHFFFAOYSA-N methimazole Chemical compound CN1C=CNC1=S PMRYVIKBURPHAH-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- FJLBFSROUSIWMA-UHFFFAOYSA-N metyrapone Chemical compound C=1C=CN=CC=1C(C)(C)C(=O)C1=CC=CN=C1 FJLBFSROUSIWMA-UHFFFAOYSA-N 0.000 description 1
- 229960004465 metyrapone Drugs 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 210000000274 microglia Anatomy 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 229960003702 moxifloxacin Drugs 0.000 description 1
- FABPRXSRWADJSP-MEDUHNTESA-N moxifloxacin Chemical compound COC1=C(N2C[C@H]3NCCC[C@H]3C2)C(F)=CC(C(C(C(O)=O)=C2)=O)=C1N2C1CC1 FABPRXSRWADJSP-MEDUHNTESA-N 0.000 description 1
- 230000003232 mucoadhesive effect Effects 0.000 description 1
- 230000004682 mucosal barrier function Effects 0.000 description 1
- 230000003387 muscular Effects 0.000 description 1
- 208000031225 myocardial ischemia Diseases 0.000 description 1
- 229960003808 nadifloxacin Drugs 0.000 description 1
- JYJTVFIEFKZWCJ-UHFFFAOYSA-N nadifloxacin Chemical compound FC1=CC(C(C(C(O)=O)=C2)=O)=C3N2C(C)CCC3=C1N1CCC(O)CC1 JYJTVFIEFKZWCJ-UHFFFAOYSA-N 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 1
- 229960001597 nifedipine Drugs 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- SNQQPOLDUKLAAF-UHFFFAOYSA-N nonylphenol Chemical compound CCCCCCCCCC1=CC=CC=C1O SNQQPOLDUKLAAF-UHFFFAOYSA-N 0.000 description 1
- 108020004017 nuclear receptors Proteins 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000035764 nutrition Effects 0.000 description 1
- 235000016709 nutrition Nutrition 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-N octanoic acid Chemical compound CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 238000001543 one-way ANOVA Methods 0.000 description 1
- 239000003605 opacifier Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 210000004789 organ system Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 210000001711 oxyntic cell Anatomy 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- LSQZJLSUYDQPKJ-UHFFFAOYSA-N p-Hydroxyampicillin Natural products O=C1N2C(C(O)=O)C(C)(C)SC2C1NC(=O)C(N)C1=CC=C(O)C=C1 LSQZJLSUYDQPKJ-UHFFFAOYSA-N 0.000 description 1
- 238000012858 packaging process Methods 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- YNWDKZIIWCEDEE-UHFFFAOYSA-N pantoprazole sodium Chemical compound [Na+].COC1=CC=NC(CS(=O)C=2[N-]C3=CC=C(OC(F)F)C=C3N=2)=C1OC YNWDKZIIWCEDEE-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 239000011087 paperboard Substances 0.000 description 1
- 229960001914 paromomycin Drugs 0.000 description 1
- UOZODPSAJZTQNH-LSWIJEOBSA-N paromomycin Chemical compound N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO UOZODPSAJZTQNH-LSWIJEOBSA-N 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 208000030613 peripheral artery disease Diseases 0.000 description 1
- 230000002572 peristaltic effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 206010034754 petechiae Diseases 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229960002695 phenobarbital Drugs 0.000 description 1
- DDBREPKUVSBGFI-UHFFFAOYSA-N phenobarbital Chemical compound C=1C=CC=CC=1C1(CC)C(=O)NC(=O)NC1=O DDBREPKUVSBGFI-UHFFFAOYSA-N 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- 150000003009 phosphonic acids Chemical class 0.000 description 1
- JQCXWCOOWVGKMT-UHFFFAOYSA-N phthalic acid diheptyl ester Natural products CCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCC JQCXWCOOWVGKMT-UHFFFAOYSA-N 0.000 description 1
- 125000001557 phthalyl group Chemical group C(=O)(O)C1=C(C(=O)*)C=CC=C1 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920000233 poly(alkylene oxides) Polymers 0.000 description 1
- 229920000212 poly(isobutyl acrylate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920001281 polyalkylene Polymers 0.000 description 1
- 229920001515 polyalkylene glycol Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920001289 polyvinyl ether Polymers 0.000 description 1
- 238000013105 post hoc analysis Methods 0.000 description 1
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 1
- 229960004618 prednisone Drugs 0.000 description 1
- 229960000249 pregnenolone Drugs 0.000 description 1
- VSBHRRMYCDQLJF-ZDNYCOCVSA-N pregnenolone 16alpha-carbonitrile Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@@H](C#N)[C@H](C(=O)C)[C@@]1(C)CC2 VSBHRRMYCDQLJF-ZDNYCOCVSA-N 0.000 description 1
- OZZAYJQNMKMUSD-DMISRAGPSA-N pregnenolone succinate Chemical compound C1C=C2C[C@@H](OC(=O)CCC(O)=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 OZZAYJQNMKMUSD-DMISRAGPSA-N 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 230000009862 primary prevention Effects 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- GMVPRGQOIOIIMI-DWKJAMRDSA-N prostaglandin E1 Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(O)=O GMVPRGQOIOIIMI-DWKJAMRDSA-N 0.000 description 1
- 150000003165 prostaglandin E1 derivatives Chemical class 0.000 description 1
- XEYBRNLFEZDVAW-UHFFFAOYSA-N prostaglandin E2 Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O XEYBRNLFEZDVAW-UHFFFAOYSA-N 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- YAAWASYJIRZXSZ-UHFFFAOYSA-N pyrimidine-2,4-diamine Chemical class NC1=CC=NC(N)=N1 YAAWASYJIRZXSZ-UHFFFAOYSA-N 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 238000004445 quantitative analysis Methods 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 239000003306 quinoline derived antiinfective agent Substances 0.000 description 1
- 229960001778 rabeprazole sodium Drugs 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 230000000552 rheumatic effect Effects 0.000 description 1
- 230000033764 rhythmic process Effects 0.000 description 1
- ATEBXHFBFRCZMA-VXTBVIBXSA-N rifabutin Chemical compound O([C@](C1=O)(C)O/C=C/[C@@H]([C@H]([C@@H](OC(C)=O)[C@H](C)[C@H](O)[C@H](C)[C@@H](O)[C@@H](C)\C=C\C=C(C)/C(=O)NC(=C2N3)C(=O)C=4C(O)=C5C)C)OC)C5=C1C=4C2=NC13CCN(CC(C)C)CC1 ATEBXHFBFRCZMA-VXTBVIBXSA-N 0.000 description 1
- 229960000885 rifabutin Drugs 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 230000037390 scarring Effects 0.000 description 1
- 230000009863 secondary prevention Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 230000001953 sensory effect Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- 239000012748 slip agent Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 229940045902 sodium stearyl fumarate Drugs 0.000 description 1
- 241000894007 species Species 0.000 description 1
- UNFWWIHTNXNPBV-WXKVUWSESA-N spectinomycin Chemical compound O([C@@H]1[C@@H](NC)[C@@H](O)[C@H]([C@@H]([C@H]1O1)O)NC)[C@]2(O)[C@H]1O[C@H](C)CC2=O UNFWWIHTNXNPBV-WXKVUWSESA-N 0.000 description 1
- 229960000268 spectinomycin Drugs 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 229960002256 spironolactone Drugs 0.000 description 1
- LXMSZDCAJNLERA-ZHYRCANASA-N spironolactone Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CCC(=O)C=C4C[C@H]([C@@H]13)SC(=O)C)C[C@@]21CCC(=O)O1 LXMSZDCAJNLERA-ZHYRCANASA-N 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 238000012109 statistical procedure Methods 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 229920003051 synthetic elastomer Polymers 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000005061 synthetic rubber Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229960001608 teicoplanin Drugs 0.000 description 1
- 229960002178 thiamazole Drugs 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 229950008187 tosufloxacin Drugs 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000027 toxicology Toxicity 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- OCHOKXCPKDPNQU-DFACZZRHSA-N trans-nonachlor Chemical compound ClC1=C(Cl)[C@]2(Cl)[C@@H]3[C@@H](Cl)[C@H](Cl)[C@@H](Cl)[C@@H]3[C@@]1(Cl)C2(Cl)Cl OCHOKXCPKDPNQU-DFACZZRHSA-N 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- WEAPVABOECTMGR-UHFFFAOYSA-N triethyl 2-acetyloxypropane-1,2,3-tricarboxylate Chemical compound CCOC(=O)CC(C(=O)OCC)(OC(C)=O)CC(=O)OCC WEAPVABOECTMGR-UHFFFAOYSA-N 0.000 description 1
- 239000001069 triethyl citrate Substances 0.000 description 1
- VMYFZRTXGLUXMZ-UHFFFAOYSA-N triethyl citrate Natural products CCOC(=O)C(O)(C(=O)OCC)C(=O)OCC VMYFZRTXGLUXMZ-UHFFFAOYSA-N 0.000 description 1
- 235000013769 triethyl citrate Nutrition 0.000 description 1
- 125000005591 trimellitate group Chemical group 0.000 description 1
- XWNXEWLCHSLQOI-UHFFFAOYSA-K trisodium;triacetate Chemical compound [Na+].[Na+].[Na+].CC([O-])=O.CC([O-])=O.CC([O-])=O XWNXEWLCHSLQOI-UHFFFAOYSA-K 0.000 description 1
- GXPHKUHSUJUWKP-UHFFFAOYSA-N troglitazone Chemical compound C1CC=2C(C)=C(O)C(C)=C(C)C=2OC1(C)COC(C=C1)=CC=C1CC1SC(=O)NC1=O GXPHKUHSUJUWKP-UHFFFAOYSA-N 0.000 description 1
- 229960001641 troglitazone Drugs 0.000 description 1
- GXPHKUHSUJUWKP-NTKDMRAZSA-N troglitazone Natural products C([C@@]1(OC=2C(C)=C(C(=C(C)C=2CC1)O)C)C)OC(C=C1)=CC=C1C[C@H]1SC(=O)NC1=O GXPHKUHSUJUWKP-NTKDMRAZSA-N 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 210000003462 vein Anatomy 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 230000036642 wellbeing Effects 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 230000022814 xenobiotic metabolic process Effects 0.000 description 1
- RAFHKEAPVIWLJC-TWYIRNIGSA-N z67lem9p1w Chemical compound O([C@](C1=O)(C)O/C=C/[C@@H]([C@H]([C@@H](OC(C)=O)[C@H](C)[C@H](O)[C@H](C)[C@@H](O)[C@@H](C)\C=C\C=C(C)/C(=O)N2)C)OC)C(C(=C3O)C)=C1C1=C3C(=O)C2=C[C@]11OCC(=O)O1 RAFHKEAPVIWLJC-TWYIRNIGSA-N 0.000 description 1
- 239000005019 zein Substances 0.000 description 1
- 229940093612 zein Drugs 0.000 description 1
- 150000003952 β-lactams Chemical class 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/196—Carboxylic acids, e.g. valproic acid having an amino group the amino group being directly attached to a ring, e.g. anthranilic acid, mefenamic acid, diclofenac, chlorambucil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
- A61K31/405—Indole-alkanecarboxylic acids; Derivatives thereof, e.g. tryptophan, indomethacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1611—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1635—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/284—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone
- A61K9/2846—Poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5026—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Inorganic Chemistry (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Physical Education & Sports Medicine (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Immunology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Rifaximina en combinacion con al menos un inhibidor de la bomba de protones y opcionalmente un antibiotico adicional para el uso en un metodo para tratar o prevenir la enteropatia en un individuo que se somete a la administracion de AINE, en donde el AINE es diclofenaco, ketoprofeno, naproxeno, ibuprofeno, acido acetilsalicilico o mezclas de los mismos y en donde la rifaximina esta en forma gastrorresistente o en forma de microgranulos gastrorresistentes y se administra por via oral en una cantidad de 20 mg a 3300 mg por dia.
Description
DESCRIPCIÓN
Administración de AINE y composiciones, métodos y sistemas relacionados
Campo de la invención
Esta descripción se refiere a la administración de fármacos antiinflamatorios no esteroideos (AINE). La presente descripción se refiere al tratamiento y/o prevención de efectos adversos que se asocian con la administración de los AINE.
Antecedentes
Los AINE se indican generalmente para el tratamiento de afecciones agudas o crónicas en donde se presentan dolor e inflamación. Continúan las investigaciones sobre su potencial para la prevención de varias enfermedades también relacionadas con el cáncer, especialmente el cáncer colorrectal, la demencia tipo Alzheimer, y el tratamiento de otras afecciones, tal como enfermedad cardiovascular.
Sin embargo, a pesar de los efectos beneficiosos que se asocian con la administración de los AINE, la minimización de los eventos adversos de los fármacos en particular a nivel del tracto gastrointestinal aún es un desafío.
Resumen
En la presente descripción se proporcionan composiciones para el uso que en varias modalidades se pueden usar para reducir y posiblemente minimizar los efectos adversos, tales como los efectos adversos gastrointestinales, que se asocian con la administración de los AINE y en particular, la administración de los AINE a largo plazo, en un individuo.
La invención se refiere a la rifaximina en combinación con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional para el uso en un método para tratar o prevenir la enteropatía en un individuo que se somete a la administración de AINE, en donde el AINE es diclofenaco, ketoprofeno, naproxeno, ibuprofeno, ácido acetilsalicílico o mezclas de los mismos y en donde la rifaximina está en forma gastrorresistente o en forma de microgránulos gastrorresistentes y se administra por vía oral en una cantidad de 20 mg a 3300 mg por día.
Las composiciones para el uso que se describen en la presente descripción, se usan en conjunto con aplicaciones en donde se desea la minimización de los eventos adversos y en particular los eventos adversos del tracto gastrointestinal, preferentemente del tracto intestinal, que se asocian con la administración de AINE al individuo. Las aplicaciones ilustrativas adecuadas comprenden aplicaciones médicas y en particular clínicas en donde se desea aliviar todos los grados de dolor e/o inflamación en un amplio intervalo de afecciones, y en particular con referencia a afecciones tales como (i) afecciones artríticas: artritis reumatoide, osteoartritis espondilitis anquilosante, gota aguda, (ii) trastornos musculoesqueléticos agudos tales como periartritis, tendinitis, tenosinovitis, bursitis, (iii) otras afecciones dolorosas que resultan de un trauma, que incluyen fracturas, lumbalgia, esguinces, distensiones, dislocaciones, dolor neuropático ortopédico, dental y de otro tipo de cirugía menor (por ejemplo, dolor neuropático diabético, neuralgia del trigémino, mielitis transversa y ciática) y dolor miofascial crónico, (iv) y/o enfermedad cardiovascular. Afecciones adicionales donde se implican dolor e/o la inflamación que se tratan con AINE comprenden varias enfermedades cardiovasculares como se entenderá por un experto.
Las aplicaciones médicas adicionales adecuadas se identificarán por un experto con particular referencia a las aplicaciones en que se desea una terapia con AINE a largo plazo de al menos una semana. Las composiciones para el uso de acuerdo con la invención son útiles en el tratamiento y/o prevención de enteropatía grave y/o enteropatía que se asocian con el tratamiento con AINE a largo plazo de al menos diez días en el individuo.
Los detalles de una o más modalidades de la presente descripción se exponen en la descripción más abajo. Otras características, objetivos, y ventajas serán evidentes de la descripción y de las reivindicaciones.
Breve descripción de los dibujos
Los dibujos adjuntos, que se incorporan y constituyen una parte de esta memoria descriptiva, ilustran una o más modalidades de la presente descripción y, junto con la descripción de las modalidades ilustrativas, sirven para explicar los principios y las implementaciones de la descripción.
La Figura 1 muestra fotografías ilustrativas que muestran la apariencia de lesiones de tipo 1, 2 y 3 en el yeyuno y el íleon de ratas que se tratan con indometacina 1,5 mg/kg BID por 14 días.
La Figura 2 muestra diagramas que ilustran los resultados del análisis microscópico del daño intestinal en muestras de yeyuno que se obtienen de ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID, ya sea sola o
en combinación con rifaximina gastrorresistente 25 mg/kg BID, 50 mg/kg BID o polimorfo alfa de rifaximina 50 mg/kg BID por 14 días. Los números anteriores a cada columna indican la tasa de ratas lesionadas que se detectaron en cada grupo de tratamiento (frecuencia) y el porcentaje respectivo. Cada columna representa la media de 5 a 7 animales ± S.E.M. *P<0,05, diferencia significativa frente al control; a P<0,05, diferencia significativa frente a indometacina.
La figura 3 muestra diagramas que ilustran los resultados del análisis microscópico del daño intestinal en muestras de íleon que se obtienen de ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID, ya sea sola o en combinación con rifaximina gastrorresistente 25 mg/kg BID, 50 mg/kg BID o polimorfo alfa de rifaximina 50 mg/kg BID por 14 días. Los números anteriores a cada columna indican la tasa de ratas lesionadas que se detectaron en cada grupo de tratamiento (frecuencia) y el porcentaje respectivo. Cada columna representa la media de 5 a 7 animales ± S.E.M. *P<0,05, diferencia significativa frente al control; aP<0,05, diferencia significativa frente a indometacina.
La Figura 4 muestra diagramas que ilustran los niveles de mieloperoxidasa en muestras de yeyuno e íleon que se obtienen de ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID, ya sea sola o en combinación con rifaximina gastrorresistente 25 mg/kg BID, rifaximina gastrorresistente 50 mg/kg BID o alfa 50 mg/kg BID por 14 días. Cada columna representa la media de 5 a 7 animales ± S.E.M. *P<0,05, diferencia significativa frente al control; aP<0,05, diferencia significativa frente a indometacina.
La Figura 5 muestra un diagrama que ilustra los resultados de los niveles de hemoglobina en sangre en ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID, ya sea sola o en combinación con rifaximina gastrorresistente 25 mg/kg BID, 50 mg/kg BID o polimorfo alfa de rifaximina 50 mg/kg BID por 14 días. Cada columna representa la media de 5 a 7 animales ± S.E.M. *P<0,05, diferencia significativa frente al control.
La Figura 6A muestra un diagrama que ilustra los resultados de los niveles de hemoglobina en sangre en ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID o indometacina 1,5 mg/kg BID más omeprazol 0,7 mg/kg/día o rifaximina gastrorresistente (50 mg/kg BID) por 1 semana seguida de indometacina 1,5 mg/kg BID más rifaximina gastrorresistente (50 mg/kg BID), o indometacina más rifaximina gastrorresistente (1,5 mg/kg BID 50 mg/kg BID), o indometacina más omeprazol más rifaximina gastrorresistente (1,5 mg/kg BID 0,7 mg/kg/día 50 mg/kg BID). La Figura 6B muestra un diagrama que ilustra los resultados de los niveles de hemoglobina en sangre en ratas con vehículo (control), o diclofenaco (4 mg/kg BID), o diclofenaco más omeprazol (4 mg/kg BID 0,7 mg/kg/día), diclofenaco más rifaximina gastrorresistente (4 mg/kg BID 50 mg/kg BID) o diclofenaco más omeprazol más rifaximina gastrorresistente (4 mg/kg BID 0,7 mg/kg 50 mg/kg BID) u omeprazol más rifaximina gastrorresistente (0,7 mg/kg diarios 50 mg/kg BID) por 14 días. Cada columna representa la media ± S.E.M que se obtiene de 8-14 animales. Los números que aparecen en cada columna indican el número de animales examinados al final del período de tratamiento.
La Figura 7A y la Figura 7C muestran diagramas que ilustran los resultados de los niveles de mieloperoxidasa intestinal (MPO) en yeyuno en ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID o indometacina 1,5 mg/kg BID más omeprazol 0,7 mg/kg/día o rifaximina gastrorresistente (50 mg/kg BID) por 1 semana seguida de indometacina 1,5 mg/kg BID más rifaximina gastrorresistente (50 mg/kg BID), o indometacina más rifaximina gastrorresistente (1,5 mg/kg BID 50 mg/kg BID), o indometacina más omeprazol más rifaximina gastrorresistente (1,5 mg/kg BID 0,7 mg/kg/día 50 mg/kg BID), o diclofenaco (4 mg/kg BID), o diclofenaco más omeprazol (4 mg/kg BID 0,7 mg/kg/día), diclofenaco más rifaximina gastrorresistente (4 mg/kg BID 50 mg/kg BID), o diclofenaco más omeprazol más rifaximina gastrorresistente (4 mg/kg BID 0,7 mg/kg 50 mg/kg BID) u omeprazol más rifaximina gastrorresistente (0,7 mg/kg diarios 50 mg/kg BID) por 14 días.
La Figura 7B y la Figura 7D muestran diagramas que ilustran los resultados de los niveles de mieloperoxidasa intestinal (MPO) en íleon (B, D) en las mismas ratas que se tratan. Cada columna representa la media ± S.E.M que se obtiene de 8-14 animales. Los números que aparecen en cada columna indican el número de animales examinados al final del período de tratamiento. La Figura 8A y la Figura 8C muestran diagramas que ilustran los resultados de los niveles de malondialdehído (MDA) en el yeyuno de ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID o indometacina 1,5 mg/kg BID más omeprazol 0,7 mg/kg/día o rifaximina gastrorresistente (50 mg/kg BID) por 1 semana seguida de indometacina 1,5 mg/kg BID más rifaximina gastrorresistente (50 mg/kg BID) o indometacina más rifaximina gastrorresistente (1,5 mg/kg BID 50 mg/kg BID), o indometacina más omeprazol más rifaximina gastrorresistente (1,5 mg/kg BID 0,7 mg/kg/día 50 mg/kg BID), o diclofenaco (4 mg/kg BID), o diclofenaco más omeprazol (4 mg/kg BID 0,7 mg/kg/día), diclofenaco más rifaximina gastrorresistente (4 mg/kg BID 50 mg/kg BID), o diclofenaco más omeprazol más rifaximina gastrorresistente (4 mg/kg BID 0,7 mg/kg 50 mg/kg BID) u omeprazol más rifaximina gastrorresistente (0,7 mg/kg diarios 50 mg/kg BID) por 14 días.
La Figura 8B y la Figura 7D muestran diagramas que ilustran los resultados de los niveles de mieloperoxidasa intestinal (MPO) en íleon (B, D) en las mismas ratas que se tratan. Cada columna representa la media ± S.E.M que se obtiene de 8-14 animales. Los números que aparecen en cada columna indican el número de animales examinados al final del período de tratamiento. La Figura 9A, la Figura 9B y la Figura 9C muestran diagramas que ilustran los resultados del análisis microscópico de daño en el yeyuno de ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID o indometacina 1,5 mg/kg BID más omeprazol 0,7 mg/kg/día o rifaximina gastrorresistente (50 mg/kg BID) por 1 semana seguida de indometacina 1,5 mg/kg BID más rifaximina gastrorresistente (50 mg/kg BID), o indometacina más
rifaximina gastrorresistente (1,5 mg/kg BID 50 mg/kg BID), o indometacina más omeprazol más rifaximina gastrorresistente (1,5 mg/kg BID 0,7 mg/kg/día 50 mg/kg BID). La Figura 9A se refiere a la lesión de tipo 1, la Figura 9B se refiere a la lesión de tipo 2 y la figura 9C se refiere a la lesión de tipo 3. Cada columna representa la media ± S.E.M. que se obtiene de 10-14 animales. Los números que aparecen en la parte superior de cada columna indican el número de animales examinados al final del período de tratamiento.
La Figura 10A, la Figura 10B y la Figura 10C muestran diagramas que ilustran los resultados del análisis microscópico de daño en el íleon de ratas que se tratan con vehículo (control), o indometacina 1,5 mg/kg BID o indometacina 1,5 mg/kg BID más omeprazol 0,7 mg/kg/día o rifaximina gastrorresistente (50 mg/kg BID) por 1 semana seguida de indometacina 1,5 mg/kg BID más rifaximina gastrorresistente (50 mg/kg BID), o indometacina más rifaximina gastrorresistente (1,5 mg/kg BID 50 mg/kg BID), o indometacina más omeprazol más rifaximina gastrorresistente (1,5 mg/kg BID 0,7 mg/kg/día 50 mg/kg BID). La Figura 10A se refiere a la lesión de tipo 1, la Figura 10B se refiere a la lesión de tipo 2 y la Figura 10C se refiere a la lesión de tipo 3. Cada columna representa la media ± S.E.M. que se obtiene de 10-14 animales. Los números que aparecen en la parte superior de cada columna indican el número de animales examinados al final del período de tratamiento.
La Figura 11A, la Figura 11B y la Figura 11C muestran diagramas que ilustran los resultados del análisis microscópico de daño en el yeyuno de ratas que se tratan con vehículo (Control), o diclofenaco (4 mg/kg BID), o diclofenaco más omeprazol (4 mg/kg BID 0,7 mg/kg/día), diclofenaco más rifaximina gastrorresistente (4 mg/kg BID 50 mg/kg BID), o diclofenaco más omeprazol más rifaximina gastrorresistente (4 mg/kg BID 0,7 mg/kg 50 mg/kg BID) u omeprazol más rifaximina gastrorresistente (0,7 mg/kg diarios 50 mg/kg BID) por 14 días. La Figura 11A se refiere a la lesión de tipo 1, la Figura 11B se refiere a la lesión de tipo 2 y la Figura 11C se refiere a la lesión de tipo 3. Cada columna representa la media ± S.E.M. que se obtiene de 8-12 animales. Los números que aparecen en la parte superior de cada columna indican el número de animales examinados al final del período de tratamiento.
La Figura 12A, la Figura 12B y la Figura 12C muestran diagramas que ilustran los resultados del análisis microscópico de daño en el íleon de ratas que se tratan con vehículo (control), o diclofenaco (4 mg/kg BID), o diclofenaco más omeprazol (4 mg/kg BID 0,7 mg/kg/día), diclofenaco más rifaximina gastrorresistente (4 mg/kg BID 50 mg/kg BID), o diclofenaco más omeprazol más rifaximina gastrorresistente (4 mg/kg BID 0,7 mg/kg 50 mg/kg BID) u omeprazol más rifaximina gastrorresistente (0,7 mg/kg diarios 50 mg/kg BID) por 14 días. La Figura 12A se refiere a la lesión de tipo 1, la Figura 12B se refiere a la lesión de tipo 2 y la Figura 12C se refiere a la lesión de tipo 3. Cada columna representa la media ± S.E.M. que se obtiene de 8-12 animales. Los números que aparecen en la parte superior de cada columna indican el número de animales examinados al final del período de tratamiento.
Descripción detallada
La presente invención se define en las reivindicaciones.
Esta descripción se refiere a composiciones para el uso para tratar y/o prevenir un efecto adverso que se asocia con la administración de AINE en un individuo.
El término "efecto adverso" o "reacción adversa" como se usa en la presente descripción con referencia a los AINE u otros fármacos indica una afección no deseada que resulta de la administración del fármaco. El término "afección" indica un estado físico del cuerpo de un individuo (en conjunto o como una o más de sus partes, por ejemplo, sistemas corporales), que no se ajusta a un estado físico estándar que se asocia con un estado de completo bienestar físico, mental y social para el individuo. Las afecciones que se describen en la presente descripción incluyen, pero no se limitan a trastornos y enfermedades en donde el término "trastorno" indica una afección del individuo vivo que se asocia a una anomalía funcional del cuerpo o de cualquiera de sus partes, y el término "enfermedad" indica una afección del individuo vivo que perjudica el funcionamiento normal del cuerpo o de cualquiera de sus partes y se manifiesta típicamente mediante signos y síntomas característicos en un individuo.
El término "individuo" o "sujeto" o "paciente", como se usa en la presente descripción en el contexto del tratamiento incluye un único animal y en particular animales superiores y en particular vertebrados tales como mamíferos y en particular seres humanos. En general "individuo" de acuerdo con la presente descripción indica un animal que tiene un sistema gastrointestinal (en la presente descripción también GI) y que es susceptible a ulceraciones gástricas e intestinales.
En particular, las composiciones para el uso se describen para tratar y/o prevenir una enteropatía por AINE, en donde la enteropatía por AINE indica un efecto adverso del sistema gastrointestinal que se asocia con la administración de AINE a un individuo.
El término "tratamiento" como se usa en la presente descripción, indica cualquier actividad que sea parte de una atención médica, o que trate, una afección, médicamente o quirúrgicamente. Los términos "tratar" y "tratamiento" se refieren a la reducción de la gravedad y/o la frecuencia de los síntomas, la eliminación de los síntomas y/o la causa subyacente, la prevención de la aparición de los síntomas y/o su causa subyacente, y la mejora o remedio del daño. Por tanto, por ejemplo, "tratar" un paciente implica la prevención de un síntoma o un evento fisiológico adverso en un
individuo susceptible, así como también la modulación y/o el alivio del estado de un individuo clínicamente sintomático mediante la inhibición o la regresión de un trastorno o enfermedad.
El término "prevención", como se usa en la presente descripción con referencia a una afección indica cualquier actividad que reduzca la carga de mortalidad o morbilidad de la afección en un individuo. Esto se lleva a cabo en los niveles de prevención primaria, secundaria y terciaria, en donde: a) la prevención primaria evita el desarrollo de una enfermedad; b) las actividades de prevención secundaria se dirigen al tratamiento temprano de la enfermedad, lo que aumenta de esta manera las oportunidades de intervenciones para prevenir la progresión de la enfermedad y la aparición de síntomas; y c) la prevención terciaria reduce el impacto negativo de una enfermedad ya establecida al restaurar la función y reducir las complicaciones relacionadas con la enfermedad.
El término "enteropatía", como se usa en la presente descripción, se refiere a una afección del sistema gastrointestinal de un individuo y se puede denominar particularmente una afección del intestino. En general, una enteropatía de acuerdo con la descripción identifica un trastorno o una enfermedad del tracto GI que presenta daño gastrointestinal ya sea en el tracto superior y/o inferior. Las enteropatías ilustrativas comprenden lesiones intestinales, particularmente en el intestino delgado, se exacerba posiblemente por disbiosis del intestino y/o por el uso de inhibidores del ácido gástrico, que, cuando se asocian con el uso de AINE, es uno de los principales factores que contribuyen al aumento de la susceptibilidad a lesión del intestino delgado inducida por la administración de AINE. Las enteropatías ilustrativas que se asocian con la administración de AINE son condiciones que se describen en Allison MC y otros en "Gastrointestinal damage associated with the use of non steroidal anti-inflammatory drugs" N. Engl. J. Med 1992; 327: 749-54; Lengeling y otros en "Ulcerative ileitis encountered at ileo-colonscopy: likely role of nonsteroidal agents" Clin. Gastroenterol. Hepatol. 2003; 1: 160-9; y Graham DY y otros en "Visible small-intestinal-mucosal injury in chronic NSAID users" Clin. Gastroenterol. Hepatol. 2005; 3: 5-9, Scarpignato C. y otros, en "NSAID-induced intestinal damage: are luminal bacteria the therapeutic target?" Gut Febrero 2008 Vol. 57 No 2, Wallace JL y otros, Gastroenterol. 2011, 141; p. 1314 y Thomas J. y otros, Clin. Rheumatol. (2006) 25 (Supl.): S22-S29.
Zwolinska - Wcislo M. y otros en Gastroenterology, 142, no. 5, Supp. 1,2012, S46 describe el uso de rifaximina en la colitis inducida por la administración de ácido 2,4,6-trinitrobencenosulfónico (TNBS) en ratas, en donde el estrés se exacerba por AINE como aspirina. Este documento se refiere al efecto beneficioso de la rifaximina c en el daño intestinal que provoca la aspirina, sin mencionar el uso de rifaximina en combinación con antiinflamatorios ni el uso de rifaximina al mismo tiempo que la administración de antiinflamatorios.
Bonomi G. y otros, en Advances Inflammation Research 6, 103, 1984 describe el cambio de la flora fecal después del tratamiento con antibióticos en la evolución de la flora intestinal inducida por indometacina. Este documento reporta que seguido del tratamiento con antibacterianos, en particular la clindamicina para proteger la mucosa intestinal contra la lesión inducida por indometacina. Este documento no reporta un antibiótico preferido o un antibiótico que no se absorbe como la rifaximina, así como también la dosificación y el período de tratamiento y no menciona el uso del inhibidor del ácido gástrico en combinación con tratamiento antiinflamatorio.
Lanas A. y otros en Digestion, 73, 1, 136, 2006 describe el daño intestinal de los AINE y el posible uso de antibióticos de mala adsorción, como la rifaximina, pero no informa si realmente la rifaximina es eficaz en el tratamiento del daño inducido por AINE. Este documento solo supone la posibilidad de usar rifaximina y, además, no informa sobre el efecto del IBP en la terapia concomitante con AINE.
Scarpignato y otros en Chemotherapy 51, S1, 26, 2005 informa que el tratamiento con AINE causa deterioro en el íleon e hipnotiza que la rifaximina podría ser útil en la enteropatía, sin demostrar la dosificación eficaz, la enfermedad que se implica, la asociación de la rifaximina y los AINE con inhibidores del ácido gástrico.
También Gargallo C y otros en Journal Digestive Disease 14, 2, 55, 2013 describen el efecto del uso de los AINE que incluye el sistema gastrointestinal, cardiovascular, hepático renal y respiratorio, en particular las erosiones intestinales y úlceras que provocan la administración de los AINE.
El documento WO 2006/094737 describe formulaciones farmacéuticas que contienen rifaximina en forma de microgránulos hechos gastrorresistentes por un polímero insoluble a valores de pH entre 1,5 y 4,0 y solubles a valores de pH entre 5,0 y 7.
El documento WO 2012/038898 describe la eficacia de tabletas que contienen microgránulos gastrorresistentes de rifaximina para el tratamiento de la enfermedad de Crohn.
El documento WO 2009/108814 describe métodos para tratar la enfermedad intestinal (BD) mediante el uso de rifaximina.
Wallace JL y otros en Gaastroenterology, vol. n. 141, no. 4, páginas 314-1322, 2011 establece que los IBP exacerban el daño intestinal inducido por AINE al menos en parte debido a cambios significativos en la población microbiana entérica. La disbiosis inducida por un PBI es un factor principal que contribuye al aumento de la susceptibilidad de la lesión del intestino delgado inducida por los AINE.
El término "AINE" o "fármaco antiinflamatorio no esteroideo" se refiere a uno o más agentes activos no esteroideos que, cuando se administran a un individuo, exhiben un efecto analgésico, un efecto antipirético y un efecto antiinflamatorio o cualquier combinación de los efectos antes mencionados.
"Administración de AINE" se refiere al tratamiento de un individuo mediante la administración de uno o más AINE solos o en combinación entre sí y con un principio activo adicional en donde el término "administración" se refiere a las vías de introducción de un compuesto o composición en un individuo para realizar la función que se pretende que comprende la administración sistémica o la administración tópica de acción local.
La expresión "administración sistémica" como se usa en la presente descripción indica una vía de administración por la que el principio activo se pone en contacto con el cuerpo del individuo de modo que el efecto que se desea no se limita necesariamente al tejido específico donde ocurre la inflamación y/o la enfermedad en general (por ejemplo, la enfermedad cardiovascular). La administración sistémica incluye la administración enteral y parenteral. La administración enteral es una vía de administración sistémica donde la sustancia se administra mediante del tracto digestivo, e incluye, pero no se limita a, administración oral, administración por sonda de alimentación gástrica, administración por sonda de alimentación duodenal, gastrostomía, nutrición enteral, y administración rectal. La administración parenteral es una vía de administración sistémica donde la sustancia se administra por una vía distinta del tracto digestivo e incluye, pero no se limita a la administración intravenosa, la administración intraarterial, la administración intramuscular, la administración subcutánea, la administración intradérmica, la administración intraperitoneal, e infusión intravesical. La expresión "administración tópica" como se usa en la presente descripción se refiere a una vía de administración en donde el agente activo generalmente se incluye en una formulación apropiada directamente a donde se desea su acción. La administración tópica incluye, pero no se limita a la administración epicutánea, la administración por inhalación (por ejemplo, en medicamentos para el asma), enema, gotas oculares (por ejemplo, sobre la conjuntiva), gotas óticas, vía intranasal (por ejemplo, atomizadores nasales descongestionantes), y administración vaginal, administración rectal y administración oral de agentes que no se absorben.
En particular, la administración de los AINE de acuerdo con la presente descripción se refiere a vías de administración en las que uno o más AINE entran en contacto con el tracto gastrointestinal de un individuo típicamente después de la administración oral, en donde una acción local persistente se debe a la recirculación enterohepática del compuesto, y el efecto sistémico que se lleva a cabo después de su absorción.
En algunas modalidades, la administración de AINE se refiere a la administración de uno o más AINE que se realiza para tratar y/o prevenir una afección de un individuo en donde se presentan dolor e/o inflamaciones, que incluye afecciones agudas o crónicas que presentan los síntomas anteriores. El término "dolor" como se usa en la presente descripción indica una experiencia sensorial y emocional desagradable que se asocia con un daño del tejido real o potencial, o que se describe en términos de dicho daño. Los términos "inflamación" y "respuesta inflamatoria" como se usan en la presente descripción indican la respuesta biológica compleja de los tejidos, que incluyen los tejidos vasculares de un individuo a estímulos dañinos, tales como patógenos, células dañadas, o irritantes, e incluye la secreción de prostaglandinas, citocinas y con mayor particularidad de citocinas proinflamatorias, es decir, citocinas que se producen predominantemente por células inmunes activadas tales como, por ejemplo, microglía y que se implican en la amplificación de reacciones inflamatorias. Las citocinas proinflamatorias ilustrativas comprenden IL-1, IL-6, TNF-a, IL-17, IL21, IL23 y TGF-p. Las inflamaciones ilustrativas incluyen inflamación aguda e inflamación crónica. La expresión "inflamación aguda" como se usa en la presente descripción indica un proceso a corto plazo que se caracteriza por los signos clásicos de inflamación (hinchazón, enrojecimiento, dolor, calor y pérdida de función) que se debe a la infiltración de los tejidos por plasma y leucocitos. Una inflamación aguda ocurre típicamente siempre que el estímulo perjudicial esté presente y cesa una vez que el estímulo se ha retirado, descompuesto, o tapiado por cicatrización (fibrosis). La expresión "inflamación crónica", como se usa en la presente descripción, indica una afección que se caracteriza por inflamación activa concurrente, destrucción de tejido e intentos de reparación. La inflamación crónica no se caracteriza por los signos clásicos de inflamación aguda enumerados anteriormente. En cambio, el tejido inflamado crónicamente se caracteriza por la infiltración de células inmunes mononucleares (monocitos, macrófagos, linfocitos, y células plasmáticas), destrucción de tejido, e intentos de curación, que incluyen angiogénesis y fibrosis. Una afección de inflamación se puede controlar de acuerdo con esta descripción al afectar y en particular inhibir cualquiera de los eventos que forman la respuesta biológica compleja que se asocia con una inflamación en un individuo. En algunas de aquellas modalidades, la administración de los AINE se puede realizar por un período de tiempo (o duración) de 1 semana hasta dos meses o más.
En algunas modalidades, la afección de un individuo en donde se presentan dolor e/o inflamaciones, es una enfermedad cardiovascular y en particular una enfermedad cardiovascular aguda o crónica. El término "enfermedad cardiovascular" como se usa en la presente descripción indica una clase de enfermedades que involucran al corazón, los vasos sanguíneos (arterias, capilares y venas) o ambos. Por consiguiente, enfermedad cardiovascular se refiere a cualquier enfermedad que afecte al sistema cardiovascular, principalmente enfermedad cardíaca, enfermedades vasculares del cerebro y riñón, y enfermedad arterial periférica. En particular, la inflamación y/o el dolor son comunes para los pacientes con enfermedades cardíacas y accidentes cerebrovasculares donde se cree que la inflamación en alguna instancia es un signo o una respuesta aterogénica. La enfermedad cardiovascular ilustrativa que se trata con
la administración de los AINE comprende enfermedad arterial coronaria (también conocida como enfermedad cardíaca coronaria y enfermedad cardíaca isquémica), miocardiopatía (enfermedades del músculo cardíaco), enfermedad cardíaca hipertensiva (enfermedades del corazón secundarias a la presión arterial alta), insuficiencia cardíaca, arritmias cardíacas (anomalías del ritmo cardíaco), enfermedad cardíaca inflamatoria como endocarditis (inflamación de la capa interna del corazón, el endocardio; las estructuras más comúnmente implicadas son las válvulas cardíacas), cardiomegalia inflamatoria y miocarditis (inflamación del miocardio, la parte muscular del corazón), enfermedad cerebrovascular (enfermedad de los vasos sanguíneos que suministran sangre al cerebro como un accidente cerebrovascular) y enfermedad arterial periférica (enfermedad de los vasos sanguíneos que suministran sangre a los brazos y las piernas). Con mayor particularidad, los AINE tales como el ácido acetilsalicílico se administran para el tratamiento o la prevención de la agregación plaquetaria, angina de pecho inestable, sospecha o diagnóstico de infarto agudo de miocardio, profilaxis de infarto de miocardio repetido, afección después de cirugía vascular (por ejemplo, PTCA, CABG), profilaxis de ataques de isquemia transitoria y accidentes cerebrovasculares en el período de síntomas iniciales, profilaxis de la trombosis coronaria en pacientes con múltiples factores de riesgo.
La expresión "puede" como se usa en la presente descripción se usa indistintamente con la palabra "puede" para indicar operabilidad de un elemento referenciado, la capacidad de un elemento referenciado para realizar una o más funciones y/o actividades, y/o inclusión de un elemento referenciado dentro del alcance de la descripción, de acuerdo con el contexto relacionado como se entenderá por un experto tras la lectura de la descripción.
En algunas modalidades del uso de la descripción, la administración de AINE se realiza en combinación con la administración de rifaximina y al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional y la administración combinada se realiza para tratar y/o prevenir el daño gastrointestinal en la parte superior y/o inferior del tracto gastrointestinal que se asocia con la administración repetida de AINE que se requieren para el tratamiento del dolor e/o inflamación, y en particular para el tratamiento y/o prevención de una enfermedad cardiovascular del individuo.
En algunas modalidades del uso de la descripción la administración de AINE se realiza en combinación con la administración de rifaximina, en asociación con AINE en una composición separada o única con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional y la administración combinada se realiza para tratar y/o prevenir el daño gastrointestinal en la parte superior y/o inferior del tracto gastrointestinal que se asocia con la administración repetida de AINE.
El término "rifaximina" como se usa en la presente descripción indica un antibiótico semisintético que pertenece a la clase de rifampicinas, con mayor precisión es una pirido-imidazo rifamicina (INN, ver The Merck Index, XIII ed., 8304, CAS No. 80621-81-4), con nomenclatura de la IUPAC (2S, 16Z, 18E, 20S, 21S, 22R, 23R, 24R, 25S, 26S, 27S, 28E)-5, 6, 21, 23, 25 pentahidroxi-27-metoxi-2, 4, 11, 16, 20, 22, 24, 26-octametil-2,7-(epoxipentadeca-(1,11,13)trienimino) benzofuro (4,5-e) pirido (1,2,-a bencimidazol-1,15(2H) diona, 25-acetato). La rifaximina está disponible actualmente bajo las marcas comerciales Normix®, Rifacol® y Xifaxan® (ver también IT 1154655 y EP 0161534 este último en particular que describe un proceso para la producción que parte de rifamicina O (The Merck Index XIII ed., 8301)).
"Rifaximina" en el sentido de la presente descripción incluye solvatos y formas polimorfas, que incluyen por ejemplo, Forma a, Forma p, Forma y, Forma 5, Forma £, Forma Z, Forma n, Forma í, Forma p-1, Forma p-2, Forma £-seca, forma mesilato, forma amorfa y cualquier mezcla de las mismas. El documento IT 1349654 describe la Forma a, la Forma p y la Forma y; el documento EP 1698630 describe la Forma 5 y la Forma £; los documentos WO 2008/035109, WO 2008/155728, US 7,709,634 describen una forma amorfa; el documento WO 2009/108730 describe la Forma Z; Forma y-1; Forma n; Forma 1 (iota); Forma p-1; Forma p-2; y la Forma amorfa; el documento WO 2011/156897 describe la Forma APO-I y la Forma APO-II; el documento WO 2011/153444 describe la Forma kappa y la Forma theta; el documento WO 2011/103120 describe la Forma Z; Forma n; Forma 1 (iota); Forma 1 -seco; y la Forma B; el documento WO 2012/155981 describe una forma pseudocristalina; el documento WO2012/156951 describe la Forma K; el documento WO 2012/150561 describe un solvato de dimetilformamida. Se describen varios polimorfos de rifaximina en las patentes de los Estados Unidos: 7,045,620 (Forma a, Forma p, Forma y), 8,217,054 (Forma estabilizada p) 8,193,196 (Forma 5 y Forma £) 8,067,429 (Forma Z, Forma n, Forma a-seca, Forma i y amorfa y 8,227,482 (Forma Mu, Forma Pi, Forma Omicrón, Forma Xi, Forma Zeta, Forma Zeta y Forma lota).
Los términos "polimorfo" "forma polimorfa" o "polimorfismo", como se usan en la presente descripción, se refiere a la aparición de diferentes formas cristalinas de un único compuesto en estado de hidrato o solvente definido, por ejemplo, una propiedad de algunos compuestos y complejos. Por tanto, los polimorfos son sólidos definidos que comparten la misma fórmula molecular, aunque cada polimorfo puede tener propiedades físicas definidas. Por lo tanto, un único compuesto puede dar lugar a una variedad de formas polimórficas donde cada forma tiene propiedades físicas diferentes y definidas, tales como perfiles de solubilidad, temperaturas de punto de fusión, higroscopicidad, forma de partículas, densidad, fluidez, compatibilidad y/o picos de difracción de rayos X. La solubilidad de cada polimorfo puede variar, por tanto, identificar la existencia de polimorfos farmacéuticos es esencial para proporcionar productos farmacéuticos con perfiles de solubilidad predecibles. Es deseable investigar todas las formas de un fármaco en estado sólido, que incluye todas las formas polimórficas, y determinar la estabilidad, la disolución y las propiedades de flujo de cada forma polimórfica. Las formas polimórficas de un compuesto se pueden distinguir en un laboratorio por espectroscopía de difracción de rayos X y por otros métodos tal como, la espectrometría infrarroja. Para una revisión
general de los polimorfos y las aplicaciones farmacéuticas de los polimorfos ver G. M. Wall, Pharm Manuf. 3, 33 (1986); J. K. Haleblian y W. McCrone, J. Pharm. Sci., 58, 911 (1969); y J. K. Haleblian, J. Pharm. Sci., 64, 1269 (1975). Como se usa en la presente descripción, el término polimorfo se usa ocasionalmente como un término general en referencia a las formas de rifaximina e incluye dentro del contexto, formas polimórficas y amorfas de sal e hidrato de rifaximina como se describe en la presente descripción. Este uso depende del contexto y será evidente para un experto en la técnica. Las características adicionales del antibiótico rifaximina que se pueden usar en las composiciones, métodos y sistemas que se describen en la presente descripción se identificarán por un experto tras la lectura de la presente descripción. Como se usa en la presente descripción, los términos "antibiótico" y "antibacteriano" se usan indistintamente y se refieren a uno o más agentes activos que inhiben el crecimiento bacteriano (bacteriostático) o matan las bacterias (bactericida).
Los documentos WO 2006/094737, WO 2012/038898 y WO 2009/108814 describen el uso de rifaximina en composiciones gastrorresistentes y no gastrorresistentes en el tratamiento de la enfermedad de Crohn, pero estos documentos no mencionan el uso de rifaximina en el tratamiento del daño intestinal que se produce por la administración de AINE.
El término "inhibidor del ácido gástrico" como se usa en la presente descripción se refiere a cualquier compuesto que tenga el efecto de reducir el contenido de ácido del estómago o inhibir la producción de ácido en el estómago.
En las modalidades que se describen en la presente descripción, uno o más de un AINE, rifaximina y opcionalmente al menos un antibiótico y/o al menos un inhibidor del ácido gástrico se administran en combinación para obtener tratamiento de las afecciones que presentan dolor e/o inflamación y en particular el tratamiento de enfermedad cardiovascular mientras se trata y/o se previene el efecto adverso que se asocia con la administración de AINE y en particular, los efectos adversos en el tracto gastrointestinal, en donde la "administración combinada" de un agente terapéutico, o la administración de un agente terapéutico "en combinación con" uno o más agentes terapéuticos adicionales de acuerdo con la presente descripción comprenden la administración simultánea (concurrente) y consecutiva (secuencial) de los agentes activos referenciados (AINE, antibiótico, y/o inhibidor del ácido gástrico) que se realiza en cualquier orden.
En algunas modalidades que se describen en la presente descripción en donde se desea el tratamiento y/o la prevención de una enteropatía por AINE, se puede administrar una cantidad efectiva de al menos un antibiótico al individuo por un período seleccionado de al menos una semana, 10 días, dos semanas o más de dos semanas, por ejemplo, hasta dos meses en combinación con al menos un AINE, y al menos un inhibidor de la bomba de protones. En algunas de aquellas modalidades, se puede administrar una combinación de al menos un AINE, al menos un inhibidor de la bomba de protones y al menos un antibiótico por dos semanas o más.
En algunas modalidades que se describen en la presente descripción la administración de al menos un antibiótico y el inhibidor de la bomba de protones se realiza en conjunto con un tratamiento con AINE que se asocia con la aparición de una enteropatía grave en el individuo.
Una enteropatía grave en el sentido de la presente descripción es una enteropatía que se asocia con signos y síntomas que pueden tener un impacto grave en la capacidad de los pacientes para llevar una vida cotidiana normal, tales como las enteropatías que se asocian con la presencia de lesiones del intestino delgado de categorías (3) y (4) de acuerdo con la categorización de enteropatía por AINE que se asigna por Graham DY et al en Clin Gastr. Hepatol. 2005, 3, 55 que asigna la lesión del intestino delgado en 4 categorías: (1) manchas rojas, que se definen como un área demarcada, generalmente circular, de 1-3 mm de mucosa carmesí con preservación del patrón velloso; (2) ulceración/erosión, que se define como una mancha roja con clara pérdida de vellosidades en el área de la lesión, <5 mm de diámetro con un borde que se define; (3) úlceras, que se definen como una lesión penetrante de la mucosa con un diámetro de >5 mm; y categoría (4), grandes úlceras erosivas. Se hace referencia a la sección de Ejemplos y en particular a. Los ejemplos 18 y 19 que muestran modalidades ilustrativas en donde el uso de rifaximina de acuerdo con la presente descripción demuestra ser particularmente efectivo en relación con el tratamiento y/o la prevención de enteropatías graves. En particular las enteropatías graves se asocian típicamente con un tratamiento a largo plazo de AINE de al menos dos semanas, al menos dos meses, dos a seis meses o un año y más, que incluye la administración crónica y tratamientos de por vida como se entenderá por un experto.
En algunas modalidades que se describen en la presente descripción, durante el tratamiento con AINE, el AINE se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario a una dosificación de 5 a 1500 mg al día, en dependencia del AINE elegido, como se entenderá por un experto en la técnica.
El momento de administración de la rifaximina para tratar y/o prevenir la enteropatía puede variar en dependencia del individuo que se trata, el efecto a alcanzar (tratamiento y/o prevención de la enteropatía) y la severidad de la enteropatía como se entenderá por un experto.
La rifaximina se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o con tan a menudo como sea necesario en dosificaciones de 20 a 3300 mg al día, o de 20 a 2400 mg al
día en dependencia del antibiótico elegido como se entenderá por un experto en la técnica.
En una modalidad particular, la rifaximina se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario en dosificaciones de 200 a 3300 mg al día en dependencia del antibiótico elegido como se entenderá por un experto en la técnica.
Con mayor particularidad, en algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo en una dosificación diaria en un intervalo que comprende 20 mg, 40 mg, 60 mg, 80 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 50 mg, 100 mg, 150 mg, a 200 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 100 mg, 200 mg, 300 mg, a 400 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 200 mg, 400 mg, 600 mg, a 800 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 400 mg, 800 mg, 1200 mg, a 1600 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 550 mg, 1100 mg, 1650 mg, a 2200 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 600 mg, 1200 mg, 1800 mg, a 2400 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 800 mg, 1600 mg, 2400 mg, a 3200 mg o más al día dentro del intervalo de dosificaciones anterior.
En algunas modalidades, la rifaximina se puede administrar OD, BID, TID o más a menudo en una dosificación diaria de 1100 mg, 2200 mg, a 3300 mg.
En algunas modalidades uno o más de un inhibidor de la bomba de protones también se pueden administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario en dosificaciones de 5 a 2000 mg al día, en dependencia del inhibidor de la bomba de protones elegido como se entenderá por un experto.
En algunas modalidades, el momento y la dosificación de un uso y administración combinados de rifaximina y al menos un inhibidor de la bomba de protones se pueden seleccionar para proporcionar al individuo una cantidad de rifaximina y el inhibidor de la bomba de protones que sea efectivo para prevenir el daño gastrointestinal por AINE en el individuo bajo administración de AINE. Cada uno de los AINE, rifaximina e inhibidor de la bomba de protones se administra mediante el uso de una dosificación y un intervalo de tiempo para cada clase de fármaco para ejercer su efecto terapéutico, específico para su clase de acción. En particular, en las modalidades que se describen en la presente descripción, cada uno de los AINE, rifaximina e inhibidor de la bomba de protones se puede administrar en combinación al menos OD, en cualquier momento del día. En algunas de aquellas modalidades, se puede administrar un AINE, rifaximina e inhibidor de la bomba de protones en combinación OD en la noche.
En algunas modalidades, un AINE y la rifaximina se pueden administrar en combinación BID, por ejemplo, en una primera administración y una segunda administración que se realiza en una combinación en un intervalo de aproximadamente 12 horas entre administraciones. En algunas de aquellas modalidades, la administración de AINE y la administración de rifaximina se pueden realizar OD, BID o TID en combinación con una OD que se administra con un inhibidor de la bomba de protones. En algunas de aquellas modalidades, se puede realizar una primera administración de al menos un AINE y/o al menos un antibiótico que se administra en combinación en la mañana y se puede realizar una segunda administración de al menos un AINE y/o rifaximina que se administra en combinación en la noche. En algunas de aquellas modalidades, también se puede administrar un inhibidor de la bomba de protones en la noche en combinación con el AINE y opcionalmente rifaximina.
En algunas modalidades, el AINE se puede administrar al individuo al menos BID, en donde la administración comprende administrar el AINE y una primera rifaximina o uno o más inhibidores de la bomba de protones al menos una vez al día y administrar el AINE y una segunda rifaximina y uno o más inhibidores de la bomba de protones al menos una vez al día.
En algunas modalidades, el antibiótico y el AINE se pueden administrar simultáneamente, que se combinan en una única forma de dosificación (por ejemplo, rifaximina y AINE en una única tableta o cápsula, o antibiótico y AINE en un
único vehículo tal como rifaximina y granulados de AINE que se disuelven en agua).
En algunas modalidades, la rifaximina y el AINE se pueden administrar en el mismo o en diferentes momentos en formas de dosificación separadas, en donde el antibiótico se puede administrar antes o después del AINE.
En particular, en algunas modalidades que se describen en la presente descripción, la rifaximina se puede administrar una, dos, tres, cuatro, cinco, seis, siete, ocho, nueve, diez, once o doce horas o más, ya sea antes o después de la administración del AINE. Dosificaciones ilustrativas y regímenes de dosificación y regímenes de los tres agentes activos de acuerdo con las modalidades se describen en la presente descripción se ilustran más abajo.
Tabla 1
En la Tabla 1 se reportan dosificaciones ilustrativas para AINE y para rifaximina cuando el antibiótico es rifaximina. Un experto podrá comprender las dosificaciones adicionales en relación con el momento de la administración tras la lectura de la presente descripción.
Por ejemplo, en algunas modalidades, ilustraciones de uso de AINE para afecciones artríticas y/o trastornos musculoesqueléticos agudos y/u otras afecciones dolorosas y/o enfermedad cardiovascular, se tratan o previenen con la administración de AINE que comprende dosificaciones diarias de 20 a 1500 mg por un período de al menos una semana hasta dos meses o más.
Dosificaciones adicionales y el momento de administración del AINE, un inhibidor de la bomba de protones (IBP) y rifaximina se identificarán por un experto en base al AINE, el inhibidor de la bomba de protones y la rifaximina seleccionados y la afección específica o más afecciones que se tratan como se entenderá por un experto. De manera similar, en base a la información que se describe en la presente descripción, las formulaciones específicas del AINE, el inhibidor de la bomba de protones y la rifaximina también se pueden determinar por un experto en base al AINE, el inhibidor de la bomba de protones y la rifaximina seleccionados y la afección específica o más afecciones que se tratan.
En algunas modalidades, la administración del AINE, rifaximina y el inhibidor de la bomba de protones se puede realizar en formas de dosificación separadas o en una única forma de dosificación unificada que comprende un AINE y rifaximina o una forma de dosificación unificada que comprende AINE, antibiótico e inhibidor de la bomba de protones. El AINE se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día o tan a menudo como sea necesario en dosificaciones que comprenden de 5 a 1500 mg al día, en dependencia del AINE elegido.
En algunas modalidades, el AINE que se administra se selecciona, por ejemplo, del grupo que consiste en: diclofenaco, ácido acetilsalicílico, ibuprofeno, ketoprofeno, naproxeno y sus sales farmacéuticamente aceptables y mezclas de los mismos. En algunas de estas modalidades, los AINE se administran una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día o tan a menudo como sea necesario en dosificaciones de 5 a 1500 mg al día, en dependencia del AINE elegido. La rifaximina se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día o tan a menudo como sea necesario en dosificaciones de 20 a 3300 mg al día y de 20 a 2400 mg al día.
Los inhibidores de la bomba de protones se pueden administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día o tan a menudo como sea necesario en dosificaciones de 5 a 2000 mg al día, en dependencia del inhibidor de la bomba de protones elegido.
En algunas modalidades, el inhibidor de la bomba de protones se puede elegir entre IBP tal como lansoprazol, ilaprazol, omeprazol, tenatoprazol, rabeprazol, esomeprazol, pantoprazol, pariprazol, leminoprazol o nepaprazol o una base libre, un ácido libre, una sal, un hidrato, un éster, una amida, un enantiómero, un isómero, un tautómero, un polimorfo, un profármaco o cualquier derivado de los mismos.
En varias modalidades, las dosis de AINE, rifaximina e inhibidor de la bomba de protones por día se pueden administrar a la misma hora (o horas) diaria, o en diferentes horas (o horas) diarios.
Se pueden usar dosificaciones adicionales que proporcionen al individuo una cantidad terapéuticamente efectiva o una cantidad profilácticamente efectiva de acuerdo con las modalidades relacionadas de la descripción. En particular, el término "cantidad efectiva" de uno o más ingredientes activos se refiere a una cantidad no tóxica pero suficiente de uno o más fármacos para proporcionar el efecto que se desea. Por ejemplo, una "cantidad efectiva" que se asocia con tratar y/o prevenir (también en la presente descripción "cantidad terapéuticamente efectiva" o "cantidad farmacéuticamente efectiva") por al menos un AINE, una afección en el individuo en la que se presenta dolor e/o inflamación, se refiere a una cantidad no tóxica pero suficiente de al menos un AINE para proporcionar el tratamiento y/o la prevención de tal afección en el individuo. Como otro ejemplo, una "cantidad efectiva" de al menos un antibiótico y un inhibidor de la bomba de protones que se asocia con tratar y/o prevenir de una enteropatía por AINE en el individuo se refiere a una cantidad no tóxica pero suficiente del al menos un antibiótico y/o al menos un inhibidor de la bomba de protones para proporcionar el tratamiento y/o la prevención de la enteropatía por NSAID en el individuo.
Por consiguiente, en algunas modalidades que se describen en la presente descripción, una cantidad terapéuticamente efectiva de al menos un antibiótico y al menos un inhibidor de la bomba de protones indica cantidades capaces de tratar y/o prevenir el daño gastrointestinal en el individuo. En algunas modalidades, una cantidad terapéuticamente efectiva de al menos un AINE indica cantidades capaces de tratar y/o prevenir una afección en la que se presentan dolor e/o inflamación en el individuo. Por consiguiente, una cantidad terapéuticamente efectiva de, al menos un antibiótico, al menos un AINE y al menos un inhibidor de la bomba de protones, comprende, por ejemplo, las dosis y formulaciones (por ejemplo, en una o más composiciones farmacéuticas que comprenden los ingredientes activos) necesarias para tratar y/o prevenir la afección mencionada en el individuo, y particularmente la artritis u otras afecciones dolorosas y/o inflamatorias mientras se trata y/o se previene el daño gastrointestinal que se asocia con el uso de AINE, con una relación beneficio/riesgo razonable aplicable a cualquier tratamiento médico.
En modalidades ilustrativas, una cantidad terapéuticamente efectiva del antibiótico se puede comprender entre 20 y 800 mg OD, BID, TID, QDS hasta el final del tratamiento con AINE. En algunas modalidades el antibiótico se puede administrar por un período de tratamiento que sigue el final del tratamiento con AINE, por ejemplo, por al menos una semana o por al menos dos semanas.
En algunas modalidades de las composiciones para el uso que se describe en la presente, la rifaximina se puede administrar en combinación con al menos un antibiótico, en combinación con el AINe y al menos un inhibidor de la bomba de protones. En particular, en algunas modalidades el antibiótico puede ser uno o más de un antibiótico que tiene efecto en el tracto GI y/o que tiene una baja absorción sistémica. La absorción sistémica baja incluye, por ejemplo, menos del 10 % de absorción, menos del 5 % de absorción, menos del 1 % de absorción y menos del 0,5 % de absorción. La absorción sistémica baja también incluye, por ejemplo, de aproximadamente 0,01 a aproximadamente 1 % de absorción, de aproximadamente 0,05 a aproximadamente 1 % de absorción, de aproximadamente 0,1 a aproximadamente 1 % de absorción, de aproximadamente 1 a aproximadamente 10 % de absorción o de aproximadamente 5 a aproximadamente 20 % de absorción.
Más en particular, en algunas modalidades el antibiótico es uno o más de un "antibiótico específico GI" y "antibiótico GI" cuyos términos, como se usan en la presente descripción, incluyen un antibiótico conocido o que se ha determinado que tiene un efecto sobre la enfermedad GI. Por ejemplo, un antibiótico de la clase rifamicina (por ejemplo, rifaximina), neomicina, metronidazol, teicoplanina, ciprofloxacina, doxiciclina, tetraciclina, augmentina, cefalexina, penicilina, ampicilina, kanamicina, rifamicina, vancomicina y combinaciones específicas de los mismos son antibióticos específicos GI útiles. En una modalidad el antibiótico puede ser un antibiótico específico GI que tenga baja absorción.
En las modalidades que se describen en la presente descripción, el antibiótico se administra mediante el uso de una dosificación y un intervalo de tiempo para que cada clase de fármaco ejerza su efecto terapéutico, específico para su clase de acción. En particular, en las modalidades que se describen en la presente descripción, al menos un antibiótico se puede administrar en combinación con cada uno de los AINE, rifaximina e inhibidor del ácido gástrico, al menos OD, en cualquier momento del día. En algunas de aquellas modalidades, un AINE, rifaximina, un inhibidor de la bomba de protones y el al menos un antibiótico se pueden administrar en combinación OD en la noche.
En algunas modalidades, al menos un antibiótico se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día o tan a menudo como sea necesario en dosificaciones de 20 a 3300 mg al día y de 20 a 2400 mg al día en dependencia del antibiótico elegido
En algunas modalidades, al menos un antibiótico se puede seleccionar, por ejemplo, del grupo que consiste en: antibióticos de la clase de rifamicina aminoglucósido, anfenicol, ansamicina, beta-lactama, carbapenem, cefamicina,
monobactama, oxacefem, lincosamida, macrólido, polipéptido, tetraciclina, un antibiótico de la clase 2,4-diaminopirimidina, penicilina, neomicina, metronidazol, vancomicina, paromomicina, timidazol, claritromicina, amoxicilina, sulfasalazina; olsalazie; mesalamina; prednisona; azatioprina; mercaptopurina; metotrexato, ampicilina, clindamicina, rifampicina, rifamicina, vancomicina, cloranfenicol, espectinomicina, fluoroquinolonas y cefalosporinas. El antibiótico fluoroquinolona puede ser al menos uno seleccionado del grupo de: balofloxacina, ciprofloxacina, difloxacina, enrofloxacina, fleroxacina, gatifloxacina, grepafloxacina, levofloxacina, lomefloxacina, marbofloxacina, moxifloxacina, paz nadifloxacina, orifloxacina, orifloxacina, esparfloxacina, temafloxacina y tosufloxacina. El antibiótico de cefalosporina puede ser al menos uno seleccionado del grupo de: cefacetrilo, cefaclomezina, cefaclor, cefadroxilo, cefalexina, cefaloglicina, cefalonio, cefaloram, cefaloridina, cefalotina, cefaparole, cefapirina, cefatrizina, cefapezolinfluur cefcaeno, cefclidina, cefdaloxima, cefdinir, cefditoren, cefedrolor, cefotrizona, cefepoxima, cefetamet, ceftrizol, cefetanazina, cefaloxima, cefmeprenam, cefalozol, cefminox, cefodizoxima, cefonicamida, cefoperazona, cefprozina, cefazolidina, cefoxitina, cefprozil, cefquinotomo, cefetanolina, ceftazidima, cefsumida, ceftarolina, ceftazidime, cefteram, ceftezol, ceftiteno, ceftiofur, ceftioleno, ceftióxido, ceftizoxima, ceftriaxona, cefestona, cefuraxima, cefotrofam, y loracarbef. En algunas de aquellas modalidades, el antibiótico se puede administrar por vía enteral o parenteral, OD o BID con dosis y horarios identificables por un experto tras la lectura de la presente descripción en relación con el efecto del que se desea tratar y/o prevenir una afección del tracto GI, particularmente del tracto intestinal.
Con mayor particularidad, en algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria en un intervalo que comprende 20 mg, 40 mg, 60 mg, 80 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 50 mg, 100 mg, 150 mg, a 200 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 100 mg, 200 mg, 300 mg, a 400 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 200 mg, 400 mg, 600 mg, a 800 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 400 mg, 800 mg, 1200 mg, a 1600 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 550 mg, 1100 mg, 1650 mg, a 2200 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 600 mg, 1200 mg, 1800 mg, a 2400 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 800 mg, 1600 mg, 2400 mg, a 3200 mg o más al día.
En algunas modalidades, al menos un antibiótico se puede administrar OD, BID, TID o más a menudo a una dosificación diaria de 1100 mg, 2200 mg a 3300 mg o más al día.
En modalidades donde se administra más de un antibiótico, los antibióticos que se administran se pueden administrar en el mismo momento o en un momento diferente en dependencia de cada clase de fármaco y la dosificación relacionado y el intervalo de tiempo que se identifica para ejercer su efecto terapéutico, específico para su clase de acción. En algunas modalidades, al menos un antibiótico se puede administrar junto con rifaximina de acuerdo con los regímenes de rifaximina de las varias modalidades que se describen en la presente descripción. Por ejemplo, en algunas modalidades, dosificaciones ilustrativas y regímenes ilustrativos de dosis y regímenes del al menos un antibiótico son los mismos que se indican para la rifaximina en la ilustración de la Tabla 1 que se puede aplicar también a al menos un antibiótico.
Las enterobacterias y las citocinas desempeñan funciones en la fisiopatología de la enteropatía inducida por AINE. En el intestino delgado, los AINE potencian la permeabilidad intestinal e inducen inflamación de la mucosa. Una vez que la barrera de la mucosa se ha afectado por los AINE, las bacterias gramnegativas luminales pueden ingresar a la célula y activar el receptor tipo Toll (TLR) 4, que reconoce el lipopolisacárido (LPS), un componente importante de la pared celular de las bacterias gramnegativas, lo que resulta en la activación de una cascada inflamatoria. El factor nuclear kB (NF-kB) es la molécula efectora final de la vía de señalización de TLR4. Promueve el desarrollo de muchas enfermedades intestinales y también juega un papel fundamental en la traducción y transcripción de mediadores inflamatorios.
En el sistema gastrointestinal, PXR tiene un papel como modulador de la inflamación en la barrera de la mucosa intestinal. El PXR es un receptor nuclear que regula los genes implicados en el metabolismo xenobiótico y la deposición y desintoxicación limitadas de antibióticos. Los mecanismos del efecto protector de la activación de PXR en la
inflamación intestinal se deben en parte a la atenuación de la señalización del factor nuclear kappa B (NF-KB) que resulta en una expresión inferior de citocinas proinflamatorias. Por ejemplo, la rifaximina, además de su actividad antibacteriana, es un agonista de PXR específico del intestino, que suprime la expresión de genes que se regulan por NF-Kappa B y es un regulador negativo de la inflamación y las respuestas inmunológicas en el intestino humano.
Por consiguiente, en algunas modalidades de las composiciones para el uso que se describen en la presente descripción, la administración de AINE se realiza en combinación con la administración de rifaximina posiblemente en combinación con al menos un agonista de PXR, al menos un inhibidor de la bomba de protones y/o al menos un antibiótico, en donde se realiza para tratar y/o prevenir el daño gastrointestinal en el tracto GI superior y/o inferior que se asocia con administraciones repetidas de AINE que se requieren para el tratamiento del dolor e/o inflamación y/o afecciones relacionadas en el individuo. En aquellas modalidades, se espera que al menos PXR aumente el efecto terapéutico con la rifaximina para tratar o prevenir la enteropatía en el individuo. En algunas modalidades, el agonista de PXR es un antibiótico.
Como se usa en la presente descripción, el término "agonista de PXR" se refiere a uno o más agentes activos que pueden activar el receptor X de pregnano ("PXR"). La activación de PXR puede resultar en inhibir, reducir o prevenir la inflamación del intestino y los tejidos y órganos relacionados. Los agonistas de PXR ilustrativos comprenden PCN, rifampicina, RU486, SR12813, taxol, hiperforina, 5p-pregnane-3,20-diona, ácido litocólico, metirapona, clotrimazol, fenobarbital, espironolactona, trans-nonaclor, nifedipina, ritonax 4-hidroxifenmoxifenmo, troglitazona, lovastatina, glutetimida, bisfenol A, dietilhexilftalato, nonilfenol, pregnenolona, derivado 17a-hidroxilado de prenenolona, progesterona, derivado 17a-hidroxilado de progesterona, estradiol y corticosterona. Otros agonistas de PXR se identificarán por los expertos en la técnica.
En las modalidades que se describen en la presente descripción, se administran en combinación un AINE, rifaximina, al menos un agonista de PXR, un inhibidor de la bomba de protones y/o al menos un antibiótico para obtener el tratamiento de las afecciones que presentan dolor e/o inflamación (por ejemplo, afecciones artríticas, enfermedades agudas), trastornos músculo-esqueléticos, afecciones que resultan de un trauma, dolor miofascial crónico y enfermedades cardiovasculares) mientras se trata y/o se previene el efecto adverso que se asocia con la administración de AINE y, en particular, el efecto adverso en el tracto gastrointestinal, en donde la "administración combinada" de un agente terapéutico, o la administración de un agente terapéutico "en combinación con" uno o más agentes terapéuticos adicionales de acuerdo con la presente descripción comprende la administración simultánea (concurrente) y consecutiva de los principios referenciados que se realiza en cualquier orden. Los diversos agentes terapéuticos para usar con la descripción se pueden administrar por lo tanto en cualquier orden para lograr el tratamiento o la prevención de la afección subyacente para la que se administran uno o más AINE y se minimiza el desarrollo o el tratamiento de enteropatías causadas por los AINE mediante la administración de una combinación apropiada de antibiótico e inhibidor del ácido gástrico, por separado o juntos, y los AINE.
En algunas modalidades que se describen en la presente descripción en donde se desea el tratamiento y/o la prevención de una enteropatía por AINE y/o de una afección que presenta dolor e/o inflamación, se puede administrar al individuo una cantidad efectiva de rifaximina en combinación con al menos un agonista de PXR para un período seleccionado de al menos una semana, 10 días, dos semanas o más de dos semanas hasta dos meses o más tarde en combinación con al menos un AINE y al menos un inhibidor de la bomba de protones. En algunas de aquellas modalidades, se puede administrar una combinación de al menos un AINE, al menos un inhibidor de la bomba de protones y al menos un agonista de PXR por dos semanas o más.
En algunas modalidades que se describen en la presente descripción, el AINE se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día o tan a menudo como sea necesario a una dosificación que comprende de 5 a 1500 mg al día, en dependencia del AINE elegido, como se entenderá por un experto.
En algunas modalidades, al menos un agonista de PXR se puede administrar una vez al día (DO), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario en dosificaciones suficientes para activar la actividad PXR. Las dosificaciones suficientes para activar la actividad de PXR variará de acuerdo con el agonista de PXR seleccionado y se entenderá por un experto. Por ejemplo, una dosificación suficiente puede comprender de 20 mg a 5000 mg por día, o de 100 a 2500 mg por día.
En algunas modalidades, se pueden administrar uno o más inhibidores de la bomba de protones una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario en las dosificaciones que comprenden de 5 a 2000 mg al día, en dependencia del inhibidor de la bomba de protones elegido como se entenderá por un experto.
En particular, en las modalidades que se describen en la presente descripción, cada uno de los AINE, rifaximina, agonista de PXR, inhibidor de la bomba de protones y antibiótico se pueden administrar en combinación al menos OD, en cualquier momento del día. En algunas de aquellas modalidades, se pueden administrar un AINE, rifaximina, agonista de PXR, inhibidor de la bomba de protones y antibiótico en combinación OD en la noche.
En algunas modalidades, se puede administrar un AINE, rifaximina y agonista de PXR en combinación BID, por ejemplo, en una primera administración y una segunda administración que se realiza en combinación en un intervalo de aproximadamente 12 horas entre administraciones. En algunas de aquellas modalidades, la administración de AINE y rifaximina y la administración de agonista de PXR se pueden realizar Od , BID o TID en combinación con un inhibidor de la bomba de protones que se administra OD. En algunas de aquellas modalidades, se puede realizar una primera administración de al menos un AINE, rifaximina y/o al menos un agonista de PXR que se administran en combinación en la mañana y se puede realizar una segunda administración de al menos un AINE, rifaximina y/o al menos un agonista de PXR que se administran en combinación en la noche. En algunas de aquellas modalidades, también se puede administrar un inhibidor de la bomba de protones en la noche en combinación con el AINE y opcionalmente rifaximina y/o el agonista de PXR.
En algunas modalidades, el AINE se puede administrar al individuo al menos BID en donde la administración comprende administrar el AINE y una primera rifaximina en combinación con uno o más agonistas de PXR o uno o más inhibidores de la bomba de protones al menos una vez al día y administrar el AINE y una segunda rifaximina en combinación con uno o más agonistas de PXR y uno o más inhibidores de la bomba de protones al menos una vez al día.
En algunas modalidades, la rifaximina, el agonista de PXR y el AINE se pueden administrar simultáneamente, combinados en una única forma de dosificación (por ejemplo, rifaximina, agonista de PXR y AINE en una única tableta o cápsula, o rifaximina, agonista de PXR y AINE en un único vehículo tal como agonista de PXR y granulados de AINE que se disuelven en agua).
En algunas modalidades, la rifaximina, el agonista de PXR y el AINE se pueden administrar en el mismo o en diferentes momentos en formas de dosificación separadas, en donde el agonista de PXR se puede administrar antes o después del AINE.
En particular, en algunas modalidades que se describen en la presente descripción, el agonista de PXR se puede administrar una, dos, tres, cuatro, cinco, seis, siete, ocho, nueve, diez, once o doce horas o más, ya sea antes o después de la administración del AINE.
Como será fácilmente evidente para un experto en la técnica, la dosificación útil in vivo a administrar y el modo de administración particular variarán en dependencia de la edad, el peso y la especie de mamífero que se trata, los compuestos particulares que se emplean y/o el uso específico para los que se emplean estos compuestos. La determinación de los niveles de dosificación efectivos, es decir, los niveles de dosificación necesarios para alcanzar el resultado que se desea, se pueden lograr por un experto en la técnica mediante el uso de métodos farmacológicos de rutina. Por lo general, las aplicaciones clínicas humanas de los productos comienzan a niveles de dosificación inferiores, con aumento del nivel de dosificación hasta alcanzar el efecto y la durabilidad de la respuesta que se desea (por ejemplo, en la práctica clínica donde se busca un efecto terapéutico o un estudio clínico de búsqueda de intervalo de dosis donde se busca seleccionar la dosis que se asocia a un efecto conjunto).
Como se usa en la presente descripción, "durabilidad de la respuesta" incluye por ejemplo, un alivio adecuado de los síntomas después de retirar el tratamiento, un alivio adecuado continuo de los síntomas después de retirar el tratamiento, o una respuesta que es mayor que o superior a la respuesta al placebo. La respuesta se puede medir, por ejemplo, mediante el uso de uno o más de los métodos que se describen más abajo, que incluyen, por ejemplo, el análisis subjetivo de un sujeto de sus síntomas o la evaluación de un proveedor de atención médica o cuidador de los síntomas de un sujeto.
En determinadas modalidades, uno o más AINE se pueden administrar cíclicamente con una o más rifaximina y opcionalmente un antibiótico, agonista de PXR y/o inhibidores de la bomba de protones. La terapia cíclica implica la administración de una primera terapia (por ejemplo, un primer agente profiláctico o terapéutico) durante un período de tiempo, seguido de la administración de una segunda terapia (por ejemplo, un segundo agente profiláctico o terapéutico) durante un período de tiempo, opcionalmente, seguido de la administración de una tercera terapia (por ejemplo, agente profiláctico o terapéutico) durante un período de tiempo y así sucesivamente, y la repetición de esta administración secuencial, por ejemplo, el ciclo con el fin de reducir el desarrollo de resistencia a una de las terapias, para evitar o reducir los efectos secundarios de una de las terapias, y/o para mejorar la eficacia de las terapias. En particular en algunas modalidades, el primer agente profiláctico o terapéutico puede comprender uno o más AINE y el segundo agente profiláctico o terapéutico puede comprender uno o más antibióticos, y en particular rifaximina. En algunas modalidades, el primer agente profiláctico o terapéutico puede comprender rifaximina opcionalmente en combinación con uno o más antibióticos y el segundo agente profiláctico o terapéutico puede ser uno o más AINE. En algunas modalidades, el primer agente profiláctico o terapéutico puede comprender uno o más AINE y el segundo agente profiláctico o terapéutico puede comprender rifaximina opcionalmente en combinación con uno o más agonistas de PXR. En algunas modalidades, el primer agente profiláctico o terapéutico puede comprender rifaximina opcionalmente en combinación con uno o más agonistas de PXR, y el segundo agente profiláctico o terapéutico puede ser uno o más AINE. En algunas de aquellas modalidades, el tercer agente profiláctico o terapéutico puede comprender un inhibidor de la bomba de protones. En algunas de aquellas modalidades, el primer agente profiláctico o terapéutico y el segundo agente profiláctico o terapéutico se pueden administrar simultáneamente o en momentos diferentes. En
algunas modalidades, el primer y segundo agente profiláctico o terapéutico se pueden administrar en una única forma de dosificación unificada. En algunas modalidades, el primer y segundo agente profiláctico o terapéutico se pueden administrar en formas de dosificación separadas. En algunas modalidades, la administración de los mismos compuestos se puede repetir y las administraciones se pueden separar por al menos aproximadamente 1 semana, 2 semanas, 3 semanas, 4 semanas, 5 semanas, 6 semanas, 8 semanas, 10 semanas, 12 semanas, 14 semanas, 16 semanas, 18 semanas, 20 semanas, 22 semanas o al menos aproximadamente de 24 semanas.
Al igual que con otros productos farmacéuticos, se entenderá que el uso diario total de una o más composiciones farmacéuticas de la presente descripción lo decidirá el médico de cabecera de un paciente dentro del alcance del buen juicio médico. El nivel de dosis específico terapéuticamente efectivo o profilácticamente efectivo para cualquier paciente en particular dependerá de una variedad de factores que incluyen el trastorno que se trata y la gravedad del trastorno; la actividad del compuesto específico que se emplea; la composición específica que se emplea; la edad, el peso corporal, la salud general, el sexo y la dieta del paciente; el tiempo de administración, la vía de administración y la tasa de excreción del compuesto específico que se emplea; la duración del tratamiento; los fármacos que se usan en combinación o coincidentes con el compuesto específico que se emplea; y otros factores conocidos por los expertos en las técnicas médicas.
En algunas modalidades de las composiciones para el uso de la descripción, la administración de AINE se realiza en combinación con la administración de rifaximina, en asociación con AINE en una composición única o separada, opcionalmente con al menos un inhibidor de la bomba de protones y/o al menos un antibiótico y la administración combinada se realiza para tratar y/o prevenir el daño gastrointestinal en el tracto GI superior y/o inferior que se asocia con la administración repetida de AINe en pacientes ancianos.
Por consiguiente, la cantidad de fármaco que es "efectiva" variará de un sujeto a otro, en dependencia de la edad y el estado general del individuo, el fármaco o fármacos particulares y similares y una "cantidad terapéuticamente efectiva" o "cantidad profilácticamente efectiva" en cualquier caso individual se puede determinar por un experto en la técnica.
En algunas modalidades de las composiciones para el uso que se describe en la presente descripción, la administración de AINE en combinación con rifaximina y/o un antibiótico, y/o un agonista de PXR y/o un inhibidor de la bomba de protones se puede realizar preferentemente mediante administración oral y parenteral de los ingredientes activos relacionados que se incluyen opcionalmente en formulaciones y kits adecuados, como se entenderá por un experto.
En las modalidades, que se describen en la presente descripción la administración de rifaximina en combinación con un AINE y/o un inhibidor de la bomba de protones se puede realizar en particular mediante la administración oral y parenteral de los ingredientes activos relacionados que se incluyen opcionalmente en formulaciones adecuadas, como se entenderá por un experto.
En las modalidades, que se describen en la presente descripción la administración de rifaximina, inhibidor de la bomba de protones en combinación con un AINE y/o antibiótico se puede realizar en particular mediante la administración oral y parenteral de los ingredientes activos relacionados que se incluyen opcionalmente en formulaciones adecuadas como se entenderá por un experto.
En algunas modalidades, las lesiones intestinales inducidas por diferentes AINE que se exacerban por disbiosis inducida por IBP, pueden ser el objetivo efectivo de la terapia antimicrobiana para reducir y curar las lesiones gastrointestinales inferiores que se asocian con el uso de AINE.
En algunas modalidades, la rifaximina puede prevenir, reducir y curar las lesiones gastrointestinales inferiores, mientras que la administración del inhibidor de la bomba de protones protege la mucosa del tracto gastrointestinal superior del bien reconocido daño inducido por AINE.
En algunas modalidades, se espera que la administración combinada de rifaximina, al menos un AINE, al menos un antibiótico y al menos un inhibidor de la bomba de protones resulte en un tratamiento exitoso para el sujeto que padece una afección que presenta dolor e/o inflamación tal como enfermedades reumatológicas para lo que necesita una terapia a largo plazo con AINE.
En las modalidades que se describen en la presente descripción, la administración de rifaximina, en combinación con un AINE y opcionalmente un inhibidor de la bomba de protones y/o un agonista de PXR se puede realizar mediante la administración oral y parenteral de los ingredientes activos relacionados que se incluyen opcionalmente en formulaciones adecuadas como se entenderá por un experto.
En las modalidades que se describen en la presente descripción, la administración de un inhibidor de la bomba de protones en combinación con un AINE y opcionalmente el agonista de PXR se puede realizar mediante administración oral y parenteral de los ingredientes activos relacionados que se incluyen opcionalmente en formulaciones adecuadas como se entenderá por un experto.
En algunas modalidades, las lesiones intestinales inducidas por diferentes AINE que se exacerban por la disbiosis inducida por IBP, pueden ser el objetivo efectivo de la activación de PXR para reducir y curar las lesiones gastrointestinales inferiores que se asocian con el uso de AINE.
En algunas modalidades, el agonista de PXR puede prevenir, reducir y curar las lesiones gastrointestinales inferiores, mientras que la administración del inhibidor de la bomba de protones protege la mucosa del tracto gastrointestinal superior del bien reconocido daño inducido por AINE.
En algunas modalidades, la administración combinada de al menos un AINE, rifaximina, al menos un agonista de PXR y al menos un inhibidor de la bomba de protones puede resultar en un tratamiento exitoso para sujetos que padecen una afección que presenta dolor e/o inflamación como enfermedades reumatológicas o enfermedad cardiovascular para la que se necesita una terapia a largo plazo con AINE. En particular, en varias modalidades, la administración combinada se puede usar en relación con una terapia con AINE de al menos diez días y en particular de al menos un mes, de uno a seis meses, de al menos un año y/o un tratamiento más largo hasta un tratamiento de por vida.
En algunas modalidades, la administración combinada de al menos un AINE, rifaximina, al menos un agonista de PXR y al menos un inhibidor de la bomba de protones se puede realizar en un individuo que es un sujeto de edad avanzada que padece de una afección que presenta dolor e/o inflamación y en particular para el tratamiento de enfermedad cardiovascular.
Por consiguiente, en algunas modalidades, los métodos que se describen en la presente descripción para tratar y/o prevenir una enteropatía por AINE en un individuo bajo administración de AINE comprenden administrar rifaximina al individuo bajo administración de AINE, en combinación con al menos un inhibidor de la bomba de protones y/o un antibiótico y/o agente PXR, en donde la rifaximina se reviste con uno o más materiales poliméricos que se disponen preferentemente en una composición multicapa, para conferir o aumentar uno o más bioadhesividad, gastrorresistencia y/o liberación controlada de la rifaximina que se administra.
En algunas modalidades, la rifaximina puede revestir con un material polimérico bioadhesivo para conferir o aumentar la bioadhesividad a la formulación de rifaximina. En algunas de aquellas modalidades, el material polimérico bioadhesivo puede ser hidroxietilcelulosa, hidroxipropilcelulosa (KLUCEL®, Hercules Corp.), hidroxipropilmetilcelulosa (METHOCEL®, Dow Chemical Corp.), polivinilpirrolidona (AVICEL®), hidroxipropilmetilcelulosa y polímeros adicionales identificables por un experto.
En particular, en algunas modalidades las composiciones farmacéuticas pueden tener propiedades bioadhesivas o mucoadhesivas para adherirse a la mucosa intestinal.
Ejemplos de polímeros, oligómeros o sus mezclas que pueden conferir propiedades bioadhesivas se eligen en el grupo que comprende: pectinas, zeínas, caseína, gelatina, albúmina, colágeno, quitosano, oligosacáridos y polisacáridos como, por ejemplo, celulosa, dextrano, polisacáridos de tamarindo. semillas, goma xantana, goma arábiga, ácido hialurónico, ácido algínico, alginato de sodio.
En algunas modalidades, el polímero bioadhesivo es un polímero sintético, el polímero se elige entre poliamidas, policarbonatos, polialquilenos, polialquilenglicoles, óxidos de polialquileno, tereftalatos de polialquileno, alcoholes polivinílicos, éteres polivinílicos, ésteres polivinílicos, polivinilpirrolidona, polisiloxanos, poliuretanos, poliestirenos, polímeros de ácido acrílico y ésteres metacrílicos, copolímero de ácido metacrílico-acrilato de etilo, polilactidas, poliácidos barbitúricos, polianhídridos, poliortoésteres y sus mezclas.
Otros polímeros adecuados para el uso en la invención incluyen, pero no se limitan a, metilcelulosa, etilcelulosa, hidroxipropilcelulosa, hidroxibutilmetilcelulosa, acetato de celulosa, propionato de celulosa, acetato butirato de celulosa, acetato ftalato de celulosa, carboximetilcelulosa, triacetato de celulosa de sodio, celulosa sulfato sal, polimetacrilato de metilo, acrilato de poliisobutilo, acrilato de polioctadecilo, polipropileno, polietilenglicol, óxido de polietileno, tereftalato de polietileno, acetato de polivinilo, cloruro de polivinilo, poliestireno, polivinilpirrolidona, polivinilfenol y sus mezclas.
Otro grupo de polímeros útiles en la obtención de bioadhesividad son los polímeros que tienen una ramificación con al menos un grupo hidrofóbico enlazado, en donde los grupos hidrofóbicos generalmente son grupos no polares. Los ejemplos de dichos grupos hidrofóbicos comprenden alquilos, alquenilos y grupos alquilo. Preferentemente, los grupos hidrófobos se eligen para aumentar la bioadhesividad de los polímeros. Otros polímeros se caracterizan por ramificaciones hidrofóbicas con al menos un grupo hidrofílico, tales como ácidos carboxílicos, ácidos sulfónicos y ácidos fosfónicos, aminas neutras y cargadas positivamente, amidas e iminas, en donde los grupos hidrofílicos son tales que aumentan la bioadhesividad del polímero.
En algunas modalidades, la rifaximina se puede recubrir con un material polimérico entérico insoluble a valores de pH entre 1,5 y 4,0 y soluble a valores de pH entre 5,0 y 7,5 para conferir gastrorresistencia a la formulación de rifaximina. En particular, en algunas modalidades, el material polimérico entérico se selecciona de polímeros acrílicos, copolímeros de ácido metacrílico, copolímeros de ácido metacrílico con un éster acrílico o metacrílico, acetato ftalato
de celulosa, acetato ftalato de hidroxipropilcelulosa, ftalato de hidroxipropil metilcelulosa, ftalato de acetato de polivinilo, ácido metacrílico copolímero y copolímero de metilmetacrilato de ácido metacrílico, ftalato de acetato de polivinilo, copolímero de acrilato de etilo de ácido metacrílico, copolímeros de ácido acrílico, tal como el copolímero ácido metacrílico-acrilato de etilo 1:1, copolímero de ácido metacrílico con un éster metacrílico o metacrílico tal como el copolímero metacrílico ácido-acrilato de etilo 1:1 y el copolímero ácido metacrílico-metacrilato de metilo 1:2, ftalato de acetato de polivinilo, ftalato de hidroxipropilmetilcelulosa y ftalato de acetato de celulosa, productos disponibles comercialmente, por ejemplo con las marcas comerciales KOLLICOAT®, EUDRAGIT®, AQUATERIC®, AQOAT®; polímeros naturales como goma laca, disponibles comercialmente con la marca comercial AQUAGOLD® (goma laca al 25 %) y etilcelulosa.
En algunas modalidades, la rifaximina puede recubrirse con un polímero semipermeable al agua posiblemente sobre el material polimérico entérico para controlar la liberación de rifaximina en la formulación de rifaximina. En algunas de estas modalidades, el polímero semipermeable al agua se selecciona de uno o más de acetato de celulosa, acetato butirato de celulosa, acetato propionato de celulosa, etilcelulosa, ácidos grasos y sus ésteres, ceras, zeína, EUDRAGIT RS y RL 30D, EUDRAGIT® NE 30D, EUDRAGIT® 40, AQUACOAT®, SURELEASE® y látex de acetato de celulosa.
En algunas modalidades, el polímero semipermeable al agua puede estar en combinación con uno o más polímeros hidrofílicos. En algunas de aquellas modalidades, el uno o más polímeros hidrofílicos comprenden hidroxietilcelulosa, hidroxipropilcelulosa, hidroxipropilmetilcelulosa, polivinilpirrolidona. En algunas de aquellas modalidades, uno o más polímeros hidrofílicos comprenden hidroxipropilcelulosa, hidroxipropilmetilcelulosa, polivinilpirrolidona.
En algunas modalidades, el material polimérico bioadhesivo, el material polimérico entérico y el material semipermeable al agua se pueden disponer en una composición multicapa en donde la rifaximina revestida se reviste por el material polimérico entérico, el material polimérico entérico se reviste por el polímero semipermeable al agua y el material semipermeable al agua se reviste por el material polimérico bioadhesivo.
En algunas modalidades la rifaximina revestida es una mezcla en base a rifaximina que comprende uno o más de un diluyente, un plastificante, un agente antiaglomerante, un agente antiadherente, un deslizante, un agente antiespumante y una sustancia colorante. En algunas modalidades, el plastificante se puede seleccionar del grupo que consiste en monoglicéridos acetilados, butil ftalil butil glicolato, dibutil tartrato, dietil ftalato, dimetil ftalato, etil ftalil etil glicolato, glicerina, etilenglicol, propilenglicol, citrato de triacetina, triacetina, tripropinoína, diacetina ftalato, monoglicérido de acetilo, polietilenglicoles, aceite de ricino, citrato de trietilo, alcoholes polihídricos, ésteres de acetato, triacetato de gilcerol, citrato de acetiltrietilo, ftalato de dibencilo, ftalato de dihexilo, ftalato de butilo octilo, ftalato de diisononil tallado, ftalato de butilo, octilato de butilo trimelitato de triisoctilo, ftalato de dietilhexilo, ftalato de di-n-octilo, ftalato de di-1-octilo, ftalato de di-1-decilo, ftalato de di-n-undecilo, ftalato de di-n-tridecilo, trimelitato de tri-2-etilhexilo, adipato de di-2-etilhexilo, sebacato de di-2-etilhexilo, azelato de di-2-etilhexilo, sebacato de dibutilo, monocaprilato de glicerilo, monocaprato de glicerilo y mezclas de los mismos.
En algunas modalidades, la rifaximina revestida comprende una o más formas polimorfas de rifaximina, una forma cruda de rifaximina o una combinación de las mismas en combinación con al menos un excipiente.
En algunas de las modalidades, en donde la rifaximina revestida está en una composición multicapa, la pluralidad de capas comprende adicionalmente una capa de película de revestimiento sobre la capa de revestimiento de barrera que comprende uno o más de celulosa y sus sustituyentes tales como hidropropilcelulosa hidrometilcelulosa, hidropropil-etilcelulosa.
En algunas modalidades, los usos que se describen en la presente descripción para tratar y/o prevenir una enteropatía por AINE en un individuo bajo administración de AINE comprenden rifaximina y, en particular, rifaximina revestida, y al menos uno de i.) al menos un AINE y ii.) al menos un inhibidor de la bomba de protones y/o al menos un antibiótico, para el uso simultáneo, combinado o secuencial en el uso que se describe en la presente descripción. En algunas modalidades, la enteropatía es una afección del tracto intestinal. En algunas modalidades, el tratamiento con AINE tiene una duración de al menos una semana, al menos 10 días o al menos dos semanas. En algunas modalidades, la rifaximina está en forma gastrorresistente.
En algunas modalidades, la rifaximina y en particular la rifaximina revestida se pueden formular en microgránulos gastrorresistentes revestidos, en composiciones sólidas que contienen microgránulos gastrorresistentes (por ejemplo, la rifaximina de liberación intestinal prolongada (EIR) como se describe en la patente de los Estados Unidos 8,568,782) (ver también los Ejemplos 2 y 12).
En algunas modalidades los gránulos, microgránulos, tabletas o tabletas multicapa se pueden revestir con una película de revestimiento que puede comprender agentes de revestimiento, opacificante, plastificante estabilizador, colorante, edulcorante, agentes hidrofóbicos y agentes enmascaradores del sabor. En algunas modalidades, la rifaximina puede ser el producto que se comercializa marcado con el nombre comercial NORMIX®, FLONORM®, XIFAXAN® y RIFACOL®.
En una modalidad, la rifaximina gastrorresistente revestida se administra a una dosificación diaria de 20 a 3300 mg. En una modalidad, la rifaximina gastrorresistente revestida se administra a una dosificación diaria de 20 a 2400 mg.
Con mayor particularidad, en algunas modalidades, la rifaximina gastrorresistente revestida se puede administrar OD, BID, TID, QDS o más a menudo en una dosificación diaria en un intervalo que comprende 20 mg, 40 mg, 60, mg, 80 mg, 100 mg, 200 mg, 400 mg, 550 mg, 600, 800 mg, 1100 mg, 1200 mg, 1600 mg, 2400 mg, 3300 mg al día.
En algunas modalidades, la rifaximina gastrorresistente revestida se puede administrar OD, BID, TID, QDS o más a menudo en una forma de dosificación de 20 mg, 40 mg, 60 mg, 80 mg, 100 mg, 200 mg, 400 mg, 550 mg, 600 mg, 800 mg. En algunas modalidades de rifaximina gastrorresistente, la rifaximina se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 20 mg a 3300 mg al día.
En algunas modalidades, la rifaximina revestida y en particular la rifaximina gastrorresistente se pueden administrar OD, BID, TID, QDS o más a menudo en una dosificación diaria de 400 mg, 800 mg, 1200 mg, a 1600 mg o más al día.
En algunas modalidades, la rifaximina gastrorresistente revestida se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 550 mg, 1100 mg, 1650 mg, a 2200 mg o más al día dentro del intervalo de dosificación anterior.
En algunas modalidades, la rifaximina gastrorresistente revestida se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 600 mg, 1200 mg, 1800 mg, 2400 mg a 3300 mg al día.
En algunas modalidades, la rifaximina gastrorresistente revestida se puede administrar OD, BID, TID, QDS o más a menudo a una dosificación diaria de 800 mg, 1600 mg, 2400 mg, a 3300 mg al día.
En algunas modalidades, la rifaximina gastrorresistente revestida se puede administrar OD, BID, TID o más a menudo a una dosificación diaria de 1100 mg, 2200 mg, 3300 mg al día.
En algunas modalidades, la rifaximina gastrorresistente revestida se puede administrar en asociación con otros antibióticos.
Como se usa en la presente descripción, el término "inhibidor de la bomba de protones" o IBP, que se usan indistintamente en la presente descripción, se refiere a cualquier agente activo lábil en ácido que posee actividad farmacológica como inhibidor de la bomba H/K.
Un IBP puede, si se desea, estar en forma de base libre, ácido libre, sal, éster, hidrato, anhidrato, amida, enantiómero, isómero, tautómero, profármaco, polimorfo, derivado o similar, siempre que la base libre, sal, éster, hidrato, amida, enantiómero, isómero, tautómero, profármaco o cualquier otro derivado farmacológicamente adecuado sea terapéuticamente activo o se somete a conversión dentro o fuera del cuerpo a una forma terapéuticamente activa.
En algunas modalidades de la descripción, el IBP que se puede usar en la presente descripción es uno o más seleccionado del grupo que consiste en: lansoprazol, ilaprazol, omeprazol, tenatoprazol, rabeprazol, esomeprazol, pantoprazol, pariprazol, leminoprazol o nepaprazol o un base, un ácido libre, una sal, un hidrato, un éster, una amida, un enantiómero, un isómero, un tautómero, un polimorfo, un profármaco o cualquier derivado del mismo.
Las "sales farmacéuticamente aceptables" o "sales" de un inhibidor de la bomba de protones incluyen, pero no se limitan a, la sal de un inhibidor de la bomba de protones que se prepara a partir de fórmico, acético, propiónico, succínico, glicólico, glucónico, láctico, málico, tartárico, cítrico, ascórbico, glucurónico, maleico, fumárico, pirúvico, aspártico, glutámico, benzoico, antranílico, mesílico, esteárico, salicílico, p-hidroxibenzoico, fenilacético, mandélico, embónico, metanosulfónico, etanosulfónico, bencenosulfónico, pantotulfénico, toluenosulfónico, 2 toluensulfónico -hidroxietanosulfónico, sulfanílico, ciclohexil-aminosulfónico, algénico, B-hidroxibutírico, galactárico y galacturónico.
Las sales de adición de ácido de los inhibidores de la bomba de protones se pueden preparar a partir de las formas de base libre mediante el uso de una metodología convencional, por ejemplo, que implica la reacción de una base libre con un ácido adecuado. Los ácidos adecuados para preparar sales de adición de ácido incluyen ambos ácidos orgánicos, por ejemplo, ácido acético, ácido propiónico, ácido glicólico, ácido pirúvico, ácido oxálico, ácido málico, ácido malónico, ácido succínico, ácido maleico, ácido fumárico, ácido tartárico, ácido cítrico, ácido benzoico, ácido cinámico, ácido mandélico, ácido metanosulfónico, ácido etanosulfónico, ácido p-toluensulfónico, ácido salicílico y similares, así como ácidos inorgánicos, por ejemplo, ácido clorhídrico, ácido bromhídrico, ácido sulfúrico, ácido nítrico, ácido fosfórico, y similares. Una sal de adición de ácido se puede reconvertir en la base libre mediante tratamiento con una base adecuada. A continuación, también se contemplan en la presente descripción las sales de adición de ácido de los inhibidores de la bomba de protones que son sal de haluro y que se pueden preparar mediante el uso de ácidos clorhídrico o bromhídrico. Adicionalmente, las sales básicas pueden ser sales de metales alcalinos, por ejemplo, sal de sodio.
Las formas de sal de los inhibidores de la bomba de protones incluyen, pero no se limitan a, una forma de sal de sodio tal como esomeprazol de sodio, rabeprazol de sodio, pantoprazol de sodio; o una forma de sal de magnesio tal como esomeprazol magnésico u omeprazol magnésico; una forma de sal de calcio; o una forma de sal de potasio tal como la sal de potasio de esomeprazol.
La preparación de ésteres de inhibidores de la bomba de protones implica funcionalizar grupos hidroxilo y/o carboxilo que pueden estar presentes dentro de la estructura molecular del fármaco. Alternativamente, los ésteres son derivados sustituidos con acilo de grupos alcohol libres, por ejemplo, porciones que se derivan de ácidos carboxílicos de fórmula RCOOR1 donde R1 es un grupo alquilo inferior. Un grupo alquilo inferior puede tener menos de 20 carbonos, preferentemente menos de 10 o 5 carbonos. Los ésteres se pueden reconvertir en ácidos libres, si se desea, mediante el uso de procedimientos convencionales tales como hidrogenólisis o hidrólisis.
Las "amidas" o inhibidores de la bomba de protones se puede preparar mediante el uso de técnicas conocidas por los expertos en la técnica o que se describen en la literatura pertinente. Por ejemplo, las amidas se pueden preparar a partir de ésteres, mediante el uso de reactivos amínicos adecuados, o se pueden preparar a partir de un anhídrido o un cloruro de ácido por reacción con un grupo amino tal como amoniaco o una amina de alquilo inferior.
Los "tautómeros" de arilimidazoles bicíclicos sustituidos incluyen, por ejemplo, tautómeros de omeprazol tales como aquellos. Un ejemplo de un "isómero" de un arilimidazol bicíclico sustituido es el isómero de omeprazol.
Como se usa en la presente descripción, "misoprostol" es un análogo sintético de prostaglandina E1 (PGE1) que se usa para la prevención de úlceras gástricas inducidas por AINE. Actúa sobre las células parietales gástricas, que inhibe la secreción de ácido gástrico mediante de la inhibición de la adenilato ciclasa mediada por el receptor acoplado a proteína G, lo que conduce a una disminución de los niveles de AMP cíclico intracelular y una disminución de la actividad de la bomba de protones en la superficie apical de la célula parietal.
En algunas modalidades, la administración de AINE, antibióticos e inhibidores de la bomba de protones se puede realizar en individuos que padecen, son capaces de, o corren el riesgo de padecer una enfermedad intestinal u otro trastorno que se trata con un antibiótico de la clase de la rifamicina (por ejemplo, rifaximina) o que se podrían de cualquier otra manera beneficiar de la administración de un antibiótico de la clase de la rifamicina (por ejemplo, rifaximina) como se describe en la presente descripción, tales como humanos y animales no humanos. En particular los animales humanos incluyen sujetos humanos tales como "un individuo", "una persona" o "un paciente". El término "animales no humanos" de la descripción incluye todos los demás animales, que incluye vertebrados, por ejemplo, mamíferos tales como roedores (por ejemplo, ratones) primates no humanos, ovejas, perros, ganado y no mamíferos, que incluye aves (por ejemplo, gallinas) anfibios, reptiles.
La frase "en riesgo de una infección bacteriana" pretende incluir un sujeto en riesgo de desarrollar una infección o una persona que está en remisión de una infección o una persona que puede recaer, por ejemplo, un sujeto que padece inmunosupresión, un sujeto que ha estado expuesto a una infección bacteriana, médicos, enfermeras, un sujeto que viaja a áreas remotas que se sabe que albergan bacterias que causan diarrea en los viajeros, una persona de edad avanzada, un individuo con daño hepático y un individuo adicional identificable por un experto.
En algunas modalidades, el AINE y la rifaximina y opcionalmente el antibiótico y/o el inhibidor de PXR se pueden administrar por vía parenteral, enteral y preferentemente por vía oral. El-IBP se puede administrar por vía oral o parenteral, por ejemplo, por vía oral TID o por vía oral OD y por vía parenteral BID. En modalidades la rifaximina se puede administrar por vía oral o rectal, el IBP se puede administrar por vía oral y el AINE se puede administrar por vía parenteral.
La rifaximina se administra por vía oral, los IBP se pueden administrar por vía oral o parenteral y los AINE se pueden administrar por vía oral, parenteral o rectal.
En algunas modalidades, el AINE que se administra es uno o más de diclofenaco, ketoprofeno, naproxeno e ibuprofeno. En algunas modalidades, el AINE se puede formular en gránulos (Ejemplo 7) y también en gránulos de liberación rápida (Ejemplo 5-6).
En algunas modalidades, el inhibidor de la bomba de protones es omeprazol. En algunas modalidades, el inhibidor de la bomba de protones, y en particular el omeprazol, se pueden formular en gránulos gastrorresistentes (Ejemplos 3 y 4).
En algunas modalidades, la rifaximina está en la rifaximina de liberación intestinal prolongada que también se indica en la presente descripción como EIR, que puede ser cualquiera de las composiciones que se describen por ejemplo de acuerdo con la descripción de solicitud de los Estados Unidos No. 2009/011020. En algunas modalidades de las composiciones para el uso que se describe en la presente descripción, la rifaximina EIR se administra una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario en dosificaciones de 20 a 3300 mg al día y en particular de 20 a 1200 mg al día y de 20 a 2400 mg al día. Con mayor preferencia en algunas modalidades se puede administrar una dosificación de 100, 200, 400, 550, 600, 800 hasta
1100 mg, en particular de 100, 200, 400, 550, 600, 800 mg o más rifaximina EIR OD, BID, TID, QDS o se pueden administrar 1100 mg de rifaximina EIR OD, BID, TID o tan a menudo como sea necesario.
En algunas de aquellas modalidades se puede administrar un AINE una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario en dosificaciones que comprenden de 5 a 1500 mg al día, de acuerdo con el AINE elegido.
En algunas de aquellas modalidades, el inhibidor de la bomba de protones se puede administrar una vez al día (OD), dos veces al día (BID), tres veces al día (TID), cuatro veces al día (QDS) o tan a menudo como sea necesario en dosificaciones que comprenden de 5 a 2000 mg al día, en dependencia del inhibidor de la bomba de protones elegido.
En algunas de aquellas modalidades, las composiciones para el uso en tratar una afección que presenta dolor o inflamación comprenden realizar una primera administración de rifaximina gastrorresistente (rifaximina EIR) y al menos un AINE y; realizar una segunda administración de rifaximina, al menos un AINE y al menos un IBP.
En las modalidades, que se describen en la presente descripción en donde se administra rifaximina, la rifaximina gastrorresistente se puede administrar en una cantidad de 20 a 1200 mg/día y los AINE se administran en una cantidad que depende del AINE elegido. En las modalidades, cuando la rifaximina EIR y el AINE se administran una vez al día, se pueden administrar en cualquier momento y cuando la administración es dos veces al día, se puede elegir la administración en la mañana y en la noche.
En algunas modalidades los usos que se describen en la presente descripción comprenden administrar por un período de al menos una semana hasta dos meses de una cantidad efectiva de rifaximina gastrorresistente en asociación con al menos un AINE, al menos un IBP, en donde la administración se puede realizar en formas de dosificación separadas o una única forma de dosificación unificada que comprende AINe y rifaximina gastrorresistente o una forma de dosificación unificada que comprende AINE, rifaximina gastrorresistente e IBP.
En algunas modalidades, los usos que se describen en la presente descripción comprenden tratar a un sujeto que padece una afección en donde se presentan inflamación y/o dolor (por ejemplo, artritis o enfermedad cardiovascular) con la administración de rifaximina y AINE que se realiza al menos una vez al día.
En algunas modalidades, uno o más inhibidores de la bomba de protones se asocian con la administración de rifaximina y AINE y se administran una vez al día. En una modalidad, la rifaximina, el AINE y el IBP se administran en la noche.
En algunas modalidades, los ingredientes activos, rifaximina, AINE e inhibidores de la bomba de protones se pueden administrar en dosis separadas, por ejemplo, en tres tabletas o cápsulas o sobres separados, o en una forma de dosificación unificada que comprende AINE, rifaximina e IBP. En una modalidad adicional, se administran al menos dos ingredientes activos en una forma de dosificación unificada y el resto se administra en una dosis separada.
La rifaximina se puede administrar también en forma de tabletas o gránulos para suspensión. La rifaximina gastrorresistente se puede usar en modalidades en las que se desea una liberación cuantitativa de rifaximina en el intestino.
En una modalidad la descripción proporciona usos para el tratamiento de enfermedades reumáticas en un sujeto, mediante la administración de rifaximina y al menos un AINE.
En una modalidad el AINE se seleccionan en el grupo que comprende diclofenaco, naproxeno, aspirina e ibuprofeno.
En una modalidad la descripción proporciona usos para el tratamiento de una enfermedad reumática en sujetos, mediante la administración de rifaximina y al menos un AINE y al menos un IBP.
En una modalidad, el IBP se selecciona del grupo que comprende omeprazol, lansoprazol, esomeprazol y pantoprazol.
Una modalidad es un uso que comprende administrar cantidades efectivas de un AINE seleccionado en el grupo de diclofenaco, naproxeno, aspirina e ibuprofeno con una cantidad efectiva de rifaximina.
Una modalidad es un uso que comprende administrar cantidades efectivas de un AINE seleccionado en el grupo de diclofenaco, naproxeno, aspirina e ibuprofeno con una cantidad efectiva de rifaximina y una cantidad efectiva de un IBP.
El IBP se selecciona preferentemente del grupo que consiste en omeprazol, lansoprazol, esomeprazol y pantoprazol, y la administración de uno entre diclofenaco, naproxeno, aspirina e ibuprofeno y al menos uno entre rifaximina u omeprazol, lansoprazol, esomeprazol y pantoprazol.
En algunas modalidades la rifaximina puede ser una rifaximina cruda o una rifaximina polimórfica, o rifaximina amorfa o su mezcla. La rifaximina es rifaximina gastrorresistente, y en particular la rifaximina gastrorresistente (rifaximina EIR).
En algunas modalidades los usos que se describen en la presente descripción comprenden administrar diclofenaco, rifaximina y omeprazol; y administrar diclofenaco y al menos uno entre rifaximina u omeprazol.
Modalidades adicionales de la descripción son usos que comprenden la administración de diclofenaco, rifaximina y omeprazol; y administrar diclofenaco y al menos rifaximina, en donde la rifaximina es rifaximina gastrorresistente, y en particular rifaximina en granulos gastrorresistentes como se describe en el documento de los Estados Unidos 8,568,782 (ver también el Ejemplo 2) y cualquier forma adicional de rifaximina gastrorresistente (por ejemplo, rifaximina EIR).
En algunas modalidades, los usos que se describen en la presente descripción comprenden administrar AINE, al menos un antibiótico y al menos un inhibidor de la bomba de protones; y la administración de un AINE y al menos uno entre antibióticos e IBP a un sujeto que padece todos los grados de dolor e inflamación en una amplia gama de afecciones, que incluyen: (i) afecciones artríticas: artritis reumatoide, osteoartritis, espondilitis anquilosante, gota aguda, (ii) trastornos musculoesqueléticos agudos como periartritis (por ejemplo, hombro congelado), tendinitis, tenosinovitis, bursitis, (iii) otras afecciones dolorosas que resultan de un traumatismo, que incluyen fracturas, lumbalgia, esguinces, distensiones, dislocaciones, ortopedia, cirugía dental y otra cirugía menor, cualquier enfermedad cardiovascular, dolor neuropático (dolor neuropático diabético, neuralgia del trigémino, mielitis transversa, ciática) dolor miofascial crónico, dolor muscular en donde el sujeto necesita una terapia a largo plazo, por ejemplo, de al menos una semana. Las afecciones adicionales comprenden varias enfermedades cardiovasculares en donde se administra un AINE tal como el ácido acetilsalicílico para el tratamiento o la prevención de la enfermedad por una terapia a largo plazo y en particular por un período de tratamiento de al menos dos semanas (por ejemplo, agregación plaquetaria, angina de pecho inestable, sospecha de o infarto agudo de miocardio diagnosticado, profilaxis de infarto de miocardio repetido, afección posterior a cirugía vascular (por ejemplo, PTCA, CABG), profilaxis de ataques isquémicos transitorios e ictus en el período de síntomas iniciales, profilaxis de trombosis coronaria en pacientes con múltiples factores de riesgo). Los usos que se describen en la presente descripción son particularmente útiles para prevenir o tratar la enteropatía que se asocia con la administración de AINE en donde el AINE se administra por un período de tiempo para tratar la enfermedad que causa la enteropatía específica. Los usos que se describen en la presente descripción son útiles para el tratamiento o la prevención de la enteropatía que se asocia típicamente con la administración de AINE a largo plazo.
En una modalidad particular, en donde se desea el tratamiento o la prevención del daño intestinal, los usos que se describen en la presente descripción pueden comprender la administración de rifaximina EIR en combinación con AINE y el inhibidor de la bomba de protones.
En algunas modalidades, los usos que se describen en la presente descripción comprenden administrar AINE, rifaximina, al menos un agonista de PXR y al menos un inhibidor de la bomba de protones; y la administración de un AINE, rifaximina y al menos uno entre el agonista de PXR y el IBP a un sujeto que padece todos los grados de dolor e inflamación en una amplia gama de afecciones, que incluyen: (i) afecciones artríticas: artritis reumatoide, osteoartritis, espondilitis anquilosante, gota aguda, (ii) trastornos musculoesqueléticos agudos como periartritis (por ejemplo, hombro congelado), tendinitis, tenosinovitis, bursitis, (iii) otras afecciones dolorosas que resultan de un traumatismo, como fracturas, lumbalgia, esguinces, distensiones, dislocaciones, ortopedia, cirugía dental y otras cirugías menores, dolor neuropático (dolor neuropático diabético, neuralgia del trigémino, mielitis transversa, ciática) dolor miofascial crónico, dolor muscular en donde el sujeto necesita una terapia a largo plazo, por ejemplo, de al menos una semana. Las afecciones adicionales comprenden varias enfermedades cardiovasculares en donde se administra un AINE tal como el ácido acetilsalicílico para el tratamiento o la prevención de la enfermedad por una terapia a largo plazo y en particular por un período de tratamiento de al menos dos semanas (por ejemplo, agregación plaquetaria, angina de pecho inestable, sospecha de o infarto agudo de miocardio diagnosticado, profilaxis de infarto de miocardio repetido, afección posterior a cirugía vascular (por ejemplo, PTCA, CABG), profilaxis de ataques isquémicos transitorios e ictus en el período de síntomas iniciales, profilaxis de trombosis coronaria en pacientes con múltiples factores de riesgo).
En particular, en algunas modalidades de los usos para tratar la artritis u otra afección que presenta dolor e/o inflamación comprenden administrar diclofenaco en dosificaciones diarias de 5 a 300 mg; o naproxeno en dosificaciones diarias de 100 mg a 1000 mg, o ibuprofeno en dosificaciones diarias de 200 a 2400 mg, o aspirina en dosificaciones diarias de 25 a 3000 mg, con rifaximina en dosificaciones diarias de 20 a 3300 mg o de 20 a 2400 mg; y omeprazol en una dosificación diaria de 5 a 100 mg, lansoprazol en dosificaciones diarias de 5 a 100 mg o esomeprazol en dosificaciones diarias de 5 a 100 mg, o pantoprazol en dosificaciones diarias de 5 a 100 mg por un período de tiempo de al menos de una semana a un mes, dos meses o por todo el período en donde se requiera tratamiento con AINE. La dosificación por día puede ser la misma o diferente entre dos días cualquiera que se administra el tratamiento.
En particular, en algunas de estas modalidades los usos para tratar enfermedades reumáticas u otra afección que presenta dolor e/o inflamación comprenden la administración de: diclofenaco en una dosis diaria de 5 a 200 mg;
rifaximina en una dosis diaria de 20 a 3300 mg, opcionalmente de 20 a 2000; y omeprazol en una dosificación diaria de 5 a 100 mg por un período de tiempo de al menos una semana a un mes, dos meses o por todo el período en donde se requiere tratamiento con AINE. En particular, en algunas de estas modalidades los usos para tratar enfermedades reumáticas u otra afección que presente dolor e/o inflamación pueden comprender administrar en una cantidad seleccionada entre 100, 200, 400, 550, 600, 800 y 1100 mg de rifaximina, y con mayor particularidad, 200, 400, 550, 600, 800 mg, una vez al día, dos veces al día, tres veces al día o cuatro veces al día y 1100 mg de rifaximina una vez al día, dos veces al día, tres veces al día o tan a menudo como sea necesario. En algunas de aquellas modalidades, la rifaximina y el diclofenaco u otro AINE se pueden administrar simultáneamente combinados en una única forma de dosificación o en el mismo o en diferentes momentos en formas de dosificación separadas. La dosificación por día puede ser la misma o diferente entre dos días cualquiera que se administra el tratamiento.
En una modalidad particular, se administran cíclicamente rifaximina, y en particular rifaximina EIR, diclofenaco y omeprazol. La terapia cíclica implica la administración de una primera terapia (por ejemplo, un primer agente profiláctico o terapéutico) durante un período de tiempo, seguido de la administración de una segunda terapia (por ejemplo, un segundo agente profiláctico o terapéutico) durante un período de tiempo, opcionalmente, seguido de la administración de una tercera terapia (por ejemplo, agente profiláctico o terapéutico) durante un período de tiempo y así sucesivamente, y la repetición de esta administración secuencial, por ejemplo, el ciclo con el fin de reducir el desarrollo de resistencia a una de las terapias, para evitar o reducir los efectos secundarios de una de las terapias, y/o para mejorar la eficacia de las terapias.
En determinadas modalidades, la administración de los mismos compuestos se puede repetir y las administraciones se pueden separar por al menos aproximadamente 1 semana, 2 semanas, 3 semanas, 4 semanas, 5 semanas, 6 semanas, 8 semanas, 10 semanas, 12 semanas, 14 semanas, 16 semanas, 18 semanas, 20 semanas, 22 semanas o al menos 24 semanas. En particular, en algunas de estas modalidades, los métodos para tratar la artritis u otra afección que presenta dolor e/o inflamación y/o enfermedad cardiovascular comprenden la administración de diclofenaco dos veces al día, omeprazol una vez al día y rifaximina dos veces al día por un período de tiempo de una semana a dos meses.
En particular, en algunas de estas modalidades de usos para tratar de enfermedades reumáticas u otra afección que presenta dolor e/o inflamación, y en particular enfermedad cardiovascular, comprenden rifaximina en una dosificación diaria de 20 a 3300 mg simultáneamente o antes de administrar: AINE e inhibidor de la bomba de protones, en donde la rifaximina se administra por un período que corresponde al período de tiempo del tratamiento con AINE y también por un tiempo de 1 a 10 días después del final del tratamiento con AINE. En una modalidad, la composición comprende rifaximina en una composición gastrorresistente (por ejemplo, rifaximina EIR), el AINE es diclofenaco y el inhibidor de la bomba de protones es omeprazol. En una modalidad particular, el diclofenaco se puede administrar en una dosificación diaria de 5 a 200 mg; omeprazol en una dosis diaria de 5 a 100 mg; y rifaximina en una dosis diaria de 20 a 2000 mg por un período de tiempo de una semana a dos meses.
En una modalidad se usa una composición que comprende rifaximina gastrorresistente en una composición sólida que comprende una cantidad de rifaximina de 20 a 1200 mg y diclofenaco en una cantidad de 5 a 75 mg en forma de tabletas, cápsulas o microgránulos en sobres.
En otra modalidad está el uso de una composición que comprende rifaximina gastrorresistente en una composición sólida que comprende una cantidad de rifaximina de 20 a 1200 mg, diclofenaco en una cantidad de 5 a 75 mg y omeprazol en una cantidad de 5 a 25 mg en forma de tabletas, cápsulas o microgránulos en sobres. Otra modalidad es un uso para tratar la artritis reumatoide, espondiloartritis, osteoartritis, gota u otras afecciones que presentan dolor e/o inflamación, como enfermedad cardiovascular, que puede comprender en algunas modalidades administrar 1 dosificación de AINE de diclofenaco 75 mg dos veces al día (cada 12 horas); 1 dosificación de omeprazol 20 mg una vez al día (es decir, 24 horas); y 2 dosificaciones de rifaximina 400 mg dos veces al día (cada 12 horas) por un período de tiempo de una semana hasta dos meses.
Alternativamente, las dosificaciones de las combinaciones de fármacos que se indican administrar en la mañana y en la noche se pueden administrar dos veces diarias, aproximadamente con 12 horas de diferencia entre sí.
En otra modalidad está el uso de una composición que comprende rifaximina y AINE en una composición única para tratar la artritis reumatoide, espondiloartritis, osteoartritis, gota u otras afecciones que presentan dolor e/o inflamación y/o enfermedad cardiovascular. En algunas de aquellas modalidades, la rifaximina gastrorresistente se encuentra en una composición gastrorresistente como rifaximina EIR.
En otra modalidad la rifaximina gastrorresistente se administra en una dosificación de 20 a 400 mg dos veces al día (cada 12 horas), o tres veces al día (cada 8 horas) con una dosificación de AINE de diclofenaco 75 mg dos veces al día (cada 12 horas) o tres veces al día (cada 8 horas), en donde la rifaximina y el diclofenaco se pueden administrar en una forma sólida única o en formas separadas junto con una cantidad de omeprazol de 20 mg una vez al día (es decir, 24 horas). Otra modalidad es la composición para el uso que se reivindica que comprende rifaximina o rifaximina gastrorresistente en asociación con una dosificación de aspirinas y un inhibidor de la bomba de protones, en donde la rifaximina se administra por todo el tiempo de la administración de aspirinas.
Otra modalidad es un uso que comprende administrar 1 dosificación de diclofenaco de 5 a 75 mg, 1 dosificación de omeprazol de 5 a 20 mg y 2 dosificaciones de rifaximina gastrorresistente de 20 a 600 mg (por ejemplo, 400 mg) en la mañana en donde la rifaximina y el diclofenaco se pueden administrar juntos en un único sobre, tableta o cápsula o en formas separadas; y 1 dosificación de diclofenaco de 5 a 75 mg y 2 dosificaciones de rifaximina gastrorresistente de 20 a 600 mg (por ejemplo, 400 mg) en donde la rifaximina y el diclofenaco se pueden administrar juntos en un único sobre, tableta o cápsula o en formas separadas en la noche por un período de tiempo de una semana a dos meses.
Una modalidad particular que comprende administrar 1 dosis de diclofenaco 75 mg, 1 dosis de omeprazol 20 mg y 2 dosis de rifaximina 400 mg en la mañana, en la que rifaximina omeprazol y diclofenaco se administran en una única bolsita, tableta o cápsula; 1 dosis de diclofenaco 75 mg y 2 dosis de rifaximina 400 mg en la que la rifaximina y el diclofenaco se pueden administrar juntos en un solo sobre, tableta, cápsula o en formas separadas en la noche, por un período de tiempo de una semana a dos meses.
En una modalidad particular la composición comprende rifaximina en gránulos gastrorresistentes, omeprazol en gránulos gastrorresistentes y diclofenaco en gránulos, en donde el diclofenaco puede ser de liberación controlada, como liberación rápida.
La administración de AINE de rifaximina e IBP se puede administrar en asociación con otras terapias concomitantes.
En otra modalidad, la composición farmacéutica que comprende rifaximina gastrorresistente en dosificaciones de 20 a 600 mg, diclofenaco de 5 a 75 mg y omeprazol se puede usar en relación con el tratamiento de patologías en donde se requiere la administración prolongada de AINE.
En una modalidad la rifaximina gastrorresistente se puede usar en el tratamiento de enteropatías causadas por la administración de AINE. La rifaximina y la rifaximina gastrorresistente previenen lesiones, ulceraciones y reducen el sangrado que causa disminución de hemoglobina y anemia.
La eficacia de la administración de rifaximina (referencial) o rifaximina gastrorresistente (invención) en individuos que se someten a la administración de AINE y en particular en donde la terapia con AINE es concomitante con la terapia con IBP se ha demostrado en un estudio preclínico en animales (Ejemplos 16 y 17) y en un estudio clínico en humanos (ver Ejemplos 18 y 19).
En particular, los resultados del estudio preclínico en animales mostrados en los Ejemplos 16 y 17 demuestran la eficacia de la rifaximina (referencial) y la rifaximina gastrorresistente (invención) en la enteropatía inducida por la administración de AINE.
Los resultados se expresan como nanogramos de MPO por miligramo de tejido intestinal y los niveles de MPO en animales que recibieron el polimorfo alfa de rifaximina se redujeron en un porcentaje de aproximadamente 22 % con respecto a los animales que no recibieron administración de rifaximina (referencial) y en animales que recibieron administración de rifaximina gastrorresistente (invención) redujo la MPO en un porcentaje de aproximadamente 50 %.
Las ratas que se trataron solo con indometacina mostraron un porcentaje de tasa de mortalidad del 40 %, mientras que las ratas que recibieron rifaximina (referencial) o rifaximina gastrorresistente (invención) no mostraron muerte.
El análisis de hemoglobina se realizó en muestras de sangre de rata que se recogieron al final del período de tratamiento (14 días), y los datos que resultan muestran que las ratas que recibieron solo indometacina mostraron una reducción en los valores de hemoglobina de aproximadamente un 20 %; las ratas que recibieron rifaximina (referencial) mostraron una reducción de hemoglobina del 12 %, mientras que las ratas que recibieron rifaximina gastrorresistente (invención) no cambian los valores de hemoglobina con respecto al control.
También las Figuras 2 y 3 demuestran que el análisis microscópico del daño intestinal se reporta cuando se administra rifaximina (referencial) y rifaximina gastrorresistente (invención) con AINE. En particular, la rifaximina gastrorresistente redujo significativamente las lesiones de tipo 2, en comparación con la indometacina sola.
La descripción demuestra que el tratamiento con rifaximina gastrorresistente 25 mg/kg, rifaximina gastrorresistente 50 mg/kg o polimorfo alfa de rifaximina 50 mg/kg BID son efectivos en la reducción de lesiones en el íleon y el yeyuno, en particular en lesiones de tipo 1 y 2.
Los datos anteriores indican que la rifaximina es más efectiva en la enteropatía causada por la administración de AINE, en una modalidad particular de la rifaximina gastrorresistente (rifaximina EIR) es más eficaz que la rifaximina no gastrorresistente en el tratamiento o prevención del daño intestinal por AINE.
Las dosis efectivas de rifaximina que se usaron en el modelo animal (16 mg/kg) en términos de dosis equivalentes en humanos son menores que la dosis que se usan en el ensayo clínico (27 mg/kg), lo que demuestra que se pueden
obtener resultados similares en humanos en términos de resultados histológicos en íleon y yeyuno y niveles de hemoglobina y resultados de MPO, como medida de daño e inflamación y/o enfermedad cardiovascular.
Por consiguiente, los datos anteriores en ratas muestran la eficacia de la rifaximina en particular en relación con enteropatías graves que en el estudio que se describe en los Ejemplos 16 y 17 se asocian con la detección de lesiones de tipo 3 en ratas, con una detección de MPO en una cantidad igual superior a 20 ng por mg de tejido en ratas, y/o detección de HBO en una cantidad igual o inferior a 13,5 g/dl.
La eficacia de la rifaximina y en particular de la rifaximina gastrorresistente (invención) se ha mostrado en el ensayo clínico de los Ejemplos 19 y 20. De acuerdo con el procedimiento que se reporta en la descripción, en un estudio de fase 2b, doble ciego, voluntarios sanos aleatorizados recibieron diclofenaco SR 75 mg BID más omeprazol 20 mg una vez al día con o sin rifaximina 800 mg BID por 14 días y se analizó el intestino mediante el uso de endoscopia con cápsula de video (VCE) multicéntrico.
Este estudio tuvo una duración de aproximadamente 5 semanas y consistió en un período de cribado que incluyó una visita de cribado para sujetos potenciales, para realizar investigaciones clínicas y pruebas de laboratorio, seguida de un VCE de referencia en la visita 2.
La visita final se realizó dentro de las 36 horas después de la última administración del fármaco e incluyó VCE, análisis clínico y pruebas de laboratorio. El criterio primario de valoración de la eficacia es el porcentaje de sujetos que desarrollan al menos una ruptura de la mucosa en la visita final que se evalúan por VCE y se analizan de acuerdo con un sistema de puntuación validado que se reporta de 0 a 4.
Los criterios secundarios de valoración de la eficacia fueron los cambios de la referencia a la visita final en el número de lesiones de la mucosa en el intestino delgado y el cambio de la referencia a la visita final en el número de lesiones de la mucosa en el intestino delgado con/sin hemorragia (sangre visible).
Los parámetros de seguridad que se consideran son: eventos adversos (EA), parámetros de laboratorio clínico tales como hematología, química clínica y análisis de orina, y signos vitales. Al final de 2 semanas de tratamiento con diclofenaco más omeprazol, la tasa de sujetos que desarrollaron al menos una lesión de la mucosa en el intestino delgado fue el doble en el grupo placebo, 13 sujetos que corresponden al 43,3 % en comparación con 6 sujetos del grupo de rifaximina que corresponden a un 20 %. En particular, la proporción de sujetos que desarrollaron las lesiones en comparación con la proporción de sujetos que no desarrollaron las lesiones fue muy inferior en el grupo de rifaximina 20 % frente a 80 % que en el grupo placebo 43,3 % frente a 56,7 %, lo que sugiere fuertemente una acción protectora de la rifaximina sobre el daño de las mucosas causado por diclofenaco durante el tratamiento de 14 días.
El cambio de la referencia en el número total de lesiones fue superior en el grupo placebo que en el grupo de rifaximina. Todas las lesiones de la mucosa que se detectaron en el análisis final fueron lesiones sin hemorragia. No se observaron lesiones con hemorragia (Tabla 30). Los resultados del análisis estadístico mediante regresión binomial negativa indicaron claramente un efecto protector de la rifaximina sobre los cambios medios de la referencia en el número total de lesiones y lesiones sin hemorragia. El efecto fue estadísticamente significativo para el total de lesiones y las lesiones sin hemorragia, respectivamente).
Al final del tratamiento de 2 semanas en la visita final, solo se detectaron grandes erosiones/úlceras (categoría 4) en el grupo placebo en los sujetos que corresponden a un valor superior al 20 %. No se observaron grandes erosiones/lesiones en el grupo de rifaximina gastrorresistente.
En el grupo placebo las erosiones se pueden categorizar como úlceras.
Mediante el estudio clínico, se observa claramente un efecto protector de la rifaximina sobre las lesiones de la mucosa inducidas por diclofenaco. Los resultados primarios de eficacia mostraron que menos sujetos en el grupo de rifaximina que en el grupo placebo desarrollaron al menos una lesión de la mucosa en el intestino delgado durante el estudio. Los resultados del análisis secundario sobre los cambios de la referencia, por otra parte, mostraron claramente una diferencia estadísticamente significativa en el número total de lesiones y lesiones sin hemorragia, lo que confirma por tanto una acción protectora de la rifaximina sobre el daño gastrointestinal inducido por diclofenaco.
En particular, en algunas modalidades, el uso de rifaximina o rifaximina gastrorresistente (invención) es útil para tratar enteropatías que se exacerban por la terapia concomitante del IBP con AINE.
Cuando se administra rifaximina o rifaximina gastrorresistente (invención) en terapia concomitante con AINE y/o AINE más IBP, con respecto al placebo sin rifaximina se redujeron las lesiones intestinales tales como hemorragia, anemia. La administración de rifaximina en una terapia concomitante con AINE reduce el estado de inflamación. La inflamación también se reduce cuando los IBP se administran concomitante con AINE. (ver, por ejemplo, los Ejemplos 16 a 19).
En una modalidad las composiciones para el uso de la presente descripción son útiles para la prevención de roturas de la mucosa en individuos bajo administración crónica de AINE. Las composiciones de la presente descripción son
útiles para el tratamiento de roturas de la mucosa en sujetos bajo administración crónica de AINE. En una modalidad las roturas de la mucosa son petequias. En otra modalidad las erosiones comprenden entre 1 y 4. En otra modalidad las erosiones son superiores a 4.
Una modalidad adicional es un uso que comprende administrar 1 tableta de diclofenaco 75 mg, 1 cápsula de omeprazol 20 mg y 2 tabletas de rifaximina gastrorresistente 400 mg en la mañana y 1 tableta de diclofenaco 75 mg y 2 tabletas de rifaximina gastrorresistente 400 mg en la noche.
Otra modalidad es un uso para tratar enfermedades cardiovasculares que comprende administrar 1 dosificación de aspirinas; 1 dosificación de inhibidor de la bomba de protones y rifaximina que en algunas modalidades puede comprender rifaximina EIR, por toda la vida del individuo. En algunas modalidades la dosificación de aspirina puede estar dentro del intervalo de 30-325 mg/día.
En determinadas modalidades, se administran cíclicamente una o más rifaximina (que puede ser en algunas modalidades rifaximina EIR), AINE e IBP. La terapia cíclica implica la administración de una primera terapia por un período de tiempo, seguida de la administración de una segunda terapia por un período de tiempo, opcionalmente, seguida de la administración de una tercera terapia por un período de tiempo y se repite esta administración secuencial, es decir, el ciclo con el fin de reducir la artritis.
La descripción se refiere también a composiciones farmacéuticas para el uso que se reivindica que comprende antibiótico, AINE e IBP con un vehículo farmacéuticamente aceptable. En particular, se puede preparar una composición que incluye el antibiótico, AINE e IBP en bolsas termosoldadas (Ejemplos 8 y 11), tabletas (Ejemplos 9, 13 y 14), y cápsulas (Ejemplos 10 y 15).
La descripción se refiere también a composiciones farmacéuticas para el uso que se reivindica que comprende antibiótico y AINE con un vehículo farmacéuticamente aceptable, por ejemplo, las tabletas gastrorresistentes se pueden hacer de una composición que comprende el AINE y el antibiótico (ver el Ejemplo 14, en donde la rifaximina y la sal de sodio de diclofenaco se describen). La descripción se refiere también a composiciones farmacéuticas que comprenden un agonista de PXR, AINE e IBP con un vehículo farmacéuticamente aceptable.
En algunas modalidades, la composición farmacéutica puede comprender al menos un antibiótico y/o agonista de PXR y al menos un inhibidor de la bomba de protones en una cantidad farmacéuticamente efectiva para tratar y/o prevenir una enteropatía por AINE de acuerdo con los usos que se describen en la presente descripción. En algunas modalidades, la enteropatía es una afección del tracto intestinal. En algunas modalidades, la composición farmacéutica se formula para la administración oral.
En algunas variantes, la composición farmacéutica puede comprender una cantidad farmacéuticamente efectiva de i) al menos un AINE y de ii) al menos un antibiótico y/o agonista de PXR para tratar y/o prevenir una afección en donde se presenta dolor e/o inflamación en un individuo mientras se trata y/o se previene la enteropatía en el individuo. En algunas modalidades, la composición farmacéutica se formula para la administración oral.
En algunas modalidades, la composición farmacéutica puede comprender una cantidad farmacéuticamente efectiva de al menos un AINE, al menos un antibiótico y/o agonista de PXR y al menos un inhibidor de la bomba de protones en una cantidad efectiva para tratar y/o prevenir una afección en donde el dolor e/o inflamación mientras se trata y/o se previene una enteropatía y en particular una enteropatía grave en el individuo. En algunas modalidades, la composición farmacéutica se formula para la administración oral.
En algunas modalidades, la composición farmacéutica para el uso que se reivindica puede comprender una cantidad farmacéuticamente efectiva de al menos uno de i) al menos un AINE y ii) al menos un inhibidor de la bomba de protones en una cantidad efectiva para tratar y/o prevenir una afección en donde se presenta dolor e/o la inflamación mientras se trata y/o se previene una enteropatía y en particular una enteropatía grave en el individuo. La rifaximina está en forma gastrorresistente
En algunas modalidades, la composición farmacéutica para el uso que se reivindica puede comprender una cantidad farmacéuticamente efectiva de rifaximina EIR y una cantidad farmacéuticamente efectiva de al menos uno de i) al menos un AINE y ii) al menos un inhibidor de la bomba de protones en forma de gránulos o microgránulos para suspensiones acuosas o composiciones sólidas multicapa en una cantidad efectiva para tratar y/o prevenir una afección en donde se produce dolor e/o inflamación. Como se usa en la presente descripción, el término "farmacéuticamente aceptable" incluye porciones o compuestos que, dentro del alcance del buen juicio médico, son adecuados para el uso en contacto con los tejidos humanos y de animales inferiores sin toxicidad, irritación, respuesta alérgica y similares indebidos, y son proporcionales a una relación beneficio/riesgo razonable.
Las preparaciones farmacéuticas se pueden administrar mediante formas adecuadas para cada vía de administración. Por ejemplo, estas preparaciones se administran en forma de tabletas o cápsulas, mediante inyección, inhalación, loción ocular, gotas oculares, ungüento, supositorio y formas adicionales identificables por un experto, administración mediante inyección, infusión o inhalación; tópico mediante loción o ungüento; y rectal mediante supositorios. La
inyección puede ser en bolo o puede ser en infusión continua. En dependencia de la vía de administración, un antibiótico específico GI se puede revestir o colocar en un material seleccionado para protegerlo de las condiciones naturales que pueden afectar negativamente su capacidad para realizar la función que se pretende. Un antibiótico específico GI se puede administrar solo, o junto con ya sea otro agente o agentes como se describe anteriormente o con un portador farmacéuticamente aceptable, o ambos. Se puede administrar un antibiótico específico GI antes de la administración del otro agente, simultáneamente con el agente, o después de la administración del agente. Además, también se puede administrar un antibiótico específico GI en un profármaco que se convierte en su metabolito activo, o metabolito más activo in vivo.
En algunas modalidades, se describen composiciones farmacéuticas que comprenden uno o más antibióticos, y uno o más AINE. Las composiciones pueden comprender adicionalmente uno o más inhibidores de la bomba de protones.
En algunas modalidades, se describen composiciones farmacéuticas que comprenden uno o más agonistas de PXR y uno o más AINE. Las composiciones pueden comprender adicionalmente uno o más inhibidores de la bomba de protones.
Las composiciones pueden ser como una única formulación farmacéutica o forma de dosificación, que también se denominan en la presente descripción composiciones multidosis. Estas composiciones se preparan para evitar la circunstancia en la que los ingredientes activos interactúen entre sí, evitando de esta manera la degradación.
Las composiciones de acuerdo con la descripción pueden ser una composición oral y, en particular, composiciones orales que liberan el ingrediente activo en el intestino también se incluyen en el alcance de la presente descripción. En una modalidad el ingrediente activo de la descripción se formula como tabletas multicapa, tabletas efervescentes, polvo, agregados, gránulos, cápsulas de gelatina dura y blanda que comprenden múltiples microesferas, cápsulas dentro de una cápsula (en las que la rifaximina, los AINE y los IBP se separan físicamente). Las formas de dosificación líquidas tales como soluciones, emulsiones, espumas y suspensiones también son adecuadas para el uso con las composiciones, métodos y sistemas que se describen actualmente.
De acuerdo con una modalidad de la presente descripción, la forma de dosificación sólida comprende rifaximina en una dosificación de 20 a 1200 mg, y uno o más AINE.
En una modalidad de la presente descripción, la forma de dosificación sólida comprende rifaximina en una dosificación de 20 a 1200 mg, uno o más AINE y un IBP. La rifaximina es rifaximina gastrorresistente. En una modalidad de la presente descripción, la forma de dosificación sólida comprende rifaximina en una dosificación de 20 a 1200 mg, y el AINE se selecciona del grupo que consiste en diclofenaco, naproxeno, ibuprofeno y aspirina. En algunas modalidades, el AINE es diclofenaco.
En algunas modalidades, la forma de dosificación sólida comprende rifaximina en una dosificación de 20 a 1200 mg, un AINE y un IBP seleccionado del grupo que consiste en omeprazol, pantoprazol, lansoprazol y esomeprazol. En algunas modalidades e IBP es omeprazol.
En algunas modalidades, la composición sólida comprende 400 mg de rifaximina, 75 mg de diclofenaco. En algunas modalidades, la composición sólida comprende 400 mg de rifaximina, 75 mg de diclofenaco y 20 mg de omeprazol.
En algunas modalidades, la composición sólida está en bolsas termosoldadas.
En varias modalidades la composición sólida puede comprender excipientes farmacéuticamente aceptables como desintegrantes, por ejemplo, tales como carboximetilcelulosa de sodio (carmelosa de sodio), carboximetilcelulosa de sodio reticulada (o croscarmelosa de sodio), polivinilpirrolidona (povidona), polivinilpolipirrolidona reticulada, (crosvidona), almidón, almidón pregelatinizado y sílice; lubricantes, por ejemplo, tales como estearato de magnesio o calcio, estearilfumarato de sodio, aceites hidrogenados vegetales, aceites minerales, polietilenglicoles, lauril sulfato de sodio, glicéridos, benzoato de sodio, talco, estearato de calcio, estearato de magnesio, polietilenglicoles sólidos, lauril sulfato de sodio y mezclas de los mismos; diluyentes, por ejemplo, tal como celulosa, celulosa microcristalina, fosfato cálcico, almidón, caolín, sulfato cálcico dihidratado, carbonato cálcico, lactosa, sacarosa, glucosa, sorbitol y manitol; aglutinantes tales como celulosa, derivados de celulosa, almidones, almidón de patata, almidón de maíz, gomas, goma sintética, carboximetilcelulosa, polivinilpirrolidona, carboximetilcelulosa de sodio, celulosa microcristalina, hidroxipropilcelulosa, hidroxietilcelulosa, hidroxipropilmetilcelulosa, etilcelulosa, polietilenglicol, gelatina, polipropilenglicol, ácido algínico, sales de alginato, azúcares; deslizantes tales como dióxido de silicio coloidal, tal; fluidificante, por ejemplo, tal como sílice o sílice pirógena. También se pueden añadir opcionalmente a las formulaciones colorantes, agentes opacificantes, aromatizantes, antioxidantes y edulcorantes.
Las suspensiones, además de los compuestos activos (por ejemplo, al menos un antibiótico, al menos un agonista de PXR, al menos un AINE, al menos un IBP o cualquier combinación de los mismos), pueden contener agentes suspensores, por ejemplo, alcoholes isoestearílicos etoxilados, polioxietileno de sorbitol y ésteres de sorbitán, celulosa microcristalina, hidróxidos de aluminio metálico, bentonita, agar-agar y tragacanto, o mezclas de estas sustancias, y similares.
Se describen los procesos para obtener la composición que comprende rifaximina o rifaximina gastrorresistente, AINE y opcionalmente un agente inhibidor gástrico.
Otra variante es el proceso para obtener la composición que comprende la dosificación efectiva de rifaximina o rifaximina gastrorresistente, dosificación efectiva de AINE, en particular diclofenaco en forma de tabletas o bolsas termosoldadas.
Otra variante es el proceso para obtener la composición que comprende la dosificación efectiva de rifaximina o rifaximina gastrorresistente, dosificación efectiva de AINE, en particular diclofenaco y un agente inhibidor gástrico, en particular omeprazol en forma tabletas o en bolsas termosoldadas, en donde el agente está en gránulo o microgránulo o gránulo o microgránulo gastrorresistente.
La rifaximina, el diclofenaco y el omeprazol se pueden formular en microgránulos, gránulos y/o gránulos o microgránulos gastrorresistentes en donde el ingrediente activo está junto con los excipientes farmacéuticamente aceptables. Los microgránulos gastrorresistentes de rifaximina se pueden preparar de acuerdo con la patente de los Estados Unidos 8,568,782.
El omeprazol se puede formular en gránulos gastrorresistentes en donde el ingrediente activo se carga en un núcleo de excipiente inerte y luego se reviste con un material gastrorresistente. Los gránulos gastrorresistentes de omeprazol pueden comprender una cantidad de omeprazol entre 1 % y 20 % (p/p) junto pero que no se limita con un diluyente, un aglutinante, un deslizante y un fluidificante.
El diclofenaco se puede formular en gránulos de liberación rápida que comprenden el diclofenaco junto con excipientes en donde la cantidad de gránulos de diclofenaco comprenden entre el 50 % y el 90 % (p/p).
En una modalidad la composición para el uso que se reivindica está en forma de bolsas termosoldadas en donde los microgránulos gastrorresistentes de rifaximina, en donde la rifaximina está en una cantidad de 20 mg a 800 mg en asociación con los gránulos de diclofenaco de liberación rápida, en donde el diclofenaco está en un cantidad de 5 a 75 mg y opcionalmente los gránulos gastrorresistentes de omeprazol, en donde el omeprazol está en una cantidad de 5 a 20 mg junto con excipientes farmacéuticamente aceptables.
En una modalidad la composición para el uso que se reivindica está en forma de bolsas termosoldadas en donde los microgránulos gastrorresistentes de rifaximina, en donde la rifaximina está en una cantidad del 10 % al 30 % en asociación con los gránulos de diclofenaco de liberación rápida en una cantidad del 54 % al 60 % (p/p), en donde y opcionalmente los gránulos gastrorresistentes de omeprazol están en una cantidad del 5 % al 12 % (p/p) mg junto con excipientes farmacéuticamente aceptables.
En otra modalidad la composición para el uso que se reivindica está en forma de bolsas termosoldadas en donde la rifaximina en una cantidad de 20 a 1200 mg está en forma de microgránulos gastrorresistentes en asociación con el diclofenaco en una cantidad de 5 a 75 mg y opcionalmente los gránulos gastrorresistentes de omeprazol en donde el omeprazol está en una cantidad de 5 a 20 mg junto con excipientes farmacéuticamente aceptables.
En otra modalidad la composición para el uso que se reivindica está en forma de bolsas termosoldadas en donde la rifaximina está en gránulos gastrorresistentes en una cantidad de 20 a 800 mg en asociación con el polvo de diclofenaco en una cantidad de 5 a 75 mg y opcionalmente los gránulos gastrorresistentes de omeprazol de 5 a 20 mg junto con excipientes farmacéuticamente aceptables.
En una modalidad la composición para el uso que se reivindica está en forma de tabletas en donde los gránulos de rifaximina en una cantidad del 50 % al 60 % (p/p) se asocian al polvo de diclofenaco en una cantidad del 2,5 % al 5 % (p/p) y opcionalmente el polvo de omeprazol en una cantidad del 0,1 % al 2 % (p/p) junto con excipientes farmacéuticamente aceptables en donde las tabletas que resultan se revisten con material gastrorresistente.
En una modalidad la composición para el uso que se reivindica está en forma de tabletas en donde los gránulos de rifaximina en una cantidad del 50 % al 60 % (p/p) se asocian al polvo de diclofenaco en una cantidad del 2,5 al 5 % (p/p) y opcionalmente el polvo de omeprazol en una cantidad del 0,1 % al 2 % (p/p) junto con excipientes farmacéuticamente aceptables que comprenden un desintegrante en una cantidad de 3 a 6 %, un lubricante en una cantidad de 0,5 % a 1,5 % (p/p) un aglutinante en una cantidad de 1,5 % a 3 % (p/p) y un diluyente en una cantidad del 45 % al 60 % (p/p), en donde las tabletas que resultan se revisten con material gastrorresistente en una cantidad del 5 % al 7 % (p/p).
En algunas modalidades, las tabletas se pueden formar mediante un núcleo de diclofenaco con una capa de rifaximina y las tabletas que resultan se pueden revestir con una capa gastrorresistente.
En algunas modalidades, la tableta se puede formar por una capa de diclofenaco y una capa de rifaximina. En una modalidad la composición está en forma de cápsulas en donde el polvo de rifaximina en una cantidad del 50 % al 65
% (p/p) se asocia con el polvo de diclofenaco en una cantidad del 6 % al 12 % (p/p) y opcionalmente granulos gastrorresistentes de omeprazol en una cantidad del 15 % al 25 % (p/p) junto con excipientes farmacéuticamente aceptables, con respecto al peso de los gránulos.
En otra modalidad la composición para el uso que se reivindica está en forma de cápsulas en donde los microgránulos gastrorresistentes de rifaximina en una cantidad del 60 % al 75 % (p/p) se asocian con el polvo de diclofenaco en una cantidad del 6 % al 12 % (p/p) y opcionalmente gránulos gastrorresistentes de omeprazol en una cantidad del 15 % al 25 % (p/p) junto con excipientes farmacéuticamente aceptables.
En una modalidad se preparan los microgránulos gastrorresistentes de rifaximina como se describe en el Ejemplo 2. El revestimiento de los microgránulos comprende materiales poliméricos que son preferentemente insolubles a valores de pH entre aproximadamente 1,5 y 4,0 y que son solubles a valores de pH entre 5,0 y 7,5. En general, el revestimiento gastrorresistente se hace de cualquier material que es insoluble en un intervalo de pH entre 1,5 y 4,0 y que es soluble a valores de pH superiores, preferentemente a valores de pH entre 5,0 y 7,5. Se eligen ejemplos de polímeros particulares que son adecuados para el uso con los sistemas de métodos y composiciones que se describen en la presente descripción entre los copolímeros de ácido acrílico, tales como el copolímero de ácido metacrílico-acrilato de etilo 1:1 y el copolímero de ácido metacrílico-metacrilato de metilo 1:2, polivinilo ftalato de acetato, ftalato de hidroxipropilmetilcelulosa, ftalato de acetato de celulosa, disponibles comercialmente, por ejemplo, con las marcas comerciales Kollicoat®, Eudragit®, Aquateric®, Aqoat®.
La cantidad de material gastrorresistente que se usa para fabricar los microgránulos para el uso con el uso y las composiciones para el uso que se describen en la presente descripción es aproximadamente entre el 10 % y el 60 % (p/p), preferentemente entre el 20 % y el 40 % (p/p), si se compara al peso total del gránulo gastrorresistente. El revestimiento gastrorresistente que se aplica sobre el principio activo en microgránulos puede contener también opcionalmente plastificantes, diluyentes, antiadherentes, antiaglomerantes, deslizantes, antiespumantes, colorantes y antioxidantes.
Los componentes que se usan para el revestimiento de microgránulos, se pueden solubilizar mediante el uso de solventes orgánicos o mantenerse en suspensión acuosa. Las soluciones o suspensiones de material de revestimiento se aplican por nebulización sobre polvos o gránulos o microgránulos que se mantienen en movimiento dentro de un recipiente de revestimiento o en suspensión de aire en aparatos de lecho fluido durante el proceso de aplicación.
Ejemplos no limitantes de solventes orgánicos se pueden usar para solubilizar el material de revestimiento son cloruro de metileno, ácido metílico, alcohol isopropílico, acetato de trietilo y alcohol etílico.
Como alternativa, el material polimérico gastrorresistente se puede aplicar a través de suspensiones acuosas, que es la técnica preferida porque no requiere el uso de solventes con los problemas toxicológicos y de seguridad relacionados.
Los microgránulos gastrorresistentes también se pueden preparar con otros procesos conocidos por aquellos especialistas en la técnica farmacéutica. Tales técnicas pueden incluir, por ejemplo, granular el principio activo de rifaximina junto con diluyentes, deslizantes y ligandos, y someter los microgránulos que se secan y se tamizan al proceso de revestimiento sucesivo con un revestimiento gastrorresistente.
Otro sistema que se puede usar para la preparación de los microgránulos implica la aplicación de rifaximina por medio un ligando de compuestos seleccionados del grupo que consiste en celulosa, derivados de celulosa, almidones, almidón de patata, almidón de maíz, gomas, goma sintética, polivinilpirrolidona, sodio. carboximetilcelulosa, celulosa microcristalina, hidroxipropilcelulosa, hidroxietilcelulosa, hidroxipropilmetilcelulosa, etilcelulosa, polietilenglicol, gelatina, polipropilenglicol, ácido algínico, sales de alginato, azúcares y combinaciones de los mismos a gránulos de celulosa microcristalina que tienen un diámetro entre aproximadamente 100 y 200 micrones y someter los microgránulos que resultan al proceso de revestimiento sucesivo con la película gastrorresistente.
Los gránulos gastrorresistentes de omeprazol comprenden omeprazol en una cantidad del 5 % al 20 % (p/p), fluidificante en una cantidad del 0,01 % al 1 % (p/p), deslizante en una cantidad del 1% al 10% (p/p), aglutinante en una cantidad del 0,5 % al 5 % (p/p) sobre un núcleo inerte en una cantidad del 64 % al 97,5 % (p/p) con respecto al peso del gránulo. Los gránulos de omeprazol se revisten con un revestimiento gastrorresistente en una cantidad del 20 % al 50 % con respecto al peso del gránulo. En una modalidad particular el aglutinante es hidroxipropilmetilcelulosa, el fluidificante es sílice pirógena, el deslizante es talco, el núcleo inerte son núcleos microcristalinos. El polímero gastrorresistente útil para preparar gránulos de omeprazol se eligen entre los copolímeros de ácido acrílico, tales como el copolímero de ácido metacrílico-acrilato de etilo 1:1 y el copolímero de ácido metacrílico-metacrilato de metilo 1:2, ftalato de acetato de polivinilo, ftalato de hidroxipropilmetilcelulosa, ftalato de acetato de celulosa, disponible comercialmente, por ejemplo, con las marcas comerciales Kollicoat®, Eudragit®, Aquateric®, Aqoat® y polímeros naturales.
Los AINE tal como el diclofenaco se pueden presentar en forma de gránulos o de gránulos de liberación rápida. Los gránulos de liberación rápida de diclofenaco pueden comprender 25 mg o 75 mg de diclofenaco correspondiente a
una cantidad porcentual del 1 % al 5 % (p/p), disgregantes en una cantidad del 0,5 al 5 % (p/p) y diluyentes en una cantidad del 90 % al 98,5 % (p /p) con respecto al peso de los granulos. Los granulos de diclofenaco pueden comprender diclofenaco en una cantidad del 10 % al 80 % (p/p), diluyentes en una cantidad del 10 % al 70 % (p/p), disgregantes del 1 % al 10 % (p/p), con respecto al peso total del gránulo. La composición farmacéutica que comprende rifaximina en gránulos gastrorresistentes, gránulos de diclofenaco o gránulos de liberación rápida de diclofenaco y opcionalmente gránulos gastrorresistentes de omeprazol puede estar en forma de bolsas termosoldadas con excipientes farmacéuticamente aceptables.
En una modalidad particular del uso que se reivindica, las bolsas termosoldadas comprenden rifaximina gastrorresistente (rifaximina EIR), en donde la rifaximina está en una cantidad de 400 mg y los gránulos de liberación rápida de diclofenaco están en una cantidad de 75 mg. Las bolsas termosoldadas también pueden contener edulcorantes, aromatizantes, conservantes y agentes antioxidantes. Las bolsas termosoldadas se pueden suspender en agua.
La composición sólida puede estar en forma de tabletas, en donde dicha tableta puede estar en forma de tabletas multicapa que puede comprender gránulos de rifaximina o gránulos gastrorresistentes de rifaximina, gránulos de diclofenaco o gránulos de liberación rápida de diclofenaco, opcionalmente gránulos gastrorresistentes de omeprazol y excipientes farmacéuticos, y dichas tabletas se pueden ser revestir con una película de revestimiento o revestimiento gastrorresistente. En una modalidad particular las tabletas pueden comprender rifaximina en una cantidad de 20 a 600 mg y diclofenaco de 5 mg a 75 mg.
La composición sólida puede estar en forma de cápsulas de gelatina, en donde dichas cápsulas comprenden rifaximina, gránulos de diclofenaco o gránulos de liberación rápida de diclofenaco y excipientes farmacéuticamente aceptables. Dichas cápsulas pueden comprender rifaximina en una cantidad de 20 a 600 mg y diclofenaco de 5 mg a 75 mg.
De acuerdo con otra variante el proceso de preparación de gránulos gastrorresistentes de omeprazol comprende una etapa en donde se añade una solución acuosa de aglutinante en una cantidad del 5 % al 25 % (p/p) a una suspensión acuosa que comprende una cantidad de omeprazol del 10 % al 40 % (p/p), un aglutinante del 2 % al 50 % (p/p) y un deslizante del 5 % al 20 % (p/p). La mezcla que resulta sobre un núcleo inerte con un flujo de aire de 10-60 m3/h se pulveriza en un lecho fluido a una temperatura de 30 °C a 80 °C. Los gránulos de omeprazol secos se revisten sucesivamente con una suspensión acuosa de HPMC en una cantidad del 10 % al 30 % (p/p) en un aparato de lecho fluido con un flujo de aire de 30 a 70 m3/h a una temperatura de 50 °C a 80 °C. Los gránulos secos se revistieron con éxito con un polímero gastrorresistente en el mismo aparato y los gránulos gastrorresistentes se secaron. El rendimiento del proceso es superior al 85 %.
De acuerdo con otra variante se describe el proceso para obtener gránulos de liberación rápida de diclofenaco, en donde una solución acuosa que comprende diclofenaco del 10 % al 50 % (p/v), disgregantes del 5 % al 10 % (p/v) y diluyentes del 40 % al 85 % (p/v) se pulveriza en un aparato de lecho fluido y el gránulo se seca hasta peso constante.
De acuerdo con otra variante se describe el proceso para obtener gránulos de diclofenaco, en donde el polvo de diclofenaco del 10 % al 80 % (p/p), diluyentes en una cantidad del 10 % al 70 %, disgregantes del 5 % al 10 % (p/p) se mezclan y la mezcla se granula. El gránulo se seca y se tamiza a aproximadamente 1-1,5 mm de tamiz.
De acuerdo con otra variante se describe el proceso para obtener bolsas termosoldadas, en donde el gránulo de diclofenaco o el gránulo de liberación rápida que comprende una cantidad unitaria de 5 a 75 mg se mezcla con gránulo de rifaximina o gránulo gastrorresistente de rifaximina en donde la rifaximina es de 20 mg a 600 mg y excipientes tales como diluyentes, lubricantes y opcionalmente edulcorantes, aromatizantes, conservantes. Se puede añadir omeprazol en gránulos gastrorresistentes a la mezcla y reducir proporcionalmente el peso de los diluyentes a la cantidad de omeprazol. De acuerdo con otra modalidad se describe un proceso para obtener tabletas, que comprende gránulos de rifaximina o gránulos gastrorresistentes de rifaximina, gránulos de diclofenaco o gránulos de diclofenaco de liberación rápida, opcionalmente omeprazol en gránulos gastrorresistentes y excipientes farmacéuticos, en donde el componente se mezcla en un mezclador en V por un tiempo de 10 a 30 minutos y la mezcla se comprime en una máquina para tabletas. Las tabletas se pueden revestir con una película de revestimiento o una película de revestimiento gastrorresistente y las tabletas que resultan se secan hasta peso constante.
De acuerdo con otra variante se describe el proceso de obtención de cápsulas de gelatina, en donde se mezclan gránulos de rifaximina y diclofenaco con excipientes y la mezcla se introduce en cápsulas de gelatina precargadas. Opcionalmente se puede añadir omeprazol a la mezcla y la cantidad de diluyentes se reduce proporcionalmente.
Los ingredientes activos de la presente descripción para el uso que se reivindica también se pueden formular en formas de dosificación separadas que se proporcionan como un sistema que puede estar en forma de un kit de partes que comprenden cualquiera de los ingredientes activos y cualquiera de las formulaciones que se describen en la siguiente descripción.
En algunas modalidades, el sistema para el uso que se reivindica comprende un antibiótico y un inhibidor de la bomba de protones, para el uso simultáneo, combinado o secuencial en un método relacionado que se describe en la siguiente descripción para tratar y/o prevenir una enteropatía por AINE en un individuo bajo administración de AINE. En algunas modalidades, la enteropatía es una afección del tracto intestinal. En algunas modalidades, la duración de la administración de AINE es de al menos una semana, al menos 10 días o al menos dos semanas. En algunas modalidades, el sistema que se describe en la presente descripción para el uso que se reivindica comprende al menos un antibiótico y al menos un inhibidor de la bomba de protones en dosificaciones que proporcionan, tras la administración oportuna al individuo, prevención del daño gastrointestinal o enteropatía por AINE en el individuo.
En algunas modalidades, el sistema para el uso que se reivindica comprende un AINE, al menos un antibiótico y opcionalmente al menos un inhibidor de la bomba de protones para el uso simultáneo, combinado o secuencial en un uso relacionado que se describe en la presente descripción para tratar y/o prevenir una afección de un individuo en donde se presentan dolor e/o inflamación. En algunas modalidades una cantidad efectiva de al menos un AINE se puede realizar por al menos una semana, al menos diez días o al menos dos semanas. En particular la administración de AINE se puede realizar por al menos dos semanas. En algunas modalidades, los sistemas que se describen en la presente descripción para el uso que se reivindica comprenden el AINE y al menos uno del antibiótico y el inhibidor de la bomba de protones en dosificaciones que permiten, tras la administración oportuna, el tratamiento y/o la prevención de una afección reumática y/u otras afecciones dolorosas y/o inflamatorias en el individuo.
En una modalidad particular, los kits para el uso que se reivindica pueden incluir dosis únicas o múltiples de uno o más ingredientes activos, cada uno empaquetado o formulado individualmente, o dosis únicas o múltiples de dos o más ingredientes activos empaquetados o formulados en combinación. Por tanto, uno o más ingredientes activos pueden estar presentes en un primer envase, y el kit puede incluir opcionalmente uno o más ingredientes activos en un segundo envase. El envase o envases se colocan dentro de un empaque, y el empaque puede incluir opcionalmente instrucciones de administración o dosificación en forma de una etiqueta en el empaque o en forma de un prospecto incluido en el kit del empaque.
En algunas modalidades, el kit de la presente descripción para el uso que se reivindica comprende como ingredientes activos cantidades terapéuticamente efectivas de i) rifaximina, ii) al menos un AINE.
En algunas modalidades, el kit de la presente descripción para el uso que se reivindica comprende como ingredientes activos cantidades terapéuticamente efectivas de i) rifaximina, ii) al menos un AINE.
En algunas modalidades, el kit de la presente descripción para el uso que se reivindica comprende como ingredientes activos cantidades terapéuticamente efectivas de i) un agonista de PXR, ii) al menos un AINE; y iii) al menos un IPB.
En una modalidad de kit ilustrativa de la presente descripción para el uso que se reivindica, el antibiótico, al menos un AINE y el BPI se proporcionan como formas de dosificación separadas e independientes, tales como, pero que no se limitan a, al menos tres formas de dosificación. Alternativamente, la rifaximina, los AINE y los IBP se combinan en una única forma de dosificación unificada. Alternativamente, la rifaximina gastrorresistente (y en particular la rifaximina EIR), los AINE y los IBP se combinan en una única forma de dosificación unificada.
Las formas de dosificación sólidas seleccionadas del grupo que consiste en cápsulas, tabletas, tabletas multicapa, polvos, gránulos, y sobres.
En algunas modalidades, el antibiótico y los AINE se combinan en una única forma de dosificación unificada y al menos un IBP se proporciona como una forma de dosificación separada e independiente. Un kit puede incluir un envase o empaque para contener las composiciones farmacéuticas y también puede incluir envases divididos tales como una botella dividida o un empaque de aluminio dividido.
El envase puede ser, por ejemplo, una caja de papel o cartón, una botella o frasco de vidrio o plástico, una bolsa resellable (por ejemplo, para contener un "relleno" de tabletas para colocarlas en un envase diferente) o un blíster con dosis individuales para presionar fuera del envase de acuerdo con un horario terapéutico. Es factible que más de un envase se puedan usar juntos en un único empaque para comercializar una única forma de dosificación. Por ejemplo, las tabletas se pueden contener en una botella que a su vez está contenida dentro de una caja.
Un ejemplo de kit es el llamado blíster. Los envases tipo blíster son bien conocidos en la industria del empaque y se usan ampliamente para el empaque de formas de dosificación de unidades farmacéuticas (tabletas, cápsulas y similares). Los blíster generalmente consisten en una hoja de material relativamente rígido que se cubre con una lámina de un material plástico preferentemente transparente. Durante el proceso de empaque, se forman hendiduras en la lámina de plástico. Las hendiduras tienen el tamaño y la forma de tabletas o cápsulas individuales a empacar o pueden tener el tamaño y la forma para acomodar múltiples tabletas y/o cápsulas a empaque. A continuación, las tabletas o cápsulas se colocan en las hendiduras por consiguiente y la hoja de material relativamente rígido se sella contra la lámina de plástico en la cara de la lámina que está opuesta a la dirección en la que se formaron las hendiduras. Como resultado, los tabletas o cápsulas se sellan individualmente o se sellan colectivamente, como se desea, en las hendiduras entre la lámina de plástico y la hoja. Preferentemente la resistencia de la hoja es tal que las
tabletas o cápsulas se pueden retirar del blíster aplicando manualmente presión sobre las hendiduras en las que se forma una abertura en la hoja en el lugar de la hendidura. La tableta o cápsula se puede retirar luego mediante dicha abertura.
En algunas modalidades, una ayuda para la memoria escrita que contiene información y/o instrucciones para el médico, el farmacéutico o el sujeto se pueden comprender con respecto a cuándo se debe tomar la medicación. Una "dosis diaria" puede ser una única tableta o cápsula o varias tabletas o cápsulas para tomar en un día determinado.
Un kit puede tomar la forma de un dispensador que se diseña para dispensar las dosis diarias una a la vez en el orden del uso que se pretende. El dispensador se puede equipar con una ayuda para la memoria, para facilitar adicionalmente el cumplimiento del régimen. Un ejemplo de tal ayuda para la memoria es un contador mecánico que indica el número de dosis diarias que se han dispensado. Otro ejemplo de tal ayuda para la memoria es una memoria de microchip que se alimenta por batería acoplado con una lectura de cristal líquido, o una señal de recordatorio audible que, por ejemplo, lee la fecha en que se tomado la última dosis diaria y/o recuerda a uno cuando se debe tomar la siguiente dosis.
El kit de la presente descripción se puede usar en los métodos que se describen en la presente descripción en el tratamiento de, por ejemplo, artritis.
En algunas modalidades, se espera que los usos y sistemas para el uso que se describe en la presente descripción y las composiciones relacionadas modulen y/o alivien las condiciones que se tratan.
El término "aliviar", "alivio", "mejora" o similares se refieren, por ejemplo, a una mejora detectable o un cambio detectable consistente con la mejora que ocurre en un sujeto o en al menos una minoría de los sujetos, por ejemplo, en al menos aproximadamente 2 %, 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 40 %, 50 %, 60 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 %, 100 % o en un intervalo entre cualquiera de los dos de estos valores. Tal mejora o cambio se puede observar en sujetos que se tratan en comparación con sujeto que no se tratan con rifaximina, donde los sujetos no que se tratan tienen, o están sujetos a desarrollar, la misma o una enfermedad similar, afección, síntoma o similar. El alivio de una enfermedad, afección, síntoma o parámetro de ensayo se puede determinar subjetivamente u objetivamente, por ejemplo, el autoanálisis de un individuo, mediante el análisis de un médico o mediante la realización de un ensayo o medición apropiado, que incluye, por ejemplo, un análisis de la calidad de vida, una progresión lenta de una afección, una gravedad reducida de una afección o un ensayo adecuado para el nivel o la actividad de una biomolécula, célula o mediante la detección de episodios de BD en un sujeto. El alivio puede ser transitorio, prolongado 0 permanente o puede ser variable en momentos relevantes durante o después de que se administra un antibiótico específico GI a un sujeto o se usa en un ensayo u otro método que se describe en la presente descripción o en una referencia que se cita, por ejemplo, dentro de los plazos de tiempo que se describen más adelante, o aproximadamente 1 hora después de la administración o uso de un antibiótico específico GI a aproximadamente 7 días, 2 semanas, 28 días, o 1, 3, 6, 9 meses o más después de que un individuo recibe tal tratamiento.
La "modulación" de, por ejemplo, un síntoma, nivel o actividad biológica de una molécula, o similar, se refiere a, por ejemplo, que el síntoma o actividad, o similar aumenta o disminuye detectablemente. Tal aumento o disminución se puede observar en sujetos que se tratan en comparación con sujetos que no se tratan con un antibiótico específico GI, donde los sujetos que no se tratan tienen, o están sujetos a desarrollar, la misma o similar enfermedad, afección, síntoma o similar. Tales aumentos o disminuciones pueden ser de al menos aproximadamente 2 %, 5 %, 10 %, 15 %, 20 %, 25 %, 30 %, 40 %, 50 %, 60 %, 70 %, 75 %, 80 %, 85 %, 90 %, 95 %, 98 %, 100 %, 150 %, 200 %, 250 %, 300 %, 400 %, 500 %, 1000 % o más o dentro de cualquier intervalo entre cualquiera de los dos de estos valores. La modulación se puede determinar subjetivamente u objetivamente, por ejemplo, mediante el autoanálisis de un individuo, mediante el análisis de un médico o mediante la realización de un ensayo o medición apropiado, que incluye, por ejemplo, un análisis de la calidad de vida o un ensayo adecuado para el nivel o la actividad de una molécula dentro de un sujeto. La modulación puede ser transitoria, prolongada o permanente o puede ser variable en momentos relevantes durante o después de que se administra un antibiótico específico GI a un sujeto o se usa en un ensayo u otro método que se describe en la presente descripción o en una referencia que se cita, por ejemplo, dentro de los tiempos que se describen más adelante, o aproximadamente 1 hora de la administración o uso de un antibiótico específico GI a aproximadamente 2 semanas, 28 días, 3, 6, 9 meses o más después de que un sujeto (s) haya recibido un antibiótico específico GI.
El término "modular" también se puede referir a aumentos o disminuciones en la actividad de una célula en respuesta a la exposición a un antibiótico específico GI, por ejemplo, la inhibición de la proliferación y/o la inducción de la diferenciación de al menos una subpoblación de células en un animal de manera que se alcance un resultado final que se desea, por ejemplo, un resultado terapéutico del antibiótico específico GI que se usa para el tratamiento puede aumentar o disminuir en el transcurso de un tratamiento particular.
Ventajas y características adicionales de la presente descripción resultarán más evidentes en lo adelante a partir de la siguiente descripción que se detalla a modo de ilustración solo con referencia a una sección experimental.
Ejemplos
Las composiciones, métodos y sistemas que se describen en la presente descripción se ilustran adicionalmente en los siguientes ejemplos, que se proporcionan a modo de ilustración y no pretenden ser limitantes.
El Ejemplo 1 describe un ensayo clínico multicéntrico, aleatorizado y clínico. El estudio se diseña para evaluar la eficacia y seguridad de la rifaximina en tabletas de microgránulos gastrorresistentes de 800 mg dos veces al día en la prevención de lesiones del intestino delgado que se deben a diclofenaco SR 75 mg BID más Omeprazol 20 mg una vez al día en voluntarios sanos.
Ejemplo 1: Estudio clínico doble ciego
Se realizará un estudio clínico aleatorizado, en donde se inscribieron 60 voluntarios sanos, de acuerdo con la descripción más abajo. El estudio es un estudio de endoscopia con cápsula de video (VCE) multicéntrico que compara los hallazgos del intestino delgado después del tratamiento con diclofenaco SR 75 mg BID más Omeprazol 20 mg una vez al día con o sin rifaximina 800 mg BID.
Los principales criterios de inclusión para inscribir voluntarios en el estudio comprenden:
- sujetos masculinos o femeninos no embarazados, no lactantes de 18 años a 65 años de edad;
- hallazgos normales en el examen físico y las evaluaciones de laboratorio;
- no más de 1 ruptura de la mucosa en el VCE de referencia;
- los sujetos firmaron por escrito el consentimiento informado.
Los principales criterios de exclusión comprenden:
- uso de esteroides orales y sistémicos, otros AINE (que incluye aspirina en dosis bajas y aminosalicilatos), compuestos biológicos, sulfasalazina, misoprostol y otros compuestos protectores de las mucosas, bisfosfonatos, dentro de las 4 semanas antes y durante el cribado;
- uso de probióticos, prebióticos, rifaximina y otros antimicrobianos, dentro de las 8 semanas antes y durante el cribado;
- uso de fármacos procinéticos dentro de las 2 semanas antes y durante el cribado;
- abuso de alcohol;
- riesgo de embarazo sin anticoncepción adecuada;
- evidencia de úlcera duodenal y/o gástrica activa, diverticulitis, gastroenteritis infecciosa, estenosis u obstrucción intestinal;
- una afección médica significativa que, en opinión del investigador impide la participación en el estudio.
Hasta 60 voluntarios aleatorizados en dos grupos de tratamiento de la siguiente manera:
Grupo 1: una tableta de diclofenaco SR 75 mg cada 12 horas más una cápsula de omeprazol 20 mg una vez al día más dos tabletas placebo de rifaximina de 400 mg se administrarán cada 12 horas, por vía oral.
Grupo 2: una tableta de diclofenaco SR 75 mg que se toma cada 12 horas más una cápsula de omeprazol 20 mg una vez al día más dos tabletas de microgránulos gastrorresistentes de rifaximina 400 mg (rifaximina EIR) cada 12 horas, por vía oral.
Se espera que el período total para completar el estudio por materia sea de 1 mes, que consiste en:
Período de cribado: los sujetos potenciales se someten a una visita de cribado (V1) para realizar una investigación sobre datos clínicos y pruebas de laboratorio, seguida de un VCE de referencia en la visita 2 (V2).
Período de tratamiento: Los sujetos elegibles se aleatorizaron en dos grupos de tratamiento en la visita de aleatorización (V3). Cada día durante el período de tratamiento de 14 días, cada sujeto recibió una cápsula de diclofenaco SR 75 mg cada 12 horas más una tableta de omeprazol 20 mg una vez al día más dos tabletas del fármaco en investigación (rifaximina-EIR o el placebo que corresponde) cada 12 horas. La visita final (V17) se realizó no más de 36 horas después de la última administración del fármaco e incluyó un segundo VCE y análisis de pruebas clínicas y de laboratorio.
El criterio primario de valoración de la eficacia es el porcentaje de sujetos que desarrollan al menos una ruptura de la mucosa en la visita final que se evalúan por VCE y se analizan de acuerdo con un sistema de puntuación validado.
Los criterios secundarios de valoración de la eficacia son el cambio de la referencia a la visita final en el número de lesiones de la mucosa en el intestino delgado y el cambio de la referencia a la visita final en el número de lesiones de la mucosa en el intestino delgado con/sin hemorragia (sangre visible).
Los parámetros de seguridad que se consideran son: eventos adversos (EA), parámetros de laboratorio clínico (hematología, química clínica y análisis de orina), signos vitales.
El resultado que se espera de este estudio es que los 60 voluntarios sanos aleatorizados (30 sujetos por grupo) proporcionen un poder del 80 % para detectar una reducción de aproximadamente el 55 % en la tasa de sujetos con roturas de la mucosa en el intestino delgado de la referencia a la visita final en el grupo de diclofenaco más omeprazol más rifaximina con respecto al grupo de diclofenaco más omeprazol a un nivel de significación unilateral de 0,05, que asume una tasa del 58 % en el grupo que se trata con diclofenaco más omeprazol y una tasa del 10 % de sujetos no evaluables.
Ejemplo 2: Preparación de rifaximina en gránulos gastrorresistentes: Rifaximina de Liberación Intestinal Extendida (EIR) (referencial)
Se prepararon microgránulos de rifaximina como se describe en la solicitud de patente de los Estados Unidos No.
11/814,628. En un aparato de lecho fluido, Glatt GPC 30, con un sistema Wurster de 18 pulgadas con un chorro de pulverización de 1,8 mm, se cargaron 25000 g de polvo de rifaximina y 125 g de Aerosil como fluidizador. Al mismo tiempo en un mezclador bajo agitación se preparó una suspensión mediante el uso de 48 107 g de agua desmineralizada, 9281 g de copolímero de acrilato de etilo de ácido metacrílico que se comercializa bajo la marca comercial Kollicoat® MAE 100 P, 1392 g 1,2 propanodiol, 2475 g de talco, 557 g de dióxido de titanio de FU y 62 g de óxido de hierro E 172. Los componentes sólidos de la suspensión se mezclaron homogéneamente en agua desmineralizada con un homogeneizador de alta velocidad (Ultra Turrax). La suspensión que se prepara se carga en el aparato tipo Wurster con una bomba peristáltica y se nebuliza, a una presión de 1,0 a 1,5 bar, a través de una boquilla de 1,8 mm sobre la mezcla de polvo de rifaximina y Aerosil® 200 que se mantuvo en suspensión en el lecho fluido mediante un flujo de aire caliente.
Las condiciones que se aplican se describen en la Tabla 2:
Tabla 2
Los microgránulos que se obtienen se someten a análisis de granulometría mediante tecnología de dispersión de luz mediante el uso de un aparato Malvern Mastersizer 2000 resulta mayor del 91 % de los microgránulos que tienen una dimensión inferior a 300 micrómetros.
La composición de microgránulos que comprende rifaximina se describe en la Tabla 3.
Tabla 3
Los microgránulos que se obtienen se analizan mediante difracción de rayos X. Los difractogramas muestran que la rifaximina tiene picos característicos de la forma p, como se identifica en Cryst. Eng. Comm. 10, 1074-1081 (2008).
Ejemplo 3: Preparación de omeprazol en granulos gastrorresistentes (referencial)
El proceso para la preparación de gránulos gastrorresistentes de omeprazol comprende tres etapas:
- pulverización en un aparato de lecho fluido sobre una suspensión que contiene omeprazol sobre núcleos de celulosa microcristalina;
- revestimiento de los núcleos que se cargan con omeprazol con una película de revestimiento de hidroxipropilmetilcelulosa;
- pulverización en un aparato de lecho fluido de una suspensión acuosa de película de revestimiento gastrorresistente sobre gránulos de omeprazol.
Se preparó una suspensión acuosa mezclando 600 g de omeprazol, 1,20 g de sílice pirógena y 60,0 g de talco en 700 ml de agua y la solución se mantuvo a 60 °C bajo agitación hasta la solubilización de los componentes y luego se añadieron 1312 g de hidroxipropilmetilcelulosa; la suspensión que resulta se pulveriza en un lecho fluido.
Se cargaron 1192,64 g de núcleos de celulosa microcristalina en un aparato de lecho fluido tipo GPCG2 preparado con un sistema de pulverización inferior y revestido con la suspensión compuesta que se agita a 300 rpm. El revestimiento del núcleo se realiza con las siguientes condiciones de la Tabla 4.
Tabla 4
Después de la etapa de pulverización, los gránulos se secaron por 10 minutos a 55 °C, luego se fijó la temperatura de entrada de aire a 36 °C y se dejó enfriar la masa a la temperatura < 36 °C, antes de detener el proceso y descargar el producto.
La composición de los núcleos que se cargan con omeprazol que se obtienen en la primera etapa se reporta en la Tabla 5.
Tabla 5
El producto altamente higroscópico que se obtiene se envasa y almacena inmediatamente en envases sellados.
La segunda etapa comprende el revestimiento de núcleos que se cargan con omeprazol en un aparato de lecho fluido con hidroxipropilmetilcelulosa.
Se aplica una suspensión de 88 g de hidroxipropilmetilcelulosa en 792 g de agua sobre 800 g de gránulos que se obtienen de la etapa 1 en un aparato de lecho fluido tipo GPCG2, preparado con sistema de pulverización de fondo y la suspensión se agita a 200 rpm.
Los parámetros del proceso se reportan en la Tabla 6.
Tabla 6
Los gránulos se secaron por 30 minutos a una temperatura de 65 °C. La composición unitaria de gránulos después de la segunda etapa se reporta en la Tabla 7.
Tabla 7
La tercera etapa comprendió el revestimiento de los gránulos de omeprazol con una película gastrorresistente. Se preparó una suspensión de revestimiento gastrorresistente mezclando 960 g de Acryl-Eze 93F19255 en 2880 ml de agua, se filtró en un tamiz de 500 gm y se pulverizó sobre 800 g de los gránulos del a etapa 2 en un aparato de lecho fluido, con el parámetro del proceso que se reporta en la Tabla 8.
Tabla 8
Después de la etapa de pulverización, los gránulos de omeprazol se mantuvieron por 10 minutos a 44 °C, y luego a 36 °C para permitir que la masa se enfriara a una temperatura de aproximadamente 36 °C. El producto que se obtuvo se mantuvo a 40 °C por 12 horas en calentador estático.
La composición del contenido de los gránulos gastrorresistentes de omeprazol se reporta en la Tabla 9.
Tabla 9
(continuación)
El revestimiento gastrorresistente comprende un copolímero de ácido metacrílico - acrilato de etilo, talco, macrogol 800, sílice coloidal anhidro, carbonato de sodio, lauril sulfato de sodio.
Ejemplo 4: Preparación de omeprazol en gránulos gastrorresistentes (referencial)
El proceso para la preparación de gránulos gastrorresistentes de omeprazol comprende tres etapas:
a. Preparación de núcleos cargados de omeprazol;
b. Preparación de gránulos de omeprazol revestidos;
c. Revestimiento de los gránulos de omeprazol con polímero gastrorresistente.
Se preparó una solución acuosa mediante la adición de 14 g de HPMC a 170 ml de agua que se calienta previamente a 60 °C y se agregó a una suspensión acuosa que se prepara mediante la adición a 500 ml de agua bajo agitación, 80 g de omeprazol, 20 g de sílice y 60 g de talco y la suspensión final se mantuvo bajo agitación durante 1,5 horas.
La suspensión se esparció sobre 1192,64 g de núcleos de celulosa microcristalina en un aparato de lecho fluido, tipo GPCG2 equipado con un sistema de pulverización inferior. La pulverización se llevó a cabo con un flujo de aire de 45 m3/hora, y una temperatura del aire en la entrada de 65 °C. Los gránulos que se obtienen se secaron a una temperatura de 55 °C por aproximadamente 1 hora. El rendimiento del proceso fue del 96 % con una pérdida por secado (LOD) del 2,10 %.
La composición unitaria de los núcleos cargados de omeprazol se reporta en la Tabla 10.
Tabla 10
La segunda etapa comprende el revestimiento de omeprazol con hidroxipropilmetilcelulosa en donde se prepara una suspensión mezclando 88 g de hidroxipropilmetilcelulosa en 792 ml de agua se pulverizó sobre 800 g de gránulos que se obtienen en la primera etapa en un aparato de lecho fluido tipo GPCG2. La etapa de pulverización se llevó a cabo con un flujo de aire en la entrada de 45 m3/hora y una temperatura del aire en la entrada de 65 °C y los gránulos que se obtienen se secan por 30 minutos a una temperatura de 25 °C. La composición de los gránulos después de la segunda etapa se reporta en la Tabla 11.
Tabla 11
La tercera etapa comprende el revestimiento de los gránulos de omeprazol con una película de revestimiento gastrorresistente. Una suspensión de 660 g de Acryl-Eze® 93F19255 en 2340 ml de agua se pulverizó sobre 550 g
de granulos de la etapa b) en un aparato de lecho fluido con un flujo de aire en la entrada de 50 m3/hora y una temperatura del aire en la entrada de 70 °C y los gránulos de omeprazol que resultas se secaron por 30 minutos con un flujo de aire de 25 °C.
La composición unitaria de los gránulos gastrorresistentes de omeprazol se reporta en la Tabla 12.
Tabla 12
El rendimiento del proceso final fue del 89,2 %.
Ejemplo 5: Preparación de gránulos de diclofenaco de liberación rápida (referencial)
Los gránulos de diclofenaco de liberación rápida se prepararon en un aparato de lecho fluido. Una solución de 270 g de diclofenaco en 1750 g de agua, 126 g de povidona y 3478 g de sorbitol se pulverizó en un lecho fluido en donde se cargaron previamente 10000 g de sorbitol. Los gránulos se secaron hasta que la pérdida de secado (LOD) fue de aproximadamente 2 %.
La composición de granulado que contiene diclofenaco se reporta en la Tabla 13.
Tabla 13
Ejemplo 6: Preparación de gránulos de diclofenaco de liberación rápida (referencial)
Una mezcla de 20 g de diclofenaco ácido y 1165 g de sorbitol, que se tamiza previamente sobre una malla de 1 mm, se cargó en un aparato de lecho fluido preparado con un sistema de pulverización superior. El polvo se granuló con 166 ml de solución acuosa que contenía 133 g de sorbitol y 25 g de PVP, con un flujo de aire en la entrada de 60 m3/hora y una temperatura del aire en la entrada de 45 °C.
Los gránulos que se obtiene se secan por 10 minutos a una temperatura de 45 °C.
La composición unitaria del granulado de diclofenaco se indica en la Tabla 14.
Tabla 14
Ejemplo 7: Preparación de gránulos de diclofenaco, (referencial)
Se mezclaron 75 g de diclofenaco con 16 g de celulosa microcristalina y 7 g de hidroxipropilmetilcelulosa en el mezclador Hi Shear Mixer; se añadieron 200 ml de agua a la mezcla sólida y la masa se granuló por 4 minutos. Los gránulos se tamizaron en un granulador oscilante con un tamiz de 1,14 mm. Los gránulos se secaron en un aparato
de lecho fluido hasta una pérdida de secado (LOD) de aproximadamente <1 %. La composición de los granulos de diclofenaco se reporta en la Tabla 15.
Tabla 15
Ejemplo 8: Preparación de composiciones que comprenden rifaximina y diclofenaco y la composición que comprende rifaximina, diclofenaco y omeprazol en bolsas termosoldadas. (referencial)
La Tabla 16 reporta las composiciones para suspensión oral que comprenden rifaximina, diclofenaco y rifaximina, diclofenaco y omeprazol en granulos en bolsas termosoldadas.
Tabla 16
Se prepararon bolsas termosoldadas sin omeprazol, en donde proporcionalmente se aumentó proporcionalmente la cantidad de sorbitol.
Ejemplo 9: Preparación de tabletas que comprenden omeprazol, rifaximina y diclofenaco y tabletas que comprenden rifaximina y diclofenaco (referencial)
Las composiciones de tabletas 1-10 se obtienen mezclando todos los componentes como se reporta en la Tabla 17 en un mezclador en V y la mezcla se comprime en una máquina de tabletas. Las tabletas se revistieron con una película de revestimiento o una película de revestimiento gastrorresistente y las tabletas que se revistieron se secaron hasta una pérdida de secado de aproximadamente 5 %. Las composiciones unitarias de tabletas se reportan en la Tabla 17.
Tabla 17
(continuación)
Se prepararon tabletas de composición como las composiciones 1-4 y 7-10 sin omeprazol en donde se aumentó proporcionalmente la cantidad de celulosa microcristalina.
Ejemplo 10: Preparación de cápsulas que comprenden omeprazol, diclofenaco y rifaximina y cápsulas que comprenden rifaximina y diclofenaco. (referencial)
La Tabla 18 reporta las composiciones de la cápsula de gelatina que comprende omeprazol, diclofenaco y rifaximina y cápsulas que comprenden rifaximina y diclofenaco, en donde las composiciones 3 y 4 comprenden 400 mg de rifaximina en gránulos gastrorresistentes y la composición 5 y 6 comprende 200 mg de rifaximina en gránulos gastrorresistentes.
Tabla 18
(continuación)
Todos los componentes se mezclaron en un mezclador en V por 20 minutos y el polvo que se mezcló se introdujo en las cápsulas de gelatina.
Ejemplo 11: Preparación de composiciones que comprenden rifaximina, diclofenaco y omeprazol en bolsas termosoldadas (referencial)
Se mezcló rifaximina en gránulos gastrorresistentes o en polvo en un mezclador en V con diclofenaco en gránulos de liberación rápida o polvo de diclofenaco o gránulos de diclofenaco, gránulos gastrorresistentes de omeprazol y los excipientes. Todos los componentes se tamizaron previamente en tamiz de malla de 0,5 mm.
La mezcla que resulta se dividió en bolsas termosoldadas que contenían 6,5 gramos de producto, en donde la rifaximina es 400 mg. En la siguiente Tabla 19, se reportan las composiciones para suspensión oral que comprenden rifaximina, diclofenaco y omeprazol.
Tabla 19
Se prepararon también las bolsas termosoldadas que comprenden rifaximina 800 mg o 1244,6 mg de rifaximina en gránulos gastrorresistentes, con reducción proporcional de carboximetilcelulosa de sodio. Las bolsas termosoldadas se prepararon también sin omeprazol aumentando proporcionalmente la cantidad de carboximetilcelulosa de sodio. Ejemplo 12: Preparación de granulados de rifaximina (referencial)
Una mezcla de 2669,5 g de rifaximina, 160,2 g de palmitoestearato de glicerilo, 8,8 g de talco, 1161,2 g de celulosa microcristalina, que se tamizó previamente sobre una malla de 1 mm, se mezcló en un mezclador en V por 10 minutos a 14 rpm.
La mezcla se granuló en un granulador seco equipado con una malla de 3,15 y 1,45 mm.
Ejemplo 13: Preparación de tabletas que comprenden omeprazol, rifaximina y diclofenaco (referencial)
Las tabletas se prepararon con un proceso con una primera etapa de preparación del núcleo y una segunda etapa en donde el núcleo se revistió con una película de revestimiento gastrorresistente.
A) Preparación de los núcleos de las tabletas
Se tamizó una mezcla de 20 g de omeprazol, 75 g de diclofenaco de sodio, 80 g de croscarmelosa de sodio, 20 g de palmitoestearato de glicerilo, 50 g de copovidona y 556,3 g de celulosa microcristalina o 556,3 g de dihidrogenofosfato de calcio sobre una malla de 0,8 mm y se mezclaron con 1198,8 g de granulos de rifaximina, que se preparan como en el Ejemplo 6 en un mezclador en V por 20 minutos a 16 rpm, y luego se comprimieron con una precompresión de 394 mm y una compresión de 280 mm.
B) Revestimiento de tabletas con una película de revestimiento
Las tabletas que se obtienen se cargaron en un recipiente y el revestimiento se llevó a cabo con una solución acuosa al 20 % (p/v) de Acryl-EZE con una temperatura de aire en la entrada de 56 °C, una presión de aire en la entrada de 200 m3/hora y una distancia de boquilla de 21 cm.
Las composiciones de tabletas se reportan en la Tabla 20.
Tabla 20
Ejemplo 14: Preparación de tabletas gastrorresistentes que comprenden rifaximina y sal de sodio de diclofenaco (referencial)
Las tabletas se prepararon en las mismas condiciones del Ejemplo 8, en donde se omitió el omeprazol.
A) Preparación de los núcleos de las tabletas
Se tamizó una mezcla de 75 g de diclofenaco de sodio, 80 g de croscarmelosa de sodio, 20 g de palmitoestearato de glicerilo, 50 g de copovidona y 576,3 g de celulosa microcristalina o 576,3 g de fosfato de calcio bifásico sobre una malla de 0,8 mm y se mezclaron con 1198,8 g de gránulos de rifaximina que se prepara como en el Ejemplo 6. La mezcla se mantuvo en un mezclador en V por 20 minutos a 16 rpm.
La mezcla que resulta se comprime con una precompresión de 394 mm y una compresión de 280 mm.
B) Revestimiento de tabletas con una película de revestimiento
Las tabletas que se obtienen se cargaron en un recipiente y el revestimiento se llevó a cabo con una solución acuosa al 20 % (p/v) de Acryl-EZE con una temperatura de aire en la entrada de 56 °C, una presión de aire en la entrada de 200 m3/h y una distancia de boquilla de 21 cm. Las composiciones de tabletas 3 y 4 se reportan en la Tabla 21.
Tabla 21
Se prepararon las mismas composiciones de tabletas con una película de revestimiento que comprende hidroxipropilmetilcelulosa, dióxido de titanio, disodio edentato, propilenglicol y óxido de hierro rojo E172.
Ejemplo 15: Preparación de cápsulas que comprenden rifaximina, omeprazol y diclofenaco. (referencial)
Se prepararon cápsulas de gelatina que comprenden omeprazol, diclofenaco y rifaximina y cápsulas que comprenden rifaximina y diclofenaco, con un proceso en donde todos los componentes se mezclaron en un mezclador en V por 20 minutos y el polvo que se mezcló se introdujo en las cápsulas de gelatina.
La Tabla 22 reporta las composiciones unitarias de cápsulas.
Tabla 22
Ejemplo 16: Efectos de la rifaximina y la rifaximina gastrorresistente en la enteropatía inducida por indometacina en ratas (referencial)
La eficacia de la rifaximina y la rifaximina gastrorresistente en la enteropatía inducida por la administración de AINE se ha evaluado en un estudio preclínico en animales.
Se analizaron un total de treinta y seis (36) ratas macho Albino Sprague Dawley, de 500 a 600 g de peso corporal (40 semanas de edad).
Se indujo la enteropatía en treinta y un (31) ratas macho Albino Sprague Dawley, mediante el uso de indometacina. Los grupos experimentales se organizaron de la siguiente manera:
- Grupo 1: cinco animales que se tratan con vehículo de fármaco por 14 días (controles normales).
- Grupo 2: diez animales que se tratan con indometacina 1,5 mg/kg BID por 14 días (controles ulcerados con indometacina).
- Grupo 3: siete animales ulcerados con indometacina que se tratan conjuntamente con rifaximina gastrorresistente 25 mg/kg BID por 14 días.
- Grupo 4: siete animales ulcerados con indometacina que se tratan conjuntamente con rifaximina gastrorresistente 50 mg/kg BID por 14 días.
- Grupo 5: siete animales ulcerados con indometacina que se tratan conjuntamente con polimorfo alfa de rifaximina 50 mg/kg BID por 14 días.
En particular los grupos 1 a 5 se trataron de la siguiente manera:
- El grupo 1 recibió metocel al 1 % (0,25 ml/rata) y metilcelulosa al 1 % (1 ml/rata) por 14 días.
- El grupo 2 se trató por 14 días con indometacina 1,5 mg/kg BID de por vía intragástrica, que se suspendió en metocel al 1 % y se administra en un volumen de 0,25 ml/rata.
- El grupo 3 recibió rifaximina gastrorresistente (25 mg/kg; 7 ratas/grupo) que se suspendió en metilcelulosa al 1 % (1 ml/rata), que se administra dos veces diarias, 1 hora antes de la administración de indometacina.
- El grupo 4 recibió rifaximina gastrorresistente (50 mg / kg; 7 ratas / grupo) que se suspendió en metilcelulosa al 1 % (1 ml/rata), que se administra dos veces diarias, 1 hora antes de la administración de indometacina.
- El grupo 5 recibió polimorfo alfa de rifaximina (50 mg/kg, 7 ratas/grupo), que se suspendió en metilcelulosa al 1 % (1 ml/rata), que se administra dos veces diarias, 1 hora antes de la administración de indometacina.
Veinticuatro horas después de la última dosis, las ratas se sacrificaron y se recogieron muestras de sangre para analizar los niveles de hemoglobina.
Se retiró y procesó todo el tracto intestinal para la evaluación de los niveles de mieloperoxidasa del tejido (MPO) y el análisis histológico del daño intestinal en el yeyuno y el íleon.
La evaluación histológica de la lesión intestinal se llevó a cabo como se describe por Anthony A, y otros, "Early histological features of small intestinal injury induced by indomethacin," Aliment. Pharmacol. Ther. 1993; 7:29-39. Tras retirarlo, todo el tracto intestinal se inyectó inmediatamente con formalina al 10 % y se dejó en la misma solución fijadora. Después de 30 min, se abrió a lo largo del borde anti-mesentérico, se limpió de contenido fecal y se fijó en formalina al 10 % por 24 h. Se tomaron muestras de tejido como se describe más abajo y se midió la longitud completa del intestino delgado.
En particular se tomaron las siguientes muestras de tejido
- Íleon: se descartó 1 cm de tejido proximal a la válvula ileocecal y se tomaron dos muestras de 1,5-2 cm de íleon en este borde así como también a 5 cm de distancia de la primera muestra de íleon.
- Yeyuno proximal: se tomaron dos muestras de 1,5-2 cm a 5 cm de distancia tanto del extremo proximal como distal del 37,5 % de la longitud total del intestino delgado.
- Yeyuno distal: se tomaron dos muestras de 1,5-2 cm a 5 cm de distancia tanto del extremo proximal como distal del 81 % de la longitud total del intestino delgado.
Después de la fijación, los tejidos se incrustaron en bloques de parafina y se cortaron en secciones consecutivas de 3 mm en serie para teñir con hematoxilina y eosina. El daño histológico se analizó por dos observadores, ciegos al tratamiento. A cada sección se le asignó una puntuación de lesión (Tipo 1 a 3) (Tabla 23).
El análisis cuantitativo del daño histológico se expresó como porcentaje de la longitud total de las lesiones sobre la longitud total de la sección histológica.
Se muestran en la Figura 1, fotografías ilustrativas que muestran la apariencia histológica de las lesiones de tipo 1,2 y 3 del yeyuno y el íleon.
Tabla 23
Los niveles de mieloperoxidasa del tejido (MPO) se asumieron como un índice cuantitativo para estimar el grado de infiltración de la mucosa por células polimorfonucleares y, de esta manera la gravedad de la enteropatía que se provoca por indometacina. Se homogeneizaron muestras de tejidos intestinales (30 mg) en hielo con un homogeneizador Polytron (QIAGEN, Milán, Italia) en 0,6 ml de tampón de lisis helado (NaCl 200 mM, EDTA 5 mM, Tris 10 mM, glicerina al 10 %, PMSF 1 mM, 1 pg/ml de leupeptina y 28 pg/ml de aprotinina (pH 7,4). El homogeneizado se centrifugó 2 veces a 4 °C por 15 min a 1500 g. El sobrenadante se diluyó 1:5 y se usó para la determinación de la concentración de MPO por medio de un ensayo de inmunoabsorción ligado a enzima (ELISA) (Hycult Biotech, Uden, Holanda). Todas las muestras se analizaron dentro de los 2 días después de la recolección. Los resultados se expresaron como nanogramos de MPO por miligramo de tejido intestinal.
El análisis de hemoglobina se realizó en muestras de sangre de rata que se recogieron como se reporta anteriormente por medio del kit de ensayo Quantichrom Hemoglobin (Bioassay Systems, Hayward, CA, EE.UU.) y se expresó como g/dl.
Al final del período de tratamiento (14 días), 4 ratas murieron en el grupo que se trata con indometacina (Grupo 2), mostrando por tanto una tasa de mortalidad del 40 %. Por el contrario, la administración conjunta de rifaximina gastrorresistente 25 mg/kg y 50 mg/kg o polimorfo alfa de rifaximina 50 mg/kg BID con indometacina no se asoció con muertes. También se registró un porcentaje del 100 % de los supervivientes en el grupo control del vehículo (Grupo 1).
En la Figura 2 y la Figura 3, se reportan los resultados del análisis microscópico del daño intestinal. En muestras de yeyuno que se obtienen de animales control (Grupo 1), el examen microscópico no reveló ninguna lesión de tipo 1,2 y 3 (Figura 2). La administración de indometacina (1,5 mg/kg BID) por 14 días se asoció con la aparición de diversos grados de lesiones de tipo 1, 2 y 3 (Figura 2).
La rifaximina gastrorresistente 25 mg/kg y 50 mg/kg o el polimorfo alfa de rifaximina 50 mg/kg BID redujeron el grado de las lesiones de tipo 1, aunque los valores medios no fueron significativamente diferentes de aquellos que se estiman en el grupo de indometacina. Por el contrario, la rifaximina redujo significativamente las lesiones de tipo 2, en comparación con la indometacina sola. En cuanto a las lesiones de tipo 3, no se detectaron diferencias significativas cuando se comparan los grupos experimentales que se tratan con rifaximina con indometacina sola (Figura 2).
En el íleon, la administración de indometacina se asoció con la aparición de lesiones de tipo 1 y 2, mientras que no se detectaron diferencias significativas para las lesiones de tipo 3, en comparación con los animales control (Figura 3). El tratamiento con rifaximina gastrorresistente 25 mg/kg, rifaximina gastrorresistente 50 mg/kg o polimorfo alfa de rifaximina 50 mg/kg BID provoca una reducción significativa de las lesiones de tipo 1, mientras que no se apreciaron diferencias significativas en la aparición de lesiones de tipo 2 (Figura 3). Las lesiones de tipo 3 no difirieron significativamente mediante la comparación de los controles con los otros grupos de tratamiento con fármacos (Figura 3) .
Los resultados de los niveles de mieloperoxidasa del tejido (MPO) se reportan en la Figura 4. Los niveles de mieloperoxidasa del tejido (MPO) que se detectan en muestras de yeyuno de ratas que se tratan con indometacina (1,5 mg/kg BID) por 14 días aumentaron significativamente, en comparación con los controles (Figura 4). En presencia de indometacina, la rifaximina gastrorresistente 25 mg/kg o 50 mg/kg BID provoca una reducción significativa de los niveles de MPO, mientras que el polimorfo alfa de rifaximina 50 mg/kg BID no ejerce ningún efecto relevante (Figura 4) . En el íleon, la indometacina también causó un aumento significativo en los niveles de MPO del tejido, que se mitigó por rifaximina gastrorresistente 25 mg/kg, rifaximina gastrorresistente 50 mg/kg o polimorfo alfa de rifaximina 50 mg/kg BID (Figura 4).
Los resultados de la hemoglobina en sangre se reportan en la Figura 5. Los animales que se tratan con indometacina (1,5 mg/kg BID) por 14 días mostraron una disminución significativa en la concentración de hemoglobina en sangre. En animales que se tratan con rifaximina gastrorresistente a ambas dosis, los niveles de hemoglobina no difirieron significativamente de aquellos que se registraron en animales control, mientras que en ratas que se tratan con polimorfo alfa de rifaximina 50 mg/kg BID, estos niveles disminuyeron (Figura 5).
La Tabla 24 muestra los efectos de la indometacina, sola o en combinación con rifaximina gastrorresistente y polimorfo alfa de rifaximina sobre la tasa de mortalidad, la hemoglobina en sangre y los niveles de mieloperoxidasa del tejido.
Tabla 24
*=P<0,05 frente al control a=P<0,05 frente al control En vista de los resultados anteriores, la administración crónica de indometacina se asoció con la aparición de daño intestinal, infiltrado de células polimorfonucleares del tejido y pérdida de sangre digestiva.
La administración de rifaximina gastrorresistente tanto a 25 como a 50 mg/kg BID se asoció con una reducción de la mortalidad (mortalidad: 0 %) con respecto a las ratas que se tratan con indometacina (mortalidad: 40 %), niveles de MPO del tejido significativamente reducidos con respecto a los animales que se tratan con indometacina y una mejoría general del daño histológico, aunque en algunos casos significativo para cada Tipo (1,2 y 3) de daño que se describe en íleon y yeyuno.
La administración de rifaximina gastrorresistente (EIR rifaximina) resultó más eficaz que la rifaximina no gastrorresistente en el tratamiento o prevención del daño intestinal por AINE.
La rifaximina es más efectiva que el control en donde la rifaximina no está presente. La alfa rifaximina parece ser menos efectiva que la rifaximina gastrorresistente para contrarrestar la enteropatía inducida por indometacina. La rifaximina gastrorresistente es efectiva en la prevención del daño inducido por indometacina, es posible comparar o la dosis diaria total que se usa en animales frente a humanos o la dosis en mg/kg mediante el uso del factor de corrección de dosis equivalente en humanos. En el caso, por ejemplo, de rifaximina gastrorresistente (3 mg/kg diarios por 14 días correspondiente a una dosis equivalente en humanos de 0,5 mg/kg) en un intervalo de dosis equivalentes en humanos entre 8 mg/kg y 16 mg/kg.
La dosificación efectiva de rifaximina que se administra en el modelo animal en términos de dosis equivalentes en humanos es menor que (8 mg/kg) o ligeramente menor (16 mg/kg) con respecto a la dosis que se usa en el ensayo clínico (27 mg/kg) e incluso si se evalúan los niveles de hemoglobina, MPO y daño histológico en humanos, se esperan los mismos resultados.
Ejemplo 17: Efectos de la rifaximina gastrorresistente en la enteropatía inducida por indometacina y diclofenaco en ratas
Se analizaron un total de ciento cuarenta y dos (142) ratas macho Albino Sprague Dawley, de 500 a 600 g de peso corporal (40 semanas de edad).
Se indujo la enteropatía en sesenta y seis (66) ratas macho Albino Sprague Dawley, mediante el uso de indometacina y en cincuenta y cuatro (54) ratas macho Albino Sprague Dawley mediante el uso de diclofenaco, en presencia o ausencia de omeprazol.
La enteropatía inducida mediante el uso de indometacina se llevó a cabo en los grupos 1 a 7 de la siguiente manera: (referencial)
Grupo 1: diez animales que se tratan con vehículo de fármaco por 14 días (controles normales).
Grupo 2: quince animales que se tratan con 1,5 mg/kg BID de indometacina por 14 días (controles ulcerados con indometacina).
Grupo 3: quince animales que se tratan con indometacina, 1,5 mg/kg BID, que se tratan conjuntamente con 0,7 mg/kg de omeprazol una vez diaria por 14 días (controles ulcerados con indometacina más omeprazol).
Grupo 4: doce animales que se tratan con indometacina, 1,5 mg/kg BID, que se tratan conjuntamente con rifaximina gastrorresistente (50 mg/kg BID) por 14 días.
Grupo 5: doce animales que se tratan con indometacina (1,5 mg/kg BID) y omeprazol (0,7 mg/kg/día), que se tratan conjuntamente con rifaximina gastrorresistente (50 mg/kg BID) por 14 días.
Grupo 6: doce animales que se tratan con omeprazol que se tratan conjuntamente con rifaximina gastrorresistente (50 mg/kg BID) por 14 días (controles de omeprazol).
Grupo 7: doce animales que se tratan previamente con rifaximina gastrorresistente, 50 mg/kg BID, por 1 semana, seguido de indometacina con tratamiento conjunto con rifaximina gastrorresistente por 14 días (50 mg/kg BID).
La enteropatía inducida mediante el uso de diclofenaco se llevó a cabo en los grupos 8 a 11 de la siguiente manera: (invención)
Grupo 8: quince animales que se tratan con diclofenaco 4 mg/kg BID (control ulcerado de diclofenaco).
Grupo 9: quince animales que se tratan con diclofenaco 4 mg/kg BID y omeprazol 0,7 mg/kg una vez diaria (control ulcerado de diclofenaco y omeprazol).
Grupo 10: doce animales que se tratan con diclofenaco que se tratan conjuntamente con rifaximina gastrorresistente (50 mg/kg BID) por 14 días.
Grupo 11: doce animales que se tratan con diclofenaco y omeprazol que se tratan conjuntamente con rifaximina gastrorresistente (50 mg/kg BID) por 14 días.
Los grupos 1 a 11 se trataron de la siguiente manera:
El grupo 1 recibió metilcelulosa al 1 % (0,3 ml/rata) y metilcelulosa al 1 % (1 ml/rata) por 14 días.
Se trataron las ratas del grupo 2 sin ayuno por 14 días con 1,5 mg/kg BID de indometacina por vía intragástrica, se suspendió en metilcelulosa al 1 % y se administró en un volumen de 0,3 ml/rata.
Se trataron las ratas del grupo 3 sin ayuno por 14 días con indometacina 1,5 mg/kg BID, más omeprazol 0,7 mg/kg una vez diaria, por vía intragástrica, se suspendieron en metilcelulosa al 1 % y se administraron en un volumen de 0,3 ml/rata.
El grupo 4 recibió rifaximina gastrorresistente (50 mg/kg; 12 ratas/grupo) que se suspendió en metilcelulosa al 1 % (1 ml/rata), dos veces diarias, 1 hora antes de la administración de indometacina.
El grupo 5 recibió rifaximina gastrorresistente (50 mg/kg; 12 ratas/grupo) que se suspendió en metilcelulosa al 1 % (1 ml/rata), dos veces diarias, 1 hora antes de la administración de indometacina más omeprazol 0,7 mg/kg una vez diaria.
El grupo 6 recibió rifaximina gastrorresistente (50 mg/kg; 12 ratas/grupo) que se suspendió en metilcelulosa al 1 % (1 ml/rata), dos veces diarias, 1 hora antes de omeprazol 0,7 mg/kg una vez diaria.
El grupo 7 recibió tratamiento previo con rifaximina gastrorresistente 50 mg/kg BID por 1 semana seguido de un tratamiento conjunto con indometacina con rifaximina gastrorresistente 1 hora antes de la administración de indometacina por 14 días.
Se trataron las ratas del grupo 8 sin ayuno por 14 días con diclofenaco 4 mg/kg BID por vía intragástrica, que se suspendió en metilcelulosa al 1 % y se administran en un volumen de 0,3 ml/rata.
Se trataron las ratas del grupo 9 sin ayuno por 14 días con diclofenaco 4 mg/kg BID, más omeprazol 0,7 mg/kg una vez diaria, por vía intragástrica, se suspendieron en metilcelulosa al 1 % y se administraron en un volumen de 0,3 ml/rata.
El grupo 10 recibió rifaximina gastrorresistente (50 mg/kg; 12 ratas/grupo) que se suspendió en metilcelulosa al 1 % (1 ml/rata), dos veces diarias, 1 hora antes de la administración de diclofenaco.
El grupo 11 recibió rifaximina gastrorresistente (50 mg/kg; 12 ratas/grupo) que se suspendió en metilcelulosa al 1 % (1 ml/rata), dos veces diarias, 1 hora antes de la administración de diclofenaco más omeprazol 0,7 mg/kg una vez diaria.
Veinticuatro horas después de la última dosis, las ratas se sacrificaron y se recogieron muestras de sangre para analizar los niveles de hemoglobina.
Se retiró todo el tracto intestinal y se procesaron muestras de tejido intestinal para la evaluación de los niveles de mieloperoxidasa del tejido (MPO), un índice de infiltración de neutrófilos en los tejidos, de los niveles de malondialdehído del tejido (MDA), un índice de peroxidación lipídica y un análisis histológico del daño intestinal en el yeyuno y el íleon.
El análisis de hemoglobina se realizó en muestras de sangre que se recogieron como se reporta anteriormente, mediante el uso de un kit de ensayo Quantichrom Hemoglobin (Bioassay Systems, Hayward, CA, Ee .UU.) y se expresó como g/dl.
La MPO se analizó como se describe por Fornai y otros, NSAID-Induced Enteropathy: Are the Currently Available Selective COX-2 Inhibitors All the Same, J Pharmacol Exp Ther enero del 2014348:86-95 y se asumió como un índice cuantitativo para estimar el grado de infiltración de la pared intestinal por células polimorfonucleares.
Se homogeneizaron muestras de 30 mg de tejidos intestinales en hielo con un homogeneizador Polytron (QIAGEN, Milán, Italia) en 0,6 ml de tampón de lisis helado que consiste en NaCI 200 mM, EDTA 5 mM, Tris 10 mM, glicerina al 10 %, fluoruro de fenilmetilsulfonilo 1 mM, 1 pg/ml de leupeptina y 28 pg/ml de aprotinina a pH 7,4. El homogeneizado se centrifugó 2 veces a pH 41 mM 15 min a 1500 g. El sobrenadante se diluyó 1:5 y se usó para la determinación de la concentración de MPO por medio de un ensayo de inmunoabsorción ligado a enzimas (ELISA) (Hycult Biotech, Uden, Holanda). Todas las muestras se analizaron como se describe en el Ejemplo 15. Los resultados se expresaron como nanogramos de MPO por miligramo de tejido intestinal.
La concentración de MDA en los tejidos intestinales se determinó para obtener estimaciones cuantitativas de la peroxidación de los lípidos de la membrana de acuerdo como se describe por Fornai y otros, NSAID-Induced Enteropathy: Are the Currently Available Selective COX-2 Inhibitors All the Same? J Pharmacol Exp Ther enero del 2014348:86-95. Para este propósito, se extrajo tejido intestinal, se pesó, se trituró con pinzas, se homogeneizó en 2 ml de tampón frío que consiste en Tris-HCl 20 mM, a pH 7,4, mediante el uso de un homogeneizador polytron (QIAGEN, Milán, Italia), y se centrifugó a 1500 g durante 10 min a 4 °C. Luego se usaron alícuotas de sobrenadantes para los procedimientos de ensayo subsecuentes. Las concentraciones de MDA en las mucosas se estimaron mediante el uso un kit de ensayo colorimétrico (Cayman Chemical, Ann Arbor, MI, EE.UU.). Los resultados se expresaron como nanomoles de MDA por miligramo de tejido intestinal.
La evaluación histológica de la lesión intestinal se llevó a cabo como se describe previamente por Fornai y otros, NSAID- Induced Enteropathy: Are the Currently Available Selective COX-2 Inhibitors All the Same? J Pharmacol Exp Ther enero del 2014348:86-95.
Tras retirarlo, todo el tracto intestinal se inyectó inmediatamente con formalina al 10 % y se dejó en la misma solución fijadora. Después de 30 min, se abrió a lo largo del borde anti-mesentérico, se limpió de contenido fecal y se fijó en formalina al 10 % por 24 h. Se tomaron muestras de tejido como se describe a más abajo para descartar cualquier sesgo:
Se midió la longitud completa del intestino delgado. En particular:
- Yeyuno proximal: se tomaron dos muestras de 1,5-2 cm a 5 cm de distancia ya sea del extremo proximal como distal del 37,5 % de la longitud total del intestino delgado.
- Yeyuno distal: se tomaron dos muestras de 1,5-2 cm a 5 cm de distancia ya sea del extremo proximal como distal del 81 % de la longitud total del intestino delgado.
- Íleon: se descartó 1 cm de tejido proximal a la válvula ileocecal y se tomaron dos muestras de 1,5-2 cm de íleon en este borde así como también a 5 cm de distancia de la primera muestra de íleon.
Las secciones del yeyuno y el íleon se incrustaron en bloques de parafina y se cortaron en 3 secciones consecutivas de 7-8 mm en serie. Las láminas se cortaron en dos puntos diferentes del bloque: dos en la superficie y tres en un nivel más profundo. Cada lámina se colocó en el portaobjetos para teñir con hematoxilina y eosina. El daño histológico se analizó por dos observadores, ciegos al tratamiento, de acuerdo con el sistema de puntuación que se propone por Fornai y otros, NSAID-Induced Enteropathy: Are the Currently Available Selective COX-2 Inhibitors All the Same? J Pharmacol Exp Ther enero del 2014348:86-95.
El daño intestinal se clasificó como se reporta en la Tabla 27, en donde se hace referencia con respecto a la apariencia histológica de las lesiones de tipo 1,2 y 3 del yeyuno y el íleon a la ilustración de la Figura 1.
Los resultados se presentaron como media ± error estándar de la media (SEM). La significación estadística de los datos se evaluó mediante un análisis de varianza de una vía (ANOVA) seguido de un análisis post hoc mediante la prueba de Student-Newman-Keuls, y los valores de P inferiores a 0,05 se consideraron significativos. Todos los procedimientos estadísticos se realizaron mediante el uso del software GraphPad Prism 3.0 (GraphPad Prism, San Diego, CA, EE.UU.).
Al final del período de tratamiento, el grupo que se trata con indometacina mostró una tasa de mortalidad del 13,3 % como se reporta en las Tablas 25 y 26. En los grupos que se tratan con indometacina más omeprazol (Grupo 3), indometacina y rifaximina gastrorresistente, con 1 semana de tratamiento previo con rifaximina gastrorresistente (Grupo 7) o indometacina y rifaximina gastrorresistente (Grupo 4) la tasa de mortalidad fue inferior a 6,7, 8,3 y 8,3 % respectivamente, mientras que no se observaron muertes en animales que se tratan con indometacina más omeprazol y rifaximina gastrorresistente (Grupo 5) u omeprazol y rifaximina gastrorresistente (Grupo 6) como se reporta en la Tabla 26. La tasa de mortalidad más destacada correspondiente al 46,7% se observa en animales que se tratan con diclofenaco (Grupo 8) como se reporta en las Tablas 25 y 26. En los animales que se tratan con diclofenaco y omeprazol (Grupo 9) o diclofenaco y rifaximina gastrorresistente (Grupo 10), la tasa de mortalidad fue significativamente inferior, 6,7 y 13,3 % respectivamente, en comparación con el grupo que se trata con diclofenaco solo, mientras que todos los animales que se tratan con diclofenaco más omeprazol y la rifaximina gastrorresistente (Grupo 11) sobrevivieron (Tabla 26).
Tabla 25: Efectos de la indometacina y el diclofenaco sobre la tasa de mortalidad, la hemoglobina en sangre y los parámetros inflamatorios y oxidativos de los tejidos
*P<0,05 frente al control **referencial ***invención
Tabla 26: Tasas de mortalidad en grupos de tratamiento
Los animales que se tratan con indometacina (1,5 mg/kg BID) o diclofenaco (4 mg/kg BID) por 14 días mostraron una disminución significativa en la concentración de hemoglobina en sangre (Tabla 25).
La administración concomitante de omeprazol no afectó a la concentración reducida de hemoglobina como se muestra en la Figura 6.
En animales que se tratan con indometacina y rifaximina gastrorresistente, con 1 semana de pretratamiento con rifaximina gastrorresistente (Grupo 7) o indometacina y rifaximina gastrorresistente (Grupo 4) o indometacina más omeprazol y rifaximina gastrorresistente (Grupo 5), los niveles de hemoglobina aumentaron significativamente en comparación con indometacina más omeprazol (Grupo 3), mientras que en ratas que se tratan con indometacina y rifaximina gastrorresistente, los niveles de hemoglobina también fueron significativamente diferentes de aquellos que se observan en el grupo que se trata con indometacina sola como se muestra en la Figura 6A y la Figura 6B. De
manera similar, en animales que se tratan con diclofenaco y rifaximina gastrorresistente (Grupo 10) o diclofenaco más omeprazol y rifaximina gastrorresistente (Grupo 11), la concentración de hemoglobina fue superior en comparación con diclofenaco solo como se muestra en la Figura 6. En ratas que se tratan con omeprazol y rifaximina gastrorresistente (Grupo 6), no hubo cambios significativos en los niveles de hemoglobina en sangre (Figura 6A y Figura 6B).
Los niveles de MPO en las muestras de yeyuno que se extraen de las ratas de control representan 9,74 ng/mg de tejido como se reporta en la Tabla 25. En los animales que se tratan con indometacina (1,5 mg/kg BID) o diclofenaco (4 mg/kg BID) por 14 días, los niveles de MPO aumentaron significativamente hasta 24,84 y 20,37 ng/mg de tejido respectivamente, como se reporta en la Tabla 25. En el íleon, la concentración de MPO en los animales de control fue de 7,48 ng / mg de tejido.
La administración de indometacina 1,5 mg/kg BID o diclofenaco 4 mg/kg BID por 14 días se asoció con un aumento significativo de MPO hasta 21,42 y 19,35 ng/mg de tejido respectivamente como se reporta en la Tabla 25.
En el yeyuno de ratas que se tratan con indometacina más omeprazol, los niveles de MPO fueron inferiores en comparación con la indometacina sola, aunque fueron significativamente superiores en comparación con los valores de control.
Los animales que se tratan con indometacina y rifaximina gastrorresistente, con 1 semana de pretratamiento con rifaximina gastrorresistente (Grupo 7) o indometacina y rifaximina gastrorresistente (Grupo 4) o indometacina más omeprazol y rifaximina gastrorresistente (Grupo 5) u omeprazol más rifaximina gastrorresistente, los niveles de MPO de yeyuno fueron similares a aquellos que se observan en ratas de control como se muestra en la Figura 7A.
En el íleon de ratas que se tratan con indometacina y rifaximina gastrorresistente, con 1 semana de pretratamiento con rifaximina gastrorresistente (grupo 7) o indometacina y rifaximina gastrorresistente (grupo 4) o indometacina más omeprazol y rifaximina gastrorresistente (grupo 5) u omeprazol más rifaximina gastrorresistente, hubo una disminución significativa en la concentración de MPO, en comparación con los animales que se tratan con indometacina sola como se muestra en la Figura 7B. En ratas que se tratan con diclofenaco, la coadministración de omeprazol no provocó ningún cambio significativo en los niveles de MPO de yeyuno, mientras que en animales que se tratan con diclofenaco y rifaximina gastrorresistente, diclofenaco más omeprazol y rifaximina gastrorresistente u omeprazol y rifaximina gastrorresistente, las concentraciones de MPO fueron similares a aquellas que se detectaron en animales de control como se muestra en la Figura 7C. Se observaron patrones similares de los niveles de MPO en el íleon como se muestra en la Figura 7D.
En el yeyuno de las ratas de control, la concentración de MDA fue 28,23 nmol/mg de tejido como se reporta en la Tabla 26. Los animales que se tratan con indometacina (1,5 mg/kg BID) o diclofenaco (4 mg/kg BID) por 14 días mostraron incrementos significativos en los niveles de MDA en el yeyuno de 66,15 y 69,44 nmol/mg de tejido respectivamente como se reporta en la Tabla 26.
En el íleon, los niveles de MDA en los animales de control fueron de 20,63 nmol/mg de tejido como se muestra en la Tabla 26. El tratamiento con indometacina o diclofenaco resultó en un aumento significativo en los niveles de MDA hasta 54,47 y 67,1 nmol/mg de tejido respectivamente, que se reporta en la Tabla 26.
En ratas que se tratan con indometacina, la coadministración de omeprazol no modificó los niveles de MDA, tanto en el yeyuno como en el íleon (Figura 8A y Figura 8B). En animales que se tratan con indometacina y rifaximina gastrorresistente, con 1 semana de pretratamiento con rifaximina gastrorresistente (Grupo 7) o indometacina y rifaximina gastrorresistente (Grupo 4) o indometacina más omeprazol y rifaximina gastrorresistente (Grupo 5) u omeprazol más rifaximina gastrorresistente, se observa una reducción significativa de los niveles de MDA, tanto en el yeyuno como en el íleon, que alcanza valores similares a los aquellos que se observan en los tejidos intestinales de los animales de control como se muestra en la Figura 8A y B.
Los niveles de MDA que se detectaron en el yeyuno y el íleon de ratas que se tratan con diclofenaco más omeprazol fueron similares a aquellos que se observan en animales que se tratan con diclofenaco solo como se muestra en la Figura 8C y la Figura 8D. En ratas que se tratan con diclofenaco y rifaximina gastrorresistente, diclofenaco más omeprazol y rifaximina gastrorresistente, las concentraciones de MDA en el yeyuno y el íleon se redujeron en comparación con los valores que se obtienen en el grupo que se trata con diclofenaco, aunque son significativamente superiores que aquellos de las ratas de control como se muestra en la Figura 8C y D.
En el yeyuno y el íleon que se obtienen de animales de control, el examen microscópico no reveló ninguna lesión de Tipo 1,2 y 3 como se reporta en la Tabla 27. La administración de 1,5 mg/kg BID de indometacina o 4 mg/kg BID de diclofenaco por 14 días se asocia con la aparición de varios grados de lesiones de tipo 1, 2 y 3 tanto en yeyuno como en íleon como se reporta en la Tabla 27.
En el yeyuno de ratas que se tratan con indometacina, la coadministración de omeprazol se asocia con una reducción significativa de las lesiones de tipo 1, 2 y 3.
En animales que se tratan con indometacina y rifaximina gastrorresistente, con 1 semana de pretratamiento con rifaximina gastrorresistente (Grupo 7) o indometacina y rifaximina gastrorresistente (Grupo 4) o indometacina más omeprazol y rifaximina gastrorresistente (Grupo 5) u omeprazol más rifaximina gastrorresistente (Grupo 6), las lesiones de yeyuno se redujeron significativamente o estaban ausentes, en comparación con el grupo que se trata con indometacina sola como se muestra en la Figura 9.
En el íleon de ratas que se tratan con indometacina más omeprazol, las tasas de lesiones de tipo 1, 2 y 3 fueron similares a aquellas que se observan en animales que se tratan con indometacina sola.
En ratas que se tratan con indometacina y rifaximina gastrorresistente, con 1 semana de pretratamiento con rifaximina gastrorresistente (Grupo 7) o indometacina y rifaximina gastrorresistente (Grupo 4) o indometacina más omeprazol y rifaximina gastrorresistente (Grupo 5) u omeprazol más rifaximina gastrorresistente (Grupo 6), las lesiones en el íleon se redujeron significativamente o estaban ausentes, en comparación con el grupo que se trata con indometacina sola como se muestra en la Figura 10.
En ratas que se tratan con diclofenaco más omeprazol, las lesiones de yeyuno de tipo 2 fueron significativamente superiores en comparación con aquellas que se observan en animales que se tratan con diclofenaco solo, mientras que no se detectaron diferencias para las lesiones de tipo 1 y 3.
En los grupos que se tratan con diclofenaco y rifaximina gastrorresistente (Grupo 10) o diclofenaco más omeprazol y rifaximina gastrorresistente (Grupo 11), todos los tipos de lesiones se redujeron significativamente, en comparación con las ratas que se tratan con diclofenaco solo, mientras que no se observaron lesiones en el yeyuno de animales que se tratan con omeprazol más rifaximina gastrorresistente como se muestra en la Figura 11.
El íleon que se extrae de animales que se tratan con diclofenaco más omeprazol (Grupo 9) muestra tasas de lesiones de tipo 1,2 y 3 similares a aquellas que se observan en animales que se tratan con diclofenaco solo.
En los grupos que se tratan con diclofenaco y rifaximina gastrorresistente (Grupo 10) o diclofenaco más omeprazol y rifaximina gastrorresistente (Grupo 11), todos los tipos de lesiones se redujeron significativamente, en comparación con aquellas que se observan en ratas que se tratan con diclofenaco solo, mientras que no se observaron lesiones en el íleon de animales que se tratan con omeprazol más rifaximina gastrorresistente como se muestra en la Figura 12.
Tabla 27: Análisis microscópico del daño del intestino delgado inducido por indometacina y diclofenaco
* P<0,05 frente al control ** invención ***referencial
La administración de rifaximina gastrorresistente a la dosis de 50 mg/kg BID se asocia con una mejora significativa de los parámetros de inflamación de tejido y estrés oxidativo, así como también las puntuaciones de lesión histológica determinadas por el AINE solo o en combinación con el IBP.
La dosis de rifaximina gastrorresistente que se usa corresponde a una dosis equivalente humana de 16 mg/kg diarios, que se compara con una dosis humana que se usa en el Ejemplo 18 de 27 mg/kg.
Las dosis de diclofenaco y omeprazol que se usan en el experimento con ratas, para inducir el daño, corresponden a una dosis equivalente humana de 1,29 mg/kg y 0,11 mg/kg, respectivamente, que se comparan con una dosis humana de 2,5 mg/kg y 0,33 mg/kg.
Los resultados mostraron que la administración de rifaximina gastrorresistente (50 mg/kg, correspondiente a una dosis equivalente humana de 16 mg/kg diarios) se asocia con una mejora significativa de los parámetros de inflamación de tejido y estrés oxidativo, así como también las puntuaciones de lesión histológica causadas por indometacina, si se administra desde 1 semana antes de iniciar la administración de AINE (en este caso en ausencia de IBP) hasta 1 hora antes de cada dosis diaria de AINE. En el estudio clínico la rifaximina se coadministra con diclofenaco o con diclofenaco más omeprazol.
Dado que la dosis efectiva de rifaximina que se usa en el Ejemplo 18, en términos de dosis equivalente humana es ligeramente inferior (16 mg/kg) con respecto a la dosis que se usa en el ensayo clínico (27 mg/kg), los resultados del estudio con ratas en términos de resultados histológicos en íleon y yeyuno y niveles de hemoglobina y los resultados de MPO se pueden usar como medida de daño e inflamación y/o enfermedad cardiovascular, en humanos, que reivindica que si estas pruebas se realizan también en el estudio clínico, se esperan obtener resultados similares.
Watanabe y otros (2013) reportaron recientemente que los IBP exacerban la lesión del intestino delgado en pacientes con artritis reumatoide que toman AINE a largo plazo. Además, los pacientes con daño grave tenían niveles de hemoglobina significativamente inferiores que aquellos sin daño, como también se observa en la rata donde el uso de diclofenaco o diclofenaco más IBP reduce los niveles de hemoglobina con respecto al grupo control. Es la primera vez que se demuestra que la rifaximina gastrorresistente es efectiva en la prevención del daño a la mucosa inducido por un AINE que se administra por 14 días en combinación con un IBP, que podría incluso exacerbar el daño intestinal. La administración de omeprazol en combinación con los AINE en el Ejemplo 17 no parece afectar los parámetros que se evaluaron de daño intestinal, con menos excepciones.
Ejemplo 18: Eficacia de la rifaximina en la prevención de lesiones del intestino delgado causadas por tabletas de Diclofenaco SR 75 mg BID más cápsulas de Omeprazol 20 mg una vez al día (OD) en voluntarios sanos
Se inscribieron 60 voluntarios sanos en un estudio clínico, aleatorizado y de un solo centro para evaluar la eficacia y seguridad de los microgránulos gastrorresistentes de rifaximina 800 mg (2 tabletas de 400 mg) dos veces al día (BID) para prevenir lesiones del intestino delgado causadas por tabletas de Diclofenaco SR 75 mg BID más cápsulas de Omeprazol 20 mg una vez al día (OD) en voluntarios sanos. Los hallazgos del intestino delgado se analizaron a través de endoscopia con cápsula de video (VCE). La demografía y otra fecha de referencia de los voluntarios que se inscribieron se reportan en la Tabla 28.
Tabla 28: Demografía y otros datos de referencia -conjunto de análisis completo modificado (mFA), conjunto de análisis por protocolo (PP) y conjunto de seguridad
Los principales criterios de inclusión para inscribir voluntarios en el estudio incluyeron:
- sujetos masculinos o femeninos no embarazadas, no lactantes de 18 años a 64 años de edad, inclusive;
- hallazgos normales en el examen físico y las evaluaciones de laboratorio;
- no más de 1 ruptura de la mucosa en el VCE de referencia;
- los sujetos firmaron por escrito el consentimiento informado.
Los principales criterios de exclusión incluyeron:
- uso de esteroides orales y sistémicos, otros AINE (que incluye aspirina en dosis bajas y aminosalicilatos), compuestos biológicos, sulfasalazina, misoprostol y otros compuestos protectores de las mucosas, bisfosfonatos, dentro de las 4 semanas antes y durante el cribado;
- uso de probióticos, prebióticos, rifaximina y otros antimicrobianos, dentro de las 8 semanas antes y durante el cribado;
- uso de fármacos procinéticos dentro de las 2 semanas antes y durante el cribado;
- abuso de alcohol;
- riesgo de embarazo sin anticoncepción adecuada;
- evidencia de úlcera duodenal y/o gástrica activa, diverticulitis, gastroenteritis infecciosa, estenosis u obstrucción intestinal;
- una afección médica significativa que, en opinión del investigador impide la participación en el estudio.
Treinta (30) sujetos sanos fueron aleatorizados en cada uno de los dos grupos de tratamiento:
Grupo 1: una tableta de diclofenaco SR 75 mg cada 12 horas más una cápsula de omeprazol 20 mg una vez al día más dos tabletas placebo que corresponden a rifaximina cada 12 horas, por vía oral, por 14 días.
Grupo 2: una tableta de diclofenaco SR 75 mg cada 12 horas más una cápsula de omeprazol 20 mg una vez al día más dos tabletas de microgránulos gastrorresistentes de rifaximina 400 mg cada 12 horas, por vía oral, por 14 días.
Este estudio tuvo una duración de aproximadamente 5 semanas y consistió en:
Período de cribado: incluyó una visita de cribado para sujetos potenciales, para realizar investigaciones clínicas y pruebas de laboratorio, seguida de un VCE de referencia en la visita 2.
Período de tratamiento: los sujetos elegibles se aleatorizaron en dos grupos de tratamiento en la visita de aleatorización. Cada día durante el período de tratamiento de 14 días, cada sujeto recibió diclofenaco y omeprazol con rifaximina o un placebo que corresponde a rifaximina.
Visita final: se realiza dentro de las 36 horas después de la última administración del fármaco e incluye VCE, análisis clínicos y pruebas de laboratorio.
Se realizó un seguimiento telefónico una semana después de la última visita.
El criterio primario de valoración de la eficacia fue el porcentaje de sujetos que desarrollaron al menos una rotura de la mucosa en la visita final que se evaluaron por VCE y se analizaron de acuerdo con un sistema de puntuación validado que se reporta en la Tabla 29.
Tabla 29
Los criterios secundarios de valoración de la eficacia fueron los cambios de la referencia a la visita final en el número de lesiones de la mucosa en el intestino delgado y el cambio de la referencia a la visita final en el número de lesiones de la mucosa en el intestino delgado con/sin hemorragia (sangre visible).
Los parámetros de seguridad que se consideran son: eventos adversos (EA), parámetros de laboratorio clínico tales como hematología, química clínica y análisis de orina, y signos vitales.
Al final de 2 semanas de tratamiento con diclofenaco más omeprazol, la tasa de sujetos que desarrollaron al menos una lesión de la mucosa en el intestino delgado fue el doble en el grupo placebo, 13 sujetos que corresponden al 43,3 % en comparación con 6 sujetos del grupo de rifaximina que corresponden a un 20 %. En particular, la proporción de sujetos que desarrollaron las lesiones en comparación con la proporción de sujetos que no desarrollaron las lesiones fue muy inferior en el grupo de rifaximina 20 % frente a 80 % que en el grupo placebo 43,3% frente a 56,7 %, lo que sugiere fuertemente una acción protectora de rifaximina sobre el daño de las mucosas causado por diclofenaco por el tratamiento de 14 días como se reporta en la Tabla 30.
Tabla 30
Un análisis de regresión logística confirmó una tendencia hacia la protección de la rifaximina en las lesiones de la mucosa inducidas por diclofenaco, con relaciones impares (OR) de 0,3269 [95 % CI 0,1035, 1,0322] (Chi-cuadrado valor de p=0,0566). En el análisis de subgrupos que incluye el sexo como efecto fijo y la edad como covariable, la diferencia entre los tratamientos fue estadísticamente significativa (OR 0,3074 [95 % CI 0,0950, 0,9948]; valor de p=0,0490).
El cambio de la referencia en el número total de lesiones fue superior en el grupo placebo que en el grupo de rifaximina (1,2±2,3 frente a 0,3±0,7). Todas las lesiones de la mucosa que se detectaron en el análisis final fueron lesiones sin hemorragia. No se observaron lesiones con hemorragia (Tabla 31). Los resultados del análisis estadístico mediante regresión binomial negativa indicaron claramente un efecto protector de la rifaximina sobre los cambios medios de referencia en el número total de lesiones (efecto del tratamiento OR -1,4137 [95 % CI -2,4935, -0,3339]) y lesiones sin hemorragia (efecto del tratamiento OR -1,4404 [95 % CI -2,5266, -0,3541]). El efecto fue estadísticamente significativo (valor de p=0,0103 y 0,0094 para el total de lesiones y lesiones sin hemorragia, respectivamente).
Tabla 31
Notablemente, al final de las 2 semanas de tratamiento en la visita final, solo se detectaron grandes erosiones/úlceras (categoría 4) en el grupo placebo en 9 sujetos que corresponden a un 30 %. No se observaron grandes erosiones/lesiones en el grupo de rifaximina. Todas las grandes erosiones/úlceras que se observaron en el grupo placebo fueron lesiones sin hemorragia.
Tabla 32
En este estudio, se observó claramente un efecto protector de la rifaximina sobre las lesiones de la mucosa inducidas por diclofenaco. Los resultados primarios de eficacia mostraron que menos sujetos en el grupo de rifaximina que en el grupo placebo desarrollaron al menos una lesión de la mucosa en el intestino delgado durante el estudio. Los resultados del análisis secundario sobre los cambios de la referencia, por otra parte, mostraron claramente una diferencia estadísticamente significativa en el número total de lesiones y lesiones sin hemorragia, lo que confirma por tanto una acción protectora de la rifaximina sobre el daño gastrointestinal inducido por diclofenaco.
Ejemplo 19: Seguridad de rifaximina de microgránulos de rifaximina gastrorresistente que se coadministran con tabletas de Diclofenaco SR 75 mg BID más cápsulas de Omeprazol 20 mg OD en voluntarios sanos
La tendencia hacia un efecto protector de la rifaximina sobre el daño gastrointestinal también se reflejó en el número de eventos adversos emergentes del tratamiento (TEAE) que se reportan en los grupos de rifaximina y placebo durante
el estudio. De hecho, apareció un número ligeramente inferior de TEAE en el grupo de rifaximina en comparación con el grupo placebo.
En general, se reportaron 97 TEAE: 44 TEAE se experimentaron por 21 sujetos que corresponden al 67,7 % en el grupo de rifaximina, y 53 TEAE por 22 sujetos que corresponden al 73,3 % en el grupo placebo. Sesenta y seis de los TEAE que se reportan, 26 con rifaximina en 14 sujetos y 40 con placebo en 18 sujetos, fueron considerados por el investigador como relacionados con el tratamiento y se reportan en la Tabla 33. En particular, los trastornos gastrointestinales, la clase más común de sistema de órganos relacionados para los TEAe , se reportaron por 11 sujetos que corresponden al 35,5 % con rifaximina y 16 sujetos que corresponden al 53,3 % con placebo. Los TEAE más frecuentes relacionados (>5 %) fueron náuseas, dolor abdominal superior, diarrea y distensión abdominal. Se reportó dolor de cabeza por 3 de 31 sujetos solo en el grupo de rifaximina. Solo se reportaron dolor abdominal, dispepsia y aumento de alanina aminotransferasa en el grupo placebo, con una frecuencia > 5 %. No hubo muertes ni EAG durante el estudio. No se observaron cambios clínicamente significativos en los signos vitales o los parámetros de laboratorio.
Tabla 33
(continuación)
La tendencia hacia una protección de la rifaximina sobre el daño gastrointestinal también se reflejó en el número de eventos adversos emergentes del tratamiento que se reportan durante el estudio. En particular, los trastornos gastrointestinales aparecieron con una frecuencia superior en el grupo placebo que en el grupo de rifaximina. En general, los resultados de seguridad confirman un perfil de tolerabilidad favorable del producto en investigación.
Claims (7)
- REIVINDICACIONESi. Rifaximina en combinación con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional para el uso en un método para tratar o prevenir la enteropatía en un individuo que se somete a la administración de AINE, en donde el AINE es diclofenaco, ketoprofeno, naproxeno, ibuprofeno, ácido acetilsalicílico o mezclas de los mismos y en donde la rifaximina está en forma gastrorresistente o en forma de microgránulos gastrorresistentes y se administra por vía oral en una cantidad de 20 mg a 3300 mg por día.
- 2. La rifaximina en combinación con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional como se define en la reivindicación 1 para el uso de acuerdo con la reivindicación 1, en donde el inhibidor de la bomba de protones se selecciona de omeprazol, ilaprazol, lansoprazol, tenatoprazol, rabeprazol, esomeprazol, pantoprazol, pariprazol, leminoprazol o nepaprazol o una base libre, un ácido libre, una sal, un hidrato, un enantiómero, un tautómero o un polimorfo de los mismos.
- 3. La rifaximina en combinación con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional como se define en la reivindicación 1 para el uso de acuerdo con la reivindicación 1 o 2, en donde el AINE es diclofenaco.
- 4. La rifaximina en combinación con al menos un inhibidor del ácido gástrico y opcionalmente un antibiótico adicional como se define en la reivindicación 1 para el uso de acuerdo con cualquiera de las reivindicaciones 1 a 3, en donde el inhibidor de la bomba de protones es omeprazol.
- 5. La rifaximina en combinación con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional como se define en la reivindicación 1 para el uso de acuerdo con las reivindicaciones 1 a 4, en donde la rifaximina se administra en una cantidad de 400 mg a 800 mg una vez al día, dos veces al día, tres veces al día, o cuatro veces al día o más a menudo.
- 6. La rifaximina en combinación con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional como se define en la reivindicación 1 para el uso de acuerdo con las reivindicaciones 1 a 5, en donde la rifaximina en forma gastrorresistente o en forma de microgránulos gastrorresistentes es una rifaximina cruda, una rifaximina polimórfica o una rifaximina amorfa o una mezcla de las mismas.
- 7. La rifaximina en combinación con al menos un inhibidor de la bomba de protones y opcionalmente un antibiótico adicional o como se define en la reivindicación 1 para el uso de acuerdo con las reivindicaciones 1 a 6, en donde la rifaximina, el al menos un inhibidor de la bomba de protones y opcionalmente el antibiótico adicional se administran simultáneamente, secuencialmente o en combinación con el AINE.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361811619P | 2013-04-12 | 2013-04-12 | |
| US201361845240P | 2013-07-11 | 2013-07-11 | |
| PCT/IB2014/060640 WO2014167533A1 (en) | 2013-04-12 | 2014-04-11 | Nsaid administration and related compositions, methods and systems. |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2829285T3 true ES2829285T3 (es) | 2021-05-31 |
Family
ID=50687535
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES14723122T Active ES2829285T3 (es) | 2013-04-12 | 2014-04-11 | Administración de AINE y composiciones, métodos y sistemas relacionados |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US20140308350A1 (es) |
| EP (1) | EP2983647B1 (es) |
| JP (1) | JP6433980B2 (es) |
| KR (1) | KR102190173B1 (es) |
| CN (1) | CN105324109A (es) |
| AU (1) | AU2014252219B2 (es) |
| CA (1) | CA2908525C (es) |
| EA (1) | EA032705B1 (es) |
| ES (1) | ES2829285T3 (es) |
| MX (1) | MX374340B (es) |
| NZ (1) | NZ713440A (es) |
| PL (1) | PL2983647T3 (es) |
| PT (1) | PT2983647T (es) |
| WO (1) | WO2014167533A1 (es) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL1698630T3 (pl) | 2005-03-03 | 2014-12-31 | Alfasigma Spa | Nowe postacie polimorficzne rifaksyminy,sposoby ich wytwarzania i ich zastosowanie w preparatach leczniczych |
| JP6576953B2 (ja) | 2014-05-12 | 2019-09-18 | アルファシグマ ソシエタ ペル アチオニ | リファキシミンの新規溶媒和物結晶形、生成物、組成物及びそれらの使用 |
| CN107550908A (zh) * | 2016-06-30 | 2018-01-09 | 康普药业股份有限公司 | 一种治疗下肠道溃疡的药物组合物 |
| US20190336511A1 (en) * | 2018-05-02 | 2019-11-07 | Georgiy Brusovanik | Treatment for Inflammation and Pain with Reduced Gastro-Intestinal Side Effects Combining Methylprednisolone, Paracetamol, and Lansoprazole |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1154655B (it) | 1980-05-22 | 1987-01-21 | Alfa Farmaceutici Spa | Derivati imidazo-rifamicinici metodi per la loro preparazione e loro uso come sostanza ad azione antibatterica |
| IT1199374B (it) | 1984-05-15 | 1988-12-30 | Alfa Farmaceutici Spa | Processo per la preparazione di pirido-imidazo-rifamicine |
| ITMI20032144A1 (it) | 2003-11-07 | 2005-05-08 | Alfa Wassermann Spa | Forme polimorfe di rifaximina, processi per ottenerle e |
| US20050249806A1 (en) * | 2004-02-10 | 2005-11-10 | Santarus, Inc. | Combination of proton pump inhibitor, buffering agent, and nonsteroidal anti-inflammatory drug |
| US8003118B2 (en) * | 2005-03-02 | 2011-08-23 | Kodsi Robert E | Use of rifaximin for the prevention of aspiration pneumonia and/or sepsis |
| PL1698630T3 (pl) | 2005-03-03 | 2014-12-31 | Alfasigma Spa | Nowe postacie polimorficzne rifaksyminy,sposoby ich wytwarzania i ich zastosowanie w preparatach leczniczych |
| ITBO20050123A1 (it) * | 2005-03-07 | 2005-06-06 | Alfa Wassermann Spa | Formulazioni farmaceutiche gastroresistenti contenenti rifaximina |
| ITMI20061692A1 (it) * | 2006-09-05 | 2008-03-06 | Alfa Wassermann Spa | Uso di polioli per ottenere forme polimorfe stabili di rifaximina |
| EP2069363B1 (en) | 2006-09-22 | 2013-03-20 | Cipla Ltd. | Rifaximin in an amorphous form |
| ITMI20071241A1 (it) | 2007-06-20 | 2008-12-21 | Solmag S P A | Processo per la preparazione di rifaximina amorfa e rifaximina amorfa cosi' ottenuta |
| US7709634B2 (en) | 2007-09-20 | 2010-05-04 | Apotex Pharmachem Inc. | Amorphous form of rifaximin and processes for its preparation |
| EP2257557A4 (en) | 2008-02-25 | 2011-06-29 | Salix Pharmaceuticals Ltd | FORMS OF RIFAXIMINE AND APPLICATIONS THEREOF |
| US8486956B2 (en) | 2008-02-25 | 2013-07-16 | Salix Pharmaceuticals, Ltd | Forms of rifaximin and uses thereof |
| DK2252148T3 (da) * | 2008-02-26 | 2019-05-06 | Salix Pharmaceuticals Ltd | Fremgangsmåder til behandling af irritabel tarmsyndrom |
| EA022490B1 (ru) | 2010-06-03 | 2016-01-29 | Саликс Фармасьютикалс, Лтд. | Новые формы рифаксимина и их применение |
| CA2802874A1 (en) | 2010-06-16 | 2011-12-22 | Apotex Pharmachem Inc. | Polymorphic forms of rifaximin |
| IT1403847B1 (it) * | 2010-09-22 | 2013-11-08 | Alfa Wassermann Spa | Composizioni farmaceutiche comprendenti rifaximina e loro uso. |
| CA2834829A1 (en) | 2011-05-02 | 2012-11-08 | Ranbaxy Laboratories Limited | Rifaximin dimethylformamide solvate |
| WO2012155981A1 (en) | 2011-05-19 | 2012-11-22 | Friulchem Spa | New process for the synthesis of rifaximin and a new pseudo-crystalline form of rifaximin obtained thereby |
| ITMI20110890A1 (it) | 2011-05-19 | 2012-11-20 | A M S A Anonima Materie Sint & Affini S P A | Polimorfo di rifaximina e processo per la sua preparazione |
| WO2013112809A2 (en) * | 2012-01-25 | 2013-08-01 | Salix Pharmaceuticals, Ltd | Rifaximin derivative and uses thereof |
-
2014
- 2014-04-11 CA CA2908525A patent/CA2908525C/en active Active
- 2014-04-11 PT PT147231229T patent/PT2983647T/pt unknown
- 2014-04-11 EP EP14723122.9A patent/EP2983647B1/en not_active Not-in-force
- 2014-04-11 WO PCT/IB2014/060640 patent/WO2014167533A1/en not_active Ceased
- 2014-04-11 PL PL14723122T patent/PL2983647T3/pl unknown
- 2014-04-11 CN CN201480033480.XA patent/CN105324109A/zh active Pending
- 2014-04-11 MX MX2015014307A patent/MX374340B/es active IP Right Grant
- 2014-04-11 NZ NZ713440A patent/NZ713440A/en not_active IP Right Cessation
- 2014-04-11 KR KR1020157032383A patent/KR102190173B1/ko not_active Expired - Fee Related
- 2014-04-11 ES ES14723122T patent/ES2829285T3/es active Active
- 2014-04-11 US US14/251,516 patent/US20140308350A1/en not_active Abandoned
- 2014-04-11 AU AU2014252219A patent/AU2014252219B2/en not_active Ceased
- 2014-04-11 JP JP2016507100A patent/JP6433980B2/ja not_active Expired - Fee Related
- 2014-04-11 EA EA201591899A patent/EA032705B1/ru not_active IP Right Cessation
-
2019
- 2019-06-28 US US16/457,814 patent/US20190388411A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| KR102190173B1 (ko) | 2020-12-14 |
| JP2016520556A (ja) | 2016-07-14 |
| PT2983647T (pt) | 2020-11-09 |
| KR20150140390A (ko) | 2015-12-15 |
| EA032705B1 (ru) | 2019-07-31 |
| CA2908525A1 (en) | 2014-10-16 |
| CA2908525C (en) | 2021-04-06 |
| JP6433980B2 (ja) | 2018-12-05 |
| EA201591899A1 (ru) | 2016-03-31 |
| EP2983647B1 (en) | 2020-09-09 |
| AU2014252219A1 (en) | 2015-10-29 |
| NZ713440A (en) | 2019-02-22 |
| PL2983647T3 (pl) | 2021-01-25 |
| HK1213810A1 (en) | 2016-07-15 |
| EP2983647A1 (en) | 2016-02-17 |
| CN105324109A (zh) | 2016-02-10 |
| MX2015014307A (es) | 2015-12-08 |
| WO2014167533A1 (en) | 2014-10-16 |
| US20140308350A1 (en) | 2014-10-16 |
| MX374340B (es) | 2025-03-06 |
| US20190388411A1 (en) | 2019-12-26 |
| AU2014252219B2 (en) | 2018-11-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2398564T3 (es) | Formulaciones farmacéuticas gastrorresistentes que contienen rifaximina | |
| ES2667944T3 (es) | Gránulos y comprimidos orodispersables que contienen oxicodona | |
| ES2649063T3 (es) | Formulaciones farmacéuticas que contienen rifaximina, procedimientos para su obtención y método de tratamiento de la enfermedad intestinal | |
| ES2958616T3 (es) | Formulaciones farmacéuticas de floroglucinol y trimetilfloroglucinol | |
| ES2482771T3 (es) | Composiciones y métodos para inhibir la secreción de ácido gástrico | |
| ES2996895T3 (en) | Pharmaceutical composition comprising antiplatelet agent and gastric acid secretion inhibitor | |
| ES2742106T3 (es) | Nueva forma de cristal solvatado de rifaximina, producción, composiciones y usos de la misma | |
| PT2043637E (pt) | Métodos e medicamentos para administração de ibuprofeno | |
| CN108348475A (zh) | 处于液体剂型的多层药学活性化合物释放微粒 | |
| CA2598668A1 (en) | Dosage forms of antibiotics and combinations of antibiotics and symptomatic relief agents | |
| ES2829285T3 (es) | Administración de AINE y composiciones, métodos y sistemas relacionados | |
| KR20170132260A (ko) | 신규한 약제학적 용도 | |
| JP2014240435A (ja) | 胃酸分泌を阻害するための組成物および方法 | |
| AU2005204014B2 (en) | Pharmaceutical compositions comprising a proton pump inhibitor and a prokinetic agent | |
| WO2004062552A2 (en) | Pharmaceutical composition containing a nsaid and a benzimidazole derivative | |
| US20040009221A1 (en) | Oral pharmaceutical compositions containing non-steroidal anti-inflammatory drugs and method for preparing the same | |
| ES2897576T3 (es) | Composiciones antimicrobianas con agentes efervescentes | |
| HK1213810B (en) | Nsaid administration and related compositions, methods and systems | |
| US11696894B2 (en) | Sequential administration of partitioned absorption aspirin or active aspirin derivative and COX-2 inhibitor | |
| BR102017003179A2 (pt) | forma de dosagem unitária, composição farmacêutica e processo para sua preparação | |
| MXPA06007779A (es) | Composiciones farmaceuticas que comprenden un inhibidor de bomba de protones y un agente procinetico | |
| TR201612543A1 (tr) | Oral farmasöti̇k terki̇pler |