ES2811110T3 - Composición farmacéutica capaz de la incorporación de Lenalidomida en diversas modificaciones cristalinas - Google Patents
Composición farmacéutica capaz de la incorporación de Lenalidomida en diversas modificaciones cristalinas Download PDFInfo
- Publication number
- ES2811110T3 ES2811110T3 ES15182621T ES15182621T ES2811110T3 ES 2811110 T3 ES2811110 T3 ES 2811110T3 ES 15182621 T ES15182621 T ES 15182621T ES 15182621 T ES15182621 T ES 15182621T ES 2811110 T3 ES2811110 T3 ES 2811110T3
- Authority
- ES
- Spain
- Prior art keywords
- lenalidomide
- mix
- weight
- pharmaceutical composition
- composition according
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4858—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
Landscapes
- Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
Una composición farmacéutica sólida oral que comprende a. del 1.0 % al 50.0 % en peso, calculado según la Lenalidomida básica, de partículas de una forma A de Lenalidomida básica; b. de 50.0 % a 99.0 % en peso de uno o más agente o agentes de relleno; y c. opcionalmente comprende uno o más desintegrante o desintegrantes, lubricante o lubricantes; aglomerante o aglomerantes, deslizante o deslizantes y otros excipientes farmacéuticamente aceptables; todos los valores de porcentaje en peso se calculan en relación con el peso total de la composición; en donde la distribución del tamaño de partícula (d90) de las partículas de Lenalidomida está en el intervalo de desde 1 μm a 100 μm.
Description
DESCRIPCIÓN
Composición farmacéutica capaz de la incorporación de Lenalidomida en diversas modificaciones cristalinas Campo de la invención
La presente invención se relaciona con composiciones farmacéuticas que comprenden el principio activo de forma A de Lenalidomida básica.
Sumario de la invención
Lenalidomida es el nombre internacional no propietario (INN) de (RS)-3-(4-Amino-1-oxo 1,3-dihidro-2H-isoindol-2-il)piperidina-2,6-diona que tiene la siguiente estructura química:
La Lenalidomida es un agente antitumoral registrado y comercializado bajo los nombres comerciales REVLIMID® y Ladevina® utilizados para el tratamiento del mieloma múltiple.
Se han descrito varias modificaciones de Lenalidomida en la técnica.
Por ejemplo, Lenalidomida básica en las formas cristalinas "A" y "B" (en lo sucesivo también denominada "forma A de Lenalidomida básica" y "forma B de Lenalidomida básica", respectivamente) se divulgan en el documento WO2005/023192. Sin embargo, esta solicitud de patente no divulga ninguna formulación farmacéutica específica que comprenda una de cualquiera de las formas. En la solicitud de patente WO 2013/012485 (Amplio Pharma) se ha divulgado un cocristal de Lenalidomida de cloruro de amonio de Lenalidomida (en lo sucesivo, también denominado cocristal de NH4Cl de Lenalidomida). Esta solicitud de patente no divulga ninguna formulación farmacéutica específica que comprenda un cocristal de cloruro de amonio de Lenalidomida.
Una sal de ácido clorhídrico de Lenalidomida (en lo sucesivo, también denominada sal de HCI de Lenalidomida) se ha divulgado en los documentos US 2011/0060010 (Tianjin Hemay Bio-tech) y WO 2011/018101 (Synthon). Una vez más, no se divulgan formulaciones farmacéuticas específicas que comprendan una sal de ácido de clorhídrico de Lenalidomida.
Se divulga un solvato de DMSO de Lenalidomida en el documento WO 2010/056384. Además, esta solicitud no menciona las formulaciones farmacéuticas que comprenden el solvato de DMSO de Lenalidomida.
El documento DE102008057284 (Ratiopharm GMBH) se relaciona con un proceso para la producción de tabletas que contienen Lenalidomida, particularmente en "Forma B" de Lenalidomida (ejemplo 1) y Lenalidomida "amorfa" (ejemplo 2)) y promotores de adhesión, los comprimidos se producen por medio de granulación seca.
El documento WO 2014/160686 (CELGENE CORP) divulga formas sólidas que comprenden 3-(4-amino-1-oxo-l, 3-dihidro-isoindol-2-il)-piperidina-2,6-diona (Lenalidomida) y un coformador y composiciones farmacéuticas que comprenden tales formas sólidas.
Para el desarrollo y registro de una versión genérica de cualquier producto de mercado existente, se deben cumplir ciertos requisitos reglamentarios. Entre ellos, la prueba de bioequivalencia es de gran importancia. En el caso de Lenalidomida, la primera etapa para apuntar a la bioequivalencia de REVLIMID® es abordar su perfil de disolución in vitro. Para hacerlo, es esencial el conocimiento de datos característicos básicos como la solubilidad de los polimorfos de Lenalidomida y sus características de disolución. Para el desarrollo de cualquier forma de dosificación terminada, generalmente es favorable establecer métodos y procesos que permitan la selección y el uso de una amplia variedad de las modificaciones de las sustancias activas como polimorfos, solvatos, cocristales y sales. Además, es favorable si los parámetros relevantes pueden adaptarse dentro de amplios intervalos. En consecuencia, el proceso de formulación farmacéutica debe ser flexible no solo en cuanto a la elección de la modificación de Lenalidomida y excipientes en cuanto a parámetros cualitativos, sino que también debe ser flexible hacia los intervalos de carga de fármaco activo, excipientes, etc. en cuanto a parámetros cuantitativos.
En el caso de Lenalidomida, la técnica anterior no dice nada sobre los datos característicos básicos de los polimorfos de Lenalidomida, tales como sus características de solubilidad y disolución, y mucho menos su comportamiento cuando se formulan con excipientes farmacéuticamente aceptables en formas de dosificación
terminadas, dejando en duda a las personas experimentadas en la técnica sobre parámetros críticos del proceso de fabricación de formas de dosificación terminadas de Lenalidomida.
Por lo tanto, un primer objeto de la presente invención es la investigación de las características básicas de diferentes modificaciones de Lenalidomida y la idoneidad para su incorporación en una forma de dosificación terminada.
Un segundo objeto de la presente invención es la provisión de un proceso de formulación que sea flexible con respecto al uso de diferentes modificaciones de Lenalidomida.
Un tercer objeto de la presente invención es la provisión de una composición farmacéutica mejorada de Lenalidomida que libera Lenalidomida de manera similar al producto comercial de marca REVLIMID® en todos los medios estándar.
Los inventores de la presente solicitud han descubierto que los objetivos mencionados anteriormente se han resuelto mediante el proceso de formulación y las composiciones farmacéuticas descritas en lo sucesivo y las reivindicaciones.
Breve descripción de los dibujos
La figura 1 muestra una fotografía de cristales de sal de ácido clorhídrico de Lenalidomida fabricados de acuerdo con el ejemplo de referencia 1.
La figura 2 muestra una fotografía de cristales de forma A de Lenalidomida básica fabricados de acuerdo con el ejemplo de referencia 1.
La figura 3 muestra una fotografía de cocristales de cloruro de amonio y Lenalidomida fabricados de acuerdo con el ejemplo de referencia 1.
La figura 4 muestra una fotografía de cristales de solvato de DMSO de Lenalidomida fabricados de acuerdo con el ejemplo de referencia 1.
La figura 5 muestra un diagrama de flujo detallado del proceso de fabricación de cápsulas de Lenalidomida de acuerdo con el ejemplo inventivo 2.
La figura 6 muestra una comparación de los perfiles de disolución de cápsulas fabricadas de acuerdo con el ejemplo de referencia 1 con REVLIMID® en ácido clorhídrico 0.1 M a pH 1.
La figura 7 muestra una comparación de los perfiles de disolución de cápsulas fabricadas de acuerdo con el ejemplo inventivo 2 con REVLIMID® en ácido clorhídrico 0.1 M a pH 1.
La figura 8 muestra una comparación de los perfiles de disolución de cápsulas fabricadas de acuerdo con el ejemplo de referencia 1 con REVLIMID® en solución reguladora de acetato a pH 4.5.
La figura 9 muestra una comparación de los perfiles de disolución de cápsulas fabricadas de acuerdo con el ejemplo 2 inventivo con REVLIMID® en solución reguladora de acetato a pH 4.5.
La figura 10 muestra una comparación de los perfiles de disolución de cápsulas fabricadas de acuerdo con el ejemplo de referencia 1 con REVLIMID® en solución reguladora de fosfato a pH 6.8.
La figura 11 muestra una comparación de los perfiles de disolución de cápsulas que se fabrican de acuerdo con el ejemplo 2 inventivo con REVLIMID® en solución reguladora de fosfato a pH 6.8.
Descripción detallada de la invención
En la presente solicitud, se investigan varias modificaciones diferentes cristalinas de Lenalidomida:
• forma A y forma B básica cristalina como ejemplos de Lenalidomida básica
• Cocristal de cloruro de amonio como un ejemplo de un cocristal de Lenalidomida
• Sal de ácido clorhídrico como un ejemplo de una sal de Lenalidomida.
• Solvato de DMSO como un ejemplo de un solvato de Lenalidomida
Como se ilustra en las figuras 1 a 4, diferentes modificaciones de Lenalidomida exhiben diferentes tipos de cristales. Los cocristales de cloruro de amonio de Lenalidomida y sal de ácido clorhídrico de Lenalidomida se cristalizan en
forma de aguja, mientras que la forma A de Lenalidomida básica exhibe principalmente cristales en forma de barra. Los cristales del solvato de DMSO de Lenalidomida aparecen como aglomerados.
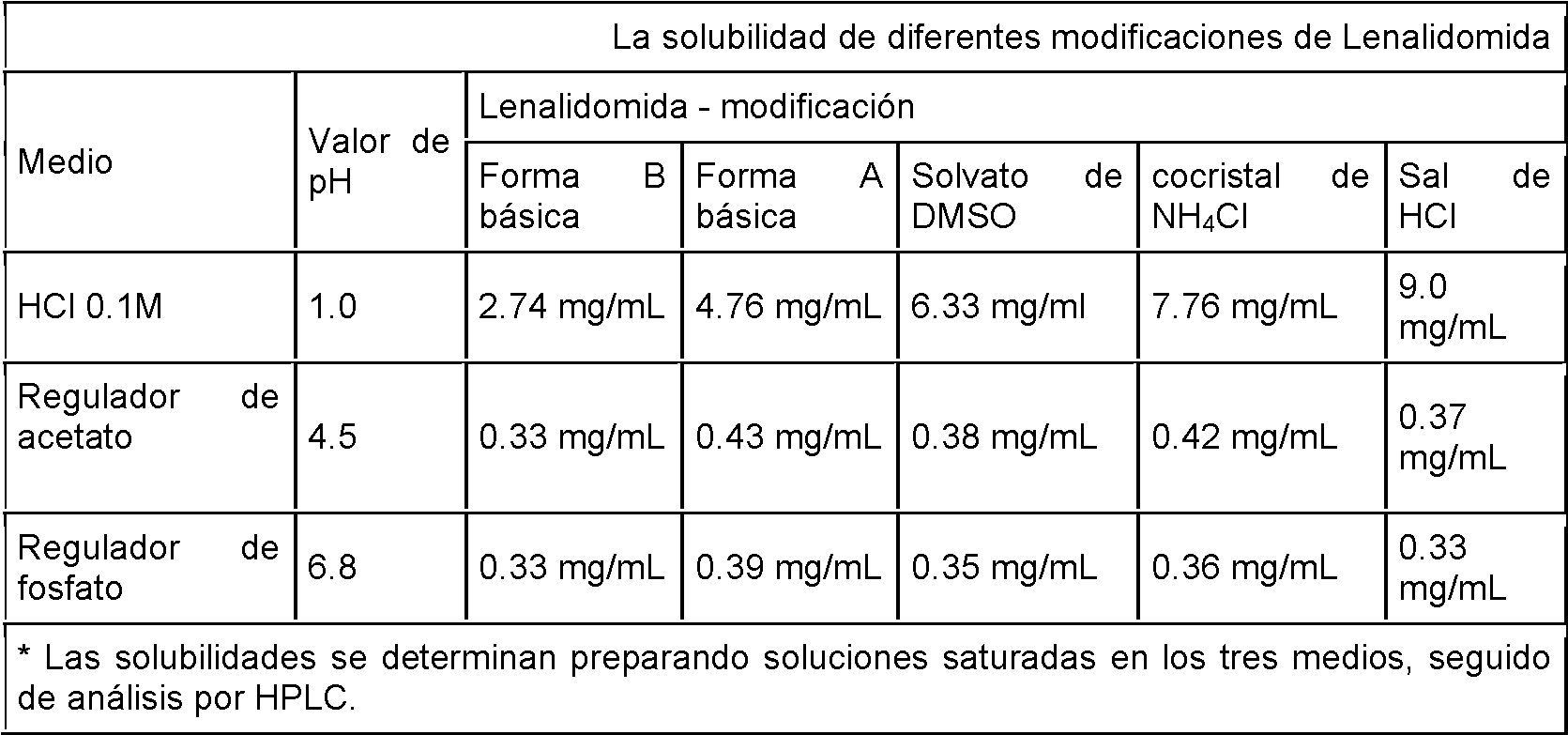
Como el caso de su apariencia visual, también la solubilidad de esas diferentes modificaciones de Lenalidomida es bastante diferente. Como se indica en la tabla 1, la sal de ácido clorhídrico es más de 3 veces más soluble que la forma B básica en ácido clorhídrico 0.1 M a pH 1, la solubilidad de las modificaciones disminuye en el siguiente orden: sal de HCI> cocristal NH4O solvato de DMSO > forma A básica > forma B básica. Por otro lado, las solubilidades en el regulador de acetato y el regulador de fosfato son mucho más bajas, pero bastante similares.
Tabla 1
Sorprendentemente, el comportamiento de disolución de las composiciones farmacéuticas que comprenden diferentes modificaciones de Lenalidomida parece ser bastante impredecible: como es evidente de la figura 6, la disolución relativa de las diferentes modificaciones en ácido clorhídrico 0.1 M es casi invertida en comparación con el orden de solubilidad de los polimorfos como indicado en la tabla 1.
Como es evidente de las figuras 6, 8 y 10, la sal de ácido clorhídrico de Lenalidomida que tiene la mayor solubilidad exhibe la rata de disolución más pobre en los tres medios estándar ácido clorhídrico 0.1 M a pH 1.0, regulador de acetato a pH 4.5 y regulador de fosfato a pH 6.8. Como es evidente de las figuras 6, 8 y 10, la forma A de Lenalidomida básica cristalina se disuelve en ácido clorhídrico 0.1 M casi idénticamente en comparación con el producto de referencia REVLIMID®. Muy diferente a REVLIMID®, la forma A de Lenalidomida básica cristalina se disuelve de forma relativamente pobre en acetato en regulador de fosfato, liberando ambos medios solo menos del 60 % del ingrediente activo en 45 minutos.
El comportamiento relativo de disolución de las diferentes modificaciones de Lenalidomida que se investigaron en comparación con el producto de referencia REVLIMID® en los 3 medios diferentes de disolución estándar se resume en la tabla 2.
Tabla 2.
Como se puede deducir de la tabla 1 y la tabla 2, el comportamiento de disolución de las diferentes modificaciones
• no muestra correlación con las solubilidades correspondientes
• parece ser impredeciblemente diferente entre sí en diferentes medios estándar
• parece ser impredeciblemente diferente del producto de referencia REVLIMID®
Como un aspecto adicional, la baja solubilidad, especialmente a valores de pH más altos, indica una baja biodisponibilidad que limita aún más las opciones de formulación y administración disponibles para este compuesto.
Concluyendo de los hechos presentados anteriormente, sigue siendo un gran desafío desarrollar una formulación que sea capaz de liberar Lenalidomida independientemente de su modificación, ya sea una forma cristalina de una de sus sales, cocristales, solvatos o base.
En particular, existe la necesidad de formulaciones farmacéuticas de Lenalidomida que liberen Lenalidomida similar al producto de mercado de marca REVLIMID® en todos los medios estándar e independientemente de la elección de la modificación de Lenalidomida que se incorpora.
Se ha encontrado ahora que las composiciones farmacéuticas cumplen ambos requisitos de acuerdo con una de las reivindicaciones. De conformidad, la invención se relaciona con una composición farmacéutica sólida oral que comprende:
a. del 1.0 % al 50.0 % en peso, calculado según la forma A de Lenalidomida básica
b. de 50.0 % a 99.0 % en peso de uno o más agente o agentes de relleno; y
c. opcionalmente comprende uno o más desintegrante o desintegrantes, lubricante o lubricantes; aglomerante o aglomerantes, deslizante o deslizantes y otros excipientes farmacéuticamente aceptables;
todo % en peso: valores calculados en relación con el peso total de la composición; en donde la distribución del tamaño de partícula (dg0) de las partículas de Lenalidomida está en el intervalo de 1 pm a 100 pm.
La Lenalidomida básica en la forma A cristalina o la forma B cristalina puede fabricarse mediante procedimientos conocidos, por ejemplo, como se divulga en la solicitud de patente WO2005/023192. El cocristal de cloruro de amonio (NH4Cl) de Lenalidomida puede fabricarse de acuerdo con la solicitud de patente WO 2013/012485.
La sal de ácido clorhídrico de Lenalidomida (HCI) se puede fabricar como se describe en los documentos US 2011/0060010 o WO 2011/018101.
El solvato de DMSO de Lenalidomida se puede fabricar como se describe en el documento WO 2010/056384.
La cantidad de Lenalidomida en la composición farmacéutica de acuerdo con la presente invención está en el intervalo de 1.0 % a 50.0 % en peso. En una realización preferida, la cantidad de Lenalidomida está en el intervalo de 2.0 % a 20.0 % en peso, más preferiblemente de 3.0 % a 10.0 % en peso y lo más preferido de 4.0 % a 8.0 % en peso, calculado con base en la base de Lenalidomida.
En esta aplicación, todos los valores en % en peso deben calcularse en relación con el peso total de la composición, a menos que se indique lo contrario.
En la presente invención, las partículas de Lenalidomida pueden ser partículas de Lenalidomida básica, una sal de Lenalidomida o un cocristal de Lenalidomida.
En la presente invención, las partículas de Lenalidomida se caracterizan por su distribución del tamaño de partícula (PSD), representada por su valor dg0, d50 y/o d-iü.
El valor Dg0 se define de modo que el 90 % en volumen de las partículas tenga un tamaño de partícula menor que el valor dg0 y el 10 % en volumen de las partículas tenga un tamaño de partícula mayor que el valor dg0. El valor d50 y el valor d-10 se definen en consecuencia.
Las partículas cristalinas de Lenalidomida en las composiciones farmacéuticas exhiben un tamaño de partícula con un dg0 de desde 1 pm a 100 pm. En una realización preferida, el valor dg0 está entre 2 pm y 80 pm, más preferiblemente de desde 3 pm a 50 pm y lo más preferido de desde 30 pm a 45 pm.
La distribución del tamaño de partícula de las partículas de Lenalidomida de acuerdo con la presente invención puede caracterizarse además por un valor d50 de desde 0.5 pm a 30 pm, preferiblemente de desde 2 pm a 20 pm, incluso más preferiblemente de desde 3 pm a 15 pm y lo más preferido de desde 4 pm a 10 pm.
La distribución del tamaño de partícula de las partículas de Lenalidomida de acuerdo con la presente invención puede caracterizarse además por un valor dio de desde 0.05 |jm a 2 |jm, preferiblemente de desde 0.05 |jm a 1 |jm, incluso más preferiblemente de desde 0.08 jim a 0.7 jim y lo más preferido de desde 0.1 jim a 0.4 jim.
Para obtener el tamaño de partícula deseado, puede ser necesaria la molienda del ingrediente farmacéutico activo (API) de Lenalidomida, que se puede lograr mediante técnicas bien conocidas en la técnica, por ejemplo, molienda en húmedo o molienda en seco.
En particular, se ha observado que las ratas de disolución y, en particular, la disolución global de la sal de ácido clorhídrico y los cocristales de NH4Cl pueden ser aún más satisfactorios si la molienda por medio de un molino convencional es soportada por un proceso adicional de ultrasonicación.
Sin desear limitarse a la teoría, la molienda puede conducir a la formación de aglomerados secundarios que se destruyen tras la aplicación del siguiente proceso de ultrasonicación desarrollado:
(a) Lenalidomida se dispersa en éter de petróleo
(b) Se aplica ultrasonido
(c) El éter de petróleo se elimina mediante filtración de la suspensión por succión
(d) El sólido se seca al aire antes del análisis
Como es evidente de las figuras 9 y 11, la aplicación de esta técnica de molienda conduce a una aproximación adicional al perfil de disolución de REVLIMID® para cocristal de NH4Cl y sa1HCI de Lenalidomida.
Las composiciones farmacéuticas de acuerdo con la presente invención comprenden además excipientes farmacéuticamente adecuados como uno o más agente o agentes de relleno, uno o más aglomerante o aglomerantes y uno o más desintegrante o desintegrantes y opcionalmente uno o más lubricante o lubricantes, uno o más deslizante o deslizantes y otro excipiente o excipientes farmacéuticamente aceptables. Los términos agente o agentes de relleno, aglomerante o aglomerantes, desintegrante o desintegrantes, lubricante o lubricantes, deslizante o deslizantes, excipiente o excipientes etc., deben entenderse que incluyen un compuesto individual pero también mezclas de compuestos.
Agente o agentes de relleno farmacéuticamente aceptables incluyen, pero no limitándose a, celulosa microcristalina (MCC), celulosa microcristalina silicificada (SMCC), lactosa, manitol, sacarosa, fosfato dicálcico, carbonato de calcio, carbonato de magnesio, almidón pregelatinizado, hidroxipropilcelulosa de baja sustitución ( L-HPC), celulosa en polvo, silicato de calcio, fosfato de calcio, sorbitol, manitol, dextrinas, caolín, óxido de magnesio, sulfato de calcio, xilitol, isomalta, glucosa, fructosa, maltosa, ácidos como ácido cítrico, ácido tartárico, ácido fumárico y copolímeros de vinilpirrolidona y acetato de vinilo o copolímeros de polietilenglicol. El agente o agentes de relleno preferidos son celulosa microcristalina (MCC) y lactosa anhidra.
La cantidad de agente o agentes de relleno está en el intervalo entre 40.0 % a 95.0 % en peso. En una realización preferida, la cantidad de agente o agentes de relleno está en el intervalo entre 85.0 % a 90.0 % en peso. El desintegrante o desintegrantes farmacéuticamente aceptables incluyen, pero no limitándose a, croscarmelosa, carboximetilcelulosa de calcio, glicolato de almidón de sodio, almidón de maíz, almidón pregelatinizado, almidón de patata, ácido algínico, polivinilpirrolidona (crospovidona) e hidroxipropilcelulosa de baja sustitución (L-HPC). El desintegrante preferido es la croscarmelosa de sodio.
El lubricante o lubricantes farmacéuticamente aceptables incluyen, pero no se limitan a, estearato de magnesio, estearato de calcio, estearato de sodio, ácido esteárico, gliceril behenato de sodio, ácido hexanodioico, aceite vegetal hidrogenado, estearil fumarato de sodio y fumarato de glicerina. El lubricante preferido es el estearato de magnesio.
El aglomerante o aglomerantes farmacéuticamente aceptables incluyen, pero no se limitan a, hidroxipropilmetilcelulosa (HPMC), dihidroxipropilcelulosa, metilcelulosa, hidroxietilcelulosa, etilcelulosa, carboxilmetilcelulosa de sodio, polietilenglicol, maltodextrina, almidón pregelatinizado, almidón, polimetacrilatos, alginato de sodio, polivinilpirrolidona (povidona) y copolímero de vinilpirrolidona/acetato de vinilo (copovidona). El deslizante o deslizantes farmacéuticamente aceptables incluyen, pero no se limitan a, dióxido de silicona coloidal, talco y carbonato de magnesio.
La composición farmacéutica preferida es una cápsula.
El proceso de fabricación de las cápsulas de acuerdo con la presente invención comprende las siguientes etapas:
a. Moler una modificación cristalina de Lenalidomida seleccionada del grupo que comprende Lenalidomida básica, sal de clorhidrato de Lenalidomida, cocristal de cloruro de amonio de Lenalidomida o mezclas de los mismos; b. Mezclar la Lenalidomida molida y la primera parte del agente o agentes de relleno para obtener la mezcla 1; c. Mezclar la mezcla 1 y la segunda parte del agente o agentes de relleno para obtener la mezcla 2;
d. Mezclar el desintegrante o desintegrantes y lubricante o lubricantes para obtener la mezcla 3;
e. Tamizar la mezcla 3;
f. Mezclar la mezcla 2 y la mezcla 3 (Lubricación) para obtener la mezcla final;
g. Llenar las cápsulas con la mezcla final.
En la figura 5 se muestra un diagrama de flujo detallado del proceso de fabricación.
De manera sorprendente y ventajosa, este sencillo proceso de mezcla de polvo seco es adecuado para la incorporación de cualquiera de las formas A de Lenalidomida básica, sal de clorhidrato de Lenalidomida y cocristal de cloruro de amonio de Lenalidomida sin la necesidad de ajustar ningún parámetro del proceso.
A diferencia de otras técnicas de fabricación, como la granulación húmeda que podría conducir a la formación más alta de partículas API agregadas, una ventaja adicional del proceso de mezcla de polvo seco de acuerdo con la presente invención es que el tamaño de las partículas de Lenalidomida no cambia durante el proceso de formulación, pero permanece igual desde la etapa API hasta la cápsula que se llena fácilmente.
Una realización preferida de la presente invención es una composición farmacéutica sólida oral que comprende a. del 2.0 % al 20.0 % en peso, calculado según la forma A de Lenalidomida básica;
b. de 60.0 % a 98.0 % en peso de uno o más agente o agentes de relleno, preferiblemente 80.0 % a 95.0 % en peso; c. de 1.0 % a 10.0 % en peso de uno o más desintegrante o desintegrantes; y
d. de 0.5 % a 2.0 % en peso de uno o más lubricante o lubricantes
todos los porcentajes en peso: los valores son relativos al peso total de la composición calculado según la Lenalidomida básica; en donde la distribución del tamaño de partícula (d») de las partículas de Lenalidomida está en el intervalo de entre 1 pm y 100 pm.
Ejemplos
Estudios de tamaño de partícula
i. Configuración experimental
Parámetros para el análisis
ii. Preparación de soluciones
Solución de muestra. Colocar 50 mg de muestra bien mezclada en un vaso de precipitados de 100 ml. Añadir 25 ml de ciclohexano. Con la pipeta Pasteur, transferir pequeñas alícuotas de la suspensión de muestra a la cubeta de medición hasta que la lectura de concentración sea buena. El vaso de precipitados se hace rotar de manera eficiente antes de cada pipeteo.
iii. Procedimiento analítico
Medición de acuerdo con las instrucciones de funcionamiento. Realizar tres determinaciones sucesivas, a partir de las cuales se calcula el valor medio.
Método de prueba de disolución
La disolución in vitro de acuerdo con los ejemplos 2 a 5 se analizaron de acuerdo con Ph. Eur. 2.9.3/USP <711> -Método 2 (Aparato de paleta) con la configuración que se muestra en la tabla 7.
Condiciones de HPLC:
Preparación de las soluciones:
Solución reguladora pH 3.5. Disolver 1.36 g de dihidrógeno fosfato de potasio en 900 ml de agua para cromatografía. Ajustar el pH de la solución preparada a 3.5 con ácido fosfórico (10 por ciento) y diluir a 1000 ml con agua para cromatografía, mezclar. Filtrar a través del filtro de membrana con un tamaño de poro no mayor de 0.45 |jm.
Solución estándar. Pesar con precisión aproximadamente 35 mg de sustancia de referencia interna de Lenalidomida, transferir a un matraz volumétrico de 25 ml, disolver en 10 ml de metanol, someter a ultrasonidos durante 5 minutos y hacer que el volumen con el medio de disolución, se mezcle. Diluir 1.0 ml de esta solución a 50 ml con medio de disolución. Preparar 2 soluciones estándar. Idoneidad del sistema. Usar los cromatogramas obtenidos con la solución estándar. El factor de simetría del pico principal debe estar en el intervalo entre 0.8 y 1.5. El número teórico
de placa del pico principal no debe ser inferior a 2000. La desviación estándar relativa entre tres inyecciones no debe ser superior al 2.0 por ciento.
Procedimiento analítico y cálculos
Equilibrar el sistema cromatográfico a una rata de flujo de 1.0 ml/min, no menos que 30 minutos. Inyectar en la columna soluciones en el siguiente orden:
■ diluyente de muestra (medio de disolución);
■ solución estándar: tres veces cada una;
■ solución de prueba: una vez cada una.
Registrar los cromatogramas y medir las áreas de los picos.
El contenido de Lenalidomida (X), porcentaje de declarado, se calcula por la fórmula:
dónde:
San - área de pico principal en el cromatograma de solución de prueba;
Sst - área de pico principal en el cromatograma de solución estándar;
mst - peso de sustancia de referencia interna de Lenalidomida, mg;
Vst - volumen de la solución estándar, ml (25);
nst. - dilución de la solución estándar, veces (50);
Cst - ensayo de sustancia de referencia interna de Lenalidomida, por ciento;
a - contenido declarado de Lenalidomida por cápsula, 25 mg;
Van - volumen del medio de disolución para la solución de prueba, ml (900).
El ensayo de Lenalidomida se calcula de acuerdo con el primer estándar, si la verificación de los estándares es entre 98.0 por ciento a 102.0 por ciento.
Verificación estándar, porcentaje, calcular por fórmula:
donde:
Sst.i - área de pico principal en la solución estándar No.1 cromatograma;
mst.i - peso de sustancia de referencia interna No.1 de Lenalidomida, mg;
Sst.2 - área de pico principal en el cromatograma de solución No.2 estándar;
mst.2 - peso de sustancia de referencia interna No.2 de Lenalidomida, mg;
100 - coeficiente de recálculo de parte de masa a porcentaje.
Ejemplo 1 (referencia)
La base de Lenalidomida en la forma cristalina A se preparó como se describe en la solicitud de patente WO2005/023192.
El cocristal de cloruro de amonio (NH4Cl) de Lenalidomida se preparó como se describe en la solicitud de patente WO 2013/012485.
La sal de ácido clorhídrico de Lenalidomida (HCI) se preparó como se describe en la solicitud de patente US 2011/0060010.
El solvato de DMSO de Lenalidomida se preparó como se describe en la solicitud de patente WO 2010/056384.
Los tamaños de partícula resultantes se muestran en la tabla 3.
Las composiciones farmacéuticas se prepararon de acuerdo con el proceso mostrado en la figura 5 con las cantidades de excipientes de acuerdo con la tabla 4.
Excipientes:
Los perfiles de disolución de las composiciones farmacéuticas de acuerdo con el ejemplo de referencia 1 en ácido clorhídrico 0.1 M a pH 1.0, regulador de acetato a pH 4.5 y regulador de fosfato a pH 6.8 se muestran en las Figuras 6, 8 y 10, respectivamente.
Ejemplo 2: Composiciones farmacéuticas de acuerdo con la invención
La Lenalidomida básica en la forma cristalina Asalt se preparó como se describe en el ejemplo de referencia 1, seguido de una etapa de molienda (15 minutos a 20 Hz, molino mezclador Retsch MM301 con recipiente de molienda de acero inoxidable de 35 ml con bolas de acero inoxidable de 20 mm de diámetro).
Los tamaños de partícula resultantes se muestran en la tabla 6.
Las composiciones farmacéuticas se prepararon de acuerdo con el proceso que se muestra en la figura 5 con las cantidades de excipientes que se muestran en la tabla 4.
Los perfiles de disolución de las composiciones farmacéuticas de acuerdo con el ejemplo de referencia 2 en ácido clorhídrico 0.1 M a pH 1.0, regulador de acetato a pH 4.5 y regulador de fosfato a pH 6.8 se muestran en las Figuras 7, 9 y 11, respectivamente.
Resultados:
Como puede deducirse de una comparación de las figuras 6, 8 y 10 con las figuras 7, 9 y 11, las composiciones farmacéuticas que se fabrican de acuerdo con el ejemplo inventivo 2 exhiben un perfil de disolución casi idéntico en todos los medios estándar (ácido clorhídrico 0.1 M a pH 1.0), regulador de acetato a pH 4.5 o regulador de fosfato a pH 6.8) independiente de la modificación de la Lenalidomida que se incorpora en la cápsula, ya sea la forma A de Lenalidomida básica, sal de clorhidrato de Lenalidomida o el cocristal de cloruro de amonio de Lenalidomida.
En otras palabras, los perfiles de disolución de las composiciones farmacéuticas de acuerdo con la presente invención son indiferentes con respecto a la modificación de Lenalidomida incorporada en la composición farmacéutica. Esto es bastante sorprendente ya que
• las solubilidades intrínsecas de las diferentes modificaciones son bastante diferentes, como es evidente de la tabla 1
• el comportamiento de disolución de las formulaciones de acuerdo con el ejemplo de referencia 1 no muestra correlación con las solubilidades intrínsecas correspondientes
• el comportamiento de disolución de las formulaciones de acuerdo con el ejemplo de referencia 1 parece ser impredeciblemente diferente entre sí en diferentes medios estándar, dependiendo de la modificación de Lenalidomida.
Además de la observación anterior y como es evidente de una comparación de los resultados experimentales, los perfiles de disolución de las composiciones farmacéuticas de acuerdo con el ejemplo 2 de la presente invención no exhiben una diferencia significativa en comparación con el producto de referencia REVLIMID®. Esto es aún más sorprendente ya que,
• el comportamiento de disolución de las formulaciones de acuerdo con el ejemplo de referencia 1 parece ser impredeciblemente diferente del producto de referencia REVLIMID® en cada medio estándar
• según el conocimiento de los inventores de la presente solicitud, ninguna de las modificaciones investigadas por los inventores de la presente solicitud se utiliza en REVLIMID®.
Ejemplo 3: Composiciones farmacéuticas de acuerdo con la invención
Las composiciones farmacéuticas se prepararon como se describe en el ejemplo 2, con la diferencia de que las composiciones farmacéuticas se prepararon con las cantidades de excipientes de acuerdo con la tabla 9.
Excipientes:
Claims (13)
1. Una composición farmacéutica sólida oral que comprende
a. del 1.0 % al 50.0 % en peso, calculado según la Lenalidomida básica, de partículas de una forma A de Lenalidomida básica;
b. de 50.0 % a 99.0 % en peso de uno o más agente o agentes de relleno; y
c. opcionalmente comprende uno o más desintegrante o desintegrantes, lubricante o lubricantes; aglomerante o aglomerantes, deslizante o deslizantes y otros excipientes farmacéuticamente aceptables;
todos los valores de porcentaje en peso se calculan en relación con el peso total de la composición;
en donde la distribución del tamaño de partícula (dg0) de las partículas de Lenalidomida está en el intervalo de desde 1 |jm a 100 |jm.
2. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde la cantidad de partículas de una modificación de Lenalidomida está en el intervalo de desde 2.0 % a 20.0 % en peso, más preferiblemente de 3.0 % a 10.0 % en peso y más preferido de 4.0 % a 8.0 % en peso.
3. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde la distribución del tamaño de partícula (dgü) de las partículas de Lenalidomida está en el intervalo de desde 2 jm a 80 jm, preferiblemente de 3 jm a 50 jm, más preferible de 30 jm a 45 jm.
4. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde la distribución del tamaño de partícula (d50) de las partículas de Lenalidomida es de desde 0.5 jm a 30 jm, preferiblemente de 2 jm a 20 jm, incluso más preferiblemente de 3 jm a 15 jm y lo más preferible de 4 jm a 10 jm.
5. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde la distribución del tamaño de partícula (d-iü) de las partículas de Lenalidomida es de desde 0.1 jm a 2 jm, preferiblemente de 0.05 jm a 1 jm, incluso más preferiblemente de 0.08 jm a 0.7 jm y lo más preferible de 0.1 jm a 0.4 jm.
6. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde el uno o más agente o agentes de relleno se seleccionan de celulosa microcristalina (MCC), celulosa microcristalina silicificada (SMCC), monohidrato de lactosa, lactosa anhidra, manitol, sacarosa, fosfato dicálcico, carbonato de calcio, carbonato de magnesio, almidón pregelatinizado, hidroxipropilcelulosa de baja sustitución (L-HPC), celulosa en polvo, silicato de calcio, fosfato de calcio, sorbitol, manitol, dextrinas, caolín, óxido de magnesio, sulfato de calcio, xilitol, isomalt, glucosa, fructosa, maltosa, ácidos como ácido cítrico, ácido tartárico, ácido fumárico y copolímeros de vinilpirrolidona y acetato de vinilo o copolímeros de polietilenglicol, preferiblemente seleccionados de MCC y lactosa anhidra.
7. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde el uno o más desintegrante o desintegrantes se seleccionan de croscarmelosa, carboximetilcelulosa de calcio, glicolato de almidón de sodio, almidón de maíz, almidón pregelatinizado, almidón de patata, ácido algínico, polivinilpirrolidona (crospovidona) e hidroxipropilcelulosa de baja sustitución (L-HPC), siendo preferiblemente croscarmelosa de sodio.
8. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde el uno o más lubricante o lubricantes se seleccionan de estearato de magnesio, estearato de calcio, estearato de sodio, ácido esteárico, gliceril behenato de sodio, ácido hexanodioico, aceite vegetal hidrogenado de sodio, fumarato de estearilo y fumarato de glicerina, siendo preferiblemente estearato de magnesio.
9. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde el uno o más aglomerante o aglomerantes se seleccionan del grupo que comprende hidroxipropilmetilcelulosa (HPMC), dihidroxipropilcelulosa, metilcelulosa, hidroxietilcelulosa, etilcelulosa, carboxil metilcelulosa de sodio, polietilenglicol, maltodextrina, almidón pregelatinizado, almidón, polimetacrilatos, alginato de sodio, polivinilpirrolidona (povidona) y copolímero de vinilpirrolidona/acetato de vinilo (copovidona).
10. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores, en donde el uno o más deslizante o deslizantes se seleccionan de dióxido de silicio coloidal, talco y carbonato de magnesio.
11. La composición farmacéutica sólida oral de acuerdo con cualquiera de las reivindicaciones anteriores en forma de una cápsula, en donde
i. la cantidad de agente o agentes de relleno está en el intervalo de desde 60.0 % a 98.0 % en peso, preferiblemente 80.0 % a 95.0 % en peso;
ii. la cantidad de uno o más desintegrante o desintegrantes está en el intervalo de desde 1.0 % a 10.0 % en peso iii. la cantidad de uno o más lubricante o lubricantes está en el intervalo de desde 0.5 % a 2.0 % en peso.
12. Un proceso de mezclado de polvo seco para la fabricación de composiciones farmacéuticas sólidas orales en forma de una cápsula de acuerdo con la reivindicación 11, que comprende las etapas de:
a. Moler una modificación cristalina de Lenalidomida seleccionada del grupo que comprende la Lenalidomida básica, sal de clorhidrato de Lenalidomida, cocristal de cloruro de amonio de Lenalidomida o mezclas de los mismos; b. Mezclar la Lenalidomida molida y una primera parte del agente o agentes de relleno para obtener la mezcla 1; c. Mezclar la mezcla 1 y una segunda parte del agente o agentes de relleno para obtener la mezcla 2;
d. Mezclar el desintegrante o desintegrantes y lubricante o lubricantes para obtener la mezcla 3;
e. Tamizar la mezcla 3;
f. Mezclar la mezcla 2 y la mezcla 3 (Lubricación) para obtener la mezcla final;
g. Llenar las cápsulas con la mezcla final.
13. El proceso para la fabricación de una cápsula de acuerdo con la reivindicación 12, que comprende las etapas de: a. Moler una modificación cristalina de Lenalidomida seleccionada del grupo que comprende la forma A de Lenalidomida básica, sal de clorhidrato de Lenalidomida, cocristal de cloruro de amonio de Lenalidomida o mezclas de los mismos;
b. Mezclar la Lenalidomida molida y lactosa para obtener la mezcla 1;
c. Mezclar la mezcla 1 y celulosa microcristalina para obtener la mezcla 2;
d. Mezclar croscarmelosa de sodio y estearato de magnesio para obtener la mezcla 3;
e. Tamizar la mezcla 3;
f. Mezclar la mezcla 2 y la mezcla 3 para obtener la mezcla final; y
g. Llenar las cápsulas con la mezcla final.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15182621.1A EP3135275B1 (en) | 2015-08-27 | 2015-08-27 | Pharmaceutical composition capable of the incorporation of lenalidomide in various crystalline modifications |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2811110T3 true ES2811110T3 (es) | 2021-03-10 |
Family
ID=54014530
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES15182621T Active ES2811110T3 (es) | 2015-08-27 | 2015-08-27 | Composición farmacéutica capaz de la incorporación de Lenalidomida en diversas modificaciones cristalinas |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US10987344B2 (es) |
| EP (2) | EP3744318A1 (es) |
| CN (1) | CN107920999A (es) |
| ES (1) | ES2811110T3 (es) |
| HR (1) | HRP20201162T1 (es) |
| LT (1) | LT3135275T (es) |
| SI (1) | SI3135275T1 (es) |
| WO (1) | WO2017032870A1 (es) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3700508A1 (en) * | 2017-10-26 | 2020-09-02 | Synbias Pharma AG | Lenalidomide immediate release formulations |
| EP3505158A1 (en) * | 2017-12-27 | 2019-07-03 | KRKA, d.d., Novo mesto | Pharmaceutical composition of lenalidomide pharmaceutically acceptable acid addition salt |
| WO2019138424A1 (en) | 2018-01-11 | 2019-07-18 | Natco Pharma Limited | Stable pharmaceutical compositions comprising lenalidomide |
| EP3545949A1 (en) * | 2018-03-29 | 2019-10-02 | Midas Pharma GmbH | Oral dosage forms comprising pomalidomide crystalline form a |
| KR102286497B1 (ko) * | 2018-04-13 | 2021-08-05 | 주식회사 삼양홀딩스 | 다양한 용량의 레날리도마이드의 경구용 정제 조성물 |
| WO2019199133A1 (ko) * | 2018-04-13 | 2019-10-17 | 주식회사 삼양바이오팜 | 레날리도마이드의 경구용 코팅 정제 조성물 |
| WO2019199135A1 (ko) * | 2018-04-13 | 2019-10-17 | 주식회사 삼양바이오팜 | 레날리도마이드를 포함하는 경구용 고형제제의 제조방법 |
| WO2019199134A1 (ko) * | 2018-04-13 | 2019-10-17 | 주식회사 삼양바이오팜 | 레날리도마이드를 포함하는 약제학적 조성물 |
| KR102286500B1 (ko) * | 2018-04-13 | 2021-08-05 | 주식회사 삼양홀딩스 | 레날리도마이드를 포함하는 경구용 고형제제의 제조방법 |
| CN117298115A (zh) * | 2022-11-18 | 2023-12-29 | 轩竹生物科技股份有限公司 | CDKs抑制剂的药物组合物及制备方法 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1668296A (zh) | 2002-05-17 | 2005-09-14 | 细胞基因公司 | 使用选择性细胞因子抑制性药物用于治疗和控制癌症和其它疾病的方法及组合物 |
| UA83504C2 (en) | 2003-09-04 | 2008-07-25 | Селджин Корпорейшн | Polymorphic forms of 3-(4-amino-1-oxo-1,3 dihydro-isoindol-2-yl)-piperidine-2,6-dione |
| WO2009114601A2 (en) * | 2008-03-11 | 2009-09-17 | Dr. Reddy's Laboratories Ltd. | Preparation of lenalidomide |
| US20110060010A1 (en) | 2008-03-13 | 2011-03-10 | Tianjin Hemay Bio-Tech Co., Ltd | Salts of 3-(4-amino-1-oxo-1,3-dihydro-isoindol-2-yl)piperidine-2,6-dione and derivatives thereof, or polymorphs of salts, process for preparing same and use thereof |
| DE102008057284A1 (de) * | 2008-11-14 | 2010-05-20 | Ratiopharm Gmbh | Tabletten enthaltend Lenalidomid und Adhäsionsverstärker |
| US20120046315A1 (en) * | 2008-11-14 | 2012-02-23 | Katrin Rimkus | Intermediate and oral administrative formats containing lenalidomide |
| WO2010056384A1 (en) | 2008-11-17 | 2010-05-20 | Dr. Reddy's Laboratories Ltd. | Lenalidomide solvates and processes |
| CN101537184B (zh) * | 2009-04-30 | 2011-04-20 | 杭州中美华东制药有限公司 | 一种含水难溶高活性药物的组合物及其制备方法 |
| WO2010129636A2 (en) * | 2009-05-08 | 2010-11-11 | Dr. Reddy's Laboratories Ltd. | Lenalidomide polymorph |
| MX2012001890A (es) | 2009-08-12 | 2012-03-26 | Synthon Bv | Sales de lenalidomida. |
| US20120220777A1 (en) | 2009-09-16 | 2012-08-30 | Ranbaxy Laboratories Limited | Process for the preparation of a crystalline form of lenalidomide |
| WO2011061611A1 (en) | 2009-11-19 | 2011-05-26 | Ranbaxy Laboratories Limited | Process for the preparation of form b of lenalidomide |
| WO2011069608A1 (en) * | 2009-12-09 | 2011-06-16 | Ratiopharm Gmbh | S-lenalidomide, polymorphic forms thereof and blend comprising s- und r-lenalidomide |
| WO2011111053A1 (en) | 2010-03-08 | 2011-09-15 | Natco Pharma Limited | Anhydrous lenalidomide form-i |
| WO2013012485A2 (en) | 2011-07-19 | 2013-01-24 | Amplio Pharma, Llc | Novel crystalline forms of 3-(4-amino-1-oxo-1,3 dihydro-isoindol-2-yl)-piperidine-2,6-dione |
| EP2573085A1 (en) * | 2011-09-26 | 2013-03-27 | AiCuris GmbH & Co. KG | N-[5-(aminosulfonyl)-4methyl-1,3-thiazol-2-yl]-N-methyl-2-[4-(2-pyridinyl)phenyl] acetamide mesylate monohydrate having a specific particle size distribution range and a specific surface area range |
| WO2014160686A1 (en) * | 2013-03-26 | 2014-10-02 | Celgene Corporation | Solid forms comprising 3-(4-amino-1-oxo-1,3-dihydro-isoindol-2-yl)-piperidine-2,6-dione and a coformer, compositions and methods of use thereof |
| CN107708951A (zh) | 2015-06-24 | 2018-02-16 | 三菱化学株式会社 | 纤维增强树脂材料、成型品、纤维增强树脂材料的制造方法和制造装置、以及纤维束组的检查装置 |
-
2015
- 2015-08-27 ES ES15182621T patent/ES2811110T3/es active Active
- 2015-08-27 SI SI201531286T patent/SI3135275T1/sl unknown
- 2015-08-27 LT LTEP15182621.1T patent/LT3135275T/lt unknown
- 2015-08-27 EP EP20173854.9A patent/EP3744318A1/en not_active Withdrawn
- 2015-08-27 EP EP15182621.1A patent/EP3135275B1/en not_active Revoked
-
2016
- 2016-08-26 WO PCT/EP2016/070165 patent/WO2017032870A1/en not_active Ceased
- 2016-08-26 US US15/754,414 patent/US10987344B2/en active Active
- 2016-08-26 CN CN201680049566.0A patent/CN107920999A/zh active Pending
-
2020
- 2020-07-24 HR HRP20201162TT patent/HRP20201162T1/hr unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CN107920999A (zh) | 2018-04-17 |
| CA2995878A1 (en) | 2017-03-02 |
| EP3744318A1 (en) | 2020-12-02 |
| US20180243283A1 (en) | 2018-08-30 |
| HRP20201162T1 (hr) | 2020-11-13 |
| SI3135275T1 (sl) | 2020-09-30 |
| WO2017032870A1 (en) | 2017-03-02 |
| US10987344B2 (en) | 2021-04-27 |
| LT3135275T (lt) | 2020-09-25 |
| EP3135275B1 (en) | 2020-05-13 |
| EP3135275A1 (en) | 2017-03-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2811110T3 (es) | Composición farmacéutica capaz de la incorporación de Lenalidomida en diversas modificaciones cristalinas | |
| ES2596554T3 (es) | Comprimidos de acetato de ulipristal | |
| ES2855426T3 (es) | Granulados, proceso de preparación de los mismos y productos farmacéuticos que los contienen | |
| ES2957912T3 (es) | Composiciones farmacéuticas que comprenden nilotinib | |
| JP6336420B2 (ja) | ニトロカテコール誘導体を含む医薬製剤及びその製造方法 | |
| ES2537063T3 (es) | Composición farmacéutica mejorada que contiene un antagonista de dihidropiridina del canal de calcio y método para preparación de la misma | |
| ES2950995T3 (es) | Un comprimido que comprende un derivado de metoxiurea y partículas de manitol | |
| WO2011093833A2 (en) | Effervescent formulations comprising second generation cephalosporin | |
| ES2616115T3 (es) | Forma farmacéutica oral de liberación controlada que comprende oxicodona | |
| ES3028429T3 (en) | Pharmaceutical capsule composite formulation comprising tadalafil and tamsulosin | |
| TW202010491A (zh) | 結晶型腎上腺素丙二酸鹽 | |
| WO2016175230A1 (ja) | 経口投与用医薬組成物 | |
| KR102598782B1 (ko) | 알펠리십을 포함하는 제약 조성물 | |
| CA3203125A1 (en) | Endoxifen for treatment of ovarian cancer | |
| ES2953126T3 (es) | Un método para fabricar una composición farmacéutica que comprende Nefopam y Acetaminofén, y la composición farmacéutica obtenida de esta manera | |
| ES2402865T3 (es) | Formulación farmacéutica que contiene fluvastatina | |
| ES2864176T3 (es) | Composición farmacéutica en comprimido que comprende la forma 3 de bilastina y una carga soluble en agua | |
| ES2862209T3 (es) | Composiciones orales sólidas de liberación prolongada no pulsátil que contienen betahistina | |
| ES2835287T3 (es) | Composición farmacéutica de comprimido que comprende la forma polimórfica 3 de bilastina y aluminometasilicato de magnesio | |
| ES2785398T3 (es) | Composición farmacéutica que comprende Aripiprazol o sal del mismo | |
| ES2933177T3 (es) | Preparación de cápsulas compuestas, que contienen tadalafilo y tamsulosina, y que tienen una estabilidad y una tasa de elución mejoradas | |
| ES2868228T3 (es) | Formas de dosificación farmacéuticas que contienen 1-[6-(morfolin-4-il)pirimidin-4-il]-4-(1H-1,2,3-triazol-1-il)-1H-pirazol-5-olato de sodio | |
| JP5791817B2 (ja) | 溶出性及び/又は吸収性が改善された経口投与用医薬組成物 | |
| CA2995878C (en) | Pharmaceutical composition capable of the incorporation of lenalidomide in various crystalline modifications | |
| JP2009209137A (ja) | 服用性が改善された錠剤 |