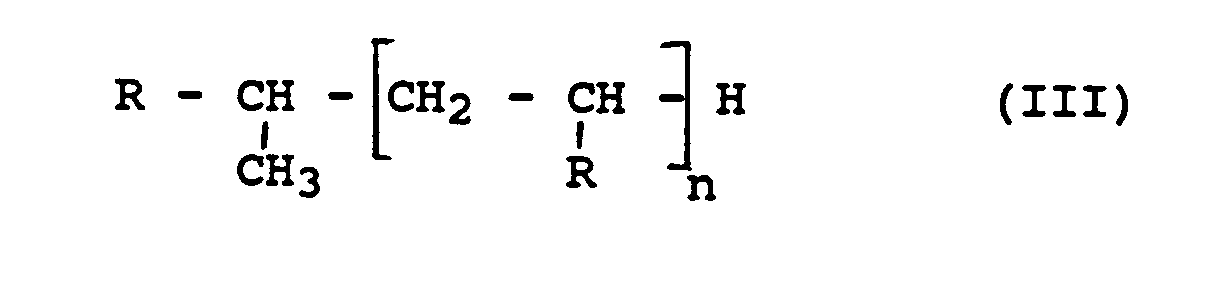EP0471266A1 - Verwendung von Oligomeren bzw. Cooligomeren von (Meth)acrylsäureestern und 1-Alkenen als Syntheseöle - Google Patents
Verwendung von Oligomeren bzw. Cooligomeren von (Meth)acrylsäureestern und 1-Alkenen als Syntheseöle Download PDFInfo
- Publication number
- EP0471266A1 EP0471266A1 EP91113123A EP91113123A EP0471266A1 EP 0471266 A1 EP0471266 A1 EP 0471266A1 EP 91113123 A EP91113123 A EP 91113123A EP 91113123 A EP91113123 A EP 91113123A EP 0471266 A1 EP0471266 A1 EP 0471266A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- degrees
- grad
- weight
- carbon atoms
- meth
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M145/00—Lubricating compositions characterised by the additive being a macromolecular compound containing oxygen
- C10M145/02—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
- C10M145/10—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate
- C10M145/12—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate monocarboxylic
- C10M145/14—Acrylate; Methacrylate
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M107/00—Lubricating compositions characterised by the base-material being a macromolecular compound
- C10M107/02—Hydrocarbon polymers; Hydrocarbon polymers modified by oxidation
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M107/00—Lubricating compositions characterised by the base-material being a macromolecular compound
- C10M107/20—Lubricating compositions characterised by the base-material being a macromolecular compound containing oxygen
- C10M107/22—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
- C10M107/28—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M111/00—Lubrication compositions characterised by the base-material being a mixture of two or more compounds covered by more than one of the main groups C10M101/00 - C10M109/00, each of these compounds being essential
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M111/00—Lubrication compositions characterised by the base-material being a mixture of two or more compounds covered by more than one of the main groups C10M101/00 - C10M109/00, each of these compounds being essential
- C10M111/04—Lubrication compositions characterised by the base-material being a mixture of two or more compounds covered by more than one of the main groups C10M101/00 - C10M109/00, each of these compounds being essential at least one of them being a macromolecular organic compound
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M143/00—Lubricating compositions characterised by the additive being a macromolecular hydrocarbon or such hydrocarbon modified by oxidation
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M169/00—Lubricating compositions characterised by containing as components a mixture of at least two types of ingredient selected from base-materials, thickeners or additives, covered by the preceding groups, each of these compounds being essential
- C10M169/04—Mixtures of base-materials and additives
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2205/00—Organic macromolecular hydrocarbon compounds or fractions, whether or not modified by oxidation as ingredients in lubricant compositions
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2205/00—Organic macromolecular hydrocarbon compounds or fractions, whether or not modified by oxidation as ingredients in lubricant compositions
- C10M2205/02—Organic macromolecular hydrocarbon compounds or fractions, whether or not modified by oxidation as ingredients in lubricant compositions containing acyclic monomers
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2205/00—Organic macromolecular hydrocarbon compounds or fractions, whether or not modified by oxidation as ingredients in lubricant compositions
- C10M2205/02—Organic macromolecular hydrocarbon compounds or fractions, whether or not modified by oxidation as ingredients in lubricant compositions containing acyclic monomers
- C10M2205/0206—Organic macromolecular hydrocarbon compounds or fractions, whether or not modified by oxidation as ingredients in lubricant compositions containing acyclic monomers used as base material
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2209/00—Organic macromolecular compounds containing oxygen as ingredients in lubricant compositions
- C10M2209/02—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
- C10M2209/08—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate type
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2209/00—Organic macromolecular compounds containing oxygen as ingredients in lubricant compositions
- C10M2209/02—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
- C10M2209/08—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate type
- C10M2209/084—Acrylate; Methacrylate
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2209/00—Organic macromolecular compounds containing oxygen as ingredients in lubricant compositions
- C10M2209/02—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
- C10M2209/08—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate type
- C10M2209/084—Acrylate; Methacrylate
- C10M2209/0845—Acrylate; Methacrylate used as base material
-
- C—CHEMISTRY; METALLURGY
- C10—PETROLEUM, GAS OR COKE INDUSTRIES; TECHNICAL GASES CONTAINING CARBON MONOXIDE; FUELS; LUBRICANTS; PEAT
- C10M—LUBRICATING COMPOSITIONS; USE OF CHEMICAL SUBSTANCES EITHER ALONE OR AS LUBRICATING INGREDIENTS IN A LUBRICATING COMPOSITION
- C10M2209/00—Organic macromolecular compounds containing oxygen as ingredients in lubricant compositions
- C10M2209/02—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
- C10M2209/08—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate type
- C10M2209/086—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate type polycarboxylic, e.g. maleic acid
- C10M2209/0863—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds containing monomers having an unsaturated radical bound to a carboxyl radical, e.g. acrylate type polycarboxylic, e.g. maleic acid used as base material
Definitions
- the invention relates to synthetic oils which consist wholly or partly of oligomers of or cooligomers of (meth) acrylic acid esters and ⁇ -olefins.
- synthetic oils synthetic oils
- the common synthetic oils belong to different classes of substances, in addition to polyethers, esters (of mono- and polybasic carboxylic acids with mono- and polybasic alcohols), phosphoric acid and phosphonic acid esters, silicones, silicate esters, polyhalocarbons and fluorinated esters, these are polyolefins and alkyl aromatics.
- Polymers obtained from a-olefins of different origins and with different polymerization processes were of particular interest. This is how polymers of a-olefins with 8-12 C atoms come, e.g. by means of Ziegler catalysts or catalysts for ionic polymerization, importance due to their good VI and pour point values. Mixtures of such a-olefin oligomers with ester oils are said to have a relatively good compatibility with rubber materials. Another advantage described is the better miscibility of the olefin oligomer / ester mixtures with polar additives compared to the pure components.
- cooligomers or copolymers of ⁇ -olefins with (meth) acrylic acid esters as mineral oil additives have attracted the interest of technology.
- the included a-olefin greatly improves the thermal stability of the additives.
- US Pat. No. 4,419,106 describes oil preparations which contain a hydrocarbon oil and a portion of a pour point depressant consisting of a copolymer of approx. 10-90% by weight alkyl acrylate units containing 8-20 alkyl C atoms and 90- Have 10% by weight of a-monoolefin units with 12-40 carbon atoms per 100% by weight of copolymer with a molecular weight Mw of 1,000-100,000.
- the narrow molecular weight range achieved and the high uniformity of the products are emphasized.
- US Pat. No. 4,009,195 describes an oligomerization process in which a wide variety of (meth) acrylic acid derivatives, such as, for example, C1-C4-alkyl esters, in proportions of 1-35% by weight in addition to (meth) acrylic acid esters of C8-C34 Alkanols in proportions of 1-45% by weight are added continuously and at the same time to a mixture of radical initiators and 10-90% by weight of a 1-alkene having 4-32 C atoms in such a way that this is essentially immediate occurring molar ratio of acid derivatives to 1-alkene in the reaction mixture is kept relatively constant in the range 0.001 to 0.2, the addition being to take place at a temperature which does not impair the oligomerization.
- DE-A 32 23 694 claims copolymers of ⁇ , ⁇ -unsaturated dicarboxylic acid esters with ⁇ -olefins.
- the ⁇ , ⁇ -unsaturated dicarboxylic acid esters by definition contain straight-chain or branched monoalcohols with 3 to 10 carbon atoms as alcohol components; the a-olefins have 10-16 carbon atoms.
- the copolymers can optionally be crosslinked and their pour point should be between -60 and 0 degrees C.
- Copolymers containing isocyanate groups in the molecular weight range 500-10,000 can be prepared by solution polymerization of C1-C20-alkyl esters of (meth) acrylic acid and olefins with 1-alkenyl isocyanate (cf. DE-A 32 45 298).
- US Pat. No. 4,526,950 describes a production process for copolymers in which, starting from at least one ⁇ -olefin having at least 6 C atoms and at least one unsaturated carboxylic acid or derivatives, copolymerizable with the olefins are, in the presence of a radical initiator, the mixture of the components is heated to at least 135 ° C.
- EP-A 217 602 discloses oil additives based on ethylene copolymers, inter alia with ethylenically unsaturated mono- or dicarboxylic acids or their esters, which have a molecular weight M n of ⁇ 1,000.
- Prior art synthetic oils are usually made from hydrocarbons such as e.g. Oligomers of 1-decene and / or esters, for example dicarboxylic acid esters. (Ullmann's Encyclopedia of Techn. Chemistry, 4th Edition, Vol. 20, 503 - 530, Verlag Chemie 1981).
- esters Due to their polar structure, the esters are known to have serious disadvantages, e.g. Problems with miscibility with mineral oils, non-mineral oil-based base oils and poor seal compatibility. In addition, the ester function can give rise to hydrolysis, with the result that corrosion of metal parts is promoted. Attempts are made to compensate for the disadvantages mentioned by mixing hydrocarbons with esters, but this requires considerable development effort in practice.
- the components A), B) and C) in the cooligomers CM should complement each other 100%.
- the cooligomers according to the invention are in the molecular weight range Mw 1,000 to 100,000, preferably 1,500 to 25,000 (determination by gel permeation chromatography, cf. HF Mark et al. Encyclopedia of Polymer Science & Technology Vol. 10, 1-19, J. Wiley 1987) .
- alkenes-1 having 10 to 32 carbon atoms which are obtained in the polymerization of ethylene, propylene or mixtures thereof, these materials in turn being obtained from hydrocracked materials.
- component A) of the cooligomers CM stands for 1-decene, dodecene or for tetradecene is particularly preferred. Decen is very particularly preferred, when it is used the best low-temperature behavior (pour point) is registered.
- cooligomers CM in which component B) consists of (meth) acrylic acid esters with 4-24, preferably 8-22, carbon atoms in the alkyl radical or mixtures thereof.
- Cooligomeric CM of the type described are synthetic oil components of the prior art quite comparable in terms of characteristics such as viscosities, VI index, low-temperature behavior, evaporation and oxidation stability and other practical properties.
- oligomers are used as a synthetic oil component, which also contain component C) in sufficient quantity, there is a good dispersing effect, sealing problems being avoided due to the oxygen-containing dispersing group and there being no loss in the shear stability of the mixture, as is the case e.g. occur when using high molecular weight VI improvers.
- Synthetic oils are to be understood in particular as the polyalphaolefins (PAO) preferred by technology and the organic esters (OE) such as dicarboxylic acid and polyol esters (cf. EI Williamson, J. Synth. Lubr. 2 (4) 329-341 (1986) ; 3 (1) 45 - 53 (1987); A. Plagge, Tribologie und Schmtechnikstechnik 34, 148 - 156 (1987); Ullmann, 4th edition, vol. 20, loc.cit. Pp. 514 - 821).
- PAO polyalphaolefins
- OE organic esters
- Crack olefins are primarily used as starting materials for the polyalphaolefins, predominantly with a boiling point between 30 and 300 degrees C.
- the polyalphaolefins generally correspond to the general formula 111 wherein R represents an alkyl radical, in particular having 6-10 carbon atoms, with a molecular weight of usually 300-6000 (Mw).
- Organic esters are, on the one hand, the esters of dicarboxylic acids with 3 to 17 carbon atoms, such as adipic acid, azelaic acid and sebacic acid with primary alcohols - the most important alcohol component in this case are polyalkylene glycols - on the other hand, the monocarboxylic acid esters, especially the esters of C6-C12 carboxylic acids with in particular branched alcohols, especially those with the neopentyl skeleton such as neopentyl alcohol, trimethylolpropane and pentaerythritol.
- the ester oils have a high adsorption capacity on metal surfaces and therefore good lubricity, but at the price of relative sensitivity to (hydrolytic) degradation, so that corrosive degradation products can occur.
- the viscosities range, for example, from around 5.9 [mm 2 / s at 38 degrees C] for the neopentyl glycol ester of n-C7 acid to 16.2 for the corresponding ester of n-C12 acid, or from the value 12 , 1 for the trimethylolpropane ester of n-C6 acid up to a value of 36.4 for the corresponding ester of n-C12 acid.
- the cooligomers of the claimed type can be prepared under certain conditions by radical-induced polymerization, for example by thermal polymerization and with the addition of a suitable initiator or a redox system.
- the polymerization can be carried out in the absence of a solvent or in the presence of suitable solvents.
- all conventional solvents identified as polymerization media can be used, as well as mineral oils, HC oils, PAO, esters or oligomers that have already been produced.
- the 1-alkene according to component A) can be specified in a suitable reaction vessel and brought to a suitable reaction temperature. In general, a temperature range of 80 to 200 degrees C, in particular 160 ⁇ 20 degrees C, can be considered as a suitable range.
- component B) or B) + c) is added in the proportions intended for this purpose in the same temperature range, preferably in the feed over a certain period, for example 0.25-10 hours, for example within 5 1/2 hours. It is expedient to allow the batch to polymerize for some time, usually a few hours - as a reference, about 6 hours. It has proven to be advantageous to add the initiator throughout the reaction, for example in portions at about thirty-minute intervals, or else continuously in the manner of a feed process.
- Known radical initiators can be used as initiators (cf.Kirk-Othmer, 3rd Ed., Vol. 13, pg. 355 - 373, Wiley Interscience 1981; Rauch-Puntigam loc.cit.).
- the total amount of initiator used is generally in the range 0.1-10% by weight, preferably in the range 0.1-5% by weight, based on the total of the monomers.
- Initiators are expediently chosen whose decay characteristics are the polymerization mo dalities are adjusted.
- a guideline is a half-life of the initiator (in benzene) at the reaction temperature of approximately 0.25 hours.
- These include, for example, peroxidic initiators, such as, for example, tert-butyl peroxide.
- the addition of 0.001-0.005 mol of initiator per portion should be given when adding in portions.
- the monomers are largely converted, for example by 98%, so that in many cases there is no need to separate off the monomers or even further work up. If the requirements for the flash point are high, for example, the residual monomer must be removed.
- the products generally are colorless, oily liquids that mix completely with mineral oil, PAO, HC oils and ester oils.
- AMA alkyl methacrylates
- PAO polyalphaolefin
- TMA-OD-Ester ester of trimethylolpropane with adipic acid
- the product is a colorless, oily liquid that is completely miscible with mineral oils, poly-olefins or ester oils.
- reaction temperature but 140 degrees C initiator used: tert-butyl perbenzoate
- reaction temperature 140 degrees C initiator: tert-butyl perbenzoate 4.8% by weight.
- reaction temperature 126 degrees C initiator: tert-butyl personoate 4.8% by weight.
- Example 4 Carried out as in Example 4, but in addition to 1 mol of 1-decene in the initial charge, 280 g of synthetic oil prepared in accordance with Example 4 were used as the solvent.
- methacrylate component is butyl methacrylate, feed time 3.5 hours.
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Emergency Medicine (AREA)
- Lubricants (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
Description
- Die Erfindung betrifft Syntheseöle, die ganz oder teilweise aus Oligomeren von bzw. Cooligomeren von (Meth)acrylsäureestern und a-Olefinen, bestehen.
- Die oft extremen Anforderungen, welche moderne Maschinen in Bezug auf die Schmierung stellen, haben zur Entwicklung synthetischer Schmiermittel (Syntheseöle) geführt. (Vgl. Ullmanns Encyclopädie der Techn. Chemie, 4. Auflage, Bd. 20, 503 - 530, Verlag Chemie 1981). Die gebräuchlichen Syntheseöle gehören verschiedenen Substanzklassen an, neben Polyethern, Estern (von ein- und mehrbasischen Carbonsäuren mit ein- und mehrbasischen Alkoholen), Phosphorsäure- und Phosphonsäureestern, Siliconen, Silicatestern, Polyhalogenkohlenstoffen und fluorierten Estern sind dies Polyolefine und Alkylaromaten.
- Besonderes Interesse fanden Polymerisate die ausgehend von a-Olefinen verschiedener Provenienzen und mit unterschiedlichem Polymerisationsverfahren gewonnen werden. So kommt Polymerisaten von a-Olefinen mit 8-12 C-Atomen, die z.B. mittels Ziegler-Katalysatoren oder Katalysatoren für die ionische Polymerisation gewonnen werden, Bedeutung zu aufgrund ihrer guten VI- und Stockpunkt-Werte. Gemischen derartiger a-Olefinoligomere mit Esterölen wird eine relativ gute Verträglichkeit mit Kautschukmaterialien zugeschrieben. Ein weiterer beschriebener Vorteil ist die im Vergleich zu den reinen Komponenten bessere Mischbarkeit der Olefinoligomeren/Ester-Gemische mit polaren Additiven. Weiter sind Cooligomere bzw. Copolymere von a-Olefinen mit (Meth)acrylsäureestern als Mineralöladditive auf das Interesse der Technik gestoßen. Im Vergleich zu den länger gebräuchlichen reinen Polymethacrylat-Polymeren wird durch das eingeschlossene a-Olefin die thermische Stabilität der Additive stark verbessert.
- In der US-A 4 419 106 werden Ölzubereitungen beschrieben, die ein Kohlenwasserstofföl und einen Anteil an einem Pour Point Depressant bestehend aus einem Copolymer aus ca. 10 - 90 Gew.-% Alkylacrylateinheiten enthaltend 8 - 20 Alkyl-C-Atome und 90 - 10 Gew.-% a-Monoolefineinheiten mit 12 - 40 C-Atomen pro 100 Gew.-% Copolymer mit einem Molekulargewicht Mw von 1 000 - 100 000 besitzen.
- In der US-A 3 968 148 bzw. der DE-A 22 43 064 werden z.B. Oligomere dieses Typs beschrieben, die aus drei Monomergruppen aufgebaut sind sowie deren Anwendung als VI-Verbesserer. Beansprucht werden Oligomere aus:
- ca. 10 - 90 Gew.-% eines 1-Alkens mit 4 bis 32 C-Atomen
- ca. 1 - 35 Gew.-% eines oder mehrerer Alkyl(meth)-acrylsäureester mit 8 - 34 C-Atomen im Alkylrest und
- ca. 1 - 35 Gew.-% eines oder mehrerer Alkylester der (Meth)acrylsäure oder homologer, endständig ungesättigter Carbonsäuren mit 1 - 4 C-Atomen im Alkylrest.
- Das Molekulargewicht derartiger Oligomerer liegt vorzugsweise bei Mn = 1 000 bis 4 000. Betont wird der erreichte enge Molekulargewichtsbereich und die hohe Einheitlichkeit der Produkte. Weiter wird in der US-A 4 009 195 ein Oligomerisierungsverfahren beschrieben, bei dem die verschiedensten (Meth)acrylsäurederivate, wie z.B. C1-C4-Alkylester in Anteilen von 1 - 35 Gew.-% neben (Meth)-acrylsäureestern von C8-C34-Alkanolen in Anteilen von 1 - 45 Gew.-% kontinuierlich und gleichzeitig zu einem Gemisch von Radikal-Initiatoren und 10 - 90 Gew.-% eines 1-Alkens mit 4 - 32 C-Atomen derart zugesetzt werden, daß das im wesentlichen sofort eintretende molare Verhältnis Säure-Derivate zu 1-Alken im Reaktionsansatz relativ konstant im Bereich 0,001 zu 0,2 gehalten wird, wobei der Zusatz bei einer Temperatur erfolgen soll, welche die Oligomerisation nicht beeinträchtigt.
- Aus derselben Prioritätsanmeldung wie die vorgenannte US-A ist auch die US-A 3 994 958 hervorgegangen, bei der ein Oligomer, dessen Zusammensetzung von der vorgenannten US-A umfaßt wird, nachträglich mit einem Alkylendiamin zur Reaktion gebracht wurde um zu dispergierwirksamen VI-Verbesserern zu kommen.
- Weiter werden in der DE-A 32 23 694 Copolymere aus a,ß-ungesättigten Dicarbonsäureestern mit a-Olefinen beansprucht. Die a,ß-ungesättigten Dicarbonsäureester enthalten dabei definitionsgemäß als Alkoholkomponente geradkettige oder verzweigte Monoalkohole mit 3 - 10 Kohlenstoffatomen; die a-Olefine weisen 10 - 16 Kohlenstoffatome auf. Die Copolymeren können gegebenenfalls vernetzt sein und ihr Pourpoint soll zwischen -60 und 0 Grad C liegen.
- Copolymere mit einem Gehalt von Isocyanat-Gruppen im Molgewichtsbereich 500 - 10 000 können durch Lösungspolymerisation von C1-C20-Alkylestern der (Meth)acrylsäure und Olefinen mit 1-Alkenylisocyanat hergestellt werden (vgl. DE-A 32 45 298). In der US-A 4 526 950 wird ein Herstellungsverfahren für Copolymere beschrieben, bei dem ausgehend von mindestens einem a-Olefin mit mindestens 6 C-Atomen und mindestens einer ungesättigten Carbonsäure bzw. Derivaten, die mit den Olefinen copolymerisierbar sind, in Gegenwart eines Radikal-Initiators die Mischung aus den Komponenten in Abwesenheit von Lösungs- oder Verdünnungsmitteln auf mindestens 135 Grad C erhitzt wird, wobei keines der reaktiven Monomeren im Überschuß zur Anwendung kommt, um eine Verdünnungwirkung zu vermeiden. Weiter werden in der SU-A 1 135 752 Copolymerisate aus Decylmethacrylat und Tetradecen mit einem Molgewicht von 8 000 - 13 000 als Schmierölverdicker beansprucht.
- Aus der EP-A 217 602 sind öladditive auf Basis von Ethylencopolymerisaten u.a. mit ethylenisch ungesättigten Mono- oder Dicarbonsäuren bzw. deren Estern bekannt, die ein Molgewicht Mn von < 1 000 besitzen.
- Der vorstehend geschilderte Stand der Technik läßt erkennen, daß der Klasse der Methacrylat/a-Olefin-Copolymeren und ihrer Anwendung als Mineralöl-Additive relativ viel Aufmerksamkeit geschenkt wurde. Diese Verbindungsklasse stand jedoch bislang in keinem unmittelbaren technologischen Zusammenhang mit den sogenannten "Syntheseölen".
- Syntheseöle des Standes der Technik sind gewöhnlich aus Kohlenwasserstoffen wie z.B. Oligomeren von 1-Decen und/oder Estern beispielsweise Dicarbonsäureestern aufgebaut. (Ullmann's Encyclopädie der Techn. Chemie, 4. Auflage, Bd. 20, 503 - 530, Verlag Chemie 1981).
- Beide verwendeten Substanzklassen besitzen jedoch Nachteile. Die Polyolefine zeigen aufgrund ihrer unpolaren Struktur zu geringe Löslichkeit, wenn sie zusammen mit polaren Komponenten beispielsweise Hochdruck-(EP)-Additiven eingesetzt werden sollen.
- Die Ester weisen aufgrund ihrer polaren Struktur bekanntermaßen gravierende Nachteile auf, wie z.B. Probleme bei der Mischbarkeit mit Mineralölen, nichtmineralölbasischen Grundölen sowie schlechte Dichtungsverträglichkeit. Darüber hinaus kann die Esterfunktion Anlaß zur Hydrolyse geben mit dem Ergebnis, daß die Korrosion von Metallteilen gefördert wird. Man versucht, die genannten Nachteile durch Abmischung von Kohlenwasserstoffen mit Estern zu kompensieren, was in der Praxis jedoch einen beträchtlichen Entwicklungsaufwand voraussetzt.
- Sollen die verwendeten Syntheseöl-Aufmischungen Dispergierwirksamkeit für z.B. Schwarzschlamm aufweisen, ist es nötig, zusätzlich nieder- oder hochmolekulare Substanzen zuzufügen (z.B. "Ashless Dispersants" vom Polyisobutenylsuccinimid-Typ oder VI-Verbesserer versehen mit polaren Gruppen). Dies bedeutet einen beträchtlichen Aufwand. Hinzu tritt, daß diese meist stickstoffhaltigen Verbindungen Dichtungsprobleme verursachen können. Sofern die erfindungsgemäß eingesetzten Cooligomeren CM die Komponente C) enthalten, wird Dispergierwirksamkeit erreicht, ohne die notorischen Probleme, die bei Verwendung beispielsweise stickstoffhaltiger Monomerer auftreten, insbesondere Dichtungsunverträglichkeit.
- Es wurde nun gefunden, daß die (Meth)acrylsäureester-a-Olefin-Cooligomeren der vorliegenden Erfindung die Anforderungen der Technik in besonderem Maße erfüllen.
- Die vorliegende Erfindung betrifft Syntheseöle enthaltend neben den üblichen Bestandteilen 5 bis 100 Gew.-% Cooligomere CM aufgebaut aus:
- A) 0 - 75 Gew.-%, vorzugsweise 10 bis 70 Gew.-%, ganz besonders 10 - 40 Gew.-% mindestens eines 1-Alkens mit 4 bis 32 Kohlenstoffatomen, vorzugsweise 10 bis 14 Kohlenstoffatomen im Molekül
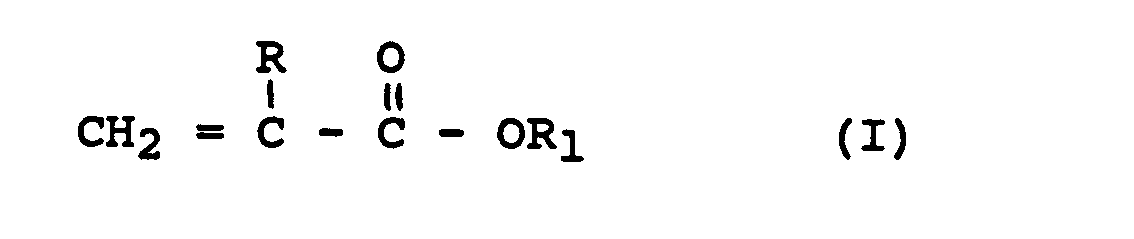
- B) 20 - 100 Gew.-%, vorzugsweise 40 - 90 Gew.-% mindestens eines (Meth)acrylsäureesters der Formel I
- C) 0 - 65 Gew.-%, vorzugsweise 5 bis 40 Gew.-% eines (Meth)acrylsäureesters der Formel 11
- Die Bestandteile A), B) und C) in den Cooligomeren CM sollen sich zu 100 % ergänzen. Die erfindungsgemäßen Cooligomeren liegen im Molekulargewichtsbereich Mw 1 000 bis 100 000, vorzugsweise 1 500 bis 25 000 (Bestimmung durch Gelpermeationschromatographie, vgl. H.F. Mark et al. Encyclopedia of Polymer Science & Technology Vol. 10, 1 - 19, J. Wiley 1987).
- Beispielhaft für Vertreter der Komponente A) seien etwa genannt:
- Buten-1, Penten-1, Hexen-1, Hepten-1, Octen-1, Nonen-1, Decen-1, Undecen-1, Dodecen-1, Tridecen-1, Tetradecen-1, Pentadecen-1, Hexadecen-1, Heptadecen-1, Octadecen-1, Nonadecen-1, Eicosen-1, Heneicosen-1, Docosen-1, Trocosen-1, Tetracosen-1, Pentacosen-1, Hexacosen-1, Heptacosen-1, Octacosen-1, Nonacosen-1, Triaconten-1, Hentriaconten-1, Dotriaconten-1, oder dergleichen. Geeignet sind ferner verzweigt-kettige Alkene, wie beispielsweise Vinylcyclohexan, 3,3-Dimethylbuten-1, 3-Methylbuten-1, Diisobutylen-4-methylpenten-1 oder dergleichen.
- Ferner eignen sich Alkene-1 mit 10 bis 32 Kohlenstoffatomen, die bei der Polymerisation von Ethylen, Propylen oder Mischungen davon anfallen, wobei diese Materialien ihrerseits aus hydrogecrackten Materialien gewonnen werden.
- Besonders bevorzugt ist die Ausführungsart bei der die Komponente A) der Cooligomeren CM für 1-Decen, Dodecen oder für Tetradecen steht. Ganz besonders bevorzugt ist Decen, bei dessen Verwendung das beste Tieftemperaturverhalten (Stockpunkt) registriert wird.
- Weiter sind von besonderem Interesse Cooligomere CM worin die Komponente B) aus (Meth)-acrylsäureestern mit 4 - 24, vorzugsweise 8 - 22 Kohlenstoffatomen im Alkylrest bzw. aus Gemischen derselben besteht.
- Genannt seien z.B. die Monomeren:
- Butylacrylat, 2-Äthylhexylacrylat, Cyclohexylacrylat, Isodecylacrylat, Decylacrylat, Undecylacrylat, Dodecylacrylat, Tridecylacrylat, Tetradecylacrylat, Pentadecylacrylat, Dodecylpentadecylacrylat, Hexadecylacrylat, Heptadecylacrylat, Octadecylacrylat, Cetylstearylacrylat, Oleylacrylat, Nonadecylacrylat, Eicosylacrylat, Cetyleicosylacrylat, Stearyleicosylacrylat, Docosylacrylat, Eicosyltetratriacontylacrylat bzw. die entsprechenden Methacrylate.
- Hervorgehoben seien Alkylmethacrylate mit C10 im Alkylrest mit einem höheren Iso-Anteil. Erwähnt seien z.B. C12-C15-Alkylester der Methacrylsäure mit ca. 60 - 90 % Iso-Anteil sowie Isodecylmethacrylat, wobei sich ein hoher Verzweigungsgrad günstig auf das Tieftemperaturverhalten, inclusive den Stockpunkt auswirkt und eine gewisse C-Zahlverteilung das Viskositäts-Temperaturverhalten verbessert.
- Cooligomere CM der beschriebenen Art sind Syntheseölbestandteilen des Standes der Technik durchaus vergleichbar in Bezug auf Kenndaten wie Viskositäten, VI-Index, Tieftemperatur-Verhalten, Verdampfungs- und Oxidationsstabilität und weitere praxisrelevante Eigenschaften.
- Gegenüber dem beschriebenen Stand der Technik weisen sie jedoch folgende Vorteile auf: Aufgrund der Kombination von polaren Monomeren mit unpolaren gibt es keinerlei Mischbarkeitsprobleme mit Mineralölen, Poly-a-Olefinen (PAO), Estern oder anderen Grundflüssigkeiten sowie keinerlei Löslichkeitsprobleme mit Additiven. Das Dichtungsverhalten ist absolut neutral. Korrosion aufgrund von Säurebildung kann ebenfalls ausgeschlossen werden.
- Darüber hinaus wurde überraschenderweise gefunden, daß Syntheseöl-Aufmischungen der Cooligomeren CM z.B. mit Polyolefinen und/oder Estern einen deutlich gegenüber den Einzelkomponenten erhöhten VI-Index aufweisen, was auf den Einfluß des Oligomers zurückzuführen ist. Weiterhin bewirkt die Coooligomerkomponente CM, daß deutlich niedrigere Tieftemperatur-Viskositäten als z.B. mit synthetischen Kohlenwasserstoffen möglich sind. (Gemessen im Cold Cranking Simulator, siehe Beispiel 12) Das Verhalten bei starker thermisch-oxidativer Belastung ist trotz teilweise vorhandener Rest-Doppel-Bindungen ausgezeichnet (Beispiel 18, VW-TD-Motortest, Vergleich mit PAO-Formulierung).
- Werden Oligomere als Syntheseölbestandteil verwendet, die auch Komponente C) in ausreichender Menge beinhalten, so ist gute Dispergierwirkung gegeben, wobei aufgrund der sauerstoffhaltigen dispergierenden Gruppe Dichtungsprobleme vermieden werden und es keine Einbußen in der Scherstabilität der Aufmischung gibt, wie sie z.B. bei der Verwendung hochmolekularer VI-Verbesserer auftreten.
- All dies hat zur Konsequenz, daß die Kenndaten für die verschiedenen Mineralölspezifikationen ohne oder mit einem geringeren Anteil an hochmolekularen VI-Verbesserern erreichbar sind. Hierdurch ergeben sich u.a. Vorteile bei der Scherstabilität. Weiter verringert sich die Gefahr der Bildung von Ablagerungen.
- Unter "Syntheseölen" seien insbesondere die von der Technik bevorzugten Polyalphaolefine (PAO) sowie die organischen Ester (OE) wie Dicarbonsäure-und Polyolester verstanden (vgl. E.I. Williamson, J. Synth. Lubr. 2(4) 329 - 341 (1986); 3 (1) 45 - 53 (1987); A. Plagge, Tribologie und Schmierungstechnik 34, 148 - 156 (1987); Ullmann, 4. Auflage, Bd. 20, loc.cit. S. 514 - 821).
- Als Ausgangsmaterialien für die Polyalphaolefine dienen primär Crack-olefine, vorwiegend mit Siedepunkt zwischen 30 und 300 Grad C. Die Polyalphaolefine entsprechen in der Regel der allgemeinen Formel 111
- Als organische Ester (OE) seien einerseits die Ester von Dicarbonsäuren mit 3 bis 17 C-Atomen wie der Adipinsäure, Azelainsäure und Sebacinsäure mit primären Alkoholen genannt - als wichtigste Alkoholkomponente haben in diesem Fall Polyalkylenglykole zu gelten - andererseits die Monocarbonsäureester, insbesondere die Ester von C6-C12-Carbonsäuren mit insbesondere verzweigten Alkoholen, speziell solchen mit dem Neopentyl-Gerüst wie Neopentylalkohol, Trimethylolpropan und Pentaerythrit. Die Esteröle weisen eine hohe Adsorptionsfähigkeit auf Metalloberflächen und damit gutes Schmiervermögen auf, allerdings um den Preis relativer Empfindlichkeit gegenüber (hydrolytischem) Abbau, so daß korrosive Abbauprodukte auftreten können.
- Die Viskositäten reichen z.B. von Werten um 5,9 [mm2/s bei 38 Grad C] für den Neopentylglykolester der n-C7-Säure bis zu 16,2 für den entsprechenden Ester der n-C12-Säure, bzw. vom Wert 12,1 für den Trimethylolpropanester der n-C6-Säure bis zum Wert 36,4 für den entsprechenden Ester der n-C12-Säure.
- Wie aus dem Stande der Technik bekannt, lassen sich die Cooligomeren des beanspruchten Typs unter bestimmten Voraussetzungen durch radikalinduzierte Polymerisation herstellen, beispielsweise durch thermische Polymerisation und unter Zugabe eines geeigneten Initiators bzw. eines Redoxsystems. Die Polymerisation kann in Abwesenheit eines Lösungsmittels aber auch in Anwesenheit geeigneter Lösungsmittel durchgeführt werden. Es können demnach alle herkömmlichen als Polymerisationsmedien ausgewiesenen Lösungsmittel verwendet werden, sowie auch Mineralöle, HC-Öle, PAO, Ester oder bereits hergestelltes Oligomer. Dabei kann z.B. das 1-Alken gemäß Komponente A) in einem geeigneten Reaktionsgefäß vorgegeben und auf eine geeignete Reaktionstemperatur gebracht werden. Im allgemeinen kann ein Temperaturbereich von 80 bis 200 Grad C, insbesondere 160 ± 20 Grad C als zweckmäßiger Bereich gelten. Dazu gibt man im gleichen Temperaturbereich, vorzugsweise im Zulauf über einen gewissen Zeitraum, beispielsweise 0,25 - 10 Stunden, beispielsweise innerhalb 5 1/2 Stunden die Komponente B) bzw. B) + c) in den dafür vorgesehenen Anteilen zu. Zweckmäßig läßt man noch einige Zeit, in der Regel einige Stunden - als Anhalt seien ca. 6 Stunden genannt - im Batch auspolymerisieren. Als vorteilhaft hat es sich erwiesen, den Initiator während der gesamten Reaktion zuzusetzen z.B. portionsweise in etwa dreißigminütigen Abständen oder auch kontinuierlich nach Art eines Zulaufverfahrens. Als Initiatoren kommen an sich bekannte Radikalstarter infrage (vgl. Kirk-Othmer, 3rd. Ed., Vol. 13, pg. 355 - 373, Wiley Interscience 1981; Rauch-Puntigam loc.cit.). Die insgesamt verwendeten Initiatormengen liegen in der Regel im Bereich 0,1 - 10 Gew.-%, bevorzugt im Bereich 0,1 - 5 Gew.-% bezogen auf die Gesamtheit der Monomeren. Zweckmäßig werden Initiatoren gewählt, deren Zerfallscharakteristika den Polymerisationsmodalitäten angepaßt sind. Als Richtwert sei eine Halbwertszeit des Initiators (in Benzol) bei der Reaktionstemperatur von ungefähr 0,25 Stunden genannt. Dazu gehören z.B. peroxidische Initiatoren, wie etwa Di- tert.Butylperoxid. Als Anhalt sei wiederum die Zugabe von 0,001 - 0,005 mol Initiator pro Portion bei portionsweiser Zugabe angegeben. Nach vorliegenden Ergebnissen tritt eine weitgehende Umsetzung der Monomeren beispielsweise um 98 % ein, so daß sich in vielen Fällen eine Abtrennung der Monomeren, ja selbst eine weitergehende Aufarbeitung erübrigt. Sind die Anforderungen z.B. an den Flammpunkt hoch, muß das Restmonomere entfernt werden.
- Die Produkte stellen i.a. farblose, ölige Flüssigkeiten dar, die sich vollständig mit Mineralöl, PAO, HC- Ölen und Esterölen mischen.
- Die folgenden Beispiele dienen zur Erläuterung der Erfindung:
- Dabei werden die physikalischen Daten anhand folgender Normen bestimmt: (Vgl. Ullmann 4. Aufl. Bd. 20 loc.cit, F.H. Mark et al. Vol. 10. loc.cit).
- Viskosität : (100 Grad C und 40 Grad C) (nach DIN 51 562 bzw. ASTM D 445 im Ubbelohde-Kapillar-Viskosimeter) : VIB Errechnet aus der 40- und 100 Grad-Viskosität des Grundöls
- Stockpunkt : im Stockpunkt-Automaten nach DIN 51 583,
- Molgewicht : (durch Gelchromatographie gegen PMMA als Standard)
- Br-Zahl : nach DIN 51 774
- Noack-Zahl : nach DIN 51 581
-
- Die im folgenden verwendete Abkürzung "AMA" steht für Alkylmethacrylate, "PAO" steht für Polyalphaolefin, "TMA-OD-Ester" steht für den Ester von Trimethylolpropan mit Adipinsäure.
- Herstellung der Syntheseöl-Bestandteile
- 1 mol 1-Decen (140 g) wird im Reaktionsgefäß auf 160 Grad C erhitzt. Ein Gemisch aus 0,5 mol Isodecylmethacrylat (113 g) und 0,5 mol C12-C15-Alkylmethacrylat mit 60 % Iso-Anteil (136 g) wird nun während 4 Stunden zulaufen gelassen. Nach Ende des Zulaufs wird noch 12 Stunden im Batch auspolymerisiert. Während der gesamten Reaktionszeit von hier 16 Stunden wird mit Ausnahme der letzten Stunde in 30-minütigen Abständen Ditert-butylperoxid als Initiator zugegeben (hier 30 Portionen, Gesamtmenge 2,8 Gew.-% bezogen auf die Monomeren).
- Nach Ende der Reaktion liegt der Umsatz der Monomeren bei ca. 98 %.
- Das Produkt ist eine farblose, ölige Flüssigkeit, die vollständig mit Mineralölen, Poly-Olefinen oder Esterölen mischbar ist.
- Stoffdaten:
- η (100 Grad C) 45,1 mm2/s,
- η (40 Grad C) = 489,0 mm2/s
- VIB = 146
- Stockpunkt = -43,2 Grad C
- Mw = 4 000
- Mn = 1 790 U = 1,23
- Verdampfungsverlust nach Noack = 4 - 5 Gew.-%
- Durchführung wie in Beispiel 1, aber Zulauf der Methacrylat-Mischung während 1,5 Stunden.
- Stoffdaten:
- η (100 Grad C) = 94,9 mm2/s,
- η (40 Grad C) = 1 210,8 mm2/s,
- VIB = 164
- Stockpunkt = -33,6 Grad C
- Mw = 8 330
- Mn = 2 280
- U = 2,65
- Monomer-Umsatz = 95 %
- Wie Beispiel 1, Reaktionstemperatur aber 140 Grad C, verwendeter Initiator: tert.-Butylperbenzoat
- Stoffdaten:
- η (100 Grad C) = 87,8 mm2/s
- η (40 Grad C) = 1 188,3 mm2/s
- VIB = 154
- Stockpunkt = -34,7 Grad C
- Mw = 6 890
- Mn = 2 240
- U = 2,00
- Monomer-Umsatz = 97 %.
- 2 mol 1-Decen (280 g) werden im Reaktionsgefäß auf 160 Grad C erhitzt. 1 mol Isodecylmethacylat (227 g) wird bei dieser Temperatur während 5 Stunden zulaufen gelassen. Nach Ende des Zulaufs wird noch 6 Stunden im Batch nachpolymerisiert. Während der gesamten Reaktionszeit von 11 Stunden wird mit Ausnahme der letzten Stunde in 30-minütigen Abständigen Di-tert-butylperoxid als Initiator zugegeben (hier 20 Portionen insgesamt 4,3 Gew.-% bez. auf die Monomeren).
- Nach Ende der Reaktion liegt der Umsatz der Monomeren bei ca. 92 %.
- Stoffdaten:
- η (100 Grad C) = 25,9 mm2/s
- η (40 Grad C) = 250,3 mm2/s
- VIB = 134
- Stockpunkt = -48,4 Grad C
- Mw = 2 240
- Mn = 1 370
- U = 0,64
- Wie Beispiel 4, aber Isodecylmethacrylat/Decen 1 : 1 mol, Gesamt-Initiator-Menge 2,8 Gew.-%.
- Stoffdaten:
- η (100 Grad C) = 47,6 mm2/s
- η (40 Grad C) = 603,8 mm2/s
- VIB = 132
- Stockpunkt = -38,9 Grad C
- Mw = 3120
- Mn = 1 610
- U = 0,94
- Wie Beispiel 4, aber Isodecylmethacrylat/Decen im Verhältnis 1 : 0,25 mol-Verhältnis, Gesamt-Initiator- Menge = 2,8 Gew.-%
- Stoffdaten:
- η (100 Grad C) = 424,6 mm2/s
- η (40 Grad C) = 1 219,7 mm2/s
- VIB = 170
- Stockpunkt = -10,7 Grad C
- Mw = 12 300
- Mn = 2 890
- U = 3,26
- Monomer-Umsatz = 98 %
- Wie Beispiel 6, aber Zulauf des Isodecylmethacrylats während 2,5 Stunden, Gesamt-Initiatormenge = 2,8 Gew.-%
- Stoffdaten:
- η (100 Grad C) = 888,2 mm2/s
- η (40 Grad C) = 27162 mm2/s
- VIB = 206
- Stockpunkt: / (zu viskos)
- Mw = 24 800
- Mn = 3 480
- U = 6,12
- Monomer-Umsatz > 99 %
- Wie Beispiel 5, aber Reaktionstemperatur 140 Grad C, Initiator: tert.-Butylperbenzoat 4,8 Gew.-%.
- Stoffdaten:
- η = (100 Grad C) = 130,7 mm2/s
- η = (40 Grad C) = 2 335,1 mm2/s
- VIB = 147
- Stockpunkt = -25,9 Grad C
- Mw = 6 690
- Mn = 2 200
- U = 2,04
- Monomer-Umsatz = 96 %
- Wie Beispiel 5, aber Reaktionstemperatur 126 Grad C, Initiator: tert.Butylpernonoat 4,8 Gew.-%.
- Stoffdaten:
- η (100 Grad C) = 460,1 mm2/s
- η (40 Grad C) = 12321,7 mm2/s
- VIB = 180
- Stockpunkt = -8,5 Grad C
- Mw = 11 800
- Mn = 2 560
- U = 2,31
- Monomer-Umsatz = 88 %
- Durchführung wie Beispiel 4, aber zusätzlich zu 1 mol 1-Decen in der Vorlage noch 280 g nach Beispiel 4 hergestelltes Syntheseöl als Lösungsmittel verwendet.
- Stoffdaten:
- η (100 Grad C) = 28,0 mm2/s
- η (40 Grad C) = 294,0 mm2/s
- VIB = 127
- Stockpunkt = -44,5 Grad C
- Mw = 2 180
- Mn = 1 350
- U = 0,61
- Monomer-Umsatz = 98 %
- Wie Beispiel 1, Methacrylat-Komponente ist aber Butylmethacrylat, Zulaufzeit 3,5 Stunden.
- Stoffdaten:
- η (100 Grad C) = 148,0 mm2/s
- η (40 Grad C) = 2836,2 mm2/s
- VIB = 147
- Stockpunkt: - 26,3 Grad C
- Mw = 6 500
- Mn = 1 860
- U = 2,51
- Monomer-Umsatz = 91 %
- 3 mol Dodecan (523 g) werden im Reaktionsgefäß auf 160 Grad C erhitzt, 1 mol C12-C15-Alkylmethacrylat mit 90 % Iso-Anteil (272 g) wird während 5,5 Stunden umlaufen gelassen. Nach Ende des Zulaufs wird noch 11 Stunden im Batch nachpolymerisiert. Die Initiator-Zugabe erfolgt wie in Beispiel 1 beschrieben. Nach der Reaktion wird das Lösungsmittel destillativ entfernt. Das erhaltene Produkt ist eine farblose, ölige Flüssigkeit, die vollständig mit Mineralölen, PAO oder Esterölen mischbar ist.
- Stoffdaten:
- η (100 Grad C) = 16,7 mm2/s,
- η (40 Grad C) = 128,1 mm2/s
- VIB = 141
- Stockpunkt < -52,1 Grad C
- Mw = 1 510
- Mn = 1 230
- U = 0,23
- Verdampfungsverlust nach Noack 6 %
- Monomer-Umsatz = 95 %
- Wie Beispiel 12, aber statt Dodecan die gleiche Gewichtsmenge Hydrocrack-ÖI als Lösungsmittel.
- Stoffdaten Hydrocrack-ÖI:
- η (100 Grad C) = 3,62 mm2/s
- VIB = 126
- Stockpunkt = -33,0 Grad C
- Stoffdaten der erhaltenen Oligomer/Öl-Mischung:
- η (100 Grad C) = 5,08 mm2/s
- η (40 Grad C) = 24,1 mm2/s
- VIB = 144
- Stockpunkt = -34,5 Grad C
- 400 g (0,28 mol) CI* werden in 450 g (1,99 mol) Isodecylmethacrylat gelöst. 250 g (1,78 mol) 1-Decen werden im Reaktionsgefäß auf 140 Grad C erhitzt. Während 1,5 Stunden wird das Methacrylat-Gemisch zulaufen gelassen. Nach Ende des Zulaufs wird noch 15 Stunden im Batch nachpolymerisiert. Die Initiator-Zugabe erfolgt wie in Beispiel 1 beschrieben. Der Initiator ist tert-Butylperbenzoat, Gesamtmenge ≈ 3 Gew.- %. Das erhaltene Produkt ist ein gelbliches Öl, das Mineralöl-löslich ist.
- C1 ist der Methacrylsäureester eines ethoxylierten C16 -C18-Fettalkoholgemisches, mittlerer Ethoxylierungsgrad 25, hier ist der Alkohol Marlipal 1618/25 R, Produkt der Hüls AG angewendet worden.
- Stoffdaten:
- η (100 Grad C) = 1 006 mm2/s
- η (40 Grad C) = 15 756 mm2/s
- VIB = 276
- Stockpunkt: / (zu viskos)
- Mw, Mn = über GPC wegen starker Adsorption nicht
- bestimmbar.
- Ausbeute: > 98 %
- 300 g (0,37 mol) Komponente C2** wird in 400 g (1,77 mol) Isodecylmethacrylat gelöst. 300 g (2,14 mol) 1-Decen wird im Reaktionsgefäß auf 160 Grad C erhitzt. Die Methacrylatmischung wird während 2 Stunden zulaufen gelassen. Gesamtreaktionszeit 16,5 Stunden, Initiator-Zugabe wie in Beispiel 1. Initiator: Di-tert.-butylperoxid, Gesamtmenge 3 Gew.-%. Das Produkt ist Mineralöl-löslich.
- C2 ist der Methacrylsäureester von Methoxypolyethylenglykol mittlerer Ethoxylierungsgrad ≈16; hier wurde der Alkohol Carbowax 750 @ (Trademark der Union Carbide) verwendet.
- Stoffdaten:
- n (100 Grad C) = 293,4 mm2/s
- n (40 Grad C) = 3 999,0 mm2/s
- VIB = 217
- Stockpunkt = -22,1 Grad C
- Mw, Mn über GPC wegen starker Adsorption nicht bestimmbar
- Umsatz annähernd 100 %
- Wie Beispiel 5, aber statt Isodecylmethacrylat C12-C15-Alkylmethacrylat mit 90 % Iso-Anteil
- Stoffdaten:
- η (100 Grad C) = 41,8 mm2/s
- η (40 Grad C) = 417,6 mm2/s
- VIB 152
- Stockpunkt = -44,1 Grad C
- Mw = 3 430
- Mn = 1 830
- U = 0,78
- Wie Beispiel 1, Methacrylatkomponente aber C12-C15-Alkylmethacrylat (90 % iso), AMA/Decen-Verhältnis: 1 : 0,5 mol, 1 Stunde AMA-Zulauf.
- Stoffdaten:
- η (100 Grad C) = 234,4 mm2/s
- η (40Grad C) = 4 810,6 mm2/s
- VIB = 165
- Stockpunkt = -25,6 Grad C
- Mw = 23 100
- Mn = 3 230
- U = 6,14
- Anwendungstechnische Beispiele
-
- Deutlich erkennbar ist, daß mit dem Cooligomeren in der Mischung trotz höherer Viskosität bei 100 Grad C eine niedrigere Viskosität bei -30 Grad C und damit ein besseres Tieftemperatur-Verhalten erreichbar ist.
-
- Mit der Oligomer/PAO-Mischung ist also eine hervorragende Dieselbewertung zu erzielen, was für sehr gute thermischoxidative Stabilität spricht. Zu berücksichtigen ist weiterhin, daß die als Vergleich herangezogene reine PAO-Formulierung bekanntermaßen sehr gute Diesel-Performance aufweist.
Claims (1)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE4025494A DE4025494A1 (de) | 1990-08-11 | 1990-08-11 | Syntheseoele, die ganz oder teilweise aus oligomeren bzw. cooligomeren von (meth)acrylsaeureestern und 1-alkenen bestehen |
| DE4025494 | 1990-08-11 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0471266A1 true EP0471266A1 (de) | 1992-02-19 |
| EP0471266B1 EP0471266B1 (de) | 1994-12-21 |
Family
ID=6412070
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP91113123A Expired - Lifetime EP0471266B1 (de) | 1990-08-11 | 1991-08-05 | Verwendung von Oligomeren bzw. Cooligomeren von (Meth)acrylsäureestern und 1-Alkenen als Syntheseöle |
Country Status (5)
| Country | Link |
|---|---|
| EP (1) | EP0471266B1 (de) |
| AT (1) | ATE115995T1 (de) |
| DE (2) | DE4025494A1 (de) |
| DK (1) | DK0471266T3 (de) |
| ES (1) | ES2068441T3 (de) |
Cited By (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0566048A1 (de) * | 1992-04-15 | 1993-10-20 | Röhm Gmbh | Syntheseöle enthaltende Cooligomere, bestehend aus I-Alkenen und (Meth)-acrylsäureestern |
| CN1045618C (zh) * | 1994-10-19 | 1999-10-13 | 阿吉佩罗里股份公司 | 与氟弹性体相容的润滑油用多官能添加剂及其制备方法 |
| US6080794A (en) * | 1996-02-02 | 2000-06-27 | Roehm Gmbh | Demulsifiers |
| DE102010001040A1 (de) | 2010-01-20 | 2011-07-21 | Evonik RohMax Additives GmbH, 64293 | (Meth)acrylat-Polymere zur Verbesserung des Viskositätsindexes |
| WO2014065984A1 (en) * | 2012-10-24 | 2014-05-01 | Exxonmobil Reearch And Engineering Company | High viscosity index lubricating oil base stock viscosity modifier combinations, and lubricating oils derived therefrom |
| WO2020099078A1 (en) | 2018-11-13 | 2020-05-22 | Evonik Operations Gmbh | Random copolymers for use as base oils or lubricant additives |
| WO2020099079A1 (en) | 2018-11-13 | 2020-05-22 | Evonik Operations Gmbh | Process for preparing random copolymers |
| EP4015604A1 (de) | 2020-12-18 | 2022-06-22 | Evonik Operations GmbH | Acrylat-olefin-copolymere als hochviskose basisflüssigkeiten |
| US11603425B2 (en) | 2020-05-05 | 2023-03-14 | Evonik Operations Gmbh | Hydrogenated linear polydiene copolymers as base stock or lubricant additives for lubricant compositions |
| EP4282936A1 (de) | 2022-05-24 | 2023-11-29 | Evonik Operations GmbH | Acrylat-olefin copolymere als hochviskose basisflüssigkeiten |
| US12098344B2 (en) | 2020-07-03 | 2024-09-24 | Evonik Operations Gmbh | High viscosity base fluids based on oil compatible polyesters prepared from long-chain epoxides |
| US12116546B2 (en) | 2020-07-03 | 2024-10-15 | Evonik Operations Gmbh | High viscosity base fluids based on oil compatible polyesters |
| WO2025082806A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Polyalkyl (meth)acrylate polymers as high viscosity base fluids |
| WO2025082807A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Lubricant formulations with acrylate-olefin copolymers as high viscosity base fluids |
| WO2025082808A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Polyalkyl (meth)acrylate polymers as high viscosity base fluids |
| WO2025082809A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Acrylate-olefin copolymers as high viscosity base fluids |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE4404620A1 (de) * | 1994-02-14 | 1995-08-17 | Roehm Gmbh | Verbesserte Additive für Schmieröle |
| DE4427473A1 (de) | 1994-08-03 | 1996-02-08 | Roehm Gmbh | Motorenöle mit hohem Dispergiervermögen und gutem Verschleißschutz |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB663702A (en) * | 1949-09-10 | 1951-12-27 | Standard Oil Dev Co | Improvements in or relating to copolymers and to lubricant compositions containing them |
| GB759918A (en) * | 1952-10-22 | 1956-10-24 | California Research Corp | Lubricant composition |
| US3001942A (en) * | 1958-12-15 | 1961-09-26 | California Research Corp | Lubricant composition |
| DE2243064A1 (de) * | 1971-09-13 | 1973-03-29 | Rohm & Haas | Copolymere aus 1-alkenen und acrylsaeure-derivaten sowie verfahren zu ihrer herstellung |
| FR2162165A1 (de) * | 1971-12-02 | 1973-07-13 | Sumitomo Chemical Co | |
| EP0339088A1 (de) * | 1987-09-25 | 1989-11-02 | Tonen Corporation | Antriebsflüssigkeit |
-
1990
- 1990-08-11 DE DE4025494A patent/DE4025494A1/de not_active Withdrawn
-
1991
- 1991-08-05 ES ES91113123T patent/ES2068441T3/es not_active Expired - Lifetime
- 1991-08-05 DK DK91113123.3T patent/DK0471266T3/da active
- 1991-08-05 DE DE59103970T patent/DE59103970D1/de not_active Expired - Lifetime
- 1991-08-05 EP EP91113123A patent/EP0471266B1/de not_active Expired - Lifetime
- 1991-08-05 AT AT91113123T patent/ATE115995T1/de not_active IP Right Cessation
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB663702A (en) * | 1949-09-10 | 1951-12-27 | Standard Oil Dev Co | Improvements in or relating to copolymers and to lubricant compositions containing them |
| GB759918A (en) * | 1952-10-22 | 1956-10-24 | California Research Corp | Lubricant composition |
| US3001942A (en) * | 1958-12-15 | 1961-09-26 | California Research Corp | Lubricant composition |
| DE2243064A1 (de) * | 1971-09-13 | 1973-03-29 | Rohm & Haas | Copolymere aus 1-alkenen und acrylsaeure-derivaten sowie verfahren zu ihrer herstellung |
| FR2162165A1 (de) * | 1971-12-02 | 1973-07-13 | Sumitomo Chemical Co | |
| EP0339088A1 (de) * | 1987-09-25 | 1989-11-02 | Tonen Corporation | Antriebsflüssigkeit |
Cited By (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0566048A1 (de) * | 1992-04-15 | 1993-10-20 | Röhm Gmbh | Syntheseöle enthaltende Cooligomere, bestehend aus I-Alkenen und (Meth)-acrylsäureestern |
| CN1045618C (zh) * | 1994-10-19 | 1999-10-13 | 阿吉佩罗里股份公司 | 与氟弹性体相容的润滑油用多官能添加剂及其制备方法 |
| US6080794A (en) * | 1996-02-02 | 2000-06-27 | Roehm Gmbh | Demulsifiers |
| DE102010001040A1 (de) | 2010-01-20 | 2011-07-21 | Evonik RohMax Additives GmbH, 64293 | (Meth)acrylat-Polymere zur Verbesserung des Viskositätsindexes |
| WO2011088929A1 (de) | 2010-01-20 | 2011-07-28 | Evonik Rohmax Additives Gmbh | (meth)acrylat-polymer zur verbesserung des viskositätsindexes |
| WO2014065984A1 (en) * | 2012-10-24 | 2014-05-01 | Exxonmobil Reearch And Engineering Company | High viscosity index lubricating oil base stock viscosity modifier combinations, and lubricating oils derived therefrom |
| US11453837B2 (en) | 2018-11-13 | 2022-09-27 | Evonik Operations Gmbh | Random copolymers for use as base oils or lubricant additives |
| WO2020099078A1 (en) | 2018-11-13 | 2020-05-22 | Evonik Operations Gmbh | Random copolymers for use as base oils or lubricant additives |
| WO2020099079A1 (en) | 2018-11-13 | 2020-05-22 | Evonik Operations Gmbh | Process for preparing random copolymers |
| US11603425B2 (en) | 2020-05-05 | 2023-03-14 | Evonik Operations Gmbh | Hydrogenated linear polydiene copolymers as base stock or lubricant additives for lubricant compositions |
| US12098344B2 (en) | 2020-07-03 | 2024-09-24 | Evonik Operations Gmbh | High viscosity base fluids based on oil compatible polyesters prepared from long-chain epoxides |
| US12116546B2 (en) | 2020-07-03 | 2024-10-15 | Evonik Operations Gmbh | High viscosity base fluids based on oil compatible polyesters |
| EP4015604A1 (de) | 2020-12-18 | 2022-06-22 | Evonik Operations GmbH | Acrylat-olefin-copolymere als hochviskose basisflüssigkeiten |
| US11618797B2 (en) | 2020-12-18 | 2023-04-04 | Evonik Operations Gmbh | Acrylate-olefin copolymers as high viscosity base fluids |
| EP4282936A1 (de) | 2022-05-24 | 2023-11-29 | Evonik Operations GmbH | Acrylat-olefin copolymere als hochviskose basisflüssigkeiten |
| US11981877B2 (en) | 2022-05-24 | 2024-05-14 | Evonik Operations Gmbh | Acrylate-olefin copolymers as high viscosity base fluids |
| WO2025082806A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Polyalkyl (meth)acrylate polymers as high viscosity base fluids |
| WO2025082807A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Lubricant formulations with acrylate-olefin copolymers as high viscosity base fluids |
| WO2025082808A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Polyalkyl (meth)acrylate polymers as high viscosity base fluids |
| WO2025082809A1 (en) | 2023-10-16 | 2025-04-24 | Evonik Operations Gmbh | Acrylate-olefin copolymers as high viscosity base fluids |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0471266B1 (de) | 1994-12-21 |
| ATE115995T1 (de) | 1995-01-15 |
| DE4025494A1 (de) | 1992-02-13 |
| ES2068441T3 (es) | 1995-04-16 |
| DE59103970D1 (de) | 1995-02-02 |
| DK0471266T3 (da) | 1995-04-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0471266B1 (de) | Verwendung von Oligomeren bzw. Cooligomeren von (Meth)acrylsäureestern und 1-Alkenen als Syntheseöle | |
| EP0418610B1 (de) | Dispergierwirksame Viskositäts-Index-Verbesserer | |
| DE69613990T2 (de) | Flüssigkeiten für automatisches getriebe mit einer verbesserten übertragungsleistung | |
| EP0140274B1 (de) | Additive für Schmieröle | |
| EP0014746B1 (de) | Schmieröladditive | |
| DE60113213T2 (de) | Dispergierende (Meth)acrylat-Copolymere mit ausgezeichneten Eigenschaften im Niedrigtemperaturbereich | |
| DE2740449C2 (de) | Verfahren zur Herstellung von Schmierölzusätzen | |
| DE69918615T2 (de) | (Meth)acrylat Copolymere mit ausgezeichneten Kälteeigenschaften | |
| DE69730568T2 (de) | Viskositätsindexverbessernde Zusätze für auf Phosphatestern basierte Hydraulikflüssigkeiten | |
| DE112006003061B4 (de) | Rostschutzmittel für hochparaffinische Grundschmieröle, fertiges Schmiermittel und Herstellungsverfahren dafür sowie dessen Verwendung | |
| EP0075217B1 (de) | Copolymere aus Alpha-Beta-ungesättigten Dicarbonsäureestern, Verfahren zu deren Herstellung sowie deren Verwendung | |
| DE2356364A1 (de) | Schmieroelgemisch | |
| US5691284A (en) | Synthetic oligomeric oils | |
| DE69007995T2 (de) | Schmierölviskositätsadditiv, Verfahren zu seiner Herstellung und dieses enthaltende Schmiermittelzusammensetzungen. | |
| DE4000753A1 (de) | Kraftuebertragungsfluessigkeit auf basis mineraloel | |
| DE1063312B (de) | Schmiermittel | |
| EP0088904A1 (de) | Konzentrierte Emulsionen von Olefincopolymerisaten | |
| DE69611735T2 (de) | Synthetisches schmieröl auf ester-basis für zweitaktmaschinen | |
| DE2159511A1 (de) | Neue Schmiermittel-Kompositionen | |
| DE69514634T2 (de) | Öllösliche Polyether | |
| EP0607553B1 (de) | Verwendung von Polymethylalkanen als biologisch abbaubare Grundöle in Schmierstoffen und funktionellen Flüssigkeiten | |
| DE4025493A1 (de) | Verfahren zur herstellung von homooligomeren und cooligomeren | |
| EP0697457B1 (de) | Motorenöle mit hohem Dispergiervermögen und gutem Verschleissschutz | |
| EP0090168A1 (de) | Konzentrierte Emulsionen von Olefincopolymerisaten | |
| DE4212569A1 (de) | Syntheseöle enthaltend Cooligomere, bestehend aus 1-Alkenen und (Meth)acrylsäureestern |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AT BE CH DE DK ES FR GB IT LI NL SE |
|
| 17P | Request for examination filed |
Effective date: 19920331 |
|
| 17Q | First examination report despatched |
Effective date: 19930305 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE CH DE DK ES FR GB IT LI NL SE |
|
| REF | Corresponds to: |
Ref document number: 115995 Country of ref document: AT Date of ref document: 19950115 Kind code of ref document: T |
|
| ITF | It: translation for a ep patent filed | ||
| REF | Corresponds to: |
Ref document number: 59103970 Country of ref document: DE Date of ref document: 19950202 |
|
| ET | Fr: translation filed | ||
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) |
Effective date: 19950314 |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FG2A Ref document number: 2068441 Country of ref document: ES Kind code of ref document: T3 |
|
| REG | Reference to a national code |
Ref country code: DK Ref legal event code: T3 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| NLT1 | Nl: modifications of names registered in virtue of documents presented to the patent office pursuant to art. 16 a, paragraph 1 |
Owner name: ROEHM GMBH & CO. KG |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: CJ |
|
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: IF02 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 20020717 Year of fee payment: 12 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 20020725 Year of fee payment: 12 Ref country code: DK Payment date: 20020725 Year of fee payment: 12 Ref country code: BE Payment date: 20020725 Year of fee payment: 12 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 20020729 Year of fee payment: 12 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: ES Payment date: 20020809 Year of fee payment: 12 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: AT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030805 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: ES Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030806 Ref country code: SE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030806 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030831 Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030831 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030831 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DK Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20030901 |
|
| BERE | Be: lapsed |
Owner name: *ROHM G.M.B.H. Effective date: 20030831 |
|
| REG | Reference to a national code |
Ref country code: DK Ref legal event code: EBP |
|
| EUG | Se: european patent has lapsed | ||
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| REG | Reference to a national code |
Ref country code: ES Ref legal event code: FD2A Effective date: 20030806 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: CD Ref country code: FR Ref legal event code: CJ |
|
| REG | Reference to a national code |
Ref country code: NL Ref legal event code: SD Effective date: 20100223 Ref country code: NL Ref legal event code: TD Effective date: 20100223 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 20100813 Year of fee payment: 20 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 20100901 Year of fee payment: 20 Ref country code: DE Payment date: 20100823 Year of fee payment: 20 Ref country code: IT Payment date: 20100824 Year of fee payment: 20 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 20100819 Year of fee payment: 20 |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R071 Ref document number: 59103970 Country of ref document: DE |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R071 Ref document number: 59103970 Country of ref document: DE |
|
| REG | Reference to a national code |
Ref country code: NL Ref legal event code: V4 Effective date: 20110805 |
|
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: PE20 Expiry date: 20110804 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Free format text: LAPSE BECAUSE OF EXPIRATION OF PROTECTION Effective date: 20110804 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF EXPIRATION OF PROTECTION Effective date: 20110805 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Free format text: LAPSE BECAUSE OF EXPIRATION OF PROTECTION Effective date: 20110806 |