EP0240711A2 - Verwendung von substituierten N-Trichlormethylthiodicarboximiden in Kombination mit N,N'-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Oligosulfiden in vulkanisierbaren Kautschukmischungen und derartige Kautschukmischungen - Google Patents
Verwendung von substituierten N-Trichlormethylthiodicarboximiden in Kombination mit N,N'-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Oligosulfiden in vulkanisierbaren Kautschukmischungen und derartige Kautschukmischungen Download PDFInfo
- Publication number
- EP0240711A2 EP0240711A2 EP87102992A EP87102992A EP0240711A2 EP 0240711 A2 EP0240711 A2 EP 0240711A2 EP 87102992 A EP87102992 A EP 87102992A EP 87102992 A EP87102992 A EP 87102992A EP 0240711 A2 EP0240711 A2 EP 0240711A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- substituted
- triazin
- formula
- parts
- bis
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 CN(*)c1nc(S)nc(N(*)*)n1 Chemical compound CN(*)c1nc(S)nc(N(*)*)n1 0.000 description 2
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/36—Sulfur-, selenium-, or tellurium-containing compounds
- C08K5/37—Thiols
- C08K5/378—Thiols containing heterocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/36—Sulfur-, selenium-, or tellurium-containing compounds
- C08K5/43—Compounds containing sulfur bound to nitrogen
Definitions
- the invention relates to the use of substituted N-trichloromethylthiodicarboximides in combination with N, N'-substituted bis (2,4-diamino-s-triazin-6-yl) oligosulfides in vulcanizable rubber mixtures as vulcanization retarders with an effect which increases the crosslinking density and the like Rubber compounds.
- a number of vulcanization accelerators are available for the crosslinking of elastomers with sulfur, the vulcanization characteristics of which are completely inadequate, which - added in small amounts - both increase the crosslink density that can be achieved chemically and improve the crosslinking kinetics so much that the vulcanization process can also be carried out efficiently on a production scale.
- the crosslinking of rubber mixtures can also be carried out without free sulfur, for example with the aid of peroxides or thiurams
- Mercaptans, disulfides and sulfenamides based on benzothiazole are the most important accelerators of sulfur vulcanization. Similar action on triazine-based compounds are described in DE-PS 16 69 954 and DE-PS 12 98 706.
- the crosslinking process in accelerated sulfur vulcanization can generally be broken down into three phases, namely the incubation time of the crosslinking reaction, the crosslinking process itself, characterized by the rate constant and the crosslinking yield, and the overheating period.
- the behavior of the aforementioned accelerators generally differs in all 3 phases.
- retarders or "pre-vulcanization inhibitors” are added to extend the incubation time of the vulcanization reaction.
- Santoguard® PVI N-cyclohexylthiophthalimide; CD Trivette et al., Rubber Chem. Technol. 50, 570 (1977), Monsanto, US Pat. No. 3,427,319, have preferably been used for delaying the sulfur vulcanization with sulfenamides.
- the object of the invention is to improve the vulcanization characteristics of vulcanizable rubber mixtures.
- the process for the preparation of the pure tetrasulfides with a linear S4 chain between the two substituted triazine radicals is characterized in that an aqueous, alkaline solution of the corresponding N, N'-substituted 2,4-diamino-6-mercaptotriazines in a two-phase system an S2Cl2 solution in an inert organic solvent, in which the reaction product is insoluble or only slightly soluble, at temperatures between -5 ° C - ⁇ + 20 ° C, preferably of + 10 ° C.
- an alkaline aqueous solution of mercaptotriazine which is at least that for the reaction necessary stoichiometric amount of alkali metal hydroxide, preferably an excess of 1 - 20 mol%, based on the mercaptotriazine used.
- This solution is mixed with a solvent in which the end product of the reaction is insoluble or only slightly soluble, preferably with C5-C10 alkanes or C5-C8 cycloalkanes, optionally substituted with 1 to 3 methyl groups, and mixtures thereof.
- This mixture is stirred vigorously and cooled, preferably to + 10 ° C. Now you can drop a solution of S2Cl2 in the solvent used in this mixture with good cooling.
- S2Cl2 is used at least in a ratio of 2 moles of mercaptotriazine: 1 mole of S2Cl2, but this ratio can also be 2: 1.1-1.2 depending on the excess of alkali.
- the resulting product is separated off using generally known measures and advantageously dried at temperatures up to + 50 ° C. under vacuum (10 torr).
- the reaction conditions must be controlled so that no free sulfur is formed.
- a process is characterized in that an isolated tetrasulfide according to formula II is heated above its melting point, preferably by 20-50 ° C.
- the tetrasulfides according to formula II are dissolved in an inert organic solvent and the disproportionation reaction is carried out in the temperature range between 20 ° C. (standing at room temperature) and the boiling point of the solvent used.
- a particularly elegant method consists in reacting an aqueous alkaline solution of the corresponding N, N'-substituted 2,4-diamino-6-mercaptotriazines in a two-phase system with a solution of S2Cl2 in an inert organic solvent which dissolves the resulting tetrasulfide. The resulting linear tetrasulfide is then immediately disproportionated into the mixture according to the invention.
- Particularly suitable solvents are chlorinated hydrocarbons, for example CH2Cl2 and CHCl3, but also ethers, esters and aromatic carbons Hydrogens and ketones are suitable for the disproportionation reaction in the absence of water. Otherwise, they can be used if they form a two-phase mixture with water.
- the reaction conditions for the preparation of the disproportionates are otherwise identical to those for the preparation of the pure tetrasulfides.
- substituted N-trichloromethylthiodicarboximides according to the formulas (I, Ia) used in accordance with the invention in combination with the triazine compounds according to formula II are not only excellent vulcanization retardants, but at the same time also change the vulcanization characteristics in such a way that all physical data responding to the crosslinking density , such as the maximum torque (rheometer) or the tension values at 300% elongation, are increased considerably.
- N-Trichloromethylthio-phthalimide (VZ a) and 1,2,3,6-tetrahydro-N- (trichloromethylthio) -phthalimide (VZ b) are preferably used.
- N-trichloromethylthio-succinimide (VZ c) N-trichloromethylthio-dodecylsuccinimide N-trichloromethylthio-7-oxabicyclo- (2.2.1) -hept-5-en-2.3-dicarboximide N-trichloromethylthio-5-norbornene-1,2-dicarboximide
- N, N'-substituted bis (2,4-diamino-s-triazin-6-yl) disulfides according to formula II are described in DE-PS 16 69 954, for example Bis (2-ethylamino-4-diethylamino-s-triazin-6-yl) disulfide Bis- (2-ethylamino-4-di-isopropylamino-s-triazin-6-yl) disulfide Bis- (2-n-propylamino-4-diethylamino-s-triazin-6-yl) disulfide Bis (2-ethylamino-4-di-n-butylamino-s-triazin-6-yl) disulfide
- the substituted N-trichloromethylthio-dicarboximides to be used according to the invention as vulcanization retarders with a crosslink density-increasing effect in combination with N, N'-substituted bis- (2,4-diamino-s-triazin-6-yl) sulfides according to formula (II) are suitable for the rubber mixtures known from the prior art with natural rubber (NR), isoprene rubbers (IR), butadiene rubbers (BR), styrene-butadiene rubbers (SBR), isobutylene-isoprene rubbers (IIR), ethylene-propylene terpolymers (EPDM), Nitrile rubbers (NBR), halogen-containing rubbers and also epoxidized natural rubbers (ENR) and their blends.
- NR natural rubber
- IR isoprene rubbers
- BR butadiene rubbers
- SBR styrene-butad
- the molar ratio of triazine crosslinker to retarder is preferably from 1: 0.3-1.5, preferably 1: 0.3-1.2. In this case the mixture contains no free sulfur.
- the substituted N-trichloromethylthiocarboximides according to the formulas (I, Ia) are added in amounts of 0.1-5 parts, preferably 0.1-2 parts, per 100 parts of rubber with amounts of sulfur of 0.1-10 parts, preferably 0.1-8 parts per 100 parts of rubber.
- Molar ratios of accelerator, retarder, sulfur of 1: 0.3-1.5: 0.5-1.5, preferably 1: 0.3-1.2: 0.5-1.5 are preferred.
- Oligosulfides according to formula II are then used in amounts of 0.1-10 parts.
- the triazine accelerators according to formula II in the form of mixtures of two or more individuals, Amounts used, in particular the preferred molar ratios, the substitution is to be carried out on a molar basis.
- N, N'-substituted bis (2,4-diaminos-triazin-6-yl) oligosulfides according to formula II in a mixture with conventional accelerators of the benzothiazole series and / or thiurams , for example N-cyclohexylbenzthiazole sulfenamide, 2-mercaptobenzothiazole, benzthiazolyl disulfide, or their zinc salts and tetramethylthiuram disulfide (see also J.van Alphen, Rubber Chemicals (1977), pp. 1-46).
- the vulcanization-retarding effect of substituted N-trichloromethylthiodicarboximides according to formula (I, Ia) also occurs when N, N'-substituted bis (2,4-diamino-s-triazin-6-yl) oligosulfides according to formula (II) alone or in a mixture together with conventional accelerators and / or with conventional sulfur donors such as Sulfasan® R (morpholine disulfide).
- silane-modified fillers and their blends in quantities of 5 - 300 parts, per 100 parts of rubber, Zinc oxide and stearic acid as promoters of vulcanization in amounts of 0.5-10 parts per 100 parts of rubber, - commonly used anti-aging agents, anti-ozone agents, anti-fatigue agents such as IPPD, TMQ etc.
- any plasticizers such as aromatic, naphthenic, paraffinic, synthetic plasticizers and their blends, - Organosilanes used in the rubber industry according to the state of the art, such as ⁇ -chloropropyltrialkoxysilanes, vinyltrialkoxysilanes, ⁇ -mercaptoalkyltrialkoxisilanes and aminoalkyl trialkoxisilanes and their blends in an amount of 0.1-25, preferably 1-10 parts per 100 parts of fillers containing silanol groups, such as silicas, silicates, clays, etc. - If necessary, dyes and processing aids in the usual dosage.
- the rubber mixtures are produced and vulcanized by the known processes and under the usual conditions.
- N- (trichloromethylthio) dicarboximides in combination with N, N'-substituted bis (2,4-diamino-s-triazin-6-yl) sulfides according to the formulas (I), (Ia) and ( II) extends to rubber mixtures as they are usually used in tire construction, to technical articles, such as mixtures for conveyor belts, V-belts, molded articles, hoses with and without inserts, roller rubbers, linings, injection profiles, freehand articles, films, shoe soles and uppers, cables , Solid rubber tires and their vulcanizates.
- the rubber mixtures are produced and vulcanized by the known processes and under the usual conditions.
- the snow-white fine powder is dried in vacuo / 12 torr at 40 - 45 ° C.
- the reaction product dissolves in CH2Cl2. At the end of the reaction, the phases are separated and the CH2Cl2 solution is worked up. An amorphous powder with a softening point of approximately 110 ° C. is thus obtained. Quantity: 46.7 g, corresponding to 90.5% of theory.
- the product consists of approx. 30% linear S4 product and 70% oligosulfides, but does not contain any free sulfur.
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Processes Of Treating Macromolecular Substances (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
- Die Erfindung betrifft die Verwendung von substituierten N-Trichlormethylthiodicarboximidenin Kombination mit N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Oligosulfiden in vulkanisierbaren Kautschukmischungen als Vulkanisationsverzögerer mit einem die Vernetzungsdichte erhöhendem Effekt und derartige Kautschukmischungen. Für die Vernetzung von Elastomeren mit Schwefel, dessen Vulkanisationscharakteristik selbst völlig unzureichend ist, steht eine Reihe von Vulkanisationsbeschleunigern zur Verfügung, die - bereits in geringer Menge zugesetzt - sowohl die auf chemischem Wege zu erreichende Vernetzungsdichte kräftig erhöhen als auch die Kinetik der Vernetzung so stark verbessern, daß der Vulkanisationsprozeß auch im Produktionsmaßstab rationell durchgeführt werden kann.
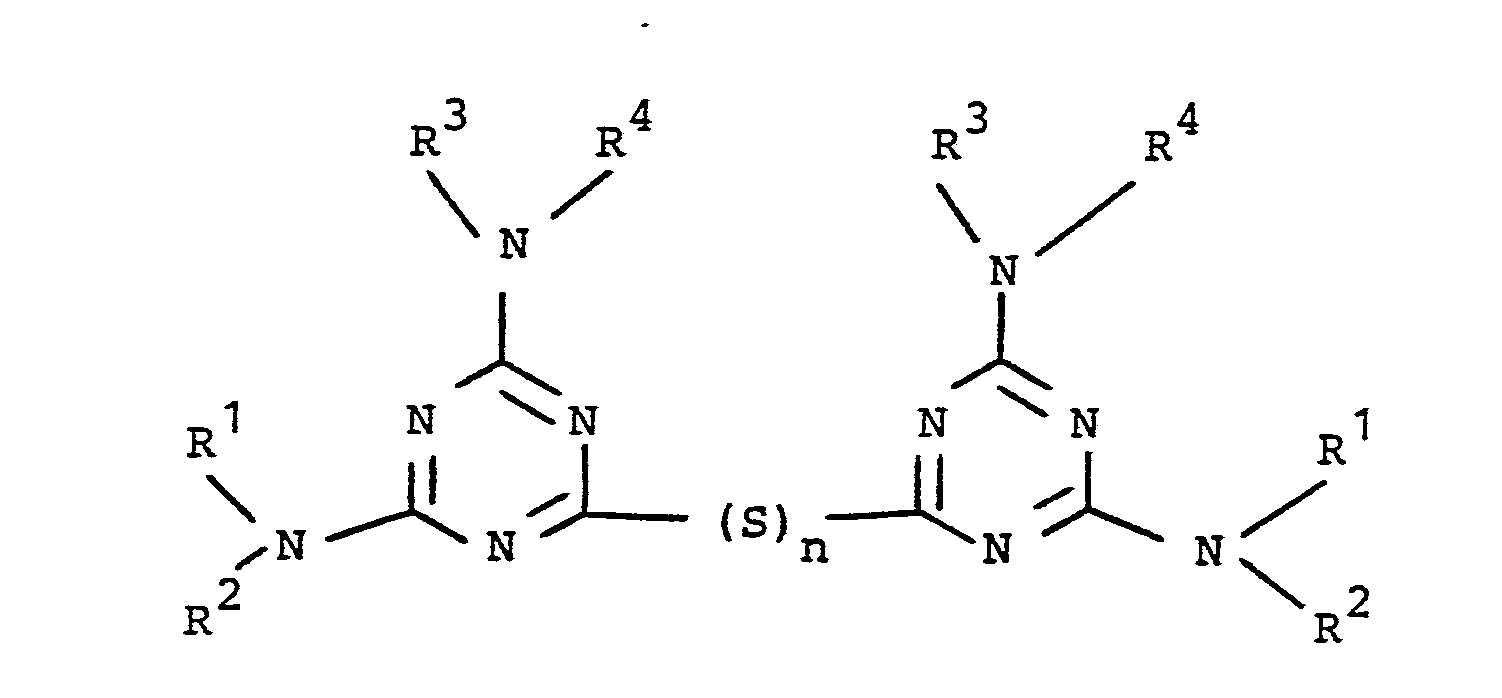
- Obwohl die Vernetzung von Kautschukmischungen auch ohne freien Schwefel durchführbar ist, zum Beispiel mit Hilfe von Peroxiden oder Thiuramen, bezieht sich die Erfindung auf die beschleunigte Schwefelvulkanisation und die Vernetzung mit N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-oligosulfden gemäß Formel (II) mit n=4 ohne freien Schwefel.
Dabei steht n=4 sowohl für Tetrasulfide als auch für Gemische von Verbindungen gemäß Formel II, bei denen Sn einer mittleren statistischen Kettenlänge mit n=4 entspricht. - Mercaptane, Disulfide und Sulfenamide auf Benzthiazolbasis sind die wichtigsten Beschleuniger der Schwefelvulkanisation. In der Wirkungsweise ähnlich sind entsprechende Verbindungen auf Triazinbasis beschrieben in DE-PS 16 69 954 und DE-PS 12 98 706. In die gleiche Kategorie gehören auch die N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-oligosulfide (n=4) gemäß Formel II, beschrieben in Patentanmeldung P die im Gegensatz zu den vorgenannten Beschleunigern auch ohne den Zusatz von freiem Schwefel vernetzen unter Aufbau einer -S-, -S-S-, -S-Sx-S-Vernetzungsstruktur.
- Der Vernetzungsvorgang bei der beschleunigten Schwefelvulkanisation läßt sich in der Regel in 3 Phasen zerlegen, nämlich in die Inkubationszeit der Vernetzungsreaktion, den Vernetzungsvorgang selbst, charakterisiert durch die Geschwindigkeitskonstante und die Vernetzungsausbeute, und die Überheizungsperiode. Die vorgenannten Beschleuniger unterscheiden sich in ihrem Verhalten in der Regel in allen 3 Phasen.
- Aus Gründen der Verarbeitungssicherheit von Kautschukmischungen, besonders wenn die Verarbeitungstemperatur zur Erhöhung der Produktivität angehoben werden muß, setzt man zur Verlängerung der Inkubationszeit der Vulkanisationsreaktion sogenannte Verzögerer oder "pre vulcanization inhibitors" zu. In der Praxis haben sich für die Verzögerung der Schwefelvulkanisation mit Sulfenamiden vorzugsweise Santoguard ® PVI (N-Cyclohexylthio-phthalimid; C.D. Trivette et al., Rubber Chem. Technol. 50, 570 (1977), Monsanto, US-PS 3.427.319, 3.546.185, 3.752.824, 3.855.262) und für Benzthiazolyldisulfid, vorzugsweise das Vulkalent ® E (Bayer AG, N-Phenyl-N-(trichlormethylsulfenyl)-benzolsulfonamid, DE-OS 1.957.484) als wirksame Mittel erwiesen.
- Aufgabe der Erfindung ist die Verbesserung der Vulkanisationscharakteristik von vulkanisierbaren Kautschukmischungen.
- Gegenstand der Erfindung ist die Verwendung von Verbindungen der allgemeinen Formel
R⁹:H
R¹⁰:H, C₁-C₁₆-Alkyl, Undecenyl, oder R⁹ und R¹⁰ bilden zusammen mit den in 3- und 4-Stellung stehenden Kohlenstoffatomen des Dicarboximids einen Sechsring, gesättigt oder ein- oder dreifach ungesättigt, der ein- bis 2-fach durch eine Methylgruppe substituiert sein kann, insbesondere Tetrahydrophthalimide des Typs
R⁵ und R⁶ eine endo-CH₂-Brücke oder eine endo-O-Brücke,
in vulkanisierbaren Kautschuken in Kombination mit oligosulfidischen Verbindungen gemäß der Formel
R²,R³,R⁴ = C₁-C₈-Alkyl, bevorzugt C₁-C₄-Alkyl, verzweigt oder unverzweigt, Allyl, C₃-C₈ Cycloalkyl, letzteres unsubstituiert oder mit 1-3 Methylgruppen substituiert, 2-Hydroxiethyl, 3-Hydroxipropyl, 2-hydroxypropyl oder
R³ und R⁴ (zusammen): C₄-C₆-Alkylen,-(CH₂-CHX)₂Y mit X = CH₃, H; Y = 0,5
n = 2 oder 4,
oder ein Gemisch von Verbindungen gemäß Formel (II), bei denen Sn einer mittleren statistischen Kettenlänge mit n = 4 entspricht. - Das Verfahren zur Herstellung der reinen Tetrasulfide mit einer linearen S₄-Kette zwischen den beiden substituierten Triazinresten ist dadurch gekennzeichnet, daß man eine wässrige, alkalische Lösung der entsprechenden N,N′-substituierten 2,4-Diamino-6-mercaptotriazine in einem Zweiphasensystem mit einer S₂Cl₂-Lösung in einem inerten organischen Lösungsmittel, in welchem das Reaktionsprodukt nicht oder sehr wenig löslich ist, bei Temperaturen zwischen -5°C - <+20°C, vorzugsweise von +10°C, umsetzt. Vorteilhaft stellt man eine alkalische wässrige Lösung des Mercaptotriazins her, die mindestens die zur Umsetzung notwendige stöchiometrische Menge an Alkalihydroxid, bevorzugt einen Überschuß von 1 - 20 Mol%, bezogen auf das eingesetzte Mercaptotriazin, enthält.
- Diese Lösung wird mit einem Lösungsmittel versetzt, in welchem das Endprodukt der Reaktion nicht oder wenig löslich ist, bevorzugt mit C₅-C₁₀-Alkanen oder C₅-C₈-Cycloalkanen, gegebenenfalls substituiert mit 1 bis 3 Methylgruppen, und deren Gemische. Diese Mischung wird stark gerührt und abgekühlt, bevorzugt auf +10°C. Nun läßt man in diese Mischung unter guter Kühlung eine Lösung von S₂Cl₂ in dem verwendeten Lösungsmittel zutropfen. S₂Cl₂ wird mindestens im Verhältnis 2 Mol Mercaptotriazin : 1 Mol S₂Cl₂ verwendet, doch kann dieses Verhältnis je nach Alkaliüberschuß auch 2 : 1,1 - 1,2 betragen.
- Unter den gegebenen Bedingungen wirkt S₂Cl₂ ausschließlich kondensierend.
- Das entstandene Produkt wird mit Hilfe allgemein bekannter Maßnahmen abgetrennt und vorteilhaft bei Temperaturen bis zu +50°C unter Vakuum (10 Torr) getrocknet.
-
- Diese Gemische aus Oligosulfiden, im folgenden Text auch als Disproportioniate bezeichnet, da sie durch Disproportionierung von Tetrasulfiden gemäß Formel II entstehen, können auf mehreren Wegen dargestellt werden.
- Dabei sind die Reaktionsbedingungen so zu steuern, daß kein freier Schwefel entsteht.
- Ein Verfahren ist dadurch gekennzeichnet, daß man ein isoliertes Tetrasulfid gemäß Formel II über seinen Schmelzpunkt hinaus erhitzt, vorzugsweise um 20 - 50°C.
- In einem weiteren Verfahren löst man die Tetrasulfide gemäß FormelII in einem inerten organischen Lösungsmittel und führt die Disproportionierungsreaktion im Temperaturbereich zwischen 20°C (Stehenlassen bei Zimmertemperatur) und Siedepunkt des eingesetzten Lösungsmittels durch.
- Eine besonders elegante Methode besteht darin, daß man eine wässrige alkalische Lösung der entsprechenden N,N′-substituierten 2,4-Diamino-6-mercaptotriazine in einem Zweiphasensystem mit einer Lösung von S₂Cl₂ in einem inerten, das entstehende Tetrasulfid lösende organischen Lösungsmittel umsetzt. Das entstehende lineare Tetrasulfid wird dann in der Folge sofort in das erfindungsgemäße Gemisch disproportioniert.
- Als Lösungsmittel sind geeignet insbesondere chlorierte Kohlenwasserstoffe zum Beispiel CH₂Cl₂ und CHCl₃, aber auch Ether, Ester, sowie aromatische Kohlen wasserstoffe und Ketone sind für die Disproportionierungsreaktion in Abwesenheit von Wasser geeignet. Ansonsten sind sie einsetzbar, wenn sie mit Wasser ein zweiphasiges Gemisch bilden. Die Reaktionsbedingungen zur Herstellung der Disproportionate sind ansonsten identisch mit denen zur Herstellung der reinen Tetrasulfide.
- Bis zu welchem Grad die Disproportionierungsreaktion fortgeschritten ist, bleibt für die Eignung des entstehenden Gemisches ohne Belang. Es darf nur kein freier Schwefel bei der Disproportionierung entstehen.
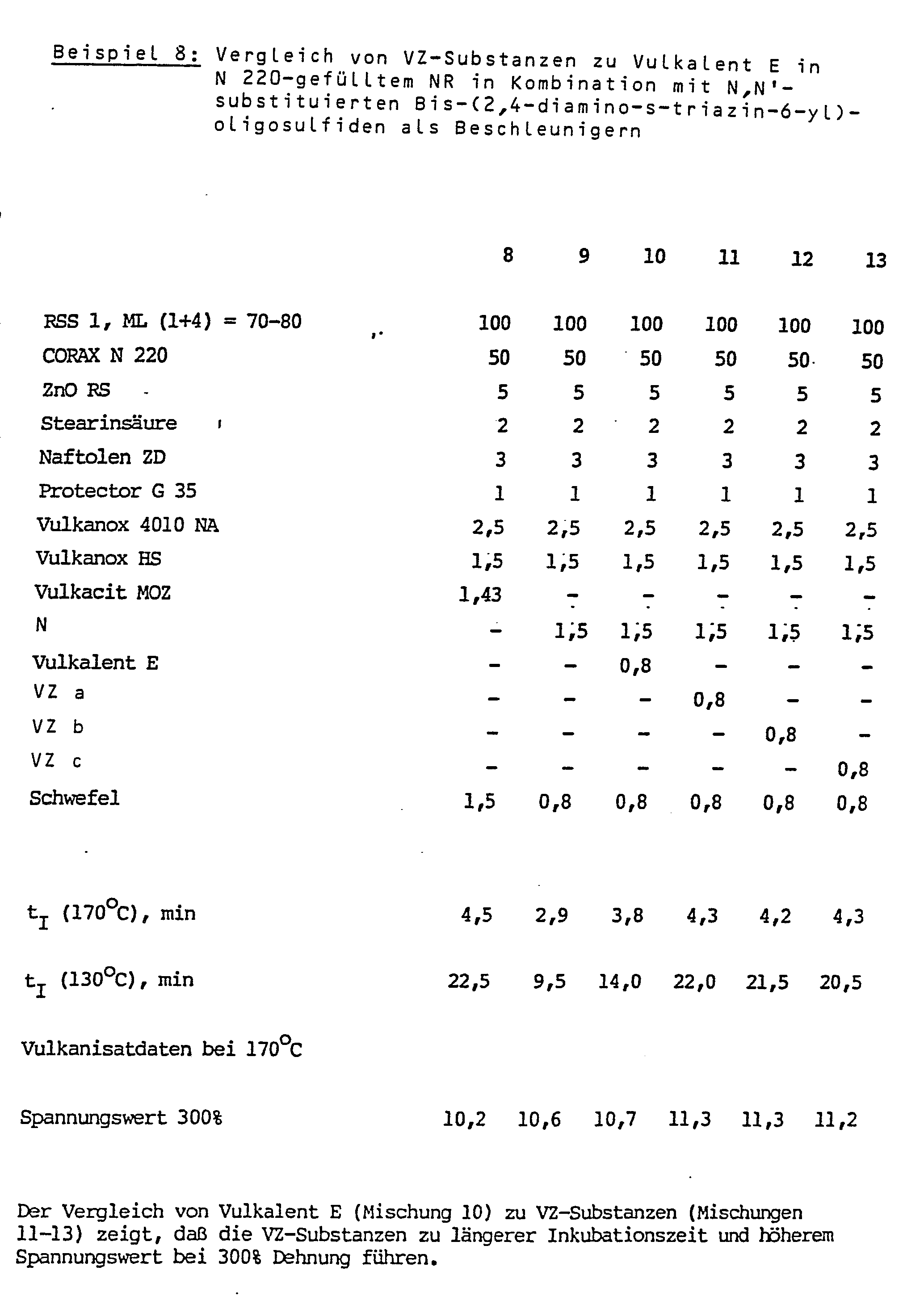
- Es zeigt sich, daß die erfindungsgemäß verwendeten substituierten N-Trichlormethylthiodicarboximide gemäß den Formeln (I, Ia) in Kombination mit den Triazinverbindungen gemäß Formel II nicht nur ausgezeichnete Vulkanisationsverzögerer sind, sondern gleichzeitig auch die Vulkanisationscharakteristik so verändern, daß alle auf die Vernetzungsdichte ansprechenden physikalischen Daten, wie das maximale Drehmoment (Rheometer) oder die Spannungswerte bei 300 % Dehnung, beträchtlich angehoben werden.
- Bevorzugt eingesetzt werden N-Trichlormethylthio-phthalimid (VZ a) und 1,2,3,6-Tetrahydro-N-(trichlormethylthio)-phthalimid (VZ b).
- Als weitere Beispiele für die erfindungsgemäß verwendbaren Verbindungen gemäß den Formeln (I, Ia) seien genannt:
N-Trichlormethylthio-succinimid (VZ c)
N-Trichlormethylthio-dodecylsuccinimid
N-Trichlormethylthio-7-oxabicyclo-(2.2.1)-hept-5-en-2.3-dicarboximid
N-Trichlormethylthio-5-norbornen-1,2-dicarboximid - Diese Substanzen sind bekannt, einige von ihnen werden großtechnisch hergestellt und als Fungizide in der Landwirtschaft verwendet (Captan ® und Folpet ®). Man stellt sie aus den entsprechenden Dicarboximiden und Perchlormethylmercaptan = Trichlorsulfenylchlorid in Gegenwart eines Säureakzeptors her (CHEVRON, US-PS 2.553.70, 2.553.771, 2.553.776; BAYER, US-PS 2.846.442; ZEFIROV und YUREF, C.A. 55.504). Beschrieben war in Kautschukmischungen bisher nur die Verwendung von N-Trichlormethylthio-phthalimid in Kombination mit Sulfenamiden des Benzthiazols, zum Beispiel des Benzthiazolyl-cyclohexyl-sulfenamids oder des Benzthiazolyl-2-sulfenmorpholids (SU-PS 164.670, J.J. Eitington et al.) mit nur schwacher verzögernder Wirkung.
- Die N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-disulfide gemäß Formel II werden in der DE-PS 16 69 954 beschrieben, zum Beispiel
Bis-(2-ethylamino-4-diethylamino-s-triazin-6-yl)-disulfid
Bis-(2-ethylamino-4-di-isopropylamino-s-triazin-6-yl)-disulfid
Bis-(2-n-propylamino-4-diethylamino-s-triazin-6-yl)-disulfid
Bis-(2-ethylamino-4-di-n-butylamino-s-triazin-6-yl)-disulfid
- Als Beispiele für N,N′-substituierte Bis-(2,4-diamino-s-triazin-6-yl)-Tetrasulfide und deren Disproportionate seien genannt:
- N Bis-(2-ethylamino-4-diethylamino-triazin-6-yl)-tetrasulfid
- A Bis-(2-ethylamino-4-di-isopropylamino-s-triazin-6-yl)-tetrasulfid
- B Bis-(2-n-butylamino-4-diethylamino-s-triazin-6-yl)-tetrasulfid
- C 8is-(2-isopropylamino-4-di-isopropylamino-s-triazin-6-yl)-tetrasulfid
- D Bis-(2-ethylamino-4-di-isobutylamino-s-triazin-6-yl)-tetrasulfid
- E Bis-(2-ethylamino-4-di-n-propylamino-s-triazin-6-yl)-tetrasulfid
- F Bis-(2-n-propylamino-4-diethylamino-s-triazin-o-yl)-tetrasulfid
- G Bis-(2-n-propylamino-4-di-n-propylamino-s-triazin-6-yl)-tetrasulfid
- H Bis-(2-n-butylamino-4-di-n-propylamino-s-triazin-6-yl)-tetrasulfid
- I Bis-(2-ethylamino-4-di-n-butylamino-s-triazin-6-yl)-tetrasulfid
- K Bis-(2-isopropylamino-4-di-isopropylamino-s-triazin-6-yl)-oligosulfid-Gemisch
- L Bis-(2-cyclohexylamino-4-diethylamino-s-triazin-6-yl)-oligosulfid-Gemisch
- M Bis-(2-ethylamino-4-diethylamino-s-triazin-6-yl)-oligosulfid-Gemisch
- O Bis-(2-amino-4-diethylamino-s-triazin-6-yl)-oligosulfid-Gemisch
- Die erfindungsgemäß als Vulkanisationsverzögerer mit Vernetzungsdichte-erhöhendem Effekt zu verwendenden substituierten N-trichlormethylthio-dicarboximide in Kombination mit N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Sulfiden gemäß Formel(II) eignen sich für die nach dem Stand der Technik bekannten Kautschukmischungen mit Naturkautschuk (NR), Isoprenkautschuke (IR), Butadienkautschuke (BR), Styrol-Butadienkautschuke (SBR), Isobutylen-isoprenkautschuke (IIR), Ethylen-Propylen-Terpolymere (EPDM), Nitrilkautschuke (NBR), halogenhaltige Kautschuke und auch epoxidierte Naturkautschuke (ENR) sowie deren Verschnitte.
- Erfindungsgemäß werden Verbindungen gemäß den Formeln (I,Ia) in einer Menge von 0,1-5 Teilen und die N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Sulfide (n=4) gemäß Formel II werden in einer Menge von 0.1 - 10 Teilen bezogen auf 100 Teile Kautschuk eingesetzt. Bevorzugt wird das molare Verhältnis von Triazin-Vernetzer zu Verzögerer von 1 : 0.3-1.5, vorzugsweise 1 : 0,3 - 1,2. In diesem Fall enthält die Mischung keinen freien Schwefel.
- Bei der beschleunigten Schwefelvulkanisation setzt man die substituierten N-Trichlormethylthiocarboximide gemäß den Formeln (I, Ia) in Mengen von 0.1 - 5 Teilen,bevorzugt 0.1 - 2 Teile pro 100 Teile Kautschuk zu bei Schwefelmengen von 0.1 - 10 Teilen, vorzugsweise 0.1 - 8 Teile pro 100 Teile Kautschuk. Bevorzugt werden molare Verhältnisse von Beschleuniger, Verzögerer, Schwefel von 1 : 0,3 - 1.5 : 0.5 - 1.5, vorzugsweise 1 : 0,3- 1.2 : 0.5 - 1.5. Oligosulfide gemäß Formel II werden dann in Mengen von 0,1 - 10 Teilen verwendet. Zur Erzielung einer weiteren Variationsbreite der Vulkanisationskinetik kann es sich als zweckmäßig erweisen, die Triazinbeschleuniger gemäß Formel II in Form von Gemischen zweier oder mehrerer Individuen einzusetzen, wobei zur Einhaltung der o.a. Anwendungsmengen, insbesondere der bevorzugten molaren Verhältnisse, die Substitution auf molarer Basis vorzunehmen ist.
- Gleichermaßen ist die Substitution bei der Verwendung der Triazinverbindungen gemäß Formel (II) vorzunehmen, wenn ohne Schwefel gearbeitet wird.
- Ebenfalls aus kinetischen Gründen kann es sich als zweckmäßig erweisen, die N,N′-substituierten Bis-(2,4-diaminos-triazin-6-yl)-oligosulfide gemäß Formel II in Gemisch mit konventionellen Beschleunigern der Benzthiazolreihe und/oder Thiurame einzusetzen, zum Beispiel N-Cyclohexylbenzthiazolsulfenamid, 2-Mercaptobenzthiazol, Benzthiazolyldisulfid, bzw. deren Zinksalze und Tetramethylthiuramdisulfid (s.a. J.van Alphen, Rubber Chemicals (1977), S. 1-46).
- Mit diesen Dosierungsrichtlinien lassen sich wichtige Vulkanisationsprobleme lösen, ohne daß es dabei zu einem Vulkanisateigenschaftsverlust kommt.
- N,N′-substituierte Bis-(2,4-diamino-s-triazin-6-yl)-oligosulfide gemäß Formel II können vorteilhaft zusammen mit Organosilanen, zum Beispiel
(III)[(R-O)₃ Si - (CH₂)n]-Sx oder (RO)₃-Si(CH₂)n-SH (IV)
mit n = 2;3, x = 2-6, R = C₁-C₆-Alkyl,Cyclohexyl
oder
vorzugsweise Bis-(3-triäthoxisilylpropyl)-Tetrasulfid (Si 69, Degussa AG) eingesetzt werden, und zwar bei der schwefelfreien Si 69-Vernetzung (DE-PS 25 36 674), bei der Schwefelvulkanisation mit Si 69 (DE-PS 22 55 577) und ebenso bei der Herstellung reversionsstabiler Vulkanisate durch Aufbau von equilibrium cure systems gemäß DE-PS 28 48 559. In allen genannten Fällen fungieren substituierte N-Trichlormethylthiodicarboximide gemäß Formel (I, Ia) als geeignete Vulkanisationsverzögerer mit Vernetzungsdichte-erhöhendem Effekt. - Die vulkanisationsverzögernde Wirkung substituierter N-Trichlormethylthiodicarboximide gemäß Formel (I, Ia) tritt auch ein, wenn N,N′-substituierte Bis-(2,4-diamino-s-triazin-6-yl)-oligosulfide gemäß Formel(II)allein oder im Gemisch zusammen mit konventionellen Beschleunigern und/oder mit üblichen Schwefelspendern wie zum Beispiel Sulfasan ® R (Morpholindisulfid) eingesetzt werden.
- Die Verwendung von substituierten N-trichlormethylthiodicarboximiden als Verzögerer mit Vernetzungsdichte-erhöhendem Effekt in Kombination mit N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-oligosulfiden gemäß Formel (II) erfolgt in Kautschukmischungen, die als weitere übliche Mischungskomponenten enthalten können:
- Verstärkungssysteme, d.h. Furnace-Ruße, Channel-Ruße, Flammruße, Thermalruße, Acetylenruße, Lichtbogenruße, CK-Ruße usw. sowie synthetische Füllstoffe wie Kieselsäuren, Silikate, Aluminiumoxidhydrate, Calciumcarbonate und natürliche Füllstoffe wie Clays, Kieselkreiden, Kreiden, Talke usw. sowie silanmodifizierte Füllstoffe und deren Verschnitte in Mengen von 5 - 300 Teilen,
je 100 Teile Kautschuk,
- Zinkoxid und Stearinsäure als Promotoren der Vulkanisation in Mengen von 0.5 - 10 Teilen pro 100 Teile Kautschuk,
- üblicherweise verwendete Alterungs-, Ozon-, Ermüdungsschutzmittel wie zum Beispiel IPPD, TMQ usw. und auch Wachse als Lichtschutzmittel und deren Verschnitte,
- beliebige Weichmacher wie zum Beispiel aromatische, naphthenische, paraffinische, synthetische Weichmacher und deren Verschnitte,
- ggfs. in der Kautschukindustrie dem Stand der Technik entsprechend verwendete Organosilane wie zum Beispiel γ-Chlorpropyltrialkoxisilane, Vinyltrialkoxysilane,γ- Mercaptoalkyltrialkoxisilane und Aminoalkyl trialkoxisilane, sowie deren Verschnitte in einer Menge von 0.1 - 25, bevorzugt 1 - 10 Teile je 100 Teile silanolgruppentragender Füllstoffe wie Kieselsäuren, Silikate, Clays usw.
- ggfs. Farbstoffe und Verarbeitungshilfsmittel in der üblichen Dosierung.
Herstellung und Vulkanisation der Kautschukmischungen erfolgt nach den bekannten Verfahren und unter den üblichen Bedingungen. - Der Anwendungsbereich der N-(trichlormethylthio)-dicarboximide in Kombination mit N,N′-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Sulfiden gemäß den Formeln (I), (Ia) und (II) erstreckt sich auf Kautschukmischungen wie sie üblicherweise im Reifenbau verwendet werden, auf technische Artikel, wie zum Beispiel Mischungen für Fördergurte, Keilriemen, Formartikel, Schläuche mit und ohne Einlagen, Walzengummierungen, Auskleidungen, Spritzprofile, Freihandartikel, Folien, Schuhsohlen und Oberteile, Kabel, Vollgummireifen und deren Vulkanisate.
- Herstellung und Vulkanisation der Kautschukmischungen erfolgt nach den bekannten Verfahren und unter den üblichen Bedingungen.
- Man löst 454 g 2-Ethylamino-4-diethylamino-6-mercaptotriazin in Natronlauge, die man aus 84 g NaOH + 1,5 Liter H₂O hergestellt hat.
- Die Lösung gibt man in einen 4 Liter 3 Tubenkolben, dann gibt man 1,5 Liter Leichtbenzin (Kp 80 - 110°C) hinzu und kühlt die Mischung unter starkem Rühren auf 0°C ab.
- Nun läßt man innerhalb von 20 min. eine Lösung von 137 g S₂Cl₂ in100 ml Benzin einlaufen, wobei man darauf achtet, daß die Temperatur +5°C nicht überschretet.
- Das Tetrasulfid fällt sofort aus. Am Ende der Reaktion wird 5 min. nachgerührt, anschließend abgenutscht und gewaschen.
- Das schneeweiße feine Pulver wird im Vakuum/12 Torr bei 40 - 45°C getrocknet.
- Menge: 499,5 g, entsprechend 97,1 % der Theorie,
F. 149 - 150°C - Bis-(2-ethylamino-4-diethylamino-s-triazin-6-yl)-Tetrasulfid,
Molgew. 516, C₁₈H₃₂N₁₀S₄
ber. C 41,9 H 6,2 N 27,1 S 24,8
gef. C 41,8 H 6,5 N 26,8 S 24,8
- TLC- und HPLC-Analyse zeigen, daß das Produkt 97,1 % lineares Tetrasulfid enthält.
- Man löst 56,6 g 2-Ethylamino-4-di-n-butylamino-6-mercaptotriazin in einer Lösung von 8,8 NaOH in 250 ml Wasser. Dazu gibt man 250 ml Benzin. Die Mischung wird nach gutem Rühren auf +5°C abgekühlt. Nun läßt man eine Lösung von 13,5 g S₂Cl₂ in 30 ml Benzin zulaufen. Es bildet sich sofort ein weißer Niederschlag. Am Ende der Reaktion wird nach Beispiel 1 aufgearbeitet.
Menge: 56 g, entsprechend 89,2 % der Theorie. -
ber. C 49,68 H 7,64 N 22,29 S 20,38
gef. C 49,59 H 7,59 N 22,18 S 20,40
HPLC-Analyse: Reinheitsgrad >96 %.
- 107,6 g 2-i-Propylamino-4-diisopropylamino-6-mercaptotriazin löst man in Natronlauge, die man aus 17,6 g NaOH in 600 ml H₂O herstellt. Dazu gibt man 600 ml Methylenchlorid.
- Bei 0-5°C läßt man eine Lösung von 27 g S₂Cl₂ in 50 ml CH₂Cl₂ zulaufen. Am Ende der Reaktion trennt man in einem Scheidetrichter die organische Phase ab, trocknet und dampft im Vakuum ein. Man erhält ein amorphes Pulver; Erweichungspunkt: 90°C.
Ausbeute: 112,5 g, entsprechend 94 % der Theorie. -
ber. C 48 H 7,33 N 23,3 S 21,3
gef. C 48,2 H 7,36 N 23,01 S 20,95
- Man löst 45,4 g 2-Ethylamino-4--diethylamino-6-mercaptotriazin in Natronlauge, hergestellt aus 8,8 g NaOH und 200 ml Wasser. Dazu gibt man 200 ml Methylenchlorid. Die Mischung wird turbiniert und auf 0°C abgekühlt. Man löst nun 14 g S₂Cl₂ in 50 ml CH₂Cl₂ und läßt diese Lösung in die Mercaptidlösung einlaufen.
- Das Reaktionsprodukt löst sich in CH₂Cl₂. Am Ende der Reaktion trennt man die Phasen und arbeitet die CH₂Cl₂-Lösung auf. Man erhält so ein amorphes Pulver mit einem Erweichungspunkt von ca. 110°C.
Menge: 46,7 g, entsprechend 90,5 % der Theorie. -
ber N 27,1 S 24,8
gef. N 26,8 S 24,4
- Laut TLC-Analyse enthält man ein Gemisch aus 4 Oligosulfide,aber keinen freien Schwefel
- Man gibt 50 g Bis-(2-ethylamino-4-diethylamino-s-triazin-6-yl)-Tetrasulfid mit einem Reinheitsgrad von 97,1 % in einen Rundkolben und erwärmt im Ölbad 1 Stunde auf 160°C. Kalt erstarrt die Schmelze amorph. Nach TLC-Analyse enthält das Produkt neben ca. 50 % Ausgangsprodukt 3 weitere Oligosulfide.
- 70,25 g 2-Cyclohexylamino-4-diethylamino-6-mercaptotriazin löst man in 11 g NaOH und 250 ml Wasser. Dazu gibt man 250 ml Chloroform. Unter starkem Rühren läßt man eine Lösung von 16,8 g S₂Cl₂ in 30 ml CHCl₃ zulaufen. Am Ende der Reaktion trennt man die Phase und arbeitet die Chloroformschicht auf. Man erhält 71,9 g eines weißen amorphen Pulvers, entsprechend 92 % der Theorie.
-
ber C 50 H 7,05 N 22,4 S 20,51
gef. C 49,1 H 6,90 N 21,8 S 20
- Laut TLC-Analyse setzt sich das Produkt aus ca. 30% linearem S₄-Produkt und 70 % Oligosulfiden zusammen, enthält aber keinen freien Schwefel.
-
-
Claims (8)
R⁹: H
R¹⁰: H, C₁ - C₁₆ -Alkyl,Undecenyl, oder R⁹ und
R¹⁰ bilden zusammen mit den in 3- und 4-Stellung stehenden Kohlenstoffatomen des Dicarboximids einen Sechsring, gesättigt oder ein- oder dreifach ungesättigt, der ein- bis 2-fach durch Methyl substituiert sein kann, insbesondere Tetrahydrophthalimide der Formel
R⁵ und R⁶ eine endo-CH₂ oder endo-O-Brücke,
in Kombination mit oligosulfidischen Verbindungen der Formel:
R¹, R² = H, R² = Benzyl,
R², R³, R⁴ = C₁-C₈-Alkyl, Allyl, C₃-C₈ Cycloalkyl, letzteres unsubstituiert oder mit 1-3 Methylgruppen substituiert, 2-Hydroxiethyl, 3-Hydroxypropyl, 2-Hydroxypropyl oder
R³ und R⁴ (zusammen): C₄-C₆ Alkylen,-(CH₂-CHX)₂Y mit X = H, CH₃, Y = O, S
n = 2 oder 4 oder ein Gemisch von Verbindungen gemäß Formel II, bei denen Sn einer mittleren statistischen Kettenlänge mit n = 4 entspricht in vulkanisierbaren Kautschukmischungen als Vulkanisationsverzögerer mit Vernetzungsdichte erhöhendem Effekt.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19863610811 DE3610811A1 (de) | 1986-04-01 | 1986-04-01 | Verwendung von substituierten n-trichlormethylthiodicarboximiden in kombination mit n;n'-substituierten bis-(2,4-diamino-s-triazin-6-yl)-oligosulfiden in vulkanisierbaren kautschukmischungen und derartige kautschukmischungen |
| DE3610811 | 1986-04-01 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0240711A2 true EP0240711A2 (de) | 1987-10-14 |
| EP0240711A3 EP0240711A3 (de) | 1989-11-08 |
Family
ID=6297624
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP87102992A Withdrawn EP0240711A3 (de) | 1986-04-01 | 1987-03-03 | Verwendung von substituierten N-Trichlormethylthiodicarboximiden in Kombination mit N,N'-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Oligosulfiden in vulkanisierbaren Kautschukmischungen und derartige Kautschukmischungen |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US5037872A (de) |
| EP (1) | EP0240711A3 (de) |
| JP (1) | JPS62241935A (de) |
| CN (1) | CN1010951B (de) |
| AU (1) | AU590689B2 (de) |
| BR (1) | BR8701447A (de) |
| CA (1) | CA1286048C (de) |
| CS (2) | CS274291B2 (de) |
| DE (1) | DE3610811A1 (de) |
| DK (1) | DK160787A (de) |
| FI (1) | FI871408A7 (de) |
| HU (1) | HUT47617A (de) |
| IL (1) | IL82007A (de) |
| IN (1) | IN168551B (de) |
| NO (1) | NO871053L (de) |
| PL (1) | PL152858B1 (de) |
| PT (1) | PT84605B (de) |
| YU (1) | YU45073B (de) |
| ZA (1) | ZA871767B (de) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3610796A1 (de) * | 1986-04-01 | 1987-10-08 | Degussa | Verwendung von substituierten n-trichlormethylthiohydantoinen in kombination mit bis-(2,4-diamino-s-triazin-6-yl)-oligosulfiden in vulkanisierbaren kautschukmischungen und derartige kautschukmischungen |
| CA2261252A1 (en) * | 1998-02-26 | 1999-08-26 | Friedrich Visel | Asymmetrical siloxy compounds |
| US6184306B1 (en) | 1999-02-18 | 2001-02-06 | The Goodyear Tire & Rubber Company | Asymmetrical siloxy compounds |
| DE10017654A1 (de) * | 2000-04-08 | 2001-10-18 | Degussa | Organosiliciumverbindungen |
| US6359046B1 (en) | 2000-09-08 | 2002-03-19 | Crompton Corporation | Hydrocarbon core polysulfide silane coupling agents for filled elastomer compositions |
| US6635700B2 (en) | 2000-12-15 | 2003-10-21 | Crompton Corporation | Mineral-filled elastomer compositions |
| US7968636B2 (en) * | 2006-12-28 | 2011-06-28 | Continental Ag | Tire compositions and components containing silated cyclic core polysulfides |
| US7968635B2 (en) * | 2006-12-28 | 2011-06-28 | Continental Ag | Tire compositions and components containing free-flowing filler compositions |
| US7696269B2 (en) | 2006-12-28 | 2010-04-13 | Momentive Performance Materials Inc. | Silated core polysulfides, their preparation and use in filled elastomer compositions |
| US7781606B2 (en) * | 2006-12-28 | 2010-08-24 | Momentive Performance Materials Inc. | Blocked mercaptosilane coupling agents, process for making and uses in rubber |
| US7968634B2 (en) * | 2006-12-28 | 2011-06-28 | Continental Ag | Tire compositions and components containing silated core polysulfides |
| US7687558B2 (en) * | 2006-12-28 | 2010-03-30 | Momentive Performance Materials Inc. | Silated cyclic core polysulfides, their preparation and use in filled elastomer compositions |
| US8592506B2 (en) * | 2006-12-28 | 2013-11-26 | Continental Ag | Tire compositions and components containing blocked mercaptosilane coupling agent |
| US7968633B2 (en) * | 2006-12-28 | 2011-06-28 | Continental Ag | Tire compositions and components containing free-flowing filler compositions |
| US7960460B2 (en) * | 2006-12-28 | 2011-06-14 | Momentive Performance Materials, Inc. | Free-flowing filler composition and rubber composition containing same |
| US7737202B2 (en) * | 2006-12-28 | 2010-06-15 | Momentive Performance Materials Inc. | Free-flowing filler composition and rubber composition containing same |
| JP5663455B2 (ja) * | 2011-10-26 | 2015-02-04 | 住友ゴム工業株式会社 | 紙送りローラおよびゴム組成物 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1669954A1 (de) * | 1951-01-28 | 1970-08-20 | Degussa | Verfahren zur Verbesserung der Gebrauchseigenschaften von Vulkanisaten |
| US3546185A (en) * | 1968-03-20 | 1970-12-08 | Monsanto Co | Inhibiting premature vulcanization of diene rubbers |
| US3862051A (en) * | 1971-02-08 | 1975-01-21 | Monsanto Co | Composition of poly(thioamides) and accelerator |
| DE2848559C2 (de) * | 1978-11-09 | 1982-01-21 | Degussa Ag, 6000 Frankfurt | Reversionsfreie Vulkanisate ergebende Kautschukmischungen und deren Verwendung |
| US4380609A (en) * | 1981-10-19 | 1983-04-19 | Monsanto Company | Prevulcanization inhibitors of thio-triazine-amines for rubber |
| DE3438290A1 (de) * | 1984-10-19 | 1986-04-24 | Degussa Ag, 6000 Frankfurt | Bis-(2-ethylamino-4-diethylamino-s-triazin-6- yl)tetrasulfid,verfahren zur herstellung, verwendung und sie enthaltende vulkanisierbare mischungen |
| DE3610796A1 (de) * | 1986-04-01 | 1987-10-08 | Degussa | Verwendung von substituierten n-trichlormethylthiohydantoinen in kombination mit bis-(2,4-diamino-s-triazin-6-yl)-oligosulfiden in vulkanisierbaren kautschukmischungen und derartige kautschukmischungen |
| DE3610794C2 (de) * | 1986-04-01 | 1995-02-09 | Degussa | N,N'-substituierte Bis-(2,4-diamino-s-triazin-6-yl)-Tetrasulfide, Verfahren zu ihrer Herstellung und ihre Verwendung in vulkanisierbaren Kautschukmischungen |
-
1986
- 1986-04-01 DE DE19863610811 patent/DE3610811A1/de not_active Withdrawn
-
1987
- 1987-03-03 EP EP87102992A patent/EP0240711A3/de not_active Withdrawn
- 1987-03-09 YU YU383/87A patent/YU45073B/xx unknown
- 1987-03-10 IN IN192/CAL/87A patent/IN168551B/en unknown
- 1987-03-11 ZA ZA871767A patent/ZA871767B/xx unknown
- 1987-03-13 NO NO871053A patent/NO871053L/no unknown
- 1987-03-16 AU AU70059/87A patent/AU590689B2/en not_active Ceased
- 1987-03-25 IL IL82007A patent/IL82007A/xx unknown
- 1987-03-30 DK DK160787A patent/DK160787A/da not_active IP Right Cessation
- 1987-03-30 JP JP62074587A patent/JPS62241935A/ja active Pending
- 1987-03-30 BR BR8701447A patent/BR8701447A/pt unknown
- 1987-03-31 CS CS224587A patent/CS274291B2/cs unknown
- 1987-03-31 HU HU871390A patent/HUT47617A/hu not_active IP Right Cessation
- 1987-03-31 CS CS901285A patent/CS9001285A3/cs unknown
- 1987-03-31 PL PL1987264910A patent/PL152858B1/pl unknown
- 1987-03-31 FI FI871408A patent/FI871408A7/fi not_active Application Discontinuation
- 1987-03-31 CA CA000533429A patent/CA1286048C/en not_active Expired - Lifetime
- 1987-04-01 PT PT84605A patent/PT84605B/pt not_active IP Right Cessation
- 1987-04-01 CN CN87102444A patent/CN1010951B/zh not_active Expired
-
1989
- 1989-02-21 US US07/312,419 patent/US5037872A/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| PL152858B1 (en) | 1991-02-28 |
| AU590689B2 (en) | 1989-11-09 |
| PT84605B (pt) | 1989-11-30 |
| HUT47617A (en) | 1989-03-28 |
| CN1010951B (zh) | 1990-12-26 |
| FI871408A7 (fi) | 1987-10-02 |
| CS275483B2 (en) | 1992-02-19 |
| CN87102444A (zh) | 1987-10-14 |
| YU45073B (en) | 1991-08-31 |
| JPS62241935A (ja) | 1987-10-22 |
| DE3610811A1 (de) | 1987-10-08 |
| CS9001285A3 (en) | 1992-02-19 |
| IN168551B (de) | 1991-04-27 |
| NO871053D0 (no) | 1987-03-13 |
| CA1286048C (en) | 1991-07-09 |
| FI871408A0 (fi) | 1987-03-31 |
| DK160787A (da) | 1987-10-02 |
| IL82007A0 (en) | 1987-10-20 |
| DK160787D0 (da) | 1987-03-30 |
| AU7005987A (en) | 1987-10-08 |
| IL82007A (en) | 1990-12-23 |
| US5037872A (en) | 1991-08-06 |
| CS274291B2 (en) | 1991-04-11 |
| PT84605A (de) | 1987-05-01 |
| YU38387A (en) | 1988-10-31 |
| CS224587A2 (en) | 1990-09-12 |
| BR8701447A (pt) | 1988-01-05 |
| NO871053L (no) | 1987-10-02 |
| ZA871767B (en) | 1987-09-01 |
| PL264910A1 (en) | 1988-07-21 |
| EP0240711A3 (de) | 1989-11-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0240711A2 (de) | Verwendung von substituierten N-Trichlormethylthiodicarboximiden in Kombination mit N,N'-substituierten Bis-(2,4-diamino-s-triazin-6-yl)-Oligosulfiden in vulkanisierbaren Kautschukmischungen und derartige Kautschukmischungen | |
| DE2265382C2 (de) | Polysulfidderivate zur Vernetzung von Kautschuk | |
| EP0178444B1 (de) | Bis-(2-Ethylamino-4-diethylamino-s-triazin-6-yl)tetrasulfid, Verfahren zur Herstellung, Verwendung und sie enthaltende vulkanisierbare Mischungen | |
| DE1670332A1 (de) | Neue Aryl-1,3,5-triazine,Verfahren zu deren Herstellung und Verwendung | |
| DE4038589A1 (de) | Kautschukvulkanisate mit guten mechanischen eigenschaften und verbessertem hystereseverhalten | |
| DE3610794C2 (de) | N,N'-substituierte Bis-(2,4-diamino-s-triazin-6-yl)-Tetrasulfide, Verfahren zu ihrer Herstellung und ihre Verwendung in vulkanisierbaren Kautschukmischungen | |
| DE2337642C3 (de) | Phosphorsäureamide und ihre Verwendung bei der Vulkanisation von Kautschuk | |
| DE2430143C3 (de) | Triazinsulfenimide von Dicarbonsäuren, Verfahren zu ihrer Herstellung und ihre Verwendung | |
| DE69521341T2 (de) | Mit schwefel vulkanisierte kautschuk-zusammensetzungen enthaltend substituierte succinimid-verbindungen | |
| DE2319647C3 (de) | ThiocarbamylsuHenamide und deren Verwendung | |
| EP0239813A2 (de) | Verwendung von substituierten N-trichlormethylthiohydantionen in Kombination mit Bis-(2,4-diamino-s-triazin-6-yl)-oligosulfiden in vulkanisierbaren Kautschukmischungen und derartige Kautschukmischungen | |
| EP0108352B1 (de) | 3-(3-Jodpropargyl)-benzo-1,2,3-triazin-4-one, Verfahren zu ihrer Herstellung und ihre Verwendung in mikrobiziden Mitteln | |
| EP0432406B1 (de) | Polysulfidderivate, Verfahren zu ihrer Herstellung und Verwendung zur Vernetzung von Natur- und Synthesekautschuken | |
| DE2732994A1 (de) | Einen vulkanisierbaren kautschuk enthaltende masse | |
| EP0347524B1 (de) | Bis(2,4-organylthio-s-triazin-6-yl)polysulfane, Verfahren zu ihrer Herstellung und sie enthaltende vulkanisierbare Kautschukmischungen | |
| DD203726A5 (de) | Zusammensetzung zur verzoegerung der anvulkanisation | |
| US4013638A (en) | Azabicyclononanecarbodithioic acid | |
| DD263297A5 (de) | Verwendung von substituierten N-Trichlormethylthiodicarboximiden in Kombination mit N,n'-Substituierten Bis-(2,4-Diamino-S-Triazin-6-yl)-oligosulfiden in vulkanisierbaren Kautschukmischungen und derartige Kautschukmischungen | |
| DD263298A5 (de) | Verwendung von substituierten N-Trichlormethylthiohydantoinen in Kombination mit Bis-(2,4-diamino-s-triazin-6-yl)-oligosulfiden in vulkanisierbaren Kautschukmischungen und derartigen Kautschukmischungen | |
| EP0427942A2 (de) | Verfahren zur Herstellung von s-Triazinsulfenimiden und deren Verwendung | |
| DE2164404C3 (de) | Sulfenamide, Verfahren zu ihrer Herstellung und ihre Verwendung | |
| DE2323466B2 (de) | Vulkanisierbare Kantschukmasse | |
| SU1348339A1 (ru) | 3,3-Бис-(4-нитрозо-6-фенил-1,2,4-триазинон-5) дисульфид в качестве структурирующего агента дл резиновых смесей | |
| DE1770574C3 (de) | Verfahren zur Verhinderung einer vorzeitigen Vulkanisation von vulkanisierbaren Dienkautschukmaterialien | |
| DE2047142A1 (de) | N Azolylsulfenamide, ihre Her stellung und Verwendung |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19870303 |
|
| AK | Designated contracting states |
Kind code of ref document: A2 Designated state(s): AT BE CH DE ES FR GB IT LI LU NL SE |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): AT BE CH DE ES FR GB IT LI LU NL SE |
|
| 17Q | First examination report despatched |
Effective date: 19910710 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION IS DEEMED TO BE WITHDRAWN |
|
| 18D | Application deemed to be withdrawn |
Effective date: 19920121 |
|
| RIN1 | Information on inventor provided before grant (corrected) |
Inventor name: LAMBERTZ, HORST Inventor name: WOLFF, SIEGFRIED Inventor name: SCHWARZE, WERNER, DR. |