EP0214588A2 - Cyklisches Oxim - Google Patents
Cyklisches Oxim Download PDFInfo
- Publication number
- EP0214588A2 EP0214588A2 EP86112050A EP86112050A EP0214588A2 EP 0214588 A2 EP0214588 A2 EP 0214588A2 EP 86112050 A EP86112050 A EP 86112050A EP 86112050 A EP86112050 A EP 86112050A EP 0214588 A2 EP0214588 A2 EP 0214588A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- oxime
- oil
- givaudan
- ethyl
- mixture
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- -1 Cyclic oxime Chemical class 0.000 title description 13
- 239000003205 fragrance Substances 0.000 claims abstract description 11
- 239000000203 mixture Substances 0.000 claims description 38
- IFSNQEZZYZSNCB-UHFFFAOYSA-N n-[1-(2,4,4,5,5-pentamethylcyclopenten-1-yl)ethylidene]hydroxylamine Chemical compound ON=C(C)C1=C(C)CC(C)(C)C1(C)C IFSNQEZZYZSNCB-UHFFFAOYSA-N 0.000 claims description 9
- 238000000034 method Methods 0.000 claims description 6
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 claims description 4
- MIUJRXDEDCVOSG-UHFFFAOYSA-N n-(4,4,5,7-tetramethylocta-5,7-dien-2-ylidene)hydroxylamine Chemical compound CC(=C)C=C(C)C(C)(C)CC(C)=NO MIUJRXDEDCVOSG-UHFFFAOYSA-N 0.000 claims description 4
- XGIQVZQUYKZWJX-UHFFFAOYSA-N n-(4,4,7-trimethyl-5-methylideneoct-6-en-2-ylidene)hydroxylamine Chemical compound CC(C)=CC(=C)C(C)(C)CC(C)=NO XGIQVZQUYKZWJX-UHFFFAOYSA-N 0.000 claims description 4
- 150000003839 salts Chemical class 0.000 claims description 4
- LLCMOZBDJDCWLT-UHFFFAOYSA-N 1-(2,4,4,5,5-pentamethylcyclopenten-1-yl)ethanone Chemical compound CC(=O)C1=C(C)CC(C)(C)C1(C)C LLCMOZBDJDCWLT-UHFFFAOYSA-N 0.000 claims description 3
- 238000002360 preparation method Methods 0.000 claims description 3
- 150000002923 oximes Chemical class 0.000 abstract description 19
- 238000004519 manufacturing process Methods 0.000 abstract description 4
- 150000001875 compounds Chemical class 0.000 description 15
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 8
- GLZPCOQZEFWAFX-UHFFFAOYSA-N Geraniol Chemical compound CC(C)=CCCC(C)=CCO GLZPCOQZEFWAFX-UHFFFAOYSA-N 0.000 description 8
- QMVPMAAFGQKVCJ-UHFFFAOYSA-N citronellol Chemical compound OCCC(C)CCC=C(C)C QMVPMAAFGQKVCJ-UHFFFAOYSA-N 0.000 description 8
- CDOSHBSSFJOMGT-UHFFFAOYSA-N linalool Chemical compound CC(C)=CCCC(C)(O)C=C CDOSHBSSFJOMGT-UHFFFAOYSA-N 0.000 description 8
- 239000000047 product Substances 0.000 description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 150000002576 ketones Chemical class 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 235000019198 oils Nutrition 0.000 description 5
- CRDAMVZIKSXKFV-FBXUGWQNSA-N (2-cis,6-cis)-farnesol Chemical compound CC(C)=CCC\C(C)=C/CC\C(C)=C/CO CRDAMVZIKSXKFV-FBXUGWQNSA-N 0.000 description 4
- 239000000260 (2E,6E)-3,7,11-trimethyldodeca-2,6,10-trien-1-ol Substances 0.000 description 4
- 239000001490 (3R)-3,7-dimethylocta-1,6-dien-3-ol Substances 0.000 description 4
- QMVPMAAFGQKVCJ-SNVBAGLBSA-N (R)-(+)-citronellol Natural products OCC[C@H](C)CCC=C(C)C QMVPMAAFGQKVCJ-SNVBAGLBSA-N 0.000 description 4
- CDOSHBSSFJOMGT-JTQLQIEISA-N (R)-linalool Natural products CC(C)=CCC[C@@](C)(O)C=C CDOSHBSSFJOMGT-JTQLQIEISA-N 0.000 description 4
- HGDVHRITTGWMJK-UHFFFAOYSA-N 2,6-dimethylheptan-2-ol Chemical compound CC(C)CCCC(C)(C)O HGDVHRITTGWMJK-UHFFFAOYSA-N 0.000 description 4
- DNRJTBAOUJJKDY-UHFFFAOYSA-N 2-Acetyl-3,5,5,6,8,8-hexamethyl-5,6,7,8- tetrahydronaphthalene Chemical compound CC(=O)C1=C(C)C=C2C(C)(C)C(C)CC(C)(C)C2=C1 DNRJTBAOUJJKDY-UHFFFAOYSA-N 0.000 description 4
- ZYEMGPIYFIJGTP-UHFFFAOYSA-N O-methyleugenol Chemical compound COC1=CC=C(CC=C)C=C1OC ZYEMGPIYFIJGTP-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 235000002911 Salvia sclarea Nutrition 0.000 description 4
- 244000182022 Salvia sclarea Species 0.000 description 4
- JGQFVRIQXUFPAH-UHFFFAOYSA-N beta-citronellol Natural products OCCC(C)CCCC(C)=C JGQFVRIQXUFPAH-UHFFFAOYSA-N 0.000 description 4
- 235000000484 citronellol Nutrition 0.000 description 4
- KSMVZQYAVGTKIV-UHFFFAOYSA-N decanal Chemical compound CCCCCCCCCC=O KSMVZQYAVGTKIV-UHFFFAOYSA-N 0.000 description 4
- HFJRKMMYBMWEAD-UHFFFAOYSA-N dodecanal Chemical compound CCCCCCCCCCCC=O HFJRKMMYBMWEAD-UHFFFAOYSA-N 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- RRAFCDWBNXTKKO-UHFFFAOYSA-N eugenol Chemical compound COC1=CC(CC=C)=CC=C1O RRAFCDWBNXTKKO-UHFFFAOYSA-N 0.000 description 4
- 229930002886 farnesol Natural products 0.000 description 4
- 229940043259 farnesol Drugs 0.000 description 4
- 229930007744 linalool Natural products 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- CRDAMVZIKSXKFV-UHFFFAOYSA-N trans-Farnesol Natural products CC(C)=CCCC(C)=CCCC(C)=CCO CRDAMVZIKSXKFV-UHFFFAOYSA-N 0.000 description 4
- QACBYNLZEUNZSC-UHFFFAOYSA-N 1-methoxy-1-methylcyclododecane Chemical compound COC1(C)CCCCCCCCCCC1 QACBYNLZEUNZSC-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 244000068485 Convallaria majalis Species 0.000 description 3
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 3
- 238000004821 distillation Methods 0.000 description 3
- 230000010354 integration Effects 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 239000002023 wood Substances 0.000 description 3
- FQTLCLSUCSAZDY-UHFFFAOYSA-N (+) E(S) nerolidol Natural products CC(C)=CCCC(C)=CCCC(C)(O)C=C FQTLCLSUCSAZDY-UHFFFAOYSA-N 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 2
- 239000001147 (3aR,5aS,9aS,9bR)-3a,6,6,9a-tetramethyl-2,4,5,5a,7,8,9,9b-octahydro-1H-benzo[e][1]benzofuran Substances 0.000 description 2
- WUOACPNHFRMFPN-SECBINFHSA-N (S)-(-)-alpha-terpineol Chemical compound CC1=CC[C@@H](C(C)(C)O)CC1 WUOACPNHFRMFPN-SECBINFHSA-N 0.000 description 2
- OZXIZRZFGJZWBF-UHFFFAOYSA-N 1,3,5-trimethyl-2-(2,4,6-trimethylphenoxy)benzene Chemical compound CC1=CC(C)=CC(C)=C1OC1=C(C)C=C(C)C=C1C OZXIZRZFGJZWBF-UHFFFAOYSA-N 0.000 description 2
- YBUIAJZFOGJGLJ-SWRJLBSHSA-N 1-cedr-8-en-9-ylethanone Chemical compound C1[C@]23[C@H](C)CC[C@H]3C(C)(C)[C@@H]1C(C)=C(C(C)=O)C2 YBUIAJZFOGJGLJ-SWRJLBSHSA-N 0.000 description 2
- FJHNSGVMPSITEQ-UHFFFAOYSA-N 10-Undecen-2-one Chemical compound CC(=O)CCCCCCCC=C FJHNSGVMPSITEQ-UHFFFAOYSA-N 0.000 description 2
- RIWRBSMFKVOJMN-UHFFFAOYSA-N 2-methyl-1-phenylpropan-2-ol Chemical compound CC(C)(O)CC1=CC=CC=C1 RIWRBSMFKVOJMN-UHFFFAOYSA-N 0.000 description 2
- NFAVNWJJYQAGNB-UHFFFAOYSA-N 2-methylundecanal Chemical compound CCCCCCCCCC(C)C=O NFAVNWJJYQAGNB-UHFFFAOYSA-N 0.000 description 2
- JYVLIDXNZAXMDK-UHFFFAOYSA-N 2-pentanol Substances CCCC(C)O JYVLIDXNZAXMDK-UHFFFAOYSA-N 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- NGYMOTOXXHCHOC-UHFFFAOYSA-N 3-methyl-5-(2,2,3-trimethylcyclopent-3-en-1-yl)pentan-2-ol Chemical compound CC(O)C(C)CCC1CC=C(C)C1(C)C NGYMOTOXXHCHOC-UHFFFAOYSA-N 0.000 description 2
- 125000003119 4-methyl-3-pentenyl group Chemical group [H]\C(=C(/C([H])([H])[H])C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- ZCTQGTTXIYCGGC-UHFFFAOYSA-N Benzyl salicylate Chemical compound OC1=CC=CC=C1C(=O)OCC1=CC=CC=C1 ZCTQGTTXIYCGGC-UHFFFAOYSA-N 0.000 description 2
- 241001090476 Castoreum Species 0.000 description 2
- NPBVQXIMTZKSBA-UHFFFAOYSA-N Chavibetol Natural products COC1=CC=C(CC=C)C=C1O NPBVQXIMTZKSBA-UHFFFAOYSA-N 0.000 description 2
- WTEVQBCEXWBHNA-UHFFFAOYSA-N Citral Natural products CC(C)=CCCC(C)=CC=O WTEVQBCEXWBHNA-UHFFFAOYSA-N 0.000 description 2
- 240000000560 Citrus x paradisi Species 0.000 description 2
- 235000009046 Convallaria majalis Nutrition 0.000 description 2
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 2
- 239000005770 Eugenol Substances 0.000 description 2
- GLZPCOQZEFWAFX-YFHOEESVSA-N Geraniol Natural products CC(C)=CCC\C(C)=C/CO GLZPCOQZEFWAFX-YFHOEESVSA-N 0.000 description 2
- 239000005792 Geraniol Substances 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 241000234269 Liliales Species 0.000 description 2
- 235000015511 Liquidambar orientalis Nutrition 0.000 description 2
- 244000174681 Michelia champaca Species 0.000 description 2
- GLZPCOQZEFWAFX-JXMROGBWSA-N Nerol Natural products CC(C)=CCC\C(C)=C\CO GLZPCOQZEFWAFX-JXMROGBWSA-N 0.000 description 2
- FQTLCLSUCSAZDY-ATGUSINASA-N Nerolidol Chemical compound CC(C)=CCC\C(C)=C\CC[C@](C)(O)C=C FQTLCLSUCSAZDY-ATGUSINASA-N 0.000 description 2
- 244000180308 Ocimum basilicum Species 0.000 description 2
- 241000333181 Osmanthus Species 0.000 description 2
- 235000019082 Osmanthus Nutrition 0.000 description 2
- DYUQAZSOFZSPHD-UHFFFAOYSA-N Phenylpropanol Chemical compound CCC(O)C1=CC=CC=C1 DYUQAZSOFZSPHD-UHFFFAOYSA-N 0.000 description 2
- UVMRYBDEERADNV-UHFFFAOYSA-N Pseudoeugenol Natural products COC1=CC(C(C)=C)=CC=C1O UVMRYBDEERADNV-UHFFFAOYSA-N 0.000 description 2
- 239000004870 Styrax Substances 0.000 description 2
- 244000028419 Styrax benzoin Species 0.000 description 2
- 235000000126 Styrax benzoin Nutrition 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- KGEKLUUHTZCSIP-HOSYDEDBSA-N [(1s,4s,6r)-1,7,7-trimethyl-6-bicyclo[2.2.1]heptanyl] acetate Chemical compound C1C[C@]2(C)[C@H](OC(=O)C)C[C@H]1C2(C)C KGEKLUUHTZCSIP-HOSYDEDBSA-N 0.000 description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- 229940022663 acetate Drugs 0.000 description 2
- OVKDFILSBMEKLT-UHFFFAOYSA-N alpha-Terpineol Natural products CC(=C)C1(O)CCC(C)=CC1 OVKDFILSBMEKLT-UHFFFAOYSA-N 0.000 description 2
- QUMXDOLUJCHOAY-UHFFFAOYSA-N alpha-methylbenzyl acetate Natural products CC(=O)OC(C)C1=CC=CC=C1 QUMXDOLUJCHOAY-UHFFFAOYSA-N 0.000 description 2
- 229940088601 alpha-terpineol Drugs 0.000 description 2
- YPZUZOLGGMJZJO-LQKXBSAESA-N ambroxan Chemical compound CC([C@@H]1CC2)(C)CCC[C@]1(C)[C@@H]1[C@]2(C)OCC1 YPZUZOLGGMJZJO-LQKXBSAESA-N 0.000 description 2
- QUKGYYKBILRGFE-UHFFFAOYSA-N benzyl acetate Chemical compound CC(=O)OCC1=CC=CC=C1 QUKGYYKBILRGFE-UHFFFAOYSA-N 0.000 description 2
- HQKQRXZEXPXXIG-VJOHVRBBSA-N chembl2333940 Chemical compound C1[C@]23[C@H](C)CC[C@H]3C(C)(C)[C@H]1[C@@](OC(C)=O)(C)CC2 HQKQRXZEXPXXIG-VJOHVRBBSA-N 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 229940043350 citral Drugs 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 229960002217 eugenol Drugs 0.000 description 2
- IFYYFLINQYPWGJ-UHFFFAOYSA-N gamma-decalactone Chemical compound CCCCCCC1CCC(=O)O1 IFYYFLINQYPWGJ-UHFFFAOYSA-N 0.000 description 2
- WTEVQBCEXWBHNA-JXMROGBWSA-N geranial Chemical compound CC(C)=CCC\C(C)=C\C=O WTEVQBCEXWBHNA-JXMROGBWSA-N 0.000 description 2
- 229940113087 geraniol Drugs 0.000 description 2
- WPFVBOQKRVRMJB-UHFFFAOYSA-N hydroxycitronellal Chemical compound O=CCC(C)CCCC(C)(C)O WPFVBOQKRVRMJB-UHFFFAOYSA-N 0.000 description 2
- 239000000171 lavandula angustifolia l. flower oil Substances 0.000 description 2
- SDQFDHOLCGWZPU-UHFFFAOYSA-N lilial Chemical compound O=CC(C)CC1=CC=C(C(C)(C)C)C=C1 SDQFDHOLCGWZPU-UHFFFAOYSA-N 0.000 description 2
- 229940041616 menthol Drugs 0.000 description 2
- SHOJXDKTYKFBRD-UHFFFAOYSA-N mesityl oxide Natural products CC(C)=CC(C)=O SHOJXDKTYKFBRD-UHFFFAOYSA-N 0.000 description 2
- 229940116837 methyleugenol Drugs 0.000 description 2
- PRHTXAOWJQTLBO-UHFFFAOYSA-N methyleugenol Natural products COC1=CC=C(C(C)=C)C=C1OC PRHTXAOWJQTLBO-UHFFFAOYSA-N 0.000 description 2
- WASNIKZYIWZQIP-AWEZNQCLSA-N nerolidol Natural products CC(=CCCC(=CCC[C@@H](O)C=C)C)C WASNIKZYIWZQIP-AWEZNQCLSA-N 0.000 description 2
- 239000002304 perfume Substances 0.000 description 2
- MDHYEMXUFSJLGV-UHFFFAOYSA-N phenethyl acetate Chemical compound CC(=O)OCCC1=CC=CC=C1 MDHYEMXUFSJLGV-UHFFFAOYSA-N 0.000 description 2
- SATCULPHIDQDRE-UHFFFAOYSA-N piperonal Chemical compound O=CC1=CC=C2OCOC2=C1 SATCULPHIDQDRE-UHFFFAOYSA-N 0.000 description 2
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 238000006456 reductive dimerization reaction Methods 0.000 description 2
- 239000000344 soap Substances 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- 229940098795 (3z)- 3-hexenyl acetate Drugs 0.000 description 1
- BFNMZJQMWPPBKE-UHFFFAOYSA-N 1-oxo-3h-2-benzofuran-4-carbonitrile Chemical compound C1=CC=C(C#N)C2=C1C(=O)OC2 BFNMZJQMWPPBKE-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- VCCCHVOVMLPOFP-UHFFFAOYSA-N 2,3,3,5-tetramethyl-2-(2-methylprop-1-enyl)furan Chemical compound CC(C)=CC1(C)OC(C)=CC1(C)C VCCCHVOVMLPOFP-UHFFFAOYSA-N 0.000 description 1
- TUCWJXMQYQTUPB-UHFFFAOYSA-N 2,4,5,7-tetramethylocta-2,6-diene-4,5-diol Chemical compound CC(C)=CC(C)(O)C(C)(O)C=C(C)C TUCWJXMQYQTUPB-UHFFFAOYSA-N 0.000 description 1
- SUSANQWSCSKXPF-UHFFFAOYSA-N 2-(2-methylpropoxy)benzoic acid Chemical compound CC(C)COC1=CC=CC=C1C(O)=O SUSANQWSCSKXPF-UHFFFAOYSA-N 0.000 description 1
- FAQVGPWFQGGIPP-UHFFFAOYSA-N 2-(2-methylpropyl)quinoline Chemical compound C1=CC=CC2=NC(CC(C)C)=CC=C21 FAQVGPWFQGGIPP-UHFFFAOYSA-N 0.000 description 1
- HMKKIXGYKWDQSV-SDNWHVSQSA-N 2-Pentyl-3-phenyl-2-propenal Chemical compound CCCCC\C(C=O)=C/C1=CC=CC=C1 HMKKIXGYKWDQSV-SDNWHVSQSA-N 0.000 description 1
- GMOYUTKNPLBTMT-UHFFFAOYSA-N 2-phenylmethoxybenzoic acid Chemical compound OC(=O)C1=CC=CC=C1OCC1=CC=CC=C1 GMOYUTKNPLBTMT-UHFFFAOYSA-N 0.000 description 1
- DRHIVDNOKHEMLG-UHFFFAOYSA-N 3,5-dimethyl-3-(2-methylprop-1-enyl)hex-4-en-2-one Chemical compound CC(C)=CC(C)(C(C)=O)C=C(C)C DRHIVDNOKHEMLG-UHFFFAOYSA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- VAJVDSVGBWFCLW-UHFFFAOYSA-N 3-Phenyl-1-propanol Chemical compound OCCCC1=CC=CC=C1 VAJVDSVGBWFCLW-UHFFFAOYSA-N 0.000 description 1
- 239000001623 3-phenylprop-2-enyl formate Substances 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N 3-phenylpropionic acid Chemical compound OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- MBZRJSQZCBXRGK-UHFFFAOYSA-N 4-tert-Butylcyclohexyl acetate Chemical compound CC(=O)OC1CCC(C(C)(C)C)CC1 MBZRJSQZCBXRGK-UHFFFAOYSA-N 0.000 description 1
- IZBHWLYKWKYMOY-UHFFFAOYSA-N 5-chloro-6-methoxypyridine-3-carbaldehyde Chemical compound COC1=NC=C(C=O)C=C1Cl IZBHWLYKWKYMOY-UHFFFAOYSA-N 0.000 description 1
- WGPCZPLRVAWXPW-NSHDSACASA-N 5-octyloxolan-2-one Chemical compound CCCCCCCC[C@H]1CCC(=O)O1 WGPCZPLRVAWXPW-NSHDSACASA-N 0.000 description 1
- AUBLFWWZTFFBNU-UHFFFAOYSA-N 6-butan-2-ylquinoline Chemical compound N1=CC=CC2=CC(C(C)CC)=CC=C21 AUBLFWWZTFFBNU-UHFFFAOYSA-N 0.000 description 1
- FMYCPRQGKSONCP-UHFFFAOYSA-N Acetal R Chemical compound CCCOC(C)OCCC1=CC=CC=C1 FMYCPRQGKSONCP-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 235000009051 Ambrosia paniculata var. peruviana Nutrition 0.000 description 1
- RANVDUNFZBMTBK-UHFFFAOYSA-N Amyl salicylate Chemical compound CCCCCOC(=O)C1=CC=CC=C1O RANVDUNFZBMTBK-UHFFFAOYSA-N 0.000 description 1
- 235000003097 Artemisia absinthium Nutrition 0.000 description 1
- 240000001851 Artemisia dracunculus Species 0.000 description 1
- 235000017731 Artemisia dracunculus ssp. dracunculus Nutrition 0.000 description 1
- 235000003261 Artemisia vulgaris Nutrition 0.000 description 1
- DBPLRLXFFUKDDB-UHFFFAOYSA-N Bornylacetat Natural products C1CC2(C)C(C(=O)C)CC1C2(C)C DBPLRLXFFUKDDB-UHFFFAOYSA-N 0.000 description 1
- 240000007436 Cananga odorata Species 0.000 description 1
- 244000223760 Cinnamomum zeylanicum Species 0.000 description 1
- PQMOXTJVIYEOQL-UHFFFAOYSA-N Cumarin Natural products CC(C)=CCC1=C(O)C(C(=O)C(C)CC)=C(O)C2=C1OC(=O)C=C2CCC PQMOXTJVIYEOQL-UHFFFAOYSA-N 0.000 description 1
- 235000018958 Gardenia augusta Nutrition 0.000 description 1
- 241000282375 Herpestidae Species 0.000 description 1
- DUKPKQFHJQGTGU-UHFFFAOYSA-N Hexyl salicylic acid Chemical compound CCCCCCOC(=O)C1=CC=CC=C1O DUKPKQFHJQGTGU-UHFFFAOYSA-N 0.000 description 1
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 1
- 235000010254 Jasminum officinale Nutrition 0.000 description 1
- 240000005385 Jasminum sambac Species 0.000 description 1
- 235000019501 Lemon oil Nutrition 0.000 description 1
- 241000114343 Lonicera caprifolium Species 0.000 description 1
- 241001570521 Lonicera periclymenum Species 0.000 description 1
- 235000007688 Lycopersicon esculentum Nutrition 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- FSOGIJPGPZWNGO-UHFFFAOYSA-N Meomammein Natural products CCC(C)C(=O)C1=C(O)C(CC=C(C)C)=C(O)C2=C1OC(=O)C=C2CCC FSOGIJPGPZWNGO-UHFFFAOYSA-N 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000010676 Ocimum basilicum Nutrition 0.000 description 1
- 229920000175 Pistacia lentiscus Polymers 0.000 description 1
- 244000299790 Rheum rhabarbarum Species 0.000 description 1
- 235000009411 Rheum rhabarbarum Nutrition 0.000 description 1
- 235000016954 Ribes hudsonianum Nutrition 0.000 description 1
- 240000001890 Ribes hudsonianum Species 0.000 description 1
- 235000001466 Ribes nigrum Nutrition 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 240000003768 Solanum lycopersicum Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000003998 acyclic ketones Chemical class 0.000 description 1
- 230000001476 alcoholic effect Effects 0.000 description 1
- 229940062909 amyl salicylate Drugs 0.000 description 1
- 239000001399 angelica archangelica l. seed absolute Substances 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000001138 artemisia absinthium Substances 0.000 description 1
- 229940007550 benzyl acetate Drugs 0.000 description 1
- 229960002903 benzyl benzoate Drugs 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229940115397 bornyl acetate Drugs 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- RADAAKRXEPVXBU-UHFFFAOYSA-N buccoxime Chemical compound C1CCC2(C)CCC1(C)C2=NO RADAAKRXEPVXBU-UHFFFAOYSA-N 0.000 description 1
- 239000001444 canarium indicum l. oil Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 239000010627 cedar oil Substances 0.000 description 1
- 235000017803 cinnamon Nutrition 0.000 description 1
- NPFVOOAXDOBMCE-PLNGDYQASA-N cis-3-Hexenyl acetate Natural products CC\C=C/CCOC(C)=O NPFVOOAXDOBMCE-PLNGDYQASA-N 0.000 description 1
- RRGOKSYVAZDNKR-ARJAWSKDSA-M cis-3-hexenylacetate Chemical compound CC\C=C/CCCC([O-])=O RRGOKSYVAZDNKR-ARJAWSKDSA-M 0.000 description 1
- 239000001111 citrus aurantium l. leaf oil Substances 0.000 description 1
- 239000001926 citrus aurantium l. subsp. bergamia wright et arn. oil Substances 0.000 description 1
- 239000001524 citrus aurantium oil Substances 0.000 description 1
- 239000001071 citrus reticulata blanco var. mandarin Substances 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000010636 coriander oil Substances 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N coumarin Chemical compound C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 229940019836 cyclamen aldehyde Drugs 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 239000002781 deodorant agent Substances 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- NYNCZOLNVTXTTP-UHFFFAOYSA-N ethyl 2-(1,3-dioxoisoindol-2-yl)acetate Chemical compound C1=CC=C2C(=O)N(CC(=O)OCC)C(=O)C2=C1 NYNCZOLNVTXTTP-UHFFFAOYSA-N 0.000 description 1
- CQHUPYQUERYPML-UHFFFAOYSA-N ethyl 2-ethyl-6,6-dimethylcyclohex-2-ene-1-carboxylate Chemical compound CCOC(=O)C1C(CC)=CCCC1(C)C CQHUPYQUERYPML-UHFFFAOYSA-N 0.000 description 1
- XYIBRDXRRQCHLP-UHFFFAOYSA-N ethyl acetoacetate Chemical compound CCOC(=O)CC(C)=O XYIBRDXRRQCHLP-UHFFFAOYSA-N 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- 239000001902 eugenia caryophyllata l. bud oil Substances 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 239000001148 ferula galbaniflua oil terpeneless Substances 0.000 description 1
- IFYYFLINQYPWGJ-VIFPVBQESA-N gamma-Decalactone Natural products CCCCCC[C@H]1CCC(=O)O1 IFYYFLINQYPWGJ-VIFPVBQESA-N 0.000 description 1
- WGPCZPLRVAWXPW-LLVKDONJSA-N gamma-Dodecalactone Natural products CCCCCCCC[C@@H]1CCC(=O)O1 WGPCZPLRVAWXPW-LLVKDONJSA-N 0.000 description 1
- 239000010648 geranium oil Substances 0.000 description 1
- 235000019717 geranium oil Nutrition 0.000 description 1
- HIGQPQRQIQDZMP-DHZHZOJOSA-N geranyl acetate Chemical compound CC(C)=CCC\C(C)=C\COC(C)=O HIGQPQRQIQDZMP-DHZHZOJOSA-N 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 239000010501 lemon oil Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000013521 mastic Substances 0.000 description 1
- 150000002773 monoterpene derivatives Chemical class 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229940067107 phenylethyl alcohol Drugs 0.000 description 1
- 239000001738 pogostemon cablin oil Substances 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 235000011056 potassium acetate Nutrition 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000010666 rose oil Substances 0.000 description 1
- 235000019719 rose oil Nutrition 0.000 description 1
- 239000010668 rosemary oil Substances 0.000 description 1
- 229940058206 rosemary oil Drugs 0.000 description 1
- 239000001691 salvia sclarea Substances 0.000 description 1
- 239000010671 sandalwood oil Substances 0.000 description 1
- 150000004354 sesquiterpene derivatives Chemical class 0.000 description 1
- 239000002453 shampoo Substances 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 238000006277 sulfonation reaction Methods 0.000 description 1
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 description 1
- NPFVOOAXDOBMCE-UHFFFAOYSA-N trans-3-hexenyl acetate Natural products CCC=CCCOC(C)=O NPFVOOAXDOBMCE-UHFFFAOYSA-N 0.000 description 1
- 230000017260 vegetative to reproductive phase transition of meristem Effects 0.000 description 1
- 239000010679 vetiver oil Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- ZFNVDHOSLNRHNN-UHFFFAOYSA-N xi-3-(4-Isopropylphenyl)-2-methylpropanal Chemical compound O=CC(C)CC1=CC=C(C(C)C)C=C1 ZFNVDHOSLNRHNN-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C11—ANIMAL OR VEGETABLE OILS, FATS, FATTY SUBSTANCES OR WAXES; FATTY ACIDS THEREFROM; DETERGENTS; CANDLES
- C11B—PRODUCING, e.g. BY PRESSING RAW MATERIALS OR BY EXTRACTION FROM WASTE MATERIALS, REFINING OR PRESERVING FATS, FATTY SUBSTANCES, e.g. LANOLIN, FATTY OILS OR WAXES; ESSENTIAL OILS; PERFUMES
- C11B9/00—Essential oils; Perfumes
- C11B9/0026—Essential oils; Perfumes compounds containing an alicyclic ring not condensed with another ring
- C11B9/003—Essential oils; Perfumes compounds containing an alicyclic ring not condensed with another ring the ring containing less than six carbon atoms
Definitions
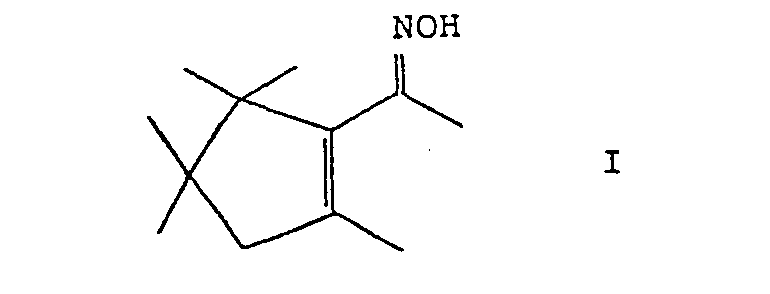
- the invention relates to a new fragrance. It is the 2- (1'-hydroximino-ethyl) -1,3,3,4,4-pentamethylcyclopentene, that is to say the compound of the formula
- Formula I is intended to encompass both geometric isomers, ie the syn and anti forms of oxime I.
- the invention further relates to a process for the preparation of the compounds I.
- This process is characterized in that 2- acetyl-1,3,3,4,4-pentamethylcyclopentene, ie the ketone of the formula reacted with hydroxylamine or one of its salts.
- reaction of the compound of formula II with hydroxylamine or a salt thereof can be carried out according to methods known per se, see e.g. Organics, basic organic chemistry internship, author collective; 7th edition; VEB German Publishing House of Sciences; Berlin 1967, 375, 555: the hydroxylamine is conveniently left in the form of a salt, e.g. react as hydrochloride or sulfate, in the presence of a base such as pyridine, sodium acetate, potassium acetate, etc., preferably in alcoholic solution with the ketone I; the reaction temperature is preferably the reflux temperature of the reaction mixture.
- a salt e.g. react as hydrochloride or sulfate
- a base such as pyridine, sodium acetate, potassium acetate, etc.
- the reaction temperature is preferably the reflux temperature of the reaction mixture.
- the processing is expediently carried out according to methods known per se: distilling off most of the alcohol, adding an organic solvent, washing with water and finally removing the unreacted ketone.
- the A usgangsketon II is known: for example, describes M. Kolobielski in Ann. Chim. 10, No. 12, (1955), 271 seq.
- the reductive dimerization of mesityl oxide with magnesium in acetic acid which results in a mixture consisting of 2-acetyl-l, 3,3,4,4-pentamethylcyclopentanol II 'as the main component and smaller amounts of 2-acetyl-1,3,3,4,4-pentamethylcyclopentene (II), 3,5-dimethyl-3 - (2'-methyl-1'-propene-1'- yl) -4-hexen-2-one or 2,4,6-trimethyl-4-acetyl-2,5-heptadiene (IIb), 2,3,3,5-tetramethyl-2-isobutenyl-2, 3-dihydrofuran (II ") and 2,4,5,7-tetramethyl-2,6-octadiene-4,5-diol (II"')
- a II-rich product can now easily be obtained by treating the product mixture mentioned with a base, such as aqueous sodium hydroxide solution, and working up the acidified reaction mixture.
- a base such as aqueous sodium hydroxide solution
- the remaining after distilling off the more volatile compounds of product now includes, for example, 67% I I addition to the acyclic ketones IIb (about 15%), IIc (about 7%) and IId (about 8%)
- the compound I or the oxime mixture described above, has special organoleptic properties which make it particularly suitable as a fragrance.
- the invention accordingly also relates to the use of the compound I or its mixture with the above acyclic oximes Ib-Id as a fragrance.
- the oxime or oxime mixture according to the invention is distinguished by a special combination of valuable properties. It is colorless, easily accessible, the individual approaches are constant in smell, not irritating, stable and easy to use.
- the compound of formula I has in particular the characteristic smell aspect of the fresh flowers of Salvia sclarea (clary sage), this smell is accompanied by herbaceous nuances.
- organoleptic properties of I are therefore completely different from the organoleptic properties of this known oxime.
- Another important and typical property of the new oxime I according to the invention is its high integration capacity in the creation of perfume compositions.
- the new oxime I develops its full effect particularly in the medium to volatile range of composition by enriching, harmonizing or harmonizing the desired odor complexes modified and fixed the same excellent.
- compositions produced with I can be used for all types of perfumed consumer goods (Eaux de Cologne, Eaux de Toilette, extras, lotions, creams, shampoos, soaps, ointments, powders, deodorants, detergents, tobacco, etc.).
- the content of I in (new) perfumery bases can easily be up to 80% and in the perfumery compositions thus produced, up to 20-30% of this base can be used without problems to achieve the desired effects.
- the experienced perfumer can achieve interesting odor nuances with concentrations of 0.1 - 0.5%, so that the concentrations used cover a fairly large range.
- compositions made with I can be used for all types of perfumed consumer goods.
- the compounds I can accordingly be used in the production of compositions and - as the above compilation shows - using a wide range of known fragrances.
- the known fragrances listed above can be used in a manner known to the perfumer, e.g. from W.A. Poucher, Perfumes, Cosmetics and Soaps 2, 7th edition, Chapman and Hall, London, 1974.
- the oxime product mixture thus obtained is separated into the individual constituents by column chromatography on a 100-fold amount of silica gel using hexane / ether 10: 1 as the eluent.
- the "new compound I" is always understood to mean a mixture of I in combination with the acyclic oximes, as is the case, for example, is accessible according to example 1.
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Wood Science & Technology (AREA)
- Organic Chemistry (AREA)
- Fats And Perfumes (AREA)
- Medicinal Preparation (AREA)
- Detergent Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
-
- Die Formel I soll beide geometrischen Isomeren, also die syn- und die anti-Form des Oxims I umfassen.
- Die Erfindung betrifft ferner ein Verfahren zur Herstellung der Verbindungen I.
-
- Die Umsetzung der Verbindung der Formel II mit Hydroxylamin bzw. einem Salz davon kann nach an sich bekannten Methoden durchgeführt werden, siehe z.B. Organikum, Organisch-chemisches Grundpraktikum, Autorenkollektiv; 7. Auflage; VEB Deutscher Verlag der Wissenschaften; Berlin 1967, 375, 555: Man lässt das Hydroxylamin, zweckmässigerweise als Salz, z.B. als Hydrochlorid oder Sulfat, in Gegenwart einer Base wie Pyridin, Natriumacetat, Kaliumacetat, etc.,vorzugsweise in alkoholischer Lösung mit dem Keton I reagieren; die Reaktionstemperatur ist dabei vorzugsweise die Rückflusstemperatur des Reaktionsgemisches.
- Die Aufarbeitung erfolgt zweckmässigerweise nach an sich bekannten Methoden: Abdestillieren des grössten Teiles des Alkohols, Zugabe eines organischen Lösungsmittels, Waschen mit Wasser und schliesslich Entfernen des nicht umgesetzten Ketones.
- Das Ausgangsketon II ist bekannt: So beschreibt beispielsweise M. Kolobielski in Ann. Chim. 10, Nr. 12, (1955), 271 seq. die reduktive Dimerisierung von Mesityloxyd mit Magnesium in Essigsäure, die zu einem Gemisch bestehend aus 2-Acetyl-l,3,3,4,4-pentamethylcyclopentanol II' als Hauptkomponente und kleineren Mengen 2-Acetyl--1,3,3,4,4-pentamethylcyclopenten (II), 3,5-Dimethyl-3--(2'-methyl-1'-propen-1'-yl)-4-hexen-2-on bzw. 2,4,6-Trimethyl-4-acetyl-2,5-heptadien (IIb), 2,3,3,5-Tetramethyl--2-isobutenyl-2,3-dihydrofuran (II") und 2,4,5,7-Tetramethyl-2,6-octadien-4,5-diol (II"') führt:
- Ein II-reiches Produkt kann nun leicht durch Behandlung des genannten Produktgemisches mit einer Base, wie wässriger Natronlauge,und Aufarbeitung des angesäuerten Reaktionsgemisches erhalten werden. Das nach Abdestillieren der leichterflüchtigen Verbindungen zurückbleibende Produkt enthält nun beispielsweise 67% II neben den acyclischen Ketonen IIb (ca. 15 %), IIc (ca. 7%) und IId (ca. 8%)
- Durch Dehydratisierung wurde dabei II' in II übergeführt.
- II kann aus diesem Produktgemisch gegebenenfalls durch Säulenchromatographie in reiner Form, oder aber durch Destillation in stark angereicherter Form gewonnen werden und gemäss erfindungsgemässem Verfahren zu I umgesetzt werden. Dies ist aber nicht nötig, da die bei der erfindungsgemässen Oximierung von II sich ebenfalls bildenden acyclischen Oxime Ib - Id
- Die verbindung I, bzw. das oben beschriebene Oximgemisch weist besondere organoleptische Eigenschaften auf, auf Grund derer es sich vorzüglich als Riechstoff eignet.
- Die Erfindung betrifft demgemäss auch die Verwendung der Verbindung I, bzw. dessen Gemisch mit den obigen acyclischen Oximen Ib - Id als Riechstoff.
- Das erfindungsgemässe Oxim bzw. Oximgemisch zeichnet sich durch eine besondere Kombination von wertvollen Eigenschaften aus. Es ist farblos, leicht zugänglich, die einzelnen Ansätze sind konstant im Geruch, nicht irritierend, stabil und bequem in der Handhabung.
- Die Verbindung der Formel I weist insbesondere den charakteristischen Geruchsaspekt der frischen Blüten von Salvia sclarea (Muskatellersalbei) auf, dieser Geruch ist begleitet von krautigen Nuancen.
- Die Geruchsnoten der acyclischen Oxime sind:
- Ib: holzig-ambrig,
- Ic: krautig mit den typischen Aspekten von Rhabarber- und Tomatenblättern,
- Id: süss, anis-artig, Aspekte von Basilikum und Grapefruit.
- Geruch des Gemisches von I mit den acyclischen Oximen im angegebenen, d.h. bei der Herstellung anfallenden Verhältnis:
- Harmonische Kombination der oben aufgeführten Geruchsaspekte, wobei die charakteristische, an blühenden Muskatellersalbei erinnernde Note eindeutig dominiert.
- Es sind zwar eine Reihe von Oximen mit interessanten organoleptischen Eigenschaften bekannt geworden, ein organoleptisch aktives, cycloaliphatisches Oxim wird jedoch nur in DT-OS 3,129,934 (Dragoco) beschrieben. Der Geruch dieses bekannten 1,5-Dimethyl-8-hydroximino-bicyclo [3.2.1]octans, also einer Verbindung mit einer Oximgruppierung direkt an einem Ring-Kohlenstoffatom, ist der von schwarzen Johannisbeeren.
- Die organoleptischen Eigenschaften von I sind demgemäss völlig verschieden von den organoleptischen Eigenschaften dieses bekannten Oxims.
- Eine weitere wichtige und typische Eigenschaft des erfindungsgemässen neuen Oxims I besteht in seinem hohen Integrationsvermögen bei der Kreation von Parfümkompositionen. Im Gegensatz zur Mehrzahl der vorbekannten Oxime, die entsprechend ihrer olfaktischen Charakteristik insbesondere zur Modifikation der "Kopfnoten" von Kompositionen eingesetzt wurden, entfaltet das neue Oxim I seine volle Wirkung besonders im mittelflüchtigen bis schwerflüchtigen Bereich der Komposition, indem es gewünschte Geruchskomplexe bereichert, harmonisiert bzw. modifiziert und dieselben ausgezeichnet fixiert.
- Das neue Oxim I bzw. dessen Gemisch eignet sich aufgrund seiner olfaktischen Eigenschaften, seines hohen Integrationsvermögens und seiner fixierenden Eigenschaften insbesondere zur Modifizierung von
- - blumigen Kompositionen,
- z.B. vom Typ "Weisse Blumen" (wie Maiglöckchen, Geissblatt, etc.), indem hier die olfaktischen Aspekte von Monoterpenderivaten wie Linalool und Citronellol mit denjenigen der Sesquiterpenderivate wie Nerolidol und Farnesol harmonisierend miteinander in Einklang gebracht werden und so diesem Geruchsaspekt zusätzlich mehr Ausstrahlungskraft verliehen wird,
- vom.Typ "Exotische Blumen" (wie Champaca, Osmanthus, etc.), indem der Komposition durch Unterstreichung der frisch-blumigen Aspekte mehr Diffusion und Transparenz verliehen wird.
- - Kompositionen des Cologne-Typs, indem hier die Effekte der verschiedenen Agrumen-Oele in harmonischen Einklang gebracht werden und ein eleganter Uebergang zu den Holznoten in Erscheinung tritt.
- - Kompositionen mit ausgeprägter Holznote, wo ein homogener Uebergang von den leichterflüchtigen zu den schwererflüchtigen Bestandteilen bewirkt wird, und die entstandene Komposition durch die dem Oxim I eigenen olfaktischen Eigenschaften erheblich an Eleganz gewinnt.
- Die Verbindung I verbindet sich mit zahlreichen bekannten Riechstoffingredienzien natürlichen oder synthetischen Ursprungs, wobei die Palette der natürlichen Rohstoffe sowohl leicht-, als auch mittel- und schwerflüchtige Komponenten, und diejenige der Synthetika Vertreter aus praktisch allen Stoffklassen umfassen kann, wie dies aus der folgenden Zusammenstellung ersichtlich ist:
- - Naturprodukte, wie Angelikasamenöl, Baummoos-Absolue, Basilikumöl, Beifussöl, Bergamotteöl, Castoreum, acety- liertes Cedernholzöl (z.B. Vertofix® IFF bzw. Cedartone ® Givaudan), Corianderöl, Eichenmoos, Elemiöl, Galbanum- öl, Geraniumöl, Jasmin Absolue und seine Substitute, Kamillenöl, Lavandinöl, Lavendelöl, Mandarinenöl, Mastix Absolue, Nelkenknospenöl, Neroliöl. Patchouliöl, Petitgrainöl Paraguay, Rosenöl, Rosmarinöl, Sandelholzöl, Styrax, Vetiveröl, Wermutöl, Ylang-Ylang-Oel, Ysopoel, Zibetöl, Zitronenöl.
- - Alkohole, wie Citronellol, Dimethylbenzylcarbinol, Dimetol® Giv. (2,6-Dimethyl-2-heptanol), Geraniol, Linalool, Menthol, 3-Methyl-5- (2',2',3'-trimethyl-cyclo- pent-3'-en-1'-yl)-pentan-2-ol (Sandalore® Givaudan), Nerol, Phenyläthylalkohol, Phenylpropylalkohol, natürliches Rhodinol, α-Terpineol, Zimtalkohol, Farnesol.
- - Aldehyde, wie a-Amylzimtaldehyd, Citral, Cyclamenaldehyd, Decanal, 3,5-Dimethyl-cyclohex-3-en-carboxalde- hyd, n-Dodecanal, Heliotropin, a-Hexylzimtaldehyd, Hydroxycitronellal, Methylnonylacetaldehyd, p-tert. Butyl-a-methyldihydrozimtaldehyd (z.B. Lilial® Givaudan). n-Undecen-10-al.
- - Ester, wie Aethylacetoacetat, 3-Aethyl-1,1-dimethyl- cyclohex-3-en-2-carbonsäureäthylester(Givescone® Givaudan), 3-Aethyl-1,1,4-trimethyl-cyclohex-3-en-2-carbon- säureäthylester (Myrascone® Givaudan), Amylsalicylat, Benzylacetat, Benzylsalicylat, Bornylacetat, Cedrylacetat, Cinnamylformiat, cis-3-Hexenylacetat, cis-3-Hexenylben- zoat, Geranylacetat, Hexylsalicylat, Isobutylsalicylat, Linalylacetat, Linalylanthranilat, Methyldihydrojasmonat, 4-[4-Methyl-3-pentenyl]-cyclohex-3-en-1-yl-carbinylacetat (z.B. Myraldylacetat® Givaudan), Oxyoctalinformiat Givaudan (Δ1-1,5,9,10-Tetramethyl-5-formoxy-octalin), Phenyläthylacetat, Styrallylacetat, Terpenylacetat, p-tert.-Butylcyclohexylacetat, Benzylbenzoat.
- - Lactone, wie Cumarin, γ-Decalacton. γ-Dodecalacton, y-Nonalacton, y-Undecalacton.
- - verschiedene weitere, in der Parfümerie oft benützten Komponenten, wie Acetaldehyd-propyl-phenyläthylacetal (Acetal® Givaudan), Cyclocitrylidenacetonitril, 1,1-Dimethyl-4-acetyl-6-tert.-butylindan, Eugenol, Galaxolid® IFF, 7-Acetyl-1,1,3,4,4,6-hexamethyltetralin (Fixolide® Givaudan), Indol, Isobutylchinolin, p-Menthan-8-thiol-3--on, Methyleugenol, Methyl-1-methyl-cyclododecyläther (z.B. Madrox® Givaudan), 8,12-Oxido-13,14,15,16-tetra- norlabdan (Fixateur 404®, Ambroxan®).
- Die mit I hergestellten Kompositionen lassen sich für alle Arten von parfümierten Verbrauchsgütern einsetzen (Eaux de Cologne, Eaux de Toilette, Extraits, Lotionen, Cremes, Shampoos, Seifen, Salben, Puder, Desodorantien, Detergentien, Tabak, etc.).
- Dank seines erstaunlich hohen Integrationsvermögens kann der Gehalt an I in (neuartigen) Parfümeriebasen ohne weiteres bis zu 80% betragen und in den damit hergestellten Parfümerie-Kompositionen können hierauf zur Erzielung gewünschter Effekte problemlos bis zu 20-30% dieser Base eingesetzt werden.
- Andererseits kann aber der erfahrene Parfümeur bereits mit Konzentrationen von 0.1 - 0,5% interessante Geruchsnuancierungen erzielen, sodass die zum Einsatz kommenden Konzentrationen einen recht grossen Bereich abdecken.
- Die bevorzugten Konzentrationen bewegen sich üblicherweise zwischen 0,05 und 10%. Die mit I hergestellten Kompositionen lassen sich, wie oben gesagt, für alle Arten von parfümierten Verbrauchsgütern einsetzen.
- Die Verbindungen I können demgemäss bei der Herstellung von Kompositionen und - wie obige Zusammenstellung zeigt - unter Verwendung einer breiten Palette bekannter Riechstoffe, verwendet werden. Bei der Herstellung solcher Kompositionen können die oben aufgeführten bekannten Riechstoffe nach (dem Parfümeur bekannter) Art und Weise verwendet werden, wie z.B. aus W.A. Poucher, Perfumes, Cosmetics and Soaps 2, 7. Auflage, Chapman und Hall, London, 1974 hervorgehend.
- In einem mit Rührer, Thermometer und Kühler versehenen 5-Liter-Sulfierkolben werden 250 g Hydroxylaminchlorhydrat in 2,5 1 Aethanol und 250 g Pyridin gelöst. Man rührt eine Viertelstunde bei Raumtemperatur und gibt zu der Lösung 250 g eines Ketongemisches II, IIb, IIc, IId. Man hält das Reaktionsgemisch während 2 Stunden bei Rückflusstemperatur und entfernt dann ca. 3/4 des eingesetzten Aethanols durch Destillation. Nach dem Abkühlen giesst man auf Eiswasser und extrahiert das Produkt mit Aether. Die Aetherphase wird 3 mal mit verdünnter Salzsäure und 3 mal mit Kochsalzlösung gewaschen und mit Natriumsulfat getrocknet. Die Destillation des nach Abdampfen des Aethers erhaltenen Rohproduktes über eine 30 cm-Widmer-Kolonne ergibt 168 g olfaktisch gutes Oximgemisch vom Siedepunkt 100-101°/0,06 mmHg, welches rund 67% I, 15% Ib, 7% Ic und 8% Id enthält.
- Zur Charakterisierung der Verbindungen I, Ib, Ic und Id wird das so erhaltene Oxim-Produktgemisch durch Säulenchromatographie an der 100fachen Menge Kieselgel unter Verwendung von Hexan/Aether 10:1 als Elutionsmittel in die einzelnen Bestandteile aufgetrennt.
- I: 2-(1'-Hydroximino-äthyl)-1,3,3,4,4-pentamethylcyclo- penten
- IR(CHCl3): 3580, 3230, 980, 890, 870 cm-1
- 1H-NMR (400 MHz): 0,90 und 0,92 (je 2 zusammenfallende s, 2 CH3-C(3) und 2CH3-C(4)); 1,65 (s, CH3-C(1)); 1,98 (s, CH3-C(1')); 2,08 (s, 2H-C(5)).
- MS: 195 (M+, 20), 180 (100), 162 (13), 148 (23), 138 (11), 122 (19), 107 (9), 95 (11), 91 (14), 79 (10), 67 (7), 55 (15), 41 (43).
- Ib: 3,5-Dimethyl-3-(2'-methyl-propen-1'-yl)-4-hexen-2-on oxim
- IR: 3260, 1655, 1060, 1000, 940, 910, 835 cm-1
- 1H-NMR(400 MHz): 1,37 (s, 3H); 1,59 und 1,70 (je 2s mit Feinaufspaltung, je 6H); 1,81 (s, 3H); 5,40 (2 zusammenfallende s mit Feinaufspaltung, 2H).
- MS: 195 (M+, 5), 178 (100), 163 (28), 148 (41), 136 (11), 122 (54), 107 (27), 95 (34), 91 (28), 79 - (21), 67 (25), 55 (40), 41 (83).
- Ic: 5-Methylen-4,4,7-trimethyl-6-octen-2-on oxim
- IR: 3230, 1655, 1618, 1125, 1062, 1028, 965, 900 cm-1
- 'H-NMR(400 MHz): 1,08 (2 zusammenfallende s, 6H); 1,73 und 1,80 (je s mit Feinaufspaltung, je 3H); 1,74 (s. 3H); 2,28 (s, 2H); 4,80 und 5,05 (je s mit Feinaufspaltung, je 1H); 5,83 (s mit Feinaufspaltung, 1H); 8,0-8,5 (breites Signal des Oxim-Protons).
- MS: 195 (M+, 7); 180 (18), 178 (35), 162 (4), 152 (8), 139 (14), 122 (47), 110 (51), 107 (26), 95 (37), 91 (22), 81 (100), 69 (41), 67 (41), 59 (36), 55 (32). 41 (8).
- Id: 4,4,5,7-Tetramethyl-5,7-octadien-2-on oxim.
- IR: 3220, 1630, 1120, 1038, 965, 890 cm-1.
- 1H-NMR(400 MHz): 1,10 (2 zusammenfallende s, 6H); 1,79 und 1,82 (je s mit Feinaufspaltung, je 3H); 1,80 (s, 3H); 2,30 (s, 2H); 4,72 und 4,98 (je s mit Feinaufspaltung, je 1H); 5,66 (s, 1H); ca. 8,0-8,5 (breites Signal des Oxim-Protons).
- MS: 195 (M+, 1); 180 (7), 139 (24), 138 (24), 123 (63), 122 (96), 107 (19), 95 (29), 91 (22), 81 (100), 67 (30), 55 (7), 41 (56).
- 200 g durch reduktive Dimerisierung von Mesityloxid erhaltenes Produktgemisch (vgl. M. Kolobielski, Ann. Chim. 10, (1955), 271 seq., insbesondere 291) werden in 300 ml Methanol gelöst, mit 10 ml 40%-iger Natronlauge versetzt und das Gemisch hierauf während einer Stunde bei Rückflusstemperatur gerührt. Anschliessend wird auf 0-10°C abgekühlt, vorsichtig mit verdünnter Schwefelsäure angesäuert und während 30 Minuten bei Raumtemperatur gerührt. Nach üblicher Aufarbeitung verbleiben 150 g Rohprodukt, aus denen durch Destillation über eine 20 cm Widmerkolonne 60 g Ketongemisch, bestehend aus II (ca. 67%), IIb (ca. 15%), IIc (ca. 7%) und IId (ca. 8%) gewonnen werden.
- In den folgenden Beispielen 2 und 3 wird unter der "neuen Verbindung I" immer ein Gemisch von I in Kombination mit den acyclischen Oximen verstanden, wie dies z.B. gemäss Beispiel 1 zugänglich ist.
-
- Durch Zugabe von 50 Teilen der neuen Verbindung I gewinnt diese blumige, an Maiglöckchen erinnernde Komposition erheblich an Ausstrahlungskraft, indem nun die Rhodinolnote in der Komposition sehr vorteilhaft unterstrichen und in harmonischen Einklang mit den schwerer flüchtigen Bestandteilen ist. Ein sehr natürlich wirkender Frischeaspekt verleiht der Komposition zudem den Eindruck von taufrischen Blumen. Diese äusserst positiven Aspekte können sogar noch in der Fondnote der Komposition festgestellt werden. Durch Zugabe von 100 Teilen der neuen Verbindungen wird die Komposition in ähnlicher Richtung modifiziert, wobei nun aber in der Fondnote zusätzlich ein elegant-wirkender, holziger und an Muskatellersalbei erinnernder Aspekt verstärkt in Erscheinung tritt.
-
- Ein Zusatz von 50 Teilen der neuen Verbindung I wirkt sich hier ausserordentlich positiv auf die Kopfnote aus, indem die verschiedenen vorhandenen Agrumenöle eine Harmonisierung erfahren, die als ideal bezeichnet werden kann. Zudem gewinnt der in der Fondnote auftretende Holzaspekt bedeutend an Eleganz und Ausstrahlungskraft. Ferner tritt in der Kopf- und in der Fondnote eine amber-artige und an Muskatellersalbei erinnernde Note in Erscheinung. Aehnliche Effekte werden bereits durch Zugabe von 20 Teilen der neuen Verbindung I bewirkt.
Claims (7)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH397485 | 1985-09-13 | ||
| CH3974/85 | 1985-09-13 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP0214588A2 true EP0214588A2 (de) | 1987-03-18 |
| EP0214588A3 EP0214588A3 (en) | 1988-02-03 |
| EP0214588B1 EP0214588B1 (de) | 1990-09-26 |
Family
ID=4267438
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP86112050A Expired - Lifetime EP0214588B1 (de) | 1985-09-13 | 1986-09-01 | Cyklisches Oxim |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US4678604A (de) |
| EP (1) | EP0214588B1 (de) |
| JP (1) | JPS6267060A (de) |
| DE (1) | DE3674517D1 (de) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993013054A1 (en) * | 1991-12-20 | 1993-07-08 | Union Camp Corporation | Nitrile and aldoxime indane compounds, their use as perfume |
| EP0672746A1 (de) * | 1994-03-18 | 1995-09-20 | Givaudan-Roure (International) S.A. | Oximäther und sie enthaltenden Riech- und Geschmackstoffkompositionen |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR112020007380B1 (pt) * | 2017-10-17 | 2023-12-19 | S H Kelkar & Company Limited | Composição compreendendo odorantes, oximas úteis em tais composições, mistura de compostos de oximas e processo de preparação das referidas oximas |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1205534B (de) * | 1962-04-11 | 1965-11-25 | Edison Soc | Verfahren zur Herstellung von Cycloalkanonoximen mit 5 bis 12 Ring-kohlenstoffatomen |
| CH644757A5 (de) * | 1978-08-21 | 1984-08-31 | Givaudan & Cie Sa | Riechstoffkompositionen. |
| EP0045861B1 (de) * | 1980-08-08 | 1984-10-03 | L. GIVAUDAN & CIE Société Anonyme | Neue ungesättigte Verbindungen, (I), Verfahren zu deren Herstellung, Verwendung von I als Riechstoffe sowie Riechstoffkompositionen mit einem Gehalt an I |
| DE3129934C2 (de) * | 1981-07-29 | 1983-09-15 | Dragoco Gerberding & Co Gmbh, 3450 Holzminden | Verwendung von 1,5-Dymethyl-8-hydroximino-bicyclo[3.2.1]octan als Riech- und Aromastoff |
| DE3361874D1 (en) * | 1982-02-03 | 1986-03-06 | Givaudan & Cie Sa | Unsaturated oximes, preparation thereof and use thereof as perfume and in the fragment compositions |
-
1986
- 1986-08-26 US US06/900,555 patent/US4678604A/en not_active Expired - Fee Related
- 1986-09-01 EP EP86112050A patent/EP0214588B1/de not_active Expired - Lifetime
- 1986-09-01 DE DE8686112050T patent/DE3674517D1/de not_active Expired - Lifetime
- 1986-09-12 JP JP61214253A patent/JPS6267060A/ja active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993013054A1 (en) * | 1991-12-20 | 1993-07-08 | Union Camp Corporation | Nitrile and aldoxime indane compounds, their use as perfume |
| EP0672746A1 (de) * | 1994-03-18 | 1995-09-20 | Givaudan-Roure (International) S.A. | Oximäther und sie enthaltenden Riech- und Geschmackstoffkompositionen |
Also Published As
| Publication number | Publication date |
|---|---|
| JPS6267060A (ja) | 1987-03-26 |
| US4678604A (en) | 1987-07-07 |
| DE3674517D1 (de) | 1990-10-31 |
| EP0214588B1 (de) | 1990-09-26 |
| EP0214588A3 (en) | 1988-02-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE60224180T2 (de) | Cycloalkancarbonsäurederivate als duftstoffe mit moschuscharakter | |
| DE69527045T2 (de) | Tetrahydrofurane und tetrahydropyrane | |
| DE2910579C2 (de) | ||
| EP0137419B1 (de) | Riechstoffkompositionen mit einem Gehalt an Benzyläthern | |
| DE918747C (de) | Verfahren zur Herstellung von kuenstlichen Moschusriechstoffen aus m- und p-Cymol | |
| EP0085352B1 (de) | Ungesättigte Oxime(I) und Verfahren zu deren Herstellung, Verwendung von (I) als Riechstoffe sowie Riechstoffkompositionen mit einem Gehalt an (I) | |
| EP0301375B1 (de) | Bicyclische Aldehyde | |
| EP0612840B1 (de) | Cyclische Verbindungen und ihre Anwendung als Riechstoffe | |
| CH626805A5 (de) | ||
| CH621105A5 (de) | ||
| EP0045861B1 (de) | Neue ungesättigte Verbindungen, (I), Verfahren zu deren Herstellung, Verwendung von I als Riechstoffe sowie Riechstoffkompositionen mit einem Gehalt an I | |
| DE69026082T2 (de) | Polyalkylierte benzodioxin-muskus-zusammensetzungen | |
| DE2812288C2 (de) | ||
| DE2756772C2 (de) | ||
| EP0191365B1 (de) | Araliphatische Oxime, Verfahren zu deren Herstellung und Riechstoffkompositionen mit einem Gehalt an solchen Verbindungen | |
| EP0983989A1 (de) | Methylcyclotetradec-5-en-1-one | |
| EP0086945B1 (de) | Neue Alkenole(I), Verfahren zu deren Herstellung, Verwendung von (I) als Riechstoffe und Riechstoffkompositionen mit einem Gehalt an (I) | |
| EP0214588B1 (de) | Cyklisches Oxim | |
| EP0002510A1 (de) | Cyclohexane, Verfahren zu deren Herstellung, deren Verwendung und diese enthaltende Kompositionen | |
| EP0684299A2 (de) | Dihydrofarnesal | |
| EP0093425B1 (de) | Ungesättigte, cyclische Ketone | |
| DE2622611C2 (de) | Riechstoffgemische, Verfahren zu deren Herstellung und ihre Verwendung als Riechstoffe | |
| DE69604821T2 (de) | Parfümgrundzusammenstellung | |
| DE2938979C2 (de) | Parfümkomposition, die 3-Phenyl-cyclohex-2-en-1-on enthält | |
| EP1476527B1 (de) | Verwendung von hexenal-derivaten als riechstoffe |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19860901 |
|
| AK | Designated contracting states |
Kind code of ref document: A2 Designated state(s): CH DE FR GB LI NL |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): CH DE FR GB LI NL |
|
| 17Q | First examination report despatched |
Effective date: 19890921 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): CH DE FR GB LI NL |
|
| REF | Corresponds to: |
Ref document number: 3674517 Country of ref document: DE Date of ref document: 19901031 |
|
| GBT | Gb: translation of ep patent filed (gb section 77(6)(a)/1977) | ||
| ET | Fr: translation filed | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PFA Free format text: GIVAUDAN-ROURE (INTERNATIONAL) S.A., VERNIER-GENEVE |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: CD |
|
| NLT1 | Nl: modifications of names registered in virtue of documents presented to the patent office pursuant to art. 16 a, paragraph 1 |
Owner name: GIVAUDAN-ROURE (INTERNATIONAL) S.A. TE VERNIER-GEN |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 19940817 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19940914 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19940915 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19940919 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19940930 Year of fee payment: 9 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19950901 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Effective date: 19950930 Ref country code: CH Effective date: 19950930 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19960401 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee |
Effective date: 19950901 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Effective date: 19960531 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19960601 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee |
Effective date: 19960401 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |