EP0135897A2 - 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloro-methylcyclopropanmethanol - Google Patents
2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloro-methylcyclopropanmethanol Download PDFInfo
- Publication number
- EP0135897A2 EP0135897A2 EP84110981A EP84110981A EP0135897A2 EP 0135897 A2 EP0135897 A2 EP 0135897A2 EP 84110981 A EP84110981 A EP 84110981A EP 84110981 A EP84110981 A EP 84110981A EP 0135897 A2 EP0135897 A2 EP 0135897A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- methyl
- trans
- dichloro
- cis
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C31/00—Saturated compounds having hydroxy or O-metal groups bound to acyclic carbon atoms
- C07C31/34—Halogenated alcohols
- C07C31/44—Halogenated alcohols containing saturated rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C31/00—Saturated compounds having hydroxy or O-metal groups bound to acyclic carbon atoms
- C07C31/13—Monohydroxylic alcohols containing saturated rings
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N31/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic oxygen or sulfur compounds
- A01N31/04—Oxygen or sulfur attached to an aliphatic side-chain of a carbocyclic ring system
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/02—Saturated carboxylic acids or thio analogues thereof; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C29/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring
- C07C29/09—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrolysis
- C07C29/095—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom not belonging to a six-membered aromatic ring by hydrolysis of esters of organic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2601/00—Systems containing only non-condensed rings
- C07C2601/02—Systems containing only non-condensed rings with a three-membered ring
Definitions
- the present invention relates to 2,2-dichloro (cis) -3-methyl- (trans) -3-chloromethylcyclopropanemethanol, a new compound used as a fungicide for agriculture and horticulture or as an intermediate for the synthesis of other cyclopropane derivatives and other compounds is valuable, as well as a method for producing this compound.
- the invention relates to 2,2-dichloro (cis) -3-methyl- (trans) -3-chloromethylcyclopropanemethanol of the formula (I) below
- the compound of formula (I) according to the present invention can be prepared, for example, by the following method, to which the invention also extends.
- a process for producing 2,2-dichloro (cis) -3-methyl- (trans) -3-chloromethylcyclopropanemethanol involves the reaction of a compound of formula (II) below with an alkali metal hydroxide.
- the aim of the present invention is to make 2,2-dichloro (cis) -3-methyl- (trans) -3-chloromethyl-cyclopropanemethanol, a new compound, and a process for its preparation available.
- the compound according to the present invention can be produced, for example, by the following method.
- M represents an alkali metal atom such as sodium or potassium.
- Invention can be carried out using a solvent or diluent. All inert solvents and diluents can be used for this purpose.
- solvents or diluents examples include water; aliphatic, alicyclic and aromatic hydrocarbons (optionally chlorinated) such as hexane, cyclohexane, petroleum ether, ligroin, benzene, toluene, xylene, methylene chloride, chloroform, carbon tetrachloride, ethylene chloride, trichloroethylene and chlorobenzene; Ethers such as diethyl ether, methyl ethyl ether, diisopropyl ether, dibutyl ether, propylene oxide, dioxane and tetrahydrofuran; Ketones such as acetone, methyl ethyl ketone, methyl isopropyl ketone and methyl isobutyl ketone; Nitriles such as acetonitrile, propionitrile and acrylonitrile; Alcohols such as methanol, ethanol, isopropanol
- the above reaction can be carried out in the presence of an acid-binding agent.
- the acid-binding agent include the hydroxides, carbonates, hydrogen carbonates and alcoholates of alkali metals which are generally used, and tertiary amines such as triethylamine, diethylaniline and pyridine.
- the method according to the present invention can be carried out in a wide temperature range. Generally, it can be at a temperature between about -20 ° C and the boiling point of the mixture, preferably between about 0 ° C and about 100 ° C.
- the reaction is expediently carried out under atmospheric pressure, but it is also possible to work under increased or reduced pressure.
- the active compound, carrier and emulsifier were pulverized and mixed together in the amounts indicated, thereby forming a wettable powder.
- a predetermined amount of the wettable powder was diluted with water, whereby a test preparation was prepared.
- Rice plants (variety: Asahi) were cultivated in flooded porcelain pots with a diameter of 12 cm, three seedlings per pot. In the morning At the stage of the expulsion of the rice plants, the test compound, which had been brought to a predetermined concentration as above, was applied in the indicated dosages to the water surface using a pipette, so that it did not come into direct contact with the above-ground parts of the rice plants.
- a suspension of spores of the Brusone mushroom Pierularia oryzae
- the plants were kept in an incubator at 23-25 ° C. and a relative atmospheric humidity of 100% for 24 h. They were then transferred to a glass greenhouse kept at 20-28 ° C. The plants were examined seven days after the inoculation and evaluated on the following evaluation scale. The control index (%) was calculated.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Agronomy & Crop Science (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Dentistry (AREA)
- General Health & Medical Sciences (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
Description
- Die vorliegende Erfindung betrifft 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmethanol, eine neue Verbindung, die als Fungizid für Landwirtschaft und Gartenbau oder als Zwischenstufe für die Synthese anderer Cyclopropan-Derivate und anderer Verbindungen wertvoll ist, sowie ein Verfahren zur Herstellung dieser Verbindung.
-
- Die Verbindung der Formel (I) gemäß der vorliegenden Erfindung kann beispielsweise mit Hilfe des folgenden Verfahrens hergestellt werden, auf das sich die Erfindung ebenfalls erstreckt.
-
- Untersuchungen seitens der Anmelderin haben ergeben, daß das vorstehende, in der bekannten Literatur nicht beschriebene 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmethanol synthetisiert werden kann und daß diese Verbindung als Zwischenprodukt für die Herstellung neuer Verbindungen mit biologischer Aktivität als Agrochemikalien, insbesondere beispielsweise einer Aktivität in bezug auf die Bekämpfung der Brusone-Krankheit von Reis, wie des 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmethanol- chloroacetats wertvoll ist.
- Weiterhin wurde gefunden, daß die Verbindung selbst eine hervorragende Bekämpfungswirkung gegen die Brusone-Krankheit von Reis zeigt.
- Dementsprechend ist es Ziel der vorliegenden Erfindung, 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethyl- cyclopropanmethanol, eine neue Verbindung, sowie ein Verfahren zu seiner Herstellung verfügbar zu machen.
-
- In dem vorstehenden Reaktionsschema steht M für ein Alkalimetall-Atom, beispielsweise Natrium oder Kalium.
-
- Erfindung unter Verwendung eines Lösungsmittels oder Verdünnungsmittels durchgeführt werden. Zu diesem Zweck können sämtliche inerten Lösungsmittel und Verdünnungsmittel verwendet werden.
- Zu Beispielen für solche Lösungsmittel oder Verdünnungsmittel zählen Wasser; aliphatische, alicyclische und aromatische Kohlenwasserstoffe (ggf. chloriert) wie Hexan, Cyclohexan, Petrolether, Ligroin, Benzol, Toluol, Xylol, Methylenchlorid, Chloroform, Kohlenstofftetrachlorid, Ethylenchlorid, Trichloroethylen und Chlorbenzol; Ether wie Diethylether, Methylethylether, Diisopropylether, Dibutylether, Propylenoxid, Dioxan und Tetrahydrofuran; Ketone wie Aceton, Methylethylketon, Methylisopropylketon und Methylisobutylketon; Nitrile wie Acetonitril, Propionitril und Acrylnitril; Alkohole wie Methanol, Ethanol, Isopropanol, Butanol und Ethylenglycol; Ester wie Ethylacetat und Amylacetat; Säureamide wie Dimethylformamid und Dimethylacetamid; Sulfone und Sulfoxide wie Dimethylsulfoxid und Sulfolan; und Basen wie Pyridin.
- Die obige Reaktion kann in Gegenwart eines säurebindenden Mittels durchgeführt werden. Zu Beispielen für das säurebindende Mittel zählen die Hydroxide, Carbonate, Hydrogencarbonate und Alkoholate von Alkalimetallen, die allgemein verwendet werden, und tertiäre Amine wie Triethylamin, Diethylanilin und Pyridin.
- Das Verfahren gemäß der vorliegenden Erfindung kann in einem weiten Temperaturbereich durchgeführt werden. Im allgemeinen kann es bei einer Temperatur zwischen etwa -20°C und dem Siedepunkt der Mischung, vorzugsweise zwischen etwa 0°C und etwa 100°C, durchgeführt werden. Die Reaktion wird zweckmäßigerweise unter Atmosphärendruck durchgeführt, jedoch ist es auch möglich, unter erhöhtem oder vermindertem Druck zu arbeiten.
- Die folgenden Beispiele erläutern die vorliegende Erfindung. Es ist jedoch darauf hinzuweisen, daß die Erfindung nicht auf diese Beispiele allein beschränkt ist.
- Eine Mischung aus 5 g 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmethanol-acetat, 50 ml Methanol und 5 ml einer 20-proz. wäßrigen Natriumhydroxid-Lösung wurde 5 h bei 50°C gerührt. Die Reaktionsmischung wurde abgekühlt und mit Diethylether extrahiert. Die etherische Schicht wurde getrocknet, und danach wurde der Ether abgedampft. Der Rückstand wurde destilliert, wonach 3,5 g des 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmethanols mit einem Sdp. von 148-150°C/30,7 mbar (23 mmHg), der gewünschten Verbindung der vorliegenden Erfindung, erhalten wurden.
- Das folgende Bezugsbeispiel 1 erläutert die Synthese des 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethyl- cyclopropanmethanol-acetats, das als Ausgangsstoff in dem vorsteheden Verfahren gemäß der vorliegenden Erfindung eingesetzt wurde.
- Natriumtrichloroacetat (45 g) wurde nach und nach im Laufe von 2 h unter Rühren bei 110°C zu 21,8 g trans-4-Chloro-3-methylcrotylacetat hinzugefügt. Nach der Zugabe wurde die Mischung weitere 2 h bei dieser Temperatur gerührt. Die Reaktionsmischung wurde abgekühlt, und 100 ml n-Hexan wurden zugegeben. Die Mischung wurde 10 min gerührt und dann über Nacht stehen gelassen. Der unlösliche Anteil wurde durch Filtration entfernt und mit 100 ml n-Hexan gewaschen, und danach wurde das Filtrat mit zwei Portionen von je 50 ml gesättigter wäßriger Natriumchloridlösung gewaschen und getrocknet. Das n-Hexan wurde abgedampft, und der Rückstand wurde bei 26,7 mbar (20 mmHg) destilliert, wobei die von 120°C bis 160°C siedenden Fraktionen abgetrennt wurden. Diese Fraktionen wurden nochmals bei 33,3 mbar (25 mmHg) fraktioniert destilliert, wonach 18,3 g 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmetha- nol-acetat mit einem Siedepunkt 152-154°C/33,3 mbar (25 mmHg) erhalten wurden.
- Nachstehend angegeben ist das Bezugs-Synthesebeispiel 2 für die Herstellung einer neuen, biologisch aktiven Verbindung aus der Verbindung gemäß der vorliegenden Erfindung als Zwischenprodukt.
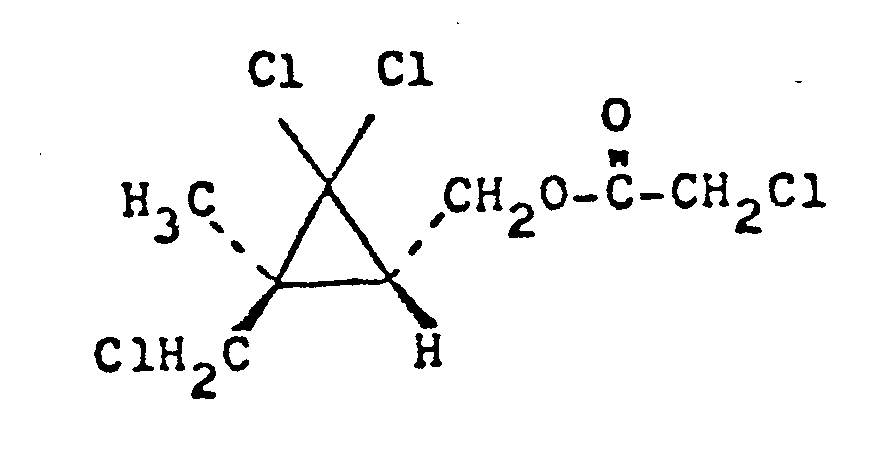
- 2,0 g 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloro- methylcyclopropanmethanol und 1,0 g Pyridin wurden in Toluol (30 ml) gelöst, und unter Rühren und Eiskühlung wurde eine Lösung von 1,2 g Chloroacetylchlorid in 10 ml Toluol tropfenweise hinzugefügt. Die Mischung wurde 8 h gerührt und dann in Wasser gegossen. Die Toluol-Schicht wurde mit einer 3-proz. wäßrigen Salzsäure-Lösung, einer 10-proz. wäßrigen Natriumhydrogencarbonat-Lösung und danach mit Wasser gewaschen und dann getrocknet. Das Toluol wurde unter vermindertem Druck abgedampft. Der Rückstand unter vermindertem Druck destilliert, wonach 2,6 g 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmethanol-chloroacetat mit einem Siedepunkt von 123-124°C/0,53 mbar (0,4 mmHg) der nachstehenden Formel erhalten wurden.
- Test auf Wirksamkeit gegen die Brusone-Krankheit von Reis bei Wasseroberflächen-Anwendung:
-
- Wirkstoff: 50 Gew.-Teile;
- Träger: 45 Gew.-Teile einer Mischung (1 : 5) aus Diatomeenerde und Kaolin;
- Emulgator: 5 Gew.-Teile Polyoxyethylenalkylphenylether.
- Die aktive Verbindung, der Träger und der Emulgator wurden pulverisiert und in den angegebenen Mengen miteinander vermischt, wodurch ein benetzbares Pulver gebildet wurde. Eine vorher festgelegte Menge des benetzbaren Pulvers wurde mit Wasser verdünnt, wodurch ein Test-Präparat hergestellt wurde.
- Reispflanzen (Varietät: Asahi) wurden in überfluteten Porzellan-Töpfen mit einem Durchmesser von 12 cm, jeweils drei Setzlinge pro Topf, kultiviert. Im Frühstadium des Austreibens der Reispflanzen wurde die wie oben auf eine vorher festgelegte Konzentration gebrachte Test-Verbindung in den angegebenen Dosierungen mit Hilfe einer Pipette auf die Wasseroberfläche aufgebracht, so daß sie nicht unmittelbar mit den oberirdischen Teilen der Reispflanzen in Berührung kam. Vier Tage später wurde eine Suspension von Sporen des Brusone-Pilzes (Piricularia oryzae) in üblicher Weise auf die Reispflanzen gesprüht, um sie mit dem Pilz zu inokulieren. Die Pflanzen wurden 24 h in einem Inkubator bei 23-25°C und einer relativen Luftfeuchtigkeit von 100 % gehalten. Danach wurden sie in ein auf 20-28°C gehaltenes Glas-Gewächshaus überführt. Sieben Tage nach der Beimpfung wurden die Pflanzen untersucht und aufgrund des folgenden Bewertungsmaßstabs beurteilt. Der Bekämpfungs-Index (%) wurde berechnet.
-
- Anmerkungen zu Tabelle 1:
- (1) Die Verbindung gemäß der vorliegenden Erfindung ist
- (2) Die Verbindung D-1 (Derivat) ist
- (3) Das Zeichen "-" in der Spalte der Phytotoxizität gibt an, daß keine Phytotoxizität vorlag.
- Die in der vorliegenden Schrift beschrieben Erfindung wird wie folgt zusammengefaßt:
- (1) 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmethanol.
- (2) Verfahren zur Herstellung von 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloromethylcyclopropanmetha- nol, bei dem eine Verbindung der Formel
Claims (2)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP58176882A JPS6069048A (ja) | 1983-09-27 | 1983-09-27 | 2,2−ジクロル−(シス)−3−メチル−(トランス)−3−クロルメチルシクロプロパンメタノ−ル及びその製法 |
| JP176882/83 | 1983-09-27 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0135897A2 true EP0135897A2 (de) | 1985-04-03 |
| EP0135897A3 EP0135897A3 (de) | 1986-05-28 |
Family
ID=16021413
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP84110981A Withdrawn EP0135897A3 (de) | 1983-09-27 | 1984-09-14 | 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloro-methylcyclopropanmethanol |
Country Status (8)
| Country | Link |
|---|---|
| EP (1) | EP0135897A3 (de) |
| JP (1) | JPS6069048A (de) |
| KR (1) | KR850002825A (de) |
| BR (1) | BR8404824A (de) |
| DK (1) | DK460684A (de) |
| HU (1) | HUT36682A (de) |
| IL (1) | IL73045A (de) |
| ZA (1) | ZA847570B (de) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5208388A (en) * | 1988-07-19 | 1993-05-04 | Bayer Aktiengesellschaft | 2,2-difluorocyclopropyl derivatives |
| US5264632A (en) * | 1988-07-19 | 1993-11-23 | Bayer Aktiengesellschaft | 2,2-difluorocyclopropyl derivatives |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3636161A (en) * | 1969-11-26 | 1972-01-18 | Ethyl Corp | Synthesis of gem-dihalocyclopropane compounds |
-
1983
- 1983-09-27 JP JP58176882A patent/JPS6069048A/ja active Pending
-
1984
- 1984-09-14 EP EP84110981A patent/EP0135897A3/de not_active Withdrawn
- 1984-09-24 IL IL73045A patent/IL73045A/xx unknown
- 1984-09-25 HU HU843622A patent/HUT36682A/hu unknown
- 1984-09-26 ZA ZA847570A patent/ZA847570B/xx unknown
- 1984-09-26 BR BR8404824A patent/BR8404824A/pt unknown
- 1984-09-26 DK DK460684A patent/DK460684A/da not_active Application Discontinuation
- 1984-09-26 KR KR1019840005908A patent/KR850002825A/ko not_active Withdrawn
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5208388A (en) * | 1988-07-19 | 1993-05-04 | Bayer Aktiengesellschaft | 2,2-difluorocyclopropyl derivatives |
| US5264632A (en) * | 1988-07-19 | 1993-11-23 | Bayer Aktiengesellschaft | 2,2-difluorocyclopropyl derivatives |
Also Published As
| Publication number | Publication date |
|---|---|
| IL73045A (en) | 1987-09-16 |
| HUT36682A (en) | 1985-10-28 |
| KR850002825A (ko) | 1985-05-20 |
| BR8404824A (pt) | 1985-08-13 |
| EP0135897A3 (de) | 1986-05-28 |
| DK460684A (da) | 1985-03-28 |
| JPS6069048A (ja) | 1985-04-19 |
| IL73045A0 (en) | 1984-12-31 |
| DK460684D0 (da) | 1984-09-26 |
| ZA847570B (en) | 1985-05-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE2515091C2 (de) | N-Acyl-N-phenyl-alaninderivate und -glycinderivate, Verfahren zu deren Herstellung und diese Verbindungen enthaltende fungizide Mittel | |
| EP0132733B1 (de) | Neue Fluorpivalsäurefluoride und Verfahren zu ihrer Herstellung | |
| EP0196547A1 (de) | Neue Benzamide | |
| EP0135897A2 (de) | 2,2-Dichloro-(cis)-3-methyl-(trans)-3-chloro-methylcyclopropanmethanol | |
| EP0068260A2 (de) | Substituierte Phenoxypropionate, Verfahren zu ihrer Herstellung und ihre Verwendung als Herbizide | |
| EP0137355B1 (de) | 2,2-Dichloro-3,3-dimethylcyclopropylmethylamin | |
| EP0007066B1 (de) | 4-Alkyl- und 4-Allyl-merkapto-, sulfinyl- und sulfonyl-methyl-2-amino-6-N,N'-dimethylcarbamoyloxy-pyrimidine, Verfahren zu ihrer Herstellung, Mittel welche diese Pyrimidine enthalten und deren Verwendung zur Bekämpfung von Insekten | |
| EP0097854B1 (de) | Thiolphosphorsäureester, ihre Herstellung und Verwendung | |
| EP0235722B1 (de) | Zimtsäurepropargylester, Verfahren zu ihrer Herstellung und ihre Verwendung zur Schädlingsbekämpfung | |
| EP0877815A1 (de) | Verfahren zur herstellung von optisch aktiven aminen | |
| EP0257448B1 (de) | Optisch aktive Cyclopropancarboxamide | |
| DE2943019A1 (de) | Mikrobizides mittel | |
| DE3211087C2 (de) | Aminosulfenylchloridderivate, Verfahren zu deren Herstellung und deren Verwendung | |
| EP0014887B1 (de) | Spiro-Derivate von 3-(3,5-Dihalogenphenyl)-oxazolidin-2-thion-4-onen, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Fungizide | |
| DE2810923B2 (de) | Zyklische Phosphorsäureamidester, Verfahren zu deren Herstellung und diese Ester enthaltende insektizide Mischungen | |
| DE2658138A1 (de) | Substituierte 2-phenylimino-thiazolidine, verfahren zu ihrer herstellung sowie ihre verwendung als ektoparasitizide | |
| EP0158248A2 (de) | Verfahren zur Herstellung von Biphenylylsulfonylharnstoff- Derivaten, Zwischenprodukte für diese sowie Verfahren für die Herstellung der Zwischenprodukte | |
| EP0012261A1 (de) | Substituierte Spiro-Derivate von 3-(3,5-Dichlorphenyl)-oxazolidin-2,4-dionen, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Fungizide | |
| EP0080106A1 (de) | Verfahren zur Herstellung von N-substituierten N-Isocyanatocarbonyl-carbamaten | |
| EP0204949B1 (de) | Phosphoroimidate | |
| DE69211194T2 (de) | Phosphorsäureesterderivate, Verfahren zu ihrer Herstellung sowie diese enthaltende insektizide und mitizide Zusammensetzungen | |
| DE2643445A1 (de) | Mikrobizide mittel | |
| DE2917893A1 (de) | N-(alkoxy- bzw. alkoxycarbonalalkyl)- n-hydroxyacetyl- bzw. propionyl-anilin- derivate als pflanzenfungizide | |
| EP0148755B1 (de) | 2-Phenoxy-phenylsulfonylisocyanat | |
| EP0066771A1 (de) | 1-Iod-1-propin-3-ole, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Pflanzenschutzmittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19840914 |
|
| AK | Designated contracting states |
Designated state(s): AT BE CH DE FR GB IT LI NL |
|
| RTI1 | Title (correction) | ||
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): AT BE CH DE FR GB IT LI NL |
|
| 17Q | First examination report despatched |
Effective date: 19870330 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION HAS BEEN WITHDRAWN |
|
| 18W | Application withdrawn |
Withdrawal date: 19870522 |
|
| RIN1 | Information on inventor provided before grant (corrected) |
Inventor name: KAGABU, SHINZO Inventor name: SHIOKAWA, KOZO Inventor name: SAKAWA, SHINJI |