EP0126254B1 - N-(2-Nitrophenyl)-4-aminopyrimidin-Derivate als Mikrobizide - Google Patents
N-(2-Nitrophenyl)-4-aminopyrimidin-Derivate als Mikrobizide Download PDFInfo
- Publication number
- EP0126254B1 EP0126254B1 EP84103804A EP84103804A EP0126254B1 EP 0126254 B1 EP0126254 B1 EP 0126254B1 EP 84103804 A EP84103804 A EP 84103804A EP 84103804 A EP84103804 A EP 84103804A EP 0126254 B1 EP0126254 B1 EP 0126254B1
- Authority
- EP
- European Patent Office
- Prior art keywords
- alkoxy
- halogen
- formula
- substituted
- methoxy
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/42—One nitrogen atom
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/48—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having rings with two nitrogen atoms as the only ring hetero atoms
- A01N43/54—1,3-Diazines; Hydrogenated 1,3-diazines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/47—One nitrogen atom and one oxygen or sulfur atom, e.g. cytosine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/52—Two oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/56—One oxygen atom and one sulfur atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/58—Two sulfur atoms
Definitions
- the present invention relates to new N (2-nitrophenyl) -4-aminopyrimidine derivatives of the formula I below.
- the invention further relates to the production of these substances and to microbicidal compositions which comprise at least one of these compounds as active ingredient.
- the invention also relates to the production of the agents mentioned and the use of the active compounds or the agents for controlling harmful microorganisms, preferably fungi which damage plants.
- alkyl itself or as a constituent of another substituent, depending on the number of carbon atoms specified, is to be understood, for example, to mean the following groups: methyl, ethyl, propyl, butyl, pentyl, hexyl, etc., and their isomers, such as, for. B. isopropyl, isobutyl, tert-butyl, isopentyl, etc.
- Alkenylmethyl is such. B. for allyl, butenyl (2), butenyl (3) etc., and chains with several double bonds.
- Alkynylmethyl means e.g. B. propargyl, butynyl- (2) etc., preferably propargyl.
- Halogen substituted alkyl is in particular mono- to perhalogenated alkyl substituents, such as. B. CHCI 2 , CH 2 Cl, CCI 3 , CF 3 , CH 2 CH 2 Cl, etc. Halogen here and below is to be understood as fluorine, chlorine, bromine or iodine, preferably CI, Br or F.
- Cycloalkyl is e.g. B. for cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl or cycloheptyl, preferably for cyclopropyl and cyclohexyl.
- the compounds of the formula are oils, resins or predominantly crystalline solids which are stable under normal conditions and are distinguished by extremely valuable microbicidal properties. For example, they can be used preventively and curatively in the agricultural sector or related fields to combat plant-damaging microorganisms.
- the active compounds of the formula I according to the invention are distinguished, in wide use concentrations, by high fungicidal activity and problem-free use.
- Group Ib Compounds of the formula I wherein R 1 is NO 2, R 2 is CF 3, R 3 is chlorine or bromine, R 5 is halogen, C 1 -C 4 -alkoxy, substituted by chlorine or bromine C 1 -C 3 alkyl, C 1 -C 2 alkoxy substituted by methoxy, C 1 -C 4 alkylthio, (C 2 -C 3 alkenyl) methoxy, (C 2 -C 3 alkynyl) methoxy or C 1 -C 3 represents alkylsulfonyl; and R 6 represents fluorine, chlorine or bromine.
- Group Ic compounds of the formula I in which R 1 is CF 3 , R 2 is N0 2 , R 3 is hydrogen and R 4 is hydrogen, R 5 is halogen, C 1 -C 6 -alkoxy, C is substituted by chlorine or bromine 1 -C 3 alkyl, by C 1 -C 3 alkoxy substituted C 1 -C 3 alkoxy, C 1 -C 6 alkylthio, cyclopentyloxy, cyclohexyloxy, cyclopentylthio, cyclohexylthio, (C 2 -C 5 alkenyl) methoxy, (C 2 -C 5 -Alkenyl) -methylthio, (C 2 -C 5 -alkynyl) methoxy, C 1 -C 3 -alkylsulfoxyl, C 1 -C 6 -alkylsulfonyl, C 1 -C 3 -alkylsulfonyloxy or
- Group Id compounds of the formula I in which R 1 is CF 3 , R 2 is N0 2 , R 3 is chlorine or bromine R 5 is halogen, C 1 -C 4 -alkoxy, C 1 -C 3 substituted by chlorine or bromine -Alkyl, C 1 -C 2 -alkoxy substituted by methoxy, C 1 -C 4 -alkylthio, (C 2 -C 3 -alkenyl) methoxy, (C 2 -C 3 -alkynyl) methoxy or C 1 -C 3 represents alkylsulfonyl; and R 6 represents fluorine, chlorine or bromine.
- Group le compounds of the formula I in which R 1 is NO 2 , R 2 is CF 3 , R 3 is halogen and R 4 is hydrogen, R 5 is C 1 -C 3 -alkoxy, C 1 -C 3 -alkylthio , C 1 -C 3 alkylsulfoxyl or C 1 -C 3 alkylsulfonyl and R 6 represents halogen.
- R is N0 2 , R 2 is CF 3 , R 3 is chlorine and R 4 is hydrogen
- R 5 and R 6 are independently halogen, C 1 -C 6 alkoxy, by chlorine or bromine-substituted C 1 -C 3 alkyl, C 1 -C 3 -alkoxy-substituted C 1 -C 3 alkoxy, C 1 -C 6 alkylthio, cyclopentyloxy, cyclohexyloxy, cyclopentylthio, cyclohexylthio, (C 2 - C 5 -alkenyl) methoxy, (C 2 -alkenyl) methylthio, (C 2 -C 5 -alkynyl) methoxy, C 1 -C 3 -alkylsulfoxyl, C 1 -C 6 -alkylsulfonyl, C 1 -C 3 - Alkylsulfon
- Group lg compounds of the formula I in which R 1 is CF 3 , R 2 is N0 2 , R 3 is hydrogen and R 4 is hydrogen and R 5 and R e are, independently of one another, C 1 -C 3 alkoxy, C 1 - C 3 alkylthio, C 3 alkenyloxy, C 1 -C 3 alkoxy, C 1 -C 3 alkylthio, (C 2 alkenyl) methoxy, C 1 -C 3 alkenyl sulfoxyl or C 1 -C 3 -Alkenylsulfonyl mean.
- Group Ih compounds of the formula I in which R 1 is CF 3 or NO 2 ; R 2 is CF 3 or NO 2 ; R 3 represents hydrogen or chlorine; R 4 represents the group C (O) -R 7 wherein R 7 is C 1 -C 3 alkyl, halogen-substituted C 1 -C 3 alkyl or C 1 -C 3 -alkoxy-substituted C 1 -C 3 -Alkyl means; R s represents halogen, C 1 -C 3 alkoxy or C 1 -C 3 alkylthio and R 8 represents chlorine.
- Group li compounds of the formula I in which R is N0 2 , R 2 is CF 3 , R 3 is hydrogen and R 4 is hydrogen, R 5 is halogen, C 1 -C 6 -alkoxy, C is substituted by chlorine or bromine 1 -C 3 alkyl, C 1 -C 3 alkoxy substituted C 1 -C 3 alkoxy, C 1 -C 6 alkylthio, cyclopentyloxy, cyclohexyloxy, cyclopentylthio, cyclohexylthio, (C 2 -C 5 alkenyl) - methoxy, (C 2 -C 5 alkenyl) methylthio, (C 2 -C 5 alkynyl) methoxy, C 1 -C 3 alkylsulfoxyl, C 1 -C 6 alkylsulfonyl, C 1 -C 3 alkylsulfonyloxy or Means cyclohexylsulf
- the compounds of the formula I are prepared according to the invention in that a compound of the formula II in the presence of a base with a pyrimidine derivative of the formula III to a compound of formula I ' implements, and the latter for the preparation of N-acylated derivatives with a reactive derivative of carboxylic acid IV
- N-acylated where the substituents R 1 to R 7 have the meanings given under formula I and X and Y are NH 2 or halogen, where in the case where X is halogen, Y is NH 2 and in the case in which X is NH 2 , Y is halogen.
- the reactions can be carried out in the presence of inert solvents or diluents.
- inert solvents or diluents for example, aliphatic and aromatic hydrocarbons such as benzene, toluene, xylenes, petroleum ether; halogenated hydrocarbons such as chlorobenzene, methylene chloride, ethylene chloride, chloroform, carbon tetrachloride, tetrachlorethylene; Ethers and ethereal compounds such as dialkyl ether (diethyl ether, diisopropyl ether, tert-butyl methyl ether, etc.), anisole, dioxane, tetrahydrofuran; Nitriles such as acetonitrile, propionitrile; N, N-dialkylated amides such as dimethylformamide; Dimethyl sulfoxide; Ketones such as acetone, diethyl ketone, methyl ethyl ket
- reaction (11) and (III) can also be carried out in an aqueous two-phase system according to the generally known principle of phase transfer catalysis.
- aliphatic and aromatic hydrocarbons such as pentane, hexane, cyclohexane, petroleum ether, ligroin, benzene, toluene, xylenes, etc.
- halogenated hydrocarbons such as dichloromethane, chloroform, carbon tetrachloride, ethylene dichloride, 1,2-dichloroethane, tetrachlorethylene etc. or aliphatic ethers such as diethyl ether, diisopropyl ether, t-butyl methyl ether etc.
- phase transfer catalysts examples include: tetraalkylammonium halides, hydrogen sulfates or hydroxides such as tetrabutylammonium chloride, bromide, iodide; Triethylbenzylammonium chloride, bromide; Tetrapropylammonium chloride, bromide, iodide; etc.
- Phosphonium salts can also be used as phase transfer catalysts.
- the reaction temperatures are generally between -30 ° and 130 ° C, or at the boiling point of the solvent or solvent mixture.
- reaction-inert solvents or diluents may in principle be present in the production of all starting, intermediate and end products mentioned here, unless expressly specified in detail.
- aliphatic and aromatic hydrocarbons such as benzene, toluene, xylenes, petroleum ether; halogenated hydrocarbons such as chlorobenzene, methylene chloride, ethylene chloride, chloroform, carbon tetrachloride, tetrachlorethylene; Ethers and ethereal compounds such as dialkyl ethers (diethyl ether, diisopropyl ether, tert-butyl methyl ether, etc.), anisole, dioxane, tetrahydrofuran; Nitriles such as acetonitrile, propionitrile; N, N-dialkylated amides such as dimethylformamide; Dimethyl sulfoxide; Ketones such as acetone, diethyl ketone,
- reaction or partial steps of a reaction are carried out under a protective gas atmosphere and / or absolute solvents.
- Inert gases such as nitrogen, helium, argon or, in certain cases, carbon dioxide are suitable as protective gases.
- British Patent No. 1,388,825 describes heterocyclic compounds, including pyrimidine derivatives. as a pesticide, e.g. B. also to combat phytopathogenic microorganisms.
- compounds of the formula have a microbicide spectrum which is very favorable for practical needs against phytopathogenic fungi and bacteria. They have very advantageous curative, systemic and, in particular, preventive properties and can be used to protect numerous crop plants.
- the microorganisms occurring on plants or on parts of plants (fruits, flowers, foliage, stems, tubers, roots) of different crops can be contained or destroyed, with the result that parts of plants which grow later are also spared by such microorganisms.
- the active ingredients of the formula are active against the phytopathogenic fungi belonging to the following classes: fungi imperfecti (e.g. botrytis, helminthosporium, fusarium septoria, cercospora and alternaria); Basidiomycetes (e.g. the genera Hemileia, Rhizocotonia, Puccinia); in particular, they act against the class of Ascomycetes (e.g. Venturia, Podosphaera, Erysiphe, Monilinia, Uncinula).
- the compounds of the formula I have a systemic action. They can also be used as dressing agents for the treatment of seeds (fruits, tubers, grains) and plant cuttings for the protection of fungal infections and against phytopathogenic fungi occurring in the soil.
- the invention thus also relates to microbicidal agents and to the use of the compounds of the formula for combating phytopathogenic microorganisms, in particular fungi which damage plants and the preventive prevention of an attack on plants.
- the present invention also includes the production of agrochemicals, which is characterized by the intimate mixing of the active substance with one or more substances or groups of substances described herein. Also included is a process for the treatment of plants which is characterized by the application of the compounds of the formula 1 or the new agents.
- the following plant species count as target cultures for the indication areas disclosed herein: cereals; (Wheat, barley, rye, oats, rice, sorghum and relatives); Beets: (sugar and fodder beets); Pome, stone and berry fruit: (apples, pears, plums, peaches, almonds, cherries, strawberries, strawberries and blackberries); Legumes: (beans, lentils, peas, soy); Oil cultures: (rapeseed, mustard, poppy seeds, olives, sunflowers, coconut, castor bean, cocoa, peanuts); Cucumber Family: (Pumpkin, Cucumber, Melon); Fiber plants: (cotton, flax, hemp, jute); Citrus fruits: (oranges, lemons, grapefruit, mandarins); Vegetables: (spinach, lettuce, asparagus, cabbage, carrots, onions, tomatoes, potatoes, peppers); Laurel plants: (avocado, cinnamonum,
- Active ingredients of the formula I are usually used in the form of compositions and can be applied simultaneously or in succession to the area or plant to be treated with further active ingredients.
- These other active ingredients can be both fertilizers, trace element mediators or other preparations which influence plant growth. But it can also be selective herbicides, insecticides. Fungicides, bactericides, nematicides, molluscicides or mixtures of several of these preparations, together with any other carriers, surfactants or other application-promoting additives that are customary in formulation technology.
- Suitable carriers and additives can be solid or liquid and correspond to the substances useful in formulation technology, such as. B. natural or regenerated mineral substances, solvents, dispersants, wetting agents, adhesives, thickeners, binders or fertilizers.
- a preferred method for applying an active ingredient of the formula I or an agrochemical composition which contains at least one of these active ingredients is application to the foliage (leaf application).
- the number of applications and the application rate depend on the infestation pressure for the corresponding pathogen (type of fungus).
- the active ingredients of formula I can also get into the plant through the roots through the roots (systemic effect) by soaking the location of the plant with a liquid preparation or introducing the substances in solid form into the soil, e.g. B. in the form of granules (floor application).
- the compounds of the formula I can also be applied to seeds (coating) by either impregnating the grains with a liquid preparation of the active ingredient or coating them with a solid preparation.
- other types of application are possible in special cases, such. B. the targeted treatment of plant stems or buds.
- the compounds of formula I are in unchanged form or preferably together used with the usual aids in formulation technology and are therefore z.
- the methods of application such as spraying, atomizing, dusting, scattering, brushing or pouring are chosen in the same way as the type of agent, in accordance with the intended goals and the prevailing conditions.
- Favorable application rates are generally 50 g to 5 kg of active substance (AS) per ha; preferably 100 g to 2 kg ai / ha, in particular at 200 g to 600 g ai / ha.
- the agents, preparations or compositions containing the active ingredient of the formula and optionally a solid or liquid additive are prepared in a known manner, for. B. by intimately mixing and / or grinding the active ingredients with extenders. such as B. with solvents, solid carriers, and optionally surface-active compounds (surfactants).
- Aromatic hydrocarbons preferably fractions C 8 to C 12 , such as.
- solid carriers e.g. B. for dusts and dispersible powders, natural rock flours are usually used, such as calcite, talc, kaolin, montmorillonite or attapulgite.
- highly disperse silica or highly disperse absorbent polymers can also be added.
- adsorptive granulate carriers come porous types such.
- pumice broken brick, sepiolite or bentonite, as non-sorptive support materials such.
- B. calcite or sand in question.
- a large number of pregranulated materials of inorganic or organic nature such as, in particular, dolomite or comminuted plant residues can be used.
- application-promoting additives that can lead to a strong reduction in the application rate are also natural (animal or vegetable) or synthetic phospholipids from the series of kephalins and lecithins, such as. B. phosphatidylethanolamine, phosphatidylserine, phosphatidylcholine, sphingomyelin, phosphatidylinositol, phosphatidylglycerol, lysolecithin, plasmalogens or cardiolipin, which can be obtained, for example, from animal or plant cells, in particular from the brain. Heart, liver, - egg yolk or soybeans. Usable commercial mixtures are e.g. B. phosphatidylcholine mixtures. Synthetic phospholipids are e.g. B. dioctanoylphosphatidylcholine and dipalmitoylphosphatidylcholine.
- nonionic, cationic and / or anionic surfactants with good emulsifying, dispersing and wetting properties are suitable as surface-active compounds.
- surfactants are also to be understood as mixtures of surfactants.
- Suitable anionic surfactants can be both so-called water-soluble soaps and water-soluble synthetic surface-active compounds.
- soaps are the alkali, alkaline earth or optionally substituted ammonium salts of higher fatty acids (C10-C22), such as. B. the Na or K salts of oleic or stearic acid, or of natural fatty acid mixtures which, for. B. can be obtained from coconut or tallow oil.
- the fatty acid methyl laurine salts should also be mentioned.
- the fatty sulfonates or sulfates are usually present as alkali, alkaline earth or optionally substituted ammonium salts and have an alkali radical having 8 to 22 carbon atoms, alkyl also including the alkyl part of acyl radicals, for.
- This subheading also includes the salts of sulfuric acid esters and sulfonic acids from fatty alcohol-ethylene oxide adducts.
- the sulfonated benzimidazole derivatives preferably contain 2-sulfonic acid groups and a fatty acid residue with 8-22 carbon atoms.
- Alkylarylsulfonates are e.g. B. the Na, Ca or triethanolamine salts of dodecylbenzenesulfonic acid, dibutylnaphthalenesulfonic acid, or a naphthalenesulfonic acid-formaldehyde condensation product.
- Corresponding phosphates such as. B. salts of the phosphoric acid ester of a p-nonylphenol (4-14) ethylene oxide adduct in question.
- Suitable nonionic surfactants are primarily polyglycol ether derivatives of aliphatic or cycloaliphatic alcohols, saturated or unsaturated fatty acids and alkylphenols, which can contain 3 to 30 glycol ether groups and 8 to 20 carbon atoms in the (aliphatic) hydrocarbon radical and 6 to 18 carbon atoms in the alkyl radical of the alkylphenols.
- nonionic surfactants are the water-soluble polyethylene oxide adducts containing 20 to 250 ethylene glycol ether groups and 10 to 100 g propylene glycol ether groups with polypropylene glycol, ethylenediaminopolypropylene glycol and alkylpolypropylene glycol with 1 to 10 carbon atoms in the alkyl chain.
- the compounds mentioned usually contain 1 per propylene glycol unit up to 5 ethylene glycol units.
- nonionic surfactants are nonylphenol polyethoxyethanols. Castor oil polyglycol ether, polypropylene-polyethylene oxide adducts, tributylphenoxypolyethyleneethanol, polyethylene glycol and octylphenoxypolyethoxyethanol are mentioned.
- Fatty acid esters of polyoxyethylene sorbitan such as polyoxyethylene sorbitan trioleate, are also suitable.
- the cationic surfactants are primarily quaternary ammonium salts which contain at least one alkyl radical having 8 to 22 carbon atoms as N substituents and, as further substituents, have lower, optionally halogenated alkyl, benzyl or lower hydroxyalkyl radicals.
- the salts are preferably in the form of halides, methyl sulfates or ethyl sulfates, e.g. B. the stearyltrimethylammonium chloride or the benzyldi (2-chloroethyl) ethylammonium bromide.
- the agrochemical preparations generally contain 0.1 to 99%, in particular 0.1 to 95% active ingredient of the formula I, 99.9 to 1%, in particular 99.8 to 5% of a solid or liquid additive and 0 to 25% , in particular 0.1 to 25% of a surfactant.
- the agents can also contain other additives such as stabilizers, defoamers, viscosity regulators, binders, adhesives and fertilizers or other active ingredients to achieve special effects.
- Such agrochemicals are part of the present invention.
- reaction mixture After stirring for 14 hours at room temperature, the reaction mixture is poured onto ice water, acidified with 15 ml of concentrated hydrochloric acid and extracted twice with 300 ml of ethyl acetate each time. The combined extracts are washed twice with 100 ml of water, dried over sodium sulfate, filtered and evaporated. The oily residue is crystallized by adding petroleum ether and recrystallized from chloroform after filtering off. Beige crystals with mp. 174-177 ° C. are obtained.
- Emulsions of any desired concentration can be prepared from such concentrates by dilution with water.
- the solutions are suitable for use in the form of tiny drops.
- the active ingredient is dissolved in methylene chloride, sprayed onto the carrier and the solvent is then evaporated off in vacuo.
- Ready-to-use dusts are obtained by intimately mixing carrier substances with the active ingredient.
- the active ingredient is mixed well with the additives and ground well in a suitable mill.
- Spray powder is obtained which can be diluted with water to form suspensions of any desired concentration.
- Emulsions of any desired concentration can be prepared from this concentrate by dilution with water.
- Ready-to-use dusts are obtained by mixing the active ingredient with the carrier in a suitable mill.
- the active ingredient is mixed with the additives, ground and moistened with water. This mixture is extruded and then dried in an air stream.
- the finely ground active ingredient is applied evenly in a mixer to the kaolin moistened with polyethylene glycol. In this way, dust-free coating granules are obtained.
- the finely ground active ingredient is intimately mixed with the additives. This gives a suspension concentrate from which suspensions of any desired concentration can be prepared by dilution with water.
- Example B1 Action against Puccinia graminis on wheat
- Wheat plants were sprayed 6 days after sowing with a spray mixture (0.02% active ingredient) prepared from wettable powder of the active ingredient. After 24 hours, the treated plants were infected with an uredospore suspension of the fungus. After incubation for 48 hours at 95-100% relative humidity and approx. 20 ° C, the infected plants were placed in a greenhouse at approx. 22 ° C. The rust pustule development was assessed 12 days after infection.
- a spray mixture 0.02% active ingredient
- a spray mixture prepared from wettable powder of the active ingredient was poured into wheat plants (0.006% of active ingredient based on the volume of the soil). After 48 hours, the treated plants were infected with an uredospore suspension of the fungus. After incubation for 48 hours at 95-100% relative humidity and approx. 20 ° C, the infected plants were placed in a greenhouse at approx. 22 ° C. The rust pustule development was assessed 12 days after infection.
- Example B2 Action against Cersopora arachidicola on peanut plants
- 10-15 cm high peanut plants were made with a spray mixture (0.006 active substance) made from wettable powder of the active substance. sprayed and infected 48 hours later with a conidia suspension of the fungus. The infected plants were incubated for 72 hours at about 21 ° C. and high atmospheric humidity and then placed in a greenhouse until the typical leaf spots appeared.
- a spray mixture 0.006 active substance
- the fungicidal activity is assessed 12 days after infection based on the number and size of the spots that appear.
- Example B3 Action against Erysiphae graminis on barley
- a spray mixture prepared from a wettable powder of the active ingredient was poured into barley plants about 8 cm high (0.006% active substance based on the volume of the earth). Care was taken to ensure that the spray mixture did not come into contact with the parts of the plants above ground. After 48 hours, the treated plants were dusted with conidia of the fungus. The infected barley plants were placed in a greenhouse at approx. 22 ° C. and the fungal attack was assessed after 10 days.
- Example B4 Residual protective action against Venturia inaequalis on apple shoots
- Apple cuttings with 10-20 cm long fresh shoots were made with a wettable powder of the active ingredient produced spray liquor (0.006% active substance) sprayed. After 24 hours, the treated plants were infected with a conidia suspension of the fungus. The plants were then incubated for 5 days at 90-100% relative atmospheric humidity and placed in a greenhouse at 20-24 ° C. for a further 10 days. Scab infestation was assessed 15 days after infection. Compounds from the tables inhibited the disease infestation to less than 25%. B. the connections 1.4. 1.5 and 1.12. In contrast, untreated but infected control instincts were 100% infected.
- Example B6 Action against Phytophthora infestans on tomato plants
- tomato plants were sprayed with a spray mixture (0.06% active substance) prepared from wettable powder of the active ingredient. After 24 hours, the treated plants were infected with a sporangia suspension of the fungus. The fungal attack was assessed after incubation of the infected plants for 5 days at 90-100% relative atmospheric humidity and 20 ° C.
- a spray mixture prepared from wettable powder of the active ingredient was poured into tomato plants (0.06% of active substance based on the volume of the earth). Care was taken to ensure that the spray mixture did not come into contact with the parts of the plants above ground. After 48 hours, the treated plants were infected with a sporangia suspension of the fungus. The fungal attack was assessed after incubation of the infected plants for 5 days at 90-100% relative atmospheric humidity and 20 ° C.
- Example B7 Action against Plasmapora viticola on vines
- vine seedlings were sprayed with a spray mixture (0.06% active substance) made from wettable powder of the active ingredient. After 24 hours, the treated plants were infected with a sporangia suspension of the fungus. After incubation for 6 days at 95-100% relative humidity and 20 ° C, the fungal attack was assessed.
- vine seedlings were infected with a sporangia suspension of the fungus. After incubation for 24 hours in a moist chamber at 95-100% relative atmospheric humidity and 20 ° C., the infected plants were dried and sprayed with a spray mixture (0.06% active substance) prepared from wettable powder of the active ingredient. After the spray coating had dried on, the treated plants were brought back into the moist chamber. The fungal infection was assessed 6 days after the infection.
- Example B8 Action against Piricularia oryzae on rice plants
- Rice plants that have been treated with a spray mixture which contains one of the compounds 1.1, 1.4, 1.5, 1.8 and 7.32 as active substance showed less than 10% fungal attack in comparison to untreated control plants (100% attack).
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Health & Medical Sciences (AREA)
- Dentistry (AREA)
- Engineering & Computer Science (AREA)
- Plant Pathology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Pest Control & Pesticides (AREA)
- Agronomy & Crop Science (AREA)
- Toxicology (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Carbon And Carbon Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Pyridine Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Immobilizing And Processing Of Enzymes And Microorganisms (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Description
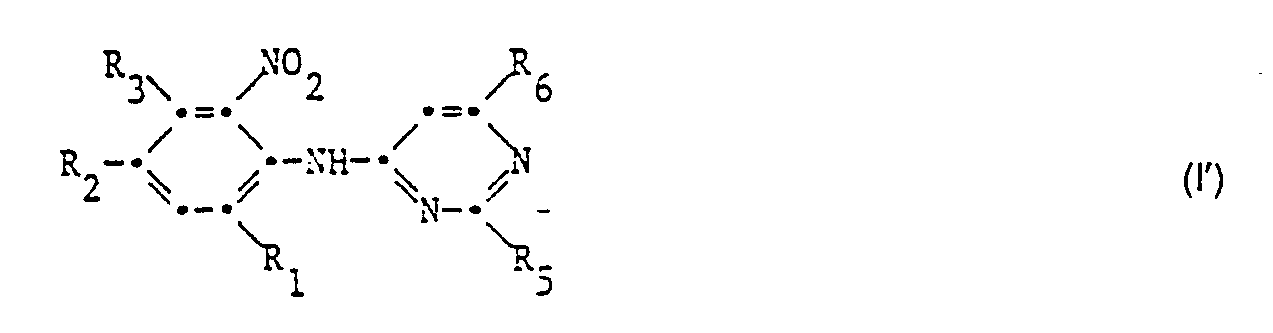
- Die vorliegende Erfindung betrifft neue N(2-Nitrophenyl)-4-amino-pyrimidin-Derivate der nachstehenden Formel I.
- Die Erfindung betrifft ferner die Herstellung dieser Substanzen sowie mikrobizide Mittel, die als Wirkstoff mindestens eine dieser Verbindungen enthalten. Die Erfindung betrifft ebenso die Herstellung der genannten Mittel sowie die Verwendung der Wirkstoffe oder der Mittel zur Bekämpfung von schädlichen Mikroorganismen, vorzugsweise pflanzenschädigenden Pilzen.
-
- R1 für NO2 oder CF3 steht ;
- R2 für N02 oder CF3 steht ;
- R3 Wasserstoff oder Halogen bedeutet;
- R4 für Wasserstoff oder die Gruppe -C(0)R7 steht, wobei R7 unsubstituiertes oder durch Halogen, C1-C3-Alkoxy oder C1-C3-Alkylthio substituiertes C1-C4-Alkyl bedeutet ;
- R5 und R6 unabhängig voneinander für Halogen, C1-C6-Alkoxy, durch Halogen oder C1-C3-Alkoxy substituiertes C1-C6-Alkyl, durch Halogen oder C1-C3-Alkoxy substituiertes C1-C6-Alkoxy, C1-C6-Alkylthio, durch Halogen oder C1-C3-Alkoxy substituiertes C1-C6-Alkylthio, C3-C6-Cycloalkoxy, C3-C6-Cycloalkylthio, (C2-C5-Alkenyl)-methoxy, (C2-C5-Alkenyl)-methylthio, (C2-C5-Alkinyl)-methoxy, C1-C6-Alkylsulfoxyl, C1-C6-Alkylsulfonyl, C1-C6-Sulfonyloxy, C3-C6-Alkenylsulfoxyl, C3-C6-Alkenylsulfonyl, C3-C6-Cycloalkylsulfoxyl oder für C3-C6-Cycloalkyisulfonyl stehen.
- Unter dem Begriff Alkyl selbst oder als Bestandteil eines anderen Substituenten sind je nach Zahl der angegebenen Kohlenstoffatome beispielsweise folgende Gruppen zu verstehen : Methyl, Ethyl, Propyl, Butyl, Pentyl, Hexyl, usw., sowie ihre Isomeren, wie z. B. Isopropyl, Isobutyl, tert.-Butyl, Isopentyl usw. Alkenylmethyl steht z. B. für Allyl, Butenyl-(2), Butenyl-(3) usw., sowie Ketten mit mehreren Doppelbindungen. Alkinylmethyl bedeutet z. B. Propargyl, Butinyl-(2) usw., bevorzugt Propargyl. Durch Halogen substituiertes Alkyl steht insbesondere für ein- bis perhalogenierten Alkylsubstituenten, wie z. B. CHCI2, CH2Cl, CCI3, CF3, CH2CH2Cl, usw. Unter Halogen soll hier und im folgenden Fluor, Chlor, Brom oder Jod, vorzugsweise CI, Br oder F verstanden werden. Cycloalkyl steht z. B. für Cyclopropyl, Cyclobutyl, Cyclopentyl, Cyclohexyl oder Cycloheptyl, bevorzugt für Cyclopropyl und Cyclohexyl.
- Die Verbindungen der Formel sind unter Normalbedingungen stabile Oele, Harze oder überwiegend kristalline Feststoffe, die sich durch äusserst wertvolle mikrobizide Eigenschaften auszeichnen. Sie lassen sich beispielsweise auf dem Agrarsektor oder verwandten Gebieten präventiv und kurativ zur Bekämpfung pflanzenschädigender Mikroorganismen einsetzen. Die erfindungsgemässen Wirkstoffe der Formel I zeichnen sich in weiten Anwendungskonzentrationen durch eine hohe fungizide Aktivität und problemlose Anwendung aus.
- Auf Grund ihrer ausgeprägten mikrobiziden, insbesondere pflanzenfungiziden Wirkung sind folgende Untergruppen la bis li bevorzugt :
- Gruppe la : Verbindungen der Formel I, worin R1 für NO2, R2 für CF3, R3 für Chlor und R4 für Wasserstoff stehen, R5 Halogen, C1-C6-Alkoxy, durch Chlor oder Brom substituiertes C1-C3-Alkyl, durch C1-C3-Alkoxy substituiertes C1-C3-Alkoxy, C1-C6-Alkylthio, Cyclopentyloxy, Cyclohexyloxy, Cyclopentylthio, Cyclohexylthio, (C2-C5-Alkenyil-methoxy, (C2-C5-Alkenyl)-methylthio, (C2-C5-Alkinyl)-methoxy, C1-C3-Alkylsulfoxyl, C1-C6-Alkylsulfonyl, C1-C3-Alkylsulfonyloxy oder Cyclohexylsulfonyl bedeutet ; und R6 für Halogen steht.
- Gruppe Ib : Verbindungen der Formel I, worin R1 für NO2, R2 für CF3, R3 für Chlor oder Brom stehen, R5 Halogen, C1-C4-Alkoxy, durch Chlor oder Brom substituiertes C1-C3-Alkyl, durch Methoxy substituiertes C1-C2 Alkoxy, C1-C4-Alkylthio, (C2-C3-Alkenyl)-methoxy, (C2-C3-Alkinyl)-methoxy oder C1-C3-Alkylsulfonyl bedeutet ; und R6 für Fluor, Chlor oder Brom steht.
- Innerhalb dieser Untergruppe Ib sind insbesondere jene Verbindungen der Formel I bevorzugt, worin R3 und R6 für Chlor stehen ; und R5 Fluor, Chlor, Brom, C1-C3-Alkoxy, C1-C3-Alkylthio, OCH2CH2OCH3, OCH2CH=CH2 oder OCH2C≡CH bedeutet. (= Gruppe Ib').
- Gruppe Ic : Verbindungen der Formel I, worin R1 für CF3, R2 für N02, R3 für Wasserstoff und R4 für Wasserstoff stehen, R5 Halogen, C1-C6-Alkoxy, durch Chlor oder Brom substituiertes C1-C3-Alkyl, durch C1-C3-Alkoxy substituiertes C1-C3-Alkoxy, C1-C6-Alkylthio, Cyclopentyloxy, Cyclohexyloxy, Cyclopentylthio, Cyclohexylthio, (C2-C5-Alkenyl)-methoxy, (C2-C5-Alkenyl)-methylthio, (C2-C5-Alkinyl)-methoxy, C1-C3-Alkylsulfoxyl, C1-C6-Alkylsulfonyl, C1-C3-Alkylsulfonyloxy oder Cyclohexylsulfonyl bedeutet ; und R6 für Halogen steht.
- Gruppe Id : Verbindungen der Formel I, worin R1 für CF3, R2 für N02, R3 für Chlor oder Brom stehen R5 Halogen, C1-C4-Alkoxy, durch Chlor oder Brom substituiertes C1-C3-Alkyl, durch Methoxy substituiertes C1-C2-Alkoxy, C1-C4-Alkylthio, (C2-C3-Alkenyl)-methoxy, (C2-C3-Alkinyl)-methoxy oder C1-C3-Alkylsulfonyl bedeutet ; und R6 für Fluor, Chlor oder Brom steht.
- Innerhalb dieser Untergruppe Id sind insbesondere jene Verbindungen der Formel bevorzugt, worin R3 und R6 für Chlor stehen ; und R5 Fluor, Chlor, Brom, C1-C3-Alkoxy, C1-C3-Alkylthio, OCH2CH2OCH3, OCH2CH=CH2 oder OCH2C≡5CH bedeutet. (= Gruppe Id').
- Gruppe le : Verbindungen der Formel I, worin R1 für NO2, R2 für CF3, R3 für Halogen und R4 für Wasserstoff stehen, R5 für C1-C3-Alkoxy, C1-C3-Alkylthio, C1-C3-Alkylsulfoxyl oder C1-C3-Alkylsulfonyl bedeutet und R6 für Halogen steht.
- Gruppe If : Verbindungen der Formel I, worin R, für N02, R2 für CF3, R3 für Chlor und R4 für Wasserstoff stehen, während R5 und R6 unabhängig voneinander halogen, C1-C6-Alkoxy, durch Chlor oder Brom substituiertes C1-C3-Alkyl, durch C1-C3-Alkoxy substituiertes C1-C3-Alkoxy, C1-C6-Alkylthio, Cyclopentyloxy, Cyclohexyloxy, Cyclopentylthio, Cyclohexylthio, (C2-C5-Alkenyl)-methoxy, (C2-Alkenyl)-methylthio, (C2-C5-Alkinyl) methoxy, C1-C3-Alkylsulfoxyl, C1-C6-Alkylsulfonyl, C1-C3-Alkylsulfonyloxy oder Cyclohexylsulfonyl bedeuten.
- Gruppe lg : Verbindungen der Formel I, worin R1 für CF3, R2 für N02, R3 für Wasserstoff und R4 für Wasserstoff stehen und R5 und Re unabhängig voneinander C1-C3-Alkoxy, C1-C3-Alkylthio, C3-Alkenylo- xy, C1-C3-Alkoxy, C1-C3-Alkylthio, (C2-Alkenyl)-methoxy, C1-C3-Alkenylsulfoxyl oder C1-C3-Alkenylsulfonyl bedeuten.
- Gruppe Ih : Verbindungen der Formel I, worin R1 für CF3 oder NO2 steht ; R2 CF3 oder NO2 bedeutet ; R3 Wasserstoff oder Chlor bedeutet ; R4 für die Gruppe C(O)―R7 steht, worin R7 C1-C3-Alkyl, durch Halogen substituiertes C1-C3-Alkyl oder durch C1-C3-Alkoxy substituiertes C1-C3-Alkyl bedeutet ; Rs für Halogen, C1-C3-Alkoxy oder C1-C3-Alkylthio steht und R8 Chlor bedeutet.
- Gruppe li : Verbindungen der Formel I, worin R, für N02, R2 für CF3, R3 für Wasserstoff und R4 für Wasserstoff stehen, R5 Halogen, C1-C6-Alkoxy, durch Chlor oder Brom substituiertes C1-C3-Alkyl, durch C1-C3-Alkoxy substituiertes C1-C3-Alkoxy, C1-C6-Alkylthio, Cyclopentyloxy, Cyclohexyloxy, Cyclopentylthio, Cyclohexylthio, (C2-C5-Alkenyl)-methoxy, (C2-C5-Alkenyl)-methylthio, (C2-C5-Alkinyl)-methoxy, C1-C3-Alkylsulfoxyl, C1-C6-Alkylsulfonyl, C1-C3-Alkylsulfonyloxy oder Cyclohexylsulfonyl bedeutet ; und R6 für Halogen steht.
- Besonders bevorzugte Einzelsubstanzen sind z. B. :
- N-(3'-Chlor-2',6'-dinitro-4'-trifluormethylphenyl)-4-amino-2,6-dichlor-pyrimidin ; (Nr. 1.1)
- N-(2',4'-Dinitro-6'-trifluormethylphenyl)-4-amino-2,6-dichlorpyrimidin ; (Nr. 2.1)
- N-(3'-Chlor-2',6'-dinitro-4'-trifluormethylphenyl)-4-amino-6-chlor-2-methylmercapto-pyrimidin ; (Nr. 1.5)
- N-(2',6')-Dinitro-4'-trifluormethylphenyl)-4-amino-6-chlor-2-methylmercapto-pyrimidin ; (Nr. 7.32)
- N-(3'-Chlor-2',6'-dinitro-4'-trifluormethylphenyl)-4-amino-6-chlor-2-methoxy-pyrimidin ; (Nr. 1.4)
- N-(3'-Chlor-2',6'-dinitro-4'-trifluormethylphenyl)-4-amino-6-chlor-2-ethoxy-pyrimidin ; (Nr. 1.12)
- N-(3'-Chlor-2',6'-dinitro-4'-trifluormethylphenyl)-4-amino-6-chlor-2-ethylmercapto-pyrimidin ; (Nr. 1.63)
- N-(3'-Chlor-2',6'-dinitro-4'-trifluormethylphenyl)-4-amino-6-chlor-2-sek.butylmercapto-pyrimidin ; (Nr. 1.80)
- N-(2',6'-Dinitro-4'-trifluormethylphenyl)-4-amino-2,6-dichlorpyrimidin ; (Nr. 7.1)
- N-(2',4'-Dinitro-6'-trifluormethylphenyl)-4-amino-2-methoxy-6-chlorpyrimidin ; (Nr. 2.7)
- N-(2',4'-Dinitro-6'-trifluormethylphenyl)-4-amino-2-ethoxy-6-chlorpyrimidin ; (Nr. 2.6).
- Die Verbindungen der Formel I werden erfindungsgemäss dadurch hergestellt, dass man eine Verbindung der Formel II
- N-acyliert, wobei die Substituenten R1 bis R7 die unter Formel I angegebenen Bedeutungen haben und X und Y für NH2 oder Halogen stehen, wobei in dem Fall, in dem X für Halogen steht, Y NH2 bedeutet und in dem Fall in dem X für NH2 steht, Y Halogen bedeutet.
- Für die Herstellung der Verbindungen der Formel I bzw. I' sind folgende Reaktionsbedingungen vorteilhaft :
- Die N-Alkylierung von (II) mit (III) zu (I'), sowie die N-Acylierung von (I') mit (IV) zu (I) erfolgen unter Halogenwasserstoffabspaltung. Die Reaktionstemperaturen liegen bei der N-Alkylierung zwischen -20° und 150 °C, vorzugsweise -20° und + 30°C, bei der N-Acylierung zwischen 0° und + 180°C, vorzugsweise 0° und 150 °C bzw. am Siedepunkt des Lösungsmittels bzw. Lösungsmittelgemisches. In beiden Fällen ist die Verwendung von säurebindenden Mitteln bzw. Kondensationsmitteln vorteilhaft. Als solche kommen organische und anorganische Basen in Betracht, z. B. tertiäre Amine wie Trialkylamine (Trimethylamin, Triethylamin, Tripropylamin usw.), Pyridin und Pyridinbasen (4-Dimethylaminopyridin, 4-Pyrrolidylaminopyridin usw.), Oxide und Hydroxide, Carbonate und Hydrogencarbonate von Alkali- und Erdalkalimetallen sowie Alkaliacetate.
- Die Reaktionen können in Anwesenheit von reaktionsinerten Lösungs- oder Verdünnungsmitteln durchgeführt werden. In Frage kommen beispielsweise aliphatische und aromatische Kohlenwasserstoffe wie Benzol, Toluol, Xylole, Petrolether ; halogenierte Kohlenwasserstoffe wie Chlorbenzol, Methylenchlorid, Ethylenchlorid, Chloroform, Tetrachlorkohlenstoff, Tetrachlorethylen ; Ether und etherartige Verbindungen wie Dialkylether (Diethylether, Diisopropylether, tert.-Butylmethylether usw.), Anisol, Dioxan, Tetrahydrofuran ; Nitrile wie Acetonitril, Propionitril ; N,N-dialkylierte Amide wie Dimethylformamid ; Dimethylsulfoxid ; Ketone wie Aceton, Diethylketon, Methylethylketon und Gemische solcher Lösungsmittel untereinander.
- Die Reaktion (11) und (III) kann auch in einem wässrigen Zweiphasensystem nach dem allgemein bekannten Prinzip der Phasentransferkatalyse durchgeführt werden.
- Für die organische, mit Wasser nicht mischbare Phase kommen dabei z. B. folgende Lösungsmittel in Frage : Aliphatische und aromatische Kohlenwasserstoffe, wie Pentan, Hexan, Cyclohexan, Petrolether, Ligroin, Benzol, Toluol, Xylole usw., halogenierte Kohlenwasserstoffe, wie Dichlormethan, Chloroform, Tetrachlorkohlenstoff, Ethylendichlorid, 1,2-Dichlorethan, Tetrachlorethylen usw. oder aliphatische Ether, wie Diethylether, Diisopropylether, t-Butylmethylether usw.. Beispiele geeigneter Phasentransfer-Katalysatoren sind : Tetraalkylammoniumhalogenide, -hydrogensulfate oder -hydroxide wie Tetrabutylammoniumchlorid, -bromid, -jodid ; Triethylbenzylammoniumchlorid, -bromid ; Tetrapropylammoniumchlorid, -bromid, -jodid ; usw. Als Phasentransfer-Katalysatoren kommen auch Phosphonium-Salze in Betracht. Die Reaktionstemperaturen liegen im allgemeinen zwischen -30° und 130 °C, bzw. am Siedepunkt des Lösungsmittels oder Lösungsmittelgemisches.
- Im übrigen kann bei der Herstellung aller hierin genannten Ausgang-, Zwischen- und Endprodukte können grundsätzlich, sofern nicht ausdrücklich im einzelnen spezifiziert, ein oder mehrere reaktionsinerte Lösungs- oder Verdünnungsmittel anwesend sein. In Frage kommen beispielsweise aliphatische und aromatische Kohlenwasserstoffe wie Benzol, Toluol, Xylole, Petrolether ; halogenierte Kohlenwasserstoffe wie Chlorbenzol, Methylenchlorid, Ethylenchlorid, Chloroform, Tetrachlorkohlenstoff, Tetrachlorethylen ; Ether und etherartige Verbindungen wie Dialkylether (Diethylether, Diisopropylether, tert.-Butylmethylether usw.), Anisol, Dioxan, Tetrahydrofuran ; Nitrile wie Acetonitril, Propionitril ; N,N-dialkylierte Amide wie Dimethylformamid ; Dimethylsulfoxid ; Ketone wie Aceton, Diethylketon, Methylethylketon und Gemische solcher Lösungsmittel untereinander. In manchen Fällen kann es auch von Vorteil sein, wenn die Reaktion oder Teilschritte einer Reaktion unter Schutzgasatmosphäre und/oder absoluten Lösungsmitteln durchgeführt werden. Als Schutzgase eignen sich inerte Gase wie Stickstoff, Helium, Argon oder in gewissen Fällen auch Kohlendioxid.
- Das beschriebene Herstellungsverfahren ist, einschliesslich aller Teilschritte, ein wichtiger Bestandteil der vorliegenden Erfindung.
- In der britischen Patentschrift Nr 1 388 825 werden heterocyclische Verbindungen, darunter auch Pyrimidinderivate. als Schädlingsbekämpfungsmittel, z. B. auch zur Bekämpfung phytopathogener Mikroorganismen, beschrieben.
- Es wurde überraschend festgestellt, dass Verbindungen der Formel ein für praktische Bedürfnisse sehr günstiges Mikrobizid-Spektrum gegen phytopathogene Pilze und Bakterien aufweisen. Sie besitzen sehr vorteilhafte kurative, systemische und insbesondere präventive Eigenschaften und lassen sich zum Schutz von zahlreichen Kulturpflanzen einsetzen. Mit den Wirkstoffen der Formel I können an Pflanzen oder an Pflanzenteilen (Früchte, Blüten, Laubwerk, Stengel, Knollen, Wurzeln) von unterschiedlichen Nutzkulturen die auftretenden Mikroorganismen eingedämmt oder vernichtet werden, wobei auch später zuwachsende Pflanzenteile von derartigen Mikroorganismen verschont bleiben.
- Die Wirkstoffe der Formel sind gegen die den folgenden Klassen angehörenden phytopathogenen Pilze wirksam : Fungi imperfecti (z. B. Botrytis, Helminthosporium, Fusarium Septoria, Cercospora und Alternaria) ; Basidiomyceten (z. B. die Gattungen Hemileia, Rhizocotonia, Puccinia) ; insbesondere wirken sie gegen die Klasse der Ascomyceten (z. B. Venturia, Podosphaera, Erysiphe, Monilinia, Uncinula). Ueberdies wirken die Verbindungen der Formel I systemisch. Sie können ferner als Beizmittel zur Behandlung von Saatgut (Früchte, Knollen, Körner) und Pflanzenstecklingen zum Schutz von Pilzinfektionen sowie gegen im Erdboden auftretende phytopathogene Pilze eingesetzt werden.
- Die Erfindung betrifft somit auch mikrobizide Mittel sowie die Verwendung der Verbindungen der Formel zur Bekämpfung phytopathogener Mikroorganismen, insbesondere pflanzenschädigender Pilze bzw. die präventive Verhütung eines Befalls an Pflanzen.
- Darüberhinaus schliesst die vorliegende Erfindung auch die Herstellung agrochemischer Mittel ein, die gekennzeichnet ist durch das innige Vermischen der Aktivsubstanz mit einem oder mehreren hierin beschriebenen Substanzen bzw. Substanzgruppen. Eingeschlossen ist auch ein Verfahren zur Behandlung von Pflanzen, das sich durch Applikation der Verbindungen der Formel 1 bzw. der neuen Mittel auszeichnet.
- Als Zielkulturen für die hierin offenbarten Indikationsgebiete gelten im Rahmen dieser Erfindung beispielsweise folgende Pflanzenarten : Getreide ; (Weizen, Gerste, Roggen, Hafer, Reis, Sorghum und Verwandte) ; Rüben : (Zucker- und Futterrüben) ; Kern-, Stein- und Beerenobst : (Aepfel, Birnen, Pflaumen, Pfirsiche, Mandeln, Kirschen, Erd-, Hirn- und Brombeeren) ; Hülsenfrüchte : (Bohnen, Linsen, Erbsen, Soja) ; Oelkulturen : (Raps, Senf, Mohn, Oliven, Sonnenblumen, Kokos, Rizinus, Kakao, Erdnüsse) ; Gurkengewächse : (Kürbis, Gurken, Melonen) ; Fasergewächse : (Baumwolle, Flachs, Hanf, Jute) ; Citrusfrüchte : (Orangen, Zitronen, Pampelmusen, Mandarinen) ; Gemüsesorten : (Spinat, Kopfsalat, Spargel, Kohlarten, Möhren, Zwiebeln, Tomaten, Kartoffeln, Paprika) ; Lorbeergewächse : (Avocado, Cinnamonum, Kampfer) oder Pflanzen wie Mais, Tabak, Nüsse, Kaffee, Zuckerrohr, Tee, Weinreben, Hopfen, Bananen- und Naturkautschukgewächse sowie Zierpflanzen (Compositen).
- Wirkstoffe der Formel I werden üblicherweise in Form von Zusammensetzungen verwendet und können gleichzeitig oder nacheinander mit weiteren Wirkstoffen auf die zu behandelnde Fläche oder Pflanze gegeben werden. Diese weiteren Wirkstoffe können sowohl Düngemittel, Spurenelement-Vermittler oder andere das Pflanzenwachstum beeinflussende Präparate sein. Es können aber auch selektive Herbizide, Insektizide. Fungizide, Bakterizide, Nematizide, Molluskizide oder Gemische mehrerer dieser Präparate sein, zusammen mit gegebenenfalls weiteren in der Formulierungstechnik üblichen Trägerstoffen, Tensiden oder anderen applikationsfördernden Zusätzen.
- Geeignete Träger und Zusätze können fest oder flüssig sein und entsprechen den in der Formulierungstechnik zweckdienlichen Stoffen, wie z. B. natürlichen oder regenerierten mineralischen Stoffen, Lösungs-, Dispergier-, Netz-, Haft-, Verdickungs-, Binde- oder Düngemitteln.
- Ein bevorzugtes Verfahren zum Aufbringen eines Wirkstoffes der Formel I bzw. eines agrochemischen Mittels, das mindestens einen dieser Wirkstoffe enthält, ist das Aufbringen auf das Blattwerk (Blattapplikation). Anzahl der Applikationen und Aufwandmenge richten sich dabei nach dem Befallsdruck für den entsprechenden Erreger (Pilzsorte). Die Wirkstoffe der Formel I können aber auch über den Erdboden durch das Wurzelwerk in die Pflanze gelangen (systemische Wirkung), indem man den Standort der Pflanze mit einer flüssigen Zubereitung tränkt oder die Substanzen in fester Form in den Boden einbringt, z. B. in Form von Granulat (Bodenapplikation). Die Verbindungen der Formel I können aber auch auf Samenkörner aufgebracht werden (Coating), indem man die Körner entweder mit einer flüssigen Zubereitung des Wirkstoffs tränkt oder sie mit einer festen Zubereitung beschichtet. Darüberhinaus sind in besonderen Fällen weitere Applikationsarten möglich, so z. B. die gezielte Behandlung der Pflanzenstengel oder der Knospen.
- Die Verbindungen der Formel I werden dabei in unveränderter Form oder vorzugsweise zusammen mit den in der Formulierungstechnik üblichen Hilfsmittel eingesetzt und werden daher z. B. zu Emulsionskonzentraten, streichfähigen Pasten, direkt versprühbaren oder verdünnbaren Lösungen, verdünnten Emulsionen, Spritzpulvern, löslichen Pulvern, Stäubemitteln, Granulaten, durch Verkapselungen in z. B. polymeren Stoffen in bekannter Weise verarbeitet. Die Anwendungsverfahren wie Versprühen, Vernebeln, Verstäuben, Verstreuen, Bestreichen oder Giessen werden gleich wie die Art der Mittel den angestrebten Zielen und den gegebenen Verhältnissen entsprechend gewählt. Günstige Aufwandmengen liegen im allgemeinen bei 50 g bis 5 kg Aktivsubstanz (AS) je ha ; bevorzugt 100 g bis 2 kg AS/ha, insbesondere bei 200 g bis 600 g AS/ha.
- Die Formulierungen d. h. die den Wirkstoff der Formel und gegebenenfalls einen festen oder flüssigen Zusatzstoff enthaltenden Mittel, Zubereitungen oder Zusammensetzungen werden in bekannter Weise hergestellt, z. B. durch inniges Vermischen und/oder Vermahlen der Wirkstoffe mit Streckmitteln. wie z. B. mit Lösungsmitteln, festen Trägerstoffen, und gegebenenfalls oberflächenaktiven Verbindungen (Tensiden).
- Als Lösungsmittel können in Frage kommen : Aromatische Kohlenwasserstoffe, bevorzugt die Fraktionen C8 bis C12, wie z. B. Xylolgemische oder substituierte Naphthaline, Phthalsäureester wie Dibutyl- oder Dioctylphthalat, aliphatische Kohlenwasserstoffe wie Cyclohexan oder Paraffine, Alkohole und Glykole sowie deren Ether und Ester, wie Ethanol, Ethylenglykol, Ethylenglykolmonomethyl- oder Ethylether, Ketone wie Cyclohexanon, stark polare Lösungsmittel wie N-Methyl-2-pyrrolidon, Dimethylsulfoxid oder Dimethylformamid, sowie gegebenenfalls epoxydierte Pflanzenöle wie epoxydiertes Kokosnussöl oder Sojaöl ; oder Wasser.
- Als feste Trägerstoffe, z. B. für Stäubemittel und dispergierbare Pulver, werden in der Regel natürliche Gesteinsmehle verwendet, wie Calcit, Talkum, Kaolin, Montmorillonit oder Attapulgit. Zur Verbesserung der physikalischen Eigenschaften können auch hochdisperse Kieselsäure oder hochdisperse saugfähige Polymerisate zugesetzt werden. Als gekörnte, adsorptive Granulatträger kommen poröse Typen wie z. B. Bimsstein, Ziegelbruch, Sepiolit oder Bentonit, als nicht sorptive Trägermaterialien z. B. Calcit oder Sand in Frage. Darüberhinaus kann eine Vielzahl von vorgranulierten Materialien anorganischer oder organischer Natur wie insbesondere Dolomit oder zerkleinerte Pflanzenrückstände verwendet werden. Besonders vorteilhafte, applikationsfördernde Zuschlagstoffe, die zu einer starken Reduktion der Aufwandmenge führen können, sind ferner natürliche (tierische oder pflanzliche) oder synthetische Phospholipide aus der Reihe der Kephaline und Lecithine, wie z. B. Phosphatidylethanolamin, Phosphatidylserin, Phosphatidylcholin, Sphingomyelin, Phosphatidylinosit, Phosphatidylglycerin, Lysolecithin, Plasmalogene oder Cardiolipin, die man beispielsweise aus tierischen oder pflanzlichen Zellen, insbesondere aus Hirn. Herz, Leber,- Eidotter oder Sojabohnen gewinnen kann. Verwendbare Handelsmischungen sind z. B. Phosphatidylcholin-Mischungen. Synthetische Phospholipide sind z. B. Dioctanoylphosphatidylcholin und Dipalmitoylphosphatidylcholin.
- - Als oberflächenaktive Verbindungen kommen je nach Art des zu formulierenden Wirkstoffes der Formel I nichtionogene, kation- und/oder anionaktive Tenside mit guten Emulgier-, Dispergier- und Netzeigenschaften in Betracht. Unter Tensiden sind auch Tensidgemische zu verstehen.
- Geeignete anionische Tenside können sowohl sog. wasserlösliche Seifen, als auch wasserlösliche synthetische oberflächenaktive Verbindungen sein.
- Als Seifen seien die Alkali-, Erdalkali- oder gegebenenfalls substituierten Ammoniumsalze von höheren Fettsäuren (C10-C22), wie z. B. die Na- oder K-Salze der Oel- oder Stearinsäure, oder von natürlichen Fettsäuregemischen, die z. B. aus Kokosnuss- oder Talgöl gewonnen werden können. Ferner sind auch die Fettsäure-methyllaurinsalze zu erwähnen.
- Häufiger werden jedoch sog. synthetische Tenside verwendet, insbesondere Fettsulfonate, Fettsulfate, sulfonierte Benzimidazolderivate oder Alkylsulfonate.
- Die Fettsulfonate oder -sulfate liegen in der Regel als Alkali-, Erdalkali- oder gegebenenfalls substituierte Ammoniumsalze vor und weisen einen Alkalirest mit 8 bis 22 C-Atomen auf, wobei Alkyl auch den Alkylteil von Acylresten einschliesst, z. B. das Na- oder Ca-Salz der Ligninsulfonsäure, des Dodecylschwefelsäureesters oder eines aus natürlichen Fettsäuren hergestellten Fettalkoholsulfatgemisches. Hierher gehören auch die Salze der Schwefelsäureester und Sulfonsäuren von Fettalkohol-Ethylenoxyd-Addukten. Die sulfonierten Benzimidazolderivate enthalten vorzugsweise 2-Sulfonsäuregruppen und einen Fettsäurerest mit 8-22 C-Atomen. Alkylarylsulfonate sind z. B. die Na-, Ca- oder Triethanolaminsalze der Dodecylbenzolsulfonsäure, der Dibutylnaphthalinsulfonsäure, oder eines Naphthalinsulfonsäure-Formaldehydkondensationsproduktes.
- Ferner kommen auch entsprechende Phosphate wie z. B. Salze des Phosphorsäureesters eines p-Nonylphenol-(4-14)-Ethylenoxyd-Adduktes in Frage.
- Als nichtionische Tenside kommen in erster Linie Polyglykoletherderivate von aliphatischen oder cycloaliphatischen Alkoholen, gesättigten oder ungesättigten Fettsäuren und Alkylphenolen in Frage, die 3 bis 30 Glykolethergruppen und 8 bis 20 Kohlenstoffatome im (aliphatischen) Kohlenwasserstoffrest und 6 bis 18 Kohlenstoffatome im Alkylrest der Alkylphenole enthalten können.
- Weitere geeignete nichtionische Tenside sind die wasserlöslichen, 20 bis 250 Aethylenglykoläthergruppen und 10 bis 100 g Propylenglykolethergruppen enthaltenden Polyethylenoxidaddukte an Polypropylenglykol, Aethylendiaminopolypropylenglykol und Alkylpolypropylenglykol mit 1 bis 10 Kohlenstoffatomen in der Alkylkette. Die genannten Verbindungen enthalten üblicherweise pro Propylenglykoi-Einheit 1 bis 5 Ethylenglykoleinheiten.
- Als Beispiele nichtionischer Tenside seien Nonylphenolpolyethoxyethanole. Ricinusölpolyglykolether, Polypropylen-Polyethylenoxydaddukte, Tributylphenoxypolyethylenethanol, Polyethylenglykol und Octylphenoxypolyethoxyethanol erwähnt.
- Ferner kommen auch Fettsäureester von Polyoxyethylensorbitan wie das Polyoxyethylensorbitantrioleat in Betracht.
- Bei den kationischen Tensiden handelt es sich vor allem um quartäre Ammoniumsalze, welche als N-Substituenten mindestens einen Alkylrest mit 8 bis 22 C-Atomen enthalten und als weitere Substituenten niedrige, gegebenenfalls halogenierte Alkyl-, Benzyl- oder niedrige Hydroxyalkylreste aufweisen. Die Salze liegen vorzugsweise als Halogenide, Methylsulfate oder Ethylsulfate vor, z. B. das Stearyltrimethylammoniumchlorid oder das Benzyldi(2-chlorethyl) ethylammoniumbromid.
- Die in der Formulierungstechnik gebräuchlichen Tenside sind u. a. in folgenden Publikationen beschrieben :
- « Mc Cutcheon's Detergents and Emulsifiers Annual BC Publishing Corp., Ringwood New Jersey, 1980 Sisely and Wood, « Encyclopedia of Surgace Active Agents •, Chemical Publishing Co., lnc. New York, 1980.
- Die agrochemischen Zubereitungen enthalten in der Regel 0,1 bis 99 %, insbesondere 0,1 bis 95 % Wirkstoff der Formel I, 99,9 bis 1 %, insbesondere 99,8 bis 5 % eines festen oder flüssigen Zusatzstoffes und 0 bis 25 %, insbesondere 0,1 bis 25 % eines Tensides.
- Während als Handelsware eher konzentrierte Mittel bevorzugt werden, verwendet der Endverbaucher in der Regel verdünnte Mittel.
- Die Mittel können auch weitere Zusätze wie Stabilisatoren, Entschäumer, Viskositätsregulatoren, Bindemittel, Haftmittel sowie Dünger oder andere Wirkstoffe zur Erzielung spezieller Effekte enthalten.
- Derartige agrochemische Mittel sind ein Bestandteil der vorliegenden Erfindung.
- Die nachfolgenden Beispiele dienen zur näheren Erläuterung der Erfindung, ohne dieselbe einzuschränken. Temperaturen sind in Celsiusgraden angegeben. Prozente und Teile beziehen sich auf das Gewicht.
-
- Eine Lösung von 19,1 Teilen 2,6-Dichlor-4-amino-pyrimidin in 430 ml Tetrahydrofuran wird bei Raumtemperatur unter Rühren portionsweise mit 16,5 Teilen 85 %igem, pulverisiertem Kaliumhydroxid versetzt, wobei die Temperatur innerhalb einer halben Stunde auf ca. 24 °C ansteigt. Das Reaktionsgemisch wird auf 0 °C abgekühlt, und zu der beigen Suspension werden innerhalb von 1 Stunde 35,4 Teile 2,4-Dichlor-3,5-dinitro-benzotrifluorid in 120 ml Tetrahydrofuran zugetropft, wobei sich die Suspension rot verfärbt. Nach 14 stündigem Rühren bei Raumtemperatur wird das Reaktionsgemisch auf Eiswasser gegossen, mit 15 ml konzentrierter Salzsäure angesäuert und zweimal mit je 300 ml Essigsäureethylester extrahiert. Die vereinigten Extrakte werden zweimal mit je 100 ml Wasser gewaschen, über Natriumsulfat getrocknet, filtriert und eingedampft. Der ölige Rückstand wird durch Zusatz von Petrolether zur Kristallisation gebracht und nach dem Abfiltrieren aus Chloroform umkristallisiert. Man erhält beige Kristalle mit Smp. 174-177 °C.
-
- Zu einer Lösung von 8,2 Teilen 2,6a-Dichlor-4-amino-pyrimidin in 200 ml absolutem Tetrahydrofuran werden 7,24 Teile 85 %iges, pulverisiertes Kaliumhydroxid gegeben. Das Gemisch wird auf 0 °C abgekühlt und unter Rühren portionsweise innerhalb von einer Stunde mit 13,5 Teilen 2-Chlor-3,5-dinitro- benzotrifluorid in 100 ml absolutem Tetrahydrofuran versetzt ; dabei schlägt die Farbe der Reaktionslösung von gelb nach rot um. Nach 12 stündigem Rühren wird die Reaktionslösung auf 500 ml Eiswasser gegossen, mit 8 ml konzentrierter Salzsäure angesäuert und zweimal mit je 200 ml Essigsäureethylester extrahiert. Die vereinigten Extrakte werden mit 50 ml Wasser gewaschen, über Natriumsulfat getrocknet, filtriert und eingedampft. Das Rohprodukt wird aus Methanol umkristallisiert. Smp. 198-200 °C.
-
- 7,9 Teile fein pulverisiertes, 85 %iges Kaliumhydroxid werden in 70 ml Dimethylsulfoxid gelöst. Dazu wird eine Lösung von 17,6 Teilen 4-Amino-6-chlor-2-methylmercaptopyrimidin in 80 ml Dimethylsulfoxid bei ca. 15 °C zugetropft und das Reaktionsgemisch eine halbe Stunde bei Raumtemperatur gerührt. Anschliessend werden bei ca. 115 °C 30,5 Teile 1,3-Dichlor-2,6-dinitro-4-trifluormethylbenzol in 100 ml Dimethylsulfoxid zugetropft, das Reaktionsgemisch über Nacht bei Raumtemperatur gerührt, dann auf 2 Liter Eiswasser gegossen und mit Essigsäureethylester extrahiert. Die vereinigten Extrakte werden mehrmals mit Wasser gewaschen, über Natriumsulfat getrocknet, filtriert und eingeengt. Das Rohprodukt wird säulenchromatographisch (Kieseigel/Dichlormethan) gereinigt. Ausbeute 22,3 Teile, Smp. 171-175°C.
- Auf.analoge Weise werden auch die nachfolgend aufgeführten Substanzen der Formel I hergestellt :
-
-
-
-
-
- Durch inniges Vermischen auf Trägerstoffe mit dem Wirkstoff erhält man gebauchsfertige Stäubemittel.
-
-
-
-
-
-
- Der fein gemahlene Wirkstoff wird mit den Zusatzstoffen innig vermischt. Man erhält so ein Suspensions-Konzentrat, aus welchem durch Verdünnen mit Wasser Suspensionen jeder gewünschten Konzentration hergestellt werden können.
- Weizenpflanzen wurden 6 Tage nach der Aussaat mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,02 % Aktivsubstanz) besprüht. Nach 24 Stunden wurden die behandelten Pflanzen mit einer Uredosporensuspension des Pilzes infiziert. Nach einer Inkubation während 48 Stunden bei 95-100 % relativer Luftfeuchtigkeit und ca. 20 °C wurden die infizierten Pflanzen in einem Gewächshaus bei ca. 22 °C aufgestellt. Die Beurteilung der Rostpustelnentwicklung erfolgte 12 Tage nach der Infektion.
- Zu Weizenpflanzen wurden 5 Tage nach Aussaat eine aus Spritzpulver des Wirkstoffes hergestellte Spritzbrühe gegossen, (0.006% Aktivsubstanz bezogen auf das Bodenvolumen). Nach 48 Stunden wurden die behandelten Pflanzen mit einer Uredosporensuspension des Pilzes infiziert. Nach einer Inkubation während 48 Stunden bei 95-100 % relativer Luftfeuchtigkeit und ca. 20 °C wurden die infizierten Pflanzen in einem Gewächshaus bei ca. 22 °C aufgestellt. Die Beurteilung der Rostpustelnentwicklung erfolgte 12 Tage nach der Infektion.
- Verbindungen aus den Tabellen 1, 2 und 7, insbesondere Verbindungen der Gruppen Ib und Id zeigten gegen Puccinia-Pilze eine sehr gute Wirkung. Ungebhandelte aber infizierte Kontrollpflanzen zeigten einen Puccinia-Befall von 100 %. Unter anderen hemmten die Verbindungen 1.1, 1.4, 1.5, 1.8, 2.1, 2.2, 2.5, 2.6, 2.7, 2.8, 2.12, 2.27, 2.32, 2.40, 2.42, 2.49, 7.2, 7.5 und 7.32 den Puccinia-Befall auf 0 bis 5 %.
- 10-15 cm hohe Erdnusspflanzen wurden mit einer aus Spritzpulver der Wirksubstanz hergestellten Spritzbrühe (0,006 Aktivsubstanz). besprüht und 48 Stunden später mit einer Konidiensuspension des Pilzes infiziert. Die infizierten Pflanzen wurden während 72 Stunden bei ca. 21 °C und hoher Luftfeuchtigkeit inkubiert und anschliessend bis zum Auftreten der typischen Blattflecken in einem Gewächshaus aufgestellt.
- Die Beurteilung der fungiziden Wirkung erfolgt 12 Tage nach der Infektion basierend auf Anzahl und Grösse der auftretenden Flecken.
- Im Vergleich zu unbehandelten, aber infizierten Kontrollpflanzen (Anzahl und Grösse der Flecken = 100 %), zeigten Erdnusspflanzen, die mit Wirkstoffen aus den Gruppen Ib und Id behandelt wurden, einen stark reduzierten Cercospora-Befall. So verhinderten die Verbindungen 1.1, 1.4, 1.5, 1.8, 1.63, 1.80, 2.2, 2.3, 2.32, 2.40, 7.1 und 7.32 in obigen Versuchen das Auftreten von Flecken fast vollständig (0-10%).
- Ca. 8 cm hohe Gerstenpflanzen wurden mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,002 % Aktivsubstanz) besprüht. Nach 3-4 Stunden wurden die behandelten Pflanzen mit Konidien des Pilzes bestäubt. Die infizierten Gerstenpflanzen wurden in einem Gewächshaus bei ca. 22 °C aufgestellt und der Pilzbefall nach 10 Tagen beurteilt.
- Zu ca. 8 cm hohen Gerstenpflanzen wurde eine aus Spritzpulver des Wirkstoffes hergestellte Spritzbrühe gegossen (0,006 % Aktivsubstanz bezogen auf das Erdvolumen). Es wurde dabei darauf geachtet, dass die Spritzbrühe nicht mit den oberirdischen Pflanzenteilen in Berührung kam. Nach 48 Stunden wurden die behandelten Pflanzen mit Konidien des Pilzes bestäubt. Die infizierten Gerstenpflanzen wurden in einem Gewächshaus bei ca. 22 °C aufgestellt und der Pilzbefall nach 10 Tagen beurteilt.
- Verbindungen der Formel I, insbesondere die aus den Gruppen Ib und Id, zeigten gute Wirkung gegen Erysiphe-Pilze. Unbehandelte, aber infizierte Kontrollpflanzen zeigten einen Erysiphe-Befall von 100 %. Unter anderen Verbindungen aus den Tabellen hemmten den Pilzbefall bei Gerste auf weniger als 30 %, so z. B. die Verbindungen 7.1, 7.5 und 7.12.
- Apfelstecklinge mit 10-20 cm langen Frischtrieben wurden mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,006 % Aktivsubstanz) besprüht. Nach 24 Stunden wurden die behandelten Pflanzen mit einer Konidiensuspension des Pilzes infiziert. Die Pflanzen wurden dann während 5 Tagen bei 90-100 % relativer Luftfeuchtigkeit inkubiert und während 10 weiteren Tagen in einem Gewächshaus bei 20-24 °C aufgestellt. Der Schorfbefall wurde 15 Tage nach der Infektion beurteilt. Verbindungen aus den Tabellen hemmten den Krankheitsbefall auf weniger als 25 %, so z. B. die Verbindungen 1.4. 1.5 und 1.12. Unbehandelte aber infizierte Kontrolltriebe wurden dagegen 100 %ig befallen.
- Ca. 10 cm hohe Bohnen-Pflanzen wurden mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,02 % Aktivsubstanz) besprüht. Nach 48 Stunden wurden die behandelten Pflanzen mit einer Konidiensuspension des Pilzes infiziert. Nach einer Inkubation der infizierten Pflanzen während 3 Tagen bei 95-100 % relativer Luftfeuchtigkeit und 21 °C erfolgte die Beurteilung des Pilzbefalls. Die Verbindungen aus der Tabelle hemmten in vielen Fällen die Pilzinfektion sehr stark. Bei einer Konzentration von 0,02 % erwiesen sich die Verbindungen aus den Tabellen 1, 2 und 7, so z. B. die Verbindungen 1.1, 1.4, 1.5, 1.8, 1,12, 7.1 und 7.32 als voll wirksam. Der Krankheitsbefall lag bei 0 bis 8 %. Der Botrytis-Befall unbehandelter ber infizierter Bohnenpflanzen betrug 100 %.
- Tomatenpflanzen wurden nach 3-wöchiger Anzucht mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,06 % Aktivsubstanz) besprüht. Nach 24 Stunden wurden die behandelten Pflanzen mit einer Sporangiensuspension des Pilzes infiziert. Die Beurteilung des Pilzbefalls erfolgte nach einer Inkubation der infizierten Pflanzen während 5 Tagen bei 90-100 % relativer Luftfeuchtigkeit und 20 °C.
- Zu Tomatenpflanzen wurde nach 3-wöchiger Anzucht eine aus Spritzpulver des Wirkstoffes hergestellte Spritzbrühe gegossen (0,06 % Aktivsubstanz bezogen auf das Erdvolumen). Es wurde dabei darauf geachtet, dass die Spritzbrühe nicht mit den oberirdischen Pflanzenteilen in Berührung kam. Nach 48 Stunden wurden die behandelten Pflanzen mit einer Sporangiensuspension des Pilzes infiziert. Die Beurteilung des Pilzbefalls erfolgte nach einer Inkubation der infizierten Pflanzen während 5 Tagen bei 90-100 % relativer Luftfeuchtigkeit und 20 °C.
- Insbesondere Verbindungen aus den Untergruppen Ib und Id zeigten in obigen Versuchen eine sehr gute systemische Wirkung, so z. B. die Verbindungen Nr. 1.1, 1.2, 1.4, 1.5, 1.7, 1.8, 1.12, 1.16, 1.20, 1.37, 1.49, 1.57, 1.74, 1.80, 1.84, 2.1, 2.2, 2.5, 2.6, 2.7, 2.8, 2.27, 2.32, 2.49, 2.55, 4.4, 7.7 und 7.32. Gegenüber unbehandelten Kontrollpflanzen (100% Befall) bewirkten diese Verbindungen eine fast vollständige Unterdrückung des Pilzbefalls (0 bis 5 %).
- Im 4-5 Blattstadium wurden Rebensämlinge mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,06 % Aktivsubstanz) besprüht. Nach 24 Stunden wurden die behandelten Pflanzen mit einer Sporangiensuspension des Pilzes infiziert. Nach einer Inkubation während 6 Tagen bei 95-100 % relativer Luftfeuchtigkeit und 20 °C wurde der Pilzbefall beurteilt.
- Im 4-5 Blattstadium wurden Rebensämlinge mit einer Sporangiensuspension des Pilzes infiziert. Nach einer Inkubation während 24 Stunden in einer Feuchtkammer bei 95-100 % relativer Luftfeuchtigkeit und 20 °C wurden die infizierten Pflanzen getrocknet und mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,06 % Aktivsubstanz) besprüht. Nach dem Antrocknen des Spritzbelages wurden die behandelten Pflanzen wieder in die Feuchtkammer gebracht. Die Beurteilung des Pilzbefalls erfolgte 6 Tage nach der Infektion.
- Verbindungen aus den Tabellen 1, 2 und 7 zeigten gegen Plasmopara viticola auf Regen eine sehr gute fungizide Wirkung, insbesondere die Wirkstoffe Nr. 1.1, 1.4, 1.5, 1.8 und 7.32 bewirkten eine vollständige Minderung des Pilzbefalls (0 bis 5%).
- Reispflanzen wurden nach zweiwöchiger Anzucht mit einer aus Spritzpulver des Wirkstoffes hergestellten Spritzbrühe (0,02% Aktivsubstanz) besprüht. Nach 48 Stunden wurden die behandelten Pflanzen mit einer Konidiensuspension des Pilzes infiziert. Nach 5 Tagen Inkubation bei 95-100 % relativer Luftfeuchtigkeit und 24 °C wurde der Pilzbefall beurteilt.
- Reispflanzen, die mit einer Spritzbrühe behandelt worden sind, die als Aktivsubstanz eine der Verbindungen 1.1, 1.4, 1.5, 1.8 und 7.32 enthielt, zeigten im Vergleich zu unbehandelten Kontrollpflanzen (100 % Befall) weniger als 10 % Pilzbefall.
Claims (18)
N-acyliert, wobei die Substituenten R1 bis R7 die unter Formel I angegebenen Bedeutungen haben und X und Y für NH2 oder Halogen stehen, wobei in dem Fall, in dem X für Halogen steht, Y NH2 bedeutet und in dem Fall in dem X für NH2 steht, Y Halogen bedeutet.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AT84103804T ATE30721T1 (de) | 1983-04-08 | 1984-04-05 | N-(2-nitrophenyl)-4-aminopyrimidin-derivate als mikrobizide. |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CH1899/83 | 1983-04-08 | ||
| CH189983 | 1983-04-08 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0126254A1 EP0126254A1 (de) | 1984-11-28 |
| EP0126254B1 true EP0126254B1 (de) | 1987-11-11 |
Family
ID=4221193
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP84103804A Expired EP0126254B1 (de) | 1983-04-08 | 1984-04-05 | N-(2-Nitrophenyl)-4-aminopyrimidin-Derivate als Mikrobizide |
Country Status (26)
| Country | Link |
|---|---|
| US (1) | US4705790A (de) |
| EP (1) | EP0126254B1 (de) |
| JP (1) | JPS59205368A (de) |
| KR (1) | KR840008413A (de) |
| AT (1) | ATE30721T1 (de) |
| AU (1) | AU572130B2 (de) |
| BR (1) | BR8401620A (de) |
| CA (1) | CA1218369A (de) |
| CS (1) | CS241078B2 (de) |
| DD (1) | DD222768A5 (de) |
| DE (1) | DE3467348D1 (de) |
| DK (1) | DK130584A (de) |
| ES (1) | ES8505970A1 (de) |
| FI (1) | FI841301A7 (de) |
| GB (1) | GB2137991B (de) |
| GR (1) | GR79586B (de) |
| HU (1) | HU198697B (de) |
| IL (1) | IL71457A (de) |
| MA (1) | MA20083A1 (de) |
| NO (1) | NO841386L (de) |
| NZ (1) | NZ207767A (de) |
| PH (1) | PH20340A (de) |
| PL (1) | PL141641B1 (de) |
| PT (1) | PT78377B (de) |
| TR (1) | TR22056A (de) |
| ZA (1) | ZA842574B (de) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4505910A (en) * | 1983-06-30 | 1985-03-19 | American Home Products Corporation | Amino-pyrimidine derivatives, compositions and use |
| US4659363A (en) * | 1983-07-25 | 1987-04-21 | Ciba-Geigy Corporation | N-(2-nitrophenyl)-2-aminopyrimidine derivatives, the preparation and use thereof |
| DE3581570D1 (de) * | 1984-06-25 | 1991-03-07 | Ciba Geigy Ag | Pyrimidinderivate wirksam als schaedlingsbekaempfungsmittel. |
| DE3618353A1 (de) * | 1986-05-31 | 1987-12-03 | Hoechst Ag | Schaedlingsbekaempfungsmittel auf der basis von aminopyrimidin-derivaten sowie neue aminopyrimidin-verbindungen |
| JPH0784445B2 (ja) * | 1986-12-03 | 1995-09-13 | クミアイ化学工業株式会社 | ピリミジン誘導体および農園芸用殺菌剤 |
| GR900100380A (el) * | 1989-05-20 | 1991-10-10 | Fisons Plc | Μέ?οδος παρασκευής αντι-φλεγμονωδών παραγώγων αμινοφενόλης. |
| KR910021383A (ko) * | 1990-02-27 | 1991-12-20 | 베그르 발데크 | N-(2, 6-디니트로-3-클로로-4-트리플루오로메틸페닐)-4-아미노-6-플루오로피리미딘 유도체 및 그의 제조방법 |
| DE4029648A1 (de) * | 1990-09-19 | 1992-03-26 | Hoechst Ag | 4-anilino-pyrimidine, verfahren zu ihrer herstellung, sie enthaltende mittel und ihre verwendung als fungizide |
| US5733932A (en) * | 1995-01-06 | 1998-03-31 | The Picower Institute For Medical Research | Compounds and methods of use to derivatize neighboring lysine residues in proteins under physiological conditions |
| US5574040A (en) * | 1995-01-06 | 1996-11-12 | Picower Institute For Medical Research | Pyrimidine compounds and methods of use to derivatize neighboring lysine residues in proteins under physiologic conditions |
| EP1871743A4 (de) * | 2005-04-11 | 2009-12-30 | Univ Murdoch | Antiparasitäre verbindungen |
| US9259535B2 (en) | 2006-06-22 | 2016-02-16 | Excelsior Medical Corporation | Antiseptic cap equipped syringe |
| US11229746B2 (en) | 2006-06-22 | 2022-01-25 | Excelsior Medical Corporation | Antiseptic cap |
| US8622995B2 (en) | 2009-10-26 | 2014-01-07 | Pursuit Vascular, Inc. | Method for delivery of antimicrobial to proximal end of catheter |
| US8622996B2 (en) | 2008-10-27 | 2014-01-07 | Pursuit Vascular, Inc. | Method for applying antimicrobial to proximal end of catheter |
| US9072868B2 (en) * | 2008-10-27 | 2015-07-07 | Pursuit Vascular, Inc. | Device for delivery of antimicrobial agent into trans-dermal catheter |
| US9078992B2 (en) | 2008-10-27 | 2015-07-14 | Pursuit Vascular, Inc. | Medical device for applying antimicrobial to proximal end of catheter |
| US10166381B2 (en) | 2011-05-23 | 2019-01-01 | Excelsior Medical Corporation | Antiseptic cap |
| CA2841832C (en) | 2011-07-12 | 2019-06-04 | Pursuit Vascular, Inc. | Device for delivery of antimicrobial agent into a trans-dermal catheter |
| ES2755352T3 (es) | 2014-05-02 | 2020-04-22 | Excelsior Medical Corp | Paquete en tira para tapón antiséptico |
| US20170280718A1 (en) * | 2014-09-10 | 2017-10-05 | The Regents Of The University Of California | Herbicidal and fungicidal compositions and their uses |
| AU2016262400B2 (en) | 2015-05-08 | 2021-01-21 | Icu Medical, Inc. | Medical connectors configured to receive emitters of therapeutic agents |
| PT3525865T (pt) | 2016-10-14 | 2022-11-17 | Icu Medical Inc | Tampas de higienização para conectores médicos |
| WO2018204206A2 (en) | 2017-05-01 | 2018-11-08 | Icu Medical, Inc. | Medical fluid connectors and methods for providing additives in medical fluid lines |
| US10525250B1 (en) | 2018-11-07 | 2020-01-07 | Pursuit Vascular, Inc. | Infusion device with antimicrobial properties |
| US11541221B2 (en) | 2018-11-07 | 2023-01-03 | Icu Medical, Inc. | Tubing set with antimicrobial properties |
| US11534595B2 (en) | 2018-11-07 | 2022-12-27 | Icu Medical, Inc. | Device for delivering an antimicrobial composition into an infusion device |
| US11541220B2 (en) | 2018-11-07 | 2023-01-03 | Icu Medical, Inc. | Needleless connector with antimicrobial properties |
| US11400195B2 (en) | 2018-11-07 | 2022-08-02 | Icu Medical, Inc. | Peritoneal dialysis transfer set with antimicrobial properties |
| US11517732B2 (en) | 2018-11-07 | 2022-12-06 | Icu Medical, Inc. | Syringe with antimicrobial properties |
| AU2019384564B2 (en) | 2018-11-21 | 2023-11-23 | Icu Medical, Inc. | Antimicrobial device comprising a cap with ring and insert |
| EP4255552A1 (de) | 2020-12-07 | 2023-10-11 | ICU Medical, Inc. | Peritonealdialysekappen, systeme und verfahren |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1388825A (en) * | 1971-03-19 | 1975-03-26 | Ici Ltd | Substituted amino pyrimidine compounds and pesticidal compo sitions thereof |
| US3906098A (en) * | 1971-03-19 | 1975-09-16 | Ici Ltd | Certain pyrimidine compounds useful against plant pests |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS57203072A (en) * | 1981-06-05 | 1982-12-13 | Sankyo Co Ltd | 4-anilinopyrimidine derivative, its preparation, antidepressant comprising it as active ingredient |
| IT1211096B (it) * | 1981-08-20 | 1989-09-29 | Lpb Ist Farm | Pirimidine e s.triazinici adattivita' ipolipidemizzante. |
-
1984
- 1984-02-29 DK DK130584A patent/DK130584A/da not_active Application Discontinuation
- 1984-04-02 MA MA20304A patent/MA20083A1/fr unknown
- 1984-04-02 FI FI841301A patent/FI841301A7/fi not_active Application Discontinuation
- 1984-04-02 GB GB08408407A patent/GB2137991B/en not_active Expired
- 1984-04-04 CS CS842604A patent/CS241078B2/cs unknown
- 1984-04-05 EP EP84103804A patent/EP0126254B1/de not_active Expired
- 1984-04-05 PH PH30504A patent/PH20340A/en unknown
- 1984-04-05 AT AT84103804T patent/ATE30721T1/de not_active IP Right Cessation
- 1984-04-05 ZA ZA842574A patent/ZA842574B/xx unknown
- 1984-04-05 DE DE8484103804T patent/DE3467348D1/de not_active Expired
- 1984-04-05 DD DD84261680A patent/DD222768A5/de not_active IP Right Cessation
- 1984-04-06 NZ NZ207767A patent/NZ207767A/en unknown
- 1984-04-06 CA CA000451480A patent/CA1218369A/en not_active Expired
- 1984-04-06 HU HU841355A patent/HU198697B/hu not_active IP Right Cessation
- 1984-04-06 PL PL1984247096A patent/PL141641B1/pl unknown
- 1984-04-06 NO NO841386A patent/NO841386L/no unknown
- 1984-04-06 TR TR22056A patent/TR22056A/xx unknown
- 1984-04-06 BR BR8401620A patent/BR8401620A/pt unknown
- 1984-04-06 IL IL71457A patent/IL71457A/xx unknown
- 1984-04-06 PT PT78377A patent/PT78377B/pt unknown
- 1984-04-06 GR GR74339A patent/GR79586B/el unknown
- 1984-04-06 AU AU26604/84A patent/AU572130B2/en not_active Ceased
- 1984-04-07 ES ES531393A patent/ES8505970A1/es not_active Expired
- 1984-04-07 JP JP59069888A patent/JPS59205368A/ja active Pending
- 1984-04-07 KR KR1019840001838A patent/KR840008413A/ko not_active Ceased
-
1985
- 1985-09-25 US US06/780,063 patent/US4705790A/en not_active Expired - Fee Related
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1388825A (en) * | 1971-03-19 | 1975-03-26 | Ici Ltd | Substituted amino pyrimidine compounds and pesticidal compo sitions thereof |
| US3906098A (en) * | 1971-03-19 | 1975-09-16 | Ici Ltd | Certain pyrimidine compounds useful against plant pests |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0126254A1 (de) | 1984-11-28 |
| MA20083A1 (fr) | 1984-12-31 |
| PL247096A1 (en) | 1985-03-12 |
| GB8408407D0 (en) | 1984-05-10 |
| DK130584D0 (da) | 1984-02-29 |
| KR840008413A (ko) | 1984-12-15 |
| IL71457A0 (en) | 1984-07-31 |
| PT78377B (en) | 1986-08-14 |
| ES531393A0 (es) | 1985-06-16 |
| GR79586B (de) | 1984-10-30 |
| IL71457A (en) | 1988-01-31 |
| NZ207767A (en) | 1987-07-31 |
| HU198697B (en) | 1989-11-28 |
| JPS59205368A (ja) | 1984-11-20 |
| FI841301A7 (fi) | 1984-10-09 |
| DD222768A5 (de) | 1985-05-29 |
| ES8505970A1 (es) | 1985-06-16 |
| PT78377A (en) | 1984-05-01 |
| BR8401620A (pt) | 1984-11-13 |
| AU572130B2 (en) | 1988-05-05 |
| DK130584A (da) | 1984-10-09 |
| PL141641B1 (en) | 1987-08-31 |
| CA1218369A (en) | 1987-02-24 |
| GB2137991B (en) | 1986-11-19 |
| TR22056A (tr) | 1986-02-18 |
| FI841301A0 (fi) | 1984-04-02 |
| US4705790A (en) | 1987-11-10 |
| ZA842574B (en) | 1984-12-24 |
| DE3467348D1 (de) | 1987-12-17 |
| GB2137991A (en) | 1984-10-17 |
| PH20340A (en) | 1986-12-04 |
| NO841386L (no) | 1984-10-09 |
| HUT34455A (en) | 1985-03-28 |
| ATE30721T1 (de) | 1987-11-15 |
| CS241078B2 (en) | 1986-03-13 |
| AU2660484A (en) | 1984-10-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0126254B1 (de) | N-(2-Nitrophenyl)-4-aminopyrimidin-Derivate als Mikrobizide | |
| EP0135472B1 (de) | N-(2-Nitrophenyl)-2-aminopyrimidin-Derivate, deren Herstellung und Verwendung | |
| EP0172786B1 (de) | Pyrimidinderivate wirksam als Schädlingsbekämpfungsmittel | |
| EP0332579B1 (de) | Mittel zum Schutz von Pflanzen gegen Krankheiten | |
| EP0206999B1 (de) | Mikrobizide Mittel | |
| EP0139613A1 (de) | N-(2-Nitrophenyl)-4-aminopyrimidin-Derivate, deren Herstellung und Verwendung | |
| EP0295210B1 (de) | Mikrobizide | |
| EP0276432A2 (de) | Schädlingsbekämpfungsmittel | |
| EP0470600B1 (de) | Naphthylalkylaminopyrimidin-Derivate, Verfahren zu ihrer Herstellung und diese enthaltende Schädlingsbekämpfungsmittel | |
| EP0388838A2 (de) | Schädlingsbekämpfungsmittel | |
| EP0198797B1 (de) | Schädlingsbekämpfungsmittel | |
| EP0133247B1 (de) | N-Aminomethyl-3-phenyl-4-cyanopyrrol-Derivate, deren Herstellung und Verwendung als Mikrobizide | |
| EP0346841A2 (de) | 1-Aryl-naphthoesäureamide und diese enthaltende mikrobizide Mittel | |
| EP0310558A2 (de) | Mikrobizide Mittel | |
| EP0130149B1 (de) | 3-Phenyl-4-cyanopyrrol-Derivate, Verfahren zu deren Herstellung und deren Verwendung als Mikrobizide | |
| EP0334813B1 (de) | Mittel zum Schutz von Pflanzen gegen Krankheiten | |
| EP0132826B1 (de) | N-(2-Nitrophenyl)-5-aminopyrimidin-Derivate, deren Herstellung und Verwendung | |
| EP0288976B1 (de) | Mittel zum Schutz gegen Pflanzenkrankheiten | |
| EP0462931B1 (de) | Benzotriazol-1-sulfonylderivate mit mikrobiziden Eigenschaften | |
| EP0207000B1 (de) | Mikrobizide | |
| EP0121651B1 (de) | Phenyl-sulfonylharnstoffe als Bakterizide | |
| EP0065483A1 (de) | Mikrobizide Acylanilin- und Acylnaphthylamin-Derivate, Verfahren zu deren Herstellung und ihre Verwendung | |
| EP0441747B1 (de) | Mikrobizide | |
| EP0832876B1 (de) | Difluorochloromethoxybenzolderivate und ihre Verwendung als Schädlingsbekämpfungsmittel | |
| EP0549532A1 (de) | Benztriazolsulfonsäure-Derivate und ihre Verwendung als Mikrobizide |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19840405 |
|
| AK | Designated contracting states |
Designated state(s): AT BE CH DE FR IT LI LU NL SE |
|
| 17Q | First examination report despatched |
Effective date: 19860901 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AT BE CH DE FR IT LI LU NL SE |
|
| REF | Corresponds to: |
Ref document number: 30721 Country of ref document: AT Date of ref document: 19871115 Kind code of ref document: T |
|
| REF | Corresponds to: |
Ref document number: 3467348 Country of ref document: DE Date of ref document: 19871217 |
|
| ITF | It: translation for a ep patent filed | ||
| ET | Fr: translation filed | ||
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |
|
| 26N | No opposition filed | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: FR Payment date: 19910215 Year of fee payment: 8 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: LU Payment date: 19910227 Year of fee payment: 8 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 19910307 Year of fee payment: 8 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: AT Payment date: 19910318 Year of fee payment: 8 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: CH Payment date: 19910327 Year of fee payment: 8 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: SE Payment date: 19910408 Year of fee payment: 8 |
|
| ITTA | It: last paid annual fee | ||
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: NL Payment date: 19910430 Year of fee payment: 8 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: BE Payment date: 19910503 Year of fee payment: 8 |
|
| EPTA | Lu: last paid annual fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 19920405 Ref country code: AT Effective date: 19920405 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SE Effective date: 19920406 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LI Effective date: 19920430 Ref country code: CH Effective date: 19920430 Ref country code: BE Effective date: 19920430 |
|
| BERE | Be: lapsed |
Owner name: CIBA-GEIGY A.G. Effective date: 19920430 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19921101 |
|
| NLV4 | Nl: lapsed or anulled due to non-payment of the annual fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Effective date: 19921230 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19930101 |
|
| REG | Reference to a national code |
Ref country code: FR Ref legal event code: ST |
|
| EUG | Se: european patent has lapsed |
Ref document number: 84103804.5 Effective date: 19921108 |