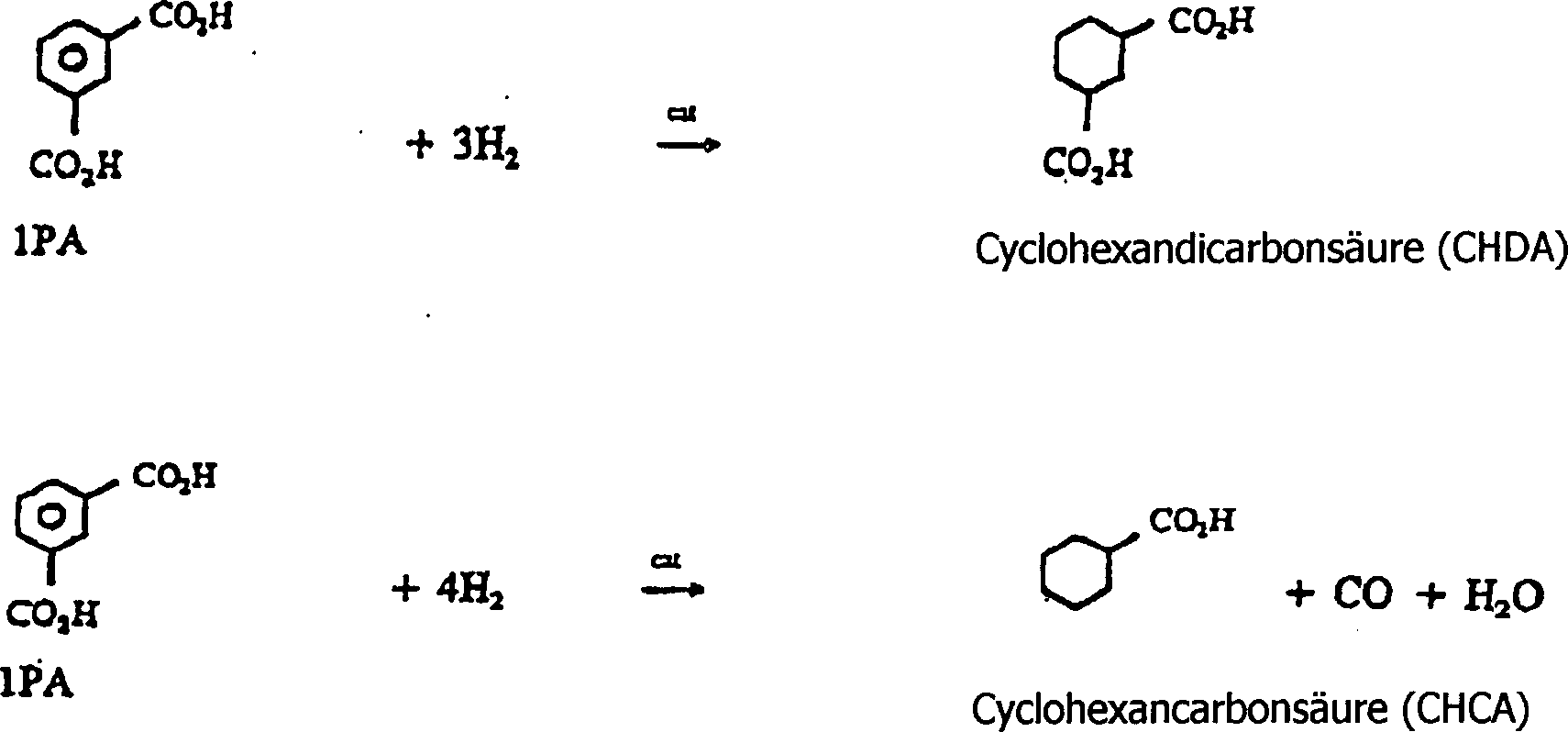DE69934404T2 - Verfahren zur reinigung von aromatischen dicarbonsäuren - Google Patents
Verfahren zur reinigung von aromatischen dicarbonsäuren Download PDFInfo
- Publication number
- DE69934404T2 DE69934404T2 DE69934404T DE69934404T DE69934404T2 DE 69934404 T2 DE69934404 T2 DE 69934404T2 DE 69934404 T DE69934404 T DE 69934404T DE 69934404 T DE69934404 T DE 69934404T DE 69934404 T2 DE69934404 T2 DE 69934404T2
- Authority
- DE
- Germany
- Prior art keywords
- aromatic dicarboxylic
- acid
- dicarboxylic acid
- purifying
- oxidation
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims description 23
- 230000008569 process Effects 0.000 title claims description 21
- 238000004140 cleaning Methods 0.000 title description 4
- 150000001991 dicarboxylic acids Chemical class 0.000 title description 2
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 claims description 40
- QQVIHTHCMHWDBS-UHFFFAOYSA-N isophthalic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 claims description 38
- 238000007254 oxidation reaction Methods 0.000 claims description 36
- 229910002091 carbon monoxide Inorganic materials 0.000 claims description 34
- 230000003647 oxidation Effects 0.000 claims description 34
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 claims description 33
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 claims description 33
- 125000003118 aryl group Chemical group 0.000 claims description 33
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 claims description 31
- 239000003054 catalyst Substances 0.000 claims description 28
- 238000005984 hydrogenation reaction Methods 0.000 claims description 26
- IVSZLXZYQVIEFR-UHFFFAOYSA-N 1,3-Dimethylbenzene Natural products CC1=CC=CC(C)=C1 IVSZLXZYQVIEFR-UHFFFAOYSA-N 0.000 claims description 16
- URLKBWYHVLBVBO-UHFFFAOYSA-N Para-Xylene Chemical group CC1=CC=C(C)C=C1 URLKBWYHVLBVBO-UHFFFAOYSA-N 0.000 claims description 16
- -1 aromatic carboxylic acid aldehyde Chemical class 0.000 claims description 16
- GOUHYARYYWKXHS-UHFFFAOYSA-N 4-formylbenzoic acid Chemical compound OC(=O)C1=CC=C(C=O)C=C1 GOUHYARYYWKXHS-UHFFFAOYSA-N 0.000 claims description 14
- 229910052763 palladium Inorganic materials 0.000 claims description 13
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 12
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 11
- 230000008034 disappearance Effects 0.000 claims description 11
- 239000002904 solvent Substances 0.000 claims description 11
- 229910052739 hydrogen Inorganic materials 0.000 claims description 10
- 239000001257 hydrogen Substances 0.000 claims description 10
- GPSDUZXPYCFOSQ-UHFFFAOYSA-N m-toluic acid Chemical compound CC1=CC=CC(C(O)=O)=C1 GPSDUZXPYCFOSQ-UHFFFAOYSA-N 0.000 claims description 10
- 150000008376 fluorenones Chemical class 0.000 claims description 9
- 238000004519 manufacturing process Methods 0.000 claims description 8
- UHDNUPHSDMOGCR-UHFFFAOYSA-N 3-Formylbenzoic acid Chemical compound OC(=O)C1=CC=CC(C=O)=C1 UHDNUPHSDMOGCR-UHFFFAOYSA-N 0.000 claims description 6
- LPNBBFKOUUSUDB-UHFFFAOYSA-N p-toluic acid Chemical compound CC1=CC=C(C(O)=O)C=C1 LPNBBFKOUUSUDB-UHFFFAOYSA-N 0.000 claims description 6
- 229910052799 carbon Inorganic materials 0.000 claims description 5
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 4
- 239000002253 acid Substances 0.000 claims description 3
- 238000009835 boiling Methods 0.000 claims description 3
- 238000012544 monitoring process Methods 0.000 claims description 3
- 230000009467 reduction Effects 0.000 claims description 3
- 239000000758 substrate Substances 0.000 claims description 3
- UOKBFIOAEPCADP-UHFFFAOYSA-N 3-(hydroxymethyl)benzoic acid Chemical compound OCC1=CC=CC(C(O)=O)=C1 UOKBFIOAEPCADP-UHFFFAOYSA-N 0.000 claims description 2
- RWQUWTMOHXGTNN-UHFFFAOYSA-N 9-n,10-n-bis(4-butylphenyl)-9-n,10-n-bis(4-methylphenyl)phenanthrene-9,10-diamine Chemical compound C1=CC(CCCC)=CC=C1N(C=1C2=CC=CC=C2C2=CC=CC=C2C=1N(C=1C=CC(C)=CC=1)C=1C=CC(CCCC)=CC=1)C1=CC=C(C)C=C1 RWQUWTMOHXGTNN-UHFFFAOYSA-N 0.000 claims description 2
- 229910010413 TiO 2 Inorganic materials 0.000 claims description 2
- FZTYDMZPQGATSQ-UHFFFAOYSA-N benzene-1,3-dicarboxylic acid;1,3-xylene Chemical compound CC1=CC=CC(C)=C1.OC(=O)C1=CC=CC(C(O)=O)=C1 FZTYDMZPQGATSQ-UHFFFAOYSA-N 0.000 claims description 2
- HSUPHZPGTAURKR-UHFFFAOYSA-N terephthalic acid;1,4-xylene Chemical compound CC1=CC=C(C)C=C1.OC(=O)C1=CC=C(C(O)=O)C=C1 HSUPHZPGTAURKR-UHFFFAOYSA-N 0.000 claims description 2
- 150000001299 aldehydes Chemical class 0.000 claims 1
- 230000001590 oxidative effect Effects 0.000 claims 1
- DYNFCHNNOHNJFG-UHFFFAOYSA-N 2-formylbenzoic acid Chemical compound OC(=O)C1=CC=CC=C1C=O DYNFCHNNOHNJFG-UHFFFAOYSA-N 0.000 description 17
- 239000000047 product Substances 0.000 description 15
- 239000012535 impurity Substances 0.000 description 11
- 238000000746 purification Methods 0.000 description 10
- 239000006227 byproduct Substances 0.000 description 9
- QYQADNCHXSEGJT-UHFFFAOYSA-N cyclohexane-1,1-dicarboxylate;hydron Chemical compound OC(=O)C1(C(O)=O)CCCCC1 QYQADNCHXSEGJT-UHFFFAOYSA-N 0.000 description 9
- ZWLPBLYKEWSWPD-UHFFFAOYSA-N o-toluic acid Chemical compound CC1=CC=CC=C1C(O)=O ZWLPBLYKEWSWPD-UHFFFAOYSA-N 0.000 description 9
- NZNMSOFKMUBTKW-UHFFFAOYSA-N cyclohexanecarboxylic acid Chemical compound OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 6
- VZFUCHSFHOYXIS-UHFFFAOYSA-N cycloheptane carboxylic acid Natural products OC(=O)C1CCCCCC1 VZFUCHSFHOYXIS-UHFFFAOYSA-N 0.000 description 4
- YLQWCDOCJODRMT-UHFFFAOYSA-N fluoren-9-one Chemical compound C1=CC=C2C(=O)C3=CC=CC=C3C2=C1 YLQWCDOCJODRMT-UHFFFAOYSA-N 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 239000010948 rhodium Substances 0.000 description 4
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 4
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 229920000728 polyester Polymers 0.000 description 3
- 229910052703 rhodium Inorganic materials 0.000 description 3
- MGMNPSAERQZUIM-UHFFFAOYSA-N 2-(hydroxymethyl)benzoic acid Chemical compound OCC1=CC=CC=C1C(O)=O MGMNPSAERQZUIM-UHFFFAOYSA-N 0.000 description 2
- 125000002843 carboxylic acid group Chemical group 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000004090 dissolution Methods 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 150000002220 fluorenes Chemical class 0.000 description 2
- 239000007791 liquid phase Substances 0.000 description 2
- 238000010926 purge Methods 0.000 description 2
- 239000005711 Benzoic acid Substances 0.000 description 1
- CWUFOXGNEQIIGX-UHFFFAOYSA-N CC(C=C1)=CCC1=C Chemical compound CC(C=C1)=CCC1=C CWUFOXGNEQIIGX-UHFFFAOYSA-N 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003610 charcoal Substances 0.000 description 1
- 239000003245 coal Substances 0.000 description 1
- 201000007750 congenital bile acid synthesis defect Diseases 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 238000006213 oxygenation reaction Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 230000007420 reactivation Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C51/00—Preparation of carboxylic acids or their salts, halides or anhydrides
- C07C51/42—Separation; Purification; Stabilisation; Use of additives
- C07C51/487—Separation; Purification; Stabilisation; Use of additives by treatment giving rise to chemical modification
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Catalysts (AREA)
Description
- 1. Gebiet der Erfindung
- Die vorliegende Erfindung betrifft die Reinigung aromatischer Dicarbonsäuren im Allgemeinen und genauer die Verbesserung der Katalysatorselektivität während der Reinigung aromatischer Dicarbonsäuren, damit das aromatische Dicarbonsäureprodukt nicht hydriert wird.
- 2. Beschreibung verwandter Technik
- Aromatische Dicarbonsäuren werden zur Herstellung verschiedener Polyesterprodukte verwendet. Aromatische Dicarbonsäuren werden im Allgemeinen durch die katalytische Oxidation der entsprechenden aromatischen Dialkylverbindung synthetisiert. Beispielsweise werden Terephthalsäure (TPA) und Isophthalsäure (IPA) durch die Oxidation von p-Xylol bzw. m-Xylol in der flüssigen Phase durch folgende Reaktionen hergestellt.
- Bei den vorstehenden Reaktionen kann Co/Mn/Br als Katalysator verwendet werden. Die vorstehenden Reaktionen funktionieren gut. Dabei werden aber nicht nur aromatische Dicarbonsäuren, sondern auch verschiedene Verunreinigungen erzeugt. Die folgenden sind die Verunreinigungen, die bei der katalytischen Oxidation von Isophthalsäure erzeugt werden:
- Carboxybenzaldehyd (CBA) und Toluylsäure entstehen durch die unvollständige Oxidation der aromatischen Dimethylverbindung. Bei der Oxidation von m-Xylol zur Herstellung von IPA wird 3-CBA erzeugt. Bei der Oxidation von p-Xylol zur Herstellung von TPA wird 4-CBA erzeugt. Ebenso ist m-Toluylsäure eine Verunreinigung bei der IPA-Herstellung, und p-Toluylsäure ist eine Verunreinigung bei der TPA-Herstellung. Weil weder die CBA noch die Toluylsäure zwei Carbonsäuregruppen aufweist, würden beide die Kette eines aus einer rohen Dicarbonsäure hergestellten Polyesters abbrechen. Daher ist sowohl CBA als auch Toluylsäure unerwünscht. Jedoch wird Toluylsäure nur in kleinen Mengen erzeugt und ist wasserlöslich, so dass sie in einem Kristallisationsschritt entfernt werden kann.
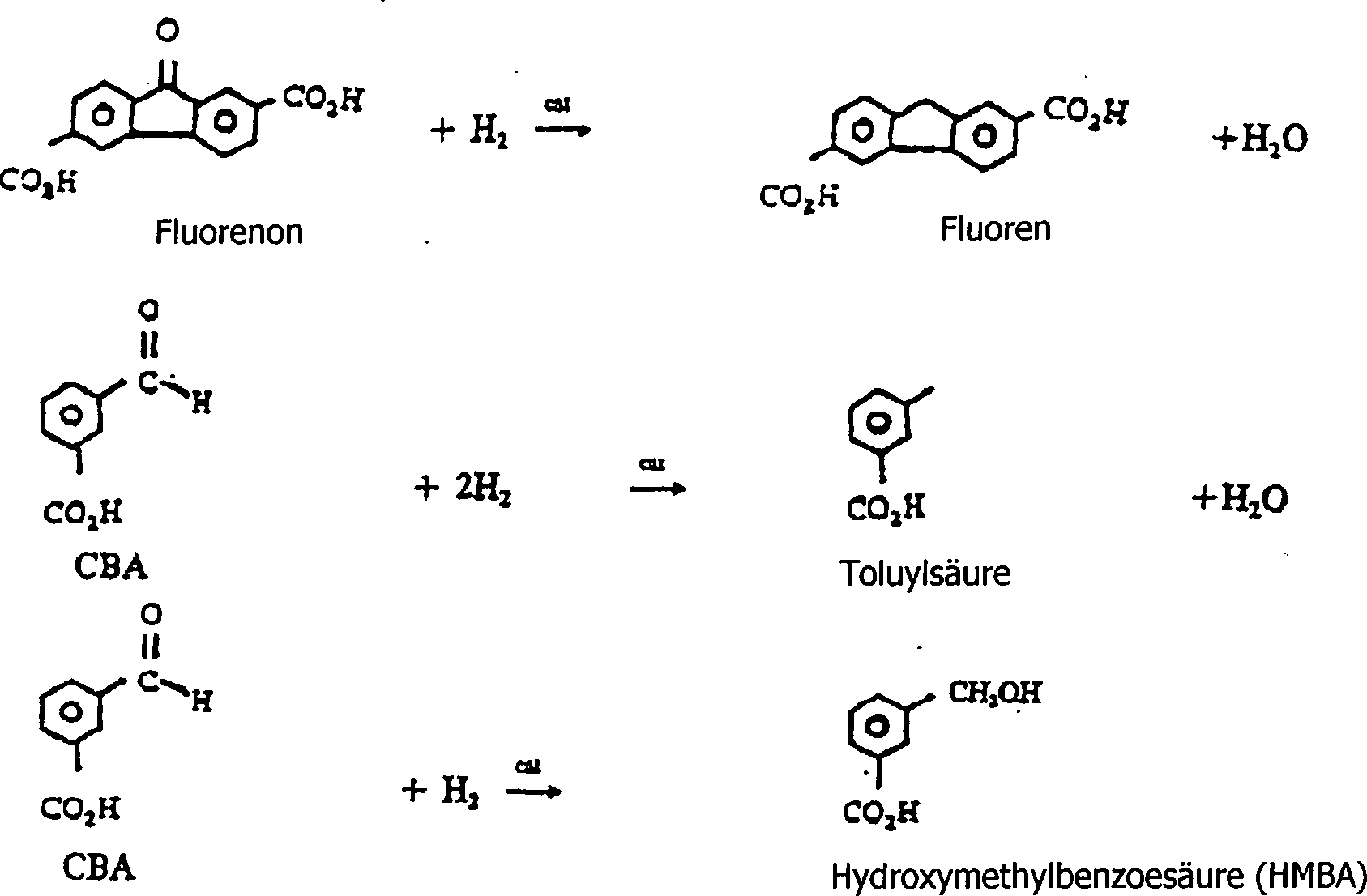
- Neben den CBA- und Toluylsäureverunreinigungen werden Verbindungen erzeugt, die allgemein als "Fluorenone" bekannt sind. Das vorstehend gezeigte Fluorenon ist nur eines von mehreren Isomeren. Fluorenone haben zwei Carbonsäuregruppen und wirken daher nicht als Kettenabbrecher. Jedoch sind Fluorenone gelb. Daher wirkt der aus der aromatischen Dicarbonsäure hergestellte Polyester schmutzig, wenn Fluorenone vorhanden sind.
- Angesichts der vorstehenden Ausführungen müssen rohe aromatische Dicarbonsäuren gereinigt werden. Die Dicarbonsäuren werden durch die katalytische Hydrierung der Verunreinigungen in den folgenden Reaktionen gereinigt.
- Wie man vorstehend sieht, werden Fluorenone zu "Fluorenen" umgewandelt und CBAs zu Toluylsäure und Hydroxymethylbenzoesäure (HMBA) umgewandelt. Fluorene sind bifunktionell und brechen daher die Polymerkette nicht ab; außerdem sind sie weiß. Die Reinigung erfolgt im Allgemeinen durch Lösen der Oxidationsprodukte in Wasser bei erhöhter Temperatur und erhöhtem Druck. Anschließend wird die resultierende Lösung in Gegenwart eines Wasserstoffpartialdrucks mit einem Bett aus Hydrierungskatalysatoren in Kontakt gebracht. Man lässt das Produktgemisch abkühlen, wodurch das gereinigte Produkt kristallisiert. Die Toluylsäure und HMBA bleiben in Lösung. Der Hydrierungskatalysator ist üblicherweise Palladium auf einem Kohlenstoffträger (künstliche Kohle), wobei der Katalysator 0,5 Gew.-% Palladium enthält.
-
- Wie man sieht, kann IPA zu Cyclohexandicarbonsäure (CHDA) und Cyclohexancarbonsäure (CHCA) hydriert werden. Es wird nur eine geringe Menge CHCA erzeugt. IPA kann auch zu m-Toluylsäure hydriert werden, aber auf diesem Weg wird nur wenig m-Toluylsäure erzeugt. Es wird darauf hingewiesen, dass auch Benzoe- und Toluylsäuren aus CBA erzeugt werden können. Die Nebenprodukte sind wasserlöslich und daher nicht übermäßig schwer zu entfernen. Jedoch sorgen die Nebenprodukte für einen Verlust an Ausbeute der erwünschten aromatischen Dicarbonsäure.
- In der Vergangenheit hat man sich meistens bemüht, die während der Reinigung, die sich auf die Zugabe von Rhodium zum beim Reinigungsverfahren typischerweise verwendeten Palladium/Kohlenstoff-Katalysator konzentrierte, erzeugte Menge von überschüssiger CHDA und CHCA zu verringern. Beispielsweise lehrt US-A-4,394,299 die Verwendung eines Pd/Rh-auf-Kohlenstoff-Katalysators mit einem Hilfsmetall zur Reinigung von Terephthalsäure und zur Verringerung der Menge an 4-CBA und zur Minimierung der Menge an CHDA-Nebenprodukt. US-A-4,629,715 und 4,892,972 lehren die Verwendung geschichteter Katalysatorbetten, die aus einer Schicht von Rh/C-Katalysator vor oder nach der Masse der Pd/C-Katalysatoren bestehen. Allerdings ist Rhodium sehr teuer.
- US-A-4,607,921 offenbart die Reinigung von roher Terephthalsäure bei erhöhten Temperaturen durch In-Kontakt-Bringen der rohen Terephthalsäure mit festen Teilchen eines Adsorptionsmittels mit einer erheblichen Sorptionskapazität für Kohlenmonoxid in Gegenwart von Kohlenmonoxid.
- Zusammenfassung der Erfindung
- Folglich ist es eine Aufgabe der vorliegenden Erfindung, aromatische Dicarbonsäuren zu reinigen, um kettenabbrechende Nebenprodukte zu eliminieren und gelbe Fluorenone zu entfernen.
- Eine weitere Aufgabe der vorliegenden Erfindung ist die katalytische Hydrierung der Verunreinigungen aus der Oxygenierung eines Dialkylaromaten bei gleichzeitiger Minimierung der Erzeugung von Nebenprodukten.
- Eine weitere Aufgabe der vorliegenden Erfindung ist die Minimierung der Hydrierung des gewünschten Dicarbonsäureprodukts, ohne dass die Hydrierrate von Verunreinigungen wie CBA und Farbkörpern gesenkt wird.
- Eine weitere Aufgabe der vorliegenden Erfindung besteht in der Reinigung aromatischer Dicarbonsäure unter Vermeidung des Einsatzes teurer Rhodiumkatalysatoren.
- Diese und andere Aufgaben werden dadurch gelöst, dass ein Verfahren zur Reinigung aromatischer Dicarbonsäuren bereitgestellt wird, das m-Xylol oder p-Xylol oxidiert, um rohe Isophthalsäure bzw. rohe Terephthalsäure zu erzeugen. Die Produkte des Oxidationsschrittes werden in Gegenwart eines Palladiumkatalysators hydriert. Während des Hydrierschrittes wird Kohlenmonoxid eingeleitet. Der Palladiumkatalysator wird auf einem Kohlenstoffsubstrat bereitgestellt. Die Produkte des Oxidationsschrittes werden vor dem Hydrierschritt in einem Lösungsmittel, bei dem es sich um Wasser handeln kann, gelöst. Die Produkte des Oxidationsschrittes können bei einer erhöhten Temperatur über dem normalen Siedepunkt des Lösungsmittels gelöst werden. Durch den Oxidationsschritt werden bei der Oxidation von m-Xylol Isophthalsäure, 3-Carboxybenzaldehyd und Fluorenone und bei der Oxidation von p-Xylol Terephthalsäure, 4-Carboxybenzaldehyd und Fluorenone erzeugt. Der Schritt kann den Schritt der Überwachung des Verschwindens von 3-Carboxybenzaldehyd im Falle der Oxidation von m-Xylol und von 4-Carboxybenzaldehyd im Falle der Oxidation von p-Xylol sowie der Verringerung des Kohlenmonoxids, wenn die Verschwindensrate unter ein vorher festgelegtes Minimum fällt, einschließen. Der Hydrierschritt hydriert im Falle der Oxidation von m-Xylol das 3-Carboxybenzaldehyd zu m-Toluylsäure und 3-Hydroxymethylbenzoesäure und im Falle der Oxidation von p-Xylol das 4-Carboxybenzaldehyd zu p-Toluylsäure und 4-Hydroxymethylbenzoesäure. Nach dem Hydrierschritt kann die Isophthalsäure oder Terephthalsäure kristallisiert werden. Das Kohlenmonoxid wird, bezogen auf zugesetzten Wasserstoff und Kohlenmonoxid, auf einer Konzentration von 10 bis 1000 ppm und vorzugsweise auf 100 bis 500 ppm gehalten. Durch dieses Verfahren können auch andere aromatische Carbonsäuren gereinigt werden.
- Detaillierte Beschreibung der bevorzugten Ausführungsformen
- Die Erfindung wird jetzt anhand der folgenden detaillierten Beschreibung und der Beispiele, die nur der Veranschaulichung und nicht der Einschränkung dienen, beschrieben. Gemäß einer bevorzugten Ausführungsform werden die Produkte einer Oxidationsreaktion eines Dialkylaromaten in Gegenwart eines Palladiumkatalysators in einer Reaktion in der flüssigen Phase hydriert. Die Reaktionsnebenprodukte werden in einem Lösungsmittel wie Wasser gelöst. Wenn Wasser als Lösungsmittel verwendet wird, muss es erwärmt werden, um die Auflösung der Produkte der Oxidationsreaktion sicherzustellen. Beispielsweise wird bei der Herstellung von IPA Wasser auf etwa 230°C erwärmt, und bei der Herstellung von TPA wird Wasser auf etwa 260°C erwärmt. Natürlich ist das Wasser bei diesen Temperaturen über seinem normalen Siedepunkt, und deshalb erfolgt die Auflösung unter Druck. Die Menge des Oxidationsproduktes, die im Lösungsmittel kombiniert werden kann, schwankt natürlich von Lösungsmittel zu Lösungsmittel. Jedoch erhält bei Wasser das Gemisch aus Oxidationsprodukt und Wasser ungefähr 20 Gew.-% Oxidationsprodukt.
- Der Hydrierkatalysator ist üblicherweise Palladium auf einem Kohlenstoffträger (künstliche Kohle), wobei der Katalysator 0,5 Gew.-% Palladium enthält. Auch andere Träger können verwendet werden. Zum Beispiel ist Palladium auf einem TiO2-Träger geeignet.
- Die Hydrierung wird unter einem solchen Partialdruck von Wasserstoffgas durchgeführt, dass der Wasserstoff in Lösung geht. Der Wasserstoffpartialdruck kann 68,95 bis 689,5 kPa (10 bis 100 psi) absolut betragen. Kohlenmonoxid wird dem Wasserstoffbeschickungsgas zugesetzt, um die aromatische Dicarbonsäure zu konservieren. Das heißt, durch Zugabe von Kohlenmonoxid zum Wasserstoffbeschickungsgas wird die Hydrierung der aromatischen Dicarbonsäure unterdrückt, so dass hydrierte Nebenprodukte verringert werden. Die Zugabe von Kohlenmonoxid hat nur eine geringe Auswirkung auf die Eliminierung von Fluorenonfarbkörpern oder kettenabbrechenden unvollständigen Oxidationsprodukten wie CBA. Die im Beschickungsgas verwendete Menge an Kohlenmonoxid schwankt, bezogen auf H2 + CO, von 10 ppm bis 1000 ppm. Vorzugsweise sollte die CO-Menge im Bereich von 100 bis 500 ppm liegen.
- Die Erfindung funktioniert mit jeder beliebigen Dicarbonsäure, ist aber besonders brauchbar für die Reinigung von Isophthalsäure (IPA) und Terephthalsäure (TPA). Die in Tabelle 1 aufgeführten Beispiele 1 bis 7 zeigen, dass die Zugabe einer kleinen Menge CO, typischerweise 100 ppm bis 500 ppm, dazu dient, die Menge der bei der Hydrierung erzeugten CHDA zu verringern, ohne dass die gewünschte Hydrierung von CBA beeinträchtigt wird. In jedem der Beispiele 1 bis 6 wurde ein 1-Gallonen-Titanautoklav, der mit einem absenkbaren Katalysatorkorb und einem am Boden angebrachten Spülventil ausgerüstet war, mit 1.400 g Wasser und 250 g roher IPA, die 800 ppm 3-CBA enthielt, beschickt.
- Für die Beispiele 1 bis 6 wurde der Autoklav verschlossen und unter Rühren des Gemischs auf 230°C erwärmt. Dann wurde H2 eingeleitet, um die verschiedenen in Tabelle 1 aufgeführten Partialdrücke zu erreichen. In den Beispielen 2 und 5 enthielt der H2 100 ppm CO, und in den Beispielen 3, 6 und 7 enthielt der H2 500 ppm CO. Ehe der Katalysator in den Autoklaven getaucht wurde, wurde durch das Spülventil eine T = 0 Probe entnommen. Zu diesem Zeitpunkt wurde der Katalysatorkorb in das Gemisch gesenkt. Der Katalysatorkorb enthielt 2 g eines Palladium/Kohlenstoff-Katalysators mit 0,5 Gew.-% Palladium. Nach 10, 20, 40, 60 und 90 Minuten wurden Proben durch das Spülventil entnommen. Diese Proben wurden bis zur Trockne verdampft und auf Hydroxymethylbenzoesäure, Toluylsäure, 3-CBA, Benzoesäure, cis- und trans-3-CHDA und IPA analysiert. Die Geschwindigkeitskonstanten der ersten Ordnung für das Verschwinden von 3-CBA und das Erscheinen von 3-CHDA wurden aus logarithmischen Darstellungen berechnet. In Beispiel 7 geht es um die Reinigung von TPA. Für Beispiel 7 wurde rohe TPA bei einer Temperatur von 260°C gelöst, die anderen Bedingungen waren gleich.
- Wie man aus einem Vergleich der Geschwindigkeitskonstanten für das Erscheinen von CHDA in Tabelle sehen kann, senkt die Zugabe geringer Mengen Kohlenmonoxid in den Beispielen 2, 3 und 5 bis 7 die Menge von unerwünschter CHDA, die im Vergleich zu den Beispielen 1 und 4, in denen kein CO verwendet wird, erzeugt wird, signifikant. Wenn mehr CO verwendet wird, sinkt die Herstellungsgeschwindigkeit von CHDA; vgl. die Beispiele 2 und 3 und die Beispiele 5 und 6.
- In Beispiel 3, in dem 500 ppm CO mit einem H2-Partialdruck von 100 psi eingeleitet werden, betrug die Geschwindigkeitskonstante zur Erzeugung von CHDA 0,0. Jedoch sank bei Beispiel 3 die Geschwindigkeitskonstante für das Verschwinden von CBA auf 0,044. Deshalb wurde in Beispiel 3 vielleicht zu viel CO verwendet. Andererseits wurden auch in Beispiel 6 500 ppm CO verwendet. Wenn man jedoch die Beispiele 4 bis 6 vergleicht, sieht man, dass die Geschwindigkeit des Verschwindens der CBA-Verunreinigung in Beispiel 6, in dem mehr CO verwendet wurde als in den Beispielen 4 oder 5, am höchsten war (116). Die Beispiele 3 und 6 verwenden beide die gleiche Konzentration an CO, 500 ppm, aber in Beispiel 6 ist der H2-Partialdruck größer. Tabelle 1 zeigt daher, dass die Verwendung von mehr Kohlenmonoxid akzeptabel ist, wenn der H2-Partialdruck erhöht wird. Die in Tabelle 1 aufgeführten Ergebnisse zeigen deutlich, dass die Zugabe kleiner Mengen CO zur Reinigung von aromatischen Dicarbonsäuren die Erzeugung unerwünschter Nebenprodukte signifikant senkt.
- In Beispiel 3 sank die Eliminierung von CBA um 59%. Daher ist zu viel Kohlenmonoxid nicht gut, obwohl kleine Mengen Kohlenmonoxid durchaus erwünscht sind. Über den genauen Grund dafür ist man sich nicht ganz im Klaren. Es hängt jedoch vom Wasserstoffdruck ab, wie viel Kohlenmonoxid zu viel ist. Das Kohlenmonoxid kann sich an einen Teil der Hydrierstellen auf dem Palladium binden. Die Oxidationsverunreinigungen (wie CBA, Toluylsäure und Fluorenone) können leichtert hydriert werden als IPA und TPA. In diesem Fall würde die Zugabe kleiner Mengen Kohlenmonoxid die Hydrierung der Oxidationsverunreinigungen nicht stark beeinflussen. Weil jedoch IPA und TPA weniger leicht hydriert werden, würde die Zugabe kleiner Mengen CO die Hydrierung von IPA und TPA verringern.
- Es gibt verschiedene Möglichkeiten, die Menge des dem Verfahren zugesetzten Kohlenmonoxids zu steuern. Beispielsweise könnte eine große Menge Kohlenmonoxid zugesetzt werden, wenn das Katalysatorbett frisch ist. Es hat sich gezeigt, dass ein frisches Katalysatorbett aromatische Dicarbonsäuren leichter hydriert. Nach der anfänglichen Zugabe von CO könnten die Produkte der Hydrierung überwacht werden. Wenn die Geschwindigkeit des Verschwindens von CBA nachzulassen beginnt, kann dies ein Anzeichen dafür sein, dass zu viele Stellen auf dem Katalysator vergiftet wurden. Zu diesem Zeitpunkt wird die Kohlenmonoxidbeschickung verringert oder die Kohlenmonoxidquelle wird einfach entfernt.
- Die Desaktivierung des Katalysators bei der Herstellung der gewünschten Dicarbonsäure ist umkehrbar. Das heißt, nach der Entfernung der Quelle des Kohlenmonoxids oder dessen Verringerung wird der Katalysator wieder aktiviert. Es ist wichtig, diese Reaktivierung zu überwachen, um sicherzustellen, dass es nicht zur Hydrierung der aromatischen Dicarbonsäure IPA oder TPA kommt. Zu diesem Zweck kann die CBA-Konzentration überwacht werden. Nachdem das Verschwinden von CBA eine akzeptable Geschwindigkeit erreicht hat, kann die Kohlenmonoxidbeschickung erhöht werden, oder, wenn die Kohlenmonoxidbeschickung ganz eingestellt wurde, kann die CO-Beschickung wieder aufgenommen werden. Natürlich könnte die CO-Beschickung letztendlich auf die gewünschte Konzentration stabilisiert werden, so dass es nicht nötig ist, die CO-Beschickungsgeschwindigkeit zu verändern.
Claims (18)
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure, umfassend die Schritte: Oxidieren eines Dialkylaromaten zu einer rohen aromatischen Dicarbonsäure; In-Kontakt-Bringen der Produkte des Oxidationsschrittes mit Wasserstoff in Gegenwart eines Palladiumkatalysators; und Einleiten von Kohlenmonoxid während des Hydrierschrittes; wobei das Kohlenmonoxid, bezogen auf zugesetzten Wasserstoff und Kohlenmonoxid, auf 10 bis 1000 ppm gehalten wird.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 1, bei dem der Palladiumkatalysator auf einem Kohlenstoffsubstrat bereitgestellt wird.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 1, bei dem die Produkte des Oxidationsschrittes vor dem Hydrierschritt in einem Lösungsmittel gelöst werden.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 3, bei dem Wasser als Lösungsmittel verwendet wird.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 3, bei dem die Produkte des Oxidationsschrittes bei einer erhöhten Temperatur über dem normalen Siedepunkt des Lösungsmittels in einem Lösungsmittel gelöst werden.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 1, bei dem der Oxidationsschritt aromatische Dicarbonsäure-Farbkörper und ein aromatisches Carbonsäurealdehyd erzeugt.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 6, umfassend außerdem den Schritt der Überwachung des Verschwindens des Säurealdehyds und der Verringerung der Kohlenmonoxideinleitung, wenn die Geschwindigkeit des Verschwindens unter einem vorher festgelegten Minimum liegt.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 6, bei dem der Hydrierschritt das aromatische Carbonsäurealdehyd zu einer aromatischen Alkylcarbonsäure und einer aromatischen Alkoholcarbonsäure hydriert.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 1, bei dem das Kohlenmonoxid während des Hydrierschrittes diskontinuierlich eingeleitet wird.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 1, das nach dem Hydrierschritt außerdem den Schritt des Kristallisierens der aromatischen Dicarbonsäure umfasst.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 1, bei dem das Kohlenmonoxid, bezogen auf zugesetzten Wasserstoff und Kohlenmonoxid, auf einer Konzentration von 100 bis 500 ppm gehalten wird.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 1, bei dem der Palladiumkatalysator auf einem TiO2-Substrat bereitgestellt wird.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach einem der vorstehenden Ansprüche, bei dem der Dialkylaromat m-Xylol oder p-Xylol ist, um rohe Isophthalsäure bzw. rohe Terephthalsäure herzustellen.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 13, bei dem der Oxidationsschritt im Falle der Oxidation von m-Xylol Isophthalsäure, 3-Carboxybenzaldehyd und Fluorenone erzeugt und im Falle der Oxidation von p-Xylol Terephthalsäure, 4-Carboxybenzaldehyd und Fluorenone erzeugt.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 14, umfassend außerdem den Schritt der Überwachung des Verschwindens von 3- Carboxybenzaldehyd im Falle der Oxidation von m-Xylol und von 4-Carboxybenzaldeyhd im Falle der Oxidation von p-Xylol sowie des Verringerns der Kohlenmonoxidmenge, wenn die Geschwindigkeit des Verschwindens unter einem vorher festgelegten Minimum liegt.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 14, bei dem der Hydrierschritt im Falle der Oxidation von m-Xylol das 3-Carboxybenzaldehyd zu m-Toluylsäure und 3-Hydroxymethylbenzoesäure hydriert und im Falle der Oxidation von p-Xylol das 4-Carboxybenzaldehyd zu p-Toluylsäure und 4-Hydroxymethylbenzoesäure hydriert.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 13, bei dem das Kohlenmonoxid während des Hydrierschrittes diskontinuierlich eingeleitet wird.
- Verfahren zur Reinigung einer aromatischen Dicarbonsäure nach Anspruch 13, das nach dem Hydrierschritt außerdem den Schritt des Kristallisierens der Isophthalsäure oder Terephthalsäure umfasst.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US09/107,401 US6265608B1 (en) | 1998-06-30 | 1998-06-30 | Method of purifying aromatic dicarboxylic acids |
| US107401 | 1998-06-30 | ||
| PCT/US1999/005055 WO2000000457A1 (en) | 1998-06-30 | 1999-03-09 | Method of purifying aromatic dicarboxylic acids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69934404D1 DE69934404D1 (de) | 2007-01-25 |
| DE69934404T2 true DE69934404T2 (de) | 2007-04-12 |
Family
ID=22316474
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69934404T Expired - Fee Related DE69934404T2 (de) | 1998-06-30 | 1999-03-09 | Verfahren zur reinigung von aromatischen dicarbonsäuren |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US6265608B1 (de) |
| EP (1) | EP1091922B1 (de) |
| JP (1) | JP2002519336A (de) |
| CN (1) | CN1217908C (de) |
| BR (1) | BR9911715A (de) |
| DE (1) | DE69934404T2 (de) |
| WO (1) | WO2000000457A1 (de) |
Families Citing this family (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20030120109A1 (en) * | 2001-12-20 | 2003-06-26 | Rosen Bruce I. | Purification of a crude acid mixture |
| US20050288527A1 (en) * | 2004-06-28 | 2005-12-29 | Cook William L | Method for preparing free-flowing crystalline material |
| WO2007001448A2 (en) | 2004-11-04 | 2007-01-04 | Massachusetts Institute Of Technology | Coated controlled release polymer particles as efficient oral delivery vehicles for biopharmaceuticals |
| US7557243B2 (en) * | 2005-05-19 | 2009-07-07 | Eastman Chemical Company | Enriched terephthalic acid composition |
| US20060264664A1 (en) * | 2005-05-19 | 2006-11-23 | Parker Kenny R | Esterification of an exchange solvent enriched composition |
| US7741516B2 (en) | 2005-05-19 | 2010-06-22 | Eastman Chemical Company | Process to enrich a carboxylic acid composition |
| US7304178B2 (en) * | 2005-05-19 | 2007-12-04 | Eastman Chemical Company | Enriched isophthalic acid composition |
| US7884231B2 (en) * | 2005-05-19 | 2011-02-08 | Eastman Chemical Company | Process to produce an enriched composition |
| US7834208B2 (en) * | 2005-05-19 | 2010-11-16 | Eastman Chemical Company | Process to produce a post catalyst removal composition |
| US20060264656A1 (en) * | 2005-05-19 | 2006-11-23 | Fujitsu Limited | Enrichment process using compounds useful in a polyester process |
| US7432395B2 (en) * | 2005-05-19 | 2008-10-07 | Eastman Chemical Company | Enriched carboxylic acid composition |
| US20060264662A1 (en) * | 2005-05-19 | 2006-11-23 | Gibson Philip E | Esterification of an enriched composition |
| US7880031B2 (en) * | 2005-05-19 | 2011-02-01 | Eastman Chemical Company | Process to produce an enrichment feed |
| US7919652B2 (en) * | 2005-05-19 | 2011-04-05 | Eastman Chemical Company | Process to produce an enriched composition through the use of a catalyst removal zone and an enrichment zone |
| US7897809B2 (en) * | 2005-05-19 | 2011-03-01 | Eastman Chemical Company | Process to produce an enrichment feed |
| US9267937B2 (en) | 2005-12-15 | 2016-02-23 | Massachusetts Institute Of Technology | System for screening particles |
| US7888529B2 (en) | 2006-03-01 | 2011-02-15 | Eastman Chemical Company | Process to produce a post catalyst removal composition |
| CA2648099C (en) | 2006-03-31 | 2012-05-29 | The Brigham And Women's Hospital, Inc | System for targeted delivery of therapeutic agents |
| US9381477B2 (en) * | 2006-06-23 | 2016-07-05 | Massachusetts Institute Of Technology | Microfluidic synthesis of organic nanoparticles |
| WO2008019142A2 (en) * | 2006-08-04 | 2008-02-14 | Massachusetts Institute Of Technology | Oligonucleotide systems for targeted intracellular delivery |
| WO2008098165A2 (en) | 2007-02-09 | 2008-08-14 | Massachusetts Institute Of Technology | Oscillating cell culture bioreactor |
| JP2010523595A (ja) * | 2007-04-04 | 2010-07-15 | マサチューセッツ インスティテュート オブ テクノロジー | ポリ(アミノ酸)ターゲッティング部分 |
| ES2627292T3 (es) | 2007-10-12 | 2017-07-27 | Massachusetts Institute Of Technology | Nanotecnología de vacunas |
| US7714094B2 (en) * | 2007-11-15 | 2010-05-11 | Eastman Chemical Company | Simplified isophthalic acid process for modifying PET |
| US8277812B2 (en) | 2008-10-12 | 2012-10-02 | Massachusetts Institute Of Technology | Immunonanotherapeutics that provide IgG humoral response without T-cell antigen |
| US8591905B2 (en) | 2008-10-12 | 2013-11-26 | The Brigham And Women's Hospital, Inc. | Nicotine immunonanotherapeutics |
| CN103301864B (zh) * | 2012-03-12 | 2014-12-31 | 中国科学院大连化学物理研究所 | 一种Pd/TiO2-C-SiC催化剂及其制备与应用 |
| US8748479B2 (en) | 2012-06-22 | 2014-06-10 | Eastman Chemical Company | Process for purifying crude furan 2,5-dicarboxylic acid using hydrogenation |
| US10464913B2 (en) | 2015-06-05 | 2019-11-05 | Synvina C.V. | Process for the preparation of a purified acid composition |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR1433325A (fr) * | 1963-03-29 | 1966-04-01 | Standard Oil Co | Perfectionnements à la purification de l'acide téréphtalique |
| US3607921A (en) * | 1968-06-12 | 1971-09-21 | Mobil Oil Corp | Catalytic purification of terephthalic acid |
| JPS5227743A (en) | 1975-08-26 | 1977-03-02 | Mitsubishi Chem Ind Ltd | Production of high-purity terephthalic acid |
| US4394299A (en) | 1981-10-29 | 1983-07-19 | Standard Oil Company (Indiana) | Palladium-rhodium catalyst for purification of crude terephthalic acid |
| US4892972A (en) | 1985-10-07 | 1990-01-09 | Amoco Corporation | Purification of crude terephthalic acid |
| US4629715A (en) | 1985-10-07 | 1986-12-16 | Amoco Corporation | Purification of terephthalic acid to relatively low levels of 4-carboxybenzaldehyde and catalyst therefor |
| US4833269A (en) | 1988-08-05 | 1989-05-23 | Amoco Corporation | Method for purifying terephthalic acid recycle streams |
| US5362908A (en) * | 1993-03-10 | 1994-11-08 | Amoco Corporation | Catalyst and method for purifying crude terephthalic acid, isophthalic acid or naphthalene dicarboxylic acid |
| US5756833A (en) * | 1996-02-01 | 1998-05-26 | Amoco Corporation | Catalytic purification and recovery of dicarboxylic aromatic acids |
-
1998
- 1998-06-30 US US09/107,401 patent/US6265608B1/en not_active Expired - Lifetime
-
1999
- 1999-03-09 WO PCT/US1999/005055 patent/WO2000000457A1/en not_active Ceased
- 1999-03-09 DE DE69934404T patent/DE69934404T2/de not_active Expired - Fee Related
- 1999-03-09 CN CN998082007A patent/CN1217908C/zh not_active Expired - Lifetime
- 1999-03-09 EP EP99912326A patent/EP1091922B1/de not_active Expired - Lifetime
- 1999-03-09 JP JP2000557218A patent/JP2002519336A/ja active Pending
- 1999-03-09 BR BR9911715-0A patent/BR9911715A/pt not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| US6265608B1 (en) | 2001-07-24 |
| EP1091922A1 (de) | 2001-04-18 |
| CN1308600A (zh) | 2001-08-15 |
| CN1217908C (zh) | 2005-09-07 |
| EP1091922B1 (de) | 2006-12-13 |
| DE69934404D1 (de) | 2007-01-25 |
| BR9911715A (pt) | 2001-10-02 |
| EP1091922A4 (de) | 2005-03-02 |
| JP2002519336A (ja) | 2002-07-02 |
| WO2000000457A1 (en) | 2000-01-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69934404T2 (de) | Verfahren zur reinigung von aromatischen dicarbonsäuren | |
| DE60303794T2 (de) | Verfahren zur entfernung von eisenverunreinigungen aus flüssigkeitsströmen bei der herstellung und oder reinigung von aromatischen säuren | |
| DE3788555T2 (de) | Reinigung von Terephthalsäure. | |
| DE69608217T2 (de) | Verfahren zur Herstellung der Akrylsäure | |
| DE69104280T2 (de) | Verfahren zur Herstellung von hochreiner Isophthalsäure. | |
| DE60011055T2 (de) | Verfahren zur herstellung von aromatischen carbonsäuren | |
| DE2423408A1 (de) | Verfahren zur herstellung von terephthalsaeure durch katalytische fluessigphasenoxydation von p-xylol | |
| DE60020128T2 (de) | Rhodium/anorganisches iodid katalysatorsystem für das verfahren zur methanolcarbonylierung mit verbessertem verunreinigungsprofil | |
| DE2223541A1 (de) | Verfahren zur reinigung von monocarbonsaeure-stroemen | |
| DE69313985T2 (de) | Verfahren zur herstellung aromatischer carbonsäuren | |
| DE69611430T2 (de) | Verfahren zur reinigung von roher naphthalendicarbonsäure | |
| DE68905512T2 (de) | Methode zum reaktivieren eines gruppe-viii-edelmetallkatalysators zur verwendung bei der reinigung roher terephthalsaeure. | |
| DE60113649T2 (de) | Niedrigtemperatur-reinigung von naphthalenedicarbonsäuren | |
| DD201774A5 (de) | Verfahren zur kontinuierlichen herstellung eines oxalsaeurediesters | |
| WO1982003625A1 (fr) | Procede d'oxydation d'aromates reactifs | |
| DE1299628B (de) | Verfahren zur Gewinnung von reiner, zur unmittelbaren Veresterung mit Glykolen geeigneter Terephthalsaeure | |
| DE69413946T2 (de) | Verfahren zur Herstellung von hochreiner 2,6-Naphthalindicarbonsäure | |
| DE2552456C3 (de) | Verfahren zum Regenerieren von verbrauchten, Vanadinoxyd enthaltenden Oxydationskatalysatoren | |
| DE2045747A1 (de) | ||
| DE2636877A1 (de) | Verfahren zur herstellung von gereinigter terephthalsaeure | |
| DE3874667T2 (de) | Verfahren zur reinigung von methacrylsaeure. | |
| DE1593539A1 (de) | Verfahren zur Herstellung reiner aromatischer Di- und Polycarbonsaeuren | |
| DE2615657C2 (de) | ||
| DE60002782T2 (de) | Verfahren zur Herstellung einer hochreinen aromatischen Polycarbonsäure | |
| DE60213462T2 (de) | Aufreinigung einer rohen säuremischung |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |