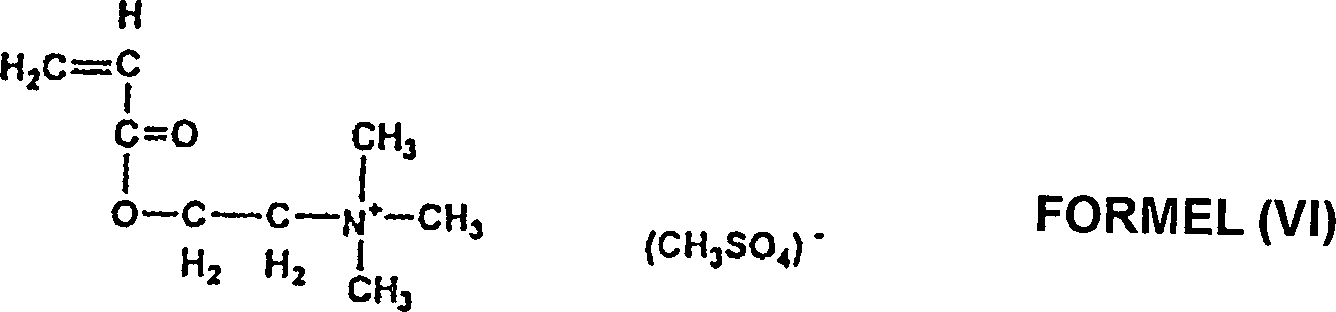DE69918707T2 - Wundverband aus hydrogelmit quaternären aminen der von sich aus mikrobentötend ist - Google Patents
Wundverband aus hydrogelmit quaternären aminen der von sich aus mikrobentötend ist Download PDFInfo
- Publication number
- DE69918707T2 DE69918707T2 DE69918707T DE69918707T DE69918707T2 DE 69918707 T2 DE69918707 T2 DE 69918707T2 DE 69918707 T DE69918707 T DE 69918707T DE 69918707 T DE69918707 T DE 69918707T DE 69918707 T2 DE69918707 T2 DE 69918707T2
- Authority
- DE
- Germany
- Prior art keywords
- polymer
- hydrogel
- group
- wound dressing
- use according
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000000017 hydrogel Substances 0.000 title claims description 82
- 150000001412 amines Chemical group 0.000 title claims description 24
- 206010052428 Wound Diseases 0.000 claims description 75
- 208000027418 Wounds and injury Diseases 0.000 claims description 74
- 229920000642 polymer Polymers 0.000 claims description 55
- 230000000845 anti-microbial effect Effects 0.000 claims description 34
- 229920000058 polyacrylate Polymers 0.000 claims description 26
- 125000002091 cationic group Chemical group 0.000 claims description 25
- 239000003795 chemical substances by application Substances 0.000 claims description 19
- 125000000217 alkyl group Chemical group 0.000 claims description 15
- 229910052799 carbon Inorganic materials 0.000 claims description 12
- 125000003118 aryl group Chemical group 0.000 claims description 11
- 229910052760 oxygen Inorganic materials 0.000 claims description 10
- 125000002877 alkyl aryl group Chemical group 0.000 claims description 9
- 125000000129 anionic group Chemical group 0.000 claims description 9
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 9
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 9
- 239000000463 material Substances 0.000 claims description 9
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 9
- 150000003973 alkyl amines Chemical class 0.000 claims description 8
- 239000004599 antimicrobial Substances 0.000 claims description 8
- 150000004982 aromatic amines Chemical class 0.000 claims description 8
- WPKYZIPODULRBM-UHFFFAOYSA-N azane;prop-2-enoic acid Chemical group N.OC(=O)C=C WPKYZIPODULRBM-UHFFFAOYSA-N 0.000 claims description 8
- 239000000758 substrate Substances 0.000 claims description 8
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 6
- 125000003944 tolyl group Chemical group 0.000 claims description 5
- 238000007789 sealing Methods 0.000 claims description 4
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 239000000499 gel Substances 0.000 description 36
- ZIUHHBKFKCYYJD-UHFFFAOYSA-N n,n'-methylenebisacrylamide Chemical compound C=CC(=O)NCNC(=O)C=C ZIUHHBKFKCYYJD-UHFFFAOYSA-N 0.000 description 21
- 238000006116 polymerization reaction Methods 0.000 description 20
- 239000000178 monomer Substances 0.000 description 19
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 18
- -1 amine salts Chemical class 0.000 description 14
- 238000000034 method Methods 0.000 description 14
- 210000003491 skin Anatomy 0.000 description 14
- FAPWRFPIFSIZLT-UHFFFAOYSA-M sodium chloride Inorganic materials [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 14
- 239000007787 solid Substances 0.000 description 13
- XMLYCEVDHLAQEL-UHFFFAOYSA-N 2-hydroxy-2-methyl-1-phenylpropan-1-one Chemical compound CC(C)(O)C(=O)C1=CC=CC=C1 XMLYCEVDHLAQEL-UHFFFAOYSA-N 0.000 description 12
- 239000004615 ingredient Substances 0.000 description 12
- 239000007858 starting material Substances 0.000 description 12
- 210000000416 exudates and transudate Anatomy 0.000 description 11
- 230000001070 adhesive effect Effects 0.000 description 9
- 239000000835 fiber Substances 0.000 description 9
- 239000011780 sodium chloride Substances 0.000 description 9
- 239000000853 adhesive Substances 0.000 description 8
- 230000000694 effects Effects 0.000 description 7
- 230000035876 healing Effects 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- 206010015150 Erythema Diseases 0.000 description 6
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 6
- 238000010521 absorption reaction Methods 0.000 description 6
- 239000000654 additive Substances 0.000 description 6
- 238000001723 curing Methods 0.000 description 6
- 231100000321 erythema Toxicity 0.000 description 6
- 230000005855 radiation Effects 0.000 description 6
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 5
- 239000004971 Cross linker Substances 0.000 description 5
- 229920001519 homopolymer Polymers 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 230000029663 wound healing Effects 0.000 description 5
- 241000222122 Candida albicans Species 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 229940095731 candida albicans Drugs 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 238000004132 cross linking Methods 0.000 description 4
- 239000003431 cross linking reagent Substances 0.000 description 4
- 150000002500 ions Chemical class 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 239000000203 mixture Substances 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 150000003254 radicals Chemical class 0.000 description 4
- 239000002250 absorbent Substances 0.000 description 3
- 230000002745 absorbent Effects 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- QGZKDVFQNNGYKY-UHFFFAOYSA-O ammonium group Chemical group [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 239000007853 buffer solution Substances 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- ISAOCJYIOMOJEB-UHFFFAOYSA-N desyl alcohol Natural products C=1C=CC=CC=1C(O)C(=O)C1=CC=CC=C1 ISAOCJYIOMOJEB-UHFFFAOYSA-N 0.000 description 3
- 238000002845 discoloration Methods 0.000 description 3
- STVZJERGLQHEKB-UHFFFAOYSA-N ethylene glycol dimethacrylate Chemical compound CC(=C)C(=O)OCCOC(=O)C(C)=C STVZJERGLQHEKB-UHFFFAOYSA-N 0.000 description 3
- 239000004744 fabric Substances 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 230000000704 physical effect Effects 0.000 description 3
- 229920000867 polyelectrolyte Polymers 0.000 description 3
- 239000001103 potassium chloride Substances 0.000 description 3
- 235000011164 potassium chloride Nutrition 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- CPKVUHPKYQGHMW-UHFFFAOYSA-N 1-ethenylpyrrolidin-2-one;molecular iodine Chemical compound II.C=CN1CCCC1=O CPKVUHPKYQGHMW-UHFFFAOYSA-N 0.000 description 2
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 2
- XMNIXWIUMCBBBL-UHFFFAOYSA-N 2-(2-phenylpropan-2-ylperoxy)propan-2-ylbenzene Chemical compound C=1C=CC=CC=1C(C)(C)OOC(C)(C)C1=CC=CC=C1 XMNIXWIUMCBBBL-UHFFFAOYSA-N 0.000 description 2
- LEJBBGNFPAFPKQ-UHFFFAOYSA-N 2-(2-prop-2-enoyloxyethoxy)ethyl prop-2-enoate Chemical compound C=CC(=O)OCCOCCOC(=O)C=C LEJBBGNFPAFPKQ-UHFFFAOYSA-N 0.000 description 2
- KUDUQBURMYMBIJ-UHFFFAOYSA-N 2-prop-2-enoyloxyethyl prop-2-enoate Chemical compound C=CC(=O)OCCOC(=O)C=C KUDUQBURMYMBIJ-UHFFFAOYSA-N 0.000 description 2
- INPXMFJMEQZYQO-UHFFFAOYSA-N 3-benzylcyclohexa-3,5-diene-1,2-dione Chemical compound C1(=CC=CC=C1)CC=1C(C(C=CC=1)=O)=O INPXMFJMEQZYQO-UHFFFAOYSA-N 0.000 description 2
- 229920001817 Agar Polymers 0.000 description 2
- 229920000742 Cotton Polymers 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 208000035874 Excoriation Diseases 0.000 description 2
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 2
- 241000588747 Klebsiella pneumoniae Species 0.000 description 2
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 2
- 241000191967 Staphylococcus aureus Species 0.000 description 2
- 244000028419 Styrax benzoin Species 0.000 description 2
- 235000000126 Styrax benzoin Nutrition 0.000 description 2
- 235000008411 Sumatra benzointree Nutrition 0.000 description 2
- 238000003848 UV Light-Curing Methods 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 239000002390 adhesive tape Substances 0.000 description 2
- 239000008272 agar Substances 0.000 description 2
- 230000002421 anti-septic effect Effects 0.000 description 2
- 229920002118 antimicrobial polymer Polymers 0.000 description 2
- 239000012736 aqueous medium Substances 0.000 description 2
- 229960002130 benzoin Drugs 0.000 description 2
- 239000012965 benzophenone Substances 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 239000000645 desinfectant Substances 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 235000019382 gum benzoic Nutrition 0.000 description 2
- 229920000669 heparin Polymers 0.000 description 2
- 229960002897 heparin Drugs 0.000 description 2
- 239000003906 humectant Substances 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 229920001477 hydrophilic polymer Polymers 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 231100000344 non-irritating Toxicity 0.000 description 2
- 239000002504 physiological saline solution Substances 0.000 description 2
- 239000004014 plasticizer Substances 0.000 description 2
- 125000001453 quaternary ammonium group Chemical group 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 2
- FZGFBJMPSHGTRQ-UHFFFAOYSA-M trimethyl(2-prop-2-enoyloxyethyl)azanium;chloride Chemical compound [Cl-].C[N+](C)(C)CCOC(=O)C=C FZGFBJMPSHGTRQ-UHFFFAOYSA-M 0.000 description 2
- JNELGWHKGNBSMD-UHFFFAOYSA-N xanthone Chemical compound C1=CC=C2C(=O)C3=CC=CC=C3OC2=C1 JNELGWHKGNBSMD-UHFFFAOYSA-N 0.000 description 2
- MSAHTMIQULFMRG-UHFFFAOYSA-N 1,2-diphenyl-2-propan-2-yloxyethanone Chemical compound C=1C=CC=CC=1C(OC(C)C)C(=O)C1=CC=CC=C1 MSAHTMIQULFMRG-UHFFFAOYSA-N 0.000 description 1
- DKEGCUDAFWNSSO-UHFFFAOYSA-N 1,8-dibromooctane Chemical compound BrCCCCCCCCBr DKEGCUDAFWNSSO-UHFFFAOYSA-N 0.000 description 1
- HUDYANRNMZDQGA-UHFFFAOYSA-N 1-[4-(dimethylamino)phenyl]ethanone Chemical compound CN(C)C1=CC=C(C(C)=O)C=C1 HUDYANRNMZDQGA-UHFFFAOYSA-N 0.000 description 1
- MULNMJMKETYRBG-UHFFFAOYSA-N 1-ethenyl-3-[2-(1-ethenyl-2-oxopyrrolidin-3-yl)ethyl]pyrrolidin-2-one Chemical compound O=C1N(C=C)CCC1CCC1C(=O)N(C=C)CC1 MULNMJMKETYRBG-UHFFFAOYSA-N 0.000 description 1
- KWVGIHKZDCUPEU-UHFFFAOYSA-N 2,2-dimethoxy-2-phenylacetophenone Chemical compound C=1C=CC=CC=1C(OC)(OC)C(=O)C1=CC=CC=C1 KWVGIHKZDCUPEU-UHFFFAOYSA-N 0.000 description 1
- NEBBLNDVSSWJLL-UHFFFAOYSA-N 2,3-bis(2-methylprop-2-enoyloxy)propyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCC(OC(=O)C(C)=C)COC(=O)C(C)=C NEBBLNDVSSWJLL-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- INQDDHNZXOAFFD-UHFFFAOYSA-N 2-[2-(2-prop-2-enoyloxyethoxy)ethoxy]ethyl prop-2-enoate Chemical compound C=CC(=O)OCCOCCOCCOC(=O)C=C INQDDHNZXOAFFD-UHFFFAOYSA-N 0.000 description 1
- HWSSEYVMGDIFMH-UHFFFAOYSA-N 2-[2-[2-(2-methylprop-2-enoyloxy)ethoxy]ethoxy]ethyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCOCCOCCOC(=O)C(C)=C HWSSEYVMGDIFMH-UHFFFAOYSA-N 0.000 description 1
- IUMRWGYGZHKZKF-UHFFFAOYSA-N 2-aminoprop-2-enamide Chemical compound NC(=C)C(N)=O IUMRWGYGZHKZKF-UHFFFAOYSA-N 0.000 description 1
- ZCDADJXRUCOCJE-UHFFFAOYSA-N 2-chlorothioxanthen-9-one Chemical compound C1=CC=C2C(=O)C3=CC(Cl)=CC=C3SC2=C1 ZCDADJXRUCOCJE-UHFFFAOYSA-N 0.000 description 1
- WFUGQJXVXHBTEM-UHFFFAOYSA-N 2-hydroperoxy-2-(2-hydroperoxybutan-2-ylperoxy)butane Chemical compound CCC(C)(OO)OOC(C)(CC)OO WFUGQJXVXHBTEM-UHFFFAOYSA-N 0.000 description 1
- QPXVRLXJHPTCPW-UHFFFAOYSA-N 2-hydroxy-2-methyl-1-(4-propan-2-ylphenyl)propan-1-one Chemical compound CC(C)C1=CC=C(C(=O)C(C)(C)O)C=C1 QPXVRLXJHPTCPW-UHFFFAOYSA-N 0.000 description 1
- JJRDRFZYKKFYMO-UHFFFAOYSA-N 2-methyl-2-(2-methylbutan-2-ylperoxy)butane Chemical compound CCC(C)(C)OOC(C)(C)CC JJRDRFZYKKFYMO-UHFFFAOYSA-N 0.000 description 1
- KTALPKYXQZGAEG-UHFFFAOYSA-N 2-propan-2-ylthioxanthen-9-one Chemical compound C1=CC=C2C(=O)C3=CC(C(C)C)=CC=C3SC2=C1 KTALPKYXQZGAEG-UHFFFAOYSA-N 0.000 description 1
- BUZICZZQJDLXJN-UHFFFAOYSA-N 3-azaniumyl-4-hydroxybutanoate Chemical compound OCC(N)CC(O)=O BUZICZZQJDLXJN-UHFFFAOYSA-N 0.000 description 1
- DBCAQXHNJOFNGC-UHFFFAOYSA-N 4-bromo-1,1,1-trifluorobutane Chemical compound FC(F)(F)CCCBr DBCAQXHNJOFNGC-UHFFFAOYSA-N 0.000 description 1
- 239000004342 Benzoyl peroxide Substances 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical group N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 description 1
- 241000194033 Enterococcus Species 0.000 description 1
- 241000194032 Enterococcus faecalis Species 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- 235000009161 Espostoa lanata Nutrition 0.000 description 1
- 240000001624 Espostoa lanata Species 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- YIVJZNGAASQVEM-UHFFFAOYSA-N Lauroyl peroxide Chemical compound CCCCCCCCCCCC(=O)OOC(=O)CCCCCCCCCCC YIVJZNGAASQVEM-UHFFFAOYSA-N 0.000 description 1
- NQSMEZJWJJVYOI-UHFFFAOYSA-N Methyl 2-benzoylbenzoate Chemical compound COC(=O)C1=CC=CC=C1C(=O)C1=CC=CC=C1 NQSMEZJWJJVYOI-UHFFFAOYSA-N 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 229920000153 Povidone-iodine Polymers 0.000 description 1
- 206010037888 Rash pustular Diseases 0.000 description 1
- 206010072170 Skin wound Diseases 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 241000194017 Streptococcus Species 0.000 description 1
- 238000005299 abrasion Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 150000008062 acetophenones Chemical class 0.000 description 1
- 125000005396 acrylic acid ester group Chemical group 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 229920006318 anionic polymer Polymers 0.000 description 1
- 229920001586 anionic polysaccharide Polymers 0.000 description 1
- 150000004836 anionic polysaccharides Chemical class 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- UHOVQNZJYSORNB-UHFFFAOYSA-N benzene Substances C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- RWCCWEUUXYIKHB-UHFFFAOYSA-N benzophenone Chemical compound C=1C=CC=CC=1C(=O)C1=CC=CC=C1 RWCCWEUUXYIKHB-UHFFFAOYSA-N 0.000 description 1
- 150000008366 benzophenones Chemical class 0.000 description 1
- 235000019400 benzoyl peroxide Nutrition 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- ZGCZDEVLEULNLJ-UHFFFAOYSA-M benzyl-dimethyl-(2-prop-2-enoyloxyethyl)azanium;chloride Chemical compound [Cl-].C=CC(=O)OCC[N+](C)(C)CC1=CC=CC=C1 ZGCZDEVLEULNLJ-UHFFFAOYSA-M 0.000 description 1
- 229940064804 betadine Drugs 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- MQDJYUACMFCOFT-UHFFFAOYSA-N bis[2-(1-hydroxycyclohexyl)phenyl]methanone Chemical compound C=1C=CC=C(C(=O)C=2C(=CC=CC=2)C2(O)CCCCC2)C=1C1(O)CCCCC1 MQDJYUACMFCOFT-UHFFFAOYSA-N 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- IAFKYHKADVFANN-UHFFFAOYSA-N bromyloxy bromate Chemical compound Br(=O)(=O)OOBr(=O)=O IAFKYHKADVFANN-UHFFFAOYSA-N 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 229920006317 cationic polymer Polymers 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 230000001332 colony forming effect Effects 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 239000004020 conductor Substances 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- LSXWFXONGKSEMY-UHFFFAOYSA-N di-tert-butyl peroxide Chemical compound CC(C)(C)OOC(C)(C)C LSXWFXONGKSEMY-UHFFFAOYSA-N 0.000 description 1
- 125000004985 dialkyl amino alkyl group Chemical group 0.000 description 1
- 239000012954 diazonium Substances 0.000 description 1
- 229940032049 enterococcus faecalis Drugs 0.000 description 1
- 210000002615 epidermis Anatomy 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 210000000245 forearm Anatomy 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 230000002070 germicidal effect Effects 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 230000036512 infertility Effects 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 239000012567 medical material Substances 0.000 description 1
- SQFDQLBYJKFDDO-UHFFFAOYSA-K merbromin Chemical compound [Na+].[Na+].C=12C=C(Br)C(=O)C=C2OC=2C([Hg]O)=C([O-])C(Br)=CC=2C=1C1=CC=CC=C1C([O-])=O SQFDQLBYJKFDDO-UHFFFAOYSA-K 0.000 description 1
- 229960002782 merbromin Drugs 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- UZLGVMYVDYNSCS-UHFFFAOYSA-M methyl sulfate;trimethyl(2-prop-2-enoyloxyethyl)azanium Chemical compound COS([O-])(=O)=O.C[N+](C)(C)CCOC(=O)C=C UZLGVMYVDYNSCS-UHFFFAOYSA-M 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 239000012569 microbial contaminant Substances 0.000 description 1
- 229940045641 monobasic sodium phosphate Drugs 0.000 description 1
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 1
- 235000019799 monosodium phosphate Nutrition 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 230000001453 nonthrombogenic effect Effects 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 239000003973 paint Substances 0.000 description 1
- FZUGPQWGEGAKET-UHFFFAOYSA-N parbenate Chemical compound CCOC(=O)C1=CC=C(N(C)C)C=C1 FZUGPQWGEGAKET-UHFFFAOYSA-N 0.000 description 1
- 239000011236 particulate material Substances 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 239000011505 plaster Substances 0.000 description 1
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920000768 polyamine Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 230000000379 polymerizing effect Effects 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 239000011970 polystyrene sulfonate Substances 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- LJCNRYVRMXRIQR-OLXYHTOASA-L potassium sodium L-tartrate Chemical compound [Na+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O LJCNRYVRMXRIQR-OLXYHTOASA-L 0.000 description 1
- 229960001621 povidone-iodine Drugs 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- BWJUFXUULUEGMA-UHFFFAOYSA-N propan-2-yl propan-2-yloxycarbonyloxy carbonate Chemical compound CC(C)OC(=O)OOC(=O)OC(C)C BWJUFXUULUEGMA-UHFFFAOYSA-N 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 208000029561 pustule Diseases 0.000 description 1
- 125000005412 pyrazyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical group 0.000 description 1
- 238000005956 quaternization reaction Methods 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 238000003847 radiation curing Methods 0.000 description 1
- 238000010526 radical polymerization reaction Methods 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000000565 sealant Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 1
- 239000001476 sodium potassium tartrate Substances 0.000 description 1
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 1
- GGCZERPQGJTIQP-UHFFFAOYSA-N sodium;9,10-dioxoanthracene-2-sulfonic acid Chemical compound [Na+].C1=CC=C2C(=O)C3=CC(S(=O)(=O)O)=CC=C3C(=O)C2=C1 GGCZERPQGJTIQP-UHFFFAOYSA-N 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- GJBRNHKUVLOCEB-UHFFFAOYSA-N tert-butyl benzenecarboperoxoate Chemical compound CC(C)(C)OOC(=O)C1=CC=CC=C1 GJBRNHKUVLOCEB-UHFFFAOYSA-N 0.000 description 1
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- YRHRIQCWCFGUEQ-UHFFFAOYSA-N thioxanthen-9-one Chemical compound C1=CC=C2C(=O)C3=CC=CC=C3SC2=C1 YRHRIQCWCFGUEQ-UHFFFAOYSA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- OEIXGLMQZVLOQX-UHFFFAOYSA-N trimethyl-[3-(prop-2-enoylamino)propyl]azanium;chloride Chemical compound [Cl-].C[N+](C)(C)CCCNC(=O)C=C OEIXGLMQZVLOQX-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F20/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride, ester, amide, imide or nitrile thereof
- C08F20/02—Monocarboxylic acids having less than ten carbon atoms, Derivatives thereof
- C08F20/52—Amides or imides
- C08F20/54—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide
- C08F20/60—Amides, e.g. N,N-dimethylacrylamide or N-isopropylacrylamide containing nitrogen in addition to the carbonamido nitrogen
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
- A01N25/08—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests containing solids as carriers or diluents
- A01N25/10—Macromolecular compounds
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N33/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic nitrogen compounds
- A01N33/02—Amines; Quaternary ammonium compounds
- A01N33/12—Quaternary ammonium compounds
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/12—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing the group, wherein Cn means a carbon skeleton not containing a ring; Thio analogues thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/18—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing the group —CO—N<, e.g. carboxylic acid amides or imides; Thio analogues thereof
- A01N37/20—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids containing the group —CO—N<, e.g. carboxylic acid amides or imides; Thio analogues thereof containing the group, wherein Cn means a carbon skeleton not containing a ring; Thio analogues thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B5/00—Measuring for diagnostic purposes; Identification of persons
- A61B5/24—Detecting, measuring or recording bioelectric or biomagnetic signals of the body or parts thereof
- A61B5/25—Bioelectric electrodes therefor
- A61B5/251—Means for maintaining electrode contact with the body
- A61B5/257—Means for maintaining electrode contact with the body using adhesive means, e.g. adhesive pads or tapes
- A61B5/259—Means for maintaining electrode contact with the body using adhesive means, e.g. adhesive pads or tapes using conductive adhesive means, e.g. gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/74—Synthetic polymeric materials
- A61K31/785—Polymers containing nitrogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0002—Galenical forms characterised by the drug release technique; Application systems commanded by energy
- A61K9/0009—Galenical forms characterised by the drug release technique; Application systems commanded by energy involving or responsive to electricity, magnetism or acoustic waves; Galenical aspects of sonophoresis, iontophoresis, electroporation or electroosmosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/46—Deodorants or malodour counteractants, e.g. to inhibit the formation of ammonia or bacteria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
- A61L15/60—Liquid-swellable gel-forming materials, e.g. super-absorbents
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F20/00—Homopolymers and copolymers of compounds having one or more unsaturated aliphatic radicals, each having only one carbon-to-carbon double bond, and only one being terminated by only one carboxyl radical or a salt, anhydride, ester, amide, imide or nitrile thereof
- C08F20/02—Monocarboxylic acids having less than ten carbon atoms, Derivatives thereof
- C08F20/10—Esters
- C08F20/34—Esters containing nitrogen, e.g. N,N-dimethylaminoethyl (meth)acrylate
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01B—CABLES; CONDUCTORS; INSULATORS; SELECTION OF MATERIALS FOR THEIR CONDUCTIVE, INSULATING OR DIELECTRIC PROPERTIES
- H01B1/00—Conductors or conductive bodies characterised by the conductive materials; Selection of materials as conductors
- H01B1/06—Conductors or conductive bodies characterised by the conductive materials; Selection of materials as conductors mainly consisting of other non-metallic substances
- H01B1/12—Conductors or conductive bodies characterised by the conductive materials; Selection of materials as conductors mainly consisting of other non-metallic substances organic substances
- H01B1/122—Ionic conductors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/20—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices containing or releasing organic materials
- A61L2300/204—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices containing or releasing organic materials with nitrogen-containing functional groups, e.g. aminoxides, nitriles, guanidines
- A61L2300/208—Quaternary ammonium compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/404—Biocides, antimicrobial agents, antiseptic agents
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Epidemiology (AREA)
- Agronomy & Crop Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Pest Control & Pesticides (AREA)
- Plant Pathology (AREA)
- Dentistry (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Environmental Sciences (AREA)
- Organic Chemistry (AREA)
- Hematology (AREA)
- Polymers & Plastics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Materials Engineering (AREA)
- Dispersion Chemistry (AREA)
- Physics & Mathematics (AREA)
- Dermatology (AREA)
- Toxicology (AREA)
- Inorganic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Biomedical Technology (AREA)
- Pathology (AREA)
- Biophysics (AREA)
- Heart & Thoracic Surgery (AREA)
- Medical Informatics (AREA)
- Molecular Biology (AREA)
- Surgery (AREA)
- Materials For Medical Uses (AREA)
- Medicinal Preparation (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
Description
- Diese Erfindung bezieht sich auf Hydrogel-Wundverbände, die aufgrund ihrer Beschaffenheit antimikrobiell sind. Im Besonderen ist diese Erfindung auf Wundverbände gerichtet, die inhärent antimikrobielle Hydrogele enthalten, wobei das Hydrogel durch die Polymerisation von acrylierten quaternären Ammonium-Monomeren in einem flüssigem Medium gebildet wird.
- In der Vergangenheit wurden Wunden mit auf die Wunde aufgetragenen antimikrobiell aktiven Substanzen behandelt und mit einer Abdeckung bedeckt, die den Wundheilungsprozess hemmt. Zum Beispiel war es zu Beginn des 20. Jahrhunderts gängige Praxis, ein antiseptisches Quecksilber-Reagenz, wie Thimerosal (Merthiolat) oder Merbromin (Mercuchrom) und Ähnliche auf eine Wunde zu applizieren, und dann die Wunde mit einer Bandage, wie Gaze oder einem klebenden Streifen, der in der Mittel einen absorbierende Gazeanteil aufwies, abzudecken oder zu umwickeln.
- Ein Nachteil dieses Vorgehens ist, dass die Wunde häufig nässt oder Flüssigkeiten, wie Blut, Eiter und Ähnliches, austritt. Während die Gaze einige dieser Flüssigkeiten absorbieren kann, haftet die Gaze oft so fest an der Wunde, dass ein Entfernen des Verbandes die Wunde wieder öffnet.
- Fortschritte im Stand der Technik wurden sowohl bei den Verbänden als auch bei den antimikrobiellen Substanzen gemacht. Bestimmte Verbände enthalten heute eine nicht-anhaftende, polymerische Beschichtung oder stattdessen hemmt die Gaze nicht nur das Anhaften des absorbierenden Materials an die Wunde, sondern auch die Absorption der Wundflüssigkeit (Exsudat), was notwendig ist, um die Wunde in geeigneter Weise zu heilen.
- Bestimmte Wundverband-Materialien wurden verwendet, um Exsudat zu absorbieren und die Heilung zu fördern. Mason et al. z. B., U.S. Patent Nr. 4,393,048, lehren eine Hydrogel-Zusammensetzung, die, als Puder auf die Wunde aufgetragen, Exsudat absorbiert. Die Hydrogel-Bildung kann nicht vollständig sein, und Klumpen von nur teilweise hydratisiertem Puder können sich bilden, so dass, wenn sie entfernt werden, die Wunde sich wieder öffnen kann.
- Es ist bekannt, dass Wunden schneller und vollständig heilen, wenn sie in einem leicht feuchten oder hydratisierten Zustand gehalten werden. Polyethylenglykol enthaltende Hydrogel-Wundabdeckungen sind in Spence, U.S. Patent Nr. 4,226,232, offenbart. Diese Hydrogele können nicht durch Strahlung sterilisiert werden, da sich dabei freie Radikale bilden.
- Rawlings et al., U.S. Patent Nr. 4,657,006, beschreiben Wundverbände, die ein hydrophiles Polymer mit feuchtigkeits- und dampfdurchlassenden Eigenschaften enthalten. Jedoch neigt das Exsudat, das von dem hydrophilen Polymer absorbiert wurde, zur Aushärtung bzw. verfestigt das Polymer.
- Ein idealer Wundverband sollte nicht nur Exsudat absorbieren, sondern auch antimikrobielle Eigenschaften aufweisen. Mason et al., z. B., U.S. Patent Nr. 4,728, 323, offenbaren einen Wundverband, der ein Substrat enthält, das mit einer antimikrobiellen Lage eines Silbersalzes bedeckt ist, das angeblich die Wunde feucht hält.
- Korol, U.S. Patent 4,563,184, offenbart Wundverbände, die ein Polymer, wie Poly(2-Hydroxyäthylmethacrylat), ein Lösungsmittel, wie Polyethylenglykol, und ein Weichmacher, wie DMSO, enthalten. Ein antimikrobieller Wirkstoff, wie Silbersulfadiazin, kann in das polymerische Material mit eingeschlossen werden.
- Widra, U.S. Patent 4,570,629, bezieht sich auf absorbierende Hydrogelmembran-Wundverbände, die aus hydrophilen, biopolymerischen Co-Polyelektrolyten hergestellt sind, die eine wasserlösliche, lineare, anionische Protein-Polyelektrolyt-Komponente aufweisen, die entweder von Kollagen oder einem Glukosaminglykan, abgeleitet ist. Die Membranen können auch Antibiotika enthalten.
- Klemm et al., U.S. Patent 4,191,743, lehren die Verabreichung von Antibiotika auf Wunden durch Verwendung von Wundverbänden, die mindestens zwei übereinander angeordnete Lagen eines synthetischen Harzes enthalten, mit einer Zwischenlage, die aus einem synthetischen Harzgranulat und eingeschlossenem Antibiotikum, zusammengesetzt ist.
- Es ist bekannt, dass bestimmte quaternäre Aminsalze antimikrobielle Eigenschaften aufweisen. Beispiele schließen Benzethoniumchlorid und Benzalkoniumchlorid (Bactin®) ein. Es ist auch bekannt, das bestimmte quaternäre Amine in polymerische Substrate eingeschlossen werden können, um einen bestimmten Grad an antimikrobieller Aktivität zu liefern.
- Rebaum et al., U.S. Patent 3,898,188 lehren kationische Polyelektrolyt-Homopolymere, die aus einem Alkylaminhalogenid-Monomer gebildet werden, die für verschiedene medizinische Anwendungen nützlich sind. Diese Polymere werden durch die Kopf-Schwanz Quaternisierungsreaktion der Monomere gebildet, um lineare Ketten zu bilden. Von solchen Polyelektrolyt-Homopolymeren wurde berichtet, dass sie bakterizide Aktivität aufweisen und topisch auf verletzte Hautgebiete aufgebracht werden können, wie bei der Behandlung von Verbrennungen, Abschürfungen und Schnitten. Die Homopolymere jedoch weisen keine gelbildenden Eigenschaften auf und müssen, um eine die Feuchtigkeit zurückhaltende Struktur zu bilden, mit Polyvinylalkohol oder Polyvinylpyrrolidon zusammengebracht werden. Solche Kombinationen resultieren in Filmen, die Gazematerialen imprägnieren können, um ein antiseptisches oder keimtödendes Verbandmaterial zu erhalten. Die Homopolymere können auch, durch das Anbinden von quaternären Homopolymeren an dem Gerüst eines Polymersubstrates, wie ein Poly-Dialkylamino-Alkylacrylat oder ein Polyalkyl-Aminoacrylamid, zu verzweigten Polymeren umgewandelt werden, die eine kammartige Struktur aufweisen. Solche kammartigen Polymere sind für das Bedecken von Substraten, wie Fotokopierpapier, nützlich. Weiterhin können die Polyelektrolyt-Monomeren mit anionischen Polymeren, wie Polystyrolsulfonaten, Polyacrylaten oder Heparin, copolymerisiert werden, um Copolymere zu liefern, die Oberflächen, wie Röhren, Kathether, Klappen und Ähnliche, mit einer nicht-thrombogenen Beschichtung bedecken können.
- Hou et al., U.S. Patent 4,791,063 lehren eine Polyionen-transformierte modifizierte Polymerpolysaccharid-Trennmatrix zur Verwendung bei der Entfernung von mikrobiellen Verunreinigungen aus biologischen Flüssigkeiten. Dieses Patent lehrt, dass die Absorption der Bakterienzellen durch Ionenaustausch-Säulen auf elektrostatische Anziehung zwischen quaternären Ammoniumgruppen auf der Säulenoberfläche und den Carboxylgruppen auf der Bakterienzellwand zurückzuführen ist.
- Hansen et al., U.S. Patent 5,498,478 beziehen sich auf die Verwendung von Polyethylenglykol oder einem ähnlichen Polymer als ein Bindemittel für Fasern jeglicher Art. Die Bindemittel und Fasern können vorbehandelt werden, indem die Fasern in Bädern aufgeschlämmt werden, die antimikrobielle Wirkstoffe als Teil der Lösung enthalten, wobei die Fasern und die nachfolgend gebildete Matrix aus Polymer und Fasern eine antimikrobielle Eigenschaft aufweist.
- Mixon et al., U.S. Patent 5,069,907 beziehen sich auf die Bildung und die Verwendung eines Polymerblatts, das einen antimikrobiellen Wirkstoff enthalten kann. Dieses Patent lehrt den Einschluss von antimikrobiellen Wirkstoffen in entweder eine druckempfindliche Schicht, wie ein Adhäsiv, oder in einem Stoff, der zum Abdecken von einer Wunde oder anderen empfindlichen Gebieten verwendet werden kann.
- Diez et al., U.S. Patente 5,674, 561 und 5,670,557 lehren polymerisierte, druckempfindliche, adhäsive, polymerisierte Mikroemulsions-Zusammensetzungen, die optional antimikrobielle und/oder andere biologisch wirksame Substanzen enthalten können. Die mögliche antimikrobielle Aktivität des quaternären Amins und des quaternären Ammoniumsalzes wird beschrieben. Weiter wird gelehrt, dass ein antimikrobieller Wirkstoff zugefügt werden kann, so dass er in einer bestimmten Schicht des druckempfindlichen, adhäsiven Mittels enthalten ist, zur Verwendung als eine medizinische Kunsthaut zum Abdecken und/oder als Wundverband.
- Young et al., U.S. Patent 5,432,000 lehren die Verwendung eines polymerisierten Netzwerkes zum Anheften von partikulärem Material an eine Faser oder ein Faserprodukt. Insbesondere lehrt dieses Patent die Verwendung eines Polymers, wie Polyethylenglykol oder Polyethylen, um die Bindung von partikulären Material an eine Faser, wie Stoff, zu bewirken. Ein solches besonderes Reagenz, das an einen Stoff befestigt werden kann, ist ein antimikrobieller Wirkstoff, wie Epoxidphenol oder eine andere antimikrobielle Substanz.
- Wo-A-98/29463 offenbart eine Klasse antimikrobieller Polymere, die eine Acrylat-Hauptstruktur in Kombination mit einer quaternären Ammoniumgruppe umfassen. Diese Veröffentlichung bezieht sich hauptsächlich auf die Verwendung dieser Polymere in Farben, insbesondere für Fassaden, die in Gefahr sind, durch Mikroorganismen beeinträchtigt zu werden. Darüber hinaus bezieht sich diese Publikation auch sehr allgemein auf die Verwendung dieser Polymere zur Herstellung von medizinischen Materialien, ohne diese näher zu spezifizieren.
- WO-A-98/19311 bezieht sich auf elektrisch leitende adhäsive Hydrogele, die kationische quaternäre Aminacrylat-Einheiten umfassen.
- Es besteht ein Bedürfnis für einen Wundverband, der die gewünschten Eigenschaften, der Exsudatabsorption, der Rückhaltung von Feuchtigkeit in der Wunde und antimikrobielle Eigenschaft in einer einzelnen Hydrogelstruktur vereinigt.
- Es ist eine Aufgabe der vorliegenden Erfindung, einen kationischen quaternären Amin-Polyacrylat-Hydrogel-Wundverband zu liefern, der aufgrund ihrer Beschaffenheit antimikrobiell ist.
- Eine andere Aufgabe dieser Erfindung ist es, einen Hydrogel-Wundverband zu liefern, der Exsudat aufsaugt und es erlaubt, die Wunde in einer hydratisierten oder feuchten, abdichtenden Umgebung zu halten.
- Eine weitere Aufgabe dieser Erfindung ist es, einen Wundverband, der ein Hydrogel enthält, zu liefern, aus der Polymerisation des kationischen quaternären Amin-Polyacrylsäureesters oder Amid-Monomeren gebildet, wobei die gebildeten Polymeren inhärent anti-mikrobiell sind und, wenn sie im hydrastisiertem Zustand vorliegen, Hydrogel-Verbände liefern, die eine adhäsive Eigenschaft aufweisen und locker an der Wunde haften, um die Wunde hydratisiert zu halten, die das Exsudat aufzusaugen und einfach entfernt werden können, ohne den Wundheilungsprozess zu stören.
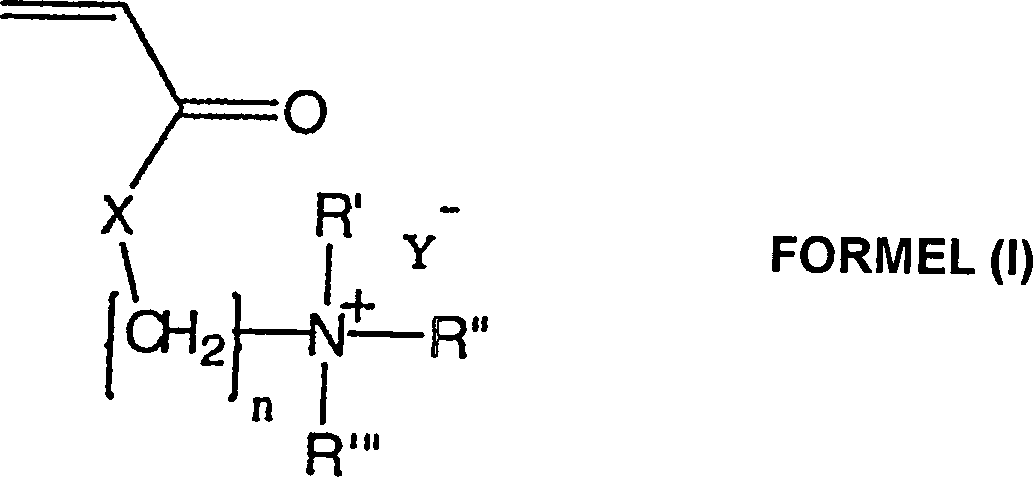
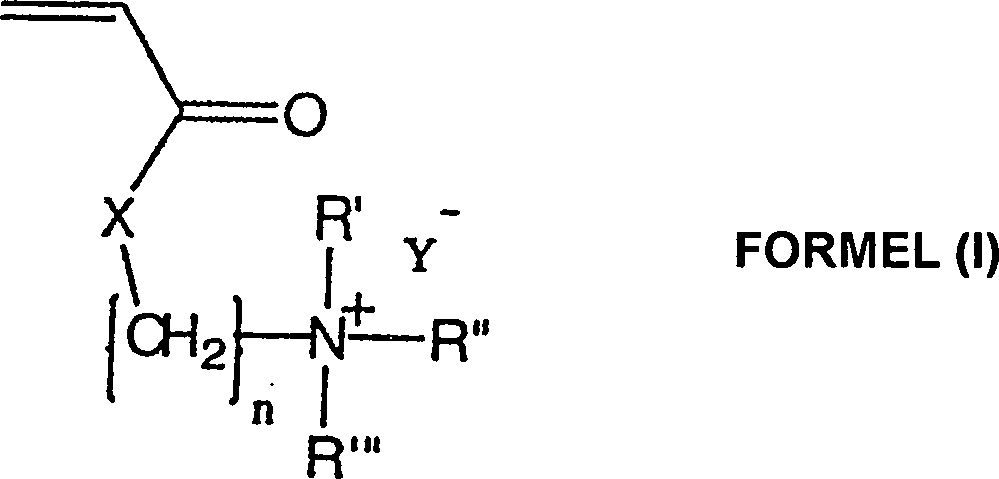
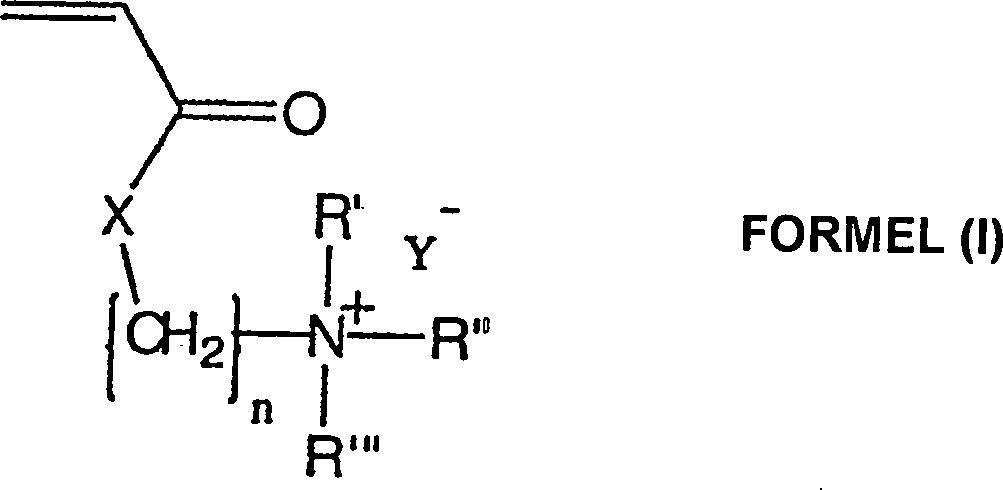
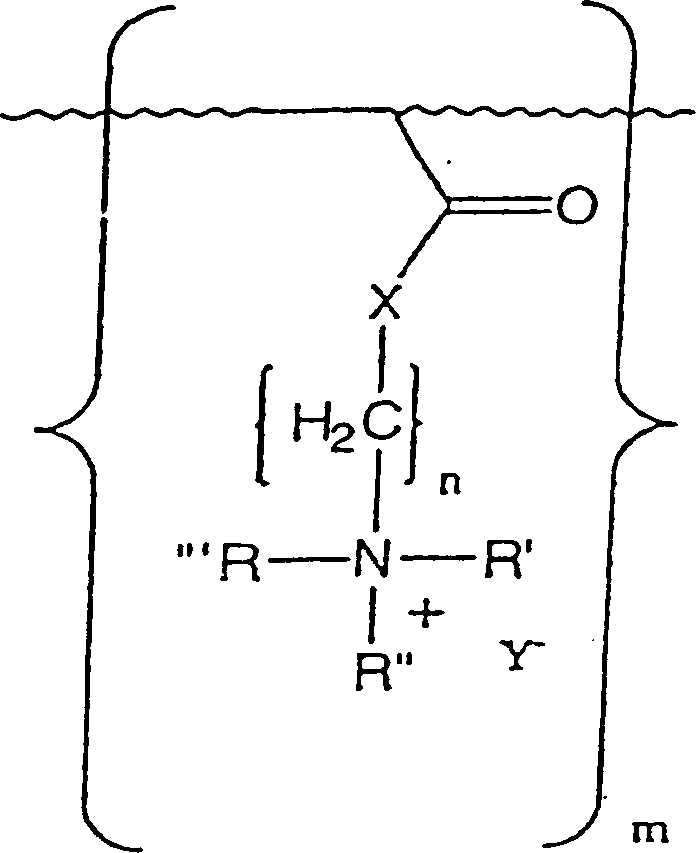
- Die vorliegende Erfindung richtet sich auf die Verwendung von einem anti-mikrobiellen kationischen quaternären Amin-Acrylat-Polymeren der Formel (I): wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus einer Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus einer Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50000 ist, als ein Wundverband.
- Die vorliegende Erfindung liefert einen Wundverband, umfassend ein Hydrogel, das von ungefähr 15 bis 95 Gewichtsprozent des inhärenten antimikrobiellen Polyamin-Acrylat-Monomeren der Formel (I); wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus einer Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus einer Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50000 ist.
- Die vorliegende Erfindung liefert weiter ein Mittel zum Abdecken von Wunden, umfassend ein Substrat, das fest daran gebunden einen Wundverband aufweist, der eine Hydrogel umfasst, das ungefähr 15 bis 95 Gewichtsprozent eines antimikrobiellen in-Acrylat-Polymeren der Formel (I) enthält: wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus einer Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus einer Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50 000 ist.
- Darüber hinaus ist die Erfindung auf die Verwendung eines Hydrogels gerichtet, das von ungefähr 15 bis 95 Gewichtsprozent eines inhärenten antimikrobiellen kationischen quaternären Amin-Polyacrylat-Polymeren der Formel (I) enthält: wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus einer Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus einer Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50000 ist zum Herstellen eines Wundverbandes.
- Bevorzugte Ausführungsformen der vorliegenden Erfindung sind in den Unteransprüchen aufgeführt.
- Die Alkylgruppen sind vorzugsweise solche mit wenigen C-Atomen, von C1 bis C6 mit Methyl- oder Äthylgruppen. Aryl ist bevorzugt Phenyl, aber kann irgendeine geeignete aromatische Teileinheit sein, wie solche, die aus der Gruppe ausgewählt sind, die aus Phenyl, Thiophenyl, Naphthyl, Biphenyl, Pyridyl, Pyrimidinyl, Pyrazyl, Pyridazinyl, Furyl, Thienyl, Pyrryl, Quinolinyl und Bipyridyl. Ein repräsentativer Vertreter einer Aralkylgruppe ist Benzyl und ein repräsentativer Vertreter aus einer Alkarylgruppe ist Tolyl. X ist O oder NH Repräsentative Gegenionen, mit Y– gekennzeichnet, sind Mitglieder, die aus der Gruppe ausgewählt sind, die aus Cl–, Br–, HSO4 – und CH3SO4 – besteht. Alkylgruppen können gerade oder unverzweigt sein und Alkyl- und Arylgruppen können durch nicht- interferierende Substituenten ersetzt werden, die die Funktionalität der Polymers nicht stören.
- Das kationische quaternäre Ammoniumpolymer kann in einem wässrigen Medium hergestellt werden und ein Hydrogel in situ bilden oder kann in einem wässrigen Medium hergestellt, getrocknet und zu einem Pulver umgewandelt werden, das dann in einem wässrigen Medium zu einem Hydrogel rekonstituiert werden kann.
- Das Polymer wird durch Polymerisation eines Acrylsäuremonomers, gemäß nachstehender Formel (II) hergestellt: wobei n, R', R'' und R''', X, Y die Bedeutungen aufweisen, die auch für die obige Formel (I) gelten. Die Polymerisation wird mit Verfahren, die im Stand der Technik bekannt sind, vorgenommen, wie Härten durch freie Radikale mittels Starter-induzierter Polymerisation in Anwesenheit von Wasser durch Ultraviolett-Härtung und einem multifunktionalenn quervernetzenden Reagenz oder durch anionische 1,2-Alkoxy-Anioninduzierte Polymerisation.
- Die kationischen quaternären Ammoniumpolymere, die in dieser Erfindung verwendet werden, besitzen aufgrund ihrer Beschaffenheit antimikrobielle Eigenschaften und sind absorbierend und nicht-reizend für die Haut oder offene Wunden. Die Absorptionskraft des Hydrogels erlaubt, dass, wenn es als Wundverband angewendet wird, weniger Verbandswechsel notwendig sind, die Wunde schneller heilt und eine feuchte heilende Umgebung aufrecht erhalten wird. Die Polymere sind resistent gegenüber Strahlung und können daher durch solche Mittel sterilisiert werden. Weil die Polymere inhärent antimikrobiell sind, wird die Wunde in einer sterilen Umgebung gehalten, die die Wundheilung fördert. Weil die Polymere polykationisch sind, ist es weiter möglich, dass die Heilung beschleunigt ist, da die Blutgerinnung aktiviert ist, weil das kationische Polymer die polyanionischen Gerinnungsinhibitoren, wie das natürlich vorkommende anionische Polysaccharid Heparin, neutralisiert,.
- Die Hydrogele werden vorzugsweise mit einer physikalischen Trägerstruktur hergestellt, um das Hydrogel auf der Wunde zu halten. Diese physikalische Trägerstruktur kann in Form eines abdichtenden Mittels, das eine undurchlässige Rückseite aufweist, vorliegen, z. B. als ein Pflaster. Da das Hydrogel sowohl inhärent adhäsiv als auch antimikrobiell ist, kann die Verwendung von dauerhafteren Haftmitteln entweder nützlich oder weniger nützlich sein. Das Hydrogel kann auch um ein Netz oder einen Faserträger gebildet werden und in geeignete Größen hinsichtlich Fläche und Tiefe, zugeschnitten werden, d. h. in Blätter, Streifen, Quadrate, Kreise oder Ovale.
- Die kationischen quaternären Amin-Polyacrylatgele, die in dieser Erfindung verwendet werden, sind geeignet, signifikante Mengen an Flüssigkeit oder Exsudat, das aus der Wunde oder anderen oberflächigen Hautabschürfungen stammt, aufzusaugen. Es ist bekannt, dass die Ansammlung von überschüssiger Wundflüssigkeit schädlich für den Heilungsprozess ist und einen fruchtbaren Ort für das Bakterienwachstum darstellt, was den Wundheilungsprozess zusätzlich hemmt. Wegen der Absorptionskraft des Hydrogels, kann ein Wechsel des Wundverbandes seltener erfolgen und eine sterile Umgebung ist trotzdem gewährleistet. Alternativ kann der Wundverband gewechselt werden, wenn die Exsudatabgabe zu hoch ist.
- Die kationischen Hydrogele belassen die Wunde in einer feuchten Umgebung, die nicht nur die Heilung erleichtert, sondern steigert auch das kosmetische Erscheinungsbild der Wunde beim Heilen.
- Wie vorher schon festgestellt, wurde zu den Hydrogelen und/oder Wundverbänden aus dem Stand der Technik ein Antibiotikum oder ein anderes Desinfektionsmittel zugefügt, um Sterilität zu erreichen und die Heilung zu beschleunigen. Während solche externen Antibiotika immer noch zugefügt werden können, wenn es notwendig erscheint, ist die Zugabe solcher externer Additiva aufgrund der inhärent antimikrobiellen Eigenschaften der in dieser Erfindung verwendeten Hydrogele unnötig. Wie man sehen wird, sind die antimikrobiellen Eigenschaften der in dieser Erfindung verwendeten Hydrogele wirksam gegenüber einem weiten Bereich an Mikroorganismen.
- Ein anderer vorteilhafter Unterschied der kationischen quaternären Amin-Polyacrylat-Hydrogele betrifft die Sterilisation. Die Anbieter von Verbänden verpacken diese im allgemeinen in einer geschlossenen Umgebung unter sterilen Bedingungen. Weil die Hydrogele Dampf und andere bei der Sterilisation verwendeten Wirkstoffe absorbieren, wie z. B. Äthylenoxid, können sie auf diese Weise nicht sterilisiert werden und die Verwendung von Strahlung wirkt sich aufgrund der Degradation durch freie Radikale nachteilig auf viele Gele aus dem Stand der Technik aus. Die Hydrogele, die in der vorliegenden Erfindung verwendet werden, können ohne negative Effekte auf die Stabilität bestrahlt und verschlossen werden. Wegen der Eigenschaft der polykationischen Hydrogele mittels Strahlung sterilisiert werden zu können, brauchen sie nicht in einem „Reinraum" oder in einer sterilen Umgebung hergestellt oder verpackt zu werden.
- Wie im U.S. Patent 5,800,685 bemerkt, sind die kationischen quaternären Amin-Polyacrylat-Hydrogele gute elektrische Leiter und können zur Verwendung als Elektroden in medizinischen Einrichtungen formuliert werden, weil sie mit der Haut bei ausreichenden Feuchte und adhäsiven Eigenschaften in Kontakt stehen, und so den Durchtritt von elektrischem Strom erlauben, ohne das Hydrogel oder die Haut wesentlich negativ zu beeinflussen.
- Wenn die Hydrogele als leitende adhäsive Hydrogele verwendet werden, werden im allgemeinen große Mengen einer die elektrische Leitfähigkeit steigernden Substanz der Formulierung zugefügt, wie z. B. Kaliumchlorid. In der vorliegenden Erfindung können Salzlösungen aus Natrium- oder Kaliumchlorid in geringeren Konzentrationen als die Polymerisation fördernde Substanzen bei der Bildung des Hydrogels anwesend sein.
- Wenn die kationischen Hydrogele als Wundverbände verwendet werden, kann das Gel auch ein Puffersystem enthalten, um die Verfärbung und/oder Hydrolyse der Hydrogele zu verhindern und/oder um ihre Haltbarkeit zu verlängern. Auch andere Additiva können den Hydrogelen, entweder vor oder nach dem Härten, zugefügt werden (d. h. Pharmaka, Feuchthaltemittel, Weichmacher). Die Eignung solcher Additiva hängt im allgemeinen davon ab, welcher Verband hergestellt und auf die Wunde aufgetragen wird.
- Zusätzlich zu der Fähigkeit, Exsudat zu absorbieren und der inhärenten antimikrobiellen Eigenschaften, sind es weitere Eigenschaften, wegen denen die kationischen Acrylat-Hydrogele, die in dieser Erfindung verwendet werden, nützlich für die Verwendung als Wundverbände sind. Sie besitzen exzellente physikalische Eigenschaften in Bezug auf die Adhäsionsfähigkeit, da sie sowohl an der Haut anhaften, wenn sie aufgebracht werden, aber auch schnell wieder von der Haut entfernt werden können, ohne einen Gelrest übrig zu lassen. Verglichen mit Hydrogelen aus dem Stand der Technik, sind die kationischen Acrylat-Hydrogele der vorliegenden Erfindung über einen weiten Hydrationsbereich wirksam. Mit anderen Worten können die Gele weniger als 15 oder soviel wie 95% Gewichtsprozent der kationischen Polyacrylate enthalten. Vorzugsweise wird das Hydrogel zwischen ungefähr 61 und 90 Gewichtsprozent des Polyacrylat-Polymers enthalten und besonders bevorzugt sind Bereiche zwischen ungefähr 65 bis 75 Gewichtsprozent. Sogar bei den höheren Feststoffgehalten der Polyacrylatpolymere sind die Hydrogele auf der Wunde oder der Hautoberfläche relativ nicht-reizend.
- Die chemische Formel für kationische Amin-Polyacrylate, die zur Verwendung in der vorliegenden Erfindung geeignet sind, wird in der Formel (I) oben angegeben. Das quaternäre Amin, das Acrylsäurester oder Amidmonomere enthält, die für den Polymerisationsprozess verwendet werden können, ist in der Formel (II) gezeigt. Das bevorzugte Verfahren zum Herstellen solcher kationischen Acrylate, die zur Verwendung in der vorliegenden Erfindung geeignet sind, ist unten beschrieben.
- Im allgemeinen wird das Polymerisationsverfahren in einer wässrigen Lösung ablaufen, so dass das gebildete Hydrogel die oben erwähnten Feststoffe enthält und durch Wasser und andere Additivs ausgeglichen wird, wie oben erwähnt. Falls gewünscht, kann das Hydrogel auch ausreichend Puffer einschließen, um den pH-Wert des Hydrogels in jedem gewünschten pH-Bereich zu halten.
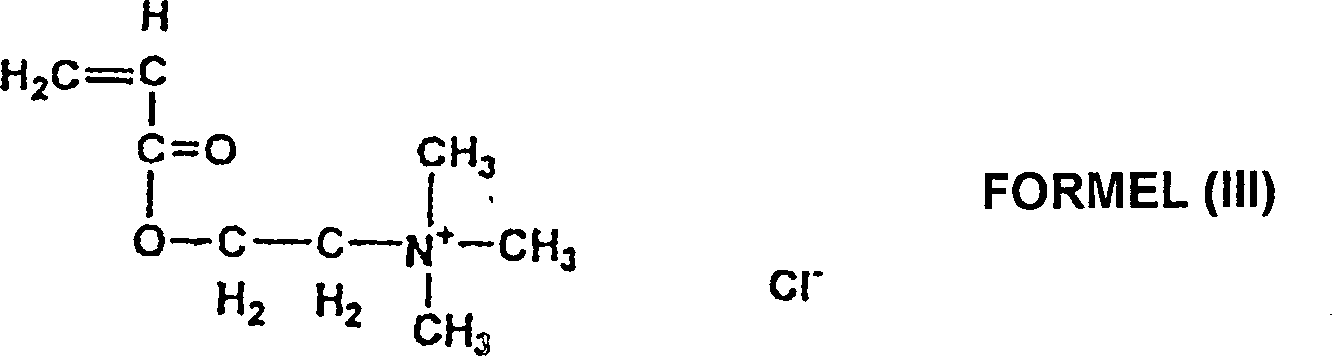
- Beispiele besonderer quaternärer kationischer Amin-Acrylatester oder von Amidmonomerern, die polymerisiert werden können, sind in den folgenden Formeln, (III), (IV), (V) und (VI) gezeigt:
- Formel (III) zeigt Acryloyloxyäthyltrimethyl-Ammoniumchlorid, das von CPS Chemical Co. erhältlich ist.
- Formel (IV) zeigt Acryloyloxyäthyltrimethyl-Ammoniummethylsulfat, das von Allied Colloid Co. erhältlich ist.
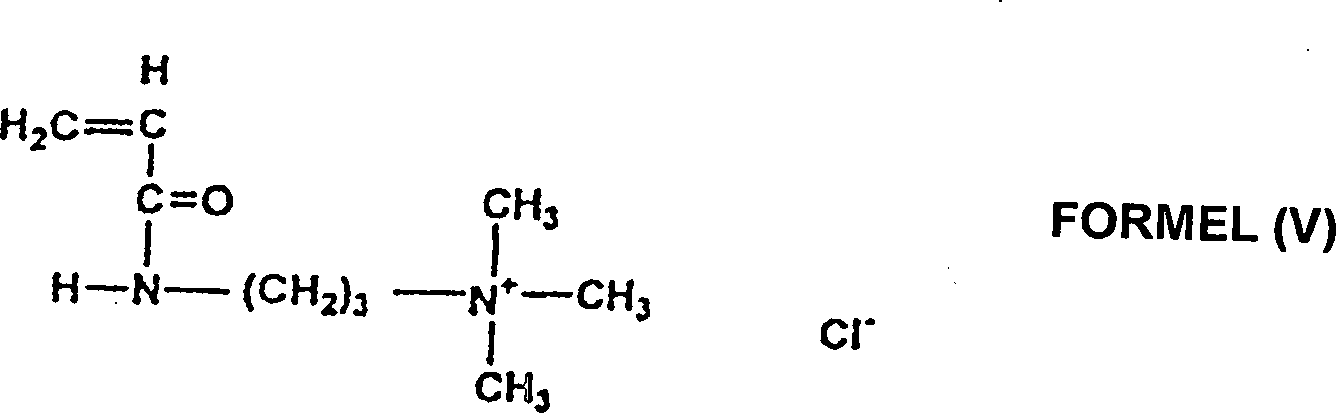
- Formel (V) zeigt Acrylamidopropyltrimethyl-Ammoniumchlorid, das von Stockhausen (Deutschland) erhältlich ist.
- Formel (VI) zeigt Acryloxyäthyldimethylbenzyl-Ammoniumchlorid, das von Elf Atochem erhältlich ist.
- Das bevorzugte Verfahren zum Herstellen der kationischen Amin-Polyacrylat-Hydrogele aus einer oder mehrerer dieser spezifischen Monomere wird im Detail unten beschrieben.
- Die kationischen quaternären Amin-Polyacrylat-Hydrogele werden vorzugsweise in situ durch freie Radikal-Polymerisation eines wasserlöslichen Monomers (wie solche, die oben gezeigt sind) in der Anwesenheit von Wasser gebildet, vorzugsweise durch Ultraviolett-Härtung mit Starter(n) und multi-funktionellen, quervernetzenden Wirkstoffen. Ein geeignetes Acrylat-Monomer z. B. (wie in der Formel (III) gezeigt), Wasser, optional zusätzliche Verstärker der Polymerisation (wie Salz, z. B. Natriumchlorid, Kaliumchlorid), Starter oder Katalysatoren (z. B. α-Hydroxy-1,α-Dimethylacetophenon in DMSO) und ein multi-funktioneller Quervernetzer (z. B. Methylen-bis-Acrylamid) werden kombiniert, in eine Form gegeben und einer Ultraviolett-Strahlung, wie im Stand der Technik bekannt, ausgesetzt. Das so gebildete kationische quaternäre Amin-Polyacrylat-Hydrogel ist etwas klarer in der Farbe, viskos und bei Berührung klebrig. Das Hydrogel haftet, als Wundverband verwendet, tendenziell in genügendem Ausmaß auf der Haut einer Person, ist aber noch genügend kohäsiv, um einfach wieder von der Haut einer Person entfernt und getrennt werden zu können.
- Wie oben erwähnt, können die in dieser Erfindung erwähnten Hydrogele ein Puffersystem einschließen, um den pH-Wert zu kontrollieren, die Verfärbung zu vermeiden, und/oder helfen, den Abbau aufgrund der verlängerten Anwesenheit von Wasser zu verhindern (d. h. die Hydrolyse zu verhindern). Die Puffer werden, wenn überhaupt, vorzugsweise vor dem Härten zu der Mischung zugefügt. Geeignete Puffer schließen z. B. Natrium-Kalium-Tartrat und/oder monobasisches Natriumphosphat ein, beide sind z. B. von Aldrich Chemical Co., IN. erhältlich. Die Verwendung eines Puffersystems mit dem Hydrogel ist bevorzugt, um das Hydrogel mit einer für den Handel geeigneten Haltbarkeit bereitzustellen (d. h. eine Haltbarkeit von über einem Jahr), ohne dass es sich verfärbt.
- Wie auch oben erwähnt, können auch andere Additiva in das Hydrogel eingeschlossen werden, entweder vor oder nach dem Härten (d. h. Pharmaka wie Antibiotika, Desinfektionsmittel, Feuchthaltemittel, Weichmacher). Die Eignung solcher Additiva ist im allgemeinen von dem bezweckten Endnutzen des besonderen Hydrogels als ein Wundverband abhängig.
- Wie oben erwähnt, werden Starter bevorzugt bei der Polymerisation der Hydrogele verwendet. Beispiele für Starter, die verwendet werden können, schließen z. B. IRGACURE® 184 (1-Hydroxycyclohexyl-Phenylketon) und DAROCURE® 1173 (α-Hydroxy-1-α-Dimethylacetophenon) ein, die beide kommerziell von der Ciba-Geigy Corp. erhältlich sind. Diese UV-Katalysatoren sind bevorzugt, weil sind keine Gelbfärbung erzeugen. Andere Starter, die die bevorzugte Wasser-weisse und Wasser-klare Erscheinung des Hydrogels gewährleisten, sind bevorzugt. Zusätzliche Beispiele von Startern jedoch (die Photo-Starter oder Wärme-Starter sein können) schließen ein: Benzoylperoxid, Azo-bis-Isobutyronitril, Di-t-Butylperoxid, Bromylperoxid, Cumylperoxid, Lauroylperoxid, Isopropylpercarbonat, Methyläthylketonperoxid, Cyclohexanperoxid, t-Butylhydroperoxid, Di-t-Amylperoxid, Dicumylperoxid, t-Butylperbenzoat, Benzoinalkyläther (wie Benzoin, Benzoin-Isopropyläther und Benzoin-Isobutyläther), Benzophenone (wie Benzophenon und Methyl-o-Benzoyl-Benzoat), Acetophenone (wie Acetophenon, Trichloroacetophenon, 2,2-Diäthyoxyacetophenon, p-t-Butyltrichloro-Acetophenon, 2,2-Dimethoxy-2-Phenylacetophenon und p-Dimethylaminoacetophenon), Thioxanthone (wie Xanthon, Thioxanthon, 2-Chlorothioxanthon und 2-Isopropylthioxanthon), Benzyl-2-Äthyl-Anthraquinon, Methylbenzoylformat, 2-Hydroxy-2-Methyl-1-Phenyl-Propan-1-on, 2-Hydroxy-4'-Isopropyl-2-Methyl-Propiophenon, α-Hydroxyketon, Tetramethyl-Thiuram-Monosulfid, Allyldiazonium-Salz und Kombinationen von Kamphoquinon und Äthyl-4-(N,N-Dimethylamino)-Benzoat. Andere Starter können z. B. in Berner et al., „Photo Initiators – An Overview", J. Radiation Curing (April 1979), pp. 2–9, gefunden werden.
- Die Menge an Starter liegt vorzugsweise innerhalb des Bereichs von ungefähr 0,02 bis 0,2 Gewichtsprozent in Bezug Gesamtmenge an Monomeren und bevorzugter innerhalb des Bereichs von ungefähr 0,05 bis 0,5 Gewichtsprozent in Bezug auf die Gesamtmenge an Monomeren.
- Die Parameter zum UV-Härten, mit denen die gewünschten Polymereigenschaften erhalten werden können, sind dem Fachmann auf seinem Gebiet gut bekannt. Ein Starter für die vorliegenden Zwecke wirkt tendenziell über die Absorption ausgewählter UV-Wellenlängen, was den Zerfall in die freien Radikale nach sich zieht und dadurch die Polymerisation startet. Die Wellenlängen und die zu härtende Fläche bestimmen die Art der UV-Lampe, die in dem Härtungsvorgang verwendet wird. Die Hemmung der Polymerisation aufgrund von gelöstem Sauerstoff, Monomeren-Schutzagenzien oder andere Komponenten können dadurch verhindert werden, dass die Strahlungsintensität durch Pulsieren verändert wird, und/oder durch Verwendung von Katalysationsbeschleunigern. Die Menge an restlichem Monomeren (nach der Polymerisation) beträgt vorzugsweise weniger als ungefähr 3%, um eine gute Biokompatibilität zu erhalten.
- Wie auch oben schon bemerkt, werden quervernetzende Wirkstoffe beim Quervernetzen der kationischen Polyacrylat-Hydrogele bevorzugt. Beispiele multifunktioneller quervernetzender Substanzen, die verwendet werden können, sind Methylen-Bis-Acrylamid (MBA) und Diäthylenglykol-Diacrylat, die beide kommerziell von Polysciences, Inc., Warrington, Pennsylvania, erhältlich sind.
- Weitere Beispiele von quervernetzenden Wirkstoffen, die zur Verwendung in der vorliegenden Erfindung akzeptabel sein können, schließen ein: Äthylenglykol-Diacrylat, Triäthylenglykol-Bis-Methacrylat, Äthylenglykol-Bis-Methacrylat, Äthylenglykol-Dimethacrylat, Bisacrylamid, Triäthylenglykol-Bis-Acrylat, 3,3'-Äthylen-Bis-(N-Vinyl-2-Pyrrolidon), Trimethylolpropat-Trimethacrylat, Glycerin-Trimethacrylat, Polyäthylenglycol-Dimethacrylat und andere Polyacrylate und Polymethacrylat-Ester.
- Die Menge an verwendetem quervernetzenden Wirkstoff liegt vorzugsweise innerhalb des Bereichs von ungefähr 0,02 bis 2,0 Gewichtsprozent in Bezug auf die Gesamtmenge an Monomeren, und bevorzugter innerhalb des Bereichs von ungefähr 0,05 bis 0,5 Gewichtsprozent in Bezug auf die Gesamtmenge an Monomeren.
- Nachfolgend sind spezifische, exemplarische Ausführungsformen kationischer quaternärer Amin-Acrylat-Hydrogele zur Verwendung in der vorliegenden Erfindung aufgeführt.
- In jedem der folgenden Beispiele war das verwendete quaternäre Amin-Acrylat-Monomer 80% Acryloyloxyäthyltrimethyl-Ammoniumchlorid in Wasser (AAC), die quervernetzende Lösung war 1% Methylen-bis-Acrylamid in Wasser (MBA), der Katalysator war 0,01% α-Hydroxyl-1,α-Dimethylacetophenon in DMSO (DAROCURE® 1173). Beispiel 1
Inhaltsstoffe Menge AAC 122 Gramm 2% Salzlösung 80 Gramm 1% MBA 20 Gramm Darocure 1173 80 μl - Diese Bestandteile wurden in der angegebenen Reihenfolge gemischt und in ein geeignetes UV-Härtungssystem überführt, wie oben beschrieben, und gemäß der im Stand der Technik gut bekannten Verfahren gehärtet. Das resultierende Gel war transparent, war leicht klebrig und hatte eine Feststoffgehalt von 61% auf das Gewicht bezogen. Beispiel 2
Inhaltsstoffe Menge AAC 61 Gramm Wasser 40 Gramm 1% MBA 10 Gramm Darocure 1173 400 μl - Das resultierende Gel hatte eine Feststoffgehalt von 61% auf das Gewicht bezogen und ist ähnlich dem in Beispiel 1, mit Ausnahme, dass die Salzlösung durch Wasser ersetzt wurde. Der Polymerisationsprozess war der gleiche wie auch die Eigenschaften des Gels. Beispiel 3
Inhaltsstoffe Menge AAC 140 Gramm 2% Salzlösung 60 Gramm 1% MBA 20 Gramm Darocure 1173 800 μl - Dem Verfahren aus Beispiel 1 wurde gefolgt und das resultierende transparente Gel war leicht klebrig und hatte eine Feststoffgehalt von 70% auf das Gewicht bezogen. Beispiel 4
Inhaltsstoffe Menge AAC 70 Gramm Wasser 30 Gramm 1% MBA 10 Gramm Darocure 1173 400 μl - Das resultierende transparente Gel war leicht klebrig und hatte eine Feststoffgehalt von 70% auf das Gewicht bezogen. Dieses Beispiel ist ähnlich dem aus Beispiel 3, mit Ausnahme, dass die Salzlösung durch Wasser ersetzt wurde. Der Polymerisationsprozess war der gleiche. Beispiel 5
Inhaltsstoffe Menge AAC 70 Gramm Wasser 30 Gramm 1% MBA 5 Gramm Darocure 1173 400 μl - Das resultierende transparente Gel hatte eine Feststoffgehalt von 70% auf das Gewicht bezogen und ist ähnlich dem aus Beispiel 4, mit Ausnahme, dass die Menge an MBA-Quervernetzer halbiert war. Der Polymerisationsprozess war der gleiche und das Gel war im wesentlichen klar und leicht klebrig. Beispiel 6
Inhaltsstoffe Menge AAC 160 Gramm 2% Salzlösung 40 Gramm 1% MBA 20 Gramm Darocure 1173 800 μl - Dem Verfahren aus Beispiel 1 wurde gefolgt und das resultierende transparente Gel war leicht klebrig und hatte eine Feststoffgehalt von 80% auf das Gewicht bezogen. Beispiel 7
Inhaltsstoffe Menge AAC 80 Gramm Wasser 20 Gramm 1% MBA 10 Gramm Darocure 1173 400 μl - Das resultierende Gel hatte eine Feststoffgehalt von 80% auf das Gewicht bezogen und ist ähnlich dem aus Beispiel 6, mit Ausnahme, dass die Salzlösung durch Wasser ersetzt wurde. Der Polymerisationsprozess war der gleiche, wie auch die physikalischen Eigenschaften des Gels. Beispiel 8
Inhaltsstoffe Menge AAC 80 Gramm Wasser 20 Gramm 1% MBA 5 Gramm Darocure 1173 400 μl - Das resultierende Gel hatte eine Feststoffgehalt von 80% auf das Gewicht bezogen und ist ähnlich dem aus Beispiel 7, mit Ausnahme, dass der Gehalt an MBA-Quervernetzter halbiert wurde. Der Polymerisationsprozess war der gleiche, wie auch die physikalischen Eigenschaften des Gels. Beispiel 9
Inhaltsstoffe Menge AAC 90 Gramm Wasser 10 Gramm 1% MBA 10 Gramm Darocure 1173 400 μl - Das Gel wurde wie in Beispiel 1 hergestellt. Das resultierende transparente Gel war leicht klebrig und hatte einen Feststoffgehalt von 90% auf das Gewicht bezogen. Beispiel 10
Inhaltsstoffe Menge AAC 90 Gramm 2% Salzlösung 10 Gramm 1% MBA 5 Gramm Darocure 1173 400 μl - Das resultierende Gel hatte einen Feststoffgehalt 90% auf das Gewicht bezogen und ist ähnlich dem auf Beispiel 9, mit Ausnahme, dass das Wasser durch 2%-ige Salzlösung ersetzte wurde und die Menge an MBA-Quervernetzer halbiert wurde. Der Polymerisationsprozess war der gleiche und die Geleigenschaften waren ähnlich. Beispiel 11
Inhaltsstoffe Menge AAC 180 Gramm 2% Salzlösung 20 Gramm 1% MBA 20 Gramm Darocure 1173 800 μl - Das resultierende Gel hatte einen Feststoffgehalt 90% auf das Gewicht bezogen und ist ähnlich dem auf Beispiel 10, mit Ausnahme, dass die Menge MBA-Quervernetzer verdoppelt wurde. Der Polymerisationsprozess war der gleiche wie auch die Geleigenschaften.
- Beispiel 12
- Das Gel aus Beispiel 11 wurde nach Anpassung mit einem Verfahren nach Kirby-Bauer zur Untersuchung von Antibiotika auf antimikrobielle Aktivität durchgemustert.
- Die folgenden Organismen wurden auf einen Soja-Casein-Verdau-Agar (SCDA) überführt und bei 37°C +/– 2°C für 24–28 Stunden inkubiert:
Pseudomonas aeruginosa, ATCC, #9027
Escherichia coli, ATCC #8739
Klebsiella pneumoniae, ATCC #4352
Staphylococcus aureus, ATCC #6538
Enterococcus (Streptococcus) faecalis, ATCC #19433
Candida albicans, ATCC #10231 - Der Test-Organismus wurde unter Verwendung von 0,9% Salzlösung geerntet. Jede Kultur wurde mittels Vortex intensiv gerührt, um die Klumpen aufzulösen. Der Titer jeder Suspension wurde auf ungefähr 106 koloniebildende Einheiten pro ml eingestellt (CFU/ml). Der Titer der Organismus-Suspensionen wurde durch für Petrischalen geeignete Auszähltechniken bestätigt.
- Auf jeder Testschale wurde eine konfluente Schicht des Organismus hergestellt, indem zuerst ein steriler Wattebausch mit der Testorganismus-Suspension befeuchtet wurde, dann auf einer Muller-Hinton-Agar (MHAG)-Schale in drei Richtungen ausgestrichen wurde, mit einem letzten Ausstreichen entlang des Randes des Platte. Insgesamt wurde für jeden Satz an Proben sieben Schalen hergestellt. Eine zusätzliche Schale wurde hergestellt und als Positivkontrolle inkubiert. Als Negativ- und Medium-Kontrolle wurde jeweils eine Probe in dem Experiment eingeschlossen.
- Die Gelproben wurden in einheitliche Stücke von ungefähr 5 mm2 geschnitten. Jede Probe wurde auf sieben verschiedenen Agarschalen getestet. Die Schalen wurde bei 37 +/– 2°C inkubiert, bis eine konfluente Schicht des Testorganismus erkennbar war. Die Schalen wurden bei 2–8°C über das Wochenende im Kühlschrank aufbewahrt, bis sie gemessen werden konnten.
- Mittlere Hemmzonen von jeder Probe und jedem Testorganismus sind in Tabelle 1 wiedergegeben.
- Der Animpfungstiter für jeden Organismus ist in Tabelle 2 beschrieben. Tabelle 2 Animpfungstiter
Test-Organismus Animpfungstiter Escherichia coli 1,3 × 106 cfu/ml Pseudomonas aeruginosa 5,5 × 106 cfu/ml Klebsiella pneumoniae 1,2 × 106 cfu/ml Staphylococcus aureus 2,5 × 106 cfu/ml Enterococcus faecalis 1,3 × 106 cfu/ml Candida albicans 3,1 × 106 cfu/ml - Es ist offensichtlich, mit Ausnahme von Candida albicans, dass das Gel aus Beispiel 11 signifikant antimikrobielle Eigenschaften aufweist, bestimmt über die mittlere Hemmzone. Obwohl keine Hemmzonen auf den Candida albicans Platten zu beobachten waren, war ein signifikant verringertes Wachstum um dieses Testproben zu sehen, was eine antimikrobielle Aktivität anzeigt.
- Beispiel 13
- Um zu bestimmten, ob die in dieser Erfindung verwendeten Gele irgendwelche ungünstigen Wirkungen auf angeritzte Stellen auf der menschlichen Haut ausüben, wurden fünf Testproben ausgewählt und untersucht. Die Tests wurden durch ein unabhängiges Testlabor unter Verwendung eines Standard-Kammer-Anritzungs- Testverfahrens durchgeführt. Nur eine Zusammenfassung dieses Verfahrens ist unten angegeben.
- Die folgenden Hydrogele wurden untersucht: Probe A (das Gel aus Beispiel 1), Probe B (das Gel aus Beispiel 5), Probe C (das Gel aus Beispiel 6), Probe D (das Gel aus Beispiel 11) und Probe E (das Gel aus Beispiel 5, dem eine kleine Menge Povidon-Jod, Betadin®, zugefügt war).
- Die Gele wurden zu kreisrunden Verbänden mit 2 cm im Durchmesser zur Insertion in eine Kammervertiefung geformt. Kontroll-Verbände aus sauberen fusselfreien Baumwollstreifen wurden ausgestanzt und mit einem Kontrollmaterial für Vergleichszwecke befeuchtet.
- Zehn Freiwillige wurde in die Testreihen untersucht. Eine spezielle Stelle auf der Oberseite der Unterarms wurde ausgewählt und für den Kontakt mit jeder der Proben A–E vorgesehen. Der Ort der Stelle, die für ein bestimmtes Testmaterial vorgesehen war, variierte von Person zu Person.
- Die Haut jedes Freiwilligen wurde mit Alkohol gereinigt und jede Stelle umrandet. Die Haut an jeder Stelle wurde mit der scharten abgeschrägten Kante einer 30-gauge Nadel angeritzt. Eine neue geöffnete sterile Nadel wurde für jeden Teilnehmer verwendet. Dreimal wurde horizontal und drei mal vertikal eingeritzt, so dass sich die Linien kreuzten. Dann wurde gerade genug Druck auf die Nadel angewendet, so dass die Epidermis gespalten wurde, ohne ein deutliches Bluten aus den Kapillaren zu verursachen. Jede Stelle wurde dann mit einer Kammer bedeckt, die Baumwolltuch enthielt, das mit 0,1 ml steriler physiologischer Salzlösung befeuchtet waren. Die Kammern wurden an den Stellen mit breiten Streifen Hypafix®-Klebeband befestigt. Nach vier Stunden wurden die Kammern entfernt, die angeritzten Stellen untersucht und auf nachteilige Wirkungen hin genormt. Diese genormten Stellen wurden dann als Basiswerte zum Bestimmen der Wirkungen der Hydrogelproben auf die Stellen verwendet.
- Nachdem die Basiswerte erhoben wurden, wurde mittels aseptischer Techniken, die schützende Abdeckung über den vorbereiteten Probenkammern entfernt und der freiliegende Gelverbandwurde direkt auf die angeritzte Stelle gelegt. Der Gelverband wurde dann mit einer Kammereinrichtung bedeckt und mit Hypafix®-Klebeband befestigt.
- Die Test-Stellen bei jedem Freiwilligen wurden täglich untersucht und genormt und die Gelverbandprobe wurde wieder ersetzt bis sie am nächsten Tag untersucht wurde.
- Nach zweiundsiebzig Stunden wurde der Test beendet und die Daten wurden für jede Versuchsperson erstellt und für jede Testprobe gemittelt. Jede Stelle wurde wie folgt ausgewertet und Punktzahlen zugeordnet: 0,1 = Keine angeritzten Stellen oder Erytheme sichtbar; 0,5 = angeritze Stellen sichtbar, aber keine Erytheme vorhanden; 1 = schwache Erytheme entlang der angeritzten Stellen; 2 = moderate bis intensive Erytheme benachbart zu den angeritzten Stellen; 3 = konfluente, schwere Erytheme, die die Gebiete zwischen den angeritzten Stellen ausfüllen; 4 = schwere Erytheme, die mit Pusteln oder Blasen zusammen auftreten.
- Von einer mittleren Punktzahl von 0,0 bis 0,49 wurde angenommen, dass sie ein nur gering reizendes Potential anzeigt. Eine mittlere Punktzahl von 0,5 bis 1,49 zeigt ein niedrig reizendes Potential an. Eine mittlere Punktzahl von 1,5 bis 2,49 zeigt ein moderat reizendes Potential an. Eine mittlere Punktzahl von 2,5 bis 4,0 zeigt ein hoch-reizendes Potential an.
- Die Ergebnisse sind unten angegeben, wobei physiologische Salzlösung als Basiswert verwendet wurde, um die anderen Proben zu normen.
- Aus der oberen Tabelle wird klar, dass alle Proben A–E in Bezug auf das Potential die Haut zu reizen, nicht signifikant verschieden von der Kontrolle sind, d. h., alle, einschließlich der Salzlösungskontrolle, fallen in die Kategorie „niedrig". Während nicht genügend Daten gesammelt wurden, um den Grad der Wundheilung, der auf die Proben zurückzuführen ist, zu ermitteln, stellten doch viele Versuchspersonen fest, dass ihre angeritzten Stellen weniger schmerzhaft waren, wenn die Verbände, die die Proben A–E enthielten, verwendet wurden. Mit anderen Worten wurde eine mildernde Wirkung beobachtet, wenn die Proben A–E auf die angeritzen Stellen aufgebracht wurden.
Claims (51)
- Verwendung eines antimikrobiellen kationischen quaternären Amin-Acrylat-Polymers der Formel: wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus der Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus der Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50 000 ist, als Wundverband.
- Die Verwendung gemäß Anspruch 1, wobei R', R'' und R''' unabhängig voneinander aus der Gruppe ausgewählt sind, die aus H, C1-C8-Alkyl, Phenyl, Tolyl und Benzyl besteht.
- Die Verwendung gemäß Anspruch 2, wobei R', R'' Methyl sind und R''' Benzyl ist.
- Die Verwendung gemäß Anspruch 2, wobei R', R'' und R''' Methyl sind.
- Die Verwendung gemäß Anspruch 4, wobei X O ist.
- Die Verwendung gemäß Anspruch 4, wobei X NH ist.
- Die Verwendung gemäß Anspruch 4, wobei Y– ein Mitglied ist, das aus der Gruppe ausgewählt ist, die aus Cl–, Br–, HSO4 – und CH3SO4 – besteht.
- Die Verwendung gemäß Anspruch 7, wobei Y– Cl– ist.
- Die Verwendung gemäß Anspruch 4, wobei n gleich 2 ist.
- Die Verwendung gemäß Anspruch 4, wobei n gleich 3 ist.
- Ein Wundverband, der ein Hydrogel umfasst, 15 bis 95 Gewichtsprozent des inhärenten antimikrobiellen kationischen quaternären Amin-Acrylat-Polymers enthaltend, mit der Formel: wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus der Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus der Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50 000 ist.
- Der Wundverband gemäß Anspruch 11, wobei in dem Polymer R', R'' und R''' unabhängig voneinander aus der Gruppe ausgewählt sind, die aus H, C1-C8-Alkyl, Phenyl, Tolyl und Benzyl besteht.
- Der Wundverband gemäß Anspruch 12, wobei R', R'' in dem Polymer Methyl ist und R''' Benzyl ist.
- Der Wundverband gemäß Anspruch 12, wobei R', R'' und R''' in dem Polymer Methyl sind.
- Der Wundverband gemäß Anspruch 14, wobei X in dem Polymer O ist.
- Der Wundverband gemäß Anspruch 14, wobei X in dem Polymer NH ist.
- Der Wundverband gemäß Anspruch 14, wobei Y– in dem Polymer ein Mitglied ist, das aus der Gruppe ausgewählt ist, die aus Cl–, Br–, HSO4 – und CH3SO4 – besteht.
- Der Wundverband gemäß Anspruch 17, wobei Y– in dem Polymer Cl– ist.
- Der Wundverband gemäß Anspruch 14, wobei n in dem Polymer gleich 2 ist.
- Der Wundverband gemäß Anspruch 14, wobei n in dem Polymer gleich 3 ist.
- Der Wundverband gemäß Anspruch 11, wobei das Hydrogel zwischen ungefähr 61 und 90 Gewichtsprozent des kationischen quaternären Amin-Polyacrylat-Polymers enthält.
- Der Wundverband gemäß Anspruch 21, wobei das Hydrogel zwischen ungefähr 65 und 75 Gewichtsprozent des kationischen quaternären Amin-Polyacrylat-Polymers enthält.
- Eine Mittel zum Bedecken von Wunden, das ein Substrat mit einem daran fest gebundenen Wundverband umfasst, das ein Hydrogel von ungefähr 15 bis 95 Gewichtsprozent eines inhärenten antimikrobiellen kationischen quaternären Amin-Acrylat-Polymers der folgenden Formel umfasst: wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus der Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus der Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50 000 ist.
- Das Mittel gemäß Anspruch 23, wobei das Substrat ein fasriges Blattmaterial ist, das in dem Hydrogel eingebettet ist, und das Hydrogel entgegengesetzte Oberflächen aufweist, mindestens eine davon ist angepasst, die Wunde abdecken und berühren zu können.
- Das Mittel gemäß Anspruch 23, wobei das Hydrogel entgegengesetzte Oberflächen hat und das Mittel eine abdichtende Struktur repräsentiert, die an eine Oberfläche des Hydrogels befestigt ist und die entgegengesetze Oberfläche angepasst ist, die Wunde abdecken und berühren zu können.
- Das Mittel gemäß Anspruch 24 oder 25, wobei R', R'' und R''' in dem Polymer formenden Hydrogel unabhängig voneinander aus der Gruppe ausgewählt sind, die aus H, C1-C8-Alkyl, Phenyl, Tolyl und Benzyl besteht.
- Das Mittel gemäß Anspruch 26, wobei R', R'' in dem Polymer Methyl und R''' Benzyl ist.
- Das Mittel gemäß Anspruch 26, wobei R', R'' und R''' in dem Polymer Methyl sind.
- Das Mittel gemäß Anspruch 28, wobei X in dem Polymer O ist.
- Das Mittel gemäß Anspruch 28, wobei X in dem Polymer NH ist.
- Das Mittel gemäß Anspruch 28, wobei Y– in dem Polymer ein Mitglied ist, das aus der Gruppe ausgewählt ist, die aus Cl–, Br–, HSO4 – und CH3SO4 – besteht.
- Das Mittel gemäß Anspruch 31, wobei Y– in dem Polymer Cl– ist.
- Die Einrichung gemäß Anspruch 28 wobei n in dem Polymer gleich 2 ist.
- Das Mittel gemäß Anspruch 28, wobei n in dem Polymer gleich 3 ist.
- Das Mittel gemäß Anspruch 23, wobei das Hydrogel zwischen ungefähr 61 und 90 Gewichtsprozent des quaternären Amin-Polyacrylat-Polymers enthält.
- Das Mittel gemäß Anspruch 23, wobei das Hydrogel zwischen ungefähr 65 und 75 Gewichtsprozent des quaternären Amin-Polyacrylat-Polymers enthält.
- Die Verwendung von Hydrogel, das von ungefähr 15 bis 95 Gewichtsprozent des inhärenten antimikrobiellen Amin-Acrylat-Polymers der folgenden Formel enthält: wobei n eine ganzzahlige Zahl von 2 bis 3 ist; R', R'' und R''' sind unabhängig voneinander aus der Gruppe ausgewählt, die aus H, C1-C16-Alkyl, Aryl, Arylamin, Alkylamin, Alkaryl und Aralkyl besteht; X ist aus der Gruppe ausgewählt, die aus O und NH besteht; Y– ist ein akzeptierbares anionisches Gegenion zu dem N+ des quaternären Amins und m ist eine ganzzahlige Zahl, die größer als 50000 ist, zur Herstellung eines Wundverbandes.
- Die Verwendung gemäß Anspruch 37, wobei der Wundverband an einem Mittel zum Bedecken von Wunden befestigt ist.
- Die Verwendung gemäß Anspruch 38, wobei das Mittel ein Substrat von einem fasrigen Blattmaterial umfasst, das in dem Hydrogel eingebettet ist und wobei das Hydrogel entgegengesetzte Oberflächen aufweist und mindestens eine davon angepasst ist, die Wunde abdecken und berühren zu können.
- Die Verwendung gemäß Anspruch 38, wobei das Mittel eine abdichtende Struktur repräsentiert, und wobei das Hydrogel entgegengesetzte Oberflächen hat, so dass eine Oberfläche des Hydrogels an eine Oberfläche der abdichtenden Struktur befestigt ist und die entgegengesetze Oberfläche angepasst ist, die Wunde abdecken und berühren zu können.
- Die Verwendung gemäß einem der Ansprüche 39 oder 40, wobei R', R'' und R''' in dem Hydropolymer bildenden Polymer unabhängig voneinander aus der Gruppe ausgewählt sind, die aus H, C1-C8-Alkyl, Phenyl, Tolyl und Benzyl besteht.
- Die Verwendung gemäß Anspruch 41, wobei R', R'' in dem Polymer Methyl und R''' Benzyl ist.
- Die Verwendung gemäß Anspruch 41, wobei R', R'' und R''' in dem Polymer Methyl sind.
- Die Verwendung gemäß Anspruch 43, wobei X in dem Polymer O ist.
- Die Verwendung gemäß Anspruch 43, wobei X in dem Polymer NH ist.
- Die Verwendung gemäß Anspruch 43, wobei Y– in dem Polymer ein Mitglied ist, das aus der Gruppe ausgewählt ist, die aus Cl–, Br–, HSO4 – und CH3SO4 – besteht.
- Die Verwendung gemäß Anspruch 46, wobei Y– in dem Polymer Cl– ist.
- Die Verwendung gemäß Anspruch 43, wobei n in dem Polymer gleich 2 ist.
- Die Verwendung gemäß Anspruch 43, wobei n in dem Polymer gleich 3 ist.
- Die Verwendung gemäß Anspruch 38, wobei das Hydrogel zwischen ungefähr 61 und 90 Gewichtsprozent des quaternären Amin-Polyacrylat-Polymers enthält.
- Die Verwendung gemäß Anspruch 50, wobei das Hydrogel zwischen ungefähr 65 und 75 Gewichtsprozent des quaternären Amin-Polyacrylat-Polymers enthält.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US144727 | 1998-09-01 | ||
| US09/144,727 US6039940A (en) | 1996-10-28 | 1998-09-01 | Inherently antimicrobial quaternary amine hydrogel wound dressings |
| PCT/US1999/019441 WO2000012100A1 (en) | 1998-09-01 | 1999-08-30 | Inherently antimicrobial quaternary amine hydrogel wound dressings |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918707D1 DE69918707D1 (de) | 2004-08-19 |
| DE69918707T2 true DE69918707T2 (de) | 2004-12-02 |
Family
ID=22509863
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69918707T Expired - Fee Related DE69918707T2 (de) | 1998-09-01 | 1999-08-30 | Wundverband aus hydrogelmit quaternären aminen der von sich aus mikrobentötend ist |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US6039940A (de) |
| EP (1) | EP1123104B1 (de) |
| JP (1) | JP2002523565A (de) |
| AU (1) | AU5785099A (de) |
| CA (1) | CA2339823A1 (de) |
| DE (1) | DE69918707T2 (de) |
| MX (1) | MXPA01002247A (de) |
| WO (1) | WO2000012100A1 (de) |
Families Citing this family (76)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6034129A (en) * | 1996-06-24 | 2000-03-07 | Geltex Pharmaceuticals, Inc. | Ionic polymers as anti-infective agents |
| US6800278B1 (en) | 1996-10-28 | 2004-10-05 | Ballard Medical Products, Inc. | Inherently antimicrobial quaternary amine hydrogel wound dressings |
| US6290947B1 (en) | 1997-09-19 | 2001-09-18 | Geltex Pharmaceuticals, Inc. | Ionic polymers as toxin-binding agents |
| US6872384B1 (en) | 1998-02-23 | 2005-03-29 | Life Medical Sciences, Inc. | Treatment of trauma |
| US7045673B1 (en) | 1998-12-08 | 2006-05-16 | Quick-Med Technologies, Inc. | Intrinsically bactericidal absorbent dressing and method of fabrication |
| US20050033251A1 (en) * | 1998-12-08 | 2005-02-10 | Quick-Med Technologies, Inc. | Controlled release of biologically active substances from select substrates |
| US7709694B2 (en) * | 1998-12-08 | 2010-05-04 | Quick-Med Technologies, Inc. | Materials with covalently-bonded, nonleachable, polymeric antimicrobial surfaces |
| US6540792B1 (en) * | 1999-04-14 | 2003-04-01 | Toray Industries, Inc. | Cellulose fiber-containing structure |
| US6482402B1 (en) * | 1999-05-13 | 2002-11-19 | Geltex Pharmaceuticals, Inc. | Antimicrobial compositions and methods |
| US6348212B2 (en) * | 1999-05-18 | 2002-02-19 | Lectec Corporation | Treating traumatic burns or blisters of the skin |
| US6232366B1 (en) * | 1999-06-09 | 2001-05-15 | 3M Innovative Properties Company | Pressure sensitive conductive adhesive having hot-melt properties and biomedical electrodes using same |
| US20050065284A1 (en) * | 1999-08-06 | 2005-03-24 | Venkataram Krishnan | Novel latex compositions for deposition on various substrates |
| FR2806629B1 (fr) * | 2000-03-22 | 2003-01-24 | Lhd Lab Hygiene Dietetique | Compresse antiseptique |
| AU2001267181A1 (en) * | 2000-05-30 | 2001-12-11 | Viridis Biotech Inc. | Polyubiquitin based hydrogel and uses thereof |
| WO2002015913A1 (en) * | 2000-08-23 | 2002-02-28 | Phairson Medical, Inc. | Treatment of trauma, and other indications |
| US20030007951A1 (en) * | 2000-08-23 | 2003-01-09 | Richard Franklin | Treatment of trauma |
| US6588425B2 (en) * | 2000-12-21 | 2003-07-08 | Kimberly-Clark Worldwide, Inc. | Respiratory suction catheter apparatus with antimicrobial chamber |
| US6399092B1 (en) | 2000-12-27 | 2002-06-04 | Healthpoint, Ltd. | Anhydrous, hydrophilic absorbent wound dressing (tube) with antimicrobials or other pharmaceutically active agents |
| US7041868B2 (en) | 2000-12-29 | 2006-05-09 | Kimberly-Clark Worldwide, Inc. | Bioabsorbable wound dressing |
| WO2002102425A2 (en) * | 2001-06-20 | 2002-12-27 | Panayiotis Spyros Spyropoulos | Compound hydrogel wound dressing |
| EP1461179B1 (de) | 2001-11-24 | 2016-01-20 | Delphi Technologies, Inc. | Verbesserungen bei kabelbäumen |
| US7005031B2 (en) * | 2002-01-16 | 2006-02-28 | 3M Innovative Properties Company | Pressure sensitive adhesives having quaternary ammonium functionality, articles, and methods |
| US6838078B2 (en) | 2002-01-16 | 2005-01-04 | 3M Innovative Properties Company | Film-forming compositions and methods |
| US7147873B2 (en) | 2002-01-16 | 2006-12-12 | 3M Innovative Properties Company | Antiseptic compositions and methods |
| GB0211529D0 (en) * | 2002-05-20 | 2002-06-26 | First Water Ltd | Ionic hydrogels with low aqueous fluid absorption |
| US20040009210A1 (en) * | 2002-07-09 | 2004-01-15 | Kimberly-Clark Worldwide, Inc. | Wound management products incorporating cationic compounds |
| US20040009141A1 (en) * | 2002-07-09 | 2004-01-15 | Kimberly-Clark Worldwide, Inc. | Skin cleansing products incorporating cationic compounds |
| US7264859B2 (en) * | 2002-12-19 | 2007-09-04 | Kimberly-Clark Worldwide, Inc. | Lubricious coating for medical devices |
| US7220491B2 (en) * | 2002-12-19 | 2007-05-22 | Kimberly-Clark Worldwide, Inc. | Lubricious coating for medical devices |
| US20040166144A1 (en) * | 2003-01-15 | 2004-08-26 | Arie Besemer | Bacteria trapping fibrous material |
| US7285576B2 (en) * | 2003-03-12 | 2007-10-23 | 3M Innovative Properties Co. | Absorbent polymer compositions, medical articles, and methods |
| EP1603600B1 (de) * | 2003-03-12 | 2013-01-02 | 3M Innovative Properties Company | Polymerzusammensetzungen enthaltend bioaktive silber-, kupfer- oder zink-verbindungen, medizinische artikel und prozesse |
| US7981946B2 (en) * | 2003-07-03 | 2011-07-19 | Mallard Creek Polymers, Inc. | Antimicrobial and antistatic polymers and methods of using such polymers on various substrates |
| US7781498B2 (en) * | 2003-07-03 | 2010-08-24 | Mallard Creek Polymers, Inc. | Cationic latex as a carrier for bioactive ingredients and methods for making and using the same |
| US7491753B2 (en) | 2003-07-03 | 2009-02-17 | Mallard Creek Polymers, Inc. | Antimicrobial and antistatic polymers and methods of using such polymers on various substrates |
| GB2404920A (en) * | 2003-08-12 | 2005-02-16 | Johnson & Johnson Medical Ltd | Antimicrobial polymer |
| US20050214376A1 (en) * | 2003-10-21 | 2005-09-29 | Marie-Pierre Faure | Hydrogel-containing medical articles and methods of using and making the same |
| US7745509B2 (en) * | 2003-12-05 | 2010-06-29 | 3M Innovative Properties Company | Polymer compositions with bioactive agent, medical articles, and methods |
| US20050123590A1 (en) * | 2003-12-05 | 2005-06-09 | 3M Innovative Properties Company | Wound dressings and methods |
| US20050123621A1 (en) * | 2003-12-05 | 2005-06-09 | 3M Innovative Properties Company | Silver coatings and methods of manufacture |
| US7144992B2 (en) | 2004-04-01 | 2006-12-05 | Kane Biotech Inc. | Synergistic antimicrobial compositions and methods for reducing biofilm formation |
| JP2008504912A (ja) * | 2004-06-30 | 2008-02-21 | コヴァロン テクノロジーズ リミテッド | 非接着性ヒドロゲル |
| US20060035039A1 (en) * | 2004-08-12 | 2006-02-16 | 3M Innovative Properties Company | Silver-releasing articles and methods of manufacture |
| GB2417248A (en) * | 2004-08-19 | 2006-02-22 | Avanticare Ltd | Photopolymerisable composition |
| WO2006132653A2 (en) | 2004-08-30 | 2006-12-14 | Southwest Research Institute | Biocidal fibrous and film materials comprising silver and chlorite ions |
| US9364579B2 (en) * | 2004-08-30 | 2016-06-14 | Southwest Research Institute | Biocidal fibrous and film materials utilizing silver ion |
| EP1841314B1 (de) * | 2004-12-30 | 2014-03-19 | Hadasit Medical Research Services And Development Ltd. | Antimikrobielle zusatzstoffe in nanopartikelform, die nicht auslaugbare hinhaltende antimikrobielle polymerzusammensetzungen bilden |
| US8399027B2 (en) * | 2005-04-14 | 2013-03-19 | 3M Innovative Properties Company | Silver coatings and methods of manufacture |
| US7398883B2 (en) * | 2005-05-23 | 2008-07-15 | Tucker Kenneth H | Blister kit and method of using same |
| US20070292469A1 (en) * | 2005-07-25 | 2007-12-20 | Rothenburger Stephen J | Antimicrobial composition |
| US7790217B2 (en) * | 2005-08-22 | 2010-09-07 | Quick-Med Technologies, Inc. | Method of attaching an antimicrobial cationic polyelectrolyte to the surface of a substrate |
| US20070048249A1 (en) | 2005-08-24 | 2007-03-01 | Purdue Research Foundation | Hydrophilized bactericidal polymers |
| JP5128483B2 (ja) | 2005-10-24 | 2013-01-23 | テイコク ファーマ ユーエスエー インコーポレーテッド | N,2,3−トリメチル−2−イソプロピルブタナミドの局所用疼痛緩和組成物並びにその使用法 |
| US20070166399A1 (en) * | 2006-01-13 | 2007-07-19 | 3M Innovative Properties Company | Silver-containing antimicrobial articles and methods of manufacture |
| US20070166344A1 (en) * | 2006-01-18 | 2007-07-19 | Xin Qu | Non-leaching surface-active film compositions for microbial adhesion prevention |
| US9220725B2 (en) * | 2006-08-24 | 2015-12-29 | Mallard Creek Polymers, Inc. | Cationic latex as a carrier for bioactive ingredients and methods for making and using the same |
| US20080207774A1 (en) * | 2006-08-24 | 2008-08-28 | Venkataram Krishnan | Anionic latex as a carrier for active ingredients and methods for making and using the same |
| JP5378217B2 (ja) | 2006-08-24 | 2013-12-25 | マラード クリーク ポリマーズ,インコーポレーテッド | 生物活性成分用の担体としてのアニオン性ラテックスならびにその製造方法および使用方法 |
| US20080233062A1 (en) * | 2006-08-24 | 2008-09-25 | Venkataram Krishnan | Cationic latex as a carrier for active ingredients and methods for making and using the same |
| US20100098949A1 (en) * | 2006-10-18 | 2010-04-22 | Burton Scott A | Antimicrobial articles and method of manufacture |
| CN100463930C (zh) * | 2006-12-21 | 2009-02-25 | 天津大学 | 可再分散pH敏感型阳离子聚合物水凝胶亚微米粒及制备方法 |
| WO2011119393A2 (en) | 2010-03-26 | 2011-09-29 | 3M Innovative Properties Company | Method of sterilization of wound dressings |
| US10307297B2 (en) * | 2010-08-16 | 2019-06-04 | Fasttrack Medical Solutions Llc | Peripheral hydrogel wound dressing |
| US8545951B2 (en) | 2012-02-29 | 2013-10-01 | Kimberly-Clark Worldwide, Inc. | Endotracheal tubes and other polymer substrates including an anti-fouling treatment |
| JP2018501194A (ja) | 2014-10-31 | 2018-01-18 | アヴェント インコーポレイテッド | 膀胱収縮の抑制に関連する用途のための方法および装置 |
| CN104358104B (zh) * | 2014-11-07 | 2016-06-15 | 江南大学 | 一种利用电子辐射技术制备抗菌纺织品的方法 |
| US9976974B2 (en) * | 2015-01-27 | 2018-05-22 | University Of Utah Research Foundation | Osmolarity-responsive hydrogel sensors and method of use |
| US10149956B2 (en) | 2015-02-28 | 2018-12-11 | John P. Ure | Bi-lateral endobronchial suctioning device and medical suctioning system for intubated patients |
| US10045885B2 (en) | 2015-09-24 | 2018-08-14 | Medline Industries, Inc. | Wound dressing materials and methods of making thereof |
| WO2017145142A1 (en) | 2016-02-25 | 2017-08-31 | Nobio Ltd. | Micro and nanoparticulate compositions comprising anti-microbially active groups |
| US20180340046A1 (en) | 2017-05-27 | 2018-11-29 | Poly Group LLC | Dispersible antimicrobial complex and coatings therefrom |
| PL3638740T3 (pl) | 2017-06-16 | 2024-10-14 | Poly Group LLC | Polimerowy przeciwdrobnoustrojowy środek powierzchniowo czynny |
| CN111148499B (zh) | 2017-08-30 | 2023-01-13 | 诺比奥有限公司 | 抗微生物颗粒及其使用方法 |
| US11864964B2 (en) | 2018-07-31 | 2024-01-09 | University Of Florida Research Foundation, Inc. | Quarternized titanium-nitride anti-bacterial coating for dental implants |
| CN113321820A (zh) * | 2021-05-28 | 2021-08-31 | 吉林大学 | 一种新型抗菌粘附保湿功能水凝胶制备方法及应用 |
| GB202204326D0 (en) * | 2022-03-28 | 2022-05-11 | Univ Bath | Composition |
Family Cites Families (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3975350A (en) * | 1972-08-02 | 1976-08-17 | Princeton Polymer Laboratories, Incorporated | Hydrophilic or hydrogel carrier systems such as coatings, body implants and other articles |
| US3898188A (en) * | 1972-08-14 | 1975-08-05 | California Inst Of Techn | Novel polyelectrolytes |
| DE2650306A1 (de) * | 1976-11-02 | 1978-05-03 | Merck Patent Gmbh | Antibakteriell wirkender wundverband und verfahren zu seiner herstellung |
| US4119094A (en) * | 1977-08-08 | 1978-10-10 | Biosearch Medical Products Inc. | Coated substrate having a low coefficient of friction hydrophilic coating and a method of making the same |
| US4226232A (en) * | 1979-04-09 | 1980-10-07 | Spenco Medical Corporation | Wound dressing |
| US4318947A (en) * | 1979-12-26 | 1982-03-09 | The Kendall Company | Polymer coating and curing process for catheters |
| US4393048A (en) * | 1980-02-15 | 1983-07-12 | The United States Of America As Represented By The Secretary Of The Army | Protective gel composition for wounds |
| US4373009A (en) * | 1981-05-18 | 1983-02-08 | International Silicone Corporation | Method of forming a hydrophilic coating on a substrate |
| US4515593A (en) * | 1981-12-31 | 1985-05-07 | C. R. Bard, Inc. | Medical tubing having exterior hydrophilic coating for microbiocide absorption therein and method for using same |
| US4570629A (en) * | 1982-03-17 | 1986-02-18 | University Of Illinois Foundation | Hydrophilic biopolymeric copolyelectrolytes, and biodegradable wound dressing comprising same |
| US4769013A (en) * | 1982-09-13 | 1988-09-06 | Hydromer, Inc. | Bio-effecting medical material and device |
| US5512329A (en) * | 1982-09-29 | 1996-04-30 | Bsi Corporation | Substrate surface preparation |
| AU562370B2 (en) * | 1982-10-02 | 1987-06-11 | Smith & Nephew Associated Companies Plc | Moisture vapour permeable adhesive surgical dressing |
| US4791063A (en) * | 1983-02-14 | 1988-12-13 | Cuno Incorporated | Polyionene transformed modified polysaccharide supports |
| US4563184A (en) * | 1983-10-17 | 1986-01-07 | Bernard Korol | Synthetic resin wound dressing and method of treatment using same |
| US4705709A (en) * | 1985-09-25 | 1987-11-10 | Sherwood Medical Company | Lubricant composition, method of coating and a coated intubation device |
| US4728323A (en) * | 1986-07-24 | 1988-03-01 | Minnesota Mining And Manufacturing Company | Antimicrobial wound dressings |
| US5019096A (en) * | 1988-02-11 | 1991-05-28 | Trustees Of Columbia University In The City Of New York | Infection-resistant compositions, medical devices and surfaces and methods for preparing and using same |
| US5082697A (en) * | 1988-02-17 | 1992-01-21 | The Dow Chemical Company | Polymer salt complex for fiber or fabric treatment |
| US5498478A (en) * | 1989-03-20 | 1996-03-12 | Weyerhaeuser Company | Polyethylene glycol as a binder material for fibers |
| US5432000A (en) * | 1989-03-20 | 1995-07-11 | Weyerhaeuser Company | Binder coated discontinuous fibers with adhered particulate materials |
| US5006267A (en) * | 1989-11-08 | 1991-04-09 | The Dow Chemical Company | Biocidal fluid filters |
| US5269770A (en) * | 1990-01-10 | 1993-12-14 | Rochester Medical Corporation | Microcidal agent releasing catheter with balloon |
| US5261896A (en) * | 1990-01-10 | 1993-11-16 | Rochester Medical Corporation | Sustained release bactericidal cannula |
| US5004760A (en) * | 1990-02-16 | 1991-04-02 | The Dow Chemical Company | Biocidal foams |
| US5069907A (en) * | 1990-03-23 | 1991-12-03 | Phoenix Medical Technology | Surgical drape having incorporated therein a broad spectrum antimicrobial agent |
| DE69125018T2 (de) * | 1990-10-12 | 1997-06-12 | Dow Chemical Co | Antimikrobielle hydrogele |
| JP3455217B2 (ja) * | 1992-02-13 | 2003-10-14 | バイオ−メトリック システムズ インコーポレイテッド | 架橋マトリックス中の化学種の固定 |
| TW369558B (en) * | 1994-01-28 | 1999-09-11 | Minnesota Mining & Mfg | Polymerized microemulsion pressure sensitive adhesive compositions and methods of preparing and using same |
| US5670557A (en) * | 1994-01-28 | 1997-09-23 | Minnesota Mining And Manufacturing Company | Polymerized microemulsion pressure sensitive adhesive compositions and methods of preparing and using same |
| US5624704A (en) * | 1995-04-24 | 1997-04-29 | Baylor College Of Medicine | Antimicrobial impregnated catheters and other medical implants and method for impregnating catheters and other medical implants with an antimicrobial agent |
| GB9521253D0 (en) * | 1995-10-17 | 1995-12-20 | Luthra Ajay K | Biocompatible lubricious hydrophilic materials for medical devices |
| US5800685A (en) * | 1996-10-28 | 1998-09-01 | Cardiotronics Systems, Inc. | Electrically conductive adhesive hydrogels |
| FR2757866B1 (fr) * | 1996-12-30 | 2004-12-17 | Catalyse | Polymeres comportant des groupes ammoniums quaternaires, leur utilisation pour la fabrication d'un materiau a propretes antibacteriennes et leurs procedes de preparation |
-
1998
- 1998-09-01 US US09/144,727 patent/US6039940A/en not_active Expired - Lifetime
-
1999
- 1999-08-30 AU AU57850/99A patent/AU5785099A/en not_active Abandoned
- 1999-08-30 DE DE69918707T patent/DE69918707T2/de not_active Expired - Fee Related
- 1999-08-30 MX MXPA01002247A patent/MXPA01002247A/es unknown
- 1999-08-30 EP EP99945192A patent/EP1123104B1/de not_active Expired - Lifetime
- 1999-08-30 CA CA002339823A patent/CA2339823A1/en not_active Abandoned
- 1999-08-30 JP JP2000567217A patent/JP2002523565A/ja not_active Abandoned
- 1999-08-30 WO PCT/US1999/019441 patent/WO2000012100A1/en not_active Ceased
Also Published As
| Publication number | Publication date |
|---|---|
| MXPA01002247A (es) | 2002-05-08 |
| AU5785099A (en) | 2000-03-21 |
| EP1123104A1 (de) | 2001-08-16 |
| CA2339823A1 (en) | 2000-03-09 |
| EP1123104B1 (de) | 2004-07-14 |
| WO2000012100A1 (en) | 2000-03-09 |
| US6039940A (en) | 2000-03-21 |
| EP1123104A4 (de) | 2002-07-17 |
| DE69918707D1 (de) | 2004-08-19 |
| JP2002523565A (ja) | 2002-07-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69918707T2 (de) | Wundverband aus hydrogelmit quaternären aminen der von sich aus mikrobentötend ist | |
| US6800278B1 (en) | Inherently antimicrobial quaternary amine hydrogel wound dressings | |
| DE69706824T2 (de) | Antimikrobielle Verbindungen enthaltende Cyanoacrylat-Zusammensetzungen | |
| DE69032125T2 (de) | Gelwundverbandszusammensetzungen und verfahren zu deren gebrauch | |
| DE602004002717T2 (de) | Blattförmige Wundauflage aus mikrobieller Zellulose, enthaltend PHMB, für chronische Wunden | |
| DE69938612T2 (de) | Funktionelle chitosanderivate | |
| DE60109487T2 (de) | Wasserfreier, hydrophiler absorbierender wundverband | |
| DE3883171T2 (de) | Druckempfindliches medizinisches Dichtungsmittel. | |
| DE60313471T2 (de) | Wundverbandmaterial mit anionischen polysaccharid-komplexen mit silber | |
| DE69214732T2 (de) | Heilender Wundverband | |
| DE2403269C2 (de) | ||
| DE69629519T2 (de) | Stable Komplexen von vernetzten Polyvinylpyrrolidone und Iod und Verfahren zur Herstellung | |
| DE10330971B4 (de) | Verfahren zur Herstellung von Haut- oder Wundauflagen mit verkapselten, wundheilungsfördernden und/oder hautpflegenden Substanzen | |
| DE3744289C2 (de) | ||
| EP1095665B1 (de) | Zusammensetzung zur wundheilung, wundverband und verfahren zur behandlung vonwunden | |
| CH637833A5 (de) | Transparentes fluessigkeitsverbandmaterial, seine herstellung und verwendung. | |
| EP1104679A2 (de) | Antimikrobiell ausgerüstete Wundauflagen | |
| DE212012000057U1 (de) | Antimikrobielles Gemisch und eine antimikrobiell wirkende Abdeckung zur Unterstützung der Wundheilung | |
| WO1999017814A1 (en) | Prepolymer compositions comprising an antimicrobial agent | |
| DE112019006443T5 (de) | Medizinischer dichtungsklebstoff zur förderung der wundheilung und verfahren zu seiner herstellung | |
| US12343238B2 (en) | Wound dressing comprising a combination of hydrogel and honey, method of preparation and uses thereof | |
| DE69508356T2 (de) | Wundverband | |
| DE69231973T2 (de) | Absorbierendes Wundenausfüllmittel | |
| DE60312969T2 (de) | Zubereitung für die wundheilung und zur verhinderung des anhaftens von verbänden an die wunde | |
| DE3785311T2 (de) | Klebstoff, verfahren zu seiner herstellung und seine verwendung. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8327 | Change in the person/name/address of the patent owner |
Owner name: KIMBERLY-CLARK WORLDWIDE, INC., NEENAH, WIS., US |
|
| 8339 | Ceased/non-payment of the annual fee |