-
Chemokine
stellen eine Familie kleiner Cytokine dar, die bei Entzündungsreaktionen
produziert werden und Leukozyten-Aktivierung steuern (Baggiolini,
M. et al., Adv. Immunol. 55 (1994), 97–179; Springer, T. A., Annu.
Rev. Physiol. 57 (1995), 827–872;
und Schall, T. J. und Bacon, Curr. Opin. Immunol. 6 (1994), 865–873). Chemokine
können
selektiv Chemotaxis der gebildeten Elemente des Bluts (andere als
rote Blutzellen) induzieren, einschließlich Leukozyten, wie Neutrophile,
Monozyten, Makrophagen, Eosinophile, Basophile, Mastzellen und Lymphozyten,
wie T-Zellen und B-Zellen. Zusätzlich
zur Stimulierung der Chemotaxis können durch Chemokine selektiv
andere Änderungen
in antwortenden Zellen induziert werden, einschließlich Änderungen
der Zellform, einem vorübergehenden
Anstieg der Konzentration an intrazellulären freien Calciumionen ([Ca2+]i), Granul-Exozytose,
Heraufregulierung von Integrin, Bildung bioaktiver Lipide (beispielsweise Leukotrienen)
und Oxidations-Ausbruch (respiratory burst), die mit Leukozyten-Aktivierung assoziiert
sind. Die Chemokine sind daher frühe Auslöser der entzündlichen
Antwort und bewirken eine Freisetzung von Entzündungs-Mediatoren, Chemotaxis
und Extravasation von Infektions- oder Entzündungsstellen.
-
Zwei
Unterfamilien von Chemokinen, die als CXC- und CC-Chemokine bezeichnet
werden, unterscheiden sich durch die Anordnung der ersten zwei der
vier konservierten Cystein-Reste, die entweder durch eine Aminosäure getrennt
(wie in den CXC-Chemokinen IL-8, γIP-10,
Mig, PF4, ENA-78, GCP-2, GROα, GROβ, GROγ, NAP-2,
NAP-4) oder benachbart sind (wie in den CC-Chemokinen MIP-1α, MIP1β, RANTES, MCP-1,
MCP-2, MCP-3, I-309). Die meisten CXC-Chemokine ziehen neutrophile
Leukozyten an. So sind beispielsweise die CXC-Chemokine Interleukin
8 (IL-8) der Plateletfaktor 4 (PF4), und das Neutrophil aktivierende Peptid
2 (NAP-2) starke Chemoattraktoren und Aktivatoren von Neutrophilen.
Die als CXC-Chemokine bezeichneten MIG (Monokin Induziertes Gamma
Interferon) und IP-10 (γIP-10,
Interferon-gamma induzierbares 10 kDa Protein) sind insbesondere
bei der Induzierung der Chemotaxis aktivierter peripherer Blut-Lymphozyten
aktiv. CC-Chemokine sind im Allgemeinen weniger selektiv und können eine
Vielzahl von Leukozyten-Zelltypen anziehen, einschließlich Monozyten,
Eosinophile, Basophile, T-Lymphozyten
und natürliche
Killerzellen. CC-Chemokine, wie die humanen Monozyten chemotaktischen
Proteine 1–3
(MCP-1, MCP-2 und MCP-3), RANTES (Reguliert bei Aktivierung, normalerweise
T-exprimiert und sezerniert), und die entzündlichen Makrophagen-Protein
1α und 1β (MIP-1α und MIP-1β) wurden
als Chemoattraktoren und als Aktivatoren von Monozyten und Lymphozyten
gekennzeichnet, scheinen jedoch keine Chemoattraktoren für Neutrophile
zu sein.
-
CC-
und CXC-Chemokine wirken über
Rezeptoren, die zu einer Superfamilie von sieben Transmembran überspannenden
G-Protein gekoppelten Rezeptoren gehören (Murphy, P. M. Ann. Rev.
Immunol. 12 (1994), 593–633;
Gerard, C. und N. P. Gerard Curr. Opin. Immunol. 6 (1994), 140–145). Diese
Familie von G-Protein gekoppelten (Serpentinen) Rezeptoren umfasst
eine grosse Gruppe integraler Membranproteine, die sieben Transmembran überspannende
Regionen aufweist. Die Rezeptoren sind mit G-Proteinen gekoppelt,
die heterodimere regulatorische Proteine sind, die GTP binden und
eine Signalübertragung
von gekoppelten Rezeptoren übermitteln
können,
beispielsweise durch Herstellung intrazellulärer Mediatoren.
-
Die
Chemokin-Rezeptoren können
in zwei Gruppen unterteilt werden: die CC-Chemokin-Rezeptoren 1
bis 5 (CCR1–5),
die CC-Chemokine binden, und die CXC-Chemokin-Rezeptoren 1 bis 4
(CXCR1–4),
die CXC-Chemokine binden. Die CC-Chemokin-Rezeptoren kommen auf
mehreren Typen von Leukozyten vor und sind für die Migration von Monozyten,
Eosinophilen, Basophilen und T-Zellen von Bedeutung (Qin, S. et al.,
Eur. J. Immunol. 26 (1996), 640–647;
Carr, M. W. et al., Proc. Natl. Acad. Sci. USA 91(9) (1994), 3652–3656; Taub,
D. D. et al., J. Clin. Invest. 95(3) (1995), 1370–1376; Neote
K. et al., Cell 72 (1993), 415–425; Gao,
J.-L. et al., J. Exp. Med. 177 (1993), 415–425; Charo, I. F. et al.,
Proc. Natl. Acad. Sci. USA 91 (1994), 2752–2756; Myers, S. J. et al.,
J. Biol. Chem. 270 (1995), 5786–5792;
Combadiere C. et al., J. Biol. Chem. 270(27) (1995), 16491–16494;
und Correction, J. Biol. Chem. 270 (1995), 30235; Ponath, P. D.
et al., J. Exp. Med. 183 (1996), 2437–2448; und Daugherty, B. L.
et al., J. Exp. Med. 183 (1996), 2349–2354; Power, C. A. et al.,
J. Biol. Chem. 270 (1995), 19495–19500; Hoogewerf, A. J. et
al., Biochem. Biophys. Res. Commun. 218 (1996), 337–343; Samson,
M. et al., Biochemistry, 35 (1996), 3362–3367). Im Gegensatz dazu sind
die zwei IL-8-Rezeptoren, CXCR1 und CXCR2, im Grossen und Ganzen
auf Neutrophile begrenzt und für
die Migration von Neutrophilen wichtig (Baggiolini, M. et al., Adv.
Immunol. 55 (1994), 97179). Die IL-8-Rezeptoren, CXCR1 (IL-8R1,
Interleukin-8 Receptortyp 1; Holmes, W. E. et al., Science 253 (1991),
1278–1280)
und CXCR2 (IL-8R2, Interleukin-8 Rezeptortyp 2; Murphy, P. M. und
H. L. Tiffany, Science 253 (1991), 1280–1283) erkennen das NH2-terminale Glu-Leu-Arg (ELR) Motiv, ein
essentielles Bindungs-Epitop in CXC-Chemokinen, das Neutrophile
Chemotaxis induziert (Clark-Lewis, I. et al., J. Biol. Chem., 266
(1991), 23128–23134;
Hébert,
C. A. et al., J. Biol. Chem. 266 (1991), 18989–18994; und Clark-Lewis, I.
et al., Proc. Natl. Acad. Sci. USA 90 (1993), 3574–3577).
-
Im
Gegensatz zu Monozyten und Granulozyten sind die Lymphozyten-Antworten
auf Chemokine nicht voll verstanden. Interessanterweise scheint
keiner der Rezeptoren bekannter Spezifität auf Lymphozyten beschränkt zu sein
und die Chemokine, die diese Rezeptoren erkennen, können daher
nicht für
Effekte verantwortlich sein, wie selektive Rekrutierung von T-Lymphozyten,
was bei T-Zell vermittelten Entzündungszuständen beobachtet
wird. Darüber
hinaus verbleiben, obwohl eine Anzahl an Proteinen mit erheblicher
Sequenzähnlichkeit
und ähnlicher
Gewebe- und Leukozyten-Subpopulations-Verteilung gegenüber bekannten
Chemokin-Rezeptoren identifiziert und kloniert wurden, die Liganden
für diese
Rezeptoren unbekannt. Diese Rezeptoren werden daher als Waisen-Rezeptoren
bezeichnet. Die Charakterisierung des/der Liganden eines Rezeptors
ist für
ein Verständnis
der Interaktion von Chemokinen mit deren Zielzellen, der durch diese
Interaktion stimulierten Abläufe,
einschließlich
Chemotaxis und zellulärer
Aktivierung von Leukozyten, und der Entwicklung von Therapien basierend
auf der Modulation der Rezeptorfunktion von Bedeutung.
-
ZUSAMMENFASSUNG DER ERFINDUNG
-
Die
vorliegende Erfindung betrifft Antikörper oder Antigen-bindende
Fragmente davon und Verfahren, wie in den anliegenden Ansprüchen definiert.
Proteine oder Polypeptide, wie hier definiert, können isolierte und/oder rekombinante
Säuger-
(beispielsweise Primaten, wie Mensch) IP-10/Mig-Rezeptorproteine
sein, die als CXC-Rezeptor 3 bezeichnet werden (CXCR3), oder Varianten
davon. Rekombinante CXCR3-Proteine und Varianten können in
Wirtszellen wie hier beschrieben, hergestellt werden. Ein CXCR3-Protein
oder eine Variante davon ist durch selektives Binden (beispielsweise
hochaffines Binden) einer oder mehrerer Chemokine, wie IP-10 und/oder
Mig, gekennzeichnet und/oder durch die Fähigkeit eine (ein oder mehrere)
zelluläre
Antwort(en) zu induzieren (beispielsweise Chemotaxis, Exocytose,
Freisetzung von einem oder mehreren Entzündungsmediatoren).
-
Isolierte
und/oder rekombinante Nukleinsäuren,
die ein Säuger-
(beispielsweise ein Primaten, wie Mensch) CXCR3-Protein oder eine
Variante davon codieren, sind hier lediglich zur Erläuterung
beschrieben.
-
Rekombinante
Nukleinsäurekonstrukte,
wie Plasmide oder retrovirale Vektoren, die eine Nukleinsäure enthalten,
die ein Protein oder eine Variante davon kodiert, sind hier lediglich
zur Erläuterung
beschrieben. Die Nukleinsäuren
und Konstrukte können
dazu verwendet werden, rekombinante Rezeptorproteine und Wirtszellen,
die ein Konstrukt enthalten, herzustellen. Die Nukleinsäure kann
eine antisense Nukleinsäure
kodieren, die mit einer zweiten Nukleinsäure, die CXCR3-Protein kodiert,
hybridisieren und, nach Einbringen in eine Zelle, die Expression
des Rezeptors inhibieren kann.
-
Die
Erfindung betrifft Antikörper,
wie hier definiert, die mit CXCR3-Proteinen reaktiv sind, und die
beispielsweise unter Verwendung der Proteine und Varianten davon
(beispielsweise einem Peptid) oder von das Rezeptorprotein oder
Varianten exprimierenden Zellen als Immunogen hergestellt werden
können.
Derartige Antikörper
oder Fragmente davon sind bei therapeutischen, diagnostischen und
Forschungs-Einsätzen,
einschließlich
der Reinigung und der Untersuchung des Rezeptorproteins, der Identifizierung
von den Oberflächerezeptor
tragenden Zellen und der Sortierung oder dem Zählen von Zellen nützlich.
Die vorliegende Erfindung umfasst daher die Verwendung eines Antikörpers oder
eines Fragments davon, wie hier beschrieben (beispielsweise dem
mAb 1C6 oder einem Antigen bindenden Fragment davon), bei der Therapie
(einschließlich Prophylaxe)
oder der Diagnose, und die Verwendung derartiger Antikörper oder
Fragmente zur Herstellung eines Medikaments zur Verwendung bei der
Behandlung von hier beschriebenen Erkrankungen oder Zuständen.
-
Von
der vorliegenden Erfindung ebenfalls umfasst sind wie vorstehend
definierte Verfahren zur Identifizierung von Liganden der Rezeptoren,
Inhibitoren (beispielsweise Antagonisten) oder Promotoren (beispielsweise
Agonisten) der Rezeptorfunktion. In einer Ausführungsform werden geeignete
Wirtszellen, die verändert
wurden, um ein von einer in die Zellen eingebrachten Nukleinsäure kodiertes
Rezeptorprotein oder eine Variante zu exprimieren in einem Assay
eingesetzt, um die Wirksamkeit von Liganden, Inhibitoren oder Promotoren
der Rezeptorfunktion zu identifizieren und zu bewerten. Derartige
Zellen sind auch bei der Bewertung der Funktion des exprimierten
Rezeptorproteins oder Polypeptids nützlich.
-
Erfindungsgemäss können Liganden,
Inhibitoren und Promotoren der Rezeptorfunktion in einem geeigneten
Assay identifiziert werden, und weiter auf eine therapeutische Auswirkung
bewertet werden. Inhibitoren der Rezeptorfunktion können dazu
verwendet werden, die Rezeptoraktivität zu inhibieren (reduzieren
und verhindern) und Liganden und/oder Promotoren können dazu
verwendet werden eine normale Rezeptorfunktion, wo angezeigt, zu
induzieren (auslösen
oder verstärken).
Die erfindungsgemässen
Antikörper
können
zur Herstellung eines Medikaments zur Behandlung entzündlicher
Erkrankungen verwendet werden, einschließlich Autoimmunerkrankungen
und Gewebeabstossung, welche umfasst, Verabreichen eine Inhibitors
einer Rezeptorfunktion an ein Individuum (beispielsweise einen Säuger).
-
KURZE BESCHREIBUNG DER ZEICHNUNGEN
-
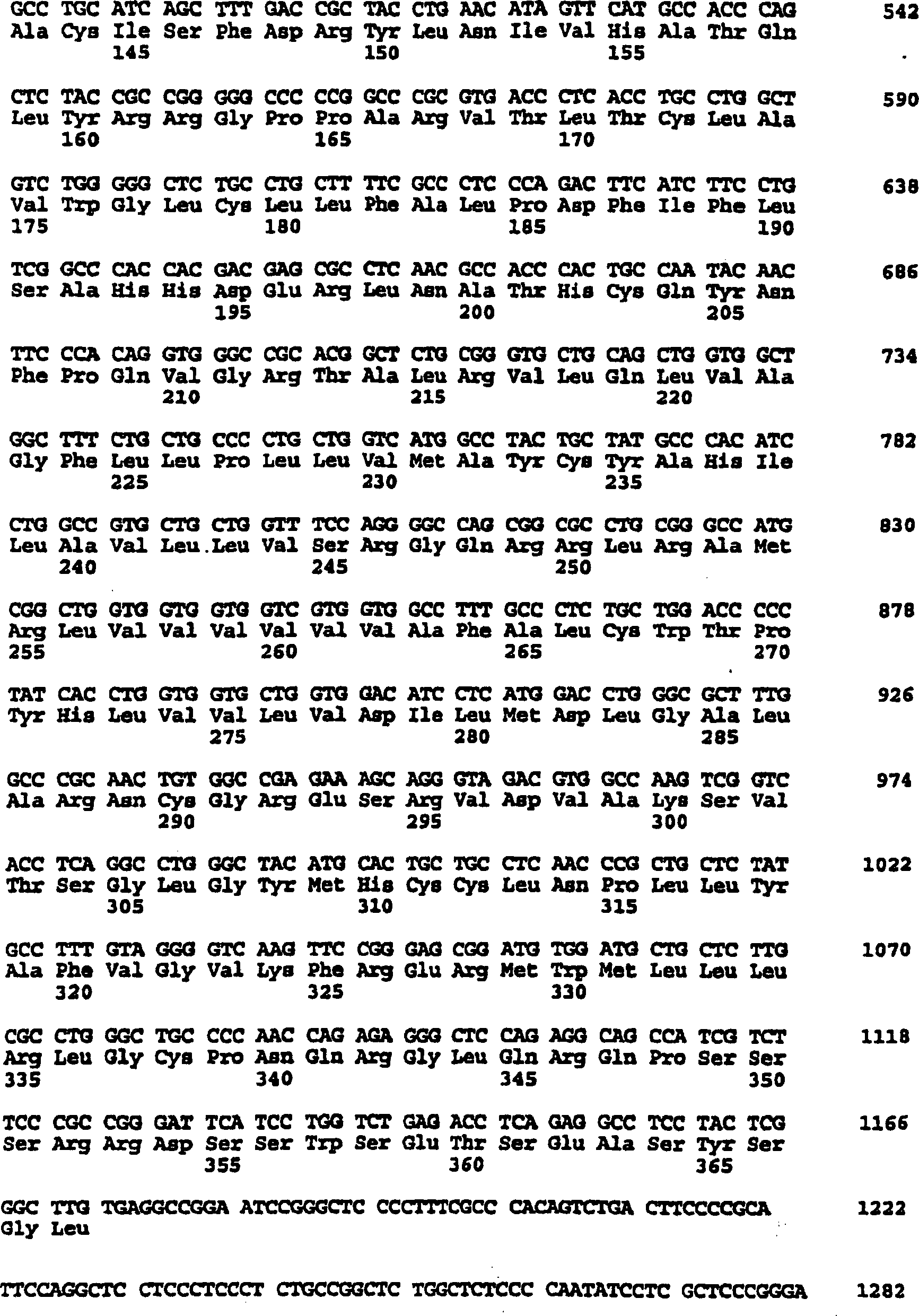
1 ist
eine Darstellung der von dem 1670 bp Insert einer cDNA bestimmten
Nukleinsäuresequenz, die
einen als CXCR3 bezeichneten humanen IP-10/Mig-Rezeptor kodiert,
und aus einer humanen CD4+ T-Zell (KT30)
cDNA-Bank (SEQ. ID. NR. 1) isoliert wurde. Ein offener Leseraster
(69–1175)
kodiert ein vorhergesagtes Protein von 368 Aminosäuren (SEQ.
ID. Nr. 2). Ein mögliches
poly-A-Signal und eine poly-A-Stelle sind an den Positionen 1534–1539 bzw.
bei 1624–1670
angeordnet.
-
2 ist
eine Darstellung der möglichen
Translation des offenen Leserasters der Sequenz in 1, die
einen humanen IP-10/Mig-Rezeptor (SEQ. ID. Nr. 2) kodiert. Pfeile
zeigen mögliche
N-verknüpfte
Glycosylierungsstellen und horizontale Linien zeigen die Stelle
der möglichen
Transmembrandomänen
(TM1–TM7).
-
Die 3A–3C sind
Graphen, die die durch IP-10 und Mig in stabil transfizierten, IP-10/Mig exprimierenden
Zellen induzierten Antworten zeigen. 3A ist
ein Graph, der die Konzentration-abhängigen [Ca2+]i-Änderungen
in den IP-10/Mig-transfizierten Zellen zeigen. IP-10 oder Mig wurden
jeweils in einer Konzentration von 1, 10 und 100 nM zu Fura-2/AM beladenen Zellen
(Pfeil) gegeben und [Ca2+]i-abhängige Fluoreszenz-Änderungen
wurden verzeichnet. Nicht transfizierte Zellen (niedrigere Verfolgung/untere
Linie) wurden mit IP-10 oder Mig bei 100 nM bei gleichen Bedingungen
stimuliert.
-
Die 3B ist ein Graph, der die Ergebnisse von Studien
zeigt, die die Rezeptor-Desensitivierung
und Quer-Desensitivierung zeigt, worin IP-10/MigR exprimierende
300–19 Zellen
nacheinander mit 100 nM IP-10 oder Mig stimuliert wurden und mit
IP-10 gefolgt von Mig oder umgekehrt, wobei Fluoreszenzänderungen
aufgezeichnet wurden.
-
Die 3C ist ein Graph, der die Chemotaxis von IP-10/MigR
exprimierenden Jurkat-Zellen,
die mit IP-10 (ausgefüllte
Kreise) oder Mig (ausgefüllte
Rechtecke) stimuliert wurden, zeigt. Das untere Panel zeigt die Antwort
nicht-transfizierter Jurkat-Zellen bei Stimulation mit ansteigenden
Mengen an IP-10 (leere Kreise) oder Mig (leere Rechtecke). Die mittleren
Werte (±SD)
migrierender/wandernder Zellen pro fünf Hochleistungsfelder (high
power fields) sind gezeigt.
-
Die 4A und 4B sind
Graphen, die die Antwort peripherer Blut-Lymphozyten (PBL) auf IP-10 und
Mig zeigen. Frisch isolierte PBL eines Donorblut-Leukozytenfilm
wurden als solche eingesetzt (untere Linie und leere Symbole), oder
wurden nach Züchten
für 10
Tage in der Anwesenheit von IL-2 (400 U/ml) (obere Verfolgung und
ausgefüllte
Symbole) eingesetzt. Die 4A ist
ein Graph, der die durch IP-10 oder Mig induzierten [Ca2+]i-Änderungen
zeigt. IP-10 oder Mig wurden jeweils bei 1, 10 und 100 nM mit Fura-2/AM-beladene, gezüchtete Zellen
(Pfeile) zugesetzt und [Ca2+]i-abhängige Fluoreszenzänderungen
wurden aufgezeichnet (obere Linie). Frisch isolierte Zellen (untere
Linie) wurden mit IP-10 oder Mig bei 100 nM unter den gleichen Bedingungen
stimuliert. Die 4B ist ein Graph, der die Chemotaxis
von PBL als Antwort auf ansteigende Konzentrationen von IP-10 (ausgefüllte Kreise)
oder Mig (ausgefüllte
Rechtecke) zeigt (mittlere Werte (±SD) von wandernden/migrierenden
Zellen pro fünf
Hochleistungsfeldern sind gezeigt).
-
Die 5A–5B sind
Graphen, die die Bindung von radioaktiv markiertem IP-10 an mit CXCR3-cDNA
transfizierte L1.2 Zellen (5A)
und an aktivierte T-Zellen (5B)
zeigt. Die Zellen wurden mit 0,05 nM 125I-markiertem
IP-10 in der Anwesenheit ansteigender Konzentrationen an nicht markiertem
IP-10 inkubiert. Eine Scatchard-Analyse (Einsatz) zeigte 37.000
Rezeptoren pro Zelle (Kd von 614 pM) für CXCR L1.2 Transfektanten
und 17.000 Rezeptoren pro Zelle (Kd von 156 pM) für CD3-Blastozysten.
-
Die 6 ist
eine Darstellung der Spezifität
des anti-CXCR3 Antikörpers
1C6, bewertet durch Anfärben
stabiler L1.2-Transfektanten, die entweder CCR1, CCR3, CCR4, CCR5,
CXCR1, CXCR2, CXCR3 oder CXCR4 exprimieren, mittels anti-CXCR3-Peptid
mAb 1C6. Ein Anfärben
als Negativkontrolle für
alle L1.-Transfektanten (nicht gezeigt) ähnelte dem Anfärben, das
für 1C6
auf nicht transfizierten L1.2-Zellen (L1.2 wt) gezeigt wurde.
-
Die 7A–7C sind
Fluoreszenz-Histogramme, die die Expression von CXCR3 auf Neutrophilen (7A), Lymphozyten (7B)
und aktivierten T-Zellen (7C)
zeigen. Leukozyten-Untergruppen wurden im Gesamtblut durch deren
Vorwärtswinkel
und Seitenstreuung identifiziert und entsprechend geleitet. Um CD3-Blastozysten
zu bilden, wurden PBMC mit anti-CD3 mAb für 3 Tage aktiviert und dann
7 Tage in Medien gehalten, das IL-2 enthielt. In jedem Ausdruck
stellt das geschwärzte
Profil ein Anfärben
mit anti-CXCR3 mAB 1C6 dar und das nicht-ausgefüllte Profil stellt ein Anfärben mit
einem Isotypen-angepassten Kontroll-mAb dar.
-
8 ist eine Reihe von Ausdrucken, die die
CXCR3-Expression auf Populationen von Blutlymphozyten zeigen. Ein
Zwei-Farben Anfärbe-Protokoll
wurde dazu verwendet, die Expression von CXCR3 auf T-Zellen (CD3),
B-Zellen (CD20) und NK-Zellen (CD56) zu bewerten.
-
9 ist eine Reihe von Ausdrucken, die die
CXCR3-Expression, aufgetragen gegen verschiedene Marker auf der
CD3+-Untermenge von Blutlymphozyten zeigen, analysiert durch drei-Farben
Analyse der Immunfluoreszenz. Anti-CD3 Cy-Chrom wurde dazu verwendet,
T-Zellen anzufärben
und diese Zellen wurden elektronisch zur Analyse geleitet (gated).
Die Quadranten wurden gemäß der Färbung der
Kontroll-mAb gesetzt. Die gezeigte Anfärbung war repräsentativ
für die
analysierten fünf
Donoren.
-
10 ist ein Histogramm, das die Inhibierung von
IP-10- oder MCP-1-vermittelter Chemotaxis aktivierter T-Zellen durch
ein Panel von anti-CXCR3-mAb. 1 × 106 humane
CD3-Blastocysten
wurde in der oberen Kammer einer Platte mit Vertiefungen (transwell)
und Chemokin (12,5 nM) wurde in die untere Kammer zugesetzt. Verschiedene
CXCR3 mAb (in Gewebekulturüberstand,
ohne FCS) wurden zusammen mit Zellen am Beginn des Assays in die
obere Vertiefung überführt. Nach
1,5 Stunden wurden die Zellen, die zum Boden der Kammer gewandert
waren, unter Verwendung von Strömungszytometrie
gemessen. Die prozentuale Inhibierung der Chemotaxis wurde berechnet,
wobei die Anzahl von Zellen, die in Abwesenheit von mAb wanderten, als
100% gesetzt wurde. Die Ergebnisse sind für mindestens 4 unterschiedliche
Experimente repräsentativ.
-
11 ist ein Graph, der die Inhibierung der IP-10
vermittelten Chemotaxis durch gereinigten anti-CXCR3 mAb 1C6 zeigt.
Verschiedene Konzentrationen von 1C6 mAb wurden in die obere Vertiefung überführt und
der Assay wurde wie für 10 gezeigt durchgeführt. mAb 1C6 inhibierte 50%
der gesamten Chemotaxis bei einer Konzentration von 856 ng/ml (IC50 = 856 ng/ml).
-
12 ist ein Graph, der die Inhibierung der Bindung
von 125I IP-10 an aktivierte T-Zellen durch mAb 1C6
zeigt. CD3-Blastozysten wurden mit 0,05 nM 125I-IP-10
in Anwesenheit steigender Konzentrationen von 1C6, wie gezeigt,
inkubiert. Nach 60 Minuten bei Raumtemperatur wurden die Pellets
gewaschen und gezählt. Die
Daten wurden mittels eines Kaleidagraphen analysiert, was einen
IC50 von 0,16 μg/ml ergab.
-
Die 13A–13H zeigen die Inhibierung von [Ca2+]i durch humane T-Zellen als Antwort auf IP-10, jedoch
nicht Mig, mittels mAb 1C6. Anti-CD3 aktivierte, IL-2 stimulierte
humane T-Zellen wurden mit Fura-2 markiert und nacheinander mit
den jeweiligen Chemokinen (13A–13B) stimuliert, oder mit mAb gefolgt 40 Sekunden
später
durch die betreffenden Chemokine (13C–13H). [Ca2+]i-Fluoreszenzänderungen
wurden unter Verwendung eines Spektrofluorimeters aufgezeichnet.
Die Verfolgungen waren für
fünf individuelle
Experimente repräsentativ.
Ein Antikörper
wurde in einer Endkonzentration von entweder 50 μg/ml (13C–13D); 25 μg/ml
(13E); 12,5 μg/ml
(13F); 6,125 μg/ml
(13G); oder 3,0625 μg/ml (13H)
eingesetzt. Die Chemokine wurden bei 2 nM eingesetzt.
-
Die 14A–14D sind Fluoreszenz-Histogramme, die die Ergebnisse
einer Strömungszytometrie-Analyse
zeigen, bei der CXCR3-exprimierende Transfektanden mit mAb 1C6 in
der Anwesenheit von P1 Peptid (14D),
P2-Peptid (14C), P3 Peptid (14D), oder in der Abwesenheit von Peptid (14A) gefärbt
wurden. In jedem Ausdruck stellt das durch die dicke Linie dargestellte
Profil eine Färbung
mit mAb 1C6 dar und das durch die gestrichelte Linie dargestellte
Profil eine Färbung
mit einem Isotypen-angepassten unbedeutenden Kontrol-mAb.
-
15 ist ein Histogramm, das die prozentuale Inhibierung
der Bindung von radioaktiv markiertem IP-10 an CXCR3-Transfektanten
durch 40 nM kaltem IP-10, mAb 1C6, gegen CXCR3 Transfektanden hergestellten
monoklonalen Antikörpern
(2F8, 3A12, 3E2, 4B4, 4D2, 5B12, 7B8 oder 8D5) oder durch anti-CXCR2 mAb
zeigt.
-
AUSFÜHRLICHE BESCHREIBUNG DER ERFINDUNG
-
Wie
hier beschrieben wurde eine Nukleinsäure kloniert und charakterisiert,
die einen neuen Chemokin-Rezeptor kodiert, der für die Chemokine IP-10 und Mig
selektiv ist. Der Klon, der aus einer humanen CD4+-T-Zellen-Bank
isoliert wurde, wurde in von Monocyten und Granulocyten abgeleiteten
cDNA-Banken nicht nachgewiesen. Sequenzanalysen des Klons zeigten
einen offenen Leserahmen von 1104 Basenpaaren (1,
SEQ ID Nr. 1), der ein vorhergesagtes Protein von 368 Aminosäuren mit
einem vorhergesagten Molekulargewicht von 40.659 Dalton (2,
SEQ ID Nr. 2) kodiert. Die Aminosäuresequenz umfasst sieben mögliche Transmembransegmente,
die für
G-Protein-gekoppelte Rezeptoren gekennzeichnet sind und in anderen Chemoattraktor-Rezeptoren
gefunden werden. Übereinstimmend
mit dieser Beobachtung vermittelt der Rezeptor eine Ca2+-(Calciumion)-Mobilisierung
und Chemotaxis als Antwort auf IP-10 und Mig (Beispiel 2). Unter gleichartigen
Bedingungen wurde keine signifikante Antwort auf die CXC-Chemokine
IL-8, GROα,
NAP-2 (Neutrophilen-aktivierendes
Protein-2), GCP-2 (Granulozyten-chemotaktisches Protein-2), ENA78
(epithelial abgeleitetes Neutrophilen-aktivierendes Peptide 78),
PF4 (Blutplättchen-Faktor 4) oder die
CC-Chemokine MCP-1 (Monozyten-chemotaktisches Protein-1), MCP-2,
MCP-3, MCP-4, MIP-1α (Makrophagen
entzündliches
Protein-1α),
MIP-1β,
RANTES (reguliert auf Aktivierung, in normalen T-Zellen exprimiert
und abgesondert, I309, Eotaxin oder Lymphotactin beobachtet.
-
Die
begrenzte Expression des humanen CXCR3 in aktivierten T-Lymphozyten
und die Ligandenselektivität
des Rezeptors für
IP-10 und Mig sind bemerkenswert. Der humane Rezeptor wird in IL-2-aktivierten T-Lymphozyten
stark exprimiert, wurde jedoch unter den in Beispiel 2 verwendeten
Bedingungen in ruhenden T-Lymphozyten, B-Lymphozyten, Monocyten
oder Granulocyten nicht nachgewiesen. Zusätzliche Studien der Rezeptor-Verteilung
zeigen, dass es hauptsächlich
CD3+-Zellen sind, die CXCR3 exprimieren, umfassend Zellen, die CD95+,
CD45RO+ und CD45RAniedrig sind, ein Phänotyp, der
mit einer vorausgegangenen Aktivierung übereinstimmt, obwohl ein Teil
der CD20+ (B)-Zellen und CD56+ (NK)-Zellen diesen Rezeptor ebenfalls exprimieren.
Die selektive Expression in aktivierten T-Lymphozyten ist von Interesse,
da andere Rezeptoren für
Chemokine, von denen berichtet wird, dass sie Lymphozyten anziehen
(beispielsweise MCP-1, MCP-2, MCP-3, MIP-1α, MIP-1β und RANTES) ebenfalls in Granulozyten,
wie Neutrophilen, Eosinophilen und Basophilen, sowie Monocyten gefunden
werden. Diese Ergebnisse lassen vermuten, dass der als CXCR3 bezeichnete
IP-10/Mig-Rezeptor an der selektiven Rekrutierung von Effektor-T- Zellen beteiligt
ist.
-
Der
Rezeptor erkennt zwei ungewöhnliche
CXC-Chemokine, die als IP-10 und Mig bezeichnet werden. Obwohl sowohl
IP-10 als auch Mig, im Unterschied zu IL-8 und anderen CXC-Chemokinen,
die starke Chemoattraktoren für
Neutrophile sind, zu der CXC-Superfamilie gehören, sind die primären Ziele
von IP-10 und Mig Lymphozyten, insbesondere Effektor-Zellen, wie
aktivierte oder stimulierte T-Lymphozyten und natürliche Killerzellen
(NK) (Taub, D. D. et al., J. Exp. Med. 177 (1993), 18090–1814; Taub,
D. D. et al., J. Immunol. 155 (1995), 3877–3888). (NK-Zellen sind größere, granuläre Lymphozyten,
denen ein spezifischer T-Zell-Rezeptor zur Antigenerkennung fehlt,
die jedoch eine zytolytische Aktivität gegen Zellen, wie Tumorzellen
und von Viren infizierten Zellen besitzen.) Übereinstimmend fehlt IP-10
und Mig das ELR-Motiv, ein wesentliches Bindungsepitop in derartigen
CXC-Chemokinen, das eine Neutrophilen-Chemotaxis wirksam induziert (Clark-Lewis, I. et al.,
J. Biol. Chem. 266 (1991), 23128–23134; Hébert, C. A. et al., J. Biol.
Chem. 266 (1991), 18989–18994;
und Clark-Lewis, I. et al., Proc. Natl. Acad. Sci. USA 90 (1993),
3574–3577).
Zusätzlich
wurde berichtet, dass sowohl rekombinantes, humanes Mig als auch
rekombinantes, humanes IP-10 einen Calcium-Fluss im Tumor-infiltrierenden
Lymphozyten (TIL) induzieren (Liao, F. et al., J. Exp. Med. 182
(1995), 1301–1314).
Obwohl berichtet wurde, dass IP-10 eine Chemotaxis von Monozyten
in vitro induziert (Taub, D. D. et al., J. Exp. Med. 177 (1993),
1809–1814),
wurde der verantwortliche Rezeptor nicht identifiziert, humanes Mig
erscheint hoch selektiv und zeigt keine derartige Wirkung (Liao,
F. et al., 1995, J. Exp. Med., 182: 1301–1314). Eine IP-10-Expression
wird in einer Vielzahl von Geweben bei entzündlichen Bedingungen, wie Psoriasis,
fixes Arzneimittelexanthem, Haut-Allergien
vom Spättyp
bzw. DTH (cutaneous delayed-type hypersensitivity responses), tuberkuloide
Leprosis, und in experimenteller Glumerulonephritis und experimenteller allergischer
Encephalomyelitis induziert. IP-10 weist weiter in vivo eine starke
Antitumorwirkung auf, die T-Zell abhängig ist, und ist berichtetermassen
in vivo ein Inhibitor der Angiogenese, und kann eine Chemotaxis
und Degranulierung von NK-Zellen in vitro induzieren, was eine Rolle
als ein Mediator einer NK-Zellen-Rekrutierung und Degranulierung
vermuten lässt
(beispielsweise bei einer Zerstörung
von Tumorzellen) (Luster, A. D. und P. Leder, J. Exp. Med., 178
(1993), 1057–1065;
Luster, A. D. et al., J. Exp. Med. 182 (1995), 219–231; Angiolillo,
A. L. et al., J. Exp. Med. 182 (1995), 155–162; Taub, D. D. et al., J. Immunol.
155 (1995), 3877–3888).
Die Expressionsmuster von IP-10 und Mig sind ebenfalls dadurch verschieden,
dass eine Expression von beiden durch Gamma-Interferon (IFNγ) induziert
wird, während
die Expression von IL-8 durch IFNγ herunter
reguliert wird (Luster, A. D. et al., Nature 315 (1985), 672–676; Farber,
J. M., Proc. Natl. Acad. Sci. USA 87 (1990), 5238–5242; Farber,
J. M., Biochem. Biophys. Res. Commun., 192(1) (1993), 223–230, Liao, F.
et al., J. Exp. Med. 182 (1995), 1301–1314; Seitz, M. et al., J.
Clin. Invest. 87 (1991), 463–469;
Galy, A. H. M. und H. Spits, J. Immunol. 147 (1991), 3823–3830).
-
Kürzlich wurden
Chemokine also die lange gesuchten Mediatoren der Rekrutierung von
Lymphozyten erkannt. Es wurde gefunden, dass mehrere CC-Chemokine
eine Lymphozyten-Chemotaxis
auslösen
(Loetscher P. et al., FASEB J. 8 (1994), 1055–1060), wobei sie jedoch ebenfalls
aktiv sind bei Granulocyten und Monocyten (Uguccioni, M. et al.,
Eur. J. Immunol. 25 (1995), 64–68;
Baggiolini, M. und C. A. Dahinden, Immunol. Today 15 (1994), 127–133). Die
Situation ist für
IP-10 und Mig verschieden, die in ihrer Wirkung auf Lymphozyten,
umfassend aktivierte T-Lymphozyten und NK-Zellen, selektiv sind
und die CXCR3 binden, ein Rezeptor, der viele andere Chemokine nicht
erkennt und der ein selektives Expressionsmuster zeigt (Beispiel
2, Beispiel 5).
-
Angesichts
dieser Beobachtungen ist es sinnvoll anzunehmen, dass die Bildung
der charakteristischen Infiltrate in entzündlichen Verletzungen, wie
Verletzungen von Allergien von Spättyp, Stellen von viralen Infektionen
und bestimmte Tumore, ein Prozess ist, der mittels CXCR3 vermittelt
und durch eine CXCR3-Expression reguliert wird. Lymphozyten, insbesondere
T-Lymphozyten, die einen CXCR3-Rezeptor als ein Ergebnis einer Aktivierung
tragen, können
zu entzündlichen
Verletzungen, Infektionsstellen oder Tumoren durch IP-10 und/oder
Mig rekrutiert werden, die lokal durch Gamma-Interferon induziert
werden können.
Somit spielt CXCR3 eine Rolle bei der selektiven Rekrutierung von
Lymphozyten, insbesondere von Effektor-Zellen, wie aktivierte oder
stimulierte T-Lymphozyten.
-
Proteine und Peptide
-
Isolierte
und/oder rekombinante (umfassend beispielsweise im Wesentlichen
reine) Proteine oder Polypeptide werden hier lediglich zur Erläuterung
beschrieben. Sie werden als Säuger-CXCR3-Proteine
und Varianten davon bezeichnet. Die isolierten und/oder rekombinanten
Proteine weisen mindestens ein Merkmal, eine Aktivität oder Funktion
auf, das/die für
ein Säuger-CXCR3-Protein
(wie hier definiert) kennzeichnend ist, wie eine Bindungs aktivität (beispielsweise
Binden eines Liganden, Inhibitors und/oder Promotors), eine Signalisierungs-Aktivität (beispielsweise
Aktivierung eines Säuger-G-Proteins,
Induktion eines schnellen und transienten Anstiegs der Konzentration
an im Cytosol frei vorkommenden Calcium [Ca2+]i, zelluläre
Antwortfunktion (beispielsweise Stimulierung einer Chemotaxis, Exozytose
oder Freisetzung von Entzündungsmediator
durch Leukozyten) und/oder ein immunologisches Merkmal, wie hier
definiert. So können
beispielsweise einige Proteine selektiv an IP-10 und/oder Mig binden,
eine zelluläre
Signalisierung und/oder eine Antwort darauf in vitro und/oder in
vivo vermitteln (beispielsweise Calcium-Fluss, Chemotaxis und/oder
Degranulation, insbesondere von aktivierten T-Lymphozyten). So kann
beispielsweise, wie hier gezeigt, ein humanes CXCR3-Protein, das in
einer Säugetierzelle
durch Expression eines cDNA-Klons erzeugt wurde, selektiv an die
CXC-Chemokine IP-10 und/oder Mig binden und eine Signalisierung
und eine zelluläre
Antwort (beispielsweise Chemotaxis) vermitteln. Hier offenbarte
Proteine können
an ein CXC-Chemokin der gleichen oder einer unterschiedlichen Säugerspezies
binden (beispielsweise humanes IP-10, murines IP-10, humanes Mig,
murines Mig) (humanes IP-10, Luster, A. D. et al., Nature 315 (1985),
672–676;
murines IP-10 (ebenfalls als CRG-2 bezeichnet), Vanguri, P. und
J. M. Farber, J. Biol. Chem. 265 (1990), 15049, und Luster, A. D.
und P. Leder, J. Exp. Med. 178 (1993), 1057–1065; murines Mig, Farber,
J. M., Proc. Natl. Acad. Sci. USA 87 (1990), 5238–5242; humanes Mig,
Farber, J. M., Biochem. Biophys. Res. Commun. 192(1) (1993), 223–230 und
Liao, F. et al., J. Exp. Med. 182 (1995), 1301–1314).
-
Proteine
oder Polypeptide, die hier als "isoliert" bezeichnet werden,
sind Proteine oder Polypeptide, die über einen Zustand gereinigt
werden, in dem sie in Säugerzellen
vorliegen, wobei sie Proteine oder Polypeptide umfassen, die durch
hier beschriebene Verfahren, ähnliche
Verfahren oder andere geeignete Verfahren erhalten wurden, wobei
umfasst sind im Wesentlichen reine Proteine oder Polypeptide, Proteine
oder Polypeptide, die durch chemische Synthese (beispielsweise synthetische
Peptide) oder durch Kombinationen von biologischen und chemischen
Verfahren erzeugt wurden, und rekombinante Proteine oder Polypeptide,
die isoliert wurden. Die Proteine können in einem isolierten Zustand
von mindestens ungefähr
50 Gew.-% erhalten werden, vorzugsweise mindestens ungefähr 75 Gew.-%
oder in einer im Wesentlichen reinen Form. Proteine oder Polypeptide,
die hier als "rekombinant" bezeichnet werden,
sind Proteine oder Polypeptide, die durch Expression rekombinanter
Nukleinsäuren
erzeugt werden.
-
Wie
hier verwendet bezieht sich "Säuger-CXCR3-Protein" auf natürlich vorkommende
oder endogene Säuger-CXCR3-Proteine
und auf Proteine, die eine Aminosäuresequenz aufweisen, die die
gleiche wie die eines entsprechenden natürlich vorkommenden oder endogenen
Säuger-CXCR3-Proteins
ist (beispielsweise rekombinante Proteine). Folglich umfasst, wie
hier definiert, der Begriff "Säuger-CXCR3-Protein" reifes Protein,
polymorphe oder allelische Varianten und andere Isoformen eines
Säuger-CXCR3
(beispielsweise erzeugt durch alternatives Spleißen oder andere zelluläre Prozesse)
und modifizierte oder nicht-modifizierte Formen der vorstehend aufgeführten (beispielsweise
glycosylierte, nicht-glykosylierte, phoshorylierte oder nicht-phosphorylierte
CXCR3-Proteine). Natürlich
vorkommende oder endogene Säuger-CXCR3-Proteine
umfassen Wildtyp-Proteine, wie reifes CXCR3, polymorphe oder allelische
Varianten und andere Isoformen, die natürlicherweise in Säugern (beispielsweise
Menschen, nicht-humanen Primaten) vorkommen. Derartige Proteine können beispielsweise
aus einer Quelle gewonnen werden, die natürlicherweise Säuger-CXCR3
erzeugt. Diese Proteine und Säuger-CXCR-3-Proteine,
die die gleiche Aminosäuresequenz
wie eine entsprechendes natürlich
vorkommendes oder endogenes Säuger-CXCR3,
aufweisen, werden durch den Namen des entsprechenden Säugetiers
gekennzeichnet. Ist beispielsweise das entsprechende Säugetier
ein Mensch, wird das Protein als ein humanes CXCR3-Protein bezeichnet
(beispielsweise ein rekombinantes humanes CXCR3, das in einer geeigneten
Wirtszelle erzeugt bzw. hergestellt wird).
-
"Funktionale Varianten" von Säuger-CXCR3-Proteinen
umfassen funktionale Fragmente, funktionale mutante Proteine und/oder
funktionale Fusionsproteine (beispielsweise mittels Mutagenese und/oder
Rekombinationstechniken erzeugt). Im Allgemeinen umfassen Fragmente
oder Abschnitte bzw. Bereiche von Säuger-CXCR3-Protein solche,
die eine Deletion (d.h. eine oder mehrere Deletionen) einer Aminosäure (d.h.
von einer oder mehrere Aminosäuren)
in Bezug auf das reife Säuger-CXCR3-Protein
aufweisen (wie N-terminale, C-terminale oder interne Deletionen).
Ebenfalls sind Fragmente oder Abschnitte, in denen lediglich in
Bezug auf das reife Säuger-CXCR3-Protein
aufeinanderfolgende Aminosäuren
deletiert sind oder in denen nicht aufeinanderfolgende Aminosäuren deletiert
sind, ins Auge gefasst.
-
Im
Allgemeinen umfassen Mutanten oder Derivate von Säuger-CXCR3-Proteinen
natürliche
und artifizielle Varianten, die sich durch die Addition, Deletion
und/oder Substitution von einer oder mehrerer aufeinanderfolgender
oder nicht-aufeinanderfolgender Aminosäurereste unterschieden, oder
modifizierte Polypeptide, bei denen ein oder mehrere Reste modifiziert
ist/sind und Mutanten, die einen oder mehrere modifizierte Reste
umfassen.
-
Mutanten
können
natürliche
und artifizielle Varianten von Säuger-CXCR3-Proteinen
sein, die sich durch die Addition, Deletion und/oder Substitution
von einer oder mehrerer aufeinanderfolgender oder nicht-aufeinanderfolgender
Aminosäurereste
unterschieden. Derartige Mutationen können beispielsweise in einer
konservierten Region oder einer nicht-konservierten Region (verglichen mit
anderen CXC- und/oder CC-Chemokin-Rezeptoren), einer extrazellulär, cytoplasmatischen
Region oder Transmembranregion sein.
-
Ein "funktionales/r Fragment
oder Anschnitt",
ein "funktionaler
Mutant" und/oder
ein "funktionales
Fusionsprotein" eines
Säuger-CXCR3-Proteins
betrifft ein isoliertes und/oder rekombinantes Protein oder Oligopeptid,
das mindestens ein Merkmal, eine Aktivität oder Funktion aufweist, das/die
für ein
Säuger-CXCR3-Protein
(wie hier definiert) kennzeichnend ist, wie eine Bindungsaktivität (beispielsweise
Binden eines Liganden, Inhibitors und/oder Promotors), eine Signalisierungs-Aktivität (beispielsweise
Aktivierung eines Säuger-G-Proteins, Induktion
eines schnellen und transienten Anstiegs der Konzentration an im
Cytosol frei vorkommenden Calcium [Ca2+]i, eine zelluläre Antwortfunktion (beispielsweise
Stimulierung einer Chemotaxis, Exocytose oder Freisetzung von Entzündungsmediator
durch Leukozyten) und/oder ein immunologisches Merkmal, wie hier definiert.
-
Wie
hier verwendet, ist eine Protein oder Polypeptide mit "mindestens einem
immunologischen Merkmal" eines
Säuger-CXCR3-Proteins
eines, das (a) durch mindestens einen Antikörper mit einer ausgewählten Epitop-Spezifität gebunden
wird, die an ein natürlich
vorkommendes oder endogenes Säuger-CXCR3-Protein oder
ein Protein bindet, das die gleiche Aminosäuresequenz, wie das natürlich vorkommende
oder endogene Säuger-CXCR3-Protein
(beispielsweise humanes CXCR3) aufweist und/oder (b) ein Immunogen
ist, das (beispielsweise wenn es an einen geeigneten Träger konjugiert
ist) in einem geeigneten Tier die Bildung eines Antikörpers mit
einer ausgewählten
Epitop-Spezifität
induzieren kann, die an natürlich
vorkommendes oder endogenes Säuger-CXCR3
oder ein Protein bindet, das die gleiche Aminosäuresequenz wie das natürlich vorkommende
oder endogene Säuger-CXCR3
aufweist. So kann beispielsweise ein geeignetes Fragment mit einem
Antikörper
kreuzreagieren, der gerichtet ist gegen und/oder reaktiv ist mit
isoliertem Säuger-CXCR3.
-
Geeignete
Fragmente oder Mutanten können
durch ein Screenen bzw. Durchmustern identifiziert werden. So können beispielsweise
die N-terminalen, C-terminalen oder internen Regionen des Proteins
in einer schrittweisen Art und Weise deletiert werden und das so
erhaltene Protein oder Polypeptid kann durch Verwendung eines geeigneten
Assays bzw. Tests durchmustert werden, wie durch einen hier beschriebenen
Assay (beispielsweise Chemotaxis, Calcium-Fluss). Zeigt das so erhaltene
Protein in dem Assay eine Aktivität, ist das so erhaltene Protein
("Fragment") funktional. Eine
Information bezüglich
der Struktur und Funktion von Säuger-G-Protein-gekoppelten
Rezeptoren, umfassend CXC-Chemokin- und CC-Chemokin-Rezeptoren, liefert
eine Basis zum Unterteilen von Säuger-CXCR3-Proteinen
in funktionale Domainen (Murphy, P. M., 1994, Annu. Rev. Immunol.,
12: 593–633
und Gerard, C. und N. P. Gerard, 1994, Curr. Opin. Immunol., 6:
140–145 sowie
darin aufgeführter
Quellen).
-
Der
Begriff Variante umfasst ebenfalls Fusionsproteine, umfassend Säuger-CXCR3-Proteine (beispielsweise
humanes CXCR3) als einen ersten Rest bzw. Teil, der mit einem zweiten
Rest verknüpft
bzw. verbunden ist, der in dem Säuger-CXCR3,
wie es in der Natur gefunden wird, nicht auftritt. Somit kann der
zweite Rest eine Aminosäure
sein, ein Oligopeptid oder ein Polypeptid. Der erste Rest kann N-terminal,
C-Terminal oder intern in dem Fusionsprotein lokalisiert sein. Das
Fusionsprotein kann als den ersten Rest einen Affinitätsliganden
umfassen (beispielsweise eine(n) Enzym-, Antigen-, Epitop-Markierung
bzw. Tag) und einen zweiten Rest, der eine Linkersequenz und humanes
CXCR3 oder einen Abschnitt davon umfasst.
-
Beispiele
für Säuger-CXCR3-Proteine
umfassen Proteine, die durch eine hier beschriebene Nukleinsäure kodiert
werden, wie ein Protein mit einer Aminosäuresequenz, die in 2 (SEQ
ID Nr. 2) dargelegt oder im Wesentlichen dargelegt ist. So kann
ein Säuger-CXCR3 oder eine Variante
(beispielsweise eine das extrazelluläre N-terminale Segment umfassende
Variante) eine Aminosäuresequenz
aufweisen, die mindestens ungefähr
50% identisch, noch bevorzugter mindestens ungefähr 70% identisch und noch mehr
bevorzugt mindestens ungefähr
80% identisch zu dem in 2 (SEQ ID Nr. 2) gezeigten
Protein ist.
-
Es
ist klar, dass isolierte und/oder rekombinante Säuger-CXCR3-Proteine und Varianten
davon modifiziert werden können,
beispielsweise durch Inkorporation von oder durch Anfügen (direkt
oder indirekt (beispielsweise mittels eines Linkers)) von einem nachweisbaren
Marker, wie ein Radioisotop, ein Spin-Marker, ein Antigen (beispielsweise
eine Epitop-Marker wie einer FLAG-Markierung) oder eine Enzym-Marker,
eine fluoreszierende oder chemolumineszierende Gruppe oder dergleichen.
-
Nukleinsäuren, Konstrukte und Vektoren
-
Es
werden hier isolierte und/oder rekombinante (umfassend beispielsweise
im Wesentlichen reine) Nukleinsäuren
beschrieben, die eine Sequenz aufweisen, die ein Säuger-CXCR3-Protein (beispielsweise
humanes) oder Varianten davon kodieren. Nukleinsäuren, die hier als "isoliert" bezeichnet werden,
sind Nukleinsäuren,
die von den Nukleinsäuren
der genomischen DNA oder zellulärer
RNA von deren Ursprungsquelle (wie es beispielsweise in Zellen oder
in einem Gemisch von Nukleinsäuren,
wie einer Bank, vorliegt) abgetrennt wurden und die einer weiteren
Bearbeitung unterzogen worden sein können. "Isolierte" Nukleinsäuren umfassen Nukleinsäuren, die
durch hier beschriebene Verfahren, ähnliche Verfahren oder andere
geeignete Verfahren erhalten wurden, wobei umfasst sind im Wesentlichen
reine Nukleinsäuren,
Nukleinsäuren,
die durch chemische Synthese, durch Kombinationen von biologischen
und chemischen Verfahren erzeugt wurden und isolierte rekombinante
Nukleinsäuren.
Nukleinsäuren,
die hier als "rekombinant" bezeichnet werden,
sind Nukleinsäuren,
die durch DNA-Rekombinationsverfahren erzeugt wurden, umfassend
solche Nukleinsäuren,
die durch Techniken erzeugt werden, die auf Verfahren einer artifiziellen
Rekombination beruhen, wie die Polymerasekettenreaktion (PCR) und/oder
Klonieren in einen Vektor unter Verwendung eines Restriktionsenzyms. "Rekombinante" Nukleinsäuren sind
ebenfalls solche, die von Rekombinationsereignissen herrühren, die durch
die natürlichen
Mechanismen der Zellen auftreten, auf die jedoch nach Einführen von
Nukleinsäuren
in die Zellen, die derart aufgebaut, dass ein gewünschtes
Rekombinationsereignis ermöglicht
und wahrscheinlich wird, selektioniert werden.
-
Die
Nukleinsäure
oder ein Abschnitt davon kann ein Protein oder Polypeptid kodieren,
das mindestens eine Funktion aufweist, die für ein Säuger-CXCR3-Protein (beispielsweise
einen humanen CXCR3-Rezeptor) kennzeichnend ist, wie eine Bindungsaktivität (beispielsweise
Binden eines Liganden, Inhibitors und/oder Promotors), eine Signalisierungs-Aktivität (beispielsweise
Aktivierung eines Säuger-G-Proteins,
Induktion eines schnellen und transienten Anstiegs der Konzentration
an im Cytosol frei vorkommenden Calcium [Ca2+]i, und/oder Stimulierung einer zelluläre Antwort
(beispielsweise Stimulierung einer Chemo taxis, Exocytose oder Freisetzung
von Entzündungsmediator
durch Leukozyten). Es werden hier im Speziellen isolierte und/oder
rekombinante Nukleinsäuren
oder ein Abschnitt davon beschrieben, die Sequenzen umfassen, die
einen Säuger-CXCR3-Rezeptor
oder einen Abschnitt davon kodieren. Ebenfalls sind hier im Speziellen
isolierte und/oder rekombinante Nukleinsäuren beschrieben, die Sequenzen
umfassen, die ein humanes CXCR3-Protein kodieren.
-
Hier
beschriebene isolierte und/oder rekombinante Nukleinsäuren umfassen
doppel- oder einzelsträngige DNA
oder RNA, die gekennzeichnet sind durch (1) ihre Fähigkeit
zu hybridisieren mit (a) einer Nukleinsäure mit der Sequenz SEQ ID
Nr. 1, (b) einer Nukleinsäure
mit einer zur SEQ ID Nr. 1 komplementären Sequenz oder (c) einem
Abschnitt der vorstehend aufgeführten,
der den offenen Leserahmen der SEQ ID Nr. 1 umfasst (ein Abschnitt
von dem in 1 gezeigten Strang oder dem
entsprechenden Abschnitt des komplementären Strangs); und/oder (2)
ihre Fähigkeit
ein Polypeptid zu kodieren, das die Aminosäuresequenz SEQ ID Nr. 2 aufweist,
oder ein funktionales Äquivalent
davon (d.h. ein Polypeptid mit einer Ligandenbindungsaktivität für einen
oder mehrere natürliche(n)
oder physiologische(n) Liganden des Rezeptors und/oder mit einer stimulatorische
Funktion als Antwort auf ein Binden eines Liganden, so dass es eine
zelluläre
Antwort induzieren kann (beispielsweise Induktion (umfassend Auslösen (triggering)
oder Stimulieren) einer Chemotaxis, Exozytose oder Freisetzung von
Entzündungsmediator
durch Leukozyten); und/oder (3) durch beide Eigenschaften.
-
Der
Prozentsatz der Aminosäuresequenzidentität zwischen
SEQ ID Nr. 2 und funktionalen Äquivalenten
davon wird in einem erläuternden
Beispiel mit mindestens ungefähr
60% (≥ 60%)
beschrieben. Funktionale Äquivalente
von SEQ ID Nr. 2 weisen zumindest eine ungefähr 70%ige Sequenzidentität mit SEQ
ID Nr. 2 auf. Noch bevorzugter beträgt der Prozentsatz der Aminosäuresequenzidentität zwischen
SEQ ID Nr. 2 und funktionalen Äquivalenten
davon mindestens ungefähr
80% und noch mehr bevorzugt mindestens ungefähr 90%.
-
Isolierte
und/oder rekombinante Nukleinsäuren,
die diese Kriterien erfüllen,
umfassen Nukleinsäuren mit
Sequenzen, die identisch mit Sequenzen von natürlich vorkommenden Säuger-CXCR3-Rezeptoren
und Abschnitten davon sind oder mit Varianten der natürlich vorkommenden
Sequenzen. Derartige Varianten umfassen Mutanten, die sich durch Addition,
Deletion oder Substitution von einem oder mehrerer Reste unterscheiden,
modifizierte Nukleinsäuren,
bei denen ein oder mehrere Reste modifiziert sind (beispielsweise
DNA- oder RNA-Analoga) und Mutanten, die einen oder mehrere modifizierte
Reste umfassen. Die Nukleinsäure kann
mindestens ungefähr
50% Nukleotidsequenzähnlichkeit
zeigen, noch bevorzugter mindestens ungefähr 75% Nukleotidsequenzähnlichkeit
und noch mehr bevorzugt mindestens ungefähr 90% Nukleotidsequenzähnlichkeit
mit einem Strang der in SEQ ID Nr. 1 gezeigten Sequenz oder mit
der kodierenden Region davon. Hier beschriebene Nukleinsäuren können Längen von
mindestens ungefähr
40 Nukleotiden, noch bevorzugter mindestens ungefähr 50 Nukleotiden
und noch mehr bevorzugt mindestens ungefähr 75 Nukleotiden aufweisen.
-
Derartige
Nukleinsäuren
können
beispielsweise durch Hybridisierung unter hoch stringenten Bedingungen
oder mäßig stringenten
Bedingungen nachgewiesen und isoliert werden. "Hoch stringente Bedingungen" und "mäßig bzw. moderat stringente
Bedingungen" für Nukleinsäurehybridisierungen
werden auf den Seiten 2.10.1–2.10.16
(siehe insbesondere 2.10.8–11)
und den Seiten 6.3.1–6
in Current Protocols in Molecular Biology (Ausubel, F. M. et al.,
Herausgeber, Band 1, Suppl. 26, 1991) erklärt. Faktoren wie Sondenlänge, Basenzusammensetzung,
prozentuale Fehlpaarung zwischen den hybridisierenden Sequenzen,
Temperatur und Ionenstärke,
beeinflussen die Stabilität
der Nukleinsäurehybride.
Somit können
hohe oder mäßige Stringenzbedingungen
empirisch bestimmt werden, um die gewünschte Selektivität zu erreichen.
-
Isolierte
und/oder rekombinante Nukleinsäuren,
die gekennzeichnet sind durch ihre Fähigkeit an eine Nukleinsäure mit
der Sequenz SEQ ID Nr. 1 oder dem Komplement davon (beispielsweise
unter hohen oder mäßigen Stringenzbedingungen)
zu hybridisieren, können
ferner ein Protein oder Polypeptid kodieren, das mindestens eine
Funktion aufweist, die für
ein Säuger-CXCR3-Protein
(beispielsweise ein humanes CXCR3-Protein) kennzeichnend ist, wie
eine Bindungsaktivität
(beispielsweise Binden eines Liganden, Inhibitors und/oder Promoters),
eine Signalisierungs-Aktivität
(beispielsweise Aktivierung eines Säuger-G-Proteins, Induktion
eines schnellen und transienten Anstiegs der Konzentration an im
Cytosol frei vorkommenden Calcium [Ca2+]i‚ und/oder
Stimulierung einer zelluläre
Antwort (beispielsweise Stimulierung einer Chemotaxis, Exocytose
oder Freisetzung von Entzündungsmediator
durch Leukozyten).
-
Die
hier beschriebene humane CXCR3-Nukleinsäure oder ausreichende Abschnitte
davon, ob isoliert, rekombinant und/oder synthetisch, umfassend
durch PCR erzeugte Fragmente, können
als Sonden oder Primer verwendet werden, um Nukleinsäuren (beispielsweise
genomische DNA, allelische Varianten, cDNA) nachzuweisen und/oder
zu gewinnen, die CXCR3-Rezeptoren (Homologe) oder andere verwandte
Rezeptorgene (beispielsweise neue CXC-Chemokin-Rezeptorgene) aus
anderen Säugerspezies
kodieren, umfassend, jedoch nicht beschränkt auf Primaten (beispielsweise
ein nicht-humaner Primat, wie eine Affe (beispielsweise Javaneraffe
(cynomolgus monkey)), Rind, Schaf, Pferd, Hund, Katze und Nager
(beispielsweise Meerschweinchen, mausartige Spezies, wie Ratte und
Maus). Dies kann durch Verwendung der hier beschriebenen Techniken
bzw. Methoden oder anderer geeigneter Verfahren erzielt werden,
umfassend Hybridisierung, PCR oder andere geeignete Techniken. Es
können
Nukleinsäuren
aus Säugern
verwendet werden, um Konstrukte (beispielsweise Vektoren), Rezeptoren
oder Fragmente davon und Wirtsstämme
herzustellen, die in der Herstellung und in Verfahren zur Verwendung
des Rezeptors nützlich
sind.
-
Eine
Nukleinsäure,
die ein Säuger-CXCR3-Protein
(oder eine Variante) kodiert, kann durch Verfahren, wie PCR-Amplifikation,
erzeugt werden. So können
beispielsweise passende Primer (beispielsweise ein Paar von Primers
oder ineinander geschachtelten (nested) Primern) gestaltet werden,
die eine Sequenz umfassen, die komplementär oder in Wesentlichen komplementär zu einem
Abschnitt der hier beschriebenen humanen CXCR3-cDNA ist. So können beispielsweise Primer
gestaltet werden, die komplementär
zu den 5'- oder 3'-Enden der kodierenden
Sequenz sind und/oder die kodierende Sequenz flankieren. Derartige
Primer können
beispielsweise in einer Polymerasekettenreaktion mit einer geeigneten
Nukleinsäurevorlage
verwendet werden, um eine Nukleinsäure zu erhalten, die ein Säuger-CXCR3
kodiert. Geeignete Vorlagen umfassen beispielsweise hier beschriebene
Konstrukte (wie pcDNA3-Klon8), eine cDNA- oder genomische Bank oder
andere geeignete Quellen von Säuger-cDNA
oder genomischer Säuger-DNA
(beispielsweise eines Menschen, Primaten). Die Primer können, soweit
erforderlich, Abschnitte enthalten, die komplementär zu flankierenden
Sequenzen eines Konstrukts sind, das als eine Vorlage ausgewählt wurde.
-
Die
bindende Funktion eines Proteins oder Polypeptides (beispielsweise
durch eine hybridisierende Nukleinsäure kodiert) kann in Bindungs-
oder Bindungsinhibierungs-Assays nachgewiesen werden, wobei beispielsweise
Rezeptor enthaltende Membranfraktionen oder Rezeptor exprimierende
Zellen verwendet werden (siehe beispielsweise Van Riper et al.,
J. Exp. Med. 177 (1993), 851–856;
Sledziewski et al., US-P-5,284,746 (8. Februar 1994). Somit kann
die Fähigkeit
des kodierten Proteins oder Polypeptides einen Liganden, wie IP-10
oder Mig, einen Inhibitor und/oder Promotor zu binden, bestimmt
werden. Die antigenischen Merkmale der durch Nukleinsäuren kodierten
Proteine oder Polypeptide können
durch immunologische Verfahren bestimmt werden, die Antikörper einsetzen,
die an Säuger-CXCR3 binden, wie
Immunoblotting, Immunopräzipitation
und Immunoassay (beispielsweise Radioimmunoassay, ELISA).
-
Die
Signalisierungs-Aktivität
eines Proteins oder Polypeptides (beispielsweise kodiert durch hybridisierende
Nukleinsäure)
kann durch enzymatische Assays für
G-Protein-Aktivität, die auf
eine Rezeptorbindung reagiert, bestimmt werden (beispielsweise Austausch
von GTP durch GDP an der α-Untereinheit
des G-Proteins, wobei Membranfraktionen verwendet werden). Eine
G-Protein-Kopplung kann ferner beispielsweise durch Assays bestimmt
werden, in denen eine Stimulierung durch G-Protein mittels Behandlung
oder Vorbehandlung der Zellen oder einer geeigneten zellulären Fraktion
(beispielsweise Membranen) mit spezifischen G-Protein-Inhibitoren
blockiert ist, wie das Bordetella pertussis-Toxin (Bischoff, S.
C. et al., Eur. J. Immunol. 23 (1993), 761–767; Sozzani, S. et al., J.
Immunol. 147 (1991), 2215–2221).
-
Die
stimulierende Funktion eines Proteins oder Polypeptides (beispielsweise
kodiert durch hybridisierende Nukleinsäure) kann durch Standardassays
für Chemotaxis
oder Mediator-Freisetzung nachgewiesen werden, wobei Zellen verwendet
werden, die das Protein oder Polypeptid exprimieren (beispielsweise
Assays, die beobachten eine Chemotaxis, Exocytose (beispielsweise
Degranulation von Enzymen, wie Esterasen (beispielsweise Serin-Esterasen),
Perforin, Granzyme) oder Mediator-Freisetzung (beispielsweise Histamin,
Leukotrien) als Antwort auf einen Liganden (beispielsweise einem
Chemokin, wie IP-10 oder Mig) oder einen Promotor (siehe beispielsweise
Taub, D. D. et al., J. Immunol. 155 (1995), 3877–3888; Baggliolini, M. und
C. A. Dahinden, Immunology Today 15 (1994), 127–133 und dort zitierte Quellen).
Funktionseigenschaften eines Säuger-CXCR3-Rezeptors können durch
andere geeignete Verfahren ebenfalls bestimmt werden.
-
Diese
Verfahren, alleine oder in Kombination mit anderen geeigneten Verfahren,
können
in Techniken/Methoden zur Identifizierung und/oder Isolierung von
Nukleinsäuren ebenfalls
verwendet werden, die ein Polypeptid mit der Aminosäuresequenz
SEQ ID Nr. 2 oder funktionaler Äquivalente
davon und mit einer durch den Assay nachgewiesen Aktivität kodieren.
In dieser Art und Weise können
weiter Abschnitte der isolierten Nukleinsäuren, die Polypeptidabschnitte
von SEQ ID Nr. 2 mit einer bestimmten Funktion kodieren, identifiziert und
isoliert werden.
-
Die
Nukleinsäuren
können
für die
Herstellung der Proteine oder Polypeptide verwendet werden. So kann
beispielsweise eine Nukleinsäure,
die die gesamte kodierende Sequenz für einen Säuger-CXCR3-Rezeptor oder einen
Teil davon enthält,
oder DNA, die an die Sequenz SEQ ID Nr. 1 hybridisiert, oder das
Komplement davon in ein Konstrukt inkorporiert werden, um die Sequenz
weiter zu manipulieren oder um das kodierte Polypeptide in geeigneten
Wirtszellen zu herzustellen. So können beispielsweise Nukleinsäuren durch Inkorporierung
von oder Anfügen
(direkt oder indirekt) von einem nachweisbaren Marker, wie einem
Radioisotop, einem Spin-Marker, einem Antigen- oder Enzym-Marker,
einer fluoreszierende oder chemolumineszierende Gruppe und dergleichen.
-
Antisense-Konstrukte
-
Die
hier beschriebene Nukleinsäure
kann eine antisense-Nukleinsäure
sein, die im Ganzen oder in einem Teil komplementär zu einem
Zielmolekül
ist, die den Sense-Strang umfasst, und mit dem Zielmolekül hybridisieren
kann. Das Ziel kann DNA oder deren RNA-Duplikat sein (d.h. worin T-Reste der
DNA U-Reste in dem RNA-Duplikat sind). Unter Verwendung geeigneter
Verfahren in eine Zelle eingeführt,
kann eine Antisense Nukleinsäure
die Expression des durch den Sense-Strang kodierten Gens unterdrücken. Antisense
Nukleinsäuren
können
durch Standardtechniken hergestellt werden.
-
Die
antisense-Nukleinsäure
kann gänzlich
oder teilweise komplementär
sein zu und kann hybridisieren mit einer Zielnukleinsäure, wobei
die Zielnukleinsäure
mit einer Nukleinsäure
mit der Sequenz des Komplements von SEQ ID Nr. 1 hybridisieren kann.
So kann beispielsweise die antisense-Nukleinsäure komplementär zu einer
Ziel-Nukleinsäure
sein, die die Sequenz von SEQ ID Nr. 1 oder einem Abschnitt davon
aufweicht, der ausreichend ist, um eine Hybridisierung zu ermöglichen.
Die antisense-Nukleinsäure
kann gänzlich oder
teilweise komplementär
sein zu und kann hybridisieren mit einer Zielnukleinsäure, die
einen Säuger-CXCR3-Rezeptor
(beispielsweise humanen IP-10/Mig-Rezeptor CXCR3) kodiert.
-
Die
antisense-Nukleinsäuren
können
für eine
Vielzahl von Zwecken verwendet werden, umfassend Forschung und therapeutische
Anwendungen. So kann beispielsweise ein eine antisense-Nukleinsäure umfassendes
Konstrukt in eine geeignete Zelle eingeführt werden, um eine Rezeptor-Expression
zu inhibieren. Eine derartige Zelle stellt eine nützliche
Kontrollzelle bereit, um beispielsweise die Spezifität einer
Rezeptor-Liganden-Wechselwirkung mit der Elternzelle oder anderen
verwandten Zelltypen zu bestimmen. Ein derartiges Konstrukt kann
in einige oder alle der Zellen eines Säugetiers eingeführt werden.
Die antisense-Nukleinsäure inhibiert
bzw. unterdrückt
eine Expression eines Rezeptors, und wobei in den Zellen, die das
Konstrukt enthalten, entzündliche
Prozesse, die durch CXCR3-Rezeptoren vermittelt werden, unterdrückt werden
können.
Somit kann eine entzündliche
Erkrankung oder ein entzündlicher
Zustand durch Verwendung einer antisense-Nukleinsäure behandelt
werden. Geeignete Labortiere, die ein antisense-Konstrukt beinhalten,
können
weiter nützliche
Modelle für
Mängel
einer Leukozyten-Funktion und insbesondere für einen Mängel einer aktivierten T-Lymphozyte
bereitstellen und können
weitere Informationen bezüglich
einer CXCR3-Rezeptor-Funktion liefern. Derartige Tiere können nützliche
Modelle für
Infektionserkrankungen oder Krebs bereitstellen, die zur Aufklärung der
Rolle der Leukozyten, wie T-Lymphozyten und NK-Zellen, in den Abwehrkräften des
Wirts nützlich sind.
-
Verfahren zur Herstellung rekombinanter
Proteine
-
Lediglich
zur Erklärung
wird hier ein Verfahren zum Erzeugen eines Säuger-CXCR3-Proteins oder einer Variante (beispielsweise
einem Abschnitt) davon beschrieben. Rekombinantes Protein kann beispielsweise
durch die Expression eines rekombinanten Nukleinsäuremoleküls (beispielsweise
DNA) erhalten werden, das ein Säuger-CXCR3
oder eine Variante davon beispielsweise in einer geeigneten Wirtszelle
kodiert.
-
Es
werden weiter Konstrukte (beispielsweise Expressionsvektoren) beschrieben,
die für
die Expression eines Säuger-CXCR3-Proteins
oder einer Variante davon geeignet sind. Die Konstrukte können in
eine geeignete Wirtszelle eingeführt
werden, wobei Zellen, die ein rekombinantes Säuger-CXCR3-Protein oder eine Variante
davon exprimieren, erzeugt und in Kultur gehalten werden können. Derartige
Zellen können
für eine Vielzahl
von Zwecken verwendet werden, beispielsweise umfassend einer Verwendung
in der Erzeugung von Protein zur Charakterisierung, Isolierung und/oder
Reinigung (beispielsweise Affinitätsreinigung), Verwendung als
Immunogen und in Bindungsassays oder anderen funktionalen Assays
(beispielsweise um nach Liganden, Inhibitoren und/oder Promotoren
der Rezeptor-Funktion zu durchmustern. Geeignete Wirtszellen können prokaryotisch
sein, umfassend Bakterienzellen wie E. coli, B. subtilis und oder
andere geeignete Bakterien, oder eukaryotisch sein, wie pilzliche
Zellen oder Hefezellen (beispielsweise Pichia pastoris, Aspergillus
species, Saccharomyces cerevisiae, Schizosaccharomyces pombe, Neurospora
crassa) oder andere Zellen niedriger Eukaryonten und Zellen höherer Eukaryonten,
wie solche von Insekten (beispielsweise Sf9-Insektenzellen (
WO 94/26087 , O'Connor, veröffentlicht
am 24. November 1994) oder von Säugern
(beispielsweise Chinese Hamster Ovary Zellen (CHO), COS-Zellen,
Hut 78-Zellen, 293-Zellen). (Siehe beispielsweise Ausubel, F. M.
et al., Herausgeber, 1993, Current Protocols in Molecular Biology,
Greene Publishing Associates und John Wiley & Söhne Inc.).
-
Wirtszellen,
die ein rekombinantes Säuger-CXCR3-Protein
oder eine Variante davon erzeugen, können wie folgt hergestellt
werden. So kann beispielsweise eine Nukleinsäure, die die gesamte kodierende
Sequenz für
das gewünschte
Protein oder einen Teil kodiert, in einen Nukleinsäurevektor
eingefügt
werden, wie beispielsweise einen DNA-Vektor, wie ein Plasmid, einen
Virus oder ein anderes geeignetes Replikon zur Expression. Es ist
eine Vielzahl an Vektoren verfügbar,
umfassend Vektoren, die in einfacher Kopie oder in Mehrfachkopie
beibehalten werden können,
oder die in ein Chromosom der Wirtszelle integriert werden.
-
Zur
Steuerung der Expression können
Transkriptions- und/oder Translationssignale eines Säuger-CXCR3-Gens
verwendet werden. Geeignete Expressionsvektoren für die Expression
einer Nukleinsäure, die
die gesamte kodierende Sequenz für
das gewünschte
Protein oder einen Teil kodiert, sind ebenfalls verfügbar. Geeignete
Expressionsvektoren können
mehrere Komponenten enthalten, die umfassen, jedoch nicht beschränkt sind
auf eines oder mehrere der folgenden: einen Replikationsursprung,
ein Gen für
einen Selektionsmarker, ein oder mehrere Expressionssteuerelemente,
wie ein Steuerelement der Transkription (beispielsweise einen Promotor,
einen Enhancer, einen Terminator) und/oder ein oder mehrere Translationssignale,
eine Signalsequenz oder Leader-Sequenz zum Membran-Targeting in
einer ausgewählten
Wirtszelle (mit beispielsweise Säugerursprung
oder von einem heterologen Säuger
oder einer Nicht-Säuger-Spezies).
So kann in einem Konstrukt eine Signalsequenz durch den Vektor,
die Säuger-CXCR3
kodierende Sequenz oder eine andere Quelle bereitgestellt werden.
Diese Elemente können
ebenfalls von Sequenzen bereitgestellt werden, die an einer Integrationsstelle
vorliegen.
-
Zur
Expression in einer geeigneten Wirtszelle kann ein Promotor bereitgestellt
werden. Die Promotoren können
konstitutiv oder induzierbar sein. So kann beispielsweise ein Promotor
mit einer Nukleinsäure
funktionsfähig
verknüpft
sein, die das Säuger-CXCR3-Protein
oder eine Variante davon kodiert, so dass er die Expression des
kodierten Polypeptides lenkt. Es ist eine Vielzahl an geeigneten
Promotoren für
prokaryotische (beispielsweise lac-, tac-, T3-, T7-Promotoren für E. coli)
und eukaryotische (beispielsweise Alkoholdehydrogenase der Hefe
(ADH1), SV40, CMV) Wirtszellen verfügbar.
-
Zusätzlich umfassen
die Expressionsvektoren üblicherweise
einen Selektionsmarker, um den Vektor tragende Wirtszellen selektionieren
zu können
und im Falle eines replizierbaren Expressionvektors einen Replikationsursprung. Übliche Selektionsmarker
sind Gene, die Produkte kodieren, die eine Antibiotika- oder Arzneimittel-Resistenz
verleihen, wobei sie in prokaryotischen (beispielsweise β-Lactamase-Gen
(Ampicillin-Resistenz), Tet-Gen für eine Tetracyclin-Resistenz)
und eukaryotischen Zellen (beispielsweise Neomycin (G418 oder Geneticin)-,
gpt (Mycophenolsäure)-,
Ampicillin- oder Hygromycin-Resistenzgene) verwendet werden können. Dihydrofolatreduktase-Marker-Gene
ermöglichen
in einer Vielzahl von Wirten eine Selektion mit Methotrexat. In
Hefe werden oftmals Gene, die das Genprodukt von auxotrophen Markern
des Wirts (beispielsweise LEU2, URA3, HIS3) kodieren, als Selektionsmarker
bzw. selektionierbare Marker verwendet. Klar ist, dass virale (beispielsweise
Baculovirus) oder Phagen-Vektoren und Vektoren, die in das Genom
der Wirtszelle integrieren können,
wie retrovirale Vektoren, ebenfalls in Betracht gezogen sind. Zellen,
die diese Expressionsvektoren tragen werden hier ebenfalls beschrieben.
-
So
kann beispielsweise eine Nukleinsäure, die Säuger-CXCR3-Protein oder eine
Variante davon kodiert, oder ein Konstrukt, das eine derartige Nukleinsäure umfasst,
in eine geeignete Wirtszelle eingeführt werden, wobei ein Verfahren
verwendet wird, das für
die ausgewählte
Wirtszelle passend ist (beispielsweise Transformation, Transfektion,
Elektroporation, Infektion), so dass die Nukleinsäure funktionsfähig an ein
oder mehrere Expressionssteuerelemente gekoppelt ist (beispielsweise
in einem Vektor, in einem Konstrukt, das durch Prozesse in der Zelle
erzeugt wird, integriert in das Genom der Wirtszelle). Wirtszellen
können
unter Bedingungen gehalten werden, die für eine Expression geeignet
sind (beispielsweise in der Gegenwart eines Induktors (inducer),
mit passenden Salzen, Wachstumsfaktoren, Antibiotika, Nahrstoffergänzungen
etc. ergänzten
Medien), wobei das kodierte Polypeptid hergestellt wird. Falls gewünscht, kann
das kodierte Protein (beispielsweise humanes CXCR3) isoliert werden
(beispielsweise von den Wirtszellen, dem Medium, der Milch). Es
ist klar, dass das Verfahren eine Expression in einer Wirtszelle
eines transgenen Tiers umfasst (siehe beispielsweise
WO 92/03918 , Genfharm International,
veröffentlicht
am 19. März
1992).
-
Auf
diese Art und Weise können
ebenfalls Fusionsproteine erzeugt werden. So können beispielsweise einige
Ausführungsformen
erzeugt werden durch die Insertion einer Säuger-CXCR3-Protein-cDNA oder eines Teils
davon in einen geeigneten Expressionsvektor, wie Bluescript® II
SK +/– (Stratagene),
pGEX-4T-2 (Pharmacia), pcDNA-3 (Invitrogen) oder pEP-15b (Novagen).
Das so erhaltene Konstrukt kann in eine geeignete Wirtszelle zur
Expression eingeführt
werden. Nach Expression kann das Fusionsprotein aus einem Zell-Lysat isoliert
oder gereinigt werden mittels einer geeigneten Affinitätsmatrix
(siehe beispielsweise Current Protocols in Molecular Biology (Ausubel,
F. M. et al., Herausgeber, 1991, Band 2, Suppl. 26, pp. 16.4.1–16.7.8).
Zusätzlich
stellen Affinitätsmarker
ein Mittel zum Nachweis eines Fusionsproteins bereit. So kann beispielsweise
die Expression an der Zelloberfläche
oder das Vorliegen in einer bestimmten Zellfraktion von einem Fusionsprotein,
das einen Antigen- oder Epitop-Affinitätsmarker umfasst, mittels eines
geeigneten Antikörpers
nachgewiesen werden.
-
Antikörper
-
Die
Erfindung betrifft Antikörper,
die mit einem Säuger-CXCR3-Protein
oder einem Abschnitt davon reagieren, wie in den anliegenden Ansprüchen definiert
ist. Die Antikörper
binden im Speziellen einen Säuger-CXCR3-Rezeptor,
der die Aminosäuresequenz
der SEQ ID Nr. 2 aufweist. In einer Ausführungsform werden Antikörper gegen
ein isoliertes und/oder rekombinantes Säuger-CXCR3-Protein oder einen
Abschnitt davon (beispielsweise ein Peptid) gerichtet oder gegen
eine Wirtszelle, die rekombinantes Säuger-CXCR3 exprimiert.
-
Die
erfindungsgemäßen Antikörper inhibieren
eine oder mehrere Funktionen, die für ein Säuger-CXCR3-Protein (beispielsweise
von einem Primaten, wie einem Menschen) kennzeichnend sind, wie
eine Bindungs-Aktivität,
eine Signalisierungs-Aktivität
und/oder eine Stimulierung einer zellulären Antwort. Die erfindungsgemäßen Antikörper inhibieren
ein Binden von IP-10 oder Mig (d.h. eines oder mehrerer Liganden)
an ein Säuger-CXCR3- Protein und/oder
können
eine oder mehrere Funktionen inhibieren, die durch ein Säuger-CXCR3-Protein als
Antwort auf das Binden eines Liganden vermittelt werden. So können beispielsweise, wie
hier gezeigt, erfindungsgemäße Antikörper die
Wechselwirkung eines humanen CXCR3-Proteins mit IP-10 selektiv inhibieren
und/oder Rezeptor-Funktionen als Antwort darauf selektiv inhibieren
(beispielsweise Signalisierungs-Aktivität und/oder eine zelluläre Antwort).
Ein als 1C6 bezeichneter Antikörper,
der diese Selektivität zeigt,
kann ein Binden von IP-10 an ein humanes CXCR3-Protein inhibieren,
sowie eine(n) durch IP-10 induzierte(n) Calcium-Fluss und Chemotaxis,
inhibiert jedoch einen durch Mig induzierten Calcium-Fluss unter
den gleichen Bedingungen nicht signifikant. Wie hier gezeigt, können zusätzliche
Antikörper
ein Binden von IP-10 an CXCR3 (beispielsweise 3A8, 2F8, 3A12, 3E2,
4B4, 4D2, 5B12, 7B8 und 8D5) oder eine IP-10 induzierte Chemotaxis
(beispielsweise 1A5, 3A8, 5F10 und 10C6) inhibieren, obwohl diese
Antikörper
unter den verwendeten Bedingungen eine Mig-induzierte Signalisierung
nicht inhibieren, was zeigt, dass sie ebenfalls selektive Inhibitoren
für die
Wechselwirkung eines humanen CXCR3-Proteins mit IP-10 und/oder von
Rezeptor-Funktionen als Antwort darauf sind.
-
In
einer besonders bevorzugten Ausführungsform
weisen die erfindungsgemäßen Antikörper eine Spezifität für ein humanes
CXCR3-Protein auf, und weisen noch mehr bevorzugt eine epitopische
Spezifität auf,
die gleich oder ähnlich
ist zu der eines mausartigen monoklonalen Antikörpers (mAb), der als 1C6 bezeichnet
ist. Antikörper,
die eine epitopische Spezifität
aufweisen, die gleich oder ähnlich
ist zu der von mAb 1C6 ist, können
durch Verwendung einer oder mehrerer geeigneter Techniken zur Charakterisierung
der epitopischen Spezifität
identifiziert werden. So können
beispielsweise Antikörper
mit einer epitopischen Spezifität,
die gleich oder ähnlich
zu der von mAb 1C6 ist durch ihre Fähigkeit identifiziert werden
mit dem mausartigen mAb 1C6 um ein Binden an ein humanes CXCR3-Protein
oder einen Abschnitt davon (beispielsweise an Zellen, die humanes
CXCR3 tragen, umfassend Lymphozyten, wie aktivierte T-Zellen, NK-Zellen
oder rekombinante Wirtzellen, die eine Nukleinsäure der vorliegenden Erfindung
umfassen) zu konkurrieren. In einer Ausführungsform sind Antikörper mit
einer Epitop-Spezifität,
die gleich oder ähnlich
zu der von mAb 1C6 ist, ferner gekennzeichnet durch die Fähigkeit,
dass ein Polypeptid mit einer Sequenz, die gleich ist zu der der
Reste 1–15
("P1") der SEQ ID Nr.
2, eine Bindung der Antikörper
an humanes CXCR3-Protein in einem geeigneten Assay unterdrückt (siehe
beispielsweise Beispiel 8). In einem Aspekt dieser Ausführungsform
wird ein Binden an ein humanes CXCR3-Protein durch derartige Antikörper nicht
signifikant unterdrückt
durch ein Polypeptid mit einer Sequenz, die gleich ist zu der der
Reste 16–30
("P2") oder 31–45 ("P3") von SEQ ID Nr.
2.
-
Andere,
durch die vorliegende Erfindung umfasste Antikörper betreffen Antikörper, die
an ein humanes CXCR3-Protein binden, wobei das Binden durch einen
Abschnitt der SEQ ID Nr. 2 unterdrückt werden kann, der dem N-terminalen,
extrazellulären
Segment oder einem Abschnitt davon entspricht. Geeignete Abschnitte des
N-terminalen, extrazellulären
Segments umfassen N-terminalen, interne oder C-terminale Abschnitte
des Segments, wie ein Polypeptid, das beispielsweise den N-Terminus
umfasst und eine Sequenz aufweist, die gleich ist zu der der Reste
1–30,
1–45 oder
1–58 von
SEQ ID Nr. 2, oder ein Polypeptid mit einer Sequenz, die gleich
ist zu der der Reste 16–30
oder 45–58
von SEQ ID Nr. 2. In einer bevorzugten Ausführungsform weisen derartige
Abschnitte "mindestens
ein immunologisches Merkmal" eines
Säuger-CXCR3-Proteins
auf, wie vorstehend erläutert,
wobei der Säuger
ein Mensch ist. So wurden beispielsweise Antikörper erhalten, die mit einem
humanen CXCR3-Protein reagieren, für die ein Binden durch ein
Polypeptid inhibiert werden kann, das eine Sequenz aufweist, die
gleich ist zu der der Reste 16–30
von SEQ ID Nr. 2 (Beispiel 9).
-
Die
erfindungsgemäßen Antikörper können polyklonal
oder monoklonal sein, und der Begriff Antikörper soll sowohl polyklonale
als auch monoklonale Antikörper
umfassen. Die Begriffe polyklonal und monoklonal beziehen sich auf
das Ausmaß der
Homogenität
einer Antikörper-Präparation
und sind nicht auf bestimmte Herstellungsverfahren beschränkt.
-
Erfindungsgemäße Antikörper können gegen
ein passendes bzw. geeignetes Immunogen gerichtet werden, umfassend
hier beschriebene Proteine oder Polypeptide, wie isoliertes und/oder
rekombinantes Säuger-CXCR3-Protein
oder ein Abschnitt davon (umfassend synthetische Moleküle, wie
synthetische Peptide). Zusätzlich
können
Zellen, die rekombinantes Säuger-CXCR3
exprimieren, wie transfizierte Zellen, als Immunogene oder zu einem
Durchmustern nach Antikörper
verwendet werden, der an Rezeptor bindet. Siehe beispielsweise Chuntharapai
et al., J. Immunol. 152 (1994), 1783–1789 und Chuntharapai et al.,
US-P-5,440,021 .
-
Eine
Präparation
eines immunisierenden Antigens und die Herstellung polyklonaler
und monoklonaler Antikörper
kann durch Verwendung einer beliebigen geeigneten Technik durchgeführt werden.
Es ist eine Vielzahl von Verfahren beschrieben (siehe beispielsweise
Kohler et al., Nature 256 (1975), 495–497 und Eur. J. Immunol. 6
(1976), 511–519;
Milstein et al., Nature 266 (1977), 550–552; Koprowski et al.,
US-P-4,172,124 ; Harlow,
E. und D. Lane, 1988, Antibodies: A Laborstory Manual, (Cold Spring
Harbor Laborstory: Cold Spring Harbor, NY); Current Protocols In
Molecular Biology, Band 2 (Supplement 27, Sommer 94), Ausubel, F.
M. et al., Herausgeber, (John Wiley & Söhne: New York, NY), Kapitel
11, (1991)). Im Allgemeinen kann ein Hybridom erzeugt werden, indem
eine geeignete, unsterbliche Zell-Linie (beispielsweise eine Myelom-Zell-Linie
wie SP2/0) mit Antikörper
erzeugenden Zellen fusioniert wird. Die Antikörper erzeugenden Zelle, vorzugsweise
solche aus der Milz oder den Lymphknoten, kann aus Tieren erhalten
werden, die mit dem interessierenden Antigen immunisiert wurden.
Die fusionierten Zellen (Hybridome) können durch Verwendung selektiver
Kulturbedingungen isoliert und durch begrenzende Verdünnung kloniert
werden. Zellen, die Antikörper
mit der gewünschten
Spezifität
erzeugen, können
mit einem geeigneten Assay (beispielsweise ELISA) ausgewählt werden.
-
Es
können
andere geeignete Verfahren zum Erzeugen oder Isolieren von Antikörpern mit
der erforderlichen Spezifität
verwendet werden, umfassend beispielsweise Verfahren, die rekombinante
Antikörper
aus einer Bank auswählen
oder die auf einer Immunisierung von transgenen Tieren (beispielsweise
Mäusen)
beruhen, die ein volles Repertoir an humanen Antikörpern erzeugen
können
(siehe beispielsweise Jakobovits et al., Proc. Natl. Acad. Sci.
USA 90 (1993), 2551–2555;
Jakobovits et al., Nature 362 (1993), 255–258; Lonberg et al.,
US-P-5,545,806 ; Surani et
al.,
US-P-5,545,807 ).
-
In
der vorliegenden Erfindung und dem Begriff "Antikörper" sind ebenfalls Einzelketten-Antikörper und chimäre, humanisierte
oder primatisierte (CDR-grafted) oder funierte (veneered) Antikörper sowie
chimäre, CDR-grafted
oder funierte Einzelketten-Antikörper,
die Abschnitte umfassen, die von verschiedenen Spezies abgeleitet
sind, und dergleichen umfasst. Die verschiedenen Abschnitte dieser
Antikörper
können
durch herkömmliche
Techniken chemisch miteinander verbunden werden, oder es kann/können (ein)
Polypeptid(e) als ein aufeinanderfolgendes Protein hergestellt werden,
wobei gentechnologische Methoden verwendet werden. Der Begriff "humanisierter Antikörper oder
Immunoglobulin" betrifft,
wie hier verwendet, einen Antikörper
oder ein Immunoglobulin, der/das Abschnitte von Immunoglobulinen
mit verschiedenem Ursprung umfasst, wobei mindestens ein Abschnitt
humanen Ursprungs ist. Entsprechend betrifft die vorliegende Erfindung
einen humanisierten Antikörper
(umfassend Antigen bindender Fragmente davon), der eine Bindungsspezifität für ein Säuger-CXCR3-Protein
(beispielsweise humanes CXCR3-Protein) aufweist, wobei Antigen bindende
Regionen mit nicht-humanen Ursprung (beispielsweise Nager) umfasst
sind und mindestens ein Abschnitt eines Immunoglobulins mit humanen
Ursprung (beispielsweise eine humane Rahmenregion, eine humane konstante Region
oder Abschnitte davon). So können
beispielsweise humanisierte Antikörper Abschnitte umfassen, die von
einem Immunglobulin mit nicht-humanem Ursprung mit der erforderlichen
Spezifität
abgeleitet sind (beispielsweise eine nicht-humane variable Region
der Maus) und von Immunglobulin-Sequenzen mit humanem Ursprung (beispielsweise
einer humanen konstanten Region oder ein Abschnitt davon), die chemisch
aneinander verbunden sind oder als ein aufeinanderfolgendes Polypeptid
durch Verwendung von gentechnologischen Techniken hergestellt werden.
Ein anderes Beispiel eines erfindungsgemäßen humanisierten Antikörpers ist
ein Immunoglobulin, das eine oder mehrere Immunoglobulinketten umfasst,
wobei das Immunoglobulin ein CDR mit nicht-humanen Ursprung (beispielsweise
ein oder mehrere CDRs, die von einem Antikörper mit nicht-humanem Ursprung
abgeleitet sind) und eine Rahmenregion umfasst, die von einer leichten
und/oder schweren Kette mit humanem Ursprung abgeleitet ist (beispielsweise
CDR-gepfropfte (CDR-grafted) Antikörper mit oder ohne Rahmenänderungen).
In einem Aspekt dieser Erfindung umfasst das Immunoglobulin die CDRs
der leichten Kette (CDR1, CDR2 und CDR3) und CDRs der schweren Kette
(CDR1, CDR2, CDR3) eines nicht-humanen Immunoglobulins. In einer
Ausführungsform
weist das humanisierte Immunoglobulin eine epitopische Spezifität auf, die
gleich oder ähnlich
zu der von mAB 1C6 ist. In einer bevorzugten Ausführungsform ist
die Antigen bindende Region des humanisierten Immunoglobulins von
mAb 1C6 abgeleitet. Der Begriff humanisierter Antikörper umfasst
ebenfalls Einzelketten-Antikörper.
Siehe beispielsweise Cabilly et al.,
US-P-4,816,567 ;
Cabilly et al.,
EP
0 125 023 B1 ; Boss et al.,
US-P-4,816,397 ;
Boss et al.,
EP 0 120
694 B1 ; Neuberger, M. S. et al.,
WO 86/01533 ; Neuberger, M. S. et al.,
EP 0 194 276 B1 ;
Winter,
US-P-5,225,539 ;
Winter,
EP 0 239 400
B1 ; Queen et al.,
EP
0 451 216 B1 ; und Padlan, E. A. et al.,
EP 0 519 596 A1 . Siehe ebenfalls Newman,
R. et al., BioTechnology 10 (1992), 1455–1460, in Bezug auf primanisierte
Antikörper
und Ladner et al.,
US-P-4,946,778 und
Bird, R. E. et al., Science 242 (1988), 423–426 in Bezug auf Einzelketten-Antikörper.
-
Weiter
können
funktionale Fragmente von Antikörpern
erzeugt werden, umfassend Fragmente von chimären, humanisierten oder primatisierten,
funierten oder Einzelketten-Antikörpern. Funktionale
Fragmente der vorstehend aufgeführten
Antikörper
behalten mindestens eine Bindungsfunktion und/oder Modulationsfunktion
des Volllängen-Antikörpers bei,
von dem sie abgeleitet sind. So umfasst die Erfindung beispielsweise Antikörper-Fragmente,
die an Säuger-CXCR3-Protein
oder einen Abschnitt davon binden können, umfassend, jedoch nicht
beschränkt
auf Fv-, Fab-, Fab'-
und F(ab')2-Fragmente. Derartige Fragmente können durch
enzymatische Spaltung oder durch Rekombinationstechniken erzeugt
werden. So kann beispielsweise eine Papain- oder Pepsin-Spaltung
Fab- bzw. F(ab')2-Fragmente hervorbringen. Antikörper können ebenfalls
in einer Vielzahl von gekürzten
Formen erzeugt werden, wobei Antikörper-Gene verwendet werden,
in denen ein oder mehrere Stopp-Codons stromaufwärts der natürlichen Stopp-Stelle eingeführt wurden.
So kann beispielsweise ein chimeres Gen aufgebaut werden, das einen
F(ab')2-Abschnitt
der schwere Kette kodiert, um eine DNA-Sequenz zu umfassen, die
die CH1-Domäne und Gelenk-Region der schweren
Kette kodiert.
-
Die
erfindungsgemäßen Antikörper können in
einer Vielzahl von Anwendungen verwendet werden, umfassend Forschung,
diagnostische und therapeutische Anwendungen. So können sie
beispielsweise verwendet werden, um Rezeptoren oder Abschnitte davon
zu isolieren, reinigen und/oder nachzuweisen und um Struktur (beispielsweise
Konformation) und Funktion eines Rezeptors zu untersuchen.
-
Die
erfindungsgemäßen Antikörper können weiter
verwendet werden, um in der Forschung und in therapeutischen Anwendungen
eine Rezeptor-Funktion zu modulieren. So können Antikörper beispielsweise als Inhibitoren
wirken, um (a) ein Binden (beispielsweise eines Liganden, eines
zweiten Inhibitors oder eines Promotors) an den Rezeptor, (b) eine
Rezeptor-Signalisierung und/oder (c) eine zelluläre Antwort zu inhibieren (verringern
oder verhindern). Antikörper,
die als Inhibitoren der Rezeptor-Funktion wirken, können das
Binden eines Liganden oder Promotors direkt oder indirekt blockieren
(beispielsweise indem sie eine Konformationsänderung in dem Rezeptor verursachen).
So können
beispielsweise Antikörper
eine Rezeptor-Funktion inhibieren, indem sie ein Binden eines Liganden
inhibieren, oder durch Desensibilisierung (mit oder ohne Inhibierung
des Bindens eines Liganden). Erfindungsgemäßen Antikörper können als Antagonisten von Effektorzellen,
wie aktivierte oder stimulierte T-Lymphozyten und natürliche Killer-Zellen
(HK-Zellen) verwendet werden, und finden eine Verwendung in Verfahren
einer Therapie (umfassend einer Prophylaxe) von Erkrankungen oder
Zuständen,
die mit Inhibitoren einer CXCR3-Funktion, wie hier beschrieben,
behandelt werden können. Antikörper, die
die Wechselwirkung eines humanen CXCR3-Proteins mit IP-10 selektiv
inhibieren können und/oder
Rezeptor-Funktionen als Antwort darauf selektiv inhibieren können (beispielsweise
mAb 1C6, Antikörper
mit einer Epitop-Spezifität,
die gleich ist zu der von mAb 1C6), sind insbesondere nützlich in
der Behandlung von Erkrankungen oder Störungen, die durch Wechselwirkungen
von IP-10 und CXCR3 vermittelt werden. So sind beispielsweise entzündliche
Erkrankungen, wie Psoriasis, entzündliche Darmerkrankung, Nephritis
und Multiple Sklerose, insbesondere für eine Therapie zugänglich.
-
Überraschenderweise
inhibiert mAb 1C6 eine T-Zell-Aktivierung, wie in einer gemischten
Lymphozyten-Reaktion (MLR) bestimmt wurde. Entsprechend können mAb
1C6 und andere anti-CXCR3-Antikörper,
die eine T-Zell-Aktivierung inhibieren können, verwendet werden, um
eine T-Zell-Aktivierung und (eine) Funktion(en), die mit der Aktivierung
assoziiert ist/sind, wie Cytokin-Produktion, cytotoxisches T-Zell-Töten und/oder Bereitstellung
einer T-Zellen-Hilfe, zu inhibieren. Bei Verwendung in Verfahren
zur Therapie oder Prophylaxe, wie hier beschrieben, können derartige
Antikörper
den zusätzlichen
Vorteil einer Inhibierung einer weiteren T-Zell-Aktivierung aufweisen.
Derartige Antikörper
sind insbesondere attraktiv als therapeutische Agenzien zur Behandlung
von Gewebeabstoßung
(beispielsweise bei Transplantationen), umfassend allogene Gewebe- bzw.
Transplantatabstoßung
oder Transplantat-gegen-Wirt-Erkrankung, oder anderen Erkrankungen
oder Bedingungen, bei denen eine Inhibierung der Aktivierung von
T-Zellen wünschenswert
ist.
-
Antikörper, die
Rezeptor binden, können
weiter als Agonisten einer Rezeptor-Funktion wirken, wobei sie eine
Rezeptor-Funktion nach Binden an einen Rezeptor auslösen oder
stimulieren, wie eine Signalisierung und/oder eine zelluläre Antwort
(beispielsweise Calcium-Fluss, Chemotaxis, Exocytose oder pro-entzündliche Mediator-Freisetzung).
Entsprechend können
derartige Antikörper
als Agonisten von Effektor-Zellen, wie aktivierte oder stimulierte
T-Lymphozyten und natürliche
Killer-Zellen (NK-Zellen) verwendet werden, und finden eine Verwendung
in Verfahren einer Therapie (umfassend einer Prophylaxe) von Erkrankungen
oder Zuständen,
die mit Promotoren einer CXCR3-Funktion, wie hier beschrieben, behandelt
werden können.
-
Zusätzlich können die
verschiedenen, erfindungsgemäßen Antikörper verwendet
werden, um die Rezeptor-Expression nachzuweisen oder zu erfassen,
beispielsweise auf Leukozyten, wie aktivierte T-Zellen oder natürliche Killer-Zellen
(NK-Zellen), oder auf Zellen, die mit einem Rezeptor-Gen transfiziert
wurden. Somit finden sie ebenfalls eine Verwendung in Anwendungen,
wie Zell-Sortierung (beispielsweise Strömungs-Zytometrie, Fluoreszenz-aktiviertes
Zell-Sortieren) für
diagnostische Zwecke und Forschungszwecke.
-
Es
werden weiter anti-idiotypische Antikörper bereitgestellt. Anti-idiotypische
Antikörper
erkennen Antigen-Determinanten, die mit der Antigen bindenden Stelle
eines anderen Antikörpers
assoziiert sind. Anti-idiotypische Antikörper können gegen einen ersten Antikörper erzeugt
werden, indem ein Tier der gleichen Spezies und vorzugsweise des
gleichen Stamms wie das Tiers, das zum Erzeugen des ersten Antikörpers verwendet
wurde, mit dem ersten Antikörper
immunisiert wird. Siehe beispielsweise
US-P-4,699,880 .
-
In
einer Ausführungsform
werden Antikörper
gegen einen Rezeptor oder einen Teil davon gerichtet, wobei diese
Antikörper
wiederum als Immunogen verwendet werden, um einen anti-idiotypischen
Antikörper zu
erzeugen. Der dadurch erzeugte anti-Id kann einen Rezeptor nachahmen
und Verbindungen binden, die ein Rezeptor bindet, wie Liganden,
Inhibitoren oder Promotoren der Rezeptor-Funktion, und kann in einem
Immunoassay verwendet werden, um derartige Verbindungen nachzuweisen,
zu identifizieren oder zu quantifizieren. Ein derartiger anti-idiotypische
Antikörper
kann ebenfalls ein Inhibitor einer Rezeptor-Funktion sein, obwohl
er einen Rezeptor selbst nicht bindet.
-
Eine
anti-idiotypische Antikörper
(d.h. Anti-Id) selbst kann verwendet werden, um einen anti-idiotypische
Antikörper
(d.h. Anti-anti-Id) zu erzeugen. Ein derartiger Antikörper kann
in der Spezifität ähnlich oder identisch
mit dem ursprünglich
immunisierenden Antikörper
sein. In einer Ausführungsform
können
Antikörper-Antagonisten
verwendet werden, die ein Binden an einen Rezeptor blockieren, um
Anti-Id zu erzeugen, wobei der Anti-Id verwendet werden kann einen
Anti-anti-Id zu erzeugen, der eine Spezifität aufweisen kann, die ähnlich oder
identisch mit der des Antikörper-Antagonisten
ist. Diese anti-anti-Id- Antikörper können hinsichtlich
einer inhibitorischen Wirkung auf eine Rezeptor-Funktion bewertet
werden, um zu bestimmen, ob sie Antagonisten sind.
-
Es
können
Einzelketten-, chimäre,
humanisierte, primatisierte (CDR-gepfropfte), funierte (veneered) Antikörper, sowie
chimäre,
CDR-gepfropfte oder funierte Einzelketten-anti-idiotypische Antikörper erzeugt
werden, wobei diese von dem Begriff anti-idiotypischer Antikörper umfasst
sind. Es können
weiter Antikörper-Fragmente
derartiger Antikörper
hergestellt werden.
-
Die
erfindungsgemäßen Antikörper und
Fragmente können
modifiziert werden, beispielsweise durch Inkorporation von oder
durch Anfügen
(direkt oder indirekt) von eines nachweisbaren Markers, wie eines
Radioisotops, eines Spin-Markers, eines Antigen- oder Enzym-Markers,
einer fluoreszierenden oder chemolumineszierenden Gruppe und dergleichen,
wobei derartige modifizierte Formen im Umfang der Erfindung umfasst sind.
-
Identifizierung von Liganden, Inhibitoren
oder Promotoren einer Rezeptor-Funktion
-
Wie
hier verwendet, ist ein Ligand eine Substanz, die an ein Rezeptorprotein
bindet. Ein Ligand eines ausgewählten
Säuger-CXCR3-Proteins
ist eine Substanz, die an ein ausgewähltes Säuger-CXCR3-Protein bindet.
In einer bevorzugten Ausführungsform
erfolgt das Binden eines Liganden an ein Säuger-CXCR3-Protein mit hoher
Affinität.
Der Begriff Ligand betrifft Substanzen, die umfassen, jedoch nicht
beschränkt
sind auf einen natürlichen
Liganden, ob isoliert und/oder gereinigt, synthetisch und/oder rekombinant,
ein Homolog eines natürlichen
Liganden (beispielsweise von einem anderen Säuger), Antikörper, Abschnitte
derartiger Moleküle
und andere Substanzen, die einen Rezeptor binden. Ein natürlicher
Ligand eines ausgewählten
Säuger-Rezeptors
kann unter physiologischen Bedingungen an den Rezeptor binden und
stammt von dem gleichen Säuger
ab, wie das Säuger-CXCR3-Protein.
Der Begriff Ligand umfasst Substanzen, die Inhibitoren oder Promotoren
einer Rezeptor-Aktivität
sind, sowie Substanzen, die selektiv an einen Rezeptor binden, denen
jedoch eine Inhibitor- oder Promotor-Aktivität fehlt.
-
Wie
hier verwendet, ist ein Inhibitor eine Substanz, die mindestens
eine Funktion inhibiert, die kennzeichnend für ein Säuger-CXCR3-Protein (beispielsweise
ein humanes CXCR3) ist, wie eine Bindungs-Aktivität (beispielsweise
Binden eines Liganden, Binden eines Promotors), eine Signalisierungs-Aktivität (beispielsweise
Aktivierung eines Säuger-G-Proteins, Induktion
eines schnellen und transienten Anstiegs der Konzentration an im
Cytosol frei vorkommenden Calcium [Ca2+]i) und/oder eine zelluläre Antwortfunktion (beispielsweise
Stimulierung einer Chemotaxis, Exozytose oder Freisetzung von Entzündungsmediator
durch Leukozyten). Der Begriff Inhibitor betrifft Substanzen, die
Antagonisten umfassen, die einen Rezeptor binden (beispielsweise
ein Antikörper,
ein Mutant eines natürlichen
Liganden oder kompetitive Inhibitoren eines Bindens eines Liganden)
und Substanzen, die eine Rezeptor-Funktion inhibieren ohne daran
zu binden (beispielsweise ein anti-idiotypischer Antikörper).
-
Wie
hier verwendet, ist ein Promotor eine Substanz, die mindestens eine
für ein
Säuger-CXCR3-Protein (beispielsweise
ein humanes CXCR3) kennzeichnende Funktion fördert (induziert oder verstärkt), wie
eine Bindungsaktivität
(beispielsweise Binden eines Liganden, Inhibitors und/oder Promotors),
eine Signalisierungs-Aktivität
(beispielsweise Aktivierung eines Säuger-G-Proteins, Induktion
eines schnellen und transienten Anstiegs der Konzentration an im
Cytosol frei vorkommenden Calcium [Ca2+]i) und/oder eine zelluläre Antwortfunktion (beispielsweise
Stimulierung einer Chemotaxis, Exocytose oder Freisetzung von Entzündungsmediator
durch Leukozyten). Der Begriff Promotor betrifft Substanzen, die
Agonisten umfassen, die einen Rezeptor binden (beispielsweise einen
Antikörper,
ein Homolog eines natürlichen
Liganden von einer anderen Spezies) und Substanzen, die eine Rezeptor-Funktion
fördern
ohne daran zu binden (beispielsweise durch Aktivieren eines assoziierten
Proteins). In einer bevorzugten Ausführungsform ist der Agonist
kein Homolog eines natürlichen
Liganden. Die nachstehend beschriebenen Assays, die auf hier beschriebene
Nukleinsäuren
und Proteine beruhen, können
alleine oder in Kombination miteinander oder mit anderen geeigneten
Verfahren verwendet werden, um Liganden, Inhibitoren oder Promotoren
eines Säuger-CXCR3-Proteins
oder eine Variante zu identifizieren. In vitro Verfahren können angepasst
werden für
ein Durchmustern im Hochdurchsatz, wobei große Probenzahlen abgearbeitet
werden (beispielsweise ein 96-Well-Format). Wirtszellen, die eine
erfindungsgemäße Nukleinsäure umfassen
und rekombinantes Säuger-CXCR3
(beispielsweise humanes CXCR3) in einer Höhe exprimieren, die für ein Durchmustern
im Hochdurchsatz geeignet ist, können
verwendet werden und sind somit insbesondere zur Identifizierung
und/oder Isolierung von Liganden, Inhibitoren und Promotoren von
Säuger-CXCR3-Proteinen
nützlich. Eine
Expression eines Rezeptors kann auf eine Vielzahl von Wegen beobachtet
werden. So kann eine Expression beispielsweise durch Verwendung
von erfindungsgemäßen Antikörpern beobachtet
werden, die einen Rezeptor oder einen Abschnitt davon binden. Es
können
ebenfalls im Handel verfügbare
Antikörper
verwendet werden, um eine Expression eines Antigen- oder Epitop-markierten Fusionsproteins
nachzuweisen, das ein Rezeptor-Protein oder -Polypeptid umfasst
(beispielsweise FLAG-markierte Rezeptoren (FLAG tagged receptors),
und es können
Zellen ausgewählt
werden, die gewünschte
Spiegel exprimieren.
-
Eine
Nukleinsäure,
die ein Säuger-CXCR3-Protein
kodiert, kann, wie vorstehend beschrieben, in ein Expressionssystem
inkorporiert werden, um ein Rezeptor-Protein oder – Polypeptid
zu erzeugen. In Tests für eine
Rezeptor-Funktion kann ein isoliertes und/oder rekombinantes Rezeptor-Protein
oder -Polypeptid, wie ein Rezeptor, der in Zellen exprimiert wird,
die stabil oder transient mit einem eine erfindungsgemäße Nukleinsäure umfassenden
Konstrukt transfiziert sind, oder eine Rezeptor-enthaltenden Zellfraktion
(beispielsweise eine Membranfraktion von transfizierten Zellen,
Rezeptor-inkorporierende Liposomen) verwendet werden. Falls gewünscht, kann
der Rezeptor weiter gereinigt werden. Ein Testen der Rezeptor-Funktion
kann in vitro oder in vivo durchgeführt werden.
-
Ein
isoliertes und/oder rekombinantes Säuger-CXCR3-Protein, wie ein
humanes CXCR3, wie in 2 (SEQ ID Nr. 2) gezeigt, kann
in dem vorliegenden Verfahren, in dem die Wirkung einer Verbindung
durch Beobachten einer Rezeptor-Funktion, wie hier beschrieben,
oder durch Verwenden anderer geeigneter Techniken bewertet wird.
So können
beispielsweise in Bindungsassays stabile oder transiente Transfektanten
verwendet werden, wie solche, die in Beispiel 2 beschrieben sind
oder andere geeignete Zellen (beispielsweise mit Baculovirus infizierte
Sf9-Zellen), stabile Transfektanten von L1-2 pre-B-Zellen der Maus
(abgeleitet von einem pre-B-Lymphom, Dr. Eugene Butcher (Stanford
University, Stanford, CA)). In Chemotaxis-Assays können beispielsweise
stabile Transfektanten von Jurkat-Zellen (Beispiel 2) oder von anderen
geeigneten Zellen, die zur Chemotaxis befähigt sind (beispielsweise L1-2
pre-B-Zellen der Maus), verwendet werden.
-
Gemäß des erfindungsgemäßen Verfahrens
können
Verbindungen individuell durchmustert werden oder es können eine
oder mehrere Verbindungen gemäß der hier
aufgeführten
Verfahren gleichzeitig getestet werden. Wird ein Gemisch an Verbindungen
getestet, können
die durch die beschriebenen Prozesse ausgewählten Verbindungen getrennt werden
(wie angebracht) und durch geeignete Verfahren (beispielsweise PCR, Sequenzieren,
Chromatographie) identifiziert werden. Gemäß dieser Verfahren kann das
Vorliegen von einer oder mehrerer Verbindungen (beispielsweise eines
Liganden, Inhibitors, Promotors) in einer Testprobe ebenfalls bestimmt
werden.
-
Es
können
große
kombinatorische Banken von Verbindungen (beispielsweise organische
Verbindungen, rekombinante oder synthetische Peptide, "Peptoide", Nukleinsäuren), die
durch kombinatorische chemische Synthese oder andere Verfahren erzeugt
wurden, getestet werden (siehe Zuckerman, R. N. et al., J. Med. Chem.
37 (1994), 2678–2685
und dort zitierte Quellen; siehe ebenfalls Ohlmeyer, M. H. J. et
al., Proc. Natl. Acad. Sci. USA 90 (1993), 10922–10926 und DeWitt, S. H. et
al., Proc. Natl. Acad. Sci. USA 90 (1993), 6909–6913, bezüglich markierter Verbindungen;
Rutter, W. J. et al.
US-P-5,010,175 ;
Huebner, V. D. et al.,
US-P-5,182,366 ;
und Geysen, H. M.,
US-P-4,833,092 ).
Werden durch das vorliegende Verfahren Verbindungen aus seiner kombinatorischen
Bank ausgewählt,
die einzigartige Markierungen bzw. Tags tragen, ist durch chromatographische
Verfahren eine Identifizierung von individuellen Verbindungen möglich.
-
In
einer Ausführungsform
wird ein Phagen-Display-Verfahren verwendet. So kann beispielsweise
ein Rezeptor mit einem Phagen in Kontakt gebracht werden (beispielsweise
einem Phagen oder einer Sammlung von Phagen, wie einer Bank), der/die
ein Polypeptid unter für
ein Binden eines Rezeptors passenden Bedingungen (beispielsweise
in einem geeigneten Bindungspuffer) präsentierten. Ein Phage, der
an einen Rezeptor gebunden ist, kann durch Verwendung von Standardtechniken
oder anderer geeigneter Verfahren ausgewählt werden. Ein Phage kann
vom Rezeptor durch Verwendung eines geeigneten Elutionspuffers getrennt
werden. So kann beispielsweise eine Änderung in der Ionenstärke oder
des pH-Werts zur
Freisetzung des Phagen (ihren. Alternativ kann der Elutionspuffer
einer Freisetzungskomponente oder -komponenten umfassen, die so gestaltet
sind, dass sie ein Binden von Verbindungen trennen (beispielsweise
einer oder mehrerer Verbindungen, die das Binden des präsentierten
Peptides an den Rezeptor trennen, wie ein Ligand, Inhibitor und/oder Promotor,
der ein Binden kompetitiv inhibieren kann). Wahlweise kann der Selektionsprozess
wiederholt werden oder es kann ein anderer Selektionsschritt verwendet
werden, um einen Phagen, der einen Rezeptor bindet, weiter anzureichern.
Das präsentierte
Polypeptid kann charakterisiert werden (beispielsweise durch Sequenzieren
der Phagen- DNA).
Die identifizierten Polypeptide können erzeugt werden und weiter
getestet werden hinsichtlich eines Bindens eines Liganden, Inhibitor-
und/oder Promotor-Funktion. Es können
Analoge derartiger Peptide erzeugt werden, die eine erhöhte Stabilität oder andere
gewünschte
Merkmale aufweisen werden.
-
In
einer Ausführungsform
kann ein Phage erzeugt werden, der Fusionsproteine exprimiert und
präsentiert,
die ein Mantelprotein (coat Protein) mit einem N-terminalen Peptid
umfassen, das durch eine zufällige
Sequenz von Nukleinsäuren
kodiert wird. Geeignete Wirtszellen, die ein erfindungsgemäßes Rezeptor-Protein oder
-Polypeptid exprimieren, werden mit dem Phagen in Kontakt gebracht,
wobei gebundener Phage ausgewählt,
gewonnen und charakterisiert wird. (Siehe beispielsweise Doorbar,
J. und G. Winter, J. Mol. Biol. 244 (1994), 361 die ein Phagen-Display-Verfahren
erläutern,
das mit einem G-Protein-gekoppelten
Rezeptor verwendet wird).
-
Andere
Quellen potentieller Liganden, Inhibitoren und/oder Promotoren von
Säuger-CXCR3-Proteinen umfassen,
sind jedoch nicht beschränkt
auf Varianten von CXCR3-Liganden,
umfassend natürlich
vorkommende, synthetische oder rekombinante Varianten von IP-10
oder Mig, Substanzen wie andere Chemoattraktoren oder Chemokine,
Varianten davon, andere Inhibitoren und/oder Promotoren (beispielsweise
anti-CXCR3-Antikörper,
Antagonisten, Agonisten), andere Liganden, Inhibitoren und/oder
Promotoren von G-Protein-gekoppelten
Rezeptoren (beispielsweise Antagonisten oder Agonisten) und lösliche Abschnitte
eines Säuger-CXCR3-Rezeptors,
wie ein geeignetes Rezeptor-Peptid oder ein Analog, das eine Rezeptor-Funktion
inhibieren kann (siehe beispielsweise Murphy, R. B.,
WO 94/05695 ).
-
Bindungs-Assays
-
Die
isolierten und/oder rekombinanten Rezeptor-Proteine oder funktionale
Varianten davon, umfassend Abschnitte davon oder geeignete Fusionsproteine,
können
in einem Verfahren verwendet werden, um Agenzien auszuwählen und
zu identifizieren, die an ein (eines oder mehrere) Säuger-CXCR3-Protein,
wie ein humanes CXCR3, binden, und die Liganden oder potentielle
Inhibitoren oder Promotoren einer Rezeptor-Aktivität sind.
Agenzien, die durch das Verfahren ausgewählt werden, umfassend Liganden,
Inhibitoren oder Promotoren, können
hinsichtlich einer inhibitorischen oder stimulierenden Wirkung auf
eine Rezeptor-Funktion und/oder hinsichtlich therapeutischer Verwendbarkeit
weiter bewertet werden.
-
In
einer Ausführungsform
wird durch das Verfahren ein Agens identifiziert, das an ein aktives,
isoliertes und/oder rekombinantes Säuger-CXCR3-Protein oder -Polypeptid
bindet. In dieser Ausführungsform
weist das verwendete Rezeptor-Protein oder -Polypeptid mindestens
ein Merkmal, eine Aktivität
oder Funktion auf, die für
ein Säuger-CXCR3-Protein
(wie hier erläutert)
kennzeichnend ist, wie eine Bindungsaktivität (beispielsweise Binden eines
Liganden, Inhibitors und/oder Promotors), eine Signalisierungs-Aktivität (beispielsweise
Aktivierung eines Säuger-G-Proteins,
Induktion eines schnellen und transienten Anstiegs der Konzentration
an im Cytosol frei vorkommenden Calcium [Ca2+]i), zelluläre Antwortfunktion (beispielsweise
Stimulierung einer Chemotaxis, Exozytose oder Freisetzung von Entzündungsmediator
durch Leukozyten) und/oder ein immunologisches Merkmal, wie hier
definiert. In einer bevorzugten Ausführungsform weist das isolierte
und/oder rekombinante Rezeptor-Protein oder eine Variante eine Liganden-Bindungs-Funktion
auf, und bindet noch bevorzugter einen natürlichen Liganden des Rezeptors.
In einer besonders bevorzugten Ausführungsform ist das isolierte
und/oder rekombinante Protein ein humanes CXCR3-Protein, das durch
die in 1 (SEQ ID Nr. 1) gezeigte Nukleinsäure kodiert
wird.
-
So
kann beispielsweise eine Zusammensetzung, die ein isoliertes und/oder
rekombinantes Säuger-CXCR3-Protein
oder eine Variante davon umfasst, unter Bedingungen gehalten werden,
die für
ein Binden geeignet sind, wobei der Rezeptor mit einem Agens (beispielsweise
eine Zusammensetzung, die ein oder mehrere Agenzien umfasst) in
Kontakt gebracht werden kann, um getestet zu werden, und wobei ein
Binden nachgewiesen und erfasst wird. In eine Ausführungsform
kann ein Rezeptor-Protein in Zellen exprimiert werden, die stabil
oder transient mit einem Konstrukt transfiziert sind, das eine einen
erfindungsgemäßen Rezeptor
kodierende Nukleinsäuresequenz
umfasst. Die Zellen können
unter Bedingungen gehalten werden, die für eine Expression des Rezeptors
geeignet sind. Die Zellen werden unter Bedingungen, die für ein Binden
geeignet sind (beispielsweise in einem geeigneten Bindungspuffer),
mit einem Agens in Kontakt gebracht, und wobei ein Binden durch
Standardtechniken nachgewiesen werden kann. So kann beispielsweise
das Ausmaß des Bindens
relativ zu einer geeigneten Kontrolle bestimmt werden (beispielsweise
verglichen mit dem Hintergrund, der in der Abwesenheit des Agens
bestimmt wird, verglichen mit einem Binden eines zweiten Agens (d.h.
eines Standards), verglichen mit einem Binden des Agens an nicht
transfizierte Zellen). Wahlweise kann anstelle von ganzen Zellen
eine Zellfraktion, wie eine den Rezeptor enthaltende Membranfraktion,
verwendet werden.
-
Ein
Binden oder eine Komplexbildung kann direkt oder indirekt nachgewiesen
werden. In einer Ausführungsform
kann das Agens mit einem geeigneten Marker markiert sein (beispielsweise
einem Fluoreszens-Marker, Chemoluminesz-Marker, Isotop-Marker-Enzym-Marker), wobei ein
Binden durch Nachweis des Markers nachgewiesen werden kann. Die
Spezifität
des Bindens kann beispielsweise durch Konkurrenz oder Ersetzen bewertet
werden, wobei ein nicht-markiertes Agens oder ein Ligand (beispielsweise
IP-10) als Konkurrent verwendet wird.
-
Auf
diese Art und Weise können
Liganden des Säuger-Rezeptors,
umfassend natürliche
Liganden aus den gleichen Säuger-Spezies
oder von anderen Spezies, identifiziert werden. Die Bindungsaktivität eines
Promotors oder Inhibitors, der einen Rezeptor bindet, kann ebenfalls
bestimmt werden, wobei ein Liganden-Bindungs-Assay verwendet wird.
-
Es
können
weiter Bindungs-Inhibierungs-Assays verwendet werden, um Liganden
und Inhibitoren und Promotoren zu identifizieren, die den Rezeptor
binden und das Binden eines anderen Agens, wie eines Liganden inhibieren.
So kann beispielsweise ein Bindungs-Assay durchgeführt werden
bei dem eine Reduktion bzw. Abnahme des Bindens eines ersten Agens
(in der Abwesenheit eines zweiten Agens) verglichen mit einem Binden
des ersten Agens in der Gegenwart des zweiten Testagens nachgewiesen
oder erfasst wird. Der Rezeptor kann mit dem ersten und zweiten
Agens gleichzeitig oder mit einem nach dem anderen in beiden Anordnungen
in Kontakt gebracht werden. Eine Reduktion im Ausmaß des Bindens
des ersten Agens in der Gegenwart des zweiten Testagens ist ein
Anzeichen für
eine Bindungsinhibierung durch das zweite Agens. So kann beispielsweise
ein Binden des ersten Agens verringert oder aufgehoben werden.
-
In
einer Ausführungsform
wird eine direkte Inhibierung des Bindens eines ersten Agens (beispielsweise
eines Chemokins, wie IP-10, Mig) an ein humanes CXCR3 durch ein
zweites Testagens beobachtet. So kann beispielsweise die Fähigkeit
eines Agens beobachtet werden das Binden eines 125I-markierten
Mig an humanes CXCR3 zu inhibieren. Ein derartiger Assay kann beispielsweise
unter Verwendung ganzer Zellen (beispielsweise einer geeigneten
Zell-Linie, die eine einen humanen CXCR3-Rezeptor kodierende Nukleinsäure umfasst)
oder einer Membranfraktion von den Zellen durchgeführt werden.
-
Es
sind andere Verfahren verfügbar,
um des Vorliegens eines Agens/von Agenzien, die einen Rezeptor binden,
zu identifizieren, wie Verfahren, die Ereignisse beobachten, die
durch Rezeptorbindung ausgelöst werden,
wobei Signalisierungs-Funktionen und/oder Stimulierung einer zellulären Antwort
umfasst sind.
-
Es
ist klar, dass die inhibitorische Wirkung der erfindungsgemäßen Antikörper in
einem Bindungs-Inhibierungs-Assay bestimmt werden kann. Weiter kann
in dem Verfahren, in dem das erste Agens in dem Assay ein anderer
Antikörper
ist, unter für
eine Antikörper-Bindung
geeigneten Bedingungen ein Wettbewerb zwischen Antikörper bezüglich einer
Rezeptorbindung bestimmt werden.
-
Auf
diese Art und Weise identifizierte Liganden, Inhibitoren und Promotoren
einer Rezeptorbindung können
weiter beurteilt bzw. bewertet werden, um zu bestimmen, ob sie nach
einem Binden als Inhibitor oder Aktivator von anderen CXCR3-Funktionen
wirken und/oder um ihre therapeutische Verwendbarkeit zu beurteilen.
-
Signalisierungs-Assays
-
Das
Binden eines G-Protein-gekoppelten Rezeptors (beispielsweise durch
einen Agonisten) kann zu einer Signalisierung durch den Rezeptor
und zu einer Stimulierung der Aktivität des G-Proteins führen. Die
Induktion einer Signalisierungs-Funktion durch ein Agens kann durch
Verwendung eines beliebigen geeigneten Verfahrens beobachtet werden.
So können
beispielsweise eine G-Protein-Aktivität, wie die Hydrolyse von GTP zu
GDP, oder spätere
durch das Binden eines Rezeptor ausgelöste Signalisierungs-Ereignisse,
wie eine Induktion eines schnellen und transienten Anstiegs der
Konzentration an intrazellulär
(cytosolisch) frei vorkommenden Calciums [Ca2+]i, durch im Stand der Technik bekannter Verfahren
oder anderer geeigneter Verfahren getestet werden (Beispiel 2; siehe
ebenfalls Neote, K. et al., Cell, 72 (1993), 415–425; Van Riper et al., J.
Exp. Med. 177 (1993), 851–856;
Dahinden, C. A. et al., J. Exp. Med. 179 (1994), 751–756).
-
Der
funktionale Assay von Sledziewski et al., der Hybrid-G-Protein-gekoppelte
Rezeptoren verwendet, kann ebenfalls verwendet werden, um eine Liganden
oder Promotor durch dessen Fähigkeit
ein Hybrid-G-Protein zu aktivieren zu identifizieren oder um einen
Inhibitor durch dessen Fähigkeit
eine derartige Aktivierung zu inhibieren zu identifizieren (Sledziewski
et al., US-P-5,284,746, wobei dessen Lehren hier unter Bezugnahme aufgenommen
sind). In einer Ausführungsform
kann eine biologische Antwort der Wirtszelle (ausgelöst durch Binden
an einen Hybrid-Rezeptor) beobachtet werden, wobei ein Nachweis
der Antwort ein Anzeichen für
das Vorliegen eines Liganden in der Testprobe ist. So wird beispielsweise
ein Verfahren zum Nachweis des Vorliegens eines Liganden in einer
Testprobe beschrieben, wobei der Ligand ein Agens ist, das durch
die Liganden-Bindungsdomäne
eines Rezeptors gebunden werden kann. In einer Ausführungsform
des Verfahrens werden Hefe-Wirtszellen mit einem DNA-Konstrukt transformiert,
das die Expression eines biologisch aktiven Hybrid-G-Protein-gekoppelten
Rezeptors (d.h. ein Fusionsprotein) steuern kann. Der Hybrid-Rezeptor
umfasst einen Säuger-G-Protein-gekoppelten
Rezeptor mit mindestens einer Domäne außer der Liganden-Bindungsdomäne, die
durch eine entsprechende Domäne
eines G-Protein-gekoppelten Rezeptors einer Hefe, wie ein STE2-Genprodukt,
ersetzt wird. Die das Konstrukt beinhaltenden Hefe-Wirtszellen werden
unter Bedingungen gehalten, unter denen der Hybrid-Rezeptor exprimiert
wird, und die Zellen werden unter Bedingungen, die das Binden eines
Liganden an den Hybrid-Rezeptor ermöglichen, mit einer Testprobe
in Kontakt gebracht. Eine biologische Antwort der Wirtszelle (ausgelöst durch
das Binden an einen Hybrid-Rezeptor) wird beobachtet, wobei ein
Nachweis der Antwort ein Anzeichen für eine Signalisierungs-Funktion
ist. So kann beispielsweise das Binden an einen Hybrid-Rezeptor,
der von einem STE2-Genprodukt abgeleitet ist, zur Induktion des BAR1-Promotors führen. Eine
Induktion des Promotors kann mittels eines Reportergens (beispielsweise β-gal) erfasst
werden, das mit dem BAR1-Promotor verknüpft und in Wirtszellen auf
einem zweiten Konstrukt eingeführt
wurde. Eine Expression des Reportergens kann beispielsweise durch
einen in vitro Enzymassay in Zell-Lysaten oder durch das Vorliegen
von blauen Kolonien auf Platten, die einen Indikator (beispielsweise X-gal)
in dem Medium enthalten, nachgewiesen werden.
-
In
einer anderen Ausführungsform
kann der Assay verwendet werden, um potentielle Inhibitoren einer Rezeptor-Funktion
zu identifizieren. So kann die inhibitorische Aktivität eines
Agens durch Verwendung eines Liganden oder Promotors in dem Assay
bestimmt werden, und wobei die Fähigkeit
des Testagens, die durch den Liganden oder Promotor induzierte Aktivität zu inhibieren,
beurteilt wird.
-
Es
können
ebenfalls Varianten bekannter Liganden hinsichtlich einer verringerten
Fähigkeit
(verminderte Fähigkeit
oder keine Fähigkeit),
eine Aktivität
eines gekoppelten G-Proteins
zu stimulieren, durchmustert werden. Obwohl das Agens eine Liganden-Bindungs aktivität aufweist
(wie durch ein anderes Verfahren bestimmt) löst in dieser Ausführungsform
das in Eingriff kommen mit dem Rezeptor keine Aktivität eines
gekoppelten G-Proteins aus oder löst sie nur schwach aus. Derartige
Agenzien sind potentielle Antagonisten und können weiter hinsichtlich einer
inhibitorischen Aktivität
bewertet bzw. beurteilt werden.
-
Chemotaxis und andere Assays
für zelluläre Antworten
-
Es
können
ebenfalls Chemotaxis-Assays verwendet werden, um eine Rezeptor-Funktion
zu bewerten. Diese Assays basieren auf der funktionalen durch ein
Agens induzierten Wanderung von Zellen in vitro oder in vivo, und
können
verwendet werden, um das Binden und/oder die Wirkung auf eine Chemotaxis
von Liganden, Inhibitoren oder Promotoren zu bewerten.
-
In
Beispiel 2 wird die Verwendung eines in vitro Chemotaxis-Assays
zum Bewerten der Antwort von Zellen auf IP-10 und Mig beschrieben.
Springer et al. beschrieben einen transendothelialen Lymphozyten-Chemotaxis-Assay
(Springer et al.,
WO 94/20142 ,
veröffentlicht
am 15. September 1994, wobei deren Lehren hier unter Bezugnahme
aufgenommen sind; siehe ebenfalls Berman et al., Immunol. Invest.
17 (1988), 625–677). Eine
Wanderung über
das Endothelium in Kollagen-Gele wurde ebenfalls beschrieben (Kavanaugh
et al., J. Immunol. 146 (1991), 4149–4156).
-
Im
Allgemeinen beobachten Chemotaxis-Assays die direktionale Bewegung
oder Wanderung geeigneter Zellen, die zur Chemotaxis befähigt sind,
wie beispielsweise eine Leukozyte (beispielsweise T-Lymphozyten,
HK-Zellen, Monozyten), stabile Transfektanten von Jurkat-Zellen,
L1-2 pre-B-Zellen von Maus oder von anderen geeigneten Wirtszellen,
in oder durch eine Barriere (beispielsweise Endothelium, einen Filter)
in Richtung eines erhöhten
Spiegels eines Agens von einer ersten Oberfläche der Barriere in Richtung
einer abgewandten zweiten Oberfläche.
Membranen oder Filter stellen zweckdienliche Barrieren dar, so dass
die direktionale Bewegung oder Wanderung einer geeigneten Zelle
in oder durch einen Filter in Richtung erhöhter Spiegel eines Agens von
einer ersten Oberfläche
des Filters in Richtung einer abgewandten zweiten Oberfläche des
Filters beobachtet wird. In einigen Assays wird die Membran mit
einer Substanz, wie ICAM-1, Fibronectin oder Collagen, beschichtet,
um eine Adhäsion
zu erleichtern.
-
So
kann beispielsweise die Wanderung von Zellen in einem geeigneten
Behälter
(einem enthaltenden Mitteln) von einer ersten Kammer in oder durch
eine mikroporöse
Membran in eine zweite Kammer nachgewiesen oder erfasst werden,
die ein zu testendes Agens enthält
und die von der ersten Kammer durch die Membran abgeteilt ist. Es
wird eine geeignete Membran, beispielsweise Nitrocellulose, Polycarbonat
umfassend, mit einer geeigneten Porengröße zum Beobachten einer spezifischen
Wanderung als Antwort auf das Agens ausgewählt. So kann beispielsweise
eine Porengröße von ungefähr 3–8 Microns
und vorzugsweise von ungefähr
5–8 Microns
verwendet werde. Die Porengröße kann
auf einem Filter einheitlich sein oder in einem Bereich von geeigneten
Porengrößen liegen.
-
Um
eine Wanderung zu bewerten, kann die Strecke bzw. Entfernung der
Wanderung in den Filter, die Anzahl der den Filter durchquerenden
Zellen, die an der zweiten Oberfläche des Filters angehaftet
bleiben und/oder die Anzahl der Zellen, die sich in der zweiten
Kammer anreichern unter Verwendung von Standardtechniken (beispielsweise
durch Mikroskopie) bestimmt werden. In einer Ausführungsform
werden die Zellen mit einem nachweisbaren Marker markiert (beispielsweise
ein Radioisotop, Fluoreszenzmarker, Antigen- oder Epitop-Marker),
wobei eine Wanderung durch Bestimmen des Vorliegens des Markers,
der an die Membran angehaftet ist und/oder in der zweiten Kammer
vorliegt durch Verwendung eines geeigneten Verfahrens (beispielsweise
durch Nachweis der Radioaktivität,
Fluoreszenz, Immunassay) bewertet werden kann. Das Ausmaß der durch
ein Agens induzierten Wanderung kann relativ zu einer geeigneten
Kontrolle bestimmt werden (beispielsweise verglichen mit einer Hintergrunds-Wanderung,
die in der Abwesenheit des Agens bestimmt wurde, mit dem Ausmaß der Wanderung,
die durch ein zweites Agens (d.h. einem Standard) induziert wurde, verglichen
mit einer durch das Agens induzierten Wanderung von nicht-transfizierten
Zellen).
-
Kammern
können
aus verschiedenen Feststoffen, wie Kunststoff, Glas, Polypropylen,
Polystyrol etc., gebildet werden. Membranen, die von den Kammern
gelöst
werden können,
wie eine Biocoat- (Collaborative Biomedical Products) oder Transwell-
(Costar, Cambridge, mGluR-Antagonist) Kultureinsatz erleichtern
das Zählen
angehaftender Zellen. In dem Behälter
kann der Filter so untergebracht werden, dass er mit einer die Zellen
umfassenden Flüssigkeit
in der ersten Kammer und der Flüssigkeit
in der zweiten Kammer in Kontakt steht. Außer des Testagens oder eines
zusätzlichen
Liganden, Inhibitors oder Promotors, die zum Zweck des Assays vorliegen,
ist die Flüssigkeit
auf beiden Seiten der Membran vorzugsweise die gleiche oder im wesentlichen ähnlich.
Die Flüssigkeit
in den Kammern kann Proteinlösungen
(beispielsweise bovines Serumalbumin, fetales Kälberserum, humanes Serumalbumin)
umfassen, die die Stabilität
erhöhen
und ein nicht spezifisches Binden von Zellen inhibieren können, und/oder
Kulturmedium.
-
In
einer Ausführungsform
wird eine transendotheliale Wanderung bewertet. Zusätzlich zu
einem geringeren Hintergrund (Signal-Stör-Verhältnis) modelliert eine transendotheliale
Wanderung in vivo Bedingungen, in denen Leukozyten von Blutgefäßen in Richtung
eines Chemoattraktors auswandern, der in den Geweben an Entzündungsstellen
vorliegt, indem sie die endotheliale Zellschicht durchqueren, die
die Gefäßwandung auskleidet.
In dieser Ausführungsform
wird ein Auswanderung durch eine endotheliale Zellschicht bewertet. Um
die Zellschicht zu erzeugen, können
endotheliale Zellen auf einem/einer mikroporösen Filter oder Membran kultiviert
werden, der/die optional mit einer Substanz wie Kollagen, Fibronectin
oder anderen extrazellulären
Matrixproteinen beschichtet ist, um das Anfügen der endothelialen Zellen
zu erleichtern. Die endothelialen Zellen werden vorzugsweise kultiviert,
bis sich eine konfluente Monoschicht gebildet hat. Es ist eine Vielzahl von
endothelialen Säuger-Zellen
zur Bildung von Monoschichten verfügbar, umfassend beispielsweise
Venen-, Arterien-Endothelium, mikrovaskuläres Endothelium, wie humane
endotheliale Zellen der Nabelvene (Clonetics Corp, San Diego, CA)
oder eine geeignete Zell-Linie,
wie die verwendete ECV 304-Zell-Linie (Europäische Sammlung tierischer Zellkulturen,
Porton Down, Salisbury, UK). Um eine Chemotaxis als Antwort auf
einen bestimmten Säuger-Rezeptor
zu testen, werden endotheliale Zellen des gleichen Säugers bevorzugt;
es können
jedoch auch endotheliale Zellen heterologer Säuger-Spezies oder -Gattungen
verwendet werden.
-
Im
Allgemeinen wird der Assay durchgeführt, indem eine direktionale
Wanderung von Zellen in oder durch eine Membran oder einen Filter
in Richtung erhöhter
Spiegel eines Agens von einer ersten Oberfläche des Filters in Richtung
einer abgewandten zweiten Oberfläche
des Filters nachgewiesen wird, wobei der Filter auf einer ersten
Oberfläche
ein Schicht endothelialer Zellen enthält. Die direktionale Wanderung
erfolgt von dem Gebiet, das an die erste Oberfläche angrenzt, in oder durch
die Membran in Richtung eines Agens, das an der abgewandten Seite
des Filters untergebracht ist. Die Konzentration des Agens in dem
an die zweite Oberfläche
angrenzenden Gebiet ist größer als
die in dem an die erste Oberfläche
angrenzenden Gebiet.
-
In
einer Ausführungsform
wird ein Chemotaxis-Assay dazu eingesetzt, ein Agens hinsichtlich
Liganden- oder Promotor-Aktivität
zu testen, wobei eine Zusammensetzung, die Zellen umfasst, die zur
Wanderung befähigt
sind und ein Säuger-CXCR3-Protein
oder eine funktionale Variante davon exprimieren, in der ersten Kammer
positioniert werden, und eine Zusammensetzung, die das zu testende
Agens umfasst (ein oder mehrere Agenzien) in der zweiten Kammer
positioniert wird, vorzugsweise in der Abwesenheit anderer Liganden oder
Promotoren, die eine Chemotaxis der Zellen in der ersten Kammer
induzieren können
(Chemoattraktor-Funktion aufweisend). Es können jedoch ein oder mehrere
Liganden oder Promotoren mit Chemoattraktor-Funktion vorliegen.
Die Fähigkeit
eines Agens eine Chemotaxis der Zellen, die einen Säuger-CXCR3-Rezeptor
exprimieren, in diesem Assay zu induzieren, ist ein Anzeichen, dass
das Agens ein Ligand oder Promotor der Rezeptor-Funktion ist.
-
In
einer Ausführungsform,
die zum Testen auf einen Inhibitor verwendet wird, wird eine Zusammensetzung,
die zur Wanderung befähigte
und ein Säuger-CXCR3-Protein
oder eine funktionale Variante davon exprimierende Zellen umfasst,
in der ersten Kammer positioniert. In der zweiten Kammer wird eine
Zusammensetzung vorgelegt, die einen Liganden oder Promotor (d.h.
einen oder mehrere Liganden oder Promotoren) umfasst, der eine Chemotaxis
der Zellen in der ersten Kammer induzieren kann (mit Chemoattraktor-Funktion). Bevor
(vorzugsweise kurz bevor) die Zellen in der ersten Kammer vorgelegt
werden, oder gleichzeitig mit den Zellen, wird vorzugsweise in der
ersten Kammer eine Zusammensetzung positioniert, die das zu testende Agens
umfasst. Die Fähigkeit
eines Agens eine Liganden- oder
Promotor-induzierte Chemotaxis der Zellen, die einen Säuger-CXCR3-Rezeptor
exprimieren, in diesem Assay zu induzieren, ist ein Anzeichen, dass
das Agens ein Inhibitor der Rezeptor-Funktion ist (beispielsweise
ein Inhibitor einer zellulären
Antwort-Funktion). Eine Verringerung des Ausmaßes der Wanderung, die durch
den Liganden oder Promotor in der Gegenwart des Testagens induziert
wird, ist ein Anzeichen bzw. Zeichen für eine inhibitorische Aktivität. Es können getrennte
Bindungsstudien (siehe vorstehend aufgeführt) durchgeführt werden,
um zu bestimmen, ob eine Inhibierung das Ergebnis des Bindens des
Testagens an einen Rezeptor ist oder ob sie über einen anderen Mechanismus
erfolgt.
-
Nachstehend
werden in vivo Assays, die eine Leukozyten-Infiltration von Gewebe,
als Antwort auf die Injektion eines Agens in das Gewebe beobachten,
beschrieben. Diese Modelle erfassen die Fähigkeit von Zellen auf einen
Liganden oder Promotor durch Emigration und Chemotaxis an eine Entzündungsstelle
zu antworten.
-
Die
Wirkungen eines Liganden, Inhibitors oder Promotors auf die zelluläre Antwort-Funktion eines CXCR3-Rezeptors
kann durch Beobachten anderer zellulärer Antworten bewertet werden,
die durch einen aktiven Rezeptor induziert werden, wobei geeignete
Wirtszellen verwendet werden, die den Rezeptor enthalten. In ähnlicher
Weise können
diese Assays verwendet werden, um die Funktion eines Rezeptors zu
bestimmen. So können
beispielsweise Exozytose (beispielsweise Degranulation von natürlichen
Killer-Zellen, die zur Freisetzung eines oder mehrerer Enzyme oder
anderer Komponenten der Körnchen
bzw. Granula führt,
wie Esterasen (beispielsweise Serin-Esterasen), Perforin und/oder
Granzyme), Freisetzung von Entzündungsmediator (wie
eine Freisetzung von bioaktiven Lipiden, wie Leukotriene (beispielsweise
Leukotrien C4)) und Atmungs-Ausbruch bzw.
-Burst (respiratory burst) durch im Stand der Technik bekannter
Verfahren und anderer geeigneter Verfahren beobachtet werden. (Siehe
beispielsweise Taub, D. D. et al., J. Immunol. 155 (1995), 3877–3888, hinsichtlich
Assays zur Freisetzung von Körnchen-abgeleiteter
Serin-Esterasen (wobei dessen Lehren hier unter Bezugnahme aufgenommen
sind) und Loetscher et al., J. Immunol., 156 (1996), 322–327, hinsichtlich
Assays zur Freisetzung von Enzym und Granzym durch NK-Zellen und
cytotoxischen T-Lymphozyten (CTLs) (wobei deren Lehren hier unter
Bezugnahme aufgenommen sind); Rot, A. et al., J. Exp. Med. 176 (1992),
1489–1495,
hinsichtlich Atmungs-Ausbruch; Bischoff, S. C. et al., Eur. J. Immunol.
23 (1993), 761–767 und
Baggliolini, M. und C. A. Dahinden, Immunology Today 15 (1994),
127–133).
-
In
einer Ausführungsform
wird ein Ligand, Inhibitor und/oder Promotor durch Beobachten der
Freisetzung eines Enzyms nach Degranulation oder Exozytose durch
eine zu dieser Funktion befähigten
Zelle identifiziert. Zellen, die eine Nukleinsäure der vorliegenden Erfindung
enthalten, die ein aktives Rezeptor-Protein kodiert, das eine Exozytose
oder Degranulation stimulieren kann, werden in einem geeigneten
Medium unter geeigneten Bedingungen gehalten, wobei ein Rezeptor
exprimiert wird und eine Degranulation induziert werden kann. Der
Rezeptor wird mit einem zu testenden Agens in Kontakt gebracht und
eine Freisetzung von Enzym wird bewertet. Die Freisetzung eines
Enzyms in das Medium kann durch Verwendung eines geeigneten Assays
nachgewiesen oder erfasst werden, wie einen immunologischen Assay
oder biochemischen Assay für eine
Enzymaktivität.
-
Das
Medium kann direkt getestet werden, in dem in das Medium (beispielsweise
bevor, gleichzeitig mit oder nachdem die Zellen und das Agens kombiniert
werden) Komponenten des Assays eingeführt werden (beispielsweise
Substrat, Cofaktoren, Antikörper).
Alternativ kann der Assay mit Medium durchgeführt werden, das vor dem Assay
von den Zellen getrennt oder weiter bearbeitet (beispielsweise fraktioniert)
wurde. So sind beispielsweise zweckdienliche Assays für Enzyme
wie Serin-Esterasen verfügbar
(siehe beispielsweise Taub, D. D. et al., 1995, J. Immunol., 155:
3877–3888,
hinsichtlich Assays zur Freisetzung von Körnchen-abgeleiteter Serin-Esterasen).
-
Eine
Stimulierung einer Degranulation durch ein Agens kann ein Anzeichen
dafür sein,
dass das Agens ein Ligand oder Promotor eines Säuger-CXCR3-Proteins ist. In
einer anderen Ausführungsform
werden Rezeptor-exprimierende Zellen mit einem Liganden oder Promotor
kombiniert, wobei ein zu testendes Agens zuvor, nachdem oder gleichzeitig
damit zugesetzt wird und die Degranulation bewertet wird. Eine Inhibierung der
Liganden- oder Promotor-induzierten
Degranulation ist ein Anzeichen, dass das Agens ein Inhibitor einer Säuger-CXCR3-Protein-Funktion
ist.
-
Durch
im Stand der Technik bekannte Verfahren oder andere geeignete Verfahren
kann weiter ein zelluläres
Anhaften beobachtet werden. So kann die Auswirkung der Chemokin-Rezeptoren eines
Lymphozyten eine Integrin-Aktivierung und eine Induktion des Anhaftens
an Adhäsionsmoleküle, die
in Gefäßen oder
dem perivaskulären
Raum exprimiert werden, bewirken. In einer Ausführungsform wird ein Ligand,
Inhibitor und/oder Promotor durch Beobachten der zellulären Anhaftung
durch eine zur Adhäsion
befähigten
Zelle identifiziert. So kann beispielsweise ein zu testendes Agens
kombiniert werden mit (a) Zellen, die einen Rezeptor exprimieren
(vorzugsweise nicht-haftende bzw. nicht-adhärente Zellen, die durch Transfektion
mit einem Rezeptor die Fähigkeit
zum Anhaften erlangen), (b) einer Zusammensetzung, die ein geeignetes
Adhäsions-Molekül umfasst
(beispielsweise ein Substrat, wie eine Kulturvertiefung, die mit
einem Adhäsions-Molekül, wie Fibronectin,
beschichtet ist) und (c) mit einem Liganden oder Promotor (beispielsweise
einem Agonisten) und unter Bedingungen gehalten werden, die für eine Liganden-
oder Promotor-induzierte Adhäsion
geeignet sind. Eine Markierung von Zellen mit einem Fluoreszenzfarbstoff
stellt ein zweckdienliches Mittel zum Nachweis haftender Zellen
bereit. Nicht-haftende Zellen können
entfernt werden (beispielsweise durch Waschen) und es kann die Anzahl
der haftenden Zellen bestimmt werden. Die Wirkung des Agens eine
Liganden- oder Promotor-induzierte Adhäsion zu inhibieren oder zu
fördern
kann ein Anzeichen für
eine Inhibitor- bzw. Promotor-Aktivität sein. In dem Assay aktive
Agenzien umfassen Inhibitoren und Promotoren eines Bindens, einer
Signalisierung und/oder von zellulären Antworten. In einer anderen
Ausführungsform
kann das zu testende Agens mit Zellen, die einen Rezeptor exprimieren,
und einer Zusammensetzung, die ein geeignetes Adhäsionsmolekül umfasst,
unter Bedingungen kombiniert werden, die für eine Liganden- oder Promotor-induzierte
Adhäsion
geeignet sind, wobei die Adhäsion
beobachtet wird. Eine relativ zu einer geeigneten Kontrolle erhöhte Adhäsion ist
ein Anzeichen für
das Vorliegen eines Liganden und/oder eines Promotors.
-
Entzündungsmodelle
-
Es
ist eine Vielzahl von in vivo Entzündungsmodellen verfügbar, die
zur Bewertung der in vivo Wirkungen von Liganden, Inhibitoren oder
Promotoren als therapeutische Agenzien verwendet werden können, umfassend,
ein Schaf-Modell für
Asthma (siehe beispielsweise Weg, V. B. et al., J. Exp. Med. 177
(1993), 561), ein Ratten-Modell für eine Allergie vom Spättyp (Rand,
M. L. et al., Am. J. Pathol. 148 (1996), 855–864) oder andere geeignete
Modelle. In derartigen Tieren kann die Aktivität der Antikörper, die mit anderen Säuger-CXCR3-Proteinen kreuzreagieren,
bewertet werden.
-
Zusätzlich kann
eine Leukozyten-Infiltration nach intradermaler Injektion einer
Verbindung in ein geeignetes Tier, wie ein Kaninchen, eine Ratte
oder ein Meerschweinchen, beobachtet werden (siehe beispielsweise
Van Damme J. et al., J. Exp. Med. 176 (1992), 59–65; Zachariae, C. O. C. et
al., J. Exp. Med. 171 (1990), 2177–2182; Jose, P. J. et al.,
J. Exp. Med. 179 (1994), 881–887).
In einer Ausführungsform
werden der Haut-Biopsien histologisch auf eine Infiltration von
Leukozyten (beispielsweise T-Lymphozyten, Monocyten, natürliche Killer-Zellen)
bewertet. In einer anderen Ausführungsform
werden einem Tier markierte Zellen (beispielsweise Zellen, die ein
Säuger-CXCR3-Protein
exprimieren, die beispielsweise mit 111In
markiert sind), die zur Chemotaxis und Extravasation befähigt sind,
verabreicht. Eine Infiltration markierter Zellen in der Nähe der Injektionsstelle
einer Testprobe (beispielsweise einer zu testenden Verbindung in
einem geeigneten Puffer oder einem physiologischen Träger) ist
ein Anzeichen dafür,
dass in der Probe ein Ligand oder Promotor, wie ein Agonist, vorliegt.
Diese Assays können
ebenfalls modifiziert werden, um Inhibitoren einer Chemotaxis und Extravasation
von Leukozyten zu identifizieren. So kann beispielsweise ein Inhibitor
verabreicht werden, entweder bevor, gleichzeitig mit oder nachdem
dem Versuchstier ein Ligand oder Agonist verabreicht worden ist. Eine
Abnahme des Ausmaßes
der Infiltration in der Gegenwart eines Inhibitors, verglichen mit
dem Ausmaß der
Infiltration in der Abwesenheit eines Inhibitors ist ein Anzeichen
für eine
Inhibierung.
-
Diagnostische Anwendungen
-
Die
vorliegende Erfindung weist eine Vielzahl von diagnostischen Anwendungen
auf. So kann/können beispielsweise
(eine) Mutation(en) in einem Gen, das ein Säuger-CXCR3-Protein kodiert, einen Mangel in mindestens
einer Funktion des kodierten Rezeptor verursachen, wodurch eine
Rezeptor-Funktion verringert oder gefördert wird. So kann beispielsweise
eine Mutation, die eine Rezeptor-Variante erzeugt oder die Expressionshöhe verändert, eine
Rezeptor-Funktion verringern oder fördern, wobei durch den Rezeptor
vermittelte Prozesse (beispielsweise entzündliche Prozesse) verringert
oder gefördert
werden. Das Vorliegen einer derartigen Mutation kann durch Verwendung
von Verfahren bestimmt werden, die das Vorliegen des Rezeptor oder
der Rezeptor-Funktion in Zellen (beispielsweise Leukozyten, wie
aktivierte T-Lymphozyten) eines Individuums oder in einer von derartigen
Zellen isolierten Rezeptor-Präparation
nachweist oder erfasst. In diesen Assays können verringerte oder erhöhte Rezeptor-Spiegel
und/oder verringerte oder erhöhte
Rezeptor-Funktionen
bewertet werden.
-
Die
hier beschriebenen Nukleinsäuren
stellen Reagenzien bereit, wie Sonden und PCR-Primer, die zum Durchmustern nach, Charakterisieren
und/oder Isolieren eines defekten Säuger-CXCR3-Gens verwendet werden
können,
das einen Rezeptor mit verringerter oder erhöhter Aktivität kodiert.
Es können
beispielsweise Standardverfahren zum Durchmustern nach einem defekten
Gen eingesetzt werden. Ein defektes Gen kann zur weiteren Bewertung,
wie hier für
Säuger-CXCR3-Proteine
beschrieben, isoliert und in einer geeigneten Wirtszelle exprimiert
werden. Eine Vielzahl von humanen Erkrankungen sind mit Mangeln
in der Funktion eines G-Protein-gekoppelten Rezeptors assoziiert
(Clapham, D. E., Cell, 75 (1993), 1237–1239; Lefkowitz, R. J., Nature,
365 (1993), 603–04).
-
Die
hier beschriebenen Nukleinsäuren
stellen Reagenzien bereit, wie Sonden und PCR-Primer, die ebenfalls dazu verwendet
werden können,
um die Expression eines Rezeptor (beispielsweise durch Nachweis der
Transkription von mRNA) durch Zellen in einer Probe (beispielsweise
durch Northern-Analyse, durch in situ Hybridisierung) zu bewerten.
So kann beispielsweise eine Expression in aktivierten T-Lymphozyten
oder in anderen Zell-Typen bewertet werden.
-
Die
erfindungsgemäßen Antikörper finden
Anwendung in Verfahren, bei denen ein Rezeptor auf der Oberfläche von
Zellen nachgewiesen werden kann. Der Rezeptor stellt einen Marker
des Leukozyten-Zelltyps bereit, in dem er exprimiert wird, insbesondere
von aktivierten T-Zellen. So können
beispielsweise Antikörper, die
gegen ein Rezeptor-Protein oder -Peptid gerichtet sind, wie die
hier beschriebenen Antikörper
(beispielsweise mAb 1C6) verwendet werden, um Zellen, die den Rezeptor
exprimieren, nachzuweisen und/oder zu quantifizieren. In einer Ausführungsform
können
die Antikörper
verwendet werden, um Zellen, die einen Rezeptor exprimieren, aus
einem Gemisch von Zellen zu sortieren (um beispielsweise aktivierte
T-Zellen, wie CD4+ T-Zellen zu isolieren).
Hierzu können
geeignete Verfahren zum Zählen
und/oder Sortieren von Zellen verwendet werden (beispielsweise Strömungszytometrie,
Fluoreszenz-aktiviertes Zellsortieren). Zellzahlen können in
der Diagnose von Erkrankungen oder Zuständen verwendet werden, bei
denen eine Zunahme oder Abnahme von Leukozyten-Zelltypen (beispielsweise
aktivierte T-Zellen) beobachtet wird. Das Vorliegen eines erhöhten Spiegels
an aktivierten T-Zellen in einer von einem Individuum erhaltenen
Probe kann ein Anzeichen für
eine Infiltration aufgrund einer entzündlichen Erkrankung oder Zustandes
sein, wie eine allergische Reaktion vom Spättyp, Allotransplantat-Abstoßung oder
ein pathologischer Zustand, umfassend eine bakterielle oder virale
Infektion.
-
Weiterhin
können
die Antikörper
verwendet werden, um die Expression eines Rezeptor nachzuweisen oder
zu erfassen. So können
beispielsweise erfindungsgemäße Antikörper verwendet
werden, um einen Rezeptor in einer Probe (beispielsweise Gewebe
oder Körperflüssigkeiten
von einem Individuum, wie Blut, Serum, Leukozyten (beispielsweise
aktivierte T-Lymphozyten), bronchoveoläre Spülungsflüssigkeit, Speichel, Darmflüssigkeit)
nachzuweisen oder zu erfassen. So kann beispielsweise eine Probe
(beispielsweise Gewebe und/oder Flüssigkeit) von einem Individuum
erhalten werden und es kann ein geeigneter Assay verwendet werden,
um das Vorliegen oder die Menge an CXCR3-Protein zu bewerten. Geeignete
Assays umfassen immunologische Verfahren, wie FACS-Analysen und
Enzym-gekoppelte
Immunoadsorptions-Assays (ELISA), umfassend Chemolumineszenz-Assays, Radioimmuno-Assay
und Immunohistologie. Im Allgemeinen werden eine Probe und ein erfindungsgemäßer Antikörper unter
Bedingungen kombiniert, die zur Bildung eines Antikörper-Rezeptor-Komplexes
geeignet sind, wobei die Bildung des Antikörper-Rezeptor-Komplexes (direkt oder
indirekt) bewertet wird.
-
Das
Vorliegen eines erhöhten
Spiegels an Rezeptor-Reaktivität
in der von einem Individuum erhaltenen Probe kann ein Anzeichen
sein für
eine Entzündung
und/oder eine Infiltration und/oder Akkumulation von Leukozyten
(beispielsweise aktivierten T-Zellen), die mit einer entzündlichen
Erkrankung oder eines Zustands assoziiert sind, wie eine Allotransplantat-Abstoßung, allergische
Reaktion von Spättyp
oder eine Infektion, wie eine virale oder bakterielle Infektion.
Die Expressionshöhe
eines Säuger-CXCR3-Proteins
oder einer Variante kann ebenfalls verwendet werden, um eine erhöhte oder
verminderte Expression eines Säuger-CXCR3-Proteins
mit einer bestimmten Erkrankung oder einem Zustand zu korrelieren,
und in der Diagnose einer Erkrankung oder eines Zustands bei der/dem
eine erhöhte
oder verminderte Expression eines Säuger-CXCR3-Proteins auftritt
(beispielsweise erhöht
oder vermindert in Bezug auf eine geeignete Kontrolle, wie die Expressionshöhe in einem
normalen Individuum). In ähnlicher
Weise kann der Verlauf einer Therapie beobachtet werden, indem in
einer Probe von einem Patienten eine CXCR3-Immunoreaktivität bewertet
wird. So können
beispielsweise erfindungsgemäße Antikörper verwendet
werden, um die Anzahl an CXCR3 tragenden Zellen in einer Probe (beispielsweise
Blut, Gewebe) eines mit einem entzündungshemmenden oder immunsuppressiven
Agens behandelten Patienten zu beobachten.
-
Transgene Tiere
-
Es
können
transgene Tiere erstellt werden, bei denen das Genom des Wirtstiers
unter Verwendung von DNA-Rekombinationstechniken verändert wurde.
Die Veränderung
kann nicht erblich sein (beispielsweise werden somatische Zellen,
wie Vorläuferzellen
im Knochenmark, verändert).
Alternativ kann die Veränderung erblich
sein (die Keimlinie wird verändert).
Transgene Tiere können
durch Verwendung von Standardtechniken oder anderer geeigneter Verfahren
konstruiert werden (siehe beispielsweise Cooke, M. P. et al., Cell
65 (1991), 281–291
hinsichtlich einer Veränderung
von T-Lymphozyten; Hanahan, D., Science (1989), 246: 1265–1275; Anderson
et al.,
US-P-5,399,346 ).
-
Ein
endogenes Säuger-CXCR3-Gen
kann in einem geeigneten Ausgangstier bzw. Wirtstier als Ganzes
oder in Teilen inaktiviert oder unbrauchbar gemacht (disabled) werden
(beispielsweise durch Genunterbrechungs-Techniken), um ein transgenes
Tier zu erzeugen. Um eine erfolgreiche Konstruktion eines Wirts,
der ein inaktiviertes oder unbrauchbar gemachtes CXCR3-Gen umfasst,
zu bewerten, können
Nukleinsäuren
verwendet werden (beispielsweise Southern-Hybridisierung). Zusätzlich kann
eine erfolgreiche Konstruktion eines Wirts, der ein inaktiviertes
oder unbrauchbar gemachtes CXCR3-Gen umfasst, durch geeignete Assays bewertet
werden, die die Funktion des kodierten Rezeptors beobachten. Derartige
Tiere können
verwendet werden, um die Wirkung einer Rezeptor-Inaktivierung auf
eine Entzündung
und Wirtsabwehrmechanismen gegen Krebs und Pathogene (beispielsweise
ein virales Pathogen) zu bewerten.
-
Eine
Nukleinsäure,
die ein Säuger-CXCR3-Protein
oder -Polypeptid kodiert, kann in einen geeigneten Wirt eingeführt werden,
um ein transgenes Tier zu erzeugen. In dem transgenen Tier vorliegende
endogene CXCR3-Rezeptorgene können
inaktiviert werden (beispielsweise gleichzeitig mit dem Einführen der
Nukleinsäure
durch homologe Rekombination, welche die endogenen Gene trennt und
ersetzt. So kann beispielsweise ein transgenes Tier (beispielsweise
eine Maus, ein Meerschweinchen, ein Schaf) erzeugt werden, das eine Nukleinsäure, die
einen Säuger-CXCR3-Rezeptor
von einer anderen Säuger-Spezies
(beispielsweise ein humanes, durch SEQ ID Nr. 1 kodiertes CXCR3)
in Leukozyten (wie Lymphozyten (beispielsweise aktivierte T-Lymphozyten),
natürliche
Killer-Zellen) exprimiert, wobei ein zweckdienliches Tiermodell
zum Bewerten der Funktion des eingeführten Rezeptors bereitgestellt
wird. Zusätzlich
kann dem transgenen Tier ein Testagens verabreicht werden und die
Wirkung des Agens auf einen Rezeptor-vermittelten Prozess (beispielsweise
Entzündung)
kann, wie hier beschrieben, oder durch Verwendung anderer geeigneter
Assays beobachtet werden. Auf diese Art und Weise können Agenzien,
die eine Rezeptor-Funktion inhibieren oder fördern, identifiziert oder für eine in
vivo Wirkung bewertet werden.
-
Therapieverfahren
-
Eine
Modulation einer Säuger-CXCR3-Funktion
gemäß der vorliegenden
Erfindung durch die Inhibierung oder Förderung mindestens einer Funktion,
die für
ein SäugerCXCR3-Protein kennzeichnend
ist, stellt einen wirksamen und selektiven Weg zum Inhibieren oder
Fördern
von Rezeptor-vermittelten Funktionen bereit. Da CXC-Chemokin-Rezeptoren
selektiv auf aktivierten Lymphozyten exprimiert werden, die auf
Chemokine wie IP-10 und Mig reagieren, deren primäre Ziele
Lymphozyten, insbesondere Effektor-Zellen wie aktivierte oder stimulierte
T-Lymphozyten und NK-Zellen sind, stellen Säuger-CXCR3-Proteine ein Ziel
zum selektiven Beeinträchtigen
oder Fördern
einer Lymphozyten-Funktion in einem Säuger, wie einem Menschen, bereit.
Sobald Lymphozyten an eine Stelle rekrutiert sind, können andere
Leukozyten-Typen, wie Monocyten, durch sekundäre Signale rekrutiert werden.
Somit können
Agenzien, die eine CXCR3-Funktion inhibieren oder fördern, umfassend
Liganden, Inhibitoren (beispielsweise 1C6) und oder Promotoren,
wie solche, die wie hier beschrieben identifiziert wurden, verwendet
werden, um für
therapeutische Zwecke eine Leukozyten-Funktion zu modulieren (beispielsweise
Leukozyten-Infiltration umfassend Rekrutierung und/oder Akkumulation),
insbesondere von Lymphozyten.
-
In
einem Aspekt stellt die vorliegende Erfindung eine Verwendung in
der Herstellung eines Medikaments zum Inhibieren oder Fördern einer
entzündlichen
Antwort in einem Individuum bereit, das eine derartige Therapie
benötigt.
Es kann ein Agens verabreicht werden, das eine Säuger-CXCR3-Funktion in einem
Individuum, das eine derartige Therapie bedarf, inhibiert oder fördert. Eine
Verbindung, die eine oder mehrere Funktionen eines Säuger-CXCR3-Proteins
(beispielsweise eines humanen CXCR3) inhibiert, kann verabreicht
werden, um eine Entzündung
zu inhibieren (verringern oder verhindern). So können beispielsweise erfindungsgemäße Antikörper, umfassend
mAb 1C6 verwendet werden. Als ein Ergebnis wird/werden ein oder
mehrere entzündliche
Prozesse, wie eine Leukozyten-Emigration,
Chemotaxis, Exozytose (beispielsweise von Enzymen) oder eine Freisetzung
von Entzündungsmediator
inhibiert. So kann beispielsweise eine Leukocyten-Infiltration in
Entzündungstellen
(beispielsweise in einer Allergie vom Spät-Typ) inhibiert werden.
-
So
kann ein Agens (beispielsweise eine Rezeptor-Agonist) verabreicht
werden, das ein oder mehrere Funktionen eines Säuger-CXCR3-Proteins (beispielsweise
humanes CXCR3) fördert,
um eine entzündliche Antwort,
wie Leukozyten-Emigration, Chemotaxis, Exocytose (beispielsweise
von Enzymen) oder eine Freisetzung von Entzündungsmediator induziert (auslöst oder
fördert),
was zu der vorteilhaften Stimulierung der entzündlichen Prozesse führt. So
können
beispielsweise natürliche
Killer-Zellen rekrutiert werden, um virale Infektionen oder eine
neoplastische Erkrankung zu bekämpfen.
-
Der
Begriff „Individuum" umfasst hier definitionsgemäß Sauger,
umfassend, jedoch nicht beschränkt auf
Primaten (beispielsweise Menschen), Kühe, Schafe, Ziegen, Pferde, Hunde,
Katzen, Kaninchen, Meerschweinchen, Raten, Mäuse oder andere rinderartige,
schafartige, pferdeartige, hundeartige, katzenartige, nagerartige
oder mausartige Spezies. Erkrankungen und Zustände, die mit einer Entzündung, Infektion
und Krebs assoziiert sind, können
durch Verwendung des Verfahrens behandelt werden. In einer bevorzugten
Ausführungsform
ist die Erkrankung oder der Zustand eine/einer, in der/dem die Wirkungen
von Lymphozyten, insbesondere von Effektor-Zellen, wie aktivierte
oder stimulierte T-Lymphozyten
und natürliche
Killer-Zellen (NK) für
therapeutische Zwecke (umfassend prophylaktische) inhibiert oder
gefördert
werden. In einer besonders bevorzugten Ausführungsform ist die entzündliche
Erkrankung oder der Zustand eine T-Zellen-vermittelte Erkrankung
oder Zustand.
-
Erkrankungen
oder Zustände,
umfassend chronische Erkrankungen, von Menschen oder anderen Spezies,
die mit Inhibitoren einer CXCR3-Funktion behandelt werden können, umfassen,
sind jedoch nicht beschränkt
auf:
- • Entzündliche
oder allergische Erkrankungen und Zustände, umfassend systemische
Anaphylaxis oder hypersensitive Antworten, Arzneimittel-Allergien
(beispielsweise gegen Penicillin, Cephalosporine), Insektenstich-Allergien,
entzündliche
Darmerkrankungen, wie Crohn's-Erkrankung,
Colitis ulcerosa, Ileitis und Enteritis; Vaginitis, Psoriasis und
entzündliche
Dermatosen, wie Dermatitis, Ekzeme, atopische Dermatitis, allergische
Kontakt-Dermatitis, Urticaria; Vasculitis (beispielsweise nekrotisierende,
kutane und hypersensitive Vasculitis); Spondyloarthopathien; Skleroderma;
Atmungs-allergische Erkrankungen, wie Asthma, allergische Rhinitis,
hypersensitive Lungenerkrankungen, hypersensitive Pneumonitis, interstitielle
Lungenerkrankungen (ILD) (beispielsweise idiopathische Lungenfibrose
oder ILD assoziiert mit rheumatoider Arthrithis oder andere Autoimmunzustände);
- • Autoimmunerkrankungen,
wie Arthritis (beispielsweise rheumatoide Arthritis, psoriatische
Arthritis), Multiple Sklerose, systemischer Lupus erythematodes,
Myasthenia gravis, Diabetes, umfassend Diabetes mellitus und jugendliche
Diabetes, Glomerulonephritis und andere nephritische Erkrankungen
(nephritides), Autoimmun-Thyreoiditis, Behcet's-Erkrankung;
- • Gewebeabstoßung (beispielsweise
bei Transplantation), umfassend Allogewebe bzw. Transplantat-Abstoßung oder
Transplantat-gegen-Wirt-Reaktions-Erkrankungen;
- • Es
können
andere Erkrankungen oder Zustände,
bei denen unerwünschte
entzündliche
Antworten inhibiert werden müssen,
behandelt werden, umfassend, jedoch nicht beschränkt auf Arteriosklerose, Cytokin-induzierte
Toxizität,
Myositis (umfassend Polymyositis, Dermatomyosists).
- • Erkrankungen
und Zustande von Menschen oder anderen Spezies, die mit Promotoren
(beispielsweise einem Agonisten) einer CXCR3-Funktion behandelt
werden können,
umfassen, sind jedoch nicht beschränkt auf:
- • Krebs,
insbesondere solche mit Leukozyten Infiltration der Haut oder von
Organen, wie kutane T-Zell-Lymphome (beispielsweise Mycosis fungoides);
- • Erkrankungen,
bei denen Angiogenese und Neovascularisation eine Rolle spielt,
umfassend neoplastische Erkrankung, Retinopathie (beispielsweise
diabetische Retinopathie) und Makuladegeneration;
- • Infektiöse Erkrankungen,
wie bakterielle Infektionen und Lepra tuberculoides, und speziell
virale Infektionen;
- • Immunsuppression,
wie die in Individuen mit Immunschwache-Syndromen, wie AIDS, in
Individuen, die sich einer Strahlentherapie, Chemotherapie oder
einer anderen Therapie unterziehen, die eine Immunsuppression verursacht;
Immunsuppression durch einen angeborenen Mangel in einer Rezeptor-Funktion
oder andere Ursachen. Promotoren einer CXCR3-Funktion können ebenfalls
schützende
Wirkungen haben, die nützlich
sind, um eine Verarmung von Stammzellen während einer Krebs-Chemotherapie
zu bekämpfen (Sarris,
A. H. et al., J. Exp. Med., 178 (1993): 1127–1132).
-
Verabreichungs-Modi
-
Es
können
ein oder mehrere Agenzien über
eine geeignete Route an den Wirt verabreicht werden, entweder alleine
oder in Kombination mit einem anderen Arzneimittel. Es wird eine
wirksame Menge eines Agens (beispielsweise eines Rezeptor-Peptides,
das das Binden eines Liganden inhibiert, ein anti-CXCR3-Antikörper oder
ein Antigen bindendes Fragment davon) verabreicht. Eine wirksame
Menge ist eine Menge, die ausreichend ist, um die gewünschte therapeutische
oder prophylaktische Wirkung unter den Bedingungen der Verabreichung
zu erzielen, wie eine Menge, die ausreichend ist, um eine CXCR3-Rezeptor- Funktion zu inhibieren oder
zu fördern,
um dadurch einen Rezeptor-vermittelten Prozess (beispielsweise einen
entzündlichen
Prozess) zu inhibieren bzw. zu fördern.
-
Es
ist eine Vielzahl an Verabreichungsrouten möglich, umfassend, jedoch nicht
notwendigerweise beschränkt
auf orale, diätetische,
topische, parenterale (beispielsweise intravenöse, intraarterielle, intramuskuläre, subkutane
Injektion) und Inhalations- (beispielsweise
intrabronchiale, intranasale oder orale Inhalation, intranasale
Tropfen) Verabreichungsrouten in Abhängigkeit von dem Agens und
der zu behandelnden Erkrankung oder des Zustands. Für respiratorische
allergische Erkrankungen, wie Asthma, stellt eine Inhalation den bevorzugten
Verabreichungsmodus dar.
-
Formulierungen
eines zu verabreichenden Agens werden gemäß der ausgewählten Verabreichungsroute
variieren (beispielsweise Lösung,
Emulsion, Kapseln). Eine geeignete Zusammensetzung, die das zu verabreichende
Agens umfasst, kann in einem physiologisch annehmbaren Vehikel oder
Träger
hergestellt werden. Für
Lösungen
oder Emulsionen umfassen geeignete Träger beispielsweise wässrige oder
alkoholische/wässrige
Lösungen,
Emulsionen oder Suspensionen, umfassend Salzlösung und gepufferte Medien.
Parenterale Vehikel können
beispielsweise umfassen Natriumchlorid-Lösung, Ringer's Dextrose, Dextrose
und Natriumchlorid, Laktat-Ringer's oder feste Öl (fixed oils). Intravenöse Vehikel
können
verschiedene Additive, Konservierungsmittel oder Fluide, Nährstoff-
oder Elektrolyt-Nachfüller und
dergleichen umfassen (siehe im Allgemeinen Remington's Pharmaceutical
Sciences, 17. Auflage, Mack Publishing Co., PA, 1985). Zur Inhalation
kann das Agens solubilisiert werden und in einen geeigneten Spender
zur Verabreichung geladen werden (beispielsweise einen Zerstäuber, Vernebler
oder einen Spender mit unter Druck stehendem Aerosol).
-
Ist
das Agens ein Protein oder Polypeptid kann es weiterhin mittels
einer in vivo Expression des rekombinanten Proteins verabreicht
werden. Eine Expression in vivo kann mittels einer somatischen Zell-Expression
gemäß geeigneter
Verfahren geleistet werden (siehe beispielsweise
US-P-5,399,346 ). In dieser Ausführungsform
kann eine das Protein kodierende Nukleinsäure zum Zuführen in einen retroviralen,
adenoviralen oder anderen geeigneten Vektor (vorzugsweise ein Replikations-defizienter
Vektor) inkorporiert werden, oder kann in eine transfizierte oder
transformierte Wirtszelle eingeführt
werden, die das Protein zum Zuführen
exprimieren kann. In der letzteren Ausführungsform können die
Zellen implantiert werden (alleine oder in einer Barriereneinrichtung),
injiziert oder andersartig in einer Menge eingeführt werden, die wirksam ist,
um das Protein in einer Therapeutisch wirksamen Menge zu exprimieren.
-
Beispiele
-
Die
vorliegende Erfindung wird nun durch die folgenden Beispiele erläutert.
-
Humane Chemokine (Beispiele 1–2)
-
Die
CXC-Chemokine Mig, IL-8, GROα,
NAP-2, GCP-2, ENA78, PF4, die CC-Chemokine
MCP-1, MCP-2, MCP-3, MCP-4, MIP-1α,
MIP-1β,
RANTES, I309, Eotaxin und das Chemokin-verwandte Lymphotactin werden
gemäß etablierter
Protokolle chemisch synthetisiert (Clark-Lewis, I. et al., 1991,
Biochemistry 30: 3128–3135).
Das CXC-Chemokin IP-10 wurde von PeproTech, Rocky Hill, NJ. bezogen.
-
Beispiel 1: Klonieren einer Rezeptor-cDNA
(erläuterndes
Beispiel)
-
Molekularbiologische
Standard-Techniken wurden verwendet (Sambrook, J. et al., 1989,
Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory
Press, Cold Spring Harbor, NY).
-
DNA-Fragmente,
die möglicherweise
auf T-Lymphozyten beschränkte
Chemokin-Rezeptoren
kodieren, werden durch Verwendung der Polymerase-Kettenreaktion
(PCR) erzeugt. Basierend auf konservierten Motiven der Chemokin-Rezeptoren
werden zwei degenerierte Oligonukleotid-Primer aufgestaltet. Die
Gestaltung der Primer basierte auf den konservierten Nukleotidsequenzen
in der Transmembrandomäne
2 (TM2) und der Transmembrandomäne
7 (TM7) der Chemokin-Rezeptoren IL-8R1 (CXCR1), IL-8R2 (CXCR2),
CC-CKR1 (CCR1), CC-CKR2 (CCR2) und den Orphan-Rezeptoren EBI I,
LESTR und BLR1/MDR15 (EBI I, Birkenbach, M. et al., J. Virol. 67
(1993), 2209–2220);
LESTR, Loetscher, M. et al., J. Biol. Chem. 269 (1994), 232–237; und BLR1/MDR15,
Dobner, T. et al., Eur. J. Immunol. 22 (1992), 2795–2799 und
Barella, L. et al., Biochem. J., 309 (1995), 773–779).
-
Die
Sequenzen der Primer waren die folgenden:
SEQ ID NO: 3:
5'-GGG CTG CAG CII
T(T/G) (T/G) C(C/A)G AC(A/C) TIC TI(C/T) T-3'
SEQ ID NO: 4:
5'-GGG TCT AGA IGG
GTT IAI (G/A)CA (G/A)C(T/A) (G/A) (T/C)G-3'
(I = Inosin). Diese Primer wurden
in einer Polymerase-Kettenreaktion (PCR) zum Amplifizieren von DNA-Fragmenten
verwendet, wobei humane genomische DNA, die von humanen peripheren
Blut-Lymphozyten isoliert wurde, als Vorlage wie folgt verwendet
wurde. Ein 100 μl
Reaktionsgemisch, das 2 μg
humane genomische DNA, 1 × DynaZyme-Puffer
(Finnzymes OY, Espoo, Finnland), 1,5 mM MgCl2,
500 μM je
Desoxynukleotid, 1 μM
von beiden Primern und 2,5 U DynaZyme DNA-Polymerase umfasste, wurde
in einem DNA-Thermocycler (rechne
PHC-2, Brouwer, Schweiz) 30 Zyklen unterzogen (94°C für 1 Minute;
55°C für 1 Minute
und 72°C
für 2 Minuten).
PCR-Produkte der vorhergesagten Größe (ungefähr 700 bp) wurden in die Gene
Scribe-Bakterien-Vektoren pTZ18/19 U/R (USB, Cleveland, OH) kloniert,
teilweise sequenziert (Sanger, F. et al., Proc. Natl. Acad. Sci.
USA 74 (1977), 5463–5467)
und hinsichtlich ihrer Ähnlichkeit
zu bekannten Chemokin-Rezeptoren und
einer Expression ihrer entsprechenden mRNA in Leukozyten beurteilt.
Eine als 2MLC22 bezeichnetes DNA-Fragment zeigte eine 64%-ige Nukleotidsequenzidentität mit IL-8R2.
Das Fragment 2MLC22 hybridisierte spezifisch mit RNA von Bakterienzellen,
jedoch nicht von Monocyten oder Neutrophilen, wie durch Northern-Blot-Analyse
bewertet wurde, wobei eine Hybridisierungsprobe verwendet wurde,
die durch enzymatische Markierung von 2MLC22 mit dem radioaktiven
Isotop 32P erzeugt wurde, wobei das Klenow-Fragment
der DNA-Polymerase I und ein im Handel verfügbarer Markierungs-Kit mit
zufälligen
Primern verwendet wurde.
-
Das
Fragment 2MLC22 wurde enzymatisch mit 32P, wie beschrieben, markiert
und als Probe verwendet, um eine humane Tetanus-Toxoid-spezifische
CD4+ T-Zell (KT30)-cDNA-Bank zu durchmustern, die in Lambda-ZAP
Express erzeugt wurde (Stratagene, Zürich, Schweiz) (Loetscher,
M. et al., 1994, J. Biol. Chem., 269: 232–237). Es wurde gemäß den Herstellerangaben
eine cDNA-Bank in einem λ ZAP
Express-System erzeugt, wobei Poly(A)+ RNA
von humanen Tetanus-Toxoid-spezifischen CD4+ T-Zellen
(KT30) verwendet wurde. Die so erhaltene Bank umfasste ungefähr 1,8 × 106 unabhängige
Klone mit einer durchschnittlichen Insertgröße von ungefähr 1,1 kb.
Zum Plaque-Hybridisierungs-Screening wurden ungefähr 4 × 105 Klone auf Biodyne Nylonmembranen (PALL
AG, Muttenz, Schweiz) übertragen
und mit MLC22 beprobt, das zu einer spezifischen Aktivität von 1 × 109 dpm/μg
DNA markiert wurde, wobei der "high
prime" DNA-Markierungs-Kit
(Boehringer Mannheim, Mannheim, Deutschland) verwendet wurde. Die
Hybridisierung erfolgte in 50% Formamide, 6 × SSC, 0,5% SDS, 100 μg/ml denaturierter
Heringssperma-DNA bei 42°C
für 20
Stunden, wobei 1 × 106 dpm 2MLC22/ml Hybridisierungslösung verwendet
wurde. Die Membranen wurden einmal in 2 × SSC, 0,1% SDS bei Raumtemperatur
für 10
Minuten, zweimal in 1 × SSC,
0,1% SDS bei 65°C
für 30
Minuten und schließlich
einmal in 0,5 × SSC,
0,1% SDS bei 65°C
für 10
Minuten gewaschen. Von positiven Lambda Plaque-Hybridisierungen nach den hochstringenten
Waschungen wurden dreiundzwanzig Klone isoliert, wobei das größte Insert
(1670 bp) sequenziert wurde. Eine CXCR3-cDNA wurde in im Handel
verfügbare
Plasmidvektoren subkloniert zur Nukleotidsequenzierung, zum Erzeugen
von Hybridisierungsproben und zur Konstruktion von stabil transfizierten
Säuger-Zell-Klonen, die
CXCR3 exprimieren, wobei diese CXCR3-cDNA umfassenden Konstrukte
in E. coli-Stämmen
gehalten wurden.
-
Ergebnisse
-
Beim
Suchen nach für
T-Lymphozyten spezifischen Chemokin-Rezeptoren wurde aus einer humanen CD4+ T-Zell-Bank ein cDNA isoliert (1,
SEQ ID Nr. 1). Diese cDNA wurde nicht aufgefunden im Verlauf eines
Absuchens einer herkömmlich
verwendeten Monozyten-abgeleiteten cDNA-Bank oder einer Granulocyten
(HL60)-abgeleiteten cDNA-Bank
nach cDNAs neuer Chemokin-Rezeptoren; wobei jedoch eine direkte
Suche der Banken speziell nach CXCR3-cDNA nicht durchgeführt wurde.
Die CXCR3-cDNA, von der gezeigt wurde, dass sie einen IP-10/Mig-Rezeptor
kodiert (siehe nachstehend aufgeführt), weist einen offenen Leserahmen
(ORF) von 1104 bp auf, der an Rest 69 beginnt und ein Protein mit
368 Aminosäuren
mit einem vorhergesagten Molekulargewicht von 40659 Dalton kodiert.
Die Aminosäuresequenz
(2, SEQ ID Nr. 2) umfasst sieben putative Transmembransegmente,
die durch G-Protein-gekoppelte Rezeptoren gekennzeichnet sind, und
drei mögliche
N-Glykosylierungsstellen (Asn22, Asn32 und Asn199) (2).
Zusätzlich
können
in der intrazellulären
COOH-terminalen Region ein Threonin- und neun Serin-Reste gefunden
werden (2), die mögliche Phosphorylisierungsstellen
für Rezeptor-Kinasen
sind (Palczewski, K. und J. L. Benovic, Trends Biochem. Sci., 16
(1991), 387–391;
Chuang, T. T. et al., J. Biol. Chem. 267 (1992), 6886–6892; und
Giannini, E. et al., J. Biol. Chem. 270 (1995), 19166–19172).
-
Die
368 Aminosäuresequenz
des Rezeptors (IP-10/MigR, 2, SEQ
ID Nr. 2) wurde mit den Aminosäuresequenzen
anderer humaner Chemokin-Rezeptoren ausgerichtet, um fassend IL-8R1
(CXCR1), IL-8R2 (CXCR2), CC-CKR1 (CCR1), CC-CKR2A (CCR2a), CC-CKR3 (CCR3) und CC-CKR4
(CCR4). Es wurden mehrere Proteinausrichtungen gemäß Higgins
und Sharp durchgeführt
(Higgins, D. G. und P. M. Sharp, "Description of the method used in CLUSTAL," Gene 73 (1988),
237–244).
Die in 2 schwarz umrandeten Reste
stellen Regionen dar, die zwischen IP-10/MigR und mindestens zwei
anderen Chemokin-Rezeptoren
identisch sind. Die Ausrichtung zeigte mehrere konservierte Motive,
insbesondere in den Transmembrandomänen und in der zweiten intrazellulären Schleife.
In der dritten und in der sechsten Transmembrandomaine (2) wurde
eine signifikante Sequenzidentität
mit den CXC-Rezeptoren IL-8R1 und IL-8R2, jedoch nicht mit den CC-Chemokin-Rezeptoren beobachtet.
-
Die
Sequenz besitzt insgesamt eine 40,9%-ige und 40,3%-ige Aminosäureidentität mit den
IL-8R1- bzw. IL-8R2-Rezeptoren, und eine 34,2%-ige bis 36,9%-ige
Identität
mit den fünf
bekannten CC-Chemokin-Rezeptoren (Tabelle 1). Ein geringerer Grad
an Ähnlichkeit
wurde mit Sieben-Transmembrandomän-Rezeptoren
gefunden, die in T-Zellen exprimiert werden, die jedoch keine Chemokine
binden, beispielsweise eine 27,2%-ige Identität mit dem Thromin-Rezeptor
(Vu, T.-K. H. et al., 1991, Cell, 64: 1057–1068). Aus einer humanen,
genomischen DNA-Bank wurde kürzlich
ein verkürzter
Klon mit nicht identifizierter Funktion isoliert mit einer unvollständigen kodierenden
Sequenz, die mit der von
2 ausgerichtet
werden kann (Marchese, A. et al., 1995, Genomics, 29: 335–344). Tabelle 1 Aminosäuresequenzvergleich
von IP-10/Mig mit humanen Chemokin-Rezeptoren
| | IL-8R1 (CXCR1) | IL-8R2 (CXCR2) | CC-CKR1
(CCR1) | CC-CKR2A (CCR2a) | CC-CKR3
(CCR3) | CC-CKR4
(CCR4) | CC-CKR(CCR5) | ThrombR |
| IP-10/MigR | 40,9a | 40,3 | 34,9 | 34,2 | 34,4 | 35,8 | 36,9 | 27,2 |
| IL-8R1 | | 77,1 | 33,7 | 32,9 | 34,3 | 39,7 | 34,3 | 29,1 |
| IL-8R2 | | | 34,9 | 33,6 | 34,1 | 40,8 | 34,4 | 29,7 |
| CC-CKR1 | | | | 54,1 | 63,1 | 49,3 | 56,3 | 26,8 |
| CC-CKR2A | | | | | 50,7 | 46,1 | 68,8 | 24,6 |
| CC-CKR3 | | | | | | 46,5 | 52,3 | 27,3 |
| CC-CKR4 | | | | | | | 50,0 | 29,2 |
| CC-CKR5 | | | | | | | | 23,6 |
- a Die Zahlen beziehen sich auf die prozentuale
Aminosäureidentität. Paarweise
Proteinsequenz-Ausrichtungen wurden unter Verwendung des Programms
PALIGN mit einem offenen Lückenaufwand
(open gap cost) und einen einheitlichen Lückenaufwand (unit gap cost)
von 3 bzw. 2 durchgeführt.
-
Beispiel 2. Biologische Aktivität (erläuterndes
Beispiel)
-
Expression in aktivieren T-Lymphozyten
-
Angesichts
der beobachteten Chemokin-Selektivität wurde das Vorliegen von IP-10/MigR in Leukozyten
und verwandten Zell-Linien durch Northern-Blot-Analysen untersucht.
Es wurden 10 μg
Proben von Gesamt-RNA aus frisch isolierten humanen Blut-Monocyten, Neutrophilen,
Lymphozyten (PBL), mit Nylonwolle gereinigte T-Zellen und von kultivierten
Zellen, umfassend geklonte humane CD4+ T-Zellen
(KT30) und CD8+ T-Zellen (ERCD8), klonierten
NK-Zellen (ERNK57) und PBL, die für 10 Tage kultiert wurden (1–2,5 × 106 Zellen/ml in RPMI 1640 Medium, das 2 mM
Glutamin, 1 × nicht-essentielle
Aminosäuren,
1 mM Natriumpyruvat, 100 μg/ml
Kanamycin, 5 × 10–5 M
2-Mercaptoethanol und 5% humanes Serum umfasste) in der Gegenwart
von 400 U/ml hrIL-2 untersucht (das humane rekombinante IL-2 wurde
von Dr. A. Lanzavecchia, Basel Institute of Immunology, Basel, Schweiz
zu Verfügung
gestellt). Agarosegele wurden mit Ethidiumbromid gefärbt, um
die Integrität
und die Menge der Gesamt-RNA auf dem Gel vor dem Transfer zu überprüfen. Die
RNA-Proben wurden mit einem 32P-markierten
5'-Fragment der
IP-10/MigR DNA (109 cpm/μg DNA) bei 5 × 106 cpm/ml Hybridisierungslösung wie beschrieben analysiert
(Loetscher, M. et al., 1994, J. Biol. Chem., 269: 232–237). Das
als Northern-Sonde verwendete 5'-Fragment
wurde durch Verdau einer CXCR3-cDNA in pBK-CMV-Vektor (Stratagene
GmbH, Zürich,
Schweiz) mit PstI erzeugt, was zu dem 724 bp 5'-Ende der CXCR3-cDNA (1) führte.
-
Ergebnisse
-
In
den klonierten CD4+ T-Zellen, KT30, wurde
eine starke Expression der mRNA der erwarteten Größe gefunden,
die zur Isolierung der Rezeptor-cDNA verwendet wurde. Ähnliche
Expressionsspiegel wurden in dem CD8+ T-Zell-Klon,
ERCD8 und dem NK-Zell-Klon,
ERNK57 gefunden. Im Unterschied dazu waren in frisch isolierten
Blut-Lymphozyten und mit Nylonwolle gereinigten T-Zellen IL 10/MigR-Transkripte
kaum nachweisbar. Wurden diese Zellen jedoch in der Gegenwart von
IL-2 kultiviert, wurde eine starke Hochregulierung beobachtet und
der Spiegel der Rezeptor-mRNA erreichte den der T- und NK-Zellklone.
Unter diesen Bedingungen wurden in frisch isolierten Blut-Monocyten,
neutrophilen Leukozyten oder eosinophilen Leukozyten keine IL-10/MigR-Transkripte
nachgewiesen. Zusätzlich
exprimierten Leukozyten-verwandte Zellen die IL 10/MigR-mRNA nicht,
umfassend die Mastzell-Linie, HMC-1, die promyelocytische Leukämie-Linie,
HL60, das histocytische Lymphom, U937, die chronische myelogene
Leukämie-Linie,
K562, die akute T-Zell-Leukämie-Linie,
Jurkat, die akute lymphoblastische Leukämie-Linie, Molt, die B-lymphoblastischen
Zell-Linien Daudi und Raji, Lymphozyten von Patienten mit chronischer
und akuter B-Lymphoid-Leukämie
(B-CLL und B-ALL), reife Basophile von einem Patient mit basophiler
Leukämie
und die Erythroleukämie-Zell-Linie,
HEL. Im Gegensatz wurde gezeigt, dass die Rezeptoren, von denen
kürzlich
gezeigt wurde, dass sie Lymphocyten anziehen, d.h. MCP-1, MCP-2,
MCP-3, MIP-1α,
MIP-1β und
RANTES (Loetscher, P. et al., FASEB J. 8 (1994), 1055–1060; Carr,
M. W. et al., Proc. Natl. Acad. Sci. USA 91 (1994), 3652–3656; Taub,
D. D. et al., Science 260 (1993), 355–358; Schall, T. J. et al.,
J. Exp. Med. 177 (1993), 1821–1825;
Schall, T. J. et al., 1990, Nature, 347: 669–672), ebenfalls auf Monocyten
und Granulocyten gefunden werden. Die begrenzte Expression von IP-10/MigR
in aktivierten T-Lymphozyten und einer natürlichen Killer-Zell-Linie läßt vermuten,
dass dieser neue Rezeptor eine selektive Lymphozyten-Rekrutierung
vermitteln kann.
-
Stabile Transfektanten
-
Die
CXCR3-cDNA wurde mittels Verdau mit BamHI and XbaI aus pBK-CMV (Stratagene
GmbH, Zürich,
Schweiz) freigesetzt und in BamHI- und XbaI-Stellen von pcDNA3 (Invitrogen
BV, WB Leek, Niederlande) kloniert, um pcDNA3-Klon 8 zu ergeben,
der in Escherichia coli (XL1 Blue) gehalten und gelagert wurde.
-
Um
stabile Transfektanten zu erzeugen, wurden entweder 4 × 106 pre-B Zellen der Maus (300–19) (Thelen,
M. et al., FASEB. J. 2 (1988), 2702–2706), humane promyelocytische
Zellen (GM-1) (Garotta, G. et al., J. Leukozyte Biol. 49 (1991),
294–301)
oder humane akute T-Zell-Leukämie-Zellen
(Jurkat) (Loetscher, P. et al., FEBS Lett. 341 (1994), 187–192) durch
Elektroporation mit 20 μg
Rezeptor-cDNA in pcDNA3, der mit BglII linearisiert wurde, wie kürzlich beschrieben,
transfiziert (Moser, B. et al., Biochem. J. 294 (1993), 285–292). IP-10/MigR-transfizierte
Zellen wurden durch begrenzende Verdünnung unter G-418-Selektion (Life Technologies,
Inc.) kloniert (1,0 mg/ml G-418 für 300–19 und 0,8 mg/ml G- 418 für Jurkat-
and GM-1-Zellen). G-418 resistente Klone wurden nach einer Rezeptor-Expression mittels
RNA-Dot-Blot-Analyse durchmustert.
-
Ca2+-Fluss
-
Um
die Funktionalität
des Rezeptors zu bestimmen, wurden Klone muriner pre-B-Zellen (300–19), humaner
promyelocytische Zellen (GM-1) und humaner T-Zell-Leukämie-Zellen (Jurkat) mit
Rezeptor-cDNA, wie vorstehend beschrieben, stabil transfiziert.
Eine Aktivierung der Chemokin-Rezeptoren führte zu einer transienten Zunahme
der im Cytosol frei vorkommenden Ca2+-Konzentration
([Ca2+]i), wobei
dieser Assay verwendet wurde, um eine Signalisierung in den transfizierten
Zellen zu beobachten.
-
Veränderungen
der im Cytosol frei vorkommenden Ca2+-Konzentration
([Ca2+]i) wurden
in Zellen, die mit Fura-2 beladen waren, erfaßt, durch eine 30-minutige
Inkubation bei 37°C
mit 0,1 nmol Fura-2-acetoxymethylester pro 106 Zellen
in einem Puffer, der 136 mM NaCl, 4,8 mM KCl, 1 mM CaCl2,
5 mM Glucose und 20 mM HEPES, pH-Wert 7,4 umfasste. Nach Zentrifugation
wurden beladene Zellen in dem gleichen Puffer (106 Zellen/ml)
resuspendiert, mit dem angezeigten Chemokin bei 37°C stimuliert
und es wurden [Ca2+]i-bezogene Fluoreszenzänderungen
aufgezeichnet (von Tscharner, V. et al., Nature 324 (1986), 69–372).
-
Ergebnisse
-
Als
Antwort auf IP-10 und Mig wurde eine schnelle [Ca2+]i-Zunahme beobachtet. Es wurde gezeigt, dass
das Chemokin IP-10 bei hypersensitiven Reaktionen der Haut von Spat-Typ exprimiert wird
(Luster, A. D. et al., 1985, Nature, 315: 672–676; Kaplan, G. et al., 1987,
J. Exp. Med., 166: 1098–1108).
Das als Mig bezeichnete Chemokin wurde kürzlich identifiziert (Farber,
J. M., 1990, Proc. Natl. Acad. Sci. USA, 87: 5238–5242; Farber,
J. M., 1993, Biophys. Res. Commun., 192: 223–230). Beide Chemokine weisen
die CXC-Anordnung
der ersten beiden Cysteine wie IL-8 auf, sind jedoch nicht chemotaktisch
für neutrophile
Leukozyten. Es wurde kürzlich
berichtet, dass IP-10 T-Lymphozyten anzieht (Luster, A. D. und P.
Leder, 1993, J. Exp. Med., 178: 1057–1065; Taub, D. D. et al.,
1993, J. Exp. Med., 177: 1809–1814),
und dass Mig chemotaktisch für
Tumor-assoziierte Lymphozyten ist (Liao, F. et al., 1995, J. Exp.
Med., 182: 1301–1314).
-
3A–3C fassen
die Wirkungen von IP-10 und Mig auf Zellen zusammen, die mit der
cDNA transfiziert wurden und die funktionalen IP-10/Mig exprimieren.
Wie durch ([Ca2+]i-Änderungen
gezeigt (3A), war die Wirkung von IP-10
und Mig konzentrationsabhängig
und bereits bei 1 nM nachweisbar, was zeigt, dass beide Chemokine
eine hohe Affinität
für den
neuen Rezeptor aufweisen. Im Gegensatz antworteten die IP-10/Mig-Transfektanten
bei Konzentration bis zu 100 nM nicht auf irgendeines der 16 anderen
potentiellen Agonisten, umfassend die Chemokine IL-8, GROα, NAP-2,
GCP-2, ENA78, PF4; die CC-Chemokine MCP-1, MCP-2, MCP-3, MCP-4,
MIP-1α,
MIP-1β,
RANTES, I309, Eotaxin oder das Chemokin-verwandte Lymphotactin (nicht
gezeigt). Mit mäuseartigen
und den humanen transfizierten Zellen wurden identische Ergebnisse
erzielt. Diese Beobachtungen zeigen, dass der neue Rezeptor hoch
selektiv für
IP-10 und Mig ist. Entsprechend wird der Rezeptor hier als ein IP-10/Mig-Rezeptor
(IP-10/MigR) oder als "CXCR3" bezeichnet, was
dessen Spezifität
für CXC-Chemokine
wiederspiegelt.
-
Wie
in 3B gezeigt führt
eine wiederholte Stimulierung mit IP-10 oder Mig zu einer Deallergisierung,
die für
Chemokin-Rezeptoren typisch ist. Weiterhin kommt es zu einer Kreuz-Deallergisierung,
wenn die Zellen mit IP-10 gefolgt von Mig oder umgekehrt stimuliert
werden, was bestätigt,
dass der Rezeptor eine hohe Affinität für beide Chemokine aufweist.
Bei einer Konzentration von 100 nM wird deutlich, dass Mig in einer Kreuz-Deallergisierung
wirksamer als IP-10 ist, was eine höhere Affinität oder Bindungs-Stabilität des IP-10/Mig-Rezeptors
für Mig
vermuten lässt.
-
Obwohl
eine Expression von funktionalem IP-10/MigR gezeigt wurde, haben
Bindungsexperimente unter Verwendung von radioaktiven Liganden ein
nicht-spezifisches Binden zwischen 60 und 80% des Gesamten deutlich
gemacht, was eine Bestimmung von Bindungsparametern verhinderte.
Da IP-10 und Mig stark kationisch sind (pI-Werte von 10,8 und 11,1)
kann eine nichtspezifische Wechselwirkung mit Proteoglykanen der Zelloberfläche diese
Ergebnisse erklären.
Tatsächlich
wurden auf einer Vielzahl von Blut- und Gewebezellen nicht auf den Chemokin-Rezeptor
bezogene, Heparine-sensitive Bindungsstellen für IP-10 (und PF4) nachgewiesen
(Luster, A. D. et al., 1995, J. Exp. Med., 182: 219–231), wobei
Heparansulfat IP-10 und Mig bindet und eine Lymphozyten-Chemotaxis verhindert
(nicht gezeigt). Die Heparin-Bindungsstelle ist wahrscheinlich nicht an
einer Bindung CXCR3-Rezeptor-Bindung beteiligt und es kann ein Einschluss
eines geeigneten Heparin-Derivates, wie Chondroitinsulfat in der
Reaktion (beispielsweise im Bindungspuffer) verwendet werden, um ein
nicht-spezifisches Binden an Zellen durch die Heparin-Bindungsstelle
zu inhibieren.
-
Chemotaxis
-
PBL
wurden von Leukozytenfilmen (buffy coats) aus Spenderblut frisch
isoliert. Die Leukozytenfilme aus Spenderblut wurden von dem zentralen
Labor-Blut-Transfusions-Service
der Schweiz (SRK) bereitgestellt. Eine Isolation von PBL des Leukozytenfilms
wurde durchgeführt
wie beschrieben in Colotta, F. et al., J. Immunol. 132 (1984), 936–944.
-
Von
Leukozytenfilmen aus Spenderblut frisch isolierte PBL wurden ohne
weiteres Bearbeiten verwendet oder wurden nach einer 10-tägigen Kultivierung
in der Gegenwart von IL-2 verwendet (1–2,5 × 106 Zellen/ml
in RPMI 1640 Medium das 2 mM Glutamin, 1 × nicht-essentielle Aminosäuren, 1
mM Natriumpyruvat, 100 μg/ml
Kanamycin, 5 × 10–5 M
2-Mercaptoethanol
und 5% humanes Serum in der Gegenwart von 400 U/ml hrIL-2 umfasste).
-
Eine
Zellwanderung wurde in Kammern mit 48 Vertiefungen bewertet (Neuro
Probe, cabin John, MD, USA), wobei Polyvinylpyrrolidine-freie Polycarbonat-Membranen
(Nucleopore) mit 5 μm
Poren für
IP-10/MigR transfizierte Zellen (Loetscher, P. et al., FEBS Lett.
341 (1994), 187–192)
oder mit 3 μm
Poren für
humane PBL (Loetscher, P. et al., FASER J. 8 (1994), 1055–1060) verwendet
wurden. Es wurde mit 20 mM Hepes, pH-Wert 7,4, und 1% pasteurisierte
Plasma-Proteinlösung
(Labor des Roten Kreuzes der Schweiz, Bern, Schweiz) ergänztes RPMI
1640 verwendet, um die Chemokine zu lösen (unter Vertiefungen) und
um die Zellen zu verdünnen
(100000 Rezeptor-Transfektanten oder PBL in der oberen Vertiefung).
Nach 60 Minuten bei 37°C
wurde die Membran entfernt, an der oberen Seite mit PBS gewaschen,
fixiert und gefärbt.
Alle Assays wurde als Dreifachbestimmung durchgeführt und
die gewanderten Zellen wurden in fünf willkürlich ausgewählten Feldern
bei 1000-facher Vergrößerung gezählt. Die
spontane Wanderung wurde in der Abwesenheit eines Chemoattraktors
durchgeführt.
-
Ergebnisse – transfizierte Zellen
-
Transfizierte
Zellen, die IP-10/MigR bereitwillig exprimieren, wandern in Richtung
IP-10 oder Mig,
während
die nicht-transfizierten Eltern-Zellen nicht antworteten (3C). beide Agonisten zeigten eine übliche zweiphasige
Konzentrationsabhängigkeit.
IP-10 induzierte eine Wanderung bei Konzentrationen unter 1 nM, während die
Antwort von Mig bei Konzentrationen über 10 nM nachweisbar wurde.
Die Wirksamkeit, die durch die maximale Zahl der gewanderten Zellen
erfasst wird, war ungefähr
zweimal so hoch für
Mig als für
IP-10. Diese Ergebnisse zeigen, dass IP-10/MigP, wie alle bekannten
Chemokin-Rezeptoren
in Leukozyten, eine Chemotaxis als Antwort auf einen Liganden vermittelt.
-
Ergebnisse – Leukozyten aus humanem Blut
-
Übereinstimmend
mit der zellulären
Verteilung des IP-10/MigR, wurde festgestellt, dass humane T-Lymphozyten
auf IP-10 and Mig stark reagieren (4A–4B).
Die Aktivität
von IP-10 und Mig als Inducer von [Ca2+]i-Änderungen
(4A) und einer in vitro Chemotaxis (4B) stimmte mit den Wirkungen überein, die bei Verwendung
von transfizierten Zellen beobachtet wurden, die IP-10/MigR exprimieren,
wobei IP-10 stärker,
aber weniger wirksam als Mig war. Eine Aktivierung der T-Lymphozyten
durch Kultiviren in der Gegenwart von IL-2 war für eine Induktion eines Calcium-Flusses
und einer Chemotaxis erforderlich, wobei mit frisch isolierten Blut-Lymphozyten
unter den verwendeten Bedingungen keine Antwort beobachtet wurde.
-
Materialien und Verfahren für Beispiele
3–9
-
In
den Beispielen 3–9
wurden die folgenden Materialien und Verfahren verwendet.
-
Chemokine
-
Rekombinante
humane Chemokine wurden von Peprotech (Rocky Hill, NJ) bezogen,
mit Ausnahme von dem kürzlich
beschriebenen Eotaxin (Ponath, P. D., et al., 1996, J. Clin. Invest.,
97: 604–612;
siehe ebenfalls Ponath et al.,
WO
97/00960 , veröffentlicht
am 9. Januar 1997), das von Dr. Ian Clark-Lewis zur Verfügung gestellt
wurde.
125I-markierte Chemokine von Du Pont
NEN (Boston, MA) bezogen.
-
Zellen und Zell-Linien
-
Neutrophile
und PBMCs wurden wie beschrieben isoliert (Ponath, P. D., et al.,
J. Clin. Invest., 97 (1996), 604–612). Um CD3-Blasten/Blastocysten
(blasts) zu erzeugen, wurde Gewebekulturplatten, die mit dem anti-CD3-Antikörper TR66
beschichtet wurden, 2 × 106 PBMC/ml in RPMI-1640 plus 10% FCS zugesetzt. Nach
4–6 Tagen
wurden Blasten/Blastocysten in neues Medium überführt und mit IL-2 (freundlicherweise
bereitgestellt von Antonio Lanzavecchia, Basel) mit 50 Units/ml
ergänzt.
-
Andere
verwendete Zell-Linien umfassten Transfektanten des mäuseartigen
L1.2 pre B-Zell-Lymphoms,
die entweder CXCR3 (siehe nachstehend aufgeführt), IL-8 RA (Ponath, P. D.,
et al., 1996, J. Exp. Med., 183: 2437–2448), IL-8 RB (Ponath, P.
D., et al., J. Exp. Med., 183 (1996), 2437–2448), CCR2b (G. LaRosa, nicht
veröffentlicht),
CCR4, CCR5 (Wu, L., et al., Nature 384 (1996), 179–183) oder
CCR1 (Campbell, J. J., et al., J. Cell Biol. 134 (1996), 255–266) exprimieren.
-
Erzeugen von CXCR3-Transfektanten
-
Zellen
-
L1.2-Zellen
wurden in RPMI-Medium 1640, 10% Fetal Clone (von Hyclone, Inc.),
50 U/ml Penicillin/Streptomycin, 1 × L-Glutamin, 1 mM Natriumpyruvat
und 5,5 × 10–5 M β-Mercaptoethanol wachsen
gelassen. Die Medienkomponenten wurden von GibcoBRL bezogen, mit
Ausnahme des 10% Fetal Clone, das von Hyclone, Inc. bezogen wurde.
Zwei Tage vor einer Transfektion wurden die L1.2-Zellen in frischem
Medium 1:5 verdünnt.
Dies führte
zu 150 Millionen Zellen in der log-Phase des Wachstums mit einer
Konzentration von ungefähr
1–3 Millionen
Zellen/ml.
-
CXCR3-DNA und Transfektion
-
E.
coli XL1Blue Zellen (Stratagene, Inc. (Kat. Nr. 200236)) wurden
gemäß dem Protokoll
des Herstellers mit pcDNA3-Klon 8 transformiert (Beispiel 2; Loetscher,
M., et al., 1996, J. Exp. Med., 184: 963–969). Die Transformanten wurden
bei 37°C
wachsen gelassen, während
sie bei 250 rpm in 500 ml 100 μg/ml
Ampicillin beinhaltendem LB geschüttelt wurden. Die Kultur wurde
dann durch Zentrifugation bei 8000 × g gesammelt, und das Plasmid
wurde unter Verwendung einer Maxi Plasmid-Reinigungs-Säule and
des Protokolls gereinigt (Qiagen, Kat. Nr. 12162). Die Plasmidkonzentration
und Reinheit wurde mittels eines 1%-igen Agarosegels und mittels
OD260/280-Verhältnissen
bestimmt. Die Plasmid-DNA
wurde in ddH2O gelöst und bis zur Verwendung bei –20°C gelagert.
-
Zum
Linearisieren des Vektors wurde eine ScaI-Endonuclease verwendet.
100 μg DNA
wurde mit 10 μl
ScaI für
8 Stunden bei 37°C
gemäß dem Herstellerprotokoll
verdaut (GibcoBRL, Kat. Nr. 15436-017). 20 μg wurde direkt zum Ausführen einer
stabilen Transfektion verwendet. 80 μg wurde von Proteinen und Salzen
mit einer Phenol:Chloroform:Isoamylalkohol (25:24:1)-Extraktion,
Fällung
in 100% Ethanol (mit 0,1 Volumen NH4COOH)
und einem Waschen mit 70% Ethanol gereinigt.
-
Stabile
Transfektanten einer mäuseartigen
pre-B Lymphom-Zellline (L1.2) wurden im Wesentlichen wie beschrieben
erzeugt (Ponath, P. D., et al., 1996, J. Exp. Med., 183: 2437–2448).
Es wurden 25 Millionen L1.2-Zellen einer Elektroporation in 0,8
ml 1 × PBS
unterzogen mit 20 μg
linearisierter DNA, 20 μg
linearisierter DNA, die dann gereinigt wurde (siehe vorstehend unter
Linearisierung des DNA aufgeführt)
oder ohne DNA. Vor der Elektroporation wurden die L1.2-Zellen und
die DNA für
10 Minuten in 50 ml konischen Röhrchen
(Falcon Modell 2070) bei sanftem Mischen (Verwirbeln) alle 2 Minuten
inkubiert. Das L1.2-Zell-DNA-Gemisch wurde in Gene Pulser-Küvetten mit
einer 0,4 cm Elektrodenlücke überführt (BioRad,
Kat. Nr. 165-2088). Das Gemisch wurde dann einer Elektroporation
bei 250 V und 960 μF
unterzogen, wobei die Dauer des Schocks und die tatsächliche
Spannung erfasst wurden. Nach der Elektroporation wurde die Küvette für 10 Minuten
bei Raumtemperatur in Ruhe gelassen. Dann wurde das gesamte L1.2-Zell-DNA-Gemisch in einen
T-25-Kolben (Costar) überführt und
für 2 Tage
in 10 ml nicht-selektivem Medium wachsen gelassen.
-
Selektion
-
CXCR3
exprimierende Zellen wurden dann einer Selektion auf Neomycinresistenz
unterzogen. Nach zweitägigem
Wachstum in nicht-selektivem Medium wurde 10 ml von 1,6 g/L Geneticin
(GibcoBRL) mit einer Endkonzentration von 0,8 g/L zugesetzt (die
selektive und beibehaltene Konzentration). Dies konnte dann für 10 bis
15 Tage wachsen, wobei frisches Selektionsmedium zugesetzt wurde,
wenn die Zellen zu überwuchern begannen.
Frisches Selektionsmedium bestand aus RPMI-1640, das mit 10% Rinderserum
und 800 μg/ml G418
ergänzt
wurde.
-
Die
Zelloberflächenexpression
von CXCR3 wurde mittels Chemotaxis bewertet, wobei ebenfalls eine Ligandenbindungs-
und Scatchard-Analyse verwendet wurde, um eine Oberflächenexpression
zu beobachten. Nach G418-Selektion wurden CXCR3-exprimierende Zellen
auf Basis der Fähigkeit
zur Chemotaxis selektioniert. Für
jede Elektroporationsreaktion wurden 30 ml (800000 Zellen/ml) gesammelt
und in 600 μl
selektivem Medium suspendiert. Das selektive Medium, 600 μl, die 10
nM IP-10 umfassten, wurde in der unteren Kammer von BioCoat-Zellkulturplatten
von Becton-Dickinson (Kat. Nr. 40575) angeordnet. In die obere Kammer
der BioCoat-Platten wurden 100 μl/Vertiefung
der L1.2-Zellen zugesetzt. Diese Zellen konnten dann über Nacht
eine Chemotaxis in einer CO2-Inkubationsvorrichtung
bei 37°C
durchführen.
Die obere Kammer mit den Zellen, die keine Chemotaxis zeigten, wurde
entfernt. Die Chemotaxis zeigenden Zellen wurden gesammelt, in frisches Medium überführt und
in einer Platte mit 24 Vertiefungen wachsen gelassen. Sie wurden
nacheinander in einen T-25 und den einen T-75-Kolben von Costar
expandiert.
-
Transfektanten,
die den Rezeptor mit hohen Spiegeln exprimierten, wurden durch begrenzende
Verdünnung
kloniert. CXCR3-transfizierte Zellen wurden in G418 umfassenden
Selektionsmedium verdünnt,
so dass zwischen 30–3
Zellen/ml vorlagen. Zu Gewebekulturplatten mit 96 Vertiefungen wurden
Teilmengen von 100 μl/Vertiefung
zugesetzt. Nach 14 Tagen bei 37°C
und 5% CO2 wurden Vertiefungen, die einzelne
Kolonien enthielten, unter einem Inversionsmikroskop identifiziert.
Es wurden dann 50 ml der Zellen überführt und
mit einem anti-CXCR3 mAb, wie vorstehend aufgeführt, gefärbt und durch Strömungszytometrie
analysiert. Die Spiegel bzw. Höhe
der Rezeptor-Expression korrelierte mit der mittleren Fluoreszenzintensität und es
wurde starke Exprimierer ausgewählt.
Sobald eine stabile Zell-Linie etabliert wurde, wurde die Linie
zur Verwendung expandiert.
-
Zusätzlich zur
Selektion nach Antibiotikaresistenz und Chemotaxis, können CXCR3-Transfektanten ferner
durch ein Sortieren nach höherer
Rezeptor-Expression durch Antikörper-Färbung selektioniert
werden, obwohl dies hier nicht durchgeführt wurde. Zum Färben können transfizierte
Zellen auf 5 × 106/ml in sterilem PBS resuspendiert werden,
das 1% Rinderserumalbumin umfasst. Es können isolierte, sterile anti-CXCR3 mAb
mit einer Endkonzentration von 3 μg/ml
zugesetzt werden, wobei die Zellen für 30 Minuten auf Eis inkubiert
werden. Nach Waschen mit kalten, sterilen PBS kann der gebundene
mAb durch FITC-konjugiertes anti-Maus IgG nachgewiesen werden, das
durch Filtration durch einen 0,2 um Filter sterilisiert wurde. Die
Zellen können
wieder gewaschen werden und mittels Strömungszytometrie sortiert werden.
Die oberen 5% an positiven Zellen können gesammelt werden und in
eine Gewebekultur rückgeführt werden,
um unter selektiven Bedingungen expandiert zu werden (beispielsweise
RPMI-1640 ergänzt
mit 10% Rinderserum und 800 μg/ml G418).
-
Beispiel 3: IP-10 bindet mit hoher Affinität an einen
Rezeptor, der auf mit CXCR3-DNA transfizierten L1.2-Zellen und auf
aktivierten Zellen exprimiert wird (erläuterndes Beispiel)
-
Es
wurden zusätzliche
Bindungsstudien unter Verwendung von radioaktiv markiertem IP-10
durchgeführt.
Ein Binden von Chemokin an Ziel-Zellen wurde wie kürzlich beschrieben
durchgeführt
(Ponath, P. D., et al., 1996, J. Clin. Invest. 97: 604–612; Van
Riper, G., et al., 1993, J. Exp. Med., 177(3): 851–856). Die
Zellen wurden einmal in PBS gewaschen und in Bindungspuffer (50
mM HEPES, pH-Wert 7,5, 1 mM CaCl2, 5 mM MgCl2, 0,5% BSA und 0,05% Azid) mit einer Konzentration
von 107/ml resuspendiert. Teilmengen von
50 μl (5 × 105 Zellen) wurden in Microfugen-Röhrchen verteilt,
gefolgt von der Zugabe von kaltem Konkurrenten (nicht-markiertes
IP-10) und radioaktiv markiertem Chemokin (0,05 nM 125I-markiertes
IP-10). Das Endreaktionsvolumen betrug 200 μl. Durch Inkubation von Zellen
mit radioaktiv markierten Chemokinen in der Gegenwart von 250–500 nM
nicht-markierten
Chemokinen wird ein nicht-spezifisches Binden bestimmt. Nach einer 60-minütigen Inkubation
bei Raumtemperatur wurden die Zellen dreimal mit 1 ml Bindungspuffer,
der 0,5 M NaCl umfasst, gewaschen. Die Zellpellets wurden dann gezählt. Der
Wettbewerb wurde dargestellt als der Prozentsatz an spezifischer
Bindung, die berechnet wurde durch 100 × [(S – B)/(T – B)], wobei S die Radioaktivität der Probe
ist, B der Bindungshintergrund und T die Gesamtbindung ohne Konkurrenten
ist. Der Bindungshintergrund wurde dadurch erhalten, dass Zellen
mit radioaktiv markierten Chemokinen und einem mindestens 400-fachen Überschuss
an nicht-markierten Chemokinen inkubiert wurden. Während der
Experimente wurden Duplikate verwendet und die Standardabweichung
betrug immer < 10%
des Mittels. Alle Experimente wurden mindestens dreimal wiederholt.
Eine Kurvenanpassung und Konzentrationen, die 50% an spezifischem
Binden inhibieren (IC50) wurden durch die
KaleidaGraph-Software/Synery Software, Reading, PA) berechnet.
-
Die 5A–5B zeigen,
dass 125I-markiertes IP-10 an L1.2-Zellen,
die mit CXCR3 transfiziert sind (5A)
und an CD3-aktivierte T-Zellen (5B)
bindet und dass dieses Binden durch ansteigende Konzentrationen
an kaltem IP-10 inhibiert werden kann. Eine Scatchard-Analyse macht
deutlich, dass IP-10 an L1.2-CXCR3-Transfektanten mit einem Kd von
614 pM gebunden ist, und dass diese Transfektanten 37000 Rezeptoren
pro Zelle exprimieren (5A,
Einfügung).
Eine ähnliche
Analyse der anti-CD3 aktivierten, IL-2 stimulierten T-Zellen verdeutlicht
einen Kd von 156 pM und 17000 Rezeptoren pro Zellen (5B). Ein Binden von 125I-markiertem
IP-10 an aktivierte T-Zellen kann durch kaltes Mig unter den gleichen
Bedingungen vollständig
inhibiert werden, auch wenn Mig etwas weniger wirksam beim Blockieren
des Bindens von 125I-markiertem IP-10 war,
als es kaltes IP-10 war (nicht gezeigt). IP-10 und Mig binden CXCR3
mit hoher Affinität
(Kd ~150–600
pM).
-
Beispiel 4: Erzeugung und Charakterisierung
monoklonaler Antikörper
(mAbs), die für
CXCR3 spezifisch sind
-
Um
Antagonisten von CXCR3 zu entwickeln und um eine Rezeptor-Expression
und Regulation zu studieren, wurde ein mAbs-Panel durch Immunisierung
von Mäusen
mit einem synthetischen Peptid erzeugt, das dem N-Terminus dieses
Rezeptor entspricht. Diese mAbs erkennen spezifisch CXCR3-Transfektanten,
jedoch nicht ein Auswahl anderer Rezeptor-Transfektanten.
-
mAb-Erzeugung und Strömungszytometrie
-
Mit
CXCR3 reagierende mAbs wurden durch fünfmalige Immunisierung über einen
Zeitraum von 10 Wochen von Balb/C-Mäusen mit 10 μg eines 37meren
synthetischen Peptides erzeugt, das den ersten 37 N-terminalen Aminosäuren von
CXCR3 entspricht (siehe ebenfalls Loetscher M., et al., J. Exp.
Med. 184 (1996), 963–969).
Dieses Peptid wurde synthetisiert und an ein gereinigtes Proteinderivat
von Tuberculin gekoppelt (Severn Biotech Ltd., Kidderminster, UK).
Die erste Immunisierung erfolgte intraperitioneal (IP) mit vollständigen Freund's Adjuvans (FCA).
Die zweite, dritte und vierte Immunisierung erfolgten IP mit unvollständigem Freund's Adjuvans (FIA)
und die letzte Immunisierung erfolgte lediglich mit Peptidkonjugat
(kein Adjuvans) und wurde intravenös (IV) verabreicht. Vier Tage
nach der letzten Immunisierung wurde die Milz entnommen und es wurde
ein Zellfusion unter Verwendung der Zell-Linie SP2/0, wie beschrieben,
durchgeführt
(Coligan, J. E., et al., 1992, Current Protocols In Immunology (John
Wiley und Söhne,
New York), Einheit 2.5.4). Es wurden mAbs erzeugt, die mit dem N-terminalen
37-mer Peptid reagieren, was mittels ELISA bewertet wurde (Coligan,
J. E., et al., 1992, Current Protocols In Immunology (John Wiley
und Söhne,
New York), Einheit 2.1.3). Es wurden mit CXCR3 reagierende mAbs
identifiziert, wobei nicht-transfizierte und CXCR3-transfizierte L1.2-Zellen oder 300.19
Zellen (eine mäuseartige
B-Zell-Linie, Loetscher, M. et al., 1996, J. Exp. Med., 184: 963–969) und
eine Immunofluoreszenz-Färbung
und -Analyse durch ein FACScan® (Becton Dickinson & Co., Mountain
View, CA) verwendet wurden.
-
Es
wurden für
CXCR3 spezifische monoklonale Antikörper erzeugt. Es wurde festgestellt,
dass acht mAbs an der Oberfläche
exprimierten CXCR3 erkennen, wie durch Färbung von CXCR3-transfizierten L1.2-Zellen
bewertet wurde, jedoch nicht nicht-transfizierte L1.2-Zellen oder L1.2-Zellen,
die mit anderen Rezeptor-Typen transfiziert wurden. Das FACS-Profil
eines dieser mAbs 1C6 ist in 6 gezeigt.
Diese mAbs färbten
ebenfalls humane T-Zellen und T-Zell-Klone, die in vitro mit PHA
oder anti-CD3 aktiviert wurden (in 7C mit
1C6 gezeigt). Diese anti-CXCR3 mAbs reagierten jedoch nicht mit
Neutrophilen (in 7A mit 1C6 gezeigt), Monocyten
oder Eosinophilen (nicht gezeigt). Dieses Reaktivitätsmuster
stimmte mit der Northern Blot-Analyse überein. Jedoch verdeutlichte
die phänotypische
Analyse überraschenderweise,
dass CXCR3 auf einer großen
Untergruppe von zirkulierenden Lymphozyten exprimiert wird (7B). Dieses Expressionsmuster wurde in allen untersuchten
Individuen beobachtet, was zeigt, dass CXCR3 üblicherweise auf einer Untergruppe
von Lymphozyten des Bluts exprimiert wird. Es wurde festgestellt,
dass CXCR3 eine Population von zirkulierenden T-Zellen markiert,
die in der CD45RO+ (Gedächtnis)
Untergruppe umfasst sind.
-
Das
murine Hybridom 1C6 (ebenfalls als LS77-1C6 bezeichnet) wurde am
28. März
1997 in der American Type Culture Collection, 12301 Parklaven Drive,
Rockville, MD, 20852, gemäß dem Budapester Übereinkommen
unter der ATCC-Hinterlegungsnummer HB-12330 von LeukoSite, Inc., 215 First
Street, Cambridge, MA, 02142, USA hinterlegt.
-
Beispiel 5: CXCR3 wird auf aktivierten
T-Zellen/Gedächtnis-T-zellen
exprimiert (erläuterndes
Beispiel)
-
Strömungszytometrie
-
mAbs
gegen CXCR1, CXCR2, CXCR3 und CCR5 sind beschrieben worden (Qin,
S., et al., Eur. J. Immunol. 26 (1996), 640–647; Heath, H., et al., 1997,
J. Clin. Invest., im Druck). Anti-CXCR4 mAb 12G5 (Endres, M. J.,
et al., 1996, Cell, 87: 745–756)
wurde freundlicherweise von Jim Hoxie (Univ. Penn.) bereitgestellt. PE-konjugierte
mAbs gegen CD4, CD8, CD14, CD20, CD25, CD26, CD69, CD45RO, CD45RA,
CD95 und anti-CD3 und anti-CD4Cy-Chrome
wurden von PharMingen (La Jolla, CA) angeboten.
-
Um
die Reaktivität
der mAbs gegen transfizierte Zellen oder Leukozyten zu bewerten,
wurde in indirekte Immunofluoreszenz und Strömungszytometrie verwendet.
Die Zellen wurden einmal in PBS gewaschen und in 100 μl PBS, der
2% humanes Serum und 0,1% Natriumazid (Färbepuffer), 5 μg/ml gereinigten
Antikörper,
5 μg/ml
IgG2a Isotyp passender Kontrol-mAb (Sigma
Chemical Co., St. Louis, MO) umfasst, oder in 50 μl Hybridomkultur-Überstand resuspendiert. Nach
20 Minuten bei 4°C
wurden die Zellen zweimal mit Färbepuffer gewaschen
und in 50 μl
FITC-konjugiertem, Affinitäts-gereinigtem
F(ab')2-Ziegen-anti-Maus
IgG (Jackson ImmunoResearch Laboratories) resuspendiert. Nach Inkubation
für 20
Minuten bei 4°C
wurden die Zellen zweimal in Färbepuffer
gewaschen und auf dem FACScan® zur Bestimmung der Höhe der Oberflächenexpression analysiert.
Zum Ausschluss von toten Zellen wurde Propidiumiodid verwendet.
-
Eine
Immunofluoreszenzanalyse mit zwei Farben von Lymphozyten zeigte,
dass es am häufigsten CD3+-Zellen
waren, die CXCR3 exprimierten, obwohl ein kleiner Anteil von CD20+
(B)-Zellen und CD56+ (NK)-Zellen diesen Rezeptor ebenfalls exprimiert
(8).
-
Eine
Analyse von T-Zellen mit drei Farben, die unter Verwendung von anti-CD3
Cy-Chrome zum Markieren
von T-Zellen durchgeführt
wurde, zeigte, dass ein Anteil der CD4+-Zellen und ein Anteil der CD8+-Zellen
CXCR3 exprimiert (9). Eine Analyse
unter Verwendung von Markern der zellulären Aktivierung, wie CD25 und
CD69, verdeutlichte, dass aktivierte T-Zellen diesen Rezeptor im
Allgemeinen exprimieren. CXCR3+ T-Zellen waren CD95+, CD45RO+ und
CD45RAniedrig, ein Phänotyp, der mit einer vorhergehenden Aktivierung übereinstimmt.
Die Expression von CXCR3 und CCR5, ein Chemokin-Rezeptor, der in seiner Expression ebenfalls
von vorher aktivierten T-Zellen beeinflußt ist (Wu, L., persönliche Mitteilung),
wurde ebenfalls verglichen. 9 zeigt,
dass die CCR5+-Zellen im Blut in der CXCR3+-Untergruppe enthalten
waren und dass CXCR3 weitreichender als CCR5 exprimiert wurde. Im
Unterschied zu anderen Chemokin-Rezeptoren der
T-Zellen, wie CCR5 oder CXCR4, wurde CXCR3 auf der Mehrheit der
zirkulierenden, aktivierten T-Zellen exprimiert.
-
Beispiel 6: Anti-CXCR3 mAb blockiert ein
Binden von IP-10 und eine Chemotaxis
-
Eine
Chemotaxis humaner Leukozyten wurde unter Verwendung einer Modifikation
eines transendothelialen Assays bewertet (Carr, M. W., et al., Proc.
Natl. Acad. Sci. USA 91(9) (1994), 3652–3656), der kürzlich beschrieben
wurde (Ponath, P. D., et al., J. Clin. Invest. 97 (1996), 604–612), wobei
die endotheliale Zell-Linie ECV 304 (Europäische Sammlung tierischer Zellkulturen,
Porton Down, Salisbury, UK) verwendet wurde. Zellen, die zu der
unteren Kammer wanderten, wurden in ein Röhrchen überführt und durch Verwendung des FACScans® wurden
relative Zellzahlen erhalten.
-
Die
anti-Peptid-mAbs wurden weiter hinsichtlich ihrer Fähigkeit
getestet, die Chemotaxis von CD3 aktivierten T-Zell-Blasten zu inhibieren.
Die Ergebnisse für
die als 1A5, 1C6, 3A8, 5F10, 10C6 und 10G12 bezeichneten mAbs sind
in 10 gezeigt. Ein mAb, 1C6, war in seiner Fähigkeit,
die Chemotaxis von T-Zellen auf IP-10 zu blockieren den anderen
mAbs überlegen.
Der mAb 1C6 konnte die Chemotaxis von T-Zellen auf IP-10 in einer
von der Dosierung abhängigen
Art und Weise vollständig
inhibieren, mit einem IC50 von ~0,8 μg/ml (11). Eine Konzentration von 2–5 μg/ml führte zu einer 100%-igen Inhibierung,
wobei in der Unterseite des Transwells eine optimale IP-10-Konzentraion
(12,5 nM) verwendet wurde. Unter den verwendeten Bedingungen konnte
1C6 eine Chemotaxis von T-Zellen
auf MCP-1, die durch den Chemokin-Rezeptor CCR2b erfolgt, nicht
signifikant inhibieren (10).
-
mAb
1C6 konnte weiter das Binden von 125I-markiertem
IP-10 an aktivierte T-Zellen vollständig blockieren, mit einem
IC50 von 0,16 μg/ml (12).
Eine vollständige
Inhibierung ergab sich zwischen 1 und 10 μg/ml des Antikörpers. Die
vollständige
Inhibierung von sowohl einem Binden von IP-10 als auch einer Chemotaxis durch
mAb 1C6 zeigt, dass aktivierte T-Zellen keinen anderen Rezeptor
exprimieren, der dieses Chemokin bindet.
-
Northern-Blot-Analysen
haben gezeigt, dass CXCR3 in aktivierten T-Zellen exprimiert wurde.
Durch Verwendung eines Panels von spezifischen mAbs wurde festgestellt,
dass CXCR3 auf einer Untergruppe von T-Zellen des Bluts sowie auf
anderen Leukozyten-Typen (B-Zellen und NK-Zellen) exprimiert wird.
CXCR3 exprimierende T-Zellen wiesen einen Phänotyp auf der mit einer vorhergehenden
Aktivierung übereinstimmt,
d.h. CD45RO+, CD26+ (Beispiel 5). Ein Färben von T-Zellen wurde merklich
erhöht,
wenn die T-Zellen durch CD3 and IL-2 aktiviert wurden, was mit einer
erhöhten
Zell-Wanderung als Antwort auf IP-10 und einem Binden von radioaktiv
markiertem Ligand übereinstimmte
bzw. korrelierte.
-
Die
geringe Empfindlichkeit von T-Zellen des Bluts auf IP-10 oder Mig,
zumindest in Chemotaxis-Assays, erscheint ungewöhnlich. Eine mögliche Erklärung ist,
dass andere Faktoren als eine Rezeptor-Expression die zelluläre Empfindlichkeit
auf Chemoattraktoren bestimmen kann. So kann zur Signalisierung
ein passendes Koppeln von G-Protein erforderlich sein. Eine andere
Möglichkeit
ist, dass das Verfahren zur Bluttrennung diesen Rezeptor zerstört, wie
es für
IL-8-Rezeptoren auf T-Zellen und NK-Zellen beobachtet wurde (C. R.
Mackay). Eine Injektion von IP-10 in die Haut eines geeigneten Versuchstiers
kann die Wichtigkeit der CXCR3-Expression auf T-Zellen des Bluts
behandeln. IP-10 ist einer der stärksten bzw. wirksamsten Chemoattraktoren
bei aktivierten T-Zellen. Eine Aktivierung von T-Zellen kann Rezeptor-Signalisierungs-Moleküle oder
ein Koppeln induzieren, das zu Signalübertragung nötig ist.
-
Beispiel 7: mAb 1C6 inhibiert selektiv
[Ca2+]i durch T-Zellen
als Antwort auf IP-10, jedoch nicht auf Mig
-
Die
intrazelluläre
Calciumkonzentration ([Ca2+]i)
wurde wie folgt bestimmt. Eine Lagerlösung von Fura-2 AM (Molecular
Probes, Eugene, OR) wurde durch Lösen von 50 μg des Farbstoffes in 44 μl DMSO hergestellt.
Unmittelbar vor Zugabe der Zellen wurde dieser Bestand in HBSS mit
Ca2+ und Mg2+ und
2% BSA 1:100 verdünnt.
Fura-2 AM wurde zu Zellen in einer Endkonzentration von 0,2 Mol/106
Zellen bei 37°C
für 30 Minuten
zugesetzt. Nach dem Markieren wurde überschüssiger Farbstoff durch Zentrifugation
entfernt und die Zellen wurden in einer Konzentration von 106/ml
in 125 mM NaCl, 5 mM KCl, 1 mM MgCl2, 1 mM CaCl2, 0,5 mM Glucose,
0,025% BSA und 20 mM HEPES, pH 7,4 resuspendiert. [Ca2+]i wurde unter Anregung bei 340 und 380 nm
auf einem Hitachi-Fluoreszenz-Spektrometer
gemessen. Eine Kalibrierung wurde unter Verwendung von 1% NP-40
für eine
Gesamtfreisetzung und 25 μM
EGTA zur Chelatierung freien Ca2+ durchgeführt.
-
IP-10
und Mig induzieren [Ca2+]i durch humane T-Zellen, wobei jedes Chemokin
in der Lage war, die Antworten auf andere Chemokine zu desensitivieren
(13A–13B). Eine Titrierung der Chemokine zeigte, dass
maximales [Ca2+]i mit
so wenig wie 2 nM IP-10 oder 2 nM Mig erreicht wird. Um die Agonisten/Antagonisten-Funktion
von mAb 1C6 zu untersuchen, wurden aktivierte T-Zellen nach Injektion
von mAb 1C6 oder einem unbedeutenden Isotypen angepassten Kontroll-mAb
auf [Ca2+]i untersucht.
Die mit einem unbedeutenden, Isotypen-angepassten Kontroll-mAb injizierten
T-Zellen zeigten auf nachfolgendes Einbringen von IP-10 eine starke
[Ca2+]i-Antwort
(nicht gezeigt). T-Zellen, die mit dem mAb 1C6 behandelte wurden,
zeigten jedoch bei Stimulierung mit 2 nM IP-10 kein [Ca2+]i. [Ca2+]i in aktivierten T-Zellen als Antwort auf
IP-10 wurde durch 12,5 mg 1C6 vollständig unterdrückt. So
viel wie 50 μg/ml
1C6 zeigte jedoch keine Auswirkungen auf die Antwort von T-Zellen
auf 2 nM Mig (13D), was anzeigt, dass die
zwei Liganden durch diesen mAb unterschiedlich beeinträchtigt wurde.
Als Kontrolle wurde mAb 1C6 auf dessen Wirksamkeit auf das [Ca2+]i in T-Zellen
als Antwort auf MIP-1a oder RANTES, was über von CXCR3 verschiedene
Rezeptoren abläuft,
untersucht (nicht gezeigt). Das mAb wies bei den verwendeten Bedingungen
keinen Effekt auf.
-
mAb
1C6, der IP-10-Bindung und IP-10 induzierte Chemotaxis inhibiert,
inhibierte auch den Calciumstrom durch aktivierte T-Zellen, inhibierte
jedoch nicht Mig-induzierten Calciumstrom unter diesen Bedingungen.
Diese Ergebnisse zeigen, dass IP-10 und Mig an unterschiedliche
Bereiche von CXCR3 binden oder darüber signalisieren, und dass
mAb 1C6 in der Lage war, die IP-10-Bindungsstelle und eine nachfolgende
Signalübertragung
zu inhibieren. Es ist daher möglich,
Rezeptor-Antagonisten zu entwickeln, die die Auswirkungen einzelner
Chemokine selektiv inhibieren, wie hier unter Verwendung von mAb
1C6 gezeigt ist.
-
Wie
nachstehend erläutert,
kann eine Färbung
von CXCR3-Transfektanten durch ein Peptid inhibiert werden, das
die ersten 15 N-terminalen Aminosäurereste von CXCR umfasst.
Die Inhibierung der IP-10-Bindung und nachfolgende Antworten durch
mAb 1C6 legen nahe, dass dieser Bereich für die Ligandenbindung von besonderer
funktioneller Bedeutung ist. Basierend auf dem Unvermögen von
1C6, Mig-induzierten Calciumstrom unter den verwendeten Bedingungen
zu inhibieren, scheint das von mAb 1C6 erkannte Epitop, das für einen
Bindung von IP-10 wichtig zu sein scheint, nicht bei der Bindung
von Mig und/oder der Signalübertragung
involviert zu sein.
-
Beispiel 8.: Epitop-Kartierung
-
Peptide
wurde von Genemed, South San Francisco, CA, bestellt. Die jeweils
15 Aminosäuren
langen Peptide entsprechen unterschiedlichen Bereichen der ersten
45 N-terminalen Reste des CXCR3-Proteins:
P1: MVLEVSDHQVLNDAE
(SEQ ID Nr. 2, Reste 1–15)
P2:
VALLENFSSSYDYG (SEQ ID Nr. 2, Reste 16–30)
P3: ENESDSCCTSPPCPQ
(SEQ ID Nr. 2, Reste 31–45)
-
Die
Peptide wurden zuerst in DMSO gelöst und auf 1 mg/ml in mit Phosphat
gepufferter Kochsalzlösung
(PBS) verdünnt.
Um die Fähigkeit
der Peptide zur Blockierung des Anfärbens mit 1C6-Antikörper zu
untersuchen, wurde 1 μg/ml
gereinigter 1C6-Antikörper
in 1 × PBS,
5% fötalem
Kälberserum,
mit CXCR3 L1.2 Transfektanten (105 Zellen; siehe Materialien und
Methoden für
Beispiele 3–9)
in der Anwesenheit von 100 μg/ml
eines jeden Peptids für
30 Minuten bei 4°C
inkubiert. Das Endvolumen betrug 100 μl. Ein positives Anfärben wurde
in Abwesenheit eines Peptids durchgeführt. Gebundener mAb wurde mit
anti-Maus IgG-FITC erfaßt
und die Ergebnisse wurden durch Strömungszytometrie analysiert.
-
Eine
Anfärbung
mit mAb 1C6 wurde durch P1 vollständig inhibiert, was darauf
hinweist, dass der mAb ein Epitop in den ersten N-terminalen 15
Aminosäuren
des CXCR3-Proteins erkennt (14A–14D). Ein Binden eines anderen, als 3A8 bezeichneten
mAb (auch als LS77-3A8 bezeichnet), der von der gleichen Fusion
(LS-77) wie mAb 1C6 hergestellt wurde, wurde durch das P1-Peptid
ebenfalls inhibiert.
-
Beispiel 9. Herstellung von monoklonalen
anti-CXCR3 Antikörpern
durch Immunisierung mit transfizierten Zellen
-
Weitere
monoklonale anti-CXCR3-Antikörper
wurden durch Immunisieren von Mäusen
mit L1.2 Zellen, die mit einem CXCR3-Konstrukt transfiziert waren
und grosse Mengen an humanem CXCR3 exprimieren erzeugt (siehe Materialien
und Methoden, vorstehend). Eine Immunisierung und Erzeugung von
Fusionshybridoma wurde wie beschrieben durchgeführt (Qin, S. et al., Eur. J.
Immunol. 26 (1996), 640; und Heath, H. et al., J. CLin. Invest.
99(2) (1997), 178). Anti-CXCR3 mAbs wurden durch positives Färben aktivierter
humaner T-Zellen und CXCR3-Transfektanten identifiziert. Acht anti-CXCR3
Antikörper
wurden in einer Fusion erhalten (LS-104).
-
Die
Fähigkeit
dieser Antikörper,
eine Bindung an CXCR3 zu inhibieren, wurde untersucht. Gewebekulturüberstände (25 μl) von positive
Klonen wurden mit CXCR3 L1.2 transfizierten Zellen (Material und
Methoden für
Beispiele 3–9)
und 0,05 nM radioaktiv mit 125I markiertem
IP-10 in 1 × PBS,
5% fötalem
Kälberserum
(FCS) (100 μl
Endvolumen) für
30 Minuten bei 4°C
inkubiert. Die Überstände des
mAb 1C6 und eines anti-CXCR2 (IL-8 Rezeptor B) mAb wurden jeweils
als spezifische und nichtspezifische mAb-Kontrollen verwendet. Eine Gesamtbindung
wurde in Abwesenheit von Antikörpern
bestimmt. Eine Hintergrundbindung wurde unter Verwendung von 40
nM nicht markiertem IP-10 als der Kompetitor erhalten und dieser
Wert wurde dazu verwendet, die prozentuale Inhibierung der mAbs
zu berechnen. Die Ergebnisse sind in 15 gezeigt.
Alle Antikörper
dieser Fusion (LS-104 waren in der Lage IP-10-Bindung zu blockieren,
wobei die prozentuale Inhibierung sich im Bereich von 50–70% bewegte.
-
Diese
mAbs wurden darüber
hinaus im Wesentlichen wie in Beispiel beschrieben auf deren Fähigkeit bewertet,
eine Signalübertragung
(Fähigkeit
zur Induzierung des Ca2+-Stromes) zu inhibieren, wobei jedoch keiner
der Antikörper
in der Lage war, Mig-vermittelte Ca2+-Signalisierung
bei den verwendeten Bedingungen zu blockieren. Eine Antikörper- Inhibierung von IP-10-vermittelter
CXCR3-Bindung und Signalübertragung,
jedoch nicht eine Mig-vermittelte Signalübertragung über CXCR3, zeigt, dass diese
Antikörper
IP-10-vermittelte CXCR3-Funktionen
selektiv inhibieren kann.
-
Epitop-Kartierungsstudien
wurden unter Verwendung der Antikörper aus der LS-104 Fusion
im Wesentlichen wie in Beispiel 8 beschrieben ebenfalls durchgeführt. Die
Ergebnis zeigen, dass eine Vielzahl von Bindungsstellen erkannt
werden (Tabelle 2). Die Ergebnisse weisen darauf hin, dass drei
der Antikörper
ein (mehrere) Epitop(e) innerhalb der ersten 15 N-terminalen Aminosäuren von
CXCR3 erkennen (Reste 1–15
von SEQ. ID. Nr. 2) und zwei der Antikörper erkennen Epitop(e) innerhalb
der Aminosäuren
16–30
von CXCR3 (Reste 16–30
der SEQ. ID. Nr. 2). Das P3-Peptid blockierte keine Anfärbung mit
diesen Antikörpern,
was darauf hinweist, dass keines dieser Antikörper das durch die Aminosäuren 31–45 von
CXCR3 dargestellte Peptid band (reste 31–45 der SEQ. ID. Nr. 2). Ein
Anfärben
unter Verwendung der drei verbleibenden mAbs konnte durch keines
der Peptide bei den verwendeten Bedingungen erheblich inhibiert
werden, was darauf hinweist, dass diese mAbs Epitope binden könnten, die überlappende
Segmente der Peptide, Konformationsepitope, die auf der Zelloberfläche gezeigt
werden oder Epitope an anderen Stellen des Rezeptors umfassen.
-
Diese
Daten weisen weiter darauf hin, dass mAbs gegen verschiedene Bereiche
von CXCR3 durch Immunisieren von Mäusen mit Rezeptor-Transfektanten
erhalten werden können. Tabelle 2 Epitop-Kartierung von anti-CXCR3-mAbs
| Fusionszahl
mAb-Name | Peptide,
die mAb-Färbung
von CXCR3-Transfektanten
inhibieren | Bindungsregion |
| LS-772 | | |
| 1C6 | P1 | AA 1–15 |
| 3A8 | P1 | AA
1–15 |
| LS-1042 | | |
| 2F8 | Kein | |
| 3A12 | P1 | AA
1–15 |
| 3E2 | P1 | AA
1–15 |
| 4B4 | P2 | AA
16–30 |
| 4D2 | Kein | |
| 5B12 | Kein | |
| 7B8 | P2 | AA
16–30 |
| 8D5 | P1 | AA
1–15 |
- 1 Antikörper, die
durch Peptid-Immunisierung erhalten wurden
- 2 Antikörper, die durch Immunisierung
mit CXCR3-Transfektanten erhalten wurden
- 3 Aminosäureposition in SEQ. ID. Nr.
2
-
Beispiel 10. Immunhistochemische Analyse
von normalen und entzündlichen
Geweben unter Verwendung des mAb 1C6
-
Gewebe
-
Humane
Gewebe (normale und entzündliche)
wurden von dem National Disease Research Institut erhalten, eine
Serviceorganisation, die vom National Institute of Health bezuschusst
wird. Normale Malak-(Macaca mulatta)Gewebe wurden vom New England
Regional Primate Research Center, Southboro, MA erhalten.
-
Immunhistochemie
-
Alkalische
Phosphatatse-Technik. Gewebe wurde in einer Dicke von 4 μm geschnitten,
getrocknet und dann in 2% Paraformaldehyd/0,5 × PBS für 10 Minuten bei 4°C fixiert.
Nach dem Waschen mit PBS wurden nicht-spezifische Antikörper-Bindungsstellen
mit 10% normalem Ziegenserum/5% humanem Ab-Serum/PBS für 30 Minuten
bei Raumtemperatur blockiert. Anschließend wurde gereinigter muriner
anti-CXCR3 mAb 1C6 auf eine Konzentration von 10 μg/ml in 0,3%
Triton X 100/0,2% Tween 20/1% FCS/5% humanes AB-Serum, und 0,1%
Natriumazid, verdünnt
und auf Gewebeschnitte aufgebracht, die über Nacht bei 4°C inkubiert
wurden. Ein Isotyp angepaßter,
unbedeutender monoklonaler Antikörper
wurde als negative Kontrolle beim Schritt Gewebeschnitte eingesetzt
(IgG1, MOPC-21, Sigma, St. Louis, MO) Anschließend wurden biotinylierte Ziegen-anti-Maus
IgG (Vektor, Burlingame, Ca) und Avidin-Biotin-alkalische Phosphatase-Komplexe
(Biogenex, San Ramon, CA) nacheinander zugesetzt. Fast Red (Biogenex,
San Remon, CA), das Levamisol zur Blockierung einer endogenen alkalischen
Phosphatase-Aktivität
enthielt, wurde als das Chromogen und Mayers Hematoxylin als die
Gegenfärbung
verwendet.
-
Ergebnisse
-
Normale
humane und Makal-Lymphknoten: in beiden Spezies war ein Anfärben auf
70–80%
der Lymphozyten in dem Paracortex und der Nebennierenrinden, was
konsistent ist mit der Expression von CXCR3 auf T-Lymphozyten.
-
Humane
und Makal-Milz: in beiden Spezies war die Anfärbung begrenzt auf Lymphozyten
entlang der Peripherie lymphoider Follikel des aus lymphatischem
Gewebe zusammengesetzten Bereichs der Milz (white pule) und verteilte
Lymphozyten in der sinusoiden Milz. Dieses Muster geht einher mit
der CXCR3-Expression auf T-Lymphozyten.
-
Humaner
Thymus: Die Thymus-Medulla enthielt verteilte CXCR3 immunreaktive mononukleäre Zellen,
konsistent mit Lymphozyten.
-
Diese
Analyse zeigte, dass Makal-CXCR3 von mAb 1C6 erkannt wird. Separate
Studien zeigten, dass CXCR3 durch Züchten von Makal-Zellen T-Lymphozyten
mit Concavalin A und IL-2 hochreguliert werden kann, wobei Makal
T-Zell-Blastocysten als Antwort auf humanes IP-10 Chemotaxis erfahren
können,
die durch mAb 1C6 blockiert werden kann, und vor Inkubation mit
humanem IP-10 Makal-Blastocysten, wie durch Chemotaxis bewertet,
desensitiviert wird.
-
In
der nachfolgenden Diskussion wurden unterschiedliche Mengen CXCR3-immunreaktiver mononuklearer
Zellen in normalem als auch entzündlichem
Geweben nachgewiesen. Diese mononukleären Zellen sind aus den folgenden
Gründen
höchstwahrscheinlich
T-Lymphozyten: Strömungszytometrie
zeigte, dass die Mehrheit von CXCR3+-Zellen T-Lymphozyten
sind, obwohl CXCR3 auf einigen B-Zellen und NK-Zellen entdeckt wurde,
jedoch nicht auf anderen mononukleären Zellen; b) in dem Lymphknoten
und der Milz, Lymphozyten in Bereichen, die bekanntermaßen von
T-Zellen populiert sind, sind nur Zellen, die für CXCR3 immunreaktiv sind;
und c) die für
CXCR3 immunreaktive mononukleären
Zellen in den nachstehende aufgeführten Geweben sind mit Lymphozyten
morphologisch konsistent.
-
Nicht-entzündliche
humane Gewebe: in nicht entzündlichen
humanen Geweben, einschließlich
Herz, Leber, Niere, Lunge, Haut, Brust, Skelettmuskel, Speicheldrüse, Pankreas,
Vagina, Uterus und Ovarien, war die CXCR3-Expression auf seltene,
verstreute interstitielle mononukleäre Zellen beschränkt. In
Bereichen des Dünn-
und Dickdarms wurden in dem Bereich der Lamina propria und den Peyer's Stellen (Peyer's patches) CXCR3-exprimierende
mononukleäre
Zellen beobachtet. In der Leber wurden periductale Lymphozyten ebenfalls
angefärbt
und Hepatozyten leicht gefärbt.
-
Humanes
Gehirn: Kein Anfärben
wurde verzeichnet.
-
Entzündliche
humane Gewebe: Mehrere Bereiche chronisch entzündlichen Gewebes, die durch
interstitielle und perivaskuläre
Akkumulierung mononukleärer
Zellen gekennzeichnet sind, wurden auf CXCR3-Expression untersucht.
In diesen Geweben, einschließlich
Gewebe von menschlichen Patienten mit interstitieller Nephritis
(1 Fall, Nierengewebe), ulcerative Colitis (1 Fall, Darmgewebe,
Enteritis (1 Fall, Dünndarm)
und chronischer Vaginitis (4 Fälle,
Vagina) waren etwa 50–90%
der mononuklearen Zellen auf CXCR3 immunreaktiv.
-
Chronisch
entzündliche
Gewebe enthielte daher verglichen mit normalem Gewebe eine grössere Anzahl
an interstitiellen mononuklearen Zelle und ein größerer Prozentsatz
dieser Zellen waren auf CXCR3 immunreaktiv.
-
Eine
Analyse von entzündlichem
Gewebe zeigt, dass etwa 50–90%
der Lymphozyten CXCR3 exprimierten, während ein viel kleinerer Prozentsatz
von Lymphozyten in den entsprechenden normalen Geweben CXCR3 exprimierte.
Diese Beobachtungen legen eine spezifische Rekrutierung von CXCR3
exprimierenden Lymphozyten, höchstwahrscheinlich
CXCR3 exprimierende T-Lymphozyten an Stellen chronischer Entzündung nahe.
CXCR3 scheint T-Zellen mit einer Vorliebe, zu Entzündungsstellen
zu gehen oder dorthin zu wandern, zu markieren.
-
-
-
-
-
-