-
Die
vorliegende Erfindung bezieht sich auf ein Verfahren zur Herstellung
stark substituierter Purinverbindungen.
-
Purinverbindungen
habe eine breite Vielfalt von pharmakologischen Aktivitäten. Beispielsweise
sind viele Purinverbindungen Kinaseinhibitoren. Deshalb sind jüngst etliche
Lösungs- und Festphasenverfahren zum
Synthetisieren von Purinverbindungen entwickelt worden.
-
Konventionelle
Verfahren zum Synthetisieren von Purinverbindungen umfassen im allgemeinen
das Ersetzen einer Austrittsgruppe in einem vorgebildeten Purinringsystem
durch ein gewünschtes
Nucleophil oder das Herstellen des Purinringsystems aus einem entsprechend
substituierten Pyrimidinringsystem. Jedoch stellt keines der derzeit
verfügbaren
Verfahren die Synthese von stark substituierten Purinverbindungen,
z. B. Purinen mit Substituenten an den 2-, 6-, 8- und 9-Stellungen
mit der Fähigkeit,
den Substituenten an jeder Stellung zu variieren, bereit.
-
Die
Synthese von Purinen aus einer Pyrimidinverbindung erfordert oftmals
die Reduktion einer Nitrogruppe, die in dem Pyrimidinringsystem
vorliegt. Leider ergeben derzeit bekannte Reduktionsverfahren nur Teilreduktion,
sind nicht durchweg reproduzierbar oder ergeben ein Produkt, das
mit unerwünschten
anorganischen Salzen, die schwer zu entfernen sind, verunreinigt
ist. Siehe J Comb. Chem., 2000, 2, 249–253.
-
Deshalb
besteht ein Bedarf an einem Verfahren zur Synthese von stark substituierten
Purinverbindungen. Es besteht ebenso ein Bedarf nach einem Verfahren
zum selektiven Reduzieren eines Nitrosubstituenten an einem Pyrimidinring
an einer Feststoffträger-gebundenen
Pyrimidinverbindung, was eine Feststoffträger-gebundene Aminopyrimidinverbindung
bereitstellt, die weitestgehend frei von anorganischen Salzen ist.
-
Die
vorliegende Erfindung stellt eine kombinatorische Bibliothek von
Purinverbindungen und ein Verfahren zur Herstellung eines substituierten
Purins und eine Bibliothek von Purinver bindungen bereit. Insbesondere
stellt die vorliegende Erfindung ein Verfahren zur Herstellung einer
Purinverbindung aus einer Pyrimidinverbindung bereit.
-
Ein
Aspekt der vorliegenden Erfindung stellt ein Verfahren zur Herstellung
einer substituierten Purinverbindung der Formel
bereit, worin
R
1 ein Feststoffträger ist;
R
2 Alkyl,
Cycloalkyl, Aryl oder eine Stickstoffschutzgruppe ist;
R
3 Wasserstoff, Alkyl, Cycloalkyl, Aryl oder
eine Stickstoffschutzgruppe ist;
R
4 Wasserstoff,
Alkyl, Aryl oder -NR
6R
7 ist,
worin jeder R
6 und R
7 unabhängig Wasserstoff,
Alkyl, Aryl oder Cycloalkyl ist; und
R
5 Alkyl,
Alkoxy, Alkenyl, Alkinyl, Aryl, Aryloxy, Cycloalkyl, Cycloalkoxy,
Thioalkyl, Thioaryl oder -NR
8R
9 ist,
worin jeder R
8 und R
9 unabhängig Wasserstoff,
Alkyl, Cycloalkyl, Aryl oder eine Stickstoffschutzgruppe ist, oder R
8 und R
9 zusammen
mit dem Stickstoffatom, an das sie gebunden sind, einen Heterocyclylring
bilden; wobei das Verfahren:
- (a) das Kontaktieren
einer 5-Nitropyrimidinverbindung der Formel: mit CrX2,
worin jedes X unabhängig
Halogenid ist, als ein Reduktionsmittel zur Herstellung eines 4,5,6-Triaminopyrimidins
der Formel: und
- (b) das Bilden eines Purinrings durch Kontaktieren des 4,5,6-Triaminopyrimidins
mit einem Cyclisierungsmittel zur Herstellung des substituierten
Purins umfaßt.
-
Bevorzugt
umfassen die Verfahren der vorliegenden Erfindung die Herstellung
einer Feststoffträger-gebundenen
Purinverbindung, d. h. worin R1 ein Feststoffträger ist.
Ebenso wird das erfindungsgemäße Verfahren
durchgeführt,
wobei R2 eine Stickstoffschutzgruppe ist.
Die üblichsten
Verfahren zum Reduzieren der Nitrogruppe an einem Feststoffträger-gebundenen
Pyrimidin führen
zur Spaltung des Pyrimidins von dem Feststoffträger oder Kontamination des
Produktes mit anorganischen Salzen oder unvollständigen Reduktion. Im Gegensatz
dazu stellt die vorliegende Erfindung Verfahren zum Reduzieren einer
Nitro-substituierten Feststoffträger-gebundenen
Pyrimidinverbindung ohne Spaltung einer signifikanten Menge des
Pyrimidins von dem Feststoffträger
bereit. Daher bleibt im wesentlichen der gesamte Feststoffträger-gebundene
Pyrimidinring an dem Feststoffträger
während
des Nitrogruppenreduktionsverfahrens gebunden.
-
Außerdem sind
die Reduktionsprodukte der vorliegenden Erfindung im wesentlichen
frei von anorganischen Salzen.
-
Das
Nitrogruppenreduktionsmittel ist CrX2, worin
jedes X unabhängig
Halogenid ist.
-
In
einer Ausführungsform
umfaßt
der Nitroreduktionsschritt die Gegenwart eines erotischen Lösungsmittels.
-
In
einer anderen Ausführungsform
wird das Feststoffträger-gebundene
Purin von dem Feststoffträger abgespalten,
um die Purinverbindung herzustellen, worin R1 Wasserstoff
ist. Die R1-Gruppe kann ferner durch jedes
konventionelle Verfahren, das dem Fachmann bekannt ist, beispielsweise
durch Alkylierung, Acylierung und dergleichen, modifiziert werden.
-
Bevorzugt
ist das Cyclisierungsmittel ein Orthoester, ein Acylanhydrid, ein
Acylhalogenid, ein Gemisch aus einem Isothiocyanat und einem Dehydratisierungsmittel,
ein Gemisch aus einem Isocyanat und einem Dehydratisierungsmittel
oder ein Gemisch aus einem Aldehyd und einem Oxidationsmittel.
-
In
einer Ausführungsform
wird die 5-Nitropyrimidinverbindung durch die Schritte hergestellt,
umfassend:
- (a) das Kontaktieren eines 4,6-Dihalogen-5-nitro-2-thioetherpyrimidins
der Formel: mit einer ersten Aminverbindung
der Formel Z1H zur Herstellung eines 6-Aminopyrimidins
der Formel:
- (b) das Kontaktieren des 6-Aminopyrimidins mit einer zweiten
Aminverbindung der Formel Z2H zur Herstellung
eines 4,6-Diaminopyrimidins der Formel:
- (c) das Kontaktieren des 4,6-Diaminopyrimidins mit einem Oxidationsmittel
zur Herstellung eines 2-Sulfonylpyrimidins der Formel:
- (d) das Kontaktieren des 2-Sulfonylpyrimidins mit einem nukleophilen
Reagens der Formel R5-M zur Herstellung
der 5-Nitropyrimidinverbindung,
worin
eines von Z1 und Z2 -NR1R2 ist und das andere
-NHR3 ist;
R1,
R2, R3 und R5 wie hierin definiert sind;
R10 Alkyl, Cycloalkyl oder Aryl ist;
R5-M ein nukleophiles Reagens ist, ausgewählt aus
der Gruppe, bestehend aus einem Alkalimetallalkoxid, Alkalimetallthioalkoxid,
Organocuprat, Organolithium und Grignard-Reagens; oder R5-M
HNR8R9 ist, jedes X
unabhängig
Halogenid ist.
-
Ein
anderer Aspekt der vorliegenden Erfindung stellt ein Verfahren zur
Herstellung eines substituierten Purins der Formel
bereit, wobei das Verfahren:
- (a) das Kontaktieren eines 4,6-Dihalogen-5-nitro-2-thioetherpyrimidins
der Formel: mit einer ersten Aminverbindung
der Formel Z1H zur Herstellung eines 6-Aminopyrimidins
der Formel:
- (b) das Kontaktieren des 6-Aminopyrimidins mit einer zweiten
Aminverbindung der Formel Z2H zur Herstellung
eines 4,6-Diaminopyrimidins der Formel:
- (c) das Kontaktieren des 4,6-Diaminopyrimidins mit einem Oxidationsmittel
zur Herstellung eines 2-Sulfonylpyrimidins der Formel: worin eines von Z1 und Z2 -NR1R2 ist und das andere
-NHR3 ist;
- (d) das Kontaktieren des 2-Sulfonylpyrimidins mit einem nukleophilen
Reagens der Formel R5-M zur Herstellung
eines 5-Nitropyrimidins der Formel:
- (e) das Kontaktieren des 5-Nitropyrimidins mit CrX2,
worin jedes X unabhängig
Halogenid ist, als ein Reduktionsmittel zur Herstellung eines 4,5,6-Triaminopyrimidins
der Formel: und
- (f) das Kontaktieren des 4,5,6-Triaminopyrimidins mit einem
Cyclisierungsmittel zur Herstellung der substituierten Purine umfaßt,
worin
R1, R2, R3,
R5 und M wie hierin definiert sind.
-
Die
Verfahren der vorliegenden Erfindung sind beim Herstellen einer
kombinatorischen Bibliothek von substituierten Purinverbindungen
besonders nützlich.
Eine solche Bibliothek von Verbindungen kann auf einem Feststoffträger hergestellt
werden, z. B. wo R1 ein Feststoffträger ist.
Ebenso bevorzugt wird das Verfahren der vorliegenden Erfindung durchgeführt, wobei
R1 ein Feststoffträger ist, und wobei die Bibliothek
von substituierten Purinen eine Bibliothek von Feststoffträger-gebundenen
substituierten Purinen ist. Jede Purinverbindung in der kombinatorischen
Bibliothek kann räumlich
getrennt sein oder die Bibliothek kann ein Gemisch aus unterschiedlichen
Purinverbindungen umfassen.
-
In
einer Ausführungsform
wird die kombinatorische Bibliothek auf einer Vielzahl von Teilchen
(d. h. Feststoffträgern)
gebildet, wobei jedes Teilchen eine Oberflächenbeschichtung von Purinmolekülen mit
denselben Substituenten aufweist.
-
In
einer anderen Ausführungsform
werden die Purinverbindungen von dem Feststoffträger abgespalten, um eine Bibliothek
von freien, d. h. nicht-Feststoffträger-gebundenen, substituierten
Purinverbindungen herzustellen.
-
Noch
ein anderer Aspekt der vorliegenden Erfindung stellt eine kombinatorische
Bibliothek von Purinen bereit, worin jedes Purin in der Bibliothek
die Formel:
aufweist, worin
R
1, R
2, R
3,
R
4 und R
5 wie hierin
definier sind.
- Noch ein anderer Aspekt der
vorliegenden Erfindung stellt ein Verfahren zur Reduzierung eines
Nitrosubstituenten an einem Pyrimidinring, der kovalent an einen
Feststoffträger
gebunden ist, wobei der Pyrimidinring gegebenenfalls mit ein, zwei
oder drei unabhängigen
Nicht-Wasserstoffsubstituenten substituiert ist, bereit, wobei das
Verfahren:
- (a) das Reduzieren der Nitro-funktionellen Gruppe zu einer Amino-funktionellen
Gruppe durch Kontaktieren der Feststoffträger-gebundenen Pyrimidinverbindung
mit Chromdihalogenid zur Herstellung eines Reaktionsgemisches, umfassend
eine Feststoffträgergebundene
Aminopyrimidinverbindung; und
- (b) das Entfernen der Feststoffträger-gebundenen Aminopyrimidinverbindung
aus dem Reaktionsgemisch umfaßt,
wobei
die Feststoffträger-gebundene
Aminopyrimidinverbindung, die aus dem Reaktionsgemisch entfernt wird,
weitestgehend frei von anorganischen Salzen ist.
-
In
einer Ausführungsform
bleibt im wesentlichen der gesamte Feststoffträger-gebundene Pyrimidinring kovalent
an dem Feststoffträger
während
des Nitrogruppenreduktionsschrittes gebunden.
-
Bevorzugt
umfaßt
das Reaktionsgemisch zur Reduzierung der Nitrogruppe ein protisches
Lösungsmittel.
-
In
einer anderen Ausführungsform
ist das Chromdihalogenid Chromdichlorid.
-
1. Definitionen
-
Wenn
nicht anders angegeben, weisen die nachstehenden Ausdrücke die
folgenden Bedeutungen auf:
Ein „2,6,8,9-substituiertes Purin" bezieht sich auf
eine Purinverbindung, die unter Verwendung eines Verfahrens der
vorliegenden Erfindung hergestellt wurde. In Abhängigkeit des speziellen Reagens,
das in jedem Schritt des Verfahrens verwendet wird, kann/können der/die
Substituent(en) an dem Purinring Wasserstoff sein. Während Wasserstoff
im konventionellen Sinne nicht als „Substituent" betrachtet wird,
umfaßt
die vorliegende Erfindung „Wasserstoff" als einen Substituenten.
-
„Alkyl" bezieht sich auf
einen unverzeigten oder verzweigtkettigen, gesättigten, einwertigen Kohlenwasserstoffrest,
der 1 bis 10 Kohlenstoffatome enthält. Der Ausdruck „Niederalkyl" gibt einen geraden
oder verzweigtkettigen Kohlenwasserstoffrest an, der 1 bis 6 Kohlenstoff
atome enthält. „C1-10-Alkyl", wie hierin verwendet, bezieht sich
auf ein Alkyl, bestehend aus 1 bis 10 Kohlenstoffen. Alkylgruppen
können
gegebenenfalls mit einem oder mehreren Substituenten substituiert
sein, wie einem Halogen, Alkenyl, Alkinyl, Aryl, Hydroxy, Amino,
Thio, Alkoxy, Carboxy, Oxo oder Cycloalkyl. In Fällen, wo mehr als ein Substituent
an die Alkylgruppen angelagert ist, können diese Substituenten dieselben
oder verschiedene sein. Es können
gegebenenfalls entlang der Alkylgruppe ein oder mehrere Sauerstoff-,
Schwefel-, substituierte oder unsubstituierte Stickstoffatome eingeführt werden.
Beispiele von Alkylgruppen umfassen Methyl, Ethyl, Propyl, i-Propyl,
n-Butyl, i-Butyl, t-Butyl oder Pentyl, Isopentyl, Neopentyl, Hexyl,
Heptyl und Octyl, sind aber nicht darauf beschränkt.
-
„Alkoxy" bezieht sich auf
eine Komponente -ORa, wo Ra eine
Alkylgruppe ist, wie hierin definiert.
-
„Alkenyl" bezieht sich auf
einen unverzweigten oder verzweigtkettigen, einwertigen Kohlenwasserstoffrest,
der 2 bis 10 Kohlenstoffatome enthält, mit mindestens einer Kohlenstoff-Kohlenstoff-Doppelbindung, unter
der Voraussetzung, daß der
Anlagerungspunkt einer Alkenylgruppe durch ein Kohlenstoffatom der
Kohlenstoff-Kohlenstoff-Doppelbindung erfolgt. Alkenylgruppen können gegebenenfalls
mit einem oder mehreren Substituenten substituiert sein, wie Halogen,
Alkyl, Alkenyl, Alkinyl, Aryl, Hydroxy, Amino, Thio, Alkoxy, Carboxy,
Oxo oder Cycloalkyl. Es können
gegebenenfalls entlang der Alkenylgruppe ein oder mehrere Sauerstoff-, Schwefel,
substituierte oder unsubstituierte Stickstoffatome eingeführt werden. „C2-10-Alkenyl", wie hierin verwendet, bezieht sich
auf ein Alkenyl, bestehend aus 2 bis 10 Kohlenstoffen. Beispiele
von Alkenylgruppen umfassen Vinyl, 1-Propenyl, 1-Propenyl oder 1-Butenyl.
-
„Alkinyl" bezieht sich auf
einen unverzweigten oder verzweigtkettigen, einwertigen Kohlenwasserstoffrest,
der 2 bis 10 Kohlenstoffatome enthält, mit mindestens einer Kohlenstoff- Kohlenstoff-Dreifachbindung,
unter der Voraussetzung, daß der
Anlagerungspunkt einer Alkinylgruppe durch ein Kohlenstoffatom der
Kohlenstoff-Kohlenstoff-Dreifachbindung erfolgt. Alkinylgruppen
können
gegebenenfalls mit einem oder mehreren Substituenten substituiert
sein, wie Halogen, Alkyl, Alkenyl, Alkinyl, Aryl, Hydroxy, Amino,
Thio, Alkoxy, Carboxy, Oxo oder Cycloalkyl. Es können gegebenenfalls entlang
der Alkinylgruppe ein oder mehrere Sauerstoff-, Schwefel-, substituierte
oder unsubstituierte Stickstoffatome eingeführt werden. „C2-10-Alkinyl", wie hierin verwendet, bezieht sich
auf Alkinyl, bestehend aus 2 bis 10 Kohlenstoffen. Beispiele von
Alkinylgruppen umfassen Ethinyl, 1-Propinyl, 1-Butinyl oder 1-Pentinyl.
-
„Acylhalogenid" bezieht sich auf
ein Reagens RC(=O)X, worin R eine Alkyl- oder Arylgruppe ist und
X ein Halogen ist, wie hierin definiert. Beispiele von Säurehalogeniden
umfassen Acetylchlorid, Acetylbromid, Propionylchlorid, Iso-butyroylchlorid
und Benzoylchlorid.
-
„Acylanhydrid" bezieht sich auf
ein Reagens [RC(=O)]2O, worin R eine Alkyl-
oder Arylgruppe ist, wie hierin definiert. Beispiele von Säureanhydriden
umfassen Essigsäureanhydrid,
Propionsäureanhydridchlorid und
2-Methoxyessigsäureanhydrid.
-
„Orthoester" bezieht sich auf
ein Reagens RaC(ORb)3, worin Ra Wasserstoff,
eine Alkyl- oder Arylgruppe ist und Rb eine
Alkylgruppe ist, wobei Alkyl wie hierin definiert ist. Beispiele
von Orthoestern sind Triethylorthoformiat und Trimethylorthoacetat.
-
„Aryl" bezieht sich auf
einen einwertigen aromatischen carbocyclischen Rest, der 5 bis 14
Kohlenstoffatome enthält
und aus einem einzelnen Ring oder einem oder mehreren anellierten
Ringen besteht, wobei mindestens ein Ring aromatisch ist, der gegebenenfalls
mit einem oder mehreren, bevorzugt einem oder zwei, Substituenten
substituiert sein kann, ausgewählt
aus Hydroxy, Thio, Cyano, Alkyl, Alkenyl, Alkinyl, Aryl, Amino, Thio,
Cycloalkyl, Alkoxy, Niederhalogenalkoxy, Alkylthio, Halogen, Halogenalkyl,
Nitro, Amino, Alkylamino, Dialkylamino, wenn nicht anders angegeben.
Alternativ können
zwei nachbarständige
Atome des Arylrings mit einer Methylendioxy- oder Ethylendioxygruppe
substituiert sein. Beispiele von Arylresten umfassen Phenyl, Naphthyl,
Biphenyl, Indanyl, Anthrachinolyl, sind aber nicht darauf beschränkt.
-
„Aryloxy” bezieht
sich auf eine Komponente -ORb, wo Rb eine Arylgruppe ist, wie hierin definiert.
Beispiele von Aryloxygruppen umfassen gegebenenfalls substituiertes
Phenoxy und gegebenenfalls substituiertes 1- oder 2-Naphthyloxy.
-
„Amino", „Alkylamino" und „Dialkylamino", wie hierin verwendet,
beziehen sich auf -NH2, -NHR1 bzw. -NR1R2, und R1 und R2 sind unabhängig Alkyl,
Cycloalkyl oder Aryl oder R2 ist eine Stickstoffschutzgruppe,
wie nachstehend definiert.
-
„Kombinatorische
Bibliothek von Purinen" bezieht
sich auf eine Bibliothek, die eine Vielzahl von Purinverbindungen,
typischerweise mindestens 20 unterschiedliche Purinverbindungen,
umfaßt.
Die kombinatorische Bibliothek kann durch jegliche konventionelle
kombinatorische Syntheseverfahren, die dem Fachmann bekannt sind,
hergestellt werden, beispielsweise parallele Syntheseverfahren,
Split-Pool-Syntheseverfahren und Kombinationen davon. Deshalb bezieht
sich der Ausdruck „kombinatorische
Bibliothek von Purinen" auf eine
Bibliothek, die ein Gemisch aus Purinverbindungen sowie eine Vielzahl
von unterschiedlichen Purinverbindungen umfaßt, bei denen jede unterschiedliche
Purinverbindung räumlich
getrennt ist, z. B. in einem separaten Behälter enthalten ist.
-
„Cyclisierungsmittel" bezieht sich auf
ein Reagens, das aus einer Diaminopyrimidinverbindung eine Purinringkomponente
bildet. Bevorzugt ist das Cyclisierungsmittel ein Orthoester, ein
Acylanhydrid, ein Acylhalogenid, ein Gemisch aus Isothiocyanat und
einem Dehydratisierungsmittel, ein Gemisch aus Isocyanat und einem
Dehydratisierungsmittel oder ein Gemisch aus einem Aldehyd und einem
Oxidationsmittel.
-
„Cycloalkyl" bezieht sich auf
alicyclische Kohlenwasserstoffe, die 3 bis 8 Kohlenstoffatome enthalten, einschließlich Carbocyclen,
wie mono- und bicyclische nichtaromatische carbocyclische Ringkomponenten; und
Heterocyclen, wie mono- und bicyclische nichtaromatische heterocyclische
Ringkomponenten. Cycloalkylgruppen können mit einem oder mehreren
Substituenten substituiert sein, wie Halogen, Alkyl, Alkenyl, Alkinyl, Aryl,
Hydroxy, Amino, Thio, Alkoxy, Carboxy, Oxo, Cycloalkyl und dergleichen. „C3-7-Cycloalkyl", wie hierin verwendet, bezieht sich
auf ein Cycloalkyl, bestehend aus 3 bis 7 Kohlenstoffen in dem carbocyclischen
Ring. Typische Cycloalkylgruppen umfassen Cyclopropyl, Cyclobutyl,
Cyclopentyl, Cyclohexyl, Cycloheptyl oder Cyclooctyl, sind aber
nicht darauf beschränkt.
-
„Cycloalkoxy” bezieht
sich auf eine Komponente -ORc, wo Rc eine Cycloalkylgruppe ist, wie hierin definiert.
Beispiele von Cycloalkoxygruppen umfassen Cyclopropyloxy, Cyclobutoxy,
Cyclopentoxy, Cyclohexoxy und Cycloheptoxy.
-
„Unterschiedliche
Purinverbindungen" beziehen
sich auf Purinverbindungen mit unterschiedlichen Substituenten,
unterschiedlichen Substituentenmustern oder Kombinationen davon
innerhalb des Purinrings. Daher bilden Purine mit denselben Substituentengruppen,
aber unterschiedlichen Positionen dieser Substituenten innerhalb
des Purinrings, d. h. Regioisomere, unterschiedliche Verbindungen.
Ferner bilden Purine mit denselben Substituenten, aber mit unterschiedlicher
Stereochemie innerhalb des Substituenten, d. h. Stereoisomere, ebenso
unterschiedliche Verbindungen.
-
„Halogenid" bedeutet Halogen,
das F, Cl, Br und I umfaßt.
-
„Heterocyclyl" bedeutet eine nichtaromatische
cyclische Komponente mit 3 bis 8 Ringatomen, wobei ein oder zwei
Ringatome Heteroatome sind, ausgewählt aus N, O oder S(O)n (wo n eine ganze Zahl von 0 bis 2 ist),
wobei die restlichen Ringatome C sind, wo ein oder zwei C-Atome
gegebenenfalls durch eine Carbonylgruppe ersetzt sein können, unter
der Voraussetzung, daß der
Anlagerungspunkt von Heterocyclyl durch das Hetereoatom erfolgt.
Der Heterocyclylring kann gegebenenfalls unabhängig mit einem, zwei oder drei
Substituenten substituiert sein, ausgewählt aus Halogen, Alkyl, Alkenyl,
Alkinyl, Aryl, Hydroxy, Amino, Thio, Alkoxy, Carboxy, Oxo, Cycloalkyl
und dergleichen. Spezieller umfaßt der Ausdruck Heterocyclo
Piperidino, Piperazino, Morpholino und Thiomorpholino, Thiomorpholino-1-oxid, Thiomorpholino-1,1-dioxid
und dergleichen, ist aber nicht darauf beschränkt.
-
„Austrittsgruppe" weist die Bedeutung
auf, die konventionell damit in der synthetischen organischen Chemie
verbunden ist, d. h. ein Atom oder eine Gruppe, das/die durch ein
Nucleophil ersetzt werden kann, und umfaßt Halogen (wie Chlor, Brom
und Iod), Alkylsulfonyl, Arylsulfonyl, Alkansulfonyloxy, Arensulfonyloxy,
Alkylcarbonyloxy (z. B. Acetoxy), Arylcarbonyloxy, Mesyloxy, Tosyloxy,
Trifluormethansulfonyloxy, Aryloxy (z. B. 2,4-Dinitrophenoxy), Methoxy,
N,O-Dimethylhydroxylamino und dergleichen.
-
„Stickstoffschutzgruppe” bezieht
sich auf eine Komponente, außer
Alkylgruppen, die, wenn sie an ein Stickstoffatom in einem Molekül angelagert
ist, die Reaktivität
des Stickstoffatoms maskiert, verringert oder verhindert. Beispiele
von Stickstoffschutzgruppen können
in T. W. Greene und P. G. M. Wuts, Protective Groups in Organic
Synthesis, 3. Auflage, John Wiley & Sons, New York, 1999, und Harrison
and Harrison et al., Compendium of Synthetic Organic Methods, Bd.
1–8 (John
Wiley and Sons, 1971–1996)
gefunden werden, die hierin durch Verweis in ihrer Gesamtheit aufgenommen
werden. Repräsentative
Stickstoffatomschutzgruppen umfassen Formyl, Acetyl, Trifluoracetyl,
Benzyl, Benzyloxycarbonyl (CBZ), tert-Butoxycarbonyl (Boc), Trityl,
substituierte Tritylgruppen, Allyloxycarbonyl, 9-Fluorenylmethyloxycarbonyl
(FMOC), Nitro-veratryloxycarbonyl (NVOC), gegebenenfalls substituiertes
Benzyl und Allylgruppen und dergleichen.
-
Die
Materialien, auf denen die kombinatorischen Synthesen der Erfindung
durchgeführt
werden, werden austauschbar als Feststoffträger, Kügelchen und Harze bezeichnet.
Diese Ausdrücke
sollen umfassen:
- a) Kügelchen, Pellets, Scheiben,
Fasern, Gele, Oberflächen
oder Teilchen, wie Cellulosekügelchen,
Porenglaskügelchen,
Kieselgele, Polystyrolkügelchen,
gegebenenfalls vernetzt mit Divinylbenzol und gegebenenfalls gepfropft
mit Polyethylenglycol und gegebenenfalls funktionalisiert mit Amino-,
Hydroxy-, Carboxy- oder Halogengruppen, gepfropfte Co-Polykügelchen,
Poly-acrylamidkügelchen,
Latexkügelchen,
Dimethylacrylamidkügelchen,
gegebenenfalls vernetzt mit N,N'-Bis-acryloylethylendiamin,
Glasteilchen, beschichtet mit hydrophobem Polymer usw., d. h., Material
mit einer rigiden oder semi-rigiden Oberfläche;
- b) lösliche
Träger,
wie nicht-vernetztes Polystyrol mit niedrigem Molekulargewicht;
und
- c) derivatisierte Formen davon.
-
Exemplarische
Harze und Feststoffträger
sind nachstehend dargestellt.
-
"Feststoffträger-gebundene
Verbindung" bedeutet,
daß die
Verbindung kovalent an einen Feststoffträger gebunden ist.
-
„Weitestgehend
frei von anorganischem Salz" bedeutet,
daß das
anorganische Salz in einer Menge von etwa 10 mol-% oder weniger,
bevorzugt etwa 5 mol-% oder weniger, stärker bevorzugt etwa 1 mol-%
oder weniger und am stärksten
bevorzugt etwa 0,1 mol-% oder weni ger des gewünschten Produktes vorliegt. „Anorganisches
Salz" bezieht sich
auf anorganische Verbindungen, abgeleitet von einer anorganischen
Verbindung, die als ein Reagens in dem Reduktionsschritt vorliegt.
-
„Alkylthio-" der "Thioalkylgruppe" bedeutet eine -S-Alkylgruppe,
wobei Alkyl wie oben definiert ist, wie Methylthio, Ethylthio, n-Propylthio,
i-Propylthio, n-Butylthio, Hexylthio, einschließlich ihre Isomere. „Niederalkylthio" oder „Niederthioalkyl", wie hierin verwendet,
gibt eine Alkylthiogruppe mit einer „Niederalkylgruppe" an, wie zuvor definiert. „C1-10-Alkylthio", wie hierin verwendet, bezieht sich
auf ein -S-Alkyl, worin Alkyl C1-10 ist.
-
„Thioaryl" oder „Arylthio" bezieht sich auf
eine Komponente der Formel -SRe, wo Re Aryl ist, wie hierin definiert. Beispiele
von Arylthiogruppen umfassen gegebenenfalls substituiertes Phenylthio
und gegebenenfalls substituiertes 1- oder 2-Naphthylthio.
-
Wie
hierin verwendet, bedeutet der Ausdruck „Behandeln", „Kontaktieren" oder „Umsetzen", wenn er sich auf
eine chemische Reaktion bezieht, das Zufügen oder Mischen zweier oder
mehrerer Reagenzien unter entsprechenden Bedingungen zur Herstellung
des angegebenen und/oder des gewünschten
Produktes. Es ist selbstverständlich,
daß die
Reaktion, die das angegebene und/oder gewünschte Produkt erzeugt, nicht
notwendigerweise direkt aus der Kombination von zwei Reagenzien
resultiert, die anfangs zugegeben wurden, d. h. es kaum ein oder
mehrere Zwischenprodukte geben, die in dem Gemisch erzeugt werden,
was schließlich zur
Bildung des angegebenen und/oder gewünschten Produktes führt.
-
Wie
hierin verwendet, gibt „Reduktionsmittel" ein Reagens an,
das in den substituierten Pyrimidinen der vorliegenden Erfindung
selektiv eine Nitrogruppe zu einer Aminogruppe reduzieren kann.
Typische Reduktionsmittel umfassen Metall, wie Sn, Fe oder Zn, CrCl2, 1,1'-Dialkyl-4,4'-bipyridinhalogenide
und ein Alkalimetallthiosulfat, katalytische Hydrierung (J. March,
Advanced Organic Chemistry, John Wiley & Sons, 1992, S. 1216–17).
-
Wie
hierin verwendet, gibt der Ausdruck „Oxidationsmittel" ein Reagens an,
das ein 8,9-Dihydro-7H-purin zu dem entsprechenden Purin oxidieren
kann. Beispiele von geeigneten Oxidationsmitteln umfassen molekularen
Sauerstoff und Dichlordicyanhydrochinon.
-
Wie
hierin verwendet, gibt der Ausdruck „Dehydratisierungsmittel" ein Reagens an,
das eine Kondensationsreaktion zwischen zwei Recktanten durch Beschleunigen
der Eliminierung von Wasser aus den zwei Recktanten katalysieren
kann. Typische Dehydratisierungsmittel, z. B. Dicyclohexylcarbodiimid,
werden üblicherweise
verwendet, um die Amid- oder Esterbildung zu beschleunigen, und
repräsentative
Dehydratisierungsmittel sind von LaRock (R. C. LaRock Comprehensive
Organic Transformations, Wiley-VCH, New York, 1999, S. 1941–49 und
1932–41)
zusammengestellt.
-
Wie
hierin verwendet, bezieht sich der Ausdruck erotisches Lösungsmittel
auf ein Lösungsmittel
mit einer -OH-Gruppe. Beispiele von erotischen Lösungsmitteln umfassen Wasser,
Methanol, Ethanol, Isopropanol, Essigsäure, sind aber nicht darauf
beschränkt.
-
Die
hierin verwendeten Ausdrücke „die oben
definierten" und „die hierin
definierten" umfassen,
wenn sie sich auf eine Variable beziehen, durch Verweis die breite
Definition der Variable sowie die bevorzugten, stärker bevorzugten
und am stärksten
bevorzugten Definitionen, sofern vorhanden.
-
II. Einführung
-
Wenn
nicht anders angegeben, wird das folgende Numerierungssystem verwendet,
um die Stellungen an dem Purinring zu beschreiben.
-
-
In
einem Aspekt basiert die vorliegende Erfindung auf der Entdeckung
einer Synthese von stark substituierten Purinverbindungen durch
die betreffenden Erfinder. Insbesondere entdeckten die betreffenden
Erfinder selektive Reaktionsbedingungen, die die Einführung von
gewünschten
Substituenten an der 2-, 6-, 8- und 9-Stellung einer Purinverbindung
erlauben. An sich sind Verfahren der vorliegenden Erfindung bei
der Synthese stark substituierter Purinverbindungen und/oder einer
kombinatorischen Bibliothek von Purinverbindungen besonders nützlich.
-
III. Synthese von Purinverbindungen
-
Die
Verfahren der vorliegenden Erfindung sind auf eine Lösungsphasen-
und eine Festphasensynthese von Purinverbindungen anwendbar. In
einem Aspekt umfassen Verfahren der vorliegenden Erfindung das herstellen
einer Purinverbindung, bevorzugt einer stark substituierten Purinverbindung,
durch Umsetzen einer entsprechend substituierten Pyrimidinverbindung
mit einer entsprechend substituierten Cyclisierungsverbindung. Insbesondere
erlauben die Verfahren der vorliegenden Erfindung die Einführung jedes
Substituenten an dem Purinringsystem; deshalb kann eine stark substituierte
Purinverbindung ohne weiteres hergestellt werden.
-
In
einer speziellen Ausführungsform
stellt die vorliegende Erfindung ein Verfahren zur Herstellung einer
Purinverbindung der Formel:
bereit, worin
R
1 ein Feststoffträger ist;
R
2 Alkyl,
Cycloalkyl, Aryl oder eine Stickstoffschutzgruppe ist;
R
3 Wasserstoff, Alkyl, Cycloalkyl, Aryl oder
eine Stickstoffschutzgruppe ist;
R
4 Wasserstoff,
Alkyl, Aryl oder -NR
6R
7 ist,
worin jeder R
6 und R
7 unabhängig Wasserstoff,
Alkyl, Aryl oder Cycloalkyl ist; und
R
5 Alkyl,
Alkoxy, Alkenyl, Alkinyl, Aryl, Aryloxy, Cycloalkyl, Cycloalkoxy,
Thioalkyl, Thioaryl oder -NR
8R
9 ist,
worin jeder R
8 und R
9 unabhängig Wasserstoff,
Alkyl, Cycloalkyl, Aryl oder eine Stickstoffschutzgruppe ist, oder R
8 und R
9 zusammen
mit dem Stickstoffatom, an das sie gebunden sind, Heterocyclyl bilden.
-
Bevorzugt
ist R4 Wasserstoff oder Alkyl.
-
Bevorzugt
ist R5 -NR8R9, wo R8 und R9 wie hierin definiert sind.
-
Bevorzugt
ist jeder von R6 und R7 unabhängig Wasserstoff
oder Alkyl.
-
In
noch einer anderen Ausführungsform
ist R3 Wasserstoff, Alkyl oder Cycloalkyl.
-
Weiterhin
bilden Kombinationen der bevorzugten Gruppen oder einer speziellen
Ausführungsform,
die oben beschrieben ist, andere bevorzugte oder spezielle Ausführungsformen.
Beispielsweise ist in einer Gruppe einer speziell bevorzugten Ausführungsform
R1 ein Feststoffträger, R3 Wasserstoff
oder Alkyl, R4 Wasserstoff oder Alkyl und
ist R5 -NR8R9.
-
In
einem speziellen Aspekt stellt die vorliegende Erfindung ein Verfahren
zur Herstellung einer Purinverbindung der Formel I durch Umsetzen
einer 4,5,6-Triaminopyrimidinverbindung der Formel:
worin R
1,
R
2, R
3 und R
5 wie hierin definiert sind, mit einer Cyclisierungsverbindung
zur Herstellung des Purinringsystems der Verbindung der Formel I
bereit. Exemplarische Cyclisierungsmittel umfassen Aldehyde, Orthoester,
aktivierte Carbonsäuren,
Isocyanate und Isothiocyanate. Exemplarische aktivierte Carbonylverbindungen
umfassen Acylhalogenide, Anhydride und andere aktivierte Carbonylverbindungen,
die dem Fachmann bekannt sind.
-
Wie
in Schema I nachstehend gezeigt, sind die Substituenten an der 2-,
6- und 9-Stellung des Purins der Formel I von der Pyrimidinverbindung
abgeleitet, während
der Substituent an der 8-Stellung von der Cyclisierungsverbindung
abgeleitet ist.
-
-
Daher
ist, wenn ein Isocyanat oder ein Thioisocyanat als das Cyclisierungsmittel
verwendet wird, der resultierende Substituent an der 8-Stellung
eine Aminokomponente, d. h. -NHR9. Wenn
eine aktivierte Carbonsäure,
ein Orthoester, ein Amid oder ein Aldehyd als das Cyclisierungsmittel
verwendet wird, ist der resultierende Substituent an der 8-Stellung
R4, wie in Schema I gezeigt.
-
In
einigen Fällen
erleichtert die Gegenwart eines Dehydratisierungsmittels oder eines
Oxidationsmittels die Bildung eines Purinringsystems oder ist dafür erforderlich.
Typischerweise ist das Oxidationsmittel ein mildes Oxidationsmittel,
das bei der Synthese eines aromatischen Ringsystems konventionell
bekannt ist. Exemplarische Oxidationsmittel umfassen Chinone wie
DDQ und Luft. Wenn ein Isothiocyanat als das Cyclisierungsmittel
verwendet wird, wird typischerweise ein Carbodiimid, bevorzugt Diisopropylcarbodiimd,
als ein Dehydratisierungsmittel verwendet. Und wenn ein Aldehyd
als die Cyclisierungsverbindung verwendet wird, wird ein Chinon,
bevorzugt DDQ, als ein Oxidationsmittel verwendet.
-
Es
ist herausgefunden worden, daß,
wenn als Cyclisierungsmittel ein Orthoester verwendet wird, einige
Reaktionsbedingungen zur Bildung eines nicht-cyclischen Zwischenproduktes
führen,
wo die Aminogruppe in 5-Stellung mit einer -C(=O)-R4-Gruppe
substituiert ist. Durch Erhöhen
der Reaktionstemperatur und/oder der Reaktionszeit kann man das
nicht-cyclische Zwischenprodukt zu einer Purinverbindung umwandeln.
Alternativ führt
die Aussetzung des nicht-cyclischen Zwischenproduktes Dehydratisierungsbedingungen,
z. B. Aussetzung DCC oder POCl3, auch zur
Bildung des Purinrings.
-
Es
sollte selbstverständlich
sein, daß,
wenn R1 Wasserstoff ist und R2 eine
andere Komponente als R3 ist, zwei unterschiedliche
Purine gebildet werden können.
Um die Bildung der zwei regioisomeren Purine zu vermeiden, umfassen
die Verfahren der vorliegenden Erfindung bevorzugt die Verwendung
eines Pyrimidins der Formel II, wo die Reaktivität der Aminogruppe an der 6-Stellung
(d. h. -NR1R2, wo
R1 Wasserstoff ist) bevorzugt langsamer
ist als die Reaktivität
der Aminogruppe an der 4-Stellung (d. h. -NHR3)
des Pyrimidinrings. Ein solcher Unterschied in der Reaktivität kann durch
unterschiedliche Substituenten an dem Stickstoffatom der Aminogruppen
erreicht werden. Typischerweise ist die Aminogruppe an der 6-Stellung,
d. h. -NR1R2, ein tertiäres Amin,
und die Aminogruppe an der 4-Stellung, d. h. -NHR3,
ist eine sekundäre
oder primäre
Aminogruppe. Da das Purinringsystem symmetrisch ist, wird die Stellung,
substituiert mit der -NR1R2-Gruppe,
willkürlich
als die 6-Stellung bezeichnet, und die Stellung, substituiert mit
der -NHR3-Gruppe, wird willkürlich als
die 4-Stellung bezeichnet.
-
Synthese von Pyrimidin der Formel II
-
Wie
in Schema I oben gezeigt, werden drei der vier Substituenten an
dem Purinring von Substituenten an dem Pyrimidin der Formel II abgeleitet.
Daher stellt ein anderer Aspekt der vorliegenden Erfindung ein Verfahren
zur Herstellung der 4,5,6-Triaminopyrimidinverbindung der Formel
II bereit. In einer speziellen Ausführungsform wird die 4,5,6-Triaminopyrimidinverbindung
der Formel II aus einem entsprechenden 5-Nitro-4,6-diaminopyrimidin
der Formel:
hergestellt, worin R
1, R
2, R
3 und
R
5 wie hierin definiert sind. Das Verfahren
umfaßt
allgemein die selektive Reduktion der Nitrogruppe. Wenn das 5-Nitro-4,6-diaminopyrimidin
der Formel III an einen Feststoffträger gebunden ist, führen viele
konventionelle Nitrogruppenreduktionsbedingungen zur Abspaltung
der Pyrimidinkomponente von dem Feststoffträger. Andere konventionelle
Reduktionsmittel führen
zu einem widersprüchlichen
Ergebnis oder einem Produkt, das mit unerwünschten anorganischen Salzen
kontaminiert ist. Siehe beispielsweise Di Lucrezia et al., J. Comb.
Chem., 2000, 2, 249–253.
-
Die
betreffenden Erfinder entdeckten, daß die Nitrogruppe eines Feststoffträger-gebundenen
Pyrimidins unter Verwendung einer Chromdihalogenidverbindung, d.
h. CrX2, wo X ein Halogenid ist, sauber
zu einer Aminogruppe reduziert werden kann. Eine besonders bevorzugte
Chromdihalogenidverbindung ist Chromdichlorid. Es ist herausgefunden
worden, daß die
Reduktion der Nitrogruppe eines Feststoffträger-gebundenen Pyrimidins mit
einer Chromdihalogenidverbindung ein Feststoffträger-gebundenes Aminopyrimidin
erzeugt, das weitestgehend frei von anorganischen Salzen ist. Außerdem führt die
Verwendung eines Chromdihalogenids als Reduktionsmittel dazu, daß im wesentlichen
der gesamte Pyrimidinring an den Feststoffträger gebunden bleibt. Typischerweise
bleiben nach dem Reduktionsschritt minde stens etwa 75% des Pyrimidinrings
an dem Feststoffträger
gebunden. Bevorzugt bleiben nach dem Reduktionsschritt mindestens
etwa 90% und stärker
bevorzugt mindestens etwa 99% des Pyrimidinrings an dem Feststoffträger gebunden.
-
In
einigen Fällen
wird die Reduktion der Feststoffträger-gebundenen Nitropyrimidinverbindung
der Formel III durch die Gegenwart eines erotischen Lösungsmittels
erleichtert. Geeignete erotische Lösungsmittel umfassen Wasser
und Alkohole, z. B. Methanol, Ethanol und Isopropanol.
-
Typische
Bedingungen zum Reduzieren der Nitrokomponente in dem Nitropyrimidin
der Formel III umfassen das Zugeben eines Reduktionsmittels zu einem
Reaktionsgemisch, umfassend das Feststoffträger-gebundene Nitropyrimidin
der Formel II in einem Gemisch aus inertem organischem Lösungsmittel.
Wie oben angegeben, umfaßt
das Reaktionsgemisch in einigen Fällen bevorzugt ein erotisches
Lösungsmittel,
das gezeigt hat, daß es
die Reduktion der Nitrogruppe erleichtert. Daher wird die Reduktion
der Nitrogruppe im allgemeinen unter Verwendung eines Lösungsmittelgemisches,
umfassend ein relativ inertes organisches Lösungsmittel, wie DMF, Dichlormethan
oder THF, und ein erotisches Lösungsmittel,
wie Wasser oder einen Alkohol, erreicht.
-
In
der Theorie erfordert die Reduktion einer Nitrogruppe 6 stöchiometrische Äquivalente
(d. h. ein funktionelles Äquivalent)
des Reduktionsmittels. Im allgemeinen wird jedoch eine überschüssige Menge
des Reduktionsmittels zugegeben, um eine relativ schnelle Reduktion
sicherzustellen und/oder die Ausbeute zu erhöhen. Typischerweise werden
etwa 10 stöchiometrische Äqu. bis
etwa 16 stöchiometrische Äqu. des
Reduktionsmittels verwendet.
-
Alternativ
kann eine katalytische Menge Chromchlorid durch Zugeben von Mangan
(Mn) und TMS-Cl oder ein anderes geeignetes Protonensurrogat verwendet
werden. Insbesondere kann festes Mn in dieser Ausführungsform
verwendet werden, wodurch ein leichtes Produktisolationsverfahren
ermöglicht
wird.
-
Andere
geeignete Reduktionsmittel umfassen ein Gemisch aus Ammoniumhalogenid
und Eisen und ein Gemisch aus Quartärpyridiniumhalogenid (z. B.
1,1'-Dioctyl-4,4'-bi pyridiniumdibromid)
und ein Metallthiosulfat (z. B. Na2S2O3) in Dichlormethan/Wasser-Gemisch, bevorzugt
in THF/Wasser-Gemisch.
-
Synthese von Nitropyrimidin der Formel
III
-
Unter
erneutem Bezug auf Schema I werden die Substituenten an der 2-,
6- und 9-Stellung des Purinringsystems durch die entsprechenden
Substituenten an dem Pyrimidinringsystem bestimmt. Da das zweite Ringsystem
aus den Aminogruppen an der 4- und der 5-Stellung des Pyrimidinrings
gebildet wird, müssen
die Substituenten an der 4- und 5-Stellung des Nitropyrimidins der
Formel III Aminsubstituenten sein. Jedoch können die Substituenten an der
2- und der 6-Stellung
ein Nicht-Aminsubstituent sein.
-
Während eine
breite Vielzahl von Ausgangsmaterialien und Synthesestrategien verwendet
werden kann, um das Nitropyrimidin der Formel III herzustellen,
ist ein tetra-substituiertes Pyrimidin der Formel IV, nachstehend
gezeigt, besonders nützlich:
wo
jedes X unabhängig Halogenid
ist; und
Y -SO
nR
10 ist,
wo n 0, 1 oder 2 ist; und R
10 Alkyl, Cycloalkyl
oder Aryl ist.
-
Bevorzugt
ist jedes X unabhängig
Chlorid, Fluorid oder Bromid, stärker
bevorzugt ist jedes X unabhängig
Chlorid oder Fluorid, und am stärksten
bevorzugt ist X Chlorid.
-
Bevorzugt
ist R10 Alkyl, stärker bevorzugt Methyl oder
Ethyl.
-
Die
tetra-substituierten Pyrimidine der Formel IV können gemäß einem Verfahren erhalten
werden, das von Brown and Jacobsen in J. Chem. Soc., 1965, 3770
und von Harnden and Hurst in Aust. J. Chem., 1990, 43, 55–62, offenbart
ist.
-
Aufgrund
der C-2-Symmetrie von Pyrimidin sind die Stellungen 4 und 6 in dem
Pyrimidin der Formel IV austauschbar. Daher ist die Reihenfolge
der Addition der Substituenten an der 4- und der 6-Stellung des Pyrimidins
der Formel IV für
die Durchführung
der erfindungsge mäßen Verfahren
nicht entscheidend. Jedoch wird aus Bequemlichkeit, wenn ein Festphasensyntheseverfahren
verwendet wird, die erste Substitutionsreaktion mit einer Festphase
mit einem terminalen Nucleophil, z. B. einer sekundären Aminogruppe,
durchgeführt, das
verwendet wird, um das Pyrimidin der Formel IV kovalent an den Feststoffträger zu binden.
In dieser Weise kann die anschließende Reinigung und Isolation
des Produktes günstigerweise
einfach durch Waschen des Harzes mit einem entsprechenden Lösungsmittel
durchgeführt
werden, um jegliche nicht umgesetzte Reagenzien und/oder unerwünschte lösliche Reaktionsnebenprodukte
zu entfernen. Eine zweite nucleophile Verbindung, z. B. eine sekundäre Aminoverbindung,
enthaltend eine primäre
Aminogruppe, wird dann zugegeben, wodurch ein Nitropyrimidin der
Formel V erhalten wird:
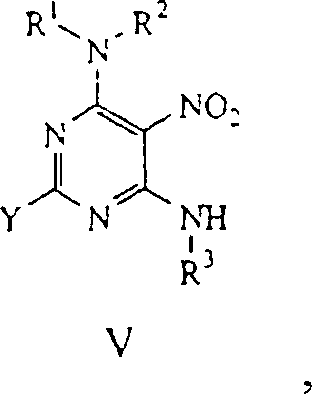
wo R
1,
R
2, R
3 und Y wie
oben definiert sind.
-
Die
betreffenden Erfinder haben entdeckt, daß sich in einer Lösungsphasensynthese
durch Zugeben von etwa einem Äquivalent
einer ersten Aminverbindung zu dem Nitropyrimidin der Formel III
beinah ausschließlich
ein monosubstituiertes Produkt ergab, d. h. es wird die Bildung
eines nicht statistischen Gemisches aus mono- und disubstituiertem
Produkt beobachtet. Ohne an irgendeine Theorie gebunden zu sein,
wird angenommen, daß die
Reaktivität
des Nitropyrimidinrings durch die Substitution von einer Halogenidgruppe
mit einer Aminokomponente signifikant reduziert wird. Es wird angenommen,
daß diese
Reduktion der Reaktivität für die fast
ausschließliche
Bildung des nicht statistischen Gemisches aus einer mono-aminosubstituierten
Nitropyrimidinverbindung verantwortlich ist.
-
Durch
die Verwendung dieses Unterschieds in der Reaktivität kann man
beide Substituenten an die 4- und die 6-Stelllung des Pyrimidinrings
in einem einzelnen Reaktionsgemisch addieren. In diesen Ausführungsformen
wird etwa ein Äquivalent
der ersten Aminverbindung zu der Nitropyrimidinverbindung der Formel
III bei Raumtemperatur zugegeben, um eine monosubstituierte Nitropyrimidinverbindung
herzustellen. Nachdem die Reaktion weitestgehend beendet ist, wird
eine zweite Aminverbindung zu demselben Reaktionsgemisch zugegeben, wodurch
eine 4,6-Diamino-substituierte Pyrimidinverbindung der Formel V
erhalten wird. Typischerweise wird die zweite Aminverbindung im Überschuß zugegeben,
und die Reaktion wird, wenn notwendig, erhitzt, z. B. auf mindestens
etwa 50 °C.
-
Wenn
das Nitropyrimidin der Formel V einmal erhalten wurde, kann der
Substituent an die 2-Stellung addiert
werden, wenn gewünscht.
Wenn die Austrittsgruppe Y beispielsweise ein Thioether ist, wird
sie durch Umsetzen des Nitropyrimidins der Formel V mit einem Thioetheroxidationsmittel
zu einer Sulfonylgruppe oxidiert. In Abhängigkeit der Nucleophilie einer
dritten nucleophilen Verbindung, die verwendet wird, um die Austrittsgruppe
Y zu verdrängen,
kann dieser Oxidationsschritt notwendig sein oder nicht. Jedoch
ergibt die Oxidation des Thioethers im allgemeinen eine Sulfonylgruppe,
die eine viel bessere Austrittsgruppe ist.
-
Die
Sulfonylpyrimidinverbindung wird dann mit einem Nucleophil, d. h.
R
5-M, umgesetzt, um ein 2,4,6-trisubstituiertes
5-Nitropyrimidin der Formel:
herzustellen.
-
Eine
Vielzahl von Nucleophilen kann die Sulfonylgruppe in dem Nitropyrimidin
der Formel V verdrängen
und einer Substitutionsreaktion mit dem Nitropyrimidin der Formel
V unterzogen werden. „Nucleophiles Reagens", wie hierin verwendet,
bezieht sich auf Alkoxide, Cycloalkoxide, Aryloxide, Thioalkoxide,
Thioaryloxide, Enolate (z. B. wo R5M R5XM ist und R5 Alkyl,
Cycloalkyl, Aryl, Alkenyl ist, X O oder S ist und M+ ein
Alkalimetall ist), Malonate (z. B. wo R5M
MCH(CO2Et)2 ist
und M+ ein Alkalimetall ist), Amine (z.
B. wo R5M NR8R9H ist) oder eine Organometallverbindung,
ist aber nicht darauf beschränkt.
Organometallverbindungen umfassen Organocupratverbindungen (z. B.
(R5)xCu, wo R5 eine konventionelle Gruppe ist, die dem
Fachmann bekannt ist, beispielsweise Alkyl, Alkenyl, Cycloalkyl
und Aryl; und x 1 oder 2 ist), Organolithiumverbindungen (z. B. R5-Li, wo R5 eine
konventionelle Gruppe ist, die dem Fachmann bekannt ist, beispielsweise
Alkyl, Alkenyl, Alkinyl, Cycloalkyl und Aryl), Grignard-Reagenzien
(z. B. R5-MgX, wo R5 eine
konventionelle Gruppe ist, die dem Fachmann bekannt ist, beispielsweise
Alkyl, Alkenyl, Cycloalkyl und Aryl; und X Halogenid ist) sowie
andere geeignete Nucleophile, die dem Fachmann bekannt sind, sind
aber nicht darauf beschränkt.
Ein „Alkalimetall", wie hierin verwendet,
bezieht sich auf ein Element der Gruppe IA.
-
Während die
Verfahren der vorliegenden Erfindung oben im Zusammenhang mit den
speziellen Recktanten und Reaktionsbedingungen dargestellt sind,
ist die vorliegende Erfindung nicht auf diese hierin angegebenen
Recktanten und Reaktionsbedingungen beschränkt. Die Reagenzien und die
Reaktionsbedingungen können
in Abhängigkeit
von speziellen Substituenten, die in dem Purinringsystem gewünscht sind,
und um die unerwünschte
Reaktion zu minimieren und/oder die Ausbeute des gewünschten
Produktes für
jede Reaktion zu erhöhen,
variieren.
-
Einige
der hierin beschriebenen Verbindungen können ein oder mehrere Asymmetriezentren
enthalten und können
daher Enantiomere, Diastereomere, geometrische Isomere und andere
Stereoisomere hervorrufen, die hinsichtlich der absoluten Stereochemie
als (R) oder (S) oder als (E) oder (Z) für Purine, die einen Olefinsubstituenten
umfassen, definiert werden. Der Umfang der vorliegenden Erfindung
umfaßt
alle möglichen Isomere
sowie ihre racemischen und optisch reinen Formen. Optisch aktive
(R)- und (S)-Isomere können
unter Verwendung von chiralen Synthonen oder chiralen Reagenzien
hergestellt oder unter Verwendung konventioneller Techniken getrennt
werden. Wenn die hierin beschriebenen Verbindungen olefinische Doppelbindungen oder
andere Zentren von geometrischer Asymmetrie enthalten, und wenn
nicht anders angegeben, sollen sowohl geometrische E- als auch Z-Isomere
umfaßt
sein. Ebenso sollen alle tautomeren Formen enthalten sein.
-
IV. Kombinatorische Bibliothek
-
Wie
oben beschrieben, stellt die vorliegende Erfindung Verfahren zur
Herstellung eines stark substituierten Purins aus einer Pyrimidinverbindung
bereit. Diese Syntheseverfahren sind beim Herstellen einer einzelnen
Purinverbindung sowie einer kombinatorischen Bibliothek von Purinen
nützlich.
Außerdem
erlauben die erfindungsgemäßen Verfahren
eine schrittweise Lösungsphasen-
oder Festphasensynthese des Purinringsystems. Die Fähigkeit,
einen breiten Bereich an Substituenten an dem Purinring zu konstruieren,
erlaubt die Konstruktion von Bi bliotheken mit praktisch jeden gewünschten
Komplexitätsgrad.
Die mögliche
Komplexität
der Bibliotheken wird durch die stereochemischen Variationen weiter
verbessert.
-
Das
Verfahren der vorliegenden Erfindung kann eine kombinatorische Bibliothek
von Purinen der Formel
bereitstellen, worin R
1, R
2, R
3,
R
4 und R
5 wie hierin
definiert sind.
-
Jede
Verbindung in der kombinatorischen Bibliothek der vorliegenden Erfindung
umfaßt
eine Purinstruktur mit verschiedenen Substituenten an der 2-, 6-,
8- und der 9-Stellung des Purinringsystems. Die Substituenten werden
durch die Reagenzien bestimmt, die in den oben beschriebenen Verfahren
verwendet werden. Einige Substituenten können in einer geschützten Form
vorliegen, was weitere Manipulation und Derivatisierung ermöglicht.
-
Eine
Vielzahl von Substituenten an dem Purinring trägt zu der strukturellen Verschiedenheit
bei, die mit dieser Klasse von Verbindungen erreichbar ist, was
wiederum die Auswahl von Purinverbindungen mit wünschenswerten biologischen
Aktivitäten
erleichtert.
-
Purinverbindungen
in der kombinatorischen Bibliothek werden unter Verwendung der oben
beschriebenen Verfahren, bevorzugt unter Verwendung eines Festphasensyntheseverfahrens,
aufgebaut. Wie oben beschrieben, erlauben die erfindungsgemäßen Verfahren
die selektive Einführung
von verschiedenen Substituenten an unterschiedlichen Purinringstellungen.
Deshalb kann eine Bibliothek von Purinverbindungen ohne weiteres
unter Verwendung eines Gemisches aus entsprechenden Reagenzien während irgendeines
Schrittes zum Einführen
eines Substituenten an dem Purinring hergestellt werden. Die resultierenden
Substituenten sollten gegen jegliche nachträgliche Synthesebedingungen
und jegliche erforderliche Schützungs-
oder Entschützungsschritte
stabil sein sowie unter den Verwendungsbedingungen stabil sein.
-
Ein
besonders bevorzugtes Aufbauverfahren ist eine Festphasensynthese,
bei der tetra- substituiertes Pyrimidin der Formel IV zunächst mit
einem Harz umgesetzt wird, um die Pyrimidinringstruktur kovalent
an einen Feststoffträger
zu binden. In dieser Weise kann in Abhängigkeit der Verschiedenheit
der Nucleophile, z. B. Aminokomponenten, die an das Harz gebunden
sind, eine breite Vielzahl von Feststoffträger-gebundenen Pyrimidinen
mit unterschiedlichen Substituenten an der 6-Stellung ohne weiteres
hergestellt werden. Dieses Feststoffträger-gebundene Pyrimidin wird
dann weiter gemäß den hierin
beschriebenen Verfahren verarbeitet, um eine Bibliothek aus stark
substituierten Purinverbindungen herzustellen. Deshalb können Hunderte
von unterschiedlichen Purinen ohne weiteres unter Verwendung der
erfindungsgemäßen Verfahren
hergestellt werden.
-
Kombinatorische
Bibliotheken des Typs, der in der Erfindung verwendet wird, können durch
eine Vielzahl von Lösungsphasen-
oder Festphasenverfahren gebildet werden, bei denen ein homogenes
Gemisch aus Reagenzien, die einen Substituenten an dem Purinring
bilden, schrittweise zugegeben wird. Da die Substituenten an jede
Stellung des Purinrings unabhängig
addiert werden, können
erfindungsgemäße Verfahren
verwendet werden, um eine Bibliothek von Purinen mit bekannten Substitutionsmustern
herzustellen.
-
Festphasenteilchenbibliothek
-
Es
gibt viele Festphasenverfahren, die zur Herstellung einer Bibliothek
von Verbindungen verfügbar sind.
Beispielsweise kann man einfach ein Gemisch aus gewünschten
Substituenten während
jedes Schrittes zugeben, was zur Durchführung der Synthese in einer
einzelnen Charge führt.
Dieses Einzelchargenverfahren ermöglicht die Einführung eines
Gemisches aus Substituenten an irgendeiner gegebenen Purinringstellung
in einer Reaktion. Jedoch kann, wenn das Gemisch aus Reagenzien
Verbindungen mit unterschiedlicher Reaktivität umfaßt, das resultierende Produkt
nicht notwendigerweise alle strukturell unterschiedlichen Purinverbindungen,
wie gewünscht,
enthalten.
-
Alternativ
kann man ein Split-Pool-Verfahren verwenden, das die Probleme vermeidet,
die mit der unterschiedlichen Reaktivität von Reagenzien verbunden
sind. Bei einem Split-Pool-Verfahren
werden die Feststoffträger,
d. h. Kügelchen,
enthaltend Pyrimidine, die die Purinbibliothek bilden, abwechselnd
gemischt und getrennt, wobei einer von einer ausgewählten Anzahl
Substituenten an jede Gruppe von getrennten Kügelchen in jedem Schritt addiert
wird. In dieser Weise enthält
jedes Kügelchen
in der resultierenden Bibliothek nur eine Purinspezies, was erlaubt,
daß ein
Einzelkügelchen,
wenn einmal identifiziert, das gewünschte Purin enthält.
-
Jegliche
konventionelle große
Kügelchen
(d. h. Harze oder Teilchen), die im allgemeinen in einer Festphasensynthese
verwendet werden, können
in der vorliegenden Erfindung verwendet werden. Das Kügelchen wird
bevorzugt mit einem Linker oder einer funktionellen Linker-Gruppe derivatisiert,
wie durch eine reduktive Aminierung einer Aldehyd-funktionellen
Gruppe, die an dem Harz vorliegt. Alternativ können Kügelchen ebenso kovalent an
einen Linker gebunden sein, der eine Aldehyd-funktionelle Gruppe
umfaßt,
die zu seinem distalen oder freien Ende nachbarständig ist.
Jegliche konventionelle Kügelchen,
die dem Fachmann bekannt sind, können
modifiziert oder derivatisiert werden, damit sie in den erfindungsgemäßen Verfahren
verwendbar sind. Beispielsweise können Harze, die eine Aldehydgruppe
umfassen, durch reduktive Aminierung funktionalisiert werden. Harze,
die eine Aminogruppe umfassen, können
als solche verwendet werden, oder wenn die Aminogruppe eine primäre Aminogruppe
ist, kamen sie zu einer sekundären
Aminogruppe umgewandelt oder monogeschützt werden. Harze, die eine
Hydroxylgruppe oder eine Halogenidgruppe nahe ihren Oberflächen umfassen,
können
so modifiziert werden, daß sie
eine Amino- oder eine Aldehyd-funktionelle Gruppe auf ihrer Oberfläche erhalten.
-
Exemplarische
Harze, die als Feststoffträger
verwendet werden können,
umfassen ArgoGelTM Harze, wie ArgoGelTM-MB-CHO-Harz, ArgoGelTM-Cl-Harz,
ArgoGelTM-NH2-Harz,
ArgoGelTM-OH-Harz, ArgoGelTM-Rink-NH-Fmoc-Harz;
ArgoPoreTM-Harze; MerrifieldTM-Harze;
und andere stark vernetzte makroporöse Polystyrolharze und kommerziell
erhältliche
Polystyrolharze mit Amin-, Hydroxyl- oder Carboxylkomponenten, die
ihre Oberflächen
abdecken, sind aber nicht darauf beschränkt. Diese Harze können direkt
verwendet werden oder können
modifiziert werden, um geeignete Stellen zum Verknüpfen geeigneter
Tether oder weiterer Funktionalisierung bereitzustellen.
-
Linker
oder Tether können
jede Kette mit 1 bis etwa 100, bevorzugt 1 bis etwa 50 und stärker bevorzugt 1
bis etwa 30 Atomen sein, wo jedes Atom der Kette unabhängig ausgewählt ist aus
der Gruppe, bestehend aus C, N, O, S und Si. Beispielsweise können Linker
Polyethylenglycole und Polypropylenglycole sein.
-
Ein
Linker und/oder Tether sollte selektiv spaltbar, gegen Bedingungen
stabil sein, die zum Anlagern verschiedener Substituenten an das
Purin- oder Pyrimidinringsystem verwendet werden, und gegen Entschützungsbedingungen
für Enden
und/oder Substituenten stabil sein. In einigen Fällen, wo der Festphasenassay verwendet
wird, um die Aktivität
zu bestimmen, sollte der Linker gegen die Bedingungen, die für die Bewertung der
Zielbindung verwendet werden, ebenso stabil sein. Der Linker sollte
ebenso leicht und selektiv unter einfachen Bedingungen spaltbar
sein.
-
Harze,
enthaltend einige Femtomol bis wenige Millimol funktionelle Stellen
auf ihren Oberflächen,
können
verwendet werden, um eine kombinatorische Festphasenbibliothek von
Purinen herzustellen. Teile der Harze können gegebenenfalls mit einer
geeigneten Markierungsverbindung, wie einer Farbstoff-, radioaktiven oder
fluoreszierenden Gruppe, umgesetzt werden, um die Identifikation
von Substituenten, die an dem Purinring vorliegen, zu erleichtern.
Alternativ kann die Markierung in die Teilchenmatrix während der
Synthese der Bibliothek eingeführt
werden. Die Verwendung von Markierungen zum Identifizieren der chemischen
Struktur innerhalb einer kombinatorischen Bibliothek ist in der
Technik allgemein bekannt. Siehe beispielsweise Still et al., Complex
Combinatorial Chemical Libraries Encoded with Tags,
WO 94/08051 , das hierin durch Verweis
in seiner Gesamtheit aufgenommen wird.
-
Bei
einem typischen Split-Pool-Verfahren werden Teilchen, enthaltend
mindestens mehrfach so viele Teilchen wie die Purinspezies in der
Bibliothek, hergestellt und in gleiche Teile geteilt. Die Anzahl
an Teilen ist typischerweise dieselbe wie die Anzahl an unterschiedlichen
Substituenten, die für
die spezielle Stellung des Purins in der Bibliothek hergestellt
werden sollen. Jeder Teil der Teilchen wird dann mit einem unterschiedlichen
Reagens, z. B. einem Nucleophil oder einer Cyclisierungsverbindung,
umgesetzt. Nach der Reaktion werden alle Teile der Teilchen vereinigt,
gründlich
gemischt und gewaschen.
-
Jedes
der oben beschriebenen Reaktionsverfahren wird durch Teilen der
Teilchen in separate Teile durchgeführt. Die resultierenden Teilchen
werden gewaschen und nach jedem Reakti onsschritt wieder vereinigt,
bis der Purinring gebildet ist, wodurch eine vollständige Bibliothek
von Purinen, die kovalent an die Teilchen gebunden sind, erhalten
wird.
-
Man
kann ebenso eine parallele Synthese verwenden, um eine Bibliothek
von Purinverbindungen herzustellen. Bei einer parallelen Synthese
werden ähnliche
Reaktionen unter Verwendung unterschiedlicher Reagenzien separat
in jedem Reaktionsbehälter
durchgeführt,
z. B. in jedem Loch einer 96-Loch-Reaktionsvorrichtung. In dieser
Weise kann eine Bibliothek von räumlich
getrennten Purinverbindungen gleichzeitig synthetisiert werden.
Da jedes Reaktionsloch ein bekanntes Reagens umfassen wird, kann
die Struktur von jeder resultierenden räumlich getrennten Bibliothek
der Purinverbindung ohne weiteres bestimmt werden, ohne die Notwendigkeit
für Dekonvolutionsverfahren.
Außerdem
kann die Struktur jeder Purinverbindung durch ihre physikalischen
Eigenschaften wie NMR, IR, UV, MS, Schmelzpunkt, Siedepunkt, Röntgenkristallographie
usw. bestimmt werden.
-
V. Nutzen
-
Die
Bibliothek der vorliegenden Erfindung ist als ein Screeningtool
zum Entdecken neuer Leitstrukturen durch Bewertung über eine
Anordnung von biologischen Assays, einschließlich der Entdeckung von selektiven
Kinaseinhibitoren, nützlich.
Die Bibliothek ist daher ein Tool zur Arzneimittelentdeckung; d.
h. als ein Mittel zum Entdecken neuer Leitverbindungen durch Screenen
der Bibliothek gegen eine Vielzahl von biologischen Targets und
zum Entwickeln von Struktur-Aktivitäts-Beziehungen (SAR) in großen Familien
von verwandten Verbindungen. Die Bibliothek kann mit den Liganden
getestet werden, die an die Feststoffträger gebunden sind, oder die
Purine können
von dem Feststoffträger
vor der Bewertung abgespalten werden. Wenn das Purin vor der Bewertung
abgelöst
wird, kann seine Beziehung zu seinem Feststoffträger aufrechterhalten werden, beispielsweise
durch Lokalisierung innerhalb des Gitters einer Standard-96-Lochplatte
oder durch Lokalisierung der Aktivität auf einem Zellrasen. Ob die
Verbindungen angelagert oder abgelöst von den Feststoffträgern getestet
werden, können
die Markierungen, angelagert an den Feststoffträger, verbunden mit der Bioaktivität, dann
decodiert werden, um die strukturelle oder synthetische Geschichte
der aktiven Verbindung zu offenbaren. Siehe beispielsweise Ohlmeyer
et al., Proc. Natl. Acad. Sci. USA, 1993, 90, 10922–10926,
und Still et al., PCT-Veröffentlichung
Nr.
WO 94/08051 . Alternativ
können
die Strukturen durch Dekonvolution oder durch ihre physikalischen
Eigenschaften wie NMR-, IR-, UV-Spektren, Massenspektrum, Röntgenkristallographie
usw. be stimmt werden. Selbst wenn keine Verbindungen in einem gegebenen
Screen als aktiv befunden werden, stellt dieser Mangel an Aktivität oftmals
nützliche
SAR-Informationen bereit.
-
Weitere
Gegenstände,
Vorteile und neue Merkmale dieser Erfindung werden dem Fachmann
bei der Prüfung
der folgenden Beispiele, die nicht einschränkend sind, offensichtlich
werden.
-
BEISPIELE
-
Beispiel 1
-
Dieses
Beispiel stellt ein Verfahren zum Synthetisieren von Olomoucin unter
Verwendung der Verfahrensweise der vorliegenden Erfindung dar.
-
-
ArgoGel-MB-CHO
(0,40 mmol/g Substitution) (2,0 g, 0,80 mmol) wurde in 20 ml Dichlorethan
(DCE) suspendiert, und Benzylamin (0,26 g, 2,40 mmol) wurde zugegeben.
Die Reaktion wurde verschlossen und für 1 Stunde auf einen Rotator
gegeben. Natriumtriacetoxyborhydrid (0,51 g, 2,4 mmol), suspendiert
in 5 ml DCE, wurde in einem Teil zu der Reaktion gegeben und die
Reaktion wurde bei Raumtemperatur für weitere 24 Stunden auf einen
Rotator gegeben. Das Harz 1 wurde dann filtriert und nacheinander
mit 3 Teilen Methanol, 3 Teilchen Dichlormethan, 3 Teilchen Methanol
und 2 Teilchen Diethylether gewaschen.
-
Das
Harz 1 (2,0 g, 0,80 mmol) wurde in 25 ml Tetrahydrofuran und Diisopropylethylamin
(0,31 g, 2,40 mmol) zugegeben, gefolgt von 4,6-Dichlor-2-methylmercapto-5-nitropyrimidin
(0,58 g, 2,40 mmol). Die Reaktion wurde verschlossen und für 3 Stunden
bei Raumtemperatur auf einen Rotator gegeben. Das resultierende Harz
2 wurde dann filtriert und nacheinander mit 3 Teilen Methanol, 3
Teilen Dichlormethan, 3 Teilen Methanol und 2 Teilen Diethylether
gewaschen.
-
Das
Harz 2 (2,0 g, 0,80 mmol) wurde in 20 ml nBuOH suspendiert und Methylamin
(2,0 M in Methanol, 4,0 ml, 8,0 mmol) wurde zugegeben. Die Reaktion
wurde verschlossen und für
4 Stunden bei Raumtemperatur auf einen Rotator gegeben. Das resultierende
Harz 3 wurde dann filtriert und nacheinander mit 3 Teilen Methanol,
3 Teilen Dichlormethan, 3 Teilen Methanol und 2 Teilen Diethylether
gewaschen.
-
Das
Harz 3 (2,0 g, 0,8 mmol) wurde in 25 ml einer Lösung aus Methanol : Dichlormethan
: Wasser 20 : 10 : 1 suspendiert. Natriumbicarbonat (0,35 g, 4,0
mmol) wurde zugegeben, gefolgt von OXONE® (1,23
g, 2,0 mmol). Die Reaktion wurde verschlossen und manuell für 15 Minuten
unter häufigem
Entlüften
geschüttelt.
Die Reaktion wurde dann für
24 Stunden bei Raumtemperatur unter periodischem Entlüften auf
einen Rotator gegeben. Das resultierende Harz 4 wurde dann filtriert
und nacheinander mit 3 Teilen Wasser, 3 Teilen Methanol, 3 Teilen.
Dichlormethan, 3 Teilen Methanol und 2 Teilen Diethylether gewaschen.
-
Das
Harz 4 (2,0 g, 0,8 mmol) wurde in 25 ml THF suspendiert und DIEA
(1,03 g, 8,0 mmol) und TBDPS-geschütztes Ethanolamin (0,8 g, 2,4
mmol) wurden nacheinander zugegeben. Die Reaktion wurde für 24 Stunden
bei Raumtemperatur auf einen Rotator gegeben. Das resultierende
Harz 5 wurde dann filtriert und nacheinander mit 3 Teilen Methanol,
3 Teilen Dichlormethan, 3 Teilen Methanol und 2 Teilen Diethylether
gewaschen.
-
Das
Harz 5 (2,0 g, 0,8 mmol) wurde in einem 20 : 1-Gemisch aus DMF :
Methanol suspendiert und wasserfreies Chromchlorid (1,0 g, 8,0 mmol)
wurde zugegeben. Die Reaktion wurde verschlossen und für 4 Stunden
bei Raumtemperatur auf einen Rotator gegeben. Die DMF : Methanol-Lösung wurde
von dem Harz abgezogen und das Harz kurz mit 1 Teil DMF gewaschen.
Das Harz wurde dann wieder in 20 ml DMF und 5 ml wasserfreiem Trimethylorthoformiat
suspendiert. Methansulfonsäure
(4 Tropfen) wurde zu der Suspension zugegeben und der Reaktionsbehälter verschlossen
und bei 80 °C
für 24
Stunden geschüttelt.
Das resultierende Harz 6 wurde dann auf Raumtemperatur abgekühlt, filtriert
und nacheinander mit 3 Teilen Methanol, 3 Teilen Dichlormethan,
3 Teilen Methanol und 2 Teilen Diethylether gewaschen.
-
Das
Harz 6 (2,0 g, 0,8 mmol) wurde in 20 ml THF suspendiert und eine
1,0 M TBAF-Lösung
in THF (8,0 ml, 8,0 mmol) wurde zugegeben. Das Harz wurde für 2 Stunden
bei Raumtempe ratur auf einen Rotator gegeben. Das resultierende
Harz 7 wurde dann filtriert und nacheinander mit 3 Teilen Methanol,
3 Teilen Dichlormethan, 3 Teilen Methanol und 2 Teilen Diethylether
gewaschen.
-
Das
Harz 7 (2,0 g, 0,8 mmol) wurde in 20 ml 95%iger wässeriger
Trifluoressigsäure
suspendiert. Der Reaktionsbehälter
wurde verschlossen und für
3 Stunden bei Raumtemperatur auf einen Rotator gegeben. Das resultierende
Harz wurde filtriert und nacheinander mit 3 Teilen Dichlormethan,
3 Teilen Methanol und 3 Teilen Wasser gewaschen. Das Filtrat wurde
im Vakuum konzentriert und mit 30 ml Wasser verdünnt. Das Rohprodukt wurde gefroren
und für
48 Stunden lyophilisiert, wodurch Olomoucin als ein flaumiges weißes Pulver erhalten
wurde. Das resultierende Rohprodukt 8 wurde mit PS-Trisamin-Harz
in Dichlormethan für
24 Stunden gerührt,
filtriert, konzentriert und durch LC-MS analysiert.
-
Analytische Daten für Olomoucin
-
- Rohprodukt: 89% Reinheit.
- Gereinigt durch Flashsäulenchromatographie
(80 : 10 : 1 EtOAc : MeOH : TEA).
- Ausbeute: 182 mg, Reinheit durch LC-MS-Analyse: 92%.
- Kann auf 100% Reinheit aus EtOAc-MeOH-Hexan umkristallisiert
werden.
- 1H NMR(300 MHz, d6-DMSO) δ 7,82 (br
s, 1H), 7,67 (s, 1H), 7,15–7,35
(m, 5H), 6,20 (br s, 1H) (in Gegenwart von D2O
nicht vorhanden), 4,63 (m, 2H), 3,54 (s, 3H), 3,48 (m, 2H), 3,31
(m, 2H).
- 13C NMR (75 MHz, d6-DMSO)
159,79, 149,9, 141,1, 138,2, 128,4, 127,7, 126,8, 113,6, 60,8, 44,3,
29,2.
- Smp: 129,4–130,3 °C
- λmax 289, 231
- ESIMS m/z 299 (M+H)+
-
Beispiel 2
-
Dieses
Beispiel stellt ein Verfahren zum Synthetisieren einer Bibliothek
von Purinverbindungen auf einer Festphase dar.
-
-
ArgoGel-MB-CHO
(0,40 mmol/g Substitution) (2,0 g, 0,8 mmol) wurde in 30 ml Dichlorethan
(DCE) suspendiert und ein Amin R1-NH2 (2,4 mmol) wurde zugegeben. Der Reaktionsbehälter wurde
verschlossen und für
1 Stunde auf einen Rotator gegeben. Natriumtriacetoxyborhydrid (0,52
g, 2,4 mmol), suspendiert in 5 ml DCE, wurde in einem Teil zu der
Reaktion zugegeben und die Reaktion bei Raumtemperatur für weitere
24 Stunden auf einen Rotator gegeben. Das Harz 1 wurde dann filtriert
und nacheinander mit 3 Teilen Methanol, 3 Teilen Dichlormethan,
3 Teilen Methanol und 2 Teilen Diethylether gewaschen.
-
Das
Harz 1 (2,0 g, 0,8 mmol) wurde in 30 ml Tetrahydrofuran suspendiert
und Diisopropylethylamin (0,31 g, 2,4 mmol) wurde zugegeben, gefolgt
von 4,6-Dichlor-2-methylmercapto-5-nitropyrimidin
(0,58 g, 2,4 mmol). Der Reaktionsbehälter wurde verschlossen und
für 3 Stunden
bei Raumtemperatur auf einen Rotator gegeben. Das resultierende
Harz 2 wurde dann filtriert und nacheinander mit 3 Teilen Methanol,
3 Teilen Dichlormethan, 3 Teilen Methanol und 2 Teilen Diethylether
gewaschen.
-
Das
Harz 2 (2,0 g, 0,8 mmol) wurde in 30 ml THF suspendiert. Diisopropylethylamin
(0,31 g, 2,4 mmol) wurde zugegeben, gefolgt von Amin R2-NH2 (2,4 mmol). Der Reaktionsbehälter wurde
verschlossen und für
4 Stunden bei Raumtemperatur auf einen Rotator gegeben. Das resultierende
Harz 3 wurde dann filtriert und nacheinander mit 3 Teilen Methanol,
3 Teilen Dichlormethan, 3 Teilen Methanol und 2 Teilen Diethylether
gewaschen.
-
Das
Harz 3 (2,0 g, 0,8 mmol) wurde in 30 ml einer Lösung aus Methanol : Dichlormethan
: Wasser 20 : 10 : 1 suspendiert. Natriumbicarbonat (0,34 g, 4,0
mmol) wurde zugegeben, gefolgt von OXONE® (1,23
g, 2,0 mmol). Der Reaktionsbehälter
wurde verschlossen und manuell für
15 Minuten unter häufigem
Entlüften
geschüttelt.
Die Reaktion wurde dann für
24 Stunden bei Raumtemperatur unter periodischem Entlüften auf
einen Rotator gegeben.
-
Das
resultierende Harz 4 wurde dann filtriert und nacheinander mit 3
Teilen Wasser, 3 Teilen Methanol, 3 Teilen Dichlormethan, 3 Teilen
Methanol und 2 Teilen Diethylether gewaschen.
-
Das
Harz 4 wurde in sieben gleiche Teile geteilt (0,28 g, 0,12 mmol)
und die folgenden Manipulationen an jedem Harz durchgeführt. Das
Harz 4 (0,28 g, 0,12 mmol) wurde in 10 ml THF suspendiert und DIEA
(0,05 g, 0,36 mmol) wurde zugegeben, gefolgt von R3-NH2
(0,36 mmol). Das Reaktionsgemisch wurde für 24 Stunden bei Raumtemperatur
auf einen Rotator gegeben. Das resultierende Harz 5 wurde dann filtriert
und nacheinander mit 3 Teilen Methanol, 3 Teilen Dichlormethan,
3 Teilen Methanol und 2 Teilen Diethylether gewaschen.
-
Das
Harz 5 (0,28 g, 0,12 mmol) wurde in einem 20 : 1-Gemisch aus DMF
: Methanol suspendiert und wasserfreies Chromchlorid (0,15 g, 1,2
mmol) wurde zugegeben. Der Reaktionsbehälter wurde verschlossen und
für 4 Stunden
bei Raumtemperatur auf einen Rotator gegeben. Die DMF : Methanol-Lösung wurde
entfernt, und das Harz wurde kurz mit 1 Teil DMF gewaschen. Das
Harz wurde dann wieder in 2 : 1 DMF : wasserfreiem Orthoester suspendiert
(Trimethylorthoformiat für
R4 = H, Trimethylorthoacetat für R4 = Methyl). Ein Tropfen Methansulfonsäure wurde
zugegeben, und der Reaktionsbehälter
wurde verschlossen und bei 80 °C für 24 Stunden
geschüttelt.
Das resultierende Harz 6 wurde dann auf Raumtemperatur abgekühlt, filtriert
und nacheinander mit 3 Teilen Methanol, 3 Teilen Dichlormethan,
3 Teilen Methanol und 2 Teilen Diethylether gewaschen.
-
Das
Harz 6 (0,28 g, 0,12 mmol) wurde in 5 ml 95%iger wässeriger
Trifluoressigsäure
suspendiert. Der Reaktionsbehälter
wurde verschlossen und für
3 Stunden bei Raumtemperatur auf einen Rotator gegeben. Das resultierende
Harz wurde filtriert und mit 6 Teilen Dichlormethan gewaschen. Das
Filtrat wurde im Vakuum konzentriert, wodurch das Rohprodukt erhalten
wurde. Das resultierende Rohprodukt 7 wurde durch LC-MS analysiert
(siehe Tabelle A). Bibliotheksmitglieder:
Tabelle A
| R1 | R2
LC-MS Reinheit | R3 | R4 |
| Benzyl | i-Propyl-pyrrolidinyl | H | 96,5% |
| Benzyl | i-Propyl-4-methoxybenzylamino | H | 50,6% |
| Benzyl | i-Propyl-4-methoxyanilinyl | H | 62,4% |
| Benzyl | i-Propyl-N-benzyl-N-2-(dimethyl-aminoethyl)amino | H | 82,3% |
| Benzyl | i-Propyl-thiomorpholino | H | 95,2% |
| Benzyl | i-Propyl-dimethylamino | H | 95,1% |
| Benzyl | i-Propyl-heptylamino | H | 28,4% |
-
Die
vorhergehende Erläuterung
der Erfindung ist für
die Zwecke der Veranschaulichung und Beschreibung dargestellt worden.
Vorhergehendes soll die Erfindung nicht auf die Form oder Formen,
die hierin offenbart ist/sind, beschränken. Obwohl die Beschreibung
der Erfindung die Beschreibung von einer oder mehreren Ausführungsformen
und bestimmten Variationen und Modifikationen umfaßt, liegen
andere Variationen und Modifikationen innerhalb des Umfangs der
vorliegenden Erfindung, z. B. können
sie innerhalb der Fähigkeit und
des Wissens des Fachmanns nach dem Verständnis der vorliegenden Offenbarung
liegen.








































