DE10233817A1 - Substituierte Diarylheterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel - Google Patents
Substituierte Diarylheterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel Download PDFInfo
- Publication number
- DE10233817A1 DE10233817A1 DE10233817A DE10233817A DE10233817A1 DE 10233817 A1 DE10233817 A1 DE 10233817A1 DE 10233817 A DE10233817 A DE 10233817A DE 10233817 A DE10233817 A DE 10233817A DE 10233817 A1 DE10233817 A1 DE 10233817A1
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- aryl
- phenyl
- independently
- compounds according
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- IODWRMICGQOLMN-UHFFFAOYSA-N CN(C)CCOc(cc1)ccc1N(C=CN1c(cc2)ccc2Oc(cccc2)c2[NH+]([O-])[O-])C1=O Chemical compound CN(C)CCOc(cc1)ccc1N(C=CN1c(cc2)ccc2Oc(cccc2)c2[NH+]([O-])[O-])C1=O IODWRMICGQOLMN-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/91—Nitro radicals
- C07D233/92—Nitro radicals attached in position 4 or 5
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/04—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member
- C07D233/28—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having one double bond between ring members or between a ring member and a non-ring member with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/30—Oxygen or sulfur atoms
- C07D233/32—One oxygen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/70—One oxygen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/72—Two oxygen atoms, e.g. hydantoin
- C07D233/74—Two oxygen atoms, e.g. hydantoin with only hydrogen atoms or radicals containing only hydrogen and carbon atoms, attached to other ring members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/66—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D233/91—Nitro radicals
- C07D233/92—Nitro radicals attached in position 4 or 5
- C07D233/94—Nitro radicals attached in position 4 or 5 with hydrocarbon radicals, substituted by oxygen or sulfur atoms, attached to other ring members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D243/00—Heterocyclic compounds containing seven-membered rings having two nitrogen atoms as the only ring hetero atoms
- C07D243/04—Heterocyclic compounds containing seven-membered rings having two nitrogen atoms as the only ring hetero atoms having the nitrogen atoms in positions 1 and 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
- C07D249/10—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D249/12—Oxygen or sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/10—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/10—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/08—Bridged systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Diabetes (AREA)
- Public Health (AREA)
- Endocrinology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Emergency Medicine (AREA)
- Psychiatry (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Child & Adolescent Psychology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Die Erfindung betrifft substituierte Diarylheterocyclen sowie deren physiologisch verträgliche Salze und physiologisch funktionelle Derivate. DOLLAR A Es werden Verbindungen der Formel I, DOLLAR F1 worin die Reste die angegebenen Bedeutungen haben, sowie deren physiologisch verträglichen Salze und Verfahren zu deren Herstellung beschrieben. Die Verbindungen eignen sich z. B. als Anorektika.
Description
- Die Erfindung betrifft substituierte Diarylheterocyclen sowie deren physiologisch verträgliche Salze und physiologisch funktionelle Derivate.
- Es sind bereits den hier beschriebenen Diarylheterocyclen in ihrer Gesamtstruktur ähnliche Verbindungen mit pharmakologischer Wirkung im Stand der Technik beschrieben (wie zum Beispiel
US006054590A ). - Der Erfindung lag die Aufgabe zugrunde, Verbindungen zur Verfügung zu stellen, die eine Gewichtsreduktion bei Säugetieren bewirken und die zur Prävention und Behandlung von Obesitas geeignet sind.
- Die Erfindung betrifft daher Verbindungen der Formel 1, worin bedeuten
R (C1-C8)-Alkyl, (C0-C8)-Alkylen-Aryl, (C3-C8)-Cycloalkyl, (C1-C4)-Alkoxy(C1-C4)-alkyl, (C2-C8)-Alkenyl, (C2-C8)-Alkinyl;
3-12 gliedriger mono-, bi- oder spirobicyclischer Ring, der ein oder mehrere Heteroatome aus der Gruppe N, O und S enthalten kann und der 3-12 gliedrige Ring weitere Substituenten wie F, Cl, Br, NO2, CF3, OCF3, CN, (C1-C6)-Alkyl, Aryl, CON(R11)(R12), N(R13)(R14), OH, O(C1-C6)-Alkyl, S-(C1-C6)-Alkyl, N(R15)CO(C1-C6)-Alkyl oder COO-(C1-C6)-Alkyl tragen kann;
R11, R12, R13, R14, R15 unabhängig voneinander H, (C1-C6)-Alkyl;
B eine Bindung oder ein Linker der aus ein oder zwei Resten aus der Gruppe (C(R19)(R20))i, C(OR21)(R22), O, N(R23), S, SO, SO2, CO besteht;
i 0, 1, 2, 3;
R19, R20, R21, R22, R23 unabhängig voneinander H, (C1-C6)-Alkyl, Aryl;
R1, R2, R3 , R4 unabhängig voneinander H, F, Cl, Br, J, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-Alkyl, O-(C1-C4)-Alkoxy-(C1-C4)-alkyl, S-(C1-C6)-Alkyl, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C3-C8)-Cycloalkyl, O-(C3-C8)-Cycloalkyl, (C3-C8)-Cycloalkenyl, O-(C3-C8)-Cycloalkenyl, (C2-C6)-Alkinyl, (C0-C8)-Alkylen-Aryl, O-(C0-C8)-Alkylen-Aryl, S-Aryl, N(R24)(R25), SO2-CH3, COOH, COO-(C1-C6)-Alkyl, CON(R26)(R27), N(R28)CO(R29), N(R30)SO2(R31), CO(R32);
R24, R25, R26, R27, R28, R30 unabhängig voneinander H, (C1-C6)-Alkyl;
R29, R31, R32 unabhängig voneinander N, (C1-C6)-Alkyl, Aryl;
W -(CH2)n -, -CH=CH-, -CH=N-, -N=CH-;
n 2, 3, 4, 5;
R5, R6, R7, R8 unabhängig voneinander N, F, Cl, Br, J, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-Alkyl, O-(C1-C4)-Alkoxy-(C1-C4)-alkyl, S-(C1-C6)-Alkyl, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C3-C8)-Cycloalkyl, O-(C3-C8)-Cycloalkyl, (C3-C8)- Cycloalkenyl, O-(C3-C8)-Cycloalkenyl, (C2-C6)-Alkinyl, (C0-C8)-Alkylen-Aryl, O-(C0-C8)-Alkylen-Aryl, S-Aryl, N(R33)(R34), SO2-CH3, COOH, COO-(C1-C6)-Alkyl, CON(R35)(R36), N(R37)CO(R38), N(R39)SO2(R40), CO(R41), ein 5-7 gliedrigen Heterocyclus mit 1-4 Heteroatomen aus der Gruppe O, N und S;
R33, R34 unabhängig voneinander H, (C1-C6)-Alkyl;
oder R33 und R34 bilden zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen 5-6 gliedrigen Ring, wobei im Falle des 6-Rings eine CH2-Gruppe durch O oder S ersetzt sein kann;
R35, R36, R37, R39 unabhängig voneinander N, (C1-C6)-Alkyl;
R38, R40, R41 unabhängig voneinander H, (C1-C6)-Alkyl, Aryl;
A eine Kette -(C(R42)(R43))m -, in der 0-2 Glieder ersetzt sein können durch ein Element aus der Gruppe O, S, N(R44), CO, SO2;
m 0, 1, 2, 3, 4, 5;
R42, R43, R44 unabhängig voneinander N, (C1-C6)-Alkyl, Aryl;.
R9, R10 unabhängig voneinander H, (C1-C8)-Alkyl, -(CH2)o-R45, (C1-C4)-Alkoxy-(C1-C4)-alkyl, Aryloxy-(C1-C4)-alkyl, (C3-C8)-Alkenyl, (C3-C8)-Alkinyl, CO-(C1-C8)-Alkyl, -CO-(CH2)o -R45, CO-(C1-C4)-Alkoxy-(C1-C4)alkyl, CO-Aryloxy-(C1-C4)-alkyl, CO-(C2-C8)-Alkenyl, CO-(C2-C8)-Alkinyl; oder R9 und R10 bilden zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen 4 bis 10-gliedrigen mono-, bi- oder spirobicyclischen Ring welcher ausser dem Stickstoffatom 0 bis 4 zusätzliche Heteroatome beinhalten kann, ausgewählt aus der Gruppe Sauerstoff, Stickstoff und Schwefel, wobei das heterocyclische Ringsystem zusätzlich substituiert sein kann mit F, Cl, Br, CF3, NO2, CN, (C1-C6)-Alkyl, O-(C1-C8)-Alkyl, (C1-C4)-Alkoxy-(C1-C4)-alkyl, (C0-C8)-Alkylen-Aryl, oxo, CO(R46), CON(R47)(R48), Hydroxy, COO(R49), N(R50)CO(C1-C6)-Alkyl, N(R51)(R52) oder SO2CH3;
R46, R47, R48, R49, R50, R51, R52 unabhängig voneinander H, (C1-C6)-Alkyl;
o 0, 1, 2, 3, 4, 5, 6;
R45 OH, CH(Aryl)2, 3-12 gliedriger mono- oder bicyclischer Ring, der ein oder mehere Heteroatome aus der Gruppe N, O und S enthalten kann und der 3-12 gliedrige Ring weitere Substituenten wie F, C1, Br, J, OH, CF3, NO2, CN, OCF3, oxo, O-(C1-C6)-Alkyl, (C1-C4)-Alkoxy-(C1-Ca)-alkyl, S-(C1-Cs)-Alkyl, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C3-C8)-Cycloalkyl, O(C3-C8)-Cycloalkyl, (C3-C8)-Cycloalkenyl, O-(C3-C8)-Cycloalkenyl, (C2-C6)-Alkinyl, (C0-C8)-Alkylen-Aryl, O-(C0-C8)-Alkylen-Aryl, S-Aryl, N(R51)(R52), SO2-CN3 und COOH enthalten kann;
sowie deren physiologisch verträglichen Salze. - Können Reste oder Substituenten mehrfach in den Verbindungen der Formel 1 auftreten, wie zum Beispiel -(CH2)o-R45, so können sie alle unabhängig voneinander die angegebenen Bedeutungen haben und gleich oder verschieden sein.
- Die Erfindung bezieht sich auf Verbindungen der Formel 1, in Form ihrer Racemate, enantiomerenangereicherten Mischungen und reinen Enantiomere sowie auf ihre Diastereomere und Mischungen davon.
- Die Alkyl-, Alkenyl- und Alkinylreste in den Substituenten R, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16, R17, R18, R19, R20, R21, R22, R23, R24, R25, R26, R27, R28, R29, R30, R31, R32, R33, R34, R35, R36, R37, R38, R39, R40, R41, R42, R43, R44, R45, R46, R46, R47, R48, R49, R50, R51 und R52 können sowohl geradkettig, verzweigt oder optional halogeniert sein.
- Unter dem Begriff "Aryl" wird eine Phenyl oder Naphthylgruppe verstanden.
- Pharmazeutisch verträgliche Salze sind aufgrund ihrer höheren Wasserlöslichkeit gegenüber den Ausgangs- bzw. Basisverbindungen besonders geeignet für medizinische Anwendungen. Diese Salze müssen ein pharmazeutisch verträgliches Anion oder Kation aufweisen. Geeignete pharmazeutisch verträgliche Säureadditionssalze der erfindungsgemäßen Verbindungen sind Salze anorganischer Säuren, wie Salzsäure, Bromwasserstoff-, Phosphor-, Metaphosphor-, Salpeter-, Sulfon- und Schwefelsäure sowie organischer Säuren, wie z.B. Essigsäure, Benzolsulfon-, Benzoe-, Zitronen-, Ethansulfon-, Fumar-, Glucon-, Glykol-, Isethion-, Milch-, Lactobion-, Malein-, Äpfel-, Methansulfon-, Bernstein-, p-Toluolsulfon-, Wein- und Trifluoressigsäure. Für medizinische Zwecke wird in besonders bevorzugter Weise das Chlorsalz verwendet. Geeignete pharmazeutisch verträgliche basische Salze sind Ammoniumsalze, Alkalimetallsalze (wie Natriumund Kaliumsalze) und Erdalkalisalze (wie Magnesium- und Calciumsalze).
- Salze mit einem nicht pharmazeutisch verträglichen Anion gehören ebenfalls in den Rahmen der Erfindung als nützliche Zwischenprodukte für die Herstellung oder Reinigung pharmazeutisch verträglicher Salze und/oder für die Verwendung in nichttherapeutischen, zum Beispiel in-vitro-Anwendungen.
- Der hier verwendete Begriff "physiologisch funktionelles Derivat" bezeichnet jedes physiologisch verträgliche Derivat einer erfindungsgemäßen Verbindung der Formel I, z.B. einen Ester, der bei Verabreichung an einen Säuger, wie z.B. den Menschen, in der Lage ist, (direkt oder indirekt) eine Verbindung der Formel 1 oder einen aktiven Metaboliten hiervon zu bilden.
- Zu den physiologisch funktionellen Derivaten zählen auch Prodrugs der erfindungsgemäßen Verbindungen. Solche Prodrugs können in vivo zu einer erfindungsgemäßen Verbindung metabolisiert werden. Diese Prodrugs können selbst wirksam sein oder nicht.
- Die erfindungsgemäßen Verbindungen können auch in verschiedenen polymorphen Formen vorliegen, z.B. als amorphe und kristalline polymorphe Formen. Alle polymorphen Formen der erfindungsgemäßen Verbindungen gehören in den Rahmen der Erfindung und sind ein weiterer Aspekt der Erfindung.
- Nachfolgend beziehen sich alle Verweise auf "Verbindung(en) gemäß Formel (I)" auf Verbindungen) der Formel (1) wie vorstehend beschrieben, sowie ihre Salze, Solvate und physiologisch funktionellen Derivate wie hierin beschrieben.
- Die Menge einer Verbindung gemäß Formel (1), die erforderlich ist, um den gewünschten biologischen Effekt zu erreichen, ist abhängig von einer Reihe von Faktoren, z.B. der gewählten spezifischen Verbindung, der beabsichtigten Verwendung, der Art der Verabreichung und dem klinischen Zustand des Patienten. Im allgemeinen liegt die Tagesdosis im Bereich von 0,3 mg bis 100 mg (typischerweise von 3 mg bis 50 mg) pro Tag pro Kilogramm Körpergewicht, z.B. 3-10 mg/kg/Tag. Eine intravenöse Dosis kann z.B. im Bereich von 0,3 mg bis 1,0 mg/kg liegen, die geeigneterweise als Infusion von 10 ng bis 100 ng pro Kilogramm pro Minute verabreicht werden kann. Geeignete Infusionslösungen für diese Zwecke können z.B. von 0,1 ng bis 10 mg, typischerweise von 1 ng bis 10 mg pro Milliliter, enthalten. Einzeldosen können z.B. von 1 mg bis 10 g des Wirkstoffs enthalten. Somit können Ampullen für Injektionen beispielsweise von 1 mg bis 100 mg, und oral verabreichbare Einzeldosisformulierungen, wie zum Beispiel Tabletten oder Kapseln, können beispielsweise von 1,0 bis 1000 mg, typischerweise von 10 bis 600 mg enthalten. Im Falle pharmazeutisch verträglicher Salze beziehen sich die vorgenannten Gewichtsangaben auf das Gewicht der dem Salz zugrunde liegenden freien Verbindung. Zur Prophylaxe oder Therapie der oben genannten Zustände können die Verbindungen gemäß Formel (I) selbst als Verbindung verwendet werden, vorzugsweise liegen sie jedoch mit einem verträglichen Träger in Form einer pharmazeutischen Zusammensetzung vor. Der Träger muß natürlich verträglich sein, in dem Sinne, daß er mit den anderen Bestandteilen der Zusammensetzung kompatibel ist und nicht gesundheitsschädlich für den Patienten ist. Der Träger kann ein Feststoff oder eine Flüssigkeit oder beides sein und wird vorzugsweise mit der Verbindung als Einzeldosis formuliert, beispielsweise als Tablette, die von 0,05% bis 95 Gew.-% des Wirkstoffs enthalten kann. Weitere pharmazeutisch aktive Substanzen können ebenfalls vorhanden sein, einschließlich weiterer Verbindungen gemäß Formel (I). Die erfindungsgemäßen pharmazeutischen Zusammensetzungen können nach einer der bekannten pharmazeutischen Methoden hergestellt werden, die im wesentlichen darin bestehen, daß die Bestandteile mit pharmakologisch verträglichen Träger- und/oder Hilfsstoffen gemischt werden.
- Erfindungsgemäße pharmazeutische Zusammensetzungen sind solche, die für orale, rektale, topische, perorale (z.B. sublinguale) und parenterale (z.B. subkutane, intramuskuläre, intradermale oder intravenöse) Verabreichung geeignet sind, wenngleich die geeignetste Verabreichungsweise in jedem Einzelfall von der Art und Schwere des zu behandelnden Zustandes und von der Art der jeweils verwendeten Verbindung gemäß Formel (I) abhängig ist. Auch dragierte Formulierungen und dragierte Retardformulierungen gehören in den Rahmen der Erfindung. Bevorzugt sind säure- und magensaftresistente Formulierungen. Geeignete magensaftresistente Beschichtungen umfassen Celluloseacetatphthalat, Polyvinylacetatphthalat, Hydroxypropylmethylcellulosephthalat und anionische Polymere von Methacnlsäure und Methacnlsäuremethylester.
- Geeignete pharmazeutische Verbindungen für die orale Verabreichung können in separaten Einheiten vorliegen, wie zum Beispiel Kapseln, Oblatenkapseln, Lutschtabletten oder Tabletten, die jeweils eine bestimmte Menge der Verbindung gemäß Formel (I) enthalten; als Pulver oder Granulate; als Lösung oder Suspension in einer wäßrigen oder nicht-wäßrigen Flüssigkeit; oder als eine Öl-in-Wasser- oder Wasser-in Öl-Emulsion. Diese Zusammensetzungen können, wie bereits erwähnt, nach jeder geeigneten pharmazeutischen Methode zubereitet werden, die einen Schritt umfaßt, bei dem der Wirkstoff und der Träger (der aus einem oder mehreren zusätzlichen Bestandteilen bestehen kann) in Kontakt gebracht werden. Im allgemeinen werden die Zusammensetzungen durch gleichmäßiges und homogenes Vermischen des Wirkstoffs mit einem flüssigen und/oder feinverteilten festen Träger hergestellt, wonach das Produkt, falls erforderlich, geformt wird. So kann beispielsweise eine Tablette hergestellt werden, indem ein Pulver oder Granulat der Verbindung verpreßt oder geformt wird, gegebenenfalls mit einem oder mehreren zusätzlichen Bestandteilen. Gepreßte Tabletten können durch Tablettieren der Verbindung in frei fließender Form, wie beispielsweise einem Pulver oder Granulat, gegebenenfalls gemischt mit einem Bindemittel, Gleitmittel, inertem Verdünnen und/oder einem (mehreren) oberflächenaktiven/dispergierenden Mittel in einer geeigneten Maschine hergestellt werden. Geformte Tabletten können durch Formen der pulverförmigen, mit einem inerten flüssigen Verdünnungsmittel befeuchteten Verbindung in einer geeigneten Maschine hergestellt werden.
- Pharmazeutische Zusammensetzungen, die für eine perorale (sublinguale) Verabreichung geeignet sind, umfassen Lutschtabletten, die eine Verbindung gemäß Formel (I) mit einem Geschmacksstoff enthalten, üblicherweise Saccharose und Gummi arabicum oder Tragant, und Pastillen, die die Verbindung in einer inerten Basis wie Gelatine und Glycerin oder Saccharose und Gummi arabicum umfassen.
- Geeignete pharmazeutische Zusammensetzungen für die parenterale Verabreichung umfassen vorzugsweise sterile wäßrige Zubereitungen einer Verbindung gemäß Formel (I), die vorzugsweise isotonisch mit dem Blut des vorgesehenen Empfängers sind. Diese Zubereitungen werden vorzugsweise intravenös verabreicht, wenngleich die Verabreichung auch subkutan, intramuskulär oder intradermal als Injektion erfolgen kann. Diese Zubereitungen können vorzugsweise hergestellt werden, indem die Verbindung mit Wasser gemischt wird und die erhaltene Lösung steril und mit dem Blut isotonisch gemacht wird. Injizierbare erfindungsgemäße Zusammensetzungen enthalten im allgemeinen von 0,1 bis 5 Gew.-% der aktiven Verbindung.
- Geeignete pharmazeutische Zusammensetzungen für die rektale Verabreichung liegen vorzugsweise als Einzeldosis-Zäpfchen vor. Diese können hergestellt werden, indem man eine Verbindung gemäß Formel (I) mit einem oder mehreren herkömmlichen festen Trägern, beispielsweise Kakaobutter, mischt und das entstehende Gemisch in Form bringt.
- Geeignete pharmazeutische Zusammensetzungen für die topische Anwendung auf der Haut liegen vorzugsweise als Salbe, Creme, Lotion, Paste, Spray, Aerosol oder Ö1 vor. Als Träger können Vaseline, Lanolin, Polyethylenglycole, Alkohole und Kombinationen von zwei oder mehreren dieser Substanzen verwendet werden. Der Wirkstoff ist im allgemeinen in einer Konzentration von 0,1 bis 15 Gew.-% der Zusammensetzung vorhanden, beispielsweise von 0,5 bis 2%.
- Auch eine transdermale Verabreichung ist möglich. Geeignete pharmazeutische Zusammensetzungen für transdermale Anwendungen können als einzelne Pflaster vorliegen, die für einen langzeitigen engen Kontakt mit der Epidermis des Patienten geeignet sind. Solche Pflaster enthalten geeigneterweise den Wirkstoff in einer gegebenenfalls gepufferten wäßrigen Lösung, gelöst und/oder dispergiert in einem Haftmittel oder dispergiert in einem Polymer. Eine geeignete Wirkstoff-Konzentration beträgt ca. 1 % bis 35%, vorzugsweise ca. 3% bis 15%. Als eine besondere Möglichkeit kann der Wirkstoff, wie beispielsweise in Pharmaceutical Research, 2(6): 318 (1986) beschrieben, durch Elektrotransport oder lontophorese freigesetzt werden.
- Die Verbindungen der Formel 1 zeichnen sich durch günstige Wirkungen auf den Fettstoffwechsel aus, insbesondere sind sie zur Gewichtsreduktion und nach erfolgter Gewichtsreduktion zum Erhalt eines reduzierten Gewichtes bei Säugetieren und als Anorektika geeignet. Die Verbindungen zeichnen sich sich durch ihre geringe Toxizität und ihre geringen Nebenwirkungen aus.
- Die Verbindungen können allein oder in Kombination mit weiteren gewichtsreduzierenden oder anorektischen Wirkstoffen eingesetzt werden. Solche weiteren anorektischen Wirkstoffe werden z.B. in der Roten Liste, Kapitel 01 unter Abmagerungsmittel/Appetitzügler genannt und können auch solche Wirkstoffe beinhalten, die den Energieumsatz des Organismus erhöhen und damit zu einer Gewichtsreduktion führen oder auch solche, welche den allgemeinen Metabolismus des Organismus so beeinflussen, dass eine erhöhte Kalorienzufuhr nicht zu einer Vergrößerung der Fettdepots und eine normale Kalorienzufuhr zu einer Verringerung der Fettdepots des Organismus führt. Die Verbindungen eignen sich zur Prophylaxe sowie insbesondere zur Behandlung von Übergewicht oder Obesitas. Die Verbindungen eignen sich weiterhin zur Prophylaxe sowie insbesondere zur Behandlung von Typ II Diabetes, der Arteriosklerose sowie zur Normalisierung des Lipidstoffwechsels und zur Behandlung des Bluthochdrucks. Die Verbindungen wirken als MCH Antagonisten und eignen sich auch zur Behandlung von Störungen des Empfindens und anderer psychiatrischen Indikationen, wie zum Beispiel Depressionen, Angstzuständen, Angstneurosen, Schizophrenie sowie zur Behandlung von Störungen assoziiert mit dem zirkadianen Rhythmus und zur Behandlung von Drogenmissbrauch.
- Bei einem weiteren Aspekt der Erfindung können die Verbindungen der Formel 1 in Kombination mit einer öder mehreren weiteren pharmakologisch wirksamen Substanzen verabreicht werden, die beispielsweise ausgewählt sind aus Antidiabetika, Antiadiposita, blutdrucksenkenden Wirkstoffen, Lipidsenkern und Wirkstoffen zur Behandlung und/oder Prävention von Komplikationen, die von Diabetes verursacht werden oder mit Diabetes assoziiert sind.
- Geeignete Antidiabetika umfassen Insuline, Amylin, GLP-1- und GLP-2-Derivate wie z.B. diejenigen die in WO 98/08871 von Novo Nordisk A/S offenbart wurden, sowie oral wirksame hypoglykämische Wirkstoffe.
- Die oral wirksamen hypoglykämischen Wirkstoffe umfassen vorzugsweise Sulphonylharnstoffe, Biguanidine, Meglitinide, Oxadiazolidindione, Thiazolidindione, Glukosidase-Inhibitoren, Glukagon-Rezeptor-Antagonisten, GLP-1-Agonisten, Kaliumkanalöffner wie z.B. diejenigen, die in WO 97/26265 und WO 99/03861 von Novo Nordisk A/S offenbart wurden, Insulin-Sensitizer, Aktivatoren der Insulin Rezeptor Kinase, Inhibitoren von Leberenzymen, die an der Stimulation der Glukoneogenese und/oder Glykogenolyse beteiligt sind, z.B. Inhibitoren der Glycogenphosphonlase, Modulatoren der Glukoseaufnahme und Glukoseausscheidung, den Fettstoffwechsel verändernde Verbindungen wie antihyperlipidämische Wirkstoffe und antilipidämische Wirkstoffe, z.B. HMGCoA-Reduktase-Inhibitoren, Inhibitoren des Cholesteroltransports/der Cholesterolaufnahme, Inhibitoren der Gallensäurerückresorption oder Inhibitoren des mikrosomalen Triglycerid-Transfer Proteins (MTP), Verbindungen, die die Nahrungsmitteleinnahme verringern, PPAR- und RXR-Agonisten und Wirkstoffe, die auf den ATP-abhängigen Kaliumkanal der Betazellen wirken.
- Bei einer Ausführungsform der Erfindung werden die vorliegenden Verbindungen in Kombination mit Insulin verabreicht.
- n Bei einer weiteren Ausführungsform werden die vorliegenden Verbindungen in Kombination mit einem Sulphonylharnstoft wie z.B. Tolbutamid, Glibenclamid, Glimepirid, Glipizid, Gliquidon, Glisoxepid, Glibornurid oder Gliclazid verabreicht.
- Bei einer anderen Ausführungsform werden die vorliegenden Verbindungen in Kombination mit einem Biguanid wie z.B. Metformin verabreicht.
- Bei wieder einer anderen Ausführungsform werden die vorliegenden Verbindungen in Kombination mit einem Meglitinid wie z.B. Repaglinid verabreicht.
- Bei noch einer weiteren Ausführungsform werden die vorliegenden Verbindungen in Kombination mit einem Thiazolidindion wie z.B. Troglitazon, Ciglitazon, Pioglitazon, Rosiglitazon oder den in WO 97/41097 von Dr. Reddy's Research Foundation offenbarten Verbindungen, insbesondere 5-[[4-[(3,4-Dihydro-3-methyl-4-oxo-2-chinazolinylmethoxy]phenyl]methyl]-2,4-thiazolidindion, verabreicht.
- Bei einer weiteren Ausführungsform werden die vorliegenden Verbindungen in Kombination mit einem ?-Glukosidase-Inhibitor wie z.B. Miglitol oder Acarbose verabreicht.
- Bei einer anderen Ausführungsform werden die vorliegenden Verbindungen in Kombination mit einem Wirkstoff verabreicht, der auf den ATP-abhängigen Kaliumkanal der Betazellen wirkt, wie z.B. Tolbutamid, Glibenclamid, Glimepirid, Glipizid, Gliclazid oder Repaglinid.
- Bei noch einer anderen Ausführungsform werden die vorliegenden Verbindungen in Kombination mit einem antihyperlidämischen Wirkstoff oder einem antilipidämischen Wirkstoff wie z.B. Cholestyramin, Colestipol, Clofibrat, Fenofibrat, Gemfibrozil, Lovastatin, Pravastatin, Simvastatin, Atorvastatin, Cerivastatin, Fluvastatin, Probucol, Ezetimibe oder Dextrothyroxin verabreicht.
- Bei einer weiteren Ausführungsform werden die vorliegenden Verbindungen in Kombination mit mehr als einer der vorstehend genannten Verbindungen, z.B. in Kombination mit einem Sulphonylharnstoff und Metformin, einem Sulphonylharnstoff und Acarbose, Repaglinid und Metformin, Insulin und einem Sulphonylharnstoff, Insulin und Metformin, Insulin und Troglitazon, Insulin und Lovastatin, etc. verabreicht.
- Weiterhin können die erfindungsgemäßen Verbindungen in Kombination mit einem oder mehreren Antiadiposita oder appetitregulierenden Wirkstoffen verabreicht werden.
- Solche Wirkstoffe können ausgewählt werden aus der Gruppe bestehend aus CART-Agonisten, NPY-Antagonisten, MC4-Agonisten, Orexin-Antagonisten, H3-Agonisten, TNF-Agonisten, CRF-Agonisten, CRF BP-Antagonisten, Urocortin-Agonisten, ß3-Agonisten, MSH (Melanocyt-stimulierendes Hormon)-Agonisten, CCK-Agonisten, Serotonin-Wiederaufnahme-Inhibitoren, gemischte Sertonin- und Noradrenalin-Wiederaufnahme-Inhibitoren, 5HT-Modulatoren, MAO-Hemmen, Bombesin-Agonisten, Galanin-Antagonisten, Wachstumshormon, Wachstumshormon freisetzende Verbindungen, TRH-Agonisten, Modulatoren der Entkopplungsproteine 2 oder 3, Leptin-Agonisten, Dopamin-Agonisten (Bromocriptin, Doprexin), Lipase/Amylase-Inhibitoren, Antagonisten des Cannabinoid Rezeptors 1, Modulatoren des die Acylierung stimulierende Protein (ASP), PPAR-Modulatoren, RXR-Modulatoren, hCNTF-Mimetika oder TR-β-Agonisten.
- Bei einer Ausführungsform der Erfindung ist das Antiadipositum Leptin oder modifiziertes Leptin.
- Bei einer anderen Ausführungsform ist das Antiadipositum Dexamphetamin oder Amphetamin.
- Bei einer anderen Ausführungsform ist das Antiadipositum Fenfluramin oder Dexfenfluramin.
- Bei noch einer anderen Ausführungsform ist das Antiadipositum Sibutramin oder die mono- und bisdemethylierten Wirkmetabolite von Sibutramin.
- Bei einer weiteren Ausführungsform ist das Antiadipositum Orlistat.
- Bei einer anderen Ausführungsform ist das Antiadipositum Mazindol, Diethylpropion oder Phentermin.
- Weiterhin können die vorliegenden Verbindungen in Kombination mit einem oder mehreren antihypertensiven Wirkstoffen verabreicht werden. Beispiele für antihypertensive Wirkstoffe sind Betablocker wie Alprenolol, Atenol, Timolol, Pindolol, Propanolol und Metoprolol, ACE (Angiotensin Converting Enzym)-Hemmer wie z.B. Benazepril, Captopril, Enalapril, Fosinopril, Lisinopril, Quinapril und Rampril, Calciumkanal-Blocker wie Nifedipin, Felodipin, Nicardipin, Isradipin, Nimodipin, Diltiazem und Verapamil, sowie Alphablocker wie Doxazosin, Urapidil, Prazosin und Terazosin. Weiterhin kann verwiesen werden auf Remington: The Science and Practice of Pharmacy, 19. Auflage, Gennaro, Hrsg., Mack Publishing Co., Easton, PA, 1995.
- Es versteht sich, dass jede geeignete Kombination der erfindungsgemäßen Verbindungen mit einer oder mehreren der vorstehend genannten Verbindungen und wahlweise einer oder mehreren weiteren pharmakologisch wirksamen Substanzen als unter den Schutzbereich der vorliegenden Erfindung fallend angesehen wird.
- Die Wirksamkeit der Verbindungen wurde wie folgt getestet:
- Biologisches Prüfmodell:
- Die Prüfung der anorektischen Wirkung erfolgte an weiblichen NMRI Mäusen. Nach 17stündigem Futterentzug wurde über eine Schlundsonde das Testpräparat verabreicht. In Einzelhaltung und bei freiem Zugang zu Trinkwasser wurde den Tieren 30 Minuten nach Präparatgabe Kondensmilch angeboten. Der Kondensmilchverbrauch wurde halbstündlich 7 Stunden lang bestimmt und das Allgemeinbefinden der Tiere beobachtet. Der gemessene Milchverbrauch wurde mit den Vehikel-behandelten Kontrolltieren verglichen. Tabelle 1: Anorektische Wirkung, gemessen als Reduktion des kumulierten Milchkonsums behandelter im Vergleich zu Kontrolltieren.
- Die nachfolgend aufgeführten Beispiele und Herstellungsmethoden dienen zur Erläuterung der Erfindung, ohne diese jedoch einzuschränken.
-
- 1-(2,2-Dimethoxy-ethyl)-3-[4-(2-dimethylamino-ethoxy)-phenyl]-1-(4-phenoxyphenyl)-harnstoff (0,33 g) wurde mit Trifluoressigsäure (5 mL) für 16 Stunden geschüttelt. Flüchtige Anteile wurden entfernt und der Rückstand in Dichlormethan (10 mL) aufgenommen und mit Natronlauge (0,1 N; 1 mL) gewaschen. Die wässrige Phase wurde mit Dichlormethan (10 mL) extrahiert und die vereinigten organischen Phasen eingeengt. Der Rückstand wurde durch Chromatographie an Kieselgel gereinigt (Eluent: Dichlormethan/Methanol 98:2 mit 1 % v/v 7 N Ammoniaklösung in Methanol). Man erhielt so das Produkt mit dem Molekulargewicht 415,50 (C25HN25N3), MS (ESI): 416 ((M+H]+).
- 1-(2,2-Dimethoxy-ethyl)-3-[4-(2-dimethylamino-ethoxy)-phenyl]-1-(4-phenoxyphenyn-harnstoff
- Eine Lösung von Triphosgen (178 mg) in Chloroform (1 mL) wurde zu einer Lösung von 4-(2-Dimethylamino-ethoxy)-anilin (324 mg) in Chloroform (2 mL) und Pyridin (0,182 mL) bei 0 °C unter Stickstoff gegeben. Die Reaktion wurde dann bei Raumtemperatur für 30 Minuten geschüttelt. Die Lösung wurde dann zu einer Lösung von (2,2-Dimethoxy-ethyl)-(4-phenoxy-phenyl)-amin (410 mg) in Chloroform (2 mL) und Pyridin (0,182 mL) gegeben und für 3 Stunden bei 70 °C geschüttelt. Wasser (1 mL) wurde zugesetzt. Die Mischung wurde mit Dichlormethan (2 x 15 mL) extrahiert. Die vereinigten organischen Phasen wurden eingeengt und der Rückstand durch Chromatographie an Kieselgel gereinigt (Eluent: Dichlormethan/Methanol 98:2 mit 1 % v/v 7 N Ammoniaklösung in Methanol). Man erhielt so das Produkt mit dem Molekulargewicht 479,58 (C27HN33 3O5); MS (ESI): 442 ([M-OMe]+).
- (2,2-Dimethoxy-ethyl)-(4-phenoxy-phenyl)-amin
- Eine Lösung von 4-Phenoxyanilin (915 mg) in Dimethylformamid (5 mL) wurde mit Bromacetaldehyddimethylacetal (1,1 mL) und BEMP (1,9 mL) versetzt. Die Reaktionsmischung wurde für 16 Stunden bei 100 °C geschüttelt. Flüchtige Anteile wurden entfernt und der Rückstand durch Chromatographie an Kieselgel gereinigt (Eluent: Dichlormethan/Hexan 1:2, später 1:1 mit jeweils 1 % v/v 7 N Ammoniaklösung in Methanol). Man erhielt so das Produkt mit dem Molekulargewicht 273,33 (C16H19NO3); MS (ESI): 274 ([M+H]+). Beispiel 2 1-[4-(2-Dimethylamino-ethylamino)-3-nitro-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydroimidazol-2-on
- Eine Lösung von 1-(4-Fluor-3-nitro-phenyl)-3-(4-phenoxy-phenyl)-1,3-dihydroimidazol-2-on (100 mg) in Dimethylformamid (2 mL) wurde mit 2-Dimethylaminoethylamin (0,3 mL) und für 2 Stunden bei 70 °C geschüttelt. Flüchtige Anteile wurden entfernt und der Rückstand zwischen Dichlormethan und Wasser verteilt. Die organische Phase wurde getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 459,51 (C25H25N5O4); MS (ESI): 460 ([M+H]+).
- 1-(4-Fluor-3-nitro-phenyl)-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
- Zu einer Lösung von (2,2-Dimethoxy-ethyl)-(4-phenoxy-phenyl)-amin (750 mg) in Chloroform (10 mL) wurde 4-Fluor-3-nitro-phenylisocyanat (0,45 mL) gegeben. Die Reaktion wurde für 2 Stunden bei 70 °C geschüttelt. Eine zweite Portion 4-Fluor-3-nitro-phenylisocyanat (0,45 mL) wurde zugesetzt. Nach 16 Stunden bei 70 °C wurden flüchtige Anteile entfernt und TFA (10 mL) zugesetzt. Nach 16 Stunden Schütteln wurden flüchtige Anteile entfernt und der Rückstand durch Chromatographie an Kieselgel (Eluent: Dichlormethan/Hexan 8:1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 391,36 (C21H14FN3O4); MS (ESI): 392 ([M+H]+). Beispiel 3 1-[3-Amino-4-(2-dimethylamino-ethylamino)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
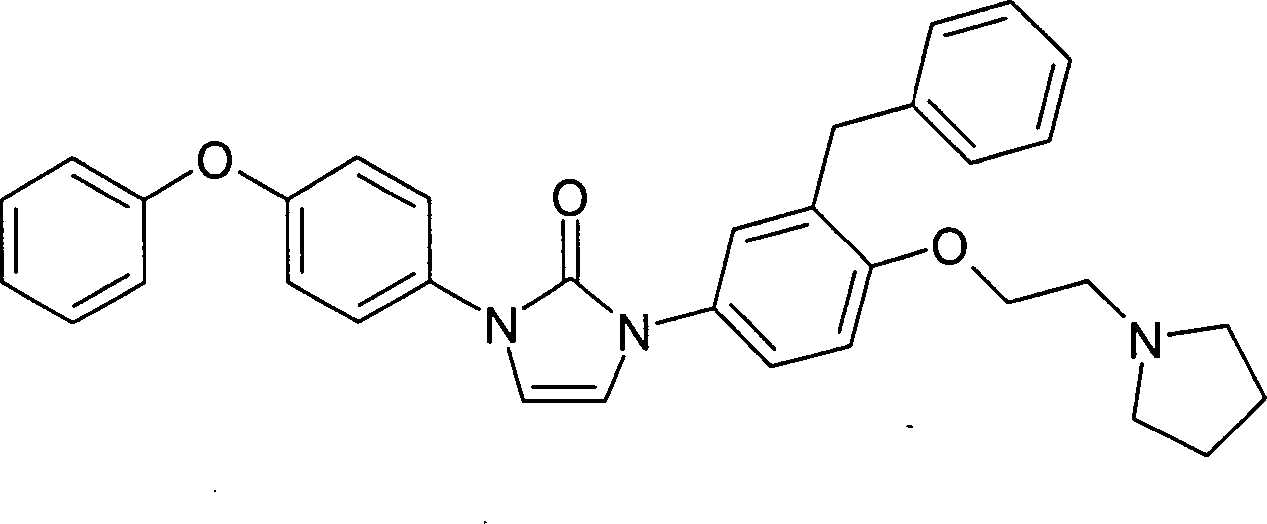
- Eine Lösung von 1-[4-(2-Dimethylamino-ethylamino)-3-nitro-phenyl]-3-(4-phenoxyphenyl)-1,3-dihydro-imidazol-2-on (50 mg) in Dichlormethan (10 ml) und Eisessig (1 mL) wurde mit Zinkstaub (250 mg) versetzt. Nach 10 Minuten wurde von festen Anteilen abfiltriert und das Filtrat mit gesättigter Natriumcarbonatlösung gewaschen. Die organische Phase wurde über Magnesiumsulfat getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 429,53 (C25H27N5O2); MS (ESI): 430 ([M+H]+). Beispiel 4 1-[3-Benzyl-4-(2-pyrrolidin-1-y1-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydroimidazol-2-on
- Eine Lösung von 1-[3-Benzyl-4-(2-brom-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on (60 mg) in Acetonitril (1 mL) wurde mit Pyrrolidin (0,2 mL) und Natriumiodid (5 mg) versetzt und für 2 Stunden am Rückfluß gekocht. Die abgekühlte Lösung wurde filtriert und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 531,66 (C34H3 3N3O3); MS (ESI): 532 ([M+H]+) als Hydroformiat.
- 1-[3-Benzyl-4-(2-brom-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
- Eine Lösung von 1-(3-Benzyl-4-hydroxy-phenyl)-3-(4-phenoxy-phenyl)-1,3-dihydroimidazol-2-on (233 mg) in 1,2-Dibromethan (1,7 mL) wurde mit Natronlauge (3 N, 0,6 mL) und Tetrabutylammoniumhydrogensulfat (12 mg) versetzt. Die Mischung wurde für 2 Stunden auf 80 °C erwärmt. Nach dem Abkühlen wurde die Reaktionsmischung mit Dichlormethan verdünnt und mit Natronlauge (1 N), Salzsäure (1 N) und gesättigter Kochsalzlösung gewaschen. Die organische Phase wurde über Magnesiumsulfat getrocknet, eingeengt und der Rückstand durch Chromatographie an Kieselgel (Eluent: Heptan/Ethylacetat 3:2) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 541,45 (C30H25N2O3); MS (ESI): 541 ([M+H]+).
- 1-(3-Benzyl-4-hydroxy-phenyl)-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
- Eine Lösung von 3-(4-Benzyloxy-phenyl)-1-(2,2-dimethoxy-ethyl)-1-(4-phenoxyphenyl)-harnstoff (498 mg) in Trifluoressigsäure (5 mL) wurde für 3 Tage stehen gelassen und dann mit gesättigter Natriumcarbonatlösung neutralisiert. Die Mischung wurde mit Ethylacetat extrahiert. Die organische Phase wurde über Magnesiumsulfat getrocknet, eingeengt und der Rückstand durch Chromatographie an Kieselgel (Eluent: Dichlormethan/Methanol 9:1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 434,50 (C28H22N2O3); MS (ESI): 435 ([M+H]+). Als weiteres Produkt fiel 1-(4-hydroxy-phenyl)-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on an.
- 3-(4-Benzyloxy-phenyl)-1-(2,2-dimethoxy-ethyl)-1-(4-phenoxy-phenyl)-harnstoff
- Zu einer Lösung von Carbonyldiimidazol (162 mg) in Dimethylformamid (1 mL) wurde bei 0 °C eine Lösung von 4-Benzyloxyanilin (199 mg) in Dimethylformamid (1 mL) getropft. Nach 10 Minuten Reaktionszeit bei 0 °C wurde noch 20 Minuten bei Raumtemperatur reagieren gelassen. Dann wurde (2,2-Dimethoxy-ethyl)-(4-phenoxyphenyl)-amin (273 mg) zugesetzt und für 1,5 Stunden auf 80 °C erwärmt. Nach dem Abkühlen wurde mit Wasser verdünnt und mit Ethylacetat extrahiert. Die organische Phase wurde über Magnesiumsulfat getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 498,58 (C30H30N2O5); MS (ESI): 499 ([M+H]+). Beispiel 5 1-[4-(2-Phenethylamino-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
- Eine Lösung von 1-[4-(2-Brom-ethoxy)-phenyl]-3-(4-phenoxy-pheriyl)-1,3-dihydroimidazol-2-on (50 mg) in Acetonitril (1 mL) wurde mit Phenethylamin (47 mg), Kaliumcarbonat (70 mg) und Natriumiodid (5 mg) versetzt und für 2 Stunden am Rückfluß gekocht. Die abgekühlte Lösung wurde filtriert und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 491,60 (C31H29N3O3); MS (ESI): 492 ([M+H]+) als Hydroformiat.
- 1-[4-(2-Brom-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
- Eine Lösung von 1-(4-Hydroxy-phenyl)-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on (4,7 g) in 1,2-Dibromethan (23,6 mL) wurde mit Natronlauge (3 N, 9,1 mL) und Tetrabutylammoniumhydrogensulfat (232 mg) versetzt. Die Mischung wurde für 2 Stunden auf 75 °C erwärmt. Nach dem Abkühlen wurde die Reaktionsmischung mit Dichlormethan verdünnt und mit Natronlauge (1 N), Salzsäure (1 N) und gesättigter Kochsalzlösung gewaschen. Die organische Phase wurde über Magnesiumsulfat getrocknet, eingeengt und der Rückstand durch Chromatographie an Kieselgel (Eluent: Dichlormethan/Methanol 9:1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 451,32 (C23H19N2O3); MS (ESI): 451 ([M+H]+).
- 1-(4-Hydroxy-phenyl)-3-(4-phenoxy-phenyl )-1,3-dihydro-imidazol-2-on
- Eine Lösung von 1-(4-Methoxy-phenyl)-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on (6,0 g) in Dichlormethan (75 mL) wurde bei 0 °C mit Bortribromid (2,5 mL) versetzt. Nach 3 Stunden wurde gesättigte Natriumhydrogencarbonatlösung zugesetzt und die organische Phase mit gesättigter Kochsalzlösung gewaschen. Die organische Phase wurde über Magnesiumsulfat getrocknet, eingeengt und der Rückstand durch Chromatographie an Kieselgel (Eluent: Dichlormethan/Methanol 9:1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 344,37 (C21H1 6N2O3); MS (ESI): 345 ([M+H]+).
- 1-(4-Methoxy-phenyl)-3-(4-phenoxy-phenyl)-1,3-d ihydro-imidazol-2-on
- Eine Lösung von 1-(2,2-Dimethoxy-ethyl)-3-(4-methoxy-phenyl)-1-(4-phenoxyphenyl)-harnstoff (6,8 g) in Trifluoressigsäure (20 mL) wurde 16 Stunden stehen gelassen und dann mit gesättigter Natriumcarbonatlösung neutralisiert. Die Mischung wurde mit Ethylacetat extrahiert. Die organische Phase wurde über Magnesiumsulfat getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 358,40 (C22H18N2O3); MS (ESI): 359 ([M+H]+).
- 1-(2,2-Dimethoxy-ethyl)-3-(4-methoxy-phenyl)-1-(4-phenoxy-phenyl)-harnstoff
- Zu einer Lösung von Carbonyldiimidazol (2,51 g) in Dimethylformamid (15 mL) wurde bei 0 °C eine Lösung von 4-Methoxyanilin (1,9 g) in Dimethylformamid (3 mL) getropft. Nach 15 Minuten Reaktionszeit bei 0 °C wurde noch 45 Minuten bei Raumtemperatur reagieren gelassen. Dann wurde (2,2-Dimethoxy-ethyl)-(4-phenoxyphenyl)-amin (4,1 g) in Dimethylformamid (2 mL) zugesetzt und für 2 Stunden auf 80 °C erwärmt. Nach dem Abkühlen wurden flüchtige Anteile entfernt und der Rückstand in Ethylacetat aufgenommen. Die organische Phase wurde mit Wasser und gesättigter Kochsalzlösung gewaschen. Die organische Phase wurde über Magnesiumsulfat getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 422,49 (C24H26N2 2O5); MS (ESI): 423 ([M+H]+). Beispiel 6 1-[4-(2-Methylamino-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
- Eine Lösung von 1-[4-(2-Brom-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydroimidazol-2-on (50 mg) in Acetonitril (1 mL) wurde mit Methylamin (1 M in THF, 1 mL) und Natriumiodid (5 mg) und 24 Stunden stehen gelassen. Die Reaktionslösung wurde filtriert und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 401,47 (C24H23N3O3); MS (ESI): 402 ([M+H]+) als Hydroformiat. Beispiel 7 1-[4-(2-Amino-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on
- Eine Lösung von 1-[4-(2-Brom-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydroimidazol-2-on (50 mg) in Acetonitril (1 mL) wurde mit Ammoniaklösung (1 mL) und Natriumiodid (5 mg) und 24 Stunden stehen gelassen. Nach wiederholter Zugabe der Ammoniaklösung wurde die Reaktion für 5 Stunden bei 40 °C gehalten. Die abgekühlte Reaktionslösung wurde filtriert und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 387,44 (C24H21N3O3); MS (ESI): 388 ([M+H]+) als Hydroformiat. Beispiel 8 1-(4-Cyclopentyloxy-phenyl)-3-[4-(3-dimethylamino-propoxy)-phenyl]-1,3-dihydroimidazol-2-on
- Ein Lösung von '4-(3-Dimethylamino-propoxy)-phenylamin (194 mg) in Dimethylformamid (5 mL) wurde bei 0 °C mit Carbonyldiimidazol (163 mg) versetzt. Nach 10 Minuten bei 0 °C und 30 Minuten bei Raumtemperatur wurde eine Lösung von (4-Cyclopentyloxy-phenyl)-(2,2-dimethoxy-ethyl)-amin (265 mg) in Dimethylformamid (1 mL) zugesetzt und die Mischung für 2 Stunden auf 80 °C erwärmt. Nach dem Abkühlen auf Raumtemperatur wurde Trifluoressigsäure (1 mL) zugesetzt. Nach 72 Stunden wurde mit Wasser verdünnt und mit Ethylacetat extrahiert. Die organische Phase wurde mit gesättigter Natriumhydrogencarbonatlösung gewaschen, getrocknet und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 421,54 (C25H31N3O3); MS (ESI): 422 ([M+H]+) als Hydrotrifluoracetat.
- 4-(3-Dimethylamino-propoxy)-phenylamin
- sEine Lösung von Dimethyl-[3-(4-nitro-phenoxy)-propyl]-amin (3,75 g) in Ethanol (75 mL) wurde unter Argon mit Palladium(II)hydroxid (20% auf Kohle; 0,4 g) versetzt. Dann wurde Ameisensäure (4 mL) zugertopft wobei sich die Reaktionsmischung unter starker Gasentwicklung auf 60 °C erwärmte. Nach einer Reaktionszeit von 90 Minuten wurde der Katalysator abfiltriert und das Filtrat eingeengt. Der Rückstand wurde zwischen Methyl-tert.-butylether und Natronlauge (2 N) verteilt. Die organische Phase wurde getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 194,28 (C11H18N2O); MS (ESI): 195 ([M+H]+).
- Dimethyl-[3-(4-nitro-phenoxy)-propyl]-amin
- Eine Mischung aus 4-Fluornitrobenzol (2.82 g), 3-Dimethylaminopropanol (2,48 g), pulverisiertes Kaliumhydroxid (1,35 g) und Aliquat 336 wurde für eine Stunde auf 85 °C erwärmt. Das abgekühlte Rohgemisch wurde durch Chromatographie an Kieselgel (Eluent: Ethylaceat/Methanol 9:1 versetzt mit 1 % v/v Triethylamin) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 224,26 (C11H16N2O3); MS (ESI): 225 ([M+H]+).
- (4-Cyclopentyloxy-phenyl)-(2,2-dimethoxy-ethyl)-amin
- Eine Suspension von 4-Cyclopentyloxy-phenylamin (8,86 g), Bromacetaldehyddimethylacetal (12,2 g), Kaliumcarbonat (13,8 g) und Dimethylformamid (100 mL) wurde für 5 Stunden auf 100 °C erhitzt. Nach dem Abkühlen wurde filtriert und das Filtrat eingeengt. Der Rückstand wurde durch Chromatographie an Kieselgel (Eluent: Heptan/Ethylacetat 4:1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 265,36 (C15H23NO3); MS (ESI): 266 ([M+H]+).s
- 4-Cyclopentyloxy-phenylamin
- Eine Lösung von 4-Aminophenol (10,9 g) in Dimethylformamid (150 mL) wurde portionsweise mit Natriumhydrid (50%ig in Öl; 4,8 g) versetzt. Nach 20 Minuten wurde Cyclopentylbromid (14,9 g) zugetropft. Nach 2 Stunden bei Raumtemperatur wurde die Reaktionsmischung mit Wasser verdünnt und mit Ethylacetat extrahiert. Die organische Phase wurde mit Wasser und Kochsalzlösung gewaschen, getrocknet und eingeengt. Der Rückstand wurde durch Chromatographie an Kieselgel (Eluent: Heptan/Ethylacetat 3:1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 177,25 (C11H15NO); MS (ESI): 178 ([M+H]+). Beispiel 9 1-(4-Cyclopentyloxy-phenyl)-3-[4-((1 R,2S)-2-dimethylamino-1-phenyl-propoxy)phenyl]-1,3-dihydro-imidazol-2-on
- Die Verbindung wurde hergestellt wie im Beispiel 8 beschrieben nur unter Verwendung von 4-((1 R,2S)-2-Dimethylamino-1-phenyl-propoxy)-phenylamin. Man erhielt so das Produkt mit dem Molekulargewicht 497,64 (C31H35N3O3); MS (ESI): 498 ([M+H]+) als Hydrotrifluoracetat.
- 4-((1R,2S)-2-Dimethylamino-1-phenyl-propoxy)-phenylamin
- Die Verbindung wurde hergestellt wie im Beispiel 8 beschrieben nur unter Verwendung von (1R,2S)-Dimethyl-[1-methyl-2-(4-nitro-phenoxy)-2-phenyl-ethyl]amin. Man erhielt so das Produkt mit dem Molekulargewicht 270,38 (C17H22N2O); MS (ESI): 271 ([M+H]+).
- (1R,2S)-Dimethyl-[1-methyl-2-(4-nitro-phenoxy)-2-phenyl-ethyl]-amin
- sDie Verbindung wurde hergestellt wie im Beispiel 8 beschrieben nur unter Verwendung von (1R,2S)-Dimethyl-[1-methyl-2-hydroxy)-2-phenyl-ethyl]-amin. Man erhielt so das Produkt mit dem Molekulargewicht 300,36 (C17H20N2O3); MS (ESI): 301 ([M+H]+). Beispiel 10 1-(4-Cyclopentyloxy-phenyl)-3-{4-[(2-dimethylamino-ethyl)-methyl-amino]-phenyl}-1,3- dihydro-imidazol-2-on
- Die Verbindung wurde hergestellt wie im Beispiel 8 beschrieben nur unter Verwendung von N-(2-Dimethylamino-ethyl)-N-methyl-benzene-1,4-diamin. Man erhielt so das Produkt mit dem Molekulargewicht 420,56 (C25H32N4O2); MS (ESI): 421 ([M+H]+) als Hydrotrifluoracetat.
- N-(2-Dimethylamino-ethyl)-N-methyl-benzene-1,4-diamin
- Die Verbindung wurde hergestellt durch Zinkstaubreduktion von N,N,N'-Trimethyl-N'(4-nitro-phenyl)-ethan-1,2-diamin analog der Vorschrift im Beispiel 3. Man erhielt so das Produkt mit dem Molekulargewicht 193,29 (C11H19N3); MS (ESI): 194 ([M+H]+).
- N,N,N'-Trimethyl-N'-(4-nitro-phenyl)-ethane-1,2-diamin
- Eine Mischung aus N,N,N'-Trimethyl-ethan-1,2-diamin (2,17 g), Kaliumcarbonat (3,0 g), 4-Nitro-fluorbenzol und Dimethylformamid (30 mL) wurde für 72 Stunden gerührt. Die Reaktionsmischung wurde mit Wasser verdünnt und mit Ethylacetat extrahiert. Die organische Phase wurde mit Wasser und gesättigter Kochsalzlösung gewaschen, getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 223,28 (C11H17N3O2); MS (ESI): 224 ([M+H]+). Beispiel 11 1-(4-Cyclopentyloxy-phenyl)-3-[4-(3-dimethylamino-propyl)-phenyl]-1,3-dihydroimidazol-2-on
- Die Verbindung wurde hergestellt wie im Beispiel 8 beschrieben nur unter Verwendung von 4-(3-Dimethylamino-propyl)-phenylamin. Man erhielt so das Produkt mit dem Molekulargewicht 405,54 (C25H31N3 3O2); MS (ESI): 406 ([M+H]+) als Hydrotrifluoracetat.
- 4-(3-Dimethylamino-propyl)-phenylamin
- Eine Lösung von 3-Dimethylamino-l-(4-nitro-phenyl)-propan-1-on (Hydrochlorid, 0,25 g) in Eisessig (10 mL) wurde mit konzentrierter Salzsäure auf pH 1 gestellt und unter Stickstoff mit Palladium(II)hydroxid (20% auf Kohle, 0,1 g) versetzt. Die Stickstoffatomsphäre wurde durch Wasserstoff ersetzt und die Suspension für 6 Stunden geschüttelt. Es wurde vom Katalysator abfiltriert und das Filrat eingeengt. Der Rückstand wurde zwischen gesättigter Natriumhydrogencarbonatlösung und Ethylacetat verteilt. Die wässrige Phase wurde mit Natronlauge auf pH > 12 gestellt und mit Ethylacetat extrahiert. Die vereinigten organischen Phasen wurden getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 178,28 (C11H18N2); MS (ESI): 179 ([M+H]+).
- 3-Dimethylamino-1-(4-nitro-phenyl)-propan-1-on
- Eine Mischung aus 4-Nitroacetophenon (1,0 g), N,N-Dimethylmethylenammoniumchlorid (0,56 g) und Acetonitril (10 mL) wurde für 4 Stunden auf 80 °C erhitzt und der nach dem Abkühlen ausgefallene Niederschlag abgesaugt. Man erhielt so das Produkt mit dem Molekulargewicht 222,25 (C11H14N2O3); MS (ESI): 223 ([M+H]+) als Hydrochlorid.
- Beispiele 12–91
-
- Eine Lösung von 1-[4-(2-Dimethylamino-ethoxy)-phenyl]-3-(4-hydroxy-phenyl)-1,3-dihydro-imidazol-2-on (50 mg) in Propionitril (1 mL) wurde mit Cäsiumcarbonat (100 mg) und 2-Butylbromid (25 mg) versetzt und für 2 Stunden auf 80 °C erwärmt. Die Reaktionslösung wurde filtriert und der eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 395,51 (C23H29N3O3); MS (ESI): 396 ([M+H]+) als Hydrotrifluoracetat.
- 1-[4-(2-Dimethylamino-ethoxy)-phenyl]-3-(4-hydroxy-phenyl)-1,3-dihydro-imidazol-2-on
- Eine Suspension aus 1-(4-Benzyloxy-phenyl)-1-(2,2-dimethoxy-ethyl)-3-[4-(2-dimethylamino-ethoxy)-phenyl]-harnstoff (4,9 g), Palladium (10% auf Kohle, 1,0 g) und Ethanol (40 mL) wurde für 5 Stunden unter Wasserstoff gerührt. Es wurde vom Katalysator abfiltriert und das Filtrat ein eengt. Der Rückstand wurde in Trifluoressigsäure (20 mL) aufgenommen und die Lösung für 48 Stunden gerührt. Die Reaktionsmischung wurde mit Dichlormethan verdünnt und mit gesättigter Natriumhydrogencarbonatlösung gewaschen. Die organische Phase wurde getrocknet und eingeengt. Der feste Rückstand wurde mit Acetonitril v errührt und das Produkt abfiltriert. Man erhielt so das Produkt mit dem Molekulargewicht 339,40 (C19H21N3O3); MS (ESI): 340 ([M+H]+).
- 1-(4-Benzyloxy-phenyl)-1-(2,2-dimethoxy-ethyl)-3-[4-(2-dimethylamino-ethoxy)phenyl]-harnstoff
- sZu einer eisgekühlten Lösung von 4-(2-Dimethylamino-ethoxy)-phenylamin (3,01 g) in Dimethylformamid {40 mL) wurde Carbonyldümidazol (2,7 g) gegeben. Nach 30 Minuten wurde (4-Benzyloxy-phenyl)-(2,2-dimethoxy-ethyl)-amin (4,8 g) zugesetzt und die Mischung für 30 Minuten auf 80 °C erhitzt. Nach dem Abkühlen wurden flüchtige Anteile entfernt und der Rückstand durch MPLC (Eluent: Heptan/Ethylacetat 9:1) gereingt. Man erhielt so das Produkt mit dem Molekulargewicht 493,61 (C28H35N3O5); MS (ESI): 494 ([M+H]+).
- (4-Benzyloxy-phenyl)-(2,2-dimethoxy-ethyl)-amin
- Eine Mischung aus 4-Benzyloxyanilin (10 g), Bromaceataldehyddimethylacetal (12,2 g), Kaliumcarbonat (13,8 g) und Dimethylformamid (150 mL) wurde für 5 Stunden auf 100 °C erwärmt. Nach dem Abkühlen wurde die Reaktionslösung filtriert und eingeengt. Der Rückstand wurde durch MPLC (Eluent: Heptan/Ethylacetat 4:1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 287,36 (C17H21NO3); MS (ESI): 288 ([M+H]+).
- Beispiele 93–130
-
- Zu einer Mischung von 1-[4-(2-Dimethylamino-ethoxy)-phenyl]-3-(4-hydroxyphenyl)-1,3-dihydro-imidazol-2-on (0,34 g), Aliquat 336 (0,04 g), Kaliumhydroxid (0,077g) und Toluol (10 mL) wurde 2-Nitrofluorbenzol (0,14 g) gegeben. Die Mischung wurde für 3 Stunden zum Rückfluss erhitzt. Nach dem Abkühlen wurde die Reaktionslösung mit Wasser gewaschen, getrocknet und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 460,49 (C25H24N4O5); MS (ESI): 461 ([M+H]+) als Hydrotrifluoracetat. Beispiel 132 1-[4-(2-Dimethylamino-ethoxy)-phenyl]-3-(4-o-tolyloxy-phenyl)-1,3-dihydroimidazol-2-on Zu einer Lösung von 4-o-Tolyloxy-phenylamin (50 mg) in Dimethylformamid (2 mL) wurde bei 0 °C Carbonyldiimidazol (40 mg) gegeben. Nach 30 Minuten wurde (2,2-Dimethoxy-ethyl)-[4-(2-dimethylamino-ethoxy)-phenyl]-amin (67 mg) zugesetzt und die Mischung für 2 Stunden auf 80 °C erwärmt. Nach dem Abkühlen auf Raumtemperatur wurde Trifluoressigsäure (0,5 mL) zugesetzt und 72 Stunden stehen gelassen. Die Reaktionslösung wurde mit Ethylacetat verdünnt und mit gesättigter Natriumhydrogencarbonatlösung gewaschen. Die organische Phase wurde getrocknet und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 429,52 (C26H27N3O3); MS (ESI): 430 ([M+H]+) als Hydrotrifluoracetat.
- (2,2-Dimethoxy-ethyl)-[4-(2-dimethylamino-ethoxy)-phenyl]-amin
- Eine Lösung von 4-(2,2-Dimethoxy-ethylamino)-phenol (4,3 g) in Dimethylformamid (25 mL) wurde mit Natriumhydrid (1,57 g) versetzt. Nach 30 Minuten wurde 2-Dimethylaminoethylchlorid (Hydrochlorid, 3,14 g) zugesetzt. Nach 12 Stunden wurde die Reaktionslösung mit Ethylacetat verdünnt und mit Wasser gewaschen. Die organische Phase wurde getrocknet und eingeengt. Der Rückstand wurde durch MPLC (Eluent: Dichlormethan/Methanol/Ammoniaklösung 95 : 4,9 : 0,1) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 268.36 (C14H24N2O3); MS (ESI): 269 ([M+H]+).
- 4-(2,2-Dimethoxy-ethylamino)-phenol
- Eine Lösung von (4-Benzyloxy-phenyl)-(2,2-dimethoxy-ethyl)-amin (3,5 g) in Ethanol (50 mL) wurde unter Stickstoff mit Palladium(II)hydroxid (20% auf Kohle, 0,5 g) versetzt. Die Stickstoffatmosphäre wurde durch Wasserstoff ausgetauscht und die Mischung für 3 Stunden geschüttelt. Der Katalysator wurde abfiltriert und das Filtrat eingeengt. Das Rohprodukt wurde ohne Reinigung weiter umgesetzt.
- Beispiele 133–166
-
- sEine Lösung von 1-(4-Cyclopentyloxy-phenyl)-1-(2,2-dimethoxy-ethyl)-3-{4-[(2-hydroxy-ethyl)-methyl-amino]- phenyl}-harnstoff (0,4 g) in Dimethylformamid (6 mL) wurde mit Trifluoressigsäure (2 mL) versetzt und für 48 Stunden stehen gelassen. Die Mischung wurde mit Wasser verdünnt und mit Ethylacetat extrahiert. Die organische Phase wurde mit Wasser und Natriumcarbonatlösung gewaschen, getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 393,49 (C23H27N3O3); MS (ESI): 394 ([M+H]+).
- 1-(4-Cyclopentyloxy-phenyl)-1-(2,2-d imethoxy-ethyl)-3-{4-[(2-hydroxy-ethyl)methyl-amino]- phenyl}-harnstoff
- Nach der in Beispiel 4 gegebenen Vorschrift wurde 2-[(4-Amino-phenyl)-methylamino]-ethanol mit Carbonyldiimidazol und (4-Cyclopentyloxy-phenyl)-(2,2-dimethoxy-ethyl)-amin umgesetzt. Das Rohprodukt wurde durch Chromatographie an Kieselgel (Eluent: Ethylacetat) gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 457,57 (C25N35N3O5); MS (ESI): 458 ([M+H]+).
- 2-[(4-Amino-phenyl)-methyl-amino]-ethanol
- Eine Lösung von 2-[Methyl-(4-nitro-phenyl)-amino]-ethanol (6 g) in Methanol (100 mL) wurde unter Stickstoff mit Palladium (10% auf Kohle, 1 g) versetzt. Die Stickstoffatmosphäre wurde durch Wasserstoff ausgetauscht und die Mischung für 4 Stunden geschüttelt. Der Katalysator wurde abfiltriert und das Filtrat eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 166,22 (C9H14N2O); MS (ESI): 167 ([M+H]+).
- 2-(Methyl-(4-nitro-phenyl)-amino]-ethanol
- Eine Mischung aus 4-Fluornitrobenzol (20 g) und 2-Methylaminoethanol (56 mL) wurde für 12 Stunden stehen gelassen und dann mit Ethylacetat verdünnt. Es wurde mit Wasser gewaschen. Die organische Phase wurde getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 196,21 (C9H12N2O3); MS (ESI): 197 ([M+H]+). Beispiel 165 1-(4-Cyclopentyloxy-phenyl)-3-{4-((2-imidazol-1-yl-ethyl)-methyl-amino]-phenyl}-1,3-dihydro-imidazol-2-on
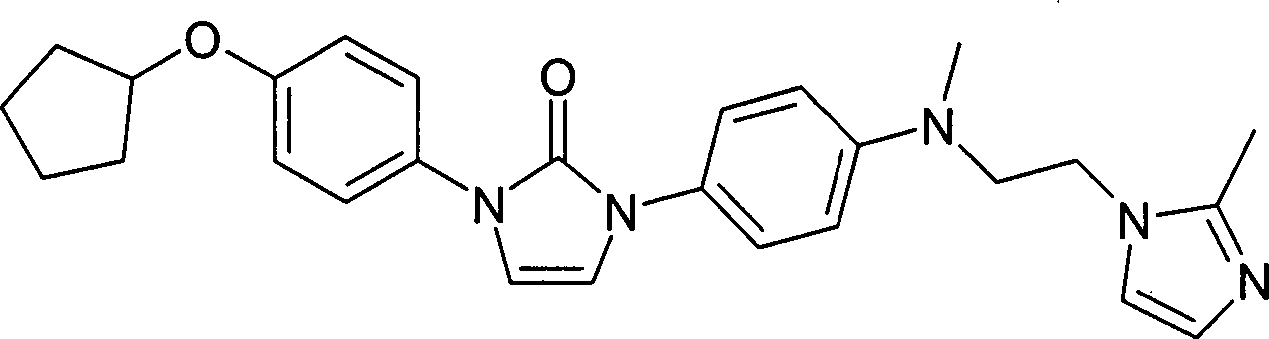
- Eine Lösung von 1-(4-Cyclopentyloxy-phenyl)-3-{4-[(2-hydroxy-ethyl)-methylamino]-phenyl}-1,3-dihydro-imidazol-2-on (0,20 g) in Dichlormethan (5 mL) wurde bei 0 °C mit Triethylamin (0,13 g) und Methansulfonsäurechlorid (0,1 mL) versetzt. Nach zwei Stunden wurden flüchtige Anteile entfernt und der Rückstand in Propionitril (5 mL) aufgenommen. Es wurde Imidazol (0,25 g) zugesetzt und für 6 Stunden auf 90 °C erwärmt. Flüchtige Anteile wurden entfernt und der Rückstand durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 443,55 (C26H29N5O2); MS (ESI): 444 ([M+H]+) als Hydrotrifluoracetat. Beispiel 166 1-(4-Cyclopentyloxy-phenyl)-3-(4-{methyl-[2-(2-methyl-imidazol-1-yl)-ethyl]-amino}phenyl)-1,3-dihydro-imidazol-2-on
- Die Verbindung wurde wie im Beispiel 165 beschrieben nur unter Verwendung von 2-Methylimidazol hergestellt. Man erhielt so das Produkt mit dem Molekulargewicht 457,58 (C27H31N5O2); MS (ESI): 458 ([M+H]+) als Hydrotrifluoracetat. Beispiel 167 1-(4-Cyclopentyloxy-phenyl)-3-{4-[methyl-(2-methylamino-ethyl)-amino]-phenyl}-1,3-dihydro-imidazol-2-on
- Die Verbindung wurde wie im Beispiel 165 beschrieben nur unter Verwendung von Methylamin (1 M in THF) hergestellt. Man erhielt so das Produkt mit dem Molekulargewicht 406,53 (C24H30N4O2); MS (ESI): 407 ([M+H]+) als Hydrotrifluoracetat. Beispiel 168 1-(4-Cyclopentyloxy-phenyl)-3-{4-[methyl-(2-piperidin-1-yl-ethyl)-amino]-phenyl}-1,3-dihydro-imidazol-2-on
- Die Verbindung wurde wie im Beispiel 165 beschrieben nur unter Verwendung von Piperidin hergestellt. Man erhielt so das Produkt mit dem Molekulargewicht 460,62 (C28H36N4O2); MS (ESI): 461 ([M+H]+) als Hydrotrifluoracetat. Beispiel 169 1-(4-Cyclopentyloxy-phenyl)-3-(4-{[2-(cyclopropylmethyl-amino)-ethyl]-methylamino}-phenyl)-1,3-dihydro-imidazol-2-on Die Verbindung wurde wie im Beispiel 165 beschrieben nur unter Verwendung von Cyclopropylamin hergestellt. Man erhielt so das Produkt mit dem Molekulargewicht 446,60 (C27H34N4O2); MS (ESI): 447 ([M+H]+) als Hydrotrifluoracetat. Beispiel 170 N-[2-({4-(3-(4-Cyclopentyloxy-phenyl)-2-oxo-2,3-dihydro-imidazol-1-yl]-phenyl}methyl-amino)-ethyl]-N-methyl-acetamid
- Eine Lösung von 1-(4-Cyclopentyloxy-phenyl)-3-{4-[methyl-(2-methylamino-ethyl)amino]-phenyl}-1,3-dihydro-imidazol-2-on (50 mg) in Dichlormethan (2 mL) wurde mit Triethylamin (25 mg) und Acetylchlorid (15 mg) versetzt. Nach 2 Stunden wurden flüchtige Anteile entfernt und der Rückstand durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 448,57 (C2 6H32N4O3); MS (ESI): 449 ([M+H]+) als Hydrotrifluoracetat. Beispiel 171 1-[4-(2-Dimethylamino-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-imidazolidin-2-on
- Eine Lösung von 1-[4-(2-Dimethylamino-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-1,3-dihydro-imidazol-2-on (50 mg) in Ethanol (5 mL) wurde unter Stickstoff mit Palladium(II)hydroxid (20 mg) versetzt. Die Stickstoffatmosphäre wurde durch Wasserstoff ausgetauscht und die Mischung für 8 Stunden geschüttelt. Der Katalysator wurde abfiltriert und das Filtrat eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 417,51 (C25H27N3O3); MS (ESI): 418 ([M+H]+).
-
- Die Verbindung wurde wie im Beispiel 171 beschrieben durch Hydrierung von 1-(4-Cyclopropylmethoxy-phenyl)-3-[4-(2-dimethylamino-ethoxy)-phenyl]-1,3-dihydro-imidazol-2-on hergestellt. Man erhielt so das Produkt mit dem Molekulargewicht 395,51 (C23H29N3O3); MS (ESI): 396 ([M+H]+). Beispiel 173 1-[4-(2-Dimethylamino-ethoxy)-phenyl]-3-(4-phenoxy-phenyl)-imidazolidin-2-on
- Eine Lösung von 1-(4-Hydroxy-phenyl)-3-(4-phenoxy-phenyl)-[1,3]diazepan-2-on (26 mg) wurde in THF (2 mL) gelöst und Natriumhydrid (80% in Ö1, 3 mg) zugegeben. Nach 30 Minuten wurde 2-Dimethylaminoethylchlorid (Hydrochlorid, 11 mg) zugesetzt. Nach 16 Stunden wurde die Reaktionsmischung mit Wasser verdünnt und mit Ethylacetat extrahiert. Die organische Phase wurde getrocknet und eingeengt. Der Rückstand wurde durch präparative HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 445,57 (C27H31N3O3); MS (ESI): 446 ([M+H]+).
- 1-(4-Hydroxy-phenyl)-3-(4-phenoxy-phenyl)-[1,3]diazepan-2-on
- Die Verbindung wurde durch Hydrierung von 1-(4-Benzyloxy-phenyl)-3-(4-phenoxy-phenyl)-1,3,4,7-tetrahydro-[1,3]diazepin-2-on analog der Vorschrift im Beispiel 171 hergestellt. Man erhielt so das Produkt mit dem Molekulargewicht 374,44 (C23H22N2O3); MS (ESI): 375 ([M+H]+).
- 1-(4-Benzyloxy-phenyl)-3-(4-phenoxy-phenyl)-1,3,4,7-tetrahydro-[1,3]diazepin-2-on
- Eine Lösung von 1,3-Diallyl-3-(4-benzyloxy-phenyl)-1-(4-phenoxy-phenyl)harnstoff (145 mg) in Dichlormethan (2 mL) wurde bei 0 °C mit dem Grubbs-Katalysator versetzt. Nach 3 Tagen bei Raumtemperatur wurden flüchtige Anteile entfernt und der Rückstand mittels präparativer HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 462,55 (C30H26N2O3); MS (ESI): 463 ([M+H]+).
- 1,3-Diallyl-3-(4-benzyloxy-phenyl)-1-(4-phenoxy-phenyl)-harnstoff
- Eine Lösung von 1-Allyl-1-(4-benzyloxy-phenyl)-3-(4-phenoxy-phenyl)-harnstoff (133 mg) in THF (3 mL) wurde bei -78 °C mit Kaliumhydrid (30% in Öl, 40 mg) versetzt. Nach 30 Minuten wurde Allylbromid (30 μL) zugesetzt. Nach 14 Stunden bei Raumtemperatur wurde die Reaktionslösung mit Dichlormethan verdünnt und mit gesättigter Natriumhydrogencarbonatlösung gewaschen. Die organische Phase wurde getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 490,61 (C32H30N2O3); MS (ESI): 491 ([M+H]+).
- 1-Allyl-1-(4-benzyloxy-phenyl)-3-(4-phenoxy-phenyl)-harnstoff
- sEine Lösung von 4-Phenoxyanilin (155 mg) in Dimethylformamid (3 mL) wurde bei 0 °C mit Carbonyldiimidazol (136 mg) versetzt. Nach 30 Minuten wurde Allyl-(4-benzyloxy-phenyl)-amin (200 mg) zugesetzt und die Temperatur für 2 Stunden auf 80 °C erhöht. Nach weiteren 2 Stunden bei 120 °C wurde die Reaktionslösung nach dem Abkühlen direkt mittels präparartiver HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 450,54 (C29H26N2O3); MS (ESI): 451 ([M+H]+).
- Allyl-(4-benzyloxy-phenyl)-amin
- Eine Mischung von 4-Benzyloxyanilin (3,0 g), Allylbromid (1,27 mL), Kaliumcarbonat (4,2 g) und Dimethylformamid (15 mL) wurde für 3 Stunden auf 80 °C erhitzt. Nach dem Abkühlen wurde die Reaktionslösung filtriert und eingeengt. Der Rückstand wurde durch MPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 239,32 (C16H17NO); MS (ESI): 240 ([M+H]+). Beispiel 174 4-[4-(2-Dimethylamino-ethoxy)-phenyl]-2-(4-phenoxy-phenyl)-2,4-dihydro[1,2,4]triazol-3-on
- sZu einer Lösung von Kaliumhydroxid (15 mg) in Methanol (20 mL) wurde 1-Formyl-2-(4-phenoxy-phenyl)-4-[4-(2-dimethylamino-ethoxy)-phenyl]-semicarbazid (60 mg) gegeben. Nach 4 Stunden bei Raumtemperatur wurde die Mischung für 24 Stunden auf 40 °C erhitzt. Nach dem Abkühlen wurde die Reaktionslösung mit Wasser verdünnt und mit Ethylacetat extrahiert. Die organische Phase wurde getrocknet und eingeengt. Man erhielt so das Produkt mit dem Molekulargewicht 416,48 (C24H24N4O3); MS (ESI): 417 ([M+H]+) .
- 1-Formyl-2-(4-phenoxy-phenyl )-4-[4-(2-dimethylamino-ethoxy)-phenyl]semicarbazid
- Zu einer Lösung von 1-Benzyliden-2-(4-phenoxy-phenyl)-4-[4-(2-dimethylaminoethoxy)-phenyl]-semicarbazid (600 mg) in Tetrahydrofuran / Ethanol (1:1, 30 mL) wurden Palladium(II)hydroxid (60 mg) und Ameisensäure (4.6 g) zugesetzt. Die Mischung wurde für fünf Stunden zum Rückfluss erhitzt und dann filtriert. Das Filtrat wurde eingeengt und der Rückstand mittels HPLC gereinigt. Man erhielt so das Produkt mit dem Molekulargewicht 434,50 (C24H26N4O4); MS (ESI): 435 ([M+H]+).
- 1-Benzyliden-2-(4-phenoxy-phenyl )-4-[4-(2-d imethylamino-ethoxy)-phenyl]semicarbazid
- Zu einer Lösung von N-Benzyliden-N'-(4-phenoxy-phenyl)-hydrazin (50 mg) in Toluol (1 mL) wurde bei 0 °C Phosgen (20 % in Toluol; 0,091 mL) getropft. Nach 24 Stunden bei Raumtemperatur wurde 4-(2-Dimethylamino-ethoxy)-anilin (31 mg) zugesetzt. Nach zwei Stunden wurden die ausgefallenen Kristalle abgesaugt. Man erhielt so das Produkt mit dem Molekulargewicht 494,60 (C30H30N4O3); MS (ESI): 495 ([M+H]+).
- N-Benzyliden-N'-(4-phenoxy-phenyl)-hydrazin
- Eine Suspension von (4-Phenoxy-phenyl)-hydrazin (J. Org. Chem. 1956, 395; 1,5 g) in Methanol (10 mL) wurde mit Benzaldehyd (0,76 mL) versetzt und zum Rückfluss erhitzt. Die beim Abkühlen ausgefallenen Kristalle wurden abgesaugt.
- Man erhielt so das Produkt mit dem Molekulargewicht 288,35 (C19H1 6N2O); MS (ESI): 289 ([M+H]+).
Claims (11)
- Verbindungen der Formel 1, worin bedeuten R (C1-C8)-Alkyl, (C0-C8)-Alkylen-Aryl, (C3-C8)-Cycloalkyl, (C1-C4)-Alkoxy(C1-C4)-alkyl, (C2-C8)-Alkenyl, (C2-C8)-Alkinyl; 3-12 gliedriger mono-, bi- oder spirobicyclischer Ring, der ein oder mehrere Heteroatome aus der Gruppe N, 0 und S enthalten kann und der 3-12 gliedrige Ring weitere Substituenten wie F, Cl, Br, NO2, CF3, OCF3, CN, (C1-C6)-Alkyl, Aryl, CON(R11)(R12), N(R13)(R14), OH, O-(C1-C6)-Alkyl, S-(C1-C6)-Alkyl, N(R15)CO(C1-C6)-Alkyl oder COO-(C1-C6)-Alkyl tragen kann; R11, R12, R13, R14, R15 unabhängig voneinander N, (C1-C6)-Alkyl; B eine Bindung oder ein Linker der aus ein oder zwei Resten aus der Gruppe (C(R19)(R20))i, C(OR21)(R22), O, N(R23), S, SO, SO2, CO besteht; i 0, 1, 2, 3; R19, R20, R21, R22, R23 unabhängig voneinander H, (C1-C6)-Alkyl, Aryl; R1, R2, R3 , R4 unabhängig voneinander H, F, Cl, Br, J, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-Alkyl, O-(C1-C4)-Alkoxy-(C1-C4)-alkyl, S-(C1-C6)-Alkyl, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C3-C8)-Cycloalkyl, O-(C3-C8)-Cycloalkyl, (C3-C8)-Cycloalkenyl, O-(C3-C89)-Cycloalkenyl, (C2-C6)-Alkinyl, (C0-C8)-Alkylen-Aryl, O-(C0-C8)-Alkylen-Aryl, S-Aryl, N(R24)(R25), SO2-CH3, COOH, COO-(C1-C6)-Alkyl, CON(R26)(R27), N(R28)CO(R29), N(R30)SO2(R31), CO(R32); R24, R25, R26, R27, R28, R30 unabhängig voneinander N, (C1-C6)-Alkyl; R29, R31, R32 unabhängig voneinander N, (C1-C6)-Alkyl, Aryl; W -(CH2)n -, -CH=CH-, -CH=N-, -N=CH-; n 2, 3, 4, 5; R5, R6, R7, R8 unabhängig voneinander N, F, Cl, Br, J, OH, CF3, NO2, CN, OCF3, O-(C1-C6)-Alkyl, O-(C1-C4)-Alkoxy-(C1-C4)-alkyl, S-(C1-C6)-Alkyl, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C3-C8)-Cycloalkyl, O-(C3-C8)-Cycloalkyl, (C3-C8)-Cycloalkenyl, O-(C3-C8)-Cycloalkenyl, (C2-C6)-Alkinyl, (C0-C8)-Alkylen-Aryl, O-(C0-C8)-Alkylen-Aryl, S-Aryl, N(R33)(R34), SO2-CH3, COOH, COO-(C1-C6)-Alkyl, CON(R35)(R36), N(R37)CO(R38), N(R39)SO2(R40), CO(R41), ein 5-7 gliedriger Heterocyclus mit 1-4 Heteroatomen aus der Gruppe O, N und S; R33, R34 unabhängig voneinander H, (C1-C6)-Alkyl; oder R33 und R34 bilden zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen 5-6 gliedrigen Ring, wobei im Falle des 6-Rings eine CH2-Gruppe durch 0 oder S ersetzt sein kann; R35, R36, R37, R39 unabhängig voneinander H, (C1-C6)-Alkyl; R38, R40, R41 unabhängig voneinander H, (C1-C6)-A1ky1, Aryl; A eine Kette -(C(R42)(R43))m -, in der 0-2 Glieder ersetzt sein können durch ein Element aus der Gruppe O, S, N(R44), CO, SO2; m 0, 1, 2, 3, 4, 5; R42, R43, R44 unabhängig voneinander N, (C1-C6)-A1ky1, Aryl; R9, R10 unabhängig voneinander H, (C1-C8)-Alkyl, -(CH2)o -R45, (C1-C4)-Alkoxy-(C1-C4)-alkyl, Aryloxy-(C1-C4)-alkyl, (C3-C8)-Alkenyl, (C3-C8)-Alkinyl, CO-(C1-Ca)-Alkyl, -CO-(CH2)o -R45, CO-(C1-C4)-Alkoxy-(C1-C4)-alkyl, CO-Anloxy-(C1-C4)-alkyl, CO-(C2-C8)-Alkenyl, CO-(C2-C8)-Alkinyl; oder R9 und R10 bilden zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen 4 bis 10-gliedrigen mono-, bi- oder spirobicyclischen Ring welcher ausser dem Stickstoffatom 0 bis 4 zusätzliche Heteroatome beinhalten kann, ausgewählt aus der Gruppe Sauerstoff, Stickstoff und Schwefel, wobei das heterocyclische Ringsystem zusätzlich substituiert sein kann mit F, Cl, Br, CF3, NO2, CN, (C1-C6)-Alkyl, O-(C1-C8)-Alkyl, (C1-C4)-Alkoxy(C1-C4)-alkyl, (C0-C8)-Alkylen-Aryl, oxo, CO(R46), CON(R47)(R48), Hydroxy, COO(R49), N(R50)CO(C1-C6)-Alkyl, N(R51)(R52) oder SO2CH3; R46, R47, R48, R49, R50, R51, R52 unabhängig voneinander H, (C1-C6)-Alkyl; o 0, 1, 2, 3, 4, 5, 6; R45 OH, CH(Aryl)2, 3-12 gliedriger mono- oder bicyclischer Ring, der ein oder mehere Neteroatome aus der Gruppe N, 0 und S enthalten kann und der 3-12 gliedrige Ring weitere Substituenten wie F, Cl, Br, J, OH, CF3, NO2, CN, OCF3, oxo, O-(C1-C6)-Alkyl, (C1-C4)-Alkoxy(C1-C4)-alkyl, S-(C1-C6)-Alkyl, (C1-C6)-Alkyl, (C2-C6)-Alkenyl, (C3-C8)-Cycloalkyl, O-(C3-C8)-Cycloalkyl, (C3-C8)-Cycloalkenyl, O-(C3-C8)-Cycloalkenyl, (C2-C6)-Alkinyl, (C0-C8)-Alkylen-Aryl, O-(C0-C8)-Alkylen-Aryl, S-Aryl, N(R51)(R52), SO2CH3 und COOH enthalten kann; sowie deren physiologisch verträglichen Salze.
- Arzneimittel enthaltend eine oder mehrere der Verbindungen gemäß Anspruch 1.
- Arzneimittel enthaltend eine oder mehrere der Verbindungen gemäß Anspruch 1 und ein oder mehrere anorektische Wirkstoffe.
- Verbindungen gemäß Anspruch 1 zur Anwendung als Medikament zur Prophylaxe oder Behandlung der Obesitas.
- Verbindungen gemäß Anspruch 1 zur Anwendung als Medikament zur Prophylaxe oder Behandlung des Typ II Diabetes.
- Verbindungen gemäß Anspruch 1 in Kombination mit mindestens einem weiteren anorektischen Wirkstoff zur Anwendung als Medikament zur Prophylaxe oder Behandlung der Obesitas.
- Verbindungen gemäß Anspruch 1 in Kombination mit mindestens einem weiteren anorektischen Wirkstoff zur Anwendung als Medikament zur Prophylaxe oder Behandlung der des Typ II Diabetes.
- Verfahren zur Herstellung eines Arzneimittels enthaltend eine oder mehrere der Verbindungen gemäß Anspruch 1, dadurch gekennzeichnet, daß der Wirkstoff mit einem pharmazeutisch geeigneten Träger vermischt wird und diese Mischung in eine für die Verabreichung geeignete Form gebracht wird.
- Verwendung der Verbindungen gemäß Anspruch 1 zur Herstellung eines Medikaments zur Gewichtsreduktion bei Säugetieren.
- Verwendung der Verbindungen gemäß Anspruch 1 zur Herstellung eines Medikaments zur Prophylaxe oder Behandlung der Obesitas.
- Verwendung der Verbindungen gemäß Anspruch 1 zur Herstellung eines Medikaments zur Prophylaxe oder Behandlung des Typ II Diabetes.
Priority Applications (17)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10233817A DE10233817A1 (de) | 2002-07-25 | 2002-07-25 | Substituierte Diarylheterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| PCT/EP2003/007639 WO2004012648A2 (de) | 2002-07-25 | 2003-07-15 | Substituierte diarylheterocyclen, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| AU2003257465A AU2003257465A1 (en) | 2002-07-25 | 2003-07-15 | Substituted diaryl heterocycles, method for the production and use thereof as medicaments |
| PCT/EP2003/007891 WO2004011438A1 (de) | 2002-07-25 | 2003-07-18 | Diarylsubstituierte cyclische harnstoffderivate mit mch-modulatorischer wirkung |
| EP03771060A EP1551810B1 (de) | 2002-07-25 | 2003-07-18 | Diarylsubstituierte cyclische harnstoffderivate mit mch-modulatorischer wirkung |
| JP2004523753A JP4568113B2 (ja) | 2002-07-25 | 2003-07-18 | Mch調節作用を有するジアリール置換環状尿素誘導体 |
| CA002493924A CA2493924A1 (en) | 2002-07-25 | 2003-07-18 | Diaryl-substituted cyclic urea derivatives having an mch-modulatory effect |
| AU2003251001A AU2003251001B9 (en) | 2002-07-25 | 2003-07-18 | Diaryl-substituted cyclic urea derivatives having an MCH-modulatory effect |
| MXPA05001048A MXPA05001048A (es) | 2002-07-25 | 2003-07-18 | Derivados de urea ciclica, sustituidos con diarilo que tienen un efecto modulador del mch. |
| BR0312916-0A BR0312916A (pt) | 2002-07-25 | 2003-07-18 | Derivados de uréa cìclicos substituìdos por diarila com eficácia moduladora mch |
| AT03771060T ATE535513T1 (de) | 2002-07-25 | 2003-07-18 | Diarylsubstituierte cyclische harnstoffderivate mit mch-modulatorischer wirkung |
| PE2003000725A PE20040702A1 (es) | 2002-07-25 | 2003-07-21 | Heterociclos diarilicos sustituidos y procedimiento para su preparacion como medicamentos |
| TW092120029A TW200408627A (en) | 2002-07-25 | 2003-07-23 | Substituted diaryl heterocycles, process for their preparation and their use as medicaments |
| AR20030102644A AR040514A1 (es) | 2002-07-25 | 2003-07-23 | Heterociclos diarilicos sustituidos, procedimiento para la preparacion de medicamentos y la utilizacion de los compuestos para tal fin |
| MYPI20032759A MY142551A (en) | 2002-07-25 | 2003-07-23 | Substituted diaryl heterocycles, process for their preparation and their use as medicaments |
| US10/626,314 US7141561B2 (en) | 2002-07-25 | 2003-07-24 | Substituted diaryl heterocycles, process for their preparation and their use as medicaments |
| IL166471A IL166471A (en) | 2002-07-25 | 2005-01-17 | Diaryl-substituted cyclic urea derivatives having an mch-modulatory effect |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE10233817A DE10233817A1 (de) | 2002-07-25 | 2002-07-25 | Substituierte Diarylheterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE10233817A1 true DE10233817A1 (de) | 2004-02-12 |
Family
ID=30128364
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE10233817A Withdrawn DE10233817A1 (de) | 2002-07-25 | 2002-07-25 | Substituierte Diarylheterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
Country Status (14)
| Country | Link |
|---|---|
| EP (1) | EP1551810B1 (de) |
| JP (1) | JP4568113B2 (de) |
| AR (1) | AR040514A1 (de) |
| AT (1) | ATE535513T1 (de) |
| AU (2) | AU2003257465A1 (de) |
| BR (1) | BR0312916A (de) |
| CA (1) | CA2493924A1 (de) |
| DE (1) | DE10233817A1 (de) |
| IL (1) | IL166471A (de) |
| MX (1) | MXPA05001048A (de) |
| MY (1) | MY142551A (de) |
| PE (1) | PE20040702A1 (de) |
| TW (1) | TW200408627A (de) |
| WO (2) | WO2004012648A2 (de) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006015279A1 (en) * | 2004-07-28 | 2006-02-09 | Neurogen Corporation | Heterocyclic diamine compounds as ligands of the melanin concentrating hormone receptor useful for the treatment of obesity, diabetes, eating and sexual disorders |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102004003811A1 (de) * | 2004-01-25 | 2005-08-11 | Aventis Pharma Deutschland Gmbh | Substituierte N-Cyclohexylimidazolinone, Verfahren ihrer Herstellung und ihre Verwendung als Arzneimittel |
| US7241787B2 (en) | 2004-01-25 | 2007-07-10 | Sanofi-Aventis Deutschland Gmbh | Substituted N-cycloexylimidazolinones, process for their preparation and their use as medicaments |
| WO2005094817A1 (en) * | 2004-03-23 | 2005-10-13 | The Regents Of The University Of California | Melanin-concentrating hormone receptor antagonists and methods of use |
| EP1634598A1 (de) * | 2004-09-07 | 2006-03-15 | Laboratorios Del Dr. Esteve, S.A. | Verwendung von Piperazinderivaten und Analogen zur Behandlung oder Prophylaxe von Essstörungen |
| JP5250967B2 (ja) * | 2005-11-30 | 2013-07-31 | 三菱化学株式会社 | 有機化合物、電荷輸送材料、電荷輸送材料用組成物および有機電界発光素子 |
| US8022617B2 (en) | 2005-11-30 | 2011-09-20 | Mitsubishi Chemical Corporation | Organic compound, charge-transporting material, composition for charge-transporting material and organic electroluminescent device |
| RU2008129679A (ru) | 2005-12-21 | 2010-01-27 | Янссен Фармацевтика Н.В. (Be) | Новые замещенные пиразиноновые производные для применения при мсн-1-опосредованных заболеваниях |
| KR20080096670A (ko) * | 2006-02-15 | 2008-10-31 | 사노피-아벤티스 | 신규한 아미노 알콜-치환된 아릴티에노피리미디논, 이의 제조 방법 및 약제로서 이의 용도 |
| EP2061767B1 (de) | 2006-08-08 | 2014-12-17 | Sanofi | Arylaminoaryl-alkyl-substituierte Imidazolidin-2,4-dione, Verfahren zu ihrer Herstellung, diese Verbindungen enthaltende Arzneimittel und ihre Verwendung |
| RU2461558C2 (ru) | 2006-12-05 | 2012-09-20 | Янссен Фармацевтика Н.В. | Новые замещенные диазаспиропиридиноновые производные для применения в лечении мсн-1-опосредованных заболеваний |
| WO2010003624A2 (en) | 2008-07-09 | 2010-01-14 | Sanofi-Aventis | Heterocyclic compounds, processes for their preparation, medicaments comprising these compounds, and the use thereof |
| DE102008049675A1 (de) | 2008-09-30 | 2010-04-01 | Markus Dr. Heinrich | Verfahren zur Herstellung von 3-Aminobiphenylen |
| CA2741125A1 (en) | 2008-10-22 | 2010-04-29 | Merck Sharp & Dohme Corp. | Novel cyclic benzimidazole derivatives useful anti-diabetic agents |
| CN102271509A (zh) | 2008-10-31 | 2011-12-07 | 默沙东公司 | 用于抗糖尿病药的新型环苯并咪唑衍生物 |
| WO2010068601A1 (en) | 2008-12-08 | 2010-06-17 | Sanofi-Aventis | A crystalline heteroaromatic fluoroglycoside hydrate, processes for making, methods of use and pharmaceutical compositions thereof |
| CN102482312A (zh) | 2009-08-26 | 2012-05-30 | 赛诺菲 | 新颖的杂芳族氟代糖苷结晶水合物、含有这些化合物的药物和它们的用途 |
| US8895596B2 (en) | 2010-02-25 | 2014-11-25 | Merck Sharp & Dohme Corp | Cyclic benzimidazole derivatives useful as anti-diabetic agents |
| EP2677869B1 (de) | 2011-02-25 | 2017-11-08 | Merck Sharp & Dohme Corp. | Neue cyclische azabenzimidazolderivate als antidiabetika |
| WO2012120056A1 (de) | 2011-03-08 | 2012-09-13 | Sanofi | Tetrasubstituierte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| WO2012120053A1 (de) | 2011-03-08 | 2012-09-13 | Sanofi | Verzweigte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| WO2012120058A1 (de) | 2011-03-08 | 2012-09-13 | Sanofi | Mit benzyl- oder heteromethylengruppen substituierte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| US8901114B2 (en) | 2011-03-08 | 2014-12-02 | Sanofi | Oxathiazine derivatives substituted with carbocycles or heterocycles, method for producing same, drugs containing said compounds, and use thereof |
| EP2683698B1 (de) | 2011-03-08 | 2017-10-04 | Sanofi | Mit adamantan- oder noradamantan substituierte benzyl-oxathiazinderivate, diese verbindungen enthaltende arzneimittel und deren verwendung |
| WO2012120054A1 (de) | 2011-03-08 | 2012-09-13 | Sanofi | Di- und trisubstituierte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| EP2683703B1 (de) | 2011-03-08 | 2015-05-27 | Sanofi | Neue substituierte phenyl-oxathiazinderivate, verfahren zu deren herstellung, diese verbindungen enthaltende arzneimittel und deren verwendung |
| WO2012120055A1 (de) | 2011-03-08 | 2012-09-13 | Sanofi | Di- und trisubstituierte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| EP2683702B1 (de) | 2011-03-08 | 2014-12-24 | Sanofi | Neue substituierte phenyl-oxathiazinderivate, verfahren zu deren herstellung, diese verbindungen enthaltende arzneimittel und deren verwendung |
| RU2465895C1 (ru) * | 2011-09-08 | 2012-11-10 | Государственное образовательное учреждение высшего профессионального образования "Мордовский государственный университет им. Н.П. Огарева" | Способ лечения депрессивного невроза |
| CA2880901A1 (en) | 2012-08-02 | 2014-02-06 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| WO2014130608A1 (en) | 2013-02-22 | 2014-08-28 | Merck Sharp & Dohme Corp. | Antidiabetic bicyclic compounds |
| EP2970119B1 (de) | 2013-03-14 | 2021-11-03 | Merck Sharp & Dohme Corp. | Neuartige indolderivate als antidiabetika |
| ES2761571T3 (es) | 2013-06-20 | 2020-05-20 | Bayer Cropscience Ag | Derivados de arilsulfuro y arilsulfóxido como acaricidas e insecticidas |
| WO2015051496A1 (en) | 2013-10-08 | 2015-04-16 | Merck Sharp & Dohme Corp. | Antidiabetic tricyclic compounds |
| EP3233799B1 (de) | 2014-12-19 | 2021-05-19 | The Broad Institute, Inc. | Dopamin-d2-rezeptor-liganden |
| EP3233077A4 (de) | 2014-12-19 | 2018-08-08 | The Broad Institute Inc. | Dopamin-d2-rezeptor-liganden |
| EP3551176A4 (de) | 2016-12-06 | 2020-06-24 | Merck Sharp & Dohme Corp. | Antidiabetische heterocyclische verbindungen |
| WO2018118670A1 (en) | 2016-12-20 | 2018-06-28 | Merck Sharp & Dohme Corp. | Antidiabetic spirochroman compounds |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0002649A2 (de) * | 1977-12-19 | 1979-06-27 | Sandoz Ag | 1-Dimethylalkyl-2-oder 4-substituierte Phenyl-imidazole, deren Herstellung und deren Anwendung gegen Fettleibigkeit |
| EP0503548A1 (de) * | 1991-03-12 | 1992-09-16 | Dr. Karl Thomae GmbH | Cyclische Harnstoffderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zu ihrer Herstellung |
| WO1998058934A1 (fr) * | 1997-06-20 | 1998-12-30 | Societe De Conseils De Recherches Et D'applications Scientifiques (S.C.R.A.S.) | Nouveaux derives du 2-(iminomethyl)amino-phenyle, leur preparation, leur application a titre de medicaments et les compositions pharmaceutiques les contenant |
| US6054590A (en) * | 1998-03-25 | 2000-04-25 | Bristol-Myers Squibb Company | Imidazolone anorectic agents: II. phenyl derivatives |
| WO2002010141A1 (en) * | 2000-07-31 | 2002-02-07 | Pfizer Products Inc. | Imidazole derivatives |
| WO2002051819A2 (en) * | 2000-12-26 | 2002-07-04 | Dr. Reddy's Laboratories Ltd. | Heterocyclic compounds having antibacterial activity, process for their preparation and pharmaceutical compositions containing them |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1996025410A1 (en) * | 1995-02-17 | 1996-08-22 | Takeda Chemical Industries, Ltd. | Azole compounds, their production and use |
| JP2002003370A (ja) * | 1999-09-20 | 2002-01-09 | Takeda Chem Ind Ltd | メラニン凝集ホルモン拮抗剤 |
| JP2004516239A (ja) * | 2000-07-06 | 2004-06-03 | ニューロジェン コーポレイション | メラニン凝集ホルモン受容体リガンド |
| AU2001278508A1 (en) * | 2000-07-31 | 2002-02-13 | Smithkline Beecham P.L.C. | Carboxamide compounds and their use as antagonists of a human 11cby receptor |
| GB0200283D0 (en) * | 2002-01-08 | 2002-02-20 | Smithkline Beecham Plc | Compounds |
-
2002
- 2002-07-25 DE DE10233817A patent/DE10233817A1/de not_active Withdrawn
-
2003
- 2003-07-15 AU AU2003257465A patent/AU2003257465A1/en not_active Abandoned
- 2003-07-15 WO PCT/EP2003/007639 patent/WO2004012648A2/de not_active Application Discontinuation
- 2003-07-18 EP EP03771060A patent/EP1551810B1/de not_active Expired - Lifetime
- 2003-07-18 WO PCT/EP2003/007891 patent/WO2004011438A1/de active Application Filing
- 2003-07-18 CA CA002493924A patent/CA2493924A1/en not_active Abandoned
- 2003-07-18 BR BR0312916-0A patent/BR0312916A/pt not_active IP Right Cessation
- 2003-07-18 AT AT03771060T patent/ATE535513T1/de active
- 2003-07-18 JP JP2004523753A patent/JP4568113B2/ja not_active Expired - Fee Related
- 2003-07-18 MX MXPA05001048A patent/MXPA05001048A/es active IP Right Grant
- 2003-07-18 AU AU2003251001A patent/AU2003251001B9/en not_active Ceased
- 2003-07-21 PE PE2003000725A patent/PE20040702A1/es not_active Application Discontinuation
- 2003-07-23 TW TW092120029A patent/TW200408627A/zh unknown
- 2003-07-23 MY MYPI20032759A patent/MY142551A/en unknown
- 2003-07-23 AR AR20030102644A patent/AR040514A1/es unknown
-
2005
- 2005-01-17 IL IL166471A patent/IL166471A/en not_active IP Right Cessation
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0002649A2 (de) * | 1977-12-19 | 1979-06-27 | Sandoz Ag | 1-Dimethylalkyl-2-oder 4-substituierte Phenyl-imidazole, deren Herstellung und deren Anwendung gegen Fettleibigkeit |
| EP0503548A1 (de) * | 1991-03-12 | 1992-09-16 | Dr. Karl Thomae GmbH | Cyclische Harnstoffderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zu ihrer Herstellung |
| WO1998058934A1 (fr) * | 1997-06-20 | 1998-12-30 | Societe De Conseils De Recherches Et D'applications Scientifiques (S.C.R.A.S.) | Nouveaux derives du 2-(iminomethyl)amino-phenyle, leur preparation, leur application a titre de medicaments et les compositions pharmaceutiques les contenant |
| US6054590A (en) * | 1998-03-25 | 2000-04-25 | Bristol-Myers Squibb Company | Imidazolone anorectic agents: II. phenyl derivatives |
| WO2002010141A1 (en) * | 2000-07-31 | 2002-02-07 | Pfizer Products Inc. | Imidazole derivatives |
| WO2002051819A2 (en) * | 2000-12-26 | 2002-07-04 | Dr. Reddy's Laboratories Ltd. | Heterocyclic compounds having antibacterial activity, process for their preparation and pharmaceutical compositions containing them |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006015279A1 (en) * | 2004-07-28 | 2006-02-09 | Neurogen Corporation | Heterocyclic diamine compounds as ligands of the melanin concentrating hormone receptor useful for the treatment of obesity, diabetes, eating and sexual disorders |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2006501202A (ja) | 2006-01-12 |
| EP1551810A1 (de) | 2005-07-13 |
| IL166471A (en) | 2009-09-01 |
| PE20040702A1 (es) | 2004-11-30 |
| MXPA05001048A (es) | 2005-04-08 |
| WO2004012648A2 (de) | 2004-02-12 |
| AU2003251001B2 (en) | 2010-01-21 |
| MY142551A (en) | 2010-12-15 |
| JP4568113B2 (ja) | 2010-10-27 |
| IL166471A0 (en) | 2006-01-15 |
| WO2004011438A1 (de) | 2004-02-05 |
| CA2493924A1 (en) | 2004-02-05 |
| ATE535513T1 (de) | 2011-12-15 |
| AU2003251001A1 (en) | 2004-02-16 |
| EP1551810B1 (de) | 2011-11-30 |
| TW200408627A (en) | 2004-06-01 |
| AU2003251001B9 (en) | 2010-03-04 |
| BR0312916A (pt) | 2005-06-14 |
| AR040514A1 (es) | 2005-04-06 |
| AU2003257465A1 (en) | 2004-02-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE10233817A1 (de) | Substituierte Diarylheterocyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel | |
| DE10139416A1 (de) | Aminoalkyl substituierte aromatische Bicyclen, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel | |
| DE602004007693T2 (de) | (3-oxo-3,4-dihydro-chinoxalin-2-yl-amino)-benzamid-derivate und verwandte verbindungen als glykogen-phosphorylase-hemmer zur behandlung von diabetes und adipositas | |
| DE69432984T2 (de) | Therapeutische substituierte guanidine | |
| DE60315354T2 (de) | Pyridazinon-derivate als gsk-3beta-hemmer | |
| EP1711473B1 (de) | Substituierte n-cyclohexylimidazolinone mit mch-modulatorischer wirkung | |
| DE69418601T2 (de) | Guanidinderivate mit therapeutischer wirkung | |
| DE60103927T2 (de) | Piperazinderivate, deren Herstellung und deren Verwendung in der Behandlung von Störungen des Zentralnervensystems | |
| DE3814549A1 (de) | N-substituierte derivate von 1-desoxynojirimycin und 1-desoxymannonojirimycin, verfahren zu deren herstellung und deren verwendung in arzneimitteln | |
| DE2836073A1 (de) | Neue nitroimidazole und verfahren zu deren herstellung | |
| EP0459256B1 (de) | Oxazolidinone mit ZNS-dämpfender Wirkung | |
| DE60114852T2 (de) | Chinazolin-derivate als alpha-1 adrenerge antagonisten | |
| DE69317399T2 (de) | Aminocycloalkanobenzodioxole als beta-3 selektive adrenergische Wirkstoffe | |
| DE69829215T2 (de) | Substituierte beta-alaninen | |
| WO2004039784A1 (de) | Neue phenylethanolaminderivate und deren verwendung als beta-3-agonisten | |
| DE3010752A1 (de) | Substituierte aethanolamine | |
| EP0271013B1 (de) | Basisch substituierte Phenylacetonitrile, ihre Herstellung und diese enthaltende Arzneimittel | |
| US20040132752A1 (en) | Substituted diaryl heterocycles, process for their preparation and their use as medicaments | |
| DE69911373T2 (de) | Azetidincarboxamidderivate zur behandlung von zns-erkrankungen | |
| DE10142663B4 (de) | C2-Disubstituierte Indan-1-ol-Systeme | |
| DE112013007543B4 (de) | Neu substituierte 2-Aminoquinazolin-4(3H)-one Derivate als Malaria Aspartat protease Inhibitoren | |
| DD271519A5 (de) | Verfahren zur herstellung von neuen 1-aryloxy-dihydrobenzothiadiazinylalkylamino-alkanen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| OP8 | Request for examination as to paragraph 44 patent law | ||
| 8127 | New person/name/address of the applicant |
Owner name: SANOFI-AVENTIS DEUTSCHLAND GMBH, 65929 FRANKFURT, |
|
| 8130 | Withdrawal |