CN1753903B - 影响转录和对炎性和传染性疾病的敏感性的白细胞介素-1基因座的功能多态性 - Google Patents
影响转录和对炎性和传染性疾病的敏感性的白细胞介素-1基因座的功能多态性 Download PDFInfo
- Publication number
- CN1753903B CN1753903B CN02827282.XA CN02827282A CN1753903B CN 1753903 B CN1753903 B CN 1753903B CN 02827282 A CN02827282 A CN 02827282A CN 1753903 B CN1753903 B CN 1753903B
- Authority
- CN
- China
- Prior art keywords
- allelotrope
- disease
- gene
- dna
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6827—Hybridisation assays for detection of mutation or polymorphism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2525/00—Reactions involving modified oligonucleotides, nucleic acids, or nucleotides
- C12Q2525/10—Modifications characterised by
- C12Q2525/204—Modifications characterised by specific length of the oligonucleotides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/14—Heterocyclic carbon compound [i.e., O, S, N, Se, Te, as only ring hetero atom]
- Y10T436/142222—Hetero-O [e.g., ascorbic acid, etc.]
- Y10T436/143333—Saccharide [e.g., DNA, etc.]
Abstract
本发明提供用于检测与白细胞介素-1β(IL-B)基因(IL-1B(-3737))上游区域有关的多态性的方法和试剂,所述多态性影响该基因的转录和对炎性和传染性疾病如牙周病和阿尔茨海默氏病的敏感性。
Description
1.发明背景
IL-1基因簇位于染色体2(2q13)的长臂上并且在430Kb的区域内包含至少关于IL-1α(IL-1A),IL-1β(IL-1B),和IL-1受体拮抗物(IL-1RN)的基因(Nicklin,等(1994)Genomics,19:382-4)。拮抗物分子,IL-1α和IL-1β具有有效的促炎活性并且在许多炎症级联的最前面。它们的作用经常通过诱导其它细胞因子如IL-6和IL-8,导致白细胞的激活和募集至受损组织中,局部产生血管活性剂,脑部发热反应和肝脏急性期反应。所有3种IL-1分子与I型和II型IL-1受体结合,但仅I型受体将信号转导至细胞内部。与此对比,II型受体从细胞膜脱落并担当引诱受体。受体拮抗物和II型受体因此在它们的作用方面都是抗炎的。
IL-1的不适当的生产在许多自身免疫和炎性疾病的病理学中起主要作用,所述疾病包括类风湿性关节炎,炎性肠道疾病,牛皮癣等。另外,在IL-1的生产速率方面存在稳定的个体间差异,并且该差异中的一些可以通过IL-1基因座位的遗传差异来解释。因此,对于确定对炎性疾病的遗传敏感性部分,IL-1基因是合理的候选物,大部分炎性疾病具有与多基因元件的多因子病原学。
已知某些来自IL-1基因簇的等位基因与特定的病状有关。例如,IL-1RN(VNTR)等位基因2已经显示与下列各项有关:骨质疏松症(美国专利5,698,399),糖尿病中的肾病(Blakemore,等(1996)Hum.Genet.97(3):369-74),斑秃(Cork,等,(1995)J.Invest.Dermatol.104(5 Supp.):15S-16S;Cork等(1996)Dermatol Clin 14:671-8),格雷夫斯病(Blakemore,等(1995)J.Clin.Endocrinol.80(1):111-5),系统性红斑狼疮(Blakemore,等(1994)Arthritis Rheum.37:1380-85),苔藓硬化症(Clay,等(1994)Hum.Genet 94:407-10),和溃疡性结肠炎(Mansfield,等(1994)Gastoenterol.106(3):637-42)。
另外,已经发现来自标记-889的IL-1A等位基因2和来自标记+3954的IL-1B(TaqI)等位基因2与牙周病有关(美国专利5,686,246;Kornman和diGiovine(1998)Ann Periodont 3:327-38;Hart和Kornman(1997)Periodontol 2000 14:202-15;Newman(1997)Compend Contin Educ Dent 18:881-4;Kornman等(1997)J.Clin Periodontol 24:72-77)。也已经发现来自标记-889的IL-1A等位基因2与幼年性慢性关节炎,特别是慢性虹膜睫状体炎有关(McDowell,等(1995)Arthritis Rheum.38:221-28)。也已经发现来自IL-1B的标记+3954的IL-1B(TaqI)等位基因2与DR3/4受试者中的牛皮癣和胰岛素依赖性糖尿病有关(di Giovine,等(1995)Cytokine 7:606;Pociot,等(1992)Eur J.Clin.Invest.22:396-402)。另外,已经发现IL-1RN(VNTR)等位基因1与糖尿病视网膜病有关(参见USSN 09/037472,和PCT/GB97/02790)。另外,已经发现IL-1RN(VNTR)的等位基因2与来自北美和欧洲的高加索人群中的溃疡性结肠炎有关(Mansfield,J.等,(1994)Gastroenterology 106:637-42)。有趣地,该关联在种族相关的德系犹太人群中特别强烈(PCT WO97/25445).另外,在美国专利5,685,246,5,698,399,6,140,047,6,251,598,和6,268,142中已经描述用于检测和关联IL-1多态性和炎性疾病的广泛方法和组合物,这些专利的内容结合于此作为参考.另外,在美国专利6,437,216中描述用于基于IL-1基因座的炎性疾病的转基因模型,其内容结合于此作为参考.
用于筛选遗传病的常规方法已经依赖于异常基因产物(例如镰形细胞贫血)或异常表型(例如精神发育迟缓)的鉴定。这些方法对于具有后发性和难以鉴定的表型的遗传病,如例如血管病的应用有限。随着简单和便宜的遗传筛选方法的发展,即使当疾病是多基因来源时,目前也可以鉴定显示发展疾病倾向的多态性。随着对多因子疾病的遗传基础的了解增加,通过分子生物学方法可以筛选的疾病数量持续增长。
遗传筛选(也称为基因分型或分子筛选),可以广泛地定义为检验以确定受试者是否有导致病状的突变(等位基因或多态性)或与导致病状的突变“连锁”的突变。连锁是指其中在基因组中紧靠的DNA序列倾向于一起遗传的现象。因为一些共遗传的选择优势两个序列可以连锁。然而,更典型地,因为在两个多态性之间的区域中发生减数分裂重组事件的相对稀少,两个多态序列共遗传。因为在给定人群中,它们倾向于在群体的任何特定成员中一起出现或根本不出现,共遗传的多态等位基因据说是彼此连锁不平衡。实际上,发现在给定染色体区域中的多个多态性彼此是连锁不平衡的,它们确定准稳态的遗传“单倍型”。与此对比,在两个多态基因座之间发生的重组事件使它们分离到不同的同源染色体上。如果两个物理连锁的多态性之间的减数分裂重组足够频繁地发生,两个多态性将似乎独立地分离并且据说是连锁布平衡。
炎症疾病和IL-1多态性之间的统计相关性未必说明多态性直接导致该疾病。相反地相关多态性可能是与导致疾病的突变连锁(即连锁不平衡)的良性等位基因变体,其已经发生在近来人的进化史中,以致还未经过足够的时间以通过插入染色体区段的重组事件达到平衡。因此,为了对于特定疾病的诊断和预测试验的目的,可以利用与该疾病有关的多态等位基因的检测而不考虑该多态性是否直接涉及疾病的病原学。另外,当给定良性多态基因座与导致显现导致疾病的多态基因座连锁不平衡时,还有其它与良性多态基因座连锁不平衡的多态基因座也可能与导致疾病的多态基因座连锁不平衡。因此这些其它的多态基因座也将预测或诊断具有导致遗传病的多态基因座的可能性。实际上,一旦在特定疾病或症状和对应的人单倍型之间已经得出关联,广泛跨度的人单倍型(描述一组连锁多态标记的等位基因共遗传的典型模式)可以用于诊断目的。因此,通过表征一个或多个疾病相关的多态等位基因(或甚至一个或多个疾病相关单倍型)可以进行个体发展特定疾病或症状的可能性的测定,而无需测定或表征致病的遗传变异。
然而,尽管在已经与发展特定炎性疾病或症状的倾向统计学相关的IL-1单倍型中检测一个或多个连锁的等位基因提供有效的预防和治疗炎性疾病的诊断方法,最终最可靠的多态指示物将是那些与构成疾病病原学要素基础最强烈相关的等位基因(即致病突变或“功能等位基因”)。
例如,全世界的许多研究已经显示组织中的3种化学物质始终与多种严重疾病或活跃进行性疾病有关。那些化学物质是白细胞介素-1(IL-1),前列腺素-E2(PGE2)和破坏胶原的酶和骨基质金属蛋白酶(MMP)(参见Offenbacher,S.(1996),Ann.Periodontol.1:821;Page,R.C.和Kornman,K.S.(1997),Periodontology 2000 14:112)。这些化学物质是炎症应答的重要介质,并且似乎在骨损失中起主要作用。IL-1是PGE2和基质金属蛋白酶的主要调节物.近来研究(参见Assuma,R.等(1998),J.Immunol.160:403)显示在齿龈组织中特异的阻断IL-1和TNFα而无任何菌斑控制措施,在猴的牙周病模型中阻止显著部分的骨损失.在组织和齿龈缝液(GCF)中的IL-1水平或细胞IL-1生产和与骨损失和更高级或渐进的牙周炎的关联有许多报告(参见例如Gemmell,E.和Seymour,G.J.(1998),J.Dent.Res.77:16;Ishihara,Y.等(1997),J.Periodontal Res.32:524;McGee,J.M.等(1998),J.Periodontol.69:865;Okada,H.和Murakami,S.(1998),Crit.Rev.Oral Biol.Med.9:248;Roberts,F.A.等(1997),Oral Microbiol.Immunol.12:336;Salvi,G.E.等(1998),J.Periodontal Res.33:212;Stashenko,P.等(1991),J.Clin.Periodontol.18:548;Yavuzyilmaz,E.等(1995),Aust.Dent.J.40(1):46)。例如,近来研究(参见Cavanaugh,P.F.等(1998),J.Periodont.Res.33:75),观察与齿龈缝液IL-1水平相比的骨损失的严重性,显示缝液中IL-1的较高水平与相对更多的骨损失相关联。
近来,在小鼠模型中显示IL-1在骨破坏中的关键作用,(Lorenzo,J.A.等(1998),Endocrinology 139(6):3022)。当将具有完好IL-1系统的小鼠切除卵巢以在绝经期间刺激雌激素耗尽,动物损失大量的骨密度。当建立在IL-1系统中阻断的小鼠时,雌激素耗尽导致无骨损失。这提示至少在小鼠中,IL-1对于雌激素耗尽后的骨损失是关键性的。在其它研究中发现IL-1是牙周炎的基本部分(参见Assuma,R.等(1998),J.Immunol.160:403)。研究者在猴子中产生牙周炎。用特异性阻断IL-1和类似化合物TNFα的化学物质处理一组猴子。不管具有严重的细菌攻击,具有阻断的IL-1和TNFα的动物发展少得多的骨损失。
多年来已经已知一些人比其它人生产更高水平的IL-1。某天的高生产者如果在稍后日期再次检查也将是高生产者,并且IL-1的高生产倾向于在家庭中进行。不知道存在当个体暴露于细菌攻击时导致IL-1高生产的特异的IL-1基因变异。约30%高加索人具有这些遗传因子。
在一些研究中,外周白细胞(参见Mark,L.L.等(2000),J.Periodontal Res.35(3):172;diGiovine,F.S.等(1995),Cytokine 7:606;Pociot,F.等(1992),Eur.J.Clin.Invest.22:396;Galbraith,G.M.等(1997),J.Periodontol.68:832),在实验室中与来自革兰氏阴性菌的细菌产物温育,如果白细胞来自具有IL-1基因特异变异的人(“正基因型”),产生显著更多的IL-1。然而,也许最重要地,在正基因型的牙周组织中IL-1水平更高。在近来研究中,在正基因型受试者的齿龈缝液中IL-1α和IL-1β水平显著高于负基因型受试者的那些(参见Engebretson,S.P.等(1999),J.Periodontol.70(6):567;Shirodaria,S.等(2000),J.Dent.Res.79(11):1864)。实际上,在这些研究中的一个(Engebretson,S.P.等(1999),J.Periodontol.70(6):567)中,在具有最小空穴深度(<4mm)的位点发现正基因型和负基因型之间的最大差异。
另外,在探测时流血可以被认为是炎症应答的临床指示物。Lang和同事(参见Lang,N.P.等(2000),J.Periodontal.Res.35(2):102)在临床回想程序(clinical recall program)中评估多于320位随机选择的受试者。在139位非吸烟者中,正基因型受试者比负基因型受试者在四次维护访问期间显著更可能具有出血位点的增加。
总之,具有IL-1正基因型的受试者倾向于具有:a)通过它们白细胞产生的增加的IL-1水平,2)齿龈缝液中增加的IL-1,和3)在探测时增加出血。
将诊断工具用于鉴定已经存在的疾病的某些方面.诊断试验的实例不仅包括放射显影而且包括主动的骨损失的生物化学标记.对于特定诊断的价值评估是基于当它实际存在时如何好的诊断检测病变和当实际上不存在疾病时试验如何好的避免“阳性”来评估.
医学和牙科学中的预后是意欲预测将来疾病各方面的风险。因为关于将来没有事实,预后涉及将来事件发生的概率。所有受试者熟悉预报的概念。60%概率雨的天气预报不保证将下雨,但考虑该预报,大多数人当天将选择不同的衣服。类似地,高胆固醇不保证一个人将在未来心脏病发作,但它将在特定年龄之前患急性冠心病的概率增加多于一倍。
IL-1正基因型的人更可能患有普遍的严重牙周炎(参见例如Gore,E.A.等(1998),J.Clin.Periodontol.25:781,Kornman,K.S.和diGiovine,F.S.(1998),Ann.Periodontol.3:327;Kornman,K.S.等(1997),J.Clin.Periodontol.24:72;McDevitt,M.J.等(2000),J.Periodontal 71:156)。在近来研究中,(McDevitt,M.J.等(2000),J.Periodontal 71:156,90),检查无吸烟史或最少吸烟史的受试者的牙周病和IL-1基因型。多变量回归模型证明受试者年龄,以前的吸烟史和IL-1表型与成人中牙周骨损失的严重性显著相关联。对于非吸烟者或以前轻吸烟者(<5pk-yr),与IL-1负基因型的受试者相比,IL-1正基因型患有中度至严重牙周病的可能性大三倍。
在对牙周维护受试者群体的研究(参见McGuire和Nunn,McGuire,M.K.等(1999),J.Periodontol.70(1):49)中,检查在牙周治疗后已经被跟踪5-14年的受试者。他们试图确定什么因素,如果有的话,预测在牙周维护期间受试者的牙齿损失。他们发现仅两种预测物(predictor):IL-1基因型和重度吸烟与后来的牙齿损失显著相关。与负基因型相比,IL-1正基因型具有牙齿损失的可能性大2.7倍,重度吸烟者比正基因型具有牙齿损失的可能性大2.9倍。既是正基因型而且是重度吸烟者的受试者比负基因型的非吸烟者具有牙齿损失的可能性大7.7倍。仅在非吸烟者的IL-1负基因型受试者中发现传统用于指示预后的临床参数是有价值的。
在另一研究中,评估治疗结果的预测物。另外,另一研究(参见DeSanctis,M.和Zuchelli,G.(2000),J.Periodontol.71:606)显示在引导组织再生(GTR)外科手术以再生破坏的牙周附着后牙周组织的长期稳定性在正基因型的受试者中显著降低(参见DeSanctis,M.和Zuchelli,G.(2000),J.Periodontol.71:606)。
重要的是强调慢性疾病,如牙周炎,涉及随时间的复杂生物相互租用。IL-1基因表达和几个单核苷酸多态性之间的关系是该复杂生物学特别关键的方面。因此,导致IL-1B或IL-1A(或其它IL-1基因座基因)增加生产的功能多态性在预测和诊断牙周病以及其它已经与IL-1β或IL-1α增加的生产有关的炎性疾病和症状中有效。例如,IL-1B的增加的生产已经显示在类风湿性关节炎,阿尔茨海默氏病,炎性肠道疾病,和移植物对抗宿主(graft-versus-host)疾病的病因学中起重要作用(参见例如Dinarello(2000)Chest 118:503-08综述)。另外,与IL-1基因座基因降低表达有关的功能多态性也可在炎性疾病中发挥作用。例如,导致IL-1 RN(IL-1基因座受体拮抗物)表达降低的功能多态性也可导致提高的白细胞介素水平和导致炎性疾病。因此,鉴定影响一个或多个IL-1基因转录或表达的IL-1基因座中的功能多态性将是有用的。
2.发明概述
一方面,本发明提供新方法和试剂盒,其用于确定受试者是否已经或易于发展与白细胞介素特别是IL-1β增加的生产有关的疾病或症状.在一个实施方案中,该方法包含确定受试者的核酸是否包含IL-1B(-3737)多态等位基因.在优选实施方案中,检测的IL-1B(-3737)等位基因是与增加的IL-1B表达和与炎性疾病有关的1型等位基因,然而由于它证实在测试受试者的一个或两个染色体上1型等位基因的不存在,2型等位基因的检测特别有用.
在特别优选的实施方案中,本发明提供分离的核酸,其包括来自人IL-1B(-3737)多态基因座的基因组序列的约20个连续核苷酸。优选的核酸包括对应于-3737IL-1B等位基因1序列的那些:TCTAGACCAGGGAGGAGAATGGAATGTCCCTTGGACTCTGCA-TGT;以及对应于-3737IL-1B等位基因2序列的那些:TCTAGACCAGGGAGGAGAATGGAATGTTCCTTGGACTCTGCATGT。
在另一个实施方案中,本发明提供分离的核酸,其包括来自人IL-1B(-1469)多态基因座的基因组序列的约20个连续核苷酸。优选的核酸包括对应于-1469IL-1B等位基因1序列的那些:ACAGAGGCTCACTCCCTTGCATAATGCAGAGCGAGCACGATACC-TGG;以及对应于-1469IL-1B等位基因2序列的那些:ACAGAGGCTCACTCCCTTGTATAATGCAGAGCGAGCACGATACCTGG。
在还有另一个实施方案中,本发明提供分离的核酸,其包括来自人IL-1B(-999)多态基因座的基因组序列的约20个连续核苷酸。优选的核酸包括对应于-999IL-1B等位基因1序列的那些:GATCGTGCCACTgcACTCCAGCCTGGGCGACAGGGTGAGACTCTGTCTC;以及对应于-999IL-1B等位基因2序列的那些:GATCGTGCCACTgcACTCCAGCCTGGGCGACAGGGTGAGACTCTGTCTC。以及对应于-999IL-1B等位基因2序列的那些:GATCGTGCCACTgcACTCCAGCCTGGGCGACAGCGTGAGACTCTGTCTC。
在其它实施方案中,本发明的核酸包括与上述那些中任何一个互补的序列,以及等位基因特异的寡核苷酸如具有对应于在-3737,-1469或-999IL-1B多态基因座处的等位基因变体的3’末端的那些。特别优选的核酸是包含上述序列之一以及可检测的标记的探针。
在另一个特别优选的实施方案中,本发明提供预测或诊断人受试者中发展炎性疾病或症状的增加的可能性的方法。在本发明的该方面,炎性疾病是一种与白细胞介素,特别是IL-1B增加的表达有关的炎性疾病,并且该方法要求从人受试者中获得核酸样品并分析以确定-3737IL-1B等位基因作为1型或2型启动子序列的同一性。1型IL-1B启动子序列的存在是增加的发展炎性疾病可能性的诊断。本发明的该方面对于诊断与增加的白细胞介素生产,特别是IL-1B生产有关的炎性疾病或症状特别有用,所述疾病或症状如牙周病和阿尔茨海默氏病。
还可以通过本发明方法诊断或预测的其它炎性疾病和病状包括短语“与IL-1多态性有关的疾病和症状”是指多种疾病或症状,基于在IL-1复合体中一个或多个等位基因的鉴定在受试者中可以显示对这些疾病或症状的敏感性。实例包括:炎性或退行性疾病,包括:系统性炎症反应(SIRS);阿尔茨海默氏病(和相关的病症和症状包括:慢性神经炎症,神经胶质激活;增加的小神经胶质细胞;神经炎斑块形成;和对治疗的应答);肌萎缩性侧索硬化症(Amylotropic Lateral Sclerosis)(ALS),关节炎(和相关的病症和症状,包括:急性关节炎,抗原诱导的关节炎,与慢性淋巴细胞性甲状腺炎有关的关节炎,胶原诱导的关节炎,幼年性慢性关节炎;幼年性类风湿关节炎,骨关节炎,预后(prognosis)和链球菌诱导的关节炎),哮喘(和相关病症和症状,包括:支气管哮喘;慢性阻塞性气道疾病,慢性阻塞性肺疾病,幼年性哮喘和职业性哮喘);心血管疾病(和相关病症和症状,包括动脉粥样硬化;自身免疫性心肌炎,慢性心脏缺氧,充血性心力衰竭,冠状动脉病,心肌病和心细胞功能障碍,包括:主动脉平滑肌细胞激活;心细胞编程性细胞死亡;和心细胞功能的免疫调节;糖尿病和相关病症和症状,包括自身免疫性糖尿病,胰岛素依赖性(1型)糖尿病,糖尿病,糖尿病视网膜病,和糖尿病肾病);肠胃炎症(和相关病症和症状,包括乳糜泻(celiac disease),相关的骨质稀少,慢性结肠炎,局限性回肠炎,炎性肠病和溃疡性结肠炎);胃溃疡;肝炎症,胆固醇胆石和肝纤维化,HIV感染(和相关病症和症状,包括退行性应答,神经变性应答,和HIV有关的霍奇森病),川崎综合征(和相关病症和症状,包括粘膜皮肤淋巴结综合征,子宫颈淋巴结病,冠状动脉损伤,浮肿,发热,增加的白细胞,轻度贫血,脱皮,皮疹,结膜发红,血小板增多;多发性硬化,肾病(和相关疾病和病症,包括糖尿病肾病,晚期肾病,肾小球性肾炎,古德帕斯彻综合症,血液透析存活和肾局部缺血再灌注损伤),神经变性病(和相关疾病和症状,包括急性神经变性,衰老和神经变性病中IL-1的诱导,IL-1诱导的下丘脑神经元的可塑性和慢性应激过度反应性),眼病(Qphthalmopathies)(和相关疾病和病症,包括糖尿病视网膜病,格雷夫斯眼病,和葡萄膜炎,骨质疏松症(和相关疾病和病症,包括牙糟,股骨,桡骨,椎骨或腕骨损失或骨折发生,经绝后的骨损失,物质(mass),骨折发生或骨损失速率),中耳炎(成人或儿科),胰腺炎或胰腺泡炎,牙周病(和相关疾病和病症,包括成人,早发性和糖尿病性);肺病,包括慢性肺病,慢性窦炎,透明膜病,缺氧和SIDS中的肺病;再狭窄;风湿病,包括类风湿性关节炎,风湿病阿孝夫小体,风湿病和风湿性心肌炎;甲状腺炎,包括慢性淋巴细胞性甲状腺炎;尿道感染,包括慢性前列腺炎,慢性骨盆疼痛综合症和尿石病。免疫疾病,包括自身免疫病,如斑秃,自身免疫性心肌炎,格雷夫斯病,格雷夫斯眼病,苔藓硬化症,多发性硬化,牛皮癣,系统性红斑狼疮,系统性硬化,甲状腺病(例如甲状腺肿和基质淋巴瘤性(桥本甲状腺炎,淋巴结样甲状腺肿),睡眠障碍和慢性疲劳综合症和肥胖症(非糖尿病性或与糖尿病有关)。对传染病的抗性,所述传染病如利什曼病,麻风病,莱姆病,莱姆心炎,疟疾,脑型疟,脑膜炎,与疟疾有关的管状肠肾炎),其是由细菌,病毒(例如巨细胞病毒,脑炎,EB病毒,人免疫缺陷病毒,流感病毒)或原生动物(例如恶性疟原虫,锥虫)导致的。对包括脑外伤的外伤的应答,(包括中风和局部缺血,脑炎,脑病,癫痫,围生期脑损伤,持续热性癫痫发作,SIDS和蛛网膜下出血),低出生体重(例如大脑性麻痹),肺损伤(急性出血性肺损伤,古德帕斯彻综合症,急性局部缺血再灌注),心肌功能障碍,其是由职业和环境污染物导致(例如对毒油综合症硅病的敏感性),辐射创伤,和伤口愈合反应的效率(例如烧伤或烫伤,慢性伤口,外科手术伤口和脊髓损伤)。对瘤形成的敏感性,包括乳腺癌相关的溶骨转移瘤,恶病质,结直肠癌,过度增殖性疾病,霍奇森病,白血病,淋巴瘤,代谢病和肿瘤,转移瘤,骨髓瘤(myeolomas),和各种癌症(包括乳房,前列腺,卵巢,结肠,肺等),厌食症和恶病质。激素调节,包括生育力/生殖力,妊娠的可能性,早产发生率,产前和新生期并发症,包括早产低出生体重,大脑性麻痹,败血病,低甲状腺素症(hypothyroxinernia),氧依赖,颅畸形,绝经提前。受试者对移植物的反应(排斥或接受),急性期反应(例如发热反应),普通炎症发应,急性呼吸窘迫反应,急性系统性炎症反应,伤口愈合,粘连,免疫炎症反应,神经内分泌反应,发热发展和抵抗,急性期反应,应激反应,疾病敏感性,重复运动应激,网球肘,和疼痛管理和反应。
本发明的另一方面提供确定人受试者是否可以用治疗药物有效治疗的方法,该方法通过检测人受试者的核酸样品和测定-3737IL-1B等位基因作为1型或2型启动子序列的同一性。在本发明这方面的优选实施方案中,1型IL-1B启动子序列的存在显示人受试者可以用治疗药物有效治疗。
在另一实施方案中,IL-1B(-3737)2型等位基因是IL-1炎性单倍型的元件,它的存在说明增加的II-1β表达(例如IL-1(3344146))。在本发明这方面的优选实施方案中,本发明提供通过检测与-3737 IL-1B 1型等位基因有关的IL-1单倍型的存在,诊断或预测发展与增加的白细胞介素生产有关的炎性疾病或症状增加的可能性的方法,其中与-3737 IL-1B 1型等位基因有关的IL-1单倍型的存在是增加的发展炎性疾病或症状的可能性的诊断。
通过多种可提供的技术中的任何一种可以检测包含IL-1炎性单倍型的等位基因,所述技术包括:1)在核酸样品和能够与等位基因杂交的探针之间进行杂交反应;2)将等位基因的至少一部分测序;或3)测定等位基因或其片段(例如通过核酸内切酶消化产生的片段)的电泳迁移率。在进行检测步骤之前可以将等位基因任选地进行扩增步骤。优选的扩增方法选自:聚合酶链式反应(PCR),连接酶链式反应(LCR),链置换扩增(SDA),克隆,和上述的变型(例如RT-PCR和等位基因特异性扩增)组成的组。扩增所需的寡核苷酸可以选自例如IL-1基因座位内部,其与所关心的标记侧邻(如PCR扩增所需)或直接重叠标记(如在ASO杂交中)。在特别优选的实施方案中,样品与一组引物杂交,并进行PCR扩增,所述引物在有义序列或反义序列的5’和3’与血管病相关的等位基因杂交。
还可以间接检测包含IL-1炎性单倍型的等位基因,例如通过分析由DNA编码的蛋白质产物。例如,当所考虑的标记导致突变蛋白质的翻译时,通过多种蛋白质检测方法中的任何一种可以检测蛋白质。这些方法包括免疫检测和生化试验,如大小分级,其中蛋白质通过截短,延长,改变的折叠或改变的翻译后修饰具有表观分子量的变化。
在另一方面,本发明特征为用于进行上述测定的试剂盒。该试剂盒可以包括核酸样品收集装置和测定受试者是否携带至少一个包含IL-1炎性单倍型的等位基因的装置。试剂盒还可以包含阳性或阴性对照样品或标样和/或用于评估结果的算法装置和另外的试剂和组分,包括:DNA扩增试剂,DNA聚合酶,核酸扩增试剂,限制酶,缓冲液,核酸取样装置,DNA纯化装置,脱氧核苷酸,寡核苷酸(例如探针和引物)等。
如上所述,对照可以是阳性或阴性对照。另外,对照样品可以包含所用等位基因检测技术的阳性(或阴性)产物。例如,当等位基因检测技术是PCR扩增时,在大小分级后,对照样品可以包含适当大小的DNA片段。同样,当等位基因检测技术涉及检测突变蛋白质时,对照样品可以包含突变的蛋白质样品。然而,优选对照样品包含待检测的物质。例如,对照可以是基因组DNA样品或克隆的部分IL-1基因簇。然而优选对照样品是高度纯化的基因组DNA样品,其中待检测的样品是基因组DNA。
存在所述试剂盒中的寡核苷酸可以用于扩增所关心的区域或用于将等位基因特异性的寡核苷酸(ASO)与所考虑的标记杂交。因此,寡核苷酸可以侧邻所关心的标记(如PCR扩增所要求)或直接重叠标记(如在ASO扩增中)。
使用测定和在此描述的试剂盒(单独或结合关于另一有助于与IL-1炎性单倍型有关的疾病或症状的遗传缺陷或环境因子的信息)获得的信息对于确定无症状的受试者是否患有或可能发展特定疾病或病症是有用的.另外,该信息可以允许更定制化(customized)的方法来预防疾病或症状的发作或进展.例如,该信息可以使临诊医师更有效地规定将涉及疾病或病症的分子基础的疗法.
在还有的另一方面,本发明特征为通过向受试者施用适当本发明的治疗剂,治疗或预防受试者中与IL-1炎性单倍型有关的疾病或病症发展的方法。在还有另一方面,本发明提供体外或体内测定,其用于筛选测试化合物以鉴定治疗或预防与IL-1炎性单倍型有关的疾病或病症的发展的治疗剂。在一个实施方案中,测定包含将转染与适当启动子可操作连接的致病突变的细胞与测试化合物接触,并且测定在测试化合物存在和不存在下细胞中蛋白质的表达水平。在优选实施方案中,致病突变导致IL-1受体拮抗物产生的降低,在测试化合物的存在下IL-1受体拮抗物增加的产生说明化合物是IL-1受体拮抗物活性的激动剂。在另一优选实施方案中,致病诱变导致IL-1α或IL-1β增加的产生,在测试化合物的存在下IL-1α或IL-1β的产生降低说明化合物是IL-1α或IL-1β活性的拮抗物。在另一实施方案中,本发明特征为转基因的非人类动物和它们在鉴定IL-1α或IL-1β活性的拮抗物或IL-1Ra活性的激动剂中的应用。
在另一实施方案中,本发明提供预测在人受试者中发展与改变的IL-1B表达有关的炎性疾病或病症的可能性的方法,其通过在来自人受试者的核酸样品中检测IL-1B的任何一种下列多态性:IL-1B4等位基因1(TGCATAGGGTC),IL-1B3等位基因1(TGCATAGGGTC),IL-1B7等位基因-1(TGCATAGGGTC),IL-1B15等位基因1(TGCATAGGGTC),IL-1B4等位基因2(TGTATAGGGTC),IL-1B3等位基因2(TACATAGGGTC),IL-1B7等位基因-2(TGCATGGGGTC),和IL-1B15等位基因2(TGCATAGGGTT)。用于检测IL-1炎性基因型的核酸如分离的核苷酸也包括在本发明中,所述分离的核苷酸包含IL-1B SNP如IL-1B4等位基因1(TGCATAGGGTC),IL-1B3等位基因1(TGCATAGGGTC),IL-1B7等位基因-1(TGCATAGGGTC),IL-1B15等位基因1(TGCATAGGGTC),IL-1B4等位基因2(TGTATAGGGTC),IL-1B3等位基因2(TACATAGGGTC),IL-1B7等位基因-2(TGCATGGGGTC),或IL-1B15等位基因2(TGCATAGGGTT)。
在特别优选的方面,本发明提供用于检测与改变的IL-1基因表达有关的功能多态性的方法,其通过鉴定IL-1 SNP,并在功能上评估SNP对IL-1基因表达或IL-1基因转录因子结合的影响。通过该方法,当SNP与改变的IL-1基因表达或改变的IL-1基因转录因子结合有关时,那么SNP是与改变的IL-1基因表达有关的功能多态性,并因此与改变的发展炎性疾病或症状的可能性有关。
本发明的其它实施方案和优势在下列详细的说明书和权利要求中阐明。
3.附图简述
图1显示IL-1B基因的序列,其包括上游启动子区域,-3737等位基因1是黑体,对应的检测寡核苷酸加下划线(参见GenBank登记号X04500和AC04500);-1469和-999多态性检测寡核苷酸和各自的多态位点也加下划线和加黑。
图2显示与IL-1B基因型有关的IL-1B转录速率的变化。
图3显示IL-1B近端启动子和远端增强子基因组区域的图示。
图4显示-31和-511多态性状态对IL1B启动子的转录活性无影响。
图5显示克隆IL-1B上游启动子区域的策略。
图6显示-511 1型和2型启动子之间的转录差异。
图7显示剂量/应答关系-1型比2型克隆。
图8显示1型和2型IL-1B克隆的剂量和时间反应性。
图9显示NF-kB p50同型二聚体与DNA底物的结合。
图10显示-3737(按SNP发现结果的注解也称为IL-1B4)SNP至RAW细胞(鼠巨噬细胞)中的转染分析。
图11显示在功能多态性转染分析中检测的IL-1B构建体序列。
图12显示来自THP-1细胞中另外的功能SNP的功能分析的结果。
4.发明详述
4.1概述
本发明涉及IL-1B基因中多态性的发现,其与改变的IL-1β生产速率有关。该多态性基因型的确定提供对其中IL-1生产有助于发病机理的疾病敏感性的有用的遗传检验,所述疾病例如牙周病和其它炎性疾病,特别是那些如阿尔茨海默氏病(参见McGeer和McGeer(2001)Arch Neurol 58:1790-2;和De Luigi等(2001)Mech Ageing Dev 122:1985-95)。
4.2定义
为了方便起见,下面提供在本说明书,实施例,和后附权利要求中使用的某些术语和短语的含义。
术语“等位基因”是指在不同多态区域发现的不同序列变体。例如IL-1RN(VNTR)具有至少5个不同的等位基因。序列变体可以是单个或多个碱基变化,无限制地包括插入,缺失,或替代,或可以是可变数量的序列重复。
术语“等位基因型”是指一个等位基因或多个等位基因在一个或多个多态区域的同一性。例如,等位基因型可以由在一个多态位点的单个等位基因组成,关于IL-1RN(VNTR)等位基因1,其是在IL-1RN基因座位的VNTR处具有至少一个拷贝的IL-1RN等位基因1的等位基因型。备选地,等位基因型可以由单个多态位点的纯合或杂合状态组成。例如,IL1-RN(VNTR)等位基因2,2是等位基因型,其中存在两拷贝的对应于纯合IL-RN(VNTR)等位基因2状态的IL-1RN的VNTR标记的第二个等位基因。备选地,等位基因型可以由在多于一个多态位点的等位基因的同一性组成。
本文所用的术语“抗体”意欲是指结合剂,其包括与IL-1多肽特异性反应的整个抗体或其结合片段。使用常规技术可以将抗体分段,以与上述关于整个抗体的相同方式筛选片段的功效。例如,通过用胃蛋白酶处理抗体可以产生F(ab)2片段。可以处理得到的F(ab)2片段以还原二硫键从而产生Fab片段。本发明的抗体另外意欲包括双特异性,单链,和嵌合和人源化分子,其具有由抗体的至少一个CDR区域赋予的对IL-1B多肽的亲和力。
“生物学活性”或“生物活性”或“活性”或“生物学功能”为了本文目的可以交换使用,是指通过IL-1多肽(无论是它的天然或变性构象)或通过其任何子序列直接或间接实施的效应物或抗原功能。生物学活性包括与靶肽,例如IL-1受体结合。可以通过直接影响IL-1多肽来调节IL-1生物活性。备选地,通过调节IL-1多肽的水平,如通过调节IL-1基因的表达,可以调节IL-1生物活性。
如本文所用,术语“IL-1多肽的生物活性片段”是指全长IL-1多肽的片段,其中该片段特异性地模拟或拮抗野生型IL-1多肽的活性.生物活性片段优选是能够与白细胞介素受体相互作用的片段.
术语“异常活性”,如应用于多肽如IL-1的活性,是指不同于野生型或天然多肽的活性或不同于健康受试者中多肽的活性的活性。因为它强于它的天然对应物的活性,所以多肽活性可以是异常的。备选地,因为它相对于它的天然对应物的活性较弱或缺乏,活性可以是异常的。异常活性还可以是活性的变化。例如异常多肽可以与不同靶肽相互作用。由于编码IL-1基因座多肽的IL-1基因座基因的过表达或表达不足(underexpression),细胞可以具有异常的IL-1活性。
“细胞”,“宿主细胞”或“重组宿主细胞”在本文中是可以交换使用的术语,不仅是指特定的受试者细胞,而且指该细胞的后代或潜在的后代。因为由于突变或环境影响导致某些改变可以在后代中发生,该后代事实上可以与母细胞不相同,但仍被包括在本文所用术语的范围内。
“异源嵌合体”,“同源嵌合体”,“嵌合的哺乳动物”等是指转基因哺乳动物,其在至少一些它的含有基因组的细胞中具有剔除或敲入(knock-in)构建体。
术语“对照”或“对照样品”是指对于所用检测技术适合的任何样品。对照样品可以包含所用等位基因检测技术的产物或待检测的材料。另外,对照可以是阳性或阴性对照。通过实施例的方式,其中等位基因检测技术是PCR扩增,接着大小分级,对照样品可以包含适当大小的DNA片段。同样,当等位基因检测技术涉及检测突变蛋白质时,对照样品可以包含突变蛋白质的样品。然而,优选对照样品包含待检测的物质。例如,对照可以是基因组DNA样品或IL-1基因簇的克隆部分。然而,当待检测的样品是基因组DNA时,优选对照样品是高度纯化的基因组DNA样品。
短语“与IL-1多态性有关的疾病和症状”是指多种疾病或症状,基于IL-1复合体内的一个或多个等位基因的鉴定可以显示在受试者中对其的敏感性.实例包括:炎性或退行性疾病,包括:系统性炎症反应(SIRS);阿尔茨海默氏病(和相关的病症和症状包括:慢性神经炎症,神经胶质激活;增加的小神经胶质细胞;神经炎斑块形成;和对治疗的应答);肌萎缩性侧索硬化症(ALS),关节炎(和相关的病症和症状,包括:急性关节炎,抗原诱导的关节炎,与慢性淋巴细胞性甲状腺炎有关的关节炎,胶原诱导的关节炎,幼年性慢性关节炎;幼年性类风湿关节炎,骨关节炎,预后和链球菌诱导的关节炎),哮喘(和相关病症和症状,包括:支气管哮喘;慢性阻塞性气道疾病,慢性阻塞性肺疾病,幼年性哮喘和职业性哮喘);心血管疾病(和相关病症和症状,包括动脉粥样硬化;自身免疫性心肌炎,慢性心脏缺氧,充血性心力衰竭,冠状动脉病,心肌病和心细胞功能障碍,包括:主动脉平滑肌细胞激活;心细胞编程性细胞死亡;和心细胞功能的免疫调节;糖尿病和相关病症和症状,包括自身免疫性糖尿病,胰岛素依赖性(1型)糖尿病,糖尿病牙周炎,糖尿病视网膜病,和糖尿病肾病);肠胃炎症(和相关病症和症状,包括乳糜泻,相关的骨质稀少,慢性结肠炎,局限性回肠炎,炎性肠病和溃疡性结肠炎);胃溃疡;肝炎症,胆固醇胆石和肝纤维化,HIV感染(和相关病症和症状,包括退行性应答,神经变性应答,和HIV有关的霍奇森病),川崎综合征(和相关病症和症状,包括粘膜皮肤淋巴结综合征,子宫颈淋巴结病,冠状动脉损伤,浮肿,发热,增加的白细胞,轻度贫血,脱皮,皮疹,结膜发红,血小板增多;多发性硬化,肾病(和相关疾病和病症,包括糖尿病肾病,晚期肾病,肾小球性肾炎,古德帕斯彻综合症,血液透析存活和肾局部缺血再灌注损伤),神经变性病(和相关疾病和症状,包括急性神经变性,衰老和神经变性病中IL-1的诱导,IL-1诱导的下丘脑神经元的可塑性和慢性应激过度反应性),眼病(和相关疾病和病症,包括糖尿病视网膜病,格雷夫斯眼病,和葡萄膜炎,骨质疏松症(和相关疾病和病症,包括牙糟,股骨,桡骨,椎骨或腕骨损失或骨折发生,经绝后的骨损失,物质,骨折发生或骨损失速率),中耳炎(成人或儿科),胰腺炎或胰腺泡炎,牙周病(和相关疾病和病症,包括成人,早发性和糖尿病性);肺病,包括慢性肺病,慢性窦炎,透明膜病,缺氧和SIDS中的肺病;再狭窄;风湿病,包括类风湿性关节炎,风湿病阿孝夫小体,风湿病和风湿性心肌炎;甲状腺炎,包括慢性淋巴细胞性甲状腺炎;尿道感染,包括慢性前列腺炎,慢性骨盆疼痛综合症和尿石病.免疫疾病,包括自身免疫病,如斑秃,自身免疫性心肌炎,格雷夫斯病,格雷夫斯眼病,苔藓硬化症,多发性硬化,牛皮癣,系统性红斑狼疮,系统性硬化,甲状腺病(例如甲状腺肿和基质淋巴瘤性(桥本甲状腺炎,淋巴结样甲状腺肿),睡眠障碍和慢性疲劳综合症和肥胖症(非糖尿病性或与糖尿病有关).对传染病的抗性,所述传染病如利什曼病,麻风病,莱姆病,莱姆心炎,疟疾,脑型疟,脑膜炎,与疟疾有关的管状肠肾炎),其是由细菌,病毒(例如巨细胞病毒,脑炎,EB病毒,人免疫缺陷病毒,流感病毒)或原生动物(例如恶性疟原虫,锥虫)导致的.对包括脑外伤的外伤的应答,(包括中风和局部缺血,脑炎,脑病,癫痫,围生期脑损伤,持续热性癫痫发作,SIDS和蛛网膜下出血),低出生体重(例如大脑性麻痹),肺损伤(急性出血性肺损伤,古德帕斯彻综合症,急性局部缺血再灌注),心肌功能障碍,其是由职业和环境污染物导致(例如对毒油综合症硅病的敏感性),辐射创伤,和伤口愈合反应的效率(例如烧伤或烫伤,慢性伤口,外科手术伤口和脊髓损伤).对瘤形成的敏感性,包括乳腺癌相关的溶骨转移瘤,恶病质,结直肠癌,过度增殖性疾病,霍奇森病,白血病,淋巴瘤,代谢病和肿瘤,转移瘤,骨髓瘤,和各种癌症(包括乳房,前列腺,卵巢,结肠,肺等),厌食症和恶病质.激素调节,包括生育力/生殖力,妊娠的可能性,早产发生率,产前和新生期并发症,包括早产低出生体重,大脑性麻痹,败血病,低甲状腺素症,氧依赖,颅畸形,绝经提前.受试者对移植物的反应(排斥或接受),急性期反应(例如发热反应),普通炎症发应,急性呼吸窘迫反应,急性系统性炎症反应,伤口愈合,粘连,免疫炎症反应,神经内分泌反应,发热发展和抵抗,急性期反应,应激反应,疾病敏感性,重复运动应激,网球肘,和疼痛管理和反应.
术语“基因破坏”和“定向破坏”或任何类似的短语是指位点特异性的破坏天然DNA序列以便与野生型拷贝的该基因相比防止在细胞中该基因的表达。间断可以由对基因的缺失,插入或修饰或其任何组合所导致。
本文所用的术语“单倍型”意欲是指一组等位基因,其在统计学有意义的水平上(pcorr<0.05)作为一组(连锁不平衡)一起遗传。如本文所用,短语“IL-1单倍型”是指IL-1基因座中的单倍型。IL-1炎性或促炎单倍型是指表示增加的激动剂和/或降低的拮抗物活性的单倍型。
“同源性”或“同一性”或“相似性”是指在两个多肽之间或两个核酸分子之间的序列相似性.通过比较每个序列中的位置可以各自确定同源性和同一性,为了比较可以将序列对比.当比较序列的相当位置由相同碱基或氨基酸占据时,那么分子在该位置是相同的;当相当位置被相同或相似氨基酸残基(例如空间和/或电子性质相似)占据时,那么分子可以称为在该位置同源(相似).作为同源性/相似性或同一性的百分比的表达是指由比较序列共有的位置的相同或类似氨基酸的数量的函数.“无关”或“非同源”的序列与本发明的序列共享小于40%同一性,尽管优选小于25%同一性.
术语“同源性”描述基于算法的序列相似性比较,其用于鉴定具有相似功能或基序的基因或蛋白质。本发明的核酸和蛋白质序列可以被用作“查询序列”来进行对公共数据库的搜索,以例如鉴定其它家族成员,相关序列或同系物。这种搜索可以使用Altschul,等(1990)J Mol.Biol.215:403-10的NBLAST和XBLAST程序(2.0版)进行。BLAST核苷酸搜索可以用NBLAST程序,分数=100,字长=12来进行,以获得与本发明核酸分子同源的核苷酸序列。BLAST蛋白质搜索可以用XBLAST程序,分数=50,字长=3来进行,以获得与本发明蛋白质分子同源的氨基酸序列。为了获得用于比较目的的有缺口对比,如Altschul等,(1997)Nucleic AcidsRes.25(17):3389-3402所述可以使用缺口BLAST。当使用BLAST和缺口BLAST程序时,可以使用各个程序(例如XBLAST和BLAST)的缺省参数。参见http://www.ncbi.nlm.nih.gov。
本文所用的术语“IL-1基因簇”和“IL-1基因座”包括位于或接近染色体2的2q13区域的所有核酸,包括至少IL-1A,IL-1B和IL-1RN基因和其它任何连锁序列。(Nicklin等,Genomics 19:382-84,1994)。本文所用的术语“IL-1A”,“IL-1B”,和“IL-1RN”分别是指编码IL-1,IL-1和IL-1受体拮抗物的基因。
“IL-1功能突变”或“致病突变”是指IL-1基因簇内导致改变的表型的突变(即影响IL-1基因或蛋白质的功能)。实例包括:IL-1A(+4845)等位基因2,IL-1B(+3954)等位基因2,IL-1B(+6912)等位基因2和IL-1RN(+2018)等位基因2。
“IL-1X(Z)等位基因Y”是指特定的等位基因型,称为Y,其出现在基因X的IL-1基因座多态位点,其中X是IL-1A,B或RN并且位于或接近核苷酸Z,其中核苷酸Z是相对于主要转录起始位点编号,其是特定IL-1基因X的核苷酸+1。如本文另外所用,术语“IL-1X等位基因(Z)”是指位于或接近核苷酸Z的基因X中IL-1多态位点的所有等位基因。例如,术语“IL-1RN(+2018)等位基因”是指在标记+2018处IL-1RN基因的备选型。“IL-1RN(+2018)等位基因1”是指IL-1RN基因型,其在有义链的位置+2018包含半胱氨酸(C)。Clay等,Hum.Genet.97:723-26,1996。“IL-1RN(+2018)等位基因2”是指IL-1RN基因,其在正链的位置+2018含有胸腺嘧啶(T)。当受试者具有两个相同的IL-1RN等位基因时,受试者被称为纯合的,或具有纯合状态。当受试者具有两个不同IL-1RN等位基因时,受试者被称为杂合的,或具有杂合状态。术语“IL-1RN(+2018)等位基因2,2”是指纯合IL-1 RN(+2018)等位基因2状态。相反,术语“IL-1 RN(+2018)等位基因1,1”是指纯合IL-1 RN(+2018)等位基因1状态。术语“IL-1 RN(+2018)等位基因1,2”是指杂合等位基因1和2状态。
本文所用的“IL-1相关”意欲包括在人染色体2(2q 12-14)上所有与人IL-1基因座基因有关的基因。这些包括位于染色体2(2q 13-14)的人IL-1基因簇的IL-1基因,包括:编码白细胞介素-1α的IL-1A基因,编码白细胞介素-1β的IL-1B基因,和编码白细胞介素-1受体拮抗物的IL-1RN(或IL-1ra)基因。另外这些IL-1相关基因包括位于人染色体2(2q12)的I型和II型人IL-1受体基因和位于小鼠染色体1位置19.5cM的它们的小鼠同系物。白细胞介素-1α,白细胞介素-1β,和白细胞介素-1RN如此相关以致它们都与IL-1 I型受体结合,然而仅白细胞介素-1α和白细胞介素-1β是激活IL-1 I型受体的激动剂配体,而白细胞介素-1RN是天然存在的拮抗物配体。当将术语“IL-1”用于参考基因产物或多肽时,意欲是指由人染色体2(2q 12-14)上的白细胞介素-1基因座所编码的所有基因产物和来自其它物种的它们对应的同系物或其功能变体.术语IL-1因此包括促进炎症应答的分泌的多肽,如IL-1α和IL-1β,以及拮抗炎症应答的分泌的多肽,如IL-1受体拮抗物和IL-1 II型(引诱)受体。
“IL-1受体”或“IL-1R”是指结合各种细胞膜的蛋白质受体,其能够结合和/或转导来自IL-1基因座编码的配体的信号。术语适用于任何能够结合白细胞介素-1(IL-1)分子的蛋白质,所述蛋白质为它们的天然构型作为哺乳动物质膜蛋白,可能在将IL-1提供的信号转导给细胞中起作用。如本文所用,术语包括具有IL-1结合或信号转导活性的天然蛋白质的类似物。实例包括在美国专利4,968,607中描述的人和鼠IL-1受体。术语“IL-1核酸”是指编码IL-1蛋白质的核酸。
“IL-1多肽”和“IL-1蛋白质”意欲包括包含由本文包含的图中显示的IL-1基因组DNA序列编码的氨基酸序列的多肽,或其片段和其同系物,并且包括激动剂和拮抗物多肽。
“增加的风险”是指与未携带特定多态等位基因的群体成员中疾病或病症发生频率相比,在携带特定多态等位基因的个体中统计学上更高的疾病或病症发生频率。
本文所用的术语“相互作用”意欲包括分子间可检测的关系或关联(例如生化相互作用),如本质上蛋白质-蛋白质,蛋白质-核酸,核酸-核酸和蛋白质-小分子或核酸-小分子之间的相互作用。
本文关于核酸如DNA或RNA所用的术语“分离的”是指分别从在大分子天然来源中存在的其它DNA,或RNA分离的分子。例如,编码受试者IL-1多肽之一的分离的核酸优选包括不超过10千碱基(kb)的天然紧邻基因组DNA中IL-1基因的核酸序列,更优选不超过5kb这种天然存在的侧翼序列,最优选小于1.5kb的这种天然存在的侧翼序列。本文所用的术语分离还指基本上不含细胞物质,病毒物质,或当通过重组DNA技术生产时培养基,或当化学合成时的化学前体或其它化学物质的核酸或肽。此外,“分离的核酸”意欲包括天然不是作为片段存在和在自然状态未发现的核酸片段。术语“分离的”在本文中还用于指从其它细胞蛋白质分离的多肽,并且意欲包括纯化和重组的多肽。
“敲入(knock-in)”转基因动物是指已经将修饰基因导入其基因组的动物,并且修饰基因可以是外源或内源性的。
“剔除”转基因动物是指其中存在对内源基因表达的部分或完全抑制的动物(例如基于缺失至少基因的一部分,用第二种序列替换至少基因的一部分,引入终止密码子,编码关键氨基酸的碱基的突变,或内含子接点的去除等)。
“剔除构建体”是指可以用于降低或抑制细胞中由内源DNA序列编码的蛋白质的表达的核酸序列。在简单实施例中,剔除构建体由基因,如IL-1RN基因组成,基因的关键部分有缺失,以便活性蛋白不能从中表达。备选地,可以将许多终止密码子加至天然基因以导致蛋白质的提前终止或可以使内含子接点失活。在典型的剔除构建体中,用可选择的标记(如neo基因)替换基因的某些部分因此基因可以如下表示:IL-1RN 5’/neo/IL-1RN3’,其中IL-1RN 5’和IL-1RN 3’是指基因组或cDNA序列,其分别在相对于部分IL-1 RN基因的上游和下游,并且其中neo是指新霉素抗性基因.在另一剔除构建体中,将第二种可选择的标记加入侧翼位置因此基因可以表示为:IL-1RN/neo/IL-1RN/TK,其中TK是胸苷激酶基因,其可以加至前述构建体的IL-1RN5’或IL-1RN3’序列并且可以另外相对在适当培养基中选择(因此是阴性可选择标记).该双标记构建体允许从典型地保留TK序列的非同源重组事件中选择去除侧翼TK标记的同源重组事件.基因缺失和/或替换可以从外显子,内含子,特别是内含子接点,和/或调节区域如启动子进行.
“连锁不平衡”是指两个等位基因以大于从给定对照群体中每个等位基因发生的分开频率所期望的频率的共遗传。独立遗传的两个等位基因发生的期望频率是第一个等位基因的频率乘以第二个等位基因的频率。以期望频率共发生的等位基因称为“连锁不平衡”。连锁不平衡的原因经常是不清楚的。它可以是由于对特定等位基因组合的选择或遗传异种群体的最近混合。另外,在标记与疾病基因非常紧密连锁的情形中,如果疾病突变在最近过去发生以致还未经过足够的时间以通过特定染色体区域的重组事件达到平衡,期望等位基因(或一组连锁等位基因)与疾病基因的关联。当提及由多于一个等位基因组成的等位基因型时,如果所有包含第一个等位基因型的等位基因与第二个等位基因型的至少一个等位基因连锁不平衡,则第一个等位基因型与第二个等位基因型连锁不平衡。连锁不平衡的实例是在IL-1RN(+2018)和IL-1RN(VNTR)多态位点的等位基因之间发生。IL-1RN(+2018)的两个等位基因与IL-1RN(VNTR)的两个最频繁的等位基因,等位基因1和等位基因2是100%连锁不平衡。
术语“标记”是指已知在个体之间变化的基因组序列。例如,IL-1RN基因具有由可变数量的串联重复(VNTR)组成的标记。
“突变基因”或“突变”或“功能突变”是指基因的等位基因型,相对于不具有突变基因的受试者,其能够改变具有突变基因的受试者的表型。通过某些试剂可以校正或补偿由突变导致的改变的表型。如果对于该突变受试者必须是纯合的以具有改变的表型,则突变称为隐性的。如果一个拷贝的突变基因足以改变受试者的表型,则突变称为显性的。如果受试者具有一个拷贝的突变基因和具有纯合和杂合受试者之间的表型(对于该基因),突变称为共显性的。
本发明的“非人类动物”包括哺乳动物如啮齿类,非人灵长类,羊,狗,牛,山羊,等,两栖类,如非洲爪蟾属成员,和转基因鸟类(例如鸡,鸟等)。术语“嵌合动物”在本文中用来指其中发现重组基因,或者其中重组基因在动物的一些但不是全部细胞中表达的动物。术语“组织特异性嵌合动物”表示重组IL-1基因之一在一些组织但不在其它组织中存在和/或表达或破坏。术语“非人类哺乳动物”是指哺乳动物纲除了人类以外的任何成员。
如本文所用,术语“核酸”是指多核苷酸或寡核苷酸如脱氧核糖核酸(DNA),并且当适当时,核糖核酸(RNA)。术语应当也被理解为包括,作为等价物,由核苷酸类似物制成的RNA或DNA的类似物(例如肽核酸)和如适用于描述的实施方案,单(有义或反义)和双链多核苷酸。
术语“多态性”是指基因或其部分(例如等位基因变体)多于一种形式的共存。存在至少两种不同形式,即两种不同核苷酸序列的基因的一部分被称为“基因的多态区域”。基因多态区域的特异基因序列是等位基因。多态区域可以是单核苷酸,其同一性在不同等位基因中不同。多态区域也可以是几个核苷酸长。
术语“对疾病的倾向”,和对疾病的“倾向”或“敏感性”或任何相似的短语含义是某些等位基因因此被发现有关于或预示受试者发展特定疾病(例如血管病)的发生率。与健康个体相比,等位基因因此在患病个体中经常过度表达。因此,这些等位基因可以用来甚至在症状前或患病前的个体中预测疾病。
本文所用的“小分子”含义是指组合物,其具有小于约5kD和最优选小于约4kD的分子量。小分子可以是核酸,肽,肽模拟物,碳水化合物,脂质或其它有机或无机分子。
如本位所用,术语“特异性杂交”或“特异性检测”是指核酸分子与样品核酸的至少约6个连续核苷酸杂交的能力。
“转录调节序列”是贯穿本说明书使用的通称,是指DNA序列,如起始信号,增强子,和启动子,其诱导或控制它们可操作连接的蛋白质编码序列的转录。
如本文所用,术语“转基因”是指已经导入细胞的核酸序列(编码例如一种IL-1多肽,或向其的反义转录物)。转基因可以对于导入其的转基因动物或细胞部分或完全异源,即外源,或对于导入其的转基因动物或细胞的内源基因同源,但其被设计来以改变插入其的细胞基因组的方式插入,或插入到动物基因组中(例如将它在不同于天然基因的位点插入或者它的插入导致剔除)。转基因还可以以附加体的形式存在于细胞中。转基因可以包括一个或多个转录调节序列和其它任何核酸,如内含子,其可能对于所选核酸的最佳表达是所需的。
“转基因动物”是指任何动物,优选非人类哺乳动物,鸟或两栖动物,其中一个或多个动物细胞包含通过人干预的方式如本领域公知的转基因技术引入的异源核酸。经过计划的遗传操作,如通过用重组病毒显微注射或通过注射,通过导入细胞前体将核酸直接或间接导入细胞。术语遗传操作不包括常规的杂交育种,或体外受精,而涉及重组DNA分子的引入。该分子可以整合到基因组中,或可以是染色体外复制的DNA。在本文所述的典型转基因动物中,转基因导致细胞表达IL-1多肽之一的重组形式,例如激动剂或拮抗物形式。然而,还考虑其中重组基因是沉默的转基因动物,例如以下描述的FLP或CRE重组酶依赖性构建体。此外,“转基因动物”还包括其中一个或多个基因的基因破坏是由人干预导致的那些重组动物,所述人干预包括重组和反义技术。术语意欲包括所有后代。因此,包括起始动物及其所有的F1,F2,F3等后代。
本文所用的术语“治疗”意欲包括治愈以及改善病症或疾病的至少一种症状。
术语“载体”是指核酸分子,其能够运输已经与它连接的另一核酸。一类优选载体是附加体,即能够在染色体外复制的核酸。优选载体是能够自主复制和/或表达与它们连接的核酸的那些。能够指导与它们可操作连接的基因表达的载体在此处被称为“表达载体”。通常,用于重组DNA技术的表达载体经常是“质粒”形式,其通常是指环状双链DNA环,它们的载体形式与染色体不结合。在本说明书中,“质粒”和“载体”可以交换使用,因为质粒是最常用的载体形式。然而,本发明随后于此意欲包括这种其它形式的表达载体,其起相当的作用并为本领域所知。
术语“野生型等位基因”是指基因的等位基因,当以两个拷贝存在受试者中时其导致野生型表型。因为基因中的某些核苷酸变化可能不影响具有两个拷贝具有核苷酸变化的基因的受试者的表型,可以存在特定基因的多个不同野生型等位基因。
4.3预测医学
4.3.1IL-1炎性单倍型和相关疾病和病症
本发明至少部分基于鉴定某些炎性单倍型,特别是包括IL-1B(-3737)多态等位基因的那些,和这些型式与某些疾病或病症的发展的关联(在统计学显著的程度上).因此,在受试者中单独或与其它方式结合检测包含单倍型的等位基因可以显示受试者患有或倾向于发展特定疾病或病症.然而,因为这些等位基因与其它等位基因连锁不平衡,检测这种其它连锁的等位基因也可以说明受试者含有或倾向于发展特定疾病或病症.例如,44112332单倍型包含下列基因型:
| IL-1A的222/223标记的等位基因4 |
| IL-1A的gz5/gz6标记的等位基因4 |
| IL-1A的-889标记的等位基因1 |
| IL-1B的+3954标记的等位基因1 |
| IL-1B的-511标记的等位基因2 |
| gaat.p33330标记的等位基因3 |
| Y31标记的等位基因3 |
| IL-1RN的+2018的等位基因2IL-1A的+4845的等位基因1 |
| IL-1RN的VNTR标记的等位基因2 |
IL-1RN可变外显子(外显子lic,其产生胞内形式的基因产物)的其它3种多态性也与IL-1RN(VNTR)的等位基因2连锁不平衡(Clay等,(1996)Hum Genet 97:723-26)。这些包括:IL-1RN外显子lic(1812)(GenBank:X77090在1812);IL-1RN外显子lic(1868)多态性(GenBank:X77090在1868);和IL-1RN外显子lic(1887)多态性(GenBank:X77090在1887)。另外启动子中其它关于可变剪接的胞内形式的基因的多态性,Pic(1731)多态性(GenBank:X77090在1731),也与IL-1RN(VNTR)多态基因座的等位基因2连锁不平衡。对于这些多态基因座中的每一个,已经确定等位基因2序列变体与IL-1RN(VNTR)基因座的等位基因2连锁不平衡(Clay等,(1996)Hum Genet 97:723-26)。
33221461单倍型包含下列基因型:
| IL-1A的222/223标记的等位基因3 |
| IL-1A的gz5/gz6标记的等位基因3 |
| IL-1A的-889标记的等位基因2 |
| IL-1B的+3954标记的等位基因2 |
| IL-1B的-511标记的等位基因1 |
| IL-1A的222/223标记的等位基因3 |
| gaat.p33330标记的等位基因4 |
| Y31标记的等位基因6 |
| IL-1RN的+2018的等位基因1IL-1A的+4845的等位基因2 |
| IL-1RN的VNTR标记的等位基因1 |
具有44112332单倍型的个体经刺激后典型地是IL-1α和IL-1β蛋白质的过量生产者。与此对比,具有33221461单倍型的个体典型地是IL-1ra的生产不足者(underproducer)。每种单倍型导致净促炎应答。每个单倍型内的等位基因可能具有效应以及复合的基因型效应。另外,特定的疾病可能与两种单倍型型式有关。
下表1列出许多基因型标记和已经发现与这些标记统计学显著程度相关的各种疾病和病症。
表1
IL-1单倍型基因标记与特定疾病的关联
| 基因型 | IL-1A(-889) | IL-1A(+4845) | IL-1B(-511) | IL-1B(+3954) | IL-1RN(+2018) |
| 疾病 | |||||
| 牙周病 | (*2) | *2 | *2 | ||
| 冠状动脉病 | *2 | *2 | |||
| 动脉粥样硬化 | |||||
| 骨质疏松症 | *2 | ||||
| 胰岛素依赖性糖尿病 | *2 | ||||
| 糖尿病视网膜病 | *1 |
| 基因型 | IL-1A(-889) | IL-1A(+4845) | IL-1B(-511) | IL-1B(+3954) | IL-1RN(+2018) |
| 晚期肾病 | (+) | ||||
| 糖尿病肾病 | *2 | ||||
| 肝纤维化(日本酒 | (+) | ||||
| 精中毒) | |||||
| 斑秃 | *2 | ||||
| 格雷夫斯病 | *2 | ||||
| 格雷夫斯眼病 | (-) | ||||
| 外甲状腺疾病 | (+) | ||||
| 系统性红斑狼疮 | *2 | ||||
| 苔藓硬化症 | *2 | ||||
| 关节炎 | (+) | ||||
| 幼年性慢性关节炎 | *2 | ||||
| 类风湿性关节炎 | (+) | ||||
| 胰岛素依赖性糖尿病 | *2 | *2VNTR | |||
| 溃疡性结肠炎 | *2 |
| 基因型 | IL-1A(-889) | IL-1A(+4845) | IL-1B(-511) | IL-1B(+3954) | IL-1RN(+2018) |
| 哮喘 | *2 | *2 | |||
| 多发性硬化 | (*2) | *2 VNTR | |||
| 绝经提前 | *2 |
除了上述等位基因型,如本文所述,本领域技术人员可以容易地鉴定与疾病或病症有关的等位基因连锁不平衡的其它等位基因(包括多态性和突变)。例如,可以收集来自无特定疾病的第一组受试者的核酸样品,以及来自患有疾病的第二组受试者的DNA。然后可以比较核酸样品以鉴定与第一组相比在第二组中过量表达的那些等位基因,其中这些等位基因推测与疾病相关,所述疾病由不适当的白细胞介素1调节导致或促进。备选地,例如通过将大的种群基因分型(genotyping)和进行统计学分析以确定哪些等位基因显得比期望的更通常在一起,可以鉴定和与疾病相关的等位基因连锁不平衡的等位基因。优选选择组群以由遗传相关的个体组成。遗传相关的个体包括来自相同种族的个体,相同的人种或甚至相同的家族。随着对照组和测试组之间的遗传相关性的程度增加,与致病等位基因曾经更远端连锁的多态等位基因的预测值增加。这是因为较少的进化时间已经经过还不允许在起始种群中与染色体连锁的多态性通过遗传交换事件再分配。因此可以开发种族特异的,人种特异的,和甚至家族特异的诊断基因分型测定以允许检测在人类进化中曾经更近的时间,例如在主要人种趋异以后,在人种群分离成不同的人种后,和甚至在特定家族系的最近历史内产生的疾病等位基因。
两个多态标记之间或一个多态标记和一个致病突变之间的连锁不平衡是亚稳态的。缺乏选择压力或构成突变事件基础的散发性连锁重现,多态性将最终通过染色体重组事件变成分离和由此将通过人类进化过程达到连锁平衡。因此,发现与疾病或病症连锁不平衡的多态等位基因的可能性可以随至少两个因素的变化而增加:降低多态标记和致病突变之间的物理距离,和连锁对分离可获得的减小减数分裂世代的数量。后者因素的考虑提示两个体越紧密相关,它们越可能共有共同的亲本染色体或含有连锁多态性的染色体区域并且这个连锁对越不可能通过每代发生的减数分裂交换事件而变得分离。结果,两个体越紧密相关,广泛隔开的多态性越可能可以共遗传。因此,对于共同种族,人种或家族相关的个体,可以依靠曾经更远隔开的多态基因座作为连锁致病突变的遗传指示物。
可以设计适当的探针以与IL-1基因座的特定基因,如IL-1A,IL-1B或IL-1RN或相关基因杂交。这些基因组DNA序列在本领域已知并可在www.ncbi.nlm.nih.gov.获得,分别在图3,4和5所示,并且另外分别对应于SEQ ID No 1,2和3.实际上人染色体2的IL-1区域横跨大约400,000碱基对,假设平均每1,000个碱基对单独一个核苷酸多态性,包括大约400个单独的SNP基因座.还有其它供本发明使用的多态性可以从各种公共资源获得.例如,人类基因组数据库汇集基因内SNP,可以通过序列搜索并且当前包含约2,700个条目(http://hgbase.interactiva.de).还可以获得由麻省理工学院维护的人类多态性数据库(MIT SNP数据库(http://www.genome.wi.mit.edu/SNP/human/index.html))。从这些来源可以发现SNP以及其它人类多态性。
例如,在任何上述数据库之一中检查人基因组的IL-1区域显示IL-1基因座基因侧邻在127.4cM(厘摩)处称为微卫星标记AFM220ze3的着丝粒近端多态标记(参见GenBank登记号Z17008)和在127.9cM处称为微卫星锚定标记AFM087xal的远端多态标记(参见GenBank登记号Z16545)。这些人多态基因座都是CA二核苷酸重复微卫星多态性和同样在人种群中显示高度杂合性。例如,以序列TGTACCTAAGCCCACCCTTTAGAGC为5’引物和以序列TGGCCTCCAGAAACCTCCAA为3’引物,AFM220ze3的一个等位基因产生211bp PCR扩增产物。另外,以序列GCTGATATTCTGGTGGGAAA为5’引物和以序列GGCAAGAGCAAAACTCTGTC为3’引物,AFM087xal的一个等位基因产生177bp PCR扩增产物。对应于出现在这些人染色体2CA二核苷酸重复多态性的5’和3’的单一序列的相当的引物对于本领域技术人员将是明显的。合理的相当的引物包括在约1kb的指定引物内杂交并且另外无论从何处开始长度约17bp至约27bp的那些。设计用于扩增独特人染色体基因组序列的引物的一般规则是它们具有至少约50℃的解链温度,其中近似的解链温度可以使用公式Tmelt=[2x(A或T的数量)+4x(G或C的数量)]来估计。
在这两个CA二核苷酸重复多态性之间存在许多其它的人多态基因座,并且为确定在家族或其它遗传相关个体的群体中预后等位基因提供另外的目标。例如,生物技术信息国家中心网站(www.nobi.nlm.nih.gov/genemap/)列出许多IL-1基因座区域中的多态性标记,并提供设计扩增和分析这些标记的适当引物的指导。
因此,因为它们与人染色体2q 12-13的互补序列或来自该区域的cDNA选择性形成双链体分子的能力或者为从该区域扩增DNA或cDNA提供引物,可以使用本发明的核苷酸片段。用于该目的的适当的探针的设计要求考虑许多因素。例如,将发现具有10,15,或18个核苷酸至约20,或至约30个核苷酸的长度的片段特别有用。对于某些实施方案甚至更优选较长的序列,例如40,50,80,90,100甚至直至全长。因为足以允许充分特异性的杂交以致被用作分子探针,至少约18-20个核苷酸的寡核苷酸的长度为本领域技术人员所普遍接受。另外,取决于设想的应用,将期望使用不同的杂交条件以获得不同程度的探针对靶序列的选择性。对于要求高选择性的应用,将典型地期望使用相对严谨的条件来形成杂交。例如,相对低的盐和/或高温条件,如在约50℃至约70℃的温度下0.02M-0.15MNaCl所提供的。该选择性的条件可以容忍很少,如果有的话,探针和模板或靶链之间的错配。
结合检测上述等位基因,在受试者中可以检测或监测其它等位基因或其它疾病的标记,例如鉴别血管壁厚度(例如通过超声测量),或者受试者是否吸烟,喝酒,超重,在压力下或锻炼。
4.3.2.等位基因的检测
许多方法可供检测人多态基因座的特定等位基因.用于检测特定多态等位基因的优选方法将部分依赖于多态性的分子性质.例如,多态基因座的不同等位基因形式可以通过DNA单碱基对区别.这种单核苷酸多态性(或SNP)是遗传变异的主要贡献者,包含约80%的所有已知多态性,它们在人类基因组中的密度估计为平均每1,000个碱基对1个.SNP是最频繁的二等位基因-仅以两种不同形式存在(尽管高达四种不同形式的SNP,对应于在DNA中出现的四种不同核苷酸碱基,在理论上是可能的).然而,SNP在突变上比其它多态性更稳定,使它们适合于关联研究,其中将标记和未知变体之间的连锁不平衡用于将致病突变作图.另外,因为SNP典型地仅具有两种等位基因,它们可以通过简单的正/负测定而不是长度测量来基因分型,使它们更易于自动化.
多种方法可供检测个体中特定单核苷酸多态等位基因的存在。该领域的进展已经提供准确,容易和便宜的大规模SNP基因分型。最近,例如已经描述几种新技术,包括动态等位基因特异性杂交(DASH),微板阵列对角凝胶电泳(MADGE),焦磷酸测序(pyrosequencing),寡核苷酸特异性连接,TaqMan系统以及各种DNA“芯片”技术如Affymetrix SNP芯片。这些方法要求靶基因区域典型地通过PCR的扩增。还有其它新开发的方法,其基于通过侵入裂解产生小信号分子,接着质谱分析或固定化锁定探针和滚环扩增,最终可能消除PCR的需要。如下总结本领域已知的用于检测特定单核苷酸多态性的几种方法。本发明的方法应当理解为包括所有可利用的方法。
已经开发几种方法以促进单核苷酸多态性的分析。在一个实施方案中,通过使用专门的抗外切核酸酶的核苷酸可以检测单碱基多态性,如例如Mundy,C.R.(美国专利4,656,127)所公开。根据该方法,与紧接多态位点3’的等位基因序列互补的引物允许与从特定动物或人获得的靶分子杂交。如果在靶分子上的多态位点包含与存在的特定抗外切核酸酶的核苷酸衍生物互补的核苷酸,那么该衍生物将被掺入到杂交引物的末端。该掺入导致引物抗外切核酸酶,由此允许它的检测。因为样品抗外切核酸酶的衍生物的身份是已知的,引物已经变得抗外切核酸酶的发现显示存在靶分子的多态位点中的核苷酸与用于反应中的核苷酸衍生物互补。该方法具有优势即它不要求测定大量的外来序列数据。
在本发明的另一实施方案中,基于溶液的方法被用于测定多态位点核苷酸的同一性。Cohen,D.等(法国专利2,650,840;PCT申请No.WO91/02087)。如在美国专利4,656,127的Mundy方法中,使用与紧接多态位点3’的等位基因序列互补的引物。使用标记的双脱氧核苷酸衍生物,该方法确定那个位点的核苷酸的同一性,所述双脱氧核苷酸衍生物如果与多态位点的核苷酸互补将变得掺入引物的末端。
Goelet,P.等(PCT申请92/15712)描述一种备选方法,称为遗传位分析法(Genetic Bit Analysis)或GBATM。Goelet,P.等的方法使用标记的终止子和引物的混合物,所述引物与多态位点3’的序列互补。掺入的标记的终止子因此通过存在于被评估的靶分子的多态位点中的核苷酸序列测定并与其互补。与Cohen等的方法(法国专利2,650,840;PCT申请No.WO91/02087)形成对比,Goelet,P.等的方法优选是不均匀相测定,其中将引物或靶分子固定于固相。
近来,已经描述几种用于测定DNA中多态位点的引物引导的核苷酸掺入方法(Komher,J.S.等,Nucl.Acids.Res.17:7779-7784(1989);Sokolov,B.P.,Nucl.Acids Res.18:3671(1990);Syvanen,A.-C.,等,Genomics 8:684-692(1990);Kuppuswamy,M.N.等,Proc.Natl.Acad.Sci.(U.S.A.)88:1143-1147(1991);Prezant,T.R.等,Hum.Mutat.1:159-164(1992);Ugozzoli,L.等,GATA 9:107-112(1992);Nyren,P.等,Anal.Biochem.208:171-175(1993))。这些方法区别于GBATM,在于它们全部依赖于标记的脱氧核苷酸的掺入以在多态位点处的碱基之间区别。在该形式中,因为信号与掺入的脱氧核苷酸的数量成比例,在相同核苷酸的运行中出现的多态性可以产生与运行长度成比例的信号(Syvanen,A.-C.,等,Amer.J.Hum.Genet.52:46-59(1993))。
对于导致蛋白质翻译的过早终止的突变,蛋白质截短试验(PTT)提供有效的诊断方法(Roest,等,(1993)Hum.Mol.Genet.2:1719-21;van derLuijt,等,(1994)Genomics 20:1-4)。对于PTT,RNA最初从可利用的组织中分离并被逆转录,通过PCR扩增所目的区段。然后将逆转录PCR的产物用作嵌套PCR扩增的模板,引物包含RNA聚合酶启动子和用于起始真核生物翻译的序列。在扩增目的区域以后,掺入到引物的单一基序允许PCR产物的连续体外转录和翻译。经过翻译产物的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳以后,截短多肽的出现显示导致翻译过早终止的突变的存在。在该技术的变体中,当目的靶区域来源于单个外显子时,将DNA(与RNA相反)用作PCR模板。
可以利用任何细胞类型或组织以获得用于本文所述诊断的核酸样品。在优选实施方案中,DNA样品获自体液,例如通过已知技术(例如静脉穿刺)获得的血液或唾液。备选地,可以在于燥样品(例如头发或皮肤)上进行核酸检验。当使用RNA或蛋白质时,可以使用的细胞或组织必须表达IL-1基因。
还可以直接在获自活组织检查或切除术的受试者组织的组织切片(固定和/或冷冻)上原位进行诊断步骤,因此不需要核酸纯化。可以将核酸试剂用作该原位方法的探针和/或引物(参见例如,Nuovo,G.J.,1992,PCR insitu hybridization:protocols and applications,Raven Press,NY)。
除了主要集中在检测一个核酸序列的方法以外,在该检测方案中还可以评估图谱。例如通过使用差异显示方法,Northern分析和/或RT-PCR可以产生指纹图谱。
优选的检测方法是使用探针的等位基因特异性杂交,所述探针重叠IL-1促炎单倍型的至少一个等位基因区域和具有突变或多态区域周围约5,10,20,25,或30个核苷酸。在本发明的优选实施方案中,将能够与其它涉及再狭窄的等位基因变体特异性杂交的几个探针附着在固相载体,例如“芯片”(其可以容纳高达约250,000个寡核苷酸)。寡核苷酸可以通过包括平版印刷术的多种方法与固相载体结合。例如在Cronin等(1996)Human Mutation 7:244中描述使用这些包含寡核苷酸的芯片,也称为“DNA探针阵列”的突变检测分析。在一个实施方案中,芯片包含基因的至少一个多态区域的所有等位基因变体。然后将固相载体与检验核酸接触并检测与特异性探针的杂交。因此,在简单的杂交实验中可以鉴定一个或多个基因的许多等位基因变体的同一性。这些技术可以还包含在分析前扩增核酸的步骤。扩增技术对于本领域技术人员是已知的,并包括但不限于克隆,聚合酶链式反应(PCR),特异性等位基因的聚合酶链式反应(ASA),连接酶链式反应(LCR),嵌套聚合酶链式反应,自动维持序列扩增(Guatelli,J.C.等,1990,Proc.Natl.Acad.Sci.USA 87:1874-1878),转录扩增系统(Kwoh,D.Y.等,1989,Proc.Natl.Acad.Sci.USA 86:1173-1177),和Q-Beta复制酶(Lizardi,P.M.等,1988,Bio/Technology 6:1197)。
扩增产物可以以多种方式测定,包括大小分析,限制消化接着大小分析,在反应产物中检测特异性标记的寡核苷酸引物,等位基因特异性寡核苷酸(ASO)杂交,等位基因特异性5’外切核酸酶检测,测序,杂交等。
基于PCR的检测方法可以包括同时多重扩增多个标记。例如,在本领域中公知选择PCR引物以产生大小不重叠并且可以同时分析的PCR产物。备选地,可以用区别标记和因此可以区别检测的引物扩增不同标记。当然,基于杂交的检测方法允许样品中多个PCR产物的差异检测。本领域已知其它技术允许多个标记的多重分析。
在仅仅说明性的实施方案中,方法包括以下步骤(i)从受试者收集细胞样品,(ii)从样品细胞中分离核酸(例如,基因组,mRNA或两者),(iii)在各种条件下将核酸样品与一个或多个引物接触以便等位基因的杂交和扩增发生,所述引物与IL-1促炎单倍型的至少一个等位基因5’和3’特异性杂交,和(iv)检测扩增产物。如果这些分子以极低数量存在,这些检测方案对于检测核酸分子特别有用。
在受试者测定的优选实施方案中,通过限制酶切割型的改变鉴定IL-1促炎单倍型的等位基因。例如,分离样品和对照DNA,扩增(任选地),用一种或多种限制内切核酸酶消化,通过凝胶电泳确定片段长度大小。
在还有另一实施方案中,本领域已知的多种测序反应中的任何一种可以用于直接将等位基因测序。示例性的测序反应包括基于由Maxim和Gilbert((1977)Proc.Natl Acad Sci USA 74:560)或Sanger(Sanger等(1977)Proc.Nat.Acad.Sci USA 74:5463)开发的技术的那些。还考虑当进行受试者测定时可以使用多种自动测序方法中的任何一种(参见例如Biotechniques(1995)19:448),包括通过质谱测序(参见例如PCT公开WO94/16101;Cohen等(1996)Adv Chromatogr 36:127-162;和Griffin等(1993)Appl Biochem Biotechnol 38:147-159)。对于本领域技术人员将明显的是,对于某些实施方案,仅仅需要在测序反应中确定一个,两个或三个核酸碱基的出现。例如,可以进行A-跟踪(track)等,如其中仅检测一个核酸。
在另一实施方案中,可以使用防止切割剂的保护(如核酸酶,羟胺或四氧化锇和哌啶)来检测RNA/RNA或RNA/DNA或DNA/DNA异源双链中的错配碱基(Myers,等(1985)Science 230:1242)。通常,“错配切割”的现有技术通过提供通过将含有野生型等位基因的(标记的)RNA或DNA与样品杂交形成的异源双链起始。用试剂处理双链体,该试剂切割双链体的单链区域,如由于对照和样品链之间的碱基对错配导致其将存在。例如,可以用RNA酶处理RNA/DNA双链体,用S1核酸酶处理DNA/DNA杂交物(hybrid)以酶促消化错配区域。在其它实施方案中,可以用羟胺或四氧化锇和哌啶处理DNA/DNA或RNA/DNA双链体以便消化错配区域。在消化错配区域以后,然后通过在变性聚丙烯酰胺凝胶上通过大小分离得到的物质以确定突变位点。参见例如Cotton等(1988)Proc.Natl Acad Sci USA85:4397;和Saleeba等(1992)Methods Enzymol.217:286-295。在优选实施方案中,可以将对照DNA或RNA标记以用于检测。
在还有另一实施方案中,错配切割反应使用一种或多种识别双链DNA中的错配碱基对的蛋白质(所谓“DNA错配修复”酶)。例如大肠杆菌mutY酶在G/A错配处切割A,来自HeLa细胞的胸苷DNA糖基化酶在G/T错配处切割T(Hsu等(1994)Carcinogenesis 15:1657-1662)。按照例举的实施方案,基于IL-1基因座单倍型的等位基因的探针与cDNA或其它来自检验细胞的DNA产物杂交。用DNA错配修复酶处理双链体,从电泳方案等可以检测切割产物,如果有的话。参见例如美国专利5,459,039。
在其它实施方案中,电泳迁移率的改变将可以用来鉴定IL-1基因座等位基因。例如,单链构象多态性(SSCP)可以用于检测突变型和野生型核酸之间的电泳迁移率的差异(Orita等(1989)Proc Natl.Acad.Sci USA 86:2766,还参见Cotton(1993)Mutat Res 285:125-144;和Hayashi(1992)Genet Anal Tech Appl 9:73-79).将样品和对照IL-1基因座等位基因的单链DNA片段变性并允许复性.单链核酸的二级结构根据序列而变化,导致的电泳迁移率的改变使能够检测甚至单一的碱基变化.可以将DNA片段标记或用标记探针检测.通过使用RNA(而不是DNA)可以增强测定的灵敏性,在RNA中二级结构对序列变化更敏感.在优选实施方案中,基于电泳迁移率的变化,主题方法使用异源双链体分析来分离双链异源双链分子(Keen等(1991)Trends Genet 7:5)。
在还有另一实施方案中,使用变性梯度凝胶电泳(DGGE)测定在含有梯度变性剂的聚丙烯酰胺凝胶中等位基因的运动(Myers等(1985)Nature313:495)。当将DGGE用作分析方法时,例如通过PCR加入约40bp高-熔解富含GC的DNA的GC夹(clamp)修饰DNA以确保它不完全变性。在另一实施方案中,使用温度梯度替代变性剂梯度来鉴定对照和样品DNA的迁移率差异(Rosenbaum和Reissner(1987)Biophys Chem 265:12753)。
其它用于检测等位基因的技术的实例包括但不限于,选择性寡核苷酸杂交,选择性扩增,或选择性引物延伸。例如,可以制备其中已知突变或核苷酸差异(例如在等位基因变体中)被放置在中央的寡核苷酸引物,然后在只有当发现完全匹配时允许杂交的条件下与靶DNA杂交(Saiki等(1986)Nature 324:163);Saiki等(1989)Proc.Natl Acad.Sci USA 86:6230)。当寡核苷酸与PCR扩增的靶DNA杂交时该等位基因特异性寡核苷酸杂交技术可以用于检测每个反应一个突变或多态区域,当寡核苷酸附着在杂交膜和与标记的靶DNA杂交时该技术可以用于检测许多不同突变或多态区域。
备选地,依赖于选择性PCR扩增的等位基因特异性扩增技术可以与本发明结合使用。用作特异性扩增的引物的寡核苷酸可以在分子中央携带所关心的突变或多态区域(因此扩增取决于示差杂交)(Gibbs等(1989)Nucleic Acids Res.17:2437-2448),或者在一条引物的最3’末端,其中在适当条件下可以防止错配,或减少聚合酶延伸(Prossner(1993)Tibtech 11:238)。另外,可以期望在突变区域引入新的限制位点以产生基于切割的检测(Gasparini等(1992)Mol.Cell Probes 6:1)。预期在某些实施方案还可以使用用于扩增的Taq连接酶来进行扩增(Barany(1991)Proc.Natl.Acad.Sci USA 88:189)。在这些情形中,只有当5’序列的3’末端存在完全匹配时发生连接,使可以通过检查扩增的存在或缺乏来检测在特定位点已知突变的存在。
在另一实施方案中,如例如U.S.专利4,998,617和在Landegren,U.等((1988)Science 241:1077-1080)所述,使用寡核苷酸连接测定(OLA)进行等位基因变体的鉴定。OLA方案使用两条寡核苷酸引物,其设计来能够与靶单链的邻接序列杂交。寡核苷酸之一与分离标记例如生物素化连接,另一条可检测地标记。如果在靶分子中发现精确的互补序列,寡核苷酸将杂交以致它们的末端邻接,并产生连接底物。然后连接允许使用抗生物素蛋白或另外的生物素配体回收标记的寡核苷酸。Nickerson,D.A.等已经描述结合PCR和OLA属性的核酸检测分析(Nickerson,D.A.等(1990)Proc.Natl.Acad.Sci.USA 87:8923-27)。在该方法中,将PCR用于实现靶DNA的指数扩增,然后使用OLA检测。
已经开发几种基于该OLA方法的技术并可以用于检测IL-1基因座单倍型的等位基因。例如,美国专利5,593,826公开OLA,其使用具有3’-氨基的寡核苷酸和5’-磷酸化寡核苷酸以形成具有氨基磷酸酯连接的偶联物。在Tobe等((1996)Nucleic Acids Res 24:3728)描述的另一种OLA变体中,与PCR结合的OLA允许在单个微量滴定孔中将两个等位基因分型.通过用独特的半抗原,即羊地黄毒苷和荧光素标记每种等位基因特异性引物,通过使用半抗原特异性抗体可以检测每种OLA反应,所述半抗原特异性抗体用不同酶报告基因(reporter),碱性磷酸酶或辣根过氧化物酶标记.该系统允许使用导致两种不同颜色产生的高通量形式检测两个等位基因.
本发明另一实施方案涉及用于检测发展再狭窄的倾向的试剂盒。该试剂盒可包含一种或多种寡核苷酸,包括与IL-1基因座单倍型的至少一个等位基因5’和3’杂交的5’和3’寡核苷酸。PCR扩增寡核苷酸应当在相隔25和2500个碱基对之间,优选相隔约100和约500个碱基之间杂交,以便产生大小便于随后分析的PCR产物。
特别优选的用于本发明诊断方法的引物包括:用于检测IL-1B(-3737)多态等位基因的
TCTAGACCAGGGAGGAGAATGGAATGTCCCTTGGACTCTGCATGT,和
TCTAGACCAGGGAGGAGAATGGAATGTTCCTTGGACTCTGCATGT;
用于检测IL-1B(-1469)多态等位基因的
ACAGAGGCTCACTCCCTTGCATAATGCAGAGCGAGCACGATACCTGG,和
ACAGAGGCTCACTCCCTTGTATAATGCAGAGCGAGCACGATACCTGG;和
用于检测IL-1B(-999)多态等位基因的
GATCGTGCCACTgcACTCCAGCCTGGGCGACAGGGTGAGACTCTGTCTC,和
GATCGTGCCACTgcACTCCAGCCTGGGCGACAGCGTGAGACTCTGTCTC。
来自包含人IL-1基因座的人染色体2q13-的最新序列信息和最新的关于该基因座可获得的人多态性信息的可用性促进用于通过本发明方法扩增和检测IL-1多态等位基因的另外的寡核苷酸的设计。例如,分别在图1(GenBank登记号X03833),2(GenBank登记号X04500)和3(GenBank登记号X64532)中分别显示关于IL-1A,IL-1B和IL-1RN的DNA序列。使用该序列信息和本领域已知用于设计和优化引物序列的标准技术,可以容易地设计用于检测这些基因中人类多态性的适当引物。例如通过使用可商购的引物选择程序如Primer 2.1,Primer 3或GeneFisher可以完成这些引物序列的最优设计(还参见Nicklin M.H.J.,Weith A.Duff G.W.,“APhysical Map of the Region Encompassing the Human Interleukin-1α,Interleukin-1β,and Interleukin-1 Receptor Antagonist Genes”Genomics 19:382(1995);Nothwang H.G.,等“Molecular Cloning of the Interleukin-1gene Cluster:Construction of an Integrated YAC/PAC Contig and a partialtranscriptional Map in the Region of Chromosome 2ql 3”Genomics 41:370(1997);Clark,等(1986)Nucl.Acids.Res.,14:7897-7914[出版错误在Nucleic Acids Res.,15:868(1987)和URL http://www.gdb.Org的GenomeDatabase(GDB)计划中出现]。
关于试剂盒中的使用,寡核苷酸可以是多种天然和/或合成组合物中的任何一种,如合成寡核苷酸,限制片段,cDNA,合成肽核酸(PNA),等。分析试剂盒和方法还可以使用标记的寡核苷酸以允许测定易于鉴定。可以使用的标记的实例包括放射标记,酶,荧光化合物,链霉抗生物素,抗生物素蛋白,生物素,磁性部分,金属结合部分,抗原或抗体部分等。
试剂盒可以任选地还包括DNA取样装置。DNA取样装置对于本领域技术人员是公知的并且可以包括但不限于基质,如滤纸,AmpliCardTM(University of Sheffield,Sheffield,England S10 2JF;Tarlow,JW.等,J.ofInvest.Dermatol.103:387-389(1994))等;DNA纯化试剂如NucleoTM试剂盒,裂解缓冲液,蛋白酶溶液等;PCR试剂,如10x反应缓冲液,热稳定性聚合酶,dNTP等;和等位基因检测装置如HinfI限制酶,等位基因特异性寡核苷酸,用于从干血的嵌套PCR的简并寡核苷酸引物.
4.3.3药物基因组学
单独或结合关于其它有助于特定疾病或病症的遗传缺陷的信息,了解与发展特定疾病或病症的敏感性相关的特定等位基因允许按照个体的遗传图谱定制化预防或治疗,这是“药物基因组学”的目标。因此,个体IL-1图谱与种群图谱关于血管疾病的比较,允许选择或设计药物或其它治疗方案,其期望对于特定患者或患者群体(即一组具有相同遗传改变的患者)是安全和有效的。
另外,基于遗传图谱瞄准期望显示最高临床益处的群体的能力使可以:1)重新定位已经上市的药物;2)拯救由于安全性或功效限制导致中断临床开发的患者亚群特异性的候选药物;和3)加速和更便宜地开发候选疗法和更优化的药物标签(例如因为测量各种剂量的药剂对致病突变的效果对于优化有效剂量是有用的)。
通过测定蛋白质(例如IL-1α,IL-1β,或IL-1Ra),mRNA和/或转录水平可以监测特定疗法的个体治疗。根据检测水平,然后可以维持或调整(增加或减少剂量)治疗方案。在优选实施方案中,用药剂治疗受试者的效力包含以下步骤:(i)在给药药剂之前从受试者中获得给药前样品;(ii)检测给药前样品中的蛋白质,mRNA或基因组DNA的水平或数量;(iii)从受试者中获得一个或多个给药后的样品;(iv)在给药后的样品中检测蛋白质,mRNA或基因组DNA的表达水平或活性;(v)将在给药前的样品中蛋白质,mRNA或基因组DNA的表达水平或活性与在给药后的样品中对应的蛋白质,mRNA或基因组DNA比较;和(vi)相应地改变对受试者的药剂给药。
还可以在治疗剂给药之前和之后获得受试者的细胞以检测除了IL-1基因以外的基因的表达水平,以证实治疗剂未增加或减少可能有害的基因的表达。这可以通过使用转录作图(profiling)的方法完成。因此,可以将来自体内暴露于治疗剂的细胞的mRNA和来自未暴露于治疗剂的相同类型细胞的mRNA逆转录和与含有来自多个基因的DNA的芯片杂交,由此比较在用治疗剂处理或未处理的细胞中基因的表达。
4.4.用于与IL-1多态性有关的疾病和病症的治疗剂
用于与IL-1多态性或单倍型有关的疾病和病症的治疗剂是指防止或延迟受试者中特定疾病或症状的发展或缓解其症状的任何试剂或治疗方案(包括药物,营养学(nutraceuticals)和外科方法).治疗剂可以是多肽,肽模拟物,核酸或其它无机或有机分子,优选包括维生素,矿物质和其它养分的“小分子”.通过模仿或加强(激动)或抑制(拮抗)天然存在的多肽作用,优选治疗剂可以调节IL-1多肽的至少一种活性,例如与受体的相互作用.激动剂可以是野生型蛋白质或其具有至少一种野生型生物活性例如受体结合活性的衍生物.激动剂还可以是上调基因表达或者增加蛋白质的至少一种生物活性的化合物.激动剂还可以是增加多肽与另一分子例如受体相互作用的化合物.拮抗物可以是抑制或减少蛋白质和另一分子例如受体之间的相互作用的化合物,或者是阻断信号转导或翻译后加工的试剂(例如IL-1转化酶(ICE)抑制剂).因此,优选的拮抗物是抑制或减少与受体结合和由此阻断随后受体激活的化合物.拮抗物还可以是下调基因表达或减少存在的蛋白质的量的化合物.拮抗物可以是显性失活形式的多肽,例如能够与靶肽例如受体相互作用但是不促进受体激活的形式的多肽.拮抗物还可以是编码显性失活形式的多肽的核酸,反义核酸,或能够与RNA特异性相互作用的核酶.还有的其它拮抗物是与多肽结合和抑制其作用的分子.这些分子包括肽,例如不具有生物活性和抑制与受体结合的各种形式的靶肽.因此,这些肽将与蛋白质的活性位点结合和防止它与靶肽相互作用.还有的拮抗物包括与分子表位特异性相互作用,以致结合干涉多肽的生物学功能的抗体.在还有另一优选实施方案中,拮抗物是小分子,如能够抑制多肽和靶受体之间相互作用的分子.备选地,通过与除了受体结合位点以外的位点相互作用,小分子可以用作拮抗物.
IL-1(例如IL-1α,IL-1β或IL-1受体拮抗物)或由与IL-1基因连锁不平衡的基因编码的蛋白质的调节物可以包含任何类型的化合物,包括蛋白质,肽,肽模拟物,小分子,或核酸。优选的拮抗物包括核酸(例如编码IL-1蛋白或被IL-1蛋白上调或下调的基因),蛋白质(例如IL-蛋白质或由此上调或下调的蛋白质)或小分子(例如调节IL-1蛋白表达或结合)。例如使用本文所述的测定可以鉴定的优选拮抗物,包括核酸(例如单(反义)或双链(三链体)DNA或PNA和核酶),蛋白质(例如抗体)和用于制止或抑制IL-1转录和/或蛋白质活性的小分子。
4.4.1.有效剂量
通过在细胞培养物或实验动物中例如用于测定LD50(50%群体致死的剂量)和Ed50(50%群体治疗有效的剂量)的标准药物程序,可以测定这些化合物的毒性和治疗功效。有毒或治疗作用之间的剂量比率是治疗指数,它可以表达为比率LD50/ED50。优选显示大的治疗指数的化合物。尽管可以使用显示毒性副作用的化合物,应当小心设计传递系统,其将这些化合物靶向受影响组织的部位,以便最小化对未感染细胞的潜在损伤和由此减小副作用。
从细胞培养测定和动物研究获得的数据可以用于配制各种用于人类的剂量。这些化合物的剂量优选位于包括ED50具有很小或无毒性的循环浓度范围内。根据所用剂型和所用给药途径,剂量可以在该范围内变化。对于本发明方法中所用的任何化合物,最初从细胞培养测定中可以评估治疗有效剂量。在动物模型中可以配制剂量以获得包括如细胞培养中测定的IC50(即获得症状最大抑制一半的检测化合物的浓度)的循环血浆浓度范围。该信息可以用于更准确地测定人类中的有效剂量。例如通过高效液相色谱可以测量血浆中的水平。
4.4.2.配制和使用
可以使用一种或多种生理上可接受的载体或赋形剂以常规方法配制按照本发明使用的组合物。因此,可以配制化合物和它们生理上可接受的盐和溶剂化物,用于通过例如注射,吸入或吹入(通过嘴或鼻)给药或口服,颊含(buccal),肠胃外或直肠给药。
对于该治疗,可以将本发明化合物配制用于各种负荷的给药,包括系统和局部(topical)或定位(localized)化给药。技术和配制通常可以在Remmington′s Pharmaceutical Sciences,Meade Publishing Co.,Easton,PA中发现。对于全身给药,优选注射,包括肌内,静脉内,腹膜内和皮下。对于注射,可以将本发明化合物配制在液体溶液中,优选在生理相容的缓冲液如Hank’s溶液或Ringer’s溶液。另外,化合物可以以固体形式配制和在即将使用前再溶解或悬浮。还包括冻干形式。
对于口服给药,组合物可以采用例如片剂或胶囊的形式,其是通过常规方法用以下各项制备:药用赋形剂如粘合剂(例如预先糊化的玉米淀粉,聚乙烯吡咯烷酮或羟丙基甲基纤维素);填充剂(例如乳糖,微晶纤维素或磷酸氢钙);润滑剂(例如硬脂酸镁,滑石或硅石);崩解剂(例如马铃薯淀粉或羟基乙酸淀粉钠);或湿润剂(例如十二烷基硫酸钠).可以用本领域公知的方法包衣片剂.用于口服给药的液体制剂可以采取例如溶液,糖浆或混悬剂的形式,或者它们可以作为在使用前与水或其它适当载体组构的干产品存在.通过常规方法用药用添加剂可以制备这些液体制剂,所述药用添加剂如悬浮剂(例如山梨糖醇糖浆,纤维素衍生物或氢化食用脂肪);乳化剂(例如卵磷脂或阿拉伯胶);非水性载体(例如ationd油,油性酯,乙醇或分级的植物油);和防腐剂(例如甲基或丙基对羟基苯甲酸酯或山梨酸).如果适当制剂还可以包含缓冲盐,调味剂,着色剂和甜味剂.
可以将用于口服给药的制剂适当地配制以产生活性化合物的控释。对于颊含给药组合物可以采取以常规方法配制的片剂或锭剂的形式。对于通过吸入给药,按照本发明使用的化合物便利地以来自加压包装或喷雾器的气溶胶喷雾呈递的形式使用适当的推进剂传递,所述推进剂例如二氯二氟甲烷,三氯氟甲烷,二氯四氟乙烷,二氧化碳或其它适当的气体。在加压气溶胶的情形中,通过提供阀门以传递计量的量可以测定剂量单位。可以配制用于吸入器或吹入器的例如明胶的胶囊和药筒,其包含化合物和适当粉末基质如乳糖或淀粉的粉末混合物。
可以配制化合物用于肠胃外给药,其通过注射例如通过大丸剂注射或连续输注。用于注射的制剂可以与加入的防腐剂以单位剂量形式,例如在安剖中或在多剂量容器中存在。组合物可以采取诸如在油性或水性载体中的混悬液,溶液或乳剂的形式,并且可以包含配制试剂如混悬剂,稳定剂和/或分散剂。备选地,活性成分可以是在使用前与适当载体例如无菌不含热原的水组构的粉剂形式。
化合物还可以配制成直肠组合物如栓剂或保留灌肠剂,例如包含常规栓剂基质如可可油或其它甘油酯。
除了前述制剂,化合物还可以配制成贮存制剂。这些长效制剂可以通过移植(例如皮下或肌内)或通过肌内注射施用。因此,例如化合物可以用适当的聚合或疏水性物质(例如作为可接受油中的乳剂)或离子交换树脂配制,或配制成微溶衍生物,例如微溶盐。其它适当的传递系统包括微球体,其提供在延长时期的时间内局部非侵害传递药物的可能性。该技术利用前毛细血管大小的微球体,其可以经由冠状动脉导管注射到例如心脏或其它器官的任何选择的部分而不导致炎症或局部缺血。施用的治疗剂从这些微球体缓慢地释放并被周围组织细胞(例如内皮细胞)吸收。
还可以通过经粘膜或经皮的方法全身给药。对于经粘膜或经皮给药,在制剂中使用适于被渗透的屏障的渗透剂。该渗透剂在本领域公知,并且包括例如用于经粘膜给药胆汁盐和梭链孢酸衍生物。另外,可以使用洗涤剂以促进渗透。经粘膜给药可以通过鼻喷雾或使用栓剂。对于局部给药,本发明的寡聚体可以配制成本领域公知的软膏,药膏,凝胶,或乳膏。可以局部使用洗液以处理损伤或炎症以加速愈合。
如果需要,组合物可以存在于包装或分配器装置之中,其可以含有一种或多种含有活性成分的单位剂量形式。包装例如可以包含金属或塑料箔,如泡罩包装。包装或分配器装置可以附有给药使用说明。
4.5.鉴定治疗剂的测定
基于导致或有助于与IL-1多态性或单倍型有关的疾病发展的突变的鉴定,本发明另外特征在于用于鉴定治疗剂的基于细胞或无细胞的测定.在一个实施方案中,在测试化合物单独存在下或在测试化合物和另外的蛋白质的存在下,温育在其细胞膜外表面上表达IL-1受体或由与IL-1基因连锁不平衡的基因编码的蛋白质的受体的细胞,并例如通过使用微生理仪(microphysiometer)(McConnell等(1992)Science 257:1906)检测测试化合物和受体之间或蛋白质(优选标记蛋白质)和受体之间的相互作用。通过微生理仪检测作为培养基酸化变化的受体和测试化合物或蛋白质之间的相互作用。该测定系统因此提供鉴定例如通过干涉蛋白质-受体相互作用起作用的分子拮抗物以及例如通过激活受体起作用的分子激动剂的方法。
细胞或无细胞测定还可以用于鉴定调节IL-1基因或与其连锁不平衡的基因的表达,调节mRNA翻译或调节mRNA或蛋白质稳定性的化合物。因此,在一个实施方案中,将能够产生IL-1的细胞,或其它蛋白质与测试化合物温育,测量细胞培养基中生产的蛋白质的量,并与从未与测试化合物接触的细胞中生产的蛋白质的量比较。通过各种对照分析,例如测量一个或多个对照基因的表达,可以证实化合物相对于蛋白质的特异性。特别是,该分析可以用于测定反义,核酶和三聚体化合物的功效。
无细胞测定还可以用于鉴定能够与蛋白质相互作用,由此改变蛋白质活性的化合物。该化合物可以例如改变蛋白质的结构由此影响它与受体结合的能力。在优选实施方案中,用于鉴定这些化合物的无细胞测定基本上由反应混合物组成,所述反应混合物包含在结合配体的存在或不存在条件下蛋白质和测试化合物或测试化合物库。测试化合物可以是例如结合配体的衍生物,例如无生物活性的靶肽或小分子。
因此,一个示例的本发明筛选测定包括将蛋白质或其功能片段与测试化合物或测试化合物库接触和检测复合体的形成的步骤。为了检测目的,分子可以用特异的标记来标记,测试化合物或测试化合物库用不同的标记标记。于是在温育步骤和洗涤步骤以后通过测定两种标记的水平可以检测测试化合物与蛋白质或其片段的相互作用。在洗涤步骤以后两种标记的存在表示相互作用。
通过使用检测表面等离子共振(SPR),一种光学现象的实时BIA(生物分子相互作用分析,Pharmacia Biosensor AB)也可以鉴定分子间的相互作用。检测依赖于在生物特异性界面大分子质量浓度的变化,不需要标记任何反应物。在一个实施方案中,可以将测试化合物库固定在传感器表面,例如,其形成微流量池的一个池壁。然后含有蛋白质或其功能片段的溶液连续流过传感器表面。如信号记录所示的共振角的变化显示相互作用已经发生。该技术例如在Pharmacia的BIA技术手册中进一步描述。
本发明另一示例的筛选测定包括以下步骤:(a)形成反应混合物,其包括:(i)IL-1或其它蛋白质,(ii)适当的受体,和(iii)测试化合物;和(b)检测蛋白质和受体的相互作用。与缺乏测试化合物的相互作用相比,在测试化合物存在条件下蛋白质和受体的相互作用的统计学显著变化(加强或抑制)显示可能的拮抗物(抑制剂)。该测试的化合物可以同时接触。备选地,蛋白质可以首先与测试化合物接触适当量的时间,接着将受体加入反应混合物。通过使用各种浓度的测试化合物获得的数据产生剂量反应曲线可以评估化合物的功效。此外,还可以进行对照测定以提供比较的基线。通过各种技术可以检测在蛋白质和受体之间的复合体形成。通过免疫测定,或通过色谱检测,使用例如可检测的标记蛋白质,如放射性标记,荧光标记,或酶促标记的蛋白质或受体,可以定量复合体形成的调节。
典型地,期望固定化蛋白质或受体以促进从非复合形式的一种或两种蛋白质中分离复合体以及适应测定的自动化.在任何适于包含反应物的容器中可以完成蛋白质和受体的结合.实例包括微量滴定板,试管,和微型离心管.在一个实施方案中,可以提供融合蛋白质,其增加允许蛋白质与基质结合的结构域.例如,谷胱甘肽-S-转移酶融合蛋白质可以吸附到谷胱甘肽琼脂糖珠粒(Sigma Chemical,St.Louis,MO)或谷胱甘肽衍生化的微量滴定板上,其然后与受体例如35S-标记的受体,和测试化合物结合,尽管稍微更严谨的条件可能更理想,在有助于复合体形成的条件下,例如在盐和pH的生理条件下,温育混合物。在温育后,洗涤珠粒以去除任何未结合的标记,将基质固定和直接测定放射性标记(例如将珠粒放于闪烁体中),或在随后将复合体解离后在上清液中测定。备选地,复合体可以从基质上解离,通过SDS-PAGE分离,使用如在后附实施例中所述的标准电泳技术从凝胶中定量在珠级分中发现的蛋白质或受体的水平。其它用于固定蛋白质于基质上的技术也可以供主题测定使用。例如,利用生物素和链霉抗生物素的偶联可以固定化蛋白质或受体。也可以制备转基因动物以鉴定激动剂和拮抗物或证实候选治疗剂的安全性和功效。本发明的转基因动物可以包括非人类动物,其包含在适当内源启动子的控制下或在异源启动子的控制下的再狭窄致病突变。
转基因动物还可以是含有在适当启动子的控制下转基因如报告基因或其片段的动物。这些动物用于例如鉴定如通过调节基因表达来调节IL-1蛋白质的生产的药物。获得转基因非人类动物的方法在本领域公知。在优选实施方案中,使用例如以期望模式控制表达的顺式作用序列,将再狭窄致病突变的表达限制在特定的细胞亚群,组织或发育阶段。在本发明中,这种蛋白质的嵌合表达可能对于许多连锁分析类型是关键性的,并且可以另外提供评估例如表达水平影响的方法,所述表达水平可能完全改变另外正常胚胎内小块组织的发育。为此,可以使用组织特异性调节序列和条件调节序列来控制在特定空间分布模式中突变的表达。此外,通过例如条件重组系统或原核转录调节序列可以提供表达的时间分布模式。遗传技术,其允许通过体内位点特异性遗传操作可以调节突变表达,对于本领域技术人员是已知的。
本发明的转基因动物在多个它们的细胞内都包括本发明的致病突变转基因,该转基因改变“宿主细胞”的表型。在说明性的实施方案中,可以使用噬菌体P1的cre/loxP重组酶系统(Lakso等(1992)PNAS 89:6232-6236;Orban等(1992)PNAS 89:6861-6865)或酿酒酵母(Saccharomyces cerevisiae)的FLP重组酶系统(O’Gorman等(1991)Science 251:1351-1355;PCT公开WO 92/15694)来产生体内位点特异性遗传重组系统。Cre重组酶催化位于loxP序列之间的插入靶序列的位点特异性重组。loxP序列是Cre重组酶结合的34个碱基对的核苷酸重复序列并且为Cre重组酶介导的遗传重组所需。当Cre重组酶存在时,loxP序列的定向决定插入靶序列被切除或倒置(Abremski等(1984)J.Biol.Chem.259:1509-1514);当loxP序列定向为正向重复时催化靶序列的切除,当loxP序列定向为反向重复时催化靶序列的倒置。因此,靶序列的遗传重组取决于Cre重组酶的表达。重组酶的表达可以通过启动子元件调节,所述启动子受调节控制,例如组织特异性,发育阶段特异性,通过外加试剂可诱导的或可抑制的。这种调节的控制将仅在重组酶表达受启动子元件介导的细胞中导致靶序列的遗传重组。因此,通过控制重组酶表达可以调节致病突变转基因的表达的激活。
将cre/loxP重组酶系统用于调节致病突变转基因的表达要求构建含有编码Cre重组酶和主题蛋白质的转基因的转基因动物.通过构建“二重”转基因动物可以提供含有Cre重组酶和再狭窄致病突变转基因的动物.提供这些动物的便利方法是使两种各自含有一种转基因的动物交配.
使用原核启动子序列可以提供类似的条件转基因,为了促进转基因的表达所述原核启动子序列要求原核蛋白质同时表达。示例的启动子和相应的反式激活原核蛋白质在美国专利4,833,080中提供。此外,通过类似基因治疗的方法可以诱导条件转基因的表达,其中将编码反式激活蛋白,例如重组酶或原核蛋白质的基因传递到组织并使如以细胞类型特异性的方式表达。通过该方法,转基因可以保持沉默至成年期直至通过引入反式激活物“开启”。
在例举的实施方案中,通过将转基因导入非人类动物的种系中生产本发明的“转基因非人类动物”。在不同发育阶段的胚胎靶细胞可以用来导入转基因。根据胚胎靶细胞的发育阶段使用不同方法。以普遍良好的健康,好的胚胎产率,在胚胎中良好的原核能见度,和良好的生殖适度选择用来实施本发明的任何动物的特定品系。另外,单倍型是一个重要因素。例如,当生产转基因小鼠时,经常使用品系如C57BL/6或FVB品系(JacksonLaboratory,Bar Harbor,ME)。优选的品系是具有H-2b,H-2d或H-2q单倍型的那些如C57BL/6或DBA/1。用于实施本发明的品系它们本身可以是转基因的,和/或者可以是剔除物(knockouts)(即从一个或多个基因部分或完全被抑制的动物获得)。
在一个实施方案中,将转基因构建体导入单一阶段的胚胎。合子是显微注射的最好目标。在小鼠中,雄性原核达到直径约20微米的大小,其允许1-2pl DNA溶液的可重复注射。将合子用作基因转移的目标具有一个主要优势,即在大多数情形中注射的DNA将在第一次卵裂之前整合到宿主基因中(Brinster等(1985)PNAS 82:4438-4442)。结果,所有转基因动物细胞将携带整合的转基因。这通常也将反映在转基因有效的传递给建立者(founder)的后代,因为50%生殖细胞将含有转基因。
通常,将受精的胚胎在适当培养基中温育直至原核出现。约在此时,如下所述将包含转基因的核苷酸序列导入雌性或雄性原核。在一些物种如小鼠中,优选雄性原核。最优选在它被卵核或合子的雌性原核加工以前将外源遗传物质加至合子的雄性DNA互补体(complement)。认为卵核或雌性原核释放影响雄性DNA互补体的分子,其可能通过用组蛋白替换雄性DNA的鱼精蛋白,由此促进雌性和雄性DNA互补体的结合以形成二倍体合子。因此,优选在它受雌性原核的影响之前将外源遗传物质加入雄性DNA互补体或任何其它DNA互补体。例如,在形成雄性原核之后尽可能快地将外源遗传物质加入早期雄性原核,这时雄性原核和雌性原核很好地分离并且都位于近细胞膜。备选地,在它已经被诱导进行解凝聚以后可以将外源遗传物质加入精核。含有外源遗传物质的精子然后可以加入卵子或者可以将解凝聚的精子加入卵子,其后尽可能快地加入转基因构建体。
通过本领域已知的任何方法如例如显微注射,电穿孔或脂转染,可以完成将转基因核苷酸序列导入胚胎。在将转基因核苷酸序列导入胚胎以后,胚胎可以体外温育不同数量的时间,或重移植到替代宿主中,或两者都进行。体外温育至成熟在本发明的范围内。取决于物种,一种常规方法是将胚胎体外温育约1-7天,然后将它们重移植到替代宿主中。
为了本发明的目的,合子基本上是二倍体细胞的形成,其能够发育成完整的生物.通常合子将由含有通过融合来自一个配子或多个配子的两个单倍体核,天然或人工形成的核的卵子组成.因此,配子核必须是天然相容的配子核,即产生能生存的能够进行分化和发育成功能生物的合子的配子核.通常,优选整倍体合子.如果获得整倍体合子,那么相对于任何一个配子起源的生物的整倍体数量,染色体的数量改变应当不超过一个.
除了类似的生物学考虑,物理考虑也决定外源遗传物质的数量(例如体积),所述外源遗传物质可以加入合子的核或者可以形成合子核的一部分的遗传物质。如果未去除遗传物质,那么可以加入的外源遗传物质的量受将被吸收而不物理破坏性的量的限制。通常,插入的外源遗传物质的体积将不超过约10皮升。加入的物理影响不应该如此大以致物理上破坏合子的生存力。因为得到的合子的遗传物质,包括外源遗传物质必须在生物学上能够起始和保持合子的分化和发育成功能生物,DNA序列的数量和种类的生物学限制将根据具体合子和外源遗传物质的功能而变化,并且对于本领域技术人员将容易明显的。
加入合子的转基因构建体的拷贝数目取决于加入的外源遗传物质的总量,并且将是能够使遗传转化发生的量。理论上仅需要一个拷贝;然而通常使用许多拷贝,例如1,000-20,000个拷贝的转基因构建体,以便确保一个拷贝有功能。关于本发明,通常将是有利的是具有多于一个功能拷贝的每个插入外源DNA序列以增强外源DNA序列的表型表达。
只要它不对细胞,核膜或其它存在的细胞或遗传结构是破坏性的,可以使用允许加入外源遗传物质于核遗传物质中的任何技术。将外源遗传物质优选通过微量注射插入核遗传物质。细胞和细胞结构的微量注射是已知的并在本领域中使用。
使用标准方法完成重移植。通常,将替代宿主麻醉,将胚胎插入输卵管。移植到具体宿主中的胚胎的数量将随物种变化,但是将通常比得上天然生产的物种后代数量。
通过任何适当方法可以筛选替代宿主的转基因后代转基因的存在和/或表达。经常使用与转基因的至少一部分互补的探针,通过DNA印迹或RNA印迹分析完成筛选。可以使用利用针对由转基因编码的蛋白质的抗体的蛋白质印迹分析作为备选或另外的筛选转基因产物存在的方法。典型地,从尾组织中制备DNA并通过DNA印迹分析或PCR分析转基因。备选地,尽管任何组织或细胞类型可以用于该分析,但使用DNA印迹分析或PCR检验认为以最高水平表达转基因的组织或细胞转基因的存在和表达。
用于评估转基因存在的备选或另外的方法无限制地包括适当的生物化学测定如酶和/或免疫学测定,针对特定标记或酶活性的组织学染色,流式细胞仪分析等。血液的分析也可以用于检测血液中转基因产物的存在,以及评估转基因对各种类型的血细胞和其它血液成分的水平的影响。
通过将转基因动物与适当的配偶交配,或通过获自转基因动物的卵和/或精子的体外受精,可以获得转基因动物的后代。当进行与配偶交配时,配偶可以是或不是转基因的和/或剔除物;当它是转基因的时,它可以包含相同或不同的转基因,或都含有。备选地,配偶可以是母本品系。当使用体外受精时,可以将受精胚胎移植到替代宿主中或体外温育,或两者都进行。使用任一方法,使用上述方法或其它适当的方法可以评估后代转基因的存在。
按照本发明生产的转基因动物将包括外源遗传物质。另外,在该实施方案中,序列将附着在转录控制元件例如启动子上,所述启动子优选允许在特定类型的细胞中表达转基因产物。
逆转录病毒感染也可以用来将转基因导入非人类动物。发育的非人类胚胎可以体外培养至胚泡期。在该期间,可以以卵裂球为逆转录感染的目标(Jaenich,R.(1976)PNAS 73:1260-1264)。通过酶处理去除透明带可以获得卵裂球的有效感染(Manipulating the Mouse Embryo,Hogan eds.(ColdSpring Harbor Laboratory Press,Cold Spring Harbor,1986)。用于导入转基因的病毒载体系统典型地是携带转基因的复制缺陷的逆转录病毒(Jahner等(1985)PNAS 82:6927-6931;Van der Putten等(1985)PNAS 82:6148-6152)。通过在生产病毒的细胞单层上培养卵裂球容易或有效地获得转染(Van derPutten,上文;Stewart等(1987)EMBO J.6:383-388)。备选地,在后期可以进行感染。可以将病毒或产生病毒的细胞注射到囊胚腔中(Jahner等(1982)Nature 298:623-628)。因为整合仅在形成转基因非人类动物的细胞亚群中发生,大多数建立者将是转基因的嵌合体。另外,建立者可以在基因组的不同位置包含转基因的各种逆转录病毒插入,其通常将在后代中分离。另外,还可以通过子宫内逆转录病毒感染怀孕间期胚胎将转基因导入种系(Jahner等(1982)上文)。
第三类用于转基因导入的靶细胞是胚胎干细胞(ES)。ES细胞获自体外培养和与胚胎融合的移植前的胚胎(Evans等(1981)Nature 292:154-156;Bradley等(1984)Nature 309:255-258;Gossler等(1986)PNAS 83:9065-9069;和Robertson等(1986)Nature 322:445-448)。通过DNA转染或通过逆转录病毒介导的转导可以将转基因有效地导入ES细胞。该转化的ES细胞此后可以与来自非人类动物的胚泡结合。ES细胞此后移植(colonize)胚胎,并有助于得到的嵌合动物的种系。关于综述参见Jaenisch,R.(1988)Science 240:1468-1474。
进一步通过下列实施例来举例说明本发明,所述实施例不应当被认为是以任何方式限制性的。所有引用的参考文献(包括贯穿本申请引用的文献参考,授权的专利,公开的专利申请)的内容特别结合于此作为参考。除非另外说明,本发明的实施将使用本技术领域内的常规技术。这些技术在文献中充分解释。参见例如Molecular Cloning A Laboratory Manual,(第二版,Sambrook,Fritsch和Maniatis,编辑.,Cold Spring Harbor LaboratoryPress:1989);DNA Cloning,卷I和II(D.N.Glover编辑.,1985);Oligonucleotide Synthesis(M.J.Gait编辑.,1984);U.S.专利4,683,195;U.S.专利4,683,202;和Nucleic Acid Hybridization(B.D.Hames & S.J.Higgins编辑.,1984)。
5.实施例
5.1.IL-1B(-3737)多态性的分子分析
在本实施例中,我们克隆,测序和分析了IL-1B基因先前未知的上游多态性对等位基因转录的影响。我们先前已经显示贯穿IL-1基因簇的标记之间的高度连锁不平衡,这新的-3737的多态性与先前已经与改变的IL-1β的生产速率和对炎性和传染病的敏感性有关的-511,-31和+3954的多态性连锁。确定该新的功能多态性的基因型提供对其中IL-1生产有助于发病机理的疾病的敏感性的更直接的遗传测试。
我们研究白细胞介素-1B(IL-1B)基因的不同等位基因的转录活性。这是所关心的,因为在北欧种群中,IL 1B等位基因状态与许多慢性炎性疾病有关,所述炎性疾病包括牙周炎(Kornman,K.S.等(1999),J.PeriodontalRes.34:353),和胃癌(El-Omar,E.等(2000),Nature 404:398)。
阐明构成这些联系的分子机制是重要的,因为它将能够合理设计干预来调节病理过程,并且将改善预后遗传测试的性能.贯穿IL1基因簇的广泛的连锁不平衡(参见Cox,A.等(1998),Am.J.Hum.Genet.62:1180)可以使当前已知的‘标记’多态性与本身与疾病过程因果相关的其它(‘致病多态性’)连锁.‘标记’和‘致病’多态性之间的连锁程度,其可以在种族之间变化,将是使用‘标记’多态性的遗传测试的全球性能的重要决定因素.该情形可以解释可商购的‘PST测试’在北欧种群以外的降低的效用,Kornman,K.S.等(1999),J.Periodontal Res.34:353;Armitage,G.C.等(2000),J.Periodontol 71:164。
鉴定负责对慢性炎性疾病(包括心血管病,牙周炎和胃癌)增加的敏感性的功能IL-1 SNP对于合理设计干预来调节这些致病过程以及改进预后遗传测试是关键性的。我们的研究是设计来研究多态性对IL1B转录的影响。El-Omar和同事(参见El-Omar,E.等(2000),Nature 404:398)描述IL1B-31(TATA框)多态性与胃癌之间的关系,提示改变的与TATA盒结合的转录因子可能负责IL1B基因的转录差异,可能与他们观察的疾病联系(胃癌)因果相关。然而转录测定在他们的文章中未出现。本研究研究了当前已知的IL-1B的SNP的转录活性以及(-3737)IL-1B多态性。
我们进行测量IL1B mRNA延伸的转录速率(核运转)测定。这些实验是在体外外周血单核细胞(PBMC)上进行。用LPS 1μg/ml刺激白细胞,2小时后制备核提取物。从基于它们贯穿IL1B簇的不同基因型选择的多个个体中提取细胞。
在3个分开的时机研究每个个体,并且每个个体计算平均转录活性。本实验设计来研究+3953IL1B多态性的影响;未观察到IL1B活性的显著差异与该多态性相关。然而,当重新分析数据以研究-511多态性的影响时,等位基因特异的转录差异是明显的(参见图2)。
图2的数据支持IL1B转录和-511多态性状态之间的联系。它们不排除其它,连锁的多态性的贡献。数据集可能太小以致不允许单倍型的重新分析(参见Cox,A.等(1998),Am.J.Hum.Genet.62:1180),尽管已经报道单倍型而不是个体多态性与几种疾病相关,所述疾病包括类风湿性关节炎,炎性肠道疾病严重性,和结核病(参见例如Cox,A.等(1998),Am.J.Hum.Genet.62:1180;Wilkinson,R.J.等(1999),J.Exp.Med.189:1863;Heresbach,D.等(1997),Am.J.Gastroenterol.92:1164;Cox,A.等(1999),Hum.Mol.Genet.8:1707)。
IL1B启动子结构
IL1B启动子是广阔的结构,延伸转录起始子上游至少4kb。以下用图解法举例说明(图3)。20世纪90年代早期几项研究通过诱变研究它的功能。该策略在所有情形中类似并由将启动子片段与报告基因连接组成。外显子1是非编码的并且ATG位于外显子2中;NcoI限制位点(CCATGG)包含第一个密码子,允许用容易的方法用报告基因替换IL1B编码序列,保留外显子1和天然剪接信号。
这些研究证明两个主要启动子区域的存在,-近端启动子,从+547(ATG)延伸至约-1000bp,和远端启动子,其位于区域-4000至-2757(图2)。该远端启动子广泛地是指文献中的‘增强子’(如Bensi,G.等(1990),CellGrowth Differ.1:491;Clark,B.D.等(1986)[出版错误出现在NucleicAcids Res 1987,1月26日;15(2):868],Nucleic Acids Res.14:7897;Cogswell,J.P.等(1994),J.Immunol.153:712;Shirakawa,F.等(1993),Mol.Cell Biol.13:1332,尽管还未用实验确定定向独立性。
近端启动子
近端启动子包含多个可能的转录因子结合位点;类似NF-kB的元件已经显示在实验上是重要的(参见Hiscott,J.等(1993),Mol.Cell Biol.13:6231;Monks,B.G.等(1994),Mol.Immunol.31:139;Zhang,Y.和Rom,W.N.(1993),Mol.Cell Biol.13:3831;Krauer,K.G.等(1998),Virology 252:418;Tsukada,J.等(1997),Blood 90:3142,NF-IL6(C/EBP),Shirakawa,F.等(1993),Mol.Cell Biol.13:1332;Zhang,Y.和Rom,W.N.(1993),Mol.CellBiol.13:3831;Godambe,S.A.等(1994),J.Immunol.153:143;Godambe,S.A.等(1994),DNA Cell Biol.13:561,和类似PU-1的元件,Buras,J.A.等(1995),[出版错误出现于Mol Immunol 1995 Oct;32(14-15):1175],Mol.Immunol.32:541;Kominato,Y.等(1995),Mol.Cell Biol.15:59;Lodie,T.A.等(1997),J.Immunol.158:1848;Wara-aswapati,N.等(1999),Mol.CellBiol.19:6803)。
远端启动子
远端启动子由核心区域(-2982→-2729)组成(参见Bensi,G.等(1990),Cell Growth Differ.1:491),其包含多个转录因子结合位点(参见Shirakawa,F.等(1993),Mol.Cell Biol.13:1332)。该区域为单核细胞中IL1B基因的LPS或PMA诱导所需(Bensi,G.等(1990),Cell Growth Differ.1:491;Shirakawa,F.等(1993),Mol.Cell Biol.13:1332)。在-2982→-2729区域内的C/EBP和NF-kB结合位点已经在实验上显示是功能重要的(参见Cogswell,J.P.等(1994),J.Immunol.153:712;Shirakawa,F.等(1993),Mol.Cell Biol.13:1332;Gray,J.G.等(1993),Mol.Cell Biol.13:6678)。缺失诱变显示远端启动子的短-2982→-2729区域负责约60-70%的整个远端启动子区域的活性(Cogswell,J.P.等(1994),J.Immunol.153:712;Shirakawa;F.等(1993),Mol.Cell Biol.13:1332),负责剩余约30%的-3753至-2982区域的序列还未确定。
下列实验论及:上面所示等位基因特异的转录差异是否可以使用报告基因构建体证明;-31或-511多态性是否可以显示与转录差异因果相关;和是否可以发现另外的多态性与转录差异相关。认为所研究区域内的这些调节多态性的存在不排除其它连锁的位于研究区域外的与生理调节有关的多态性的存在。
方法
含有IL1B的粘粒
该粘粒pCOS-IL1 Bus1由我们实验室的M.Nicklin博士提供。它是由Nicklin博士在1993年从EMBL基因组DNA文库中通过杂交分离。用于构建该文库的个体的人种来源未知。限制酶图谱由Nicklin博士提供。将它转化到DH5α大肠杆菌并保持在卡那霉素50μg/ml LB琼脂板上。从单菌落在37℃下在20ml含有5μg/ml卡那霉素的2xYT培养基中扩增。
来源于含有IL1B的粘粒的报告基因构建体
构建一系列这些质粒。预备实验显示载体pGL3-基型(basic)而不是pGL3-增强子(两者来自Promega)适合于计划的转染实验。最初,用NcoI和BamHI切割载体pGL3-基型,来自含有近端IL1B启动子(-1815→+547)的粘粒pCOS-IL1 BusI的NcoI-BamHI片段连接,产生质粒pILG-A1。随后制备第二个质粒,其也包括远端启动子。这是通过用Asp718I和HindIII消化粘粒pCOS-IL1 Bus1和pILG-A1,和将远端启动子-4000至-1815连接到切割的pILG-A1载体中构建的,产生pILG-S1.利用单一的内部限制位点消化pILG-S1和pILG-A1,接着用Klenow DNA聚合酶填补,分子内重连用于产生一系列IL1B启动子的缺失突变体。如此产生的质粒在下表1中显示。
表1:衍生于粘粒pCOS-IL1 Bus1的质粒
| 质粒 | 插入片段 | 所用限制酶 | 源质粒 |
| pILG-S1 | -4200→+547 | Asp718-HindIII,HindIII-NcoI | pCOS-IL1Bus1,pILG-A1 |
| pILG-T1 | -2729→+547 | Asp718I,XhoI | pILG-S1 |
| pILG-A1 | -1815→+547 | BamHI-NcoI | pCOS-IL1Bus1,PGL3-基型 |
| pILG-E1 | -1604→+547 | NheI+EcoRV | pILG-A1 |
| pILG-F1 | -1063→+547 | SmaI | pILG-A1 |
| pILG-G1 | -548→+547 | BstXI+NheI | pILG-A1 |
| pILG-H1 | -516→+547 | SacI | pILG-A1 |
| pILG-J1 | -131→+547 | NheI+HindIII | pILG-A1 |
| PGL3-基型 | 无 | 无 | Promega |
IL1B启动子的诱变
在克隆S1上进行双链自动测序。使用获得的序列信息,设计寡核苷酸改变-511和-31残基(参见El-Omar,E.等(2000),Nature 404:398;和di Giovine,F.S.等(1992),Hum.Mol.Genet.1:450)为备选的碱基。这些寡核苷酸被称为‘-31探针1’和‘-511探针1’。这些寡核苷酸的序列在下面显示(在图1中加下划线)。按照制造商的推荐,使用GeneEditor系统(Promega)将它们用于诱变pILG-A1质粒。单独地和一起使用寡核苷酸以便产生-31和-511状态所有可能的组合。通过双链DNA测序证实成功的诱变和缺乏第二个突变。
pILG-A1衍生物仅包含IL1B启动子的-1815→+547片段,因此用Asp718I和XmaI(SmaI)消化含有这些插入片段的载体,含有2型远端启动子的pILG-S1 Asp718I→XmaI片段连接到突变的近端启动子上。得到的启动子在下表2中显示。
表2突变型2IL1B启动子--31和-511位点的突变的基因型
| -1815→+547 | -4000→+547 | -31的基因型 | -511的基因型 |
| pILG-A1 | pILG-S1 | 2 | 2 |
| pILG-V1 | pILG-AA1 | 1 | 2 |
| pILG-W1 | pILG-AC1 | 2 | 1 |
| pILG-X1 | pILG-AE1 | 1 | 1 |
从人血液和细胞系中提取DNA,和基因分型
这是按照制造商的推荐使用Gentra PureGene血液试剂盒进行的。将DNA重悬浮在50μl TE缓冲液中并保存在-20℃。如ATCC推荐培养细胞系,如下:HL60,A549细胞,U937,MonoMac6,EHEB-1。所有这些细胞系是高加索血统。提取1x107个细胞。从一位人志愿者的PBMC中提取DNA。使用的唯一人志愿者,Ken Kornman博士(R&D主管,白细胞介素遗传公司)提供他对实验的知情同意书。细胞系的基因型如先前所述通过TaqMan方法测定。获得的基因型在表3中显示。
表3所用细胞系的基因型
| 细胞系 | -2018 IL1A | -511 IL1B |
| KK PBMC DNA | 1.2 | 2.2 |
| EHEB-1 | 1.2 | 1.1 |
| MonoMac6 | 2.2 | 1.2 |
| U937 | 未测定 | 1.1 |
| A549 | 1.1 | 2.2 |
| HL60 | 1.1 | 1.2 |
人IL1B启动子的PCR克隆
优化用于PCR克隆人IL1B启动子的条件。研究单独校对酶(Pfu和Pfx),但仅观察到校对/Taq组合有产物。最终使用的条件是Trioblock温度循环仪,薄壁管,油,25μl反应物,500pg模板,200nM dNTPs,1mM引物ILG-9和ILG-18,制造商(Stratagene)提供的1xHerculase聚合酶缓冲液。Herculase是Pfu-turbo和Taq DNA聚合酶的混合物。循环如下:94℃2分钟,然后用0.5μl Herculase聚合酶热起始,然后30个循环(94℃30秒,66℃30秒,72℃6分钟).将产物稀释至50μl,使用按照制造厂商的方案(Clontech)使用Chromospin 200凝胶过滤柱去除聚合酶和缓冲液。用下列酶消化洗脱产物:10U Asp718I,0.02U NcoI。这实现内部和3’NcoI位点的部分消化。将混合物热灭活并以适当比率连接到Asp718I-NcoI消化的pGL3-基型载体,并转化到文库效率DH5α细胞(LifeTechnologies)。通过针对远端增强子的PCR筛选和/或通过限制酶分子鉴定阳性克隆。
从每个模板获得每种基因型的至少两个克隆。这些克隆来自完全独立的PCR反应,因此即使发生在PCR循环的早期,PCR突变可以基于它们在多个分离株中的存在而区分于多态性。
在LB培养基中培养质粒。对于大量制备,使用150ml培养物。并保存于不含内毒素的TE缓冲液(Qiagen)和管子(Cryovials,对所有用于转录分析的质粒进行ElutioPlasmid大量制备,并且使用Qiagen不含内毒素的大量制备系统,如制造厂商推荐,除了在50ml不含内毒素的一次性离心管中在3,500rpm下在Sanyo外开式组织培养离心机中进行最后的异丙醇沉淀步骤,该方法产生极好的沉淀。Nalgene)。在至少两个时机下通过UV分光光度法测定浓度并通过限制酶分析和凝胶定量证实。
多态性鉴定
分离克隆并使用一组为该目的设计的内部引物通过自动测序来测序。如果用Factura碱基调用算法(base calling algorithm)(ABI)评估存在>2%的模糊度,序列不被接受。在用Factura 1.1模糊度标记以后,通过一次完成的AutoAssembler 2.1(ABI)将序列轨迹装配成单个重叠群。进行手工编辑装配不好的区域和碱基调用。将获得的重叠群和注释的色谱图附在CD上。通过自动装配器使用缺省参数计算共有序列,使用从http://www.ncbi.nlm.nih.gov获得的独立式Mac可执行的Genetyx-Mac 7.3(Software Development Corp.)和/或ClustalX对比和检查获得的序列。通过视觉检查在对比序列中搜索多态性,并且认为在相同位置在多于一个序列中出现的序列之间是有差异的。在仅一个序列中发现的单碱基对差异被认为是可能PCR诱导的突变并同样标记。
细胞系
在含有氨苄青霉素-链霉素和10%热灭活的胎牛血清的RPMI1640中培养RAW264.7细胞(ECACC 91062702)。使用低内毒素(<10mIU/ml)血清(Life Technologies)。通过每3-4天刮削1∶6(面积∶面积)分离细胞。
转染和转录测定
将在100μl完全培养基中的RAW264.7细胞以2.5x104细胞/孔的密度铺至96孔平板中。24小时后用400ng驱动萤火虫荧光素酶表达的表达载体和100ng驱动Renilla荧光素酶在组成型启动子下表达的pTK-rLuc(Promega)转染它们。这按照制造商的方案使用2.5μl Superfect(Qiagen)进行。在加入后2.5小时将培养基/DNA/脂质体混合物吸出并替换以150μl预先加热的完全培养基。其后24小时,加入激动剂,在加入激动剂6小时后进行两种荧光素酶活性(Dual-Luciferase,Promega)的测定。标准化的荧光素酶活性表示为萤火虫/renilla荧光素酶光产生。
结果&讨论
RAW细胞-适于IL1B研究的细胞系
本研究使用RAW264细胞,分化的类似巨噬细胞的细胞系,其先前已经显示是适合于研究IL1B启动子的模型.Shirakawa,F.等(1993),Mol.Cell Biol.13:1332。结果显示远端启动子对于有效诱导导入质粒的IL1B启动子是必需的(见图)。
-31或-511多态性的突变对2型启动子的影响
已经提出IL1B启动子的-31 TATA盒的多态性负责等位基因间的转录差异,和随之发生的与IL1B表型相关的病理作用(参见El-Omar,E.等(2000),Nature 404:398)。对于几种其它基因已经证明该机制(参见例如Antonarakis,S.E.等(1984),Proc.Natl.Acad.Sci.U S A 81:1154;Humphries,A.等(1999),Blood Cells Mol.Dis.25:210;Peltoketo,H.等(1994),Genomics 23:250;Takihara,Y.等(1986),Blood 67:547)。如方法中所述,通过定点诱变突变获自基因组DNA文库的-511启动子构建体,以获得具有在-31和-511位置多态性的所有可能组合的2型构建体。通过该技术应当可辨别单独或结合可归因于这些多态性的转录活性。其中1型启动子具有突变的这些位点的相反的实验与显示的2型启动子的数据互补(参见图4)。
图4显示进行的3个代表性的实验,其中没有一个观察到与-31或-511等位基因状态相关的转录差异。在左手图片中,对于突变株(-31=2,-511=2)和野生型(-31=1,-511=1)启动子,显示使用的LPS浓度和启动子反应之间的剂量-反应关系。在所有测试的浓度下两个启动子之间的转录等价是明显的。
不同来源的IL1B等位基因的克隆
使用长距离PCR来扩增IL1B启动子。这要求优化,但实现特异性扩增。最初单独使用校对聚合酶的尝试是不成功的(参见图5)。为了克隆产物,用Asp718I和NcoI消化PCR产物并连接到报告基因载体pGL3-基型中。决定不使用序列独立的克隆方法,因为来自这些的产率极低而没有选择系统来阳性选择插入片段。这可能有助于不利的序列中的偶然突变(oddmutation),并且难以控制。
通过PCR获得克隆
尽管从所有经过试验的PCR模板获得产物,克隆仅以一定比例(in aproportion)成功。从KK模板和EHEB-1模板的产物获得两个独立的反应;从MonoMac6DNA获得一个。从每个反应挑取一个克隆。表4显示获得的克隆。总之,存在两个1型克隆(两者都来自EHEB-1细胞系),两个来源于KK DNA的2型克隆,一个来自MonoMac6DNA的2型克隆。
表4通过PCR克隆获得的基因组克隆
来源 PCR-1 PCR-2
Ken K 2,2 AN1 在-511和-31处 AM1 该克隆还
基因型=2 未测序
MonoMac6 1,2 AI3 基因型
-511=2,-31=2
AI13 还未检测功能
Eheb1 1,1 AJ2 1型 AT1 1型
粘粒 2 S1 基因型=2
-511 1型和2型启动子之间的转录差异的评估
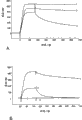
用上述构建体转染RAW264细胞,在加入不同剂量的脂多糖以后测定转录活性。尝试两种制剂-商业制剂和高度纯化的制剂,后者是Dr S.Vogel的礼物.在用pILG-S1和它的突变体的较早实验中用两种制剂获得类似的结果,并且在这些实验中仅使用高度再纯化的制剂.进行3组实验来研究IL1B等位基因的转录.所有3次实验显示1型和2型启动子活性之间的差异.
图6显示三次实验之一。用不同等位基因转染孔。每个启动子转染三个孔。每个孔的转染混合物单独设置。左手图片显示当用300pg/ml LPS刺激细胞时每个孔的转录活性。与2型启动子相比,1型观察到增加的转录活性。1型比2型启动子的几何平均值的差异是显著不同的(P<0.01,Kruskall-Wallis)。右图显示仅在低剂量LPS时该现象明显。该图显示三个在每个剂量下转染的三份的孔的平均值。误差棒未显示(为了清楚)但偏差为每个点平均值的约15-20%。在较高剂量下(在6小时,本实验所用时间点)在低剂量下显示的差异不明显。
在第二个实验(图7)中,更详细地检验剂量和基因型之间的关系。仅检验克隆pILG-AJ2(2型,来自KK)和pILG-AM1(1型,来自EHEB-1)(参见图6)。结果显示与上述实验完全相同的模式。特别是,含有新的IL-1B(-3737)多态性的质粒在等位基因1和等位基因2之间在转录速率方面显示2-3倍的差异,等位基因1与较高的转录速率相关。该影响在LPS剂量<10ng/ml下显著。通过新的SNP的等位基因的特异性突变证实启动子活性的差别影响。因此似乎在IL-1B基因很远上游增强子区域中的该新的IL-1B(-3737)多态性导致对LPS应答的转录的功能差异。
在第三个实验(图8)中,如测定时间和观察的差异之间的关系那样再次检验剂量反应关系。在本实验中,在AM1和AJ2(1型和2型)克隆之间也存在差异,但剂量反应曲线的形状稍微不同。这个差异的原因不清楚。所有实验以表面上相同的方式进行,但可能技术差异,如精确的细胞密度可能改变细胞行为。
图8的下图显示取样时间对在6小时观察到的差异的影响,6小时是在所有其它实验中使用的时间。时间不是所观察到的差异的决定因素。将载体平行加入对照孔:在这些实验中未观察到报告基因的诱导(未显示)。总之,实验证明存在在所有进行的实验中可证明的清楚和可重复的转录活性差异(1型>2型)。
克隆的测序&新的多态性的功能潜力的评估
根据观察到的功能差异,如方法中所述将获得的基因组克隆测序并分析。检测到5个多态性;2个是已知的,并且是-31和-511多态性。3个是新的。
通过BLSAT搜索(http://www.ncbi.nlm.nih.gov/blast),将这些新的多态性约20bp上游和下游的基因组与非冗余人DNA数据库比较。使用位于(http://transfac.gbfbraunschweig.de/TRANSFAC/index.html)的生物信息学服务器使用TRANSFAC 4.0数据库在相同片段中搜索转录结合位点。
所用的序列在下面表示:
对于在-3737的多态性:
5’TCTAGACCAGGGAGGAGAATGGAATGT(C/T)CCTTGGACTCTGCATGT 3’
所示序列跨越在IL-1B启动子的-3737的C/T多态性。等位基因1是C,等位基因2是T。
对于在-1469的多态性:
5’ACAGAGGCTCACTCCCTTG(C/T)ATAATGCAGAGCGAGCACGATACCTGG3’
所示序列跨越在IL-1B启动子的-1469的C/T多态性.等位基因1是C,等位基因2是T.
对于在-999的多态性:
5’GATCGTGCCACTgcACTCCAGCCTGGGCGACAG(G/C)GTGAGACTCTGTCTC3’
所示序列跨越在IL-1B启动子的-999的G/C多态性。等位基因1是G,等位基因2是C。
仅在人IL-1B基因中发现-3737和-1469片段。在>200个基因中发现-999片段,提示它是重复元件的一部分。在-999重复元件中未鉴定转录因子结合位点,但其它两个片段都含有针对促炎转录因子的共有序列。-3737多态性是在NF-kB共有结合序列中,而-1469是在NF-IL6(C/EBP)共有结合序列中。在两种情形中,用负链对比。显示搜索引擎的输出。左边的代码与Transfac条目连接。显示的概率反映匹配的优度,使用两种不同算法计算,并表示良好的匹配。
-3737 5’TCTAGACCAGGGAGGAGAATGGAATGT(C/T)CCTTGGACTCTGCATGT 3’
矩阵代码 起始 P1 P2
V$NFKB_Q6 |19(-)|1.000|0.927|aaGGGAcattccat
-14695’
ACAGAGGCTCACTCCCTTG(C/T)ATAATGCAGAGCGAGCACGATACC
TGG 3’
矩阵代码 起始 P1 P2
V$CEBP_C |11(-)|0.992|0.901|tgcattatGCAAGggagt
V$CEBPB_01 |14(-)|1.000|0.967|gcattatGCAAggg
结果在下表5中总结。
表5通过该克隆/测序方案检测的多态性
| SN多态性 | 与-511相关和转录测定 | 发现转录因子结合共有序列 |
| -31 | 是 | TATA |
| -511 | 是 | 无 |
| -999 | 否 | 无 |
| -1469 | 否 | C/EBP/NF-IL6家族 |
| -3737 | 是 | NF-κB家族 |
结论
先前未知的-3737多态性位于远端启动子区域中的候选NF-kB结合位点,所述远端启动子先前通过诱变显示负责整个启动子高达30%的活性.当将该启动子的不同等位基因放置在报告基因的上游时发现可重复的和显著的差异.贯穿该区域的连锁不平衡产生单倍型,具有先前已知的在-31和-511的SNP,其在这些实验中显示对报告基因的转录无可检测的独立的影响.结果证明与这些近端上游多态性相关的疾病不能机械地通过由这些多态性它们本身导致的功能改变来解释,它们与在远端上游启动子中的新发现的改变功能的-3737多态性连锁是更可能的解释.
实验总结
1.RAW264.7类巨噬细胞的细胞对人I-L1B启动子的片段反应。最大反应性需要包含Asp718I(-4000)→NcoI(+547)的片段的片段。该结果符合公布的数据。
2.通过长距离PCR可以克隆人IL1B启动子的该区域。
3.使用高加索人血统的DNA为模板,从独立的PCR实验中获得1型(在-511处)IL-1B等位基因的两个等位基因和三个2型(在-511处)等位基因。
4.这些克隆的转录分析显示在用LPS诱导后转录速率的统计学显著差异。在所有进行的实验中都发现这些差异。
5.IL-1B启动子的LPS诱导在剂量-反应关系方面在转染和转染之间不同。其原因还不清楚。在一些实验中,1型和2型等位基因之间的差异在次最大(submaximal)的LPS剂量下明显,此时1型和2型等位基因之间的转录速率差异约2-3倍。
6.在-31和-511的2型等位基因的诱变不影响启动子的转录活性。
7.1型和2型启动子之间的转录差异因此应当是由于除了迄今发现的那些以外的多态性导致。进行获得的克隆的自动双链测序以便鉴定未知的多态性。
8.多态性定义为在不同克隆中的相同位置出现的变异。在仅一个克隆中观察到的单碱基对改变被认为是PCR诱导的突变。在该段DNA(IL-1BAsp718I(-4000)→NcoI(+547))序列中检测到5个多态性。2个在-511和-31的多态性是已知的,其它3个还未在文献中描述。
| 单核苷酸多态性 | 与-511相关和转录测定 | 发现转录因子结合共有序列 |
| -31 | 是 | TATA盒 |
| -511 | 是 | 无 |
| -999 | 否 | 无 |
| -1469 | 否 | C/EBP/NF-IL6家族 |
| -3737 | 是 | NF-kB家族 |
9.先前未知的-3737多态性位于远端启动子区域中的候选NF-kB结合位点,所述远端启动子先前通过诱变显示负责启动子高达30%的活性.
5.2IL-1B(-3737)多态性与中国种群的牙周炎相关
尽管某些IL-1基因多态性,如IL-1A(+4845)和IL-1B(+3954),已经与高加索人中牙周病的严重性相关联,它们偶尔在一些种群包括中国人中发现。在这方面先前还未研究新的单核苷酸多态性(SNP),存在IL-1b基因的远上游增强子区域中的IL-1B(-3737)。特别地,IL-1B(-3737)多态性的等位基因1已经显示增加转录速率(参见以上)。在本研究中,我们评估IL-1B(-3737)基因型的种群分布和确定它与中国人遗传个体中的疾病的相关性。
方法
通过TaqMan方法进行IL-1B(-3737)和其它IL-1SNP的基因分型。在500个成人(年龄27-77岁)的未知牙周病状态的高加索人群体中,和300个中国人遗传个体(年龄21-69岁)中评估IL-1B(-3737)的分布。如果他们的生母和父亲祖父母和曾祖父母是源于中国大陆,台湾,澳门或香港,受试者被认为是中国人遗传。为了包括在本研究中,受试者必须健康良好和具有至少14颗天然牙齿。通过多变量逻辑回归模型的方法确定在中国人种群中IL-1B(-3737)和牙周病的关联。
结果
IL-1B(-3737)基因型分布如下表所示:
| IL-1B3基因型 | 高加索人%(N) | 中国人%(N) |
| 1.1 | 30.2(151) | 22.3(67) |
| 1.2 | 49.0(245) | 54.0(162) |
| 2.2 | 20.8(104) | 23.7(71) |
在高加索人中,在携带低转录基因型,IL-1B(-3737)=2.2(n=97)的受试者中,88.3%对于复合IL-1基因型也是负的,所述复合IL-1基因型包括在IL-1A(+4845)和IL-1B(+3954)处的等位基因2。在复合IL-1基因型为正的受试者((n=201))中,94%在IL-1B(-3737)处携带等位基因1,高转录等位基因。在非吸烟者的中国人受试者(n=163)中,IL-1B(-3737)基因型与疾病显著相关(OR=3.027;95%CI:1.139-8.046;p=0.026),在携带高转录基因型1.1的那些中有增加的风险。
结论
在高加索人中,大多数对于复合IL-1基因型为正的个体对于新发现的增加转录速率的IL-1B(-3737)基因型为正。发现IL-1B(-3737)基因多态性在中国人中频繁出现,基因型的分布在中国人和高加索人中类似。在中国人个体中,IL-1B(-3737)高转录基因型与牙周病显著相关。
5.3.NF-κB与-3737和其它功能多态性结合的Biacore结合分析
p50同型二聚体与DNA相互作用的动力学分析
使用BIAcore研究NF-κB p50结合以获得蛋白质与附着在链霉抗生物素传感器芯片的DNA底物(substrate)相互作用的动力学参数.双链体1含有共有NF-κB结合位点,双链体2和3区别于共有序列内的单核苷酸多态性(参见表6).在低盐条件(75mM NaCl)和高盐浓度(150mM NaCl)下将各种浓度的蛋白质通过传感器芯片表面。Hart,等((1999)NucleicAcids Res.27,1063-1069)。先前已经显示盐浓度影响DNA识别的亲和力和特异性。在图9A中显示在低盐浓度下NF-κB p50与DNA底物的结合。图9显示NF-κB p50同型二聚体与DNA底物的结合。(A)显示在75mMNaCl下NF-κB p50(17.5nM)与不同双链体DNA底物结合的传感图(sensorgram)。(B)显示在150mM NaCl下NF-κB p50(17.5nM)与不同双链体DNA底物结合的传感图。结合是对全部3个DNA底物观察的,然而可以从传感图清楚地看到解离速率常数(解离梯度)在3种复合体中不同。分别从传感图的缔合和解离阶段计算缔合和解离速率常数,并在表7中表示。这些结果显示NF-κB p50以相似的1-5X106(M-1s-1)数量级的缔合速率常数与不同的DNA底物结合。然而,各种DNA-蛋白质复合体的解离速率常数显著不同。NF-κB p50-共有DNA复合体(双链体1)具有最低的解离速率常数(最稳定的复合体)。使用实验ka和kd值计算平衡解离常数并在表7中表示。显示NF-κB p50与它的共有序列以15pM的亲和力结合(在75mM的盐下),这符合先前的SPR分析(Hart等,1999),而双链体2的亲和力是130pM,双链体3为2000pM。
然后在类似更生理学条件(0.15M NaCl)的更高的盐浓度下重复SPR分析。NF-κB p50与DNA底物的结合在图9B中显示。结果显示在这些条件下未观察到与双链体3结合。此外,双链体1和2显示相似的缔合但是不同的解离动力学,而且与在75mM NaCl下的结合相比,蛋白质与双链体2结合(如通过反应的水平发现)的水平低很多。在150mM NaCl下结合的动力学数据在表7中显示。结果再次显示相似的缔合速率常数,但显著不同的解离速率常数。与在75mM NaCl下的速率相比,对于两种蛋白质-DNA复合体的解离速率常数较高,显示在较高盐浓度下复合体降低的稳定性。此外,与在较低盐浓度下看到的4倍差异相比,双链体1/2-NF-κBp50复合体的解离速率常数现在存在36倍差异。共有序列-NF-κB p50结合的平衡解离常数分别是0.2nM和12nM,与在低盐条件下看到的9倍亲和力差异相比,显示60倍的亲和力差异。这些结果显示在较高盐浓度下对DNA底物的总亲和力降低,然而DNA识别的特异性提高,对于双链体3未观察到结合,与共有序列和双链体2比较60倍的亲和力差异。
IF-KB结合位点的分子识别
对于结合DNA底物的NF-κB p50同型二聚体的相互作用已经获得两个晶体结构(参见Müller,等(1995)Nature,373,311-317;Ghosh,等(1995)Nature,373,303-310)。尽管两个共晶体结构包含不同长度和序列的DNA底物,存在许多相似性。在每个p50同型二聚体亚基中两个Arg侧链捐助一对氢键给两个中央的鸟嘌呤(G2和G3,见表6)。这些接触预计是DNA识别的最关键的元件(Müller等,1995)。尽管由于Lys侧链的相对无约束的性质特异性较不可预测,还已知Lys残基与最内部的G4进行特异性的接触。还在来自Müller等,1995的结构中确定最外面的G1与His侧链接触。在侧链和碱基之间存在许多其它特异性的相互作用,其在两个共晶体结构中稍微不同。这提示一些DNA结合元件是柔性的并因此能够识别共有序列的可变部分内的不同序列。通过比较在SPR实验中使用双链体2和3获得的动力学数据,检查SNP对p50同型二聚体的DNA识别的影响。与双链体2中的G/C碱基对相比,双链体3在+4位置包含A/T碱基对。G4显示与晶体结构中的Lys(编号241,来自Ghosh等,1995)进行重要相互作用(见图9B).然而,用腺嘌呤替换鸟嘌呤取消了该相互作用,并且在Lys侧链和腺嘌呤的N6氨基之间产生可能的空间抵触.在此处提供的亲和力数据中清楚地证明该相互作用的影响,其显示在低盐条件下亲和力降低15倍.因为由于极快的脱离速率和蛋白质-DNA复合体的不稳定性导致对双链体3未发现结合,在较高盐条件下该差异预计大得多.这些结果证明SNP对NF-κB p50的分子识别的显著影响。结果还显示共有序列中G1位置的改变的影响。与双链体1(共有序列)相比,双链体2在位置1和12含有A/T碱基对。晶体结构(Müller等,1995)显示His 67与每个p50亚基的G1接触(见图9D),用腺嘌呤替换G1再次消除该相互作用。该影响在亲和力数据中再次证明。在低盐条件下,存在亲和力9倍的减小,在高盐下这增加到60倍的差异。总之此处提供的亲和力数据显示,与G1至A1的改变相比,将G4改变成A4导致大得多的对NF-κB p50的DNA相互作用的亲和力的影响。这些对亲和力的影响可以容易地与结构数据一致。
材料和方法
寡核苷酸底物
氰乙基亚磷酰胺化学在Applied Biosystems 394DNA合成仪上进行寡核苷酸的合成。从Glen Research获得生物素亚磷酰胺。通过退火长度为23个碱基的互补寡核苷酸产生3种双链体DNA底物,其中一条链在5’末端被生物素化。通过加热至95℃5分钟和冷却至25℃35分钟,以在10mM Tris-HCl(pH.7.4),0.1M NaCl,3mM EDTA中1μM的最终DNA浓度进行退火。在构建双链体DNA中使用的序列是:
双链体15’-生物素-AGTTGAGGGGACTTTCCCAGGC和互补链5’-GCCTGGGAAAGTCCCCTCAACT。
双链体2,5’-生物素-GAGAATGGAATGTCCCTTGGACT和互补链5’-AGTCCAAGGGACATTCCATTCTC。
双链体3,5’-生物素-GAGAATGGAATGTTCCTTGGACT和互补链5’-AGTCCAAGGAACATTCCATTCTC。下划线区域是p50结合位点,黑体字母表示在本研究中分析的SNP。
表面等离子共振
使用BIAcore 2000TM(Uppsala,瑞典)进行表面等离子共振(SPR)。将寡核苷酸稀释在HBS缓冲液(10mM HEPES pH 7.4,75-150mM NaCl,3mM EDTA,0.05%(v/v)表面活性剂P20)中至终浓度为1ng/ml,并以10μl/分钟的流速经过链霉抗生物素传感芯片(SA)直至约50个反应单位(RU)的寡核苷酸与传感芯片表面结合。也将重组(人)NF-κB p50(Promega)稀释在含有150mM或75mM NaCl的HBS缓冲液中,并将各种浓度(2-100nM)以20μl/分钟的流速注射到带DNA的传感芯片上3分钟,并允许解离5分钟。通过注射10μl 1M NaCl去除结合的蛋白质。该再生方法不改变NF-κB p50对DNA的能力。使用BIA评估软件进行数据分析。为了去除在注射开始和结束时体积(bulk)折射率变化(其是由于流动的缓冲液和注射蛋白的组成的差异而发生)的影响,从每个蛋白注射中减去在链霉抗生物素表面获得的对照传感图。所有测定在25℃下进行。
动力学分析
在二元缔合中复合体形成速率由下式描述:
dR/dt=kaC(Rmax-R)-kdR (1)
其中dR/dt是SPR信号变化的速率,C是分析物的浓度,Rmax是在RU中最大分析物结合量,R是在t时刻RU中的SPR信号。可以重新排列方程给出:
dR/dT=kaCRmax-(kaC+kd)R
在至少5个不同分析物浓度下记录传感图,对于每个浓度将dR/dT对R作图。这些直线每一个的斜率(kaC+kd)表示观察到的缔合率,-kobs。将-kobs对C作图允许从以下方程确定ka。
-kobs=kaC+kd
在样品注射结束时,通过流动缓冲液替换蛋白质,结合的蛋白质从DNA上解离。因为在流动缓冲液中的蛋白质浓度为零,并假设重结合可忽略,那么使用下列方程假设零级离解使用线性回归分析可以计算解离速率常数:
其中dR/dt是SPR信号的变化速率,R和R0是在时间t和t0的响应,kd是解离速率常数。
从速率常数的比率可以获得平衡解离常数(KD):
KD=kd/ka
| DNA | 序列5’-3’ |
| 双链体1 | AGTTGA<u>GGGGACTTTCCC</u>AGGCTCAACT<u>CCCCTGAAAGGG</u>TCCG |
| 双链体2 | AGTCCA<u>AGGGACATTCCA</u>TTCTCTCAGGT<u>TCCCTGTAAGGT</u>AAGAG |
| 双链体3 | AGTCCA<u>AGGAACATTCCA</u>TTCTC |
| TCAGGT<u>TCCTTGTAAGGT</u>AAGAG | |
| 共有序列 | 123456789101112GGGGXNYYYCCCCCCCYNXXXGGG |
表6.用于SPR结合分析的寡脱氧核苷酸底物。共有序列和编号方案在下面显示,其中X表示嘌呤,Y嘧啶。
表7.p50与寡脱氧核苷酸底物结合的动力学速率常数(ka和kd)和计算的平衡结合常数(KD)。
5.4.另外的功能多态性的发现
遗传发现组已经证实通过在RAW细胞中转染分析IL-1B4 SNP(-3737)是有功能的(参见图10),另外发现如下本测定中也是有功能的其它多态性。功能SNP分析的构建策略和序列信息在图11中显示,该图显示所有产生和分析的构建体的名称。
鉴定三个另外的功能SNP,称为IL-1B3,IL-1B7和IL-1B15(这些SNP名称使用用于在图11中显示的单独等位基因2多态性的命名系统)。
IL-1B3等位基因2和IL-1B15等位基因-2减小RAW(鼠巨噬细胞)和THP-1细胞(人单核细胞)中的转录速率(参见图11中的序列数据和图10及图12中的实验数据)。IL-1B7等位基因-2(基因型TGCATGGGGTC)减小RAW细胞中的转录速率(见图10),IL-1B7等位基因-2增加THP-1细胞中的转录速率(见图12)(等位基因1SNP)。图10还显示IL-1B3(基因型TACATAGGGTC)和IL-1B15(基因型TGCATAGGGTT)显著降低RAW细胞中IL-1B的表达。
结合参考
本文引用的所有专利和出版物在此引用作为参考。
等价物
本领域技术人员将认识到或能够仅仅使用常规实验确定,在此描述的本发明具体实施方案的许多等价物。这些等价物意欲被包含在后附的权利要求中。
Claims (4)
1.一种分离的核酸,其包含人基因组序列的20个邻接的核苷酸,所述核苷酸包括-3737白细胞介素-1β多态等位基因,其中所述20个邻接的核苷酸对应于所述-3737白细胞介素-1β等位基因1序列:
TCTAGACCAGGGAGGAGAATGGAATGTCCCTTGGACTCTGCATGT。
2.一种分离的核酸,其包含权利要求1的互补序列。
3.权利要求1的分离的核酸,其中所述对应于白细胞介素-1β的-3737的核苷酸位于所述核酸分子的3’末端。
4.权利要求1-3中任何一项的核酸,其另外包含可检测的标记。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US33168101P | 2001-11-19 | 2001-11-19 | |
| US60/331,681 | 2001-11-19 | ||
| US38602002P | 2002-06-05 | 2002-06-05 | |
| US60/386,020 | 2002-06-05 | ||
| PCT/US2002/037222 WO2003044176A2 (en) | 2001-11-19 | 2002-11-19 | Functional polymorphisms of the interleukin-1 locus affecting transcription and susceptibility to inflammatory and infectious diseases |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201010156318.0A Division CN101955943A (zh) | 2001-11-19 | 2002-11-19 | 影响转录和对炎性和传染性疾病的敏感性的白细胞介素-1基因座的功能多态性 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1753903A CN1753903A (zh) | 2006-03-29 |
| CN1753903B true CN1753903B (zh) | 2010-05-12 |
Family
ID=26987865
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201010156318.0A Pending CN101955943A (zh) | 2001-11-19 | 2002-11-19 | 影响转录和对炎性和传染性疾病的敏感性的白细胞介素-1基因座的功能多态性 |
| CN02827282.XA Expired - Fee Related CN1753903B (zh) | 2001-11-19 | 2002-11-19 | 影响转录和对炎性和传染性疾病的敏感性的白细胞介素-1基因座的功能多态性 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201010156318.0A Pending CN101955943A (zh) | 2001-11-19 | 2002-11-19 | 影响转录和对炎性和传染性疾病的敏感性的白细胞介素-1基因座的功能多态性 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US20030235890A1 (zh) |
| EP (1) | EP1463745A4 (zh) |
| JP (2) | JP4492849B2 (zh) |
| KR (2) | KR101019131B1 (zh) |
| CN (2) | CN101955943A (zh) |
| AU (1) | AU2002359431A1 (zh) |
| CA (1) | CA2467717A1 (zh) |
| WO (1) | WO2003044176A2 (zh) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7820383B2 (en) | 1997-03-10 | 2010-10-26 | Interleukin Genetics, Inc. | Method for diagnosing myocardial infarction |
| GB9711040D0 (en) * | 1997-05-29 | 1997-07-23 | Duff Gordon W | Prediction of inflammatory disease |
| IL147182A0 (en) * | 1999-06-30 | 2002-08-14 | Interleukin Genetics Inc | Diagnostics and therapeutics for diseases associated with an il-1 inflammatory haplorype |
| US20080311581A1 (en) * | 2001-11-19 | 2008-12-18 | David Wyllie | Functional polymorphisms of the interleukin-1 locus affecting transcription and susceptibility to inflammatory and infectious diseases |
| US20070264645A1 (en) * | 2002-01-25 | 2007-11-15 | Kenneth Kornman | IL-1 gene cluster and associated inflammatory polymorphisms and haplotypes |
| DE60319719T2 (de) * | 2002-09-30 | 2009-03-12 | Novartis Ag | Verfahren zur voraussage der erhöhung von cholesterin während einer immunosuppresiven therapie |
| US20050175721A1 (en) * | 2004-02-06 | 2005-08-11 | Brovelli Ernesto A. | Method of augmenting the immune-modulatory activity of standardized Echinacea preparations |
| DK1720893T3 (en) * | 2004-02-26 | 2014-11-24 | Baylor Res Inst | COMPOSITIONS AND PROCEDURES FOR THE SYSTEMIC TREATMENT OF ARTHRITIS |
| WO2005108619A2 (en) * | 2004-05-03 | 2005-11-17 | Interleukin Genetics, Inc. | Diagnostics and therapeutics for diseases associated with an il-1 inflammatory haplotype |
| JP4664298B2 (ja) * | 2004-08-24 | 2011-04-06 | 富士フイルム株式会社 | 表面プラズモン共鳴分析における解離定数の算出方法 |
| JP2006262826A (ja) * | 2005-03-25 | 2006-10-05 | Institute Of Physical & Chemical Research | インターロイキン−1受容体2遺伝子の多型に基づく炎症性疾患の検査法 |
| WO2007050794A2 (en) * | 2005-10-25 | 2007-05-03 | Interleuken Genetics, Inc. | The il-1 gene cluster and associated inflammatory polymorphisms and haplotypes |
| JP4870976B2 (ja) * | 2005-11-10 | 2012-02-08 | 株式会社Dnaチップ研究所 | 全血を用いた自己免疫疾患の検査方法 |
| US8101360B2 (en) | 2006-11-15 | 2012-01-24 | Interleukin Genetics, Inc. | IL-1 gene cluster, insulin resistance and coronary artery disease associated polymorphisms and haplotypes and methods of using same |
| JP2011502510A (ja) * | 2007-11-08 | 2011-01-27 | インタールーキン ジェネティクス, インコーポレイテッド | 老化に関係がある皮膚疾患の診断 |
| CA3011363A1 (en) | 2016-01-12 | 2017-07-20 | Interleukin Genetics, Inc. | Methods for predicting response to treatment |
| KR102543907B1 (ko) * | 2016-06-17 | 2023-06-15 | 서울대학교산학협력단 | 치주질환 위험도 평가용 유전자 마커 |
| US10337070B2 (en) | 2017-01-12 | 2019-07-02 | Cardioforecast Ltd. | Methods and kits for treating cardiovascular disease |
| JP7097855B2 (ja) * | 2019-04-24 | 2022-07-08 | ジェネシスヘルスケア株式会社 | 歯周病のリスクを判定する方法 |
| US20220249660A1 (en) | 2019-06-06 | 2022-08-11 | Sitokine Limited | Compositions and methods for treating lung, colorectal and breast cancer |
| WO2021028469A1 (en) | 2019-08-12 | 2021-02-18 | Sitokine Limited | Compositions and methods for treating cytokine release syndrome and neurotoxicity |
| WO2021205013A1 (en) | 2020-04-09 | 2021-10-14 | Sitokine Limited | Compositions and methods for treating covid-19 |
| WO2022040090A1 (en) * | 2020-08-17 | 2022-02-24 | The Regents Of The University Of California | Application of microbial glycosidase as an anti-viral therapeutic, prognostic, and diagnostic |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8311018D0 (en) * | 1983-04-22 | 1983-05-25 | Amersham Int Plc | Detecting mutations in dna |
| US4683202A (en) * | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| US4683195A (en) * | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4833080A (en) * | 1985-12-12 | 1989-05-23 | President And Fellows Of Harvard College | Regulation of eucaryotic gene expression |
| US4998617A (en) * | 1986-09-15 | 1991-03-12 | Laura Lupton Inc | Facial cosmetic liquid make up kit |
| US4968607A (en) * | 1987-11-25 | 1990-11-06 | Immunex Corporation | Interleukin-1 receptors |
| US5459039A (en) * | 1989-05-12 | 1995-10-17 | Duke University | Methods for mapping genetic mutations |
| US5593826A (en) * | 1993-03-22 | 1997-01-14 | Perkin-Elmer Corporation, Applied Biosystems, Inc. | Enzymatic ligation of 3'amino-substituted oligonucleotides |
| US5747498A (en) * | 1996-05-28 | 1998-05-05 | Pfizer Inc. | Alkynyl and azido-substituted 4-anilinoquinazolines |
| US5686246A (en) * | 1995-08-03 | 1997-11-11 | Kornman; Kenneth S. | Detecting genetic predisposition to periodontal disease |
| GB9603095D0 (en) * | 1996-02-14 | 1996-04-10 | Zeneca Ltd | Quinazoline derivatives |
| US5698399A (en) * | 1996-04-05 | 1997-12-16 | Duff; Gordon W. | Detecting genetic predisposition for osteoporosis |
| GB9621129D0 (en) * | 1996-10-10 | 1996-11-27 | Duff Gordon W | Detecting genetic predisposition to sight-threatening diabetic retinopathy |
| US6210877B1 (en) * | 1997-03-10 | 2001-04-03 | Interleukin Genetics, Inc. | Prediction of coronary artery disease |
| US6524795B1 (en) | 1997-03-10 | 2003-02-25 | Interleukin Genetics, Inc. | Diagnostics for cardiovascular disorders |
| GB9723553D0 (en) * | 1997-11-07 | 1998-01-07 | Duff Gordon W | Prediction of the risk of chronic obstructive airway disease |
| GB9711040D0 (en) * | 1997-05-29 | 1997-07-23 | Duff Gordon W | Prediction of inflammatory disease |
| US6437216B1 (en) * | 1997-11-13 | 2002-08-20 | Interleukin Genetics Inc. | Transgenic models of inflammatory disease |
| US6251598B1 (en) * | 1998-10-30 | 2001-06-26 | Interleukin Genetics, Inc. | Methods for diagnosing sepsis |
| IL147182A0 (en) | 1999-06-30 | 2002-08-14 | Interleukin Genetics Inc | Diagnostics and therapeutics for diseases associated with an il-1 inflammatory haplorype |
| EE200200149A (et) * | 1999-09-21 | 2003-04-15 | Astrazeneca Ab | Kinasoliinühendid ja neid sisaldavad ravimkoostised |
| US6617329B2 (en) * | 2000-08-26 | 2003-09-09 | Boehringer Ingelheim Pharma Kg | Aminoquinazolines and their use as medicaments |
| US6656946B2 (en) * | 2000-08-26 | 2003-12-02 | Boehringer Ingelheim Pharma Kg | Aminoquinazolines which inhibit signal transduction mediated by tyrosine kinases |
| CN100424182C (zh) | 2001-06-15 | 2008-10-08 | 白介素遗传公司 | 衰老相关疾病早期发作的检测与治疗方法 |
| TW200813014A (en) * | 2002-03-28 | 2008-03-16 | Astrazeneca Ab | Quinazoline derivatives |
| US6924285B2 (en) * | 2002-03-30 | 2005-08-02 | Boehringer Ingelheim Pharma Gmbh & Co. | Bicyclic heterocyclic compounds, pharmaceutical compositions containing these compounds, their use and process for preparing them |
| US8071304B2 (en) * | 2003-04-05 | 2011-12-06 | The Johns Hopkins University | Methods for detecting a polymorphism in the NFKB1 gene promoter |
-
2002
- 2002-11-19 WO PCT/US2002/037222 patent/WO2003044176A2/en active Application Filing
- 2002-11-19 JP JP2003545801A patent/JP4492849B2/ja not_active Expired - Lifetime
- 2002-11-19 CA CA002467717A patent/CA2467717A1/en not_active Abandoned
- 2002-11-19 CN CN201010156318.0A patent/CN101955943A/zh active Pending
- 2002-11-19 AU AU2002359431A patent/AU2002359431A1/en not_active Abandoned
- 2002-11-19 CN CN02827282.XA patent/CN1753903B/zh not_active Expired - Fee Related
- 2002-11-19 EP EP02793968A patent/EP1463745A4/en not_active Withdrawn
- 2002-11-19 KR KR1020047007653A patent/KR101019131B1/ko active IP Right Grant
- 2002-11-19 US US10/300,011 patent/US20030235890A1/en not_active Abandoned
- 2002-11-19 KR KR1020107016833A patent/KR101059898B1/ko active IP Right Grant
-
2008
- 2008-03-13 US US12/048,077 patent/US20100279280A1/en not_active Abandoned
-
2009
- 2009-11-16 JP JP2009260743A patent/JP2010029220A/ja active Pending
Non-Patent Citations (1)
| Title |
|---|
| Gray,J.G等.accession no. U26540: "A CRE/ATF-like site in the upstreamregulatory sequence of the human interleukin 1 beta gene isnecessary for induction in U937 and THP-1 monocytic celllines".Genbank.1995,全文. * |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2002359431A1 (en) | 2003-06-10 |
| WO2003044176A2 (en) | 2003-05-30 |
| WO2003044176A9 (en) | 2003-10-16 |
| JP2005509432A (ja) | 2005-04-14 |
| KR101019131B1 (ko) | 2011-03-07 |
| WO2003044176A8 (en) | 2003-08-21 |
| EP1463745A4 (en) | 2007-11-07 |
| KR101059898B1 (ko) | 2011-08-29 |
| EP1463745A2 (en) | 2004-10-06 |
| JP2010029220A (ja) | 2010-02-12 |
| JP4492849B2 (ja) | 2010-06-30 |
| WO2003044176A3 (en) | 2004-07-29 |
| CN1753903A (zh) | 2006-03-29 |
| US20030235890A1 (en) | 2003-12-25 |
| AU2002359431A8 (en) | 2003-06-10 |
| US20100279280A1 (en) | 2010-11-04 |
| KR20100095652A (ko) | 2010-08-31 |
| CA2467717A1 (en) | 2003-05-30 |
| CN101955943A (zh) | 2011-01-26 |
| KR20040066832A (ko) | 2004-07-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1753903B (zh) | 影响转录和对炎性和传染性疾病的敏感性的白细胞介素-1基因座的功能多态性 | |
| US20020146700A1 (en) | Diagnostics and therapeutics for diseases associated with an IL-1 inflammatory haplotype | |
| US20050282198A1 (en) | Diagnostics and therapeutics for diseases associated with an IL-1 inflammatory haplotype | |
| AU784224B2 (en) | Diagnostics and therapeutics for diseases associated with an IL-1 inflammatory haplotype | |
| US8105775B2 (en) | IL-1 gene cluster and associated inflammatory polymorphisms and haplotypes | |
| WO2006128042A2 (en) | Methods of identifying mutations in nucleic acid | |
| CN103547680B (zh) | 用于确定牙周病的严重性和进展的改进方法和试剂盒 | |
| US20080254476A1 (en) | il-1 gene cluster and associated inflammatory polymorphisms and haplotypes | |
| ES2261239T3 (es) | Diagnostico y terapia para la osteoporosis. | |
| ES2356167T3 (es) | Método de diagnóstico y terapia para enfermedades asociadas con un haplotipo inflamatorio il-1. | |
| US20080118920A1 (en) | Diagnostics And Therapeutics For Diseases Associated With An Il-1 Inflammatory Haplotype | |
| US20080311581A1 (en) | Functional polymorphisms of the interleukin-1 locus affecting transcription and susceptibility to inflammatory and infectious diseases | |
| KR100924468B1 (ko) | Il-1 유전자 집단 및 관련된 염증성 다형성과 일배체형 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20100512 Termination date: 20111119 |