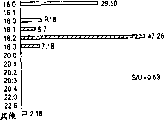CN1200036A - 含有磷脂混合物并具有抗细胞程序死亡活性的组合物 - Google Patents
含有磷脂混合物并具有抗细胞程序死亡活性的组合物 Download PDFInfo
- Publication number
- CN1200036A CN1200036A CN96197739A CN96197739A CN1200036A CN 1200036 A CN1200036 A CN 1200036A CN 96197739 A CN96197739 A CN 96197739A CN 96197739 A CN96197739 A CN 96197739A CN 1200036 A CN1200036 A CN 1200036A
- Authority
- CN
- China
- Prior art keywords
- compositions
- phospholipid
- cell
- sonication
- elirex
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/683—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols
- A61K31/685—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols one of the hydroxy compounds having nitrogen atoms, e.g. phosphatidylserine, lecithin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/16—Emollients or protectives, e.g. against radiation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Dermatology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Virology (AREA)
- AIDS & HIV (AREA)
- Heart & Thoracic Surgery (AREA)
- Tropical Medicine & Parasitology (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Vascular Medicine (AREA)
- Cardiology (AREA)
- Toxicology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本发明涉及了一种具有抗细胞程序死亡活性的组合物,该组合物包括磷脂酸、磷脂酰肌醇、溶血性磷脂酸、溶血性磷脂酰肌醇和溶血性磷脂酰胆碱。
Description
发明领域
本发明涉及了对细胞程序死亡具有抑制作用的物质的组合物。更具体地说,本发明涉及了具有抗细胞程序死亡活性的磷脂(PA、PI、LPA、LPI和LPC)混合物的组合物。发明背景
细胞程序死亡是一种导致个体细胞死亡的正常生理过程。这种细胞程序死亡的过程涉及到多种正常的或病原性的生物作用,并且该过程可以由许多不相关的刺激所引发。在衰老过程中也会出现细胞程序死亡的生物调节的变化,并且会引起许多与衰老有关的病症和疾病。
细胞程序死亡的最新研究揭示出,诱发细胞程序死亡的正常代谢途径能够被很多种信号启动,这些信号包括激素,血清生长因子的缺失,化学治疗剂,电离辐射,和因人体免疫缺损病毒(HIV)造成的感染。Wyllie(1980)Nature 284:555-556;Kanter等人(1984)Biochem.Biophys.Res.Commun 118:392-399;Duke和Cohen(1986)Lymphokine Res.5:289-299;Tomei等人(1988)Biochem.Biophys.Res.Commun.155:324-331;Kruman等人(1991)J.Cell.Physiol.148:267-173;Ameisen和Capron(1991)Immunol.Today12:102-105;及Sheppard和Ascher(1992)J.AIDS 5:143-147。那些影响细胞程序死亡的生物控制的试剂对大量临床病症都具有治疗功效。
编程性细胞死亡的特点表现为细胞收缩、染色质凝聚、细胞质水泡状生长、膜通透性增大和核小体间DNA裂解。Gerschenson等人(1992)FASEB J. 6:2450-2455;及Cohen和Duke(1992)Ann.Rev.Immunol.10:267-293。
含有部分的、经一定程度加工的植物提取物的多种食品补充剂已被用于改善化疗、辐射和艾滋病(AIDS)中伴随的肠胃紊乱。这些补充剂通常含有碳水化合物、脂肪和植物性蛋白水解物。例如,可以参见Tomei和Coe等人的in Apoptosis The Molecular Basis of Cell Death(1991)ColdSpring Harbor Laboratory Press。
一些由植物提取物中得到的一些蛋白酶抑制剂具有抗癌活性。Troll等人(1987)Adv.Canner Res.49:265-283。Bowman-Birk抑制剂是这些抑制剂中最好的。Birk(1985)Int.J.Pep.pro.Res.25:113-131。Bowman-Birk抑制剂被描述成一类能抑制细胞转化且分子量约是8KD的二硫化物键合蛋白。Chou等人(1974)Proc.Natl.Acad.Sci.USA71:1748-1752;Yavelow等人(1985)Proc.Natl.Acad.Sci.USA82:5395-5399;及Yavelow等人(1983)Cancer Res.(Suppl.)43:2454s-2459s。对含有Bowman-Birk抑制剂的大豆粗提物进行了具体的描述。Kennedy等人的美国专利4,793,3996;PCT公开号WO94/20121;和Kennedy,A.R.(1994)Canner Res.(Suppl)54:1999s-2005s。还有关于Bowman-Birk抑制剂免疫性的描述。WO90/03574;和美国专利4,959,310;和5,053,327。Bowman-Birk抑制剂还被发现有巨噬细胞脱粒的活性。日本特许公报63051335。
磷脂是一类亲水亲油性的含磷脂类,它们是生物膜的重要组成。不同的磷脂制品可以应用于烹饪、药物转运(脂质体)、缓释传递体系、疏水性药物的载体介质、基因转移和基因替代治疗、防晒剂、乳剂、消泡剂、缺损肺表面活性剂的替代、去污剂和膜稳定剂。
在许多植物和动物产品中都发现含有磷脂酸(PA)、磷脂酰肌醇(PI)、溶血性磷脂酸(LPA)、溶血性磷脂酰肌醇(LPI)、和溶血性磷脂酰胆碱(LPC)。很多植物和动物产品中含有LPA,据报导它具有许多包括致有丝分裂、生长因子作用在内的生理活性,并且可以作为一种抗皱剂。美国专利4,263,286;4,746,652;5,326,690;和5,340,568。下列文献对LPA有详细的评述,Moolenaar(1994)TICB4:213-219;和Eichholtz等人(1990)Biochem.J.291:677-680;和Moolenaar(1995)J.Biol.Chem.270:12949-12952。
PCT专利公开号WO95/15173描述了植物来源的脱脂(delipidated)提取物可以产生抗细胞程序死亡的作用。现在认为,这些提取物中含有重量比是2∶1∶2∶20∶20的LPA、LPC、LPI、PA和PI,提取物还含有许多蛋白质和碳水化合物组分在内。
在本发明中引用的所有参考文献都作为参考文献以其全部内容并入本发明。发明概述
本发明涉及抑制细胞程序死亡的组合物和制备这些组合物的方法。本发明还涉及这些组合物制备和应用的方法。
因此,本发明一方面涉及了含有磷脂的组合物,这些磷脂是磷脂酸(PA)、磷脂酰肌醇(PI)、溶血性磷脂酸(LPA)、溶血性磷脂酰肌醇(LPI)、和溶血性磷脂酰胆碱(LPC),它们之间的配比是能产生抗细胞程序死亡作用的比例。
另一方面,本发明提供了制备这些组合物的方法。这些方法包括将有效量的上述磷脂以它们各自相应的比例进行结合,并且将这些磷脂进行声处理直至所得溶液具有光学透明度。
又一方面,本发明提供了这些组合物的应用方法。这些方法包括将这些组合物用于治疗细胞程序死亡,治疗是通过给予需要这类治疗的患者以有效治疗量的含有上述组合物的可药用治疗剂来实现的。该方法包括用组合物来治疗与细胞程序死亡有关的病症。使用这些组合物的其他方法包括:防止培养的细胞发生细胞程序死亡,改善连续性器官移植中的器官保藏和分流术中的器官原位保藏,例如,心脏、肝脏、肺、脑等,以及治疗牵涉有细胞程序死亡的皮肤病病症的方法。对附图的简单描述
附图1(A)和1(B)是ElirexTM(以前称为“ROM”)在不同温度条件下储存一周后的稳定性棒图。棒的阴影部分代表了活的粘附性细胞(ADH)。棒的空白部分代表了程序死亡的无血清的释放性细胞(SDR)。稳定性是以细胞密度(附图1(A))和百分率(附图1(B))来表示的。在附图1(A)中,空心环代表粘附性细胞的具有统计学意义的显著性增加;实心环代表了程序死亡细胞的具有统计意义的显著性减少。附图1(B),空心方块代表了具有统计学意义的存活细胞的百分率;实心方块代表了程序死亡细胞的具有统计学意义的百分率。
附图2(A)和2(B)是NM和RNM在10T 1/2细胞中的抗细胞程序死亡活性的对比棒图。棒的阴影部分代表了活细胞(ADH)。棒的空白部分代表了程序死亡的无血清释放细胞。NM是一种具有抗细胞程序死亡活性的大豆来源的提取物。RNM是具有10∶10∶2∶2∶1(PA∶PI∶LPA∶LPI∶LPC)比例的重组脂混合物。加有牛血清白蛋白(BSA)并且最终浓度为0.01%的RNM被表示为RNM+。抗细胞程序死亡活性是以细胞密度(附图2(A))和百分率(附图2(B))来表示。附图2(A)中,空心环代表了活细胞的具有统计意义的显著性增加;实心环代表了程序死亡细胞的具有统计学意义的显著性减少。附图2(B),空心方块代表了存活细胞的统计学意义的百分率;实心方块代表了程序死亡细胞的统计学意义的百分率。
附图3(A)和3(B)是含有植物来源磷脂的RNM和含有动物来源磷脂的RNM分别所具有的抗细胞程序死亡活性的对比棒图。剂量浓度是100μg/ml。溶液不论含有或不含BSA其最终浓度都是0.01%。棒图的阴影部分表示细胞(ADH)。棒图的空白部分代表程序死亡细胞(SDR)。抗细胞程序死亡活性是以细胞密度(附图3(A))和百分率(附图3(B))来表示。在各附图中,第二和第三个棒代表大豆来源的磷脂;第四和第五棒代表了动物来源的磷脂。附图3(A)中,空心环代表了活细胞(ADH)的具有统计意义的显著性增加;实心环代表了程序死亡细胞(SDR)的具有统计学意义的显著性减少。附图3(B),空心方块代表了存活细胞的有统计学意义的百分率;实心方块代表了程序死亡细胞的有统计学意义的百分率。
附图4(A)是以PI为具体实例(采用Avanti Polar Lipids1994的目录),将含有大豆来源磷脂的脂肪酸[A]和含有牛肝脏来源磷脂的脂肪酸[B]进行比较。空白部分的棒表示饱和脂肪酸;阴影部分的棒表示不饱和脂肪酸。各脂肪酸的种类是以X∶Y来划分,其中X代表了链的长度,Y代表了双键的数目。“S/U”是指饱和脂肪酸相对于不饱和脂肪酸的比例。
附图5(A)至(E)是一系列图示,用来表示RNM中的PA(附图5(A))、PI(附图5(B))、LPA(附图5(C))、LPI(附图5(D))、和LPC(附图5(E))在不同浓度下的抗细胞程序死亡活性。所含磷脂的比例分别保持在常数10∶10∶2∶2∶1(PA∶PI∶LPA∶LPI∶LPC),但所研究磷脂的浓度(μg/ml)是不同的。箭头代表磷脂在100μg/ml的剂量下当比例为10∶10∶2∶2∶1时的起始浓度。
附图6是附图5所述各磷脂在不同浓度下的抗细胞程序死亡活性试验的总图示。所含磷脂的比例保持在常数10∶10∶2∶2∶1(PA∶PI∶LPA∶LPI∶LPC),但这些磷脂在100μg/ml当量剂量下的浓度(μg/ml)是不同的。附图中的磷脂表示如下:LPA(由实线连接的方块)、LPI(由实线连接的环)、LPA(由实线连接的三角)、PA(由虚线连接的方块)、PI(由虚线连接的环)。
附图7是重组RNM和ElirexTM在不同剂量时的抗细胞程序死亡活性对比图示。ElirexTM是由实线连接的空心方块表示,并且ElirexTM的磷脂比例是由附图5和6中优选出的。抗细胞程序死亡是以存活细胞的百分率表示。
附图8表示在不同pH条件下用Eagel基础培养基稀释(BME)得到的ElirexTM的抗细胞程序死亡活性。由虚线连接的实心三角代表了BME中的ElirexTM在不同浓度(μg/ml)下的抗细胞程序死亡活性。实心方块代表ElirexTM在pH为8(碳酸氢铵缓冲液)时的活性。实心三角代表ElirexTM在pH为5.0(醋酸钠缓冲液)时的活性。实心环代表ElirexTM在pH为6.5(磷酸钠缓冲液)时的活性。在用细胞培养介质稀释前,都必须先在含有100-200mMNaCl的测试缓冲液中进行声处理,使之重新混悬。本发明实施方法
现已发现,含有特定比例五种磷脂的组合物比含天然比例的这些磷脂具有更高的抗细胞程序死亡活性,其中的五种磷脂可以来源于植物、动物或合成。这些组合物很容易从各种渠道得到,包括来源于植物和动物。组合物还可以采用脂合成领域的已知方法来合成。组合物将因为来源和植物生长条件的不同而使化学组成略有差异。组合物在此被称为ElirexTM。
我们以前对植物来源的、可产生抗细胞程序死亡作用的提取物进行过描述,提取物活性测定采用体外细胞试验来完成,该体外细胞试验是能够对细胞程序死亡信号产生应答的试验。如PCT WO95/15173所述。现在,我们发现活性组分是磷脂磷脂酸(PA)、磷脂酰肌醇(PI)、溶血性磷脂酸(LPA)、溶血性磷脂酰肌醇(LPI)、和溶血性磷脂酰胆碱(LPC)。天然提取物分别含有这些磷脂并且它们的比例是约20∶20∶2∶1∶2。在此它被称为“天然混合物”(NM)。这些磷脂可以这种比例重新进行结合,以得到重组天然混合物(RNM),该RNM中不含有天然混合物所含的杂质。RNM是ElirexTM的一个具体实例。虽然这个比例是最常见的标准含量比例,但是它可以因各种原因而在很小的范围内变化,改变的原因包括:季节、生长条件、生长区域、收获条件、储存、种子(育种)类型和种子的基因技术,但是不仅仅局限于此。本发明中,这些磷脂的比例不同于发现的天然来源比例,但却更有效。
本发明所述组合物含有活性成分磷脂PA、PI、LPA、LPI、和LPC。所含各磷脂的比例范围分别是0-20∶5-20∶2-16∶0-4∶0-8。优选各磷脂的比例范围大约分别是2-15∶8-15∶6-10∶2-4∶2-8。更优选这些磷脂的比例分别是近10∶10∶8∶2∶4的比例。虽然这些磷脂的结构是确定的,但由于脂链长度和饱和程度的不同而使它们各不相同。通常,这些磷脂具有下列结构式,也包括本领域已知的其他结构的磷脂,但这些磷脂必须能够在任一标准细胞程序死亡试验中产生抗细胞程序死亡应答。
LPA结构式是:
其中R是一个非取代或取代的、饱和或不饱和的、直链或支链的、含有11-23个碳原子的烷基。
或LPA的可药用盐,其中R是一个非取代或取代的、饱和或不饱和的、直链或支链的、含有11-23个碳原子的烷基;X分别是O或S;Y是O或(CH)n,其中n=0-2;并且Z是H、卤素、NH2、SH、OH、或OPO3H2。
还包括RC(O)O基,例如,它可以是月桂酰基、肉豆蔻酰基、棕榈酰基、硬脂酰基、棕榈油酰基、油酰基、亚油酰基;优选油酰基、棕榈油酰基、肉豆蔻酰基、棕榈酰基、或月桂酰基。最优选16碳链的棕榈酰基和棕榈油酰基,和18碳链的硬脂酰基、油酰基和亚油酰基,但是不排除其他碳链长度的脂肪酸,包括C12、C14、C20和C22,但不局限于此。适当磷脂的具体例子可以参见任何磷脂商品目录,如(1994)Avanticatalog,具体是其中的第14和21页。
其中R是非取代或取代的、饱和或不饱和的、直链或支链的、带有大约11-23个碳原子的烷基。
LPC的结构式为:
其中R是非取代或取代的、饱和或不饱和的、直链或支链的、带有大约11-23个碳原子的烷基。
磷脂的可药用盐包括游离酸形式、碱金属盐,例如钠和钾;碱土金属盐,例如钙和镁;无毒重金属盐;铵盐;三烷基铵盐,如三甲基铵和三乙基铵;以及三烷氧基铵盐,例如三乙醇铵、三(2-羟乙基)铵、和Tromethamine(三(羟甲基)氨基甲烷),但是不仅限于此。尤其优选钠盐和铵盐。
组合物中的磷脂可以由市场上买到,或从多种植物(包括植物的某些部分)和动物中分离到。优选的植物是豆类,但是磷脂也可以从其他植物中分离得到,其他植物可包括豆科植物(扁豆和豌豆等),但不仅限于此。磷脂还可以由纯化的植物提取物中分离出来,纯植物提取物包括了大豆糖浆、卵磷脂、部分提纯的蛋白浓缩物、部分提纯的蛋白水解物、和其他可从中提取脂的大豆成分,但不仅局限于此。本领域所属技术人员能够按照在此描述的方法来判断,是否可以从特定种类的植物、植物提取物和植物的某些部分中分离出本发明所述磷脂。美国专利3,365,440中描述了可从豆类中提取到磷脂。
任何可以产生组合物磷脂的植物提取物或其某些部分都适用于本发明。可以利用的植物器官包括了茎、叶、根、花、根状茎、和尤其是植物的储存器官,如种子、块茎和球茎,但不仅限于此。所用植物组成部分优选的是储存器官。最优选使用的是干燥的大豆种子。虽然在此使用了术语“种子”和“种子类”,但应该理解成任何可以产生至少一种本发明所述磷脂的植物组成部分。
可以采用所属技术领域中任何已知的方法从植物中获得磷脂,只要这些方法能够纯化得到至少一种本发明所述磷脂。所属技术领域中,有许多已知的方法是用于纯化和分析植物来源磷脂的。例如,参见Bligh和Dyer(1959)Can.J.Biochem.Physiol.37:911-917;Patton等人(1982)J.Lipid Res.23:190-196;Jungalwala(1985)Recent Developments inTechniques for Phospholipid Analysis,in Phospholipids in Nervous Tissues(编辑Eichberg)Jphn Wiley和Sons,第1-44页;Hamilton等人(1992)的系列文献,A Practical Approach(Rickwood等人编辑)IRLPress at Oxford Unicersity Press;和Kates(1986)Techniques ofLipidology:Isolation,Analysis and Identification in LaboratoryTechniques in Biochemistry and Molecular Biology(Burdon等人编辑)Elsevier。
磷脂还可以来自于动物。优选的动物是哺乳动物,最优选的是来源于肝脏细胞的磷脂。这种磷脂可以从市场上买到或采用所属领域的已知方法从动物组织中纯化得到。例如从动物和蛋的卵磷脂,或从WO95/15173所述的组合物中得到。
本发明所述的磷脂还可以采用所属技术领域的已知方法来合成。适宜的半合成磷脂及它们的合成在Kates的Techniques of Lipidology(1972)中进行了描述。
可以使用不同纯度的磷脂。纯度可以采用任何已知的技术方法来进行分析,例如二维的TLC和HPLC,同时也对全脂、磷脂或磷酸酯进行分析。Kates概括了许多适当的方法。尤其是,磷脂必须达到足够的纯度,当它们被混合且总浓度大约是10mg/ml时,混合物可以经下述方法的声处理得到相对透明的溶液。理想的情况是,磷脂至少达到90%的纯度,更优选至少达到95%纯度,最优选至少达到99%纯度。
在应用中,磷脂可以结合也可不结合蛋白质。在此,“结合蛋白”是指任何能够保护LPA使之保持其活性的蛋白。结合蛋白的实例包括白蛋白,如牛血清白蛋白(BSA)和豌豆白蛋白,但是不局限于此。
能够影响ElirexTM组合物活性的其他因素是磷脂的链长、不饱和度、是否含有胆甾醇、是否存在微团、脂质体、洗涤剂和乳化剂、及LPA中链的位置,即链是位于甘油的第一还是第二个碳原子上。毋庸置疑,声处理可以导致脂质体和/或微团或其他多层脂质体的形成,引起ElirexTM活性的提高。短链LPA不如C16和C18链的LPA更有效。
不容怀疑的是,PA、PI、LPI、和LPC的存在被推断为能够保护LPA,使其不发生降解,并且可以提高LPA的生理作用。
本发明进一步涉及了制备ElirexTM组合物的方法。各磷脂的比例范围分别地是(PA∶PI∶LPA∶LPI∶LPC)0-20∶5-20∶2-16∶0-4∶0-8。优选各磷脂的比例分别地大约是2-15∶8-15∶6-10∶2-4∶2-8。优选的组合物是其所含磷脂以大约10∶10∶8∶2∶4的重量比例混合。比例值的“大约”是指磷脂比例可以在接近多至15%的范围内变化,但优选其变化不超过5%的范围,更优选比例在±0.5%之间变化。
磷脂可以在任何缓冲溶液中混悬,优选pH值为5-8的含游离二价阳离子的溶液。例如D-PBS(磷酸盐缓冲盐水,游离的钙和镁盐,GibcoBRL)或浓度是50mM的含有等渗氯化钠的碳酸氢铵溶液。在用于治疗的组合物中,优选那些可生理用缓冲溶液。很宽范围的pH值都是有效的。优选pH介于5.5-8,即使任何使ElirexTM活性减小的pH值也可以被采用。我们发现混合物在pH为8时具有最高活性。优选的是,磷脂在浓度为50mM且用0.154M氯化钠溶液配制的碳酸氢铵溶液中混悬,溶液pH值为7.7-8.0。
特别是,为了获得最大活性可以将磷脂混合物破裂。可以采用任何不引起变性或不产生磷脂化学修饰的破裂方法,其包括了微流化、挤压、和声处理,但不限于此。通常将混合物进行声处理直至产生光学透明度,只要不使混合物过热声处理就可以持续进行。本文具体例举了优选的声处理参数。此处的“光学透明度”是指混合物由不透明变成透明。该变化可以很容易地通过肉眼观察到,而不需要更多地测定。然而,“透明”可以规定为混合物在600O.D.(光密度)的条件下吸收度小于0.2AU。
混合物浓度可以制成近50mg/ml。优选采用的浓度是10mg/ml。通常,间隔5分钟进行一次声处理循环,即5分钟的声处理,随后5分钟平衡化作用。然而,该过程可以根据所处理混合物的体积和声处理产生热量的多少而改变。
需要进行声处理的混合物的浓度和体积、以及声处理器的输出功率决定了声处理所需的总时间。声处理必须持续直至混合物变为透明。通常,混合物需要3-90分钟长的声处理。优选的是,声处理分成数个持续5分钟的阶段,共进行6-12次这样的阶段,每个阶段间间隔1-5分钟,以使混合物达到平衡及散热。水浴温度不超过约60℃;然而,混合物能够经高压热处理但不损失活性。优选水浴的温度不超过37℃。还优选经声处理过的混合物在使用前应该进行无菌过滤。
ElirexTM的活性可以通过已知的多种抗细胞程序死亡试验来测定。这些方法包括:除去血清的C3H/10T1/2细胞试验,该试验通常可参见PCT公开号WO94/25621中的详细描述,此试验是优选的试验方法,优选方法还包括该参考专利文献实施例3中所述方法,但不仅仅局限于此。另外,体内细胞程序死亡抑制作用可以通过任何已知的方法进行测定。
本发明还涉及了含有已基本纯化ElirexTM的治疗用组合物。组合物所需的纯度可以通过实验来测定,所属技术领域的技术人员是已知的。组合物适用于如下所述的多种疾病,并且同时适于人用和兽用。
通常,ElirexTM组合物是可药用的,这是因为它们在治疗剂量范围内具备了低毒性、稳定性、及能够和很多种载体进行混合以满足多种途径给药的性能。ElirexTM可以单独或与其他有效药用试剂结合使用,其中有效药用剂包括抗生素、创伤愈合剂、抗氧化剂和其他治疗剂,但不仅仅局限于此。适宜的抗生素包括,氨苄青霉素、四环素、氯霉素和青霉素,但不只是这些。适宜的创伤愈合剂包括转移生长因子(TGF-βs)、表皮生长因子(EGFs)、成纤维细胞生长因子(FGFs)和血小板来源生长因子(PDGFs),但不局限于此。适宜的抗氧化剂包括维生素C和E,但不局限于此。
组合物含有至少有效治疗量的一种ElirexTM,并且可以含有至少一种生理用载体。所用的可生理用载体应该是使用后不会对身体产生副作用,而且能够使ElirexTM充分溶解以运送有效治疗量的化合物。ElirexTM的有效治疗量要部分地根据进药的方式、需治疗的病症、和本领域普通技术人员所熟知的其他依据来判断。通常,有效治疗量是指足够缓解所治疗病症中的细胞程序死亡、以及显示出症状改善迹象的用量。尽管由于病症的不同导致有效量范围较宽,并且该有效量可以根据实验来测定,但治序有效量通常是不低于0.0001%重量或1μg/ml。特殊病症的给药途径将在下面进行讨论,对于本领域技术人员而言是易于理解的。
给药途径包括:局部、透皮、肠胃外、经肠胃的、经支气管和经肺泡的。局部给药是通过局部涂敷含有有效治疗量ElirexTM的膏霜、凝胶、漂洗剂等来完成的。局部给药是通过局部施用膏霜、凝胶、漂洗剂等含有效治疗量的ElirexTM的物质完成的。透皮给药是通过涂敷膏霜、漂洗剂、凝胶等物质,以使ElirexTM能够透过皮肤进入血流。肠胃外途径的给药包括直接注射,如静脉内、肌肉内、腹膜内或皮下注射,但不只局限于此。肠胃内途径给药包括食入和直肠给药,但不局限于此。经支气管和经肺泡途径给药包括:经口腔或经鼻腔的吸入,及直接注射到气道中,如通过气管造口术,但是不局限于这些。
当ElirexTM单独局部涂敷时,可以根据需要将它们与可局部药用或化妆品用载体共同制成混合物来给药。此处的“局部可药用载体”是指任何基本无毒的、局部给药的常规用载体,载体中的ElirexTM能够在直接应用于皮肤或粘膜表面时保持其稳定性和生物作用。例如,ElirexTM可以以常规方式溶解在液体中,或在介质中分散或乳化以形成液体制剂,或与半固体(凝胶)或固体载体混合以形成糊剂、粉剂、软膏剂、膏霜、洗剂等等,但不局限于此。
适宜的可局部药用载体包括水、石油膏(凡士林)、矿脂、矿物油、植物油、动物油、有机和无机蜡,例如微晶、石蜡和地蜡,天然聚合物,例如黄原胶、明胶、纤维素、胶原蛋白、淀粉、或阿拉伯树胶,合成聚合物,例如在下面将讨论的物质、醇、多羟基化合物等等。载体可以是水溶性载体组合物,它基本溶于水。这些水溶性的、可局部药用的载体组合物不仅可以包括一种或多种上述适当的组分,还可以包括持续或缓慢释放用载体,载体包括含水性、水分散性或水溶性组合物,例如脂质体、微绵体、微球或微囊、含水基质软膏、油包水或水包油乳化剂、凝胶或类似物。
本发明的一个具体方案中,可局部药用载体包括了长释或缓释用载体。载体是任何能够长释或缓释ElirexTM以达到更有效给药效果的物质,应用它们可以达到减少一次或数次ElirexTM的给药次数和/或减少ElirexTM给药剂量、易于使用、及延长或延缓对皮肤病症作用的效果。载体在任何油性、脂肪、蜡、或潮湿环境条件中,都能够通过扩散或释放作用将ElirexTM释放于需治疗的患处,这就要根据载体对ElirexTM的负载水平来决定,以便达到ElirexTM被释放的效果。这类载体的非局限实例包括:天然或合成的脂质体、微绵体、微球、或微囊等等。适于在潮湿环境中持续或缓慢释放的载体实例包括:明胶、阿拉伯胶、黄原烷聚合物;有ElirexTM负载水平的物质有木质素聚合物及其类似物;油性、脂肪或蜡质环境包括了热塑性树脂或软质热固性树脂或高弹体,其中的热塑性树脂,例如聚卤乙烯、聚乙烯酯、聚偏卤乙烯和卤代聚烯烃,高弹体例如是brasiliensis、聚二烯、和卤代天然或合成橡胶;及软质热固性树脂,例如聚氨基甲酸乙酯、环氧树脂及其类似物。长释或缓释载体优选脂质体、微绵体、微球或凝胶。
本发明的皮肤病病症治疗方法中,将所用的组合物直接涂敷在需治疗的患处。若无特殊需要,局部用组合物将在所需部位维持大约24-48小时以释放ElirexTM。
如果需要,可以将一种或多种的、在局部药用或化妆品组合物的常规用附加成分与载体结合,例如增湿剂、湿润剂、矫味剂、缓冲剂、颜料、防腐剂、维生素如A、C和E、乳化剂、分散剂、浸润剂、气味调节剂、胶凝剂、稳定剂、推进剂、抗微生物剂、防晒剂、酶等等。局部药物制剂领域的技术人员能很容易地选择出适当的特定附加成分和它们的用量。适当的附加成分的非限定性实例包括:超氧化歧化酶、十八烷醇、肉豆蔻酸异丙酯、山梨醇单油酸酯、聚氧乙烯硬脂酸酯、丙二醇、水、十二烷基硫酸碱金属或碱土金属盐、羟苯甲酸甲酯、辛基二甲基-对-氨基苯甲酸(Padimate O)、尿酸、网硬蛋白、粘多糖、羟乙基淀粉(例如,DuPontPentafraction)、透明质酸、芦荟、卵磷脂、聚氧乙烯山梨醇单油酸酯。聚乙二醇、维生素A或C、生育酚(维生素E)、α-羟基或α酮基的酸如丙酮酸、乳酸或乙醇酸,或任何在美国专利4,340,586,4,695,590,4,959,353,或5,130,298和5,140,043中公开的局部用成分。
由于需治疗的皮肤病病症是肉眼可见的,局部用载体还可以是局部化妆品用载体。此处的“局部化妆品用载体”表示任何基本无毒的、局部用化妆品的常规用载体,这些载体中的ElirexTM在直接涂敷在皮肤表面时仍然保持其稳定性和生物有效性。适当的化妆用载体是所属领域技术人员熟知的,可以包括化妆用的液体、膏霜、油、洗剂、软膏剂、凝胶、或固体,例如化妆晚霜、粉底霜、晒黑洗剂、防晒剂、手部洗剂、化妆品和化妆品基质、面膜等等,但是不局限于此。因此,局部化妆品用载体基本与可药用载体相似,但常不相同;事实上,对于可药用载体的早期探讨也适于化妆品用载体。组合物可以含有其他化妆品常规组分,包括香料、雌激素、维生素A、C或E、α-羟基或α-酮基酸,例如丙酮酸、乳酸或乙醇酸,羊毛脂、凡士林、芦荟、羟苯甲酸甲酯或丙酯、颜料及其类似物。
组合物中,治疗皮肤病病症或疾病所需的ElirexTM有效量可以根据下列因素而改变,即皮肤症状、皮肤老化程度、磷脂的特定比例或所用磷脂的纯度、制剂和所用载体的类型、给药频率、被治疗个体的整体健康状况,及类似因素。所属领域技术人员可以根据这些因素和本文内容来决定任何特定患者所需的准确用量。优选组合物在1天内至少给药两次但不超过六次,或者,当使用长释或缓释剂型时减少给药次数。
局部、口服和肠胃外给药的组合物通常含有占组合物总重量约0.001%-10%重量的ElirexTM,优选含有约占组合物0.01%-2%重量的ElirexTM,特别优选ElirexTM约占组合物总重量的0.1%-1.5%。
局部用组合物的给药是将其在需治疗皮肤或粘膜的患处涂敷成覆盖层或膜层。为了简便,只将涂敷用物质擦抹在患处。涂敷是不需要将药抹入皮肤内,形成的膜层或覆盖层可在皮肤上保持过夜。
本发明所述组合物适用于透皮给药,包括但不限于:可药用洗剂、混悬剂、油、膏霜、软膏剂、漂洗剂、凝胶、以及脂质体载体,该脂质体载体是混悬于适当赋形剂中的,其中含有有效治疗量ElirexTM。这些组合物直接涂敷在皮肤上,或与保护性载体混合,例如透皮制剂(称为“贴剂”)。适当的膏霜、软膏剂等实例,例如可以在Physician’s Desk Refernce中查到。适合的透皮制剂有具体的描述,如美国专利4,818,540(Chien等人)。
本发明涉及了适于肠胃外给药的ElirexTM组合物,不只包括可药用的无菌等渗溶液。这些溶液包括ElirexTM在静脉内、肌肉内、腹膜内或皮下注射时所需的生理盐水和磷酸盐缓冲盐水。
本发明涉及了适于经胃肠给药的ElirexTM组合物,包括可药用的、口服给药的粉剂、丸或液体,及直肠给药的栓剂,但不局限于此。
本发明涉及了适于经支气管和经肺泡给药的ElirexTM组合物,包括各种可药用的、吸入用的气雾剂,但是不仅是这些。以气雾剂剂型给药的具体药物是五脒,该药物是通过吸入给予AIDS病患者以预防由卡氏肺囊虫诱发的肺炎。
本发明进一步涉及了适于经支气管和经肺泡给予ElirexTM的装置。该装置包括但不限于雾化器和汽化器。本发明还涉及了电子注射和直接注射的装置。电子注射,或称离子电渗疗法,是一种采用很小的电流使带电荷的元素、化合物和药物透过皮肤以使治疗药物转运到局部组织或全身的方法,该方法不对皮肤造成破坏。
本发明涉及了适于移植前器官储存的溶液。Chien等人(1993)在“Hibernation Induction Trigger for Organ Preservation”in MedicalIntelligence Unit,R.g.Landes Co.Ausin,TX.对适用的溶液进行了描述。ElirexTM可以用来,例如,代替和改进通常使用的极其不纯的大豆制品。
上述组合物是为了说明适于本发明ElirexTM给药的组合物,但不局限于此。生产不同种类组合物的方法是所属领域技术人员所能够了解的,在此不详细描述。
生产适当注射用、局部涂敷用装置,如雾化器和汽化器,的方法也是所属领域技术人员所能够了解的,在此不详细描述。
本发明还提供了与细胞程序死亡相关的病症的治疗方法,该方法包括给予一定量ElirexTM以有效地抑制细胞程序死亡。在这些方法中需给予有效治疗量的、包括上述组合物在内的可药用组合物。“有效治疗量”是指能够达到有效作用或所需临床效果的量。有效治疗量可以一次或多次给予。许多与细胞程序死亡相关的但能够治疗的疾病包括:皮肤老化作用、局部缺血后的再灌注作用、免疫抑制、胃肠紊乱症、心血管紊乱、组织移植排异、创伤愈合、和阿尔茨海默氏病症,但不局限于此。
与免疫抑制有关的病症是由于多种刺激引起的,这些刺激包括:病毒,包括但不限于HIV病毒,化疗剂、和辐射。这些刺激引发了许多病症中的细胞程序死亡,不仅仅包括消化道组织和相关胃肠性的紊乱。
胃肠紊乱包括但不限于肠内膜损伤、严重的慢性溃疡、结肠炎、辐射诱发的损伤、化疗引发性损伤、寄生虫导致的胃肠道紊乱症、和由任何其他原因造成的腹泻。许多病毒性和细菌性感染会导致胃肠紊乱;ElirexTM还适合治疗这些感染伴随的副作用。ElirexTM特别适于用来改善化疗引发的胃肠紊乱症。现已知道,用氨甲蝶呤和磷脂处理的大鼠与空白对照动物相比,遭受较小的喂食困扰且没有腹泻。如下所示,优选的ElirexTM实施方案比天然来源的、不纯的磷脂混合物,有超过200%的抗细胞程序死亡活性。因此,ElirexTM不仅适用于预防化疗诱发的腹泻还可以预防恶心。
ElirexTM尤其适于治疗动物的各种胃肠疾病,特别是家畜。这些病症,尤其是腹泻,造成许多幼仔损失。胃肠疾病的治疗优选以胃肠方式给药。对于家畜,有效量的ElirexTM通常是与饲料混合在一起。对于人,可以通过任何所属领域所熟知的胃肠给药方法来给予。优选口服。
另外,可以将ElirexTM给予免疫缺损患者,尤其是HIV-阳性患者,以达到预防或至少是缓解那些与疾病有关的T细胞的程序死亡,该细胞程序死亡会导致免疫缺损症恶化,正如所看到的那样,病人体内会患上恶性膨胀的AIDS。优选通过肠胃外方式给予这类患者以ElirexTM,但也可以是透皮或经胃肠给药。
ElirexTM还可以用来治疗与再灌注损伤相关的细胞程序死亡,该再灌注损伤涉及多种疾病,包括但不限于冠状动脉梗阻、大脑梗塞、脊柱/头部创伤和伴随性的严重麻痹、其他损害造成的再灌注损伤,例如冻伤,以及任何以往认为可以用超氧化物歧化酶(SOD)治疗的病症。氧自由基在心脏疾病中的作用的综述可以参见Singal(1988)“Oxygen Radicals in thePathophysiology of Heart Disease”Kluwer Academic Publishers,MA,USA.。
心肌梗塞和脑梗塞通常是由突发性动脉或静脉血供应不足造成的,这种供血不足是由气栓、血栓、或压力引起并造成微小区域的坏死;心脏、脑、脾、肾、肠、肺和睾丸都容易受到影响。血液再灌注造成梗塞,而细胞程序死亡则出现在梗塞区域的周围组织中;因此,须在刚形成梗塞在再灌注过程中或梗塞形成后很短时间内就给予ElirexTM,这样才能达到治疗效果。
因此,本发明涉及与再灌注相关的细胞程序死亡的治疗方法,该方法包括给予需要这种治疗的患者以有效治疗量ElirexTM。
本发明进一步涉及减轻与心肌和大脑梗塞有关的细胞程序死亡和再灌注损伤的方法,患者在梗塞时会有心脏病发作和心脏搏动的危险,该方法是给予需要这种治疗的患者以有效治疗量的ElirexTM。
优选肠胃外给予本发明所述组合物来治疗再灌注损伤。任何其他适合的方法也可使用,例如心肌梗塞时直心脏注射。这种注射的装置是所属领域技术人员熟知的,例如,Aboject心肌注射器。
本发明还涉及了在哺乳动物器官、组织、和细胞培养与保藏过程中抑制和预防细胞发生程序死亡的方法。该方法是将有效量的ElirexTM加入到任何种的介质或溶液中,该介质和溶液是所属领域中常用于培养或保藏哺乳动物器官、组织、和细胞的。
本发明又涉及了技术人员所熟知的、用于培养和保藏哺乳动物器官、组织和细胞的介质和溶液,该介质和溶液中含有一定量的ElirexTM,以有效地抑制或预防培养细胞发生的程序死亡。
本发明上述方面涉及了哺乳动物细胞培养用介质,该介质包括至少一种有效量的ElirexTM,及应用该介质来抑制或预防哺乳动物细胞培养中的细胞程序死亡。有效量是指能够降低细胞程序死亡速率的量。现在发现,ElirexTM能够抑制或预防细胞在受到轻度损伤情况下发生的细胞程序死亡,这种损伤通常会诱发细胞程序死亡。这种损伤包括但不限于低度辐射、冷冻细胞贮存物的解冻、温度、pH、渗透性、或培养介质离子浓度的快速改变、长期在不适温度、pH、渗透性、或培养介质离子浓度下暴露、与细胞毒素接触、原始细胞培养制备中细胞从完整组织解离下来、无血清生长(或无血清介质中的生长)。
本发明涉及了含有组织培养介质和有效量ElirexTM的组合物。将ElirexTM作为抗细胞程序死亡介质添加剂加入到无血清介质中,无血清介质包括但不限于:AIM V介质、Neuman和Tytell’s无血清介质、Trowell’s T8介质、Waymouth’s MB752/1和705/1介质、和Williams’介质E。除了无血清介质以外,还有其他适当的哺乳动物细胞培养介质,该培养介质也能够与作为抗细胞程序死亡介质添加剂的ElirexTM混合,包括Eagel基础培养基、Fisher’s介质、McCoy’s介质、介质199、RPMI介质1630和1640、以F-10&F-12营养混合物为基础的介质、Leibovitz’sL-15介质、Glasgow极限必需介质、和Dulbecco改进的Eagle介质,但是不仅限于此。可含有ElirexTM的哺乳动物细胞培养介质还可以进一步是任何所属领域技术人员已知的介质添加剂,包括蔗糖、维生素、激素、金属蛋白质、抗生素、抗真菌素、生长因子、脂蛋白和血清,但不限于此。
本发明还涉及哺乳动物移植前用的器官保藏溶液,以及这种溶液应用于抑制或预防哺乳动物器官在移植前的手术摘除和外科处理中的细胞程序死亡,其中该溶液包括有效量的ElirexTM。就所有情况而言,抑制和预防细胞程序死亡所需的ElirexTM浓度可以通过所属领域技术人员按照例如本发明下列实施例所描述的方法,以及本领域其他已知的方法进行实验性测定。
ElirexTM被认为可以局部涂敷在皮肤上以治疗多种皮肤病病症。这些病症包括但不限于:衰老造成的皱缩或松弛和/或失去光泽或鳞皮病。从而本发明涉及了皮肤病治疗方法。另外,秃发是由毛囊细胞程序死亡造成的。因此,适合采用ElirexTM的皮肤局部治疗方式来防止连续脱发。Stenn等人(1994)J.Invest.Dermatol.103:107-111。
如上所述,优选采用含有效量ElirexTM的组合物的局部涂敷方式来治疗这些病症。有效量的ElirexTM是指可以改善或减轻皮肤病症状的用量。尤其是,能够达到消除皮肤病病症或恢复正常皮肤功能的治疗效果;然而,本发明也包括所有对疾病症状的改善或缓解。
下来的实施例是用来说明本发明,但不局限于此。实施例1:最佳重组混合物的合成
将从市场购买到的纯化大豆磷脂PA、PI、LPA、LPI、LPC(例如,得自AvantiPolar Lipids,Inc.)悬浮在pH为8.0且含有154mM NaCl的50mM碳酸氢铵溶液中,或含有游离二价阳离子的pH在5-8范围内的缓冲水溶液中。可以使用总浓度大于10mg/ml的磷脂溶液,但需经声处理后达到透明。所用磷脂的最高总浓度大约是50mg/ml。
通常,磷脂混合物混悬在缓冲液中,混合物放置在一次性的硼硅酸盐玻璃杯中,优选使用2-3ml的16×100mm的试管或1.2ml的13×100mm试管,或1ml的12×75mm试管。然后将混合的磷脂进行声处理。优选采用小型浴式声处理器,例如带有大小为9×19cm椭圆型浴槽的Branson200型声处理器,声处理频率是40kHz并且耗电率是24W。水浴温度在21-40℃范围内。优选在25-37℃之间。水位高度调至接近于试管内磷脂混合物的高度。另外,还可以采用探针式声处理器(Fisher Scientific SonicDismenbrator model 550)进行处理,但是要防止混合物过热。
混合物进行声处理的时间是在3-90分钟内,该声处理过程中,先进行5分钟声处理,随后放置5分钟以使混合物达到平衡,将声处理过程和平衡过程交替进行直至混合物变成透明溶液,并且该混合物能很容易地通过滤器而被吸入到孔径是0.22μm的5ml注射器内。
ElirexTM在不同温度下的稳定性如附图1所示。ElirexTM是在4℃、室温、和65℃下储存一周。所得结果表明,ElirexTM在65℃条件下储存会造成活性损失,但在4℃或室温下没有发生显著的活性损失。
各磷脂组分的最佳比例可以通过将各纯化磷脂以不同比例混合、并且每次改变一种磷脂组分的方法来测定。实施例2中对各种混合物抗细胞程序死亡活性进行了分析。当确定最佳相对配比后,可以通过改变最有效磷脂组分的比例来发现最佳绝对活性。下表表示最终测试的配比。
| PA: PI: LPA: LPI∶LPC10: 10: 2: 2∶1(RNM)10: 10: 2: 2∶210: 10: 2: 2∶410: 10: 4: 2∶410: 10: 4: 2∶110: 10: 4: 2∶2 |
| 10: 10: 8: 2∶4(ElirexTM) |
所得结果如附图5-6所示。LPA的浓度随链长度进行改变,以测定这些参数对活性的作用。ElirexTM在不向温度下的稳定性如附图1所示。实施例2采用C3H/10T1/2细胞进行的细胞程序死亡分析试验
为了测定ElirexTM的抗细胞程序死亡活性,采用下面所述试验。PCT公开号WO94/25621和WO95/15173中描述了细胞分析试验。简单地说,将C3H/10T1/2克隆8细胞在50-58%融合的条件下和呈指数生长期下进行分析试验,该细胞指数生长期是随机分布的细胞周期位置,没有处于G0期和静止状态的细胞。在试验开始前,将2000个细胞/ml(5ml,在60mm培养平板中)育种5天,以使细胞呈指数生长状态。当T=0时,将作为细胞程序死亡刺激因素的培养物转移到无血清介质中,将种子提取物加入其中。空白对照物含有10-7和5×10-1M的12-O-十四烷酰佛波醇-13-乙酸酯(TPA),以保证细胞培养的反应性。将ElirexTM样品加入无血清介质中,并且当加入到培养基之前将其无菌过滤。分析试验以一式三份或四份的平行试验进行。细胞应答试验是在含有或不含有ElirexTM的无血清物中在18-28小时间进行。在各自含有不同细胞数量的细胞培养平板中进行两种分析试验。
1.将所有非粘附性或松散粘附细胞从培养皿中转移出来并采用适当的技术来计数,通常是使用电子颗粒计数器。这些是程序死亡性细胞,即无血清释放细胞(SDR),是在无血清介质培养的作用中释放出来的。通过紫外结构分析和DNA片段分析法看出,这些释放细胞中的近95%是程序死亡细胞。
2.将保留的粘附性细胞与缓冲液接触,常采用的缓冲液是平衡盐溶液,例如pH为7.3、不含有钙和镁盐的、含有0.05%胰蛋白酶和0.53mM乙二胺四乙酸(EDTA)的Hanks平衡盐溶液。在室温或37℃条件下将各培养物温育,该温育是在振摇平台上进行,这样可以保证胰蛋白酶试剂能均匀分布在培养物表面。当达到标准时间阶段后,通常是10分钟,将释放细胞从各培养皿中转移出来,并且按照上述的方法测定,通常采用电子颗粒计数法。该ADH细胞计数包括了胰蛋白酶耐受性细胞和胰蛋白酶敏感细胞,如PCT WO94/25621所述。
抗细胞程序死亡活性是以计算出来的材料浓度(μg/ml的介质)来表示,该浓度是指能够使50%经无血清处理释放的细胞存活的浓度。
由程序死亡细胞试验中得到的结果如附图7-8所示。在附图中,发生程序死亡的细胞(SDR)和粘附性细胞(ADH)的百分率是分别表示的。附图所示数据证明,ElirexTM组合物有效地减少了融合细胞的程序死亡,该结果是相比于Eagle基础培养基(BME)的无血清空白对照而言的。实施例3pH和盐浓度对ElirexTM的抗细胞程序死亡活性的影响
在不同的pH和盐浓度条件下测定ElirexTM组合物的抗细胞程序死亡活性。
ElirexTM活性测定是按照实施例1中所述,将磷脂重新混悬在pH为8.0的碳酸氢铵、或pH为6.5的磷酸钠、或pH为6.5的HEPES、或pH为5.0的醋酸钠溶液中,上述溶液的浓度都是50mM并且含有154mM(等渗)氯化钠。附图1表示所得的结果,其中pH为8时活性最高。
为了测定溶液所含盐浓度对活性的影响,将pH.为8的溶液在氯化钠浓度分别为0、100、500和1000mM的条件下进行测定。为了处理细胞,所有样品都先制备成浓溶液,然后用BME稀释。最佳盐浓度是在100-200mM之间,但结果并没用图表示。
还做了不同温度下的贮藏稳定性试验。所有溶液在4、37和69℃下储存一周然后测定它们的活性。所得结果在附图1中表示。
最佳的溶液是含有105mM氯化钠的50mM溶液碳酸氢氨溶液,该溶液pH值为8,并且储存在4℃条件下。
虽然本发明通过一些具体的说明和实施例来使本发明发明目的易于理解,但很显然地是,所属领域的技术人员一定能够在实际工作中作出进一步的改进和修饰。因此,本发明的说明和实施例不能作为本发明保护范围的限定,本发明将在权利要求书中另有规定。
Claims (48)
1.一种具有抗细胞程序死亡活性的组合物,该组合物包括:
(a)磷脂酸(PA);
(b)磷脂酰肌醇(PI);
(c)溶血性磷脂酸(LPA)
(d)溶血性磷脂酰肌醇(LPI);和
(e)溶血性磷脂酰胆碱(LPC);
其中各磷脂基本上是纯的磷脂。
2.根据权利要求1所述的组合物,其中,各磷脂的含量比例是在约分别0∶5∶2∶0∶0-20∶20∶16∶4∶8的范围内。
3.根据权利要求1所述的组合物,其中各磷脂的含量比例是在约2∶8∶6∶2∶2-15∶15∶10∶4∶8的范围内。
4.根据权利要求1所述的组合物,其中各磷脂含量比例是在大约4∶16∶12∶4∶4-7.5∶7.5∶5∶2∶4的范围内。
5.根据权利要求1所述的组合物,其中各磷脂含量比例约是分别10∶10∶8∶2∶4。
6.根据权利要求1所述的组合物,其中的磷脂是来源于植物、动物或经合成得到,但其中LPA是非动物性来源的。
7.根据权利要求6所述的组合物,其中,动物来源的磷脂是从肝脏中提取的。
8.根据权利要求1所述的组合物,其中组合物已经声处理。
9.根据权利要求8所述的组合物,其中,进行的声处理直至使组合物呈透明状。
10.根据权利要求8所述的组合物,其中,声处理所持续的时间大约是3-90分钟。
11.根据权利要求8所述的组合物,其中声处理过程是将声处理过程和平衡过程交替进行,各过程分别持续5分钟。
12.根据权利要求8所述的组合物,其中,声处理时使组合物温度不得高于60℃。
13.根据权利要求1所述的组合物,还包括可生理用缓冲液。
14.根据权利要求13所述的组合物,其中的缓冲液pH值约在5.5-8.0之间。
15.根据权利要求14所述的组合物,其中的缓冲液的pH值是约8.0。
16.根据权利要求1的组合物,其中所含磷脂的总浓度大约为10mg/ml。
17.一种制备具有抗细胞程序死亡活性组合物的方法,该方法包括的步骤是:
(a)将一定量的下列物质,以能够产生抗细胞程序死亡活性的比例混合,并且溶于可生理用的缓冲液中,这些物质是:
(i)磷脂酸(PA);
(ii)磷脂酰肌醇(PI);
(iii)溶血性磷脂酸(LPA)
(iv)溶血性磷脂酰肌醇(LPI);和
(v)溶血性磷脂酰胆碱(LPC)。
(b)将磷脂/缓冲液混合物进行声处理。
18.根据权利要求17的方法,其中磷脂可以是来自植物、动物或合成来源的,但其中LPA是非动物来源的。
19.根据权利要求18所述的方法,其中动物来源的磷脂是从肝脏提取的。
20.根据权利要求18的方法,其中所含磷脂的总浓度大约为10mg/ml。
21.根据权利要求17所述的方法,其中,持续进行声处理直至磷脂组合物呈透明状。
22.根据权利要求17所述的方法,其中声处理所持续的时间大约是3-90分钟。
23.根据权利要求17所述的方法,其中的声处理是将声处理过程和平衡过程交替进行,各过程分别持续5分钟。
24.根据权利要求17所述的方法,其中声处理时组合物温度不得高于60℃。
25.根据权利要求17所述的方法,其中缓冲液的pH值是约8.0。
26.根据权利要求25所述的方法,其中,缓冲液是选自含碳酸氢盐的一系列溶液。
27.根据权利要求1、7、19或21所述方法制得的组合物。
28.一种细胞程序死亡的治疗方法,包括给予需要这种治疗的患者以有效治疗量的可药用组合物,该可药用组合物含有权利要求27所述的组合物。
29.根据权利要求28所述的方法,其中患者患有胃肠性紊乱。
30.根据权利要求29的方法,其中,胃肠性紊乱是由刺激因素引起,这些刺激是选自人体免疫缺陷病毒、化疗剂和辐射和那些有关的传染性疾病。
31.根据权利要求29所述的方法,其中,胃肠性紊乱是由于炎性肠疾病。
32.根据权利要求30所述的方法,其中的传染性疾病选自由致腹泻性生物引发的一系列疾病。
33.根据权利要求31所述的方法,其中该治疗能够减轻与免疫抑制病毒、化疗剂、或辐射和免疫抑制药物有关的病症。
34.根据权利要求33所述的方法,其中的病毒是人体免疫缺陷病毒。
35.根据权利要求28所述的方法,其中患者患有与局部缺血和/或在局部缺血后再灌注有关的细胞程序死亡疾病。
36.根据权利要求35所述的方法,其中的再灌注与冠状动脉梗阻;脑梗塞;脊柱/头部创伤和严重的并发性麻痹和冻伤有关。
37.一种组合物,该组合物含有组织培养介质和有效量的、如权利要求27所述的组合物。
38.一种预防培养细胞中发生细胞程序死亡的方法,该方法包括用权利要求27所述的组合物处理细胞。
39.根据权利要求38所述的方法,其中的细胞是哺乳动物细胞。
40.根据权利要求39所述的方法,其中细胞是人体细胞。
41.根据权利要求38所述的方法,其中的细胞是昆虫细胞。
42.根据权利要求39所述的方法,其中的细胞来源于组织或器官的某部分。
43.一种器官保藏的方法,该方法包括在储存器官的溶液内加入有效量的、如权利要求27所述的组合物。
44.一种器官保藏的方法,该方法包括:给予受体动物至少一个静脉内型药物团,该静脉内药物含有有效量的如权利要求27所述组合物。
45.一种治疗皮肤病的方法,该皮肤病与细胞程序死亡有关,该治疗方法包括:采用局部给予方式,给予需要这种治疗的患者以有效治疗量的可药用组合物,该组合物包括了权利要求27所述的组合物。
46.根据权利要求45所述的方法,其中的皮肤病是指皮肤的皱缩、松弛、鳞皮病、秃发或脱发。
47.根据权利要求46所述的方法,其中权利要求27所述组合物是膏霜剂或软膏剂或凝胶剂。
48.一种治疗创伤的方法,该方法包括给予有效量的含有权利要求27所述的组合物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US378995P | 1995-09-14 | 1995-09-14 | |
| US08/003,789 | 1995-09-14 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1200036A true CN1200036A (zh) | 1998-11-25 |
Family
ID=21707614
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN96197739A Pending CN1200036A (zh) | 1995-09-14 | 1996-09-13 | 含有磷脂混合物并具有抗细胞程序死亡活性的组合物 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US6004579A (zh) |
| EP (1) | EP0850064A1 (zh) |
| JP (2) | JPH11512439A (zh) |
| CN (1) | CN1200036A (zh) |
| AU (1) | AU7071896A (zh) |
| CA (1) | CA2229435A1 (zh) |
| WO (1) | WO1997009989A1 (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106032912A (zh) * | 2015-03-11 | 2016-10-19 | 潍坊桂禾散热片科技有限公司 | 一种原子介质二次传导散热器 |
| CN112843072A (zh) * | 2021-01-12 | 2021-05-28 | 山东省科学院生物研究所 | 磷脂在调控血管生成方面的应用 |
Families Citing this family (46)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5756126A (en) * | 1991-05-29 | 1998-05-26 | Flinders Technologies Pty. Ltd. | Dry solid medium for storage and analysis of genetic material |
| US6627226B2 (en) | 1988-10-05 | 2003-09-30 | Whatman, Inc. | Dry solid medium for storage and analysis of genetic material |
| CA2180954C (en) | 1994-01-11 | 2007-03-20 | William Markland | Inhibitors of human plasmin derived from the kunitz domains |
| US6057287A (en) | 1994-01-11 | 2000-05-02 | Dyax Corp. | Kallikrein-binding "Kunitz domain" proteins and analogues thereof |
| US6495532B1 (en) * | 1997-03-19 | 2002-12-17 | Sky High, Llc | Compositions containing lysophosphotidic acids which inhibit apoptosis and uses thereof |
| WO1999008514A1 (en) * | 1997-08-20 | 1999-02-25 | Lxr Biotechnology, Inc. | Compositions containing polyethylene glycol and uses thereof |
| US6949528B1 (en) * | 1998-03-18 | 2005-09-27 | Goddard John G | Compositions containing lysophosphatidic acids which inhibit apoptosis and uses thereof |
| US6270781B1 (en) * | 1999-01-08 | 2001-08-07 | Maxim Pharmaceuticals, Inc. | Method and compositions for topical treatment of damaged tissue using reactive oxygen metabolite production or release inhibitors |
| US6413556B1 (en) * | 1999-01-08 | 2002-07-02 | Sky High, Llc | Aqueous anti-apoptotic compositions |
| WO2001012141A1 (fr) | 1999-08-18 | 2001-02-22 | Kyowa Hakko Kogyo Co., Ltd. | Stimulants pour la pousse de cheveux |
| AU2580801A (en) * | 1999-12-14 | 2001-06-25 | Sky High, Llc | Phospholipid compositions as anti-inflammation agents |
| US20060063738A1 (en) * | 2000-02-28 | 2006-03-23 | Sky High, Llc | Compositions containing lysophosphotidic acids which inhibit apoptosis and uses thereof |
| US20030130237A1 (en) * | 2000-03-17 | 2003-07-10 | Miller Duane D. | LPA receptor agonists and antagonists and methods of use |
| CA2371400A1 (en) | 2001-02-16 | 2002-08-16 | Kyowa Hakko Kogyo Co., Ltd. | Hair-growing agent |
| US6562804B2 (en) | 2001-02-16 | 2003-05-13 | Kyowa Hakko Kogyo Co., Ltd. | Hair-growing agent |
| JP4836345B2 (ja) * | 2001-04-13 | 2011-12-14 | きみ子 室伏 | 環状ホスファチジン酸誘導体を含む神経細胞の生存促進剤 |
| EP1425020A4 (en) * | 2001-08-20 | 2005-05-18 | Tatton Technologies Llc | METHOD AND COMPOSITIONS FOR TREATING APOPTOSIS-RELATED DISEASES |
| AU2003201570A1 (en) * | 2002-01-21 | 2003-09-02 | Vasogen Ireland Limited | Peptide-carrying bodies for immune response |
| CA2368656A1 (en) * | 2002-01-21 | 2003-07-21 | Vasogen Ireland Limited | Receptor-ligand pairing for anti-inflammatory response |
| US20050058698A1 (en) * | 2002-01-21 | 2005-03-17 | Nolan Yvonne Mairead | Pharmaceutically acceptable phosphate-glycerol carrying bodies and uses relating to Parkinson's Disease |
| WO2003103475A2 (en) | 2002-06-07 | 2003-12-18 | Dyax Corp. | Prevention and reduction of blood loss |
| US7153829B2 (en) | 2002-06-07 | 2006-12-26 | Dyax Corp. | Kallikrein-inhibitor therapies |
| ITMI20021280A1 (it) * | 2002-06-11 | 2003-12-11 | Carlo Ghisalberti | Metodo di trattamento anticellulite |
| DE10238831A1 (de) * | 2002-08-23 | 2004-03-11 | Siemens Ag | Verfahren und Vorrichtung zur Prozessoptimierung |
| SI2386310T1 (sl) * | 2002-08-28 | 2019-03-29 | Dyax Corp. | Metode za ohranjanje organov in tkiv |
| EP1398019A1 (de) | 2002-09-13 | 2004-03-17 | Cognis France S.A. | Verfahren zum Schutz und zur Modulation von Dermal Epidermal Junctions |
| US20040209243A1 (en) * | 2003-01-07 | 2004-10-21 | Andrew Nixon | Kunitz domain library |
| US6989369B2 (en) * | 2003-02-07 | 2006-01-24 | Dyax Corp. | Kunitz domain peptides |
| EP1475434A1 (en) | 2003-05-09 | 2004-11-10 | Oncoscience AG | Method for storing tumor cells |
| WO2005021557A2 (en) * | 2003-08-29 | 2005-03-10 | Dyax Corp. | Poly-pegylated protease inhibitors |
| US7638099B2 (en) | 2004-04-09 | 2009-12-29 | Vivebio, Llc | Devices and methods for collection, storage and transportation of biological specimens |
| US7235530B2 (en) | 2004-09-27 | 2007-06-26 | Dyax Corporation | Kallikrein inhibitors and anti-thrombolytic agents and uses thereof |
| WO2007026358A2 (en) * | 2005-08-31 | 2007-03-08 | Modus Biological Membranes Ltd. | Compositons comprising phosphatidic acid for treatment of eosinophilia and related disorders |
| US7276480B1 (en) | 2005-12-30 | 2007-10-02 | Dyax Corp. | Prevention and reduction of blood loss |
| AU2006344178A1 (en) * | 2006-06-09 | 2007-12-13 | Erasmus University Medical Center Rotterdam | Modulation of the immune system by inositol phospholipids |
| CA2674949A1 (en) | 2007-01-12 | 2008-07-24 | J. Marc Simard | Targeting ncca-atp channel for organ protection following ischemic episode |
| CN101358609A (zh) * | 2007-08-03 | 2009-02-04 | 富准精密工业(深圳)有限公司 | 风扇转子 |
| CN102307594A (zh) * | 2009-01-06 | 2012-01-04 | 戴埃克斯有限公司 | 用激肽释放酶抑制剂治疗粘膜炎 |
| JP5826742B2 (ja) * | 2009-05-07 | 2015-12-02 | ドンコック ファーマシューティカル カンパニー リミテッド | 神経損傷及び神経疾患の予防または治療用薬学組成物 |
| HUE039605T2 (hu) | 2010-01-06 | 2019-01-28 | Dyax Corp | Plazma kallikreint kötõ proteinek |
| KR102320178B1 (ko) | 2011-01-06 | 2021-11-02 | 다케다 파머수티컬 컴패니 리미티드 | 혈장 칼리크레인 결합 단백질 |
| US9034820B2 (en) | 2011-03-14 | 2015-05-19 | Hsinyu Lee | Method and composition for modulating erythropoiesis |
| WO2015148790A1 (en) | 2014-03-27 | 2015-10-01 | Dyax Corp. | Compositions and methods for treatment of diabetic macular edema |
| NZ744233A (en) | 2015-12-11 | 2023-11-24 | Takeda Pharmaceuticals Co | Plasma kallikrein inhibitors and uses thereof for treating hereditary angioedema attack |
| WO2021173535A1 (en) | 2020-02-26 | 2021-09-02 | Finless Foods Inc. | Systems and methods for live fish tissue preservation |
| WO2023023309A1 (en) | 2021-08-20 | 2023-02-23 | Finless Foods Inc. | Systems and methods for fish tissue preservation |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1165238A (en) * | 1980-03-12 | 1984-04-10 | Demetrios P. Papahadjopoulos | Activated liposomes and method |
| EP0047480B1 (en) * | 1980-09-05 | 1986-02-05 | Institut Armand Frappier | Formation of an immunosome exclusively made of viral antigens reconstituted on an artificial membrane |
| JP2524586B2 (ja) * | 1985-06-26 | 1996-08-14 | シタス コーポレイション | ポリマ−接合を利用する医薬組成物用蛋白質の可溶化 |
| JPS6351335A (ja) * | 1986-08-20 | 1988-03-04 | Fuji Oil Co Ltd | 肥満細胞脱顆粒抑制剤 |
| US5053327A (en) * | 1988-09-20 | 1991-10-01 | The United States Of America As Represented By The Secretary Of Agriculture | High affinity monoclonal antibodies to bowman-birk inhibitor and immunoassay methods |
| US5376373A (en) * | 1990-09-06 | 1994-12-27 | Trustees Of The University Of Pennsylvania | Method of inhibiting radiation induced weight and hair loss |
| AU655823B2 (en) * | 1991-05-08 | 1995-01-12 | Crucell Switzerland Ag | Immunostimulating and immunopotentiating reconstituted influenza virosomes and vaccines containing them |
| CA2150956A1 (en) * | 1992-12-10 | 1994-06-23 | Robert G. L. Shorr | Glycolipid enzyme-polymer conjugates |
| EP0703990A4 (en) * | 1993-04-30 | 1997-09-24 | Lxr Biotechnology Inc | METHOD FOR DETECTING POTENTIALLY THERAPEUTICALLY EFFECTIVE AGENTS AND CELL LINES THAT CAN BE USED FOR THIS |
| NZ248603A (en) * | 1993-05-28 | 1994-12-22 | Abbott Lab | Nutritional product for enteral nutritional support of hiv victims comprising proteins and fat |
| US5759548A (en) * | 1993-11-30 | 1998-06-02 | Lxr Biotechnology Inc. | Compositions which inhibit apoptosis, methods of purifying the compositions and uses thereof |
| EP0762870B1 (en) * | 1994-05-31 | 2002-09-11 | INEX Pharmaceutical Corp. | Virosome-mediated intracellular delivery of therapeutic agents |
-
1996
- 1996-09-13 US US08/704,732 patent/US6004579A/en not_active Expired - Fee Related
- 1996-09-13 CN CN96197739A patent/CN1200036A/zh active Pending
- 1996-09-13 EP EP96931580A patent/EP0850064A1/en not_active Withdrawn
- 1996-09-13 CA CA002229435A patent/CA2229435A1/en not_active Abandoned
- 1996-09-13 WO PCT/US1996/014752 patent/WO1997009989A1/en not_active Application Discontinuation
- 1996-09-13 JP JP9512148A patent/JPH11512439A/ja not_active Ceased
- 1996-09-13 AU AU70718/96A patent/AU7071896A/en not_active Abandoned
-
2007
- 2007-11-15 JP JP2007297344A patent/JP2008101009A/ja active Pending
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106032912A (zh) * | 2015-03-11 | 2016-10-19 | 潍坊桂禾散热片科技有限公司 | 一种原子介质二次传导散热器 |
| CN112843072A (zh) * | 2021-01-12 | 2021-05-28 | 山东省科学院生物研究所 | 磷脂在调控血管生成方面的应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| US6004579A (en) | 1999-12-21 |
| EP0850064A1 (en) | 1998-07-01 |
| CA2229435A1 (en) | 1997-03-20 |
| AU7071896A (en) | 1997-04-01 |
| JP2008101009A (ja) | 2008-05-01 |
| JPH11512439A (ja) | 1999-10-26 |
| WO1997009989A1 (en) | 1997-03-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1200036A (zh) | 含有磷脂混合物并具有抗细胞程序死亡活性的组合物 | |
| US6793945B2 (en) | Aqueous anti-apoptotic compositions | |
| ES2305256T3 (es) | Acido lipoteicoico derivado de bacterias de acido lactico para el uso como medicamento y en el tratamiento de enfermedades bacterianas. | |
| AU657969B2 (en) | Phospholipids | |
| CN1827766B (zh) | 体外细胞的培养方法 | |
| EP0374390B1 (en) | Whey protein composition, a method for producing it and application of the whey protein composition | |
| CN1140998A (zh) | 抑制编程性细胞死亡的组合物、其纯化方法及其用途 | |
| EP1040833B1 (en) | Bone resorption suppressing agent | |
| DE60317639T3 (de) | Zusammensetzungen enthaltend n-acyl-phosphatidyl-ethanolamin und/oder mischungen von n-acyl-ethanolaminen mit phosphatidinsäuren oder lysophosphatidinsäuren | |
| JP2002535288A (ja) | リポタンパク質複合体およびそれらを含む組成物 | |
| JPH01287040A (ja) | 免疫系を刺激する方法 | |
| Laoli et al. | PRODUCTIVITY OF SNAKEHEAD FISH (Channa striata) AS A SOURCE OF WOUND HEALING | |
| JP4051475B2 (ja) | 成長因子複合体の抽出方法 | |
| JPH0427964B2 (zh) | ||
| KR20090104089A (ko) | 피부미용제 | |
| CN101505763A (zh) | 通过肌醇磷脂调节免疫系统 | |
| CN101112393B (zh) | 一种表面活性物质组合物莫尔尤菲及其制备方法与用途 | |
| RU2376978C2 (ru) | Комплексный апипрепарат в виде суппозиториев для лечения андрологических заболеваний и способ его получения | |
| EP1529784A1 (en) | Polymeric anhydride of magnesium and proteic ammonium phospholinoleate-palmitoleate. | |
| JPH1075750A (ja) | にんにく系健康飲料 | |
| JP2010202569A (ja) | 抗アレルギー及び抗炎症用組成物 | |
| CN1393222B (zh) | 一种溶解在油脂中的甾醇化合物的组合物的新用途 | |
| JP2009143854A (ja) | 創傷治癒促進剤 | |
| RU2311171C1 (ru) | Противоинфекционный липосомный препарат и фармацевтическая композиция на его основе | |
| JP3172599B2 (ja) | 細胞賦活剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C01 | Deemed withdrawal of patent application (patent law 1993) | ||
| WD01 | Invention patent application deemed withdrawn after publication |