CN113683491A - 一种4-(2-溴乙基)苯酚的制备方法 - Google Patents
一种4-(2-溴乙基)苯酚的制备方法 Download PDFInfo
- Publication number
- CN113683491A CN113683491A CN202111020580.7A CN202111020580A CN113683491A CN 113683491 A CN113683491 A CN 113683491A CN 202111020580 A CN202111020580 A CN 202111020580A CN 113683491 A CN113683491 A CN 113683491A
- Authority
- CN
- China
- Prior art keywords
- hydrobromic acid
- bromoethyl
- phenol
- reaction
- tyrosol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C37/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom of a six-membered aromatic ring
- C07C37/62—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom of a six-membered aromatic ring by introduction of halogen; by substitution of halogen atoms by other halogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C37/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom of a six-membered aromatic ring
- C07C37/68—Purification; separation; Use of additives, e.g. for stabilisation
- C07C37/685—Processes comprising at least two steps in series
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C37/00—Preparation of compounds having hydroxy or O-metal groups bound to a carbon atom of a six-membered aromatic ring
- C07C37/68—Purification; separation; Use of additives, e.g. for stabilisation
- C07C37/70—Purification; separation; Use of additives, e.g. for stabilisation by physical treatment
- C07C37/84—Purification; separation; Use of additives, e.g. for stabilisation by physical treatment by crystallisation
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Crystallography & Structural Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
本发明公开了一种4‑(2‑溴乙基)苯酚的制备方法,其采用了相对易购价廉的酪醇和氢溴酸为原料,利用溴原子置换醇羟基的溴化反应,属于经典有机反应之置换卤化反应;该反应不发生多卤化,产品纯度高,收率普遍较高等技术效果;采用价廉易制造易购买的氢溴酸为溴化剂,适当的过量使用就能将反应平衡推向生成产物的方向;产物收率可达96%以上,纯度可达97.5%以上,反应液通过蒸馏浓缩处理后可以循环使用,取得非常好的技术效果。
Description
技术领域
本发明涉及医药化工技术领域,特别是一种4-(2-溴乙基)苯酚的制备方法。
背景技术
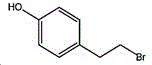
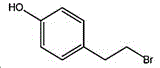
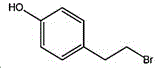
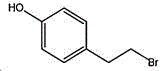
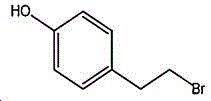
4-(2-溴乙基)苯酚;国际化联命名:4-(2-bromoethyl)phenol;又名:4-羟基苯乙基溴,对羟基苯乙基溴;英文别名:4-Hydroxy-1-(2-bromoethyl)benzene,4-HYDROXYPHENETHYL BROMIDE;CAS14140-15-9,分子式C8H9BrO,分子量201.063;
物理性质:密度1.5±0.1g/cm-3,沸点276.5±15.0℃(760mmHg),熔点88-92℃(lit.),闪点121.1±20.4℃ ,折射率1.593,蒸汽压0.00283mmHg(25℃),微溶于水(1.3g/L25℃),易溶于醇、醚和卤代烷。
化学性质:分子结构中的活泼烷基溴极易发生亲核取代反应。
用途:有机合成中间体,特别是药物合成中间体;比如:
合成一种LTA4H水解酶抑制剂药物,US 20080194630 A1;
合成一种疾病诊断和检查药物,US20060083681 A1;
合成高活性镇痛和抗抑郁等药物,US20180072654A1;
合成光电压敏材料,US7977020 B2;
合成橄榄油中的功能成份,US20090076142A1;
合成运动性或平滑肌张力改变相关的治疗药物,US5231104;
合成亲水芬太尼衍生物类药物,US20180273475A1;
合成一种有用的季铵盐化合物作为毒蕈碱受体拮抗剂,US20080269190A1;
合成恶唑烷酮抑制剂的前药,US20110218177A1;
合成选择性sigma-1受体配体,US20130102571A1;
合成惰性衍生物作为组蛋白去甲基化酶抑制剂,US20200289463A1;
合成治疗阿尔茨海默氏病的特效药物加兰他敏(GALANTAMINE),以及合成一些天然生物碱药物等;更多的应用被开发,而采用高纯度的4-(2-溴乙基)苯酚为原料是这些合成的优先选择。
4-(2-溴乙基)苯酚的合成方法有如下报道:
1. Barchuk, William T.; Dunford, Paul J.;Edwards, James P.; Fourie,Anne M.;Karlsson, Lars;Quan, Joanne M.US 20080194630 A1 【 LTA4H水解酶抑制剂及其使用】Location in patent: Page/Page column 28;该专利方法为:用酪醇为原料和氢溴酸反应;这种浅黄色溶液加热到80℃,搅拌16小时。反应混合物被冷却到室温,然后用二氯甲烷(CH2Cl2)提取(3×50毫升),混合提取物过滤、减压浓缩和干燥,得到棕褐色固体产物。
这个方法能以较高的转化率得到粗产品;但缺点是:苯环溴代物多,产物不纯,无法结晶出来,只能用有机溶剂萃取分离,产物杂质多,纯化困难。
2. Moriya,Toshimitsu;Yoneda,Shinichiro; Kawana,Keita;Ikeda,Reiko;Konakahara,Takeo;Sakai, Norio Organic Letters,2012,vol.14,#18 p.4842-4845,以对羟基苯乙酸为原料合成;需要高压加氢还原,路线太长,工业化困难。
3. US20060083681 A1【心肌灌注成像的化合物】;Page/Page column 11;该专利方法为:在一个圆形底部烧瓶中,加入15毫升甲醇,加入4-溴乙酰酚(4.6mmol);然后加入10wt% Pd/C(10wt%,0.10g),混合物充满氢气加氢;反应10个小时,然后通过硅藻柱分离;分离液集中,在真空中浓缩获得4-(2-溴乙基)酚作为纯化产品。
这个方法的缺点是:原料很贵,钯碳加氢,安全性差,产物杂质多,只能用层析柱分离,污染大,工业化困难。
4.Krysin;Egorova;Vasil'Ev Russian Journal of General Chemistry,2010,vol.80,#2p.275-283;以di[2-(4-hydroxyphenyl)]ethyl ether为原料;该法原料价格比产物还高;无工业化意义。
5.Bioorganic and Medicinal Chemistry Letters,vol.9,#11p. 1619 - 1624以4-甲氧基苯乙基溴为原料;相当于逆合成,无工业化生产价值。
6.Bioorganic and Medicinal Chemistry Letters,vol.9,#11 p.1619 -1624以4-甲氧基苯乙酸为原料;原料贵,路线长,还需加氢,脱烷基,无工业化生产价值。
7.Bioorganic and Medicinal Chemistry Letters,vol.9,#11 p.1619 -1624以4-甲氧基苯乙醇为原料;原料贵,还需脱烷基,无工业化生产价值。
8.Monatshefte fuer Chemie,vol.41,p.9以1-甲氧基-4-(2-甲氧基乙基)苯为原料;原料贵,还需脱烷基,无工业化生产价值。
9.Prosenko;Skorobogatov;Dyubchenko;Pinko;Kandalintseva;Shakirov;Pokrovsky Russian Chemical Bulletin,2007,vol.56,#6p.1119-1124以2-(3,5-di-tert-butyl-4-hydroxyphenyl)-ethanol为原料;原料不易得,无工业化生产价值。
10.Journal of the Chemical Society,p.1571以4-(2-Bromoethyl)anilinehydrochloride (1:1)为原料;相当于逆合成,无工业化意义。
11.Bulletin de la Societe Chimique de France,p.3427-3432以4-甲氧基苯乙酸甲酯为原料;原料昂贵,工艺复杂、路线长,还需加氢,脱烷基,无工业化生产价值。
12.Monatshefte fuer Chemie,vol.41,p.89以(E)-1-(p-Methoxyphenyl)-2-methoxyethylene为原料;相当于逆合成, 无工业化生产价值。
13.Monatshefte fuer Chemie,vol.41,p.89以4-甲氧基溴苄1-(bromomethyl)-4-methoxybenzene为原料;原料昂贵,工艺路线长,还需脱烷基,污染大,无工业化生产价值。
14.Tetrahedron Letters,vol.52,# 28p.3551-3554以bis(4-(2-bromoethyl)phenol) oxalate为原料;相当于逆合成,无工业化意义。
15.Monatshefte fuer Chemie,vol.41,p.89以1-甲氧基-4-(2-甲氧基乙基)苯为原料;原料贵不易得,工艺路线长,还需脱烷基,污染大,无工业化生产价值。
目前,以上4-(2-溴乙基)苯酚制备方法都存在一些不足,特别是制备高纯度产品和工业化生产工艺的缺陷。
随着4-(2-溴乙基)苯酚的新用途被不断开发,市场对4-(2-溴乙基)苯酚的需求也出现较大增长,急需开发一种原料易得,反应条件温和,产品收率高,纯化简单,生产成本相对低,三废少,操作简便,易于清洁化工业生产的高效合成制备方法。
发明内容
为了克服背景技术中的技术问题,本发明提供了一种4-(2-溴乙基)苯酚的制备方法。
本发明解决其技术问题所采用的技术方案是:
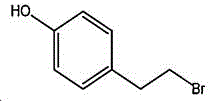
一种4-(2-溴乙基)苯酚的制备方法,以酪醇为原料与氢溴酸进行溴化反应得到4-(2-溴乙基)苯酚,冷却结晶后,再分别用碳酸氢钾溶液和水洗涤结晶物,真空干燥后得到4-(2-溴乙基)苯酚制品。
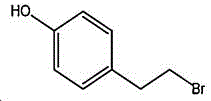
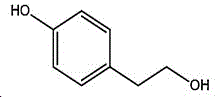
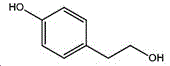
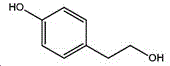
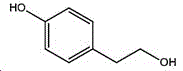
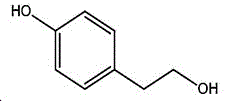
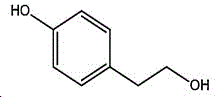
本制备方法采用酪醇为原料,酪醇中文别名:4-羟基苯乙醇,对羟苯基乙醇,2-(4-羟苯基)乙醇,4-(2-羟乙基)苯酚;英文名Tyrosol,英文别名:2-(4-Hydroxyphenyl)ethanol,4-Hydroxyphenethyl,alcohol,4-Hydroxyphenylethanol,p-HPEA;国际化联命名:4-(2-hydroxyethyl)phenol;CAS:501-94-0;为白色晶体粉末,密度:1.168(g/ m3,20/4℃),相对蒸汽密度:4.76(g/cm3,空气=1),熔点:89~93℃,沸点:287.8℃(常压),195℃(18mmHg);该原料易购相对价廉,也可以多种方法合成。
进一步,本发明的一种4-(2-溴乙基)苯酚的制备方法具体如下:
以酪醇为原料加入氢溴酸,所述酪醇与氢溴酸中溴化氢的摩尔比为1: 3.0~4.8,在73~95℃的温度下搅拌进行溴化反应12~24小时得到4-(2-溴乙基)苯酚,然后冷却降温至常温,再陈化1~5小时至结晶完全;滤出反应液后得到4-(2-溴乙基)苯酚结晶物,用碳酸氢钾溶液中和4-(2-溴乙基)苯酚结晶物中残留的氢溴酸后生成溴化钾,再用水洗涤出溴化钾,过滤出4-(2-溴乙基)苯酚结晶物,在60℃温度下真空干燥,得到4-(2-溴乙基)苯酚制品;
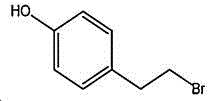
其中,所述酪醇的结构式为:
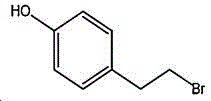
所述4-(2-溴乙基)苯酚的结构式为:
反应式为:
溴原子置换醇羟基的溴化反应,属于经典有机反应之置换卤化反应;由于该反应不发生多卤化,产品纯度高,收率普遍较高等优点;在精细有机合成中经常被采用,这是本专业技术人员熟知的技术手段。
醇的分子结构和溴化剂以及溴化条件是溴化反应结果的关键影响因素。其中,溴化剂可选择溴化磷(PBr3)和溴化氢气体或氢溴酸(溴化氢的水溶液),但溴化磷价格高不易购买,运输不便,反应元素利用率低被放弃;而溴化氢气体的直接使用将会把气体发生装置和溴化装置紧密的配合在一起才可实施,工艺要求高,安全性差,也被放弃;选择价廉易购易制得的氢溴酸为溴化剂为最佳选择。
氢溴酸(Hydrobromic acid):是溴化氢的水溶液,是一种强酸,室温下饱和的氢溴酸中溴化氢含量为68.85%(重量);化学式HBr,分子量80.91,CAS登录号10035-10-6,恒沸点126℃(47%wt),密度1.49g/cm³(47%);无色透明至淡黄色液体,具有刺激性酸味;与水混溶,可混溶于乙醇、乙酸;容易被硫酸、氧等氧化产生游离溴素,露于空气及日光中因溴游离而逐渐变成黄棕色;应密封避光保存于阴凉干燥处。
目前,采用氢溴酸为溴化剂的方法又有以下方式可选:
①用酸原位制取氢溴酸对酪醇的溴化反应。
反应式为:
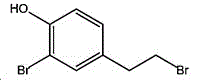
其中,硫酸法的结果是:4-(2-溴乙基)苯酚收率可达80%;但是,其中含有3-5%的很难分离的苯环溴代物杂质(结构式Ⅰ);4-(2-溴乙基)苯酚的纯度只能达94%,满足不了产品的纯度要求;而且产生的大量硫酸氢盐废物的处理也是难题。
酚和取代酚的苯环都很容易和溴素发生邻﹑对位的溴代反应,当对位被其它基团占位时,就只发生邻位的取代反应;特别是在氢溴酸溶液中,像酪醇和4-(2-溴乙基)苯酚这样的活性物就更容易和溴素发生邻位的单溴代副反应,从而产生(结构式Ⅰ)的副产物;若溴素更多的话,还会产生双邻位溴代副反应。这是本专业技术人员熟知的基本有机合成反应原理。
其中,磷酸法的结果是:虽然受浓磷酸的粘度较大反应搅拌困难的影响,还是取得了相似的产物收率,产物中的苯环溴代物杂质(结构式Ⅰ)相比用硫酸少了许多;产物还是不能满足产品的纯度要求;而且包含产物﹑过量磷酸﹑过量氢溴酸和副产磷酸二氢钾的处理非常麻烦。
②催化剂催化氢溴酸对酪醇的溴化反应;
反应式为:
催化剂除了代表性的硫酸外,还可以使用包括:溴化锌(ZnBr2),对甲苯磺酸,氢型聚苯乙烯磺酸树脂(如732,D001等),三氟甲烷磺酸等。其中,硫酸法的结果是:4-(2-溴乙基)苯酚收率可达85%,但纯度只有96%,也含有2~5%的苯环溴代物杂质(结构式Ⅰ),此法也不适用。
其中,溴化锌或对甲苯磺酸或氢型聚苯乙烯磺酸树脂(732或D001)或三氟甲烷磺酸法的结果是:产物收率被保持或更高,纯度也能保持或更高;产物中苯环溴代物杂质(结构式Ⅰ)相比用硫酸少了许多,产物还是不能满足产品的纯度要求,而且,催化剂的失效以及产生的污染物也不好解决。
③在带水剂作用下氢溴酸对酪醇的溴化反应,
反应式为:
实验结果是:产物收率可达92%,纯度可达97%,也含有少量苯环溴代物杂质(结构式Ⅰ);反应液通过浓缩处理后可以循环使用。
但是,这种有毒﹑易燃﹑易挥发有机溶剂的使用,总是会带来较大安全风险和VoCs控制的问题。
本发明的制备方法采用过量氢溴酸与酪醇的溴化反应;对于像酪醇这样活性较强的醇的溴化,采用价廉易制造易购买的氢溴酸,其中含43~48%的溴化氢为溴化剂,适当的过量使用就能将反应平衡推向生成产物的方向。
反应式为:
酪醇与氢溴酸中溴化氢的摩尔比为1: 3.0~4.8的配比混合搅拌,升温进行溴化反应,最后冷却结晶4-(2-溴乙基)苯酚,产物收率可达96%以上,纯度可达97.5%以上,含有少量苯环溴代物杂质;反应液通过浓缩处理后可以循环使用,并得到非常好的技术效果。
进一步优选的,以酪醇为原料加入氢溴酸进行溴化反应时,所述酪醇与氢溴酸中溴化氢的摩尔比为1:3.5~4.5。因通常酪醇与氢溴酸中溴化氢的摩尔比为1:1.5以上,溴化反应后就能得到4-(2-溴乙基)苯酚,但产物收率较低;而酪醇与氢溴酸中溴化氢采用较大过量摩尔比为1: 4.8以上配比量进行溴化时,产物收率可在96%以上增长,但增长缓慢;当配比量以1/10mol反应时,转化率虽然达到97.5%,但增加一倍体积后的反应设备成本过高;本发明优选采用酪醇与氢溴酸中溴化氢的摩尔比摩尔比为1:3.5~4.5,可获得较好的产物收率,同时提高了工艺的经济性。
优选的,以酪醇为原料加入氢溴酸进行溴化反应时,同时通入氮气。通入氮气可避免氢溴酸在溴化反应过程中被空气中的氧气氧化为溴素,提高溴化反应的效果并可避免产生难以分离的苯环溴代物杂质(结构式Ⅰ)。
优选的,所述酪醇与氢溴酸进行溴化反应后;冷却降温至15~25℃,同时加入4-(2-溴乙基)苯酚作晶种,再陈化1~5小时至结晶完全。加入4-(2-溴乙基)苯酚作晶种,可控制结晶过程,大大提高结晶速率和结晶物品质。
优选的,以酪醇为原料加入氢溴酸进行溴化反应时,所述的氢溴酸为经去除游离溴处理后的氢溴酸。氢溴酸经过除游离溴处理后颜色变成浅黄至无色后再和酪醇进行溴化反应;最终冷却结晶的4-(2-溴乙基)苯酚产物收率可达97%,纯度可达99%,产物中几乎不含苯环溴代物杂质(结构式Ⅰ);提高收率,同时可制得高纯度的4-(2-溴乙基)苯酚。
优选的,所述氢溴酸中溴化氢含量为43~48%(重量)。氢溴酸中溴化氢含量低于43%(重量),溴化反应时间超过24小时,时间过长、收率也低于90%;而氢溴酸中溴化氢含量高于48%为发烟氢溴酸,使用运输都不方便。
进一步,本发明的制备方法中酪醇与氢溴酸溴化反应后的反应液可进行回收后循环使用,具体步骤如下:
将酪醇与氢溴酸溴化反应完成后,冷却结晶后滤出的反应液加入到蒸馏釜中,在搅拌和加热下,蒸馏出氢溴酸恒沸点前的水分;蒸馏釜内得到溴化氢含量大于43%(重量)的氢溴酸,循环用于酪醇与氢溴酸的溴化反应。
因酪醇与过量的氢溴酸进行溴化反应后,消耗了1mol氢溴酸,反应液中氢溴酸浓度就降低了,而且,反应液中还含有少量未反应的原料酪醇,通过蒸馏去恒沸点前的前馏分,即124℃前的馏分,其中还含有少量的氢溴酸,可方便提浓氢溴酸浓度,达到溴化反应所需浓度,其实反应液是可以一直反复循环使用;其中,釜内得到溴化氢含量大于43%的氢溴酸可采用两种方式提纯处理:蒸馏釜中蒸出前馏分后,再蒸出恒沸物(124~128℃)得纯化的43~48%的氢溴酸,和市售的商品氢溴酸品质相当;残馏物为杂质,收集送专业废物处理;或者在蒸馏釜内加入活性碳吸附其中杂质,过滤,得到43~48%的氢溴酸,和市售的商品氢溴酸品质相当;废活性碳收集送专业废物处理;
进一步本发明提供第二种回收循环方法,将所述碳酸氢钾溶液中和4-(2-溴乙基)苯酚结晶物后的中和滤液及水洗后含有溴化钾的水洗滤液可进行回收后循环使用,具体步骤如下:
a、将碳酸氢钾溶液中和4-(2-溴乙基)苯酚结晶物后的中和滤液及水洗后含有溴化钾的水洗滤液,通过蒸发去除水分,回收得到的溴化钾;再与硫酸反应生成溴化氢气体和硫酸氢钾;
b、将步骤a制得的溴化氢气体通入酪醇与氢溴酸溴化反应后滤出的反应液中,在25℃及以下温度进行溶解吸收提高氢溴酸浓度,得到溴化氢含量43~48%(重量)的氢溴酸,再循环用于酪醇与氢溴酸的溴化反应。
采用回收方法,大大减少了废弃物的排放,并提高了制备工艺的经济效益。
进一步优选的,将上述两种回收方法得到的氢溴酸加入红磷去除其中的游离溴后,再循环用于酪醇与氢溴酸的溴化反应;
氢溴酸经过除溴处理后颜色变成浅黄至无色后再和酪醇进行溴化反应;可大大提高收率,同时制得高纯度的4-(2-溴乙基)苯酚产品。
本发明的有益效果是:本发明采用了相对易购价廉的酪醇和氢溴酸为原料,利用溴原子置换醇羟基的溴化反应,属于经典有机反应之置换卤化反应;该反应不发生多卤化,产品纯度高,收率普遍较高等技术效果;采用价廉易制造易购买的氢溴酸(其中溴化氢含量为43~48%)为溴化剂,适当的过量使用就能将反应平衡推向生成产物的方向;产物收率可达96%以上,纯度可达97.5%以上,反应液通过蒸馏浓缩处理后可以循环使用,取得了非常好的技术效果。
其中,以酪醇为原料加入氢溴酸进行溴化反应时,所述酪醇与氢溴酸中溴化氢的摩尔比为1:3.5~4.5。可获得较好的产物收率,同时提高了工艺的经济性。
以酪醇为原料加入氢溴酸进行溴化反应时,同时通入氮气。通入氮气可避免氢溴酸在溴化反应过程中被空气中的氧气氧化为溴素,提高溴化反应的效果并可避免产生难以分离的苯环溴代物杂质(结构式Ⅰ)。
以酪醇为原料加入氢溴酸进行溴化反应时,所述的氢溴酸为经去除游离溴处理后的氢溴酸。氢溴酸经过除游离溴处理后颜色变成浅黄至无色后再和酪醇进行溴化反应;最终冷却结晶的4-(2-溴乙基)苯酚产物收率可达97%,纯度可达99%,产物中几乎不含苯环溴代物杂质(结构式Ⅰ);提高了收率,同时制得高纯度的4-(2-溴乙基)苯酚。
所述氢溴酸中溴化氢含量为43~48%(重量)。氢溴酸中溴化氢含量含量低于43%(重量),溴化反应时间超过24小时,收率也低于90%;而氢溴酸中溴化氢含量高于48%为发烟氢溴酸,使用运输都不方便。
本发明制备方法还提供了二种反应物回收循环方法,大大减少了反应后废弃物的排放,并提高了制备工艺的经济效益,实现了工艺的增效环保。
附图说明
图1是本发明的制备方法工艺示意图。
具体实施方式
以下实施例用于说明本发明的一种4-(2-溴乙基)苯酚的制备方法,以酪醇为原料与氢溴酸进行溴化反应得到4-(2-溴乙基)苯酚,冷却结晶后,再分别用碳酸氢钾溶液和水洗涤结晶物,真空干燥后得到4-(2-溴乙基)苯酚制品,其制备方法工艺如图1所示。
实施例1
商品氢溴酸的除溴处理 :
取市售标注溴化氢含量为47%(重量)的工业品氢溴酸9000克(红棕色),实测溴化氢含量为45.5%(重量),游离溴含量为2.5%(重量);加入到一个带有通气管﹑回流冷凝器﹑温度计﹑搅拌器的10升体积的圆形四口玻璃反应瓶中,通氮气置换瓶内空气,反应瓶置于调温水浴锅中;再加入21克红磷粉。搅拌升温至90℃,12小时后,溶液变为淡黄色,分析HBr含量为48.0%(重量),游离溴180PPm。
实施例2
4-(2-溴乙基)苯酚的制备:
取558g(4.0mol)的酪醇(工业品99%)加入到5升带有通气管﹑回流冷凝器﹑温度计﹑搅拌器的圆形四口玻璃反应瓶中,通氮气置换瓶内空气,反应瓶置于调温水浴锅中;再加入实施例1制备的氢溴酸2030克,其中含溴化氢48%(重量)经除溴处理后的氢溴酸(其中含溴化氢12.0mol);搅拌反应混合物并加热,控制反应温度在90℃~95℃下继续搅拌反应24小时;停止加热反应,继续搅拌下自然降温,反应液中出现浅黄色的结晶颗粒,至常温后继续搅拌5小时;结晶物通过过滤分离出溴化反应液后,用10%的碳酸氢钾溶液中和洗涤结晶物后过滤,再用水洗涤后过滤;得到的结晶物于60℃真空干燥,得到 4-(2-溴乙基)苯酚的类白色结晶粉末782.5克,分析纯度为99.1%(HPLC),收率以酪醇计为96.1%,检测不到苯环溴代物杂质(结构式Ⅰ)。
另:得到1600克淡黄色的溴化反应后的反应液;分析溴化氢含量为38.2%(重量)。
过滤后还得到碳酸氢钾中和滤液和水洗滤液合并1.5升,PH值为7.5。
实施例3
使用未除溴处理氢溴酸制备4-(2-溴乙基)苯酚:
按实施例2的操作过程实施,所不同的是;使用的是未经除溴处理的市售标注为47%工业品氢溴酸3000克(红棕色),不通氮气进行溴化反应。得到深棕色的膏状物沉淀于瓶底,分析(HPLC法)含有1.8%的苯环溴代物杂质(结构式Ⅰ);分离出膏状物用乙醇溶解并加入活性炭粉脱色处理得到红棕色溶液,上硅藻土柱吸附﹑洗脱分离﹑浓缩﹑结晶得到浅灰色粉末产物689克,分析(HPLC法)4-(2-溴乙基)苯酚含量为96.3%,收率以酪醇计为82.1%,含0.5%的环溴物杂质(结构式Ⅰ)。
实施例4
4-(2-溴乙基)苯酚的制备:
按实施例2 的操作过程,所不同的是:经除溴处理的氢溴酸用量为2700克,反应温度为80~85℃,反应时间为16小时;得到 4-(2-溴乙基)苯酚的类白色结晶粉末785克,分析纯度为99.2%(HPLC),收率以酪醇计为96.4%,检测不到苯环溴代物杂质(结构式Ⅰ)。
另:得到2270克淡黄色的溴化反应后的反应液;分析溴化氢含量为41.0%(重量)。
还得到碳酸氢钾中和滤液和水洗滤液合并1.5升,PH值7.5。
实施例5
4-(2-溴乙基)苯酚的制备:
按实施例2 的操作过程,所不同的是:经除溴处理的氢溴酸用量为3240克,反应温度为73~78℃,反应时间为12小时;得到 4-(2-溴乙基)苯酚的类白色结晶粉末788克,分析纯度为99%(HPLC),收率以酪醇计为96.5%,检测不到苯环溴代物杂质(结构式Ⅰ)。
另:得到2610克淡黄色的溴化反应后的反应液;分析溴化氢含量为42.5%(重量)。
得到碳酸氢钾中和滤液和水洗滤液合并1.5升,PH值7.5。
实施例6
4-(2-溴乙基)苯酚的制备:
按实施例4的操作过程;所不同的是:停止加热反应后加入4-(2-溴乙基)苯酚10克作晶种,继续搅拌下冷水浴降温,1小时后温度降到15~25℃常温,再搅拌1小时后过滤。得到4-(2-溴乙基)苯酚799克,分析纯度为99.3%,收率以酪醇计为97%,检测不到苯环溴代物杂质(结构式Ⅰ)。
另:得到2268克淡黄色的溴化反应后的反应液;分析溴化氢含量为41%(重量)。
得到碳酸氢钾中和滤液和水洗滤液合并1.5升,PH值为7.5。
实施例7
溴化反应液的浓缩回收:
将实施例2﹑实施例4﹑实施例6的溴化反应后的反应液一并加入到一个10升四口蒸馏瓶中,在搅拌下加热蒸馏,蒸出124℃前馏水分0.6升后,冷水浴降至常温得到5715克淡黄色的氢溴酸,分析溴化氢含量为43.2%;游离溴240PPm。
实施例8
溴化反应液的吸收回收:
将实施例2﹑实施例4﹑实施例5﹑实施例6得到的中和滤液和水洗滤液合并6升,加入到一个10升四口蒸馏瓶中,在搅拌下加热真空蒸馏脱水至出现晶体物,转移至烘箱干燥得到黄色的固体溴化钾265克;再转移至一个0.5升的四口玻璃瓶中,先加入100克90%的硫酸,搅拌加热至有气体发生后,再通过滴液瓶向反应瓶内滴加入230克90%的硫酸,通过滴加速度控制产气速度;产生的溴化氢气体,通入实施例4得到的2610克淡黄色的溴化反应后的反应液中,反应液平均分装于两个串联的1升吸收瓶中以鼓泡方式溶解吸收(两个吸收瓶用冰水冷却,保持吸收过程中吸收液的温度小于20℃);滴加完硫酸后,氮气吹扫。合并两瓶吸收液得到2750克淡黄色的氢溴酸,分析溴化氢含量为45.2%,游离溴255PPm。
实施例9
溴化反应液的除溴处理:
将实施例3分离出的红棕色溴化反应后的反应液2600克﹑实施例7得到的5715克淡黄色氢溴酸﹑实施例8得到的2750克淡黄色氢溴酸一并加入到一个10升的反应瓶中,加入红磷粉24克,加入氮气保护下搅拌加热至95℃反应18小时,溶液变为浅黄色;降至常温后,得到浅黄色氢溴酸10800克;分析溴化氢含量为43.3%(重量),游离溴125PPm。
实施例10
回收的氢溴酸循环用于4-(2-溴乙基)苯酚的制备:
按实施例2的操作过程实施;所不同的是:加入实施例9制得的氢溴酸3600克,停止加热反应后加入4-(2-溴乙基)苯酚10克,继续搅拌下冷水浴降温,2小时后温度降到15℃,再搅拌2小时后过滤。得到4-(2-溴乙基)苯酚805克,分析纯度为99.5%,收率以酪醇计为97.9%,检测不到苯环溴代物杂质(结构式Ⅰ)。
在此说明书中,本发明已参照其特定的实施例做了描述,但是,很显然仍可以做出各种修改而不背离本发明的范围。因此,说明书应被认为是说明性的而非限制性的。
Claims (10)
1.一种4-(2-溴乙基)苯酚的制备方法,其特征在于,以酪醇为原料与氢溴酸进行溴化反应得到4-(2-溴乙基)苯酚,冷却结晶后,再分别用碳酸氢钾溶液和水洗涤结晶物,真空干燥后得到4-(2-溴乙基)苯酚制品。
2.根据权利要求1所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,制备方法具体如下:
以酪醇为原料加入氢溴酸,所述酪醇与氢溴酸中溴化氢的摩尔比为1: 3.0~4.8,在73~95℃的温度下搅拌进行溴化反应12~24小时得到4-(2-溴乙基)苯酚,然后冷却降温至常温,再陈化1~5小时至结晶完全;滤出反应液后得到4-(2-溴乙基)苯酚结晶物,用碳酸氢钾溶液中和4-(2-溴乙基)苯酚结晶物中残留的氢溴酸后生成溴化钾,再用水洗涤出溴化钾,过滤出4-(2-溴乙基)苯酚结晶物,在60℃温度下真空干燥,得到4-(2-溴乙基)苯酚制品;
其中,所述酪醇的结构式为:
所述4-(2-溴乙基)苯酚的结构式为:
反应式为:
3.根据权利要求2所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,以酪醇为原料加入氢溴酸进行溴化反应,所述酪醇与氢溴酸中溴化氢的摩尔比为1:3.5~4.5。
4.根据权利要求2所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,以酪醇为原料加入氢溴酸中进行溴化反应时,同时通入氮气。
5.根据权利要求2所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,所述酪醇与氢溴酸进行溴化反应后;冷却降温至15~25℃,同时加入4-(2-溴乙基)苯酚作晶种,再陈化1~5小时至结晶完全。
6.根据权利要求1~5任一项所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,以酪醇为原料加入氢溴酸进行溴化反应,所述的氢溴酸为经去除游离溴处理后的氢溴酸。
7.根据权利要求6所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,所述氢溴酸中溴化氢含量为43~48%(重量)。
8.根据权利要求2所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,所述酪醇与氢溴酸溴化反应后的反应液进行回收后循环使用,具体步骤如下:
将酪醇与氢溴酸溴化反应完成后,冷却结晶后滤出的反应液加入到蒸馏釜中,在搅拌和加热下,蒸馏出氢溴酸恒沸点前的水分;蒸馏釜内得到溴化氢含量大于43%(重量)的氢溴酸,循环用于酪醇与氢溴酸的溴化反应。
9.根据权利要求2所述的一种4-(2-溴乙基)苯酚的制备方法,其特征在于,所述碳酸氢钾溶液中和4-(2-溴乙基)苯酚结晶物后的中和滤液及水洗后含有溴化钾的水洗滤液进行回收后循环使用,具体步骤如下:
a、将碳酸氢钾溶液中和4-(2-溴乙基)苯酚结晶物后的中和滤液及水洗后含有溴化钾的水洗滤液,通过蒸发去除水分,回收得到的溴化钾;再与硫酸反应生成溴化氢气体和硫酸氢钾;
b、将步骤a制得的溴化氢气体通入酪醇与氢溴酸溴化反应后滤出的反应液中,在25℃及以下温度进行溶解吸收,得到溴化氢含量43~48%(重量)的氢溴酸,循环用于酪醇与氢溴酸的溴化反应。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202111020580.7A CN113683491A (zh) | 2021-09-01 | 2021-09-01 | 一种4-(2-溴乙基)苯酚的制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202111020580.7A CN113683491A (zh) | 2021-09-01 | 2021-09-01 | 一种4-(2-溴乙基)苯酚的制备方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN113683491A true CN113683491A (zh) | 2021-11-23 |
Family
ID=78584718
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202111020580.7A Pending CN113683491A (zh) | 2021-09-01 | 2021-09-01 | 一种4-(2-溴乙基)苯酚的制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN113683491A (zh) |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6218584B1 (en) * | 1995-03-06 | 2001-04-17 | Albemarle Corporation | Process for the preparation of tetrabromobisphenol-A |
| CN1860117A (zh) * | 2003-07-28 | 2006-11-08 | 詹森药业有限公司 | 苯并咪唑、苯并噻唑和苯并噁唑衍生物及其作为lta4h调节剂的应用 |
| CN101189012A (zh) * | 2005-03-31 | 2008-05-28 | 詹森药业有限公司 | 苯基和吡啶基lta4h调节剂 |
| US20080194630A1 (en) * | 2007-02-14 | 2008-08-14 | Barchuk William T | LTA4H modulators and uses thereof |
| CN101674835A (zh) * | 2007-04-12 | 2010-03-17 | 台湾神隆股份有限公司 | 制备加兰他敏的方法 |
| CN108658730A (zh) * | 2018-05-11 | 2018-10-16 | 常州大学 | 一种对氟苯酚的制备方法 |
| CN109879769A (zh) * | 2019-03-22 | 2019-06-14 | 邯郸市赵都精细化工有限公司 | 一种溴元素循环利用制备氨甲苯酸的方法 |
| CN110753693A (zh) * | 2016-12-23 | 2020-02-04 | 阿尔维纳斯运营股份有限公司 | Egfr蛋白水解靶向嵌合分子和相关使用方法 |
| CN112745213A (zh) * | 2020-12-31 | 2021-05-04 | 江苏恒沛药物科技有限公司 | 合成2-溴代戊二酸二丁酯废水中溴资源的回收套用方法 |
-
2021
- 2021-09-01 CN CN202111020580.7A patent/CN113683491A/zh active Pending
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6218584B1 (en) * | 1995-03-06 | 2001-04-17 | Albemarle Corporation | Process for the preparation of tetrabromobisphenol-A |
| CN1860117A (zh) * | 2003-07-28 | 2006-11-08 | 詹森药业有限公司 | 苯并咪唑、苯并噻唑和苯并噁唑衍生物及其作为lta4h调节剂的应用 |
| CN101189012A (zh) * | 2005-03-31 | 2008-05-28 | 詹森药业有限公司 | 苯基和吡啶基lta4h调节剂 |
| US20080194630A1 (en) * | 2007-02-14 | 2008-08-14 | Barchuk William T | LTA4H modulators and uses thereof |
| CN101674835A (zh) * | 2007-04-12 | 2010-03-17 | 台湾神隆股份有限公司 | 制备加兰他敏的方法 |
| CN110753693A (zh) * | 2016-12-23 | 2020-02-04 | 阿尔维纳斯运营股份有限公司 | Egfr蛋白水解靶向嵌合分子和相关使用方法 |
| CN108658730A (zh) * | 2018-05-11 | 2018-10-16 | 常州大学 | 一种对氟苯酚的制备方法 |
| CN109879769A (zh) * | 2019-03-22 | 2019-06-14 | 邯郸市赵都精细化工有限公司 | 一种溴元素循环利用制备氨甲苯酸的方法 |
| CN112745213A (zh) * | 2020-12-31 | 2021-05-04 | 江苏恒沛药物科技有限公司 | 合成2-溴代戊二酸二丁酯废水中溴资源的回收套用方法 |
Non-Patent Citations (1)
| Title |
|---|
| (日)日本化学会编,曹惠民等译: "《无机化合物合成手册 第一卷》", 化学工业出版社, pages: 121 - 122 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2924738T3 (es) | Proceso para la preparación de 6-(2,4-diclorofenil)-5-[4-[(3S)-1-(3-fluoropropil)pirrolidin-3-il]oxifenil]-8,9-dihidro-7H-benzo[7]anuleno-2-carboxilato de metilo y una sal del mismo | |
| WO2009040367A1 (en) | Process for the preparation of fluorine containing organic compound | |
| CN113683491A (zh) | 一种4-(2-溴乙基)苯酚的制备方法 | |
| JP5069236B2 (ja) | フルオロメチル1,1,1,3,3,3−ヘキサフルオロイソプロピルエーテル(セボフルラン)の精製方法 | |
| Schwab et al. | Synthesis of (2R, 3R)-and (2S, 3S)-[2, 3-2H2] oxirane and application of it to the synthesis of chirally labeled homoserine | |
| CN114524718A (zh) | 一种由邻苯二甲酸二酯制备高纯邻苯二甲醛的方法 | |
| WO2000068173A1 (fr) | Procédé de production de tétrafluoro benzèneméthanols | |
| JP3777408B2 (ja) | カルボン酸誘導体の製造法 | |
| WO1999029699A1 (en) | Process for producing toluene derivatives | |
| CN107641067B (zh) | 一种邻二酮的α位溴化方法 | |
| McKenzie et al. | LXVII.—The isomeric tropic acids | |
| KR101670527B1 (ko) | 파라-니트로벤질 브로마이드를 제조하기 위한 개선된 방법 | |
| JP3885497B2 (ja) | 1,2,4−ブタントリオールの製造方法 | |
| JPH0791264B2 (ja) | N−(2−アミノ−3−ヒドロキシベンゾイル)−l−プロリナ−ルアセタ−ルおよびその製造方法 | |
| JP2001261644A (ja) | ヘキサヒドロイソインドリン・酸付加塩およびその使用方法 | |
| JPWO1999044976A1 (ja) | 1,2,4−ブタントリオールの製造方法 | |
| Margaretha et al. | Synthesis of imines of. alpha.,. beta.-acetylenic ketones | |
| CH630893A5 (fr) | Procede de preparation d'o-(2,6-dichloroanilino)phenylacetamides n,n-disubstitues. | |
| KR890005062B1 (ko) | 헤미아세탈로부터 플루오랄 및 헥사플루오로아세톤의 순수한 히드레이트를 제조하는 방법 | |
| EP1392631A2 (en) | Process for removal of dimethyl ether in the synthesis of sevoflurane | |
| JPS6216937B2 (zh) | ||
| CN1891680B (zh) | 制备高纯度的无卤邻苯二醛的方法 | |
| JP2897833B2 (ja) | 2―クロロ―4―フルオロフェノールの製造方法 | |
| JPH021827B2 (zh) | ||
| JPS6133014B2 (zh) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20211123 |