CN107922459B - 粘附性肽及其用途 - Google Patents
粘附性肽及其用途 Download PDFInfo
- Publication number
- CN107922459B CN107922459B CN201680028082.8A CN201680028082A CN107922459B CN 107922459 B CN107922459 B CN 107922459B CN 201680028082 A CN201680028082 A CN 201680028082A CN 107922459 B CN107922459 B CN 107922459B
- Authority
- CN
- China
- Prior art keywords
- cells
- peptide
- peptides
- adhesion
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/1875—Bone morphogenic factor; Osteogenins; Osteogenic factor; Bone-inducing factor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/04—Surgical adhesives or cements; Adhesives for colostomy devices containing macromolecular materials
- A61L24/10—Polypeptides; Proteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/08—Peptides having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/10—Peptides having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L24/00—Surgical adhesives or cements; Adhesives for colostomy devices
- A61L24/001—Use of materials characterised by their function or physical properties
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/43504—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates
- C07K14/43563—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from insects
- C07K14/43586—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from insects from silkworms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09J—ADHESIVES; NON-MECHANICAL ASPECTS OF ADHESIVE PROCESSES IN GENERAL; ADHESIVE PROCESSES NOT PROVIDED FOR ELSEWHERE; USE OF MATERIALS AS ADHESIVES
- C09J189/00—Adhesives based on proteins; Adhesives based on derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/0068—General culture methods using substrates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0603—Embryonic cells ; Embryoid bodies
- C12N5/0606—Pluripotent embryonic cells, e.g. embryonic stem cells [ES]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0618—Cells of the nervous system
- C12N5/0619—Neurons
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2400/00—Materials characterised by their function or physical properties
- A61L2400/06—Flowable or injectable implant compositions
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2533/00—Supports or coatings for cell culture, characterised by material
- C12N2533/50—Proteins
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2539/00—Supports and/or coatings for cell culture characterised by properties
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Biomedical Technology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- Epidemiology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Biophysics (AREA)
- Wood Science & Technology (AREA)
- Immunology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Pathology (AREA)
- Food Science & Technology (AREA)
- Plant Pathology (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Reproductive Health (AREA)
- Neurology (AREA)
- Developmental Biology & Embryology (AREA)
- Gynecology & Obstetrics (AREA)
- Surgery (AREA)
Abstract
本申请公开了被用作生物粘附性物质的具有新型序列的肽;以及它的用途。根据本申请的肽不仅允许比如细胞和组织的生物衍生物质还允许非生物衍生物质附着到各种物体或物质上,并且可以通过与比如标志物质、蛋白质、碳水化合物和脂质的有机材料结合而且与各种无机材料结合而用于比如不仅粘附性组合物而且生物缀合组合物的不同的应用领域。
Description
技术领域
本公开涉及具有包括附着或吸附到各种表面的粘附性质的多肽。
背景技术
生物粘合剂是充当用于细胞、组织的粘合剂的聚合材料或从其衍生的任何衍 生物,并且在各个领域中具有许多实际应用。例如,它们可以用于医学领域中用 于附着在组织之间或组织和细胞之间,用于愈合伤口、再生或修复组织,或者在 生物技术中用于培养干细胞或其他一般的细胞、充当载体递送药物,用于生物缀 合或组织填充物等。
因而,除了良好的粘附性之外,生物粘合剂要求具有足以在体内安全和长期 使用的较少的副作用和较长的半衰期。
生物粘合剂的例子包括氰基丙烯酸酯、纤维蛋白、明胶、白蛋白或聚氨酯类 材料。氰基丙烯酸酯通常用于局部伤口闭合;然而,该用途受到从氰基丙烯酸酯 释放的有毒物质的限制。基于合成聚合物的生物粘合剂由于其在水性条件下的弱 的粘附性而也具有缺点。美国专利申请公开2002-0022588和WO99/66964公开了 与碳二亚胺交联的白蛋白或明胶。然而用于交联的碳二亚胺是有毒的并且具有弱 的粘附性,因而限制了其在体内的用途。
因此,需要开发具有改善的粘附性以及适用于各种条件(特别是在体内)的较小的毒性的新型生物粘合剂。
发明内容
本公开提供具有改善的粘附性的具有较小毒性或无毒性的在各种条件下具有 广泛应用的新型多肽以及其用途。
在一个方面,本公开提供了具有式I的肽或其衍生物:[X1-X2-X3-X4-X5]n:
其中:
X1为任何氨基酸,
X2、X3和X4可以相同或不同,各自为L、V、I、E或A,
X5为K或R,
n为1至5的整数,并且如果n为2或更大,则每个肽可以相同或不同,其中, 所述氨基酸为天然的或非天然的L-型或D-型。
在本公开中,氨基酸由相关领域中定义的单字母代码表示如下:A,丙氨酸; R,精氨酸;N,天门冬酰胺;D,天门冬氨酸;C,半胱氨酸;E,谷氨酸;Q, 谷氨酰胺;G,甘氨酸;H,组氨酸;I,异亮氨酸;L,亮氨酸;K,赖氨酸;M, 甲硫氨酸;F,苯丙氨酸;P,脯氨酸;S,丝氨酸;T,苏氨酸;W,色氨酸;Y, 酪氨酸;V,缬氨酸;Z,谷氨酸和谷氨酰胺;X,序列表中的任何氨基酸。
在一个实施方式中,式I的X1为S、T、C、P、N或Q。
在其他实施方式中,式I的X2-X3-X4的序列可以由AAA、EEE、LVA、LVL、 LVV、LLA、LLL或LLV表示。
在其他实施方式中,式I的肽的序列可以由QLVVK(SEQ ID NO:1)、 QEEEK(SEQ IDNO:2)、QAAAK(SEQ ID NO:3)、NLVVK(SEQ ID NO:4)或 SLVVK(SEQ ID NO:5)表示。
在本公开的其他方面,式II或式I的肽进一步包括[式II],其可以与N端或C 端连接或者与N端和C端都连接:[X6-X7-X8-X9-X10-X11]n:
在式II中,
X6为F、Y或W;
X7为K或R,
X8为A、M或I,
X9为L、M或G,
X10为任何氨基酸,
X11为C、S或T,
n为1或2,
其中作为整体的X8和X9和/或作为另一个整体的X10和X11可以不存在,
其中式I的X2、X3和X4中的至少一个可以不存在。
在一个实施方式中,式II的多肽可以由FRALPC(SEQ ID NO:6)、FREEPC (SEQ IDNO:7)、FRVVPC(SEQ ID NO:8)、FEALPC(SEQ ID NO:9)、YRALPC (SEQ ID NO:10)、WRALPC(SEQ ID NO:11)、FRALP(SEQ ID NO:12)、FRAL(SEQ ID NO:13)或FRPC(SEQ ID NO:14)表示。
在本公开的另外的方面,式I和/或式II的多肽可以在其N端和/或C端进一 步包括式III的多肽:X12 1-15,其中式I、II和III的多肽可以从N端至C端按照式III-I-II的顺序连接,其中X为带正电荷的或带负电荷的氨基酸。在一个实施方式 中,带正电荷的氨基酸为K或R,并且带负电荷的氨基酸为D或E。
本公开的多肽可以根据取决于特定目的的需要与各种用于靶向或标记的试剂 缀合。
在仍其他方面,本公开提供包括如本文公开的本发明的多肽的生物缀合组合 物。
在仍其他方面,本公开提供用于将各种生物或非生物来源的材料附着到其它 各种生物或非生物来源的材料或者改善各种生物或非生物来源的材料附着到其它 各种生物或非生物来源的材料的粘附性的粘附性组合物。
在仍其他方面,本公开提供本发明的肽用于生物缀合的用途。
在仍其他方面,本公开提供本发明的肽用于将各种生物或非生物来源的材料 附着到其它各种生物或非生物来源的材料或者改善各种生物或非生物来源的材料 附着到其它各种生物或非生物来源的材料的粘附性的用途。
在仍其他方面,本公开提供本发明的多肽用于细胞附着的用途。
有益效果
本公开的新型肽可以有利地用作用于将比如细胞或组织的生物材料附着到各 种表面的生物粘合剂。而且,本发明的肽可以用作与比如核酸、蛋白质、碳水化 合物或脂质等的各种无机或有机材料缀合,用于将它们附着到各种表面,并且因 而可以在需要它的领域中有许多应用。
附图说明
图1A至1D为示出根据本公开的一个实施方式的肽(A7-1)粘附至作为非生物 材料的玻璃、Zr、乙烯基类塑料(Vinyl)、聚苯乙烯纤维、聚己内酯、Ti和胶原(Col) 的结果。
在图1A中,将通过二硫键与生物素缀合的根据本公开的一个实施方式的肽附 着到玻璃上,并且分析来自生物素的信号。该信号表明本发明的肽附着到玻璃上。 当用DTT对其处理以除去二硫键时信号消失,表明该信号来自与本发明的肽缀合 的生物素。
图1B为图1A中采用的方法的示意性表示,示出附着到玻璃上的本发明的肽 与生物素缀合,然后通过生物素的抗体对其进行检测。通过用去除SH键的DTT 处理,并且从而将生物素从本发明的肽释放,信号消失。
图1C为用来测试本发明的肽对各种非生物材料的粘附性的方法的示意性表 示,除了使用FITC(异硫氰酸荧光素)代替生物素作为标记试剂以外,其基本上与 图1A相同。
图1D为如图1C所述进行分析的结果,并示出了本发明的肽对各种非生物材 料的表面的粘附性。从左到右,每个图上的圆圈分别表示仅PBS(磷酸盐缓冲盐水)、 FITC缀合的A7-1以及仅FITC染料。
图2B为与FITC缀合的本发明的肽对骨移植物MBCPTM(Biomatlante)的表面的 粘附性的测试结果,并示出本发明的肽对商业骨移植物的优异粘附性。荧光显微 镜图像以X200拍摄。
图2C为与FITC缀合的本发明的肽对小鼠的关节软骨组织/细胞的粘附性的测 试结果,其中小鼠在软骨组织处被注射PBS、FITC缀合的A7-1或FITC。处死小 鼠,并且用荧光图像分析仪检查该组织。仅在注射了本发明的肽的软骨组织中检 测到荧光信号。这表明本发明的肽对软骨组织(*)也具有优异的粘附性,该软骨组 织的主要组分为GAG(糖胺聚糖),包括硫酸乙酰肝素、肝素或硫酸软骨素等。该 结果对应于图4B的结果。
图2D为与Cy缀合的本发明的肽对小鼠中关节软骨组织/细胞的粘附性的测试 结果,其中小鼠在软骨组织中被注射PBS、Cy-缀合的A7-1或Cy。处死小鼠,并 用共聚焦图像分析仪检查该组织。仅在注射了本发明的肽的软骨组织中检测到荧 光信号。这表明本发明的肽对于软骨组织(*)和骨(#)具有优异的粘附性,与图4B 的结果相对应。
图2E为基本上以与图2D所述的相同方式进行测试的结果,不同之处是将用 本发明的肽注射的小鼠的组织分解并固定并通过共聚焦图像分析仪检查。结果示 出,本发明的肽对已知包括大量GAG或ECM(细胞外基质)的弹性纤维具有优异的 粘附性。这对应于下述图4B的结果。
图2F为基本上以与图2E所述的相同方式进行测试的结果,不同之处是将本 发明的肽应用于小鼠的皮肤。结果示出,本发明的肽对已知含有大量皮肤的弹性 纤维的皮肤以及表皮和真皮的ECM具有优异的粘附性。这对应于下述图4B的结 果。
图2G为基本上以与图2F所述的相同方式进行测试的结果,不同之处是将本 发明的肽应用于小鼠的毛发。结果示出,本发明的肽对已知含有大量弹性纤维的 毛发具有优异的粘附性。这对应于下述图4B的结果。
图2H为基本上以与图2F所述的相同方式进行测试的结果,不同之处是本发 明的肽被应用于小鼠的皮下脂肪,并且示出对结缔组织(CT)优异的粘附性。
图2I为基本上以与图2F所述的相同方式进行测试的结果,不同之处是本发明 的肽被应用于小鼠的眼球,并且在处理后30分钟示出眼球表面上的强着色。这表 明本发明的肽对胶原的优异粘附性。
图2J为通过使用与肝素或N-乙酰葡糖胺连接的珠的亲和色谱法来测试用 FITC标记的本发明的肽对肝素或N-乙酰葡糖胺的亲和性的结果。结果示出,添加 未标记的冷(cold)肽导致FITC信号的突然下降,表明本发明的肽对被测试物质的 粘附性。结果还表明,对肝素具有粘附性/结合亲和性的本发明的肽可用来减轻肝 素的抗凝血作用,或通过结合到生长因子来增加对细胞外基质的可接近性。
图2K为本发明的肽对几丁质(GlcNAc)和β(1,3)葡聚糖的粘附性的测试结果, 其中肽用Cy标记并用荧光显微镜检查。结果示出本发明的肽对用FITC标记的酵 母聚糖颗粒的积累。酵母聚糖颗粒包括几丁质(GlcNAc)和β(1,3)葡聚糖,并且是酵 母细胞壁的组分。几丁质为N-乙酰葡糖胺的聚合物,并且β(1,3)葡聚糖为葡萄糖 的聚合物。
图2L为示出本发明的肽对革兰氏阴性菌细胞壁的粘附性的结果。细胞壁的主 要成分为由GlcNAc(N-乙酰葡糖胺)和MurNAc(N-乙酰胞壁酸)组成的蛋白多糖。通 过荧光显微镜检查结果,并用DAPI进行对比染色。
图2M为示出本发明的肽对革兰氏阳性菌细胞壁的粘附性的结果。细胞壁的主 要成分为由GlcNAc(N-乙酰葡糖胺)和MurNAc(N-乙酰胞壁酸)组成的蛋白多糖。通 过荧光显微镜检查结果,并用DAPI进行对比染色。
图3A为本发明的肽增加锚着依存性细胞MC3T3-E1对培养板的粘附性的能力 的测试结果。结果示出,与仅用PBS处理的阴性对照相比,用本发明的肽处理的 细胞具有粗糙的膜边界。这表明本发明的肽可以增加比如细胞的生物材料对比如 培养板的非生物材料的粘附性。
图3B为与目前用来增加细胞粘附性的PLL(聚-L-赖氨酸)处理的那些锚着依存 性细胞相比,用本发明的肽处理的锚着依存性细胞MC3T3-E1对疏水性培养板的 粘附性的测试结果。结果示出,与用PBS或PLL处理的细胞相比,用本发明的肽 处理的细胞具有增加的粘附性。这表明本发明的肽可以通过补偿各种目前使用的 组织植入材料(比如PCL)的低粘附性而具有工业应用性。
图3C为与仅用缓冲液处理的对照相比,用本发明的肽处理的锚着依存性细胞 ST2对疏水性培养板的粘附性的测试结果。结果示出,如荧光显微镜分析所示,与 对照相比,用本发明的肽处理的细胞具有增加的粘附性。
图3D为用本发明的肽处理的锚着依存性细胞C2C12在细胞从冷冻解冻之后 对培养板的粘附性的测试结果。结果示出,如荧光显微镜分析所示,与对照相比, 用本发明的肽处理的细胞具有增加的粘附性。尤其,已知解冻后细胞的粘附性对 细胞的存活有很大的影响。结果表明,本发明的肽通过最小化细胞解冻后的细胞 死亡而可以有利地用于细胞培养领域,特别是原代细胞培养领域。
图3E为与作为阴性对照的Mock和明胶相比,用本发明的肽处理的经丝裂霉 素处理的STO饲养细胞对亲水性培养板的粘附性的测试结果。结果示出,如荧光 显微镜分析所示,与阴性对照和明胶对照相比,用本发明的肽处理的细胞具有增 加的粘附性。
图3F为与阴性对照(Mock)相比,本发明的肽增加图中所示的各种细胞(建成的 细胞系和原代细胞)对疏水性培养板的粘附性的能力的测试结果。通过测量细胞代 谢来分析结果。结果示出,与阴性对照相比,本发明的肽可以增加各种细胞的粘 附性。
图4A至4C示出本发明的肽增加细胞的粘附性的可能的机制的分析结果。
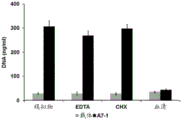
图4A为示出通过A7-1增加细胞的粘附性不需要用电解质处理细胞(EDTA处 理),并且也不需要新的蛋白质合成(CHX处理)的结果。然而,通过用血清处理细 胞,早期阶段的粘附性被抑制。这可以解释为,血清中丰富存在的各种类型的GAG 首先或优先与本发明的肽结合,留下较少量的肽给细胞。
图4B为本发明的肽促进粘附性的机制中GAG或胶原的参与的测试结果。结 果示出,GAG和胶原均参与了本发明的肽促进细胞粘附性的机制,证据是当细胞 用酶处理以去除潜在靶时粘附性消失的结果。通过用胶原酶处理细胞的细胞粘附 性的降低表明粘附性的增加部分是由于与胶原的相互作用。并且用透明质酸酶处 理的结果表明硫酸肝素的水解,因而GAG中的硫酸肝素与本发明的肽之间的相互 作用也至少部分上是通过本发明的肽促进粘附性的原因。下部分的图表明GAG参 与的测试结果,并且示出通过加入肝素和C-硫酸盐(C-sulfate)(CS),通过本发明的 肽A7-1增加的粘附性以浓度依赖方式显著降低。这表明GAG参与本发明的肽A7-1 的粘附性。已知GAG浓度的变化与各种疾病的发展有关。因而,本发明的肽可以 被利用来控制血液中的GAG浓度或作为靶向GAG的药物载体。
图4C为在存在作为竞争剂的可溶性RGDS肽的情况下,本发明的肽粘附性的 测试结果,并且示出在不存在A7-1的情况下,RGDS的添加显著降低细胞对底部 的粘附性,因为RGDS首先或优先与粘附分子整合素结合。然而,在A7-1的存在 下,发现细胞粘附性不受RGDS的添加的影响。这表明本发明的肽具有与通过整 合素的锚着依存性粘附性不同的机制。
图5A为能够测试Oct4的活性的报告系统和实验过程的示意图,该Oct4为干 细胞特性指标,用来分析促进iPSC(诱导多能干细胞)的粘附性的本发明的肽。
图5B为使用图5A的系统获得的结果,其中在培养的第2天和第3天检查Oct4 的表达以分析在存在或不存本发明的肽的情况下,iPSC的干细胞特性和粘附性。 在实验中,使用预涂布有饲养细胞或明胶的培养板作为对照,并且通过预涂布培 养板和在细胞介质中加入肽或混合肽来测试本发明的肽。结果发现在存在本发明 的肽的情况下,在培养介质中加入肽和预涂布板的两个测试中,iPSC的干细胞特 性和粘附性得到良好的保持。
除了在第4天检查细胞之外,图5C与图5B相同。结果表明在存在本发明的 肽的情况下,良好保持了iPSC的干细胞特性和粘附性。
图6A为使用Alp(碱性磷酸酶)作为另一种干细胞特性标志物的实验结果,其 通过将该标志物的细胞染色来分析。结果也表明,本发明的肽能够介导iPSC的粘 附性,并且同时在预涂布板和在培养介质中加入肽的两个测试中都保持干细胞特 性。
图6B为使用Nanog作为另一种干细胞特性标志物的实验结果,其通过将该标 志物的细胞染色来进行分析。结果也表明,本发明的肽能够介导iPSC的粘附性, 并且在预涂布板和在培养介质中加入肽的两种情况下都保持干细胞特性。
图7A为使用本发明的肽的生物缀合过程的示意性表示,其中本发明的肽通过 连接物DSS(辛二酸二琥珀酰亚胺酯)与BMP2缀合。
图7B为通过用本发明的肽涂布培养板来用本发明的肽处理C2C12细胞后48 小时,在C2C12细胞中作为用于骨分化的标志物的A1p的表达的测试结果。结果 示出,与BMP组(rhBMP2)或CL组(用交联剂处理)相比,Alp的表达增加,这表明 本发明的肽能够促进骨分化。
图8A至8C为本发明的肽在成骨细胞MC3T3-E1中的稳定性的测试结果。
图8D为本发明的肽在从小鼠中分离的单核细胞中的安全性的测试结果,其中 用本发明的肽刺激单核细胞并检查炎症的诱导。
图9A至9C为本发明的肽与先前已知的粘附性肽的粘附性的比较结果。
图9A为本发明的肽A7-1与层粘连蛋白和聚-L-鸟氨酸的粘附性的比较结果, 其中来自脊髓的神经细胞在涂布有上述每种肽的培养板上孵育,并且在图中所示 的小时处检查CCK-8。
图9B为培养后第4天的显微镜检查结果。
图9C为确认用本发明的肽A7-1包覆的原代细胞确实为来源于神经的细胞的 实验结果,其中通过免疫荧光然后共聚焦显微镜来检查针对神经细胞的特异性的 蛋白质标志物。结果表明,与其它已知的粘附性肽相比,本发明的肽具有优越的 粘附性。
图10A至10C为示出通过本发明的肽促进粘附进程的结果,其中在培养后6 小时对细胞进行分析。
图10A为示出以下的结果:在阴性对照细胞中观察到许多肌动蛋白环 (actin-rings)(细胞处于粘附性的早期阶段的征兆),与用本发明的肽A7-1处理的细 胞相反,其中观察到许多应力纤维形成,表明细胞处于粘附性的晚期阶段。
图10B为对图10A的结果进行定量的图。
图10C为测量细胞的几何形状的结果(细胞长宽比:细胞纵向/横向比,其中在 粘附过程期间的非常早期阶段中,完全圆形的细胞的值接近1,并且随着细胞附着 而增加)。结果示出,与对照相比,用A7-1处理的细胞具有优异的粘附性。
图11为根据本公开的各种肽通过与细胞外基质组分肝素和GAG的相互作用 来促进粘附性的测试结果。
具体实施方式
在一个方面,本公开涉及具有式I的肽或多肽或其衍生物:[X1-X2-X3-X4-X5]n:
其中
X1为任何氨基酸,特别是具有极性不带电荷的侧链,
X2、X3和X4可以相同或不同,各自为L、V、I、E或A,
X5为K或R,
n为1至5的整数,如果n为2或更大,则每个多肽可以相同或不同,其中, 氨基酸为天然的或非天然的D-型或L-型残基。
如本文所使用的,术语“氨基酸”指天然存在的20种氨基酸或非天然氨基酸, 以及翻译修饰后的氨基酸,以类似于天然存在的氨基酸的方式起作用的氨基酸类 似物和氨基酸模拟物,包括例如磷酸丝氨酸和磷酸苏氨酸;稀有氨基酸,比如2- 氨基己二酸、羟赖氨酸、正缬氨酸和正亮氨酸;被修饰以提高其在细胞中的稳定 性的氨基酸;以及D-型和L-型的光学异构体。可用于本公开的带正电荷的氨基酸、 带负电荷的氨基酸、极性不带电荷的氨基酸和非极性脂族氨基酸,是本领域公知 的,并且可以由本领域普通技术人员毫不费力地选择。
在本公开的一个实施方式中,带正电荷的氨基酸为K或R。
在本公开的其他实施方式中,带负电荷的氨基酸为D或E。
在本公开的仍其他实施方式中,极性不带电荷的氨基酸为S、T、C、P、N或 Q。
在本公开的仍其他实施方式中,非极性脂族氨基酸为G、A、L、V、M或I。
如本文使用的,术语天然的和非天然的分别各自指在细胞、组织或体内发现 的化合物;和为了特定目的对其人工修饰的化合物。
如本文使用的,术语“肽”和“多肽”可互换使用,并且除非另有定义,从N 端至C端读取,并且指其中氨基酸单体共价连接的分子,并且被解释为包括肽, 该肽包括天然氨基酸或其裂解产物、合成肽、以重组方式制备的肽、肽模拟物(通 常为合成肽)、肽类似物(比如类肽和半类肽)以及被修饰来改善其在细胞中的稳定 性或渗透功能的肽。修饰的例子包括N端修饰、C端修饰、肽键修饰(比如CH2-NH、 CH2-S、CH2-S=O和CH2-CH2)、主链修饰以及侧链修饰。肽模拟物通过本领域已 知的方法制备,该方法可以参考,例如,QuantitativeDrug Design,C.A.Ramsden Gd., Choplin Pergamon出版社(1992年)。
如本文使用的,术语“粘附”包括附着或吸附,其包括可逆或不可逆的粘附。 在其它方面,粘附包括通过包括共价键、离子键、范德华键和氢键的至少一种化 学相互作用的附着或吸附。
在本公开中,无机材料或无机材料的表面可互换使用。无机材料包括在普遍 接受的含义内的材料,其不含有碳、硅或氮,或者由于高度的静电导电性而具有 相对自由的电子构型。本公开中特别包括的是具有疏水性表面的无机材料,比如 金属,例如铁、铜或包括金、银或铂的贵金属、钛或铝;陶瓷,比如氧化锆;钙 磷灰石晶体,比如羟基磷灰石;高分子量合成树脂,比如聚乙烯以及;玻璃及其 组合,但不限于此。
本文使用的术语表面以最广泛的意义来解释,并且在具有至少二维结构的材 料但不限于具有特定形状和/或尺寸的材料中存在。并且,包括分子水平或单元水 平的表面以及由包括这样的分子或单元的材料形成的表面。例如,本公开中包括 的表面可以以从几纳米至几微米的范围内的尺寸的颗粒或者从几毫米至几米的范 围内的尺寸的材料出现/存在。
在本公开中,发现式I的肽(也称为第一域/区)参与到对细胞表面或细胞膜的粘附中,并且还可以取决于本文所述的感兴趣的具体应用以多种数目存在。另外, 如下所述,第一区被认为是可以影响本发明的肽的二级结构的核心区,且有助于 保持其它区的分子特性。特别地,第一区本质上是疏水性的,使得能够与感兴趣 的分子或细胞进行疏水相互作用,并且可以有利地用于组织再生,例如被提供作 为纳米结构载体或凝胶组分。
在本公开中,第一区或式I的肽可以包括多个由5个氨基酸构成的单元,并且 当包括两个或更多个单元时,每个单元可以相同或不同。包括在本发明的肽中的 单元的数目可以不同,并且鉴于本发明的肽的感兴趣的功能(比如用于制备、储存 或递送)或者鉴于下文所述的效果或各种应用而确定。例如,在式I中,n可以为1 至10、1至9、1至7、1至6、1至5、1至4、1至3、1至2或1。
在其他实施方式中,在式I中,X1为任何氨基酸,特别是极性不带电荷的氨 基酸,更特别地为S、T、C、P、N或Q。
在其他实施方式中,在式I中,X2、X3和X4可以相同或不同,并且各自为L、 V、I、E或A。X2-X3-X4的序列例如为AAA、EEE、LVA、LVL、LVV、LLA、 LLL或LLV等,但不限于此。在其他实施方式中,式I可以为X1-LVV-X5、 X1-AAA-X5或X1-EEE-X5。
在一个实施方式中,式I的序列由QLVVK(SEQ ID NO:1)、QEEEK(SEQ ID NO:2)、QAAAK(SEQ ID NO:3)、NLVVK(SEQ ID NO:4)或SLVVK(SEQ ID NO: 5)表示。
在其他方面,本公开涉及式II的肽或进一步包括以下式II的式I的肽。
[X6-X7-X8-X9-X10-X11]n,
在式II中,
X6为F、Y和W中的任一个,
X7为K或R,
X8为A、M和I中的任一个,
X9为L、M和G中的任一个,
X10为任何氨基酸,
X11为C、S和T中的任一个
其中(X7和X8)以及(X10和X11)中的至少一个组可以不存在,
其中n为1或2。
式II的肽可以连接到氨基端(N端)或羧基端(C端),或N端和C端两者。
根据本公开,式II的肽(称为第二区/域)赋予本发明的肽亲水性质,使得能够 容易地解离,并且当其与式I的肽组合,作为单个分子存在时可以形成α螺旋作为 二级结构。
在一个实施方式中,式I的肽和式II的肽中的至少一个可以各自以各种布置 包括在本发明的肽中。例如,本发明的肽可以包括其中至少一个式I的肽连接到至 少一个式II的肽的肽,例如包括式I-II的肽、式II-I的肽、式I-I-式II-II的肽,或 者其中至少两个连续连接的式I的肽和式II的肽进一步连接的肽,例如包括式 I-II-I-II的肽或式I-II-I的肽或式II-I-II的肽。该顺序可以改变。
在本公开的一个实施方式中,式II的肽由FRALPC(SEQ ID NO:6)、FREEPC (SEQ IDNO:7)、FRVVPC(SEQ ID NO:8)、FEALPC(SEQ ID NO:9)、YRALPC (SEQ ID NO:10)、WRALPC(SEQ ID NO:11)、FRALP(SEQ ID NO:12)、FRAL(SEQ ID NO:13)或FRPC(SEQ ID NO:14)表示。
在本公开的其他方面,式I的肽、式II的肽或包括式I和II两者的肽可以在 其N端或C端进一步包括式III的肽:X12 1-15,包括比如式III-I-II,其中X12为带 正电荷的或带负电荷的氨基酸。当本发明的多肽以式III开始时,第一个氨基酸可 以是带正电荷或带负电荷的,其也包含在本公开中。
在一个实施方式中,在式III中,带正电荷的氨基酸为K或R。
在其他实施方式中,在式III中,带负电荷的氨基酸为D或E。
在本公开的一个实施方式中,与在N端连接的式III结合的式I和/或式II所 包含的本发明的肽可以由以下表示:RQLVVK(SEQ ID NO:15);FRALPC(SEQ ID NO:6);FRALPCRQLVVK(SEQ ID NO:16);RQLVVKFRALPC(SEQ ID NO:17);RQLVVKFRALPCRQLVVKFRALPC(SEQ ID NO:18);RQLVVKFRALP(SEQ ID NO:19);RQLVVKFRAL(SEQ ID NO:20);KQLVVKFRALPC(SEQ ID NO:21); RQKFRALPC(SEQ ID NO:22);RQEEEKFRALPC(SEQ ID NO:23); RQAAAKFRALPC(SEQ ID NO:24);RQLVVKFRPC(SEQ ID NO:25); RQLVVKFREEPC(SEQ ID NO:26);RQLVVKFRVVPC(SEQ ID NO:27); RQEEEKFREEPC(SEQID NO:28);EQLVVEFEALPC(SEQ ID NO:29); RQLVVKYRALPC(SEQ ID NO:30);RQLVVKWRALPC(SEQ ID NO:31); RNLVVKFRALPC(SEQ ID NO:32);RSLVVKFRALPC(SEQ ID NO:33); R-(QLVV)2-KFRALPC(SEQ ID NO:34);R-(QLVV)3-KFRALPC(SEQ ID NO:35); R-(QLVV)4-KFRALPC(SEQ ID NO:36);RQLVVK-(FRALPC)2(SEQ ID NO:37);(R)2-QLVVKFRALPC(SEQ IDNO:38);(R)5-QLVVKFRALPC(SEQ ID NO:39); (R)10-QLVVKFRALPC(SEQ ID NO:40)或(R)15-QLVVKFRALPC(SEQ ID NO:41)。
在本公开的其他实施方式中,与在N端连接的式III结合的式I和/或式II所 包含的本发明的肽可以由以下表示:RQLVVKFRALPC(SEQ ID NO:17); KQLVVKFRALPC(SEQ IDNO:21);RNLVVKFRALPC(SEQ ID NO:32); RSLVVKFRALPC(SEQ ID NO:33);RQVVVKFRALPC(SEQ ID NO:42); RQIVVKFRALPC(SEQ ID NO:43);RQAVVKFRALPC(SEQ ID NO:44);RQEVVKFRALPC(SEQ ID NO:45);RQLLVKFRALPC(SEQ ID NO:46); RQLIVKFRALPC(SEQ IDNO:47);RQLAVKFRALPC(SEQ ID NO:48); RQLEVKFRALPC(SEQ ID NO:49);RQLVLKFRALPC(SEQ ID NO:50); RQLVIKFRALPC(SEQ ID NO:51);RQLVAKFRALPC(SEQ ID NO:52);RQLVEKFRALPC(SEQ ID NO:53);RQAAAKFRALPC(SEQ ID NO:24); RQEEEKFRALPC(SEQ IDNO:23);RQLVVRFRALPC(SEQ ID NO:54); RQLVVKYRALPC(SEQ ID NO:30);RQLVVKWRALPC(SEQ ID NO:31); RQLVVKFKALPC(SEQ ID NO:55);RQLVVEFEALPC(SEQ ID NO:56);RQLVVKFRLLPC(SEQ ID NO:57);RQLVVKFRILPC(SEQ ID NO:58); RQLVVKFRVLPC(SEQ IDNO:59);RQLVVKFRELPC(SEQ ID NO:60); RQLVVKFRAAPC(SEQ ID NO:61);RQLVVKFRAIPC(SEQ ID NO:62); RQLVVKFRAVPC(SEQ ID NO:63);RQLVVKFRAEPC(SEQ ID NO:64);RQLVVKFRVVPC(SEQ ID NO:27);RQLVVKFREEPC(SEQ ID NO:26); RQEEEKFREEPC(SEQ IDNO:28);RQEEEEFEEEPC(SEQ ID NO:65); RQLVVKFRALXC(SEQ ID NO:66);RQLVVKFRALPS(SEQ ID NO:67); RQLVVKFRALPT(SEQ ID NO:68)或RQLVVKFRALPX(SEQ ID NO:69)。鉴于用于表征本发明的肽的粘附性活性的实验结果,上面公开的肽在各种位置处有替换, 并且基于SEQ ID NO:17的12肽而产生,因而显然它们也具有粘附性活性,因而 被本公开所包含。
在其它实施方式中,本公开涉及具有SEQ ID NO:15至69的多肽。还包含其 中第一残基根据式III的定义而改变的肽。
然而,根据本发明的多肽不限于上述序列,而是包括其生物等同物。术语生 物等同物指含有对本文公开的氨基酸序列的额外修饰但具有与本文公开的多肽基 本上相同或类似的活性的多肽。这样的修饰包括,例如,删除、插入和/或替换氨 基酸序列中的一个或多个残基。该修饰可以鉴于比如尺寸、电荷、疏水性或亲水 性的侧链的相似性的性质来确定。基于侧链在尺寸、形状和化学/电学性质方面的 特性,认为精氨酸、赖氨酸和组氨酸为带正电荷的残基;丙氨酸、甘氨酸和丝氨 酸具有类似的侧链尺寸;苯丙氨酸、色氨酸和酪氨酸具有类似的侧链结构。因而, 鉴于此,精氨酸、赖氨酸和组氨酸;丙氨酸、甘氨酸和丝氨酸;苯丙氨酸、色氨 酸和酪氨酸被认为是生物学上等同的。
当引入修饰时也考虑疏水指数。每个氨基酸根据其疏水性和电荷被赋予唯一 的疏水指数,如下:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8); 半胱氨酸/胱氨酸(+2.5);甲硫氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7); 丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5); 谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。
如上所述的疏水指数可用于赋予蛋白质交互式生物功能。已知,类似的生物 活性可用具有类似疏水指数的氨基酸的替换来获得。当参考疏水指数进行修饰时, 优选的是选择疏水指数差在±2,更优选±1,特别优选±0.5以内的氨基酸用于替换。
还已知,具有类似亲水性值的氨基酸之间的替换产生生物学上等同的蛋白质。
例如,可以参考美国专利号4,554,101,其中亲水性值公开如下:精氨酸(+3.0);赖氨酸(+3.0);天冬氨酸(+3.0±1);谷氨酸(+3.0±1);丝氨酸(+0.3);天冬酰胺(+0.2);谷氨酰胺(+0.2);甘氨酸(0);苏氨酸(-0.4);脯氨酸(-0.5±1);丙氨酸(-0.5);组氨酸 (-0.5);半胱氨酸(-1.0);甲硫氨酸(-1.3);缬氨酸(-1.5);亮氨酸(-1.8);异亮氨酸(-1.8);酪氨酸(-2.3);苯丙氨酸(-2.5);色氨酸(-3.4)。
另外,对于落入该范围内,不会导致与亲本蛋白质相比生物特性实质变化的 氨基酸替换,可以参考H.Neurath,RLHill,The Proteins,第三版,Academic出版 社,纽约,1979年。例如,典型的替换包括Ala/Ser、Val/Ile、Asp/Glu、Thr/Ser、 Ala/Gly、Ala/Thr、Ser/Asn、Ala/Val、Ser/Gly、Thr/Phe、Ala/Pro、Lys/Arg、Asp/Asn、 Leu/Ile、Leu/Val、Ala/Glu和Asp/Gly。
此外,当考虑如上所述具有生物学上等效活性的变体时,本发明不仅包含本 文公开的氨基酸序列或下述编码该氨基酸序列的核酸,而且还包含与本文公开的 序列基本上相同的序列。术语“基本上相同的序列”指当将序列与本文公开的序 列比对以便尽可能高程度地彼此对应,并且使用本领域中一般使用的算法来分析 比对的序列时,示出优选至少61%,更优选至少70%,更优选至少80%,最优选 至少90%的与本文公开的序列的相似度的那些序列。比对序列用于比较的方法是 本领域公知的。例如,在Smith和Waterman,Adv.Appl.Math.(1981年)2:482; Needleman和Wunsch,J.Mol.Bio.(1970年)48:443;Pearson和Lipman,Methods in Mol.Biol.(1988年)24:307-31;Higgins和Sharp,Gene(1988年)73:237-44; Higgins和Sharp,CABIOS(1989年)5:151-3;Corpet等,Nuc.AcidsRes.(1988年) 16:10881-90;Huang等,Comp.Appl.BioSci.(1992年)8:155-65以及Pearson等, Meth.Mol.Biol.(1994年)24:307-31中描述了各种程序和比对算法。NCBI BasicLocal Alignment Search Tool(BLAST)(Altschul等,J.Mol.Biol.(1990年)215:403-10)可从NBCI等获得,用于与序列分析程序(比如blast、blastp、blasm、blastx、tblastn 和tblastx)组合使用。BLAST在http://www.ncbi.nlm.nih.gov/BLAST/上可获得。如 何使用此程序确定序列一致性的说明在 http://www.ncbi.nlm.nih.gov/BLAST/blast_help.html上可获得。
在一个实施方式中,C端和/或N端,特别是C端可以用惰性基团比如NH2基团取代,以增加肽的稳定性。
在另外的方面,本公开还涉及编码本文公开的肽的核苷酸序列或核酸分子以 及含有其的载体和包括该载体的细胞。本领域普通技术人员将能够从本领域已知 的密码子表中确定核苷酸序列,并且还将能够分别选择本发明的核苷酸被克隆和 递送到的合适的载体和细胞。
本文公开的本发明的肽可用来附着或改善各种生物或非生物来源的材料或其 表面的粘附性。因而,这样的性质可用于介导相同或不同材料之间的附着。例如, 本发明的肽可以用于将细胞附着到培养板上,或用于在细胞之间附着,或者被缀 合到比如荧光染料的标记物上的本发明的肽可以用于标记细胞或组织。而且,当 用其处理感兴趣的组织时,可以使用被缀合到比如骨形态发生蛋白质等的治疗剂 的本发明的肽来增加试剂的治疗效果。
不希望受到该理论的限制,发现本发明的肽通过具有对肽聚糖层,以及进一 步对微生物的细胞壁的组分(包括脂多糖)以及对(1,3)-β葡聚糖(酵母细胞壁的组分) 的亲和性来增加粘附性。因而,本发明的肽可以在各种领域中广泛应用。
而且,本发明的肽可以通过ε氨基连接到各种化合物上,并用于递送化合物。
不希望受到该理论的限制,本发明的肽对蛋白多糖(软骨的组分)表现出优异的亲和性。因而,本发明的肽可以有利地用于组织再生还有整形外科领域。因而, 本发明的肽可以应用于软骨再生等。可以与本发明的肽一起使用的材料包括材料 或其表面,该材料特别是生物材料,其被分类成比如动物、植物以及来自其的任 何部分(包括例如细胞、组织和器官)的生物材料。
从这个角度,本发明的肽可以进一步包括靶向试剂或标记试剂。
在其他方面,本公开涉及包括本文公开的本发明的肽的生物缀合组合物
在仍其他方面,本公开涉及用于生物或非生物材料的粘附性组合物。
在一个实施方式中,将本发明的肽或包括该肽的组合物应用于用于附着的细 胞,包括来自植物、昆虫和动物的细胞。例如,本发明的肽可以用于附着多潜能 细胞、成体干细胞和前体细胞。多能细胞的例子包括ES细胞、GS细胞和iPS(诱 导的多能干细胞)。成体干细胞的例子包括MSC(间充质干细胞)、造血干细胞和神 经干细胞。前体细胞的例子包括来自皮肤、真皮、内皮、表皮、肌肉、心肌、神 经、骨、软骨、脑、上皮、心脏、肾脏、胰腺、脾脏、口腔、角膜或毛发的细胞。
来自人的细胞的例子包括但不限于ES细胞、iPS细胞、MSC、软骨细胞、成 骨细胞、破骨细胞、间充质细胞、肌细胞、心肌细胞、神经细胞、肝细胞、胚胎 细胞、成纤维细胞、角膜上皮细胞、角膜内皮细胞、血管内皮细胞以及造血细胞。 细胞可以是同源的或异源的。
将本发明的肽或组合物应用在其上的表面没有特别限制,并且包括具有亲水 或疏水性质的有机或无机表面。在一个实施方式中,本发明的肽或组合物可以应 用于生物来源或非生物来源(比如塑料、玻璃、高分子量合成树脂和金属)的表面。
本发明的肽或组合物的用途包括但不限于(1)在水(水或盐水)中底物之间的粘附;(2)矫形治疗,比如骨、韧带、肌腱、半月板和肌肉治疗以及人造材料植入; (3)比如穿孔、裂缝、切口或眼部粘附(比如角膜移植和人造角膜插入)的治疗;(4) 牙科应用,比如牙套、加工义齿、牙冠安装、牙齿固定、断牙治疗和填充剂固定; (5)手术治疗,比如血管闭塞、细胞组织移植、人造材料移植、伤口闭合;(6)植物 中的粘附,比如植物嫁接、伤口愈合;(7)包括干细胞的细胞或组织培养物;(8)用 于比如人造器官、牙科、手术或眼科装置的医疗装置(比如植入物、骨剔除器、骨 笼、导丝、导管和支架)的基材;(9)骨、钛或陶瓷等的粘附;以及(10)包括生物活 性剂、标记试剂和靶材料的各种生物材料的生物缀合。
在一个实施方式中,本发明的肽或组合物可以用于牙科、眼科或矫形治疗用 于细胞或组织移植或再生,在这种情况下,可以在其上应用本发明的肽或组合物 的表面包括但不限于PLGA、羟基磷灰石、锆、钛、铁、不锈钢、钛、铂、金和合 金。
在仍其他实施方式中,本发明的肽或组合物可以用于将比如细胞的第一材料 附着到比如载体的第二材料的方法。该载体包括但不限于细胞培养板、微珠、基 板、组织植入物等。本发明的肽或组合物可以用于细胞或组织培养物,特别是用 于干细胞培养物。根据本公开的一个实施方式,发现本发明的肽与用于细胞粘附 的目前使用的试剂相比在附着细胞方面非常有效(参见图1、2、3、4、5和6等)。
在仍其他实施方式中,本发明的肽或组合物可以用于生物缀合。生物缀合意 为通过稳定的共价键连接两个生物分子的化学方法/手段。本发明的肽可以直接或 通过小分子量连接体与比如蛋白质、核酸、脂质或碳水化合物的各种生物分子(包 括酶或激素)缀合。生物缀合可以用作用于检测或监测生化材料的研究工具,或者 用于靶向治疗的治疗剂的缀合或改善试剂的功效。在一个实施方式中,本发明的 肽用于缀合骨形态发生蛋白质以增加蛋白质的治疗功效。
本发明的肽或组合物可以以本领域公知的方式用作粘合剂。并且典型的方法 为将本发明的肽或组合物应用于表面。例如,配方、使用量、用法可以参考比如 Cell-(BD Biosciences,美国)的商业产品。
包括本发明的肽的组合物可以制备为溶剂型、水溶型或无溶剂型,并且可以 基于待处理的表面的面积以0.1ng/mm2至1000ng/mm2,特别地1ng/mm2至100 ng/mm2的量使用,但不限于此。
可以通过用表面活性剂、氧化剂、交联剂或填充物处理或者通过调节本发明 的肽的浓度来确定或控制待应用的本发明的组合物的量或组合物的粘附性。例如, 该填充物可以包括但不限于,胶原、透明质酸、硫酸软骨素、弹性蛋白、层粘连 蛋白、酪蛋白、羟基磷灰石、白蛋白或纤连蛋白。
下文将参照实施例更详细地描述本发明。然而,要理解的是,这些实施例仅 用于说明的目的,而并不旨在限制本发明的范围。
实施例
实施例1.本发明的肽的制备
实施例中使用的肽由9-芴基甲氧羰基(Fmoc)法(Lugen Sci,韩国;Peptron,韩国)合成。为了确认使用肽的实验结果的再现性,相同组的肽分别独立地由Lugen Sci和Peptron合成2次或3次。从不同公司和不同批次之间合成的肽获得一致的 结果。
实施例2.分析用于缀合荧光材料的本发明的肽以及其与各种非生物来源表 面的粘附性。
将实施例1中合成的肽A7-1(RQLVVKFRALPC;SEQ ID NO:17)(对应于表1 的12mer(A))通过-SH基团与生物素(Thermo Scientific,美国)或FITC(Sigma,美国) 缀合为半胱氨酸残基,然后将其用来处理玻璃、PCL、Ti、Col、Zr、乙烯基类塑 料和PS纤维(在PBS中浓度为10μM,在室温下吸附20分钟,然后用PBS洗涤一 次)。通过FITC荧光图像分析仪LAS(Fuji,日本)分析吸附。为了从肽释放生物素, 用DTT(在PBS中为100mM,在室温下20分钟,然后用PBS洗涤一次)处理缀合 的肽。单独使用染料作为对照。
结果在图1A至1D中。如图所示,发现生物素通过本发明的肽牢固地附着到 所采用的材料的表面。尤其,通过用DTT处理表面该附着消失(图1A)。这证了实 生物素和FITC通过本发明的肽附着到表面。
实施例3.分析本发明的肽对各种生物或非生物来源的材料的粘附性。
除了使用Bio-(Geistlich Pharma,Inc)和MBCPTM(Biomatlante)(一种广泛使用的骨移植物)代替玻璃之外,进行与实施例1基本上相同的实验。条件如下: 将Bio-颗粒与10μM的与FITC缀合的本发明的肽在室温下反应10分钟,然 后将其在含有0.05%-20的PBS中洗涤5次,持续48小时,并通过共聚 焦显微镜(Zeiss LSM-700型号,带有Zen 2011软件,x20)分析。
而且,为了确认本发明的肽在体内环境中的粘附性,将本发明的肽注射到各 种组织中,并且从组织制备薄切片用于分析。具体地,将10-20μl的溶于PBS的浓 度为10μM的未与Cys或FITC染料缀合或者与Cys或FITC染料缀合的本发明的 肽A7-1或者单独的Cys或FITC染料,通过注射或局部应用来施用给各种组织。 施用两小时后,处死小鼠,并获得组织。然后将组织在PBS中洗涤三次,持续30 分钟,并从其制备薄切片,并且通过共聚焦显微镜分析。实验中使用的组织为软 骨、皮肤、毛发、皮下脂肪和眼球。在软骨的情况中,用胶原酶部分处理组织以 暴露弹性纤维,然后进行大量洗涤。
结果示于图2A至2M中,其表明本发明的肽能够附着到各种生物和非生物来 源的材料。结果示出,本发明的肽对商业骨移植物,特别是比如弹性组织和结缔 组织的含有大量蛋白多糖的组织和含有大量胶原或透明质酸的组织,以及酵母和 细菌的细胞壁,具有优异的粘附性。
而且,本发明的肽对于富含GAG(糖胺聚糖)(比如硫酸乙酰肝素、肝素、硫酸 软骨素)的软骨组织(*)显示出优异的粘附性,这对应于图4B的结果。同时,GAG 包括四类材料,透明质酸、硫酸皮肤素、硫酸软骨素、肝素和硫酸乙酰肝素以及 硫酸角质素。它们都基本上由与氨基或半乳糖结合的葡萄糖、N-乙酰葡糖胺或N- 乙酰半乳糖胺等组成。在本公开中发现的结果表明,本发明的肽对己糖具有亲和 性,因而能够以靶向特异性的方式起作用。
实施例4.通过本发明的肽改善细胞附着
本实施例中使用的材料如下:PBS中10mM的肽溶液(储备溶液);直径为35mm 的塑料疏水细胞培养板(用于细胞培养,康宁);DMEM(Dulbecco改良的Eagle培 养基,细胞培养基:Hyclone);胎牛血清(Hyclone);和C2C12(小鼠成肌细胞,ATCC, CRL-1772);MC3T3-E1(小鼠C57BL/6颅盖细胞,ATCC,CRL-2593)和ST2(源于 骨髓的基质细胞:EMBO J.7:1337-1343,1983年);STO(饲养细胞,ATCC, CRL-1573)、HEK-293(ATCC,CRL-1573)、SaOS2(ATCC,HTB-85)、HeLa(ATCC, CCL-2)、ROS17/2.8、NIH3T3(ATCC,CRL-1658)、RAW264.7(ATCC,TIB-71)、 hMSC(Lonza,PT-2501)、hPDL(HPLF)(Sciencell,Cat.#2630)、hDPSC(根据CellsTissues Organs 184:105-16从人体组织分离)、mBMSC(来自小鼠的原代骨髓基质 细胞)、MC(原代小鼠颅盖细胞)、MEF(小鼠胚胎成纤维细胞)。
如下所述进行实验。
通过使用预涂布有本发明的肽的培养板或通过将本发明的肽直接加入到培养 基中来检查本发明的肽对细胞附着的作用。两种方法都产生了相同的结果。为了 制备预涂布有本发明的肽的板,将本发明的肽加入到不含FBS的PBS或细胞培养 基中,然后使用其涂布培养板30分钟,并除去。然后向其中加入细胞,并以不同 的次数测量细胞与板的附着。而且,为了通过直接加入培养基来测试本发明的肽, 本发明的肽在当细胞悬浮在培养基中临到将其加到板上时加入。如下所述测量细 胞附着。使用未用本发明的肽处理的细胞作为阴性对照。并且使用在用PBS或聚 -L-赖氨酸处理的板上培养的细胞作为阳性对照。然后通过光学显微镜或共聚焦显 微镜检查细胞,以全面检查细胞、细胞的肌动蛋白丝结构和细胞膜边缘形状的不 规则性,为此将细胞染色用于F-肌动蛋白。为了进一步定量附着,测量细胞代谢 的DNA量。通过使用CK-8(Dojindo)测量吸光度来确定代谢,并且通过根据制造 商的说明书使用Picogreen测定试剂盒(Life Technologies)测量荧光来确定DNA量。 为了仅使用附着的细胞用于DNA量和细胞代谢,通过用PBS洗涤2次来去掉未附 着的细胞。
结果示于图3A至3F中。如图所示,本发明的肽能够增加来自原代细胞、建 成的细胞、冷冻且解冻的细胞以及饲养细胞的各种类型的锚着依存性细胞的附着, 并且示出与先前用于细胞附着的材料PLL相比更优的效果。
实施例5.本发明的粘附性肽的机理的鉴定
进行以下实验以鉴定本发明的肽的粘附性的机理。
(1)蛋白质合成要求的确定
首先,用EDTA或已知阻止蛋白质合成的环己酰胺(CHX)(10μM,37℃,1小 时)或上述GAC处理细胞,并测试粘附性。
结果示于图4A中。从图中观察到EDTA或CHX不影响细胞的粘附性。也就 是,可以表明本发明的肽A7-1表现出的粘附性不需要在细胞表面上存在电解质(来 自EDTA的结果)或新的蛋白质合成(来自CHX的结果)。另一方面,观察到血清在 早期阶段抑制细胞的粘附性,这可归因于血清中丰富存在的各种类型的GAG与本 发明的肽的结合。血清中存在的GAG浓度的变化已知与各种疾病的发展相关联 (Volpi N.等,Biochim Biophys Acta.(1995年)第18卷:49-58;Komosinska-Vassev K. 等,Clin Chim Acta.(2003年)第331卷:97-102;Anttonen A.等,Lung Cancer(2003 年)第41卷:171-7;Fuster M.M.等,Nat Rev Cancer.(2005年)第5卷:526-42;Hong Lu等,2010年.Glycobiol.Insights第2卷:13-28;Anower-E-Khuda M.F.等, Glycobiology.(2013年)第23卷:865-76;Ibrahim S.A.等,J.of MedicalLab.& Diagnosis(2013年)第4卷:8-20)。因此,这表明本发明的肽可以有利地用作用于 调节血液中GAG的浓度的试剂或靶向GAG的试剂。结果还示出,本发明的肽不 通过与细胞膜中的蛋白质相互作用来表现其改善细胞粘附性的功能。
(2)非蛋白质材料参与的确定
在该实验中,确定非蛋白质材料的参与。为此,测试了大量包含在ECM(细胞 外基质)中的蛋白多糖的参与。
-本发明的肽对蛋白多糖的分子亲和性
GAG(糖胺聚糖)(比如硫酸乙酰肝素、肝素、硫酸软骨素、硫酸皮肤素、硫酸 角质素等)作为蛋白多糖的主要组分,是ECM的主要组分,并且有助于通过保持 ECM的结构完整性来保持细胞的形态。另外,已知它们调节细胞的粘附性和极性。 ECM表现出的这样的功能有助于细胞适应环境,以及因为它们直接参与细胞中一 系列复杂的代谢所以调节细胞的生理机能。通过以下三个实验测试本发明的肽对 蛋白多糖的亲和性:(i)亲和色谱法;(ii)使用纯化的GAG通过竞争性结合测定进行 细胞附着分析;(iii)通过酶特异性分解包括GAG组分的ECM进行细胞附着抑制的 分析。在酶处理的情况中,使用透明质酸酶(Sigma)和胶原酶(Sigma)。作为纯化的 GAG,使用透明质酸(Sigma)、硫酸软骨素(Sigma)、肝素(Sigma)、硫酸乙酰肝素 (Sigma)。
(i)通过亲和色谱法分析本发明的肽-肝素或肽-N-乙酰葡糖胺(GlcNAc)的相互作用
对于色谱法,使用肝素-琼脂糖珠(Biovision)和GlcNAc-琼脂糖珠(Sigma)。将10ng的FITC标记的肽(F-肽)在PBS-T缓冲液中与肝素-琼脂糖珠和GlcNAc-琼脂 糖珠混合,各自用BSA预涂布,并在室温下孵育10分钟。然后将混合物用PBS-T 缓冲液洗涤3次,并重新悬浮于PBS中进行荧光测量。对于竞争性结合实验,将 未用FITC标记的本发明的肽(Cold)以1:1、1:10(10次)和1:100(100次)的各种比例 加入到混合物中,并使其孵育,随后荧光测量。作为阴性对照,仅使用FITC染料 与珠反应。另外,使用来自仅含有悬浮在PBS中的珠的样品的荧光信号作为空白。 图4B的结果示出,本发明的肽对肝素和GlcNAc(GAG的组分)具有很强的亲和性。
(ii)通过使用纯化的GAG竞争性结合来分析细胞粘附性。
图4B的结果示出通过竞争性方式用GAG处理来抑制本发明的肽的粘附性, 表明本发明的肽的粘附性被肝素、硫酸乙酰肝素和硫酸软骨素的加入抑制。
(iii)通过使用特异性消化含有GAG的ECM的酶来抑制本发明的肽所表现出的 粘附性的改善:不仅构成ECM的蛋白多糖而且包括胶原等的原纤维蛋白质都包括 GAG作为它们的组分之一。当使用胶原酶水解包括GAG的胶原或者使用透明质 酸酶水解透明质酸时,发现它们都抑制本发明的肽的粘附性。这也表明本发明的 肽所表现出的细胞粘附性与GAG相关。
如下进行实验:(i)为了通过用纯化的GAG处理进行竞争性抑制,将GAG以 5mg/ml的浓度加入用胰蛋白酶处理的细胞悬液并在37℃下孵育10分钟,然后将 其转移到涂布有本发明的肽的培养皿,并孵育30分钟。之后,对附着的细胞中所 含的DNA的量进行定量以测量粘附性。DNA的定量通过picogreen测定试剂盒(Life Technologies)进行;(ii)为了测定胶原酶和透明质酸酶对粘附性的影响,将用胰蛋 白酶处理的细胞悬浮于不含胎牛血清的培养基中,并且向其加入酶,随后在37℃ 下孵育30分钟。以10,000单位/103个细胞的浓度使用酶。在与酶一起孵育后,通 过加入EDTA和FBS使酶失活。然后将细胞离心并重新悬浮于新鲜的培养基中并 孵育2小时。将附着的细胞用PBS洗涤2次,并通过picogreen测定获得DNA定 量。
结果示于图4B中。从图中观察到,本发明的肽对作为软骨组织的主要成分的 蛋白多糖具有很强的亲和性,表明本发明的肽可以有利地用于组织再生,并且用 于整形外科领域等的临床应用。因而,对比如软骨的组织的蛋白多糖层的优异的 亲和性表明本发明的肽用于组织再生和药物递送的用处。
(3)用RGD的比较实验
将本发明的肽A7-1(10μM)或者A7-1与用于竞争测定的可溶性RGD肽(0、10、 100和1000μM)一起加入到试管中的锚着依存性细胞MC3T3-E1中,并孵育10分 钟。然后将细胞转移到培养板上并在恒温培养箱中孵育10分钟以允许细胞附着。 10分钟后,取出培养基,并用PBS洗涤细胞2次以除去任何未附着的细胞,并且 将不含肽的新鲜培养基和CCK-8(Dojindo)加入到细胞中并在恒温培养箱中孵育1 小时。然后在450nm处测量吸光度。使用仅与CCK-8混合的培养基作为空白。
结果示于图4C中。从图中,当单独使用RGDS肽时,观察到细胞的粘附性以 浓度依赖的方式降低。相比之下,当竞争性地使用A7-1和RGD肽时,观察到可 溶性RGD通过与未用A7-1处理的组中的整合素结合而显著降低细胞与底部(基板) 的粘附性。在A7-1处理的组中,观察到细胞的粘附性根本不受影响。这表明本发 明的肽通过与RGD不同的机制(在该机制中RGD通过与整合素的相互作用促进锚 着依存性细胞的附着)来增加细胞的粘附性。
结果表明,本发明的肽具有与RGD区别的特性,RGD在细胞附着和组织再生 领域中已被广泛使用,但已知其有效性不佳。因而,本发明的肽可以有利地代替 RGD使用。
实施例6.使用本发明的肽改善胚胎干细胞
以100μM的浓度水平使用本发明的肽涂布培养板或制备纳米结构,以探究诱 导多能干细胞和人胚胎干细胞的附着和多能性。
将人胚胎干细胞培养在hESC培养基(具有通常用于相关领域的组合物)、 mTeSR(从Stem cell technology购买的hES特异性培养基)、Essential 8(从Gibco BRL 购买的hES特异性培养基)和仅含有10ng/ml bFGF而不含任何血清(以排除血清对 细胞附着的可能的抑制)的培养基中,以测试本发明的肽与目前使用的各种培养基 的相容性。另外,通过以群体状态培养细胞以及通过以单细胞状态培养细胞(用 0.25%的胰蛋白酶-EDTA处理细胞)来分析细胞。为了测试在无饲养条件下培养 ESC或iPSC的效果,使用(hESC)和明胶(miPSC)作为阳性对照进行比较。 也在存在饲养细胞的情况下培养细胞作为阳性对照。
如图5A所示,通过利用质粒(Szabo等,2002年,Mechanisms of Development 第115卷:157-160)分析细胞,该质粒能够检测Oct4基因(胚胎干细胞的干细胞特 性的标志物)(图5)。而且,其他用于干细胞特性的标志物(Alp和Nanog基因的表 达)通过用特异性针对每种标志物的抗体进行染色来检测,并通过荧光显微镜检查。 还检查了hES细胞培养物中细胞附着的改善(图6)。
结果示于图5和图6中。从图5中观察到,本发明的肽无论用来预涂布板还 是在培养基中混合都能够介导iPSC的附着并保持细胞的干细胞特性(图5B)。另外, 在培养的第4天,观察到了iPSC附着和干细胞特性保持的影响(图5C)。还如图6A 和6B所示,通过Oct4和Nanog的表达,本发明的肽无论用来预涂布板还是在培 养基中混合都能够介导iPSC的附着并保持细胞的干细胞特性。在使用hESC的实 验中获得了相同的结果,在该实验中细胞可以借由通过本发明的肽附着并且保持 干细胞特性而生长,而无需使用饲养细胞或和干细胞特性(图6C)。
实施例7.本发明的肽与蛋白质的生物缀合
在本实施例中使用以下材料:以10μM的PBS中的浓度使用如实施例1中所 述合成的本发明的肽;具有1.9cm2的面积的塑料培养板(24孔板,康宁);DSS(辛 二酸二琥珀酰亚胺酯,C16H20N2O8,Thermo Scientific Inc.);重组人BMP2(rhBMP2, BD bioscience);DMSO(用于溶解DSS的二甲基亚砜,Sigma-Aldrich);Tris-HCl, pH7.0(终止溶液);PBS(磷酸盐缓冲盐水,反应溶液)。
说明分析逻辑的示意图示于图7A中。如图7A所示,当本发明的肽可以通过 交联剂与比如BMP的具有期望活性的治疗性蛋白质缀合时,由于本发明的肽的粘 附性,可以有效提高治疗性蛋白质的局部浓度,从而使治疗效果最大化。
实验方法如下。基本上如制造商的(交联剂)方法所述进行肽-rhBMP2共价键(交联)反应。简要总结如下:(i)肽涂布:将200μl肽溶液(如在实施例1中制备的PBS 中10μM)分配到细胞培养板上,并使其在4℃下吸附到板上18小时;(ii)DSS-BMP2 络合物形成:使20摩尔的相对于rhBMP2过量的DDS在总体积为100μl的反应溶 液中形成共价键持续1小时。rhBMP2以300ng每1.9cm2的浓度使用。在这种情况 下,使用各自涂布以DSS、rhBMP2和DSS-rhBMP2的培养板作为阴性对照,因为 观察到它们在洗涤步骤期间由于其对板的表面缺乏粘附性而被显著去除;(iii)肽 -DSS-BMP2络合物形成:将100μl的DSS-BMP2络合物小心地叠加到涂布有本发 明的肽的板上,并在4℃下孵育24小时;(iv)终止反应:加入200μl的1MTris溶 液,并在室温下孵育15分钟以中和共价键形成后剩余的所有DSS;(v)洗涤步骤: 用PBS洗10次,加入不含FBS的DMEM,在加入细胞之前在37℃下放置;(vi)C2C12 悬浮液的制备和分化成成骨细胞:将4×105个C2C12细胞悬浮于含有DMEM的 300μl的2%FBS中。将预涂布有肽-DSS-BMP2络合物的板上的DMEM去除,并 加入300μl的细胞培养基,并在5%CO2/37℃培养箱中孵育48小时以诱导细胞分化; (vii)细胞分化的测量:通过染色细胞检测碱性磷酸酶的活性来检查C2C12细胞向 成骨细胞的分化能力。
结果示于图7B中。从图中观察到,分别与用BMP(rhBMP2)和交联剂(CL)处 理的组相比,Alp活性显著增加。这表明本发明的肽促进了分化。
实施例8.本发明的肽的安全性测试
使用成骨细胞MC3TC-E1确定本发明的肽的安全性。用实施例1中制备的A7-1 肽以0.1μM、1μM、10μM和100μM的浓度处理成骨细胞。然后检查本发明的肽对 细胞增殖(图8A)、存活性(图8B)和分化(图8C)的影响。为了测试对增殖的影响, 用BMP(rhBMP2,10ng/ml,3天)和骨形成分化培养基处理MC3T3-E1和C2C12 细胞系6天以诱导分化。通过细胞染色检查结果。结果如图8A至8C所示。观察 到本发明的肽对增殖率、存活率或细胞是否分化没有影响。
还测试了小鼠单核细胞中本发明的肽的安全性。从小鼠的骨髓中分离单核细 胞,并用本发明的肽处理并检查对炎症的诱导。作为阳性对照,用LPS处理细胞。 处理24小时后,通过定量实时逆转录PCR检查细胞的炎症标志物IL-1β(白细胞介 素-1β)、Tnf-α(肿瘤坏死因子-α)、iNos(诱导型一氧化氮合酶、Cox-2(环氧合酶-2) 的表达。结果示于图8D中。从图中观察到,本发明的肽在细胞中不诱导炎症,因 而被证实为在体内使用的安全的材料。
实施例9.测试本发明的肽对原代神经细胞和培养物的粘附性的改善
在本实施例中,与目前使用的粘附性肽相比,本发明的肽对原代神经细胞的 附着和培养的影响。使用浓度为100μM的肽涂布培养板或制备纳米结构,以通过 光学显微镜以及经由CCK-8确定代谢来分析从小鼠胚胎的脑和小鼠的脊髓获得的 神经细胞。作为阳性对照,根据制造商的说明使用层粘连蛋白和聚-L-鸟氨酸(Sigma) 进行涂布。为了定量在指示的每个小时的细胞附着,通过用PBS洗涤除去未附着 的细胞,将细胞培养基和CCK-8溶液(Dojindo)的混合物加入到细胞中并孵育1小 时,然后在450nm处测量吸光度。
结果示于图9中。从其中在用层粘连蛋白和聚-L-鸟氨酸或用本发明的肽处理 的板上的培养组中指示的小时分析CCK-8的图9A中,观察到用本发明的肽A7-1 处理的细胞示出与其他组显著不同的结果。图9B示出培养4天时的显微镜观察结 果,表明即使在相同数量的细胞的条件下,本发明的肽在粘附性方面也是最好的。 图9C是通过使用神经细胞特异性标志物GFAP、MAP2和巢蛋白来证实在用本发 明的肽涂布的板上培养的原代神经细胞是神经细胞的结果,该细胞特异性标志物 GFAP、MAP2和巢蛋白通过免疫荧光分析和共聚焦显微镜来分析。结果表明,本 发明的肽具有优于目前使用的肽的粘附性。
实施例10.人MSC(间充质干细胞)的附着的改善
使用本公开的A7-1肽以100μM的浓度涂布灭菌的盖玻片。然后将MSC(间充 质干细胞)在涂布的盖玻片上培养6小时,并通过针对肌动蛋白纤维的荧光染料罗 丹明鬼笔环肽(Life Technology Cat.#R415)和针对细胞核的DAPI(Sigma D9542) 染色细胞,来检查粘附进程,其通过共聚焦显微镜检测。在这种情况下,使用未 涂布有A7-1肽的盖玻片上培养的细胞作为阴性对照。结果示于图10中。从图10A 观察到,大多数阴性对照细胞仍然停留在指示粘附进程早期阶段的肌动蛋白环形 成中。相比之下,观察到大部分用A7-1处理的细胞在经过了肌动蛋白环阶段的应 力纤维形成阶段。图10B为示出图10A的定量结果的图。图10C为示出细胞附着 到盖玻片时的细胞的几何形状的图(细胞长宽比:细胞的宽度/高度,1表示完全圆 形和粘附进展的非常早期阶段。参考Prager-Khoutorsky等,2011年.NatureCell Biology 13,1457-1465),并且表明A7-1与对照相比的优异的粘附性。
实施例11.本发明的肽与各种氨基酸序列的粘附性测试
如实施例1所述合成表1中列出和描述的肽,并根据实施例5中描述的方法 测试其对肝素和N-乙酰基葡糖胺(GAG)的粘附性。
[表1]
结果示于图11中。从图中观察到,以第一区(式)、第二区(式)和第三区(式)的 各种组合的本发明的肽,或具有用本公开定义的氨基酸残基替换的本发明的肽表 现出粘附性。
实施例12.本发明的肽与各种氨基酸序列的粘附性的测试II
如表2所列出的,生成使用RQLVVKFRALPC(SEQ ID NO:17)作为母体肽在 各种位置上具有替换的肽,并测试其粘附性,其中鉴于化学特性、尺寸和替换残 基的侧链的电荷和/或表中列出的肽的结果来确定替换的残基,并以粗体字母表示。
结果呈现在右栏中,并与RQLVVKFRALPC的结果相比表示为+的数目。
[表2]
在表2中,替换的残基用粗体表示。在示出测试肽的粘附性的右栏中,粗体 表示的字母代表基于替换的残基的特性和本文公开的结果的预测结果,而不以粗 体表示的字母代表从实施例11和图11解释的结果。
为了清楚起见,本文可以明确地阐述各种单数/复数排列。尽管已经示出和描 述了本公开的一些实施方式,但是本领域技术人员将理解,在不脱离本发明的原 理和精神的情况下,本实施方式可以做出改变,本发明的范围由权利要求书及其 等同物限定。
除非另有定义或说明,本文使用的所有科技术语以及任何首字母缩略词具有与在本发明领域中本领域普通技术人员通常理解的相同的含义。本文中作为参考公开的所 有公开文献的内容通过引用并入本文。
Claims (8)
1.一种分离的多肽,其由以下氨基酸序列组成,所述氨基酸序列由以下所示的氨基酸序列组成:SEQ ID NO:6、15-22、24-27、29-37、38-41、42-64、67或68。
2.如权利要求1所述的多肽,其中所述多肽的N端或C端被惰性基团修饰。
3.一种核酸分子,所述核酸分子编码如权利要求1或2所述的多肽。
4.一种载体,所述载体包括权利要求3所述的核酸分子。
5.一种细胞,所述细胞包括权利要求4所述的载体。
6.如权利要求1或2所述的多肽在制备用作粘合剂的组合物中的用途。
7.一种粘附性组合物,其包括如权利要求1或2所述的多肽。
8.一种将第一生物材料或非生物材料粘附至第二生物材料或非生物材料的方法,其通过用如权利要求1或2所述的多肽处理所述第一生物材料或非生物材料和/或所述第二生物材料或非生物材料进行,其中所述第一生物材料或非生物材料和所述第二生物材料或非生物材料各自选自由塑料、玻璃、高分子量的合成树脂、金属、细胞、组织和微生物的细胞壁组成的组中。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2015-0042167 | 2015-03-26 | ||
| KR1020150042167A KR101794401B1 (ko) | 2015-03-26 | 2015-03-26 | 접착성 펩타이드 및 그 용도 |
| PCT/KR2016/002864 WO2016153256A1 (ko) | 2015-03-26 | 2016-03-22 | 접착성 펩타이드 및 그 용도 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107922459A CN107922459A (zh) | 2018-04-17 |
| CN107922459B true CN107922459B (zh) | 2021-06-25 |
Family
ID=56977649
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201680028082.8A Expired - Fee Related CN107922459B (zh) | 2015-03-26 | 2016-03-22 | 粘附性肽及其用途 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US10857258B2 (zh) |
| EP (1) | EP3279209A4 (zh) |
| JP (1) | JP6856618B2 (zh) |
| KR (1) | KR101794401B1 (zh) |
| CN (1) | CN107922459B (zh) |
| WO (1) | WO2016153256A1 (zh) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20160040063A (ko) * | 2014-10-02 | 2016-04-12 | 포항공과대학교 산학협력단 | 생활성 융합단백질 및 이를 포함하는 실리카 나노입자를 포함하는 표면 코팅제 |
| US9801972B2 (en) | 2014-10-02 | 2017-10-31 | Postech Academy-Industry Foundation | Mussel-inspired bioactive surface coating composition generating silica nanoparticles |
| KR101865451B1 (ko) * | 2015-08-26 | 2018-07-13 | 윤원준 | 무기물 표면 접착 또는 코팅용 단백질 접착제 |
| CN109863163B (zh) * | 2016-08-26 | 2023-07-21 | (株)世援生命工学 | 促进骨再生或骨形成的多肽及其用途 |
| KR102000507B1 (ko) * | 2016-09-12 | 2019-07-16 | (주)세원생명공학 | 피더세포 없이 줄기세포 배양이 가능한 배양 조성물 및 방법 |
| KR102010871B1 (ko) * | 2016-09-13 | 2019-10-21 | (주)세원생명공학 | 세포접착용 조성물 및 방법 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101163496A (zh) * | 2005-02-25 | 2008-04-16 | 犹他大学研究基金会 | 促进内皮细胞的粘附或迁移的弹性蛋白原 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0625290A (ja) * | 1992-07-10 | 1994-02-01 | Sumitomo Pharmaceut Co Ltd | 細胞接着活性ペプチド |
| US20020022588A1 (en) | 1998-06-23 | 2002-02-21 | James Wilkie | Methods and compositions for sealing tissue leaks |
| CA2335952A1 (en) | 1998-06-23 | 1999-12-29 | Shekharam Tammishetti | Carbodiimide cross-linked albumin for bioadhesives, surgical sealants and implantable devices |
| KR100885071B1 (ko) * | 2002-05-14 | 2009-02-25 | 재단법인서울대학교산학협력재단 | 세포에 부착하는 올리고펩타이드 |
| JP3906924B2 (ja) * | 2003-02-28 | 2007-04-18 | 独立行政法人農業生物資源研究所 | 絹タンパクから細胞生育ペプチドの抽出と利用 |
| WO2005068495A1 (ja) * | 2004-01-13 | 2005-07-28 | Toray Industries, Inc. | クモ糸タンパク質を含む絹糸および該絹糸を産生するカイコ |
| JP2007252327A (ja) * | 2006-03-24 | 2007-10-04 | Toray Ind Inc | 細胞接着性絹糸及びその製造方法 |
| WO2009097540A1 (en) * | 2008-02-01 | 2009-08-06 | Entogenetics, Inc. | Methods, compositions, and systems for production of recombinant spider silk polypeptides |
| KR101094445B1 (ko) * | 2009-05-13 | 2011-12-15 | 한국과학기술연구원 | 줄기세포에 대한 접착활성을 갖는 섬유아세포 성장인자의 재조합 단백질 및 이를 이용한 줄기세포의 배양방법 |
| KR101209233B1 (ko) * | 2011-02-21 | 2012-12-06 | 서울대학교산학협력단 | 피브린 결합능을 가진 생리활성 펩타이드가 함유된 피브린 수화젤 |
| KR101865451B1 (ko) * | 2015-08-26 | 2018-07-13 | 윤원준 | 무기물 표면 접착 또는 코팅용 단백질 접착제 |
-
2015
- 2015-03-26 KR KR1020150042167A patent/KR101794401B1/ko not_active Expired - Fee Related
-
2016
- 2016-03-22 JP JP2018501837A patent/JP6856618B2/ja not_active Expired - Fee Related
- 2016-03-22 CN CN201680028082.8A patent/CN107922459B/zh not_active Expired - Fee Related
- 2016-03-22 EP EP16769074.2A patent/EP3279209A4/en not_active Withdrawn
- 2016-03-22 WO PCT/KR2016/002864 patent/WO2016153256A1/ko active Application Filing
-
2017
- 2017-09-25 US US15/714,357 patent/US10857258B2/en not_active Expired - Fee Related
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101163496A (zh) * | 2005-02-25 | 2008-04-16 | 犹他大学研究基金会 | 促进内皮细胞的粘附或迁移的弹性蛋白原 |
Non-Patent Citations (1)
| Title |
|---|
| fibroin heavy chain, partial [Bombyx mori],ACCESSION NO.:ABE77387.1;Wang,S.等;《GenBank Database》;20060423;1 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3279209A4 (en) | 2019-01-02 |
| JP6856618B2 (ja) | 2021-04-07 |
| US20180085488A1 (en) | 2018-03-29 |
| JP2018511344A (ja) | 2018-04-26 |
| KR20160115115A (ko) | 2016-10-06 |
| WO2016153256A1 (ko) | 2016-09-29 |
| KR101794401B1 (ko) | 2017-11-06 |
| EP3279209A1 (en) | 2018-02-07 |
| US10857258B2 (en) | 2020-12-08 |
| CN107922459A (zh) | 2018-04-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107922459B (zh) | 粘附性肽及其用途 | |
| Alshehri et al. | Scaffolds from self-assembling tetrapeptides support 3D spreading, osteogenic differentiation, and angiogenesis of mesenchymal stem cells | |
| Xu et al. | A carboxymethyl chitosan and peptide-decorated polyetheretherketone ternary biocomposite with enhanced antibacterial activity and osseointegration as orthopedic/dental implants | |
| Sagnella et al. | Human endothelial cell interaction with biomimetic surfactant polymers containing peptide ligands from the heparin binding domain of fibronectin | |
| Yaylaci et al. | Chondrogenic differentiation of mesenchymal stem cells on glycosaminoglycan-mimetic peptide nanofibers | |
| Xie et al. | Enhanced proliferation and differentiation of neural stem cells grown on PHA films coated with recombinant fusion proteins | |
| HK1225745A1 (zh) | 自组装肽、肽模拟物和肽缀合物作为构件用於生物制造和打印 | |
| Lee et al. | Injectable gel with synthetic collagen-binding peptide for enhanced osteogenesis in vitro and in vivo | |
| US10851132B2 (en) | Protein based adhesive composition and method | |
| Chen et al. | Osteogenesis regulation of mesenchymal stem cells via autophagy induced by silica–titanium composite surfaces with different mechanical moduli | |
| Zhao et al. | Construction of multifunctional coating with cationic amino acid-coupled peptides for osseointegration of implants | |
| Zhang et al. | Compatibility of neural stem cells with functionalized self-assembling peptide scaffold in vitro | |
| Pugliese et al. | Functionalization of self-assembling peptides for neural tissue engineering | |
| JP2010088933A (ja) | ペプチド被覆インプラントおよびその調製方法 | |
| JP2021514676A (ja) | 幹細胞の拡大および分化 | |
| KR101794482B1 (ko) | 생체 또는 비생체 접착성 펩타이드 및 그 용도 | |
| KR102010871B1 (ko) | 세포접착용 조성물 및 방법 | |
| JP5236313B2 (ja) | 細胞の形態及び機能の調節活性を有するアリールスルファターゼタンパク質 | |
| EP4253527A1 (en) | Coated article for culturing primary cells and stem cells and method for preparing the same | |
| US20250207087A1 (en) | Extracellular matrix-containing composition and method for producing same, and three-dimensional tissue construct and method for producing same | |
| EP4148133A1 (en) | Chimeric protein containing fibrinogen fragment and laminin fragment, and use thereof | |
| JPWO2019163948A1 (ja) | 細胞培養用基材及び培養方法 | |
| JP2020172470A (ja) | 人工コラーゲン様ペプチドを用いた細胞培養足場材 | |
| Dağdaş | Characterization and corneal tissue engineering application of peptide amphiphiles |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| TA01 | Transfer of patent application right | ||
| TA01 | Transfer of patent application right |
Effective date of registration: 20180810 Address after: Seoul, South Kerean Applicant after: World aid life engineering Address before: Seoul, South Kerean Applicant before: Yin Yuanjun |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20210625 |