CN107530090B - 可扩张体装置和使用方法 - Google Patents
可扩张体装置和使用方法 Download PDFInfo
- Publication number
- CN107530090B CN107530090B CN201580062443.6A CN201580062443A CN107530090B CN 107530090 B CN107530090 B CN 107530090B CN 201580062443 A CN201580062443 A CN 201580062443A CN 107530090 B CN107530090 B CN 107530090B
- Authority
- CN
- China
- Prior art keywords
- expandable body
- catheter
- expandable
- expanded
- proximal
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 *CC1CCCC1 Chemical compound *CC1CCCC1 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12136—Balloons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12099—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder
- A61B17/12109—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder in a blood vessel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12099—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder
- A61B17/12109—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder in a blood vessel
- A61B17/12113—Occluding by internal devices, e.g. balloons or releasable wires characterised by the location of the occluder in a blood vessel within an aneurysm
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/1214—Coils or wires
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/1214—Coils or wires
- A61B17/12145—Coils or wires having a pre-set deployed three-dimensional shape
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12168—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure
- A61B17/12172—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure having a pre-set deployed three-dimensional shape
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B17/12131—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device
- A61B17/12168—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure
- A61B17/12177—Occluding by internal devices, e.g. balloons or releasable wires characterised by the type of occluding device having a mesh structure comprising additional materials, e.g. thrombogenic, having filaments, having fibers or being coated
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00526—Methods of manufacturing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00876—Material properties magnetic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00893—Material properties pharmaceutically effective
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00942—Material properties hydrophilic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00831—Material properties
- A61B2017/00946—Material properties malleable
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B2017/00982—General structural features
- A61B2017/00991—Telescopic means
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B2017/1205—Introduction devices
- A61B2017/12054—Details concerning the detachment of the occluding device from the introduction device
- A61B2017/12063—Details concerning the detachment of the occluding device from the introduction device electrolytically detachable
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B2017/1205—Introduction devices
- A61B2017/12054—Details concerning the detachment of the occluding device from the introduction device
- A61B2017/12068—Details concerning the detachment of the occluding device from the introduction device detachable by heat
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B17/00—Surgical instruments, devices or methods, e.g. tourniquets
- A61B17/12—Surgical instruments, devices or methods, e.g. tourniquets for ligaturing or otherwise compressing tubular parts of the body, e.g. blood vessels, umbilical cord
- A61B17/12022—Occluding by internal devices, e.g. balloons or releasable wires
- A61B2017/1205—Introduction devices
- A61B2017/12054—Details concerning the detachment of the occluding device from the introduction device
- A61B2017/12095—Threaded connection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B90/00—Instruments, implements or accessories specially adapted for surgery or diagnosis and not covered by any of the groups A61B1/00 - A61B50/00, e.g. for luxation treatment or for protecting wound edges
- A61B90/39—Markers, e.g. radio-opaque or breast lesions markers
- A61B2090/3966—Radiopaque markers visible in an X-ray image
Abstract
本文中公开了制造并且使用医疗装置的装置、设计和方法,所述医疗装置包括用于治疗囊状血管动脉瘤并且闭塞血管和其他生物管道段的可扩张体。示例性可扩张体包括中空金结构,所述结构可折叠、卷绕并且压缩,结合至输送装置,行进至需要治疗的患者体内的位置,通过将流体注入至中心空隙中而扩张,且与所述输送装置分离,在不添加支撑结构至所述中心空隙的情况下以敞开、扩张形式保持在适当位置中。其他可扩张体包括线圈丝,所述线圈丝可装载至输送导管中并且使用推进装置从所述输送导管排出。本文中也公开了使用多个医疗装置和可扩张体的方法,其中所述可扩张体邻近彼此放置以闭塞囊状动脉瘤。
Description
相关申请的交叉引用
本申请要求2014年9月17日提交的标题为“Expandable Body Device and Methodof Use”的美国临时专利申请号62/051873的优先权;其全部内容以引用的方式全部并入本文中。
技术领域
本公开涉及包括可扩张体的医疗装置和系统,包括一个或多个医疗装置或系统的使用,所述一个或多个医疗装置或系统包括用于治疗血管系统的囊状动脉瘤的可扩张体,其中一个或多个可扩张体最终以扩张状态保留在动脉瘤中。此外,本公开涉及用于输送和定位可扩张体的各种实施方案的方法和系统,其被定尺寸和构造来填充和/或密封囊状动脉瘤的至少一部分,使得可扩张体以扩张状态保留在适当位置中。本公开也涉及医疗装置和系统以及其使用,所述医疗装置和系统包括:一种形式的可扩张体,其包括中空金属球囊或包括金属的球囊;和输送导管。本公开也涉及用于治疗囊状动脉瘤的装置、系统和方法,其中可以组合方式部署不同形式的可扩张体。例如,可将中空金属球囊形式的可扩张体放置在动脉瘤囊中且使其扩张,且接着可将一个或多个线圈丝形式的可扩张体放置在动脉瘤囊中,使得线圈丝接触动脉瘤的壁和位于动脉瘤颈部附近的经扩张中空金属球囊的壁且施加力在经扩张中空金属球囊上以协助密封动脉瘤颈部。
本公开也涉及包括可扩张体的医疗装置和系统,包括一个或多个医疗装置或系统的使用,所述一个或多个医疗装置或系统包括用于闭塞血管段或其他生物管道的可扩张体,其中可扩张体最终以扩张状态保留在血管段或生物管道段中。此外,本公开涉及用于输送和定位可扩张体的各种实施方案的方法和系统,其被定尺寸和构造来填充和/或密封血管段或生物管道段的至少一部分,使得可扩张体以扩张状态保留在适当位置中。本公开也涉及医疗装置和系统以及其使用,所述医疗装置和系统包括:一种形式的可扩张体,其包括中空金属球囊或包括金属的球囊;和输送导管。本公开也涉及用于闭塞血管段或其他生物管道的装置、系统和方法,其中可以组合方式部署不同形式的可扩张体。
本公开也涉及可扩张体的制造,其中将不锈钢环耦接至心轴的近端,将金属层沉积在心轴上方和至少不锈钢环或管的一部分上方,且可选地移除心轴,产生具有心轴的形状的中空体形式的金属层,其可塑形为可扩张体。制造方法的这个实施方案包括其中通过电铸沉积金属的方法以及其中所沉积金属是金的方法。不锈钢环因此结合至中空体的近端区域且从所述区域延伸,形成颈部,包括形成近端颈部。也可通过将单独段焊接至可扩张体的颈部或主体而添加不锈钢环,主体被界定为包括近端区域和远端区域,且可选地包括中间区域。在特定实施方案中,不锈钢环或管耦接至输送装置,且被构造,其中环或管可通过电解分开。
背景技术
动脉瘤是血管的异常向外凸出,其可在身体的任何位置出现。这种凸出使血管壁变弱,使其易于破裂,其可能导致出血或大出血。动脉瘤常见于脑动脉循环中,其中它们被称作脑动脉瘤或颅内动脉瘤。当脑动脉瘤破裂时,这通常导致出血性中风、脑损伤且有时导致死亡。脑动脉瘤是常见病症,影响估计2%的成人人口。大约90%的脑动脉瘤是囊状的,具有圆形、囊或袋状形状。侵入性外科手术是传统的治疗模式,其中外科手术涉及打开颅骨并且通过将小手术夹放置在动脉瘤的颈部或主体的外侧而密封动脉瘤,由此限制至动脉瘤囊中的血流。
替代地,基于导管的微创血管内治疗已被使用,其中一系列小金属线圈丝(“线圈”)用于填充动脉瘤囊、血管段或生物管道段以实现闭塞。为了用线圈闭塞动脉瘤或血管,医师将导管插入至血管系统的内腔中,且将导管尖端操纵至期望闭塞的位置。在导管尖端处于适当位置的情况下,医师将线圈传递穿过导管至动脉瘤、血管段或生物管道段的内腔或内部空腔中。
虽然有效,但囊状脑动脉瘤的线圈栓塞具有缺陷。首先,线圈放置难以控制,通常导致线圈突起至载瘤血管或线圈迁移至非目标位置。其次,线圈仅部分填充且闭塞动脉瘤囊。需要血栓和纤维组织的累积来密封动脉瘤,这是一个通常需要花费数周至数月的时间来完成且有时不完全完成的过程,其可减小线圈在治疗带蛛网膜下出血的急性动脉瘤破裂时的有效性。即使当线圈的使用最初有效时,也常常发生动脉瘤、血管或生物管道重通,导致血流返回至动脉瘤且随时间流逝增大破裂的风险。用线圈不完全填充囊状动脉瘤在囊状动脉瘤的颈部区域中尤为常见,其中线圈密度可能是低的且血液流速可能是高的。第三,通常需要大量线圈来治疗动脉瘤,导致成本高且治疗时间久。第四,线圈易被压扁,进一步暴露动脉瘤颈部,且由此促进高的动脉瘤复发率。
最近,传统的管状支架已被调适用于脑动脉瘤的治疗。这些支架被放置在导管输送装置上且在载瘤血管中邻近于动脉瘤定位。接着在载瘤血管中用输送装置使这些支架扩张,随后移除输送装置。经扩张金属支架作用以减小至动脉瘤囊中的血流且促进动脉瘤血栓形成。虽然有效,但是这些“导流”支架的使用具有缺陷。首先,支架可能覆盖邻近动脉瘤的重要动脉分支且将血流导离所述动脉分支,有时导致局部缺血和中风,这是分叉部动脉瘤的治疗中尤为常见的问题。第二,这些支架是载瘤血管中血栓和内膜增生形成的来源,其可导致载瘤血管内腔变窄、局部缺血和中风。
更近期,丝网可扩张体已被调适用于脑动脉瘤的治疗。这些丝网可扩张体使用推进装置(包括推丝、推进导管或推进系统)穿过导管输送装置放置,且定位在动脉瘤囊中。这些丝网可扩张体接着在动脉瘤囊中扩张且从推进装置脱卸。丝网可扩张体作用以减小至动脉瘤囊中的血流且促进动脉瘤血栓形成。
仍需要用于治疗囊状动脉瘤(包括脑动脉瘤)的医疗装置、系统和方法,其导致至囊状动脉瘤的血流的更快速、有效和完全减小,其更有效密封颈部且更耐用且持久。进一步期望具有更快速密封动脉瘤颈部的医疗装置、系统和方法。最后,期望具有用于治疗囊状动脉瘤的医疗装置、系统和方法,其在与现有治疗相比时可更容易且在较短时间内使用,并发症风险较低且成本较低。
在其他临床情况下,患者可受益于特定动脉或静脉段的闭塞。其中血管内血管闭塞有利的临床情况包括减小受伤血管的出血,减小至肿瘤的血流且为了其他目的(诸如减小至血管异常和畸形的血流)重新排布血管系统中的血液路径。基于导管的微创血管内治疗已被开发来闭塞血管段。用于血管闭塞的血管内医疗装置包括球囊导管,其中球囊可充胀以填充血管段的内腔且从导管脱卸。将可脱卸球囊导管用于血管闭塞存在两个主要缺陷。首先,球囊由通常阻止组织长入的聚合物制成。这限制它们被所放置的装置的固定且增大迁移风险。其次,球囊被构造有随加压而扩张的弹性壁,和被设计来在脱卸后维持所述压力的阀门。不幸的是,存在高的球囊和阀门故障率,其导致排空。在无组织长入的情况下,球囊排空可导致血管或生物管道重通或球囊迁移和非目标血管段的闭塞。
更近期,已开发用于血管闭塞的血管内医疗装置,其包括可扩张体形式的丝网结构,其用于填充血管段的内腔的一部分以诱发血栓形成和血管段的闭塞。虽然,通常仅需单个丝网可扩张体来闭塞血管段,且装置通常更易于控制,但是这些装置仅部分填充血管,且需要血栓和纤维组织的累积来闭塞血管。在使用线圈的情况下,这个过程花费数周来完成且有时不完全,通常导致不完全闭塞或重通和治疗失败。
仍需要用于闭塞血管段和其他生物管道的段的基于导管的医疗装置、系统和方法,其执行简单,导致快速、受控和完全闭塞,具有低重通、装置迁移或其他并发症的风险,且可以合理成本购买。
发明内容
本文中公开用于使用可扩张体治疗囊状动脉瘤的医疗系统和装置,包含包括中空金属球囊或包括金属的中空球囊的可扩张体或组合以闭塞囊状动脉瘤的一个或多个可扩张体。也公开用于使用可扩张体闭塞或阻塞血管段(包括动脉、静脉、其他血管和其他生物管道)的医疗系统和装置,包含包括中空金属球囊或包括金属的中空球囊的可扩张体或组合的一个或多个可扩张体。
一般来说,可扩张体是可以经压缩、经收缩、经摺叠、经折叠、经卷绕、经约束、经拉长或另外未扩张的形式从体外输送至体内的位置且接着在治疗位点处扩张以占据空间或施加力在相邻结构上的结构。可扩张体的一个实例是中空金金属结构可被摺叠、卷绕且被压缩、输送至治疗位置,且通过将流体注入至中空金金属结构的中心空隙中而扩张。可扩张体的另一个实施例是镍钛诺、铂或不锈钢丝可形成为线圈形状且接着被拉长或约束在导管的内腔中,以这种构造被输送至治疗位点,且接着从导管排出,此时其可扩张成线圈形状。可扩张装置的又另一个实施例是包括镍钛诺的单体丝网装置,其可被压缩、拉长且约束在导管的内腔中,以这种构造被输送至治疗位点且接着从导管排出,此时其可重新扩张至扩张形状。
如本文中使用的术语“可扩张体”、“扩张体”、“经扩张可扩张体”、“可扩张结构”、“可扩张球囊”、“中空金属结构”、“中空金属可扩张体”、“金属球囊”、“球状支架”和“块状支架”指的是可扩张体,其中可首先可选地使用输送装置以未扩张状态将可扩张体引入至患者体内;其次,使其以未扩张状态穿越患者的一个或多个生物管道至目标治疗位点(即,植入位点);第三,使其在目标治疗位点处扩张至扩张状态;且第四,使其从输送装置分离从而以扩张构造保留在患者体内的目标或治疗位点。
在特定实施方案中,扩张体可被构造用作中空金属结构,所述中空金属结构可通过将流体注入至中心空隙中而充胀或扩张。在这个背景下,当描述这个特定实施方案时,如本文中所述,使用术语“可扩张体”、“可扩张结构”、“可扩张球囊”、“中空金属结构”、“中空金属可扩张体”、“金属球囊”、“球状支架”和“块状支架”。在一些实施方案中,在这个背景下,可扩张体可具有单层或多层壁,其具有大致实心表面,而无普遍的敞开单元或开孔。
本文中公开的医疗系统可用于填充患者的生物空间。这样一种医疗系统可包括单瓣金属可扩张体和输送装置。这样一种医疗系统也可包括一个或多个额外可扩张体,各被称作“线圈丝可扩张体”,其包括可紧邻单瓣可扩张体放置的线圈丝。生物空间的填充包括闭塞破裂或未破裂囊状动脉瘤的内腔或血管段(包括动脉和静脉)的内腔或另一种类型的生物管道的内腔的至少一部分。
单瓣中空金属可扩张体包括远端区域、与远端区域大致相对的近端区域和可选地从远端区域过渡至近端区域的中间区域。中心轴线在单瓣金属可扩张体的近端区域与远端区域之间从近端延伸至远端。在一个实施方案中,这种可扩张体的壁大致连续从近端区域延伸,可选地穿过中间区域至远端区域,以界定可扩张体的外表面和可扩张体的内表面。内表面界定可扩张体的内部体积。可扩张体被构造来从可输送(即,收缩或未扩张)构造扩张至扩张构造。在另一个实施方案中,可扩张体的壁包括具有丝组件之间的间隙、开孔或敞开单元的单体丝网装置。
在各种实施方案中,单瓣中空金属可扩张体包括通过中间区域分离的近端区域和远端区域,所述中间区域形成可扩张体的单体构造。单瓣金属可扩张体可进一步由第一轴线和横向于第一轴线的第二轴线界定。第一轴线在可扩张体的近端颈部与远端颈部之间延伸,或换句话说,在近端表面的中间部分至远端表面的中间部分之间延伸。在一个方面中,中间区域的形状可通过平行于第一轴线的弧度描述并且界定。在各种实施方案中,可扩张体沿着第二轴线的宽度或长度大于可扩张体沿着第一轴线的高度或长度。在一些实施方案中,当扩张时,远端区域平行于第二轴线的最大半径小于或等于近端区域平行于第二轴线的最大半径。在一些实施方案中,当扩张时,远端区域平行于第一轴线的最大半径小于或等于近端区域平行于第一轴线的最大半径。
在各种其他实施方案中,单瓣中空金属可扩张体也可被界定并且描述为具有附贴至大致半球形远端区域的大致半球形近端区域。由各区域形成的半球形可进一步由与第一轴线或第二轴线对准的半长轴线和半短轴线界定。在一些实施方案中,各区域具有对应颈部且可独立界定扁半球体、长半球体或半球形。
在一个实施方案中,单瓣中空金属可扩张体和其输送装置具备充当导丝内腔的内导管轴(即,导丝轴)。在荧光透视引导下,将导丝插入动脉中且使其行进至预期治疗位点。接着经由导丝传递未扩张可扩张体在其远端处的输送装置且将主体输送至预期治疗位点。在一些实施方案中,导丝在这个可扩张体的输送、扩张以及脱卸后移除。在其他实施方案中,可扩张体被输送且扩张,且导丝在脱卸前被移除。在其他实施方案中,可扩张体被输送,且接着导丝在可扩张体的扩张和脱卸之前被移除。
输送装置具有纵向延伸体,所述纵向延伸体包括近端和大致与近端相对的远端。输送装置的远端可操作地耦接至单瓣中空金属可扩张体的近端颈部。在一些实施方案中,输送装置的远端也可操作地耦接至可扩张体的远端颈部。在一个实施方案中,当可扩张体呈可输送构造时,壁呈现摺叠构造,其具有在相对于第一轴线或中心轴线的顺时针方向上或替代地,在相对于第一轴线或中心轴线的逆时针方向上对折的多个褶以形成可扩张体的对折区域。相反地,当可扩张体呈扩张构造时,多个褶未对折,且摺叠构造大体上不再存在。
在相关实施方案中,单瓣中空金属可扩张体的远端进一步包括不同的管状结构,其被称作“桥接段”。在一些实施方案中,桥接段是包括硬质金属或聚合物管(“伸缩管”)的两件式伸缩桥接段,所述管在导管或导管轴(“桥接导管”)的远端上方滑动。在其他实施方案中,桥接段是单件式柔性桥接段,其包括具有或不具有编织加固的聚合物管。在一些实施方案中,桥接段通过胶水、粘合剂或焊接结合至可扩张体的主体。在可扩张体的扩张期间,桥接段允许可扩张体的主体在轴向方向上自由变短。这接着使经扩张中空金属可扩张体的远端与动脉瘤的圆顶之间的距离最大化,使得可以在刺孔动脉瘤的圆顶的最小风险情况下将线圈丝可扩张体放置在其中。此外,桥接段减小注入流体介质从可扩张体的泄漏,其接着减小扩张所需的施加压力。
各种方法可用于使经扩张中空金属可扩张体从输送装置脱卸。在一个实施方案中,系统或医疗系统包括具有电路的脱卸系统,所述电路部分支撑于输送装置上且被构造来通过电解使可扩张体从输送装置的远端解耦。在另一个实施方案中,脱卸可通过电热过程,由此电路熔化输送装置与经扩张中空金属可扩张体的颈部段之间的热塑性连结。在其他实施方案中,可采用机械脱卸手段,诸如通过扭转输送装置而分离的螺纹连接或通过使输送装置从放置于可扩张体中或可扩张体上的套筒、阀门或多个阀门缩回而分离的滑动配合连接。在机械脱卸的情况下,可采用单独的脱卸导管来防止可扩张体在输送装置缩回时的轴向移动。
本文中也公开用于填充患者的生物空间的至少一部分的方法。一种方法包括提供被构造来从可输送构造扩张为扩张构造的单瓣中空金属可扩张体。经由具有可操作地接合至可扩张体的近端颈部、近端区域或远端颈部的远端的输送装置以可输送构造将可扩张体引入至患者的生物空间中。可经由输送装置将流体介质输送至可扩张体的内部体积中以使可扩张体充胀或扩张,使它呈现扩张构造。在扩张后,将可扩张体从输送装置脱卸。在一些实施方案中,方法包括使用脱卸系统,所述脱卸系统具有部分支撑于输送装置上的电路以使可扩张体从输送装置的远端电解分开。在此,输送装置的部分(包括近端颈部的部分)在脱卸前经历电解。在特定实施方案中,经历电解的近端颈部的部分是环形的。
本文中也公开用于制造用于填充患者的生物空间的装置或系统的方法。一种方法包括制造单瓣中空金属可扩张体,其具有远端区域、与远端区域大致相对的近端区域和从远端区域过渡至近端区域的可选中间区域。中心轴线或第一轴线在单瓣金属可扩张体的近端颈部与远端颈部之间延伸。可扩张体的壁大致连续从近端区域延伸穿过中间区域,且至近端区域以界定可扩张体的外表面和可扩张体的内表面。内表面界定可扩张体的内部体积。方法也包括将近端或远端颈部段的所有或一部分焊接或结合至可扩张体或焊接或结合近端颈部段和远端颈部段两者。在其他实施方案中,近端颈部段、远端颈部段或近端颈部段和远端颈部段两者可在电铸过程期间结合以形成可扩张体。
方法也包括制造具有纵向延伸体的输送装置,所述纵向延伸体包括近端和与近端大致相对的远端,将输送装置的远端可操作地耦接至中空金属可扩张体,包括至可扩张体的近端颈部或近端区域。制造方法也包括使可扩张体的壁形成为摺叠构造。摺叠构造包括在相对于第一轴线或中心轴线的顺时针方向上或替代地,在相对于第一轴线或中心轴线的逆时针方向上折叠的多个褶以形成可扩张体的对折区域。
方法也包括制造中空金属可扩张体,包括将不锈钢环耦接至牺牲性心轴(诸如铝心轴)的近端,将金属层沉积在牺牲性心轴上方以及至少不锈钢环或管的一部分上方,且剔除牺牲性心轴以留下具有牺牲性心轴的形状的中空体形式的金属层,所述金属层可塑形为可扩张体。制造方法的这个实施方案包括其中通过电铸沉积金属的方法以及其中所沉积金属是金的方法。不锈钢环因此结合至中空体的近端区域且从所述区域延伸,形成颈部,包括形成近端颈部。也可通过将单独段焊接至可扩张体的颈部或主体而添加不锈钢环,主体被界定为包括近端区域和远端区域,且可选地包括中间区域。在特定实施方案中,不锈钢环或管耦接至输送装置,且被构造,其中环或管可通过电解分开。
方法也包括制造中空金属可扩张体,其包括将不锈钢环耦接至中空非牺牲性心轴(诸如PET球囊)的近端,将金属层沉积在非牺牲性心轴上方以及至少不锈钢环或管的一部分上方,且将非牺牲性心轴留在适当位置作为内层,导致具有非牺牲性心轴的形状的中空双层可扩张体,所述中空双层可扩张体可塑形为可扩张体。制造方法的这个实施方案包括其中通过溅镀或电铸,溅镀接着电铸或电铸且接着溅射而沉积金属的方法以及其中所沉积金属是金的方法。溅镀可包括溅射沉积。
在上述过程中,不锈钢环因此结合至中空金属体的近端区域且从所述区域延伸,形成颈部,包括形成近端颈部。也可通过将单独段焊接至可扩张体的颈部或主体而添加不锈钢环,主体被界定为包括近端区域和远端区域,且可选地包括中间区域。在特定实施方案中,不锈钢环或管耦接至输送装置,且被构造,其中环或管可通过电解分开。在特定实施方案中,覆盖金的不锈钢的区域可被蚀刻以暴露下方不锈钢,导致对电偶腐蚀敏感的区域,且其中经蚀刻区域可通过电解分开。在特定实施方案中,蚀刻通过激光完成。
方法可包括将金属涂层或电绝缘材料施加至中空金属可扩张体的外表面或内表面以及不锈钢环的外表面或内表面的所有或一部分,以及通过使由不锈钢环组成的颈部的区域的外表面的一部分无金属涂层或电绝缘材料而形成阳极。方法进一步包括将不锈钢环的至少一部分耦接至输送装置的远端以及将电解系统电耦接至不锈钢环以通过前行穿过输送装置的导电路径形成潜在阳极。
方法也包括将一个或多个端盖或鼻锥附贴至中空金属可扩张体的颈部或附贴至输送导管的远端。端盖或鼻锥可包括聚合物材料。此外,聚合物鞘管或涂层可附接至可扩张体和端盖或鼻锥,使得在处于折叠、卷绕或压缩输送构造中时聚合物鞘管囊封可扩张体。
在上述装置、系统和方法的各种实施方案中,中空金属可扩张体的壁可包括具有大约5μm至50μm的厚度的至少一个金属层。在一个实施例中,近端区域、中间区域和远端区域的金属层可包括金或铂或其合金。可扩张体的壁也可包括在金属层的内表面上方延伸的非金属涂层的内层和/或在金属层的外表面上方延伸的非金属涂层的外层。非金属“涂层”可为制造期间使用的中空、非牺牲性心轴或可为随后添加的电绝缘材料,包括例如PET或聚对二甲苯。在一个实施方案中,可能存在PET或聚对二甲苯内层和金外层。在另一个实施例中,可能存在覆盖金或铂金属的中心层的聚对二甲苯内层和外层。金属层的表面可包括圆形、粗粒或粒状表面结构,其具有大约0.001μm至0.01μm,大约0.001μm至0.1μm,大约0.001μm至1μm,或大约0.001μm至10μm的表面高度。金属层的外表面可包括大致管状突起。在一个实施方案中,大致管状突起的一些是分支的。在另一个实施方案中,一些在两端上结合至金属层以形成环。
中空金属可扩张体的金属层可通过在心轴上电铸而制造,其中可选地心轴的所有或一部分是牺牲性的。牺牲性心轴可通过诸如钻孔和酸蚀刻的工艺从电铸内部移除。心轴的部分可包括牺牲性铝组件,以及由其他金属(诸如不锈钢、锌、镁或铜)制成的非牺牲性组件。在其他实施方案中,非牺牲性心轴的所有或一部分可为中空的,包括由不锈钢(针对颈部)和由聚合物(诸如PET和聚对二甲苯)制成的非牺牲性部分。非牺牲性不锈钢心轴组件可包括金或铂的表面层,所述表面层在非牺牲性心轴组件的内表面或外表面之一的至少一部分上方延伸。
心轴可具有1至30微英寸Ra(即,绝对值的算数平均值)的表面光洁度。心轴表面光洁度可被选择来优化中空金属可扩张体的所得表面光洁度。
替代地,心轴可具有摺叠外表面,其大致复制中空金属可扩张体的摺叠构造,其是可输送构造与扩张构造之间的中间形状。
在一个实施方案中,心轴可包括水溶性聚合物,其溅镀有金,因此缩短制造以及蚀刻心轴的时间。在一个实施例中,心轴可由溅镀有大约10nm至50nm厚的一层金的聚乙二醇(PEG)或聚氧化乙烯(PEO)注塑成型。可使用瞄准线工艺溅镀金,其中旋转样品台形成可导电的表面,且接着可通过电铸工艺进一步涂布经溅镀聚合物心轴,且接着可在电铸工艺完成时用温水溶解水溶性聚合物心轴。
在各种实施方案中,中空金属可扩张体可经历一个或多个退火工艺。可扩张体可在折叠成可输送构造之前以及之后退火。此外,可扩张体可在包括非金属涂层的同时经历退火工艺。
在一些实施方案中,中空金属可扩张体的壁可包括孔或开孔,其可从内表面完全延伸穿过壁的厚度至外表面。孔可为微观的且直径范围从0.1μm至500μm或可为宏观的,且直径范围从500μm至3mm。开孔可扩张体的一个实例是具有宏观开孔的自扩张丝网结构,包括由镍钛诺丝制成的结构。开孔可扩张体的另一个实施例是具有几乎连续壁和微观开孔的中空金属结构。因而,这个可扩张体可通过经由输送装置与可扩张体的内部体积流体连通的流体供应装置而充胀。流体供应装置被构造来提供至内部体积的供应流体流速,其超过在流体输送压力下从多个孔逸出的流体流速。在一个实施方案中,在可扩张体扩张时,孔填充有可生物降解或可生物消化的材料,使得孔在活体内扩张后敞开一定时间段。
一种制造中空金属可扩张体的方法包括:a)提供牺牲性心轴;b)将金属层沉积在牺牲性心轴上方;c)移除牺牲性心轴,且留下中空金属体的形式的金属层;和d)折叠中空金属体,折叠包括在相对于中空金属摺叠体的中心轴线的顺时针方向上或在相对于中空金属摺叠体的中心轴线的逆时针方向上对折多个褶。在折叠前,中空摺叠体可填充生物相容和血液相容润滑流体来减小摩擦,减小在折叠期间对可扩张体的损害风险,且使压缩装置的剖面最小化。
另一种制造中空金属可扩张体的方法包括:a)提供中空非牺牲性心轴;b)将金属层沉积在中空非牺牲性心轴上方;和c)折叠多层中空金属体,折叠包括在相对于中空金属摺叠体的中心轴线的顺时针方向上或在相对于中空金属摺叠体的中心轴线的逆时针方向上对折多个褶。在折叠前,中空摺叠体可填充生物相容和血液相容润滑流体来减小摩擦,减小在折叠期间对可扩张体的损害风险,且使压缩装置的剖面最小化。
当呈输送或可输送构造时,中空金属可扩张体的对折或压缩区域可界定丝接收通道。在一个实施方案中,未在可扩张体的对折或压缩区域内发现输送装置或输送导管的部分。在另一个实施方案中,在可扩张体的对折或压缩区域内发现输送装置或输送导管的部分。对于摺叠实施方案,每个褶包括从近端延伸至远端且远离中心轴线径向延伸的脊线,且每个褶通过从近端延伸至远端的夹置谷与任何紧邻褶分离,使得摺叠构造具有交替的脊-谷配置。当折叠时,每个褶在相对于第一轴线或中心轴线的顺时针方向上或在相对于第一轴线或中心轴线的逆时针方向上折叠在紧邻褶上方。在一个实施方案中,未在可扩张体的对折或压缩区域内发现输送装置的部分。在另一个实施方案中,可扩张体的对折或压缩区域可界定用于接收导丝的通道。在另一个实施方案中,在可扩张体的对折或压缩区域内发现输送装置或输送导管的部分。
在各种实施方案中,中空金属可扩张体被充胀或扩张以达成扩张构造。可扩张体经由将流体介质输送至可扩张体的内部体积而充胀或扩张。流体介质通常包括液体或气体。在各种实施方案中,在扩张期间,可扩张体内的压力是6个大气压(atm)或更小。其他适当压力包括5个大气压或更小、4个大气压或更小、3个大气压或更小、2个大气压或更小和1个大气压或更小。
在扩张或充胀期间,摺叠构造和存在于呈可输送构造的中空金属可扩张体的多个褶大体上被剔除。当扩张时,可扩张体具有足够的强度来在从输送装置脱卸或分离后,在生物空间内将它自身维持为扩张构造,包括在经扩张可扩张体未密封且在经扩张可扩张体的空隙内的压力与经扩张可扩张体外的压力相同或类似时具有足够强度。
在一些实施方案中,中空金属可扩张体和输送装置被构造来允许可扩张体的内部体积可选地至少部分填充固体或半固体支撑结构。支撑结构包括金属或聚合物线圈或丝、金属或聚合物扩张性结构、珠、球、微球体、可生物吸收或可生物消化材料或其组合。在一个实施方案中,可扩张体的内部体积中不需要非源自患者的固体或半固体材料或构件来导致可扩张体在可扩张体与输送装置分离后呈现或维持扩张构造。
当呈扩张构造时,中空金属可扩张体可具有球形、球体或椭圆体的总体形状。在一个实施方案中,形状可为圆盘顶上的压扁球体。在各种实施方案中,选择比待填充生物空间小的可扩张体。在各种实施方案中,当扩张时,可扩张体具有平行于第二轴线的最大宽度、长度或直径,其大于至生物空间的口或开口的宽度,使得扩张形式的可扩张体可减小至生物空间中的生物流体的流量或密封至生物空间中的口、颈部或开口。例如,可扩张体可用于密封至囊状动脉瘤的开口或颈部或至少减小至囊状动脉瘤中的血流。
为了维持与动脉瘤的口、颈部或开口的接触,可结合一个或多个额外可扩张体部署中空金属可扩张体。在一个实施方案中,将一个或多个线圈丝可扩张体放置在动脉瘤囊中邻近经扩张中空金属可扩张体,使得一个或多个线圈丝填充生物空间中的剩余空隙的至少一部分,且施加力至经扩张中空金属可扩张体的表面以维持其在空间内的位置且维持与动脉瘤的口、颈部或开口的持续接触。在特定实施方案中,线圈丝可扩张体包括镍钛诺或另一个自扩张材料。在其他实施方案中,线圈丝可扩张体包括铂或不锈钢。在特定实施方案中,将一个或多个线圈丝可扩张体(被称作“辅助线圈”)部署在经扩张中空金属可扩张体(被称作球状支架)与动脉瘤的与从载瘤血管且至动脉瘤内腔或囊中的口、颈部或开口相对的壁之间的动脉瘤的空隙内。如本文中所使用,载瘤血管是从其中形成动脉瘤的血管。
选择经扩张中空金属可扩张体的大小,使得经扩张中空金属可扩张体比动脉瘤的口、颈部或开口大或宽,且无法被推出或拉出动脉瘤且被推进或拉进载瘤血管中,使得将闭塞超过载瘤血管的内腔横截面积的50%。在这个背景下,放置一个或多个辅助线圈使得它接触i)动脉瘤的与动脉瘤的口、颈部或开口相对的壁和ii)经扩张中空金属可扩张体且辅助线圈施加力来抵靠动脉瘤的口、颈部或开口按压或保持经扩张中空金属可扩张体。在一个实施方案中,辅助线圈可用向线圈赋予自扩张品质的方法和材料制造。例如,辅助线圈可为包括镍钛诺的球形线圈。在其他实施方案中,辅助线圈可为各种其他形状,包括但不限于球形、球体、椭圆体或圆柱形构造。在其他实施方案中,辅助线圈可涂布有聚合物材料(诸如PTFE)以衬垫线圈且增大线圈的润滑性,使得可减小对动脉瘤的壁的创伤并且可减小将线圈推动穿过且推出线圈输送导管所需的力。在各种方面中,辅助线圈可具有在大约0.002英寸与0.035英寸之间的范围内的直径。优选地,辅助线圈针对较小动脉瘤和脑动脉瘤具有介于大约0.004英寸与0.008英寸之间的直径,且针对较大动脉瘤和周围动脉瘤具有介于大约0.008英寸与0.038英寸之间的直径。类似地,辅助线圈上的聚合物涂层可具有在介于大约0.001英寸与0.004英寸之间的范围内的厚度。优选地,聚合物涂层具有介于大约0.0015英寸与0.002英寸之间的厚度。
可将辅助线圈输送至生物空间,诸如动脉瘤的内腔,而无需单独且不同的输送导管。例如,可将辅助线圈插入至包括单瓣金属可扩张体和输送导管的医疗装置的导丝内腔中且使其行进至动脉瘤囊中,包括通过使用推进装置。辅助线圈接着从推进装置脱离,包括导致推进装置与辅助线圈之间的接合区域的电解的方式。
可使用单独且不同的输送导管将辅助线圈输送至生物空间,诸如动脉瘤的内腔。例如,可将辅助线圈装载至“辅助线圈输送导管”的内腔中,且可将辅助线圈/辅助线圈输送导管组件插入至包括单瓣金属可扩张体和输送导管的医疗装置的导丝内腔中,且可使辅助线圈/辅助线圈输送导管组件行进至动脉瘤囊中。接着使用推进装置将辅助线圈从辅助线圈输送排出,且使辅助线圈从推进装置脱离,包括导致推进装置与辅助线圈之间的接合区域的电解的方式。接着将辅助线圈输送导管从患者身体移除。
辅助线圈输送导管可具有在介于大约0.010英寸与0.050英寸之间的范围内的外径,且优选地介于大约0.016英寸与0.020英寸之间的外径。类似地,辅助线圈输送导管可具有在介于大约0.006英寸与0.044英寸之间的范围内的内径,且优选地介于大约0.010英寸与0.014英寸之间的内径。
辅助线圈可为可推进或可脱卸类型。在可脱卸类型的情况下,使线圈从其输送导管脱卸的示例性方法包括使用电解或电热系统。为增强荧光透视可见性,辅助线圈和/或其输送导管的尖端可电镀有不透射线金属(诸如金)或配备不透射线标记,包括标记带或丝段。这些不透射线标记包括含铂、不锈钢和铂-铱的标记。可替代地,辅助线圈可涂布有包括不透射线液体或粉末的聚合物。在各种实施方案中,第一可扩张体(包括单瓣中空金属可扩张体)和第二可扩张体(包括一个或多个线圈丝可扩张体或辅助线圈)可结合其他基于导管的微创血管内装置使用,诸如框架线圈或血管支架,包括被设计来将线圈保持在动脉瘤的囊中用于闭塞的支架和被设计来在不使用线圈的情况下闭塞动脉瘤的“导流”支架。
在特定实施方案中,中空金属可扩张体可包括各远离可扩张体延伸的近端颈部和远端颈部。在一个实施方案中,可扩张体和颈部两者整体由可锻金属(诸如金或铂)形成。在另一个实施方案中,至少一个颈部的至少一部分包括不锈钢,所述不锈钢后续可经由电解分开,包括不绣钢环。在又一个实施方案中,可扩张体的近端颈部或近端主体涂布有水凝胶以增强动脉瘤颈部的闭塞。
输送装置包括纵向延伸体,所述纵向延伸体可具有导管的外形和功能,且可具有亲水或润滑涂层。这个涂层也可存在于可扩张体上。纵向延伸体的远端段可操作地耦接至可扩张体,包括耦接至近端颈部和近端区域。纵向延伸体的远端段也可可操作地耦接至远端颈部。例如,纵向延伸体的远端可在可扩张体的近端区域处接收在颈部中,使得纵向延伸体的远端段的外表面与可扩张体的近端颈部的内表面接触。在另一个实施例中,纵向延伸体的远端段在可扩张体的颈部中的暴露金属的环形区域的近端边缘附近终止。在另一个实施例中,纵向延伸体的远端段延伸穿过可扩张体且与可扩张体的远端颈部的内表面接触。在另一个实施例中,纵向延伸体的远端段延伸穿过可扩张体且延伸穿过可扩张体的远端颈部。
各种系统和方法可包括或使用电解系统,所述电解系统被构造来将电流输送至中空金属可扩张体,其中电力被输送至中空金属可扩张体的近端颈部或远端颈部上的暴露金属表面。各种系统和方法也可包括或使用电解系统,所述电解系统被构造来将电流输送至线圈丝可扩张体,其中电流被输送至线圈丝可扩张体与推进装置之间的接合区上的暴露金属表面。各种系统和方法也可包括或使用电解系统,所述电解系统被构造来将电流输送至丝网可扩张体,其中电流被输送至丝网可扩张体与推进装置之间的接合区上的暴露金属表面。
在各种实施方案中,电流包括恒定电流、恒定电压或方波电压。在具体实施方案中,电流包括2mA直流和恒定2mA直流。当纵向延伸体或输送导管耦接至可扩张体时,电流的输送可导致输送导管从可扩张体分离或脱卸。分离可在由具有金涂层或镀层的不锈钢形成的颈部的圆周或环形未涂布或暴露金属表面区域中发生,其中圆周或环形未涂布或暴露金属表面区域是通过蚀刻(例如通过激光蚀刻)暴露的不锈钢表面。在电解期间,颈部的圆周未涂布或暴露金属表面区域充当阳极。当输送方波电压时,阳极的电压基于阳极的电压与支撑在输送装置上或驻留在输送装置外部的参比电极的电压调变,诸如使用驻留在患者身体上或患者体内的针或电极垫或驻留在输送导管的主体上的电极。
支撑在输送装置上的电解系统的部分包括嵌入于输送导管的壁上或壁中的充当电系统的电导体的一个或多个导体。这些导体也可同时为输送导管的壁提供结构加固。导体是丝、电缆或可以多种构造(包括螺旋、编织或笔直构造)排布在导管或导管壁上或穿过导管或导管壁的其他电导体。在一些实施方案中,一个导体与可充当阳极的可扩张体的一部分电连通,诸如在具有暴露金属表面的颈部的圆周区域处或附近,而另一个导体与支撑在输送装置上的可充当阴极的结构(诸如铂金属电极或环)电连通。在其他实施方案中,一个导体与可充当阳极的可扩张体的一部分电连通,诸如在线圈丝与推进装置之间的接合区域处或附近,而另一个导体与支撑在输送装置上的可充当阴极的结构(诸如铂金属电极或环)电连通。在其他实施方案中,第三导体与支撑在输送装置上的可充当参比电极的结构电连通。
当呈扩张构造时,可扩张体可具有圆柱形的总体形状。在各种实施方案中,可扩张体的端部可具有半球或圆锥形。这样一种可扩张体可优化用于闭塞动脉或静脉段。在各种实施方案中,可扩张体的近端鼻锥或远端鼻锥可包括一个或多个阀门,所述阀门阻挡血液流动穿过经扩张可扩张体的中心空隙且促进目标血管段的闭塞。
本申请涉及2014年3月14日申请,标题为“Expandable Body Device and Methodof Use”的PCT国际专利申请号PCT/US14/30869;2012年7月17日申请,标题为“ExpandableBody Device and Method of Use”的PCT国际专利申请号PCT/US12/47072;2012年1月17日申请,标题为“Detachable Metal Balloon Delivery Device and Method”的PCT国际专利申请号PCT/US12/21620;2012年1月17日申请,标题为“Ballstent Device and Methods ofUse”的PCT国际专利申请号PCT/US12/21621;2012年1月17日申请,标题为“BlockstentDevice and Methods of Use”的PCT国际专利申请号PCT/US12/00030和2011年1月17日申请的标题为“Detachable Metal Balloon Delivery Device and Method”的美国临时申请号61/433,305(‘305申请)。每个以上列出的专利申请是共同拥有的,由相同发明主体在申请时共同拥有,且以引用的方式全部并入本文中。
附图说明
图1A至图1D是可扩张体的实施方案的平面图。
图2A是可扩张体的实施方案的透视图。
图2B至图2C分别是图2A的可扩张体的实施方案的部分内部图和横截面图。
图2D至图2E分别是可扩张体的实施方案的透视图和横截面图。
图2F是可扩张体的实施方案的平面图。
图2G是图2F的可扩张体的实施方案的部分内部图。
图2H是图2F的可扩张体的实施方案的特写平面图。
图2I至图2K是图2F的可扩张体的实施方案的特写横截面图。
图2L是可扩张体的实施方案的透视图。
图2M是图2L的可扩张体的实施方案的平面图。
图2N是图2L的可扩张体的实施方案的横截面图。
图2O是图2L的可扩张体的实施方案的特写横截面图。
图2P是图示横穿图2L的可扩张体的内部的输送装置和线圈的横截面图。
图2Q是图示横穿图2L的可扩张体的内部的输送装置的部分内部图。
图3A至图3B分别是可扩张体的实施方案的横截面图和特写横截面图。
图3C至图3D是具有桥接导管的可扩张体的透视图,所述桥接导管在它们的远端处具有不透射线标记。
图3E至图3G是可扩张体内的硬质伸缩桥接段的实施方案的横截面图。
图3H至图3I是可扩张体内的柔性桥接段的实施方案的横截面图。
图4A至图4B分别是可扩张体的实施方案的平面图和特写横截面图。
图5A至图5B分别是可扩张体的实施方案的电解颈部段的平面图和特写横截面图。
图6A至图6B分别是可扩张体和输送装置的实施方案的透视图和横截面图。
图6C至图6D分别是可扩张体的实施方案的透视图和横截面图。
图6E是具有带圆锥端部的圆柱形的可扩张体的实施方案的平面图。
图7是双导管输送装置的实施方案的透视图。
图8A至图8F是可扩张体的实施方案的各种构造的平面图。
图8G至图8V是可扩张体的实施方案的各种构造的透视图、平面图和横截面图。
图8W至图8X是具有圆盘顶上的压扁球体的形状的可扩张体的实施方案的平面图和透视图。
图9A至图9D是在远端和近端鼻锥中并入阀门的可扩张体的纵向横截面图。
图9E至图9G是在远端和/或近端鼻锥中使用的阀门的实施方案的各种中心孔隙构造的透视图。
图9H至图9I是在远端和/或近端鼻锥中使用多个阀门的实施方案的平面图和横截面图。
图10A是医疗装置的实施方案的平面图。
图10B至图10C是医疗装置的实施方案的平面图。
图11A至图11F是图示与将可扩张体输送至动脉瘤和部署相关联的步骤序列的医疗装置的实施方案的示意图。
图11G至图11K是图示与将可扩张体部署在血管段中相关联的步骤序列的医疗装置的实施方案的示意图。
图12A至图12B是辅助线圈的实施方案的透视图。
图12C至图12E示出具有增强其润滑性和荧光透视可见性的部件的辅助线圈的实施方案的透视图和横截面图。
图13是医疗装置的实施方案的平面图。
图14A至图14B是医疗装置的实施方案的平面图。
图15A至图15F是图示与将可扩张体部署在动脉瘤中相关联的步骤序列的医疗装置的实施方案的示意图。
图15G至图15K是图示与将可扩张体部署在血管段中相关联的步骤序列的医疗装置的实施方案的示意图。
图16A至图16D是沿着可扩张体的实施方案的直径取得的半球形横截面图。
图16E是支撑在输送导管的远端上的可扩张体的纵向横截面,其中可扩张体是球形且可作为球状支架的实施方案利用。
图16F是穿透图16E的球状支架的壁的部分横截面。
图16G是支撑在输送导管的远端上的可扩张体的纵向横截面,其中可扩张体是具有半球形端部的圆柱形且可作为球状支架或块状支架的实施方案利用。
图16H是穿透图16G的可扩张体的壁的部分横截面。
图16I是支撑在输送导管的远端上的可扩张体的纵向横截面,其中可扩张体是球形且可作为球状支架的实施方案利用。
图16J是穿透图16I的球状支架的壁的部分横截面。
图16K是支撑在输送导管的远端上的可扩张体的纵向横截面,其中可扩张体是具有半球形端部的圆柱形且可作为球状支架或块状支架的实施方案利用。
图16L是穿透图16K的可扩张体的壁的部分横截面。
图17A至图17B是根据一个实施方案的用辅助线圈部署在分叉部动脉瘤中的可扩张体的平面图。
图17C是在辅助线圈插入后部署在分叉部动脉瘤中的可扩张体的平面图,所述辅助线圈定位在可扩张体和生物空间的空隙内。
图17D是在磁性内部支撑结构和外部磁性线圈插入后部署在分叉部动脉瘤中的可扩张体的平面图。
图17E是内部支撑结构插入后的可扩张体的平面图。
图17F是可扩张体的实施方案的平面图,其中通过使用球囊导管施加外力而改变扩张体的形状。
图17G是插入于分叉部动脉瘤后的可扩张体的实施方案的平面图。
图17H至图17J示出描绘使用各种医疗装置的治疗对动脉瘤宽径比的影响的宽颈动脉瘤的横截面图。
图17K提供示出连同框架线圈一起使用医疗装置来闭塞动脉瘤的步骤的横截面图。
图17L示出连同血管支架一起使用来闭塞动脉瘤的医疗装置的实施方案的横截面图。
图17M至图17N是详述连同框架线圈一起使用医疗装置来闭塞动脉瘤的步骤的流程图。
图17O是在其远端处具有不透射线标记的辅助线圈输送导管的透视图。
图17P提供示出适合与辅助线圈的实施方案一起使用的典型电解脱卸系统的操作的序列的平面图。
图17Q提供示出适合与辅助线圈的实施方案一起使用的典型电热脱卸系统的操作的序列的透视图。
图18A至图18E是具有促进动脉瘤中的组织长入的多孔表面层的可扩张体的实施方案的部分横截面图。
图18F是在接触且固定分叉部动脉瘤内的血栓的辅助线圈插入后的可扩张体的平面图。
图18G至图18H是具有用于将扩张体锚固至周围组织的外表面突出的可扩张体的实施方案的平面图。
图18I是具有促进动脉瘤中的组织长入的近端局域化水凝胶表面层的可扩张体的实施方案的横截面图。
图19A是如抵靠输送导管压缩的可扩张体的实施方案的透视图。
图19B是经压缩可扩张体的实施方案的端视图。
图19C是界定偏心通道的经压缩可扩张体的实施方案的端视图。
图19D是经压缩可扩张体的实施方案的端视图。
图20A至图20D是具有多个内腔的医疗装置的输送导管的实施方案的横截面。
图21A是具有被构造来接纳引导导管而非导丝的内腔的医疗装置的实施方案的平面图。
图21B是如沿着图21A中的截面线A-A取得的装置的横截面。
图21C至图21F分别是在可扩张体的近端颈部处并入弹性体套筒的机械脱卸系统的实施方案的平面图、特写平面图、部分横截面图和透视图。
图21G至图21H是并入脱卸导管的机械脱卸系统的实施方案的横截面图。
图21I至图21J分别是有关并入脱卸导管的机械脱卸系统的实施方案的平面图和部分内部图。
图22是用于使可扩张体充胀或排空的配置的透视图。
图23A是医疗装置的实施方案的平面图,其中可扩张体用粘合剂附接至输送导管,且通过可扩张体的颈部的一部分的电解而从输送导管分离。
图23B至图23F是各种输送导管的横截面图和平面图。
图23G是支撑两个电极环的导管的照片。
图23H至图23I是附接至输送装置的可扩张体的部分横截面图和透视图。
图24A图示具有圆柱形中间部分和半球形端部的可扩张体的各种尺寸。
图24B至图24C是图示可扩张体的颈部区域的各种尺寸的纵向横截面。
图25A至图25C是描绘用于在心轴上电铸可扩张体的序列的部分横截面图和透视图。
图26是描绘用于电铸金属可扩张体的心轴的实施方案的透视图。
图27是描绘用于电铸金属可扩张体的心轴的另一个实施方案的横截面。
图28是通过电铸制造的金属可扩张体的部分横截面。
图29A至图29D是心轴和形成于其上的金属可扩张体的各种实施方案的照片。
图29E是示出根据一个实施方案的金属可扩张体的外表面的扫描电子显微照片。
图30A至图30B是分别描绘可扩张体的球形实施方案的外表面和内表面上的涂层的平面图和横截面图。
图30C至图30F是描绘暴露金属表面的区域的各种平面图和横截面,其中金属扩张体通过电解从输送导管脱卸。
图31A至图31B是用于输送可扩张体的各种实施方案的医疗装置的实施方案的透视图。
图32A是结合医疗装置使用的轴套的横截面图,其中通过将电流传递至医疗装置中来执行扩张体的电解脱卸。
图32B至图32C是结合医疗装置使用的轴套的部分透视图。
图32D至图32F是结合医疗装置使用的双重锁定轴套的实施方案的透视部分内部图,其中执行扩张体的机械脱卸。
图32G是根据一个实施方案的输送导管轴的近端的透视图。
图33示出结合医疗装置使用的手持控制器的俯视平面图和侧视平面图,其中通过将电流传递至医疗装置中来执行扩张体的脱卸。
图34至图36是图示用于制造可扩张体、输送导管和含有医疗装置的医疗包的步骤的流程图。
图37A至图37D是如在可扩张体的实施方案的非临床测试期间执行的在新建颈动脉终端分叉上手术构造囊状动脉瘤的过程的图示。
图38是在可扩张体的实施方案的非临床测试期间获得的囊状动脉瘤的血管造影照片。
图39A至图39B是在可扩张体的实施方案的非临床测试期间获得的经闭塞囊状动脉瘤的血管造影照片。
图40A示出在可扩张体的实施方案的非临床测试期间收集的囊状动脉瘤组织样本的显微照片。
图40B是在传统神经血管线圈的非临床测试期间获得的经闭塞囊状动脉瘤的血管造影照片。
图40C示出在传统神经血管线圈的非临床测试期间收集的囊状动脉瘤组织样本的显微照片。
图41描绘在可扩张体的实施方案的非临床测试期间执行的经治疗动脉的血管造影术的结果。
图42A示出在可扩张体的实施方案的非临床测试期间收集的经治疗动脉组织样本的显微照片。
图42B示出在传统血管塞的实施方案的非临床测试期间收集的经治疗动脉组织样本的显微照片。
图43A是经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案的透视图。
图43B是经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案的平面图。
图43C是经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案的横截面图。
图43D是经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案的部分横截面图。
图43E是经由导丝部署以闭塞动脉瘤的经扩张可扩张体的实施方案的平面图。
图43F是经由导丝部署以闭塞动脉瘤的经扩张可扩张体的实施方案的横截面图。
图43G是经由导丝部署以闭塞动脉瘤的经扩张可扩张体的实施方案的远端部分的细节横截面图。
图43H是经由导丝部署以闭塞动脉瘤的经扩张可扩张体的实施方案的近端部分的细节横截面图。
图43I是经由导丝部署以闭塞动脉瘤的经扩张且脱卸可扩张体的实施方案的平面图。
图43J是经由导丝部署以闭塞动脉瘤的经扩张且脱卸可扩张体的实施方案的横截面图。
图43K是示出经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案的部分横截面图。
图43L是示出在经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案内用于1)充胀和2)导丝插入或X射线造影介质注入的双内腔的横截面图(穿透图43K上指示的平面A-A)。
图43M是示出在经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案内用于导丝插入或X射线造影介质注入的内腔的横截面图(穿透图43K上指示的平面B-B)。
图44A是经由导丝部署以闭塞动脉或静脉的未扩张可扩张体的实施方案的透视图。
图44B是经由导丝部署以闭塞动脉或静脉的经扩张可扩张体的实施方案的透视图。
图44C是经由导丝部署以闭塞动脉或静脉的经扩张可扩张体的实施方案的横截面图。
图44D是经由导丝部署以闭塞动脉或静脉的经扩张可扩张体的实施方案的脱卸期间的透视图。
图44E是经由导丝部署以闭塞动脉或静脉的经扩张且脱卸的可扩张体的实施方案脱卸后的透视图。
图44F是示出在经由导丝部署以闭塞动脉或静脉的未扩张可扩张体的实施方案内用于充胀和X射线造影介质的内腔的横截面图。
图44G是示出在经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案内用于1)充胀,2)导丝插入,和3)X射线造影介质注入的三内腔的横截面图(穿透图44F上指示的平面A-A)。
图44H是示出在经由导丝部署以闭塞动脉瘤的未扩张可扩张体的实施方案内用于导丝插入的内腔的横截面图(穿透图44F上指示的平面B-B)。
图45A是经由导丝部署以闭塞动脉或静脉的未扩张可扩张体的低剖面实施方案的横截面图。
图45B是经由导丝部署以闭塞动脉或静脉的经扩张可扩张体的低剖面实施方案的透视图。
图45C是经由导丝部署以闭塞动脉或静脉的经扩张可扩张体的低剖面实施方案的横截面图。
图46A是用于热处理镍钛诺框架线圈的心轴的透视图。
图46B至图46D是正穿过经扩张可扩张体部署的框架线圈的依序平面图。
图47A至图47C是可扩张体的一个实施方案的平面图、透视图和横截面图。
图48是医疗装置的实施方案的平面图,其中使用共同的电源和阴极使中空金属可扩张体和线圈可扩张体个别从它们的输送导管分离。
图49A至图49B是根据一个实施方案的辅助线圈导管和可扩张体的透视图和平面图。
图49C至图49E是根据一个实施方案的正从辅助线圈导管和可扩张体排出的辅助线圈的平面图和透视图。
图50A至图50D是根据一个实施方案的辅助线圈输送系统的平面图和透视图。
图50E是根据一个实施方案的从辅助线圈输送系统排出的辅助线圈的透视图。
图51A至图51C是根据一个实施方案的可通过电解脱卸的辅助线圈的透视图和平面图。
图52A至图52B是根据一个实施方案的辅助线圈和标记丝的透视图和横截面图。
图53A至图53C是根据一个实施方案的辅助线圈和标记带的平面图、透视图和横截面图。
图54A是根据一个实施方案的导丝导管轴的横截面图。
在图的各种视图间,对应的参考符号指示对应元件。图中使用的标题不应解释为限制权利要求的范围。
具体实施方式
本公开涉及包括可扩张体的医疗装置和系统,包括一个或多个医疗装置或系统的使用,所述一个或多个医疗装置或系统包括用于治疗血管系统的囊状动脉瘤的可扩张体,其中可扩张体最终以扩张状态保留在动脉瘤中。此外,本公开涉及用于输送和定位可扩张体的各种实施方案的方法和系统,其被定尺寸和构造来填充和/或密封囊状动脉瘤的至少一部分,使得可扩张体以扩张状态保留在适当位置中。
本公开也涉及医疗装置和系统以及其使用,所述医疗装置和系统包括:一种形式的中空金属可扩张体,其包括金属球囊或包括金属的球囊;和输送导管。这种形式的可扩张体是薄壁、中空金属结构,其可被压缩且接着扩张为半硬质形式,所述半硬质形式可长时间保留在体内且在于可扩张体的中心空隙中不存在硬质或半硬质材料的情况下抵抗压缩,且可在未密封的情况下且当经扩张可扩张体的中心空隙中的压力与经扩张可扩张体外的压力相同或类似时抵抗压缩。
本公开也涉及用于治疗囊状动脉瘤的装置、系统和方法,其中可组合部署不同形式的可扩张体。例如,可将中空金属形式的可扩张体放置在动脉瘤囊中且使其扩张,且接着将一个或多个线圈丝形式的可扩张体放置在动脉瘤囊中,使得线圈丝接触动脉瘤的壁和位于动脉瘤颈部附近的经扩张金属球囊的壁且施加力在经扩张金属球囊上以协助密封动脉瘤颈部。
本公开也涉及包括可扩张体的医疗装置和系统,包括一个或多个医疗装置或系统的使用,所述一个或多个医疗装置或系统包括用于闭塞血管段或其他生物管道的中空金属可扩张体,其中可扩张体最终以扩张状态保留在血管段或生物管道段中。此外,本公开涉及用于输送和定位可扩张体的各种实施方案的方法和系统,其被定尺寸和构造来填充和/或密封血管段或生物管道段的至少一部分,使得可扩张体以扩张状态保留在适当位置中。本公开也涉及医疗装置和系统以及其使用,所述医疗装置和系统包括:一种形式的可扩张体,其包括金属球囊或包括金属的球囊;和输送导管。本公开也涉及用于闭塞血管段或其他生物管道的装置、系统和方法,其中可以组合方式部署不同形式的可扩张体。
本文中描述的术语“可扩张体”、“扩张体”、“经扩张可扩张体”、“可扩张结构”、“可扩张球囊”、“中空金属结构”、“中空金属可扩张体”、“金属球囊”、“球状支架”和“块状支架”用于用可扩张体填充生物空间,其中可扩张体可首先使用输送装置以未扩张状态引入至患者体内;其次,以未扩张状态穿越患者的心血管系统至目标治疗位点(即,植入位点);第三,在目标治疗位点处扩张至扩张状态;且第四,从输送装置脱卸从而以扩张构造保留在患者体内的目标或治疗位点。
在特定实施方案中,扩张体可被构造用作中空金属结构,所述中空金属结构可通过将流体注入至中心空隙中而充胀或扩张。在这个背景下,当描述这个特定实施方案时,如本文中使用的术语“可扩张体”、“可扩张结构”、“可扩张球囊”、“中空金属结构”、“中空金属可扩张体”、“金属球囊”、“球状支架”和“块状支架”指具有带大体实心表面,而无普遍的敞开单元或开孔的单层或多层壁的可扩张体。
在一个实施例中,术语“球状支架”有时用于描述大致圆形形式的中空金属可扩张体和可用于治疗囊状脑动脉瘤的可扩张体。在另一个实施例中,术语“块状支架”有时可用于描述大致椭圆形或圆柱形形式的中空金属可扩张体,和可用于填充动脉或静脉段的内腔的一部分或另一种形式的生物管道段的内腔的一部分的可扩张体。具体地,球状支架被构造用于填充和闭塞血管的囊状动脉瘤,尤其是囊状脑动脉瘤和破裂动脉瘤。具体地,块状支架被构造用于阻塞或闭塞动脉、静脉和其他生物管道段的内腔。
可使用输送装置将球状支架输送至囊状动脉瘤。输送装置也提供穿过中空圆柱形构件或圆柱形构件的内腔的路径以供流体介质移动至球状支架的空隙以使球状支架扩张且填充动脉瘤囊的体积的至少一部分。输送装置也提供穿过中空圆柱形构件或圆柱形构件的内腔的用于导丝的路径。输送装置也可被构造来通过提供穿过中空圆柱形构件或圆柱形构件的内腔以供线圈丝或丝网可扩张体从患者体外传递至动脉瘤的内腔或空腔的路径而将第二可扩张体或其他结构(诸如线圈丝或丝网可扩张体)输送至动脉瘤。在一些实施方案中,导丝的路径和线圈丝或丝网可扩张体的路径是相同路径。在一些实施方案中,导丝的路径和线圈丝或丝网可扩张体的路径是不同路径。
可使用输送装置将块状支架输送至动脉、静脉或生物管道的目标区域。输送导管也提供穿过圆柱形构件或圆柱形构件的内腔的路径以供流体移动至块状支架的中心空隙中以使块状支架扩张且填充血管段的内腔的至少一部分。
可将中空金属可扩张体折叠为可输送构造用于引入至动脉瘤、动脉或静脉段或另一种形式的生物管道段。当被折叠为可输送构造时,可扩张体可形成为具有许多褶的摺叠构造,所述褶可在顺时针或逆时针方向上绕可扩张体的中心轴线卷绕。
当用于填充动脉瘤时,使导管输送装置和附接的球状支架行进至囊状动脉瘤的内腔或空腔中。类似地,当用于闭塞血管或其他生物管道时,使输送装置和附接块状支架行进至血管或生物管道的内腔或空隙中。输送装置也可将流体、固体或其组合输送至可扩张体的内部空隙以使主体在动脉瘤囊或血管段的内腔中扩张且帮助维持扩张体的扩张。可通过多种配置和方法的一个或多个(包括机械、电解、电热、化学、液压或声波装置、系统、配置和方法)使扩张体从输送装置脱卸。
医疗装置可用作各种系统、方法和医疗包的部分。这些系统、方法和医疗包可用于治疗囊状动脉瘤(诸如囊状脑动脉瘤)且闭塞动脉或静脉或生物管道段,诸如动脉导管、支气管、胰管、胆管、输尿管或输卵管。这些系统、方法和医疗包可用于治疗多种医学病症。
可扩张体
在各种实施方案中,被构造用于闭塞囊状脑动脉瘤的可扩张体被统称作球状支架且可具有包括球形、球体、椭圆体或心形的许多形状。在各种其他实施方案中,可扩张体可被构造为用于闭塞生物管道(包括动脉和静脉段)的内腔的块状支架,且可具有包括椭圆形或大致圆柱形(包括带平坦和圆形端部的圆柱形)的许多形状。
一般来说,球形球状支架100和150示于图1A至图1D和图2A至图4B中。具体地,在图1A至图4A中,球形球状支架100被示于扩张状态中。球状支架100和150具有从球状支架突起的近端颈部116,所述近端颈部116界定用于使流体、液体、气体、凝胶或固体传递至或穿过球状支架的空隙的开口112。在图1B中所示的球状支架100中,颈部116突起至空隙中以界定用于使流体、液体、气体、凝胶或固体传递至球状支架100的开口112。
球状支架100的另一个球形实施方案以扩张状态示于图1C中。这个实施方案包括近端颈部116,所述近端颈部116界定用于使流体、液体、气体、凝胶或固体传递至球状支架或穿过球状支架的开口112。球状支架100也包括从球状支架突出的远端颈部118,所述远端颈部118界定用于使如图2A至图2B和图3A至图3B中所示的导丝302或线圈162传递穿过球状支架或从球状支架的内部传递至球状支架的外部(包括从远端至远端颈部)的开口114。球状支架100的类似球形实施方案以扩张状态示于图1D中。这个实施方案包括界定开口112的近端颈部116和界定开口114的远端颈部118,两个开口突起至球状支架100的内部以使流体、液体、气体、凝胶或固体(包括导丝302或线圈162)传递至或穿过球状支架的内部。
最终,本文中公开的金属可扩张体可具有多种构造且任何构造可用于多种用途,包括闭塞动脉瘤(包括囊状动脉瘤)和生物管道(包括动脉和静脉)段。一般来说,一些构造可更容易或有效地适用于一个应用或另一个应用。例如,图1A至图1D的球形可扩张体100在充当用于填充囊状动脉瘤的内腔(或空隙或空腔)的球状支架时特别有利。类似地,如下文进一步所述,例如,图1A至图1D和图2A至图4B的球形可扩张体100和150以及图6A至图6D、图8A至图8S、图16G和图16K的可扩张体140和170A至170F可与线圈或辅助线圈162一起使用以填充囊状动脉瘤的内腔(或空隙或空腔)的至少一部分且减小或阻挡从载瘤血管穿过开口至动脉瘤的内腔的血流或减小或阻挡穿过囊状动脉瘤的颈部至动脉瘤内腔(或空隙或空腔)的主体的血流。在各种实施方案中,线圈或辅助线圈162包括自扩张材料,诸如镍钛诺丝。
在一些实施方案中,如图8A至图8G和图8U中所示,可扩张体170A至170H的特征可为包括近端区域174A至174G、中间区域173A至173G和远端区域172A至172G,其中近端区域和远端区域大致彼此相对。针对每个主体170A至170H,近端区域174A至174G、中间区域173A至173G和远端区域172A至172G形成可扩张体的单体构造。针对这个特征,近端区域、中间区域和远端区域一起形成可扩张体的“主体”,其不含颈部。可扩张体170A至170H可进一步由第一轴线176和横向于第一轴线的第二轴线178界定。在一个方面中,第一轴线176在颈部116与118之间延伸。
在一个实施方案中,可扩张体170A至170H的中间区域173A至173G的形状可由沿着第一轴线形成的可变半径弧绕第一轴线176的旋转界定,其中可变弧的最大半径等于远端区域172的最大半径181或近端区域174的最大半径180,如沿着第二轴线178测量。对于一些实施方案,经扩张可扩张体170A至170H具有沿着第一轴线176的总长度179,所述总长度179小于或等于经扩张可扩张体沿着第二轴线178的最大直径182。
在无中间区域的一些实施方案中,如图8A至图8G和图8U中所示,可扩张体170A至170H的特征可为包括近端区域174和远端区域172,其中近端区域和远端区域大致彼此相对。针对每个主体170A至170H,近端区域174和远端区域172形成可扩张体的单体构造。针对这个特征,近端区域和远端区域一起形成可扩张体的“主体”,其不含颈部。可扩张体170A至170H也可进一步由第一轴线176和横向于第一轴线的第二轴线178界定。在一个方面中,第一轴线176在颈部116与118之间延伸。对于一些实施方案,经扩张可扩张体170A至170H具有沿着第一轴线176的总长度179,所述总长度179大于或等于经扩张可扩张体沿着第二轴线178的最大直径182。
在各种其他实施方案中,可扩张体可由近端区域174和远端区域172界定和描述,其中每个区域为大致半球体。由每个区域172和174形成的半球体进一步由可与第一轴线176或第二轴线178平行的半长轴线和半短轴线界定,其依据每个轴线的长度。在各种实施方案中,近端区域174的半球体可具有与远端区域172不同的半长轴线和半短轴线。在其他实施方案中,近端区域174的半球体可具有与远端区域176中相同的半长轴线和半短轴线。类似地,分别对于远端区域172和近端区域174的每个,半长轴线和半短轴线可彼此相同或相同,使得对应区域可具有扁半球体、长半球体或半球形的大致形状。如所示,可扩张体170A至170H也可制造为具有大致球体或椭圆体形状的多种其他构造。可扩张体170A至170H也可包括近端颈部116和远端颈部118。
在一些实施方案中,经扩张可扩张体170A至170H具有从近端颈部116至远端颈部118的大约4mm至16mm或更大的长度179和大约4mm至16mm或更大的最大直径182。如图8A至图8F和图8U中所示,近端区域174A至174G和远端区域172A至172G的最大半径长度是相等的,使得可扩张体170A至170H在从沿着第一轴线176的横截面观看时是大致圆形横截面。如图8A至图8E和图8U中所示,近端区域174A至174G和远端区域172A至172G的任何等效位置处的半径长度可能不相等,使得可扩张体170A至170H在从沿着第二轴线176的横截面观看时可能不具有大致圆形横截面。在其他实施方案中,如图8F中所示,近端区域174A至174G和远端区域172A至172G的任何等效位置处的半径长度可能是相等的,使得可扩张体170A至170H在从沿着第二轴线176的横截面观看时是大致圆形横截面。
在一个方面中,可通过针对近端区域174A至174G和远端区域172A至172G沿着第一轴线176独立地变动最大长度(“高度”)而获得可扩张体170A至170H的不同构造。例如,如图8A、8C和8E中所示,近端区域174A的高度183可小于远端区域172A的高度184。在其他实施例中,如图8B、8D和8F中所示,近端区域174A的高度183可等于远端区域172A的高度184。在其他实施例中,近端区域174A的高度183可大于远端区域172A的高度184。虽然可扩张体170A和170B两者具有相同最大直径,但是每个可扩张体的近端区域和远端区域的高度差异导致可扩张体的不同总体形状。如所示,可扩张体170A是大致心形,而可扩张体170B具有球体形状。
在图8A至图8F和图8U中所示的其他实施例中,近端部分174A至174F的高度183和远端部分173A至173F的高度184分别可独立地变动以制造多种构造的可扩张体170A至170H。近端区域174C的高度183可为大约2mm,而远端区域172C的高度是大约4mm。类似地,近端区域174D的高度183可为大约3mm,而远端区域172D的高度也为大约3mm。对于可扩张体170E,近端区域174E的高度183可为大约2mm,而远端区域172E的高度184是大约3.5mm,而对于可扩张体170F,近端区域174F的高度183可为大约3mm,而远端区域172F的高度184是大约4mm。如所示,可扩张体170A至170H可具有许多构造,所述构造可为大致球体、大致球形或大致心形。
在图8W至图8X中所示的另一个实施例中,可扩张体170H可具有圆盘顶上的压扁球的形状。近端区域174可类似直径远大于其长度的圆柱体,而远端区域172可类似扁球体。近端区域的形状可被优化来闭塞囊状动脉瘤700的开口。
在图6E中所示的另一个实施例中,可扩张体140具有圆柱形,但具有锥形而非如先前在图6A至图6D中所示的半球形端部。这样一种可扩张体可优化用于闭塞动脉或静脉段。金属可扩张体(诸如图1A至图1D和图2A至图4B的经扩张球形球状支架100和150以及图8A至图8U、图16G和图16K的经扩张可扩张体140和170A至170H)可具有由单个连续层122组成的壁102,如图16A中所示。壁102包括材料,优选地生物相容和可延展金属,其可形成为薄壁,且可在扩张后呈现多种形状。举例来说且非限制,金属可选自由金、铂、银、镍、钛、钒、铝、钽、锆、铬、银、镁、铌、钪、钴、钯、锰、钼、其合金和其组合组成的组。优选的金属包括金、铂和银、其合金以及其组合。可扩张体也可由替代材料制成,所述替代材料可形成为薄壁结构,所述薄壁结构足够硬质或半硬质以耐压缩和扩张,并且可在活体内维持扩张状态。替代材料包括用金属线圈或编织加固的聚合物或塑料,和具有类似性质的其他材料。选择形成壁102的材料和壁的厚度,使得可扩张体100、140、150或170A至170H具有足够刚度来在扩张且从输送导管分离后在典型生理条件下在活体内保持在扩张状态中,当中心空隙或空间108内和外的压力相同或类似以及当外部压力大于内部压力时。
此外,期望用于形成且支撑可扩张体100、140、150或170A至170H的材料具有延展性、可锻性和塑性的足够机械性质以压缩或折叠而不撕裂且随后扩张而不破裂。一般来说,延展性是材料变形而不损坏的能力的度量,而材料的可锻性确定在金属经受压力或力时变形而不损坏的容易性。材料的延展性和可锻性纳入材料的塑性,其大致指允许材料经受形状的永久变化而不破裂或损坏的材料性质。因而,可扩张体可由具有足够延展性、可锻性和塑性来经受一次或更多次压缩、折叠过程和扩张的任何生物相容材料组成。
壁102的中心层122具有界定壁厚120的内表面106和外表面124。具体地,对于图16A和图16B,内表面106与外表面124之间的距离是壁102的总壁厚120。优选地,壁102的中心层122具有从大约3μm至大约50μm且优选地大约10μm厚的厚度120。壁厚120可为均匀的。例如,壁102可具有3μm、5μm、10μm、15μm、20μm、30μm、40μm或50μm的均匀厚度。例如,可选择壁102的厚度120,使得可扩张体足够强来抵抗来自血液脉动的压力,但足够弱来在经治疗囊状动脉瘤或经闭塞动脉或静脉或其他形式的生物管道段的治愈和萎缩期间屈服并且收缩。
替代地,不同位置处的壁102的厚度可在厚度上变动。可替代地,可扩张体100、140、150或170A至170H可由具有孔或微穿孔1300的单个多孔层或壁122(如图16B中所示)组成,其中至少一些或所有微穿孔从内表面106一路延伸至外表面124。针对这个实施方案,壁102可为均匀厚度或变动厚度。在这个实施方案的球状支架100的扩张期间,流体介质可在压力下从空隙或空间108前行穿过壁102且在外表面124处离开球状支架。针对这个实施方案,微穿孔1300的直径范围可从1μm至500μm。微穿孔直径的另一个实施例范围是0.01μm至50μm。
可扩张体100、140、150或170A至170H包括中心层或中心壁122,可选地具有外壁或外层104,且可选地具有内壁或内层214,如图16D中所示。如所提及,中心层或中心壁122和层104和214的构造可为均匀、多孔或其组合。在用于治疗囊状动脉瘤的球状支架100的一个实施方案中,壁102包括完全延伸穿过壁102的厚度120的多个微穿孔1300。
在一个构造中,中心层或中心壁122是连续的且由金形成。可选地,可将由多孔金形成的外层104添加至这个优选的构造。可选地,由聚对二甲苯形成的内层214可能存在。可选地,由聚对二甲苯形成的外层104可能存在。在电解用于将经扩张可扩张体100、140、150或170A至170H从输送导管分离的特定实施方案中,球状支架或经扩张可扩张体的特定部分(诸如颈部或主体)涂布有绝缘体或聚合物,诸如聚对二甲苯。在电解用于将经扩张可扩张体100、140、150或170A至170H从输送导管分离的特定实施方案中,球状支架或经扩张可扩张体的特定部分(诸如颈部或主体)涂布有相对抗电解的金属,诸如金或铂。这些部分包括外表面、内表面或内表面和外表面两者,而颈部或主体的一部分保持未涂布或未绝缘。在这个实施例中,通过电流从壁的暴露金属传递至周围电解液(即,血液或血清)而电解溶解(即,腐蚀)壁的未涂布或未绝缘部分。在特定实施方案中,在涂布过程期间通过遮罩形成壁的未涂布或未绝缘部分。在其他实施方案中,将涂层或绝缘从壁或颈部的未涂布或未绝缘部分移除,如通过蚀刻或烧蚀,诸如使用激光蚀刻或激光烧蚀。
大致球形球状支架150的一个实施方案示于图1A至图4B中。大致球形球状支架100或150包括在扩张时形成球形体的壁102。在一个方面中,壁102的远端区域152包括一个或多个环状部分154A至154B。环状部分154A至154B具有大于壁102的其余部分的曲率半径,使得远端区域呈现比壁的其余部分更平的表面。大致球形球状支架150也包括近端颈部116和从远端区域152突起的远端颈部118。在另一个实施方案中,远端颈部可突起至经扩张可扩张体的内部空隙中。
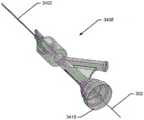
在各种实施方案中,如图2B至图2C和图2E中所示,桥接导管160延伸穿过近端颈部116,穿过经扩张可扩张体的内部空隙,且延伸至远端颈部118中。在一个方面中,桥接导管160是为球状支架150提供结构支撑的输送导管的长形管状构件组件。在一个实施方案中,桥接导管160具有在介于大约0.5mm与2.0mm之间的范围内的外部内径和在介于大约0.4mm与1.9mm之间的范围内的内径。在一些实施方案中,桥接导管是输送导管的组件或可操作地耦接至输送导管。
在另一个方面中,桥接导管160提供路径以经由远端颈部118输送固体材料(诸如导丝302或线圈162,如图2B至图2C、图2E、图2G、图2N至图2P、图8H、图8J至图8O和图8R至图8S中所示)穿过内部空间108至球状支架的外部。桥接导管160也可包括用于将流体、液体、气体、凝胶或甚至固体传递至球状支架150的内部108中的一个或多个开口164。因此,如下文更全面所述,桥接导管160可用于使可扩张体充胀或扩张,同时也允许导丝302或线圈162传递至或穿过球状支架150的内部108,且传递至远端区域152的外部。
在各种实施方案中,桥接导管160内的开口164可具有在介于大约200μm与1mm之间的范围内的直径。如图3A至图3B中所示,桥接导管160可被定尺寸,使得它可接收线圈或辅助线圈162。线圈或辅助线圈162可被直接馈送穿过桥接导管160的内腔或可被馈送穿过第二导管352B(“线圈输送导管”),所述第二导管352B被传递穿过桥接导管160,如图7中所示,且以此方式包括适于与球状支架可扩张体一起使用的双导管输送系统。
在另一个实施方案中,桥接导管160也可允许线圈输送导管352B穿过可扩张体100、140、150或170A至170H的内部以将线圈或辅助线圈162输送至囊状动脉瘤700的内腔、空腔或空隙701。如所示,在图2L至2Q中,线圈输送导管352B可被馈送穿过可扩张体,且辅助线圈162可同时或随后被馈送穿过线圈输送导管352B。
在另一个实施方案中,桥接导管160在其远端处包括不透射线点或标记165,如图3C至图3D中所示。标记165旨在在脱卸过程期间增强可扩张体150与桥接导管160的尖端的相对位置的荧光透视可见性。标记可包括各种不透射线材料,包括钡或金属,诸如金、铂、铱、钽或不锈钢。标记的几何形状可被构造为带、点或线。在一个方面中,不透射线材料可为在桥接导管160的挤出期间混合至聚合物熔体中的不透射线液体或粒子的形式。
在各种实施方案中,包括图3E至图3F中所示的实施方案,在本文中被称作伸缩管630或640的伸缩组件可连接至可扩张体150的远端内的近端轴套362A且在桥接导管160上方滑动,形成充当硬质伸缩桥接段的组件642。依据其相对于可扩张体150的长度,伸缩管可被称作短伸缩管630或长伸缩管640。在扩张期间,伸缩桥接段642允许可扩张体150在轴向方向644上自由缩短并且也减小注入流体介质的泄漏。净效应是可扩张体150扩张所需的所施加压力的减小。
在一个实施方案中,伸缩管630或640可为包括金、铂、铱、钽或不锈钢的金属管段,其也可充当不透射线标记。在一个方面中,伸缩管630或640增强可扩张体150在荧光透视成像下的可见性。
在各种实施方案中,伸缩桥接段642在可扩张体150从输送导管306脱卸时分成其组成组件。具体地,桥接导管160从可扩张体150移除,而伸缩管630或640保留时,如可从图3G了解。
在图3H至图3I中所示的各种其他实施方案中,柔性桥接段643允许可扩张体150在轴向方向644上自由缩短并且减小注入流体介质的泄漏。如图3H中所示,柔性桥接段643可为编织加固聚合物管段(即,编织挤出物),其包括聚酰亚胺或聚氨酯的挤出叠层内的不锈钢或镍钛诺平坦编织。在另一个实施方案中,如图3I中所示,柔性桥接段643可被构造为包括不锈钢、镍钛诺或其组合的金属波纹管。这些替代实施方案的方面可增强可扩张体150的柔性和可追踪性。在可扩张体150从输送导管306脱卸后,柔性桥接段643连同输送导管306一起被移除。
图47A至图47C图示可扩张体190的另一个实施方案。在这个实施方案中,可扩张体190包括接合至远端颈部362A的远端区域202。邻近远端区域202的是远端过渡区域203,所述远端过渡区域203设置于远端区域与中间区域206之间。近端过渡区域205设置为邻近中间区域206且与远端过渡区域203相对。近端过渡区域205将中间区域206结合至近端区域208,所述近端区域208进一步接合至近端颈部362B。可扩张体190是单瓣金属可扩张体的形式。图47C是如沿着截面线B-B观看的可扩张体190的横截面图。
在一个方面中,远端区域202和近端区域208是分别由从可扩张体190的中心193开始的半径191和192界定的可扩张体190的半椭圆体表面,使得191和192小于中间区域206的从中心纵轴线开始的半径194。此外,远端过渡区域的半径195等于邻近中间区域206的半径194,且在可扩张体190过渡至远端区域202的情况下减小至半径191,由此在其靠近远端区域时增大远端过渡区域的曲率。类似地,近端过渡区域的半径196等于邻近中间区域206的半径194,且在可扩张体190过渡至近端区域208的情况下减小至半径191,由此在其靠近近端区域时增大近端过渡区域的曲率。因此,可扩张体190的这个实施方案表现为如同远端区域202和近端区域208已朝向中间区域206向内压缩或压扁。
可扩张体外部
如讨论,可扩张体100、140、150或170A至170H可具有中心层122的外表面124上的一个或多个额外涂层或层104,如图16C至图16D中所示。壁102和任何额外外层界定外表面110,所述外表面110在扩张时接触动脉瘤或血管的内壁。外层104可为均匀或变动厚度,优选地在大约1μm与大约59μm之间。在一个实施方案中,外层124具有介于0.1μm与10μm之间的厚度。在具体实施方案中,外层124具有大约1μm的厚度。
外层124可由聚合物、乳胶、弹性体或金属形成。外层124可为电绝缘体,且在优选实施方案中,外层124由聚对二甲苯涂层形成。外层124可为更不易电解或电偶腐蚀的金属或非金属材料,诸如贵金属,且在优选实施方案中为金或铂。可扩张体100、140、150或170A至170H的内涂层或内层104可为多孔的且含有多个孔200,如图16C和图16D中所示。可替代地,外层104可为光滑的,具有有限的孔隙度或突起。例如,外层104可为抛光金属表面。在一个实施方案中,外层104的部分可为光滑的,而其他部分可为多孔的或含有突起。在一个实施方案中,表面变动可包括图案。图29E描绘电铸和聚对二甲苯涂布后的外表面110的结构。如所示,壁102的外表面110可具有圆形、粗粒或粒状结构。在各种实施方案中,圆形、粗粒或粒状表面结构具有大约0.1μm至10μm的高度。
当被构造为多孔或海绵状层时,外层104可含有(或被构造为含有)溶液,所述溶液包括孔200内的药物、药理活性分子或药物组合物。因而,诸如药物、药理活性分子或药物组合物的溶液可被输送至治疗位点。促进血栓形成、刺激细胞增殖或细胞外基质产生或组织生长的药物、药理活性分子或药物组合物是可被放置在外层104的孔200中的试剂的实施例。在将可扩张体100、140、150或170A至170H定位在期望位置处之前将药物、药理活性分子或药物组合物并入壁或外层104的孔200中。可经由毛细管作用或芯吸作用将药物组合物输送至孔200中。孔200的直径范围从大约0.01μm至大约500μm。每个可扩张体的孔径可根据将并入的具体药物、药理活性分子或药物组合物和在活体内的期望释放速率而变动。举例来说且非限制,可扩张体100、140、150或170A至170H可具有多孔外层104,其中孔径平均从大约0.01μm至大约0.05μm,从大约0.05μm至大约0.5μm,从0.5μm至大约5μm,从大约5μm至大约25μm,从大约25μm至大约500μm,从大约0.05μm至大约500μm,或从大约0.01μm至大约500μm。
药物、药理活性分子或药物组合物可包括凝血酶、血小板衍生的生长因子、或其组合。也可使用促进血栓形成,刺激细胞增殖,刺激细胞外基质的合成或组织生长至可扩张体100、140、150或170A至170H的多孔外壁的其他药物化合物和组成。这些药物或药物组合物可包括促进细胞增殖、细胞外基质产生或组织生长的分子,使得经扩张可扩张体100、140、150或170A至170H将在治疗位置处变得更牢固附接至装置。药物、药理活性分子或药物组合物并入壁102或外层104的剂量和方式是依据所执行治疗的选择事项。其他化合物可用于促进可扩张体周围的血液凝结或血栓形成。在各种方面中,孔200可填充可生物降解或可生物消化材料,使得孔中的材料的体积随时间而减小,且孔在可扩张体放置后的时间点在活体内敞开。对于具有多孔层104的可扩张体100、140、150或170A至170H的实施方案,随时间过去,球状支架、块状支架或可扩张体保持扩张,其中扩张体最终变为附贴至周围组织。
如可从图18G至图18H了解,可扩张体100、140、150或170A至170H的外表面110也可包括可增大扩张体至相邻组织的附接强度并且由此减小移动或迁移风险的一个或多个突起或突出1800(其可为大致管状或具有其他构造)。突起可具有范围介于大约0.01μm与大约167μm之间的长度。一些突起可具有分支构造,而其他可在两个端部处结合至外表面110以形成环。在一些实施方案中,突起是硬质或半硬质的。在其他实施方案中,突起是柔性以及毛发状的,且可进一步包括球状端部,类似于壁虎足趾的表面上的突起。突起可在形成后附接至可扩张体100、140、150或170A至170H。可替代地或额外地,突起可在电铸期间并入可扩张体中。
在另一个实施方案中,球状支架100可包括多孔外层或外壁104或具有外突起1800的壁以促进外表面110上或孔200中的血栓形成且促进细胞增殖、细胞外基质产生或至球状支架100的壁102中或围绕其的组织生长,使得球状支架100将随着时间变为更强劲地附接至相邻动脉瘤壁中的组织。
如图18A至图18D中所示,放置至囊状动脉瘤700中的球状支架100的中心层122和多孔外层104可被构造来促进外层上的血栓1206形成。血栓可由血红细胞1208、血小板1210和纤维蛋白1212组成。随时间过去,当新内皮细胞1214形成于血栓上方时,血栓1206可被部分吸收至外层104中。新内皮细胞可形成跨囊状动脉瘤700的开口的结缔组织1216的密封。除密封囊状动脉瘤700的开口外,来自动脉瘤的壁704的结缔组织1216可生长至块状支架100的多孔外层104中以使球状支架粘附至动脉瘤的壁,如图18E中所示。在其他实施方案中,突出或突起1800可为大致管状、笔直、弯曲、钩形或构造为辫状钩,如图18G至图18H中所示。在宏观形式中,突出可由镍钛诺或任何其他适当生物相容材料组成。
图18H描绘锚固至囊状动脉瘤700的壁704的经扩张球状支架100。突起的大小和形状可基于所治疗病症选择并且可被设计和定尺寸来提供充分锚固支撑,而不导致对动脉瘤的壁或周围组织的过度损害。可替代地,宏观突起或细丝可用于锚固球状支架。对于一些实施方案,这些微观突起的长度范围从0.01μm至大约57μm,并且可为笔直或分支。在各种实施方案中,一个或多个突起的两个端部可结合至球状支架100的外表面110和/或壁102的外表面216以形成环。
在其他实施方案中,在部署之前,可将一层水凝胶720施加至可扩张体100的近端区域208的外表面110,如图16E至图16F中和图18I中描绘。这个层旨在促进血栓形成,且刺激细胞增殖、细胞外基质产生或囊状动脉瘤700的开口703处的组织生长。各种方法可用于使水凝胶720层附接至期望位置。聚合水凝胶层可通过粘合剂附接。可替代地,粘性液体水凝胶预聚物可被施加且随后使用紫外光聚合以形成水凝胶层。
球状支架或可扩张体100、140、150或170A至170H也可用于容纳或捕获已在动脉瘤或其他生物空间内形成的血栓,诸如附壁血栓。如图18F中所示,可将可扩张体170G放置在具有一个或多个血栓的囊状动脉瘤700(包括附壁血栓707)内,动脉瘤的空腔701或圆顶内。在一个方面中,选择具有比动脉瘤内腔701的体积小的经扩张体积的可扩张体170G。如先前描述,可扩张体被输送至动脉瘤,被充胀或扩张,且被插入的辅助线圈162接触。在这个方面中,辅助线圈162同时接触可扩张体170G、血栓707和动脉瘤的壁。可扩张体170G结合辅助线圈162作用以将血栓707捕获在动脉瘤内,将其保持在适当位置中,直至被患者吸收。
在各种实施方案中,未完全填充囊状动脉瘤700的可潜在容纳血液凝块的空腔701的可扩张体是优选的。因而,更完全填充空腔701的较大可扩张体是不太期望的,因为它可能将囊状动脉瘤700内的血栓推出至载瘤血管1202或1203,其中血栓可能栓塞,前行穿过血管系统,且导致中风。
在各种实施方案中,可扩张体100可包括薄聚合物鞘管,其呈输送或可输送构造时围绕可扩张体的整个主体卷绕。鞘管可在可扩张体的制造期间添加至可扩张体100的外部。鞘管可附贴至近端鼻锥362B、远端鼻锥360或362A或两者,诸如图2A至图2Q中所示。聚合物鞘管增大可扩张体100的可追踪性且在可扩张体在被输送穿过血管系统时减小与血管内壁的摩擦。在可扩张体100的充胀或扩张期间,聚合物鞘管敞开,同时保持附贴至可扩张体、输送导管、近端鼻锥362B或远端鼻锥360或362A。在一个实施方案中,鞘管可在部署前穿孔或部分刻划以允许可扩张体100的更容易扩张。
可扩张体内部
在一些实施方案中,可扩张体100、140、150或170A至170H可包括中心层122的内表面106上的额外层或内衬214,如图16D、图16F、图16H、图16J和图16L中所示。内层可由与中心层相同的材料制成或可由不同材料制成。内层可由金、铂、银、其合金或其组合形成。可扩张体100、140、150或170A至170H的中心层122的内表面106上的额外层214也可由聚合物、塑料、乳胶、橡胶、编织或针织纤维材料、金属或另一种材料或其组合形成。优选地,内层214是接合至中心层122的内表面106的弹性体涂层。内层214可为多种厚度,优选地范围介于大约0.1μm与大约59μm之间。在一个实施方案中,外层214具有介于大约0.1μm与大约10μm之间的厚度。壁102(包括中心层122、外层104和内层214)的总厚度优选地介于大约2μm与大约50μm之间,而不管壁是含有一层、两层、三层或更多层。内层214可包括聚合物、乳胶或弹性体。在优选实施方案中,内层214包括聚对二甲苯。内层214也为壁102增加机械性质(诸如强度)。此外,可选地,内层214可形成密封,所述密封阻止流体介质从可扩张体100、140、150或170A至170H逸出,前提是中心层122含有缺陷或孔。中心层122和任何额外层分别界定内表面106或218,使得当用流体、液体、气体或固体扩张球状支架或可扩张体时,界定中心空隙或空间108。如图16D中所示,内表面218与外表面110之间的距离是壁102的总壁厚120。
可扩张体颈部和开口
在特定实施方案中,中空金属可扩张体包括定位在可扩张体的相对端部处的两个颈部。在一些实施方案中,一个颈部可定位于可扩张体的近端处,且另一个颈部可定位于可扩张体的远端处。可选地,至少一个颈部可包括对电偶腐蚀敏感的金属,诸如不锈钢,其可在将可扩张体放置于生物空间中后通过电解分开。在一些实施方案中,不锈钢环可结合至可扩张体的颈部,且在其他实施方案中,不锈钢环可诸如通过使用粘合剂、胶水或焊接结合至可扩张体的主体。在这个实施例中,可扩张体的其余部分可包括更不易电解或电偶腐蚀的材料,诸如贵金属,包括但不限于金,而颈部或颈部的部分可包括更易电解或电偶腐蚀的相对不太贵重材料,诸如不锈钢。
在另一个实施方案中,中空金属可扩张体的主体和颈部可包括在其易电解性或易电偶腐蚀性方面更类似的材料,且主体和可选地颈部的一部分可涂布有充当电绝缘体以在电解期间限制对颈部或颈部的经涂布部分的电解或电偶腐蚀的材料。这种电绝缘体可包括聚对二甲苯。
在又一个实施方案中,中空金属可扩张体的颈部可包括更易电解或电偶腐蚀的不太贵重材料,诸如不锈钢,且更易电解或电偶腐蚀的这种材料的一部分可涂布有更不易电解或电偶腐蚀的额外材料,诸如贵金属,包括但不限于金,使得电解将集中在其中更易电解或电偶腐蚀的不太贵重材料,诸如不锈钢暴露或未涂布的颈部的部分中。
中空金属可扩张体的每个颈部可包括尖端或鼻锥以改进装置的动态剖面,其减小装置在动脉、静脉或其他生物管道内在向前或向后方向上行进期间的阻力。以此方式,尖端或鼻锥可减小对动脉、静脉或其他生物管道的壁的伤害风险。尖端或鼻锥可包括聚合物、金属或其他材料,包括可生物降解或可生物消化的材料。尖端或鼻锥在可扩张体上的存在可减小摩擦、减小由主体的近端或远端导致的创伤并且改进装置在其定位和重新定位时的可追踪性。这在将可扩张体放置在动脉瘤内时尤为相关,因为动脉瘤的圆顶是脆弱的并且在用锋利或尖头装置探测时易受壁破裂。尖端或鼻锥也可提供在主体定位在患者体内时围绕经折叠、经卷绕或经压缩可扩张体的聚合物卷绕的附接点。聚合物卷绕在可扩张体被输送穿过血管系统时进一步增大主体的可追踪性并且减小摩擦。尖端或鼻锥也可被放置在输送导管的远端部分上,其中其可用于类似目的。
如图1A至图1D、图2A至图4B、图8A至图8S、图8U、图16A至图16D、图16G和图16K中所示,可扩张体140、150或170A至170H具有由壁102或由近端颈部116或远端颈部118界定的一个或多个开口112和114。在各种实施方案中,球状支架、块状支架或可扩张体具有分别由颈部116或118界定的一个或多个开口112和114。在所有实施方案中,流体介质可进入开口112并且移动至由内表面106或218界定的中心空隙或空间108中,由此使可扩张体充胀或扩张。在各种实施方案中,颈部116和118之一或两者可从可扩张体100、140、150或170A至170H的其各自端部区域(近端区域或远端区域)向外延伸,如图1A、图1C、图2A至图4B、图8A至图8S、图8U、图16G和图16K中所示。可替代地,颈部116和118之一或两者可从其各自端部区域向内延伸且延伸至内部空隙108中,如图1B和图1D中所示。近端颈部116可用于将可扩张体100、140、150或170A至170H附接至输送导管,且可用于将球状支架或可扩张体从输送导管分离。在各种实施方案中,颈部116和118和壁102或主体可由不同金属形成。例如,在一个实施方案中,颈部116和118和壁102或主体可由金形成。在其他实施方案中,颈部116和118可包括不锈钢,包括但不限于304系列或316L系列不锈钢,且壁102和主体可由金、铂或另一种可锻金属形成。颈部116和118可包括多种金属,诸如不锈钢和另一种金属,诸如金或铂,包括其中可扩张体100、140、150或170A至170H的各种区域在其金属含量上不同的实施方案和其中不同金属在各种区域中形成为层的实施方案,包括其中颈部包括具有金外层的不锈钢内层的实施方案和其中颈部包括具有金内层和外层的不锈钢中心层的实施方案,包括其中外层的表面的至少一部分是不锈钢的实施方案,包括其中通过遮罩或通过蚀刻(包括激光蚀刻)而使金外层的一部分不存在的实施方案。
此外,颈部116和118可被设计并且定尺寸,使得开口112或114(优选地近端开口112)在扩张体从输送导管分离之前、期间或之后闭合或部分闭合。一个或多个开口112或114可保持可敞开。可选地,在分离之前、期间或之后,颈部116和118可折叠、夹紧或闭合以形成密封。颈部116和118或替代地不锈钢环250可具有长度N1,如图24A和图30C中所示,范围介于大约0.5mm与大约20mm之间,优选地介于大约0.5mm与大约5mm之间的长度。在一个实施方案中,颈部长度N1是大约1.27mm±0.08mm。
在各种实施方案中,如图2A至图2E、图24A和图30D中所示,颈部116和118和不锈钢环250的至少一个具有分别界定开口112和114的外径N2和内径N3。外径N2在介于大约0.25mm与大约2mm之间的范围内,且内径N3在介于大约0.24mm与大约1.95mm之间的范围内。在一个实施方案中,颈部外径N2是大约0.99±0.01mm,且颈部内径N3是大约0.89±0.01mm。
颈部116和118的任一个或两者的壁的厚度可与球状支架、块状支架或可扩张体的主体相同,或可比主体的壁薄或厚。优选地,颈部116和118的任一个或两者具有介于大约3μm与大约60μm之间的壁厚N4,如图24B至图24C、图30D和图30F中所示。在一个特定实施方案中,颈部具有大约50μm的厚度。在其中如图1B和图1D中所指示颈部116和118延伸至中心空隙空间108的球状支架100的一个实施方案中,经扩张球状支架的外表面110保持更圆的表面轮廓,增大经扩张球状支架的强度,且减小在放置期间对动脉瘤壁或相邻组织的损害风险。
颈部116或118之一或两者可在内壁、外壁或两者上涂布或绝缘。这个涂层可包括金属(诸如金或铂)和聚合物(诸如聚对二甲苯)。此外,颈部116和118可包括如图2A至图2C和图4A至图4B中所示的一个或多个盖或鼻锥360或如图2D至图2Q中所示的鼻锥362A至362B以改进输送和放置期间可扩张体100的可追踪性。除改进放置期间可扩张体100的可追踪性外,鼻锥360或362A至362B也用于在定位期间保护颈部116和118以及在放置期间减小对被可扩张体100横穿的任何血管或管道的壁或内壁的损害风险。在一些实施方案中,附贴至输送导管的远端部分的鼻锥可用于相同目的。
如图2C和图4B中所示,鼻锥360或362A至362B包括环绕且接合颈部116和118的中心通道364。在一个实施方案中,鼻锥360是如图2A至图2C和图4A至图4B中所示的大致圆柱形,而在其他实施方案中,鼻锥362A至362B可具有如图2D至图2Q中所示的截头圆锥形或“子弹形”构造。鼻锥360或362A至362B可由任何生物相容材料(包括聚合物和金属)组成。在一个实施方案中,鼻锥360或362A至362B由PTFE组成。在各种实施方案中,鼻锥360或362A至362B具有在介于大约0.75mm与2.5mm之间的范围内的外径,在介于大约0.25mm与2mm之间的范围内的内径,具有在介于大约1mm与4mm之间的范围内的长度。
在各种实施方案(诸如图9A至图9D中所示的实施方案)中,鼻锥362A至362B各由两个部分形成,并且可包括阻挡血液流动穿过经扩张可扩张体150的内导管轴的内腔(即,导丝内腔)且促进目标血管段的闭塞的各自阀门560A至560B。在一个方面中,阀门560A至560B可为由一种或更多种弹性聚合物组成的圆盘,诸如但不限于硅橡胶,所述圆盘具有沿着直径的狭缝。可替代地,阀门560A至560B可由注入至鼻锥362A至362B中的粘合剂制成,各具有沿着直径的狭缝或孔隙。阀门560A至560B可被并入至鼻锥362A至362B的任一个或两者中。当被并入至远端鼻锥362A中时,阀门560A被固定在外远端鼻锥575与内远端鼻锥580之间。当被并入至近端鼻锥362B中时,阀门560B被固定在外近端鼻锥585与内近端鼻锥590之间。如可从图9A至图9B了解,当可扩张体150附接至输送导管306时,阀门560A或560B抵靠桥接导管160密封。在脱卸后,阀门560A或560B抵靠其自身密封,如图9C至图9D中所示。除在可扩张体150内提供止血外,在一些实施方案中,阀门560A和/或560B可提供至输送导管306的唯一附接构件。
在图9E至图9G中所示的各种实施方案中,阀门560A至560B可包括具有介于大约0.010英寸与0.020英寸之间的厚度的圆盘。穿透阀门的全厚度的中心空隙565可为类似加号或减号的狭缝或圆形刺孔。如图9A至图9D和图9H至图9K中所示,鼻锥262A至262B可含有与各种组合的中心空隙几何形状串联放置的单个阀门或多个阀门。在优选实施方案中,仅远端鼻锥362A含有阀门且在医疗装置的组装期间,在远端至近端方向上将导丝轴160装载至远端鼻锥362A中。在另一个优选实施方案中,使用单个远端阀门560A,其包括范围从大约40肖氏硬度A至大约90肖氏硬度A的硬度的硅橡胶圆盘,其具有0.010英寸厚度和圆形刺孔中心空隙。
在各种实施方案中,颈部116和118被进一步修改来提供用于使可扩张体100、140、150或170A至170H从输送导管脱卸的脱卸点。例如,导电材料的条状物,包括颈部的未涂布或未绝缘区段、焊接、钎焊或其他固定点或球状支架、块状支架或可扩张体本身的一部分被保留暴露、未涂布或未绝缘或随后在涂布后暴露,包括金属或导电材料的圆周或环形暴露表面的形状的暴露、未涂布或未绝缘区域,其可经受电解以实现经扩张可扩张体与输送装置的远端之间的分离。优选地,不锈钢环附贴至可扩张体的壁102或主体,因为不锈钢对电偶腐蚀和电解高度敏感。例如,如可从图16E、图16G、图16I、图16K、图28和图30A至图30B了解,在一个实施方案中,通过使输送装置的远端部分的外表面沿着金属可扩张体的颈部的金属层的内表面延伸而使金属可扩张体的颈部的金属层的内表面的至少一部分电绝缘。在一些实施方案中,在近端颈部116的内表面上,环形暴露金属表面的近端边界可由颈部区域中的输送装置的远端边界界定,且环形暴露金属表面的远端边界可由颈部区域中的内绝缘层的边界界定。对于近端颈部116的外表面,环形暴露金属表面的近端和远端边界可由颈部区域中的外绝缘层的边界界定。在这样一个实施方案中,输送导管300或400的远端可在颈部的环形暴露金属表面的近端边缘附近远端终止。如图23A中所指示,导电丝可在颈部与输送导管之间或在可扩张体100、140、150或170A至170H本身上接合为与颈部的未涂布或未绝缘部分或焊接或钎焊电接触以允许未涂布或未绝缘部分经由电解溶解(腐蚀)或移除。
在其他实施方案中,一或两个颈部116和118可与金属环250附贴,如图2A、图2B、图5A和图5B中所示,其可随后使用电解分开。金属环250可由不锈钢组成,且如下文所述,可经历一个或多个加热程序以使钢对电偶腐蚀敏感,由此允许经由电解的更快分离或分开。
可扩张体形状和尺寸
图16E至图16F和图16I至图16J图示球状支架100和可用于输送球状支架的输送导管220。在一个特性化中,球状支架100包括远端区域202,所述远端区域202包括球状支架的远端204。与远端区域202相邻的是中间区域206,其中球状支架从远端区域202过渡至包括球状支架的近端210的近端区域208。近端区域208与远端区域202大致相对。中心轴线212在近端区域208与远端区域202之间从近端延伸至远端。球状支架壁102从近端区域208大致连续延伸穿过中间区域206至远端区域202,且球状支架100是单瓣金属可扩张体的形式。在另一个特性化中,球状支架100包括直接结合至近端区域228的远端区域222,所述近端区域228与远端区域222大致相对。中心轴线212在近端区域208与远端区域202之间从近端延伸至远端。球状支架壁102从近端区域208大致连续延伸至远端区域202,且球状支架100是单瓣金属可扩张体的形式。
在一个实施方案中,当球状支架100扩张时,中间区域206、近端区域208和远端区域202组合以形成大致球形形状。在各种实施方案中,基于所治疗的囊状动脉瘤的大小和形状选择球状支架100的尺寸。球状支架100的优选形状包括圆形、椭圆形和不规则形。圆形经扩张球状支架100的直径范围从大约2mm至大约30mm,且优选地具有范围从大约2mm至大约20mm的经扩张直径。椭圆形球状支架或块状支架的经扩张长度优选地范围介于大约2mm至大约30mm之间。球状支架100可具有范围介于大约0.001mL与大约65mL之间的经扩张体积。在优选实施方案中,球形球状支架100的经扩张直径范围从大约2mm至大约10mm,而优选经扩张体积的范围从大约0.004mL至大约40mL。在优选实施方案中,椭圆形球状支架或块状支架100的经扩张长度范围介于大约2mm至大约30mm之间。
图16G至图16H和图16K至图16L图示可扩张体140和可用于输送可扩张体的导管220。在一些实施方案中,可扩张体140可包括大致圆柱形中间区域206(其中圆柱形部分的纵轴线垂直于中心轴线212)、大致半球形近端区域208和大致半球形远端区域208,如图16G中所示。在其他实施方案中,可扩张体140可包括大致圆柱形中间区域206(其中圆柱形部分的纵轴线沿着颈部116的纵轴线对准)、大致半球形近端区域208和大致半球形远端区域208,如图24A中所示。中间区域206可具有等于近端区域208和远端区域208两者的半径R2的半径R1,如图24A中所示。在各种实施方案中,输送导管220通常接合至可扩张体的近端颈部116或近端区域208。
在其他实施方案中,可扩张体壁102的一个或多个部分可比壁的其余部分厚。举例来说且非限制,可扩张体的主体的中间或中间区域的壁可比可扩张体的近端区域和远端区域或部分中的壁厚或薄,或颈部的壁可比可扩张体的主体厚或薄。在各种实施方案中,如图16A至图16D中所示,壁厚120可相对于可扩张体的总直径按比例调整以避免壁应力随直径增大而非期望地增大。在可扩张体100、140、150或170A至170H的各种实施方案中,可在薄至足以实现各种小压缩形式的输送构造且允许可扩张体在较低压力下扩张的壁厚120与厚至足以在输送和脱卸后维持结构完整性和抵抗压缩的壁厚之间作出平衡。因此,平均壁厚120优选地在大约10μm与大约50μm之间的范围内。举例来说且非限制,具有大约4mm的经扩张直径的可扩张体100、140、150或170A至170H的壁厚120可为大约10μm,而具有大约10mm的经扩张直径的可扩张体的壁厚可为大约25μm。在优选实施方案中,块状支架可扩张体150可具有针对4mm经扩张直径的装置的12.5μm的平均壁厚以及针对6mm的经扩张直径的20μm的平均壁厚。在另一个优选实施方案中,球状支架可扩张体150可具有针对8mm经扩张直径和6mm经扩张长度的装置的20μm的平均壁厚。
如图24A中所示,可扩张体140可具有带圆形或半球形端部的大致圆柱形(其中圆柱形的纵轴线与颈部116的纵轴线对准),使得可扩张体的主体平行于第一轴线的长度L1大于可扩张体平行于第二轴线的总宽度(即,径向距离R1的两倍)。在其他实施方案中,可扩张体140可具有如图16G和图16K中所示的带压扁或平坦端部的大致圆柱形,使得可扩张体的主体沿着中心轴线212的总长度小于可扩张体垂直于中心轴线的总宽度。可扩张体140是单瓣金属可扩张体的形式。
在各种实施方案中,可扩张体140具有范围从大约2mm至大约30mm的经扩张直径(沿着中心轴线212以及垂直于中心轴线)。假设壁厚120无变化,当中间区域206的半径R1(见图24A)增大时,可扩张体140的壁中的应力将增大。因此,在一些实施方案中,可扩张体140的直径由用于形成可扩张体的材料(例如,金)的最终抗拉强度和扩张经压缩可扩张体的压力限制。如可从图24A中了解,可扩张体140可具有介于大约2mm至大约120mm之间的经扩张长度L1,这个长度L1包括近端区域、中间区域和远端区域。优选地,长度介于大约5mm至大约60mm之间,且在特定实施方案中,经扩张长度L1是大约40±0.03mm,且中间区域206的长度L2可为大约24±0.03mm,这个长度L2仅包括中间区域。
可通过增大颈部与近端区域之间的半径R4减小或抵消可扩张体100、140、150或170A至170H的颈部116与近端区域或端部208之间的应力集中,如图24B至图24C中所示。例如,由具有半径R4的图24B中的壁102经历的应力大于由具有半径R4'的图24C中的壁经历的应力,其中R4'大于R4。此外,由于在可扩张体的形成期间并入至颈部116中的金属环,应力可集中在其中颈部116过渡至可扩张体100、140、150或170A至170H的近端区域208的壁的点处。这个应力集中可通过减小颈部116的总壁厚N4而减轻。举例来说且非限制,图24B中所示的颈部116可具有大约25μm的壁厚N4,而图24C中所示的颈部可具有大约12.5μm的壁厚N4'。
形成可扩张体的方法
可通过使用电铸工艺在心轴上方沉积金属层而形成中空金属可扩张体。在电铸工艺期间,可将金属环或结构并入至金属层中以形成可扩张体的颈部。这个环或结构可包括不锈钢、锌、铜或金或易于电偶腐蚀的其他材料的区域。可替代地,环或结构可包含包括能够电热分离的聚合物的区域。心轴可为牺牲性心轴,其可在电铸后从可扩张体剔除,以留下中空金属结构,所述中空金属结构是可扩张体或可形成为可扩张体。心轴的所有或一部分可为中空非牺牲性心轴,其可在电铸后与可扩张体一起保留,在一些实施方案中导致作为可扩张体或可形成为可扩张体的多层中空金属结构。
在一个实施方案中,使用一种工艺制造中空金属可扩张体,其中将不锈钢环耦接至心轴的近端,将金属层沉积在心轴上方和至少不锈钢环或管的一部分上方,且可选地移除心轴,导致具有心轴的形状的中空体形式的金属层,所述金属层可塑形为可扩张体。这个实施方案包括其中通过电铸沉积金属的方法以及其中所沉积金属是金的方法。不锈钢环因此结合至中空体的近端区域且从所述区域延伸,形成颈部,包括形成近端颈部。也可通过将单独段焊接至可扩张体的颈部或主体而添加不锈钢环,主体被界定为包括近端区域和远端区域,且可选地包括中间区域。在特定实施方案中,不锈钢环或管耦接至输送装置,且被构造,其中环或管可通过电解分开。
在形成可扩张体100、140、150或170A至170H的示例性方法中,壁102的中心层122可通过蒸汽沉积而形成,其中来自一种或更多种聚合物、纯金属、金属合金或其层的蒸汽凝结在基板或模具(例如,心轴)上。可将模具移除以提供由纯金属或金属合金形成的中空壳。
在优选实施方案中,通过在可移除模型或模具(例如,心轴)上电铸或电镀金属壳而形成壁102的中心层122。例如,如图25A至图25C中所示,以部分横截面示出用于电铸可扩张体100、140、150或170A至170H的多件式心轴3200。心轴3200包括钢底座3202和可从底座移除的模型构件3204。优选地,模型构件3204由硬质材料组成,包括但不限于铝或不锈钢。虽然被示为球形,但模型构件3204的其他实施方案可为其他形状,包括但不限于部分摺叠或部分折叠体3204的形状,其产生具有位于可输送(即,完全收缩或摺叠和折叠)构造与完全扩张构造中间的构造的可扩张体100、140、150或170A至170H,诸如图26中所描绘的部分摺叠心轴3204。此外,如图18G至图18H中所示的突起1800可被塑形至模型构件3204上,使得突起1800在电铸或电镀工艺期间形成。模型构件3204可为如图25A至图25B和图27中所示的球形以形成球形可扩张体100或150。类似地,模型构件3204可为椭圆形、具有半球形端部的圆柱体或任何其他形状以形成可扩张体140和170A至170H。在各种实施方案中,心轴3200或至少可移除模型3204是牺牲性的,使得它在形成可扩张体100、140、150或170A至170H的过程中被消耗。
为了形成金属可扩张体,将模型构件3204从底座3202移除。模型构件3204的一部分可为螺纹的,使得它可接合从底座3202延伸的螺纹主轴3206。在模型构件3204从底座3202脱卸后,将金属环3208定位在螺纹主轴3206上。在图27中所示的一个实施方案中,螺纹主轴3206包括肩部3212,所述肩部3212具有比螺纹主轴3206大的直径,使得金属环3208可座落在期望位置中。
金属环3208是心轴3200的非牺牲性组件。在一个实施方案中,金属环3208是对电解具有反应性的任何生物相容金属。例如,金属环3208可由金、316L不锈钢或304不锈钢组成。优选地,金属环包括304不锈钢,因为304不锈钢具有比316L不锈钢低的镍含量,且将使电解期间的细胞毒性风险最小化。在一些实施方案中,304不锈钢是优选的,因为它具有低于水的电解电势(大约0.82V)的点蚀电势(相对于参比电极大约0.18V至0.38V)。因此,与使用316L不锈钢或金执行的电解相比,使用304不锈钢的电解可在更受控条件下执行,具有更可重复的结果,所述316L不锈钢或金的点蚀电势(分别是大约0.98V至1.18V和大约0.7V至0.9V)超过水的电解电势。
在各种实施方案中,金属环3208的长度介于大约0.025英寸与0.150英寸之间,其具有厚度介于大约25.4μm与254μm之间的壁。在一个实施方案中,金属环3208的长度是0.05英寸。金镀层或涂层可可选地施加至金属环3208的至少一部分3210以促进将用于形成金可扩张体的金的沉积。类似地,由另一种金属(包括但不限于铂)组成的镀层或涂层可用于促进另一种金属的沉积。因而,金属环3208将整合至可扩张体100、140、150或170A至170H中且形成可扩张体的颈部116或118的所有或一部分。可将不导电聚合物结合部放置在可扩张体100的颈部116或118与圆形主体部分之间。这个结合部将为可扩张体100提供额外柔性,以及进一步使可扩张体与用于脱卸可扩张体的各种实施方案的电解电流绝缘。
一旦金属环3208和模型构件3204定位在螺纹主轴3206上,将心轴3200放置在含有金属离子(诸如金)的电解液浴(未示出)中,其中金离子沉积在模型构件和金属环3208的至少一部分上。具体地,定位心轴3200,使得可扩张体100、140、150或170A至170H电铸于模型构件3204和具有金飞边的金属环3208的部分,由此将金属环接合至可扩张体。在一些实施方案中,金属环3208的一部分未涂布金,包括在电铸前使用遮罩的方法。
在各种实施方案中,且如可从图16A至图16D中了解,可通过变动电铸工艺而控制球状支架壁102的厚度120。例如,通过调整电铸工艺的持续时间,可形成更大或更小厚度的壁。类似地,可通过将一个或多个遮罩应用至心轴3200而在特定位置中变动壁厚120。此外,心轴3200相对于溶液浴中的阳极的位置也将影响壁厚。例如,可扩张体100、140、150或170A至170H的颈部处的内部部件可具有比可扩张体的圆形球形部分更薄的壁。可扩张体100、140、150或170A至170H可有意地形成为具有更薄且因此更弱颈部区域,所述颈部区域可分开以使可扩张体从颈部116分离,包括含金属环3208的颈部。可替代地或额外地,线或条状物形式的应力集中环可界定在可扩张体100、140、150或170A至170H的颈部中或近端部分208中,更具体地暴露金属的环形区域(例如,环3208的不锈钢部分或颈部116的金部分)中以帮助促进输送装置或导管在暴露金属的环形区域处从经扩张可扩张体分离。这样一种应力集中线可通过通过各种方法形成为暴露金属的环形区域,包括通过激光蚀刻;通过各种机械操作,诸如锯切、加工或磨削;通过化学加工;通过放电加工;或通过电解。在各种制造方法中,可精确控制颈部的壁厚和公差。例如,颈部部分可通过管状结构的挤出而形成。可替代地,颈部部分可通过无心磨削而形成。
在形成后,将可扩张体100、140、150或170A至170H和模型构件3204从心轴底座3202移除,其中模型构件被移除以仅留下金属环3208,所述金属环3208可形成可扩张体的颈部和其余部分的所有或一部分,其可包括主体和可选地远端颈部,如图28中的部分截面图中所示。在一个实施方案中,通过化学和/或热浸出或蚀刻而穿过颈部116移除铝模型构件3204。在另一个实施方案中,通过机械操作(诸如但不限于用螺旋钻头钻孔)穿透颈部116钻孔至铝模型构件3204中。孔可用于加速并且调节化学蚀刻工艺以将铝模型构件3204从可扩张体100、140、150或170A至170H移除。优选地,机械、化学和热方法的组合用于确保模型构件3204的所有成分被移除。期望将模型构件3204从可扩张体100、140、150或170A至170H完全移除以确保可扩张体的充分塑性或可锻性,且使植入后的任何毒性效应最小化,诸如可能具体是当可扩张体包括残余铝的情况。
为了减少可扩张体100、140、150或170A至170H的应力集中区域或表面变动的存在,且为了消除同心机器标记从模型构件3204转移,心轴3200和具体地模型构件可在电铸可扩张体之前抛光或磨光。未抛光模型构件3204和所得金可扩张体100、140、150或170A至170H分别示于图29A和图29B中。相反地,具有经磨光光洁度的经抛光模型构件3204和所得金可扩张体100、140、150或170A至170H分别示于图29C和图29D中。在一个实施方案中,抛光模型构件3204提供16微英寸Ra的表面光洁度。
一旦模型构件3204已从可扩张体100、140、150或170A至170H移除,可扩张体就可经历退火工艺以改进可扩张体的柔度。在一个实施方案中,将可扩张体加热至大约300℃达大约1小时,且接着立即在室温下在蒸馏水浴中淬火。在其他实施方案中,可扩张体100、140、150或170A至170H在第一次退火工艺后折叠或另外变形,且接着经历一次或更多次额外退火工艺。在进一步实施方案中,可扩张体100、140、150或170A至170H在外表面上被涂布(包括用聚合物(诸如聚对二甲苯)涂布),且接着经历一次或更多次额外退火工艺。
可清洁可扩张体100、140、150或170A至170H的内表面和外表面以移除制造残余的任何污染物。例如,在一个实施方案中,将可扩张体100、140、150或170A至170H放置在含有异丙醇浴的超声波清洁器中达大约10分钟。接着将可扩张体100、140、150或170A至170H从所述浴移除,且用蒸馏水注入以移除保留在可扩张体内部的任何污染物。可选地,可扩张体100、140、150或170A至170H可在保持于大约90℃的真空烘箱中干燥。在各种实施方案中,可用铂电镀可扩张体的外表面和可选地内表面以减小部署期间与患者的非期望反应性的可能性,包括减小经扩张可扩张体的主体或远端颈部的表面上的电解的可能性。
如图16D、图30A和图30B中所示,球状支架100的外表面110、内表面106或两者可涂布诸如聚对二甲苯或丙烯酸聚合物的聚合物。可通过将预形成材料并入至期望定向中、通过蒸汽沉积或其他方法添加聚合物。在一些实施方案中,颈部116的至少一部分或金属环3208的内表面3304未涂布。在一个实施方案中,球状支架100可如先前描述在施加非金属涂层之后至少退火一次。
在壁102由在电解期间高度无反应性的材料(诸如铂)组成的可扩张体100、140、150或170A至170H的实施方案中,颈部116或118的内部和外部可被涂布,而其余表面未被涂布。类似地,在可扩张体100、140、150或170A至170H将通过除电解以外的操作脱卸的一些实施方案中,仅内表面106可涂布有非金属涂层。
在一些实施方案中,在涂布后,将聚合物涂层的一部分从外表面3300移除以暴露条状物或环构造的金属表面,如图30C至图30F中所示。在其他实施方案中,暴露金属表面可通过在涂布前遮罩这个区域且接着移除遮罩材料而形成。电解可用于在包括暴露金属表面的区域处将经扩张可扩张体与颈部3300和输送导管的其余部分分离。脱卸位点(即条状物或环构造的暴露金属表面)3302的宽度W可在介于大约0.1mm与大约0.4mm之间的范围内。脱卸位点3302可沿着颈部116的长度N1定位在任何位置。在一些实施方案中,W可定位于由金属环3208形成的颈部的区域中。在一个特定实施方案中,脱卸位点3302的经暴露条状物具有0.25mm±0.03mm的宽度W,且定位于与颈部116的端部相距大约0.51mm±0.03mm的长度N5处。金属条状物可通过任何适当方法暴露,包括但不限于激光蚀刻或激光烧蚀。在其他实施方案中,脱卸位点3302的金属条状物可在可扩张体100、140、150或170A至170H的折叠或压缩之前或之后暴露。举例来说且非限制,在一个实施方案中,区域3302中的暴露金属是金,而在其他实施方案中,暴露金属是不锈钢。在其他实施方案中,脱卸位点3302可通过激光蚀刻不锈钢的镀金部分而形成,其最终在电铸可扩张体之前形成可扩张体的颈部。在优选实施方案中,颈部316具有23μm±5μm的平均壁厚,且经激光蚀刻脱卸位点3302具有大约15μm的平均壁厚,大约125μm的宽度,且定位为与颈部116的端部相距大约1mm。在这个实施方案中,随后在电铸工艺期间遮罩经激光蚀刻部分。
在各种实施方案中,将可扩张体100、140、150或170A至170H的壁102穿孔以形成多个微穿孔1300,如图16B中所示。举例来说且非限制,可通过将壁102激光穿孔而形成微穿孔1300。微穿孔1300或孔的直径范围可从大约1μm至500μm,且可从内部空隙108完全延伸穿过壁1022厚度至外表面110。可替代地,经微穿孔可扩张体100、140、150或170A至170H可在电铸工艺期间形成,诸如使用遮罩图案。
在穿孔后,可扩张体表面110和106可涂布未完全覆盖微穿孔1300的聚合物,由此在内表面与外表面之间留下通道。可替代地,可扩张体100、140、150或170A至170H可在涂布后激光穿孔。微穿孔1300允许可扩张体100、140、150或170A至170H的内部空隙108与可扩张体外部的环境之间的流体交换。
在各种实施方案中,如图16C至图16D中所示,外层104可通过额外电镀或电铸,通过蒸汽沉积或通过溅射沉积而形成在可扩张体100、140、150或170A至170H的中心层122的外部上,其中材料从目标(例如,金属或金属合金)腐蚀且接着沉积至基板(例如,心轴或模具)上,在基板上形成薄层。类似地,内层214可通过额外电镀或电铸,或通过蒸汽沉积或溅射沉积而形成在可扩张体100、140、150或170A至170H的中心层122的内部上。
在各种实施方案中,将额外聚合物涂层施加至可扩张体100、140、150或170A至170H以修改壁102的强度和柔性特性。例如,聚合物可经由浸涂、旋涂或喷涂或通过专用于具体聚合物的沉积工艺而施加以为壁提供额外强度或柔性。额外涂层可为聚对二甲苯、生物相容聚氨酯、PTFE和硅酮和其他。在一个实施方案中,可通过使用机械或化学模板而将这个涂层限于可扩张体100、140、150或170A至170H的颈部116或118。在各种实施方案中,可将详细几何形状和设计激光蚀刻至加固涂层中以进一步用折叠几何形状优化壁性质。此外,无需加固涂层的区域中的加固涂层的移除也将把不需要的材料从经收缩和卷绕可扩张体100、140、150或170A至170H的最终直径移除。
可通过与颈部116不同的方法形成可扩张体100、140、150或170A-170H的主体的壁102。如图16C至图16D中所示,可通过与外层或外涂层104或内层或内涂层214不同的方法形成可扩张体100、140、150或170A至170H的中心层122。在各种其他实施方案中,可通过将一个或多个金属片操控并且固定为期望构造以形成壁102和/或外层104而形成可扩张体100、140、150或170A至170H。这些二维片可进一步包括橡胶、塑料、聚合物、编织或针织纤维材料或其他材料或其组合。举例来说且非限制,一个或多个二维金属片可折叠成可扩张体形状,且被焊接、钎焊、胶合或接合在一起。类似地,二维材料片可被操纵并且固定以形成外层104或内层214。
在另一个实施方案中,如图2A、图2B、图5A和图5B中所示,不锈钢(SST)环250在可扩张体100、140、150或170A至170H形成之后经由焊接附接至近端颈部116。在其他实施方案中,整个颈部116可为不锈钢,且可在可扩张体的形成期间并入或随后焊接至主体。SST环250或SST颈部116可由任何生物相容不锈钢合金组成,包括但不限于300系列不锈钢或400系列不锈钢和优选地304、316、316L或316LVM不锈钢。
SST环250可经历一次或更多次热处理工艺以使SST环对由电解导致的电偶腐蚀更敏感。因此,热处理工艺允许SST环250更容易分开,由此缩短使可扩张体从输送导管脱卸所需的时间。在一个方面中,通过激光蚀刻SST环的表面而加热SST环。SST环250也通过焊接工艺加热以将环附接至近端颈部116。相信焊接或激光蚀刻的加热工艺可使SST环250对电解的电偶腐蚀敏感。
在一个实施方案中,SST环250可被包括在长形电解段260中,如图2A至图2B、图2D至图2I、图2K至图2N、图2P至图2Q、图6A至图6D、图8G至图8K、图8P、图10C和图14B中所示。在这个实施方案中,电解段260是线圈段,类似于附接至输送导管400的远端部分的导管或导丝,所述远端部分已被修改为包括阴极环262和充当电解阳极的SST环250的至少一部分。类似于下文参考图23H至图23I所述的热固性聚合物段1020,电解段260包括将环阴极电极262与SST环阳极250分离的绝缘涂层264。在另一个实施方案中,电解段260可独立制造且接着使用任何适当方法附贴至输送导管400。举例来说且非限制,用于将电解段260附贴至输送导管400的方法可包括焊接、钎焊或粘合剂。
中空金属可扩张体可经历一次或更多次退火工艺。退火工艺可在包括不锈钢的颈部段焊接或另外结合至可扩张体之前或之后发生。退火工艺可在折叠、卷绕或压缩之前或之后发生。金属可扩张体的内表面和外表面可涂布有作为电绝缘材料的金属或非金属材料,包括诸如聚对二甲苯的聚合物。金属可扩张体的内表面和外表面可涂布或部分涂布有更不易电解或电偶腐蚀的金属或非金属材料,诸如贵金属,包括但不限于金。金属体可在涂层施加之前或之后退火,包括电绝缘材料的涂布。金属可扩张体可在已使金属可扩张体呈现可输送(即,经压缩、经收缩、经摺叠、经折叠、经卷绕、经约束、经拉长或其他未扩张)构造之前和之后退火。
作为可扩张体输送装置的单内腔导管
图10A描绘医疗装置500的输送导管部分400的单内腔实施方案的纵向图,且图20A描绘单内腔导管的横截面。如图11A至图11F中所示,针对单内腔实施方案,输送导管400移动穿过引导导管800的内腔以将经压缩球状支架100输送至囊状动脉瘤700的内腔701。针对这个单内腔实施方案,输送导管400不包括界定被定尺寸以允许引导构件或导丝的通过的内腔的中空圆柱形构件。
输送导管300、352A至352B或400的尺寸是依据将治疗的动脉瘤的大小和动脉瘤在血管系统中的位置的设计选择事项。将治疗的动脉瘤与医疗装置插入至血管系统中的位点之间的距离将部分确定输送导管300、352A至352B或400的长度。输送导管长度范围介于大约5cm与大约300cm之间,优选范围介于大约75cm与大约225cm之间。医疗装置插入至血管系统的位点与将治疗的动脉瘤之间的路径中的最小直径血管段将部分确定输送导管300、352A至352B或400的直径。输送导管直径范围介于2Fr与7Fr之间,优选范围介于2Fr与5Fr之间。
图10B至图10C描绘医疗装置500的输送导管400部分的单内腔实施方案的纵向图。图10B描绘其中球状支架100处于压缩形式中的医疗装置500的单内腔实施方案的纵向图。图10C描绘其中球状支架100处于扩张形式中的医疗装置500的单内腔实施方案的纵向图。
在一些实施方案中,如图10B至图10C中所示,输送导管400的近端构造有轴套3408,所述轴套可促进用于将流体介质源(诸如注射器314(未示出)或泵(未示出,例如KarlStorz的))连接至中空圆柱形构件的内腔312的鲁尔锁紧或鲁尔滑锁型连接,所述中空圆柱形构件被构造来将流体介质从输送导管的近端传输至可扩张体100、140、150或170A至170H的中心空隙或空间。如所示,在图22中,输送导管400的内腔312通过母鲁尔配件2802连接至流体介质源,诸如注射器314。管闩2804或流量开关可定位在流体介质源与输送导管400之间以实现对流体介质移入和移出输送导管的更大控制。
如图17E中所示,在一个实施方案中,单内腔输送导管可用于将球状支架100放置在动脉瘤700的内腔701中。针对这个实施方案,将可选的可移除丝或闭塞器404从输送导管移除。可移除丝或闭塞器404可包括用于促进插入和移除的手柄408或其他装置。接着,流体介质源,诸如注射器314(未示出)或泵(未示出,例如Karl Storz的)可连接至轴套3408,且流体介质可在压力下从注射器314移动至球状支架100的中心空隙或空间108,导致球状支架在动脉瘤700的内腔701内的充胀或扩张,且填充动脉瘤囊的大体上所有或一部分。流体介质诸如水(包括去离子水)、盐水、射线造影剂溶液或药物溶液(诸如凝血酶)可用于使经压缩球状支架100扩张。如图17E中所示,在球状支架100的充胀或扩张后,可将线圈、辅助线圈、扩张性丝或扩张性结构1204放置在球状支架100的中心空隙中。
多种方法和装置可用于将输送导管400从球状支架、块状支架或可扩张体分离。在如图9、图10B至图10C和图23A中所指示的一个实施方案中,输送导管300或400包括一个或多个电解丝320或经绝缘导体丝。针对这个实施方案,在球状支架100扩张后,将电流施加至电解丝320或经绝缘导体丝以通过电解溶解球状支架100的近端颈部的一部分(包括不锈钢部分)。在替代实施方案中,可施加电流以通过电解溶解球状支架100与输送导管300或400之间的不锈钢环250的一部分或溶解球状支架100的近端区域的一部分。直流(DC)可用于任何这些实施方案。一旦近端颈部、不锈钢环250或球状支架100的近端区域的一部分被溶解或腐蚀,将输送导管300或400从经扩张球状支架分离,且移除输送导管和引导导管800。
在如图23B至图23C中所示的各种实施方案中,单内腔导管1000具有由一个、两个或三个电导体(例如,丝或电缆)组成的线圈加固壁1002以提供用于执行电解的导电路径,如下文更全面所述。在一个实施方案中,壁1002的外表面1004由聚酰亚胺组成,且具有亲水或润滑涂层,而导电路径包括0.001英寸×0.003英寸不锈钢扁平线圈1006。导体线圈1006可被构造为单导体、双导体或三导体配置1008,如图23B至图23F中所示,如下文参考执行电解所讨论。线圈1006的导体和任何其他导体可为笔直、编织或成线圈的。由导体线圈1006界定的导体路径可涂布绝缘聚合物,诸如聚对二甲苯,而内腔1012可内衬有PTFE,包括PTFE复合物,诸如聚酰亚胺/PTFE。
在特定实施方案中,具有可移除核心的经修改输液丝可用作单内腔输送导管。输液丝是经修改导丝,其中固体金属核心可被移除以留下可用于注入流体介质的内腔。具有可移除核心的输液丝可被修改,使得可扩张体100、140、150或170A至170H可附接至远端,且在核心丝移除后扩张穿过丝内腔。
在一些实施方案中,输送装置的内表面和外表面的所有或一部分可进一步涂布有亲水或润滑涂层。在其他实施方案中,可扩张体100、140、150或170A至170H的所有或一部分也可涂布有亲水或润滑涂层。
作为可扩张体输送装置的多内腔导管
如图13和图20B中所示,输送导管300可包括额外中空圆柱形构件,其界定第二内腔324以接收引导构件(诸如导丝302)以协助将医疗装置的球状支架100组件引导至期望位置,如可从图14A至图14B和图15A至图15F了解。这个第二内腔324大致邻近且平行于第一内腔312。如图13和图20B中所示,输送导管300可为双内腔导管,其中一个内腔312被构造来使流体介质能从输送导管的近端处的流体介质源传递至输送导管的远端处的球状支架的中心空隙或空间108,且另一个内腔324被构造来接纳引导构件(诸如导丝302)以促进医疗装置在血管系统中的行进和定位。在特定实施方案中,被构造来接纳引导构件的内腔324的远端可由桥接导管界定,类似于如图2B至图2C、图2E、图2G、图2L至图2N、图2O至图2P、图8H、图8J至图8O和图8R至图8S中所示的桥接导管160,作为从近端轴套传递至输送导管的远端的输送导管的部分或作为耦接或接合至输送导管的远端的不同元件。如前所述,这个引导导管可穿过近端颈部、穿过可扩张体的空隙,且可操作地耦接至远端颈部,使得导丝、引导构件、线圈、辅助线圈或辅助线圈导管可被传递穿过输送导管的轴套且离开医疗装置的远端,包括用于将导丝或引导构件定位在动脉、静脉或其他生物管道中并且也包括用于将线圈或辅助线圈放置在囊状动脉瘤的内腔中。
如图20B中所示,输送导管300包括两个中空圆柱形构件,各具有内腔,其中中空圆柱形构件304或306具有范围从大约0.05mm至大约0.25mm的壁厚。优选地,中空圆柱形构件304或306壁厚范围从大约0.1mm至大约0.2mm。由中空圆柱形构件304界定用于接纳导丝302的内腔具有范围从大约0.25mm至大约0.5mm的直径。用于将流体介质传递至球状支架100的内腔的直径和用于接纳引导构件324的内腔的直径可类似地定尺寸。可替代地,用于将流体介质传递至球状支架、块状支架或可扩张构件的内腔的直径可大于或小于用于接纳引导构件(诸如导丝302)或用于接纳线圈、辅助线圈或辅助线圈导管的内腔的直径。
对于具有两个内腔的输送导管,第一中空圆柱形构件和第二中空圆柱形构件可类似地定尺寸。可替代地,第二中空圆柱形构件可具有较大直径以接纳导丝、引导构件、线圈、辅助线圈或辅助线圈导管,或可具有较小直径。第二中空圆柱形构件304的近端接合至轴套3408。轴套3408促进将导丝302、引导构件、线圈、辅助线圈或辅助线圈导管插入至第二中空圆柱形构件304中。如可从图13、图14A至图14B、图15A至图15F和图20B了解,在一些实施方案中,导丝302、引导构件、线圈、辅助线圈或辅助线圈导管可被馈送穿过第二中空圆柱形构件304,且延伸出输送导管300的远端,并且也延伸出医疗装置的远端。在其他实施方案中,包括无桥接导管组件的那些实施方案,线圈、辅助线圈或辅助线圈导管可被馈送穿过第二中空圆柱形构件304且被放置在球状支架、块状支架或可扩张体的中心空隙中。在具有双内腔输送导管的一些实施方案中,输送导管300经由导丝302行进,直至经压缩球状支架140定位在囊状动脉瘤的内腔中。一旦经压缩球状支架140在期望位置中,就通过由连接至球状支架扩张轴套3408的注射器314(未示出)或泵(未示出,例如Karl Storz的)提供至第一中空圆柱形构件306的流体介质使球状支架140扩张。流体介质(诸如水、盐水、射线造影剂溶液或药物溶液(诸如凝血酶))可用于使经压缩球状支架扩张。导丝302优选地是使导丝的远端尖端到达动脉瘤和延伸出且远离至血管系统的进入点的近端的足够长度的血管造影丝。在一些实施方案中,导丝302具有笔直或倾斜远端尖端,而在其他实施方案中,导丝302具有通常由形状记忆合金或编织金属构成的弯曲J形远端尖端,其使尖端在任何所施加应力被移除后恢复至J形。可基于所横穿的血管的直径、长度和迂曲度选择导丝302的材料和尺寸。通常,导丝302可由任何适当生物相容材料构成,且具有范围介于大约0.012英寸与0.035英寸之间的外径。在用于针对一般目的用途放置经压缩可扩张体100、140、150或170A至170H的一个实施方案中,导丝直径可为0.018英寸或0.035英寸。在用于治疗需要特别低剖面装置的远端或迂曲血管解剖结构的另一个实施方案中,导丝直径可为0.012或0.014英寸。
在图20C中描绘的双内腔导管的另一个实施方案中,输送导管300可具备两个单独的同心导管轴。外导管轴306(即,输送轴)连接至可扩张体100用于定位和输送的目的。内导管轴160(即,导丝轴或桥接导管)滑动至可扩张体100中用于密封可扩张体100的颈部116和118,且允许导丝302平顺穿过输送导管300和可扩张体100的目的。这两个导管轴之间的环状间隙充当充胀内腔312,而内导管轴160的内部充当导丝内腔324。在无导丝302的情况下,导丝内腔324可用于X射线造影剂注入。在各种实施方案中,外导管轴306的内径与内导管轴160的外径或内导管轴160的内径与导丝302之间的最小间隙是大约0.004英寸。
在相关实施方案中,在图20D中描绘三内腔导管。输送导管300可具备三个单独同心导管轴。除上文和图20C中描述的部件外,存在围绕输送导管轴306的脱卸导管轴610。这两个导管轴之间的环状间隙充当X射线造影剂内腔760。在各种实施方案中,脱卸导管轴610的内径与输送导管轴160的外径之间的最小间隙是大约0.004英寸。脱卸导管轴610可用于将轴向力传输至机械脱卸机构。在脱卸后,脱卸导管轴610可用于各种诊断或治疗手术中。
在图54A中所示的另一个实施方案中,导丝导管轴160具有层压设计。外层160A包括聚合物(诸如聚酰亚胺)以增加轴向刚性。中层160B包括金属编织(诸如不锈钢平坦编织)以增加扭转和弯曲刚性。内层160C包括润滑聚合物(诸如PTFE或聚酰亚胺/PTFE复合物(例如,International Wire Group的PD-SlickTM))以减小导丝导管轴160与导丝302之间的摩擦。在一些实施方案中,导丝导管轴160的内表面和外表面的所有或一部分可进一步涂布有亲水或润滑涂层。
图14A至图14B描绘医疗装置500的输送导管部分300的双内腔实施方案的纵向图。图14A描绘可扩张体140处于压缩形式中的医疗装置500的双内腔实施方案的纵向图,而图14B描绘球状支架140处于扩张形式中的医疗装置500的双内腔实施方案的纵向图。输送导管300用于使球状支架140经由导丝302行进且行进至动脉瘤囊的内腔中。输送导管300也用于输送流体、液体、气体、固体或其组合以在动脉瘤700的内腔701中使球状支架140扩张。在一些实施方案中,输送导管300或400包括一个或多个电解丝320或经绝缘导体丝。针对这些实施方案,在球状支架100扩张后,将电流施加至电解丝320或经绝缘导体丝以通过电解溶解球状支架100的近端颈部的一部分(包括不锈钢部分)。在替代实施方案中,可施加电流以通过电解溶解球状支架100与输送导管300或400之间的不锈钢环250的一部分或溶解球状支架100的近端区域的一部分。直流(DC)可用于任何这些实施方案。一旦近端颈部、不锈钢环250或球状支架100的近端区域的一部分被溶解或腐蚀,将输送导管300或400从经扩张球状支架分离,且移除输送导管和引导导管800。
在一个实施方案中,电解丝320或经绝缘导体丝连接或电耦接至球状支架的近端颈部的一部分,包括暴露金属表面3302。在另一个实施方案中,电解丝320或经绝缘导体丝连接或电耦接至球状支架与输送导管之间的焊接、钎焊或其他形式的接合,包括粘合剂。在另一个实施方案中,电解丝320或经绝缘导体丝连接或电耦接至球状支架140的另一部分,也包括在暴露金属表面3302处。
在如下文参考图10B至图10C、图13、图14A至图14B、图15A至图15F和图17O所述的“经由丝的”球状支架医疗装置500的各种实施方案中,可扩张体100或140用于闭塞囊状动脉瘤700。最先,放置导丝302,使得其远端尖端位于动脉瘤的囊、内腔或空腔701内,如图15A中所示。接下来,输送导管300或400使经附接和经压缩可扩张体100或140经由导丝302行进,且穿过动脉瘤的颈部或口703,如图15B中所示。
一旦经压缩球状支架100或140已被放置在囊状动脉瘤700的内腔701中,就如图15C中所示移除导丝302。此时,穿过输送导管300或400的导丝内腔注入X射线造影剂以允许使用荧光透视评估经压缩可扩张体100或140的位置。
一旦已实现并且确认可扩张体100在囊状动脉瘤700的内腔701中的适当定位,就使医疗装置500扩张,如图15D中所示。流体介质源(诸如注射器314(未示出)或泵,例如KarlStorz的(未示出))连接至轴套3408,且将流体介质注入至球状支架100或140的中心空隙或空间108中,导致球状支架的扩张,直至它填充动脉瘤的内腔的至少一部分。
在充胀或扩张后,在动脉瘤囊701中将输送导管300或400拉回以将经扩张可扩张体100或140朝向载瘤血管与动脉瘤之间的开口703拉动,包括朝向颈部或口,指示为图15D中的702。这接着使经扩张可扩张体100或140在囊状动脉瘤700的颈部或口703中、附近或相邻处与动脉瘤壁704接触,如图15E中所示。此时,穿过输送导管300或400的导丝内腔注入X射线造影剂以允许使用荧光透视评估经扩张可扩张体100或140的位置。接着将线圈或辅助线圈162馈送穿过导管300或400,穿过可扩张体100或140的内部且将其输送至动脉瘤内腔701中,如图15E中所示,包括将线圈或辅助线圈传递穿过导丝内腔。插入辅助线圈162,直至辅助线圈接触与口703相对的动脉瘤壁704和可扩张体100或140的外表面,其中辅助线圈施加连续力在可扩张体上,导致可扩张体密封动脉瘤的口。此时,可再次穿过输送导管300或400的导丝内腔注入X射线造影剂以允许使用荧光透视评估辅助线圈162和经扩张可扩张体100或140的最终位置。
接着使经扩张可扩张体100或140从输送导管300或400脱卸且移除输送导管,如图15F中所示。将球状支架扩张体留在囊状动脉瘤700的内腔701中,其中它密封动脉瘤的口703。同样地,将辅助线圈留在动脉瘤的内腔中的扩张体的后方,其中它作用以将球状支架保持在适当位置中。
经由丝的实施方案可特别适用于治疗远端且迂曲的血管解剖结构中的脑动脉瘤。当面对这种解剖结构时,可将细长导丝302的尖端直接定位至囊状动脉瘤700的内腔或701中,如图15A中所示。导丝302可具备预成形(例如,弯曲J形)远端(如图15A中所示)以协助穿过动脉瘤的口703。
如可从图15G至图15K中所示的过程了解,经由丝的块状支架医疗装置500的各种实施方案可用于闭塞血管802。最先,放置导丝302,使得它的远端尖端刚好位于将闭塞的血管内腔804的目标区域的远端,如图15G中所示。接下来,输送导管300使经附接和经压缩可扩张体100经由导丝302行进(如图15H中所示),且使其行进至血管内腔804的目标区域中(如图15I中所示)。此时,可穿过脱卸导管610的内腔注入X射线造影剂以允许使用荧光透视评估经压缩可扩张体100的位置。
一旦已实现并且确认可扩张体100在血管内腔804中的适当定位,就使医疗装置500扩张,如图15J中所示。流体介质源(诸如注射器314(未示出)或泵(未示出)(例如KarlStorz的))连接至轴套3408,且将流体介质注入至块状支架100的中心空隙或空间108中,导致块状支架的扩张,直至它填充内腔的目标区域,且接触血管的内腔表面806。现在闭塞血管802。此时,可穿过脱卸导管610的内腔注入X射线造影剂以允许使用荧光透视评估经压缩可扩张体100的最终位置和血管闭塞程度。
接着如图15J至图15K中所示且由图3F和图9A至图9D阐明执行脱卸过程。在导丝302仍处于适当位置中的情况下,缩回输送导管300,将桥接导管160拉出远端阀门560A且将输送导管300拉出近端阀门560B,同时抵靠近端鼻锥362B保持脱卸导管610的远端。脱卸导管610的远端处的不透射线标记带620增强脱卸过程期间的荧光透视可见性。最后,脱卸导管610和导丝302缩回。将块状支架扩张体100留在血管802的内腔804中,其中它维持永久闭塞。
多种方法和装置可用于将输送导管300或400从球状支架、块状支架或可扩张体100或140分离。在如图10A至图10C和图23A中所指示的一个实施方案中,输送导管300或400包括一个或多个电解丝320或经绝缘导体丝。针对这个实施方案,在球状支架100扩张后,将电流施加至电解丝320或经绝缘导体丝以通过电解溶解球状支架100的近端颈部的一部分(包括不锈钢部分)。在替代实施方案中,可施加电流以通过电解溶解球状支架100与输送导管300或400之间的不锈钢环250的一部分或溶解球状支架100的近端区域的一部分。直流(DC)可用于任何这些实施方案。一旦近端颈部、不锈钢环250或球状支架100的近端区域的一部分被溶解或腐蚀,将输送导管300或400从经扩张球状支架分离,且移除输送导管和引导导管800。
在各种实施方案中,双内腔导管具有由一个、两个或三个电导体(例如,丝或电缆)组成的线圈加固壁以提供用于执行电解的导电路径,如下文更全面所述。在一个实施方案中,壁的外表面由聚酰亚胺组成,且具有亲水或润滑涂层,而导电路径包括0.001英寸×0.003英寸不锈钢或铜扁平线圈。导体线圈1006可被构造为单导体、双导体或三导体配置,如下文参考执行电解所讨论。线圈的导体和任何其他导体可为笔直、编织或成线圈的。由导体线圈界定的导体路径可涂布绝缘聚合物(诸如聚对二甲苯),而内腔可内衬有PTFE,包括PTFE复合物,诸如聚酰亚胺/PTFE。
在一些实施方案中,输送装置或导管的内表面和外表面的所有或一部分可进一步涂布有亲水或润滑涂层。在其他实施方案中,可扩张体100、140、150或170A至170H的所有或一部分也可涂布有亲水或润滑涂层。
包括可扩张体和用于可扩张体的输送装置的医疗装置
通过被称作“输送装置”或“输送导管”的医疗装置的长形部分使可扩张体100、140、150或170A至170H在人体内行进并且定位,其中输送导管特别在医疗装置的长形部分是柔性时使用。在一个实施方案中,输送装置是界定至少一个内腔或潜在内腔的长形医疗装置。输送装置具有近端和远端,且被定尺寸来将流体介质从装置的近端处的流体介质源输送至可扩张体100、140、150或170A至170H的中心空隙或空间108中,所述可扩张体100、140、150或170A至170H附接或耦接至输送装置的远端。此外,可将可扩张体100、140、150或170A至170H定位在血管系统中的期望位置(诸如囊状动脉瘤的内腔或目标血管的内腔),促进可扩张体的扩张且接着促进可扩张体从输送装置分离的任何医疗装置或医疗装置的组件可被大致接受为输送装置。通常,输送装置是柔性导管(“输送导管”)。优选地,输送导管可为任何柔性导管、中空丝、可移除核心丝或其组合,其适于接达血管系统的位置,包括图7、图9和图13中所示的输送导管300、352A至352B和400。输送装置也可为任何其他类型的导管、中空丝或可移除核心丝或替代地针或套针、口针或其组合,其适于接达血管系统内或其他生物管道中的位置。在各种实施方案中,输送装置是可将附接的经压缩可扩张体100、140、150或170A至170H携载至囊状动脉瘤的内腔或目标动脉或静脉或其他形式的生物管道的内腔的导管300、352A至352B或400。
导管是被构造用于插入至身体腔室(包括血管)中以允许流体的注入或撤出以及其他功能的柔性、管状、长形医疗装置。导管通常由聚合物或塑料形成,且可选地进一步包括金属,诸如以线圈或编织构造用于加固。导管可被构造来实现附接至可扩张体100、140、150或170A至170H,促进将经压缩可扩张体输送至动脉瘤囊的内腔或目标血管或其他生物管道的内腔,促进经压缩可扩张体的充胀或扩张且从经扩张可扩张体分离。在一些实施方案中,输送导管300、352A至352B或400可被构造来在附接可扩张体100、140、150或170A至170H处于压缩形式的情况下穿过血管系统,如图10B和图17A中所示。在扩张后,可扩张体100、140、150或170A至170H与输送导管300、352A至352B或400分离,由此允许经扩张可扩张体在输送导管从身体移除时保持在适当位置中。以此方式,输送导管类似于血管成形术球囊导管,其被构造来实现附接至传统的硬质管状支架,促进将附接的经压缩传统管状支架输送至血管或其他生物管道的特定段的内腔,实现经压缩传统管状支架的扩张,且从经扩张传统管状支架分离。
输送导管300、352A至352B或400由生物相容材料组成。举例来说且非限制,输送导管300、352A至352B或400和其各种组件可由硅橡胶、天然橡胶、聚氯乙烯、聚氨酯、共聚酯聚合物、热塑性橡胶、硅酮-聚碳酸酯共聚物、聚乙烯乙基醋酸乙烯酯共聚物、编织聚酯纤维或其组合形成。在一个实施方案中,输送导管300、352A至352B或400的壁可用金属(诸如线圈或编织不锈钢或镍钛诺)加固,以在使用期间增强控制且减小输送导管的扭结。适于输送导管加固的金属包括不锈钢和镍钛诺。
如图7、图9、图10B至图10C、图13、图14A至图14B和图23A至图23B中所示,输送导管300、352A至352B或400将具有中空或潜在中空圆柱形构件,所述中空圆柱形构件界定内腔以允许流体介质从输送导管的近端传递至输送导管的远端且进入可扩张体的中心空隙108。输送导管352A至342B或被设计且定尺寸,使得它可插入身体中以将经压缩可扩张体100、140、150或170A至170H输送至期望位置,促进可扩张体的充胀或扩张,且促进经扩张可扩张体从输送导管分离。当使用单内腔输送导管300、352A至352B或400时,经压缩可扩张体可在行进穿过定位为其远端在目标血管内的动脉瘤或目标位置内或附近的单独的较大导管、引导导管或引导鞘管后定位于囊状动脉瘤的内腔或目标血管的内腔中。一旦在动脉瘤囊的内腔或目标血管的内腔且离开引导导管,经压缩可扩张体100、140、150或170A至170H就可扩张,且接着可分离经扩张可扩张体与输送导管300、352A至352B或400,且可在经扩张可扩张体保持在适当位置中的同时,将输送导管和引导导管从身体移除。输送导管300、352A至352B或400的中空或潜在地中空圆柱形构件306具有范围从大约0.05mm至大约0.25mm的壁厚。优选地,中空圆柱形构件306的壁厚范围从大约0.1mm至大约0.2mm。由中空圆柱形构件306界定用于实现流体介质传递至可扩张体108的中心空隙或空间的目的的内腔312具有范围从大约0.4mm至大约1mm的直径。中空圆柱形构件306的近端包括端口或轴套3408以与含有例如水、盐水或射线造影剂溶液的加压流体介质源(诸如注射器314或泵(未示出,例如Karl Storz的))连通。用于使可扩张体扩张的流体介质穿过轴套或端口3408被接收至输送导管300、352A至352B或400中。
包括可扩张体的医疗装置
图31A描绘可用作球状支架导管3400A的可扩张体医疗装置的实施方案。如所示,球状支架导管医疗装置3400A包括构造在远端3404处用于接合球状支架100的输送导管3402。输送导管3402的近端3406接合至轴套3408,所述轴套3408允许穿过导管与球状支架100电连通且流体连通。注射器314或泵(未示出,例如Karl Storz的)可用于将流体介质输送至球状支架100。装置3400A也包括用于建立从手持控制器3418至球状支架100的电连通的电连接器或端口3422,包括通过存在于输送导管的壁中的电解丝或导体。
图31B描绘可用作块状支架医疗装置3400B的可扩张体医疗装置的实施方案。如所示,医疗装置3400B包括构造在远端3404处用于接合可扩张体100的输送导管3402。输送导管3402的近端3406接合至轴套,所述轴套允许穿过导管与可扩张体150电连通且流体连通。注射器314可用于将流体介质输送至可扩张体150。装置3400B也包括用于建立从电源(未示出)至可扩张体150的电连通的电连接器或端口3422,包括通过存在于输送导管的壁中的电解丝或导体。
用于具有单内腔输送导管的医疗装置的轴套3408的横截面图示于图32A中,其中主要脱卸方法是电解。轴套3408包括第一连接端口3410,所述第一连接端口被构造有鲁尔轴套或锥体,所述鲁尔轴套或锥体可促进用于将流体介质源(诸如注射器314(未示出)或泵(例如,Karl Storz的未示出))连接至被构造来将流体介质从输送导管的近端传输至可扩张体100、140、150或170A至170H的中心空隙或空间108的输送导管3402的中空圆柱形构件的内腔312的鲁尔锁紧或鲁尔滑锁型连接。可选地,第一连接接口3410也可接纳导丝或引导构件。轴套3408也构造有第二连接端口3422,所述第二连接端口3422被构造来允许与导管3402电连通。例如,与安装在导管3402和/或球状支架、块状支架或可扩张构件100上的电极电连通的一个或多个电解丝320可延伸穿过轴套3408的通道3416且进入第二连接端口3422。可替代地,一个或多个电阻丝可延伸穿过轴套3408的通道3416且进入第二连接端口3422中。电源或电力源(诸如图31A和图33中所示的手持控制器3418)可与丝320连通以执行各种功能,包括但不限于电解或加热热敏材料,这种连通通过手持控制器的电连接器部分3424与轴套3408的连接端口3422的耦接而发生。
用于具有双内腔输送导管的医疗装置的轴套3408的视图示于图32B中,其中主要脱卸方法是电解。轴套3408包括第一连接端口3410,所述第一连接端口3410被构造有鲁尔轴套或锥体,所述鲁尔轴套或锥体可促进用于将流体介质源(诸如注射器314)连接至被构造来将流体介质从输送导管的近端传输至可扩张体100、140、150或170A至170H的中心空隙或空间108的输送导管3402的中空圆柱形构件的内腔312的鲁尔锁紧或鲁尔滑锁型连接。轴套3408也构造有第二连接端口3422,所述第二连接端口3422被构造来允许与导管3402电连通。例如,与安装在导管3402和/或球状支架、块状支架或可扩张构件100上的电极电连通的一个或多个电解丝320可延伸穿过轴套3408的通道3416且进入第二连接端口3422。可替代地,一个或多个电阻丝可延伸穿过轴套3408的通道3416且进入第二连接端口3422中。电源或电力源(诸如图31A和图33中所示的手持控制器3418)可与丝320连通以执行各种功能,包括但不限于电解或加热热敏材料,这种连通通过手持控制器3418的电连接部分3424与轴套3408的连接端口3422部分的耦接而发生。第三连接端口3410也被构造来接收且接合导丝302或闭塞丝404。
用于具有双内腔输送导管的医疗装置的轴套3408的视图示于图32C中,其中主要脱卸方法是机械的。轴套3408包括第一连接端口3410,所述第一连接端口被构造有鲁尔轴套或锥体,所述鲁尔轴套或锥体可促进用于将流体介质源(诸如注射器314(未示出)或泵(例如,Karl Storz的未示出))连接至被构造来将流体介质从输送导管的近端传输至可扩张体100、140、150或170A至170H的中心空隙或空间108的输送导管3402的中空圆柱形构件的内腔312的鲁尔锁紧或鲁尔滑锁型连接。第二连接端口3410也被构造来接收且接合导丝302或闭塞丝404。
用于具有双内腔输送导管的医疗装置的轴套3408的替代设计示于图32D至32F中,其中主要脱卸方法是机械的。轴套3408是双重锁定型,将Y形输送导管轴套670与Y形脱卸导管轴套650组合,其在输送导管306插入脱卸导管610后经由公鲁尔配件695和母鲁尔配件675锁定在一起。图32D示出处于其组装构造中的轴套3408,而图32E至32F示出其拆卸构造,其中仅脱卸导管轴套650保留。轴套3408也适于与块状支架可扩张体一起使用。根据各种实施方案,轴套3408的组件(包括轴套650和670)可被染色来协助识别并且接达组件。优选地,避免红色以防止与进入轴套3408的血液混淆。
输送导管轴套670附接至输送导管306(即,外轴)和桥接导管160(即,内轴),其中这两个导管轴之间的环状间隙充当充胀内腔。输送导管轴套670的底座具备用于连接脱卸导管轴套650的公鲁尔旋锁695。输送导管轴套670的一个臂含有用于连接用于使可扩张体150(未示出)充胀的流体介质源(诸如注射器314或泵(未示出)(例如,Karl Storz的))的公鲁尔锁紧配件680。这个臂也含有泄压阀685来保护可扩张体150不过度充胀。输送导管轴套670的另一个臂容纳锥形母鲁尔锁紧配件680以充当用于插入导丝302的内腔,包括止血手段。可替代地,这个臂可用于从具有公鲁尔锁紧配件的注射器或其他适当分配工具(未示出)注入X射线造影剂。
脱卸导管轴套650经由溢放口615附接至脱卸导管610。输送导管306与脱卸导管610之间的环状间隙充当用以接收X射线造影剂的内腔。脱卸导管轴套650的一个臂663含有用于连接输送导管轴套670的母鲁尔锁紧配件675。可替代地,这可容纳在可扩张体150脱卸且输送导管轴套670移除后使用的止血阀665。脱卸导管轴套的另一个臂含有附接至用于注入X射线造影剂的管道和管闩660的侧向端口655。
如图32A中所示,在优选实施方案中,第二连接端口3414接合至螺纹螺母3420,使得电端子3422可固定至螺母和轴套3408。电端子3422与一个或多个导电丝电连通,且被构造来接收来自外部电源(诸如手持控制器3418)的电连接器。举例来说且非限制,电连接器3424可为3.5mm音频插孔。也可使用其他电连接器。
如图33中所示,手持控制器3418可通过插孔3424连接至电端子3422以穿过导管3402输送电流用于脱卸可扩张体100、140、150或170A至170H。例如,在一个实施方案中,导管3402包括导电线圈1006,所述导电线圈1006可分别配置于单导体配置1007、双导体配置1008或三导体配置1010中,如图23C和图23E和图23F中所示。如下文所述,各种导体配置1008和1010可提供加固强度和沿着导管3402的长度的导电路径。手持控制器3418提供电流或电压电势至延伸穿过导管3402的电极1014、1016和可选地1026,以通过电解或热脱卸使可扩张体100、140、150或170A至170H脱卸。在一个实施方案中,手持控制器3418包括主体3426、电源(诸如电池)、一个或多个致动按钮3428和一个或多个指示器3430,所述指示器用以指示控制器的状态、可扩张体100、140、150或170A至170H的脱卸和电源(诸如电池)的状态。
图50A至图50F图示辅助线圈输送系统(ACDS)900的一个实施方案。如所示,辅助线圈输送系统(ACDS)包括预装载有辅助线圈162和推丝950的辅助线圈导管902。如所示,辅助线圈导管的近端接收于外海波管(hypotube)906中,其进一步接合至母鲁尔锁紧连接器908。鲁尔锁紧连接908进一步接合至Y接头轴套970,所述Y接头轴套970通过各种端口912至914提供至辅助线圈导管轴910和可扩张体190的接达。如所示,一个端口912被构造来接收推丝950和接收推丝的内海波管916。在一个方面中,内海波管为推丝950提供刚度以在推丝行进穿过轴套970时,使推丝上的切向力矩最小化。
在一个实施方案中,推丝950可配备有手柄918,所述手柄为用户提供使推丝行进的握把。结合也在部署期间充当力矩手柄的y接头轴套970,推动手柄918为用户提供更大控制。当用户施加力在推丝950上以使其行进穿过轴套970时,推丝和内海波管行进穿过轴套970,且行进至辅助线圈导管轴910和外海波管906中。当推丝950行进穿过辅助线圈导管轴910以排出辅助线圈162时,内海波管和外海波管以伸缩方式被匹配在一起以在推丝的行进期间提供刚度。
包括可扩张体的医疗装置的不透射线标记
根据可扩张体100、140、150或170A至170H从输送导管脱卸或分离的任何方法,除鼻锥360或362A至362B外,一个或多个不透射线标记可被并入至可扩张体或输送导管的适当部分中以协助可扩张体的定位、可扩张体的扩张、经扩张可扩张体从输送导管的脱卸或分离和在脱卸或分离后移除输送导管。例如,不透射线标记带或点可被并入至医疗装置中以识别分离被期望或设计发生的位置。此外,不透射线材料可被并入至可扩张体100、140、150或170A至170H中。此外,不透射线点或标记带可被并入至输送导管的远端中,使得在将输送导管拉离经扩张可扩张体100、140、150或170A至170H的同时,输送导管的尖端可在荧光透视下可视化。也可根据需要将不透射线点或标记带放置在脱卸组件上。不透射线记可包括各种不透射线材料,包括但不限于金属带、金属点或线或钡点或线。不透射线材料可包括混合至聚合物挤出或涂层中的不透射线液体或粒子。
在各种实施方案中,囊状动脉瘤700或血管可通过使用不透射线染料而可视化。不透射线染料可在引入可扩张体100、140、150或170A至170H之前注入,并且可用于确认经压缩体或扩张体的适当大小和位置。
图52A至图52B图示可被并入至导丝302、辅助线圈162或推丝950的任意者中的标记丝930。根据一个实施方案,标记丝930包括不透射线材料,诸如铂、铱、钡、金、钽、不锈钢和其合金。在一个实施例中,标记丝930包括铂,且直径是大约0.004英寸至0.005英寸,具有0.075英寸的长度。
标记丝930与导丝302、辅助线圈162或推丝950同轴对准。例如,图52B是如设置在ACDS 900的实施方案内且如沿着截面线C-C观看的具有标记丝930的实施例辅助线圈162的横截面图。标记丝930至少部分通过沿着标记丝和导丝302、辅助线圈162或推丝950的长度施加PTFE鞘管932保持在适当位置中。在一个方面中,PTFE鞘管932是收缩膜,其被加热以收缩且贴合标记丝930和相关联的线圈或丝。
图53A至图53C图示可接合本文中公开的任何丝、导管或部署系统的标记带920。包括但不限于输送导管220或辅助线圈162。根据一个实施方案,标记带920包括不透射线材料,诸如铂、铱、钡、金、钽、不锈钢和其合金。标记带920接合至丝、导管或部署系统的外部分。例如,图53C是如设置在ACDS 900的实施方案内且沿着截面线D-D观看的具有标记带920的实施例辅助线圈162的横截面图。在一个实施例中,标记带920包括铂铱合金,其直径是大约0.006英寸,厚度是0.010英寸且长度是大约0.068英寸。
至少部分通过PTFE收缩卷绕鞘管932将标记带920保持在适当位置中。在另一个实施例中,标记带920可由接收且接合至丝、导管或部署系统的外表面的管状构造界定。
将可扩张体放置为可输送构造
为了促进可扩张体行进穿过血管系统,可将可扩张体100、140、150或170A至170H压缩为各种形状和尺寸。可选地,这种压缩可包括各种形式和样式的折叠或摺叠。例如,可在可扩张体100、140、150或170A至170H中制造一个或多个褶,且接着可将褶卷绕为圆柱形。可替代地,可扩张体100、140、150或170A至170H可被压扁为平坦形状且接着被卷成圆柱形。可替代地,可将可扩张体100、140、150或170A至170H压缩为小型球形。此外,可扩张体100、140、150或170A至170H的部分可在压缩期间扭转。在特定实施方案中,可扩张体可绕输送导管300压缩,如在图14A中。在其他实施例中,可扩张体可绕闭塞器404压缩,如在图10B中。在其他实施方案中,可扩张体可绕导丝压缩,包括其中医疗装置具有带单个内腔的输送导管的实施方案,其中单个内腔用于将流体输送至可扩张体的中心空隙用于充胀或扩张以及用于接纳导丝或引导构件。在其他实施方案中,可扩张体100、140、150或170A至170H可自行压缩,而中心导管、闭塞器或导丝不压缩。
在图32G中所示的另一个实施方案中,输送导管轴3402在其近端处具有与轴套3408连接的溢放口3403。这个溢放口防止输送导管轴3402以及插入其内的导丝导管轴160在其近端处的扭结。这个配置适于结合输送导管的各种实施方案(包括单内腔、双内腔和三内腔设计)和各种脱卸方法(包括机械和电解)使用。
在图19A中,可扩张体100、140、150或170A至170H已绕输送导管300的中空圆柱形构件304摺叠、折叠或卷绕,这种中空圆柱形构件包括类似于桥接导管160的桥接导管。这种实施方案也可包括经折叠和经卷绕可扩张体抵靠输送导管的压缩。在图19B中,可扩张体100、140、150或170A至170H摺叠且卷绕,而不围绕中空圆柱形构件或输送导管卷绕。在另一个实施方案中,可扩张体100、140、150或170A至170H被折叠为褶且接着经折叠可扩张体的褶围绕闭塞器、可移除丝、导丝或引导构件304卷绕,如图19C中所示。这种实施方案也可包括经折叠和经卷绕可扩张体抵靠闭塞器、可移除丝、导丝或引导构件304压缩。在另一个实施方案中,可扩张体100、140、150或170A至170H被折叠为褶且接着经摺叠折叠物被卷成大致圆柱形状,而可移除丝、闭塞器、导丝、引导构件或导管不充当中心固定点,如图19D中所示。
在各种实施方案中,可扩张体100、140、150或170A至170H附接至输送导管300、400,接着形成褶,且接着将经摺叠折叠物卷绕且压缩至输送导管300、闭塞器404或导丝上。在另一个实施方案中,首先将可扩张体100、140、150或170A至170H折叠以形成褶,且接着将其附接至输送导管300、400,且接着将经摺叠折叠物卷绕且压缩至输送导管300、闭塞器404或导丝的外表面上。在另一个实施方案中,可以类似于日本折纸的方式将可扩张体100、140、150或170A至170H折叠并且压缩为多种形状。
可折叠可扩张体100、140、150或170A至170H以形成一个或多个褶,其可被进一步折叠、卷并且压缩,类似于非柔性血管成形术可扩张体的折叠。在各种其他实施方案中,将经摺叠可扩张体折叠并且压缩以配合在柔性导丝的端部上,且在单独导管的中空圆柱形构件内前行。可使用任何适当配置和方法折叠并且压缩可扩张体100、140、150或170A至170H。期望可扩张体100、140、150或170A至170H的表面在输送构造中时是平顺的。在特定实施方案中,期望可扩张体100、140、150或170A至170H的折叠产生均匀折叠。
在各种实施方案中,可扩张体100、140、150或170A至170H可在折叠、卷绕和压缩前填充润滑流体以减小摩擦,减小对身体和周围组织的损害风险以及使经压缩装置的剖面最小化。润滑流体优选地是生物相容且血液相容的。
可扩张体的扩张
可扩张体100、140、150或170A至170H的中心空隙或空间108可填充流体或凝胶或其组合或固体(即,固体、格状物、颗粒或其组合)以使可扩张体100、140、150或170A至170H扩张或充胀。术语扩张、充胀和其形式可互换使用来指将可扩张体从输送或可输送构造改变为扩张或至少部分扩张构造的动作。流体介质是具有容易移动且改变其相对位置而质量不分离的粒子的物质。可用于使可扩张体100、140、150或170A至170H扩张的流体介质包括液体、气体、凝胶和其组合。举例来说且非限制,流体介质可为水、盐水溶液、射线造影剂溶液或其混合物。在一个实施方案中,流体介质可进一步包括药物、药理活性分子或药物制备的溶液或混悬液。
在各种实施方案中,可扩张体100、140、150或170A至170H的形状和构造(包括多层构造)允许可扩张体保持为充胀或扩张构造,而不使用源自患者的任何支撑结构。例如,用于使可扩张体100、140、150或170A至170H充胀的流体介质和可选地来自患者的血液将填充内部空隙108,且导致球状支架、块状支架或可扩张体保持为扩张构造。此外,源自患者的支撑结构(包括但不限于血液凝块和组织长入)可支撑并且保持可扩张体100、140、150或170A至170H在扩张时的结构完整性。
在一个实施方案中,如图17A至图17B中所示,可扩张体100、140、150或170A至170H可用于密封定位于血管1202和1203的相交部附近的囊状动脉瘤700。如所示,可扩张体100、140、150或170A至170H可通过输送导管352A定位并且充胀以在线圈或辅助线圈162的协助下密封囊状动脉瘤700的开口703,所述线圈或辅助线圈通过穿过输送导管352A以及穿过经扩张可扩张体而引入至动脉瘤中。线圈或辅助线圈162接触囊状动脉瘤700的壁(包括与从载瘤血管1202和1203至动脉瘤703的开口相对的壁)以及可扩张体100、140、150或170A至170H的外部,其中线圈162朝向开口703在可扩张体上施加力(如通过705指示)以抵靠开口按压可扩张体。因此,可扩张体100、140、150或170A至170H防止如通过706指示的血流进入动脉瘤。在一个方面中,可扩张体100、140、150或170A至170H可在引入辅助线圈162之前完全扩张。在另一个方面中,辅助线圈162可至少部分在可扩张体100、140、150或170A至170H充胀之前引入。在又另一个方面中,可扩张体100、140、150或170A至170H的扩张以及辅助线圈162的引入可同时或以交替递增方式发生。在特定实施方案中,在可扩张体100、140、150或170A至170H充胀或扩张以及线圈或辅助线圈162插入后,通过电解使可扩张体100、140、150或170A至170H从输送导管352A脱卸,所述电解腐蚀近端颈部250的部分,包括暴露的不锈钢的环形区域。
在一个实施方案中,多个线圈或辅助线圈162可部署在囊状动脉瘤700内。在一个实施方案中,如图17C中所示,一个或多个线圈或辅助线圈162的一部分部署在动脉瘤的内腔、空隙或空腔内,而线圈的另一个部分部署在可扩张体100、140、150或170A至170H的空隙内。例如,在使可扩张体充胀或扩张后,辅助线圈输送导管352B可完全穿过输送导管352A,穿过可扩张体100、140、150或170A至170H插入且插入至囊状动脉瘤700的内腔中,且辅助线圈162可插入囊状动脉瘤700的未填充部分中。线圈输送导管352B接着缩回,使得其远端定位于可扩张体100、140、150或170A至170H内,且辅助线圈162或另一个辅助线圈的其余部分与可扩张体一起部署。辅助线圈162在可扩张体100、140、150或170A至170H内部和外部的部署可用于稳定并且维持可扩张体在囊状动脉瘤700内的位置。
在另一个实施方案中,辅助线圈162可为磁性的,使得可部署多个铁磁辅助线圈以通过线圈的磁性吸引将可扩张体100、140、150或170A至170H稳定在动脉瘤内。例如,如图17D中所示,第一磁性辅助线圈162A可部署在经充胀可扩张体100、140、150、170A至170H内,如前所述。磁性线圈可包括涂布有磁性纳米粒子(MNP)的镍钛诺或不锈钢线圈或磁性线圈可为内嵌有MNP的聚合物线圈。MNP可包括涂布有精氨酸-甘氨酸-天冬酰胺(RGD)肽、纤连蛋白或葡聚糖或其组合的铁、镍或钴。一个或多个其他铁磁辅助线圈162B接着部署在囊状动脉瘤700的颈部或开口703内。铁磁线圈可包括马氏体不锈钢合金,包括410系列、416系列、420系列和440系列不锈钢。在部署可扩张体100、140、150或170A至170H后,辅助线圈162B填充并且闭塞颈部或开口703中的任何剩余空间。在一个方面中,辅助线圈162A至162B被吸引且接触可扩张体100、140、150或170A至170H的外表面。在另一个方面中,辅助线圈162A至162B穿透可扩张体100、140、150或170A至170H的壁被吸引至彼此。磁性线圈和铁磁线圈的设计可针对磁共振(MR)环境中的安全性和兼容性而优化。
多种方法和装置可用于输送辅助线圈162。辅助线圈可为可推进型或可脱卸型。如果辅助线圈162是可推进型,那么在一个实施方案中通过注入流体而将其从辅助线圈输送导管352B排出。如图17O中所示,辅助线圈输送导管352B的一个实施方案具备其远端处的不透射线点或标记355,如所示。这个标记355是为了在线圈部署期间增强导管尖端的荧光透视可见性。标记可包括各种不透射线材料,包括钡或金属,诸如金、铂、铱、钽或不锈钢。标记的几何形状可被构造为带、点或线。在一个方面中,不透射线材料可为在输送导管352B的挤出期间混合至聚合物熔体中的不透射线液体或粒子的形式。
如果辅助线圈162是可脱卸型,那么它被插入于辅助线圈输送导管352B的远端上,且通过电解系统3419(如图17P中所示)或电热系统3421(如图17Q中所示)分离。电热系统3421并入电加热电路550,其熔化辅助线圈输送导管352B的远端与辅助线圈162的近端上的环540之间的热塑性连结530。
在各种其他实施方案中,通过将固体材料或支撑结构放置至中心空隙或空间108中而维持经扩张可扩张体100、140、150或170A至170H的形状。这个固体材料的实施例包括金属或聚合物线圈或丝、金属或聚合物固体支撑结构、可生物吸收材料、径向扩张性材料、珠、粒子、颗粒、球体、微球体或海绵体。在特定实施方案中,这些固体材料也可用于帮助使可扩张体100、140、150或170A至170H扩张。在其他实施方案中,这些固体材料在扩张后添加。在一个实施方案中,如图17E中所示,载瘤血管1202内的囊状动脉瘤700填充有含有至少一个线圈或扩张性丝1204的球状支架100。在一个方面中,可扩张体100、140、150或170A至170H可仅通过线圈或扩张性丝1204扩张。在其他方面中,可扩张体100、140、150或170A至170H可通过流体介质扩张,且随后可添加固体材料来提供支撑以维持可扩张体的经扩张形状,或反之亦然。也可使用其他适当生物相容固体材料。固体填充构件可充当格状物来确保可扩张体100、140、150或170A至170H的结构完整性。例如,线圈1204可促进可扩张体100、140、150或170A至170H的结构完整性并且减小可扩张体的压缩。在一个实施方案中,固体材料可被设计并且制造来匹配特定大小或形状的可扩张体100、140、150或170A至170H,并且可作为医疗装置的部分包装以结合经包装可扩张体一起使用。
使用机械方法将可扩张体从输送装置分离
可通过摩擦配合、通过组件的联合或通过从阀门、夹、环、弹性体套筒或卷绕物或压缩球囊施加压缩力而使可扩张体100、140、150或170A至170H附接或接合输送导管36或1000。各种方法和装置可用于将经扩张可扩张体100、140、150或170A至170H从输送导管306或1000分离。
在将可扩张体150机械附接至输送导管306的各种实施方案中,可使用柔性、薄壁弹性体套筒710,如图21C至图21E中所示。弹性体套筒将近端鼻锥362B连接至输送导管306的远端部分。在其远端处,弹性体套筒在外近端鼻锥585与可扩张体的近端颈部116之间压缩。在其近端处,弹性体套筒用摩擦配合在输送导管上方滑动。在施加轴向张紧力至输送导管的情况下,可扩张体在弹性体套筒自由滑动时从输送导管脱卸。弹性体套筒可接合至近端颈部(在脱卸后与可扩张体保留在一起)或接合至输送导管(在脱卸后与输送导管保留在一起)。
在各种实施方案中,弹性体套筒710具有大约0.005至0.015英寸的壁厚且可包括范围从大约Shore 80A至大约Shore 72D的硬度的聚氨酯。弹性体套筒的内径可针对较高所需脱卸力而减小或针对较低所需脱卸力而扩大。弹性体套筒可包括其外表面上的纵向肋部以增大刚性且防止脱卸期间在轴向方向上的拉伸。
在机械脱卸的情况下,可采用单独的脱卸导管610来在输送导管306或1000缩回时防止可扩张体100、140、150或170A至170H的轴向移动,如图3F、图9B和图21F中所示。脱卸导管610是邻接近端鼻锥362B的刚性中空轴,且被定尺寸来在输送导管306或1000上方滑动,且两个导管之间的环状间隙充当用于注入X射线造影剂的内腔。
在图21G至图21H中所示的各种实施方案中,脱卸导管610针对高侧向柔性(实现穿过迂曲的血管解剖结构定位)和高轴向刚性(实现用于可扩张体150从输送导管306的机械分离的轴向力的传输)而优化。导管的壁厚可从其近端至其远端渐缩。可使用包括挤出聚合物和金属加固的层压设计。外层610A包括聚合物,诸如硬度范围从大约55肖氏硬度D至大约72肖氏硬度D的Pebax以增加轴向刚性,其中优选实施方案使用硬度72肖氏硬度D的Pebax。中层610B包括不锈钢或镍钛诺的平坦编织或圆形线圈丝以增加扭转和弯曲刚性。内层610C包括润滑聚合物(诸如PTFE或聚酰亚胺/PTFE复合物(例如,International Wire Group的PD-SlickTM))以减小脱卸导管与输送导管306之间的摩擦。也可使用定位于内层与中层之间的包括诸如聚酰亚胺的聚合物的第四层610D以进一步增强轴向刚性。在一些实施方案中,脱卸导管610的内表面和外表面的所有或一部分可进一步涂布有亲水或润滑涂层。
在图21I至图21J中所示的另一个实施方案中,脱卸导管610的远端部分可包括具有或不具有不透射线标记带620的喇叭形端部615。喇叭形端部被定尺寸以接触近端轴套362B,而不接触可扩张体150的壁102。不透射线标记带旨在增强脱卸过程期间的荧光透视可见性。
在另一个实施方案中,电热工艺可用于脱卸球状支架、块状支架或可扩张体100或140。如可从图17Q中所示的构造了解,电路550熔化两个部分之间的热塑性连结530。在这个应用中,装置输送导管400将取代辅助线圈输送导管352B,且近端轴套362B将取代辅助线圈162。
通过电解分离可扩张体和输送装置
可使用粘合剂或胶水、通过焊接或钎焊、通过组件的相交部或联合或通过从夹、环、弹性体套筒或卷绕物或压缩球囊施加压缩力而使可扩张体100、140、150或170A至170H附接或接合输送导管36或1000。各种方法和装置可用于将经扩张可扩张体100、140、150或170A至170H从输送导管306或1000分离。
可扩张体100、140、150或170A至170H可通过电解从输送导管306或1000脱卸或分离。当使用电解时,可使用恒定电流、恒定电压或方波电压电势。可扩张体100、140、150或170A至170H从输送导管脱卸可使用具有一个、两个或三个电导体的医疗装置或系统执行,如图23B至图23F中所示。在一个实施方案中,导体配置1010包括被并入至输送导管1000中且由其携载的三个导体。在三导体配置的替代实施方案中,两个导体被并入至输送导管1000中或由其携载,且第三导体被构造来以另一种方式与患者电接触,诸如使用电极贴片或电极针。类似地,一个导体可被并入至输送导管1000中或由其携载,且两个导体被构造来以另一种方式与患者电接触,诸如使用电极贴片或电极针,诸如图23A中所示的贴片3106。在双导体配置1008中,两个导体被并入至输送导管1000中或由其携载。可替代地,一个导体可被并入至输送导管1000中或由其携载,且一个导体被构造来以另一种方式与患者电接触,诸如使用电极贴片3106或电极针,如图23A中所示。如图23F中所示,另一个导体配置1007包括单导体配置,其中单个导体被并入至输送导管1000中或由其携载。
医疗装置或系统可进一步包括终端,诸如导体的远端处的电极,包括作为管状或环形阴极环1028的终端。在其他实施方案中,终端是可扩张体的近端颈部中的暴露不锈钢的环形段,这个段能够充当阳极。
双导体配置可用于执行恒定电流电解,其中一个导体电耦接至阳极,且一个导体电耦接至阴极,如图23G中所示。各种三导体配置可用于执行恒定电压电解或使用方波电压电势的电解,其中一个导体电耦接至阳极,一个导体电耦接至阴极,且第三导体电耦接至参比电极。在这些配置的任意者中,电导体或电极可由任何生物相容导电材料组成,包括铂、不锈钢、金或银和其合金。在一个实施例中,电导体或电极可包括铂-铱合金。
当使用双电导体配置1008来执行恒定电流电解时,存在对阳极或工作电极1014中的电压电势的较小控制。因而,工作电极1014和阳极位点或部分3102处的电压电势增大,直至电势和流动至工作电极或阳极的电流足够导致工作电极或阳极附近的血流中的离子的氧化。例如,电流可分解血流中的H2O分子以形成H+离子和电负性O2分子。在一个实施例中,O2分子可接着接合至金可扩张体100、140、150或170A至170H的工作电极或阳极处的暴露金且溶解暴露的金条状物,由此实现可扩张体和输送导管的脱卸。
在一个实施方案中,可扩张体100、140、150或170A至170H上的聚合物涂层可为电绝缘体或介电材料,所述电绝缘体或介电材料防止或延迟H+离子和O2分子与可扩张体的经涂布部分反应。在另一个实施例中,电解可发生在可扩张体的颈部中的阳极位点3102处的暴露不锈钢的环形条状物中,其中主体包括金,导致暴露不锈钢的溶解,由此实现可扩张体和输送导管的脱卸。在一个实施方案中,可扩张体100、140、150或170A至170H上的聚合物涂层可为电绝缘体或介电材料,所述电绝缘体或介电材料防止或延迟可扩张体的经涂布部分的电解,改进不锈钢阳极位点3102处的电解效率。一个这种聚合物涂层可包括硫醇,其经由强硫-金相互作用接合至金表面,使表面疏水,且易于阻挡电子转移。可替代地,亲水表面可通过将在其端部处具有羧基的硫醇分子改性而实现。这个涂层可通过使金表面浸没在含长(例如,C18)烷基链的烷硫醇溶液中,其形成自组装单层(SAM)而施加。可替代地,周围血清中的含硫醇蛋白质(白蛋白)可在电解期间自发在金表面上形成SAM。
在一个实施方案中,可将生物相容凝胶涂层施加至阳极3102或3302或阳极和阴极1028或3106,如可在图23A、图23G、图30A和图30C至30F中设想。凝胶防止阳极和阴极被蛋白质沉积污染,因此改进电解的效率。可使用含水凝胶,诸如聚乙二醇(PEG)(例如,DowCarbowax 600NF)或明胶(>20%w/v)。
在一个实施方案中,在阳极位点3102或工作电极与阴极或接地电极3106之间提供大约0.01mA至5.0mA的恒定电流,所述阴极或接地电极电接合至充当电解系统和工艺的阴极的患者皮肤上的电极贴片3106或患者体内的针。在另一个实施方案中,阴极或接地电极安装在输送导管300上,如通过图23G上的1028所示,包括导电阴极环或管的形式。双电导体配置的另一个实施方案示于图23H至图23I中。在这个实施方案中,热固性聚合物段1020的近端1018接合至导管1000的远端1022,而热固性聚合物段的远端1024接合至在可扩张体100、140、150或170A至170H的颈部116或3208中形成的金属环3208。阳极位点3102存在于可扩张体100、140、150或170A至170H的颈部116中。如图23H中所示,导体丝1014内嵌于聚合物段1020内且接合至可扩张体100、140、150或170A至170H的颈部116或3208,产生经由工作电极1014至环形阳极位点3102的电连接。在一个实施方案中,导体丝可直接接合至阳极位点3102。在一些实施方案中,导体丝1014可使用银粘合剂或任何其他适当粘合剂接合至可扩张体100、140、150或170A至170H的颈部116或3208。在其他实施方案中,导体丝1014可焊接至可扩张体100、140、150或170A至170H的颈部116或3208,包括通过激光焊接。
如图23H中所示,阴极或接地电极1028安装在输送导管1000上。此外,导体丝1016内嵌于输送导管的壁内且接合至阴极或接地电极1028,产生环形的至阴极或接地电极1028的电连接。在一个实施方案中,导体丝可直接接合至阴极环1028。在一些实施方案中,导体丝1016可使用银粘合剂或任何其他适当粘合剂接合至阴极环1028。在其他实施方案中,导体丝1016可焊接至阴极环1028,包括通过激光焊接。
在另一个实施方案中,三电导体配置可用于提供阳极位点3102的电压电势的更大控制和可选择性。除工作电极1014和接地电极1016外,三电导体配置包括参比电极(未示出)和恒电势仪(未示出),所述恒电势仪用于监测并且控制工作电极1014相对于参比电极的电压电势。在各种实施方案中,参比电极优选地由铂、银或氯化银制成。举例来说且非限制,三电导体配置可用于使用恒定电流、恒定电压或交替方波电势电压使可扩张体100、140、150或170A至170H脱卸。工作电极1014基于经由工作电极1014的阳极位点3102的电压与参比电极的电压之间的比较而调变,所述参比电极在一些实施方案中可支撑在输送导管上并且在其他实施方案中可被构造来以另一种方式与患者电接触,诸如使用电极贴片或电极针。在一个实施方案中,恒电势仪被构造来在工作电极1014处提供相对于参比电极的介于大约+0.5V与+1.5V之间的范围内的电压。
在各种实施方案中,电流通过内嵌于输送导管的壁中的导电丝1016从支撑在输送导管1000上的阴极环1028前行至患者体外的位置。导体丝1016也可同时为输送导管1000的壁提供结构加固。
在另一个实施方案中,可扩张体100、140、150或170A至170H和输送导管300可通过一个或多个未绝缘焊接316、钎焊或粘合剂318结合,如图23A中所示,包括其中结合在近端颈部116与输送导管304或306的远端之间的实施方案。可为依靠导管壁的周围电绝缘材料和/或电导体本身用于电绝缘的专用电绝缘夹套的丝或电缆形式的电导体320沿着输送导管的长度从输送导管300的近端延伸至输送导管的远端。电导体320的近端电耦接至患者体外的电源或电流3100源。电源3100也与患者皮肤上充当电解工艺的阴极的针或电极贴片3106电连通。电导体320的远端耦接至可扩张体100、140、150或170A至170H的近端部分,所述近端部分也耦接至输送导管的远端部分。在这个实施方案中,可扩张体100、140、150或170A至170H的颈部的一部分充当用于电解的阳极位点3102。在这个实施方案中,电解电导体320与未电绝缘且未接合至输送导管(即,阳极位点)的可扩张体的部分3102电连通。在各种实施方案中,电解电导体320可位于输送导管300的壁内(如图23A中所示),沿着输送导管的外表面或在输送导管的内腔内。
在一些实施方案中,如图23A中所示,电导体320被绝缘,其中可扩张体100、140、150或170A至170H的近端阳极部分3102未被绝缘,包括近端颈部的一部分,其类似于如图30A至图30F中所示的脱卸位点3302。在一些实施方案中,电导体320和可扩张体100、140、150或170A至170H和116的其余部分(包括颈部的其余部分)被绝缘;而可扩张体的近端阳极部分3102未被绝缘,在一些实施方案中包括近端颈部的一部分。在一些实施方案中,可扩张体100、140、150或170A至170H的颈部116由可易于经历电解的金属(诸如不锈钢)组成,其中可扩张体的其余部分由不易于经历电解的金属(诸如金或铂)组成。针对这个实施方案,可扩张体100、140、150或170A至170H的金或铂部分可能无需绝缘。在可扩张体100、140、150或170A至170H扩张后将电流或电荷施加至电导体320。以足以溶解可扩张体100、140、150或170A至170H的未绝缘阳极部分3102的至少一部分的量和时间施加电流,实现输送导管从可扩张体分离,其中经扩张可扩张体在输送导管300被移除的同时保持在期望位置的适当位置中。
在另一个实施方案中,在可扩张体100、140、150或170A至170H扩张后将电流施加至电导体320。以足以溶解可扩张体100、140、150或170A至170H与输送导管300之间的焊接或钎焊的至少一部分的量和时间施加电流,实现输送导管从可扩张体分离,其中经扩张可扩张体在输送导管300被移除的同时保持在期望位置的适当位置中。在另一个实施方案中,以足以溶解可扩张体的主体的至少一部分的量和时间施加电流,实现输送导管从可扩张体分离,其中经扩张可扩张体在输送导管300被移除的同时保持在期望位置的适当位置中。在一个实施方案中,电流是直流(DC),而在另一个实施方案中,电流是交流(AC)。
通常,在恒定电流电解期间,作为电解副产物形成的气泡易于在脱卸位点处形成绝缘障壁。气泡障壁结合非离子血液成分(脂肪、蛋白质和氨基酸等)在脱卸位点处的聚集易于增大脱卸位点处的阻抗,且增加脱卸所需的时间,因为电解速率减小。类似地,血液可能开始在脱卸位点3302处结块,进一步阻碍脱卸过程。
电解优选地在可扩张体100、140、150或170A至170H定位时执行,使得图30A至图30F中所示的脱卸位点3302在离子血液成分的恒定流内。例如,当球状支架100被定位来填充动脉瘤时,脱卸位点3302可被定位,使得脱卸位点突起至相邻载瘤血管中或突起于相邻载瘤血管的附近。虽然在相邻载瘤血管中或附近,但脱卸位点3302暴露于离子血液成分的恒定流,其协助电解工艺来脱卸球状支架100。恒定血流也使电解期间在脱卸位点3302处的血液凝固的发生率最小化,由此潜在地缩短分离经扩张可扩张体100、140、150或170A至170H与输送导管所需的时间,且在治疗脑动脉瘤时减小血栓栓塞和中风的风险。
在另一个实施方案中,使用交替方波电势电压执行电压控制的电解。举例来说且非限制,如图23H至图23I中所示,阳极位点3102或工作电极1014处的电势按在介于0.1Hz与10Hz之间的范围内的频率在相对于参比电极的大约+0.5V与+0.8V之间交替。在一个方面中,阳极位点3102或工作电极1014的电压电势变动的速率可被配置来允许形成于阳极或工作电极的表面上和可能形成的蛋白质的任何凝聚的移除。在这个实施方案中,在较低电压的“去钝化”期间移除氧化物,而在较高电压的“钝化或电解”期间移除凝聚的蛋白质。通过电压循环促进氧化物和凝聚的蛋白质的移除。因此,交替方波电势电压的使用或方波电压脉冲的使用可允许较短或更持续的脱卸时间。
在各种实施方案中,用于执行电压控制电解的电压范围可响应于脱卸位点3302(例如,阳极部分3102)和参比电极处的材料的组成而变动。例如,如果脱卸位点3302由金组成,且参比电极1026由铂组成,那么金阳极处的电压可按大约1Hz在相对于参比电极的大约+0.6V与+1.4V之间交替。相反地,由304不锈钢组成的脱卸位点3302处的电压电势可按大约1Hz在相对于铂参比电极的大约+0.1V与+0.4V之间交替。在一个实施方案中,充当阳极位点3102的脱卸位点3302是316L不锈钢。在这个实施方案中,执行电解,使得316L不锈钢阳极处的电势按大约1Hz在相对于铂参比电极的大约+0.7V与+1.2V之间交替。在各种实施方案中,期望交替方波电压电势的较低电压低于水的电解电势。
图51A至图51C描绘辅助线圈输送系统(ACDS)900的另一个实施方案。具体地,辅助线圈输送系统(ACDS)900的这个实施方案包括通过未绝缘不锈钢段922接合至推丝950的辅助线圈162。不锈钢段充当辅助线圈162的电解脱卸的阳极。在部署时,辅助线圈162如前所述行进穿过辅助线圈导管902,且定位在期望位置中。推丝950行进直至阳极段922从辅助线圈导管902排出。辅助线圈162和推丝950上的标记带920分别在放置期间协助使阳极段922可视化。在一个实施方案中,阳极段922使用用于脱卸可扩张体100、140、150或170A至170H的相同电解控制器和电源溶解。在其他实施方案中,单独的控制器和电源可接合至ACDS900以脱卸辅助线圈162。
在优选实施方案中,如图48中所示且参考图23A、图23G至图23I、图30C至图30F和图51A至图51C,相同电源3100可用于独立起始并且控制中空金属可扩张体(即,球状支架)100和线圈可扩张体(即,辅助线圈)162的电解脱卸。每个可扩张体具有其自身的阳极:针对球状支架的镀金不锈钢近端颈部的外表面3302上的激光蚀刻脱卸位点3302,且针对辅助线圈的将其连接至推丝950的未绝缘不锈钢段922。在每个可扩张体的脱卸期间使用相同阴极,即安装在球状支架的输送导管1000的远端上的阴极环1028。这个实施方案免除对如图23A中所示与患者皮肤接触的电极贴片3106或电极针的需要,其是传统电解脱卸栓塞线圈普遍需要的。
在另一个实施方案中,上述电解脱卸系统与被设计来治疗闭塞脑动脉和静脉的大体上圆柱形块状支架可扩张体150一起使用。
使用其他方法将可扩张体从输送装置分离
举例来说且非限制,将经扩张可扩张体从输送装置分离的方法可被广泛地归类为物理或机械、电、热、化学、液压和声波的。
在一个实施方案中,电热工艺可用于脱卸球状支架、块状支架或可扩张体100或140。如可从图17Q中所示的构造了解,电路550熔化两个部分之间的热塑性连结530。
在从输送装置分离后密封可扩张体
在一个实施方案中,经扩张可扩张体100、140、150或170A至170H的开口112和或114在手术结束时被保留敞开,包括近端颈部或远端颈部中的开口。在其他实施方案中,经扩张可扩张体100、140、150或170A至170H的开口112和/或114在手术结束前闭合。举例来说且非限制,可通过用邻近经扩张可扩张体100、140、150或170A至170H的球囊导管1100的球囊部分1102的充胀施加外力而密封开口112,如图17E中所示。可替代地,可通过在经扩张可扩张体与输送导管分离之前围绕可扩张体100、140、150或170A至170H的颈部的外表面适贴柔性材料环而密封。在这种方法中,材料环可包括丝、聚合物线束、细丝、绳、线或圈。
在各种实施方案中,可扩张体100、140、150或170A至170H的一个或两个颈部116和118在充胀后被插塞或以其他方式密封。例如,可通过插入被定尺寸来牢固配合在颈部内的固体结构而插塞颈部116和118。这种材料可为海绵体、线圈或金属盖,其被放置在颈部116和118上方或内部。
可扩张体的收缩和取回
如果可扩张体100、140、150或170A至170H未被适当定大小或定位用于期望治疗,可扩张体可被有意地收缩并且重新收回。在一个实施方案中,在可扩张体100、140、150或170A至170H仍附接至输送导管的情况下,可在输送导管内产生负压以协助可扩张体的收缩。在这个实施方案中,可扩张体100、140、150或170A至170H可能仅因为真空压力而重新收缩。
在其他实施方案中,由于可扩张体的内在稳定几何形状,在部署后需要额外努力来收缩可扩张体100、140、150或170A至170H。此外,可将结构部件并入可扩张体100、140、150或170A至170H中以促进有意收缩。例如,可在电铸工艺期间在可扩张体100、140、150或170A至170H中形成一系列垂直槽以产生促进足够真空压力下的收缩的几何应力集中。在另一个实施方案中,可扩张体100、140、150或170A至170H的外表面涂布有聚合物(包括厚聚合物),且接着聚合物涂层被蚀刻(包括通过激光蚀刻)以沿着可扩张体的外表面110留下一系列“肋部”、通道或槽。槽可围绕可扩张体100、140、150或170A至170H横向或纵向形成。
在其他实施方案中,可使用被设计来收缩可扩张体100、140、150或170A至170H的一个或多个工具。在一个实施例中,可使用具有若干向外偏转或展开“指状物”的长形管状收缩工具。当收缩工具插入患者体内时,指状物向内收缩。当收缩工具被致动时,指状物径向弹出且环绕经扩张可扩张体100、140、150或170A至170H。收缩工具接着缩回,使得指状物接合并且压缩以及排空经扩张可扩张体100、140、150或170A至170H。也可在工艺内施加真空以促进可扩张体100、140、150或170A至170H的收缩。
在一个实施方案中,在可扩张体100、140、150或170A至170H不再附接至输送导管的情况下,专用的取回导管可用于收缩并且收回可扩张体100、140、150或170A至170H。
与包括可扩张体的医疗装置一起使用的引导构件
如图15A至图15F中所示,针对使用双内腔导管的实施方案,输送导管300经由引导构件或导丝302移动以将经压缩球状支架140输送至囊状动脉瘤700的内腔701。引导构件的实施例包括柔性导丝。导丝302可包括柔性线、线圈或细杆的形式的金属。例如,基本的血管造影术导丝由被金属弹簧线圈覆盖的固定固体金属核心组成。在其他情况下,输送导管经由针或套针行进。导丝302占据输送导管中的内腔,其中这个内腔由输送导管的管状部分界定。一旦定位在适当位置中,就可移除导丝302以允许流体介质的注入或撤出。
如图21A至图21B中所示,在另一个实施方案,医疗装置的输送导管可构造有可接纳引导导管800作为引导构件的内腔。使用这种构造,医疗装置可在三重轴向构造中行进,其中医疗装置500经由引导导管800推进,所述引导导管800经由导丝行进。在特定实施方案中,可移除引导导管上的近端轴套以允许医疗装置500的输送导管300的中空圆柱形构件304的内腔接纳引导导管800。在特定实施例中,医疗装置的这个实施方案可导致对经压缩可扩张体被输送至动脉瘤或目标血管内腔的更好控制和经压缩可扩张体100、140、150或170A至170H在行进至期望位置时的更好可追踪性。如所示,在一个方面中,输送导管300的中空圆柱形构件304可为环状形并且完全环绕引导导管800,而在其他方面中,输送导管可接合引导导管的圆周的60%、70%、80%、90%或更多。
包括可扩张体的医疗装置的使用
有利地,如图17F中所示,球状支架100可被输送至囊状动脉瘤700的内腔、空腔或圆顶701,扩张且接着从输送导管300分离,使得输送导管可在经扩张球状支架保持在适当位置以扩张状态填充动脉瘤的内腔的一部分、大体上所有或所有的同时移除。经扩张球状支架100通常将符合其所放置的囊状动脉瘤空腔701的形状。也可用外力使经扩张球状支架100成形,诸如由相邻球囊导管1100的经充胀球囊部分1102施加的实体力,如图17F中所示。在精确放置并且成形的情况下,球状支架100可定位,使得囊状动脉瘤内腔701被完全或大体上填充并且密封,且进一步无球状支架或最小量的球状支架延伸至从其中形成囊状动脉瘤的载瘤血管1202的内腔中。
在治疗各种形状的囊状动脉瘤时,许多经扩张球状支架形状是可接受的,包括圆形、椭圆形和不规则形,只要形状是大致圆形的且经扩张球状支架包括单瓣。无论所形成的形状,在一个实施方案中,当球状支架在动脉瘤700的空腔701中扩张时,球状支架被设计来至少部分符合空腔的形状。
在一个实施方案中,可扩张体可用于治疗位于两个或更多个血管的交叉处的分叉部动脉瘤。如图17G中所示,分叉部动脉瘤600具有形成至血管1202和1203的适当直角的颈部或开口603。在一个方面中,可通过如图8T至图8V中所示的可扩张体170G治疗分叉部动脉瘤600,其中图8V是当沿着第一轴线176(如通过185指示)观看近端区域174G时的可扩张体的视图。可扩张体170G包括:近端区域174G,其具有大致截头圆锥形构造;和远端区域172G,其具有类似于图8A至图8F和图8U中所示的可扩张体170A至170H的远端区域172A至172G的任一个的构造。可扩张体170G也分别包括近端颈部116和远端颈部118。如图17G中所示,可扩张体170G的截头圆锥形构造允许可扩张体在分叉部动脉瘤600的开口603处接触并且密封血管1202和1203的垂直表面。线圈或辅助线圈162在可扩张体170G内部和/或外部的部署可进一步用于稳定并且维持可扩张体170G在分叉部动脉瘤600内的位置。
研究表明在特定临床情况下,完好内皮的存在与血管和动脉瘤的内腔的扩张相关。在这些情境中,内皮细胞感测到血管或动脉瘤的内腔的变化并且刺激生物过程,所述生物过程导致与壁的细胞外和细胞组分变化以及内腔的扩张或扩大相关联的血管段或动脉瘤的壁中的细胞和酶活性的增大。研究也已表明内皮细胞需要其内腔表面上的流动血液来保持健康以及存活。因此,可能减小或消除内衬动脉瘤或血管段的内皮细胞的内腔表面上方的流动血液的医疗装置、系统或方法可由此减小内皮细胞存活率,减小来自内皮细胞和细胞的生物化学信号发射并且减小与血管或动脉瘤扩张或扩大相关联的酶活性,其是预防或治疗动脉瘤的重要目标。有鉴于此,在特定实施方案中,球状支架100被完全扩张来治疗囊状动脉瘤。除经扩张球状支架在动脉瘤囊中的填充和阻塞的物理性质外,这种治疗也减小动脉瘤囊中的内皮存活率。在其他实施方案中,球状支架100无需完全扩张来治疗囊状动脉瘤,而可在部分扩张的同时成功密封动脉瘤或减小内皮细胞存活率。在所有实施方案中,球状支架在从输送导管脱卸后(部分或完全)保持在扩张状态中。扩张状态指的是球状支架100的至少部分膨胀,诸如最大球状支架体积的至少20%、50%、75%或90%且高达100%。在各种方面中,生物空间的大小可通过任何适当方法确定。接着选择可扩张体100、140、150和170A至170H的大小和构造以最佳填充空间或空间的期望部分。
在如下文参考图10B至图10C和图11A至图11F所述的“不经由丝的”球状支架医疗装置500的各种实施方案中,可扩张体100或140用于闭塞囊状动脉瘤,如图11A中所示。最先,放置微导管805和引导导管或引导鞘管800,使得它们的远端尖端位于动脉瘤的开口703内,如图11B中所示。接着穿过引导导管800将其输送导管400上的可扩张体100或140定位在动脉瘤的囊、内腔或空腔701内,如图11C中所示。如图11D中所示,使用注射器(未示出)或泵(未示出)(诸如但不限于Karl Storz的)使可扩张体充胀至扩张状态,由此抵靠动脉瘤的壁704“扣牢”微导管805。在这个实施方案中,可扩张体100或140被定尺寸为具有大于来自载瘤血管1202的动脉瘤的开口703的宽度的经扩张宽度或直径(如横向于从近端鼻锥362B延伸至远端鼻锥362A的轴线测量)。
在充胀或扩张后,可扩张体100或140朝向囊状动脉瘤700的开口703缩回,如在图11E中指示为702。可穿过引导导管或引导鞘管800注入X射线造影剂以允许使用荧光透视评估经扩张可扩张体100或140的位置。接着将线圈或辅助线圈162输送穿过扣牢的微导管805且定位在动脉瘤的囊、内腔或空腔内的圆顶701的区域中,如图11E中所示。辅助线圈162接触动脉瘤的壁的内表面704和可扩张体100或140的外表面,包括可扩张体的远端表面。辅助线圈162抵靠可扩张体100或140施加力以抵靠动脉瘤的开口703推动可扩张体。此时,可再次穿过引导导管800注入X射线造影剂以允许使用荧光透视评估辅助线圈162和经扩张可扩张体100或140的位置。
接着使可扩张体100或140从输送导管400脱卸且移除输送导管、引导导管800和微导管805,如图11F中所示。将球状支架扩张体100或140留在囊状动脉瘤700的内腔701中,其中它密封动脉瘤的口703。同样地,将辅助线圈162留在动脉瘤的内腔中,其中它作用以将球状支架保持在适当位置中。
不经由丝的实施方案可特别适用于治疗既非远端也非迂曲的血管解剖结构中的外周动脉瘤。在非远端或迂曲的血管解剖结构中,使引导导管800的远端尖端可远离,但尽可能靠近囊状动脉瘤700的开口703定位。引导导管800可具备如图11B中所示的预成形远端以促进穿过动脉瘤的口703输送可扩张体100或140。
如可从图11G至图11K中所示的过程了解,不经由丝的块状支架医疗装置500的各种实施方案可用于闭塞图11G中描绘的血管802。
最先,放置引导导管或引导鞘管800,使得它的远端尖端刚好位于如图11H中所示的将闭塞的血管内腔的目标区域的近端。接着使其输送导管400上的经压缩可扩张体100行进穿过引导导管,且进入血管内腔的目标区域中,如11I中所示。此时,可穿过引导导管800注入X射线造影剂以允许使用荧光透视评估经压缩可扩张体100的位置。
一旦已实现并且确认可扩张体100在血管内腔804中的适当定位,就使用注射器314(未示出)或泵(未示出)(诸如但不限于Karl Storz的)使医疗装置500充胀至扩张状态,如图11I至图11J中所示。可扩张体100填充内腔的目标区域并且接触血管的内腔表面806。现在闭塞血管802。此时,可穿过引导导管800的内腔注入X射线造影剂以允许使用荧光透视评估经压缩可扩张体100的最终位置和血管闭塞程度。
接着如图11J至图11K和图21C中所示执行脱卸过程。在引导导管800仍在适当位置中的情况下,缩回输送导管300,而同时抵靠近端鼻锥362B保持引导导管800的远端,其作用以将输送导管300拉出近端鼻锥362B上的弹性体套筒710。最后,缩回引导导管800。将块状支架扩张体100留在血管802的内腔804中,其中它维持永久闭塞。
如图17H至图17J中所述,结合辅助线圈162使用球状支架可扩张体150遵循与用于闭塞“宽颈”囊状动脉瘤700的典型线圈栓塞技术不同的范例。在一个方面中,囊状动脉瘤700的几何形状由颈部宽度(N)、圆顶高度(H)和圆顶直径(D)界定,如图17H中所示。在传统的线圈栓塞治疗中,宽颈动脉瘤被界定为具有小于2的圆顶高度-颈部宽度(H/N)比。如图17I中描绘,当比较未治疗动脉瘤700A与线圈治疗700B后的动脉瘤时,H/N比未显著变化,因为线圈易于在动脉瘤700的顶点708和侧壁704上均匀外推。此外,由于动脉血压已使动脉瘤704的壁移位至其最大扩张水平,使得在动脉瘤壁中存在非常少的弹性来允许进一步扩张。在本文中公开的球状支架可扩张体治疗中,宽颈动脉瘤被界定为具有小于2的圆顶直径-颈部宽度(D/N)比。如图17J中描绘,当比较未治疗动脉瘤700A与球状支架治疗后的动脉瘤700C时,这个比率未显著变化,因为经扩张球状支架仅在动脉瘤704的侧壁上外推且由此作用以将动脉瘤圆顶708的顶点向下拉,即,较高、较窄的动脉瘤变为较短且较宽。球状支架可扩张体使D/N比增大,由此改进其在经治疗宽颈动脉瘤700C内的配合且防止装置穿出动脉瘤颈部703。
在各种实施方案中,辅助线圈162由镍钛诺组成。在一个方面中,辅助线圈162可由具有在大约0.05mm至0.20mm的范围内的直径的丝形成。为了增强其润滑性,镍钛诺丝可进一步涂布有聚合物161,包括但不限于PTFE,如图3B中所示。聚合物涂布的方法包括但不限于浸涂、喷涂或热缩管的应用。
在一个方面中,辅助线圈162的经涂布镍钛诺丝或纤维可包括端盖163,包括如图3A中所示的聚合物端盖以最小化对被线圈横穿的动脉瘤表面或其他血管的伤害可能。涂层和端盖也可在用辅助线圈输送导管352B插入线圈时减小摩擦,如图7中所示。
在各种实施方案中,辅助线圈162可具有在大约0.002英寸与0.012英寸之间的范围内的直径。优选地,辅助线圈162具有介于大约0.004英寸与0.008英寸之间的直径。类似地,辅助线圈162上的聚合物涂层161可具有在介于大约0.001英寸与0.003英寸之间的范围内的厚度。优选地,聚合物涂层具有介于大约0.0015英寸与0.002英寸之间的厚度。线圈输送导管352B可具有在介于大约0.014英寸与0.022英寸之间的范围内的外径,且优选地具有介于大约0.016英寸与0.020英寸之间的外径。类似地,线圈输送导管352B可具有在介于大约0.008英寸与0.016英寸之间的范围内的内径,且优选地具有介于大约0.010英寸与0.014英寸之间的内径。
在各种实施方案中,如图12C至图12E中所示,辅助线圈162可包括用以增强其在荧光透视成像下的可见性的结构和性质。这对于包括由镍钛诺组成的辅助线圈162的实施方案是有利的。在一个方面中,将金或铂镀层施加至辅助线圈162的所有或部分。在第二方面中,将包括金、铂、铱、钽或不锈钢的标记带510施加在辅助线圈162的端部处或其附近,和/或沿着辅助线圈162的长度按间隔施加,如图12D中所示。在第三方面中,将子弹形标记520施加在辅助线圈162的端部处或其附近,如图12E中所示。标记带510或子弹形520可通过粘合剂或聚合物热缩管(诸如PTFE)固定。在另一个方面(未示出)中,辅助线圈由具有在制造期间混合至聚合物中的不透射线材料的聚合物形成。
在一个实施方案中,辅助线圈被输送至动脉瘤中且被允许填充动脉瘤中未被可扩张体占据的空隙。在另一个实施方案中,辅助线圈预形成为具有如图12A中所示的尺寸X1×Y1的球形形状或预形成为具有如图12B中所示的尺寸X1×Y1或X2×Y2的椭圆形形状。举例来说,辅助线圈162可形成为大约8mm直径球或大约8mm×4mm球体。在其他实施例中,辅助线圈可被构造为具有介于大约50mm3与300mm3之间的体积的三维构造。
图49A至图49E图示可扩张体190的实施方案,其中辅助线圈导管902的一个实施方案延伸穿过其中用于部署辅助线圈162。为了说明的目的,可扩张体190被示为处于充胀构造中。但是,辅助线圈导管902可穿过未充胀且可选地经折叠或摺叠可扩张体100行进并且部署开。
在将可扩张体190和辅助线圈导管902输送至期望部署位点后,通过插入至辅助线圈导管的近端中的推丝950将辅助线圈162从辅助线圈导管902排出。推丝950接触辅助线圈162的近端,且将辅助线圈推出辅助线圈导管902,如图49D至图49E中所示。在一个实施方案中,推丝950是涂布有PTFE的不锈钢丝。在其他实施方案中,可使用生物相容金属和涂层的任何适当组合。
根据一个实施方案,如所示,辅助线圈导管902的远端904包括标记带920以协助辅助线圈的放置期间的可视化。在各种方面中,标记带920可由不透射线材料组成,包括但不限于铂、铱、钡、金、钽、不锈钢和其合金。在一个特定实施例中,标记带920是铂-铱合金。标记带920可被并入至辅助线圈导管902的轴中或可接合至辅助线圈导管的远端。
在其他实施方案中,辅助线圈162可包括嵌入的不透射线标记丝930,如参考图52A至图52B所示以及描述。标记可包括各种不透射线材料,包括诸如铂、铱、钡、金、钽、不锈钢和其合金的金属。
包括可扩张体的医疗装置和治疗人类患者体内的囊状动脉瘤的用途
适用于动脉瘤闭塞的球状支架可扩张体的实施方案已被设计来经由0.014和0.018英寸导丝平台部署,如图43A至图43J中所示。每个实施方案的设计特征是类似的,其中几何形状按比例调整以匹配导丝的直径。
球状支架装置的未扩张构造示于图43A至图43D中。远端鼻锥362A在可扩张体150的远端颈部118处附接至可扩张体150。近端鼻锥362B在未扩张可扩张体150的近端颈部116附接至未扩张可扩张体150。在一个实施方案中,电解段260包括充当具有125μm宽和18μm厚的经激光蚀刻脱卸位点3302的阳极的302或304系列不锈钢环250。绝缘涂层264使阴极环262从阳极环250分离。可扩张体150经由硬质伸缩桥接段642安装在输送导管1000上,所述硬质伸缩桥接段包括由聚酰亚胺组成的桥接导管160和由90%铂和10%铱组成的长伸缩管640。双导体配置1008用于将电解段260连接至手持控制器3418(未示出)。输送导管1000包括用不锈钢编织加固的聚酰亚胺的壁1002和PEBA的外覆盖物1004。输送导管1000和桥接导管160的内腔1012(未示出)内衬有PTFE或PTFE复合物,诸如聚酰亚胺/PTFE(例如,International Wire Group的PD-SlickTM),其提供润滑表面以在导丝302上方滑动。
球状支架的扩张构造示于图43E和图43H中。在扩张期间,远端鼻锥362A朝向固定近端鼻锥362B轴向移动,延长桥接导管160和导丝302的经暴露远端部分,如可通过比较图43D至图43E了解。在可扩张体150内,包括桥接导管160和伸缩管640的伸缩桥接段642的总长度减小,如可通过比较图43C和图43F了解。
经扩张球状支架装置的脱卸构造示于图43I至图43J中。在导丝302缩回,辅助线圈162放置和阳极环250通过电解分开后,将输送导管1000连同近端鼻锥362B和桥接导管160一起移除。具有其远端鼻锥362A和伸缩管640的可扩张体150因此保留在适当位置中。
在各种实施方案中,两个内腔或流体路径存在于球状支架可扩张体150和输送导管1000内用于充胀和导丝插入或X射线造影介质的注入,如参考图20C在图43K至图43M中所示。(应注意在图43L至图43M中,未示出导丝。)充胀内腔312由输送导管1000的内壁与桥接导管160的外壁之间的环状间隙界定,终止于近端颈部116内的退出点745。导丝内腔324由桥接导管160的内壁界定,终止于桥接导管160的远端处的退出点755。在无导丝302的情况下,导丝内腔324可用于X射线造影剂注入。
包括可扩张体的医疗装置和治疗人类患者体内的囊状动脉瘤的用途
举例来说且非限制,用于使用包括可扩张体的两个医疗装置(第一医疗装置包括中空金属可扩张体3400A,且第二装置包括辅助线圈可扩张体)来治疗动脉的囊状动脉瘤的典型方法包括:接达人的动脉系统(包括举例来说且非限制使用针),将导丝302传递至动脉中,可选地放置血管鞘管以固定血管接达位点,且接着可选地将引导导管插入动脉系统中。包括经折叠、经卷绕和经压缩球状支架100和输送导管300或400的医疗装置接着插入引导导管中且经由导丝行进直至经折叠、经卷绕和经压缩球状支架定位于动脉瘤700的内腔701中,这种球状支架被构造来仅占据囊状动脉瘤的内腔或空腔的一部分且被构造使得经扩张球状支架的直径大于动脉瘤的颈部的宽度。通过将填充流体的注射器附接至医疗装置的近端轴套并且将流体穿过输送导管的内腔注入,且注入至球状支架的中心空隙或空间108中而使球状支架100扩张。将经扩张球状支架拉回直至它邻近于动脉瘤的颈部接触动脉瘤的壁。可选地,将射线造影剂穿过引导导管注入至载瘤血管1202中以评估球状支架的大小是否适合以及它是否适当地定位在动脉瘤中,以及囊状动脉瘤700的动脉瘤颈部是否被完全闭塞。移除导丝,且将具有预装载辅助线圈的辅助线圈输送导管传递穿过导丝内腔,直至它的尖端已退出包括球状支架的医疗装置的远端,包括退出经扩张球状支架的主体、经扩张球状支架的远端颈部、附贴至经扩张球状支架的远端鼻锥或包括球状支架的医疗装置的导管轴。使用荧光透视来监测辅助线圈输送导管的位置以监测辅助线圈输送导管的远端尖端附近的不透射线标记。接着使用推丝将辅助线圈从线圈输送导管排出,将辅助线圈推至动脉瘤的内腔的未填充部分中,使得辅助线圈接触动脉瘤的与从载瘤血管至动脉瘤内腔中的开口相对的壁接触,且同时与经扩张球状支架的壁的外表面接触。将空的辅助线圈输送导管从患者身体移除。可选地,根据需要放置一个或多个额外辅助线圈。接着将输送导管与经扩张球状支架100分离,且将输送导管从身体移除,而经扩张球状支架和辅助线圈保留在动脉瘤700的内腔701内的适当位置中。可通过所公开的任何脱卸方法完成经扩张球状支架从输送导管300的分离。
可通过任何适当方法监测手术期间和之后的球状支架100和辅助线圈的位置,包括荧光透视、计算机断层扫描、MRI和超声波,包括血管内超声波。可在经扩张球状支架100从输送导管脱卸之前和之后使用血管造影术来评估动脉瘤的闭塞程度。经扩张球状支架100和辅助线圈被留在患者体内且用于减小至动脉瘤中的血流,由此减小动脉瘤出血或扩张的风险,减轻患者经历的当前医疗问题或减小患者在囊状动脉瘤700未被治疗的情况下可能经历的未来医疗问题的风险。
在球状支架100的各种实施方案中,已在囊状动脉瘤的内腔中扩张的球状支架的直径、长度和形状至少部分由球状支架的经形成直径、长度和形状确定。例如,在一些实施方案中,球状支架100被制造为具有3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、12mm或更大的直径,其中特定直径被选择为大于动脉瘤的开口或颈部的直径。在各种实施方案中,依据颈部、主体的直径和特定动脉瘤700的高度,用于治疗动脉瘤的经扩张球状支架的主体的最大直径大于、相同于或小于球状支架的主体的最大长度。经扩张球状支架的最终扩张大小和形状也由囊状动脉瘤的内腔的大小和形状确定以及大致限制。也可通过外力的施加,诸如使邻近经扩张球状支架100的球囊导管的球囊部分充胀而确定经扩张球状支架的最终扩张大小和形状。在方法的特定实施方案中,球囊导管1100的球囊部分1102在载瘤血管1202的内腔中邻近于动脉瘤囊的内腔中的经扩张球状支架100充胀,由此将球状支架100的壁1104朝向动脉瘤推动,如图17E中所示。在其他实施方案中,可在将经扩张球状支架可扩张体从输送导管分离的步骤之前或之后的一个步骤中使球状支架可扩张体成形。在其他实施方案中,球状支架100被制造为非球形定向以匹配特定囊状动脉瘤700的空腔的轮廓。
在多数实施方案中,球状支架100的扩张大小和形状由下列因素确定:1)球状支架100的制成大小和形状;2)球状支架扩张程度;3)被治疗的囊状动脉瘤700的大小和形状;和4)任何所施加外力对扩张后的球状支架的影响。举例来说且非限制,可通过对囊状动脉瘤700进行测量而确定球状支架100的制成大小和形状。可通过使用医疗图像进行测量,包括二维和三维重建和标准距离参考标记。也可使用测量动脉瘤的其他方法。
在另一个实施方案中,可在经扩张球状支架100定位于囊状动脉瘤700内时操控其位置、大小和形状。通过球状支架的扩张程度和外力的施加使球状支架100成形。例如,可通过使邻近经扩张球状支架100的球囊导管的球囊部分充胀或通过穿过或围绕输送导管400或引导导管800插入的工具施加外力。在其他实施方案中,可在将经扩张球状支架从输送导管400分离之前或之后的一个步骤中使球状支架100成形。
在各种实施方案中,球状支架100被设计使得经扩张球状支架100的外表面110或124与囊状动脉瘤700的内表面704的大部分接触,如图11A至图11F和图15A至图15F中所示。在一些实施方案中,球状支架100和140的外表面110或124与囊状动脉瘤700的内表面704的至少10%、20%、30%、50%、75%、90%或更大接触,包括高达100%。在一些实施方案中,经扩张球状支架100和140被设计来完全或接近完全填充囊状动脉瘤700的内腔701,包括高达100%。在其他实施方案中,经扩张球状支架100和140填充囊状动脉瘤700的内腔701的体积的至少10%、20%、30%、50%、75%、90%或更大。
在另一个实施方案中,球状支架可扩张体100、140、150或170A至170H可在急救期间快速部署。具体地,球状支架可扩张体100、140、150或170A至170H可快速部署以治疗破裂脑动脉瘤,以立即减少来自动脉瘤的出血。
在所有实施方案中,经扩张球状支架可扩张体100、140、150或170A至170H可被构造来维持它们的扩张形状。因而,经扩张球状支架可扩张体非设计或非旨在在从输送导管分离之前或之后压扁为圆盘状结构。
包括可扩张体的医疗装置与包括可扩张体的医疗装置和其他医疗装置一起使用
在各种实施方案中,可扩张体100、140、150或170A至170H和辅助线圈162可结合其他基于导管的微创血管内装置使用。组合地,这些装置可能在治疗可能具有挑战性的几何形状和/或可能不适于标准线圈栓塞技术的囊状动脉瘤700时特别有利。
如图17K中所示,球状支架可扩张体150和辅助线圈162可结合框架线圈725使用以治疗囊状动脉瘤700。在所描绘的“框架线圈优先”方法中,(1)框架线圈725首先被部署且沿着动脉瘤壁704形成为大的环,其稳定动脉瘤并且使动脉瘤空腔701保持敞开,(2)随后部署球状支架150,且接着(3)部署辅助线圈162。这种方法的潜在优点可包括:a)减小可扩张体150将迁移出动脉瘤700且迁移至载瘤血管1202或1203中的风险;b)通过减小球状支架150的壁与动脉瘤704的壁之间的血流而增大完全动脉瘤血栓形成的速率;和c)更精确界定动脉瘤空腔701的大小和形状以协助选择具有最佳大小和形状的球状支架扩张体150。
在各种实施方案中,框架线圈725可包括直径介于大约0.004英寸与0.006英寸之间的镍钛诺丝。在各种实施方案中,框架线圈725可包括用以增强其在荧光透视成像下的可见性的部件。在一个方面中,将金或铂镀层施加至框架线圈725的所有或部分。在第二方面中,将包括金、铂、铱、钽或不锈钢的标记带510施加在框架线圈725的端部处,和/或沿着框架线圈725的长度按间隔施加,类似于如图12D中所示的辅助线圈162。在第三方面中,将子弹形标记520施加在框架线圈725的端部处,类似于如图12E中所示的辅助线圈162。标记可通过粘合剂或聚合物热缩管(诸如PTFE)固定。在另一个方面(未示出)中,辅助线圈由具有在制造期间混合至聚合物熔体中的不透射线液体或颗粒的聚合物形成。在各种实施方案中,用于输送框架线圈的导管(未示出)可具有介于大约0.010英寸与0.016英寸之间的直径的框架线圈。
如图17L至图17N中所示,球状支架可扩张体150和辅助线圈162可结合载瘤动脉1202中的血管支架730使用以治疗具有大开口703的囊状动脉瘤700。可使用各种治疗方法。根据图17M中描绘的一个实施方案,首先放置可扩张体150,随后放置血管支架730且接着放置辅助线圈162。根据图17N中描绘的另一个实施方案,首先放置血管支架730,随后放置可扩张体150且接着放置辅助线圈162。血管支架730可为任何适当支架,包括但不限于球囊扩张支架、自扩张支架或导流支架。
包括可扩张体的医疗装置和闭塞人类患者体内的血管段或其他生物管道段的用
途
举例来说且非限制,如可从图13、图14A至图14B和图15A至图15F了解,一种使用包括可扩张体500或3400A的医疗装置来闭塞需要闭塞血管段的患者体内的血管段的方法可包括检查患者和收集诊断医疗图像来识别将治疗的血管段的步骤。可使用任何适当方法接达血管系统,包括使用塞丁格技术接达动脉。接着将导丝302插入至血管系统中。可选地,将血管鞘管插入至血管系统中以固定血管接达位点。可选地,将引导导管800插入至血管系统中且用导丝302行进直至导丝302定位于将治疗的血管段(目标血管段)的内腔中或其附近。接着通过在荧光透视下的射线造影剂溶液的腔内注入而使目标血管段的位置和内腔尺寸可视化。
接着将包括经折叠、经卷绕和经压缩块状支架100和输送导管300或400的医疗装置插入引导导管中且经由导丝行进直至经折叠、经卷绕和经压缩块状支架定位于目标血管段的内腔中,这种块状支架被构造使得经扩张块状支架的直径比将治疗的血管段的直径大大约20%。可选地,在荧光透视下从轴套穿过由脱卸轴约束的内腔将射线造影剂注入至医疗装置的尖端以评估装置位置。通过将填充有流体的注射器附接至医疗装置的近端轴套并且将流体注入穿过输送导管的内腔,且注入至块状支架的中心空隙或空间中而使块状支架扩张。可选地,在荧光透视下从轴套穿过由脱卸轴约束的内腔将射线造影剂注入至医疗装置的尖端以评估装置位置和血管段闭塞。此时可将导丝移除或保留在适当位置中。脱卸轴接着在轴套处从医疗装置的其余部分分离,且向前行进,直至它触碰经扩张块状支架的近端鼻锥。接着在将脱卸轴固定在适当位置的同时,将输送轴/导丝轴组件拉回,导致经扩张块状支架从输送轴/导丝轴组件分离,所述组件接着从患者身体移除。此时可将导丝移除或保留在适当位置中。可选地,在荧光透视下穿过脱卸轴注入射线造影剂以评估经扩张块状支架的位置和目标血管段闭塞程度。如果经扩张块状支架的位置和目标血管段闭塞程度是可接受的,那么在块状支架保留在目标血管段中的适当位置中的同时将导丝从块状支架移除。在一些实施方案中,近端颈部或远端颈部或鼻锥可进一步包括弹性体阀门,所述弹性体阀门可在输送轴/导丝轴组件和导丝移除后闭合以减小穿过经扩张块状支架的中心空隙的血流。在一个实施方案中,将弹性体阀门并入至远端鼻锥中以在经扩张块状支架的近端颈部保持敞开的同时,在脱卸后闭合经扩张块状支架的中心空隙。使用这个实施方案,经扩张块状支架的中心空隙中和经扩张块状支架外的压力相同或类似,且经扩张块状支架被构造来在无硬质或半硬质材料存在于中心空隙中的情况下保持在扩张状态中。
可通过任何适当方法监测手术期间和之后的块状支架的位置,包括荧光透视、计算机断层扫描、MRI和超声波,包括血管内超声波。经扩张块状支架被留在患者体内且用于减小至目标血管段中的血流,由此减小血流,出血风险,或减轻患者经历的其他当前医疗问题或减小患者在血管未被治疗的情况下可能经历的未来医疗问题的风险。
在块状支架100的各种实施方案中,部分通过块状支架的经形成直径、长度和形状确定已在目标血管段的内腔中扩张的块状支架的直径、长度和形状。例如,在一些实施方案中,球状支架100被制造为具有2mm、3mm、4mm、5mm、6mm、7mm、8mm、9mm、10mm、12mm、14mm、16mm、18mm、20mm、22mm、24mm或更大的直径,其中特定直径被选择为比经治疗血管段的直径大大约20%。经扩张块状支架的最终扩张大小和形状也由目标血管段的内腔的大小和形状确定以及大致限制。也可通过外力的施加,诸如使邻近经扩张块状支架的球囊导管的球囊部分充胀而确定经扩张球状支架的最终扩张大小和形状。在方法的特定实施方案中,球囊导管的球囊部分在载瘤血管的内腔中邻近于目标血管段的内腔中的经扩张块状支架充胀,由此推动块状支架的壁1104。在其他实施方案中,可在将经扩张块状支架可扩张体从输送导管分离的步骤之前或之后的一个步骤中使块状支架可扩张体成形。
在多数实施方案中,块状支架的扩张大小和形状由下列因素确定:1)块状支架的制成大小和形状;2)块状支架扩张程度;3)被治疗的目标血管段的大小和形状;和4)任何所施加外力对扩张后的块状支架的影响。举例来说且非限制,可通过对目标血管段进行测量而确定块状支架100的制成大小和形状。可通过使用医疗图像进行测量,包括二维和三维重建和标准距离参考标记。也可使用测量目标血管段的其他方法。
在各种实施方案中,块状支架被设计使得经扩张块状支架的外表面与目标血管段的内表面的大部分接触。在一些实施方案中,块状支架的外部与目标血管段的内表面704的至少10%、20%、30%、50%、75%、90%或更大接触,包括高达100%。经扩张块状支架被设计来完全或接近完全填充目标血管段的内腔,包括高达100%。
举例来说且非限制,可通过对将填充的内腔、空隙或空腔进行测量而确定块状支架可扩张体的制成大小和形状。可通过使用医疗图像进行测量,包括二维和三维重建和标准距离参考标记。也可使用测量内腔、空隙或空腔的其他方法。
在另一个实施方案中,块状支架可扩张体100、140、150或170A至170H可在急救期间快速部署。具体地,块状支架可扩张体100、140、150或170A至170H可快速部署以治疗破裂或出血血管段,以立即减少来自动脉瘤的出血,包括其中经扩张块状支架覆盖破裂或出血区域的实施方案。
在所有实施方案中,经扩张块状支架可扩张体被构造来维持它们的扩张形状。因而,经扩张块状支架可扩张体非设计或非旨在在从输送导管分离之前或之后压扁为圆盘状结构。
包括可扩张体的医疗装置和治疗人类患者体内的外周动脉的用途
适于通用于动脉或静脉闭塞的块状支架可扩张体的实施方案已被设计用于经由0.014或0.018英寸导丝部署,如图3F、图3H、图9C至图9D和图44A至图44E中所示。
块状支架装置的未扩张构造示于图3F和图44A中。远端鼻锥362A在可扩张体150的远端颈部118处附接至可扩张体150。近端鼻锥362B在可扩张体150的近端颈部116处附接至可扩张体150。如图9C至图9D中所示,远端阀门560A被并入至远端鼻锥362A中,其中在阀门组件中具有中心刺孔。近端弹性体套筒接合至输送导管组件的远端,且在可扩张体的近端颈部上方伸展以形成摩擦配合。
块状支架可扩张体150安装在输送导管组件306上,其中块状支架可扩张体的近端颈部接合输送导管(其由用不锈钢编织加固的挤出聚酰亚胺组成)组件的输送轴部分的远端接合且接合至可扩张体的远端颈部的伸缩桥接段(由90%铂和10%铱组成)接合导丝轴(由用不锈钢编织加固的挤出聚酰亚胺组成)的远端。输送导管组件的导丝轴组件的内腔内衬有PTFE或PTFE复合物(诸如聚酰亚胺/PTFE(例如,International Wire Group的PD-SlickTM)),其提供润滑表面以供导丝302在上方滑动。在输送导管组件306上方放置在其远端处具备不透射线标记带620的外导管轴610。
作为提供额外说明的手段,块状支架医疗装置包括输送导管组件,所述输送导管组件包括两个中空圆柱形体或内腔,第一内腔用于传递0.014英寸或0.018英寸导丝(由导丝轴的内表面界定),且第二内腔用于将流体从近端轴套注入至块状支架的中心空隙中以导致充胀或扩张(由输送轴的内表面和导丝轴的外表面界定)。块状支架医疗装置进一步包括具有单独轴套的外部轴,所述单独轴套被构造来与输送导管组件的轴套锁定在一起。这个外部轴界定外部轴的内表面与输送导管组件的外表面之间的内腔。外部轴的轴套包括阀门和侧臂,其实现将X射线造影剂注入至这个内腔中,所述X射线造影剂在医疗装置的尖端附近退出。
块状支架装置的扩张构造示于图44B至图44C中。在扩张期间,远端鼻锥362A朝向固定近端鼻锥362B轴向移动,延长导丝轴160的经暴露远端部分,如可通过比较图44A至图44B了解。在可扩张体150内,伸缩桥接段642(包括导丝轴160的远端的桥接部分和接合至块状支架的远端颈部的伸缩段640)的总长度减小,如可通过比较图3F和图44C了解。
对于块状支架放置,在引导鞘管或引导导管的放置以及0.018英寸导丝在胸内动脉中放置之后,经压缩块状支架经由导丝行进,使用外部轴(和轴套)的组件、输送轴/导丝组件(具有轴套)定位在胸内动脉中,其中两个轴套被锁定在一起。经压缩块状支架接着充胀或扩张。通过穿过引导鞘管或引导导管注入X射线造影剂来执行血管造影术以评估动脉闭塞程度。两个轴套接着被解除锁定,且外部轴的尖端向前行进,直至它触碰经扩张块状支架的近端鼻锥。接着将输送导管组件拉回,通过使经扩张块状支架的近端颈部从输送导管组件的远端上的弹性套筒脱离而导致经扩张球状支架从输送导管组件机械脱卸。通过穿过现在充当引导导管的外部轴注入而用血管造影术评估经扩张、经脱卸块状支架的位置和目标血管的闭塞。接着,移除导丝且重复胸内动脉的血管造影术。
在手术结束时,块状支架的远端鼻锥中的阀门已密封供血液前行穿过经扩张块状支架的中心空隙的路径。近端鼻锥无阀门且因此对血流敞开。鉴于这个构造,在手术结束时块状支架的中心空隙内的压力相同于、类似于或低于块状支架外的压力且不高于它。不将硬质或半硬质材料放置在块状支架的中心空隙中。
参考图44D和图9A至图9B描述脱卸过程。在导丝可选地302仍处于适当位置中的情况下,缩回输送导管306,将桥接导管160拉出远端阀门560A且将输送导管306拉出近端阀门560B,同时抵靠近端鼻锥362B保持脱卸导管610的远端。脱卸导管610的远端处的不透射线标记带620增强脱卸过程期间的荧光透视可见性。最后,缩回导丝302。
基于上文提供的扩张和脱卸过程的描述,可了解阀门560A至560B和脱卸导管610充当一个单元。因此,阀门560A至560B必须足够强硬以在充胀期间将可扩张体150保持在输送导管306上,且脱卸导管610必须足够强硬以在输送导管306从阀门560A至560B缩回期间将可扩张体150保持在适当位置中。
经扩张块状支架装置的完全脱卸构造示于图3H、图9C至图9D和图44E中。具有其远端鼻锥362A、伸缩管640和近端鼻锥362B的可扩张体150因此保留在适当位置中。远端阀门560A和近端阀门560B关闭以阻止穿过可扩张体150的血流。
在上述机械脱卸系统的另一个实施方案中,用弹性体套筒710替换近端阀门560B,如图21C至图21F中所示。在优选实施方案中,用于使弹性体套筒从近端鼻锥362B以及使桥接导管160从远端阀门560A脱卸的力的范围是大约0.3lb至大约1.3lb。
在各种实施方案中,三个内腔或流体路径存在于球状支架可扩张体150、输送导管306和脱卸导管610中用于导丝插入、充胀和X射线造介质的注入,如参考图20D在图44F至图44H中所示。(应注意在图44G至图44H中,未示出导丝。此外,桥接导管160和输送导管306在近端方向上缩回以实现阀门560A和560B的闭合。)充胀内腔312由输送导管306的内壁与桥接导管160的外壁之间的环状间隙界定,终止于近端颈部116内的退出点745。导丝内腔324由桥接导管160的内壁界定,终止于桥接导管160的远端处的退出点755。X射线造影剂内腔760由脱卸导管610的内壁与输送导管306的外壁之间的环状间隙界定,终止于脱卸导管610的远端处的退出点765。
在另一个实施方案中,上述机械脱卸系统与被设计来治疗外周动脉中的囊状动脉瘤的大体上球形球状支架可扩张体150一起使用。
含有包括可扩张体的医疗装置的医疗包
在各种实施方案中,提供医疗包以用医疗装置治疗患者。医疗包可包括医疗装置500、导丝302、一个或多个引导导管800、一个或多个可扩张体支撑结构、一个或多个辅助线圈和用于将经扩张可扩张体100、140、150或170A至170H从输送导管300或400分离的方法的说明。在各种实施方案中,医疗包可包含包括辅助线圈或用于辅助线圈的输送导管的医疗装置和用于分离的单独医疗装置,诸如用于执行电解或加热结合可扩张体100、140、150或170A至170H和输送装置的热敏接合结构的电源和控制器。此外,医疗包可包括用于收回并且移除不当定位的经脱卸可扩张体100、140、150或170A至170H的取回导管。医疗包可进一步包括使用说明书。使用说明书可以标签形式提供在医疗包的包装上。使用说明书可以与医疗包分开或包含于医疗装置的包装内的任何有形媒介提供(例如,纸、CD或DVD)。使用说明书可经由电子数据馈送或经由发布在互联网上的说明而提供。
医疗装置3400A可用作各种系统、方法和医疗包的部分。这些系统、方法和医疗包可用于治疗囊状动脉瘤,诸如囊状脑动脉瘤。可替代地,这些系统、方法和医疗包可用于治疗多种医学病症。在一个实施方案中,系统、方法和医疗包可用于闭塞需要闭塞生物管道的患者体内的生物管道,生物管道包括动脉、静脉、血管结构、管、呼吸道、胆管、胰管、肠外瘘、输尿管、输卵管和尿道和其他。医疗包包括医疗装置和使用说明书。医疗包也可包含用于使用医疗装置500执行多种治疗的额外组件。
制造包含包括被构造来通过电解脱卸的中空金属可扩张体的医疗装置的医疗包
图34至图36是制造可扩张体100、140、150或170A至170H、输送导管1000和医疗包的方法的流程图。在一个实施方案中,用于制造可扩张体100、140、150或170A至170H的方法4000包括在步骤4002处在心轴上形成可扩张体。在步骤4006处,暴露脱卸位点和导电丝接合至可扩张体100、140、150或170A至170H的位点。可扩张体100、140、150或170A至170H接着在步骤4008至4012处被退火、折叠、卷绕并且再次退火。
提供制造或另外准备现有输送导管的方法4100。在步骤4102处,获得具有导电丝的加固导管3402,且在步骤4104处将外涂层从导管移除以暴露导电丝的一部分。在步骤4106处,展开暴露的导电丝的一部分,在步骤4108处将阴极环1028接合至导管1000和其导电丝,且接着在步骤4110处用绝缘材料覆盖暴露的导电丝。在步骤4112和4114处遮罩导管3402上的接合位点,且用亲水或润滑涂层涂布导管。导管3402的近端被构造来接合至流体源,包括举例而言且非限制,接合至具有鲁尔配件的注射器。导管3402的近端的一部分也被构造来接合至导电丝和电流源,包括举例而言且非限制电插孔或端口。导管3402的近端的一部分也被构造用于传递导丝。被构造来接合至流体源、电流源和被构造来接纳导丝的导管的近端的部分可包括接合至导管的轴套。
在步骤4118和4120处,电导体1014和1016分别接合至阳极和阴极,且接着电导体从输送导管延伸且覆盖在绝缘夹套中。在步骤4122和4124处,延伸电导体焊接至电插头,诸如电端子3422,且焊接结合部被绝缘。
如图36中所示,用以组装医疗装置3400A和医疗包的方法4200包括在步骤4202处将可扩张体100、140、150或170A至170H接合至导管3402。在步骤4204处,将电导体1014接合至可扩张体100、140、150或170A至170H以形成阳极,且在步骤4206处进一步将暴露的导电表面绝缘。一旦组装,装置3400A就在步骤4208处测试并且在步骤4210处包装在医疗包中。
实施例
在非临床模型中将包括可扩张体的医疗装置用于治疗囊状动脉瘤的示例性方法
使用大、端部、颈动脉、静脉囊状动脉瘤的犬类模型,在使用球状支架的治疗(n=2)与使用标准线圈的治疗(n=1)之间进行比较。
方法
实验模型使用重约16kg的犬科杂交猎狗。在每只狗体内,在根据图37A至图37D中的新建颈动脉端部分叉上手术构造单个囊状动脉瘤,图37A至图37D图示颈动脉的横断(图37A)、端部分叉的构造(图37B)、囊状动脉瘤的添加(图37C)和从离体颈静脉的移植段中塑造的动脉瘤的最终构造(图37D)。在动脉瘤形成后执行血管造影术以验证动脉瘤的完整性。
在动脉瘤形成大约3周后,经由血管的手术切开将合适大小的鞘管放置在股动脉中。施用肝素以实现大于等于300秒的目标活化凝血时间(ACT)。在荧光透视引导下,使引导鞘管(6Fr×90cm长)行进至动脉瘤尾部的近端右颈总动脉中。接着执行血管造影术以使动脉瘤和载瘤血管的内腔可视化。接着将0.018英寸导丝放置至动脉瘤的内腔中,且使引导鞘管朝向动脉瘤行进。
对于球状支架测试组,在治疗时,第一个动物体内的动脉瘤测量值为大约12mm×9mm×6mm(图38),而第二个动物体内的动脉瘤测量值为大约15mm×9mm×10mm。每只狗体内的动脉瘤用一种系统治疗,所述系统包括:第一医疗装置,其进一步包括球状支架可扩张体;和一个或多个第二医疗装置,其包括预装载至辅助线圈输送导管中的辅助线圈。扩张形式的球状支架是具有稍微压扁的远端表面的大致球形。球状支架的主体和远端颈部包括金,而近端颈部包括具有金涂层或镀层的不锈钢。球状支架的主体在第一轴线上的直径(直径)测量值为8mm,且在第二轴线上的直径(长度)测量值为大约6mm,且由厚度测量值为20μm的单个金层形成。聚合物鼻锥附接至球状支架的远端颈部且也附接至输送导管的远端。输送导管具有3.5Fr的外径,且包括两个中空圆柱形体或内腔,一个在另一个内,第一内腔(内)由导丝轴的内表面界定且被构造用于传递0.014或0.018英寸导丝或辅助线圈或辅助线圈导管,且第二内腔(外)由输送轴的内表面和导丝轴的外表面界定,且被构造用于将流体从输送导管的近端轴套注入至球状支架的中心空隙以使球状支架从经折叠、经卷绕、经压缩和经拉长输送构造充胀或扩张。第一内腔的远端部分由伸缩桥接段界定。伸缩桥接段的近端部分由导丝轴的柔性远端形成且由聚酰亚胺组成。伸缩桥接段的远端部分由铂铱的硬质管形成,其接合至球状支架的远端颈部。桥接段的近端聚酰亚胺部分在铂-铱管的远端部分内伸缩。输送导管的壁由PEBA外层和用不锈钢编织加固的聚酰亚胺内层形成,具有内腔的聚酰亚胺/PTFE复合物(例如,InternationalWire Group的PD-SlickTM)内衬。两根经绝缘导电丝也内嵌在输送导管的壁中。一根导电丝电连接至球状支架的近端颈部的不锈钢部分,且因此电连接至近端颈部的环形区域,其中这个区域的外表面由304系列的暴露、未绝缘不锈钢组成,进一步其中暴露区域通过激光蚀刻形成以形成阳极。第二导电丝电连接至包括90%铂和10%铱的未绝缘环形电极,其安装在输送导管上以形成阴极。两个导电丝连接至被并入至输送导管的近端轴套中的电插孔。球状支架的近端颈部耦接至输送导管且通过粘合剂保持,折叠成褶,且将褶围绕输送导管的远端和桥接段卷绕,且接着将其压缩至桥接段上。
经压缩球状支架/输送导管组件经由定位于动脉瘤囊中的0.018英寸导丝行进,且接着使用充胀装置以在压力下从输送导管的轴套,穿过输送轴内腔注入盐水且注入至球状支架的中心空隙而充胀或扩张,同时测量充胀压力。接着将经扩张球状支架拉回以闭塞从载瘤血管至动脉瘤囊的内腔中的开口,包括颈部。接着移除导丝,且使预装载包括镍钛诺的8mm直径辅助线圈的辅助线圈导管行进穿过导丝内腔,直至辅助线圈导管的尖端已被传递穿过经扩张球状支架,穿过桥接段且经过远端颈部且在经扩张球状支架与动脉瘤的大致与从载瘤血管至动脉瘤内腔中的开口相对的壁的内衬之间的动脉瘤的未填充部分的内腔中。接着使用镍钛诺丝作为推进装置将辅助线圈从辅助线圈导管排出。在放置后,辅助线圈与经扩张球状支架的外表面和动脉瘤的大致与从载瘤血管至动脉瘤内腔中的开口相对的壁的内衬接触,且朝向从载瘤血管至动脉瘤内腔中的开口在经扩张球状支架上施加力。在第一个动物体内,放置一个辅助线圈。在第二个动物体内,放置三个辅助线圈。为了帮助诱发血栓形成,将少量凝血酶穿过空的线圈输送导管注入,且注入至经扩张球状支架与动脉瘤的大致与从载瘤血管至动脉瘤内腔中的开口相对的壁的内衬之间的动脉瘤内腔的未填充部分中。在此之后,移除辅助线圈输送导管,且通过穿过引导导管注入X射线造影剂来执行血管造影术以评估动脉瘤闭塞程度。通过用使用恒电流系统(VersSTAT3-200,AMETEK,Inc.,OakRidge,TN)提供至被并入至输送导管的轴套上的端口中的电插孔的2mA的DC电流的电解使球状支架脱卸。在通过穿过引导导管注入X射线造影剂使经扩张球状支架和输送导管脱卸后执行血管造影术以评估动脉瘤闭塞程度。接着移除引导导管和鞘管且使动物恢复意识。
在医疗装置的植入部分中不存在阀门。在手术结束时,球状支架的近端颈部和远端颈部向血流敞开。鉴于这个构造,在手术结束时球状支架的中心空隙内的压力相同于、类似于或低于球状支架外的压力且不高于它。不将硬质或半硬质材料放置在球状支架的中心空隙中。
对于线圈测试组,使用标准微导管和导丝以及标准线圈栓塞技术使动脉瘤的内腔部分填充足以减小至动脉瘤囊中的血流的各种大小的多个线圈(爱尔兰都柏林的CovidienPLC的AxiumTM)。通过穿过引导导管注入X射线造影剂而用血管造影术(包括最终血管造影照片)评估线圈的位置和实验动脉瘤的闭塞程度。对于两个测试组,在每次装置部署后立即执行血管造影术。测量手术结束时的治疗时间、装置数量和成本以及闭塞程度。接着移除引导导管和鞘管且使动物恢复意识。
在4周后,经由对血管进行手术切开将合适大小的鞘管放置在股动脉中。施用肝素以实现大于等于300秒的目标ACT。在荧光透视引导下,使导管行进至动脉瘤尾部的近端右颈总动脉中。接着执行血管造影术以使动脉瘤可视化。接着用过量的戊巴比妥使动物安乐死,且收集组织样本用于组织病理检查,包括动脉瘤和载瘤血管的相邻部分。
结果
对于球状支架测试组中的第一个动物,以$11,750的估计成本在39分钟的治疗周期内放置一个球状支架和一个辅助线圈。通过血管造影术估计使用这种球状支架治疗的急性阻塞程度为100%(图39A)。在治疗四周后,球状支架展现动脉瘤(图39B)的持续闭塞,其具有覆盖在病理组织检查(图40A)上所见的整个动脉瘤颈部的有序、成熟和完全内皮化的新生内膜。
对于线圈测试组中的动物,以$29,750的标价成本在56分钟的治疗周期内放置17个线圈。通过血管造影术估计在线圈治疗结束时的急性闭塞程度为85%至99%。在治疗四周后,血管造影术再次指示动脉瘤的85%至99%的闭塞(图40B),而病理组织检查展现50%颈部闭塞和至动脉瘤的主体中的明显重通通道(图40C)。
对于两种治疗,载瘤动脉保持未闭。当与球状支架比较时,用线圈治疗花费时间长几乎50%,成本高近三倍,且无法完全闭塞动脉瘤(急性或在4周后)。在由FDA普遍接受用于测试脑动脉瘤闭塞用装置的动物模型中这些极其鼓舞人心的试用结果表明,球状支架可提供更快、更容易且更节约成本的治疗,其中闭塞速率优于线圈。
用包括可扩张体的医疗装置治疗患脑动脉瘤的患者的示例性方法
将医疗装置500或3400A用于治疗患囊状脑动脉瘤的患者的假想方法可以一次或更多次术前咨询开始,其中可执行若干测试。测试可包括血液测试、尿液测试、心电图和成像测试,包括头部CT、头部MRI和脑血管造影照片,以及其他。可从诊断成像测试获得动脉瘤的图像和测量,展现动脉瘤的位置、大小和形状。咨询可在执行手术前数天或当天进行。
在手术当日,患者准备进行手术并且通常被给予局部麻醉。患者的腹股沟接着被预备且以无菌方式覆盖。接着医师可选地用微穿刺装置接达患者体内的股动脉。以逆向方式将软尖端导丝302插入至股动脉中。可选地,放置血管鞘管。诊断导管经由导丝行进,直至诊断导管的尖端在囊状脑动脉瘤的内腔中或其附近,且执行诊断血管造影。将导丝的尖端放置在动脉瘤中或附近,同时移除诊断导管。当医师在定位导丝时,手术助理准备医疗装置。医疗装置500或3400A经由导丝行进,且定位在动脉瘤700的内腔701中。在经压缩球状支架100在期望位置中后,通过穿过输送导管300或400的内腔312注入水或盐水溶液且注射至球状支架的中心空隙108中直至球状支架扩张以填充动脉瘤的至少一部分而使经压缩球状支架扩张。医师通过注入射线造影材料而获得囊状动脉瘤700和载瘤血管1202的血管造影照片以确认经扩张球状支架100适当定位于囊状动脉瘤700的内腔701内,且充分填充动脉瘤的一部分。移除导丝,且将具有预装载辅助线圈的线圈输送导管传递穿过导丝,直至它的尖端已退出医疗装置的远端,包括从可扩张体、可扩张体的颈部或附贴至可扩张体的鼻锥退出。接着将辅助线圈从线圈输送导管排出,且进入动脉瘤的内腔的未填充部分中,使得辅助线圈接触动脉瘤的与从载瘤血管至动脉瘤内腔的开口相对的壁接触,且同时与经扩张可扩张体的壁的外表面接触。可选地,可根据需要放置一个或多个额外辅助线圈。
操作者接着将电解丝320或经绝缘导体丝电耦接至DC电源,且以足以导致未涂布的球状支架的颈部或近端主体208的一部分的溶解,且在未绝缘的情况下导致经扩张球状支架和输送导管的分离的量和时间将电流施加至电耦接至球状支架100的颈部116的电解丝或经绝缘导体丝。例如,操作者施加1mA或2mA的DC电流达1分钟、2分钟、3分钟、4分钟、5分钟或6分钟。医师可选地通过穿过引导导管注入射线造影剂而获得囊状动脉瘤700和载瘤血管1202的另一幅血管造影照片以确认经扩张、经释放球状支架100适当定位于囊状动脉瘤的内腔内,且充分填充动脉瘤的一部分。医师移除输送导管400。可选地,医师使球囊导管1100经由导丝302行进,直至球囊1102邻近经扩张球状支架100。接着用盐水溶液使球囊导管1100的球囊部分1102充胀,直至它填充载瘤动脉1202的内腔并将经扩张球状支架100的壁1104朝向囊状动脉瘤700压扁且推动。医师获得囊状动脉瘤700和载瘤血管1202的另一幅血管造影照片以确认经扩张、经释放球状支架100适当定位于囊状动脉瘤的内腔内,充分填充动脉瘤,且载瘤动脉1202的内腔无阻碍。医师取回球囊导管1100、导丝302和鞘管,且用压缩实现股动脉穿刺的止血。接着将患者运送至观察病房。在恢复期间以及之后,医师定期监测患者以及球状支架100和辅助线圈的定位和囊状动脉瘤700的密封的完全性。
在非临床腋动脉模型中将包括可扩张体的医疗装置用于治疗外周动脉的示例性 方法
方法
实验模型使用各重约20kg的犬科杂交猎狗。研究涉及使用一种医疗装置,其包括中空金金属“块状支架”可扩张体和用以将6mm直径块状支架可扩张体放置在一侧的腋动脉中的输送装置,同时使用引导导管将6mm AVP2放置在对侧腋动脉中。经由血管的手术切开将合适大小的鞘管放置在股动脉中。施用肝素以实现250秒至300秒的目标活化凝血时间(ACT)。在荧光透视引导下,使0.018英寸导丝行进超出腋动脉中的预期闭塞位点。经由导丝使引导鞘管(6Fr×90cm长)或引导导管行进至腋动脉中。接着执行血管造影术以使腋动脉和其侧分支可视化。
块状支架医疗装置包括块状支架形式的可扩张体。经扩张形式的块状支架是圆柱形的,具有圆形端部。块状支架具有近端颈部和远端颈部并且包括金。块状支架的主体在直径上测量值为6mm且在长度上测量值为11.5mm(经折叠、经卷绕和经压缩),且在长度上测量值为10mm(经扩张)且由在厚度上测量值为20μm的单个金层形成。无阀门的聚合物鼻锥附接至远端颈部。块状支架医疗装置进一步包括具有3.25Fr的外径的输送导管,所述输送导管包括两个中空圆柱形体或内腔,第一内腔用于传递0.014英寸或0.018英寸导丝(由导丝轴的内表面界定),且第二内腔用于将流体从近端轴套注入至块状支架的中心空隙中以导致充胀或扩张(由输送轴的内表面和导丝轴的外表面界定)。
块状支架的近端颈部耦接至输送导管,折叠成褶,围绕输送导管的远端和闭塞丝卷绕,且被压缩。通过弹性体外套筒将块状支架的近端颈部保持至输送导管的远端,其中套筒的近端部分接合至输送轴,且套筒的远端部分在块状支架的近端颈部上方拉伸,且握持块状支架的颈部以形成摩擦配合。
在引导鞘管或引导导管放置在近端腋动脉中后以及在0.018英寸导丝的放置后,经压缩块状支架经由导丝行进,使用输送导管(即,具有近端轴套的输送轴/导丝轴)定位在腋动脉中,且接着充胀或扩张。通过穿过引导鞘管或引导导管注入X射线造影剂来执行血管造影术以评估动脉闭塞程度。使引导鞘管或引导导管的尖端向前行进,直至它触碰经扩张块状支架的近端。将输送导管拉回,通过使经扩张块状支架的近端颈部从输送导管的远端上的弹性套筒脱离而导致经扩张球状支架从输送导管机械脱卸。用血管造影术评估经扩张、经脱卸块状支架的位置和目标血管的闭塞,且移除导丝。
对于AVP2治疗,移除导丝,且交换成AVP2,注意不要使装置的输送丝扭转。将AVP2的远端定位在预期闭塞位点的远端边缘处。接着拉回引导鞘管或引导导管以暴露AVP2,导致扩张。用血管造影术确认经扩张装置的位置。接着通过将AVP2的输送丝旋出而使AVP2脱卸。用血管造影术评估经扩张、经脱卸AVP2的位置,且将引导鞘管连同输送丝一起移除。
对于两种治疗,在装置部署后立即执行血管造影术。在前30分钟或在观测到闭塞之前每隔2.5分钟用连续血管造影术监测经治疗血管段。
在医疗装置的植入部分中不存在阀门。在手术结束时,块状支架的近端颈部和远端颈部向血流敞开。鉴于这个构造,在手术结束时块状支架的中心空隙内的压力相同于、类似于或低于块状支架外的压力且不高于它。不将硬质或半硬质材料放置在块状支架的中心空隙中。
在第29天,经由对血管进行手术切开将合适大小的鞘管放置在股动脉中。施用肝素以实现大于等于300秒的目标ACT。在荧光透视引导下,使引导导管行进至腋动脉中。接着执行血管造影术以使动脉和其侧分支可视化。接着在对侧上重复这个过程。接着用过量的戊巴比妥使动物安乐死,且收集组织样本用于结合H&E染色进行组织病理检查,包括经治疗动脉段、经植入块状支架和AVP2装置。
结果
在图41中提供每个装置的血管造影术结果的概要。块状支架展现优异的荧光透视可见性、良好的可追踪性、低压(1至3个大气压)扩张和可靠的脱卸。在使用块状支架的所有3个动脉中于10分钟内且在使用AVP2的所有3个动脉中于10分钟内实现完全闭塞。所有动物存活至计划的第29天终止。在第29天,在使用块状支架的所有3个动脉中维持完全闭塞(100%)且在第29天,在使用AVP2的3个动脉中无动脉维持完全闭塞(0%)。也通过组织病理检查完全闭塞所有经块状支架治疗的动脉,其具有对血管壁的极小炎症响应或装置相关损伤,如图42A中所示。部分块状支架变形随时间而发生,可能由组织长入或狗的前肢与胸壁之间的压缩导致,但这种变形对块状支架完全并且永久闭塞目标动脉段的能力无影响。通过组织病理检查在第29天无经AVP2治疗动脉被完全闭塞,如图42B中所示。
当与用AVP2的当前护理治疗标准相比,块状支架治疗导致更快速并且更耐久的动脉闭塞。在被普遍接受用于测试外周动脉瘤闭塞用装置的动物模型中这些极其鼓舞人心的试用结果表明,块状支架可提供相对于血管塞更好的长期闭塞速率。
在非临床胸内动脉和腋动脉模型中将包括可扩张体的医疗装置用于治疗外周动
脉的示例性方法
使用块状支架治疗犬类腋动脉和胸内动脉(n=3)。
方法
实验模型使用各重约20kg的犬科杂交猎狗。研究涉及使用一种医疗装置,其包括中空金金属“块状支架”可扩张体和用以将6mm直径块状支架可扩张体放置在腋动脉中,或将4mm直径块状支架可扩张体放置在胸内动脉中的输送装置。经由血管的手术切开将合适大小的鞘管放置在股动脉中。施用肝素以实现250秒至300秒的目标活化凝血时间(ACT)。在荧光透视引导下,使0.018英寸导丝行进超出腋动脉或胸内动脉中的预期闭塞位点。对于腋动脉治疗,引导鞘管(6Fr×90cm长)或引导导管经由导丝行进至近端腋动脉中。对于胸内动脉,使引导鞘管或引导导管行进至胸内动脉的开端附近的锁骨下动脉中的位置。接着执行血管造影术以使腋动脉或胸内动脉和其侧分支可视化。
块状支架医疗装置包括块状支架形式的可扩张体。经扩张形式的块状支架是圆柱形的,具有圆形端部。块状支架具有近端颈部和远端颈部并且包括金。6mm块状支架的主体在直径上测量值为6mm且在长度上测量值为11.5mm(经折叠、经卷绕和经压缩),且在长度上测量值为10mm(经扩张)且由在厚度上测量值为20μm的单个金层形成。4mm块状支架的主体在直径上测量值为4mm且在长度上测量值为8.5mm(经折叠、经卷绕和经压缩),且在长度上测量值为7.5mm(经扩张)且由在厚度上测量值为12.5μm的单个金层形成。针对两个装置,将具有阀门的聚合物鼻锥附接至块状支架的远端颈部。块状支架医疗装置进一步包括具有3.25Fr的外径的输送导管,所述输送导管包括两个中空圆柱形体或内腔,第一内腔用于传递0.014英寸或0.018英寸导丝(由导丝轴的内表面界定),且第二内腔用于将流体从近端轴套注入至块状支架的中心空隙中以导致充胀或扩张(由输送轴的内表面和导丝轴的外表面界定)。
块状支架的近端颈部耦接至输送导管,折叠成褶,围绕输送导管的远端和闭塞丝卷绕,且被压缩。通过弹性体外套筒将块状支架的近端颈部保持至输送导管的远端,其中套筒的近端部分接合至输送轴,且套筒的远端部分在块状支架的近端颈部上方拉伸,且握持块状支架的颈部以形成摩擦配合。
在引导鞘管或引导导管的放置以及在0.018英寸导丝的放置后,经压缩块状支架经由导丝行进,使用输送导管(即,具有近端轴套的输送轴/导丝轴组件)定位在腋动脉和胸内动脉中,且接着充胀或扩张。通过穿过引导鞘管或引导导管注入X射线造影剂来执行血管造影术以评估动脉闭塞程度。使引导鞘管或引导导管的尖端向前行进,直至它触碰经扩张块状支架的近端。将输送导管拉回,通过使经扩张块状支架的近端颈部从输送导管的远端上的弹性套筒脱离而导致经扩张球状支架从输送导管机械脱卸。用血管造影术评估经扩张、经脱卸块状支架的位置和目标血管的闭塞,且移除导丝。
在装置部署后立即执行血管造影术。在前30分钟或在观测到闭塞之前每隔2.5分钟用连续血管造影术监测经治疗血管段。
在手术结束时,块状支架的远端鼻锥中的阀门被构造来阻挡供血液前行穿过经扩张块状支架的中心空隙的路径。近端鼻锥无阀门且因此对血流敞开。鉴于这个构造,在手术结束时块状支架的中心空隙内的压力相同于、类似于或低于块状支架外的压力且不高于它。不将硬质或半硬质材料放置在块状支架的中心空隙中。
结果
块状支架展现优异的荧光透视可见性、良好的可追踪性和低压(1至3个大气压)扩张。在用远端阀门并入至远端鼻锥的块状支架的所有7个动脉中立即实现完全闭塞。当与使用结合AVP2的当前护理治疗标准的先前结果比较时,块状支架治疗导致更快速的动脉闭塞。
在非临床胸内动脉模型中将包括可扩张体的医疗装置用于治疗外周动脉的示例 性方法
使用犬类胸内动脉闭塞模型,在用块状支架的治疗(n=3)与用CookNester线圈的治疗(n=4)之间进行比较。
方法
实验模型使用各重约20kg的犬科杂交猎狗。研究涉及使用一种医疗装置,其包括中空金金属“块状支架”可扩张体和用以将4mm直径块状支架或两个4mm直径Cook Nester线圈放置在胸内动脉中的输送装置。经由血管的手术切开将合适大小的鞘管放置在股动脉中。施用肝素以实现250秒至300秒的目标活化凝血时间(ACT)。在荧光透视引导下,使0.018英寸导丝行进超出胸动脉中的预期闭塞位点。引导鞘管(6Fr×90cm长)或引导导管经由导丝行进至胸内动脉的开端附近的位置。接着执行血管造影术以使胸动脉和其侧分支可视化。
Cook Nester线圈是G26988装置,其是被设计来穿过用大约11个环扩张至4mm的直径的0.021英寸导管插入的0.018英寸线圈,呈现14cm的延伸长度用于栓塞。
块状支架医疗装置包括块状支架形式的可扩张体。经扩张形式的块状支架是圆柱形的,具有圆形端部。块状支架具有近端颈部和远端颈部并且包括金。4mm块状支架的主体在直径上测量值为4mm且在长度上测量值为8.5mm(经折叠、经卷绕和经压缩),且在长度上测量值为7.5mm(经扩张)且由在厚度上测量值为12.5μm的单个金层形成。将具有阀门的聚合物鼻锥附接至远端颈部。将无阀门的聚合物鼻锥附接至近端颈部。
块状支架医疗装置进一步包括具有3.25Fr的外径的输送导管组件,所述输送导管组件包括两个中空圆柱形体或内腔,第一内腔用于传递0.014英寸或0.018英寸导丝(由导丝轴的内表面界定),且第二内腔用于将流体从近端轴套注入至块状支架的中心空隙中以导致充胀或扩张(由输送轴的内表面和导丝轴的外表面界定)。块状支架医疗装置进一步包括具有单独轴套的外部轴,所述单独轴套被构造来与输送导管组件的轴套锁定在一起。这个外部轴界定外部轴的内表面与输送导管组件的外表面之间的内腔。外部轴的轴套包括阀门和侧臂,其实现将X射线造影剂注入至这个内腔中,所述X射线造影剂在医疗装置的尖端附近退出。
块状支架的近端颈部耦接至输送导管,折叠成褶,围绕输送导管组件的远端和闭塞丝卷绕,且被压缩。通过弹性体外套筒将块状支架的近端颈部保持至输送导管组件的远端,其中套筒的近端部分接合至输送轴组件,且套筒的远端部分在块状支架的近端颈部上方拉伸,且握持块状支架的颈部以形成摩擦配合。
对于Cook Nester线圈放置,5Fr导管经由导丝行进穿过引导鞘管或引导导管,且行进至胸内动脉中。将导丝移除且穿过5Fr导管以同轴方式放置0.021英寸导管。接着使用推丝将线圈推动穿过0.021英寸导管且将其放置在胸内动脉中。通过穿过0.021英寸导管或引导鞘管/导管注入X射线造影剂而用血管造影术确认每个经放置线圈的位置。在每条经治疗血管中放置两个线圈。
在最后一个线圈放置之后(当线圈被推出微导管且达到它的最终形状时),在前30分钟或在观测到血管段的完全闭塞之前每隔2.5分钟用连续血管造影术监测经治疗血管段。
对于块状支架放置,在引导鞘管或引导导管的放置以及0.018英寸导丝在胸内动脉中放置之后,经压缩块状支架经由导丝行进,使用外部轴(和轴套)的组件、输送轴/导丝组件(具有轴套)定位在胸内动脉中,其中两个轴套被锁定在一起。经压缩块状支架接着充胀或扩张。通过使用侧臂穿过外部轴的内腔注入X射线造影剂来执行血管造影术以评估动脉闭塞程度。两个轴套接着被解除锁定,且外部轴的尖端向前行进,直至它触碰经扩张块状支架的近端鼻锥。接着将输送导管组件拉回,通过使经扩张块状支架的近端颈部从输送导管组件的远端上的弹性套筒脱离而导致经扩张球状支架从输送导管组件机械脱卸。通过穿过现在充当引导导管的外部轴注入而用血管造影术评估经扩张、经脱卸块状支架的位置和目标血管的闭塞。接着,移除导丝且重复胸内动脉的血管造影术。
在手术结束时,块状支架的远端鼻锥中的阀门已密封供血液前行穿过经扩张块状支架的中心空隙的路径。近端鼻锥无阀门且因此对血流敞开。鉴于这个构造,在手术结束时块状支架的中心空隙内的压力相同于、类似于或低于块状支架外的压力且不高于它。不将硬质或半硬质材料放置在块状支架的中心空隙中。
在第28天,经由对血管进行手术切开将合适大小的鞘管放置在股动脉中。施用肝素以实现大于等于300秒的目标ACT。在荧光透视引导下,使引导导管行进至腋动脉中。接着执行血管造影术以使动脉和其侧分支可视化。接着在对侧上重复这个过程。接着用过量的戊巴比妥使动物安乐死,且收集组织样本用于结合H&E染色进行组织病理检查,包括经治疗动脉段、经植入块状支架和Cook Nester线圈装置。
结果
块状支架展现优异的荧光透视可见性、良好的可追踪性和低压(1至3个大气压)扩张。可用外部轴实行血管造影术和脱卸。通过组织分析和血管造影术,在第28天,用块状支架治疗的所有3个胸内动脉被完全闭塞(100%)。通过组织分析和血管造影术,在第28天,用块状支架治疗的3个胸内动脉中无胸内动脉被完全闭塞(0%)。
将包括可扩张体的医疗装置用于治疗患者体内的外周动脉的示例性方法
将医疗装置用于治疗需动脉栓塞的患者的假想方法可以一次或更多次术前咨询开始,其中可执行若干测试。测试可包括血液测试、尿液测试、心电图和成像测试,包括CT、MRI和血管造影照片,以及其他。可从诊断成像测试获得目标血管段的图像和测量,展现目标血管段的位置、大小和形状。咨询可在执行手术前数天或当天进行。
在手术当日,患者准备进行手术并且通常被给予局部麻醉。患者的腹股沟接着被预备且以无菌方式覆盖。接着医师可选地用微穿刺装置接达患者体内的股动脉。以逆向方式将软尖端导丝302插入至股动脉中。可选地,放置血管鞘管。诊断导管经由导丝行进,直至诊断导管的尖端在目标血管段的内腔中或其附近,且执行诊断血管造影。移除诊断导管且插入引导导管。
医师选择适当大小和形状的块状支架医疗装置用于治疗目标血管段,在这个情况下装置包括具有圆柱形经扩张形式、圆形端部的12.5μm的金层、近端颈部和远端颈部且主体在直径上测量值为4mm且在长度上测量值为8.5mm(经折叠、经卷绕和经压缩),且在长度上测量值为7.5mm(经扩张)。将具有阀门的聚合物鼻锥附接至远端颈部。将无阀门的聚合物鼻锥附接至近端颈部。
块状支架医疗装置进一步包括具有3.25Fr的外径的输送导管组件,所述输送导管组件包括两个中空圆柱形体或内腔,第一内腔用于传递0.014英寸导丝(由导丝轴的内表面界定),且第二内腔用于将流体从近端轴套注入至块状支架的中心空隙中以导致充胀或扩张(由输送轴的内表面和导丝轴的外表面界定)。块状支架医疗装置进一步包括具有单独轴套的外部轴,所述单独轴套被构造来与输送导管组件的轴套锁定在一起。这个外部轴界定外部轴的内表面与输送导管组件的外表面之间的内腔。外部轴的轴套包括阀门和侧臂,其实现将X射线造影剂注入至这个内腔中,所述X射线造影剂在医疗装置的尖端附近退出。
块状支架的近端颈部耦接至输送导管,折叠成褶,围绕输送导管组件的远端和闭塞丝卷绕,且被压缩。通过弹性体外套筒将块状支架的近端颈部保持至输送导管组件的远端,其中套筒的近端部分接合至输送轴组件,且套筒的远端部分在块状支架的近端颈部上方拉伸,且握持块状支架的颈部以形成摩擦配合。
将0.014英寸导丝放置在目标血管中,且经压缩块状支架经由导丝行进,使用外部轴(和轴套)的组件、输送轴/导丝组件(具有轴套)定位于目标动脉段中,其中两个轴套被锁定在一起。接着使经压缩块状支架充胀或扩张。通过穿过引导鞘管或引导导管注入X射线造影剂来执行血管造影术以评估动脉闭塞程度。将两个轴套解除锁定,且外部轴的尖端向前行进,直至它触碰经扩张块状支架的近端鼻锥。接着将输送导管组件拉回,通过使经扩张块状支架的近端颈部从输送导管组件的远端上的弹性套筒脱离而导致经扩张球状支架从输送导管组件机械脱卸。通过穿过现在充当引导导管或诊断导管的外部轴注入而用血管造影术评估经扩张、经脱卸块状支架的位置和目标血管的闭塞。接着,移除导丝且重复目标血管的血管造影术。
在手术结束时,块状支架的远端鼻锥中的阀门密封供血液前行穿过经扩张块状支架的中心空隙的路径。近端鼻锥无阀门且因此对血流敞开。鉴于这个构造,在手术结束时块状支架的中心空隙内的压力将相同于、类似于或低于块状支架外的压力且不高于它。不将硬质或半硬质材料放置在块状支架的中心空隙中。
医师取回导丝、外部轴和和血管鞘管(若有),且用压缩实现股动脉穿刺的止血。接着将患者运送至观察病房。在恢复期间以及之后,医师定期监测患者以及植入块状支架的位置和目标动脉段的闭塞的完全性。
将包括可扩张体的低剖面医疗装置用于治疗患者体内的外周动脉的示例性方法
包括被优化用于治疗远端或迂曲血管的中空金金属块状支架可扩张体的医疗装置的低剖面实施方案已被设计用于穿过4Fr或5Fr导管部署。医疗装置包括圆柱形中空金金属可扩张体,其包括近端颈部和远端颈部。远端颈部闭合。远端鼻锥附接至远端颈部。近端颈部敞开。近端鼻锥附接至远端颈部。中空金金属可扩张体被折叠成褶,顺时针或逆时针卷绕,且压缩至丝心轴上。经折叠、经卷绕和经压缩可扩张体的近端颈部通过物理耦接,在无胶水、粘合剂或焊接的情况下结合至单内腔输送导管。在这个实施例中,弹性体近端套筒的近端部分接合至单内腔导管,且近端套筒的远端部分在可扩张体的近端颈部上方伸展。将闭塞丝放置在单内腔导管的内腔中。
5Fr导管行进穿过动脉系统至待治疗段。包括上述中空金金属块状支架可扩张体的医疗装置行进至5Fr诊断导管的轴套中,且传递穿过导管,直至经折叠、经卷绕和经压缩可扩张体完全退出5Fr导管的远端尖端。接着,将闭塞丝从医疗装置移除,同时将流体滴至轴套上以防止空气吸入至医疗装置的内腔中。接着,将填充有流体的注射器或充胀体附接至医疗装置的轴套,且将其用于在压力下将流体注入至可扩张体的空隙中,导致扩张。接着,5Fr导管行进,直至它的远端尖端接触近端鼻锥,且在5Fr导管保持在适当位置中的情况下将医疗装置的导管部分拉回,导致经扩张可扩张体从输送导管脱卸。将输送导管从患者身体移除,且在荧光透视下将射线造影剂注入至5Fr导管中以确认目标血管段闭塞。
优化中空金属可扩张体的壁厚的实施例
可优化中空金属可扩张体的壁厚来满足各种相互矛盾的设计要求。例如,具有20μm的壁厚的8mm直径的球形、中空金金属球状支架可扩张体已展现有关处置和组装期间的耐用性、方便折叠和卷绕、低压下的扩张以及在活体内扩张后抵抗压缩方面的良好性能。
扩张后对压缩(或屈曲)的抵抗力是依据可扩张体直径和壁厚。例如,使用压力室进行经密封球状支架和大体上圆柱形块状支架可扩张体的扩张后压缩特性的研究。发现未退火电铸的屈曲压力随(壁厚/直径)3按比例调整,接近薄壁压力容器理论。3mm至10mm直径和10μm至20μm壁厚的球状支架的屈曲压力具有680mmHg的中值和165mmHg的最小值,比由血流动量效应导致的估计局部压力负载大约两个数量级。4mm至6mm直径和10μm至20μm壁厚的块状支架的屈曲压力具有350mmHg的中值和170mmHg的最小值,比由四肢移动和体重导致的估计局部接触压力负载明显更高。退火电铸的后续压缩研究展现小于未退火电铸的屈曲压力的一半的屈曲压力。
优化用于制造中空金属可扩张体的金属牺牲性心轴的表面光洁度的实施例
在一个实施例中,牺牲性铝心轴上的16微英寸表面光洁度已表明导致具有低针孔缺陷率的中空金金属可扩张体,同时保留在活体内超过4周的至可扩张体表面的组织增生(图40A)。
制造并且使用用于制造中空金属可扩张体的聚合物牺牲性心轴的实施例
在将金涂层施加至水溶性聚合物的可行性的实施例中,PEG薄片被溅涂有约10nm厚的一层金。当用胶带触碰经涂布表面时无金损失,因此展现足够的粘着性。
制造辅助线圈可扩张体并且结合中空金属“球状支架”可扩张体使用辅助线圈可
扩张体的实施例
如前所述,线圈丝“辅助线圈”可扩张体可与“球状支架”中空金金属可扩张体一起使用。在一个实施方案中,辅助线圈由镍钛诺形成。
下列实施例涉及根据一个实施方案的形成并且部署镍钛诺辅助线圈的方法。从冷加工条件中(即,如拉制)的0.005英寸直径镍钛诺丝开始,通过将镍钛诺丝卷绕至成形心轴或模具735(图46A中所示)而将镍钛诺丝牢固约束至其新形状中且接着热处理且退火以赋予超弹性和形状记忆。在这个实施例中,将心轴定大小以形成8mm×8mm球形辅助线圈725。遵循众所周知的形状设定退火指南。加热方法可包括空气或真空炉、盐浴、砂浴或加热模具。温度在500℃至550℃的范围内,其中较高温度导致较低抗拉强度。冷却是快速的以避免老化效应;因而,使用水淬火。热处理时间使材料在其横截面内达到期望温度。时间依据夹具和材料的质量和加热方法。举例来说且非限制,加热时间可以比在盐浴或加热模具中加热小零件短一分钟。
接着测试辅助线圈725,如在图46B至图46D中依序所示。将辅助线圈装载至具有0.016英寸内径的辅助线圈输送导管805的内腔中。接着将所得辅助线圈/辅助线圈输送导管组件(第二医疗装置)传递穿过包括在扩张构造中的8mm中空金属“球状支架”可扩张体的医疗装置(第一医疗装置)的导丝内腔,在退出球状支架可扩张体之前穿过附接至球状支架可扩张体的远端颈部的伸缩段。使用0.009英寸不锈钢推丝将辅助线圈从辅助线圈输送导管的内腔完全排出。将辅助线圈输送导管从第一医疗装置移除。辅助线圈达到其预期形状,形成界定8mm直径球形区的大环。
可采用成形和部署过程的各种实施方案。例如,可通过使用更短或更长轴向尺寸的成形心轴735而使辅助线圈形成为非球形形状(即,8mm×4mm、8mm×6mm、8mm×12mm或8mm×16mm)。
制造具有不透射线标记的辅助线圈可扩张体的实施例
参考图46A、图50A至图50D和图53A至图53C的下列实施例涉及根据一个实施方案的形成镍钛诺辅助线圈725,将不透射线标记带920附接至其端部且将其组装至辅助线圈输送系统900中的方法。
从冷加工条件中(即,如拉制)的0.005英寸直径镍钛诺丝开始,通过将镍钛诺丝卷绕至成形心轴或模具735而将镍钛诺丝牢固约束至其新形状中且接着将其热处理且退火以赋予超弹性和形状记忆。在这个实施例中,将心轴定大小以形成期望形状的辅助线圈725。在650℃±10℃下在烘箱中执行热处理达15至30分钟。接着通过在室温水中淬火达15至30秒而使仍在其成形心轴上的线圈冷却。
接着将辅助线圈725从成形心轴735移除且将其插入至PFTE管932段中以覆盖它的完整长度。在400℃±10℃下使用点加热器,接着使PTFE管收缩至辅助线圈上。接着从线圈的两端反向修剪PTFE收缩管以容纳90%铂/10%铱标记带920,其被激光焊接在适当位置中。
通过将母鲁尔接头908接合至316不锈钢外海波管906而组装辅助线圈输送导管900。接着将聚酰亚胺辅助线圈导管轴910的近端插入至外海波管中并且接合。接着将铂铱标记带920接合至辅助线圈导管轴的远端。将UV固化环氧树脂用于所有接合步骤。最后,将母鲁尔接头紧固至Y接头轴套970。
通过将304不锈钢推丝950插入至316不锈钢内海波管916,直至在近端处对齐,将近端激光焊接在一起,将丝手柄918固定至内海波管的近端,且接着施加UV固化环氧树脂以在内海波管的远端与推丝的结合部处形成平滑圆角来执行推丝子系统的组装。
接着通过将推丝950的远端插入至Y接头轴套970的近端中,激光修整推丝的远端使得仅1mm至2mm从辅助线圈导管轴910的远端突起,将手柄918拉回,将辅助线圈162装载至辅助线圈导管轴的远端中,手柄行进直至辅助线圈162开始从辅助线圈导管轴的远端突起,且将Y接头轴套收紧至海波管916上而完成辅助线圈输送系统900的组装。接着将辅助线圈输送系统准备用于包装、消毒和装运。
将了解本发明的装置和方法能够以多种实施方案的形式被并入,上文仅已图示并且描述所述实施方案的一些。本公开可以其它具体形式体现而不脱离其精神或本质特性。所述实施方案将在所有方面被视为仅为说明性且非限制性的,且本发明的范围因此由随附权利要求而非上述描述指示。权利要求的等效物的含义和范围内的所有变化将涵盖在其范畴内。
Claims (31)
1.一种医疗系统,其包括:
金属可扩张体,其被构造用于永久植入动脉或静脉中,所述可扩张体包括:
远端区域、大致与所述远端区域相对的近端区域、从所述远端区域过渡至所述近端区域的中间区域、在所述近端区域与所述远端区域之间从近端延伸至远端的中心轴线;
壁,其从所述远端区域延伸穿过所述中间区域至所述近端区域,这界定所述可扩张体的外表面和所述可扩张体的内表面,所述内表面界定所述可扩张体的中心空隙或空间;
三个同心导管,其包括:
具有与近端大致相对的远端的内导管,所述内导管界定从所述内导管的所述近端连续至所述远端且被构造来接纳导丝的第一内腔;并且其中所述内导管的外壁的至少一部分界定第二内腔的最内部分以允许流体介质从中间导管的近端传递至远端,且传递至所述可扩张体的所述中心空隙或空间中;
具有与所述近端大致相对的远端的中间导管,其中所述中间导管的所述远端可操作地耦接至所述可扩张体的所述近端区域;并且其中所述中间导管的内壁的至少一部分界定第二内腔的最外部分以允许流体介质从所述中间导管的所述近端传递至所述远端,且传递至所述可扩张体的所述中心空隙或空间中;并且其中所述中间导管的外壁的至少一部分界定第三内腔的最内部分以允许流体介质从所述中间导管的所述近端传递至所述远端,且传递至邻近于所述金属可扩张体的空间中;
具有与近端大致相对的远端的外导管,其中所述外导管的内壁的至少一部分界定第三内腔的最外部分以允许流体介质从所述外导管的所述近端传递至所述远端,且传递至所述金属可扩张体的所述中心空隙或空间外的空间中;
其中所述可扩张体被构造来从可输送构造扩张至扩张构造;
其中,当所述可扩张体呈所述可输送构造时,所述壁呈现摺叠构造,所述摺叠构造包括在相对于所述中心轴线的顺时针方向上或在相对于所述中心轴线的逆时针方向上对折的多个褶以形成所述可扩张体的对折区域;
其中所述外导管可独立于所述中间导管和所述内导管而行进和缩回;并且
其中可通过将所述可扩张体和所述中间导管拉开而使所述可扩张体从所述中间导管分离。
2.根据权利要求1所述的医疗系统,其中在经扩张可扩张体和所述中间导管在生物空间内的分离之后,所述经扩张可扩张体具有足够的强度来自行维持扩张或部分扩张构造。
3.根据权利要求1所述的医疗系统,其中所述第二内腔的至少一部分由所述中间导管的内壁与所述内导管的外壁之间的环状间隙界定,并且所述第二内腔实现所述中间导管的近端轴套与所述可扩张体的所述中心空隙或空间之间的流体连通。
4.根据权利要求1所述的医疗系统,其中所述第三内腔的至少一部分由所述外导管的内壁与所述中间导管的外壁之间的环状间隙界定。
5.根据权利要求1所述的医疗系统,其中所述第一中空构件轴包括:
外层,其包括聚合物;
中层,其包括编织金属;其中所述中层设置于所述外层与内层之间;和
所述内层,其包括润滑涂层,一种润滑聚合物。
6.根据权利要求1所述的医疗系统,其中所述第二中空构件轴包括:
一个层,其包括聚合物;和
第二层,其包括编织金属;其中中层设置于外层与内层之间。
7.根据权利要求1所述的医疗系统,其中所述第三中空构件轴包括:
润滑外表面涂层;
外层,其包括聚合物,
中层,其包括线圈金属丝,其中所述中层设置于所述外层与内层之间;和
内层,其包括润滑涂层,一种润滑聚合物。
8.根据权利要求7所述的医疗系统,其中所述第三中空构件轴的所述壁包括具有等于或大于55肖氏硬度D的肖氏硬度计硬度的材料。
9.根据权利要求1至2中任一项所述的医疗系统,其中当经扩张可扩张体与输送装置分离时,一个或多个弹性体阀门闭合。
10.根据权利要求1所述的医疗系统,其中所述可扩张体包括一个或多个弹性体阀门。
11.根据权利要求10所述的医疗系统,其中所述一个或多个弹性体阀门包括中心孔,所述中心孔包括圆形刺孔、沿着直径的狭缝或跨两个直径的正交狭缝。
12.根据权利要求10所述的医疗系统,其中所述一个或多个弹性体阀门整合至鼻锥或端盖中。
13.根据权利要求10所述的医疗系统,其中,在所述可扩张体和所述中间导管的分离之前,所述内导管插入穿过所述弹性体阀门,并且在所述弹性体阀门与内导管轴的外表面之间形成摩擦配合。
14.根据权利要求1至2中任一项所述的医疗系统,其中所述可扩张体具有在从3微米至50微米的范围内的壁厚。
15.根据权利要求1至3中任一项所述的医疗系统,其中所述可扩张体的所述壁包括至少一个层,其中所述至少一个层是金属层。
16.根据权利要求1至2中任一项所述的医疗系统,其中所述可扩张体的所述壁包括至少一个层,其中所述至少一个层是金属层,其中所述金属层包括金。
17.根据权利要求1至2中任一项所述的医疗系统,其中所述可扩张体的所述壁的至少一部分被退火。
18.根据权利要求1至2中任一项所述的医疗系统,其中所述可扩张体具有单瓣。
19.根据权利要求1至2中任一项所述的医疗系统,其中经扩张可扩张体包括大致椭圆形的总体形状。
20.根据权利要求1至2中任一项所述的医疗系统,其中经扩张可扩张体包括大致圆柱形的总体形状。
21.根据权利要求1至2中任一项所述的医疗系统,其中经压缩可扩张体可通过在6个大气压或更小的压力下将流体注射至所述经压缩可扩张体的所述中心空隙或空间中来扩张。
22.根据权利要求1至2中任一项所述的医疗系统,其中经扩张可扩张体具有范围从2mm至60 mm的经扩张长度。
23.根据权利要求1至2中任一项所述的医疗系统,其中所述可扩张体具有单瓣,其中所述可扩张体具有介于5 mm至60 mm之间的经扩张长度。
24.根据权利要求1至2中任一项所述的医疗系统,其中经扩张可扩张体包括大致椭圆形的总体形状,其中所述可扩张体具有介于5 mm至60 mm之间的经扩张长度。
25.根据权利要求1至2中任一项所述的医疗系统,其中经扩张可扩张体包括具有圆形端部的大致圆柱形的总体形状,其中所述可扩张体具有介于5 mm至60 mm之间的经扩张长度。
26.根据权利要求1至2中任一项所述的医疗系统,其中所述中间导管的外径是2 Fr至5Fr。
27.根据权利要求1至3中任一项所述的医疗系统,其中呈可输送构造的所述可扩张体的外径是2 Fr至8 Fr。
28.根据权利要求10所述的医疗系统,其中所述一个或多个弹性体阀门包括聚合物圆盘。
29.根据权利要求1所述的医疗系统,其中不透射线标记带并入到医疗装置中以识别所述外导管、中间导管或内导管中的一个或多个的所述远端。
30.根据权利要求1所述的医疗系统,其中所述内导管被构造来允许固体或半固体材料从所述内导管的所述近端传递穿过所述内导管的所述内腔且至经扩张可扩张体的所述中心空隙或空间中。
31.根据权利要求5所述的医疗系统,其中所述润滑聚合物为PTFE或聚酰亚胺/PTFE复合物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462051873P | 2014-09-17 | 2014-09-17 | |
| US62/051873 | 2014-09-17 | ||
| PCT/US2015/050783 WO2016044647A2 (en) | 2014-09-17 | 2015-09-17 | Expandable body device and method of use |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107530090A CN107530090A (zh) | 2018-01-02 |
| CN107530090B true CN107530090B (zh) | 2021-03-09 |
Family
ID=55534013
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580062443.6A Active CN107530090B (zh) | 2014-09-17 | 2015-09-17 | 可扩张体装置和使用方法 |
Country Status (14)
| Country | Link |
|---|---|
| US (1) | US11033275B2 (zh) |
| EP (2) | EP3193746A4 (zh) |
| JP (3) | JP2017528247A (zh) |
| KR (1) | KR20170056666A (zh) |
| CN (1) | CN107530090B (zh) |
| AU (2) | AU2015317507A1 (zh) |
| BR (1) | BR112017005170B1 (zh) |
| CA (1) | CA2957601C (zh) |
| HK (1) | HK1248499A1 (zh) |
| IL (1) | IL250496A0 (zh) |
| NZ (2) | NZ768100A (zh) |
| RU (2) | RU2721288C2 (zh) |
| TW (2) | TWI732743B (zh) |
| WO (1) | WO2016044647A2 (zh) |
Families Citing this family (113)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10716573B2 (en) | 2008-05-01 | 2020-07-21 | Aneuclose | Janjua aneurysm net with a resilient neck-bridging portion for occluding a cerebral aneurysm |
| US11583289B2 (en) | 2008-05-01 | 2023-02-21 | Aneuclose Llc | Aneurysm-occluding mesh ribbon with a series of loops or segments having distal-to-proximal variation in size, shape, and/or orientation |
| US11357511B2 (en) | 2008-05-01 | 2022-06-14 | Aneuclose Llc | Intrasacular aneurysm occlusion device with globular first configuration and bowl-shaped second configuration |
| US11471164B2 (en) | 2008-05-01 | 2022-10-18 | Aneuclose Llc | Methods of occluding a cerebral aneurysm by inserting embolic members or material into an intrasacular implant |
| US9402707B2 (en) | 2008-07-22 | 2016-08-02 | Neuravi Limited | Clot capture systems and associated methods |
| US8790387B2 (en) | 2008-10-10 | 2014-07-29 | Edwards Lifesciences Corporation | Expandable sheath for introducing an endovascular delivery device into a body |
| ES2683943T3 (es) | 2010-10-22 | 2018-09-28 | Neuravi Limited | Sistema de captura y extirpación de coágulos |
| US11484318B2 (en) | 2011-01-17 | 2022-11-01 | Artio Medical, Inc. | Expandable body device and method of use |
| KR102109781B1 (ko) | 2011-01-17 | 2020-05-14 | 메타랙티브 메디컬, 인크. | 블록스텐트 장치 및 사용방법 |
| US11259824B2 (en) | 2011-03-09 | 2022-03-01 | Neuravi Limited | Clot retrieval device for removing occlusive clot from a blood vessel |
| AU2012366236B2 (en) | 2012-01-17 | 2017-10-12 | Artio Medical, Inc. | Expandable body device and method of use |
| US10857274B2 (en) | 2012-11-06 | 2020-12-08 | Queen Mary University Of London | Mechanical circulatory support device with centrifugal impeller designed for implantation in the descending aorta |
| US9433429B2 (en) | 2013-03-14 | 2016-09-06 | Neuravi Limited | Clot retrieval devices |
| ES2960917T3 (es) | 2013-03-14 | 2024-03-07 | Neuravi Ltd | Dispositivo de recuperación de coágulos para eliminar coágulos oclusivos de un vaso sanguíneo |
| US11076860B2 (en) | 2014-03-31 | 2021-08-03 | DePuy Synthes Products, Inc. | Aneurysm occlusion device |
| US11154302B2 (en) | 2014-03-31 | 2021-10-26 | DePuy Synthes Products, Inc. | Aneurysm occlusion device |
| US9918718B2 (en) | 2014-08-08 | 2018-03-20 | DePuy Synthes Products, Inc. | Embolic coil delivery system with retractable mechanical release mechanism |
| CA2957601C (en) | 2014-09-17 | 2021-11-02 | Metactive Medical, Inc. | Expandable body device and method of use |
| US10617435B2 (en) | 2014-11-26 | 2020-04-14 | Neuravi Limited | Clot retrieval device for removing clot from a blood vessel |
| US11253278B2 (en) | 2014-11-26 | 2022-02-22 | Neuravi Limited | Clot retrieval system for removing occlusive clot from a blood vessel |
| EP3682821B1 (en) | 2014-11-26 | 2022-05-11 | Neuravi Limited | A clot retrieval device for removing an occlusive clot from a blood vessel |
| US10792471B2 (en) | 2015-04-10 | 2020-10-06 | Edwards Lifesciences Corporation | Expandable sheath |
| US10327896B2 (en) | 2015-04-10 | 2019-06-25 | Edwards Lifesciences Corporation | Expandable sheath with elastomeric cross sectional portions |
| US20210128929A1 (en) * | 2016-02-29 | 2021-05-06 | Michael B. McDonald | Microcatheter Structural Wire with Pacing Function |
| EP3457954A4 (en) * | 2016-05-18 | 2020-01-08 | Microvention, Inc. | EMBOLIC CONTAINMENT |
| US11191611B2 (en) | 2016-06-03 | 2021-12-07 | Somatex Medical Technologies Gmbh | Marking device and implantation system |
| ES2867599T3 (es) * | 2016-09-06 | 2021-10-20 | Neuravi Ltd | Un dispositivo de recuperación de coágulos para eliminar el coágulo oclusivo de un vaso sanguíneo |
| RU2019110988A (ru) * | 2016-09-14 | 2020-10-15 | Мединол Лтд. | Устройство для закрытия аневризмы |
| US11524153B2 (en) | 2016-10-03 | 2022-12-13 | Queen Mary University Of London | Mechanical circulatory support device with axial flow turbomachine optimized for heart failure and cardio-renal syndrome by implantation in the descending aorta |
| US20180206851A1 (en) * | 2016-10-19 | 2018-07-26 | Daniel E. Walzman | Hydrogel intrasaccular occlusion device |
| US20180104454A1 (en) * | 2016-10-19 | 2018-04-19 | Daniel E. Walzman | Disc balloon microcatheter |
| JP7261160B2 (ja) | 2016-11-23 | 2023-04-19 | ホロジック, インコーポレイテッド | 生検部位マーカー |
| US10448970B2 (en) * | 2016-12-05 | 2019-10-22 | Daniel E. Walzman | Alternative use for hydrogel intrasaccular occlusion device with telescoping central support element |
| US11090078B2 (en) | 2016-12-05 | 2021-08-17 | Daniel E. Walzman | Alternative use for hydrogel intrasaccular occlusion device with vertically oriented reinforcement members for structural support |
| US10653523B2 (en) | 2017-01-19 | 2020-05-19 | 4C Medical Technologies, Inc. | Systems, methods and devices for delivery systems, methods and devices for implanting prosthetic heart valves |
| US10561495B2 (en) | 2017-01-24 | 2020-02-18 | 4C Medical Technologies, Inc. | Systems, methods and devices for two-step delivery and implantation of prosthetic heart valve |
| EP3585275A1 (en) | 2017-02-23 | 2020-01-01 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| US10799685B2 (en) | 2017-03-09 | 2020-10-13 | Edwards Lifesciences Corporation | Expandable sheath with longitudinally extending reinforcing members |
| AU2018239680A1 (en) * | 2017-03-24 | 2019-10-10 | Artio Medical, Inc. | Medical devices comprising detachable balloons and methods of manufacturing and use |
| US20190046156A1 (en) * | 2017-08-10 | 2019-02-14 | Koninklijke Philips N.V. | Ivus and external imaging to map aneurysm to determine placement of coils and likelihood of success |
| JP7114691B2 (ja) * | 2017-08-15 | 2022-08-08 | ボストン サイエンティフィック サイムド,インコーポレイテッド | 閉塞性医療装置システム |
| KR20200038886A (ko) * | 2017-09-01 | 2020-04-14 | 메타랙티브 메디컬, 인크. | 분리가능 벌룬을 포함하는 의료 장치 및 제조 방법 및 사용 |
| US10806462B2 (en) | 2017-12-21 | 2020-10-20 | DePuy Synthes Products, Inc. | Implantable medical device detachment system with split tube and cylindrical coupling |
| US10905430B2 (en) | 2018-01-24 | 2021-02-02 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| WO2019161175A1 (en) | 2018-02-15 | 2019-08-22 | Boston Scientific Scimed, Inc. | Introducer with expandable capabilities |
| US11596412B2 (en) | 2018-05-25 | 2023-03-07 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| US11058430B2 (en) | 2018-05-25 | 2021-07-13 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| CN112513930A (zh) * | 2018-05-29 | 2021-03-16 | 光实验成像公司 | 支架扩张显示、系统和方法 |
| US10939915B2 (en) | 2018-05-31 | 2021-03-09 | DePuy Synthes Products, Inc. | Aneurysm device and delivery system |
| KR20210068392A (ko) * | 2018-08-03 | 2021-06-09 | 넥테로 메디칼, 인크. | 정제된 펜타갈로일 글루코스 및 전달하기 위한 장치 |
| US11051825B2 (en) | 2018-08-08 | 2021-07-06 | DePuy Synthes Products, Inc. | Delivery system for embolic braid |
| US11857441B2 (en) | 2018-09-04 | 2024-01-02 | 4C Medical Technologies, Inc. | Stent loading device |
| IL269005A (en) * | 2018-09-12 | 2019-10-31 | Depuy Synthes Products Inc | Improved aneurysm occlusion device |
| US11123077B2 (en) | 2018-09-25 | 2021-09-21 | DePuy Synthes Products, Inc. | Intrasaccular device positioning and deployment system |
| US11406416B2 (en) | 2018-10-02 | 2022-08-09 | Neuravi Limited | Joint assembly for vasculature obstruction capture device |
| US11076861B2 (en) | 2018-10-12 | 2021-08-03 | DePuy Synthes Products, Inc. | Folded aneurysm treatment device and delivery method |
| US11406392B2 (en) | 2018-12-12 | 2022-08-09 | DePuy Synthes Products, Inc. | Aneurysm occluding device for use with coagulating agents |
| US11147562B2 (en) | 2018-12-12 | 2021-10-19 | DePuy Synthes Products, Inc. | Systems and methods for embolic implant detachment |
| US11272939B2 (en) | 2018-12-18 | 2022-03-15 | DePuy Synthes Products, Inc. | Intrasaccular flow diverter for treating cerebral aneurysms |
| US20220183698A1 (en) * | 2019-01-31 | 2022-06-16 | Icahn School Of Medicine At Mount Sinai | Detachable-tip balloon microcatheter for embolization of vascular pathology |
| US11134953B2 (en) | 2019-02-06 | 2021-10-05 | DePuy Synthes Products, Inc. | Adhesive cover occluding device for aneurysm treatment |
| US20220175388A1 (en) * | 2019-03-13 | 2022-06-09 | Prasad Sunkara | Devices, systems, and methods for minimally invasive modulation of abdominal tissue |
| WO2020191203A1 (en) | 2019-03-20 | 2020-09-24 | inQB8 Medical Technologies, LLC | Aortic dissection implant |
| US11337706B2 (en) | 2019-03-27 | 2022-05-24 | DePuy Synthes Products, Inc. | Aneurysm treatment device |
| US11602350B2 (en) | 2019-12-05 | 2023-03-14 | DePuy Synthes Products, Inc. | Intrasaccular inverting braid with highly flexible fill material |
| US11672542B2 (en) | 2019-05-21 | 2023-06-13 | DePuy Synthes Products, Inc. | Aneurysm treatment with pushable ball segment |
| US10653425B1 (en) | 2019-05-21 | 2020-05-19 | DePuy Synthes Products, Inc. | Layered braided aneurysm treatment device |
| US11413046B2 (en) | 2019-05-21 | 2022-08-16 | DePuy Synthes Products, Inc. | Layered braided aneurysm treatment device |
| US11278292B2 (en) | 2019-05-21 | 2022-03-22 | DePuy Synthes Products, Inc. | Inverting braided aneurysm treatment system and method |
| US11497504B2 (en) | 2019-05-21 | 2022-11-15 | DePuy Synthes Products, Inc. | Aneurysm treatment with pushable implanted braid |
| US11607226B2 (en) | 2019-05-21 | 2023-03-21 | DePuy Synthes Products, Inc. | Layered braided aneurysm treatment device with corrugations |
| US11253265B2 (en) | 2019-06-18 | 2022-02-22 | DePuy Synthes Products, Inc. | Pull wire detachment for intravascular devices |
| CN114828942A (zh) | 2019-06-28 | 2022-07-29 | 狄奥多西·亚历山大 | 用于短期使用的可移除式机械循环支持装置 |
| US11426174B2 (en) | 2019-10-03 | 2022-08-30 | DePuy Synthes Products, Inc. | Medical device delivery member with flexible stretch resistant mechanical release |
| US11207494B2 (en) | 2019-07-03 | 2021-12-28 | DePuy Synthes Products, Inc. | Medical device delivery member with flexible stretch resistant distal portion |
| CN110501778B (zh) * | 2019-08-16 | 2021-04-30 | 武汉唐联光电科技有限公司 | 一种保偏光纤、制造模具及方法 |
| US11707351B2 (en) | 2019-08-19 | 2023-07-25 | Encompass Technologies, Inc. | Embolic protection and access system |
| KR102359614B1 (ko) | 2020-07-20 | 2022-02-08 | 인제대학교 산학협력단 | 외피 탄성막 고정형 양방향 동맥 도관 |
| US11439403B2 (en) | 2019-09-17 | 2022-09-13 | DePuy Synthes Products, Inc. | Embolic coil proximal connecting element and stretch resistant fiber |
| US11672946B2 (en) | 2019-09-24 | 2023-06-13 | Boston Scientific Scimed, Inc. | Protection and actuation mechanism for controlled release of implantable embolic devices |
| KR102326469B1 (ko) | 2019-10-24 | 2021-11-12 | 인제대학교 산학협력단 | 폐냉동생검을 위한 지혈용 삽입관 유닛 |
| US11712231B2 (en) | 2019-10-29 | 2023-08-01 | Neuravi Limited | Proximal locking assembly design for dual stent mechanical thrombectomy device |
| US11376013B2 (en) | 2019-11-18 | 2022-07-05 | DePuy Synthes Products, Inc. | Implant delivery system with braid cup formation |
| US11517340B2 (en) | 2019-12-03 | 2022-12-06 | Neuravi Limited | Stentriever devices for removing an occlusive clot from a vessel and methods thereof |
| US11457926B2 (en) | 2019-12-18 | 2022-10-04 | DePuy Synthes Products, Inc. | Implant having an intrasaccular section and intravascular section |
| US11457922B2 (en) | 2020-01-22 | 2022-10-04 | DePuy Synthes Products, Inc. | Medical device delivery member with flexible stretch resistant distal portion |
| US11931253B2 (en) | 2020-01-31 | 2024-03-19 | 4C Medical Technologies, Inc. | Prosthetic heart valve delivery system: ball-slide attachment |
| JP6789559B1 (ja) * | 2020-02-12 | 2020-11-25 | リバーフィールド株式会社 | 絶縁シャフト及び高周波鉗子 |
| US11432822B2 (en) | 2020-02-14 | 2022-09-06 | DePuy Synthes Products, Inc. | Intravascular implant deployment system |
| US11871946B2 (en) | 2020-04-17 | 2024-01-16 | Neuravi Limited | Clot retrieval device for removing clot from a blood vessel |
| US11717308B2 (en) | 2020-04-17 | 2023-08-08 | Neuravi Limited | Clot retrieval device for removing heterogeneous clots from a blood vessel |
| US11730501B2 (en) | 2020-04-17 | 2023-08-22 | Neuravi Limited | Floating clot retrieval device for removing clots from a blood vessel |
| US11224436B2 (en) * | 2020-05-21 | 2022-01-18 | Cesar Munoz | Hemorrhage control device |
| EP3861946B1 (en) * | 2020-05-28 | 2022-06-08 | Medinice S.A. | Cannula for percutaneous minimally invasive cannulation of the vena cava |
| US11737771B2 (en) | 2020-06-18 | 2023-08-29 | Neuravi Limited | Dual channel thrombectomy device |
| US11937836B2 (en) | 2020-06-22 | 2024-03-26 | Neuravi Limited | Clot retrieval system with expandable clot engaging framework |
| US11439418B2 (en) | 2020-06-23 | 2022-09-13 | Neuravi Limited | Clot retrieval device for removing clot from a blood vessel |
| US11395669B2 (en) | 2020-06-23 | 2022-07-26 | Neuravi Limited | Clot retrieval device with flexible collapsible frame |
| US11951026B2 (en) | 2020-06-30 | 2024-04-09 | DePuy Synthes Products, Inc. | Implantable medical device detachment system with flexible braid section |
| EP4178478A1 (en) * | 2020-07-13 | 2023-05-17 | Boston Scientific Medical Device Limited | A puncturing device comprising a distal balloon feature |
| IL300392A (en) * | 2020-08-18 | 2023-04-01 | Encompass Tech Inc | Defense system and embolic access |
| US11864781B2 (en) | 2020-09-23 | 2024-01-09 | Neuravi Limited | Rotating frame thrombectomy device |
| US11937837B2 (en) | 2020-12-29 | 2024-03-26 | Neuravi Limited | Fibrin rich / soft clot mechanical thrombectomy device |
| US20220280077A1 (en) * | 2021-03-08 | 2022-09-08 | Douglas Stockton | Glucose electrolysis method and apparatus |
| KR102599998B1 (ko) | 2021-08-17 | 2023-11-07 | 인제대학교 산학협력단 | 양방향 동맥 도관 |
| CN114287991A (zh) * | 2021-12-06 | 2022-04-08 | 贵州中医药大学第一附属医院 | 一种防失效气囊止血带 |
| US11844490B2 (en) | 2021-12-30 | 2023-12-19 | DePuy Synthes Products, Inc. | Suture linkage for inhibiting premature embolic implant deployment |
| US11937824B2 (en) | 2021-12-30 | 2024-03-26 | DePuy Synthes Products, Inc. | Implant detachment systems with a modified pull wire |
| US11937825B2 (en) | 2022-03-02 | 2024-03-26 | DePuy Synthes Products, Inc. | Hook wire for preventing premature embolic implant detachment |
| US11937826B2 (en) | 2022-03-14 | 2024-03-26 | DePuy Synthes Products, Inc. | Proximal link wire for preventing premature implant detachment |
| WO2023186258A1 (en) * | 2022-03-28 | 2023-10-05 | Clearstream Technologies Limited | Delivery systems for implants |
| CN117815518A (zh) * | 2022-09-28 | 2024-04-05 | 神途医疗科技(上海)有限公司 | 封堵导管及医疗系统 |
| WO2024081613A1 (en) * | 2022-10-10 | 2024-04-18 | Artio Medical, Inc. | Medical devices comprising detachable balloon-like implants and methods of manufacturing and use |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4638803A (en) * | 1982-09-30 | 1987-01-27 | Rand Robert W | Medical apparatus for inducing scar tissue formation in a body |
| US6293960B1 (en) * | 1998-05-22 | 2001-09-25 | Micrus Corporation | Catheter with shape memory polymer distal tip for deployment of therapeutic devices |
| CN2680205Y (zh) * | 2004-03-16 | 2005-02-23 | 安丹 | 子宫腔压力止血囊 |
| WO2012099704A2 (en) * | 2011-01-17 | 2012-07-26 | Novita Therapeutics, Llc | Blockstent device and methods of use |
| EP2713961B1 (en) * | 2011-06-03 | 2016-09-28 | Covidien LP | Embolic implant |
Family Cites Families (175)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3794268A (en) | 1970-12-29 | 1974-02-26 | Tee Pak Inc | Tubular films or webs |
| US4471779A (en) | 1976-08-25 | 1984-09-18 | Becton, Dickinson And Company | Miniature balloon catheter |
| US4341218A (en) | 1978-05-30 | 1982-07-27 | University Of California | Detachable balloon catheter |
| US4346712A (en) | 1979-04-06 | 1982-08-31 | Kuraray Company, Ltd. | Releasable balloon catheter |
| US4395806A (en) | 1980-05-08 | 1983-08-02 | Sorenson Research Co., Inc. | Method of manufacturing a detachable balloon catheter assembly |
| US4311146A (en) | 1980-05-08 | 1982-01-19 | Sorenson Research Co., Inc. | Detachable balloon catheter apparatus and method |
| US4364392A (en) | 1980-12-04 | 1982-12-21 | Wisconsin Alumni Research Foundation | Detachable balloon catheter |
| US4416028A (en) | 1981-01-22 | 1983-11-22 | Ingvar Eriksson | Blood vessel prosthesis |
| US4441495A (en) | 1982-08-16 | 1984-04-10 | Becton, Dickinson And Company | Detachable balloon catheter device and method of use |
| US4517979A (en) | 1983-07-14 | 1985-05-21 | Cordis Corporation | Detachable balloon catheter |
| US4770067A (en) | 1987-06-08 | 1988-09-13 | Kollmorgen Corporation | Method of manufacturing surgical cutting tools for thermally aided surgery |
| US5527337A (en) | 1987-06-25 | 1996-06-18 | Duke University | Bioabsorbable stent and method of making the same |
| US4819637A (en) * | 1987-09-01 | 1989-04-11 | Interventional Therapeutics Corporation | System for artificial vessel embolization and devices for use therewith |
| WO1989006551A1 (en) | 1988-01-12 | 1989-07-27 | Kievsky Nauchno-Issledovatelsky Institut Neirokhir | Occluding device |
| US6425893B1 (en) | 1990-03-13 | 2002-07-30 | The Regents Of The University Of California | Method and apparatus for fast electrolytic detachment of an implant |
| US5354295A (en) | 1990-03-13 | 1994-10-11 | Target Therapeutics, Inc. | In an endovascular electrolytically detachable wire and tip for the formation of thrombus in arteries, veins, aneurysms, vascular malformations and arteriovenous fistulas |
| DE69120532T2 (de) | 1990-04-12 | 1997-02-06 | Htc As | Bohrloch und verfahren zu dessen herstellung |
| JP2514087Y2 (ja) | 1990-05-25 | 1996-10-16 | 幸三 牧田 | 離脱式両端逆止弁付きバル―ン |
| US5167627A (en) | 1990-09-13 | 1992-12-01 | Abbott Laboratories | Stoma creator gastrostomy device and method for placement of a feeding tube |
| US5282847A (en) | 1991-02-28 | 1994-02-01 | Medtronic, Inc. | Prosthetic vascular grafts with a pleated structure |
| EP0581866B1 (en) * | 1991-04-24 | 1998-03-04 | Baxter International Inc. | Exchangeable integrated-wire balloon catheter |
| US5222970A (en) | 1991-09-06 | 1993-06-29 | William A. Cook Australia Pty. Ltd. | Method of and system for mounting a vascular occlusion balloon on a delivery catheter |
| US5327885A (en) | 1991-10-08 | 1994-07-12 | Griffith James M | Combination catheter for invasive probe delivery and balloon dilation |
| EP0549100A1 (en) | 1991-12-20 | 1993-06-30 | Interventional Technologies Inc | Catheter balloon formed from a polymeric composite |
| US5250059A (en) | 1992-01-22 | 1993-10-05 | Devices For Vascular Intervention, Inc. | Atherectomy catheter having flexible nose cone |
| US5382261A (en) | 1992-09-01 | 1995-01-17 | Expandable Grafts Partnership | Method and apparatus for occluding vessels |
| US5370691A (en) | 1993-01-26 | 1994-12-06 | Target Therapeutics, Inc. | Intravascular inflatable stent |
| CA2114988A1 (en) | 1993-02-05 | 1994-08-06 | Matthew O'boyle | Ultrasonic angioplasty balloon catheter |
| US5522836A (en) | 1994-06-27 | 1996-06-04 | Target Therapeutics, Inc. | Electrolytically severable coil assembly with movable detachment point |
| US5695468A (en) * | 1994-09-16 | 1997-12-09 | Scimed Life Systems, Inc. | Balloon catheter with improved pressure source |
| US5752522A (en) | 1995-05-04 | 1998-05-19 | Cardiovascular Concepts, Inc. | Lesion diameter measurement catheter and method |
| US6099558A (en) | 1995-10-10 | 2000-08-08 | Edwards Lifesciences Corp. | Intraluminal grafting of a bifuricated artery |
| US5843117A (en) | 1996-02-14 | 1998-12-01 | Inflow Dynamics Inc. | Implantable vascular and endoluminal stents and process of fabricating the same |
| US6270477B1 (en) * | 1996-05-20 | 2001-08-07 | Percusurge, Inc. | Catheter for emboli containment |
| US20050245894A1 (en) | 1996-05-20 | 2005-11-03 | Medtronic Vascular, Inc. | Methods and apparatuses for drug delivery to an intravascular occlusion |
| US5833671A (en) | 1996-06-17 | 1998-11-10 | Cardeon Corporation | Triple lumen catheter with controllable antegrade and retrograde fluid flow |
| US5980514A (en) | 1996-07-26 | 1999-11-09 | Target Therapeutics, Inc. | Aneurysm closure device assembly |
| GB9616267D0 (en) | 1996-08-02 | 1996-09-11 | Ranier Ltd | Balloon catheter |
| US6186978B1 (en) | 1996-08-07 | 2001-02-13 | Target Therapeutics, Inc. | Braid reinforced infusion catheter with inflatable membrane |
| US5980530A (en) | 1996-08-23 | 1999-11-09 | Scimed Life Systems Inc | Stent delivery system |
| US6395008B1 (en) | 1996-08-23 | 2002-05-28 | Scimed Life Systems, Inc. | Stent delivery device using stent cups and mounting collars |
| EP1007139A1 (en) | 1997-02-12 | 2000-06-14 | Prolifix Medical, Inc. | Apparatus for removal of material from stents |
| US5769817A (en) | 1997-02-28 | 1998-06-23 | Schneider (Usa) Inc. | Coextruded balloon and method of making same |
| GB9713624D0 (en) | 1997-06-28 | 1997-09-03 | Anson Medical Ltd | Expandable device |
| GB9715241D0 (en) | 1997-07-18 | 1997-09-24 | Jeffree Martin A | Device for treating aneurysms |
| ATE339919T1 (de) | 1997-08-04 | 2006-10-15 | Boston Scient Ltd | Okklussionssystem zum ausbessern eines aneurysmas |
| US6063070A (en) | 1997-08-05 | 2000-05-16 | Target Therapeutics, Inc. | Detachable aneurysm neck bridge (II) |
| EP0917886B1 (en) | 1997-10-23 | 2003-10-01 | Schneider (Europe) GmbH | Seal for catheter assembly with dilation and occlusion balloon |
| CA2326504A1 (en) | 1998-03-30 | 1999-10-07 | David Forest Kallmes | Flow arrest, double balloon technique for occluding aneurysms or blood vessels |
| US7713297B2 (en) | 1998-04-11 | 2010-05-11 | Boston Scientific Scimed, Inc. | Drug-releasing stent with ceramic-containing layer |
| US6463317B1 (en) | 1998-05-19 | 2002-10-08 | Regents Of The University Of Minnesota | Device and method for the endovascular treatment of aneurysms |
| US6719773B1 (en) | 1998-06-01 | 2004-04-13 | Kyphon Inc. | Expandable structures for deployment in interior body regions |
| US7410482B2 (en) | 1998-09-04 | 2008-08-12 | Boston Scientific-Scimed, Inc. | Detachable aneurysm neck bridge |
| US6152144A (en) | 1998-11-06 | 2000-11-28 | Appriva Medical, Inc. | Method and device for left atrial appendage occlusion |
| US6723112B2 (en) | 1998-11-10 | 2004-04-20 | Scimed Life Systems, Inc. | Bioactive three loop coil |
| US8016852B2 (en) | 1998-11-10 | 2011-09-13 | Stryker Corporation | Bioactive components for incorporation with vaso-occlusive members |
| US6146372A (en) | 1998-12-24 | 2000-11-14 | Datascope Investment Corp | Apparatus and method for the percutaneous insertion of a pediatric intra-aortic balloon catheter |
| US7329236B2 (en) | 1999-01-11 | 2008-02-12 | Flowmedica, Inc. | Intra-aortic renal drug delivery catheter |
| US6187034B1 (en) | 1999-01-13 | 2001-02-13 | John J. Frantzen | Segmented stent for flexible stent delivery system |
| US6022359A (en) | 1999-01-13 | 2000-02-08 | Frantzen; John J. | Stent delivery system featuring a flexible balloon |
| US6312405B1 (en) | 1999-02-02 | 2001-11-06 | American Medical Systems, Inc. | Self-sealing detachable balloon |
| US6258099B1 (en) | 1999-03-31 | 2001-07-10 | Scimed Life Systems, Inc. | Stent security balloon/balloon catheter |
| US6270521B1 (en) | 1999-05-21 | 2001-08-07 | Cordis Corporation | Stent delivery catheter system for primary stenting |
| US20020169473A1 (en) | 1999-06-02 | 2002-11-14 | Concentric Medical, Inc. | Devices and methods for treating vascular malformations |
| US20070299422A1 (en) | 1999-06-21 | 2007-12-27 | Olle Inganas | Surgical device, method for operation thereof and body-implantable device |
| CA2376903A1 (en) | 1999-06-25 | 2001-01-04 | Emory University | Devices and methods for vagus nerve stimulation |
| US6409754B1 (en) | 1999-07-02 | 2002-06-25 | Scimed Life Systems, Inc. | Flexible segmented stent |
| US7527622B2 (en) | 1999-08-23 | 2009-05-05 | Cryocath Technologies Inc. | Endovascular cryotreatment catheter |
| US6293968B1 (en) | 1999-09-02 | 2001-09-25 | Syde A. Taheri | Inflatable intraluminal vascular stent |
| US6733513B2 (en) | 1999-11-04 | 2004-05-11 | Advanced Bioprosthetic Surfaces, Ltd. | Balloon catheter having metal balloon and method of making same |
| US20070129746A1 (en) | 1999-12-09 | 2007-06-07 | Mische Hans A | Methods and devices for the treatment of neurological and physiological disorders |
| US6350270B1 (en) | 2000-01-24 | 2002-02-26 | Scimed Life Systems, Inc. | Aneurysm liner |
| US6346117B1 (en) | 2000-03-02 | 2002-02-12 | Prodesco, Inc. | Bag for use in the intravascular treatment of saccular aneurysms |
| US6988983B2 (en) | 2000-04-14 | 2006-01-24 | Solace Therapeutics, Inc. | Implantable self-inflating attenuation device |
| KR100387384B1 (ko) | 2000-07-26 | 2003-06-12 | 규 호 이 | 색전 물질 분리 검출 시스템 및 그의 방법과 색전술용어셈블리 |
| US6855154B2 (en) | 2000-08-11 | 2005-02-15 | University Of Louisville Research Foundation, Inc. | Endovascular aneurysm treatment device and method |
| US6527761B1 (en) | 2000-10-27 | 2003-03-04 | Pulmonx, Inc. | Methods and devices for obstructing and aspirating lung tissue segments |
| US20060135947A1 (en) | 2000-10-27 | 2006-06-22 | Pulmonx | Occlusal stent and methods for its use |
| US6893456B2 (en) * | 2000-12-22 | 2005-05-17 | Advanced Cardiovascular Systems, Inc. | Catheter and method for making the same |
| US6547804B2 (en) | 2000-12-27 | 2003-04-15 | Scimed Life Systems, Inc. | Selectively permeable highly distensible occlusion balloon |
| CA2435304C (en) * | 2001-01-19 | 2010-01-05 | Boston Scientific Limited | Introducer for deployment of branched prosthesis |
| US20030027330A1 (en) | 2001-04-02 | 2003-02-06 | Robert Lanza | Method for facilitating the production of differentiated cell types and tissues from embryonic and adult pluripotent and multipotent cells |
| US6855153B2 (en) | 2001-05-01 | 2005-02-15 | Vahid Saadat | Embolic balloon |
| US6692510B2 (en) | 2001-06-14 | 2004-02-17 | Cordis Neurovascular, Inc. | Aneurysm embolization device and deployment system |
| US6454780B1 (en) | 2001-06-21 | 2002-09-24 | Scimed Life Systems, Inc. | Aneurysm neck obstruction device |
| US7572288B2 (en) | 2001-07-20 | 2009-08-11 | Microvention, Inc. | Aneurysm treatment device and method of use |
| US6811560B2 (en) | 2001-09-20 | 2004-11-02 | Cordis Neurovascular, Inc. | Stent aneurysm embolization method and device |
| AU2002337598A1 (en) | 2001-10-04 | 2003-04-14 | Neovasc Medical Ltd. | Flow reducing implant |
| US7572287B2 (en) | 2001-10-25 | 2009-08-11 | Boston Scientific Scimed, Inc. | Balloon expandable polymer stent with reduced elastic recoil |
| US20030135265A1 (en) | 2002-01-04 | 2003-07-17 | Stinson Jonathan S. | Prostheses implantable in enteral vessels |
| US7060089B2 (en) | 2002-01-23 | 2006-06-13 | Boston Scientific Scimed, Inc. | Multi-layer stent |
| US7288111B1 (en) | 2002-03-26 | 2007-10-30 | Thoratec Corporation | Flexible stent and method of making the same |
| US20030187492A1 (en) | 2002-03-27 | 2003-10-02 | Mchale Tom | Curved wing balloon and manufacture thereof |
| US20030208221A1 (en) * | 2002-05-02 | 2003-11-06 | Fozan El-Nounou | Catheter with a coiled support member |
| US7338511B2 (en) | 2002-05-24 | 2008-03-04 | Boston Scientific-Scimed, Inc. | Solid embolic material with variable expansion |
| US7070606B2 (en) | 2002-05-28 | 2006-07-04 | Mercator Medsystems, Inc. | Methods and apparatus for aspiration and priming of inflatable structures in catheters |
| US20040002752A1 (en) | 2002-06-26 | 2004-01-01 | Scimed Life Systems, Inc. | Sacrificial anode stent system |
| US7309334B2 (en) | 2002-07-23 | 2007-12-18 | Von Hoffmann Gerard | Intracranial aspiration catheter |
| US7037319B2 (en) | 2002-10-15 | 2006-05-02 | Scimed Life Systems, Inc. | Nanotube paper-based medical device |
| US8328710B2 (en) * | 2002-11-06 | 2012-12-11 | Senorx, Inc. | Temporary catheter for biopsy site tissue fixation |
| DE10302241A1 (de) | 2003-01-22 | 2004-08-05 | Czerwinski, Frank, Dr. | Ballonimplantat zur Okkludierung von Aneurysmen |
| US7744583B2 (en) | 2003-02-03 | 2010-06-29 | Boston Scientific Scimed | Systems and methods of de-endothelialization |
| CA2523777C (en) | 2003-03-14 | 2016-05-10 | Light Sciences Corporation | Light generating device to intravascular use |
| DE602004018282D1 (de) | 2003-03-17 | 2009-01-22 | Ev3 Endovascular Inc | Stent mit laminierter dünnfilmverbund |
| US7527632B2 (en) | 2003-03-31 | 2009-05-05 | Cordis Corporation | Modified delivery device for coated medical devices |
| US20040230290A1 (en) | 2003-05-15 | 2004-11-18 | Jan Weber | Medical devices and methods of making the same |
| US20040236278A1 (en) | 2003-05-22 | 2004-11-25 | Atrium Medical Corp. | Therapeutic agent delivery |
| US7632291B2 (en) | 2003-06-13 | 2009-12-15 | Trivascular2, Inc. | Inflatable implant |
| US20050090888A1 (en) | 2003-10-28 | 2005-04-28 | Hines Richard A. | Pleated stent assembly |
| WO2005044361A1 (en) | 2003-11-07 | 2005-05-19 | Merlin Md Pte Ltd | Implantable medical devices with enhanced visibility, mechanical properties and biocompatibility |
| US8652502B2 (en) | 2003-12-19 | 2014-02-18 | Cordis Corporation | Local vascular delivery of trichostatin A alone or in combination with sirolimus to prevent restenosis following vascular injury |
| US20050137619A1 (en) | 2003-12-19 | 2005-06-23 | Scott Schewe | Molds and related methods and articles |
| US7316709B2 (en) | 2004-01-13 | 2008-01-08 | Advanced Cardiovascular Systems, Inc. | Balloon catheter having a textured member for enhancing balloon or stent retention |
| US7803178B2 (en) | 2004-01-30 | 2010-09-28 | Trivascular, Inc. | Inflatable porous implants and methods for drug delivery |
| WO2005082276A1 (en) * | 2004-02-23 | 2005-09-09 | Uromedica, Inc. | Method and apparatus for fecal continence |
| US8777974B2 (en) | 2004-03-19 | 2014-07-15 | Aga Medical Corporation | Multi-layer braided structures for occluding vascular defects |
| EP1765429A2 (en) | 2004-05-12 | 2007-03-28 | Medtronic Vascular, Inc. | Drug-polymer coated stent |
| US8388671B2 (en) | 2004-07-15 | 2013-03-05 | Medtronic Vascular, Inc. | Methods for treatment of aneurysmal tissue |
| US20060079923A1 (en) * | 2004-08-09 | 2006-04-13 | Manik Chhabra | Aneurysm treatment using semi-compliant balloon |
| US8409282B2 (en) | 2004-10-20 | 2013-04-02 | Vertiflex, Inc. | Systems and methods for posterior dynamic stabilization of the spine |
| US20090297582A1 (en) | 2004-11-26 | 2009-12-03 | Biomerix Corporation | Vascular occlusion devices and methods |
| US8292944B2 (en) | 2004-12-17 | 2012-10-23 | Reva Medical, Inc. | Slide-and-lock stent |
| PE20060861A1 (es) | 2005-01-07 | 2006-10-25 | Celonova Biosciences Inc | Soporte oseo tridimensional implantable |
| US20060155367A1 (en) | 2005-01-07 | 2006-07-13 | Hines Richard A | Micro-pleated stent assembly |
| CN100589767C (zh) | 2005-02-06 | 2010-02-17 | 桑戈S.A.S.迪卡塔尼里塔有限公司 | 通过牵拉静脉瓣的相互接合的壁恢复静脉瓣的机能的外部支撑 |
| US20060206199A1 (en) | 2005-03-12 | 2006-09-14 | Churchwell Stacey D | Aneurysm treatment devices |
| EP1707161B1 (en) | 2005-03-30 | 2012-09-05 | Terumo Kabushiki Kaisha | Stent and stent delivery device |
| WO2007006139A1 (en) | 2005-07-12 | 2007-01-18 | Smart Biotech Inc. | Aneurysm occlusion device |
| EP2359943B1 (en) | 2005-11-08 | 2014-01-22 | SurModics, Inc. | Ultra-thin photo-polymeric coatings and uses thereof |
| US20070135826A1 (en) * | 2005-12-01 | 2007-06-14 | Steve Zaver | Method and apparatus for delivering an implant without bias to a left atrial appendage |
| WO2007076308A2 (en) | 2005-12-15 | 2007-07-05 | Stout Medical Group, L.P. | Expandable support device and method of use |
| US20070150041A1 (en) | 2005-12-22 | 2007-06-28 | Nellix, Inc. | Methods and systems for aneurysm treatment using filling structures |
| US20070185231A1 (en) | 2006-01-23 | 2007-08-09 | Liu Y K | Bone cement composite containing particles in a non-uniform spatial distribution and devices for implementation |
| US20080077164A1 (en) | 2006-02-24 | 2008-03-27 | National University Of Ireland, Galway | Minimally Invasive Intravascular Treatment Device |
| JP2007236472A (ja) | 2006-03-06 | 2007-09-20 | Terumo Corp | カテーテル |
| US7771451B2 (en) | 2006-04-05 | 2010-08-10 | Boston Scientific Scimed, Inc. | Method and apparatus for the deployment of vaso-occlusive coils |
| US20070288083A1 (en) | 2006-05-12 | 2007-12-13 | Hines Richard A | Exclusion Device and System For Delivery |
| EP1982655B2 (de) | 2007-04-16 | 2022-12-07 | Occlutech Holding AG | Occluder zum Verschliessen eines Herzohres und Herstellungsverfahren dafür |
| WO2008063455A1 (en) | 2006-11-13 | 2008-05-29 | Hines Richard A | Over-the wire exclusion device and system for delivery |
| WO2008074027A1 (en) * | 2006-12-13 | 2008-06-19 | Biomerix Corporation | Aneurysm occlusion devices |
| US20100241178A1 (en) * | 2008-06-02 | 2010-09-23 | Loma Vista Medical, Inc. | Inflatable medical devices |
| US20080188825A1 (en) | 2007-02-01 | 2008-08-07 | Liliana Atanasoska | Catheters and medical balloons |
| US20080188923A1 (en) | 2007-02-01 | 2008-08-07 | Jack Fa-De Chu | Endovascular devices to protect aneurysmal wall |
| AU2008254770A1 (en) | 2007-05-18 | 2008-11-27 | Stryker Corporation | Medical implant detachment systems |
| WO2009018289A2 (en) | 2007-07-30 | 2009-02-05 | Tini Alloy Company | Method and devices for preventing restenosis in cardiovascular stents |
| US8046897B2 (en) | 2007-09-28 | 2011-11-01 | Abbott Cardiovascular Systems Inc. | Method and apparatus for stent retention on a balloon catheter |
| US20090112158A1 (en) | 2007-10-29 | 2009-04-30 | Velasco Regina | Medical device including a thin metallic film component attached to a polymeric component and associated methods |
| BRPI0819404B8 (pt) | 2007-12-11 | 2021-06-22 | Univ Cornell | estrutura esférica expansível, sistema de vedação de aberturas na parede lateral de um vaso sanguíneo ou outro lúmen do corpo, dispositivo endoluminal e dispositivo para posicionamento em um vaso sanguíneo adjacente a um aneurisma |
| US20160206321A1 (en) | 2008-05-01 | 2016-07-21 | Aneuclose Llc | Aneurysm Occlusion Device with Sequence of Shape-Changing Embolic Members |
| JP2011519300A (ja) | 2008-05-01 | 2011-07-07 | アニュクローズ エルエルシー | 動脈瘤閉塞装置 |
| BRPI0911923B8 (pt) | 2008-05-02 | 2021-06-22 | Sequent Medical Inc | dispositivo para tratamento de um aneurisma cerebral |
| AU2009289479B2 (en) | 2008-09-05 | 2014-10-30 | Cardiopolymers, Inc. | Process for generating microwalled encapsulation balloons |
| EP2367503A1 (en) | 2008-11-25 | 2011-09-28 | AttenueX Technologies, Inc. | Implant with high vapor pressure medium |
| US8308798B2 (en) | 2008-12-19 | 2012-11-13 | Edwards Lifesciences Corporation | Quick-connect prosthetic heart valve and methods |
| JP4312255B1 (ja) | 2008-12-22 | 2009-08-12 | 規方 田熊 | 動脈瘤塞栓具、及びその取り扱い方法 |
| WO2010085344A1 (en) | 2009-01-22 | 2010-07-29 | Cornell University | Method and apparatus for restricting flow through the wall of a lumen |
| EP2408402B1 (en) | 2009-03-17 | 2020-05-06 | Stryker Corporation | Joint-spacing balloon catheter |
| CN101843949A (zh) | 2009-03-26 | 2010-09-29 | 东莞市迪凯精密管材有限公司 | 抗菌型ptca球囊导管 |
| US8758423B2 (en) | 2009-06-18 | 2014-06-24 | Graftcraft I Goteborg Ab | Device and method for treating ruptured aneurysms |
| WO2011075745A2 (en) | 2009-12-18 | 2011-06-23 | Palmaz Scientific, Inc. | Interosteal and intramedullary implants and method of implanting same |
| CN102770091B (zh) * | 2010-01-28 | 2015-07-08 | 泰科保健集团有限合伙公司 | 脉管重塑装置 |
| US9211396B2 (en) | 2010-02-23 | 2015-12-15 | Covidien Lp | Devices and methods for vascular recanalization |
| US20110264185A1 (en) | 2010-04-21 | 2011-10-27 | Thomas Haslinger | Balloon catheter and balloon mold to facilitate marker placement and method for using same |
| US8261423B2 (en) | 2010-04-30 | 2012-09-11 | Abbott Cardiovascular Systems Inc. | Methods for crimping a polymeric stent onto a delivery balloon |
| US8268382B2 (en) | 2010-07-12 | 2012-09-18 | Medtronic Vascular, Inc. | Method of making a stent with hollow struts |
| US11484318B2 (en) | 2011-01-17 | 2022-11-01 | Artio Medical, Inc. | Expandable body device and method of use |
| US20120283768A1 (en) * | 2011-05-05 | 2012-11-08 | Sequent Medical Inc. | Method and apparatus for the treatment of large and giant vascular defects |
| US9101507B2 (en) | 2011-05-18 | 2015-08-11 | Ralph F. Caselnova | Apparatus and method for proximal-to-distal endoluminal stent deployment |
| AU2012366236B2 (en) * | 2012-01-17 | 2017-10-12 | Artio Medical, Inc. | Expandable body device and method of use |
| US9084857B2 (en) * | 2012-04-16 | 2015-07-21 | W. L. Gore & Associates, Inc. | Single access flow-reversal catheter devices and methods |
| US9283100B2 (en) | 2012-05-16 | 2016-03-15 | Abbott Cardiovascular Systems Inc. | Polymer scaffold with multi-pleated balloon |
| KR102309795B1 (ko) | 2012-11-13 | 2021-10-08 | 코비디엔 엘피 | 폐색 장치 |
| US8992817B2 (en) * | 2012-12-10 | 2015-03-31 | Abbott Cardiovascular Systems, Inc. | Process of making a medical balloon |
| AU2014232323B2 (en) | 2013-03-15 | 2019-02-14 | Artio Medical, Inc. | Expandable body device and method of use |
| CA2957601C (en) | 2014-09-17 | 2021-11-02 | Metactive Medical, Inc. | Expandable body device and method of use |
-
2015
- 2015-09-17 CA CA2957601A patent/CA2957601C/en active Active
- 2015-09-17 KR KR1020177010354A patent/KR20170056666A/ko not_active Application Discontinuation
- 2015-09-17 CN CN201580062443.6A patent/CN107530090B/zh active Active
- 2015-09-17 BR BR112017005170-2A patent/BR112017005170B1/pt active IP Right Grant
- 2015-09-17 US US15/512,519 patent/US11033275B2/en active Active
- 2015-09-17 JP JP2017514868A patent/JP2017528247A/ja active Pending
- 2015-09-17 RU RU2017112929A patent/RU2721288C2/ru active
- 2015-09-17 WO PCT/US2015/050783 patent/WO2016044647A2/en active Application Filing
- 2015-09-17 AU AU2015317507A patent/AU2015317507A1/en not_active Abandoned
- 2015-09-17 EP EP15841152.0A patent/EP3193746A4/en not_active Withdrawn
- 2015-09-17 NZ NZ768100A patent/NZ768100A/en not_active IP Right Cessation
- 2015-09-17 EP EP21163511.5A patent/EP3906862A1/en active Pending
- 2015-09-17 NZ NZ728984A patent/NZ728984A/en not_active IP Right Cessation
- 2015-09-17 TW TW104131097A patent/TWI732743B/zh not_active IP Right Cessation
- 2015-09-17 RU RU2020115524A patent/RU2020115524A/ru unknown
- 2015-09-17 TW TW110120805A patent/TWI789782B/zh active
-
2017
- 2017-02-07 IL IL250496A patent/IL250496A0/en unknown
-
2018
- 2018-06-26 HK HK18108160.7A patent/HK1248499A1/zh unknown
-
2020
- 2020-07-14 AU AU2020205241A patent/AU2020205241B2/en not_active Ceased
- 2020-10-07 JP JP2020170088A patent/JP7121088B2/ja active Active
-
2022
- 2022-08-04 JP JP2022124904A patent/JP2022160578A/ja active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4638803A (en) * | 1982-09-30 | 1987-01-27 | Rand Robert W | Medical apparatus for inducing scar tissue formation in a body |
| US6293960B1 (en) * | 1998-05-22 | 2001-09-25 | Micrus Corporation | Catheter with shape memory polymer distal tip for deployment of therapeutic devices |
| CN2680205Y (zh) * | 2004-03-16 | 2005-02-23 | 安丹 | 子宫腔压力止血囊 |
| WO2012099704A2 (en) * | 2011-01-17 | 2012-07-26 | Novita Therapeutics, Llc | Blockstent device and methods of use |
| CN103391797A (zh) * | 2011-01-17 | 2013-11-13 | 诺维塔治疗有限责任公司 | 可脱离金属球囊递送装置和方法 |
| CN103476349A (zh) * | 2011-01-17 | 2013-12-25 | 诺维塔治疗有限责任公司 | 球囊支架装置和使用方法 |
| EP2713961B1 (en) * | 2011-06-03 | 2016-09-28 | Covidien LP | Embolic implant |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107530090B (zh) | 可扩张体装置和使用方法 | |
| AU2019203321B2 (en) | Expandable body device and method of use | |
| US11484318B2 (en) | Expandable body device and method of use | |
| EP2806825B1 (en) | Expandable body device |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1248499 Country of ref document: HK |
|
| CB02 | Change of applicant information |
Address after: Kansas, USA Applicant after: AteO medical company Address before: Kansas, USA Applicant before: Metak Pharmaceutical |
|
| CB02 | Change of applicant information | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |