CN107250348B - 使用表达lgr4、lgr5和lgr6的上皮干细胞在组织应用中开发和使用最小极性化功能细胞微聚集体单元的方法 - Google Patents
使用表达lgr4、lgr5和lgr6的上皮干细胞在组织应用中开发和使用最小极性化功能细胞微聚集体单元的方法 Download PDFInfo
- Publication number
- CN107250348B CN107250348B CN201580075326.3A CN201580075326A CN107250348B CN 107250348 B CN107250348 B CN 107250348B CN 201580075326 A CN201580075326 A CN 201580075326A CN 107250348 B CN107250348 B CN 107250348B
- Authority
- CN
- China
- Prior art keywords
- tissue
- lgr
- lgr6
- wound
- cells expressing
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/36—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix
- A61L27/38—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells
- A61L27/3804—Materials for grafts or prostheses or for coating grafts or prostheses containing ingredients of undetermined constitution or reaction products thereof, e.g. transplant tissue, natural bone, extracellular matrix containing added animal cells characterised by specific cells or progenitors thereof, e.g. fibroblasts, connective tissue cells, kidney cells
- A61L27/3813—Epithelial cells, e.g. keratinocytes, urothelial cells
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N1/00—Preservation of bodies of humans or animals, or parts thereof
- A01N1/02—Preservation of living parts
- A01N1/0205—Chemical aspects
- A01N1/021—Preservation or perfusion media, liquids, solids or gases used in the preservation of cells, tissue, organs or bodily fluids
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N1/00—Preservation of bodies of humans or animals, or parts thereof
- A01N1/02—Preservation of living parts
- A01N1/0205—Chemical aspects
- A01N1/021—Preservation or perfusion media, liquids, solids or gases used in the preservation of cells, tissue, organs or bodily fluids
- A01N1/0221—Freeze-process protecting agents, i.e. substances protecting cells from effects of the physical process, e.g. cryoprotectants, osmolarity regulators like oncotic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0625—Epidermal cells, skin cells; Cells of the oral mucosa
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2430/00—Materials or treatment for tissue regeneration
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2513/00—3D culture
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- General Health & Medical Sciences (AREA)
- Zoology (AREA)
- Medicinal Chemistry (AREA)
- Wood Science & Technology (AREA)
- Dermatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Cell Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Epidemiology (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Transplantation (AREA)
- Environmental Sciences (AREA)
- Dentistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Microbiology (AREA)
- Biochemistry (AREA)
- General Engineering & Computer Science (AREA)
- Botany (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Endocrinology (AREA)
- Diabetes (AREA)
- Materials For Medical Uses (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Peptides Or Proteins (AREA)
- Developmental Biology & Embryology (AREA)
Abstract
本文提供的是微聚集体多细胞、最小极性化移植物的构建体,其含有表达含有富含亮氨酸重复序列的G‑蛋白偶联受体(LGR)的细胞,用于伤口治疗应用、组织工程学、细胞疗法应用、再生医学应用、医学/治疗应用、组织愈合应用、免疫疗法应用和组织移植疗法应用,其优选与递送载体/基底/支持物/支架联合以用于直接施用。
Description
优先权声明
本PCT国际申请要求2015年11月30日提交的美国系列号14/954335的优先权,其本身要求2014年12月2日提交的美国临时申请系列号62/086,526的权益,所述申请通过引用结合到本文中。
技术领域
本发明涉及含有表达含有富含亮氨酸重复序列的G-蛋白偶联受体(LGR)的细胞的微聚集体多细胞移植物的构建体,用于伤口治疗应用、组织工程学、细胞疗法应用、再生医学应用、医学/治疗应用、组织愈合应用、免疫疗法应用和组织移植疗法应用。更具体而言,本发明提供用于直接施用的在递送载体/基底/支持物/支架上的可递送微聚集体多细胞LGR构建体。
背景
多年以来,临床医生和研究人员在寻找这样的抗微生物剂,其不仅减轻微生物伤口负荷,还具有更小的细胞毒性副作用。从烧伤到急性和慢性伤口二者,存在操作天然存在的源于自身的抗微生物肽的可能性,因为这些物质通常通过膜透化作用起作用,其为较不可能导致微生物耐药性的机制。随着伤口中感染的持续风险以及对现有抗生素疗法的细菌耐药性的渐进流行,对开发用于皮肤烧伤和创伤的新一类局部抗微生物剂存在真正需求。
基本上存在伤口愈合的四个阶段,其在过去的一个世纪里进行阐述:(1)止血阶段,(2)炎症阶段,(3)增生阶段和(4)重塑阶段。这些连续阶段首先通过迁移到伤口中的细胞类型来定义,并随后通过在组织内表达的细胞因子和生长因子的类型来定义。
随着在间充质细胞和脂肪来源的干细胞分离和移植方面的最新进展,研究人员已开始研究这些细胞如何在各阶段改进愈合并改变表达,特别是贯穿晚期炎症阶段至重塑阶段。非常类似于较深层区室的间充质细胞和脂肪来源的干细胞,上皮干细胞从原始外胚层形成,其随后形成更表面的上皮区室,并因此在皮肤伤口愈合中亦具有潜在作用。目前对于移植和施用分离的表达LGR4、LGR5和LGR6的上皮干细胞如何改变伤口愈合基因表达,只有有限的研究。
已知的是,在对皮肤的严重全厚度损伤之后,表达LGR4、LGR5和LGR6的上皮干细胞群体常常被破坏,使组织不能产生可存活且自我维持的上皮区室。尽管有通过局部炎症和后续的一系列细胞实体的趋化作用驱动的肉芽组织形成(granulatory)和纤维变性作用的组合,在没有上皮干细胞局灶龛(focal niche)的情况下,剩余组织不具有形成功能上皮、毛囊、汗腺等的再生潜能。
对人和哺乳动物组织的复合性全厚度损伤和/或涉及多个组织成分(皮肤、肌肉、脂肪、血管、神经和骨)的复合性损伤,本质上难以愈合。通过当前伤口护理方法、使有当前获准技术的手术干预(利用细胞、组织、装置、生物制品、药物和/或生长因子),治疗所述损伤和后续所致的伤口亦很困难。所述困难的一个常见原因为,保留在受伤或受损组织床之中或周围的组织通常缺乏相互依赖的必需组分:1)祖细胞和/或干细胞群体;2)胞外基质/支架成分和基底;和3)细胞实体和基底之间的相互作用的组合。细胞龛、ECM(胞外基质)支架和相关交互界面的这种缺乏,随后导致不能再生或生成细胞迁移、分化和组织极性化所需的基本多维结构。在没有这些细胞与细胞和细胞与基质相互作用的情况下,伤口床内的剩余细胞实体(不论其增殖或谱系潜能)被迫主要提供屏障效用,而不是形成能够进行可识别“功能”的更复杂的多组织构建体。因此,不论是否涉及皮肤、肌肉、脂肪、腱、骨,伤口均随后变为有瘢痕、杂乱且机能失调的。
在培养皮肤、软骨、骨、肌肉、血管、神经、淋巴和相关替代物的组织工程学领域的当前应用,主要基于三部分策略:1)获得组织来源并从所述组织收获细胞悬液;2)将这些细胞施用至基质或支架;和3)将构建体移植到人或动物的靶部位之上或之中。然而,在缺乏上文确定的相互依赖的必需组分的情况下,组织工程学应用、细胞疗法应用、再生医学应用、组织愈合应用和组织移植疗法应用不具有有能力装配功能极性化组织所需的天然细胞微聚集体结构。因此,因缺乏适当的相互依赖、祖细胞群和适当的支架所致,阻止了所述构建体用于诸如多区室组织再生和/或骨和肌肉重建等治疗性应用。
因此,部分因前述原因所致,产业界和学术界二者将大量努力和资源引导至开发合成组织替代物、自体移植构建体以及患者来源的表皮扩张自体移植物(即来自CambridgeMA的Vericel Corporation的)。尽管这些产品有益,但常常很昂贵,且不能给患者提供真正的多区室组织构建体。例如,培养的上皮自体移植物(CEA)仍不能修复在天然皮肤中见到的上皮和真皮区室二者。但是鉴于缺少相互依赖的功能性区室,培养细胞不具有形成真正定义皮肤的体被(表皮、真皮、腺体和毛发)所需的扩展的局部干细胞群和逐渐发展的组织极性化。该缺乏继而导致单细胞层脆性、上皮不稳定性、屏障破坏和瘢痕。
备选地,诸如来自LifeCell Corporation的来自IntegraLifeSciences Corporation的和来自Musculoskeletal TransplantFoundation的产品等更稳健的非细胞基质,尽管是优秀的重建选项,但缺乏形成功能天然组织所必需的适当安置的谱系特异性干细胞群。
本发明人已记述了关于LGR5和LGR6作为哺乳动物中的肠和表皮干细胞两者的标志物的相对较新的认识。在用肠来源的人α防御素5刺激毛囊隆突LGR5+和LGR6+干细胞导致减少的细菌存在,增强的伤口愈合以及从缺乏附属结构的组织中的毛发生长(Stimulationof the Follicular Bulge LGR5+and LGR6+Stem Cells with the Gut-Derived HumanAlpha Defensin 5Results in Decreased Bacterial Presence,Enhanced WoundHealing,and Hair Growth from Tissues Devoid of Adnexal Structures),Plast.Reconstr.Surg.132:1159,2013中,含有富含亮氨酸重复序列的G-蛋白偶联受体(LGR)为与促卵泡激素、促甲状腺激素和促黄体生成素受体家族具有显著序列和结构同源性的七次跨膜蛋白受体。
在该研究中,认识的是,与人β防御素1和磺胺嘧啶相比,人α防御素5肽显著增强伤口愈合并减少基础细菌负荷。人α防御素5为诱导LGR干细胞迁移到伤口床中的唯一疗法。此外,基因热图显示关键伤口愈合和Wnt途径转录物(例如Wnt1和Wisp1等)的显著的mRNA上调。因此推断通过增加关键的Wnt和伤口愈合转录物,人α防御素5可用于增进伤口愈合,因为观察到增加的LGR干细胞迁移到伤口床中以及相关细菌减少和毛发产生。简单说来,该工作及其它工作使得认识到在直接生物医学工程软组织构建体中使用表达LGR4+、LGR5+和LGR6+的上皮干细胞的可能性。
发明概述
在第一个实施方案中,本发明提供一种最小极性化的微聚集体多细胞组合物,其包含分离的表达LGR的活细胞和选自支架、胶原、基质、颗粒和纤维的多维支持物。
在前述实施方案的进一步实施方案中,本发明提供一种最小极性化的微聚集体多细胞组合物,其包含分离的表达LGR的活细胞和选自支架、胶原、基质、颗粒和纤维的多维支持物,其中对表达LGR的细胞补充生长因子,且其中表达LGR的细胞选自LGR4、LGR5和LGR6。
在任何前述实施方案的进一步实施方案中,本发明提供一种最小极性化的微聚集体多细胞组合物,其包含分离的表达LGR的活细胞和选自支架、胶原、基质、颗粒和纤维的多维支持物,其中对表达LGR的细胞补充迁移/募集分析物,且表达LGR的细胞选自LGR4、LGR5和LGR6。
在任何前述实施方案的进一步实施方案中,本发明提供一种最小极性化的微聚集体多细胞组合物,其包含分离的表达LGR的活细胞和选自支架、胶原、基质、颗粒和纤维的多维支持物,其中对表达LGR的细胞补充选自配体家族、R脊椎蛋白(R-spondin)、EDGF、PDGF、Wnt、VEGF和抗微生物肽的LGR特异性结合成分,且其中表达LGR的细胞选自LGR4、LGR5和LGR6。
在任何前述实施方案的进一步实施方案中,本发明提供一种最小极性化的微聚集体多细胞组合物,其包含分离的表达LGR的活细胞和选自支架、胶原、基质、颗粒和纤维的多维支持物,其中组合物用作治疗性构建体用于由组织区域、伤口、空隙、缺损组织或血液组成的所选靶标,以改变任一种周围邻近组织。
在任何前述实施方案的进一步实施方案中,本发明提供一种最小极性化的微聚集体多细胞组合物,其特征在于分离的表达LGR的活细胞被移植到受损组织以加速其愈合。
在任何前述实施方案的进一步实施方案中,本发明提供用于在身体各处的组织系统修复或恢复的最小极性化的微聚集体多细胞组合物,其包含具有与之固定的分离的含LGR细胞的支持支架。
在任何前述实施方案的进一步实施方案中,本发明提供用于在哺乳动物身体各处施用于外胚层、中胚层或内胚层来源的组织系统的组织移植物。
本发明的另一个实施方案特征在于用于获得最小极性化的微聚集体多细胞组合物的方法,其特征在于生长和分离表达LGR的活细胞以移植到所选哺乳动物靶组织的步骤。
在前述方法的进一步实施方案中,本发明提供用于获得最小极性化的微聚集体多细胞组合物的方法,特征在于生长和分离表达LGR的活细胞以移植到所选哺乳动物靶组织的步骤,进一步特征在于使分离的表达LGR的活细胞附着于选自支架、胶原、基质、颗粒和纤维的多维支持物上的步骤。
在又另一个实施方案中,本发明特征在于用于获得最小极性化的微聚集体多细胞组合物的方法,特征在于生长和分离表达LGR的活细胞以移植到所选哺乳动物靶组织的步骤,进一步特征在于从LGR4、LGR5和LGR6中选择表达LGR的细胞的步骤。
在任何前述方法实施方案的进一步实施方案中,本发明提供将最小极性化的微聚集体多细胞组合物施用于上皮系统、腺体、毛发、神经、骨、肌肉、脂肪、腱、血管、筋膜、眼组织和肽分泌性细胞成分之一的步骤,其采用通过选自以下的技术来递送:施用、移植、植入、定向接种、定向迁移、定向追踪、沉淀(in setting)、层压(laminating)和/或注射细胞成分,用于产生、再生、增强和愈合。
在任何前述方法实施方案的进一步实施方案中,本发明提供用于获得最小极性化的微聚集体多细胞组合物的方法,特征在于生长和分离表达LGR的活细胞以移植到所选哺乳动物靶组织的步骤,进一步特征在于将最小极性化的微聚集体多细胞组合物直接施用于体内组织以进行组织修复的步骤。
在任何前述方法实施方案的进一步实施方案中,本发明提供用于获得最小极性化的微聚集体多细胞组合物的方法,特征在于生长和分离表达LGR的活细胞以移植到所选哺乳动物靶组织的步骤,进一步特征在于将最小极性化的微聚集体多细胞组合物经由血流间接施用于身体以进行组织修复的步骤。
在又另一个实施方案中,本发明特征在于用于产生最小极性化的微聚集体多细胞组合物的方法,其特征在于以下步骤:
a)获得组织样品;
b)从样品中提取含表达LGR的细胞的最小极性化功能单元;
c)加工来自适当来源的皮下组织和皮下脂肪细胞组分;
d)向提取的最小极性化功能单元中加入经加工的皮下组织和皮下脂肪组分,以产生上皮干细胞单一(singularity)单元;
e)富集上皮干细胞单一单元;
f)向构建体支架添加上皮干细胞单一单元;和
g)验证所得组合物的最小极性化的维持。
在任何前述实施方案的进一步实施方案中,本发明提供用于获得最小极性化的微聚集体多细胞组合物的培养基配方,其使用细胞维持培养基组合物以在组织的运输和加工期间降低微生物的生存力,特征在于:a)上皮细胞和角质形成细胞的混合物;b)至少一种选自青霉素、链霉素和两性霉素B的药剂;和c)纤维蛋白原。
在前述实施方案的进一步实施方案中,本发明提供用于在组织的运输和加工期间降低微生物的生存力的细胞维持培养基组合物,其特征在于:a)上皮细胞和角质形成细胞的混合物;b)至少一种选自青霉素、链霉素和两性霉素B的药剂;和c)纤维蛋白原,其中纤维蛋白原为人类的且其中药剂包括用于稳定人组织的抗生素和抗真菌药二者。
在本发明的第一方面的情况下,其特征在于将表达LGR的细胞施用于支架、基质和/或纤维,从而建立用于组织工程学应用、细胞疗法应用、再生医学应用、医学/治疗应用的微聚集体多细胞移植物,将移植物直接施用于组织或血液以在身体各处改进和/或改变上皮系统。
本发明的第二方面特征在于在施用于组织或血液以改进和/或改变体内上皮系统之前或之后,在含或不含另外的增强因子或分析物的情况下,将表达LGR的细胞施用于支架、基质和/或纤维。
本发明的又一方面特征在于通过增强因子或分析物改变表达LGR的细胞,将其作为身体、组织或血液中的靶标施用,用于通过在身体各处的局部或远端迁移来改进和/或改变上皮系统和/或修复腺体和毛发生长。
本发明的第四方面特征在于从组织、血液或培养物中移植表达LGR的细胞以改变周围邻近组织或远端组织,例如但不限于,在施用于组织或血液以在身体各处改进和/或改变外胚层、中胚层或内胚层来源的组织系统之前或之后,将表达LGR的细胞施用于支架、基质和纤维。
本发明的第五方面特征在于在施用于组织或血液以在身体各处改进和/或改变外胚层、中胚层或内胚层来源的组织系统之前或之后,在含或不含另外的增强因子或分析物的情况下将表达LGR的细胞直接施用于选自支架、基质和纤维的递送基底载体。
本发明的又另一方面特征在于将通过增强因子或分析物改变的表达LGR的细胞与递送支持基底组合,作为身体、组织或血液中的靶标,用于在身体各处通过局部或远端迁移在身体各处改进和/或改变外胚层、中胚层或内胚层来源的组织系统。
本发明的又一个方面特征在于使表达LGR的细胞附着于支持基底,其用于递送、施用、移植、植入、定向接种、定向迁移、定向追踪、沉淀、层压和/或注射细胞成分,用于产生、再生、增强和/或愈合上皮系统、腺体、毛发、神经、骨、肌肉、脂肪、腱、血管、筋膜、眼组织和肽分泌性细胞成分。
本发明的最后说明方面为产生作为微聚集体多细胞功能单元的表达LGR的干细胞,其表现出最小极性化,用于移植和直接施用于哺乳动物身体、组织或血液中的靶标,以增强和加速组织产生、再生、增强和/或愈合。
概括地,本文的发明考虑移植和/或递送分离的表达LGR的细胞(含有富含亮氨酸重复序列的G-蛋白偶联受体)用于产生、再生、募集或增强上皮系统、毛发、腺体、骨。本发明亦考虑在补充或未补充生长因子、迁移/募集分析物或LGR特异性结合成分(例如但不限于配体家族:R-脊椎蛋白、EDGF、PDGF、Wnt、VEGF、抗微生物肽)的情况下,使用呈支架、基质或纤维形式的递送载体,施用于临床医学、生物工程和/或研究构建体中的局部/近端和远端/远距离组织。
使用LGR上皮干细胞,特别是联合成形的支架基底,给上皮系统中的全厚度伤口和/或空隙提供富含干细胞的组织替代物。此外,向上皮系统中添加该最小极性化的功能细胞单元(MPFU)增强/改进该上皮的状态,其包括维持和促进上皮和局部周围组织成分的健康和生存力通常所需的毛发、腺体、分泌性抗微生物肽、生长因子和分析物的生长、产生或再生。
认识到LGR4+、LGR5+和LGR6+干细胞和祖细胞增殖动力学保持较高,特别是当与基底支架接触时,所以完全上皮更新(turnover)速率通常少于12天(1cm群体间距离间隔)。这种再生足够的双层组织及后续屏障功能的能力,表明这些细胞作为用于复合型全厚度和多组织创伤的一类逐渐发展的生物敷料的作用。
除快速再生皮肤、肌肉和骨的能力之外,LGR4、LGR5和LGR6干细胞的祖细胞亦具有产生天然抗微生物肽的能力,其不仅降低伤口床中微生物的基础水平,还增进祖细胞扩增和分化,导致减少伤口和伤口周边感染,加速伤口闭合和毛囊形成。
本文的发明描述了表达LGR的上皮干细胞接种的支架在提供即用的可递送和活组织屏障中的转化(translational)适用性,所述屏障能够维持具有伴随的活性子代的干细胞集落灶。从这些干细胞灶中,子代可经历迁移增殖-分化,以刺激上皮组织成分、愈合和移植物整合。已发现的是,LGR上皮干细胞可单独施用、与促进支架结合群体的极性化的支架、可溶性生长因子和/或另外的细胞系以及在上皮愈合和细胞再生作用中所需的内在组织结构一起施用。
广泛定义的是,本发明的方案包括:a)收获活的人/哺乳动物组织;b)加工组织成分以生成含表达LGR的细胞的微聚集体多细胞功能单元;c)将表达LGR的细胞微聚集体多细胞功能单元施用于选自支架、基质、颗粒、细胞和纤维的递送载体基底以产生构建体;d)任选包含所选的额外的增强因子;和e)将构建体施用于组织以产生、再生、增强和/或愈合组织系统,包括涉及外胚层、中胚层和/或内胚层原始组织的组织系统,包括但不限于皮肤、腺体、毛发、神经、骨、肌肉、脂肪、腱、血管、筋膜、眼组织、骨髓、肺、心、指(趾)甲、胃肠组织、口腔组织、牙、味蕾、泌尿生殖组织、肾组织、生殖组织、淋巴组织、免疫系统组织/成分和这类相关的附属物和蛋白质细胞成分。
本发明考虑通过施用、移植、植入、定向接种、定向迁移、定向追踪、沉淀、层压和/或注射细胞成分来直接递送经支持的表达LGR的上皮干细胞,以在疗法、装置、生物制品、药物和生物工程中改变哺乳动物组织。
定义
在此详述中,提及“一个实施方案”、“实施方案”或“在实施方案中”,意指所提及的特征包含在本发明的至少一个实施方案中。此外,分开提及“一个实施方案”、“实施方案”或“多个实施方案”,不一定是指相同的实施方案;然而,除非这样规定,且除对本领域技术人员而言将是容易显而易见的,否则二者并非互相排斥的实施方案。因此,本发明可包括本文所述实施方案的任意多种组合和/或整合。本文使用的术语仅以描述具体实施方案为目的,且不旨在限制本发明。
除非上下文另外明确指出,否则本文使用的单数形式“一个”、“一种”和“所述”,亦旨在包括复数形式。要进一步理解的是,词根术语“包括”和/或“具有”,当用于本说明书时,规定所述特征、步骤、操作、成分和/或组分的存在,但不排除存在或添加至少一个其它特征、步骤、操作、成分、组分和/或其群组。
本文使用的骨,意指由嵌入矿化基质(ground substance)和胶原纤维的基质(matrix)中的细胞组成的硬结缔组织。纤维浸渍有无机组分,包括磷酸钙的晶体,由此使用X-射线衍射,其显示为以羟磷灰石形式(磷酸钙为85%重量)以及碳酸钙(10%)和镁构成;按重量,骨由65-75%无机物和25-35%有机物构成;一部分确定形状和大小的骨组织,形成动物骨骼的一部分;在人类中,在骨骼中存在约200块不同的骨,不包括鼓室中的听小骨或者除两块膝盖骨之外的籽骨。骨被纤维膜(骨膜)包被,除关节软骨之外,其覆盖骨的整个表面。在骨膜之下为致密层(骨密质),且在其之下为海绵状层(骨松质)。长骨的核心充满骨髓。
本文使用的术语“包含(comprises)”、“含有(comprising)”、“包括(includes)”、“包括(including)”、“有”、“具有”或其任何其它变化,意图涵盖非排他性包含物。例如,包含一系列特征的过程、方法、制品或设备,不一定仅限于所述特征,还可包含未在所述过程、方法、制品或设备中明确列出或并非其固有的其它特征。
如在本文中使用的上皮,意指覆盖所有游离表面、皮肤、粘液和浆液的细胞层,包括来源于其中的腺体及其它结构。
如在本文中使用的GMP,意指药品生产质量管理规范(good manufacturingpractices)。
如在本文中使用的体被,意指身体的包被膜;除表皮和真皮之外,包括表皮、毛发、指(趾)甲、汗腺和皮脂腺及乳腺的所有衍生物,以及皮下组织。
如在本文中使用的LGR4,意指含有富含亮氨酸重复序列的G蛋白偶联受体4,为在多种生理功能中起重要作用的G蛋白偶联受体(GPCR)。富含亮氨酸GPCR(LGR)家族的成员,例如GPR48,具有多个N-端富含亮氨酸重复序列(LRR)和7-跨膜结构域。LGR4(含有富含亮氨酸重复序列的G蛋白偶联受体4)为蛋白质编码基因。与LGR4相关的疾病包括低骨矿物质密度。其相关的途径包括Wnt信号传导途径(KEGG)。涉及该基因的GO注释包括G-蛋白偶联受体活性和跨膜信号传导受体活性。该基因的一个重要旁系同源物(paralog)为LGR6。用于R-脊椎蛋白的受体增强典型Wnt信号传导途径并涉及多种器官的形成。在与R-脊椎蛋白(RSPO1、RSPO2、RSPO3或RSPO4)结合之后,与通过胞外Wnt受体激活的磷酸化LRP6和frizzled受体结合,触发典型Wnt信号传导途径以增加靶基因的表达。
与经典的G-蛋白偶联受体相比,LGR4不激活异源三聚体G-蛋白以转导信号。其作为Wnt信号传导途径的激活物的功能,为多种器官的发育所必需的,所述器官包括肝、肾、肠、骨、生殖道和眼。LGR4亦可充当norrin(NDP)的受体,且在精子发生期间为必需的,以在小管周肌样细胞中激活Wnt信号传导途径。同样,需要LGR4来维持出生后肠隐窝中的肠干细胞和帕内特细胞分化。除涉及肾发育之外,LGR4亦充当骨形成和重塑的调节物;为将输尿管芽维持在未分化状态所必需。LGR4涉及眼前段的发育,在红细胞生成期间为必需的,且通过抑制TLR2/TLR4相关的模式识别和促炎细胞因子产生来充当先天免疫的负调节物。LGR在调节血浆脂质的昼夜节律中起重要作用,部分地通过调节MTTP的节律性表达进行(通过类似方式)。用于LGR4的通常已知的别名包括:GPR48;G蛋白偶联受体48;BNMD17;含有富含亮氨酸重复序列的G蛋白偶联受体4;含有富含亮氨酸重复序列的G-蛋白偶联受体4;和G-蛋白偶联受体48。用于LGR4的外部数据库标识符包括:HGNC:13299、Entrez Gene:55366、Ensembl:ENSG00000205213、OMIM:606666和UniProtKB:Q9BXB。
如在本文中使用的LGR5,意指含有富含亮氨酸重复序列的G蛋白偶联受体5,为蛋白质编码基因。其相关的途径包括Wnt信号传导途径(KEGG)。涉及该基因的GO注释包括G-蛋白偶联受体活性和跨膜信号传导受体活性。该基因的一个重要旁系同源物为LGR6。LGR5受体用于R-脊椎蛋白,其增强典型Wnt信号传导途径并充当肠上皮和毛囊的干细胞标志物。在与R-脊椎蛋白(RSPO1、RSPO2、RSPO3或RSPO4)结合之后,与通过胞外Wnt受体激活的磷酸化LRP6和frizzled受体结合,触发典型Wnt信号传导途径以增加靶基因的表达。与经典的G-蛋白偶联受体相比,LGR5不激活异源三聚体G-蛋白以转导信号。其在胚后发育期间涉及成体肠干细胞的发育和/或维持。用于LGR5的通常已知的别名包括:G-蛋白偶联受体HG38;G-蛋白偶联受体49;G-蛋白偶联受体67;GPR67;GPR49和含有富含亮氨酸重复序列的G-蛋白偶联受体5。用于LGR5的外部数据库标识符包括HGNC:4504、Entrez Gene:8549、Ensembl:ENSG00000139292、OMIM:606667和UniProtKB:O75473。
如在本文中使用的LGR6,意指含有富含亮氨酸重复序列的G蛋白偶联受体6,其为蛋白质编码基因,该基因编码G蛋白偶联的7-跨膜蛋白超家族的含有富含亮氨酸重复序列的亚族的成员。编码的蛋白质为具有大型N-端胞外结构域的糖蛋白激素受体,其含有对形成用于配体结合的马蹄形相互作用基序而言重要的富含亮氨酸的重复序列。该基因的选择剪接得到多种转录物变体。与LGR6相关的疾病包括粘液水肿和卵巢囊腺瘤。其相关的途径包括Wnt信号传导途径(KEGG)和GPCR。涉及该基因的其它注释包括G-蛋白偶联受体活性和跨膜信号传导受体活性。该基因的一个重要旁系同源物为TSHR。用于R-脊椎蛋白的受体增强典型Wnt信号传导途径并充当表皮中的多能干细胞的标志物。在与R-脊椎蛋白(RSPO1、RSPO2、RSPO3或RSPO4)结合之后,与通过胞外Wnt受体激活的磷酸化LRP6和frizzled受体结合,触发典型Wnt信号传导途径以增加靶基因的表达。与经典的G-蛋白偶联受体相比,LGR6不激活异源三聚体G-蛋白以转导信号且可充当肿瘤抑制物。用于LGR6的常见别名包括:促性腺激素受体;VTS20631和GPCR。用于LGR6的外部数据库标识符包括HGNC:19719、EntrezGene:59352、Ensembl:ENSG00000133067、OMIM:606653和UniProtKB:Q9HBX8。
如在本文中使用的间充质,意指间充质细胞的聚集物。由间充质细胞组成的原始胚胎结缔组织,通常呈星状形式,在层间胶状物中得到支持。
如在本文中使用的肌肉,意指主要由高度特化的收缩细胞组成的基本组织,其可分为骨骼肌、心肌或平滑肌;在显微镜下,后者缺乏其它两种类型的横纹特征;其为通过其实现多个器官和部件的运动的身体的收缩性器官之一;典型的肌肉为通过腱在各末端附着于骨或其它结构的一群肌纤维(突起或肌腹);更近端或更固定的附着称为起点(q.v.),更远端或更加可活动的附着为止点(q.v.);附着于起点的腱的肌腹的变窄部分称为头或头部。
如在本文中使用的神经的(Neural),意指包括由神经细胞或其突起构成的任何结构,或者在进一步发育后将进化成神经细胞的任何结构。涉及椎体或其前体的背侧,其中具有脊髓,与血管相反。
如在本文中使用且除非明确相反说明,否则“或”是指可兼或且不是指异或。例如,下列的任一项均满足条件A或B:A为真(或存在)且B为假(或不存在),A为假(或不存在)和B为真(或存在),以及A和B二者均为真(或存在)。
颗粒的含义在本文中意味着十微米或更小的最大域,且包括但不限于纳米粒子、大分子缔合物、胶束、血影细胞(cell ghost)、树枝状聚合物等等,其可充当用于细胞微聚集体的合适的锚。
如在本文中使用的极性,意指细胞、组织和/或生物体沿轴差异发育的趋势。
如在本文中使用的脉冲复苏培养基(PRM),为细胞维持培养基混合物的配方,包含角质形成细胞-SFM(1X)、选自青霉素、链霉素和两性霉素B的抗生素-抗真菌药和纤维蛋白原,其中角质形成细胞-SFM由上皮细胞和角质形成细胞的混合物构成。使用所述试剂以稳定原代组织并降低微生物在运输和加工期间的生存力。
如在本文中使用的皮肤,意指身体的膜状保护性覆盖物,由表皮和真皮(dermis(corium))组成。
如在本文中使用的干细胞,意指任何前体细胞;具有可分化成其它细胞类型的子细胞的细胞;能够在给一个或多个细胞系输出子代的同时维持其自身数量的细胞。
如在本文中使用的“基本上”、“一般”和其它程度词,均为相对修饰词,旨在指示与如此修饰的特征的允许偏差。不旨在限于其修饰的绝对值或特征,而是与其对立面相比具有更多物理或功能特征,以及优选靠近或接近这样的物理或功能特征。
如在本文中使用的组织,意指相似细胞及围绕其的细胞间物质的集合。身体中存在四种基本类型的组织:上皮组织;结缔组织,包括脂肪组织、血、骨和软骨;肌肉组织;和神经组织。任何身体或部位的外皮、被膜或覆盖物。
在下列描述中,参考这样的附图,提供其用于说明目的。以足以使本领域技术人员能够实施本发明的详细程度来阐述下文图解的实施方案。要理解的是,可采用其它实施方案,且可在不背离本发明范围的情况下进行基于目前已知结构和/或功能等同物的结构改变。
附图简述
图1A描述所述皮肤来源的表达LGR的细胞的位置的实例。
图1B为荧光激活的细胞分选图表。
图1C为考虑联合本发明使用的一系列不同的非细胞支持物的照片。
图2A为可用于接种的整体细胞构建体/去细胞化胶原支架的照片。
图2B为在接种部分消化细胞的聚集体之后的胶原构建体的免疫荧光显微照片。
图3A-3F通过不同的技术显示一系列不同LGR6+上皮干细胞接种基底的多个图像。
图4A描述对照和接种LGR的基质的实例的体内愈合进展的延时摄影。图4B为第十天的细胞角蛋白-17转录物表达的图示表达。图4C-E描述通过生物发光成像和扫描电子显微镜术,对照和接种LGR ESC的基质。
图5A-E描述具有LGR ESC和基质血管部分细胞分离群的构建体的实例,显示初始极性化形式,随附图表比较。
图6A-B描述含和不含基质血管部分细胞实体的含LGR细胞的构建体的实例,以及生长因子的相对产生量。
图7A-H阐述三度伤口床诱导并验证LGR干细胞毛囊隆突和附属结构的去除。
图8A-Q描述具有DEFA5的伤口/损伤/空隙涉及细菌粘附的时间进展。
图9A和B为伤口床内的表达DEFA5的细胞实体的对比照片,其涉及在缺乏附属结构的情况下在治疗的烧伤伤口中增强愈合、组织和附属物再生及后续毛发生长。
图10A-L阐述在用局灶剂处理之后的伤口床愈合动力学以及进入烧伤组织的LGR5和LGR6干细胞迁移的定量。
图11A和B阐述涉及增强促愈合途径的与SDZ相比的用DEFA5处理的伤口/损伤/组织空隙的RT-PCR定量和基因热图比较。
图12A-1阐述毛囊细胞的LGR6表达和共表达LGR6+、CD34+CD73+GFP标记细胞的荧光激活的细胞分选术,用于培养扩大。
图13A-D为在初始接种和1天之后的时间,通过共聚焦显微镜和生物发光的功能单一单元(aFSU)的显微照片。
图13E为胶原支架的显微照片。
图14A-E描述LGR细胞位置多样性的实例,其涉及皮肤组织内的位置、表型、界面和极性。从毛囊隆突处分离和培养LGR6+ESC。
图15A-E提供表达LGR的细胞灶的实例,其涉及通过放置在伤口/损伤/组织空隙周围和/或之中来递送的方法。
图16A-D描述含LGR的干细胞灶的实例,其涉及经由可递送载体递送到伤口之中和周围以及组织和支持结构的后续治愈、再生。
图17A-D显示移植之后10天在全厚度伤口床中的LGR6+上皮干细胞迁移和分化。
图18提供具有表达LGR的细胞灶的伤口/损伤/组织空隙的RT-PCR定量和插入的基因热图比较。
图19描述涉及递送到伤口/损伤/组织空隙之中和/或周围并增强伤口愈合因子的所述表达LGR的细胞灶的实例。
图20A-F阐述涉及骨组织的再生的表达LGR的细胞灶的实例。分离的LGR灶可接种至骨并保持活性。
发明详述
图1A-C为存在于毛囊周围的细胞群体的流式细胞术和在接种时所述细胞容易附着的支架的实例。更具体而言,图1A描述皮肤来源的所述表达LGR的细胞的位置的实例。40x放大倍数下的免疫荧光共聚焦显微镜描述毛囊隆突(白色箭头)、LGR6+(绿色)、DNA(蓝色)。图1B为荧光激活的细胞分选图表,门分析指出示例性细胞标志物。图1C描述可用于接种根据本发明的一系列非细胞基质/基底/支架/材料的一组细胞类型。
图2A为不含根据本发明的含表达LGR的干细胞灶的微聚集体多细胞功能单元的整体构建体的实例的摄像显示。图2B描述在用部分消化细胞的聚集体接种基底之后的构建体。
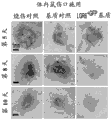
图3A为分列格式的通过微分干涉差(DIC)共聚焦显微镜的LGR接种的来自不同来源的基底的图像系列。图3B为通过20x放大倍数下的免疫荧光共聚焦显微镜的LGR6+ESC接种的含表达LGR的细胞的各构建体的基质的对应列。插入的白框表示在图3D列中显示的局部放大区,而图3C为描述图3A的各图像(DIC)和图3B的免疫荧光的数字合并的列,指出基质轮廓和边界。图3E和3F的列分别表示以非细胞基质对照和接种后72小时的相应的LGR6+ESC接种的基质的辐射效率测得的生物发光。
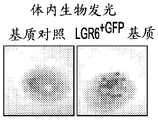
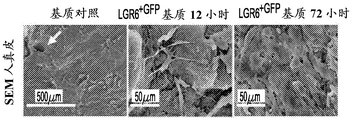
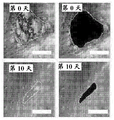
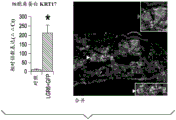
图4A-E描述放入活的哺乳动物系统中的所述含LGR构建体的实例。放置LGR6+GFPESC接种的基质增强治愈毛囊生长。图4A为不含基质(烧伤对照)、含基质(基质对照)和LGR6+GFP ESC的3mm人去细胞化真皮全厚度烧伤伤口床在第5天、第8天和第10天的3x3显微照片矩阵。图4B图示描述图4A中所述的伤口床在第10天的细胞角蛋白-17转录物表达的相对表达。使用作为ImageJ NCBI应用中的百分面积函数的伤口床愈合率的定量分析来确定愈合的伤口床百分数。伤口对照仅包含烧伤伤口床。基质对照仅包含基质,而LGR6+GFP包含用LGR6+GFP ESC接种的ADM。图4C为第5天在鼠全厚度烧伤伤口床中的体内生物发光成像的显微照片。图4D为对照以及在接种ESC之后的12小时和72小时的含LGR6+GFP的真皮在100x下的人真皮的显微照片。白色箭头指示皮肤小孔的存在。图4E提供对照和含有具有防止干燥的硅酮保护覆盖物的用ESC接种的人真皮的本发明的构建体的图像。LGR6+GFP基质图像包括一对小黑箭头,指出来自全厚度Nu/Nu鼠伤口床的新生毛发块(hair patch)。
图5A-E描述所述构建体的实例,向LGR6+ESC接种的基质添加基质血管部分(SVF)在促进组织极性化和双区室皮肤样系统中的作用。图5A为在接种至代表性肾上腺髓质素(ADM)(例如可以名称获自Integra LifeSciences Corporation)之后24小时的5x105个表达RFP的基质血管部分细胞的分离群的20x共聚焦成像。图5B为在接种至代表性ADM之后24小时的5x105个表达GFP的LGR6+的细胞分离群的20x共聚焦图像。图5C描述在培养中共同接种之后24小时的用5x105个表达RFP的SVF和5x105个表达GFP的LGR6+分离群双重接种的代表性ADM的20x共聚焦成像。图5D为在培养中生长5天之后的含5x105个表达RFP的SVFRFP和5x105个表达GFP的LGR6+的共同接种的基质。平行虚线指出蓄积在ADM基底边缘的上皮LGR6+GFP谱系。小括弧和大括弧指出与LGR6+GFP和SVFRFP丰度相关的两个区室的相对位置。标有箭头的“U”形实线指出含有通过32号无菌针头诱导的预接种孔的区域。图5E为使用绿色表达LGR的细胞和红色表达SVF的细胞共同接种的胶原基底的增殖动力学的图示。
图6A和6B描述含或不含支持性细胞实体的含LGR细胞的构建体的实例,以及生长因子的相对产生量。来自富含LGR6+GFP ESC和SVFRFP的支架培养构建体的促血管发生转录物和蛋白质分析物的相关表达谱。图6A图示了来自总RNA的指定基因成分的转录物相对倍数表达(ΔΔCT):在各支架基底上的LGR6+GFP ESC(黑色条)、SVFRFP(灰色条)和共培养LGR6+GFPESC+SVFRFP(白框)。x轴上方的显著性(LGR6+SVF)表示所指示支架上的共培养LGR6+GFP ESC+SVFRFP表达与单一LGR6+GFP ESC和SVFRFP表达的相互比较。例如,除共培养(+LGR6+SVF)之外,共培养基质的平均FGF-2基因表达均高于两种单一系统(支架+LGR6或+SVF)的平均表达。x轴下方的显著性(LGR6)或(SVF)指示在细胞实体保持不变时基底的内部比较。例如,单独的+LGR6+GFP ESC与单独的+LGR6+GFP ESC的VEGF-A基因表达无显著性(NS)。图6B图示来自总蛋白质分离物的所指示蛋白质分析物的相对密度单位(RDU):各支架基底上的LGR6+GFP ESC(黑色条)、SVFRFP(灰色条)和共培养LGR6+GFP ESC+SVFRFP(白框)。(*)表示(p值<0.05),一式三份完成测定,GAPDH看家基因对照。
图7A-H阐述接受增加进入伤口(称为三度伤口床)中的LGR细胞迁移、增殖和生存力的治疗实例的伤口/损伤/空隙,诱导并验证LGR干细胞毛囊隆突和附属结构的去除。图7A描述3mm直径的伤口床模板标记。图7B描述第0天的伤口床结构(白色比例尺为1mm)。图7C图示2x3 3mm伤口床网格的实例。图7D显示在伤口部位局部施用重悬浮的肽。图7E为具有毛囊和附属结构的未烧伤完整体被/皮肤的H&E染色的显微照片。箭头指示放大的毛囊的位置(插图),其中白色比例尺为500μm。图7F为在高温烧灼之后的鼠背部皮肤的H&E染色,其显示去除了包括毛囊隆突在内的表皮、真皮和皮下组织。图7G为具有毛囊和附属结构的未烧伤完整皮肤的DAPI/DNA染色(4’,6-二脒基-2-苯基吲哚)。箭头指示免疫荧光LGR5和LGR6抗体(分别为绿色和红色)共同标记的放大的毛囊(插图)。图7H为在高温烧灼之后的鼠背部皮肤的DAPI/DNA染色,其显示去除了包括毛囊隆突在内的表皮、真皮和皮下组织,其中白色比例尺为100μm。
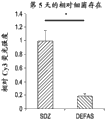
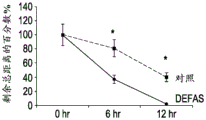
图8A-Q描述涉及五天和十天时间内的抗微生物性能的具有LGR的伤口/损伤/空隙。使用16S rRNA荧光寡核苷酸探针,原位杂交指出三度烧伤伤口床处细菌粘附的存在。图8A显示每天用SDZ处理的在烧伤诱导之后第五天的3度烧伤伤口床的DNA/DAPI标记。在图8B中,描述了每天用SDZ处理的在烧伤诱导之后第五天的3度烧伤伤口床细菌生物(黄色颗粒)的经5’-Cy3-EUB338标记的16s rRNA。图8C为图8A和8B的数字合并图像。图8D对应于图8A,除了在第十天用DNA/DAPI标记每天用SDZ处理的3度烧伤伤口床。相应地,图8E为每天用SDZ处理的在烧伤诱导之后第十天的3度烧伤伤口床细菌生物(黄色颗粒)的经5’-Cy3-EUB338标记的16s rRNA的显微照片。图8F为图8D和E的合并图像。图8G-8L为分别对应于图8A-F的五天和十天烧伤后时期的图像,但经历使用防御素、α5(DEFA5)而不是SDZ进行每天处理。H中的箭头表示具有覆盖的含纤维物质的组织的界面,其中在DEFA5处理的情况下观察到更少细菌。带有插图8N的图8M显示用SDZ处理且每单位面积含更多16s rRNA标记的伤口床的Cy3荧光灰度转换图像的白像素强度的定量。图8O和插图8P相应地显示用DEFA5处理且每单位面积含减少的16s rRNA标记的伤口床的Cy3荧光灰度转换图像(插图p)的白像素强度的定量。使用灰度成像软件,该插图描述第五天在SDZ和DEFA5处理的烧伤伤口床二者中表达的16s rRNA的平均白像素强度。最后,图8Q为说明第五天在SDZ和DEFA5处理的烧伤伤口床二者中表达的16s rRNA的平均红色通道荧光的图表。图8H中的白色箭头指示DEFA5处理的伤口床中的潜在的膜,和图8M中的黑色箭头指示白像素强度。比例尺100μm。(*)表示p值<0.05。
图9A和B为表示伤口内的表达LGR的细胞实体的实例的一系列时间进展照片,其涉及在缺乏附属结构的情况下在治疗的烧伤伤口中增强愈合、组织和附属物再生以及后续毛发生长、伤口愈合动力学和新生毛发生长。使用Leica Wild M680外科显微镜对包括图9A在内的照片系列进行整体成像,以将在用指定药剂MQH2O、DEFA5、DEFB1、SDZ处理时在10天内的3度烧伤伤口床的愈合成像。白色比例尺代表1mm。图9B的第二照片系列同样包括使用Leica Wild M680进行整体成像,以并排比较DEFA5与对照处理的伤口床来追踪在16天内的3度烧伤伤口床的新生毛发生长。白色箭头指示新毛发的生长。同样,比例尺为1mm。
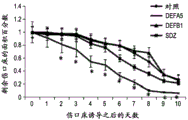
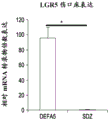
图10A-L包括涉及增强所述实体的愈合、增殖的伤口/损伤/组织空隙中的所述表达LGR的细胞实体的实例。包括图10K和10L在内的图表提供在用局灶剂处理之后的伤口床愈合动力学以及进入烧伤组织的LGR5和LGR6干细胞迁移的定量的证据。简单说来,这些测试用于确认来自对LGR5和LGR6成像的定量共聚焦显微强度模式,且是基于对烧伤伤口组织的反转录酶聚合酶链反应。如在图表中所示,与第5天在磺胺嘧啶处理伤口中的LGR5和LGR6的未检出水平相比,发现在人α防御素5中的平均LGR5和LGR6 mRNA表达分别为95.8±10.6和259.2±20.2(图4,右)。在人α防御素5处理的组织和用磺胺嘧啶处理的样品中的这些倍数水平比较的数量级,表明迁移到伤口中的表达LGR5和LGR6的细胞的绝对存在或者绝对缺乏定义倍数值。
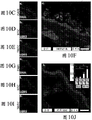
转向具体附图,图10A显示具有代表1mm的白色比例尺的伤口区域的照片,且以黑色显示伤口面积计算。图10B以图表显示在指定局灶剂施用的10天时间内表达为剩余伤口面积的百分数%的平均伤口愈合率。星号(*)代表p值<0.05。图10C-J为在第5天的DEFA5处理伤口床的LGR5和LGR6免疫荧光抗体标记,其中图10C为DNA/DAPI/蓝,图10D为LGR5/FITC/绿,图10E为LGR6/TRITC/红,和图10F为10C-10E的合并。图10G-I为在第5天的SDZ(磺胺嘧啶)处理伤口床的对应的LGR5和LGR6免疫荧光抗体标记(DNA/DAPI/蓝、LGR5/FITC/绿和LGR6/TRITC/红)。图10J为10G-10I的合并图像且包含使用在第5天的每个伤口床的绿色和红色荧光强度显示平均LGR5和LGR6表达的插图。显示从反转录酶PCR定量RNA的倍数增加获得的比较值,所述RNA提取自用DEFA5和SDZ处理的伤口床重复。白色比例尺50μm且同样地,星号(*)代表p值<0.05。
图11A和B阐述涉及增强促愈合途径的具有放入伤口中的表达LGR的细胞实体的伤口/损伤/组织空隙。所述附图分别代表与SDZ相比的用DEFA5处理的伤口床的RT-PCR定量和基因热图比较。这些附图显示人α防御素5相对于磺胺嘧啶在增强伤口中的关键转录物表达的作用。结果显示在与磺胺嘧啶疗法进行比较时,在接受人α防御素5的伤口床内,数个基因亚组显著上调,且在LGR干细胞系统响应肠道和皮肤二者中的Wnt配体中,某些Wnt途径基因亚组显著上调。
图11A显示对于将DEFA5与SDZ处理系统进行比较的伤口床,具有倍数调节的平均伤口愈合RT2-PCR阵列途径热图和相应的基因图。图11B显示对于将DEFA5与SDZ处理系统进行比较的伤口床,具有倍数调节的平均Wnt RT2-PCR阵列愈合途径热图和相应的基因图。热图的颜色显示为红色:在DEFA5处理的烧伤中更多表达,绿色:在SDZ处理的烧伤中更多表达。
图12A-I表示涉及位置、群体身份和伤口愈合能力的含表达LGR的干细胞灶的微聚集体多细胞单元的实例。使用简单的离体伤口愈合试验和荧光激活的细胞分选术,分离LGR6+、CD34+和CD73+C57BL/6(UBC-GFP)鼠细胞用于细胞培养扩大。图12A描述在10个单位/μL分散酶部分消化表皮之后毛囊上细胞的LGR6荧光抗体(绿色)表达。(WorthingtonBiochemical Corp.,Lakewood,N.J.)于37℃在慢速摇床上消化30分钟。图12B为表达额外的CD34和CD73标志物的LGR6+细胞(箭头指示包含全部细胞的约1-3%的分离群)。图12C-H为体外伤口试验的eFluor450表达直方图,分别显示周期性内在的来自C57BL/6(UBC-GFP)鼠细胞的GFP表达、CD34+PE/Cy7表达、LGR6+APC表达和CD73+。虚线指示在破坏细胞层之后在0、6和12小时的分离距离,且比例尺=50μm。图12I的图表显示随时间在距离线上的平均减小,表示为荧光分选之后的初始距离的百分数,其中星号(*)代表p值<0.05。
图13A-D为在初始接种和1天之后的时间,通过共聚焦显微镜和生物发光的激活的功能单一单元(aFSU)的显微照片,其显示正在胶原基质(图13E)上经历初始增殖的含表达LGR的干细胞灶的微聚集体多细胞单元的实例。
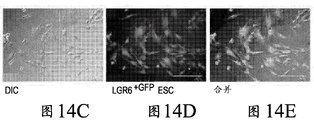
图14A-E描述LGR细胞位置多样性的实例,其涉及皮肤组织内的位置、表型、界面和极性。图14A通过免疫荧光染色显示LGR6(绿色/异硫氰酸荧光素(FITC))和LGR 5(红色/异硫氰酸四甲基罗丹明(TRITC))表达的局部区域。比例尺为20μm。图14B显示来自C57BL/6(UBCGFP)鼠皮肤的LGR6+GFP上皮干细胞的荧光激活的细胞分选分离,左侧为使用LGR6+、CD34和CD73的最终分选门,且右侧为描述细胞GFP表达和相关抗体-缀合标记的各个直方图:CD73/PE-7、LGR6/Cy5、CD34/eFlour450。图14C显示在荧光激活的细胞分选分离之后涂布的LGR6+GFP上皮干细胞的微分干涉差图像。图14D描述LGR6+GFP上皮干细胞的内在GFP表达,且图14E为图14C和14D的合并图像。比例尺代表20μm。
图15A-E提供表达LGR的细胞灶的实例,其涉及通过放置在伤口/损伤/组织空隙周围和/或之中来递送的方法。图15A的三个图像分别描述初始烧伤模板;Nu/Nu小鼠背部的全厚度烧伤;和在伤口床的基部递送含105个LGR6+GFP上皮干细胞的用于图15A的比例尺为1mm。图15B为第0天注射袋(pocket)DNA/DAPI-蓝的免疫荧光图像。图15B为抗LGR6/TRITC抗体标记的免疫荧光图像,和图15C为LGR6+GFP上皮干细胞的相同图像。图15E为图15B-D的合并图像,且具有20μm的比例尺。图15A-E显示全厚度烧伤伤口床诱导并验证LGR6+干细胞植入后续软组织缺损中。
图16A-D描述含LGR的干细胞灶的实例,其涉及经由可递送载体递送到伤口之中和周围以及组织和支持结构的后续治愈、再生,包括但不限于血管发生(angiogenesis)和/或血管生成(angiogenesis)。在LGR6+上皮干细胞移植到全厚度伤口中之后的伤口愈合进展。与图16B在15天内的LGR6+GFP上皮干细胞接种的进行比较,在图16A中描述在注射来自BD Biosciences,San Jose,Calif.的(对照)之后的伤口愈合进展。比例尺为1mm。在图16C中,显示第15天之后的植入袋,白色箭头指示位于愈合伤口床内的剩余LGR6+GFP上皮干细胞群体的存在。在图16D中,黑色箭头指示不含LGR6+GFP上皮干细胞的烧伤伤口基部的位置。
图17A-D描述在递送到伤口之中和/或周围之后的含LGR干细胞灶的实例,其随后治愈并再生组织和相关附属物,例如但不限于毛囊及相关支持结构。图17A为将LGR6+上皮干细胞移入伤口床的移植10天之后,在第10天的免疫荧光标记的组织样品的共聚焦图像的四图矩阵(four panel matrix)。包括图17A在内的图像包括DNA/DAPI-蓝;抗LGR6/TRITC;LGR6+GFP ESC的GFP表达。
图17B为所有通道的微分干涉差图像合并。红色箭头指示新生毛囊形成的区域。(亦参见上方插图)。虚线显示覆盖新生毛囊的上皮极性化,而白色箭头指示移植物注射袋的位置(对于初始注射袋细胞群体的图像,亦参见其在下方插图中的放大)。图17B的插图表示在对照和LGR6++GFP处理的指定烧伤床中的相当的KRT17/细胞角蛋白17基因表达。
参考图17C,三个图像为用于覆盖毛囊研究群体烧伤伤口床的移植圆顶(transplant dome)、具有新生毛囊(空心箭头)毛囊囊肿形成(follicle cyst formation)的第10天的LGR6++GFP ESC处理的伤口床(实心箭头)和第10天的对照伤口床。包括图17D在内的图表定量第10天伤口床,其得自RT-PCR,指出WNT配体的相对倍数基因表达。正数表示在LGR6+GFP上皮干细胞伤口床中更高表达,而负数表示在对照伤口床中更高表达。
图18提供具有表达LGR的细胞灶的伤口/损伤/组织空隙的RT-PCR定量和插入的基因热图比较,其涉及递送到伤口/损伤/组织空隙之中和/或周围,涉及与对照相比增强接受LGR6+上皮干细胞的伤口的促愈合途径和相当的基因表达。所述图表阐述用于血管发生、伤口愈合和表皮生长因子的基因的相对倍数表达。比较接受LGR6+上皮干细胞和对照治疗的伤口床的数据的相关图示。对于插入的热图,红色表示在LGR6+上皮干细胞伤口床中更高表达,而绿色表示在对照伤口床中更高表达。在条形图中,正数表示在LGR6+GFP上皮干细胞伤口床中更高表达,而负数表示在对照伤口床中更高表达。在各定量柱上方显示NCBIUnigene术语,星号(*)P值表示<0.05显著性。
图19以图表显示涉及递送到伤口/损伤/组织空隙之中和/或周围并增强伤口愈合因子的表达LGR的细胞灶的实例的相对蛋白密度测定。与调节和增强血管发生的常见蛋白质相比,接受LGR6+ESC蛋白质组阵列的伤口有相当的血管发生分析物表达。灰色柱表示对照伤口,而黑色柱表示接受LGR6+GFP ESC的伤口。插图显示在用HRP化学发光显影之后的蛋白质组阵列膜实例。颜色越亮表示蛋白质表达水平越高。
图20A-F阐述涉及骨组织的再生的表达LGR的细胞灶的实例。分离的LGR灶可接种至骨并保持活性。图20A为采集用于培养的骨的整体骨图像。图20B为接种之后7天的含LGRGFP的骨的DIC图像。图20C为接种之后7天的含LGR6+GFP的骨的488nm绿激光共聚焦图像。注意的是,LGR灶可经历体外骨诱导。图20D描述使用补充培养基骨诱导1周之后的LGR灶。图20E为骨诱导之后的LGR灶的茜素红染色,其可经历体外骨诱导并上调关键成骨基因。最后,图20F为显示相对倍数基因表达的RT-PCR数据,其中灰色柱表示(对照)非骨诱导的LGR,和黑色柱表示在培养7天之后接受骨诱导培养基的LGR。GAPDH用作参照标准看家基因。
示例性方案以下为提供用于实施本发明的一个实施方案的说明性方案顺序的一系列实施例。
在生成根据本发明的最小极性化功能单元之前,可通过如下众所周知的程序生成诸如示例性三维胶原支架等的凝胶状支持物:
i.在温和涡旋下,向8份冷冻的基于胶原的溶液中缓慢加入1份冷冻的10X培养基的10XPBS。向混悬液中加入ECM和活性蛋白;
ii.使用无菌的0.1M NaOH将混合物的pH调至7.2-7.6,并小心监测pH调节;
iii.使用无菌的分子级水将终体积调至总计10份;
iv.将混合物的温度维持在2-10℃以防止胶凝作用,
v.通过加温至37℃达约90-120分钟来形成凝胶;
vi.使用无菌微针压力机(micro-needle press)将支架穿孔(如有需要,支架可经历冷冻干燥过程用于储存)。
亦推荐的是,在开始LGR聚集体提取程序之前,制备并获得称为脉冲挽救培养基(Pulse Rescue Media,PRM)的额外材料。
在此实施方案中,针对人类的PRM为含L-谷氨酰胺的细胞维持无血清培养基混合物Keratinocyte-SFM,其以独立包装的预先证明合格的人重组表皮生长因子1-53(EGF 1-53)和牛垂体提取物(BPE)提供,作为Keratinocyte-SFM(1X)由Thermo Fisher Scientific销售,连同GMP-纤维蛋白原(人)一起向其中加入抗生素-抗真菌药青霉素、链霉素和两性霉素B。用于一个实施方案的药剂为来自Thermo Fisher Scientific的抗生素-抗真菌药,其为含10,000单位/mL青霉素、10,000μg/mL链霉素和25μg/mL抗真菌药的溶液。因为将PRM用于运输人组织,所以利用补充试剂来稳定原代组织并降低微生物在运输和加工期间的生存力。
以下具体涉及根据本发明的一个实施方案的含表达LGR的上皮的干细胞微聚集体功能单元的产生和保存。
实施例1
实施例1涉及用于提取根据本发明的一个实施方案的最小极性化功能单元的方法。在获得样品之后,将其从伴随的运输容器中取出,接着:
i.将样品放入含脉冲复苏培养基的无菌的50ml锥形管中并放在摇床上达5分钟,使用新鲜培养基和容器重复达总计三次;
ii.取出样品并放入含脉冲培养基的无菌培养皿中,并小心地从真皮和表皮区室中切下脂肪和皮下成分。将毛囊单元留在原地且不要过度切割;
iii.将切下的皮下脂肪组分放入含PRM的单独的50ml锥形管中,并放在+4℃慢速摇床上。
v.将MPFU组分放入含脉冲培养基的单独的50ml锥形管中并置于+4℃。
下文涉及二次加工,其中利用酶促制备,使用符合FDA和/或GMP认证的常规CLIA设备和试剂,建立原代培养物并制备功能组织成分:
实施例2
实施例2涉及皮下组织和皮下脂肪细胞组分的加工。实施例2叙述了下列步骤:
i.在组织容器的外侧喷洒70%乙醇(EtOH)并将组织容器放入层流空气柜中;
ii.送出组织的样品或转移培养基进行微生物检验;
iii.将先前洗涤的脂肪组织和皮下组织放入150mm无菌培养皿中;
iv.用PRM将组织洗涤两次;
v.使用无菌外科器械将组织修剪成小块(3mm)并放入含脉冲培养基的无菌培养支持平皿中,同时完成切割;
vi.从支持平皿中吸出培养基并用无菌铲或镊子取出样品,接着将样品放入含MSC酶促消化培养基的50ml锥形管中,所述培养基为预混合的消化酶溶液(基于胶原酶和分散酶),将锥形管放入37℃水浴或干热慢速振荡器中并振荡30分钟或者直至剩余少量微粒物质;
vii.加入37℃磷酸缓冲盐水(PBS)乙二胺四乙酸(EDTA)(等体积PBS-EDTA)以终止消化;
viii.将混悬液离心10分钟以生成“软”沉淀;
ix.弃去上面液体部分并使用无菌移液器从保留团块中的基质血管部分(SVF)中分离脂肪群体;
x.在两个单独的锥形管中,用磷酸缓冲盐水/EDTA(PBS-EDTA,1mM的EDTA)重悬浮SVF,并用PRM重悬浮脂肪细胞群体;
xi.使用100μm无菌过滤器,将混悬液过滤到新的无菌锥形管中;
xii.用PBS-EDTA洗涤过滤器;
xiii.于室温将混悬液旋转过滤10分钟,接着吸出培养基并用已知体积的新鲜培养基替换吸出的培养基;
xv.移出20%的所得细胞群体用于使用来自Thermo Fisher Scientific的CTSTM(Cell Therapy Systems)深低温保藏并随后适当分类,同时使用剩下的80%群体进行构建体装配。
实施例3
实施例3涉及向根据本发明的一个实施方案的构建体的实例添加皮下组织和皮下脂肪组分。说明性的组分添加实例包括:
ii.在各培养皿上插入带有追踪号的标签;
iii.每个平皿系统转移约5x105-1x106个混合的SVF细胞以及每个平皿1x105个脂肪细胞;
iv.如根据情况的具体要求而定,向装载储存器中加入含或不含自体PRP的完全培养基;
v.将平皿转移到慢速摇床上的培养箱中达1小时,接着从其中取出平皿并在单独的标记(sentinel)培养箱中静置平放48小时;
vii.每72小时替换培养基;
viii.在汇合时,用Dulbecco's磷酸缓冲盐水(DPBS)洗涤培养物并用新鲜培养基替换培养基。
ix.将上皮干细胞功能单一构建体(ESCFSU)直接置于间充质干细胞(MSC)构建体的表面上,添加ESC培养基以覆盖两个构建体,以相同方式成像并将构建体放回培养箱中。
x.每48小时更换/替换构建体培养基。
实施例4
实施例4涉及最小极性化的上皮干细胞单一单元的富集。遵循实施例1,将MPFU放入含脉冲复苏培养基的15ml锥形管中并旋转/离心成软沉淀。然后使该物质经历下列部分消化过程:
i.获得先前等分的冷冻的10ml消化缓冲液(基于胶原酶和分散酶),在添加至MPFU之前使之达到室温;
ii.向MPFU的软沉淀中加入消化液并通过吹打温和混合管,以使MPFU分布在溶液各处;
iii.将管置于37℃水浴或干培养箱中达10分钟;
iv.从水浴/培养箱中取出管,温和吹打管并对内容物检测线状物(string);
v.观察到线状物,将内容物离心成软沉淀;
vi.用5-10mL完全确定成分的角质形成细胞SFM培养基(来自ThermoFisherScientific的Keratinocyte-SFM(1X))洗涤细胞沉淀并再次离心成软沉淀;
vii.用5mL的完全的Keratinocyte-SFM培养基重悬浮激活的功能单一单元的沉淀;和
实施例5
实施例5包括向构建体/支架添加从实施例4获得的上皮干细胞功能单一单元(ESCaFSU)。程序必须包括:
i.放置已含有经装配和洗涤的支架的UPCELLTM表面皮肤移植物细胞培养皿,并保证生理pH,在添加细胞之前用脉冲培养基将支架再次洗涤两次;
ii.用独特的追踪号标记各培养皿;
iii.使用完全确定成分的角质形成细胞SFM培养基(任选额外的自体PRP)经由一次性转移移液管向构建体转移ESC aFSU;
iv.向所选装载储存器中加入完全培养基并确保完全覆盖构建体;
v.将平皿转移到慢速摇床上的培养箱中达1小时。然后从摇床中取出平皿并使之在单独的标记培养箱中保持平放48小时;
vi.在48小时时,吸出培养基并添加新鲜角质形成细胞SFM培养基。用EVOS将培养物成像并用分配的追踪号储存培养物。如果此时发现有需要,则增加牙龈成纤维细胞(GF)群体和活性蛋白和/或补充PRP。
vii.每48-72小时替换培养基;
viii.在完成汇合之后,用DPBS洗涤培养物并替换培养基。使用基于温度的系统降低ESC构建体支架的温度以利于从平皿的释放;
ix.将ESC直接置于MSC构建体的表面上,并添加组合培养基以覆盖两个构建体。将构建体成像,放回培养箱中并每48小时更换构建体培养基。
x.为了确认极性化保持,每天将构建体成像,并在确认极性化已维持48小时之后添加适当的角化(外皮形成)培养基;
实施例6
实施例6显示用于质量保证和包括深低温保藏在内的构建体定型的说明性方案,其必须包含遵循限定的药品生产质量管理规范(GMP)制备用于运输的构建体,以用于细胞疗法且包括:
iv.根据制造商说明书,立即将获得的混悬液的等份分配到冷冻小瓶中;
v.将冷冻小瓶放入适当的低温系统中,例如可获自Thermo Fisher ScientificInc.的MR.FROSTYTM系统,其将冰箱温度维持在-80℃;
vi.将小瓶转移至-200℃至-125℃下液氮长期气相储存。
在前述说明书中已提供本发明的所述实施方案。本发明所属领域的技术人员应理解的是,将想到本发明的许多修改和实施方案,其得益于前文描述和相关附图中所示的教导。因此,亦应理解的是,本发明不限于本文所公开的具体实施方案,且意图本发明的许多修改和其它实施方案亦包含在本发明的范围之内。此外,尽管在本文中使用了具体的术语,其仅以通用和描述性意义使用,且不以限制本发明描述为目的。
工业适用性
本发明涉及用于制备含有分离的表达含有富含亮氨酸重复序列的G-蛋白偶联受体(LGR)的细胞的微聚集体多细胞移植物的构建体的方法,以及使用所述构建体的方法,用于递送、施用、移植、植入、定向接种、定向迁移、定向追踪、沉淀、层压和/或注射细胞成分,用于产生、再生、增强和/或愈合上皮系统、腺体、毛发、神经、骨、肌肉、脂肪、腱、血管、筋膜、眼组织和肽分泌性细胞成分,以用于伤口治疗应用、组织工程学、细胞疗法应用、再生医学应用、医学/治疗应用、组织愈合应用、免疫疗法应用和组织移植疗法应用。
Claims (10)
1.一种组合物,其包含:
i)递送载体基底,其选自由支架、基质、颗粒和纤维组成的群组;和
ii)微聚集体多细胞功能单元,其包含分割的表皮区室、分割的真皮区室和分割的毛囊区室,所述分割的毛囊区室包含表达LGR的活细胞,所述表达LGR的活细胞选自表达LGR4的活细胞、表达LGR5的活细胞、表达LGR6的活细胞或其任意组合;
其中所述组合物能够再生皮肤组织。
2.根据权利要求1所述的组合物,其进一步包含可溶性生长因子。
3.根据权利要求1所述的组合物,其进一步包含迁移或募集分析物。
4.根据权利要求1所述的组合物,其进一步包含选自配体家族、R脊椎蛋白(R-spondin)、表皮来源的生长因子(EDGF)、血小板来源的生长因子(PDGF)、Wnt蛋白质、血管内皮生长因子(VEGF)和抗微生物肽的LGR特异性结合成分。
5.一种方法,其包含:
a)通过以下来加工经分离的活的哺乳动物组织:从所述活的哺乳动物组织分离脂肪和皮下成分以制备经切除的哺乳动物组织;并分割所述经切除的哺乳动物组织以产生微聚集体多细胞功能单元,所述微聚集体多细胞功能单元包含分割的表皮区室、分割的真皮区室和分割的毛囊区室,所述分割的毛囊区室包含表达LGR的活细胞,所述表达LGR的活细胞选自表达LGR4的活细胞、表达LGR5的活细胞、表达LGR6的活细胞或其任意组合;且
b)将所述微聚集体多细胞功能单元施用于递送载体基底以产生构建体,所述递送载体基底选自由支架、基质、颗粒和纤维组成的群组;
其中所述构建体能够再生皮肤组织。
6.根据权利要求5所述的方法,其进一步包含深低温保藏所述构建体。
7.根据权利要求5或6所述的方法,其进一步包含向所述构建体中添加增强因子。
8.根据权利要求5或6所述的方法,其进一步包含向所述构建体中添加分析物。
9.一种根据权利要求1到4中任一项所述的组合物,所述组合物用于疗法中。
10.一种根据权利要求1到4中任一项所述的组合物,所述组合物用于:
i)伤口的治疗,其中所述组合物加速所述伤口愈合;和/或
ii)组织的治疗,其中所述组合物修复或重建组织;和/或
iii)作为用于治疗组织区域、伤口、空隙、缺损组织或血液中任一者的治疗性构建体;和/或
iv)作为改变周围邻近组织的治疗中的治疗性构建体。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462086526P | 2014-12-02 | 2014-12-02 | |
| US62/086526 | 2014-12-02 | ||
| US14/954335 | 2015-11-30 | ||
| US14/954,335 US10926001B2 (en) | 2014-12-02 | 2015-11-30 | Methods related to minimally polarized functional units |
| PCT/US2015/063114 WO2016089825A1 (en) | 2014-12-02 | 2015-12-01 | Methods for development and use of minimally polarized function cell micro-aggregate units in tissue applications using lgr4, lgr5 and lgr6 expressing epithelial stem cells |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107250348A CN107250348A (zh) | 2017-10-13 |
| CN107250348B true CN107250348B (zh) | 2021-09-03 |
Family
ID=56078499
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580075326.3A Active CN107250348B (zh) | 2014-12-02 | 2015-12-01 | 使用表达lgr4、lgr5和lgr6的上皮干细胞在组织应用中开发和使用最小极性化功能细胞微聚集体单元的方法 |
Country Status (21)
| Country | Link |
|---|---|
| US (7) | US10926001B2 (zh) |
| EP (1) | EP3227431A4 (zh) |
| JP (3) | JP6791854B2 (zh) |
| KR (5) | KR20210043024A (zh) |
| CN (1) | CN107250348B (zh) |
| AU (3) | AU2015355187C1 (zh) |
| BR (1) | BR112017011808A2 (zh) |
| CA (1) | CA2969707C (zh) |
| CO (1) | CO2017006640A2 (zh) |
| CR (1) | CR20170296A (zh) |
| EA (1) | EA201791125A1 (zh) |
| GB (2) | GB2569056B (zh) |
| HK (2) | HK1250515A1 (zh) |
| IL (2) | IL252613B (zh) |
| MX (2) | MX2017007243A (zh) |
| MY (1) | MY184931A (zh) |
| NZ (2) | NZ733433A (zh) |
| PH (1) | PH12017501009B1 (zh) |
| SG (2) | SG11201704502RA (zh) |
| WO (1) | WO2016089825A1 (zh) |
| ZA (1) | ZA201703907B (zh) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2019212976A1 (en) * | 2018-01-26 | 2020-07-23 | Polarityte, Inc. | Complex living interface-coordinated self-assembling materials (CLICSAM) |
| EP3743125A4 (en) * | 2018-01-26 | 2022-03-02 | Polarityte, Inc. | BIOMATERIAL ACCELERATING SUBSTRATE WITH COMPOSITE INTERFACE |
| FR3082123B1 (fr) | 2018-06-07 | 2020-10-16 | Urgo Rech Innovation Et Developpement | Pansement cellularise et son procede de fabrication |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2412800A1 (en) * | 2010-07-29 | 2012-02-01 | Koninklijke Nederlandse Akademie van Wetenschappen | Liver organoid, uses thereof and culture method for obtaining them |
| CN103550828A (zh) * | 2013-10-17 | 2014-02-05 | 中国科学院动物研究所 | 一种基于毛囊干细胞和硅凝胶敷料的皮肤重建方法 |
Family Cites Families (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040126881A1 (en) * | 2002-09-06 | 2004-07-01 | Vincent Ronfard | Fibrin cell supports and methods of use thereof |
| WO2006008009A2 (en) | 2004-07-23 | 2006-01-26 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with leucine-rich repeat-containing gpcr 6 (lgr6) |
| WO2006026617A2 (en) | 2004-08-30 | 2006-03-09 | Iken Tissue Therapeutics, Inc. | Compositions and methods of promoting hair growth |
| BRPI0617818A2 (pt) | 2005-10-27 | 2011-08-09 | Coloplast As | suporte polimérico biodegradável com material de ecm |
| EP2043731A4 (en) | 2006-07-13 | 2010-07-21 | St Jude Medical | MEDICAL INFORMATION MANAGEMENT IN A PATIENT INFORMATION HUD SYSTEM |
| US8366723B2 (en) | 2006-08-03 | 2013-02-05 | Rassman Licensing, Llc | Hair harvesting device and method with localized subsurface dermal fluid insertion |
| EP2066787A1 (en) | 2006-09-12 | 2009-06-10 | DKFZ Deutsches Krebsforschungszentrum, Stiftung des Öffentlichen Rechts | Cell culture of keratinocytes under non-differentiating conditions |
| GB201111244D0 (en) | 2011-06-30 | 2011-08-17 | Konink Nl Akademie Van Wetenschappen Knaw | Culture media for stem cells |
| US9752124B2 (en) | 2009-02-03 | 2017-09-05 | Koninklijke Nederlandse Akademie Van Wetenschappen | Culture medium for epithelial stem cells and organoids comprising the stem cells |
| FI20095355A0 (fi) | 2009-04-01 | 2009-04-01 | Helsingin Yliopisto | Regeneroituva aktiivinen matriisi ja sen käytöt |
| WO2010150922A2 (en) | 2009-06-25 | 2010-12-29 | Shiseido Company, Ltd. | Methods for screening for anti-graying agents on the basis of aff-4 |
| US20110130711A1 (en) | 2009-11-19 | 2011-06-02 | Follica, Inc. | Hair growth treatment |
| US20130101564A1 (en) | 2010-06-30 | 2013-04-25 | Jinxi Chen | Method for preparing dermis tissue cells aggregation and uses thereof |
| GB201106395D0 (en) | 2011-04-14 | 2011-06-01 | Hubrecht Inst | Compounds |
| US9801977B2 (en) | 2011-10-27 | 2017-10-31 | Universität Leipzig | Method for deriving melanocytes from the hair follicle outer root sheath and preparation for grafting |
| JP6186997B2 (ja) | 2012-08-07 | 2017-08-30 | 日油株式会社 | 塗布型帯電防止剤 |
| US9655930B2 (en) | 2012-10-01 | 2017-05-23 | Aderans Research Institute, Inc. | Compositions and methods for producing reconstituted skin |
| US20140106447A1 (en) | 2012-10-12 | 2014-04-17 | Mimedx Group, Inc. | Compositions and methods for recruiting stem cells |
| CN108865972B (zh) | 2013-03-14 | 2022-07-29 | 布里格海姆妇女医院公司 | 一种细胞培养溶液 |
| US9592257B2 (en) | 2013-10-11 | 2017-03-14 | MWV Cell, LLC | Complete human skin organ generated from culture-expanded cells |
| TWI548413B (zh) | 2014-11-07 | 2016-09-11 | 國立臺灣大學 | 誘導毛囊新生的皮膚萃取物、組合物及其用途 |
-
2015
- 2015-11-30 US US14/954,335 patent/US10926001B2/en active Active
- 2015-12-01 EA EA201791125A patent/EA201791125A1/ru unknown
- 2015-12-01 NZ NZ733433A patent/NZ733433A/en unknown
- 2015-12-01 GB GB201902819A patent/GB2569056B/en active Active
- 2015-12-01 CA CA2969707A patent/CA2969707C/en active Active
- 2015-12-01 MX MX2017007243A patent/MX2017007243A/es unknown
- 2015-12-01 JP JP2017530217A patent/JP6791854B2/ja active Active
- 2015-12-01 BR BR112017011808A patent/BR112017011808A2/pt not_active Application Discontinuation
- 2015-12-01 KR KR1020217010934A patent/KR20210043024A/ko not_active Application Discontinuation
- 2015-12-01 SG SG11201704502RA patent/SG11201704502RA/en unknown
- 2015-12-01 KR KR1020197028100A patent/KR20190111167A/ko not_active Application Discontinuation
- 2015-12-01 GB GB1710646.9A patent/GB2549872A/en not_active Withdrawn
- 2015-12-01 SG SG10201914058QA patent/SG10201914058QA/en unknown
- 2015-12-01 NZ NZ755260A patent/NZ755260A/en unknown
- 2015-12-01 KR KR1020187036618A patent/KR20180136587A/ko not_active Application Discontinuation
- 2015-12-01 KR KR1020187036619A patent/KR20180136588A/ko not_active Application Discontinuation
- 2015-12-01 MY MYPI2017701990A patent/MY184931A/en unknown
- 2015-12-01 AU AU2015355187A patent/AU2015355187C1/en active Active
- 2015-12-01 CR CR20170296A patent/CR20170296A/es unknown
- 2015-12-01 WO PCT/US2015/063114 patent/WO2016089825A1/en active Application Filing
- 2015-12-01 CN CN201580075326.3A patent/CN107250348B/zh active Active
- 2015-12-01 KR KR1020177017887A patent/KR20170098844A/ko active Application Filing
- 2015-12-01 EP EP15865131.5A patent/EP3227431A4/en active Pending
-
2017
- 2017-05-31 PH PH12017501009A patent/PH12017501009B1/en unknown
- 2017-06-01 IL IL252613A patent/IL252613B/en unknown
- 2017-06-05 MX MX2023001655A patent/MX2023001655A/es unknown
- 2017-06-07 ZA ZA2017/03907A patent/ZA201703907B/en unknown
- 2017-06-30 CO CONC2017/0006640A patent/CO2017006640A2/es unknown
- 2017-07-14 US US15/650,659 patent/US11266765B2/en active Active
- 2017-07-14 US US15/650,656 patent/US20180154043A1/en not_active Abandoned
-
2018
- 2018-04-10 HK HK18104680.7A patent/HK1250515A1/zh unknown
- 2018-04-10 HK HK18104679.0A patent/HK1245327A1/zh unknown
- 2018-10-19 US US16/165,169 patent/US11000629B2/en active Active
-
2019
- 2019-01-16 JP JP2019004921A patent/JP2019088299A/ja active Pending
- 2019-10-02 AU AU2019240603A patent/AU2019240603B2/en active Active
-
2020
- 2020-07-30 JP JP2020129610A patent/JP2020182880A/ja active Pending
-
2021
- 2021-05-21 US US17/326,734 patent/US11338060B2/en active Active
- 2021-10-21 IL IL287488A patent/IL287488B2/en unknown
-
2022
- 2022-04-19 US US17/723,748 patent/US11596714B2/en active Active
-
2023
- 2023-02-03 US US18/164,308 patent/US20230181797A1/en active Pending
- 2023-05-08 AU AU2023202857A patent/AU2023202857A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2412800A1 (en) * | 2010-07-29 | 2012-02-01 | Koninklijke Nederlandse Akademie van Wetenschappen | Liver organoid, uses thereof and culture method for obtaining them |
| CN103550828A (zh) * | 2013-10-17 | 2014-02-05 | 中国科学院动物研究所 | 一种基于毛囊干细胞和硅凝胶敷料的皮肤重建方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Tian et al. | Myogenic differentiation of human bone marrow mesenchymal stem cells on a 3D nano fibrous scaffold for bladder tissue engineering | |
| Bearzi et al. | PlGF–MMP9-engineered iPS cells supported on a PEG–fibrinogen hydrogel scaffold possess an enhanced capacity to repair damaged myocardium | |
| US11596714B2 (en) | Methods for development and use of minimally polarized function cell micro-aggregate units in tissue applications using LGR4, LGR5 and LGR6 expressing epithelial stem cells | |
| Sordi et al. | Three-dimensional bioactive hydrogel-based scaffolds for bone regeneration in implant dentistry | |
| US20030153078A1 (en) | Method for in vitro production of three-dimensional vital cartilage or bone tissue and use thereof as transplant material | |
| Zhang et al. | Use of extracellular matrix hydrogel from human placenta to restore hair-inductive potential of dermal papilla cells | |
| AU2005279878A1 (en) | Conditioned medium comprising Wnt proteins to promote repair of damaged tissue | |
| CN110478528B (zh) | 一种新型的促组织修复材料的制备方法及其应用 | |
| CN105874060A (zh) | 间皮细胞在组织生物工程和人造组织中的用途 | |
| JP2017538411A5 (zh) | ||
| AU2003294621A1 (en) | Method for the treatment of diseased, degenerated, or damaged tissue using three-dimensional tissue produced in vitro in combination with tissue cells and/or exogenic factors | |
| WO2017125159A1 (en) | Method for conditioning stem cells | |
| OA19578A (en) | Methods for development and use of minimally polarized function cell microaggregate units in tissue applications using LGR4, LGR5 and LGR6 expressing epithelial stem cells | |
| US20120207715A1 (en) | Methods and systems for storing and prolonging viability of matrix dependent cells | |
| KR102283340B1 (ko) | 심근 직분화를 위한 심장 모사 세포 배양장치 및 이를 이용한 세포 분화 방법 | |
| OA19580A (en) | Methods for development and use of minimally polarized function cell microaggregate units in tissue applications using LGR4, LGR5 and LGR6 expressing epithelial stem cells | |
| JP6654323B2 (ja) | 重層上皮組織形成能を有する細胞、及びその製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |