CN105358163B - 内皮功能障碍和炎症的疾病的治疗 - Google Patents
内皮功能障碍和炎症的疾病的治疗 Download PDFInfo
- Publication number
- CN105358163B CN105358163B CN201380072732.5A CN201380072732A CN105358163B CN 105358163 B CN105358163 B CN 105358163B CN 201380072732 A CN201380072732 A CN 201380072732A CN 105358163 B CN105358163 B CN 105358163B
- Authority
- CN
- China
- Prior art keywords
- cells
- stro
- cell
- progeny
- endothelial dysfunction
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0662—Stem cells
- C12N5/0663—Bone marrow mesenchymal stem cells (BM-MSC)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Developmental Biology & Embryology (AREA)
- Immunology (AREA)
- Cardiology (AREA)
- Cell Biology (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Wood Science & Technology (AREA)
- Genetics & Genomics (AREA)
- Epidemiology (AREA)
- Rheumatology (AREA)
- Virology (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Urology & Nephrology (AREA)
- Diabetes (AREA)
- Hospice & Palliative Care (AREA)
- Vascular Medicine (AREA)
- Dermatology (AREA)
- Molecular Biology (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
Abstract
本公开提供了用于治疗或预防个体的内皮功能障碍的方法,所述方法包括全身给予个体富集STRO‑1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子细胞群。
Description
优先权细节
本申请要求于2012年12月12日提交的名称为“内皮功能障碍和炎症的疾病的治疗”的美国临时专利申请号61/736,361的优先权,其全部内容在此通过引用并入。
技术领域
本公开涉及用于治疗或预防内皮功能障碍或炎症的疾病及其相关病症的方法。
技术背景
内皮功能障碍的特征为内皮作用向着降低血管舒张、促炎性状态和促凝血特性变化。血管生物学家通常认为具有导致功能障碍的内皮损伤是动脉粥样硬化中的启动事件(Ross Nature 362:801–9,1993)并且在冠心病缺血性临床表现中起重要作用。内皮功能障碍还先于动脉粥样硬化的实际存在(Reddy et al.,J Am Coll Cardiol 23:833–843,1994)。它还与大多形式的心血管病(如高血压、冠状动脉疾病、慢性心力衰竭和外周动脉疾病)、糖尿病并发症(如肾病)和慢性肾衰竭相关。
在内皮功能障碍中参与降低的血管舒张反应的机制包括降低的一氧化氮形成、氧化过度以及减少超极化因子产生。粘附分子的上调、趋化因子如巨噬细胞趋化肽(chemoattractant peptide)-1的形成、以及纤溶酶原激活物抑制剂-1的产生参与了炎症反应并有助于促凝血状态。血管活性肽如血管紧张素II和内皮素-1;不对称二甲基精氨酸(内源性一氧化氮抑制剂)的累积;高胆固醇血症;高同型半胱氨酸血症;改变的胰岛素信号;以及高血糖症可促进这些不同的机制。例如,在与内皮功能障碍相关的病症中观测到血管紧张素II过量。血管紧张素II被认为是血管紧张素I的竞争性抑制剂,与血管紧张素I一起参与抑制内皮增厚,促进内皮存活,使支持血管周围的细胞稳定以及抑制内皮通透性。过量水平的血管紧张素II抑制这些有益效果。
内皮功能障碍还是动脉粥样硬化发病的重要早期事件,促进血小板启动和进展。
内皮功能障碍还是炎性疾病如败血症效果的主要促成者。败血症的发病是复杂网络事件的结果。革兰氏阴性细菌细胞壁的组分(内毒素)是造成败血症发生的主要(虽然不是唯一的)种类。除了其他细菌分子之外,内毒素引发涉及促炎性介质和抗炎性介质产生的细胞和体液途径的普遍反应。这些介质包括细胞因子、凝血因子、粘附分子、心肌抑制物和和热休克蛋白。内皮是败血症-诱导的事件的主要靶标,并且内皮细胞受损和功能障碍在败血性休克的病理学中占很大比例。血管内皮细胞是机体与循环的细菌分子首先相接触的细胞。内皮细胞具有识别细菌病原体的结构模式并且随后启动炎性介质的表达的机制。
用于治疗内皮功能障碍的方法是处理疾病过程中引起内皮功能障碍的组分。例如,通过补充叶酸降低高同型半胱氨酸血症中的同型半胱氨酸水平可改善内皮功能障碍。L-精氨酸和四氢生物嘌呤以及四氢生物嘌呤模拟物可通过增强一氧化氮的生物利用度而改善内皮功能。然而,一些研究并未发现给予L-精氨酸能改善内皮功能障碍。
已证实他汀类药物对内皮功能障碍具有有益效果,这可能部分是脂质降低的结果,也是其多效抗炎效应的结果。然而,他汀类药物与肌肉疼痛和横纹肌溶解(其可导致肾衰竭和死亡)、肌无力、神经病变和健忘相关。此外,他汀类药物具有相对短的半衰期并且需要定期给药以提供疗效。例如,阿托伐他汀具有约20-30小时的有效半衰期并且被认为是长效的他汀类药物。
还表明过氧化物酶体增殖物激活受体γ激动剂改善内皮功能障碍。然而,应当针对与这类化合物相关的安全考虑而小心评估这些化合物的潜在益处,所述安全考虑涉及对液体潴留和充血性心力衰竭以及可能增加心血管风险。
通过前述清楚地可知,本领域对治疗或预防内皮功能障碍或炎症的疾病存在需要。
简述
在得到本发明中,本发明人表明,全身(如通过静脉)给予患有内皮功能障碍的动物表达STRO-1的间充质祖细胞或其后代增加了冠状动脉对内皮特异性扩张剂(缓激肽和卡巴胆碱)的反应,但没有增加对平滑肌扩张剂硝普钠的反应。例如,相比没有用MPC或其后代治疗的动物中的结果,MPC或其后代增加对内皮特异性扩张剂的最大反应,其指示降低的内皮功能障碍。这些数据表明表达STRO-1的MPC或其后代或由它们分泌的一种或多种因子治疗或预防内皮功能障碍的发展。
基于本发明人的发现,本公开提供了用于治疗或预防个体的血管内皮功能障碍或炎症的疾病的方法,所述方法包括全身给予个体富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子。.
在一实例中,所述个体患有由内皮功能障碍引起的病症。
在一实例中,所述内皮功能障碍位于血管内,例如为血管内皮功能障碍。
在一实例中,由内皮功能障碍引起的病症选自:败血症、高血压、冠状动脉疾病、慢性心力衰竭和外周动脉疾病、肾病及慢性肾衰竭。
在一实例中,由内皮功能障碍引起的病症为肾病。因而,在一实例中,本公开提供了用于治疗或预防个体肾病的方法,所述方法包括全身给予个体富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子。
在一实例中,所述肾病为糖尿病肾病。因而,在一实例中,本公开提供了用于治疗或预防个体糖尿病肾病的方法,所述方法包括全身给予个体富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子。
在另一实例中,所述病症为动脉粥样硬化。因而,在一实例中,本公开提供了用于治疗或预防个体动脉粥样硬化的方法,所述方法包括全身给予个体富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子。
在一实例中,所述疾病为炎症疾病。炎症疾病可以为全身炎症反应综合征,如败血症、败血性休克或败血症样病症。在另一实例中,所述病症为败血症或败血性休克。因而,在一实例中,本公开提供了用于治疗或预防个体败血症或败血性休克的方法,所述方法包括全身给予个体富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子。
败血症、败血性休克或败血症样病症可由病毒、真菌、原生动物或细菌引起。
在一实例中,所述方法包括给予富集STRO-1亮细胞的细胞群和/或其后代和/或源自它们的可溶性因子。
在一实例中,所述富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子通过静脉给予。在这方面,本发明人已表明,全身给予STRO-1+细胞和/或其后代能够改善内皮功能障碍。因而,本公开考虑在个体远离内皮功能障碍部位的位置处给予STRO-1+细胞和/或其后代。
在一实例中,以足以减少个体IL-6、TNFα和/或IL-17的量给予STRO-1+细胞和/或其后代和/或源自它们的可溶性因子。通过减少这些炎性细胞因子的水平,本公开的方法预防了内皮功能障碍。
在一实例中,以足以增加个体(如个体内皮中)血管生成素I水平的量给予STRO-1+细胞和/或其后代和/或源自它们的可溶性因子。如上所述,血管生成素II(血管生成素I的拮抗剂)的水平在患有内皮功能障碍的个体中提高。本发明人已表明,STRO-1+MPC和/或其后代分泌血管生成素II,推断这将有助于治疗内皮功能障碍。
在一实例中,以足以增强个体内皮(如,血管内皮)扩张(如,在应答诸如缓激肽或卡巴胆碱的内皮扩张剂时)的量给予STRO-1+细胞和/或其后代和/或源自它们的可溶性因子。
在一实例中,STRO-1+细胞和/或其后代和/或源自它们的可溶性因子以足以增强个体内皮(如,血管内皮)扩张而不增强平滑肌(如,血管平滑肌)扩张(如,在应答诸如硝普钠的平滑肌扩张剂时)的量给予。
细胞的示例性剂量包括每千克0.1×106至5×106STRO-1+细胞和/或其后代。例如,所述方法包括每千克给予0.3×106至2×106STRO-1+细胞和/或其后代。
在一实例中,将细胞以约0.3×106细胞/kg至约4×106细胞/kg的剂量给予,如约0.3×106细胞/kg至约2×106细胞/kg。
本方法的一种方式涉及给予低剂量STRO-1+细胞和/或其后代。这种低剂量为,例如0.1×105至约0.5×106STRO-1+细胞/kg,如约0.3×106STRO-1+细胞/kg。
在另一实例中,将高剂量的细胞给予个体。示例性剂量包括至少约1.5×106细胞/kg。例如,高剂量包括约1.5×106至约4×106细胞/kg。例如,高剂量包括约1.5×106或约2×106细胞/kg。
在一实例中,以恒定的身体剂量(body dose)给予细胞,即不考虑个体体重。
在一实例中,不考虑个体体重,以约10000万至30000万细胞的剂量给予细胞。
在一实例中,不考虑个体体重,以约10000万至20000万细胞的剂量给予细胞。
在一实例中,不考虑个体体重,以约10000万细胞的剂量给予细胞。
在一实例中,不考虑个体体重,以约15000万细胞的剂量给予细胞。
在一实例中,不考虑患者体重,以约20000万细胞的剂量给予细胞。
在一实例中,不考虑患者体重,以约30000万细胞的剂量给予细胞。
在一实例中,将STRO-1+细胞和/或其后代和/或源自它们的可溶性因子与多硫酸化聚糖相组合给予。
在另一实例中,所述多硫酸化聚糖为戊聚糖多硫酸酯(PPS)或其药学可接受的盐,例如,所述PPS为PPS的钠盐(NaPPS)或PPS的钙盐(CaPPS)。例如,PPS的盐为NaPPS。
在一实例中,所述PPS的浓度依赖于组合物中STRO-1+细胞和/或其后代和/或源自它们的可溶性因子的数目。
在一实例中,所述PPS的浓度为约5ng/ml/百万细胞至10mg/ml/百万细胞或500ng/ml/百万细胞至10mg/ml/百万细胞,500ng/ml/百万细胞至2000μg/ml/百万细胞,1μg/ml/百万细胞至1000μg/ml/百万细胞,或1μg/ml/百万细胞至500μg/ml/百万细胞,500ng至10μg/ml/百万细胞,1μg至10μg/ml/百万细胞,1μg至8μg/ml/百万细胞,1μg至6μg/ml/百万细胞,1μg至5μg/ml/百万细胞,1μg至3μg/ml/百万细胞,2μg至6μg/ml/百万细胞,2.5μg至5μg/ml/百万细胞,或3μg至5μg/ml/百万细胞,1μg至100μg/ml/百万细胞,1μg至50μg/ml/百万细胞,1μg至20μg/ml/百万细胞,1μg至15μg/ml/百万细胞,10μg至100μg/ml/百万细胞,20μg至100μg/ml/百万细胞,或50μg至100μg/ml/百万细胞,1μg至1000μg/ml/百万细胞,100μg至800μg/ml/百万细胞,100μg至600μg/ml/百万细胞,100μg至500μg/ml/百万细胞,200μg至500μg/ml/百万细胞。
在一实例中,PPS的量为约1mg至100mg/7500万细胞,例如约25-75mg/7500万细胞,如,约75mg/7500万细胞(如,1mg/百万细胞)。
在进一步的实例中,PPS的浓度为约500ng,1μg,2μg,2.5μg,5μg,10μg,15μg,20μg,30μg,40μg,50μg,60μg,70μg,80μg,90μg,100μg,150μg,200μg,250μg,300μg,350μg,400μg,450μg,500μg,550μg,600μg,650μg,700μg,750μg,800μg,850μg,900μg,950μg,1000μg,1050μg,1100μg,1150μg,1200μg,1250μg,1300μg,1350μg,1400μg,1450μg,1500μg,1550μg,1600μg,1650μg,1700μg,1750μg,1800μg,1850μg,1900μg,1950μg,或2000μg/ml/百万细胞。
例如,给予的PPS总量为约1至100mg。
例如,给予的PPS总量为约75mg。
在另一实例中,可以诸如以在每毫升待给予个体的组合物中产生0.01至100微克PPS的浓度的量给予PPS,例如,每毫升组合物0.1至50微克,每毫升组合物0.1至50微克,每毫升组合物0.1至10微克,每毫升组合物1至10微克,每毫升组合物2至8微克,每毫升组合物4至6微克,或者每毫升组合物4、5或6微克。
在一实例中,将富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子与PPS一起或不与PPS一起每周一次或更少给予,如每四周一次或更少。
本公开还考虑多次给予细胞和/或可溶性因子。例如,这种方法可包括给予细胞并监测个体以确定何时内皮功能障碍的一种或多种症状出现或重现,以及给予进一步剂量的细胞和/或可溶性因子。评估内皮功能障碍症状的合适方法对本领域技术人员是显而易见的和/或如本文所述。
在另一实例中,将细胞和/或可溶性因子按固定时间表给予,例如,一周或两周或三周或四周或五周或六周或更长时间一次。
在一实例中,富集STRO-1+细胞的细胞群和/或后代细胞为自体或同种异体的,和/或可溶性因子可源自自体或同种异体细胞。
在一实例中,在给予前和/或获得可溶性因子之前,将富集STRO-1+细胞的细胞群和/或后代细胞经培养扩增。
在一实例中,富集STRO-1+细胞的细胞群为STRO-1亮和/或表达组织非特异性碱性磷酸酶(TNAP),和/或后代细胞和/或可溶性因子源自为STRO-1亮和/或表达TNAP的STRO-1+细胞。
在一实例中,将STRO-1+细胞和/或其后代细胞和/或源自它们的可溶性因子以组合物的形式给予,所述组合物包括所述STRO-1+细胞和/或其后代细胞和/或源自它们的可溶性因子以及载体和/或赋形剂。
在一实例中,所述个体为哺乳动物,例如灵长类动物,如人类。在另一实例中,所述个体为非人的动物(如非人的哺乳动物),如家养哺乳动物,如狗或猫或马或牛或绵羊。
本公开另外提供了富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子,任选地与PPS相组合,用于治疗或预防个体内皮功能障碍或由内皮功能障碍引起的病症。
本公开另外提供了富集STRO-1+细胞的细胞群和/或其后代和/或源自它们的可溶性因子,任选地与PPS相组合,在制备用于治疗或预防个体内皮功能障碍或由内皮功能障碍引起的病症中的应用。
附图说明
图1.由成人骨髓单个核细胞(BMMNC)共表达TNAP(STRO-3)和间充质前体细胞标志物-STRO-1亮。双色免疫荧光和流式细胞术通过孵育STRO-1 MACS-选择的BMMNC来进行,用与FITC结合的山羊抗-鼠IgM抗体间接标记(x轴),以及用与PE结合的山羊抗-鼠IgG间接标记的STRO-3mAb(鼠IgG1)(y轴)。点状直方图代表以列表型(listmode)数据收集的5×104个事件。将垂直线和水平线设定为反应水平<利用在相同条件下处理的同种型匹配对照抗体-1B5(IgG)和1A6.12(IgM)获得的平均荧光的1.0%。结果证明,STRO-1亮细胞的较小群共表达TNAP(右上象限),而剩余的STRO-1+细胞不能与STRO-3mAb反应。
图2.培养和扩增的STRO-1亮MPC的STRO-1亮或STRO-1暗淡后代的基因表达谱。离体扩增的骨髓MPC的单细胞悬液通过胰蛋白酶/EDTA处理来制备。将细胞用STRO-1抗体染色,随后通过与山羊-抗鼠IgM-异硫氰酸荧光素孵育来显现。荧光活化细胞分选之后(A),由表达STRO-1暗淡或STRO-1亮的细胞的纯化群制备总细胞RNA。利用RNAzolB提取法和标准程序,从每个亚细胞群中分离总RNA并用作cDNA合成的模板。使用如前所述的标准方案(Gronthos etal.J Cell Sci.116:1827-1835,2003),通过PCR扩增来评估不同转录物的表达。在本研究中使用的引物组显示于表2中。扩增之后,每一反应混合物通过1.5%琼脂糖凝胶电泳来分析并通过溴化乙锭染色显现(B)。利用ImageQant软件,参照管家基因GAPDH的表达来评估各个细胞标志物的相对基因表达(C)。
图3.培养和扩增的STRO-1+MPC的STRO-1亮后代表达高水平的SDF-1,STRO-1暗淡后代则没有。(A)利用FACS,根据STRO-1亮和STRO-1暗淡/暗区域,将MACS-分离的STRO-1+BMMNC制备物分成不同的STRO-1亚集。从各个STRO-1亚群制备总RNA并用于构建STRO-1亮消减杂交库(B-C)。复制硝化纤维素滤膜,其已具有从用STRO-1亮消减的cDNA转化的细菌克隆扩增的代表性PCR产物的印迹。接着用[32P]脱氧胞苷三磷酸(dCTP)-标记的STRO-1亮(B)或STRO-1暗淡/暗消减的cDNA(C)来探测滤膜。箭头指示含有对应于人SDF-1的cDNA片段的1个克隆的差异表达。(D)逆转录酶(RT)-PCR分析,其显示了培养前由新鲜的MACS/FACS分离的BMMNC STRO-1细胞群制备的总RNA中SDF-1和甘油醛-3-磷酸脱氢酶(GAPDH)转录物的相对表达。bp指示碱基对。
图4为显示基质细胞和原代长期培养物中CD146、CXCL12和血管生成素1表达的一系列图示。(A)对基质细胞系HS5和HS27a的CD146(MCAM)以及同种型对照的FACS分析。(B)对原代LTC第一代的CD146以及同种型对照的FACS分析。通过FACS辅助的流式分选将原代LTC分类成CD146hi和CD146lo细胞群。还指示了用于hi和lo细胞群的近似设门。(C)将9个LTC的CXCL12水平分类成CD146hi和CD146lo并通过RT-PCR定量(相对于β-肌动蛋白,乘以因子1000)。来自同一培养物的成对样品由线连接。(D)同样9个LTC的血管生成素-1水平也通过RT-PCR定量(相对于β-肌动蛋白,乘以因子10000)。图A中的试验以三个独立试验来验证,图B、C和D中的试验以9个独立样品来验证。通过Wilcoxon's配对检验图C和D中数据集的统计学分析显示在两种情况下p-值<0.01。
图5示出通过给予胶原蛋白诱导内皮功能障碍之后两周时间内治疗和未治疗的绵羊血浆中的IL-10水平(ng/ml)的平均值±SEM。
图6示出通过给予胶原蛋白诱导内皮功能障碍之后两周时间内治疗和未治疗的绵羊血浆中的纤维蛋白原水平(g/L)的平均值±SEM。
图7示出通过给予胶原蛋白诱导内皮功能障碍之后两周时间内治疗和未治疗的绵羊血浆中的肌动蛋白A水平(pg/ml)的平均值±SEM。
图8示出通过给予胶原蛋白诱导内皮功能障碍之后两周时间内治疗和未治疗的绵羊血浆中的C-反应蛋白水平(mg/L)的平均值±SEM。
图9示出通过给予胶原蛋白诱导内皮功能障碍之后两周时间内治疗和未治疗的绵羊血浆中的C-反应蛋白水平的变化百分比。
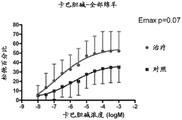
图10为显示来自给予MPC(“治疗”)或盐水(“对照”)的绵羊的绵羊冠状动脉(A和C)或指动脉(B和D)的松弛百分比的一系列图示,所述动脉用内皮素-1收缩,随后用缓激肽(A)、卡巴胆碱(C)或硝普钠(B和D)松弛。
图11为显示通过给予胶原蛋白诱导内皮功能障碍之后MPC±PPS治疗和未治疗的绵羊血浆中相对于基线的峰值IL10水平(ng/mL)的平均值±SD的图示。
图12为显示通过给予胶原蛋白诱导内皮功能障碍之后两周时间内MPC±PPS治疗和未治疗的绵羊血浆中相对于基线的纤维蛋白原水平(g/L)变化的平均值±SEM的图示。
图13为显示通过给予胶原蛋白诱导内皮功能障碍之后两周时间内MPC±PPS治疗和未治疗的绵羊血浆中肌动蛋白A水平(pg/ml)的平均值±SEM。
图14为显示通过给予胶原蛋白诱导内皮功能障碍之后两周时间内MPC±PPS治疗和未治疗的绵羊血浆中相对于基线的C-反应蛋白水平变化的平均值±SEM。
图15为显示来自给予MPC±PPS(“治疗”)或盐水(“对照”)的绵羊的绵羊冠状动脉(A和C)或指动脉(B和D)的松弛百分比的一系列图示,所述动脉用内皮素-1收缩,随后用缓激肽(A)、卡巴胆碱(C)或硝普钠(B和D)松弛。
发明详述
一般技术和所选定义
在本说明书中,除非另有明确说明或者上下文另有要求,提及单一步骤、物质组合物、步骤组或物质组合物的组应当理解为包括一个和多个(即一个或多个)此类步骤、物质组合物、步骤组或物质组合物的组。
除非另有明确说明,本文描述的各个实施方案或实例加以必要的修改可适用于每一个其他的实施方案。
除了具体描述的那些外,本领域技术人员应当理解,可对本文所述的公开内容进行变型和修改。应当理解本公开包括所有这类变型和修改。本公开还单独或整体地包括本说明书提及的或说明的所有步骤、特征、组合物和化合物,以及所述步骤或特征的任何和所有组合,或任何两个或更多个所述步骤或特征。
本公开不限于本文包括的本文所述的具体实施方案的范围,其仅意图用于例证目的。如本文所述,功能等同的产品、组合物和方法明显位于本公开的范围内。
除非另有说明,利用分子生物学、微生物学、病毒学、重组DNA技术、溶液中的肽合成、固相肽合成和免疫学的常规技术实施本公开,不需要过度的实验。此类程序描述于例如Sambrook,Fritsch&Maniatis,Molecular Cloning:A Laboratory Manual,Cold SpringHarbor Laboratories,New York,Second Edition(1989),整个I、II和III卷;DNACloning:A Practical Approach,Vols.Iand II(D.N.Glover,ed.,1985),IRL Press,Oxford,全文;Oligonucleotide Synthesis:A Practical Approach(M.J.Gait,ed,1984)IRL Press,Oxford,全文,尤其是其中Gait的文章,ppl-22;Atkinson et al,pp35-81;Sproat et al,pp 83-115;和Wu et al,pp 135-151;4.Nucleic Acid Hybridization:APractical Approach(B.D.Hames&S.J.Higginseds.,1985)IRL Press,Oxford,全文;Immobilized Cell and Enzymes:A Practical Approach(1986)IRL Press,Oxford,全文;Perbal,B.,A Practical Guide to Molecular Cloning(1984);Methods In Enzymology(S.Colowick and N.Kaplaneds.,Academic Press,Inc.),整个系列;J.F.RamalhoOrtigao,"The Chemistry of Peptide Synthesis"Knowledge database of Access toVirtual Laboratory website(Interactiva,Germany);Sakakibara,D.,Teichman,J.,Lien,E.Land Fenichel,R.L.(1976).Biochem.Biophys.Res.Commun.73336-342;Merrifield,R.B.(1963).J.Am.Chem.Soc.85,2149-2154;Barany,G.and Merrifield,R.B.(1979),The Peptides(Gross,E.and Meienhofer,J.eds.),vol.2,pp.1-284,AcademicPress,New York.12.Wünsch,E.ed.(1974)Synthese von Peptiden in Houben-WeylsMetoden der Organischen Chemie(Müler,E.ed.),vol.15,4th edn.,第1和2部分,Thieme,Stuttgart;Bodanszky,M.(1984)Principles of Peptide Synthesis,Springer-Verlag,Heidelberg;Bodanszky,M.&Bodanszky,A.(1984)The Practice of PeptideSynthesis,Springer-Verlag,Heidelberg;Bodanszky,M.(1985)Int.J.Peptide ProteinRes.25,449-474;Handbook of Experimental Immunology,Vols.I-IV(D.M.Weir andC.C.Blackwelleds.,1986,Blackwell Scientific Publications);以及Animal CellCulture:Practical Approach,Third Edition(John R.W.Masterseds.,2000),ISBN0199637970,全文。
在本说明书中,除非上下文另有要求,单词“包括(comprise)或者变体(comprises或comprising)”应当被理解为意指包括所述的步骤或要素或整体(integer),或者步骤或要素或整体的组,但不排除任何其他步骤或要素或整体,或者要素或整体的组。
如本文所用,术语“源自”应当被理解为指示,指定整体(integer)可以获自特定来源,虽然不一定直接来自该来源。在源自干细胞和/或其后代细胞的可溶性因子的情形下,该术语应当理解为指干细胞和/或其后代细胞的体外培养期间产生的一个或多个因子,例如蛋白、肽、糖类等。
如本文所用,术语“内皮功能障碍”将被理解为意指个体这样的状态(例如,全身状态),其以血管舒张与血管收缩物质之间不平衡为特征,和/或其以内皮作用向着降低血管舒张和/或促炎状态和/或促凝血特征变化为特征。用于检测内皮功能障碍的方法对本领域技术人员显而易见和/或如本文所述。
如本文所用,术语“由内皮功能障碍引起的病症”将被理解为意指其中内皮功能障碍起病理学作用的任何医学病症。在一实例中,所述病症为血管病症。例如,所述病症为心血管疾病(如高血压、冠状动脉疾病、慢性心力衰竭和外周动脉疾病),糖尿病的血管并发症(如肾病)或慢性肾衰竭。
如本文所用,术语“肾病”将被理解为意指以肾受损为特征的病症,并且包括非炎性肾病(肾变病)和炎性肾病(肾炎)。肾病的原因包括肾小球中IgA抗体的沉积,给予止痛剂,黄嘌呤氧化酶缺乏和/或长期接触铅或其盐。可形成肾病的慢性病症包括全身性红斑狼疮(SLE),糖尿病或高血压(血压高),其分别导致糖尿病肾病和高血压肾病。
术语“糖尿病肾病”(又被称为Kimmelstiel-Wilson综合征或结节性糖尿病肾小球硬化和毛细管间肾小球肾炎)将被理解为指由肾脏肾小球中的毛细血管病变引起的进展性肾病症。它以肾病综合征和弥漫性肾小球硬化症为特征。通常在该病症中检测到的首次实验室异常为阳性微量白蛋白尿测试。通常,当常规尿分析患有糖尿病的人显示尿液中蛋白太多(蛋白尿)时,诊断为疑似的。尿分析也可在尿液中显示糖尿病,特别是血糖控制不良时。血清肌酐可随肾损伤进展而增加。可将肾脏活组织检查用于确认诊断,尽管这在具有随时间记录的蛋白尿进展以及检查眼睛视网膜时出现糖尿病视网膜病变的明确情况下并不总是必要的。
本文使用的术语“全身炎症反应综合征”(或“SIRS”)与其通常意义一致,是指没有感染源的全身炎症状态。诊断SIRS有四个主要症状,尽管这些中的任意两个就足以诊断(参见,例如Nystrom(1998)Journal of Antimicrobial Chemotherapy,41,Suppl A,1-7).
术语“败血症”是指SIRS的一种形式,其由疑似或证实的感染引起(参见,例如Nystrom(1998)Journal of Antimicrobial Chemotherapy,41,Suppl.A,1-7)。导致败血病的感染可由例如病毒、真菌、原生动物或细菌引起。
术语“败血性休克”是指具有低血压的败血症,尽管用流体足够复苏(难治性低血压),连同存在灌注异常(参见,例如Nystrom(1998)Journal of AntimicrobialChemotherapy,41,Suppl.A,1-7)。
术语“败血症样病症”是指患者出现类似于败血症或败血性休克的症状但是炎性介质级联和/或血流动力学参数变化并非主要或初始由感染因子引起的状态。例如,败血症样病症可见于患有急性或慢性肝衰竭的患者(参见Wasmuth H E,et al.JHepatol.2005February;42(2):195-201),心脏骤停之后患有复苏后疾病的患者(参见Adrie C et al.Curr Opin Crit Care.2004June;10(3):208-12),癌症化疗之后患有败血症-样症状的患者(参见Tsuji E et al.Int J Cancer.2003Nov.1;107(2):303-8),经历用重组TNF-α肢体隔离热灌注或类似治疗的患者(参见Zwaveling J H et al.Crit CareMed.1996May;24(5):765-70)或者新生儿败血症-样疾病(参见Griffin M P etal.Pediatr Res.2003June;53(6):920-6)。
如本文所用,术语“有效量”应当被理解为意指足够量的干细胞和/或其后代细胞和/或源自它们的可溶性因子,以实现个体中血管扩张(例如在存在内皮扩张剂如缓激肽或卡巴胆碱的情形下)显著增加和/或个体内皮中或个体组织或其组织区域(如功能障碍的内皮区域)中血管生成素I水平增加。该术语并不意味着每次都针对这些效果测试“有效量”,而是指该量能够在初步研究中确立,并且基于这些研究结果可推断该量将在大部分个体中具有相同的效果。
如本文所用,术语“治疗有效量”应当被理解为意指足够量的干细胞和/或其后代细胞和/或源自它们的可溶性因子,以治疗由内皮功能障碍引起的病症或其症状或其临床指征。
如本文所用,术语“预防有效量”应当被理解为意指足够量的干细胞和/或其后代细胞和/或源自它们的可溶性因子,以预防或抑制或延缓由内皮功能障碍导致的病症或其症状或其临床指征的出现。
如本文所用,术语“低剂量”应当被理解为意指干细胞和/或其后代的量少于1×106,但仍足以为本文所定义的“有效量”和/或本文所定义的“治疗有效量”和/或“预防有效量”。例如,低剂量包括0.5×106或更少的细胞,或者0.4×106或更少的细胞,或者0.3×106或更少的细胞,或者0.1×106或更少的细胞。
如本文所用,术语“高剂量”应当被理解为高于1.5×106细胞/kg。例如,剂量包括约1.5×106至约4×106细胞/kg。例如,高剂量包括约1.5×106或约2×106/kg。
提及“固定的身体剂量”应当被理解为意指不考虑其体重而给予个体或个体群体规定的剂量。
如本文所用,术语“治疗(treat/treatment/treating)”应当被理解为意指给予治疗有效量的可溶性因子和/或细胞,并且减轻或抑制由内皮功能障碍引起的病症的症状,使得个体不再被临床诊断为患有该病症,或者使得病症的水平或严重程度被减轻。
如本文所用,术语“预防(prevent/preventing/prevention)”应当被理解为意指给予预防有效量的可溶性因子和/或细胞,并且阻止或阻碍或延缓由内皮功能障碍引起的病症的发生或进展。
如本文所用,术语“可溶性因子”应当理解为指干细胞和/或其后代产生的可溶于水的任何分子,例如,蛋白、肽、糖蛋白、糖肽、脂蛋白、脂肽、糖类等。此类可溶性因子可以为细胞内的,和/或由细胞分泌。此类可溶性因子可以为复合混合物(例如,上清液)和/或其一部分,和/或可以为纯化的因子。在本公开的一实例中,可溶性因子位于上清液中,或包含在上清液中。因此,本文中涉及给予一种或多种可溶性因子的任何实例都应当理解为加以必要的修改后适用于给予上清液。
如本文所用,术语“上清液”是指在适当的培养基例如液体培养基中,体外培养干细胞和/或其后代后产生的非细胞物质。通常,上清液通过以下产生:于适当的条件和时间下在培养基中培养细胞,然后通过诸如离心的方法去除细胞物质。在施用前上清液可以经过或可以不经过进一步的纯化步骤。在一实例中,上清液包含少于105个的活细胞,例如少于104,如少于103,例如,没有活细胞。
如本文所用,术语“正常或健康个体”应当被理解为意指通过本领域已知和/或本文所述的任何方法评估的没有内皮功能障碍的个体。在一实例中,“正常”或“健康个体”并不患有任何由内皮功能障碍引起的病症的症状。
内皮功能障碍
评估内皮功能的众多测试为本领域内已知和/或在下文被描述,并且可用于检测内皮功能障碍。
当测试内皮功能时常见的评估参数为内皮依赖性血管舒张。在冠状动脉中,这由多普勒流量测定通过造影进行,评估内皮依赖性激动剂,主要是乙酰胆碱的作用(Schachinger et al.,Circulation 101:1899–1906,2000)。
通过正电子发射断层扫描利用冠状动脉灌注测量的冷加压试验也可用作内皮功能的测量(Gokce et al.,Am Coll Cardiol 41:1769–1775,2003).
由于剪切应力为内皮对释放NO的刺激,无创技术由在反应性充血期间诱导剪切应力增加以通过超声来评估流量介导的肱动脉血管舒张而组成(Celermajer et al.,Lancet340:1111–1115,1992)。
由于内皮功能障碍伴随有动脉炎症,内皮功能障碍的标志物包括可溶形式的ICAM-1、VCAM-1和E-选择素,其可在血浆中评估。
微量白蛋白尿有一段时间已被认为是内皮功能障碍的表现。大多数病理状况下微量白蛋白尿似乎是肾小球中毛细血管壁的失调,导致白蛋白经毛细血管漏出。在糖尿病中,内皮功能障碍已与微量白蛋白尿相关联,并且可出现在微量白蛋白尿发生之前。已显示微量白蛋白尿与内皮功能障碍的标志物相关联。
心肌血流量和代谢活性的定量评估可通过正电子发射断层扫描术来进行(Gouldet al.,Circulation 89:1530–1538,1994)。可获得基础流量和充血流量(通常为静脉内双嘧达莫)以计算冠状动脉血流储备。由于心肌血流量增加与腺苷诱导的增加和流量介导的血管舒张相关,它部分是内皮功能的测量。该技术无创伤并且可能具有每名患者多次测试的优势。
Hokanson等(IEEE Trans Biomed Eng 22:25–29,1975)描述了用于直接测量肢体血流量的电动校准的体积描记法。该仪器由于直接在动脉内输注醋甲胆碱或乙酰胆碱评估内皮功能而相对便宜且多功能。由于测量了前臂血流量(ml/min/100ml),静脉闭塞体积描记法反映了前臂中的阻力血管功能。
干细胞或后代细胞以及源自它们的上清液或者一种或多种可溶性因子
如本文所用,术语“干细胞”是指自我更新的细胞,其能产生表型和基因型相同的子代,以及至少一种其他终细胞类型(例如,终末分化的细胞)。术语“干细胞”包括全能性、多能性和专能性细胞,以及源自它们分化的祖细胞和/或前体细胞。干细胞可以为成体干细胞或胚胎干细胞,或者可以为诱导的多能干细胞(iPS)。
如本文所用,术语“全能细胞(totipotent cell)”或“全能性细胞(totipotentialcell)”是指能形成完整胚胎(例如,囊胚)的细胞。
如本文所用,术语“多能细胞(pluripotent cell)”或“多能性细胞(pluripotential cell)”是指具有完整的分化多功能性的细胞,即,能够成长为哺乳动物身体中约260种细胞类型的任何一种。多能细胞能够自我更新,并且能够在组织中保持休眠或静止。
所用“专能性细胞(multipotential cell)”或“专能细胞(multipotent cell)”是指能够产生几种成熟细胞类型中任何一种的细胞。如本文使用,该短语包括成体或胚胎干细胞和祖细胞,如间充质前体细胞(MPC)和这些细胞的专能性后代。与多能细胞不同,专能细胞不具有形成所有细胞类型的能力。
如本文所用,术语“祖细胞”是指定型于分化为特定类型细胞或形成特定类型组织的细胞。
如本文所用,短语“STRO-1+专能性细胞”应当理解为指能够形成专能性细胞集落的STRO-1+和/或TNAP+祖细胞。
STRO-1+专能性细胞为发现于骨髓、血液、牙髓细胞、脂肪组织、皮肤、脾脏、胰腺、脑、肾脏、肝、心脏、视网膜、脑、毛囊、肠、肺、淋巴结、胸腺、骨、韧带、腱、骨骼肌、真皮和骨膜中的细胞;并且其能分化为胚系如中胚层和/或内胚层和/或外胚层。因此,STRO-1+专能性细胞能够分化为大量的细胞类型,包括但不限于:脂肪组织、骨组织、软骨组织、弹性组织、肌肉组织和纤维结缔组织。这些细胞进入的具体定型谱系和分化途径,取决于来自机械影响和/或内源性生物活性因子如生长因子、细胞因子和/或宿主组织确立的局部微环境条件的多种影响。在一个实施方案中,STRO-1+专能性细胞为非造血祖细胞,其分裂产生的子代细胞为干细胞或前体细胞,它们会适时地不可逆地分化而产生表型细胞。
在一实例中,STRO-1+细胞从获自个体的样品富集而来,例如,待治疗的个体或相关的个体或不相关的个体(相同物种或不同物种的个体)。本文所用术语“富集(enriched/enrichment)”或其变型用来描述,当相比未处理的细胞群(例如,处于它们天然环境中的细胞)时,细胞群中一种特定细胞类型的比例或多种特定细胞类型的比例增加。在一实例中,富集STRO-1+细胞的群包含至少约0.1%,或0.5%,或1%,或2%,或5%,或10%,或15%,或20%,或25%,或30%,或50%,或75%的STRO-1+细胞。在这方面,术语“富集STRO-1+细胞的细胞群”应当理解为给术语“包含X%的STRO1+细胞的细胞群”提供了明确的支持,其中X%为本文所述的百分比。在一些实例中,STRO-1+细胞可以形成克隆性集落,例如CFU-F(成纤维细胞)或其子集(例如,50%,或60%,或70%,或70%,或90%,或95%)可以具有这种活性。
在一实例中,细胞群以可选择的形式从包含STRO-1+细胞的细胞制备物富集而来。在这方面,术语“可选择的形式”应当理解为指细胞表达允许选择STRO-1+细胞的标志物(例如,细胞表面标志物)的细胞。所述标志物可以是但不必是STRO-1。例如,如本文所述和/或例示,表达STRO-2和/或STRO-3(TNAP)和/或STRO-4和/或VCAM-1和/或CD146和/或3G5的细胞(例如,MPCs)还表达STRO-1(且可以为STRO-1亮)。因此,指示细胞为STRO-1+不意味着该细胞通过STRO-1表达来选择。在一实例中,所述细胞基于至少STRO-3表达来选择,例如,它们为STRO-3+(TNAP+)。
提及细胞或其群体的选择时不必然要求从特定组织来源选择。如本文所述,STRO-1+细胞可以从大量不同来源选择或分离或富集。即,在一些实例中,这些术语为从包含STRO-1+细胞(例如,MPCs)的任何组织或血管化组织或包含周细胞(例如,STRO-1+周细胞)的组织或任何一种或多种本文所述的组织进行选择提供支持。
在一实例中,用于本公开的细胞表达一种或多种标志物,其单独地或共同地选自:TNAP+、VCAM-1+、THY-1+、STRO-2+、STRO-4+(HSP-90β)、CD45+、CD146+、3G5+或它们的任何组合。
所用“单独地(individually)”是指本公开分别涵盖所述标志物或标志物的组,并且,虽然本文可能没有分别列出个别标志物或标志物的组,所附的权利要求可以分别地地和彼此可分地定义此类标志物或标志物的组。
所用“共同地(collectively)”是指本公开包括任何数目或组合的所述标志物或肽的组,并且,虽然本文可能没有明确列出此类数目或组合的标志物或标志物的组,所附的权利要求可以分别地和与任何其他标志物或标志物的组的组合可分地定义此类组合或亚组合。
例如,STRO-1+细胞为STRO-1亮(同义词为STRO-1bri)。在一实例中,所述Stro-1bri细胞相对于STRO-1暗淡或STRO-1中间细胞优先被富集。
例如,所述STRO-1亮细胞为另外的一种或多种TNAP+、VCAM-1+、THY-1+、STRO-2+、STRO-4+(HSP-90β)和/或CD146+。例如,所述细胞针对一种或多种前述标志物进行选择,和/或被证明表达一种或多种前述标志物。在这方面,显示表达标志物的细胞不需要被特别测试,但先前富集的或分离的细胞可以被测试并且随后使用,分离或富集的细胞可以被合理地假定为也表达相同标志物。
在一实例中,间充质前体细胞为WO 2004/85630中所定义的血管周间充质前体细胞。例如,所述间充质前体细胞表达血管周细胞的标志物,例如,所述细胞为STRO-1+或STRO-1亮和/或3G5+。在一实例中,所述细胞为或先前为从血管化组织或器官或其部分分离的细胞,或为从血管化组织或器官或其部分分离的细胞的后代。
被称为对于给定标志物为“阳性”的细胞,其可以表达低(lo或暗淡)或高(亮,bri)水平的该标志物,这取决于标志物在细胞表面上存在的程度,其中该术语与用于所述细胞的分选过程中的荧光或其他标志物的强度有关。在将标志物用于被分选的特定细胞群的情形下,lo(或者,暗淡或暗)和bri的区别容易理解。被称为对于给定标志物为“阴性”的细胞,不一定完全不存在于该细胞中。该术语是指细胞以相对非常低的水平表达标志物,并且其在当可检测地标计时产生非常低的信号,或在背景水平例如利用同种型对照抗体检测的水平上不可检测。
当用于本文时,术语“亮”是指当被可检测地标记时,产生相对高信号的细胞表面标志物。不希望受理论的束缚,提出相比样品中的其他细胞,“亮”细胞表达更多的靶标标志物蛋白(例如被STRO-1识别的抗原)。例如,相比非亮细胞(STRO-1暗/暗淡),标记有FITC偶联的STRO-1抗体时,STRO-1bri细胞产生更强的荧光信号,如通过荧光活化的细胞分选(FACS)分析所测定。在一实例中,“亮”细胞构成起始样品中所含的被最亮标记的骨髓单个核细胞中的至少约0.1%。在其它实例中,“亮”细胞构成起始样品中所含的被最亮标记的骨髓单个核细胞的至少约0.1%、至少约0.5%、至少约1%、至少约1.5%或至少约2%。在一个实例中,相对于“背景”即STRO-1-细胞,STRO-1亮细胞具有高于2个对数量级表达的STRO-1表面表达。通过比较,相比“背景”,STRO-1暗淡和/或STRO-1中间细胞具有小于2个对数量级的更高表达的STRO-1表面表达,通常约为1个对数量级或小于背景。
如本文所用,术语“TNAP”旨在包括组织非特异性碱性磷酸酶的所有同种型。例如,该术语包括肝同种型(LAP)、骨同种型(BAP)和肾同种型(KAP)。在一实例中,所述TNAP为BAP。在一实例中,如本文所用,TNAP是指能结合由杂交瘤细胞系产生的STRO-3抗体的分子,所述杂交瘤细胞系根据布达佩斯条约的条款于2005年12月19日保藏在ATCC,保藏登录号为PTA-7282。
此外,在一实例中,STRO-1+细胞能够产生克隆性CFU-F。
在一实例中,显著部分的STRO-1+专能性细胞能够分化为至少两种不同的胚系。专能性细胞可以定向的谱系的非限制性实例包括:骨前体细胞;肝细胞祖细胞,其能专能分化为胆管上皮细胞和肝细胞;神经受限细胞,其能产生能发展为少突胶质细胞和星形胶质细胞的神经胶质细胞前体;神经元前体,其发展为神经元;心肌和心肌细胞、葡萄糖响应性胰岛素分泌性胰β细胞系的前体。其他谱系包括但不限于,成牙本质细胞、牙质生成细胞(denti-producing cells)和软骨细胞,以及以下细胞的前体细胞:视网膜色素上皮细胞、成纤维细胞、皮肤细胞如角质细胞、树状细胞、毛囊细胞、肾管上皮细胞、平滑肌和骨骼肌肉细胞、睾丸祖细胞、血管内皮细胞、腱细胞、韧带细胞、软骨细胞、脂肪细胞、成纤维细胞、骨髓基质、心肌细胞、平滑肌细胞、骨骼肌细胞、周细胞、血管细胞、上皮细胞、神经胶质细胞、神经元细胞、星形胶质细胞和少突胶质细胞。
在另一实例中,STRO-1+细胞培养后不能产生造血细胞。
在一实例中,细胞采自待治疗的个体,并利用标准技术体外培养以用于获得作为自体型或同种异体型组合物的上清液或可溶性因子或扩增细胞,用于给予个体。在可选的实例中,使用了一种或多种已建立的人细胞系的细胞。在本公开另一有用的实例中,使用了非人的动物(或者如果患者不为人,则来自另一物种)的细胞。
本公开还考虑应用获自或源自经体外培养产生的STRO-1+细胞和/或其后代细胞(后者也被称为扩增细胞)的上清液或可溶性因子。根据培养条件(包括培养基中刺激因子的数目和/或类型)、传代次数等,本公开的扩增细胞可以具有多种表型。在某些实例中,所述后代细胞在从亲本细胞群传代约2、约3、约4、约5、约6、约7、约8、约9或约10次后获得。然而,所述后代细胞可以在从亲本细胞群经任何传代次数后获得。
后代细胞可以通过在任何合适的培养基中培养获得。关于细胞培养物,所使用的术语“培养基”包括细胞周围环境的组分。培养基可以为固体、液体、气体或相和物质的混合。培养基包括液体生长培养基以及不维持细胞生长的液体培养基。培养基还包括凝胶状培养基如琼脂、琼脂糖、明胶和胶原基质。示例性气体培养基包括生长在培养皿或其他固体或半固体支持物上的细胞暴露于其中的气相。术语“培养基”还指旨在用于细胞培养的物质,即使其还未与细胞接触。换句话说,制备用于细菌培养的营养富集性液体即为培养基。与水或其他液体混合时变得适于细胞培养的粉末状混合物可以称为“粉末状培养基”。
在一实例中,通过利用标记有STRO-3抗体的磁珠从骨髓中分离TNAP+STRO-1+细胞可以得到用于本公开方法的后代细胞,然后培养扩增分离的细胞(合适培养条件的实例,参见Gronthos et al.Blood 85:929-940,1995)。
在一实例中,这种扩增细胞(后代)(例如,至少5次传代后)可以为TNAP-、CC9+、HLAI+类、HLA II-类、CD14-、CD19-、CD3-、CD11a-c-、CD31-、CD86-、CD34-和/或CD80-。然而,可能在与本文描述的那些不同的培养条件下,不同标志物的表达可能存在差异。另外,虽然这些表型的细胞可能在扩增的细胞群中占优势,但这不意味着存在小比例的不具有该表型的细胞(例如,小百分比的扩增细胞可以为CC9-)。在一实例中,扩增细胞仍然具有分化为不同细胞类型的能力。
在一实例中,用来得到上清液或可溶性因子或细胞本身的扩增细胞群,包含其中至少25%(例如至少50%)的细胞为CC9+的细胞。
在另一实例中,用来得到上清液或可溶性因子或细胞本身的扩增细胞群,包含其中至少40%(例如至少45%)的细胞为STRO-1+的细胞。
在其他实例中,扩增细胞可以表达一种或多种标志物,其共同地或单独地选自LFA-3、THY-1、VCAM-1、ICAM-1、PECAM-1、P-选择素、L-选择素、3G5、CD49a/CD49b/CD29、CD49c/CD29、CD49d/CD29、CD90、CD29、CD18、CD61、整合素β6-19、血栓调节蛋白、CD10、CD13、SCF、PDGF-R、EGF-R、IGF1-R、NGF-R、FGF-R、瘦素-R(STRO-2=瘦素-R)、RANKL、STRO-4(HSP-90β)、STRO-1亮和CD146或这些标志物的任何组合。
在一实例中,后代细胞为专能性扩增的STRO-1+专能性细胞后代(MEMP),如WO2006/032092中所定义和/或描述的。制备可由其衍生后代细胞的富集STRO-1+专能性细胞群的方法描述于WO 01/04268和WO 2004/085630中。在体外情形下,STRO-1+专能性细胞很少作为完全纯的制备物提供,并且通常与为组织特异性定型细胞(TSCC)的其他细胞一起提供。WO 01/04268涉及以约0.1%至90%的纯度水平从骨髓收获此类细胞。包含可衍生后代的MPC细胞群可以直接从组织源收获,或可选地,其可以为已体外扩增的细胞群。
例如,所述后代可以获自基本上纯化的STRO-1+专能性细胞的收获的未扩增细胞群,其包含所存在的细胞群总细胞的至少约0.1%、1%、5%、10%、20%、30%、40%、50%、60%、70%、80%或95%。例如,可以通过选择对至少一个标志物为阳性的细胞来达到该水平,所述标志物单独地或共同地选自TNAP、STRO-4(HSP-90β)、STRO-1亮、3G5+、VCAM-1、THY-1、CD146和STRO-2。
MEMPS与新鲜收获的STRO-1+专能性细胞的区别在于,它们对标志物STRO-1bri为阳性,而对标志物碱性磷酸酶(ALP)为阴性。相反,新鲜分离的STRO-1+专能性细胞对STRO-1bri和ALP均为阳性。在本公开的一实例中,被给予的细胞中至少15%、20%、30%、40%、50%、60%、70%、80%、90%或95%具有STRO-1bri、ALP-表型。在其他实例中,MEMPS对标志物Ki67、CD44和/或CD49c/CD29、VLA-3、α3β1中的一种或多种为阳性。在又一实例中,MEMP不显示TERT活性,和/或对标志物CD18为阴性。
STRO-1+细胞起始细胞群可以源自WO 01/04268或WO 2004/085630中所列的任何一种或多种组织类型,即骨髓、牙髓细胞、脂肪组织和皮肤,或者可能更广义地来自:脂肪组织、牙、牙髓、皮肤、肝、肾、心脏、视网膜、脑、毛囊、肠、肺、脾脏、淋巴结、胸腺、胰腺、骨、韧带、骨髓、腱和骨骼肌。
应当理解,在实施本公开所述方法时,对携带任何给定细胞表面标志物的细胞进行分离可受到多种不同方法的影响,然而,一些示例性方法依赖于,将结合剂(例如,抗体或其抗原结合片段)结合至相关的标志物,然后分离展现所述结合的那些,其为高水平结合,或低水平结合或无结合。最方便的结合剂为抗体或基于抗体的分子,例如单克隆抗体或基于单克隆抗体的(例如,包含其抗原结合片段的蛋白)分子,这是由于这些后述试剂的特异性。抗体可以用于这两个步骤,然而还可以使用其他试剂,因此还可以利用这些标志物的配体来富集携带它们或缺少它们的细胞。
可以将抗体或配体结合到固相支持体上,以允许粗分离。在一些实例中,分离技术将收集部分的活力保留最大化。可以利用多种不同效率的技术来获得相对的粗分离。采用的具体技术取决于分离效率、相关的细胞毒性、进行的容易度和速度,以及所需的尖端设备和/或专业技术。分离方案可以包括但不限于:利用包覆有抗体的磁珠的磁力分离、亲和层析和用结合至固相基质的抗体“淘选”。提供精确分离的技术包括但不限于FACS。进行FACS的方法对本领域技术人员显而易见。
针对本文所述每一种标志物的抗体是可商购的(例如,针对STRO-1的单克隆抗体可从R&D Systems,USA商购),从ATCC或其他保藏机构得到,和/或可以利用领域公认的技术制备。
在一实例中,用于分离STRO-1+细胞的方法包括的第一步骤为固相分选步骤,其利用例如磁力活化的细胞分选(MACS)来识别STRO-1的高水平表达。随后可以进行的第二分选步骤(如需要)导致如专利说明书WO 01/14268所描述的较高水平的前体细胞表达。该第二分选步骤可涉及使用两种或更多种标志物。
获得STRO-1+细胞的方法还可包括利用已知的技术在第一富集步骤前收获细胞来源。因此,可手术去除组织。然后,将包含所述组织来源的细胞分离为所称的单细胞悬液。可以通过物理和/或酶促方式达到该分离。
一旦得到合适的STRO-1+细胞群,其可以通过任何合适的方式培养或扩增,以获得MEMP。
在一实例中,所述细胞采自待治疗的个体,并利用标准技术体外培养以及用于获得作为自体型或同种异体型组合物的上清液或可溶性因子或扩增的细胞,用于给予个体。在可选的实例中,使用一种或多种已建立的人细胞系细胞来获得上清液或可溶性因子。在本公开另一有用的实例中,非人的动物(或如果患者不为人,则来自另一物种)的细胞被用来获得上清液或可溶性因子。
可以利用来自任何非人的动物物种的细胞来实施本公开的方法和用途,包括但不限于:非人的灵长类细胞、有蹄类、犬科动物、猫科动物、兔类、啮齿动物、鸟类和鱼类的细胞。可以用以实施本公开的灵长类细胞包括但不限于:黑猩猩、狒狒、猕猴和任何其他新世界或旧世界猴的细胞。可以用以实施本公开的有蹄类动物细胞包括但不限于:牛、猪、绵羊、山羊、马、水牛和野牛的细胞。可以用以实施本公开的啮齿类动物细胞包括但不限于:小鼠、大鼠、豚鼠、仓鼠和沙鼠的细胞。可以用以实施本公开的兔类动物物种实例包括家兔、长腿大野兔、野兔、白尾灰兔、雪鞋兔和鼠兔。鸡(原鸡)为可以用以实施本公开的鸟类物种的一个实例。
在一个实例中,细胞为人细胞。
在使用前,或在得到上清液或可溶性因子前,可以将用于本公开方法的细胞保存备用。用于保存和储存真核细胞尤其是哺乳动物细胞的方法和方案为本领域已知(参照,例如,Pollard,J.W.and Walker,J.M.(1997)Basic Cell Culture Protocols,SecondEdition,Humana Press,Totowa,N.J.;Freshney,R.I.(2000)Culture of Animal Cells,Fourth Edition,Wiley-Liss,Hoboken,N.J.)。任何维持所分离的干细胞如间充质干/祖细胞或其后代的生物活性的方法都可用于本公开。在一实例中,所述细胞通过利用冷冻保存维持和贮藏。
多硫酸化聚糖
多硫酸化聚糖可为任何天然存在或半合成/合成的多硫酸化聚糖或其生物活性片段,其包含两个或更多个糖环或碳水化合物结构,其中一个或多个硫酸酯基团通过共价键合与之相连,例如肝素和戊聚糖多硫酸酯。
在一实例中,将STRO-1+细胞和/或其后代和/或源自它们的可溶性因子与多硫酸化聚糖相组合给予。
在另一实例中,多硫酸化聚糖为PPS和其药学可接受的盐。
在一实例中,PPS分离自山毛榉木半纤维素(Fagus silvatica),具有戊聚糖多硫酸酯的线性木聚糖(戊聚糖)骨架,平均每十个木糖(戊糖)环包含一个连接到2位上的4-O-甲基-葡萄糖醛酸酯侧链。例如,戊聚糖多硫酸酯及其药学可接受的盐具有以下结构:
在一实例中,具体的络合离子(以形成PPS的盐)可选自:碱金属,如Na+和K+,碱土金属,如Ca2+,Zn2+,Mg2+,Ba2+以及Ag+,Au+,Pb2+,Cu2+,Au2+,Pd2+,Pd4+,Pt4+,Pt2+,三价金属离子以及季铵化合复合物。后面化合物的实例为氯化吡啶,四烷基氯化铵,氯化胆碱,十六烷基氯化吡啶,N-十六烷基-N,N,N-三烷基氯化铵或其衍生物。
例如,络合离子为钠,即PPS为NaPPS。例如,NaPPS为SP54,由Bene Pharmachem(Germany)公司制造。
在一实例中,PPS提高祖细胞的存活,增强祖细胞的冷冻保存,调节祖细胞的增殖和/或调节祖细胞的分化。
遗传修饰的细胞
在一个实例中,干细胞和/或其后代细胞被遗传修饰,例如,以表达和/或分泌目标蛋白。例如,细胞被改造以表达在治疗内皮功能障碍中有用的蛋白,例如血管生成素I或一氧化氮合成酶(如eNOS或iNOS)。
用于遗传修饰细胞的方法对本领域技术人员显而易见。例如,要在细胞中表达的核酸被可操作地连接至启动子,以诱导细胞内的表达。例如,将核酸连接至在个体的多种细胞中可操作的启动子,诸如例如病毒启动子,例如CMV启动子(例如,CMV-IE启动子)或SV-40启动子。其他合适的启动子为本领域已知,且应当理解为加以必要的修改适用于本公开的当前实例。
在一个实例中,核酸以表达构建体的形式提供。如本文所用,术语“表达构建体”是指能够使得与其可操作地连接的核酸(例如报告基因和/或反选择性报告基因)在细胞内进行表达的核酸。在本公开的情形中应当理解,表达构建体可以包括或为质粒、噬菌体、噬菌粒、粘粒、病毒亚基因组或基因组片段,或能够以可表达形式维持和/或复制异源DNA的其他核酸。
用于完成本公开的合适表达构建体的构建方法对本领域技术人员显而易见,并且描述于,例如,Ausubel等(In:Current Protocols in Molecular Biology.WileyInterscience,ISBN 047150338,1987)或Sambrook等(In:Molecular Cloning:MolecularCloning:A Laboratory Manual,Cold Spring Harbor Laboratories,New York,ThirdEdition 2001)。例如,利用例如PCR从合适的模板核酸扩增表达构建体的每个组分,随后克隆至合适的表达构建体,例如,质粒或噬菌粒。
适合此类表达构建体的载体为本领域已知,和/或在本文有描述。例如,哺乳动物细胞中适合本公开方法的表达载体为,例如,Invitrogen提供的pcDNA载体组的载体、pCI载体组(Promega)的载体、pCMV载体组(Clontech)的载体、pM载体(Clontech)、pSI载体(Promega)、VP 16载体(Clontech)或pcDNA载体组(Invitrogen)的载体。
本领域的技术人员知道其他载体和此类载体的来源,诸如例如,LifeTechnologies Corporation,Clontech或Promega公司。
将分离的核酸分子或包含其的基因构建体导入至细胞进行表达的方法是本领域技术人员已知的。用于给定生物体的技术取决于已知的成功技术。将重组DNA导入至细胞的方法包括显微注射、DEAE-葡聚糖介导的转染、脂质体(诸如使用lipofectamine(Gibco,MD,USA)和/或cellfectin(Gibco,MD,USA))介导的转染、PEG-介导的DNA摄取、电穿孔和微粒轰击,如通过利用包覆有DNA的钨或金颗粒(Agracetus Inc.,WI,USA)等。
可选择地,本公开的表达构建体为病毒载体。合适的病毒载体为本领域已知,且可商购。用于递送核酸以及将该核酸整合到宿主细胞基因组的常规基于病毒的系统包括,例如,逆转录病毒载体、慢病毒载体或腺相关病毒载体。可选地,腺病毒载体用于将保持附加体形式的核酸引入至宿主细胞。病毒载体为在靶细胞和组织中进行基因转移的有效和通用的方法。另外,在许多不同细胞类型和靶组织中已观察到高转导效率。
例如,逆转录病毒载体通常包含顺式作用长末端重复(LTR),其具有多达6-10kb的外源序列的包装能力。最小的顺式作用LTR足以用于载体的复制和包装,其随后被用于将表达构建体整合至靶细胞,以提供长期表达。广泛使用的逆转录病毒载体包括基于鼠白血病病毒(MuLV)、长臂猿白血病病毒(GaLV)、猿猴免疫缺陷病毒(SrV)、人免疫缺陷病毒(HIV)和它们的组合的那些(参见,例如,Buchscher et al.,J Virol.56:2731-2739(1992);Johannet al,J.Virol.65:1635-1640(1992);Sommerfelt et al,Virol.76:58-59(1990);Wilsonet al,J.Virol.63:274-2318(1989);Miller et al.,J.Virol.65:2220-2224(1991);PCT/US94/05700;Miller andRosman BioTechniques 7:980-990,1989;Miller,A.D.HumanGene Therapy 7:5-14,1990;Scarpa et al Virology 75:849-852,1991;Burns etal.Proc.Natl.Acad.Sci USA 90:8033-8037,1993)。
已开发出多种腺相关病毒(AAV)载体系统用于核酸递送。可以利用本领域已知技术容易地构建AAV载体。参见,例如,美国专利第5,173,414号和第5,139,941号;国际公开第WO 92/01070号和第WO 93/03769号;Lebkowski et al.Molec.Cell.Biol.5:3988-3996,1988;Vincent et al.(1990)Vaccines 90(Cold Spring Harbor Laboratory Press);Carter Current Opinion in Biotechnology 5:533-539,1992;Muzyczka.CurrentTopics in Microbiol,and Immunol.158:97-129,1992;Kotin,Human Gene Therapy 5:793-801,1994;Shelling and Smith Gene Therapy 7:165-169,1994;以及Zhou et al.JExp.Med.179:1867-1875,1994。
用于递送本公开的表达构建体的其他病毒载体包括,例如源自痘病毒家族的那些载体,如牛痘病毒和鸟痘病毒,或甲病毒属,或缀合的病毒载体(例如Fisher-Hoch et al.,Proc.Natl Acad.Sci.USA 56:317-321,1989中所描述的)。
分析细胞和可溶性因子的治疗/预防潜力
用于研究内皮功能/功能障碍的多种模型是本领域已知的。示例性体外模型包括:
·在高葡萄糖培养基中培养内皮细胞,其导致增殖抑制,粘附分子表达增加以及细胞凋亡增加;以及
·肠系膜动脉的器官培养,例如,如在Alm et al.,BMC CardiovascularDisorders,2:8,2002中所描述的。
内皮功能/功能障碍的体内模型包括:
·如Eberhardt等(J Clin Invest 106:483-491,2000)所述的高同型半胱氨酸小鼠模型。
·使用goldblatt技术制备的大鼠高血压模型,如2-肾1-夹模型和1-肾1-夹模型,已证实其增加动脉血压、总外周阻力(TPR)以及降低对乙酰胆碱(Ach)的内皮依赖性松弛(Share et al.,Clin.Exp.Hypertens.,4:1261-1270,2982;Sventek et al.,Hypertensive,27:49-55,1996)。
·啮齿动物单侧肾切除之后给予橄榄油中的DOCA盐(40mg/kg,s.c.)连同1%NaCl和0.5%KCl,每周两次,持续6周,形成血管内皮功能障碍(Shah and Singh,Naun.Schmie.Arch.Pharmacol.,373:221-229,2006)。
·用L-NAME(eNOS抑制剂)(50mg/kg/天)处理啮齿动物6周已显示在大鼠中增加血压以及降低内皮依赖性松弛(Kung et al.,Hypertensive,26:744-751,1995)。
·给啮齿动物输注血管紧张素-II(0.7mg/kg/天)5天,注意到增加收缩压,形成超氧阴离子以及导致Ach-诱导的松弛受损(Rajagopalan et al.,J.Clin.Invest.,97:1916-1923,1996)。
·长期给予啮齿动物炔雌醇(1.5mg/kg/天)已显示增加血压,并由此降低内皮依赖性松弛(Thakre et al.,Ind.J.Pharmacol.,32:15-20,2000).
·喂食啮齿动物适度高脂肪饮食,给予10周已显示发展了血管内皮功能障碍,其以高血压、增加活性氧种类(ROS)以及脂质过氧化为特征(Dobrian et al.,Hypertensive,37:554-560,2001)。
·给予大鼠链脲霉素(55mg/kg,i.p.一次)产生糖尿病,并由此诱导血管内皮功能障碍(Shah和Singh,Mol.Cell.Biochem.,283:191-199,2006)。
内皮功能障碍的其他模型描述于例如Balakumar et al.,Trends in MedicalResearch,2:12-20,2007等。
细胞组合物
在本公开的一实例中,STRO-1+细胞和/或其后代细胞以组合物的形式施用。例如,这类组合物包含药学可接受的载体和/或赋形剂。
术语“载体”和“赋形剂”是指本领域常规使用以促进活性化合物的储存、给药和/或生物活性的物质组合物(参见,例如,Remington's Pharmaceutical Sciences,16thEd.,Mac Publishing Company(1980)。载体还可以减少活性化合物任何不需要的副作用。合适的载体是例如稳定的,例如不能与载体内的其他成分反应。在一个实例中,所述载体在治疗采用的剂量和浓度下对接受者不产生明显的局部或全身性不利影响。
本公开的合适载体包括常规使用的那些载体,例如,水、盐水、葡萄糖水溶液、乳糖、林格氏溶液、缓冲溶液、透明质酸和乙二醇为示例性液体载体,尤其是对于溶液(等渗时)。合适的药物载体和赋形剂包括淀粉、纤维素、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸镁、硬脂酸钠、单硬脂酸甘油酯、氯化钠、甘油、丙二醇、水、乙醇等。
在另一实例中,载体为培养基组合物,例如,其中生长或悬浮有细胞。例如,这类培养基组合物对于待给药的个体不诱发任何不利的影响。
示例性载体和赋形剂不对细胞存活力和/或细胞减轻、预防或延缓炎性关节病的能力产生不利影响。
在一实例中,载体或赋形剂提供了缓冲活性,以维持细胞和/或可溶性因子处于合适的pH,从而发挥生物活性,例如,所述载体或赋形剂为磷酸盐缓冲液(PBS)。PBS代表了有吸引力的载体或赋形剂,因为其与细胞和因子最小相互作用,并允许细胞和因子的快速释放,在这种情形下,本发明的组合物可以作为液体制备,以直接应用于血流或组织或组织周围或邻近区域,例如,通过注射。
还可以将STRO-1+细胞和/或其后代细胞并入或植入到支架内,所述支架与接受者相容且降解为对接受者无害的产物。这些支架为要移植到接受者个体中的细胞提供了支持和保护。天然和/或合成的可生物降解支架即为此类支架的实例。
多种不同的支架可以成功用于实施本发明。示例性支架包括但不限于生物可降解的支架。天然的生物可降解支架包括胶原、纤连蛋白和层粘连蛋白支架。适用于细胞移植支架的合成材料应当能够支持大量的细胞生长和细胞功能。此类支架还可以为可吸收的。合适的支架包括聚乙醇酸支架,例如,如Vacanti等(J.Ped.Surg.23:3-91988);Cima等(Biotechnol.Bioeng.38:1451991);Vacanti等(Plast.Reconstr.Surg.88:753-91991)所描述的;或合成聚合物如聚酸酐、聚原酸酯(polyorthoesters)和聚乳酸。
在另一实例中,细胞可以在凝胶支架(如来自Upjohn公司的Gelfoam)内给药。
用于本文所述方法的细胞组合物可以单独地或作为与其他细胞的混合物一起给药。可以与本发明的组合物共同给药的细胞包括但不限于其他专能或多能细胞或干细胞,或骨髓细胞。不同类型的细胞可以在给药前即刻或不久与本发明的组合物混合,或者可以将它们在给药前一起共培养一段时间。
在一实例中,组合物包括有效量或者治疗或预防有效量的细胞。例如,所述组合物包括约1×105个STRO-1+细胞/kg至约1×107个STRO-1+细胞/kg或约1×106个STRO-1+细胞/kg至约5×106个STRO-1+细胞/kg。待给予细胞的准确量取决于不同因素,包括患者的年龄、体重、性别,以及炎性关节病的程度和严重性。
在一实例中,将低剂量的细胞给予个体。示例性剂量包括每千克约0.1×104至约0.5×106个细胞,例如,每千克约0.1×105至约0.5×106个细胞,例如每千克约0.5×105至约0.5×106个细胞,例如,每千克约0.1×106至约0.5×106个细胞,例如,每千克约0.2×106或0.3×106个或0.4×106个细胞。
在一实例中,将高剂量细胞给予个体。示例性剂量包括至少约1.5×106个细胞/kg.例如,高剂量包括约1.5×106个至约6×106个细胞/kg,如约1.5×106至约5×106个细胞/kg,例如,约1.5×106至约4×106个细胞/kg,例如约1.5×106至约3×106细胞/kg。例如,高剂量包括约1.5×106或约2×106细胞/kg。
在一实例中,不考虑患者体重,将细胞以总细胞数的剂量给予。
例如,在一实例中,不考虑患者体重,将细胞以约10000万至30000万细胞的剂量给予。
例如,在一实例中,不考虑患者体重,将细胞以约10000万至20000万细胞的剂量给予。
在一实例中,不考虑患者体重,将细胞以约10000万细胞的剂量给予。
在一实例中,不考虑患者体重,将细胞以约15000万细胞的剂量给予。
在一实例中,不考虑患者体重,将细胞以约20000万细胞的剂量给予。
在一实例中,不考虑患者体重,将细胞以约30000万细胞的剂量给予。
在一些实例中,细胞被包含于腔室内,所述腔室不允许细胞逸出进入个体的循环却允许由该细胞分泌的因子进入循环。以这种方式,通过允许细胞分泌因子进入个体的循环中,可将可溶性因子给予个体。这种腔室可以同样地植入个体的部位,以增加可溶性因子的局部水平,例如,植入胰腺内或胰腺附近。
在本发明的一些实例中,在启动细胞组合物治疗前抑制患者的免疫反应可能是不需要的或不合适的。因此,用同种异体或甚至异种STRO-1+细胞或其后代移植在一些情形下可能是耐受的。
然而,在其他情形下,在启动细胞治疗前通过药理学方式免疫抑制患者和/或减少个体针对所述细胞组合物的免疫反应可能是可取的或合适的。这可以通过应用全身性或局部性免疫抑制剂来实现,或其可以通过在密封装置内递送细胞来实现。细胞可以封装在胶囊内,所述胶囊对细胞所需的营养物和氧以及治疗因子具有通透性,然而细胞对免疫体液因子和细胞不具有通透性。例如,胶囊密封材料为低敏感性的,容易并稳定地置入靶组织,并为植入的结构提供额外防护。减少或消除对移植的细胞的免疫反应的这些和其他方式为本领域所已知。作为可选选择,可以对细胞进行遗传修饰,以减少它们的免疫原性。
可溶性因子组合物
在本发明的一实例中,源自STRO-1+细胞和/或源自后代细胞的上清液或可溶性因子以组合物的形式给药,例如,所述组合物包含合适的载体和/或赋形剂。例如,所述载体或赋形剂不对可溶性因子或上清液的生物效应产生不利影响。
在一实例中,所述组合物包含物质组合物,以稳定可溶性因子或上清液组分,例如,蛋白酶抑制剂。例如,包含的蛋白酶抑制剂的量不足以对个体带来不利影响。
可以将包含源自STRO-1+细胞和/或源自后代细胞的上清液或可溶性因子的组合物制备为合适的液体悬液,例如,在培养基或稳定的载体或缓冲溶液中,例如,磷酸盐缓冲盐水。合适的载体在上文有描述。在另一个实例中,包含源自STRO-1+细胞和/或源自后代细胞的上清液或可溶性因子的悬液为用于注射的油性悬液。合适的亲脂性溶剂或载体包括:脂肪油如芝麻油;或合成的脂肪酸酯如油酸乙酯或甘油三酯;或脂质体。用于注射的悬液还可以含有增加悬液粘性的物质如羧甲基纤维素钠、山梨醇或葡聚糖。任选地,所述悬液还可以含有合适的稳定剂或增加化合物溶解性的试剂,以允许制备高浓缩的溶液。
根据需要,无菌注射液可通过将在合适溶剂中的所需量的上清液或可溶性因子与上述成分的一种或组合合并,然后过滤灭菌来制备。。
通常,通过将上清液或可溶性因子合并至含有基础分散介质和来自以上所列举那些的所需其他成分的无菌载体中制备分散液。在用于制备无菌注射溶液的无菌粉末情形下,示例性制备方法为真空干燥和冷冻干燥,其产生活性成分加上来自其先前无菌过滤的溶液的任何其他所需成分的粉末。根据本发明的可选方面,可以将所述上清液或可溶性因子与一种或多种增加其溶解性的其他化合物一起配制。
其他示例性载体或赋形剂描述于,例如Hardman,et al.(2001)Goodman和Gilman's The Pharmacological Basis of Therapeutics,McGraw-Hill,New York,N.Y.;Gennaro(2000)Remington:The Science和Practice of Pharmacy,Lippincott,Williams,和Wilkins,New York,N.Y.;Avis,et al.(eds.)(1993)Pharmaceutical Dosage Forms:Parenteral Medications,Marcel Dekker,NY;Lieberman,et al.(eds.)(1990)Pharmaceutical Dosage Forms:Tablets,Marcel Dekker,NY;Lieberman,et al.(eds.)(1990)Pharmaceutical Dosage Forms:Disperse Systems,Marcel Dekker,NY;Weinerand Kotkoskie(2000)Excipient Toxicity and Safety,Marcel Dekker,Inc.,New York,N.Y。
治疗性组合物在生产和存储条件下通常应当为无菌且稳定的。可以将组合物配制为溶液、微乳剂、脂质体或其他有序结构。载体可以为溶剂或分散介质,其含有例如水、乙醇、多元醇(例如,甘油、丙二醇和聚乙二醇液体等),以及它们的合适混合物。例如,通过使用包衣如卵磷脂、通过维持分散情形下所需粒径,以及通过使用表面活性剂,可以维持合适的流动性。在许多情形下,在组合物中包含等渗剂,例如糖类、多元醇如甘露醇、山梨醇、或氯化钠是理想的。可以通过将延迟吸收的试剂例如单硬脂酸盐和明胶包含在组合物中,达到注射组合物的延长吸收。此外,可溶性因子可以在延时释放制剂中给予,例如在包含有缓释性聚合物的组合物中。可以将活性化合物与防止化合物快速释放的载体一起制备,如控释制剂,包括埋植剂和微胶囊化的递送系统。可以使用可生物降解的、生物相容的聚合物,如乙烯醋酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯、聚乳酸和聚乳酸-聚乙醇酸共聚物(PLG)。用于制备此类制剂的许多方法已获得专利,或为本领域技术人员熟知。
上清液或可溶性因子可以与合适的基质相组合给予,例如,以提供可溶性因子的缓慢释放。
组合物的其他组分
源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代可以与其他有益的药物或生物分子(生长因子、营养因子)一起给药。当与其他试剂给药时,它们可以在单一药物组合物中或在分开的药物组合物中,与其他药剂同时或依次(在给予其他试剂之前或之后)一起给药。可以共同给药的生物活性因子包括抗凋亡剂(例如,EPO、EPO模拟体(mimetibody)、TPO、IGF-I和IGF-II、HGF、半胱天冬酶抑制剂);抗炎剂(例如,p38MAPK抑制剂、TGF-β抑制剂、他汀类、IL-6和IL-1抑制剂、PEMIROLAST、TRANILAST、REMICADE、SIROLIMUS和NSAIDs(非甾族抗炎药;例如,TEPOXALIN、TOLMETIN、SUPROFEN);免疫抑制剂/免疫调节剂(例如,钙调神经磷酸酶抑制剂如环孢霉素、他克莫司;mTOR抑制剂(例如,SIROLIMUS、EVEROLIMUS);抗-增殖剂(例如,咪唑硫嘌呤(azathioprine)、霉酚酸酯(mycophenolate mofetil));皮质类固醇(例如,氢化泼尼松(prednisolone)、氢化可的松(hydrocortisone));抗体如单克隆抗-IL-2Rα受体抗体(例如,巴利昔单抗、达利珠单抗(daclizumab))、多克隆抗-T-细胞抗体(例如,抗-胸腺细胞球蛋白(ATG);抗-淋巴细胞球蛋白(ALG);单克隆抗-T细胞抗体OKT3));抗-血栓形成剂(例如,肝素、肝素衍生物、尿激酶、PPack(右旋苯丙氨酸脯氨酸精氨酸氯甲基酮)、抗凝血酶化合物、血小板受体拮抗剂、抗-凝血酶抗体、抗-血小板受体抗体、阿司匹林、双嘧达莫、鱼精蛋白、水蛭素、前列腺素抑制剂和血小板抑制剂);及抗-氧化剂(例如,普罗布考、维生素A、抗坏血酸、生育酚、辅酶Q-10、谷胱甘肽、L-半胱氨酸、N-乙酰半胱氨酸)以及局部麻醉剂。
在一实例中,将源自STRO-1+细胞的上清液或可溶性因子,STRO-1+细胞或其后代与治疗内皮功能障碍有用的化合物一起给药,所述化合物如血管紧张素转换酶抑制剂,过氧化物酶体增殖物-活化的受体-活化剂(胰岛素致敏剂,如格列酮类吡格列酮和罗格列酮)以及过氧化物酶体增殖物-活化的受体-活化剂(贝特类药物,如非诺贝特),抗氧化剂(如,抗坏血酸或维生素E)或激素替代疗法。
在另一实例中,本文根据任一实例所述的组合物还包含诱导或促进祖细分化为血管细胞的因子。示例性因子包括血管内皮生长因子(VEGF)、源自血小板的生长因子(PDGF;例如,PDGF-BB)和FGF。
在另一实例中,本文根据任一实例所述的组合物还包含组织特异性定型细胞(TSCC)。在这方面,国际专利申请第PCT/AU2005/001445号表明,给予TSCC和STRO-1+细胞能够导致TSCC增殖的增加。在一实例中,TSCC为血管细胞。将此类组合物给予个体可以导致血管生成的增加,例如,导致递送至受影响组织的营养物增加。
医疗设备
本公开还提供了用于或当被使用于本文根据任一实例所述的方法的医疗设备。例如,本公开提供了注射器或导管或其他合适的递送装置,其包含STRO-1+细胞和/或其后代细胞和/或源自它们的可溶性因子和/或本文根据任一实例所述的组合物。任选地,所述注射器或导管包装有用于本文根据任一实例所述方法的说明书。
在另一个实例中,本公开提供了植入物,其包含STRO-1+细胞和/或其后代细胞和/或源自它们的可溶性因子和/或本文根据任一实例所述的组合物。任选地,所述植入物包装有用于本文根据任一实例所述方法的说明书。合适的植入物可以由例如,如上文所述的支架以及干细胞和/或其后代细胞和/或源自它们的可溶性因子组成。
给药方式
可将源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代手术植入、注射、递送(如通过导管或注射器),或以其他方式全身给予。
在一个实例中,可将源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代递送至个体的血流。例如,源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代经肠胃外递送。示例性肠胃外给予途径包括但不限于腹膜内、心室内、脑室内、囊内、动脉内、节内或静脉内。在一个实例中,源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代经动脉内递送至主动脉、心脏心房或心室中,或例如经静脉内至血管中。
在递送细胞至心脏的心房或心室情形下,可将细胞给予至左心房或左心室,以避免可能由细胞至肺的快速递送引起的并发症。
在一个实例中,源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代被注射入递送部位,例如,利用注射器或通过导管或中心线(central line)。
治疗性制剂给药方案的选择取决于几种因素,包括实体的血清或组织更新率、症状水平和实体的免疫原性。例如,给药方案将递送至患者的治疗化合物的量最大化,并符合可接受水平的副作用。因此,所递送的制剂的量部分取决于特定实体和所治疗病症的严重性。
在一个实例中,源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代作为单次团注剂量递送。可选择地,源自STRO-1+细胞的上清液或可溶性因子、STRO-1+细胞或其后代通过连续输注给予,或通过以间隔例如一天、一周或每周1-7次的剂量给予。示例性剂量方案涉及避免明显的不良副作用的最大剂量或剂量频率。总的每周剂量取决于所用化合物的类型和活性。合适剂量的确定由临床医生进行,例如,利用本领域已知的或者怀疑影响治疗或预期影响治疗的参数或因素。通常,剂量以稍微低于最佳剂量的量开始,并在其后以小的增量增加,直到相对于任何不利副作用达到所需的或最佳的效应。重要的诊断测量包括糖尿病的那些症状。
在一些实例中,以每周一次、每两周一次、每三周一次或每四周一次给予细胞。
根据本发明涉及治疗或延缓炎症性关节病进程的实例,例如,在病症诊断后,给予STRO-1+细胞和/或其后代细胞和/或源自它们的可溶性因子,例如,利用本领域已知的和/或本文描述的标准方法。
实施例
实施例1:通过选择STRO-3+细胞对MPC进行免疫选择
骨髓(BM)获自健康正常成人志愿者(20-35岁)。简单地说,从臀部髂后嵴吸取40mlBM至含肝素锂抗凝剂的管中。
如先前所述(Zannettino,A.C.et al.(1998)Blood 92:2613-2628),利用LymphoprepTM(Nycomed Pharma,Oslo,Norway)通过密度梯度分离来制备BMMNC。4℃下以400×g离心30分钟后,用移液管去除棕黄层(buffy layer),并在“HHF”中洗涤3次,所述“HHF”由Hank’s平衡盐溶液(HBSS;Life Technologies,Gaithersburg,MD)组成,含有5%的胎牛血清(FCS,CSL Limited,Victoria,Australia)。
随后按照先前所述(Gronthos et al.(2003)Journal of Cell Science 116:1827-1835;Gronthos,S.和Simmons,P.J.(1995)Blood 85:929-940),通过磁力活化的细胞分选分离STRO-3+(或TNAP+)细胞。简单地说,将约1-3×108个BMMNC在封闭缓冲液中于冰上孵育20分钟,所述缓冲液由HHF中的10%(v/v)正常兔血清组成。将细胞与200μl的10μg/mlSTRO-3mAb溶液一起在封闭缓冲液中于冰上孵育1小时。随后通过400×g离心,将细胞在HHF中洗涤两次。加入HHF缓冲液中以1/50稀释的山羊抗-小鼠γ-生物素(SouthernBiotechnology Associates,Birmingham,UK),并将细胞在冰上孵育1小时。按如上所述将细胞在MACS缓冲液(无Ca2+和Mn2+的PBS,补充有1%BSA、5mM EDTA和0.01%叠氮化钠)中洗涤两次,并重悬在0.9ml终体积的MACS缓冲液中。
将100μl链霉亲和素微珠(Miltenyi Biotec;Bergisch Gladbach,Germany)加入细胞悬液中,并在冰上孵育15分钟。将细胞悬液洗涤两次,并重悬在0.5ml MACS缓冲液中,然后上样至小型MACS柱(MS Columns,Miltenyi Biotec),并用0.5ml MACS缓冲液洗涤3次,以回收未结合STRO-3mAb的细胞(于2005年12月19日保藏在美国典型培养物保藏中心(ATCC),登录号为PTA-7282-参见国际公开第WO 2006/108229号)。加入另外的1ml MACS缓冲液后,从磁体移走柱子,并通过正压分离TNAP+细胞。来自每个级分的细胞等分试样可用链霉亲和素-FITC进行染色,并通过流式细胞术来评估纯度。
实施例2:通过STRO-3mAb选择的细胞为STRO-1亮细胞
设计了实验以验证利用STRO-3mAb作为单一试剂分离细胞STRO-1亮细胞的可能性。
考虑到STRO-3(IgG1)与STRO-1(IgM)是不同的同种型,基于其与利用MACS程序分离的STRO-1+细胞共表达,通过双色FACS分析评估了STRO-3识别克隆性CFU-F的能力(图1)。点状直方图代表了以列表型数据收集的5×104个事件。垂直线和水平线设定为小于利用在相同条件下处理的同种型匹配的对照抗体1B5(IgG)和1A6.12(IgM)获得的平均荧光的1.0%的反应水平。结果证明,STRO-1亮细胞的较小群共表达TNAP(右上象限),而其余STRO-1+细胞与STRO-3mAb不反应。随后分析来自所有4个象限通过FACS分离的细胞的CFU-F发生率(表1)。
表1:基于细胞表面标志物STRO-1和TNAP的共表达,通过双色FACS分析人骨髓细胞的富集(参见图1)。将FACS分选的细胞于标准的克隆形成条件下于补充有20%FCS的αMEM中培养。数据表示为每接种105个细胞第14天时的集落形成细胞(CFU-F)的平均数±SE(n=3个不同骨髓抽吸物)。这些数据表明,人MPC仅局限于鲜明地共表达STRO-1抗原的BM的TNAP阳性部分。
实施例3:STRO-1暗和STRO-1亮细胞的相对基因和表面蛋白表达
在第一系列实验中,采用半定量RT-PCR分析来检测由荧光活化细胞分选术分离的STRO-1暗和STRO-1亮细胞群表达的不同谱系相关基因的基因表达谱(图2A)。在第二系列实验中,采用流式细胞术和平均通道荧光分析来检测由荧光活化细胞分选术分离的STRO-1暗和STRO-1亮细胞群表达的不同谱系相关蛋白的表面蛋白表达谱。
从2×106STRO-1亮或STRO-1暗分选的原代细胞、软骨细胞团和其他诱导的培养物制备总细胞RNA,以及利用RNAzolB提取法(Biotecx Lab.Inc.,Houston,TX),按照生产商的建议裂解细胞。然后将从每个亚群体分离的RNA用作cDNA合成的模板,使用第一链cDNA合成试剂盒(Pharmacia Biotech,Uppsala,Sweden)来制备。使用以前所述的标准方案(Gronthoset al.,J.Bone和Min.Res.14:48-57,1999),通过PCR扩增来评估不同转录物的表达。在本研究中使用的引物组示于表2中。扩增之后,每一个反应混合物通过1.5%琼脂糖凝胶电泳分析并通过溴化乙锭染色显现。通过GAPDH表达来评估RNA完整性。
使用ImageQant软件,参照管家基因GAPDH的表达来评估各个细胞标志物的相对基因表达(图2B,C)。此外,基于其表达更广泛的细胞谱系相关标志物结合STRO-1抗体,使用双色流式细胞分析来检测离体扩增的MPC的蛋白表达谱。基于STRO-1暗和STRO-1亮培养细胞的基因和蛋白表达的一般表型的总结示于表3中。数据表明,离体扩增的STRO-1亮MPC显示差异地更高表达与血管周细胞相关的标志物,包括血管生成素-1、VCAM-1、SDF-1、IL-1β、TNFα以及RANKL。STRO-1暗与STRO-1亮培养的细胞的蛋白和基因表达谱之间的比较总结于表3和表4中。
为了鉴定由STRO-1亮细胞独特表达的基因,还进行了消减杂交研究。简而言之,如上所述将STRO-1暗和STRO-1亮分离(见图3A)。使用RNA STAT-60系统(TEL-TEST),从合并自5种不同骨髓样品的STRO-1暗和STRO-1亮细胞制备总RNA。使用SMART cDNA合成试剂盒(Clontech Laboratories)进行第一链的合成。根据生产商的说明书,利用在初始RT步骤期间形成的在3'和5'引物端的特异性引物位点,通过长距离PCR(Advantage 2PCR试剂盒;Clontech)扩增所得到的mRNA/单链cDNA杂交物。RsaI消化STRO-1亮cDNA之后,使用ClontechPCR-Select cDNA消减试剂盒,将2等分试样用于连接不同的特异性适配子寡核苷酸。根据厂商方案,使用STRO-1亮(样品方(tester))和STRO-1暗(参照方(driver))cDNA,以及反之亦然,进行两轮消减杂交。还利用针对STRO-1亮参照方cDNA杂交的STRO-1暗样品方cDNA,反向进行该步骤。
为鉴定由STRO-1亮细胞群独特表达的基因,将STRO-1亮消减的cDNA用于构建复制低密度微阵列滤器,其包含用连接到T/A克隆载体的STRO-1亮消减的cDNA转化的200个随机选择的细菌克隆。随后用[32P]dCTP-标记的STRO-1亮或STRO-1暗消减的cDNA微阵列来探测微阵列(图3B-C)。差异筛选鉴定了总共44个克隆,其在STRO-1暗和STRO-1亮亚细胞群之间高度差异表达。所有差异表达的克隆的DNA测序显示,仅有1个克隆代表已知的基质细胞分裂素,即血小板衍生生长因子(PDGF)(Gronthos和Simmons,Blood.85:929-940,1995)。有趣的是,发现44个克隆中有6个包含对应于趋化因子基质衍生因子-1(SDF-1)的DNA插入。通过对从新鲜分选的STRO-1亮,STRO-1暗和STRO-1阴性骨髓亚细胞群制备的总RNA进行半定量RT-PCR,验证了SDF-1转录物在人STRO-1亮细胞中的高丰度(图3D和表3)。
表2特异性扩增人mRNA的RT-PCR引物和条件
表3.STRO-1亮和STRO-1暗细胞群中相对基因表达总结。呈现了通过逆转录PCR确定的显示STRO-1亮和STRO-1暗细胞群之间可测量且差异表达的基因列表。数值代表相对管家基因GAPDH的相对基因表达。
为了使蛋白表面表达与STRO-1表达密度相关联,离体扩增的源自骨髓MPC的单细胞悬液通过胰蛋白酶/EDTA分离来制备且随后用STRO-1抗体联合鉴定广泛细胞谱系相关标志物的抗体来孵育。使用山羊抗鼠IgM-异硫氰酸荧光素来鉴定STRO-1,使用山羊抗-小鼠或抗-兔IgG-藻红蛋白来鉴定所有其他的标志物。对于鉴定细胞内抗原的那些抗体,细胞制备物首先用STRO-1抗体标记,用冷的70%乙醇固定以对细胞膜透化处理,接着用细胞内抗原特异性抗体孵育。在相同条件下使用同种型匹配的对照抗体。使用COULTER EPICS流式细胞仪进行双色流式细胞分析并以列表模式采集数据。点图代表指示每一种谱系细胞标志物(y-轴)和STRO-1(x-轴)的荧光强度水平的5,000个列表模式事件。参照同种型匹配的阴性对照抗体建立垂直和水平象限。
表4.STRO-1亮和STRO-1暗细胞群中相对蛋白表达总结。给出了通过流式细胞术确定的在STRO-1亮和STRO-1暗细胞群之间显示差异表达的蛋白列表。数值代表染色的相对平均荧光强度。
实施例4:基质细胞表达血管紧张素I
在补充有10%胎牛血清(FCS)以及青霉素(100U/ml)和链霉素(100μg/mL)的RPMI-1640中培养人基质细胞系HS5和HS27A。如之前所述,由骨髓单个核细胞(BMMNC)培养原代基质成纤维细胞(Pillai et al.,Blood107:3520–3526,2006)。细胞用偶联FITC的抗-CD146抗体(Ebiosciences,San Diego,CA)以及合适的同种型对照染色用于分析,以及利用FACSAria细胞分析仪(BD Biosciences,San Jose,CA)将细胞分选为CD146高和CD146低细胞群。
对于定量RT-PCR,使用miRNEasy试剂盒(Qiagen,Valencia,CA)按照厂商说明,制备总RNA;进行柱上DNA酶消化以消除基因组DNA的污染。基于通过逆转录产生的cDNA,通过SYBR-GREEN定量实时聚合酶链式反应(qRT-PCR)定量mRNA水平。
看起来HS27a基质细胞系与所报道的CD146高基质前体共享相似的功能和转录谱。因而,评估CD14在该细胞系的表达。对HS27a和HS5细胞进行流式细胞计数分析CD146,显示CD146在HS27a强烈表达,而HS5则没有(图4A)。还评估了由正常骨髓建立的9个原代培养物中的CD146表达。在两至三代内分析的培养物显示CD146高细胞比例不定(6至40%),其中的一个例子在图4B中示出。接着评估来自原代培养物的CD146高和CD146低细胞的两种基因CXCL12和血管生成素I的表达。如图3C和图3D所示,与CD146低细胞相比,CD146高细胞群具有显著更高水平的CXCL12和血管生成素I表达。
这些数据表明,表达高水平CD146的基质前体细胞,如表达MPC的STRO-1,同样表达血管生成素I。
实施例5:MPC治疗或预防内皮功能障碍
方法
通过第0天皮下注射给予弗氏完全佐剂(1mL)和BColl-II(5mg)的乳剂,然后第14天第二次注射弗氏不完全佐剂(1mL)和BColl-II(5mg),使绵羊对牛II型胶原蛋白(BColl-II]致敏。第28天,将0.5mL等渗盐水中的100μg BColl-II通过关节内注射至左跗关节以促进伴随全身炎症的急性关节炎。第29天,向绵羊经静脉注射盐水(n=8)或悬浮于PBS的15000万MPC(n=8)。在随后13天采集血液,并使用ELISA商品化试剂盒来测定Il-10、纤维蛋白原、激活素A和C-反应蛋白(CRP)的血浆水平。第42天处死全部动物。
收集组织并保存于冰冷的改良克-亨氏(Krebs-Henseleit)溶液(KHS)中。在解剖显微镜(Stemi 2000立体显微镜,Carl Zeiss,Germany)下从周围组织分离出冠状动脉左前降支的二级分支,并且使用Mulvany-Halpern金属丝肌动描记器(wiremyograph)(Danish Myo Technologies,Denmark)制备~1mm长的血管环用于血管舒缩功能研究。简而言之,在附着于金属丝肌动描记器钳口的两个平行不锈钢线(40μm直径)之间安装血管段。
从同一绵羊的左前肢获得绵羊指动脉。从掌中指动脉的第一分支获取1mm节段并如上所述安装于金属丝肌动描记器。
药品和溶液
所使用的改良的KHS具有以下成分(mM):NaCl 118,KCl 4.57,CaCl2 1.27,KH2PO41.19,MgSO4 1.19,NaHCO3 25以及葡萄糖5.55。所有药品都获自Sigma-Aldrich有限公司(Australia)。所有药品和KHS溶液都在实验当天新配制且溶解于蒸馏水。随后将所有药品稀释于KHS中。
等长张力记录
将制备物置于含有5ml KHS的腔室内,保持37℃并充入95%O2和5%CO2。平衡15分钟的时间之后,根据Mulvany和Halpern(Circulation Res.41:19-26,1977)开发的方法使血管段标准化时,测定标准化过程中的最佳内部周长。根据其标准化内部周长对血管施加静息张力,对应于13.3kPa(100mmHg),具有0.9的调节系数。确定静息张力之后,使血管在KHS中经过另外30分钟的平衡时间,之后进行对标准去极化Krebs溶液(DKS;118mM KCl)的收缩反应。
冠状动脉:缓激肽和硝普钠诱导的动脉松弛,动脉用内皮素-1预收缩
冲洗和再平衡(15分钟)之后,用含有布洛芬(10μM)的KHS孵育来自同一个体的两个血管段,以消除任何前列腺素介导的缓激肽效应。然后使用内皮素-1(3×10-8M),将它们收缩到其最大DKS反应的75%。达到稳态收缩后,获得对累积增加浓度的内皮依赖性血管扩张剂缓激肽(10-11M至10-5M)或内皮非依赖性血管扩张剂硝普钠(10-10M至10-4M)的松弛反应。在每一血管段中仅实施一种浓度反应曲线,且在每个实验中使用两个相邻的血管段。
指动脉:卡巴胆碱和硝普钠诱导的动脉松弛,动脉用5-HT预收缩
冲洗和再平衡(15分钟)之后,使用5-HT(3×10-6M)将来自同一个体的两个血管段收缩到其最大DKS反应的75%。达到稳态收缩后,获得对累积增加浓度的内皮依赖性血管扩张剂卡巴胆碱(10-9M至10-4M)或内皮非依赖性血管扩张剂硝普钠(10-10M至10-4M)的松弛反应。每一血管段中仅实施一种浓度反应曲线,且在每个实验中使用两个相邻的血管段。
数据分析
通过计算机采集系统连续记录张力,并将结果表示为所示次数的单独实验(n)的平均值±平均值的标准误(s.e.m.),每一次实验来自单独的制备物。将数据用于建立累积的浓度反应曲线(CRC),其中计算EC50值(激动剂浓度产生最大反应的50%,表示为几何平均值和95%置信区间)和最大反应,并通过曲线拟合软件(GraphPad Prism 5.0),合适时使用单因素或双因素方差分析和Dunnett’s事后检验进行统计学比较。
结果
结果表明,单次静脉注射给予15000万同种异体MPC导致给予后当天IL-10产量水平激增(图5)。IL-10是炎性细胞因子,其促进嗜中性粒细胞的循环水平并有助于限制它们的促炎性状态。这反过来有助于增强全身感染疾病如败血症的治疗。
相对于未治疗的绵羊,单剂量MPC还有效减少血浆纤维蛋白原、激活素A和C-反应蛋白(图6-9)。纤维蛋白原、激活素A和C-反应蛋白全部都是败血症的标志物,它们在血浆水平的减少指示给予MPC之后败血症症状的减轻。
与未治疗的绵羊相比,用MPC治疗的绵羊显示对卡巴胆碱或缓激肽显著更高的最大反应(p<0.05)(图10A和10B)。来自这两组的冠状动脉或指动脉对硝普钠的反应没有显著差异(图10C和10D),表明血管平滑肌功能未受治疗影响。该临床前研究表明,当静脉给予时,MPC能够减弱全身内皮功能障碍的发展。
实施例6:MPC联合PPS诱导抗炎效应
方法
通过第0天皮下注射给予弗氏完全佐剂(1mL)和BColl-II(5mg)的乳剂,接着第14天第二次注射弗氏不完全佐剂(1mL)和BColl-II(5mg),使绵羊对牛II型胶原蛋白(BColl-II]致敏。第28天,将0.5mL等渗盐水中的100μg BColl-II通过关节内注射至左跗关节以促进伴随全身炎症的急性关节炎。第29天,绵羊被经静脉注射悬浮于PBS的7500万MPC(n=6),或者悬浮于PBS的7500万MPC加上75毫克戊聚糖多硫酸酯(PPS)(n=6),或者75毫克PPS。在随后13天采集血液,并利用ELISA商品化试剂盒来测定Il-10、纤维蛋白原、激活素A和C-反应蛋白(CRP)的血浆水平。第42天处死全部动物。
如上所详述获得绵羊指动脉和冠状动脉。此外,如上所述进行等长张力记录,数据分析以及指动脉和冠状动脉功能分析。
结果
结果表明,相比单独的PPS,单次静脉注射给予7500万同种异体MPC加上PPS导致血浆IL-10产量水平显著提高(相对于基线)(图11)。IL-10是炎性细胞因子,其促进嗜中性粒细胞的循环水平并有助于限制它们的促炎性状态。这反过来有助于增强全身感染性疾病如败血症的治疗。
相比单独的MPC或PPS,从第36天起单剂量MPC加上PPS有效减少血浆纤维蛋白原(图12)。相对于PPS处理的对照,MPC处理的两组(7500万MPC±PPS)中激活素A蛋白水平都减少(图13和图14)。C-反应蛋白水平在MPC处理的两组(7500万MPC±PPS)中相对于基线都减少,但是在PPS处理组中没有减少。纤维蛋白原、激活素A和C-反应蛋白都是败血症的标志物,它们在血浆水平的减少指示给予MPC±PPS之后败血症症状的减轻。
相比单独用PPS处理的绵羊,用MPC加上PPS处理的绵羊显示冠状动脉对缓激肽显著更高的最大反应(p<0.05)(图15A),表明对血管内皮的直接有益效果。相比单独用PPS处理的绵羊,用MPC加上PPS处理的绵羊显示指动脉对卡巴胆碱的最大内皮依赖性松弛反应的改善(图15B)。来自这两组的冠状动脉或指动脉对硝普钠的反应没有显著差异(图15C和图15D),表明血管平滑肌功能未受治疗影响。
Claims (8)
1.富集STRO-1+间充质祖细胞的细胞群在制备经配制以全身给予从而治疗或预防糖尿病肾病或慢性肾衰竭的药物中的用途,其中所述药物以足以增加个体血管生成素I水平或增强个体内皮扩张的量给予,其中所述细胞群富集STRO-1亮间充质祖细胞或者所述细胞群为TNAP+。
2.如权利要求1所述的用途,其中所述药物用于治疗糖尿病肾病。
3.如权利要求1所述的用途,其中所述药物用于治疗慢性肾衰竭。
4.如权利要求1所述的用途,其中所述群为同种异体的。
5.如权利要求1所述的用途,其中所述群为经培养扩增的群。
6.如权利要求1至5中任一项所述的用途,其中所述药物还包含戊聚糖多硫酸酯或其药学可接受的盐。
7.如权利要求6所述的用途,其中所述戊聚糖多硫酸酯或其药学可接受的盐为戊聚糖多硫酸酯的钠盐。
8.如权利要求1所述的用途,其中所述群为自体的。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202010796960.9A CN111840329B (zh) | 2012-12-12 | 2013-12-12 | 内皮功能障碍和炎症的疾病的治疗 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261736361P | 2012-12-12 | 2012-12-12 | |
| US61/736,361 | 2012-12-12 | ||
| PCT/AU2013/001452 WO2014089623A1 (en) | 2012-12-12 | 2013-12-12 | Treatment of diseases of endothelial dysfunction and inflammation |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202010796960.9A Division CN111840329B (zh) | 2012-12-12 | 2013-12-12 | 内皮功能障碍和炎症的疾病的治疗 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN105358163A CN105358163A (zh) | 2016-02-24 |
| CN105358163B true CN105358163B (zh) | 2020-09-11 |
Family
ID=50933585
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202010796960.9A Active CN111840329B (zh) | 2012-12-12 | 2013-12-12 | 内皮功能障碍和炎症的疾病的治疗 |
| CN201380072732.5A Active CN105358163B (zh) | 2012-12-12 | 2013-12-12 | 内皮功能障碍和炎症的疾病的治疗 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202010796960.9A Active CN111840329B (zh) | 2012-12-12 | 2013-12-12 | 内皮功能障碍和炎症的疾病的治疗 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US20160175360A1 (zh) |
| EP (2) | EP2931876B1 (zh) |
| JP (5) | JP6572130B2 (zh) |
| KR (3) | KR102506612B1 (zh) |
| CN (2) | CN111840329B (zh) |
| AU (4) | AU2013360024B2 (zh) |
| CA (1) | CA2893942C (zh) |
| ES (1) | ES2742035T3 (zh) |
| HK (1) | HK1210209A1 (zh) |
| IL (1) | IL239308A0 (zh) |
| SG (2) | SG11201504340YA (zh) |
| WO (1) | WO2014089623A1 (zh) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110014701A1 (en) | 2007-12-04 | 2011-01-20 | Proteobioactives Pty Ltd. | Protection of Progenitor Cells and Regulation of Their Differentiation |
| JPWO2022114111A1 (zh) * | 2020-11-27 | 2022-06-02 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1822846A (zh) * | 2003-03-28 | 2006-08-23 | 成血管细胞系统公司 | 血管周围间充质前体细胞诱导的血管形成 |
| CN101939417A (zh) * | 2007-12-04 | 2011-01-05 | 蛋白生物动力私人有限公司 | 祖细胞的保护和它们的分化的调节 |
| WO2012162754A1 (en) * | 2011-06-03 | 2012-12-06 | Mesoblast, Inc | Methods of treating or preventing neurological diseases |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5139941A (en) | 1985-10-31 | 1992-08-18 | University Of Florida Research Foundation, Inc. | AAV transduction vectors |
| WO1992001070A1 (en) | 1990-07-09 | 1992-01-23 | The United States Of America, As Represented By The Secretary, U.S. Department Of Commerce | High efficiency packaging of mutant adeno-associated virus using amber suppressions |
| US5173414A (en) | 1990-10-30 | 1992-12-22 | Applied Immune Sciences, Inc. | Production of recombinant adeno-associated virus vectors |
| ATE237694T1 (de) | 1991-08-20 | 2003-05-15 | Us Gov Health & Human Serv | Adenovirus vermittelter gentransfer in den gastrointestinaltrakt |
| DK1493439T3 (da) | 1997-04-02 | 2012-01-30 | Brigham & Womens Hospital | Middel til fastlæggelse af en persons risikoprofil for aterosklerotisk sygdom |
| AUPQ147799A0 (en) | 1999-07-07 | 1999-07-29 | Medvet Science Pty. Ltd. | Mesenchymal precursor cell |
| DE19939781C2 (de) | 1999-08-21 | 2003-06-18 | Schott Glas | Skulltiegel für das Erschmelzen oder das Läutern von anorganischen Substanzen, insbesondere von Gläsern und Glaskeramiken |
| US20080095749A1 (en) * | 2004-03-22 | 2008-04-24 | Sudeepta Aggarwal | Mesenchymal stem cells and uses therefor |
| CN102391981B (zh) | 2004-09-24 | 2014-08-20 | 麦索布莱斯特公司 | 多能扩增间充质前体细胞子代(memp)及其应用 |
| KR101617319B1 (ko) | 2005-04-12 | 2016-05-02 | 메소블라스트, 아이엔씨. | 조직 비특이적인 알카리 포스파타제에 의한 다분화성 성체 세포의 분리 |
| BRPI0520280A2 (pt) * | 2005-05-10 | 2009-04-28 | Us Of America Dept Of Veteran | terapia de disfunÇÕes renais e falÊncia méltipla de àrgços com cÉlulas-tronco mesenquimais e meio condicionado por exposiÇço a cÉlulas-tronco mesenquimais |
| US20080260703A1 (en) * | 2007-04-23 | 2008-10-23 | Medistem Labortories | Treatment of Insulin Resistance and Diabetes |
| US8124071B2 (en) * | 2007-11-30 | 2012-02-28 | New York Medical College | Methods of reducing transplant rejection and cardiac allograft vasculopathy by implanting autologous stem cells |
| CA2743698A1 (en) * | 2007-11-30 | 2009-06-11 | New York Medical College | Compositions comprising vascular and myocyte progenitor cells and methods of their use |
| EP2294184A4 (en) * | 2008-06-30 | 2013-03-06 | Mesoblast Inc | TREATMENT OF EYE DISEASES AND EXCESSIVE NEOVASCULARIZATION WITH THE HELP OF COMBINED THERAPY |
| ES2651503T3 (es) * | 2008-11-20 | 2018-01-26 | Mesoblast, Inc. | Método para tratar o prevenir una disfunción pancreática |
| WO2010138180A2 (en) * | 2009-05-26 | 2010-12-02 | The University Of Vermont And State Agriculture College | Compositions and methods for cardiac tissue repair |
| WO2011073521A1 (en) * | 2009-12-15 | 2011-06-23 | Petri Salven | Methods for enriching adult-derived endothelial progenitor cells and uses thereof |
| US20120195969A1 (en) * | 2010-09-29 | 2012-08-02 | Aidan Research And Consulting, Llc | Treatment of acne by conditioned media |
| US9405700B2 (en) | 2010-11-04 | 2016-08-02 | Sonics, Inc. | Methods and apparatus for virtualization in an integrated circuit |
| JP6227527B2 (ja) * | 2011-07-04 | 2017-11-08 | メゾブラスト,インコーポレーテッド | リウマチ性疾患を予防または治療する方法 |
| KR102143255B1 (ko) * | 2012-08-01 | 2020-08-10 | 유나이티드 세러퓨틱스 코오포레이션 | 중간엽 줄기 세포를 사용한 폐동맥 고혈압의 치료 |
| ES2697573T3 (es) * | 2013-01-09 | 2019-01-25 | United Therapeutics Corp | Tratamiento de la vasculopatía con prostaciclina y células madre mesenquimatosas |
-
2013
- 2013-12-12 CA CA2893942A patent/CA2893942C/en active Active
- 2013-12-12 KR KR1020227005920A patent/KR102506612B1/ko active IP Right Grant
- 2013-12-12 CN CN202010796960.9A patent/CN111840329B/zh active Active
- 2013-12-12 EP EP13862555.3A patent/EP2931876B1/en active Active
- 2013-12-12 SG SG11201504340YA patent/SG11201504340YA/en unknown
- 2013-12-12 EP EP19174698.1A patent/EP3556850A1/en active Pending
- 2013-12-12 KR KR1020157017531A patent/KR102217962B1/ko active IP Right Grant
- 2013-12-12 KR KR1020217004422A patent/KR102367981B1/ko active IP Right Grant
- 2013-12-12 SG SG10201705061RA patent/SG10201705061RA/en unknown
- 2013-12-12 WO PCT/AU2013/001452 patent/WO2014089623A1/en active Application Filing
- 2013-12-12 CN CN201380072732.5A patent/CN105358163B/zh active Active
- 2013-12-12 US US14/650,172 patent/US20160175360A1/en not_active Abandoned
- 2013-12-12 AU AU2013360024A patent/AU2013360024B2/en active Active
- 2013-12-12 JP JP2015546770A patent/JP6572130B2/ja active Active
- 2013-12-12 ES ES13862555T patent/ES2742035T3/es active Active
-
2015
- 2015-06-09 IL IL239308A patent/IL239308A0/en unknown
- 2015-10-29 HK HK15110737.0A patent/HK1210209A1/zh unknown
-
2019
- 2019-04-29 AU AU2019202960A patent/AU2019202960B2/en active Active
- 2019-07-01 JP JP2019123243A patent/JP6829288B2/ja active Active
-
2021
- 2021-01-21 JP JP2021008250A patent/JP7201715B2/ja active Active
- 2021-10-12 AU AU2021250848A patent/AU2021250848A1/en not_active Abandoned
-
2022
- 2022-12-22 JP JP2022206042A patent/JP2023030116A/ja active Pending
-
2023
- 2023-10-04 US US18/481,041 patent/US20240115618A1/en active Pending
-
2024
- 2024-07-11 JP JP2024111736A patent/JP2024147655A/ja active Pending
- 2024-10-10 AU AU2024227208A patent/AU2024227208A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1822846A (zh) * | 2003-03-28 | 2006-08-23 | 成血管细胞系统公司 | 血管周围间充质前体细胞诱导的血管形成 |
| CN101939417A (zh) * | 2007-12-04 | 2011-01-05 | 蛋白生物动力私人有限公司 | 祖细胞的保护和它们的分化的调节 |
| WO2012162754A1 (en) * | 2011-06-03 | 2012-12-06 | Mesoblast, Inc | Methods of treating or preventing neurological diseases |
Non-Patent Citations (2)
| Title |
|---|
| Human mesenchymal stem cells suppress chronic airway inflammation in the;Tracey L. Bonfield等;《Am J Physiol Lung Cell Mol Physiol》;20100903;第299卷;第760-770页 * |
| Immunomodulatory properties of stem cells from human exfoliated deciduous teeth;Takayoshi Yamaza等;《Stem Cell Research & Therapy》;20101231;第1卷(第5期);第1-10页 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6505148B2 (ja) | 移植片対宿主病の治療法 | |
| US20240115618A1 (en) | Treatment of diseases of endothelial dysfunction and inflammation | |
| AU2018247196A1 (en) | Methods for treating obesity and/or metabolic syndrome |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |