CN103946397B - 用于通用实时多重分析检测的双功能寡核苷酸探针 - Google Patents
用于通用实时多重分析检测的双功能寡核苷酸探针 Download PDFInfo
- Publication number
- CN103946397B CN103946397B CN201280055550.2A CN201280055550A CN103946397B CN 103946397 B CN103946397 B CN 103946397B CN 201280055550 A CN201280055550 A CN 201280055550A CN 103946397 B CN103946397 B CN 103946397B
- Authority
- CN
- China
- Prior art keywords
- molecule
- region
- detection
- probe
- mediator
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
- C12Q1/6823—Release of bound markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
- C12Q1/6818—Hybridisation assays characterised by the detection means involving interaction of two or more labels, e.g. resonant energy transfer
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Health & Medical Sciences (AREA)
- Zoology (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Analytical Chemistry (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Physics & Mathematics (AREA)
- Biophysics (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Chemical Kinetics & Catalysis (AREA)
Abstract
本发明涉及一种包括探针区域和介质区域的介质探针。进一步,本发明涉及一种包括介质探针和检测分子的系统,该系统的用途以及用于检测至少一种靶分子的方法。
Description
技术领域
本发明涉及一种包括探针区域和介质区域的介质探针。进一步,本发明涉及一种包括介质探针和检测分子的系统、该系统的用途以及检测至少一种靶分子的方法。
背景技术
现有技术中已经记载了样品的分子生物学检测和光学分析的大量研究方法。这些方法中的其中一种,是利用微阵列在少量生物样品材料中进行检测或进行几千种单独检测的平行分析。微阵列有各种形式,有时也称作“基因芯片”或生物芯片,类似于计算机芯片,其在非常小的空间内包含了大量的信息。
微阵列使得能够在通常为二维的基质上对各种分析物进行高度平行的检测。微阵列的固定探针分子在生产过程中在适当的基质上,通过少量液体的转运而被固定和/或合成在栅格(阵列)上的确定位置(点)。可以设计捕捉分子的这种二维、空间溶解的固定化,从而能够检测到核酸或肽和/或蛋白质。作为规则,原位复制(lithography)方法仅允许短寡核苷酸和/或氨基酸链的合成。所生产的DNA微阵列可以在适当的条件下保存数月,但蛋白质阵列仅能短时间保存。
对于微阵列分析,待分析样品与合适的缓冲液混合并与相应的微阵列一起孵育,于是,通常与互补序列片段发生杂交事件。基于微阵列系统的低敏感性,当要检测核酸(例如通过聚合酶链反应(PCR)、RT-PCR或全基因组扩增(WGA))的情况下,样品在先前的反应步骤中扩增,并且被用于检测的荧光染料标记,或例如与微阵列上额外的检测探针一起孵育。肽和蛋白质不能酶促扩增,通过样品的纯化而被浓缩用于分析。另一方面,还有一些方法,例如在成功杂交后通过滚环扩增(RCA)在微阵列上进行信号扩增。这种过程包括几个耗时的步骤,并且提高了不准确和污染的风险。通常的应用方式包括表达分析以及病原体或抗性标记的检测中的微阵列。对于本领域技术人员来说,在现有技术中能够看到对各种合成技术和应用的概览。
在现有技术中,描述了扩增的DNA片段在固定化的等位基因特异性寡核苷酸上的杂交,并且认为本领域技术人员能够获得常规方法中的一种。在各种浓度下利用引物分子的前述的扩增步骤使得能够产生单链标记的DNA,其优选地与待产生的微阵列的捕捉分子相互作用。将培养基转移到微阵列后,可以在成功杂交后利用荧光或通过使用标记生物素的引物直接进行检测,从而在杂交步骤以后接着进行孵育,特别是与链酶亲和素修饰的辣根过氧化物酶一起孵育,将可溶的物质转化为不可溶的反应产物。通过检测显色沉淀物,可以检测靶分子与捕捉分子之间的结合事件。固定化引物的延长反应可选地在预先扩增的靶序列的杂交之后进行,其中结合了标记生物素的核苷酸。在与链酶亲和素修饰的碱性磷酸酶一起孵育以及在添加适当的基质后,可以通过形成显色反应产物来检测靶序列的存在。
在另一实施方式(基于多重定量DNA阵列的PCR、MQDA-PCR)中,待检测的核酸首先与双功能引物平行地扩增,进行几个PCR循环。这会产生具有通用5’端的扩增产物,使得接下来能够进行与通用引物的竞争性准单倍体(quasi-monoplex)扩增。接着,在分离步骤中,靶序列特异性的探针通过添加修饰的核苷酸而被标记并且在微阵列上杂交。通过使用双功能引物,可以进行多重等级提高的两步PCR反应,并且不同序列不会对反应效率带来显著影响。这种复杂的程序方案对于整合成为工作程序具有消极影响。重复添加和除去反应物和/或反应产物并且在多容器之间转移反应批次物,会导致大量的手动工作量(“动手时间(hands-on time)”)、长等待时间(“等待结果的时间”)以及程序错误的风险。除了准备单个PCR反应批次物之外,程序包括多个孵育步骤,其中将双功能引物消解,例如探针被标记并且在微阵列上孵育。这导致待测靶序列与芯片表面上的固定化的捕捉分子之间的直接关联。因此,这种方法不适于在不产生新的微阵列的情况下区分靶序列。这些方法的另一缺点是扩增以后必须将样品材料在两个反应器皿之间转移,而在这个过程中可能产生程序错误和污染。
减少污染风险的一个可能是在反应器皿中进行扩增和杂交。通过将两个隔室空间分离,可能在一个器皿内发生不同的反应,从而它们及时地彼此分开。现有技术描述了“试管内微阵列”系统,其中两个隔室和一个缓冲池整合到反应器皿中(Liu,Q.等,2007,microarray-in-a-tube for detection of multiple viruses(多重病毒检测的管内微阵列),Clin.Chem.,53,188-194)。通过颠倒器皿,液体从底部转移到顶部,并且与先前的反应缓冲液混合,从而不需要打开反应器皿。因此,可以进行扩增步骤,随后进行杂交,但不需要将反应介质在两个器皿之间转移或不需要使用活性元素(active element)来操作。由于固定化的捕捉分子取决于待测靶序列,因此使用特殊的阵列排列仅能检测到选定的序列。如此产生的微阵列不能适用于新的选定的靶序列,需要的时候必须产生新的工作程序,然后整合到系统中。
另外,现有技术中记载了可以通过固定化探针的链延长来进行反应批次物中特定核酸的检测。为此,将靶序列在dUTP的存在下扩增,并且在下游步骤中被尿苷酶(uracil-N-glycosylase)酶促片段化成为大约20至50个碱基对长度的片段。接着,将批次物在微阵列上孵育,该微阵列由在5’末端固定的与靶序列互补的探针组成。杂交之后,通常形成二倍体,其中靶分子的5’区域与探针的3’区域重叠。除去未结合的片段后,将阵列与反应混合物一起孵育,反应混合物尤其包括聚合酶和标记的ddNTP。对于四种核苷酸中的每一种,标记(荧光染料)都不同。使用ddNTP使得能够在互补靶序列的存在下将先前的一种核苷酸特定地添加至固相探针,因为其他核苷酸都不能连接至ddNTP。从而,利用适当的检测方法,能够确定哪个核苷酸接附至哪个探针段。因此,如果使用合适的探针段,这种方法就适合用于检测靶序列和排序。在特定的实施方式中,该方法使得实现高度多重化,并使得能够进行多达640个靶序列的平行SNP检测。与其他的现有方法一样,在进行扩增后必须转移反应批次物的情况下,该批次物同样也存在污染和程序错误的风险。固相芯片内(on-chip)探针通常必须涵盖完整的待测位点,从而对于每个序列段,需要多个探针。
美国专利5,641,658和美国专利6,300,070B1都记载了基于PCR的扩增方法,其中所需的引物分子被固定化于固相。结果,扩增的核酸分子也排他地存在于固相。在待测样品中存在靶序列时,核酸可结合至“引物1”并且可酶促延长。在重复的变性步骤中,核酸模板与新形成的核酸链分离,从而在接下来的退火循环中可用。在接下来的循环中,由此产生的扩增产物可以与固定化的“引物2”杂交,其中“引物2”能够延长并且还形成固定化的核酸链。通过这种程序形成的核酸链能够与其他引物分子相互作用,并且作为核酸模板。这种检测核酸的方法也称为“桥式TM-PCR”。
通过在确定的阵列中固定各种引物对,由于由此达到多重等级,所以能够平行检测多个模板序列。这种方法的一个缺点是各种引物分子需要是同源并且在各个斑点以足够的密度分布,从而通过延长引物所产生的核酸链具有足够数量的额外的相互作用对象以用于下一个循环。因此,该固相PCR的反应效率为约30%,从而线性相间扩增(linearinterphasic amplification)的量比表面扩增的量大大约10倍。对于这些研究,通过使用固定在水凝胶上的引物和液相中的额外引物,Pemov等人实现了相当高的反应效率(≈34%)(Pemov,A.等,2005,DNA analysis with multiplex microarray-enhanced PCR(使用多重微阵列增强PCR的DNA分析).Nucleic acids Res.,33,e11)。5’固定的引物由两个功能片段组成,并且每个由通用的5’区域和靶序列特异性的3’区域构成。在反应溶液中自由存在的通用引物具有与固相引物的通用片段完全相同的序列。经修饰的靶序列副本在相间扩增和固相扩增的程序中产生,并且能够在准单倍体PCR中使用通用的液相引物扩增。这种固相支持的多重化方法具有如下缺点:后PCR步骤(例如,与经修饰的寡核苷酸一起孵育和/或洗涤步骤和孵育步骤)必须在并入经修饰的核苷酸之后进行。
嵌套式固相PCR是现有技术中记载的另一种方法,用于在扩增步骤期间在固相上将扩增产物固定化(嵌套式芯片内PCR(NOC PCR))。这种方法使用至少3个不同的引物分子,其中两个形成外部引物对(P1和P2),第三个引物分子(P3)在由P1和P2限定边界的段内结合,并且P3固定化于固相。与P3相比,P1和P2是过量存在。这种方法是液相/固相结合的扩增系统。这种方法的优点是灵敏度和特异性提高,比如嵌套式PCR的情况。通过适当的固定化方法和基质的选择,可以进行多个靶序列的高度平行检测。该分析可以利用序列特异性的探针或标记的核苷酸进行,并且使用后者变体能够进行实时检测。这种方式的一个缺点是使用靶序列特异性的P3引物分子,其序列与靶分子直接相关联。
使用固定化的引物分子用于核酸的特异性检测并不仅限于基于PCR的方法。现有技术中记载了通过使用解旋酶依赖性的扩增(HDA)成功地在120分钟内进行了病原体的等温检测。扩增产物由荧光标记的反向引物标记。进行反应以后,洗涤芯片,分析荧光信号。为了进行专一性灵敏的反应,反应批次物必须加热至65℃。另外,芯片必须连接至泵元件,从而相对较大的50μL样品被充分混合。活性促进剂与生物芯片的结合通常认为是缺点,会增加劳动量。达到的灵敏度对于临床诊断目的而言过低。因此,例如记载了检测限度为5×104基因组等价金黄色葡萄球菌(Staphylococcus aureus)和1.3×105基因组等价淋球菌(Neisseria gonorrhoeae)(Andresen,D.,von Nickisch Rosenegk,M.和Bier,F.F.,2009,Helicase-dependent on-chip amplification and its use in multiplex pathogendetection(解旋酶依赖的芯片内扩增及其在多个病原体检测中的应用),Clin.Chim.Acta,403,244-248)。通过这种方法产生的生物芯片将仅用于检测确定的靶序列,因为固定化形式中存在分析物特异性的核苷酸。
另外,现有技术中公开的方法记载了实时和/或没有额外处理步骤地进行靶序列的检测。这种方法通过结合扩增和检测系统来实施。例如,文字记载了能够进行捐献者血浆样品中三种不同病毒的平行检测和定量。需要外部引物对和内部引物对,外部引物对用于反转录。内部引物对中正向引物固定于水凝胶片且反向引物在液相中自由存在,该内部引物用于芯片内PCR。通过使用合适的染料,斑点中的双链扩增产物在退火步骤中被标记和检测。这种方法的动态范围是6log(100至106次复制)。使用序列非特异性的染料使得能够进行任何双链扩增产物的通用检测。然而,缺点是不能保证特异性,从而不能区分非特异性的扩增产物。
DE 10316159 A1记载了一种方法,其中靶序列特异性的引物分子在流动细胞中被固定,其能够进行热调节。该流动池还具有如下性质,利用全内反射荧光(total internalresonance fluorescence,TIRF)使得激发光传递通过表面(通常是平面)。在加入靶序列和通常的PCR试剂以及荧光标记的核苷酸(例如Cy5-dUTP)后,通过适当的方法可以检测到DNA依赖的固相引物的延长。
Liu等开发了用于核酸的多重分析方法,其将利用PCR的扩增和利用微阵列分析的检测结合在一个反应中(Liu,H.P.等,2006,TaqMan probe array for quantitativedetection of DNA targets,Nucleic Acids Research,34)。这是利用液相中的引物分子和靶序列特异性的3’-固定化TaqMan探针的阵列来完成。在互补靶序列的存在下,利用聚合酶将TaqMan探针裂解,从而恢复被抑制的荧光信号。局部分辨信号可以通过光学设备检测。该平台用于检测一个样品中的5个不同靶序列。该批次物还潜在地适用于实时分析。由于引物在反应溶液中自由存在,因此靶序列的酶促扩增可以仅在液相中发生。探针不是必需的相互作用对象,因而扩增反应可选地不通过荧光信号在固相上成像。额外的荧光团标记的寡核苷酸探针用于靶序列的特异性检测。现有技术中已经记载了为了灵敏和特异性的核酸检测所使用的作为生物传感器的分子信标。使用分子信标或TaqMan探针用于微阵列分析具有的优点是,不需要用荧光染料标记靶序列,如在单独的反应步骤中使用寡核苷酸微阵列的情况那样,其中该单独的反应步骤在杂交事件之前或之后进行。然而,如果在微阵列以外需要预扩增步骤,则结果是劳动量增加,并导致污染的风险。固定化的分子信标或TaqMan探针通常具有至少三处修饰(对应于固定化、荧光供体和荧光受体的基团),因此当靶序列或阵列排列中存在变化时,会立刻出现生产和固定化新的探针所需的高成本。
此外,现有技术中记载了Hologic公司(原先的Third Wave Technology)开发的所谓“侵染检测(侵染检测)”。这种分析能够在等温条件下检测靶序列的存在。在最简单的情况中,该方法需要结构特异性的核酸酶、两个靶序列特异性的寡核苷酸(即侵染寡核苷酸和具有荧光供体和荧光受体的探针)。在检测反应期间,两个寡核苷酸在靶序列的链上杂交,从而侵染寡核苷酸的3’末端和探针的5’末端重叠并形成三倍体结构(三元复合体)。如此形成的三倍体是结构特异性的核酸酶的基质,其使探针裂解(初级反应)并从而恢复先前被抑制的荧光信号。在侵染检测的另一个实施方式中,探针不具有任何荧光修饰,但是被释放的探针的5’区域能够通过与FRET检测分子相互作用从而激活后续的检测反应(次级反应),形成局部三倍体结构。在使该复合体裂解后,获得荧光信号。在描述的反应中,发生信号扩增但不存在靶序列的扩增。这种“侵染检测”还可用于检测单核苷酸多态性(singlenucleotide polymorphism,SNP)。
从“侵染检测”发展出的系统将靶序列的预扩增和Assay(侵染检测)相结合,其中靶序列首先通过PCR进行扩增,然后转移至反应套管并孵育几个小时(检测反应)。反应通过使用来自水生栖热菌(Thermus aquaticus)的酶和酶将PCR与侵染反应结合在一个反应器皿中。首先,通过PCR扩增靶序列,然后在99℃使聚合酶失活。在接下来的步骤中,将反应混合物冷却至某一温度,在该温度时将侵染核酸和探针加入到靶序列上。该结构通过识别,在此可发生裂解反应并产生信号。该终点反应通常持续2小时。一个缺点是为了能够检测到,必须存在大量的靶分子。不能够平行地进行检测方法和扩增。因此,该分析的灵敏度不足以研究许多问题。
现有技术中已知几种基于固相的方法,其中,靶序列特异性的探针被固定化在具有局部分别率的适当表面上,并且能够用于基因组DNA中SNP的检测。通过荧光性的变化直接进行检测;和/或在成功将裂解产物与引物连结、进行通用滚环扩增并且使用非序列特异性的荧光染料和/或生物素标记的寡核苷酸进行标记,然后与链酶亲和素包覆的金粒子一起孵育后,间接进行检测。由于在这种等温过程中不发生靶序列扩增,因此一次分析通常的孵育时间高达24小时,接下来进行荧光测量。
微阵列分析包括多个步骤,固定化的捕捉分子的序列的通常选择,样品准备和扩增,杂交和/或孵育,然后是接下来的洗涤步骤,以及信号测量和数据处理。现有技术中记载的微阵列目前为止是基于靶分子与固定化的捕捉分子之间直接相互作用的原则,因此必须在检测到不同靶分子之后立刻使用经修饰的捕捉分子。原则上,这需要合成经修饰的阵列,并且是重要的时间和成本因素。由于复合体的缩减过程,由于经济原因,会产生大量的序列排列。因此,使用微阵列使得关于待测靶分子的灵活性降低,因为经修饰的序列排列会承担后续的高成本和处理劳动量。进一步,现有技术中公开了通用微阵列。固定化捕捉分子的序列不依赖于靶序列的通用核酸微阵列可以通过市售获得,例如昂飞(affymetrix)的“GeneChip Universal Tag arrays(基因芯片通用标签阵列)”。这种方法是基于通用微阵列序列排列,其中固定化的寡核苷酸(ZOP编码和/或通用标签)不依赖于待测序列,并且不对其干扰。在通常的检测反应中,靶序列常常在分离的反应器皿中扩增,并可选地被纯化。然而,进行连接步骤,在靶序列的存在下,特定检测探针与荧光探针在靶序列的碱基序列上直接并排杂交。检测探针具有非靶序列特异性的悬挂物(互补ZIP编码,cZIP编码),起到寻址序列的作用,并且与微阵列的ZIP编码探针互补。连接产生检测探针和荧光探针的产物,其用于在ZIP编码微阵列上的杂交。某一特定ZIP编码点的荧光信号是反应混合物中存在靶序列的间接指示。也可以使用编码的微珠(珠粒)作为固相。然后,对每个捕捉分子分配可明确辨认的珠粒,这是通过规定的核苷酸序列或着色和/或强度来实现。基于这种分配,在后续步骤中可以进行珠粒自动检测以及平行分析。这种方法的优点是珠粒以均质形式存在于液相中,并且结果反应动力比同等的液/固相相互作用要高。
现有技术中也记载了将标题为“cDNA-Mediated Annealing,Selection,Extension and Ligation(cDNA介导的退火、选择、扩展和连接)”(DASL)的方法通过通用微阵列用于表达分析。首先通过生物素标记的oligo-d(T)18重写RNA,并且将具有任意序列的引物分子转录到cDNA。接着,进行两个位点特异性寡核苷酸的杂交步骤,其中两个寡核苷酸具有共同的非位点特异性序列悬挂物。3’-末端寡核苷酸具有寻址序列,其整个在序列特异性区域和非特异性序列悬挂物之间。寻址序列与通用微阵列上规定的序列互补。在延长反应中,寡核苷酸之间的区域以互补的方式被补足,并且在下面的步骤中连接。于是,使用特定寡核苷酸,连接产物可通过PCR复制,扩增的连接产物被荧光标记的引物标记。在接下来的步骤中,在通用阵列和/或珠粒上进行杂交。DASL处理提供了与上述通用微阵列相比的优点,即,更有可能选择要连接的寡核苷酸,因为延长反应补足了缺失的核苷酸。然而,通过该反应,在过程中引入了另一个容易出错的步骤。这是高度时间密集型的方法,因为处理步骤和分析步骤多,并且还存在污染的风险,因为扩增的核酸片段必须在反应器皿之间转移。进一步,该方法仅设计用于终点测量。
美国专利5,653,939和美国专利6,099,803记载了如下方法,其中允许通过操作电场,在微电子芯片上使带电(生物)分子向规定的微位置(点)电泳运输。这里的“活性微电子阵列”是商业上可获得的,商品名为由独立可寻址电极的有序结构组成。通过对一个或多个电极施加电压,可将带电分析物特定地移动到半导体芯片上规定的点,并在那里聚集。如果该点具有互补的捕捉分子或具有亲和性的分子,则会通过电泳运输而在短时间内发生杂交或亲和性事件。由于电极的极性和施加的电压可以随意改变,因此这种方法能够操作带有负的净电荷的粒子(例如核酸、一些蛋白质)和带有正的净电荷的粒子(例如一些蛋白质)。通过占据具有各种捕捉分子的多个点,可以对应用的样品进行多重分析。于是,通过逆转电极的极性,诱导靶分子与捕捉分子排斥,确定相互作用(选择性)的强度,使非特异性结合(电应激)最小化。捕捉分子通常通过生物素修饰被固定,其选择性地结合至芯片表面的由链酶亲和素修饰的聚合物凝胶。纳米芯片器件平台原则上适合DNA杂交、SNP或STR分析以及分类确定和芯片内SDA反应。通过已标记探针的被动杂交或通过传统抗体技术可以进行检测。由于施加的电压,在电极区域形成能够破坏靶分子的电解产物(H+,OH-,H2,O2和游离自由基)。为了减弱这种效应,需要使用聚合物凝胶形式的分离中间层。这种平台仅能够检测分子相互作用,因此样品材料必须经常在上游步骤中富集。这对于核酸尤其必要,核酸通常通过不对称PCR扩增。器件平台由系统和微芯片控制单元组成,其调节例如应用电压的控制和射流。
用于检测靶分子的另一个通用方法被High-Throughput Genomics(HTG)公司市场化(例如US 2001/0034025 A1或US专利6,238,869 B1)。这种方法的基础是各种锚定寡核苷酸的通用阵列,其在3’末端固定于固相上(微量滴定板)。连接分子具有与上述锚定寡核苷酸互补的5’段并且还具有靶分子特异性的3’段,在该阵列位置杂交后,连接分子改变结合特异性。如果用新配置阵列检测核酸,则连接分子由寡核苷酸组成;对于蛋白质的检测,分子通常由寡核苷酸-抗体结合体组成。由HGT提出的用于检测表达分析用mRNA的实施方式允许在市售微量滴定板的每个孔中平行检测16个不同位点。为此,例如使细胞在分离的器皿中、在mRNA-互补的DNA探针存在下裂解并变性。成功杂交后,通过添加S1核酸酶消解单链核酸(mRNA和过量的DNA探针。二倍体的RNA部分通过碱性水解降级,从而中和之后在批次物中存在化学计量的DNA探针。接着,批次物转移至阵列,从而用检测探针和互补检测结合物进行序列杂交,检测探针与DNA探针部分互补,互补检测结合物具有过氧化物酶修饰。在加入合适的物质后,在成功形成上述杂交复合体的阵列位置发生本位化学发光信号。这种方法为劳动密集型,因为有大量的处理步骤。另一个缺点是分析的灵敏度低,因为扩增反应没有整合到分析程序中。因此,例如不能以足够的灵敏度检测非常低的核酸浓度。进一步,额外的杂交步骤会带来干扰,从而带来不需要的非特异性反应或假阳性信号。
现有技术中记载了通过基于核酸的方法的蛋白质检测方法。在这些方法中,分析物与固定的蛋白质(例如抗体)相互作用,然后与蛋白质核酸结合体一起孵育。在后续的洗涤步骤中,除去未结合分子。结合体包括与之后添加的环状DNA分子互补的核苷酸序列。通过采用合适的聚合酶处理,引物被DNA分子的RCA多联体延长并且生成。在与由金修饰的探针或非序列特异性荧光染料一起孵育后,具有捕捉分子的微阵列区域和与分析物结合的检测结合体被特异性标记。通过合适的检测方法,可以利用局部溶解来检测分析物的结合结果。这里,一个缺点是,这些方法使用两种不同的蛋白质和/或蛋白质-核酸结合体,其与相应的分析物直接关联。蛋白质的使用和由此得来的方法成为主要的成本因素,因为涉及合成。Chimera Biotec公司获得一种方法,其在原则上与其开发的技术类似,使用抗体-DNA嵌合体即与抗体耦合的合成DNA片段。如果该抗体结合到适当的抗原,则耦合的DNA片段可以通过实时PCR来扩增,并且在后续洗涤步骤之后检测。
在中心实验室中,在自动分析仪的帮助下进行医学诊断试验,并且涉及临床化学、医学微生物学和医学免疫生物学以及输血医学领域。除了这些高处理量的系统之外,当然还有较小的系统,其允许例如重要血液值或标记蛋白质的定点多重分析。它们采用各种检测原理,例如利用反应套管中已经存在的试剂进行样品的显色反应测量(例如AbaxisXpress),通过由抗体标记的膜然后用由金修饰的检测抗体标记分析物的流通免疫检测(例如Axis Shield Afinion)或线性检测条带(例如Abbott Point-of-CareRoche Cobas h232,系统)。在这些方法中,试验液体应用到特定额反应套管中,在该套管中,吸收材料通过毛细管力吸收样品,转运样品并且可选地分离样品。市售可得的检测试剂盒通常是基于免疫荧光技术。在规定的区域,试剂已经应用到材料(检测抗体)和/或固定于此(捕捉抗体)。这个程序通常不需要预备任何样品,从而可以用全血、血浆或尿液进行试验(可选地带有用于全血或离子的内置过滤器),在多数情况中,在一个反应中检测几个分析物。在大约15分钟内可得到结果。目前,市场上的检测试剂盒包括用于心脏病、病原体以及各种药物代谢物的标记物。此处描述的实施方式的优点是,具有高用户友好性(样品处理程序,不需要预备样品)和短处理时间。缺点是,这些设备主要用于临床诊断检测,仅与私有的消耗材料兼容,并且其用途限于临床相关的标记物和参数(例如心血管疾病)。进一步,其用途严重受到制造商的限制,因为检测反应仅能用于制造商制造了检测试剂盒的一定靶分子。
上述测试条带原则还用于核酸分析,其中待测核酸被扩增,并应用于测试条带,测试条带上有靶序列特异性的捕捉分子和检测分子。通过毛细管力,靶序列穿过测试条带上的各区域,与各种互补分子或近亲分子相互作用。通过在测试条带上的规定位置确定检测带(例如通过由金标记的检测分子),可以确定待分析样品溶液中靶序列的存在。现有技术中记载了检测任何核酸序列的通用方法(例如Baeumner,A.J.等,2004,A universalnucleic acid sequence biosensor with nanomolar detection limits(具有纳米检测限的通用核酸序列生物传感器),Anal.Chem.,76,888-894)。这里,样品溶液扩增,并与双功能报告探针一起孵育。探针的一部分在靶序列上杂交,而探针的另一部分在带有固定化的互补序列寡核苷酸的载体上杂交。扩增的靶序列的另一部分结合至生物素修饰的寡核苷酸。在将测试条带应用到溶液后,发生杂交复合体的定向运输,杂交复合体积累与链酶亲和素修饰的区域并且被检测。基于测试条带的核酸分析需要上游扩增步骤以及后PCR产物的相关处理。另外,系统受到低的多参数等级、低灵敏度和有限定量能力的限制。
在临床分析和体外诊断测试的各个领域中,多重分析检测方法至关重要,因此以下仅给出少量例子(但不限于这些例子):例如,为了检测血型,ABO基因型不仅涉及并且对于产生人类嗜中性抗原(HNA)特征也很重要,血液灌输和组织灌输时必须确定。血液供体样品中HIV变体和B型和/或C性肝炎病毒的平行检测通常利用免疫检测或基于核酸的技术进行。病原体的特定检测需要确定几个基因组位点,以允许在短的分析之间之后由此产生的诊断。
确定各种标记基因和控制基因的活性,使得能够产生表达特征。这可以用于例如鉴定致癌基因,其影响细胞分裂和分化,从而与癌症密切相关,或者根据患者的基因型预测一定药物的效果(定制药物)。经常发生的遗传疾病可以通过分子生物学(胎儿期)诊断试验来检测;其中包括囊性纤维化(粘稠物阻塞症)、苯丙酮尿症(代谢紊乱)和地中海贫血(红细胞降解)。另外,炎症标记物(例如原降钙素和细胞分子)的联合检测使得能够推测感染的严重程度。
多个诊断问题都要求多个靶分子、基因位点或其他标记物的分析,以及内部对照和/或参照,从而每个分析仅允许确定单个参数的方法通常意义不大。如果对于多个参数检测平行进行各种单个分析,则另一方面是不经济的:样品溶液必须分为均匀的反应批次物,其中检测不同的靶分子。这里,一个缺点是,由于将样品溶液分为“n”等分,因此单个反应中物质的质量按照1/n的因子降低,这也相应降低检测反应的灵敏度。
另一个缺点是,不使用分析物依赖性的在先浓缩步骤和/或扩增步骤,则不能进行使用低核苷酸浓度或蛋白质浓度的样品分析,这是因为许多检测方法灵敏度低。在基于平行微阵列的低浓度核酸的分析中,另一方面预扩增作为额外步骤,还导致不能发生同源扩增的问题,这取决于物质的初始量和反应效率,而定量结果仅在有限范围内可能实现。另一个缺点是需要将扩增产物在不同反应器皿和设备之间转移,这不仅涉及额外的步骤,还导致污染的风险。
微阵列分析是基于固定的捕捉分子(结合对象或探针)与靶分子的直接相互作用,固定的捕捉分子通常局部溶解在平面基质上,靶分子自由且可扩散地存在与液相中。该方法的一个缺点是包括几个步骤:上游扩增和/或富集、标记靶分子以检测靶分子与捕捉分子的相互作用,以及几个杂交和洗涤步骤。另外,所述的捕捉分子与靶分子直接相相关的另一个问题是,当出现新的试验问题时,例如当要检测不同基因型的病毒时,则需要固定另一探针。
另一个缺点是,由于复合体制造过程和高启动成本(配置阵列,净化处理元件),序列排列仅在制造大量时才是经济的(规模效应)。这种有限的灵活性降低了高度平行和可自动处理的优点。使用探针不依赖于待测靶分子的通用核酸微阵列可以克服这个缺点,但是,这些方法涉及的劳动量大,因此没有成功。除了这里描述的通用微阵列的技术缺点之外,目前现有技术中没有已知的生物化学系统能允许对于各种物质种类(例如核酸和蛋白质)进行结合的多重分析,从而必须使用各种方法或多个设备用于不同类型的检测。
US20020110826涉及固相发卡寡核苷酸的用途。酶反应导致与靶序列互补的部分断裂掉,该酶反应被靶序列在发卡寡核苷酸上的杂交反应促进。从而,标记物可结合至发卡寡核苷酸。一个缺点是,靶序列必须扩散至固相发卡寡核苷酸。由于靶序列的大小,因此此处的扩散率较慢。
因此,本发明的目的在于提供一种系统、装置或方法,其能允许生物分子的检测,从而能够通用使用且不具有现有技术中的缺点或不足。
发明内容
通过独立权利要求实现了这一目的。由从属权利要求衍生出有利的实施方式。
在第一实施方式中,本发明涉及一种用于检测至少一种靶分子的介质探针,其包括探针区域和介质区域,其特征在于,所述介质探针是寡核苷酸,所述探针区域位于寡核苷酸的3’末端并且所述介质区域位于寡核苷酸的5’末端,在所述区域之间存在化学、生物和/或物理裂解点,所述探针区域具有对于模板分子的亲和性并且所述介质区域具有进一步的对于检测分子的亲和性,其中在模板分子的扩增过程期间所述介质探针在裂解位点裂解,并且裂解的介质区域与检测分子的相互作用触发检测信号。
完全出人意料的是,介质探针可以被制作成可用于检测靶分子和/或检测分子,而不具有现有技术中所公开的探针或系统的缺点或不足。尤其是优点在于,释放的介质区域的存在触发了检测反应。靶分子的存在与检测反应之间的耦合仅取决于介质区域和/或介质探针的性质,因而允许任何靶分子与任何检测反应和/或检测分子的自由耦合。
因此,介质探针的特征尤其在于具有至少两个功能区域的分子,其可以与靶分子、和/或模板分子和/或检测分子相互作用。介质探针有利地在靶分子的存在下触发检测反应-可选地包括与辅助分子相互作用。
探针区域优选与模板分子和/或靶分子的片段互补。介质探针的探针区域结合至模板分子,其中模板分子被扩增。这种结合仅发生在介质探针的探针区域,因为探针区域具有对于模板分子的亲和性。介质区域不具有对于模板分子的亲和性,也不具有互补的序列片段。因此,介质探针的这一部分不结合至模板分子,从而形成了瓣状结构。在扩增反应期间,介质探针在裂解位点裂解,从而介质区域被释放。介质区域是自由的。介质区域优选具有与检测分子的片段互补的区域。介质区域结合至检测分子,从而触发可检测的信号。从可检测的信号可以推测模板分子的存在。模板分子本身可以是待测的靶分子或可以与待测靶分子相关联,从而通过模板分子能够产生关于靶分子存在的信息。
通过使介质探针断裂掉,介质分子被释放,除了检测分子以外没有相互作用对象。因此,与传统的基于核酸的方法相比,如在不对称PCR或LATE PCR的情况中那样,不需要通过额外优化引物关系来防止待测链的再退火。这大大降低了劳动量。由于介质分子的长度通常为20至25个核苷酸,介质分子具有比核酸片段更高的扩散常数,该核酸片段例如通过扩增机制产生并且产生用于杂交反应。
根据本发明,术语“检测分子”或检测分子的特征尤其在于如下分子,介质区域能直接或间接与该分子相互作用,并且可选地通过处理而触发检测反应(例如荧光信号的变化)。
术语“扩增”尤其是指核酸分子的复制。
辅助分子尤其是指在靶分子和/或模板分子的存在下给介质探针的状态带来变化的分子。可以使用来自一个或多个物质类别的各种辅助分子,例如,酶(聚合酶)、核酸(寡核苷酸)。优选地,结合至靶分子或模板分子的探针区域通过辅助分子而被酶促延长。
优选地,介质探针具有1至70个核苷酸,优选15至60个核苷酸,特别优选35至45个核苷酸。使用这种尺寸能够实现特别优选的结果,这是因为由于裂解后的尺寸小,所以介质区域能够以高扩散率扩散至检测分子。因而,本发明与现有技术的实施方式相比更有利,在现有技术的实施方式中,靶分子本身必须到达检测分子。
另外特别有利的是,介质探针由寡核苷酸组成,其能够以低价合成,不需要任何技术上的复合体修饰,例如荧光供体和/或受体。
优选地,靶分子和/或模板分子是选自包括DNA、RNA、蛋白质、适配子和/或其组合的组中的生物分子。还可以优选的是,只是分子的一部分要进行检测,例如识别序列或表位,因此根据本发明为靶分子。靶分子优选地存在于样品溶液中。根据本发明,靶分子的组合也指作为混合物。意料不到的是,能够单独或平行检测批次物中的不同物质种类的分子(例如,蛋白质和DNA或DNA和RNA),从而可以使用通用的试剂。
根据本发明,适配子尤其表示能与其他物质种类的分子(例如蛋白质)相互作用或结合的寡核苷酸,这是因为它们的结构性质。适配子优选为单链核酸,具有对于其他分子(例如蛋白质)更大的结合亲和性。优选的适配子还具有末端区域“区域i”和“区域ii”,这两个区域能够相互作用(根据本发明,是指闭合形式)。两个区域与以下相区分:“区域iii”具有对于靶分子的亲和性,“区域iv”是对于引物分子和介质探针的结合序列。如果区域iii与靶分子相互作用和/或相关联,则区域iv仅允许结合引物和介质探针。
优选地,靶分子同时为模板分子。在例如靶分子为DNA序列时使用该实施方式。这种情况下,扩增反应不需要额外的模板分子,因此靶分子本身被扩增。
如果靶分子本身不能被扩增,则使用模板分子用于扩增反应是有利的,其中扩增反应必须使得能够推断出靶分子的存在,从而能够检测靶分子。根据本发明,这可以通过各种方式来实现。因此,优选的是,仅由于存在靶分子、或者模板分子与靶分子相互作用从而发生结构的变化,才形成模板分子。
例如,优选靶分子是蛋白质并且对应的模板分子是适配子。适配子具有用于探针区域的结合位点。这里,优选适配子结合至蛋白质,并且探针区域仅在该结合时能够到达结合位点。这防止仅检测到适配子的存在而不能推测出待测靶分子(蛋白质)的存在。仅当靶分子存在时适配子才能结合到其上,并且探针区域的结合位点优选通过二级结构的变化而能够到达。接着,介质探针的探针区域可结合至适配子。通过适配子的扩增,介质区域从探针区域断裂掉,从而可结合至检测分子。从而,能够通过适配子的存在检测蛋白质。
如果待测靶分子是RNA序列,优选模板分子是对应的cDNA,cDNA优选通过反转录酶产生。于是,以此方式产生的cDNA是用于扩增的模板分子。对于反转录,使用经修饰的悬挂5’序列的引物是有利的。当还存在原始DNA时,这种实施方式尤其有利,因为这确保介质探针仅结合至cDNA而不是还结合到RNA模板的原始DNA位点。由于该实施方式,还可能进行如下的检测,即允许关于各种基因的基因表达的推论,因为基因的DNA和由其转录的RNA(通过悬挂有引物的cDNA的途径)能够被平行检测。在这样的方法中使用两个不同的介质探针,两个探针区域之一结合到包括一部分悬挂有引物的区域。因此,该探针区域可以仅结合至cDNA而不结合至原始DNA。
适配子的复合体和相关联的靶分子或两个或两个以上物质种类(例如核酸和蛋白质)的相互作用产物也可以用作靶分子。可以在一个反应批次物中单独或平行检测各种靶分子。优选地,介质探针由寡核苷酸或相应的衍生物组成,而靶分子是核酸、相应的衍生物或包含下列的分子:DNA、RNA、蛋白质、适配子和/或适配子的复合体和相关联的DNA、RNA或蛋白质;而对于检测分子,则是寡核苷酸或其衍生物。
在另一个优选实施方式中,本发明涉及介质探针,其中探针区域和介质区域在功能上和/或空间上重叠,优选以核苷酸重叠。
优选地,介质探针除了探针区域和介质区域之外,还包含另一个区域。该区域优选为锁区域,其与介质区域互补或具有与介质区域的亲和性。锁区域有利地位于探针区域的3’端。于是三个区域可以在功能上和空间上重叠。探针区域与模板分子的直接或间接相互作用产生介质区域和/或锁区域的变化,因而改变介质区域和锁区域和/或模板介质探针的亲和性和/或相互作用。包含锁区域的介质区域是有利的,因为通过这种方式产生额外的保护,防止介质区域结合至模板分子或在模板分子上退火。由于介质区域和锁区域彼此具有亲和性或者彼此互补,所以当不存在模板分子和/或靶分子时,介质探针可形成发卡结构。
还优选的是,介质探针在其3’端具有保护性化学基团。该实施方式是有利的,因为这防止未裂解的介质探针发生酶催化的序列延长。保护性化学基团可以选自包括磷酸基团、生物素、反向核苷酸、不与靶序列互补的核苷酸的组。本领域技术人员也熟悉能够防止寡核苷酸(特别是3’末端)延长的其他保护性化学基团。
优选地,探针区域和介质区域独立地相互自由结合。因此,例如,通过将组装介质区域与探针区域连接并合成组装介质区域,检测分子还可以与其他靶分子相关联。这实现了使用本发明的介质探针时特别高的灵活性。
在另一个优选实施方式中,本发明涉及包括介质探针和检测分子的系统,其特征在于检测分子是寡核苷酸并且具有至少以下区域:
a.位于检测分子5’末端的第一区域,其具有荧光受体或荧光供体和/或用于结合至固相的化学基团和/或保护性化学基团,
b.第二区域,其与介质区域相互作用,以及
c.第三区域,其具有荧光供体或荧光受体和/或保护性化学基团。
完全出乎意料的是,能够通用的系统是可获得的且将有利于减少微生物检测方法中的污染。通过生物化学反应可以检测各种分子,优选在通用的检测芯片上,使用标准检测分子来检测。特别地,这是由于取消了靶分子和检测分子之间的直接物理相互作用,才成为可能。介质探针起到靶分子与检测分子之间的介质(信息载体)的功能。介质探针(当存在额外的辅助分子时)优选地通过与靶分子或模板分子的相互作用而裂解,并释放活化的介质分子,活化的介质分子启动检测反应。
本发明的系统使得检测分子的设计可以不依赖于靶分子而进行设计。因此,通过使用检测分子的标准套组,能够检测样品中的各种靶分子,从而通过调整介质探针并使用适当的辅助分子(例如引物)或模板分子(例如适配子)可以对应于各个靶分子以低成本进行调整。由于这种有利的性质,现有技术中记载的靶分子与固定化的捕捉分子之间通常直接相关联的问题得以解决。
介质区域有利地在裂解之后扩散性地存在于反应溶液中,并且能与区域2相互作用,区域2为检测分子的介质杂交序列。检测分子可优选地结合至固相或也可自由存在于溶液中。
这些检测分子不与这些靶分子发生物理相互作用。靶分子与检测分子仅通过相应介质探针的方式间接耦合。通过使用介质探针,靶分子可以自由分配给任何检测分子。
如果检测分子被固定化于固相,则可使通用微阵列或检测阵列可用。由此产生的通用微阵列可在规定的保存条件下长时间保存,这与现有技术的蛋白质序列相比是明显的优势。因此,计划试验的独立保存并不困难。
由此,本发明首次使得可以使用不依赖于靶分子的标准微阵列,并且可用于各种多重分析物分析,因为可以将特定的液相反应对应于靶分子快速且低成本进行调整。
因此,通过制造标准微阵列,可以不进行预处理步骤和/或后处理步骤,使用反应套管实施各种实验,因此,这具有节省成本的优点,并且可以大量制造套管(规模效应)。因此,可以使用一个批次的标准反应套管进行检测反应(例如在常规分析的范畴内)。
微阵列优选指固定化捕捉分子在合适的固相(通常为平面)上局部溶解的至少一维阵列。替代的方法允许使用珠粒的固相支持的方法,其使得能够基于例如不同的染色进行清楚的辨别。一定的捕捉分子可以被固定化于规定种类的珠粒上。
珠粒优选是指直径尤其为5-100指直的微珠。它们可选地以经修饰的和/或官能化的形式存在于表面和/或内部。使用珠粒使得能够在规定的反应体积内使用大的表面积。
由于合适的辅助分子(例如酶、尤其是聚合酶),介质区域被延长,其中检测分子的区域1发生序列降级。检测分子优选通过使5’末端和相关联的荧光受体Q断裂掉从而被改变,先前被抑制的荧光供体F的荧光信号得以恢复。如果区域1和区域3的相互作用由于使该末端断裂掉而被抑制,那么二级结构的结构被消除。这种情况下,介质分子在一定条件下被上述辅助分子以互补方式延长,一直达到检测分子的新形成的5’末端。由于这种延长,延长的序列分子具有与检测分子的区域1和区域2互补的序列片段。
本发明的系统允许在封闭反应器皿内检测各种靶分子,其在处理后可以丢弃而没有污染的风险。这成为与现有技术相比的实质优点。
另外,有利地,检测分子d在检测分子的3’末端具有第四区域,其中第四区域包括用于结合至固相的化学基团和/或保护性化学基团。
这种变体是有利的,因为可以通过这种方式将检测分子固定化,并且例如产生微阵列。列出可能的用于固定寡核苷酸的化学基团作为例子。化学基团取决于所使用的表面化学和可能需要的任何耦合分子:OH(羟基)、NH2(氨基)、Ph(磷酸基)、吖啶或硅烷。本领域技术人员熟悉将寡核苷酸固定化于表面的方法。特别地为了允许5’末端的推定的固定化,检测分子具有化学基团和/或保护性化学基团。
优选地,发卡结构涉及为通过检测分子5’末端的互补杂交而具有内含序列片段,并且检测分子的3’末端包括未配对的序列片段。在将介质区域添加到未配对3’序列片段的序列区域后,介质区域优选被聚合酶延长,其中,基于聚合酶的核酸酶活性,检测分子的发卡结构的5’末端的核苷酸被移除。在形成这种结构之后,荧光供体F和荧光受体Q彼此相互作用,抑制荧光信号F(荧光共振能量转移,FRET)。
优选地,介质探针和/或检测分子具有荧光标记的核苷酸。尤其优选地,检测分子在5’末端和/或在发卡结构内具有至少一处荧光修饰。检测分子具有一处或多处荧光修饰,其能够进行荧光共振能量转移并且能够在裂解后在空间上彼此分离,从而允许检测荧光信号的变化。
序列特异性或非序列特异性的荧光和/或显色探针或荧光染料可以有利地与介质探针和/或检测分子的至少一个区域相互作用。另外,如果检测分子在5’末端区域和/或在发卡结构内具有至少一处荧光修饰,其可能是有利的;如果荧光修饰在与介质区域反应后利用辅助分子而被从检体分子上断裂掉,其可能是有利的;和/或如果去除检测分子的发卡结构的5’末端并且在检测分子上检测到荧光信号,其可能是有利的。
优选地,检测分子由于与介质区域的直接或间接相互作用而被改变,包括二级结构的变化,荧光性、磷光性、质量、吸收性、光散射、导电性、酶活性和/或亲和性的变化。
由于介质区域与检测分子的第二区域的直接或间接相互作用,检测分子中发生变化,并且优选物理地或化学地测量这种变化。
还被证明为有利的是,结合至检测分子的第二区域的介质区域被至少一个辅助分子酶促延长,从而辅助分子优选地结合至所结合的介质区域的3’末端。
辅助分子选自包括下列的组:催化剂、蛋白质、核酸、天然物质、酶、酶体系、细胞裂解物、细胞成分、衍生自细胞成分的衍生物和/或人工分子。
还优选的是,辅助分子是来自核酸扩增系统和/或限制酶系统的分子。
在优选实施方式中,检测分子还可以在5’末端区域和/或在发卡结构内具有一处或多处荧光修饰,从而在合适的酶的帮助下处理杂交的介质区域之后,在合适的酶的帮助下5’末端核苷酸从该检测分子上断裂掉,并且能够检测到检测分子上荧光信号的变化。因此,介质分子优选与至少一个检测分子复合体相互作用,其自由存在于溶液中或固定化在固相上。检测分子复合体可以具有一处或多处相同或相似的化学修饰,并且在与介质区域相互作用后产生可检测的信号。优选地,通过介质区域与检测分子的第二区域的直接或间接的相互作用,检测分子中会发生物理或化学可测量的变化。仅在介质探针断裂掉以后,该区域触发信号。介质探针的介质区域由于仍然与介质探针相关联,因此优选不直接(例如通过杂交)或间接(例如通过聚合酶处理)触发信号,因为否则的话,则属于不依赖于靶分子发生的信号的情况。这种可测量的变化还可能发源于辅助分子(例如聚合酶)。
在介质区域的直接检测反应中,介质区域直接改变检测分子。在间接检测区域,介质区域通过与辅助检测分子(特别是使介质区域延长的聚合酶)相互作用而诱发检测分子的变化。介质区域有利地在检测反应期间导致检体分子的变化,并且其本身由于合适的辅助检测分子而发生变化。该实施方式是有利的,因为其使得能够清楚区分在检测反应中被改变的介质分子和直接衍生自介质探针裂解的介质分子。
辅助检测分子特别是描述为如下的分子,其有利地与介质区域和检测分子相互作用,从而检测反应被优选地触发。可以使用一种或各种物质种类的各种辅助检测分子。
辅助检测分子优选地选自各种物质种类,例如催化剂、蛋白质、核酸、天然物质、酶、酶体系、细胞裂解物、细胞成分、衍生自细胞成分的衍生物和/或人工分子,或这些物质种类的各种分子的混合物。
进一步,优选地,辅助检测分子以结构特异性的方式断裂。优选地,辅助分子包括来自核酸扩增系统和/或限制酶系统的分子。介质探针的探针区域可优选地通过碱基配对与靶分子和/或模板分子相互作用,并且辅助分子可裂解介质探针,其中介质区域通过碱基配对与检测分子相互作用,并且辅助检测分子使检测分子的组分断裂掉。这种裂解反应起到间接保护靶分子的作用。断裂掉的检测分子的组分优选地可以是荧光供体或荧光受体。
然而,还优选的是,辅助检测分子进行序列特异性的裂解,其中辅助分子是核酸扩增系统并且辅助检测分子是限制酶系统或者核酸扩增系统与限制酶系统的混合物。检测分子是寡核苷酸或衍生物,并且包含限制酶系统对应的识别序列,其中检测分子上的介质区域结合至互补部分,并且通过核酸扩增系统被延长。因此,由此产生的序列二倍体包括限制酶系统的至少一个识别序列样式,其中限制酶系统将序列二倍体断裂成两部分。在序列二倍体裂解后,优选可检测到信号,例如荧光性或质量的变化。然而,还有利的是,在使序列二倍体断裂后,至少一个裂解片段可启动与所存在的互补或部分互补的核酸序列的扩增反应,其中所述核酸序列可在溶液中自由存在或可被固定化在固相上。
在优选实施方式中,通过将荧光探针或标记的核苷酸结合、或者添加序列特异性的、荧光或显色探针、或者添加非序列特异性的荧光染料来检测扩增。扩增产物有利地直接或间接检测,这种检测提供靶分子的间接证据。
由此释放的介质区域可优选地启动酶催化的扩增反应或聚合反应,优选在合适核酸的存在下并且通过一种或多种不同的酶(例如聚合酶)。合适的核酸可以单链或双链形式存在并且还可在检测反应中另外使用反向引物。
优选地,检测分子结合至固相或自由存在于溶液中。
进一步,优选地,检测分子是单链核酸分子或核酸衍生物,优选具有发卡结构。这里,有利地设计发卡结构,从而检测分子的5’末端以互补的方式与内含序列段杂交,并且检测分子的3’末端包括未配对的序列段。
检测分子优选地具有一处或多处相似或不同的修饰(例如碱性核苷酸和/或磷脂酸化物和/或功能基团例如荧光染料)。优选地,检测分子通过与介质直接或间接相互作用而变化,并且涉及以下的一种或多种变化:荧光性、磷光性、质量、吸收性、光散射、导电性、酶活性或亲和性;从而可以对这种变化进行物理检测。在介质的存在下,检测分子可优选地经历化学修饰,例如磷酸化、去磷酸化、酰胺化、化学基团的结合或裂解、或荧光性、磷光性或化学发光性的变化。
根据本发明,碱性核苷酸特别是描述DNA构造块,其中脱氧核糖没有连接至碱基,因此只是磷酸-糖骨架。在DNA二倍体中,在该位置没有形成氢桥键。这种修饰可以通过使用四氢呋喃(THF)来合成。
还优选的是,检测分子包含至少一处在5’末端和/或在发卡结构内的荧光修饰。
在另一优选实施方式中,本发明涉及用于检测至少一种靶分子的方法,其包括根据本发明的介质探针和/或根据本发明的系统,包括以下步骤:
e.将介质探针的探针区域结合至模板分子和/或靶分子的序列,
f.扩增模板分子和/或靶分子,
g.利用至少一个辅助分子使介质探针在裂解位点断裂掉,并且
h.将介质探针的裂解的介质区域结合至检测分子。
优选地,介质探针的断裂引发介质探针的至少一个区域的物理和/或化学性质的变化,选自包括下列的组:分子量;酶活性;包括亲和性或亲合力在内的结合性质;化学反应性;化学基团的存在;包括导电性、极性或电荷在内的电学性质;和/或包括光吸收和光发射的光学性质。
在尤其有利的实施方式中,靶分子基于核酸的扩增可以直接扩增模板分子(例如适配子),从而提高灵敏度。扩增和检测反应可以组合并平行进行。这将本发明与(侵染)反应明显区别,反应记载于现有技术中并且利用线性信号扩增和/或连续扩增和检测来进行检测。
靶分子和/或模板分子与介质探针的相互作用优选导致介质探针直接或间接断裂掉,从而优选生成这些片段:
-介质区域的片段和探针区域的片段,或
-介质区域,和探针区域的片段,或
-介质区域,和探针区域的一部分,和探针区域的片段,或
-介质区域的片段,锁区域,和/或锁区域的片段,和探针区域的片段,或
-介质区域,和锁区域,和/或来自锁区域的片段,和来自探针区域的片段,或
-介质区域,和作为连续片段的探针区域的一部分,以及锁区域,和/或锁区域的片段,和探针区域的片段。
特别优选的是,包含介质区域的一部分的裂解的介质或片段结合至检测分子的第二区域。
在检测反应的帮助下检测介质分子。反应机制与靶分子和/或模板分子的所述扩增可以平行地发生。
本发明的方法是有利的,因为已经开发出新的液相反应,其解除靶分子和检测分子的耦合,并且当与标准微阵列结合使用时几乎能检测任何的靶分子。通过将新的液相反应与通用微阵列结合,各种靶分子的平行检测成为可能。
优选地,模板分子和/或靶分子的扩增利用PCR、优选利用实时PCR进行。
PCR特别是指聚合酶链链式反应,即,由引物分子界定的核酸段呈指数扩增的方法。循环地加热和冷却反应批次物。
引物优选地描述寡核苷酸,其通常与要扩增的核酸的片段互补,并界定该片段。规定了扩增子的两个引物通常是指正向引物和反向引物。由于从5’末端向3’末端进行聚合,因此引物需要3’-OH末端,在该3’-OH末端,聚合酶共价连接其他核苷酸。
特别优选地,在实时PCR期间使用本发明的介质探针。大部分已建立的监测实时PCR技术是使用单独的靶向特异性荧光探针。这提高合成的成本,是这种系统主要的缺点。因此,长期以来人们对能够用于监测扩增反应的通用方法感兴趣,其将结合序列特异性和低成本。本发明能够利用本发明的介质探针解决这一问题,本发明的介质探针可以在扩增反应、特别优选实时PCR期间使用。在这种应用中,靶分子是DNA核酸,用常规寡核苷酸引物和聚合酶扩增。序列特异性检测、优选实时检测通过本发明的双功能介质探针来实施,该介质探针在与靶序列相互作用以后在扩增期间裂解。这种裂解由聚合酶催化。介质区域优选地设计为不与靶序列互补。接下来,介质区域扩散至检测分子,该检测分子被固定或者存在于溶液中。检测分子是封闭单元,并且不依赖于靶物。该监测分子因此可以通用使用且不结合至特定靶物。这大大降低此类检测的成本,因为检测分子不需要针对每个反应和每个靶分子而定制。
检测分子优选具有发卡结构并且包含荧光团和淬灭剂,二者优选在空间上彼此接近。通过这种配置,使得能够进行特别有效的利用FRET的检测。在未配对的3’端,检测分子还包含与介质区域互补的介质杂交区域。
FRET优选是指荧光共振能量转移,特别是从供体分子向受体分子的能量转移。
在实时PCR期间,靶物扩增和检测在组合反应中同时发生。在DNA模板的变性步骤中,分为两个单链。同时冷却至达到退火温度,引物和介质探针的探针区域都经历杂交。5’区域(介质区域)不结合至靶DNA。因此形成瓣状结构。在引物延长期间,介质区域被拉入聚合酶的核酸酶域从而被裂解。于是,裂解的区域(介质区域)具有3’-OH基团。接着,探针区域在引物延长期间被降解。在靶物的任何副本中,介质区域被释放。扩散到检测分子的介质区域与其介质杂交位点杂交。优选地,聚合酶延长介质区域的3’端,导致荧光反淬灭。这里,优选两个信号途径。检测分子的5’末端由聚合酶的5’-核酸酶活性降级,并且淬灭剂自由基断裂掉。然而,还优选的是,聚合酶使检测分子的亲本二倍体不稳定,发卡结构打开但5’末端不降级。两个途径最终都导致荧光团的反淬灭。两个途径可以平行发生,这是因为已知例如Taq聚合酶具有不同的核酸外切酶活性。本发明的一个优点在于,在每个扩增循环中连续积累发射荧光量,因而,即使靶分子的初始量特别少,也能成功检测。
使用介质探针作为检测手段的实时PCR与现有技术中已知的系统(例如SISAR或侵染系统)相比是有利的。通过将检测与扩增反应结合,能够对靶分子进行灵敏的检测,从而分析变得更加准确。本发明的系统需要聚合活性和Taq酶活性这两者。假阳性结果被排除,因为引物错误结合造成的错误扩增不会出现在断裂掉的介质区域内,这是由于没有对于探针区域的互补区域,因此也不能结合。进一步,可以在多重PCR系统中和/或二重PCR系统中使用介质探针,从而能够使用几个不同荧光团而用于多个不同的检测分子。这是与现有技术系统相比的主要优点,因为通过这种方式能够平行地检测多个靶分子。因此,本发明的多重PCR系统能够用于例如诊断测试,并且能够加速和简化此处的检测工艺,从而可以同时减少劳动量、材料和成本。
在多个批次物中,使用相同组的不同检测分子可以检测不同组的多个分析物。这里,优点在于可以使用相同组的不同检测分子进行多个批次检测。先前在现有技术中这是不可能的。
本发明的另一个主要优点是解除扩增反应与检测的耦合。这使得能够使用标准检测分子,从而检测分子能够大量生产,因此生产成本降低。
还优选的是,检测分子由于利用至少一个辅助检测分子而与介质区域相互作用,从而发生改变,包括裂解;消化;链加倍;内部杂交;磷酸化;去磷酸化;酰胺化;化学基团的结合或裂解;或荧光性、磷光性或化学发光性的变化。这里,特别优选检测分子在5’末端区域和/或在发卡结构内具有至少一处荧光修饰,并且在与介质区域反应后,荧光修饰通过辅助检测分子而从检测分子上断裂掉,和/或检测分子的发卡结构的5’末端被去除,在检测分子中检测到荧光信号的变化。
还优选至少一种靶分子是RNA的方法。在这种情况下,RNA首先转录为cDNA,优选通过反向转录。接着,得到的cDNA成为模板分子,介质探针的探针区域结合至该模板分子,扩增该模板分子。尤其有利的是,通过转录至cDNA,还可以扩增RNA靶分子,因为通过这种方式,仅需要少量的RNA就能够检测。
还优选的是,悬挂有序列的引物用于转录反应中,优选反向转录。这使得能够使用介质探针,该介质探针能够结合至cDNA但不结合至基因的原始DNA。对此,使用介质探针,其探针区域结合至包括cDNA和悬挂序列的区域。由于原始DNA没有悬挂序列,因此介质探针能够区分DNA和cDNA。这确保仅检测DNA的存在,并且DNA不能触发相应的信号。
进一步,可以使用这种方法来平行检测相同基因的RNA(通过带有悬挂序列的对应cDNA)和DNA。优选将两个不同的检测分子和两个不同的介质探针用于该目的。
如果分析真核细胞样品,则也可以使用内显子/外显子序列来区分相同基因的RNA和DNA。因此,可以选择探针区域以结合至cDNA,从而覆盖两个转录的外显子的区域。由于这些区域被基因的DNA中的内显子分开,所以介质区域不能也结合到DNA而只是结合到cDNA。
在另一优选方法中,至少一个靶分子是肽或蛋白质。模板分子优选是适配子,从而适配子结合至肽或蛋白质,因此用于介质探针的探针区域的结合位点可以到达。优选地,适配子自己不具有可达到的用于探针区域的结合位点。仅当适配子已与靶分子(肽或蛋白质)相互作用时,结合位点空出并且可到达。这优选通过二级结构的变化而发生。于是,介质探针的探针区域可结合至适配子。同时,适配子可用于扩增反应。通过适配子的扩增,介质区域从探针区域断裂掉,从而能够结合至检测分子。因此,通过适配子的存在,可以检测蛋白质。
由于适配子被扩增,因此信号也扩增,从而即使是非常少量的肽和/或蛋白质也能够被检测。
还优选的是,通过检测多个靶分子,例如DNA和蛋白质或蛋白质和DNA。
根据反应条件,本发明允许通过多重分析在一个步骤中进行各种分子和分子种类(例如蛋白质和核酸)的平行检测,从而能够汇总出组合的DNA-RNA蛋白质的样品档案。
因此,本发明的方法还用于检测混合物中的一种或多种相似或不同的生物分子。
这优选通过使用限制酶的活性而发生,其特征是,检测分子在3’末端区域具有保护性化学基团,在与介质区域反应后,该保护性化学基团通过辅助分子而从检测分子断裂掉,从而形成3’-末端OH基团。
还优选的是,本发明的方法用于多重分析。多重分析特别地描述在一个反应批次中平行检测几个靶分子。
对于相比于现有技术中描述的PCR反应的多重化等级超出几个数量级的各种不同的靶分子,可以使用标准的阵列排列并且以尤其低成本的方式调整介质探针,从而进行检测。由例如长度为20个核苷酸的核酸分子组成的介质区域可能计算得到假设420(约1×1012)个可能的不同核苷酸序列。
在靶分子和/或模板分子与介质探针的直接相互作用中,靶分子和/或模板分子的存在导致来自介质探针的介质区域被活化。在间接相互作用中,靶分子和/或模板分子(尤其是核酸)诱导与介质探针和辅助分子(特别是寡核苷酸)的相互作用,辅助分子在结构上不与介质探针相互作用。此处描述的辅助分子起到引物的作用,并且通过不同类型的辅助分子被延长,特别是适当的聚合酶,通过该聚合酶,介质探针在与聚合酶相互作用以后裂解为介质区域和探针区域。由此形成的介质区域在靶分子的存在下形成介质探针。这些辅助分子优选选自包括下列的组:催化剂、蛋白质、核酸、天然物质、酶、酶体系、细胞裂解物、细胞成分、衍生自细胞成分的衍生物或人工分子或其混合物。
出人意料的是,介质探针的断裂导致介质探针的至少一个区域的物理和/或化学性质的变化,这些性质选自包括下列的组:分子量(介质探针断裂后,断裂的片段与介质探针不同);酶活性(介质探针的性质有利地改变为能够根据新的自由3’端的存在而启动检测反应);包括亲和性或亲合力在内的结合性质;化学反应性(介质探针断裂后,包含介质探针的介质区域的裂解片段在3’端具有羟基,其可被辅助分子(例如聚合酶)延长,这对于未裂解的探针是不可能的);化学基团的存在;包括导电性、极性或电荷在内的电学性质;和/或包括光吸收和光发射的光学性质(如果介质探针标记有至少一种荧光染料,则优选在裂解后能够检测到改变的荧光信号)。
在优选实施方式中,介质区域与多个相似的检测分子有一系列的相互作用,从而导致信号扩增。这提高检测反应的灵敏性。在该实施方式中,经修饰的核酸有利地用于合成检测分子,允许检测反应期间仅发生有限的5’-末端降级。这可以通过结合在分子合成期间在5’末端的倒数第二个核苷酸处进行一个或多个硫代磷酸酯(PTO)修饰而发生。PTO修饰的位置优选位于区域1,特别优选在荧光供体F和荧光受体Q之间。图6示出了经修饰核苷酸的优选位置。优选的辅助检测分子不能使PTO键断裂,或者仅能以低效率使PTO键断裂,并且5’末端(区域1)不能降级超过该核苷酸。因此,介质分子也不会进一步延长。通过适当调整反应条件,辅助检测分子和介质分子可以从检测分子断开,于是重新能够用于活化另外的检测分子。
在特别优选的实施方式中,介质分子可以在每个反应循环和/或反应时间段与多个相同的特定检测分子相互作用,从而触发产生信号的检测反应。反应的灵敏度显著提高,因为靶分子的扩增导致累积效应。
还优选的是,允许检测在使用适当的实时设备时发生,和/或终点测量可检测。在两种情况下,本发明的实施方式都有利地不需要任何后处理,例如洗涤步骤或孵育步骤。
在另一优选实施方式中,与前述PTO修饰兼容,但不限于组合应用,碱性核苷酸(四氢呋喃THF修饰)结合到区域c中,不能与互补的核苷酸形成任何氢桥。这抑制介质区域在碱性核苷酸相反位置上的延长反应,在该位置,辅助检测分子和延长的介质区域从检测分子断开(参见图7)。应用其中一种优选的修饰可允许介质分子与多个检测分子的一系列相互作用,根据本发明,这特别是指介质回收。介质区域利用辅助检测分子在与检测分子的首次相互作用和后续处理中被延长,还可在该延长状态下与额外的检测分子相互作用并且在合适的辅助检测分子(例如具有5’核酸酶活性的聚合酶)的帮助下允许5’-末端的降级(因此还有荧光受体Q)。这种反应机制允许信号扩增,因为信号分子生成并扩增,而不考虑靶分子扩增。如果靶分子在合适辅助分子的帮助下扩增,并且如果这个过程与介质探针裂解相关联,则介质累积,这就将靶分子扩增与信号扩增结合,并且将检测反应中的检测限降低几个数量级。这是完全出人意料的,并且在现有技术中没有记载。进一步,这与现有技术中的惯常认识相违背。在发生该过程后,可有利地改变反应条件,例如提高反应温度,从而酶(例如聚合酶)和延长的介质区域将从检测分子断开。本领域技术人员知晓,反应条件可经历循环变化,从而在本发明特别优选的实施方式中,介质分子可以与多个相似的检测分子相互作用。这出人意料地导致信号扩增,这显著增加了反应的灵敏性。
检测反应优选被设计为,与介质区域相反,未裂解的介质探针不出发任何产生信号的反应,并且从而不会产生假阳性结果。介质探针断裂得到的介质区域具有3’-OH末端,其对于聚合酶介导的延长反应特别有利。如果该裂解不发生,则介质不可能延长,因为介质序列共价连接至介质探针的杂交序列(参见图8)。另外,可以利用例如磷酸基团或其他化学基团来防止介质探针的3’-末端的非特异性延长。
局部、可检测(荧光性)信号优选由于介质区域与检测分子的相互作用事件而发生。如果足够的检测分子通过优选的介质延长而活化并导致5’-末端的裂解,则信号扩增并且能够通过合适的检测设备(特别是光学设备)而被检测。这允许在反应混合物的存在下进行检测,并且不需要任何处理步骤。优选实施方式的有利性质是允许在合适的反应空间内检测而不需要在进行反应之后打开反应空间。这避免现有技术中记载的问题,即由于杂交步骤、着色步骤和/或洗涤步骤而涉及到微阵列分析,这些步骤涉及额外的劳动力和高污染风险。因此,认为优选实施方式与本领域的惯常认识相背离,因为其开启了新的技术领域,并且解决了现有技术中长期存在的问题。
除了上述优点之外,优选实施方式使得能够产生的信号在反应期间在任何点可及时读取。这允许反应的实时检测,其对于核酸扩增的定量或确定例如蛋白质相互作用的结合动力是必须的。因此,该优选实施方式区别于现有技术,现有技术中通常只确定终点,从而不能在任何点及时进行信号检测。
多重分子确定反应混合物中的多种不同的分析物。由于优选反应的多重等级提高,因此优选使用“n”个不同的介质探针用于“n”个不同的靶分子。在优选实施方式中,介质探针的区域1特异性地与靶分子相互作用,该介质探针可被指定给每个待测的靶分子。相应探针的区域2代表成功裂解后的介质,该区域2不具有对于靶分子的亲和性也不与其互补,但是代表对于规定检测分子的特定相互作用点。因此,检测分子被间接指定给每个靶分子,这种指定是通过介质探针进行。检测各种靶分子需要各种检测分子。基于优选的结构,若这些分子仅在区域5不同,则是充分的。实际上,任何平行级别都有可能,因此任何系列的序列都有可能,从而用于多参数分析的检测方法有效。因此,优选使用该系统作为多参数分析的检测方法。该系统优选用于检测混合物中的一种或多种相似或不同的生物分子。进一步,该系统有利地用于扩增至少一个或尤其是多个靶分子,但有利地,它们不是相同的靶分子。另外,可优选使用该系统,同时利用限制酶的活性,从而检测分子在3’-末端区域具有化学保护性基团,在与介质区域反应后,该化学保护性基团在辅助分子的帮助下从检测分子断裂掉,并且产生3’-末端OH基团。
在本发明对该问题的解决方案中,将带有待分析样品的介质探针应用于固定在用后即弃的反应套管中的检测分子。然后用合适的方法处理并检测。然后,丢弃反应套管,但不会造成后续污染。另外,可以在检测之前或与检测平行地在反应器皿中进行扩增步骤,从而可选地,可以实现靶分子的特异性富集。因此,反应批次物以高靶分子浓度(例如后PCR批次物)从扩增区域转移到检测区域,连接步骤和污染风险变为多余的。
本发明还涉及用于使用本方法或系统的处理机器和微流体反应盒。套管具有至少一个反应室,在该反应室内特别存在通用检测阵列,优选由局部溶解配置的一个或多个检测分子组成。
处理机器优选受制于套管和反应液,以达到恒定温度和/或规定的温度特征(加热和/或冷却)。该处理机器可通过优选的系统或方法检测检测分子中的变化。例如,可以以这种方式使用荧光信号。另外,该机器可允许利用有源或无源元件进行反应套管内的液体转运。前面的讨论可适用于介质探针、系统和方法。
实施本发明方法能够降低成本,因为在一个可能实施方式中,可在用后即弃的套管中自动应用将待分析样品和所需试剂。这使得不需要用于这些步骤的专用人员。
在另一优选实施方式中,本发明涉及试剂盒,其包括根据本发明的至少一种检测分子、聚合酶和dNTP。因而,所提供的该试剂盒可用于任何检测反应,从而有利地是一种通用检测试剂盒。
实施例
下面参照附图和示例性实施方式更加详细解释本发明和现有技术,但本发明不限于此。附图表示:
图1(A-D)表示固定化探针侵染裂解后的各种基于固相的检测方法;
图2表示介质探针的优选结构;
图3A、图3B表示优选的介质探针与靶分子的相互作用和介质探针裂解;
图4A、图4B示出优选的检测分子;
图5i)至图5vi)表示酶化介质的优选延长的示意图;
图6表示在检测分子内化学修饰的优选位置的示意图;
图7表示在固定化检测分子的帮助下对介质进行优选的检测;
图8表示优选的介质探针与检测分子的相互作用;
图9表示介质探针技术的优选应用领域的示意图;
图10表示使用优选介质探针和反应器皿中的固定化检测分子进行的PCR的归一化的荧光点图;
图11表示优选PCR方法的示意图;
图12表示介质探针PCR与水解探针PCR的特性比较;
图13表示利用介质探针PCR和水解探针PCR进行各种靶物的扩增。
图1(A-D)表示固定化探针侵染裂解后的各种基于固相的检测方法。(A)直接的基于荧光的侵染裂解检测。可能性1:探针固定化在基质表面。侵染寡核苷酸(上游寡核苷酸)和靶序列(靶物)加入到反应溶液中(参见图1)。可能性2:探针和侵染寡核苷酸固定在表面上。将靶序列加入到反应混合物中(参见图2)。在两种情况中,探针分子都裂解,其导致荧光信号的变化。来源:Lu,M.C.等,2002,A surface invasive cleavage assay for highlyparallel SNP analysis(用于高度平行SNP分析的表面侵染裂解分析),Hum.Mutat.,19,416-422。
(B)间接裂解反应。Dabcyl修饰的探针固定化在固相上。在成功侵染裂解后,连接至结合了包覆有链酶亲和素的金粒子的生物素标记的连接物。来源:Nie,B.等,2006,Quantitative detection of individual cleaved DNA molecules on surfaces usinggold nanoparticles and scanning electron microscope imaging(使用纳米粒子进行表面上单个裂解DNA分子的定量分析和扫描电镜成像),Anal.Chem.,78,1528-1534。
(C)通过后续的滚环扩增进行间接裂解检测。在固定化5’-标记的探针的侵染裂解后,利用后续的滚环扩增进行连接步骤。表示了两种不同策略,其中只有探针(a)固定化和/或探针和侵染寡核苷酸(b)固定化。来源:Chen,Y.等,2004,Surface amplification ofinvasive cleavage products(侵染裂解产物的表面扩增),J.Amer.Chem.Soc.,126,3016-3017。
(D)间接的基于荧光的裂解检测。标记的检测探针在荧光标记的探针上杂交,并检测荧光信号。在进行洗涤步骤和侵染裂解后,还存在已描述的额外的与检测探针的杂交步骤。后续的荧光测量使得能够推测反应批次物中靶序列的存在。来源:Lockett,M.R.等,2007,Molecular beacon-style hybridization assay for quantitative analysis ofsurface invasive cleavage reactions(用于表面侵染裂解反应的定量分析的分子信标类型杂交分析),Anal.Chem.,79,6031-6036。
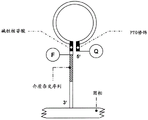
图2表示介质探针的优选设计。介质探针特别地由寡核苷酸组成,并且细分成两个功能区域。区域1具有对于原始和/或靶分子的亲和性或者与其互补,而区域2排他地与特定检测分子相互作用。这些区域间有潜在的裂解位点。
图3表示优选的介质探针与模板分子和/或靶分子的相互作用和介质探针裂解。介质探针、辅助分子1(此处为引物)和辅助分子2(此处为具有聚合和核酸酶活性的酶(聚合酶))与模板分子和/或靶分子(此处为核酸序列)相互作用(A)。在合适的反应条件下,引物被聚合酶延长,介质探针裂解,从而介质区域被释放(B)。
图4A、4B表示优选检测分子的图。线性表示(A)。形成二级结构的3’-固定化检测分子的图(B)。反向互补序列段的相互作用导致检测分子的二级结构,其表示为黑色区域,而介质杂交序列表示为斜条纹区域。区域a可具有或不具有PTO修饰。
在优选实施方式中,检测分子由寡核苷酸组成,其细分为多个区域(优选参考图4)。
区域a(=第一区域)包括检测分子的5’-末端,在优选实施方式中,其由序列片段和荧光受体Q组成。区域c是区域a的反向互补序列,并且通过区域b与其隔开。区域d(=第三区域)将区域c和区域e(=第二区域)隔开,其可特异性地与介质分子相互作用。区域f(=第四区域)包括3’-末端序列区域,其优选具有化学修饰,因此允许寡核苷酸的定向固定。荧光供体F通过本领域技术人员熟悉的方式与区域b至区域f的部分相关联,例如区域d。优选地,检测分子具有发卡结构。检测分子的区域a和区域c在反应条件下形成规定的二级结构(根据本发明,是指发卡结构),其中5’-末端与内含序列片段杂交。
图5i)至图5vi)表示酶化介质的优选延长的示意图。i)检测分子存在、固定于固相,并且在反应条件下呈现规定的二级结构。两个合适的荧光修饰F和Q彼此相互作用,从而抑制F的荧光信号。ii)介质可以在规定的位置(介质杂交区域5)与检测分子相互作用,从而iii-iv)利用辅助检测分子(此处为聚合酶)进行酶促延长。如此一来,荧光受体分子Q从检测分子断裂掉,从而恢复荧光染料F的荧光强度。vi)从区域1断裂后,检测分子呈现线性确认,从而介质进一步延长。图5表示的该机制在存在PTO修饰时也发生。
图6表示检测分子中化学修饰的优选位置的示意图。其将潜在的介质延长在规定位置中断的经修饰的核苷酸在合适序列位置被引入至区域1和/或区域2内。
图7表示在固定化检测分子的帮助下进行介质的优选检测。i)检测分子固定在固相上,并且在反应条件下呈现规定的二级结构。两个合适的荧光修饰F和Q彼此相互作用,从而抑制F的荧光信号。3’-末端序列区域未配对,并且起到潜在介质杂交序列的作用(斜条纹区域)。ii)在该规定位置,介质可与检测分子相互作用,iii-iv)利用辅助检测分子(此处为聚合酶)被酶促延长。V)接着荧光受体分子Q从检测分子断裂掉,从而恢复荧光染料F的荧光强度。在合适的时间段之后,通过加热反应溶液来改变反应条件,从而聚合酶和延长的介质从检测分子断开。
图8表示优选的介质探针与检测分子的相互作用。如果未裂解的介质探针与检测分子相互作用,则即使存在合适的辅助检测分子也不会发生酶促延长反应,这是因为其需要介质序列中的3’-OH末端。这就防止发生假阳性信号。另外,可存在3’-末端修饰,以抑制非特异性延长。
图9表示介质探针技术的优选应用领域的示意图。介质探针技术能够检测DNA、转录成cDNA的RNA或与蛋白质相关联的适配子。介质探针的处理可选地可整合到靶分子的扩增步骤(A)中。这显示通过固定化的介质特异性的检测分子进行检测。通过与辅助分子(此处为聚合酶)相互作用,通过介质介导的反应产生检测分子状态的变化(此处为荧光性变化)。
图10表示使用优选介质探针和固定化在反应器皿中的检测分子进行的PCR的规格化荧光斑。试剂中包含靶序列特异性的引物、以及介质探针和各种金黄色葡萄球菌基因组等价物,将该试剂用移液管移至合适的反应器皿内,该反应器皿具有固定化的检测分子并且由合适的密封膜密封。在热循环仪中进行反应,从而在所示循环的分离装置中进行荧光测量。在每个PCR循环中,要扩增的序列段加倍,从而在每个复制步骤中由于介质探针的裂解而产生介质。释放的介质以合适的方式与检测分子相互作用,结果产生可检测的荧光信号。该图显示DNA量与荧光特征之间的相关性。荧光强度规格化为循环1的值(循环37的测量值为假性,因为覆膜上发生浓缩,因此不考虑)。
图11表示优选方法的示意图。步骤A至H示出扩增反应和检测。在此处示出的情况中,核酸靶物同时也是靶分子和模板分子。在变性(B)后,添加介质探针、引物和聚合酶(C)。步骤(D)示出引物延长以及介质探针断裂和探针区域降解。在该步骤中,释放介质区域。接着,介质区域加入(E)到检测分子(=通用报告子)。在步骤(F)中,介质区域被聚合酶延长。可以通过两种该方法进行反淬灭:通过检测分子的5’端的序列降解并释放淬灭自由基(G),或者通过取代5’端并打开发卡状结构(H)。接着在热循环仪中进行所有步骤。
图12表示介质探针PCR和水解探针PCR的各种特性的比较。各种浓度的HAPV18DNA被扩增,并使用没有DNA的对照。将介质探针PCR副本的计算数量在x轴上作图。将水解探针PCR副本的数量在y轴上作图。A显示HPV18检测的LOD或限制。通过概率分析,确定一定数量的输入副本(y轴)发生成功扩增(x轴)的可能性。介质探针的结果为黑线,水解探针的结果为灰线。顶部和底部显示的虚线表示95%CI。(B)中给出了5个不同DNA浓度的体内分析变化。(C)显示5个不同PCR通路中5个DNA浓度的体内分析变化。(D)中的图表示双重PCR的结果。
图13表示利用介质探针PCR和水解探针PCR进行各种靶物的扩增的结果。(A)HPV18,(B)大肠杆菌(E.coli),(C):金黄色葡萄球菌(S.aureus),(D):人类β生物素。
示例性实施方式i)
图9中还示意性图示了示例性的实施方式。可进行的优选核酸检测可以简单解释如下:对于待分析样品中的细菌DNA的检测,检测分子固定于合适的反应器皿中。然而,检测分子还可存在于溶液中。接着,将样品和所需试剂加入到反应器皿中,在95℃的初始温度保持步骤之后,对混合物进行循环加热和冷却。在该过程中,在循环中的规定蚀刻检测反应器皿中的荧光性。下面详细表述该示例性实施方式:
将序列为5'-DABCYL-CCGCAG*A*A*GATGAGATC(dTFAM)GCGGTGTTGGTC-GTAGAGCCCAGAACGATTTTTTTTTTTTTTTTTTTTTT-[C6NH2]-3'(*=硫代磷酸酯)(IBA,哥廷根,德国)的100nM检测分子溶液中的25μL“NucleoLink strips(核连接条带)”(NUNC,兰根塞尔伯尔德,德国,分类号248650),用移液管移至耦合缓冲液(10mM 1-甲基咪唑(1-Meim)(pH7.0)(Sigma-Aldrich,斯坦海姆,德国)和10mM 1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)(Sigma-Aldrich,斯坦海姆,德国)),用ViewSEALTM覆膜(Greiner BioOne,福利肯豪森,德国,分类号676070)密封,并在50封孵育过夜。丢弃上清液,然后用100μL洗涤缓冲液(100mM tris-HCl(pH 7.5)、150mM NaCl、0.1%吐温20(Carl Roth,卡尔斯鲁厄,德国))洗涤微反应器皿,并用25μL 1M的甘氨酸溶液(Carl Roth,卡尔斯鲁厄,德国)在耦合缓冲液中在50℃孵育1小时,然后再次洗涤。
反应器皿中添加有25μL PCR反应混合物(1×Finnzymes DyNamo Flash探针(Finnzymes,分类号F-455)、序列5'-GAGGTAGGAAACTCTGGATCAGGTAT-3'(300nM)(biomers.net,乌尔姆,德国)、5'TCTATTGAAAAACACTCCTATTGGAAGA-3'(300nM)(biomers.net,乌尔姆,德国)的介质探针、序列5'-TCTGGGCTCTACGACCAACAGGTATTCACAGTGGTAAAGGCGGACAACAAGAGCCCAG A-[磷酸根]-3'(200nM)(biomers.net,乌尔姆,德国))的介质探针以及包含剥脱性毒素B位点的各种浓度的金黄色葡萄球菌DNA(NCBI查询编号M17348)。根据DNA浓度,使用4个微反应器皿。反应器皿用ViewSEALTM覆膜密封,并转移到9700热循环仪(Perkin Elmer,马赛诸塞)中。孵育阶段(95℃7分钟)之后,进行循环温度程序(95℃30秒,58℃3分钟),然后,在规定的循环后将反应器皿从热循环仪移除,并且在微量滴定板读取设备Victor2 1420多标记计数器(multi-label counter)(Perkin Elmer,马赛诸塞)的帮助下测量荧光信号。接着,再将反应器皿转移至热循环仪。将单个微反应器皿的荧光值规格化为第一循环的对应值,从而扩增因子可以制定为每个反应器皿的处理循环的函数(参见图10)。
示例性实施方式ii)
在第二实施例中,使用RNA作为靶分子。通过反向转录或通过其他合适的酶体系将RNA转录成cDNA。这个步骤在分离的反应器皿中进行,并且根据示例性实施方式i),将一等份加入到检测反应中。或者,根据示例性实施方式i)在相同的反应器皿中进行反向转录和后续扩增。在该实施例中,一个或多个基因的表达分析主要被考虑作为实验目标。
示例性实施方式iii)
样品中DNA和RNA的平行检测可以通过结合合适的酶体系来进行。如此一来,待测RNA在具有规定的5’序列悬挂物的引物帮助下扩增(参见图9)。用于该检测的介质探针设计为部分结合至序列悬挂物、引物以及延长引物的片段。由于该规定位点,必然只有由RNA产生的cDNA能够通过特定介质探针进行检测,但是RNA被转录的基因组位点不会被检测。为了检测反应批次物中的基因组DNA,使用与该序列排他性互补的介质探针。由此产生的cDNA和基因组DNA的特定片段在接下来进行的扩增反应中扩增,其中位点特异性的介质探针裂解,并且通过合适的检测方法在局部溶解的固定化的检测分子上对介质进行检测。
示例性实施方式iv)
将含有靶分子特异性适配子和待分析样品的试剂置于合适的反应器皿中,其中检测分子以局部溶解的方式固定化(参见图9)或存在于溶液中。待测的靶分子可以是例如蛋白质或肽,但不限于此。适配子结合至靶分子并且改变其结构使得在成功的相互作用之后能够将适配子特异性的介质探针和引物退火。通过使用合适的酶体系处理,退火的引物可以延长,于是介质探针断裂掉。由此释放的介质可以在特定检测分子的帮助下检测。酶扩增处理包括但不限于等温方法。
示例性实施方式v)
在特定实施方式变体中,利用这里描述的方法i)至iv)在一批次中平行检测DNA、RNA和肽和/或前述物质种类的其他组合。该方法包括但不限于等温扩增方法。该实施方式示于图9。
示例性实施方式vi)
不管什么检测类型,反应器皿具有成熟和广泛使用的例如微量滴定板形式(96孔板),由此,可以使用市售的温度调节和读取设备和/或将这两个功能结合的设备。在所有情况中,检测分子以局部溶解的形式(阵列)固定。流动池也可以当做可能的反应器皿,其可选地在进行分析之后进行清洗和再使用。在特别的实施方式中,反应器皿可以是套管,其中检测分子以固定形式存在。反应空间也可以通过使用改性的显微镜载片和合适的框架来界定。该实施方式的有利性质是,现有技术中描述了在合适材料上固定检测分子,并且合适的粘合框架(Peqlab原位粘合框架,Peqlab Biotechnologie,埃朗根,德国)和热可控处理器皿(原位Peqlab PeqStar,Peqlab Biotechnologie,埃朗根,德国)以及读取设备(BioAnalyzer,LaVision BioTec GmbH比勒菲尔德,德国)市售可得。套管的形式没有限定,可选地可以根据用户意愿进行制造。在集成棱镜的帮助下,套管可以传导入射光,集成棱镜用于利用TIRF在整个读数范围激发表面附近的荧光团。进一步,该套管可以与具有温度调节设备和用于激发和检测荧光信号的光学器件的装置组合使用。套管可选地具有微流体结构,例如填充和排放口、有源元件的连接件、混合室、测量室和等分抽样室,通道或结构或可用于其他目的的机构。该系统可以具有泵或其他制动器,借此处理液体。另外,还可以使用其他试剂。
示例性实施方式vii)
根据本发明,使用优选的介质探针实行PCR(另参见图11)。为了进行扩增反应,使用常规的寡核苷酸引物和Taq聚合酶。本发明的介质探针是双功能寡核苷酸,其允许PCR实时检测。为了将本发明与现有技术比较,这些实验可以使用现有技术中的水解探针平行进行。
样品材料
使用来自金黄色葡萄球菌(Genomic Research Laboratory(基因组研究实验室),Prof.Jacques Schrenzel,日内瓦,瑞士)的DNA样品用于该实验。样品包含剥脱性毒素B(基因库查询编号AP003088)的基因组位点。pBR322质粒包括人类乳突病毒18(HPV18)基因组并且GenolD(Budapest,匈牙利)使其可用。大肠杆菌K12DH5_Z1DNA包含与肽聚糖相关的脂蛋白(基因库查询编号65796)的基因组位点,使用基于磁珠的DNA分离试剂盒来分离该大肠杆菌。使用QIAamp DNA血液迷你试剂盒(Qiagen)从全血中分离人类基因组DNA。对于双重PCR反应,使用市售可得的人类DNA(Roche Diagnostics)。将DNA样品在0.2×Tris-EDTA缓冲液中溶解,加入10ng/μL,的鲤鱼精子DNA(Invitrogen)以防止靶DNA非特异性结合到反应器皿上。
寡核苷酸
使用如下的寡核苷酸:
检测分子01:
CCGCAG*A*A*GATGAGATC(dTFAM)GCGGTGTTGGT-
CGTAGAGCCCAGAACGATTTTTTTTTTTTTTTTTTTTT
修饰:5':DABCYL;3':C6NH2
*=硫代磷酸酯
检测分子02:
CCGCAG*A*A*GATGAGATC(dT-
Cy5)GCGGTGTTCACTGACCGAACTGGAGCATTTTTTTTTTTTTTTTTTTTTT
修饰:5':BHQ-2;3':C6NH2
靶物:大肠杆菌K12与肽聚糖相关的脂蛋白(pal基因),基因库查询编号X05123
正向引物:GGCAATTGCGGCATGTTCTTCC
反向引物:TGTTGCATTTGCAGACGAGCCT
水解探针:ATGCGAACGGCGGCAACGGCAACATGT
修饰:5':6-FAM;3':BHQ-1
介质探针:
AATCGTTCTGGGCTCTACGCGAACGGCGGCAACGGCAACATGT
修饰:3':PH
靶物:金黄色葡萄球菌剥脱性毒素B
正向引物:AGATGCACGTACTGCTGAAATGAG
反向引物:AATAAAGTACGGATCAACAGCTAAAC
水解探针:CCGCCTACTCCTGGACCAGG
修饰:5':6-FAM;3':BBQ
介质探针:
AAATCGTTCTGGGCTCTACGGTATTCACAGTGGTAAAGGC-
GGACAACA
修饰:3':PH
靶物:HPV18基因库查询编号NC_001357.1
正向引物:GCTGGCAGCTCTAGATTATTAACTG
反向引物:GGTCAGGTAACTGCACCCTAA
水解探针:GGTTCCTGCAGGTGGTGGCA
修饰:5':6-FAM;3':BHQ-1
介质探针:AATCGTTCTGGGCTCTACGGTTCCTGCAGGTGGTGGCA
修饰:3':PH
靶物:智人ACTB基因库查询编号AC_000068.1/HGNC:132
正向引物:TCACCCACACTGTGCCCATCTACGA
反向引物:CAGCGGAACCGCTCATTGCCAATGG
水解探针01:ATGCCCTCCCCCATGCCATCCTGCGT
修饰:5':6-FAM;3':DDQ-1
水解探针02:ATGCCCTCCCCCATGCCATCCTGCGT
修饰:5'Cy5;3':DDQ-2
介质探针01:
AATCGTTCTGGGCTCTACGCCCTCCCCCATGCCATCCTGCGT
修饰:3':PH
介质探针02:
ATGCTCCAGTTCGGTCAGTGCCCTCCCCCATGCCATCCTGCGT
修饰:3':PH
所有修饰的寡核苷酸利用HPLC纯化。
介质探针的设计进行两步处理。探针区域和介质区域以核苷酸重叠。因此,探针区域的5’端必须与介质区域的3’端匹配。在本实施方式中,将鸟嘌呤核苷酸用于该用途。探针区域根据开发水解探针的方针进行设计:长度25-30个核苷酸,探针熔解温度5-10℃且大于引物的熔点)。设计介质区域,使得该区域不具有与靶物的任何同源性。用磷酸基团封闭3’-末端以防止介质探针的延长。
检测分子的设计在硅中制造,以获得带有未配对单链3’种的发卡状结构。通过RNA折叠来进行关于二级结构的预测,使用VisOMP(Visual Oligonucleotide ModelingProgram,可视寡核苷酸建模程序)计算熔点。对于二级结构,在“高级折叠”选项中选择“无悬挂末端能量”、“DNA设置”、“60℃”。链(GC含量71%)的熔点是71.4℃,使得能够在每个热循环期间、在冷却步骤(60℃)中再折叠。折叠的结构提供FRET对,这种对位于空间上相互接近的两条封闭链上。FRET对包括5’末端淬灭剂,并且选择内部荧光团以实现高淬灭效率。3’未配对的链包括介质区域的结合位点,其与介质区域反向互补。为了防止检测分子的延长,所述3’末端用氨基堵塞。设计第二检测分子用于双重PCR实验,其中具有与第一检测分子的序列相同的序列,但是使用了经修饰的介质结合位点和另一FRET对。
淬灭效率
为了允许高淬灭效率和检测特别少量核酸时的分析物灵敏性,合适的荧光团染料和淬灭剂自由基的选择尤其重要。为了确定淬灭效率,对于每个双标记水解探针和检测分子确定荧光发射量,其中使用以及不使用DNase(脱氧核糖核酸酶)I处理。淬火效率(Eq)确定如下:
Eq=1-(I未消化/I消化)×100
其中,I未消化是未消化样品的荧光发射量,I消化是用DNaseI处理的样品的荧光发射量。
介质探针PCR和水解探针PCR实验
介质探针PCR反应批次物包含1×PCR缓冲液(GenolD,布达佩斯,匈牙利)、0.1U/μLHot StarTaq加聚合酶(Qiagen)、200μmol/L脱氧核苷酸(Qiagen)、300nmol/L检测分子(由IBA合成)、300nmol/L靶向特异性引物对和200nmol/L介质探针(通过biomers.net合成)。水解探针PCR反应批次物包含相同量的试剂,但不包括介质探针,介质探针被水解探针(200nmol/L,通过biomers.net合成)替代。进一步,不添加检测分子。接着,将DNA模板分子添加到两个批次(在阴性对照中,替代性地添加相同量的H2O)。反应体积是10μ0。
所有实时PCR反应在Corbett Rotor Gene 6000(Corbett Research Pty,现在的Qiagen GmbH)中进行,采用以下的通用热循环参数:
初始聚合酶活化:95℃,5分钟
45个循环,其中在95℃变形15
结合的退火和延长步骤,60℃,45秒
在每个延长步骤结束时执行荧光信号。使用Rotor Gene 6000软件(版本1.7.87)进行数据分析。
统计分析
HPV18检测的检测限(LOD)通过以下来确定:
扩增各种DNA浓度(每个反应104,103,5×102,102,5×101,101,100和10-1个副本)。确定每个DNA浓度的正性扩增的量。利用SPSS(Statistical Package for SocialSciences(社会科学统计软件包),版本19,IBM)进行的概率分析使得能够推测每个反应的副本数量,正性扩增的结果是95%的概率。
结果
淬灭效率
所有荧光分子的荧光发射量在降级中与未消解探针相比增加。特定水解探针的观测Eq值介于54.5%(3.1%)[Cy5/2,3-二氯-5,6-二氰基-1,4-苯醌-2(DDQ-2)]和92.7%(0.5%)[FAM/二叔丁基氢醌-1(BHQ-1)]之间。然而,检测分子的淬灭效率介于83.7%(1.4%)(Cy5/BHQ-2)和90.9%(0.4%)(FAM/Dabcyl)之间。这些结果对应于优化条件下的FAM/Dabcyl(80-91%)、FAM/BHQ-1(88-93%)和Cy5/BHQ-2(91-96%)的Eq值。
在本实验中,介质探针PCR与水解探针PCR相比较。首先,分析反应效率、LOD、分析间差异、分析内差异和双重性质。对于这些实验,使用两种技术平行进行不同浓度HPV18DNA(每个反应102、103、104、105和106个副本,除非另有描述)的扩增。然后,使用两种技术平行进行不同靶物的扩增。
LOD(检测限)
根据DNA浓度,产生95%概率的正性扩增,从而确定LOD。概率分析显示分析灵敏度为,介质探针PCR是每个反应78.3个副本(95%CI:每个反应47.0-372.5个副本),水解探针PCR是每个反应85.1个副本(95%CI:每个反应55.7-209.4个副本)(图12A)。
分析内差异
HPV18DNA稀释系列物(每个反应102,103,104,105个副本)的5个浓度进行8个重复的扩增。R2值为0.975(介质探针PCR)和0.983(水解探针PCR),表明优异的线性性质(图12B)。每个反应102-106个副本的扩增的CV百分比是55.1%-9.9%(介质探针PCR)和38.3%-10.7%(水解探针PCR)。准确率的范围是+21.6%至-8.1%(介质探针PCR)和+19.4%至-9.8%(水解探针PCR)。
分析间差异
使用分别准备的5个批次物用于HPV18DNA稀释系列物(每个反应102,103,104,105个副本)的5个浓度的扩增。每个浓度准备三次。R2值为0.940(介质探针PCR)和0.954(水解探针PCR),表明扩增的线性性质(图12C)。每个反应102-106个副本数量的分析间差异介于25%到8.7%之间(介质探针PCR)和介于34.7%和12.7%之间(水解探针PCR)。准确率的范围是+3.4%至-7%(介质探针PCR)和-2%至-12.4%(水解探针PCR)。
双重扩增
包含HPV18DNA的质粒的片段(102,103,104,105和106个原始副本)与300个副本的智人基因组共扩增。在一式三份的批次中进行各个反应。用于HPV18的水解探针用FAM/BHQ-1标记,β肌动蛋白(ACTB)探针用Cy5/DDQ-2标记。对于双重PCR,检测分子01被FAM/Dabcyl标记并且检测分子02被Cy5/BHQ-2标记。图12D显示了不同DNA浓度的HPV18扩增,分别对于介质探针PCR(R2=0.998)和水解探针PCR(R2=0.998)。计算ACTB值不能仅进行计数,因为在双重实验中仅使用了一种浓度。对于介质探针PCR和水解探针PCR,在红色通道中以0.02的阈值确定循环值(定量周期;Cq)。对于介质探针PCR和水解探针PCR,共扩增的ACTB和HPV18DNA样品的平均Cq值为33.0(0.5)和31.8(0.4)。
各种靶物
介质探针PCR的共同性质通过使用四个与临床相关的靶物测试来显示。为了比较,将水解探针PCR平行引导向每个引物。对于每个靶物和每种扩增技术,确定输入与计算输出的副本数量之间的线性关系(图13)。HPV18L1基因(介质探针PCR R2=0.999/水解探针PCRR2=0.975)、金黄色葡萄球菌剥脱性毒素B基因(0.991/0.988)、大肠杆菌的与肽聚糖相关的脂蛋白(E.coli pal)基因(0.996/0.988)和人类β肌动蛋白基因(0.991/0.993)的稀释序列物检测结果显示出两种PCR方法的高度相关。
讨论:
此处显示的该试验的优异特性是,解除扩增与荧光检测的耦合,使得能够使用标准的检测分子。介质区域和检测分子的序列在硅上设计,并且根据BLAST检索,没有显示与靶物的相关性。检测分子具有发卡状二级结构,从而呈现最佳的FRET淬灭条件[>90%(FAM/Dabcyl),>80%(Cy5/BHQ-2)]。荧光团与淬灭剂在发卡状结构中空间接近,导致高且恒定的淬灭效率。与此处显示的结果相反,现有技术的FAM标记的水解探针通常得到60%至93%的淬灭效率,取决于不同的淬灭自由基和供体与受体之间的距离。Cy5/DDQ-2标记的水解探针具有仅为55%的低Eq值。
选择HPV18DNA的扩增作为模板分析,从而将新的介质探针与现有技术中最标准的水解探针彼此进行比较。
对于两种探针,使用概率分析来确定LOD(介质探针:每个反应78.3个副本;水解探针:每个反应85.1个副本)。对于每个反应102至106个副本,分析间和分析内差异为相同数量级(介质探针25%-8.7%,55.1%-9.9%;水解探针34.7%-12.7%,38.3%-10.7%)。
在各种PCR试验中,将延长时间减少50秒至60秒不会对定量产生负面影响。这些结果显示介质探针PCR适于快速循环方案,其能够利用最新的实时热循环仪来实施。
设计带有不同杂交序列的两个不同检测分子和FRET修饰。这些报告系统能够检测任何靶基因的组合,其中这些系统降低了成本,并且能够用于常规诊断检测。因此成功证明了不同量HPV18DNA的共扩增和ACTB的恒定副本数量。
Claims (20)
1.一种用于检测至少一种靶分子的用于非诊断目的的方法,包括一种系统,所述系统包括介质探针和检测分子,所述介质探针用于检测至少一种靶分子且包括探针区域和介质区域,其特征在于,所述介质探针是寡核苷酸,所述探针区域位于所述寡核苷酸的3’-末端,并且所述介质区域位于所述寡核苷酸的5’-末端,其中在所述区域之间存在化学、生物和/或物理裂解位点,并且所述探针区域具有对于模板分子的亲和性,而所述介质区域具有另外的对于检测分子的亲和性,并且其中在所述模板分子的扩增过程期间所述介质探针在所述裂解位点裂解,并且裂解的介质区域与所述检测分子的相互作用触发可检测信号,
所述检测分子的特征在于,所述检测分子是寡核苷酸且具有至少下述区域:
a.位于所述检测分子的5’-末端的第一区域,其具有荧光受体和荧光供体中的一个,
b.第二区域,其与所述介质区域相互作用,和
c.第三区域,其具有荧光供体和荧光受体中的另一个,
所述方法包括下述步骤:
I.将所述介质探针的探针区域结合至所述模板分子和/或所述靶分子的序列;
II.借助辅助分子扩增所述模板分子和/或所述靶分子;
III.在步骤II期间利用所述辅助分子使所述介质探针在所述裂解位点裂解,其中所述辅助分子是带有5’核酸酶活性的聚合酶;以及
IV.将所述介质探针的裂解的介质区域结合至所述检测分子,其中所述介质区域的3’-末端结合至所述第二区域,
V.通过聚合酶将结合至所述检测分子的第二区域的所述介质区域进行酶促延长,其中所述聚合酶结合至结合后的介质区域的3’-末端。
2.根据权利要求1所述的方法,其特征在于,使所述介质探针断裂掉诱导所述介质探针的至少一个区域的物理和/或化学性质的变化,所述物理和/或化学性质选自以下性质的组:分子量;酶活性;亲和性或亲合力;化学反应性;化学基团的存在;导电性、极性或电荷;和/或光吸收和光发射。
3.根据权利要求1所述的方法,其特征在于,所述介质区域结合至所述检测分子的所述第二区域。
4.根据权利要求1至3中任一项所述的方法,其特征在于,所述辅助分子选自下列分子的组:催化剂、天然物质、细胞裂解物、细胞成分和/或合成分子。
5.根据权利要求1至3中任一项所述的方法,其特征在于,所述辅助分子选自下列分子的组:蛋白质和/或核酸。
6.根据权利要求1至3中任一项所述的方法,其特征在于,所述辅助分子为酶。
7.根据权利要求1至3中任一项所述的方法,其特征在于,所述辅助分子为酶体系。
8.根据权利要求1至3中任一项所述的方法,其特征在于,所述辅助分子是来自核酸扩增系统和/或限制酶系统的分子。
9.根据权利要求1至3中任一项所述的方法,其特征在于,所述模板分子和/或所述靶分子的扩增是通过PCR来完成。
10.根据权利要求1至3中任一项所述的方法,其特征在于,所述模板分子和/或所述靶分子的扩增是通过实时PCR来完成。
11.根据权利要求1至3中任一项所述的方法,其特征在于,所述检测分子由于与所述介质区域发生直接或间接的相互作用从而被修饰,所述修饰选自二级结构的变化;荧光性、磷光性、质量、吸收性、光散射、导电性、酶活性和/或亲和性的变化。
12.根据权利要求3所述的方法,其特征在于,由于所述介质区域与所述检测分子的第二区域的直接或间接的相互作用,所述检测分子中发生物理或化学上可测量的变化。
13.根据权利要求1至3中任一项所述的方法,其特征在于,序列特异性或非序列特异性荧光探针和/或显色探针或荧光染料与所述介质探针和/或所述检测分子的至少一个区域相互作用。
14.根据权利要求1至3中任一项所述的方法,其特征在于,所述检测分子利用至少一种辅助检测分子通过与所述介质区域的相互作用而被修饰,所述修饰选自裂解;消化;链加倍;内部杂交;磷酸化;去磷酸化;酰胺化;化学基团的结合或裂解;或荧光性、磷光性或化学发光性的变化。
15.根据权利要求1至3中任一项所述的方法,其特征在于,所述检测分子具有发卡状结构并且在所述5’-末端区域和/或在所述发卡状结构内具有至少一处荧光修饰,在与所述介质区域反应后,所述荧光修饰利用辅助检测分子而从所述检测分子断裂掉,和/或所述检测分子的所述发卡状结构的5’-末端被移除,和/或所述发卡状结构被打开,并且在所述检测分子上检测到荧光信号的变化。
16.根据权利要求1至3中任一项所述的方法,其特征在于,至少一种靶分子是RNA,并且所述RNA反转录成cDNA,其中所述cDNA为所述模板分子。
17.根据权利要求1至3中任一项所述的方法,其特征在于,将具有序列粘性末端的引物用于转录反应,并且所述介质探针的所述探针区域结合至包含cDNA和粘性末端序列的区域。
18.根据权利要求1至3中任一项所述的方法,其特征在于,至少一种靶分子是肽或蛋白质,并且所述模板分子是适配子,其中所述适配子结合至所述肽或所述蛋白质,并且结合位点是所述介质探针的所述探针区域可到达的。
19.权利要求1至18中任一项所述的方法在检测混合物中的一种或多种相似或不同的生物分子中的用途。
20.根据权利要求19所述的用途,其特征在于,所述检测分子在3’-末端区域具有化学保护性基团,其在与所述介质区域反应后利用限制酶从所述检测分子断裂掉,并且生成3’-末端OH基团。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102011055247.2 | 2011-11-10 | ||
| DE102011055247A DE102011055247A1 (de) | 2011-11-10 | 2011-11-10 | Multianalyt-Reportersystem |
| PCT/EP2012/072402 WO2013079307A1 (de) | 2011-11-10 | 2012-11-12 | Bifunktionale oligonukleotidsonde zur universellen echtzeit multianalytdetektion |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN103946397A CN103946397A (zh) | 2014-07-23 |
| CN103946397B true CN103946397B (zh) | 2021-03-16 |
Family
ID=47324049
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201280055550.2A Active CN103946397B (zh) | 2011-11-10 | 2012-11-12 | 用于通用实时多重分析检测的双功能寡核苷酸探针 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US11293053B2 (zh) |
| EP (1) | EP2776585B8 (zh) |
| JP (1) | JP6265905B2 (zh) |
| CN (1) | CN103946397B (zh) |
| CA (1) | CA2854427A1 (zh) |
| DE (1) | DE102011055247A1 (zh) |
| ES (1) | ES2698903T3 (zh) |
| IN (1) | IN2014DN04645A (zh) |
| WO (1) | WO2013079307A1 (zh) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102012100824A1 (de) | 2012-02-01 | 2013-09-05 | Albert-Ludwigs-Universität Freiburg | Gemultiplexte Digital PCR |
| US20150031577A1 (en) * | 2012-03-20 | 2015-01-29 | UNIVERSITé LAVAL | Nucleic acid detection method comprising target specific indexing probes (tsip) comprising a releasable segment to be detected via fluorescence when bound to a capture probe |
| US20140272959A1 (en) * | 2013-03-14 | 2014-09-18 | President And Fellows Of Harvard College | Methods of Hybridizing Probes to Genomic DNA |
| EP3011056B1 (en) * | 2013-06-19 | 2019-03-06 | Luminex Corporation | Real-time multiplexed hydrolysis probe assay |
| EP3034619B1 (de) * | 2014-12-16 | 2018-10-17 | microBIOMix GmbH | Modifizierte Oligonukleotide und Verfahren zum Einschleusen von Primern oder Kontrollmolekülen oder Sonden in geschlossene PCR-Systeme |
| KR20170116157A (ko) * | 2015-02-18 | 2017-10-18 | 싱귤러 바이오, 인코포레이티드 | 단일분자 검출용 분석 및 그의 용도 |
| KR101875662B1 (ko) | 2015-12-01 | 2018-08-02 | 에스디 바이오센서 주식회사 | 등온 핵산 증폭을 위한 리포터 염료, 퀀처가 포함되는 등온 기반 이중 기능성 올리고뉴클레오타이드 및 이를 이용한 핵산 증폭과 측정 방법 |
| CN107024583B (zh) * | 2016-01-29 | 2019-03-08 | 中国科学院苏州纳米技术与纳米仿生研究所 | 硫黄素t适配体、其筛选方法及应用 |
| BR112019012925A2 (pt) * | 2016-12-23 | 2019-12-10 | Albert-Ludwigs-Universität Freiburg | sonda mediadora em duas partes |
| CN108823287B (zh) | 2017-04-28 | 2019-04-12 | 厦门大学 | 一种检测靶核酸序列的方法 |
| GB201713251D0 (en) * | 2017-08-18 | 2017-10-04 | Lgc Genomics Ltd | Methods and kits for detection of nucleic acid molecules |
| CN111100935B (zh) * | 2018-10-26 | 2023-03-31 | 厦门大学 | 一种细菌耐药基因检测的方法 |
| WO2022090521A1 (en) * | 2020-10-29 | 2022-05-05 | Biocartis Nv | Generic cartridge and method for multiplex nucleic acid detection |
| CN116356075A (zh) * | 2021-12-27 | 2023-06-30 | 迈克生物股份有限公司 | 一种用于检测的引物探针、引物探针组及其应用 |
| EP4265734A1 (de) | 2022-04-22 | 2023-10-25 | Hahn-Schickard-Gesellschaft für angewandte Forschung e.V. | Nukleinsäurenachweis in einer pcr mittels eines zielsequenz-unspezifischem modularer reporterkomplexes |
| WO2023203230A1 (de) | 2022-04-22 | 2023-10-26 | Hahn-Schickard-Gesellschaft Für Angewandte Forschung E. V. | Nukleinsäurenachweis in einer pcr mittels eines zielsequenz-unspezifischem modularer reporterkomplexes |
| WO2023203227A1 (de) | 2022-04-22 | 2023-10-26 | Hahn-Schickard-Gesellschaft Für Angewandte Forschung E. V. | Pcr-multiplexing durch zielsequenz-unabhängige-reportermoleküle mit unterscheidbaren signalstärken |
| EP4265735A1 (de) | 2022-04-22 | 2023-10-25 | Hahn-Schickard-Gesellschaft für angewandte Forschung e.V. | Pcr-multiplexing durch zielsequenz-unabhängige-reportermoleküle mit unterscheid-baren signalstäken |
| EP4372100A1 (en) | 2022-11-15 | 2024-05-22 | Stilla Technologies | Data analysis method for multiplex digital pcr using color-combination |
| CN117144067A (zh) * | 2023-10-31 | 2023-12-01 | 中国医学科学院北京协和医院 | 用于多重化核酸检测的组合物和方法 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4751177A (en) * | 1985-06-13 | 1988-06-14 | Amgen | Methods and kits for performing nucleic acid hybridization assays |
| US5846708A (en) | 1991-11-19 | 1998-12-08 | Massachusetts Institiute Of Technology | Optical and electrical methods and apparatus for molecule detection |
| US6099803A (en) | 1994-07-07 | 2000-08-08 | Nanogen, Inc. | Advanced active electronic devices for molecular biological analysis and diagnostics |
| US5641658A (en) | 1994-08-03 | 1997-06-24 | Mosaic Technologies, Inc. | Method for performing amplification of nucleic acid with two primers bound to a single solid support |
| GB9615516D0 (en) * | 1996-07-24 | 1996-09-04 | Jsd Tech Ltd | Bacillus cereus |
| WO2000042209A1 (en) | 1999-01-15 | 2000-07-20 | Ljl Biosystems, Inc. | Methods and apparatus for detecting polynucleotide hybridization |
| US6238869B1 (en) | 1997-12-19 | 2001-05-29 | High Throughput Genomics, Inc. | High throughput assay system |
| US6300070B1 (en) | 1999-06-04 | 2001-10-09 | Mosaic Technologies, Inc. | Solid phase methods for amplifying multiple nucleic acids |
| EP1194592B1 (en) * | 1999-07-14 | 2008-09-24 | Packard Bioscience Company | Derivative nucleic acids and uses thereof |
| US6380377B1 (en) * | 2000-07-14 | 2002-04-30 | Applied Gene Technologies, Inc. | Nucleic acid hairpin probes and uses thereof |
| AU2002246612B2 (en) * | 2000-10-24 | 2007-11-01 | The Board Of Trustees Of The Leland Stanford Junior University | Direct multiplex characterization of genomic DNA |
| US20040014078A1 (en) * | 2002-02-06 | 2004-01-22 | James Xia | Compositions and methods for rolling circle amplification |
| GB0230238D0 (en) * | 2002-12-28 | 2003-02-05 | Fu Guoliang | Combined exponential and linear amplification |
| DE10316159A1 (de) | 2003-04-09 | 2004-10-28 | Klapproth, Holger, Dr. | 5`-3`-Exonuklease Assay zur Bestimmung der Konzentration von Nukleinsäuren |
| JP5520449B2 (ja) | 2007-03-06 | 2014-06-11 | 株式会社ビー・エム・エル | 核酸の検出方法 |
| BRPI0908748A2 (pt) | 2008-03-15 | 2015-07-28 | Hologic Inc | Composições e métodos para análise de moléculas de ácido nucleico durante reações de amplificação |
| MX2017015093A (es) | 2011-01-11 | 2023-03-10 | Seegene Inc | Detección de secuencias de ácido nucleico objetivo mediante ensayo de escisión y extensión del pto. |
-
2011
- 2011-11-10 DE DE102011055247A patent/DE102011055247A1/de not_active Withdrawn
-
2012
- 2012-11-12 CA CA2854427A patent/CA2854427A1/en not_active Abandoned
- 2012-11-12 US US14/357,574 patent/US11293053B2/en active Active
- 2012-11-12 WO PCT/EP2012/072402 patent/WO2013079307A1/de active Application Filing
- 2012-11-12 JP JP2014540506A patent/JP6265905B2/ja active Active
- 2012-11-12 CN CN201280055550.2A patent/CN103946397B/zh active Active
- 2012-11-12 EP EP12798176.9A patent/EP2776585B8/de active Active
- 2012-11-12 ES ES12798176T patent/ES2698903T3/es active Active
- 2012-11-12 IN IN4645DEN2014 patent/IN2014DN04645A/en unknown
Non-Patent Citations (3)
| Title |
|---|
| IN SITU AMPLIFICATION USING UNIVERSIAL ENERGY TRANSFER-LABELED PRIMERS;NUOVO G J ET AL;《JOURNAL OF HISTOCHEMISTRY AND CYTOCHEMISTRY,HISTOCHEMICAL SOCIETY,NY》;19990301;第47卷(第3期);第273-279页 * |
| Sensitive detection of DNA polymorphism by the serial invasive signal amplification reaction;HALL J G ET AL;《PNAS》;20000718;图1以及第8272-8273页 * |
| Universal molecular beacon-based tracer system for real-time polymerase chain reaction;LI X ET AL;《ANANLYTICAL CHEMISTRY,AMERICAN CHEMICAL SOCIETY》;20061115;第7886-7890页 * |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2854427A1 (en) | 2013-06-06 |
| US11293053B2 (en) | 2022-04-05 |
| EP2776585B1 (de) | 2018-08-22 |
| EP2776585A1 (de) | 2014-09-17 |
| JP6265905B2 (ja) | 2018-01-24 |
| CN103946397A (zh) | 2014-07-23 |
| JP2014533107A (ja) | 2014-12-11 |
| DE102011055247A1 (de) | 2013-05-16 |
| US20140315747A1 (en) | 2014-10-23 |
| ES2698903T3 (es) | 2019-02-06 |
| IN2014DN04645A (zh) | 2015-05-08 |
| WO2013079307A1 (de) | 2013-06-06 |
| EP2776585B8 (de) | 2019-04-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103946397B (zh) | 用于通用实时多重分析检测的双功能寡核苷酸探针 | |
| US7851148B2 (en) | Method and kit for primer based multiplex amplification of nucleic acids employing primer binding tags | |
| JP5099920B2 (ja) | 核酸試験用対照 | |
| US11993804B2 (en) | Generic sample preparation | |
| EP2007901B1 (en) | Rapid genotyping analysis and the device thereof | |
| US20120107820A1 (en) | Multiplexed Quantitative PCR End Point Analysis of Nucleic Acid Targets | |
| SE516272C2 (sv) | Metoder och kit för analytdetektion mha proximitets-probning | |
| WO2009007438A1 (en) | Method for the simultaneous detection of multiple nucleic acid sequences in a sample | |
| US20100086918A1 (en) | Methods for High Sensitivity Detection of Genetic Polymorphisms | |
| JP2022145606A (ja) | 核酸の正確な並行定量のための高感度な方法 | |
| KR102323375B1 (ko) | 다중 프로브 | |
| JP5916740B2 (ja) | 核酸標的の定量的多重同定 | |
| EP2598653B1 (en) | Generic pcr | |
| EP1426448A1 (en) | Method for lowering the effects of sequence variations in a diagnostic hybridization assay, probe for use in the assay and assay | |
| US20160230208A1 (en) | Generic PCR | |
| Santiago-McRae et al. | Rapid Nucleic Acid Reaction Circuits for Point-of-care Diagnosis of Diseases | |
| US20140073530A1 (en) | Rapid Genotyping Analysis and the Method Thereof | |
| Kamau-Gatogo | Development of RNA microchip for pathogen and cancer direct detection | |
| Razdan et al. | Diagnosis of Medically Important Viruses: A Molecular Approach |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |