CN102753199A - 癌干细胞标记物及其用途 - Google Patents
癌干细胞标记物及其用途 Download PDFInfo
- Publication number
- CN102753199A CN102753199A CN2011800065922A CN201180006592A CN102753199A CN 102753199 A CN102753199 A CN 102753199A CN 2011800065922 A CN2011800065922 A CN 2011800065922A CN 201180006592 A CN201180006592 A CN 201180006592A CN 102753199 A CN102753199 A CN 102753199A
- Authority
- CN
- China
- Prior art keywords
- cell
- stem cell
- cancer
- cancer stem
- tumor associated
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57469—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving tumor associated glycolinkage, i.e. TAG
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70596—Molecules with a "CD"-designation not provided for elsewhere in G01N2333/705
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Hematology (AREA)
- Medicinal Chemistry (AREA)
- Oncology (AREA)
- Urology & Nephrology (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Hospice & Palliative Care (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Physics & Mathematics (AREA)
- Microbiology (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
本发明尤其与这样的处理方法相关,其基于特异性结合肿瘤相关的糖抗原的试剂用于处理癌干细胞及相关疾病的用途。还提供了使用肿瘤相关的糖抗原作为癌干细胞标记物的诊断及预后方法。
Description
本发明尤其与这样的处理方法相关,其基于特异性结合肿瘤相关的糖抗原的试剂用于处理癌干细胞及相关疾病的用途。还提供了使用肿瘤相关的糖抗原作为癌干细胞标记物的诊断及预后方法。
发明背景
肿瘤可视为由致瘤性癌细胞起始的异常器官,此过程需要通过积累的突变产生无限增殖的能力。在将肿瘤视为异常器官的理解中,可应用正常干细胞生物学的原理以更好地理解肿瘤是如何发展及扩散的。许多发现表示将正常干细胞和致瘤性细胞之间进行类比是恰当的。正常干细胞与致瘤性细胞二者都具有很强的增殖潜力并能够产生新的(正常或异常)组织。致瘤性细胞可被视为癌干细胞(CSC)或癌起始细胞(CIC——在本文中术语CSC与CIC作为同义词使用),其与正常干细胞类似地经历了异常及调控不良的器官发生过程。肿瘤和正常组织都由杂合组合的细胞组成,具有不同表型特征及不同扩增潜力的。
癌干细胞被认为是具有干细胞样特性的肿瘤的特定部分,其起始并维持了瘤克隆。这些细胞具有自我更新的能力,但是也形成了产生表型多样的癌细胞但具有较低致瘤性潜能的祖细胞。与并非癌干细胞的肿瘤细胞相比,这种干细胞样细胞的亚群在肿瘤形成和转移性肿瘤扩散方面是高效的。
已经在广泛多种癌症,包括白血病、成胶质细胞瘤、髓母细胞瘤以及几乎所有类型的上皮肿瘤(癌)中鉴定出癌干细胞(CSC)。
现在已经广泛接受了癌干细胞(CSC)通常为癌症发生的前提条件这一理论。癌干细胞表现出低的增殖速率、高的自我更新能力、倾向于分化成活跃增殖的肿瘤细胞,并显示出对化疗或放疗的抗性(参见例如,Van der Griend等人,2008)。
可根据对原发性肿瘤内不同表面标记物形式的研究来表征癌干细胞。在数目不断增加的建议CSC标记物中,最显著并最为接受而且也在不同肿瘤类型的CSC中广泛分布的有两种:CD44和CD133。有报道称CD44为癌干细胞的强标记物(Chu等人,2009;Takaishi等人2009)。来自结肠肿瘤的单个CD44+细胞可在体外形成球体并能够产生类似于原发性肿瘤特性的异种移植瘤(Du等人,2008)。CD133也是癌干细胞的标记物。一开始CD133被描述为特异性针对人造血干细胞的表面抗原以及小鼠神经上皮及几种其他胚胎上皮的标记物(Singh等人2004)。在大量的近期研究中,将CD133单独或与其他标记物联合用于从结肠、肺和肝脏的恶性肿瘤中分离癌干细胞(Haraguchi等人,2008)。CD133+肿瘤细胞比CD133-肿瘤细胞更能有效地修复放射性诱导的DNA损伤(Bao等人,2006)。
癌干细胞的存在对于癌症治疗有深远的意义。现有的疗法大部分是针对肿瘤细胞的大块群体而研发的,因为这些疗法是通过其缩小肿瘤实质的能力鉴定的。然而,癌干细胞经常对化疗有抗性并能使化疗失败(Sell等人,2008)。为设计(也)靶向癌起始细胞(本文中也称为癌干细胞)的治疗试剂,需要寻找优选地在良性肿瘤和/或正常非肿瘤细胞中不存在的癌干细胞的分子靶标,同时此靶标特异性针对癌干细胞。预期这些试剂对肿瘤(尤其是转移肿瘤)产生更持久的应答及疗效。因此,需要新的癌干细胞标记物以提供新型治疗性靶标以改进疗法。大多数已知的干细胞标记物为蛋白质。也已经发现其中多数为正常干细胞标记物,因此在非肿瘤干细胞上表达。这使得其不适合或不那么适合作为治疗性靶标。目前,正常和癌干细胞之间没有非常明显的区别。
因此,非常需要能够鉴定其它合适的癌干细胞标记物,和使用这些标记物用于诊断和预后方法和/或发展靶向癌干细胞的疗法。
发明概述
本发明基于肿瘤相关糖抗原为合适的癌干细胞标记物这一发现。因为几乎所有迄今描述的癌干细胞标记物都为蛋白质,因此发现肿瘤相关糖抗原如CD176、CD174和CD173表达于癌干细胞这一点很出乎意料。因此,这些肿瘤相关糖抗原为用于癌干细胞的合适的标记物,进一步地,其提供攻击癌干细胞的疗法的合适的治疗性靶标。
根据本发明的第一方面,提供了特异性结合肿瘤相关糖抗原的结合试剂,用于处理表达所述肿瘤相关糖抗原的癌干细胞。还提供了药物组合物,其包含用于处理表达所述肿瘤相关糖抗原的癌干细胞的相应结合试剂。
根据第二方面,提供了用于鉴定包含对用特异性结合肿瘤相关糖抗原的结合试剂的处理易感的癌干细胞的癌的方法,其中所述处理对癌干细胞有效,所述方法确定获自患者的癌样品是否含有表达由结合试剂特异性针对的肿瘤相关糖抗原的癌干细胞,其中癌干细胞上所述肿瘤相关糖抗原的存在表示此癌对用特异性结合所述肿瘤相关糖抗原的结合试剂进行的处理易感,其中所述处理对癌干细胞有效。
根据第三方面,提供了对癌进行诊断、分期和/或预后和/或其对处理的易感性进行监视的方法,包括分析分离自患者的样品中细胞上肿瘤相关糖抗原表达的步骤,其中表达肿瘤相关糖抗原的细胞的存在表示所述样品中存在癌干细胞。
根据第四方面,提供了哺乳动物癌干细胞的组合物,其中组合物中至少50%、优选地至少75%的细胞为癌干细胞,其表达肿瘤相关糖抗原。根据相关的方面,提供了用于分离干细胞的方法,包括对表达肿瘤相关糖抗原的癌干细胞进行选择性的富集。
根据第五方面,提供了用于根据本发明的方法的试剂盒,包括特异性结合肿瘤相关糖抗原的结合试剂以及用于根据本发明的方法的说明书。
根据第六方面,提供了就表达肿瘤相关糖抗原的癌干细胞的有效性,筛选候选治疗试剂例如化疗试剂或其他抗癌药物的方法,所述方法包括:
a.将所述试剂与根据本发明的细胞组合物相接触,以及
b.确定所述试剂针对所述肿瘤相关糖抗原阳性的癌细胞的有效性。
本领域技术人员从以下说明和附随的权利要求中了解本发明的其他目标、特征、优点及方面。然而,要理解的是以下描述、附随的权利要求及具体实施例代表本申请优选的实施方式,是以说明的方式给出的。本领域技术人员在阅读以下内容后会清楚公开的发明的精神和范围内的多种变化和修饰。
定义
如本文所使用的,以下词句除了在使用其的上下文中有另有说明外,一般优选地意欲具有如下文提出的意义。
“结合试剂”可以为任何能够结合靶标物质如肿瘤相关糖抗原的化合物或化合物复合体。优选地,结合试剂能够特异性结合靶标物质。通过筛选结合试剂库以鉴定/获得结合靶标物质的结合试剂来获得合适的结合试剂。各结合试剂库的实例为例如展示有结合试剂的噬菌体或噬菌粒的库。用于在体外获得例如抗体的方法也在Hudson和Souriau(Hudson,P.J.and Souriau,C.(2003)"Engineered antibodies"Nat.Med.9,129-134)中有描述。
只要其能识别和结合靶标物质,在本文中是肿瘤相关糖抗原,结合试剂可以具有任何结构。结合试剂可选自抗体、其抗原结合片段或衍生物或者具有提供了结合功能的蛋白质骨架的结合试剂如anticalin或植物凝集素。结合试剂还可以为提供了结合功能的肽或融合蛋白质。对具有与抗体类似的结合功能的结合试剂的概述见于Hey等人(Hey等人,(2005)"Artificial,non-antibody binding proteins forpharmaceutical and industrial application",Trends in Biotechnology23(10),514-522)。抗体衍生物还包括具有相同结合功能但例如改变的氨基酸序列的抗体或抗体片段。
术语“抗体”具体指的是包含由二硫键相连的至少两条重链和两条轻链的蛋白质。术语“抗体”包括天然发生的抗体以及抗体的所有重组形式,例如,表达于原核细胞中的抗体、非糖基化抗体、人源化抗体及嵌合抗体。每条重链由重链可变区(VH)和重链恒定区(CH)组成。每条轻链由轻链可变区(VL)和轻链恒定区(CL)组成。重链恒定区包含三个或在IgM-或IgE-型抗体的情况下四个重链恒定区(CH1、CH2、CH3和CH4),其中第一个重链结构域CH1与可变区临近并与通过铰链区第二个恒定区CH2相连。轻链恒定区仅由一个恒定结构域构成。可变区可进一步划分为超可变区(称为互补决定区(CDR)),其分散于称为骨架区(FR)的更保守的区域之间,其中各个可变区包含三个CDR以及四个FR。重链和轻链的可变区包含与抗原相互作用的结合结构域。重链和轻链可变区包含一个与抗体相互作用的结合结构域。抗体的恒定区可介导所述免疫球蛋白与宿主组织或因子(包括免疫系统的多种细胞如效应子细胞以及经典补体系统的第一组分C1q)的结合。IgA和IgM分子通常具有J链,但也明确地包括由其衍生的如不具有J链的分子。进一步地,根据本发明的术语“抗体”还包括单链抗体以及重链抗体,即,只由一条或多条(尤其是两条)重链组成的抗体,和纳米抗体,即,只由单个单体可变结构域组成。
抗体的“抗原结合片段或衍生物”具体而言为蛋白质或糖蛋白,其能够如参考抗体那样结合至例如抗原的相同表位。因此,本文中抗体的抗原结合片段或衍生物通常指的是功能性的抗原结合片段。优选地,所述抗原结合片段包含完全抗体的至少20个氨基酸、更优选地至少100个氨基酸,优选地包含抗体的结合区域。在具体的优选实施方式中,抗体的抗原结合片段包含重链可变区域。显示全长抗体的片段能起到抗体的抗原结合功能。抗体片段的实例包括(i)Fab片段,由各个重链和轻链的可变区和第一恒定结构域构成的单价片段;(ii)F(ab)2片段,包含例如由铰链区的二硫桥连在一起的两条Fab片段的二价片段;(iii)由重链的可变区和第一恒定区结构域CH1构成的Fd片段;(iv)由抗体单臂的重链和轻链可变区构成的Fv片段;(v)scFv片段,由单一多肽链构成的Fv片段;(vi)由两条Fv片段共价相连构成的(Fv)2片段;(vii)重链可变结构域;以及(viii)由以重链和轻链可变区之间的相连只能在分子间发生而不能分子内发生的方式共价连接的重链可变区和轻链可变区构成的多价抗体。术语“抗体或者其抗原结合片段或衍生物”还包括单一结构域的抗体。具有不同聚糖侧链的抗体或抗体片段也在此定义理解之内。可使用本领域技术人员已知的常规技术获得这些抗体片段或衍生物。
“特异性结合”优选地表示结合试剂如抗体或抗原结合片段或衍生物,相比于与另一种靶标的结合,其与其特异性针对的靶标如表位结合地更强。如果试剂结合第一种靶标的解离常数(Kd)比其结合第二种靶标的解离常数低,则其对第一种靶标的结合相比于第二种靶标更强。优选地所述试剂特异性结合的靶标的解离常数比对所述试剂不特异性结合的靶标的解离常数低,是超过1/2、更优选地超过1/5,更优选超过1/10,甚至更优选超过1/20、1/50、1/100、1/200、1/500或1/1000。优选地,特异性结合指的是解离常数为10μM或更低、更优选地为3μM或更低、1μM或更低、700nM或更低、500nM或更低、300nM或更低、200nM或更低、优选地为100nM或更低、70nM或更低、50nM或更低、30nM或更低、20nM或更低、并且最优选地10nM或更低、5nM或更低、2nM或更低或1nM或更低的结合。解离常数优选地在标准条件下测量,尤其是在生理条件下。如果特异性结合靶标化合物(如CD176)的结合试剂用于具体方法以结合至所述靶标化合物,优选地选择能够使所述结合试剂对其他尤其是类似的化合物(如其他糖抗原)的结合在此方法中检测不到或不干扰检测和/或确定其与靶标的结合的条件。特异性结合靶标结构如根据本发明的肿瘤相关糖抗原的结合试剂还包括以下实施方式,其中只要能够特异性地识别靶标结构,结合试剂还结合除了靶标结构外的其他结构。例如,术语“特异性结合肿瘤相关糖抗原的结合试剂”包括结合肿瘤相关糖抗原并也结合其他结构的结合试剂,尤其是所述肿瘤相关糖抗原所连接的载体分子。优选地,所述其他的结构,尤其是肿瘤相关糖抗原的载体分子,在没有肿瘤相关糖抗原时不受结合试剂的结合,或只是在结合非特异性靶标时相比于特异性靶标以高得多的(如上文限定的)解离常数结合。
如本文所使用的,术语“蛋白质”具体而言指的是氨基酸的分子链或超过一种氨基酸链的复合体。蛋白质可包含任何天然发生的氨基酸以及人工氨基酸,并可为生物或合成来源。可对蛋白质进行天然(翻译后修饰)或合成的修饰,通过例如糖基化、酰胺化、羧基化和/或磷酸化。蛋白质包含至少两个氨基酸,但不需要为任何特定的长度;此术语不包括任何的大小限制。在本申请中,术语“蛋白质”“多肽”和“肽”交换使用。优选地,蛋白质包含至少10个氨基酸、优选地至少50个氨基酸、至少100个氨基酸以及最优选地至少100个氨基酸。
根据本发明,术语“患者”具体而言指的是人类、非人灵长类或其他动物,具体而言为哺乳动物如牛、马、猪、绵羊、山羊、狗、猫或啮齿类如小鼠或大鼠。在一个具体优选的实施方式中,患者为人类。
根据本发明的术语“癌症”具体而言指的是白血病、精原细胞瘤、黑色素瘤、畸胎瘤、淋巴瘤、骨髓瘤、成神经细胞瘤、神经胶质瘤、直肠癌、子宫内膜癌、肾癌、肾上腺癌、甲状腺癌、皮肤癌、脑癌、子宫癌、肠道癌、肝癌、结肠癌、胃癌、小肠癌、头颈癌、胃肠癌、淋巴结癌、食道癌、结肠癌、胰腺癌、耳鼻喉(ENT)癌、乳腺癌、前列腺癌、子宫癌、卵巢癌和肺癌,以及其转移癌。如本文使用的,癌指的是增值过度的病况。该术语指的是恶性及非恶性细胞群体,但优选地指恶性细胞及其细胞群体。这些障碍具有一种或多种细胞亚群的过度细胞增殖,其经常看上去与周围组织在形态上和基因型上有差异。过度的细胞增殖可通过与一般群体对照和/或通过与具体患者在例如患者人生的较早时间点进行对照而确定。过度增殖的细胞障碍可在不同的动物类型及人类中发生,并产生不同的物理表现,取决于受影响的细胞。
通过“肿瘤”具体而言指的是通过错调控的细胞增殖形成的一组细胞或组织。肿瘤显示了正常组织的结构组织和功能性协作上的部分或全部缺失,并通常来自不同的组织实质,其可为良性或恶性的。具体而言,术语肿瘤指的是恶性肿瘤。根据一个实施方式,术语“肿瘤细胞”还包括非实体癌的细胞,如白血病细胞。根据另一个实施方式,非实体癌的细胞不在术语“肿瘤细胞”范围内。
通过“转移”具体而言指的是癌细胞从其原始位点扩散到身体的其他部分。转移的形成是非常复杂的过程,一般涉及癌细胞从原发性肿瘤的脱离,进入身体循环并稳定下来在身体内其他位置的正常组织中生长。当肿瘤细胞转移时,新肿瘤叫做二级或转移肿瘤,其细胞一般与原始肿瘤中的细胞类似。这意味着,例如,如果乳腺癌转移到肺,二级肿瘤是以异常乳腺细胞构成,而不是异常肺细胞。肺中的肿瘤叫做转移乳腺癌,不是肺癌。
根据本发明,癌的“分期”优选地指的是对癌的进程及程度的分类。优选的癌分期系统是恶性肿瘤的TNM分类,其中T描述的是肿瘤的大小及其是否侵入附近的组织,N描述的是所涉及的区域性淋巴结,而M描述了远处的转移情况。根据患者中的情况,对这些参数中每个给出具体值,其中一般较高的数字表示更严重的情况(T(0-4)、N(0-3)、M(0/1))。另外,对于更详细的分类,可确定进一步的参数并/或可使用前缀。进一步地,可根据UICC在癌分期系统中总结TNM分类,其参考0期-IV期的癌。
根据本发明,“样品”具体而言指的是但不限于组织样品、体液和/或细胞样品,并可通过常规方式如通过组织活检(包括穿刺活检)或通过取含有或疑似含有癌细胞的血、支气管排出物、痰、尿、排泄物或其他体液或组织切片、样片等获得。根据本发明,术语“样品”还包括各样品的级分或组分。
如本文所描述的,术语“细胞增殖”及“增殖”具体而言指的是通过细胞分裂进行的细胞扩增。
术语“癌干细胞”具体而言涉及但不限于在合适的条件下能在体外产生非分化细胞的聚合体(称为肿瘤球)的细胞。形成球体的细胞能够自我更新;当将其分离并在相同条件下生长时,其将再次形成球体。在体内,癌干细胞特征在于其形成转移的潜力及干细胞标记物如CD44的表达。其还可提供药物抗性。术语“癌干细胞”及“癌起始细胞”在本文用作同义词。
术语“肿瘤相关糖抗原”具体而言指的是表达于癌和/或肿瘤细胞尤其是恶性癌和/或恶性肿瘤细胞上的糖抗原。
术语“肿瘤特异性糖抗原”具体而言指的是主要或甚至专门表达在癌和/或肿瘤细胞上的糖抗原,而因此其在非癌或非肿瘤细胞上只以很低的量生长。优选地,术语“肿瘤特异性糖抗原”指的是主要或优选地专门表达在恶性癌和/或恶性肿瘤细胞上的糖抗原,而因此其在非癌或非肿瘤细胞、良性癌和/或良性肿瘤细胞和/或在同一患者的健康组织中只以很低的量生长。优先地,肿瘤特异性糖抗原不在大多数正常细胞上表达,甚至更优选地,其只在少数正常细胞或细胞类型上表达,甚至更优选地,在这些正常细胞上的表达具有特定的定位,例如,严格处于顶部或在紧密的连接之间,因此,系统性尤其是i.v.施用的结合分子不会或仅仅到达正常细胞上的抗原,甚至更优选地,其在正常上皮细胞上不表达,最优选的是其在正常细胞上不表达。在特定实施方式中,肿瘤特异性糖抗原在表达时可连接于载体分子。这种载体分子具体而言为蛋白质、肽或糖类。
“CD176”指的是肿瘤相关的Thomsen-Friedenreich抗原(TF)。TF以TFα和TFβ两种形式存在,其可与蛋白质或糖脂相连。Core-1为二糖Galβ1-3GalNAc,其具体而言以α-异构构象的O-糖苷键连接于肿瘤细胞中羟基氨基酸丝氨酸或苏氨酸或蛋白质。Core-1对应TFα结构。而此二糖为发现于正常细胞的许多膜糖蛋白上的隐藏的广泛的核心结构,其在肿瘤细胞上的暴露及由此产生的抗原新生限制在少数特异性载体蛋白质上。已经表示CD176表达于多种癌细胞表面上,如乳腺癌(Imai等人,2001;Goletz等人,2003)、结肠癌(Cao等人,1995)、肝细胞癌(Cao等人,1999)、数种白血病(Cao等人,2008)以及其他类型的癌上。作为功能性分子实体,癌细胞表面上的CD176参与细胞的侵入和转移特性(Cao等人,1995)。此后,术语CD176优选地指肿瘤特异性core-1结构Galβ1-3GalNAα1-O-。
“CD175”指的是Tn抗原,其为具有GalNAcα1-O-结构的肿瘤相关糖抗原。其在高比例的情况下表达于大多数上皮癌及数种白血病中。其还在一定程度上表达于良性肿瘤。CD175为肿瘤特异性抗原。
“CD175s”指的是s-Tn抗原(也称为唾液酸化-Tn或TAG-72),其为具有NeuAcα2-6GalNAcα1-O-结构的肿瘤相关糖抗原。其在高比例的情况下表达于大多数上皮癌及数种白血病中。
“CD173”指的是血液O型抗原(也称为2型H),其为具有Fucα1-2Galβ1-4GlcNAcβ1-结构的肿瘤相关糖抗原。其表达于红血细胞及血液O型个体的内皮细胞上。其在除了O型之外的血型的患者中为癌相关抗原。
“CD174”指的是路易斯Y抗原(也称为Le Y),其为具有Fucα1-2Galβ1-4[Fucα1-3]GlcNAcβ1-结构的肿瘤相关糖抗原。CD174在许多上皮癌、数种白血病及造血祖细胞上为肿瘤特异性的。
“CA19-9”指的是唾液酸化-Le a抗原,其为具有NeuAcα2-3Galβ1-3[Fucα1-4]GlcNAcβ1-3Galβ1-结构的肿瘤相关糖抗原。其在肠胃及胰腺癌上高度表达而不在乳腺、肾或前列腺肿瘤上表达。
“CD34”,一种膜糖蛋白(105-120kDa),为熟知的造血祖细胞的标记物。其还表达于大多数白血病细胞上。
“CD44”为具有多种分子量的粘附分子(H-CAM,Pgp-1)。其为细胞表面透明质酸受体,与基质金属蛋白酶相互作用且在细胞迁移中起重要作用。已将CD44描述为乳腺、卵巢、胰腺、前列腺、结肠、胃及其他癌症类型中的癌干细胞标记物(见Li等人,2007及Takaishi等人,2009)。其还为正常多能干细胞的标记物。在一些癌症类型上产生CD44的剪接变体,如结肠癌上的CD44v6。
“CD133”(prominin,120kDa)为5次跨膜结构域糖蛋白。该基因编码865氨基酸的糖蛋白,并在整个动物界中保守。已经将其描述为许多癌症类型中的癌干细胞标记物(例如,结肠癌、胰腺癌、前列腺癌、非小细胞肺癌以及肝细胞癌,以及黑色素瘤和成神经细胞瘤)。
“CD164”(MGC-24,24kDa)为造血祖细胞的标记物,也是胃癌的癌干细胞标记物(见Masuzawa等人,1992)。
术语“细胞”和“多种细胞”及“细胞群体”交换使用,具体而言指的是一种或多种细胞,尤其是哺乳动物细胞。该术语包括细胞或细胞群体的后代。本领域技术人员会认识到“细胞”包括单一细胞的后代,而且由于天然、随机或有意的突变和/或变化,此后代不必(在形态学或总的DNA互补上)与原始亲本细胞完全同一。
“有效量”具体而言是足以影响有益的或想要的临床结果的量。有效量可以在一次或多次施用中进行施用。作为活性成分的结合试剂的有效量具体而言为足以诊断、减弱、减轻、稳定、逆转、减缓或延迟疾病状态进展的量。活性成分的毒性和治疗效力可根据标准制药步骤在细胞培养物和/或实验动物中确定,包括例如确定LD50(对50%的群体产生致死性的剂量)以及ED50(对50%群体有治疗效应的剂量)。毒性和治疗效应之间的剂量比例为治疗指数,并可表示为LD50/ED50比例。表现出大的治疗指数的结合试剂是优选的。获自细胞培养物和/或动物研究的数据可用于对用于人的剂量范围进行配制。活性成分的剂量一般在循环浓度的范围内,其包括低毒性的ED50。剂量可根据所使用的剂型以及所应用的施用途径在所述范围内变动。
发明详述
本发明是基于肿瘤相关糖抗原表达于癌干细胞上并因此作为癌干细胞标记物这一发现。此发现很出乎意料,因为迄今所描述的癌干细胞标记物几乎都是蛋白质。因此,本发明涉及肿瘤相关的糖抗原,优选的肿瘤特异性糖抗原作为癌干细胞标记物的用途,所述肿瘤特异性糖抗原优选地选自CD176、CD175、CD175s、CD174、CD173和CA19-9,更优选地选自CD176、CD175和CD175s。
根据第一个方面,本发明提供了特异性结合肿瘤相关糖抗原的结合试剂用于处理表达所述肿瘤相关糖抗原的癌干细胞的用途。
本发明人显示了数种肿瘤相关糖抗原如CD176、CD174和CD173表达于癌干细胞上并因此成为新型癌干细胞标记物。鉴定肿瘤相关糖抗原作为癌干细胞标记物提供了用于特异性结合肿瘤相关糖抗原的试剂的新型治疗应用。特异性结合相应的肿瘤相关糖抗原的试剂现在可以治疗性地应用于靶向表达所述癌干细胞肿瘤相关糖抗原的癌干细胞。这提供了靶向并优选地杀死癌干细胞的治疗性处理的机会。相应的治疗试剂可例如用于靶向并因此破坏对常规化疗有抗性的癌干细胞。因此,本发明提供了改善的癌症疗法。
根据一个实施方式,肿瘤相关糖抗原主要地或甚至专门地表达于癌干细胞上。根据另一个实施方式,肿瘤相关糖抗原表达于癌干细胞以及并非是癌干细胞的癌细胞上。如果肿瘤相关糖抗原表达于两种细胞群体上,则此具有优点是:用所述特异性结合肿瘤相关糖抗原的结合试剂靶向两种细胞群体进行处理。这在例如少量但有记载的情况下很重要,这些情况中肿瘤生长期间具有癌干细胞特性的新细胞例如通过上皮-间充质转变(EMT)而发展。
根据一个实施方式,特异性结合肿瘤相关糖抗原的结合试剂有治疗活性。相应实施方式的一个实例是使用治疗活性的抗体或者其抗原结合片段或衍生物作为结合试剂。治疗活性的抗体或者其抗原结合片段或衍生物优选地能够诱导补体依赖的细胞毒性(CDC)和/或抗体依赖的细胞毒性(ADCC),其优选地导致靶标细胞的裂解,特别是表达所述肿瘤相关糖抗原的癌干细胞的裂解。根据一个进一步的实施方式,特异性结合肿瘤相关糖抗原的结合试剂起靶向分子的作用并与至少一种治疗试剂偶联。可通过共价或非共价方式进行偶联。当特异性结合肿瘤相关糖抗原的结合试剂起靶向分子作用时,其可以自身为治疗活性的或其可能不是治疗活性的。在其不是治疗活性的情况下,其起到分子载体的基础作用,将实际的治疗试剂(如放射性药物、化疗试剂或毒素)带向所需的靶标作用一侧,即表达肿瘤相关糖抗原的癌干细胞。偶联至特异性结合肿瘤相关糖抗原的结合试剂的治疗试剂可为例如化疗试剂或其他抗癌药物。所述偶联的治疗试剂优选地破坏或杀死所靶向的癌干细胞或抑制其增殖。这可直接由偶联的治疗试剂完成或间接通过诱导所靶向的癌干细胞和/或待治疗的患者中合适的生物学机制而完成。
根据一个实施方式,肿瘤相关糖抗原选自CD176、CD175、CD175s、CD174、CD173和CA19-9。优选地,肿瘤相关糖抗原选自CD176、CD173、CD174和CD175或CD175s。在上文中描述了与这些肿瘤相关糖抗原相关的细节。本发明人显示了这些肿瘤相关糖抗原是新颖的并且是合适的癌干细胞标记物。
优选地,肿瘤相关糖抗原为肿瘤特异性的。这具有的优点是降低了非肿瘤即非癌细胞受处理所影响的风险。关于优选的肿瘤特异性的细节也在上文描述;参考相应的公开。
根据一个实施方式,癌干细胞是用至少共表达一种干细胞标记物的所述结合试剂进行处理的,其优选地为糖蛋白。本发明人已经发现肿瘤相关糖抗原如特别是CD176、CD173和CD174与其他干细胞标记物如CD44和CD133共表达,已知这些标记物为癌干细胞标记物。根据一个优选的实施方式,处理表达是(糖)蛋白的至少一种干细胞标记物的癌干细胞,此标记物携带被结合试剂特异性结合的肿瘤相关糖抗原。在特定实施方式中,结合试剂还结合携带肿瘤相关糖抗原的(糖)蛋白。然而,只有存在肿瘤相关糖抗原时才能发生特异性结合。本发明人已经证明作为癌干细胞标记物的肿瘤相关糖抗原例如CD176经常几乎专门地携带于已知为正常及癌干细胞的标记物如CD34、CD44、CD133、CD164的蛋白质上和/或携带于肿瘤相关(糖)蛋白。这表示正常(糖)蛋白干细胞标记物和/或肿瘤相关(糖)蛋白在恶性转化为癌干细胞的其糖基化过程中经历了特征性变化,而致使出现(表达)本文鉴定为癌干细胞标记物的肿瘤相关糖抗原。因此,鉴定肿瘤相关糖抗原为新型癌干细胞标记物提供了用于处理癌干细胞的有用的治疗性靶标。
根据一个实施方式,癌干细胞表达一种或多种选自CD34、CD44、CD44v6、CD133和CD164的干细胞标记物。优选地,所述肿瘤相关糖抗原携带于选自CD34、CD44、CD44v6、CD133和CD164的糖蛋白上。例如,已经发现CD176、CD175和CD175s尤其表达于CD44和CD133上。
根据一个实施方式,癌干细胞源自为具有一种或多种以下特征的癌:
a)其为实体瘤;
b)其为白血病;
c)其为多发性骨髓瘤或淋巴瘤;
d)其为上皮来源的肿瘤;和/或
e)其为选自肺癌、乳腺癌、肝癌、卵巢癌、胃肠癌、胰腺癌、前列腺癌、脑癌以及头颈癌的肿瘤。
对于此实施方式,其中癌干细胞表达作为肿瘤相关糖抗原的CD176、CD175或CD175s,癌干细胞优选地为白血病或形成实体瘤的癌,即,其为除白血病和淋巴瘤之外的癌。优选地,癌为上皮恶化,更优选地选自肺癌、乳腺癌及肝癌。如本文实施例中提供的,CD176表达于这些癌类型的癌干细胞上。进一步地,发现CD176与例如CD34在白血病上共表达。
对于此实施方式,其中癌干细胞表达作为肿瘤相关糖抗原的CA19-9,所述癌干细胞根据本发明的实施方式为形成实体瘤的癌。优选地,所述癌为胃肠癌。
根据一个实施方式,结合试剂特异性结合所述肿瘤相关糖抗原,其为肿瘤特异性糖抗原。优选地,在生理条件下及因此在治疗性应用所述结合试剂的条件下,结合试剂不结合表达于非癌细胞、非肿瘤细胞、良性癌细胞和/或良性肿瘤细胞上的抗原,尤其是糖抗原。使用相应的肿瘤特异性结合试剂具有数种优点。其确保当用于治疗时,结合试剂只识别并因此只结合靶标细胞以及因此的表达肿瘤特异性糖抗原的细胞而不结合非靶标细胞,具体而言为表达几乎相似抗原(具体而言为糖抗原)的良性或正常细胞。这确保了肿瘤、相应的癌特异性疗法,因此降低了不想要的副作用的风险。合适的肿瘤特异性结合试剂随后描述,具体而言是在其中肿瘤特异性糖抗原为CD176或CD175的实施例中。
根据一个优选的实施方式,特异性结合肿瘤相关糖抗原的结合试剂,起是抗体或者其抗原结合片段或衍生物。合适的实例在上文及实施例中有描述。
根据本发明的用作结合试剂的抗体或者抗体的抗原结合片段或衍生物具有一种或多种以下特征:
a)其介导癌和/或肿瘤细胞尤其是癌干细胞的ADCC和/或CDC;
b)其诱导和/或促进癌和/或肿瘤癌细胞尤其是癌干细胞的凋亡;
c)其抑制靶标癌和/或肿瘤细胞尤其是癌干细胞的增殖;
d)其诱导和/或促进癌和/或肿瘤细胞尤其是癌干细胞的细胞吞噬;和/或
e)其诱导和/或促进细胞毒性试剂的释放。
根据一个实施方式,CD176特异性抗体或者其抗原结合片段或衍生物用于处理表达CD176的癌干细胞。优选地,所述CD176特异性抗体或者其抗原结合片段或衍生物包含至少一个互补决定区(CDR),其选自具有SEQ ID No.1的氨基酸序列的CDRH1;具有SEQ ID No.2或3的氨基酸序列的CDRH2;以及具有SEQ ID No.4或5或6的氨基酸序列的CDRH3。更优选地,其包含至少两个CDR,如CDRH1和CDRH2、CDRH1和CDRH3或CDRH2和CDRH3,每一个具有如上文限定的氨基酸序列。最优选地,其包含所有三个CDR,即CDRH1、CDRH2和CDRH3,每一个具有如上文限定的氨基酸序列。备选地,CDRH1具有SEQ ID NO:14-17中任何一项的氨基酸序列,和/或CDRH2具有SEQ ID NO:18-27中任何一项的氨基酸序列。具体而言,这些CDR存在于CD176特异性抗体或者其功能性活性片段或衍生物的重链可变区中。CD176特异性抗体或者其抗原结合片段或衍生物的重链可变区优选地包含或由SEQ ID No.46-79中任何一项的氨基酸序列组成。
进一步地,所述CD176特异性抗体或者其抗原结合片段或衍生物的重链可变区优选地包含至少一个互补决定区(CDR),选自具有SEQID No.7或8或9的氨基酸序列的CDRL1,具有SEQ ID No.10或11的氨基酸序列的CDRL2以及具有SEQ ID No.12或13的氨基酸序列的CDRL3。更优选地,其包含至少两个CDR,如CDRL1和CDRL2、CDRL1和CDRL3、或CDRL2和CDRL3,每一个具有如上文限定的氨基酸序列。最优选地,其包含所有三个CDR,即为CDRL1、CDRL2和CDRL3,每一个具有如上文限定的氨基酸序列。备选地,CDRL1具有SEQ ID NO:28-45任何一项的氨基酸序列。具体而言,这些CDR存在于CD176特异性抗体或者其抗原结合片段或衍生物的轻链可变区中。CD176特异性抗体或者其抗原结合片段或衍生物的轻链可变区优选地包含或由SEQ ID No.80-94中任何一项的氨基酸序列构成。
在优选的实施方式中,CD176特异性抗体包含以下互补决定区(CDR)组中的一种:
序列显示于图3。相应的序列也公开于EP 1572747中,因此本文使用了相同的序列编号。
根据本发明的结合试剂的CD176特异性抗体或者其抗原结合片段或衍生物可以为人、鼠、人源化或嵌合抗体或者其功能活性片段或衍生物。进一步地,其可以为单链抗体片段(例如scFv)、Fv片段、Fab片段、F(ab)2片段、多价抗体(例如,二价、三价或四价抗体)、IgG、IgM、IgA、IgE、IgD同种型或其任何亚型的免疫球蛋白如IgG1、或衍生自免疫球蛋白的识别分子,其包含至少一个恒定区域,或缺少(完全或部分的)J链的那些。优选地,CD176特异性抗体为IgG1抗体或IgM抗体,尤其是包含J链的IgM抗体或缺少J链的IgM抗体,其优选地为六聚体形式,即,其包含6个各自包含两条重链和两条轻链的抗体。
在具体的优选实施方式中,在生理条件下(如EP 1572747中实施例7描述的条件)CD176特异性抗体或者其抗原结合片段或衍生物不会与Galα1-3GalNAcα,Galα1-3GalNAcβ,GalNAcα,Neu5Acα2-3Galβ1-3GalNAcα,Galβ1-3(Neu5Acα2-6)GalNAcα,GlcNAcβ1-2Galβ1-3GalNAcα,GlcNAcα1-3Galβ1-3GalNAcα,GalNAcα1-3Galβ和/或3'-O-Su-Galβ1-3GalNAcα有特异性地相互作用。
根据一个实施方式,CD176特异性抗体结合core-1结构并显示有与结构core-2的交叉反应性,core-2为GlcNAcβ1-6[Galβ1-3]GalNAcα1-O-。
结合CD176的合适的抗体的实例包括但不限于HH8(Clausen H等人,Mol Immunol 25:199-204(1988))、A78-G/A7(GlycotopeGmbH,Berlin,Germany)、Nemod-TF1和Nemod-TF2(GlycotopeGmbH,Berlin,Germany)以及HB-TF1(DakoCytomation,Hamburg,Germany)。
进一步地,根据本发明的结合试剂可包括抗体或者其抗原结合片段或衍生物,其显示有与上文描述的CD176特异性抗体或者其抗原结合片段或衍生物有交叉反应性。具体而言,根据本发明的结合试剂可以为抗体或者其抗原结合片段或衍生物,其结合可由上文描述的CD176特异性抗体或者其抗原结合片段或衍生物或溶液中的CD176结构有效地抑制,或其以使本领域技术人员可确定的足够浓度或量偶联于载体分子如聚丙烯酰胺或偶联至肽、蛋白质或脂类。
根据一个进一步的实施方式,CD175特异性抗体或者其抗原结合片段或衍生物用于处理表达CD175的癌干细胞。合适的特异性抗体可通过现有技术和/或如上文所描述的方法获得。针对CD175的已知抗体为例如HB-Tn 1(可获自DakoCytomation,Hamburg,Germany)、TKH6(Kjeldsen等人,Cancer Res 48:2214,1988)以及1E3(Thurnher等人,Glycobiology 4:429,1994)。
根据一个实施方式,CD175s特异性抗体或者其抗原结合片段或衍生物用于处理表达CD175s的癌干细胞。合适的特异性抗体可通过现有技术和/或如上文所描述的方法获得。已知的针对CD175s的抗体为例如HB-STn1(可获自DakoCytomation,Hamburg,Germany)、TKH2(Kjeldsen等人,Cancer Res 48:2214,1988)、B72.3(Zhang等人,Cancer Res 55:3364,1995)和MLS102(Nakada等人,J BiolChem 266:12402,1991)。
根据一个实施方式,CD174特异性抗体或者其抗原结合片段或衍生物用于处理表达CD174的癌干细胞。合适的特异性抗体可通过现有技术和/或如上文所描述的方法获得。已知的针对CD174的抗体为例如A70-C/C8(Glycotope GmbH,Berlin,Germany)、BR55-2(Blaszczyk-Thurin等人,J Biol Chem 262:372,1987)和NCC-ST-433(Watanabe等人,Gann 76:43,1985)。已知的针对CD174的治疗性抗体为例如ABL364(Sandoz)和BR96(Bristol-MyersSquibb)。
根据一个实施方式,CD173特异性抗体或者其抗原结合片段或衍生物用于处理表达CD173的癌干细胞。合适的特异性抗体可通过现有技术和/或如上文所描述的方法获得。已知的针对CD173的抗体为例如A46-B/B10(Glycotope GmbH,Berlin,Germany)、BE2(Young等人,J Biol Chem 256:10967,1981)和92FRA2(Dako Cytomation,Hamburg,Germany)。
根据一个实施方式,CA19-9特异性抗体或者其抗原结合片段或衍生物用于处理表达CA19-9的癌干细胞。合适的特异性抗体可通过现有技术和/或如上文所描述的方法获得。已知的针对CA19-9的抗体为例如,1116NS-19-9(Magnani等人,Cancer Res 43:5489,1983)和121SLE(Herrero-Zabaleta等人,Bull Cancer 74:387,1987)。
还提供了药物组合物,其包含特异性结合肿瘤相关糖抗原的结合试剂,用于处理表达所述肿瘤相关糖抗原的癌干细胞,其中结合试剂、癌干细胞以及肿瘤相关糖抗原具有一种或多种如上文及权利要求中描述的特征。参考相应的公开。
在另一个实施方式中,公开了在患者中处理癌干细胞的方法,包括以治疗有效量对患者施用药物组合物,所述药物组合物包含(a)特异性结合待处理的所述癌干细胞上表达的肿瘤相关糖抗原的结合试剂以及(b)药物可接受载体。关于结合试剂、肿瘤相关糖抗原以及癌干细胞的特征连同用于此目的的化合物在上文有详细描述。参考了上文的公开。主题的方法用于预防和治疗目的。如本文所使用的,术语“治疗”或“处理”用于指对疾病预防以及现有病况的治疗或处理。对进行中的疾病进行治疗以稳定或改善患者的临床症状是本发明提供的尤其重要的益处。可取地,该治疗在受影响组织功能丧失前进行;因此,本发明提供的预防治疗益处也很重要。例如,对癌症患者的治疗可以为减小肿瘤大小、消除恶性细胞、预防转移以及预防患者中病情复发,所述患者的扩散的癌(尤其是肿瘤细胞或转移癌,尤其是循环系统中的细胞或者迁移或侵入中的细胞)已经减弱、减少、部分或全部被杀死、延长存活期给/或延长肿瘤对应的癌进展的时间。描述了根据本发明的特异性结合癌干细胞上表达的肿瘤相关糖抗原的结合试剂以及包含其的药物组合物用于所述目的。
根据制剂需要,药物组合物可包括药物可接受的非毒性稀释剂载体,其限定为通常用于配制动物或人施用的药物组合物的媒介物。以不影响组合的生物学活性的方式选择稀释剂。所述稀释剂的实例为蒸馏水、缓冲水、生理盐水、PBS、Ringer’s溶液、葡萄糖溶液及Hank’s溶液。另外,药物组合物或制剂可包括其他载体、佐剂或非毒性、非治疗性、非免疫原性的稳定剂、赋形剂等等。组合物还可包括另外的物质以保持大致的生理条件,如pH调整及缓冲试剂、毒性调整试剂、润湿试剂及去污剂。
组合物还可包括多种稳定剂如抗氧化剂为一个实例。当药物组合物包括多肽时,多肽可与多种熟知的增强多肽体内稳定性或此外增强其药学特性(例如,增加多肽的半衰期、降低其毒性、增强可溶性或摄取)的化合物相复合。这些修饰或复合试剂的实例包括硫酸盐、葡糖酸盐、柠檬酸盐和磷酸盐。组合物的多肽还可与增强其体内属性的分子复合。这些分子包括,例如,糖类、聚胺、氨基酸、其他肽、离子(例如,钠、钾、钙、镁、锰)以及脂类。
关于适合于多种施用类型的制剂的指导见于Remington'sPharmaceutical Sciences,Mace Publishing Company,Philadelphia,Pa.,17th ed.(1985)。药物递送方法的简单总览见,Langer,Science249:1527-1533(1990)。
本文描述的药用组合物可以以多种不同方式施用。实例包括以口、鼻内、直肠、局部、腹膜内、静脉内、肌内、皮下、真皮下、透膜、鞘内及颅内方式施用含有药物可接受载体的组合物。
根据本发明进一步的方面,提供了鉴定包含对用特异性结合肿瘤相关糖抗原的结合试剂的处理易感的癌干细胞的癌的方法,其中所述处理对癌干细胞起作用,所述方法包括确定获自患者的癌样品是否包含表达所述结合试剂特异性针对的肿瘤相关糖抗原的癌干细胞,其中癌干细胞上存在所述肿瘤相关糖抗原表示此癌对用特异性结合肿瘤相关糖抗原的结合试剂进行的处理易感,且其中所述处理也影响所述癌干细胞。
根据本发明的此方法使得能够测试癌的癌干细胞是否对用特异性结合肿瘤相关糖抗原的结合试剂进行的处理易感。此方法的结果为药剂师提供了有用的诊断信息。例如在癌包含不表达所述肿瘤相关糖抗原的癌干细胞的情况下,用特异性结合肿瘤相关糖抗原的结合试剂进行的处理不会影响所述癌干细胞并因此对所述癌干细胞没有用。然而,在所述方法显示此癌干细胞表达所述肿瘤相关糖抗原的情况下,结合试剂特异性针对、靶向并因此影响癌干细胞,用所述结合试剂处理的机会就很良好。因此,根据本发明的方法为药剂师对患者选择最好的疗法以及为估计特定处理是否影响癌的癌干细胞提供了有用的帮助。
根据相关诊断方面,提供了方法,用于诊断、分期和/或预防癌和/或监视对治疗易感性,包含在分离自患者的样品中分析细胞上的肿瘤相关糖抗原的表达的步骤,其中表达肿瘤相关糖抗原的细胞的存在表示所述样品中存在癌干细胞。
患者样品中存在癌干细胞是癌分期的指示。此外,对癌干细胞的检测可用于监视对疗法的应答及帮助预后。通过根据本发明的方法获得的信息可用于预后和诊断,包括分析对疾病加速发展的易感性,通过对疾病进行活性监视的分析(其中分析了癌是否进展以及例如是否需要治疗),疾病状态的情况、对环境中变化如传代时间、用所选的治疗试剂(尤其是如上文描述的结合试剂)处理的应答,或其他状态。通过分析样品中包含的细胞是否表达肿瘤相关糖抗原及因此样品是否包含癌干细胞,还可将细胞根据其对治疗试剂和处理的应答能力分类。进一步地,所得到的信息对于确定和/或预测癌的转移行为有用。鉴定为癌干细胞标记物的肿瘤相关糖抗原,尤其是CD176、CD175和CD175s经常在转移物上以高量表达。存在本文描述的癌干细胞的肿瘤相关糖抗原并且其能被本发明的结合试剂所结合经常与不良预后有关,尤其当肿瘤相关糖抗原为肿瘤特异性时,更具体地,当其为CD176时。在通过肿瘤相关糖抗原标记物表达而鉴定为癌干细胞时,患者具有增加的发展为转移癌的风险。
可根据本发明通过分析是否存在(尤其是基于使用肿瘤相关糖抗原为标记物靶标而鉴定的)癌干细胞而对癌进行分期。分期可用于预后及治疗。
根据本发明的诊断方法的一个方面,特异性结合癌干细胞上表达的肿瘤相关糖抗原的根据本发明的结合试剂用于体内诊断,尤其是体内成像。相应的方法还用于诊断目的。例如,可以确定是否能够在患者中鉴定和/或定位表达癌干细胞上表达的肿瘤相关糖抗原的癌细胞。如果是这种情况,就有存在癌干细胞的风险。如上文及下文所描述的,优选的是另外检测第二种干细胞标记物以验证和/或确定癌干细胞的性质。进一步地,可监视对治疗的应答以确定例如肿瘤大小是否减小或转移是否发展。进一步地,相应的方法在鉴定用于患者的合适的剂量上有优势。根据一个实施方式,结合试剂带有标签,例如,为包含放射性核素的放射性药物。然而,结合试剂还可与其他试剂/化合物如PET追踪子偶联,这样可以进行体内成像。合适的化合物在现有技术中已知,因此,不需要在此处进一步描述。关于结合试剂、肿瘤相关糖抗原、其它癌干细胞标记物以及癌类型在上文和下文详细描述,其也适用于体内成像的实施方式。其参考对应的公开。
因此,鉴定肿瘤相关糖抗原如CD176、CD174和CD173为癌干细胞标记物及本发明所描述的方法(其基于利用相应的发现)提供了重要并有优势的诊断和预后工具。
根据一个优选的实施方式,根据本发明的方法另外包括分析细胞是否共表达至少一种第二种癌干细胞标记物的步骤。由此,可进一步验证癌干细胞的表型。鉴定所分析的样品中是否存在细胞共表达肿瘤相关糖抗原以及至少一种第二种癌干细胞标记物表示/验证了相应的细胞为癌干细胞以及例如,所分析的样品包含癌干细胞或通过体内诊断方法检测到了癌干细胞。除肿瘤相关糖抗原外的合适的癌干细胞标记物可根据癌症类型而确定。根据一个优选的实施方式,测试了至少一种另外的糖蛋白癌干细胞标记物的共表达情况,其选自CD34、CD44、CD44v6、CD133和CD164。
根据一个实施方式,肿瘤相关糖抗原选自CD176、CD175、CD175s、CD174、CD173和CA19-9。关于所述肿瘤相关糖抗原在上文有详细描述。其参考了上文的公开。
优选地,肿瘤相关糖抗原为肿瘤特异性的并优选地只表达于恶性细胞上。根据一个实施方式,肿瘤相关糖抗原主要地或专门地表达于癌干细胞上。根据另一个实施方式,肿瘤相关糖抗原表达于癌干细胞上以及本身不是癌干细胞但例如是这些细胞的衍生物或为不是癌干细胞的癌相应的肿瘤细胞的癌细胞上。
根据一个实施方式,样品中癌干细胞的存在情况是通过对具有本文描述的癌干细胞表型并因此表达肿瘤相关糖抗原及优选地表达其它癌干细胞标记物的细胞而确定。鉴定样品中有大量的癌干细胞表示更侵略性的癌表型。根据一个实施方式,对样品中存在的细胞进行定量(定量/定量分析)以了解肿瘤相关糖抗原以及可选的至少一种其它癌干细胞标记物的表达。对于肿瘤相关糖抗原阳性的细胞的“干细胞”特征可进一步由实验验证,例如通过确定细胞在培养中自我更新和增殖如在形成球体的能力。备选地或另外地,可在动物模型中测试细胞的致瘤性。
在本发明一个实施方式中,用至少一种特异于肿瘤相关糖抗原的试剂对来自癌症患者如患有或疑似有上文描述的癌的患者的样品进行染色。在分析至少一种其它癌干细胞标记物的共表达的情况下,优选的是还用至少一种特异于所述其它癌干细胞标记物的试剂对样品进行染色。
对染色形式的分析可提供样品中存在的癌干细胞的量的信息。进一步地,其可提供关于癌干细胞的相对分布的信息,此分布使得能够预测癌的致瘤性并还可使得对癌的进展进行预后。
根据一个实施方式,将包含或疑似包含癌细胞的样品与以下物质接触或用以下物质对其进行染色:至少一种特异性结合肿瘤相关的抗原,优选地为肿瘤特异性糖抗原,因此结合癌干细胞标记物的试剂以及可选的至少一种其它特异性结合至少一种第二种癌干细胞标记物(优选地为CD44)的试剂。这使得能够检测样品中癌干细胞的存在。根据一个实施方式,结合针对肿瘤相关糖抗原的结合试剂,优选地针结合针对第二种癌干细胞标记物的结合试剂通过本领域已知的以及本文描述的恰当的检测方法进行检测。合适的检测方法为例如ELISA、FACS、荧光显微镜观察等等。
要通过本发明的方法分析的样品可获自多种来源,尤其是来自生物活检样品。这些样品的细胞可通过离心、淘析、密度梯度分离、提取(apheresis)、亲和选择、淘选(panning)、FACS、Hypaque离心等方法在分析之前进行分离。一旦获得样品,可直接使用、或冷冻、或短期维持于合适的培养基中,或固定在合适的固定溶液中,或固定并包埋于适合于组织学或免疫组织学检查的基质中。多种基质可用于维持细胞。样品可通过任何简便的步骤获得,如生物活检,或来自手术标本。通常,样品会包含至少大约102个细胞,更通常地至少大约103个细胞,以及优选地104、105或更多个细胞。一般地,样品获自人类患者,尽管也可使用动物模型例如马,牛,猪,犬,猫,啮齿动物如小鼠、大鼠、仓鼠,灵长类等等。
样品可冷冻、包埋、固定、放置于组织微阵列等等。用于结合、检测尤其是染色肿瘤相关糖抗原以及可选的其它癌干细胞标记物的试剂可为例如特异性结合癌干细胞标记物的结合试剂如抗体。合适的实施例在上文描述。在染色步骤中,这些试剂可以是可检测地标记的也可以间接标记。根据一个实施方式,标签也可用于分离肿瘤相关糖抗原阳性细胞。合适的标签及染色步骤在现有领域已知,因此不需要此处进一步描述,尽管本文也描述了一些实施例。分析的标准步骤可包括例如在实施例中描述的,对样品进行组织学固定(如使用福尔马林)及随后进行染色。所得的数据使得能够确定样品中癌干细胞的数量和分布。
适合于检测和/或定量表达肿瘤相关糖抗原的方法包括例如,免疫测定如ELISA、RIA、Western印迹、免疫组织化学、流式细胞术、免疫组织化学或诸如此类。这些方法使得能够鉴定表达肿瘤相关糖抗原和可选地至少一种其它癌干细胞标记物的细胞的存在情况,如果需要也可定量该细胞的数量,所述肿瘤相关糖抗原如具体而言是新型癌干细胞标记物CD176、CD175、CD175s、CD174和CD173,。
尤其有意义的是使用相应的抗体作为特异性结合肿瘤相关糖抗原的结合试剂。方便地,这些抗体与用于检测和/或用于分离的标签相缀合。标签包括能够直接分离的磁珠、能够用结合支持物的抗生物素蛋白或链霉亲和素分离的生物素、可与荧光激活的细胞分选仪一起使用的荧色物,或诸如此类,以在需要时能够容易地分离特定细胞类型。使用的荧色物包括藻胆蛋白如藻红蛋白和别藻蓝蛋白、荧光素衍生物、Cy3、Cy5、或德克萨斯红。在除了肿瘤相关糖抗原外还检测其它癌干细胞标记物的情况下,优选的是特异性结合所述其它癌干细胞标记物的试剂是用不同的荧色物标记的,这样可以对各个癌干细胞标记物进行独立分选。
根据一个实施方式,将特异性结合癌干细胞标记物的结合试剂加入细胞悬液,并孵育足以结合可及的细胞表面抗原的一段时间。可取的是在反应混合物中有足够浓度的试剂,这样分离的效率不会受到特异性结合癌干细胞标记物的试剂不足的限制。合适的浓度通过滴定而确定。细胞进行分离的基质可以为任何维持细胞活力的基质。然后优选地对标记的细胞进行定量以确定细胞表面标记物的表达情况,如前文描述的。大量的这种方法在本领域也已知。
分化祖细胞的分析的对比;或获自患者样品的癌干细胞分析以及参考分析可通过使用合适的推导流程、人工智能(AI)系统、数据对比等等而完成。与来自正常细胞、类似的疾病组织的细胞等等的对照分化祖细胞的分析的对比可为疾病分期提供指示。可以汇编参考分化祖细胞分析的数据库。一种尤其有意义的分析是对患者进行追踪,这样能在早期观察到疾病的加速发展。本发明的方法提供了临床症状发生前对疾病加速发展的检测,因此能够进行早期治疗性干预,例如开始化疗、加大化疗剂量、改变化疗药物或其他抗癌药物的选择,等等。
可使用多种方法对所选择的标记物的存在情况进行定量。为了测量存在的分子的量,一种简便的方法是用可检测部分(可以为荧光的、化学发光的、放射活性的、酶活性的等等)标记分子,特别是用对结合的特异性达到高亲和力参数的分子。用于标记几乎任何生物分子、结构或细胞类型的荧光部分很容易得到,可引导荧光部分不仅仅结合特异性蛋白质也可结合特异性构象、裂解产物或位点修饰如磷酸化。可将个别的肽和蛋白质工程改造为自发荧光,例如通过在细胞内以绿色荧光蛋白嵌合物的形式进行表达(概述见于Jones等人(1999)Trends Biotechnol.17(12):477-81)。因此,可对抗体进行遗传修饰以将荧光染料作为其结构的部分而提供。根据所选择的标签,除了荧光标签之外也可测量这些参数,如使用免疫测定技术如放射性免疫测定(RIA)或酶联免疫吸附测定(ELISA)、同源酶免疫测定及相关的非酶技术。
在所分析的样品中鉴定出表达肿瘤相关糖抗原和可选地但优选地至少一种其它癌干细胞标记物的细胞表示所分析的样品中存在癌干细胞,还能对原发肿瘤及转移癌中对癌干细胞结构域进行限定。进一步地,如上文描述的,鉴定表达特异性肿瘤相关糖抗原的癌干细胞使得能够选择适当的疗法以治疗癌,包括癌干细胞。
根据一个实施方式,根据本发明的方法中所使用的结合试剂特异性结合肿瘤特异性糖抗原。优选地,结合试剂在用于进行上文所述本发明的诊断相关方法的条件下不结合表达于非癌细胞、非肿瘤细胞、良性癌细胞和/或良性肿瘤上的抗原,尤其是糖抗原,并且相关方法在在权利要求9和10中有限定。在本发明的方法中使用相应的肿瘤特异性结合试剂具有几种优势。其确保了结合试剂只识别并因此只结合靶标细胞,这样其只结合表达肿瘤特异性糖抗原的细胞而不结合表达只是类似的抗原(具体而言是类似的糖抗原)的非靶标细胞。这降低了根据本发明的方法中假阳性的风险。适合的肿瘤特异性结合试剂在上文描述,尤其是用于其中肿瘤特异性糖抗原为CD176的实施方式。
根据一个优选的实施方式,特异性结合肿瘤相关糖抗原的结合试剂为抗体或者抗体的抗原结合片段或衍生物。
根据一个实施方式,特异于待检测的肿瘤相关糖抗原的抗体或者其抗原结合片段或衍生物用于对表达所述肿瘤相关糖抗原的癌干细胞进行染色。结合CD176、CD175、CD175s、CD174、CD173和CA19-9的抗体的合适的实例在上文详细描述。其参考了上文的公开。
表达肿瘤相关糖抗原,并且特别是表达CD176、CD175、CD175s、CD174、CD173和/或CA19-9的细胞类型在上文描述。其参考了上文的公开
在一个实施方式中,将患者样品与参考或标准测试值进行对比。在另一个实施方式中,将患者的样品与前癌样品或与疾病过程中一个或多个时间点获得的患者样品进行比较。
在本发明的一些实施方式中,提供了根据所存在的癌干细胞对癌进行分类和/或临床分期的方法,其中更大数量的癌干细胞表示更侵略性的癌表型。
在本发明另一个实施方式中,提供了表达肿瘤相关糖抗原的分离的癌干细胞的组合物。因此,还提供了哺乳动物癌干细胞的组合物,其中组合物中至少50%、优选地至少75%、最优选地至少90%的细胞为癌干细胞,其为对于肿瘤相关的优选地为肿瘤特异性糖抗原为阳性的细胞。
这些细胞相应的组合物可例如用于实验评估,并用做细胞系来源及细胞特异性产物以及作为靶标用于发现影响其的因子或试剂。这些癌干细胞相应的组合物可用于例如筛选对癌干细胞有作用的试剂的方法。这包括将候选试剂与本发明的细胞群体组合,然后确定由所述试剂产生的任何调制效应。这包括对细胞的毒性、代谢变化或细胞功能影响上的检查。本文描述的癌干细胞的表型提供了预后疾病进展、减弱、及药物抗性发展的方法。
进一步地,所述表达肿瘤相关糖抗原的分离的癌干细胞的组合物或者包含所述肿瘤相关糖抗原的其裂解物、片段或级分可用于免疫治疗的目的,靶向癌干细胞。例如,其可用作自体或同种异体疫苗。这些癌干细胞组合物,可以为完整的、活的或死亡(优选地,细胞不能分裂)的,可以为这些的裂解物、片段、部分或纯化物,其单独或与其他试剂如佐剂联合使用而用于免疫动物或人,以实现针对癌干细胞、表达肿瘤相关糖抗原的癌、表达肿瘤相关糖抗原的转移癌和/或表达肿瘤相关糖抗原的扩散的肿瘤细胞的免疫应答。优选地,其诱导针对肿瘤相关糖抗原自身的免疫应答。优选地,由此获得至少一种针对表达肿瘤相关、优选地为肿瘤特异性抗原的癌干细胞的结合试剂。优选地,所获得的结合试剂为肿瘤特异性的,因此只识别并结合肿瘤特异性糖抗原而不结合不在癌细胞(优选地为癌干细胞)上表达的类似的糖结构。
根据一个实施方式,包含肿瘤相关糖抗原的癌干细胞或者其裂解物、片段或部分可用于获得基于抗原呈递细胞的疫苗。优选地,将抗原呈递细胞如树突细胞前体进行离体刺激仪使之成熟并摄取呈递表达于癌干细胞上的肿瘤相关糖抗原。用于此目的,抗原呈递细胞能够与根据本发明的组合物和/或表达肿瘤相关糖抗原的其裂解物、片段或部分共同孵育。其可来自接受所述疫苗的患者,或可来自具有相同类型癌的患者。然后可将成熟的树突细胞注射入患者以引发针对表达所述肿瘤相关糖抗原的癌干细胞的免疫应答。合适的及优选的肿瘤相关糖抗原在上文描述,其参考了相应的公开。
上文描述的通过使用根据本发明的组合物或者包含表达于癌干细胞的肿瘤相关糖抗原的其裂解物、片段或部分而获得的疫苗优选地诱导针对癌干细胞,优选地针对实体瘤的癌干细胞的免疫应答,其减少或治愈癌、转移癌或扩散的肿瘤细胞的生长。
进一步地,包含肿瘤相关糖抗原的根据本发明的所述组合物或者其裂解物、片段或部分可用于鉴定和/或分离合适的结合试剂用于上文描述的治疗目的。例如,其可用作筛选靶标以鉴定靶向癌干细胞的合适的结合分子。合适的筛选方法在现有技术中已知。根据一个实施方式,根据其对这些根据本发明的前述组合物、表达肿瘤相关糖抗原的癌干细胞或者包含肿瘤相关糖抗原的其的裂解物、部分或纯化物的结合,通过本领域技术人员已知的筛选技术选择表达和/或展示结合试剂的细胞、噬菌体、细菌或酵母。进一步地,根据本发明的所述组合物或者包含肿瘤相关糖抗原的其裂解物或部分在用作免疫原时,用于获得合适的结合试剂。例如用于获得合适抗体的相应的免疫方法在现有技术中已知并也在上文有所描述。
表达肿瘤相关糖抗原的目的癌干细胞可使用富集具有上述特征的细胞的技术分离自复杂的细胞混合物。实例在上文有所描述,包括但不限于FACS分选方法或涉及使用携带有特异性结合所述肿瘤相关糖抗原的结合试剂的磁性颗粒的方法。合适的特异性结合肿瘤相关糖抗原的结合试剂在上文有描述;其参考了相应的公开。
根据一个实施方式,肿瘤相关糖抗原选自CD176、CD175、CD175s、CD174、CD173和CA19-9、优选地其选自CD176、CD174以及CD173。关于所述肿瘤相关糖抗原的细节在上文有详细描述。其参考上文的公开。
优选地,组合物包含癌干细胞,其对至少一种其他干细胞标记物为阳性。优选地,此癌干细胞表达糖蛋白,其更优选地选自CD34、CD44、CD44v6、CD133和CD164。
还提供了用于分离癌干细胞的方法,包括分离表达肿瘤相关糖抗原的癌干细胞,所述肿瘤相关糖抗原优选地选自CD176、CD175、CD175s、CD174、CD173和CA19-9且更优选地选自CD176、CD174和CD 173。所述方法包括以下步骤:
a)将包含或疑似包含表达肿瘤相关糖抗原的癌干细胞的组合物与特异性结合所述肿瘤相关糖抗原的结合试剂相接触,以结合表达肿瘤相关糖抗原的癌干细胞;
b)将至少一种表达肿瘤相关糖抗原的癌干细胞从余下的组合物中分离出来。
合适的结合试剂、表达对应的肿瘤相关糖抗原的癌类型及其他细节在上文和下文有所描述。其参考上文的公开。
为从组织分离相应的细胞,可使用恰当的溶液进行分散和重悬。这种溶液一般为平衡盐溶液,例如,生理盐水、PBS、Hank’s平衡盐溶液,等等,其中可方便地补充胎牛血清或其他天然发生的因子,其与可接受缓冲液以低浓度结合使用,一般5-25mM。方便的缓冲液包括HEPES、磷酸缓冲液、乳酸缓冲液等等。
分离的细胞可收集于维持细胞活力的任何基质中,通常在收集管底部具有血清缓冲物。多种基质商业可得并可根据细胞的性质使用,包括dMEM、HBSS、dPBS、RPMI、Iscove's培养基等等,常常补充有胎牛血清。
以此方式产生了高度富含表达肿瘤相关糖抗原的癌干细胞的组合物。目标群体可以为或大约为细胞组合物的50%或以上,优选地为或大约为细胞组合物的75%或以上,且可以为90%或以上。通过表面表型鉴定出想要的细胞。细节在上文有所描述,其参考对应的公开。优选地,其癌干细胞表型另外可由其自我更新的能力而确认,这种能力是干细胞的根本属性。富集的癌干细胞群体可立即使用,或可冷冻于液氮的温度下长期储存,在解冻后可以重新使用。细胞可储存于例如10%DMSO、50%FCS、40%RPMI 1640培养基中。富含表达肿瘤相关糖抗原和任选的其它癌干细胞标记物的癌干细胞的细胞群体可用于多种筛选测定和培养中,如下文描述的。
富集的癌干细胞群体可在多种培养条件下在体外生长。培养基可以为液体或半固体的,例如,含有琼脂、甲基纤维素等等。细胞群体可方便地重悬于恰当的营养培养基中,如Iscove's修饰的DMEM或RPMI-1640,一般补充有胎牛血清(大约5-10%)、L-谷氨酰胺、硫醇(尤其是2-巯基乙醇)和抗生素如青霉素和链霉素。
培养基可包含细胞对其有应答的生长因子。如本文限定的,生长因子为能够通过对跨膜受体的特异性作用而促进细胞在培养基或在完好的组织中的存活、生长和/或分化的分子。生长因子包括多肽和非多肽因子。多种生长因子可用于培养细胞如,LIF、青灰因子(steel factor,c-kit配体)、EGF、胰岛素、IGF、NGF等等。除了生长因子之外,目标细胞可与成纤维细胞、基质细胞或其他饲养层细胞共同培养而生长。
还提供了一种试剂盒,用于对癌、癌的转移行为进行诊断、分期和/或预后,用于体内成像和/或监视治疗性癌处理的效力,其包括特异性结合肿瘤相关糖抗原的结合试剂及使用说明书。优选地、所述结合试剂结合表达于癌干细胞的肿瘤相关糖抗原,选自CD176、CD175、CD175s、CD174、CD173和CA19-9,更优选地选自CD176、CD174和CD173。
优选地,所述结合试剂是标记的。合适的结合试剂及标记在上文有描述,其参考相应的公开。试剂盒还可包括试管、缓冲液等等,以及使用说明书。
根据一个优选的实施方式,试剂盒包含至少一种其他试剂,其特异性结合其他干细胞标记物。优选地,所述干细胞标记物为糖蛋白。根据一个优选的实施方式,试剂盒包含至少一种进一步的试剂,其特异性结合糖蛋白,选自CD34、CD44、CD44v6、CD133和CD164。
还提供了筛选候选治疗剂用于有效地针对表达肿瘤相关糖抗原的癌干细胞的方法,此方法包括:
a)将所述试剂与根据本发明的细胞组合物相接触;
b)确定所述试剂针对所述肿瘤相关糖抗原的有效性。
相应的筛选方法尤其可用于体外测定和筛选方法,以检测、鉴定和/或分离对癌干细胞有活性的因子和治疗试剂,如化疗试剂、结合试剂或其他抗癌药物。尤其有意义的是对在人细胞上有活性的试剂进行筛选测定。多种测定可用于此目的,包括免疫测定法,用于检测蛋白质结合、确定细胞生长、分化及功能活性、因子产生等等。
在对候选治疗试剂的筛选测定中,通常将包含表达目的肿瘤相关糖抗原的癌干细胞的培养物与目的结合试剂相接触,试剂的作用是通过监视输出参数进行评估的,如标记物的表达、细胞活力等等。筛选还可以涉及确定相比于没有候选治疗试剂存在时的生长、增殖、活力和/或分化状态的调节,在候选治疗试剂存在下细胞的生长、增殖、活力和/或分化状态的调节。
优选地,所述肿瘤相关糖抗原选自CD176、CD175、CD175s、CD174、CD173和CA19-9、更优选地选自CD176、CD174和CD173。细节在上文有所描述,其参考了对应的公开。
细胞可如上文所描述是新鲜地分离、培养、遗传改造的以提供用于信号通路激活的标记物等等。细胞可以为克隆培养物的环境诱导变体:例如,将其分为独立的培养物并在不同条件下生长,例如在含或不含药物;存在或不存细胞因子。细胞对试剂(尤其是药学试剂)产生应答的形式,包括应答的时间性,是细胞生理状态的重要反映。
参数是细胞的可定量的组分,尤其是可精确测量的组分,可取地在高通量系统中。
通过将试剂加入至少一种哺乳动物癌干细胞的组合物而对候选试剂的生物学活性进行筛选,其中组合物中至少50%的细胞为对目的肿瘤相关糖抗原为阳性的细胞。组合物的进一步的特征在上文有描述,我们参考了相应的公开。测量应答试剂时的参数变化,结果通过与参考培养物进行比较而评估,例如为所述试剂存在或不存在时或由其他试剂获得。
可将试剂以溶液或易溶形式方便地加入培养细胞的培养基中。可以在直通系统中作为流液间歇地或连续地或备选地加入化合物丸剂以单一量或增量地加入原本静止的溶液。在直通系统中,使用了两种液体,一种是生理中性溶液,另一种为添加有测试化合物的相同溶液。第一种溶液在细胞上通过,随后是第二种。在单一溶液的方法中,测试化合物丸剂是加到细胞周围的培养基中的。培养基组分的总体浓度在添加丸剂之后或在直通方法的两种溶液之间不应当有显著的变化
要理解的是,本发明不限于所描述的具体的方法学、操作流程、细胞系、动物物种或属以及反应剂,这些可以变动。还要理解的是,本文所使用的术语只是用于描述具体实施方式的目的,不意欲限制本发明的范围,其只受到附随的权利要求的限制。
附图简述
附图显示了下文描述的实施例所得到的结果。
图1.1
a-c:对肺癌细胞系NCIH446进行共聚焦显微镜分析(放大率为×400)。用特异于CD44(红色)和CD176(绿色)的单克隆抗体对细胞进行染色。用DAPI(蓝色)对细胞核进行复染。CD44在多数NCIH446细胞中有强表达(a)。CD176表达可见于细胞团的细胞膜上(b)。融合的图片(c)显示了CD44和CD176在这些细胞团中共定位(黄色)。
d-i:CD44和CD176以及CD133和CD176在HCC组织中的共表达通过双重免疫荧光染色进行显示(放大率×200)。分别发现了CD176(绿色,d)/CD44(红色,e)及CD133(红色,g)/CD176(绿色,h)的共表达,由荧光重叠而显示(黄色,f和i)。
j,k:CD176在肺癌组织中的表达,通过免疫组织化学分析(放大率×200)。CD176发现于肺癌细胞(j)及肺鳞癌细胞(k)的细胞表面及细胞质中。
图1.2A
对细胞系SPC-A-1、GLC(肺癌)和HepG2(HCC)的细胞中CD44和CD176的共表达进行FACS分析。将细胞与抗-CD44(IgG)和抗-CD176(IgM)孵育,接着与抗-IgG-Cy3(γ-链特异性)及抗-IgM-FITC(μ-链特异)孵育。每个样品最少收集了10,000个事件。具有相应组合的标记物的细胞百分比在图表的每个部分有表示,表示两种标记物都有很强的关联。所显示的数据代表了数次独立的实验。
图1.2B
在4-OHT处理MDA-435(乳腺癌)细胞之前和之后对CD44和CD176的共表达进行FACS分析。具有标记物的相应组合的细胞百分比在图表的每个部分有表示。CD44+/CD176+细胞的数量在用4-OHT处理24h后有所增加。所显示的数据代表了数次独立的实验。
图2.1:
乳腺癌细胞的双重荧光染色。
a-c:细胞系MCF-7;d-l:乳腺癌组织切片。用单克隆抗体G44-26(CD44,IgG2b)或ANC9C5(CD133)以及用A70-C/C8(CD174,IgM)或A46-B/B10(CD173,IgM),对细胞进行染色,之后与抗-IgG-Cy3(γ链特异性,红色)及抗-IgM-FITC(μ链特异性,绿色)一同孵育。
c,f,i,l为融合图片;用DAPI(蓝色)复染细胞核。
CD173(a,d)在多种情况下与CD44(b,e)共表达。CD174(g,j)显示了与CD44(h)及与CD133(k)的共表达。放大率:200x。
图2.2:
A:对乳腺癌细胞系MDA-MB-435和MCF-7中CD44+/CD173+表达进行流式细胞分析。将癌细胞分别与抗-CD44(IgG)和抗-CD174(IgM)抗体进行孵育,随后与抗-IgG-Cy3(γ链特异性)及抗-IgM-FITC(μ链特异性)进行孵育。从三次类似的试验中取一次的值。两种细胞系的大部分都有两种标记物阳性表达(CD44和H2)。
B:在4-OHT处理之前和之后MDA-MB-231细胞上的CD44+/CD174+表达进行流式细胞分析。4-OHT处理导致表达CD44和CD174(LeY)两种的细胞比例增加。从三次类似的试验中取一次的值。
图2.3:
用CD173mAb A46-B/B10染色的管内腺癌切片的免疫组织化学。剩余的管壁上的基底细胞(干细胞样细胞)有强染色。
图2.4:
乳腺癌细胞系MDA-MB-231、MDA-MB-435和MCF的裂解物的免疫沉淀。CD44-免疫沉淀的材料通过SDS-PAGE分离并使用mAbCD173进行免疫杂交而分析。数据显示在乳腺癌中CD44携带有CD173。
图3:
抗-CD176抗体的氨基酸序列
图4:
通过BrdU细胞增殖ELISA测量对肿瘤细胞增殖的抑制。将CD176-阳性的NM-D4细胞与抗-CD176IgM抗体(包含或缺少J链)或不相关同种型对照(hIgM)一同培养。用羊抗人IgM Fab2抗体(Fc5μ)进行交联。显示了相对未处理对照细胞的增殖百分比。数据说明用两种IgM形式(含或不含J链)都产生了浓度依赖的增殖抑制。
图5:
通过膜联蛋白V检测来测量抗-CD176IgM抗体诱导的凋亡。将AML细胞系KG-1的两种亚系(CD176-阳性(A)及CD176-阴性(B))与抗-CD176IgM抗体(包含或缺少J链)一同孵育。hIgM:不相关同种型对照。死亡细胞通过Sytox绿色荧光进行测量。显示了抗-CD176IgM抗体诱导的CD176-特异性凋亡。
图6:
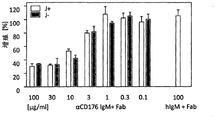
通过铕释放测定来测量抗-CD176IgM抗体诱导的补体依赖细胞毒性(CDC)。将AML细胞系KG-1(CD176-阳性)在抗-CD176IgM抗体(含(J+)或不含(J-)J链)存在下进行培养,加入兔的补体。不相关的IgM同种型用作对照(hIgM)。如所显示的,浓度依赖的CDC是由抗-CD176IgM抗体诱导的。
图7:
通过铕释放测定来测量抗-CD176IgG1抗体诱导的抗体依赖细胞毒性(ADCC)。将腺癌细胞系PANC-1(CD176-阳性)在抗-CD176IgG1抗体的存在下进行培养,并以E:T比例100:1加入来自健康供体的PBMC。hIgG1:不相关同种型对照。如所显示的,浓度依赖的ADCC是由抗-CD176IgG1抗体诱导的。
实施例
I.肺、乳腺及肝的癌干细胞上CD176(Thomsen-Friedenreich抗原)的表达
1.材料和方法
抗体
所使用的抗体为:CD44mAb(G44-26,BD Biosciences,FranklinLakes,NJ,USA)、CD 133mAb(ANC9C5,Ancell,Bayport,MN,USA,CD176mAb(NM-TF2,Glycotope GmbH,Berlin,Germany)、MUC1mAb(PankoMab,Glycotope GmbH)。
细胞系和细胞培养
广泛的人癌细胞系,包括来自乳腺癌(MDA231、MDA435和MCF-7)、肺癌(SPC-A-1和GLC-82,肺腺癌;NCIH446,小细胞肺癌;801-D,巨细胞肺癌),及肝细胞癌(HepG2和HuH-7)用于此研究。将细胞系于含有10%胎牛血清的Dulbecco’s Modified EagleMedium(DMEM)中进行常规培养。
免疫组织化学
将培养的细胞铺于多聚赖氨酸(Sigma,Saint Louis,MO,USA)包被的玻片上,在含有10%胎牛血清的DMEM/F12基质中过夜。此后,小心吸走基质,将玻片风干。包好的玻片可储存于-80℃直到使用。为进行免疫荧光双染色,将细胞以冷的(-20℃)丙酮固定15min,用溶于磷酸缓冲盐溶液(PBS)的2%牛血清白蛋白(BSA)封闭30分钟,将其与针对CD44或CD133的抗体以及针对CD176的mAb一起孵育60min。然后将玻片与异硫氰酸荧光素(FITC)-缀合的抗-小鼠IgM(μ-链特异性)(F9259,Sigma)及Cy3-缀合的山羊抗-小鼠IgG(γ-连特异性)(#69732,Jackson Laboratories,West Grove,PA,USA)的混合物一同孵育。用4',6-二脒基-2-苯基吲哚二盐酸(DAPI)(Beyotime Biotechnology,Jiangsu,China)进行复染。阴性对照以培养基代替特异性mAb进行反应。用甘油进行封片并使用共聚焦显微镜(Olympus,Tokyo,Japan)及荧光显微镜进行分析。在数字图像上对阳性细胞或双阳性细胞的百分比进行计数。
流式细胞分析
制备细胞系的细胞混悬液,为1×106个细胞/100μl。细胞用含有2%BSA的PBS洗两次并与合适稀释度的一抗在4℃孵育20min,随后与合适浓度的抗-IgG-Cy3(γ链特异性)及抗-IgM-FITC(μ链特异性)在4℃孵育20min。用FACScan(BD Biosciences,Franklin Lakes,NJ,USA)进行流式细胞术。收集10,000个细胞的数据并使用WinMDI软件分析FCS数据文件。
为进行4-羟基他莫昔芬处理,将MDA231、MDA435和MCF-7乳腺癌细胞系接触4-OHT(#H6278,Sigma),终浓度为20nM,孵育24h。然后如上文所描述的进行流式细胞术分析。
组织及免疫组织化学
21个肺癌(13个腺癌及8个鳞细胞癌)、15个乳腺癌以及21个肝细胞癌(HCC)标本获自做过初步手术的患者。样品是完全加密的,以保护患者的隐私,并得到地方研究伦理委员会及所有参与单位的认可。
将新鲜组织在-20℃与OCT化合物(最适切割温度)小心地包埋于塑料模具中,在低温恒温小室中平衡后将其切成4-8μm的切片,并用冷的(-20℃)丙酮固定15min。为进行免疫荧光双染色,将组织切片封闭并与合适稀释度的一抗孵育60min,然后与抗-IgG-Cy3(γ-链特异性)及抗-IgM-FITC(μ-链特异性)二抗孵育,用DAPI复染,用甘油进行封片于玻璃片上用于显微镜分析。为进行免疫过氧化物酶染色,将组织切片用3%H2O2处理30min以封闭内源过氧化物酶,用PBS洗涤3次,并用2%BSA进行封闭。将其与一抗一起孵育,然后用过氧化物酶标记的山羊抗-小鼠免疫球蛋白抗血清(DAKO,Copenhagen,Denmark)处理。阴性对照是用溶于PBS的2%BSA代替mAb进行反应。抗-MUC mAb(PankoMab)用于肺癌标本作为所有批次中的阳性对照。用过氧化物酶底物二氨基苯联胺显色。复染是用苏木精进行的。在100×放大率下使用Nikon显微镜对细胞进行计数。在数字图像上评估双阳性细胞的百分比。
夹心ELISA
用1ml的1%Triton-100(溶于100mM磷酸钠PH 7.5,150mM NaCl)含有蛋白酶抑制剂混合物(#539134,Calbiochem,Darmstadt,Germany)处理1,000,000个细胞并在4℃振荡30min进行均质化。在离心机中以15,000g离心10min后,取出上清。使用针对CD44的捕获抗体(工作浓度为1μg/ml)对96孔聚苯乙烯微孔板进行包被,4℃,14h。用5%BSA封闭剩余的蛋白质结合位点,将100μl的抗体上清加至孔中并于室温下孵育2h。然后将平板与CD176mAb孵育,随后与过氧化物酶标记的山羊抗-小鼠IgM抗体(μ-链特异性)(SouthernBiotech,Birmingham,AL,USA)一同孵育。用o-苯二胺二盐酸(OPD)溶液在室温下进行显色反应。反应以2.5M硫酸终止。阴性对照是用溶于PBS的2%BSA代替mAb进行反应。在30min内使用微孔板读数仪(Bio-Rad,Hercules,CA,USA)确定每个孔492nm处的光学密度。
统计学分析
使用卡方检验或Fisher精确概率检验分析数据。还对计算数据进行了皮尔森相关性分析。P<0.05的值被认为具有统计显著性。
2.结果
肺、乳腺、肝脏的癌细胞系中CD44和CD133的表达
在大多数的癌细胞系中,超过60%的细胞上检测到了CD44。一种细胞系HuH-7(HCC)显示了低百分比的CD44-阳性细胞。CD133+细胞只占本研究使用的细胞系的很小的亚群(少于1%的细胞),除了801-D(巨细胞肺癌)和HuH-7(HCC)外。这两种细胞系分别在15%及6%的细胞表面有持续的CD133的表达。
肺、乳腺、肝脏的癌细胞系中CD176的表达
通过用mAb NM-TF2进行流式细胞术和免疫细胞化学分析,我们发现CD176定位于细胞表面及细胞质中。细胞系以不同的强度表达CD176:MDA231、MDA435(乳腺癌)及HuH-7(HCC)包含5%-30%的阳性细胞;SPC-A-1(肺腺癌)、801-D(巨细胞肺癌)及HepG2(HCC)显示有30%-60%的阳性细胞;GLC-82(肺腺癌)、NCIH446(小细胞肺癌)及MCF-7(乳腺癌)具有超过60%的阳性细胞。
肺、乳腺、肝脏的癌细胞系中CD176、CD44、CD133的共表达
由于CD44和CD133是癌起始细胞的公认标记物(Chu等人2009;Bao等人2006;Ponnusamy and Batra 2008),我们检查了是否其中之一或二者都与CD176共表达。在细胞系中进行的双重免疫荧光染色实验表明CD44和CD176位于细胞表面并在单个细胞或细胞团上都显示出共表达(图1.1,a-i)。流式细胞术实验显示了以下的共表达数据。MCF-7(乳腺癌)包含大约7%的CD44+/CD176+细胞,SPC-A-1、801-D及HepG2包含30%-60%的CD44+/CD176+细胞,且GLC-82和NCIH446具有超过60%的CD44+/CD176+细胞(见表1.1、图1.1、1.2)。
表1.1:在上皮癌细胞系中对CD44和CD176表达的流式细胞术及免疫荧光分析
对阳性细胞百分比的计数
相反,大多数细胞系只包含少量具有CD133+/CD176+表型的细胞(少于1%)。例外的是,801-D和HuH-7具有超过5%的细胞有CD133+/CD176+表型(表1.2)。
表1.2:在上皮癌细胞系中对CD133和CD176表达进行的流式细胞术及免疫荧光分析
对阳性细胞百分比的计数
为评估CD44和CD176的表达是否同时受到外部处理的影响,将雌激素受体配体他莫西芬(4-OHT)加入乳腺癌细胞(24h,20nM)。我们的结果表示,如流式细胞术所显示的,MDA231和MCF-7没有显著增加CD44+/CD176+共表达细胞的数量,而MDA435中CD44+/CD176+细胞百分比在处理后有所增加(图1.2B)。
CD176在肺癌组织中的表达
在本研究中,肺癌组织中CD176的表达是通过使用mAb NM-TF2而研究的。所检查的组织来自21个患者,其包括13种腺癌及8种鳞细胞癌。CD176分布于细胞表面及细胞质中。实施例显示于图1.1,j、k。肺癌中CD176-阳性细胞的百分比显示于表3。4例肺癌显示超过50%的阳性细胞。这些数据确认了CD176在肺癌组织中的表达,这与较早的文献相反(Toma等人1999),这是共表达实验的前提条件。通过统计分析的方式,将CD176表达与临床病理特征进行比较。显示>5%阳性细胞的例子被定义为阳性。这些结果显示了CD176状态与患有肺癌的患者中的肿瘤分级及转移有相关性(P<0.05)。然而,CD176表达与其他临床病理特征包括患者年龄、性别或组织学亚型(腺癌或鳞细胞癌)有统计学显著的相关性。
肺、乳腺及肝细胞癌组织中CD176与CD44或CD133的共表达
所考虑的组织中CD44、CD133和CD176表达的免疫组织化学数据显示于表1.3。与癌细胞系类似,CD44在所有癌中有强烈的分散的表达,且有高百分比的表达(超过60%)。CD133+细胞在大多数病例中有所发现,但是只存在于给定的癌细胞组织中的一小部分细胞亚群中(少于总癌细胞的10%)。有2例肺癌、3例乳腺癌及1例HCC完全不表达CD133。CD133+细胞以分散的形式或成团的形式存在。CD133的表达未显示与性别、年龄或肺癌组织学亚型的任何统计学显著的相关性。
表1.3:在肺、乳腺、肝癌组织中评估免疫组织化学阳性率
发生反应的病例数量/所检查的病例总数量
检查了新鲜临床样品中CD176与CD44或CD133的共表达。在癌组织中进行的双重染色结果显示5~30%的CD44+细胞同时表达了CD176(见,表1.4),且大多数CD133+细胞也表达CD176。然而,我们还注意到CD176与CD44或CD133的共表达并非发现于每个有标记物之一的阳性表达的细胞中。一些CD44+和CD133+细胞不表达CD176,反之亦然。HCC比肺癌或乳腺癌具有显著多的CD133+CD176+表型的细胞。肺癌中CD176和CD133的状态之间有统计学显著的相关性(P<0.05)。本研究中未观察到临床病理特征与CD44+CD176+表型间的相关性。
表1.4:肺、乳腺及肝脏癌组织中的CD44,CD133and CD176表达的免疫荧光分析
对阳性细胞百分比的计数
对CD44携带CD176的检测
在数种癌细胞系中通过夹心ELISA分析潜在的CD176的糖蛋白载体分子。我们使用以CD44作为捕获抗体包被的聚苯乙烯微孔板以收集全细胞裂解物中的CD44糖蛋白。然后将平板与作为检测抗体的NM-TF2(CD176)一同孵育。如显示于表1.5的,发现所捕获的CD44在所有肺(4)和肝脏(2)癌细胞系及3种乳腺癌细胞系中的2种当中都与CD176mAb反应,表示CD44在这些例子中显然为CD176的载体分子。
表1.5:夹心ELISA中对CD176的反应性结合
根据OD490减去空白的计分,如下:++,>0.5;+,0.2-0.5;(+),0.1-0.2;-,<0.1。
表1.6:乳腺癌细胞中CD44+/CD176+细胞在4-OHT处理后有所增加
对阳性细胞百分比的计数
3.讨论
大量的出版物使得人们普遍接受了这样一种观点:如果不是全部,大多数肿瘤类型的起始、维持及扩散在本质上是由于一小部分细胞群体,称为癌起始细胞或癌干细胞(Chu等人2009;Bao等人2006)。
癌干细胞显示有分化为活性扩增的肿瘤细胞的倾向。其与肿瘤实质中大多数细胞有明显的差异,但是其应当作为癌治疗中的(共同)靶标。近年来已经描述了癌起始细胞的大量的或多或少有特异性的标记物。这些标记物的症结在于有太多,并且其不够一致。在这些标记物中,最为广泛接受的为CD44(Ponnusamy和Batra 2008;Shipitsin等人2007)。另一种膜糖蛋白,CD133,也已被提出能够鉴定脑、结肠、肺和其他实体瘤中的癌起始群体(Tirino等人2008)。CD133是一种独立的预后标记物,其与患有恶性肿瘤的患者整体存活率低相关(Horst等人2008)。然而,一份最近的报告显示CD133阴性细胞也能够在NOD/SCID小鼠中具有长期的致瘤性(Shmelkov等人,2008)。
在作为本发明基础的本研究中,在来自肺癌、乳腺癌和肝癌的细胞系及临床样品中评估了CD44和CD133的表达。发现肿瘤细胞中大多数对于CD44成阳性染色。相反,所研究的大多数癌细胞系显示了低的CD133表达。染色后发现,CD133在肺癌、乳腺癌和肝癌组织中有不同强度的持续表达。其他作者报道了CD133分别表达于结肠癌(Ricci-Vitiani等人,2007)、非小细胞肺癌(Tirino等人,2009)及脑肿瘤(Singh等人,2004)中肿瘤细胞总数的大约2.5%及6-29%的细胞上。
然后分析癌起始细胞的这两个标记物CD44和CD133与CD176的共表达。大多数细胞共表达CD176和CD44,尤其是在肺癌细胞系及HepG-2中在所有其他所检查的细胞系中有显著数量的细胞表达二者。在所检查的肺、乳腺和肝脏的癌组织中,共表达CD176和CD44的细胞数量达到5-30%。共表达CD176和CD133的细胞数量在所有病例中都低得多(表达CD133的细胞总数也低得多),但是共表达的细胞也从没有完全缺失。
本文显示的数据表示CD176不仅仅表达于实体瘤的成熟的癌细胞中,也表达于癌起始细胞中。这为CD176作为引人注目的治疗性靶标添加了更多的砝码。还分析了CD176+乳腺癌细胞数量是否在用他莫昔芬(4-OHT)处理后得到加强。据报道,他莫昔芬诱导G0/G1期生长停滞并抑制乳腺癌细胞的增殖。一项近期的研究显示他莫昔芬处理增加了乳腺癌干细胞样细胞的数量(Mani等人,2008)。在我们的研究中,他莫昔芬处理乳腺癌细胞在3种细胞系中的1种(MDA-435)中增强了CD44+/CD176+表型。根据癌干细胞的理论,癌的复发和转移依赖于癌起始细胞。这样的具有与肿瘤实质特性不同性质的细胞群体的存在可以解释为何常规治疗如用他莫昔芬的治疗仅仅能够抑制癌但是经常不能完全将其消除。相反,治疗可能甚至增加癌起始细胞的数量(Mani等人。2008)。理论上,癌起始细胞的消除能够阻止肿瘤的复发。靶向癌起始细胞的新的治疗手段的发展因此可对癌症治疗有深刻的影响。因此,对实体瘤的癌起始细胞上CD176的鉴定对未来基于CD176的免疫治疗的应用非常重要。
CD176的解蔽似乎是只涉及细胞膜上存在的所有可能的候选糖蛋白中的一些糖蛋白的选择性过程。上皮细胞中鉴定出的CD176的最为主导载体分子为多形上皮粘蛋白MUC-1,例如在结肠癌中(Barr等人,1989;Cao等人,1997;Baldus等人1998)。本文中,确定了所分析的细胞中CD44是否为core-1的载体分子。为此,我们应用了特殊的夹心ELISA并用其检查肺癌、乳腺癌和肝癌。我们的数据表示在除了结肠癌之外的肿瘤中CD176很大部分由CD44携带。已经发现CD176抗原为肺癌患者中有用的预后标记物(Takanami,1996),但是对其在此组织中的表达还有相矛盾的报道(Toma等人,1999)。在我们的研究中,我们重新检查了该问题,使用了单克隆抗体NM-TF2,其已经有很好的定性并适合用于免疫组织化学及其他技术。在大多数肺癌细胞系中观察到CD176的表达。在临床肺癌样品中,我们还发现超过50%的病例中为CD176+,在阈值(5%阳性细胞)之上。
总之,在人的肺癌、乳腺癌和肝癌以及衍生自这些恶性肿瘤的细胞系中观察到CD176(Thomsen-Friedenreich抗原,core-1)的表达。人的肺癌、乳腺癌和肝癌中的CD44和CD176以及CD133和CD176的共表达表示CD176不仅仅表达于成熟的癌细胞上,也表达于癌起始细胞上。这使得CD176由于其在正常和良性成年人组织中几乎不存在(Cao等人1996)而成为肿瘤治疗的甚至更有前途的靶标。
II.CD173(H2)和CD174(LewisY)与CD44在乳腺癌引发细胞
上的共表达
1.方法和材料
细胞系和细胞培养
乳腺癌细胞系MDA-MB-231、MDA-MB-435和MCF-7用于本研究。将这些细胞系于含有10%胎牛血清的Dulbecco’s Modified EagleMedium(DMEM)中进行常规培养。细胞在37℃、5%CO2/95%空气的环境及几乎100%的相对湿度下生长。
免疫细胞化学
将培养的细胞铺于多聚赖氨酸(Sigma,SaintLouis,MO,USA)包被的玻片上,在培养基中过夜。此后,小心吸走培养基,将玻片风干。包好的玻片可储存于-80℃直到使用。为进行免疫细胞化学,将细胞以冷的(-20℃)丙酮固定15min,用2%牛血清白蛋白(BSA)封闭30分钟,将其与CD44mAb(G44-26,小鼠IgG2b,BDBiosciences,FranklinLakes,NJ,USA)连同mAb CD173(A46-B/B10,小鼠IgM,Karsten1988)或CD174(A70-C/C8,小鼠IgM)一同孵育60min,后两种抗体皆来自GlycotopeGmbH(Berlin,Germany)。此外,还使用了CD133抗体(ANC9C5,Ancell,Bayport,MN,USA)。然后将玻片与异硫氰酸荧光素(FITC)-缀合的抗-小鼠IgM(μ-链特异性)(F9259,Sigma)及Cy3-缀合的山羊抗-小鼠IgG(γ-连特异性)(#69732,Jackson Laboratories,WestGrove,PA,USA)的混合物一同孵育。用4',6-二脒基-2-苯基吲哚二盐酸(DAPI)(Beyotime Biotechnology,Jiangsu,China)进行复染。阴性对照与小鼠血清而不是特异性mAb一同孵育。用甘油进行封片并使用荧光显微镜进行分析。
流式细胞分析
制备细胞系的细胞混悬液,为1×106个细胞/100μl。用含有2%BSA的PBS洗两次并与一抗在4℃孵育20min,随后与合适浓度的抗-IgG-Cy3(γ链特异性)和抗-IgM-FITC(μ链特异性)在4℃孵育20min。用FACScan(BDBiosciences,Franklin Lakes,NJ,USA)进行流式细胞术。收集10,000个细胞的数据并使用WinMDI软件分析FACS数据文件。
为进行4-羟基他莫昔芬处理,将MDA-MB-231、MDA-MB-435和MCF-7乳腺癌细胞系接触4-OHT(#H6278,Sigma),终浓度为20nM,孵育24h。然后如上文所描述的进行流式细胞术分析。
免疫沉淀
用1ml的1%Triton-100(溶于50mM Tris-HCl pH8.0,150mMNaCl)含有蛋白酶抑制剂混合物(#539134,Calbiochem,Darmstadt,Germany)处理1,000,000个细胞并在4℃振荡30min进行均质化。在以15,000g离心10min后,取出上清。蛋白质G-琼脂糖珠子(#P-4691,Sigma)已经经过预清除以移除非特异性结合的物质,并与抗-CD44抗体在摇床上于4℃下孵育4h。将蛋白质G-琼脂糖珠子加入上清并在翻滚式混合仪上于4℃下孵育过夜。通过离心收集珠子并进行洗涤。将沉淀重悬于SDS-聚丙烯酰胺凝胶电泳(PAGE)样品缓冲液中并煮沸5min。然后将免疫沉淀物在聚丙烯酰胺凝胶(8%)上分离并用抗-CD173和抗-CD174抗体在蛋白质杂交中进行探针检测。
夹心ELISA
使用针对CD44的捕获抗体以PBS中1μg/ml对96孔聚苯乙烯微孔板进行包被,4℃,14h。用5%BSA封闭后,将100μl的如上文制备的上清加至孔中并于室温下孵育2h。然后将平板与CD173或CD174mAb孵育,随后与过氧化物酶标记的山羊抗-小鼠IgM抗体(μ-链特异性)(Southern Biotech,Birmingham,AL,USA)一同孵育。用o-苯二胺二盐酸(OPD)溶液在室温下进行显色反应。反应以2.5M硫酸终止。阴性对照是用2%BSA代替mAb进行反应。在30min内使用微孔板读数仪(Bio-Rad,Hercules,CA,USA)确定每个孔492nm处的光学密度。
组织和免疫组织化学
15个肺癌标本获自做过初步手术的患者。样品是完全加密的,以保护患者的隐私,并得到地方研究伦理委员会及所有参与单位的认可。
将新鲜组织在-20℃下与OCT化合物(最适切割温度)小心地包埋于塑料模具中,在低温恒温小室中平衡后将其切成4-8μm的切片,用冷的(-20℃)丙酮固定15min。然后用上文所描述的方法进行免疫荧光双染色。在100×放大率下使用Nikon显微镜对细胞数量进行计数。在数字图像上评估双阳性细胞的百分比。
在3个另外的乳腺管内癌的病例中,还进行了免疫过氧化物酶染色,将组织切片用3%H2O2处理30min以抑制内源过氧化物酶,用PBS洗涤3次,并用2%BSA进行封闭。将其与CD173抗体一起孵育,然后用过氧化物酶标记的山羊抗-小鼠免疫球蛋白抗血清(DAKO,Copenhagen,Denmark)处理。阴性对照是用2%BSA代替CD173进行反应。用二氨基苯联胺显色。复染是用苏木精进行的。
统计学分析
使用未配对t检验、Fisher精确检验或Spearman相关检验进行统计学分析数据表示为平均值(平均值的标准偏差±SEM)。P<0.05被认为是统计学显著的。
2.结果
乳腺癌细胞系上CD173和CD174的表达
流式细胞分析和免疫组织学染色显示了CD173和CD174定位于细胞表面(图2.1a)。乳腺细胞系显示了CD173和CD174常有表达:MDA-MB-231、MDA-MB-435和MCF-7分别包含大约27%、92%及80%的CD173阳性细胞,以及大约44%、57%和72%的CD174阳性细胞。
乳腺癌细胞系中CD44与CD173或CD174的共表达
进行免疫细胞学染色实验以研究乳腺癌细胞上CD173或CD174与CD44的共表达。我们在许多细胞中观察到CD44的染色与CD173及CD174有重叠;图1a-c中给出一个实例。来自流式细胞术实验的半定量数据显示于图2.2A,并总结于表2.1。
表2.1:对乳腺癌细胞系中CD44、CD173和CD174的表达进行的流式细胞分析
为评估CD44、CD173和CD174的表达在外源处理后是否同时受到影响,我们用4-OHT处理了这些乳腺癌培养细胞。在半定量的流式细胞分析中,4-OHT处理增加了MDA231(P<0.05)(图2.2B)而不是MDA-MB-435和MCF-7细胞(P>0.05,数据未显示)中CD44+CD173+和CD44+CD174+的细胞百分比。
乳腺癌组织中CD44或CD133与CD173或CD174的共表达
在所检查的15个乳腺癌组织中,CD44、CD173和CD174染色也主要在细胞膜上观察到。CD44、CD173和CD174阳性细胞以分散或成团的形式存在,在不同个体中有变化。CD173和CD174阳性细胞可见于大多数病例。CD173和CD174阳性细胞的平均百分比分别为总癌细胞的51%和52%。所有病例中的CD44都显示了强的免疫反应性(阳性染色的癌细胞达到53%)。有意义的是,有CD173和CD174表达增加的病例与CD44表达提高有相关性(P<0.05)。最重要地,分别有95%的CD173和CD174阳性细胞共表达了CD44抗原(图2.1,d-i)。
CD133也是癌起始细胞的标记物。因此,我们提出在乳腺癌组织中CD173或CD174是否与此标记物共表达的问题。我们发现CD133确实与CD173和CD174共表达,尽管百分比较低(图2.1j-l)。此外,我们发现有CD173和CD174表达增加的病例与CD133表达提高相关(P<0.05)(数据未显示)。
管内乳腺癌基底细胞上CD173的表达
在3例管内乳腺癌中,CD173mAb对剩余的管壁基底细胞染色(图2.3)。在相同切片的过渡组织的正常管道中,周围的管(主要是基底)细胞层只是偶尔有CD173阳性。这些细胞中CD173的表达不依赖于个体的ABH血型或分泌腺状态(数据未显示)。
CD44携带CD173或CD174的证据
在3个乳腺癌细胞系中通过免疫沉淀及夹心ELISA分析了潜在的携带CD173或CD174的糖蛋白。使用mAb CD173和CD174对来自这三个细胞系裂解物的CD44免疫沉淀物进行免疫杂交分析。两种抗体都染出了CD44条带(图2.4)。
进行夹心ELISA,用抗-CD44作为捕获抗体,之后使用mAbsCD173和CD174,两种抗体在所检查的3种细胞系中都为阳性得分,表示CD173和CD174表位表达于CD44分子上(表2.2)。
表2.2:对3个乳腺癌细胞系进行的夹心ELISA中CD173和CD174抗体对作为捕获抗体的CD44的结合
根据OD490值减去空白的得分如下:++,>0.5;+,0.1-0.5;(+),0.05-0.1;-,<0.05
3.讨论
脑癌、肺癌和乳腺癌中已经很好地记载了癌起始细胞的存在(Tirino,2008)。其在功能上被限定为自我更新、静态的多能细胞,能够进行多系的分化。根据癌干细胞理论,癌的复发和转移依赖于癌起始细胞(Gilbert,2009)。由于癌起始细胞或癌干细胞与肿瘤实质的大部分细胞有明显差异,所以研究癌起始细胞上的表面分子的表达和功能为肿瘤生物学的重要方面。
在此研究中,我们检查了乳腺癌中CD173和/或CD174是否与癌起始细胞标记物CD44共表达。
本研究表明CD44与CD173或CD174一同位于细胞表面并在显著比例的培养的乳腺癌细胞及取自乳腺癌的组织标本中有共表达。据报道,他莫昔芬增加乳腺癌干细胞的数量(Mani,2008)。在此研究中,他莫昔芬(4-OHT)处理后培养的细胞中,CD44+/CD173+或CD44+/CD174+乳腺癌细胞的数量可以得到加强。因此,我们推断乳腺癌中CD44与CD173和CD174共表达。
一项有意义的观察为管内乳腺癌的病例中,剩余管壁细胞上有CD173的强染色。这表示在肿瘤实质扩张的机械压力下干细胞样基底细胞的增殖活性。由于H和LeY抗原为发育调节的抗原,因此该现象可能也暗示了这些细胞正在进行上皮-间充质转化(EMT)。
基于2型的ABH寡糖携带于数种不同的糖蛋白和糖脂上(Hakomori,1981)。在上皮卵巢癌中,CD174的主要载体蛋白质为CA125和MUC1(Yin,1996)。在CD34+造血干细胞中,CD173和CD174的主要载体为一种170kDa的糖蛋白(Cao,2001)。CD44还是H抗原的载体(Rapoport,1999)。本文我们使用了夹心ELISA及免疫沉淀以证明乳腺癌细胞中CD44为CD173和CD174的主要载体。
人们认为癌表达的糖蛋白上的CD173和CD174结构有助于粘附、细胞聚集、侵入及转移。CD174参与了肿瘤相关血管生成的早期细胞-细胞接触(Moehler,2008)。单单靠组织化学无法决定癌起始细胞上CD173和CD174的表达有何等的功能与意义。然而,已经证明癌中CD173和CD174表达的病理生理学意义。CD173和CD174为癌患者中恶性肿瘤程度的明显的标记物(Fujitani,2001;Steplewska-Mazur,2000)。相比于具有较好预后的患者,较高的CD173和CD174表达常常见于具有高等级且预后不良的患者中(Baldus,2006)。在淋巴结阴性乳腺癌中,CD174的过表达与显著降低的病人存活率相关(Madjd,2005)。由α1-2岩藻糖基化介导的致瘤性增加与对凋亡的抗性及由免疫控制的逃逸增加有关(Goupille,2000)。
当前的癌症治疗的失败可归咎于药物对潜在的静态癌干细胞效果甚微。因此治疗策略需要考虑癌干细胞的存在。乳腺癌中癌干细胞表明上的CD173尤其是CD174的高表达表示这些抗原为有前途的抗体介导的诊断和治疗的靶标。更近的研究已经表示施用低剂量的抗-CD174mAb可产生有效的抗肿瘤应答,甚至不会诱导TNF-α释放(Dettke,2000),目前正在评估缀合阿霉素的抗-CD174抗体在上皮肿瘤治疗中的效应(Tolcher,1999)。
总之,对癌干细胞上CD173和CD174的鉴定为靶向癌起始细胞的治疗提供了新的机遇,尤其是其能防止复发。
III.抗-CD176抗体的治疗活性
以下实施例是使用IgM-或IgG1-型的单克隆抗-CD176抗体进行的,其具有以下的互补决定区组:
表3:抗-CD176抗体的互补决定区
1.细胞增殖的抑制
为证明抗-CD176抗体抑制表达肿瘤相关糖抗原CD176的癌细胞的细胞增殖能力,将抗-CD176IgM抗体加入CD176-阳性癌细胞系的扩增细胞中。使用溴脱氧尿苷细胞增殖ELISA测量对癌细胞增殖的抑制。简言之,将CD176-阳性的髓细胞性白血病细胞系NM-D4(描述于WO 05/017130)的细胞接种于96-孔板(2,000个细胞/孔),于补充有5%FCS和1%谷氨酰胺的RPMI中。用抗-CD176IgM抗体(含或不含J链)或不相关同种型对照(ChromPure hIgM,JacksonImmuno Research)处理细胞。加入交联的二抗Fab2山羊抗人IgM(Fc5μ)(Jackson Immuno Research)至终浓度为10μg/ml。培养5天后,与未处理的对照细胞相对的增殖百分比通过BrdU细胞增殖ELISA(Roche)而测量。
结果是,本测定显示了抗-CD176IgM抗体对CD176-阳性癌细胞增殖的浓度依赖性抑制(图4)。使用抗-CD176IgG抗体获得了类似的结果。
2.细胞凋亡的诱导
使用膜联蛋白V测定法来测试抗-CD176抗体诱导表达CD176的癌细胞的凋亡的能力。将急性骨髓性白血病细胞系KG-1的CD176-阳性及CD176-阴性(对照)亚系接种于96-孔板(1.5x105个细胞/孔),于补充有1%FCS的RPMI中。加入用抗-CD176IgM抗体(含或不含J链)或不相关同种型对照(ChromPure hIgM,Jackson ImmunoResearch)至终浓度为10μg/ml。24小时后,分析磷脂酰丝氨酸暴露情况,其为凋亡的早期标记物。用膜联蛋白V-APC(BD Biosciences)和Sytox绿(标记死亡细胞)对细胞进行15分钟的染色并通过流式细胞术分析。
结果是,实验表示抗-CD176IgM抗体诱导了CD176-特异性的凋亡(图5)。使用抗-CD176IgG抗体得到类似的结果。
3.针对癌细胞的CDC的诱导
抗-CD176抗体诱导补体依赖的细胞毒性(CDC)的能力导致表达CD176的癌细胞裂解,这一点由以下的CDC-测定得到证明。通过电穿孔向急性骨髓性白血病细胞系KG-1(CD176-阳性)的细胞加载铕并与不同浓度的抗-CD176IgM抗体(含或不含J链)或不相关同种型对照(ChromPure hIgM,Jackson Immuno Research)在96孔板中孵育。加入幼兔补体(Cedarlane)至终浓度为0.8%。4小时后,将25μl上清转移至200μl的增强溶液中(Delfia)并使用荧光读数仪Infinite F200(Tecan)对铕释放进行定量。最大释放(具有TritonX-100的靶标细胞),自发释放(靶标细胞)及基础释放(靶标细胞的上清)用作计算特异性细胞毒性的对照。
因此,CDC-测定表明浓度依赖的CDC是由抗-CD176IgM抗体诱导的(图6)。
4.针对癌细胞的ADCC的诱导
抗-CD176抗体诱导抗体依赖的细胞毒性(ADCC)的能力导致表达CD176的癌细胞裂解,这一点由以下的ADCC-测定得到证明。通过电穿孔向胰腺癌细胞系PANC-1的细胞中加载铕并与不同浓度的抗-CD176IgG1抗体或不相关同种型对照(hIgG1,Sigma Aldrich)在96孔板中孵育。以100:1的比例向靶标细胞加入原代的人外周血单核细胞(PBMC)作为效应子。6小时后,将25μl上清转移至200μl的增强溶液中(Delfia)并使用荧光读数仪Infinite F200(Tecan)对铕释放进行定量。最大释放(具有Triton X-100的靶标细胞),自发释放(靶标细胞)及基础释放(靶标细胞的上清)用作计算特异性细胞毒性的对照。
因此,ADCC-测定表示浓度依赖的ADCC是由抗-CD176IgG1抗体诱导的(图7)。
5.总结
上述实验表示针对CD176的抗体能够在表达肿瘤相关糖抗原CD176的细胞中抑制细胞增殖、诱导凋亡并诱导CDC和/或ADCC.因此,显示了抗-CD176抗体为针对表达CD176的癌干细胞的潜在的治疗试剂。
Claims (18)
1.特异性结合肿瘤相关糖抗原的结合试剂,用于处理表达所述肿瘤相关糖抗原的癌干细胞。
2.根据权利要求1的结合试剂,其中肿瘤相关糖抗原选自CD176、CD175、CD175s、CD174、CD173和CA19-9。
3.根据权利要求1或2的结合试剂,其中癌干细胞具有一项或多项下列特征:
a)该癌干细胞表达至少一种干细胞标记物,其为携带所述肿瘤相关糖抗原的糖蛋白;
b)该癌干细胞表达一种或多种干细胞标记物,其选自CD34、CD44、CD44v6、CD133和CD164;
c)所述肿瘤相关糖抗原是携带于该癌干细胞所表达的肿瘤相关糖蛋白上的;
d)所述肿瘤相关糖抗原为肿瘤特异性的;和/或
e)所述肿瘤相关糖抗原主要或专门地表达于癌干细胞上而不表达于并非癌干细胞的癌细胞上。
4.根据权利要求1-3中任何一项的结合试剂,其中癌干细胞来自具有一项或多项下列特征的癌:
a)其为实体瘤;
b)其为白血病;
c)其为多发性骨髓瘤或淋巴瘤;
d)其为上皮来源的肿瘤;和/或
e)其为选自肺癌、乳腺癌、肝癌、卵巢癌、胃肠癌、胰腺癌、前列腺癌、子宫癌和头颈癌的肿瘤。
5.根据权利要求1-4中任何一项的结合试剂,其中所述结合试剂具有一项或多项以下特征:
a)其为抗体或者抗体的抗原结合片段或衍生物;
b)其为人、鼠、人源化或嵌合抗体或者相应的抗原结合片段或衍生物;
c)其为单链抗体片段、多价抗体、Fab片段和/或IgG、IgM、IgA、IgE、IgD同种型的免疫球蛋白和/或其亚型;
d)其为具有一项或多项下列特征的抗体或者抗体的抗原结合片段或衍生物:
i.其介导癌细胞的ADCC和/或CDC;
ii.其诱导和/或促进癌细胞的凋亡;
iii.其抑制癌细胞的靶标细胞的增殖;
iv.其诱导和/或促进癌细胞的吞噬作用;和/或
v.其诱导和/或促进细胞毒性试剂的释放;
e)其特异性结合为肿瘤特异性糖抗原的所述肿瘤相关糖抗原;
f)其不结合表达于非癌细胞、非肿瘤细胞、良性癌细胞和/或良性肿瘤细胞上的抗原,尤其是糖抗原;和/或
g)其特异性结合表达于癌干细胞和正常癌细胞上的肿瘤相关糖抗原。
6.根据权利要求5的结合试剂,其中所述抗体或者所述抗体的所述功能活性片段或衍生物选自:
a)CD176特异性抗体或者其抗原结合片段或衍生物,其优选地具有至少一种以下特征:
i)其包含至少一个互补决定区(CDR),优选地至少两个CDR,更优选地所有三个CDR,选自具有SEQ ID No.1的氨基酸序列的CDRH1、具有SEQ ID No.2或3的氨基酸序列的CDRH2以及具有SEQID No.4或5或6的氨基酸序列的CDRH3;
ii)其包含至少一个互补决定区(CDR),优选地至少两个CDR,更优选地所有三个CDR,选自具有SEQ ID No.7或8或9的氨基酸序列的CDRL1、具有SEQ ID No.10或11的氨基酸序列的CDRL2以及具有SEQ ID No.12或13的氨基酸序列的CDRL3;
iii)其包含含有SEQ ID No.46-79中任何一项的氨基酸序列的重链可变区;
iv)其包含含有SEQ ID No.80-94中任何一项的氨基酸序列的轻链可变区;
v)其在生理条件下不与Galα1-3GaINAcα、Galα1-3GalNAcβ、GalNAcα、Neu5Acα2-3Galβ1-3GalNAcα、Galβ1-3(Neu5Acα2-6)GaINAcα、GlcNAcβ1-2Galβ1-3GalNAcα、GlcNAcα1-3Galβ1-3GaINAcα、GalNAcα1-3Galβ和/或3'-O-Su-Galβ1-3GalNAcα特异性地相互作用;
b)抗体或者其抗原结合片段或衍生物,其显示了与(a)中限定的抗体有交叉特异性;
c)CD173特异性抗体或者其抗原结合片段或衍生物;
d)CD174特异性抗体或者其抗原结合片段或衍生物;
e)CD175特异性抗体或者其抗原结合片段或衍生物;
f)CD175s特异性抗体或者其抗原结合片段或衍生物;和/或
g)CA19-9特异性抗体或者其抗原结合片段或衍生物。
7.药用组合物,其包含特异性结合肿瘤相关糖抗原的结合试剂,用于处理表达所述肿瘤相关糖抗原的癌干细胞,其中结合试剂、癌干细胞以及肿瘤相关糖抗原具有如权利要求1-6中任何一项所限定的一项或多项特征。
8.根据权利要求1-6中任何一项的结合试剂或根据权利要求7的药用组合物,用于治疗的用途,以减小肿瘤大小、消除恶性细胞、防止转移、防止复发、降低或杀死扩散的癌、延长存活时间和/或延长肿瘤相应的癌进展时间。
9.一种方法,用于鉴定包含对用特异性结合肿瘤相关糖抗原的结合试剂的处理易感的癌干细胞的癌,其中所述处理影响癌干细胞,所述方法包括确定获自患者的癌样品是否包含表达该结合试剂特异性针对的肿瘤相关糖抗原的癌干细胞,其中癌干细胞上存在所述肿瘤相关糖抗原表示该癌对用特异性结合所述肿瘤相关糖抗原的结合试剂的处理易感,且其中所述处理影响这些癌干细胞。
10.一种用于对癌进行诊断、分期和/或预后和/或对治疗易感性进行监视的方法,包括分析分离自患者的样品中的细胞上肿瘤相关糖抗原表达的步骤,其中表达肿瘤相关糖抗原的细胞的存在表示所述样品中存在癌干细胞。
11.根据权利要求9或10的方法,其中用特异性结合肿瘤相关糖抗原的结合试剂对来自所述患者的样品进行染色.
12.根据权利要求9-11中任何一项的方法,其中肿瘤相关糖抗原选自CD176、CD175、CD175s、CD174、CD173和CA19-9。
13.根据权利要求9-12中任何一项的方法,其中共表达至少一种第二种癌干细胞标记物的细胞的存在表示存在癌干细胞。
14.根据权利要求9-13中任何一项的方法,其中测试了至少一种另外的糖蛋白癌干细胞标记物的共表达,所述标记物选自CD34、CD44、CD44v6、CD133和CD164。
15.根据权利要求9-14中任何一项的方法,其中对染色形式的分析提供了癌干细胞的相对分布,此分布情况预测了癌的致瘤性。
16.哺乳动物癌干细胞的组合物,其中组合物中至少50%、优选地至少75%的细胞为表达肿瘤相关糖抗原的癌干细胞。
17.一种试剂盒,用于根据权利要求9-15中任何一项的方法,包含特异性结合肿瘤相关糖抗原的结合试剂及用于根据权利要求9-15中任何一项的方法的说明书。
18.就针对表达肿瘤相关糖抗原的癌干细胞的有效性筛选候选治疗试剂的方法,该方法包括:
a)将所述试剂与权利要求16的细胞组合物接触,以及
b)确定所述试剂针对所述肿瘤相关糖抗原阳性的癌细胞的有效性。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US29673810P | 2010-01-20 | 2010-01-20 | |
| EP10000527.1 | 2010-01-20 | ||
| EP10000527A EP2347769A1 (en) | 2010-01-20 | 2010-01-20 | Cancer stem cell markers and uses thereof |
| US61/296,738 | 2010-01-20 | ||
| PCT/EP2011/000217 WO2011089004A1 (en) | 2010-01-20 | 2011-01-20 | Cancer stem cell markers and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102753199A true CN102753199A (zh) | 2012-10-24 |
Family
ID=42173400
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2011800065922A Pending CN102753199A (zh) | 2010-01-20 | 2011-01-20 | 癌干细胞标记物及其用途 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20120294859A1 (zh) |
| EP (2) | EP2347769A1 (zh) |
| JP (2) | JP2013517487A (zh) |
| CN (1) | CN102753199A (zh) |
| AU (1) | AU2011208874B2 (zh) |
| BR (1) | BR112012018132A2 (zh) |
| CA (1) | CA2786212A1 (zh) |
| WO (1) | WO2011089004A1 (zh) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103969437A (zh) * | 2014-04-22 | 2014-08-06 | 广州恒泰生物科技有限公司 | 用于卵巢癌早中期快速诊断试剂盒的制备方法 |
| CN111363008A (zh) * | 2020-03-18 | 2020-07-03 | 北京鼎成肽源生物技术有限公司 | 一种输卵管癌靶标抗原组合、输卵管癌靶标抗原组合刺激培养的ctl细胞及其应用 |
| CN113804531A (zh) * | 2021-09-10 | 2021-12-17 | 北京大学 | 一种细胞高活性染色方法 |
Families Citing this family (57)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7960139B2 (en) | 2007-03-23 | 2011-06-14 | Academia Sinica | Alkynyl sugar analogs for the labeling and visualization of glycoconjugates in cells |
| ES2442024T3 (es) | 2008-07-15 | 2014-02-07 | Academia Sinica | Matrices de glucano sobre portaobjetos de vidrio revestidos con aluminio de tipo PTFE y métodos relacionados |
| US10087236B2 (en) | 2009-12-02 | 2018-10-02 | Academia Sinica | Methods for modifying human antibodies by glycan engineering |
| US11377485B2 (en) | 2009-12-02 | 2022-07-05 | Academia Sinica | Methods for modifying human antibodies by glycan engineering |
| WO2011130332A1 (en) | 2010-04-12 | 2011-10-20 | Academia Sinica | Glycan arrays for high throughput screening of viruses |
| CA2809864A1 (en) | 2010-09-03 | 2012-03-08 | Stem Centrx, Inc. | Identification and enrichment of cell subpopulations |
| US9778264B2 (en) | 2010-09-03 | 2017-10-03 | Abbvie Stemcentrx Llc | Identification and enrichment of cell subpopulations |
| WO2012039430A1 (ja) * | 2010-09-21 | 2012-03-29 | 株式会社Gpバイオサイエンス | がん幹細胞の単離方法 |
| US10130714B2 (en) | 2012-04-14 | 2018-11-20 | Academia Sinica | Enhanced anti-influenza agents conjugated with anti-inflammatory activity |
| AU2013306098A1 (en) | 2012-08-18 | 2015-02-12 | Academia Sinica | Cell-permeable probes for identification and imaging of sialidases |
| WO2014160018A1 (en) | 2013-03-14 | 2014-10-02 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Hyposialylation disorders |
| WO2014210397A1 (en) | 2013-06-26 | 2014-12-31 | Academia Sinica | Rm2 antigens and use thereof |
| US9981030B2 (en) | 2013-06-27 | 2018-05-29 | Academia Sinica | Glycan conjugates and use thereof |
| JP6486368B2 (ja) | 2013-09-06 | 2019-03-20 | アカデミア シニカAcademia Sinica | 改変されたグリコシル基を含む糖脂質を用いたヒトiNKT細胞の活性化 |
| US10150818B2 (en) | 2014-01-16 | 2018-12-11 | Academia Sinica | Compositions and methods for treatment and detection of cancers |
| EP3094352B1 (en) | 2014-01-16 | 2020-09-23 | Academia Sinica | Compositions and methods for treatment and detection of cancers |
| TWI687428B (zh) | 2014-03-27 | 2020-03-11 | 中央研究院 | 反應性標記化合物及其用途 |
| US10023651B2 (en) | 2014-04-18 | 2018-07-17 | The Research Foundation For The State University Of New York | Humanized anti-TF-antigen antibodies |
| RU2699717C2 (ru) | 2014-04-18 | 2019-09-09 | Дзе Ресёч Фаундэйшен Фор Дзе Штат Юниверсити Ов Нью-Йорк | Гуманизированные антитела к антигену Томсена-Фриденрайха |
| JP6894239B2 (ja) | 2014-05-27 | 2021-06-30 | アカデミア シニカAcademia Sinica | 増強された抗体の有効性のための普遍的グリコフォームに関する組成物および方法 |
| WO2015184002A1 (en) | 2014-05-27 | 2015-12-03 | Academia Sinica | Anti-her2 glycoantibodies and uses thereof |
| TWI670078B (zh) | 2014-05-27 | 2019-09-01 | 中央研究院 | 抗cd20醣抗體及其用途 |
| US10118969B2 (en) | 2014-05-27 | 2018-11-06 | Academia Sinica | Compositions and methods relating to universal glycoforms for enhanced antibody efficacy |
| AU2015267044A1 (en) | 2014-05-28 | 2016-12-15 | Academia Sinica | Anti-TNF-alpha glycoantibodies and uses thereof |
| EP3191500A4 (en) | 2014-09-08 | 2018-04-11 | Academia Sinica | HUMAN iNKT CELL ACTIVATION USING GLYCOLIPIDS |
| SI3218005T1 (sl) | 2014-11-12 | 2023-06-30 | Seagen Inc. | Z glikanom delujoče spojine, in postopki uporabe |
| US9975965B2 (en) | 2015-01-16 | 2018-05-22 | Academia Sinica | Compositions and methods for treatment and detection of cancers |
| US10495645B2 (en) | 2015-01-16 | 2019-12-03 | Academia Sinica | Cancer markers and methods of use thereof |
| EP3248013B1 (en) * | 2015-01-24 | 2020-07-15 | Academia Sinica | Cancer markers and methods of use thereof |
| EP3789766A1 (en) | 2015-01-24 | 2021-03-10 | Academia Sinica | Novel glycan conjugates and methods of use thereof |
| CA2979640A1 (en) | 2015-02-25 | 2016-09-01 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Sialylation-increasing therapies for diseases associated with oxidative stress |
| WO2017041027A1 (en) | 2015-09-04 | 2017-03-09 | Obi Pharma, Inc. | Glycan arrays and method of use |
| KR20180088381A (ko) | 2015-11-12 | 2018-08-03 | 시아맙 쎄라퓨틱스, 인코포레이티드 | 글리칸-상호작용 화합물 및 사용방법 |
| WO2017100796A1 (en) * | 2015-12-11 | 2017-06-15 | SINACA, Academia | Modulation of globoseries glycosphingolipid synthesis and cancer biomarkers |
| US10336784B2 (en) | 2016-03-08 | 2019-07-02 | Academia Sinica | Methods for modular synthesis of N-glycans and arrays thereof |
| WO2017172990A1 (en) | 2016-03-29 | 2017-10-05 | Obi Pharma, Inc. | Antibodies, pharmaceutical compositions and methods |
| US10980894B2 (en) | 2016-03-29 | 2021-04-20 | Obi Pharma, Inc. | Antibodies, pharmaceutical compositions and methods |
| MY200886A (en) | 2016-04-22 | 2024-01-22 | Obi Pharma Inc | Cancer Immunotherapy by Immune Activation or Immune Modulation Via Globo Series Antigens |
| AU2017302038B2 (en) | 2016-07-27 | 2024-03-21 | Obi Pharma, Inc. | Immunogenic/therapeutic glycan compositions and uses thereof |
| KR102528998B1 (ko) | 2016-07-29 | 2023-05-03 | 오비아이 파머 인코퍼레이티드 | 인간 항체, 제약 조성물 및 방법 |
| US10538592B2 (en) | 2016-08-22 | 2020-01-21 | Cho Pharma, Inc. | Antibodies, binding fragments, and methods of use |
| WO2018094143A1 (en) | 2016-11-17 | 2018-05-24 | Siamab Therapeutics, Inc. | Glycan-interacting compounds and methods of use |
| MX2019005558A (es) * | 2016-11-18 | 2019-08-12 | Astellas Pharma Inc | Fragmento fab de anticuerpo anti-muc1 de humano novedoso. |
| TWI767959B (zh) | 2016-11-21 | 2022-06-21 | 台灣浩鼎生技股份有限公司 | 共軛生物分子、醫藥組成物及方法 |
| MX2019010202A (es) | 2017-03-03 | 2019-10-02 | Seattle Genetics Inc | Compuestos que interactuan con glicano y metodos de uso. |
| EP3601357A1 (en) * | 2017-03-29 | 2020-02-05 | Glycotope GmbH | Multispecific antibody constructs binding to muc1 and cd3 |
| TWI795415B (zh) | 2017-07-07 | 2023-03-11 | 日商安斯泰來製藥股份有限公司 | 新穎的抗人類CEACAM5抗體Fab片段 |
| CA3092470A1 (en) | 2018-02-27 | 2019-09-06 | Incyte Corporation | Imidazopyrimidines and triazolopyrimidines as a2a / a2b inhibitors |
| PT110722B (pt) * | 2018-05-03 | 2021-08-17 | Instituto De Patologia E Imunologia Molecular Da Univ Do Porto Ipatimup | Uso de anticorpos para o antigénio thomsen-friedenreich num método e estojo para avaliação de instabilidade de microsatelites |
| MA52940A (fr) | 2018-05-18 | 2021-04-28 | Incyte Corp | Dérivés de pyrimidine fusionnés utilisés en tant qu'inhibiteurs de a2a/a2b |
| DK3794042T3 (da) | 2018-05-18 | 2024-04-15 | Daiichi Sankyo Co Ltd | Anti-muc1-exatecet-antistof-lægemiddelkonjugat |
| WO2020006176A1 (en) | 2018-06-27 | 2020-01-02 | Obi Pharma, Inc. | Glycosynthase variants for glycoprotein engineering and methods of use |
| TWI829857B (zh) | 2019-01-29 | 2024-01-21 | 美商英塞特公司 | 作為a2a / a2b抑制劑之吡唑并吡啶及三唑并吡啶 |
| CN110161241A (zh) * | 2019-04-30 | 2019-08-23 | 丁晓昆 | 一种快速检测生物组织切片cosmc基因突变试剂盒 |
| IL294437A (en) | 2020-01-03 | 2022-09-01 | Incyte Corp | Combination therapy cd73 and a2a/a2b adenosine receptor inhibitors |
| CA3207066A1 (en) | 2020-12-29 | 2022-07-07 | Incyte Corporation | Combination therapy comprising a2a/a2b inhibitors, pd-1/pd-l1 inhibitors, and anti-cd73 antibodies |
| CN115197915A (zh) * | 2022-08-01 | 2022-10-18 | 首都医科大学附属北京胸科医院 | 恶性表型大细胞肺癌细胞株及其应用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020192223A1 (en) * | 1989-06-30 | 2002-12-19 | Ingegerg Hellstrom | Novel antibody conjugates reactive with human carcinomas |
| US20060251668A1 (en) * | 2002-11-29 | 2006-11-09 | Steffen Goletz | Tumor-specific recognition molecules |
| US7374755B2 (en) * | 2004-07-26 | 2008-05-20 | The Research Foundation Of State University Of New York | Therapeutic use of anti-TF-Antigen antibody |
| US20090041836A1 (en) * | 2006-01-03 | 2009-02-12 | University Of Georgia Research Foundation, Inc. | Glycolipopeptide and uses thereof |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1654353B1 (en) | 2003-08-18 | 2013-05-22 | Glycotope GmbH | Tumour cell lines nm-f9 (dsm acc2606) and nm-d4 (dsm acc2605), uses threreof |
| US20110190166A1 (en) * | 2006-05-26 | 2011-08-04 | Susan Wong | Erythroid progenitor cells and methods for producing parvovirus b19 therein |
-
2010
- 2010-01-20 EP EP10000527A patent/EP2347769A1/en not_active Withdrawn
-
2011
- 2011-01-20 US US13/574,260 patent/US20120294859A1/en not_active Abandoned
- 2011-01-20 AU AU2011208874A patent/AU2011208874B2/en not_active Ceased
- 2011-01-20 CN CN2011800065922A patent/CN102753199A/zh active Pending
- 2011-01-20 BR BR112012018132A patent/BR112012018132A2/pt active Search and Examination
- 2011-01-20 JP JP2012549291A patent/JP2013517487A/ja not_active Ceased
- 2011-01-20 CA CA2786212A patent/CA2786212A1/en not_active Abandoned
- 2011-01-20 EP EP11703580A patent/EP2525832A1/en not_active Withdrawn
- 2011-01-20 WO PCT/EP2011/000217 patent/WO2011089004A1/en active Application Filing
-
2015
- 2015-12-25 JP JP2015253064A patent/JP2016047848A/ja not_active Withdrawn
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020192223A1 (en) * | 1989-06-30 | 2002-12-19 | Ingegerg Hellstrom | Novel antibody conjugates reactive with human carcinomas |
| US20060251668A1 (en) * | 2002-11-29 | 2006-11-09 | Steffen Goletz | Tumor-specific recognition molecules |
| US7374755B2 (en) * | 2004-07-26 | 2008-05-20 | The Research Foundation Of State University Of New York | Therapeutic use of anti-TF-Antigen antibody |
| US20090041836A1 (en) * | 2006-01-03 | 2009-02-12 | University Of Georgia Research Foundation, Inc. | Glycolipopeptide and uses thereof |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103969437A (zh) * | 2014-04-22 | 2014-08-06 | 广州恒泰生物科技有限公司 | 用于卵巢癌早中期快速诊断试剂盒的制备方法 |
| CN111363008A (zh) * | 2020-03-18 | 2020-07-03 | 北京鼎成肽源生物技术有限公司 | 一种输卵管癌靶标抗原组合、输卵管癌靶标抗原组合刺激培养的ctl细胞及其应用 |
| CN113388023A (zh) * | 2020-03-18 | 2021-09-14 | 北京鼎成肽源生物技术有限公司 | 一种输卵管癌靶标抗原、输卵管癌靶标抗原刺激培养的ctl细胞及其应用 |
| CN113429473A (zh) * | 2020-03-18 | 2021-09-24 | 北京鼎成肽源生物技术有限公司 | 一种输卵管癌靶标抗原、输卵管癌靶标抗原刺激培养的ctl细胞及其应用 |
| CN111363008B (zh) * | 2020-03-18 | 2021-11-16 | 北京鼎成肽源生物技术有限公司 | 一种输卵管癌靶标抗原组合、输卵管癌靶标抗原组合刺激培养的ctl细胞及其应用 |
| CN113429473B (zh) * | 2020-03-18 | 2022-11-04 | 北京鼎成肽源生物技术有限公司 | 一种输卵管癌靶标抗原、输卵管癌靶标抗原刺激培养的ctl细胞及其应用 |
| CN113804531A (zh) * | 2021-09-10 | 2021-12-17 | 北京大学 | 一种细胞高活性染色方法 |
| CN113804531B (zh) * | 2021-09-10 | 2024-02-06 | 北京大学 | 一种细胞高活性染色方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2011208874A1 (en) | 2012-08-02 |
| JP2013517487A (ja) | 2013-05-16 |
| BR112012018132A2 (pt) | 2017-06-20 |
| JP2016047848A (ja) | 2016-04-07 |
| AU2011208874B2 (en) | 2015-06-25 |
| EP2347769A1 (en) | 2011-07-27 |
| WO2011089004A1 (en) | 2011-07-28 |
| EP2525832A1 (en) | 2012-11-28 |
| US20120294859A1 (en) | 2012-11-22 |
| CA2786212A1 (en) | 2011-07-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102753199A (zh) | 癌干细胞标记物及其用途 | |
| Oak et al. | Combinatorial treatment of mammospheres with trastuzumab and salinomycin efficiently targets HER2‐positive cancer cells and cancer stem cells | |
| JP5219827B2 (ja) | invivoで抗腫瘍活性を有する抗ヒトDlk−1抗体 | |
| JP5689133B2 (ja) | 結腸直腸癌におけるpodxlタンパク質 | |
| Lin et al. | Expression of CD176 (Thomsen‐Friedenreich antigen) on lung, breast and liver cancer‐initiating cells | |
| Trerotola et al. | CD133, Trop-2 and α2β1 integrin surface receptors as markers of putative human prostate cancer stem cells | |
| Gebauer et al. | Selectin binding is essential for peritoneal carcinomatosis in a xenograft model of human pancreatic adenocarcinoma in pfp−−/rag2−− mice | |
| US20210322513A1 (en) | Method for detecting cancer cells, reagent for introducing substance into cancer cells, and composition for treating cancer | |
| JPWO2009116670A1 (ja) | invivoで抗腫瘍活性を有する抗ヒトDlk−1抗体 | |
| CN108064343B (zh) | 用于前列腺癌分析的组合物和方法 | |
| CN101622273A (zh) | 治疗、诊断或检测与liv-1过量表达相关的癌症的方法 | |
| RU2641968C2 (ru) | Композиции и способы анализа рака предстательной железы | |
| JP2020125352A (ja) | 抗−cd43抗体およびその癌治療用途 | |
| Okamura et al. | Superficially located enlarged lymphoid follicles characterise nodular gastritis | |
| Glumac et al. | The identification of a novel antibody for CD133 using human antibody phage display | |
| KR101374758B1 (ko) | 항-사이토케라틴 8/18 복합체 자가면역항체를 포함하는 암 진단 마커 및 이의 항원을 포함하는 암 진단용 조성물 | |
| JP2019528437A (ja) | 腫瘍関連マクロファージをターゲティングすることによるガン疾患の処置方法 | |
| EP3923985A1 (en) | Antibodies to cell adhesion molecule-related/down-regulated by oncogenes (cdon) and uses thereof | |
| US9206258B2 (en) | Anti-prostate cancer antibodies and methods of detection and treatment of prostate cancer using the same | |
| JP2005519120A (ja) | 個別化抗ガン抗体 | |
| JP5711877B2 (ja) | 癌の悪性度の検知方法及び癌の悪性度の診断剤 | |
| Cai et al. | CD52 knockdown inhibits aerobic glycolysis and malignant behavior of NSCLC cells through AKT signaling pathway | |
| US20130143231A1 (en) | MST1/STK4 PHOSPHO-THREONINE 120 (pMST-T120) ANTIBODY | |
| JP2011001267A (ja) | 大腸癌治療薬 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20121024 |