CN102516552B - 一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法 - Google Patents
一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法 Download PDFInfo
- Publication number
- CN102516552B CN102516552B CN201110367602.7A CN201110367602A CN102516552B CN 102516552 B CN102516552 B CN 102516552B CN 201110367602 A CN201110367602 A CN 201110367602A CN 102516552 B CN102516552 B CN 102516552B
- Authority
- CN
- China
- Prior art keywords
- acid
- block copolymer
- sensitive
- preparation
- cationic block
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Medicinal Preparation (AREA)
Abstract
本发明公开了一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法。本发明高分子两亲性嵌段共聚物的亲疏水段分别由聚赖氨酸和带有酸敏基团的聚天冬氨酸衍生物组成。本发明高分子两亲性嵌段共聚物的制备方法是以小分子胺引发剂引发带有活性侧基的L型氨基酸苄酯的N-羧酸酐开环聚合,经点击化学将亲疏水段连接起来,通过进一步的氨解反应引入酸敏基团,最后通过酸性条件下脱苄基保护基团后得到目标产品。本发明共聚物具有良好的酸敏感性、生物相容性和生物可降解性,可在水溶液中自组装并形成纳米级的胶束,该胶束能够同时负载抗癌药物如阿霉素和基因如BCL-2siRNA,且能够在肿瘤部位实现对负载物的智能控释。
Description
技术领域
本发明涉及高分子化学、药学和生物医学工程领域,具体地说,涉及一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法。
背景技术
多药耐药 (multidrug resistance, MDR) 是目前癌症治疗中化疗失败的主要原因之一。多药耐药是指肿瘤细胞对一种药物产生耐药性的同时也对与之结构无关、作用机制完全不同的药物产生交叉性耐药的广谱耐药现象。
由于肿瘤细胞的多药耐药性产生的原因较复杂, 通常涉及多种因素, 多种基因的异常, 若只使用单一模式的多药耐药调节剂或者免疫治疗方法很难有效的逆转肿瘤细胞的多药耐药性。为了提高化疗效果, 亟需发展有效的逆转肿瘤细胞多药耐药性的方法。
RNA干扰(RNA interference,RNAi)是近些年来发现的一种基因沉默现象。通常是指内源或外源RNA(double-stranded RNA, dsRNA)分子高效而特异地阻断体内特定基因表达,使目标mRNA特异性降解,诱使细胞表现出特定的基因缺失的现象。RNA 干扰技术的出现, 能够针对多个基因或基因族的共同序列来同时抑制多个基因的表达, 有望从根本上逆转肿瘤细胞的多药耐药性。
具有酸敏响应性的阳离子聚合物载体有着特殊的功能, 其疏水的内核能够负载疏水性的抗癌药物, 表面的阳离子能够有效的复合基因。该载体复合物能够同时将抗癌药物和siRNA 联合传输到肿瘤病灶部位, 且能够实现智能控释。在抗肿瘤药物进行化疗的同时通过 siRNA 技术阻断抗凋亡基因 BCl-2 及其蛋白的表达,有望同时发挥化疗治疗 和 siRNA的作用而提高化疗效果。此类酸敏响应性的阳离子双载体目前没有文献报道, 作为新型的生物医用高分子载体材料具有重要的研究价值和广阔的应用前景。
发明内容
本发明的目的在于提供一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法。
本发明上述目的通过以下技术方案予以实现:
一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物,包括亲疏水段,所述亲疏水段分别由聚赖氨酸和酸敏基团修饰的聚天冬氨酸衍生物组成。
在上述高分子两亲性阳离子嵌段共聚物中,所述酸敏基团为二异丙基乙二胺基。所述酸敏基团在 pH 6.4-8.0 之间表现出很强的酸敏响应性。
上述高分子两亲性阳离子嵌段共聚物的制备方法,包括如下步骤: 正丁胺引发L型赖氨基酸苄酯N-羧酸酐开环聚合, 丙炔胺引发L型天冬氨基酸苄酯N-羧酸酐开环聚合, 通过点击化学反应将两个嵌段连接起来, 再通过氨解反应引入酸敏基因, 最后酸性条件下脱保护得到目标产品。
上述高分子两亲性阳离子嵌段共聚物的胶束粒子的制备方法,包括如下步骤: 将5~10 mg共聚物与1 mg疏水性药物共溶于1 ml的二甲基亚砜溶液中,在超声作用下于冰浴中滴加到2.5~10 ml的水中,然后将该混合液装入Mcro 14000的透析袋中在水中透析一至三天即得;对于酸敏感药物需在溶解时加1 ml三乙胺保证其疏水性。
上述高分子两亲性阳离子嵌段共聚物负载药物和基因的胶束粒子的制备方法,其特征在于包括如下步骤:抗凋亡基因 BCL-2 siRNA 被加入到已知量的负载了DOX的阳离子胶束溶液中,接着该混合体系被强烈涡旋15s后在室温下静置 30 min,得到一系列不同N/P比的同时负载了DOX和siRNA的胶束。
上述阳离子嵌段共聚物在 pH 7.4 时能够自组装形成稳定的胶束粒子。
上述高分子两亲性阳离子嵌段共聚物胶束粒子能够同时负载抗癌药物和基因,胶束粒子能够将负载的抗癌药物和基因靶向传输到肿瘤病灶部位,胶束粒子能够在肿瘤病灶部位实现对负载物的智能控释。
作为联合传输药物和 BCL-2 siRNA 的双载体, 药物的负载量和 BCl-2 siRNA 的负载量相匹配才能产生良好的协同作用, 最大程度地提高化疗效果, 因此嵌段聚合物载体的结构调控非常关键。
为了控制共聚物两嵌段的比例, 我们分别使用小分子的引发剂正丁胺和丙炔胺来引发 Lys-NCA 和 BLA-NCA 的开环聚合反应, 通过控制引发剂和单体的比例、反应温度、反应时间等来实现对预聚物分子量的控制。两种预聚物通过高效的点击化学反应连接起来。 具有酸敏响应性小分子二异丙基乙二胺通过氨解反应来实现。聚苄基-L 赖氨酸中的苄基的脱保护反应在 33% 乙酸/氢溴酸条件下进行。
作为一种优选方案,上述制备方法包括如下步骤:将1摩尔份数三光气与2.5摩尔份数带有活性侧基的L型赖氨酸苄酯在干燥无水的四氢呋喃中反应制得相应的N-羧酸酐,然后根据预期均聚物的分子量计算所用的小分子引发剂正丁胺的用量来引发L型赖氨酸苄酯N-羧酸酐的开环聚合得到均聚物 PLLm-NH2, 端胺基再分别与溴代乙酰溴和叠氮钠反应生成含有叠氮根基团的均聚物 PLLm-N3。用小分子引发剂丙炔胺引发 L 型天冬氨酸苄酯N-羧酸酐的开环聚合得到均聚物 PBLAn-NH2, 用乙酸酐封端得到带有炔基基团的均聚物alkyne-PBLAn-Ac。两种均聚物通过点击化学连接起来, 然后再通过氨解反应将酸敏基团二乙丙基乙二胺引入, 最后通过酸性条件下的水解反应除去聚赖氨酸苄酯中的保护基团, 最终得到具有 pH 敏感性的两亲性阳离子嵌段共聚物。
与现有技术相比,本发明具有以下有益效果:
(1)本发明的可降解的酸敏感高分子两亲性阳离子嵌段共聚物载体材料是由聚赖氨酸与聚天冬氨酸衍生物组成,无毒且具有优良的生物相容性和生物可降解性;
(2)本发明可降解的酸敏感高分子两亲性阳离子嵌段共聚物载体材料具有显著的质子响应性,其pKa值(约6.3)处于体内弱酸性生理环境的pH值范围内,适用于大部分有低pH值要求的部位或组织;
(3)本发明的可降解的酸敏感高分子两亲性嵌段共聚物载体材料所形成的纳米结构可以在质子浓度(即pH值)的影响下实现对负载药物和基因的智能控释;
(4)本发明的可降解的酸敏感高分子两亲性阳离子嵌段共聚物载体材料的独特结构使其能够同时负载抗肿瘤药物和基因, 从而使得药物疗法和基因治疗产生很好的协同作用, 促进化疗技术的进步。
附图说明
图1 是均聚物 PLL10-N3 (a) 和 alkyne-PBLA32-Ac (b) 在 DMSO-d 6 中的 1H NMR 谱图。
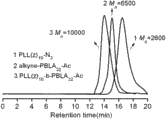
图2 均聚物 alkyne-PBLA11-Ac 、alkyne-PBLA14-Ac和alkyne-PBLA32-Ac 以 DMF 为流动相的凝胶渗透色谱图 (a); 均聚物 PLL(z)10-N3 以 DMF为流动相的凝胶渗透色谱图 (b); 均聚物 PLL10 与嵌段共聚物 PLL10-b-PAsp(DIP)11 以水为流动相的凝胶渗透色谱图 (c)。
图 3 是点击化学反应后的嵌段共聚物 PLL(z)10-b-PBLA32 (a); 氨解之后的嵌段共聚物 PLL(z)10-b-PAsp(DIP)32 在 DMSO-d 6 中的 1H NMR 谱图 (b)。
图 4 是聚合物 PLL(z)10-N3、PLL(z)10-b-PBLA32-Ac、 PLL(z)10-b-PAsp(DIP)32-Ac和PLL10-b-PAsp(DIP)32-Ac 的红外光谱对比图。
图 5 均聚物 PLL(z)10-N3、 alkyne-PBLA32-Ac及点击化学反应后生成的嵌段共聚物 PLL(z)10-b-PBLA32-Ac 的凝胶渗透色谱对比图。
图 6 是目标产品 PLL10-b-PAsp(DIP)32-Ac 在 D2O 中的 1H NMR 谱图。
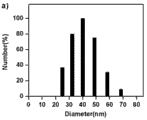
图 7 是聚合物 PLL34-b-PAsp(DIP)12的动态光散射谱图。
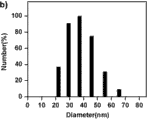
图8是聚合物PLL10-b-PAsp(DIP)11 的动态光散射谱图。
图9是聚合物 PLL10-b-PAsp(DIP)32-Ac 在 pH 7.4 时的临界胶束浓度图。
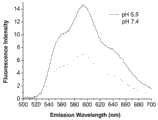
图10是负载阿霉素的聚合物 PLL10-b-PAsp(DIP)32-Ac 胶束在 pH 5.5 和 7.4 时的荧光光谱对比图。
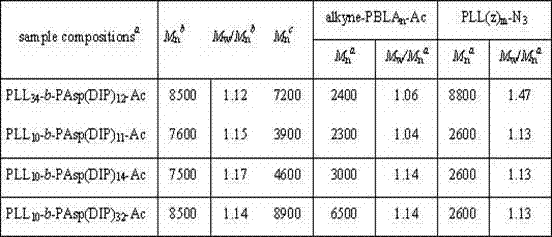
表1是均聚物 PLL(z)m-N3、alkyne-PBLAn-Ac 及嵌段共聚物PLL34-b-PAsp(DIP)12、PLL10-b-PAsp(DIP)11、PLL10-b-PAsp(DIP)14和PLL10-b-PAsp(DIP)32 的凝胶渗透色谱对比数据。
表2是聚合物PLL10-b-PAsp(DIP)11-Ac、 PLL10-b-PAsp(DIP)14-Ac、PLL10-b-PAsp(DIP)32-Ac 和PLL34-b-PAsp(DIP)12-Ac 的粒径与电位数据对比图。
具体实施方式
以下通过具体的实施例进一步说明本发明的技术方案,但实施例并不对本发明做任何形式的限定。
实施例1
可生物降解的酸敏感的两亲性阳离子嵌段共聚物的制备
1.两亲性嵌段共聚物的制备:
1.1 L型氨基酸苄酯N-羧酸酐的制备以天冬氨酸苄酯N-羧酸酐 为例 (BLA-NCA):
25.0 g (0.11 mol) β-天冬氨酸苄酯悬浮在 150 mL 干燥的 THF 中, 氩气保护, 加热到 40 °C. 13.5 g (0.045 mol) 三聚光气在 25 mL 的 THF 中溶解后慢慢滴加到反应瓶中。反应溶液变澄清后, 再继续反应 1 小时. 通入氩气流鼓泡 30 min 以除去生成的 HCl。反应溶液过滤除去少量没有反应的苄酯, 而后减压浓缩到 50 mL, 沉淀到大量正己烷中(THF/ hexane 为 1/3),把初产品 BLA-NCA 在THF/ hexane 混合溶剂中重结晶三次除去生成的盐。产品氩气保护,-18 ℃ 保存。
1.2 聚赖氨酸苄酯均聚物 (PLL(z)10-N3) 的合成
1.2.1 PLL(z)10-NH2 的合成
5.0 g (0.016 mol) Lys-NCA 在氩气保护下溶解在 100 mL DMF 中, 充分搅拌, 加热到 40 °C,0.16 mL (0.0017 mol) 小分子引发剂正丁胺 (n-Butylamine) 溶解在 5.0 mL DMF中, 氩气保护下转移到Lys-NCA 的DMF 溶液中。大量气泡冒出,反应 72 小时停止。
1.2. 2 PLL(z)10-Br 的合成
接着上步反应进行端氨基与溴代乙酰溴的反应. 将反应瓶放置在冰水浴中, 1.45 mL (0.017 mol) 溴代乙酰溴 (bromoacetyl bromide) 用 2 mL DMF稀释, 慢慢滴加到反应瓶中, 30 min 后滴加完毕。室温下反应 3 小时。 反应溶剂 DMF 减压浓缩为 15 mL, 沉淀到冷的乙醚中, 乙醚洗数次, 抽干。
1.2. 3 PLL(z)10-N3 的合成
4.0 g (0.0013 mol) PLL(z)m-Br 溶解在 50 mL DMF 中, 0.88 g (0.013 mol) NaN3 加入反应瓶中。常温反应 48 h。减压蒸馏除去大部分 DMF, 将浓缩后的溶液沉淀到冷的乙醚中。产品水洗数次除去过量的 NaN3, 冻干, -18 °C 保存。
1.3聚天冬氨酸苄酯均聚物 (alkyne-PBLA32-Ac) 的合成
3.0 g (0.012 mol) BLA-NCA 溶解在DMF (40 mL) 中, 加热到 40 °C。 将溶解在 5.0 mL DMF中的 0.029 mL (0.0004 mol) 小分子引发剂丙炔胺 (propargylamine) 加入到反应瓶中。大量气泡冒出。反应 72 h。然后将0.11 mL (0.0012 mol) 乙酸酐 (acetic anhydride ) 加入到反应瓶中将端氨基封端, 35 °C 反应 1 小时。将反应液沉淀到冷的乙醚中, 乙醚洗数次, 抽干。
1.4通过点击化学反应合成两嵌段聚合物 PLL(z)10-b-PBLA32-Ac
此反应在手套箱中操作以防其中的催化剂体系暴露空气中的氧气而失活. 带有炔基基团的alkyne-PBLA32-Ac 2.0 g (0.28 mmol, 1 equivalent) 和带有叠氮根的PLL(z)10-N3 1.7 g (0.56 mmol, 2 equivalents) 一起溶解在 20 mL 的 DMF 中。 催化剂体系溴化亚铜/五甲基二乙烯三胺即CuBr/PMDTA CuBr为0.04 g (0.28 mmol, 1 equivalent), PMDTA为 0.05 g (0.28 mmol, 1 equivalent) 加入到反应瓶中. 氩气保护, 80 °C 下反应 48 h. 反应溶液沉淀到冷的乙醚中, 乙醚洗数次。沉淀分级, 除去过量的PLL(z)10-N3。
1.5通过氨解反应合成两嵌段聚合物 PLL(z)10-b-PAsp(DIP)32-Ac
2.5 g (0.25 mmol) 嵌段共聚物PLL(z)10-b-PBLA32-Ac 溶解在 15 mL DMF 中, 加热到 40 °C,二异丙基乙二胺即DIP 42 mL (20 eq to the benzyl group of PBLA) 加入到反应瓶中。反应24 h. 沉淀到冷的乙醚中, 乙醚洗数次, 抽干。
实施例2
聚合物纳米载体的制备
2.1 PLL(z)10-b-PAsp(DIP)32-Ac聚合物空白胶束的制备
10 mg 聚合物溶解在 1 ml DMSO/THF 混合溶剂中, 充分搅拌, 加入 0.5 mL 三乙胺使聚赖氨酸嵌段中的伯胺基去质子化, 在超声作用下缓慢滴到 10 mL pH 7.4 PBS 溶液中。胶束溶液用PBS透析 12 h, 冻干。 0.45 μm 水相过滤头过滤, 超滤离心管浓缩为10 mL即聚合物浓度为 1 mg/mL, 4 °C 冰箱保存备用。
2.2负载DOX聚合物 PLL(z)10-b-P Asp(DIP)32-Ac 胶束的制备
2 mg水溶性 DOX 溶解在 1 mL DMSO/THF混合溶剂中, 加入0.5 mL 三乙胺使 DOX 去质子化由亲水性转变为疏水性; 10 mg 聚合物溶解在 1 mL DMSO/THF混合溶剂中, 加入0.5 mL 三乙胺充分搅拌. 将两者混合, 充分搅拌后在超声作用下滴到 20 mL pH 7.4 PBS 溶液中。微碱性透析 12 h除去有机溶剂和没有被负载的DOX,0.45 μm 水相过滤头过滤, 超滤离心管浓缩为 10 mL 聚合物浓度为 1 mg/mL, 4 °C 冰箱保存备用。
2.3 同时负载 DOX 以及 siRNA 的聚合物胶束的制备
一定量(e.g. 0.1 μg)的 BCL-2 siRNA 被加入到已知量的负载了DOX的 PLL(z)10-b-PAsp(DIP)32-Ac 阳离子胶束溶液中,接着该混合体系被强烈涡旋15s后在室温下静置 30 min。得到一系列不同N/P比的同时负载了DOX和siRNA的胶束。
实施例3
3.1纳米载药胶束粒径的测试
分别将所得的 1 mg/mL 聚合物空白胶束溶液采用动态光散射法对其粒径进行测量PLL34-b-PAsp(DIP)12 和PLL10-b-PAsp(DIP)11制成的胶束的平均粒径分别为38.0 nm、40.0 nm。
3.2 临界胶束浓度的测定
将芘配成 3.0×10-4 M 的苯溶液, 待苯挥发完后称取一定量的聚合物, 用 pH 7.4 PBS 溶液定容, 依次配成 0.1-1000 ug/ml 的聚合物及芘的水溶液。每个样品低强度超声 30 分钟以促使芘被包到疏水的胶束中, 然后检测其荧光强度。
3.3荧光光谱的测定
将负载 DOX 的聚合物 PLL(z)10-b-PAsp(DIP)32-Ac 胶束溶液分别调节 pH 为5.5 和 7.4, 检测其荧光强度。其中激发波长为 490 nm, 发射波长为 510 nm 至 700 nm, 狭缝宽度为 12 nm。
表1
表2
| Samples | Rh/nm | Zeta potential/mV |
| PLL10-b-PAsp(DIP)11-Ac | 38.0 ± 3.5 | 20.5 ± 0.02 |
| PLL10-b-PAsp(DIP)14-Ac | 41.0 ± 2.6 | 20.1 ± 0.10 |
| PLL10-b-PAsp(DIP)32-Ac | 45.7 ± 1.8 | 25.5 ± 0.04 |
| PLL34-b-PAsp(DIP)12-Ac | 40.5 ± 0.5 | 30.0 ± 0.01 |
Claims (4)
1.一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物,包括亲疏水段,其特征在于所述的亲疏水段分别由聚赖氨酸和酸敏基团修饰的聚天冬氨酸衍生物组成;
该高分子两亲性阳离子嵌段共聚物由包括如下步骤的方法制备而得: 正丁胺引发L型赖氨基酸苄酯N-羧酸酐开环聚合, 丙炔胺引发L型天冬氨基酸苄酯N-羧酸酐开环聚合, 通过点击化学反应将两个嵌段连接起来, 再通过氨解反应引入酸敏基因, 最后酸性条件下脱保护得到目标产品。
2.根据权利要求1所述的高分子两亲性阳离子嵌段共聚物,其特征在于,所述酸敏基团为二异丙基乙二胺基。
3.权利要求 1 所述的高分子两亲性阳离子嵌段共聚物的胶束粒子的制备方法,其特征在于包括如下步骤: 将5~10 mg共聚物与1 mg疏水性药物共溶于1 ml的二甲基亚砜溶液中,在超声作用下于冰浴中滴加到2.5~10 ml的水中,然后将该混合液装入Mcro 14000的透析袋中在水中透析一至三天即得;对于酸敏感药物需在溶解时加1ml三乙胺保证其疏水性。
4.权利要求1所述的高分子两亲性阳离子嵌段共聚物负载药物和基因的胶束粒子的制备方法,其特征在于包括如下步骤:抗凋亡基因 BCL-2 siRNA 被加入到已知量的负载了DOX的阳离子胶束溶液中,接着该混合体系被强烈涡旋15s后在室温下静置 30 min,得到一系列不同N/P比的同时负载了DOX和siRNA的胶束。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201110367602.7A CN102516552B (zh) | 2011-11-18 | 2011-11-18 | 一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201110367602.7A CN102516552B (zh) | 2011-11-18 | 2011-11-18 | 一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN102516552A CN102516552A (zh) | 2012-06-27 |
| CN102516552B true CN102516552B (zh) | 2014-01-15 |
Family
ID=46287648
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201110367602.7A Expired - Fee Related CN102516552B (zh) | 2011-11-18 | 2011-11-18 | 一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN102516552B (zh) |
Families Citing this family (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103656652B (zh) * | 2013-12-10 | 2015-09-09 | 深圳先进技术研究院 | 一种双敏感响应型聚合物纳米胶束及其制备方法和应用 |
| CN104592522B (zh) * | 2014-10-30 | 2018-02-06 | 中山大学 | 一种可降解的酸敏型聚天冬酰胺共聚物及其制备方法和应用 |
| CN105153412B (zh) * | 2015-07-15 | 2017-04-05 | 河南省眼科研究所 | 一种多肽嵌段聚合物及其制备方法、用途 |
| CN105997879B (zh) * | 2016-07-12 | 2019-02-05 | 中山大学 | 一种pH与温度双重敏感性的纳米囊泡及其制备方法和应用 |
| CN107233581A (zh) * | 2017-06-15 | 2017-10-10 | 中山大学 | 一种能进行mr‑荧光双模态淋巴成像、可降解小粒径纳米胶束及其制备方法和应用 |
| CN110179749B (zh) * | 2018-04-27 | 2020-09-01 | 中山大学 | 可用于治疗类风湿性关节炎的聚合物纳米颗粒 |
| CN113004515B (zh) * | 2021-03-02 | 2023-02-24 | 厦门大学附属中山医院 | 一种仿透明质酸聚氨基酸衍生物、其制备方法及其应用 |
| CN114437357B (zh) * | 2021-11-22 | 2022-10-18 | 中山大学 | 一种分级释药的肿瘤高渗透聚合物及其制备方法与应用 |
| CN116003792B (zh) * | 2022-12-15 | 2024-12-13 | 中山大学 | 一种用于治疗癌症转移的聚合物及其制备方法和应用 |
| CN118005913B (zh) * | 2024-04-10 | 2024-08-06 | 四川大学 | 一种具有细胞膜成孔性能的嵌段共聚物及其制备方法和应用 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2822834B1 (fr) * | 2001-04-02 | 2005-02-25 | Flamel Tech Sa | Suspension colloidale de nanoparticules a base de copolymeres amphiphile pour la vectorisation de principes actifs et leur mode de preparation |
-
2011
- 2011-11-18 CN CN201110367602.7A patent/CN102516552B/zh not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| CN102516552A (zh) | 2012-06-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102516552B (zh) | 一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法 | |
| Sun et al. | Self-assembled biodegradable micellar nanoparticles of amphiphilic and cationic block copolymer for siRNA delivery | |
| Xu et al. | Pulmonary delivery by exploiting doxorubicin and cisplatin co-loaded nanoparticles for metastatic lung cancer therapy | |
| Yang et al. | The role of non-covalent interactions in anticancer drug loading and kinetic stability of polymeric micelles | |
| Shrestha et al. | Endosomal escape and siRNA delivery with cationic shell crosslinked knedel-like nanoparticles with tunable buffering capacities | |
| Lee et al. | Poly (l-histidine)–PEG block copolymer micelles and pH-induced destabilization | |
| CN101970541B (zh) | 包含非荷电性亲水性嵌段以及侧链的一部分引入了疏水性基团的阳离子性聚氨基酸嵌段的共聚物、及其使用 | |
| Wei et al. | Dual-drug delivery system based on hydrogel/micelle composites | |
| Du et al. | pH-sensitive block copolymer vesicles with variable trigger points for drug delivery | |
| Malhotra et al. | Glycine-terminated dendritic amphiphiles for nonviral gene delivery | |
| JP5271715B2 (ja) | ジスルフィド架橋高分子ミセルを用いた環境応答性siRNAキャリア | |
| Liu et al. | A pH-and thermo-responsive poly (amino acid)-based drug delivery system | |
| CN107281497B (zh) | 基于dna水凝胶的功能性核酸保护性载体及其制备方法、应用 | |
| Zhu et al. | Novel polycationic micelles for drug delivery and gene transfer | |
| San Miguel et al. | Biodegradable and thermoresponsive micelles of triblock copolymers based on 2-(N, N-dimethylamino) ethyl methacrylate and ε-caprolactone for controlled drug delivery | |
| CN102911326B (zh) | 一种酸敏感可降解聚合物囊泡及其制备和应用 | |
| CN103002982A (zh) | 物质内包囊泡及其制造方法 | |
| CN111320750B (zh) | 一种弱酸可电离的两亲性两性离子载体、胶束递药系统及其制备方法与应用 | |
| CN105997880A (zh) | 一种基于交联生物可降解聚合物囊泡的抗肿瘤纳米药物及其制备方法 | |
| Hao et al. | Synthesis of an acid-cleavable and fluorescent amphiphilic block copolymer as a combined delivery vector of DNA and doxorubicin | |
| Qian et al. | Synthesis and preliminary cellular evaluation of phosphonium chitosan derivatives as novel non-viral vector | |
| Li et al. | Dual pH-responsive micelles with both charge-conversional property and hydrophobic–hydrophilic transition for effective cellular uptake and intracellular drug release | |
| Wu et al. | Novel hydroxyl-containing reduction-responsive pseudo-poly (aminoacid) via click polymerization as an efficient drug carrier | |
| CN117777378A (zh) | 一种具有pH和氧化还原双重刺激响应型聚合物载体的制备方法及应用 | |
| CN105131182B (zh) | 普朗尼克‑聚(β‑氨基酯)聚合物及其合成和应用方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20140115 Termination date: 20211118 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |