CN102174533A - 编码b族链球菌粘着因子的核酸、b族链球菌的粘着因子和它们的用途 - Google Patents
编码b族链球菌粘着因子的核酸、b族链球菌的粘着因子和它们的用途 Download PDFInfo
- Publication number
- CN102174533A CN102174533A CN2011100420771A CN201110042077A CN102174533A CN 102174533 A CN102174533 A CN 102174533A CN 2011100420771 A CN2011100420771 A CN 2011100420771A CN 201110042077 A CN201110042077 A CN 201110042077A CN 102174533 A CN102174533 A CN 102174533A
- Authority
- CN
- China
- Prior art keywords
- polypeptide
- nucleic acid
- fbsa
- fibrinogen
- present
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000007523 nucleic acids Chemical class 0.000 title claims abstract description 169
- 102000039446 nucleic acids Human genes 0.000 title claims abstract description 165
- 108020004707 nucleic acids Proteins 0.000 title claims abstract description 165
- 241000193990 Streptococcus sp. 'group B' Species 0.000 title abstract 4
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 486
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 381
- 229920001184 polypeptide Polymers 0.000 claims abstract description 371
- 125000003275 alpha amino acid group Chemical group 0.000 claims abstract description 71
- 229960005486 vaccine Drugs 0.000 claims abstract description 22
- 210000004027 cell Anatomy 0.000 claims description 150
- 241000193985 Streptococcus agalactiae Species 0.000 claims description 131
- 238000000034 method Methods 0.000 claims description 121
- 241000894006 Bacteria Species 0.000 claims description 96
- 239000012634 fragment Substances 0.000 claims description 91
- 235000001014 amino acid Nutrition 0.000 claims description 83
- 150000001413 amino acids Chemical class 0.000 claims description 82
- 230000003993 interaction Effects 0.000 claims description 58
- 239000005557 antagonist Substances 0.000 claims description 47
- 239000002773 nucleotide Substances 0.000 claims description 39
- 239000000203 mixture Substances 0.000 claims description 38
- 230000000694 effects Effects 0.000 claims description 36
- 125000003729 nucleotide group Chemical group 0.000 claims description 36
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims description 35
- 230000014509 gene expression Effects 0.000 claims description 31
- 150000001875 compounds Chemical class 0.000 claims description 29
- 238000002360 preparation method Methods 0.000 claims description 29
- 108091092562 ribozyme Proteins 0.000 claims description 28
- 238000009396 hybridization Methods 0.000 claims description 27
- 210000002919 epithelial cell Anatomy 0.000 claims description 26
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 25
- 230000013011 mating Effects 0.000 claims description 25
- 201000010099 disease Diseases 0.000 claims description 24
- 238000003745 diagnosis Methods 0.000 claims description 16
- 239000008194 pharmaceutical composition Substances 0.000 claims description 16
- 230000003308 immunostimulating effect Effects 0.000 claims description 15
- 239000000463 material Substances 0.000 claims description 15
- 230000000295 complement effect Effects 0.000 claims description 14
- 239000003814 drug Substances 0.000 claims description 13
- 239000000126 substance Substances 0.000 claims description 13
- 238000011282 treatment Methods 0.000 claims description 11
- 230000002068 genetic effect Effects 0.000 claims description 10
- 238000000926 separation method Methods 0.000 claims description 10
- 102000053642 Catalytic RNA Human genes 0.000 claims description 9
- 108090000994 Catalytic RNA Proteins 0.000 claims description 9
- 241000894007 species Species 0.000 claims description 9
- 102000040650 (ribonucleotides)n+m Human genes 0.000 claims description 8
- 238000006243 chemical reaction Methods 0.000 claims description 8
- 230000000692 anti-sense effect Effects 0.000 claims description 7
- 230000001900 immune effect Effects 0.000 claims description 7
- 238000000338 in vitro Methods 0.000 claims description 7
- 238000001890 transfection Methods 0.000 claims description 7
- 229920002851 polycationic polymer Polymers 0.000 claims description 6
- 230000004044 response Effects 0.000 claims description 5
- PXFBZOLANLWPMH-UHFFFAOYSA-N 16-Epiaffinine Natural products C1C(C2=CC=CC=C2N2)=C2C(=O)CC2C(=CC)CN(C)C1C2CO PXFBZOLANLWPMH-UHFFFAOYSA-N 0.000 claims description 4
- 108020004459 Small interfering RNA Proteins 0.000 claims description 4
- 230000000890 antigenic effect Effects 0.000 claims description 4
- 238000011156 evaluation Methods 0.000 claims description 4
- 238000007899 nucleic acid hybridization Methods 0.000 claims description 4
- 229940046166 oligodeoxynucleotide Drugs 0.000 claims description 4
- 101500027983 Rattus norvegicus Octadecaneuropeptide Proteins 0.000 claims description 3
- 230000002265 prevention Effects 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 abstract description 22
- 229940012952 fibrinogen Drugs 0.000 description 161
- 102000008946 Fibrinogen Human genes 0.000 description 160
- 108010049003 Fibrinogen Proteins 0.000 description 160
- 208000035895 Guillain-Barré syndrome Diseases 0.000 description 151
- 108090000623 proteins and genes Proteins 0.000 description 149
- 229940030998 streptococcus agalactiae Drugs 0.000 description 125
- 230000001580 bacterial effect Effects 0.000 description 118
- 102000040430 polynucleotide Human genes 0.000 description 105
- 108091033319 polynucleotide Proteins 0.000 description 105
- 239000002157 polynucleotide Substances 0.000 description 104
- 229940024606 amino acid Drugs 0.000 description 82
- 102000004169 proteins and genes Human genes 0.000 description 71
- 235000018102 proteins Nutrition 0.000 description 69
- 230000004927 fusion Effects 0.000 description 63
- 108020004414 DNA Proteins 0.000 description 56
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 44
- 238000002474 experimental method Methods 0.000 description 38
- 238000003752 polymerase chain reaction Methods 0.000 description 37
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 32
- 239000013612 plasmid Substances 0.000 description 32
- 239000011324 bead Substances 0.000 description 31
- 239000004816 latex Substances 0.000 description 30
- 229920000126 latex Polymers 0.000 description 29
- 238000012217 deletion Methods 0.000 description 28
- 230000037430 deletion Effects 0.000 description 28
- 108091028043 Nucleic acid sequence Proteins 0.000 description 27
- 238000004458 analytical method Methods 0.000 description 27
- 239000000523 sample Substances 0.000 description 27
- 230000027455 binding Effects 0.000 description 25
- 108091034117 Oligonucleotide Proteins 0.000 description 24
- 108010076504 Protein Sorting Signals Proteins 0.000 description 24
- 238000012986 modification Methods 0.000 description 24
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 22
- 230000008034 disappearance Effects 0.000 description 22
- 230000004048 modification Effects 0.000 description 22
- 101150072510 pabA gene Proteins 0.000 description 22
- 230000008859 change Effects 0.000 description 21
- 101150070572 pabC gene Proteins 0.000 description 21
- 239000000047 product Substances 0.000 description 20
- 238000005406 washing Methods 0.000 description 19
- 238000001262 western blot Methods 0.000 description 19
- 229940106780 human fibrinogen Drugs 0.000 description 18
- 101150013947 pabB gene Proteins 0.000 description 18
- 238000003556 assay Methods 0.000 description 17
- 208000015181 infectious disease Diseases 0.000 description 17
- 210000002966 serum Anatomy 0.000 description 16
- 238000002105 Southern blotting Methods 0.000 description 15
- 238000005516 engineering process Methods 0.000 description 15
- 108091026890 Coding region Proteins 0.000 description 14
- 108700026244 Open Reading Frames Proteins 0.000 description 14
- 239000000427 antigen Substances 0.000 description 14
- 108091007433 antigens Proteins 0.000 description 14
- 102000036639 antigens Human genes 0.000 description 14
- 238000012216 screening Methods 0.000 description 14
- 238000012360 testing method Methods 0.000 description 14
- 241000588724 Escherichia coli Species 0.000 description 13
- 230000004913 activation Effects 0.000 description 13
- 230000003321 amplification Effects 0.000 description 13
- 239000003795 chemical substances by application Substances 0.000 description 13
- 230000000968 intestinal effect Effects 0.000 description 13
- 210000004379 membrane Anatomy 0.000 description 13
- 239000012528 membrane Substances 0.000 description 13
- 238000003199 nucleic acid amplification method Methods 0.000 description 13
- 210000001519 tissue Anatomy 0.000 description 13
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 12
- 229940098773 bovine serum albumin Drugs 0.000 description 12
- 239000013611 chromosomal DNA Substances 0.000 description 12
- 230000008569 process Effects 0.000 description 12
- 238000002965 ELISA Methods 0.000 description 11
- 125000000539 amino acid group Chemical group 0.000 description 11
- 229960003276 erythromycin Drugs 0.000 description 11
- 241000124008 Mammalia Species 0.000 description 10
- 241000699666 Mus <mouse, genus> Species 0.000 description 10
- 239000000074 antisense oligonucleotide Substances 0.000 description 10
- 238000012230 antisense oligonucleotides Methods 0.000 description 10
- 230000010065 bacterial adhesion Effects 0.000 description 10
- 239000004927 clay Substances 0.000 description 10
- 239000012228 culture supernatant Substances 0.000 description 10
- 238000001514 detection method Methods 0.000 description 10
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 238000013016 damping Methods 0.000 description 9
- 230000029087 digestion Effects 0.000 description 9
- 229950003499 fibrin Drugs 0.000 description 9
- 239000012530 fluid Substances 0.000 description 9
- 239000007788 liquid Substances 0.000 description 9
- 230000002685 pulmonary effect Effects 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- 230000014616 translation Effects 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- 229920001817 Agar Polymers 0.000 description 8
- 208000027418 Wounds and injury Diseases 0.000 description 8
- 239000008272 agar Substances 0.000 description 8
- 239000000556 agonist Substances 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 210000004899 c-terminal region Anatomy 0.000 description 8
- 108010007004 cathelin Proteins 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- 239000002299 complementary DNA Substances 0.000 description 8
- 210000003527 eukaryotic cell Anatomy 0.000 description 8
- 230000006870 function Effects 0.000 description 8
- 230000005764 inhibitory process Effects 0.000 description 8
- 238000003780 insertion Methods 0.000 description 8
- 230000037431 insertion Effects 0.000 description 8
- 244000005700 microbiome Species 0.000 description 8
- 230000003287 optical effect Effects 0.000 description 8
- 239000002243 precursor Substances 0.000 description 8
- 238000004626 scanning electron microscopy Methods 0.000 description 8
- 239000000758 substrate Substances 0.000 description 8
- 238000013519 translation Methods 0.000 description 8
- 108010073385 Fibrin Proteins 0.000 description 7
- 102000009123 Fibrin Human genes 0.000 description 7
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 7
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 7
- 206010052428 Wound Diseases 0.000 description 7
- 239000008280 blood Substances 0.000 description 7
- 239000013604 expression vector Substances 0.000 description 7
- 230000036039 immunity Effects 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 230000035800 maturation Effects 0.000 description 7
- 108020004999 messenger RNA Proteins 0.000 description 7
- 238000011160 research Methods 0.000 description 7
- 238000010561 standard procedure Methods 0.000 description 7
- 238000013518 transcription Methods 0.000 description 7
- 230000035897 transcription Effects 0.000 description 7
- 102000040350 B family Human genes 0.000 description 6
- 108091072128 B family Proteins 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 108010067306 Fibronectins Proteins 0.000 description 6
- 102000016359 Fibronectins Human genes 0.000 description 6
- 101710198693 Invasin Proteins 0.000 description 6
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 6
- 102000018697 Membrane Proteins Human genes 0.000 description 6
- 108010052285 Membrane Proteins Proteins 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 239000002671 adjuvant Substances 0.000 description 6
- 238000009795 derivation Methods 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 230000013595 glycosylation Effects 0.000 description 6
- 108010037896 heparin-binding hemagglutinin Proteins 0.000 description 6
- 230000008676 import Effects 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 238000012545 processing Methods 0.000 description 6
- 238000003757 reverse transcription PCR Methods 0.000 description 6
- 238000007789 sealing Methods 0.000 description 6
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 239000003104 tissue culture media Substances 0.000 description 6
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 5
- 239000000020 Nitrocellulose Substances 0.000 description 5
- 206010057249 Phagocytosis Diseases 0.000 description 5
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 5
- 241000194019 Streptococcus mutans Species 0.000 description 5
- 241000193998 Streptococcus pneumoniae Species 0.000 description 5
- 241000193996 Streptococcus pyogenes Species 0.000 description 5
- 102220477417 Uncharacterized protein FLJ30774_R14K_mutation Human genes 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 210000002421 cell wall Anatomy 0.000 description 5
- 238000005119 centrifugation Methods 0.000 description 5
- 238000010367 cloning Methods 0.000 description 5
- 230000006957 competitive inhibition Effects 0.000 description 5
- 230000003750 conditioning effect Effects 0.000 description 5
- 230000008878 coupling Effects 0.000 description 5
- 238000010168 coupling process Methods 0.000 description 5
- 238000005859 coupling reaction Methods 0.000 description 5
- 238000013461 design Methods 0.000 description 5
- 238000006206 glycosylation reaction Methods 0.000 description 5
- 230000012010 growth Effects 0.000 description 5
- 230000012447 hatching Effects 0.000 description 5
- 230000028993 immune response Effects 0.000 description 5
- 230000002163 immunogen Effects 0.000 description 5
- 230000005847 immunogenicity Effects 0.000 description 5
- 210000000088 lip Anatomy 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- 229920001220 nitrocellulos Polymers 0.000 description 5
- 230000008782 phagocytosis Effects 0.000 description 5
- 230000004481 post-translational protein modification Effects 0.000 description 5
- 230000001737 promoting effect Effects 0.000 description 5
- 230000006798 recombination Effects 0.000 description 5
- 238000005215 recombination Methods 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000008521 reorganization Effects 0.000 description 5
- 230000028327 secretion Effects 0.000 description 5
- 238000013207 serial dilution Methods 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 5
- 241000283707 Capra Species 0.000 description 4
- 229920002160 Celluloid Polymers 0.000 description 4
- 102000053602 DNA Human genes 0.000 description 4
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 4
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 4
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- 206010040047 Sepsis Diseases 0.000 description 4
- 241000191940 Staphylococcus Species 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 230000001464 adherent effect Effects 0.000 description 4
- 238000001042 affinity chromatography Methods 0.000 description 4
- 230000003115 biocidal effect Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 230000003197 catalytic effect Effects 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 4
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 4
- OGGXGZAMXPVRFZ-UHFFFAOYSA-N dimethylarsinic acid Chemical compound C[As](C)(O)=O OGGXGZAMXPVRFZ-UHFFFAOYSA-N 0.000 description 4
- 210000002950 fibroblast Anatomy 0.000 description 4
- 238000006062 fragmentation reaction Methods 0.000 description 4
- 108020001507 fusion proteins Proteins 0.000 description 4
- 102000037865 fusion proteins Human genes 0.000 description 4
- 230000003053 immunization Effects 0.000 description 4
- 238000002649 immunization Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 231100000350 mutagenesis Toxicity 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- 239000011049 pearl Substances 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N phosphoric acid Substances OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 230000035479 physiological effects, processes and functions Effects 0.000 description 4
- -1 polyoxyethylene Polymers 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 230000009257 reactivity Effects 0.000 description 4
- 108020003175 receptors Proteins 0.000 description 4
- 102000005962 receptors Human genes 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 102200082902 rs33947457 Human genes 0.000 description 4
- 238000012163 sequencing technique Methods 0.000 description 4
- 230000002103 transcriptional effect Effects 0.000 description 4
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 238000001712 DNA sequencing Methods 0.000 description 3
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 3
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 3
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 3
- 241000238631 Hexapoda Species 0.000 description 3
- 241000829100 Macaca mulatta polyomavirus 1 Species 0.000 description 3
- 238000012300 Sequence Analysis Methods 0.000 description 3
- 241001540742 Streptococcus agalactiae NEM316 Species 0.000 description 3
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical compound OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 3
- 230000000996 additive effect Effects 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 3
- 238000000137 annealing Methods 0.000 description 3
- 230000021164 cell adhesion Effects 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 238000005336 cracking Methods 0.000 description 3
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical class NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 238000000502 dialysis Methods 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 229940000406 drug candidate Drugs 0.000 description 3
- 238000004520 electroporation Methods 0.000 description 3
- 238000013467 fragmentation Methods 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 239000011159 matrix material Substances 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 3
- 235000013336 milk Nutrition 0.000 description 3
- 239000008267 milk Substances 0.000 description 3
- 210000004080 milk Anatomy 0.000 description 3
- 238000010369 molecular cloning Methods 0.000 description 3
- 150000004713 phosphodiesters Chemical class 0.000 description 3
- 229920001282 polysaccharide Polymers 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 230000003449 preventive effect Effects 0.000 description 3
- 238000011321 prophylaxis Methods 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 230000003252 repetitive effect Effects 0.000 description 3
- 108091008146 restriction endonucleases Proteins 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 210000001215 vagina Anatomy 0.000 description 3
- 239000013598 vector Substances 0.000 description 3
- DIGQNXIGRZPYDK-WKSCXVIASA-N (2R)-6-amino-2-[[2-[[(2S)-2-[[2-[[(2R)-2-[[(2S)-2-[[(2R,3S)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S,3S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2R)-2-[[2-[[2-[[2-[(2-amino-1-hydroxyethylidene)amino]-3-carboxy-1-hydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxypropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1,5-dihydroxy-5-iminopentylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxybutylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1,3-dihydroxypropylidene]amino]-1-hydroxyethylidene]amino]-1-hydroxy-3-sulfanylpropylidene]amino]-1-hydroxyethylidene]amino]hexanoic acid Chemical compound C[C@@H]([C@@H](C(=N[C@@H](CS)C(=N[C@@H](C)C(=N[C@@H](CO)C(=NCC(=N[C@@H](CCC(=N)O)C(=NC(CS)C(=N[C@H]([C@H](C)O)C(=N[C@H](CS)C(=N[C@H](CO)C(=NCC(=N[C@H](CS)C(=NCC(=N[C@H](CCCCN)C(=O)O)O)O)O)O)O)O)O)O)O)O)O)O)O)N=C([C@H](CS)N=C([C@H](CO)N=C([C@H](CO)N=C([C@H](C)N=C(CN=C([C@H](CO)N=C([C@H](CS)N=C(CN=C(C(CS)N=C(C(CC(=O)O)N=C(CN)O)O)O)O)O)O)O)O)O)O)O)O DIGQNXIGRZPYDK-WKSCXVIASA-N 0.000 description 2
- 230000005730 ADP ribosylation Effects 0.000 description 2
- 108700042778 Antimicrobial Peptides Proteins 0.000 description 2
- 102000044503 Antimicrobial Peptides Human genes 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- 108010060123 Conjugate Vaccines Proteins 0.000 description 2
- 230000004544 DNA amplification Effects 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 108700039691 Genetic Promoter Regions Proteins 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 102220622304 Huntingtin-associated protein 1_D10G_mutation Human genes 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- UGQMRVRMYYASKQ-KQYNXXCUSA-N Inosine Chemical group O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C2=NC=NC(O)=C2N=C1 UGQMRVRMYYASKQ-KQYNXXCUSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical group OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- 241000194036 Lactococcus Species 0.000 description 2
- 201000009906 Meningitis Diseases 0.000 description 2
- 206010027336 Menstruation delayed Diseases 0.000 description 2
- 102000003792 Metallothionein Human genes 0.000 description 2
- 108090000157 Metallothionein Proteins 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 101710163270 Nuclease Proteins 0.000 description 2
- 238000012408 PCR amplification Methods 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- 206010035664 Pneumonia Diseases 0.000 description 2
- 108010059712 Pronase Proteins 0.000 description 2
- 101000749830 Rattus norvegicus Connector enhancer of kinase suppressor of ras 2 Proteins 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108700008625 Reporter Genes Proteins 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 108091081024 Start codon Proteins 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- 206010061372 Streptococcal infection Diseases 0.000 description 2
- 241000194017 Streptococcus Species 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 108010031318 Vitronectin Proteins 0.000 description 2
- 102100035140 Vitronectin Human genes 0.000 description 2
- 150000001408 amides Chemical group 0.000 description 2
- 230000000845 anti-microbial effect Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- OHDRQQURAXLVGJ-HLVWOLMTSA-N azane;(2e)-3-ethyl-2-[(e)-(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S/1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C\1=N/N=C1/SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-HLVWOLMTSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- 239000007853 buffer solution Substances 0.000 description 2
- 229950004243 cacodylic acid Drugs 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 244000309466 calf Species 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- 108060001132 cathelicidin Proteins 0.000 description 2
- 102000014509 cathelicidin Human genes 0.000 description 2
- POIUWJQBRNEFGX-XAMSXPGMSA-N cathelicidin Chemical compound C([C@@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(C)C)C1=CC=CC=C1 POIUWJQBRNEFGX-XAMSXPGMSA-N 0.000 description 2
- 238000005277 cation exchange chromatography Methods 0.000 description 2
- 210000000170 cell membrane Anatomy 0.000 description 2
- 238000001311 chemical methods and process Methods 0.000 description 2
- 230000002759 chromosomal effect Effects 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 230000005757 colony formation Effects 0.000 description 2
- 238000012875 competitive assay Methods 0.000 description 2
- 230000024203 complement activation Effects 0.000 description 2
- 238000004590 computer program Methods 0.000 description 2
- 238000012790 confirmation Methods 0.000 description 2
- 229940031670 conjugate vaccine Drugs 0.000 description 2
- 230000009260 cross reactivity Effects 0.000 description 2
- 238000005520 cutting process Methods 0.000 description 2
- 230000007123 defense Effects 0.000 description 2
- 239000005547 deoxyribonucleotide Substances 0.000 description 2
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 2
- 239000012153 distilled water Substances 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000004043 dyeing Methods 0.000 description 2
- 238000001976 enzyme digestion Methods 0.000 description 2
- 210000000981 epithelium Anatomy 0.000 description 2
- 230000006251 gamma-carboxylation Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 238000001502 gel electrophoresis Methods 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 210000004408 hybridoma Anatomy 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 230000033444 hydroxylation Effects 0.000 description 2
- 238000005805 hydroxylation reaction Methods 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 238000002513 implantation Methods 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 2
- 239000006210 lotion Substances 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 235000013372 meat Nutrition 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Natural products C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 102000013415 peroxidase activity proteins Human genes 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- 230000002688 persistence Effects 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- 239000011574 phosphorus Substances 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 239000004033 plastic Substances 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 239000003910 polypeptide antibiotic agent Substances 0.000 description 2
- 238000002203 pretreatment Methods 0.000 description 2
- XXPDBLUZJRXNNZ-UHFFFAOYSA-N promethazine hydrochloride Chemical compound Cl.C1=CC=C2N(CC(C)N(C)C)C3=CC=CC=C3SC2=C1 XXPDBLUZJRXNNZ-UHFFFAOYSA-N 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 238000007894 restriction fragment length polymorphism technique Methods 0.000 description 2
- 239000012266 salt solution Substances 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 235000014347 soups Nutrition 0.000 description 2
- 230000019635 sulfation Effects 0.000 description 2
- 238000005670 sulfation reaction Methods 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- 150000003582 thiophosphoric acids Chemical class 0.000 description 2
- 208000037816 tissue injury Diseases 0.000 description 2
- 231100000027 toxicology Toxicity 0.000 description 2
- 230000005030 transcription termination Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 239000003656 tris buffered saline Substances 0.000 description 2
- 241001430294 unidentified retrovirus Species 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- 229940088594 vitamin Drugs 0.000 description 2
- 239000011782 vitamin Substances 0.000 description 2
- 235000013343 vitamin Nutrition 0.000 description 2
- 229930003231 vitamin Natural products 0.000 description 2
- 150000003722 vitamin derivatives Chemical class 0.000 description 2
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 1
- BLSQLHNBWJLIBQ-OZXSUGGESA-N (2R,4S)-terconazole Chemical compound C1CN(C(C)C)CCN1C(C=C1)=CC=C1OC[C@@H]1O[C@@](CN2N=CN=C2)(C=2C(=CC(Cl)=CC=2)Cl)OC1 BLSQLHNBWJLIBQ-OZXSUGGESA-N 0.000 description 1
- IVWWFWFVSWOTLP-YVZVNANGSA-N (3'as,4r,7'as)-2,2,2',2'-tetramethylspiro[1,3-dioxolane-4,6'-4,7a-dihydro-3ah-[1,3]dioxolo[4,5-c]pyran]-7'-one Chemical compound C([C@@H]1OC(O[C@@H]1C1=O)(C)C)O[C@]21COC(C)(C)O2 IVWWFWFVSWOTLP-YVZVNANGSA-N 0.000 description 1
- NWXMGUDVXFXRIG-WESIUVDSSA-N (4s,4as,5as,6s,12ar)-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4,4a,5,5a-tetrahydrotetracene-2-carboxamide Chemical compound C1=CC=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]4(O)C(=O)C3=C(O)C2=C1O NWXMGUDVXFXRIG-WESIUVDSSA-N 0.000 description 1
- ALSTYHKOOCGGFT-KTKRTIGZSA-N (9Z)-octadecen-1-ol Chemical compound CCCCCCCC\C=C/CCCCCCCCO ALSTYHKOOCGGFT-KTKRTIGZSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-UHFFFAOYSA-N 1-beta-D-Xylofuranosyl-NH-Cytosine Natural products O=C1N=C(N)C=CN1C1C(O)C(O)C(CO)O1 UHDGCWIWMRVCDJ-UHFFFAOYSA-N 0.000 description 1
- MXHRCPNRJAMMIM-SHYZEUOFSA-N 2'-deoxyuridine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C=C1 MXHRCPNRJAMMIM-SHYZEUOFSA-N 0.000 description 1
- YRNWIFYIFSBPAU-UHFFFAOYSA-N 4-[4-(dimethylamino)phenyl]-n,n-dimethylaniline Chemical compound C1=CC(N(C)C)=CC=C1C1=CC=C(N(C)C)C=C1 YRNWIFYIFSBPAU-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- FPCPONSZWYDXRD-UHFFFAOYSA-N 6-(9h-fluoren-9-ylmethoxycarbonylamino)hexanoic acid Chemical compound C1=CC=C2C(COC(=O)NCCCCCC(=O)O)C3=CC=CC=C3C2=C1 FPCPONSZWYDXRD-UHFFFAOYSA-N 0.000 description 1
- 108010011619 6-Phytase Proteins 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 206010060937 Amniotic cavity infection Diseases 0.000 description 1
- 108020004491 Antisense DNA Proteins 0.000 description 1
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241000228232 Aspergillus tubingensis Species 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000345998 Calamus manan Species 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 108010035563 Chloramphenicol O-acetyltransferase Proteins 0.000 description 1
- 208000008158 Chorioamnionitis Diseases 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- 108091033380 Coding strand Proteins 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 208000028698 Cognitive impairment Diseases 0.000 description 1
- 102000012422 Collagen Type I Human genes 0.000 description 1
- 108010022452 Collagen Type I Proteins 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- UHDGCWIWMRVCDJ-PSQAKQOGSA-N Cytidine Natural products O=C1N=C(N)C=CN1[C@@H]1[C@@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-PSQAKQOGSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-ZXXMMSQZSA-N D-iditol Chemical compound OC[C@@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-ZXXMMSQZSA-N 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 206010011878 Deafness Diseases 0.000 description 1
- 102000000541 Defensins Human genes 0.000 description 1
- 108010002069 Defensins Proteins 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 108010012088 Fibrinogen Receptors Proteins 0.000 description 1
- 241000192125 Firmicutes Species 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 241000700662 Fowlpox virus Species 0.000 description 1
- 108010001515 Galectin 4 Proteins 0.000 description 1
- 102100039556 Galectin-4 Human genes 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108700007698 Genetic Terminator Regions Proteins 0.000 description 1
- 206010071602 Genetic polymorphism Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 206010019663 Hepatic failure Diseases 0.000 description 1
- 208000028523 Hereditary Complement Deficiency disease Diseases 0.000 description 1
- 101000777550 Homo sapiens CCN family member 2 Proteins 0.000 description 1
- 101000911390 Homo sapiens Coagulation factor VIII Proteins 0.000 description 1
- 101001132113 Homo sapiens Peroxisomal testis-specific protein 1 Proteins 0.000 description 1
- 102000002265 Human Growth Hormone Human genes 0.000 description 1
- 108010000521 Human Growth Hormone Proteins 0.000 description 1
- 239000000854 Human Growth Hormone Substances 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 208000032754 Infant Death Diseases 0.000 description 1
- LEVWYRKDKASIDU-IMJSIDKUSA-N L-cystine Chemical compound [O-]C(=O)[C@@H]([NH3+])CSSC[C@H]([NH3+])C([O-])=O LEVWYRKDKASIDU-IMJSIDKUSA-N 0.000 description 1
- 208000020358 Learning disease Diseases 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 241001625930 Luria Species 0.000 description 1
- 108091027974 Mature messenger RNA Proteins 0.000 description 1
- 101100023016 Methanothermobacter marburgensis (strain ATCC BAA-927 / DSM 2133 / JCM 14651 / NBRC 100331 / OCM 82 / Marburg) mat gene Proteins 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 108010064696 N,O-diacetylmuramidase Proteins 0.000 description 1
- PYUSHNKNPOHWEZ-YFKPBYRVSA-N N-formyl-L-methionine Chemical compound CSCC[C@@H](C(O)=O)NC=O PYUSHNKNPOHWEZ-YFKPBYRVSA-N 0.000 description 1
- 108091092724 Noncoding DNA Proteins 0.000 description 1
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- XKQTZZAQYYWSKE-UHFFFAOYSA-N P(O)(O)(=O)N.P(O)(O)(=O)N Chemical compound P(O)(O)(=O)N.P(O)(O)(=O)N XKQTZZAQYYWSKE-UHFFFAOYSA-N 0.000 description 1
- 238000010222 PCR analysis Methods 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 108010067902 Peptide Library Proteins 0.000 description 1
- 102100034529 Peroxisomal testis-specific protein 1 Human genes 0.000 description 1
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 1
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 108010039918 Polylysine Proteins 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 241000714474 Rous sarcoma virus Species 0.000 description 1
- 108091081021 Sense strand Proteins 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- BLRPTPMANUNPDV-UHFFFAOYSA-N Silane Chemical compound [SiH4] BLRPTPMANUNPDV-UHFFFAOYSA-N 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 206010062255 Soft tissue infection Diseases 0.000 description 1
- 102220557642 Sperm acrosome-associated protein 5_D10N_mutation Human genes 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- 241000295644 Staphylococcaceae Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 241001655322 Streptomycetales Species 0.000 description 1
- 208000037065 Subacute sclerosing leukoencephalitis Diseases 0.000 description 1
- 206010042297 Subacute sclerosing panencephalitis Diseases 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 241000701093 Suid alphaherpesvirus 1 Species 0.000 description 1
- 230000005867 T cell response Effects 0.000 description 1
- 108020005038 Terminator Codon Proteins 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 108700009124 Transcription Initiation Site Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108020004566 Transfer RNA Proteins 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 101150117115 V gene Proteins 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 229930003756 Vitamin B7 Natural products 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 210000005006 adaptive immune system Anatomy 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 239000004411 aluminium Substances 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 208000019812 amnionitis Diseases 0.000 description 1
- 210000004381 amniotic fluid Anatomy 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 229940124350 antibacterial drug Drugs 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000003816 antisense DNA Substances 0.000 description 1
- 210000000436 anus Anatomy 0.000 description 1
- 239000002473 artificial blood Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000008952 bacterial invasion Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 125000004057 biotinyl group Chemical group [H]N1C(=O)N([H])[C@]2([H])[C@@]([H])(SC([H])([H])[C@]12[H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C(*)=O 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 229940041514 candida albicans extract Drugs 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 101150055766 cat gene Proteins 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 125000002091 cationic group Chemical group 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 210000003756 cervix mucus Anatomy 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000013626 chemical specie Substances 0.000 description 1
- 238000002038 chemiluminescence detection Methods 0.000 description 1
- VDQQXEISLMTGAB-UHFFFAOYSA-N chloramine T Chemical compound [Na+].CC1=CC=C(S(=O)(=O)[N-]Cl)C=C1 VDQQXEISLMTGAB-UHFFFAOYSA-N 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- 238000000975 co-precipitation Methods 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 230000001332 colony forming effect Effects 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 201000002388 complement deficiency Diseases 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000000287 crude extract Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- UHDGCWIWMRVCDJ-ZAKLUEHWSA-N cytidine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O1 UHDGCWIWMRVCDJ-ZAKLUEHWSA-N 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 231100000895 deafness Toxicity 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000018044 dehydration Effects 0.000 description 1
- 238000006297 dehydration reaction Methods 0.000 description 1
- 230000017858 demethylation Effects 0.000 description 1
- 238000010520 demethylation reaction Methods 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- OGGXGZAMXPVRFZ-UHFFFAOYSA-M dimethylarsinate Chemical compound C[As](C)([O-])=O OGGXGZAMXPVRFZ-UHFFFAOYSA-M 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 210000003725 endotheliocyte Anatomy 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000003885 eye ointment Substances 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 239000002319 fibrinogen receptor antagonist Substances 0.000 description 1
- 244000144992 flock Species 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 230000004907 flux Effects 0.000 description 1
- 230000022244 formylation Effects 0.000 description 1
- 238000006170 formylation reaction Methods 0.000 description 1
- 238000010230 functional analysis Methods 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 229940089256 fungistat Drugs 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 239000011544 gradient gel Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 150000003278 haem Chemical group 0.000 description 1
- 238000003306 harvesting Methods 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000016354 hearing loss disease Diseases 0.000 description 1
- 210000003709 heart valve Anatomy 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 102000047612 human CCN2 Human genes 0.000 description 1
- 102000057593 human F8 Human genes 0.000 description 1
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 238000012872 hydroxylapatite chromatography Methods 0.000 description 1
- 230000007124 immune defense Effects 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000001524 infective effect Effects 0.000 description 1
- 206010022000 influenza Diseases 0.000 description 1
- 238000013383 initial experiment Methods 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- ICIWUVCWSCSTAQ-UHFFFAOYSA-M iodate Chemical compound [O-]I(=O)=O ICIWUVCWSCSTAQ-UHFFFAOYSA-M 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 230000006122 isoprenylation Effects 0.000 description 1
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 201000003723 learning disability Diseases 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 208000007903 liver failure Diseases 0.000 description 1
- 231100000835 liver failure Toxicity 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000005296 lung carcinoma Diseases 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 206010025482 malaise Diseases 0.000 description 1
- 210000005075 mammary gland Anatomy 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 238000001840 matrix-assisted laser desorption--ionisation time-of-flight mass spectrometry Methods 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 101150095438 metK gene Proteins 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 1
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical compound CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 239000011859 microparticle Substances 0.000 description 1
- 210000000110 microvilli Anatomy 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 230000007498 myristoylation Effects 0.000 description 1
- 239000006225 natural substrate Substances 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 235000020939 nutritional additive Nutrition 0.000 description 1
- 239000003883 ointment base Substances 0.000 description 1
- 229940055577 oleyl alcohol Drugs 0.000 description 1
- XMLQWXUVTXCDDL-UHFFFAOYSA-N oleyl alcohol Natural products CCCCCCC=CCCCCCCCCCCO XMLQWXUVTXCDDL-UHFFFAOYSA-N 0.000 description 1
- 229940124276 oligodeoxyribonucleotide Drugs 0.000 description 1
- 239000002751 oligonucleotide probe Substances 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 230000014207 opsonization Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 230000008520 organization Effects 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 230000005298 paramagnetic effect Effects 0.000 description 1
- 229940049547 paraxin Drugs 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000003182 parenteral nutrition solution Substances 0.000 description 1
- 230000032696 parturition Effects 0.000 description 1
- 238000002161 passivation Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- MCYTYTUNNNZWOK-LCLOTLQISA-N penetratin Chemical compound C([C@H](NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CCCNC(N)=N)[C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(N)=O)C1=CC=CC=C1 MCYTYTUNNNZWOK-LCLOTLQISA-N 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 229940056360 penicillin g Drugs 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 201000001245 periodontitis Diseases 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 230000002399 phagocytotic effect Effects 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 229940067626 phosphatidylinositols Drugs 0.000 description 1
- 150000003905 phosphatidylinositols Chemical class 0.000 description 1
- 229940085127 phytase Drugs 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 238000002616 plasmapheresis Methods 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229920000724 poly(L-arginine) polymer Polymers 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 108010011110 polyarginine Proteins 0.000 description 1
- 229920000656 polylysine Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 238000001243 protein synthesis Methods 0.000 description 1
- 230000003161 proteinsynthetic effect Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 210000001243 pseudopodia Anatomy 0.000 description 1
- 230000020878 pseudopodium assembly Effects 0.000 description 1
- 229940079889 pyrrolidonecarboxylic acid Drugs 0.000 description 1
- 230000006340 racemization Effects 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 239000002516 radical scavenger Substances 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 235000012950 rattan cane Nutrition 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 229940047431 recombinate Drugs 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 238000003571 reporter gene assay Methods 0.000 description 1
- 230000000452 restraining effect Effects 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 102220075538 rs796053378 Human genes 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000012106 screening analysis Methods 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 208000002254 stillbirth Diseases 0.000 description 1
- 231100000537 stillbirth Toxicity 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- QTENRWWVYAAPBI-YCRXJPFRSA-N streptomycin sulfate Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.OS(O)(=O)=O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](N=C(N)N)[C@H](O)[C@@H](N=C(N)N)[C@H](O)[C@H]1O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](N=C(N)N)[C@H](O)[C@@H](N=C(N)N)[C@H](O)[C@H]1O QTENRWWVYAAPBI-YCRXJPFRSA-N 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 238000000352 supercritical drying Methods 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 230000009182 swimming Effects 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000003685 thermal hair damage Effects 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000014621 translational initiation Effects 0.000 description 1
- 230000017105 transposition Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 238000005866 tritylation reaction Methods 0.000 description 1
- 238000010798 ubiquitination Methods 0.000 description 1
- 230000034512 ubiquitination Effects 0.000 description 1
- 238000002525 ultrasonication Methods 0.000 description 1
- 108020005087 unfolded proteins Proteins 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001515965 unidentified phage Species 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 210000003708 urethra Anatomy 0.000 description 1
- 208000019206 urinary tract infection Diseases 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000004304 visual acuity Effects 0.000 description 1
- 235000011912 vitamin B7 Nutrition 0.000 description 1
- 239000011735 vitamin B7 Substances 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 239000012138 yeast extract Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/315—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Streptococcus (G), e.g. Enterococci
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
Abstract
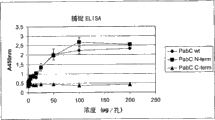
本发明涉及编码B族链球菌的粘着因子的核酸、B族链球菌的粘着因子及其用途。更具体地,本发明涉及为这种粘着因子并包含氨基酸序列的多肽,其中该氨基酸序列选自SEQ ID NO11到SEQ ID NO20,还涉及所述多肽用于生产疫苗的用途。
Description
本申请是发明名称为“编码B族链球菌粘着因子的核酸、B族链球菌的粘着因子和它们的用途”,国际申请日为2003年10月15日,国际申请号为PCT/EP2003/011436,进入中国国家阶段日期为2005年4月5日,中国申请号为200380101524.X的分案申请。
本发明涉及编码细菌粘着因子的分离的核酸分子、细菌粘着因子和它们的各种用途。
发明背景
无乳链球菌(Streptococcus agalactiae),或者B族链球菌(GBS),是婴儿死亡的最主要的原因。GBS具有每年几千例的估计流行率,导致美国的年死亡率为约10%到15%(Schuchat,1998)。来自美国的研究表明每1000个活产1-2例的危险(Zangwill等人,1992),不同的欧洲国家的发病率为每1000个活产0.24到1.26例(Carstensen等人,1985;Faxelius等人,1988)。在美国,高达30%的怀孕妇女在阴道或直肠中至少暂时携带GBS而无症状(Schuchat,1998)。这些妇女所生的婴儿在分娩过程中被GBS定居(Baker和Edwards,1995)。受感染的羊水或者阴道分泌物的吸入使得GBS进入肺中。该感染的通常表现包括菌血症、肺炎和脑膜炎(Spellerberg,2000)。甚至GBS脑膜炎的幸存婴儿也患有神经后遗症,包括耳聋、学习障碍,以及运动、感觉和认知损伤(Baker和Edwards,1995)。目前,临产时抗生素预防是预防GBS导致的新生儿疾病的推荐方法(Baker等人,1999);然而,随着其他链球菌种中抗生素抗性的再现,在GBS中可能发生类似的困境。
除了婴儿感染,GBS也是老年和免疫受损的人中的重要病原,其中侵染性GBS疾病的发生率为100,000人中约9例(Farley等人,1993)。这些感染中,死亡率可高达30%。
一种重要的GBS毒性决定簇是类型-特异的荚膜多糖,其防止宿主补体因子C3b的沉积并从而抑制细菌的调理吞噬作用(opsonophagocytosis)(Rubens等人,1987)。迄今为止,已经鉴定了GBS中9种不同的荚膜血清型:Ia、Ib、和II到VIII(Wessels,1997)。目前正在基于临床相关的血清型荚膜多糖的开发针对GBS的多效价的缀合疫苗(Paoletti等人,1999;Baker等人,1999;Baker等人,2000;Paoletti和Kasper,2002)。然而,对于含有荚膜的缀合疫苗有许多技术困难需要克服:需要多种血清型,需要鉴定和验证适宜的蛋白质缀合物,并且需要处理与人组织的潜在交叉反应性(Korzeniowska-Kowal等人,2001)。使用GBS的细胞表面蛋白代表了对于针对这些细菌的疫苗开发,对荚膜多糖的有吸引力的备选方案。已经表明来自GBS的表面蛋白Sip、Rib、α和β赋予小鼠针对GBS感染的保护性免疫(Madoff等人,1992;Larsson等人,1997;Larsson等人,1999;Brodeur等人,2000)。还表明来自血清型V菌株的两种独特的表面蛋白在小鼠模型中保护小鼠免受GBS感染(Areschoug等人,1999)。最后,发现针对GBS C5a肽酶的抗体引起细胞的巨噬细胞杀伤(Cheng等人,2001)。
GBS与其宿主的相互作用是一种复杂的过程,包括定居和上皮和内皮表面的穿透和免疫防御的逃避(Spellerberg,2000)。在链球菌中,已经表明血纤蛋白原结合在对宿主表面的粘附(Courtney等人,1994;Cheung等人,1991;Ni等人,1998;Pei和Flock,2001)和免受免疫系统破坏的保护(Courtney等人,1997;Thern等人,1998;Ringdahl等人,2000)中起着重要的作用。因此,一些研究已经着手研究A、C和G血清群的链球菌中血纤蛋白原结合的分子基础(Fischetti,1989;Meehan等人,1998;Vasi等人,2000)。
血纤蛋白原是在血浆中以高浓度发现的一种330kDa糖蛋白(Fuss等人,2001;Mosesson等人,2001)。其是由通过二硫键连接在一起的Aα-、Bβ-和γ-链各两条组成的六聚体。血纤蛋白原是止血中的关键角色并且介导损伤处血小板粘附和聚集。此外,其被凝血酶切割形成血纤蛋白,其是血凝块的主要成分。血纤蛋白原在调理吞噬作用中也起作用。已经表明其抑制活化的补体因子C3b的结合,从而阻碍补体旁路的活化(Whitnack等人,1984;Whitnack和Beachey,1985)新生儿对弥散的GBS感染的独特敏感性与相对补体缺乏有关(Mills等人,1979;Edwards等人,1983)。从而GBS的血纤蛋白原结合在新生儿中残余补体活性的抑制中起着重要作用(Noel等人,1991)。
在一些研究中,已经阐明了GBS与人血纤蛋白原的相互作用(Schonbeck等人,1981;Lammler等人,1983;Chhatwal等人,1984;Spellerberg等人,2002)。然而,GBS中血纤蛋白原结合的分子基础仍然未知。
已经阐明GBS结合并侵染上皮和内皮细胞(Gibson等人,1993;LaPenta等人,1997;Winram等人,1998)。用蛋白酶胰蛋白酶处理GBS除去了细菌的粘附和侵染性质(Valentin-Weigand和Chhatwal,1995;Winram等人,1998),表明GBS中粘附素和侵染素的蛋白质本质。由于粘附素和侵染素位于细菌的表面并且对于GBS的毒性是重要的,所以它们代表GBS疫苗开发的理想靶标。
本发明的问题是提供开发如针对细菌感染的疫苗的药物的方法。更具体地,该问题是提供可用于所述药物生产的GBS的新粘着因子。
在第一方面中,通过优选编码血纤蛋白原-结合-多肽或这种蛋白或者其片段的分离的核酸分子解决了该问题,该分离的核酸分子含有选自包含下面的组的核酸序列:
a)具有与选自SEQ ID NO 1到SEQ ID NO 6的核酸序列至少70%同一性的核酸,
b)与a)的核酸基本互补的核酸,
c)含有a)或b)的核酸的至少15个连续碱基的核酸,
d)在严格杂交条件下与a)、b)或c)的多核苷酸退火的核酸和
e)如果没有遗传密码简并性,将与a)、b)、c)或d)中定义的核酸杂交的核酸。
在第二方面,通过优选编码粘着因子或者其片段的分离的核酸分子解决了该问题,该分离的核酸分子含有选自下面组的核酸序列:
a)与SeqID NO 7、SeqID NO 8、SeqID NO 9或SeqID NO 10中提出的核酸序列具有至少70%同一性的核酸,
b)与a)的核酸基本上互补的核酸,
c)含有a)或b)的核酸的至少15个连续碱基的核酸,
d)在严格杂交条件下与a)、b)或c)的核酸退火的核酸,和
e)如果没有遗传密码简并性,将与a)、b)、c)或d)中定义的核酸杂交的核酸。
在本发明的两个方面的一个实施方案中,同一性为至少80%,优选至少90%,更优选100%。
在本发明的两个方面的另一个实施方案中,核酸是DNA。
在本发明的两个方面的另一个实施方案中,核酸是RNA。
在本发明的两个方面的一个优选实施方案中,从细菌分离核酸分子。
在本发明的两个方面的一个更优选实施方案中,细菌是选自链球菌属、葡萄球菌属(Staphylococci)和乳球菌属(Lactococci)的菌种。
在本发明的两个方面的一个甚至更优选实施方案中,细菌是选自无乳链球菌、酿脓链球菌(Streptococcus pyogenes)、肺炎链球菌(Streptococcus pneumoniae)和变异链球菌(Streptococcus mutans)的菌种。
在本发明的两个方面的最优选实施方案中,细菌是无乳链球菌。
在本发明的第一方面的一个实施方案中,核酸分子编码一种血纤蛋白原-结合-蛋白,该蛋白含有包括16个氨基酸的氨基酸基序(motive)的至少一个重复。
在本发明的第二方面的一个实施方案中,核酸分子编码与上皮细胞相互作用的粘着因子。
在本发明的第一方面的一个优选实施方案中,所编码的血纤蛋白原结合蛋白含有该氨基酸基序的19个重复,其中该氨基酸基序是此处指出或公开的氨基酸基序的任一种。
在本发明的第一方面的一个更优选实施方案中,该重复被选自SEQ ID NO 21到SEQ ID NO 112的一个多核苷酸编码。
在第三方面,通过含有一个核酸序列的分离的核酸分子解决了本发明的问题,其中该核酸序列选自SEQ ID NO 21到112。
在第四方面,通过编码一种多肽的分离的核酸分子解决了本发明的问题,其中该多肽含有一氨基酸基序,其中该氨基酸基序为G-N/S/T-V-L-A/E/M/Q-R-R-X-K/R/W-A/D/E/N/Q--A/F/I/L/V/Y-X-X-K/R-X-X(SEQ ID NO 222)。
在本发明的1到4方面的任一方面的优选实施方案中,核酸为DNA、RNA或者它们的混合物,优选该核酸分子从基因组DNA分离。
在第五方面,通过含有根据本发明的任一方面的核酸分子的载体解决了本发明的问题。
在优选的实施方案中,该载体适于被根据本发明的任一方面的核酸分子编码的多肽的重组表达。
在第六方面,通过含有根据本发明的载体的细胞解决了本发明的问题。
在优选的实施方案中,细胞为宿主细胞。
在第七方面,通过含有一种氨基酸序列的多肽和所述多肽的片段,优选血纤蛋白原-结合-多肽和/或粘着因子解决了本发明的问题,其中该氨基酸序列由根据本发明的任一方面的核酸分子编码。
在第八方面,通过含有一种氨基酸序列的多肽,优选血纤蛋白原-结合-多肽和/或粘着因子解决了本发明的问题,该氨基酸序列选自SEQ ID NO 11到SEQ ID NO 20。
在本发明的该方面的一个实施方案中,具有根据SEQ ID NO 11到16任一项的氨基酸序列的多肽,优选血纤蛋白原-结合-多肽和/或粘着因子,是血纤蛋白原-结合蛋白。
在本发明的该方面的另一个实施方案中,多肽是与上皮细胞相互作用的粘着因子。在甚至更优选的实施方案中,上皮细胞是人上皮细胞。
在第九方面,通过含有一种氨基酸序列的多肽解决了本发明的问题,其中该氨基酸序列选自SEQ ID NO 113到SEQ ID NO 205。在一个实施方案中,该多肽含有根据SEQ ID NO 113到SEQ ID NO 225的至少一种氨基酸序列与至少一种其他氨基酸序列。更优选地,该至少一种其他氨基酸序列是根据SEQ ID NO 113到SEQ ID NO 205任一个的氨基酸序列。
在第十方面,通过含有一种氨基酸基序的多肽解决了本发明的问题,其中该多肽含有一种氨基酸基序,其中该氨基酸基序是G-N/S/T-V-L-A/E/M/Q-R-R-X-K/R/W-A/D/E/N/Q-A/F/I/L/V/Y-X-X-K/R-X-X(SEQ ID NO 222)。
在第十一方面,通过产生根据本发明的任一方面的多肽的方法解决了本发明的问题,该方法包括表达根据本发明的任一方面的核酸分子。
在第十二方面,通过产生表达根据本发明的任一方面的多肽或者其片段的细胞解决了本发明的问题,该方法包括用根据本发明的载体转化或转染适宜的宿主细胞,从而该转化或转染的细胞表达该载体中所含多核苷酸编码的多肽。
在第十三方面,通过药物组合物,特别是疫苗,解决了本发明的问题,该药物组合物含有如本发明的任一方面定义的多肽或者其片段,或者根据本发明的任一方面的核酸分子。
在优选的实施方案中,药物组合物含有免疫刺激物质,其中该免疫刺激物质优选选自聚阳离子聚合物、免疫刺激性脱氧核苷酸(ODNs)、合成的KLK肽、神经活性化合物、alumn、弗氏完全或不完全佐剂或它们的组合。
在优选的实施方案中,免疫刺激物质是聚阳离子聚合物和免疫刺激脱氧核苷酸的组合或者合成的KLK肽和免疫刺激脱氧核苷酸的组合。
在更优选的实施方案中,聚阳离子聚合物是聚阳离子肽和/或其中神经活性化合物是人生长激素。
在第十四方面,通过使用根据本发明的任一方面的多肽或者其片段生产药物,尤其生产针对细菌感染的疫苗,解决了本发明的问题。
在优选的实施方案中,细菌感染是无乳链球菌的细菌感染。
在第十五方面,通过使用抑制根据本发明的任一方面的多肽与血纤蛋白原结合的分子生产防止和治疗细菌感染的药物,解决了本发明的问题。优选地,该细菌感染是无乳链球菌感染。
在另一实施方案中,分子选自结合根据本发明的任一方面的多肽的血纤蛋白原受体抗体、血纤蛋白原受体mimotopes和血纤蛋白原受体拮抗剂。
在第十六方面,通过使用抑制根据本发明任一方面的多肽与上皮细胞,优选人上皮细胞的结合的分子,解决了本发明的问题。
在第十七方面,通过结合根据本发明的任一方面的多肽或者其片段的至少一个选择性部分的抗体,或者至少该抗体的有效部分,解决了本发明的问题。
在一个实施方案中,抗体是单克隆抗体。
在另一实施方案中,所述有效部分包括Fab片段。
在另一实施方案中,抗体是嵌合抗体。
在优选的实施方案中,抗体是人源化抗体。
在第十八方面,通过产生根据本发明的抗体的杂交瘤细胞系解决了本发明的问题。
在第十九方面,通过使用根据本发明的抗体制备治疗或预防细菌感染,尤其无乳链球菌感染的药物,解决了本发明的问题。
在第二十方面,通过减小或者抑制根据本发明的任一方面的多肽或者其片段的活性的拮抗剂,解决了本发明的问题。
在第二十一方面,通过鉴定能够减小或者抑制根据本发明的任一方面的多肽或者其片段的活性的拮抗剂的方法,解决了本发明的问题,该方法包括:
a)将根据本发明的任一方面的分离的或固定化多肽或者其片段与候选拮抗剂在允许所述候选拮抗剂与所述多肽或者其片段结合,存在能够提供响应候选拮抗剂与所述多肽或者其片段的结合的可检测信号的组分的条件下接触;和
b)检测响应该拮抗剂与该多肽或者其片段的结合产生的信号的存在或者不存在,优选该信号的存在指示能够抑制或者降低该多肽或者其片段的活性的化合物。
在第二十二方面,通过鉴定能够抑制或者降低根据本发明任一方面的多肽或者其片段的活性的拮抗剂的方法,解决了本发明的问题,该方法包括:
a)提供根据本发明任一方面的多肽或者其片段,
b)提供根据本发明任一方面的多肽、优选根据本发明的抗体的相互作用配偶体,
c)提供候选拮抗剂,
d)将该多肽、该多肽的相互作用配偶体和候选拮抗剂反应,和
e)确定该候选拮抗剂是否抑制或降低该多肽的活性。
在第二十三方面,通过鉴定能够减少或抑制根据本发明的多肽或者其片段与其相互作用配偶体的相互作用活性的拮抗剂的方法,解决了本发明的问题,该方法包括:
a)提供根据本发明的多肽或者其片段,
b)提供所述多肽或者其片段、优选根据本发明的抗体的相互作用配偶体,
c)允许所述多肽或者其片段与所述相互作用配偶体相互作用形成相互作用复合体,
d)提供候选拮抗剂,
e)允许在候选拮抗剂和相互作用复合体之间发生竞争反应,和
f)确定候选拮抗剂是否抑制或减少该多肽或者其片段与相互作用配偶体之间的相互作用活性。
在第二十四方面,通过用根据本发明的第二十二或者二十三方面的方法鉴定或者可鉴定的拮抗剂解决了本发明问题。
在第二十五方面,通过根据本发明的任一方面的多肽或者其片段的表达相关的疾病的体外诊断方法,解决了本发明的问题,该体外诊断方法包括确定根据本发明的任一方面的多肽的存在或者编码所述多肽的多核苷酸序列的存在。
在第二十六方面,通过根据本发明的任一方面的多肽或者其片段的表达相关的疾病的体外诊断方法,解决了本发明的问题,该方法包括确定编码根据本发明的所述多肽或者其片段的核酸序列的存在,或者根据本发明的多肽或者其片段的存在。
在第二十七方面,通过细菌感染,优选无乳链球菌感染的体外诊断方法,解决了本发明问题,该方法包括确定根据本发明的任一方面的核酸分子或者根据本发明任一方面的多肽的存在的步骤。
在本发明的后三方面的优选实施方案中,确定了优选来自宿主生物体的样品中的存在。
在第二十八方面,通过含有支持物质和固定到所述支持物质的根据本发明的任一方面的多肽或者根据本发明任一方面的核酸分子的亲和装置解决了本发明的问题。
在第二十九方面,通过使用根据本发明任一方面的多肽分离和/或纯化和/或鉴定所述多肽的相互作用配偶体,解决了本发明的问题。
在第三十方面,通过使用根据本发明的任一方面的任一多肽产生结合所述多肽的肽,解决了本发明问题。
在优选的实施方案中,该肽选自anticalines。
在第三十一方面,通过使用根据本发明的任一方面的多肽生产功能核酸解决了本发明问题,其中该功能核酸选自包含适体和spiegelmers的组。
在第三十二方面,通过使用根据本发明的任一方面的核酸生产功能核糖核酸解决了本发明的问题,其中该功能核糖核酸选自包含核酶、反义核酸和SiRNA的组。
在第三十三方面,通过使用根据本发明的多肽或者其片段作为抗原解决了本发明的问题。
在第三十四方面,通过使用根据本发明的任一方面的核酸生产或产生功能核酸,优选核糖核酸,其中该功能核糖核酸选自核酶、反义核酸和siRNA,解决了本发明的问题。
在的三十五方面,通过使用根据本发明的多肽或者其任何片段产生或生产抗体,解决了本发明的问题。
如此处所用的术语SEQ ID NO X到SEQ ID NO Y是被X和Y所包含(包括X和Y)的SEQ ID Nos任一个的缩写。
本发明人已经令人惊奇地发现GBS的基因组含有各种粘着因子,它们具有共同的氨基酸基序。该氨基酸基序负责该粘着因子与血纤蛋白原的结合。如此处所用的,粘着因子为一种因子,优选介导微生物与基质的结合的肽或蛋白质。优选地,微生物为GBS。更优选地,该基质分别为纤维蛋白原和宿主细胞。如此处所用的粘着因子可以是粘附素或侵染素。可以如下使用氨基酸的一字母码描述共同的氨基酸基序:
G-N/S/T-V-L-A/E/M/Q-R-R-X-K/R/W-A/D/E/N/Q-A/F/I/L/V/Y-X-X-K/R-X-X(SEQ ID NO 222)。
如可以从上面的序列得到的,该氨基酸基序含有共16个位置。一些位置如,例如,1或3或4位不得不被独特的氨基酸占据。其他位置如15或16位可以被任何氨基酸,优选被天然存在的氨基酸占据。这些位置在上面的序列中以“X”标记。还有一些位置可以被不同的氨基酸占据。这些不同的氨基酸在上面的基序中指出,其中各种氨基酸通过“/”分开。因此,在2位可以存在N、S或T。上面的氨基酸序列的任何排列都可以由本领域技术人员实现,从而这些排列在本发明的范围内。
从而本发明在一方面涉及上面的氨基酸基序。更具体地,本发明涉及含有该氨基酸基序的任何肽或多肽。应该理解如果不相反地指出,肽和多肽以同义的方式使用。
多肽,如此处所用的,包括下述所有多肽。多肽的基本结构是熟知的并且已经在无数教科书和本领域中的其他出版物中描述。在该背景中,此处所用的该术语指含有通过肽键在线性链中相互连接的两个或多个氨基酸的任一种肽或蛋白质。如此处所用的,除非另外指出,该术语指短链,其在本领域中通常被称为例如肽、寡肽和寡聚体,和更长的链,其在本领域中通常被称为蛋白质,蛋白质有许多类型。将被理解多肽通常含有一般被称为20种天然存在的氨基酸的20种氨基酸之外的氨基酸,并且在给定多肽中,许多氨基酸,包括末端氨基酸,可被天然方法,如加工和其他翻译后修饰,还可被本领域中熟知的化学修饰技术修饰。甚至多肽中天然发生的常见修饰也太多而不能在此处详尽列出,但是它们在基础课本和更详细的专题论文中,以及分卷研究文献中详细描述,并且它们是本领域技术人员熟知的。在公知的修饰中,可以在本发明的多肽中出现的为(提出说明性的少数)乙酰化、酰化、ADP-核糖基化、酰胺化、fiavin的共价连接、血红素部分的共价连接、核苷酸或核苷酸衍生物的共价连接、脂质或脂质衍生物的共价连接、磷脂酰肌醇的共价连接、交联、环化、二硫键形成、去甲基化、共价交联的形成、胱氨酸的形成、焦谷氨酸的形成、甲酰化、γ-羧化、糖基化、GPI锚形成、羟化、碘化、甲基化、豆蔻酰化、氧化、蛋白水解加工、磷酸化、异戊二烯化、外消旋作用、selenoylation、硫酸化、转运RNA介导的氨基酸向蛋白质的加入如精氨酰化,和遍在蛋白化。这些修饰是本领域技术人员熟知的并且在科学文献中非常详细的描述。一些尤其常见的修饰,例如糖基化、脂质连接、硫酸化、谷氨酸残基的γ-羧化、羟化和ADP-核糖基化在多数基础课本如,例如,PROTEINS-STRUCTURE AND MOLECULAR PROPERTIES,第二版,T.E.Creighton,W.H.Freeman和Company,纽约(1993)中描述。关于该主题有许多详细的评论,如,例如,POSTTRANSLATIONALCOVALENT MODIFICATION OF PROTEINS,B.C.Johnson,Ed.,Academic Press,纽约(1983)中Wold,F.,的Posttranslational ProteinModifications:Perspectives and Prospects,1-12页;Seifter等人,Meth.Enzymol.182:626-646(1990)和Rattan等人,Protein Synthesis:Posttranslational Modification and Aging,Ann.N.Y.Acad.Sci.663:48-62(1992)所提供的。如熟知和上面指出的,将明白多肽并不总是线性的。例如,多肽通常可以作为翻译后事件,包括天然加工事件和非天然发生的由人操作引起的事件的结果。通过非翻译天然过程和完全合成方法可以合成环状、分枝的和分枝的环状多肽。在多肽的任何地方包括肽主链、氨基酸侧链、和氨基或羧基末端可以发生修饰。实际上,通过共价修饰对多肽中氨基或羧基或两者的封闭在天然发生的和合成多肽中是常见的,并且这种修饰也可以存在于本发明的多肽中。例如,蛋白溶解加工之前在大肠杆菌或其他细胞中产生的多肽的氨基末端残基几乎总是N-甲酰甲硫氨酸。在肽的翻译后修饰过程中,NH2-末端的甲硫氨酸残基可被缺失,因此,本发明打算使用本发明的蛋白质的含甲硫氨酸和无甲硫氨酸氨基末端变体。在多肽中发生的修饰通常将是它是怎样产生的功能(function)。对于通过在宿主中表达克隆基因产生的多肽,例如,修饰的性质和程度将大部分由宿主细胞翻译后修饰能力和该多肽氨基酸序列中存在的修饰信号决定。例如,如熟知的,在细菌宿主,例如大肠杆菌中通常不发生糖基化。因此,当希望糖基化时,应该在糖基化宿主,通常真核细胞中表达多肽。昆虫细胞通常进行和哺乳动物细胞相同的翻译后糖基化,因为该原因,已经开发了昆虫细胞表达系统以有效表达具有糖基化的天然模式的哺乳动物蛋白。类似的考虑应用于其他修饰。应当理解,相同类型的修饰可以在给定多肽的几个位点相同或不同程度地存在。另外,给定多肽可包含多种类型的修饰。通常,如此处所用的,术语多肽包括所有这些修饰,尤其存在于通过在宿主细胞中表达多核苷酸重组合成的多肽中的那些修饰。
含有该氨基酸基序的任一多肽被认为是根据本发明的多肽。如在实施例中更详细解释的,本发明人已经发现GBS含有许多粘着因子,它们不仅含有该氨基酸基序的一份拷贝,而且含有多份拷贝。因此,包含多个氨基酸基序或由多个氨基酸基序组成的任何多肽是根据本发明的多肽。例如,在此处被称为FbsA的粘着因子可以含有少至该氨基酸基序的一个单位到多至其十九份拷贝。
根据本发明的其他粘着因子在此处被称为PabA、PabB、PabC和PabD。还将理解术语根据本发明的多肽还包括其任何片段、衍生物或类似物。其他优选的根据本发明的多肽为相应于SEQ ID 11到20的氨基酸序列。
本发明的多肽的片段、衍生物或类似物可以是(i)一种该多肽的片段、衍生物或类似物,其中一个或多个氨基酸残基被保守或非保守氨基酸残基(优选保守氨基酸残基)取代并且这些被取代的氨基酸残基可以是或者不是被该遗传密码编码的氨基酸残基,或者(ii)该多肽的片段、衍生物或类似物,其中一个或多个氨基酸残基包括取代基,或者(iii)该多肽的片段、衍生物或类似物,其中成熟多肽与另一化合物,如增加该多肽的半寿期的化合物(例如,聚乙二醇)融合,或者(iv)该多肽的片段、衍生物或类似物,其中额外的氨基酸,如引导或分泌序列或者用于该成熟多肽或前蛋白质(proprotein)序列的纯化的序列被融合到成熟多肽。根据此处的教导,认为这些片段、衍生物和类似物在本领域技术人员的范围内。
在该方面本发明的尤其优选的实施方案中是在序列表中提出的多肽,其变体、类似物、衍生物和片段,和该片段的变体、类似物和衍生物。此外除了异源多肽,含有这些多肽、其变体、类似物、衍生物和片段,和该片段的变体、类似物和衍生物的融合多肽也被本发明预期。使用标准技术可以容易地得到这些融合多肽和蛋白,以及编码它们的多核苷酸,这些标准技术包括用于产生和表达编码融合蛋白的重组多核苷酸的标准重组技术。
在优选的变体中是通过保守氨基酸取代不同于参照物的变体。这些取代是通过将多肽中给定氨基酸用具有类似特征的另一氨基酸代替的那些取代。通常被看作是保守取代的是脂肪族氨基酸Ala、Val、Leu和Ile中的相互替换;羟基残基Ser和Thr的互换;酸性残基Asp和Glu的互换;酰胺残基Asn和Gln之间的取代;碱性残基Lys和Arg的互换和芳香残基Phe和Tyr中的替换。
在该方面其他尤其优选的是变体、类似物、衍生物和片段,和该片段的变体、类似物和衍生物,其具有序列表中提出的任一多肽的氨基酸序列,其中一些,少数、5到10、1到5、1到3、2、1或没有氨基酸残基被(任意组合的)取代、缺失或添加。它们中尤其优选的是沉默取代、添加和缺失,它们不改变本发明多肽的性质和活性。在该方面还特别优选的是保守取代。最高度优选具有序列表中提出的氨基酸序列而无取代的多肽。
本发明的多肽和多核苷酸优选以分离的形式提供,并且优选被纯化到同质性。根据本发明的多肽也优选为分离的多肽。
本发明的多肽包括序列表中提出的任何多肽(尤其是成熟多肽)以及与序列表中提出的多肽具有至少70%同一性,优选与序列表中提出的多肽具有至少80%或85%同一性,更优选与序列表中提出的多肽具有至少90%类似性(更优选至少90%同一性),更优选与序列表中提出的多肽具有至少95%、96%、97%、98%、99%、或99.5%类似性(更优选至少95%、96%、97%、98%、99%、或99.5%同一性)的多肽,并且还包括这些多肽的部分,该多肽的部分通常含有其至少5个氨基酸,更优选至少10、15或16个氨基酸或其多个氨基酸。优选地,该多个氨基酸为多个重复的16个氨基酸,其中该16个氨基酸相应于此处公开的氨基酸基序。
本发明的多肽的片段或部分可用于通过肽合成产生相应的全长多肽,因此,该片段可用作产生全长多肽的中间物。
本发明多肽的片段或部分可用于合成本发明的全长多核苷酸。
本发明的该方面的优选的实施方案中是含有具有序列表中提出的氨基酸的多肽的片段,和序列表中提出的该多肽的变体和衍生物的片段的多肽。
如此处所用的,片段是具有氨基酸序列的多肽,所述氨基酸序列与前述无乳链球菌多肽和其变体或衍生物的氨基酸序列的部分但不是所有的完全相同。
这种片段可以是“自立的”,即不是氨基酸或多肽的部分或者融合到该氨基酸或多肽,或者它们可以包含在更大的多肽中,这些片段形成该更大的多肽的一部分或区域。当包含在更大的多肽时,该讨论的片段最优选形成单个连续区域。然而,在单个更大的多肽中可以含有数个片段。例如,某些优选的实施方案涉及包含在前体多肽中的本发明的多肽片段,设计该前体多肽用于在宿主中表达并且其具有融合到该片段的氨基端的异源前-多肽和原多肽区和融合到该片段的羧基末端的附加区。因此,此处所指的意思的一方面中的片段指从本发明的多肽衍生的融合多肽或融合蛋白的一部分或几部分。
本发明的多肽片段的代表性实例包括,例如,在任一选择的多肽中,此处公开的氨基酸序列的约氨基酸编号45-60、61-76、77-92、93-108、109-124、125-140、141-156、157-172、173-188、189-204、205-220、221-236、237-252、253-268、269-284、285-300、301-316、317-332、333-348、410-414的片段,或者任何重复,它们单独的或者与下面的表1和2中提出的一个或几个组合,任选与信号肽或LPXTG基序组合。
表1:
| GBS株6313的FbsA | GBS株706S2的FbsA |
| 1-35信号肽 | 1-35信号肽 |
| 45-60重复1(SEQ ID 113) | 45-60重复1(SEQ ID 132) |
| 61-76重复2(SEQ ID 114) | 61-76重复2(SEQ ID 133) |
| 77-92重复3(SEQ ID 115) | 77-92重复3(SEQ ID 134) |
| 93-108重复4(SEQ ID 116) | 93-108重复4(SEQ ID 135) |
| 109-124重复5(SEQ ID 117) | 109-124重复5(SEQ ID 136) |
| 125-140重复6(SEQ ID 118) | 125-140重复6(SEQ ID 137) |
| 141-156重复7(SEQ ID 119) | 141-156重复7(SEQ ID 138) |
| 157-172重复8(SEQ ID 120) | 157-172重复8(SEQ ID 139) |
| 173-188重复9(SEQ ID 121) | 173-188重复9(SEQ ID 140) |
| 189-204重复10(SEQ ID 122) | 189-204重复10(SEQ ID 141) |
| 205-220重复11(SEQ ID 123) | 205-220重复11(SEQ ID 142) |
| 221-236重复12(SEQ ID 124) | 221-236重复12(SEQ ID 143) |
| 237-252重复13(SEQ ID 125) | 237-252重复13(SEQ ID 144) |
| 253-268重复14(SEQ ID 126) | 253-268重复14(SEQ ID 145) |
| 269-284重复15(SEQ ID 127) | 269-284重复15(SEQ ID 146) |
| 285-300重复16(SEQ ID 128) | 285-300重复16(SEQ ID 147) |
| 301-316重复17(SEQ ID 129) | 301-316重复17(SEQ ID 148) |
| 317-332重复18(SEQ ID 130) | 378-382LPXTG基序 |
| 333-348重复19(SEQ ID 131) | |
| 410-414LPXTG基序 |
表2:
| GBS株33H1A的FbsA | GBS株176H4A的FbsA |
| 1-35信号肽 | 1-35信号肽 |
| 45-60重复1(SEQ ID 149) | 45-60重复1(SEQ ID 162) |
| 61-76重复2(SEQ ID 150) | 61-76重复2(SEQ ID 163) |
| 77-92重复3(SEQ ID 151) | 77-92重复3(SEQ ID 164) |
| 93-108重复4(SEQ ID 152) | 154-158LPXTG基序 |
| 109-124重复5(SEQ ID 153) | |
| 125-140重复6(SEQ ID 154) | |
| 141-156重复7(SEQ ID 155) |
| 157-172重复8(SEQ ID 156) | |
| 173-188重复9(SEQ ID 157) | |
| 189-204重复10(SEQ ID 158) | |
| 205-220重复11(SEQ ID 159) | |
| 221-236重复12(SEQ ID 160) | |
| 237-252重复13(SEQ ID 161) | |
| 314-318LPXTG基序 |
表3:
| GBS株O90R的FbsA | GBS株SS1169的FbsA |
| 1-35信号肽 | 1-35信号肽 |
| 45-60重复1(SEQ ID 165) | 45-60重复1(SEQ ID 175) |
| 61-76重复2(SEQ ID 166) | 61-76重复2(SEQ ID 176) |
| 77-92重复3(SEQ ID 167) | 77-92重复3(SEQ ID 177) |
| 93-108重复4(SEQ ID 168) | 93-108重复4(SEQ ID 178) |
| 109-124重复5(SEQ ID 169) | 109-124重复5(SEQ ID 179) |
| 125-140重复6(SEQ ID 170) | 125-140重复6(SEQ ID 180) |
| 141-156重复7(SEQ ID 171) | 141-156重复7(SEQ ID 181) |
| 157-172重复8(SEQ ID 172) | 157-172重复8(SEQ ID 182) |
| 173-188重复9(SEQ ID 173) | 173-188重复9(SEQ ID 183) |
| 189-204重复10(SEQ ID 174) | 189-204重复10(SEQ ID 184) |
| 267-270LPXTG基序 | 205-220重复11(SEQ ID 185) |
| 221-236重复12(SEQ ID 186) | |
| 237-252重复13(SEQ ID 187) |
| 253-268重复14(SEQ ID 188) | |
| 269-284重复15(SEQ ID 189) | |
| 285-300重复16(SEQ ID 190) | |
| 301-316重复17(SEQ ID 191) | |
| 317-332重复18(SEQ ID 192) | |
| 333-348重复19(SEQ ID 193) | |
| 349-364重复20(SEQ ID 194) | |
| 365-380重复21(SEQ ID 195) | |
| 381-396重复22(SEQ ID 196) | |
| 397-412重复23(SEQ ID 197) | |
| 413-428重复24(SEQ ID 198) | |
| 429-444重复25(SEQ ID 199) | |
| 445-460重复26(SEQ ID 200) | |
| 461-476重复27(SEQ ID 201) | |
| 477-492重复28(SEQ ID 202) | |
| 493-508重复29(SEQ ID 203) | |
| 509-524重复30(SEQ ID 204) | |
| 586-590LPXTG基序 |
如此处所用的“约”包括在一个端值或者两个端值,具体引用的范围的更大或更小一些、几个、5、4、3、2、或1个氨基酸。
本发明的优选片段包括,例如,截短多肽,包括具有序列表中提出的氨基酸序列的多肽,或者其变体或衍生物,除了缺失包括氨基末端的连续系列的残基(即,连续区域、部分),或者缺失包括羧基末端的连续系列残基,或者,在双截短突变体中,缺失两个连续系列的残基,一个包括氨基末端和另一个包括羧基末端。具有上面陈述的大小范围的片段也是截短片段的优选实施方案,其通常是片段中特别优选的。还优选宿主细胞中本发明的多肽的降解形式。
本发明的该方面中还优选的是具有本发明的多肽的结构或功能属性的片段。在该方面本发明的优选实施方案包括含有α-螺旋和α-螺旋形成区,β-折叠和β-折叠形成区、转角和转角形成区、卷曲和卷曲形成区、亲水区、疏水区、α两性区、β两性区、柔性区、表面-形成区、底物结合区和本发明的多肽的高抗原指数区的片段,和这些片段的组合。
优选的区域为介导本发明的多肽活性的区域。在该方面最高度优选的是具有本发明的多肽的化学、生物或其他活性的片段,包括具有类似活性或者改善的活性,或者具有降低的不希望的活性的片段。尤其优选的是含有对于如,例如,FbsA的情况中血纤蛋白原或者PabA、PabB、PabC和PabD的情况中宿主细胞的受体活性的片段,该片段赋予无乳链球菌能够导致人中的疾病和/或能够介导无乳链球菌的附着和/或侵染到或者进入上皮细胞,更优选人上皮细胞所必需的功能。进一步优选的多肽片段是含有动物中,特别是人中抗原或免疫原决定簇的那些多肽片段。如此处所用的宿主细胞是能够摄取天然宿主中或者在内在化测定法如,例如,实施例1中描述的测定法中GBS的细胞。
根据本发明的多肽可用于在含有这些多肽的样品中检测一种或几种生物。优选地,这种检测用于诊断,更优选地用于疾病的诊断,最优选地,用于与革兰氏阳性细菌,特别是选自链球菌属、葡萄球菌属和乳球菌属的细菌的存在或大量存在相关或有关的疾病的诊断。更优选地,微生物选自无乳链球菌、酿脓链球菌、肺炎链球菌和变异链球菌。
本发明还涉及诊断测定法,如用于检测细胞和组织中本发明的多肽的水平,包括确定正常和异常水平的定量和诊断性测定法。这样,例如,用于检测与正常对照组织样品相比该多肽的过表达的根据本发明的诊断性测定法可用于检测感染的存在,例如,鉴定感染性生物。可用于确定来自宿主的样品中多肽的水平的测定技术是本领域技术人员熟知的。这些测定方法包括放射免疫测定法、竞争性结合测定法、蛋白质印迹分析和ELISA测定法。其中,通常优选ELISA。ELISA测定法最初包括制备对该多肽特异的抗体,优选单克隆抗体。此外,制备的报道抗体通常结合该单克隆抗体。该报道抗体附着到可检测的试剂如放射活性、荧光或酶试剂,如辣根过氧化物酶。
根据本发明的多肽也可以用于阵列的目的或者与阵列有关。更具体地,根据本发明的多肽的至少一种可以固定在支持体上。所述支持体通常含有各种多肽,其中可以使用根据本发明的多肽的一种或几种和/或与它们不同的多肽产生这各种多肽。这种阵列以及通常任一阵列的特征性特征是在所述支持体或者其表面上独特的或者预定的区域或位置上固定了独特的多肽。为此,阵列上独特位置或者区域的任何活性可以与特定多肽联系起来。固定在支持体上不同多肽的数目可为少至10到几千种不同的多肽。在优选的实施方案中每cm2多肽的密度少至每cm2为10种寡核苷酸-至少400种不同的多核苷酸,更具体地每cm2至少1000种不同的多肽。
这种阵列的生产是本领域技术人员公知的,并且,例如在美国专利5,744,309中描述。该阵列优选含有具有至少一个表面的平面、有空或无孔的固体支持体。如此处描述的多肽被固定在所述表面。优选的载体材料为,尤其是玻璃或纤维素。本发明还包括用于此处描述的诊断应用之一的阵列。除了根据本发明的多肽,根据本发明的核酸分子还可用于产生如上面描述的阵列。这也应用于抗体,优选如其中此处描述的单克隆抗体制成的阵列。
根据本发明的分离的核酸分子,在此处也称作根据本发明的核酸(分子),编码根据本发明的氨基酸基序或者多肽。根据本发明的核酸分子在第一个备选方案中可以是具有与SEQ ID No.1到10中指出的核酸序列的核酸分子至少70%同一性的核酸(分子)。本发明还包括与任一序列具有至少70%相似性的分离的核酸分子,其编码本发明的任一多肽。优选地,同一性为至少80%,更优选该同一性为至少90%。同一性还可以为95%、96%、97%、98%、99%或99.5%。
如本领域中公知的和此处所用的同一性是如通过序列比较确定的两种或多种多肽序列或者两种或多种多核苷酸序列之间的关系。在该领域中,同一性还指多肽或多核苷酸之间的序列相关性程度,如该情况可以是如通过这种序列串之间的匹配所确定的。可以容易地计算同一性(Computational Molecular Biology,Lesk,A.M.,编者,OxfordUniversity Press,纽约,1988;Biocomputing:Informatics and GenomeProjects,Smith,D.W.,编者,Academic Press,纽约,1993;ComputerAnalysis of Sequence Data,第I部分,Griffin,A.M.,和Griffin,H.G.,编者,Humana Press,New Jersey,1994;Sequence Analysis in MolecularBiology,von Heinje,G.,Academic Press,1987;和Sequence AnalysisPrimer,Gribskov,M.和Devereux,J.,编者,M Stockton Press,纽约,1991)。尽管存在许多测量两个多核苷酸或两个多肽序列之间同一性的方法,但是该术语是技术人员熟知的(Sequence Analysis in MolecularBiology,von Heinje,G.,Academic Press,1987;Sequence Analysis Primer,Gribskov,M.和Devereux,J.,编者,M Stockton Press,New York,1991;和Carillo,H.,和Lipman,D.,SIAM J.Applied Math.,48:1073(1988))。确定同一性的优选方法被设计以得到所试验的序列之间的最大匹配。确定同一性的方法被在计算机程序中编码。优选的确定两个序列之间同一性的计算机程序方法包括,但不限于,GCG程序包(Devereux,J.,等人,Nucleic Acids Research 12(1):387(1984))、BLASTP、BLASTN、和FASTA(Atschul,S.F.等人,J.Molec.Biol.215:403(1990))。
根据本发明的核酸作为第二备选方案也可以是与如上面的第一个备选方案描述的核酸至少基本上互补的核酸。如此处所用的互补指核酸链通过Watson-Crick碱基配对与另一条核酸链碱基配对。如此处所用的基本上互补指对于各自链的所有碱基不都发生碱基配对而是剩下一些或者一定百分比的碱基未配对或者错误地配对。正确的配对碱基的百分比优选至少70%,更优选80%,甚至更优选90%,最优选高于90%的任何百分比。应该注意70%的匹配碱基的百分比被认为是同源的并且具有该程度的匹配碱基对的杂交被认为是严格的。这种严格杂交的杂交条件可从Current Protocols in Molecular Biology,John Wileyand Sons,Inc.,1987得到。更具体地,杂交条件可以如下:
·例如在5x SSPE,5x Denhardt’s试剂,0.1%SDS,100g/mL剪切的DNA,68℃下进行杂交
·在0.2xSSC,0.1%SDS,42℃下中等严格洗涤
·0.1xSSC,0.1%SDS,68℃下高度严格洗涤。
GC含量为50%的基因组DNA具有约96℃的TM。对于1%错配,TM减小约1℃。
此外,此处描述的任何其他杂交条件在原则上也可以应用。
根据本发明的核酸作为第三个备选方案也可以是含有根据如上列出的根据本发明的核酸分子的第一和第二备选方案的核酸的至少15个碱基的一段序列的核酸。优选地,这些碱基形成碱基的相邻一段序列。然而,由被许多碱基分开的两个或多个部分组成的一段序列也在本发明内。
根据本发明的核酸作为第四种备选方案也可以是在严格杂交条件下与根据上面列出的第一、第二和第三个备选方案的本发明的核酸之一退火的核酸。严格杂交条件通常为此处所描述的。
最后,根据本发明的核酸作为第五个备选方案也可以是如果没有遗传密码的简并,将与如上面所列的根据本发明的第一、第二、第三和第四个备选方案的本发明的核酸之一的任一核酸杂交的核酸。这种类型的核酸指优选地,根据本发明的核酸编码根据本发明的多肽和因而分别编码粘附素和侵染素。这种核酸尤其用于检测从而诊断根据本发明的核酸分子从而各自微生物如GBS和与这种微生物有关的疾病或病症。优选地,将在如与上述第四个备选方案一起描述的严格条件下发生或者实施杂交。
如此处所用的多核苷酸通常指任何多核糖核苷酸或者多脱氧核糖核苷酸,其可以是未修饰的RNA或DNA或者修饰的RNA或DNA。从而,例如,如此处所用的多核苷酸指,尤其是单链和双链DNA、为单链和双链RNA混合物的DNA、和单链和双链区混合物的RNA、含有DNA和RNA的杂交分子,其可以是单链的,或者更典型地,双链的,或者三链的,或者单链和双链区的混合物。此外,如此处描述的多核苷酸指含有RNA或DNA或RNA和DNA的三链区。这些区域中的链可以来自相同分子或者不同分子。该区域可包括所有的一种或多种分子,但是更典型地仅包括几种分子的一个区域。三螺旋区分子之一通常是寡核苷酸。如此处所用的,术语多核苷酸包括含有一个或多个修饰碱基的如上述的DNA或RNA。从而,为了稳定性或者其他原因主链被修饰的DNA或RNA是“多核苷酸”,如该术语在此处的意思。此外,含有不寻常的碱基,如次黄苷或者修饰的碱基,如三苯甲基化碱基(仅提出两个实例),的DNAR或RNA也是多核苷酸,如此所用的术语。将明白已经对DNA和RNA做出了各种修饰,这些修饰适合本领域技术人员公知的许多有用的目的。如此处所用的术语多核苷酸包括多核苷酸的这些化学地、酶地或者代谢修饰的形式,以及尤其是病毒和细胞,包括简单的和复杂的细胞的特征性DNA和RNA的化学形式。术语多核苷酸还包括通常称为寡核苷酸的短多核苷酸。“多核苷酸”和“核酸”或者“核酸分子”在此处通常可以互换使用。
使用此处提供的和公知的信息,标准方法,如用于克隆和测序,和用于合成多核苷酸和多肽的那些(见,例如,Sambrook等人,Molecular Cloning:A Laboratory Manual,第二版,Cold Spring HarborLaboratory Press,Cold Spring Harbor,NY(1989)),可以产生无乳链球菌基因组和无乳链球菌编码区的比序列表中提出多核苷酸和多肽更长和更短的许多独特片段,这些片段被本发明所包括。为了独特,片段必须具有足够大小以将其与其他公知的核酸序列区分,这可以非常容易地通过将任何所选的无乳链球菌片段与计算机数据库如GenBank中的核苷酸序列比较来确定。这些比较搜索在本领域中是标准的。许多独特的片段将是无乳链球菌特异的。通常,可用作引物或探针的独特片段长度将至少为约20到25个核苷酸,其依赖于该序列的特定核苷酸含量。此外,片段可以例如长为至少约30、40、50、60、75、80、90、100、150、200、250、300、400、500或更多核苷酸。根据其目的,该核酸片段可以是单链、双链或三链的。
此外,如上面和下面讨论的,可以对本发明所包括的无乳链球菌的多核苷酸和多肽进行修饰。例如,可以进行核苷酸取代,该取代不影响该核酸所编码的多肽,从而编码本发明的多肽的任何多核苷酸都在本发明内。此外,可以进行在本领域中公知为中性的一些氨基酸取代(相应于编码它们的核苷酸取代)(Robinson W.E.Jr.和Mitchell,W.m.,AIDS 4:S141-S162(1990))。这些变异可以天然地作为等位基因变异而发生(例如,由于遗传多态性)或者可以通过人为干预产生(例如,通过所克隆的DNA序列的诱变),如诱导的点突变、缺失、插入和取代突变。通常优选氨基酸序列中的微小改变,如保守氨基酸取代、小内部缺失或插入,和分子末端的加入或缺失。可以基于,例如,Dayhoff.等人(Atlas of Protein Sequence and Structure 1978,Nat’l Biomed.Res.Found.,Washington D.C.)的模型设计取代。这些修饰可导致氨基酸序列中的改变,提供沉默突变,修饰限制位点,或者提供其他特异突变。同样,这些氨基酸改变导致编码该多肽和蛋白的不同的核酸。从而,这些修饰预期了备选的多核苷酸,其在本发明的参数内。
此外,在序列表中提出的多核苷酸序列的一些是可读框(ORFs),即无乳链球菌的编码区。可以推导被每种可读框编码的多肽,从而使用本领域中熟知的氨基酸残基分子量值计算该多肽的分子量。使用标准技术如标准亚克隆技术,可以将任何所选的编码区功能地连接到任何希望的调节序列——无乳链球菌调节序列或者异源调节序列,或者连接到异源编码序列以产生融合蛋白,如此处进一步描述的。
本发明的多核苷酸可以是RNA的形式,如mRNA或cRNA,或者DNA的形式,包括,例如,cDNA和基因组DNA,它们通过克隆或者通过化学合成技术或者通过它们的组合生产而得到。DNA可以是三链的、双链的或者单链的。单链DNA可以是编码链,也称作有义链,或者其可以是非-编码链,也称作反义链。
编码本发明的无乳链球菌多肽的编码序列可以与序列表中提出的多核苷酸的编码序列相同。其也可以是具有不同序列的多核苷酸,其作为遗传密码冗余性(简并性)的结果,该多核苷酸编码序列表中提出的无乳链球菌多肽。
编码如此处公开的无乳链球菌多肽包括序列表中提出的那些的本发明的多核苷酸,可以包括,但不限于,自身是成熟多肽的编码序列;成熟多肽的编码序列和额外的编码序列,所述额外的编码序列如编码引导或分泌序列的那些,如前-或原-或前原-蛋白序列;成熟多肽的编码序列,其具有或者没有上述额外的编码序列,结合额外的非编码序列,该非编码序列包括例如,但不限于非编码的5’和3’序列,如在转录(例如,包括终止信号)、核糖体结合、mRNA稳定元件中起作用的转录的非翻译序列,和编码额外的氨基酸,如提供额外的功能性的那些的额外的编码序列在一起。这样,例如,多肽可以融合到标记序列,如促进该融合多肽的纯化的肽。在本发明的该方面的一些实施方案中,标记序列为六-组氨酸肽,如在pQE载体(Qiagen,Inc.)中提供的标记,其中,它们的许多是可通过商业途径得到的。例如,如在Gentz等人,Proc.Natl.Acad.Sci.,USA 86:821-824(1989)中描述的,例如,六-组氨酸为融合蛋白的纯化提供了便利。HA标记也可用于产生融合蛋白并相应于流感血凝素(hermagglutinin)蛋白的一个表位,其已经被例如Wilson等人,Cell 37:767(1984)描述。本发明的多核苷酸还包括,但不限于,含有结构基因和其天然结合的遗传元件的多核苷酸。
根据前面的,如此处所用的术语“编码多肽的多核苷酸”包括多核苷酸,其包含编码本发明的多肽,尤其是具有序列表中提出的无乳链球菌氨基酸序列的多肽的序列。该术语包括多核苷酸,其包含编码该多肽的单一连续区或不连续区(例如,被整合的噬菌体或者插入序列中断或者编辑)以及也可以含有编码和/或非编码序列的额外区。
本发明还涉及此处上面描述的多核苷酸的变体,其编码具有序列表中提出的推导的无乳链球菌氨基酸序列的多肽的片段、类似物和衍生物。该多核苷酸的变体可以是天然发生的变体如天然发生的等位基因变体,或者其可以是非已知天然存在的变体。可通过诱变技术,包括应用于多核苷酸、细胞或生物体的诱变技术产生该多核苷酸的这种非-天然存在的变体。
在这方面的变体中是由于核苷酸取代、缺失或加入而与上面提到的多核苷酸不同的变体。该取代、缺失或加入可以包括一个或多个核苷酸。可以在编码或非编码区或者两种中改变变体。编码区中的改变可产生保守或非保守氨基酸取代、缺失或加入。优选编码变体、类似物、衍生物或片段,或者片段的变体、类似物或衍生物的多核苷酸,其具有序列表中提出的无乳链球菌序列,其中一些、几个、5到10、1到5、1到3、2、1个或无氨基酸被取代、缺失或者加入(以任何组合的方式)。其中特别优选的是沉默取代、加入或缺失,它们不改变序列表中提出的无乳链球菌多肽的性质和活性。在这方面还特别优选的是保守取代。
本发明的进一步优选的实施方案是在全长上与编码根据本发明的多肽,更具体地具有序列表中提出的氨基酸序列的那些多肽的多核苷酸具有至少70%同一性的多核苷酸,和与这些多核苷酸互补的多核苷酸。备选地,最高度优选的是含有全长上与编码根据本发明的无乳链球菌多肽,更具体地序列表中提出的那些多肽的多核苷酸具有至少80%或至少85%同一性的区域的多核苷酸,包括互补多核苷酸。在这方面,特别优选在全长上与编码根据本发明的无乳链球菌多肽,更具体地序列表中提出的那些多肽的多核苷酸具有至少90%、91%、92%、93%、94%、95%、或96%同一性的多核苷酸,在这些尤其优选的多肽中,尤其优选具有至少95%同一性的那些。此外,在具有至少95%同一性的那些中高度优选具有至少97%同一性的那些,其中,尤其高度优选具有至少98%和至少99%的那些,更优选至少99%或者99.5%同一性的那些。
而且,在该方面,优选的实施方案是编码保持与序列表中提出的DNA编码的成熟多肽基本上相同的生物学功能或活性的多肽的多核苷酸。
本发明还涉及与此处上述序列杂交的多核苷酸。在这点上,本发明特别涉及在严格条件下与此处上述多核苷酸杂交的多核苷酸。严格条件是典型的选择条件。如此处所用的,术语“严格条件”指仅当序列之间有至少95%和优选至少97%同一性时才发生杂交的条件。对于特定序列,严格条件也可以通过经验根据核苷酸含量来确定,如在本领域中公知并且也在此处例证的。例如,严格条件的典型实例是具有55%GC含量的48聚体在42℃下在50%甲酰胺和750mM NaCl中杂交,然后在15mM NaCl和0.1%SDS中在55℃洗涤。
如此处关于本发明的多核苷酸测定法额外讨论的,例如,如上面讨论的本发明的多核苷酸可用作RNA、cDNA和基因组DNA的杂交探针以分离编码本发明多肽的全长cDNA和基因组克隆和分离具有与本发明的多核苷酸高度序列相似性的其他基因的cDNA和基因组克隆。这些探针通常将含有至少15个碱基。优选地,这种探针将具有至少20,至少25或至少30个碱基,并且可以具有至少50个碱基。尤其优选的探针将具有至少30个碱基,并且将具有50个碱基或者更少,如30、35、40、45、或50个碱基。
例如,通过使用公知的DNA序列合成寡核苷酸探针筛选分离本发明多核苷酸的编码区。然后,具有与本发明的基因的序列互补的序列的标记的寡核苷酸被用于筛选cDNA、基因组DNA或者mRNA文库以确定该探针杂交文库的哪些成员。
本发明的多核苷酸和多肽可用作开发用于疾病,尤其人类疾病的治疗和诊断的试剂和物质,尤其如此处关于多核苷酸测定法所进一步讨论的。
为寡核苷酸的本发明的多核苷酸可用于如此处描述的方法,但是优选用于PCR,以确定是否此处鉴定的无乳链球菌基因全部或部分在受感染的组织如血液中存在和/或被转录。认识到这些序列将也可用于诊断病原体所达到的感染阶段和感染类型。为了该目的和其他目的,可以使用含有如此处描述根据本发明的核酸的至少一种的阵列。
多核苷酸可以编码多肽,该多肽是成熟蛋白加额外的氨基或羧基-末端氨基酸,或者该成熟肽的内在氨基酸(例如,当成熟形式具有一种以上的多肽链时)。这些序列可以在从前体到成熟形式的蛋白质加工中起作用,并且可允许蛋白质运输,可以延长或缩短蛋白质半寿期或者可以方便测定法或生产中蛋白质的操作,等等。如在体内通常的情况,通过细胞酶,该额外的氨基酸可以从成熟蛋白被加工除去。
具有融合到一个或多个原序列的多肽的成熟形式的前体蛋白可以是该多肽的非活化形式。当原序列被除去时,这种非活性前体通常被活化。活化前可以除去一些或所有原序列。通常,这种前体被称为原蛋白。
本发明还预期功能地编码融合多肽的多核苷酸,其中该融合多肽包括无乳链球菌多肽的一个片段和从另一种无乳链球菌多肽或者从另一生物得到的一种或多种多肽或者合成的多氨基酸序列。这种多核苷酸可以编码或不编码促进在适宜条件下该无乳链球菌多肽从其他多肽切割的氨基酸序列。
总之,本发明的多核苷酸可优选编码成熟蛋白、成熟蛋白加引导序列(其可被称为前蛋白)、具有一个或多个原序列的成熟蛋白的前体,该原序列不是前蛋白的引导序列,或者一种前原蛋白,其是原蛋白的前体,具有引导序列和一个或多个原序列,其通常在加工步骤中除去,该加工步骤产生该多肽的活性和成熟形式。
如此处所用的分离是指通过“人的手”从其天然状态分开,即,如果其在自然中发生,其已经改变或从其原来的环境中除去,或者两者。例如,以其天然状态存在于活的生物中的天然存在的多核苷酸或者多肽不是“分离的”,但是分离自其天然状态的共存材料的相同多核苷酸或多肽是“分离的”,如此处所用的术语。作为分离的一部分或分离后,为了诱变,这些多核苷酸可被与其他多核苷酸,如DNA,连接在一起,形成融合蛋白,以例如在宿主中增殖或表达。单独的或者与其他多核苷酸如载体连接的分离的多核苷酸可被导入培养或者完整生物中的宿主细胞。导入培养或者完整生物中的宿主细胞,这些DNA仍然将是分离的,如此处所用的术语,因为它们将不是它们天然存在的形式或者在环境中。类似地,多核苷酸和多肽可以在组合物,如培养基制剂,溶液中存在以将多核苷酸或多肽导入到,例如,细胞中,用于化学或酶反应的组合物或溶液,例如非天然存在的组合物,和,其中保持如此处所用的术语的意义内的分离的多核苷酸或多肽。
可以化学合成根据本发明的核酸。备选地,通过本领域技术人员公知的方法可以从各种微生物分离核酸。适宜的来源为,例如,无乳链球菌、酿脓链球菌、变异链球菌和肺炎链球菌。
根据本发明的核酸可用于检测核酸和含有这些核酸的生物体或样品。优选地,这种检测用于诊断,更优选地,用于疾病的诊断,最优选地,用于与无乳链球菌的存在或大量存在有关或相关的疾病的诊断。
可以通过各种技术在DNA水平上检测感染真核生物(此处也为“个体”),特别是哺乳动物,尤其是人的无乳链球菌细菌。通过选择在无乳链球菌的菌株间变化的核酸区域,可以得到用于区分无乳链球菌的特定菌株的优选候选物。此外,通过选择在无乳链球菌和其他生物之间变化的核酸的区域,可以得到用于区分无乳链球菌和其他生物的优选的候选物。可以从感染的个体的细胞和组织,如骨、血、肌肉、软骨和皮肤得到用于诊断的核酸。基因组DNA可以直接用于检测或者可以在分析前通过用PCR(Saiki等人,Nature,324:163-166(1986))酶促扩增。RNA或cDNA也可以以相同的方式使用。作为实例,与形成部分本发明的多核苷酸的核酸互补的PCR引物可用于鉴定和分析其存在和/或表达。使用PCR,通过原核生物基因的基因型分析可以表征哺乳动物,特别是人体中存在的无乳链球菌菌株。例如,通过与参比序列的基因型比较扩增产物大小的变化,可以检测缺失和插入。通过将扩增的DNA与放射标记的RNA,或者备选地,放射标记的反义DNA序列杂交,可以鉴定点突变。用RNA酶A消化或者通过熔解温度的不同可以区分完全匹配的序列与错配的双链体。
通过直接DNA测序也可以揭示参比基因和具有突变的基因之间的序列差异。此外,克隆的DNA片段可用作检测特定DNA片段的探针。这种方法的灵敏性可以通过PCR或另一种扩增方法的适当使用而被极大地增强。例如,测序引物可以与双链PCR产物或者通过改良PCR产生的单链模板分子一起使用。通过常规方法用放射标记的核苷酸或者通过自动测序方法使用荧光-标记,可以实施序列测定。
使用或不使用变性剂,通过检测凝胶中DNA片段的电泳迁移率的改变可以实现基于DNA序列差异的遗传表征。通过高分辨率凝胶电泳可以显示小序列缺失和插入。可以在变性甲酰胺梯度凝胶中区分不同序列的DNA片段,其中不同DNA片段的迁移率根据它们的特定熔点或者部分熔解温度而在凝胶中不同位置被滞留(见,例如,Myers等人,Science,230:1242(1985))。
通过核酸酶保护测定法,如RNA酶和S1保护或者化学切割方法(例如,Cotton等人,Proc.Natl.Acad.Sci.,USA,85:4397-4401(1985))也可以揭示特定位置的序列变化。
这样,通过如杂交、RNA酶保护、化学切割、直接DNA测序或者使用限制酶的方法,例如,限制性片段长度多态性(RFLP)和基因组DNA的DNA印迹,可以实现特异DNA序列的检测。
除了更常规的凝胶电泳和DNA测序,也可以通过原位分析检测突变。
通过各种技术也可以在DNA水平上检测本发明的基因中携带突变或多态性的细胞,以容许例如,按血清型分类。例如,可以用RT-PCR检测突变。尤其优选使用RT-PCR与自动化检测系统,如,例如,GeneScan连用。RNA或cDNA也可用于相同的目的,PCR或RT-PCR。作为实例,与编码本发明的多肽的核酸互补的PCR引物可用于鉴定和分析突变。该引物可用于扩增从个体分离的基因从而然后可对该基因实施各种技术以阐明DNA序列。这样,可以诊断DNA序列中的突变。
本发明提供了诊断无乳链球菌感染引起的疾病的方法,该方法包括从分离或来自个体的样品确定具有序列表中提出的多核苷酸序列的多核苷酸的表达的升高的水平。使用任何一种本领域中公知的用于定量多核苷酸的方法,如,例如,PCR、RT-PCR、RNA酶保护、RNA印迹、其他杂交方法和此处描述的阵列,可以测量多核苷酸的表达。
本发明还涉及含有本发明的多核苷酸或多肽的载体、用本发明的载体基因工程化的宿主细胞和通过重组技术产生本发明的多肽。
细胞可被基因工程化以掺入多核苷酸和表达本发明的多肽。通过磷酸钙转染、DEAE-葡聚糖介导的转染、转位、显微注射、阳离子脂质-介导的转染、电穿孔、转导、scrape loading、弹道导入、感染或其他方法可以实现多核苷酸向宿主细胞的导入。这些方法在许多标准实验室手册,如Davis等人,BASIC METHODS IN MOLECULARBIOLOGY,(1986)和Sambrook等人,MOLECULAR CLONONG:ALABORATORY MANUAL,第二版,Cold Spring Harbor LaboratoryPress,Cold Spring Harbor,N.Y.(1989)中描述。
可以以常规方法使用细胞中的多核苷酸构建体以产生被该重组序列编码的基因产物。备选地,可通过常规肽合成仪通过合成产生本发明的多肽。
可以在适宜的启动子控制下,在哺乳动物细胞、酵母、细菌或者其他细胞中表达成熟蛋白。也可以用无细胞的翻译系统,用来自本发明的DNA构建体的RNA,产生这些蛋白。用于原核和真核细胞宿主的适宜克隆和表达载体由Sambrook等人,MOLECULAR CLONING:ALABORATORY MANUAL,第二版,Cold Spring Harbor LaboratoryPress,Cold Spring Harbor,N.Y.(1989)描述。
根据本发明的该方面,载体可以是,例如,质粒载体、单或双链噬菌体载体、单或双链RNA或DNA病毒载体、单或双链RNA或DNA病毒载体。按照本领域技术人员熟知的标准命名惯例,质粒通常在此处以小写p开始和/或跟着大写字母和/或数字命名。此处公开的起始质粒或者是通过商业途径可得到的、可公开得到的,或者可以通过熟知的、公开的方法的常规应用,考虑此处的教导,可以从现有质粒构建的。可以根据本发明使用的许多质粒和其他克隆和表达载体是本领域技术人员熟知的和容易得到的。
在某些方面,优选的载体是用于本发明的多核苷酸和多肽的表达的质粒。通常地,这些载体含有可操作地连接到所要表达的多核苷酸的顺式作用控制区,其有效用于在宿主中的表达。适宜的反式作用因子或者由宿主提供、由互补载体提供,或者在导入宿主中时由载体自身提供。
在这点上一些优选的实施方案中,载体提供了特异表达。这种特异表达可以是可诱导的表达或者仅在某些类型的细胞中表达或者同时是可诱导的和细胞-特异的。尤其优选的可诱导的载体是为了被容易操纵的环境因素,如温度和营养添加剂诱导而表达的载体。适于本发明的该方面的许多载体,包括用于原核和真核细胞中组成型和可诱导型表达载体,是熟知的并且被本领域技术人员常规地使用。
各种表达载体可用于表达本发明的多肽。这些载体包括,尤其是染色体、附加体和病毒来源的载体,例如,来自细菌质粒、噬菌体、转座子、酵母附加体、插入元件、酵母染色体元件、病毒如杆状病毒、组病毒,如SV40、牛痘病毒、腺病毒、禽痘病毒、伪狂犬病毒和逆转录病毒的载体,和来自它们的组合的载体,如来自质粒和噬菌体遗传元件,如粘粒和噬菌粒的载体,所有都可用于根据本发明的该方面的表达。通常,适于保持、增殖或表达多核苷酸以在宿主中表达多肽的载体可用于该方面的表达。
通过各种熟知的和常规技术,如,例如,Sambrook等人,MOLECULAR CLONING,A LABORATORY MANUAL,2nd Ed.;ColdSpring Harbor Laboratory Press,Cold Spring Harbor,New York(1989)中提出的技术,可以将适宜的DNA序列插入到载体中。
表达载体中的DNA序列可操作的连接到适宜的表达控制序列,包括,例如,指导mRNA转录的启动子。这种启动子的代表包括,但不限于,噬菌体λPL启动子、大肠杆菌lac、trp和tac启动子、SV40早期和晚期启动子和逆转录病毒LTRs的启动子。
通常,表达构建体将含有转录起始和终止的位点,和在转录区中用于翻译的核糖体结合位点。被构建体表达的成熟转录物的编码部分将包括在所要翻译的多肽末端的适当位置上的起始和终止密码子处的翻译起始AUG或其他的如GUG和UUG。
此外,该构建体可含有调节和引起表达的控制区。通常,根据许多通常实践的方法,其中,将通过控制转录,如转录因子、抑制剂结合位点和终止等操作这种区域。
用于增殖和表达的载体通常将包括可选择的标记物和扩增区域,如,例如,Sambrook等人,MOLECULAR CLONONG,ALABORATORY MANUAL,2nd Ed.;Cold Spring Harbor LaboratoryPress,Cold Spring Harbor,New York(1989)中提出的那些。
容纳所述载体的适宜的细胞的代表性实例包括细菌细胞,如链球菌、葡萄球菌、大肠杆菌、链霉菌和枯草芽孢杆菌细胞;真菌细胞,如酵母细胞和曲霉菌(Aspergillus)细胞;昆虫细胞如果蝇S2和Spodoptera Sf9细胞;动物细胞如CHO、COS、HeLa、C127、3T3、BHK、293和Bowes黑素瘤细胞;和植物细胞。
通过实例提供了下面的通过商业途径可得到的载体。其中,优选用于细菌的载体为pQE70、pQE60和pQE-9,它们可从Qiagen得到;pBS载体、Phagescript载体、Bluescript载体、pNH8A、pNH16a、pNH18A、pNH46A,它们可从Stratagene得到,和ptrc99a、pKK223-3、Pkk233-3、pDR540、pRIT5,它们可从Pharmacia得到,和pBR322(ATCC37017)。优选的真核载体为可从Stratagene得到的pWLNEO、pSV2CAT、pOG44、PXT1和pSG;和可从Pharmacia得到的pSVK3、pBPV、pMSG和pSVL。列出这些载体仅用于阐明这许多可通过商业途径得到和本领域技术人员可得到的熟知的载体,以根据本发明的该方面使用。应该明白在本发明的该方面中可以使用适于例如,在宿主中导入、保持、增殖或表达本发明的多核苷酸或多肽的任何其他质粒或载体。
使用在用于导入候选启动子片段,即可以含有启动子的片段的一个或几个限制位点的下游含有缺少启动子区域的报道物转录单元的载体可从任何希望的基因选择启动子区,所述单元如氯霉素乙酰基转移酶(“CAT”)转录单元。如熟知的,在cat基因的上游限制位点导入含有启动子片段的载体引起了CAT活性的产生,该活性可被标准CAT测定法检测到。适于该目的的载体是熟知的并且容易得到,如pKK232-8和pCM7。用于本发明的多核苷酸表达的启动子不仅包括熟知的和容易得到的启动子,还包括通过前面的技术,使用报道基因可以容易地得到的启动子。
适于表达根据本发明的多核苷酸和多肽的公知的原核启动子为大肠杆菌lacl和laZ启动子、T3和T7启动子、gpt启动子、λPR、PL启动子和trp启动子。
在这点上适宜的公知的真核启动子为CMV即早期启动子、HSV胸腺嘧啶核苷激酶启动子、早期和晚期SV40启动子、逆转录病毒LTRs的启动子,如劳斯肉瘤病毒(“RSV”)的启动子和金属硫蛋白启动子,如小鼠金属硫蛋白-I启动子。
重组表达载体将包括,例如,复制起点、优选来自高表达基因以指导下游结构序列的转录的启动子,和可选择标记物,其允许暴露于载体后含有该载体的细胞的分离。
通常使用标准技术将编码本发明的多肽的异源结构序列的本发明的多核苷酸插入到载体中,从而其可操作地与用于表达的启动子连接。该多核苷酸将被如此安置从而转录起始位点将是5’AUG,AUG起始所要表达的多肽的翻译。通常,不存在以起始密码子,通常AUG开始并且位于核糖体结合位点和起始密码子之间的其他可读框。而且,通常,在该多肽的末端将有翻译终止密码子并且构建体中将有多腺苷酸化信号以用于真核宿主。适当位于转录区的3’末端的转录终止信号也可包括在多核苷酸构建体中。
为了使翻译的蛋白质分泌到内质网腔中,周质间隙或者胞外环境中,可将适宜的分泌信号整合到表达多肽中。
这些信号对于该多肽可以是内源的或者它们可以是异源信号。
多肽可以以修饰的形式,如融合蛋白的形式表达,并且可以不仅包括分泌信号而且还包括额外的异源功能区。从而,例如,额外的氨基酸,尤其带电氨基酸的区域可被加到该多肽的N-或C-末端以提高在纯化或随后的处理和保存过程中在宿主细胞中的稳定性和持久性。而且,该区域可以加到该多肽以方便纯化。这些区域可在多肽的最后制备之前被除去。其中,向多肽加入肽部分以引起分泌或排出,以增强稳定性或促进纯化是本领域熟悉的和常规技术。优选的融合蛋白含有来自免疫球蛋白的异源区域,其可用于溶解或纯化多肽。例如,EP-A-O464 533(加拿大副本2045869)公开了包含各个部分免疫球蛋白分子的恒定区与另一蛋白或者其部分的融合蛋白。在药物发现中,例如,为了高通量筛选分析以鉴定拮抗剂,已经将蛋白质与抗体Fc部分融合。参见,D.Bennett等人,Journal of Molecular Recognition,卷852-58(1995)和K.Johanson等人,The Journal of Biological Chemistry,卷270,No.16,9459-9471页(1995)。
然后通常通过离心收获细胞,通过物理或化学方法使细胞破裂,并保留所得粗提物用于进一步纯化。
可通过一种方便的方法破坏用于蛋白质表达的微生物细胞,该方法包括反复冻融、超声处理、机械破裂,或者使用细胞裂解剂;这些方法是本领域技术人员熟知的。
哺乳动物表达载体可含有表达序列,如复制起点、稳定启动子和增强子,以及任何必须的核糖体结合位点、多腺苷酸化区、剪接供体和受体位点、转录终止序列,和用于表达或者表达必需的5’侧翼非转录序列。
通过熟知的方法可以从重组细胞培养物回收和纯化多肽,这些方法包括硫酸铵或乙醇沉淀、酸提取、阴离子或阳离子交换层析、磷纤维素层析、疏水作用层析、亲和层析、羟基磷灰石层析(hydroxylapatitechromatography)和凝集素层析。最优选地,高效液相层析用于纯化。当多肽分离和/或纯化中变性时,可以使用用于再折叠蛋白质的熟知技术以再生活性构象。
可通过化学合成以及生物技术方法产生根据本发明的多肽。生物技术方法包括用含有根据本发明的核酸的载体转染或转化宿主细胞,并在本领域技术人员公知的条件下培养所转染或转化的宿主细胞。生产方法还可以包括纯化步骤以纯化和/或分离所要生产的多肽。在优选的实施方案中,载体是根据本发明的载体。
在另一方面,本发明涉及针对根据本发明的多肽、其衍生物或片段的任何一种的抗体。本发明包括,例如,单克隆和多克隆抗体、嵌合的、单链的、和人源化抗体,以及Fab片段,或者Fab表达文库的产物。在本发明内,该抗体可以是嵌合的,即,其不同的部分来自不同的物种或者至少各自序列来自不同的物种。
通过将相应于本发明的序列的多肽直接注射到动物或者通过将该多肽施用于动物,优选非-人,可以得到针对该多肽产生的抗体。然后,这样得到的抗体将结合该多肽自身。这样,甚至编码该多肽的仅一个片段的序列也可用于产生结合完整天然多肽的抗体。然后这种抗体可用于从表达该多肽的组织分离该多肽。
为了制备单克隆抗体,可以使用本领域中公知的技术,其提供了通过传代细胞系培养物产生的抗体。实例包括各种技术,如G.和Milstein,C.,Nature 256:495-497(1975)、Kozbor等人,ImmunologyToday 4:72(1983)、Cole等人,77-96页,MONOCLONALANTIBODIES AND CANCER THERAPY,Alan R.Liss,Inc.(1985)、美国专利号5,545,403、美国专利号5,545,405、美国专利号5,654,403、美国专利号5,792,838、美国专利号5,316,938、美国专利号5,633,162、美国专利号5,644,036、美国专利号5,858,725中描述的技术。
关于单链抗体的产生所描述的技术(美国专利号4,946,778)可适于产生针对本发明的免疫原性多肽产物的单链抗体。而且,转基因小鼠,或者其他生物如其他哺乳动物,可用于表达针对本发明的免疫原性多肽产物的人源化抗体。
备选地,噬菌体展示技术可用于选择抗体基因,它们具有针对多肽的结合活性,所述多肽来自用于筛选具有抗-Fab的人淋巴细胞的PCR扩增的v-基因的所有组成成分或者来自原初文库(library)(McCafferty,J.等人,(1990),Nature 348,552-554;Marks,J.等人,(1992)Biotechnology 10,779-783)。通过链改组也可以提高这些抗体的亲和力(Clackson,T.等人,(1991)Nature 352,624-628)。
如果存在两个抗原结合结构域,每个结构域可针对不同的表位-命名为“双特异”抗体。
上述抗体可用于分离或鉴定表达本发明的多肽的克隆或者纯化该多肽,这可通过将该抗体粘附到固体支持体以通过亲和层析分离和/或纯化来实现。
这样,尤其是,针对根据本发明的多肽的抗体可用于抑制和/或治疗感染,尤其是细菌感染和特别是无乳链球菌引起的感染。
多肽衍生物包括抗原、表位或者免疫等价的衍生物,它们形成本发明的一个具体方面。如此处所用的术语“抗原等价衍生物”包括多肽或者其衍生物,其被某些抗体特异识别,该抗体当针对根据本发明的蛋白质或多肽产生时,干扰病原体和哺乳动物宿主之间的直接生理相互作用。如此处所用的术语“免疫等价衍生物”包括肽或其等价物,其当用于适宜的制剂中以在脊椎动物中产生抗体时,该抗体用于干扰病原体和哺乳动物宿主之间的直接生理相互作用。
多肽,如其抗原或免疫等价衍生物或者其融合蛋白可用作抗原以免疫小鼠或者其他动物如大鼠或鸡。对于多肽,该融合蛋白可提供稳定性。通过例如,缀合,抗原可以与免疫原性载体蛋白,例如,牛血清白蛋白(BSA)或者匙孔血蓝蛋白(KLH)结合。备选地,含有该蛋白或多肽的多份拷贝,或者其抗原或免疫等价多肽的多份拷贝的多抗原肽,可以具有足够抗原性以提供免疫原性从而避免使用载体。
优选地,该抗体或者其衍生物被修饰,使得其在个体中具有较少的免疫原性。例如,如果个体为人,那么抗体可以最优选地被“人源化”,其中杂交瘤来源的抗体的互补决定区已经被嫁接到人单克隆抗体,例如如Jones,P.等人(1986),Nature 321,522-525或Tempest等人,(1991)Biotechnology 9,266-273中所描述的。
本发明的多核苷酸在基因免疫中的用途将优选使用适宜的递送方法,如质粒DNA直接注射到肌肉中(Wolff等人,(1992)Hum.Mol.Genet.1,363;Manthorpe等人,(1963)Hum.Gene Ther.4,419)、与特异蛋白质载体复合的DNA的递送(Wu等人,(1989)J Biol.Chem.264,16985)、DNA与磷酸钙的共沉淀(Benvenisty & Reshef(1986)PNAS 83,9551)、DNA在各种形式脂质体中的包封(Kaneda等人,(1989)Science243,375)、微粒轰击(Tang等人,(1992)Nature 356,152;Eisenbraun等人,(1993)DNA Cell.Biol.12,791)和使用克隆的逆转录载体的体外感染(Seeger等人,(1984)PNAS 81,5849)。
在另一方面,本发明涉及结合根据本发明的任一多肽的肽,和生产这种肽的方法,其中该方法的特征是使用根据本发明的多肽并且基本步骤是本领域技术人员公知的。
使用根据本领域现有技术的方法如噬菌体展示或核糖体展示可以产生这种肽。对于噬菌体展示,基本上产生如噬菌体形式的肽文库,并且将这种文库与靶分子接触,在本发明情况中,该靶分子是根据本发明的多肽。随后从各自反应除去优选作为与靶分子的复合体的结合到靶分子的那些肽。对本领域技术人员公知的是该结合特征,至少在一定程度上,依赖于具体实施的实验设置如盐浓度等。用具有更高亲和力或者更大的力将结合靶分子的那些肽与文库的非-结合成员分开后,并任选还从靶分子和肽的复合体除去靶分子后,可以随后表征各自肽。表征前,任选如,例如通过增殖编码肽的噬菌体实现扩增步骤。该表征优选包括测序靶结合肽。基本上,肽不被它们的长度限制,然而,优选地,在各自方法中优选得到具有约8到20个氨基酸长度的肽。文库的大小可以是约102到1018,优选108到1015种不同的肽,然而,不限于此。
其中,靶结合多肽的一种具体形式是所谓的“anticalines”,其在德国专利申请DE 197 42 706中描述。
在另一方面,本发明涉及与根据本发明的任一多肽相互作用的功能核酸,和生产这种功能核酸的方法,其中该方法的特征是使用根据本发明的多肽并且基本步骤是本领域技术人员公知的。功能核酸优选为适体(aptamers)和spiegelmers。
适体是单链或者双链的并且与靶分子特异作用的D-核酸。在例如欧洲专利EP 0 533 838中描述了适体的生产或选择。基本上实施了下面的步骤。首先,提供核酸混合物即潜在适体,其中每种核酸典型地含有几个,优选至少8个随后随机化的核苷酸的片段。随后将该混合物与靶分子接触,从而该核酸结合(如基于与候选混合物相比,对靶增加的亲和力或者使用更大的力)靶分子。然后将结合核酸与混合物的剩余物分离。任选地,使用,例如,聚合酶链式反应扩增如此获得的核酸。可以重复这些步骤几次最后得到特异结合靶的核酸比例增加的混合物,然后任选从该混合物选择最终结合核酸。这些特异结合核酸被称为适体。显然的是在用于产生和鉴定适体的方法的任何阶段,可以取出个别核酸的混合物样品以使用标准技术确定其序列。在本发明范围内,可以如,例如通过导入在生产适体的领域中技术人员公知的特定化学基团来稳定适体。这种修饰可以例如在于在核苷酸的糖部分的2’位导入氨基。适体在当前被用作治疗剂。然而,本发明还包括如此选择或产生的适体可用于靶证实和/或作为开发药物,优选基于小分子的药物中的前导物质。这实际上通过竞争测定法进行,其中靶分子和适体之间的特异相互作用被候选药物抑制,从而,当替换靶与适体复合体中的适体时,可以设想各自药物候选者容许靶和适体之间相互作用的特异抑制,并且如果该相互作用是特异的,所述候选药物将,至少在理论上,适于阻碍该靶并因此降低其生物学利用度或者在含有这种靶的各自系统中的活性。然后可以进一步衍生和修饰所得的小分子以优化其物理、化学、生物学和/或医学特征如毒性、特异性、生物可降解性和生物利用度。
Spiegelmers和它们的产生或生产是基于类似的原理。在国际专利申请WO 98/08856中描述了spiegelmers的生产。Spiegelmers是L-核酸,这意味着它们由L-核苷酸而不是如适体那样由D-核苷酸组成。Spiegelmers的特征是它们在生物系统中具有非常高的稳定性并且,和适体相当,与它们所针对的靶分子特异相互作用。在产生spiegelmers的过程中,产生了D-核酸的异源群体并且该群体与靶分子的光学对映体接触,在本情况下,例如与根据本发明的多肽的天然存在的L-对映异构体的D-对映异构体接触。随后,分离不与靶分子的光学对映体相互作用的那些D-核酸。但是与靶分子的光学对映体相互作用的那些D-核酸被分离,任选被确定和/或测序并随后基于从该D-核酸得到的核酸序列信息合成相应的L-核酸。这些L-核酸与和靶标分子的光学对映体相互作用的上述D-核酸在序列上相同,该L-核酸将与天然存在的靶分子而不是其光学对映体特异相互作用。类似于产生适体的方法,也可以重复各种步骤几次从而富集与靶分子的光学对映体特异相互作用的那些核酸。
在本发明的另一方面涉及与根据本发明的核酸分子相互作用的功能核酸,和生产这种功能核酸的方法,其中该方法的特征是使用根据本发明的核酸分子和它们的各自序列,并且基本步骤是本领域技术人员公知的。该功能核酸优选为核酶、反义寡核苷酸和siRNA。
核酶是具有催化活性的核酸,其优选由基本上含有两部分的RNA组成。第一部分表现出催化活性而第二部分负责与靶核酸的特异相互作用,在本发明情况中,靶核酸是编码根据本发明的多肽的核酸。当靶核酸和核酶的第二部分相互作用时(通常通过杂交和两条杂交链上基本上互补一段碱基序列的Watson-Crick碱基配对),催化活性部分可以变得有活性,这意味着如果该核酶的催化活性是磷酸二酯酶活性,那么其分子内或分子间地催化靶核酸。随后,可能存在靶核酸的进一步降解,其最后导致靶核酸以及从所述靶核酸衍生的蛋白质的降解。核酶、它们的使用和设计原理是本领域技术人员公知的并且,例如,在Doherty和Doudna(Ribozym structures and mechanism.Annu Rev.Biophys.Biomolstruct.2001;30:457-75)和Lewin和Hauswirth(Ribozyme Gene Therapy:Applications for molecular medicine.2001 7:221-8)中描述。
分别用于生产药物和作为诊断剂的反义寡核苷酸的活性和设计基于类似的作用模式。基本上,反义寡核苷酸基于碱基互补而与靶RNA,优选与mRNA杂交,从而激活RNA酶H。RNA酶H被磷酸二酯和硫代磷酸-偶联的DNA激活。然而,除了硫代磷酸-偶联的DNA之外,磷酸二酯-偶联的DNA被细胞内核酸酶快速降解。这些抗性的、非-天然存在的DNA衍生物与RNA杂交时不抑制RNA酶H。换句话说,反义多核苷酸仅作为DNA RNA杂交复合体有效。其中,这种反义寡核苷酸的实例在美国专利US 5,849,902和US 5,989,912中描述。换句话说,基于靶分子(在本发明中为编码根据本发明的多肽的核酸分子)的核酸序列,其或者来自原理上可以从靶蛋白推理出各自核酸序列,或者通过了解核酸序列本身,具体地,mRNA,可以根据碱基互补原则设计适宜的反义寡核苷酸。
尤其优选的是具有一小段硫代磷酸DNA(3到9个碱基)的反义-寡核苷酸。对于细菌RNA酶H的激活需要最少3个DNA碱基,对于哺乳动物RNA酶H的激活需要最少5个碱基。在这些嵌合寡核苷酸中有一个中心区,其形成了RNA酶H的底物,该中心区的侧翼是杂交“臂”,其由不形成RNA酶H的底物的修饰核苷酸组成。可通过如2’-O-甲基或者2’-氟修饰嵌合寡核苷酸的杂交臂。备选方法使用所述杂交臂中的甲基膦酸酯或氨基磷酸酯(phosphoramidate)键。用于本发明实践中的反义寡核苷酸的其他实施方案是P-甲氧基寡核苷酸、部分P-甲氧基寡脱氧核糖核苷酸或P-甲氧基寡核苷酸。
对本发明尤其相关和有用的是如更具体地在上面提到的两件美国专利中描述的那些反义寡核苷酸。这些寡核苷酸不含有天然存在的5′→3′-连接的核苷酸。相反,该寡核苷酸有两种类型的核苷酸:2’-脱氧硫代磷酸,其活化RNA酶H,和2’-修饰核苷酸,其不活化RNA酶H。2’-修饰核苷酸之间的键可以是磷酸二酯、硫代磷酸酯或P-乙氧基磷酸二酯。通过邻近的RNA酶H-活化区实现RNA酶H的活化,该活化区含有3和5之间的2’-脱氧硫代磷酸核苷酸以活化细菌RNA酶H和5和10之间的2’-脱氧硫代磷酸核苷酸以活化真核生物,具体地哺乳动物的RNA酶H。通过使得5’和3’末端碱基高度核酸酶抗性和,任选地,通过安置3’末端封闭基团,可以防止降解。
更具体地,该反义寡核苷酸含有5’末端和3’末端;和从11到595′→3′-连接的核苷酸,其独立地选自2’-修饰的磷酸二酯核苷酸和2’-修饰的P-烷氧基磷酸三酯核苷酸;并且其中5’-末端核苷酸附着到3到10个相邻硫代磷酸-连接的脱氧核糖核苷酸之间的RNA酶H-活化区,并且其中所述寡核苷酸的3’-末端选自倒置的脱氧核糖核苷酸、1到3个硫代磷酸2’-修饰的核糖核苷酸的一段连续序列、生物素基团和P-烷氧基磷酸三酯核苷酸。
还可以使用反义寡核苷酸,其中不是5’末端核苷酸而是如上面指出的3’末端核苷连接到RNA酶H-活化区。而且,5’末端选自特定基团而不是所述寡核苷酸的3’末端。
根据本发明的核酸以及多肽可用作疫苗或者用于生产疫苗。优选地,这种疫苗用于防止或治疗GBS导致、与之相关或有关的疾病。目前本发明的另一方面涉及在个体,尤其哺乳动物中诱导免疫应答的方法,该方法包括用本发明的多肽、其片段或变体接种该个体,足以产生保护所述个体免于感染,具体地细菌感染,最具体地链球菌感染的抗体。
本发明的另一方面涉及在个体中诱导免疫应答的方法,该方法包括,通过基因治疗或其他方法,递送功能地编码该多肽、或者其片段或变体的核酸,以体内表达该多肽、或者其片段或变体,从而诱导免疫应答以产生抗体或者细胞介导的T细胞应答,或者产生细胞因子的T细胞或者细胞毒性T细胞,以保护所述个体免于疾病,无论该疾病已经在个体中建立或者未建立。施用该基因的一种方法是将其作为微粒上面的包衣等使其加速进入所希望的细胞中。
本发明的另一方面涉及免疫组合物,其当被导入到能够在其中诱导免疫应答的宿主中时,在该宿主中诱导免疫应答,其中该组合物含有重组DNA,其编码和表达本发明的多肽的抗原。该免疫应答可用于治疗或预防并且可以采用抗体免疫或细胞免疫形式如CTL或CD4+T细胞引起的免疫。
本发明的多肽或者其片段可与共-蛋白融合,该共-蛋白不能自身产生抗体,但是能够稳定第一蛋白并产生融合蛋白,该融合蛋白将具有免疫原性和保护性质。该融合的重组蛋白优选还含有抗原性共-蛋白,如谷胱甘肽-S-转移酶(GST)或者β-半乳糖苷酶,和相对大的共-蛋白,其稳定该蛋白并促进其生产和纯化。此外,该共-蛋白可作为提供免疫系统的一般化刺激意义上的佐剂。该共-蛋白可连接到第一蛋白的氨基或羧基末端。
本发明提供了含有本发明的多肽或多核苷酸和免疫刺激DNA序列(如在Sato,Y.等人,Science 273:352(1996)中描述的)的组合物,尤其疫苗组合物和方法。
本发明还提供了在无乳链球菌感染的动物模型中所描述的多核苷酸或其特定片段的使用方法,所述多核苷酸或其特定片段已经表明在用于这种基因免疫实验中的DNA构建体中编码细菌细胞表面蛋白的非-可变区。这种片段将具体用于鉴定能够引起预防性或治疗性免疫应答的蛋白质表位。该方法可允许从成功抵抗或者清除感染的动物的必要器官随后制备特定价值的单克隆抗体以开发哺乳动物,尤其是人中无乳链球菌感染的预防剂或治疗性疗法。
该多肽可用作抗原接种宿主以产生特异抗体,其例如通过阻碍细菌向受损组织的粘附而防止细菌侵染。组织损伤的实例包括例如通过机械、化学或热损伤或者通过内在装置的植入导致的皮肤或结缔组织中的伤口,或者粘膜,如口、乳腺、尿道或阴道中的伤口。
本发明还包括疫苗制剂,其含有免疫原性重组蛋白与适宜的载体。因为该蛋白可以在胃中被分解,所以其优选被肠胃外施用,包括,例如,皮下、肌内、静脉内或者皮内施用。适于肠胃外使用的制剂包括水性和非水性无菌注射液,其可以含有抗氧化剂、缓冲剂、抑菌剂和溶质,该溶质使得该制剂与个体的体液,优选血液是等渗的;和水性和非水性无菌悬浮液,其可以包括悬浮剂或增稠剂。该制剂可以在单位剂量或者多剂量容器,例如,密封的安瓿和小瓶中存在,并且可以保存在冰冻-干燥的条件下,仅需要在使用前立即加入无菌液体载体。该疫苗制剂还可以包括用于增强该制剂的免疫原性的佐剂系统,如水包油系统和本领域中公知的其他系统。剂量将依赖于疫苗的比活并且可通过常规实验容易地确定。
还在本发明内的是,疫苗除了根据本发明的多肽和/或核酸分子还包括其他化合物,该化合物是生物学或药学活性的。优选地,疫苗组合物含有至少一种聚阳离子肽。将根据本发明使用的该聚阳离子化合物可以是任一种聚阳离子化合物,其表现出根据WO 97/30721的特征性效果。优选的聚阳离子化合物选自碱性聚肽、有机聚阳离子、碱性聚氨基酸或它们的混合物。这些聚氨基酸将具有至少4个氨基酸残基的链长度(WO 97/30721)。特别优选的是物质像聚赖氨酸、聚精氨酸和多肽,所述多肽在多于8特别多于20个氨基酸残基的范围内含有多于20%,特别多于50%的碱性氨基酸,或者它们的混合物。其他优选的聚阳离子和它们的药物组合物在WO 97/30721(例如聚乙烯亚胺)和WO 99/38528中描述。优选地,这些多肽含有20到500个氨基酸残基,特别地30到200个残基。
这些聚阳离子化合物可通过化学方法或重组产生或者可以来自天然来源。
阳离子(多)肽也可以是抗微生物的,具有如Ganz等人,1999;Hancock,1999中评论的性质。这些(多)肽可以是原核生物或动物或植物来源或者可以通过化学或重组方法产生(WO 02/13857)。肽也可以属于防卫素类(WO 02/13857)。例如,在下面的因特网址下的抗微生物序列数据库中发现这些肽的序列:
http://www.bbcm.univ.trieste.it/~tossi/pag2.html
这些宿主防卫肽或者防御肽也是根据本发明的聚阳离子聚合物的优选形式。通常,允许作为优选被APCs(包括树突细胞)介导的适应性免疫系统的终产物活化(或者下调)的化合物被用作聚阳离子聚合物。
特别优选用于本发明的聚阳离子物质是cathelicidin来源的抗微生物肽或者其衍生物(国际专利申请WO 02/13857,在此处被并入作为参考),特别是从哺乳动物cathelicidin,优选从人、牛或小鼠得到的抗微生物肽。
从天然来源得到的聚阳离子化合物包括HIV-REV或HIV-TAT,(衍生的阳离子肽、antennapedia肽、壳聚糖或壳多糖的其他衍生物)或者通过生物化学或重组生产从这些肽或蛋白质衍生的其他肽。其他优选的聚阳离子化合物是cathelin或者与cathelin相关的或衍生的物质。例如,小鼠cathelin是一种肽,其具有氨基酸序列NH2-RLAGLLRKGGEKIGEKLKKIGOKIKNFFQ KLVPQPE-COOH。相关的或衍生的cathelin物质含有至少15-20个氨基酸残基的完整的或者部分cathelin序列。衍生可以包括通过非20种标准氨基酸的氨基酸取代或修饰天然氨基酸。而且,其他阳离子残基可以被导入这种cathelin分子中。这些cathelin分子优选与该抗原组合。这些cathelin分子令人惊奇地原来也可以有效作为抗原的佐剂而不用加入其他佐剂。因此,可能使用这种cathelin分子作为有或没有其他免疫激活物质的疫苗制剂中的有效佐剂。
根据本发明使用的另一种优选的聚阳离子物质是一种合成肽,其含有通过3-7个疏水氨基酸的接头分开的至少两个KLK-基序(国际专利申请WO 02/32451,此处被并入作为参考)。
本发明的药物组合物可以还含有免疫刺激性核酸。免疫刺激性核酸是例如,天然或人工的含CpG的核酸,其来自无脊椎动物的核酸的一段短序列或者含有在一些碱基环境中未甲基化的胞嘧啶鸟嘌呤二核苷酸(CpG)的短寡核苷酸(ODNs)的形式(例如在WO 96/02555中描述)。备选地,如WO 01/93903中描述的基于次黄苷和胞苷的核酸,或者含有脱氧-次黄苷和/或脱氧尿苷残基的脱氧核酸(WO 01/93905和PCT/IEP 02/05448中描述,此处并入作为参考)也可以优选地作为本发明的免疫刺激性核酸。优选地,可以根据本发明使用不同的免疫刺激核酸的混合物。
还在本发明内的是上面提到的聚阳离子化合物的任一种与如上面提到的免疫刺激性核酸的任一种组合。优选地,这种组合是根据如WO 01/93905、WO 02/32451、WO 01/54720、WO 01/93903、WO02/13857和PCT/EP 02/05448和奥地利专利申请A 1924/2001中描述的组合,这些文献在此处被并入作为参考。
附加地或备选地,这种疫苗组合物除了根据本发明的多肽和/或核酸分子之外还可以含有神经活性化合物。优选地,神经活性化合物是人生长因子如,例如,WO 01/24822中描述的。还优选地,神经活性化合物与如前面提到的聚阳离子化合物和/或免疫刺激性核酸的任一个组合。
在另一方面,本发明涉及药物组合物。这种药物组合物为例如,此处描述的疫苗。药物组合物还是含有下面化合物任一种或者它们的组合的药物组合物:根据本发明的核酸、根据本发明的多肽、根据本发明的载体、根据本发明的细胞、根据本发明的抗体、根据本发明的功能核酸和根据本发明的结合肽如anticalines,如此处描述的所筛选的任何激动剂和拮抗剂。与之相关的是,这些化合物的任一种可以与非-无菌或无菌的一种或几种与细胞、组织或生物体使用的载体组合,如与适于施用于受试者的药物载体组合。这种组合物含有,例如,介质添加剂或治疗有效量的本发明多肽和药用载体或赋形剂。这种载体可包括,但不限于,盐水、缓冲盐水、右旋糖、水、甘油、乙醇和它们的组合。该制剂应该适于施用模式。
药物组合物可以以任一有效、方便的方式施用,包括,例如,其中通过局部、经口、肛门、阴道、静脉内、腹膜内、肌内、皮下、鼻内或者皮内途径施用。
该药物组合物通常以治疗或预防特定的一种或几种适应症有效的量施用。通常,组合物以活性剂为至少约10μg/kg体重的量施用。在多数情况下它们将以一个或多个剂量施用,日剂量不超过约8mg/kg体重。优选地,在多数情况下,日剂量为约10μg/kg到约1mg/kg体重。对于具体施用于哺乳动物,尤其是人,预期活性剂的日剂量水平将为0.01mg/kg到10mg/kg,通常约1mg/kg。例如,日剂量可以是1mg/kg。将理解将通过标准方法为每种治疗模式和适应症确定最佳剂量,考虑适应症、其严重性、施用途径、并发症等。医生无论如何将确定实际剂量,其将最适于个体并且将随着年龄、体重和具体个体的反应而变。上面的剂量是通常情况的示例。当然,可以有个别情况,其中应该使用更高或更低的剂量范围,这些剂量范围在本发明的范围内。
在治疗中或作为预防剂,活性剂可作为可注射的组合物,例如作为无菌水性分散体,优选等渗的,施用于个体。
备选地,可制备该组合物用于局部应用,例如,为软膏剂、霜剂、洗剂、眼膏剂、眼滴剂、耳滴剂、漱口水、浸渍的敷料和缝合线和气溶胶,并且可含有适宜的常规添加剂,包括,例如,防腐剂、帮助药物渗透的溶剂,和软膏和霜剂中的润滑剂。这种局部制剂也可含有可相容的常规载体,例如,霜剂或软膏剂基质,和用于洗剂的乙醇或油醇。这些载体可构成按重量计该制剂的约1%到约98%;更通常地它们将构成按重量计制剂的约80%。
药物组合物可以与内在装置(in-dwelling device)一起施用。内在装置包括手术植入物、修复装置和导管,即,导入个体的身体和长时间保留在该位置的装置。这种装置包括,例如,人工关节、心脏瓣膜、起搏器、人造血管、血管导管、脑脊液分流器、尿导管、持续性非固定腹膜透析(CAPD)导管,等。
通过注射可以施用本发明的组合物以实现内在装置插入稍前针对相关细菌的全身性作用。手术后在装置停留体内时间的过程中可以持续治疗。此外,该组合物也可用于为任一手术技术扩宽牙周炎保护(periopertive cover)以防止链球菌感染。
许多整形外科医生考虑在为具有假体关节的人进行牙齿治疗前应该考虑抗生素预防,因为该牙齿治疗可以产生菌血症。晚期深度感染(late deep infection)是一种严重的并发症,有时导致假体关节的丧失并伴随着严重的发病率和死亡率。因此可能扩大该活性剂作为对该情况中预防性抗生素的替代品的用途。
除了上述治疗,本发明的组合物通常可用作伤口治疗剂以防止细菌附着到暴露在伤口组织中的基质蛋白并且可在牙齿治疗中预防性用作抗生素预防的备选方案或者与其连用。
备选地,本发明的组合物可用于在内在装置将插入前浸泡该内在装置。活性剂将优选以1μg/ml到10mg/ml的浓度存在以浸泡伤口或内在装置。
疫苗组合物便利地为可注射形式。常规的佐剂可用于增强免疫应答。用于接种的适宜单位剂量为0.5-5μg/kg抗原,并且该剂量优选施用1-3次,时间间隔为1-3周。
用所指出的剂量范围,使用本发明的化合物将不会观察到不利的毒理学作用,该毒理学作用将排除它们对于适宜的个体的施用。
上述抗体还可以用作诊断试剂以检测含有根据本发明的多肽的细菌的存在。
在另一实施方案中,本发明涉及含有装有本发明的上述组合物的一种或多种成分的一个或多个容器的诊断和药物包和试剂盒。成分可以以有用的量、剂量、制剂或组合存在。与这种容器在一起的可以是说明,其可以是管理药物或生物制品的生产、使用或销售的政府部分所规定的形式,反映得到管理用于人体施用的产品的生产、使用或销售的部门的批准。
关于本发明,如此处公开的任一疾病相关的应用如,例如,药物组合物或疫苗的用途,具体为疾病或病症,该疾病或病症被革兰氏阳性细菌,更具体地选自链球菌、葡萄球菌和乳球菌的细菌导致或者与之相关或有关。更优选地,微生物选自无乳链球菌、酿脓链球菌、肺炎链球菌和变异链球菌。与之相关的是,注意到无乳链球菌包括如此处公开的一些菌株。而且,该疾病可以尤其为在选自患有慢性疾病如糖尿病和肝脏衰竭的人、怀孕妇女、胎儿和新生儿的任一患者中发生的疾病。需要根据本发明预防和/或治疗的与细菌感染相关、由细菌感染导致或与细菌感染相关的疾病包括新生儿脓毒症、肺炎和脑膜炎,和成人脓毒症和软组织感染。怀孕相关的感染为脓毒症、羊膜炎、尿道感染和死产。
在另一实施方案中,本发明涉及使用根据本发明的多肽或核酸的任一种的筛选方法。筛选方法同样是本领域技术人员公知的并且可被如此设计使得激动剂或拮抗剂被筛选。优选地,筛选拮抗剂,其在本情况中抑制或防止根据本发明的任一多肽与相互作用配偶体的结合。这种相互作用配偶体可以是天然存在的相互作用配偶体或者非天然存在的相互作用配偶体。优选地,该相互作用配偶体是对于FbsA为血纤蛋白原或者其片段或者对于PabA、PabB、PabC和PabD为任一宿主细胞,包括上皮细胞,优选人上皮细胞。
本发明还提供了筛选化合物的方法,以鉴定增强(激动剂)或阻碍(拮抗剂)本发明的多肽或多核苷酸功能,如其与结合分子的相互作用的那些化合物。筛选方法可包括高通量。
例如,为筛选激动剂或拮抗剂,可以从表达结合本发明的多肽的分子的细胞制备根据本发明的多核苷酸和核酸各自的相互作用配偶体、合成反应混合物、细胞隔室,如膜、细胞包膜或细胞壁,或者它们任一种的制剂。在候选分子(其可以是激动剂或拮抗剂)不存在或存在下将制剂与标记的多肽孵育。候选分子结合该结合分子的能力反映在被标记的配体的降低的结合中。无故结合,即不诱导多肽的功能效果的分子最可能是好的拮抗剂。结合良好并且引起和该多肽相同或者紧密相关的功能效果的分子是好的激动剂。
通过例如候选分子与细胞或者适宜的细胞制剂相互作用后确定报道系统的活性,并将该效果与使用本发明的多肽的效果或者引起与该多肽相同效果的分子的效果比较,可以测定潜在的激动剂和拮抗剂的功能效果。可用于该方面的报道系统包括,但不限于转化成产物的比色标记的底物、对该多肽的功能活性的改变应答的报道基因,和本领域中公知的结合测定法。
拮抗剂测定法的另一实例是竞争性测定法,其组合了本发明的多肽和潜在拮抗剂与膜结合的结合分子、重组结合分子、天然底物或配体,或者底物或配体模拟物,在适宜的条件下用于竞争性抑制测定法。该多肽可被如放射性或比色化合物标记,从而结合到结合分子或者转化成产物的多肽分子的数目可被准确测定以评估该潜在拮抗剂的有效性。
潜在拮抗剂包括小有机分子、肽、多肽和结合本发明的多肽并从而抑制或者压制其活性的抗体。潜在的拮抗剂还可以是小有机分子、肽和多肽如结合到结合分子的相同位点而不诱导本发明的多肽的功能活性的密切相关的蛋白质或者抗体。
潜在的拮抗剂包括小分子,其结合并占据该多肽的结合位点从而防止对细胞结合分子的结合,从而正常的生物学功能被防止。小分子的实例包括但不限于小有机分子、肽或类似肽的分子。
其他潜在的拮抗剂包括反义分子(关于这些分子的描述见Okano,J.Neurochem.56:560(1991);OLIGODEOXYNUCLEOTIDES ASANTISENSE INHIBITOR S OF GENE EXPRESSION;CRC Press,BocaRaton,FL(1988))。
优选的潜在拮抗剂包括本发明的多肽的衍生物。
如此处所用的,根据本发明的多肽的活性是其结合任何的其相互作用配偶体的能力,或者其结合其任何相互作用配偶体的这种能力的程度。
在具体方面,本发明提供了本发明的多肽、多核苷酸或抑制剂的用途,用于干扰病原体和哺乳动物宿主之间的最初生理相互作用,该最初生理相互作用是造成感染后遗症的原因。具体地,本发明的分子可用于:i)防止无乳链球菌对内在装置上的哺乳动物胞外基质蛋白或者伤口中的胞外基质蛋白的粘附;ii)通过例如启动哺乳动物酪氨酸激酶的磷酸化阻碍蛋白质介导的哺乳动物细胞侵染(Rosenshire等人,Infect.Immun.60:2211(1992));iii)阻碍哺乳动物胞外基质蛋白和介导组织损伤的细菌蛋白之间的细菌粘附;iv)阻碍不是通过内在装置的植入或通过其它手术技术引起的感染中病理的正常发展。
此处提供了每种DNA编码序列可用于抗细菌化合物的发现和开发。表达时编码的蛋白质可用作筛选抗细菌药物的标靶。此外,编码该编码蛋白的氨基末端区或者SD序列或者各自mRNA的其他翻译促进序列的DNA序列可用于构建反义序列以控制目标编码序列的表达。
拮抗剂和激动剂可以用于,例如,抑制链球菌,特别是无乳链球菌的感染引起的疾病,如脓毒症。
在另一方面,本发明涉及亲和装置,该亲和装置含有至少一种支持物质和附着到该支持物质的根据本发明的多肽的任一种。由于根据本发明的多肽对它们的靶细胞或靶分子或者它们的相互作用配偶体的特异性,该多肽允许从应用于支持物质的任何一种样品选择性除去它们的相互作用配偶体,只要满足结合的条件。样品可以是生物或医学样品,包括但不限于,发酵液、细胞碎片、细胞制剂、组织制剂、器官制剂、血、尿、淋巴液、溶液等。
该多肽可以以共价或非共价方式附着到基质。适宜的支持物质是本领域技术人员公知的并且可选自纤维素、硅、玻璃、铝、顺磁珠、淀粉和右旋糖苷。
还通过下面的附图、实施例和序列表进一步阐明本发明,从这些附图、实施例和序列表中可以得到进一步的特征、实施方案和优点。应该理解该实施例仅用于阐明而不是限制本公开的内容。
与本发明相关
图1显示了来自血清型III GBS株6313的fbsA-编码区的DNA序列和所推导的FbsA蛋白;
图2是DNA印迹分析的结果;
图3来自血清型Ia GBS株706S2的fbsA-编码区的DNA序列和所推导的FbsA蛋白;
图4来自血清型Ib GBS株33H1A的fbsA-编码区的DNA序列和所推导的FbsA蛋白;
图5来自血清型II GBS株176H4A的fbsA-编码区的DNA序列和所推导的FbsA蛋白;
图6来自荚膜GBS突变体O90R的fbsA-编码区的DNA序列和所推导的FbsA蛋白;
图7来自血清型V GBS株SS1169的fbsA-编码区的DNA序列和所推导的FbsA蛋白;
图8:分别来自GBS株6313(血清型III)、706 S2(血清型Ia)、33H1A(血清型Ib)、O176 H4A(血清型II)、O90R(来自血清型Ia)和SS 1169(血清型V)的FbsA的示意性比较;
图9用于鉴定FbsA中血纤蛋白原结合结构域的截短的FbsA衍生物的蛋白质印迹分析的结果;
图10阐明分别通过纯化的融合蛋白FbsA-19、FbsA-9和Bsp竞争性抑制血纤蛋白原与GBS 6313的结合的图;
图11通过来自FbsA的重复单位的合成肽结合血纤蛋白原的点膜分析结果;
图12血纤蛋白原结合重复单位的点膜分析结果;
图13阐明合成肽对血纤蛋白原与GBS 6313的结合的竞争性抑制的图;
图14阐明GBS株6313、706 S2和O90R和它们的各自fbsA缺失突变株的真核细胞粘附(A)和侵染(B)的图;
图15FbsA肽与人血清的肽ELISA结果;
图16来自GBS 6313的pabA/B-编码区的DNA序列和推导的PabA(nt 319-2964)和PabB(nt 3087-5111)蛋白;
图17来自GBS 6313的pabC/D-编码区的DNA序列和推导的PabC(nt 487-2394)和PabD(nt 2461-3006)蛋白;
图18A549细胞的扫描电子显微术图;
图19阐明存在100μg/ml PabA、PabB、PabC或PabD融合蛋白时GBS 6313对A549细胞的粘附和侵染的图;
图20阐明通过GBS 6313和其pabA和pabB缺失突变体的真核细胞粘附和内化的图;
图21测试抗-PabA、抗-PabB和抗-PabD抗血清的灵敏性的蛋白质印迹结果;
图22用于确定血纤蛋白原结合蛋白的存在的不同无乳链球菌菌株和它们的等基因fbsA缺失突变体的培养上清液的蛋白质印迹分析;
图23不同无乳链球菌菌株和它们的fbsA缺失突变体对固定化血纤蛋白原的结合;
图24不同无乳链球菌菌株和它们的等基因fbsA缺失突变体向肺上皮细胞系A549的粘附和内化;
图25无乳链球菌菌株6313和6313ΔfbsA向成纤维细胞系HEL299的粘附和内化;
图26FbsA蛋白对无乳链球菌对A549细胞的粘附的影响;
图27FbA-包衣的乳胶珠对人A549细胞的结合;
图28无乳链球菌的pabC-编码区的转录组构;
图29确定pabC和pabD基因的存在的GBS菌株的PCR-分析;
图30来自不同无乳链球菌菌株的PabC蛋白的氨基酸序列的比较;
图31pabC-编码区的限制性图、PabC和Gbs0851融合蛋白的蛋白质印迹分析,其为了确定血纤蛋白原结合和鉴定人血纤蛋白原内FbsA和Pabc-结合位点;
图32通过ELISA,重组PabC融合蛋白与固定化血纤蛋白原的结合,和
图33无乳链球菌pabC菌株对肺上皮细胞系A549的粘附和侵染。
下面更详细地描述说明书中可能提到的这些图。
图1显示了来自血清型III GBS株6313的fbsA-编码区的DNA序列和所推导的FbsA蛋白。假定的核糖体结合位点(RBS)用下划线标出,潜在的转录终止子通过反平行箭头指出。在所推导的FbsA蛋白内,粗体和斜体字母指示假定的信号肽序列,粗体和下划线标记的字母指示细胞壁锚定基序LPKTG。FbsA中的重复被编号并通过箭头标记。
图2显示了确定GBS的不同临床分离物中fbsA基因的存在的DNA印迹分析。用HindIII消化分别属于血清型Ia、Ib、II、III、IV和V的不同GBS菌株的染色体DNA,和大小分离和印迹到尼农膜上后,与地高辛-标记的fbsA-特异DNA探针杂交。
图3显示了来自血清型Ia GBS株706S2的fbsA-编码区的DNA序列和所推导的FbsA蛋白。假定的核糖体结合位点(RBS)用下划线标出,潜在的转录终止子通过反平行箭头指出。在所推导的FbsA蛋白内,粗体和斜体字母指示假定的信号肽序列,粗体和下划线标记的字母指示细胞壁锚定基序LPKTG。FbsA中的重复被编号并通过箭头标记。
图4显示了来自血清型Ib GBS株33H1A的fbsA-编码区的DNA序列和所推导的FbsA蛋白。假定的核糖体结合位点(RBS)用下划线标出,潜在的转录终止子通过反平行箭头指出。在所推导的FbsA蛋白内,粗体和斜体字母指示假定的信号肽序列,粗体和下划线标记的字母指示细胞壁锚定基序LPKTG。FbsA中的重复被编号并通过箭头标记。
图5显示了来自血清型II GBS株176H4A的fbsA-编码区的DNA序列和所推导的FbsA蛋白。假定的核糖体结合位点(RBS)用下划线标出,潜在的转录终止子通过反平行箭头指出。在所推导的FbsA蛋白内,粗体和斜体字母指示假定的信号肽序列,粗体和下划线标记的字母指示细胞壁锚定基序LPKTG。FbsA中的重复被编号并通过箭头标记。
图6显示了来自荚膜GBS突变体O90R的fbsA-编码区的DNA序列和所推导的FbsA蛋白。假定的核糖体结合位点(RBS)用下划线标出,潜在的转录终止子通过反平行箭头指出。在所推导的FbsA蛋白内,粗体和斜体字母指示假定的信号肽序列,粗体和下划线标记的字母指示细胞壁锚定基序LPKTG。FbsA中的重复被编号并通过箭头标记。
图7显示了来自血清型V GBS株SS1169的fbsA-编码区的DNA序列和所推导的FbsA蛋白。假定的核糖体结合位点(RBS)用下划线标出,潜在的转录终止子通过反平行箭头指出。在所推导的FbsA蛋白内,粗体和斜体字母指示假定的信号肽序列,粗体和下划线标记的字母指示细胞壁锚定基序LPKTG。FbsA中的重复被编号并通过箭头标记。
图8显示了分别来自GBS株6313(血清型III)、706S2(血清型Ia)、33H1A(血清型Ib)、O176H4A(血清型II)、O90R(来自血清型Ia)和SS 1169(血清型V)的FbsA蛋白的示意性比较。指出了信号肽(黑盒)、跨壁区(WSR;具有垂直线的盒)、细胞壁锚定基序(LPKTG)和跨膜区(MSR;具有对角线的盒)的位置。
为每种蛋白质指出了各自重复的编号。灰色盒代表具有序列基序“GNVLERRQRDAENRSQ”的重复,具有水平线的盒代表具有R14K取代的重复,有点的盒显示了具有A11V和R14K取代的重复的位置。在来自GBS株系33H1A和SS1169的FbsA蛋白质下面指出了携带E12D取代的重复。在来自33H1A的FbsA上面,指出了携带单个A11V取代的重复。
图9显示了用于鉴定FbsA中血纤蛋白原结合结构域的截短的FbsA衍生物的蛋白质印迹分析。通过SDS-PAGE分离代表成熟FbsA蛋白(FbsA-19)、含有N-末端重复的区域(FbsA-N)或FbsA的C-末端部分(FbsA-C)的六组氨酰-标记的融合蛋白,印迹到硝酸纤维素并测试它们与人血纤蛋白原的结合。在示意性FbsA图下面指出了不同构建体编码的这三种蛋白的血纤蛋白原结合活性。
图10显示了分别通过纯化的融合蛋白FbsA-19、FbsA-9和Bsp竞争性抑制血纤蛋白原与GBS 6313的结合。FbsA-9与FbsA-19的不同之处在于FbsA-9在其重复结构域中仅含有9个重复。在不同浓度的每种融合蛋白的存在下用125I标记的血纤蛋白原实施结合测定法。每种实验至少一式三份地进行。
图11显示了通过来自FbsA的重复单位的合成肽结合血纤蛋白原的点膜分析。用携带FbsA重复基序‘GNVLERRQRDAENRSQ’(SEQ ID113)和含有扰乱的序列(scrambled sequence)‘GLSQNRDVRENQRARE’(SEQ ID 205)的肽测试了血纤蛋白原结合。合成肽与重复基序的不同之处在于单个氨基酸已经被丙氨酸代替,用该合成肽探测血纤蛋白原结合。除了点膜,还列出了每种合成肽的序列。粗体和下划线字母指示重复基序内的氨基酸取代。
图12显示了血纤蛋白原结合重复单元的点膜分析。测试合成肽的血纤蛋白原结合,其中血纤蛋白原结合重复的氨基酸的每一个被20种氨基酸的每一个代替。粗体印刷的垂直字母代表FbsA-衍生的血纤蛋白原结合序列“GNVLERRQRDAENRSQ”。水平字母代表各自位置上导入合成肽而不是原来的氨基酸的那些氨基酸。
图13显示了合成肽对血纤蛋白原与GBS 6313的结合的竞争性抑制。在不同浓度的肽pep_FbsA(SEQ ID 211)(携带来自FbsAd的重复单元)、和pep_R6A(重复单位内具有R6A取代)的存在下用125I标记的血纤蛋白原实施结合测定法。每种实验至少一式三份地进行。
图14显示了GBS株6313、706S2和O90R和它们的各自fbsA缺失突变株的真核细胞粘附(A)和侵染(B)。数值代表一式三份地进行的至少4个独立实验中的结果。显示了误差棒。
图15显示了FbsA肽与人血清的肽ELISA。5种生物素化的肽(野生型<1>:GNVLERRQRDAENRSQ SEQ ID No.113;丙氨酸突变肽:<2>GAVLERRQRDAENRSQ SEQ ID No.207,<3>GNALERRQRDAENRSQ SEQ ID No.208,<4>GNVLEARQRDAENRSQ SEQ IDNo.211,<5>GNVLERAQRDAENRSQ SEQ ID No.212;见图11)被包被在链霉抗生物素蛋白包被的ELISA板上并使用来自GBS感染的患者的5种血清分析。将患者血清以1∶200和1∶1000稀释应用。用偶联辣根过氧化物酶的第二抗人抗体和ABTS作为底物检测IgG(A)和IgA(B)。
图16显示了来自GBS 6313的pabA/B-编码区的DNA序列和推导的PabA(nt 319-2964)和PabB(nt 3087-5111)蛋白。假定的核糖体结合位点(RBS)用下划线标出,粗体和斜体字母指示推导的PabA和PabB蛋白的假定的信号肽,粗体和下划线的字母标记与来自革兰氏阳性细菌的细胞壁锚定基序具有高度同一性的区域。
图17显示了来自GBS 6313的pabC/D-编码区的DNA序列和推导的PabC(nt 487-2394)和PabD(nt 2461-3006)蛋白。假定的核糖体结合位点(RBS)用下划线标出。粗体和斜体字母指示推导的PabC和PabD蛋白的假定的信号肽。
图18显示了用分别以PabA、PabB、PabC、PabD包被的胶乳珠孵育2小时的A549细胞的扫描电子显微术图。BSA包被的胶乳珠用作对照。
图19显示了存在100μg/ml PabA、PabB、PabC或PabD融合蛋白时GBS 6313对的A549细胞的粘附和侵染。GBS6313对A549细胞的粘附(A)和其向这些细胞的内化(B)被任意地设为100%,存在不同融合蛋白时所得的结果与这些值相关。每种实验至少一式三份地进行至少3次。
图20显示了通过GBS 6313和其pabA和pabB缺失突变体对真核细胞的粘附和内化。GBS6313对A549细胞的粘附(A)和其向这些细胞的内化(B)被任意地设为100%,用GBS突变体6313ΔpabA和6313ΔpabB所得的结果与这些值相关。每种实验至少一式三份地进行至少3次。
图21显示了测试抗-PabA、抗-PabB和抗-PabD抗血清在检测它们的各自抗原中的灵敏性。将融合蛋白PabA、PabB、和PabD的连续稀释液点到硝酸纤维素上,并用针对各自蛋白质的小鼠血清的1∶1000稀释液探测。将结合的抗体用抗-小鼠-HRP缀合物标记并通过化学发光显现。
图22显示了用于确定血纤蛋白原结合蛋白的存在的不同无乳链球菌菌株和它们的等基因fbsA缺失突变体的培养上清液的蛋白质印迹分析。将来自不同无乳链球菌和它们的fbsA缺失突变体的浓缩的培养上清液的蛋白质15μg通过SPS-PAGE进行大小分离,印迹到硝酸纤维素上并测试与人血纤蛋白原的相互作用。通过将印迹与兔抗血纤蛋白原抗体孵育然后与偶联到辣根过氧化物酶的山羊抗兔抗体孵育检测结合的血纤蛋白原。对于血纤蛋白原-抗体复合体的检测,使用化学发光。
图23显示了不同无乳链球菌菌株和它们的fbsA缺失突变株与固定的血纤蛋白原的结合。类似的细胞数的不同菌株与固定到Terasaki板的血纤蛋白原孵育。结合到血纤蛋白原的细菌数与输入到该测定法中的细菌的数目相关。
图24显示了不同无乳链球菌菌株和它们的等基因fbsA缺失突变体向肺上皮细胞系A549的粘附和内化。类似数目的细菌被用于感染A549细胞并且粘附到A549细胞(A)和被A549细胞内化的细菌数与输入细菌数相关。
图25显示了无乳链球菌菌株6313和6313ΔfbsA向成纤维细胞系HEL299的粘附和内化。以10∶1的MOI用无乳链球菌感染HEL299,细胞粘附和内化的细菌与输入的细菌数相关。
图26显示了FbsA蛋白对无乳链球菌对A549细胞的粘附的影响。在不同量的纯化FbsA融合蛋白的存在下实施粘附测定法,细胞粘附的细菌数与输入的细菌数相关。
图27显示了FbA-包被的胶乳珠对人A549细胞的结合。将胶乳珠用BSA(A)或FbsA融合蛋白(B-D)包被,并通过扫描电子显微术分析包被的珠子与肺上皮细胞系A549的相互作用。
图28显示了无乳链球菌中pabC-编码区的转录组构。图上的名称指示PCR过程中用无乳链球菌6313的总RNA(A)与引物对退火的基因、RT-PCR过程中用无乳链球菌6313的总RNA(B)与引物对退火的基因、PCR过程中用无乳链球菌6313的染色体DNA(C)与引物对退火的基因。
图29显示了确定pabC和pabD基因的存在的GBS菌株的PCR-分析。下面的菌株用于PCR:1,无乳链球菌1137(Ia);2,无乳链球菌A90/14(Ib);3,无乳链球菌6313(III);4,无乳链球菌4416 S3(III);5,无乳链球菌4357(V);6,无乳链球菌4327(V)。
图30:显示了来自无乳链球菌6313、无乳链球菌NEM316、无乳链球菌2003V_R的PabC蛋白的氨基酸序列的比较。
图31:显示了(A)无乳链球菌中pabC-编码区的限制性图和(B)PabC和Gbs0851融合蛋白对血纤蛋白原结合的蛋白印迹分析。融合蛋白被通过SDS-PAGE按大小分离,转移到硝酸纤维素膜上并通过蛋白质印迹检测血纤蛋白原结合。用兔抗-血纤蛋白原抗体,然后通过过氧化物酶-标记的山羊抗兔抗体,并通过化学发光显色来检测结合的血纤蛋白原。PabC和Gbs0851:全长融合蛋白;PabC-N:PabC的N-末端388个氨基酸;PabC-C:PabC的C-末端222个氨基酸。(C)通过蛋白质印迹分析鉴定人血纤蛋白原内的FbsA和PabC-结合位点。通过SDS-PAGE根据大小分离人血纤蛋白原并考马斯染色(左泳道)或者转移到硝酸纤维素并通过蛋白质印迹检验FbsA-或PabC-结合。用小鼠抗-His标记抗体,然后通过过氧化物酶-缀合的山羊抗小鼠IgG Fab片段,并通过化学发光显色来检测结合的融合蛋白。
图32:显示了捕获ELISA测定法中重组PabC融合蛋白与固定化血纤蛋白原的结合。将微量滴定孔用固定量的人血纤蛋白原包被,然后加入浓度增加的不同PabC融合蛋白。用小鼠抗-His标记抗体和过氧化物酶-缀合的山羊抗小鼠IgG Fab片段检测结合的融合蛋白。通过加入四甲基-联苯胺底物开始显色并用H2SO4中止。在450nm读出微量滴定孔的吸收。数值代表三次独立实验的平均值,每个实验一式三份的进行。
图33:显示了无乳链球菌菌株6313 pAT32、ΔpabC pAT32和ΔpabCpATpabC菌株分别对肺上皮细胞系A549的粘附(A)和侵染(B)。如下计算细菌粘附和侵染:粘附=粘附细菌数/测定法中的细菌总数×100。侵染=内化的细菌数/测定法中的细菌总数×100。每种实验至少一式三份地进行至少3次。存在不同量PabC和Bsp融合蛋白时无乳链球菌6313的真核细胞粘附(C)和侵染(D)。如图32图例中描述计算细菌粘附和侵染。每种实验至少一式三份地进行至少3次。
实施例
实施例1:实验方法
应该注意如果不另外相反指出,下面的材料和方法用于此处描述的全部实施例中。
细菌菌株和培养条件
GBS菌株6313(血清型III)和SS1169(血清型V)代表参比菌株并且以前已经被描述(Wibawan和Lammler,1992)。GBS菌株706 S2(血清型Ia)、33H1A(血清型Ib),和176H4A(血清型II)由G.S.Chhatwal(GBF Braunschweig)友好地提供。GBS菌株O90R(ATCC 12386)是血清型Ia菌株O90的衍生物。分别属于血清群Ia、Ib、II、III和V的所有GBS菌株都是临床分离物并且从受感染的新生儿分离,而血清群IV的GBS菌株分离自患有乳腺炎的奶牛(Chhatwal等人,1984)。大肠杆菌DH5α(Hanahan,1985)用于克隆目的并且大肠杆菌BL2I(Dubendorff和Studier,1991)作为生产FbsA融合蛋白的宿主。碱性磷酸酶-阴性大肠杆菌菌株CC118(Manoil和Beckwith,1985)作为pHRM104-衍生物的宿主并用于从GBS筛选信号肽编码序列。
GBS在37℃下培养于含有1%酵母提取物的Todd-Hewitt酵母肉汤(THY)中。大肠杆菌在37℃下生长在Luria肉汤(LB)中并在氯霉素(15μg/ml)、卡那霉素(50μg/ml)、或者红霉素(300μg/ml)的存在下选择携带粘粒pTEX5236或质粒pET28a或pHRM 104的克隆。在含有80μ/mlX-磷酸(Sigma)的LB-平板上进行分泌碱性磷酸酶的大肠杆菌CC118克隆的筛选。
抗体、酶、肽和人蛋白
从Dako-Biochemicals得到亲和纯化的兔抗血纤蛋白原和过氧化物酶-标记的抗-兔抗体。从Dianova购买过氧化物酶-标记的山羊抗小鼠抗体。从Roche Diagnostics得到单克隆抗-his-标记抗体。从Sigma-Aldrich购买纯化的兔抗-血纤蛋白原抗体、胰蛋白酶、链霉蛋白酶、玻连蛋白、层粘连蛋白、IgG、纤连蛋白和血纤蛋白原。将血纤蛋白原(Sigma)穿过明胶-琼脂糖(Sepharose)柱以除去制剂中残留的污染性纤连蛋白。通过SDS-PAGE和考马斯-染色并使用抗-纤连蛋白抗体进行蛋白质印迹证实血纤蛋白原制剂的纯度。如以前描述的(Frank和Overwin,1996)合成用于点膜分析和抑制实验的合成肽。
用于克隆目的的质粒和粘粒
GBS 6313的粘粒基因文库(Reinscheid等人,2001)被用于从GBS分离fbsA基因。低-拷贝粘粒pTEX5236还被用于用Sau3A部分消化携带fbsA基因的粘粒后亚克隆fbsA基因。质粒pET28a(Novagen)用于合成六组氨酰-标记的FbsA、PabA、PabB、PabC、和PabD融合蛋白,它们被如下构建:使用引物1:5’GTCCTGTATCTGCCATGGATAGTGTTGG(SEQ ID No.223)和2:5’CCGCGGATCCACATTTTGATCAT CACCTG(SEQ ID No.224)通过PCR从GBS 6313的染色体DNA扩增没有信号肽和跨膜结构域的编码区的截短的fbsA基因。用引物35’GTCCTGTATCTGCCATGGATAGTGTTGG(SEQ ID No.225)和45’CCGCGGATCCCCTATAAGTTGACCTAC(SEQ ID No.226)扩增fbsA的重复-编码区。用引物5:5’TGCTTTGCCATGGTAGGTCAACTTATAGGG(SEQ ID No.227)和6:5’CCGCGGATCCACATTTTGATCATCACCTG(SEQ ID No.228)实施fbsA非重复区的扩增。用于克隆的NcoI和BamHI的限制性位点被下划线标出。用引物pabA1:5’GTGCCTTGCCATGGAAAGTACCGTACCGG(SEQ ID No.229)、pabA2:5’GCGGACAGCTCGAGTTTCCCACCTGTCATCGG(SEQ IDNo.230)、pabB1:5’GTGCCTTGCCATGGACGACGTAACAACTGATA C(SEQ ID No.231)、pabB2:5’GCGGACAGCTCGAGTGTACCAATACCACCTG(SEQ ID No.232)、pabC1 5’GTGCCTTGCCATGGGCCGGGATAACTAAAG(SEQ ID No.233)、pabC2:5’GCGGACAGCTCGAGCTCTTTTATACGCCATGAG(SEQ ID No.234)、pabD1:5’CCGCGGA TCCGATGATAACTTTGAAATGCC(SEQ ID No.235)和pabD2:5’TGGCACAAGCTTACATTCTGAGCAGAAAGC(SEQ ID No.236)进行缺少信号肽和,如果存在,跨膜结构域的编码区的pabA、pabB、pabC和pabD基因的扩增。
用于克隆的NcoI、XhoI和BamHI和HindIII限制性位点用下划线标出。将PCR产物和质粒pET28a用所指出的限制性酶消化,连接并转化到大肠杆菌BL21中。通过用XbaI部分消化pETfbsA-19,随后再连接并转化到大肠杆菌BL21中构建携带具有9个内部重复fbsA的质粒pETfbsA-9。
基本如别处(Pearce等人,1993)描述的在质粒pHRM104中构建GBS染色体片段的质粒文库。简言之,将来自GBS6313的染色体DNA通过超声破碎45分钟,将所得片段通过Klenow聚合酶钝化末端,连接到SmaI消化的pHRM 104中,并将连接混合物转化到大肠杆菌CC118中。将转化株涂布到含有红霉素和X-磷酸的琼脂板上并孵育3天。
DNA印迹和斑点印迹分析
如别处描述的(Pospiech,1995)从GBS制备染色体DNA。通过PCR使用引物7:5’AATATCGCCCTGAGC(SEQ ID No.237)和8:5’GGTTTTCCCAGTCACG(SEQ ID No.238)得到质粒pHRM104中的插入物的地高辛-标记的探针。同样的引物也用于对pHRM104衍生物中插入物的测序。通过PCR使用引物fbsA1:5’GTCCTGTATCTGCTATGGATAGTGTTGG(SFQ ID No.239)、fbsA2:5‘ACATTTTGATCATCACCTG(SEQ ID No.240)、pabA:5’ACTGCTGAGCTAACAGGTG(SEQ ID No.241)、pabB:5’ACATCACCTGACAATGTCGC(SEQ ID No.242)、pab C:5‘GCGATTGTGAATAGAATGAG(SEQ IDNo.243)和pabD:5‘TATACAAAGCCTGAGCTTC(SEQ ID No.244)分别得到基因fbsA、pabA/B和pabC/D的地高辛标记的探针。为分析基因fbsA、pabA/B和pabC/D在GBS的不同临床分离物中的分布,将它们的染色体DNA用HindIII、BstEII或NcoI消化并与fbsA-、pabA/B-或pabB/C特异探针杂交。使用地高辛标记和检测试剂盒(RocheDiagnostics)根据生产商的使用说明书进行DNA印迹中的标记、杂交、洗涤和检测,并随后通过化学发光检测。
来自不同GBS菌株的fbsA的PCR扩增和测序
通过PCR使用引物9:5‘TTACCGTAGCCTGTATCACC(SEQ IDNo.245)和10:5’CGACCTACGATAGCAACG(SEQ ID No.246)从GBS菌株706 S2、33H1A、176H4A、O90R和SS1169的染色体扩增fbsA基因,并随后测序PCR产物。通过对pTEXfbsA的2.6kb插入物测序得到来自菌株6313的fbsA基因的核苷酸序列。
fbsA缺失突变体的构建
热敏感质粒pG+host6(Appligene)分别用于GBS菌株6313、706S2和O90R中fbsA基因的靶向缺失。使用引物对fbsA_del1:5’CCGCGGATCCGAATATGCTACCATCAC(SEQ ID No.247)和(SEQ ID No.248)以及fbsA_del3:5’TGCGGTTTGAGACGC(SEQ ID No.249)和fbsA_del4:5‘TGGCACAAG CTTTACCTGCTGAGCGACTTG(SEQ ID No.250)通过PCR从GBS6313的染色体DNA扩增fbsA基因侧翼的两个片段。引物fbsA_del2和fbsA_del3中的互补DNA序列以斜体标记并且引物fbsA_del1和fbsA_del4中的BamHI和HindII限制性位点以下划线标出。将fbsA侧翼PCR产物以等量相互混合并进行使用引物fbsA_del1和fbsA_del4的交换PCR。所得PCR产物由单个DNA片段上的fabsA侧翼区组成。交换PCR产物和质粒pG+host6被BamHI和HindIII消化,连接并转化到大肠杆菌DH5α中。将所得质粒pG+ΔfbsA分别转化到GBS菌株6313、706S2和O90R中,并通过在红霉素琼脂上30℃下生长选择转化株。通过如描述的(Maguin等人,1996)用红霉素选择在39℃下转化株的生长选择pG+ΔfbsA已经整合到染色体中的细胞。来自每种菌株的这种整合体的四种在没有红霉素选择的液体培养基中30℃下被连续传代3天以促进质粒pG+ΔfbsA的切除,留下染色体中所希望的fbsA缺失。将连续传代的培养物的稀释液涂琼脂板并检验单个菌落的红霉素敏感性以鉴定pG+ΔfbsA切除体。亲代GBS菌株6313、706S2和O90R的染色体DNA和每种菌株的10种红霉素敏感的GBS切除体的染色体DNA通过HindIII消化后,通过使用以引物fbsA_del3和fbsA_del4得到的地高辛标记的fbsA侧翼片段的DNA印迹检验。
pabA和pabB缺失突变体的构建
如关于fbsA缺失突变体的构建所描述的在GBS 6313中分别构建基因pabA和pabB中的缺失突变体。用于构建pabA缺失突变体的引物对是pabA_del1:5’GTTAAAGGTAACCTGCCTG(SEQ ID No.251)、pabA_del2:5‘CCCATCCACTAAACTTAAACATACAACTCCTATTGTGCCGAAATGTCG(SEQ ID No.252)以及pabA_del3:5’TGTTTAAGTTTAGTGGATGGGCACTTAGAGATTTTCCAATCC(SEQ ID No.253)和pabA_del4:5‘GACATCATAGATCCACC (SEQ ID No.254)。交换PCR后将所得PCR片段和载体pG+host6用HindIII和EcoRI消化并随后连接,得到质粒pG+ΔpabA。用于检测缺失pabB的引物对是pabB_del1:5’CCGCGGATCCGGAGCTACGTTTGAACTTC(SEQ ID No.255)、pabB_del2:5’CCCATCCACTAAACTTAAACAATATTACCGCAGCACCAC(SEQ ID No.256)以及pabB_del3:5‘TGTTTAAGTTTAGTGGATGGGACAAGAAGGCCAAGAAGG(SEQ ID No.257)和pabB_del4:5’CACGCAACGCGTCGACGCACAGCTTTAACTGTAC(SEQ IDNo.258)。BamHI和SalI限制性位点被下划线标出。将通过交换PCR所得片段和载体pG+host6用BamHI和SalI消化并连接,得到质粒pG+ΔpabB。随后将质粒pG+ΔpabA和pG+ΔpabB转化到GBS 6313中。用于产生pabA和pabB缺失突变体的方法与用于构建fbsA缺失突变体的方法相同。
常规DNA技术
如Sambrook等人(Sambrook等人,1989)所描述的进行DNA操作常规技术,如限制酶消化、PCR、连接、通过电穿孔转化和DNA印迹。可溶的125I-标记的血纤蛋白原与GBS结合
使用chloramin T方法(Hunter和Greenwood,1962)用125I放射标记纯化的人血纤蛋白原。基本如Chhatwal等人(1983)描述实施标记的血纤蛋白原与GBS的结合。简言之,将GBS的过夜培养物通过离心沉淀,用补加0.02%Tween 20的磷酸缓冲盐水(PBST)洗涤两次并调节光度到在600nm处透射为10%。将共0.2ml细菌悬浮液加到含有23ng血纤蛋白原的20μl 125I-标记的血纤蛋白原。室温下孵育1h后,通过离心沉淀链球菌并用1ml PBST洗涤。最终在gamma计数器(PackardInstruments)中测量沉淀的放射性。细菌结合的血纤蛋白原的量被计算为加入细菌的总的放射标记的血纤蛋白原的百分比。在抑制实验中,在FbsA融合蛋白、Bsp融合蛋白或合成肽的各种量的存在下确定23ng放射标记的血纤蛋白原与0.2ml GBS(T=10%)的结合。每种实验至少一式三份地重复至少三次。
FITC-标记的GBS与固定化血纤蛋白原的结合
将Terasaki板用人血纤蛋白原包被,并如Podbielski等人(Podbielski等人,1999)描述测量FITC-标记的细菌与固定化血纤蛋白原的结合。简言之,将10μl 100μg/ml人纤连蛋白、血纤蛋白原、层粘连蛋白和胶原I和IV的储存液分别加到每孔中,并在湿室中室温下整夜孵育。随后,用PBS洗涤微量滴定板并小心除去残留的缓冲液。用指数(OD600:0.5)和静止(OD600:1.5)生长期的培养物进行GBS的FITC-标记。将12ml细菌培养物通过离心沉淀,用12ml PBS洗涤并重悬在2ml FITC-溶液(1mg/ml FITC在50mM碳酸钠缓冲液中,pH 9.2)。黑暗中孵育20分钟后,将细胞离心沉淀,用PBS洗涤两次并超声破裂20秒以破坏细菌链。用PBS调节细菌悬浮液到OD600:1.0,剧烈涡流并保存在黑暗中待用。将10μl FITC-标记的GBS悬浮液加到用不同人蛋白包被的每个Terasaki孔中。37℃温育60分钟后,用PBS洗涤5次除去未结合的细菌,并用0.5%戊二醛固定结合的细菌5分钟。最后用PBS洗涤板两次并在自动化Cyto Fluor II荧光读出器(PerSeptive Biosystems)中分别以激发波长485nm和检测波长530nm确定每孔的荧光。通过在37℃下孵育500μl FITC-标记的细菌60分钟,用PBS洗涤细菌3次,将细胞重悬在500μl PBS中并在未包被的Terasaki微量滴定板中测量10μl悬浮液的等分试样的荧光,确定细菌的FITC-标记的效率。每种测定法一式三份地测量并重复至少4次。
融合蛋白的制备和纯化
在重组大肠杆菌BL21中加入1mM IPTG,培养物达到光密度1.0后合成了不同的FbsA融合蛋白以及融合蛋白PabA、PabB、PabC、PabD和Bsp(Reinscheid等人,2002)。使用French Press cell破坏细胞并根据Qiagen的使用说明书用Ni2+亲和层析进行融合蛋白的纯化。随后,将PabA、PabB和PabC融合蛋白对20mM Tris/HCl,pH 8.5透析并加到MonoQ阴离子交换柱(Amersham/Pharmacia)。从20mMTris/HCl中的0M到1.0M NaCl的线性梯度用于从柱子洗脱融合蛋白。为进一步纯化PabD,将该融合蛋白对20mM Tris/HCl缓冲液透析并加到MonoS阳离子交换柱(Amersham/Pharmacia)。从20mMTris/HCl缓冲液中的0M到1.0M NaCl的线性梯度用于PabD的洗脱。所有融合蛋白最后对PBS透析并保存在-20℃。
血纤蛋白原-结合菌落的筛选
将携带粘粒的大肠杆菌克隆一式两份转移到含有四环素的LB板并整夜孵育。第二天将一个板的菌落转移到硝酸纤维素6h。滤器上的细胞通过氯仿蒸气裂解20分钟并随后在PBS中与1mg/ml溶菌酶和1mM PMSF整夜孵育。用磷酸缓冲的盐水(PBS)中的10%脱脂乳封闭膜过夜并随后如下描述的检测人血纤蛋白原的结合。
蛋白质印迹和点膜分析
在蛋白质印迹实验中,通过SDS-PAGE分离蛋白质并将其电印迹到硝酸纤维素上。随后用PBS中的10%脱脂乳封闭膜过夜。对于点膜实验,合成16个氨基酸的肽,并如以前描述的(Frank和Overwin,1996)将等量肽直接点到纤维素纸上。在由20ml基于酪蛋白的封闭缓冲液(Genosys Biotechnologies,Cambridge,英国)、80ml Tris缓冲的盐水(TBS)、0.05%吐温20和5g蔗糖组成的膜封闭液(MBS)中实施封闭。如下述进行血纤蛋白原-结合的检测。
通过蛋白质印迹、点膜和菌落印迹检测血纤蛋白原结合
用2μg/ml人血纤蛋白原将已经封闭过夜的膜孵育1h。对于蛋白质印迹和菌落印迹实验,将血纤蛋白原和抗体在PBS中稀释,而对于点膜分析,它们在MBS中稀释。用PBS洗涤三次后,将膜用抗-血纤蛋白原抗体(1∶1000PBS或MBS中)孵育1小时。该孵育后用含有0.05%吐温20的PBS(PBST)洗涤3次并用PBS洗涤2次。随后,用过氧化物酶标记的抗-兔IgG(1∶1000PBS或MBS中)孵育膜1小时。用PBST洗涤3次和PBS洗涤2次后,通过化学发光使用ECL-试剂盒(Amersham/Pharmacia)检测结合的血纤蛋白原。在对照实验中,没有检测到所用抗体与固定的蛋白质和肽的交叉反应性。
调理吞噬作用测定(Opsonophagocytosis assay)
如Podbielski等人,(1996)描述测量对吞噬作用的抗性。简言之,将GBS的生长培养物调节到每微升103个菌落-形成单位。将100μl悬浮液加到300μl肝素化人血液中并用end-over-end旋转在37℃下孵育反应混合物3h。连续稀释孵育前和孵育后等分试样并将其涂THY琼脂板并整夜培养。对于每种菌株,计算用人血孵育3h之前和之后的菌落-形成单位的比。每个实验一式三份地进行3次。
上皮细胞粘附和内化测定
基本上如以前描述的(Caparon等人,1991;Rubens等人,1992)测定GBS对上皮细胞的粘附和对上皮细胞的内化。简言之,将A549细胞以约4×105个细胞/孔转移到24孔组织培养板中并在补加10%胎牛血清的RPMI(Gibco BRL)组织培养基中过夜培养。用1ml新鲜培养基替换该培养基后,将细胞用5×106链球菌/孔感染细胞并在37℃孵育2h。用PBS洗涤3次除去未粘附的细菌。在粘附测定中,通过加入胰蛋白酶/EDTA使上皮细胞与孔分开,并加入300μl蒸馏水裂解。通过将裂解物的连续稀释液涂THY琼脂板定量粘附的细菌。对于内化测定,感染2小时后,将上皮细胞在补加青霉素G(10U)和链霉素(0.01mg)的组织培养基中再孵育2小时以杀死胞外细菌。用PBS洗涤3次后,通过加入胰蛋白酶/EDTA使上皮细胞分离并在300μl蒸馏水中裂解。通过将裂解物的连续稀释液涂THY琼脂板定量胞内细菌的量。每个实验一式三份地重复至少3次。
在竞争性研究中,将含有50μg纯化的融合蛋白或1μg血纤蛋白原的1ml新鲜组织培养基加到A549细胞并随后,用GBS 6313感染细胞。
蛋白质-包被的胶乳珠与A549细胞的相互作用
将约108个胶乳珠(直径3μm,Sigma)在PBS中洗涤3次并用300μg融合蛋白或BSA的500μl PBS溶液在4℃包被过夜。包被的珠子在PBS中洗涤1次然后用200μl 10mg/ml BSA的PBS溶液室温下封闭1h。将珠子在PBS中洗涤2次并在RPMI+10%FCS中洗涤1次,然后重悬在1ml RPMI+10%FCS中。将300μl珠子加到24-孔板中的约4×105个A549细胞。细胞在37℃(5%CO2)孵育1h,用PBS洗涤5次,并在含有3%戊二醛和5%甲醛的二甲胂酸盐缓冲液中冰上固定45分钟。用二甲胂酸盐缓冲液洗涤样品,在丙酮梯度中脱水并用CO2临界点干燥。然后用10nm厚的金膜包被样品,并通过如以前描述的通过扫描电子显微术检查(Reinscheid等人,2001)。
生物素化肽的合成
使用标准F-moc化学在Rink酰胺树脂(PepChem,Tübingen,德国)上使用SyroII合成仪(Multisyntech,Witten,德国)小规模合成肽。序列装配后,用Fmoc-ε-氨基己酸(作为接头)和生物素(Sigma,St.Louis,MO;像正常氨基酸一样活化)延长肽。用93%TFA、5%三乙基硅烷和2%水在1小时内从树脂切除肽。在真空干燥肽并从乙腈/水(1∶1)冰冻干燥3次。通过质谱在Reflex III MALDI-TOF(Bruker,Bremen德国)上验证正确质量的存在。肽不进一步纯化而直接使用。
酶联免疫测定法(ELISA)
根据生产商的使用说明书,在链霉抗生物素蛋白ELISA板(EXICON)上以10μg/ml浓度包被生物素-标记的肽。以200倍和1000倍两种稀释液检验血清。
根据生产商的推荐(稀释:1000倍)使用高度特异的辣根过氧化物酶(HRP)-缀合的抗-人IgG或抗人-IgA第二抗体(Southern Biotech)。通过基于自动化ELISA读出器(TECAN SUNRISE)中的OD405nm的读数测量底物(ABTS)向有色产物的转化来定量抗原-抗体复合体。手工包被后,通过具有嵌入式读出器(GENIOS,TECAN)的Gemini 160 ELISA机器人(TECAN)处理并分析肽板。
实施例2:通过信号肽标记筛选鉴定新的无乳链球菌粘附
结果
在结合实验中检验了属于血清型III的GBS菌株6313与放射标记的人玻连蛋白、层粘连蛋白、纤连蛋白、血纤蛋白原和IgG的相互作用。菌株6313在其表面积累了约50%总血纤蛋白原。在检验的其他蛋白中,没有一种以显著量(>5%)与GBS 6313相互作用。用胰蛋白酶或链霉蛋白酶处理细菌将结合的血纤蛋白原的量减少到低于5%的水平,表明GBS 6313的血纤蛋白原-结合结构的蛋白质性质(proteinaciousnature)。
通过菌落印迹筛选GBS 6313的大肠杆菌粘粒基因文库以确定血纤蛋白原结合大肠杆菌菌落的存在,鉴定了一个克隆,其揭示了与人血纤蛋白原的强烈相互作用。用Sau3A对其粘粒的部分消化和质粒pTEX5236中2-3kb的片段的亚克隆导致质粒pTEXfbsA的分离,质粒pTEXfbsA携带一个2.6kb插入片段,其赋予对大肠杆菌DH5α的血纤蛋白原结合。对pTEXfbsA的插入片段测序,所得序列的分析鉴定了1329bp的一个可读框,其命名为fbsA,因为其编码来自无乳链球菌的血纤蛋白原结合蛋白(图1)。fbsA基因在前面为典型的核糖体结合位点(AGGAGA),并且后面为类似转录终止子的序列(ΔG°=-18kcal/mol)。fbsA-编码区的分析揭示了链球菌的一种位于表面的蛋白的推导的FbsA蛋白的典型特征(图1),即其N-末端的35个氨基酸的信号肽序列(Nielsen等人,1997)和其C-末端的细胞壁锚定基序(LPKTG)(Schneewind等人,1993)。该fbsA基因编码442个氨基酸的最初翻译产物(Mr 51319),其一般认为被翻译后处理产生378个氨基酸的成熟蛋白(Mr 44260)。FbsA的最显著的特点是其高度重复的性质:FbsA携带16个氨基酸的19个完全重复,这些重复几乎相同。这19个重复的14个由序列基序‘GNVLERRQRDAENRSQ’组成而两个重复(3和10)携带R14K取代并且3个重复(2、9和19)具有A11V和R14K取代。
实施属于血清型Ia、Ib、II、III、IV和V的临床GBS分离物的DNA印迹实验以分析GBS中fbsA的存在。通过DNA印迹分析,在27个菌株的25个中检测到fbsA基因(图2),表明fbsA在GBS的不同血清型中的广泛分布。有趣的是,在DNA印迹分析中fbsA基因的大小在单个菌株中变化很大。为了解开该大小变化的分子基础,通过PCR从GBS菌株706S2(血清型Ia)、33H1A(血清型Ib)、O176H4A(血清型II)、SS1169(血清型V)、和O90R(来自血清型Ia菌株的荚膜突变株)扩增fbsA基因并测序。所得序列的分析揭示了每种PCR产物中的一个可读框,其与来自GBS菌株6313的fbsA具有高度同一性(图3-7)。对所推导的FbsA蛋白的分析在它们全体中鉴定了在它们的N-末端的一个推定的信号肽和它们的C-末端的一个推定的细胞壁锚。如从DNA印迹实验所预期的,单个蛋白的大小显著不同。fbsA的最初翻译产物对于菌株706S2是410个氨基酸(图3),对于菌株33H1A是346个氨基酸(图4),对于菌株176H4A是186个氨基酸(图5),对于菌株O90R是298个氨基酸(图6),对于菌株SS1169是618个氨基酸(图7)。如图8中所示,由于单个蛋白内不同数目的重复,单个FbsA蛋白之间的不同大小是唯一的。图8还表明,所推导的FbsA蛋白的个别重复揭示了它们的氨基酸组成中的差异。从而,来自不同GBS菌株的fbsA基因似乎在单个重复-编码单元的数目和组成中的灵活性是高度可变的。
实施例3:FbsA是无乳链球菌的血纤蛋白原受体
结果
对于FbsA的功能分析,合成了截短的FbsA多肽(FbsA-19),其没有信号肽和跨膜区,该多肽作为大肠杆菌BL21中的六-组氨酰融合蛋白,并通过亲和层析纯化。在蛋白质印迹实验中,FbsA-19揭示了与人血纤蛋白原的结合(图9),证明了FbsA作为来自GBS的血纤蛋白原受体。为了定位FbsA蛋白中的血纤蛋白原结合区,合成了FbsA的N-末端和C-末端区作为FbsA-N和FbsA-C融合蛋白并检验血纤蛋白原结合。如图9中所示,对FbsA-N但不是对FbsA-C观察到血纤蛋白原结合,表明FbsA的N-末端重复介导血纤蛋白原结合。
在使用125I-标记的血纤蛋白原竞争性抑制实验中,检验了不同蛋白质对于干扰放射标记的血纤蛋白原与GBS的结合的能力。作为对照,检验了来自GBS的非血纤蛋白原结合表面蛋白Bsp(Reinscheid等人,2002)对血纤蛋白原与GBS的结合的抑制。如图10所示,不断增加浓度的Bsp的加入对于血纤蛋白原与GBS的结合没有影响。然而,增加浓度的纯化的FbsA-19实质上抑制125I-标记的血纤蛋白原与GBS 6131细胞的结合。为了分析,FbsA的重复数是否对血纤蛋白原结合有影响,检验了具有仅9个重复的FbsA衍生物(FbsA-9)抑制GBS对血纤蛋白原的结合的能力。有趣地,不得不使用显著更高的浓度的FbsA-9以得到如用FbsA-19所得到的对血纤蛋白原结合的相当的抑制。该发现表明增加重复数或者增加了FbsA对血纤蛋白原的亲和力和/或提供了将被FbsA结合的更大量的血纤蛋白原。
为进一步表征分子水平上FbsA与血纤蛋白原的相互作用,检验了来自FbsA的合成肽与人血纤蛋白原的相互作用。首先,我们分析了FbsA的单个重复单位(GNVLERRQRDAENRSQ)与人血纤蛋白原的相互作用的能力。在斑点印迹实验中,观察到该合成肽人血纤蛋白原的强烈相互作用,而含有等量但是不同顺序的氨基酸的随机化肽没有显示出血纤蛋白原结合(图11)。该结果表明FbsA的单个重复单元能够特异结合人血纤蛋白原。为鉴定该重复区中对于血纤蛋白原结合必需的氨基酸,我们合成了含有不同位置上单个丙氨酸取代的肽。检验这些肽与血纤蛋白原的相互作用(图11)鉴定了该重复序列的N2、V3、L4、R6和R7对于血纤蛋白原结合是必需的。此外,G1、R9和R14被丙氨酸的取代显著降低了该重复单元与人血纤蛋白原的相互作用。
实施了这16个氨基酸基序对血纤蛋白原结合的全面分析以鉴定该重复区内的推定的保守取代。因此,合成了来自序列基元‘GNVLERRQRDAENRSQ’的合成肽,并将其直接点到膜上。由于单个氨基酸取代使得每种肽彼此不同。这样,该重复内的每个氨基酸被20中蛋白质氨基酸之一连续代替。单个点与血纤蛋白原的结合的试验导致血纤蛋白原与重复单元之间相互作用的复杂图(图12)。通过任何其他氨基酸代替G1降低了该重复对血纤蛋白原的结合,尽管结合不被完全消除。N2S和N2T取代不影响血纤蛋白原结合,虽然通过任何其他氨基酸代替N2显著降低了血纤蛋白原结合。V3和L4被其他氨基酸代替显著降低结合功能。血纤蛋白原结合不受E5A、E5M和E5Q取代的影响,但是在该位置的任何其他氨基酸导致更低的血纤蛋白原结合。R6的取代显著导致血纤蛋白原结合的损失,而具有R6A、R6K和R6W取代的肽几乎不保持结合活性。然而,R7被任何其他氨基酸取代导致血纤蛋白原结合的损失。Q8可被许多氨基酸取代而不影响结合,而R9仅可以被K或W代替才不影响结合。D10A、D10E、D10N和D10Q取代对血纤蛋白原结合没有影响而对于A11F、A11I、A11L、A11V和A11Y改变也是这样的。E12和N13可以被各种氨基酸代替而不影响结合。相反,仅R14K取代保留该肽的血纤蛋白原结合。最后,S15和Q16可以被各种其它氨基酸代替而无结合损失。从点膜实验的结果,可以假定下面的血纤蛋白原结合基序:G-N/S/T-V-L-A/E/M/Q-R-R-X-K/R/W-A/D/E/N/QA/F/I/L/V/Y-X-X-K/R-X-X(SEQ ID NO 222)。在来自其他生物的血纤蛋白原结合蛋白中不能鉴定该共有基序,表明其代表新的类型的血纤蛋白原结合位点。
根据点膜分析的结果,检验了两种不同合成肽抑制GBS的血纤蛋白原结合的能力。一种肽(pep_FbsA)代表最初的重复单位序列‘GNVLERRQRDAENRSQ’(SEQ ID No.113),而另一种肽(pep_R6A)携带R6A取代。在点膜分析中,后一肽已揭示了对血纤蛋白原的结合的显著降低。在竞争性抑制实验中,试验了两种肽对放射标记的血纤蛋白原与GBS结合的抑制(图13)。浓度为160μM的pep_FbsA抑制血纤蛋白原结合的80%,而相同浓度的pep_R6A仅导致血纤蛋白原结合的20%抑制。这些发现表明可溶形式的FbsA重复单元能够结合血纤蛋白原。此外,两种肽之间血纤蛋白原结合的抑制中的差异证实了点膜分析的结果,并表明R6在血纤蛋白原结合中起重要作用。
为了分析FbsA对GBS的血纤蛋白原结合的贡献,分别在GBS菌株6313、760S2和O90R中构建了fbsA缺失突变体。DNA印迹分析揭示了各自菌株中fbsA的成功缺失(数据未显示),这些菌株因此被称为6313ΔfbsA、706 S2ΔfbsA、和O90RΔfbsA。随后检验了突变株和亲本菌株对可溶的和被固定的血纤蛋白原的结合。尽管GBS菌株6313、760S2和O90R表现出对125I-标记的可溶血纤蛋白原的约50%、8%,和12%的结合,但是它们的各自fbsA突变体结合小于2%。类似地,在使用FITC-标记的细菌的结合实验中,来自GBS菌株6313、760S2和O90R的总细菌的约45%、15%和24%结合到被固定的血纤蛋白原,但是小于2%的各自fbsA突变体与被固定的血纤蛋白原相互作用。从这些结果可以推断FbsA分别是GBS菌株6313、760S2和O90R中的主要的血纤蛋白原结合蛋白,并且其介导细菌对可溶的和固定化的血纤蛋白原的结合。
实施例4:FbsA有助于上皮细胞的粘附和侵染并抑制调理吞噬作用
结果
为了分析FbsA对于保护GBS免受调理吞噬作用的影响的重要性,检验了GBS菌株6313和6313ΔfbsA在常规杀细菌测定法中在人全血中的存活。将肝素化人血与两种菌株之一的100±30菌落形成单位(cfu)孵育后,两种菌株都显示生长,然而,3小时的孵育后,菌株6313生长到2500±500cfu/测定,而菌株6313ΔfbsA仅生长到800±100cfu/测定。该发现表明FbsA在防止调理作用中的作用。
还检验了GBS菌株6313、760 S2和O90R和它们各自的fbsA缺失突变株粘附和侵染人肺上皮细胞系A549的能力。如图14A中所示,fbsA缺失突变株与它们的亲本菌株相比对A549细胞的粘附被严重削弱。类似地,fbsA缺失突变体侵染A549细胞的能力也显著降低(图14B)。为了更详细地分析该影响,定量了在1μg/ml外在加入的血纤蛋白原存在下GBS 6313粘附并侵染A549细胞的能力。血纤蛋白原的加入导致GBS 6313粘附和侵染A549细胞降低了90%。一并考虑,这些发现表明在GBS中,FbsA对血纤蛋白原的结合在细菌粘附和侵染人上皮细胞中起着重要的作用。
实施例5:FbsA在人中是高度免疫原性的
结果
分析了来自患者的5种血清是否存在针对5种肽(野生型<1>:GNVLERRQRDAENRSQ(SEQ ID No.113)、丙氨酸突变肽:<2>GAVLERRQRDAENRSQ(SEQ ID No.207)、<3>GNALERRQRDAENRSQ(SEQID No.209)、<4>GNVLEARQRDAENRSQ(SEQ ID No.211)、<5>GNVLERAQRDAENRSQ(SEQ ID No.212);见图11)的抗体。除了重复区的野生型序列,还选择了具有丙氨酸取代的4种肽,其没有血纤蛋白原结合活性。试图消除肽的血纤蛋白原结合活性以评估血纤蛋白原是否干扰结合抗体。用N-末端生物素-标记合成所有肽,并将其用作链霉抗生物素蛋白-包被的ELISA板上的包被试剂。
用Gemini 160 ELISA机器人实施ELISA分析。为具有所有5种肽的所指出的血清提供了IgA和IgG抗体水平(图15)。在用于该分析所选的5种血清中,主要地,一种表现出与所分析的肽的非常高的反应性。比较野生型和突变的肽,突变肽2、3和4表现出与IgA和IgG抗体的类似反应性,而野生型肽和肽5较少被所有血清良好地识别。对于野生型肽,这可通过在人血清中存在血纤蛋白原,其与抗体竞争结合该肽,来解释。肽5中的突变可能已经改变了抗体的结合,并因此降低了反应性。有趣的是,肽与IgA抗体的反应性非常高而与IgG的较不显著,表明人体中抗体应答主要包括IgA抗体的产生,该IgA抗体对于定居的防止特别重要。这些数据明显指出感染期间FbsA蛋白被体内表达并且其对于人抗体是表面可接近的。
实施例6:通过信号肽标记筛选鉴定额外的无乳链球菌粘附
结果
为了鉴定来自GBS的其他粘附素和侵染素,通过超身处理将来自GBS 6313的染色体DNA片段化,通过Klenow聚合酶处理补平所得片段,随后将其连接到质粒pHRM 104中并转化到大肠杆菌CC118中。在含有X-磷酸盐(X-phosphate)的LB-板上筛选后,四个菌落被宽的蓝色晕圈包围。分离这些克隆的质粒并对它们的插入片段测序。所得序列的分析鉴定了4个不完全的可读框,每个以信号肽-编码序列开始。由于这些基因代表来自B族链球菌的潜在粘附素,所以它们分别被命名为pabA、pabB、pabC、和pabD。通过PCR从4个不完全基因扩增地高辛-标记的探针。DNA探针用于筛选大肠杆菌中的GBS 6313粘粒基因库,导致鉴定了一个杂交pabA和pabB探针两者的大肠杆菌克隆和与pabC和pabD探针都杂交的一个大肠杆菌克隆。从这些克隆分离粘粒DNA,并测序确定基因pabA-D的全部序列。所得序列信息的分析揭示pabA基因位于pabB基因的前面(图16),而pabC基因在pabD基因的前面(图17)。基因pabA、pabB、pabC、和pabD分别编码901aa、674aa、643aa和182aa的蛋白质。通过Nielsen等人(1997)的方法,可以分别为蛋白质PabA、PabB、PabC、和PabD预测32aa、29aa、26aa和23aa的假定的信号肽(图16和17)。此外,蛋白质PabA和PabB在它们的C-末端分别携带序列IPMTG和IPQTG,其揭示与革兰氏-阳性细菌的细胞壁锚定基序的高度同一性。通过DNA印迹分析,在35种所测试的临床GBS分离物的90-95%中检测到基因pabA-D,表明GBS中这些基因的广泛分布。
实施例7:PabA-D有助于GBS对人上皮细胞的粘附和侵染
结果
为了分析四种蛋白对GBS对上皮细胞的粘附的重要性,在大肠杆菌表达载体pET28a中克隆了基因pabA和pabB,它们缺少它们的信号肽编码序列和细胞壁锚定基序,将六-组氨酰标记置于PabA和PabB融合蛋白的C-末端。平行地,在pET28a中克隆了没有信号肽编码序列的基因pabC和pabD,导致C-末端his-标记的融合蛋白PabC和PabD的合成。在大肠杆菌DH5a中构建质粒后,将构建体转化到大肠杆菌BL21(DE)中,并通过加入IPTG诱导融合蛋白的合成。随后通过Ni2+亲和层析纯化不同的融合蛋白。通过阳离子交换层析进一步纯化蛋白质PabA、PabB和PabC,并通过阴离子交换层析将PabD蛋白纯化到均一。将纯化的蛋白质包被到胶乳珠上并使胶乳珠与人肺上皮细胞系A549相互作用。作为对照,牛血清白蛋白(BSA)包被的胶乳珠也被容许结合A549细胞。如图18中所示,BSA包被的胶乳珠没有揭示与肺上皮细胞的相互作用,而用蛋白质PabA、PabB、PabC或PabD包被的胶乳珠揭示了对A549细胞的显著结合。该发现表明蛋白质PabA、PabB、PabC和PabD介导细菌与宿主细胞的结合。在竞争性实验中,在纯化的PabA、PabB、PabC或PabD融合蛋白的缺少和存在下定量GBS 6313对A549细胞的粘附和该细菌对该细胞系的侵染。如图19中所示,PabA、PabC和PabD的加入显著降低了GBS 6313粘附和侵染A549细胞的能力。令人惊奇地,PabB的加入增加了GBS 6313对A549细胞的粘附和侵染。该观察再次支持PabA、PabB、PabC和PabD是GBS的粘附素这一想法。
为了进一步分析该影响,将基因pabA和pabB分别在GBS 6313的染色体中缺失。测试所得突变体对上皮细胞的粘附和侵染。与亲本GBS菌株6313相比,两种突变体都揭示了它们粘附和侵染A459细胞中约50%的降低(图20)。
一起考虑,这些数据表明蛋白质PabA、PabB、PabC和PabD分别在GBS对上皮细胞的粘附和侵染中起作用。
为了检验蛋白质PabA、PabB和PabD是否在小鼠中引起免疫应答,将纯化的PabA、PabB和PabD融合蛋白用于小鼠的皮下免疫。3周后对小鼠强化免疫并在第一次免疫后6周收集血清。将PabA、PabB和PabD融合蛋白的连续稀释液印迹到硝酸纤维素上,并用针对不同蛋白的小鼠血清检测。如图21中所描绘的,融合蛋白PabA、PabB和PabD被它们各自的抗血清灵敏地检测到,表明三种蛋白在小鼠中的高免疫原性。
实施例8:实验方法II
细菌菌株、上皮细胞和生长调节
细胞系A549(ATCC CCL-185)和HEL299(ATCC CCL-137)来自美国典型培养物保藏中心。A549是人肺癌细胞,其具有I型alveolarpneumocyte的许多特征。HEL299是人成纤维细胞系。A549和HEL299细胞在补加10%胎牛血清的RPMI或DMEM组织培养基(都来自GibcoBRL)中增殖。在湿润空气中37℃下以5%CO2孵育组织培养物。
无乳链球菌中fbsA缺失突变体的构建
根据以前描述的方法(Schubert等人,2002)在无乳链球菌O176H4A中缺失fbsA基因。简言之,通过电穿孔将热敏感质粒pG+ΔfbsA转化到无乳链球菌菌株,并通过在红霉素琼脂上30℃生长选择转化体。通过如所描述的(Maguin等人,1996)在39℃用红霉素选择生长转化体来选择其中pG+ΔfbsA已经整合到染色体的转化体。整合菌株在没有红霉素选择的液体培养基中30℃下连续传代5天以促进质粒pG+ΔfbsA的切除,剩下染色体中所希望的fbsA缺失。将连续传代的培养物的稀释液涂琼脂板,并检验单个菌落的红霉素敏感性以鉴定pG+ΔfbsA切除体。如以前描述的(Schubert等人,2002),用HindIII消化后,用地高辛标记的fbsA侧翼片段通过DNA印迹检验红霉素敏感的无乳链球菌切除体的染色体DNA。
六组氨酰-标记的融合蛋白的制备
蛋白质FbsA-19代表来自无乳链球菌6313的全长FbsA蛋白,并由其N-末端的16个氨基酸单位的19个重复组成,而蛋白质FbsA-N含有FbsA-19的19个N-末端重复,但是在其C-末端被截短(Schubert等人,2002)。Bsp蛋白是无乳链球菌的表面蛋白,其在该细菌的形态发生中起作用(Reinscheid等人,2002),并且作为本研究的对照。培养物的光密度达到1.0后通过加入1mM IPTG在重组大肠杆菌BL21中合成融合蛋白。使用French Press cell破坏细胞并根据Qiagen的使用说明书用Ni2+亲和层析进行融合蛋白的纯化。
粘附和侵染测定
基本如实施例1中对于A549细胞所描述,测定无乳链球菌对A549和HEL299细胞的粘附和向这些细胞中的内化。在一些实验中,将A549细胞与不同量的FbsA蛋白或者FbsA-衍生肽在RPMI培养基中预孵育30分钟,并随后用PBS洗涤3次。
FbsA-包被的胶乳珠的扫描电子显微术
用25mM 2-N-吗啉代乙磺酸(MES),pH 6.8中洗涤约1×109胶乳珠(3μm直径,Sigma)三次。将一半重悬在含有500μg/ml FbsA融合蛋白的1.0ml MES缓冲液中,另一半重悬在1.0ml MES缓冲液中。胶乳珠在4℃end-over-end旋转下过夜孵育。离心沉淀胶乳珠后,用Bradford蛋白质测定试剂盒(BioRad)确定上清液中剩余蛋白质的量。将胶乳珠用MES缓冲液洗涤1次,并在室温下用MES缓冲液中的10mg/ml BSA封闭1h。胶乳珠用MES缓冲液洗涤2次,用RPMI+10%FCS洗涤一次,并重悬在RPMI+10%FCS中。将汇合的A549细胞在24-孔板中以2×108个胶乳珠/孔接种,总体积1.0ml。胶乳珠单层混合物在5%CO2空气中37℃下孵育2h。将细胞用PBS洗涤5次并用0.1%二甲胂酸盐中的3%多聚甲醛和4%戊二醛固定用于扫描电子显微术。用Zeiss DSM 962显微镜实施扫描电子显微术。
实施例9:不同无乳链球菌菌株对血纤蛋白原的结合需要fbsA基因和蛋白
结果
在血清型III无乳链球菌菌株6313中,表明FbsA蛋白对于该菌株的血纤蛋白原结合是必需的(实施例3)。无乳链球菌菌株6313、706S2(血清型Ia)和荚膜突变株O90R中fbsA基因已经被缺失(实施例3)。为了进一步检验FbsA对于不同血清型的无乳链球菌菌株的血纤蛋白原结合的重要性,在无乳链球菌菌株O176 H4A(血清型II)和SS 1169(血清型V)的基因组中缺失fbsA基因。通过DNA印迹分析证实了上述菌株的基因组中fbsA的成功缺失(数据未显示),并根据它们最初的菌株以后缀ΔfbsA命名各自突变株。随后通过蛋白质印迹分析研究不同无乳链球菌中fbsA基因对血纤蛋白原结合蛋白合成的重要性。将等量的无乳链球菌菌株6313、O90R、706S2、O176H4A和SS1169和它们的各自fbsA缺失突变体的培养上清液通过SDS-PAGE分离,印迹到硝酸纤维素上并随后检验血纤蛋白原-结合蛋白的存在。如图22中所描绘的,无乳链球菌菌株6313和706 S2揭示了它们的培养上清液中存在大量血纤蛋白原结合蛋白,而无乳链球菌菌株O90R、O176H4A和SS1169仅显示在它们的培养上清液中仅存在少量血纤蛋白原结合蛋白。而且不同菌株之间血纤蛋白原结合蛋白的大小变化显著。然而,FbsA是一种高度重复的蛋白,在不同无乳链球菌菌株中具有不同数目的重复单元。所用的无乳链球菌菌株已经被选择用于进一步研究,因为它们揭示了在它们的fbsA基因中重复单元的数目的显著不同。根据不同菌株的fbsA基因序列,对于无乳链球菌菌株6313、O90R、706S2、O176H4A和SS1169,预测FbsA蛋白的分子量分别为51kDa、34kDa、47kDa、20kDa、和71kDa。这些菌株的培养上清液中血纤蛋白原结合蛋白的所观察的大小与所预测的不同菌株中FbsA蛋白的大小良好地对应(图22)。在不同fbsA缺失突变体的培养上清液中,没有检测到血纤蛋白原结合蛋白。这表明来自不同菌株的培养上清液中所观察的血纤蛋白原结合蛋白代表FbsA蛋白,并且FbsA是所有测试的菌株中培养上清液中的主要血纤蛋白原结合蛋白。
检验了不同无乳链球菌菌株和它们的fbsA突变体对它们表面上的125I-标记的血纤蛋白原的结合。无乳链球菌6313揭示了放射标记的血纤蛋白原的显著结合。然而,菌株O90R和706S2表现出人血纤蛋白原的中等结合,菌株O176H4A和SS1169表现出弱结合。不同菌株的血纤蛋白原结合中的差异不与这些菌株中FbsA蛋白中血纤蛋白原结合重复的数目相关。然而,在fbsA缺失突变体中,血纤蛋白原结合被减少到1%到3%的数值。类似地,在使用FITC-标记的细菌的结合实验中,菌株6313、O90R、706S2、O176H4A和SS1 169的总细菌的约45%、18%、14%、4%和7%结合到固定的血纤蛋白原,而2%以下的各自fbsA突变体结合到固定的血纤蛋白原(图23)。这些结果进一步表明FbsA是所分析的无乳链球菌菌株中主要的血纤蛋白原结合蛋白,并且其介导细菌对可溶的和固定的血纤蛋白原的结合。
实施例10:无乳链球菌有效粘附和内化到人细胞需要fbsA基因和蛋白质
结果
检验了无乳链球菌菌株6313、O90R、706S2、O176H4A和SS1169和它们的等基因fbsA突变体粘附和侵染人肺上皮细胞系A549的能力。如图24中所示,无乳链球菌菌株6313大量结合和侵染A549细胞,而菌株O90R、706S2和SS1 169中等地粘附和内化到A549细胞。相反,无乳链球菌菌株O176H4A以非常的数目粘附和侵染A549细胞。不考虑各种菌株粘附和侵染A549细胞的最初差异,不同菌株中fbsA基因的缺失将不同菌株间粘附和侵染A549细胞降低到非常低但是类似的数值。仅在已经表现出几乎不内化到A549细胞的菌株O176H4A中,fbsA基因的缺失不降低该细菌向A549细胞的内化。这些发现表明fbsA基因对于无乳链球菌粘附和内化到人上皮细胞的重要作用。为了评估fbsA基因对无乳链球菌结合到不同细胞系的作用,我们用人成纤维细胞系HEL299分析了无乳链球菌6313和其fbsA缺失突变体的粘附和内化。如图25所示,菌株6313ΔfbsA对HEL299细胞的结合和该细菌向该细胞系的内化降低了约90%。这些数据表明,fbsA基因对于无乳链球菌粘附和内化到不同人细胞中具有普遍的重要性。
为评估FbsA蛋白在细菌粘附和内化中的角色,评估了用FbsA-19融合蛋白预处理真核细胞对无乳链球菌6313粘附和侵染的影响。蛋白FbsA-19代表来自菌株6313并携带19个重复单元的FbsA蛋白。如图26所示,用增加量的FbsA-19蛋白预处理A549细胞基本上抑制了无乳链球菌6313对该细胞系的粘附和侵染。应注意的是,我们还发现了细菌粘附的降低和HEL299细胞侵染之间的相关性。
前面知道FbsA蛋白结合血纤蛋白原(实施例3)。我们因此检验了无乳链球菌6313与血纤蛋白原预孵育对A549细胞的细菌粘附和侵染的影响。我们观察到通过用0.1μg/ml到1.0μg/ml血纤蛋白原预孵育无乳链球菌6313对A549细胞的细菌粘附和侵染依赖剂量的抑制(数据未显示)。然而,细菌的显微观察揭示了使用增加量的血纤蛋白原导致的细菌集块。因此,通过血纤蛋白原对细菌粘附和侵染的所观察到的抑制可规因于由于FbsA蛋白中一些血纤蛋白原结合位点导致的细菌表面上FbsA蛋白的封闭或者细菌的凝聚。我们还检验了纤连蛋白对无乳链球菌6313的粘附和侵染的影响,然而,甚至10μg/ml纤连蛋白也不对细菌的粘附和内化产生抑制作用(数据未显示)。
实施例11:FbsA-包被的胶乳珠粘附到A549细胞
结果
前面的实验已经指出了FbsA在无乳链球菌和宿主细胞之间相互作用中的角色。为了研究是否FbsA与真核细胞的相互作用需要额外的因子,将胶乳珠用FbsA-19蛋白包被并检验它们与人A549细胞的相互作用。作为对照,还分析了BSA包被的胶乳珠与A549细胞的相互作用。通过扫描电子显微术仅发现少许BSA包被的胶乳珠结合A549细胞,而FbsA-19包被的胶乳珠大量结合A549细胞(图27)。FbsA-19包被的胶乳珠粘附血浆膜的特征在于与微绒毛接触和类似早期伪足形成的结构(图27C)。在一些情况中,伪足似乎围绕胶乳珠的表面,表明该胶乳珠被最终内化(图27D)。然而,FbsA-19包被的胶乳珠的内化相当稀少地被观察到,表明FbsA-19通常不引发无乳链球菌或者FbsA-19包被的胶乳珠被真核细胞吸收。
实施例12:基因pabC和pabD被共转录并在无乳链球菌的临床菌株中保守
结果
在图31中显示了含有pabC基因的区域的基因组构。使用RT-PCR和适于扩增四种基因的各自重叠区域的寡核苷酸,表明pabC和gbs0851(pabD)基因被转录为单一转录物,而RNA聚合酶为metK和gbs0853基因产生了独立的转录物(图28)。该结果表明pabC和gbs0851基因产物可能发挥对于无乳链球菌的相同和类似过程所需要的功能。
为了确定编码PabC和gbs0851的基因在各种血清型和GBS的临床分离物中是否保守,分离了33个不同无乳链球菌菌株的染色体DNA并进行PCR分析,用特异探针扩增完整基因。表明在所有检验的菌株中都存在这两种基因pabC和gbs0851。图29显示了作为实例对于GBS的大多数优势血清型Ia、Ib、III和V的PCR结果。从所有菌株扩增了具有相同长度的gbs0851基因,表明该序列的保守性和该基因的大小。pabC基因的PCR令人惊奇地导致依赖用于分析的菌株两种不同大小的产物,在相同血清型的菌株中也观察到大小差异。在图30中显示了来自无乳链球菌6313(血清型III)、无乳链球菌NEM316(血清型III)和无乳链球菌2003V_R(血清型V)的PabC蛋白的氨基酸序列的比较。其表明来自无乳链球菌6313和无乳链球菌NEM316的PabC蛋白是相同的,但是在来自无乳链球菌2003V_R的PabC蛋白中明显存在差异。PabC序列的分歧可完全规因于该蛋白的N-末端部分,而在所有三种血清型中C-末端部分几乎是相同的。所观察的大小的差异也与图29中的PCR结果一致。其他PCR实验证实大小的差异来自该基因的5’部分而不是3’末端部分的变化(数据未显示)。
实施例13:来自无乳链球菌的PabC结合人血纤蛋白原并且与真核细胞的侵染有关
最初的实验表明PabC结合血纤蛋白原的α-亚单位(图31A,C)。为了描绘PabC的哪个区域负责血纤蛋白原结合,将完整蛋白以及PabC的N-末端和C-末端部分表达为His-标记的融合蛋白。加入血纤蛋白原后,用针对血纤蛋白原的抗体检测结合(图31B)。该实验表明PabC的保守的C-末端部分自身缺乏血纤蛋白原结合活性,而N-末端部分足够提供与全长蛋白的程度类似的活性。
为证实蛋白质印迹结果,用相同的纯化的PabC蛋白质衍生物进行捕获ELISA测定(图32)。为此,4℃下每孔2μg血纤蛋白原包被过夜。通过基于His-标记抗体的过氧化物酶测定法定量增量浓度的PabC衍生物的结合活性。该捕获ELISA实验证实了PabC蛋白的N-末端部分含有血纤蛋白原结合区的结果。
在图19中表明相对高浓度的PabC可以抑制无乳链球菌对真核A549细胞的粘附和侵染。使用较低浓度的重组PabC蛋白,变得显然,PabC更可能促进GBS侵染而不是粘附(图33C,D)。用pabC缺失突变体也得到了证实性结果,该突变体也表现出向A549细胞的减弱的侵染(图33A,B)。这些结果表明PabC可能作为无乳链球菌的侵染素以使其定居真核细胞。
下面是此处参考的所有出版物和文献。应该理解这些参考文献的全部内容在此处被并入作为参考。
参考文献列表
Areschoug,T.,Stalhammar-Carlemalm,M.,Larsson,C.,and Lindahl,G.(1999)Group B streptococcal surface proteins as targets for protectiveantibodies:identification of two novel proteins in strains of serotype V Infect.Immun.67:6350-6357.
Baker,C.J.,Edwards,M.S.(1995)Group B streptococcal infections.InInfectious disease of the fetus and newborn infant.Remington,J.S.,Klein,J.O.(eds).W.B.Saunders Company,pp.980-1054.
Baker,C.J.,Halsey,N.A.,and Schuchat,A.(1999)1997 AAP guidelines forprevention of early-onset group B streptococcal disease Pediatrics 103:701.
Baker,C.J.,Paoletti,L.C.,Rench,M.A.,Guttormsen,H.K.,Carey,V.J.,Hickman,M.E.,and Kasper,D.L.(2000)Use of capsularpolysaccharide-tetanus toxoid conjugate vaccine for type II group Bstreptococcus in healthy women J.Infect.Dis.182:1129-1138.
Baker,C.J.,Paoletti,L.C.,Wessels,M.R.,Guttormsen,H.K.,Rench,M.A.,Hickman,M.E.,and Kasper,D.L.(1999)Safety and immunogenicity ofcapsular polysaccharide-tetanus toxoid conjugate vaccines for group Bstreptococcal types Ia and Ib J.Infect.Dis 179:142-150.
Brodeur,B.R.,Boyer,M.,Charlebois,I.,Hamel,J.,Couture,F.,Rioux,C.R.,and Martin,D.(2000)Identification of group B streptococcal Sip protein,which elicits cross-protective immunity Infect.Immun.68:5610-5618.
Capron,M.G.,Stephens,D.S.,0lsen,A.,and Scott,J.R.(1991)Role of Mprotein in adherence of group A streptococci Infect.Immun.59:1811-1817.
Carstensen,H.,Henrichsen,J.,and Jepsen,O.B.(1985)A national survey ofsevere group B streptococcal infections in neonates and young infants inDenmark,1978-83 Acta Paediatr.Scand 74:934-941.
Cheng,Q.,Carlson,B.,Pillai,S.,Eby,R.,Edwards,L.,0lmsted,S.B.,andCleary,P.(2001)Antibody against surface-bound C5a peptidase is opsonic andinitiates macrophage killing of group B streptococci Infect.Immun.69:2302-2308.
Cheung,A.L.,Krishnan,M.,Jaffe,E.A.,and Fischetti,V.A.(1991)Fibrinogen acts as a bridging molecule in the adherence of Staphylococcusaureus to cultured human endothelial cells.
Chhatwal,G.S.,Lammler,C.,and Blobel,H.(1984)Guanidine extractionenhances the binding of human fibrinogen to group-B streptococci Med.Microbiol.Immunol.173:19-27.
Chhatwal,G.S.Muller H.P.,and Blobel,H.(1983)Characterization of bindingof human alpha 2-macroglobulin to group G streptococci Infecf.Immun.41:9590964.
Courtney,H.S.,Liu,S.,Dale,J.B.,and Hasty,D.L.(1997)Conversion of Mserotype 24 of Streptococcus pyogenes to M serotypes 5 and 18:effect onresistance to phagocytosis and adhesion to host cells Infect.Immun.65:2472-2474.
Dubendorff,J.W.,Studier F.W.(1991)Controlling basal expression in aninducible T7 expression system by blocking the target T7 promoter with lacrepressor.J.Mol.Biol.219:45-59.
Edwards M.S.,Buffone,G.J.,Fuselier,P.A.,Weeks,J.L.,and Baker,C.J.(1983)Deficient classical complement pathway activity in newborn seraPediatr.Res.17:685-688.
Farley,M.M.,Harvey,R.C.,Stull,J.D.,Schuchat,A.,Wenger,J.D.,andStephens,D.S.(1993)A population-based assessment of invasive disease dueto group B streptococcus in nonpregnant adults N.Engl.J.Med.328:1807-1811.
Faxelius,G.,Bremme,K.,Kvist-Christensen,K.,Christensen,P.,and Ringertz,S.(1988)Neonatal septicemia due to group B streptococci-perinatal riskfactors and outcome of subsequent pregnancies J.Perinat,Med,16:423-430.
Fischetti,V.A.,(1989)Streptococcal M protein:molecular design andbiological behavior Clin Microbiol.Rev.2:285-314.
Frank,R.,Overwin,H.(1996)SPOT synthesis.Epitope analysis with arrays ofsynthetic peptides prepared on cellulose membranes Methods Mol.Biol.66:149-169.
Fuss,C.,Palmaz,J.C.,and Sprague,E.A.(2001)Fibrinogen:structure,function,and surface interactions J.Vasc.Interv.Radiol.12:677-682.
Gibson,R.L.,Lee,M.K.,Soderland,C.,Chi,E.Y.,and Rubens,C.E.(1993)Group B streptococci invade endothelial cells:type III capsularpolysaccharide attenuates invasion Infect.Immun.61:478-485.
Hanahan,D.(1985)Studies on transformation of Escherichia coli withplasmids J.Mol.Biol.166:557-580.
Hunter,W.H.,Greenwood,F.C.(1962)Preparation of iodine-131 labelledhuman growth hormone of high specific activity Nature 194:495-496.
Korzeniowska-Kowal,A.,Witkowska,D.,and Gamian,A.(2001)Molecularmimicry of bacterial polysaccharides and their role in etiology of infectiousand autoimmune diseases Postepy Hig.Med.Dosw.55:211-232.
La Penta,D.,Framson,P.,Nizet,V.,and Rubens,C.(1997)Epithelial cellinvasion by group B streptococci is important to virulence Adv.Exp.Med.Biol.418:631-634.
Lammler,C.,Chhatwal,G.S.,and Blobel,H.(1983)Binding of humanfibrinogen and its polypeptide chains to group B streptococci Med.Microbiol.Immunol.172:149-153.
Larsson,C.,Stalhammar-Carlemalm,M.,and Lindahl,G.(1999)Protectionagainst experimental infection with group B streptoccus by immunoizationwith a bivalent protein vaccine Vaccine 17:454-458.
Madoff,L.C.,Michel,J.L.,Gong,E.W.,Rodewald,A.K.,and Kasperk,D.L.,(1992)Protection of neonatal mice from group B streptoccal infection bymateranl immunizaition with beta C protein Infect.Immun.60:4989-4994.
Maguin,E.,Prevost,H.,Ehrlich,S.,and Gruss,A.,(1996)Efficient insertionalmutagenesis in lactococci and other gram-positive bacteria J.Bacteriol,178:931-935.
Manoil,C.,Beckwith,J.(1985)TnphoA:a transposon probe for proteinexport signals Proc.Natl.Acad.Sci.U.S.A 82:8129-8133.
Meehan,M.,Nowlan,P.,and Owen,P.(1998)Affinity purification andcharacterization of a fibrinogen-binding protein complex which protects miceagainst lethal challenge with Streptococcus equi subsp.equi Microbiology 144:993-1003.
Mills,E.L.,Bjorksten,B.,and Quie,P.G.(1979)Deficient alternativecomplement pathway activity in newborn sera Pediatr.Res.13:1341-1344.
Mosesson,M.W.,Siebenlist,K.R.,and Meh,D.A.(2001)The structure andbiological features of fibrinogen and fibrin Ann.N.Y.Acad.Sci.936:11-30.
Ni,E.D.,Perkins,S.,Francois,P.,Vaudaux,P.,Hook,M.,and Foster,T.J.(1998)Clumping factor B(ClfB),a new surface-located fibrinogen-bindingadhesin of Staphylococcus aureus Mol.Microbiol.30:245-257.
Noel,G.J.,Katz,S.L.,and Edelson,P.J.(1991)The role of C3 in mediatingbinding and ingestion of group B streptococcus serotype III by murinemacrophages Pediatr.Res.30:118-123.
Paoletti,L.C.,Kasper,D.L.(2002)Conjugate vaccines against group Bstreptococcus types IV and VII J.Infect.Dis.186:123-126.
Paoletti,L.C.,Pinel,J.,Johnson,K.D.,Reinap,B.,Ross,R.A.,andKasper,D.L.(1999)Synthesis and preclinical evaluation of glycoconjugatevaccines against group B streptococcus types VI and VIII J.Infect.Dis.180:892-895.
Pearce,B.J.,Yin,Y.B.,and Masure,H.R.(1993)Genetic identification ofexported proteins in Streptococcus pneumoniae Mol.Microbiol.9:1037-1050.
Pei,L.,Flock,J.I.(2001)Functional study of antibodies against afibrogenin-binding protein in Staphylococcus epidermidis adherence topolyethylene catheters.
Podbielski,A.,Woischnik,M.,Leonard,B.A.,and Schmidt,K.H.(1999)Characterization of nra,a global negative regulator gene in group Astreptococci Mol.Microbiol.31:1051-1064.
Pospiech,A.,and Neumann,B.(1995)A versatile quick-prep of genomicDNA from Gram-positive bacteria.Trends Genet 11:217-218.
Reinscheid,D.J.,Gottschalk,B.,Schubert,A.,Eikmanns,B.J.,andChhatwal,G.S.(2001)Identification and molecular analysis of PcsB,a proteinrequired for cell wall separation of group B streptococcus J.Bacteriol.183:1175-1183.
Reinscheid,D.J.,Stoesser,C.,Moeller,K.,Ehlert,K.,Jack,R.W.,Eikmanns,B.E.,and Chhatwal,G.S.(2002)The influence of proteins Bspand FemH on cell shape and peptidoglycan composition in group Bstreptococcus Microbiol.148:3245-3254.
Ringdahl,U.,Svensson,H.G.,Kotarsky,H.,Gustafsson,M.,Weineisen,M.,and sjobring,U.(2000)A role for the fibrinogen-binding regions ofstreptococcal M proteins in phagocytosis resistance Mol.Microbiol.37:1318-1326.
Rubens,C.E.,Smith,S.,Hulse,M.,Chi,E.Y.,and van Belle,G.(1992)Respiratory epithelial cell invasion by group B streptococci Infect.Immun.60:5157-5163.
Rubens,C.E.,Wessels,M.R.,Heggen,L.M.,and Kasper,D.L.(1987)Transposon mutagenesis of type III group B streptococcus:correlation ofcapsule expression with virulence Proc.Natl.Acad.Sci.U.S.A.84:7208-7212.
Sambrook,J.,Fritsch,E.F.,and Maniatis,J.(1989)Molecular Cloning:alaboratory Manual NY:Cold Spring Harbor.
Schneewind,O.,Mihaylova-Petkov,D.,and Model,P.(1993)Cell wal sortingtsignals in surface proteins of gram-positive bacteria EMBO J.12:4803-4811.
Schonbeck,C.,Bjorck,L.,and Kronvall,G.(1981)Receptors for fibrinogenand aggregated beta 2-microglubulin detected in strains of group Bstreptococci Infect.Immun.31:856-861.
Schubert,A.,Zakikhany,K.,Schreiner,M.,Frank,R.,Spellerberg,B.,Eikmanns,B.J.and Reinscheid,D.J.(2002)A fibrinogen receptor from groupB Streptococcus interacts with fibrinogen by repetitive units with novel ligandbinding sites.Mol.Microbiol.46:557-569.
Schuchat,A.,(1998)Epidemiology of group B streptoccal disease in theUnited States:shifting paradigms Clin Microbiol Rev.11:497-513.
Spellerberg,B.(2000)Pathogenesis of neonatal Streptococcus agalactiaeinfections Microbes.Infect.2:1733-1742.
Spellerberg,B.,Rozdzinski,E.,Martin,S.,Weber-Heynemann,J.,andLutticken,R.(2002)rgf encodes a novel two-component signal transductionsystem of Streptococcus agalactiae Infect.Immun.70:2434-2440.
Thern,A.,Wastfelt,M.,and Lindahl,G.(1998)Expression of two differentantiphagocytic M proteins by Streptococcus pyogenes of the OF+lineage J.Immunol.160:860-869.
Valentin-Weigand,P.,Chhatwal,G.S.(1995)Correlation of epithelial cellinvasiveness of group B streptococci with clinical source of isolation Microb.Pathog.19:83-91.
Vasi,J.,Frykberg,L.,Carlsson,L.E.,Lindberg,M.,and Guss,B.(2000)M-like proteins of Streptococcus dysgalactiae Infect.Immun.68:294-302.
Wessels,M.R.(1997)Biology of streptococcal capsular polysaccharides Soc.Appl.Bacteriol.Symp.Ser.26:20S-31S.
Whitnack,E.,Beachey,E.H.(1985)Degradation products of fibrinogen andfibrin prevent opsonization of group A streptococci Trans.Assoc.Am.Physicians 98:392-398.
Whitnack,E.,Dale,J.B.,and Beachey,E.H.(1984)Common protectiveantigens of group A streptococcal M proteins masked by fibrinogen J.Exp.Med.159:1201-1212.
Wibawan,I.W.,Lammler,C.(1992)Relationship between group Bstreptococcal serotypes and cell surface hydrophobicity.
Winram,S.B.,Jonas,M.,Chi,E.,and Rubens,C.E.(1998)Characterizationof group B streptococcal invasion of human chorion and amnion epithelialcells In vitro Infect.Immun.66:4932-4941.
Zangwill,K.M.,Schuchat,A.,and Wenger,J.D.(1992)Group Bstreptococcal disease in the United States,1990:report from a multistate activesurveillance system Mor Mortal.Wkly.Rep.CDC Surveill Summ.41:25-32.
本说明书中公开的本发明的特征、权利要求书和/或附图可以单独地和以它们的任何组合成为实现各种形式的本发明的材料。
Claims (36)
1.一种分离的核酸分子,其优选编码粘着因子或者其片段,其含有选自包含下面的组的核酸序列:
a)与SeqID NO 7、SeqID NO 8、SeqID NO 9或SeqID NO 10中提出的核酸序列具有至少70%同一性的核酸,
b)与a)的核酸基本上互补的核酸,
c)含有a)或b)的核酸的至少15个连续碱基的核酸,
d)在严格杂交条件下与a)、b)或c)的核酸退火的核酸,和
e)如果没有遗传密码简并性,将与a)、b)、c)或d)中定义的核酸杂交的核酸。
2.根据权利要求1的分离的核酸分子,其中同一性为至少80%,优选至少90%,更优选100%。
3.根据权利要求1或2的分离的核酸分子,其中该核酸分子编码含有至少一个重复的氨基酸基序的血纤蛋白原-结合-蛋白,所述氨基酸基序包含16个氨基酸。
4.根据权利要求3的分离的核酸分子,其中所编码的血纤蛋白原-结合-蛋白含有19个重复的氨基酸基序,其中该氨基酸基序是权利要求7和15中任一项中指定的氨基酸基序。
5.根据权利要求1或2的分离的核酸分子,其中该核酸分子编码与上皮细胞,优选人上皮细胞相互作用的粘着因子。
6.一种编码多肽的分离的核酸分子,其中所述多肽含有氨基酸基序,其中所述氨基酸基序为G-N/S/T-V-L-A/E/M/Q-R-R-X-K/R/W-A/D/E/N/Q-A/F/I/L/V/Y-X-X-K/R-X-X(SEQ ID NO 222)。
7.根据权利要求1到6任一项的核酸,其中核酸是DNA、RNA或其混合物,优选地该核酸分子从基因组DNA分离。
8.一种载体,其含有根据权利要求1到7任一项的核酸分子。
9.根据权利要求8的载体,其中该载体适于重组表达多肽,所述多肽由根据权利要求1到7任一项的核酸分子之一编码。
10.一种细胞,优选宿主细胞,其含有根据权利要求8或9的载体。
11.一种多肽,优选血纤蛋白原-结合-多肽和/或粘着因子,其含有氨基酸序列,其中该氨基酸序列由根据权利要求1到7任一项的核酸分子编码,和所述多肽的片段。
12.一种多肽,优选血纤蛋白原-结合-多肽和/或粘着因子,其含有氨基酸序列,其中该氨基酸序列选自包含Seq ID NO 17-20的组。
13.一种多肽,优选血纤蛋白原-结合-多肽和/或粘着因子,其含有氨基酸序列,其中该氨基酸序列选自包含Seq IDNO 205的组。
14.一种多肽,优选血纤蛋白原-结合-多肽和/或粘着因子,其含有氨基酸基序,其中所述多肽包含氨基酸基序,其中该氨基酸基序是G-N/S/T-V-L-A/E/M/Q-R-R-X-K/R/W-A/D/E/N/Q-A/F/I/L/V/Y-X-X-K/R-X-X(SEQ ID NO 222)。
15.一种产生根据权利要求11到14任一项的多肽或者其片段的方法,该方法包括表达根据权利要求1到7任一项的核酸分子。
16.一种产生表达根据权利要求11到14任一项的多肽或者其片段的细胞的方法,该方法包括用根据权利要求8或9的载体转化或转染适宜的宿主细胞。
17.一种药物组合物,特别是疫苗,其含有如权利要求11到14任一项中定义的多肽或其片段或者根据权利要求1到7任一项的核酸分子。
18.根据权利要求17的药物组合物,其特征在于该药物组合物含有免疫刺激物质,其中该免疫刺激物质优选选自包括聚阳离子聚合物、免疫刺激性脱氧核苷酸(ODNs)、合成的KLK肽、神经活性化合物、alumn、弗氏完全或不完全佐剂或它们的组合的组。
19.根据权利要求11到14任一项的多肽或者其片段的用途,用于生产药物,特别用于生产抵抗细菌感染的疫苗。
20.一种抗体,或至少其有效部分,其结合至少根据权利要求11-14的多肽或者其片段的选择性部分。
21.根据权利要求20的抗体,其中该抗体选自包括单克隆抗体、多克隆抗体、嵌合抗体、人源化抗体或它们每一种的片段的组。
22.根据权利要求11到14任一项的多肽或者其片段的用途,用于生产抗体。
23.根据权利要求20或21的抗体的用途,用于制备治疗或预防细菌感染,特别是无乳链球菌(Streptococcus agalactiae)感染的药物。
24.一种鉴定能够减小或者抑制根据权利要求11-14任一项的多肽或者其片段的活性或者能够结合根据权利要求11-14任一项的多肽的拮抗剂的方法,该方法包括:
a)在存在能够提供响应于候选拮抗剂与所述多肽或者其片段的结合的可检测信号的组分的情况下,将分离的或固定的根据权利要求11-14任一项的多肽或者其片段与候选拮抗剂在允许所述候选拮抗剂与所述多肽或者其片段结合的条件下接触;和
b)检测响应于该拮抗剂与该多肽或者其片段的结合产生的信号的存在或者不存在,优选存在指示能够抑制或者降低该多肽或者其片段的活性的化合物的信号。
25.一种鉴定能够减少或者抑制根据权利要求11-14任一项的多肽或者其片段的活性的拮抗剂的方法,该方法包括:
a)提供根据权利要求11到14任一项的多肽或者其片段,
b)提供相互作用配偶体,其针对根据权利要求11-14任一项的多肽,优选根据权利要求20或21的抗体,
c)提供候选拮抗剂,
d)将该多肽、该多肽的相互作用配偶体和候选拮抗剂反应,和
e)确定该候选拮抗剂是否抑制或降低该多肽的活性。
26.一种鉴定能够减少或抑制根据权利要求11到14任一项的多肽或者其片段与其相互作用配偶体的相互作用活性的拮抗剂的方法,该方法包括:
a)提供根据权利要求11到14任一项的多肽或者其片段,
b)提供相互作用配偶体,其针对所述多肽或者其片段,优选根据权利要求20或21的抗体,
c)允许所述多肽或者其片段与所述相互作用配偶体相互作用形成相互作用复合体,
d)提供候选拮抗剂,
e)允许在该候选拮抗剂和相互作用复合体之间发生竞争反应,和
f)确定该候选拮抗剂是否抑制或减少该多肽或者其片段与相互作用配偶体的相互作用活性。
27.一种拮抗剂,其由根据权利要求25或26的方法鉴定或者可由根据权利要求25或26的方法鉴定。
28.一种体外诊断细菌感染、优选无乳链球菌感染的方法,该方法包括确定根据前面权利要求任一项的核酸分子或者前面权利要求任一项的多肽的存在的步骤。
29.一种体外诊断疾病的方法,所述疾病与根据权利要求11到14任一项的多肽或者其片段的表达相关,该方法包括确定根据权利要求1到7任一项的编码所述多肽或者其片段的核酸序列的存在,或者根据权利要求11到14任一项的多肽或者其片段的存在。
30.一种亲和装置,其含有支持物质和固定到所述支持物质的根据前面权利要求任一项的多肽或者根据前面权利要求任一项的核酸分子。
31.根据前面权利要求任一项的多肽或者其片段的用途,用于分离和/或纯化和/或鉴定所述多肽或者其片段的相互作用配偶体。
32.根据前面权利要求任一项的任一多肽用于产生结合所述多肽的肽的用途。
33.根据权利要求32的用途,其中该肽选自包含anticalines的组。
34.根据前面权利要求任一项的多肽用于生产或产生功能核酸的用途,其中该功能核酸选自包含适体和spiegelmers的组。
35.根据前面权利要求任一项的多肽用作抗原的用途。
36.根据权利要求1到7任一项的核酸的用途,用于生产或产生功能核糖核酸,其中该功能核糖核酸选自包含核酶,反义核酸和siRNA的组。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP02023141 | 2002-10-15 | ||
| EP02023141.1 | 2002-10-15 | ||
| EP03006393.7 | 2003-03-20 | ||
| EP03006393 | 2003-03-20 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200380101524XA Division CN1705679B (zh) | 2002-10-15 | 2003-10-15 | 编码b族链球菌粘着因子的核酸、b族链球菌的粘着因子和它们的用途 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102174533A true CN102174533A (zh) | 2011-09-07 |
Family
ID=32109135
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200380101524XA Expired - Fee Related CN1705679B (zh) | 2002-10-15 | 2003-10-15 | 编码b族链球菌粘着因子的核酸、b族链球菌的粘着因子和它们的用途 |
| CN2011100420771A Pending CN102174533A (zh) | 2002-10-15 | 2003-10-15 | 编码b族链球菌粘着因子的核酸、b族链球菌的粘着因子和它们的用途 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200380101524XA Expired - Fee Related CN1705679B (zh) | 2002-10-15 | 2003-10-15 | 编码b族链球菌粘着因子的核酸、b族链球菌的粘着因子和它们的用途 |
Country Status (7)
| Country | Link |
|---|---|
| US (3) | US7485710B2 (zh) |
| EP (3) | EP2314604A3 (zh) |
| JP (3) | JP5116971B2 (zh) |
| CN (2) | CN1705679B (zh) |
| AU (2) | AU2003274011B2 (zh) |
| CA (1) | CA2502414A1 (zh) |
| WO (1) | WO2004035618A2 (zh) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2284182A1 (en) * | 2000-10-27 | 2011-02-16 | Novartis Vaccines and Diagnostics S.r.l. | Nucleic acids and proteins from streptococcus groups A and B |
| EP1597348A4 (en) * | 2002-08-26 | 2010-03-31 | Novartis Vaccines & Diagnostic | GENES OF STREPTOCOCCUS PRESERVED OR SPECIFIC |
| US7485710B2 (en) | 2002-10-15 | 2009-02-03 | Intercell Ag | Nucleic acids coding for adhesion factor of group B streptococcus, adhesion factors of group B streptococcus and further uses thereof |
| WO2005032582A2 (en) | 2003-07-31 | 2005-04-14 | Chiron Corporation | Immunogenic compositions for streptococcus pyogenes |
| US8945589B2 (en) * | 2003-09-15 | 2015-02-03 | Novartis Vaccines And Diagnostics, Srl | Immunogenic compositions for Streptococcus agalactiae |
| WO2005076827A2 (en) * | 2004-02-04 | 2005-08-25 | Universita' Degli Studi Di Pavia | Fbsa compositions for use in promoting fibrinogen aggregation and potentiating fibrin polymerization |
| US20060165716A1 (en) * | 2004-07-29 | 2006-07-27 | Telford John L | Immunogenic compositions for gram positive bacteria such as streptococcus agalactiae |
| WO2006042027A2 (en) * | 2004-10-08 | 2006-04-20 | Novartis Vaccines And Diagnostics Inc. | Immunogenic and therapeutic compositions for streptococcus pyogenes |
| US20090104218A1 (en) * | 2004-12-22 | 2009-04-23 | J. Craig Venter Institute | Group B Streptococcus |
| JP4682351B2 (ja) * | 2004-12-23 | 2011-05-11 | ダイムラー・アクチェンゲゼルシャフト | 車両乗員用の拘束装置 |
| US8401159B2 (en) * | 2005-11-30 | 2013-03-19 | On-Q Telecom Systems Co., Inc. | Data provision to a virtual personal assistant for handling calls in a communication system |
| PL2054431T3 (pl) * | 2006-06-09 | 2012-07-31 | Novartis Ag | Konformery adhezyn bakteryjnych |
| AU2007348285A1 (en) * | 2006-10-30 | 2008-09-12 | Novartis Ag | Immunogenic and therapeutic compositions for streptococcus pyogenes |
| EP2120984A2 (en) * | 2007-01-12 | 2009-11-25 | Intercell AG | Protective proteins of s. agalactiae, combinations thereof and methods of using the same |
| JP5653215B2 (ja) | 2007-09-12 | 2015-01-14 | ノバルティス アーゲー | Gas57変異体抗原およびgas57抗体 |
| EP2235046B1 (en) | 2007-12-21 | 2012-08-01 | Novartis AG | Mutant forms of streptolysin o |
| WO2009094391A1 (en) * | 2008-01-23 | 2009-07-30 | Xencor, Inc. | Optimized cd40 antibodies and methods of using the same |
| US10738338B2 (en) | 2016-10-18 | 2020-08-11 | The Research Foundation for the State University | Method and composition for biocatalytic protein-oligonucleotide conjugation and protein-oligonucleotide conjugate |
| CN108840914B (zh) * | 2018-08-13 | 2022-07-01 | 内蒙古民族大学 | 一种具有免疫原性的多肽、其抗体的制备方法以及用途 |
| CN111690584A (zh) * | 2020-06-16 | 2020-09-22 | 中国水产科学研究院珠江水产研究所 | 重组乳酸乳球菌和罗非鱼无乳链球菌病疫苗 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5910441A (en) * | 1996-09-16 | 1999-06-08 | The Rockefeller University | DNA encoding fibronectin and fibrinogen binding protein from group A streptococci |
| CN1344323A (zh) * | 1998-07-27 | 2002-04-10 | 微生物技术有限公司 | 来源于b组链球菌的核酸和蛋白质 |
| CN1351503A (zh) * | 1999-03-19 | 2002-05-29 | 史密丝克莱恩比彻姆生物有限公司 | 疫苗 |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| CA2084987C (en) | 1990-06-11 | 2007-02-13 | Larry Gold | Nucleic acid ligands |
| DE59109269D1 (de) | 1990-06-28 | 2005-12-15 | Hoechst Ag | Fusionsproteine mit Immunglobulinanteilen, ihre Herstellung und Verwendung |
| US5858725A (en) | 1990-10-10 | 1999-01-12 | Glaxo Wellcome Inc. | Preparation of chimaeric antibodies using the recombinant PCR strategy |
| GB9022545D0 (en) | 1990-10-17 | 1990-11-28 | Wellcome Found | Culture medium |
| GB9022547D0 (en) | 1990-10-17 | 1990-11-28 | Wellcome Found | Purified immunoglobulin |
| GB9022543D0 (en) | 1990-10-17 | 1990-11-28 | Wellcome Found | Antibody production |
| GB9122820D0 (en) | 1991-10-28 | 1991-12-11 | Wellcome Found | Stabilised antibodies |
| US6194388B1 (en) | 1994-07-15 | 2001-02-27 | The University Of Iowa Research Foundation | Immunomodulatory oligonucleotides |
| FR2735478B1 (fr) * | 1995-06-13 | 1997-08-22 | Pasteur Institut | Molecules polypeptidiques de stade pre-erythrocytaire du paludisme |
| CO4600681A1 (es) | 1996-02-24 | 1998-05-08 | Boehringer Ingelheim Pharma | Composicion farmaceutica para la modulacion inmunitaria |
| EP0934331B1 (de) | 1996-08-30 | 2002-11-27 | Jens Peter Fürste | Spiegelselektion und spiegelevolution von nucleinsäuren |
| US5849902A (en) | 1996-09-26 | 1998-12-15 | Oligos Etc. Inc. | Three component chimeric antisense oligonucleotides |
| US6958239B2 (en) | 1996-11-21 | 2005-10-25 | Oligos Etc Inc. | Three component chimeric antisense oligonucleotides |
| DE19742706B4 (de) | 1997-09-26 | 2013-07-25 | Pieris Proteolab Ag | Lipocalinmuteine |
| DE19803453A1 (de) | 1998-01-30 | 1999-08-12 | Boehringer Ingelheim Int | Vakzine |
| JP2002531054A (ja) * | 1998-07-27 | 2002-09-24 | マイクロビアル テクニクス リミティッド | B群連鎖球菌由来の核酸およびタンパク質 |
| US7098182B2 (en) * | 1998-07-27 | 2006-08-29 | Microbial Technics Limited | Nucleic acids and proteins from group B streptococcus |
| AT408721B (de) | 1999-10-01 | 2002-02-25 | Cistem Biotechnologies Gmbh | Pharmazeutische zusammensetzung enthaltend ein antigen |
| AT409085B (de) | 2000-01-28 | 2002-05-27 | Cistem Biotechnologies Gmbh | Pharmazeutische zusammensetzung zur immunmodulation und herstellung von vakzinen |
| PT1296713E (pt) | 2000-06-08 | 2004-02-27 | Intercell Biomediz Forschungs | Oligodesoxinucleotidos imunoestimuladores |
| AT410173B (de) | 2000-06-08 | 2003-02-25 | Cistem Biotechnologies Gmbh | Antigene zusammensetzung |
| US20040170642A1 (en) | 2000-08-17 | 2004-09-02 | Jorg Fritiz | Vaccine which comprises at least one antigen and a cathelididin derived antimicrobial peptide of a derivative thereof |
| AT410635B (de) | 2000-10-18 | 2003-06-25 | Cistem Biotechnologies Gmbh | Vakzin-zusammensetzung |
| EP2284182A1 (en) * | 2000-10-27 | 2011-02-16 | Novartis Vaccines and Diagnostics S.r.l. | Nucleic acids and proteins from streptococcus groups A and B |
| FR2824074A1 (fr) * | 2001-04-26 | 2002-10-31 | Pasteur Institut | Sequence du genome streptococcus agalactiae, application au developpement de vaccins, d'outils de diagnostic, et a l'identification de cibles therapeutiques |
| US7485710B2 (en) | 2002-10-15 | 2009-02-03 | Intercell Ag | Nucleic acids coding for adhesion factor of group B streptococcus, adhesion factors of group B streptococcus and further uses thereof |
-
2003
- 2003-10-15 US US10/531,659 patent/US7485710B2/en not_active Expired - Fee Related
- 2003-10-15 EP EP10010867A patent/EP2314604A3/en not_active Withdrawn
- 2003-10-15 EP EP03757983A patent/EP1551869A2/en not_active Ceased
- 2003-10-15 EP EP10010866A patent/EP2314603A3/en not_active Withdrawn
- 2003-10-15 CN CN200380101524XA patent/CN1705679B/zh not_active Expired - Fee Related
- 2003-10-15 CA CA002502414A patent/CA2502414A1/en not_active Abandoned
- 2003-10-15 JP JP2005501294A patent/JP5116971B2/ja not_active Expired - Fee Related
- 2003-10-15 WO PCT/EP2003/011436 patent/WO2004035618A2/en active Application Filing
- 2003-10-15 CN CN2011100420771A patent/CN102174533A/zh active Pending
- 2003-10-15 AU AU2003274011A patent/AU2003274011B2/en not_active Ceased
-
2009
- 2009-01-30 US US12/363,229 patent/US7960533B2/en not_active Expired - Fee Related
-
2010
- 2010-03-09 JP JP2010051266A patent/JP2010207219A/ja active Pending
- 2010-03-16 AU AU2010201016A patent/AU2010201016B2/en not_active Ceased
-
2011
- 2011-05-24 US US13/114,615 patent/US8318908B2/en not_active Expired - Fee Related
-
2013
- 2013-07-02 JP JP2013138528A patent/JP2014003979A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5910441A (en) * | 1996-09-16 | 1999-06-08 | The Rockefeller University | DNA encoding fibronectin and fibrinogen binding protein from group A streptococci |
| CN1344323A (zh) * | 1998-07-27 | 2002-04-10 | 微生物技术有限公司 | 来源于b组链球菌的核酸和蛋白质 |
| CN1351503A (zh) * | 1999-03-19 | 2002-05-29 | 史密丝克莱恩比彻姆生物有限公司 | 疫苗 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2010201016B2 (en) | 2012-06-14 |
| WO2004035618A3 (en) | 2004-09-30 |
| EP2314604A3 (en) | 2011-05-25 |
| JP2006520583A (ja) | 2006-09-14 |
| CN1705679B (zh) | 2011-04-06 |
| US8318908B2 (en) | 2012-11-27 |
| US7485710B2 (en) | 2009-02-03 |
| JP2014003979A (ja) | 2014-01-16 |
| EP2314603A2 (en) | 2011-04-27 |
| US7960533B2 (en) | 2011-06-14 |
| CN1705679A (zh) | 2005-12-07 |
| EP2314603A3 (en) | 2011-05-18 |
| EP1551869A2 (en) | 2005-07-13 |
| EP2314604A2 (en) | 2011-04-27 |
| US20100113340A1 (en) | 2010-05-06 |
| US20060115479A1 (en) | 2006-06-01 |
| US20110287013A1 (en) | 2011-11-24 |
| CA2502414A1 (en) | 2004-04-29 |
| JP5116971B2 (ja) | 2013-01-09 |
| WO2004035618A2 (en) | 2004-04-29 |
| AU2003274011B2 (en) | 2010-03-04 |
| AU2010201016A1 (en) | 2010-04-08 |
| JP2010207219A (ja) | 2010-09-24 |
| AU2003274011A1 (en) | 2004-05-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1705679B (zh) | 编码b族链球菌粘着因子的核酸、b族链球菌的粘着因子和它们的用途 | |
| Schubert et al. | A fibrinogen receptor from group B Streptococcus interacts with fibrinogen by repetitive units with novel ligand binding sites | |
| von Eichel-Streiber et al. | Clostridium difficile toxin A carries a C-terminal repetitive structure homologous to the carbohydrate binding region of streptococcal glycosyltransferases | |
| Pietrocola et al. | Streptococcus agalactiae non-pilus, cell wall-anchored proteins: involvement in colonization and pathogenesis and potential as vaccine candidates | |
| CN102512670A (zh) | 化脓链球菌抗原 | |
| EA006232B1 (ru) | Стрептококковые антигены | |
| JP2010178737A (ja) | 黄色ブドウ球菌由来の細胞外マトリックス結合タンパク質 | |
| CN101490083A (zh) | 小化脓性链球菌抗原及其用途 | |
| Brandt et al. | Human antibodies to the conserved region of the M protein: opsonization of heterologous strains of group A streptococci | |
| TW200911999A (en) | Immunogenic streptococcus proteins | |
| EP1959015A2 (en) | Secreted streptococcus pneumoniae proteins | |
| EP1141308B1 (en) | Group b streptococcus proteins, and their use | |
| JP2001524073A (ja) | 肺炎連鎖球菌の新規の表面タンパク質(SpsA−タンパク質)、欠失した誘導体、該タンパク質用の発現システム及び該タンパク質を含むワクチン | |
| Kling et al. | Characterization of two distinct opsonic and protective epitopes within the alpha C protein of the group B Streptococcus | |
| CA2259141C (en) | Treatment and diagnosis of infections of gram positive cocci | |
| EP0740703A1 (en) | Diagnosis and treatment of infections due to streptococci and enterococci | |
| JPH10201484A (ja) | 新規FtsL | |
| US20050002950A1 (en) | Use of a novel cell surface protease from Group B Streptococcus | |
| US20050131210A1 (en) | Genes and proteins, and their use | |
| AU2004201404B2 (en) | Genes and proteins, and their use | |
| Conaldi et al. | Antibody Response to Fibronectin-Binding | |
| WO2002072623A1 (en) | Genes and proteins, and their use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| AD01 | Patent right deemed abandoned |
Effective date of abandoning: 20110907 |
|
| C20 | Patent right or utility model deemed to be abandoned or is abandoned |