CN101896221B - 用于治疗膀胱和其它体囊或体腔的可植入式药物递送设备和方法 - Google Patents
用于治疗膀胱和其它体囊或体腔的可植入式药物递送设备和方法 Download PDFInfo
- Publication number
- CN101896221B CN101896221B CN2008801203523A CN200880120352A CN101896221B CN 101896221 B CN101896221 B CN 101896221B CN 2008801203523 A CN2008801203523 A CN 2008801203523A CN 200880120352 A CN200880120352 A CN 200880120352A CN 101896221 B CN101896221 B CN 101896221B
- Authority
- CN
- China
- Prior art keywords
- equipment
- medicine
- bladder
- reservoir
- lignocaine
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/01—Introducing, guiding, advancing, emplacing or holding catheters
- A61M25/0102—Insertion or introduction using an inner stiffening member, e.g. stylet or push-rod
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
- A61K31/167—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide having the nitrogen of a carboxamide group directly attached to the aromatic ring, e.g. lidocaine, paracetamol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0034—Urogenital system, e.g. vagina, uterus, cervix, penis, scrotum, urethra, bladder; Personal lubricants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M25/00—Catheters; Hollow probes
- A61M25/01—Introducing, guiding, advancing, emplacing or holding catheters
- A61M25/0105—Steering means as part of the catheter or advancing means; Markers for positioning
- A61M25/0108—Steering means as part of the catheter or advancing means; Markers for positioning using radio-opaque or ultrasound markers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
- A61M31/002—Devices for releasing a drug at a continuous and controlled rate for a prolonged period of time
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P23/00—Anaesthetics
- A61P23/02—Local anaesthetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
- A61F2250/0068—Means for introducing or releasing pharmaceutical products into the body the pharmaceutical product being in a reservoir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/02—General characteristics of the apparatus characterised by a particular materials
- A61M2205/0216—Materials providing elastic properties, e.g. for facilitating deformation and avoid breaking
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2210/00—Anatomical parts of the body
- A61M2210/10—Trunk
- A61M2210/1078—Urinary tract
- A61M2210/1085—Bladder
Abstract
本发明提供了用于膀胱或其它体囊内的控制的药物递送的可植入式医疗设备(10)。该设备包括:至少一个药物储蓄器部件(12),其包括药物;以及囊保持框架(14),其包括具有第一端、相对的第二端和其间的中间区域的弹性丝(16),其中药物储蓄器部件(12)连接到囊保持框架(14)的中间区域。保持框架(14)防止设备从膀胱意外地排泄出,且它优选地具有为设备选择的弹簧常数,以在排尿期间有效地保留在膀胱中,同时最小化膀胱的刺激。
Description
相关申请的交叉引用
本申请要求2007年12月11日提交的美国临时申请号61/007,177和2008年7月30日提交的美国临时申请号61/084,927的利益,其中每个申请通过引用被全部并入。
技术领域
本发明通常在可植入式药物递送设备的领域中,尤其是在用于从可植入在膀胱或其它体腔中的设备控制地释放药物的设备的领域中。
发明背景
药物递送是医学治疗的重要方面。很多药物的功效直接与它们被施用的方式有关。药物递送的各种全身性方法包括口服、静脉内、肌内和经皮。这些全身性方法可能产生不希望有的副作用,并可能导致药物通过生理过程的新陈代谢作用,最终减少到达期望部位的药物的数量。因此,发展了以更靶向的方式递送药物的各种设备和方法。例如,这些设备和方法可局部地递送药物,这可处理与全身药物递送相关的很多问题。
近年来,用于局部药物递送的微型设备的发展是稳定前进的一个领域。可被动或主动地控制药物释放的触发。在美国专利第5,797,898号、第6,730,027号、第6,808,522号和第6,875,208号中公开了控制的药物递送设备的例子。
这些微型设备可粗略地分成两类:可再吸收的基于聚合物的设备和不可再吸收的设备。聚合物设备有生物可降解的潜力,因此避免了在植入之后移除的需要。这些设备一般设计成通过在患者的施用之后的预定时期内药物从聚合物的扩散和/或通过聚合的降解来提供体内药物的控制的释放。
间质性膀胱炎(IC)和慢性前列腺炎/慢性盆腔疼痛综合征(CP/CPPS) 是影响美国每100,000个妇女中的大约67个(Curhan等,J.Urol.161(2).549-52(1999))和每100,000个男人中的大约7个(Collins等,J.Urol.159(4):1224-28(1998))的慢性疼痛疾患。这两种病症都以慢性盆腔疼痛、尿频和尿急以及可变的性功能障碍程度为特征。木聚硫钠(PPS)目前用于治疗这种病症。然而,用于递送药物的常规方法和设备有明显的缺点。例如,口服递送(ELMIRONTM,Ortho-McNeil)由于高的首过效应(Parsons等,J.Urol.153(1):139-42(1990))而具有低至3%的低生物利用率的缺点,并引起一些轻微的副作用,例如头痛。通过膀胱镜检查膀胱内递送的PPS(使用通过尿道的导管)可提供提高的治疗效果,同时减少药物的副作用(Bade等,Br.J.Urol 79(2):168-71(1997))。然而,滴注程序是疼痛的且在三个月内每星期需要重复该程序两次。该程序的重复性质也产生对尿路感染和菌血症的高风险。因此,存在对膀胱内药物递送设备的明显需要,该设备将实质上减少在延长的一段时间内递送有效量的PPS或需要用于局部递送的其它药物所必需的膀胱镜程序的数量。
对IC/PBS的一种治疗需要通过滴注将利多卡因溶液递送到膀胱(R.Henry等,″Absorption of alkalized intravesical lidocaine in normal andinflamed bladders:a simple method for improving bladder anesthesia.(在正常和发炎的膀胱内碱性膀胱内利多卡因的吸收:改进膀胱麻醉的简单方法)″JUrol,165:1900-03,2001:CL.Parsons,″Successful downreguiation of bladdersensory nerves with combination of heparin and alkalinized lidocaine inpatients with interstitial cystitis.(在患有间质性膀胱炎患者中组合肝素和碱性利多卡因对膀胱感觉神经的成功下调)″Urology,65:45-48,2005)。膀胱内衬具有如此强大的粘液屏障,以至于正常利多卡因很难穿过它。然而,研究人员发现,如果麻醉剂以精确数量的重碳酸钠碱化,则它提高麻醉剂通过粘液到达并缓和受刺激的神经和下面的组织的能力。在常规程序中,滴注将大丸剂量的利多卡因(或丁哌卡因)、肝素和重碳酸钠递送到膀胱。在溶液存在于膀胱中的相对短的时间内,膀胱组织吸收利多卡因以给患者提供从疼痛和急迫的立即减缓。当利多卡因从膀胱组织降解时,所吸收的利多卡因也提供连续的减缓。然而,利多卡因具有相对短的半衰期,因此利多卡因的相对高的初始浓度可能需要提供连续的减缓和被限制在持续 时间中的减缓期。为了实现持续的减缓,可能需要随后的滴注,例如在两个星期内每星期三次。这样的滴注的频率可能是不希望有的,因为每次滴注带来不方便、不适和与导尿管插入术相关的感染的风险。通过增加吸收进膀胱内的利多卡因的初始浓度,例如通过增加溶液中的浓度,可增加减缓的持续时间。然而,如果利多卡因的初始浓度太高,则不希望有的全身效应可能产生。
其它治疗可受益于改进的膀胱内药物递送设备,特别是在药物到膀胱的局部递送是优选的或必要的场合-例如当与药物的全身递送相关的副作用是无法忍受时和/或当来自口服施用的生物利用率太低时。例如,奥昔布宁用于膀胱过度活动综合症的治疗。目前,奥昔布宁被口服或经皮递送。然而不幸的是,服用药物的大约61%的患者经受副作用,且大约7%到11%的患者实际上由于副作用的严重性而停止治疗。
Situs公司发展了用于递送药物的药学上的溶液例如奥昔布宁(对于膀胱过度活动的治疗)和丝裂霉素C(对于膀胱癌的治疗)的膀胱内药物递送系统(UROS注入器设备)。在美国专利第6,171,298号、第6,183,461号和第6,139,535号中描述了UROS注入器设备以及制造并植入设备的方法。UROS注入器设备具有弹性外部管并包括连接两个内部端的不能伸展的导丝。设备在膀胱镜插入膀胱中期间具有线性形状,在植入并给设备填充药学上的溶液之后改变到新月形状,并在释放所有药学上的溶液之后返回到线性形状。药学上的溶液的持久的释放通过压力响应阀和/或管内部的流阻元件控制。UROS注入器设备的尺寸依赖于每个内部部件的尺寸,且内部体积的相当大的一部分用于包括机械部件而不是药液。使用大约10cm的长度和大约0.6cm的外径,UROS注入器设备的大尺寸可能对患者引起明显的不适和疼痛,特别是在设备的泌尿道部署和收回期间。UROS注入器设备还需要用于在植入之后将药学上的溶液液装入设备中的额外的外科手术程序。因此,存在对尺寸较小的膀胱内药物递送设备的需要,以避免患者体内不必要的不适和疼痛。此外,提供可最小化在治疗期内植入和药物递送所需的外科手术程序的数量的膀胱内药物递送设备将是合乎需要的。
还存在提供在一段时间内的持续递送并在膀胱中完成此的需要,在药物载荷可实质上至少被释放之前,设备理想地应保留在膀胱中且不被排泄,即使药物有效载荷需要在几天或几星期的时期内被递送。通常,对药物到膀胱的控制的递送需要更好的设备。理想地,可植入式设备应容易在对患者的最少疼痛或不适的情况下递送到膀胱中(且如果必要,从膀胱移除)。
发明概述
在一个方面,提供了用于膀胱或其它体囊内的控制药物递送的可植入式医疗设备。在一个实施方式中,设备包括:至少一个药物储蓄器部件,其包括药物;以及囊保持框架,其包括具有第一端、相对的第二端和其间的中间区域的弹性丝,其中药物储蓄器部件连接到囊保持框架的中间区域。保持框架被确定为对防止设备从膀胱意外地排泄出是极其重要的。它优选地具有为设备选择的弹簧常数,以在排尿期间有效地保留在膀胱中,同时最小化膀胱的刺激。
在一个实施方式中,弹性丝可包括低模量弹性体或由其组成,例如硅树脂、聚氨基甲酸酯、苯乙烯热塑性弹性体、聚(甘油-癸二酸酯)或其组合。在另一实施方式中,弹性丝可包括超弹性合金或其它形状记忆材料或由它们组成。例如,超弹性合金可包括生物相容的镍钛合金(例如,镍钛诺)或钛钼合金(例如,Flexium)。在一个实施方式中,弹性丝可具有生物相容的聚合物涂层,例如硅树脂、聚氨基甲酸酯、苯乙烯热塑性弹性体、Silitek、Tecoflex、C-flex和Percuflex。
在一个实施方式中,在未压缩状态中的弹性丝可以卷曲的形状,例如,以两个或多个环、螺旋或圈的形状。弹性丝的第一和第二端可被限制在所述一个或多个环内。弹性丝的第一和第二端优选地是软和钝的。在未压缩状态中的弹性丝可被卷曲成两个或多个环的形状,使得丝可展开成大致线性的形状,以允许设备穿过导管的腔,该导管依尺寸制造成通过患者的尿道插入。
在一个实施方式中,药物储蓄器部件包括至少一个细长的弹性管,其具有第一端部分和相对的第二端部分并包括其中的药物制剂,该管可操作以控制的速率分配体内药物。在一个实施方式中,管由渗水材料例如硅树脂形成。在一个实施方式中,管可由可再吸收的材料形成。在优选实施方式中,管由包括生物相容的低模量弹性体或由其组成的材料形成。
可放置药物制剂作为管内的核心。药物可通过渗透和/或通过扩散以控制的速率从设备分配,即,从体内管(例如,在膀胱内)释放。在一个实施方式中,管可没有孔,且药物可根据其分子尺寸和/或结构通过管扩散。在一个实施方式中,管可包括一个或多个孔,且药物可通过渗透以控制的速率释放。在一个实施方式中,药物至少部分地通过基质材料的扩散和/或再吸收或溶解以控制的速率分配,例如,其中管包括复合物,例如聚合物/药物复合物。药物制剂优选地以固体或半固体形式。这可便于将所需的剂量装入相对小的容积中,以最小化在设备的植入期间和之后对患者的不适当的刺激和不适。
设备可包括至少一个磁性元件,以例如在药物递送完成之后便于设备的膀胱镜从膀胱撤回。在某些实施方式中,磁性元件可位于囊保持框架的第一端、第二端或第一和第二端两处。软聚合物涂层可设置在磁性元件上。
在可选的实施方式中,设备可由可再吸收的材料形成,使得设备的收回是不需要的,因为它将完全降解或至少足以排泄出设备的残余物。
在至少一个优选实施方式中,用于释放药物的孔在一尺寸范围内,其中释放被渗透地控制。在一个实施方式中,孔是圆形的并具有在大约25μm和大约500μm之间的直径。如果孔太大,则药物释放可能发生得太快,且发现如果孔尺寸太小,则液压可能使药物储蓄器管变形并可能改变孔。
通过使用低密度材料和/或在设备的某个部分中包括空气或另一气体,设备还可包括浮动特征。浮动特征可最小化膀胱的三角的可能刺激。设备还可包括例如嵌入式不透射线的材料用于设备的可能的x射线监测。
药物储蓄器部件的管腔的尺寸确定可能的药物有效载荷容积。在一个实施方式中,药物储蓄器部件的中空管可具有在大约0.3mm和大约2mm 之间的内径(I.D.)和在大约0.6mm和大约3mm之间的外径(O.D.)。在端部封口之间的管的长度可变化,连接到任何一个保持框架的管节的数量也可变化。
在特定的实施方式中,用于控制的药物递送的可植入式医疗设备可包括:至少一个药物储蓄器部件,其包括具有第一端和相对的第二端的细长渗水的弹性管、在管内的固体或半固体药物制剂核心,其中该管具有用于以控制的速率分配药物的一个或多个孔;以及囊保持框架,其包括具有第一端、相对的第二端和其间的中间区域的弹性丝,其中弹性丝包括超弹性合金或其它形状记忆材料或低模量弹性体,且药物储蓄器部件的弹性管连接到围绕中间区域的囊保持框架。在优选实施方式中,弹性管由硅树脂形成。
在另一方面,提供了用于将药物施用到患者的体腔内/附近例如患者膀胱内的局部组织部位的方法。在一种情况下,该方法可包括:提供具有远端、相对的近端以及在其间延伸的开口腔的腔设备,例如导尿管或膀胱镜;在需要治疗时将导尿管的远端插入患者的膀胱中,其中导尿管的近端保持在患者体外;使可植入式药物递送设备变形(例如,展开)并使其通到导尿管的腔的近端中;推动变形的设备通过腔并从腔出来,随之设备返回到其未变形的形状用于保持在膀胱中;以及从患者移除导尿管。其后,药物以控制的方式从设备的药物储蓄器部件被释放。在该方法的某些实施方式中,患者可能需要对间质性膀胱炎、膀胱过度活动综合症或膀胱癌的治疗。
在又一方面,提供了治疗患者体内的膀胱的方法。在一个实施方式中,该方法包括在患者的膀胱内整个植入药物释放设备;以及以在膀胱的尿道上皮中提供麻醉剂的持续的治疗有效的浓度的方式从药物递送设备可控制地释放局部麻醉剂,同时避免麻醉剂的高峰值血浆浓度。麻醉剂可为利多卡因。在一个实施方式中,尿道上皮中的麻醉剂的浓度比血浆浓度高至少1000倍。在一个实施方式中,尿道上皮中的麻醉剂的治疗有效的浓度维持在1和30天之间。
在又一实施方式中,提供了用于治疗患者体内的膀胱的方法,其中该方法包括在患者的膀胱内整个植入药物释放设备;以及以在膀胱的尿道上 皮中提供药物的持续的治疗有效的浓度的方式从药物递送设备可控制地释放药物,同时避免麻醉剂的高峰值血浆浓度,其中药物具有等于利多卡因的半衰期的25%或在利多卡因的半衰期的25%内的半衰期。
附图简述
图1是以相对扩张形状的药物递送设备的实施方式的平面图。
图2是图1所示的药物递送设备的实施方式的平面图,其示出在导管内部在相对较低剖面形状中的药物递送设备。
图3示出药物递送设备的药物储蓄器部分的实施方式,其中图3A是侧视图,图3B是横截面视图,而图3C是横截面视图。
图4是包括由分隔结构分离的多个储蓄器的药物储蓄器部分的实施方式的横截面视图。
图5是具有在一端的口结构和通过口结构形成的孔的药物储蓄器部分的实施方式的横截面视图。
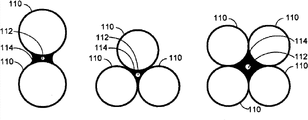
图6示出药物递送设备的囊保持框架部分的示例性形状,这些形状包括一个或多个环、圈或子圆。
图7示出框架的示例性形状,该框架包括在两维或三维配置中布置的一个或多个圆或椭圆。
图8示出具有在保持框架的中间区域处连接的一个或多个药物储蓄器的纽结形(pretzel)保持框架的示例性实施方式。
图9示出具有在保持框架的中间区域处连接的多个药物储蓄器部分的保持框架的另一实施方式,图9A示出以相对扩张的形状显示的设备,而图9B示出在导管内以相对较低剖面形状的设备。
图10示出具有实质上与保持框架对准的药物储蓄器部分的药物递送设备的示例性实施方式的横截面视图。
图11示出具有实质上与保持框架对准的多个药物储蓄器部分的药物递送设备的示例性实施方式的横截面视图。
图12示出药物递送设备的实施方式,其中保持框架部件通过药物储蓄器部件的一部分延伸以将两个部件连接在一起。
图13是药物递送设备的实施方式的侧视图,其示出位于释放孔附近的速率控制涂层或套,设备的内部部件以交叉影线示出。
图14是示出制造可植入式药物递送设备的方法的实施方式的方框图。
图15示出植入膀胱内药物递送设备的方法。
图16是示出将利多卡因递送到膀胱的方法的方框图。
图17示出药物递送设备的三个不同实施方式的横截面视图。
图18是示出图17所示的药物递送设备的三个实施方式的体外药物释放概况的曲线。
图19示出在压缩测试期间在三个不同点处纽结形保持框架的实施方式,其中压缩力施加到框架。
图20是示出在图19所示的设备上执行的压缩测试期间收集的力和位移数据的曲线。
图21是示出在体外由各种植入式药物递送设备展示的利多卡因随着时间释放的曲线。
图22是示出对在兔膀胱中的各种滴注和体内植入设备展示的利多卡因血浆浓度随着时间的曲线。
图23是示出对在兔膀胱中的各种滴注和体内植入设备展示的利多卡因血浆浓度随着时间的y轴被更改的曲线。
图24是示出对在兔膀胱中的各种体内植入设备展示的利多卡因组织浓度随着时间的曲线。
图25是示出对在兔膀胱中的各种滴注和体内植入设备展示的在利多卡因组织浓度和利多卡因血浆浓度之间的关联的曲线。
图26是示出在三天内和六天内由兔膀胱中的体内植入设备展示的在组织和尿中的利多卡因浓度的曲线。
图27是分别示出在一小时内和一天内在兔膀胱上在体外执行的研究期间展示的pH对利多卡因的吸收的影响的曲线。
图28是示出使用变化的pH的10-5%和1%的利多卡因溶液在兔膀胱上在体外执行的研究期间展示的利多卡因组织浓度随着时间的曲线。
发明详述
提供了用于植入并保持在膀胱或其它体囊或体腔中的改进的药物递送设备。设备可设计成适合于对于需要大丸剂(一次)、脉动的或恒定的药物递送的治疗以预定的方式在延长的一段时间内释放一种或多种药物。
重要地,可植入式设备设计成保持在体内,例如膀胱内。也就是说,设备设计成例如响应于与排尿相关的力而抵抗排泄。例如,设备可包括保持框架。保持框架可配置成相对低的剖面以部署在体内,且一旦被植入就可呈现相对扩张的剖面以便于保持。设备可为高度柔性的,以便药物装载设备可容易例如从卷曲的形状变形到直的形状,以允许通过导管的腔部署到膀胱中。
设备可为例如通过膀胱镜非外科手术植入的,且设备可在膀胱镜移除之后很久继续递送药物。与可充当细菌转移到膀胱中的路径的留置导管相反,植入设备有利地能够完全位于膀胱内。因此,使用现有设备,感染的机会大大减小了。
特别地关于膀胱,设备还有利地处理传统治疗选择的很多不足,例如通过滴注的药物递送、全身药物递送和通过在膀胱中植入的膀胱镜设备的药物递送。本设备可被植入一次,并可在延长的时期内释放药物,而不需要外科手术或频繁的干预(例如,再次填充传统设备的药物储蓄器)。通过限制将在治疗过程期间对患者执行的所需程序的数量,本局部药物递送系统可在治疗过程期间提高患者的生命的质量。药物递送设备还可避免与药物的全身施用相关的潜在副作用,同时增加局部递送到膀胱的药物的数量。
在一个实施方式中,药物递送设备可允许在相对延长的一段时间内将 利多卡因(或另一可卡因类似物)局部递送到膀胱。因此,设备可为IC/PBS的治疗提供利多卡因溶液的频繁的膀胱内滴注的有益的可选方案。设备可为惰性的不可再吸收的设备,其可通过传统导管插入术-一种简单的非外科手术门诊病人程序被部署和收回。与在相对短的一段时间内给膀胱装入相对高浓度的利多卡因的膀胱内滴注不同,本设备可允许在相对较长的时间间隔内连续释放相对较低水平的利多卡因。因此,患者可能经历从IC/PBS的症状的持续减缓,而不接收高初始浓度的利多卡因,且不经受重复的膀胱内滴注的不适和不方便。进一步地,不必递送在碱性溶液中的利多卡因,以便获得有效的膀胱组织浓度。
I.可植入式药物递送设备
在实施方式中,药物递送设备可包括两个主要部分:药物储蓄器部分和囊保持框架部分。药物储蓄器部分在这里可称为“设备主体”并可容纳药物以递送到体内。保持框架部分可与药物储蓄器部分相结合,并可便于将设备保持在体内。图1示出设备10的示例性实施方式,该设备具有药物储蓄器部分12和保持框架部分14。在设备设计成植入膀胱中的实施方式中,保持框架部分可阻止设备和由此的药物储蓄器部分从膀胱意外排泄出。
更具体地,药物递送设备可在相对扩张的形状和相对较低剖面形状之间弹性地变形。相对较低剖面的形状可适合于将药物递送设备插入体内。例如,相对较低剖面的形状可适合于将药物递送设备通过导管插入体腔内,例如通过导尿管插入膀胱中。一个例子在图2中示出,其示出在导管20例如膀胱镜的工作通道或其它导管中图1的设备10。在这样的实施方式中,相对较低剖面的形状可为相对管状、细长或线性形状,例如图2所示的形状,使得设备可通过导管。在通到体内之后,设备可呈现相对扩张的形状,例如图1所示的形状,其可便于将药物递送设备保持在体腔中。
在实施方式中,药物递送设备可自然地呈现相对扩张的形状。设备可弹性地变形成相对较低剖面的形状用于插入体内,且设备一旦被植入就可自发或自然地返回到初始的相对扩张的形状以保持在体内。
保持框架可具有某个弹性限制和模量,其允许设备以相对较低剖面的 形状插入体内,但接着允许设备一旦在体内就返回到相对扩张的形状。设备还可具有足够的弹性模量来阻止设备一旦被植入时呈现相对较低剖面的形状,以便限制或防止设备在预期力下从身体意外地排出。例如,保持框架的特征可被选择成便于将设备保持在相对扩张的形状中,而不管膀胱中的预期力,例如与排尿或逼尿肌的收缩相关的液体动力。因此,从膀胱的排出被阻止或防止。
在药物递送设备设计成被植入膀胱中的实施方式中,药物递送设备可设计成膀胱镜式地通过尿道插入膀胱中并从膀胱中收回。因此,设备可依尺寸制造和成形为适合于通过膀胱镜的窄管状路径。一般,成人的膀胱镜具有大约5mm的外径和直径为大约2.4mm的工作通道。因此,设备可在尺寸上相对小。例如,当设备弹性地变形为相对较低剖面的形状时,设备可具有小于大约2.4mm,例如在大约2.0mm和大约2.3mm之间的总外径。
除了允许插入以外,设备的相对小的尺寸也可能减小患者对膀胱的不适和创伤。例如,设备的相对小的尺寸可减小膀胱三角的刺激,膀胱三角负责产生尿急的感觉。设备也可具有小于尿或水的密度的密度,使得设备可漂浮在膀胱内部。这样的漂浮虽然不是需要的,但可防止设备接触膀胱颈部附近的膀胱的敏感三角区。例如,设备可从相对低密度的构造材料形成,或空气或其它气体可被截留在设备中。此外,设备的外表面可能柔软和平滑,而没有尖锐的边缘或尖端。
可根据各种因素,包括植入的特定部位、植入的路线、药物、剂量方案和设备的治疗应用来选择膀胱内药物递送设备的确切配置和形状。优选地,设备的设计将最小化患者的疼痛和不适,同时将药物的治疗有效剂量局部递送到患者。
膀胱内药物递送设备可制成完全或部分可再吸收的,以便在药物制剂的释放之后不需要设备的移植。如这里所述的,术语“可再吸收的”意指设备或其部分通过溶解、酶水解、腐蚀或其组合在体内降解。该降解出现在不干扰来自设备的药物的释放的预期动力学时。例如,设备的大量吸收可能不出现,直到药物制剂实质上或完全被释放之后。可选地,膀胱内药物递送设备可为至少部分地不可再吸收的,使得设备可在药物制剂的释放 之后被移除。在这样的实施方式中,设备可以不是完全可再吸收的;例如,设备可为部分可再吸收的,以便设备在部分吸收时分解成小到足以从膀胱排泄出的不可再吸收的块。有用的生物相容的可再吸收和不可再吸收的构造材料在本领域中是已知的。在实施方式中,设备可从适合于泌尿道应用的材料形成,例如医疗级硅树脂、天然乳胶、PTFE、ePTFE、不锈钢、镍钛诺、埃尔吉洛伊非磁性合金(非铁磁性金属合金)、聚丙烯、聚乙烯、聚碳酸酯、聚脂、尼龙或其组合。
药物储蓄器部分
设备的药物储蓄器部分可包括细长管。管可具有第一端和相对的第二端。管的内部可限定储蓄器,且药物制剂核心可容纳在储蓄器中。药物制剂可以是实质上固体的形式,例如药棒,虽然其它配置是可能的。管可具有例如通过渗透、扩散或其组合连同其它方式来分配药物的一个或多个孔。在实施方式中,可控制药物从药物储蓄器部分的释放率。例如,可降解的膜可布置在一个或多个孔上或内,以控制药物制剂从储蓄器的释放的开始。作为另一例子,套可位于管的一部分上,以例如通过减小管的渗透表面积或通过减小经由管壁的扩散来减小释放率。此外,药物储蓄器部分可从设计成以已知速率释放的药物聚合复合物形成。
图3A-3C示出这样的药物储蓄器部分的例子。如所示,药物储蓄器部分通常包括从弹性管30形成的主体。管30限定储蓄器32,储蓄器32限制药棒34。管30的端部可使用下面进一步描述的密封结构35被密封。孔36的阵列可布置在由可降解的定时膜38隔离的管30中。
在优选实施方式中,药物储蓄器部分作为渗透泵操作。在这样的实施方式中,管可从渗水材料例如硅树脂形成。在植入之后,水或尿通过管壁渗透,进入储蓄器,并通过药物制剂吸收。溶解的药物通过一个或多个孔以所控制的速率从储蓄器分配,被储蓄器中的渗透压力驱动。递送率被管的表面积、管壁的厚度、液体对用于形成管的材料的渗透率、以及孔的形状、尺寸、数量和布置连同其它因素影响。递送率可根据公知的原理从限定特定的药物递送系统的物理化学参数预测,这些原理例如在Theeuwes,J.Pharm.Sci.,64(12):1987-91(1975)中被描述。下面参考实例1-3描述示例 性渗透泵设计和用于选择这样的设计的方程。
在可选的实施方式中,设备可本质上通过药物经由例如一个或多个孔、管壁或其组合从管扩散来操作。在又一些其它实施方式中,设备可通过渗透和扩散的组合来操作。
在实施方式中,药物储蓄器部分可从弹性材料形成,弹性材料可允许使设备弹性地变形用于插入。例如,管连同囊保持框架一起可弹性地变形用于膀胱内植入,如在下面更详细描述的。
在实施方式中,药物储蓄器部分可由本领域中已知的生物相容的渗水材料制成,该材料可允许药物通过渗透从储蓄器释放。药物储蓄器部分可选地可实质上为不渗水的。
在实施方式中,药物储蓄器部分可从既弹性又渗水的材料形成。示例性材料是既弹性又渗水的硅树脂,虽然可使用其它生物相容的材料。
可根据待包含的药物制剂的体积、药物从管的期望递送速率、体内设备的植入的预期部位、设备的期望机械完整性、水和尿的期望释放率或渗透率、以及插入体内的期望方法或路线连同其它因素来选择管的长度、直径和厚度。在实施方式中,药物储蓄器部分具有在大约1cm到大约10cm的范围内的长度、在大约0.3mm到大约2mm的范围内的内径和在大约0.6mm到大约3mm的范围内的外径。
在一个实施方式中,设备主体是不可再吸收的。它可由如本领域中已知的医疗级硅树脂管形成。适当的不可再吸收的材料的其它例子包括选自如下的合成聚合物:聚(醚)、聚(丙烯酸脂)、聚(甲基丙烯酸酯)、聚(乙烯基吡咯烷酮)、聚(乙烯基醋酸酯)、聚(聚氨基甲酸酯)、纤维素、醋酸纤维素、聚(硅氧烷)、聚(乙烯)、聚(四氟乙烯)和其它氟化聚合物、聚(硅氧烷)、其共聚物和其组合。
在另一实施方式中,设备主体是可再吸收的。在可再吸收设备的一个实施方式中,主体的管由生物可降解或生物可侵蚀的聚合物形成。适当的可再吸收材料的例子包括选自如下的合成聚合物:聚(酰胺)、聚(酯)、聚(酯酰胺)、聚(酐)、聚(原酸酯)、聚磷腈、假聚(氨基酸)、聚(甘 油-癸二酸酯)、其共聚物和其混合物。在优选实施方式中,可再吸收的合成聚合物选自:聚(乳酸)、聚(乙醇酸)、聚(乳酸-共-乙醇酸)、聚(己内酯)和其混合物。其它可固化的生物可再吸收的弹性体包括聚(己内酯)(PC)衍生物、氨基醇基聚(酯酰胺)(PEA)和聚(辛烷二醇柠檬酸脂)(POC)。PC基聚合物可能需要额外的交联剂例如赖氨酸二异氰酸酯或2,2-双(己内酯-4-基)丙烷来获得弹性特性。
药物储蓄器部分可被制造为如在Lee等人的美国专利申请公布号2007/0202151中描述的,该申请在这里通过引用被并入。
如所述,管可为中空的,使得药物储蓄器被限制在其中。例如,管实质上可为线性的,例如在形状上实质上为圆柱体。因此,管可具有圆形的横截面;然而,设想了管的其它横截面形状,例如正方形、三角形、六边形和其它多边形连同其它形状。管的端部可被密封,以限制药物的漏出。例如,可使用密封结构、医疗级硅树脂粘合剂、本领域中已知的其它密封装置或其组合隔离管的每个端部。在使用密封结构密封的管的实施方式中,密封结构可为球、圆盘或适合于塞住、封闭管的端部的任何其它形状。图3B中示出了球形密封结构35的实施方式。这样的密封结构可从材料如生物相容的金属材料例如不锈钢或生物相容的聚合材料例如生物可降解或生物可侵蚀的聚合物形成,虽然可使用其它材料。密封结构可具有比管的内径相对大的直径,使得管伸长以贴身地安装在密封结构周围。
在一个实施方式中,管具有多个储蓄器。多个孔可共享公共药物储蓄器或具有单独的储蓄器。这样的多储蓄器设备在至少两种特定类型的设备实施方式中是有用的:(1)当两个或多个单独的药物制剂从单个设备被递送时,或(2)在植入之后当单个药物以两个不同的速率或在不同的时间被递送时,例如当第一剂量的药物被预先安排成在第一时间释放,而第二剂量被预先安排成在第二、以后的时间释放时。通过对不同的储蓄器例如两个或多个储蓄器使用不同的定时膜可实现这个不同的预先安排,储蓄器由管的内表面和至少一个分隔物限定。管中的分隔结构可以是球形物体例如陶瓷珠或其它微球体的形状。分隔结构也可以是圆盘或圆柱体的形状。其它配置也是可能的。分隔物可为不可再吸收的或可再吸收的。在一个实 施方式中,分隔结构可由生物相容的聚合物材料例如生物可降解或生物可侵蚀的聚合物制成。
在图4中示出这样的药物储蓄器部分的实施方式。药物储蓄器部分具有包括线性管40的主体。管40中的中空空间被分隔成三个储蓄器42a、42b、42c,其中每个具有单个相应的孔44a、44b、44c。储蓄器42由代表管侧壁的管40的内表面以及在管的内部空间内间隔开的球形分隔结构46a、46b、46c和46d限定。如可看到的,分隔结构通过具有比未伸长的弹性管的内径大的直径固定在管40内的适当位置上,这使管伸长并贴身地安装在分隔结构周围,密封每个储蓄器。
在实施方式中,被分隔的储蓄器可防止具有较快生物可降解的膜的孔垄断所装载的药物材料的释放,可能留下很少或没有留下用于使用随后降解的膜从孔释放的药物材料。为每个释放孔提供单独的储蓄器可增加多个生物可降解定时膜的效果。
在优选实施方式中,储蓄器(或组合的储蓄器)的总体积足以包含在单次治疗的过程中局部递送所需的所有药物。也就是说,药物储蓄器部分理想地包含所有剂量的预期药物,使得多个膀胱镜检查程序是不需要的,并在数量/频率上减少以完成对给定的疾病或病症指定的治疗。
孔
在一个实施方式中,设备主体包括通过管的侧壁或端部的一个或多个孔或口。一个或多个孔提供通路以从药物递送设备释放药物制剂。在一个实施方式中,设备包括在管中隔开的位置上的两个或多个分立的孔的阵列。两个或多个孔可与单个储蓄器或多个储蓄器流体相通。在膀胱镜插入期间将被折叠的管的部分附近的孔的布置可被避免,以便防止孔上的聚合物生物可降解膜的可能撕裂。孔36的实施方式在图3A所示的药物储蓄器部分的管30上示出。
孔的尺寸可被选择成提供释放药物的控制的速率。在设备用来主要作为渗透泵操作的实施方式中,孔的尺寸可被选择成使得孔足够小以最小化或以另外方式减小药物通过孔的扩散。孔还可配置成防止管中流体静压的 过多累积,这可增加储蓄器中流体的体积,导致管的膨胀。例如,通过确保孔的尺寸足够大和/或通过使多个孔沿着管的长度间隔开可防止储蓄器内流体静压的增加。在对孔尺寸和数量的这些限制内,可接着改变在单个设备中(或在单个储蓄器中)使用的这样的孔的尺寸和数量,以便提供所释放的药物的所需总速率。在示例性实施方式中,孔的直径在大约20μm和大约300μm(例如,20到100μm,25到75μm,等等)之间。在一个例子中,孔是圆形的并具有在大约25μm和大约500μm之间的直径。在另一例子中,孔是圆形的并具有在大约20μm和大约75μm之间的直径。在一个特定的例子中,孔具有大约50μm的直径。在设备主要通过扩散操作的实施方式中,孔可在这个范围或更大范围内。
单个设备可具有两个或多个不同尺寸的孔。孔一般在形状上是圆形的,虽然其它形状是可能的并被设想,且将一般取决于制造考虑。
在一个实施方式中,穿过管例如硅树脂管的壁通过激光烧蚀来钻孔。例如,孔可使用紫外受激准分子激光器微加工系统来产生。在这样的实施方式中,孔可从管的外部到管的内部轻微地逐渐变细。例如,孔可具有沿着管壁的外表面的大约55μm的直径,且孔可具有沿着管壁的内表面的大约45μm的直径,虽然任何其它配置是可能的。孔可接着用生物可降解定时膜覆盖。技术人员可能能够使用激光烧蚀通过通孔钻孔或深度控制的钻孔来在医疗级聚合物中钻孔,以产生具有小至0.050mm的直径的界限分明的孔。因此,孔可在药物被装入管中之前或之后产生。
在另一实施方式中,一个或多个孔可在布置在管的一端的口结构中形成。图5示出这样的实施方式。药物储蓄器部分可具有管状硅树脂主体50,其具有塞住主体的中央钻孔的一端的精密口结构52。口结构52可包括孔54。密封结构例如微珠56可塞住管的相对端,且药物制剂58可布置在储蓄器中,储蓄器被界定在口结构52和微珠56之间。口结构可为本领域已知的精密口(例如从Swiss Jewel公司的Bird Precision Orifices可得到)。口可被插入硅树脂管内和/或使用硅树脂粘合剂连接到硅树脂管。在一个例子中,设备可包括具有305μm的内径和635μm的外径的硅树脂管,精密口结构由红宝石或蓝宝石制成并具有大约1.5mm或更小的外径。
可降解膜
在一个实施方式中,一个或多个孔中的每个具有布置在每个孔上或中(例如,与孔对准)的可降解膜,以控制药物制剂的释放开始的时间。在一个实施方式中,可降解膜是以覆盖设备主体的管的外表面的均匀涂层的形式。在另一实施方式中,分立的可降解膜实质上可设置在孔内。两个或多个可降解膜的组合可用于控制从一个孔的释放。
在特定系统中的可降解膜的厚度将依赖于例如为可降解膜选择的结构材料的化学和机械特性(其主要控制降解的速率),以及依赖于对特定药物递送设备的药物释放的期望延迟时间。见例如Richards Grayson等人的″Molecular release from a polymeric microreservoir device:influence ofchemistry,polymer swelling,and loading on device performance(从聚合物微储蓄器设备的分子释放:化学、聚合物膨胀和装载对设备性能的影响)″Wiley InterScience(6 April 2004);Grayson等人的″Multi-pulse drug deliveryform a resorbable polymeric microchip device(从可再吸收的聚合物微芯片设备的多脉冲药物递送)″Nature Materials,Advance Online Publication (19October 2003);美国专利号6.808,522。在一个实施方式中,可降解膜具有在大约100μm和大约200μm之间,例如在145μm和160μm之间的厚度。
膜可由生物相容材料形成。在一个实施方式中,膜由可再吸收合成聚合物例如聚酯、聚(酐)或聚己内酯形成。在另一实施方式中,膜由可再吸收生物材料例如胆固醇、其它脂质和脂肪形成。
对于希望在一段短时间内释放药物的这些设备的实施方式,可降解膜可从快速分解的材料制造,包括例如包含高乙交酯含量的聚(丙交酯-共-乙交酯)共聚物、具有快速降解时间的聚(内酯)的共聚物、某些聚(酐)、水凝胶、寡糖和多糖。对于希望较长或延迟的释放时间的应用,可降解膜可从花费较长时间来分解的材料制造,例如可再吸收生物材料如胆固醇、其它脂质和脂肪、以及脂质双分子层、聚合物如聚(己内酯)或某些聚(酐)以及具有高乳酸含量的PLGA共聚物。
在某些实施方式中,可降解膜允许从单个药物递送设备实现复杂的释放概况。在一个实施方式中,这可通过对相同的储蓄器或不同的储蓄器在 不同的孔上有不同的膜来实现。在一种情况下,膜中的一个由第一材料形成,而膜中的另一个由第二材料形成,其中第一材料具有与第二材料相比不同的体内降解率。在另一情况下,膜中的一个具有第一厚度而膜中的另一个具有第二较大的厚度。这些方法可混合并匹配,以根据使用释放控制赋形剂材料配制药物或使用如下所述的释放改变套覆盖药物储蓄器部分的一部分,来单独地或与动力学改变方法结合而设计特定的释放概况。
药物制剂
药物制剂可基本上包括任何治疗剂、预防剂或诊断剂,其对局部递送到体腔是有用的。药物制剂可只由药物组成,或可包括一种或多种药学上可接受的赋形剂。
在优选实施方式中,药物制剂是以固体或半固体形式,以便减小药物制剂的总体积,从而减小设备的尺寸,以促进植入的容易。半固体形式可例如为乳状液或悬浮液、凝胶或糊剂。在一个例子中,药物制剂是以固体药棒的形式。药棒的实施方式和用于制造这样的药棒的方法在美国专利申请号11/463,956中被描述,该专利通过引用被全部并入。通过改编本领域中已知的其它挤压或铸造技术可形成药棒。例如,包括6-硫酸软骨素或硫酸C软骨素的药棒可通过给管填充含水CSC溶液并接着允许溶液蒸发来形成。作为另一例子,包括利多卡因的药棒可通过给管填充包括利多卡因的水溶液、允许溶液蒸发并接着结晶化因而产生的凝胶来形成。在很多实施方式中,由于体积/尺寸最小化的相同原因,药物制剂理想地不包括或包括最少量的赋形剂。
在其它实施方式中,药物制剂可以是液体、溶液、悬浮液、乳状液、乳状液、胶态悬浮液、浆、凝胶混合物例如水凝胶或其组合的形式。药物制剂可以是粉末或微颗粒形式,例如,作为能水合或水可溶解的固体。
药学可接受的赋形剂在本领域中是已知的,并可包括粘性改良剂、填充剂、表面活性剂、分散剂、渗透剂、稀释剂以及用来促进处理、稳定性、可分散性、可湿性和/或药物(即,活性药物成分或诊断剂)的释放动力学的制剂的其它非活性成分。
在特定的实施方式中,膀胱内药物递送设备用于给患者提供疼痛减轻。可使用各种麻醉剂、止痛剂和其组合。适当的这样的试剂的代表性例子包括盐酸利多卡因、盐酸普鲁卡因、水杨醇、盐酸丁卡因、盐酸非那吡啶、醋氨酚、乙酰水杨酸、氟苯柳、布洛芬、吲哚洛芬、茚甲新、萘普生、可待因、羟考酮和枸橼酸芬太尼。在优选实施方式中,设备用于递送一种或多种局部麻醉剂。局部麻醉剂可为可卡因类似物。在设备的特定实施方式中,局部麻醉剂是氨基酰胺、酰胺酯或其混合物。设想了不同氨基酰胺的组合或不同酰胺酯的组合。可能的氨基酰胺的代表性例子包括利多卡因、丙胺卡因、甲哌卡因和罗哌卡因。可能的酰胺酯的代表性例子包括苯佐卡因、普鲁卡因、丙美卡因和丁卡因。这些局部麻醉剂一般是弱碱,并通常被配制为盐例如盐酸盐,以使它们变成水可溶的。
在优选实施方式中,本膀胱内药物递送设备用于治疗炎性病症,例如间质性膀胱炎、放射性膀胱炎、膀胱疼痛综合症、前列腺炎和尿道炎。针对这些病症的特定药物的非限制性例子包括盐酸利多卡因、葡萄糖胺聚糖(例如,硫酸软骨素、舒洛地特)、木聚硫钠(PPS)、二甲基亚砜(DMSO)、奥西布宁、丝裂霉素C、肝素、黄酮哌酯或其组合。
本膀胱内药物递送设备可用于治疗尿失禁,包括急迫性尿失禁和神经性尿失禁。可使用的药物包括抗胆碱能药、抗痉挛药、抗毒蕈碱药、β-2激动药、去甲基肾上腺素摄取抑制剂、5-羟色胺摄取抑制剂、钙通道阻滞药、钾通道开放剂和肌肉驰缓药。用于治疗失禁的适当药物的代表性例子包括奥西布宁、S-奥西布宁、依美铵、异搏定、丙咪嗪、黄酮哌酯、阿托品、丙胺太林、托特罗定、罗西维林、克仑特罗、达非那新、特罗地林、曲司铵、莨菪碱、丙哌维林、去氨加压素、伐米胺、YM-46303(YamanouchiCo.,Japan)、兰吡立松(Nippon Kayaku Co.,Japan)、依那立松、NS-21(NipponShinyaku Orion,Formenti,Japan/Italy)、NC-1800(Nippon Chemiphar Co..Japan)、ZD-6169(Zeneca Co.,United Kingdom)和司洛碘铵。
在另一实施方式中,本膀胱内药物递送设备用于治疗尿道癌,例如膀胱癌和前列腺癌。可使用的药物包括抗增殖剂、细胞毒素剂、化疗药或其组合。用于治疗尿道癌的适当药物的代表性例子包括卡介苗(BCG)疫苗、 顺铂、阿霉素、氨甲喋呤、长春碱、塞替派、丝裂霉素、氟尿嘧啶、亮丙瑞林、氟他胺、己烯雌酚、雌莫司汀、醋酸甲地孕酮、环丙孕酮、氟他胺和环磷酰胺。药物治疗可与靶向癌组织的传统放射或外科手术治疗结合。
在又一实施方式中,本膀胱内药物递送设备用于治疗涉及膀胱、前列腺和尿道的感染。抗生素、抗菌药、抗真菌剂、抗原虫药、抗病毒药和其它抗感染药可被施用来治疗这样的感染。用于治疗感染的适当药物的代表性例子包括丝裂霉素、环丙沙星、诺氟沙星、氧氟沙星、甲胺、呋喃妥因、氨苄西林、阿莫西林、萘夫西林、三甲氧苄二氨嘧啶、磺胺、三甲氧苄二氨嘧啶磺胺甲噁唑、红霉素、多西环素、甲硝唑、四环素、卡那霉素、盘尼西林、头孢菌素和氨基糖苷类。
其它药物和赋形剂可用于其它疗法和在其它非膀胱体腔部位。储存在设备中的相同或分开的储蓄器中(或从储蓄器释放)的两种或多种药物的组合被设想。
药物制剂的赋形剂可为基质材料,其被选择成调节或控制来自储蓄器的药物的释放率。在一个实施方式中,基质材料可为如上所述的可再吸收或不可再吸收的聚合物。在另一实施方式中,赋形剂包括疏水或两亲化合物,例如脂质(例如,选自脂肪酸和衍生物、甘油单酸酯、甘油双酸酯和甘油三酸酯、磷脂、鞘脂、胆固醇和类固醇衍生物、油、维他命和萜烯)。
药物制剂可提供时间上调节的释放概况或更连续或一致的释放概况。脉动释放可从多个储蓄器获得。例如,不同的可降解膜可用于使来自几个储蓄器的每个的释放时间上交错。
囊保持框架
如上所述,药物递送设备包括囊保持框架部分。保持框架部分与药物储蓄器部分相结合,并允许将药物储蓄器部分保持在体内,例如膀胱中。保持框架可在相对扩张的形状和相对较低的剖面形状之间弹性地变形。例如,保持框架可自然呈现相对扩张的形状,可被处理成相对较低的剖面形状用于插入体内,并可在插入体内时自发地返回到相对扩张的形状。
相对扩张的形状的保持框架可被成形为保持在体腔中,且相对较低的剖面形状的保持框架可被成形为通过导管的腔插入体内。例如,保持框架可在适合于通过膀胱镜的工作通道插入体内的形状和适合于即使在被暴露给与排尿或逼尿肌的收缩相关的力时也保持在膀胱中的形状之间弹性地变形。这样的实施方式的例子在图1-2中示出,其中保持框架在扩张位置上时呈现纽结形形状,而保持框架在较低剖面位置上时呈现相对细长的线性形状。
为了实现这样的结果,保持框架可具有弹性限制、模量和/或弹簧常数,其被选择成一旦被植入就阻止设备呈现相对较低的剖面形状。这样的配置可限制或防止设备在预期力下从体内意外排出。例如,设备可在排尿或逼尿肌的收缩期间保持在膀胱中。
在优选实施方式中,保持框架包括弹性丝。在一个实施方式中,弹性丝可包括本领域已知的超弹合金或其它形状记忆材料。例如,超弹合金可包括生物相容的镍钛合金(例如,镍钛诺)或钛钼合金(例如,Flexium)。在Langer等人的美国专利号6,160,084中描述了生物可降解的生物相容的形状记忆聚合物。在另一实施方式中,弹性丝是相对低模量弹性体或包括相对低模量弹性体。低模量弹性体一旦被植入时可能相对较不可能引起对膀胱的刺激或引起溃疡。此外,一些低模量弹性体可能是完全生物可降解的,这可允许产生在植入和药物递送之后不需要被移除的设备。低模量弹性体的例子包括聚氨基甲酸酯、硅树脂、苯乙烯热塑性弹性体和聚(甘油-癸二酸酯)(PGS)。弹性丝可被涂有生物相容的聚合物,例如从硅树脂、聚氨基甲酸酯、苯乙烯热塑性弹性体、Silitek、Tecoflex、C-flex和Percuflex中的一种或多种形成的涂层。
例如,在图1-2所示的实施方式中,保持框架14包括从超弹合金形成并覆盖在聚合物涂层18中的弹性丝16。弹性丝16可为例如镍钛诺丝。聚合物涂层18可为例如硅树脂套。在图1所示的相对扩张的或纽结形形状中,设备10可占据具有适合于阻止从膀胱排出的尺寸的区域。在图2所示的相对较低的剖面形状中,设备10可占据适合于插入进体内的区域。因此,当在相对较低的剖面形状例如膀胱镜的工作通道中时,设备10可 安装在导管20中。由于弹性丝的特性,设备可作为弹簧起作用。因此,设备可响应于压缩负载而变形,但一旦负载被移除时可自发地返回到其初始形状。聚合物涂层可使设备的外表面相对平滑和柔软,以便避免膀胱的刺激。
在实施方式中,保持框架也可包括不透射线的材料,其可提高设备对X射线的可见性或其它成像技术。在图1-2所示的实施方式中,例如,不透射线的材料是缠绕在弹性丝16的端部周围的铂丝20,虽然铂丝20可缠绕在弹性丝16的其它部分周围。平滑材料也可应用于弹性丝的端部以减小端部的钝性。在图1-2所示的实施方式中,例如,平滑材料22是应用于端部的紫外可固化的环氧树脂。紫外环氧树脂也可有助于将铂丝20保持在适当的地方。
在保持框架呈现纽结形形状的实施方式中,保持框架可能对压缩力相对有抵抗力。纽结形形状基本上包括两个子圆,每个子圆具有其自己的较小的弓形,且子圆共享公共的较大的弓形。当两个子圆首先被压缩在一起时,最大的弓形吸收大部分压缩力并开始变形。由于压缩力的连续施加,两个子圆的较小弓形重叠。随后,所有三个弓形抵抗压缩力。一旦两个子圆重叠,设备的压缩阻力就作为整体增加。这样的配置可在排尿期间在膀胱收缩时防止设备塌陷,以阻止从膀胱中意外排出。实例4较详细地解释了这个结果。
在保持框架包括形状记忆材料的实施方式中,用于形成框架的材料可“记住”相对扩张的形状,并可在将热应用于设备时自发地呈现相对扩张的形状。例如,保持框架可设计成在暴露给体温时返回到相对扩张的形状,以便设备可在进入膀胱时扩张。
保持框架可以是具有足够高的弹簧常数以将设备保持在体腔例如膀胱内的形状。这可通过从高模量材料或低模量材料形成保持框架来实现。特别地,在保持框架从相对低模量材料形成的实施方式中,保持框架可形成为具有提供适当的弹簧常数的直径和/或形状的配置。在一种情况下,弹性丝可包括具有弹簧常数的形状的低模量弹性体,当受到与排尿相关的力时,在没有该低模量弹性体的情况下,弹性丝将以另外方式经受明显的变 形。例如,保持框架的弹性丝可包括一个或多个圈、线圈、螺旋或其组合,这可减少弹性丝在排尿期间变形的趋势。换句话说,由于圈、线圈和/或螺旋,弹性丝可充当弹簧,即使在弹性丝从低模量弹性体例如聚氨基甲酸酯或硅树脂形成的情况下。
圈、线圈或螺旋可特别设计成获得期望的弹簧常数。在各种实施方式中,弹簧常数可在大约3N/m到大约60N/m的范围内。例如,弹簧常数可在大约3.6N/m到大约3.8N/m的范围内。这样的弹簧常数可通过下列技术中的一种或多种获得:增加用于形成框架的弹性丝的直径,增加弹性丝的一个或多个圈的曲率,以及给弹性丝添加额外的圈。下面在实例5中提供了某些低模量丝的示例性弹簧常数。
框架的圈、线圈或螺旋可具有很多配置。例如,框架可在卷曲的配置中,例如在包括一个或多个环、卷曲或子圆的配置中。图6示出包括一个或多个环、卷曲或子圆的框架的示例性形状。卷曲可以如实例B、C、D和E中所示的线性方式或以如实例F和G中所示的径向方式整体地连接。卷曲可在同一方向上旋转,如实例B和E中所示,或在交变的方向上旋转,如实例C和D中所示。卷曲也可重叠,如实例A、B和E所示。弹性丝的相对端可适合于避免组织刺激和结疤。例如,端部可为柔软的、钝的、向内指向的、连接在一起的或其组合。框架还可包括布置在两维或三维配置中的一个或多个圆或椭圆。图7示出包括布置在两维或三维配置中的一个或多个圆或椭圆的框架的示例性形状。框架可包括如实例A中所示的多个同心圆或如实例B和C中所示的多个同心椭圆。每个圆或椭圆可为封闭的,且圆或椭圆可在公共连接点被连接。可选地,一个或多个圆和椭圆可为开放的。圆和椭圆也可在公共连接点被连接。框架还可包括多个重叠的圆或椭圆。重叠的圆和椭圆每个可实质上是相同的尺寸,如实例D中所示,或圆或椭圆可在尺寸上变化,如实例E和F中所示。圆也可与椭圆合并,取决于实施方式。进一步地,框架可为开口端螺旋,如实例G中所示,或框架可为具有封闭端的螺旋。
部件的组合
囊保持框架与药物储蓄器部分相结合,以形成药物递送设备。设想了各种不同的结合。例如,药物储蓄器部分可连接到囊保持框架的中间区域。更具体地,囊保持框架可具有第一端、相对的第二端和其间的中间区域,且药物递送部分可具有连接到囊保持框架的中间区域的第一和第二端部分。药物储蓄器的端部部分可在囊保持框架处终止,端部部分可与囊保持框架重叠,或这两者的组合。药物储蓄器部分可参考保持框架被定向,使得药物储蓄器部分位于保持框架的周界内,保持框架的周界之外,或其中的组合。此外,多个药物储蓄器部分可与单个保持框架结合,取决于设备的配置。
图8示出纽结形形状的保持框架80的示例性实施方式,其具有连接在保持框架80的中间区域处的一个或多个药物储蓄器82。特别地,实例A示出具有一个药物储蓄器的实施方式,其中药物储蓄器位于保持框架的周界内,并具有在保持框架处终止的连接到保持框架的中间区域的端部部分。实例B示出具有一个药物储蓄器的实施方式,其中药物储蓄器位于保持框架的周界的外部,并具有与保持框架稍微重叠的连接到保持框架的中间区域的端部部分。实例C示出具有多个药物储蓄器部分的实施方式,每个药物储蓄器部分位于保持框架的周界内,而实例D示出具有多个药物储蓄器部分的实施方式,一些药物储蓄器部分位于保持框架的周界内,而一些药物储蓄器部分位于保持框架的周界外。
在一个实施方式中,多个药物储蓄器部分与单个保持框架结合。例如,图9示出保持框架90的实施方式,其具有连接在保持框架90的中间区域处的多个药物储蓄器部分92,设备在图9A中被示为相对扩张的形状,而设备在图9B中被示为在导管内相对较低的剖面形状。包括多个分立的药物储蓄器部分可便于将多种不同的药物递送到体内,将不同形式的药物递送到体内,以变化的速率将药物递送到体内,或其中的组合。
在其它实施方式中,药物储蓄器部分和囊保持框架部分可至少部分地对准。换句话说,药物储蓄器部分可沿着保持框架部分的长度的至少一部分延伸,实质上与保持框架部分平行或重合。例如,药物储蓄器部分可沿着保持框架部分的整个长度延伸。这样的实施方式的实例在图10中示出,图10以横截面示出几个可选的实施方式。虽然只示出一个横截面,设备沿着实质上设备的整个长度或沿着设备的相当大的部分可具有相同的横截面或类似的横截面配置。保持框架可包括与药物储蓄器部分的管100结合的弹性丝102,如实例A、B、C和D中所示的。弹性丝102可沿着管100的外表面延伸,如实例A中所示的。弹性丝102也可沿着管100的内表面延伸,如实例C中所示的。弹性丝102还可通过管100的表面延伸,如实例B中所示的。在实施方式中,管100可在弹性丝102附近以加固区104加强,加固区104可减少弹性丝102通过管100撕裂或变得与管100分离的危险。例如,加固区104可为额外硅树脂的区域。弹性丝102也可位于被网106支撑的管100的内部之内,如实例E、F和G中所示的。除了支撑弹性丝102之外,网106可将管100分隔成多个隔间。例如,网106将管100分隔成实例E中的两个隔间、实例F中的三个隔间以及实例G中的四个隔间,虽然其它配置是可能的。网106可被穿孔或以另外方式是非连续的,使得隔间彼此相通。可选地,网106可为相对连续的,以便隔间彼此隔离。在这样的实施方式中,分立的隔间可形成可适合于保持不同的药物制剂的不同的储蓄器。网106可从与管相同的材料或从对水或尿有不同的渗透性的材料形成,取决于实施方式。
在又一些其它实施方式中,弹性丝可与多个管结合,沿着管或在管之间延伸。这样的实施方式的实例在图11中示出,图11以横截面示出几个可选实施方式。在这样的实施方式中,多个分立的管110可通过加固区114连接在一起,弹性丝112嵌入加固区114中,如实例A、B和C中所示的。管110的数量可变化。例如,在实例A中示出两个管110,在实例B中示出三个管110,而在实例C中示出四个管110,虽然在没有示出的实施方式中可提供额外的管。在这样的实施方式中,相同或不同的药物制剂可被装入分立的管110中。分立的管110也可从相同或不同结构材料形成,例如对尿或其它水液体或体液的渗透性不同的材料。
上述实施方式可合并且变化,以产生落在本公开的范围内的其它药物递送设备。例如,药物储蓄器部分可用任何方式连接到除了中间区域以外的保持框架的任何部分。此外,药物储蓄器部分可缠绕在保持框架的弹性 丝周围一次或任何数量的次数。应注意,为了简单起见,保持框架通常被描述为弹性丝,以及在这些实施方式的任一个中弹性丝可被覆盖有聚合物管,如上面参考图1所述的。此外,术语“药物储蓄器部分”通常指与保持框架结合的分立的管,虽然该管可为分离的或以另外方式分隔成任何数量的分立的药物储蓄器,如上面参考图4和图11所述的。提供多个药物储蓄器部分、将单个药物储蓄器部分分成多个药物储蓄器、或两者的组合可便于将多种不同的药物递送到体内,将不同形式的药物递送到体内,以变化的速率将药物递送到体内,或其中的组合。例如,设备可将药物保持在液体形式中用于在植入时较早地释放,并保持在固体或半固体形式中用于在药物溶解之后稍后释放。
药物储蓄器部件可使用基本上任何生物相容材料或结构连接到囊保持框架。例如,药物储蓄器部分可使用医疗级硅树脂粘合剂连接到保持框架。
在实施方式中,药物储蓄器部件可通过至少部分地将保持框架的弹性丝嵌入药物储蓄器部分的弹性管内而连接到囊保持框架。在图12所示的实施方式中,纽结形形状的弹性丝120的一部分延伸而通过药物储蓄器部分122的第一和第二端,虽然其它配置是可能的。在这样的实施方式中,药物储蓄器部分的管可与其内的丝一起形成,或管可在这两个部分形成之后被丝穿过,以连接它们。
在又一些实施方式中,药物储蓄器部分可与保持框架整体地形成。例如,可使用铸造方法,其可包括将可固化硅树脂灌注到模子中并允许硅树脂固化。在一些这样的实施方式中,弹性丝可连同硅树脂一起位于模子中。
进一步地,在一些实施方式中,药物储蓄器部分和保持框架部分可为相同的部件。在这样的情况下,设备可包括硅树脂管,其在具有足够的弹簧常数以将设备保持在体内的配置中形成,如上所述。在这样的情况下,连接可能不是必要的。
其它设备特征
从单个设备递送的药物的速率和总量可依赖于例如药物储蓄器部分的表面积、药物储蓄器部分的结构材料的类型和渗透性、通过药物储蓄器部 分形成的孔的数量、以及药物载荷的总质量连同其它因素。可为不同的药物和治疗选择对特定体腔和植入路线的特定的目标治疗剂量和可接受的植入尺寸。
在实施方式中,药物储蓄器部分可部分地或全部覆盖有涂层或套,这可便于控制释放率。与药物储蓄器部分相比,涂层或套对水的渗透性可能相对更小。因此,涂层或套可调节或减小药物储蓄器部分的渗水性,以控制或减慢药物从设备的释放率。在一些情况下,涂层或套可能对水是部分渗透的,在这种情况下涂层或套可覆盖药物储蓄器部分的全部或一部分。例如,涂层或套可包括覆盖实质上整个设备的网状物。在其它情况下,涂层或套可实质上对水是不可渗透的,在这种情况下涂层或套可只覆盖设备主体的一部分。不管怎样,涂层或套可减小或改变设备主体的渗透表面积。由于减小的或改变的渗透表面积,药物从药物储蓄器部分的释放率可被减小或改变。
因为涂层或套可允许控制释放率,药物储蓄器部分可依尺寸制造、成形并构造成容纳某个药物有效载荷体积,以获得一定的柔韧性或弹簧常数,或在植入期间或在植入时呈现某种形状,连同其它特征。可选择药物储蓄器部分的这些特征,而不考虑这种特征如何影响释放率,因为释放率可独立地通过控制具有涂层或套的渗透表面积来控制。因此,释放率可改变,而不改变设备主体的总尺寸、设备主体的形状或用于形成设备主体的材料。
在药物储蓄器部分由硅树脂管形成的情况下,涂层或套可由与硅树脂相比对水或尿的渗透性相对更小的材料形成。例如,涂层或套可由聚合物、聚对二甲苯、可固化的硅树脂或本领域已知的另一生物相容的涂层或套材料形成。在一个实施方式中,设备主体可由硅管形成,而套可由聚氨基甲酸酯形成。
涂层或套可为沿着设备主体是相对均匀的,以便于药物从储蓄器的相对均匀的释放。可选地,涂层或套可沿着设备主体变化,使得设备主体的某些部分具有相对于设备主体的其它部分更高或更低的渗水性。例如,涂层或套的一个或多个特征可在设备主体上变化,以获得期望释放率。可变 化的涂层或套的示例性特征包括:涂层或套的厚度、尺寸或形状;设备主体上的涂层或套的定位、位置或方向;以及用于形成涂层或套的材料,连同其它特征。
进一步地,沿着设备主体的不同部分可设置多个涂层或套。在一些情况下,多个涂层或套可相应于在设备主体中形成的多个储蓄器,多个储蓄器中的每个包含不同的药物。在这样的情况下,多个涂层或套可具有相同的特征,以允许不同药物从不同储蓄器的相对均匀的释放。可选地,多个涂层或套可具有不同的特征,以允许不同药物从不同储蓄器的不同释放率。示例性涂层或套的特征可以不同以改变释放率,这些特征包括厚度、尺寸、形状、位置和材料连同其它特征,如上所述。例如,在第一储蓄器周围的管可涂有第一材料和第一厚度的第一涂层,而第二储蓄器周围的管可不被涂覆、涂有第二(不同的)涂覆材料、或涂有第一涂覆材料但以第二(不同的)厚度。因此,来自第一储蓄器的释放率可不同于来自第二储蓄器的释放率。
在实施方式中,在设备主体周围的涂层或套的定位可被选择成增加或以另外方式控制药物的固体或半固体形式的溶解。在图13中示出一个实例。如所示,设备主体130可由管132例如硅树脂管形成。管132可具有两个相对的端部133。微球体134可封住每个端部133,且储蓄器135可在端部133之间形成。通过管132形成的口136可允许药物从储蓄器135释放。为了控制药物从口136的释放,至少一个套138可位于管132周围。例如,套138可位于在口136和端部133之间的管132的每侧上。所以药物不变得淤塞在套138之下,套138可与端部133向内间隔开。如所示,套138可比端部133相对于较接近于口136,例如正好相邻于口136,虽然其它配置是可能的。套138的这样的布置可便于将药物从口136释放,因为该定位可允许水渗透过与端部133相邻的管132。当水通过与端部133相邻的管132渗透时,药物可通过管132的被套138覆盖的部分被推动并从口136出来。因此,可避免位于套138之下的药物的隔离或淤塞。下面的实例11和12提供了对具有套的药物递送设备的释放率数据,并且还提供了用于选择套的长度以获得期望释放率的示例性方程。
在优选实施方式中,管优选地包括至少一个不透射线部分或结构,以便于设备的检测或观察,作为植入或解释程序的部分。在一个实施方式中,管由包括不透射线填料材料的材料构成,例如硫酸钡或本领域已知的另一不透射线材料。
在管的处理期间,硅树脂管可通过混合不透射线填料例如硫酸钡或其它适当的材料被制成不透射线的(对于X射线成像或荧光镜透视)。超声成像也可检测体内硅树脂,但如果设备保持小则超声成像可能经受缺乏能够使设备正确地成像的分辨率。通过给执行程序的专业人员提供设备的位置和方向的精确实时的成像,荧光镜透视在不可再吸收的设备的部署/收回期间可能是优选的方法。
在一个实施方式中,膀胱内药物递送设备的主体还包括至少一个收回特征。收回特征可以是便于设备从体腔移除的结构,例如对于在药物制剂的释放之后不可再吸收的设备主体的移除。在美国专利申请号11/463,956中描述了收回特征的实施方式。在这些和其它实施方式中,可使用常规内窥镜抓握仪器例如鳄口钳、三或四叉光学抓紧器来收回设备。例如,如果设备具有O形或卷曲的部分,则设备的移除可通过那些抓握仪器而更容易。
在实施方式中,可设计设备,以施用药物来在急性期期间获得直接的效果并在维护期期间获得延长的效果。例如,设备具有两个药物储蓄器或药物储蓄器部分,其中之一配置成在植入之后相对快地释放药物,而其中之一在开始释放之前经历诱导时间。为了实现这样的结果,这两个药物储蓄器或药物储蓄器部分可具有不同的配置,例如不同的渗透性,或这两个药物储蓄器或药物储蓄器部分可存储不同形式的药物,例如用于立即释放的液体形式和在释放之前溶解的固体形式。这些实施方式可合并,并随着这里描述的其它实施方式变化,以获得期望释放概况。
II.制造设备的方法
在另一方面,提供了制造可植入式药物递送设备的方法。图14是示出这样的方法140的实施方式的方框图。在框142中,形成药物储蓄器部分。在框144中,形成囊保持框架部分。在框146中,药物储蓄器部分与囊保持框架部分结合。
在实施方式中,在框142中形成药物储蓄器部分可包括下列子步骤中的一个或多个:形成药物储蓄器管,形成相对固态的药棒,将药棒装入管中,将密封材料插入管中药棒的一端和管的一端之间,以及在管中形成一个或多个孔。
可使用传统方法,例如注射成型、模压成型、挤出成型、传递成型、插入成型、热成形、铸造或其组合来形成药物储蓄器管。中空管可从生物相容的、可渗水的、弹性或其任何组合的材料形成。例如,管可包括硅树脂。
通过用包括药物的水溶液填充模子并允许溶剂从容液蒸发可形成药棒。例如,通过用利多卡因的水溶液填充模子,允许溶剂的至少一部分蒸发以形成药物的饱和或过饱和的溶液,并接着结晶化因而产生的凝胶以形成利多卡因药棒,可形成利多卡因药棒。种子晶体可被放入饱和或过饱和溶液中,以开始晶体生长因而开始药物的沉淀。在这样的情况下,可在一个或多个被控制的温度时完成蒸发和结晶步骤。作为另一例子,盐酸利多卡因可按70∶30的混合比率与硫酸C软骨素合并,以产生具有一些硬度的药棒来增强设备的处理,虽然这样的过程牺牲盐酸利多卡因的一些有效载荷。该牺牲是否是可接受的取决于特定的设备设计和应用/使用。
在形成药棒的实施方式中,药物储蓄器部分的管可以或可以不用作模子。在管不用作模子的实施方式中,通过使用例如导丝和/或镊子将药棒操纵到管中可将完整的药棒装入管中。
在药物制剂是液体形式的实施方式中,药物制剂可通过孔或通过随后被密封的另一开口来被装入药物储蓄器部分中。然而,装入以固体或半固体形式的药物可能相对更容易,且这样的形式可进一步减小设备的尺寸,这可便于减小对周围组织的刺激。
一个或多个孔可在下列的一个或多个中形成:管的侧壁、管的端部或其组合。一个或多个孔可通过在管中以激光钻一个或多个孔来形成。激光钻孔可出现在药棒被装入管之前或之后。可选地,孔可与设备主体同时形成,例如,如Richards等人的美国专利号6,808,522中描述的通过使用压头模制。
在实施方式中,在框142中形成药物储蓄器部分可包括在单个药物储蓄器部分中形成多个不同的药物储蓄器。在这样的实施方式中,一个或多个分隔结构可例如使用导丝被插入并放置在管内。在多个储蓄器和分隔物被使用的情况下,分隔结构的安装可与药物制剂的装入交替。例如在分隔物具有比管的内径稍微大的外径的情况下,可使用粘合剂或通过与管的摩擦啮合来固定分隔结构的位置。
在实施方式中,在框142中形成药物储蓄器部分还可包括使一个或多个释放控制结构与药物储蓄器部分结合。例如,套或涂层可放置在管的表面的至少一部分上,以控制药物的释放率。此外,可降解膜可位于一个或多个孔上或内,以控制药物通过其释放的开始时间。通过微量注射或喷墨打印流体以在孔的一端例如在管的外表面开口中/上形成膜,可形成可降解膜。例如,流体可为包括溶解在溶剂中的可再吸收材料的溶液、包括非溶剂中的可再吸收材料的悬浮液、或液化的可再吸收材料。此外,药物储蓄器部分可由设计成以已知的速率释放的药物聚合复合物形成。
在实施方式中,形成囊保持框架部分的步骤可根据用于形成框架的材料变化。在保持框架包括由超弹性合金或形状记忆材料形成的弹性丝的实施方式中,例如,形成囊保持框架的步骤可包括使弹性丝形成为相对扩张的形状,以及通过热处理将该形状“设计”成弹性丝。例如,通过使弹性丝16形成为纽结形形状且在超过五分钟的时期内在高于500℃的温度时对弹性丝16进行热处理可形成图1所示的保持框架14。同样,在这样的实施方式中,形成囊保持框架部分可包括下列中的一个或多个:在弹性丝上形成聚合物涂层或套,使弹性丝的端部平滑,以及将不透射线的材料应用于弹性丝的至少一部分。在这样的实施方式中,聚合物套、不透射线的材料和平滑材料可按任何顺序应用于弹性丝。例如,铂丝可缠绕在弹性丝的端部周围,以提高设备对x射线的不透射线性,弹性丝的端部可使用紫外可固化的环氧树脂被平滑,且聚合物套或涂层可放置在弹性丝上。
在保持框架包括低模量弹性体的实施方式中,形成囊保持框架的步骤可包括在框架中形成一个或多个圈、线圈、环或螺旋,以便框架作为弹簧 起作用。例如,保持框架可通过挤压、液体注射成型、传递成型或插入成型连同其它方式形成。
在实施方式中,使药物储蓄器部分与囊保持框架部分结合的步骤可包括使药物储蓄器部分关于保持框架部分定向,以及在其间施用粘合剂。药物储蓄器部分可如上所述在各种方向上被定向。在其它实施方式中,使药物储蓄器部分与囊保持框架部分结合的步骤可包括将保持框架部分的弹性丝至少部分地插入通过药物储蓄器部分。在又一些其它实施方式中,使药物储蓄器部分与囊保持框架部分结合的步骤可包括将这两个部分整体地形成在一起。
III.设备的使用和应用
膀胱内药物递送设备可用于将药物局部递送到基本上任何体腔部位。在优选实施方式中,体腔可为需要治疗的男性或女性人患者的膀胱。例如,膀胱内药物递送设备可用在间质性膀胱炎、放射性膀胱炎、膀胱过度活动综合症或膀胱癌的治疗中,虽然设备也可将药物递送到膀胱用于其它疾病的治疗。在其它实施方式中,本膀胱内设备可用在患者的其它体腔中。例如,小设备可被植入阴道、胃腔、腹膜腔或眼眶的空间中。
在一个实施方式中,膀胱内药物递送设备被植入患者的膀胱内,以局部递送局部麻醉剂,用于治疗从任何源产生的相关疼痛。例如,它可以是来自泌尿生殖器组织中的任何疾病或疾患的疼痛、起源于任何膀胱导管插入操作本身例如术后导管插入术的疼痛。
设备可通过任何适当的腔设备来植入患者的膀胱中,该腔设备在这里通常被称为如本领域已知的导管、导尿管或膀胱镜。这些术语可在这里可互换地使用,除非另外明确指示。导管可为在市场上可买到的设备或特别适合于适应本药物递送设备的实施方式的设备。
在一个例子中,在体腔内植入膀胱内药物递送设备的方法包括使膀胱内药物递送设备以相对低剖面形状通过导管,以及将设备从导管释放到体腔中,一旦设备从导管出现时设备呈现相对扩张的形状,以保持在体腔中。在实施方式中,相对较低的剖面形状可为相对线性的、折叠的、扩张的或 压缩的形式。导管可插入尿道中以允许接近膀胱。图15示出该方法的释放步骤的实施方式。如图15所示,设备152可使用管心针154被推动而通过导管150。如所示,设备152在从导管150出现时改变形状,返回到相对扩张的形状用于保持在膀胱中。美国专利号6,139,535也描述了用于通过尿道将医疗设备放置在膀胱中的方法和装置。
在实施方式中,膀胱内药物递送设备包括以相对固体形式例如药棒或粉末形式的药物。当药棒溶解时,来自设备的药物洗脱出现。也就是说,当药物接触并在进入设备的体液中被溶解时,溶解的药物在渗透压下从植入设备扩散或流动。例如,设备可被递送到膀胱,在这种情况下药物可在与膀胱中的尿接触时被溶解。
在一个实施方式中,膀胱内药物递送设备是不可再吸收的或以其他方式需要在植入之后被移除。在一个这样的情况下,在前面的段落中描述的方法还包括在药物的释放之后从体腔移除膀胱内药物递送设备。专用收回设备在本领域中是已知的,并可容易为此目的产生。例如,美国专利号5,499,997描述了膀胱镜抓握方法和装置。
设备可用于将药物局部递送到膀胱作为全身递送的可选方案,这在全身递送可能引起不希望有的副作用或导致药物的不足的生物利用率的情况下是合乎需要的。
本膀胱内药物递送设备治疗方法提供了期望数量的药物在期望的(预定的)一段时间内的延长的、连续的、间歇的或周期性的释放。在一个实施方式中,设备可在延长的一段时间例如24小时、5天、7天、10天、14天或20、25、30、45、60或90天或更多天内递送期望剂量的药物。药物的递送率和剂量可根据正被递送的药物和正被治疗的疾病/病症来选择。不同降解率和/或赋形剂材料的使用连同改变设备中孔的数量和尺寸可用于使设备适合于有不同的释放动力学。
在优选实施方式中,设备被施用至(即,植入)患者的膀胱中,并以控制的方式将药物制剂递送到膀胱。在特定的实施方式中,药物制剂包括在膀胱过度活动综合症、膀胱癌、间质性膀胱炎的治疗或疼痛缓解中有用的一种或多种药物。
例如,设备可用于在延长的一段时间例如多于一天的时期内将利多卡因局部递送到膀胱。有利地,设备实现例如利多卡因到膀胱的递送,以提供在膀胱组织中的利多卡因的局部浓度的增加,而不产生高的全身水平。
图16是示出将利多卡因递送到膀胱的方法160的方框图。在框162中,具有利多卡因的有效载荷的设备被递送到膀胱。在框164中,利多卡因在延长的一段时间内从设备连续地释放。在这样的实施方式中,设备可为上述设备的实施方式,或设备可为任何其它设备。在实施方式中,利多卡因的有效载荷可在大约50mg到大约100mg的范围内。这段延长的时间可在例如大约一天到大约14天的范围内。这样的方法可在膀胱的尿道上皮中达到利多卡因的持续水平。
有利地,在尿道上皮中使用本设备和方法可达到的利多卡因的持续水平可能超过通常被认为全身可容忍的水平。提供了药物的高局部浓度,而没有相当大的全身浓度。这实现利多卡因的相对小的有效载荷的有效使用,以在尿道上皮中产生利多卡因的在治疗上有效的浓度。尿道上皮利多卡因浓度可能超过可在全身得到的浓度,而不引起全身效应。尿道上皮利多卡因浓度也可超过可通过滴注获得的浓度,且进一步地,与滴注相关的高初始峰值浓度可被避免。小的有效载荷可便于设备安全,因为有效载荷可足够小以避免不希望有的全身效应,即使在设备故障的情况下。然而,由于递送的局部性质,小有效载荷可能产生尿道上皮中的利多卡因的有效浓度。见下面的实例8。
在实施方式中,该方法可递送利多卡因,而不考虑尿的pH。例如,利多卡因不需要与缓冲剂例如重碳酸钠一起被施用。见下面的实例9。
在实施方式中,该方法可递送以相对固体形式的利多卡因,这可允许减小设备的尺寸以避免膀胱刺激和患者不适。
在实施方式中,(1)将具有利多卡因的有效载荷的设备递送到膀胱可包括将具有利多卡因的第一和第二有效载荷的设备递送到膀胱;以及(2)在延长的一段时间内从设备连续释放利多卡因可包括开始释放利多卡因的第一有效载荷以及随后开始释放利多卡因的第二有效载荷。第一有效载荷可适合于相对快的释放,而第二有效载荷可适合于更连续的释放。例如, 第一有效载荷可为液体形式,而第二有效载荷可为固体形式。作为另一例子,第一有效载荷可被容纳在相对快起作用的渗透泵中,例如具有相对较薄的壁的硅树脂管,而第二有效载荷在释放之前可被容纳在经历初始延迟或诱导时间的渗透泵中,例如具有相对较厚的壁的硅树脂管。因此,该方法可在初始急性期期间和在维持期期间将利多卡因连续释放到膀胱中。这样的方法可补偿设备的初始诱导时间,如下面参考实例8所述的。
参考下面的非限制性实例可进一步理解本发明。
实例1:管状渗透泵的设计
下面描述了由硅树脂制成的管状渗透泵的设计。根据对水(和药物)的渗透性和医学特性可使用其它生物相容的聚合物管例如聚氨基甲酸酯。管状渗透泵的设计方程允许获得期望药物有效载荷和释放率。管厚度与机械完整性和水渗透性有关。管内径和管壁厚度确定药物有效载荷和管的外径。管长度影响药物有效载荷以及管状渗透泵的宏观尺寸或环直径。水或尿可通过管渗透的渗透表面积被管外径和管长度影响。这些参数影响渗透泵的总性能。
管状渗透泵将药物保持在内部储蓄器上,并能够将药物传输到外部介质。下面定义管状渗透泵的参数。
C:设备储蓄器中的瞬时药物浓度
ρ:药物密度
S:药物溶解性
d:管内径
h:管壁厚度
D:由管制成的宏观环的直径
L:管总长度,L=πD
Ln:没有渗透阻挡套的管长度
LS:有渗透阻挡套的管长度,LS=L-Ln
V:药物储蓄器的体积,
m:在设备储蓄器中剩余的瞬时药物量,
mρ:总药物有效载荷,
Δ∏:在管内部和外部之间的渗透压差
Δ∏s:在管内部和外部之间在饱和时的渗透压差
k:溶剂输送的渗透率系数
A:水渗透的渗透表面积,A=π(d+h)Ln
tZ:零级释放的持续时间
在储蓄器中的药物质量变化的速率,
ms:在零级释放期间释放的量,
参数“dm/dt”被定义为在设备储蓄器中的药物质量损失的速率,因为“m”指示在设备储蓄器中剩余的瞬时药物量。表达式“dm/dt”中的负号反映一旦设备被浸没在水或尿中设备就将通过渗透释放而失去其药物的事实。当周围介质的渗透压与药物储蓄器内部的制剂的渗透压比较足够小时,范特霍夫(van’t Hoff’s)定律可用于获得:
其中使用在渗透压和浓度之间的比例关系。
当药物储蓄器内部的浓度是所装入的药物的溶解性时来自设备的药物释放率在初始时间段时是恒定的。在该初始“零级释放期”期间释放的药物的量可被表示为:
药物释放率在零级释放期之后减小,是因为储蓄器内部的药物浓度减小。储蓄器中药物质量变化的速率(dm/dt)仍然可按照零级释放率 表示:
在储蓄器中剩余的药物的量(m)和药物质量变化速率(dm/dt)的表 达式对两个时间段一零级释放期和非零级释放期是不同的。零级释放期(0≤t≤tz)的表达式是:
方程(1.3)可被积分以找到对非零级释放期(t≥tz)的表达式。药物浓度(C)和药物质量(m)是时间依赖性变量且通过下式相关:
m=CV (1.6)
在合并方程(1.6)与方程(1.3)之后,方程(1.3)可从tz被积分到t以得到
在时刻t(≥tz)时储蓄器内部剩余的药物质量可被表示为:
以及
其中
在tz之外设备储蓄器中的药物质量可被表示为:
m=αmρ(α≤1) (1.11)
其中α是指示与初始装载比较剩余的药物质量的比率参数(例如,如果α是0.05,则在设备中保留5%的总有效载荷或95%的总有效载荷被释放出)。将方程(1.11)代入方程(1.8)中得到时间t为
实例2:不同设备的释放概况的比较
在这里介绍了方程(1.12)的应用的实例。图17示出三个不同的设备A、B和C,而图18是示出这三个不同的设备A、B和C的体外药物释放概况的曲线。每个设备是作为渗透泵起作用的管。管由硅树脂形成。每个管限定内部储蓄器,并且利多卡因的体积被装入储蓄器中。每个管也限定外部渗透表面积,且口在渗透表面积中形成。口允许利多卡因在渗透压下从储蓄器释放。
更具体地,设备A是具有大约2cm的渗透表面积和大约2mg的储蓄器体积的硅树脂管。设备B是具有大约1cm的渗透表面积和大约1mg的储蓄器体积的硅树脂管。设备C是具有大约2cm的渗透表面积和大约2mg的储蓄器体积的硅树脂管,该渗透表面积的一半覆盖有在释放口附近的两个聚氨基甲酸酯套。由于套,设备C的有效渗透表面积与设备B的渗透表面积大约相同,然而设备C的储蓄器体积与设备A的储蓄器体积大约相同。对于每个设备,硅树脂管的端部用微球体密封,且储蓄器载有利多卡因。在设备C的情况下,套放置成相对接近口,以在释放期间限制利多卡因的隔离。
设备接着在体外在37℃的水中被测试,且因而产生的释放概况在图18中绘制出。在表1中示出每个设备的药物有效载荷(mρ)、零级药物释放率 和递送时间比例 作为相对于设备A的值的相对值。因为设备B具有设备A的长度的大约一半的长度,设备B的药物有效载荷和零级释放率都为设备A的值的大约一半,这导致设备A和设备B的相同的递送时间比例。图18显示,相对于时间的总的体外释放概况对设备A和设备B是类似的。设备C具有与设备A的长度大约相同的长度,但设备C的长度的大约一半覆盖有聚氨基甲酸酯套,以减少或最小化水渗透。因此,设备C的零级释放率为设备A的零级释放率的大约一半。因此,设备C的递送时间比例为设备A的递送时间比例的大约两倍。图18显示, 设备C的药物释放比设备A的药物释放慢大约两倍。
表1:在图17中所示的被标为A、B和C的三个设备的比较
实例3:达到期望释放率的设备特征的选择
下面列出的是允许选择设备特征以达到期望释放率的方程。更具体地,方程可允许确定设备的多少应被覆盖有涂层或套,以对某个有效载荷达到某个释放率。可确定关于控制尺寸的控制设备的设备特征,该控制设备在体外测试期间根据控制释放概况释放控制药物有效载荷。一旦这些控制参数是已知的,方程就可确定与控制设备比较展示目标释放率的目标设备的特征。
为了举例的目的,图17的设备A是控制设备。设备A具有下面的设计参数:
管内径:do=0.3048mm
管壁厚度:ho=0.1651mm
管长度:Lo=2cm
有效载荷:mρ,o=2mg
处理持续时间:大约3天
在图18中图示出设备A的控制释放率mz,o。在控制设备上以这样的参数开始,下面的方程允许获得与控制设备比较展示对期望有效载荷的期望递送率的目标设备的设备特征。更具体地,定义了两个变量:
a=目标零级递送率的乘法因子
b=分别地,目标有效载荷的乘法因子。该定义产生如下的期望目标条件:
药物有效载荷(mρ):与基本条件比较增加b倍
这里假定药物和管材料对基本条件和目标条件都保持相同。目标条件的参数在这里没有下标。零级递送率条件给出:
且药物有效载荷条件给出:
管壁厚度可变化,但在这里为了简单起见它是固定的:
h=ho (1.15)
注意,太薄的管壁可能没有足够的机械完整性,而太厚的管壁可能对从设备的初始药物释放经历不合乎需要地长的诱导时间。因此,管壁厚度的合理范围可根据用于形成聚合物管的材料的机械特性和渗水性来确定。
当药物被装入管内时,具有适当的薄壁的硅树脂管可充当可渗水的膜。下面的方程首先考虑渗水管未覆盖有聚合物套的情况。图18中的设备A和设备B示出这样的情况。水可通过管的整个长度渗透到药物储蓄器中,因此
L=Ln (1.16)
内径的二次方程可从方程(1.13)和方程(1.14)得到为:
其中一个解为正而另一解为负。正解被表示为d1,因而对管长度的解为:
因此,一旦选择了递送率和药物有效载荷的乘法因子,就可计算管内径和管长度。下面在表2中示出两个实例。对于由不同的聚合物形成或容纳其它药物的管,可执行额外的体外释放研究来获得对聚合物管和药物的 那个特定组合的基本条件。
表2:对人类应用的设备的两个实例的规格
如上所述,覆盖有套的长度被表示为LS。前面的部分相应于LS=0的情况,这常常是通常希望减小设备的直径的情况。例如,省略套可便于将设备插入通过膀胱镜的工作通道,该工作通道具有大约2.4mm或更小的直径。然而,方程接着考虑渗水管至少部分地覆盖有减小管的渗水性的材料,意味着LS>0。图18中的设备C示出这样的情况。设备C可至少部分地覆盖有套或涂层,其由具有对水的相对低的渗透性的聚合物如聚氨基甲酸脂制成,这样的聚合物可减小或最小化水渗透入管中。特殊涂层例如聚对二甲苯也可用于减小水渗透。方程(1.13)和方程(1.14)显示,当管内径(d)减小(L∞1/d2和Ln∞1/(d+h))时,管长度(L)增加得比套覆盖长度(Ln)快。覆盖有套的部分的长度为
LS=L-Ln (1.19)
使用方程(1.13)、(1.14)和(1.19),覆盖有套的长度被表示为:
或使用方程(1.18),得到如下
其中下标1指示不使用套的情况。覆盖有套的管长度的部分可按照管内径 (d)表示为
或按照环直径(D)表示为
实例4:选择弹性丝的特征
在图19所示的纽结形形状的保持框架上执行压缩测试,以展示各种设计因素如何影响保持框架的弹簧常数。纽结形形状的弹性丝由具有0.009英寸或0.2286mm的超弹性镍钛诺丝制成。当执行压缩测试时,收集关于力和位移的数据。该数据被绘制在图20所示的曲线上。
当压缩负载施加到保持框架时,框架从A中所示的形状变形到B中所示的形状,且最后到C中所示的形状。特别地,图19所示的设备A、B和C的三个形状相应于图20中的曲线上的三个数据点A、B和C。
如图19所示,当框架从形状A和形状B变形时,压缩力通常由纽结形形状的弹性丝的较大公共弓形吸收。一旦框架呈现形状B,构成弹性丝的两个半圆就重叠。力/位移图展示斜率的增加(大约15倍),这在框架从形状B变形到形状C时持续。
测试和随后的分析显示,低模量弹性体的小杨氏模量E(Young’smodulus E)可通过下列中的一个或多个被补偿:通过减小弓形的半径、通过增加丝直径、以及通过具有多个和/或重叠的圆或圈。例如,将由框架形成的弓形的半径减小2倍和将用于形成框架的丝的直径增加2倍可明显增加弹簧常数27或128倍。
实例5:某些低模量丝的样本弹簧常数
具有大约30GPa的杨氏模量、大约0.2286mm的直径、大约1.5cm的弧半径和一个线圈的镍钛诺丝可具有大约3.7N/m的弹簧常数。具有大约25MPa的杨氏模量、大约1mm的直径、大约1cm的孤半径和一个线圈的聚氨基甲酸酯丝可具有大约3.8N/m的弹簧常数。具有大约2.41MPa 的杨氏模量、大约1.2mm的直径、大约0.75cm的弧半径和两个线圈的硅树脂丝可具有大约3.6N/m的弹簧常数。具有大约1.7MPa的杨氏模量、大约1.2mm的直径、大约0.76cm的弧半径和三个线圈的聚(甘油-癸二酸酯)(PGS)丝可具有大约3.7N/m的弹簧常数。
实例6:利多卡因从各种设备的体外递送
使用五个不同的设备来执行体外利多卡因释放研究。每个设备是装有结晶化的利多卡因块的硅树脂管。使用两个不同尺寸的硅树脂管。在表3中示出设备的规格。使用插入端部中的不锈钢微球体密封每个管。除了控制设备以外,一个口在每个管中在微球体之间被钻出。每个口具有大约50μm的直径。直径被选择成根据来自使用CSC执行的体外释放实验的结果获得一级释放概况。在表中称为类型III的设备具有类似于图13所示的套的聚氨基甲酸酯套,以减小水渗透到设备中。在表中称为对照的设备没有口。在实验期间,由于管内液体静压的内部累积,微球体被向外推。图21示出设备的体外利多卡因释放曲线。
| 类型 | 有效载荷 | I.D.xO.D. (英寸) | 管壁厚度 (英寸) | 总管长度(cm) |
| I | 2mg | 0.012x0.025 | 0.0065 | 2 |
| II | 1mg | 0.012x0.025 | 0.0065 | 1 |
| III | 2mg | 0.012x0.025 | 0.0065 | 2(一半覆盖有套) |
| IV | 4mg | 0.020x0.037 | 0.0085 | 2 |
| 对照 | 4mg | 0.020x0.037 | 0.0085 | 2(没有口) |
表3:用于体外利多卡因释放研究的设备的规格
实例7:在兔膀胱中设备的体内递送和保持
囊保持框架由覆盖有硅树脂管的镍钛诺丝(直径0.009英寸)制成。铂丝在镍钛诺丝的顶端处卷曲,且生物相容的UV环氧树脂被使用和固化以在镍钛诺丝上制造钝的顶端。顶端是钝的和软的,以避免膀胱组织表面例如膀胱的可能刺激和结疤。被涂覆的丝设备是以两个重叠的环的形状, 环端部位于由环限定的圆形外部周界内部。囊保持框架实质上是纽结形形状的。
保持设备通过10Fr导尿管被植入兔膀胱内。设备的形状被选择成当两个环(即子圆)压缩时对压缩的抵抗力增加。这个弹簧状特征用来防止结构的塌陷,使得它可不进入尿道。由于镍钛诺的超弹性特点,一旦压缩被移除,设备就立即返回到其原始形状。不是将设备压缩到导管核心中,设备被展开并使用管心针推动通过导管腔。设备在从导管的远端出现之后卷曲回其原始形状。设备不从膀胱排泄出。
实例8:兔膀胱中的利多卡因的体内递送
在兔体内执行药物暴露研究,以研究利多卡因通过膀胱的吸收。该研究以新西兰公白兔进行。利多卡因通过膀胱内植入式药物递送设备被递送到一些兔,而为了比较的目的在其它兔上执行滴注。
对于通过滴注治疗的兔,10mL的含水利多卡因溶液被滴注到膀胱中。根据现有的临床研究,利多卡因剂量为每公斤体重2mg或5mg。溶液使用通过尿道插入的10-Fr小儿科Foley导管被滴注,且容易保留在膀胱中一个或两个小时。在滴注之前和之后在多个时间点收集样本血液。在滴注之后的一天从兔收集膀胱,且尿样本也在那时被收集。
通过膀胱内植入治疗的兔接收“三天”设备或“六天”设备。这两种设备在形状上与图1所示的设备是可比较的,每个设备都有与硅树脂药物储蓄器部件结合的纽结形保持框架。三天设备的药物储蓄器部件具有大约0.0065英寸的厚度、大约0.012英寸的内径、大约0.025英寸的外径和大约2mg利多卡因的药物载荷,而六天设备的药物储蓄器部件具有大约0.0085英寸的厚度、大约0.020英寸的内径、大约0.037英寸的外径和大约2mg利多卡因的药物载荷。术语“三天设备”和“六天设备”指设备的配置而不是植入的长度。对于每个兔,设备通过更改的10Fr导尿管使用上面参考图16描述的操作被插入。导管在设备被植入之后移除。在设备植入之前和之后在多个点收集血液样本。此外,在植入之后立即、在植入之后两天和在植入之后九天在右侧面斜躺位置和仰卧位置两者上对一个兔拍摄x射线图像。在不同的时间拍摄的多个x射线图像显示,设备在 膀胱内自由地移动而不是停留在一个位置。设备在体内研究的过程中被兔很好地忍受,而没有任何健康问题。在植入之后在多个时间点从兔收集膀胱,包括一天、两天、三天和六天。尿样本也在膀胱被移除的时间被收集。
血液、膀胱和尿样本被分析,以确定血浆、膀胱组织和尿中的利多卡因浓度。图22是示出对于各种治疗随着时间的利多卡因血浆浓度的曲线,而图23是y轴更改的同一曲线。在这些曲线中,以虚线示出滴注治疗,而以实线示出设备治疗。关键字指示每个兔的重量连同治疗类型。图22中的数据表示通常允许比较各种滴注治疗与各种膀胱内植入治疗,而图23中的数据表示通常允许使各种膀胱内植入治疗彼此比较。
如图22所示,利多卡因溶液的滴注导致利多卡因血浆浓度的初始猛增,但在一天之后利多卡因不再在血浆中被检测到。因此,滴注治疗允许利多卡因血浆浓度的突然增加,但这个增加快速地跟随有快速的下降。在通过5mg/kg利多卡因溶液滴注两小时治疗的兔的情况下,峰值血浆浓度超过100ng/ml,其在10倍的利多卡因的已知毒性限制内。然而,这样的高初始峰值浓度对提供重复的滴注之间的减缓可能是必要的,即使是全身地不希望有的。
图22还显示,在使用植入式设备治疗的兔中利多卡因血浆浓度比在通过滴注治疗的兔中相对更低。然而,使用植入式设备治疗的兔随着时间的过去维持相对较高的利多卡因血浆浓度。
图23显示,从三天设备的释放在12个小时之后减慢,这与在实例6的体外释放研究中获得的结果一致。具有两倍于三天设备的有效载荷的六天设备展示更扩展的释放概况。然而,六天设备展示初始诱导时间,其与在实例6的体外释放研究中获得的结果一致。诱导时间归因于用于六天设备的较厚的管,其在诱导时间内被水合以开始利多卡因从设备的释放。总而言之,结果表明,当与通过滴注的递送比较时,利多卡因的沉淀物通过植入式设备的递送可允许随着时间的过去维持相对较高的利多卡因血浆浓度,同时避免高峰值利多卡因血浆浓度。
因为膀胱内治疗的目标部位是膀胱组织,利多卡因的膀胱组织浓度与血浆浓度相比是通过膀胱内植入治疗的功效更直接的指标。图24示出对 于通过膀胱内植入的各种治疗随着时间在膀胱组织中的利多卡因浓度。在植入之后在多个时间点对三天设备示出利多卡因组织浓度,包括在植入之后的一天、在植入之后的两天和在植入之后的三天。换句话说,设备不必在膀胱内保留三天。还示出了对于六天设备在植入之后六天的时间点处利多卡因组织浓度。如所示,三天设备展示在三天的过程中的减小的利多卡因组织浓度,而六天设备展示在六天之后的利多卡因组织浓度,其与由三天设备展示的在一天之后的利多卡因组织浓度比较。利多卡因组织浓度也在膀胱内滴注之后的一天被测量,但组织浓度低于检测水平。还应注意,利多卡因组织浓度为大约每克组织数微克。
图25示出对于膀胱内植入在利多卡因血浆浓度和利多卡因组织浓度之间的关联。也对在滴注之后一天的滴注治疗示出关联,但这些浓度与设备治疗相比是可忽略的。如所示,较高的利多卡因血浆浓度通常与较高的利多卡因组织浓度相关。然而,利多卡因组织浓度比利多卡因血浆浓度高大约1000倍。因此,利多卡因的沉淀物通过植入式设备的递送可向膀胱组织提供较高的药物暴露,同时避免高峰值血浆浓度。
也对分别使用三天设备和六天设备治疗的两种动物测量利多卡因尿液浓度。结果在图26中示出。在植入之后三天对接收三天设备的兔以及在植入之后六天对接收六天设备的兔收集膀胱组织和尿样本。如所示,利多卡因尿液浓度的数量级可与利多卡因组织浓度比较,这与参考下面的实例9和图27在下面描述的体外研究一致。
实例9:兔膀胱中的利多卡因的体外吸收
在兔膀胱上在体外执行研究,以研究pH和时间对吸收到膀胱的尿道上皮中的利多卡因的效应。很多不同的利多卡因溶液从人造尿液和放射性同位素示踪的利多卡因制造。每种利多卡因溶液具有10-5%(10-4mg/mL)或1%(10mg/mL)的利多卡因浓度和范围从4.0到8.5的pH。
兔膀胱被内翻以暴露尿道上皮或膀胱的内衬。内翻的膀胱放置在利多卡因溶液中,每种利多卡因溶液具有不同的浓度和pH。膀胱在利多卡因溶液中被孵育下列时间量之一:十分钟、一小时、一天、三天或五天。在所指定的孵育时间终止之后,每个膀胱从利多卡因溶液被移除,且组织中的 利多卡因浓度被确定。
图27是示出pH对利多卡因溶液在体外吸收到兔膀胱组织中一小时的时间段和一天的效应的曲线。曲线与只有1%利多卡因浓度的利多卡因溶液有关。如所示,利多卡因溶液的pH稍微影响在一小时之后利多卡因到膀胱组织中的吸收,但pH不明显影响在一天之后的利多卡因吸收。对于每个膀胱,平稳的组织浓度(或每膀胱组织质量所吸收的利多卡因质量)为大约10000mg/kg或1%,其是膀胱被浸没的利多卡因溶液的利多卡因浓度。这个结果暗示在延长的一段时间内利多卡因到膀胱的局部吸收可与利多卡因溶液的pH无关。该结果还指示,使利多卡因溶液缓冲可能对通过尿道上皮借助于在膀胱中的长期体内暴露的利多卡因的局部吸收是不必要的。
图28是示出使用变化的pH的10-5%和1%的利多卡因溶液在兔膀胱上在体外执行的研究期间展示的随着时间的利多卡因组织浓度的曲线。曲线示出随着时间利多卡因浓度和pH对利多卡因吸收到兔膀胱组织中的效应。具有10-5%浓度的利多卡因溶液的结果与具有1%浓度的结果分开地绘制出。如所示,利多卡因组织浓度快速增加(在大约10分钟内)并对10-5%和1%两者的利多卡因溶液达到平稳。如所示,10-5%的利多卡因溶液的平稳利多卡因组织浓度为大约0.1mg/mg或10-5%,而1%的利多卡因溶液的平稳利多卡因组织浓度为大约10000mg/mg或1%。该结果表明,对于到尿道上皮中的体外利多卡因吸收,利多卡因组织与利多卡因溶液的分隔系数为大约1。较高的利多卡因浓度显示较高的利多卡因吸收到尿道上皮中。
从前述详细描述中,这里所述的方法和设备的更改和变形对本领域技术人员将是明显的。这样的更改和变形被预期出现在所附权利要求的范围内。
Claims (42)
1.一种用于控制的药物递送的可植入式医疗设备,包括:
药物储蓄器部分,其包括弹性管和位于所述管内的药物制剂,所述药物制剂包括药物;以及
保持框架部分,其包括弹性丝,
其中所述药物储蓄器部分连接到所述保持框架部分并连同所述保持框架部分一起变形用于通过腔植入体腔,
其中未压缩状态的所述弹性丝被卷曲成两个或多于两个的环的形式,使得所述弹性丝能够展开成大致线性的形状,以允许所述设备穿过导管的腔,所述导管依尺寸制造成通过患者的尿道插入,且由于所述弹性丝,所述设备起弹簧作用,使得所述设备响应于压缩负载而变形且一旦负载被移除所述设备就自发地返回到其初始形状。
2.如权利要求1所述的设备,其中所述药物储蓄器部分沿着所述保持框架部分的长度的至少一部分延伸,实质上与所述保持框架部分平行,所述药物储蓄器部分和所述保持框架部分两者在用于部署在体内的相对较低的剖面和用于体腔内保持的相对扩张的剖面之间可变形。
3.如权利要求1或2所述的设备,其中所述药物储蓄器部分连同所述保持框架部分一起弹性地可变形。
4.如权利要求1所述的设备,其中所述弹性丝具有在3N/m和60N/m之间的弹簧常数。
5.如权利要求4所述的设备,其中所述弹性丝具有在3.6N/m和3.8N/m之间的弹簧常数。
6.如权利要求1所述的设备,其中所述弹性丝包括低模量弹性体。
7.如权利要求6所述的设备,其中所述低模量弹性体包括硅树脂、聚氨基甲酸酯、苯乙烯热塑性弹性体或聚(甘油-癸二酸酯)。
8.如权利要求1所述的设备,其中所述弹性丝包括生物相容的镍钛合金、钛钼合金或另一超弹性合金或其它形状记忆材料。
9.如权利要求1所述的设备,其中所述弹性丝的第一端和第二端被限制在所述两个或多于两个的环内。
10.如权利要求1所述的设备,其中所述药物储蓄器部分的弹性管在体内可操作以控制的速率分配所述药物。
11.如权利要求10所述的设备,其中所述弹性管由渗水硅树脂或其它渗水材料形成。
12.如权利要求10所述的设备,其中所述弹性管通过渗透、扩散或其组合控制所述药物的释放。
13.如权利要求10所述的设备,其中所述弹性管通过渗透控制所述药物的释放。
14.如权利要求13所述的设备,其中所述弹性管包括用于以控制的速率分配药物的一个或多个孔。
15.如权利要求14所述的设备,其中所述一个或多个孔中的每个是圆形的并具有在25μm和500μm之间的直径。
16.如权利要求10所述的设备,其中所述弹性管是具有在0.3mm和2mm之间的内径和在0.6mm和3mm之间的外径的圆柱体。
17.如权利要求10所述的设备,其中所述药物制剂被放置作为所述弹性管内的核心。
18.如权利要求1所述的设备,其中所述药物制剂是固体或半固体的形式。
19.如权利要求10所述的设备,其中所述弹性管包括生物可再吸收基质材料和药物的复合物。
20.如权利要求1所述的设备,其中所述药物包括局部麻醉剂、肝素、透明质酸钠、葡萄糖胺聚糖、二甲基亚砜、奥昔布宁、丝裂霉素C、黄酮哌酯、木聚硫钠或其组合。
21.如权利要求1所述的设备,其中所述药物包括作为氨基酰胺的盐或酰胺酯的盐的局部麻醉剂。
22.如权利要求21所述的设备,其中所述药物包括利多卡因、丙胺卡因、甲哌卡因、罗哌卡因、苯佐卡因、普鲁卡因、丙美卡因、丁卡因、布比卡因或其组合。
23.如权利要求1所述的设备,其是体内可再吸收的。
24.如权利要求1所述的设备,其中所述药物储蓄器部分包括:
第一端,其连接到在所述保持框架部分的中间区域上的第一位置;以及
第二端,其连接到在所述保持框架部分的中间区域上的第二位置。
25.如权利要求24所述的设备,其中所述药物储蓄器部分包括在所述第一端和所述第二端之间的中央部分,所述中央部分未连接到所述保持框架部分。
26.如权利要求1所述的设备,其中所述药物储蓄器部分与所述保持框架部分至少部分地对准,所述药物储蓄器部分沿着所述保持框架部分的长度的至少一部分延伸。
27.如权利要求26所述的设备,其还包括沿着所述保持框架部分的长度的至少一部分实质上与所述保持框架部分对准的另一个药物储蓄器部分。
28.如权利要求1所述的可植入式医疗设备,其中:
所述弹性管是具有第一端和相对的第二端的细长渗水硅树脂管,
所述药物制剂被放置作为所述管内的核心,且所述药物制剂是固体或半固体形式,以及
所述弹性丝包括低模量弹性体或超弹性合金。
29.如权利要求28所述的设备,其具有高剖面形状和低剖面形状,在所述高剖面形状中所述弹性丝卷曲成不能通过导管或膀胱镜的腔的两个或多于两个的环,而在所述低剖面形状中所述设备能够通过所述导管或膀胱镜的腔。
30.如权利要求28所述的设备,其中所述弹性丝具有在3N/m和60N/m之间的弹簧常数。
31.如权利要求28所述的设备,其中所述弹性管具有孔,所述药物能够通过所述孔以渗透地控制的速率在体内被释放。
32.如权利要求31所述的设备,其中所述弹性丝具有在3.6N/m和3.8N/m之间的弹簧常数。
33.如权利要求28所述的设备,其中所述低模量弹性体包括硅树脂、聚氨基甲酸酯、苯乙烯热塑性弹性体或聚(甘油-癸二酸酯)。
34.如权利要求28所述的设备,其中所述药物包括局部麻醉剂。
35.如权利要求28所述的设备,其中所述弹性管具有外部渗透表面和通过所述渗透表面形成的口;以及覆盖所述渗透表面的至少一部分以减小所述渗透表面的渗透性的涂层或套。
36.如权利要求1所述的设备,其中所述保持框架部分被配置成在体腔内保持所述设备。
37.如权利要求28所述的设备,其中:
所述弹性管在其内部界定储蓄器;并且
所述药物制剂核心容纳在所述储蓄器中。
38.如权利要求28所述的设备,其中所述超弹性合金包括生物相容的镍钛合金或钛钼合金。
39.如权利要求1所述的设备,其中所述保持框架部分还包括用于所述弹性丝的聚合物涂层。
40.如权利要求28所述的设备,其中所述保持框架部分还包括用于所述弹性丝的聚合物涂层。
41.如权利要求40所述的设备,其中所述聚合物涂层包括硅树脂。
42.如权利要求2所述的设备,其中所述体腔是膀胱,且当所述设备处于所述较低的剖面时,所述设备占据适合于通过腔设备的工作通道插入进所述膀胱的区域,而当所述设备处于所述扩张的剖面时,所述设备占据具有适合于阻止所述设备从所述膀胱排出的尺寸的区域。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US717707P | 2007-12-11 | 2007-12-11 | |
| US61/007,177 | 2007-12-11 | ||
| US8492708P | 2008-07-30 | 2008-07-30 | |
| US61/084,927 | 2008-07-30 | ||
| PCT/US2008/086467 WO2009076547A2 (en) | 2007-12-11 | 2008-12-11 | Implantable drug delivery device ant) methods for treatment of the bladder and other body vestcles or lumens |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN101896221A CN101896221A (zh) | 2010-11-24 |
| CN101896221B true CN101896221B (zh) | 2013-06-05 |
Family
ID=40551355
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2008801203523A Active CN101896221B (zh) | 2007-12-11 | 2008-12-11 | 用于治疗膀胱和其它体囊或体腔的可植入式药物递送设备和方法 |
Country Status (17)
| Country | Link |
|---|---|
| US (4) | US9586035B2 (zh) |
| EP (1) | EP2231254B9 (zh) |
| JP (1) | JP5560200B2 (zh) |
| KR (1) | KR101538748B1 (zh) |
| CN (1) | CN101896221B (zh) |
| AU (1) | AU2008335077B2 (zh) |
| BR (1) | BRPI0820800B8 (zh) |
| CA (1) | CA2706384C (zh) |
| DK (1) | DK2231254T3 (zh) |
| EA (1) | EA201070703A1 (zh) |
| ES (1) | ES2481454T3 (zh) |
| IL (1) | IL205960A0 (zh) |
| MX (1) | MX348005B (zh) |
| NZ (1) | NZ585449A (zh) |
| PL (1) | PL2231254T3 (zh) |
| WO (1) | WO2009076547A2 (zh) |
| ZA (1) | ZA201003779B (zh) |
Families Citing this family (64)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2618349C (en) * | 2005-08-11 | 2016-05-31 | Massachusetts Institute Of Technology | Intravesical drug delivery device and method |
| BRPI0820800B8 (pt) | 2007-12-11 | 2021-06-22 | Massachusetts Inst Technology | dispositivo médico implantável para liberação controlada de droga |
| CN102176931B (zh) | 2008-08-09 | 2015-03-04 | 麻省理工学院 | 治疗男性泌尿生殖组织和外周组织的可植入药物递送设备和方法 |
| US11331424B2 (en) | 2009-01-26 | 2022-05-17 | Incube Labs, Llc | Apparatus, systems and methods for delivery of medication to the brain to treat neurological conditions |
| US9014787B2 (en) | 2009-06-01 | 2015-04-21 | Focal Therapeutics, Inc. | Bioabsorbable target for diagnostic or therapeutic procedure |
| ES2401007T3 (es) | 2009-06-26 | 2013-04-16 | Taris Biomedical, Inc. | Dispositivos de administración de fármaco implantables y procedimientos de fabricación de los mismos |
| US20110052497A1 (en) * | 2009-08-27 | 2011-03-03 | Taris Biomedical, Inc. | Minimally Invasive Systems and Methods for In Vivo Testing of Materials |
| US9017312B2 (en) | 2009-09-10 | 2015-04-28 | Taris Biomedical Llc | Implantable device for controlled drug delivery |
| US8721621B2 (en) | 2009-09-10 | 2014-05-13 | Taris Biomedical, Inc. | Systems and methods for deploying devices to genitourinary sites |
| US8167836B2 (en) * | 2009-12-08 | 2012-05-01 | Taris Biomedical, Inc. | Tissue expander configured for drug delivery |
| ES2867399T3 (es) | 2009-12-17 | 2021-10-20 | Taris Biomedical Llc | Dispositivo implantable con tolerabilidad intravesical |
| AU2015201123B2 (en) * | 2009-12-17 | 2016-04-21 | Taris Biomedical Llc | Implantable device with intravesical tolerability and methods of treatment |
| US20110218488A1 (en) * | 2010-03-05 | 2011-09-08 | Taris Biomedical, Inc. | Systems and Methods for Implanting Devices in the Bladder and Other Genitourinary Sites |
| DK2600848T3 (da) * | 2010-08-05 | 2019-06-24 | Taris Biomedical Llc | Implanterbare lægemiddelafgivelsesindretninger til urogenitale positioner |
| PT2600800T (pt) | 2010-08-05 | 2020-11-05 | Taris Biomedical Llc | Dispositivo de administração de drogas por stent ureteral, kit e método |
| US9457176B2 (en) | 2010-10-06 | 2016-10-04 | Taris Biomedical Llc | Implantable drug delivery device with bladder retention feature |
| WO2012048114A1 (en) | 2010-10-06 | 2012-04-12 | Taris Biomedical, Inc. | Time-selective bioresorbable or collapsible drug delivery systems and methods |
| CA2823783C (en) * | 2011-01-10 | 2023-03-21 | Taris Biomedical, Inc. | Lidocaine regimen for the use of sustained treatment of bladder pain and irritative voiding |
| CN103379902B (zh) * | 2011-02-04 | 2015-11-25 | 塔里斯生物医药公司 | 用于低溶解度药物的控制释放的可植入装置 |
| US8685106B2 (en) | 2011-11-15 | 2014-04-01 | Abraham Lin | Method of a pharmaceutical delivery system for use within a joint replacement |
| WO2013078256A1 (en) | 2011-11-21 | 2013-05-30 | Incube Labs, Llc | Myocardial drug delivery apparatus and methods |
| US20150032088A1 (en) * | 2012-01-24 | 2015-01-29 | The Methodist Hospital Research Institute | Sustained drug delivery from solid state compositions with nanochannel membranes |
| US20130289389A1 (en) | 2012-04-26 | 2013-10-31 | Focal Therapeutics | Surgical implant for marking soft tissue |
| EP3492076A1 (en) | 2012-04-30 | 2019-06-05 | Allergan, Inc. | Methods for treatment of pelvic pain and/or comorbid conditions |
| US20140012180A1 (en) * | 2012-05-01 | 2014-01-09 | Nidus Medical, Llc | Peritoneal drain and infusion |
| WO2013170069A1 (en) | 2012-05-09 | 2013-11-14 | Massachusetts Institute Of Technology | Medicament, method, and drug delivery device for treatment of ovarian cancer |
| WO2013177068A1 (en) * | 2012-05-19 | 2013-11-28 | Taris Biomedical, Inc. | Implantable urological device with improved retrieval feature |
| CA2882575C (en) | 2012-08-31 | 2020-05-26 | Dennis GIESING | Drug delivery systems and methods for treatment of prostate |
| SI2890384T1 (sl) | 2012-08-31 | 2022-02-28 | Taris Biomedical Llc | Sistemi za dostavo zdravila in postopki za zdravljenje raka sečnega mehurja, ki obsegajo oksaliplatin |
| AU2013318146B2 (en) | 2012-09-18 | 2018-05-10 | Taris Biomedical Llc | Drug delivery systems and methods for treatment of bladder voiding dysfunction|and other lower urinary tract disorders by using trospium |
| JP2016508842A (ja) * | 2013-03-05 | 2016-03-24 | タリス バイオメディカル エルエルシー | 装置の開口部を通じて制御された薬物放出のための薬物送達装置及び方法 |
| KR102339132B1 (ko) | 2013-03-15 | 2021-12-13 | 타리스 바이오메디컬 엘엘씨 | 약물 전달 장치 및 약물 전달 방법 |
| RU2666684C2 (ru) | 2013-03-15 | 2018-09-11 | ТАРИС Биомедикал ЛЛК | Устройство для доставки лекарственных средств с проницаемым для лекарственного средства компонентом и способ доставки лекарственных средств |
| JP5408682B1 (ja) * | 2013-06-28 | 2014-02-05 | ガデリウス・メディカル株式会社 | ステントキット |
| CN113413393A (zh) | 2013-08-19 | 2021-09-21 | 塔里斯生物医药公司 | 多单元药物递送装置和方法 |
| SE539540C2 (sv) * | 2013-09-12 | 2017-10-10 | Qpharma Ab | Ett läkemedelsavgivningssystem för en eller flera aktiva beståndsdelar |
| CA2929554A1 (en) * | 2013-11-05 | 2015-05-14 | Taris Biomedical Llc | Osmotic drug delivery devices, kits, and methods |
| MX2016011333A (es) | 2014-03-06 | 2016-12-07 | Taris Biomedical Llc | Sistemas de administracion de farmaco y metodo para el tratamiento de cancer de vejiga con gemcitabina. |
| EP3517099B1 (en) * | 2014-06-26 | 2022-12-28 | TARIS Biomedical LLC | Intravesical drug delivery devices and methods including elastic polymer-drug matrix systems |
| CA2955956C (en) * | 2014-07-25 | 2022-10-18 | Focal Therapeutics, Inc. | Implantable devices and techniques for oncoplastic surgery |
| EP3597176A1 (en) | 2014-08-19 | 2020-01-22 | The Regents Of The University Of California | Implants for localized drug delivery and methods of use thereof |
| JP6743041B2 (ja) | 2015-03-30 | 2020-08-19 | タリス バイオメディカル エルエルシー | 上部尿路への薬剤の局所的な送達装置及び方法 |
| WO2016172704A1 (en) | 2015-04-23 | 2016-10-27 | Taris Biomedical Llc | Drug delivery devices with drug-permeable component and methods |
| US11185670B2 (en) | 2016-01-26 | 2021-11-30 | Taris Biomedical Llc | Multi-lumen drug delivery devices |
| WO2017151983A1 (en) | 2016-03-02 | 2017-09-08 | Taris Biomedical Llc | Osmotic drug delivery devices and methods of making osmotic drug delivery devices |
| FR3059553B1 (fr) | 2016-12-07 | 2021-04-23 | Univ Grenoble Alpes | Dispositif implantable |
| ES2873084T3 (es) | 2017-02-01 | 2021-11-03 | Taris Biomedical Llc | Dispositivos para la administración de fármacos in vivo |
| US20200375890A1 (en) * | 2017-03-23 | 2020-12-03 | Particle Sciences, Inc. | Implantable and removable drug delivery device |
| AU2018269547B2 (en) * | 2017-05-17 | 2024-01-04 | Massachusetts Institute Of Technology | Self-actuating articles |
| US11541015B2 (en) | 2017-05-17 | 2023-01-03 | Massachusetts Institute Of Technology | Self-righting systems, methods, and related components |
| BR112020000832A2 (pt) | 2017-07-25 | 2020-07-21 | Taris Biomedical Llc | métodos para tratar metástase tumoral |
| WO2019232292A1 (en) | 2018-05-31 | 2019-12-05 | Massachusetts Institute Of Technology | Resident articles for gram-level dosing |
| CA3107461A1 (en) | 2018-08-01 | 2020-02-06 | Taris Biomedical Llc | Methods of treating overactive bladder using trospium |
| CA3113345A1 (en) * | 2018-11-09 | 2020-05-14 | Taris Biomedical Llc | Drug delivery devices, systems, and methods for local drug deivery to the upper urinary tract |
| KR102281386B1 (ko) * | 2019-09-03 | 2021-07-23 | 인제대학교 산학협력단 | 요도 협착 억제장치 |
| US11890438B1 (en) * | 2019-09-12 | 2024-02-06 | Cochlear Limited | Therapeutic substance delivery |
| WO2021071974A1 (en) | 2019-10-07 | 2021-04-15 | Oak Crest Institute Of Science | Orally implantable drug delivery device |
| CN114980861A (zh) | 2019-11-27 | 2022-08-30 | 橡冠科学研究院 | 缓释药物递送装置 |
| US11338119B2 (en) | 2020-03-20 | 2022-05-24 | The Regents Of The University Of California | Implantable drug delivery devices for localized drug delivery |
| US11173291B2 (en) | 2020-03-20 | 2021-11-16 | The Regents Of The University Of California | Implantable drug delivery devices for localized drug delivery |
| US11344526B2 (en) | 2020-03-20 | 2022-05-31 | The Regents Of The University Of California | Implantable drug delivery devices for localized drug delivery |
| WO2023085144A1 (ja) * | 2021-11-10 | 2023-05-19 | テルモ株式会社 | 投与装置 |
| WO2023100571A1 (ja) * | 2021-11-30 | 2023-06-08 | テルモ株式会社 | 医療器具および医療デバイス |
| WO2023133517A1 (en) | 2022-01-06 | 2023-07-13 | Oak Crest Institute Of Science | Subdermal implant for sustained drug delivery |
Family Cites Families (112)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3089815A (en) | 1951-10-11 | 1963-05-14 | Lieb Hans | Injectable pharmaceutical preparation, and a method of making same |
| NL105769C (zh) * | 1960-02-27 | |||
| GB1166613A (en) * | 1965-10-07 | 1969-10-08 | Hylton Frederick Grif Sheppard | Intrauterine Contraceptives |
| US3425411A (en) * | 1966-05-19 | 1969-02-04 | Ralph R Robinson | Intra-uterine device |
| US3312214A (en) * | 1966-06-06 | 1967-04-04 | Burdick Charles Lalor | Intra-uterine device |
| US3457915A (en) * | 1966-08-10 | 1969-07-29 | Frank R Eshelman | Intrauterine device |
| US3854480A (en) * | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US3789838A (en) * | 1971-02-19 | 1974-02-05 | E Fournier | Force transmitting intrauterine device |
| US4016251A (en) * | 1972-08-17 | 1977-04-05 | Alza Corporation | Vaginal drug dispensing device |
| US3888975A (en) * | 1972-12-27 | 1975-06-10 | Alza Corp | Erodible intrauterine device |
| US3901232A (en) * | 1973-10-26 | 1975-08-26 | Alza Corp | Integrated device for administering beneficial drug at programmed rate |
| US3935860A (en) * | 1974-08-21 | 1976-02-03 | Alza Corporation | Intrauterine device with restrictor for maintaining device in uterine cavity |
| CH583552A5 (zh) * | 1975-04-23 | 1977-01-14 | Akad Wroclawiu Med | |
| US4326552A (en) | 1979-01-23 | 1982-04-27 | Ingo Bleckmann | Heater for heating flows of fluid and dishwashing machine provided therewith |
| US4235236A (en) * | 1979-02-12 | 1980-11-25 | Alza Corporation | Device for dispensing drug by combined diffusional and osmotic operations |
| US4392848A (en) * | 1979-06-25 | 1983-07-12 | The Procter & Gamble Company | Catheterization |
| AU538961B2 (en) * | 1980-06-09 | 1984-09-06 | Alex Harvey Industries Limited | Intra-vaginal device |
| US4475916A (en) * | 1982-03-18 | 1984-10-09 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4629449A (en) * | 1982-07-29 | 1986-12-16 | Alza Corporation | Vaginal dispenser for dispensing beneficial hormone |
| US5366738A (en) * | 1982-07-29 | 1994-11-22 | Merck & Co., Inc. | Controlled release drug dispersion delivery device |
| US4655219A (en) * | 1983-07-22 | 1987-04-07 | American Hospital Supply Corporation | Multicomponent flexible grasping device |
| DE3332156A1 (de) * | 1983-09-06 | 1985-03-21 | Peter 6000 Frankfurt Prezelj | Nasenspange |
| GB8328916D0 (en) | 1983-10-28 | 1983-11-30 | Castex Prod | Pharmaceutical pellet |
| GB8403138D0 (en) | 1984-02-07 | 1984-03-14 | Graham N B | Sustained release of active ingredient |
| NZ207341A (en) * | 1984-03-01 | 1988-02-29 | Harvey Alex Ind Ltd | Device containing chemical impregnants for insertion into a body cavity of an animal |
| US4968507A (en) * | 1984-06-20 | 1990-11-06 | Merck & Co., Inc. | Controlled porosity osmotic pump |
| CH667209A5 (de) | 1985-07-02 | 1988-09-30 | Sulzer Ag | Medizinische depotsonde. |
| US4871542A (en) * | 1987-04-30 | 1989-10-03 | Ferring Service Center, N.V. | Method and apparatus useful for delivering medicinal compositions into the bladder and urinary tract |
| BE1002600A3 (fr) * | 1988-11-23 | 1991-04-09 | Wildemeersch Dirk | Dispositif intra-uterin perfectionne. |
| NZ228382A (en) * | 1989-03-17 | 1992-08-26 | Carter Holt Harvey Plastic Pro | Drug administering coil-like device for insertion in body cavity of animal |
| US5545208A (en) * | 1990-02-28 | 1996-08-13 | Medtronic, Inc. | Intralumenal drug eluting prosthesis |
| WO1993006792A1 (en) * | 1991-10-04 | 1993-04-15 | Scimed Life Systems, Inc. | Biodegradable drug delivery vascular stent |
| PT100944B (pt) * | 1991-10-10 | 2000-02-29 | Alza Corp | Dispositivo para o fornecimento osmotico de farmacos com paredes de materiais hidrofobicos |
| US5441550A (en) * | 1992-03-26 | 1995-08-15 | The University Of Tennessee Research Corporation | Post-treatment of laminated nonwoven cellulosic fiber webs |
| US5499997A (en) * | 1992-04-10 | 1996-03-19 | Sharpe Endosurgical Corporation | Endoscopic tenaculum surgical instrument |
| DE69329407T2 (de) | 1992-06-02 | 2001-05-03 | Bard Inc C R | Verfahren und Implantatvorrichtung für Langzeitwirkstoffabgabe |
| US5368588A (en) * | 1993-02-26 | 1994-11-29 | Bettinger; David S. | Parenteral fluid medication reservoir pump |
| US5523092A (en) * | 1993-04-14 | 1996-06-04 | Emory University | Device for local drug delivery and methods for using the same |
| US5516522A (en) * | 1994-03-14 | 1996-05-14 | Board Of Supervisors Of Louisiana State University | Biodegradable porous device for long-term drug delivery with constant rate release and method of making the same |
| IL116433A (en) * | 1994-12-19 | 2002-02-10 | Galen Chemicals Ltd | INTRAVAGINAL DRUG DELIVERY DEVICES FOR THE ADMINISTRATION OF 17β-OESTRADIOL PRECURSORS |
| GB9522403D0 (en) * | 1995-11-01 | 1996-01-03 | Hoechst Roussel Ltd | Intravaginal drug delivery device |
| US6171298B1 (en) * | 1996-05-03 | 2001-01-09 | Situs Corporation | Intravesical infuser |
| US5869081A (en) * | 1996-06-28 | 1999-02-09 | The Population Council | Progesterone vaginal ring for treatment of infertility |
| US5797898A (en) * | 1996-07-02 | 1998-08-25 | Massachusetts Institute Of Technology | Microchip drug delivery devices |
| US5972372A (en) * | 1996-07-31 | 1999-10-26 | The Population Council, Inc. | Intravaginal rings with insertable drug-containing core |
| ZA9710342B (en) * | 1996-11-25 | 1998-06-10 | Alza Corp | Directional drug delivery stent and method of use. |
| US5868719A (en) | 1997-01-15 | 1999-02-09 | Boston Scientific Corporation | Drug delivery balloon catheter device |
| US5830230A (en) * | 1997-03-07 | 1998-11-03 | Micro Therapeutics, Inc. | Method of intracranial vascular embolotherapy using self anchoring coils |
| GB2338414B (en) * | 1997-04-03 | 2001-12-19 | Point Biomedical Corp | Intravesical drug delivery system |
| IL123813A0 (en) * | 1997-04-11 | 1998-10-30 | Akzo Nobel Nv | Drug delivery system for two or more active substances |
| US6416780B1 (en) * | 1997-05-07 | 2002-07-09 | Galen (Chemicals) Limited | Intravaginal drug delivery devices for the administration of testosterone and testosterone precursors |
| CA2292402C (en) * | 1997-05-28 | 2007-03-06 | Dec International Nz Limited | Intra-vaginal device for pigs |
| US6197327B1 (en) * | 1997-06-11 | 2001-03-06 | Umd, Inc. | Device and method for treatment of dysmenorrhea |
| US6039968A (en) * | 1997-06-24 | 2000-03-21 | Hoechst Marion Roussel | Intravaginal drug delivery device |
| US6267761B1 (en) * | 1997-09-09 | 2001-07-31 | Sherwood Services Ag | Apparatus and method for sealing and cutting tissue |
| ES2292206T3 (es) * | 1997-10-10 | 2008-03-01 | Bioniche Life Sciences Inc. | Sistema de administracion de farmacos. |
| US6749617B1 (en) * | 1997-11-04 | 2004-06-15 | Scimed Life Systems, Inc. | Catheter and implants for the delivery of therapeutic agents to tissues |
| AU751861B2 (en) * | 1998-02-23 | 2002-08-29 | Massachusetts Institute Of Technology | Biodegradable shape memory polymers |
| US6183461B1 (en) * | 1998-03-11 | 2001-02-06 | Situs Corporation | Method for delivering a medication |
| US6482837B1 (en) * | 1998-04-24 | 2002-11-19 | University Of Rochester | Antimuscarinic compounds and methods for treatment of bladder diseases |
| US6159143A (en) | 1998-06-17 | 2000-12-12 | Scimed Life Systems, Inc. | Method and device for delivery of therapeutic agents in conjunction with isotope seed placement |
| US6464999B1 (en) * | 1998-06-17 | 2002-10-15 | Galt Incorporated | Bioadhesive medical devices |
| AU1853400A (en) | 1999-01-06 | 2000-07-24 | Richard Henry | Topical anesthesia of the urinary bladder |
| US6293923B1 (en) * | 1999-03-15 | 2001-09-25 | Innoventions, Inc. | Intravesicular balloon |
| US6083933A (en) * | 1999-04-19 | 2000-07-04 | Stellar International Inc. | Treatment of cystitis-like symptoms with chondroitin sulfate following administration of a challenge solution |
| US6139535A (en) * | 1999-05-27 | 2000-10-31 | Situs Corporation | Method and apparatus for placement and activation of a medical device within a body cavity |
| ES2332869T3 (es) * | 1999-11-17 | 2010-02-15 | Boston Scientific Limited | Dispositivos microfabricados para la entrega de moleculas en fluidos portadores. |
| AU782639B2 (en) * | 1999-12-10 | 2005-08-18 | Massachusetts Institute Of Technology | Microchip devices for delivery of molecules and methods of fabrication thereof |
| US20050238733A1 (en) * | 2000-01-05 | 2005-10-27 | Richard Henry | Topical anesthesia of the urinary bladder |
| US6753011B2 (en) * | 2000-01-14 | 2004-06-22 | Osmotica Corp | Combined diffusion/osmotic pumping drug delivery system |
| US6379382B1 (en) | 2000-03-13 | 2002-04-30 | Jun Yang | Stent having cover with drug delivery capability |
| US7470228B2 (en) * | 2000-04-14 | 2008-12-30 | Attenuex Technologies, Inc. | Method of treating benign hypertrophy of the prostate |
| US6682473B1 (en) * | 2000-04-14 | 2004-01-27 | Solace Therapeutics, Inc. | Devices and methods for attenuation of pressure waves in the body |
| US7232421B1 (en) * | 2000-05-12 | 2007-06-19 | C. R. Bard, Inc. | Agent delivery systems |
| US6398718B1 (en) * | 2000-06-15 | 2002-06-04 | Innoventions, Inc. | Intravesicular device |
| ATE455526T1 (de) * | 2000-08-24 | 2010-02-15 | Sidney Lerner | Nicht-hormonales vaginales verhütungsmittel |
| US6752829B2 (en) * | 2001-01-30 | 2004-06-22 | Scimed Life Systems, Inc. | Stent with channel(s) for containing and delivering a biologically active material and method for manufacturing the same |
| US6951654B2 (en) * | 2001-03-27 | 2005-10-04 | Galen (Chemicals) Limited | Intravaginal drug delivery devices for the administration of an antimicrobial agent |
| US6973718B2 (en) * | 2001-05-30 | 2005-12-13 | Microchips, Inc. | Methods for conformal coating and sealing microchip reservoir devices |
| US7438701B2 (en) | 2001-07-26 | 2008-10-21 | Durect Corporation | Local concentration management system |
| AU2002341959A1 (en) * | 2001-10-04 | 2003-04-14 | Case Western Reserve University | Drug delivery devices and methods |
| US7722894B2 (en) * | 2001-10-22 | 2010-05-25 | Massachusetts Institute Of Technology | Biodegradable polymer |
| US7005138B2 (en) * | 2001-12-21 | 2006-02-28 | Duramed Pharmaceuticals, Inc. | Method of systematically delivering SSRIs |
| US7473273B2 (en) * | 2002-01-22 | 2009-01-06 | Medtronic Vascular, Inc. | Stent assembly with therapeutic agent exterior banding |
| US8685427B2 (en) * | 2002-07-31 | 2014-04-01 | Boston Scientific Scimed, Inc. | Controlled drug delivery |
| GB2385273B (en) * | 2002-02-13 | 2004-05-26 | Deborah Huang | Drug delivery device |
| US6899890B2 (en) * | 2002-03-20 | 2005-05-31 | Kv Pharmaceutical Company | Bioadhesive drug delivery system |
| EP1400258A1 (en) * | 2002-09-18 | 2004-03-24 | Schering Oy | Pharmaceutical composition delivery device and its manufacturing process |
| DE10247689A1 (de) * | 2002-10-12 | 2004-04-22 | Martin Rahe | Implantat in der Harnblase |
| US7504387B2 (en) * | 2002-10-16 | 2009-03-17 | Arthrodynamic Technologies, Animal Health Division, Inc. | Glycosaminoglycan composition and method for treatment and prevention of interstitial cystitis |
| US20040260272A1 (en) * | 2002-10-22 | 2004-12-23 | Friedman Craig D. | Method and system for intravesicular delivery of therapeutic agents |
| EP1587450A2 (en) * | 2002-12-16 | 2005-10-26 | The Regents Of The University Of Michigan | Assembly and planar structure for use therein which is expandable into a 3-d structure such as a stent and device for making the planar structure |
| ATE411063T1 (de) * | 2002-12-23 | 2008-10-15 | Medtronic Inc | Katheter mit mehreren infusionsabschnitten und zugehörige methoden |
| SI1708722T1 (sl) | 2004-01-28 | 2014-10-30 | The Regents Of The University Of California | Nova intersticijska terapija za takojšnje simptome sprostitve in kronična terapija pri intersticijskem cistitisu |
| ATE534426T1 (de) * | 2004-02-10 | 2011-12-15 | Synecor Llc | Intravaskuläres abgabesystem für therapeutische mittel |
| US7647112B2 (en) * | 2004-02-11 | 2010-01-12 | Ethicon, Inc. | System and method for selectively stimulating different body parts |
| WO2005115245A1 (en) | 2004-05-28 | 2005-12-08 | Dynaventions Inc. | Intravesicular device |
| KR20080012834A (ko) | 2005-03-01 | 2008-02-12 | 코럼나 피티와이 리미티드 | 추간원판 복원 |
| WO2006113913A2 (en) * | 2005-04-20 | 2006-10-26 | Cook Incorporated | Joint for medical device delivery system |
| US7862552B2 (en) | 2005-05-09 | 2011-01-04 | Boston Scientific Scimed, Inc. | Medical devices for treating urological and uterine conditions |
| CA2618349C (en) * | 2005-08-11 | 2016-05-31 | Massachusetts Institute Of Technology | Intravesical drug delivery device and method |
| US20070172508A1 (en) * | 2006-01-26 | 2007-07-26 | Paul Zupkas | Transluminal drug delivery methods and devices |
| US20070172507A1 (en) * | 2006-01-26 | 2007-07-26 | Paul Zupkas | Transluminal drug delivery methods and devices |
| EP2001350A4 (en) * | 2006-03-20 | 2013-04-17 | Teva Womens Health Inc | FLEXIBLE COMPRESSED INTRAVAGINAL RINGS, METHOD FOR THEIR PRODUCTION AND USE AND DEVICE FOR THEIR PRODUCTION |
| US20070255222A1 (en) * | 2006-03-27 | 2007-11-01 | Changqing Li | Catheter assembly including internal bolster |
| KR20090006153A (ko) | 2006-03-31 | 2009-01-14 | 큐엘티 플러그 딜리버리, 인코포레이티드 | 비루관계에 대한 약물 전달 방법, 구조, 및 조성물 |
| US7824383B2 (en) * | 2006-06-16 | 2010-11-02 | Family Health International | Vaginal drug delivery system and method |
| WO2008038281A2 (en) | 2006-09-28 | 2008-04-03 | Medvision Inc. | Examination device |
| ES2696999T3 (es) * | 2007-06-26 | 2019-01-21 | Allergan Pharmaceuticals Int Ltd | Dispositivos de administración intravaginal de medicamentos para la administración de macromoléculas y medicamentos solubles en agua |
| US8303536B2 (en) | 2007-08-30 | 2012-11-06 | Sunstorm Research Corp. | Implantable delivery device |
| BRPI0820800B8 (pt) | 2007-12-11 | 2021-06-22 | Massachusetts Inst Technology | dispositivo médico implantável para liberação controlada de droga |
| CN102176931B (zh) * | 2008-08-09 | 2015-03-04 | 麻省理工学院 | 治疗男性泌尿生殖组织和外周组织的可植入药物递送设备和方法 |
-
2008
- 2008-12-11 BR BRPI0820800A patent/BRPI0820800B8/pt active IP Right Grant
- 2008-12-11 EP EP08859044.3A patent/EP2231254B9/en active Active
- 2008-12-11 JP JP2010538164A patent/JP5560200B2/ja active Active
- 2008-12-11 KR KR1020107015434A patent/KR101538748B1/ko active IP Right Grant
- 2008-12-11 CN CN2008801203523A patent/CN101896221B/zh active Active
- 2008-12-11 NZ NZ585449A patent/NZ585449A/en unknown
- 2008-12-11 WO PCT/US2008/086467 patent/WO2009076547A2/en active Application Filing
- 2008-12-11 US US12/333,182 patent/US9586035B2/en active Active
- 2008-12-11 EA EA201070703A patent/EA201070703A1/ru unknown
- 2008-12-11 ES ES08859044.3T patent/ES2481454T3/es active Active
- 2008-12-11 AU AU2008335077A patent/AU2008335077B2/en active Active
- 2008-12-11 CA CA2706384A patent/CA2706384C/en active Active
- 2008-12-11 MX MX2010006283A patent/MX348005B/es active IP Right Grant
- 2008-12-11 DK DK08859044.3T patent/DK2231254T3/da active
- 2008-12-11 PL PL08859044T patent/PL2231254T3/pl unknown
-
2010
- 2010-05-25 IL IL205960A patent/IL205960A0/en active IP Right Grant
- 2010-05-26 ZA ZA2010/03779A patent/ZA201003779B/en unknown
-
2017
- 2017-01-23 US US15/412,240 patent/US10646691B2/en active Active
-
2020
- 2020-04-14 US US16/847,862 patent/US11612718B2/en active Active
-
2023
- 2023-03-24 US US18/125,810 patent/US20230226314A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101896221B (zh) | 用于治疗膀胱和其它体囊或体腔的可植入式药物递送设备和方法 | |
| JP6854210B2 (ja) | 膀胱内における耐容性を備えた植込み型装置及び治療方法 | |
| US9561353B2 (en) | Intravesical drug delivery device | |
| JP5945544B2 (ja) | 時間選択的に生体吸収可能または崩壊可能な薬剤送達システムおよび方法 | |
| CN102481438B (zh) | 可植入药物递送装置及制造所述装置的方法 | |
| US9492266B2 (en) | Ureteral stent drug delivery device, kit, and method | |
| JP2013504584A (ja) | 薬物を制御送達するための植込み型装置 | |
| JP2018516096A (ja) | 上部尿路への薬剤の局所的な送達装置及び方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1150789 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1150789 Country of ref document: HK |