CN101115847A - 检测样品中的分析物的方法 - Google Patents
检测样品中的分析物的方法 Download PDFInfo
- Publication number
- CN101115847A CN101115847A CNA2005800467145A CN200580046714A CN101115847A CN 101115847 A CN101115847 A CN 101115847A CN A2005800467145 A CNA2005800467145 A CN A2005800467145A CN 200580046714 A CN200580046714 A CN 200580046714A CN 101115847 A CN101115847 A CN 101115847A
- Authority
- CN
- China
- Prior art keywords
- compound
- analyte
- complex body
- polynucleotide
- enzyme
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6816—Hybridisation assays characterised by the detection means
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Medicinal Chemistry (AREA)
- Analytical Chemistry (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
Abstract
本发明涉及用于检测样品中的分析物的方法。本方法是基于聚合酶对多核苷酸底物的活性,其中多核苷酸底物连接于结合分析物的分子,例如抗体。通过掺入适当标记的核苷酸,和/或掺入半抗原偶联的核苷酸,可检测聚合酶的活性,其中半抗原偶联的核苷酸能够结合适当标记的半抗原的配体。
Description
技术领域
本发明总体上涉及用于检测样品中的分析物的方法。本方法是基于以多核苷酸为底物的聚合酶活性,其中多核苷酸底物连接于结合分析物的分子,例如抗体。通过掺入适当标记的核苷酸,和/或掺入半抗原偶联核苷酸,可检测聚合酶的活性,其中半抗原偶联核苷酸能够结合半抗原的适当标记的配体。
背景技术
低水平的靶分析物的检测、计数和鉴定,是常规医疗、工业和环境诊断法的基础。例如,对样品进行分析,以检测来自感染体、癌细胞、激素、生产杂质、污染物和用于生物恐怖主义(bioterrorism)的介质的分子。
许多不同类型的所述检测方法被广泛用于生物医学研究和临床实验医学中。已经证实在生物学和医学中,用于检测特异大分子种类(例如蛋白质)的方法是很有价值的分析技术,特别是用于鉴定正常和异常组织样品的分子组分。所述检测方法的实例包括:免疫测定法、用于镜检的免疫化学染色法、荧光激活细胞分选法(FACS)等等。
通常,检测方法使用至少一种结合特异靶分析物并产生可检测信号的分析试剂。这些分析试剂通常具有两种组分:(1)探针大分子,例如,可通过高度特异性和亲合性结合靶分析物的抗体,和(2)可检测标记,例如放射性同位素或共价连接的可检测分子。通常,探针大分子的结合特性限定了检测方法的特异性,相关标记的检测能力决定了检测方法的灵敏性。检测法的灵敏性反过来涉及所用标记的类型和用于检测标记的现有设备的质量以及类型。
在个体中,癌症的诊断仍然是难以实现的任务。尽管可以使用从血液或组织样品中获得的一些诊断性标记,例如癌胚抗原(CEA)、甲胎蛋白(AFP)或前列腺特异抗原(PSA),但迄今为止,对于这些个体中的癌症存在,根据其它临床诊断的证实,使用这些标记的分析法并不具有显著的灵敏性和/或特异性。
免疫学检测、或免疫测定法,广泛用于医疗诊断中。以抗体和相应的靶分析物的相互作用为基础,免疫测定法用于检测从小尺寸(如,滥用的药物)到大尺寸(如,HIV蛋白)范围的宽范围的分子。血清学检测是检测宿主对预先暴露抗原的免疫反应、而不是直接测试抗原的免疫测定法,即它们检测针对抗原的宿主抗体的存在。从大型自动化中心实验室系统到非处方(over-the-counter,OTC)妊娠测试均可获得许多的免疫测定系统。检测覆盖各种形式,包括乳胶凝集试验、沉淀试验、酶联免疫测定、直接荧光分析、免疫组织学测试、补体结合试验、血清学试验、免疫电泳分析、快速“试纸”检测 (如,侧向横流测试(lateralflow test)和流动测试(flow through test))。许多免疫学检测的一个缺点是它们相对不敏感。更具体地说,许多免疫测定法,例如酶联免疫测定(ELISA),仅仅导致单个标记部分与分析物的结合。结果,样品中分析物水平较低时,所述的方法不产生足够强的信号来提供样品中分析物的量的精确读数,并因此容易产生假阴性结果。
在已经发展的试图改进免疫测定法灵敏性的方法中,至少一种方法是“免疫PCR”(Sano等,1992;Adler等,2003;Joerger等,1995;Sperl等,1995)。该方法以形成分析物-抗体复合体为基础,其中抗体偶联于多核苷酸。然后,将多核苷酸作为模板用于聚合酶链反应(PCR),扩增产物作为测试样品中分析物水平的指示物。然而,众所周知,该方法的主要问题是PCR指数扩增靶多核苷酸的缺陷,和由此引起的在灵敏性与准确性之间获得合适平衡以提供样品中分析物水平的真实指示的困难。
Zhang等人(2001)描述了已经研发的、试图改进免疫测定法的灵敏性的另一方法。Zhang等人(2001)设计了涉及包含RNA聚合酶启动子的多核苷酸的方法,而不是依赖于偶联抗体的多核苷酸的PCR扩增。RNA聚合酶结合启动子之后,转录互补于多核苷酸的RNA。然而,该方法的缺点在于:所产生的产物是RNA,而RNA在许多生物样品中非常易于降解。
需要可用于检测样品中的分析物的另外的分析方法。
发明内容
本发明人设计了用于在样品中检测分析物的分析方法。本发明的分析方法导致形成可检测的复合体,其包含超过一种与分析物结合的标记部分。
在第一个方面中,本发明提供用于筛查样品中存在或不存在分析物的方法,该方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,
ii)将分析物-第一化合物复合体暴露于结合分析物-第一化合物复合体的第二化合物,以形成分析物-第一化合物-第二化合物复合体,其中第二化合物包含多核苷酸,
iii)在下列条件下将分析物-第一化合物-第二化合物复合体暴露于聚合酶,其中所述的条件是a)能容许聚合酶延长多核苷酸,或b)能容许聚合酶合成多核苷酸的互补链,和
iv)检测步骤iii)中的a)或b)部分的产物,
其中步骤iii)的部分b)不包括使用互补链作为模板进一步合成多核苷酸。
在第二个方面中,本发明提供用于筛查样品中存在或不存在分析物的方法,该方法包括:
i)将样品暴露于结合分析物-第二化合物复合体的第二化合物,以形成分析物-第二化合物复合体,其中第二化合物包含多核苷酸,
ii)将分析物-第二化合物复合体暴露于结合分析物的第一化合物,以形成分析物-第一化合物-第二化合物复合体,
iii)在下列条件下将分析物-第一化合物-第二化合物复合体暴露于聚合酶,其中所述的条件是a)能容许聚合酶延长多核苷酸,或b)能容许聚合酶合成多核苷酸的互补链,和
iv)检测步骤iii)中的a)或b)部分的产物,
其中步骤iii)的部分b)不包括使用互补链作为模板进一步合成多核苷酸。
检测到分析中所产生的聚合酶产物,表明存在所分析的分析物。还可测定产物的量,并且产物的量与被分析的分析物的量有关。因此,本发明的方法可用于检测、或用于检测并定量测试样品中的分析物。
在特别优选的实施方案中,聚合酶延长单链多核苷酸或部分双链多核苷酸的单链突出端(single stranded overhang)。
上述实施方案不但具有不需要加入引物的优点,而且额外的优点在于连接于(例如)抗体的多核苷酸相对较短。因此,在另外的优选实施方案中,多核苷酸长度小于约100个核苷酸、更优选长度小于约75个核苷酸、更优选长度小于约50个核苷酸、更优选长度小于约40个核苷酸、更优选长度小于约30个核苷酸、更优选长度小于约20个核苷酸。
在另一个实施方案中,该方法不包括使用杂交多核苷酸的引物。
延长单链多核苷酸或部分双链多核苷酸的单链突出端的聚合酶的实例,包括但不限于,poly(A)聚合酶、T4 RNA连接酶、端粒酶以及末端转移酶。优选地,聚合酶为端粒酶或末端转移酶。
端粒酶可分离自天然来源或重组产生。此外,端粒酶可来自产生所述分子的生物体,或其具有端粒酶活性的变体/衍生物/突变体。
本发明人已经发现癌细胞、特别是人癌细胞,可提供用于本发明方法的端粒酶的便利来源。因此在优选的实施方案中,通过裂解产生端粒酶的癌细胞来获得端粒酶。值得注意的是,现已确定在被用于本发明方法之前,不必从细胞裂解物其它成分中纯化端粒酶。因此,优选不必实施任何过程来从被裂解细胞的其它成分中纯化端粒酶。
如上指出的,优选地,聚合酶能够在缺少合适引物时延伸多核苷酸或合成多核苷酸的互补链。然而,在一些利用酶(例如Taq聚合酶)的实施方案中,需要有合适的引物,所述的引物在反应条件下可杂交多核苷酸并起到引发互补链的合成的作用。根据多核苷酸序列,很容易设计合适的引物。所述的引物通常较小,长度至少约12个核苷酸、长度至少约15个核苷酸、长度至少约18个核苷酸、长度至少约21个核苷酸、或长度至少约24个核苷酸。在特别优选的实施方案中,引物是线性的。在另一特别优选的实施方案中,引物是非环状的。
在另一个实施方案中,聚合酶是DNA聚合酶。合适的DNA聚合酶包括但不限于,Taq聚合酶、噬菌体T4聚合酶、噬菌体T7聚合酶以及大肠杆菌(E.coli)DNA聚合酶I的Klenow片段。
在另外的实施方案中,其中在聚合酶是RNA聚合酶的情况下,多核苷酸不包含被RNA聚合酶用来引发RNA转录的启动子区。
优选地,第一化合物和/或第二化合物附着在固相支持物上。可使用技术人员已知的任何合适的固相支持物。实例包括但不限于,磁珠、生物传感器芯片、微量滴定板的孔、浸染棒以及微阵列玻片。
在另一个实施方案中,在存在至少一种以可检测方式标记的核苷酸的情况下,实施步骤iii)。可使用技术人员已知的任何适当标记的核苷酸。实例包括但不限于,放射性同位素、荧光标记、化学发光标记、生物发光标记以及酶标记。
在另外的实施方案中,在存在至少一种半抗原偶联的核苷酸的情况下,实施步骤iii),其中半抗原能结合配体。合适半抗原的实例包括但不限于,半胱氨酸、赖氨酸、丝氨酸、生物素、抗生物素蛋白以及链霉抗生物素蛋白。
优选地,以可检测方式标记配体。可使用技术人员已知的任何合适的可检测标记。实例包括但不限于,放射性同位素、荧光标记、化学发光标记、生物发光标记以及酶标记。
优选地,步骤iii)还包括将聚合酶活性的产物暴露于以可检测方式标记的配体。
优选地,可检测的标记是酶。可使用技术人员已知的任何合适的标记的酶。实例包括但不限于,β-半乳糖苷酶、萤光素酶、碱性磷酸酶、神经氨酸酶以及辣根过氧化物酶。优选地,步骤iii)的聚合酶活性的产物是至少包含多核苷酸和掺入其中的半抗原偶联的核苷酸的复合体,其中至少部分半抗原结合于酶标配体,并且步骤iv)包括将步骤iii)的产物暴露于可允许酶产生可检测信号的条件。
优选地,通过酶与底物反应来产生可检测信号。用于本发明方法的合适底物是本领域技术人员所知的。实例包括但不限于,鲁米诺或9,10-二氢化吖啶(acridan)。还需要用于酶活的辅因子,例如在包含鲁米诺作为底物的反应中所存在的过氧化氢。此外,提供可增强可检测信号的分子。所述的分子在本领域中是已知的,并且包括但不限于对碘酚或对苯基苯酚。
优选地,可检测信号是发光或荧光。
本发明的每种方法都极有可能包括除去未结合的分析物、化合物、底物等等的步骤。所述步骤的实例包括但不限于:
●第一方面的步骤i)还包括洗涤分析物-第一化合物复合体,以除去未结合的第一化合物,
●第二方面的步骤i)还包括洗涤分析物-第二化合物复合体,以除去未结合的第二化合物,
●步骤ii)还包括洗涤分析物-第一化合物-第二化合物复合体,以除去未结合的第一和/或第二化合物,
●除去未掺入的以可检测方式标记的核苷酸、和/或
●除去未掺入的以可检测方式标记的配体。
第一化合物是特异结合样品中的分析物的任何化合物。在优选的实施方案中,第一化合物是蛋白质。更优选地,第一化合物是抗体。
第二化合物包含多核苷酸,特异结合分析物和/或第一化合物-分析物复合体。优选地,第二化合物是蛋白质-多核苷酸偶联物。更优选地,第二化合物是抗体-多核苷酸偶联物。此外,优选第二化合物结合分析物。
在优选的实施方案中,分析物是疾病状态的标记。更优选地,疾病状态选自但不限于,癌症和感染。
使用本发明方法可检测的合适分析物,包括有机和无机分子,所述分子包括生物分子。在优选的实施方案中,分析物是蛋白质、肽或小分子,例如有机小分子。
在一个特别优选的实施方案中,所述方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,其中第一化合物附着于固相支持物,
ii)将分析物-第一化合物复合体暴露于结合分析物的第二化合物,以形成分析物-第一化合物-第二化合物复合体,其中第二化合物包含可被端粒酶延伸的多核苷酸,
iii)在允许端粒酶延伸多核苷酸的条件下,在存在至少一种半抗原偶联的核苷酸的情况下,将分析物-第一化合物-第二化合物复合体暴露于端粒酶,
iv)在允许半抗原结合配体的条件下,将端粒酶活性的产物暴露于酶标记的配体,
v)在存在酶的底物的情况下,温育多核苷酸-半抗原-配体-酶复合体,以及
vi)检测由酶对底物的活性产生的可检测信号。
在另一个特别优选的实施方案中,所述方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,其中第一化合物附着于固相支持物,
ii)将分析物-第一化合物复合体暴露于结合分析物的第二化合物,以形成分析物-第一化合物-第二化合物复合体,其中第二化合物包含可被末端转移酶延伸的多核苷酸,
iii)在允许末端转移酶延伸多核苷酸的条件下,在存在至少一种半抗原偶联的核苷酸的情况下,将分析物-第一化合物-第二化合物复合体暴露于末端转移酶,
iv)在允许半抗原结合配体的条件下,将末端转移酶活性的产物暴露于酶标记的配体,
v)在存在酶的底物的情况下,温育多核苷酸-半抗原-配体-酶复合体,以及
vi)检测由酶对底物的活性产生的可检测信号。
在另一方面中,本发明提供了用于筛查样品中存在或不存在分析物的方法,该方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,
ii)将分析物-第一化合物复合体暴露于结合分析物-第一化合物复合体的第二化合物,以形成分析物-第一化合物-第二化合物复合体,
iii)将分析物-第一化合物-第二化合物复合体暴露于结合第二化合物的第三化合物,其中第三化合物包含多核苷酸,
iv)在下列条件下将分析物-第一化合物-第二化合物-第三化合物复合体暴露于聚合酶,其中所述的条件是a)能容许聚合酶延长多核苷酸,或b)能容许聚合酶合成多核苷酸的互补链,和
v)检测步骤iv)中的a)或b)部分的产物,
其中步骤iii)的部分b)不包括使用互补链作为模板进一步合成多核苷酸,并且其中将第一和/或第二化合物附着于固相支持物。
在本发明的该方面中,“第三化合物”被认为是可用于任何分析物的检测方法的“通用”试剂。在该方面中,优选第二化合物是抗体,第三化合物包含抗体,其中第二化合物(抗体)来自于第一动物物种,第三化合物的抗体结合第二化合物(抗体)并来自于不同的动物物种。所述的抗体及其制备方法是本领域中众所周知的。例如,第二化合物(抗体)来源于用分析物免疫的小鼠,第三化合物包含抗小鼠抗-IgG兔抗体。在另一个实例中,第二化合物(抗体)来源于用分析物免疫的兔,第三化合物包含抗兔抗-IgG山羊抗体。
使用“通用”试剂的测定法所具有的优点,在于不需要生成用于检测不同分析物的多核苷酸偶联物。例如,可从小鼠制备两种分别独立地结合已知癌标记CEA和PSA的不同抗体,然而,相同的多核苷酸偶联的抗-小鼠抗-IgG兔抗体可用于检测这些分析物的不同方法。
在应用聚合酶后,可从复合体解离出所合成或延伸的多核苷酸链,然而在本发明的任何方面中,不需要实施解离步骤即可容易地进行所合成或延伸的链的检测。
通过改变关键因子的浓度(例如结合分析物的化合物浓度、核苷酸前体浓度、标记的核苷酸前体与未标记的核苷酸前体的比例、聚合酶量以及检测方法),实施者可将本发明方法的灵敏性控制在某种程度上。通过所属领域技术人员已知的方法,可优化具体的分析法。
还提供了蛋白质-DNA偶联物,其中DNA包含可结合端粒酶并被其延伸的序列,蛋白质共价连接于DNA。所述的偶联物可用于本发明的方法中。优选地,蛋白质是抗体。
在另一个方面中,本发明提供包含了本发明的蛋白质-DNA偶联物的试剂盒。
显而易见的是,本发明的一个方面的优选特征和特性可适用于本发明的许多其它方面。
贯穿说明书的用语“包括”,或其变体,例如“包含”或“含有”,可被理解为暗示包括了所述的要素、整体或步骤,或包括了所述的要素、整体或步骤的集合,但不排除任何其它的要素、整体或步骤,或不排除任何其它的要素、整体或步骤的集合。
在下文中通过下列非限制性实施例并参照附图,来描述本发明。
附图说明
图1-本发明第一个方面的方法的实施方案的示意图。在该实例中,第一化合物是结合磁珠的抗体。磁珠使得在洗涤步骤中使用磁选机容易地将磁珠上形成的复合体与未结合成分分离。将包含分析物的样品与可使得分析物结合其上的第一化合物一起温育,而后通过第二化合物进行温育步骤。在该实例中,第二化合物是抗体-DNA偶联物,其与第一化合物在不同的位置结合分析物。多核苷酸包括能结合人端粒酶并被其延伸的序列。然后,在存在合适的核苷酸前体(包括生物素标记的dUTP)的情况下,将分析物-第一化合物-第二化合物复合体与人端粒酶一起温育。然后,将掺入到延长的多核苷酸中的生物素标记的dUTP,与抗生物素蛋白标记的辣根过氧化物酶(HRP)一起温育。然后,在存在过氧化氢、鲁米诺和碘酚的情况下,通过温育分析物-第一化合物-第二化合物-生物素dUTP-抗生物素蛋白-HRP复合体,并在光度计中检测光信号,以将HRP活性作为样品中分析物的量的指示物。
图2-NY-ESO与两种抗NY-ESO-1抗体(ES121和E978)的同时结合的BIAcore分析。
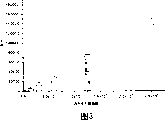
图3-通过使用抗-NY-ESO-1抗体偶联的珠和作为抗原的NY-ESO-1阳性黑素瘤细胞系的裂解物,基于磁珠的夹心法ELISA表明与黑素瘤细胞数目直接相关的线性响应。
图4-通过使用抗-EGFR抗体偶联的珠和作为抗原的纯化的EGFR,基于磁珠的夹心法ELISA表明与重组蛋白浓度直接相关的线性响应。
图5-在Superdex75柱(Amersham Bioscience)上可将交联剂修饰的抗体与未修饰的抗体分离,这表明使用两种不同的抗体的偶联反应是成功的,并且根据表观分子大小可纯化这些试剂。
图6-在与还原的寡核苷酸偶联后进行1.5%琼脂糖凝胶电泳。这些数据证实在图5中所报道的观测结果,其中当用溴化乙锭染色时,结合寡核苷酸的抗体产生强的带。
图7-在Superose12柱(30/10)(Amersham Bioscience)上,使用空间排阻层析法,从过量寡核苷酸分离的偶联抗体的分布型。这些数据支持了图5中所作的预测:使用标准色谱法,可实施结合寡核苷酸的抗体的纯化。
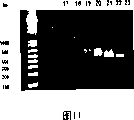
图8-1.5%琼脂糖凝胶,其显示了通过空间排阻层析法,在Superose12柱(30/10)(Amersham Bioscience)上进行纯化后的寡核苷酸偶联抗体。显示了每种抗体的峰值洗脱馏分8、9、10。
图9-偶联之前的抗体(泳道1&3)和纯化的偶联抗体(泳道2&4)的SDS-PAGE(3-8%Tris-乙酸),表明寡核苷酸结合抗体的复合体具有合适的和预期的分子量。
图10-在Superose 12层析后,偶联抗体的Mono Q洗脱曲线。峰值不均一性表明:多个寡核苷酸可偶联抗体,进一步提供适于延伸反应的时机,并因此增强了本发明的测定法的检测能力。
图11-在离子交换分离层析(MonoQ柱)后,寡核苷酸-偶联抗体的1.5%琼脂糖凝胶。独立地证实某些寡核苷酸-偶联抗体具有多个附着的核酸部分。
图12-使用端粒酶,延伸结合抗体的寡核苷酸。增强的发光表明:在存在端粒酶的情况下,所掺入的生物素化UTP增加。
图13-通过放大发光法(amplified luminescence)检测NY-ESO-1的测定结果(n=3)。
图14-在使用末端转移酶而放大信号后,检测磁珠结合寡核苷酸。
图15-显示偶联抗体的端粒酶识别序列的延伸反应的基于磁珠的分析。将末端转移酶与作为底物的荧光素-dUTP一起用于延伸反应。HI=热失活。
图16-放大的蛋白发光分析,其中显示:在存在末端转移酶和荧光素-dUTP的情况下,通过LMH42-寡核苷酸偶联物对可溶性EGFR(残基1-621)的特异检测。
图17-基于磁珠的端粒酶分析,其中显示:在衍生于膀胱癌细胞系(LAR 41)的粗提取物和预净化的提取物中的酶活性。HI=热失活。
具体实施方式
常规技术和定义
除非另外特别定义,本发明中使用的所有技术和科学的术语具有对于所属领域(如,细胞培养、分子遗传学、免疫学、免疫组织化学、蛋白质化学以及生物化学领域)的普通技术人员通常所理解的相同含义。
除非另外指出,本发明中所用的重组蛋白质、细胞培养以及免疫技术对于本领域技术人员而言是众所周知的标准方法。所述的技术在下列来源的文献中已经得到全部描述和说明,例如:J.Perbal,A PracticalGuide to Molecular Cloning,John Wiley和Sons(1984);J.Sambrook等,Molecular Cloning:A Laboratory Manual,Cold Spring Harbour LaboratoryPress(1989);T.A.Brown(编者),Essential Molecular Biology:APractical Approach,第1卷和第2卷,IRL Press(1991);D.M.Glover和B.D.Hames(编者),DNA Cloning:A Practical Approach,第1-4卷,IRLPress(1995年和1996年);和F.M.Ausubel等(编者),CurrentProtocols in Molecular Biology,Greene Pub.Associates and Wiley-Interscience(1988年,包括迄今为止的所有更新版);Ed Harlow和DavidLane(editors)Antibodies:A Laboratory Manual,Cold Spring HarbourLaboratory,(1988);和J.E.Coligan等(编者)Current Protocols inImmunology,John Wiley&Sons(包括迄今为止的所有更新版),并且以引用的方式并入本文。
“样品”指疑似含有目的分析物的物质。可使用从来源直接获得的样品,或在至少一个步骤后,使用至少部分纯化来自从来源直接获得的样品的目的分析物。所述的样品包括,例如,人、动物、植物、微生物或人造样品。可在不干涉分析的任何便利的介质中制备样品。通常,样品是如下更详述的水性溶液或生物流体。样品可来源于任何来源,例如生理流体,包括血液、血清、血浆、唾液、痰液、眼晶状体液、汗液、粪便、尿液、乳液、腹水、粘液、滑液、腹膜液、皮肤分泌液、咽分泌液、支气管肺泡灌洗液、气管吸痰液、脑脊髓液、精液、子宫颈粘液、阴道分泌液或尿道分泌液、羊水,等等。本文中,细胞组织的流体匀浆液,例如毛发、皮肤和指甲碎屑、肌肉的提取液,以及水果和坚果的皮也被认为是生物流体。预处理包括从血液、稀释的粘性流体等等制备血浆。处理方法包括过滤、蒸馏、分离、浓缩、干扰组分的失活以及加入试剂。除了生理流体之外,可使用适于工业、环境或食品生产分析以及诊断分析的其它样品,例如水、食品、土壤浸出液等等。另外,疑似含有分析物的固体物质可作为测试样品,只要将其改变以形成液体介质或释放分析物。在测试之前,生物、工业以及环境样品的选择和预处理,在本领域中是众所周知的,并不需要另外说明。
术语“分析物”指通过本发明方法而被检测或分析的物质。典型分析物包括但不限于,有机分子、无机分子、蛋白质、肽、细胞、微生物及其片段和产物,或用于研究附着位点、结合元件或受体(例如抗体)的任何物质。
如本文中所用的,“核苷酸”指碱基-糖-磷酸酯组合。核苷酸是核酸序列(DNA和RNA)的单体单元。术语核苷酸包括脱氧核糖核苷三磷酸,例如dATP、dCTP、dITP、dUTP、dGTP、dTTP或其衍生物。所述的衍生物包括,例如,7-脱氮-dGTP和7-脱氮-dATP。根据本发明,“核苷酸”可以是未标记的,或者通过众所周知的技术进行可检测标记。然而,本发明方法中所用的至少一种核苷酸是可被检测标记的,或被偶联于合适的半抗原。
术语“半抗原”指可连接于核苷酸并被聚合酶掺入多核苷酸的任何分子。此外,半抗原能结合至少一种分子(本文中通常是指“半抗原”的“配体”),也就是说连接于合适的可检测标记,例如本文中所述的标记。正如技术人员理解的,用语“半抗原”和“配体”仅仅作为限定本发明实施方案的便利术语。具体地说,半抗原和配体是结合对的成员,然而,究竟结合对的哪一个成员连接于例如核苷酸并不重要。例如在一个实施方案中,半抗原可以是生物素,配体是链霉抗生物素蛋白,然而在另一个实施方案中,半抗原是链霉抗生物素蛋白,而配体是生物素。用于本发明方法的合适半抗原和配体(“结合对”)是本领域中众所周知的。
多核苷酸偶联物
本发明方法需要包含多核苷酸的偶联化合物和结合目的靶的分子(例如蛋白质,如抗体)。在许多实施方案中,目的靶是待测分析物。然而,本发明也提供使用“通用”偶联化合物,这是针对可直接结合分析物的分子(例如抗体)。
多核苷酸可以是DNA或RNA或其组合。多核苷酸可以是单链或双链或其组合。
如本文中所用的,术语“多核苷酸”也指还能被延伸或作为多核苷酸合成的模板的DNA和/或RNA衍生物。所述衍生物的实例是肽核酸(PNA)。PNA通常具有由肽键连接的重复N-(2-氨乙基)-甘氨酸单元组成的骨架,而不是具有核糖骨架。通过甲叉羰基键,各种嘧啶和嘌呤碱基连接于骨架。与DNA/DNA双螺旋相比,PNA对降解较不敏感,并且与DNA可形成更加稳固的双螺旋。
通过本领域中任何已知的技术,将多核苷酸偶联于结合目的靶的分子上。实例包括但不限于,使用生物素-抗生物素蛋白的相互作用、二硫键的形成、胺偶联(参见,例如,Hendrickson等人,1995年)、硫醇偶联(参见,例如,Niemeyer等人,2003年)、或醛-肼的相互作用(参见,例如,Kozlov等人,2004年)。本领域技术人员已知的其它偶联剂,包括间-马来酰亚胺苯甲酰-N-羟基琥珀酰亚胺酯或相关化合物、碳二亚胺(例如1-乙基-3-(3-二乙氨基丙基)碳二亚胺(EDC))、琥珀酰亚胺基4-(N-马来酰亚胺甲基)环乙烷-1-羧酸酯(SMCC)、戊二醛交联剂。
如本领域技术人员理解的是,可将超过一种的多核苷酸偶联于单个分子(例如抗体)上。这可增强分析的灵敏性。
例如,将多核苷酸偶联于抗生物素蛋白,优选是链霉抗生物素蛋白或中性抗生物素蛋白,然后连接于生物素化抗体。另外,例如,可使用类似于Chu等人(1986)描述的方法,其中生物素通过二硫键连接于多核苷酸的5′末端,并且生物素化的多核苷酸与抗生物素蛋白结合以形成多核苷酸-生物素-抗生物素蛋白加合物,于是这可偶联于生物素化抗体。对于本领域技术人员而言,用于将抗生物素蛋白连接于多核苷酸的其它方法是已知的,例如使用蛋白A(Sano等人,1992)的方法、使用结合目的靶的分子(例如蛋白质,如抗体)的方法
本领域技术人员可理解,在一些情况中,将多核苷酸偶联于可结合目的靶的分子(例如蛋白质,如抗体),可引起空间位阻,导致聚合酶的减少。通过使用合适接头(例如在文献中以前描述的那些接头,包括Kwon等人(2004)、Arora等人(2002)以及Ansari等人(2001)论述的接头),可防止这种情况。
聚合酶
通常,在本发明方法中,可使用任何能延伸多核苷酸、和/或合成多核苷酸互补链的聚合酶。
本发明方法中所用的合适的依赖DNA的DNA聚合酶实例包括,但不限于Tth DNA聚合酶、Vent DNA聚合酶、Pwo聚合酶、来自细菌例如大肠杆菌(E.coli)的DNA聚合酶I的Klenow片段,以及T4 DNA聚合酶。
本发明方法中所用的合适的依赖RNA的DNA聚合酶实例包括,但不限于AMV逆转录酶和M-MLV逆转录酶、SuperScript III和Tth聚合酶。
本发明方法中所用的合适的依赖DNA的RNA聚合酶实例包括,但不限于T7 RNA聚合酶、SP6 RNA聚合酶和T3 RNA聚合酶。
本发明方法中所用的合适的依赖RNA的RNA聚合酶实例包括,但不限于Qβ复制酶、丙型肝炎RdRp、水泡性口炎病毒(vesicular stomatitisvirus)dRp、芜菁黄花叶病毒(turnip yellow mosaic virus)复制酶和RNA噬菌体phi6的依赖RNA的RNA聚合酶。
在特别优选的实施方案中,聚合酶延伸单链多核苷酸或部分双链多核苷酸的单链突出端。所述聚合酶的实例包括但不限于,poly(A)聚合酶、T4 RNA连接酶、端粒酶和末端转移酶。
本发明方法中所用的端粒酶可分离自永生性人细胞。通过在低渗缓冲液中或非离子型去垢剂中进行提取,可纯化端粒酶。还可通过DEAE柱和后续纯化技术,来进行纯化。然而,通过仅仅裂解合适的细胞而不需要实施任何纯化步骤,可获得端粒酶。含有端粒酶的细胞来源可以是人肿瘤细胞系,例如LIM 1215(Whitehead等,1985)、Hela细胞、HEK293细胞(Graham等,1977)以及T-75细胞(van Bokhoven等,2001)。
端粒酶还可分离自许多其它来源,例如酵母或四膜虫(Bryan等,1998)。或者,可使用本领域技术人员公知的重组方法制备端粒酶。
通过人端粒酶而延伸的合适的多核苷酸序列实例包括,但不限于TTAGGGTTAGGGTTAGGG(SEQ ID NO:1)、TTTTTTAATCCGTCGAGCAGAGTT(SEQ ID NO2)、TTTTTTAATCCGTCGAGCAGAGTTAGGGTTAGGGTTAG(SEQ IDNO:3)以及TTTTTTAATCCGTCGAGCAGAGTTAG(SEQ ID NO:4)。如技术人员应当理解的,上述核酸可以是截短的或延长的,并还可用于本发明方法。
四膜虫可合成端粒重复序列5′TTGGGG 3′(SEQ ID NO:5)。克隆编码序列上的模板,并可改变其序列,以编码人端粒重复序列5′TTAGGG3′(SEQ ID NO:6)。然后通过改变RNA序列重组四膜虫酶,以制备合成人端粒序列的端粒酶。可从四膜虫获得大量的这种酶,纯化,并加入细胞。
在本领域中,已知通常通过癌细胞生产端粒酶。因此,在本发明方法中,当使用端粒酶(特别是哺乳动物端粒酶)作为用于检测癌分析物的酶时,优选所述分析物与可内源性包含在来自受检对象的样品中的任何端粒酶是分离的。
末端转移酶是催化单核苷酸dNTP反复添加到多核苷酸底物末端的3′-OH上的聚合酶。适于这种酶的许多优选的底物是突出的3′端,但所述底物也可将核苷酸添加到DNA片段的平末端和3′凹末端上。通常钴是适于这种酶活性的必需辅因子,这些酶在某些情况下,可被引入分析。末端转移酶是在淋巴细胞中表达的哺乳动物酶类。可商业上购买酶,也通常可通过牛基因在大肠杆菌中的表达来进行生产。商业来源的实例是Promega(麦迪逊,威斯康星,美国)。
poly(A)聚合酶以不依赖序列的模式将腺苷添加到RNA的3’末端上。通常使用距polyA位点约10-30个核苷酸的共有序列AAUAAA(SEQ ID NO:7)和该位点3’端的富GU和/或富U元件。如果AAUAAA信号位于分子末端的合适距离,该信号通常对于聚腺苷酸化起始和延伸反应是足够的。技术人员很容易制备可作为poly(A)聚合酶底物的RNA分子。如本文中概述,酶可用于将标记ATP添加到RNA分子的3′端,以生成标记RNA。可重组制备poly(A)聚合酶,或通过从基本上任何真核细胞进行纯化而获得poly(A)聚合酶。本发明方法中所用的poly(A)聚合酶商业来源包括Ambion公司(Austin,得克萨斯,美国)、Invitrogen(Carlsbad,加利福尼亚,美国)以及USB公司(Cleveland,俄亥俄,美国)。
多核苷酸合成及其检测
在一个实施方案中,偶联多核苷酸作为用于聚合酶合成互补链的模板。在另一个实施方案中,通过聚合酶的作用,来延伸偶联的多核苷酸。
在一个实施方案中,通过将合适引物退火到偶联多核苷酸区来引发聚合酶活性。只要能特异退火到多核苷酸区,引物可以是任何长度或碱基组成。在存在一种或多种核苷三磷酸的情况下,并且如果需要,还可在存在辅助结合蛋白的情况下,实施延伸反应。
优选通过分析与掺入的核苷酸相结合的半抗原的存在,测定dNTP的掺入。在优选的实施方案中,通过测量连接于特异dNTP的生物素分子的存在,来检测合成的多核苷酸链。通过酶联链霉抗生物素蛋白分子和例如化学发光的底物,显示与多核苷酸链相关的生物素的存在。
在一个实施方案中,通过聚合酶,将半抗原标记的核苷酸(例如生物素、地高辛配基)掺入不断延伸的多核苷酸链。然后加入与半抗原结合蛋白(配体)偶联的酶以标记多核苷酸。加入适于酶(例如碱性磷酸酶、辣根过氧化物酶或β-半乳糖苷酶)的化学发光底物,来发光(由检测器记录)。
用于将底物转变成光的合适酶,包括萤光素酶,例如昆虫萤光素酶。萤光素酶产生作为催化终产物的光。最著名的发光酶是萤火虫(Photinus pyralis)(鞘翅目)的发光酶(参见,例如,美国专利5,618,722)。另外,已经克隆了许多来自牙买加叩头虫(Pyroplorusplagiophihalamus)(鞘翅目)的萤光素酶基因。在存在萤光素、5′三磷酸腺苷(ATP)、镁离子和氧的情况下,萤火虫萤光素酶催化生物发光,得到0.88的量子产率。个别萤光素酶有时可产生不同波长的光,这使得能够同时监测不同波长的发光。
萤光素酶可直接水解dATP,同时伴随释放光子。这产生假阳性信号,因为水解发生独立于由于聚合酶活性引起的dATP的掺入。为了避免这种问题,可使用被掺入DNA中的dATP类似物,即,dATP类似物是DNA聚合酶的底物而不是萤光素酶的底物。一种所述的类似物是α-硫代-dATP。因此,使用α-硫代-dATP避免了假性光子的产生,其中当dATP被水解而没有被掺入生长的核酸链时,可出现假性光子的产生。
具有市售化学发光底物的酶的实例,包括β-半乳糖苷酶、碱性磷酸酶、神经氨酸酶和辣根过氧化物酶。
碱性磷酸酶常常偶联于被用作二级检测试剂的链霉抗生物素蛋白、抗生物素蛋白或抗体。这些检测试剂广泛地用于各种应用,包括ELISA、和Northern、Southern以及Western印迹技术。可使用显色底物(例如产生深蓝色沉淀的BCIP)、荧光磷酸酶底物以及化学发光底物。碱性磷酸酶的CDP-StarTM和CSPDTM(购自AppliedBiosystems,Foster City,加利福尼亚,美国)的化学发光底物,能相对灵敏、快速、简易地检测碱性磷酸酶和碱性磷酸酶标记的分子。
NA-StarTM化学发光底物(Applied Biosystems)能灵敏地检测神经氨酸酶活性。这种底物为广泛应用的荧光底物甲基伞形基N-乙酰神经氨酸的高灵敏度的替代物。通过产生用膜或仪器检测的可见光,1,2-二氧环丁烷化学发光底物能极敏感地检测生物分子。酶诱导分解时,化学发光底物放射可见光,提供低本底发光伴随着高强度光输出。
辣根过氧化物酶(HRP)的化学发光底物可购自几家制造商,包括Alpha Diagnostic International,Inc.(San Antonio,Tex.)和PierceBiotechnology Inc.(Rockford,IL,USA)。Alpha Diagnostic International′s Nu-Glo底物以稳定的两种组分溶液提供,且为基于鲁米诺的溶液。在存在过氧化氢的情况下,HRP将鲁米诺转换成激发态二阶阴离子,它们在恢复成其基态时发光。可通过使用暗室光度计或X光胶片测量所得的信号,以提供永久记录。
使用各种检测装置,如胶片、光电倍增管、CCD、CMOS、消光光度计、光度计、电荷注入器件(CID)、或其它固态检测器,以及本文中所述的装置,可检测和量化发光。在一个实施方案中,通过使用配备熔合光导纤维束,进行确定放射的光子量。在另一个实施方案中,通过使用配备了微通道板增强器的CCD相机,实现了放射的光子的定量。可使用薄型背照式CCD(back-thinned CCD)来提高灵敏性。Bronks等人(1995)描述了CCD检测器。
示例性CCD系统是配备了Lockheed-Martin LM485 CCD芯片和单根纤维直径6-8μm的1-1光纤连接器(束)的Spectral Instruments,Inc.(Tucson,Arizona,美国)系列的600 4-端口相机。这种系统具有超过1600万像素,并具有10%至大于40%的量子效率。因此,根据波长,在CCD传感器上成像的差不多40%的光子被转变成可检测的电子。
在其它实施方案中,荧光部分可用作标记,并可使用共聚焦扫描显微镜来检测反应事件。另外,可使用扫描隧道显微镜和原子力显微镜。
在本发明方法中,可利用其它可通过放射的光子而被检测的底物(标记)的实例。9,10-二氢化吖啶底物与酶的反应,产生可发光的激发态中间体。例如,反应可发生在Pierce Lumi-Phos WB底物和碱性磷酸酶之间,然而可根据被其上的9,10-二氢化吖啶分子所取代的可裂部分而改变所用的酶。鲁米诺底物与过氧化物酶的反应,产生不稳定中间体,该中间体发光可发光并被转化成3-aminophtalate二阶阴离子。这种反应出现在Pierce SuperSignalTM ELISA Femto最高灵敏度的底物中。此外,1,2-二氧环丁烷底物与酶的反应,会产生不稳定中间体,该中间体断裂产生两种产物分子,即能发光的金刚烷酮和化学激发的荧光团。例如,反应可发生在Lumigen PPD和碱性磷酸酶之间。根据基于1,2-二氧环丁烷的底物上取代的可裂部分,所用的酶可以不同。
对于大多数应用而言,需要洗去未掺入的试剂,例如,用洗涤缓冲液洗去未掺入的dNTP。可使用不妨碍复合体的形成/稳定性、和/或其检测的任何洗涤缓冲液。所述的洗涤缓冲液为本领域技术人员公知的。
固相支持物
通常,本发明方法中所用的至少一种试剂需要被附着于合适的固相支持物。在特别优选的实施方案中,将第一化合物附着在固相支持物上。然而,在某些情况中,通过与载体的非特异性相互作用(例如,在蛋白质和聚苯乙烯之间的疏水性相互作用)而被直接吸收,分析物可起到俘获试剂的作用。
在本领域中,本发明方法中所用的合适的固相支持物是常规的和众所周知的。可考虑各种可能的载体。例如,合适的固定化支持物包括但不限于,合成聚合物支持物,例如聚苯乙烯、聚丙烯、聚甲基丙烯酸缩水甘油酯(polyglycidylmethacrylate)、取代的聚苯乙烯(如,氨化(animated)或羧化的聚苯乙烯、聚丙烯酰胺、聚酰胺、聚氯乙烯,等等),玻璃,金,琼脂糖,硝酸纤维素,和尼龙。这些材料可作为薄膜、微量滴定板、加样孔、珠、玻片、粒子、针(pin)、钉(peg)、试管、膜或生物传感器芯片。或者,载体包括磁性和非磁性粒子。优选的磁性粒子是磁珠,例如购自Dynal Biotech(Oslo,挪威)、Polymer LabsLodestar Beads(Shropshire,英国)或Millipore CPG Beads(Millipore,LaneCove,澳大利亚)的磁珠。
对于本领域技术人员而言,用于将各种分子附着到各种金属、玻璃、塑料等等的许多方法和接头分子以及底物都是众所周知的(参见,例如,EP188,256;US,671,958;US4,659,839;US4,414,148;US4,699,784;US4,680,338;US4,569,789;US4,589,071以及H.Weetall,Immobilized Enzymes,Antigens,Antibodies and Peptides,Marcell Dekker,Inc.,纽约(1975))。例如,“接头”可用于将合适分子附着到固相支持物上。对于本领域技术人员而言,合适的接头是众所周知的,包括但不限于,直链或支链碳接头、杂环碳接头或肽接头。
具有与表面基团反应的一种官能团和与期望分子(例如第一化合物)反应的另一种官能团的双功能接头,可用于形成所需的偶联物。或者,衍生化作用可包括化学处理。例如,将二氧化硅或玻璃基板进行硅烷化,以构建官能团。类似地,例如,通过将连接于蛋白抗体的糖部分与过碘酸酯进行二元醇裂解(glycol cleavage)以产生游离醛基,可将蛋白质或糖蛋白进行衍生化。在抗体或蛋白质或糖蛋白上的游离醛基可与表面的游离胺基或肼基反应,以结合其上面的结合配偶体(参见US4,671,958)。用于在多肽(例如抗体或抗体片段)上产生游离巯基的方法,也是已知的(参见US4,659,839)。
在水性环境中,可使用阵列来实施独立平行的普通反应。阵列具有至少1,000个离散的反应室的基片,其中反应室含有能与试剂反应的原料,测量每个反应室的容积,以便当将含有至少一种试剂的一种或多种流体输送到每个反应室中时,试剂溢出加样孔的扩散时间超出原料与试剂反应以形成产物所需的时间。通过在基片上形成多个空腔,可形成反应室。通过蚀刻、铸模或微切削加工,可在基片中形成多个空腔。空腔具有平底或凹底。在优选的实施方案中,基片是光导纤维束。在另外的实施方案中,通过在平面表面上形成不连续的膜片(pach),可形成反应室。与周围的平表面相比,膜片具有不同的表面化学。
抗体
出于本发明目的,除非相反规定,术语“抗体”包括保持对靶分析物的结合活性的所有的抗体片段。所述的片段包括Fv、F(ab′)、F(ab′)2和dAb片段,以及单链抗体(scFv)。此外,抗体及其片段可以是人源化抗体,例如EP-A-239400中所述的抗体。
用于本发明方法的抗体可以是单克隆或多克隆的。然而,为了降低与本底信号相关的任何问题,优选抗体是单克隆的。
术语“特异性结合”指抗体结合样品中的特殊分析物但不是其它分子和/或非靶分析物的能力。
如果期望是多克隆抗体,可用目的分析物(例如免疫原性多肽)来免疫所选的哺乳动物(如,鼠、兔、羊、马,等等)。收集来自免疫动物的血清,并根据已知方法进行处理。如果含多克隆抗体的血清含有其它抗原的抗体,可通过免疫亲和层析来纯化多克隆抗体。在本领域中,用于制备和加工多克隆抗血清的技术是已知的。
本领域技术人员还可容易地生产直接针对目的分析物的单克隆抗体。通过杂交瘤来制备单克隆抗体的常规方法是众所周知的。通过细胞融合,也可通过其它方法,例如用致癌性DNA直接转化B-淋巴细胞、或用Epstein-Barr病毒转染,可构建生产永生化抗体的细胞系。根据各种性质,即,同种型和表位亲合力,来筛选所生产的单克隆抗体组。
可选择的技术包括筛选噬菌体展示文库,其中,例如噬菌体在其衣壳的表面上表达scFv片段与大量不同的互补决定区(CDR)。这种技术也是本领域中众所周知的。
用途
通过本发明方法可检测的合适分析物,包括有机和无机分子,所述分子包括生物分子。在优选的实施方案中,分析物可以是环境污染物(包括农药、杀虫剂、毒素,等等)、化学品(包括溶剂、有机材料,等等)、治疗性分子(包括治疗性和滥用的药物、抗生素,等等)、生物分子(包括激素、细胞因子、蛋白质、脂质、碳水化合物、细胞膜抗原和受体(神经、激素、营养物以及细胞表面受体)或其配体,等等)、全细胞(包括原核细胞(例如病原菌)和真核细胞(包括哺乳动物肿瘤细胞))、病毒(包括逆转录病毒、疱疹病毒、腺病毒、慢病毒,等等)、可用于生物恐怖主义的因子(例如炭疽)和孢子,等等。特别优选的分析物是环境污染物、核酸、蛋白质(包括酶、抗体、抗原、生长因子、细胞因子,等等)、治疗性和滥用的药物、细胞、以及病毒。
特别优选的靶分析物包括蛋白质和核酸。如本文中所用的“蛋白质”,包括蛋白质、多肽和肽。蛋白质可由天然存在的氨基酸和肽键、或合成的多肽模拟物结构而组成。侧链可以是(R)构型或(S)构型。
待检的分析物包括:激素,例如生长激素、胰岛素、促肾上腺皮质激素(ACTH)、甲状腺刺激激素(TSH)、促黄体生成素(LH),以及胃肠激素,如胰高血糖素样肽;生长因子,例如表皮生长因子(EGF)、血管内皮细胞生长因子例如VEGF、VEGF-B、VEGF-C、VEGF-D以及VEGF-E、神经生长因子(NGF)、血小板衍生生长因子(PDGF)以及相关分子、成纤维细胞生长因子(FGF)、胰岛素样生长因子(IGF)以及肝细胞生长因子;细菌毒素;细菌代谢物及其抗体;外生孢子成分;病毒壳体成分;酶,例如碱性磷酸酶(ALP)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)、乳酸脱氢酶(LDH)、凝血因子;脂蛋白,例如极低密度脂蛋白(VLDL)、高密度脂蛋白(HDL)以及低密度脂蛋白(LDL);受体,例如激素受体,如胰岛素受体、生长激素受体、EGF受体,和神经受体,如乙酰胆碱受体;癌标记,例如下述癌标记;细胞表面抗原,例如组织相容性抗原;自身抗体;C-反应蛋白;以及其它生理活性的物质,例如肽酶抑制剂,如巨球蛋白;以及补体,例如载体蛋白、IGF-结合蛋白以及转铁蛋白。
本发明可用于检测样品中肿瘤抗原(分析物)的存在。使用本发明方法,可检测的肿瘤抗原实例,包括但不限于,AFP(适于肝细胞癌和生殖细胞肿瘤的标记)、CA 15-3(适于众多癌的标记,包括乳腺癌)、CA 19-9(适于众多癌的标记,包括胰腺癌和胆道肿瘤)、CA125(适于各种癌的标记,包括卵巢癌)、降钙素(适于各种肿瘤的标记,包括甲状腺髓样癌)、苯邻二酚胺和代谢物(phaeochromoctoma)、CEA(适于各种癌的标记,包括结肠直肠癌及其他胃肠道癌)、上皮生长因子(EGF)和/或上皮生长因子受体(EGFR)(两者都与各种上皮癌相关,包括结肠癌)、A33结肠上皮抗原(结肠癌)、hCG/βhCG(适于各种癌的标记,包括生殖细胞肿瘤和绒毛膜癌)、尿中的5HIAA(类癌瘤综合征)、PSA(前列腺癌)、血清素(类癌瘤综合征)、甲状腺球蛋白(甲状腺癌)、和CT抗原(Scanlan等,2002)例如NY-ESO-1(食道癌和膀胱癌以及黑素瘤的标记)、LAGE、MAGE(与许多肝癌以及黑素瘤相关)、GAGE(肝癌)、SSX2(肉瘤)分化抗原(例如Melan A/MART1,GP100和酪氨酸酶)、突变抗原(例如CDK4、β-连环蛋白)、扩增抗原(例如P53和Her2)、以及剪接变体抗原(例如ING1)。
本发明还可用于检测样品中微生物和/或其产生的分析物的存在。靶可以是但不限于,病毒、细菌、真菌或原生动物。可用于本发明的具体的非限制实例包括细菌,例如结核分枝杆菌(Mycobacteriatuberculosis)、立克次氏体(Rickettsia rickettsii)、莱姆病螺旋体(Borreliaburgdorferi)、鼠疫耶尔森氏菌(Yersinia pestis)、梅毒螺旋体(Treponemapallidum)、沙眼衣原体(Chlamydia trachomatis)、肺炎衣原体(Chlamydiapneumoniae)、肺炎支原体(Mycoplasma pneumoniae)、支原体属(Mycoplasma sp.)、嗜肺军团菌(Legionella pneumophila)、杜莫夫军团菌(Legionella dumoffii)、发酵支原体(Mycoplasma fermentans)、埃立克体(Ehrlichia sp.)、流感嗜血杆菌(Haemophilus influenzae)、脑膜炎奈瑟氏球菌(Neisseria meningitidis)、肺炎链球菌(Streptococcus pneumonia)、无乳链球菌(S.agalactiae)以及单核细胞增生性李斯特菌(Listeriamonocytogenes);病毒,例如1型人免疫缺陷病毒(HIV-1)、1型人T细胞嗜淋巴细胞病毒(HTLV-1)、乙肝病毒(HBV)、丙肝病毒(HCV)、单纯性疱疹、疱疹病毒6、疱疹病毒7、Epstein-Barr病毒、巨细胞病毒、水痘带状疱疹病毒、JC病毒、细小病毒B 19、流感病毒A、B和C、轮状病毒、人腺病毒、风疹病毒、人肠道病毒、生殖器人乳头瘤病毒(HPV)、以及汉坦病毒;真菌,例如新型隐球菌(Cryptococcusneoformans)、卡氏肺囊虫(Pneumocystis carinii)、荚膜组织胞浆菌(Histoplasma capsulatum)、皮炎芽生菌(Blastomyces dermatitidis)、粗球孢子菌(Coccidioides immitis)以及红色毛癣菌(Trichophyton rubrum);和原生动物,例如克鲁斯氏锥体虫(Trypanosoma cruzi)、利什曼原虫属(Leishmania sp.)、疟原虫属(Plasmodium sp.)、痢疾阿米巴(Entamoebahistolytica)、田鼠巴贝虫(Babesia microti)、兰氏贾第鞭毛虫(Giardialamblia)、环孢子虫(Cyclospora sp.)以及艾美耳球虫属(Eimeria sp)。本发明方法也可用于检测隐孢子虫属(Cryptosporidium sp.)卵囊;用于鉴定细菌毒素,例如来自霍乱弧菌(Vibrio cholerae 01)、产肠毒素大肠杆菌、志贺氏杆菌属(Shigella sp.)、肠侵染性大肠杆菌、幽门螺杆菌(Helicobacter pylori)、产毒素难辨梭菌(Clostridium difficile)、金黄葡萄球菌(Staphylococcus aureus)以及化脓性链球菌(Streptococcus pyogenes)外毒素。
试剂盒
公开的检测方法所需要的至少部分材料和试剂可一起组装在试剂盒中。本公开的试剂盒通常至少包括为实施请求保护的方法所必需的聚合酶和核苷酸。在优选的实施方案中,试剂盒包含蛋白质-DNA偶联物,其中DNA包含可结合端粒酶并被其延伸的序列。在另一优选实施方案中,试剂盒也包含用于检测样品中的分析物的说明书。试剂盒还可包含用于检测聚合酶活性的工具。
试剂盒可还包含以不同的浓度提供的对照样品,以使使用者你能绘制合适的标准曲线。例如,用于检测NY-ESO-1的试剂盒包含浓度为25、50、100、250以及500ng/ml的重组NY ESO-1。
在每种情况中,优选试剂盒具有适于每种单个试剂和聚合酶的不同容器。通常将每种生物制剂在它们各自的容器中进行适宜地等分。试剂盒的容器工具通常包括至少一种小瓶或试管。装有试剂并对其进行等分的培养瓶、瓶及其它容器工具也是可以的。优选严格限制地保持试剂盒的单个容器,以备商业销售。
实施例
实施例1-NY-ESO-1与两种抗NY-ESO-1抗体(ES121和E978)的同时结
合
通过胺偶联化学作用,将小鼠抗人-NY-ESO-1 mAbES121(Jungbluth等,2001)固定化在CM5 BIACore表面等离子共振(SPR)生物传感器表面上。以流速5μl/min,将重组抗原NY-ESO-1(40mM尿素/DDW中含150μg/ml)(Murphy等,2005)注射在ES121固定化表面上。以流速5μl/min,注射抗体ES121,以确保没有非特异性结合,然后将小鼠抗人-NY-ESO-1 mAb E978(Jungbluth等,2001)(Invitrogen Carlsbad,California,美国)注射在表面上。
结果表明:抗原NY-ESO-1以相对较高的亲合力与固定化ES121mAb的表面结合,而且当再次将ES121 mAb注射在抗体-抗原表面上时,几乎看不到非特异性结合(图2)。mAb E978的最后注射,显示它通过高亲合力和特异性可识别和结合表面上所捕获的NY-ESO-1。以抗体结合的相反顺序实施该实验,具有相似的结果(数据未显示)。
实施例2-一级抗体偶联和鉴定
将M270 Carboxylic Acid Dynal珠偶联于抗NY-ESO-1抗体(E978)或抗EGFR抗体。根据制造商的说明书,使用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)/N-羟基琥珀酰亚胺(NHS)试剂,通过胺偶联化学作用,将各种抗体(25mM MES pH5)共价偶联于M270羧酸珠。使用Superose 12柱(10/30),通过空间排阻层析(SEC)来监测偶联效率。
为了测定有效的mAb偶联,和为了证实mAb仍然具有生物活性,将基于珠的自动化夹心ELISA分析进行显色。将偶联于磁珠(300μg/ml的偶联珠)的抗体与其各种抗原(细胞裂解物或纯化蛋白)进行温育,然后将该复合体与另一种已被生物素化的抗NY-ESO-1或抗EGFR抗体(含2μg/ml的PBS/3%BSA缓冲液)进行温育。根据ECL ProteinBiotinylation Module试剂盒(Amersham Bioscience),进行生物素化。为了检测,然后将它与作为最终化学发光读出的底物的链霉抗生物素蛋白-HRP(1μg/ml KPL)一起温育。加入50μl鲁米诺和50μl过氧化物(Supersignal ELISA Femto底物,Pierce)时,产生了化学发光。
结果表明:对于两个实施例而言,偶联于磁珠都是有效的,并且抗体以允许各种抗原结合的方向进行偶联(图3和图4)。
实施例3-寡核苷酸-抗体偶联
将两种抗体(抗-NY-ESO-1(ES121)和抗-EGFR)顺利地偶联于端粒酶识别寡核苷酸(5′-TTTTTTAATCCGTCGAGCAGAGTTAGGGTTAGGGTTAG-3’-SEQ ID NO:3),所述的寡核苷酸包含5′硫醇修饰,容许通过使用NHS-酯-马来酰亚胺交联剂N-[γ-马来酰亚胺基丁酰-氧代]磺基琥珀酰亚胺酯(磺基-GMBS,Pierce)经过硫醇偶联化学作用而进行偶联(Schweitzer等,2000)。使用HPLC、SDS-PAGE凝胶电泳和TBE-琼脂糖电泳,监测偶联和纯度(图5至图9)。使用BCA(Pierce)和Oligreen(Pierce)分析(参见下文),通过分光光度法获得定量和化学当量。通过氨基酸定量分析,获得蛋白质绝对浓度。
由于多个标记经过赖氨酸残基的偶联,使用Mono-Q层析实现了不均一性的进一步分析(图10)。通过SDS-PAGE(数据未显示)和1.5%琼脂糖凝胶,分析馏分17-22回收的峰值,以显示所产生的不同寡核苷酸-抗体同工型(图11)。
实施例4-寡核苷酸-抗体鉴定
在基于珠的延伸反应分析中,分析实施例3中描述的寡核苷酸-抗体,来确保寡核苷酸-抗体仍然具有生物活性,并能分别结合NY-ESO-1或EGFR:该分析也表明寡核苷酸识别序列可通过酶(端粒酶)进行延伸。
经过胺偶联化学作用,将DynalM270胺磁珠与可溶性的EGFR的高亲合力形式进行偶联。在Kingfisher微粒处理器中,进行自动化分析。将6μl/孔的偶联EGFR的磁珠用封闭缓冲液(PBS/1%BSA)进行封闭,然后在室温(RT)下将其与寡核苷酸-抗EGFR抗体一起温育30分钟,或用于非放大分析抗EGFR抗体-生物素。根据ECL ProteinBiotinylation Module试剂盒(Amersham Bioscience),进行生物素化。然后将样品与用于扩增的反应混合液一起温育,其中混合液含有20mMTris-HCl、1.5mM MgCl2、63mM KCl、1mM EGTA、1mM EDTA、150mM NaCl、0.005%Tween 20、12.5μM生物素-21-dUTP、18.75μMdAdG、1μl端粒酶和来自106个细胞的LIM1215裂解物(墨尔本路德维格学院细胞系1215-Whitehead等,1985)。包括热失活的端粒酶(95℃,20分钟)作为对照。在扩增步骤后,进行多次洗涤,然后室温下将样品与0.5μg/ml链霉抗生物素蛋白-HRP一起温育30分钟。在这次温育后,在重悬浮于终容积50μl的工作缓冲液中之前,用工作缓冲液洗涤样品(0.1M Tris,0.1M KCl,pH7.4),然后将样品转入白色发光96孔平板,并在刚一加入50μl鲁米诺和50μl过氧化物(Supersignal ELISA Femto底物,Pierce)就在BMG Flurostar光度计中读出发光。
结果(n=2)表明:来自放大分析的信号显著地高于热失活的对照和未放大的ELISA信号(图12)。
实施例5-寡核苷酸-抗体定量
通过检测ssDNA的基于荧光分析的Oligreen(Pierce)分析,来确定寡核苷酸的含量。以通过未修饰寡核苷酸所生成的标准曲线为基准,定量寡核苷酸-抗体。
通过标准BCA分析来测定抗体浓度,由于没有寡核苷酸引起的信号干扰,使得可准确地估计蛋白质含量。在550nm读出吸光度。
实施例6-使用端粒酶检测NY-ESO-1
将偶联于E978 mAb(180μg)的磁珠与分离自黑素瘤细胞系LAR41的NY-ESO-1阳性胞质提取物一起温育(0.5×107细胞,室温,60分钟)。黑素瘤细胞系的LAR(Ludwig Austin Repatriation)系列来源于路德维格学院的病人活检样品,并在建立之前得到各个病人的同意。
在抗原结合后,将磁珠与ES121 mAb一起温育(16μg/ml,室温下60分钟),其中所述的ES121 mAb用适于端粒酶的寡核苷酸识别序列(5′-TTTTTTAATCCGTCGAGCAGAGTTAGGGTTAGGGTTAG-3’-SEQID NO:3)进行标记,其中所述的寡核苷酸识别序列包含5′硫醇修饰,使得使用NHS-酯-马来酰亚胺交联剂N-[γ-马来酰亚胺基丁酰-氧代]磺基琥珀酰亚胺酯(磺基-GMBS,Pierce)(如上所述)通过硫醇偶联化学作用来进行偶联。
在存在反应混合缓冲液(20mM Tris-HCl、1.5mM MgCl2、63mMKCl、1mM EGTA、1mM EDTA、150mM NaCl、0.005%Tween20、12.5μm生物素-21-dUTP、18.75μM dAdG)的情况下,分离自HEK293(人胚肾)细胞德端粒酶用于延伸寡核苷酸(37℃,60分钟)。该步骤在酶延伸DNA序列时,沿着DNA序列加入许多生物素残基。然后将复合体与链霉抗生物素蛋白-HRP一起温育(0.5μg/ml,室温下30分钟)。在这次温育后,用工作缓冲液洗涤样品(0.1M Tris,0.1MKCl,pH7.4),然后将样品重悬浮于终容积50μl的工作缓冲液中。然后将样品转入白色发光96孔平板,并在刚一加入50μl鲁米诺和50μl过氧化物(Supersignal ELISA Femto底物,Pierce)就在BMG Flurostar光度计中读出发光。
使用适于自动操作的Kingfisher微粒处理器进行收集分析。结果(n=3)表明:刚一加入50μl鲁米诺和50μl过氧化物(Pierce)就产生强烈的发光信号(图13)。
实施例7-使用末端转移酶延伸结合于磁珠的寡核苷酸模板
将磁性Dynal珠与单链DNA寡核苷酸(TTTTTTAATCCGTCGAGCAGAGTTAGGGTTAGGGTTAG-SEQ ID NO:3)进行偶联。在这种情况中,由于末端转移酶不象端粒酶那样优先延伸特异序列,因此上述序列是端粒酶所用的相同序列。为了这种酶修改了延伸条件,所用的延伸缓冲液是50mM乙酸钾、20mM Tris-乙酸、10mM乙酸镁、0.25mM氯化钴、12.5μM生物素-21-dUTP、18.75μM dAdG、10U末端转移酶,pH7.9。将末端转移酶加入各孔中,每孔有10μl寡核苷酸偶联的磁珠(30mg/ml)、100μl延伸缓冲液,37℃下延伸30分钟。然后在工作缓冲液(0.1M Tris、0.1M氯化钾)中洗涤延伸的磁珠三次。然后将磁珠与0.5μg/ml链霉抗生物素蛋白-HRP一起于室温下温育30分钟,并在重悬浮于终体积50μl的工作缓冲液中之前,用工作缓冲液洗涤3次。然后将样品转入白色发光96孔平板,并在一加入50μl鲁米诺和50μl过氧化物(Supersignal ELISA Femto底物,Pierce)后就在BMG Flurostar光度计中读出发光。重复实验两次,包括热失活的对照,其中通过在95℃下加热20分钟来失活末端转移酶。
结果显示:发光信号显著地高于热失活的对照,表明在该方法中,端粒酶可被末端转移酶取代(图14)。
实施例8-使用末端转移酶延伸结合于抗体的寡核苷酸模板
在0.1M硼酸盐(pH9.6)中,通过过夜温育,将Tosyl活化的Dynal珠(15mg)偶联于300μg的501FC(连接于抗体Fc区的EGF受体的配体结合区)。偶联之后,充分洗涤珠,并通过与0.2MTris/0.1%BSA一起于37℃温育4小时,给未反应的基团进行加帽。然后洗涤珠,并贮存在PBS/0.1%BSA中。
利用如前所述的肼化学作用(Kozlov等,2004),以含有端粒酶识别序列(TTTTTTAATCCGTCGAGCAGAGTTAGGGTTAGGGTTAG)(SEQ IDNO:3)的靶核苷酸功能化抗-EGFR抗体。使用PBS缓冲液,以流速1ml/分钟和25℃柱温,在Superose12 10/300柱(GE Amersham)上,利用尺寸排阻HPLC从残余反应体纯化所得的偶联物。
在存在以端粒酶识别序列功能化的LMH42抗体的情况下,将10μl体积的501FC-偶联的珠在室温下温育60分钟,然后彻底洗涤。随后用1%BSA处理珠-501FC-抗体复合体,来降低非特异性本底信号。进一步洗涤之后,在存在50μl反应缓冲液(50mM乙酸钾、20mM Tris-乙酸、10mM乙酸镁、0.25mM氯化钴、12.5μM荧光素-dUTP、18.75μMdAdG;pH7.9)和0.5μl末端转移酶(10U酶)的情况下,将复合体在37℃下温育60分钟。在工作缓冲液(0.1MTris、0.1M氯化钾)中,将延长的磁珠洗涤三次,然后与1μg/ml抗荧光素-HRP在室温下温育30分钟。之后,用工作缓冲液将磁珠洗涤三次,然后重悬浮于终容积50μl的工作缓冲液中。然后将样品转入白色发光96孔板,并在加入50μl鲁米诺和50μl过氧化物(Supersignal ELISA Femto底物,Pierce)后在BMGFluorostar光度计中读出发光。重复处理两次,包括热失活的对照,其中通过在95℃下加热30分钟来失活末端转移酶。
结果显示(图15):末端转移酶能延伸寡核苷酸底物并包含标记的核苷酸。因此,末端转移酶显然可用于本发明方法。
实施例9-使用末端转移酶和荧光素-dUTP特异性检测EGFR抗原
在0.1M硼酸盐缓冲液(pH9.6)中,通过在37℃下过夜温育,将Tosyl活化的Dynal珠(15mg)偶联于300μg的LMH41抗-EGFR mAb。偶联之后,充分洗涤磁珠,并通过与0.2MTris/0.1%BSA一起于37℃温育4小时,给未反应的基团进行加帽。然后洗涤磁珠,并贮存在PBS/0.1%BSA中。
利用如前所述的肼化学作用(Kozlov等,2004),以含有端粒酶识别序列(TTTTTTAATCCGTCGAGCAGAGTTAGGGTTAGGGTTAG)(SEQ IDNO:3)的靶核苷酸功能化抗-EGFR抗体。使用PBS缓冲液,以流速1ml/分钟和25℃柱温,在Superose12 10/300柱(GE Amersham)上,利用尺寸排阻HPLC来从残余反应体纯化所得的偶联物。
在存在不同浓度的EGFR抗原(sEGFR 1-621,Domagala等,2000)的情况下,将10μl体积的LMH41-偶联珠在室温下温育60分钟。多个洗涤步骤之后,将抗原-抗体-磁珠复合体与被端粒酶识别序列功能化的LMH42抗体在室温下温育60分钟,然后彻底洗涤。随后洗涤珠复合体,然后在存在50μl反应缓冲液(50mM乙酸钾、20mM Tris-乙酸、10mM乙酸镁、0.25mM氯化钴、12.5μM荧光素-dUTP、18.75μMdAdG;pH7.9)和0.5μl末端转移酶(10U酶)的情况下,将复合体在37℃下温育60分钟。在工作缓冲液(0.1MTris、0.1M氯化钾)中,将延长的磁珠洗涤三次,然后与1μg/ml抗荧光素-HRP在室温下温育30分钟。之后,用工作缓冲液洗涤磁珠三次,然后重悬浮于终容积50μl的工作缓冲液中。然后将样品转入白色的荧光96孔平板,并在加入50μl鲁米诺和50μl过氧化物(Supersignal ELISA Femto底物,Pierce)后在BMGFluorostar光度计中读出荧光。重复处理两次,包括热失活的对照,其中通过在95℃下加热30分钟来失活末端转移酶。
结果显示(图16):末端转移酶能延伸寡核苷酸底物并包含标记的核苷酸。这种延伸反应发生于与抗体形成复合体的寡核苷酸上,所述抗体则结合于抗原,而所述抗原又结合于与磁珠偶联的抗体。因此,在该实施例中,分析法能检测靶分析物(EGFR)。
实施例10-粗提取物和预净化物中的端粒酶活性的比较
用10mlPBS,将铺满LAR41细胞的10cm培养皿在原位洗涤两次。将细胞从平板上刮入1ml PBS中,并转入1.5ml管中。进行细胞计数,并以13,000r.p.m离心细胞5分钟。除去上清液,并将RIPA裂解缓冲液(50mM Tris、150mM NaCl、1mM EDTA,1%Triton X-100、1%去氧胆酸钠、0.1%SDS、蛋白酶抑制剂药片(Roche))加入细胞(200μl/1×106细胞)中。上下多次吸打细胞来裂解细胞,然后冰上温育30分钟。随后,以13,000r.p.m于4℃离心25分钟。将上清液转入鲜的1.5ml管中,并分析端粒酶活性。
在存在反应缓冲液(20mM Tris-HCl、1.5mM MgCl2、63mM KCl、1mM EGTA、1mM EDTA、150mM NaCl、0.005%Tween20、12.5μM生物素-21-dUTP、18.75μM dAdG)和1μl源自膀胱癌细胞系(LAR41)的提取物的情况下,将通过胺偶联化学作用(参见上文)偶联了端粒酶识别序列的磁珠在37℃下温育30分钟,其中所述的提取物可以是未处理的(细胞裂解后没有对提取物进行进一步的操作),或可以是通过以13,000r.p.m将提取物离心25分钟(Sorvall Heraeus Fresco Biofuge,转子514400)而预净化的。离心之后,上清液(预净化的提取物)用于与粗提物一起进行并列式端粒酶延伸反应。
结果如图17所示。作为对照,也显示了热失活(Hi)的样品。显然,表达端粒酶的粗裂解细胞可作为用于本发明方法的酶源。
实施例11-用于检测CT抗原NY-ESO-1的放大的蛋白发光(APL)分析
利用标准的胺偶联化学作用(过夜偶联,pH8.3),将Tosyl活化的Dynal珠偶联于抗-NY-ESO-1 mAb E978(Sugita等,2004)。偶联之后,充分洗涤磁珠,并贮存在PBS中。
利用如前所述的肼化学作用(Kozlov等,2004),以含有端粒酶识别序列(TTTTTTAATCCGTCGAGCAGAGTTAGGGTTAGGGTTAG)的靶核苷酸功能化抗-NY-ESO-1抗体ES121(Chitale等,2004)。使用PBS缓冲液,以流速1ml/分钟和25℃柱温,在Superose12 10/300柱(GE Amersham)上,利用尺寸排阻HPLC来从残余反应体纯化所得的偶联物。
利用BIAcore3000光学生物传感器和固定化在传感器表面上的mAbES978,通过NHS/EDC化学作用以及夹心法ELISA,确定两种抗体同时结合NY-ESO-1的能力。
在含有0.5%甘油和蛋白酶抑制剂(MiniProtease,Roche)的0.5%CHAPS、10mM Tris-HCl、1mM MgCl2以及1mM EGTA(pH7.5)中,通过裂解LIM 1215细胞(107细胞/ml)来产生活性的端粒酶制备物。通过TRAP分析(Chemicon)确认活性,通过BCA分析测定蛋白水平,并将等分试样贮存在-70℃中以备在APL分析中活化端粒酶的寡核苷酸靶。
使用重组NY-ESO-1验证APL分析(Davis等,2004)。在TC培养基中,通过连续稀释来制备NY-ESO校准标准。
将mAbE978-Dynal珠(约107珠)加入1.5ml Eppendorf管中含有NY-ESO-1标准品的组织培养基(高达1ml)。通过在25℃下振荡1小时将NY-ESO-1选择性回收于偶联Dynal珠上。然后通过磁性粒子收集器来吸附珠,并用PBS洗涤。洗涤之后,将珠重悬浮在200μl的PBS缓冲液中,其中该缓冲液含有寡核苷酸功能化的mAb ES121,在25℃进一步振荡1小时,与已被捕获在Dynal珠上的NY-ESO-1形成复合体。然后吸附珠,并以延伸缓冲液(20mM Tris-HCl、1.5mM MgCl2、63mMKCl、1mM EGTA、0.1μg/ml,含0.005%Tween20(Xu等,2002))洗涤,然后将珠重悬浮于含有dATP和dGTP以及生物素化dUTP(200μl)的延伸缓冲液中。然后加入提取自LIM 1215细胞的端粒酶(1μl,参见上文),并将管在32℃下振荡温育30分钟。然后用1×延伸缓冲液洗涤珠,随后进一步洗涤(多次)来除去本底信号(例如通过提高NaCl浓度、0.1MNaOH、降低pH或使用低浓度洗涤剂),然后加入链霉抗生物素蛋白-HRP(150μl PBS中,含2μg/ml)并在32℃下温育30分钟。在重悬浮于25μl相同缓冲液以备转入96孔LumiNunc平板中之前,用含有0.1M KCl的5×0.1M Tris-HCl(pH8.5)洗涤珠。
将LumiNunc平板转入BMG FluoroStar光度计中,并使用仪器的自动输送泵来加入50μl鲁米诺与增强剂以及50μl H2O2(SuperSignal,PierceBiotechnology Inc.),并记录发光信号。
实施例12-用于检测抗CT抗原抗体的放大的蛋白发光(APL)分析
利用标准的胺偶联化学作用(过夜偶联,pH8.3),将Tosyl活化的Dynal珠偶联于重组NY-ESO-1(Davis等,2004)。偶联之后,充分洗涤珠,并贮存在PBS中。
利用如前所述的肼化学作用(Kozlov等,2004),以末端转移酶的靶核苷酸序列功能化抗人抗IgG山羊抗体。使用PBS缓冲液,以流速1ml/分钟和25℃柱温,在Superose12 10/300柱(GE Amersham)上,利用尺寸排阻HPLC来从残余反应体纯化所得的偶联物。
将含有潜在的抗NY-ESO-1抗体的尿样(100μl)加到含有NY-ESO-1-Dynal珠(约107珠)的白色Nunc 96孔平板中。通过在25℃下振荡(10,000rpm)1小时,将抗-NY-ESO-1抗体选择性回收到Dynal珠上。然后通过磁力将珠吸附到平板表面,并用PBS充分洗涤。洗涤之后,将珠重悬浮在150μl的PBS缓冲液中,其中该缓冲液含有寡核苷酸功能化的抗人抗IgG山羊抗体,在25℃进一步振荡(10,000rpm)1小时,与已被捕获在Dynal珠上的抗NY-ESO-1抗体形成复合体。然后将珠吸附到平板表面,并用末端转移酶延伸缓冲液(Genesearch反应缓冲液,2.5mMCoCl2)洗涤珠,然后重悬浮于含有dATP和dGTP以及生物素化dUTP的延伸缓冲液(50μl)。然后加入末端转移酶(1μl,Genesearch,澳大利亚),并将管在32℃下振荡(10,000rpm)温育30分钟。然后用1×延伸缓冲液洗涤珠,随后进一步洗涤(多次)来除去本底信号(例如通过提高NaCl浓度、0.1MNaOH、降低pH或使用低浓度洗涤剂),然后加入链霉抗生物素蛋白-HRP(150μl PBS中,含2μg/ml)并在32℃下温育30分钟。然后用含有0.1M KCl的5×0.1M Tris-HCl(pH8.5)洗涤珠,然后重悬浮于25μl相同缓冲液以备转入96孔LumiNunc平板中。
将LumiNunc平板转入BMG FluoroStar光度计中,并使用仪器的自动输送泵来加入50μl鲁米诺与增强剂以及50μl H2O2(SuperSignal,PierceBiotechnology Inc.),并记录发光信号。
本领域技术人员可理解的是:在不背离本发明广泛描述的精神或范围的前提下,可如具体实施方案所示对本发明进行多种改变和/或修饰。因此,无论从哪一点来看,本发明的实施方案都被认为是用于举例说明的,而不是限制性的。
以上论述的AU出版物全文并入本文中。
本说明书中所包括的任何讨论的文件、法案、材料、设备、论文等等,仅仅用于给出本发明的范围。不应当理解为:由于其存在于本申请的各项权利要求的优先权日之前,这些材料的任何或全部都已成为现有技术基础的一部分,或是在与本发明有关的领域中属于公知常识。
参考文献:
Adler et al.(2003)Biochem.Biophys.Res.Commun.308:240-250.
Ansari et al.(2001)Chem.Biol.8:583-592.
Arora et al.(2002)J.Am.Chem.Soc.124:13067-13071.
Bronks et al.(1995)Anal.Chem.65:2750-2757.
Bryan et al.(1998)Proc Natl Acad Sci U S A.95:8479-8484.
Chitale et al.(2004)Mod Pathol.23 July[Epub ahead of print].
Chu et al.(1986)Nucl.Acids Res.14:5591-5603.
Davis et al.(2004)Proc Natl Acad Sci USA.101:10697-10702.
Domagala et al.(2000)Growth Factors 18:11-29.
Graham et al.(1977)J.Gen Virol 36:59-72.
Hendrickson et al.(1995)Nucl.Acids Res.23:522-529.
Joeger(1995)Clin.Chem.41:1371-1377.
Jungbluth et al.(2001)Int.J.Cancer:92:856-860.
Kozlov et al.(2004)Biopolymers 73:621-630.
Kwon et al.(2004)J.Am.Chem.Soc.126:15940-15941.
Murphy et al.(2005)Prep.Biochem.Biotech.35:119-134.
Niemeyer et al.(2003)Nucl.Acids Res.31:e90.
Sano et al.(1992)Science 258:120-122.
Scanlan et al.(2002)Immunol.Rev.188:22-32.
Schweitzer et al.(2000)Proc Natl Acad Sci USA.97:10113-10119.
Sperl et al.(1995)J.Immunol.Meth.186:181-194.
Sugita et al.(2004)Cancer Res.64:2199-2204.
Whitehead et al.(1985)J Natl Cancer Inst.74:759-765.
Xu et al.(2002)Clinical Chem.48:1016-1020.
Zhang et al.(2001)Proc.Natl.Acad.Sci.USA 98:5497-5502.
序列表
<110>希艾娜癌症诊疗有限公司
<120>检测样品中的分析物的方法
<130>503884
<150>US 60/627,947
<151>2004-11-16
<160>7
<170>PatentIn version 3.3
<210>1
<211>18
<212>DNA
<213>Artificial
<220>
<223>Telomerase initiation site
<400>1
ttagggttag ggttaggg 18
<210>2
<211>24
<212>DNA
<213>Artificial
<220>
<223>Telomerase initiation site
<400>2
ttttttaatc cgtcgagcag agtt 24
<210>3
<211>38
<212>DNA
<213>Artificial
<220>
<223>Telomerase initiation site
<400>3
ttttttaatc cgtcgagcag agttagggtt agggttag 38
<210>4
<211>26
<212>DNA
<213>Artificial
<220>
<223>Telomerase initiation site
<400>4
ttttttaatc cgtcgagcag agttag 26
<210>5
<211>6
<212>DNA
<213>Artificial
<220>
<223>Typical telomere repeat synthsized by Tetrahymena telomerase
<400>5
ttgggg 6
<210>6
<211>6
<212>DNA
<213>Artificial
<220>
<223>Typical telomere repeat synthesized by human telomerase
<400>6
ttaggg 6
<210>7
<211>6
<212>RNA
<213>Artificial
<220>
<223>Consensus polyadenylation signal
<400>7
aauaaa 6
Claims (43)
1.一种用于筛查样品中存在或不存在分析物的方法,该方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,
ii)将所述分析物-第一化合物复合体暴露于结合所述分析物-第一化合物复合体的第二化合物,以形成分析物-第一化合物-第二化合物复合体,其中第二化合物包含多核苷酸,
iii)在下列条件下将所述分析物-第一化合物-第二化合物复合体暴露于聚合酶,其中所述的条件是a)能容许聚合酶延伸所述多核苷酸,或b)能容许聚合酶合成所述多核苷酸的互补链,和
iv)检测步骤iii)中的a)或b)部分的产物,
其中步骤iii)的部分b)不包括使用所述互补链作为模板进一步合成多核苷酸。
2.一种用于筛查样品中存在或不存在分析物的方法,该方法包括:
i)将样品暴露于结合分析物的第二化合物,以形成分析物-第二化合物复合体,其中第二化合物包含多核苷酸,
ii)将所述分析物-第二化合物复合体暴露于结合所述分析物-第二化合物复合体的第一化合物,以形成分析物-第一化合物-第二化合物复合体,
iii)在下列条件下将所述分析物-第一化合物-第二化合物复合体暴露于聚合酶,其中所述的条件是a)能容许聚合酶延伸所述多核苷酸,或b)能容许聚合酶合成所述多核苷酸的互补链,和
iv)检测步骤iii)中的a)或b)部分的产物,
其中步骤iii)的部分b)不包括使用所述互补链作为模板进一步合成多核苷酸。
3.权利要求1或2中所述的方法,其中聚合酶延长单链多核苷酸或部分双链多核苷酸的单链突出端。
4.权利要求3中所述的方法,其中聚合酶选自poly(A)聚合酶、端粒酶和末端转移酶。
5.权利要求4中所述的方法,其中聚合酶是端粒酶,并且所述端粒酶通过裂解产生端粒酶的癌细胞而获得。
6.权利要求5中所述的方法,其中不进行将端粒酶与裂解的细胞的其它成分分离的过程。
7.权利要求1或权利要求2中所述的方法,其中聚合酶是选自下列的DNA聚合酶:Taq聚合酶、噬菌体T4聚合酶、噬菌体T7聚合酶以及大肠杆菌DNA聚合酶I的Klenow片段。
8.权利要求1至7中任何一项所述的方法,其中第一化合物和/或第二化合物附着于固相支持物上。
9.权利要求8中所述的方法,其中固相支持物选自磁珠、生物传感器芯片、微量滴定板的加样孔、浸染棒以及微阵列玻片。
10.权利要求1至9中任何一项所述的方法,其中在存在至少一种以可检测方式标记的核苷酸的情况下,实施步骤iii)。
11.权利要求10中所述的方法,其中可检测的标记选自放射性同位素、荧光标记、化学发光标记、生物发光标记以及酶标记。
12.权利要求1至9中任何一项所述的方法,其中在存在至少一种半抗原偶联的核苷酸的情况下,实施步骤iii),其中所述的半抗原能够结合配体。
13.权利要求12中所述的方法,其中半抗原选自半胱氨酸、赖氨酸、丝氨酸、生物素、抗生物素蛋白以及链霉抗生物素蛋白。
14.权利要求12或13中所述的方法,其中配体是以可检测方式标记的。
15.权利要求14中所述的方法,其中可检测的标记选自放射性同位素、荧光标记、化学发光标记、生物发光标记以及酶标记。
16.权利要求14或15中所述的方法,其中步骤iii)还包括将聚合酶活性的产物暴露于所述以可检测方式标记的配体。
17.权利要求15或16中所述的方法,其中可检测的标记是酶。
18.权利要求17中所述的方法,其中酶选自β-半乳糖苷酶、萤光素酶、碱性磷酸酶、神经氨酸酶以及辣根过氧化物酶。
19.权利要求17或18中所述的方法,其中步骤iii)的聚合酶活性的产物是至少包含其中掺入了半抗原偶联的核苷酸的多核苷酸的复合体,其中至少部分半抗原结合于酶标记的配体,并且步骤iv)包括将步骤iii)的产物暴露于允许酶产生可检测信号的条件下。
20.权利要求19中所述的方法,其中通过酶与底物反应产生可检测信号。
21.权利要求20中所述的方法,其中底物是鲁米诺或9,10-二氢化吖啶。
22.权利要求20或21中所述的方法,其中方法还包括提供增强所述可检测信号的分子。
23.权利要求22中所述的方法,其中增强所述可检测信号的分子是对碘酚或对苯基苯酚。
24.权利要求19至23中任何一项所述的方法,其中所述可检测信号是发光或荧光。
25.权利要求1或3至24中任何一项所述的方法,其中步骤i)还包括洗涤分析物-第一化合物复合体,以除去未结合的第一化合物。
26.权利要求2至24中任何一项所述的方法,其中步骤i)还包括洗涤分析物-第二化合物复合体,以除去未结合的第二化合物。
27.权利要求1至26中任何一项所述的方法,其中步骤ii)还包括洗涤分析物-第一化合物-第二化合物复合体,以除去未结合的第一和/或第二化合物。
28.权利要求1至9或25至27中任何一项所述的方法,其中方法还包括除去未掺入的以可检测方式标记的核苷酸。
29.权利要求1至7或14至27中任何一项所述的方法,其中方法还包括除去未掺入的以可检测方式标记的配体。
30.权利要求1至29中任何一项所述的方法,其中第一化合物是蛋白质。
31.权利要求1至30中任何一项所述的方法,其中第一化合物是抗体。
32.权利要求1至31中任何一项所述的方法,其中第二化合物是蛋白质-多核苷酸偶联物。
33.权利要求1至32中任何一项所述的方法,其中第二化合物是抗体-多核苷酸偶联物。
34.权利要求1至33中任何一项所述的方法,其中第二化合物结合所述分析物。
35.权利要求1至34中任何一项所述的方法,其中所述分析物是疾病状态的标记。
36.权利要求35中所述的方法,其中疾病状态选自癌症和感染。
37.权利要求1至36中任何一项所述的方法,其中所述分析物是蛋白质或肽。
38.权利要求1中所述的方法,其中方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,其中第一化合物附着于固相支持物上,
ii)将所述分析物-第一化合物复合体暴露于结合所述分析物的第二化合物,以形成分析物-第一化合物-第二化合物复合体,其中第二化合物包含可被端粒酶延伸的多核苷酸,
iii)在允许端粒酶延伸所述多核苷酸的条件下,在存在至少一种半抗原偶联的核苷酸的情况下,将所述分析物-第一化合物-第二化合物复合体暴露于端粒酶,
iv)在允许半抗原结合配体的条件下,将端粒酶活性的产物暴露于酶标记的配体,
v)在存在所述酶的底物的情况下,温育多核苷酸-半抗原-配体-酶复合体,以及
vi)检测由所述酶对底物的活性产生的可检测信号。
39.权利要求1中所述的方法,其中方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,其中第一化合物附着于固相支持物上,
ii)将所述分析物-第一化合物复合体暴露于结合所述分析物的第二化合物,以形成分析物-第一化合物-第二化合物复合体,其中第二化合物包含可被末端转移酶延伸的多核苷酸,
iii)在允许末端转移酶延伸所述多核苷酸的条件下,在存在至少一种半抗原偶联的核苷酸的情况下,将所述分析物-第一化合物-第二化合物复合体暴露于末端转移酶,
iv)在允许所述半抗原结合配体的条件下,将末端转移酶活性的产物暴露于酶标记的配体,
v)在存在所述酶的底物的情况下,温育多核苷酸-半抗原-配体-酶复合体,以及
vi)检测由所述酶对底物的活性产生的可检测信号。
40.一种用于筛查样品中存在或不存在分析物的方法,方法包括:
i)将样品暴露于结合分析物的第一化合物,以形成分析物-第一化合物复合体,
ii)将所述分析物-第一化合物复合体暴露于结合所述分析物-第一化合物复合体的第二化合物,以形成分析物-第一化合物-第二化合物复合体,
iii)将所述分析物-第一化合物-第二化合物复合体暴露于结合所述第二化合物的第三化合物,其中第三化合物包含多核苷酸,
iv)在下列条件下将分析物-第一化合物-第二化合物-第三化合物复合体暴露于聚合酶,其中所述的条件是a)能容许聚合酶延伸所述多核苷酸,或b)能容许聚合酶合成所述多核苷酸的互补链,和
v)检测步骤iv)中的a)或b)部分的产物,
其中步骤iii)的部分b)不包括使用所述互补链作为模板进一步合成多核苷酸,和其中所述第一和/或第二化合物附着在固相支持物上。
41.一种蛋白质-DNA偶联物,其中DNA包含可结合端粒酶并被其延伸的序列。
42.权利要求41中所述的蛋白质-DNA偶联物,其中蛋白质是抗体。
43.一种试剂盒,包含权利要求41或42中所述的蛋白质-DNA偶联物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US62794704P | 2004-11-16 | 2004-11-16 | |
| US60/627,947 | 2004-11-16 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN101115847A true CN101115847A (zh) | 2008-01-30 |
Family
ID=36406765
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA2005800467145A Pending CN101115847A (zh) | 2004-11-16 | 2005-11-16 | 检测样品中的分析物的方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20090208932A1 (zh) |
| EP (1) | EP1828405A4 (zh) |
| JP (1) | JP2008520963A (zh) |
| CN (1) | CN101115847A (zh) |
| AU (1) | AU2005306576A1 (zh) |
| CA (1) | CA2595673A1 (zh) |
| WO (1) | WO2006053380A1 (zh) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102893151A (zh) * | 2010-04-14 | 2013-01-23 | 荣研化学株式会社 | 标记化探针-水溶性载体复合物 |
| CN103529023A (zh) * | 2013-10-11 | 2014-01-22 | 东南大学 | 一种端粒酶活性检测方法 |
| CN105051270A (zh) * | 2013-03-15 | 2015-11-11 | 代表亚利桑那大学的亚利桑那校董会 | 生物传感器微阵列构成和方法 |
| CN112410400A (zh) * | 2019-08-22 | 2021-02-26 | 深圳市第二人民医院 | 一种端粒酶活性检测试剂盒及端粒酶活性检测方法 |
| CN113607520A (zh) * | 2021-08-02 | 2021-11-05 | 湖州中科湖兴生物科技有限公司 | 一种提高抗药抗体分析中药物耐受的操作方法 |
| CN115430469A (zh) * | 2022-09-01 | 2022-12-06 | 中国科学院上海微系统与信息技术研究所 | 一种用于病原菌快速检测的滑动微流控芯片 |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TW200808974A (en) * | 2006-08-02 | 2008-02-16 | Ind Tech Res Inst | Luminescence-based recipe |
| JP2008064475A (ja) * | 2006-09-04 | 2008-03-21 | Osaka Univ | 標的物質の高感度検出方法、検出用キットおよび検出装置 |
| WO2011106671A1 (en) * | 2010-02-26 | 2011-09-01 | Geron Corporation | Assay for telomerase activity |
| US9624532B2 (en) * | 2013-02-05 | 2017-04-18 | Neil Gordon | Ultra-sensitive detection of extremely low level biological analytes using electrochemical signal amplification and biosensor |
| CN109100512A (zh) * | 2018-08-02 | 2018-12-28 | 宁波奥丞生物科技有限公司 | 一种检测egfr的化学发光试剂盒 |
| CN109781986B (zh) * | 2019-03-11 | 2022-03-25 | 复旦大学附属妇产科医院 | 一种磁微粒化学发光免疫检测CA125表面Tn抗原的试剂盒及其制备方法 |
| CN110333217A (zh) * | 2019-06-05 | 2019-10-15 | 青岛科技大学 | 一种新型的双光谱跷跷板式比率探针及构建方法 |
| US20240209413A1 (en) | 2021-05-25 | 2024-06-27 | Cavidi Ab | Method for sensitive analyte detection assays and kits therefor |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2504010B1 (fr) * | 1981-04-15 | 1985-10-25 | Sanofi Sa | Medicaments anticancereux contenant la chaine a de la ricine associee a un anticorps antimelanome et procede pour leur preparation |
| US4671958A (en) * | 1982-03-09 | 1987-06-09 | Cytogen Corporation | Antibody conjugates for the delivery of compounds to target sites |
| EP0092227B1 (en) * | 1982-04-19 | 1988-07-27 | Nissan Motor Co., Ltd. | Method for controlling reduction ratio of continuously variable transmission with acceleration compensation |
| US4542225A (en) * | 1984-08-29 | 1985-09-17 | Dana-Farber Cancer Institute, Inc. | Acid-cleavable compound |
| US4659839A (en) * | 1984-10-10 | 1987-04-21 | Mallinckrodt, Inc. | Coupling agents for radiolabeled antibody fragments |
| US4680338A (en) * | 1985-10-17 | 1987-07-14 | Immunomedics, Inc. | Bifunctional linker |
| US4699784A (en) * | 1986-02-25 | 1987-10-13 | Center For Molecular Medicine & Immunology | Tumoricidal methotrexate-antibody conjugate |
| US5049490A (en) * | 1990-02-20 | 1991-09-17 | Eastman Kodak Co. | Quantitative determination of a DNA polymerase and a test kit useful in same |
| US5665539A (en) * | 1991-07-12 | 1997-09-09 | The Regents Of The University Of California | Immuno-polymerase chain reaction system for antigen detection |
| US6007989A (en) * | 1992-05-13 | 1999-12-28 | Board Of Regents, The University Of Texas System | Methods of screening for compounds that derepress or increase telomerase activity |
| US6255060B1 (en) * | 1996-11-21 | 2001-07-03 | Trustees Of The University Of Pennsylvania | Method of detecting protein by immuno RNA |
| US6511809B2 (en) * | 2000-06-13 | 2003-01-28 | E. I. Du Pont De Nemours And Company | Method for the detection of an analyte by means of a nucleic acid reporter |
| US6743592B1 (en) * | 2000-07-25 | 2004-06-01 | The Trustees Of The University Of Pennsylvania | Methods, systems and kits for immuno-detection of epitopes expressed on molecules |
| US7341831B2 (en) * | 2001-07-18 | 2008-03-11 | The Trustees Of The University Of Pennsylvania | Method for immuno-detection of epitopes |
| US20040197845A1 (en) * | 2002-08-30 | 2004-10-07 | Arjang Hassibi | Methods and apparatus for pathogen detection, identification and/or quantification |
-
2005
- 2005-11-16 CN CNA2005800467145A patent/CN101115847A/zh active Pending
- 2005-11-16 WO PCT/AU2005/001742 patent/WO2006053380A1/en active Application Filing
- 2005-11-16 EP EP05803026A patent/EP1828405A4/en not_active Withdrawn
- 2005-11-16 US US11/791,006 patent/US20090208932A1/en not_active Abandoned
- 2005-11-16 AU AU2005306576A patent/AU2005306576A1/en not_active Abandoned
- 2005-11-16 CA CA002595673A patent/CA2595673A1/en not_active Abandoned
- 2005-11-16 JP JP2007540459A patent/JP2008520963A/ja active Pending
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102893151A (zh) * | 2010-04-14 | 2013-01-23 | 荣研化学株式会社 | 标记化探针-水溶性载体复合物 |
| CN102893151B (zh) * | 2010-04-14 | 2015-06-03 | 荣研化学株式会社 | 标记化探针-水溶性载体复合物 |
| CN105051270A (zh) * | 2013-03-15 | 2015-11-11 | 代表亚利桑那大学的亚利桑那校董会 | 生物传感器微阵列构成和方法 |
| CN105051270B (zh) * | 2013-03-15 | 2019-05-07 | 代表亚利桑那大学的亚利桑那校董会 | 生物传感器微阵列构成和方法 |
| CN103529023A (zh) * | 2013-10-11 | 2014-01-22 | 东南大学 | 一种端粒酶活性检测方法 |
| CN103529023B (zh) * | 2013-10-11 | 2015-07-29 | 东南大学 | 一种端粒酶活性检测方法 |
| CN112410400A (zh) * | 2019-08-22 | 2021-02-26 | 深圳市第二人民医院 | 一种端粒酶活性检测试剂盒及端粒酶活性检测方法 |
| CN112410400B (zh) * | 2019-08-22 | 2024-08-13 | 深圳市第二人民医院 | 一种端粒酶活性检测试剂盒及端粒酶活性检测方法 |
| CN113607520A (zh) * | 2021-08-02 | 2021-11-05 | 湖州中科湖兴生物科技有限公司 | 一种提高抗药抗体分析中药物耐受的操作方法 |
| CN115430469A (zh) * | 2022-09-01 | 2022-12-06 | 中国科学院上海微系统与信息技术研究所 | 一种用于病原菌快速检测的滑动微流控芯片 |
| CN115430469B (zh) * | 2022-09-01 | 2023-08-04 | 中国科学院上海微系统与信息技术研究所 | 一种用于病原菌快速检测的滑动微流控芯片 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2005306576A1 (en) | 2006-05-26 |
| US20090208932A1 (en) | 2009-08-20 |
| EP1828405A4 (en) | 2009-04-15 |
| CA2595673A1 (en) | 2006-05-26 |
| EP1828405A1 (en) | 2007-09-05 |
| JP2008520963A (ja) | 2008-06-19 |
| WO2006053380A1 (en) | 2006-05-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101115847A (zh) | 检测样品中的分析物的方法 | |
| CN102227638B (zh) | Rna展示的改良方法 | |
| CN102227440A (zh) | 改良的抗体文库 | |
| CN108490174B (zh) | 检测car-t细胞的方法及其应用 | |
| JP5941615B2 (ja) | ヒトcxcl1タンパク質の免疫学的測定方法 | |
| Pinder et al. | Isolation and characterization of antigen-specific plasmablasts using a novel flow cytometry–based Ig capture assay | |
| CN1875116A (zh) | 可溶性分析物的检测和扩增 | |
| JP2010534836A (ja) | 検出アッセイとそれらの使用 | |
| Grzeschik et al. | Yeast surface display in combination with fluorescence‐activated cell sorting enables the rapid isolation of antibody fragments derived from immunized chickens | |
| US10494430B2 (en) | Anti-active GIP antibody | |
| US20220155300A1 (en) | Multiplex competition assay for profiling binding epitopes of affinity agents for clinical diagnostics use | |
| JPWO2016159211A1 (ja) | 試験管内淘汰及び分子間相互作用解析用高速光架橋型共用リンカー、そのリンカーを用いた試験管内淘汰方法 | |
| Hou et al. | Detection of a single circulating tumor cell using a genetically engineered antibody-like phage nanofiber probe | |
| JP6032470B2 (ja) | Pivka−ii測定方法、測定試薬及び測定キット | |
| Puettmann et al. | A monoclonal antibody for the detection of SNAP/CLIP-tagged proteins | |
| CN106939034B (zh) | 用于鉴定受试者所感染的hev基因型的方法和试剂盒 | |
| Song et al. | A cell-based multiplex immunoassay platform using fluorescent protein-barcoded reporter cell lines | |
| JP6808178B2 (ja) | ヒトパルボウイルスb19抗原および抗体の同時検出方法及びキット | |
| RU2733379C1 (ru) | Тест-система для диагностики возбудителей острых респираторных вирусных инфекций | |
| CN117264071B (zh) | 一种抗rankl单克隆抗体或其衍生物的结合剂及其应用 | |
| WO2020183133A1 (en) | Method of selecting for antibodies | |
| CN118221816A (zh) | Lag3单克隆抗体及其应用 | |
| JP6407990B2 (ja) | アウグリン免疫学的検定 | |
| US20170248587A1 (en) | Polymeric Dye Specific Binding Members and Methods of Making and Using the Same | |
| CN117285637B (zh) | 一种抗独特型抗体及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Open date: 20080130 |