BR112017007509B1 - processo para a preparação de 1-(3,5-dicloro-4-fluorofenil)-2,2,2-trifluoro-etanona - Google Patents
processo para a preparação de 1-(3,5-dicloro-4-fluorofenil)-2,2,2-trifluoro-etanona Download PDFInfo
- Publication number
- BR112017007509B1 BR112017007509B1 BR112017007509-1A BR112017007509A BR112017007509B1 BR 112017007509 B1 BR112017007509 B1 BR 112017007509B1 BR 112017007509 A BR112017007509 A BR 112017007509A BR 112017007509 B1 BR112017007509 B1 BR 112017007509B1
- Authority
- BR
- Brazil
- Prior art keywords
- formula
- compound
- halogen
- magnesium
- reacting
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/45—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by condensation
- C07C45/46—Friedel-Crafts reactions
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/61—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups
- C07C45/63—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reactions not involving the formation of >C = O groups by introduction of halogen; by substitution of halogen atoms by other halogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/004—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reaction with organometalhalides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C49/00—Ketones; Ketenes; Dimeric ketenes; Ketonic chelates
- C07C49/76—Ketones containing a keto group bound to a six-membered aromatic ring
- C07C49/80—Ketones containing a keto group bound to a six-membered aromatic ring containing halogen
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
PROCESSO PARA A PREPARAÇÃO DE 1-(3,5-DICLORO-4-FLUORO- FENIL)-2,2,2-TRIFLUORO-ETANONA. A invenção refere-se a um processo para a preparação de um composto da fórmula I que compreende a) fazer reagir um composto da fórmula II na presença de magnésio ou um reagente organometálico da fórmula III R1-M2X (III), em que R1 é C1-C4alquila; M2 é Li ou Mg e X é halogênio ou está ausente; com um composto da fórmula IV CF3-C (0) -R2 (IV), em que R2 é halogênio, hidroxila, C1-C4 alcóxi,(di-C1- C4alquil) amino, OC (0) CF3, fenóxi ou OM1; em que M1 é Lítio, Magnésio, Sódio ou Potássio; para formar um composto da fórmula V, e b) fazer reagir o composto da fórmula V com fluoreto de metal alcalino na presença de quantidades catalíticas de um catalisador de transferência de fase na presença de um solvente polar para formar o composto da fórmula I.
Description
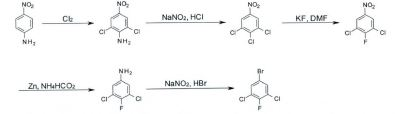
[0001] A presente invenção refere-se à preparação de l-(3,5- dicloro-4-fluoro-fenil)-2,2, 2-trifluoro-etanona usando 5- bromo-1,2,3-tricloro-benzeno como material de partida.
[0002] 1-(3,5-Dicloro-4-fluoro-fenil)-2,2,2-trifluoro-etanona é um intermediário importante para a preparação de benzamidas substituídas com isoxazolina pesticidamente ativas como revelado, por exemplo, em EP 1932836A1.
[0003] 1-(3,5-Dicloro-4-fluoro-fenil)-2,2,2-trifluoro-etanona pode ser vantajosamente preparado usando 5-bromo- 1,2,3-tricloro-benzeno como material de partida. 5-Bromo- 1,2,3-tricloro-benzeno pode ser preparado como descrito em Narander, N.; Srinivasu, P.; Kulkarni, S.J.; Raghavan, K.V. Synth. Comm. 2000, 30, 3669 e Soft, R. ; Hawner, C.; Johansen, J.E. Tetrahedron 2008, 64, 4135. 3-Trifluorometilchalconaspodem ser preparadas de acordo com métodos revelados em WO 2009/126668.
[0004] A sintese de ariltrifluorometilcetonas por reação de derivados do ácido trifluoroacético com reagentes organometálicos derivados de haloarenos é bem conhecida e é descrita, por exemplo, em
[0005] WO 2012/120135 para a preparação de 2,2,2-trifluoro- 1-(3,4,5-triclorofenil)etanona. Para a sintese de l-(3,5-dicloro-4-fluoro-fenil)-2,2,2-trifluoro-etanona o material de partida correspondente é 5-bromo-l, 3-dicloro-2-fluoro-benzeno. No entanto, é dificil preparar esta substância em particular em larga escala sendo que a única sintese descrita é uma abordagem ineficiente em múltiplas etapas descrita em Miller, M.W.; Mylari, B.L.; Howes, H.L.; Figdor, S.K.; Lynch, M.J.; Lynch, J.E.; Koch, R.C. J. Med. Chem. 1980, 23, 1083, CN 101177379, WO 2009/070485 e CN 103664511 (Esquema 1).
[0006] Em consequência, é altamente desejável preparar 1- (3,5-dicloro-4-fluoro-fenil)-2,2,2-trifluoro-etanona a partir do composto mais facilmente acessivel 2,2,2-trifluoro-1- (3,4,5-triclorofenil)etanona. Surpreendentemente, foi descoberto que a reação de 2,2,2-trifluoro-1-(3,4,5- triclorofenil)etanona com fluoreto de potássio na presença de um catalisador de transferência de fase e um solvente polar proporcionou o composto desejado 1-(3,5-dicloro-4-fluoro- fenil )-2,2,2-trifluoro-etanona. Não obstante tais reações de substituição aromática nucleofilica serem bem conhecidas para compostos nitroaromáticos (como revelado, por exemplo, em WO 92/00270) não há nenhuma técnica anterior que descreva reações comparáveis com trifluorometilcetonas uma vez que em geral se sabe que este grupo não é um grupo ativador suficientemente forte.
[0007] Em consequência, o objetivo da presente invenção consiste em proporcionar um processo para a preparação de 1- (3,5-dicloro-4-fluoro-fenil)-2,2,2-trifluoro-etanona usando 5-bromo-l,2,3-tricloro-benzeno como intermediário. O processo de acordo com a invenção é caracterizado por um número reduzido de etapas reacionais e elevada seletividade e rendimento.
[0008] Assim, de acordo com a presente invenção, é proporcionado um processo para a preparação do composto da fórmula I que compreende a) fazer reagir o composto da fórmula II na presença de magnésio ou um reagente organometálico da fórmula III Ri-M2X (III), em que Ri é Ci-C4alquila; M2 é Litio ou Magnésio e X é halogênio ou está ausente; com um composto da fórmula IV CF3-C(O)-R2(IV), em que R2 é halogênio, hidroxila, Ci-C4alcóxi, (di-Ci- Cíalquil) amino, OC(O)CF3, fenóxi ou OM1; em que M1 é Litio, Magnésio, Sódio ou Potássio; para formar o composto da fórmula V, e b) fazer reagir o composto da fórmula V com um fluoreto de metal alcalino na presença de quantidades catalíticas de um catalisador de transferência de fase na presença de um solvente polar para formar o composto da fórmula I.
[0009] Os grupos alquila que ocorrem nas definições dos substituintes podem ter cadeia linear ou ramificada e são, por exemplo, metila, etila, n-propila, isopropila, n-butila, sec- butila, iso-butila ou tert-butila. Alcóxi é, por exemplo, metóxi, etóxi, propóxi, i-propóxi, n-butóxi, isobutóxi, sec- butóxi e tert-butóxi.
[0011] O composto da fórmula V pode ser preparado fazendo reagir um composto da fórmula II primeiramente com magnésioentão com um composto da fórmula IV CF3-C(O)R2 (IV), em que R2 é halogênio, hidroxila, Ci-C4alcóxi, (di-Ci- C4alquil) amino, OC(O)CF3, fenóxi ou OM1; em que M1 é Litio, Magnésio, Sódio ou Potássio. Alternativamente, o composto da fórmula V pode ser preparado fazendo reagir um composto da fórmula II primeiramente com um reagente organometálico da fórmula III Ri-M2X (III), em que Ri é Ci-C4alquila; M2 é Litio ou Magnésio e X é halogênio ou está ausente; e então com o composto da fórmula IV CF3-C(O)R2 (IV), em que R2 é halogênio, hidroxila, Ci-C4alcóxi, (di-Ci- C4alquil) amino, OC(0)CF3, fenóxi ou OM1; em que M1 é Litio, Magnésio, Sódio ou Potássio. 0 composto da fórmula III épreferencialmente usado na forma de um complexo com LiCl.
[0012] Tipicamente, a reação é realizada em um solvente orgânico aprótico. Solventes adequados incluem mas não estão limitados a éteres orgânicos tais como tetraidrofurano, 2- metil-tetraidrofurano, 1,4-dioxano, éter de dietila, éter de t-butilmetila e hidrocarbonetos tais como tolueno, benzeno, hexano e ciclo-hexano. A reação pode ser realizada a uma temperatura de -80 °C a 50 °C, preferencialmente de -20 °C a 25 °C.
[0013] O composto da fórmula I pode ser preparado por reação de um composto da fórmula V com um fluoreto de metal alcalino na presença de um catalisador de transferência de fase. Fluoretos metálicos adequados incluem KF, LiF e NaF. Catalisadores de transferência de fase adequados incluem sais de fosfônio de fórmula geral (R3HPX e sais de amónio de fórmula geral (R3) 4NX em que R3 é Ci-C4alquila ou fenila e X é halogênio. São preferenciais sais de fosfônio.
[0014] Tipicamente a reação é realizada em um solvente orgânico ou suas misturas. Solventes adequados são de natureza polar e incluem, mas não se limitam a sulfolano, dimetilformamida e dimetilsulfóxido.
[0015] A reação pode ser realizada a uma temperatura de 100 °C a 250 °C, preferencialmente de 120 °C a 160 °C.
[0016] Uma modalidade preferencial do processo da invenção que compreende a) fazer reagir o composto da fórmula II na presença de um reagente organometálico da fórmula III Ri-M2X (III), em que Ri é Ci-Cíalquila; M2 é Litio ou Magnésio e X é halogênio ou está ausente; com um composto da fórmula IV CF3-C(O)-R2 (IV), em que R2 é halogênio, hidroxila, Ci-C4alcóxi, (di-Ci- Cαalquil) amino, OC(O)CF3, fenóxi ou OM1; em que M1 é Litio, Magnésio, Sódio ou Potássio; para formar o composto da fórmula V, b) fazer reagir o composto da fórmula V com fluoreto metálico selecionado de KF, LiF e NaF na presença de quantidades catalíticas de um catalisador de transferência de fase selecionado do grupo que consiste em sais de fosfônio de fórmula geral (R3)4PX e sais de amónio de fórmula geral (R3)4NX em que R3 é Ci-C4alquila ou fenila e X é halogênio; na presença co Rub de um solvente polar selecionado do grupo que consiste em sulfolano, dimetilformamida e dimetilsulfóxido, para formar o composto da fórmula I. Na referida modalidade preferencial da invenção, o reagente organometálico é cloreto de isopropilmagnésio complexado com LiCl. Exemplos preparatórios: Exemplo 1: Preparação de 2,2,2-trifluoro-1-(3,4,5-triclorofenil)etanona da fórmula V:
[0017] A uma solução de 5-bromo-l,2,3-tricloro-benzeno (220 g, 811 mmol) em tetraidrofurano (1600 mL) adicionou-se iPrMgCl*LiCl 1,3 M em THE (1250 mL, 1622 mmol) lentamente a 20 °C. A mistura reacional foi agitada durante 2 horas e esfriada para 0 °C. Adicionou-se lentamente 2,2,2-trifluroacetato de metila (314,8 g, 2434 mmol) e a mistura reacional foi agitada à temperatura ambiente durante 1 hora. A mistura reacional foi esfriada para 0 °C e adicionou-se gota a gota HC1 2,0 M (810 mL, 1622 mmol) durante 30 min. A mistura resultante foi diluida com acetato de etila, a camada orgânica foi lavada com salmoura, seca em MgSCU anidro e evaporada sob pressão reduzida. O produto bruto foi dissolvido em uma quantidade minima de ciclo-hexano e a solução foi esfriada para -10 °C. Oprecipitado formado foi removido por filtração, dando origem a 2,2,2-trifluoro-1-(3,4,5-triclorofenil}etanona (122 g) na forma de um sólido amarelo. O filtrado foi diluido com ciclo-hexano e lavado duas vezes com acetonitrila. A fase de ciclo-hexano foi evaporada sob pressão reduzida e o residuo foi dissolvido em uma quantidade minima de ciclo-hexano. A solução foi esfriada para -10 °C e outra porção de 2,2,2-trifluoro-1-(3, 4, 5- triclorofenil)etanona (35 g) foi removida por filtração.
[0018] RMN (400 MHz, CDC13) δ 8,07-8,05 (m, 2H). Exemplo 2: Preparação de 1- (3,5-dicloro-4-fluoro-fenil)- 2,2,2-trifluoro-etanona da fórmula I:
[0019] A uma solução de 2,2,2-trifluoro-1-(3,4,5- triclorofenil)etanona (1,0 g, 3,6 mmol) em sulfolano (3 mL) adicionou-se fluoreto de potássio seco (0,35 g, 4,32 mmol) e brometo de tetrafenilfosfônio (0,015 g, 0,036 mmol). A mistura reacional resultante foi agitada a 160 °C durante 5 horas. A mistura reacional foi destilada sob pressão reduzida. Frações contendo o produto foram adicionalmente purificadas por cromatografia em silica gel (eluindo com heptano puro), dando origem a 1-(3,5-dicloro-4-fluoro-fenil)-2,2,2-trifluoro- etanona (0,571 g) na forma de um óleo incolor e uma mistura de formas de cetona e hidrato (cerca de 3:1) .
[0020] 19F RMN (400 MHz, CDCI3) δ-71,5, -84,7, -102,4, -112,9.
Claims (8)
1. Processo para a preparação do composto da fórmula I caracterizado por compreender a) fazer reagir o composto da fórmula II na presença de magnésio ou um reagente organometálico da fórmula III Ri-M2X (III), em que Ri é Ci-C4alquila; M2 é Litio ou Magnésio e X é halogênio ou está ausente; com um composto da fórmula IV CF3-C(O)-R2 (IV), em que R2 é halogênio, hidroxila, Ci-C4alcóxi, (di-Ci- C4alquil) amino, OC(O)CF3, fenóxi ou OM1; em que M1 é Litio, Magnésio, Sódio ou Potássio; para formar o composto da fórmula V, e b) fazer reagir o composto da fórmula V com um fluoreto de metal alcalino na presença de quantidades catalíticas de um catalisador de transferência de fase na presença de um solvente polar para formar o composto da fórmula I.
3. Processo, de acordo com a reivindicação 2, caracterizado por o reagente organometálico ser cloreto de isopropilmagnésio complexado com LiCl.
4. Processo, de acordo com a reivindicação 1, caracterizado por o fluoreto de metal alcalino ser selecionado de KF, LiF e NaF.
5. Processo, de acordo com a reivindicação 1, caracterizado por o catalisador de transferência de fase ser selecionado do grupo que consiste em sais de fosfônio de fórmula geral (R3)4PX e sais de amónio de fórmula geral (R3) 4NX em que R3 é Ci~C4alquila ou fenila e X é halogênio.
6. Processo, de acordo com a reivindicação 1, caracterizado por o solvente polar ser selecionado do grupo que consiste em sulfolano, dimetilformamida e dimetilsulfóxido.
7. Processo, de acordo com a reivindicação 1, caracterizado por compreender a) fazer reagir o composto da fórmula II na presença de um reagente organometálico da fórmula III Ri-M2X (III), em que Ri é Ci-C4alquila; M2 é Litio ou Magnésio e X é halogênio ou está ausente; com um composto da fórmula IV CF3-C(O)-R2 (IV), em que R2 é halogênio, hidroxila, Ci-C4alcóxi, (di-Ci- C^alquil) amino, OC(O)CF3, fenóxi ou OM1; em que M1 é Litio, Magnésio, Sódio ou Potássio; para formar o composto da fórmula V, b) fazer reagir o composto da fórmula V com um fluoreto de metal alcalino selecionado de KF, LiF e NaF na presença de quantidades catalíticas de um catalisador de transferência de fase selecionado do grupo que consiste em sais de fosfônio de fórmula geral (RaHPX e sais de amónio de fórmula geral (R3) 4NX em que R3 é Ci~C4alquila ou fenila e X é halogênio; na presença de um solvente polar selecionado do grupo que consiste em sulfolano, dimetilformamida e dimetilsulfóxido, para formar o composto da fórmula I.
8. Processo, de acordo com a reivindicação 7, caracterizado por o reagente organometálico ser cloreto de isopropilmagnésio complexado com LiCl.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP14188741.4 | 2014-10-14 | ||
| EP14188741 | 2014-10-14 | ||
| PCT/EP2015/073218 WO2016058896A1 (en) | 2014-10-14 | 2015-10-08 | Process for the preparation of 1-(3,5-dichloro-4-fluoro-phenyl)-2,2,2-trifluoro-ethanone |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112017007509A2 BR112017007509A2 (pt) | 2018-06-19 |
| BR112017007509B1 true BR112017007509B1 (pt) | 2021-02-02 |
Family
ID=51690929
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112017007509-1A BR112017007509B1 (pt) | 2014-10-14 | 2015-10-08 | processo para a preparação de 1-(3,5-dicloro-4-fluorofenil)-2,2,2-trifluoro-etanona |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US9809524B1 (pt) |
| EP (1) | EP3207018B1 (pt) |
| JP (1) | JP6640210B2 (pt) |
| KR (1) | KR102443434B1 (pt) |
| CN (2) | CN117550960A (pt) |
| BR (1) | BR112017007509B1 (pt) |
| IL (1) | IL251249B (pt) |
| MX (1) | MX2017004544A (pt) |
| WO (1) | WO2016058896A1 (pt) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106518636A (zh) * | 2016-10-18 | 2017-03-22 | 浙江天宇药业股份有限公司 | 4‑氯‑2‑(三氟乙酰基)苯胺盐酸盐水合物及其游离碱的制备方法 |
| WO2022061914A1 (zh) * | 2020-09-28 | 2022-03-31 | 台州臻挚生物科技有限公司 | 一种3,5-二卤三氟苯乙酮及其衍生物的制备方法 |
| CN112876345B (zh) * | 2020-10-26 | 2022-11-15 | 上海康鹏科技股份有限公司 | 一种卤代三氟乙酰苯的制备方法 |
| CN113024390B (zh) * | 2021-02-22 | 2023-12-05 | 台州臻挚生物科技有限公司 | 3’,5’-二氯-2,2,2-三氟苯乙酮衍生物的合成方法 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4642398A (en) | 1986-01-06 | 1987-02-10 | Mallinckrodt, Inc. | Preparation of fluoronitrobenzene compounds in dispersion of potassium fluoride |
| EP0536175B1 (de) | 1990-06-25 | 1995-09-20 | Hoechst Aktiengesellschaft | Verfahren zur herstellung von chlorfluornitrobenzolen und difluornitrobenzolen |
| ES2443690T3 (es) | 2005-09-02 | 2014-02-20 | Nissan Chemical Industries, Ltd. | Compuesto de benzamida sustituido con isoxazolina y agente controlador de organismos dañinos |
| CN101177379A (zh) | 2006-11-10 | 2008-05-14 | 浙江富盛控股集团有限公司 | 一种2,4,6-三氯氟苯的制备方法 |
| JP2010521432A (ja) * | 2007-03-16 | 2010-06-24 | ビーエーエスエフ ソシエタス・ヨーロピア | ジクロロ−フルオロ−トリフルオロメチルベンゼンの混合物を用いた2,6−ジクロロ−4−(トリフルオロメチル)フェニルヒドラジンの調製方法 |
| JP5485164B2 (ja) | 2007-11-29 | 2014-05-07 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 6,7−ジヒドロ−5H−イミダゾ[1,2−a]イミダゾール−3−カルボン酸アミドの誘導体 |
| TWI518076B (zh) * | 2008-04-09 | 2016-01-21 | 杜邦股份有限公司 | 製備雜環化合物之方法 |
| DE102009030681A1 (de) * | 2009-06-26 | 2010-12-30 | Saltigo Gmbh | Herstellung von substituierten 2-Fluoracrylsäurederivaten |
| DE102009049419B4 (de) | 2009-10-14 | 2012-03-08 | Saltigo Gmbh | Verbessertes Verfahren zur Herstellung von 3-Chlor-4,5-difluorbenzotrifluorid |
| JP2012082186A (ja) * | 2010-09-15 | 2012-04-26 | Bayer Cropscience Ag | 殺虫性アリールピロリジン類 |
| AU2012224521B2 (en) | 2011-03-10 | 2015-10-29 | Novartis Tiergesundheit Ag | Isoxazole derivatives |
| CN103664511B (zh) | 2013-12-13 | 2015-07-08 | 浙江林江化工股份有限公司 | 一种3,5-二氯-4-氟溴苯的制备方法 |
-
2015
- 2015-10-08 WO PCT/EP2015/073218 patent/WO2016058896A1/en active Application Filing
- 2015-10-08 BR BR112017007509-1A patent/BR112017007509B1/pt active IP Right Grant
- 2015-10-08 EP EP15778278.0A patent/EP3207018B1/en active Active
- 2015-10-08 CN CN202311467973.1A patent/CN117550960A/zh active Pending
- 2015-10-08 US US15/516,087 patent/US9809524B1/en active Active
- 2015-10-08 KR KR1020177009974A patent/KR102443434B1/ko active IP Right Grant
- 2015-10-08 CN CN201580055704.1A patent/CN106795082A/zh active Pending
- 2015-10-08 JP JP2017519851A patent/JP6640210B2/ja active Active
- 2015-10-08 MX MX2017004544A patent/MX2017004544A/es active IP Right Grant
-
2017
- 2017-03-19 IL IL251249A patent/IL251249B/en active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| US9809524B1 (en) | 2017-11-07 |
| IL251249A0 (en) | 2017-05-29 |
| CN117550960A (zh) | 2024-02-13 |
| CN106795082A (zh) | 2017-05-31 |
| EP3207018B1 (en) | 2018-07-25 |
| KR102443434B1 (ko) | 2022-09-14 |
| WO2016058896A1 (en) | 2016-04-21 |
| BR112017007509A2 (pt) | 2018-06-19 |
| JP6640210B2 (ja) | 2020-02-05 |
| JP2017531004A (ja) | 2017-10-19 |
| MX2017004544A (es) | 2017-06-23 |
| KR20170066429A (ko) | 2017-06-14 |
| US20170305828A1 (en) | 2017-10-26 |
| EP3207018A1 (en) | 2017-08-23 |
| IL251249B (en) | 2019-08-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Zhu et al. | N-Difluoromethylthiophthalimide: a shelf-stable, electrophilic reagent for difluoromethylthiolation | |
| Zhou et al. | Air oxidative radical hydroxysulfurization of styrenes leading to β-hydroxysulfides | |
| Zhu et al. | Visible-light-mediated direct difluoromethylation of alkynoates: synthesis of 3-difluoromethylated coumarins | |
| Zhang et al. | Metal-free iodine-mediated synthesis of vinyl sulfones at room temperature using water as solvent | |
| BR112017007509B1 (pt) | processo para a preparação de 1-(3,5-dicloro-4-fluorofenil)-2,2,2-trifluoro-etanona | |
| Enders et al. | Chemo-and Enantioselective Brønsted Acid-Catalyzed Reduction of α-Imino Esters with Catecholborane. | |
| Han et al. | A metal-free diverse synthesis of difluoromethylthioethers and difluorobis (arylthio) methanes from RSX (X= SR, Cl, SO2Ph) and TMSCF2H | |
| Zhang et al. | Catalytic asymmetric detrifluoroacetylative aldol reactions of aliphatic aldehydes for construction of CF quaternary stereogenic centers | |
| Goh et al. | Synthesis of vinylic sulfones in aqueous media | |
| Luo et al. | Xanthate-mediated synthesis of (E)-alkenes by semi-hydrogenation of alkynes using water as the hydrogen donor | |
| Shieh et al. | Syntheses of thioethers and selenide ethers from anilines | |
| Kidwai et al. | A novel method for the synthesis of tetrahydrobenzo [a]-xanthen-11-one derivatives using cerium (III) chloride as a highly efficient catalyst | |
| WO2022149617A1 (ja) | 化合物ライブラリ | |
| CN107540598B (zh) | 一种制备n-二氟甲硫基邻苯酰亚胺类化合物的方法 | |
| Paramanik et al. | Catalytic nucleophilic fluorination by an imidazolium ionic liquid possessing trialkylphosphine oxide functionality | |
| WO2009122834A1 (ja) | 4-パーフルオロイソプロピルアニリン類の製造方法 | |
| JPWO2018159515A1 (ja) | ペンタフルオロスルファニル芳香族化合物の製造方法 | |
| Sidler et al. | Toward a Scalable Synthesis and Process for EMA401, Part II: Development and Scale-Up of a Pyridine-and Piperidine-Free Knoevenagel–Doebner Condensation | |
| EP2522648B1 (en) | Process for producing difluorocyclopropane compound | |
| Reichel et al. | Fluoromethyl-2, 4, 6-trinitrophenylsulfonate: A New Electrophilic Monofluoromethylating Reagent | |
| JPWO2011118625A1 (ja) | 光学活性なn−モノアルキル−3−ヒドロキシ−3−アリールプロピルアミン化合物の製造方法 | |
| Yuan et al. | Ammonium iodide-promoted unprecedented arylsulfonylation of quinone with sodium arylsulfinates | |
| Cai et al. | Regiospecific and highly stereoselective synthesis of β-amino (Z)-enylphosphonates via β-hydrogen migration reaction of dialkyl α-diazophosphonates catalyzed by AgOTf | |
| JP2008174552A (ja) | 4−パーフルオロイソプロピルアニリン類の製造方法 | |
| CN105061290A (zh) | 一种吲哚酮类化合物的合成方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 08/10/2015, OBSERVADAS AS CONDICOES LEGAIS. |