BR112015010703B1 - uso de uma composição farmacêutica e composição farmacêutica - Google Patents
uso de uma composição farmacêutica e composição farmacêutica Download PDFInfo
- Publication number
- BR112015010703B1 BR112015010703B1 BR112015010703-6A BR112015010703A BR112015010703B1 BR 112015010703 B1 BR112015010703 B1 BR 112015010703B1 BR 112015010703 A BR112015010703 A BR 112015010703A BR 112015010703 B1 BR112015010703 B1 BR 112015010703B1
- Authority
- BR
- Brazil
- Prior art keywords
- tocotrienol
- administration
- tocotrienols
- pharmaceutical composition
- sublingual
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
- A61K31/353—3,4-Dihydrobenzopyrans, e.g. chroman, catechin
- A61K31/355—Tocopherols, e.g. vitamin E
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
- A61K31/353—3,4-Dihydrobenzopyrans, e.g. chroman, catechin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/006—Oral mucosa, e.g. mucoadhesive forms, sublingual droplets; Buccal patches or films; Buccal sprays
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/16—Emollients or protectives, e.g. against radiation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/02—Antidotes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Physiology (AREA)
- Nutrition Science (AREA)
- Hematology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Obesity (AREA)
- Toxicology (AREA)
- Dermatology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Neurology (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
Abstract
COMPOSIÇÃO FARMACÊUTICA, USOS DE PELO MENOS UM TOCOTRIENOL OU DERIVADO DESTE, E USOS DE UMA COMPOSiÇãO FARMACÊUTICA. A presente invenção se refere às composições farmacêuticas formuladas para administração transmucosal que incluem pelo menos um tocotrienóis ou derivados destes e os usos destas composições.
Description
[001] A presente invenção se refere a composições farmacêuticas que incluem tocotrienóis e seus derivados para administração transmucosal (na forma bucal, sublingual e nasal).
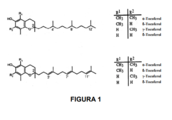
[002] Um nutriente essencial para o corpo, a vitamina E é composta de quatro tocoferóis (alfa, beta, gama, delta) e quatro tocotrienóis (alfa, beta, gama, delta), com a diferença entre tocotrienóis e tocoferóis encontrando-se na cadeia lateral insaturada que possui três ligações duplas em sua cauda isoprenoide farnesil para tocotrienóis enquanto estas ligações duplas são ligações únicas nos tocoferóis (Figura 1).
[003] Os tocotrienóis ocorrem em óleos vegetais selecionados, como palma e farelo de arroz, determinados tipos de frutas, como urucum e Saw palmetto, nozes, como macadâmia e produtos vegetais, como látex de seringueira. O componente de tocotrienol da Vitamina E total é normalmente inferior ao componente de tocoferol.
[004] Quimicamente, cada isômero de tocotrienol e tocoferol possui uma atividade antioxidante devido à sua capacidade de doar um átomo de hidrogênio (um próton mais elétron) do grupo hidroxila no anel cromanol para um radical livre no corpo. Este processo inativa ("extingue") o radical livre ao doar de forma eficaz um único elétron sem par (o qual vem com o átomo de hidrogênio) ao radical.
[005] A Vitamina E tem sido conhecida por suas propriedades antioxidantes contra peroxidação lipídica em membranas biológicas e o alfa-tocoferol foi anteriormente considerado a forma mais ativa. No entanto, in vivo, os tocotrienóis são os antioxidantes mais poderosos, e os valores de capacidade de absorção de radical do oxigênio (ORAC) lipídico são mais elevados para o delta-tocotrienol. Dados recentes sugeririam que os tocotrienóis são melhores antioxidantes que os tocoferóis na prevenção de doenças e cânceres cardiovasculares, e no tratamento de diabetes. As formulações atuais de suplementos de Vitamina E são compostas principalmente de alfa- tocoferol.
[006] Os tocotrienóis possuem muitos usos além de sua propriedade de antioxidante lipossolúvel. Eles inibem especificamente a biossíntese do colesterol pelo fígado através da degradação potencializada da enzima HMG-CoA redutase (Song et al "Insig dependent ubiquitination and degradation of 3-hydroxy-3-methylglutaryl coenzyme a reductase by delta- and gamma- tocotrienols" The Journal of Biological Chemistry 281 (35):25054-61). Os tocotrienóis demonstraram inibir as vias inflamatórias mediadas por NF-kB (Nesaretnam et al "Tocotrienols: inflammation and cancer" Ann N Y Acad Sci. 2011 Jul;1229:18-22). Eles também foram identificados como agonistas do receptor ativado por proliferador de peroxissoma (PPAR), em particular PPAR-gama, que é um sensibilizador de insulina em adição à adipogênese crescente (Fang et al "Vitamin E tocotrienols improve insulin sensitivity through activating peroxisome proliferator-activated receptors" Mol Nutr Food Res 2010 Mar;54 (3):345-52) . De fato, os tocotrienóis influenciam muito mais vias bioquímicas que os tocoferóis, e estão sendo desenvolvidos como tratamentos para inflamação, doenças associadas à isquemia, como acidente vascular cerebral e infarto do miocárdio, dislipidemia e mesmo o câncer (Khosla et al "Postprandial levels of the natural Vitamin E tocotrienol in human circulation" Antioxidants & Redox Signalling 8(5-6): 1059-68).
[007] Os tocotrienóis têm mostrado ou possuem potencial para:
- • possuir fortes propriedades antioxidantes (Serbinova et al "Free radical recycling and intramembrane mobility in the antioxidant properties of alpha-tocoferol and alpha-tocotrienol" Free Radical Biology & Medicine 10(5):263-75) .
- • reverter hipertensão e fibrose cardíaca (Black et al "Palm tocotrienols protect ApoE +/- mice from diet induced atheroma formation" J Nutrition 2000;130(10):2420-6).
- • melhorar o controle de glicemia e resposta à insulina (Kuhad et al (2009) "Suppression of NF-κβ signalling pathway by tocotrienol can prevent diabetes associated cognitive defects" Pharmacology Biochemistry, and Behaviour 92 (2) : 251 -9)
- • inibir especificamente a biossíntese de colesterol pelo fígado, ou seja, eles podem diminuir os níveis de colesterol e melhorar a dislipidemia (Song et al "Insig dependent ubiquitination and degradation of 3-hydroxy-3-methylglutaryl coenzyme a reductase by delta- and gamma-tocotrienols" The Journal of Biological Chemistry 281 (35) :25054 - 61)
- • inibir as vias inflamatórias mediadas por ciclooxigenase-2 e 12-lipoxigenase, ou seja, eles podem ser utilizados como tratamentos para inflamação (Khanna et al "Molecular basis of Vitamin E action: tocotrienol modulates 12-lipoxygenase, a key mediator of glutamate induced neurodegeneration" J Biol Chem 2003;278:43508-43515)
- • ser potencialmente úteis como tratamentos para acidente vascular cerebral, infarto do miocárdio e mesmo o câncer (Hussein et al "d-Delta-tocotrienol-mediated suppression of the proliferation of human PANC-1, MIA PaCa-2, and BxPC-3 pancreatic carcinoma cells" Pancreas 38(4):e124-36)
- • melhorar a resistência a exercícios e melhorar os níveis de glicogênio no músculo (Lee et al "Effects of tocotrienol-rich fraction on exercise endurance capacity and oxidative stress in forced swimming rats" Eur J Appl Physiol 2009; 107 (5) :587-95)
- • atuar como contramedidas radioativas para pessoas expostas à radiação (Ghosh et al "Gamma-tocotrienol, a tocol antioxidant as a potent radioprotector" Int J Radiat Biol 85 (7) : 598-606)
[008] Os lipídios alimentares e vitaminas lipossolúveis devem ser primeiramente emulsionados pela bile e incorporados em micelas para transporte na circulação para ser absorvidas a partir do trato gastrointestinal. A excreção biliar é dependente do nível e tipo de gordura da dieta consumida, e os estudos mostraram que a absorção de tocotrienol é reduzida em indivíduos em jejum versus indivíduos alimentados (Yap et al "Pharmacokinetics and biovailability of alfa-, gamma- and delta-tocotrienols under different food status" J Pharm Pharmacol 2001 Jan;53 (1):67- 71). A administração oral de tocotrienóis isolados por sonda gástrica ou cápsulas em gel pode, portanto, não ter o conteúdo lipídico suficiente para estimular excreção biliar suficiente no intestino delgado que seria necessária para promover a absorção de tocotrienol.
[009] Após a administração oral, os tocotrienóis são absorvidos a partir do intestino e transportados à circulação sistêmica através da via linfática. Os estudos em humanos mostraram que a biodisponibilidade relativa de gama-tocotrienol aumentou quando administrado com alimentos e que, em humanos em jejum, a concentração plásmica de tocotrienol não aumenta de forma significativa após a ingestão de tocotrienol (Yap et al "Pharmacokinetics and biovailability of alfa-, gamma- and delta-tocotrienols under different food status" J Pharm Pharmacol 2001 Jan;53 (1):67-71) . Embora os alimentos potencializem a absorção de gama-tocotrienol ao estimular a excreção biliar e de enzimas pancreáticas que potencializam a formação de micelas mistas, a absorção de gama-tocotrienol permanece limitada e longe de ser completa.
[010] Pareceria que é muito difícil obter e/ou sustentar os níveis terapêuticos de gama-tocotrienol no sangue e tecidos alvo pela simples administração oral, por que a absorção e os mecanismos de transporte no corpo são extremamente limitantes e exibem preferência significativa por alfa-tocoferol. Embora diversos produtos contendo tocotrienol já estejam comercialmente disponíveis, estes produtos são simplesmente cápsulas preenchidas com uma mistura de diversos óleos de tocoferóis e tocotrienol e vendidos como suplementos nutricionais para consumo oral. Este tipo de formulação ou sistema de administração exibe fraca solubilidade em fluidos do intestino e as doses orais elevadas de tocotrienóis inibem sua própria absorção a partir do intestino. Consequentemente, somente níveis relativamente baixos de tocotrienol atingirão o sangue quando simplesmente formuladas na forma de sistema de administração de cápsula preenchida com óleo e, portanto, uma estratégia que está atualmente em uso é a utilização de agente emulsificante para potencializar a absorção a partir do trato gastrointestinal.
[011] Os tocotrienóis podem ser associados a partículas lipoproteicas, denominadas quilomícrons, e levadas por meio do sistema lácteo do intestino onde são transportadas por meio do sistema linfático à circulação. A partir daqui, o grau de captação pelos tecidos varia. Alguns relatos dizem que a maioria termina no tecido cutâneo e adiposo, com menor captação nos demais tecidos (Gee, P.T., "Unleashing the untold and misunderstood observations on Vitamin E" Genes & Nutrition February 2011, Vol 6, Issue 1, p 5-16). Elas podem ser incorporadas em lipoproteínas de densidade muito baixa pelo menos em parte, mediada pela ligação de proteína de transporte de alfa-tocoferol para ser levada ao fígado e reacondicionada em lipoproteínas para exportação a outros tecidos por meio da circulação. Por exemplo, o gama-tocotrienol e o delta-tocotrienol parecem possuir níveis muito baixos de captação pelos principais tecidos metabólicos, como musculoesquelético e hepático.
[012] A suplementação de tocotrienol não parece conferir um efeito terapêutico em estudos clínicos de tamanho moderado em pacientes com dislipidemia, apesar do fato de que os tocotrienóis plasmáticos tenham sido elevados pela suplementação oral. Isto pode ter ocorrido devido à dosagem inadequada, aos efeitos concorrentes do alfa-tocoferol que foi cosuplmentado ou aos níveis insuficientes de tocotrienóis presentes no fígado de modo a inibir a biossíntese de colesterol. Isto significou que os relatos de efeitos positivos foram restritos a estudos com roedores e alguns pequenos estudos clínicos com seres humanos. Portanto, duvidou-se se os efeitos benéficos encontrados em estudos com animais seriam traduzidos aos seres humanos, e se a absorção/armazenamento de tocotrienóis foi deficiente. Também está claro que o alfa-tocoferol possui a mais elevada afinidade com a proteína de transporte (denominada proteína de transporte de alfa-tocoferol - alfa-TTP) e que os tocotrienóis parecem ser mais rapidamente metabolizados que o alfa-tocoferol, talvez devido à sua cauda isoprenoide insaturada e estabilização reduzida por alfa-TTP devido à concorrência de alfa-tocoferol. Acreditou-se que a falta de qualquer efeito benéfico observado nestes estudos fosse devido à fraca biodisponibilidade de tocotrienóis administrados por via oral ou aos efeitos competitivos de alfa-tocoferol presente nas composições, ou uma combinação de ambos estes fatores.
[013] Tendo em consideração os potenciais benefícios clínicos de tocotrienóis, e sua baixa toxicidade (Nakamura et al, "Oral Toxicity of a tocotrienol preparation in rats" Food Chem Toxicol 2001 Aug;39(8): 799-805), seria útil prover formulações de tocotrienóis com biodisponibilidade mais elevada do que tem sido possível até o momento. Foram realizadas tentativas de melhorar a biodisponibilidade dos tocotrienóis ao incorporá-los às nanopartículas de lipídio ou vesículas multilamelares com ligação de transferrina, as quais parecem potencializar o efeito antitumoral dos tocotrienóis em até 70 vezes (Fu et al, "Novel tocotrienol-entrapping vesicles can eradicate solid tumours after intravenous delivery" J Control Release 2011 Aug 25; 154(1):20-6) . No entanto, tais formulações estão limitadas na medida em que devem ser introduzidas via intravenosa (o que não é prático ou adequado para aplicações não clínicas e possuem aceitação de mercado limitada para todos, além das indicações mais sérias e de risco à vida) e são dependentes da utilização de tocoferil baseados nas vesículas multilamelares que podem por si interferir na atividade dos tocotrienóis presentes.
[014] Há uma disponibilidade e captação relativamente baixas de tocotrienóis nos principais tecidos metabólicos, como músculo e fígado, por meio da administração oral. Em um artigo recente, a suplementação de 400 mg de tocotrienóis ao dia durante 12 semanas atingiu apenas níveis baixos ou sub-nanomolares/g nos tecidos, e o nível sérico permaneceu abaixo de 2 umol/L em todos os indivíduos do sexo masculino. (Patel et al, "Oral tocotrienols are transported to human tissues and delay the progression of a model of end-stage liver disease", Journal of Nutrition 2012, 142 (3): 512-519). Portanto, existe a necessidade de um método de administração de níveis mais elevados de tocotrienóis nestes tecidos apesar da minimização da degradação metabólica pelo fígado.
[015] Os inventores da presente invenção descobriram que a administração de tocotrienóis por via transmucosal prove biodisponibilidade intensificada em comparação à administração oral de tocotrienóis.
[016] Da mesma forma, a presente invenção se refere a uma composição farmacêutica formulada para administração transmucosal, que inclui pelo menos um tocotrienol ou seu derivado com um ou mais excipientes farmaceuticamente aceitáveis.
[017] Em uma realização preferida, a administração transmucosal é administração sublingual ou oral.
[018] Em uma realização preferida adicional, a composição inclui pelo menos um tocotrienol ou seu derivado e pelo menos um tocoferol, em que o componente de tocoferol é inferior ao componente de tocotrienol.
[019] Em uma realização preferida adicional, a composição inclui pelo menos um tocotrienol ou seu derivado na forma de uma fração rica em tocotrienol de um extrato de Vitamina E, em que o componente de alfa-tocoferol é inferior ao componente de tocotrienol.
[020] Em uma realização preferida adicional, a composição inclui um tocoferol e a capacidade do tocoferol de interferir ou competir com a atividade terapêutica do tocotrienol, ou seu derivado, tenha sido eliminada, reduzida ou minimizada.
[021] A presente invenção se refere ainda a um método de tratamento ou prevenção de uma doença ou condição passível de tratamento com um tocotrienol, que inclui administração transmucosal de pelo menos um tocotrienol ou seu derivado.
[022] Em uma realização preferida, o tocotrienol ou seu derivado é administrado via sublingual ou oral.
[023] Em uma realização preferida adicional, o tocotrienol ou seu derivado é administrado em um comprimido farmacêutico, película, pastilha, pó, spray, solução ou formulação em gel.
[024] Em uma realização adicional preferida, a doença ou condição é selecionada a partir do grupo que consiste em: dor muscular após exercício, dor muscular de início postergado, fibrose cardíaca, hipertensão, inflamação, acidente vascular cerebral, câncer, colesterol e/ou triglicerídeos elevados, calvície e uma condição resultante de exposição à radiação.
[025] A presente invenção se refere ainda a um método de melhora da resistência a exercícios, que inclui a administração transmucosal de pelo menos um tocotrienol ou seu derivado.
[026] A presente invenção se refere ainda a um método de promoção de perda de peso e gordura corporal, que inclui a administração transmucosal de pelo menos um tocotrienol ou seu derivado.
[027] A presente invenção se refere ainda a um método de estabilização e/ou controle de glicemia em um animal, que inclui a administração transmucosal de pelo menos um tocotrienol, ou seu derivado.
[028] A presente invenção se refere ainda a uma composição farmacêutica transmucosal, que inclui pelo menos um tocotrienol ou seu derivado para o uso na prevenção ou tratamento de uma doença ou condição passível de tratamento com um tocotrienol.
[029] Em uma realização preferida, a composição farmacêutica transmucosal é formulada para a administração sublingual ou oral.
[030] Em uma realização preferida adicional, a composição farmacêutica transmucosal encontra-se na forma de um comprimido, película, pastilha, resina, pós, spray, solução ou gel.
[031] A presente invenção se refere ainda a uma composição farmacêutica transmucosal que compreende uma fração de Vitamina E rica em tocotrienol, onde o componente de alfa-tocoferol é inferior ao componente de tocotrienol.
[032] Em uma realização preferida adicional, a composição farmacêutica transmucosal que compreende uma fração rica em tocotrienol, onde o componente de alfa-tocoferol constitui não mais que aproximadamente 10 % da fração de Vitamina E.
[033] Em uma realização preferida adicional, a doença ou condição é selecionada a partir do grupo que consiste em: dor muscular após exercício, dor muscular de início postergado, fibrose cardíaca, hipertensão, inflamação, acidente vascular cerebral, câncer, colesterol e/ou triglicerídeos elevados, calvície e uma condição resultante de exposição à radiação.
[034] A presente invenção se refere ainda a uma composição farmacêutica transmucosal, que inclui pelo menos um tocotrienol ou seu derivado para uso na melhora da resistência a exercício em um animal.
[035] A presente invenção se refere ainda a uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu deriva para o uso na promoção de perda de peso em um animal.
[036] A presente invenção se refere ainda a uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu derivado para o uso na estabilização e/ou controle de glicemia em um animal.
[037] A presente invenção se refere ainda ao uso de pelo menos um tocotrienol ou seu derivado na preparação de um medicamento para a administração transmucosal.
[038] A presente invenção se refere ainda ao tocotrienol para uso na administração transmucosal.
[039] A presente invenção se refere ao uso de pelo menos um tocotrienol ou seu derivado na preparação de um medicamento para a prevenção ou tratamento de uma doença ou condição passível de tratamento com um tocotrienol, em que o medicamento é formulado para a administração transmucosal.
[040] Em uma realização preferida, o medicamento é formulado para a administração sublingual ou oral.
[041] Em uma realização preferida adicional, o medicamento é formulado para a administração sublingual e encontra-se na forma de um comprimido, película, pastilha, resina, pó, spray, solução ou gel.
[042] A presente invenção se refere ainda a uma composição farmacêutica para o tratamento ou prevenção de uma doença ou condição passível de tratamento com um tocotrienol, que inclui uma quantidade terapeuticamente eficaz de pelo menos um tocotrienol ou seu derivado e um ou mais excipientes adequados para a administração medicamentosa transmucosal.
[043] Em uma realização preferida, a composição farmacêutica é formulada para administração sublingual ou oral.
[044] Em uma realização preferida adicional, a composição farmacêutica é formulada para administração sublingual e encontra-se na forma de comprimido, película,pastilha, resina, pó, spray, solução ou gel.
[045] A presente invenção se refere ainda a um método de aumento da biodisponibilidade de um tocotrienol administrado a um animal, que inclui a administração transmucosal de pelo menos um tocotrienol ou seu derivado.
[046] A presente invenção se refere ainda a um método para minimização da dosagem exigida de tocotrienol para se atingir um efeito terapêutico em um animal, que inclui a administração transmucosal de pelo menos um tocotrienol ou seu derivado.
[047] A presente invenção se refere ainda a uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu derivado para uso no aumento da biodisponibilidade de um tocotrienol administrado a um animal.
[048] A presente invenção se refere ainda a uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu derivado para uso na minimização da dosagem exigida para se atingir um efeito terapêutico pela administração de um tocotrienol em um animal.
[049] A presente invenção se refere ainda ao uso de uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu derivado para a prevenção ou tratamento de uma doença ou condição passível de tratamento com um tocotrienol.
[050] Em uma realização preferida, a composição farmacêutica transmucosal é formulada para administração sublingual ou oral.
[051] Em uma realização preferida adicional, a composição farmacêutica transmucosal encontra-se na forma de um comprimido, película, pastilha, resina, pó, spray, solução ou gel.
[052] Em uma realização preferida adicional, a composição farmacêutica transmucosal inclui uma fração de Vitamina E rica em tocotrienol, em que o componente de alfa-tocoferol constitui não mais do que aproximadamente 10% da fração de Vitamina E.
[053] Em uma realização preferida adicional, a doença ou condição é selecionada a partir do grupo que consiste em dor muscular pós-exercício, dor muscular de início postergado, fibrose cardíaca, hipertensão, inflamação, acidente vascular cerebral, câncer, colesterol e/ou triglicerídeos elevados, calvície e uma condição resultante da exposição à radiação.
[054] A presente invenção se refere ainda ao uso de uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu derivado para melhora da resistência a exercício em um animal.
[055] A presente invenção se refere ainda ao uso de uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu derivado para promoção de perda de peso em um animal.
[056] A presente invenção se refere ainda ao uso de uma composição farmacêutica transmucosal que inclui pelo menos um tocotrienol ou seu derivado para estabilização e/ou controle de glicemia em um animal.
[057] Ao longo desta especificação e reivindicações, exceto com o contexto que exija o contrário, os termos "compreender", "compreende" "compreendendo" e "compreendido" não pretendem excluir os componentes adicionais, número inteiros ou etapas.
[058] A referência a qualquer técnica anterior na especificação não é e não deve ser interpretada como um reconhecimento ou qualquer forma de sugestão de que esta técnica anterior forma parte do conhecimento geral comum em qualquer jurisdição, ou que se espera que esta técnica anterior seja razoavelmente determinada, compreendida e considerada como relevante por um perito na técnica.
[059] Figura 1: Mostra a estrutura dos tocoferóis e tocotrienóis mais comuns. A única diferença entre os principais tocotrienóis e tocoferóis é de que o formador possui uma cauda isoprenoide insaturada. Além das estruturas aqui mostradas, há alguns novos tocotrienóis que forma isolados a partir, por exemplo, da fruta Kiwi.
[060] Figura 2: Em ratos Sprague-Dawley com obesidade induzida pela alimentação de dieta de alto teor de gordura (22%) durante 8 semanas, os tocotrienóis da dieta (25 mg/kg/d) melhoraram a tolerância a uma carga de glicose (2 g/kg, i.p.) em comparação aos animais que não receberam tocotrienóis (n=9, p<0,01; Mathai et al, 2011)
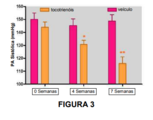
[061] Figura 3: Em ratos Sprague-Dawley mantidos em uma dieta com alto teor de gordura durante 8 semanas, os tocotrienóis da dieta (50 mg/kg/d) reverteram gradualmente a hipertensão estabelecida em comparação ao grupo controle placebo.
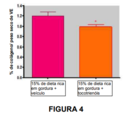
[062] Figura 4: A redução na pressão arterial observada na Figura 3 foi acompanhada de uma redução na fibrose cardíaca, conforme medido pelo conteúdo de hidroxiprolina do ventrículo esquerdo.
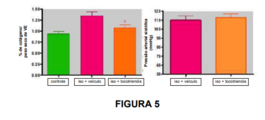
[063] Figura 5: Um experimento separado mostrou que a fibrose cardíaca induzida por isoproterenol foi inibida pela suplementação de tocotrienol. Como este modelo de fibrose cardíaca não aumentou a pressão arterial, ele mostra que o efeito antifibrótico dos tocotrienóis é separado do efeito anti-hipertensivo.
[064] Figura 6: A suplementação da dieta com tocotrienóis aumentou a excreção renal de sódio em ratos alimentados com uma dieta rica em gordura. Isto é importante uma vez que a obesidade é geralmente acompanhada de retenção de sódio e água, que pode levar a morbidades concomitantes, como volume sanguíneo e pressão arterial elevados e doença cardiovascular.
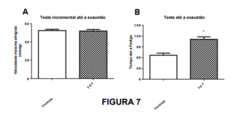
[065] Figura 7: O efeito de tocotrienóis na resistência ao exercício em ratos. A: velocidade máxima à exaustão em ratos que receberam tocotrienóis (TCT) versus controle. B: Tempo para exaustão em ratos que receberam tocotrienóis (TCT) versus controle.
[066] Figura 8: O efeito de tocotrienóis na resistência ao exercício em humanos. O tempo para exaustão após o ciclo foi medido em indivíduos que receberam um comprimido sublingual que incluía tocotrienóis versus placebo.
[067] Figura 9: Aparência das concentrações plasmáticas séricas utilizando formulações sublinguais de gel e comprimido de uma dose de 40 mg de tocotrienóis. Os níveis de delta-tocotrienol (delta-T3) e gama-tocotrienol (gama-T3) foram medidos no plasma nos timepoints até 180 minutos desde a administração da formulação gel ou comprimido (tab).
[068] Figura 10: Dor muscular de início postergado na escala visual análoga 1 e 2 dias após a contração excêntrica do antebraço.
[069] Os presentes inventores constataram surpreendentemente que a administração transmucosal de tocotrienóis resulta em uma biodisponibilidade e eficácia potencializadas dos tocotrienóis sobre a administração oral.
[070] A administração transmucosal e, particularmente, a sublingual dos tocotrienóis evita a degradação de primeira passagem dos tocotrienóis pelo fígado, aumentando assim a captação dos tocotrienóis nos tecidos alvo, inclusive musculoesquelético, tecido adiposo, pâncreas, coração e cérebro, bem como fígado, e o tecido endotelial dos vasos sanguíneos.
[071] Diversos fatores podem afetar a adequabilidade da administração transmucosal (como a sublingual) para componentes particulares, inclusive, entre outros, a lipofilicidade do composto de interesse e se o composto possui um coeficiente de partição de óleo para água favorável. Uma variação do coeficiente de partição de óleo-água de 40 a 2000 é considerada ideal para a administração sublingual de uma droga. Levando em consideração que os tocotrienóis são altamente lipofílicos, a administração de tocotrienóis via transmucosal e, particularmente, a via sublingual (onde todas as membranas são revestidas com uma camada aquosa de saliva/mucosa que seria uma barreira de contato e entrado) não seria um método de administração considerado viável antes do desenvolvimento da invenção atual.
[072] Os tocotrienóis, ou seus derivados, que podem ser utilizados nas composições e métodos da presente invenção incluem os tocotrienóis de ocorrência natural (extraídos de fontes naturais) e tocotrienóis sintéticos. Os tocotrienóis de ocorrência natural incluem os alfa, beta, gama e delta tocotrienóis. Apesar dos tocotrienóis de ocorrência natural serem conhecidos por existir em apenas uma forma estereoisomérica, outros estereoisômeros podem ser sinteticamente produzidos.
[073] Os derivados de tocotrienóis incluem, entre outros; ésteres, amidos, formas fosforiladas, nitrosiladas e succinato/ seleno-succinato de tocotrienóis.
[074] Os tocotrienóis, ou seus derivados, utilizados na composição e métodos da presente invenção podem ser extraídos de fontes naturais ou sintetizados de acordo com os métodos conhecidos na técnica. Os tocotrienóis podem ser derivados de extratos de plantas, como óleo de palma, óleo de farelo de arroz, germe de trigo, cevada e vagem de urucum. Em uma realização preferida, os tocotrienóis são derivados de óleo de palma ou urucum.
[075] As composições da presente invenção podem incluir uma forma de tocotrienol, ou seu derivado, ou uma mistura de diferentes tocotrienóis, ou derivados destes.
[076] Os tocotrienóis na composição da presente invenção podem ser isolados de outros componentes de um extrato de Vitamina E, ou podem estar presentes na combinação com outros componentes da Vitamina E.
[077] Em uma realização preferida, o componente de tocotrienol em uma composição farmacêutica é superior ao componente de tocoferol.
[078] Os tocotrienóis podem se apresentar em uma fração rica em tocotrienol produzida a partir de um extrato de Vitamina E. a fração rica em tocotrienol pode incluir alguns componente de alfa-tocoferol a partir da Vitamina E. Em uma realização preferida, a fração rica em tocotrienol inclui não mais que aproximadamente 50%, preferencialmente não mais que aproximadamente 40%, mais preferencialmente não mais que aproximadamente 30%, mais preferencialmente não mais que aproximadamente 20%, mais preferencialmente não mais que aproximadamente 10% de alfa-tocoferol.
[079] Em uma realização preferida, a composição da presente invenção inclui menos de 10% de tocoferol.
[080] Em outra realização, o tocoferol presente em um extrato de Vitamina E pode ser removido, modificado de tal modo que a atividade competitiva com os tocotrienóis foi eliminada ou reduzida. Um perito na técnica apreciaria que há qualquer número de meios pelos quais poderia ser atingido, inclusive, entre outros, a modificação enzimática (vide Torres et al "Enzymatic Modification for Ascorbic Acid and Alfa-Tocoferol Enhances their Stability in Food and Nutritional Application" The Open Food Science Journal 2008, 2, 1-9)
[081] Em uma realização preferida, a composição da presente invenção inclui um, ou ambos, dos gama-tocotrienol e delta-tocotrienol, ou derivados destes.
[082] A administração transmucosal se refere à via de administração pela passagem de um componente farmacêutico através da membrana mucosa. A administração transmucosal inclui, dentro de seu escopo, a administração sublingual, sublabial, oral e nasal.
[083] A administração transmucosal é atingida devido aos tecidos conjuntivos sob o epitélio das membranas transmucosais conterem capilares que possuem a capacidade de permitir que algumas substâncias se propaguem através delas e permitir que entrem na circulação venosa.
[084] A formulação para administração transmucosal pode ser uma forma de administração sólida, como um comprimido, cápsula, pastilha ou película, gel, líquido, emulsão, suspensão, spray ou uma formulação aerossol.
[085] As formulações de acordo com a presente invenção podem incluir excipientes farmaceuticamente aceitáveis ou portadores adequados para os sistemas de administração transmucosal. Os excipientes adequados são descritos, por exemplo, no Guia dos Excipientes Farmacêuticos, Rowe, Raymond C; Sheskey, Paul J; Cook, Walter G; Fenton, Marian E (eds), Pharmaceutical Press.
[086] Os excipientes adequados incluem, entre outros, ciclodextrinas, etilcelulose, celulose microcristalina, polivinilpirrolidona de ligação cruzada, fosfato dicálcico, carbonato de cálcio, sílica, metilcelulose, carboximetilcelulose, hidroximetilcelulose, hidroxipropilmetilcelulose, alginatos, gelatina, goma de guar, goma adragante, goma de acácia, ácido poliacrílico, ácido polimetacrílico, ácido polissilício e os sais destes, ácido polilático, ácido polimaleico, álcool polivinílico, polietileno glicol, polivinilpirrolidona, copolímeros em bloco não iônicos, carbômeros, policarbofilas, polissorbatos e amidos solúveis em água.
[087] As formulações em gel podem incluir os excipientes carboximetilcelulose e polietileno glicol.
[088] Em uma realização preferida da presente invenção, a composição é formulada para administração sublingual de pelo menos um tocotrienol, ou um derivado deste.
[089] Há diversos exemplos de métodos de administração sublingual e sistemas portadores adequados que podem ser utilizados para os fins de administração de tocotrienóis para os fins desta invenção, alguns dos quais podem ser encontrados em "An Overview on: Sublingual Route for Systemic Drug Delivery" - International Journal of Research in Pharmaceutical and Biomedical Sciences Vol. 3 (2) Apr - Jun 2012, o qual é aqui incorporado por referência em sua totalidade.
[090] Os aspectos da presente invenção incluem:
ii) Intensificação da absorção de tocotrienóis pela formulação em sistemas portadores destinados a auxiliar a absorção por vias de administração transmucosal, inclusive, entre outros, oral, bucal, sublingual/sublabial, retal e nasal; e/ou
iii) Melhora da administração de tocotrienóis aos tecidos alvo, inclusive, através da vesícula ou formulações denanopartícula, como os sistemas portadores de automontagem que atuam de forma similar aos quilomicrons, lipoproteínas de baixa densidade, cubossomos, mesofase, anfililas de automontagem e anfifilas de não automontagem para aumentar a biodisponibilidade de tocotrienóis e minimizar seu metabolismo hepáticos; e/ou
iv) Combinação com outros agentes, como extratos de plantas, vitaminas (inclusive, entre outros, niacina) e minerais, proteína e lipídios e carboidratos e drogas que forneceriam um efeito sinergético na combinação com tocotrienóis.
ii) Intensificação da absorção de tocotrienóis pela formulação em sistemas portadores destinados a auxiliar a absorção por vias de administração transmucosal, inclusive, entre outros, oral, bucal, sublingual/sublabial, retal e nasal; e/ou
iii) Melhora da administração de tocotrienóis aos tecidos alvo, inclusive, através da vesícula ou formulações denanopartícula, como os sistemas portadores de automontagem que atuam de forma similar aos quilomicrons, lipoproteínas de baixa densidade, cubossomos, mesofase, anfililas de automontagem e anfifilas de não automontagem para aumentar a biodisponibilidade de tocotrienóis e minimizar seu metabolismo hepáticos; e/ou
iv) Combinação com outros agentes, como extratos de plantas, vitaminas (inclusive, entre outros, niacina) e minerais, proteína e lipídios e carboidratos e drogas que forneceriam um efeito sinergético na combinação com tocotrienóis.
[001] Como os tocotrienóis possuem diversas ações, o equilíbrio entre i) e ii) pode ser ajustado de acordo com a ação terapêutica desejada. Por exemplo, se a ação natriurética de gama-tocotrienol é o alvo terapêutico, então a formulação incluiria o gama-tocotrienol isoladamente, ou com o tocoferol, os quais são metabolizados por 2,7,8-trimetil-2-(b-carboxietil)-6-hidroxicromano (gama-CEHC), que age no rim para aumentar a excreção de sódio.
[002] Há reconhecimento crescente de que a redução de alfa-tocoferol na ingestão alimentar ou suplementar é importante para reduzir a interferência do efeito redutor de colesterol dos tocotrienóis, especialmente os gama- e delta-tocotrienóis. Um estudo em galinhas revelou que há uma grande redução nos parâmetros de lipídio (inclusive produção de colesterol) em aves que receberam uma quantidade mínima de alfa-tocoferol em relação ao tocotrienol. Em contraste, as aves que receberam a quantidade mais elevada de alfa-tocoferol apresentaram um aumento na produção de colesterol (Qureshi et al. "Dietary alpha-tocoferol attenuates the impact of gamma-tocotrienol on hepatic 3-hydroxy-3- methylglutaryl coenzyme A reductase activity in chickens" J Nutrition 1996 Feb;126(2):389-94). Um estudo separado confirmou que níveis elevados de alfa-tocoferol aumentam a produção de colesterol (Khor et al "Lipidaemic effects of tocotrienols, tocopherols and squalene: studies in the hamster" Asia Pacific J Clin Nutr (1997) 6(1):36-40). A interferência de alfa-tocoferol na absorção de tocotrienol também foi descrição por Ikeda et al., que mostraram que alfa-tocoferol interferiu na absorção de alfa-tocotrienol, mas não na de gama-tocotrienol (Ikeda et al "Dietary alpha-tocopherol decreases alpha tocotrienol but not gamma- tocotrienol concentration in rats" J Nutr 2003 Feb;133(2):428-34). Mais recentemente, pesquisadores japoneses descobriram que os tocoferóis, e alfa-tocoferol em particular, interferiram na capacidade de delta-tocotrienol de induzir a apoptose nas células cancerosas, enquanto bloqueavam a absorção de delta-tocotrienol (Shibata et al "alpha-Tocoferol attenuates the cytotoxic effect of delta-tocotrienol in human colorectal adenocarcinoma cells" Biocehm. Piophys. Res. Commun. 397(2):214-9). Finalmente, alfa-tocoferol mostrou interferir nos tocotrienóis ao aumentar seu catabolismo (Sontag et al "influence of major structural features of tocopherols and tocotrienols on their omega oxidation by tocopherol-omega hydroxylase" J. Lipid Res. 48 (5) : 1090-8) .
[003] Deve ser compreendido que estão incluídos no escopo da presente invenção os componentes terapêuticos que compreendem um ou mais tocotrienóis, ou derivados destes, e os quais:
- (a) não contêm tocoferóis;
- (b) contêm níveis de tocoferóis que foram minimizados tanto quanto possível; ou
- (c) contêm tocoferóis que foram modificados de modo a garantir que qualquer interferência de tocoferol em tocotrienol seja reduzida ou removida.
[004] Da mesma forma, as terapias de combinação que podem produzir efeitos sinergéticos com os tocotrienóis estão incluídas. Por exemplo, utilizando i) e iii), gama ou delta-tocotrienol podem ser combinados com um fármaco fibrato (que são, eles próprios, anfifílicos) em um sistema portador de automontagem destinado à absorção sublingual. Isto pode evitar o metabolismo hepático de tocotrienóis e evitar um dos principais efeitos colaterais dos fibratos, que é o desconforto estomacal. O efeito combinado pode então ser a redução da biossíntese de colesterol (redução na HMG-CoA redutase) pelo tocotrienol e aumento em HDL + redução nos triglicerídeos pelo fibrato (atuando via PPAR-alfa).
[005] Os tocotrienóis nas composições da presente invenção podem estar associados anfifílicos químicos (inclusive aqueles que se automontam em estruturas moleculares como cubossomos e mesofases) que intensificam a absorção sublingual. Em particular, os tocotrienóis podem estar associados aos anfifílicos químicos de automontagem que se montam em estruturas conhecidas como cubossomos. A montagem de tocotrienóis em cubossomos também pode inibir a degradação metabólica de tocotrienóis. Os cubossomos são materiais de cristalinos líquidos cúbicos bicontínuos que permitem a incorporação simultânea de materiais solúveis em água e óleo, bem como anfifilas. O uso de cubossomos pode intensificar a biodisponibilidade dos tocotrienóis e permite que os tocotrienóis evitem o fígado, o que pode interferir na administração de tocotrienóis.
[006] Os cubossomos podem ser caracterizados por apresentar uma área de superfície interna elevada com as estruturas de cristalino cúbico e também compreendem vantagens como método de preparação simples, biodegradabilidade de lipídios, a capacidade de encapsulamento de substâncias hidrofóbicas, hidrofílicas, anfifílicas, visando a liberação controlada de agentes bioativos. A preparação dos cubossomos envolve normalmente a emulsificação de monoglicerídeos com um polímero acompanhado via sonicação e homogeneização. Os métodos alternativos da preparação de cubossomos conhecidos na técnica também podem ser empregados.
[007] A composição da presente invenção também pode incluir nanopartículas de núcleo lipídico sólido na formulação, que agem como quilomícrons para intensificar a absorção de lipídios a partir do trato intestinal no sistema linfático, evitando o fígado (Paliwal, R et al "Effect of lipid core material on characteristics of solid lipid nanopartículas designed for oral lymphatic delivery", Nanomedicine: Nanotechnology, Biology and Medicine 5 (2009) 184-191) .
[008] O escopo da invenção também contempla sistemas portadores como lipoproteína sintética de nano-baixa densidade (Nikanjam, 2006). Tais sistemas permite a administração de drogas lipofílicas via o receptor de LDL das células, intensificando assim a captação nos tecidos corporais sem a necessidade de reacondicionamento e exportação pelo fígado nas lipoproteínas naturais.
[009] Em uma realização da invenção atual, o tocotrienol ou os derivados deste podem ser formulados na forma de dosagem sublingual ou oral adaptados das formulações descritas no Pedido de Patente Australiana № 2010262738 (Cumming et al).
[010] Em outra realização, a composição da presente invenção inclui pelo menos um tocotrienol ou derivado deste formulado em vesículas ou partículas, como lipossomos, niossomas, transfersomas, farmacossomos e nanopartículas. Tais vesículas e partículas incluem, entre outros, aquelas descritas em Gangwar, M. et al "Recent Advances in various emerging vesicular systems: An overview", Asia Pacific Journal of Tropical Biomedicine (2012)S1176-S1188, Paliwal, R et al (2009), and Sagnella, S.M. et al "Anandamide and analogous endocannabinoids: a lipid self-assembly study", Soft Matter, 2011, 7, 5319, and Hood, E. et al "Nanocarriers for vascular delivery of antioxidants", Nanomedicine (Lond). 2011 September; 6(7): 1257-1272, and Gupta, S. et al "Polyether based amphiphiles for delivery of active components", Polymer 53 (2012) 3053-3078, que são aqui incorporados por referência em sua totalidade.
[011] A composição de tocotrienol transmucosal da presente invenção pode ser produzida pelo método descrito na WO 2012/109694 (Ko. Sai, Ying), que é aqui incorporada por referência em sua totalidade. A partir da revelação de Ko, pareceria que os componentes solúveis em água nas composições e formulações reveladas se dissolvem ao entrar em contato com a saliva, resultando na geração de microporos na superfície de revestimento, que facilita a desintegração das microcápsulas em um gel líquido. O gel se alinha à superfície da mucosa, liberando assim o princípio ativo e otimizando a absorção. Além disso, Ko mostrou que esta plataforma de administração sublingual pode transportar moléculas como proteínas, que compreendem porções hidrofílicas e hidrofóbicas através da mucosa sublingual.
[012] A composição da presente invenção pode incluir tocotrienóis, beta-ciclodextrina (e/ou outras variantes de ciclodextrinas) em proporções adequadas de modo a receber os tocotrienóis no núcleo hidrofóbico da molécula de ciclodextrina. Um exemplo desta formulação é encontrado no trabalho de Mannila J, Jarvinen T, Jarvine K & Jarho P, "Precipitation complexation method produces cannabidiol/beta cyclodextrin inclusion complex suitable for sublingual delivery on cannabidiol" Journal of Pharmaceutical Sciences 96, 312-319, 2007. Os tocotrienóis são conhecidos por formar complexos com gama-ciclodextrina, mas esta formulação é inadequada devido à degradação da gama-ciclodextrina pela amilase salivar, ao passo que a as formas alfa e beta são resistentes (Ikeda S, Uchida T, Ichikawa T et al, "Complexation of tocotrienol with gamma-cyclodextrin enhances intestinal absorption of tocotrienols in rats" Bioscience, Biotechnology and Biochemistry 74, 1453-1457, 2010).
[013] Qualquer número de formulações e composições pode ser empregado para os fins de realização da invenção atual, contanto que as ditas composições e formulações compreendam excipientes e portadores farmaceuticamente aceitáveis que, quando expostos ao ambiente aquoso/da mucosa salivar, permitirão que os tocotrienóis presentes na composição permaneçam em contato com a superfície da mucosa por um período suficiente para permitir a absorção, facilitar, ou pelo menos impedir, a absorção dos tocotrienóis pela membrana mucosa e permitir que os tocotrienóis sejam absorvidos em uma forma biodisponível.
[014] Em outra realização, tocotrienol administrado via transmucosal pode ser combinado com qualquer outro composto que complementará e intensificará o efeito terapêutico do tocotrienol, ou derivado deste, inclusive, entre outros, monoglicerídeos, lignanas isoprenóides, aminoácidos, CoQ10, polifenóis, ácidos graxos de ômega-3, agonistas e antagonistas do sistema endocanabinoide, flavonoides, carotenoides, mono e oligossacarídeos, niacina e peptídeos bioativos.
[015] Em outra realização, o tocotrienol administrado via transmucosal pode ser combinado com extratos de semente de gergelim e/ou lignanas de gergelim.
[016] Também é compreendido que os derivados dos tocotrienóis que intensificam o efeito terapêutico devam ser incluídos, como as formas fosforiladas, nitrosiladas e succinato/ seleno-succinato. Um exemplo de um método de modificação de tocotrienóis pode ser encontrado em Vraka et al "Synthesis and study of the cancer cell growth inhibitory properties of α-, γ- tocopheryl and γ-tocotrienyl 2-phenylselenyl succinates" Bioorganic & Medicinal Chemistry 14 (2006) 2684-2696, que é aqui incorporada por referência em sua totalidade.
[017] Em uma realização adicional, o tocotrienol (e/ou seus derivados), é administrado na forma de uma composição farmacêutica adequada para a administração oral, sublingual, mucosal ou nasal, embora preferencialmente a administração sublingual, em combinação com um composto adicional destinado a complementar e intensificar o efeito terapêutico do tocotrienol, ou seu derivado, selecionado a partir do grupo que consiste em: monoglicerídeos; lignanas; isoprenóides; polifenóis; flavonoides; carotenoides; mono e oligossacarídeos; niacina e peptídeos bioativos.
[018] Em outra realização, o tocotrienol (e/ou seus derivados) é administrado na forma de uma composição farmacêutica adequada para a administração oral, sublingual, mucosal ou nasal, preferencialmente a administração sublingual, e em que tocoferol esteja ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva (em relação ao tocotrienol) de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonoides, carotenoides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito terapêutico dos tocotrienóis.
[019] Os tocotrienóis ingeridos via oral possuem uma biodisponibilidade mais baixa que os tocoferóis ingeridos via oral, conforme mostrado pelas concentrações máximas reduzidas no plasma após a ingestão e meia-vidas mais curtas em um estudo recente com seres humanos (S, Fairus, S. et al Nutr J. 2012 Jan 17;11:5) . Um estudo com animais estimou que a biodisponibilidade oral seja 4 vezes mais baixa para os tocotrienóis em comparação ao tocoferol (9% vs 36%) (Abuasal, BS. et al Biopharm Drug Dispos. 2012 Jul;33 (5):246-56). Os mecanismos que determinam a biodisponibilidade dos tocotrienóis não foram totalmente elucidados, mas a absorção intestinal e o processamento hepático parecem ser fatores importantes.
[020] A absorção de isômeros de Vitamina E varia entre os indivíduos, talvez devido às diferenças na expressão de diferentes transportadores, como o Receptor B1 de Scavenger e o receptor C1L1 de Niemann-Pick, bem como a presença de outros lipídios que compartilham estes mecanismos de transporte, como colesterol (Reboul, E. and Borel, P. Prog Lipid Res 2011 50:388-402). O processamento hepático é outra fonte de biodiscriminação entre os isômeros de tocoferol e tocotrienol, com base nas diferenças de afinidade para a proteína de transporte intracelular de alfa-tocoferol (a-TTP) . A afinidade relativa dos isômeros de Vitamina E para a a-TTP foi demonstrada como sendo a ordem de alfa-tocoferol (100%) > alfa-tocotrienol (12%) > gama-tocotrienol (9%) > delta-tocoferol (2%) (Hosomi, A. et al FEBS Letters 1997, 409:105-108) . Este mecanismo ajuda a explicar a ocorrência de alfa-tocoferol como o importante isômero de Vitamina E detectado nas partículas ricas em triglicerídeos, lipoproteínas de baixa densidade e alta densidade, e nos rápidos desaparecimentos de alfa-tocotrienol, gama-tocotrienol e delta-tocotrienol do plasma e lipoproteínas circulantes. Nos seres humanos, as concentrações plasmáticas de alfa-tocotrienol foram 2 vezes superiores que aquelas de gama-tocotrienol, e quase 10 vezes superiores que delta-tocotrienol após suplementação com a mesma dose das preparações de tocotrienol (O'Byrne, D. et al Free Radic Biol Med 2000, 29:834-845).
[021] Sem pretender ficar limitado à teoria, acredita-se que a administração sublingual dos tocotrienóis, ou seus derivados, de acordo com a invenção atual, possua pelo menos duas vantagens distintas em comparação à administração oral tradicional. Em primeiro lugar, pode superar o problema de baixa absorção intestinal dos tocotrienóis ao garantir alta absorção via sistema linfático sublingual. Esta técnica também evitará a baixa afinidade dos tocotrienóis com a proteína de transporte de alfa-tocoferol, porque a circulação linfática os levará aos tecidos alvo sem a necessidade de incorporação pelo fígado no triglicerídeo e lipoproteínas, e exportação na circulação. Este método também minimizará o metabolismo de primeira passagem dos tocotrienóis pelo fígado e aumentará a quantidade de tocotrienóis entregues a outros órgãos.
[022] Além disso, ao utilizar o sistema de entrega sublingual em combinação com outras técnicas, como montagem de tocotrienóis em nanopartículas em sua forma natural ou na forma de derivados químicos, ou em combinação com outras moléculas (Abuasal, B.S. et al Lipids. 2012 May;47(5):461-9. doi: 10.1007/s11745-012-3655-4. Epub 2012 Jan 24), a entrega e a bioatividade podem ajustadas aos tecidos alvo em particular e aplicações terapêuticas.
[023] Da mesma forma, em uma realização adicional, a composição da presente invenção inclui tocotrienol, ou derivado deste, montado em nanopartículas.
[024] Os inventores do presente pedido confirmaram um estudo anterior (Lee, S. P., Mar, G. Y. & Ng, L. T. 2009, European Journal of Applied Physiology, 107, 587-595.) de que os tocotrienóis podem melhorar a resistência a exercício em ratos Wistar de peso normal, ao mostrar que esta melhora também se estende a ratos Sprague-Dawley com obesidade induzida por dieta. Além disso, os inventores da presente aplicação demonstraram um aumento surpreendente na eficácia de uma formulação sublingual de tocotrienol sobre a formulação oral na melhora de resistência a exercício em seres humanos.
[025] Da mesma forma, em outro aspecto, a presente invenção prove um método de melhora da resistência e desempenho ao exercício em um animal e, em particular, um ser humano, através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, preferencialmente administração sublingual.
[026] Em outro aspecto, a presente invenção prove um método de melhora de resistência a exercício e desempenho em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonoides, carotenoides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à melhora na resistência a exercício.
[027] Em outro aspecto, a presente invenção prove um método de melhora de resistência a exercício e desempenho em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol seja maior que o componente de tocoferol, ou tocoferol esteja ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à melhora na resistência a exercício.
[028] Em outro aspecto, a presente invenção prove um método de promoção de perda de peso em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) que esteja na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual.
[029] Em outro aspecto, a presente invenção prove um método de promoção de perda de peso em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) que esteja na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à promoção de perda de peso.
[030] Em outro aspecto, a presente invenção prove um método de promoção de perda de peso em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol seja maior que o componente de tocoferol, ou tocoferol esteja ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificação o efeito de tocotrienóis em relação à promoção de perda de peso.
[031] Os tocotrienóis mostraram melhorar o controle de glicemia e resposta à insulina (Kuhad et al (2009)) .
[032] Da mesma forma, em outro aspecto a presente invenção prove um método de estabilização e/ou controle de glicemia em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) que esteja na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal administração, embora preferencialmente a administração sublingual.
[033] Em outro aspecto, a presente invenção prove um método de estabilização e/ou controle de glicemia em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) que esteja na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à estabilização e/ou controle de glicemia.
[034] Em outro aspecto, a presente invenção prove um método de estabilização e/ou controle de glicemia em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol seja maior que o componente de tocoferol ou tocoferol esteja ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à estabilização e/ou controle de glicemia.
[035] Em outro aspecto, a presente invenção prove um método de redução de hipertensão em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) que esteja na forma de uma composição farmacêutica adequada para administração oral, sublingual, transdérmica, mucosal ou nasal, embora preferencialmente administração sublingual.
[036] Em outro aspecto, a presente invenção prove um método de redução da hipertensão em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) que esteja na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução da hipertensão.
[037] Em outro aspecto, a presente invenção prove um método de redução da hipertensão em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal administração, apesar de preferencialmente administração sublingual, e em que o componente de tocotrienol seja maior que o componente de tocoferol ou tocoferol esteja ausente ou, se tocoferol estiver presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução da hipertensão.
[038] Em outro aspecto, a presente invenção prove um método de tratamento da doença isquêmica em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual.
[039] Em outro aspecto, a presente invenção prove um método de tratamento de doença isquêmica em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, mucosal ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao tratamento de doença isquêmica.
[040] Em outro aspecto, a presente invenção prove um método de tratamento de doença isquêmica em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol seja maior que o componente de tocoferol ou tocoferol esteja ausente ou, se tocoferol estiver presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao tratamento de doença isquêmica.
[041] Em outro aspecto, a presente invenção prove um método de redução de colesterol e/ou triglicerídeos em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral sublingual ou nasal, embora preferencialmente administração sublingual.
[042] Em outro aspecto, a presente invenção prove um método de redução de colesterol e/ou triglicerídeos em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução de colesterol e/ou triglicerídeo.
[043] Em outro aspecto, a presente invenção prove um método de redução de colesterol e/ou triglicerídeos em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol seja maior que o componente de tocoferol ou tocoferol esteja ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer componente de tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução de colesterol e/ou triglicerídeos.
[044] Em outro aspecto, a presente invenção prove um método de tratamento de tratamento do câncer em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual, transdérmica, mucosal ou nasal, embora preferencialmente administração sublingual.
[045] Em outro aspecto, a presente invenção prove um método de tratamento do câncer em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao tratamento de câncer.
[046] Em outro aspecto, a presente invenção prove um método de tratamento do câncer em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dirá composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao tratamento do câncer.
[047] Em outro aspecto, a presente invenção prove um método de tratamento do câncer em animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[048] Em outro aspecto, a presente invenção prove um método de aumento da biodisponibilidade de tocotrienóis administrado a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao aumento da biodisponibilidade de tocotrienóis administrado a animais.
[049] Em outro aspecto, a presente invenção prove um método de aumento da biodisponibilidade de tocotrienóis administrado a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol seja maior que o componente de tocoferol, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao aumento da biodisponibilidade de tocotrienóis administrado a animais.
[050] Em outro aspecto, a presente invenção prove um método de minimização da dosagem exigida para atingir um efeito terapêutico pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[051] Em outro aspecto, a presente invenção prove um método de minimização da dosagem exigida para atingir um efeito terapêutico pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à minimização da dosagem exigida para atingir um efeito terapêutico pela administração de tocotrienóis.
[052] Em outro aspecto, a presente invenção prove um método de minimização da dosagem exigida para atingir um efeito terapêutico pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à minimização da dosagem exigida para atingir um efeito terapêutico pela administração de tocotrienóis.
[053] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de inflamação pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[054] Em outro aspecto, a presente invenção prove um método de redução ou inibição de inflamação pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou inibição de inflamação pela administração de tocotrienóis.
[055] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de inflamação pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou inibição de inflamação pela administração de tocotrienóis.
[056] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de dor muscular pós-exercício pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[057] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de dor muscular pós-exercício pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou inibição de dor muscular pós-exercício pela administração de tocotrienóis.
[058] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de dor muscular pós-exercício pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou inibição de dor muscular pós-exercício pela administração de tocotrienóis.
[059] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de dor muscular de início postergado pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[060] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de dor muscular de início postergado pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou inibição de dor muscular de início postergado pela administração de tocotrienóis.
[061] Em outro aspecto, a presente invenção prove um método de redução e/ou inibição de dor muscular de início postergado pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou inibição de dor muscular de início postergado pela administração de tocotrienóis.
[062] Em outro aspecto, a presente invenção prove um método de redução e/ou tratamento de fibrose cardíaca pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[063] Em outro aspecto, a presente invenção prove um método de redução e/ou tratamento de fibrose cardíaca pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou tratamento de fibrose cardíaca pela administração de tocotrienóis.
[064] Em outro aspecto, a presente invenção prove um método de redução e/ou tratamento de fibrose cardíaca pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação à redução e/ou tratamento de fibrose cardíaca pela administração de tocotrienóis.
[065] Em outro aspecto, a presente invenção prove um método de tratamento de exposição à radiação em um animal pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[066] Em outro aspecto, a presente invenção prove um método de tratamento de exposição à radiação em um animal pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao tratamento de exposição à radiação em um animal pela administração de tocotrienóis.
[067] Em outro aspecto, a presente invenção prove um método de tratamento de exposição à radiação em um animal pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao tratamento de exposição à radiação em um animal pela administração de tocotrienóis.
[068] Em outro aspecto, a presente invenção prove um método de tratamento de calvície padrão masculina pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual.
[069] Em outro aspecto, a presente invenção prove um método de tratamento de calvície padrão masculina pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, em combinação com qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao de calvície padrão masculina pela administração de tocotrienóis.
[070] Em outro aspecto, a presente invenção prove um método de tratamento de calvície padrão masculina pela administração de tocotrienóis a animais e, em particular, seres humanos através da administração de tocotrienol (e/ou seus derivados) na forma de uma composição farmacêutica adequada para administração oral, sublingual ou nasal, embora preferencialmente administração sublingual, e em que o componente de tocotrienol é maior que o componente de tocoferol ou, tocoferol está ausente ou, caso tocoferol esteja presente, a interferência e/ou atividade competitiva de qualquer tocoferol presente na dita composição farmacêutica tenha sido eliminada, reduzida ou minimizada. A dita composição pode incluir, ou ser administrada em combinação com, qualquer outro composto, como monoglicerídeos, lignanas isoprenóides, polifenóis, flavonóides, carotenóides, mono e oligossacarídeos, niacina e peptídeos bioativos que complementarão e intensificarão o efeito de tocotrienóis em relação ao de calvície padrão masculina pela administração de tocotrienóis.
[071] A invenção é descrita ainda em referência aos seguintes exemplos ao limitantes.
[072] Exemplos
[073] Exemplo 1: O efeito de tocotrienóis da dieta na tolerância à glicose, hipertensão, fibrose cardíaca e excreção renal de sódio em ratos.
[074] Ratos Sprague-Dawley foram alimentados com uma dieta rica em gordura (22%) durante 8 semanas para induzir obesidade.
[075] Conforme mostrado na Figura 2, os tocotrienóis da dieta (25 mg/kg/d) melhoraram a tolerância a uma carga de glicose (2 g/kg, i.p.) em ratos obesos em comparação aos animais que não receberam tocotrienóis (n=9, p<0,01; Mathai et al, 2011)
[076] Conforme mostrado na Figura 3, os tocotrienóis da dieta (50 mg/kg/d) reverter gradualmente a hipertensão estabelecida em ratos obesos em comparação ao grupo controle placebo. Além disso, conforme mostrado na Figura 4, a redução na pressão arterial observada na Figura 3 foi acompanhada de uma redução na fibrose cardíaca, conforme medido pelo conteúdo de hidroxiprolina do ventrículo esquerdo.
[077] Conforme mostrado na Figura 5, a fibrose cardíaca induzida por isoproterenol foi inibida pela suplementação de tocotrienol. Como este modelo de fibrose cardíaca não aumenta a pressão arterial, ele mostra que o efeito antifibrótico de tocotrienóis é separado do efeito anti-hipertensivo.
[078] Conforme mostrado na Figura 6, a suplementação de dieta com tocotrienóis aumenta a excreção renal de sódio em ratos alimentos com uma dieta rica em gordura. Isto é importante, uma vez que a obesidade é geralmente acompanhada de retenção de sódio e água que pode levar a morbidades concomitantes, como volume sanguíneo e pressão arterial elevados e doença cardiovascular.
[079] Exemplo 2: A suplementação de tocotrienol aumenta a capacidade de exercícios em ratos
[080] Quinze ratos Sprague-Dawley tornaram-se obesos durante 10 semanas alimentando-se com uma dieta rica em gordura e então divididos em um grupo controle (n=7) e um grupo suplementado com tocotrienol (n=8). Conforme mostrado na Figura 7, a suplementação da dieta com uma fração rica em tocotrienol quase dobrou a capacidade de exercícios em uma esteira para os ratos não tratados.
[081] Na primeira parte deste estudo clínico, foi realizado um teste adicional até a exaustão para determinar a velocidade de marcha máxima de taxas nos grupos de controle e de tocotrienol. A Figura 7A mostra uma velocidade máxima média atingida nos grupos Controle e suplementado com tocotrienol (50 mg/kg/d) realizando o teste adicional até a exaustão na semana 8. Isto mostrou que a velocidade máxima foi similar entre os grupos. Durante este segundo ciclo da esteira, as os ratos correram em 65% de sua velocidade máxima. A Figura 7B mostra o tempo médio levado para atingir a fadiga durante o tempo até a exaustão para os 2 grupos na semana 10. Os dados mostraram como média ± SEM (n= 7-8/grupo). O "*" significa uma diferença estatística significativa (P<0,05) em comparação ao grupo Controle.
[082] Estes resultados complementam os resultados anteriores que mostraram que os ratos Wistar normais mais que dobraram o tempo de exercício de natação quando alimentados com tocotrienóis (Lee, S. P., Mar, G. Y. & Ng, L. T. 2009, "Effects of tocotrienol-rich fraction on endurance a exercise capacity and oxidative stress in forced swimming rats", European Journal of Applied Physiology, 107, 587-595.).
[083] Exemplo 3: A suplementação de tocotrienol intensifica a resistência a exercício em seres humanos.
[084] Os tocotrienóis foram formulados na seguinte forma de dosagem sublingual: A formulação de comprimido sublingual de 220 mg foi preparada contendo uma dose de 10 mg de tocotrienol compostos de 9 mg de delta-tocotrienol ativos e 1 mg de gama-tocotrienol, e os excipientes a seguir: dextrose, manitol, gelatina marina, l-leucina, l-arginina, amido pré-gel, PEG-200, propileno glicol, talco, dióxido de sílica, estearato de magnésio, carotenóides.
[085] Quatro indivíduos receberam duas doses de 20 mg de comprimidos sublinguais de tocotrienol pela manhã e à noite durante um total de quatro semanas, com um placebo sendo administrado do mesmo modo por um período adicional de quatro semanas daí por diante tanto antes quanto após o tratamento com tocotrienol.
[086] À conclusão de cada período de quatro semanas, os indivíduos realizaram um exercício adicional de teste até a exaustão em uma bicicleta de exercício padrão que compreende composto de ciclismo em uma bicicleta estática em aumentos estagiados de capacidade máxima (65%, 70%, 75%, 80%, 85% de acordo com a frequência cardíaca máxima ajustada à idade para cada participante). Os indivíduos foram equipados com monitores de frequência cardíaca e classificações de Borg de esforço físico (escala de 11-20) foram obtidas a cada 5 min durante o exercício de ciclismo, bem como até a exaustão.
[087] Em comparação ao tratamento com placebo (média de 92 minutos), a suplementação com tocotrienol aumento o tempo médio de ciclismo para (média de 133 minutos) , um aumento de ~40% (Figura 8). As medições subjetivas de exaustão também foram mais lentamente atingidas durante os aumentos na intensidade do exercício, e a distância total viajada calculada foi superior durante o tratamento com tocotrienol (51 km) em comparação ao placebo (32 km).
[088] Estes resultados contrastam a única publicação sobre exercitação de seres humanos, que suplementou tanto a dose de placebo quanto a dose oral diária de 50 mg de tocotrienóis com base em palma por 6 semanas em homens jovens hígidos, o que mostra ausência de aumento no tempo de exercício até a exaustão executado em uma esteira, apesar dos aumentos no status antioxidante plasmático (Keong CC, Singh HJ & Singh R. " Effects of palm Vitamin E supplementation on exercise-induced oxidative stress and endurance performance in the heat". Journal of Sports Science and Medicine 5, 629- 639.
[089] Considerados em conjunto, estes 2 estudos demonstram que a via sublingual é importante para a tradução dos efeitos benéficos observados por meio da administração oral em ratos para resultados eficazes em seres humanos.
[090] Exemplo 4: A suplementação de tocotrienol reduz a dor pós-exercício e dor muscular de início postergado (DOMS):
[091] Os indivíduos que receberam uma formulação sublingual de tocotrienol descrita no Exemplo 2 foram avaliados quanto à dor pós-exercício e DOMS.
[092] DOMS foi induzida por meio da contração excêntrica lenta do antebraço em quatro indivíduos. Os indivíduos sentaram e repousaram seu antebraço e cotovelo em uma mesa. Solicitou-se que eles baixassem um haltere de 10-12 kg (dependendo da capacidade de controlar o peso) a partir de uma posição vertical do braço em relação à mesa, levando 3 segundos. Isto foi repetido por 3 séries de 12 repetições, com um período de repouso de um minuto entre cada série. Cada indivíduo realizou este teste no término de um período de suplementação de 3 semanas com comprimidos sublinguais de tocotrienóis (40 mg/d) ou sublinguais de placebo, em uma ordem em modo cego e randomizada.
[093] As classificações de dor foram avaliadas 24 e 48 h após o exercício por dois métodos: uma escala visual análoga de uma linha de 10 cm onde os indivíduos foram solicitados a classificar sua dor entre 1-sem dor e 10-dor extrema; além disso, os indivíduos foram solicitados a corresponder sua sensação às frases descritivas: sem dor, dor imprecisa, dor discreta, dor mais discreta, dor moderada, dor grave, dor extrema. A Figura 10 mostra a classificação análoga visual para os 4 indivíduos onde virtualmente nenhuma dor (0,25 em 24 h e 0 em 48 h) foi apresentada após a suplementação de tocotrienol em comparação às classificações de dor discreta a dor mais discreta após a suplementação com placebo (2,25 em 24 h e 48 h).
[094] Além disso, os indivíduos também se voluntariaram às classificações de dor após exercício até a exaustão e após o exercício incidental durante os períodos de tratamento com tocotrienol e placebo. Os indivíduos classificaram sua dor após o exercício até a exaustão, sendo cansados de forma uniforme seguidos de ambos os suplementos após o exercício até a exaustão, mas apresentando apenas os descritores "rigidez muscular", "dor nos dias seguintes", "cansaço e impossibilidade de ir novamente", "rigidez com dor nos adutores" ao administrar o suplemento com placebo.
[095] Durante o exercício incidental, os indivíduos relataram dor pequena e recuperação mais rápida do exercício durante a suplementação com tocotrienol em comparação ao período com placebo.
[096] Exemplo 5: Aumento de presença de concentrações de tocotrienóis no plasma sérico após administração sublingual de tocotrienóis em gel.
[097] Foi formulada uma formulação em gel para administração sublingual de tocotrienóis da seguinte forma: 2% de carboximetilcelulose e polietileno glicol (0,5%) em água para formar um gel que então é misturado com DeltaGold (extrato de tocotrienol puro de 70% à base de urucum) para produzir um gel de 20 mg/ml de tocotrienol.
[098] Foi realizado um teste em 2 indivíduos que receberam 40 mg de tocotrienóis em 2 ml de gel via sublingual. As amostras de sangue foram coletadas de um cateter venoso no antebraço antes da administração e 15, 60, e 180 minutos após a administração.
[099] Conforme mostrado na Figura 9, os tocotrienóis apareceram rapidamente no plasma, com um nível de 15 μM para o delta isômero 15 minutos após a administração, reduzindo para 3,2 μM, 1,5 μM e 0,4 μM 60 minutos, 120 minutos e 180 minutos após a administração. Os níveis de delta e gama-tocotrienol no plasma mantiveram sua proporção de composição do comprimido de 9:1, mostrando que ambos os tocotrienóis foram igualmente bem absorvidos via sublingual. Isto contraste com a via oral, onde há uma diferença no aparecimento plasmático de tocotrienóis na ordem: alfa-tocotrienol > gama-tocotrienol > delta-tocotrienol (Fairus S. et al, " Alpha-tocotrienol is the most abundant tocotrienol isomer circulated in plasma and lipoproteins after postprandial tocotrienol-rich Vitamin E supplementation",Nutrition Journal 2012, 11: 5).
[0100] Exemplo 6: Aumento da presença de concentrações de tocotrienóis no plasma sérico após a administração sublingual de tocotrienóis na forma de comprimido.
[0101] Foi preparada uma formulação de 220 mg de comprimido sublingual contendo uma dose de 10 mg de tocotrienol composto dos ativos: 9 mg de delta-tocotrienol, 1 mg de gama tocotrienol; e os seguintes excipientes: dextrose, manitol, gelatina marina, l-leucina, l-arginina, amido pré-gel, PEG-200, propileno glicol, talco, dióxido de sílica, estearato de magnésio, carotenóides.
[0102] Foi realizado um teste em 2 indivíduos que dissolveram 4 comprimidos de 10 mg via sublingual. As amostras de sangue foram coletadas de um cateter venosa do antebraço antes e depois da dissolução dos comprimidos (20 min); então a intervalos de hora em hora por 5 horas.
[0103] Conforme mostrado na Figura 9, os delta e gama-tocotrienóis apareceram no plasma em níveis elevados no momento de 20 minutos (8,2 μM para delta-tocotrienol e 0,8 μM para gama-tocotrienol) e reduziu durante as próximas 3 horas (3,8 e 0,4 μM em 1 h; 1,7 e 0,19 μM e 0,02 em 2 h; 0,15 e 0,07 μM em 3 h).
[0104] Embora o aparecimento no plasma de tocotrienóis pareça inicialmente maior com o gel em comparação ao comprimido, isto é um artefato do momento de amostragem, conforme pode ser mostrado pelos níveis plasmáticos equivalentes atingidos tanto pelas formulações de comprimido quanto de gel nos timepoints posteriores. Os comprimidos foram eficazes em nossos parâmetros medidos de redução de DOMS e aumento do tempo de exercícios de ciclismo durante o teste incremental até a exaustão.
[0105] Uma importante diferença entre a administração oral e ambas as formulações sublinguais é o rápido aparecimento de tocotrienóis no plasma, dentro de minutos, em comparação a aproximadamente 2 h para a via oral. Além disso, os níveis de CMáx observados (embora a partir deste pequeno número de participantes) foram superiores para a dose de 40 mg de tocotrienóis sublinguais que aqueles atingidos pela ingestão oral de doses mais elevadas (200 mg de tocotrienóis individuais; Hay YK, et al http://www.tocotrienol.org/bioavailability-study.html).
[0106] Exemplo 7: A suplementação de tocotrienol reduz a inflamação.
[0107] Foi preparada uma formulação de comprimido sublingual de 220 mg contendo uma dose de 10 mg de tocotrienol composto dos ativos: 9 mg de delta-tocotrienol, 1 mg de gama-tocotrienol; e os seguintes excipientes: dextrose, manitol, gelatina marina, l-leucina, l-arginina, amido pré-gel, PEG-200, propileno glicol, talco, dióxido de sílica, estearato de magnésio, carotenóides.
[0108] Um indivíduo recebeu duas doses de comprimidos sublinguais de 20 mg de tocotrienol de manhã e à noite por um total de quatro semanas. O dito indivíduo relatou uma redução na inflamação e alívio da dor de um abscesso oral.
[0109] O mesmo indivíduo com hipertrofia prostática benigna relatou aumento no fluxo e volume de urina durante a suplementação de tocotrienol, que regrediu gradualmente aos níveis inferiores anteriores após o término da suplementação com tocotrienol.
[0110] Os peritos na técnica apreciarão que as variações e modificações ficarão evidentes. Todas estas variações e modificações que ficaram evidentes ao perito na técnica devem ser consideradas incluídas no espírito e escopo da invenção, conforme descrito.
Claims (18)
- COMPOSIÇÃO FARMACEUTICA, formulada para administração, caracterizada por incluir pelo menos um tocotrienol ou derivado deste com um ou mais excipientes farmaceuticamente aceitáveis.
- COMPOSIÇÃO FARMACÊUTICA, de acordo com a reivindicação 1, caracterizada pela administração ser administração sublingual.
- COMPOSIÇÃO FARMACÊUTICA, de acordo com a reivindicação 1, caracterizada pela composição incluir pelo menos um tocotrienol ou derivado deste e pelo menos um tocoferol, em que o componente tocoferol é inferior ao componente ao componente tocotrienol.
- COMPOSIÇÃO FARMACÊUTICA, de acordo com a reivindicação 3, caracterizada pela composição incluir menos de aproximadamente 10% de tocoferol.
- COMPOSIÇÃO FARMACÊUTICA, de acordo com a reivindicação 1, caracterizada pela composição incluir um tocoferol, e a capacidade do tocoferol em interferir ou competir com a atividade terapêutica do tocotrienol, ou derivado deste, ter sido eliminada, reduzida ou minimizada.
- USO DE PELO MENOS UM TOCOTRIENOL OU DERIVADO DESTE, caracterizado por ser na fabricação de um medicamento de administração transmucosal para tratamento ou prevenção de uma doença ou condição susceptível a tratamento com um tocotrienol.
- USO, de acordo com a reivindicação 6, caracterizado pela doença ou condição ser selecionada a partir do grupo que consiste de sensibilidade muscular pós-exercício, sensibilidade muscular com início postergado, fibrose cardíaca, hipertensão, inflamação, acidente vascular cerebral, câncer, colesterol e/ou triglicerídeos elevados, calvície, hipertrofia e uma condição que resulte de exposição à radiação.
- USO, de acordo com a reivindicação 6, caracterizado pela administração transmucosal ser sublingual.
- USO DE UMA COMPOSIÇÃO FARMACÊUTICA, conforme definida na reivindicação 1, caracterizado por ser na fabricação de um medicamento administração transmucosal para estabilização e/ou controle de glicemia em um animal.
- USO, de acordo com a reivindicação 9, caracterizado pela administração transmucosal ser administração sublingual.
- USO DE UMA COMPOSIÇÃO FARMACÊUTICA, conforme definida na reivindicação 1, caracterizado por ser na fabricação de um medicamento administração transmucosal para minimização da dosagem exigida para atingir um efeito terapêutico pela administração de um tocotrienol em um animal.
- USO, de acordo com a reivindicação 11, caracterizado pela administração transmucosal ser administração sublingual.
- USO DE UMA COMPOSIÇÃO FARMACÊUTICA, conforme definida na reivindicação 1, caracterizado por ser na fabricação de um medicamento administração transmucosal para aumento da biodisponibilidade de um tocotrienol administrado a um animal.
- USO, de acordo com a reivindicação 13, caracterizado pela administração transmucosal ser administração sublingual.
- USO DE UMA COMPOSIÇÃO FARMACEUTICA, conforme definida na reivindicação 1, caracterizado por ser na fabricação de um medicamento administração transmucosal para aperfeiçoamento de resistência ao exercício em um animal.
- USO, de acordo com a reivindicação 15, caracterizado pela administração transmucosal ser administração sublingual.
- USO DE UMA COMPOSIÇÃO FARMACÊUTICA, conforme definida na reivindicação 1, caracterizado por ser na fabricação de um medicamento administração transmucosal para aperfeiçoamento da capacidade de exercício em um animal.
- USO, de acordo com a reivindicação 17, caracterizado pela administração transmucosal ser administração sublingual.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2012904937A AU2012904937A0 (en) | 2012-11-13 | Sublingual and buccal delivery of tocotrienol derivatives as therapeutic agents | |
| AUAU2012904937 | 2012-11-13 | ||
| AU2012905406A AU2012905406A0 (en) | 2012-12-11 | Sublingual and buccal delivery of tocotrienol derivatives as therapeutic agents | |
| AUAU2012905406 | 2012-12-11 | ||
| PCT/AU2013/001310 WO2014075135A1 (en) | 2012-11-13 | 2013-11-13 | Transmucosal delivery of tocotrienol |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| BR112015010703A2 BR112015010703A2 (pt) | 2017-07-11 |
| BR112015010703A8 BR112015010703A8 (pt) | 2018-08-14 |
| BR112015010703B1 true BR112015010703B1 (pt) | 2021-02-17 |
Family
ID=50730398
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112015010703-6A BR112015010703B1 (pt) | 2012-11-13 | 2013-11-13 | uso de uma composição farmacêutica e composição farmacêutica |
Country Status (23)
| Country | Link |
|---|---|
| US (2) | US10675265B2 (pt) |
| EP (1) | EP2919777B1 (pt) |
| JP (3) | JP6460998B2 (pt) |
| KR (1) | KR20150082109A (pt) |
| CN (2) | CN104582700B (pt) |
| AU (1) | AU2013344817B2 (pt) |
| BR (1) | BR112015010703B1 (pt) |
| CA (1) | CA2891164C (pt) |
| DK (1) | DK2919777T3 (pt) |
| ES (1) | ES2778065T3 (pt) |
| HK (1) | HK1207295A1 (pt) |
| IL (1) | IL238727A0 (pt) |
| IN (1) | IN2015DN04006A (pt) |
| MY (1) | MY177940A (pt) |
| NZ (1) | NZ628963A (pt) |
| PE (1) | PE20151518A1 (pt) |
| PH (1) | PH12015501048A1 (pt) |
| PL (1) | PL2919777T3 (pt) |
| PT (1) | PT2919777T (pt) |
| RU (1) | RU2015120181A (pt) |
| SG (1) | SG11201503640WA (pt) |
| WO (1) | WO2014075135A1 (pt) |
| ZA (1) | ZA201504191B (pt) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9171343B1 (en) | 2012-09-11 | 2015-10-27 | Aseko, Inc. | Means and method for improved glycemic control for diabetic patients |
| US9897565B1 (en) | 2012-09-11 | 2018-02-20 | Aseko, Inc. | System and method for optimizing insulin dosages for diabetic subjects |
| PT2919777T (pt) * | 2012-11-13 | 2020-03-30 | Invictus Biotechnology Pty Ltd | Distribuição transmucosa de tocotrienol |
| US9233204B2 (en) | 2014-01-31 | 2016-01-12 | Aseko, Inc. | Insulin management |
| US9486580B2 (en) | 2014-01-31 | 2016-11-08 | Aseko, Inc. | Insulin management |
| WO2016069475A1 (en) | 2014-10-27 | 2016-05-06 | Aseko, Inc. | Subcutaneous outpatient management |
| US11081226B2 (en) | 2014-10-27 | 2021-08-03 | Aseko, Inc. | Method and controller for administering recommended insulin dosages to a patient |
| WO2017025808A1 (en) * | 2015-08-11 | 2017-02-16 | Satoru Sugiyama | System and method for improved blood circulation and maintaining mitochondrial energy production |
| AU2016308953B2 (en) | 2015-08-20 | 2020-09-10 | Glytec, Llc | Diabetes management therapy advisor |
| US11612613B2 (en) | 2017-08-08 | 2023-03-28 | Robert Petcavich | Formulations for the delivery of autophagy stimulating Trehalose |
| KR20230145045A (ko) * | 2020-12-04 | 2023-10-17 | 인빅터스 바이오테크놀러지 피티와이 엘티디 | 토코트리에놀의 경점막 전달 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0543417A1 (en) * | 1991-11-22 | 1993-05-26 | Lipogenics, Incorporated | Tocotrienols and tocotrienol-like compounds and methods for their use |
| JPH0892050A (ja) | 1994-09-27 | 1996-04-09 | Lion Corp | 消臭剤及び口腔用組成物 |
| JP4271742B2 (ja) | 1997-08-07 | 2009-06-03 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 免疫機能改善剤 |
| US6264981B1 (en) | 1999-10-27 | 2001-07-24 | Anesta Corporation | Oral transmucosal drug dosage using solid solution |
| EP1270004B1 (en) * | 2000-03-31 | 2010-06-09 | Eisai R&D Management Co., Ltd. | Use of gamma-tocotrienol as diuretic |
| JP2001342133A (ja) | 2000-03-31 | 2001-12-11 | Eisai Co Ltd | γ―トコトリエノール含有利尿剤 |
| JP2002037727A (ja) | 2000-07-26 | 2002-02-06 | Eisai Co Ltd | 脂溶性薬物を配合した速崩性固形製剤及びその製造方法 |
| JP4693140B2 (ja) | 2000-10-06 | 2011-06-01 | 富士化学工業株式会社 | トコトリエノール含有医薬用剤 |
| US6608103B2 (en) * | 2001-02-08 | 2003-08-19 | Fuji Chemical Industry Co., Ltd. | Inhibitor for neovasculation, cell multiplication, lumen formation and FGF |
| JP4447198B2 (ja) | 2001-02-08 | 2010-04-07 | 富士化学工業株式会社 | トコトリエノールを有効成分とする血管新生阻害剤、細胞増殖阻害剤、管腔形成阻害剤及びfgf阻害剤並びに食品或いは食品添加物 |
| US7919525B2 (en) | 2003-02-14 | 2011-04-05 | Henry M. Jackson Foundation For The Advancement Of Military Medicine, Inc. | Radiation protection by gamma-tocotrienol |
| WO2005009135A1 (en) * | 2003-04-10 | 2005-02-03 | Barrie Tan | Annatto extract compositions including tocotrienols and tocopherols and methods of use |
| US20050209315A1 (en) * | 2004-03-20 | 2005-09-22 | Papas Andreas M | Bioavailable nutritional supplement and method of treatment of malabsorption |
| ZA200610168B (en) * | 2004-05-26 | 2008-06-25 | Kgk Synergize Inc | Compositions comprising flavonoids and tocotrienols and methods thereof |
| CN1775289B (zh) | 2004-11-15 | 2011-08-24 | 杭州赛诺菲民生健康药业有限公司 | 多维生素口腔崩解片制剂及其制备方法 |
| US20090258865A1 (en) | 2008-03-28 | 2009-10-15 | Hale Biopharma Ventures, Llc | Administration of benzodiazepine compositions |
| WO2009126866A2 (en) | 2008-04-10 | 2009-10-15 | Henry M. Jackson Foundation For The Advancement Of Military Medicine, Inc. | Delta-tocotrienol as a radioprotective countermeasure agent |
| AU2010262738A1 (en) | 2009-05-20 | 2011-10-13 | Lingual Consegna Pty Ltd | Buccal and/or sublingual therapeutic formulation |
| US20120122969A1 (en) | 2009-06-25 | 2012-05-17 | Ampere Life Sciences, Inc. | Treatment of pervasive developmental disorders with tocotrienols or tocotrienol enriched extracts |
| DK2470168T3 (en) * | 2009-08-26 | 2018-05-07 | Bioelectron Tech Corp | PROCEDURES FOR PREVENTION AND TREATMENT OF CEREBRAL ISCAM |
| US20110172312A1 (en) | 2009-12-31 | 2011-07-14 | Miller Guy M | Treatment of leigh syndrome and leigh-like syndrome with tocotrienol quinones |
| EP2555765A4 (en) | 2010-04-06 | 2013-08-14 | Edison Pharmaceuticals Inc | TREATMENT OF ATAXIE TÉLANGIECTASIE |
| WO2012068552A1 (en) * | 2010-11-19 | 2012-05-24 | Edison Pharmaceuticals, Inc. | Methods for improving blood glucose control |
| MX359670B (es) | 2011-02-18 | 2018-10-05 | Biolingus Ip Llc | Proceso para preparar productos que comprenden activos estabilizados y composiciones que los comprenden. |
| PT3415139T (pt) | 2011-06-14 | 2022-06-20 | Neurelis Inc | Administração de benzodiazepina |
| PT2919777T (pt) * | 2012-11-13 | 2020-03-30 | Invictus Biotechnology Pty Ltd | Distribuição transmucosa de tocotrienol |
-
2013
- 2013-11-13 PT PT138544408T patent/PT2919777T/pt unknown
- 2013-11-13 KR KR1020147022626A patent/KR20150082109A/ko not_active Application Discontinuation
- 2013-11-13 PL PL13854440T patent/PL2919777T3/pl unknown
- 2013-11-13 JP JP2015540965A patent/JP6460998B2/ja active Active
- 2013-11-13 CA CA2891164A patent/CA2891164C/en active Active
- 2013-11-13 CN CN201380022566.8A patent/CN104582700B/zh active Active
- 2013-11-13 EP EP13854440.8A patent/EP2919777B1/en active Active
- 2013-11-13 PE PE2015000622A patent/PE20151518A1/es not_active Application Discontinuation
- 2013-11-13 MY MYPI2015000856A patent/MY177940A/en unknown
- 2013-11-13 DK DK13854440.8T patent/DK2919777T3/da active
- 2013-11-13 US US14/435,607 patent/US10675265B2/en active Active
- 2013-11-13 SG SG11201503640WA patent/SG11201503640WA/en unknown
- 2013-11-13 BR BR112015010703-6A patent/BR112015010703B1/pt active IP Right Grant
- 2013-11-13 RU RU2015120181A patent/RU2015120181A/ru not_active Application Discontinuation
- 2013-11-13 CN CN202011457257.1A patent/CN112451518A/zh active Pending
- 2013-11-13 NZ NZ628963A patent/NZ628963A/en unknown
- 2013-11-13 AU AU2013344817A patent/AU2013344817B2/en active Active
- 2013-11-13 ES ES13854440T patent/ES2778065T3/es active Active
- 2013-11-13 WO PCT/AU2013/001310 patent/WO2014075135A1/en active Application Filing
-
2015
- 2015-05-10 IL IL238727A patent/IL238727A0/en unknown
- 2015-05-11 IN IN4006DEN2015 patent/IN2015DN04006A/en unknown
- 2015-05-11 PH PH12015501048A patent/PH12015501048A1/en unknown
- 2015-06-10 ZA ZA2015/04191A patent/ZA201504191B/en unknown
- 2015-08-14 HK HK15107895.4A patent/HK1207295A1/xx unknown
-
2018
- 2018-09-21 JP JP2018177662A patent/JP6978392B2/ja active Active
-
2020
- 2020-04-23 US US15/929,297 patent/US11331302B2/en active Active
- 2020-10-09 JP JP2020171008A patent/JP2021008509A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11331302B2 (en) | Transmucosal delivery of tocotrienol | |
| KR101068603B1 (ko) | 지방 조직, 피부 조직, 피부 질환 및 근육 조직의 치료를 위한 제제 | |
| US8716249B2 (en) | Compositions and methods for improving cardiovascular health | |
| KR20010022148A (ko) | 필수 지방산과 생물활성 이황화물을 함유하는 치료 및식이요법 조성물 | |
| US20040110828A1 (en) | Tetrahydrocannabinol compositions and methods of manufacture and use thereof | |
| HU197840B (en) | Process for producing synergic pharmaceutical compositions comprising amantadin and selegilin | |
| CA2645833C (en) | Compositions containing riboflavin and sesamin-class compounds | |
| US11896598B2 (en) | Appetite suppressant compositions and methods thereof | |
| JP2019182881A (ja) | 末梢神経障害の予防又は改善用組成物 | |
| EP2859896A1 (en) | Pharmaceutical compositions for the treatment of muscular disorders | |
| US20110117070A1 (en) | Compositions and methods for treating headache | |
| JP4355967B2 (ja) | 医薬組成物 | |
| JP5584411B2 (ja) | ホモシステイン低下用組成物 | |
| JP5452042B2 (ja) | 医薬組成物 | |
| JP4896531B2 (ja) | 血中CoQ10量を増加させる医薬組成物 | |
| CA3167614C (en) | Nutritional compositions and methods containing a lignan and a methyl donor | |
| US20220362188A1 (en) | Administration of butyrate, beta-hydroxybutyrate, cannabidiol, and related compounds in humans | |
| JPH0319208B2 (pt) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B25A | Requested transfer of rights approved |
Owner name: INVICTUS BIOTECHNOLOGY PTY LTD (AU) |
|
| B07G | Grant request does not fulfill article 229-c lpi (prior consent of anvisa) [chapter 7.7 patent gazette] |
Free format text: NOTIFICACAO DE DEVOLUCAO DO PEDIDO POR NAO SE ENQUADRAR NO ART. 229-C DA LPI. |
|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 13/11/2013, OBSERVADAS AS CONDICOES LEGAIS. |