BR112014032974B1 - Método para detecção, identificação e/ou quantificação de um ou mais carboidratos e uso de um oligotiofeno conjugado luminescente - Google Patents
Método para detecção, identificação e/ou quantificação de um ou mais carboidratos e uso de um oligotiofeno conjugado luminescente Download PDFInfo
- Publication number
- BR112014032974B1 BR112014032974B1 BR112014032974-5A BR112014032974A BR112014032974B1 BR 112014032974 B1 BR112014032974 B1 BR 112014032974B1 BR 112014032974 A BR112014032974 A BR 112014032974A BR 112014032974 B1 BR112014032974 B1 BR 112014032974B1
- Authority
- BR
- Brazil
- Prior art keywords
- phta
- carbohydrate
- carbohydrates
- lco
- signal
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/06—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to the ring carbon atoms
- C07D333/24—Radicals substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/5308—Immunoassay; Biospecific binding assay; Materials therefor for analytes not provided for elsewhere, e.g. nucleic acids, uric acid, worms, mites
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/52—Use of compounds or compositions for colorimetric, spectrophotometric or fluorometric investigation, e.g. use of reagent paper and including single- and multilayer analytical elements
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/582—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances with fluorescent label
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D333/00—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom
- C07D333/02—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings
- C07D333/04—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom
- C07D333/06—Heterocyclic compounds containing five-membered rings having one sulfur atom as the only ring hetero atom not condensed with other rings not substituted on the ring sulphur atom with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to the ring carbon atoms
- C07D333/14—Radicals substituted by singly bound hetero atoms other than halogen
- C07D333/20—Radicals substituted by singly bound hetero atoms other than halogen by nitrogen atoms
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2400/00—Assays, e.g. immunoassays or enzyme assays, involving carbohydrates
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2400/00—Assays, e.g. immunoassays or enzyme assays, involving carbohydrates
- G01N2400/10—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2400/00—Assays, e.g. immunoassays or enzyme assays, involving carbohydrates
- G01N2400/10—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- G01N2400/12—Homoglycans, i.e. polysaccharides having a main chain consisting of one single sugar
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2400/00—Assays, e.g. immunoassays or enzyme assays, involving carbohydrates
- G01N2400/10—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- G01N2400/38—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence, e.g. gluco- or galactomannans, e.g. Konjac gum, Locust bean gum, Guar gum
- G01N2400/40—Glycosaminoglycans, i.e. GAG or mucopolysaccharides, e.g. chondroitin sulfate, dermatan sulfate, hyaluronic acid, heparin, heparan sulfate, and related sulfated polysaccharides
Abstract
MÉTODO PARA DETECÇÃO, IDENTIFICAÇÃO E/OU QUANTIFICAÇÃO DE UM OU MAIS CARBOIDRATOS, USO DE UM OLIGOTIOFENO CONJUGADO LUMINESCENTE, E COMPOSTO. A presente invenção refere-se a um método para detecção, identificação e/ou quantificação de um ou mais carboidratos. O método compreende as etapas de colocar um objeto ou uma amostra em contato com um oligotiofeno conjugado luminescente (LCO) e detectar pelo menos um sinal de detecção do oligotiofeno conjugado luminescente. A presença e/ou a identidade e/ou a quantidade de um ou mais carboidratos que está ou estão presentes no dito objeto ou na dita amostra é determinada com base no dito sinal de detecção detectado do LCO. A invenção engloba métodos para detecção de carboidrato através do uso de derivados de oligotiofeno. Os métodos são rápidos, fáceis e diretos e podem ser realizados em tempo real bem como in situ.
Description
[001] A presente invenção refere-se ao uso de oligotiofenos conjugados luminescentes (LCOs) para a detecção de carboidratos e monitoramento da formação de carboidrato ou conversão de carboidrato.
[002] Os carboidratos são frequentemente poliméricos e são nomeados, agrupados e classificados de acordo com a identidade do monossacarídeo composto, o número de unidades monoméricas e a posição de carbono das ligações covalentes que ligam cada monossacarídeo.
[003] Atualmente, uma ampla faixa de métodos para a detecção, identificação e quantificação de carboidratos são conhecidos e aplicados em todas as indústrias. Entretanto, poucos desses métodos têm resolução suficiente para identificar a molécula precisa. Isso é devido à natureza inerente da estrutura química dos polissacarídeos, que são macromoléculas grandes compostas por um grupo pequeno de subunidades idênticas. Como um resultado dessa natureza repetitiva, os carboidratos não apresentam comumente epítopos únicos ou superfícies de ligação para a detecção fácil com sondas. A falta de epítopos únicos e a dificuldade da detecção estão em contraste com as proteínas, que têm diversos níveis de conformações estruturais e qualidades únicas adicionalmente à sequência de aminoácidos primária. Em contraste com as proteínas, os sistemas de detecção com base em anticorpo são raramente eficazes quando usados para carboidratos.
[004] A identificação de carboidratos é comumente realizada por meios indiretos e é inclinada para carboidratos solúveis. Por exemplo, a identidade de carboidrato pode ser revelada por uma etapa de monomerização inicial, seguida por uma etapa de identificação na qual cada monômero e a porcentagem de cada monômero presente são identificados. As informações de monômero adquiridas são, então, retroalimentadas para uma etapa de determinação na qual a identidade do carboidrato original é determinada.
[005] Outras técnicas comuns para a análise de carboidrato usam uma combinação de cromatografia (por exemplo, cromatografia de camada fina, cromatografia gasosa, cromatografia líquida de alto desempenho) e análise química detalhada por eletroforese ou espectrometria de massa de polímeros ou monômeros. Frequentemente, a espectrometria de massa é usada em combinação com uma etapa anterior de separação para purificar uma mistura antes da análise. Adicionalmente, a monomerização da cadeia de polissacarídeo é frequentemente uma exigência para a análise de carboidratos maiores. Embora altamente preciso, o uso singular e/ou sequencial dos métodos acima pode ser lendo e enfadonho e exige uma quantidade significativa de conhecimento específico (Zídková J e Chmelík J, J. Mass Spectrom. (2001), 36(4):417 a 421).
[006] Na natureza, os carboidratos são abundantes como as proteínas. Os mesmos funcionam tanto como substratos no metabolismo, como macromoléculas estruturais quanto como ligantes/alvos para a adesão, sinalização e em muitas interações biológicas. Nas indústrias farmacêuticas assim como outras instalações industriais, os carboidratos representam diversos produtos de alta procura no mercado. Esses produtos variam de fármacos a alimentos e suplementos para novos polímeros para materiais “verdes”. Um método sensível simples para a identificação e quantificação de carboidrato é antecipado para ser de grande utilidade nessas instalações.
[007] O documento no WO2010/044744 A1 revela os compostos de tiofeno inovadores para o uso no imageamento in vivo de amiloide ou formas agregadas de proteínas. O documento revela politiofenos polimerizados aleatoriamente, assim como tiofenos oligoméricos de comprimento definido, que se ligam e permitem a detecção de tais proteínas. Os compostos de oligotiofeno revelados são, por exemplo, úteis para o diagnóstico da doença de Alzheimer e outras doenças que envolvem proteínas agregadas ou mal dobradas.
[008] O documento WO2005/045065 A1 revela um método colorimétrico para detectar patógenos bacterianos ou fúngicos através da detecção de peptidoglicano ou (1-3)-β-D- glucano em uma amostra.
[009] O documento WO2011/102789 A1 descreve derivados de oligotiofeno que se ligam especificamente a células estaminais neurais e células estaminais de câncer neural. Mais especificamente, a invenção refere-se a métodos para detectar células-tronco neurais ou células-tronco de câncer neural usando os referidos derivados de oligotiofeno em uma amostra biológica, bem como usos e kits relacionados a eles.
[010] Harvey, D (Mass Spectrometry Reviews (2012) 31: 183-311) revela a análise de carboidratos e glicoconjugados.
[011] Database medline, US national library of medicine (NLM) Bethesda MD, EUA; 2012, Nilsson, P et al., acesso à base de dados n° . NLM22528107 revela oligotiofeno conjugado luminescente pentamérico para geração de imagens ópticas de fibrilas amilóides formadas in vitro e agregados de proteína em seções de tecido.
[012] Âslund, A et al (ACS Chem. Biol.(2009), 4(8):673 a 684) revela oligotiofenos conjugados luminescentes pentaméricos para a identificação seletiva de agregados de proteína. Os LCOs revelados podem ser utilizados como ferramentas de pesquisa para estudar doenças de agregação de proteína tal como doenças priônicas e a doença de Alzheimer.
[013] Klingstedt, T et al (Org. Biomol. Chem. (2011), 9:8.356 a 8.370) revela uma biblioteca de oligotiofenos conjugados luminescentes de diferentes comprimentos assim como seus métodos de síntese. Os oligotiofenos conjugados luminescentes revelados são úteis para a identificação seletiva dos agregados de proteína. Os mesmos facilitam o estudo de doenças de agregação de proteína e poderiam também ser utilizados para o desenvolvimento de ferramentas de diagnóstico inovadoras para tais doenças.
[014] É um objetivo geral da presente invenção fornecer sondas moleculares e métodos que utilizam tais sondas moleculares que podem ser usadas para a análise e detecção de carboidrato. É outro objetivo da invenção fornecer sondas e métodos que discriminem entre diferentes carboidratos. As áreas de análise incluem quantificação, determinação de pureza e rastreamento da eficácia e taxa de síntese. Um objetivo abrangente da presente invenção é fornecer sondas para a análise e detecção in vitro, in vivo e in situ de carboidratos biologicamente relevantes. Ainda outro objetivo da invenção é fornecer sondas e métodos para seguir a síntese, verificação e análise de carboidrato de produtos finais/identidade de substrato e análise da pureza.
[015] Esses objetivos são alcançados por uma sonda molecular e um método de acordo com as reivindicações anexas.
[016] A invenção refere-se ao uso de um oligotiofeno conjugado luminescente para a detecção, identificação e/ou quantificação de um ou mais carboidratos.
[017] Em um aspecto da invenção é fornecido um método para a detecção, identificação e/ou quantificação de um ou mais carboidratos que compreende as etapas de: - contatar um objeto ou uma amostra com um oligotiofeno conjugado luminescente; - detectar pelo menos um sinal de detecção do oligotiofeno conjugado luminescente; e - com base no dito sinal de detecção detectado, determinar a presença, identidade e/ou quantidade do carboidrato ou carboidratos no dito objeto ou na dita amostra.
[018] O oligotiofeno conjugado luminescente (LCO) pode ser um oligotiofeno conjugado luminescente pentamérico a 15-mérico. De preferência, o oligotiofeno conjugado luminescente é um oligotiofeno conjugado luminescente pentamérico ou heptamérico. Em uma modalidade, o oligotiofeno conjugado luminescente compreende uma ou mais cadeias laterais funcionais, tais como aminoácidos, derivados de aminoácido, neurotransmissores, monossacarídeos, polissacarídeos, ácidos nucleicos e derivados assim como combinações dos mesmos. São revelados no presente documento os oligotiofenos conjugados luminescentes heptaméricos exemplificativos h-FTAA e h-HTAA e os oligotiofenos conjugados luminescentes pentaméricos exemplificativos p-HTA- Lys, p-HTEA, p-HTIm, p-HTA-Tyr, p-HTA-Arg, p-HTA-Asp e p-HTA- Glu.
[019] Em uma modalidade, o sinal de detecção é um sinal óptico, tal como um sinal de fluorescência ou um sinal colorimétrico ou um sinal elétrico tal como condutividade.
[020] Em uma modalidade vantajosa, o conjugado luminescente pode discriminar entre pelo menos dois carboidratos diferentes, permitindo a identificação e/ou quantificação de diferentes carboidratos no objeto ou na amostra.
[021] O oligotiofeno conjugado luminescente pode alvejar pelo menos um carboidrato insolúvel, tal como celulose, quitina, β-glucano, alginato, amilose e glicogênio ou combinações dos mesmos.
[022] Alternativa ou adicionalmente, o oligotiofeno conjugado luminescente pode alvejar pelo menos um carboidrato solúvel, tal como glicose, celulobiose, heparina, sulfato de condroitina A ou combinações dos mesmos.
[023] As etapas de contato e/ou detecção podem ser executadas in vivo ou in situ.
[024] São fornecidos compostos de oligotiofeno conjugado luminescente inovadores selecionados dentre pHTA- Tyr, pHTA-Arg, pHTA-Asp, pHTA-Glu e pHTA-Lys, todos úteis nos métodos de acordo com a presente revelação.
[025] A invenção é agora descrita, a título de exemplo, em referência às figuras anexas, nas quais:
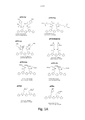
[026] A Figura 1 mostra A) modalidades exemplificativas de oligotiofenos conjugados luminescentes (LCOs) pentaméricos da presente revelação e B) modalidades exemplificativas de oligotiofenos conjugados luminescentes (LCOs) heptaméricos da presente revelação.
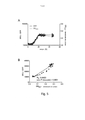
[027] A Figura 2 mostra A) uma representação esquemática de uma configuração para uma formação de biofilme, que ocorre na interface de ar-líquido, com o uso de uma lamínula de vidro inclinada estabelecida na cavidade de uma placa de 6 cavidades; B) o ensaio de vermelho Congo para a verificação dos perfis de biofilme de Salmonella enteritidis (S. enteritidis) 3934 wt e mutantes isogênicos (ΔbscA, ΔcsgAe ΔcsgD)de fenótipos conhecidos.; C-D) a morfologia de biofilme de S. enteritidis 3934 wt e mutantes isogênicos localizados na interface de ar-líquido mostrada por C) manchamento de h-FTAA e D) manchamento de h-HTAA. A análise confocal de fluorescência (lado esquerdo) e a análise de contraste de fase (lado direito) da mesma lâmina são mostradas lado a lado.
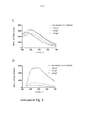
[028] A Figura 3 mostra A-B) o estudo espectral das culturas de biofilme não processadas (nenhuma etapa de lavagem realizada) de S. enteritidis 3934 wt e mutantes isogênicos. Os espectros de excitação de A) h-HTAA e B) h- FTAA em 24 horas de culturas não processadas de wt ( __ ), ΔbscA( _ _ ), ΔcsgA( ) e ΔcsgD( _ . ) com a leitura de emissão a 545 nm; C-D) o estudo espectral de S. enteritidis 3934 wt e mutantes isogênicos não processados (nenhuma etapa de lavagem realizada). O espectro de emissão das culturas de h-FTAA em 24 h de wt ( ), ΔbscA ( _ _ ), ΔcsgA ( ) e ΔcsgD ( _ . ) quando excitado a C) 405 nm e D) 500 nm.
[029] A Figura 4 mostra um estudo espectral do espectro de excitação de suspensões de celulose microcristalina insolúvel pura de 6,25 mg/ml ( __ ), 3,125 mg/ml ( _ _ ), 1,5 6 mg/ml ( ) e 0,7 8 mg/ml (_.), quando misturadas com 3 μg/ml de h-FTAA.
[030] A Figura 5 mostra o rastreamento em tempo real da proliferação bacteriana e a formação de biofilme de S. enteritidis 3934 wt e mutantes isogênicos ΔbscA, ΔcsgA e ΔcsgD em uma placa de 96 cavidades. A) comparação de OD600 ( ) ao sinal de GFP ( ) de uma cultura de biofilme de wt ao longo de 48 horas; B) correlação de OD600 ao sinal de GFP; C-F) rastreamento em tempo real de formação de biofilme de C) S. enteritidis 3934 wt, D) ΔcsgD, E) ΔcsgA e F) ΔbscA pelo uso de h-FTAA em comparação a GFP. Os sinais de GFP ( __ ) curli ( _ _ ) e celulose ( ) são mostrados. Curli é detectado com um comprimento de onda de excitação de 405 nm e comprimento de onda de emissão de 556 e a celulose é detectada com um comprimento de onda de excitação de 500 nm e comprimento de onda de emissão de 600 nm.
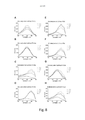
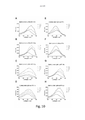
[031] A Figura 6 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra suspensões de carboidrato em pó insolúvel puro de β-1,3,-glucano. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato insolúvel do qual as concentrações mostradas aqui são 10 mg/ml (_ .), 5 mg/ml ( ), 2,5 mg/ml ( _ _ ) e 0 mg/ml ( __ ). O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; β-1,3,-glucano contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[032] A Figura 7 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das suspensões de carboidrato em pó insolúvel puro de β-1,3,-glucano presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato insolúvel. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; β-1,3,-glucano contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( __ ) com [β-1,3-Glucano] e a linha de regressão de ajuste ( _ _ ) é mostrada.
[033] A Figura 8 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra suspensões de carboidrato microcristalino insolúvel puro de celulose. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato insolúvel do qual as concentrações mostradas aqui são 10 mg/ml (_ .), 5 mg/ml ( ), 2,5 mg/ml ( _ _ ) e 0 mg/ml ( __ ). O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; celulose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[034] A Figura 9 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das suspensões de carboidrato microcristalino insolúvel puro de celulose presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato insolúvel. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; celulose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. __O aumento médio no sinal ( __ ) com [celulose] e a linha de regressão de ajuste ( _ _ ) é mostrada.
[035] A Figura 10 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra suspensões de carboidrato em pó insolúvel puro de Quitina. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato insolúvel do qual as concentrações mostradas aqui são 10 mg/ml (_ .), 5 mg/ml ( ), 2,5 mg/ml ( _ _ ) e 0 mg/ml ( __ ). O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; Quitina contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[036] A Figura 11 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das suspensões de carboidrato em pó insolúvel puro de Quitina presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato insolúvel. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; Quitina contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( __ ) com [Quitina] e a linha de regressão de ajuste ( _ _ ) é mostrada.
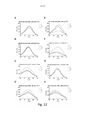
[037] A Figura 12 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra suspensões de carboidrato em pó insolúvel puro de alginato de sódio. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato insolúvel do qual as concentrações mostradas aqui são 5 mg/ml (_ .), 2,5 mg/ml ( ), 1,25 mg/ml ( _ _ ) e 0 mg/ml ( __ ). O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; alginato de sódio contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[038] A Figura 13 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das suspensões de carboidrato em pó insolúvel puro de alginato de sódio presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato insolúvel. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; alginato de sódio contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( __ ) com [alginato de sódio] e a linha de regressão de ajuste ( _ _ ) é mostrada.
[039] A Figura 14 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra soluções de carboidrato puro de Glicose. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato do qual as concentrações mostradas aqui são 5 mg/ml (_ .), 2,5 mg/ml ( ), 1,2 5 mg/ml ( _ _ ) e 0 mg/ml ( ) . O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; Glicose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[040] A Figura 15 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração de soluções de carboidrato puro de Glicose presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; Glicose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( ) com [Glicose] e a linha de regressão de ajuste ( _ _ ) é mostrada.
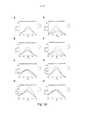
[041] A Figura 16 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra suspensões de carboidrato puro de amilose. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato do qual as concentrações mostradas aqui são 5 mg/ml (_ .), 2,5 mg/ml ( ), 1,2 5 mg/ml ( _ _ ) e 0 mg/ml ( ) . O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; amilose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[042] A Figura 17 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das suspensões de carboidrato puro de amilose presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; amilose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( __ ) com [Amilose] e a linha de regressão de ajuste ( _ _ ) é mostrada.
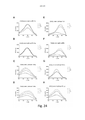
[043] A Figura 18 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra suspensões de carboidrato puro de glicogênio. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato do qual as concentrações mostradas aqui são 5 mg/ml (_ .), 2,5 mg/ml ( ), 1,2 5 mg/ml ( _ _ ) e 0 mg/ml ( ) . O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; glicogênio contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[044] A Figura 19 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das suspensões de carboidrato puro de glicogênio presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; glicogênio contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( __ ) com [glicogênio] e a linha de regressão de ajuste ( _ _ ) é mostrada.
[045] A Figura 20 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra soluções de carboidrato puro de celulobiose. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato do qual as concentrações mostradas aqui são 5 mg/ml (_ .), 2,5 mg/ml ( ), 1,2 5 mg/ml ( _ _ ) e 0 mg/ml ( ) . O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; celulobiose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[046] A Figura 21 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das soluções de carboidrato puro de celulobiose presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; celulobiose contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( __ ) com [celulobiose] e a linha de regressão de ajuste ( _ _ ) é mostrada.
[047] A Figura 22 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra soluções de carboidrato puro de heparina. 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato do qual as concentrações mostradas aqui são 5 mg/ml (_ .), 2,5 mg/ml ( ), 1,2 5 mg/ml ( _ _ ) e 0 mg/ml ( ) . O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; heparina contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[048] A Figura 23 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das soluções de carboidrato puro de heparina presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; heparina contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. O aumento médio no sinal ( __ ) com [heparina] e a linha de regressão de ajuste ( _ _ ) é mostrada.
[049] A Figura 24 mostra uma tela espectrofluorométrica de LCOs pentaméricos contra soluções de carboidrato puro de Sulfato de Condroitina A (CS(A)) 3 μM de cada sonda foram aplicados às diluições de duas vezes em série do carboidrato do qual as concentrações mostradas aqui são 0,5 mg/ml (_ .), 0,25 mg/ml ( ), 0,125 mg/ml ( _ _ ) e 0 mg/ml ( __ ). O espectro de excitação da sonda foi analisado para comprimentos de ondas de 300 a 500 nm com leitura de emissão de 545 nm. As combinações são conforme segue; CS(A) contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys.
[050] A Figura 25 mostra uma análise de correlação entre a intensidade de fluorescência dos LCOs pentaméricos e a concentração das soluções de carboidrato puro de CS(A) presentes no ensaio. 3 μM de cada sonda foram aplicados a diluições de duas vezes em série do carboidrato. As respectivas sondas foram excitadas a comprimentos de onda únicos para cada sonda (especificada na figura) e a emissão foi lida a 545 nm. As combinações são mostradas conforme segue; CS(A) contra A) pHTA-Tyr; B) pHTA-Asp; C) pHTA-Arg; D) pHTA-His; E) pHTEA; F) pHTIm; G) pHTA-Glu; e H) pHTA-Lys. __ O aumento médio no sinal ( __ ) com [Sulfato de Condroitina A] e a linha de regressão de ajuste ( _ _ ) é mostrada.
[051] A presente invenção refere-se a sondas moleculares, os assim chamados oligotiofenos conjugados luminescentes (LCOs) para o uso na detecção, identificação e análise de carboidrato.
[052] Uma sonda de LCO particular alveja e se liga a um ou diversos carboidratos diferentes, conforme exemplificado pelas sondas de protótipo nesta revelação. Quando o LCO é exposto a e interage com um carboidrato alvo, a molécula de LCO passa por uma alteração geométrica única, que é refletida por um sinal de saída específico ao alvo que pode ser detectado como um sinal de detecção. O sinal de saída pode, por exemplo, ser detectado como um sinal espectrofluorométrico, um sinal colorimétrico, uma alteração na condutividade elétrica ou uma combinação de diferentes sinais. A alteração geométrica pode, por exemplo, resultar em um sinal de fluorescência emitido aumentado ou diminuído e/ou em um desvio no comprimento de onda de excitação para a emissão de pico (Àmáx) . Em uma alternativa, a alteração geométrica pode resultar em uma alteração mensurável na condutividade do LCO ou um polímero condutor acoplado ao mesmo.
[053] A perfilagem de sinais de detecção específicos ao alvo individuais de um LCO, que são produzidos com cada alvo de ligação, permite a identificação e a quantificação de carboidratos específicos. Muitos dos LCOs de protótipo nesta revelação têm sensibilidade dupla ou múltipla para diferentes carboidratos e podem discriminar entre os mesmos produzindo-se sinais de detecção que são específicos para cada carboidrato alvo.
[054] A análise de sinais de detecção de LCO nesta revelação é compreendida significativamente de leituras espectrofluorométricas, às quais o comprimento de onda de excitação para a emissão de pico (Àmáx) assim como a intensidade da fluorescência emitida são de interesse particular. São incluídos os espectros de excitação e emissão de LCOs ligados alvo. O espectro de excitação confere a detecção da intensidade da fluorescência emitida a um comprimento de onda específico quando o LCO em uma amostra é excitado por lasers dentro de uma faixa de comprimentos de onda. O espectro de emissão confere a detecção da intensidade de emissões a diferentes comprimentos de onda dentro de uma faixa especificada, quando os LCOs dentro de uma amostra são excitados a um comprimento de onda definido.
[055] Os LCOs de protótipo nesta revelação mostram sensibilidade a carboidratos em uma faixa de detecção biologicamente relevante. Isso inclui carboidratos estruturais (por exemplo, β-1,3-glucano, celulose, quitina e alginato de sódio), substratos metabólicos e intermediários (α-D-glicose e celulobiose), carboidratos de armazenamento (amilose e glicogênio) e glicoaminoglicanos (heparina e sulfato de condroitina A).
[056] Os oligotiofenos conjugados resultam da oligomerização de tiofenos, um heterociclo de enxofre. Os elétrons são deslocalizados ao longo de suas estruturas principais conjugadas, dando a esses oligômeros propriedades condutoras e/ou ópticas. Os oligotiofenos conjugados podem se tornar condutores quando elétrons são adicionados ou removidos das orbitais π conjugados por meio de dopagem. A ligação da sonda de LCO a alvos é ativada por interações eletrostáticas. Também, a interação desses oligômeros com moléculas alvo pode causar a torção de sua estrutura principal, resultando na distorção de elétron e desvios drásticos em suas propriedades ópticas. Como tal, os oligotiofenos têm uma ampla faixa de alvos de ligação que podem ser individualmente identificados através de um sinal relacionado à estrutura principal de oligômero único correspondente.
[057] Os LCOs da presente invenção são compostos de um oligotiofeno de núcleo ao qual grupos laterais podem ser adicionados para melhorar a função intrínseca do componente de núcleo. O componente de núcleo consiste em um oligotiofeno pentamérico, hexamérico, heptamérico, octamérico, nonamérico, decamérico ou 11, 12, 13, 14 ou 15-mérico, isto é, de tiofenos poliméricos que consistem em cinco a quinze monômeros de tiofeno. De preferência, o componente consiste em um número ímpar de monômeros conforme os mesmos podem reter um grande número de grupos laterais. Os LCOs de números pares também alvejam carboidratos e produzem um sinal de detecção, mas são restritos nos números de grupos laterais que podem ser adicionados.
[058] Uma ampla variedade de grupos laterais que têm diferentes propriedades pode ser ligada ao componente de núcleo. Por exemplo, os grupos laterais podem ter funcionalidades aniônicas, catiônicas ou zwitteriônicas. Os grupos laterais podem ser derivados de, por exemplo, aminoácidos, derivados de aminoácido, neurotransmissores, monossacarídeos, polissacarídeos, ácidos nucleicos ou combinações e derivados dos mesmos. Os grupos laterais fornecem os LCOs com propriedades moleculares que aumentam sua afinidade a seus compostos alvo e que permitem que os LCOs se liguem a e formem complexos com seus compostos alvos. Por exemplo, grupos laterais carregados negativa ou positivamente permitem uma ligação iônica entre o LCO e o alvo. A funcionalidade iônica e outras funcionalidades de grupo lateral podem também ou alternativamente permitir a ligação ou outras formas de ligação não covalente entre o LCO e seus componentes alvo.
[059] Os LCOs de protótipo para o uso com a presente invenção são formas pentamérica (isto é, que têm um componente de núcleo de oligotiofeno pentamérico) e heptamérico (isto é, que têm um componente de núcleo de oligotiofeno heptamérico) mostradas nas Figuras 1A e 1B, respectivamente. Os exemplos de formas pentaméricas incluem, pHTEA (penta Hidrogênio Tiofeno Etanol Amina), pHTIm (penta Hidrogênio Tiofeno Imidazol), pHTA Lys (penta Hidrogênio Tiofeno Ácido Acético Lisina), pHTA Tyr (penta Hidrogênio Tiofeno Ácido Acético Tirosina) pHTA Arg (penta Hidrogênio Tiofeno Ácido Acético Arginina), pHTA Asp (penta Hidrogênio Tiofeno Ácido Acético Ácido Aspártico), pHTA His (penta Hidrogênio Tiofeno Ácido Acético Histidina) e pHTA Glu (penta Hidrogênio Tiofeno Ácido Acético Ácido Glutâmico). Os exemplos de formas heptaméricas incluem h HTAA (hepta Hidrogênio Tiofeno Ácido Acético) e hFTAA (hepta Tiofeno Fórmico Ácido Acético).
[060] Em um aspecto, a invenção compreende um composto inovador selecionado dentre pHTA-Tyr, pHTA-Arg, pHTA-Asp, pHTA-Glu e pHTA-Lys.
[061] Os LCOs da presente revelação são designados para alvejar carboidratos enquanto são não citotóxicos. Cada uma das sondas de LCO de protótipo possui uma ampla afinidade de macromoléculas que estão relacionadas sob a categoria de carboidratos. Os mesmos podem ser relacionados por carga, hidrofobicidade, geometria, estrutura e/ou propriedades doadoras e aceitantes de hidrogênio. Os pares de sonda-carboidrato diferentes possuem uma assinatura espectrofluorométrica única, através da qual os pares ou, se o LCO for conhecido, o carboidrato pode ser identificado.
[062] Alguns dos LCOs da presente invenção alvejam e produzem um sinal de detecção com um carboidrato específico, mas não para outros carboidratos. Tais LCOs permitem a detecção e a identificação de um único carboidrato específico. Outros LCOs da presente invenção alvejam diversos carboidratos diferentes e produzem um sinal de detecção específico, por exemplo, um espectro de excitação/emissão específico para cada alvo. No último caso, as assinaturas espectrais únicas do LCO para os respectivos alvos de carboidrato permitem a identificação do componente ligado. Tais LCOs permitem, assim, a detecção e discriminação dupla ou múltipla de diversos carboidratos diferentes, com o uso de um único LCO. Ainda outros LCOs alvejam múltiplos carboidratos e produzem um sinal de detecção idêntico ou similar para todos os carboidratos alvos. Tais LCOs permitem a detecção e a determinação da presença de carboidrato, mas não permitem a discriminação entre ou a identificação de diferentes carboidratos.
[063] Os grupos laterais selecionados podem ser adicionados a um LCO de núcleo para aprimorar sua sensibilidade para um determinado alvo ou aprimorar sua capacidade de discriminar entre os diferentes alvos. Os grupos laterais assim como outras modificações do componente de núcleo podem também ser usados para adicionar outras funcionalidades.
[064] Em uma modalidade, o LCO é designado de modo que um sinal eletrônico é direta ou indiretamente incitado quando a sonda se liga a seu carboidrato alvo. O sinal eletrônico pode originar do próprio polímero de LCO ou um material orgânico ou inorgânico condutor acoplado que traduz a alteração geométrica a do LCO em um sinal elétrico. Na dita modalidade, a ligação de sonda a um carboidrato é traduzida a uma leitura eletrônica, por exemplo, por um detector elétrico ou dispositivo portátil. Tal detector ou dispositivo pode, adicionalmente, ser disposto para alertar um usuário da presença do carboidrato, por exemplo, conforme a quantidade de carboidrato alcança um limite definido. Como um exemplo específico, tal sistema de alerta pode, por exemplo, ser usado para alertar a presença de biofilme, pela detecção dos componentes de carboidrato no biofilme. Assim como detectores de glicose no sangue, tais dispositivos detectores podem também ser usados para indicar a ausência, a presença ou uma presença excessiva de um carboidrato. As aplicações incluem o monitoramento de sangue, alimentos, saúde do paciente ou tubulações de fabricação, para boas práticas de fabricação (GMP) ou para garantia de qualidade.
[065] Os LCOs conforme revelados no presente documento podem ser fornecidos para o uso em uma variedade de meios, sensores, dispositivos ou produtos. Por exemplo, os LCOs da presente revelação podem ser compreendidos como um aditivo líquido. A sonda pode também ser impressa em superfícies ou pode ser constituída em aspersões líquidas ou de aerossol.
[066] Os procedimentos para sintetizar LCOs foram descritos em Klingstedt, T. et al. (Org. Biomol, Chem (2011), 9:8.356 a 8.370); Âslund, A et al. (ACS Chem. Biol. (2009), 4:673 a 684; Âslund, A et al. (Bioconjugate Chem. (2007), 18:1.860 a 1.868) e WO2010/044744. Uma variedade de LCOs que podem ser usados em concordância com a presente invenção pode ser preparada pelo versado na técnica, em luz dos ensinamentos no presente documento.
[067] A presente invenção fornece um método para a detecção, identificação e/ou quantificação de um ou mais carboidratos que compreende as etapas de: - contatar um objeto ou uma amostra com um oligotiofeno conjugado luminescente; - detectar pelo menos um sinal de detecção do oligotiofeno conjugado luminescente; e - com base no dito sinal de detecção detectado, determinar a presença, identidade e/ou quantidade do carboidrato ou carboidratos no dito objeto ou na dita amostra.
[068] No presente documento, a expressão “detectar, identificar e/ou quantificar carboidratos” inclui qualquer tipo de atividade pelo qual a presença, identidade e/ou quantidade de um ou mais carboidratos é analisada. Tais atividades incluem, porém sem limitação, a identificação de carboidratos desconhecidos dentro de uma amostra, determinação da presença ou ausência de um carboidrato ou carboidratos em uma amostra, quantificação de carboidratos conhecidos em uma preparação, rastreamento da conversão de carboidrato do substrato em produto durante a fabricação de um carboidrato, determinação da localização e identidade de um carboidrato em uma amostra biológica ou em superfícies biológicas ou não biológicas com o uso de estudos de tempo final ou estudos em tempo real. Por exemplo, a presença de glicoproteínas ou carboidratos na superfície celular pode ser identificada e quantificada. Na fabricação de novos materiais à base de carboidrato “verdes”, a identidade e a pureza de carboidratos presentes em tais materiais podem ser avaliadas ou verificadas. A meia vida ou o tempo de degradação de um material à base de carboidrato pode também ser avaliado. Similarmente, na fabricação de fármacos ou produtos farmacêuticos moleculares ou biológicos, a identidade e a pureza dos carboidratos presentes em tais preparações farmacêuticas ou de fármaco podem ser avaliadas ou verificadas.
[069] O objeto ou a amostra a ser contatada pode ser qualquer tipo de objeto ou amostra sobre ou dentro do qual é desejável avaliar a presença, identidade ou quantidade de carboidratos. Uma amostra pode, por exemplo, ser uma amostra química ou biológica, tal como uma amostra de um processo de fabricação de carboidrato ou um processo de extração de carboidrato. Uma amostra pode ser uma amostra de sangue ou tecido em ou a partir de um paciente humano ou animal ou uma amostra de água da natureza ou de uma indústria, al como uma estação de tratamento de água de refugo. O monitoramento ou detecção de carboidrato em/sobre uma amostra de tecido de um paciente inclui monitorar ou detectar o carboidrato em/sobre uma amostra isolada adquirida a partir do paciente assim como monitorar ou detectar uma amostra de tecido in vivo ou in situ. Um objeto pode, por exemplo, ser uma superfície ambiental, tal como a superfície de um banco, mesa, pia, parede, piso, tubo, móvel ou quaisquer outros artefatos interiores de um hospital, um ambiente doméstico ou uma fábrica. O mesmo pode também ser um dispositivo tal como um dispositivo médico, um aparelho, uma peça de equipamento, uma ferramenta, equipamentos esportivos ou outros tipos de equipamento ou qualquer outro dispositivo. A ligação do LCO a seu alvo pode, assim, ser detectada na solução ou em uma superfície, isto é, o método é utilizável tanto em ensaios sólidos quanto líquidos. Uma vantagem particular da presente invenção é que nenhuma etapa de lavagem é exigida; o carboidrato pode ser detectado diretamente em culturas ou amostras biológicas não processadas in vitro, in vivo ou in situ. Isso permite estudos de, por exemplo, comportamento e/ou formação de carboidrato em objetos ou em amostras in vitro, in vivo ou in situ em tempo real. Estendendo-se a aplicação acima aos estudos de desenvolvimento temporais, seguindo um sinal específico único para um carboidrato, a dinâmica temporal de sua produção pode ser determinada.
[070] O carboidrato pode ser analisado em uma forma pura a relativamente pura, isto é, uma amostra que compreende principalmente o carboidrato ou pode ser detectado em uma forma mais complexa, isto é, em que o carboidrato está presente em uma mistura mais complexa tal como em um tecido ou amostra biológica.
[071] O método da presente invenção é igualmente aplicável para detecção, identificação e/ou quantificação de carboidratos solúveis e insolúveis. É particularmente útil para a análise de carboidratos insolúveis, para à qual nenhum outro método de uso fácil está disponível até o momento. Carboidratos que podem ser analisados incluem carboidratos de qualquer tamanho, isto é, monossacarídeos bem como oligossacarídeos e polissacarídeos maiores. O carboidrato pode ser isolados dos outros compostos ou pode estar em uma mistura com outros compostos ou pode ser ligado de modo intermolecular ou covalente a outras moléculas ou estruturas. Exemplos de carboidratos que podem ser analisados incluem, porém sem limitação, os carboidratos demonstrados no presente documento; β-1,3-glucano, celulose, quitina, alginato de sódio, α-D-glicose, celulobiose, amilose, glicogênio, heparina e sulfato de condroitina A.
[072] O oligotiofeno conjugado luminescente (LCO) do método da presente invenção é qualquer LCO conforme definido no presente documento, que compreende homooligômeros de tiofeno. O oligotiofeno conjugado pode ser um oligotiofeno conjugado de 5 a 15 monômeros, preferencialmente um oligotiofeno conjugado pentamérico ou heptamérico. O LCO pode compreender, também, um ou mais grupos laterais funcionais tais como grupos laterais derivados de aminoácidos, derivados de aminoácido, neurotransmissores, monossacarídeos, polissacarídeos, ácidos nucleicos ou outros grupos laterais aniônicos, catiônicos ou zwitteriônicos. Exemplos de oligotiofeno conjugado heptamérico que pode ser utilizado no método da invenção incluem h-FTAA ou h-HTAA. Exemplos de oligotiofeno conjugado pentamérico que podem ser utilizados no método da invenção include pHTA-His, pHTA-Lys, pHTEA, pHTIm, pHTA-Tyr, pHTA-Arg, pHTA-Asp e pHTA-Glu.
[073] A ligação de LCO a carboidratos resulta em mudanças conformacionais da estrutura principal de LCO, que, por sua vez, altera processos intracadeia e intercadeia do LCO. Essa mudança conformacional pode ser detectada como um sinal de detecção do LCO, por exemplo, um sinal óptico tal como um sinal fluorométrico, ou um sinal elétrico tal como condutividade. Sinais fluorométricos podem ser detectados através de imageamento fluorescente, por exemplo, com uso de microscopia confocal de fluorescência. Alternativamente, sinais fluorométricos podem ser detectados por espectroscopia de fluorescência, através de excitação e emissão de espectros e/ou subsequentemente conjuntos únicos previamente definidos de excitação e emissão dependentes do LCO utilizado e/ou do carboidrato a ser determinado.
[074] Esta revelação apresenta, como prova de conceito, sinais espectrofluorométricos detectados por espectroscopia de fluorescência. Espectros de excitação e emissão e/ou subsequentemente conjuntos únicos previamente definidos de excitação e emissão são utilizados para demonstrar sensibilidade de LCOs a carboidratos. Tipicamente, os comprimentos de onda de excitação se encontram na faixa de 300 a 500 nm e os comprimentos de onda de emissão se encontram na faixa de 500 a 700 nm. A análise de espectros de excitação e emissão alimentam, então, a seleção de um único conjunto de excitação e emissão relevante. Cada carboidrato ligado induz torção diferente da estrutura principal de LCO, resultando em assinaturas espectrais únicas para cada carboidrato ligado. Essas assinaturas espectrais únicas e intensidades de sinal podem ser utilizadas para distinguir os compostos e, portanto, determinar sua identidade e quantidade em uma dada amostra, líquida ou em uma superfície.
[075] A propriedade de fluorescência de uma sonda tem o efeito direto na cor visual que a mesma apresenta. Isso pode, por sua vez, ser um parâmetro para detecção. Métodos colorimétricos indiretos em que um sinal detectado (de qualquer natureza) é representado por uma pseudo-cor podem servir, também, como meios de representação de ligação a alvo de LCO.
[076] Em modalidades alternativas, a mudança conformacional do LCO, e, portanto, a ligação do LCO ao seu alvo, pode ser detectada por métodos que são direcionados a monitorar desvios em parâmetros físicos. Isso pode incluir de modo não exclusivo óptica (FRET, resfriamento brusco com fluorescência, colorimétrica de absorção, índice de refração), propriedades de material (massa, propriedades visco-elásticas, espessura ou outras propriedades) e propriedades eletrônicas (condutividade de material, absorção ou liberação de íon, absorção ou liberação de eléctron, resistência).
[077] Em um ambiente de laboratório, a ligação do LCO ao seu alvo de carboidrato é adequadamente detectada através de sinalização fluorométrica. Métodos e dispositivos para detecção fluorométrica são bem conhecidos na técnica e incluem microscopia com base em fluorescência, por exemplo, microscopia confocal fluorescente e leitores de placa fluorométricos. Tais métodos e dispositivos são adequados para a detecção de carboidratos em solução, cultura ou amostras de tecido.
[078] Em outros ambientes, dispositivos de mão, conhecidos na técnica, para detecção de fluorescência podem ser mais adequados, por exemplo, em um ambiente industrial ou de hospital. Tais dispositivos compactos podem ser úteis, também, em ambientes em que peso mínimo é preferencial, tal como na indústria de transporte aéreo ou em veículos benéficos ao meio ambiente.
[079] Em outras modalidades, o LCO, ou uma combinação de LCOs, é adequadamente implantado como uma parte ativa de um dispositivo biossensor e/ou sensor baseado em chip, por exemplo, imobilizando-se o(s) LCO(s) em um substrato em uma célula biossensora. Grupos laterais modificáveis para o componente principal do LCO permite a adaptação funcional da sonda de LCO para uso em biossensores bem como para imobilização da sonda para o substrato. Um complexo entre o LCO e o carboidrato-alvo é formado na superfície do substrato, a formação de complexo que induz uma mudança física que pode ser transformada em um sinal de detecção. Adequadamente o dispositivo biossensor compreende um receptáculo para o dito substrato bem como meio de detecção. Descrevendo um dispositivo biossensor genérico, um biossensor de detecção de fluorescência pode, por exemplo, compreender uma fonte de luz interna ou externa para gerar energia de excitação para excitar o LCO ligado ao alvo, e um detector interno ou externo para detectar energia fluorescente gerada pelo LCO mediante detecção excitação.
[080] Com base no sinal de detecção detectado, vários tipos de informações relacionadas ao carboidrato podem ser determinados.
[081] Em uma modalidade do método, é determinado se o carboidrato está presente ou ausente no objeto ou na amostra. Conclusões de ausência ou presença de carboidrato podem, por exemplo, ser tiradas comparando-se o sinal fluorescente do LCO, conforme determinado, por exemplo, por imageamento de fluorescência confocal ou por espectroscopia de fluorescência, adquirido do objeto ou amostra analisada, com uma amostra de controle negativo que sabe-se não ter carboidratos. O controle negativo define a qualidade de sinal de sonda de LCO não ligada. Isso estabelece os comprimentos de onda de excitação/emissão de pico de linha de base e magnitude de sinal da dita sonda não ligada. Conclui-se que a amostra analisada compreende carboidrato quando um desvio para o vermelho no comprimento de onda de excitação/emissão de pico e/ou um aumento ou uma diminuição simultânea na magnitude de sinal é detectada. A mudança em propriedades de sinal a partir da linha de base depende da mudança geométrica na estrutura principal molecular da sonda, que surge da ligação positiva do LCO ao carboidrato. Essa ligação leva, em geral, a um desvio para o vermelho no comprimento de onda de excitação/emissão de pico e/ou um aumento na magnitude de sinal. Em alguns casos, a ligação do LCO com o carboidrato pode, no entanto, levar a resfriamento brusco do sinal fluorescente do LCO.
[082] Em uma modalidade, a quantidade de carboidrato que está presente no objeto ou na amostra é determinada. Para esse propósito, uma curva de calibração das propriedades de excitação e emissão de LCO selecionado ao longo de comprimentos de onda com quantidades conhecidas de um carboidrato específico é preparada. Um único conjunto de excitação/emissão específico a um carboidrato é definido, então, para o qual uma curva de calibração é construída, em que a curva de calibração define uma relação entre sinal de detecção de excitação/emissão e quantia de carboidrato. A magnitude do sinal de detecção adquirida a partir do objeto ou amostra analisada é comparada com a curva de calibração e a conclusão da quantia de carboidrato no objeto analisado ou na amostra analisada é tirada.
[083] Em outra modalidade, a identidade de carboidrato ou carboidratos que estão presente em um objeto ou em uma amostra é determinada. Em tal modalidade, um LCO com a capacidade de distinguir entre carboidratos diferentes é utilizado para entrar em contato com o objeto ou a amostra. O LCO a ser utilizado pode, por exemplo, ser selecionado por ser conhecido por se ligar a um carboidrato especifico, porém não a outros carboidratos. Um painel de LCOs gerados a partir de uma biblioteca de LCOs relacionados pode ser aplicado para a identificação do carboidrato ou carboidratos presentes em uma amostra. Alternativamente, o LCO a ser utilizado pode ter a capacidade de se ligar a vários tipos de carboidratos e render um sinal de detecção específico, por exemplo, um espectro de excitação/emissão específico para cada alvo. Assinaturas únicas do LCO para alvos de respectivos alvos de carboidrato permitem a identificação do componente ligado. Novamente nessa modalidade, um controle negativo é utilizado para definir as qualidades de linha de base do sinal de sondas não ligadas.
[084] Com base na geração de uma biblioteca de assinaturas espectrais de carboidratos conhecidos (controles positivos), a detecção da ausência de picos característicos durante a comparação de uma amostra conhecida com essa biblioteca sugere a ausência do carboidrato. A definição de um único conjunto de excitação/emissão para um carboidrato particular e construção subsequente de uma curva padrão serve, também, para concluir se o dito componente está ausente. Um painel de diferentes LCOs que são sensíveis a carboidratos excessivamente diferentes com base em estrutura/mudança pode ser utilizado, também, para identificar um grande grupo de substâncias poliméricas.
[085] Alternativamente, a detecção de um carboidrato identificado pode ser aperfeiçoada por modificação progressiva do protótipo de LCO. Essa modalidade englobaria a adição e/ou a remoção de grupos químicos funcionais da sonda para ou aperfeiçoar a ligação com uma molécula específica e/ou aperfeiçoar a propriedade fluorescente de um LCO ligado, de modo que a excitação/emissão de pico e magnitude de sinal se destaque contra pares de alvo de LCO.
[086] Os carboidratos são úteis em muitas áreas e são utilizados em várias aplicações como, por exemplo, fármacos, suplementos, condimentos e adoçantes, bem como materiais. LCOs são, portanto, úteis como indicadores para a produção e avaliação de qualidade de compostos de carboidrato para tais aplicações. O uso de LCOs na detecção, identificação e quantificação de carboidrato será, em grande parte, nas indústrias farmacêuticas e alimentícias, bem como em pesquisa.
[087] Em indústrias farmacêuticas, os carboidratos formam uma grande biblioteca de produtos. Grupos e produtos exemplificativos são suplementos de carboidrato; produtos biofarmacêuticos; materiais biodegradáveis para uso médico; fármacos, bem como filtros; polímeros; e superfícies. Heparina, um anticoagulante importante é um carboidrato bem conhecido para usos farmacêuticos. De modo similar, sulfato de condroitina A, um carboidrato particularmente relacionado à heparina, está no mercado como um suplemento de saúde. Os regulamentos de GMP ditam a importância de mostrar a identidade e pureza de um produto. O método de LCO da presente invenção pode ser aplicado como um método barato e rápido para tais finalidades. Os LCOs podem ser utilizados, também, como indicadores que mostram a eficiência de síntese para a produção de carboidratos importantes.
[088] Na indústria de alimentos e bebidas, adoçantes artificiais são comumente utilizados como substitutos de açúcar e, até certo ponto, como medidas de corte de custo. Condimentos e aditivos baseados em carboidrato também são crescentemente utilizados nas indústrias de alimentos e bebidas. A análise de adição relevante de carboidrato a alimentos e alteração dos mesmos pode se tornar crescentemente importante visto que as implicações de saúde a longo prazo para tais moléculas não são completamente compreendidas. Os LCOs pode, portanto, ser úteis na indicação da presença de carboidratos naturais específicos ou da presença e da identidade de moléculas substituídas que são carboidrato em natureza. A detecção de carboidratos metabolicamente importantes tais como glicose, amilose e glicogênio é mostrada nessa revelação.
[089] Em alimentos prontos e empacotados, os LCOs podem ser utilizados como indicadores que detectam uma mudança na qualidade de alimento quando colocados em proximidade próxima com os ditos itens alimentícios. Essa mudança pode ser a detecção da presença de um carboidrato que parece/se torna gradualmente detectado, visto que o alimento se desvia da qualidade original quando inicialmente feito.
[090] Os LCOs e os métodos revelados no presente documento podem ser utilizados em pesquisa básica para estudar e adquirir uma compreensão maior de formação e quebra de carboidratos e de características de carboidrato. A conversão de celulose em biocombustíveis foi o assunto de pesquisa extensiva. A celulose é convertida em celulobiose e glicose durante o processo. Isso pode englobar uma variedade ampla de ambientes em que a quantidade e a quantidade de carboidratos é relevante. Os desvios fluorométricos em perfis ópticos de LCO, adquiridos conforme um substrato de carboidrato é convertido em um produto, podem fornecer, novamente, um método barato e rápido para análise da eficiência de um método de síntese e da qualidade do produto formado. Os LCOs podem ser aplicados para rastrear a conversão de qualquer carboidrato detectável.
[091] Os LCOs pode ser adicionalmente utilizados na pesquisa biológica para análise de formação e/ou comportamento de uma entidade biológica que contém carboidrato tal como uma célula ou uma glicoproteína. Com uso dos LCOs da presente invenção, tal pesquisa pode ser realizada in vitro, in vivo ou em uma amostra de tecido vivo in situ.
[092] As sondas nessa revelação são sensíveis a carboidratos estruturais na matriz extracelular (ECM) de biofilme microbiano. Diferentes micróbios são conhecidos por utilizar uma variedade de possíveis carboidratos estruturais em sua ECM, em que os melhores carboidratos conhecidos são celulose, β-1,3-glucano, quitina e alginato. A identificação com base em carboidrato de morfologias e quantidade de biofilme pode ser uma abordagem inovadora e altamente precisa para detecção de biofilme. Visto que a ECM de um biofilme é uma organização heterogênea de estruturas insolúveis, um painel de diferentes LCOs permitirá a identificação de tais estruturas insolúveis. Adicionalmente, visto que acredita-se que a composição de biofilme formada a partir de diferentes espécies de bactérias seja única, um painel de diferentes LCOs também permite a identificação de diferentes espécies bacterianas.
[093] Na indústria de plantas e florestamento, materiais e produtos (madeira, polpa e papel) são primariamente carboidratos (carboidratos estruturais insolúveis). Madeira, polpa e papel que se originam de diferentes fontes (por exemplo, diferentes árvores) podem ser detectados determinando-se o perfil do tipo, da quantidade e da qualidade dos carboidratos compostos. Os LCOs com a habilidade de detectar carboidratos podem ser de grande uso para essa finalidade. De modo similar, a qualidade de madeira, polpa e papel pode ser identificada com uso de LCOs. Isso pode envolver aplicar LCOs para determinar a pureza de carboidratos presentes.
[094] Conforme será demonstrado abaixo, a habilidade dos LCOs da presente invenção de alvejar não só proteínas amiloides porém também carboidratos foi surpreendentemente constatada enquanto se estudava biofilme. Os biofilmes são matrizes em 3D complexas e heterogêneas que compreendem uma população de células microbianas, que são embutidas em uma matriz extracelular (ECM). Dois componentes bem caracterizados da ECM são polissacarídeos estruturais, tal como celulose, e o de proteína amiloide. Os seguintes exemplos demonstram a habilidade de LCOs de alvejar e identificar o componente de carboidrato de biofilmes, carboidratos de armazenamento mamíferos, intermediários metabólicos de carboidratos e glicosoaminoglicanos, tanto em estudos finais quanto estudos em tempo real, bem como detectar, identificar e quantificar carboidratos em estruturas complexas tal como biofilme e em forma mais pura.
[095] Demonstrar que o protótipo H-FTAA de LCO tem a capacidade de detectar um componente de carboidrato, isto é, celulose, em biofilme com uso de análise confocal.
[096] Para verificar a morfologia de biofilme relacionada à produção de curli e/ou celulose, cepa de tipo selvagem 3934 de S. enteritidis e mutações isogênicas ΔbscA (curli+, celulose-), ΔcsgA(curli-, celulose+), e ΔcsgD (curli-, celulose-) foram cultivadas em placas de ágar de caldo de lisogenia (LB) (sem sal), suplementadas com vermelho do Congo (40 μg/ml) e azul brilhante de Coomassie G-250 (20 μg/ml). As placas foram incubadas por 48 h em 28 °C.
[097] Lamínulas de vidro foram introduzidas nas cavidades de uma placa de 6 cavidades (de acordo com a configuração mostrada na Figura 2A) para fornecer superfícies para formação de biofilme, que, no fim do experimento, pudessem ser facilmente removidas para análise microscópica. Para preparar o experimento de biofilme, culturas individuais de cepa de tipo selvagem 3934 de S. enteritidis e mutações isogênicas ΔbscA, ΔcsgA, e ΔcsgD foram cultivadas em meio de LB em frascos durante a noite. Cada cultura foi diluída 100 vezes em LB fresco e cultivada em um incubador de agitação (230 rpm) em 37 °C a OD600 = 0,6. As culturas foram diluídas a uma densidade de cultura de 105CFU/ml em LB sem sal e dispensadas nas placas de 6 cavidades que continham lamínula em alíquotas de 8 ml. Após a incubação das placas por 48 h em 28 °C, as lamínulas de vidro foram removidas e lavadas duas vezes com PBS antes da fixação em 4 ml de 4% de formaldeído por 1 h. As amostras fixas forma lavadas duas vezes, então imersas em soluções de h-FTAA (2 μg/ml), h-HTAA (2 μg/ml) e PBS respectivamente, por 30 minutos no escuro. O PBS funcionou como o controle negativo, utilizado para avaliar o nível de autofluorescência. As lâminas tratadas foram lavadas, então, duas vezes com PBS e montadas com Vectashield® para análise de microscopia de varredura a laser com base em fluorescência. Especificamente, a borda do biofilme formada na interface de líquido e ar foi visualizada com uso dos filtros de fluorescência apropriados. Na Figura 2C a D cada lâmina é representada por uma imagem que mostra a fluorescência produzida por biofilme ligado a LCOs quando excitados (lado esquerdo). O lado direito é uma sobreposição de uma inspeção óptica de presença bacteriana em por contraste de fase com fluorescência de LCO. Contraste de fase é um método tradicional para confirmação visual de fixação de biofilme em superfícies.
[098] Todas as cepas mostraram o morfotipo esperado no ensaio de vermelho do Congo (a Figura 2B). As especificidades de cada morfotipo de cepa são relacionadas à sua capacidade de formação de biofilme em termos de produção de curli e celulose, e essa conexão foi previamente relatada por outros.
[099] O ensaio de LCO tem a capacidade de diferencial morfologias de curli/celulose (Figura 2C a D, em que a Figura 2C mostra resultados para h-FTAA e a Figura 2D para h-HTAA). O sinal fluorescente dos LCOs (h-FTAA bem como h-HTAA) coincide com agregados de bactérias visíveis quando verificados por microscopia de contraste de fase. Com curli presente (tipo selvagem e ΔbscA), o biofilme formado foi grande e em agrupamentos separados. Quando somente celulose é expressa (ΔcsgA), a quantidade de biofilme fixado em lamínula foi reduzida em grande parte, aparecendo como uma camada fina de células fluorescentes. h-FTAA gerou um sinal fluorescente que coincidia com os agregados de bactérias visíveis produzidos por celulose+e curli-ΔcsgA. ΔcsgD, que não tem tanto expressão de curli quanto expressão de celulose, não produziu biofilme detectável.
[0100] A microscopia de contraste de fase mostra características superficiais da morfologia de biofilme. As observações ópticas feitas sobre a morfologia de biofilme coincidiram com aquelas de análise confocal de fluorescência de LCOs ligados a biofilme.
[0101] As sondas de LCO se ligaram aos biofilmes e permitiram a visualização de biofilmes sob a análise de fluorescência. Além de as mesmas serem permitidas discriminar as morfologias de biofilmes que se originam dos diferentes fenótipos bacterianos. A sonda de H-FTAA de LCO mostrou render um sinal de detecção de fluorescência para a cepa ΔcsgA, que expressa celulose porém não curli, indicando que h-FTAA tem a capacidade de detectar outro componente que não seja curli, possivelmente celulose.
[0102] Mostrar a habilidade de LCOs de discriminar entre morfologias de biofilme que compreendem teor de curli e celulose diferente, mostrando-se os processos de LCOs de assinatura espectral única LCOs com cada biofilme.
[0103] Uma cultura noturna fresca da cepa de tipo selvagem 3934 de S. enteritidis e mutações isogênicas (ΔbscA; ΔcsgAe ΔcsgD)foi inoculada em LB fresco e cultivada em 37 °C a OD600 = 0,6. Após a diluição de cada respectiva cultura com LB (sem sal) a uma densidade celular de 105 CFU/ml, a mesma foi separada em alíquotas em três frascos separados. h-FTAA (2 μg/ml) e h-HTAA (2 μg/ml) foram, cada um, adicionados a dois dos frascos, enquanto que PBS, utilizado como controle, foi adicionado ao terceiro frasco. 50 μl de cada cultura foram inoculados em seguida em triplicados em cavidades separadas de placas de 96 cavidades e incubado em 28 °C por 48 horas.
[0104] Após remover as culturas de biofilme do incubador, nenhuma etapa de processamento foi implantada antes da detecção de sinais de LCO. As placas foram lidas com uso do Leitor de Microplaca de Múltiplos Modos baseado em Monocromador Mx de Sinergia. Os espectros de excitação de LCOs foram coletados excitando-se a amostra de 300 a 500 nm e detectando-se a emissão em 545 nm. Os espectros de emissão para LCOs ligados a curli foram coletados lendo-se o sinal de emissão entre 500 a 700 nm quando a amostra foi excitada em 405 nm. Os espectros de emissão para LCOs ligado a celulose foram coletados lendo-se o sinal de emissão entre 520 a 700 nm quando a amostra foi excitada em 500 nm.
[0105] Perfis espectrais de h-HTAA não diferenciaram morfologias de biofilme formadas por mutações isogênicas diferentes (Figura 3A). Os padrões de espectros de excitação de h-HTAA foram idênticos ao longo de todas as cepas isogênicas. Por outro lado, h-FTAA produziu padrões espectrais distinguíveis de picos e ombros de excitação com cada cepa (a Figura 3B). Quando h-FTAA é excitado em 380 nm na presença de curli (tipo selvagem e ΔbscA), um pique único em emissão (ombro de excitação) é detectado. Quando h-FTAA é excitado em 380 nm na ausência de curli (ΔcsgA ΔcsgD), um pique em emissão (ombro de excitação) em aproximadamente 355 nm é detectado ao invés. Finalmente, quando h-FTAA é excitado em 480 nm na presença de celulose (tipo selvagem e ΔcsgA) uma emissão de pico único é detectada.
[0106] Em uma visão geral, h-FTAA em cepas positivas para curli (tipo selvagem e ΔbscA) teve emissão mais alta quando excitado entre 360 nm e 425 nm. Os dados sugerem que a excitação de h-FTAA ligado a biofilme abaixo de 425 nm geram um sinal mais específico para curli ligado a h- FTAA, enquanto que excitação acima de 480 nm gera um sinal mais específico para celulose ligada a h-FTAA.
[0107] O uso de um comprimento de onda de excitação de 405 nm para curli e 500 nm para celulose respectivamente, os espectros de emissão para as cepas isogênicas e tipo selvagem de S. enteritidis foram analisados.
[0108] Quando excitado em 405 nm (a Figura 3C), h-FTAA em cepas positivas para curli (tipo selvagem e bscA) teve uma intensidade de sinal emitido mais alta em aproximadamente 556 nm versus ΔcsgA e ΔcsgD negativos para curli. A comparação de tipo selvagem, ΔbscA e ΔcsgA com ΔcsgD indica que quando o biofilme é expresso há um desvio para o vermelho no pico de emissão de 525 nm a 550 a 560 nm.
[0109] Com uso de um comprimento de onda de excitação de 500 nm (Figura 3D), a emissão de h-FTAA foi mais alta ao longo de todos os comprimentos de onda em cepas positivas para celulose com dois picos proeminentes em emissão em 560 e 600 nm. O pico de emissão único em 600 nm formou um sinal específico à celulose que discrimina sua presença de biofilmes negativos para celulose.
[0110] O h-FTAA de LCO produz assinaturas espectrais únicas para cada morfologia de biofilme. O h-FTAA discrimina biofilme com base em perfis espectrais únicos através da interação com os componentes de ECM curli e celulose. O método não exige separação física de biofilme de uma cultura crua. O h-HTAA de LCO não pode diferenciar quantias de biofilme diferentes formadas por diferentes fenótipos bacterianos sem etapas de lavagem. O h-HTAA pode ser aplicado melhor como uma sonda geral para detecção de biofilme com etapas de lavagem similares ao violeta de genciana. No entanto, o h-HTAA tem a vantagem de ser uma sonda não bactericida que pode estar presente no meio de crescimento durante todo o experimento.
[0111] Verificar a habilidade do H-FTAA de LCO de alvejar e gerar uma assinatura espectral para celulose e verificar sua utilidade na quantificação de celulose.
[0112] Diluições seriais de duas vezes de suspensões de celulose microcristalinas insolúveis de 6,25 mg/ml a 0,0488 foram preparadas às quais h-FTAA foi adicionado a uma concentração de 3 μM. Alíquotas de 100 μl foram dispensadas em uma placa de 96 cavidades. As placas foram lidas com uso do Leitor de Microplaca de Múltiplos Modos baseado em Monocromador Mx de Sinergia. Os espectros de excitação de LCOs foram coletados excitando-se a amostra de 300 a 500 nm e detectando-se a emissão em 545 nm. As concentrações de celulose mostradas aqui são 6,25 mg/ml, 3,125 mg/ml, 1,5625 mg/ml e 0,78125 mg/ml.
[0113] Na presença de celulose pura, a excitação de h-FTAA em aproximadamente 480 nm gera um pico em emissão detectada em 545 nm (Figura 4). Essa intensidade de sinal aumentou proporcionalmente com concentração de celulose, verificando que h-FTAA se liga, de fato, a celulose.
[0114] O H-FTAA de LCO heptamérico pode ser utilizado para detecção e quantificação do celulose de carboidrato.
[0115] Demonstrar o uso de h-FTAA em rastreamento em tempo real de formação de biofilme, mostrando a mudança em RFU (unidade de fluorescência relativa) correlacionada a biofilme com o tempo em relação ao crescimento de cultura.
[0116] A turbidez de uma cultura bacteriana, medida por absorbância em OD600, é utilizada para definir densidade de cultura. A expressão de GFP fornece uma representação direta de crescimento bacteriano e densidade de cultura. O tipo selvagem de S. enteritidis 3934 e as mutações isogênicas ΔbscA, ΔcsgAe ΔcsgDforam transformadas com o plasmídeo P2777 que porta o gene gfp para uma representação mais direta de densidade de cultura através de detecção de fluorescência. Culturas noturnas frescas de cada cepa foram inoculadas em LB fresco e cultivadas em 37 °C a OD600 = 0,6. Após diluir a cultura com LB (sem sal) a uma densidade celular de 105CFU/ml, a mesma foi separada em alíquotas em dois frascos. O h-FTAA (2 μg/ml) foi adicionado a um frasco, enquanto que o PBS, utilizado como um controle, foi adicionado ao segundo frasco. 50 μl de cada mistura de cultura foram inoculados em triplicados em 4 placas de 96 cavidades e incubados em 28 °C. As placas foram lidas para expressão de GFP bem como sinal de h-FTAA ligado a curli (Excitação 405 nm, Emissão 556 nm) e sinal de h-FTAA ligado à curli (Excitação 500 nm, Emissão 600 nm) em tandem de hora em hora durante 48 horas, para permitir varreduras de intervalo de 4 horas de cada placa na tentativa de evitar o branqueamento de fluoróforos. Os dados de RFU de GFP e h-FTAA das quatro placas foram combinados em um único gráfico para visualizar a mudança de hora em hora nos sinais com o tempo.
[0117] A comparação da tendência de aumento em sinal de GFP plotado contra absorbância em OD600 em culturas de biofilme mostrou correlação próxima (Figura 5A). A absorbância de plotagem contra sinal GFP gerou um valor R2de 0,9423 (a Figura 5B), sugerindo correlação próxima dos dois sinais. Isso indicou que a expressão de GFP pode ser utilizada como um meio para monitorar crescimento bacteriano.
[0118] O rastreamento de sinais de h-FTAA (Figura 5C a F) em paralelo com fluorescência de GFP mostra a relação temporal entre as fases de formação de biofilme e crescimento de cultura. Na cepa de tipo selvagem 3934 de S. enteritidis (Figura 5C), o sinal de GFP se mantém constante nas primeiras 6 horas (fase de atraso) antes de aumentar exponencialmente (fase de crescimento logarítmica) antes de alcançar um platô em 15 horas (fase estacionária). Em relação, tanto o sinal de curli quanto o sinal de celulose se mantêm constante pelas primeiras 16 horas, então aumentam para um platô após 22 horas. Os dados implicam que a formação de biofilme é iniciada na fase exponencial tardia de crescimento de cultura e que a produção de celulose e curli é simultânea.
[0119] O sinal de h-FTAA detectado não contém vazamento significativo através da fluorescência de GFP. Observando-se o perfil de fluorescência de ΔcsgD de hora em hora durante 48 horas em um ensaio paralelo, o aumento no sinal de GFP não causou um aumento em sinais de curli e celulose (Figura 5D). A tendência observada nos conjuntos de excitação e emissão para rastreamento de curli e celulose não foi, portanto, o resultado de sobrecarga de sinal da presença de GFP.
[0120] A análise de ΔcsgA (Figura 5E) mostra que na ausência de expressão de curli a cinética de formação de biofilme é alterada. O início de expressão de celulose de pico ocorre mais cedo em 13 horas, alcança um platô em 18 horas com uma taxa mais alta. A intensidade de RFU no platô também é mais alta que o tipo selvagem quando na mesma fase de crescimento de biofilme. Isso indica que a expressão de celulose pode ser aumentada em resposta à ausência de curli. Devido ao perfil de emissão ampla de h-FTAA ligado à celulose, uma quantia substancial de repercussão é detectada no calão de fluorescência de curli.
[0121] A análise de ΔbscA (a Figura 5F) mostra que na ausência de expressão de celulose a expressão de curli não segue mais uma tendência sigmoide vista na Figura 6C. A produção de curli parece aumentar gradualmente durante todo o processo. Uma vez mais, devido ao espectro de emissão amplo de LCO ligado a curli, um grau de repercussão é detectado no canal de fluorescência de celulose.
[0122] Quando a celulose não está presente na ECM, como em ΔbscA (Figura 5F), a dinâmica de formação de ECM é alterada. Em contrapartida às culturas de tipo selvagem (Figura 5C) e ΔcsgA (Figura 5E), não houve “atraso de tempo” aparente entre a fase exponencial de crescimento de cultura e a indução de formação de ECM. A produção de curli pareceu aumentar gradualmente durante todo o processo.
[0123] A sonda de h-FTAA de LCO permite análise de formação de biofilme em tempo real. Os sinais específicos a celulose e curli podem ser detectados a cada hora em uma cultura contínua. O aumento em sinal com o tempo reflete o aumento em quantidade de biofilme conforme o mesmo está sendo formado. A comparação de sinais de crescimento de cultura (representado pelo sinal de GFP) e de biofilme do h-FTAA sugerem que a formação de biofilme ocorre quando a cultura alcança a fase estacionária, que está em concordância com estudos anteriores. Os canais selecionados para detecção de curli e celulose não experimentam ruído significativo de fluorescência de GFP. O espectro de emissão amplo de h-FTAA ligado a curli/celulose vaza para o canal de GFP. No entanto, isso não afeta a análise. EXEMPLO 5 - Avaliação da habilidade de LCOs de ligar e discriminar carboidratos estruturais (por exemplo, β- 1,3-glucano, celulose, quitina, alginato de sódio), substratos metabólicos e intermediários (por exemplo, α-D- glicose, celulobiose), carboidratos de armazenamento (por exemplo, amilose, glicogênio) e glicoaminoglicanos (por exemplo, heparina, sulfato de condroitina A).
[0124] Demonstrar o uso de LCOs pentaméricos na diferenciação de β-1,3-glucano, celulose, quitina, alginato de sódio, α-D-glicose, celulobiose, amilose, glicogênio, heparina, e sulfato de condroitina A estudando-se as mudanças no comprimento de onda de excitação para a emissão máxima (Àmáx) e a correlação entre intensidade de sinal e concentração de carboidrato.
[0125] Diluições seriais de suspensões de carboidrato foram preparadas em dH2O. As concentrações na faixa de 10 a 0,039 mg/ml foram utilizadas para β-1,3- glucano, celulose e quitina, enquanto que 5 a 0,019 mg/ml foram utilizadas para alginato de sódio, glicose, amilose, glicogênio, celulobiose, heparina, sulfato de condroitina A. 3 μM de cada sonda de LCO foram adicionados a alíquotas de 1 ml de cada concentração de carboidrato, após o que 100 μl foram dispensados em triplicados em placas de 96 cavidades. Os espectros de excitação foram coletados excitando-se a amostra de 300 a 500 nm e detectando-se emissão em 545 nm. A detecção de carboidrato é concluída quando há uma mudança reproduzível em Àmáx e/ou intensidade de RFU com referência ao controle negativo. Os dados das três concentrações, bem como do controle negativo, são mostrados para cada carboidrato conforme especificado na respectiva figura.
[0126] A correlação e tendência entre intensidade de sinal e concentração de carboidrato foi mostrada por plotagem da concentração do carboidrato contra o sinal fluorescente correspondente de LCO ligado a carboidrato. O comprimento de onda de excitação (emissão detectada em 545 nm) selecionado para cada LCO é ou (1) a Àmáx, ou (2) o comprimento de onda de excitação que sofre o plano de fundo mais baixo. Uma análise de regressão linear é realizada para determinar a relação entre a concentração de carboidrato e RFU.
[0127] Os resultados são mostrados nas Figuras 6 a 25 e são resumidos nas Tabelas 1 a 10 abaixo. Tabela 1: β-1,3-glucano (10 a 0,039 mg/ml) Tabela 2: Celulose (10 a 0,039 mg/ml)
Tabela 3: Quitina (10 a 0,039 mg/ml)
Tabela 4: Alginato de Sódio (5 a 0,019 mg/ml)
Tabela 5: Glicose (5 a 0,019 mg/ml)
Tabela 6: Amilose (5 a 0,019 mg/ml)
Tabela 7: Glicogênio (5 a 0,019 mg/ml)
Tabela 8: Celulobiose (5 a 0,019 mg/ml)
Tabela 9: Heparina (5 a 0,019 mg/ml)
Tabela 10: Sulfato de Condroitina A (5 a 0,019 mg/ml)
[0124] Com base em uma mudança (positiva ou negativa) em magnitude de sinal detectado e/ou um desvio em Àmáx mediante ligação do LCO ao carboidrato, conclui-se que os carboidratos podem ser detectados e/ou diferenciados por LCOs específicos conforme indicado abaixo: β-1,3-GlucanopHTA-Asp, pHTA-Arg, pHTEA, pHTA-Glu, pHTA-Lys Celulose pHTA-Arg, pHTA-His, pHTEA, pHTIm, pHTA-Lys Quitina pHTA-Tyr, pHTA-Asp, pHTA-Arg, pHTA-His, pHTEA, pHTIm, pHTA-Glu, pHTA-Lys Alginato de sódio pHTA-Arg, pHTA-His, pHTEA, pHTIm, pHTA-Lys Glicose pHTA-Tyr, pHTA-Asp, pHTA-Glu Amilose pHTA-Asp, pHTA-His, pHTEA, pHTIm, pHTA-Glu, pHTA-Lys Glicogênio pHTA-Tyr, pHTA-Asp, pHTA-Arg, pHTA-His, pHTEA, pHTIm pHTA-Glu, pHTA-Lys Celulobiose pHTA-Tyr, pHTA-Asp, pHTA-Glu Heparina pHTA-Arg, pHTIm, pHTA-Glu Sulfato de condroitina A: pHTA-Tyr, pHTA-Arg, pHTA- His. pHTEA, pHTIm, pHTA-Lys.
Claims (15)
1. MÉTODO PARA DETECÇÃO, IDENTIFICAÇÃO E/OU QUANTIFICAÇÃO DE UM OU MAIS CARBOIDRATOS, caracterizado por compreender as etapas de: a) colocar um objeto ou uma amostra em contato com um oligotiofeno conjugado luminescente; b) detectar pelo menos um sinal de detecção do oligotiofeno conjugado luminescente; e c) baseado no dito sinal de detecção detectado, determinar a presença, a identidade e/ou a quantidade do carboidrato ou dos carboidratos no dito objeto ou na dita amostra.
2. MÉTODO, de acordo com a reivindicação 1, caracterizado pelo dito oligotiofeno conjugado luminescente ser um oligotiofeno conjugado luminescente de cinco a 15 monômeros.
3. MÉTODO, de acordo com a reivindicação 1, caracterizado pelo dito oligotiofeno conjugado luminescente ser um oligotiofeno conjugado luminescente pentamérico ou heptamérico.
4. MÉTODO, de acordo com qualquer uma das reivindicações 2 a 3, caracterizado pelo dito oligotiofeno conjugado luminescente compreender uma ou mais cadeias laterais funcionais.
5. MÉTODO, de acordo com a reivindicação 4, caracterizado pela(s) dita(s) cadeia(s) lateral(ais) funcional(ais) ser/serem selecionada(s) dentre aminoácidos, derivados de aminoácido, neurotransmissores, monossacarídeos, polissacarídeos, ácidos nucleicos e derivados bem como combinações dos mesmos.
6. MÉTODO, de acordo com qualquer uma das reivindicações 1 a 5, caracterizado pelo dito oligotiofeno conjugado luminescente heptamérico ser h-FTAA ou h-HTAA, e o dito oligotiofeno conjugado luminescente pentamérico é qualquer um dentre pHTA-His, pHTA-Lys, pHTEA, pHTIm, pHTA- Tyr, pHTA-Arg, pHTA-Asp e pHTA-Glu.
7. MÉTODO, de acordo com qualquer uma das reivindicações 1 a 6, caracterizado pelo dito sinal de detecção ser um sinal óptico tal como um sinal fluorescente, um sinal colorimétrico ou um sinal elétrico tal como condutividade.
8. MÉTODO, de acordo com qualquer uma das reivindicações 1 a 7, caracterizado pelo oligotiofeno conjugado luminescente ter a capacidade de discriminar entre pelo menos dois carboidratos diferentes.
9. MÉTODO, de acordo com qualquer uma das reivindicações 1 a 8, caracterizado por pelo menos um dos carboidratos ser um carboidrato insolúvel.
10. MÉTODO, de acordo com a reivindicação 9, caracterizado pelo dito polissacarídeo insolúvel ser qualquer um dentre celulose, quitina, β-glucano, alginato, amilose e glicogênio, ou combinações dos mesmos.
11. MÉTODO, de acordo com qualquer uma das reivindicações 1 a 9, caracterizado por pelo menos um dos carboidratos ser um carboidrato solúvel.
12. MÉTODO, de acordo com a reivindicação 11, caracterizado pelo dito carboidrato solúvel ser qualquer um dentre glicose, celulobiose, heparina, sulfato de condroitina A, ou combinações dos mesmos.
13. MÉTODO, de acordo com qualquer uma das reivindicações 1 a 12, caracterizado por pelo menos um dos carboidratos ser um carboidrato estrutural, um carboidrato de armazenamento, um glicoaminoglicano, um produto intermediário de conversão de carboidrato e/ou um substrato metabólico.
14. MÉTODO, de acordo com qualquer uma das reivindicações 1 a 13, caracterizado por pelo menos a etapa a) e/ou a etapa b) ser ou serem executadas IN VIVO, IN VITRO ou IN SITU.
15. USO DE UM OLIGOTIOFENO CONJUGADO LUMINESCENTE, caracterizado por ser para detecção, identificação e/ou quantificação de um ou mais carboidratos.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SE1250751A SE536793C2 (sv) | 2012-07-02 | 2012-07-02 | Detektion av kolhydrater |
| SE1250751-3 | 2012-07-02 | ||
| PCT/SE2013/050810 WO2014007730A1 (en) | 2012-07-02 | 2013-06-27 | Carbohydrate detection |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112014032974A2 BR112014032974A2 (pt) | 2017-06-27 |
| BR112014032974B1 true BR112014032974B1 (pt) | 2021-09-14 |
Family
ID=49882344
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112014032974-5A BR112014032974B1 (pt) | 2012-07-02 | 2013-06-27 | Método para detecção, identificação e/ou quantificação de um ou mais carboidratos e uso de um oligotiofeno conjugado luminescente |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US9958439B2 (pt) |
| EP (1) | EP2867673B1 (pt) |
| JP (1) | JP6317342B2 (pt) |
| AU (1) | AU2013285614B2 (pt) |
| BR (1) | BR112014032974B1 (pt) |
| CA (1) | CA2877470C (pt) |
| IN (1) | IN2014DN10649A (pt) |
| NO (1) | NO2867673T3 (pt) |
| PL (1) | PL2867673T3 (pt) |
| SE (1) | SE536793C2 (pt) |
| WO (1) | WO2014007730A1 (pt) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2016331156B2 (en) * | 2015-10-01 | 2022-03-03 | Richter Life Science Development Ab | Detection of microbial peptides |
| FR3050271B1 (fr) | 2016-04-18 | 2018-04-13 | Centre National De La Recherche Scientifique | Procede de sequencage d'oligosaccharides |
| DE102016113166B4 (de) * | 2016-07-18 | 2022-02-24 | Joanneum Research Forschungsgesellschaft Mbh | Verfahren zum Nachweis eines Biofilms und Mittel zum Nachweis eines Biofilms |
| SE543571C2 (en) * | 2019-02-07 | 2021-03-30 | Christian Strietzel | Conducting redox oligomers |
| JP2020165847A (ja) * | 2019-03-29 | 2020-10-08 | 株式会社島津製作所 | 食品の品質判定方法、及び、食品品質判定装置 |
| US20230151405A1 (en) * | 2020-04-15 | 2023-05-18 | The Penn State Research Foundation | Biodegradable dna-alginate conjugate for reversible protein and cell labeling and imaging |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4777898B2 (ja) | 2003-10-31 | 2011-09-21 | イミューネティクス インコーポレイテッド | 血小板への雑菌混入検出を目的とするペプチドグリカンに基づく迅速アッセイ法 |
| WO2007075595A2 (en) * | 2005-12-20 | 2007-07-05 | Vertex Pharmacueticals Incorporated | Biofilm assay |
| WO2010044743A1 (en) | 2008-10-17 | 2010-04-22 | Biochromix Pharma Ab | Novel thiophene compounds for use in theraphy |
| JP5766721B2 (ja) * | 2010-02-16 | 2015-08-19 | セルミノバ・エービーCelluminova AB | 分子プローブとしてのオリゴチオフェン誘導体 |
| GB201020236D0 (en) * | 2010-11-30 | 2011-01-12 | Convatec Technologies Inc | A composition for detecting biofilms on viable tissues |
-
2012
- 2012-07-02 SE SE1250751A patent/SE536793C2/sv not_active IP Right Cessation
-
2013
- 2013-06-27 PL PL13813945T patent/PL2867673T3/pl unknown
- 2013-06-27 CA CA2877470A patent/CA2877470C/en active Active
- 2013-06-27 JP JP2015520123A patent/JP6317342B2/ja active Active
- 2013-06-27 US US14/408,440 patent/US9958439B2/en active Active
- 2013-06-27 AU AU2013285614A patent/AU2013285614B2/en active Active
- 2013-06-27 IN IN10649DEN2014 patent/IN2014DN10649A/en unknown
- 2013-06-27 WO PCT/SE2013/050810 patent/WO2014007730A1/en active Application Filing
- 2013-06-27 NO NO13813945A patent/NO2867673T3/no unknown
- 2013-06-27 EP EP13813945.6A patent/EP2867673B1/en active Active
- 2013-06-27 BR BR112014032974-5A patent/BR112014032974B1/pt active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| WO2014007730A1 (en) | 2014-01-09 |
| JP6317342B2 (ja) | 2018-04-25 |
| CA2877470C (en) | 2022-07-19 |
| NO2867673T3 (pt) | 2018-05-05 |
| JP2015524552A (ja) | 2015-08-24 |
| US20150212076A1 (en) | 2015-07-30 |
| EP2867673A1 (en) | 2015-05-06 |
| EP2867673A4 (en) | 2016-03-02 |
| US9958439B2 (en) | 2018-05-01 |
| AU2013285614A1 (en) | 2015-01-22 |
| SE1250751A1 (sv) | 2014-01-03 |
| SE536793C2 (sv) | 2014-08-19 |
| CA2877470A1 (en) | 2014-01-09 |
| IN2014DN10649A (pt) | 2015-09-11 |
| BR112014032974A2 (pt) | 2017-06-27 |
| PL2867673T3 (pl) | 2018-07-31 |
| EP2867673B1 (en) | 2017-12-06 |
| AU2013285614B2 (en) | 2018-10-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| BR112014032974B1 (pt) | Método para detecção, identificação e/ou quantificação de um ou mais carboidratos e uso de um oligotiofeno conjugado luminescente | |
| Schlafer et al. | Confocal microscopy imaging of the biofilm matrix | |
| Si et al. | Rapid and accurate detection of Escherichia coli growth by fluorescent pH-sensitive organic nanoparticles for high-throughput screening applications | |
| Levitt et al. | Fluorescence lifetime and polarization-resolved imaging in cell biology | |
| Liu et al. | A facile, sensitive and selective fluorescent probe for heparin based on aggregation-induced emission | |
| EP2217927B1 (en) | Visual glucose sensor and methods of use thereof | |
| Mudliar et al. | An efficient J-aggregate based fluorescence turn-on and ratiometric sensor for heparin | |
| Wu et al. | A novel colorimetric aptasensor for detection of chloramphenicol based on lanthanum ion–assisted gold nanoparticle aggregation and smartphone imaging | |
| Liu et al. | Development of fluorescent probes targeting the cell wall of pathogenic bacteria | |
| Amdursky et al. | Excited-state proton transfer of photoacids adsorbed on biomaterials | |
| McGoverin et al. | Optical methods for bacterial detection and characterization | |
| Si et al. | Carboxylate-containing two-photon probe for the simultaneous detection of extra-and intracellular pH values in colon cancer tissue | |
| Chen et al. | Amyloid-like staining property of RADA16-I nanofibers and its potential application in detecting and imaging the nanomaterial | |
| Li et al. | Near-infrared-fluorescent probe for turn-on lipopolysaccharide analysis based on PEG-modified gold nanorods with plasmon-enhanced fluorescence | |
| Hou et al. | Pyrene-porphyrin based ratiometric fluorescent sensor array for discrimination of glycosaminoglycans | |
| Ge et al. | Utilizing hyaluronic acid as a versatile platform for fluorescence resonance energy transfer-based glucose sensing | |
| US20140024813A1 (en) | Binding of pathological forms of proteins using conjugated polyelectrolytes | |
| Francoia et al. | A KISS (keep it simple, sensor) array for glycosaminoglycans | |
| Jia et al. | Dyes inspired sensor arrays for discrimination of glycosaminoglycans | |
| Meng et al. | A Multiple‐Stimulus‐Responsive Biomimetic Assembly Based on a Polyisocyanopeptide and Conjugated Polymer | |
| CN107941773A (zh) | 一种基于荧光分子的内毒素的检测方法 | |
| Leong et al. | Surface-Enhanced Raman Scattering-Based Surface Chemotaxonomy: Combining Bacteria Extracellular Matrices and Machine Learning for Rapid and Universal Species Identification | |
| Xu et al. | A simple fluorescent strategy for in situ evaluation of cell surface carbohydrate with a quantum dot–lectin nanoprobe | |
| Nesměrák et al. | Spectrometric methods in pharmaceutical analysis of glycosaminoglycans: the state-of-the-art | |
| BR102012003901A2 (pt) | dispositivo óptico para detecção de marcador específico de lesão cardíaca |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B06I | Publication of requirement cancelled [chapter 6.9 patent gazette] |
Free format text: ANULADA A PUBLICACAO CODIGO 6.6.1 NA RPI NO 2462 DE 13/03/2018 POR TER SIDO INDEVIDA. |
|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 27/06/2013, OBSERVADAS AS CONDICOES LEGAIS. |