BR112014025527B1 - Método para detectar um ou mais micro-organismos em uma amostra, vaso para medição de uma quantidade desejada de uma amostra e montagem de tampa - Google Patents
Método para detectar um ou mais micro-organismos em uma amostra, vaso para medição de uma quantidade desejada de uma amostra e montagem de tampa Download PDFInfo
- Publication number
- BR112014025527B1 BR112014025527B1 BR112014025527-0A BR112014025527A BR112014025527B1 BR 112014025527 B1 BR112014025527 B1 BR 112014025527B1 BR 112014025527 A BR112014025527 A BR 112014025527A BR 112014025527 B1 BR112014025527 B1 BR 112014025527B1
- Authority
- BR
- Brazil
- Prior art keywords
- sample
- reservoir
- sers
- needle
- culture
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54313—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals the carrier being characterised by its particulate form
- G01N33/54326—Magnetic particles
- G01N33/54333—Modification of conditions of immunological binding reaction, e.g. use of more than one type of particle, use of chemical agents to improve binding, choice of incubation time or application of magnetic field during binding reaction
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56911—Bacteria
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/02—Burettes; Pipettes
- B01L3/021—Pipettes, i.e. with only one conduit for withdrawing and redistributing liquids
- B01L3/0217—Pipettes, i.e. with only one conduit for withdrawing and redistributing liquids of the plunger pump type
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/508—Containers for the purpose of retaining a material to be analysed, e.g. test tubes rigid containers not provided for above
- B01L3/5082—Test tubes per se
- B01L3/50825—Closing or opening means, corks, bungs
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C1/00—Magnetic separation
- B03C1/005—Pretreatment specially adapted for magnetic separation
- B03C1/01—Pretreatment specially adapted for magnetic separation by addition of magnetic adjuvants
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C1/00—Magnetic separation
- B03C1/02—Magnetic separation acting directly on the substance being separated
- B03C1/28—Magnetic plugs and dipsticks
- B03C1/288—Magnetic plugs and dipsticks disposed at the outer circumference of a recipient
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/02—Form or structure of the vessel
- C12M23/08—Flask, bottle or test tube
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/22—Transparent or translucent parts
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/38—Caps; Covers; Plugs; Pouring means
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M33/00—Means for introduction, transport, positioning, extraction, harvesting, peeling or sampling of biological material in or from the apparatus
- C12M33/04—Means for introduction, transport, positioning, extraction, harvesting, peeling or sampling of biological material in or from the apparatus by injection or suction, e.g. using pipettes, syringes, needles
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M41/00—Means for regulation, monitoring, measurement or control, e.g. flow regulation
- C12M41/12—Means for regulation, monitoring, measurement or control, e.g. flow regulation of temperature
- C12M41/14—Incubators; Climatic chambers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M41/00—Means for regulation, monitoring, measurement or control, e.g. flow regulation
- C12M41/30—Means for regulation, monitoring, measurement or control, e.g. flow regulation of concentration
- C12M41/36—Means for regulation, monitoring, measurement or control, e.g. flow regulation of concentration of biomass, e.g. colony counters or by turbidity measurements
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/0098—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor involving analyte bound to insoluble magnetic carrier, e.g. using magnetic separation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/02—Adapting objects or devices to another
- B01L2200/026—Fluid interfacing between devices or objects, e.g. connectors, inlet details
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0605—Metering of fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/10—Integrating sample preparation and analysis in single entity, e.g. lab-on-a-chip concept
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B03—SEPARATION OF SOLID MATERIALS USING LIQUIDS OR USING PNEUMATIC TABLES OR JIGS; MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C—MAGNETIC OR ELECTROSTATIC SEPARATION OF SOLID MATERIALS FROM SOLID MATERIALS OR FLUIDS; SEPARATION BY HIGH-VOLTAGE ELECTRIC FIELDS
- B03C2201/00—Details of magnetic or electrostatic separation
- B03C2201/26—Details of magnetic or electrostatic separation for use in medical applications
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Sustainable Development (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- Physics & Mathematics (AREA)
- Urology & Nephrology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Virology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Thermal Sciences (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
Abstract
métodos, sistemas e dispositivos para detectar e identificar micro-organismos em amostras de cultura microbiológica. a presente invenção refere-se a métodos, sistemas e dispositivos para detectar e/ou identificar um ou mais micro-organismos específicos em uma amostra de cultura. partículas indicadoras, como nanopartículas ativas por espectroscopia de raman de superfície melhorada (sers), cada uma tendo associada com esta um ou mais elementos de ligação específicos tendo uma afinidade para o um ou mais micro-organismos de interesse, podem formar complexo com micro-organismos específicos na amostra de cultura. ainda, partículas de captura magnéticas em agitação também tendo associada a estas um ou mais elementos de ligação específicos tendo uma afinidade para o um ou mais micro-organismos de interesse podem ser usadas para capturar o complexo de partícula indicadora de micro-organismo e concentrar o complexo em uma área localizada de um vaso de ensaio para subsequente detecção e identificação. o complexo pode ser disperso, peletizado e novamente disperso, de modo que a amostra de cultura possa ser novamente testada um número de vezes durante a incubação, de modo a permitir o monitoramento em tempo real da amostra de cultura.
Description
[001] O objeto presentemente divulgado refere-se a métodos, sistemas e dispositivos para detectar, identificar, quantificar e micro-organismos em uma amostra de cultura. Mais particularmente, o objeto refere-se ao uso de partículas indicadoras para detectar e identificar um ou mais micro-organismos em uma amostra biocontida capaz de suportar o crescimento de micro-organismos.
[002] A capacidade de detectar níveis baixos de micro organismos, incluindo patógenos, em uma cultura microbiológica em amostras clínicas (por exemplo, sangue, fezes, urina, etc.) ganhou importância significativa nos últimos anos. Da mesma forma, a cultura microbiológica é importante para a saúde pública para detectar microorganismos, incluindo patógenos, em amostras industriais, tais como alimentos, cosméticos e produtos farmacêuticos. A capacidade para detectar tais micro-organismos não só fornece técnicas para tratar pessoas que já foram expostas, mas também aos casos em que a exposição pode ser prevenida, como ao testar amostras de alimentos.
[003] Doenças transmitidas por alimentos impactam significativamente a sociedade, não só no que diz respeito à saúde, mas também os custos de cuidados de saúde. O CDC estima que a cada ano cerca de 1 em 6 americanos (ou 48 milhões de pessoas) fica doente, 128 mil são hospitalizadas e 3.000 morrem de doenças transmitidas por alimentos (ver http://www.cdc.gov/foodsafety/facts.html). Também foi estimado que doenças transmitidas por alimentos contribuem para 152 bilhões de dólares em despesas relacionadas com a saúde a cada ano nos EUA, especialmente para infecções bacterianas causadas por Campylobacter spp., Salmonella, Listeria monocytogenes e E.coli (ver http://www.producesafetyproject.org/admin/assets/files/Health-Related- Foodborne-Illness-Costs-Report.pdf-1.pdf).
[004] O atual nível de segurança alimentar encontrado nos EUA é o resultado de regulamentações governamentais combinada com a indústria de automonitoramento influenciada por incentivos de mercado, como a responsabilidade legal, o valor da marca, reputação, e o desejo de vender mais produto alimentar. Nos EUA, as agências principais responsáveis pela segurança alimentar são dos Serviços de Segurança Alimentar e Inspeção (FSIS) do Departamento de Agricultura dos EUA (USDA), que é responsável pela segurança da carne, aves e produtos de ovos processados, e a Food and Drug Administration (FDA), que é responsável por virtualmente todos os outros alimentos. Em 1996, FSIS da USDA promulgou a regra de ponto crítico de controle para análise de risco para redução de patógeno (PR/HACCP), que, por exemplo, exige teste para E. coli por plantas de abate. Outras regras de FSIS impõem limites zero para dois patógenos mortais - Listeria monocytogenes em carnes e porcos prontos para comer e E. coli O157:H7 em carne moída (ver http://www.ers.usda.gov/briefing/foodsafety/private.htm). Recentemente, a Lei de Modernização da Segurança Alimentar foi aprovada pelo Congresso, a urgência por esta legislação ter sido sublinhada por contínuos surtos de doenças transmitidas por alimentos nos últimos anos - de espinafre às pimentas ao amendoim.
[005] Análise de alimentos pode ocorrer em amostras próprias de alimentos, materiais ou produtos finais, intermediários ou matérias- primas recebidas. Além disso, os planos de HACCP (Análise de Perigos e Pontos Críticos de Controle) são implementados para controlar o ambiente de produção de modo a minimizar o risco de introdução de patógenos na amostra de alimentos. Como parte de muitos planos de HACCP, amostras ambientais são adquiridas a partir de superfícies, pisos, ralos, e equipamentos de processamento e, em seguida, analisadas quanto à presença e ausência de organismos patogênicos. Se for detectado um patógeno, este pode ser isolado e submetido a mais testes de confirmação.
[006] Hoje em dia, todos os testes de patógenos conduzidos implicaram uma etapa de cultura para enriquecer os níveis potencialmente baixos de micro-organismos contidos em uma amostra. Após a cultura da amostra, uma fração é removida e testada quanto à presença de agentes patogênicos. Testes patogênicos depois da cultura podem ser realizados por imunoensaios (por exemplo, plataforma automatizada bioMerieux’s Vidas® ELISA ou ensaios de fluxo lateral SDIX’s RapidChek®) ou por testes baseados em PCR (por exemplo, sistema DuPont Qualicon’s BAX®, sistema Bio-Rad's iQ-Check™). Se um patógeno está presente na amostra de partida, a etapa de cultura pode aumentar a concentração do patógeno tão alta quando 1,0E8 - 1,0E9 cfu/mL, de modo que a abertura da amostra após cultura expõe tanto para o usuário e o meio ambiente para um risco de contaminação. Esta exposição inibe muitos produtores de alimentos de realizarem testes de patógeno no local, em vez de escolher o envio de amostras para laboratórios externos para testes. Além disso, uma vez que não se sabe quais as amostras contêm patógenos e em que níveis, protocolos de teste de segurança alimentar usam tempos de cultivo longos para garantir que o pior cenário de um patógeno danificado seja dado tempo suficiente para crescer em uma concentração detectável. Como consequência, as amostras com cargas mais elevadas de patógenos são cultivadas por mais tempo do que pode ser estritamente necessário, levando a um atraso no tempo para os resultados. Existe assim uma necessidade no campo de métodos de ensaio de patógenos que minimize o tempo para os resultados e reduza o risco de exposição do pessoal de instalação aos patógenos cultivados.
[007] Preocupações semelhantes estão presentes em amostras clínicas, como sangue. Desde meados de 1980, juntamente com o tamanho da expansão da população paciente imunodeprimida, a incidência de septicemia provocada por infecções oportunistas, tais como leveduras, fungos, e micobactérias, aumentou. Bacteremia, a presença de bactérias na corrente sanguínea, e fungemia, a presença de fungos ou leveduras na corrente sanguínea, normalmente são detectados através da coleta de uma amostra de sangue venoso e a disposição da amostra de sangue em um frasco de cultura de sangue, contendo um meio de crescimento adequado para promover o crescimento das bactérias ou fungos de interesse. Ver em geral, Reimer et al., "Update on Detection of Bacteremia and Fungemia," Clinical Microbiology Reviews 10(3), 444-465 (1997). A amostra de cultura de sangue pode, então, ser incubada durante um período de tempo e verificada de forma intermitente por uma indicação de crescimento bacteriano ou fúngico.
[008] Métodos instrumentais conhecidos na técnica para o controle de crescimento de bactérias ou fungos em frascos de cultura de sangue, tipicamente detectam alterações no dióxido de carbono e/ou concentração de oxigênio no frasco de cultura de sangue. Esses instrumentos detectam a presença e ausência de micro-organismos, mas não são específicos em relação ao tipo específico de organismo presente. Para uma amostra nominalmente estéril, tal como o sangue, detectar um microrganismo na amostra pode ser indicativo de doença grave. No entanto, o resultado positivo é considerado um resultado parcial ou prejudicial e não é, tipicamente, acionável. Como o tratamento ideal da doença baseia-se na identificação do organismo e determinação de sua sensibilidade aos antibióticos, o pessoal do laboratório deve estar disponível para avançar culturas positivas para a plena identificar (ID) e testes de susceptibilidade antimicrobiana (AST). Identificar o organismo exige acessar a amostra de hemocultura positiva por profissionais de laboratório para outra amostra do trabalho.
[009] Amostra de trabalho após uma hemocultura positiva, ou seja, um resultado que indica a presença, mas não a identidade de um micro-organismo, muitas vezes inclui a categorização do micro-organismo em uma das duas grandes classes de organismos: Gram positivo ou Gram negativo. Os ensaios de hemocultura baseados na detecção de CO2 ou O2 durante o processo de cultura não pode distinguir entre os organismos patogênicos, tais como S. aureus, e contaminantes, tais como S. epidermidis visto que estes métodos são só sensíveis ao crescimento e ausência de crescimento. A classificação e identificação de organismos é realizada após a detecção de crescimento em cultura uma amostra de sangue. Por exemplo, estão disponíveis kits para diferenciar entre as espécies de Staphylococcus e Streptococcus e outros organismos. Kits também estão disponíveis para a diferenciação entre os organismos, tais como S. aureus e S. epidermidis. Estes kits, no entanto, requerem a remoção de pelo menos uma alíquota de uma amostra de hemocultura a partir do frasco de hemocultura e outros procedimentos, que podem, potencialmente, expor o operador à um patógeno ou destruir uma parte da hemocultura que poderia ser utilizada para outras análises. Eles também exigem normalmente que o pessoal de laboratório treinado esteja disponível para realizar os testes, podendo levar a um atraso nos resultados clínicos acionáveis no caso de uma amostra de hemocultura vai ser positiva quando o pessoal do laboratório não está disponível para realizar testes adicionais (por exemplo, em hospitais que operam em um único turno).
[0010] Enquanto hoje existam instrumentos para detectar a presença ou ausência de micro-organismos no sangue (por exemplo, através da utilização de um sensor de dióxido de carbono ou oxigênio), estes instrumentos não são geralmente úteis em amostras não estéreis, tais como fezes ou amostras alimentares. Para as amostras, como, por exemplo, alimentos, não se espera que seja significativa a concentração de micro-organismos benignos, e assim detectar organismos por sensores de dióxido de carbono ou oxigênio não é inerentemente útil. Para uma amostra de alimento, é crítico detectar a presença de níveis baixos de organismos patogênicos em um fundo de uma microflora benigna elevada para evitar a propagação de doenças veiculadas por alimentos.
[0011] Portanto, existe uma necessidade de métodos, sistemas e dispositivos para detectar não só a presença ou a ausência de organismos durante a etapa de cultura de amostras nominalmente estéreis, mas também identificar os organismos. Para as amostras não esterilizadas, tais como as fezes e comida, há também uma necessidade de métodos, sistemas e dispositivos para identificar organismos potencialmente prejudiciais em uma cultura em um modo biocontido. Ditos métodos, sistemas e dispositivos para minimizar a intervenção do usuário, minimizam assim o tempo, pessoal treinado, além de exposição potencial do pessoal e ambiente ao patógeno.
[0012] As modalidades do objeto presentemente divulgado fornecem métodos, sistemas e dispositivos para detectar a presença, quantidade e/ou identidade de micro-organismos específicos em uma cultura microbiológica. De acordo com uma modalidade, os ensaios presentemente descritos podem ser realizados no interior do vaso de cultura, de modo que detectar e/ou identificar micro-organismos específicos ocorre em conjunto com a cultura, sem a necessidade de intervenção do usuário. Um ou mais micro-organismos podem ser identificados em uma única cultura. O vaso de cultura pode ser totalmente biocontido de modo que o crescimento do micro-organismo e a detecção e identificação do micro-organismo possam ocorrer sem expor o usuário ao ambiente circundante. Além disso, devido à biocontenção da cultura, a análise da cultura pode ocorrer sem a necessidade de o usuário acessar a cultura ou lavar a cultura.
[0013] Opcionalmente partículas indicadoras opticamente ativas, tais como nanopartículas ativas de Espalhamento de Raman em Superfície Melhorada (SERS), cada uma tendo a ela associado um ou mais membros de ligação específicos tendo uma afinidade para um ou mais micro-organismos de interesse, pode formar um complexo com micro-organismos específicos na amostra de cultura microbiológica. Assim, as partículas indicadoras opticamente ativas podem ser qualquer partícula capaz de produzir um sinal óptico que pode ser detectado em uma amostra de cultura, sem etapas de lavagem. Além disso, as partículas magnéticas de captura, tendo também a elas associados um ou mais membros de ligação específicos com uma afinidade para um ou mais micro-organismos de interesse, que podem ser o mesmo ou diferente a partir dos membros de ligação específicos associados com as partículas indicadoras, podem ser utilizadas para capturar o complexo micro-organismo-partícula indicadora e concentrar o complexo em uma área localizada de um vaso de ensaio para detecção subsequente. É importante notar que modalidades dos métodos, sistemas e dispositivos atualmente divulgados permitem detectar de e identificar micro-organismos "tempo real" em uma amostra, em que o crescimento ativo do micro-organismo ocorre. As amostras podem incluir cultura microbiológica compreendendo um meio de crescimento e uma amostra clínica de um ser humano ou animal (doméstico ou estoque), tais como sangue, fezes, urina, ou fluido cérebro-espinhal. As amostras também podem incluir culturas microbiológicas compreendendo um meio de crescimento e uma amostra industrial, tais como alimentos, laticínios, bebidas, água, produtos agrícolas, ambientais, produtos de cuidados pessoais (incluindo cosméticos), biotecnologia, ou medicamentos. É importante notar que o ensaio pode ser conduzido de uma forma biocontida sem exposição do usuário ou do ambiente à amostra ("sistema fechado") e pode fornecer detecção e identificação de micro-organismos de modo automatizado, em torno do relógio, através do monitoramento do sinal de ensaio ao longo do tempo conforme a cultura progride. A combinação de detecção e identificação de cultura microbiológica pode levar à disponibilidade prévia de resultados acionáveis.
[0014] Detectar micro-organismos pela presente invenção pode ser realizado diretamente ou indiretamente. Para a detecção direta de micro-organismos crescendo em cultura, os membros de ligação específicos associados com as partículas magnéticas de captura e as partículas indicadoras podem ter uma afinidade para o micro-organismo praticamente intacto, por exemplo, através da ligação à superfície de bactérias ou leveduras. Para a detecção indireta, os membros de ligação associados com as partículas magnéticas de captura e as partículas indicadoras podem ter uma afinidade para os subprodutos do micro-organismo. Exemplos de derivados podem incluir, entre outros, proteínas secretadas, toxinas, e os componentes da parede celular. Modos diretos e indiretos de detecção podem ser utilizados sozinhos ou em combinação.
[0015] De acordo com outra modalidade da presente invenção, um vaso para a dosagem de uma quantidade desejada da amostra de cultura é fornecido. O vaso inclui um vaso para a recepção de uma amostra de cultura no seu interior, em que o vaso tem uma extremidade aberta e uma extremidade fechada. O vaso também inclui uma tampa configurada para encaixar a extremidade aberta do vaso em uma conexão estanque aos fluidos. Além disso, o vaso inclui uma cesta acoplada à tampa e incluindo um ou mais reservatórios, em que a cesta é colocada entre a extremidade aberta e a extremidade fechada do vaso. Onde é utilizada uma pluralidade de reservatórios, cada reservatório é configurado para conter um volume diferente de amostra de cultura. Além disso, o vaso inclui um ou mais conjuntos de agulha conectados à tampa, em que o conjunto de agulha inclui uma agulha que se prolonga dentro de um respectivo reservatório. Cada agulha está configurada para retirar seletivamente uma amostra contida no respectivo reservatório, em que cada agulha é ainda configurada para engatar um frasco para transferência biocontida da amostra a partir do reservatório para o frasco. Assim, o vaso pode ser adequado para a dosagem de uma quantidade desejada de amostra para dois ensaios diferentes (por exemplo, Salmonella ou Listeria) em um único recipiente, facilitando ao mesmo tempo a transferência da amostra para um tubo de ensaio de detecção de uma maneira biocontida. Em outra modalidade da presente invenção, o frasco de ensaio para receber uma amostra é fechado por uma rolha ou septo e tampa configurados para manter um vácuo. Após a conexão da tampa do frasco de ensaio com uma porta compatível contendo uma agulha no vaso de medição, a amostra é transferida de uma maneira biocontida. A tampa do frasco contém recursos para reter fluido expresso externamente a partir da transferência e proteger o usuário do contato com superfícies de transferência.
[0016] Outra modalidade da presente invenção é direcionada a um sistema para processar automaticamente uma pluralidade de tubos de ensaio contendo uma amostra de cultura. O sistema inclui uma incubadora para receber uma pluralidade de tubos de amostra nele contidas, em que a incubadora está configurada para incubar os tubos de amostra e uma temperatura predeterminada. Por exemplo, os tubos podem ser posicionados horizontalmente e adjacentes uns aos outros. A incubadora pode ser configurada para incubar diferentes ensaios em diferentes temperaturas de acordo com uma modalidade. O sistema inclui ainda um primeiro dispositivo de translação (por exemplo, um "estágio em Y" para o movimento ao longo de um eixo geométrico Y) acoplado ao tabuleiro e configurado para mover os tubos de amostra no interior da incubadora, na qual o primeiro dispositivo de translação é ainda configurado para mover os tubos de amostra da incubadora para uma zona de detecção e para agitar os tubos de amostra no interior da zona de detecção. Por exemplo, o primeiro dispositivo de translação pode mover os tubos de amostras ao longo dos seus eixos longitudinais. O sistema também inclui um conjunto de magnetos configurado para aplicar um campo magnético para a pluralidade de tubos de amostra no interior da zona de detecção, bem como um dispositivo óptico configurado para interrogar cada um da pluralidade de tubos de amostra no interior da zona de detecção para detectar um ou mais microorganismos. O sistema inclui um segundo dispositivo de translação (por exemplo, uma "etapa X" para o movimento ao longo do eixo geométrico X) acoplado ao dispositivo óptico e configurado para mover o dispositivo óptico dentro da zona de detecção para interrogar cada um dos tubos de amostra. O sistema pode também incluir um terceiro dispositivo de translação (por exemplo, uma "etapa Z" para o movimento ao longo do eixo geométrico Z), acoplado ao conjunto magnético e o dispositivo óptico e configurado para mover o conjunto de magnetos e dispositivos ópticos dentro da zona de detecção para acessar outra bandeja de tubos empilhados verticalmente acima da primeira bandeja. Assim, o sistema fornece um sistema automatizado e de alto rendimento para o processamento de uma pluralidade de amostras em tempo real durante a incubação dos tubos de cultura.
[0017] Tendo assim descrito o objeto presentemente descrito, em termos gerais, será agora feita referência aos desenhos anexos, que não estão, necessariamente, desenhadas em escala, e em que:
[0018] A Figura 1 é um diagrama esquemático que mostra um método para detectar e identificar um micro-organismo em uma amostra de cultura de acordo com uma modalidade da invenção.
[0019] A Figura 2 é um diagrama esquemático que mostra um vaso de enriquecimento e um frasco de detecção para conter e transferir uma amostra de cultura de acordo com uma modalidade da presente invenção.
[0020] A Figura 3 é um diagrama esquemático mostrando um método de detecção e identificação intermitente de um micro-organismo em uma amostra de cultura de acordo com uma modalidade da invenção.
[0021] A Figura 4 é um diagrama esquemático mostrando um método de detecção e identificação em tempo real de um microorganismo em uma amostra de cultura de acordo com uma modalidade da invenção.
[0022] As Figuras 5A a 5E ilustram várias vistas de um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
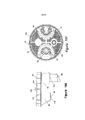
[0023] A Figura 6 é uma vista em corte transversal de um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[0024] A Figura 7 é uma vista explodida de um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[0025] A Figura 8 é uma vista de fundo da tampa para um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[0026] As Figuras 9A a 9C são várias vistas de um cesto para um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[0027] As Figuras 10A e 10B ilustram uma tampa para um frasco de detecção de acordo com uma modalidade da presente invenção.
[0028] As Figuras 11A e 11B ilustram uma tampa para um frasco de detecção de acordo com uma modalidade da presente invenção.
[0029] A Figura 12 é uma vista em corte transversal de uma tampa de encaixe de um frasco de detecção de acordo com uma modalidade da presente invenção.
[0030] As Figuras 13A e 13B são uma vista em perspectiva e uma vista explodida de uma tampa de encaixe de um frasco de detecção de acordo com uma modalidade da presente invenção.
[0031] As Figuras 14A e 14B são uma vista em perspectiva e uma vista explodida de uma tampa de encaixe de um frasco de detecção de acordo com uma modalidade da presente invenção.
[0032] A Figura 15 é uma vista em corte transversal dos frascos de detecção encaixando em um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[0033] As Figuras 16 e 17 são vistas em corte transversal de um frasco de detecção encaixando em um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[0034] A Figura 18 é um diagrama esquemático, que mostra um complexo de partícula magnética de captura-micro-organismo-SERS- partícula indicadora ativa dentro de um frasco de cultura de acordo com uma modalidade da invenção.
[0035] A Figura 19 descreve um SERS-partícula indicadora ativa de acordo com uma modalidade da presente invenção.
[0036] A Figura 20 descreve uma SERS-partícula indicadora ativa de acordo com uma modalidade da presente invenção.
[0037] A Figura 21 descreve uma SERS-partícula indicadora ativa de acordo com uma modalidade da presente invenção.
[0038] A Figura 22 mostra um espectro representativo SERS de uma SERS-partícula indicadora ativa tendo associado com este um corante ativo em Raman 4,4'-dipiridil (DIPY) de acordo com uma modalidade da invenção.
[0039] A Figura 23 mostra um sinal representativo SERS plotado ao longo do tempo de cultura para Salmonella de acordo com uma modalidade da invenção.
[0040] A Figura 24 representa um sistema para o monitoramento em tempo real de crescimento do micro-organismo de acordo com uma modalidade da invenção.
[0041] A Figura 25 representa um sistema para o monitoramento em tempo real de crescimento do micro-organismo de acordo com outra modalidade da invenção.
[0042] As Figuras 26 a 29 ilustram diversas vistas de um sistema para o monitoramento em tempo real de crescimento do microorganismo de acordo com uma modalidade adicional da invenção.
[0043] A Figura 30 é uma vista em perspectiva de uma bandeja para manter tubos de amostra de acordo com uma modalidade da presente invenção.
[0044] A Figura 31 ilustra as etapas sequenciais para carregar os tubos de amostra em uma bandeja, a bandeja de carregamento em uma incubadora, e a remoção das bandejas da incubadora, de acordo com uma modalidade da presente invenção.
[0045] A Figura 32 é uma vista em perspectiva de uma bandeja para manter tubos de amostra de acordo com outra modalidade da presente invenção.
[0046] As Figuras 33A a 33C são vistas parciais de bandejas para manter tubos de amostra de acordo com várias modalidades da presente invenção.
[0047] A Figura 34 é uma vista em perspectiva de uma incubadora de acordo com uma modalidade da presente invenção.
[0048] As Figuras 35 a 39 são várias vistas em corte transversal do sistema mostrado nas Figuras 26-29.
[0049] A Figura 40 é uma vista ampliada de uma porta traseira de uma incubadora de acordo com uma modalidade da presente invenção.
[0050] A Figura 41 é uma vista em perspectiva de um estágio X de acordo com uma modalidade da presente invenção.
[0051] A Figura 42 é uma vista em perspectiva de um conjunto magnético, um estágio X, e um estágio Z de acordo com uma modalidade da presente invenção.
[0052] A Figura 43 é uma vista lateral de um conjunto magnético, uma montagem de peletização/leitura, um estágio X, um estágio Y e um estágio Z em uma posição descida de acordo com uma modalidade da presente invenção.
[0053] A Figura 44 é outra vista em perspectiva do sistema mostrado nas Figuras 26 a 29.
[0054] As Figuras 45 e 46 são vistas em perspectiva parciais de um conjunto magnético, uma montagem de peletização/leitura, e um estágio X de acordo com uma modalidade da presente invenção.
[0055] A Figura 47 é uma vista parcial em perspectiva de um conjunto magnético e um estágio Y de acordo com uma modalidade da presente invenção.
[0056] As Figuras 48A a 48B são vistas em perspectiva de um sistema para o monitoramento em tempo real de crescimento do micro-organismo encerrado em um recinto fechado de acordo com modalidades da presente invenção.
[0057] A Figura 49 ilustra um método para a agitação e peletização de uma amostra de cultura de acordo com uma modalidade da presente invenção.
[0058] A Figura 50 ilustra um sistema de peletização e óptico de acordo com uma modalidade da invenção.
[0059] As Figuras 51 e 52 ilustram arranjos alternativos de magnetos para a peletização de uma amostra de cultura de acordo com modalidades da presente invenção.
[0060] A Figura 53 ilustra uma detecção multiplex de S. aureus e S. epidermidis de acordo com uma modalidade da invenção.
[0061] A Figura 54 mostra os resultados de um experimento em cujo foi tempo para a detecção de E. coli foi comparado para amostras de hemocultura com e sem os reagentes SERS HNW apropriados para uso nas várias modalidades da invenção.
[0062] A Figura 55 mostra um gráfico em que o crescimento de subespécies de Salmonella enterica enterica serovar Typhimurium, daqui em diante referenciadas como Salmonella Typhimurium (ou outro nome serovar de Salmonlla), foi monitorado em relação ao efeito de peletização nesta de acordo com uma modalidade da invenção.
[0063] A Figura 56 mostra um gráfico que ilustra o efeito de peletização sobre o crescimento de micro-organismos de acordo com uma modalidade da invenção.
[0064] A Figura 57 ilustra uma imagem de um pré-complexo de SERS-esfera magnética (PC) em água após a peletização com um magneto fixo de acordo com uma modalidade.
[0065] As Figuras 58A a 58B são imagens da formação de pélete PC em meio secundário SDIX para Salmonella usando um ímã fixo e diferentes frequências de agitação de acordo com uma modalidade.
[0066] As Figuras 59A a 59B são imagens da formação de pélete PC em meio secundário SDIX para Salmonella usando um ímã acoplado e diferentes frequências de agitação de acordo com uma modalidade.
[0067] A Figura 60 mostra um gráfico em cujo tempo para detectar C. albicans no sangue foi comparado utilizando uma detecção de SERS singleplex de acordo com uma modalidade da invenção.
[0068] A Figura 61 mostra um gráfico em que o tempo para detectar C. albicans no sangue foi comparado utilizando um método de SERS multiplex de acordo com uma modalidade da invenção.
[0069] A Figura 62 mostra um gráfico em que o tempo para detectar E. coli e S. epidermidis no sangue foi comparado utilizando um método de SERS multiplex de acordo com uma modalidade da invenção.
[0070] A Figura 63 ilustra um gráfico de detecção em tempo real de E. coli no sangue com meio aeróbico e resinas de absorção de antibióticos de acordo com uma modalidade da presente invenção.
[0071] A Figura 64 mostra um gráfico para detectar E. coli no sangue para diferentes volumes de amostra, de acordo com uma modalidade da presente invenção.
[0072] A Figura 65A mostra uma curva de SERS com imagens capturadas em vários tempos durante o enriquecimento secundário de Salmonella Typhimurium, de acordo com uma modalidade.
[0073] A Figura 65B mostra uma curva de SERS com imagens capturadas em vários tempos durante o enriquecimento secundário de uma amostra negativa de acordo com uma modalidade.
[0074] A Figura 65C mostra uma curva de SERS com imagens capturadas em vários tempos durante o enriquecimento secundário de Salmonella Typhimurium, de acordo com uma modalidade.
[0075] A Figura 66 mostra as curvas sobrepostas de SERS para diferentes taxas de agitação durante enriquecimento secundário de Salmonella Typhimurium de acordo com uma modalidade.
[0076] A Figura 67 mostra imagens de péletes de uma amostra positiva e uma amostra negativa, respectivamente, de acordo com uma modalidade da presente invenção.
[0077] As Figuras 68A a 68C ilustram curvas SERS para detectar em tempo real E. coli durante a cultura em amostras de alimentos de acordo com modalidades da presente invenção.
[0078] A Figura 69 ilustra as curvas de SERS para detectar em tempo real Salmonella Enteritidis durante cultura em amostras de alimentos de acordo com uma modalidade da presente invenção.
[0079] A Figura 70 ilustra as curvas de SERS para detectar em tempo real Listeria esfregada de aço inoxidável, durante a cultura de acordo com uma modalidade da presente invenção.
[0080] A Figura 71 mostra um fluxograma das fases para detectarSalmonella Typhimurium usando agitação linear de acordo com uma modalidade da presente invenção.
[0081] A Figura 72 ilustra as curvas de sobreposição de SERS durante enriquecimento secundário para Salmonella Typhimurium, Salmonella Enteritidis, e as amostras negativas de acordo com uma modalidade da presente invenção.
[0082] A Figura 73 mostra imagens de péletes formados durante o enriquecimento secundário de Salmonella Typhimurium de acordo com uma modalidade da presente invenção.
[0083] A Figura 74 mostra as curvas de SERS obtidas a partir de agitação com balanço e agitação linear durante enriquecimento secundário de S. Enteritidis e S. Kentucky de acordo com uma modalidade.
[0084] A Figura 75 mostra imagens de tubos de amostra contendo S. aureus e S. epidermidis em EDTA de plasma de coelho, com e sem reagentes de SERS, de acordo com uma modalidade da presente invenção.
[0085] A Figura 76 mostra imagens de ensaios de aglutinação de látex com S. aureus e S. epidermidis, com e sem reagentes de SERS, de acordo com uma modalidade da presente invenção.
[0086] A Figura 77 é uma imagem ampliada de coloração gram de uma mistura de partículas magnéticas e marcadores SERS de acordo com uma modalidade da presente invenção.
[0087] A Figura 78 é uma imagem ampliada de controles gram corados de S. aureus e E. coli com partículas magnéticas e marcadores SERS de acordo com uma modalidade da presente invenção.
[0088] A Figura 79 mostra imagens de placas CHROMagar de S. aureus estriadas com uma hemocultura de S. aureus e S. epidermdis com reagentes de SERS de acordo com modalidades da presente invenção.
[0089] A Figura 80 é uma imagem de uma placa de ágar estriada com uma hemocultura de E. coli com discos de teste Sensi-disc™ de acordo com uma modalidade da presente invenção.
[0090] A Figura 81 é uma tabela que mostra medições do diâmetro da zona para E. coli, com e sem reagentes, de acordo com uma modalidade da presente invenção.
[0091] A Figura 82 é uma tabela mostrando um resumo dos resultados dos testes de sensibilidade manual aos antibióticos usando BD Sensi-discsTM e vários micro-organismos com e sem reagentes de SERS, de acordo com uma modalidade da presente invenção.
[0092] A Figura 83 mostra imagens de placas de ágar estriada com uma hemocultura de E. coli e C. albicans, com e sem reagentes, cobertas com discos antifúngicos BD TaxoTM, de acordo com uma modalidade da presente invenção.
[0093] A Figura 84 é uma tabela que mostra imagens de péletes formados em meios secundários de Salmonella usando diferentes frequências de agitação e tempos de peletização, de acordo com uma modalidade da presente invenção.
[0094] A Figura 85 é uma tabela que mostra o efeito da frequência de agitação na dispersão de pélete, de acordo com uma modalidade da presente invenção.
[0095] A Figura 86 ilustra um vaso de enriquecimento de acordo com outra modalidade da presente invenção.
[0096] A Figura 87 é uma vista em corte transversal de uma seringa de acordo com uma modalidade da presente invenção.
[0097] A Figura 88 é uma vista em corte transversal de uma seringa encaixada com um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[0098] Figuras 89A a 89C são vistas ampliadas em corte transversal de uma seringa encaixada com um vaso de enriquecimento de acordo com várias modalidades da presente invenção.
[0099] As Figuras 90A e 90B são vistas em corte transversal ampliadas de uma seringa de acordo com uma modalidade da presente invenção.
[00100] A Figura 91 é uma vista em corte transversal de uma seringa e uma vista em perspectiva de um êmbolo de acordo com uma modalidade da presente invenção.
[00101] A Figura 92 é uma vista em corte transversal de uma seringa e uma vista em perspectiva de um êmbolo de acordo com outra modalidade da presente invenção.
[00102] As Figuras 93 a 95 ilustram estações de reconstituição de acordo com várias modalidades da presente invenção.
[00103] A Figura 96 é uma imagem de nanopartículas de sílica fluorescentes fabricadas de acordo com uma modalidade da presente invenção.
[00104] A Figura 97 mostra um gráfico que representa a intensidade de sinal de nanopartículas de sílica fluorescentes fabricadas e marcadores SERS convencionais de acordo com uma modalidade da presente invenção.
[00105] A Figura 98 mostra um gráfico que representa a intensidade de sinal ao longo do tempo de nanopartículas de sílica fluorescentes fabricadas e marcadores SERS convencionais para detectar a presença de Listeria no espinafre de acordo com uma modalidade da presente invenção.
[00106] A Figura 99 mostra um gráfico que representa a intensidade de sinal ao longo do tempo de nanopartículas de sílica fluorescentes fabricadas e marcadores SERS convencionais para detectar a presença de Listeria em couve de acordo com uma modalidade da presente invenção.
[00107] A Figura 100 é uma vista em perspectiva de um recipiente para um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[00108] A Figura 101 é uma vista superior da tampa para um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[00109] A Figura 102 é uma vista inferior da tampa mostrada na Figura 101.
[00110] A Figura 103 é uma vista em perspectiva inferior da tampa mostrada na Figura 101.
[00111] A Figura 104 é uma vista lateral da tampa mostrada na Figura 101.
[00112] A Figura 105 é uma vista em corte transversal da tampa mostrada na Figura 101.
[00113] A Figura 106 é uma vista lateral de um cesto de um vaso de enriquecimento de acordo com uma modalidade da presente invenção.
[00114] A Figura 107 é uma vista de topo do cesto ilustrado na Figura 106.
[00115] A Figura 108 é uma vista de fundo do cesto ilustrado na Figura 106.
[00116] A Figura 109 é uma vista em perspectiva do cesto representado na Figura 106.
[00117] O objeto presentemente descrito será agora descrito mais completamente a seguir com referência aos desenhos anexos, em que algumas, mas não todas as modalidades do objeto presentemente descrito são mostradas. Muitas modificações e outras modalidades do objeto presentemente divulgado aqui enunciado virão à mente de um versado na técnica à qual o objeto presentemente divulgado se refere tendo o beneficio dos ensinamentos apresentados nas descrições anteriores e nos desenhos associados. Por conseguinte, deve ser entendido que o objeto presentemente divulgado não deve ser limitado às modalidades específicas divulgadas e que modificações e outras modalidades destinam-se a ser incluídas no escopo das reivindicações anexas. Embora termos específicos sejam aqui utilizados, são usados em um sentido genérico e descritivo e não para fins de limitação.
[00118] Os termos "um", "uma" e "a/a" referem-se a "um ou mais" quando utilizados nesta aplicação, incluindo as reivindicações. Assim, por exemplo, a referência a "uma amostra" inclui uma pluralidade de amostras, a menos que o contexto claramente indique o contrário (por exemplo, uma pluralidade de amostras), e assim por diante.
[00119] Ao longo desta especificação e das reivindicações, as palavras "compreende", "compreender" e "compreendendo" são usadas em um sentido não exclusivo, salvo disposições em contrário.
[00120] Tal como aqui utilizado, o termo "cerca de", quando se refere a um valor pretende incluir um valor especificado e suas variações. Tais variações podem ser, em algumas modalidades ± 100%, em algumas modalidades, ± 50%, em algumas modalidades ± 20%, em algumas modalidades ± 10%, em algumas modalidades ± 5%, em algumas modalidades ± 1%, em algumas modalidades ± 0,5%, e em algumas modalidades ± 0,1% do valor especificado, uma vez que tais variações são apropriadas para realizar os métodos descritos ou empregar as composições descritas.
[00121] Além disso, quando uma quantidade, concentração, ou outro valor ou parâmetro é dado como uma faixa, a faixa preferencial, ou uma lista de valores preferenciais valores superiores e inferiores preferenciais, isto deve ser entendido como especificamente revelando todas as faixas formadas por qualquer par de qualquer limite superior da faixa ou valor preferencial e qualquer limite de alcance inferior ou valor preferencial, independentemente de faixas são divulgadas separadamente. Quando uma faixa de valores numéricos é aqui descrita, a menos que indicado de outra forma, a faixa tem a intenção de incluir os terminais destes, e todos os inteiros e frações dentro da faixa. Não se pretende que o escopo do objeto presentemente divulgado seja limitado aos valores específicos citados na definição de uma faixa.
[00122] As modalidades da presente invenção fornecem sistemas e métodos que utilizam as partículas indicadoras (por exemplo, partículas indicadoras ativas de espalhamento por Raman melhorado de superfície (SERS)), para detectar e/ou identificar um ou vários micro-organismos em uma amostra de cultura bacteriana por um ensaio homogêneo Sem Lavagem (HNW). Mais especificamente, modalidades da invenção descrevem técnicas para o monitoramento da concentração do micro-organismo em "tempo real", conforme o nível de micro-organismos aumenta ao longo do tempo dentro de uma amostra. As partículas indicadoras têm associadas com as mesmas um ou mais membros de ligação específicos com uma afinidade para um ou mais micro-organismos em teste. Quando posto em contato com uma amostra de cultura microbiológica que contém um ou mais microorganismos de interesse, um complexo, geralmente aqui referido como um complexo partícula indicadora-micro-organismo, entre um ou mais micro-organismos de interesse e as partículas indicadoras com um membro de ligação específica associado pode ser formado. O complexo partícula indicadora-micro-organismo pode ser capturado por uma partícula magnética de captura e concentrado para formar um pélete em uma área localizada (isto é, uma "zona de medição") para detectar através da medição do sinal (por exemplo, o espectro de SERS) e/ou inspeção visual de uma imagem do pélete. O termo "pélete", como é aqui utilizado, não se destina a ser limitativo e em uma modalidade, refere-se a um conjunto de uma pluralidade de partículas indicadoras e de partículas magnéticas de captura situadas em uma área localizada facilitada pela aplicação de um campo magnético, em que o pélete é detectável utilizando meios adequados visuais, ópticos, ou outros. O pélete pode também incluir micro-organismos capturados entre os mesmos, se presente, e de componentes e/ou micro-organismos podem não ser especificamente ligados às partículas magnéticas. O pélete pode ser formado temporariamente de modo que o pélete pode ser disperso após remoção do campo magnético, como discutido em maior detalhe abaixo.
[00123] Além disso, as várias modalidades da invenção referem-se à capacidade de conduzir o ensaio HNW repetidamente dentro da mesma amostra de cultura microbiológica, por formação, dispersão, e reforma do pélete ao longo do tempo. Isto permite que a concentração de um analito particular seja monitorada em tempo real dentro de uma amostra de cultura microbiológica e é particularmente valiosa quando a concentração de micro-organismos está mudando ao longo do tempo, por exemplo, em resposta ao crescimento bacteriano. Mais particularmente, modalidades da invenção referem-se à capacidade de conduzir o ensaio HNW dentro de um vaso de cultura microbiológica, e assim detectar e identificar simultaneamente um micro-organismo à medida que cresce. Além disso, a técnica pode ser utilizada em conjunto com outros métodos de monitoramento da amostra de cultura (tal como um sensor de gás, ou de análise de imagem).
[00124] De acordo com uma modalidade da invenção, uma cultura microbiológica da amostra é realizada em um vaso que contém os reagentes HNW. O vaso de cultura é inserido um instrumento que permite a incubação a uma temperatura controlada e contém dispositivos ópticos (por exemplo, óptica de Raman, um laser Raman, e um espectrômetro). Em intervalos de tempo regulares, durante a cultura, um campo magnético é aplicado, e o sinal de SERS é lido a partir do pélete magnético. O pélete é disperso entre as leituras para permitir interações continuadas dos reagentes com a amostra. Conforme os organismos alvo de concentração aumentam ao longo do processo de enriquecimento, detectar e identificar o micro-organismo com a tecnologia SERS ocorre assim que a concentração de microorganismos atinge o limiar de detecção da tecnologia. A capacidade de monitorar continuamente o sinal SERS durante a cultura garante que o tempo de cultivo mínimo exigido seja utilizado e que o instrumento possa alertar o usuário automaticamente quando um micro-organismo é detectado e identificado.
[00125] Outra modalidade utiliza uma câmara para monitorar a formação e o tamanho de um pélete durante um ensaio HNW que contém partículas indicadoras conjugadas e as esferas magnéticas e o patógeno alvo dentro de um vaso de cultura. Imagens mostram que o tamanho do pélete aumenta e, em alguns casos, o pélete desaparece, a partir da visão da câmera conforme o ensaio HNW progride. O crescimento no tamanho do pélete e/ou desaparecimento do pélete é uma indicação da presença do patógeno alvo. Imagens capturadas durante a análise de amostras que contêm partículas indicadoras conjugadas e esferas magnéticas sem patógeno não mostram nenhuma mudança no tamanho do pélete e nenhum desaparecimento do pélete. Este método de detecção pode ser utilizado sozinho ou em conjunção com outro método de detecção.
[00126] Tal como aqui utilizado, o termo "amostra de cultura microbiológica" refere-se a uma composição que compreende uma amostra "clínica" ou "industrial" com a possibilidade de conter micro- organismos que estão dispostas nesta, misturados, ou associados de outra forma com um meio de cultura, por exemplo, um caldo de hemocultura, capaz de suportar o crescimento de um ou mais microorganismos suspeitos de estarem presentes na amostra. Mais particularmente, modalidades do objeto presentemente divulgado fornecem métodos, sistemas e dispositivos para detectar microorganismos em uma amostra de cultura microbiológica compreendendo um meio capaz de suportar o crescimento de micro-organismos em uma amostra clínica, tal como sangue, fezes, urina ou fluido cerebrospinal, ou em uma amostra do produto industrial, tais como alimentos, swabs ambientais ou esponjas, água, cosméticos, produtos de higiene, produtos farmacêuticos ou outros produtos destinados ao uso ou consumo por animais ou seres humanos.
[00127] Detectar e/ou identificar micro-organismos em amostras de culturas microbiológicas, especialmente com métodos ópticos ou de espectrometria, pode apresentar muitos desafios devido à complexidade da matriz de amostra. As amostras clínicas, particularmente aquelas como o sangue ou fezes, são opticamente absorventes, tornando difícil detectar os sinais ópticos ou espectrais, sem etapas de lavagem ou lise para remover os componentes que interferem opticamente das amostras originais. Amostras industriais, tais como, por exemplo, amostras de alimentos ou cosméticos, podem ser opticamente absorventes, novamente necessitando de etapas de lavagem ou lise para remover os interferentes ópticos na amostra original. Embora tenha sido relatada a aplicação de SERS para detectar células de mamíferos e de micro-organismos e para a aplicação de diagnóstico de partículas indicadoras ativas de SERS para detectar de uma variedade de analitos na presença de sangue e amostras de alimentos, as partículas indicadoras ativas SERS para monitorar concentrações de bactérias e de fungos em "tempo real" conforme concentrações mudam devido ao crescimento de micro-organismos não foi relatada. Tal como aqui usado, "em tempo real" não se destina a ser limitante e pode referir-se ao monitoramento da amostra de cultura continuamente ou em incrementos de tempo predeterminados. Por exemplo, a amostra de cultura pode ser ensaiada várias vezes em intervalos de tempo predeterminados (por exemplo, a cada 30 minutos, 1 hora, etc.) ao longo de um período de incubação predeterminado, sem abrir o tubo de amostra, assim, mantendo biocontenção da amostra. "Biocontenção", tal como aqui utilizado, também não se destina a ser limitante e pode se referir à amostra de cultura estando em um sistema fechado de modo a que o meio circundante exterior ao vaso, em que a amostra de cultura está confinada não está exposto aos micro-organismos sendo cultivados.
[00128] Além disso, os métodos presentemente divulgados permitem a utilização de partículas indicadoras de diagnóstico em culturas microbiológicas de um modo que não iniba o crescimento do microorganismo sob detecção.
[00129] Os métodos atuais para detectar a presença ou ausência de patógenos durante o crescimento microbiológico, por exemplo, armários de hemocultura, não especificamente detectam organismos, mas em vez, um produto não específico do metabolismo (por exemplo, dióxido de carbono). Portanto, esses sensores podem potencialmente ser falsamente desencadeados por dióxido de carbono produzido por outros processos, tais como oxidação, degradação e, a respiração das células de hemocultura (por exemplo, células de mamíferos) que são a flora normal de uma amostra de sangue. Este sinal significativo de "fundo de sangue" é uma fonte de ruído importante que complica algoritmos de positividade e diminui a sensibilidade analítica geral. O sinal gerado a partir de um evento de ligação específico, tal como descrito nos métodos presentemente divulgados, será claro que um indicador de um patógeno está presente e não irá provavelmente ser mal interpretado.
[00130] As várias modalidades da presente invenção permitem o crescimento contínuo, detecção e identificação de todos dentro da geometria de um único frasco. A tecnologia SERS HNW permite que um sistema de cultura capaz de fornecer aletas ao longo do dia (24 horas/7 dias por semana) sobre o crescimento de amostras positivas juntamente com informações adicionais de identificação (por exemplo, informações de coloração Gram ou identificação). Em contraste com os sistemas de hemocultura atualmente no mercado, os quais detectam a presença ou ausência de crescimento, o ensaio de SERS HNW pode fornecer uma identificação do micro-organismo ou classe de micro-organismos. Os anticorpos conjugados aos SERS e as partículas magnéticas podem ser selecionados especificamente para identificar bactérias Gram positivas contra bactérias Gram negativas. É importante ressaltar que as capacidades de multiplexação inerentes à tecnologia SERS são fundamentais para a hemocultura e aplicações industriais.
[00131] Os sensores à base de gás existentes, como os utilizados em armários de hemocultura não são adequados para detectar a presença de micro-organismos patogênicos em amostras (por exemplo, fezes, alimentos ou amostras ambientais) em que há um elevado nível esperado de fundo de micro-organismos benignos. Existem atualmente métodos já conhecidos para detectar patógenos em tempo real dentro de um alimento ou de uma amostra ambiental, porque estes tipos de amostras têm tipicamente micro-organismos de fundo (benignos) que também crescem durante a cultura, de modo que um sensor baseado em crescimento não consegue distinguir entre o crescimento de organismos de fundo e crescimento do patógeno alvo.
[00132] Além disso, os métodos existentes para identificar microorganismos necessitam de uma combinação da preparação da amostra e/ou etapas de lavagem para remover os componentes interferentes, minimizar o sinal de fundo, e/ou gerar uma amostra que é opticamente transparente. Por causa das exigências de preparação de amostras e de lavagem, estes métodos não podem ser aplicados dentro de uma cultura permanente.
[00133] O ensaio em SERS HNW supera os problemas da necessidade de etapas de lavagem, gerando um sinal de Raman que podem ser lido em uma amostra suja ou não isolada. Ele também permite detecção e identificação multiplexada em matrizes complexas, tornando-o adequado para detecção multiplexada de infecções da corrente sanguínea ou patógenos alimentares. Estes atributos do ensaio HNW foram previamente divulgados. No entanto, em todas as divulgações anteriores conhecidas, o ensaio HNW foi aplicado uma única vez para uma única amostra, ou seja, um pélete foi formado e lido para gerar a "resposta" (identificação + detecção). Não houve nenhuma indicação de que a condução do ensaio HNW seria compatível com os requisitos específicos de monitoramento em tempo real na cultura, especificamente:
[00134] - A necessidade de manter a viabilidade da cultura (formação do complexo com o micro-organismo não pode inibir o crescimento);
[00135] - Capacidade de dispersar de forma confiável e reprodutível o pélete magnético uma vez que foi formado para permitir que os reagentes SERS e magnéticos continuem a interagir com a amostra;
[00136] - Capacidade de sinal do ensaio SERS HNW em aumentar e diminuir ao longo do tempo em resposta às mudanças contínuas na concentração desejada; e
[00137] - Capacidade de realizar o ensaio HNW em grandes volumes, tais como são normalmente utilizados na hemocultura e aplicações industriais, como seria de se esperar que, inicialmente, os requisitos de volume de reagente teriam um custo proibitivo e/ou que seria incapaz de formar um pélete que fosse representante de todo o volume. (Qualquer campo magnético de tamanho razoável seria de se esperar que apenas retirasse as partículas magnéticas a partir do microambiente local.)
[00138] Um ensaio HNW de acordo com uma modalidade da invenção pode ser usado para detectar patógenos, tais como E. coli, Listeria, Salmonella, etc. crescendo em alimentos ou amostras ambientais. Uma vez que a presença de até mesmo um único organismo danificado é significativa, as amostras são tipicamente cultivadas de modo a recuperar e crescer seletivamente o patógeno para um nível detectável. Devido à amostra inicial poder ter uma faixa de concentrações de patógenos, variando os níveis de danos para o patógeno, e/ou micro-organismos de fundo concorrentes altamente variáveis, o tempo de cultura requerido para atingir o limite de detecção para qualquer método analítico dado pode variar muito. Por esta razão, os protocolos de detecção são tipicamente formulados para cenários de "pior caso", isto é, o período de tempo da cultura é escolhido para assegurar que o único patógeno danificado é crescido a um nível detectável. Detectar e identificar o patógeno (por exemplo, por imunoensaio ou por PCR) é, então, realizada no final da cultura. Uma vez que a carga inicial de patógeno em qualquer amostra não pode ser conhecida a priori, todas as amostras são submetidas a este protocolo de cultura longa para garantir que nenhum patógeno seja perdido. No entanto, é provável que muitas amostras que geraram detecção e identificação positiva após os protocolos de cultura mais curtos, proporcionaram notificação anterior para o testador que existe um problema com a amostra. A combinação do ensaio HNW baseado em SERS com cultura permite monitoramento em tempo real da carga de patógeno na amostra ao longo da cultura, proporcionando a vantagem significativa de que as amostras com cargas mais elevadas de patógenos são detectadas tão cedo quanto possível no protocolo de cultura.
[00139] Modalidades da presente invenção são direcionadas aos métodos, sistemas e dispositivos para detectar e identificar microorganismos em uma amostra de cultura. Com referência à Figura 1, o processo inclui geralmente proporcionar uma pluralidade de partículas indicadoras, os membros de ligação, e partículas magnéticas de captura em um vaso e a adição de uma amostra que inclui, potencialmente, um ou mais micro-organismos. O vaso pode também incluir a cultura ou meio de crescimento para ajudar a seletividade ou crescimento adicional de micro-organismos. A amostra é então incubada e agitada por um período de tempo predeterminado. Em pontos de tempo selecionados ou sobre um cronograma predeterminado ao longo de incubação, um campo magnético é aplicado ao vaso de modo a formar um pélete. O pélete é então interrogado com uma fonte de luz para produzir um sinal detectável (por exemplo, um espectro de SERS) que é detectado e analisado. O pélete pode então ser disperso e o processo repetido no seguinte ponto de tempo determinado.
[00140] A Figura 2 mostra uma modalidade da metodologia e dos dispositivos que podem ser utilizados para detectar e identificar os micro-organismos em uma amostra de cultura. A este respeito, a Figura 2 ilustra que um volume desejado de uma amostra do ambiente (por exemplo, cerca de 1 L ou menos), uma amostra de alimentos (por exemplo, cerca de 25 g a 375 g, resultando em um volume de cerca de 250 ml para 3 L), ou uma amostra clínica (por exemplo, cerca de 100 mL ou menos) é obtida e colocada em um vaso de enriquecimento. Neste exemplo, o vaso de enriquecimento está configurado para facilitar a análise de ensaios de Salmonella ou Listeria. O vaso de enriquecimento é incubado durante um período de tempo predeterminado, após o qual uma quantidade predeterminada de amostra é transferida para um tubo de ensaio de detecção de uma maneira biocontida, o que será explicado em maior detalhe abaixo. O frasco de detecção é então colocado em um sistema de SERS em tempo real para a posterior incubação e análise automatizada utilizando tecnologia de SERS, que também é discutida em mais detalhe a seguir.
[00141] De acordo com uma modalidade, o sistema de SERS é configurado para acomodar uma pluralidade de frascos de detecção e assim proporcionar um sistema de elevado rendimento. O sistema de SERS pode também ser configurado para facilitar a análise automática de uma pluralidade de ensaios diferentes. Por exemplo, o sistema de SERS pode incluir zonas dedicadas para a manipulação e análise de cada ensaio.
[00142] Os sistemas e métodos de acordo com as modalidades da invenção fornecem um monitoramento em tempo real do crescimento de micro-organismos em amostras de cultura microbiológica. A Figura 3 mostra uma modalidade de monitoramento intermitente de crescimento do micro-organismo ou uma modalidade de ponto final. Nesta modalidade, os reagentes de HNW SERS 1 são adicionados ao vaso 2 onde ocorre a cultura. Os meios 3 e 4 são da amostra adicionada ao vaso 2, e o vaso 2 são colocados em uma incubadora 5 de modo que o micro-organismo (por exemplo, bactérias, leveduras ou células) seja deixado crescer. Nos pontos de tempo selecionados pelo usuário (ou durante a cultura, ou no final de um período de cultura) o vaso é removido da incubadora e 5 colocado em um leitor SERS 6, que (após mistura apropriada da amostra) forma um pélete magnético e lê o sinal de Raman. O vaso pode então ser reinserido na incubadora 5 para permitir mais tempo de crescimento, se nenhum sinal Raman for detectado.
[00143] A Figura 4 mostra uma modalidade alternativa em que o sinal de SERS é monitorado continuamente durante o crescimento bacteriano. Nesta modalidade, a incubadora e leitor SERS são integrados em um único instrumento 7 que, em pontos de tempo prescritos, formam péletes magnéticos, leem o sinal de SERS, e dispersam os reagentes sem necessidade de intervenção do usuário. A. Vaso de Enriquecimento e Frasco de Detecção
[00144] Frascos de cultura microbiológica, tubos, seringas, frascos, vasos, e semelhantes (por exemplo, vasos de enriquecimento e de detecção) adequados para uso com os métodos presentemente descritos, sistemas e dispositivos podem, em algumas modalidades, ser feitos de vidro ou de plástico. Em algumas aplicações, um plástico de várias camadas é desejável para controlar a permeabilidade aos gases. Nestas modalidades em que o vaso de cultura microbiológica é feito de plástico de múltiplas camadas, a garrafa pode ser por injeção ou por sopro e tem camadas interior e exterior de poliéster, polipropileno, polietileno, cloreto de polivinil, policarbonato, tereftalato de polietileno (PET), copolímero olefina cíclica (COC), ou qualquer copolímero ou mistura dos mesmos separadas por uma camada intermediária de náilon, álcool de vinil etileno (EVOH), álcool de vinil de polietileno, ou copolímeros ou misturas dos mesmos. No entanto, entende-se que o vaso não pode ser multicamadas, em outras modalidades e formado utilizando técnicas semelhantes (por exemplo, moldagem por injeção ou por sopro). Em algumas aplicações, os componentes do vaso podem ser tratados com os métodos de revestimento da superfície ou químicos para controlar as interações do vaso/amostra ou propriedades físicas. Em algumas modalidades, o vaso pode ser transparente à radiação visível, embora, em modalidades particulares, dita transparência não é necessária. Além disso, em algumas modalidades, os vasos presentemente revelados podem ser adaptáveis à esterilização. Além disso, em algumas modalidades, o vaso é apropriado para a cultura aeróbia ou anaeróbia. Em uma modalidade, o vaso é permeável a gás. Além disso, o vaso pode incluir uma parede de espessura constante ao longo do seu comprimento, o que pode melhorar a peletização e a análise óptica.
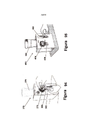
[00145] As Figuras 5A a 5E e 7 ilustram um vaso de enriquecimento 50 de acordo com uma modalidade da presente invenção. Opcionalmente, o vaso de enriquecimento de 50 pode deter meios de cultura líquidos ou secos. O vaso de enriquecimento inclui geralmente uma tampa 52, um cesto 54, montagens de agulhas 56, e um recipiente 58. A tampa 52 está engatada com o cesto 54 e está configurada para encaixar e vedar o vaso 58 em uma ligação estanque aos fluidos, tal como usando um acessório de rosca ou encaixe rápido. Em um exemplo, a tampa 52 pode ser enroscada no vaso 58, mas incluiria uma ou mais recursos de retirada para evitar o desenroscamento da tampa, sem o desengate adicional do recurso de retirada (por exemplo, pressionar para baixo e rodar a tampa para remoção). Assim, a tampa 52, a montagem de agulhas 56, e um cesto 54 podem ser acoplados em conjunto, de modo a ser capaz de engatar e desengatar o vaso 58 como uma unidade. Por exemplo, a tampa 52 e o cesto 54 podem ser acoplados em conjunto em um encaixe sob pressão ou através de outras técnicas adequadas, tais como adesivos, calor de escoramento, ou prendedores. A este respeito, a Figura 9C ilustra que o cesto 54 pode incluir furos de fixação 60 para o encaixe com elementos de fixação 62 para fixar a tampa e cesto em conjunto (ver também a Figura 5A). A Figura 8 mostra a parte inferior da tampa incluindo uma pluralidade de orifícios 65 que se alinham com os respectivos orifícios 60 no cesto (ver Figura 9C), para receber os elementos de fixação 62 através dos mesmos. Da mesma forma, as montagens de agulha 56 podem ser ligadas à tampa 52 através de técnicas de fixação semelhantes, como um ajuste forçado, acoplamento roscado, ou adesivos. O vaso 58 é configurado para conter uma quantidade desejada de amostra no seu interior e, assim, pode ser de vários tamanhos e formas, conforme necessário. Por exemplo, as Figuras 5A-5C, 7, 100 e ilustram formas exemplares de um recipiente 58. Em uma modalidade, o cesto 54 e o recipiente 58 podem ser transparentes ou translúcidos para facilitar a visibilidade no interior do recipiente e, em particular, a visibilidade da amostra dentro dos reservatórios 64, 66. Além disso, a Figura 100 ilustra que o recipiente 58 pode incluir uma ou mais linhas de volume 59 para visualizar a quantidade de amostra contida no recipiente. A Figura 7 ilustra também que o vaso 50 pode incluir uma junta de vedação 68 ou outro elemento de vedação utilizado para assegurar uma ligação estanque aos fluidos entre a tampa 52 e o recipiente 58.
[00146] O vaso de enriquecimento 50 inclui um par de conjuntos de agulha 56 e reservatórios 64, 66. No entanto, entende-se que pode haver uma ou mais montagens de agulha 56 e reservatórios 64, 66 em modalidades alternativas. Na modalidade ilustrada, uma montagem de agulha 56 e do reservatório 64 ou 66 é configurada para utilização com um tipo particular de ensaio (por exemplo, Salmonella ou Listeria). Como diferentes micro-organismos são cultivados utilizando diferentes meios e tamanhos de amostra, o vaso de enriquecimento facilita o uso de um único cesto para diferentes ensaios.
[00147] O cesto 54 está mostrado em maior detalhe nas Figuras 9A- 9C. O cesto 54 inclui um par de reservatórios 64, 66, com cada reservatório configurado para conter um volume de amostra predeterminada. Como mostrado, os reservatórios 64, 66 são afastados do fundo do recipiente 58, em que esse espaço é configurado para manter uma amostra desejada. A este respeito, o primeiro reservatório 66 é configurado para manter um volume maior do que o segundo reservatório 64. Em uma modalidade específica, o primeiro reservatório 66 é configurado para armazenar cerca de 5 ml e o segundo reservatório 64 está configurado para conter cerca de 100 μl. Como mostrado, os reservatórios 64, 66 podem ser moldados para facilitar a medição da amostra, assim como um respectivo alinhamento com o conjunto de agulha 56. Por exemplo, as Figuras 5A-5C e 6 ilustram que cada agulha 70 é inserida dentro de um reservatório 64, 66 e na posição mais baixa deste a fim de assegurarem que substancialmente toda a amostra medida é removida. Assim, o comprimento da agulha 70 pode ser ajustado dependendo do tamanho do reservatório, como a agulha que se prolonga dentro do primeiro reservatório 66 é mais longa do que o da agulha que se estende para dentro do segundo reservatório 64. A forma do reservatório 64, 66 pode ser qualquer forma que seja adequada para reter a quantidade desejada de amostra. Por exemplo, as Figuras 5A, 5B, 5C, 5E e 9B mostram que o segundo reservatório 64 tem uma forma geralmente cônica, enquanto que o primeiro reservatório 66 tem superfícies que se estendem ao longo da agulha e afunilam em direção à base da agulha.
[00148] A Figura 9C ilustra particularmente que o cesto 54 inclui um número de orifícios 72, 74 definidos através do mesmo. Tipicamente, a quantidade de amostra no recipiente 58 seria abaixo dos orifícios 72, quando o vaso está em uma posição vertical, mas será, pelo menos, abaixo do reservatório de entrada para cada um de 64, 66 de modo a que um volume desejado pode ser medido. Orifícios 72 podem ser definidos no interior do cesto dos reservatórios adjacentes, enquanto os orifícios 74 podem ser definidos através de uma superfície superior 76 do cesto de uma porção adjacente ao encaixe da tampa 78. Os orifícios 72 localizados adjacentes aos reservatórios 64, 66 são configurados para drenar o excesso de amostra dentro de um respectivo reservatório. Nomeadamente, quando o vaso de enriquecimento 50 é inclinado a partir de uma posição horizontal na posição vertical para encher um dos reservatórios 64, 66, retornando o vaso para a posição vertical resulta no reservatório sendo preenchido com a amostra e, posteriormente, o excesso de amostra irá escoar através dos orifícios 72. Como tal, o volume desejado é medido de um modo repetitivo no interior de cada reservatório 64, 66. Os orifícios 74 definidos na superfície superior 76 do cesto 54 podem ser usados para permitir que a amostra entre nos reservatórios 64, 66 e ao mesmo tempo previna que partículas indesejáveis da amostra sejam transferidas para os reservatórios. Entende-se que o cesto 54 pode ser modificado, dependendo da quantidade de amostra a ser medida e o tipo de amostra, tal como através da modificação do tamanho e da profundidade do reservatório 64, 66, bem como o tamanho e a profundidade dos orifícios. A este respeito, a Figura 9C ilustra que os orifícios 72, 74 podem ser afunilados em direções diferentes um do outro para ajudar na drenagem, com a entrada para os orifícios 72 adjacentes ao reservatório sendo maiores do que a entrada dos orifícios 74 na superfície superior 76 do cesto. O orifício de entrada menor pode ser utilizado para filtrar quaisquer partículas indesejáveis de entrar nos reservatórios. Além disso, as Figuras 106-109 ilustram uma modalidade em que o cesto 54 inclui orifícios 72, 74 que são, aproximadamente, do mesmo tamanho. Além disso, o cesto 54 também pode incluir uma nervura 75 ou outra superfície elevada que esteja configurada para ajudar na drenagem do líquido através do cesto. Em particular, a nervura 75 pode ser colocada no centro do cesto 54, para facilitar a ventilação durante a filtragem e secagem, oferecendo uma superfície capaz de drenar o excesso de líquido acima do cesto com diferentes características de drenagem do que a parte restante dos orifícios na superfície superior 76 do cesto. As Figuras 106 e 108 mostram uma modalidade em que uma superfície inferior dos reservatórios 64, 66 pode incluir uma ou mais saliências 119, que ajudam a drenagem por infiltração de fluido do reservatório e permitindo que o fluido a partir de vários orifícios de drenagem 72 se funda.
[00149] Como mostrado na Figura 9B, cada reservatório 64, 66 é separado a partir de uma superfície superior 76 do cesto com um respectivo espaço de cabeça 80, 82. Os espaços da cabeça 80, 82 permitem que a amostra entre facilmente em um respectivo reservatório 64, 66, quando o recipiente é inclinado. Assim, quando o recipiente 58 é inclinado, a amostra entra através dos orifícios 74, definidos na superfície superior 76 do cesto 54, no espaço de cabeça 80 ou 82, e entra no reservatório 64 ou 66. Quando o recipiente 58 é retornado para uma posição vertical, o reservatório 64 ou 66 é sobrecarregado devido ao excesso de amostra localizada no espaço de cabeça 80 ou 82, em que a amostra em excesso, em seguida, escoa através dos orifícios 72 definidos adjacentes ao reservatório e de volta para dentro do recipiente. Como mostrado na Figura 9B, os orifícios 72 definidos adjacentes aos reservatórios 64, 66 estão localizados por baixo da abertura que conduz para o reservatório para facilitar a drenagem e medição da quantidade desejada de amostra.
[00150] Cada reservatório 64, 66 está alinhado com um respectivo conjunto de agulha 56, como mostrado nas Figuras 5A a 5C e 6. Em uma modalidade a tampa 52 inclui uma porção de tampa de encaixe 78, em que a tampa da parte de encaixe é configurada para acoplar o cesto 54 e tampa em conjunto, como discutido acima. A parte de tampa de encaixe 78 e cesto 54 têm um diâmetro externo menor do que o diâmetro interno da abertura do recipiente 58, de modo a ser configurado para ser inserido dentro do recipiente. A porção de tampa de encaixe 78 pode também incluir aberturas para receber as respectivas montagens de agulha 56 que se estendem para dentro dos reservatórios 64, 66. As agulhas 70 estão localizadas dentro da porção de tampa de encaixe 78 de modo que as agulhas estejam configuradas para envolver um frasco de detecção tal como discutido em maior detalhe abaixo. A este respeito, a porção de tampa de encaixe 78 inclui uma superfície cônica ou roscada 105 oposta a uma respectiva abertura 102, 104 que está configurada para receber e engatar a uma montagem de agulha 56. As agulhas 70 ainda se estendem através das respectivas aberturas definidas no fundo da superfície cônica 105 dentro do espaço de cabeça 80, 82 e dentro de um respectivo reservatório 64, 66 (ver Figuras 5A a 5C e 6). A Figura 6 ilustra que cada conjunto de agulha 56 pode ser engatado com a parte de encaixe da tampa 78 de tal modo que as agulhas 70 se estendem na proximidade dos reservatórios 64, 66. A Figura 6 ilustra que a tampa 52 pode também incluir uma abertura 86 nela definida para permitir que qualquer subproduto gasoso não danoso escape do recipiente para evitar o aumento de pressão durante a cultura. As Figuras 102 a 103 e 105 ilustram uma modalidade alternativa, onde um poste de ventilação 125 se estende a partir de uma superfície inferior da tampa 52. O poste de ventilação 125 define uma abertura através da mesma para receber e engatar um filtro para filtrar quaisquer subprodutos gasosos que saem do recipiente 58. O poste de ventilação 125 se alinha com ventilação 86. A este respeito, o poste de ventilação 125 está configurado para direcionar subprodutos gasosos não perigosos através da abertura no poste de ventilação e através do orifício 86 definido na superfície superior da tampa 52.
[00151] As Figuras 102 a 103 e 105 também ilustram que a tampa 52 pode incluir ainda um engate 127 que se estende para fora de uma superfície inferior da tampa. O engate pós 127 está configurado para se alinhar com e engatar um correspondente pós acoplamento 129 que se estende para fora a partir de uma superfície superior do cesto 54, como mostrado nas Figuras 106, 107, e 109. Tal como ilustrado, o poste de acoplamento 127 tem um diâmetro menor do que o poste de acoplamento 129, embora os tamanhos relativos dos postes possam ser invertidos, se desejado. Além disso, a porção de encaixe 78 mostrada nas Figuras 103 a 105 está configurada para encaixar uma porção de encaixe correspondente 121 definida em uma superfície superior do cesto 54 (ver as Figuras 106, 107, e 109). Em particular, a porção de encaixe 78 pode ser dimensionada e configurada para se sobrepor e envolver a parte de encaixe 121. A periferia exterior da superfície de acoplamento 121 pode definir uma pluralidade de nervuras 123. Quando a superfícies de encaixe 78 e 121 são postas em contato com outra (por exemplo, por deslizamento e/ou rotação relativamente uma à outra), as nervuras podem ser configuradas para comprimir as nervuras 123. A compressão pode ser suficiente para criar um ajuste por fricção entre a tampa 52 e o cesto 54. Em uma modalidade, as nervuras 123 podem ser trituradas ou de outro modo deformadas para criar um encaixe por fricção.
[00152] Cada conjunto de agulha 56 está configurado para se engatar a um respectivo frasco de detecção 100. Frasco de detecção 100 pode incluir uma configuração especial para a tampa de combinação com uma abertura respectiva 102, 104 definida na tampa 52. Assim, cada tampa pode ser associada com um tipo específico da amostra de modo que o risco de usar o meio errado para um microorganismo é minimizado. Por exemplo, a tampa 52 pode incluir uma abertura de conector 104 que permite apenas a combinação com a tampa do frasco de detecção quando a tampa está orientada para engatar as chavetas 110 (ver Figura 6). A Figura 101 mostra uma modalidade alternativa de uma tampa 52 para as chavetas 110, onde são definidos ao longo do comprimento da abertura 104, incluindo ao longo da superfície cônica 105. As chavetas 110 podem ser definidas na superfície interior da abertura, como mostrado na Figura 6, ou em ambas as superfícies interior e exterior da abertura, como mostrado nas Figuras 101-103.
[00153] As Figuras 10A e 10B ilustram uma modalidade exemplar de uma tampa 106 adequada para utilização com um frasco de detecção. A este respeito, a tampa 106 inclui uma pluralidade de nervuras 108 que são configuradas para engatar respectivas chavetas 110 definidas na abertura 104 da tampa 52 (ver Figura 5D). Assim, a fim de que a tampa 106 seja inserida no interior da abertura 104, as nervuras 108 deveriam ser alinhadas radialmente no interior das ranhuras das chavetas 110. Além disso, a tampa 106 inclui uma pluralidade de características de acoplamento 112 que são configuradas para engatar o frasco de detecção 100 em um encaixe rápido. A conexão snap pode minimizar a ovalização do frasco de detecção 100, bem como o deslocamento da tampa 106 durante o manuseamento. Entende-se que a tampa 106 e frasco de detecção 100 podem ser presos um ao outro usando outras técnicas adequadas, tais como uma manga roscada ou de cravamento/engate com tampa, adesivos, soldadura ultrassônica, e/ou cravamento a quente. A Figura 13A ilustra a tampa 106 engatada com um frasco de detecção 100, de acordo com uma modalidade da presente invenção.
[00154] Como mencionado acima, a tampa 106 pode ter configurações diferentes para diferentes ensaios de modo que o risco de uso incorreto do frasco detecção 100 é eliminado. Por exemplo, as Figuras 11 A e 11 B ilustram uma configuração alternativa de tampa 114, enquanto que a Figura 14A mostra a tampa 114 engatada com um frasco de detecção 100. Tal como ilustrado, cada tampa 106, 114 pode incluir uma pluralidade de nervuras 108 e características de acoplamento 112. A tampa 114 pode ser configurada para ser recebida no interior de uma respectiva abertura 102, ainda que a abertura não precise incluir chavetas correspondentes. Assim, a tampa 114 pode ser recebida dentro da abertura 102, independentemente da sua orientação radial, mas a tampa 114 seria incapaz de ser inserida no interior da abertura 104. Deste modo, as nervuras 108 do tampão 106 podem impedir o acesso à abertura 102 na tampa 52, assim como o diâmetro externo da tampa 114 pode impedir o acesso à abertura 104.
[00155] As Figuras 12, 13B, 14B e ilustram características adicionais do frasco de detecção 100 e a tampa 114 de acordo com uma modalidade da presente invenção. Ou seja, a tampa 114 inclui uma rolha 116 e uma almofada absorvente 118 disposta entre a tampa e a rolha. A almofada absorvente 118 pode ser utilizada para absorver qualquer amostra que sai do frasco de detecção 100, após a transferência da amostra do vaso de enriquecimento 50 para dentro do frasco de detecção minimizando assim a exposição do técnico ou do ambiente. A tampa 114 também pode ter um prolongamento de dedo 117 para evitar o contato acidental de um bloco potencialmente molhado. Além disso, a rolha 116 pode ser qualquer material adequado que é configurado para criar uma ligação estanque aos fluidos com o frasco de detecção 100 (isto é, líquido e gás), assim como para ser perfurado por uma agulha para selar uma ligação estanque aos fluidos após ser perfurado por uma agulha e para envolver o frasco de detecção. Por exemplo, a rolha 116 pode ser uma borracha apropriada ou material elastomérico. A Figura 12 ilustra também o engate entre as características de engate 112 e a saliência 115 do frasco de detecção de 100. Assim, as tampas 106, 114 podem engatar com o frasco de detecção 100 em um encaixe rápido, o que impediria a remoção involuntária ou o deslocamento da tampa. A forma da saliência 115 pode ser de qualquer forma que permita um encaixe em encaixe rápido com as características de engate 112.
[00156] Frascos de detecção de ensaio 100 podem incluir os reagentes e, opcionalmente, um meio, tal como, por exemplo, um meio de crescimento específico, dependendo do micro-organismo que está sendo testado na amostra. Os reagentes e os meios podem estar presentes no frasco de detecção em um formato seco (por exemplo, desidratado) ou em um formato úmido (por exemplo, hidratado). Por exemplo, os meios e reagentes podem ser secos. Frasco de detecção 100 podem também manter um vácuo quando a rolha 116 está engatada com os mesmos. Assim, quando o frasco de detecção 100 é inserido dentro de uma abertura respectiva 102, 104, na tampa 52, a rolha 116 e uma almofada absorvente 118 são perfuradas pela agulha 70, e a amostra no interior do reservatório 64 ou 66 é puxada através da agulha e para dentro do frasco de detecção (ver Figuras 15-17). Em um exemplo, a porção da agulha 70 que se prolonga para dentro da abertura 102 ou 104 pode incluir uma manga de proteção 120 que é configurada para ser comprimida quando o frasco de detecção 100 é empurrado para baixo e em um encaixe com a agulha. Quando a manga de proteção 120 é comprimida, a agulha 70 é exposta e penetra da rolha 116, permitindo que o vácuo puxe a porção de amostra contida no interior do reservatório 64 ou 66. Depois de completada a transferência de fluido e a remoção do frasco de detecção 100, as mangas de proteção 120 retornam à sua forma original, cobrindo a agulha 70. Como tal, a transferência das amostras entre o vaso de enriquecimento 50 e o frasco de detecção 100, ocorre de uma forma biocontida. O vácuo no interior de cada frasco de detecção 100 pode ser qualquer quantidade suficiente para puxar uma quantidade desejada da amostra a partir do reservatório (por exemplo, capacidade de extração de 8-10mL para amostra de 5 mL). Qualquer outra excesso de vácuo no frasco detecção 100 é esgotado por via aérea após o fluido do reservatório de 64 ou 66.
[00157] O frasco de detecção 100 pode ser fornecido com os reagentes, com ou sem cultura ou meio de crescimento, rolha 116, almofada 118, e a tampa 106 ou 114, com vácuo ou sem vácuo, dependendo do usuário final (por exemplo, utilização uso terceirizado versus uso interno). Nesse sentido, o frasco de detecção 100 pode ser montado apenas para a rolha 116 para retenção apenas de reagentes, enquanto a tampa 106 ou 114 é fornecida em separado para os usuários que precisam acessar o interior do frasco de detecção. Alternativamente, o frasco de detecção 100 pode ser pré-montado com combinações de rolha 116, almofada 118, e a tampa 106, 114, conforme ilustrado na Figura 12. Além disso, a quantidade meio e reagente é determinada pelo frasco de detecção 100, e não o volume de enriquecimento inicial, de acordo com uma modalidade.
[00158] Como tal, a configuração do vaso de enriquecimento de 50 e frasco de detecção 100 permite que a amostra seja contida e transferida de um modo biocontida, limitando assim a exposição do técnico ou da instalação. O vaso de enriquecimento 50 também facilita uma medição precisa de um volume desejado da amostra, enquanto sendo configurado para acomodar uma pluralidade de tipos de amostras. Por exemplo, isto pode ser particularmente útil para Salmonella e Listeria, em que os diferentes ensaios, meios, e quantidade de amostra são utilizados. O vaso de enriquecimento 50 e frasco de detecção 100 também estão configurados para reduzir o risco de que o frasco incorreto seja utilizado para o teste através da incorporação de características de acoplamento entre o vaso de enriquecimento e o frasco de detecção.
[00159] As Figuras 86 e 88 ilustram outra modalidade de um vaso de enriquecimento 125. Tal como anteriormente, o vaso 125 inclui uma tampa 126 engatada com um recipiente 128 de uma maneira estanque a fluidos. Como mostrado, o vaso de enriquecimento 125 inclui um apoio longitudinal da seringa 130 que se estende a partir da tampa 126 e para dentro do vaso 128. O suporte da seringa 130 pode ser ligado à tampa 126 ou pode ser integralmente formado com a mesma. O suporte de seringa 130 inclui uma abertura 132, configurada para receber uma seringa 134 no seu interior, e tem geralmente a forma de uma relação de encaixe com a seringa 134. Engatado na base do suporte de seringa 130 está uma montagem de agulha, incluindo um cubo 133 e uma agulha 135, em que o cubo está engatado com o suporte de seringa, a agulha e se estende dentro do vaso 128 e está configurado para extrair a amostra através da mesma. A agulha 135 pode incluir uma cobertura compressível 141 que se estende ao longo da parte da agulha no interior da seringa 134. Tal como também discutido acima, a tampa 126 pode incluir uma abertura 131 para permitir que subprodutos gasosos não perigosos escapem do recipiente.
[00160] A Figura 87 ilustra uma modalidade de uma seringa 134 que geralmente inclui um cabo 136, uma haste de êmbolo 137 acoplado ao cabo, um tampão 138, um êmbolo 139 ligado à extremidade da haste de êmbolo, um septo 140, e um vedante 146. A Figura 87 ilustra ainda que a seringa 134 é configurada para engatar a abertura 132, tal como com uma interface de torção de bloqueio 142, para suportar a força de tração aplicada ao extrair a amostra para fora do recipiente 128. Assim, o êmbolo 137 é deslocável longitudinalmente dentro da seringa 134. O septo 140 é configurado para ser perfurado por uma agulha e uma vedado novamente com a remoção da agulha. Em outras modalidades, o septo 140 também inclui uma almofada absorvente e uma característica de prolongamento para evitar a contaminação do usuário devido a qualquer fluido que possa escapar através do septo. O selo 146 está engatado com a seringa 134 e a tampa 138 para criar uma conexão estanque. A seringa 134 pode também incluir um primeiro orifício maior 149 disposto no interior da abertura 132 e uma região de pescoço 157 incluindo um segundo diâmetro menor 151. Tal como mostrado nas Figuras 87 e 88, uma extensão 153 se estende da região de pescoço 157 e para dentro do orifício maior 149 de tal modo que uma porção menor do orifício 151 se estende para dentro do orifício maior 149. Pode haver um ou mais entalhes ou aberturas 155 definidos entre a extensão 153 e a base da região do pescoço 157, como discutido em maior detalhe abaixo.
[00161] As Figuras 89A a 89C ilustram a progressão de uma posição de partida, uma paragem "suave", e uma paragem "dura" quando removendo a amostra do recipiente 128 e na seringa 134. Como mostrado na Figura 89A, quando a seringa 134 é engatada com o suporte de seringa 130, o êmbolo 139 é posicionado adjacente à agulha 135 na posição de início e é configurada para comprimir a tampa 141, a fim de permitir a comunicação fluida entre o recipiente 128 e a seringa 134 através da agulha. A Figura 88 ilustra ainda que a agulha 135 é configurada para penetrar no septo 140 quando a seringa 134 é engatada com o suporte da seringa 130. À medida que o êmbolo 137 é puxado para fora a partir da seringa 134, uma porção 144 da amostra é puxada através da agulha 135 e para dentro do orifício 151, e uma primeira característica de acoplamento 145 sobre o êmbolo 146 engata a vedação para impedir uma maior retirada da mesma. Neste modo, a amostra é retirada a uma velocidade desejada através do qual o fluido é capaz de utilizar o vácuo de modo que a amostra abaixo seja impedida.
[00162] Na Figura 89C, o êmbolo 137 é retirado ainda da seringa 134 através do qual uma segunda característica de acoplamento 147 sobre o êmbolo 137 engata ao vedante 146 para impedir a retirada da haste do êmbolo. Além disso, a primeira característica de engate 145 está engatada dentro de uma bolsa 148 definida no vedante 146 que impede que a haste do êmbolo 137 seja deslocada ainda mais para fora da seringa 134. Como mostrado na Figura 89C, o êmbolo 139 pode ser disposto no interior da extensão 153 da seringa 134 de modo a que nenhum vácuo possa ser removido devido à haste de êmbolo 137 e o êmbolo 139 sendo posicionados de modo que o orifício 151 não esteja fechado. Isto é, quando o êmbolo 139 não está cobrindo as aberturas 155, os orifícios 149 e 151 estão em comunicação fluida um com o outro de tal modo que o vácuo não está sendo puxado. Além disso, o engate da haste de êmbolo 137 e o vedante 146 impedem que o êmbolo seja puxado para dentro da seringa 134, e ao mesmo tempo prevenindo que um usuário retire o êmbolo ainda mais e arriscando a exposição à amostra.
[00163] As Figuras 90A e 90B ilustram outra modalidade de uma haste de êmbolo 137. O êmbolo 137 inclui nervuras longitudinais 159 que são configuradas para deslizar dentro das ranhuras definidas no interior da tampa 138. Por outro lado, a Figura 90B mostra que o êmbolo 137 é capaz de ser torcido para soltar as nervudas 159 das ranhuras e engatar a tampa 138 para impedir que o êmbolo retorne para dentro da seringa 134.
[00164] As Figuras 91 e 92 ilustram as hastes de êmbolo e êmbolos alternativos que podem ser utilizados para a retirada de volumes diferentes a partir do recipiente 128. A este respeito, a Figura 91 corresponde ao descrito em conexão com as Figuras 87, 88 e 89A a C. Assim, o êmbolo 139 é apropriado para retirar volumes menores para o orifício menor 151 (por exemplo, cerca de 125 μl). Deste modo, o tamanho do êmbolo e o comprimento da haste do êmbolo podem ser variados conforme necessário. Em outra modalidade, a Figura 92 mostra um êmbolo 161 adequado para a retirada de amostras para dentro do orifício maior 149 (por exemplo, cerca de 5 ml). Deste modo, a seringa 134 é adequada para utilização com diferentes êmbolos para retirar diferentes volumes de amostra, o que é útil quando se testa para diferentes micro-organismos (por exemplo, Listeria e Salmonella). Além disso, o usuário pode receber a seringa 134 e êmbolo/haste do êmbolo pré-montados, ou o usuário pode ser capaz de adicionar reagentes, fluido de reconstituição, etc., e, em seguida, montar o êmbolo/haste de êmbolo para a seringa.
[00165] Um método para detectar e identificar um ou vários micro- organismos em uma amostra de cultura microbiológica de acordo com uma modalidade da invenção pode ser realizado em um vaso de cultura microbiológica. Um vaso de cultura microbiológica pode ter disposto nele uma ou mais partículas indicadoras e um ou mais partículas magnéticas de captura cada uma tendo a esta associada um ou mais membros de ligação, por exemplo, um anticorpo, que tem uma afinidade para um ou mais micro-organismos em teste. As partículas indicadoras e as partículas magnéticas de captura podem ser dispostas no vaso de cultura microbiológica antes de, concorrentemente com, ou após a eliminação nestas de uma amostra clínica ou industrial que se suspeita conter um ou mais micro-organismos em teste. Os meios de cultura podem ser dispostos no vaso de cultura microbiológica antes de, concorrentemente com, ou após a adição da amostra clínica ou industrial. Uma vez que as partículas indicadoras, as partículas magnéticas de captura, meios de cultura, e amostra clínica ou industrial foram introduzidas no vaso de cultura, o vaso de cultura é, em seguida, agitado de forma contínua ou intermitente, a fim de misturar as partículas indicadoras e as partículas magnéticas de captura com a amostra combinada e meio de cultura. Em modalidades preferenciais aqui descritas o perfil de agitação (por exemplo, velocidade e/ou deslocamento) pode ser variado em diferentes estágios do ciclo de cultura ou leitura. Quando presente na amostra clínica ou industrial, os um ou mais micro-organismos em teste podem se ligar com um ou mais membros de ligação associados com as partículas indicadoras e partículas magnéticas de captura de modo a formar um complexo de partícula de captura magnética-micro-organismo-partícula indicadora.
[00166] Onde a partícula indicadora é SERS ativa, a Figura 18 mostra um exemplo de um complexo de partícula de captura magnética- micro-organismo-SERS-partícula indicadora ativa dentro de um vaso de cultura 2. A SERS-partícula indicadora ativa 10, tem associado a esta um ou mais membros de ligação específicos 11 que possuem uma afinidade para um ou mais micro-organismos 12 em teste. Uma partícula magnética de captura 13 também tem associado a esta um ou mais membros de ligação específicos 14 com uma afinidade para um ou mais micro-organismos 12 em teste. Partículas magnéticas de captura 13 podem se ligar a um ou mais micro-organismos 12, que também podem ser ligados às SERS-partículas ativas 10, de modo a formar o complexo de partículas magnéticas de captura-micro-organismo-SERS-partícula ativa, que é também referida no presente documento como um complexo de sanduíche, em que o micro-organismo está ligado simultaneamente por mais do que um membro de ligação específico. Neste complexo de sanduíche específico, pelo menos, um membro de ligação específico 14 está ligado a uma partícula magnética de captura 13 e, pelo menos, um membro de ligação específico 11 é ligado a um SERS-partícula indicadora ativa 10. Assim, o micro-organismo 12 é "ensanduichado" entre a partícula magnética de captura 13 e SERS- partícula indicadora ativa 10.
[00167] Um campo magnético é aplicado à amostra através de um magneto 15 para atrair a partículas magnéticas de captura 13 a fim de localizar os complexo de partículas magnéticas de captura-micro- organismo-SERS-partícula indicadora ativa em um pélete no interior da zona de medição 9 dentro do vaso de cultura 2 para detectar o sinal de SERS. A radiação da fonte de luz 16 pode então ser dirigida para o pélete e o sinal de SERS pode ser detectado por detector de Raman 17. A fonte de luz 16 e um detector 17 são usados para induzir e medir, respectivamente, a assinatura de Raman produzida por SERS- partículas indicadoras ativas 10. A localização dos complexos de partículas magnéticas de captura-micro-organismo-SERS-partícula indicadora ativa fornecem um sinal SERS, cuja intensidade é reflexo da concentração de micro-organismos, através da localização de SERS- partículas indicadoras ativas que são ligados às partículas magnéticas na zona de detecção, assim, secretando os mesmos de SERS- partículas indicadoras ativas restantes em solução.
[00168] Em algumas modalidades, a zona de medição pode ser localizada ao longo de uma superfície interior de uma garrafa ou vaso de cultura microbiológica. Por exemplo, no que diz respeito a uma garrafa, a zona de medição pode ser localizada ao longo de uma superfície interna no interior ou adjacente ao pescoço da garrafa; uma superfície interna que compreende a seção média da garrafa; ou uma superfície interna ao longo da base da garrafa adjacente para, por exemplo, um sensor separado, por exemplo, um sensor à base de fluorescência ou um sensor com base em colorimetria, ou em modalidades em que um sensor separado não está presente, ao longo de uma superfície interna da base, ou seja, o fundo do frasco de cultura microbiológica. Em uma modalidade preferencial, a zona de medida situa-se ao longo de uma superfície interna geralmente na seção média da garrafa ou vaso de cultura. Assim, a zona de medição pode ser localizada em ou próxima ao centro da garrafa ou vaso do que as extremidades da garrafa ou vaso (por exemplo, dentro da média de 50% do vaso).
[00169] A detecção e/ou identificação de um ou mais microorganismos de interesse é realizada apenas quando o micro-organismo é ligado no pélete como parte de um complexo membro de ligação- micro-organismo-partícula indicadora. Isto é, nenhum sinal é gerado quando um ou mais micro-organismos não estão presentes na amostra de cultura microbiológica ou, se estiver presente, o micro-organismo não ter um epítopo reconhecido pelo membro de ligação associado com o indicador de partícula. Sob tais circunstâncias, as partículas indicadoras não são substancialmente presentes na zona de medição.
[00170] Se nenhum sinal SERS significativo é observado após a aplicação de um campo magnético e a interrogação óptica do pélete, as partículas magnéticas puxadas para o pélete podem ser dispersas de novo na solução a fim de continuar a interagir com a amostra. Se um micro-organismo está presente abaixo do limite de detecção da tecnologia, em seguida, a concentração de micro-organismos pode aumentar ao longo do tempo conforme o micro-organismo cresce em meio de cultura de modo que o sinal de SERS seja finalmente detectado na zona de medição mediante aplicação futura do campo magnético. Em essência, um pélete magnético é formado, opticamente interrogado, disperso, pode interagir com a amostra, e depois reformado a uma frequência especificada, até que seja observado um sinal a partir do complexo membro de ligação-micro-organismo-partícula indicadora ou a amostra é determinada sendo negativa para o micro-organismo de interesse. A agitação do vaso de cultura em várias fases ao longo deste processo pode desempenhar um papel crítico. A agitação serve para uma variedade de fins. Em primeiro lugar, assegura uma mistura de SERS e partículas magnéticas com os meios de amostra e de cultura que permitem a formação dos complexos membro de ligação-micro- organismo-partículas indicadoras. Em segundo lugar, permite a dispersão das partículas magnéticas de volta à solução uma vez que o pélete é formado. Em terceiro lugar, em uma modalidade preferencial, a agitação pode ocorrer enquanto o campo magnético é aplicado. A agitação durante a aplicação do campo magnético traz o fluido a partir de vários pontos espaciais no interior do vaso de cultura na região do campo magnético localizado, garantindo que as partículas magnéticas sejam coletadas a partir de regiões da amostra fora do campo magnético localizado. Finalmente, em amostras contendo partículas (por exemplo, resinas, carvão ou carbonato de cálcio), agitação antes e durante a peletização pode limitar o número dessas partículas de se depositarem na região de detecção, e interferindo com o sinal óptico. Taxas de agitação e perfis diferentes podem ser otimizados para cada uma destas funções diferentes.
[00171] Por exemplo, diferentes velocidades de agitação (ou seja, a frequência) e "arremessar" (isto é, o deslocamento do frasco ao longo de um eixo geométrico) podem ser utilizados em diferentes fases de um ciclo de medição. Em uma modalidade exemplar, um ciclo de medição pode incluir mistura, dispersão de pré-pélete, peletização, leitura e dispersão, com cada fase com uma velocidade de agitação e arremesso particular. A este respeito, a mistura inclui a fase onde a agitação ocorre durante a incubação, enquanto a etapa de dispersão pré-pélete ocorre após a mistura e antes da peletização. Peletização prossegue após a dispersão pré-pélete e é seguida pela fase de leitura. A fase de leitura corresponde à interrogação dos frascos pela cabeça de leitura, enquanto que a fase de dispersão é fornecida para o pélete ser redisperso no interior do frasco. Pode ou não pode haver atrasos entre as fases. Em uma modalidade, a velocidade de agitação e arremesso para as fases pode variar de cerca de 0 a 3 Hz e cerca de 0 a 100 mm, respectivamente. Por exemplo, as seguintes taxas de agitação e arremesso podem ser utilizadas de acordo com modalidades da presente invenção: mistura - cerca de 0,5 a 1,5 Hz e 25 a 75 mm; dispersão pré-pélete - cerca de 1 a 2 Hz e 25 a 75 mm; peletização - cerca de 0,5 a 2 Hz e 25 a 75 mm; leitura - 0 Hz e de 0 mm; e dispersão - cerca de 1 a 2 Hz e cerca de 25 a 75 mm. Além disso, o período de tempo determinado para cada fase pode também ser variado. Por exemplo, a fase de mistura pode ser significativamente maior (por exemplo, cerca de 5 a 60 min) do que a dispersão pré-pélete, peletização, leitura, e as fases de dispersão (por exemplo, cerca de 5 a 120 segundos por fase).
[00172] A Figura 23 mostra um exemplo da intensidade do sinal SERS dependente do tempo de complexos de membro de ligação- micro-organismo-partícula indicadora capturados por partículas magnéticas de captura para Salmonella. Em geral, o início da curva ascendente do sinal de SERS pode ser indicativo da presença do microorganismo. A este respeito, após cerca de 6 horas de tempo de cultura, a presença de micro-organismos pode ser indicada, enquanto que o pico em cerca de 9 horas indica uma concentração mais elevada de micro-organismos. Contudo, como também se mostra na Figura 23, na curva descendente do sinal de SERS, micro-organismos podem continuar presentes, tal como em cerca de 12 horas. Neste exemplo, a curva descendente também pode significar a presença de um microorganismo, o que pode fornecer um meio útil para identificar positividade em certos casos, tais como quando um grande número de microorganismos está presente no início da incubação. Como tal, uma curva ascendente ou curva descendente do sinal SERS podem ser indicativas da presença de um micro-organismo na amostra de cultura. A este respeito, as leituras podem ser feitas periodicamente, ao longo do tempo durante o período de incubação, de modo a identificar tais alterações no sinal de SERS. B. Partículas indicadoras
[00173] "Partículas indicadoras", tal como aqui utilizado, pode ser qualquer partícula que é capaz de produzir um sinal que pode ser detectado diretamente na amostra de cultura, sem a remoção da amostra, tal como para a realização ds etapas de lavagem. Por exemplo, as partículas indicadoras podem produzir qualquer sinal óptico (por exemplo, fluorescência ou Raman ou uma imagem óptica) quando interrogada (por exemplo, com uma fonte de luz). Exemplos de partículas indicadoras incluem partículas SERS-ativas, pontos quânticos, fluoróforos do infravermelho próximo, ou partículas fluorescentes de infravermelho próximo.
[00174] "Espalhamento de Raman de superfície melhorada" ou "SERS" refere-se ao fenómeno que ocorre quando o sinal de espalhamento de Raman, ou a intensidade é aumentado quando uma molécula de Raman ativa é adsorvida sobre ou na proximidade de, por exemplo, dentro de cerca de 50 Â de, a superfície de determinados metais (por exemplo, ouro ou prata). Sob tais circunstâncias, a intensidade do sinal de Raman a partir da molécula ativa de Raman pode ser melhorada. "Espalhamento de Ressonância de Raman em superfície melhorada" ou "SERRS" refere-se a um aumento do sinal de SERS que ocorre quando a molécula repórter na proximidade de uma superfície de nanopartículas SERS-ativo está em ressonância com o comprimento de onda de excitação. "Espalhamento de Raman" geralmente refere-se ao espalhamento inelástico de um fóton incidente em uma molécula. Os fótons que são elasticamente espalhados têm uma frequência óptica (vi), que é diferente da frequência da luz incidente (v0). A diferença de energia (ΔE) entre a luz incidente e a luz inelasticamente espalhada pode ser representada como (ΔE) = h|v0 - vi|, em que h é a constante de Planck, e corresponde às energias que são absorvidas pela molécula. A radiação incidente pode ser de qualquer frequência v0, mas tipicamente é uma radiação monocromática na região espectral visível ou próximo do infravermelho. A diferença absoluta |v0 - vi| é uma frequência de infravermelho, por exemplo, de vibração. A frequência v1 de radiação de "Raman espalhada" pode ser maior ou menor do que v0, mas a quantidade de luz com frequência v1 < v0 (radiação de Stokes) é maior do que a frequência com v1 > v0 (radiação anti-Stokes).
[00175] Tal como aqui utilizado, o termo "radiação" refere-se à energia sob a forma de radiação eletromagnética que pode induzir superfície melhorada de Raman em uma amostra em teste, por exemplo, uma amostra que compreende uma nanopartícula SERS ativa tendo uma ou mais moleculares repórter SERS ativas que estão associados com esta. Mais particularmente, o termo "radiação" refere- se à energia sob a forma de radiação eletromagnética, que faz com que a superfície de uma nanopartícula induza, emita, suporte, ou de outro modo provoque a dispersão da luz, por exemplo, espalhamento de Raman, em uma molécula repórter na proximidade da superfície da nanopartícula.
[00176] Tal como aqui utilizado, uma "molécula repórter" refere-se a qualquer molécula ou composto químico que é capaz de produzir um espectro de Raman quando é iluminada com radiação de um comprimento de onda adequado. Uma "molécula repórter", também pode ser aqui referida como um "marcador", um "corante", uma "molécula ativa de Raman," ou "molécula SERS ativa," cada um dos quais pode ser utilizado de forma intercambiável.
[00177] Um versado na técnica apreciará que uma variedade de moléculas pode atuar como moléculas repórter SERS. Por exemplo, algumas moléculas de corante fluorescente também podem ser utilizadas como moléculas repórter SERS. Ver, por exemplo, Pedido de Patente US 12/134,594 para Thomas et al., depositado em 6 de junho de 2008, e Pedido de patente internacional PCT PCT/US2008/066023 para Thomas et al., depositado em 6 de junho de 2008, cada um dos quais é incorporado por referência na sua totalidade. Geralmente, as moléculas adequadas para utilização como moléculas repórter SERS podem ser uma molécula pequena, uma molécula grande, ou uma molécula complexa, apesar de a molécula não precisar ser complexa para atuar como uma molécula repórter SERS. Moléculas repórter SERS, em algumas modalidades, podem ter pelo menos um anel aromático. Além disso, sem pretender estar ligado a qualquer teoria em particular, uma alteração na polarizabilidade de uma ligação é necessária para a atividade de Raman. Além disso, as moléculas simétricas tendem a exibir sinais de Raman específicos e fortes. De um modo vantajoso, uma molécula repórter exibe uma seção transversal elevada de espalhamento de Raman e uma assinatura espectral bem caracterizada.
[00178] Uma nanopartícula SERS ativa, como aqui referida, inclui uma nanopartícula com uma superfície que induz, causa, ou de outra forma suporta espalhamento de luz de Raman de superfície melhorada (SERS) ou espalhamento de luz em Raman de superfície melhorada (SERRS). Um certo número de superfícies é capaz de produzir um sinal de SERS, incluindo as superfícies rugosas, superfícies texturizadas, e outras superfícies, incluindo as superfícies lisas.
[00179] Uma partícula indicadora SERS ativa adequada para utilização com os ensaios presentemente descritos inclui um núcleo, que induz o efeito Raman, e pode ainda incluir uma ou mais camadas e tipos de materiais de SERS ativos localizados na superfície exterior do núcleo, e opcionalmente um encapsulante que parcialmente ou totalmente encapsula o núcleo ou os materiais SERS ativos.
[00180] As Figuras 19 a 21 mostram vários exemplos de partículas indicadoras SERS ativas. A Figura 19 mostra uma partícula indicadora SERS ativa 20 com uma única nanopartícula SERS ativa 21, tal como um núcleo, com uma molécula repórter 22 localizada na superfície exterior do núcleo de nanopartículas e uma camada de sílica 23 encapsulando completamente o núcleo e a molécula repórter. Tais partículas indicadoras SERS ativas encontram-se descritas na patente US 6.514.767 para Natan, que é aqui incorporada por referência na sua totalidade.
[00181] Tal como aqui utilizado, o termo "nanopartícula", refere-se a uma partícula possuindo pelo menos uma dimensão na faixa de cerca de 1 nm a cerca de 1000 nm, incluindo qualquer valor inteiro entre 1 nm e 1000 nm (incluindo cerca de 1, 2, 5, 10, 20, 50, 60, 70, 80, 90, 100, 200, 500 e 1000 nm). Em algumas modalidades, o núcleo da partícula indicadora SERS ativa é uma nanopartícula metálica. Em algumas modalidades, a partícula indicadora SERS ativa é uma partícula esférica, ou partícula substancialmente esférica, com um diâmetro entre cerca de 2 nm e cerca de 200 nm (incluindo cerca de 2, 5, 10, 20, 50, 60, 70, 80, 90, 100, e 200 nm). Em algumas modalidades, a partícula indicadora SERS ativa tem um diâmetro entre cerca de 2 nm e cerca de 100 nm (incluindo cerca de 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, e 100 nm) e em algumas modalidades, entre cerca de 20 nm e 100 nm (incluindo cerca de 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 e 100 nm).
[00182] Partículas indicadoras SERS ativa adequadas para utilização com os ensaios presentemente descritos podem também incluir um núcleo que compreende duas ou mais nanopartículas. A Figura 20 mostra uma partícula indicadora SERS ativa 30 com uma primeira nanopartícula SERS ativa 31 e uma segunda nanopartícula SERS ativa 32 no núcleo, tendo uma molécula repórter 33 localizada entre a primeira 31 e segunda nanopartículas 32 SERS ativa. Tais partículas indicadoras SERS ativas estão descritas na Patente US 6.861.263 para Natan, que é aqui incorporada por referência na sua totalidade. Veja também, em outro exemplo, Publicação do Pedido de Patente US 2003/0232388 Kreimer et al., publicada em 18 de dezembro de 2003, que é aqui incorporada por referência na sua totalidade. Assim, o núcleo de uma partícula indicadora SERS ativa pode incluir uma única nanopartícula ou pode incluir várias nanopartículas agregadas. Estas agregadas podem também ser encapsuladas como adicionalmente aqui se descreve.
[00183] O núcleo de uma Partícula indicadora SERS ativa apropriado para uso com os métodos presentemente revelados tipicamente compreende pelo menos um metal, isto é, pelo menos, um elemento selecionado a partir da Tabela Periódica dos Elementos, que é normalmente conhecido como um metal. Os metais adequados incluem metais do Grupo 11, tais como Cu, Ag, e Au, ou quaisquer outros metais conhecidos pelos versados na técnica para suportar SERS, tais como os metais alcalinos. Em algumas modalidades, o núcleo das nanopartículas compreende substancialmente um único elemento de metal. Por exemplo, a preparação de nanopartículas de ouro é descrita por Frens, G., Nat. Phys. Sci., 241, 20 (1972). Em outras modalidades, o núcleo da nanopartícula compreende uma combinação de pelo menos dois elementos, tais como uma liga, por exemplo, uma liga binária. Em algumas modalidades, o núcleo da nanopartícula é magnético.
[00184] Em outras modalidades, o núcleo de uma partícula indicadora SERS ativa inclui dois componentes em que um primeiro material forma um núcleo interior, que cercado por uma concha formada de um segundo material, tal como em uma partícula de núcleo-concha de Au2S/Au. A Figura 21 mostra uma dita partícula indicadora SERS ativa 40 com um núcleo interno 41 de Au2S rodeado por um invólucro exterior 42 formado a partir de Au como um núcleo, com uma camada de molécula repórter 43 localizada na superfície exterior do núcleo e uma camada de sílica 44 completamente encapsulando o núcleo e camada de molécula repórter. Partículas núcleo-concha Au2S/Au foram relatadas tendo ressonância óptica no IR próximo amplamente sintonizável. Ver Averitt, R. D., et al., "Ultrafast optical properties of gold nanoshells," JOSA B, 16(10), 1824-1832 (1999). Além disso, partículas com núcleo de Ag/concha de Au, tais como os descritos por Cao, Y.W., et al., "DNA-modified core-shell Ag/Au nanoparticles," J. Am. Chem. Soc., 123(32), 7961-7962 (2001), ou partículas com núcleo de Au /concha de Ag, ou qualquer combinação de núcleo-concha envolvendo metais de SERS ativa, podem ser utilizadas. Outras combinações adequadas para uso em partículas com núcleo-concha são também adequadas para utilização com o objeto presentemente divulgado, coloides de sílica/alumina funcionalizados com Ag, coloides de TiO2 funcionalizados com Au- ou Ag-, nanopartículas de Au capeadas com nanopartícula de Au (ver, por exemplo, , Mucic, et al., "DNA-directed synthesis of binary nanoparticle network materials," J. Am. Chem. Soc., 120(48), 12674 (1998)); Coloides de TiO2 capeados com nanopartícula de Au; e partículas tendo um núcleo de Si com uma concha de metal (ou seja, "nanoconchas"), como coloides de SiO2 capeados com prata ou coloides de SiO2 capeados com ouro. Ver, por exemplo, Jackson, et al., Proc. Natl. Acad. Sci. U.S.A. 101(52):17930-5 (2004); ver ainda Patentes US 6.344.272 e 6.685.986 para Oldenburg et al., cada uma das quais é aqui incorporada por referência na sua totalidade. O uso de ditas nanoconchas nas aplicações de biodetecção tem sido descrito. Ver Patente US 6.699.724 para West et al., que é incorporado aqui por referência em sua totalidade.
[00185] Outra classe de nanopartículas adequadas para utilização como um núcleo de uma partícula indicadora SERS ativa inclui nanopartículas com uma superfície interna. Essas nanopartículas incluem partículas ocas e nanocristais ocos ou nanopartículas porosas ou semiporosas. Ver, por exemplo, a patente US 6.913.825 para Ostafin et al., que é aqui incorporada por referência na sua totalidade. Em algumas modalidades, o núcleo/concha e as nanopartículas que têm uma superfície interna podem apresentar um sinal de SERS melhorado.
[00186] Embora se reconheça que a forma das partículas e a relação de aspecto podem afetar as características físicas, ópticas e eletrônicas de nanopartículas, a forma específica, relação de aspecto, ou presença/ausência de área de superfície interna não conta para a qualificação de uma partícula como uma nanopartícula. Por conseguinte, as nanopartículas adequadas para utilização como um núcleo de uma partícula indicadora SERS ativa podem ter uma variedade de formas, tamanhos e composições. Além disso, o núcleo de nanopartículas pode ser sólido, ou em algumas modalidades, tal como descrito imediatamente acima, oco. Exemplos não limitativos de nanopartículas adequadas para utilização como um núcleo oco incluem metal coloidal oco ou nanobarras cheias, magnético, nanopartículas paramagnéticas, condutoras ou isolantes, partículas sintéticas, hidrogeis (coloides ou barras), e semelhantes. Será apreciado por um versado na técnica que as nanopartículas podem existir em uma variedade de formas, incluindo, entre outras, esferoides, varetas, discos, cubos, pirâmides, cilindros, nano-hélices, nanomolas, nanoaneis nanopartículas em forma de haste, nanopartículas em forma de seta, as nanopartículas em forma de lágrima, nanopartículas em forma de tetrápodes, nanopartículas em forma prismática, e uma pluralidade de outras formas geométricas e não geométricas.
[00187] Além disso, as nanopartículas adequadas para utilização como um núcleo de uma partícula indicadora SERS ativa podem ser isotrópicas ou anisotrópicas. Como referido aqui, as nanopartículas anisotrópicas têm um comprimento e uma largura. Em algumas modalidades, o comprimento de um núcleo de nanopartícula anisotrópica é a dimensão paralela à abertura, em que a nanopartícula foi produzida. Em algumas modalidades, o núcleo da nanopartículas anisotrópica tem um diâmetro (largura) de cerca de 350 nm ou menos. Em outras modalidades, o núcleo da nanopartícula anisotrópica tem um diâmetro (largura) de cerca de 250 nm ou menos, e em algumas modalidades, um diâmetro (largura) de cerca de 100 nm ou menos. Em algumas modalidades, a largura do núcleo de nanopartícula anisotrópica está entre cerca de 15 nm a cerca de 300 nm. Além disso, em algumas modalidades, o núcleo de nanopartícula anisotrópica tem um comprimento, em que o comprimento é de entre cerca de 10 nm e 350 nm.
[00188] Muita da literatura de SERS (experimental e teórica) sugere que as partículas anisotrópicas (hastes, triângulos, prismas) podem proporcionar uma melhora aumentada do sinal de Raman em comparação com as esferas. Por exemplo, o chamado "efeito de antena" prevê que a melhora em Raman está prevista para ser maior em áreas de maior curvatura. Muitos relatórios de partículas anisotrópicas foram descritos recentemente, incluindo partículas prismas de prata (Ag) e "ramificadas" de ouro (Au).
[00189] Nano-hastes anisotrópicas de Au e Ag podem ser produzidas por eletrodeposição em moldes de alumina pré-formados, de maneira semelhante à produção de partículas Nanobarcodes® (Oxonica Inc., Mountain View, Califórnia). Ver, por exemplo, Nicewarner-Pena, S. R., et al., "Submicrometer metallic barcodes," Science, 294, 137-141 (2001); Walton, I. D., et al., "Particles for multiplexed analysis in solution: detection and identification of striped metallic particles using optical microscopy," Anal. Chem. 74, 2240-2247 (2002). Estas partículas podem ser preparadas pela deposição de camadas alternadas de materiais, tipicamente, Au e Ag, em modelos de alumina pré-moldados, e podem ter um diâmetro de cerca de 250 nm e um comprimento de cerca de 6 mícrons.
[00190] As partículas indicadoras SERS ativas também adequadas para utilização nos métodos presentemente divulgados incluem nanoestruturas compósitos, por exemplo, estruturas de satélite e estruturas de núcleo-concha, tal como descrito no Pedido de Patente Internacional PCT PCT/US2008/057700 para Weidemaier et al., depositado em 20 de março de 2008, que é aqui incorporado por referência na sua totalidade.
[00191] Uma vantagem das modalidades de ensaios e dispositivos SERS para detectar micro-organismos em amostras de culturas é a variedade de nanopartículas SERS ativas que podem ser preparadas, cada uma com uma única assinatura SERS. Partículas indicadoras SERS ativas representativas úteis para os métodos presentemente divulgados incluem, entre outras, partículas indicadoras SERS ativas da Oxonica Inc. (Mountain View, Califórnia). Tais partículas indicadoras SERS ativas incluem um núcleo de nanopartículas marcado com moléculas repórter SERS e encapsulado em uma casca de vidro.
[00192] Moléculas representantes não limitativas incluem 4,4’- dipiridil (DIPY), D8-4,4'-dipiridil (d8DIPY), trans-1, 2-bis(4-piridil)-etileno (BPE), e 2-quinolinetiol (QSH), cada um dos quais têm sido descritos como corantes repórter úteis para Raman ativo na publicação de Patente US 2006/0038979 para Natan et al., publicada em 23 de fevereiro de 2006, que é aqui incorporada por referência na sua totalidade. Exemplos adicionais não limitativos de moléculas repórter adequadas para os métodos presentemente divulgados incluem 1,2-dil (4-piridil)acetileno (BPA), 4-azobis (piridina) (4-AZP), GM19, 1-(4 piridil)- 1-ciano-2-(2-fluoro-4-piridil) -etileno (CNFBPE), 1-ciano-1-(4-quinolinil)- 2-(4-piridil)-etileno (CQPE), corante 10, e 4 (4-hidroxifenilazo)piridina (136-7). Um espectro SERS representativo de nanopartículas SERS ativas marcadas com 4,4’-dipiridil (DIPY) é fornecido na Figura 22. Como mostrado na Figura 22, a molécula de corante DIPY tem um pico dominante em cerca de 1601 cm-1.
[00193] Partículas indicadoras SERS ativas adequadas para utilização com os métodos presentemente divulgados incluem, entre outras, os núcleos de nanopartículas compreendendo uma molécula repórter de espalhamento de Raman de superfície melhorada ativa (SERS) divulgada no pedido de patente US 12/134594 para Thomas et al., depositado em 6 de junho de 2008, e Pedido de Patente Internacional PCT PCT/US2008/066023 para Thomas et al., depositado em 6 de junho de 2008, cada um dos quais é incorporado por referência na sua totalidade, e a variedade de partículas indicadoras SERS ativas revelada no Pedido de Patente Internacional PCT PCT/US2008/057700 para Weidemaier et al. depositado em 20 de março de 2008, que é aqui incorporado por referência na sua totalidade.
[00194] Em algumas modalidades, a partícula indicadora SERS ativa compreende um encapsulante. Nanopartículas SERS ativas têm uma tendência para se agregar em solução aquosa e uma vez agregadas são difíceis de voltar a dispersar. Além disso, a composição química de algumas moléculas de Raman ativas é incompatível com os produtos químicos utilizados para ligar outras moléculas, tais como as proteínas, às nanopartículas metálicas. Estas características podem limitar a escolha de uma molécula ativa em Raman, produtos químicos de ligação, e outras moléculas a serem ligadas às nanopartículas metálicas. Por conseguinte, em algumas modalidades, os métodos presentemente divulgados compreendem partículas indicadoras SERS ativas em que a molécula repórter, quando, por exemplo, fixada ou adsorvida ou ligada de forma covalente a um núcleo de nanopartículas, pode ser revestida ou encapsulada, por exemplo, em uma concha, de um material diferente, incluindo um material dielétrico, tal como um polímero, vidro, metais, óxidos metálicos, tais como TiO2 e SnO2, sulfetos de metal ou de um material cerâmico. Os métodos para a preparação de tais partículas indicadoras SERS ativas encontram-se descritos na patente US 6.514.767 para Natan, que é aqui incorporada por referência na sua totalidade.
[00195] A espessura do encapsulante pode ser variada, dependendo das propriedades físicas exigidas da partícula indicadora SERS ativa. Dependendo da combinação particular de núcleo de nanopartículas, o encapsulante, e corante, espessura de revestimentos do encapsulante, por exemplo, revestimentos da ordem de um mícron ou mais, poderia atenuar o sinal de Raman. Além disso, um revestimento fino pode levar a interferência no espectro de Raman do micro-organismo associado pelas moléculas na superfície do encapsulante. Ao mesmo tempo, as propriedades físicas, tais como o coeficiente de sedimentação podem ser afetadas pela espessura de encapsulante. Em geral, quanto mais espesso for o encapsulante, mais eficaz o sequestro dos corantes SERS ativos sobre o núcleo de nanopartículas de metal do solvente envolvente.
[00196] Nas modalidades em que o encapsulante é vidro, a espessura do vidro tipicamente pode variar desde cerca de 1 nm a cerca de 70 nm. Em modalidades exemplares, não limitativas, as partículas indicadoras SERS ativas compreendem nanopartículas de ouro que têm um diâmetro que varia de cerca de 50 nm a cerca de 100 nm, encapsulada em uma esfera de vidro com uma espessura que varia de cerca de 5 nm a cerca de 65 nm, em alguns modalidades, a partir de cerca de 10 nm a cerca de 50 nm; em algumas modalidades, a partir de cerca de 15 nm a cerca de 40 nm; e, em algumas modalidades, cerca de 35 nm. A otimização das dimensões das partículas indicadoras SERS ativas presentemente reveladas pode ser realizada por um versado na técnica.
[00197] Além disso, as partículas indicadoras SERS ativas que compreendem corantes SERS ativos podem ser funcionalizadas com uma molécula, tal como um elemento de ligação específica de um par de ligação, o qual pode ligar-se a um micro-organismo alvo. Após a ligação do micro-organismo alvo, o sinal de SERS da molécula repórter SERS ativa muda de tal forma que a presença ou quantidade do microorganismo alvo pode ser determinada. A utilização de uma partícula indicadora SERS ativa funcionalizada tem várias vantagens em relação às partículas indicadoras não funcionalizadas. Em primeiro lugar, o grupo funcional proporciona um grau de especificidade para a partícula indicadora proporcionando uma interação específica com um microorganismo alvo. Em segundo lugar, o micro-organismo alvo não tenha que ser ele próprio ativo em Raman; a sua presença pode ser determinada observando as alterações do sinal de SERS do corante ativo em Raman ligado ao núcleo das nanopartículas. Tais medições são referidas aqui como "detecção indireta", em que a presença ou ausência de um micro-organismo alvo em uma amostra de cultura é determinada por detecção de um sinal de que a SERS que não emana diretamente a partir do micro-organismo de interesse.
[00198] Em outras modalidades, a partícula indicadora SERS ativa compreende uma nanopartícula SERS ativa como um núcleo, com nenhuma molécula repórter ou encapsulante presente. A superfície do núcleo pode ser funcionalizada com uma molécula, tal como um elemento de ligação específica de um par de ligação, o qual pode ligar- se a um micro-organismo alvo. Após a ligação do micro-organismo alvo, o espectro de SERS do próprio micro-organismo alvo é detectado para confirmar a presença ou quantidade do micro-organismo alvo. Tais medições são aqui referidas como "detecção direta", em que a presença ou ausência de um micro-organismo alvo em uma amostra de hemocultura é determinada através da detecção de um sinal de SERS que emana diretamente a partir do micro-organismo de interesse.
[00199] As partículas indicadoras SERS ativas podem ser funcionalizadas para se ligarem a um analito alvo em, pelo menos, duas maneiras diferentes. Em algumas modalidades, a molécula repórter SERS ativa, ou seja, o corante SERS ativo, pode ser conjugada com um elemento de ligação específica de um par de ligação, enquanto que em outras modalidades, um elemento específico de ligação de um par de ligação pode ser ligado diretamente ao núcleo de nanopartículas. Em modalidades em que o núcleo de nanopartículas é, pelo menos parcialmente cercado por uma concha de encapsulamento, o elemento de ligação pode ser ligado a uma superfície externa do invólucro de encapsulamento. C. Elementos de Ligação Específica
[00200] Tal como aqui utilizado, o termo "elemento de ligação específica" e derivações gramaticais destes, refere-se a uma molécula para a qual existe, pelo menos, uma molécula de ligação complementar. Um elemento de ligação específica é uma molécula que se liga, se conecta, ou de outra forma se associa com uma molécula específica, por exemplo, um micro-organismo de interesse. Quando um elemento de ligação específica de um determinado tipo se liga a um tipo particular de molécula, os membros de ligação específica são referidos como um "par de ligação especifica". Por exemplo, um anticorpo que se liga especificamente a um antígeno. Consequentemente, um "par de ligação específica" refere-se à duas moléculas diferentes, em que uma das moléculas através de meios químicos ou físicos se liga especificamente à segunda molécula. Neste sentido, um micro-organismo sob teste é um membro recíproco de um par de ligação específica. Os membros de ligação representativos adequados para utilização com determinados micro-organismos sob teste são fornecidos aqui a seguir.
[00201] Além disso, os pares de ligação específicos podem incluir membros que são análogos dos parceiros específicos de ligação originais, por exemplo, um análogo de analito possuindo uma estrutura semelhante ao analito. Por "semelhante" pretende-se que, por exemplo, um análogo de analito tenha uma sequência de aminoácidos que tem pelo menos cerca de 60% ou 65% de identidade de sequência, de cerca de 70% ou 75% de identidade de sequência, de cerca de 80% ou 85% de identidade de sequência, cerca de 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% ou mais de identidade de sequência de aminoácidos em comparação com uma sequência de aminoácidos de analito utilizando programas de alinhamento e parâmetros padrões bem conhecidos na técnica. Um análogo de um analito pode também ter a mesma função que um analito.
[00202] Um elemento de ligação específica, quando conjugado, por exemplo, com uma partícula indicadora ativa em SERS, interage com um micro-organismo específico sob teste de um modo capaz de produzir um sinal detectável Raman diferenciável de um particular quando microorganismo está presente ou ausente, ou quando um micro-organismo particular está presente em concentrações variáveis ao longo do tempo.
[00203] O termo "produzir um sinal detectável " refere-se à capacidade de reconhecer a presença de um grupo relatado ou uma mudança em uma propriedade de um grupo repórter, por exemplo, molécula repórter SERS ativa, de uma maneira que permite detectar o complexo de elemento de ligação-micro-organismo. Além disso, a produção de um sinal detectável pode ser reversível ou irreversível. O evento de produção do sinal inclui meios contínuos, programados e meios episódicos, incluindo aplicações reutilizáveis ou de uma só vez. O evento de produção de sinal reversível pode ser instantânea ou pode ser dependente do tempo, enquanto uma correlação com a presença ou concentração do analito é estabelecida.
[00204] A ligação, conexão ligação, ou a associação entre o elemento de ligação específica e, por exemplo, um micro-organismo, pode ser química ou física. O termo "afinidade" refere-se à força de atração entre um elemento de ligação a um outro membro de um par de ligação em um local de ligação específico. O termo "especificidade" e derivações do mesmo, referem-se à probabilidade de que um elemento de ligação irá se ligar preferencialmente ao outro membro pretendido de um par de ligação (o alvo em oposição a outros componentes na amostra). Tal ligação entre um elemento de ligação, por exemplo, uma proteína de ligação, para outro elemento de ligação de um par de ligação, por exemplo, um ligando ou analito, pode ser reversível.
[00205] Além disso, conforme divulgado no pedido de patente US 12/134594 para Thomas et al., depositado em 6 de junho de 2008, e Pedido de Patente Internacional PCT PCT/US2008/066023 para Thomas et al., depositado 06 de junho de 2008, cada um das quais é incorporada por referência na sua totalidade, em algumas modalidades, um ligante polietileno glicol (PEG) pode ser usado para ligar um elemento de ligação específico para uma partícula indicadora SERS ativa, uma partícula magnética de captura, ou a um suporte sólido. Nos métodos presentemente divulgados, uma molécula ligante, por exemplo, PEG, também pode ser utilizada para ligar um elemento de ligação específico para uma partícula indicadora SERS ativa, ou uma partícula magnética de captura. A utilização de um ligante de PEG pode reduzir a ligação não específica nos ensaios presentemente descritos. Eliminar a adsorção não específica pode ser um desafio importante para o desempenho do ensaio. Por exemplo, em ensaios de captura magnética, ligação não específica pode incluir o processo em que as proteínas ou outras biomoléculas a partir de aderem às superfícies da partícula magnética de captura ou partícula indicadora SERS ativa apresentando membros de ligação ao analito alvo ou o processo pelo qual as superfícies da partícula magnética de captura e nanopartículas SERS ativas aderem uma à outra através de interações não específicas. Em algumas modalidades, o ligante de PEG compreende uma molécula de PEG bifuncional possuindo um grupo funcional em cada extremidade terminal da molécula linear, separados por duas ou mais subunidades de etilenoglicol. Em algumas modalidades, a molécula de PEG compreende entre 2 e cerca de 1000 subunidades etilenoglicol. Em modalidades particulares, o ligante de PEG compreende pelo menos 12 subunidades de etileno glicol. Além disso, o ligante de PEG pode ser caracterizado por ter um peso molecular de cerca de 200 Da a cerca de 100.000 Da.
[00206] Dependendo do elemento de ligação, um versado na técnica reconhecerá mediante revisão do objeto presentemente divulgado que outros ligantes de PEG podem ser usados. Por exemplo, alcanotiois podem ser utilizados como ligantes para os anticorpos e peptídeos. Alcanotiois de cadeia curta, incluindo, entre outros, N-succinimidil-S- acetiltioacetato (SATA) e N-succinimidil-S-acetiltiopropionato (SATP) pode ser utilizado como ligantes após desproteção de sulfidril. Outras propriedades também podem determinar a escolha do ligante, tal como o comprimento da cadeia de ligação. Por exemplo, pode ser desejável que PEG também atue para proteger a superfície do reagente e é flexível, o que pode aumentar a capacidade de o reagente em se ligar ao analito de interesse.
[00207] Em algumas modalidades, o elemento de ligação específico é uma imunoglobulina, também aqui referida como um anticorpo, que compreende uma região de ligação ao antígeno que se liga aos antígenos no micro-organismo alvo ou secretados deste modo.
[00208] Anticorpos e fragmentos adequados dos mesmos para utilização nos métodos e dispositivos atualmente divulgados podem ser de ocorrência natural ou obtidos por via recombinante e podem incluir, entre outros, anticorpos policlonais, monoclonais, multiespecíficos, humanos, humanizados, primatizados ou anticorpos quiméricos, anticorpos de cadeia única, fragmentos de ligação ao epítopo, por exemplo, Fab, Fab' e F(ab')2, Fd, Fvs, Fvs de cadeia simples (scFv), Fvs ligados por pontes dissulfeto (sdFv), fragmentos que compreendem um domínio variável leve (VL) ou variável pesado (VH), fragmentos produzidos por uma biblioteca de expressão de Fab, e anticorpos anti- idiotípicos (anti-Id). Em todos os casos, o anticorpo ou fragmento do mesmo terá uma ou mais regiões determinantes de complementaridade (CDRs) específicas para o antígeno alvo. Para os fins da invenção, uma "região determinante de complementaridade de um anticorpo" é a fração de um anticorpo que se liga a um epítopo, incluindo quaisquer regiões estruturais necessárias para tal ligação, e que pode ser constituída por um subconjunto de resíduos de aminoácidos codificados pelas regiões V, D e J de cadeia pesada humana e regiões V e J de cadeia leve humana e/ou suas combinações.
[00209] Os versados na técnica são capazes de preparar tais derivados de anticorpos, utilizando técnicas reconhecidas na técnica normal. Por exemplo, Jones et al. (1986) Nature 321: 522-525 descreve a substituição das CDRs de um anticorpo humano com as de um anticorpo de camundongo. Marx (1985) Science 229: 455-456 discute anticorpos quiméricos tendo regiões variáveis de camundongo e regiões constantes humanas. Rodwell (1989) Nature 342: 99-100 discute elementos de reconhecimento de pesos moleculares inferiores derivados da informação CDR de anticorpo. Clackson (1991) Br. J. Rheumatol. 3052: 36-39 discute anticorpos monoclonais geneticamente modificados, incluindo derivados de fragmentos Fv, anticorpos de cadeia simples, proteínas de fusão de anticorpos quiméricos e anticorpos de roedores humanizados. Reichman et al. (1988) Nature 332: 323-327 divulga o anticorpo humano em que ratos regiões hipervariáveis foram enxertadas. Verhoeyen et al. (1988) Science 239: 1534-1536 ensina enxerto de um sítio de ligação ao antígeno de camundongo para um anticorpo humano. D. Partículas Magnéticas de Captura
[00210] Partículas magnéticas de captura adequadas para o uso com os modalidades presentemente divulgadas podem compreender de cerca de 15% a cerca de 100% de material magnético, tal como, por exemplo, magnetita, incluindo cerca de 15% de magnetita, e cerca de 20% de magnetita, e cerca de 25% de magnetita, e cerca de 30% de magnetita, e cerca de 35% de magnetita, e cerca de 40% magnetita, cerca de 45% de magnetita, e cerca de 50% de magnetita, e cerca de 55% de magnetita, e cerca de 60% magnetita, cerca de 65% de magnetita, e cerca de 70% de magnetita, e cerca de 75% de magnetita, e cerca de 80% de magnetita, e cerca de 85% de magnetita, e cerca de 90% de magnetita, e cerca de 95% de magnetita, e qualquer número inteiro entre cerca de 15% e cerca de 100%. Além disso, as partículas magnéticas de captura podem ter um diâmetro variando entre cerca de 100 nm a cerca de 12 mícron. Em algumas modalidades, as partículas magnéticas de captura possuem um diâmetro que varia entre cerca de 400 nm a cerca de 8 mícron. Em outras modalidades, as partículas magnéticas de captura possuem um diâmetro que varia entre cerca de 800 nm a cerca de 4 mícron. Em ainda outras modalidades, as partículas magnéticas de captura possuem um diâmetro que varia de cerca de 1,6 mícron a cerca de 3,5 micrómetros, incluindo, entre outros, de cerca de 1,6, cerca de 1,7, cerca de 1,8, cerca de 1,9, cerca de 2,0, cerca de 2,1, cerca de 2,2, cerca 2,3, cerca de 2,4, cerca de 2,5, cerca de 2,6, cerca de 2,7, cerca de 2,8, cerca de 2,9, cerca de 3,0, cerca de 3,1, cerca de 3,2, e cerca de 3,3, cerca de 3,4, cerca de 3,5, e cerca de 4,5 mícron. Partículas representativas adequadas para utilização como partículas magnéticas de captura podem ser obtidas a partir de Bangs Laboratories, Inc. (Fishers, Indiana), Life Technologies (Carlsbad, CA), ou Polyscience Laboratories (Warrington, Pensilvania).
[00211] A captura magnética das partículas pode ser obtida usando qualquer método conhecido na técnica, incluindo, entre outros, a colocação de um magneto forte ou induzindo um campo magnético em uma área localizada do vaso de ensaio. O campo magnético localizado pode ser induzido, por exemplo, por uma ou mais magnetos permanentes, eletromagnetos, e/ou materiais (por exemplo, metais ferrosos) para conduzir, restringir, ou focar um campo magnético. Como representado na Figura 18, que representa uma modalidade, o magneto 15 é utilizado para localizar a captura magnética de complexos partícula-micro-organismo-SERS-partículas indicadoras ativas dentro da zona de medição 9. Radiação incidente de um comprimento de onda desejado, por exemplo, um feixe de laser, pode então ser focado no pélete de complexos concentrados de partículas magnética de captura- micro-organismos SERS-partícula indicadora ativa e o sinal de SERS é obtido a partir de complexos. E. Sistema em Tempo Real para Monitorar o Crescimento em uma Amostra em Cultura Microbiológica
[00212] A Figura 24 representa uma modalidade de um sistema em tempo real 150 que proporciona o monitoramento em tempo real do crescimento de micro-organismos em amostras de cultura microbiológica para detecção automática de patógenos em amostras clínicas e industriais. O sistema 150 inclui um carrossel 152 que contém uma pluralidade de vasos de cultura 154 dentro de um gabinete de temperatura controlada. Por exemplo, até 25 frascos de cultura microbiológica podem ser utilizados. Nesta modalidade, os vasos 154 são colocados em torno da periferia de um carrossel 152, que roda para apresentar cada vaso para uma estação de peletização e estação de leitura 156 em sequência em uma frequência programável (por exemplo, uma leitura a cada 10 - 60 minutos). A peletização e estação de leitura 156 inclui uma montagem magnética para formar um pélete, juntamente com uma cabeça de leitura óptica contendo filtros e lentes apropriados para epi-iluminação e coleta de sinal. Por exemplo, a iluminação pode ser fornecida por um laser de comprimento de onda estabilizado 785 nm, e o sinal coletado é detectado em um espectrômetro apropriado para a espectroscopia de Raman. Após peletização e leitura de uma dada amostra, o carrossel 152 roda para apresentar o lado da amostra no carrossel para peletização e estação de leitura 156. A sequência continua até que todas as amostras do carrossel 152 sejam lidas, em cujo ponto o carrossel entre em um modo de movimento giratório em que o carrossel gira continuamente até o próximo ciclo de medição. O carrossel e peletização e estação de leitura são montados para um braço que se estende a partir de uma plataforma de equilíbrio. O movimento resultante "deslocamento de equilíbrio", prevê agitação através de movimento linear e de equilíbrio. A plataforma de equilíbrio opera em uma frequência selecionada para todas as fases de um ciclo de medição, pela duração do experimento. A agitação tem múltiplas finalidades. Em primeiro lugar, a partir do final de um ciclo de medição para o início do próximo, isto garante a mistura das partículas magnéticas e SERS com os meios de amostra e cultura, permitindo a formação de complexos de elemento de ligação-micro-organismo- partículas indicadoras. Em segundo lugar, após o pélete ter sido lido, isto permite a dispersão das partículas magnéticas na solução. Terceiro, durante a peletização, a agitação transporta as partículas magnéticas no fluido a partir de vários pontos espaciais no interior do vaso de amostragem para a região do campo magnético localizado, garantindo que as partículas magnéticas sejam coletadas a partir de regiões da amostra fora do campo magnético localizado. Finalmente, em amostras contendo partículas (por exemplo, resinas, carvão ou carbonato de cálcio) agitação antes e durante a peletização pode impedir que essas partículas se depositem na região de detecção e interfiram com o sinal óptico. Como os organismos alvo de concentração aumentam ao longo do processo de enriquecimento, detectar e identificar micro-organismos por óptica, tais como a tecnologia de SERS, ocorre assim que a concentração de micro-organismos atingir o limiar de detecção da tecnologia. A capacidade de monitorar continuamente o sinal SERS durante cultura assegura que o tempo de cultura mínimo requerido é utilizado e que o instrumento pode alertar automaticamente o usuário, quando um patógeno ou micro-organismos é detectado e identificado.
[00213] A Figura 25 mostra outra modalidade de um sistema 200 configurado para processar uma pluralidade de amostras. Nesta modalidade particular, cada uma das amostras de cultura microbiológica é processada em paralelo e incubada na mesma zona térmica. Nesta modalidade, os tubos de amostra estão alinhados no mesmo plano horizontal. O sistema 200 pode ser colocado dentro de um compartimento que forma a zona térmica.
[00214] Todas as amostras agitam juntas para a ligação do reagente, peletização e fases de dispersão do pélete. Em uma modalidade, após a peletização, a agitação é interrompida para todas as amostras, e estas são lidas em sucessão. O processamento paralelo requer um arranjo diferente de amostra diferente do carrossel usado na primeira configuração do sistema 150. Aqui, os tubos de amostra 202 estão posicionados adjacentes uns aos outros em uma bandeja plana 204. Nesta modalidade, agitação é por movimento alternativo linear ao longo do eixo geométrico longitudinal dos tubos 202, que pode ser programada para frequências diferentes e os perfis de todo o ensaio. Isto permite que diferentes tipos e níveis de agitação para a formação de pélete, dispersão de pélete, e as fases de ligação aos reagentes. Também permite que a agitação seja parada para leitura. A programação de agitação diferente em cada fase é possível através da abordagem de processamento da amostra paralela.
[00215] O sistema 200 mostrado na Figura 25 inclui uma montagem de magnetos 206 que é configurada para rodar em uma posição adjacente aos tubos 202 para a peletização e, em seguida, rodar longe dos tubos de amostra para a interrogação. Para a modalidade do sistema 200 mostrada na Figura 25, a interrogação óptica pode ocorrer com a montagem de magnetos 206 articulada longe dos tubos de amostra 202 depois da formação do pélete para permitir o acesso da cabeça de leitura óptica 208 para a zona de medição dos tubos de amostra. Retirar a montagem magnética 206 é possível nesta configuração, porque as amostras não estão em agitação durante a leitura. Como alternativa, um par de magnetos pode ser arranjado de tal modo a proporcionar uma ranhura através da qual as leituras são tomadas pela cabeça de leitura 208, com magnetos mantidos em posição após a peletização. Assim, a cabeça de leitura 208 é configurada para se mover ao longo da ranhura entre os magnetos para interrogar cada tubo. Isto oferece vantagens ao eliminar a necessidade de mover os magnetos entre a peletização e a leitura dos tubos.
[00216] As Figuras 26 a 29 ilustram outra modalidade de um sistema 250 para o monitoramento automático e em tempo real do crescimento de micro-organismos em amostras de cultura. O sistema 250 é configurado para processar automaticamente um ou mais ensaios diferentes simultaneamente. Em geral, o sistema 250 inclui uma pluralidade de incubadoras 252 servidas por uma única montagem de peletização/leitura 254 que se move para trás das incubadoras servir (pélete e leitura) cada bandeja 256 um de cada vez, em uma zona de detecção. Cada incubadora 252 está configurada para receber uma bandeja 256 segurando uma pluralidade de tubos de amostra 258. Cada bandeja 256 de tubos é configurada para mover da incubadora 252 para a montagem de peletização/leitura 254 em que péletes foram formados e os dados coletados na zona de detecção. A montagem de peletização/leitura 254 compreende uma montagem magnética 260 para formar péletes e os componentes ópticos (por exemplo, a óptica de Raman, laser, e espectrômetro) para coletar os sinais ópticos.
[00217] Em uma modalidade, o sistema 250 inclui uma pluralidade de incubadoras 252. Vários ensaios podem incubar amostras de cultura em diferentes temperaturas. Deste modo, o sistema 250 pode incluir uma pluralidade de zonas térmicas 262 (zonas de incubação) que podem operar em temperaturas diferentes, em que cada zona inclui uma ou mais incubadoras. Os ensaios em cada incubadora 252 são processados em simultâneo, em que cada incubadora pode incluir uma ou mais bandejas 256 que prendem um ou mais tubos de amostra 258. No entanto, os tubos de amostra 258 podem não necessariamente ser transformados em um lote. A este respeito, cada tubo de ensaio 258 pode ser colocado na incubadora 252 em um momento diferente, tendo, assim, um tempo de partida diferente para o período de teste. Os tubos de amostra 258 podem todos ser expostos ao mesmo ciclo de ensaio de repetição, durante os períodos de ensaio. A maioria dos tubos de amostra 258 pode ser introduzida em conjunto em lotes. Como mostrado nas Figuras 26 e 27, o sistema inclui quatro incubadoras 252 que são divididas em duas zonas térmicas 262. As zonas térmicas 262 podem estar dispostas na vertical de modo que duas incubadoras 252 estejam associadas com uma respectiva zona térmica. Zonas térmicas idênticas 262 são empilhadas verticalmente conforme mostrado na Figura 27. No entanto, entende-se que as zonas térmicas 262 podem estar dispostas horizontalmente, ou lado a lado, se desejado. Cada zona 262 pode incluir uma ou mais incubadoras 252 mantidas em níveis idênticos de incubadoras que operam em uma temperatura comum. Em uma modalidade exemplar, as zonas 262 são configuradas para processamento de ensaios para Salmonella e Listeria, que são mantidos em temperaturas diferentes (por exemplo, cerca de 42°C e 30°C, respectivamente). Deste modo, o sistema 250 é configurado para processar diferentes tubos de amostra 258 (por exemplo, frascos de detecção), independentemente do tipo de ensaio.
[00218] Em uma modalidade, cada incubadora 252 forma um compartimento adequado para receber uma bandeja 256 no seu interior e a manutenção de uma temperatura predeterminada necessária para a cultura de uma amostra em particular. Um exemplo de uma incubadora 252 é mostrado na Figura 34. A incubadora 252 pode incluir um bloco de base 264, incluindo as superfícies de fundo e laterais, frontais e portas traseiras 266, 268, e uma superfície superior 270. A incubadora 252 pode ser formada de uma variedade de materiais adequados para proporcionar um invólucro com temperatura controlada. Por exemplo, as incubadoras 252 podem ser construídas a partir de um único bloco de base de metal maquinado 264 (por exemplo, alumínio) que forma o fundo e os lados da região de temperatura controlada, enquanto que uma placa de metal (por exemplo, alumínio) constitui a parte superior da superfície 270. A incubadora 252 pode também incluir um canal 272 no lado esquerdo do bloco de base, que está configurado para suportar uma correia de transmissão 274 para a oscilação da bandeja 256 em uma direção Y sob o controle de uma fase Y 278. A faixa de movimento da bandeja 256 se estende para além da profundidade da zona aquecida para fornecer movimento da bandeja na área do pélete/leitura por trás da incubadora 252. Assim, a amplitude de movimento de cada bandeja 256 irá basear-se na quantidade de percurso necessário para agitar adequadamente os tubos 258 como bem como reposicionar os tubos fora da incubadora 252 para a peletização e análise de imagem pela montagem peletização/leitura 254.
[00219] Em uma modalidade, a incubadora 252 inclui uma porta de entrada 266 e uma porta traseira 268, em que as portas cooperaram com a superfície superior 270 e o bloco de base 264 para formar um invólucro. A porta de entrada 266 é configurada para ser aberta e fechada seletivamente por um operador (ver, por exemplo, Figura 31). Por exemplo, a porta frontal 266 pode ser configurada para oscilar para baixo de modo que a bandeja 256 possa se estender da frente da incubadora 252 a uma distância mínima e a porta não impedirá o acesso ou visibilidade do tubo. A porta frontal 266 pode ser montada utilizando uma variedade de técnicas para facilitar a abertura e fechamento. Por exemplo, a porta frontal 266 pode ser montada em dobradiças de mola de torção que fecham a porta quando da retirada da bandeja na incubadora 252. Um mecanismo impulsor pode estender-se a partir de um ou de ambos os lados da frente da bandeja, para ajudar na abertura da porta. De acordo com um aspecto, uma bandeira está localizada dentro da porta frontal 266, que é configurada para interromper um sensor óptico montado sobre a parede lateral interior da incubadora 252 para detectar quando a porta é fechada.
[00220] Do mesmo modo, a porta traseira 268 pode ser configurada para abrir e fechar sobre a bandeja 256 que sai e entra novamente na parte traseira da incubadora 252 (ver Figura 40). Assim, como a bandeja 256 sai da incubadora 252, a bandeja é configurada para empurrar a porta traseira 268, pelo menos parcialmente aberta. Como a porta frontal 266, a porta traseira 268 pode ser montada em dobradiças com mola de torção, e uma característica na parte de trás da bandeja 256 pode ser configurada para empurrar a porta traseira aberta conforme a bandeja emerge a partir da parte traseira da incubadora 252. A bainha 276 está configurada para receber a bandeja 256 ao sair da incubadora 252, e está configurada para se movimentar ao longo de um eixo geométrico Z, como explicado em maior detalhe abaixo. Uma vez que a porta traseira 268 é parcialmente aberta, a bainha 276 pode ser configurada para abrir totalmente a porta traseira, conforme a bainha se eleva ao longo do eixo geométrico Z para se alinhar com a incubadora 252. Com a bainha 276 que prende a porta aberta, a bandeja 256 é livre para se mover na área de pélete/leitura sem interferência a partir da porta traseira 268. A porta traseira 268 está configurada para fechar quando a bandeja 256 é retraída para dentro da incubadora 252 e a bainha 276 diminui. A incubadora 252 pode incluir um sensor para indicar que a bandeja 256 está devidamente posicionada na mesma. Por exemplo, uma bandeira no interior da porta traseira 268 pode ser configurada para interromper um sensor óptico montado sobre a parede lateral interior da incubadora para detectar quando a porta traseira é fechada. Este sensor também pode ser utilizado como um indicador inicial para a bandeja 256. Assim, o sensor de porta traseira pode estabelecer a posição da bandeja 256 como dentro ou fora da parte traseira da incubadora 252. Um segundo sensor de origem pode localizar a origem para cada bandeja 256 em relação à peletização e hardware óptico durante cada incursão na região de peletização/leitura.
[00221] Porque cada incubadora 252 é de temperatura controlada, a incubadora pode ser envolvida por um material isolante (por exemplo, um isolamento de espuma de células fechadas). Cada uma das zonas térmicas 262, também pode ser separada por um material isolante, o que é útil quando as zonas são mantidas em temperaturas diferentes. Também pode haver lacunas entre as zonas para limitar comunicações cruzadas entre as zonas. Além disso, o material de isolamento pode ser utilizado para evitar a interação térmica quando uma porta de incubadora 266 ou 268 está aberta para a parte da frente ou na traseira, a outra está fechada. Espaçadores isolantes podem se separar das incubadoras em uma zona 262. Da mesma forma, as zonas 262, também podem ser separadas utilizando espaçadores e material isolante.
[00222] Cada incubadora 252 é aquecida através de um elemento de aquecimento. Por exemplo, o elemento de aquecimento pode ser configurado para conduzir o calor através da base do bloco 264 ou fornecer ar aquecido no interior da incubadora. De acordo com uma modalidade, o elemento de aquecimento é um elemento de aquecimento plano aderido a, ou de outro modo integrado, com a superfície inferior do bloco de base 264. A distribuição de energia do elemento de aquecimento pode ser adaptada para minimizar os gradientes térmicos através dos tubos 258 na bandeja 256 para compensar a perda térmica, através dos componentes da unidade Y 278 no lado esquerdo da incubadora 252. Cada incubadora 252 pode ser fornecida com um ou mais sensores para monitorar a temperatura nele, tal como a temperatura do bloco de base 264 e/ou o ar dentro da incubadora.
[00223] Como discutido acima, cada incubadora 252 está configurada para receber uma respectiva bandeja 256 no seu interior. As Figuras 30 a 32 ilustram modalidades exemplares de bandejas 256 adequadas para posicionar dentro de uma respectiva incubadora. Uma bandeja 256 em cada incubadora 252 está configurada para acomodar uma pluralidade de tubos 258. Na modalidade ilustrada, a bandeja 256 possui 15 tubos 258 de tal modo que cada zona térmica 30 possui tubos 262, embora possa ser utilizado qualquer número de tubos. Os tubos 258 podem estar dispostos horizontalmente em uma matriz plana em cada uma das bandejas 256. Em uma modalidade mostrada na Figura 31, um técnico coloca manualmente os tubos de amostra 258 em bandejas de amostras removíveis 256. O técnico então coloca as bandejas 256 nas incubadoras 252. Um ensaio está completo quando um resultado positivo é determinado ou quando o resultado negativo permanece por um período de tempo predeterminado. Quando o ensaio é completado, o técnico retira as bandejas 256 sendo recarregadas com novos tubos 258. Alternativamente, o técnico pode remover e/ou adicionar os tubos para a bandeja individualmente, conforme necessário, sem parar os ensaios já em curso dentro de outros tubos na bandeja ou incubadoras adjacentes. As amostras positivas podem ser separadas para análise posterior. Em outra modalidade, as bandejas 256 não são removíveis. Assim, os tubos 258 podem ser colocados individualmente dentro de uma bandeja não removível 256 em cada incubadora 252. Ainda em outra modalidade, a bandeja 256 pode ser desnecessária quando a incubadora 252 inclui meios adequados para a manutenção dos tubos 258 nele contidas.
[00224] A disposição dos tubos 258 horizontalmente e lado-a-lado em bandejas 256 facilita o carregamento de tubos de amostras individuais ou bandejas a partir da frente da incubadora 252. O carregamento frontal evita usar espaço de bancada ou espaço em ilha na frente do sistema, uma vez que uma bandeja carregada na superfície seria necessária estender para fora da parte frontal do sistema quase o comprimento de um tubo para facilitar a carga na superfície. Além disso, a bandeja e o suporte de deslizamento seriam necessários para suportar cargas elevadas, quando um usuário exerce demasiada pressão sobre a bandeja estendida em cantilever.
[00225] Cada bandeja 256 pode ser uma variedade de tamanhos e configurações para a manutenção dos tubos 258 e facilitar a colocação dentro da incubadora 252. Por exemplo, a Figura 31 ilustra que os tubos 258 são inseridos dentro das respectivas ranhuras 284 definidas na bandeja 256. Os tubos 258 podem ser mantidos no lugar com uma força ou um encaixe de interferência ou de elementos de polarização no interior da bandeja 256. Quando as bandejas 256 podem ser afastadas da incubadora 252, as bandejas podem incluir uma ou mais características de preensão 286, que permitem que um técnico segure as bandejas e manipule as bandejas em uma incubadora, tal como mostrado nas Figuras 33A-33C.
[00226] Em uma modalidade, a bandeja 256 inclui ranhuras longitudinais 284 de modo que uma parte dos tubos 258 é visível através da bandeja. Ranhuras longitudinais 284 também permitem que os tubos de 258 se projetem para baixo da superfície inferior da bandeja 256 para fornecer uma área de contato com os magnetos de revestimento 288. Para assegurar um contato suficiente com os magnetos em toda a bandeja 256, cada tubo 258 pode ter conformidade vertical na bandeja. Por exemplo, uma mola pode prender o tubo 258 para baixo contra os magnetos à medida que sobem para encontrar o tubo. A mola também pode reter os tubos 258 na bandeja 256 por atrito contra o movimento oscilatório da bandeja.
[00227] De acordo com uma modalidade, as bandejas 256 estão configuradas para oscilar horizontalmente ao longo do eixo geométrico Y em cada incubadora 252, sob o controle de uma fase Y 278 para agitar os tubos contendo uma amostra, o meio de cultura, e reagentes. Este movimento horizontal pode realizar várias funções: a) A agitação para uma mistura cinética na incubadora 252; b) A extensão dos tubos para frente da incubadora 252 para carga e descarga pelo operador; c) Estender os tubos fora da parte traseira das incubadoras 252 para a montagem de peletização/leitura 254; d) A agitação dos tubos 258 para dispersar materiais assentados, por exemplo, componentes sólidos do meio ou amostras; e) Agitação dos tubos de 258 e magnetos 288 na montagem pélete/leitura 254 para formar péletes; f) Posicionamento dos tubos 258 sobre a cabeça de leitura 290 para coleta de dados; g) Posicionamento de marcadores do tubo sobre um leitor de código de barras para identificar da amostra; h) Posicionar os péletes sobre uma câmera para visualizar péletes de controles internos, métodos de detecção baseados em imagem, ou diagnósticos remotos; i) Agitação dos tubos 258 para dispersar péletes após a leitura; j) Operar a porta da frente da incubadora 266; k) Operar a porta traseira incubadora 268; l) Circulação de ar na incubadora 252 para reduzir os gradientes de temperatura.
[00228] Como mostrado na Figura 34, o sistema inclui uma fase Y 278 para deslocar as bandejas 256 ao longo de um eixo geométrico Y, nomeadamente para oscilar ou agitar as bandejas e deslocar as bandejas para dentro e para fora da parte traseira da incubadora 252. Como mostrado na Figura 27, cada incubadora 252 pode incluir uma respectiva fase Y 278 disposta ao longo do eixo geométrico Z, de modo a ser espaçada verticalmente uma da outra. A bandeja 256 pode ser acoplada à fase Y 278, utilizando um ou mais cestos 282. Por exemplo, a bandeja 256 pode ser em cantilever a partir de um cesto 282 montado em um carril linear 292, em que o carril linear está montado no bloco de base da incubadora 264. A fase Y 278 inclui um motor 280 para a condução de um cinto 274 em torno de polias em ambas as extremidades do trilho 292. Entende-se que a fase Y 278 é configurada para agitar as bandejas 256 em uma variedade de frequências e amplitudes, dependendo do ensaio particular e a aplicação. Por exemplo, as bandejas 256 podem ser osciladas mais lentamente, enquanto nas incubadoras 252 quando posicionadas na montagem de peletização/leitura 254.
[00229] Os componentes da fase Y 278 também podem ser fechados por um material isolante, enquanto que o motor 280 de condução do estágio Y está fora da área de isolamento. As bandejas 256 e cesto 282 podem se mover através de uma abertura no material de isolamento.
[00230] O sistema 250 também inclui uma fase Z 294 localizada atrás das incubadoras 252 (Ver Figuras 39, 42 e 43). A fase Z 294 é configurada para transportar a bainha 276, conjunto de magnetos 260, componentes ópticos (por exemplo, espectrômetro 308, sonda de Raman 310, etc.), e fase X 296 ao longo de um eixo geométrico Z. A fase Z 294 pode incluir um transporte 298 configurado para montar em um trilho linear vertical 300. Um motor 302 está configurado para levantar e abaixar a fase Z na direção Z (por exemplo, usando um parafuso e porca linear dispostos dentro do eixo geométrico 304 acoplados a um suporte de fase Z 306). Um sensor pode ser utilizado para indicar quando a fase Z 294 está na parte inferior do seu curso na direção Z. O espectrômetro 308, conjunto de magnetos 260, bainha 276, e fase X 296, são montados no suporte da fase Z 306 e todos percorrem juntos na direção Z como uma unidade. A fase Z 294 está configurada para se mover na direção Z para acomodar cada bandeja 256 que sai da incubadora 252. A fase Z 294 também está configurada para viajar abaixo do inferior da incubadora 252 o suficiente para permitir que a porta traseira inferior da incubadora 268 se feche.
[00231] O sistema 250 também inclui uma montagem de magneto 260, como mostrado nas Figuras 42, 45, e 46. A montagem de magneto 260 pode incluir um ou mais magnetos 288 montados em uma estrutura de magneto 318 configurado para aplicar um campo magnético aos tubos 258, assim facilitando a formação de um pélete no interior de cada tubo. Por exemplo, as Figuras 45 e 46 ilustram um par de magnetos longitudinais 288 afastados a uma distância suficiente para permitir que a cabeça de leitura 290 se estenda através da mesma para obter uma leitura. Assim, os ímãs 288 podem permanecer na posição após a peletização e enquanto os tubos de 258 estão sendo lidos pela cabeça de leitura 290. Cada magneto longitudinal 288 pode ser um único magneto ou uma coleção de uma pluralidade de magnetos dispostos de ponta a ponta.
[00232] Os péletes podem ser formados quando magnetos 288 são postos em contato com, ou em estreita proximidade com, a parte inferior dos tubos orientados horizontalmente 258. Os tubos 258 e magnetos 288 oscilam suavemente durante a formação do pélete para assegurar que as partículas magnéticas em suspensão passem através do campo magnético e sejam atraídas para um ponto focal do campo magnético. De acordo com uma modalidade, a montagem de magnetos 260 é montada em um cesto 312 que corre na direção Y em um trilho 314 afixada ao suporte de fase Z 306 (ver Figura 46). O trilho 314 pode ser paralelo ao trilho de fase Y 292.
[00233] Quando a bandeja 256 se estende para fora da parte traseira da incubadora 252 e na montagem de peletização/leitura 254, a fase Z 294 pode ser levantada a partir de baixo ao longo de um eixo geométrico Z. Como mostrado nas Figuras 42 e 47, um pino 316 que se estende para fora a partir da estrutura de magneto 318 está configurado para se engatar com um buraco na parte de baixo da bandeja 256. Uma vez ligado, a estrutura de magneto 318 é acoplada com a bandeja 256 e a estrutura de magneto e bandeja são capazes de se mover em conjunto na direção Y ao longo do trilho 314. Portanto, em uma modalidade, a montagem de peletização/leitura 254 é configurada para processar uma bandeja 256 de cada vez. A amplitude de oscilação de peletização pode variar dependendo de um número de fatores específicos para um determinado ensaio. Em um exemplo, a amplitude de oscilação pode ser de até cerca de 50 mm. A estrutura de magneto 318 e bandeja 256 podem ser acopladas a uma posição do curso total da fase Y na direção Y, enquanto que o centro das oscilações de peletização pode ser localizado para a frente a partir do local de acoplamento para acomodar % amplitude na direção Y.
[00234] Em uma modalidade, uma pequena quantidade de movimento relativo entre tubos oscilantes 258 e os magnetos 288 permite que o campo magnético reúna as partículas magnéticas em um pélete mais justo. Assim, um acoplamento entre a bandeja 256 e a estrutura de magneto 318 pode ser desejável. Tal acoplamento pode ser executado, por exemplo, através da montagem da estrutura 318 sobre um bloco mantido em uma ranhura na estrutura 318 entre duas molas. À medida que a bandeja 256 oscila para frente e para trás na direção Y, a estrutura 318 se move em relação à bandeja, conforme as molas comprimem alternadamente em um segundo movimento oscilatório. O acoplamento frouxo pode ser, por exemplo, cerca de 5 mm. As constantes de mola serão selecionadas para fornecer a melhor frequência de oscilação.
[00235] A montagem do magneto 260 está configurada para peletizar cada um dos tubos 258 da bandeja 256 ao mesmo tempo, de acordo com uma modalidade da presente invenção. Os magnetos 288 podem ser configurados para permanecer no lugar enquanto os tubos 258 são lidos pela cabeça de leitura 290. Em alternativa, os péletes podem ser adequadamente persistentes para permitir que o magneto 288 ou tubos 258 sejam afastados uns dos outros para a leitura.
[00236] A Figura 41 mostra um exemplo de uma fase X 296, que é acoplada à fase Z 294. Assim, a fase X 296 é configurada para ser movida na direção Z pela fase Z. A fase X 296 também facilita o movimento da cabeça de leitura 290 na direção X para a leitura de cada um dos tubos 258. A fase X 296 faz a varredura da cabeça de leitura 290 sob a montagem de tubos 258 para coletar dados de ensaio depois de péletes terem sido formados. Durante a peletização, a fase X 296 é movida para uma posição X que permite que uma bandeja 256 acoplada seja transferida, sem interferência com a cabeça de leitura 290 e da montagem de magnetos 260. Após peletização, com a bandeja 256 mantida estacionária, a fase X 296 traduz a cada tubo 258, fazendo uma pausa para coleta de dados até que todos os tubos sejam lidos. A fase X 296 é então reposicionada na sua posição inicial antes da bandeja 256 ser movida. Em uma modalidade exemplar, a unidade de fase X (por exemplo, o motor 320 e correia 322) é montada em um canal 324 no suporte de fase Z 306 e utiliza um design semelhante ao da fase Y 278. A cabeça de leitura 290 está montada a um cesto 326 que está configurado para se mover ao longo de um trilho 328 da fase X 296. Uma manga flexível 330 pode ser utilizada para conduzir a cabeça de leitura 290 por cabos elétricos e cabos de fibra óptica flexível da fase Z 294 para mover a cabeça de leitura. A manga flexível 330 está configurada para proteger não só o feixe de fibras ópticas, mas também permite que a fibra de flexione na direção X e proporcione um raio de curvatura desejado.
[00237] De acordo com outra modalidade, a fase X 296 é configurada para transportar um leitor de código de barras (não mostrado) para a leitura de um código de barras ou outro identificador de cada um dos tubos 258. Por exemplo, o leitor de código de barras pode ser usado para confirmar que o tubo 258 está na zona térmica correta 262, impedindo, assim, os falsos negativos. O código de barras pode incluir outros dados, tais identificação e análise da informação. Como discutido acima, os tubos 258 podem incluir ranhuras longitudinais 284 que facilitam essa leitura por um leitor de código de barras. Além disso, o leitor de código de barras pode fornecer dados de imagem em péletes para controles internos, métodos de detecção baseados em imagem e/ou diagnósticos remotos.
[00238] Como discutido acima, uma bainha 276 está configurada para receber cada bandeja 256 conforme a bandeja sai da parte de trás da incubadora 252. Em particular, a bainha de isolamento 276 é carreada na fase Z 294 e está configurada para se alinhar com cada incubadora 252 para rodear a bandeja 256, quando esta se estende para fora da parte traseira da incubadora para a região de peletização/leitura 254. A bainha isolada 276 minimiza a variação de temperatura da bandeja enquanto a bandeja 256 é estendida para fora da incubadora 252. A bainha 276 fornece uma manga isolante e bloqueia o fluxo de ar de resfriamento da bandeja 256 e tubos 258 nela contidos. Além disso, a bainha 276 é construída a partir de materiais que minimizam a sua massa térmica e, assim, a energia de troca de calor com uma bandeja 256 em uma temperatura diferente daquela da zona anterior. Por exemplo, a bainha 276 pode compreender uma estrutura de alumínio fina em torno de um material isolante. Em uma modalidade específica, uma bandeja em cerca de 30°C entrando em uma bainha em cerca de 42°C, não irá aumentar a temperatura em mais do que cerca de 0,5°C.
[00239] Pode haver uma lacuna 332 definida entre a incubadora 252 e a bainha alinhada 276 de modo que a incubadora não consegue regular a temperatura totalmente na bainha. Nos nestes casos, onde a temperatura na incubadora 252 é maior do que a temperatura ambiente, o ar que envolve a bainha 276 pode ser mais frio do que a bandeja 256, de modo que a transferência térmica a partir da bainha ficará voltada para uma temperatura inferior da bandeja. No entanto, alguns ensaios têm uma tolerância de temperatura aceitável e deve haver variações resultantes do movimento da bandeja 256 da incubadora 252 na bainha 276. Por exemplo, os ensaios são mais tolerantes a quedas curtas em temperaturas negativas, por exemplo, cerca de -2°C, do que aumentos de temperatura, por exemplo, cerca de +0,5°C para Salmonella a 42°C e Listeria a 30°C. Assim, pode não ser necessário formar uma boa vedação térmica com a incubadora 252 enquanto excursões negativas estão dentro de tolerâncias aceitáveis.
[00240] Além de circundar a bandeja estendida 256, a bainha 276 pode também incluir a montagem de magneto 260 como mostrado na Figura 42. Assim, a bainha 276 pode ser dimensionada para permitir a fase Z 294 para se mover verticalmente com a montagem de magnetos 260 para acoplamento e desacoplamento da bandeja 256, como discutido acima. Além disso, a bainha 276 pode incluir cortes para fornecer saída para a cabeça de leitura 290 ao longo da parte inferior da bainha e para os carros 282 se movimentando ao longo da lateral através da fase Y 278. A parte superior da bainha 276 pode também incluir o corte para porta traseira da incubadora 268.
[00241] Os componentes do sistema 250 acima mencionados podem ser colocados em um armário de 334, como mostrado nas Figuras 48A e 48B. A pele forma um armário de 334 ao redor da incubadora 252 e região de peletização/leitura 254 para controlar o fluxo de ar e adicionar controle térmico. O armário 334 também pode também proporcionar um invólucro de segurança, em que os componentes ópticos operam (por exemplo, laser). O sistema 250 pode ainda incluir um ou mais sinais visíveis ou audíveis para indicar o estado dos ensaios. Por exemplo, um ou mais LEDs 336 podem ser utilizados para indicar que o teste está em progresso e, quando ocorre um resultado positivo. Cada tubo 258 e/ou bandeja 256 pode incluir um LED associado 336 para um dito propósito. LED de diferentes cores podem ser utilizados para diversas indicações, em que as cores podem ser visíveis quando a porta da frente 266 da incubadora 252 é aberta ou fechada.
[00242] As incubadoras 252 tipicamente são mantidas em uma temperatura que é mais elevada que a temperatura ambiente. Para ajudar na obtenção desta diferença de temperatura e garantir que o excesso de calor não é liberado às bandejas 256 que se estende no interior da bainha 276, um caminho de fluxo de ar pode ser empregado. Os ventiladores com filtros podem também ser usados para a pressurização do armário 334 para reduzir a infiltração de poeiras, e podem ser utilizadas outras técnicas de dissipação de calor para os componentes, tais como os motores. Outras técnicas, tal como um resfriador elétrico térmico pode ser usado para resfriar ainda mais o armário 334.
[00243] Vários componentes elétricos podem ser utilizados para fazer a interface com e controlar o sistema 250, como é conhecido pelos versados na técnica. Por exemplo, várias placas de unidade do motor podem ser usadas para controlar os motores e fornecer a interface com os outros dispositivos, tais como os sensores e codificadores. Outras placas podem ser usadas para proporcionar a funcionalidade adicional, tal como o fornecimento de sinais de energia e de interface para a cabeça de leitura 290 e o espectrômetro 308, bem como aquecedores de condução e lendo os termistores associados. Além disso, o sistema 250 pode empregar vários outros componentes, tais como um microcontrolador para controlar o sistema de uma forma automatizada, como é conhecido pelos versados na técnica.
[00244] A Figura 49 ilustra métodos de agitação e peletização de acordo com uma modalidade da invenção, que têm sido desenvolvidos, que minimizam o volume de reagentes e obtêm uma leitura que é representativa de um grande volume (por exemplo, até 250 ml). Este é principalmente obtido por agitação do vaso de cultura ao longo do seu eixo geométrico longitudinal durante a aplicação do campo magnético. O pélete é formado ao lado do tubo, ao longo da direção do eixo geométrico longitudinal. Uma combinação de volume de amostra para tubo (por exemplo, 1:2), a proporção de comprimento do tubo/aspecto de largura (por exemplo, 7:1), e os resultados de parâmetros de agitação podem ser selecionados para otimizar o desempenho. A agitação promove a formação de pélete mais eficiente, garantindo que as partículas de maior volume sejam trazidas para perto com o magneto. Além disso, a agitação ajuda a manter as células não complexadas, micro-organismos e os sólidos soltos (por exemplo, resinas em amostras de hemocultura) fora do pélete através da aplicação de uma força para longe da direção do campo magnético.
[00245] A Figura 50 ilustra uma modalidade de um dispositivo para formar e interrogar o pélete magnético. Este dispositivo pode ser utilizado na modalidade de sistema de carrossel 150 mostrada na Figura 24. Na modalidade ilustrada na Figura 50, a montagem magnética é composta por uma pilha de anéis de magnetos circundantes e colinear com a parte da cabeça de leitura óptica que contém a lente objetiva. Uma ponta de aço cónico oca concentra o campo magnético na ponta do cone, fazendo com que o pélete seja formado no foco da cabeça de leitura. Este arranjo alinha automaticamente o pélete com o foco da cabeça de leitura e relaxa as restrições sobre o alinhamento do tubo, magneto, e cabeça de leitura. O alinhamento consistente de péletes, magneto, e cabeça de leitura é importante para medições consistentes em todas as amostras ao longo do ensaio, e este desenho fornece a formação de pélete confiável e repetível em todos os tubos de amostra, sobre várias leituras durante o curso de um ensaio, e em todos os instrumentos.
[00246] As Figuras 51 e 52 mostram métodos alternativos para formar o pélete que têm sido utilizados em conformidade com os sistemas descritos acima. O alinhamento dos tubos em um plano horizontal permite que o sinal óptico seja lido com os magnetos retirados após a peletização ou mantida na posição de peletização. Isto permite que várias geometrias de magneto sejam testadas. Duas demonstraram ser especialmente eficazes. Uma delas, chamada "North-up" usa um magneto de barra com magnetização direta normal ao tubo (Figura 52). Isto forma um pélete circular simétrica ideal para leitura com a cabeça de leitura. A outra geometria é denominada "Nort-facing-North pair" (Figura 51) em que duas barras magnéticas são posicionadas adjacentes e paralelas umas às outras. A magnetização é dirigida ao longo da linha normal para os magnetos através da espessura de cada magneto, de tal forma que os polos Norte se enfrentam. Com o espaçamento adequado entre os magnetos, a região de maior gradiente de campo está na região entre os magnetos, resultando em um pélete centrado na região entre os magnetos, que é facilmente acessível para a leitura com os magnetos no lugar.
[00247] Em outra modalidade da invenção, uma câmara é também adicionada à estação de teste para controlar a formação e o tamanho do pélete durante o ensaio de SERS - HNW que contém partículas indicadoras SERS conjugados e as esferas magnéticas e o patógeno alvo dentro de um vaso de cultura. O tamanho do pélete aumenta e, em alguns casos, o pélete desaparece, a partir da visão da câmera conforme o ensaio HNW progride. O crescimento no tamanho do pélete e/ou desaparecimento do pélete é uma indicação da presença do patógeno alvo. Imagens capturadas durante a análise de amostras que contêm partículas conjugadas indicadoras SERS e esferas magnéticas sem patógeno não mostram nenhuma mudança no tamanho do pélete e nenhum desaparecimento do pélete. Este método de detecção de patógenos pode ser utilizado isoladamente ou em conjunto com um outro método de detecção, tais como a análise de SERS anteriormente descrita como um meio de validação.
[00248] As modalidades dos métodos presentemente revelados podem ser realizadas com qualquer espectrômetro adequado ou sistemas de espectrometria de Raman conhecidos na técnica, incluindo, por exemplo, um espectrômetro de Raman de Espectrômetro de múltiplo multimodo (Centice, Morrisville, Carolina do Norte, Estados Unidos da América), tal como o sistema de espectrômetro Raman divulgado na patente US 7.002.679 para Brady et al., que é aqui incorporada por referência na sua totalidade. Outros exemplos não limitativos de espectrômetros adequados ou sistemas de espectrometria de Raman incluem o Hamamatsu C9405CA e o Intevac ReporteR, e incluem ambas as configurações ópticas acopladas à fibra e de espaço livre. Instrumentação adequada adicional para utilização com as partículas indicadoras SERS ativas presentemente reveladas é divulgado no Pedido de Patente Internacional PCT PCT/US2008/057700 para Weidemaier et al., depositado em 20 de março de 2008, que é aqui incorporado por referência na sua totalidade.
[00249] Métodos representativos para a realização de ensaios de captura magnética de SERS em base líquida são revelados no Pedido de Patente Internacional PCT PCT/US2008/057700 para Weidemaier et al., depositado em 20 de março de 2008, que é aqui incorporado por referência na sua totalidade. Tais métodos podem incluir referência aos métodos de controle e para compensar variações em tamanho de pélete magnético, forma ou posicionamento, e os métodos para a geração de espectros de referência melhorado de Raman e análise espectral em ensaios baseados em líquidos magnéticos suspensos, como também descrito em PCT/US2008/057700. Além disso, várias moléculas repórter podem ser utilizadas para criar um sinal de referência interno que pode ser utilizado para distinguir do ruído de fundo a partir do sinal de detecção, particularmente em amostras que apresentam ou se espera que exibam um sinal relativamente fraco.
[00250] Além disso, conforme divulgado no pedido de patente US 12/134594 para Thomas et al., depositado em 6 de junho de 2008, e Pedido de Patente Internacional PCT PCT/US2008/066023 para Thomas et al., depositado 06 de junho de 2008, cada um das quais é incorporado por referência na sua totalidade, corantes adequados para utilização como moléculas repórter em partículas indicadoras SERS ativas tipicamente exibem espectros de Raman simples relativamente com larguras de linha estreitas. Esta característica permite detectar várias diferentes espécies ativas de Raman no mesmo volume de amostra. Consequentemente, esta característica permite que várias partículas indicadoras SERS ativas, cada uma incluindo diferentes corantes, sejam fabricadas de modo a que o espectro de Raman de cada corante pode ser distinguido de uma mistura de diferentes tipos de partículas indicadoras. Esta característica permite detectar multiplex de várias espécies alvos diferentes em um pequeno volume da amostra, aqui referidos como ensaios multiplex.
[00251] Por conseguinte, em algumas modalidades, mais do que um tipo de elemento de ligação pode ser ligado à partícula indicadora SERS ativa. Por exemplo, o tipo de elemento de ligação ligado à partícula indicadora SERS ativa pode ser variado para proporcionar vários reagentes que têm diferentes afinidades para diferentes microorganismos alvos. Deste modo, o ensaio pode detectar mais do que um micro-organismo de interesse ou exibir seletividade ou sensibilidade diferente para por mais do que um micro-organismo. A partícula indicadora SERS ativa pode ser adaptada para as amostras de cultura em que a presença de um ou mais patógenos, ou as concentrações de um ou mais micro-organismos, pode variar.
[00252] Um reagente de ensaio de SERS pode incluir mais do que um tipo de marcador, por exemplo, mais do que um tipo de molécula repórter SERS ativa, dependendo dos requisitos do ensaio. Por exemplo, as moléculas repórter SERS ativas que exibem um sinal de Raman, em diferentes comprimentos de onda, podem ser utilizadas para criar uma única "impressão digital" de Raman de um microorganismo de interesse específico, aumentando assim a especificidade do ensaio. Diferentes moléculas repórter podem ser ligadas aos núcleos de nanopartículas que têm ligados a eles membros de ligação específica diferentes para proporcionar um reagente capaz de detectar mais do que um micro-organismo de interesse, por exemplo, uma pluralidade de micro-organismos de interesse.
[00253] Em uma modalidade da invenção, os recursos de multiplexação da tecnologia SERS HNW são usados para identificar seis dos organismos mais comuns causadores de infecções da corrente sanguínea. Seis tipos diferentes, ou "tipos" de partículas indicadoras SERS ativas estão presentes em um frasco de hemocultura, cada um conjugado com anticorpos específicos para um dos seis organismos a ser detectado. Também no vaso estão as partículas magnéticas de captura capazes de formar sanduíches com as partículas indicadoras SERS ativas. As partículas magnéticas de captura podem ser configuradas de modo que há um anticorpo de captura comum ou conjunto de anticorpos que forma sanduíche com múltiplas partículas indicadoras SERS ativas, ou, alternativamente, poderá haver seis conjugados magnéticos separados presentes no vaso, com cada conjugado magnético único capaz de formar um sanduíche com cada uma das seis partículas indicadoras SERS ativa. Quando um pélete magnético é formado e o sinal de SERS do pélete é lido, o espectro de Raman medido será uma contribuição de cada tipo de partícula indicadora SERS ativa presente no pélete; a presença de uma partícula indicadora SERS ativa indica a presença do micro-organismo em que as partículas indicadoras SERS ativas são específicas. Algoritmos de desconvolução podem distinguir eficientemente os espectros das seis partículas indicadoras SERS ativas individuais do espectro total medido.
[00254] A Figura 53 mostra um esquema de uma modalidade multiplexada utilizando apenas duas partículas indicadoras SERS ativas. Em uma modalidade preferencial, um sensor de gás padrão (por exemplo, BACTEC™) é retido, de modo que o sinal de SERS e os sinais dos sensores de pH são monitorados simultaneamente. Isto permite a detecção eficiente de qualquer micro-organismo que não é reconhecido pelos anticorpos SERS HNW.
[00255] Tal como ainda descrito no Pedido de Patente Internacional PCT PCT/US2008/057700 para Weidemaier et al. depositado em 20 de março de 2008, nos ensaios presentemente revelados envolvendo partículas indicadoras SERS ativas, os espectros de SERS podem ser amplificados por meio da adição de uma segunda alíquota de moléculas repórter capaz de gerar um sinal detectável e tendo a ele associado, pelo menos, um elemento de ligação específico tendo uma afinidade para, pelo menos, uma molécula repórter SERS ativa associada com as uma ou mais partículas indicadoras de SERS ativas antes de, concorrentemente com, ou após a eliminação da amostra e/ou, pelo menos, uma das moléculas do repórter SERS ativa nele contidas, em que a segunda alíquota de moléculas repórter é a mesma que, pelo menos, uma molécula repórter SERS ativa associada com as partículas indicadoras SERS ativas. Em algumas modalidades, a segunda alíquota de moléculas repórter compreende uma molécula repórter SERS ativa associada com uma partícula indicadora SERS ativa capaz de produzir um sinal de SERS. Nestas modalidades, em que uma segunda alíquota de moléculas repórter está disposta dentro do vaso de ensaio, o elemento de ligação específico da segunda alíquota de moléculas repórter não reconhece os um ou mais membros de ligação específicos que compreendem a zona de captura ou ligada às partículas magnéticas de captura.
[00256] De acordo com uma modalidade exemplar, uma amostra de cultura para detectar e identificar Salmonella pode ser fornecida em conjunto com as modalidades acima mencionadas. Em uma modalidade, Salmonella é primeiro cultivada em um meio não seletivo no interior do vaso de enriquecimento, seguido por uma transferência para um frasco de detecção biocontido contendo os reagentes de detecção e um segundo meio seletivo. Geralmente, o teste de Salmonella inclui a adição de meio com suplemento opcional em um vaso para a preparação do meio. O meio é então dispensado para o vaso de enriquecimento e uma amostra é adicionada ao vaso de enriquecimento. Opcionalmente, a amostra é homogeneizada (por exemplo, por consumação ou mistura) antes da adição ao vaso de enriquecimento. Neste caso, a meio do vaso de preparação de meio é adicionado juntamente com a amostra ao homogeneizador. Após a homogeneização, a amostra é transferida para o vaso de enriquecimento, e uma tampa é conectada ao vaso. Uma vez que o meio e amostra foram adicionados ao vaso de enriquecimento e a tampa do vaso de enriquecimento foi conectada, um código de barras sobre o vaso pode ser lido para efeitos de identificação da cadeia de custódia. O vaso de enriquecimento é em seguida incubado durante um período de tempo predeterminado. Após a incubação, o vaso de enriquecimento e um frasco de detecção podem ser verificados com um leitor de código de barras. O frasco de detecção inclui um meio seletivo e reagentes de detecção que são específicos para detectar Salmonella. No caso em que os meios de detecção no frasco são desidratados, fluido de reconstituição é adicionado ao frasco de detecção, e o frasco é invertido para a mistura. O vaso de enriquecimento é então inclinado para encher um respectivo reservatório com uma quantidade desejada de amostra (por exemplo, 100 μL). O frasco de detecção é introduzido no vaso de enriquecimento para engatar uma agulha no interior da abertura de uma transferência biocontida da amostra no frasco de detecção. O frasco de detecção é então inserido dentro de um sistema em tempo real para incubação automatizada e realização de testes automatizados da amostra, incluindo a peletização e a análise óptica da amostra. Após detectar uma amostra positiva, o frasco de detecção pode ser removido, escaneado por um escâner de código de barras, e encaminhado para processamento adicional.
[00257] Em uma modalidade exemplar alternativa, uma amostra de cultura para detectar e identificar Listeria pode ser fornecida em conjunto com as modalidades acima mencionadas. Em uma modalidade preferencial, a cultura de Listeria no interior do frasco de detecção ocorre no mesmo meio que é utilizado no vaso de enriquecimento, de modo que um único meio é usado em todo o fluxo de trabalho. Geralmente, o teste de Listeria inclui a adição de meio com suplemento opcional em um vaso para a preparação de meio. O meio é então dispensado para o vaso de enriquecimento e uma amostra é adicionada ao vaso de enriquecimento. Opcionalmente, a amostra é homogeneizada (por exemplo, por consumação ou mistura) antes da adição ao vaso de enriquecimento. Neste caso, a meio do vaso de preparação de meio é adicionado juntamente com a amostra ao homogeneizador. Após a homogeneização, a amostra é transferida para o vaso de enriquecimento, e uma tampa é conectada ao vaso. Uma vez que meios e amostra foram adicionados ao vaso de enriquecimento e a tampa do vaso de enriquecimento foi conectada, um código de barras sobre o vaso pode também ser lido para efeitos de identificação da cadeia de custódia. O vaso de enriquecimento é em seguida incubado durante um período de tempo predeterminado. Após a incubação, o vaso de enriquecimento e um frasco de detecção podem ser verificados com um leitor de código de barras. O frasco de detecção inclui os reagentes de detecção que são específicos para detectar Listeria. O vaso de enriquecimento é então inclinado para encher um respectivo reservatório com uma quantidade desejada de amostra (por exemplo, 5 ml). O frasco de detecção é introduzido no vaso de enriquecimento para engatar uma agulha no interior da porta para uma transferência biocontida da amostra no frasco de detecção. O frasco de detecção é então inserido dentro de um sistema em tempo real para incubação automatizada e realização de testes automatizados da amostra, incluindo a peletização e a análise óptica da amostra. Após detectar uma amostra positiva, o frasco de detecção pode ser removido, escaneado por um escâner de código de barras, e encaminhado para processamento adicional.
[00258] As Figuras 93 a 95 ilustram estações de reconstituição que podem ser usadas em conjunto com modalidades da presente invenção. Como discutido acima, o fluido de reconstituição pode ser adicionado ao frasco de detecção, onde os meios de detecção no frasco são desidratados. As estações de reconstituição facilitam a medição de um volume desejado e permitem a adição do fluido de reconstituição sem esgotar um vácuo retido dentro do frasco de detecção. A Figura 93 ilustra uma modalidade em que a estação de reconstituição 350 inclui uma bexiga 352 ou reservatório secundário similar, com uma válvula de estrangulamento 354. A estação de reconstituição 350 é alimentada por gravidade de modo que fluido é configurado para percorrer a partir do reservatório principal, através da tubagem 358, e para dentro da bexiga 352 quando a válvula 354 é aberta. Por exemplo, uma alavanca 356 pode ser rodada no sentido horário para engatar ou prender o tubo 358 para fechar a tubagem na válvula 354. Um usuário é então capaz de inserir o frasco de detecção 360 para a porta de acesso 362, para que uma agulha disposta dentro do orifício de acesso engate a rolha 364 para retirar o fluido de reconstituição no tubo. Um usuário é então capaz de inserir o frasco de detecção 360 para a porta de acesso 362, para que uma agulha disposta dentro do orifício de acesso engate a rolha 364 para retirar o fluido de reconstituição no tubo. Além disso, a bexiga 352 está configurada para encher automaticamente de modo que a estação 350 seja sempre a reconstituição provida.
[00259] Em alternativa, a Figura 94 ilustra uma estação de reconstituição 375 que inclui uma válvula rotativa 376, de acordo com outra modalidade. A este respeito, o fluido de reconstituição é armazenado no reservatório 378 e é alimentado por gravidade para um segundo reservatório ou bexiga. Quando a válvula rotativa 376 está na posição "fechada", nenhum fluido pode escapar a partir da porta de acesso 380, devido ao risco de fuga a partir da bexiga. Para transferir fluido, a válvula rotativa 376 pode ser girada para a posição "aberta". Um frasco de detecção 382 é inserido no interior da abertura de acesso 380 através do qual o fluido pode então ser removido a partir da bexiga quando a rolha engata uma agulha disposta dentro da porta de acesso. A rotação da válvula 376 para a posição aberta também fecha a linha de alimentação por gravidade para dentro da bexiga. Quando a válvula 376 é rodada para trás para a posição fechada, a bexiga pode ser automaticamente preenchida. A válvula rotativa 376 pode ser operada por um botão ou outro mecanismo apropriado para abrir e fechar a válvula, embora não seja necessária uma ação de rotação, a fim de efetuar esta abertura e fechamento da válvula (por exemplo, uma válvula acionada por meio de um movimento linear).
[00260] A Figura 95 representa uma estação de reconstituição 400 que inclui uma seringa 402 em comunicação fluida com uma válvula rotativa 404, de acordo com outra modalidade da presente invenção. Ao contrário das modalidades anteriores, a estação de reconstituição 400 não é alimentada por gravidade, de tal modo que o fluido de reconstituição é retirado do reservatório 406 e na seringa 402 por meio de acionamento da seringa. A este respeito, a seringa 402 pode ser configurada para retirar uma quantidade desejada de fluido de reconstituição na seringa ou uma bexiga disposta nela quando a válvula rotativa 404 está na posição fechada. Uma vez que a seringa é cheia, a válvula rotativa 404 para uma posição aberta permite o acesso ao fluido contido no interior da seringa através da inserção de um frasco de detecção no interior da porta de acesso 408 e engatando a agulha disposta na porta de acesso 408. Girar a válvula 404 para a posição aberta fecha a linha de alimentação a partir da bexiga para o reservatório 406. Mais uma vez, compreende-se que a válvula rotativa 404 pode ser qualquer mecanismo apropriado para facilitar a abertura e fechamento da válvula. Do mesmo modo, a seringa 402 pode ser qualquer dispositivo adequado configurado para retirar uma quantidade desejada de fluido a partir do reservatório de reconstituição 406.
[00261] Os exemplos retratados demonstram estações de reconstituição que não requerem fontes de alimentação externas. Um versado na técnica pode também prever que os sistemas de medição de fluidos são alimentados.
[00262] Modalidades da presente invenção podem ser utilizadas para detectar suspeitas de infecções de corrente sanguínea decorrentes da bacteremia e fungemia. Várias amostras de sangue são coletadas tipicamente separadas a partir de veias de um sujeito, por exemplo, um paciente, em intervalos de tempo diferentes, dependendo dos sintomas do sujeito, por exemplo, a observação de uma febre, ou algum outro diagnóstico inicial. Um volume da amostra de sangue, por exemplo, cerca de 3 ml até cerca de 10 ml para adultos e cerca de 1 ml para amostras pediátricas, pode ser disposto em um frasco de cultura de crescimento do sangue após a sua coleta. Normalmente, para cada ciclo de coleta, uma amostra é colocada em um frasco de cultura de crescimento do sangue apropriado para organismos aeróbios e uma amostra é colocada em um frasco de cultura de crescimento do sangue apropriado para os organismos anaeróbios.
[00263] Ao contrário dos métodos conhecidos na técnica que detectam um aumento na produção de gás, como uma medida de crescimento microbiano nas amostras de hemocultura, os métodos presentemente divulgados vantajosamente permitem detectar patógenos intracelulares (por exemplo, bacterianos, virais). Microorganismos intracelulares ou patogênicos crescem e se reproduzem dentro de outras células (por exemplo, células eucarióticas) e, portanto, não podem ser detectados por meio de sensores de gás conhecidos na técnica. Micro-organismos intracelulares representativos que podem ser detectados com os métodos presentemente divulgados incluem, entre outros, Chlamydia trachomatis e Mycobacterium tuberculosis.
[00264] Os micro-organismos apresentados na Tabela 1 são comumente encontrados em sujeitos como a causa de bacteremia ou septicemia e são classificados na ordem em que são encontradas em sujeitos. Também anotados na Tabela 2 são os micro-organismos que em conjunto representam 80% de todos os resultados positivos em amostras de hemocultura e aqueles micro-organismos que são considerados a serem tratados. Tabela 1 Organismos de Ocorrência de espécie ou grupo bacteriano, em 20021
[00265] Comida, água, cosméticos, produtos farmacêuticos e amostras ambientais são geralmente rastreados para microorganismos, incluindo, entre outros, espécies de Escherichia coli enterotoxigênica (ETEC), Escherichia coli enteropatogênica (EPEC), Escherichia coli enterohemorrágica (EHEC), Escherichia coli enteroinvasiva (EIEC), Escherichia coli enteroagregada (EAEC), Escherichia coli difusamente aderente (DAEC), Escherichia coli produtora de toxina shiga (STEC), E. coli O157, E. coli O157:H7, E. coli O104, E. coli O26, E. coli O45, E. coli O103, E. coli O111, E. coli O121 e E. coli O145, Shigella, espécies de Salmonella, espécies de Salmonella bongori, Salmonella enterica, Campylobacter, Yersinia enterocolitica, Yersinia pseudotuberculosis, espécies de Vibrio, Vibrio cholerae, Listeria species, Listeria monocytogenes, Listeria grayii, Listeria innocua, Listeria ivanovii, Listeria seeligeri, Listeria welshmeri, espécies de Staphylococcus, espécies de Coagulase negativa Staphylococcus , Staphylococcus aureus, Bacillus cereus, Bacillus subtilis, Clostridium perfringens, Clostridium botulinum, Clostridium tetani, Clostridium sporogenes, espécies de Cronobacter, Cronobacter sakazakii (formalmente Enterobacter sakazakii), espécies de Streptococcus, S. pyogenes, espécies de Micrococcus, espécies de Psuedomonas, P. aeruginosa, P. fluorescens, P. putida, espécies de Legionella, espécies de Serratia, K. pneumoniae, espécies de Enterobacter, espécies de Alcaligenes, espécies de Achromobacter, leveduras e bolores como espécies de Aspergillus, espécies de Penicillium, espécies de Acremonium, espécies de Cladosporium, espécies de Fusarium, espécies de Mucor, espécies de Rhizopus, espécies de Stachybotrys, espécies de Trichoderma, espécies de Alternaria, espécies de Geotrichum, espécies de Neurospora, espécies de Rhizomucor, espécies de Rhizopus, espécies de Ustilago,espécies de Tolypocladium, espécies de Mizukabi, espécies de Spinellus, espécies de Cladosporium, espécies de Alternaria, espécies de Botrytis , espécies de Monilia, espécies de Manoscus, espécies de Mortierella, espécies de Oidium, espécies de Oosproa, espécies de Thamnidium, espécies de Candida, espécies de Saccharomyces,espécies de Trichophyton.
[00266] Além disso, estas amostras são frequentemente rastreadas para organismos indicadores, incluindo, entre outros, coliformes, coliformes fecais, E. coli, Enterobacteriaceae, espécies de Enterococcus , colifago ou bacteriófago.
[00267] Além disso, algumas amostras são testadas para as cepas resistentes aos antibióticos clinicamente significativos de microorganismos, incluindo, entre outros, resistente a meticilina S. aureus e espécies de vancomicina-resistente Enterococcus.
[00268] Os micro-organismos que podem ser detectados de acordo com modalidades da presente invenção incluem, entre outras, bactérias Gram negativas, bactérias Gram positivas, bactérias positivas para Gram ácido rápido e fungos, incluindo leveduras. Micro-organismos bacterianos e fúngicos representativas, isto é, antígenos, que são alvos para os ensaios de hemocultura presentemente divulgados são fornecidos aqui imediatamente abaixo, de acordo com uma modalidade da presente invenção. Como notado aqui em outro local, anticorpos com especificidade para os antígenos apresentados imediatamente a seguir aqui podem incluir, entre outros, anticorpos policlonais, monoclonais, Fab', Fab’’, anticorpos recombinantes, anticorpos de cadeia simples (SCA), anticorpos humanizados ou anticorpos quiméricos. Em todos os casos, o anticorpo terá uma ou mais CDR específicas para o antígeno aqui listado imediatamente abaixo. Anticorpos são conhecidos na técnica e estão prontamente disponíveis para os antígenos selecionados. Em alguns casos, os antígenos estão presentes na superfície da célula. Em outros casos, os antígenos são secretados a partir da célula e estão presentes no meio de hemocultura, como "antígeno livre." Ainda em outros casos, o antígeno livre e ligado pode ser medido simultaneamente para confirmar uma bacteremia ou fungemia.
[00269] Independentemente da informação de diagnóstico procurada no vaso de cultura, um elemento de ligação específico, muitas vezes, terá uma ampla especificidade. Os membros de ligação específicos podem ser pan-cepa, pan-sorogrupo, pan-espécies ou pan-gêneros.
[00270] A parede da célula bacteriana é, uma estrutura complexa semirrígida, o qual define a forma do organismo, rodeia a membrana citoplasmática frágil subjacente, e protege a célula bacteriana a partir do ambiente externo. A parede da célula bacteriana é composta de uma rede macromolecular conhecida como peptidoglicano, compreendendo carboidratos e polipeptídeos que formam uma estrutura em torno da célula bacteriana. A parede da célula bacteriana proporciona a estabilidade mecânica para a célula bacteriana e evita a lise osmótica. Mais relevante para a presente invenção, é a composição química da parede da célula que é utilizada para diferenciar as principais espécies de bactérias.
[00271] As paredes das células de diferentes espécies de bactérias podem diferir muito na espessura, estrutura e composição. No entanto, existem dois tipos predominantes de parede celular bacteriana, e se uma dada espécie de bactérias tem um ou outro tipo de parede celular pode ser geralmente determinado por reação da célula para certos corantes. Talvez o corante mais utilizado para a coloração de bactérias seja a coloração de Gram. Quando corados com este violeta cristal e coloração de iodo, as bactérias que retêm a coloração são chamadas de Gram positivas, e aquelas que não retêm são chamadas de Gram negativas.
[00272] Tal como aqui utilizado, por "bactérias gram-positivas" entende-se uma cepa, tipo, espécie, ou gênero de bactérias que, quando expostas à coloração de Gram, retém o corante e é, assim, tingida de azul-violeta.
[00273] Tal como aqui utilizado, por "bactérias gram negativas" entende-se uma cepa, tipo, espécie, ou gênero de bactéria que, quando exposta à coloração de Gram não retém o corante e é, portanto, não corada de azul-violeta. O versado na técnica reconhecerá, claro, que, dependendo da concentração do corante e da duração da exposição, as bactérias Gram-negativas podem pegar uma pequena quantidade de coloração de Gram e tornar-se coradas de azul-violeta claro. No entanto, em comparação com as bactérias Gram positivas coradas com a mesma formulação de Gram para a mesma quantidade de tempo, uma bactéria Gram-negativa, será muito mais clara no azul-violeta, em comparação com uma bactéria Gram positiva.
[00274] Bactérias Gram negativas representativas incluem, entre outras, bactérias da família Enterobacteriaceae. Bactérias Gram negativas representativas na Família Enterobacteriaceae incluem, entre outras, bactérias do gênero Escherichia, como espécies de E. coli (modelo). Membros de ligação adequados, como por exemplo, anticorpos, que têm uma afinidade para as bactérias Gram negativas da família Enterobacteriaceae incluem, entre outros, aqueles anticorpos que se ligam especificamente ao lipopolissacarídeo (LPS) ou proteínas da membrana externa (OMP). O componente LPS lipídeo-A, a Região O de LPS, e o núcleo LPS com regiões do núcleo interior e exterior pode servir como antígenos adequados para membros de ligação específicos que têm uma afinidade para as bactérias Gram negativas no gênero Escherichia.
[00275] Os membros representativos do gênero Escherichia incluem: E. adecarboxylata, E. albertii, E. blattae, E. coli, E. fergusonii, E. hermannii, e E. vulneris.
[00276] Outro gênero representante dentro da família Enterobacteriaceae é o gênero Klebsiella, incluindo, entre outros, Klebsiella pneumoniae (modelo). Os membros de ligação adequados, por exemplo, anticorpos, que tem uma afinidade para as bactérias Gram negativas do gênero Klebsiella incluem, entre outros, aqueles que se ligam especificamente com LPS, polissacarídeo capsular (CPS) ou antígenos K (polissacarídeo capsular de elevado de peso molecular, com um molecular peso de cerca de 50 a cerca de 70 kDa), ou OMP.
[00277] Os membros representativos do gênero Klebsiella incluemK. granulomatis, K. mobilis, K. ornithinolytica, K. oxytoca, K. ozaenae, K. planticola, K. pneumoniae, K. rhinoscleromatis, K. singaporensis, K. terrigena, K. trevisanii, e K. varricola.
[00278] Bactérias Gram negativas também incluem bactérias que pertencem à família Chlamydiaceae. As bactérias Gram negativas representativas da família Chlamydiaceae incluem, entre outras, bactérias do gênero Chlamydia, como espécies de C. trachomatis (modelo). Os membros de ligação adequados, por exemplo, anticorpos, que têm uma afinidade para as bactérias Gram negativas na família Chlamydiaceae incluem, entre outros, aqueles que se ligam especificamente ao lipopolissacarídeo (LPS) ou proteínas de membrana externa (OMP), incluindo a proteína membranar externa principal (MOMP).
[00279] Os elementos representativos do gênero Chlamydia incluem: C. muridarum, C. suis, e C. trachomatis.
[00280] Bactérias Gram negativas adequadas podem também incluir aquelas do gênero Pseudomonas, Incluindo, entre outras, P. aeruginosa (modelo), o gênero Stenotrophomonas, incluindo, entre outros, S. maltophilia (modelo), e o gênero Acinetobacter, incluindo, entre outras, A. baumannii (modelo). Antígenos adequados que são reconhecidos por elementos de ligação específico com afinidade para as bactérias Gram negativas do gênero Pseudomonas incluem, entre outras, LPS, OMP, proteínas de membrana reguladas pelo ferro (IRMP), flagelos, exopolissacarídeo mucoide (MEP), e proteína de membrana exterior F (OprF). Os antígenos adequados que são reconhecidos por elementos de ligação específicos com afinidade para as bactérias Gram negativas dentro dos gêneros Stenotrophomonas incluem, entre outros, LPS, flagelos, protease extracelular principal, OMP, proteína exposta de 30 kDa que se liga a Fc da IgG, e a proteína de membrana de 48,5 kDa. Os antígenos adequados que são reconhecidos pelos elementos de ligação específicos com afinidade para as bactérias Gram negativas do gênero Acinetobacter incluem, entre outros, LPS, LPS com D-ramos, Bap (fator associado a biofilme), polissacarídeo capsular (CPS), e OMP.
[00281] As bactérias Gram positivas representativas incluem, entre outras, bactérias da família Micrococcaceae. Bactérias Gram positivas na família Micrococcaceae incluem, entre outras, bactérias do gênero Staphylococcus genus, incluindo espécies de S. epidermidis (modelo). Os elementos de ligação adequados, por exemplo, anticorpos, que tem uma afinidade para a bactéria Gram positiva incluem, entre outros, aqueles que se ligam especificamente ao ácido lipoteicoico (LTA), peptidoglicano, antígenos do biofilme, incluindo antígenos de biofilme de 140/200 kDa e polissacárido (PS)de 20 kDa, ou Lipídeo S (glicerofosfo-glicolipídico). Outros elementos de ligação adequados que têm uma afinidade para as bactérias Gram positivas do gênero Staphylococcus, Incluindo, entre outros, S. aureus, incluem aqueles que se ligam especificamente o ácido teicoico, componentes da superfície microbianas que reconhecem moléculas de adesão da matriz (MSCRAMMS), determinante superfície A responsivo ao ferro (IsdA), proteínas de 110 kDa, 98 kDa e 67 kDa, proteína ativando RNAIII (RAP), alvo de proteína ativando RNAIII (TRAP), toxina alfa, poli-n-succinil beta-1-6-glucosamina (PNSG), lipase, estafilolisina, FnBPA, FnBPB, antígeno estafilocócico imunodominante, polissacarídeo capsular, ou o antígeno de superfície celular associado com resistência a meticilina.
[00282] Os elementos representativos do gênero Staphylococcus incluem: S. aureus, S. auricularis, S. capitis, S. caprae, S. cohnii, S. epidermidis, S. felis, S. haemolyticus, S. hominis, S. intermedius, S. lugdunensis, S. pettenkoferi, S. saprophyticus, S. schleiferi, S. simulans, S. vitulus, S. warneri, e S. xylosus.
[00283] Outras bactérias Gram positivas representante incluem bactérias do gênero Enterococcus, incluindo, entre outros, E. faecalis (também conhecido como Grupo D de Streptococcus) e E. faecium. Os elementos de ligação adequados, por exemplo, anticorpos, que tem uma afinidade para E. faecalis incluem, entre outros, aqueles que se ligam especificamente ao ácido lipoteicoico (LTA), antígeno de superfície de ligação ao colágeno (CNA), substância de agregação (AS), polissacarídeo capsular, polissacarídeo capsular tipo ácido teicoico, produto do gene Esp, Gls24, produto do gene Epa, Ace (aglutinante ECM), ou peptidoglicano. Elementos de ligação adequados, como por exemplo, anticorpos, que têm uma afinidade para E. faecalis incluem, entre outros, aqueles que se ligam especificamente à proteína de ACM (ligante de colágeno) ou proteína SagA.
[00284] Bactérias Gram positivas a ácido rápido representativas incluem, entre outras, bactérias da família Mycobacteriaceae. Bactérias Gram positivas resistentes ao ácido na família Mycobacteriaceae incluem, entre outras, bactérias do gênero Mycobacterium, como espécies de M. bovis (modelo) e espécies de M. tuberculosis (modelo). Elementos de ligação adequados, por exemplo, anticorpos, que tem uma afinidade para as bactérias Gram positivas de ácido rápido incluem, entre outros, aqueles que se ligam especificamente a arabinomanon (AM), lipoarabinomanon (LAM) ou o antígeno de 38 kDa.
[00285] Os elementos representativos do gênero Mycobacterium incluem: M. abscessus, M. africanum, M. agri, M. aichiense, M. alvei, M. arupense, M. asiaticum, M. aubagnense, M. aurum, M. austroafricanum, complexo Mycobacterium avium (MAC), incluindo, M. avium, M. avium paratuberculosis, M. avium silvaticum, M. avium "hominissuis," M. boenickei, M. bohemicum, M. bolletii, M. botniense, M. bovis, M. branderi. M. brisbanense, M. brumae, M. canariasense, M. caprae, M. celatum, M. chelonae, M. chimaera, M. chitae, M. chlorophenolicum, M. chubuense, M. colombiense, M. conceptionense, M. confluentis, M. conspicuum, M. cookii, M. cosmeticum, M. diernhoferi, M. doricum, M. duvalii, M. elephantis, M. fallax, M. farcinogenes, M. flavescens, M. florentinum, M. fluoroanthenivorans, M. fortuitum, M. fortuitum subsp. acetamidolyticum, M. frederiksbergense, M. gadium, M. gastri, M. genavense, M. gilvum, M. goodii, M. gordonae, M. haemophilum, M. hassiacum, M. heckeshornense, M. heidelbergense, M. hiberniae, M. hodleri, M. holsaticum, M. houstonense, M. immunogenum, M. interjectum, M. intermedium, M. intracellulare, M. kansasii, M. komossense, M. kubicae, M. kumamotonense, M. lacus, M. lentiflavum, M. leprae, M. lepraemurium, M. madagascariense, M. mageritense, M. malmoense, M. marinum, M. massiliense, M. microti, M. monacense, M. montefiorense, M. moriokaense, M. mucogenicum, M. murale, M. nebraskense, M. neoaurum, M. neworleansense, M. nonchromogenicum, M. novocastrense, M. obuense, M. palustre, M. parafortuitum, M. parascrofulaceum, M. parmense, M. peregrinum, M. phlei, M. phocaicum, M. pinnipedii, M. porcinum, M. poriferae, M. pseudoshottsii, M. pulveris, M. psychrotolerans, M. pyrenivorans, M. rhodesiae, M. saskatchewanense, M. scrofulaceum, M. senegalense, M. seoulense, M. septicum, M. shimoidei, M. shottsii, M. simiae, M. smegmatis, M. sphagni, M. szulgai, M. terrae, M. thermoresistibile, M. tokaiense, M. triplex, M. triviale, Mycobacterium tuberculosis complex (MTBC), including M. tuberculosis, M. bovis, M. bovis BCG, M. africanum, M. canetti, M. caprae, M. pinnipedii', M. tusciae, M. ulcerans, M. vaccae, M. vanbaalenii, M. wolinskyi, e M. xenopi.
[00286] Fungos representativos, incluindo leveduras, incluem, entre outros, a família de Saccharomycetaceae, incluindo, o gênero Candida, como com C. albicans (modelo). Os elementos de ligação adequados, por exemplo, anticorpos, que tem uma afinidade para os fungos que pertencem ao gênero Candida incluem, entre outros, aqueles que se ligam especificamente a manana, fosfomanana, anoproteína 58 (MP58), galactomanana, beta-D-glucana, metaloabinitol, gliceraldeído-3-fosfato desidrogenase associado à parede celular, Enolase-(47/48kDa), aspartil-proteinase secretada (SAP), ou proteína de choque térmico 90 (HSP-90).
[00287] Os elementos representativos do gênero Candida incluem: C. aaseri, C. albicans, C. amapae, C. anatomiae, C. ancudensis, C. antillancae, C. apicola, C. apis, C. atlantica, C. atmosphaerica, C. auringiensis, C. austromarina, C. azyma, C. beechii, C. bertae, C. berthetii, C. blankii, C. boidinii, C. boleticola, C. bombi, C. bombicola, C. buinensis, C. butyri, C. cantarellii, C. caseinolytica . C. castellii, C. castrensis, C. catenulata, C. chilensis, C. chiropterorum, C. chodatii, C. ciferrii, C. coipomoensis, C. conglobata, C. cylindracea, C. dendrica, C. dendronema, C. deserticola, C. diddensiae, C. diversa, C. drimydis, C. dubliniensis, C. edax, C. entomophila, C. ergastensis, C. ernobii, C. ethanolica, C. euphorbiae, C. euphorbiiphila, C. fabianii, C. famata, C. famata var. famata, C. famata var. flareri, C. fennica, C. fermenticarens, C. firmetaria, C. floricola, C. fluviatilis, C. freyschussii, C. friedrichii, C. fructus, C. galacta, C. geochares, C. glabrata, C. glaebosa, C. glucosophila, C. gropengiesseri, C. guilliermondii, C. guilliermondii var. guilliermondii, C. guilliermondii var. membranaefaciens, C. haemulonii, C. homilentoma, C. humilis, C. incommunis, C. inconspicua, C. insectalens, C. insectamans, C. insectorum, C. intermedia, C. ishiwadae, C. karawaiewii, C. kefyr, C. krissii, C. kruisii, C. krusei, C. lactis-condensi, C. laureliae, C. lipolytica, C. llanquihuensis, C. lodderae, C. lusitaniae, C. lyxosophila, C. magnoliae, C. maltosa, C. maris, C. maritima, C. melibiosica, C. membranifaciens, C. mesenterica, C. methanosorbosa, C. milleri, C. mogii, C. montana, C. multigemmis, C. musae, C. naeodendra, C. natalensis, C. nemodendra, C. norvegensis, C. norvegica, C. odintsovae, C. oleophila, C. oregonensis, C. ovalis, C. palmioleophila . C. paludigena, C. parapsilosis, C. pararugosa, C. pelliculosa, C. peltata, C. petrohuensis, C. pignaliae, C. pini, C. populi, C. pseudointermedia, C. pseudolambica, C. psychrophila, C. pulcherrima, C. quercitrusa, C. quercuum, C. railenensis, C. reukaufii, C. rhagii, C. robusta, C. rugopelliculosa, C. rugosa, C. saitoana, C. sake, C. salida, C. salmanticensis, C. santamariae, C. santjacobensis, C. savonica, C. schatavii, C. sequanensis, C. shehatae, C. shehatae var. Insectosa, C. shehatae var. lignosa, C. shehatae var. shehatae, C. silvae, C. silvanorum, C. silvatica, C. silvicultrix, C. solani , C. sonorensis, C. sophiae-reginae, C. sorbophila, C. sorbosa, C. sorboxylosa, C. spandovensis, C. stellata, C. succiphila, C. suecica, C. tanzawaensis, C. tapae, C. techellsii, C. tenuis, C. torresii, C. tropicalis, C. tsuchiyae, C. utilis, C. vaccinii, C. valdiviana, C. valida, C. vanderwaltii, C. vartiovaarae, C. versatilis, C. vini, C. viswanathii, C. wickerhamii, C. xestobii, e C. zeylanoides.
[00288] Anticorpos terapêuticos como AurograbTM com especificidade para cepas de S. aureus (MRSA) resistentes à meticilina também podem ser usados em superfícies de captura ou indicadores. Do mesmo modo que o anticorpo monoclonal terapêutico (mab) MyograbTM (Efungumabe) com uma especificidade para a proteína de choque térmico HSP90 pode ser utilizado para detectar C. albicans.
[00289] As partículas indicadoras SERS ativas presentemente divulgadas podem ser distinguidas dos muitos outros materiais opticamente ativos que podem estar presentes em um meio de cultura, tais como componentes de meios de cultura utilizados para suportar o crescimento, sangue total, anticoagulante SPS, partículas de alimentos, e aditivos. Além disso, as partículas específicas indicadoras SERS ativas exibem a intensidade de sinal necessária para permitir detectar pequenas quantidades de células bacterianas. Além disso, uma variedade de partículas indicadoras SERS ativas, tendo cada uma única assinatura SERS, permite que amostras de hemocultura sejam interrogadas por qualquer um de uma pluralidade de micro-organismos (por exemplo, vinte) que podem ser encontrados normalmente em mamíferos, por exemplo, humanos, sangue. Em tais modalidades, detectar cada micro-organismo particular pode ocorrer simultaneamente, o que é referido aqui como um "ensaio multiplex."
[00290] De acordo com uma modalidade, por exemplo, a hemocultura, os principais alvos para os ensaios multiplex presentemente divulgados incluem: Coagulase-negativa Staphylococci, S. aureus, E. faecalis, E. coli, K. pneumoniae, E. faecium, Viridans grupo Streptococci, Pseudomonas aeruginosa, S. pneumoniae, Enterobacter cloacae, Serratia marcescens, Acinetobacter baumannii, Proteus mirabilis, Streptococcus agalactie, Klebsiella oxytoca, Enterobacter aerogenes, Stenotrophomonas maltophilia, Citrobacter freundii, Streptococcus pyogenes, e Enterococcus avium. Ditos múltiplos alvos podem ser, em algumas modalidades, detectados simultaneamente por um ensaio multiplex presentemente divulgado.
[00291] Meios de cultura representativos adequados para utilização com as modalidades da presente invenção são fornecidos aqui a seguir imediatamente. Um versado na técnica reconhecerá que as formulações presentemente reveladas podem ser modificadas para satisfazer as necessidades específicas de desempenho. Além disso, estas formulações, dependendo da aplicação particular, podem ter colocado nestas, CO2, O2, N2, combinações dos mesmos, para criar um ambiente adequado para crescimento de aeróbios, anaeróbios, ou microaerofilia. Opcionalmente, alguns meios de cultura contêm adsorventes para isolar, por exemplo, remover, a partir do meio de cultura, os interferentes, tais como antibióticos ou elementos do sistema imunológico que podem estar presentes na amostra de sangue de um sujeito ou metabolitos produzidos durante a cultura. Ver, por exemplo, a Patente U.S. No. 5.624.814, que é aqui incorporada por referência na sua totalidade. Por exemplo, o BD BACTEC™ Media Plus Anaerobic/F, BD BACTEC™ Plus Aerobic/F, e BD BACTEC™ PEDS Plus/F, cada um dos quais está disponível a partir de Becton, Dickinson and Company, Franklin Lakes, New Jersey, todos contêm resinas para isolar antibióticos que de outro modo podem inibir o crescimento microbiano no meio de hemocultura. As resinas são substancialmente maiores em diâmetro do que qualquer componente de sangue e são mais rígidas do que as células encontradas no sangue de mamíferos. Outro exemplo de um absorvente de cultura é o carbonato de cálcio precipitado (1% - 2,5% p/v) encontrado em várias formulações de caldo de tetrationato utilizadas para a cultura seletiva de Salmonella em alimentos e amostras ambientais. As partículas de carbonato de cálcio neutralizam o ácido sulfúrico produzido pela redução de tetrationato por crescimento Salmonella.
[00292] Frascos de Cultura BD BACTEC™ Myco/F Lytic suportam o crescimento e detectam micro-organismos aeróbios. Mais particularmente, frascos de cultura BD BACTEC™ Myco/F são meios de cultura não seletivos para serem usados como um complemento para o meio de uma cultura aeróbia para a recuperação de micobactérias a partir de amostras de sangue e leveduras e fungos de sangue e fluidos corporais estéreis.
[00293] Mycobacterium tuberculosis (MTB) e micobactérias que não tuberculose (MOTT), especialmente o complexo Mycobacterium avium (MAC), se tornara ressurgentes. De 1985 a 1992, o número de casos de MTB relatados aumentou 18%. Entre 1981 e 1987, vigilâncias de casos de AIDS indicaram que 5,5% dos pacientes com AIDS disseminaram infecções por micobactérias não tuberculosas, por exemplo, MAC. Em 1990, o aumento dos casos de infecções por micobactérias não tuberculosas disseminadas resultou em uma incidência cumulativa de 7,6%. A incidência de fungemia também tem aumentado desde o início de 1980. Estes aumentos têm destacado a necessidade de procedimentos diagnósticos eficazes para fungemia e micobacteremia.
[00294] Os componentes das formulações presentemente divulgadas podem incluir, entre outros, citrato férrico de amônio ou um equivalente que proporciona uma fonte de ferro para as cepas específicas de micobactérias e fungos, a saponina ou um agente de lise de sangue equivalente, e proteínas e açúcares para fornecer suplementos nutricionais específicos.
[00295] O meio de micobactéria qualitativo BACTEC™ 12B pode ser utilizado para a cultura e recuperação de micobactérias a partir de amostras clínicas, expectoração, gástrica, urina, tecidos, amostras mucopurulentas, outros fluidos corporais e outras secreções respiratórias, diferenciação do complexo Mycobacterium tuberculosis a partir de outras micobactérias e teste de sensibilidade do M. tuberculosis.
[00296] O meio BACTEC™ LYTIC/10 Anaerobic/FO meio BACTEC™ LYTIC/10 Anaerobic/F é também adequado para modalidades da presente invenção.
[00297] Meio BACTEC™ Plus Aerobic/F e Plus Anaerobic/F fornece um procedimento qualitativo para a cultura e recuperação de microorganismos (bactérias e leveduras) de sangue e foi formulado para permitir a adição de até 10 ml de sangue. A adição destes grandes volumes de amostra resulta em taxas de detecção geral mais elevadas e tempos anteriores para detecção.
[00298] Frascos de cultura de BD BACTEC™ Standard Anaerobic/F de caldo de Digestão de Soja-Caseína fornece um procedimento qualitativo para a cultura e recuperação de micro-organismos anaeróbios a partir do sangue.
[00299] Frascos de cultura BACTEC™ tipo PEDS PLUS™/F (caldo de digestão de caseína-soja enriquecido com CO2) são destinados ao uso com culturas de bactérias aeróbias e fornecem para a cultura e recuperação de micro-organismos aeróbicos (principalmente bactérias e leveduras) a partir de amostras pediátricas de sangue e outras que são, geralmente, menos do que 3 ml de volume.
[00300] Frascos de cultura BACTEC™ Standard/10 Aerobic/F (caldo de digestão de caseína-soja enriquecido com CO2) são destinados ao uso em hemoculturas aeróbias e fornecer para a cultura e recuperação de micro-organismos aeróbios (bactérias e leveduras) do sangue.
[00301] Frascos de cultura BacT/ALERT™ FAN, BacT/ALERT™ FN, e BacT/ALERT™ SN (bioMérieux, Durham, NC) são destinados ao uso em hemoculturas anaeróbias e fornecer para a cultura e recuperação de micro-organismos anaeróbios (bactérias e leveduras) a partir do sangue.
[00302] Água modificada por peptona tamponada com piruvato (mBPWp) e suplemento de Acriflavina-cefsulodina-Vancomicina (ACV) é uma meio prescrito pelo FDA Bacteriological Analytical Manual (BAM) para enriquecimento de amostras para detectar Escherichia coli diarreagênica.
[00303] Caldo Base Frasier e Caldo Suplemento Fraser são usados para enriquecer e detectar espécies de Listeria. O USDA Microbiological Laboratory Guidebook (MLG) recomenda o uso de Caldo Fraser quando testar para L. monocytogenes em carnes vermelhas, aves, ovos e amostras ambientais (USDA MLG Capítulo 8.07, revisado em 8/3/09). K. Meios de Cultura Seletivos para Salmonella
[00304] Caldo Base Tetrationato, Hajna é uma meio projetado para o enriquecimento seletivo de Salmonella. Tetrationato é gerado por meio da adição de iodo e iodeto de potássio, imediatamente antes de enriquecimento. O USDA Microbiological Laboratory Manual estipula este caldo para o enriquecimento seletivo de Salmonella em carnes, aves, ovos pasteurizados e produtos de peixe de gato (USDA MLG Capítulo 4.05, revisado em 1/20/11).
[00305] Além dos meios de cultura acima listados, existem vários caldos comumente conhecidos na técnica de cultura ou sustentam Salmonella, incluindo, entre outros, Caldo de infusão de cérebro e coração, Enriquecimento Verde Brilhante Sulfa (BD Difco™), Caldo Verde Brilhante modificado (BD Difco™), água peptonada tamponada (BD Difco™), Água peptonada tamponada caseína (BD Difco™), Caldo Dey-Engly (BD Difco™), Caldo de Enriquecimento EE Mossel (BD Difco™), Caldo Gram negativo (BD Difco™), Caldo Hajna Gram negativo (BD Difco™), Caldo Lactose (BD Difco™), Caldo Letheen (BD Difco™), Caldo Lisina Decarboxilase, Caldo M (BD Difco™), Caldo Malonato (BD Difco™), Caldo MR-VP, Caldo Nutriente , Um Caldo- Salmonella (Oxoide), Caldo Carboidratos vermelho de fenol (BD BBL™), Caldo cianeto de potássio, Caldo Carboidrato Roxo (BD BBL™), RapidChek® Salmonella meio primário (SDIX), RapidChek® SELECT™ Salmonella primário com suplemento (SDIX), RapidChek® SELECT™ Salmonella meio secundário (SDIX), Meio Rappaport- Vassiliadis, Meio Rappaport-Vassiliadis modificado, Rappaport- Vassiliadis R10 Broth (BD Difco™), Rappaport-Vassiliadis Salmonella (RVS) Caldo Soja (BD Difco™), Rappaport-Vassiliadis Caldo Soja Peptona, Caldo Selenita (BD Difco™), Caldo Selenita-F (BD BBL™), Caldo Selenita Cistina (BD Difco™), caldo Tetrationato, Caldo Tetrationato (Hajna), Caldo Triptona, Caldo Tripticase Soja, Caldo Tripticase Soja com sulfato ferroso, Caldo Pré-enriquecimento Universal, Caldo Pré-enriquecimento Universal com citrato de amônio férrico, e caldo ureia.
[00306] Além do meio de cultura listado acima, há vários caldos comumente conhecidos na técnica para cultivar ou sustentar Listeria, incluindo, entre outros, caldo de infusão de cérebro e coração (BHI), caldo de enriquecimento tamponado para Listeria (BLEB), caldo Nutriente, base de caldo de fermentação de carboidrato roxo (M13015), contendo 0,5% soluções de dextrose, esculina, maltose, ramnose, manitol, e xilose, meio SIM, soja Tripticase com 0,6% extrato de levedura, caldo Triptose, caldo da universidade de Vermont modificado (UVM), caldo de enriquecimento tamponado com morfolinapropanosulfônico para Listeria (MOPS-BLEB), Demi-Frasier, caldo Fraser, caldo de enriquecimento para Listeria (BD Difco™, Oxoid), Um Caldo-Listeria (Oxoid), meio RapidChek® Listeria com suplemento (SDIX) e meio RapidChek® Listeria F.A.S.T.™ (SDIX).
[00307] A quantidade de um ou mais micro-organismos presentes em uma amostra em teste podem ser representada como uma concentração. A concentração pode ser expressa como um valor qualitativo, por exemplo, como um resultado tipo negativo ou positivo, por exemplo, uma resposta "SIM" ou "NÃO", que indica a presença ou ausência de um micro-organismo, ou como um valor quantitativo. Além disso, a concentração de um determinado micro-organismo em uma amostra de cultura pode ser avaliada como uma quantidade relativa ou absoluta de uma quantidade, por exemplo, como um "valor quantitativo".
[00308] A quantidade (isto é, concentração) de um micro-organismo pode ser igual a zero, indicando a ausência do analito particular buscado ou que a concentração da substância particular se encontra abaixo dos limites de detecção do ensaio. A quantidade medida pode ser o sinal, por exemplo, um sinal de SERS, sem quaisquer medidas adicionais ou manipulações. Alternativamente, a quantidade medida pode ser expressa como uma diferença, uma percentagem ou uma proporção entre o valor medido do micro-organismo particular para um valor medido de outro composto, incluindo, entre outros, um micro-organismo padrão ou outro. A diferença pode ser negativa, indicando uma diminuição na quantidade de micro-organismo medido. As quantidades também podem ser expressas como uma diferença ou proporção entre o próprio micro-organismo, medida em um ponto diferente no tempo. As quantidades de micro-organismo podem ser determinadas diretamente a partir de um sinal gerado, ou o sinal gerado pode ser utilizado em um algoritmo, com o algoritmo projetado para correlacionar o valor dos sinais gerados para a quantidade de micro-organismo na amostra. Como discutido acima, modalidades da presente invenção são passíveis de utilização com dispositivos capazes de medir as concentrações de um ou mais micro-organismos em tempo real.
[00309] Os Exemplos seguintes foram incluídos para proporcionar orientação para um versado na técnica para a prática de modalidades representativas do objeto presentemente divulgado. À luz da presente divulgação e do nível geral de perícia na técnica, os especialistas podem apreciar que os exemplos seguintes destinam-se a ser apenas exemplificativos, e que numerosas alterações, modificações e mudanças podem ser empregues sem se afastar do escopo do objeto presentemente divulgado. Os exemplos que se seguem são oferecidos a título de ilustração e não como forma de limitação.
[00310] A Figura 54 mostra o resultado de um experimento em cujo tempo para detectar de crescimento de E. coli foi comparado para amostras de hemocultura com e sem a reagentes SERS HNW adequados para uso nas várias modalidades da invenção.
[00311] Neste exemplo, a partículas indicadoras SERS ativas não conjugadas (marcadores SERS 440) e partículas magnéticas de captura não conjugadas(esferas Dynal®) foram esterilizadas por meio de lavagem com etanol a 70%. As partículas indicadoras SERS ativas esterilizadas e as partículas magnéticas de captura foram então adicionadas aos frascos de meio BACTEC™ Standard/10 Aerobic/F inoculados com E. coli. Foi comparado o tempo para detectar crescimento de E. coli por um sensor BACTEC™ 9050 para garrafas com e sem os reagentes de ensaio HNW. Garrafas BACTEC™ sem E. coli mas com e sem os reagentes do ensaio HNW foram incluídos como controles negativos. Como pode ser observado, tempo de detecção de BACTEC ™ não foi afetado pela presença das partículas indicadoras SERS ativas e partículas magnéticas neste experimento. Assim, os reagentes de ensaio SERS HNW não impactam significativamente a capacidade de um micro-organismo de crescer. EXEMPLO 2 Peletização repetida é compatível com o crescimento de micro-organismos
[00312] A Figura 55 mostra o resultado de um experimento em que o crescimento de Salmonella foi monitorado durante o curso de um experimento para determinar se a peletização afeta negativamente o crescimento do organismo.
[00313] Neste exemplo, S. Typhimurium (ATCC 14028) foi cultivado em uma cultura durante a noite em meio primário SDIX para selecionar Salmonella com suplemento a 42°C. Uma diluição de 1:100 foi transformada em meio secundário SDIX para Salmonella. A inoculação de partida em meio secundário foi determinada como sendo 1,8 x 107 cfu/ml por contagem em placa em placas de ágar nutriente. O meio secundário inoculado foi então colocado em vários tubos, contendo todas as marcadores SERS e partículas magnéticas conjugadas com anticorpos SDIX para Salmonella. Os tubos foram colocados no sistema 150 (ver Figura 24) para o monitoramento durante o crescimento a 42°C. Os tubos foram peletizados e interrogados a cada 0,5 hora durante o crescimento. Neste experimento, os tubos foram removidos a partir do instrumento depois de 1, 3, 6, 9 e 11 ciclos de peletização e de leitura. Estes tubos foram enumerados por plaqueamento de diluições em placas de agar Nutriente. Como pode ser observado, o crescimento de S. Typhimurium não é comprometido pela presença de marcadores SERS e partículas magnéticas, também não é comprometido por peletização repetida e interrogação do pélete pelo laser.
[00314] Em um experimento avaliando o efeito de peletização repetida sobre o crescimento de micro-organismos e o desempenho do ensaio, uma única colônia de Salmonella Kentucky (ATCC 9263) foi escolhida a partir de uma placa de estrias BD BBL™ Nutriente Agar e cultivada durante a noite a 42°C em 6 ml de meio de cultura primário SDIX RapidChek® Salmonella SELECT™ com 60 μL de suplemento de fago. Seguindo a cultura primária, 5 ml de um meio de cultura secundário foi preparado, consistindo em 90% secundário e 10% primário de meio SDIX RapidChek® Salmonella SELECT™. Em paralelo, uma diluição de 1:100 de uma cultura primária em meio primário foi preparada, e 125 μL de modo que a diluição foi inoculada em um tubo BD MGIT™ contendo 5 ml de meio secundário, 16 μL de marcadores SERS, e 20 μL de esferas magnéticas. A diluição resultante de 1: 4000 a partir da concentração final da cultura primária originou uma concentração de inoculação de aproximadamente 2,5 x 105 CFU/mL. Os tubos foram então colocados em um de dois sistemas baseados em carrossel (ver, por exemplo, Figura 24) durante 24 horas a 42°C a uma velocidade de agitação linear de ~1 Hz. Todos os parâmetros experimentais, exceto frequência lida foram mantidos os mesmos entre os dois instrumentos. A frequência de leitura para cada instrumento foi ajustada para 5 ou 2 leituras/hora.
[00315] A Figura 56 mostra um conjunto de dados representativo a partir do experimento. Os dados a partir dos dois sistemas são mostrados, com os eixos de intensidade dimensionados para comparação. (Note-se que as intensidades absolutas de pesos de marcador entre instrumentos não devem ser comparadas devido às diferenças nas eficiências ópticas.) As formas das curvas de crescimento são quase idênticas, indicando que o aumento do número de ciclos de formação de péletes, medição, e dispersão não impediram o crescimento ou detecção. A única diferença significativa é que a curva com leituras mais frequentes proporciona melhor resolução sobre a cinética do crescimento.
[00316] Formação de pélete reprodutível é uma etapa fundamental para conseguir sinal de ensaio reprodutível. Este exemplo refere-se a duas formas distintas, para formar um pélete. Na primeira (magneto fixo), o magneto é mantido fixo no lugar, enquanto o tubo é movido sobre o magneto para toda a extensão do arremesso em agitação. Na segunda configuração preferencial (acoplada), mostrado na Figura 49, o magneto se move juntamente com o tubo. Em uma série de experimentos, as marcadores SERS foram covalentemente ligadas a partículas magnéticas ativadas por tosil para formar um pré-complexo SERS-esfera magnética (PC). Esferas pré-complexadas são preparadas por ligação covalente de partículas SERS para partículas magnéticas ativadas por tosil Dynabeads® M-280 através da reação dos grupos tiol (-SH) na superfície da SERS com grupos tosil (TOS), na superfície de partículas magnéticas PC atua como um sistema modelo para testes de formação de pélete em que o pélete pode ser interrogado para sinal SERS. Formação de péletes de PC em água, bem como em um meio secundário comercial para Salmonella (SDIX RapidChek® Salmonella SELECT™) foi comparada para as geometrias de magneto fixo e acoplado. Estes testes foram realizados utilizando uma configuração do sistema de leito plano (ver, por exemplo, Figura 25).
[00317] A Figura 57 mostra uma imagem de PC em água após a peletização com um magneto fixo. PC em água foi sedimentado durante 1,5 minutos movendo o tubo sobre um magneto de barra fixa em 0,5 Hz frequência de agitação e 25 milímetros de arremesso. A agitação foi interrompida e o magneto foi deixado persistir durante 30 segundos antes de mover a barra para longo dos tubos. Como mostrado na Figura 57, um único pélete foi formado. Esta imagem destaca a capacidade de arrastar os complexos magnéticos com o magneto através da água.
[00318] Em contraste, Figuras 58A e 58B mostram a formação de pélete PC em meio secundário SDIX Salmonella usando um magneto fixo e duas frequências de agitação diferentes. PC em meio secundário SDIX foi peletizado por 3 minutos movendo o tubo sobre um magneto de barra fixa em 2 Hz (21 A) ou 0,5 Hz (21 B) de frequência de agitação e 25 milímetros arremesso. A agitação foi interrompida e o magneto foi deixado persistir durante 30 segundos antes de se mover a barra de magneto para longe dos tubos. Como mostrado na Figura 58A, dois péletes de complexos magnéticos foram puxados para o fundo do tubo, localizados nos limites do movimento relativo entre o tubo e o magneto. . Para a agitação lenta (Figura 58B), dois péletes foram formados nas extremidades do percurso do magneto juntamente com uma linha mal definida ligando os péletes. Como sinal de SERS reprodutível é mais bem obtido com um pélete denso colocado de forma reprodutível, as Figuras 58A e 58B realçam as desvantagens da configuração do magneto fixo, o que parece ser incapaz de arrastar as esferas magnéticas por meio de meios secundários SDIX Salmonella, presumivelmente devido às partículas sólidas presentes neste meio.
[00319] A Figura 59A mostra uma modalidade preferencial utilizando a configuração do magneto acoplado. PC em meio secundário SDIX Salmonella foi peletizado durante 1,5 minutos movendo o tubo acoplado com um magneto de barra na frequência de agitação de 1,5 Hz e 25 milímetros arremesso. A agitação foi interrompida e o magneto foi deixado persistir durante 30 segundos antes de movimentar a barra magnética para longe dos tubos. O único pélete denso foi formado, onde em contato magneto em barra contata o tubo de amostra. Em comparação com os péletes formados usando a configuração do magneto fixo, o pélete formado através de magnetos acoplados é mais compacto e denso, como mostrado na Figura 59A. A Figura 59B mostra um experimento semelhante com um magneto acoplado, usando apenas uma frequência de agitação de 0,8 Hz. Embora um único pélete tenha sido formado, meio determinado interfere com a capacidade para puxar um pélete denso, tal como evidenciado pelas partículas difusas no centro do pélete.
[00320] Os resultados ilustrados nas Figuras 57-59 mostram que, para um arremesso de 25 mm, a abordagem de peletização por magneto fixo não conseguiu formar um único pélete denso na presença de meios secundários SDIX usando uma variedade de frequências de agitação. Este suporte de dados contém as partículas sólidas que se depositam rapidamente e interferem com a capacidade do magneto para arrastar os complexos magnéticos ao longo da parte inferior do tubo. Embora a agitação rápida mantenhaá meios sólidos de sedimentação, dois péletes são formados nos limites do movimento relativo entre o tubo e o magneto. Como a agitação diminui até parar, os péletes não podem ser arrastados através do meio para formar um único pélete. Uma vez que os complexos magnéticos podem ser arrastados por meio de água, a abordagem de magneto fixo pode ser utilizada para peletizar o PC em água.
[00321] A abordagem de peletização de magneto acoplado forma um único pélete denso na presença de meios secundários SDIX Salmonella em uma variedade de frequências de agitação. Magnetos de acoplamento ao tubo para a peletização não requerem complexos magnéticos para arrastar ao longo da parte inferior do tubo, porque são puxados para um ponto comum para formar um único pélete.
[00322] Usando magnetos acoplados, agitação rápida forma um pélete mais denso em comparação com agitação lenta. Isto é provavelmente devido aos meios sólidos de sedimentação utilizando agitação lenta e interferem com a formação de pélete. Usando agitação rápida, o sólido é suspenso em solução e complexos magnéticos podem ser puxados para dentro de um pélete com menos interferência dos meios.
[00323] A Figura 60 mostra um exemplo de detecção e identificação de micro-organismos dentro de uma amostra de hemocultura (sangue concentrado) para um formato singleplex. Neste experimento, Candida albicans (ATCC 10231) foi cultivada em cultura durante a noite em um Caldo de Dextrose Sabouraud a partir de uma colônia única a 30°C em uma cultura de agitação. A cultura foi diluída para baixo e inoculada em sangue humano a 3 cfu/ml ou 0 cfu/ml como um controle negativo. As amostras positivas e negativas foram inoculadas em garrafas BACTECTM Std 10 Aerobic/F sem reagentes de detecção, bem como em tubos contendo meio BACTECTM Std 10 Aerobic/F e os reagentes de detecção (marcadores SERS e partículas magnéticas conjugadas com anticorpo Virostat 6411 anti-Candida albicans). A proporção de sangue total para o meio foi de 1:8. Os inóculos foram semeados em BBLTM CHROMagarTM para enumeração. Sondas de detecção foram inseridas no sistema de carrossel 150 (ver Figura 24) e as garrafas BACTECTM foram inseridas no instrumento BACTECTM FX para o monitoramento em tempo real, durante o crescimento, a 35°C. O tubo de SERS positivo foi detectado em 18 horas e a garrafa BACTECTM foi positivo em 30 horas. Sinal SERS fornece detecção e identificação de pelo menos 12 horas antes de BACTECTM FX para este ensaio singleplex no sangue humano.
[00324] A Figura 61 mostra um exemplo de detecção e identificação de micro-organismos dentro de uma amostra de hemocultura (sangue concentrado) para um formato multiplex. Neste ensaio 4-plex para a detecção de C. albicans, E. coli 0157, K. pneumoniae, e S. aureus, marcadores SERS com quatro repórteres Raman distintas foram, cada um, conjugados com anticorpos de um dos quatro organismos. (Anticorpos conjugados a marcadores SERS Virostat 6411 policlonal anti-C. albicans, Biodesign MAV119-499 monoclonal anti-E. coli O157:H7, Biodesign C55573M monoclonal anti-Staphylococcus e Santa Cruz Biotechnology sc-80861 monoclonal anti-K. pneumoniae). Todos os quatro tipos de marcadores SERS estavam presentes na mistura de ensaio, juntamente com esferas magnéticas conjugadas com anticorpos de captura para os quatro micro-organismos. As esferas magnéticas presentes no ensaio foram um pool de esferas magnéticas que consistem em partículas magnéticas Dynal® anti-E. coli 0157 (Life Technologies catalog #710-03), esferas Dynal® M280 conjugadas a Virostat 6411 policlonal anti-C. albicans, esferas Dynal® M280 conjugadas com Biodesign C55573M monoclonal anti- Staphylococcus, e esfera Dynal® M280 conjugada com Affinity Bioreagents PA1-7226 policlonal anti- K. pneumoniae.
[00325] No experimento ilustrado na Figura 61, C. albicans (ATCC 10231) foi cultivada em uma cultura durante a noite em caldo de Sabouraud Dextrose a partir de uma colônia simples, a 30°C em uma cultura de agitação. A cultura foi diluída para baixo e inoculada em sangue humano a 3 cfu/ml ou 0 cfu/ml como um controle negativo. As amostras positivas e negativas foram inoculadas em garrafas BACTECTM Std 10 Aerobic/F As amostras positivas e negativas foram inoculadas em garrafas meio BACTECTM Std 10 Aerobic/F com os reagentes de detecção. A proporção de sangue para meio na amostra final foi de 1:8. Os inóculos C. albicans foram semeados em BBLTM CHROMagarTM para enumeração. Os tubos de ensaio contendo os reagentes SERS foram inseridos em um sistema de carrossel (ver Figura 24), enquanto que as garrafas BACTECTM sem reagentes de detecção foram inseridas no instrumento BACTECTM FX para o monitoramento em tempo real, durante o crescimento, a 35°C.
[00326] C. albicans foi detectada por SERS em 16,6 horas, enquanto sensor de gás BACTECTM gerou detecção positiva em 28 horas. Além disso, a detecção por SERS foi acompanhada por uma identificação do micro-organismo como C. albicans, enquanto que instrumento BACTECTM não forneceu informações de identificação. Como pode ser observado na Figura 61, a detecção de C. albicans por SERS em um formato multiplex não resultou em nenhum sinal SERS significativa a partir de outros marcadores SERS (não C. albicans).
[00327] A Figura 62 mostra um exemplo de detecção multiplexada e identificação de micro-organismos dentro de uma amostra de hemocultura (sangue concentrado), por um modelo de coinfecção. E. coli O157:H7 (ATCC 700728) e S. epidermidis (ATCC 55133) foram cultivadas separadamente em culturas durante a noite em Caldo Nutriente BD a partir de uma colônia única a 37°C em uma cultura de agitação. As culturas foram diluídas e coinoculadas no sangue de coelho a 2,6 cfu/ml para E. coli O157:H7 e 12.5 cfu/ml para S. epidermidis. As amostras positivas e negativas foram inoculadas em garrafas BACTECTM Std 10 Aerobic/F (sem reagentes SERS) bem como tubos contendo meio BACTECTM Std 10 Aerobic/F e os reagentes de detecção descritos no Exemplo 6. (marcadores SERS conjugados com Virostat 6411, Biodesign MAV119-499, Biodesign C55573M e Santa Cruz Biotechnology sc-80861, assim como partículas magnéticas Dynal® anti-E. coli O157 e partículas Dynal® M280 conjugadas com Virostat 6411, Biodesign C55573M e Affinity Bioreagents PA1-7226.) O sangue foi diluído a 1:8 em meio BACTECTM. Os inóculos foram semeados em BBLTM CHROMagarTM para enumeração. Tubos de detecção contendo os reagentes SERS foram inseridos no sistema de carrossel 150 (ver Figura 24), enquanto garrafas BACTECTM sem reagentes SERS foram inseridas no instrumento BACTECTM FX para o monitoramento em tempo real, durante o crescimento, a 35°C. E. coli O157:H7 foi detectada e identificada por SERS em 7,9 horas, enquanto que S. epidermidis foi detectada e identificada por uma SERS em 1,4 horas. O frasco BACTECTM foi positivo em 10,4 horas, mas não forneceu nenhum nível de identificação.
[00328] Neste exemplo, E. coli O157:H7 (ATCC 700728) foi descongelada a partir de um estoque de glicerol e inoculada em sangue de coelho diluído em meio BACTECTM Plus Aerobic/F em uma proporção de 1:8. Meio BACTECTM Plus Aerobic/F contém partículas de resina (17% p/v), para aumentar a recuperação de organismos sem a necessidade de um processamento especial. O sangue mais meio inoculado foi enumerado por contagens em placa para confirmar a inoculação de 5 cfu/ml. A amostra foi colocada em três tubos em replicado contendo SERS e conjugados de esferas magnéticas (anticorpos Biodesign MAV119-499 e G5V119-500). Sondas de detecção foram inseridas no sistema de carrossel 150 (ver Figura 24) para o monitoramento em tempo real, durante o crescimento, a 35°C. Os resultados são mostrados na Figura 63. O sistema de carrossel é capaz de formar de forma eficiente e interrogar um pélete na presença da resina.
[00329] A agitação proporcionada durante a peletização permite que as esferas magnéticas sejam capturadas eficientemente, mesmo nos grandes volumes de amostra ou em concentrações baixas de esferas magnéticas.
[00330] Em um exemplo, os ensaios foram conduzidos com SERS e os volumes de reagente de partículas magnéticas constantes, enquanto se varia o volume da amostra para alcançar uma faixa de concentrações de reagente. Amostras de 5, 10, 20, 30, 40 e 50 ml de uma diluição de 1:10 de sangue de coelho meio de cultura de sangue BD BACTEC™ Standard 10 Aerobic/F foram testados em tubos 50 mL Falcon™ em um sistema de ensaio baseado em carrossel modificado para grandes volumes de amostra (ver, por exemplo, Figura 24). E. coli O157 foi descongelada a partir de um estoque congelado e concentrada em cada amostra em 10 4 cfu/mL. Ao longo de um período de seis dias, cada volume foi testado em triplicado, com apenas uma amostra de um determinado volume testado por dia.
[00331] Em cada um dos tubos, uma mistura principal tipicamente utilizada para amostras de 5 ml foi criada combinando 125 μL de marcadores SERS e 80 μL de partículas magnéticas em 795 μL de 1:10 sangue e meio. A mistura máster de 1 ml resultante foi adicionada a cada amostra de teste. Tag SERS conjugados com Biodesign anticorpos MAV119-499 anti-E. coli, e partículas magnéticas Dynabeads® Anti-E. coli O157 (710-04) de Life Technologies™, foram usados.
[00332] As amostras foram colocadas em um sistema de ensaio baseado em carrossel (ver, por exemplo, Figura 24), a 35°C, com a peletização durante 60 segundos, uma potência de laser incidente de 50 mW, um tempo de integração de 5 segundos do CCD, oscilador operando a ~0,5 ciclos/s, e uma frequência de leitura de 5/hora.
[00333] Os resultados para uma amostra representativa de cada volume são mostrados na Figura 64. Embora a intensidade do sinal seja reduzida com concentrações mais baixas de reagentes, o sistema é capaz de formar eficazmente péletes e detectar crescimento mesmo em uma concentração 10 vezes menor do que o normal. Como pode ser observado, o ensaio detecta eficazmente o crescimento de uma variedade de volumes.
[00334] No sistema de carrossel (ver, por exemplo, Figura 24), as amostras são agitadas enquanto o pélete magnético está sendo formado para assegurar que complexos magnéticos do volume de fluido total passam através do campo magnético localizado. Uma câmara capta imagens de pélete durante a interrogação do laser para controlar a formação de pélete durante todo o ensaio.
[00335] A Figura 65A mostra um exemplo em que um pélete não se forma dentro de poucas horas de enriquecimento secundário de 107 CFU/mL Salmonella Typhimurium (ATCC 14028) em agitação rápida em frequências do sistema de carrossel 150 (ver Figura 24). Salmonella Typhimurium (ATCC 14028) foi cultivada durante a noite em meio primário SDIX RapidChek® Salmonella SELECT™ com suplemento a 42°C. Uma diluição 1:100 de cultura com SDIX Salmonella meio secundário foi inoculada em um recipiente secundário com partículas magnéticas conjugadas e marcadores SERS e colocada no sistema de carrossel 150. A inoculação a partir de meios secundários foi determinada como sendo de 1 x 107 CFU/mL por plaqueamento em placas de ágar nutriente. O instrumento lido duas vezes por hora, peletizado durante 30 segundos, e agitado a 2 Hz, com 25 milímetros de arremesso. A Figura 65A mostra a curva de SERS resultante com imagens capturadas em vários momentos durante o enriquecimento secundário. A primeira imagem de pélete contém um círculo amarelo para destacar a área onde o pélete deve formar. Esta Figura mostra que o pélete cresce de tamanho por 2 horas, e falha em se formar perto de 3 horas do tempo de enriquecimento secundário.
[00336] Para cargas muito altas de Salmonella, o pélete torna-se particularmente grande porque há uma grande quantidade de patógenos presentes no pélete. Quando a agitação é muito rápida, o campo magnético é incapaz de superar a dinâmica dos fluidos, e o pélete não se forma.
[00337] A Figura 65B mostra a curva de SERS e imagens correspondentes durante o enriquecimento secundário para uma amostra negativa (esferas magnéticas conjugadas e marcadores SERS conjugados no meio). Estes dados mostram um sinal de Raman consistentemente baixo e tamanho de pélete consistente durante o ensaio.
[00338] Ao reduzir a frequência de agitação para 1 Hz durante enriquecimento secundário de 107 CFU/mL de Salmonella Typhimurium (ATCC 14028), o pélete formou-se de forma consistente durante todo o ensaio. Salmonella Typhimurium (ATCC 14028) foi cultivada durante a noite em meio primário SDIX RapidChek® Salmonella SELECT™ com suplemento a 42°C. Uma diluição 1: 100 de cultura com meio secundário SDIX Salmonella foi inoculada em um recipiente secundário com partículas magnéticas conjugadas e marcadores SERS e colocada no sistema de carrossel 150. A inoculação a partir de meios secundários foi determinada como sendo de 1 x 107 CFU/mL por plaqueamento em placas de ágar nutriente. O instrumento lido 2 vezes por hora, peletizado por 30 segundos, e agitado a 1 Hz com 25 milímetros de arremesso. A Figura 65C mostra a curva SERS resultante com imagens capturadas em vários momentos durante o enriquecimento secundário. A primeira imagem de pélete contém um círculo amarelo para destacar a área onde o pélete deve formar. A Figura 65C mostra que o pélete é mantido durante todo o experimento. A Figura 66 mostra o impacto da velocidade de agitação na persistência do pélete em sobrepor as curvas SERS de taxas de agitação de 2 Hz e 1 Hz (Figuras 65A e 65C, respectivamente). Com agitação mais lenta, a decadência do sinal é muito mais lenta e o pico é muito mais amplo do que quando a agitação é rápida. Além disso, o monitoramento em tempo real do pélete através de uma câmara em linha indica que a perda de sinal para a agitação é rápida, devido à ausência do pélete, enquanto para a agitação lenta para o pélete é formado sempre. O pélete não se forma perto de 3 horas a 2 Hz de agitação, mas está sempre presente com 1 Hz de agitação. A formação consistente do pélete com carga alta de organismo leva a persistência maior do sinal SERS. Esta persistência no sinal SERS pode ser vantajosa se, por exemplo, existir um atraso entre quando a amostra é adicionada aos reagentes de detecção e quando a amostra é colocada no instrumento.
[00339] Neste exemplo, um método para detectar micro-organismos em uma amostra microbiológica que pode eliminar a necessidade para o laser, a óptica, e espectrômetro de acordo com uma modalidade da invenção é descrito. Este método envolve a utilização de uma câmara para capturar imagens durante as leituras, de modo a controlar a formação de um pélete durante o curso de um ensaio em SERS HNW.
[00340] No experimento descrito no exemplo 11 e mostrado na Figura 65A, 65B, e 65C, a presença do micro-organismo faz com que o pélete cresça em tamanho (Figuras 65A e 65C). Em contraste, quando o micro-organismo é ausente, o tamanho do pélete e o sinal de SERS permanecem estáveis. Sem a presença do patógeno alvo, nenhum sanduíche pode ser formado, o que resulta em ausência de sinal de Raman e nenhum aumento no tamanho do pélete. A Figura 67 mostra o tamanho do pélete para uma amostra negativa em comparação com o tamanho do pélete para uma amostra positiva, depois de 3 horas de enriquecimento secundário em um sistema de carrossel (ver, por exemplo, Figura 24). Esta Figura mostra um pélete formado maior para a amostra positiva em comparação com a amostra negativa.
[00341] Durante enriquecimento secundário de uma amostra que contém os marcadores SERS conjugadas e as esferas magnéticas e o patógeno alvo, imagens mostram que o tamanho do pélete aumenta, e, em alguns casos, não se forma conforme o ensaio progride. O crescimento no tamanho do pélete e/ou desaparecimento do pélete é uma indicação da presença do patógeno alvo. Imagens capturadas durante as leituras de amostras que contêm marcadores SERS conjugadas e esferas magnéticas sem patógeno não mostram nenhuma mudança no tamanho do pélete e nenhum desaparecimento do pélete. Utilizando a análise de imagem para controlar o tamanho do pélete pode apresentar um método para detectar micro-organismos no ensaio. Este método de detecção pode ser utilizado sozinho ou em conjunção com outro método de detecção.
[00342] As Figuras 68A, 68B e 68C mostram dados representativos adquiridos com um sistema de carrossel (ver, por exemplo, a Figura 24) para detectar E. coli 0157 em carne digerida, espinafre enxaguado e sólidos do leite.
[00343] Carne moída crua foi preparada de acordo com USDA Microbiology Laboratory Guidebook (MLG Chapter 5). Amostras de 25 g de carne moída foram diluídas com 225 ml de mTSB com Novobiocin em bolsas stomacher. Cada bolsa Stomacher foi então digerida em um Seward Stomacher® 400 durante 2 minutos. Alíquotas de 5 ml a carne moída digerida foram transferidas para tubos contendo marcador SERS e partículas magnéticas conjugadas. E. coli O157:H7 (ATCC 43888) foi cultivada em uma cultura durante a noite em caldo Nutriente a partir de uma colônia única a 37°C em uma cultura de agitação. A cultura foi diluída em série até aproximadamente 102 - 104 em Caldo Nutriente. Uma alíquota de 0,05 ml foi acrescentada a cada tubo positivo e uma alíquota de 0,05 ml de Caldo Nutriente foi adicionada em tubos de controle negativo.
[00344] A amostra de espinafre enxaguado foi preparada de acordo com FDA Bacteriological Analytical Manual (BAM Chapter 4A). Um peso igual de tampão de fosfato de Butterfield foi adicionado às folhas de espinafre em um saco de plástico hermeticamente fechado e agitado manualmente durante 5 minutos. O rinsado de espinafre foi, então, adicionado a um volume igual de força dupla (x2) mBPWp. E. coli O157:H7 (ATCC 43888) foi cultivada em uma cultura durante a noite em caldo Nutriente a partir de uma colônia única a 37°C em uma cultura de agitação. A cultura foi diluída em série e inoculada no rinsado de espinafre + (x2) mBPWp em uma concentração de 103 ou 0 cfu/ml. Alíquotas de 5 ml destas amostras foram adicionadas em tubos contendo marcador SERS e partículas magnéticas conjugadas.
[00345] A amostra de leite foi preparada de acordo com FDA Bacteriological Analytical Manual (BAM Chapter 4A). Leite integral foi centrifugado durante 10 minutos a 10.000 x g. A camada sobrenadante foi decantada e o pélete foi ressuspenso em mBPWp a 1,125 vezes o volume de leite original. E. coli O157:H7 (ATCC 43888) foi cultivada em uma cultura durante a noite em caldo Nutriente a partir de uma colônia única a 37°C em uma cultura de agitação. A cultura foi diluída até 5000 cfu/ml em Caldo Nutriente. Alíquotas de 50 ul de cultura diluída de E. coli O157:H7 ou Caldo Nutriente (controle negativo) foram adicionadas aos tubos de 5 ml da cultura de leite ressuspensa mais reagentes de ensaio.
[00346] Todos os inóculos foram plaqueados para a enumeração em placas BD BBL™ CHROMagar™. Os tubos foram inseridos no sistema de carrossel para o monitoramento em tempo real, durante o crescimento, a 35°C durante 8 horas.
[00347] A Figura 69 mostra um exemplo em que S. Enteritidis (ATCC 13076) estressada por calor foi detectada durante o crescimento em tempo real, em carne moída, mais meios de cultura. Salmonella Enteritidis foi cultivada em uma cultura durante a noite em Caldo Nutriente a partir de uma colônia única a 37°C em uma cultura de agitação. A cultura foi diluída para baixo 1: 100 em Caldo Nutriente e submetidas ao calor durante 20 minutos a 54°C. A amostra estressada por calor foi ainda diluído para baixo para 200 cfu/ml em Caldo Nutriente. Duas amostras de 25 g de carne moída em bruto foram inoculadas com 1 ml de alíquotas da cultura diluída estressada pelo calor de S. Enteritidis. O inóculo foi preparado para a enumeração em placas de ágar Nutriente. As amostras de carne moída foram amassadas à mão em uma bolsa de stomacher por 2 minutos para misturar bem o inóculo. 225 ml de meio primário SDIX RapidChek® Salmonella SELECT™ com suplemento foram adicionados às amostras inoculadas na bolsa Stomacher. Amostras de controle negativo foram preparadas com 25 g de carne moída crua em 225 ml meio primário SDIX RapidChek® Salmonella SELECT™ com suplemento. Cada bolsa Stomacher foi então digerida em um Seward Stomacher® 400 durante 2 minutos. As bolsas Stomacher foram então colocadas em uma incubadora a 42°C durante aproximadamente 22 horas. 100 ul de amostras de culturas primárias de enriquecimento foram então adicionadas aos tubos contendo 4,5 ml de meio secundário SDIX Salmonella, 0,4 ml de meio primário SDIX RapidChek® Salmonella SELECT™ e os reagentes de ensaio. Os tubos foram, em seguida, inseridos no sistema de carrossel (ver Figura 24) para o monitoramento em tempo real, durante o crescimento, a 42°C durante 8 horas. As amostras positivas foram detectadas dentro de aproximadamente 2 horas, enquanto que as amostras negativas resultaram em curvas de detecção planas.
[00348] A Figura mostra a detecção de Listeria monocytogenes (ATCC 19115) sobre uma placa de aço inoxidável. L. monocytogenes (ATCC 19115) foi cultivada em uma cultura durante a noite em caldo de infusão de cérebro e coração a partir de uma colônia simples a 30°C em uma cultura de agitação. A cultura foi diluída para 5 x 104 ou 0 cfu/ml em PBS + 5% leite. Uma alíquota de 0,1 ml foi colocada sobre uma placa de aço inoxidável de 1’’ x 1’’ e deixada secar ao ar durante a noite. No dia seguinte, swabs com ponta de algodão molhados em caldo D/E de neutralização, foram passados em toda a superfície várias vezes. Os swabs foram, então, adicionados a 5 ml de meio SDIX Listeria com suplemento, marcadores SERS e partículas magnéticas em tubos. Os tubos foram, em seguida, inseridos no sistema de carrossel (ver Figura 24) para o monitoramento em tempo real, durante o crescimento, a 30°C. As amostras positivas foram detectadas entre cerca de 19 e 27 horas, enquanto que as amostras negativas resultaram em curvas de detecção planas.
[00349] Neste exemplo Salmonella foi detectada usando agitação linear e um sistema de leito plano (ver, por exemplo, Figura 25). Salmonella Typhimurium (ATCC 14028) e Salmonella Enteritidis (ATCC 13076) foram cultivadas separadamente em culturas durante a noite em meio primário SDIX RapidChek® Salmonella SELECT™ com suplemento a 42°C. Uma diluição de 1: 100 de cada cepa foi preparada em lotes de meio secundário Salmonella. A inoculação inicial para cada cepa em meio secundário foi determinada como sendo de 1 x 107 CFU/mL por contagem em placa em placas de ágar Nutriente. Cada cepa foi inoculada em duplicatas em tubos contendo marcadores SERS e partículas magnéticas conjugadas com anticorpos anti-Salmonella (Virostat 0701). Estes tubos, juntamente com duas amostras negativas (meio secundário SDIX e marcadores SERS conjugados e partículas magnéticas sem Salmonella) foram colocados no instrumento para o monitoramento durante o enriquecimento secundário a 42°C.
[00350] O sistema utilizado neste exemplo era uma configuração de leito plano (ver, por exemplo, Figura 25). Nesta configuração, a agitação é de movimento alternativo linear ao longo do eixo geométrico dos tubos, que podem ser programados para frequências diferentes e os perfis de todo o ensaio. Cada ciclo é composto pelas seguintes fases: mistura, dispersão pré-pélete, peletização, leitura e dispersão. A configuração do magneto utilizado neste exemplo foi uma única barra magnética com N-polo virado para as amostras. Uma vez que um pélete foi formado, a barra foi afastada das amostras para permitir a leitura. A Figura 71 mostra a frequência de agitação e arremesso usado para cada fase. O experimento teve duração de ~ 19 horas com um ciclo de repetição a cada ~ 20 minutos.
[00351] A fase de dispersão pré-pélete tem a intenção de suspender sólida assentado no meio secundário SDIX antes da peletização. Sólido assentado a partir da meio é conhecida por interferir com a peletização de complexos magnéticos. O magneto de barra simples é colocado em contato com os tubos durante a agitação e as amostras foram peletizadas durante 60 segundos. A agitação é interrompida por 5 segundos e o magneto está afastado dos tubos de amostra para permitir que o motor óptico interrogue cada pélete. Uma câmera também captura imagens de cada pélete. A agitação é retomada para dispersar o pélete e o ciclo repete.
[00352] A Figura 72 mostra as curvas de SERS durante enriquecimento secundário de S. Typhimurium (ATCC 14028), S. Enteriditis (ATCC 13076), e as amostras negativas. Como pode ser observado, as curvas de SERS são planas e podem ser facilmente distinguidas das negativas. A Figura 73 mostra imagens dos péletes formados em vários momentos durante o enriquecimento secundário de S. Typhimurium. Como pode ser observado, péletes redondos densos são consistentemente formados ao longo do ensaio usando o instrumento de leito plano.
[00353] Neste exemplo, os ensaios idênticos de Salmonella foram executados em dois sistemas de carrossel (ver, por exemplo, Figura 24), utilizando diferentes métodos de agitação: um movimento alternativo linear ao longo do eixo geométrico dos tubos e uma oscilação de equilíbrio. Salmonella Enteritidis (ATCC 13076) e Salmonella Kentucky (ATCC 9263) foram cultivadas separadamente em culturas durante a noite em meio primário SDIX RapidChek® Salmonella SELECT™ com suplemento a 42°C. Uma diluição de 1: 100 de cada cepa foi preparada em lotes separados de meio secundário SDIX Salmonella. A inoculação inicial para cada cepa em meio secundário foi determinada como sendo de 1 x 107 CFU/mL por contagem em placa em placas de ágar Nutriente. Cada cepa foi inoculada em duplicada em tubos contendo marcadores SERS e partículas magnéticas conjugadas com anticorpos antiSalmonella de Virostat (0701). Estes tubos foram colocados nos sistemas de carrossel paro monitoramento durante o enriquecimento secundário a 42°C. Cada instrumento lê duas vezes por hora, peletizou por 30 segundos, e agitou a 1 Hz.
[00354] A Figura 74 mostra curvas SERS obtidas a partir da agitação com oscilação e sistema carrossel em agitação linear durante o enriquecimento secundário de S. Enteriditis e S. Kentucky. Pode ser observado que são obtidos bons resultados com ambos os métodos.
[00355] Neste exemplo, a agitação linear resultou em algumas vantagens em relação ao movimento de equilíbrio. Desempenho de peletização foi melhor, usando agitação linear em comparação ao equilíbrio porque o pélete foi sempre formado no centro da cabeça de leitura, usando agitação linear. O sistema de agitação de equilíbrio não oscila simetricamente em relação ao braço oscilante, fazendo com que a roda de tubos favoreça o movimento de avanço. Este movimento assimétrico de fluido faz com que o força de fluido sobre o pélete favoreça o lado da frente dos tubos. Devido à sua simplicidade mecânica em relação ao equilíbrio de agitação, agitação linear é um método preferencial de agitação.
[00356] Neste exemplo, a compatibilidade do ensaio em tempo real baseado em SERS com os testes de processamento de amostras que são tipicamente realizados na sequência da detecção de uma amostra de hemocultura positiva por meio de sensores de gás convencionais foi testada. Estes testes podem ser utilizados para proporcionar identificação do organismo foram de um frasco de hemocultura positiva. Estes testes incluem ensaios padrão de coagulase em tubo, ensaios de aglutinação de látex, coloração de Gram, desenvolvimento de meio cromogênico, teste de sensibilidade aos antibióticos manual e inibição de antifúngicos em culturas de placas.
[00357] Os ensaios de coagulase em tubo padrão foram realizados separadamente selecionando várias colônias de S. aureus ou S. epidermidis de uma placa estriada e emulsificando as mesmas em meio BACTEC™. Uma amostra de 50 μl bactérias emulsificadas com ou sem reagentes SERS (em concentrações de ensaio) foi adicionada a 500 μl de EDTA de plasma de coelho e incubada a 37°C. As amostras de S. aureus com e sem reagentes SERS ambos coagularam o plasma dentro de 4 horas (Figura 75). As amostras de S. epidermidis não coagularam o plasma de coelho a 4 horas. Portanto, a presença de reagentes SERS não impede a capacidade para distinguir amostras deS. aureus de S. epidermidis via atividade da coagulase, mesmo em concentrações relativamente elevadas de reagentes SERS.
[00358] Um teste de aglutinação em látex para identificar S. aureus foi avaliado para qualquer interferência causada pelas partículas de ensaio SERS. Amostras de S. aureus e S. epidermidis com e sem reagentes SERS (em concentrações de ensaio) foram preparadas como descrito acima. Uma gota de látex teste BD BBLTM Staphyloslide™ foi então adicionada à placa de ensaio, como foi uma gota de látex de controle. Para cada tipo de látex, amostras de 10 μl de 1) S. epidermidis com reagentes SERS, 2) S. epidermidis sem reagentes SERS, 3) S. aureus com reagentes SERS, e 4) S. aureus sem reagentes SERS foram adicionados. As soluções foram misturadas e osciladas por ~ 20 s. A Figura 76 mostra as placas com S. epidermidis (placa à esquerda) e S. aureus tipo 8 (placa à direita). Amostras bacterianas com reagentes SERS foram adicionadas à linha superior, enquanto que as amostras sem reagentes SERS foram adicionadas para a linha inferior. Os resultados são idênticos para as amostras com e sem reagentes, apenas com as amostras de S. aureus exibiram aglutinação. As únicas amostras que mostram aglutinação foram as amostras de S. aureus com e sem reagentes de SERS, demonstrando que os reagentes SERS não impedem aglutinação em látex na presença de S. aureus, não falsamente aglutinam o látex de controle, e não falsamente aglutinam látex teste na presença de S. epidermidis.
[00359] A coloração Gram com reagentes do ensaio também foi realizada como um teste de compatibilidade de processamento à jusante. Tags SERS e partículas magnéticas em tampão foram adicionadas às Lâminas Gram Controle BD BBL contendo Staphylococcus aureus ATCC 25923 (cocos Gram positivos) e Escherichia coli ATCC 25922 (bastonetes gram negativas) e fotografados usando uma objetiva com imersão em óleo de 100X, como é normalmente usado na clínica. A Figura 77 mostra as partículas magnéticas e marcadores SERS sem os organismos de controle. As partículas magnéticas são claramente visíveis como grandes esferas marrons. As partículas magnéticas também são uniformes em cor e tamanho, efetivamente servindo como um tamanho padrão interno (~ 3 μm) para microscopia. Os marcadores SERS, que são 0,1-0,2 μm de diâmetro, não são visíveis. A Figura 78 mostra uma partícula magnética, na presença de uma mistura de S. aureus (cocos roxo) e E. coli (bastonetes rosas) fotografadas em 100X. Partículas magnéticas são claramente não corada e facilmente distinguíveis dos micro-organismos nesta imagem.
[00360] Meio cromogênico CHROMagar™ permite a identificação, diferenciação e separação de um único patógeno por uma única cor desenvolvida no meio sólido. As amostras de hemoculturas durante a noite de S. aureus tipo 8 e S. epidermidis contendo reagentes SERS foram semeadas em placas CHROMagar™. Os resultados obtidos (Figura 79) indicaram que os reagentes SERS não afetam a capacidade de obter colônias isoladas e não impedem o desenvolvimento de cor CHROMagar™ específica para espécie, em que S. aureus é mostrado à esquerda e S. epidermidis é mostrado à direita. Como esperado, as colônias de S. aureus são malvas enquanto colônias de S. epidermidis são brancas quando semeadas em placas de BD BBL™ CHROMagar™ Staph aureus.
[00361] Teste de antibiótico manual usando o método de difusão em disco de ágar (BD Sensi-disc™) foi também testado na presença de reagentes de SERS. Culturas de sangue durante a noite de E. coli O157 com reagentes SERS foram estriados em placas de ágar BD BBL™ Mueller Hinton II e os três discos de teste BD BBL™ Sensi-disc™ foram colocados na parte superior e a cultura deixada crescer a 37°C durante a noite. No dia seguinte, as zonas de inibição (Figura 80) foram medidas (em mm) e comparadas com as tabelas de intepretação de diâmetro de zona Sensi-disc™ para a determinação dos isolados sensíveis, inibidores ou resistentes. A Figura 80 mostra Ampicilina-10 (superior esquerdo), levofloxacina-5 (canto superior direito), vancomicina-30 (abaixo)). As medições de diâmetro da zona não variaram mais do que 1 a 2 mm entre a cultura de E. coli com reagentes e a cultura sem reagentes (Figura 81). Este processo foi repetido com outras bactérias de hemocultura e leveduras (Tabela 82), o que mostra que a capacidade de determinar a sensibilidade aos antibióticos de um micro-organismo utilizando o método de difusão em disco não é afetada pela presença de reagentes SERS.
[00362] Para o ensaio de levedura, foram utilizados discos de Nistatina TaxoTM. Estes discos não são usados para os testes de susceptibilidade, mas para a diferenciação e o isolamento de bactérias a partir de amostras com ambas as bactérias e leveduras. Por isso, um método ligeiramente diferente foi testado. Hemoculturas mistas de E. coli e C. albicans com e sem reagentes SERS foram estriadas em placas de TSA II. Os discos de Nistatina TaxoTM foram colocados na parte superior e as culturas foram cultivadas a 37°C durante a noite. Em ambas as amostras com (imagem da esquerda da Figura 83) e sem (imagem da direita da Figura 83) os reagentes do ensaio, a inibição de Nistatina do crescimento de C. albicans resultou em áreas de colônias isoladas de E. coli.
[00363] Este exemplo refere-se à peletização com uma configuração em que o tubo é acoplado ao magneto (ver, por exemplo, Figura 49), de tal modo que o magneto se move com o tubo e é mantido na mesma posição em relação ao tubo em toda a agitação. Em uma série de experimentos, as marcadores SERS foram covalentemente ligadas a partículas magnéticas ativadas por tosil de modo a formar um pré- complexo de SERS-esfera magnética (PC). Esferas pré-complexadas são preparadas por ligação covalente de partículas SERS para partículas magnéticas Dynabeads® M-280 ativadas por tosil através da reação dos grupos tiol (-SH) na superfície da SERS com grupos tosil (Tos), na superfície de partículas magnéticas do PC atua como um sistema modelo para testes de formação de pélete em que o pélete pode ser interrogado para sinal SERS. Neste exemplo, a formação de pélete de PC em um meio secundário comercial para Salmonella (SDIX RapidChek® Salmonella SELECT™ ) foi comparada usando uma variedade de frequências de agitação e tempos de revestimento. Estes testes foram realizados utilizando uma configuração do sistema de leito plano (ver, por exemplo, Figura 25) com uma única barra magnética, com a N-polo virado para os tubos (ver, por exemplo, Figura 52).
[00364] A Figura 84 mostra uma tabela com imagens de péletes formados utilizando PC em meio secundárias SDIX Salmonella usando três frequências de agitação diferentes e três vezes de peletização diferentes. PC em meio secundário SDIX foi peletizado por agitação dos tubos juntamente com a barra magnética em diferentes frequências de agitação a 50 milímetros de arremesso (amplitude). A agitação foi interrompida e o magneto foi deixado persistir durante 5 segundos, antes de mover a barra magnética para longe dos tubos. Imagens dos péletes foram capturadas uma vez que a barra magnética foi retirada dos tubos.
[00365] Como mostrado na Figura 84, a agitação rápida forma um pélete mais denso em comparação com agitação lenta. Isto é provavelmente devido aos meios sólidos de sedimentação utilizando agitação lenta e interferem com a formação de pélete. Usando agitação rápida, o sólido é suspenso em solução e complexos magnéticos podem ser puxados para dentro de um pélete com menos interferência dos meios. Pode ser observado nos péletes formados usando 0,7 Hz de frequência de agitação com tempos de peletização de 30, 60 e 90 segundos que assentaram no meio interfere com a capacidade para puxar um pélete denso, tal como evidenciado pelo pélete difuso.
[00366] Este exemplo refere-se à medição do tempo necessário para dispersar completamente o pélete utilizando uma variedade de arremessos de agitação (amplitude) e frequências. Em cada caso, um pélete foi formado utilizando uma configuração na qual o tubo é acoplado ao magneto (ver, por exemplo, Figura 49), de tal modo que o magneto se desloca com o tubo e é mantido na mesma posição em relação ao tubo em toda a agitação. O magneto utilizado neste exemplo foi uma única barra magnética com o N-polo virado para os tubos de amostra, como mostrado na Figura 52.
[00367] Neste exemplo, o tubo foi agitado manualmente antes de cada ensaio, para misturar completamente o meio (SDIX RapidChek® Salmonella SELECT™) e PC. A amostra foi carregada no instrumento de leito plano e um pélete foi formado agitando a 1,8 Hz e 25 milímetros de arremesso durante 90 segundos. A agitação foi interrompida e o magneto foi deixado persistir durante 5 segundos, antes de mover a barra magnética para longe dos tubos. Várias frequências de agitação e arremessos foram usados em ensaios separados para dispersar o pélete. A dispersão do pélete foi monitorada por inspeção visual e o tempo necessário para dispersar completamente o pélete foi medido. Os dados com asterisco indicam que nenhum meio assentado foi observado.
[00368] Como mostrado na Figura 85, a agitação rápida dispersa o pélete em menos tempo em comparação com agitação lenta. Além disso, para uma determinada frequência de agitação, o pélete dispersa mais rápido com arremesso de agitação maior. Com base em observações neste exemplo, meio sólido no meio secundário permanece suspenso em solução em frequências de agitação acima de 2,5 Hz a 25 milímetros de arremesso e acima de 1,5 Hz a 50 milímetros de arremesso.
[00369] Este exemplo demonstra a viabilidade de se realizar um ensaio homogêneo sem lavagem em conjunto com a cultura utilizando partículas fluorescentes no infravermelho próximo ("NIR") em vez de marcadores SERS. Neste exemplo, nanopartículas de sílica fluorescentes foram fabricadas utilizando uma técnica de crescimento de Stober modificada incorporando um conjugado de corante silano-NIR (para fornecer o sinal fluorescente) e um silano tiolado (para proporcionar uma pegada química de conjugação de anticorpo). As partículas foram caracterizadas por microscopia eletrônica de transmissão ("TEM"), espectroscopia por extinção UV/Vis, e espectroscopia de fluorescência, e demonstraram ser relativamente monodispersas e brilhantes. Figura 96 ilustra uma imagem TEM de nanopartículas de sílica fluorescente NIR (barra de escala é de 200 nm), enquanto a Figura 97 ilustra um espectro de fluorescência de nanopartículas fluorescentes NIR (OD 0,5) e espectro Raman de marcadores SERS padrão ES/HB (OD 1,2). Nanopartículas fluorescentes foram conjugadas Listeria Ab usando um protocolo padrão de conjugação, que foi modificado para explicar as diferenças na concentração de nanopartícula fluorescente, área de superfície e massa relativa às marcadores SERS. Conjugados de nanopartículas de sílica fluorescentes foram testados em um ensaio de Listeria HNW em um sistema de carrossel 150 (Ver Figura 24) usando 10% p/v de amostras de misturas de espinafre e couve. Os testes de controle foram realizados utilizando marcadores SERS com amostras de espinafre e repolho.
[00370] Os marcadores fluorescentes foram capazes de detectar com êxitoListeria em ambas as amostras de alimentos. A Figura 98 mostra os dados de espinafre coletados por meio marcadores de nanopartículas fluorescentes NIR e marcadores SERS, enquanto a Figura 99 mostra os dados coletados de couve usando marcadores de nanopartículas fluorescentes NIR e marcadores SERS. Ambos sinal de background demonstraram a ser mais elevados para marcadores fluorescentes do que para marcadores SERS, no entanto, a detecção foi bem sucedida com sinal relativamente alta para as proporções de background de ~ 4:1.
[00371] Embora a questão anterior objeto tenha sido descrita em algum detalhe por meio de ilustração e exemplo para fins de clareza de compreensão, será entendido aos versados na técnica que certas alterações e modificações podem ser praticadas dentro do escopo das reivindicações anexas e seus equivalentes.
[00372] Todas as publicações, pedidos de patentes, patentes e outras referências estão aqui incorporadas por referência na mesma extensão como se cada publicação, pedido de patente, patentes, e outras referências fosse especificamente e individualmente indicada para ser incorporada por referência. Deve ser entendido que, embora um número de pedidos de patentes, patentes e outras referências, seja aqui referenciado, tal referência não constitui uma admissão de que qualquer um destes documentos faz parte do conhecimento geral comum na técnica.
[00373] A descrição anterior destina-se a ser um exemplo de várias modalidades da invenção. Será entendido por versados na técnica que várias alterações e modificações às modalidades descritas podem ser feitas sem se afastar do escopo e do espírito da invenção tal como definido nas reivindicações anexas.
Claims (15)
1. Método para detectar um ou mais micro-organismos em uma amostra, o método caracterizado pelo fato de que compreende: (a) fornecer uma amostra suspeita de conter um ou mais micro-organismos; (b) dispor a referida amostra em um frasco de ensaio, em que o referido frasco de ensaio tem disposto neste um meio de cultura capaz de suportar o crescimento de micro-organismos de modo a formar uma amostra de cultura e um reagente compreendendo uma ou mais partículas indicadoras tendo associado a estas, pelo menos, um elemento de ligação específico possuindo uma afinidade para o dito um ou mais micro-organismos; e uma ou mais partículas magnéticas de captura tendo associado a esta, pelo menos, um elemento de ligação específico que tem uma afinidade para o dito um ou mais microorganismos, em que o elemento de ligação associado com as partículas indicadoras pode ser o mesmo ou diferente do elemento de ligação associado com as partículas magnéticas de captura; (c) incubar a amostra de cultura durante um período de tempo predeterminado para formar um complexo magnético de captura de partículas indicadoras de microorganismos se o dito um ou mais micro-organismos estão presentes na amostra; (d) agitar o frasco de ensaio; (e) expor dito complexo magnético de captura de partículas indicadoras de microorganismos a um campo magnético para induzir o dito complexo para migrar para uma área localizada do dito frasco de ensaio; (f) opticamente interrogar a dita área localizada do dito frasco de ensaio para induzir a dita partícula indicadora para produzir um sinal detectável para detectar os ditos um ou mais micro-organismos na dita amostra; (g) dispersar o dito complexo magnético de captura de partículas indicadoras de microorganismos; e (h) repetir as etapas (c) a (g) uma ou mais vezes.
2. Método, de acordo com a reivindicação 1, caracterizado pelo fato de que: (i) a repetição das etapas (c) a (g) ocorre em intervalos de tempo regulares; (ii) as etapas (c) e (d) ocorrem concomitantemente; ou (iii) a etapa (e) forma um pélete compreendendo complexo magnético de captura de partículas indicadoras de microorganismos, opcionalmente em que o pélete é detectável utilizando meios visuais ou ópticos.
3. Método, de acordo com a reivindicação 1, caracterizado pelo fato de que a amostra compreende uma amostra de sangue, uma amostra de alimentos, ou uma amostra ambiental.
4. Método, de acordo com a reivindicação 1, caracterizado pelo fato de que a disposição da dita amostra em um frasco de ensaio compreende a transferência de uma quantidade desejada da dita amostra, juntamente com o meio de cultura opcional, a partir de um vaso, em que o vaso compreende: um recipiente para receber uma amostra de cultura neste, o recipiente tendo uma extremidade aberta e uma extremidade fechada; uma tampa configurada para encaixar a extremidade aberta do vaso em uma ligação estanque aos fluidos; um cesto acoplado à tampa e que inclui pelo menos um reservatório, o cesto estando disposto entre a extremidade aberta e a extremidade fechada do recipiente, o reservatório configurado para conter um volume de amostra de cultura neste; e pelo menos uma montagem de agulha acoplada com a tampa, a montagem de agulha incluindo uma agulha que se prolonga dentro do reservatório, em que a agulha é configurada para retirar seletivamente uma amostra contida no reservatório, e em que a agulha é ainda configurada para acoplar um frasco para transferência biocontida da amostra a partir do reservatório para o frasco.
5. Método, de acordo com a reivindicação 1, caracterizado pelo fato de que a disposição da dita amostra em um frasco de ensaio compreende a extração da amostra, juntamente com meios de cultura opcionais, de um modo biocontida de um vaso no qual partículas indicadoras e as partículas magnéticas não estão presentes.
6. Vaso para medição de uma quantidade desejada de uma amostra, o vaso caracterizado pelo fato de que compreende: um recipiente para receber uma amostra de cultura no seu interior para utilização no método conforme definido na reivindicação 1, o recipiente tendo uma extremidade aberta e uma extremidade fechada; uma tampa configurada para encaixar a extremidade aberta do recipiente em uma ligação estanque aos fluidos; um cesto acoplado à tampa e que inclui pelo menos um reservatório, o cesto estando disposto entre a extremidade aberta e a extremidade fechada do recipiente, o reservatório configurado para conter um volume de amostra predeterminado no seu interior, o cesto e reservatório configurados de modo que o reservatório seja preenchido quando o vaso for inclinado a partir de uma posição horizontal ereta e a amostra flui do recipiente através do cesto; e pelo menos uma montagem de agulha acoplada com a tampa, a montagem de agulha incluindo uma agulha que se prolonga dentro do reservatório, em que a agulha é configurada para retirar seletivamente uma amostra contida no reservatório, e em que a agulha é ainda configurada para acoplar um frasco para transferência biocontida da amostra do reservatório para o frasco.
7. Vaso, de acordo com a reivindicação 6, caracterizado pelo fato de que: (i) o recipiente é construído de um material transparente à radiação visível; ou (ii) a agulha compreende uma manga protetora que cobre a agulha, em que a manga protetora é configurada para ser comprimida quando o frasco é empurrado para baixo e em encaixe com a agulha, e em que a manga protetora é configurada para voltar à sua forma original para cobrir a agulha, conforme o frasco é retirado do encaixe com a agulha, a fim de permitir a transferência biocontida.
8. Vaso, de acordo com a reivindicação 6, caracterizado pelo fato de que o cesto define: (i) um primeiro reservatório e um segundo reservatório, em que a tampa define uma primeira montagem de agulha com uma primeira agulha que se estende dentro do primeiro reservatório e uma segunda montagem de agulha com uma segunda agulha que se estende dentro do segundo reservatório; (ii) uma nervura que é configurada para ajudar na drenagem do líquido através do cesto; ou (iii) pelo menos um orifício, em que o orifício é configurado para permitir que o excesso de amostra drene para dentro do vaso, após o vaso ser rodado para trás para a posição vertical; opcionalmente em que a primeira agulha e o primeiro reservatório são configurados para utilização com um primeiro tipo de ensaio, em que a segunda agulha e o segundo reservatório são configurados para uso com um segundo tipo de ensaio, e o primeiro tipo de ensaio é diferente do segundo tipo de ensaio, preferencialmente em que o primeiro reservatório é configurado para conter 5 ml, e em que o segundo reservatório é configurado para conter 100 μl.
9. Vaso, de acordo com a reivindicação 6, caracterizado pelo fato de que compreende ainda: (i) um espaço superior acima do pelo menos um reservatório, para permitir que a amostra entre facilmente em pelo menos um reservatório quando o recipiente está inclinado; (ii) um poste de ventilação que se estende a partir de uma superfície inferior da tampa, em que o poste de ventilação define uma abertura através da mesma para receber e engatar um filtro para filtrar os subprodutos gasosos que saem do recipiente; ou (iii) um primeiro poste de engate que se prolonga para fora a partir de uma superfície inferior da tampa e um segundo poste de engate que se estende para fora a partir de uma superfície superior do cesto, em que o primeiro poste de engate é configurado para alinhar com e engatar o segundo poste de engate.
10. Vaso, de acordo com a reivindicação 6, caracterizado pelo fato de que a tampa: (i) define uma abertura para permitir que quaisquer subprodutos gasosos, não perigosos escapem do recipiente para prevenir o aumento de pressão no interior do recipiente; (ii) define pelo menos uma abertura chaveada que é configurada para permitir o acoplamento de uma tampa específica do frasco; ou (iii) compreende ainda pelo menos uma característica de retorno para evitar o desenroscamento da tampa, sem desengate adicional da característica de retorno.
11. Montagem de tampa para utilização com um recipiente, no método conforme definido na reivindicação 1, para a dosagem de uma quantidade desejada de uma amostra, a montagem de tampa caracterizada pelo fato de que compreende: uma tampa configurada para encaixar a extremidade aberta de um recipiente em uma ligação estanque aos fluidos, a tampa, contendo opcionalmente uma junta; um cesto acoplado à tampa e que inclui pelo menos um reservatório, o reservatório configurado para conter um volume de amostra predeterminado no seu interior, o cesto e reservatório configurados de modo que o reservatório seja preenchido quando a montagem de tampa for usada com o recipiente e o recipiente está inclinado de uma posição horizontal ereta e a amostra flui do recipiente através do cesto; e pelo menos uma montagem de agulha acoplada com a tampa, a montagem de agulha incluindo uma agulha que se prolonga dentro do reservatório, em que a agulha é configurada para engatar em um frasco para uma transferência biocontida de uma amostra do reservatório para o frasco.
12. Montagem de tampa, de acordo com a reivindicação 11, caracterizada pelo fato de que o cesto define um primeiro reservatório e um segundo reservatório, e em que a tampa define uma primeira montagem de agulha com uma primeira agulha que se estende para dentro do primeiro reservatório e uma segunda montagem de agulha com uma segunda agulha que se estende para dentro do segundo reservatório, ou o cesto define uma nervura que é configurada para ajudar na drenagem do líquido através do cesto.
13. Montagem de tampa, de acordo com a reivindicação 12, caracterizada pelo fato de que a primeira agulha e o primeiro reservatório são configurados para utilização com um primeiro tipo de ensaio, em que a segunda agulha e o segundo reservatório são configurados para uso com um segundo tipo de ensaio, e o primeiro tipo de ensaio é diferente do segundo tipo de ensaio e opcionalmente em que o primeiro reservatório é configurado para conter 5 ml, e em que o segundo reservatório é configurado para conter 100 μL.
14. Montagem de tampa, de acordo com a reivindicação 11, caracterizada pelo fato de que a tampa: (i) define uma abertura para permitir que quaisquer subprodutos gasosos não perigosos escapem; (ii) define pelo menos uma abertura chaveada que é configurada para permitir o acoplamento de uma tampa específica de um frasco; ou (iii) compreende ainda pelo menos uma característica de retorno para evitar o desenroscamento da tampa, sem desengate adicional da característica de retorno.
15. Montagem de tampa, de acordo com a reivindicação 11, caracterizada pelo fato de que: (i) compreende ainda um poste de ventilação que se estende a partir de uma superfície inferior da tampa, em que o poste de ventilação define uma abertura através da mesma para receber e engatar um filtro para filtrar os subprodutos gasosos; (ii) compreende ainda um primeiro poste de engate que se prolonga para fora a partir de uma superfície inferior da tampa e um segundo poste de engate que se estende para fora a partir de uma superfície superior do cesto, em que o primeiro poste de engate é configurado para alinhar com e envolver o segundo poste de engate; ou (iii) em que a agulha compreende uma manga protetora que cobre a agulha, em que a manga de proteção é configurada para ser comprimida conforme um frasco é empurrado para baixo e em encaixe com a agulha, e em que a manga protetora é configurada para voltar à sua forma original para cobrir a agulha, conforme um frasco é retirado do encaixe com a agulha, a fim de permitir a transferência biocontida.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261623522P | 2012-04-12 | 2012-04-12 | |
| US61/623,522 | 2012-04-12 | ||
| US201261732650P | 2012-12-03 | 2012-12-03 | |
| US61/732,650 | 2012-12-03 | ||
| PCT/US2013/032499 WO2013165615A2 (en) | 2012-04-12 | 2013-03-15 | Methods, systems, and devices for detecting and identifying microorganisms in microbiological culture samples |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112014025527A2 BR112014025527A2 (pt) | 2017-06-20 |
| BR112014025527B1 true BR112014025527B1 (pt) | 2022-03-29 |
Family
ID=49035920
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112014025527-0A BR112014025527B1 (pt) | 2012-04-12 | 2013-03-15 | Método para detectar um ou mais micro-organismos em uma amostra, vaso para medição de uma quantidade desejada de uma amostra e montagem de tampa |
Country Status (9)
| Country | Link |
|---|---|
| US (2) | US9874555B2 (pt) |
| EP (3) | EP3674708B1 (pt) |
| JP (3) | JP6226956B2 (pt) |
| CN (2) | CN104364653B (pt) |
| AU (3) | AU2013257163B2 (pt) |
| BR (1) | BR112014025527B1 (pt) |
| CA (2) | CA2869732C (pt) |
| ES (3) | ES2805025T3 (pt) |
| WO (1) | WO2013165615A2 (pt) |
Families Citing this family (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI541504B (zh) * | 2014-01-20 | 2016-07-11 | 國立陽明大學 | 尿晶體檢測系統及方法 |
| US10422795B2 (en) | 2014-01-20 | 2019-09-24 | National Yang-Ming University | Urinary crystal detection method |
| CN105462824B (zh) | 2014-05-27 | 2021-02-02 | Bd控股私人有限公司 | 在商业无菌检测中使用血培养基平台的改进 |
| CN104062276A (zh) * | 2014-06-06 | 2014-09-24 | 上海交通大学 | 基于dna快速组装技术的核壳拉曼探针的制备方法 |
| FR3027678B1 (fr) | 2014-10-24 | 2016-12-30 | Viovy Jean Louis | Procede de detection d'organismes dans un echantillon dilue |
| US20180001319A1 (en) | 2014-12-16 | 2018-01-04 | Medcom Advance, S.A. | Analysis device, analysis apparatus for identification of analytes in fluids and use of the analysis device |
| US20160291002A1 (en) * | 2015-03-12 | 2016-10-06 | Pathogen Systems, Inc. dba Crystal Diagnostics Ltd | Sample Preparation and Specific Capture for Multiplex Detection of Target Analytes (i.e., Bacteria, Viruses, Etc.) |
| US10719691B2 (en) * | 2015-04-21 | 2020-07-21 | Purdue Research Foundation | Culture imaging system |
| CN104807993B (zh) * | 2015-04-23 | 2017-01-25 | 广东国际旅行卫生保健中心(广东出入境检验检疫局口岸门诊部) | 一种结核分枝杆菌esat‑6蛋白检测试剂盒、制备方法以及使用方法 |
| CN105137072B (zh) * | 2015-04-30 | 2017-03-01 | 广东国际旅行卫生保健中心(广东出入境检验检疫局口岸门诊部) | 一种结核分枝杆菌lam检测试剂盒、制备方法以及使用方法 |
| US10054522B1 (en) * | 2015-05-15 | 2018-08-21 | Colleen Kraft | Systems, devices, and methods for specimen preparation |
| CN206975048U (zh) * | 2015-05-28 | 2018-02-06 | Bd科斯特公司 | 制备用于鉴定和抗生素敏感性试验的单样本悬浮液的自动化系统 |
| EP3108962A1 (de) * | 2015-06-22 | 2016-12-28 | Thinxxs Microtechnology Ag | Probenträger |
| FR3046797A1 (fr) * | 2016-01-15 | 2017-07-21 | Biofilm Control | Procede de detection rapide de sensibilite de microorganismes aux drogues |
| FR3046795A1 (fr) * | 2016-01-15 | 2017-07-21 | Biofilm Control | Procede de classification de microorganismes |
| EP3405559B1 (en) * | 2016-01-21 | 2021-11-17 | T2 Biosystems, Inc. | Rapid antimicrobial susceptibility testing using high-sensitivity direct detection methods |
| CN109070084A (zh) | 2016-03-18 | 2018-12-21 | 安德鲁联合有限公司 | 液体处理器的尖端中的珠子操作方法及装置 |
| JP2017169479A (ja) * | 2016-03-23 | 2017-09-28 | オリンパス株式会社 | 観察装置、測定システム及び培養容器 |
| KR102043491B1 (ko) * | 2016-03-29 | 2019-11-13 | 주식회사 포스코 | 철분 제거 장치 및 이를 포함하는 재생 시스템 |
| WO2017176679A1 (en) * | 2016-04-04 | 2017-10-12 | The Trustees Of Columbia University In The City Of New York | Dna sequencing by synthesis with nucleotide analogues and raman detection |
| CN105866436B (zh) * | 2016-06-01 | 2017-12-15 | 中国农业科学院兰州兽医研究所 | 一种华纳氏葡萄球菌间接血凝检测试剂盒及其应用 |
| CN110072532A (zh) | 2016-07-21 | 2019-07-30 | 艾欧根有限责任公司 | 润肤局部消毒剂 |
| EP3512637A4 (en) * | 2016-09-16 | 2020-08-12 | The University Of Western Australia | MAGNETIC TOOL AND METHOD OF COLLECTING MAGNETIC PARTICLES THEREFORE |
| CN106370644A (zh) * | 2016-12-01 | 2017-02-01 | 无锡艾科瑞思产品设计与研究有限公司 | 一种动物组织中磺胺二甲基嘧啶的检测方法及试纸条 |
| CN108795790A (zh) * | 2017-04-28 | 2018-11-13 | 上海凯赛生物技术研发中心有限公司 | 一种培养基及其制备方法和用途 |
| EP3605107A4 (en) * | 2017-04-28 | 2020-12-30 | Ezdia Tech Inc. | AUTOMATED IMMUNOASSAY DEVICE AND METHOD USING A LARGE MAGNETIC COMPLEX OF PARTICLES |
| EP3619318A4 (en) | 2017-04-30 | 2020-11-18 | Genefluidics, Inc. | GENERATION OF DATA FOR USE WITH ANTIMICROBIAL AGENTS |
| US11433402B2 (en) | 2017-07-19 | 2022-09-06 | Amgen Inc. | Magnetic assisted separation apparatuses and related methods |
| US11371071B2 (en) | 2017-08-08 | 2022-06-28 | International Business Machines Corporation | Cell culturing structure including growth medium and non-growth medium |
| CN108254559A (zh) * | 2018-01-03 | 2018-07-06 | 北京市理化分析测试中心 | 快速检测微生物的方法 |
| CN113039282A (zh) * | 2018-07-18 | 2021-06-25 | 赛录科试诊断公司 | 抗微生物剂敏感性测试和微生物鉴定 |
| EP3837531A4 (en) * | 2018-08-17 | 2022-05-04 | Genefluidics, Inc. | GENERATION OF DATA FOR USE WITH ANTIMICROBIAL SUBSTANCES |
| CN109395875B (zh) * | 2018-12-11 | 2023-10-20 | 苏州英赛斯智能科技有限公司 | 一种磁珠分离机构、装置以及磁珠分离方法 |
| KR102170259B1 (ko) * | 2019-07-15 | 2020-10-28 | 주식회사 어큐노스 | 형광 이미징 기반의 미생물 신속 검출을 위한 용액 치환형 자성입자 농축방법 및 장치 |
| KR102257511B1 (ko) * | 2019-08-13 | 2021-05-31 | 고려대학교 산학협력단 | 자성-광학 복합 나노구조체 |
| CN110954696A (zh) * | 2019-11-27 | 2020-04-03 | 深圳华瑞达生物科技有限公司 | 一种曲霉半乳甘露聚糖聚糖检测试剂盒及其应用 |
| CN112834749B (zh) * | 2020-12-14 | 2023-05-02 | 黑龙江大学 | 一种检测阪崎克罗诺杆菌试纸的制备方法以及应用 |
| CN112646720B (zh) * | 2021-01-07 | 2022-07-05 | 东莞兰卫医学检验实验室有限公司 | 一种针对突变型小分子抗癌药物研发装置 |
| CN112725403A (zh) * | 2021-01-25 | 2021-04-30 | 宁夏医科大学总医院 | 一种血流感染病原阴性菌微量肉汤荧光药敏方法 |
| CN113504346B (zh) * | 2021-09-09 | 2021-11-23 | 南通化学环境监测站有限公司 | 一种用于公共场所的卫生检测装置 |
| KR102594680B1 (ko) * | 2021-10-08 | 2023-10-25 | 한국생명공학연구원 | 표면증강라만산란 기반 표적 바이러스 면역검정법 |
| WO2023073399A1 (en) * | 2021-10-26 | 2023-05-04 | Alakhmimi Nuha | An automated system for microbial testing |
| EP4205849A1 (en) * | 2021-12-30 | 2023-07-05 | Elmedix NV | System and method for thermal treatment of cancer cells |
| WO2023235793A2 (en) * | 2022-06-01 | 2023-12-07 | The Regents Of The University Of California | Novel technique to quantify gaseous reactive chlorine species by liquid ion chromatograpy |
Family Cites Families (35)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5624814A (en) | 1981-08-20 | 1997-04-29 | Becton Dickinson And Company | Culture medium and method for culturing body fluids containing antibiotics |
| GB9020352D0 (en) * | 1990-09-18 | 1990-10-31 | Anagen Ltd | Assay or reaction apparatus |
| US5128103A (en) * | 1990-12-14 | 1992-07-07 | E. I. Du Pont De Nemours And Company | Apparatus for automatically processing magnetic solid phase reagents |
| US5312009A (en) | 1993-06-07 | 1994-05-17 | Sage Products, Inc. | Liquid specimen collector with removable extraction device |
| US5374395A (en) * | 1993-10-14 | 1994-12-20 | Amoco Corporation | Diagnostics instrument |
| US5653686A (en) | 1995-01-13 | 1997-08-05 | Coulter Corporation | Closed vial transfer method and system |
| US6344272B1 (en) | 1997-03-12 | 2002-02-05 | Wm. Marsh Rice University | Metal nanoshells |
| US6699724B1 (en) | 1998-03-11 | 2004-03-02 | Wm. Marsh Rice University | Metal nanoshells for biosensing applications |
| US6335166B1 (en) | 1998-05-01 | 2002-01-01 | Gen-Probe Incorporated | Automated process for isolating and amplifying a target nucleic acid sequence |
| US20030232388A1 (en) | 1999-09-27 | 2003-12-18 | Kreimer David I. | Beads having identifiable Raman markers |
| DK1226422T3 (da) | 1999-10-06 | 2008-04-14 | Oxonica Inc | Overflade-forstærkede spektroskopi-aktive nano-partikler |
| WO2002079764A1 (en) | 2001-01-26 | 2002-10-10 | Nanoplex Technologies, Inc. | Surface-enhanced spectroscopy-active sandwich nanoparticles |
| JP4513085B2 (ja) * | 2001-09-11 | 2010-07-28 | アイキューム インク | 試料の容器 |
| US20030053938A1 (en) * | 2001-09-19 | 2003-03-20 | Becton, Dickinson And Company. | Liquid specimen collection container |
| US6913825B2 (en) | 2001-09-20 | 2005-07-05 | University Of Notre Dame Du Lac | Process for making mesoporous silicate nanoparticle coatings and hollow mesoporous silica nano-shells |
| US20060038979A1 (en) | 2004-08-05 | 2006-02-23 | Michael Natan | Nanoparticles as covert taggants in currency, bank notes, and related documents |
| WO2005010162A2 (en) * | 2003-07-17 | 2005-02-03 | Global Cell Solutions, Llc. | Automated cell culture system and process |
| US20050191665A1 (en) | 2003-12-29 | 2005-09-01 | Xing Su | Composite organic-inorganic nanoclusters |
| US7002679B2 (en) | 2004-05-11 | 2006-02-21 | Duke University | Encoded excitation source Raman spectroscopy methods and systems |
| US8008066B2 (en) * | 2005-03-10 | 2011-08-30 | Gen-Probe Incorporated | System for performing multi-formatted assays |
| ES2493990T3 (es) * | 2006-02-08 | 2014-09-12 | Becton Dickinson And Company | Ensayos con nanoetiquetas SERS |
| US20080025877A1 (en) * | 2006-05-15 | 2008-01-31 | Alley Kenneth A | Specimen collection and testing apparatus |
| EP2044402B2 (en) * | 2006-07-24 | 2016-11-30 | Becton Dickinson and Company | Apparatus and method for performing an assay using magnetic particles |
| US7891446B2 (en) | 2006-10-06 | 2011-02-22 | Irobot Corporation | Robotic vehicle deck adjustment |
| US7745169B2 (en) * | 2006-11-10 | 2010-06-29 | Biolumix Inc. | Device and method for the detection and enumeration of multiple groups of microorganisms |
| US9823253B2 (en) * | 2007-03-20 | 2017-11-21 | Becton, Dickinson And Company | Assays using surface-enhanced raman spectroscopy (SERS)-active particles |
| US8962342B2 (en) | 2007-06-06 | 2015-02-24 | Beckton, Dickinson And Company | Near-infrared dyes as surface enhanced raman scattering reporters |
| ITFI20070275A1 (it) * | 2007-12-07 | 2009-06-08 | Diesse Diagnostica Senese Spa | "dispositivo e metodo di analisi microbiologica di campioni biologici" |
| US20090169433A1 (en) * | 2007-12-28 | 2009-07-02 | Sankaran Kumar | System for improved biodetection |
| EP2247950A4 (en) | 2008-02-14 | 2011-04-13 | 3M Innovative Properties Co | METHODS AND COMPOSITIONS FOR DETECTING MICROORGANISMS |
| WO2009125971A2 (ko) * | 2008-04-09 | 2009-10-15 | (주)바이오니아 | 자동정제장치, 멀티 웰 플레이트 키트 및 생물학적 시료로부터 핵산을 추출하는 방법 |
| AU2009296528A1 (en) * | 2008-09-24 | 2010-04-01 | Straus Holdings Inc. | Imaging analyzer for testing analytes |
| EP2507663B1 (en) | 2009-12-04 | 2017-02-22 | Koninklijke Philips N.V. | System and method for time-related microscopy of biological organisms |
| JP2011163910A (ja) * | 2010-02-09 | 2011-08-25 | Beckman Coulter Inc | 分注精度管理方法、分注量補正方法、攪拌性能管理方法、自動分析装置および分析キット |
| FR2962445B1 (fr) | 2010-07-08 | 2013-06-28 | Biomerieux Sa | Procede de detection et d'identification directe d'un microorganisme dans un echantillon biologique dilue dans un bouillon d'enrichissement |
-
2013
- 2013-03-15 CN CN201380030468.9A patent/CN104364653B/zh active Active
- 2013-03-15 CN CN201811371605.6A patent/CN109321447B/zh active Active
- 2013-03-15 ES ES17182180T patent/ES2805025T3/es active Active
- 2013-03-15 EP EP20157243.5A patent/EP3674708B1/en active Active
- 2013-03-15 US US14/391,340 patent/US9874555B2/en active Active
- 2013-03-15 BR BR112014025527-0A patent/BR112014025527B1/pt active IP Right Grant
- 2013-03-15 WO PCT/US2013/032499 patent/WO2013165615A2/en active Application Filing
- 2013-03-15 ES ES20157243T patent/ES2922318T3/es active Active
- 2013-03-15 CA CA2869732A patent/CA2869732C/en active Active
- 2013-03-15 AU AU2013257163A patent/AU2013257163B2/en active Active
- 2013-03-15 EP EP17182180.4A patent/EP3254762B1/en active Active
- 2013-03-15 CA CA2995232A patent/CA2995232C/en active Active
- 2013-03-15 JP JP2015505770A patent/JP6226956B2/ja active Active
- 2013-03-15 EP EP13753216.4A patent/EP2836835B1/en active Active
- 2013-03-15 ES ES13753216.4T patent/ES2641337T3/es active Active
-
2017
- 2017-03-20 AU AU2017201877A patent/AU2017201877B2/en active Active
- 2017-10-10 JP JP2017196609A patent/JP6470375B2/ja active Active
- 2017-11-27 US US15/822,879 patent/US10962533B2/en active Active
-
2019
- 2019-01-16 JP JP2019005099A patent/JP6814231B2/ja active Active
- 2019-09-30 AU AU2019240567A patent/AU2019240567B2/en active Active
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2019240567B2 (en) | Methods, systems, and devices for detecting and identifying microorganisms in microbiological culture samples | |
| Boardman et al. | Rapid detection of bacteria from blood with surface-enhanced Raman spectroscopy | |
| Schreier et al. | Leptospirosis: current situation and trends of specific laboratory tests | |
| Liandris et al. | Detection of pathogenic mycobacteria based on functionalized quantum dots coupled with immunomagnetic separation | |
| JP2012507712A (ja) | 分光法を使用した微生物の分離、キャラクタリゼーションおよび/または同定方法 | |
| JP2012507710A (ja) | 同定作用物質を使用した微生物の分離、キャラクタリゼーションおよび/または同定方法 | |
| van Elsland et al. | Ultrastructural Imaging of Salmonella–Host Interactions Using Super‐resolution Correlative Light‐Electron Microscopy of Bioorthogonal Pathogens | |
| JP6182574B2 (ja) | 分光法を使用した微生物の分離、キャラクタリゼーションおよび/または同定方法 | |
| Schwaminger et al. | Detection of targeted bacteria species on filtration membranes | |
| Kennedy | Development of rapid molecular methods for the detection of food-borne pathogens based on immunostaining and physiological profiling using FACS technology | |
| Schweizer et al. | Antibacterial Neutrophil Effector Response: Ex Vivo Quantification of Regulated Cell Death Associated with Extracellular Trap Release | |
| WO2021130242A1 (en) | Identification of microbial contaminations or infections in liquid samples by raman spectroscopy | |
| Liandris et al. | Detection of Pathogenic Mycobacteria Based on Functionalized Quantum Dots | |
| Gazouli et al. | Detection of Pathogenic Mycobacteria Based on Functionalized Quantum Dots Coupled with Immunomagnetic Separation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 15/03/2013, OBSERVADAS AS CONDICOES LEGAIS. |