BR112014014868B1 - Composições de hormônio estimulante da tiroide, métodos de produção do mesmo e uso de tais composições - Google Patents
Composições de hormônio estimulante da tiroide, métodos de produção do mesmo e uso de tais composições Download PDFInfo
- Publication number
- BR112014014868B1 BR112014014868B1 BR112014014868-6A BR112014014868A BR112014014868B1 BR 112014014868 B1 BR112014014868 B1 BR 112014014868B1 BR 112014014868 A BR112014014868 A BR 112014014868A BR 112014014868 B1 BR112014014868 B1 BR 112014014868B1
- Authority
- BR
- Brazil
- Prior art keywords
- rhtsh
- tsh
- subunit
- peg
- amino acid
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/24—Follicle-stimulating hormone [FSH]; Chorionic gonadotropins, e.g. HCG; Luteinising hormone [LH]; Thyroid-stimulating hormone [TSH]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Endocrinology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Immunology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Reproductive Health (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Inorganic Chemistry (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
COMPOSIÇÕES DE HORMÔNIO ESTIMULANTE DA TIROIDE, MÉTODOS DE PRODUÇÃO DO MESMO E USO DE TAIS COMPOSIÇÕES. A presente invenção refere-se composições de Hormônio Estimulante da Tiroide (TSH), no qual pelo menos um polímero de polialquileno glicol é fixado a um local de carboidrato do TSH. Também são descritas composições de Hormônio Estimulante da Tiroide (TSH) mutado, e pelo menos um polímero de polialquileno glicol, no qual o TSH mutado compreende um TSH em que um ou mais resíduos de aminoácido foi substituído com resíduo de cisteína, e o polímero de polialquileno glicol é fixado ao TSH mutado no local do resíduo de cisteína substituído. Composições farmacêuticas compreendendo estas composições de TSH e método de tratamento de uma condição de tiroide em um paciente em necessidade do mesmo, por administração ao paciente de uma quantidade eficaz das composições farmacêuticas, são também descritos.
Description
[001] O câncer de tiroide é uma coleção de doenças em que existe crescimento descontrolado de células derivadas da tiroide. O câncer de tiroide comumente foi classificado como câncer de tiroide diferenciado, incluindo câncer de célula papilar, folicular e de Hurthle, e outros cânceres de tiroide, incluindo câncer medular e anaplástico. Com o tempo, alguns cânceres de tiroide diferenciados tornaram-se menos bem diferenciados, e podem ser classificados como câncer de- diferenciado ou câncer pobremente diferenciado. A administração de Hormônio Estimulante da Tiroide (TSH) a pacientes pode desempenhar um papel na abordagem diagnóstica ou terapêutica para várias doenças da tiroide, incluindo câncer de bócio e câncer de tiroide. Para estas doenças, o perfil farmacocinético do TSH administrado pode ser importante para o ótimo sucesso dos procedimentos diagnósticos ou terapêuticos.
[002] O TSH humano recombinante (rhTSH), comercializado como Hormônio Estimulante da Tiroide THYROGEN® (Genzyme Corp., NDA 2-898), é dosado em injeções múltiplas em dias consecutivos, seguido por dosagem de RAI e retirada de sangue para diagnósticos de tumor no dia 3 e 5. Este regime de dosagem estrito foi necessitado pela duração relativamente curta de ação de TSH, que também resulta em eficácia reduzida e efeitos colaterais. Uma composição de TSH com duração prolongada de ação provavelmente aperfeiçoará o tratamento e detecção de várias doenças de tiroide, e reduzirá os efeitos colaterais.
[003] Desse modo, existe uma necessidade de composições aperfeiçoadas contendo TSH que otimizam as farmacocinéticas de liberação de TSH e reduzem a necessidade de injeções múltiplas.
[004] A presente invenção refere-se à composições de Hormônio Estimulante da Tiroide (TSH) conjugado com um (um ou mais) polímero de polialquileno glicol, tal como polietileno glicol (PEG), que prolonga a duração da ação do TSH in vivo. Adicionalmente, a invenção se relaciona a composições de TSH mutante, no qual o TSH foi mutado para introduzir sítios adicionais que podem ser conjugados com um polímero de polialquileno glicol. As composições de TSH da presente invenção aqui descritas são úteis como preparação de composições farmacêuticas, e podem ser usadas para o tratamento de pacientes em necessidade do mesmo com condições de tiroide.
[005] De acordo com uma concretização, a invenção pertence a composições compreendendo TSH, no qual pelo menos um polímero de polialquileno glicol é fixado a um sítio de carboidrato do TSH. Em certos aspectos, o TSH das composições é isolado de um mamífero, por exemplo, um ser humano, ou o TSH é TSH de mamífero recombinante, por exemplo, TSH humano recombinante (rhTSH).
[006] Em certas concretizações, o sítio de carboidrato do TSH é um ácido siálico em um aminoácido, por exemplo, resíduos de asparagina ASN52 da subunidade α de rhTSH, ASN78 da subunidade α de rhTSH, ou ASN23 da subunidade β do rhTSH, e combinações destes.
[007] Em ainda outras concretizações, o sítio de carboidrato no TSH é galactose em um aminoácido, por exemplo, asparagina. Em concretizações particulares, o grupo da galactose está localizado em um sítio no TSH, por exemplo, aminoácido ASN52 da subunidade α do rhTSH, o aminoácido ASN78 da subunidade α do rhTSH, ou o aminoácido ASN23 da subunidade β do rhTSH, e combinações destes.
[008] Em aspectos relacionados da invenção, as composições da invenção exibem uma resposta T4 intensificada comparada a um controle.
[009] Em outros aspectos relacionados da invenção, o polímero de polialquileno glicol fixado ao sítio de carboidrato de TSH é polietileno glicol (PEG). Em concretizações particulares, o PEG tem um peso molecular médio de entre cerca de 3.000 e cerca de 100.000 Daltons. Em outras concretizações, uma ou mais do que uma(s) molécula(s) de PEG linear(es) ou ramificada(s) é/são fixada(s) ao TSH.
[0010] Em ainda outra concretização relacionada da invenção, uma composição compreendendo um Hormônio Estimulante da Tiroide (TSH) mutado, e pelo menos um polímero de polialquileno glicol, no qual o TSH mutado compreende um TSH em que um ou mais resíduos de aminoácido foram substituídos com um resíduo de cisteína, no qual o polímero de polialquileno glicol é fixado ao TSH mutado nos resíduos de cisteína, e o TSH mutado é biologicamente ativo, é descrita.
[0011] Em certas concretizações, o resíduo de aminoácido que foi substituído com cisteína está localizado na subunidade alfa de TSH. Em uma concretização particular, o resíduo de aminoácido que foi substituído com cisteína está localizado em uma posição de aminoácido de TSH humano recombinante selecionado a partir do grupo consistindo em ASN52, ASN78, MET71, ASN66, THR69, e GLY22, e combinações destes.
[0012] Em ainda outras concretizações, o resíduo de aminoácido que foi substituído com cisteína está localizado na subunidade beta de TSH. Em uma concretização particular, o resíduo de aminoácido que foi substituído com cisteína está localizado em uma posição de aminoácido de TSH humano recombinante selecionado a partir do grupo consistindo em ASN23, VAL118, THR21, GLU63, e ASP56, e combinações destes. Em certos aspectos, o TSH mutado com a modificação de cisteína foi fixado ao polietileno glicol (PEG) como o polímero de polialquileno glicol.Em concretizações particulares, o PEG tem um peso molecular médio de entre cerca de 3.000 e cerca de 100.000 Daltons. Em outras concretizações, uma ou mais do que uma linear ou ramificada ou combinações de moléculas de PEG é/são fixada(s) ao TSH.
[0013] De acordo com outras concretizações da invenção, composições farmacêuticas compreendendo uma quantidade terapêutica eficaz de uma composição da invenção junto com um veículo farmaceuticamente aceitável, são descritas.
[0014] Estas composições farmacêuticas são usadas nos métodos de tratamento de uma condição de tiroide em um paciente em necessidade do mesmo, por administração ao paciente de uma quantidade eficaz das composições farmacêuticas da invenção. Em concretizações particulares, a condição de tiroide é câncer de tiroide. Em outras concretizações, a composição é distribuída por injeção intramuscular.
[0015] A invenção também se relaciona a métodos de produção de um Hormônio Estimulante da Tiroide (TSH), biologicamente ativo, PEGuilado, compreendendo fixar pelo menos um polímero de polialquileno glicol a um sítio de carboidrato de um TSH.
[0016] Em outro aspecto relacionado, a invenção pertence a um método de produção de um Hormônio Estimulante da Tiroide, mutado, biologicamente ativo, PEGuilado, (TSH) compreendendo (a) introduzir um ou mais resíduos de cisteína adicionais na sequência de aminoácido de TSH, produzindo, desse modo, um TSH mutado; (b) fixar um ou mais polímeros de polialquileno glicol ao um ou mais resíduos de cisteína introduzidos na etapa (a), produzindo, desse modo, um TSH mutado, biologicamente ativo, PEGuilado. Em concretizações particulares, o resíduo de cisteína substitui um resíduo de aminoácido endógeno no TSH.
[0017] A invenção também se relaciona a métodos de tratamento de uma condição de tiroide em um indivíduo em necessidade do mesmo, compreendendo administrar uma quantidade eficaz de um Hormônio Estimulante da Tiroide (TSH), biologicamente ativo, PEGuilado.
[0018] Os precedentes serão aparentes da seguinte descrição mais particular de concretizações exemplos da invenção, conforme ilustradas nos desenhos acompanhantes em que caracteres de referência similares às mesmas partes através de todas as vistas diferentes. Os desenhos não estão necessariamente em escala, ênfase, ao invés, sendo colocada após concretizações ilustradas da presente invenção.
[0019] As FIG. 1A - FIG. 1B são esquemas (FIG. 1 A) e esquemas tridimensionais (FIG. 1B) mostrando a modelagem estrutural das subunidades de TSH com alvos de PEGuilação em N-terminais, resíduos de aminoácido de lisina, e sítios de carboidrato naturais.
[0020] As FIG. 2A- FIG. 2D são reações de PEGuilação de Lisina e N-terminal. A análise de SDS-PAGE de mistura de reação de PEGuilação de PEGuilação de Lisina com razão diferente de PEG:proteína é mostrada na FIG. 2A (azul de Coomassie), e a FIG. 2B (coloração de PEG). A mistura de reação com razão 1:1 de PEG:proteína é realçada com caixas, que foi adicionalmente analisada em uma SEC-HPLC (FIG. 2C). A FIG. 2D é um perfil de SEC-HPLC de uma reação de PEGuilação N-terminal na razão de 2:1 de PEG:proteína.
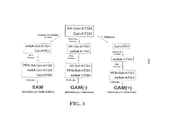
[0021] A FIG. 3 é um esquema mostrando três trajetórias de PEGuilação de carboidrato diferentes.
[0022] A FIG. 4 é um modelo estrutural mostrando as posições de beta-carbono dos mutantes selecionados.
[0023] A FIG. 5 é um SDS-PAGE de não redução corado com prata para avaliar o nível de expressão e oligomerização dos mutantes.
[0024] A FIG. 6 é um gel mostrando a PEGuilação de três mutantes direcionados de sítio de cisteína.
[0025] A FIG. 7 é uma série de cromatogramas dos perfis de SEC- HPLC de várias reações de PEGuilação de TSH mutante.
[0026] As FIG. 8A - FIG. 8B são a otimização das condições de PEGuilação de αG22C TSH.
[0027] As FIG. 9A - FIG. 9B são confirmação de conjugação de subunidade e sítio específica para G22C TSH.
[0028] As FIG. 10A- FIG. 10D são análises de SDS-PAGE de misturas de reação de PEGuilação de carboidrato e conjugados de rhTSH PEGuilados de carboidrato purificados. Misturas de reação GAM(+) e GAM(-) com razões molares variadas (PEGProteína) são mostradas na FIG. 10A e FIG. 10B, respectivamente. Os conjugados de rhTSH PEGuilado de carboidrato purificado são mostrados na FIG. 10C (coloração de PEG) e FIG. 10D (azul de Coomassie).
[0029] As FIG. 11A-FIG. 11B são perfis de SEC-HPLC da mistura de reação 40kD de SAM (FIG. 11 A) e conjugados de rhTSH PEGuilado de carboidrato purificado (FIG. 11B).
[0030] A FIG. 12 é um mapa de peptídeo tríptico de conjugado monoPEGuilado purificado 40kD de SAM, e o resultado do sequenciamento N-terminal dos fragmentos trípticos PEGuilados coletados, conforme explanado no Exemplo 10.
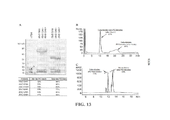
[0031] As FIG. 13A - FIG. 13C são determinações da quantidade relativa de PEGuilação em cada subunidade de conjugados de rhTSH PEGuilado de carboidrato purificado, conforme explanado no Exemplo 11.
[0032] As FIG. 14A-FIG. 14C são gráficos mostrando os resultados de ensaios de ligação de receptor de SAM PEGuilada, GAM(+), GAM(- ) com vários PEGs dimensionados.
[0033] A FIG. 15 é um gráfico de dados farmacodinâmicos de vários TSHs PEGuilados mostrando os efeitos nos níveis de T4 (μg/dL) com o tempo relativos ao controle de rhTSH, conforme explanado no Exemplo 13.
[0034] A FIG. 16 é um gráfico mostrando a concentração de vários TSHs PEGuilados no soro com o tempo, comparada com o controle, conforme explanado no Exemplo 13.
[0035] A FIG. 17 é um gráfico mostrando a concentração de vários TSHs PEGuilados em soro com o tempo, comparada com o controle, conforme explanado no Exemplo 14.
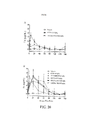
[0036] A FIG. 18A- FIG.18D são gráficos mostrando a concentração de T4 no soro para vários TSHs PEGuilados com o tempo, comparada com o controle, conforme explanado no Exemplo 16.
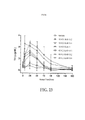
[0037] As FIG. 19A- FIG. 19C são gráficos mostrando a concentração de T4 no soro para doses diferentes de 40kD de SAM com o tempo, comparada com o controle, conforme explanado no Exemplo 17.
[0038] As FIG. 20A- FIG. 20B são gráficos mostrando a concentração de T4 no soro para vários TSHs PEGuilados com o tempo, comparada com o controle, conforme explanado no Exemplo 18.
[0039] As FIG. 21 A- FIG. 21F são gráficos mostrando a concentração de T4 no soro para vários TSHs PEGuilados com o tempo, comparada com o controle, conforme explanado no Exemplo 19.
[0040] A FIG. 22 é um gráfico mostrando a concentração de T4 no soro para vários TSHs PEGuilados com o tempo, comparada com o controle, conforme explanado no Exemplo 19.
[0041] A FIG. 23 é um gráfico mostrando a concentração de T4 no soro para 10kD de multiSAM e 40kD de SAM com o tempo, conforme explanado no Exemplo 20.
[0042] A FIG. 24 é um gráfico mostrando a concentração de T4 no soro para 40kD de SAM e 40kD de G22C com o tempo, comparada com o controle, conforme explanado no Exemplo 21.
[0043] THYROGEN®, Hormônio Estimulante da Tiroide (Genzyme Corp., NDA 2-898) é o TSH humano recombinante (rhTSH) atualmente comercializado para a diagnose e/ou tratamento de câncer de tiroide. Ele é vendido como um pó liofilizado para reconstituição com água antes da administração intramuscular.
[0044] Tais formulações existentes de TSH têm regimes de dosagem rígidos, requerem injeções múltiplas, têm perfis farmacocinéticos limitados, e produzem efeitos colaterais, tal como náusea. Estes problemas são proporcionados pelas composições de TSH e composições de TSH mutado da presente invenção. As composições de hormônio estimulante de tiroide de ação mais longa (TSH) que reduzem a frequência de injeção, proporcionam regimes de administração flexíveis, aperfeiçoam o índice terapêutico, e têm melhor eficácia para estimular o tecido da tiroide, são aqui descritas. Em adição, outros parâmetros de potência são positivamente afetados pelas composições de TSH de ação mais longa da invenção, incluindo meia vida prolongada de TSH, e duração aumentada de liberação de T4.
[0045] Conforme aqui mostrado, a conjugação de um polímero de polialquileno glicol, por exemplo, polietileno glicol a TSH, beneficamente altera o perfil farmacocinético e perfil farmacodinâmico do TSH. Conforme descrito em maiores detalhes abaixo, a PEGuilação N- terminal, a PEGuilação de lisina e a fixação de polímero de carboidrato de TSH, foram estudados. A expectativa era que a PEGuilação N- terminal de TSH resultaria em um TSH com duração de ação prolongada, enquanto a PEGuilação de lisina e a PEGuilação de carboidrato de TSH resultariam em uma diminuição severa na potência de TSH. Os resultados do estudo aqui descritos mostram que a PEGuilação de carboidrato de TSH tem um efeito positivo na potência de TSH, e ambas a PEGuilação N-terminal e a PEGuilação de lisina de TSH reduzem grandemente a potência de TSH.
[0046] Consequentemente, em um aspecto, a invenção é direcionada a uma composição compreendendo Hormônio Estimulante da Tiroide (TSH), no qual pelo menos um polímero de polialquileno glicol é fixado a um sítio de carboidrato do TSH. Também aqui mostrado é a PEGuilação sítio específica do TSH que foi mutado para introduzir resíduos de cisteína direcionada para PEGuilação, que resulta em um efeito positivo na potência do TSH. Desse modo, em outro aspecto, a invenção é direcionada a uma composição compreendendo um Hormônio Estimulante da Tiroide (TSH) mutado, e pelo menos um polímero de polialquileno glicol, no qual o TSH mutado compreende um TSH em que um ou mais resíduos de aminoácido foi substituído com um resíduo de cisteína, no qual o polímero de polialquileno glicol é fixado ao TSH mutado nos resíduos de cisteína, e o TSH mutado é biologicamente ativo. As Composições de TSH PEGuiladas aqui proporcionadas têm um ou mais dos seguintes efeitos de índice terapêutico relativos ao TSH que não é conjugado a um polímero de polietileno glicol: solubilidade intensificada, proteólise diminuída, imunogenicidade diminuída, taxa reduzida de desobstrução do rim, tempo de vida de circulação de sangue prolongado, duração aumentada de ação, e distribuição e absorção alteradas.
[0047] O TSH é uma glicoproteína tendo duas subunidades, a subunidade alfa e a subunidade beta. A subunidade α (alfa) (isto é, alfa gonadotrofina coriônica) é idêntica àquela da gonadotrofina coriônica humana, hormônio luteinizante, e hormônio estimulante de folículo (FSH). A subunidade β (beta) é única ao TSH, e determina sua função.
[0048] rhTSH se refere a TSH recombinantemente sintetizado. Os métodos de DNA recombinante aqui descritos são geralmente aqueles colocados em Sambrook et al, Molecular Cloning: A Laboratory Manual (Cold String Harbor Laboratory Press, 1989, and/or Current Protocols in Molecular Biology (Ausubel et al, eds., Green Publishers Inc., e Wiley and Sons 1994, with Supplements). O termo "recombinante" se refere a um polinucleotídeo sintetizado, ou, de outro modo, manipulado in vitro (por exemplo, "polinucleotídeo recombinante"), e a métodos de uso de polinucleotídeos recombinantes para produzir produtos de gene em células ou outros sistemas biológicos, e a um polipeptídeo ("proteína recombinante") codificado por um polinucleotídeo recombinante.
[0049] O TSH usado nos métodos e composições aqui descritos pode ser purificado de fontes de mamífero que ocorrem naturalmente, tais como bovinas, porcinas, primatas, ou humanas, ou alternativamente isoladas em uma forma recombinante de fontes que ocorrem não naturalmente usando métodos conhecidos na técnica, tal como descrito nas Patentes U.S. Nos. 5.840.566 e 6.365.127.
[0050] É conhecido que a conjugação de macromoléculas a polímeros, (por exemplo, polissacarídeos, polímeros de ácido siálico, hidroxietil amido e polialquileno glicóis (por exemplo, polipropileno glicol, polibutileno glicol, polietileno glicol), e outras porções similares), pode ser usada para alterar efetivamente a eficácia in vivo de fármacos por mudança do equilíbrio entre suas propriedades farmacodinâmicas e farmacocinéticas. Contudo, tal conjugação frequentemente conduz a perda de afinidade de ligação do fármaco e, com efeito, perda de potência. Em casos limitados, uma diminuição de potência é afastada por uma meia-vida de circulação mais longa dos fármacos modificados por polímero que tornam os perfis farmacocinéticos (PK) e farmacodinâmicos (PD) resultantes úteis para terapia.
[0051] Enquanto que a conjugação de polietileno glicol (PEG), referida como PEGuilação, a certas macromoléculas, retém mais atividade, os hormônios PEGuilados e citocinas, cuja atividade geralmente requer altas interações de afinidade com receptores de superfície de célula, mostram redução significante na atividade. Frequentemente, a PEGuilação a hormônios afeta adversamente o perfil PD e o perfil PK do hormônio.
[0052] O polietileno glicol (PEG) é um polímero inerte não antigênico que mostrou-se prolongar o comprimento de tempo que uma proteína circula no corpo. Tipicamente, estes reagentes de PEG comuns se fixam a aminas primárias e secundárias nas proteínas, geralmente em resíduos de lisina e/ou no aminoácido N-terminal. O PEG é comercialmente disponível em tamanhos diferentes e, uma vez fixado, pode ser proporcionado para indicações individuais pelo uso da variação de tamanhos e fixações múltiplas a uma molécula de fármaco única. O PEG mostrou-se aperfeiçoar a meia-vida do plasma da proteína PEGuilada injetada, mas, conforme citado acima, a potência pode ser perdida devido a impedimento estérico por PEG (Fishburn, C.S., J Pharm Sci 97:4167 (2008)). Para evitar problemas de potência e gerar perfis desejáveis de PD e PK, uma compreensão detalhada do relacionamento estrutura-função da proteína alvo a ser PEGuilada é proveitosa para geração de produtos PEGuilados que retêm atividade funcional máxima.
[0053] Recentemente, progresso foi feito na determinação das estruturas de membros da superfamília de hormônio de crescimento, que conduziu a terapêuticos potenciais. A compreensão de como estas proteínas interagem com seus alvos acoplados com a informação estrutural gerou fármacos efetivos pelo uso de informação estrutural para delinear conjugados de polímero para maximização dos benefícios terapêuticos da proteína em seu respectivo alvo. Infelizmente, a informação estrutural para a estrutura complexa de TSH com seu receptor não é disponível; contudo, a estrutura de cristal de um hormônio estimulante de folículo de proteína relacionado (FSH) complexado ao receptor de FSH (FSHR) tem sido tencionada (Fan and Hendrickson, Nature 433:269 (2004)). O TSH tem alta homologia com FSH, compartilhando a subunidade alfa idêntica e a subunidade beta similar. Do mesmo modo, o receptor de TSH e o receptor de FSH são altamente homólogos. Desse modo, o complexo de receptor de FSH- FSH pode servir como um modelo inicial para interação de TSH com seu receptor.
[0054] Conforme aqui mostrado, quando a sequência de TSH foi superimposta no modelo estrutural 3D do complexo de FSH-FSHR (PDB coordenada 1XWD), os N-terminais parecem estar mais distantes da região de interação do receptor, e, desse modo, são provavelmente sítios ideais para fixação de PEG para minimizar a perda de ligação de receptor após PEGuilação (Vide FIG.1 B). Desde que existem muitas lisinas em TSH, e algumas delas estejam próximas ao sítio de ligação de receptor, a fixação do PEG em lisinas seria esperada interferir com a ligação do receptor.
[0055] O TSH é uma proteína glicosilada. As cadeias de carboidrato constituem 15-25% de seu peso, e incluem três cadeias de carboidrato ligadas a asparagina. Duas destas cadeias são encontradas na subunidade alfa de TSH, ligadas a asparagina 52 (ASN 52) e asparagina 78 (ASN 78), respectivamente, e a terceira está na subunidade beta de TSH, ligada a asparagina 23 (ASN 23). As cadeias de carboidrato ligadas a asparagina são sítios potenciais de conjugação de PEG; contudo, na proteína de TSH, suas respectivas proximidades à região de interação de receptor, em particular, ASN 52, sugerem que a conjugação de PEG em tais sítios teria provavelmente um efeito negativo na ligação do receptor. Desse modo, a seleção de sítios potenciais para conjugação de polímeros a TSH apresentou muita incerteza.
[0056] Além disso, a deglicosilação de TSH tem sido há muito conhecida por resultar em perda de transdução de sinal eficiente sob ligação de receptor (Szkudlinski et al, Physiol Rev. 82:473 (2002)). Enquanto que a remoção dos ácidos siálicos terminais a partir de carboidratos de TSH aperfeiçoa a atividade in vitro, o tempo de circulação in vivo grandemente reduzido foi observado, presumivelmente devido a folga por receptor de sialoglicoproteína hepática. Thotakura, N.R., Szkudlinski, M.W. and Weintraub, B.D., Glycobiology 4, 525-533 (1994). A anulação do sítio individual de carboidratos também intensifica a atividade funcional in vitro, especialmente para a posição de aminoácido de cadeia alfa 52, novamente sugerindo que os carboidratos podem estar próximos o bastante ao receptor para repulsão eletrostática entre as cargas negativas dos ácidos siálicos as e cargas negativas no receptor. Juntando tudo, esta análise de função de estrutura de TSH indicou que PEGuilação N-terminal é, de longe, mais preferível do que a PEGuilação de carboidrato para minimizar o efeito na potência funcional. Conforme aqui descrito, a PEGuilação N-terminal, a PEGuilação de lisina, e a fixação de polímero de carboidrato, foram estudadas.
[0057] Consequentemente, a metodologia de polímero de carboidrato para produzir TSH conjugado com polímero é um aspecto da presente invenção. Em uma concretização, o polímero é polialquileno glicol. Conforme aqui usado, o "polialquileno glicol (PAG)" inclui polietileno glicol (PEG), polipropileno glicol (PPG), polibutileno glicol, e similares. Os polímeros podem ser lineares ou ramificados. O PAG é fixado covalentemente a uma molécula. Conforme usado no presente contexto, o termo "fixação" ou "fixado" se refere ao acoplamento ou conjugação de um sítio ou porção da proteína de TSH e um polímero, tal como um polialquileno glicol, por exemplo, ou diretamente covalentemente unidos entre si, ou ainda são indiretamente covalentemente unidos entre si através de uma porção ou porções de intervenção, tal como uma ponte, um espaçador, ou porção ou porções de articulação. Um polímero fixado ou conjugado ao TSH é diferenciado do polímero sendo misturado, combinado, ou em solução com o TSH.
[0058] O "sítio de carboidrato" se refere a uma cadeia lateral de carboidrato encontrada no TSH. O sítio pode ser um sítio naturalmente glicosilado, ou um sítio que foi enzimaticamente proporcionado. Em certas concretizações, o sítio de carboidrato é especificamente selecionado para encontrar os critérios desejados para interação de TSH ótima com o receptor, ou para outros requerimentos funcionais, tal como desenovelamento ou mobilidade da proteína. O sítio de carboidrato é disponível para fixação de uma porção de polímero, tal como PEG. Os sítios de carboidrato típicos na proteína são asparagina, serina ou treonina. O TSH tem três cadeias de carboidrato ligadas à asparagina.
[0059] Em certas concretizações, um polímero simples é fixado ao TSH. Em outras concretizações, polímeros múltiplos são fixados ao TSH. Os polímeros fixados múltiplos podem ser de uma espécie simples, ou uma espécie múltipla. Por exemplo, no caso onde uma molécula de PEG simples é fixada à proteína, a proteína é referida como "monoPEGuilada" e, no caso onde mais do que uma molécula de PEG é fixada à proteína, a proteína é referida como "multiPEGuilada". Quando a proteína é multiPEGuilada, um PEG individual fixado à proteína (em relação a outros PEGs fixados), pode ter o mesmo ou um peso molecular diferente, e pode ser de uma estrutura linear ou ramificada. A faixa de peso molecular da molécula de PEG é 3.000100.000 Daltons. Em certas concretizações, o peso molecular do PEG fixado é 5kD, 10kD, 20kD, 30kD, 40kD, ou 60kD, ou combinações destes.
[0060] São aqui proporcionados três esquemas alternativos para PEGuilação de carboidrato de TSH: (i) PEGuilação mediada por ácido siálico (referida como "SAM"), (ii) PEGuilação mediada por galactose (referida como "GAM(-)"), e (iii) remoção de ácido siálico acoplado com PEGuilação mediada por galactose (referida como "GAM(+)"). Brevemente, conforme mostrado na FIG. 3, na PEGuilação SAM mediada por ácido siálico, o ácido siálico é oxidado, seguido por fixação química de PEG. Na PEGuilação GAM(-), a porção de galactose é oxidada, seguida por fixação química de PEG. E em GAM(+), uma porção de ácido siálico é enzimaticamente removida, e o resíduo de galactose exposto é, em seguida, oxidado, seguido pela fixação química de PEG.
[0061] Os métodos de PEGuilação sítio especificas a TSH são também incluídos na presente invenção. Tal método fixa PEG aos resíduos de cisteína usando PEGs reativos com cisteína. Um número de PEGs reativos com cisteína altamente específicos com grupos reativos diferentes (por exemplo, maleimida, vinilsulfona), e PEGs de tamanho diferente (2-40 kDa), são comercialmente disponíveis. Em pH neutro, estes reagentes de PEG se fixam seletivamente aos resíduos de cisteína "livres", isto é, resíduos de cisteína não envolvidos em ligações dissulfeto na proteína alvo. Alternativamente, uma das duas cisteínas envolvidas em uma ligação de dissulfeto nativo pode ser anulada ou substituída com outro aminoácido, deixando uma cisteína nativa (o resíduo de cisteína na proteína que normalmente formaria uma ligação dissulfeto com o resíduo de cisteína anulado ou substituído), livre e disponível para modificação química. Preferivelmente, o aminoácido substituído por cisteína seria um aminoácido neutro, tal como serina ou alanina.
[0062] Através de mutagênese in vitro usando técnicas de DNA recombinante, resíduos de cisteína adicionais podem ser introduzidos em qualquer posição útil na proteína. As cisteínas "livres" recentemente adicionadas podem, em seguida, servirem como sítios para a fixação específica de uma molécula de PEG usando PEGs reativos por cisteína.O resíduo de cisteína adicionado é uma substituição para um aminoácido existente em uma proteína. Os resíduos de cisteína podem ser adicionados ao amino-terminal precedente da proteína, após o carbóxi-terminal da proteína, ou inseridos entre dois aminoácidos na proteína. O termo "TSH mutante", conforme aqui usado, se refere um TSH onde um ou mais aminoácidos do TSH tipo selvagem foi substituído com outro aminoácido que permite a formação de um ou mais sítios de glicosilação na molécula de TSH. Consequentemente, a substituição de aminoácido de TSH capacita o acoplamento sítio específico de pelo menos um polímero, tal como um polialquileno glicol. Por exemplo, o acoplamento sítio específico com moléculas de PEG ao TSH mutante, permite a geração de um TSH que possui os benefícios farmacodinâmicos e farmacocinéticos de um TDH de polietileno- glicosilado.
[0063] Em concretizações particulares, a substituição de aminoácido com cisteína pode ser nas posições mostradas para os mutantes nas Tabelas 1 e 2.
[0064] Em uma concretização preferida, a substituição não muda substancialmente a característica estrutural de TSH nativo. Em certas concretizações, o resíduo de aminoácido que foi substituído com cisteína está localizado na subunidade alfa de TSH, ou na subunidade beta. Em concretizações particulares, o resíduo de aminoácido que foi substituído com cisteína está localizado em uma posição de aminoácido na subunidade alfa de TSH humano recombinante selecionado a partir do grupo consistindo em ASN52, ASN78, MET71, ASN66, THR69, e GLY22, e combinações destes, ou está localizado em uma posição de aminoácido na subunidade beta de TSH humano recombinante selecionada a partir do grupo consistindo em ASN23, VAL118, THR21, GLU63, e ASP56, e combinações destes.
[0065] As composições de TSH aqui descritas são biologicamente ativas. "Biologicamente ativas" significa que as composições de TSH da invenção têm um ou mais dos seguintes efeitos: duração mais longa de ação, meia-vida prolongada, duração aumentada de liberação de T4, AUEC mais alta, alteração positiva em Tmáx, e uma exposição através do pico mais alta, que podem reduzir os efeitos colaterais. Em certas concretizações, as composições são comparadas a um controle, e o efeito é substancialmente similar, um tanto menor ou um tanto maior, ou substancialmente maior. A atividade biológica de composições de TSH produzidas de acordo com a presente invenção, pode ser avaliada usando uma variedade de técnicas conhecidas àqueles versados na técnica.
[0066] Quando se avalia a atividade biológica de uma composição de TSH da presente invenção, a atividade biológica pode ser comparada a um controle. Conforme apreciado por um técnico no assunto, uma variedade de controles adequados pode ser usada. Em uma concretização, o "controle", conforme aqui usado, se refere a TSH nativo (tipo selvagem), ou rhTSH.
[0067] As composições desta invenção, quando administradas a um paciente em necessidade destas (por exemplo, um paciente com câncer de tiroide que apresenta tiroidectomia próxima do total ou total), proporcionará uma concentração de soro de sangue de TSH que foi provida para o uso indicado. Em uma certa concretização, a duração de ação para as composições aqui descritas é aumentada por pelo menos 2 vezes sobre rhTSH. Em outra concretização, a duração de ação para as composições de TSH é aumentada por pelo menos 3 vezes sobre rhTSH. Tais concretizações tendo duração aumentada de ação efetivamente reduz a frequência de administração, enquanto que mantém eficácia comparável à formulação atual de rhTSH.
[0068] Em uma concretização, as composições proporcionam meia- vida mais longa (t1/2), comparada a rhTSH. Em concretizações particulares, a t1/2 é até 23 vezes mais longa do que rhTSH em rato.
[0069] Em outra concretização, o nível de T4 é mostrado ter um efeito colorido maior sobre rhTSH. No rato, o nível de T4 no grupo de rhTSH foi voltado para o nível de veículo por 48 horas pós-dose, onde, em uma concretização, T4 foi sustentado por 168 horas pós-dose.
[0070] Uma "Tmáx efetiva", conforme aqui usado, se refere a um "Tempo da Concentração de Altura de Pico", que é característico da composição em referência. Uma "Cmáx efetiva", conforme aqui usado, se refere a uma "Concentração de Altura de Pico", que é característica da composição em referência. Em muitas situações, uma Tmáx e Cmáx efetiva proporciona uma curva de tempo de concentração de sangue (ou soro ou plasma) em que a concentração de um fármaco está em uma faixa terapêutica. "t1/2" se refere a duração de ação de um fármaco que é conhecida, e ao período de tempo requerido para a concentração ou quantidade de fármaco no corpo a ser reduzida pela metade.
[0071] A sequência de ácido nucleico da subunidade alfa de TSH humano é: gctcctgatgtgcaggattgcccagaatgcacgctacaggaaaacccattcttctcccagccggg tgccccaatacttcagtgcatgggctgctgcttctctagagcatatcccactccactaaggtccaag aagacgatgttggtccaaaagaacgtcacctcagagtccacttgctgtgtagctaaatcatataac agggtcacagtaatggggggtttcaaagtggagaaccacacggcgtgccactgcagtacttgtta ttatcacaaatct (SEQ. ID NO:1)
[0072] A sequência de aminoácido da subunidade alfa de TSH humano é: APDVQDCPECTLQENPFFSQPGAPILQCMGCCFSRAYPTPLRSKKT MLVQKNVTSESTCCVAKSYNRVTVMGGFKVENHTACHCSTCYYHKS (SEQ ID NO: 2)
[0073] A sequência de ácido nucleico da subunidade beta de TSH humano é: ttttgtattccaactgagtatacaatgcacatcgaaaggagagagtgtgcttattgcctaaccatcaa caccaccatctgtgctggatattgtatgacacgggatatcaatggcaaactgtttcttcccaaatatg ctctgtcccaggatgtttgcacatatagagacttcatctacaggactgtagaaataccaggatgccc actccatgttgctccctatttttcctatcctgttgctttaagctgtaagtgtggcaagtgcaatactgacta tagtgactgcatacatgaagccatcaagacaaactactgtaccaaacctcagaagtcttatctggt aggattttctgtc (SEQ ID NO: 3)
[0074] A sequência de aminoácido da subunidade beta de TSH humano é: FCIPTEYTMHIERRECAYCLTINTTICAGYCMTRDINGKLFLPKYALSQ DVCTYRDFIYRTVEIPGCPLHVAPYFSYPVALSCKCGKCNTDYSDCIH EAIKTNYCTK PQKSYLVGFSV (SEQ ID NO: 4)
[0075] Conforme aqui usado, o termo "resíduos de aminoácido correspondentes a resíduos de aminoácido das subunidades de TSH é pretendido indicar os resíduos de aminoácido correspondentes à sequência de subunidades de TSH tipo selvagem (SEQ ID NOs: 2 e 4) quando as sequências estão alinhadas. A identidade/homologia de sequência de aminoácido é convenientemente determinada de sequências alinhadas, usando um programa de computador adequado para alinhamento de sequência, tal como, por exemplo, o programa ClustalW, versão 1.8, 1999 (Thompson et al., 1994, Nucleic Acid Research, 22: 4673-4680).
[0076] Oxidação de periodato de sódio: 25 mM de periodato de sódio (Sigma, 311448) em 100 mM de acetato de sódio, pH 5,6, foi adicionado a 4,5 mg/mL de TSH em 100 mM de acetato de sódio, pH 5,6, a concentrações finais variando de 0,2 mM a 2mM, em um frasco de vidro envolvido em folha de alumínio. A mistura foi brandamente sacudida em gelo no escuro por 30 minutos. Após 30 minutos, 50% de glicerol foi adicionado a 3% do volume de reação e, em seguida, sacudido por 15 minutos. A mistura foi, em seguida, trocada com tampão a 100 mM de acetato de sódio, pH 5,6, e concentrada a uma concentração de TSH de pelo menos 4,3 mg/mL, de modo a realizar a PEGuilação.
[0077] PEGuilação: O PEG aminoxi de tamanho apropriado (100 mg/mL em dH20) foi adicionado ao TSH oxidado a razões molares variantes (PEGProteína). O volume de reação foi ajustado com 100 mM de acetato de sódio, pH 5,6, a uma concentração final de TSH de 4 mg/mL. A mistura foi, em seguida, incubada a 25°C por 16 horas, ou a 8°C por 16 horas com sacudimento brando. Após incubação, um excesso de 50 molar de 0,05M de hidroxilamina foi adicionado para extinção da mistura de reação, e incubado a 25°C por 6 horas com sacudimento brando.
[0078] Tratamento de Neuraminidase: 20 mil de neuraminidase (His6-Clostridium neuramindase (520 mU/μL)) foi adicionado por mg de TSH e incubada a 37°C por 6 horas.
[0079] Tratamento de Catalase/Galactose Oxidase: 2 U de Catalase (Sigma 442 U/μL) por mg de TSH foi adicionado ao TSH tratado com neuraminidase. 4 μg de galactose oxidase (Worthington GAO, 1,2 mg/mL) por mg de TSH foi adicionado à mistura e, em seguida, incubada a 37°C por 16 horas. Após incubação, a mistura foi trocada com tampão, e concentrada em 100 mM de acetato de sódio, pH 5,6, a uma concentração de pelo menos 5,5 mg/mL, de modo a realizar a PEGuilação.
[0080] PEGuilação: O aminoxi PEG de tamanho apropriado (100 mg/mL em dH20) foi adicionado ao TSH oxidado e trocado com tampão a razão molar (PEGProteína) de 1:1. O volume de reação foi ajustado com 100 mM de acetato de sódio, pH 5,6, de modo que a concentração final de TSH na reação foi 5 mg/mL. A mistura foi, em seguida, incubada a 25°C por 16 horas com sacudimento brando. Um excesso molar de 50 de 0,05M de hidroxilamina (m.p. 69,49) foi, em seguida, adicionado à mistura de reação, e incubado a 25°C por 6 horas com sacudimento brando.
[0081] Tratamento de Catalase/Galactose Oxidase: 2 U de Catalase (Sigma 442 U/μL) por mg e 4 μg de galactose oxidase (Worthington GAO, 1,2 mg/mL) por mg, foram adicionados ao TSH. A mistura foi, em seguida, incubada a 37°C por 16 horas. Após incubação, a mistura foi trocada com tampão e concentrada em 100 mM de acetato de sódio, pH 5,6, a uma concentração final de pelo menos 5,5 mg/mL, de modo a realizar a PEGuilação.
[0082] PEGuilação: O aminoxi PEG de tamanho apropriado (100 mg/mL em dH20) foi adicionado ao TSH oxidado e trocada com tampão a razão molar (PEGProteína) de 1:2. O volume de reação foi ajustado com 100 mM de acetato de sódio, pH 5,6, de modo que a concentração final de TSH na reação foi 5 mg/mL. A mistura foi, em seguida, incubada a 25°C por 16 horas com sacudimento brando. Um excesso molar de 50 de 0,05M de hidroxilamina (m.p. 69,49) foi, em seguida, adicionado à mistura de reação, e incubado a 25°C por 6 horas com sacudimento brando.
[0083] PEG de aldeído de tamanho apropriado (100 mg/mL em tampão de reação) foi adicionado a uma concentração final de 5 mg/mL de rhTSH em razões variantes (PEGProteína) em 100 mM de acetato de sódio, pH 5 ou pH 5,6, com 20 mM de cianoborohidreto de sódio. Incubação foi feita a 25°C por 16 horas ou 8°C por até 2 dias, antes da extinção da reação com 0,1 volume de 1M Tris, pH 7,5, por 3 horas a 25°C.
[0084] PEGuilação no N-terminal produziu conjugados que perdem grande afinidade de ligação de receptor de TSH do que conjugação de carboidrato. Mono-PEGuilação N-terminal com 40kD de PEG resultou em uma diminuição 11,1 vezes de afinidade de ligação de receptor de TSH in vitro, comparada ao controle de rhTSH.
[0085] PEG de NHS de tamanho apropriado (N-hidroxisuccinimida) (50mg/mL em dH20) foi adicionado a uma concentração final de 0,8 mg/mL de rhTSH em razões variantes (PEGuilação) (por exemplo, (0,5:1), (1;1), (2:1), (4:1), (8:1)) em tampão de PBS (salina tamponada com fosfato), pH 7,2. A incubação foi feita a 25°C por 1,5 horas.
[0086] A conjugação de lisina com PEG de N-hidroxisuccinimida éster (NHS) foi explorada. Para PEGs de 40 kDa, razões diferentes (PEG:proteína) e tempos de incubação diferentes, foram testados no tampão de PBS (salina tamponada com fosfato), pH 7,2. A concentração final de TSH foi 0,8 mg por ml. A PEGuilação foi feita a 25°C ou 37°C por 1,5 horas ou 19,5 horas. O tempo curto de incubação testado (1,5 horas) mostrou os mesmos resultados, considerando-se o tempo de incubação (19,5 horas). Isto foi presumivelmente devido a uma hidrólise rápida de PEG de NHS em solução aquosa. A extensão de PEGuilação depende das razões molares (PEGProteína), com excesso molar de PEG mais alto que produz mais conjugados multi-PEGuilados.
[0087] As frações de cromatografia de exclusão de tamanho (SEC) de espécies mono-PEGuiladas foram coletadas e submetidas a ensaio de ligação de receptor de TSH in vitro. Os resultados do ensaio de ligação de receptor de TSH in vitro mostraram que o mono-40kDa NHS PEG-TSH (PEGuilação de lisina) tem uma afinidade 31,2 vezes mais baixa do que o TSH de controle, material de partida, enquanto que mono-40kDa aminoxi PEG-TSH (SAM PEGuilação) tem afinidade 5,3 vezes mais baixa.
[0088] Os mutantes simples de TSH foram designados e preparados para introduzir cisteínas para PEGuilação sítio específica. Estes mutantes foram designados para minimizar seu efeito no desdobramento da proteína, ligação de receptor, e para seus potenciais serem efetivamente conjugados.
[0089] As seguintes considerações foram aplicadas a sítios de projeto para introduzir mutantes de cisteína baseados em um modelo estrutural de receptor de TSH/TSH: 1) O sítio de mutação não deve ser localizado em ou adjacente a um sítio de ligação de receptor; 2) O sítio de mutação não deve ser localizado em ou adjacente a uma interface de dimerização de subunidade alfa/beta; 3) O sítio de mutação não deve ser localizado em ou adjacente a uma ligação dissulfeto; 4) Evitar sítios que quando mutados, resulta em perda dramática na atividade específica baseada na literatura reportada; 5) O sítio de mutação deve ser solvente exposto para subsequente PEGuilação; 6) Selecionar sítios que cobririam uniformemente muita da superfície de TSH oposta do sítio de ligação do receptor para avaliar completamente a viabilidade de PEGuilação em cada região. Algumas destas considerações são resumidas na Tabela 1. As posições de beta-carbono dos mutantes selecionados foram expostas a solvente em nosso modelo de estrutura, conforme mostrado na FIG. 4. Isto prevê que estas posições são prováveis de serem acessíveis a reagentes de PEGuilação quando mutados para cisteína. Os primeiros três sítios selecionados na Tabela 1 foram sítios de glicosilação nativos em TSH.Tabela 1
[0090] Os DNAs que codificam genes de rhTSH (incluindo seus peptídeos de sinal) foram sintetizados e clonados em um vetor de entrada de Gateway (por exemplo, pDONOR221). A mutagênese sítio - direcionada à base de oligonucleotídeo foi usada para introduzir mutações Cys em sítios múltiplos em ambas subunidades de TSH. Os vetores tipo selvagem e mutantes resultantes foram embaralhados em vetores de expressão (por exemplo, pCEP4.DEST), via clonagem de Gateway. As proteínas foram preparadas de meio de célula HEK293 transientemente transfectada e caracterizada por ensaios à base de célula e bioquímica, por exemplo, eletroforese de gel, coloração de Western, cromatografia de SEC-HPLC, rendimento de modificação de PEG, e ensaios de repórter de célula.
[0091] Os resultados foram avaliados e comparados ao seu nível de expressão, tendência de agregação (dimerização), eficácia de PEGuilação, e perturbação para função de TSH. Por exemplo, análise de coloração de prata de TSH mutante purificado revelou que TSH mutantes N66C(alfa), TSH G22C(alfa), TSH M71C(alfa), TSH T69C(alfa), e TSH V118C (beta) têm os melhores níveis de expressão (Vide FIG. 5). Experimentos de PEGuilação sugerem que TSH G22C(alfa), TSH N66C(alfa), TSH T69C(alfa), e TSH V118C (beta) foram efetivamente PEGuilados (Vide FIG. 6 para resultados representativos de PEGuilação). M71C(alfa) pareceu formar agregados na incubação de PEGuilação. (Dados não mostrados). A decisão foi feita para mover mutantes selecionados (por exemplo, G22C) para frente da produção de grande escala e estudos in vivo (Vide Tabela 2). Tabela 2
[0092] Mutantes Cys de escala maior foram preparados de reuniões de CHO. Os DNAs que codificam o gene rhTSH tipo selvagem (WT) e mutante foram otimizados por códon e sintetizados. Estes genes foram clonados em vetores de expressão de CHO (por exemplo, pGEN600, pGEN620) para transfecção transiente em células de CHO. As células de CHO transfectadas foram amplificadas com seleção de metotrexato (MTX). As reuniões de CHO resultantes foram usadas para produção de proteína em escala.
[0093] Os mutantes de TSH de cisteína foram verificados serem capeados na cisteína introduzida após expressão e purificação; desse modo, metodologia adicional de redução foi necessária para criar TSH de mutante PEGuilado. O TSH mutante primeiro necessita ser reduzido com um redutor brando para liberar a capa da cisteína introduzida sem quebra irreversivelmente das ligações dissulfeto nativas que inativariam a proteína.
[0094] Consequentemente, métodos múltiplos foram empregados em um esforço para reduzir a cisteína capeada. Por exemplo, várias concentrações de solução de TCEP (Tris(2-carboxietil)fosfina HCI) foram incubadas com rhTSH mutantes para redução. Enquanto que a remoção da capa da cisteína foi efetiva usando este método, também parece existir alguma redução de outras ligações dissulfeto que conduzem a PEGuilação não específica mais tarde. Outro método de redução usando esferas imobilizadas com TCEP parece ser mais brando na redução de rhTSH; contudo, este método também resultou em alguns níveis baixos de redução dissulfeto. Nós verificamos que 110 mM de cisteína (como um redutor) foi particularmente efetiva para reduzir o Cys capeado sem quebra das ligações dissulfeto existentes no rhTSH.
[0095] O redutor de cisteína foi removido junto com a capa para permitir que os dissulfetos se reformem. A cisteína introduzida "de- capeada" foi, em seguida, seletivamente conjugada a um reagente de PEG reativo com cisteína. Embora este método tenha sido demonstrado em outras proteínas, tais como FVIII (Mei et al., Blood 116:270-9 (2010)) e fragmentos de anticorpo (Yang et al., Protein Engineering 16:761-770 (2003)); contudo, não existem relatórios conhecidos de tentativa disto em uma proteína contendo cisteína atada.
[0096] Enquanto os exemplos reportados anteriores tiveram somente 1-2% de teor de cisteína, o TSH tem 11% de teor de cisteína (23/210 aminoácidos), que produzem a introdução de uma 24a cisteína no TSH sem embaralhar os dissulfetos nativos (e, desse modo, abaixando dramaticamente a afinidade de ligação de receptor) particularmente difícil. Consequentemente, nós temos que classificar posições múltiplas para introdução da mutação de cisteína, com somente uns poucos que podem serem bem sucedidamente conjugados com um PEG.
[0097] PEGuilação de Cys Sítio Específica: G22C rhTSH foi produzido de células de CHO para PEGuilação sítio específica. A cisteína foi adicionada a G22C rhTSH (1-2mg/mL) à uma concentração final de 2 mM após otimização de experimentos mostrados na FIG. 8. A proteína foi incubada durante a noite a 4°C para remover a capa em Cys22. A mistura foi dialfiltrada em tampão de PEGuilação (10 mM de fosfato de sódio, 2mM de EDTA, pH 7,0). O PEG foi adicionado à proteína para obter 5x de excesso molar, e incubado a 25°C por 2 horas. A PEGuilação foi cessada com 2x de cisteína, e o rendimento foi verificado por SEC-HPLC. O pH da mistura de ação foi abaixado a pH 5,0 e, em seguida, carregada em uma coluna monoS para purificação.
[0098] Os perfis de SEC-HPLC de várias reações de PEGuilação são mostrados na FIG.8. Aproximadamente 75% de G22C TSH mono- PEGuilado foi obtido, que é de conjugação muito efetiva. A confirmação de conjugação de subunidade e sítio específica para G22C é mostrada na FIG. 9A - FIG. 9B.
[0099] Amostras foram purificadas sobre uma coluna monoS (GE Healthcare), e eluídas usando um gradiente com 10 mM de acetato de sódio, pH5, e 10 mM de acetato de sódio, 1M de cloreto de sódio, pH5, a uma taxa de fluxo de 4 ml/min. O gradiente começou com 0% de fase B móvel (10 mM de acetato de sódio, 1M de cloreto de sódio, pH5), em seguida, aumentado para 50% de fase B móvel sobre 25 volumes de coluna, seguido por 100% de fase B móvel para lavar a coluna.
[00100] Géis de gradiente pré-derramados (4-12% de Bis Tris, Invitrogen) foram carregados com 4-5 μg de TSH. Tampão de operação de MOPS (ácido 3-(N-morfolino)propanosulfônico) (Invitrogen) foi preparado. O aparelho de eletroforese foi colocado em uma cuba de gelo com gelo. O gel foi usado por aproximadamente 50 minutos a 200V, e foi, em seguida, enxaguado três vezes, 5 minutos cada com água destilada. 50 mL de 5% de cloreto de bário foi adicionado ao gel e, em seguida, sacudido por 10 minutos. O cloreto de bário foi removido por lavagem do gel por 5 minutos com água destilada. A água destilada foi, em seguida, removida, e o gel foi primeiro corado para PEG com 1x de solução de iodo/iodeto de potássio até que as bandas foram visíveis. O gel foi, em seguida, descorado com água destilada e escaneado imediatamente. Para coloração de proteína, descoloração de Coomassie (10% de ácido acético, 20% de metanol) foi usada para remover todos os traços de coloração para PEG, e o gel foi, em seguida, corado com coloração de azul de Coomassie. Os resultados de análise de SDS-PAGE dos conjugados de carboidrato rhTSH PEGuilado purificado são mostrados na FIG. 10C (coloração para PEG) e FIG. 10D (coloração de Coomassie).
[00101] Amostras foram operadas em uma coluna Superdex 200 10/300GL (GE Healthcare), e eluídas a uma taxa de fluxo de 0,4 ml por min em 50 mM de fosfato de sódio, 150 mM de tampão de cloreto de sódio, pH 7. Os perfis representativos de SEC-HPLC da reação de SAM de 40 kD e conjugados de rhTSH PEGuilado purificados são mostrados na FIG. 11A e FIG. 11B, respectivamente.
[00102] Vinte microgramas de cada amostra foi diluída em 0,1 M de Tris, pH 8,5, contendo 6 M de hidrocloreto de guanidina e 38 mM de ditiotreitol, sobrepostos com nitrogênio, e incubados a 25°C durante a noite. Após incubação, iodoacetamida foi adicionada a 50 mM. As amostras foram, em seguida, sobrepostas com nitrogênio, e incubadas a 25°C por 2 horas. A reação de alquilação foi extinta por adição 1/1 (v/v) de 0,25% de ácido trifluoroacético, e as amostras foram dialisadas em 0,1 M de Tris, pH 8,5, usando unidade de mini-diálise 3,500 MWCO Slide-A-Lyzer (Thermo Scientific). As amostras foram digeridas com razão de 1:25 (Enzima:Amostra) durante a noite a 37°C. As reações de digestão foram extintas com 1/1 (v/v) de 0,25% de ácido trifluoroacético. As amostras digeridas com tripsina foram fracionadas usando um Agilent 1200 HPLC equipado com um injetor automático e coletor de fração, uma bomba de solvente binária, um compartimento de coluna termoestatado, e um detector de comprimento de onda variável. As amostras foram carregadas em uma coluna Poroshell 300SB-C8 (2,1 x 75 mm, partículas de 5 μm, Agilent Technologies, CA) que foi mantida a 50°C, e pré-equilibradas em 98% de solvente A (0,1% de ácido trifluoroacético em água) e 2% de solvente B (0,08% de ácido trifluoroacético em acetonitrila). Peptídeos trípticos foram eluídos usando um gradiente linear de solvente B de 2% a 60% acima de 25 min a uma taxa de fluxo de 0,4 mL/min. Os fragmentos PEGuilados, eluindo a uma % de B maior do que os fragmentos não PEGuilados, foram coletados e secados em um concentrador centrífugo (Thermo Scientific, MA). A análise de sequência N-terminal automática foi realizada usando um sequenciador de proteína Procise (Applied Biosystems, CA). Duzentos pmol de amostra e controle foram submetidas a 18 ciclos da degradação de Edman automática usando o método líquido pré-programado pulsado. A FIG. 12 mostra o mapa de peptídeo e os resultados do sequenciamento N-terminal do conjugado de SAM de 40 kD. Somente 3 glicopeptídeos trípticos (AT9, AT6, BT3) foram detectados, indicando a especificidade do sítio de PEGuilação de carboidrato. N sublinhado corresponde ao sítio de glicosilação N-ligado.
[00103] PEGuilação específica de subunidade foi calculada por medição da quantidade relativa de subunidades α e β não PEGuiladas após isolamento das mesmas a partir das subunidades PEGuiladas, usando dois cursos de HPLC de fase reversa consecutivos. Este método de inferência foi usado porque as condições cromatográficas que resolvem as subunidades α e β PEGuiladas não podem ser identificadas. As amostras (100 μg) foram concentradas a 20 μL por ultrafiltração centrífuga e, em seguida, desnaturadas em 6 M de hidrocloreto de guanidina, 10 mM de fosfato de sódio, 100 mM de cloreto de sódio, pH 7,0. Após incubação durante a noite a 25°C, as amostras foram carregadas em uma coluna Poroshell 300SB-C8 (2,1 x 75 mm, partículas de 5 μm, Agilent Technologies, CA), pré-equilibradas com 75% de solvente A (10 mM de fosfato de sódio, pH 6,5) e 25% de solvente B (40% de 10 mM de fosfato de sódio, pH 6,5, 60% de acetonitrila). A coluna foi eluída com 25-50% de B acima de 5 min, seguido por 50-75% de B acima de 20 min a 0,4 ml/min a 25°C. A fração de pico correspondente a subunidades de TSH não PEGuiladas (-9,512,5 min) foi coletada (FIG. 13B) em sua totalidade, e concentrada a menos do que 50 μL por ultrafiltração centrífuga. As amostras foram ajustadas a 50 μL com água e, em seguida, reduzidas por adição de 4,7 μL de 2 M de ditiotreitol e 150 μL de 6 M de hidrocloreto de guanidina, 0,1 M de Tris, pH 8,5, sobrepostas com nitrogênio, e incubadas a 25°C durante a noite. Tióis livres foram, em seguida, alquilatados por adição de 9,3 μL de 2 M de iodoacetamida, sobrepondo com nitrogênio, e incubando por 2 hr a 25°C. A reação de alquilação foi extinta por adição de 150 μL de 0,25% de ácido trifluoroacético.
[00104] As subunidades de TSH não PEGuiladas reduzidas e alquiladas foram perfiladas pelo segundo curso de HPLC de fase reversa. A composição da coluna de HPLC foi idêntica àquela indicada acima, com a exceção que o solvente A consistia de 0,1% de ácido trifluoroacético em água, e o solvente B consistia de 0,08% de ácido trifluoroacético em acetonitrila, e a coluna foi mantida a 50°C. A coluna foi eluída com um gradiente linear de 2-75% de B em 15 min a 0,3 ml/min. A percentagem relativa de subunidades α vs. β não PEGuiladas foi determinada pela integração dos cromatogramas A214 nm resultantes (FIG. 13C) de injeções triplas por amostra. A percentagem relativa de subunidades α vs. β PEGuiladas foi, em seguida, tomada como o inverso destes valores. Esta análise mostrou a fração de subunidade α modificada nos conjugados de 40kD de GAM-, GAM+ e SAM mono PEGuilados ser 77%, 66%, e 58%, respectivamente, de acordo com os resultados obtidos por SDS-PAGE (FIG. 13A).
[00105] Os conjugados PEGuilados purificados foram analisados por ensaio de ligação de receptor de TSH de suíno in vitro usando o kit TSH Receptor Autoantibody 2nd Generation ELISA de RSR Limited (Kronus, Star, ID). Ao invés de usar o autoanticorpo monoclonal humano biotinilado ao receptor de TSH provido pelo kit, nós usamos Thyrogen® biotinilado (rhTSH) para inibição competitiva de ligação ao receptor de TSH. A ligação de rhTSH biotinilado para receptor de TSH de suíno imobilizado foi inibida por, ou controle de rhTSH, ou conjugados de rhTSH PEGuilados, e os valores de IC50 foram medidos.
[00106] Thyrogen® foi biotinilado com 1,7 a 1,8 de biotinas por proteína usando o Reagente de Etiquetamento ChromaLink™ Biotin, de acordo com o protocolo do fabricante (QED Bioscience Inc., San Diego,CA) e tampão trocado em 50 mM de fosfato de sódio, 150 mM de cloreto de sódio, pH 7,0, com uma Coluna Zeba™ Desalt Spin (Thermo Scientific, Rockford, IL). A medição in vitro de ligação de receptor foi realizada por competição de Thyrogen® biotinilado e conjugado de PEG-rhTSH para ligação do receptor de TSH imobilizado em placas de 96 cavidades supridas com o kit TSH Receptor Autoantibody 2nd Generation ELISA de RSR Limited (Kronus, Star, ID). Os conjugados de PEG-rhTSH foram diluídos em série 1:5 de 16 μM a 41 pM em tampão de ensaio (100 mM de HEPES, pH 7,5, 20 mM de EDTA, 1% de BSA, 0,5% de Triton X-100), e misturados 1:1 com Thyrogen® biotinilado diluído 1000 vezes em tampão de ensaio. A mistura foi adicionada a cada cavidade revestida com receptor e incubada a 25°C por 25 minutos. rhTSH não ligado foi lavado, e estreptavidina peroxidase foi adicionada a 25°C por 20 minutos, de acordo com o protocolo RSR Limited ELISA, para determinar a quantidade de Thyrogen® biotinilado ligado à placa. A placa foi, em seguida, lavada três vezes para remover excesso de estreptavidina peroxidase não ligada, e, em seguida, tetrametilbenzidina (TMB) foi adicionada à cada cavidade, e incubada no escuro a 25°C por 30 minutos. A reação foi extinta com 0,5M de tampão de cessamento de ácido sulfúrico, e a absorvência de cada cavidade foi lida a 450 nm usando uma leitora de placa SpectraMax® 340pc (Molecular Devices, Sunnyvale, CA). O dado foi ajustado usando uma equação de resposta de dose sigmoidal com software GraphPad Prism para gerar valores de IC50.
[00107] N-terminal e PEGuilação de lisina produziu conjugados com afinidade de receptor de TSH mais baixa do que a conjugação de carboidrato. A mono-PEGuilação N-terminal com 40 kD de PEG resultou em afinidade de ligação de receptor 10,8 vezes mais baixa, comparada ao controle de TSH. Lisina-PEGuilação com 40 kD de PEG resultou em afinidade de ligação de receptor 31,2 vezes mais baixa, comparada ao controle de TSH. Em contraste, mono-PEGuilação GAM+ resultou em afinidade de ligação de receptor 2,2 vezes mais baixa para 20 kD de conjugação de PEG, e afinidade de ligação de receptor 3,6 vezes mais baixa para 40 kD de conjugação de PEG. Mono-PEGuilação SAM também resultou em diminuição moderada em afinidade de ligação de receptor de TSH in vitro comparada a PEGuilação N-terminal, variando de diminuição de 2,1 a 5,3 vezes, dependendo do tamanho do PEG conjugado. Mono-PEGuilação GAM(-) causou a maior perda entre todas as estratégias de PEGuilação de carboidrato, com 20 kD de conjugação de PEG causando diminuição de 2,7 vezes, e 40kD de conjugação de PEG, diminuição de 8,0 vezes em afinidade de ligação de receptor de TDH in vitro. (Vide Tabelas 3a e 3b e FIG. 14).Tabela 3aTabela 3b
[00108] O farmacocinético de rhTSH e rhTSH PEGuilado (20 kD de SAM, 20 kD de GAM(-), 20 kD de GAM(+), 40 kD de GAM(+)) foi avaliado em ratos machos e fêmeas em seguida a uma injeção intramuscular (IM) única.
[00109] Uma dose única de rhTSH ou rhTSH PEGuilado (20 kD de SAM, 20 kD de GAM(-), 20 kD de GAM(+), 40 kD de GAM(+)) foi administrada IM à ratos de veia canulada jugular machos e fêmeas em jejum a uma dose de 0,5 mg/kg. Devido às limitações de volume de dose, os animais receberam artigos de teste na forma de duas ou três injeções intramusculares em músculo dos quadrícepes. As pernas foram alternadas para dosagem. As amostras de sangue foram coletadas a partir da pré-dose dos animais nos seguintes pontos de tempo de pós-dosagem: 0,5, 1, 2, 4, 8, 24, e 48 horas. A alimentação foi removida das gaiolas do animal na noite antes da administração do artigo de teste. Os animais tinham acesso à água durante este tempo. A alimentação foi adicionada de volta às gaiolas em seguida às coletas de pré-dose e administração do artigo de teste. A alimentação foi removida novamente no final do dia, tal que os animais foram colocados em jejum por 24 horas da coleta de amostra de pós-dose. A alimentação foi adicionada de volta às gaiolas em seguida a coleta da amostra, e removida novamente no final do dia tal que os animais foram colocados em jejum 48 horas da coleta de amostra de pós-dose. O sangue foi coletado a partir da cânula jugular de orifício único. Aproximadamente 400 μL de sangue total foi coletado em tubos separadores de soro e processados para soro. O soro foi separado em dois tubos (-100 μL cada). Todas as amostras foram armazenadas a -80°C até que elas foram analisadas para concentração de rhTSH ou rhTSH PEGuilado por ELISA de TSH. Em seguida à última coleta de amostra, os animais foram eutanasiados com CO2.Tabela 4Tabela 5
[00110] Os dados PK mostraram que 20 kD de SAM e 20 kD de GAM(-) têm t1/2 > 5 vezes prolongada, Tmáx prolongada, e exposição aumentada (área sob a curva, AUC), comparadas ao controle de rhTSH. O perfil de PK de 20 kD de GAM(+) mostrou menos aperfeiçoamento comparado a 20 kD de SAM e 20 kD de GAM(-), e 40 kD de GAM(+) mostrou somente um aperfeiçoamento moderado. O valor aumentado de Vz (volume aparente de distribuição) indicou que os conjugados de GAM(+) podem suportar uma folga mediada por receptor. (Vide a FIG. 16 e Tabela 5). A concentração de T4 de soro foi medida para coletar o dado farmacodinâmico (Vide a FIG. 15), usando sistema de química clínica de ACE (Alfa Wassermann Diagnostic Technologies, LLC), de acordo com o protocolo do fabricante.
[00111] Os farmacocinéticos de RhTSH PEGuilado (10 kD de multiSAM, 10 kD de SAM, 40 kD de SAM, 40 kD de GAM(-)) foram avaliados em ratos machos e fêmeas em seguida a um injeção intramuscular (IM) única.
[00112] Uma dose única de rhTSH ou rhTSH PEGuilado (10 kD de multiSAM, 10 kD de SAM, 40 kD de SAM, 40 kD de GAM(-)) foi administrada IM a ratos machos e fêmeas em jejum canulados na veia jugular a uma dose de 0,5 mg/kg. Devido a estas limitações de volume de dose, os animais receberam artigo de testes na forma de duas ou três injeções intramusculares em músculo dos quadrícepes. As pernas foram alternadas para dosagem. As amostras de sangue foram da pré- dose dos animais e nos seguintes pontos de tempo de pós-dosagem: 0,5, 1, 3, 6, 24, 48, 72, e 96 horas. A alimentação foi removida das gaiolas do animal na noite antes da administração do artigo de teste. Os animais tiveram acesso à água durante este tempo. A alimentação foi adicionada de volta às gaiolas em seguida às coletas de amostra de pré-dose, e administração do artigo de teste. A alimentação foi removida novamente no final de cada dia, tal que os animais foram colocados em jejum para a coleta de amostra de pós-dose nas manhãs seguintes. A alimentação foi adicionada de volta às gaiolas após cada coleta de amostra de pós-dose. O sangue foi coletado a partir da cânula jugular de orifício único. Aproximadamente 400 μL de sangue total foi coletado em tubos separadores de soro e processados para soro. O soro foi separado em dois tubos (-100 μL cada). Todas as amostras foram armazenadas a -80°C até que elas foram analisadas para concentração de rhTSH ou rhTSH PEGuilado por ELISA de TSH. Em seguida à última coleta da amostra, os animais foram eutanasiados com CO2.Tabela 6Table 7
[00113] O dado de PK mostrou que 10 kD de multi-SAM, 40 kD de SAM, e 40 kD de GAM(-) tem t1/2 14 ~ 23 vezes prolongada, Tmáx prolongada, e exposição aumentada (área sob a curva, AUC), comparadas ao controle de rhTSH. (Vide FIG. 17 e Tabela 7). O aperfeiçoamento observado nos perfis de PK de 40 kD de SAM e 40 kD de GAM(-) é maior do que aquele de 20 kD de SAM e 20 kD de GAM(-) no Exemplo 13.
[00114] Estudos farmacocinéticos de rato in vivo de conjugados de PEG (Exemplos 13 e 14): A meia-vida de plasma total foi aumentada proporcional ao tamanho do PEG conjugado ao rhTSH conforme esperado. Para os mesmos conjugados de SAM e GAM(-) de tamanho de PEG, não existe diferença aparente entre as duas estratégias de PEGuilação para aperfeiçoamento de parâmetros de PK, diferente da afinidade de ligação de receptor, sugerindo que o efeito no PK é somente dependente do tamanho do PEG, e não dependente do sítio de PEGuilação. Por exemplo, ambos 40 kD de SAM e 40 kD de GAM (- ) mostraram aumento de 23 vezes na meia-vida do plasma, comparado ao controle de rhTSH (3,42 ± 0,61 hora) a 77,9 ± 16,9 horas e 80,1 ± 16,1 horas, respectivamente. A multiPEGuilação (10 kD de multiSAM) tem um grande aumento de meia-vida de plasma comparada a monoPEGuilação do PEG de mesmo tamanho (10kD SAM). 10 kD de multiSAM tem aumento de 13,7 vezes a 46,8 ± 10,4 horas comparado ao controle de rhTSH onde 10 kD de SAM tem somente aumento de 4,6 vezes a 15,8 ± 1,23 hora. (Vide Tabela 7), retardo dependente do tamanho do PEG no tempo de pico de concentração (Tmáx) foi também observado. Por exemplo, 10 kD, 20 kD e 40 kD de SAM mostrou Tmáx a 5,40 ± 1,34 hora, 16,0 ± 8,76 horas e 30,0 ± 12,0 horas,respectivamente, comparado ao controle de rhTSH a 2,00 ± 0,00 hora ou 1,50 ± 1,18 hora. (Vide Tabela 5 e Tabela 7).
[00115] As placas ELISA de 96 cavidades de alta ligação foram revestidas com anticorpo de captura anti-hCG de murino a 1,33 μg/mL diluído em 0,1 M de tampão de bicarbonato de sódio a pH 9,2, e adicionado a 100 μL por cavidade. Uma curva padrão de rhTSH ou rhTSH PEGuilado foi preparada de proteína purificada e diluída em tampão de diluição de amostra (SDB) consistindo em 1,0% p/v de BSA em lavagem da placa 1X. O padrão foi diluído de 25-1,463 ng/mL, 8,334-0,488 ng/mL, ou 5,556 a 0,325 ng/mL, usando um esquema de diluição em série 2:3, dependendo da faixa linear qualificada de espécie de rhTSH ou rhTSH PEGuilado por ensaio. As amostras foram diluídas em SDB em não menos do que uma diluição 1:10. 500 ng/mL, e 25 ng/mL de controles de rhTSH preparados em soro de rato normal são diluídos 1:100 e 1:10 respectivamente em SDB. 0,5 ng/mL de controle de rhTSH preparado em SDB foi adicionado não diluído. As placas revestidas foram lavadas e 100 μL de amostras, padrões e controles, foram adicionados às placas e incubadas por 1 hora a 37°C.
[00116] O anticorpo de detecção monoclonal anti-rhTSH biotinilado (clone TS8) foi diluído em SDB, de acordo com a diluição apropriada específica para cada lote. As placas foram lavadas, e 100 μL do anticorpo de detecção biotinilado diluído foi adicionado às cavidades, e incubado por 1 hora a 37°C.
[00117] Conjugado de estreptavidina-peroxidase de rábano silvestre (SA-HRP) foi diluído em SDB, de acordo com a diluição apropriada específica para cada lote. As placas foram lavadas, e 100 μL do SA- HRP diluído foi adicionado às cavidades e incubados por 15 minutos a 25°C.
[00118] As placas foram lavadas, e 100 μL de substrato de tetrametil benzidina (TMB) foi adicionado à todas as cavidades, e incubado por 20 minutos a 25°C.
[00119] 100 μL de tampão de cessamento de TMB foi adicionado a todas as cavidades, e a placa foi lida a 450 nm.
[00120] Os farmacodinâmicos de rhTSH PEGuilado foram avaliados em camundongos machos e fêmeas em seguida a uma injeção IP única, três dias pós implante de pélete de T3. Neste modelo de PD de camundongo, o camundongo de T4 endógeno foi suprimido durante o período de estudo por implantação de liberação lenta de pélete de T3 três dias antes da dosagem (Vide grupo de veículo na FIG. 18A- FIG. 18D). Portanto, somente a quantidade de T4 liberada pelo controle dos conjugados de rhTSH ou de rhTSH PEGuilado foi medida. Devido ao volume de sangue limitado de camundongo, quatro pontos de tempo de 6, 24, 48 e 72 horas pós-dose foram coletados.
[00121] Os animais foram anestesiados com isoflurano e 0,1 mg de pélete de T3 (T-261, Innovative Research of America) foi implantado subcutaneamente usando um trochar. Nos três dias pós implantação de pélete, uma dose única de rhTSH (0,4 ou 4,0 mg/kg), ou de rhTSH PEGuilado (4 mg/kg), foi administrada IP a camundongos machos (cepa ICR, 6 semanas de idade, Taconic Farms). Os animais foram anestesiados com isoflurano, e amostras de sangue foram coletadas a partir do plexo retro-orbital. As amostras de sangue do grupo 1 foram coletadas pré-dose (animais 1-4), 6 (animais 5-8), 24, 48 e 72 horas, em seguida a administração de artigo de teste. As amostras de sangue de todos os outros grupos foram coletadas em 6, 24, 48, e 72 horas em seguida a administração do artigo de teste. Aproximadamente 60 μL de sangue total foi coletado em tubos capilares micro-hematocríticos e processado para soro. Em seguida a última coleta de amostra, os animais foram eutanasiados com CO2. Todas as amostras de soro foram armazenadas a -80°C até que elas foram analisadas para concentrações de T4 pelo ensaio de T4 químico clínico de ACE®. A concentração de T4 de soro foi medida pelo sistema químico clínico de ACE (Alfa Wassermann Diagnostic Technologies, LLC) de acordo com o protocolo do fabricante.Tabela 8
[00122] Dados de animais tratados com veículo indicaram a validade do modelo devido a supressão de T4 para duração do estudo, via pélete de T3 subcutânea. Em 6 horas, todos os tratamentos aumentaram significantemente (p< 0,001) T4, comparados ao veículo (FIG.18A). Em 24 horas, 0,4 mg/kg de rhTSH começou a retornar para níveis similares á veículo de T4 onde o restante dos tratamentos permaneceu significantemente (p< 0,001) elevados comparados ao veículo (FIG.18B). Por 48 horas, ambos (0,4 mg/kg e 4 mg/kg) tratamentos de rhTSH retornaram a níveis similares ao veículo de T4 e os três conjugados de PEG aumentaram modestamente, mas foram significantemente (p< 0,001) elevados, comparados a rhTSH a 4mg/kg (FIG.18C). Em 72 horas, 40 KD de SAM e 10 KD de multi-SAM permaneceram elevados (similar ao ponto de tempo de 48 horas), enquanto que 10 KD de multi-GAM(+) caiu modestamente (FIG.18D). Todos os conjugados permaneceram elevados comparados a rhTSH 4 mg/kg e, adicionalmente, 40 KD de SAM e 10 KD de multi-SAM foram (p< 0,001) elevados, comparados a 10 KD de Multi-GAM(+).
[00123] 10 KD de Multi SAM e 40 KD de SAM pareceram serem candidatos promissores baseados nos dados de PK (Exemplo 14) e de PD (Exemplo 16). 10 KD de Multi-GAM(+) pareceu promissor também, mas não teve duração muito aperfeiçoada de ação comparada aos dois candidatos mais promissores.
[00124] Os farmacodinâmicos de rhTSH PEGuilado (40kD de SAM) foram avaliados em três níveis de dose diferentes em camundongos machos em seguida a uma injeção intraperitoneal (IP) única, três dias pós implantação de pélete de T3.
[00125] Os animais foram anestesiados com isoflurano e 0,1 mg de pélete de T3 (T-261, Innovative Research of America) foi implantada subcutaneamente usando um trochar. Nos três dias pós implantação de pélete, uma dose única de rhTSH ou de rhTSH PEGuilado (40kD de SAM) foi administrado IP a camundongos machos (cepa ICR, 6 semanas de idade, Taconic Farms) a uma dose de 0,04 mg/kg (FIG. 19A), 0,4 mg/kg (FIG. 19B), ou 4 mg/kg (FIG. 19C). Os animais foram anestesiados com isoflurano, e amostras de sangue foram coletadas a partir do plexo retro-orbital. As amostras de sangue do grupo 1 foram coletadas 6 (animais 1-4), 24, 48, 72 e 96 (animais 5-8) horas em seguida a administração de artigo de teste. As amostras de sangue de todos os outros grupos foram coletadas a 6, 24, 48, e 72 horas em seguida a administração do artigo de teste. Aproximadamente 60 μL de sangue total foi coletado em tubos capilares micro-hematocríticos e processado para soro. Em seguida a última coleta de amostra, os animais foram eutanasiados com CO2. Todas as amostras de soro foram armazenadas a -80°C até que elas foram analisadas para concentrações de T4 pelo ensaio de T4 químico clínico de ACE®. A concentração de T4 de soro foi medida por sistema químico clínico de ACE (Alfa Wassermann Diagnostic Technologies, LLC), de acordo com o protocolo do fabricante.Tabela 9
Tabela 10 Avaliação de Prolongamento por Cálculo de AUEC (Área Sob a Curva Efetiva) *p < 0,001 comparado a rhTSH
[00126] Os dados de animais tratados com veículo indicaram validade de modelo devido a supressão de T4 para duração de estudo, via pélete de T3 subcutânea. Todas as doses de rhTSH mostraram AUEC equivalente, e induziram um efeito máximo aparente no topo da curva de resposta de dose. 40 KD de SAM exibiu AUEC representando uma curva de resposta de dose total, de nenhum efeito, a efeito modesto, a efeito máximo aparente. O tratamento de hTSH aumentou os níveis de T4 em todas as doses em 6 horas e, em seguida, diminuiu aos níveis similares a veículo de T4 a 24 horas, exceto para a dose mais alta, 4 mg/kg, que mostrou níveis de T4 retornando a níveis de veículo de veículo a 48 horas pós-dose. O prolongamento do efeito com 40 KD de SAM foi dependente da dose neste modelo de PD de camundongo, mais significante a 4 mg/kg de nível de dose. Somente uma intensificação branda do efeito foi vista com nível de 0,4 mg/kg.
[00127] Os farmacodinâmicos de rhTSH PEGuilado foram avaliados em ratos machos e fêmeas em seguida a uma injeção intramuscular (IM) única, três dias pós implantação de pélete de T3.
[00128] Os animais foram anestesiados com isoflurano e 1,5 mg de pélete de T3 (T-261, Innovative Research of America) foi implantado subcutaneamente usando um trochar. Nos três dias pós implantação da pélete, uma dose única de rhTSH ou rhTSH PEGuilado foi administrada IM a ratos machos e fêmeas canulados na veia jugular a uma dose de 0,0 mg/kg (veículo), 0,04 mg/kg, 0,4 mg/kg, ou 0,65 mg/kg. Para 40kD de multiSAM e 50kD de multiSAM, 0,65 mg/kg de dose foi determinada baseado no teor de espécie de monoPEGuilado. Devido a estas limitações de volume de dose, os animais receberam artigos de teste na forma de duas injeções intramusculares no músculo dos quadríceps. As pernas foram alternadas para dosagem. As amostras de sangue foram coletadas dos animais pré-dose e nos seguintes pontos de tempo pós dosagem: 1, 3, 6, 24, 48, 72, 96, 120, 144, e 168 horas. O sangue foi coletado a partir da cânula jugular de orifício único. Aproximadamente 250 μL de sangue total foi coletado em tubos separadores de soro, e o sangue foi permitido coagular por um mínimo de 30 minutos. Os tubos foram centrifugados em uma centrífuga a 10.000 rpm por 5 minutos, e o soro foi separado em dois tubos (-50 μL cada).
[00129] Todas as amostras foram armazenadas a -80°C até que elas foram analisadas para concentrações de T4 por ensaio de T4 químico clínico de ACE®. Em seguida a última coleta de amostra, os animais foram eutanasiados com CO2. A concentração de T4 de soro foi medida pelo sistema químico clínico de ACE (Alfa Wassermann Diagnostic Technologies, LLC), de acordo com o protocolo do fabricante.Tabela 11 Tabela 12 Cálculo de Avaliação de Prolongamento por AUEC (Área Sob A Curva Efetiva)
*p<0,05 comparado ao rhTSH
[00130] Os dados dos animais tratados com veículo indicam validade de modelo devido a supressão de T4 para duração de estudo, via pélete de T3 subcutânea. A Tmáx de rhTSH ocorreu a 6 horas pós-dose, e retornou para a linha base (isto é, níveis de grupo de veículo) por 72 horas pós-dose. A Tmáx de 10 KD de multiSAM ocorreu a 24 horas pós- dose, e retornou para a linha base a 72 horas pós-dose para 0,04 mg/kg de dose e 96 horas pós-dose para 0,4 mg/kg dose. Os dados de dose baixa mostraram potência diminuída de 10 KD de multiSAM relativo a rhTSH neste modelo, que pode refletir afinidade de ligação de receptor de TSH diminuída. Os dados de dose alta confirmaram efeitos farmacodinâmicos intensificados com 10 KD de multiSAM a 48 e 72 horas de pós-dose. Todos os candidatos, incluindo 40 kD de multiSAM e 50 kD de multiSAM, mostraram resposta de T4 intensificada comparada a rhTSH a 0,4 mg/kg, que pode ter sido em parte mediada por alteração na Tmáx a 24 horas pós-dose. A atividade farmacodinâmica prolongada foi observada através de 96-120 horas de pós-dose. (Para 40 kD de multiSAM e 50 kD de multiSAM, 0,65 mg/kg de dose igualada a 0,4 mg/kg baseado no teor de percentagem de espécie monoPEGuilada nestes conjugados). Para todos os artigos de teste, aproximadamente 95% dos efeitos farmacodinâmicos foram observados dentro de 96 horas pós-dose em seguida a administração intramuscular.
[00131] As AUECs mais altas observadas com conjugados PEGuilados são acionadas por níveis de T4 mais altos entre 24-96 horas pós-dose. Para o período de 0-96 horas, 10 KD de multiSAM exibiu 1,3 vezes de AUEC de rhTSH, 40 KD de SAM, 1,5 vezes, 40 KD de multiSAM, 1,7 vezes, e 50 KD de multiSAM, 1,9 vezes. (Tabela 12, FIG. 20).
[00132] Os farmacodinâmicos de rhTSH PEGuilado foram avaliados em ratos machos e fêmeas em seguida a uma injeção intramuscular (IM) única, três dias pós implantação de pélete de T3.
[00133] Os animais foram anestesiados com isoflurano e 1,5 mg de pélete de T3 (T-261, Innovative Research of America) foi implantado subcutaneamente usando um trochar. Nos três dias pós implantação de pélete, uma dose única de rhTSH ou rhTSH PEGuilado foi administrada IM a ratos machos e fêmeas canulados na veia jugular a uma dose de 0,0 mg/kg (veículo), 0,4 mg/kg, ou 0,65 mg/kg. Para 50 kD de multiSAM, 0,65 mg/kg de dose foi determinado baseado no teor de espécie monoPEGiltada. Devido a estas limitações de volume de dose, os animais receberam artigos de teste na forma de duas injeções intramusculares no músculo dos quadríceps. As pernas foram alternadas para dosagem. As amostras de sangue foram coletadas a partir da pré-dose dos animais e nos seguintes pontos de tempo de pós- dosagem: 6 (FIG. 21A), 24 (FIG. 21B), 48 (FIG. 21C), 72 (FIG. 21D), 96 (FIG. 21E), e 168 (FIG. 21F) horas. O sangue foi coletado a partir da cânula jugular de orifício único.
[00134] Aproximadamente 250 μL de sangue total foi coletado em tubos separadores de soro, e o sangue foi permitido coagular por um mínimo de 30 minutos. Os tubos foram centrifugados em uma centrífuga a 10.000 rpm por 5 minutos, e o soro foi separado em dois tubos (-50 μL cada). Todas as amostras foram armazenadas a -80°C até que elas foram analisadas para concentrações de T4 pelo ensaio de T4 químico clínico de ACE®. Em seguida a última coleta de amostra, os animais foram eutanasiados com CO2. A concentração de T4 de soro foi medida por sistema químico clínico de ACE (Alfa Wassermann Diagnostic Technologies, LLC), de acordo com o protocolo do fabricante.Tabela 13 Tabela 14 Cálculo de Avaliação de Prolongamento por AUEC (Área Sob A Curva Efetiva)
[00135] Os dados dos animais tratados com veículo indicaram validade de modelo devido a supressão de T4 para duração do estudo, via pélete de T3 subcutânea. (Vide FIG. 22). Os efeitos farmacodinâmicos prolongados foram consistentes dentro do grupo para cada artigo de teste. Ambas a duração de ação e AUEC ranqueados de rhTSH < 10 KD de multiSAM < 40 KD de SAM < 50 KD de multiSAM, consistente com o Exemplo 18.
[00136] Os farmacodinâmicos de rhTSH PEGuilado (10 KD de MultiSAM e 40KD de SAM) foram avaliados em ratos machos e fêmeas em seguida a uma injeção intramuscular (IM) única, três dias pós implantação de pélete de T3.
[00137] Os animais foram anestesiados com isoflurano e 1,5 mg de pélete de T3 (T-261, Innovative Research of America) foi implantado subcutaneamente usando um trochar. Nos três dias pós implantação da pélete, uma dose única de veículo ou rhTSH PEGuilado (10 KD de MultiSAM ou 40 KD de SAM) foi administrada IM a ratos machos e fêmeas canulados na veia jugular a uma dose de 0,0 mg/kg (veículo), 0,1, 0,2, 0,4, ou 1,0 mg/kg, conforme especificado na Tabela 15. Devido a estas limitações de volume de dose, os animais receberam artigos de teste na forma de duas injeções intramusculares no músculo dos quadríceps. As pernas foram alternadas para dosagem. As amostras de sangue foram coletadas da pré-dose dos animais nos seguintes pontos de tempo de pós-dosagem: 6, 24, 48, 72, 96, e 168 horas. O sangue foi coletado da cânula jugular de orifício único. Aproximadamente 250 μL de sangue total foi coletado em tubos separadores de soro, e o sangue foi permitido coagular por um mínimo de 30 minutos. Os tubos foram centrifugados em uma centrífuga a 10.000 rpm por 5 minutos, e o soro foi separado em dois tubos (-50 μL cada). Todas as amostras foram armazenadas a -80°C até que elas foram analisadas para concentrações de T4 pelo ensaio químico clínico de ACE. Em seguida à última coleta da amostra, os animais foram eutanasiados com CO2. A concentração de T4 de soro foi medida pelo sistema químico clínico de ACE (Alfa Wassermann Diagnostic Technologies, LLC), de acordo com o protocolo do fabricante.Tabela 15Tabela 16 Cálculo de Avaliação de Prolongamento por AUEC (Área Sob A Curva Efetiva)
[00138] Os dados de animais tratados com veículo indicaram validade de modelo devido a supressão de T4 para duração de estudo, via pélete de T3 subcutânea. (Vide a FIG. 23). 10 KD de multiSAM não produziu uma resposta de PD máxima a 0,4 mg/kg, e 1 mg/kg resultou em respostas de T4 mais pronunciadas (em grau e duração). 40 KD de SAM 0,2 mg/kg exibiu uma resposta de PD moderada, enquanto que 0,1 mg/kg tem pouco ou nenhum efeito. Interessantemente, 10 KD de multiSAM e 40 KD de SAM exibiram PD quase idêntico a 0,2 mg/kg. Em 0,4 mg/kg, contudo, 40kD de SAM induziu um efeito farmacodinâmico mais forte do que 10 kD de multiSAM. No todo, os dados de três estudos separados (Exemplos 18, 19 e 20) são consistentes para 10 kD de multiSAM e 40 kD de SAM.
[00139] Os farmacodinâmicos de Cys-Mutante TSH PEGuilado (40 KD de G22C) foram avaliados e comparados aos farmacodinâmicos de rhTSH e 40 kD de SAM de rhTSH PEGuilado em ratos Sprague Dawley implantados com pélete de T3.
[00140] Os animais foram anestesiados com isoflurano e 1,5 mg de pélete de T3 (T-261, Innovative Research of America) foi implantado subcutaneamente usando um trochar. Nos três dias pós implantação da pélete, uma dose única de veículo ou rhTSH, RhTSH PEGuilado (40 KD de SAM), ou Cys-mutante TSH PEGuilado (40 KD de G22C) foi administrada IM a ratos machos e fêmeas canulados na veia jugular a uma dose de 0,0 mg/kg (veículo), 0,1, 0,2, ou 0,4, mg/kg. Devido a estas limitações de volume de dose, os animais receberam artigos de teste na forma de duas injeções intramusculares no músculo dos quadríceps. As pernas foram alternadas para dosagem. As amostras de sangue foram coletadas da pré-dose dos animais nos seguintes pontos de tempo de pós-dosagem: 6, 24, 48, 72, 96, e 168 horas. O sangue foi coletado da cânula jugular de orifício único. Aproximadamente 250 μL de sangue total foi coletado em tubos separadores de soro, e o sangue foi permitido coagular por um mínimo de 30 minutos. Os tubos foram centrifugados em uma centrífuga a 10.000 rpm por 5 minutos, e o soro foi separado em dois tubos (~50 μL cada). Todas as amostras foram armazenadas a -80°C até que elas foram analisadas para concentrações de T4 pelo ensaio químico clínico de ACE. Em seguida à última coleta da amostra, os animais foram eutanasiados com CO2. A concentração de T4 de soro foi medida pelo sistema químico clínico de ACE (Alfa Wassermann Diagnostic Technologies, LLC), de acordo com o protocolo do fabricante.Tabela 17 Tabela 18 Cálculo de Avaliação de Prolongamento por AUEC (Área Sob A Curva Efetiva)
[00141] Os dados dos animais tratados com veículo indicaram validade de modelo devido a supressão de T4 para duração do estudo, via pélete de T3 subcutânea. (Vide a FIG. 24). De uma perspectiva dos farmacodinâmicos, os 40 kD de G22C Cys-Mutante não pareceram serem superiores a 40 kD de SAM. 40 kD de SAM pareceram mostrar duração aumentada de ação comparara aos 40 kD de G22C Cys- Mutante.
[00142] Os ensinamentos de todas as patentes, pedidos publicados e referências aqui citados são incorporados por referência em sua totalidade.
[00143] Enquanto que esta invenção foi particularmente mostrada e descrita com referência às concretizações de exemplo desta, será compreendido por aqueles versados na técnica que várias mudanças na forma e detalhes podem ser feitas nesta sem fugir do escopo da invenção envolvida pelas reivindicações em anexo.
Claims (17)
1. Composição, caracterizada pelo fato de que compreende hormônio estimulante da tiroide humano recombinante (rhTSH), em que pelo menos um polímero de polialquileno glicol é fixado ao rhTSH em: a) um grupo de ácido siálico selecionado a partir do grupo que consiste em ASN52 da subunidade α de rhTSH, ASN78 da subunidade α de rhTSH e ASN23 da subunidade β de rhTSH, ou uma combinação dos mesmos; b) uma galactose localizada em ASN52 da subunidade α de rhTSH, ASN78 da subunidade α de rhTSH, ASN23 da subunidade β de rhTSH ou uma combinação dos mesmos; ou c) ambos a) e b); em que as subunidades α e β do rhTSH apresentam as sequências de aminoácidos de SEQ ID NO: 2 e 4, respectivamente.
2. Composição, caracterizada pelo fato de que compreende um hormônio estimulante da tiroide humano recombinante (rhTSH) fixado a pelo menos um polímero de polialquileno glicol, em que o rhTSH apresenta um ou mais resíduos de aminoácido substituído com um resíduo de cisteína, em que o resíduo de aminoácido que foi substituído com um resíduo de cisteína está localizado na subunidade α de rhTSH (SEQ ID NO: 2) em uma posição de aminoácido selecionada a partir do grupo que consiste em ASN66, THR69, GLY22 e qualquer combinação dos mesmos; ou está localizado na subunidade β de rhTSH (SEQ ID NO: 4) na posição de aminoácido de VAL118; ou qualquer combinação destes; e em que o polímero de polialquileno glicol é fixado ao TSH mutado no resíduo de cisteína, e o TSH mutado é biologicamente ativo.
3. Composição de acordo com a reivindicação 1 ou 2, caracterizada pelo fato de que o polímero de polialquileno glicol é polietileno glicol (PEG).
4. Composição de acordo com a reivindicação 3, caracterizada pelo fato de que o PEG tem um peso molecular médio de entre cerca de 3.000 e cerca de 100.000 kDa.
5. Composição de acordo com a reivindicação 3 ou 4, caracterizada pelo fato de que um PEG é fixado ao rhTSH.
6. Composição de acordo com a reivindicação 3 ou 4, caracterizada pelo fato de que mais do que um PEG é fixado ao rhTSH.
7. Composição de acordo com qualquer uma das reivindicações 1 a 6, caracterizada pelo fato de que o TSH exibe uma resposta T4 prolongada comparada a um controle.
8. Método de produção de um hormônio estimulante da tiroide humano recombinate (rhTSH) biologicamente ativo, conjugado com pelo menos um polímero de polialquileno glicol, caracterizado pelo fato de que compreende fixar pelo menos um polímero de polialquileno glicol a um rhTSH em: a) um grupo de ácido siálico selecionado a partir do grupo que consiste em ASN52 da subunidade α de rhTSH, ASN78 da subunidade α de rhTSH e ASN23 da subunidade β de rhTSH, ou uma combinação dos mesmos; b) uma galactose localizada em ASN52 da subunidade α de rhTSH, ASN78 da subunidade α de rhTSH, ASN23 da subunidade β de rhTSH ou uma combinação dos mesmos; ou c) ambos a) e b); em que as subunidades α e β do rhTSH apresentam as sequências de aminoácidos de SEQ ID NO: 2 e 4, respectivamente.
9. Método de produção de um hormônio estimulante da tiroide humano recombinate (rhTSH) mutado biologicamente ativo, conjugado com pelo menos um polímero de polialquileno glicol, caracterizado pelo fato de que compreende: a) introduzir um ou mais resíduos de cisteína adicionais no rhTSH, produzindo, desse modo, um rhTSH mutado, em que o resíduo de cisteína substitui um resíduo de aminoácido endógeno localizado na subunidade α de rhTSH (SEQ ID NO: 2) em uma posição de aminoácido selecionada a partir do grupo que consiste em ASN66, THR69, GLY22 e qualquer combinação dos mesmos; ou localizado na subunidade β de rhTSH (SEQ ID NO: 4) na posição de aminoácido VAL118; ou qualquer combinação dos mesmos; e b) fixar um ou mais polímeros de polialquileno glicol ao um ou mais resíduos de cisteína introduzidos na etapa a), produzindo, desse modo, um rhTSH mutado, biologicamente ativo, conjugado com pelo menos um polímero de polialquileno glicol.
10. Método, de acordo com a reivindicação 8 ou 9, caracterizado pelo fato de que o polímero de polialquileno glicol é polietileno glicol (PEG).
11. Método, de acordo com a reivindicação 10, caracterizado pelo fato de que o PEG tem um peso molecular médio entre cerca de 3.000 e cerca de 100.000 kDa.
12. Método, de acordo com a reivindicação 10 ou 11, caracterizado pelo fato de que um PEG é fixado ao rhTSH.
13. Método, de acordo com a reivindicação 10 ou 11, caracterizado pelo fato de que mais de um PEG está ligado ao rhTSH.
14. Composição farmacêutica, caracterizada pelo fato de que compreende uma quantidade terapêutica eficaz de uma composição como definida em qualquer uma das reivindicações 1 a 7 e um veículo farmaceuticamente aceitável.
15. Uso de uma composição como definida em qualquer uma das reivindicações 1 a 7, caracterizado pelo fato de ser para a preparação de uma composição farmacêutica para o tratamento de uma condição de tiroide em um paciente em necessidade do mesmo.
16. Uso, de acordo com a reivindicação 15, caracterizado pelo fato de que a condição de tireoide é câncer de tireoide.
17. Uso, de acordo com a reivindicação 15 ou 16, caracterizado pelo fato de que a composição farmacêutica é fornecida via injeção intramuscular.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161577412P | 2011-12-19 | 2011-12-19 | |
| US61/577,412 | 2011-12-19 | ||
| PCT/US2012/067705 WO2013095905A1 (en) | 2011-12-19 | 2012-12-04 | Thyroid stimulating hormone compositions |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112014014868A2 BR112014014868A2 (pt) | 2020-10-27 |
| BR112014014868B1 true BR112014014868B1 (pt) | 2022-12-27 |
Family
ID=47520247
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112014014868-6A BR112014014868B1 (pt) | 2011-12-19 | 2012-12-04 | Composições de hormônio estimulante da tiroide, métodos de produção do mesmo e uso de tais composições |
Country Status (8)
| Country | Link |
|---|---|
| US (4) | US20140357846A1 (pt) |
| EP (1) | EP2793948B1 (pt) |
| JP (1) | JP6255348B2 (pt) |
| KR (1) | KR102071731B1 (pt) |
| CN (1) | CN104220097B (pt) |
| BR (1) | BR112014014868B1 (pt) |
| HK (1) | HK1198424A1 (pt) |
| WO (1) | WO2013095905A1 (pt) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101687270B1 (ko) | 2013-10-29 | 2016-12-19 | 한국 한의학 연구원 | 상륙 추출물 또는 이의 분획물을 함유하는 갑상선 질환의 예방 또는 치료용 조성물 |
| KR101794289B1 (ko) * | 2015-11-05 | 2017-11-06 | 주식회사 프로젠 | 재조합 인간 갑상선 자극 호르몬을 포함하는 조성물 및 상기 재조합 인간 갑상선 자극 호르몬의 정제 방법 |
| MA45473A (fr) * | 2016-04-04 | 2019-02-13 | Shire Human Genetic Therapies | Inhibiteur de c1 estérase conjugué et ses utilisations |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4179337A (en) * | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| EP0228604A3 (en) | 1985-12-11 | 1988-10-12 | Sloan-Kettering Institute For Cancer Research | Isolation of a gene encoding human thyrotropin beta subunit |
| BR122013003013B8 (pt) * | 1999-01-14 | 2021-07-06 | Bolder Biotechnology Inc | proteína isolada monopeguilada do hormônio do crescimento e método para sua obtenção |
| US20040077540A1 (en) * | 2002-06-28 | 2004-04-22 | Nastech Pharmaceutical Company Inc. | Compositions and methods for modulating physiology of epithelial junctional adhesion molecules for enhanced mucosal delivery of therapeutic compounds |
| GB0216780D0 (en) | 2002-07-19 | 2002-08-28 | Bradford Particle Design Ltd | Methods of particle formation |
| ATE425767T1 (de) * | 2002-12-19 | 2009-04-15 | Nektar Therapeutics Al Corp | Konjugate von cyanovirin-varianten und einem polyalkylenoxid |
| US20050171017A1 (en) * | 2003-12-05 | 2005-08-04 | Kelly James D. | Methods for treating inflammation using thyroid stimulating hormone |
| JP5216580B2 (ja) * | 2005-05-25 | 2013-06-19 | ノヴォ ノルディスク アー/エス | グリコペグ化第ix因子 |
| US20080171696A1 (en) * | 2005-10-21 | 2008-07-17 | Avigenics, Inc. | Pharmacodynamically enhanced therapeutic proteins |
| AU2007281998B2 (en) * | 2006-08-04 | 2014-02-20 | Pharmathene Inc. | Long half-life recombinant butyrylcholinesterase |
| DK2063909T3 (da) * | 2006-09-19 | 2013-01-02 | Genzyme Corp | Formuleringer til terapeutisk administration af thyroid-stimuleringshormon (TSH) |
| CA2711503A1 (en) * | 2008-01-08 | 2009-07-16 | Biogenerix Ag | Glycoconjugation of polypeptides using oligosaccharyltransferases |
| US20120135912A1 (en) * | 2010-05-10 | 2012-05-31 | Perseid Therapeutics Llc | Polypeptide inhibitors of vla4 |
| IT1404011B1 (it) * | 2010-12-03 | 2013-11-08 | Uni Degli Studi Magna Graecia Di Catanzaro | Nanovettore coniugato con tsh per il trattamento del cancro della tiroide |
-
2012
- 2012-12-04 EP EP12812433.6A patent/EP2793948B1/en active Active
- 2012-12-04 CN CN201280069717.0A patent/CN104220097B/zh active Active
- 2012-12-04 WO PCT/US2012/067705 patent/WO2013095905A1/en active Application Filing
- 2012-12-04 BR BR112014014868-6A patent/BR112014014868B1/pt active IP Right Grant
- 2012-12-04 KR KR1020147019638A patent/KR102071731B1/ko active IP Right Grant
- 2012-12-04 JP JP2014547275A patent/JP6255348B2/ja active Active
-
2014
- 2014-06-18 US US14/308,284 patent/US20140357846A1/en not_active Abandoned
- 2014-11-26 HK HK14111926.0A patent/HK1198424A1/xx unknown
-
2016
- 2016-04-12 US US15/096,879 patent/US20170065725A1/en not_active Abandoned
-
2017
- 2017-12-22 US US15/852,581 patent/US20180326082A1/en not_active Abandoned
-
2022
- 2022-05-23 US US17/751,433 patent/US20230126645A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| HK1198424A1 (en) | 2015-04-24 |
| EP2793948A1 (en) | 2014-10-29 |
| US20180326082A1 (en) | 2018-11-15 |
| KR20140103165A (ko) | 2014-08-25 |
| US20140357846A1 (en) | 2014-12-04 |
| US20230126645A1 (en) | 2023-04-27 |
| KR102071731B1 (ko) | 2020-01-30 |
| JP2015502363A (ja) | 2015-01-22 |
| WO2013095905A1 (en) | 2013-06-27 |
| CN104220097A (zh) | 2014-12-17 |
| CN104220097B (zh) | 2019-08-09 |
| BR112014014868A2 (pt) | 2020-10-27 |
| US20170065725A1 (en) | 2017-03-09 |
| EP2793948B1 (en) | 2022-03-23 |
| JP6255348B2 (ja) | 2017-12-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230126645A1 (en) | Thyroid stimulating hormone compositions | |
| KR101483917B1 (ko) | Fviii의 부위 지향 변형 | |
| KR101503085B1 (ko) | 방출가능한 연결을 갖는 폰 빌레브란드 인자 및 인자 ⅷ폴리머 컨주게이트 | |
| JP5878757B2 (ja) | Fgf21変異体およびその使用 | |
| US8642545B2 (en) | Erythropoietin mimetic peptide derivative and its pharmaceutical salts, the preparation and uses thereof | |
| BRPI0721984B1 (pt) | interferon-2b peguilado (ifn-2b), seu método de preparo e de purificação, composição, bem como uso dos mesmos | |
| Yi et al. | Pluronic modified leptin with increased systemic circulation, brain uptake and efficacy for treatment of obesity | |
| ES2386575T3 (es) | Interferón alfa 2a modificado por polietilenglicol, su proceso de síntesis y su aplicación | |
| BRPI0822530A2 (pt) | hormônio do crescimento modificado por polietileno glicol de fita dupla, método de preparação e sua aplicação | |
| WO2023227015A1 (zh) | 具有延长的半衰期的fviii融合蛋白缀合物及其应用 | |
| KR20190031256A (ko) | 옥심-함유 결합을 갖는 인자 viii 모이어티의 컨쥬게이트 | |
| JP6367952B2 (ja) | エリスロポエチンおよび分枝ポリマー構造を含む複合体 | |
| RU2607527C2 (ru) | Ковалентный моноконъюгат полиэтиленгликоля с тимозином бета 4, устойчивый к деградации в токе крови, и способ его получения |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] |
Free format text: DE ACORDO COM O ARTIGO 229-C DA LEI NO 10196/2001, QUE MODIFICOU A LEI NO 9279/96, A CONCESSAO DA PATENTE ESTA CONDICIONADA A ANUENCIA PREVIA DA ANVISA. CONSIDERANDO A APROVACAO DOS TERMOS DO PARECER NO 337/PGF/EA/2010, BEM COMO A PORTARIA INTERMINISTERIAL NO 1065 DE 24/05/2012, ENCAMINHA-SE O PRESENTE PEDIDO PARA AS PROVIDENCIAS CABIVEIS. |
|
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] | ||
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B350 | Update of information on the portal [chapter 15.35 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 04/12/2012, OBSERVADAS AS CONDICOES LEGAIS. PATENTE CONCEDIDA CONFORME ADI 5.529/DF, QUE DETERMINA A ALTERACAO DO PRAZO DE CONCESSAO. |