WO2021148684A1 - Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario - Google Patents
Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario Download PDFInfo
- Publication number
- WO2021148684A1 WO2021148684A1 PCT/ES2020/070037 ES2020070037W WO2021148684A1 WO 2021148684 A1 WO2021148684 A1 WO 2021148684A1 ES 2020070037 W ES2020070037 W ES 2020070037W WO 2021148684 A1 WO2021148684 A1 WO 2021148684A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- biopesticidal
- composition according
- cinnamaldehyde
- biopesticidal composition
- cinnamomum
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N65/00—Biocides, pest repellants or attractants, or plant growth regulators containing material from algae, lichens, bryophyta, multi-cellular fungi or plants, or extracts thereof
- A01N65/40—Liliopsida [monocotyledons]
- A01N65/48—Zingiberaceae [Ginger family], e.g. ginger or galangal
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01P—BIOCIDAL, PEST REPELLANT, PEST ATTRACTANT OR PLANT GROWTH REGULATORY ACTIVITY OF CHEMICAL COMPOUNDS OR PREPARATIONS
- A01P7/00—Arthropodicides
- A01P7/04—Insecticides
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N25/00—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests
- A01N25/26—Biocides, pest repellants or attractants, or plant growth regulators, characterised by their forms, or by their non-active ingredients or by their methods of application, e.g. seed treatment or sequential application; Substances for reducing the noxious effect of the active ingredients to organisms other than pests in coated particulate form
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N35/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having two bonds to hetero atoms with at the most one bond to halogen, e.g. aldehyde radical
- A01N35/02—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having two bonds to hetero atoms with at the most one bond to halogen, e.g. aldehyde radical containing aliphatically bound aldehyde or keto groups, or thio analogues thereof; Derivatives thereof, e.g. acetals
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N37/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom having three bonds to hetero atoms with at the most two bonds to halogen, e.g. carboxylic acids
- A01N37/10—Aromatic or araliphatic carboxylic acids, or thio analogues thereof; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N49/00—Biocides, pest repellants or attractants, or plant growth regulators, containing compounds containing the group, wherein m+n>=1, both X together may also mean —Y— or a direct carbon-to-carbon bond, and the carbon atoms marked with an asterisk are not part of any ring system other than that which may be formed by the atoms X, the carbon atoms in square brackets being part of any acyclic or cyclic structure, or the group, wherein A means a carbon atom or Y, n>=0, and not more than one of these carbon atoms being a member of the same ring system, e.g. juvenile insect hormones or mimics thereof
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N65/00—Biocides, pest repellants or attractants, or plant growth regulators containing material from algae, lichens, bryophyta, multi-cellular fungi or plants, or extracts thereof
- A01N65/08—Magnoliopsida [dicotyledons]
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N65/00—Biocides, pest repellants or attractants, or plant growth regulators containing material from algae, lichens, bryophyta, multi-cellular fungi or plants, or extracts thereof
- A01N65/08—Magnoliopsida [dicotyledons]
- A01N65/20—Fabaceae or Leguminosae [Pea or Legume family], e.g. pea, lentil, soybean, clover, acacia, honey locust, derris or millettia
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N65/00—Biocides, pest repellants or attractants, or plant growth regulators containing material from algae, lichens, bryophyta, multi-cellular fungi or plants, or extracts thereof
- A01N65/08—Magnoliopsida [dicotyledons]
- A01N65/22—Lamiaceae or Labiatae [Mint family], e.g. thyme, rosemary, skullcap, selfheal, lavender, perilla, pennyroyal, peppermint or spearmint
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N65/00—Biocides, pest repellants or attractants, or plant growth regulators containing material from algae, lichens, bryophyta, multi-cellular fungi or plants, or extracts thereof
- A01N65/08—Magnoliopsida [dicotyledons]
- A01N65/24—Lauraceae [Laurel family], e.g. laurel, avocado, sassafras, cinnamon or camphor
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Definitions
- the invention falls within the field of Agriculture and Plant Biotechnology; and more specifically in the field of biopesticides derived from plant materials and particularly within the field of biochemical biopesticides that comprise natural substances such as extracts and fatty acids that control pests and diseases.
- Plants constitute a natural factory of chemical substances with biopesticidal activity, derived mainly from secondary metabolism and as a consequence of millions of years of coevolution between plants and pests. These substances are characterized by belonging to different chemical classes, which results in a great multifunctionality. Among them are: terpenes, sterols, alkaloids, polyphenols (flavones, isoflavones, coumarins, lignans, iridoids, phenylpropanoids), glucosinolates, isothiocyanates, fatty acids, esters and essential oils.
- ESAs essential oils
- EAs essential oils
- Plant Oils obtained mainly from aromatic, medicinal and / or condiment plants through different distillation and / or extraction processes with low polarity solvents including CO2 (supercritical extraction).
- EAs constitute the most volatile part of numerous plant species, fundamentally belonging to the Lamiaceae family, and comprise complex mixtures of monoterpenes, sesquiterpenes and aromatic compounds. These compounds, without a doubt, are the natural components most used in the development of biopesticides. Papers that refer to the application of EPAs as "potential" biopesticides for the control of pests and diseases occupy more than 70% of the total scientific publications on plant protection compounds derived from plants. However, 95% of these publications only deal with studies at the laboratory level and very few refer to real possibilities for scaling up. (Green Pesticides Handbook. Essential Oils for Pest Control. ISBN: 13: 978-1-4987-5938-0, 2017).
- the present invention overcomes the limitations existing in the state of the art. It consists in the development of new biopesticidal compositions that can be used in the phytosanitary treatment of fly pests, mainly of the whitefly complex (Hemiptera: Aleyrodidae).
- the biopesticidal compositions of the invention are at the same time easily obtainable, scalable and effective; equaling and / or exceeding the efficacy of chemical synthesis products and / or products of natural origin currently used in conventional and organic agricultural systems.
- they have the advantage of attenuating the development of cross-resistance, not presenting phytotoxicity and being respectful with the environment.
- Conventional insecticides contain one or two active molecules obtained by chemical synthesis and generally belonging to the same chemical group or closely related groups. These molecules affect in a very specific way a single point of action (target site) of the target. This specificity of action on a common receptor is the main cause of the appearance of cross-resistance with the consequent loss of efficacy (IRAC, 2019; https://bit.ly/33t9FF8). Likewise, most of the natural solutions on the market come from plant extracts where those containing between 3-5 active molecules predominate, with the consequent risk of resistance development.
- compositions claimed in this invention have a complex chemical composition. They have in common a synergistic bioactive nucleus made up of active molecules belonging to widely divergent chemical classes. Said complexity is directly associated with the multifunctionality of the formulation in terms of modes of action and overall efficacy. Chemically different molecules can affect the same mode of action (eg, repellency) by acting on different receptors (sites of action). In these cases, the risk of developing cross-resistance is almost nil.
- the formulations contain secondary plant metabolites that normally exist in nature and exhibit a rapid degradation rate.
- Requiem® (Bayer): Contains approximately 25% of Chenopodium ambrosioides extract components, specifically a mixture of ⁇ -terpinene, p-cymene and limonene.
- Pre-VAM® (Oro Agri SA. Ltd.): Contains between 6-10% orange oil (Orange oil) with a limonene content greater than 90%.
- Pirecris® (SEIPASA): Contains 2% natural pyrethrins.
- Agroneem TM (Ajay Bio Tech India Limited Body Join). It contains azadirachtin, the main component of Neem oil (Azadirachta indica).
- compositions disclosed in the present invention have clear advantages over such formulations as regards:
- Table 1 shows a comparison of the advantages of the disclosed compositions compared to formulations of a similar nature.
- Pre-VAM® (Oro Agri SA. Ltd.) is a natural formulation composed of orange oil and approved for use as a phytosanitary in the USA, Canada, Europe and other countries. Despite its effectiveness, it has several disadvantages compared to the compositions claimed in this invention. The majority presence in its composition of a single ingredient (more than 95% d-limonene) with a proposed mechanism of action, increases the risk of the appearance of resistance. Furthermore, the high volatility and instability of orange oil make its application difficult in open field conditions (Green Pesticides Handbook. Essential oil for pest control. Chapter 15. Orange oil.
- Biopesticidal compositions or biopesticidal compositions or phytosanitary compositions are terms that are used interchangeably herein. They can be defined as any biological entity, living or of natural origin, including by-products and / or chemical substances derived from them; that controls / regulates everything that we call plague and / or plant disease.
- essential oils, oleoresins, aqueous, alcoholic or hydroalcoholic extracts are products obtained from the root or rhizomes of Zingiberoff ⁇ cinale Roscoe. These products can be crude products as they are obtained from their extraction process or they can be fractions thereof that can be obtained by a fractionation directed by chromatographic methods, liquid-liquid separation, evaporation, crystallization or distillation. Furthermore, these products can be pure substances or mixtures of substances.
- Source of cinnamaldehyde herein includes any mixture of compounds which includes cinnamaldehyde or from which cinnamaldehyde can be obtained.
- bioactive core equates to "first component”.
- active elements equates to “active ingredients”.
- encapsulating agent equates to "encapsulating matrix.”
- Fluid application broth or solution refers to the dilute biopesticidal composition ready for application.
- Additional substances and coformulants are terms that are used interchangeably herein. They refer to inert substances that can be part of the pesticidal composition and whose objective is to increase its effectiveness. Examples of these substances are adjuvants, dispersing agents, penetrating agents, emulsifiers, stabilizers, flavors, antifoams and / or preservatives.
- Pure compounds refers to any natural compound that acts as a second active component in the biopesticide composition and that can be obtained by a synthetic process, as part of a semi-purified fraction or isolated in its pure state from natural sources that contain it.
- the technical problem solved by the present invention is the development of biopesticidal compositions used in the phytosanitary treatment of pests included in the group of whiteflies.
- the compositions comprise a bioactive core (consisting of an essential oil, oleoresin, aqueous, alcoholic or hydroalcoholic extract of the root or rhizomes of Zingiber officinale and cinnamaldehyde or a source of cinnamaldehyde).
- a bioactive core consisting of an essential oil, oleoresin, aqueous, alcoholic or hydroalcoholic extract of the root or rhizomes of Zingiber officinale and cinnamaldehyde or a source of cinnamaldehyde.
- the present invention discloses a biopesticidal composition
- a biopesticidal composition comprising a synergistic bioactive core formed by: essential oil, oleoresin, aqueous, alcoholic or hydroalcoholic extract of the root or rhizomes of Zingiber officinale Roscoe and - cinnamaldehyde or a source of cinnamaldehyde.
- the concentration,% w / w (% w / w) of each component in the bioactive nucleus is in the following ranges: essential oil, oleoresin, aqueous, alcoholic or hydroalcoholic extract from the root or rhizomes of Zingiber officinale Roscoe: 0, 1-99.9% (w / w), preferably 10-90% (w / w), more preferably 20-80% (w / w), still more preferably 30-70% (w / w) and more preferably 40-60% (w / w) and cinnamaldehyde or a cinnamaldehyde source: 0.1-99, 9% (w / w), preferably 10-90% (w / w), more preferably 20-80% (w / w), even more preferably 30-70% (w / w) and more preferably 40-60% (p / p).
- Cinnamaldehyde can be the trans isomer, cis or the mixture of isomers.
- Cinnamaldehyde as a component of the bioactive core is obtained as:
- the source of cinnamaldehyde as a component of the bioactive core can be extracts / essential oils of plant species that contain it, preferably of the genus Cinnamomum sp.
- Significant examples of species of this genus that contain cinnamaldehyde are: C. verum. (synonymy Cinnamomum zeylanicum), C. cassia, C. lourestory, C. burmannii, C. tamala, C. osmophloeum, C. bejolghota, C. dubium, C. rivulomm, C. citriodomm and C. camphora.
- the cinnamaldehyde and / or the cinnamaldehyde source can be used in free form and / or encapsulated in an encapsulating agent.
- the encapsulating agent can be selected from: maltodextrins, cyclodextrins, lecithins, vegetable oils and / or silica excipients, the latter comprising silica gel (silica gel), colloidal silica and silicon dioxides, preferably cyclodextrins are used.
- the encapsulated form of the cinnamaldehyde source increases its biological activity and favors the controlled release of the active ingredient or element.
- the biopesticidal compositions further comprise a second component.
- This second component can be one or more elements or active ingredients.
- the active ingredient as the second component can be selected from one or more of: botanical extracts or fractions of the extracts, extract obtained from fermented microorganisms or fractions of said extracts, pure compounds selected from geranial (citral A), neral (citral B ), saponins, benzyl alcohol, benzyl benzoate, benzyl acetate, eugenol, 1,8-cineole, thymol, geraniol, geranyl acetate and fatty acids, selected from: saturated short and long chain, preferably long chain and unsaturated and fatty acid derivatives (eg methylated, fatty acid methyl esters, FAME, “fatty acid methyl ester”) more preferably long chain saturated fatty acids and / or unsaturated fatty acids and lecithin, preferably from egg, sunflower, rapes
- the botanical extract can be selected from: aqueous, alcoholic and hydroalcoholic extracts and / or essential oils.
- the origin of the botanical extract can be selected from agroindustrial residues, bulbs, seeds, leaves, follicles, flowers and / or complete aerial part from plants belonging to the following genera: Allium sp., Angelica sp., Annona sp., Artemisia sp., Camm sp., Cass / a sp., Chenopodium sp., Citrus sp., Coffea sp., Crccus sp., Turmeric sp., Cyamopsis sp., Cymbopogon sp., Cytisus sp., Eucalyptus sp., Eurycoma sp., Ficus sp., Foeniculum sp., Fumaria sp., Geranium sp., Ginkgo sp., Helianthus sp., Hyssopus sp., Jatropha sp., Lavandula
- Ocimum sp. Olea sp., Papa ver sp., Pelargononium sp., Persea sp., Petroselinum sp., Pimpinella sp., Prunus sp., Quassia sp., Retama sp., Rheum sp., Rosmarinus sp., Salvia sp., Satureja sp., Schoenocaulon sp., Syzygium sp., Trigonella sp., Thymus sp.
- Vitis sp. preferably the species: Allium sativum, Angelica archangelica, Annona cherimola, Artemisia absinthium, Camm carvi, Cassia angustifolia, Cassia senna, Chenopodium ambmsioides, Citrus aurantium, Citrus lemon, Citms sinensis, Coffea arabica, Crocus corsivus, Crocus , Crocus speciosus, Crocus vemus, Aromatic turmeric, Turmeric loriga, Cymbopogon citratus, Cyamopsis tetragonoloba, Cymbopogon flexuosus, Cymbopogon martinii, Cymbopogon nardus, Cytisus scoparius, Eucalyptus camaldulensis, Eucalyptus, Eucalyptus globulis, Eucalyptus globulisinalia, Eucalyptus
- Pinpinella anisum Pinpinella anisum
- Prunus tigrsica Quassia amara
- Retama monosperma Retama monosperma
- Rheum rhabarbarum Rheum officinale
- Rosmarinus officinalis Rosmarinus officinalis
- Salvia lavandulifolia Salvia off ⁇ cinalis
- Satureja montana Schoenocaulon officinale
- Syzygium aromaticum Trigonella foenum-graecum
- Thymus vulgaris Thymus zygis and Vitis vinifera.
- Microorganism ferments refer to the fermentation extract or liquid (pure or previously extracted with an organic solvent) resulting from the fermentation process of a microorganism (fungus or bacteria) in the presence of a plant substrate and once the living microorganism has been eliminated by means of a pasteurization process.
- the extract obtained from the ferment of microorganisms can be selected from extracts obtained from the fermentation of a substrate with Bacillus sp., Pseudomonas sp., Trichoderma sp., Corynebacterium sp. and Aspergillus sp, preferably: Aspergillus niger, Trichoderma harzianum, Bacillus thuringiensis, Pseudomonas fluorescens, Bacillus amyloliquefaciens, Corynebacterium eff ⁇ ciens and Bacillus subtilis.
- the fermentation substrate can be chosen from agro-industrial residues, bulbs, seeds, leaves, follicles, flowers and / or complete aerial part from plants belonging to the following genera: Zingiber sp., Citrus sp., Cyamopsis sp., Crocus sp. ., Helianthus sp., Petroselinum sp., Papaver sp., Rheum sp., Salvia sp., Retama sp., Lavandula sp., Prunus sp., Persea sp., Turmeric sp. and Thymus sp, preferably: Agaricus bisporus, Cyamopsis tetragonoloba, Helianthus annus, Citrus x sinensis and Glycine max.
- the pure compounds can be obtained from one (s) of the following sources: for the citral, geranial and neral isomers, the species included in the genera Cymbopogon sp. [ex. C. citratus, C. martinii, C. flexuosus, C. winterianus, C. nardus), among others], Litsea sp. (eg L cubeba, L citrate., among others), Aloysia sp. (eg A. citrodora, among others), Odmun sp. (eg O. gratissimum, among others), Melissa sp. (eg M. off ⁇ cinalis, among others) and Citrus sp.
- Cymbopogon sp. eg L cubeba, L citrate., among others
- Aloysia sp. eg A. citrodora, among others
- Odmun sp. eg O. gratissimum,
- Cinnamomum sp. for eugenol those included in the genus Cinnamomum sp. [ex. C. verum (syn., Cinnamomum zeylanicum), C. cassia, C. citriodorum, C. camphora, among others], Syzygium sp. (eg S. aromaticum, among others), Turmeric sp. (eg C. longa, among others), Zingiber sp. (eg Z. officinale, among others) and Ocimum sp. (eg O. tenuif ⁇ orum, among others), for saponins the species included in the genera Cyamopsis sp. (eg C. verum (syn., Cinnamomum zeylanicum), C. cassia, C. citriodorum, C. camphora, among others], Syzygium sp. (eg S. aromaticum, among others), Turmeric sp. (e
- Quillaja sp. eg Q. saponaria, among others
- Trigonella sp. eg T. foenum-graceum, among others
- Saponaria sp. S. off ⁇ cinalis, among others
- Crocus sp. eg C. sativus, among others
- Yucca sp. eg Y. schidigera, among others
- Beta sp. ex.
- B. vulgaris, among others Hederá sp. (eg H. helix, among others), Polygala sp. and Primrose sp.
- benzyl alcohol those included in the genera Cinnamomum sp. (eg C. cassia) and Jasminum sp. (eg J. grandiflorum, among others), for 1.8 cineole (Eucalyptol) the species included in the genera Eucalyptus sp. (eg E. globulus, E. camaldulensis, among others), Salvia sp. (eg S. officinalis, S. fructicosa, among others), Thymus sp. (eg T. vulgaris, T. zlgys, T. capitatus, among others), Turmeric sp. (ex.
- Rosmarinus sp. eg R. officinalis, among others
- Artemisia sp. eg A. vulgaris, among others
- Cymbopogon sp. eg C. citratus, C. martini, C. flexuosus, C. winterianus, C. nardus, among others
- Geranium sp. G. pretense, G. macrorrhizum, among others
- Pelargonium sp. eg P.
- hirsutum, among others for fatty acids are the species included in the genera Persea sp. (eg P. americana, among others), Glycine sp. (eg G. max, among others), Helianthus sp. (eg H. annuus, among others), Olea sp. (eg Olea europaea) and other oilseeds, total synthesis, semisynthesis or biomimetic synthesis of the pure compound and / or analogues by means of structure activity relationship studies (SAR) and
- filamentous fungi such as Aspergillus sp., bacteria and insects in biotransformation and / or bioconversion processes.
- Lecithin is selected from:
- the second component can be used in free or encapsulated form.
- the concentration of the second component in the biopesticidal composition is combined with the bioactive core, in the following concentration range, weight / total volume of the composition: 1-30% (w / v), preferably 5-25% (w / v) and even more preferably 10-20% (w / v).
- the biopesticidal compositions can also comprise at least one inert substance that can be selected from: adjuvants, emulsifiers, dispersants, flavorings, preservatives, defoamers, thixotropic agents, encapsulation matrices, fatty acids, phospholipids, and mixtures thereof.
- the adjuvants can be organosilicon compounds from the group of organosiloxanes.
- Thixotropic agents can be carboxymethyl cellulose, sodium carboxymethyl cellulose, microcrystalline cellulose and other cellulose derivatives, preferably rubber and gel.
- the encapsulation matrices can be selected from: maltodextrins, ci el od extrins, lecithins, vegetable oils and / or silica excipients, the latter comprising silica gel (silica gel), colloidal silica and silicon dioxides, preferably cyclodextrins are used.
- the biopesticidal composition comprises the bioactive core, lecithin and optionally other substances mentioned as second components and / or inert substances.
- the biopesticidal composition is selected from the biopesticidal compositions that comprise:
- the present invention also relates to a final application broth or solution comprising the biopesticidal composition defined above diluted with a solvent, preferably aqueous and more preferably water.
- the concentration of each component of the bioactive core in the final application broth is in the range: essential oil, oleoresin, aqueous, alcoholic or hydroalcoholic extract of the root or rhizomes of Zingiber officinale Roscoe: 0.01-0.99% (p / v), preferably 0.05-0.95% (w / v), preferably 0.1-0.9% (w / v), more preferably 0.2-0.8% (w / v), even more preferably 0.3-0.7% (w / v) and more preferably 0.4-0.6% (w / v) and cinnamaldehyde or a source of cinnamaldehyde: 0.01-0.99% (p / v), preferably 0.05-0.95% (w / v), preferably 0.1-0.9% (w / v), more preferably 0.2-0.8% (w / v), even more preferably 0.3-0.7% (w / v) and more preferably 0.4-0.6% (w / v).
- the selected plant species present great biodiversity and sustainability in cultivation, guaranteeing the availability of the starting material.
- obtaining the extract, as a component of some biopesticidal compositions constitutes an alternative to the recovery of a plant material with very little or no commercial value and that is managed as waste in the processing of the agri-food industry.
- the optimized extraction and formulation process disclosed is clean, fast, efficient and easily scalable, which results in a reduction in the final cost of the product in the market.
- An additional object of the invention constitutes the process for obtaining the biopesticidal composition of the invention, which comprises the mixture in an aqueous medium of the components of the bioactive core:
- the essential oil, oleoresin, aqueous, alcoholic or hydroalcoholic extract of Zingiber officinale Roscoe can be obtained by maceration, percolation, decoction, infusion, hydrodistillation- Clevenger; extraction assisted by ultrasound, by microwaves, by supercritical fluids; Soxhlet type extraction, extrusion, steam distillation (direct, indirect, through pressure and / or vacuum) or solvent extraction (hot or cold) and preferably in a multifunctional dispersion system with a colloid mill.
- the source of cinnamaldehyde can be obtained by distilling a species of those indicated above that contains it. Cinnamaldehyde can be encapsulated prior to the formation of the bioactive core.
- the biopesticidal compositions are obtained from the ordered mixture and in specific proportions, of the synergistic bioactive core, at least one secondary component and / or at least one inert substance. They are subsequently added to the mixture, in an orderly manner, and with a stirring period after the addition of each component.
- the mixing of the components of the bioactive core is carried out at a speed in the range between 500 and 4000 rpm, preferably between 1500 and 3000 rpm.
- the mixture is carried out in an aqueous medium.
- the temperature of the mixture is between 20 and 40 ° C, preferably between 24 and 35 ° C and for a period between 30 and 120 minutes, preferably 40 and 100 minutes.
- the process for preparing the biopesticidal compositions can be carried out in the apparatus or reactors commonly used to carry out these tasks in the technical field.
- a further object of the invention constitutes the use of biopesticidal compositions for the control of fly pests.
- whiteflies preferably those belonging to the genera Bemisia sp. "Complex" (biotypes), Dialeurodes sp., Trialeurodes sp. Encarsia sp., Aleurolobus sp., Aleurothr ⁇ xus sp., Aleurodicus sp., Aleyrodes sp., Parabemisia sp., Paraleyrodes sp., Orchamoplatus sp., Siphoninus sp. and Tetraleurodes sp.
- Complex biotypes
- Dialeurodes sp. Trialeurodes sp. Encarsia sp.
- Aleurolobus sp. Aleurothr ⁇ xus sp.
- Aleurodicus sp. Aleurodicus sp.
- Aleyrodes sp. Parabemisia sp.
- the elements of the biopesticidal compositions act in a synergistic, additive, polyvalent and / or potentiating way.
- Biopesticides have a prolonged effect through a controlled release mechanism.
- the biopesticidal composition can be used:
- biopesticides can be applied individually or in combination with other phytosanitary products or pest and disease control systems.
- phytosanitary products or pest control systems we mean any type of insecticides, nematicides, acaricides, fungicides, bactericides, herbicides, plant growth regulators, elicitors, fertilizers, soil conditioners, and baits, among others.
- the application of the biopesticide composition can be by foliar spraying.
- the applications of the biopesticidal compositions are carried out in agricultural crops for food and non-food use, be it conventional, organic or ecological agriculture, preferably in horticultural, extensive and ornamental crops and gardening, as well as parks and sports facilities.
- the applications are made in greenhouses and in open fields, as well as gardens and green areas of sports and recreational facilities.
- the dose of the biopesticide composition can increase or decrease according to the type of formulation, type and intensity of attack of the pest to be controlled, cultivation and country of use.
- Mode of action refers to the specific physical and / or biochemical interaction through which a biopesticide produces its effect.
- microassays in vitro and in vivo developed and / or adapted from the scientific literature were used (for example, choice vs. non-choice tests, direct spraying, ingestion toxicity, bioassay with Y-tube olfactometer, priming bioassays, microscopy, etc.).
- the following bioassays are preferably performed:
- Settling inhibition tests The objective is to evaluate the effect of different doses of the substance on the behavior (settlement) of fly adults. White. It is based on the flies' preference for treated and untreated plants located in the same entomological box (choice trials) or in different (no choice).
- Oviposition inhibition tests The objective is to evaluate the effect of different doses of the substance on the egg laying of adult whiteflies. It is based on the flies' preference for ovipositing on treated and untreated plant surfaces located in the same entomological box (choice trials) or in different (no choice).
- Spatial repellency tests The objective is to measure the ability of the substance to inhibit the preference of whitefly adults for its host plant (olfactometer tests).
- Mode of action 1 Direct contact ("knock down” effect).
- the mechanisms of action involved in this mode of action are:
- Mode of action 2 Action on the olfactory and taste receptors of the fly.
- the mechanisms of action involved in this mode of action are:
- Anti-food effect Inhibition of feeding through the interaction of the components of the formula with the taste receptors.
- Repellent effect Strong repellent effect through the controlled release of encapsulated volatile components and their interaction with olfactory receptors.
- Inhibition of oviposition It considerably reduces the laying of eggs through the interaction of the components of the formula with the chemoreceptors of the adult.
- the mechanisms and modes of action of each of the elements of the bioactive nucleus are summarized in Table 2.
- the ingredients of the bioactive core have a complex chemical composition associated with a great multifunctionality in terms of mechanisms of action.
- the combination of the proposed mechanisms of action determine the efficacy of the bioactive core and minimize the risk of cross-resistance. This efficacy is enhanced with the addition of at least one second active component, as well as inert coformulants (substances) that contribute to increasing the stability of the formulation and favor the controlled release of the active ingredients.
- Figure 2 Diagram of the steam distillation process.
- Figure 3 Flow diagram of the fermentation process.
- Figure 4 Scheme of a biodirected chemical fractionation.
- Figure 5 Design of an in vitro contact mortality test.
- Figure 6 Microscopic observation of whitefly adults in contact mortality tests. A: destabilization of cell membranes, B: blockage of tracheal spiracles (asphyxia).
- Figure 7 “Y” olfactometer designed for spatial repellency tests.
- Figure 8 Experimental design of the in planta feeding inhibition tests.
- Figure 9 Isobolographic analysis of the interaction between the bioactive core components.
- FIG. 10 Chromatogram (GC-MS-MS) of the essential oil of Cinnamomum zeylanicum pure (A) and encapsulated (B).
- Figure 11 Dose-response curve of bioactive core elements for contact mortality (% M).
- Figure 12 Dose-response curve of bioactive core elements for settlement inhibition (% SI).
- Figure 13 Dose-response curve of the elements of the bioactive nucleus for the inhibition of egg laying (% IO).
- Figure 14 Gibbs Triangle Methodology for the study of synergistic, potentiating and / or cooperative mixtures.
- the upper triangle shows the number of synergistic combinations generated between components A, B and C.
- the lower triangle represents the proportion of each of the ingredients A, B and C in the combination.
- Figure 15 Experimental design and distribution of experimental and sample plots in the test of the composition WF_F4 against whitefly in eggplant.
- bioactive nucleus comprises 10.5% of hydroalcoholic extract of roots / rhizomes of Zingiberoff ⁇ cinale and 15% of essential oil of Cinnamomum verum J. Presl. (syn., C. zeylanicum Blume), as a source of cinnamaldehyde (CAS 8015-91-6) in water.
- the essential oil can be incorporated freely (as 100% essential oil) and / or partially or totally encapsulated with an encapsulating agent.
- the encapsulating agent is ⁇ -cyclodextrin.
- the mixing of the elements of the bioactive core is carried out in a stainless steel reactor ( Figure 1) with a total capacity of 650 liters and a useful capacity of 560 liters. It is equipped with a double jacket through which a heat exchanger fluid circulates to control the temperature inside the tank through a PT100 sensor.
- the reactor is equipped with two stirrers: a central disk stirrer type cowles (maximum speed 1500 rpm) and a high speed emulsifier (3000 rpm, ultra-turrax type) located at the bottom of the reactor. Both agitators are independently controlled to achieve specific speed and rotation control for each ingredient and moment during the mixing process.
- the reactor is connected to a vacuum pump that is used to eliminate air bubbles that form in the product and prevent the formation of gas-liquid interfaces. It also presents an inert gas injection system to avoid work in the presence of oxygen and thus avoid oxidative processes. Finally, the reactor has a CIP (“cleaning in place”) type cleaning system for automatic cleaning.
- CIP cleaning in place
- Each biopesticide composition is formulated according to a specific mixing order according to the nature of the active elements and coformulants that compose it.
- the elements of the bioactive core are used in the final composition in two ways:
- the procedure consists of the following general stages: a. Selection of raw materials ⁇ Active elements
- Table 3 includes several examples of biopesticidal compositions disclosed within the framework of this patent.
- An example of the procedure for obtaining each of the variants is detailed below. This process is extensive for the rest of the compositions that are listed in Table 3 (MxM14, MxM15, MxM22, MxM19, MxM12, MxM16 and MxM25).
- composition M1 a biopesticidal composition
- bioactive nucleus 7.5% of hydroalcoholic extract of Z officinale and 10% of essential oil of C. verum as a source of cinnamaldehyde
- 17.5 % soy lecithin CAS: 8002-43-5
- Biopesticidal composition formed by the bioactive nucleus and extract of Persea americana as the second component.
- the bioactive nucleus (7.5% of hydroalcoholic extract of Z officinale and 5% of Cinnamaldehyde (CAS 104-55-2), as a source of cinnamaldehyde) are mixed with 20% of hydroalcoholic extract of Persea americana (second component), to form composition M2 (Table 3).
- Biopesticidal composition formed by the bioactive nucleus + inert substances.
- the bioactive nucleus (12.5% of hydroalcoholic extract of Z officinale and 12.5% of essential oil of C. verum, as a source of cinnamaldehyde) are mixed with a 10% of a silicone derivative of the organosiloxane type (adjuvant), to form the composition M3 (Table 3).
- composition M4 a biopesticidal composition
- bioactive nucleus 1% of hydroalcoholic extract of Z officinaie and 12.5% of essential oil of C. verum, as a source of cinnamaldehyde
- composition M4 Second components
- Biopesticidal composition formed by the bioactive core, soy lecithin, inert substances and / or a second active component.
- the bioactive core (7.5% hydroalcoholic extract of Z. off ⁇ cinale and 16.0% essential oil of C. verum, as a source of cinnamaldehyde) are mixed with 17.5% lecithin soybean (second component with emulsifier and enhancer function), 13% of an organosilicon adjuvant and 10% of a polymeric adjuvant that acts as a dispersing agent.
- lecithin soybean second component with emulsifier and enhancer function
- 13% of an organosilicon adjuvant 13%
- 10% of a polymeric adjuvant that acts as a dispersing agent 13% of the essential oil of C. verum is added in free form
- 3% of the essential oil of C. verum is added encapsulated in 10% of ⁇ -cyclodextrin to form the composition WF_F4 y (Table 3 ).
- bioactive nucleus 7 of hydroalcoholic extract of Z. officinale and 2.5% of essential oil of C. cassia, as a source of cinnamaldehyde
- bioactive nucleus 7 of hydroalcoholic extract of Z. officinale and 2.5% of essential oil of C. cassia, as a source of cinnamaldehyde
- hydroalcoholic extract of Persea americana 10% Cymbopogon citratus essential oil
- soy lecithin second component with emulsifier and enhancer function
- the extract of P. americana and essential oil of C. citratus are also considered as second components.
- the bioactive core 3% hydroalcoholic extract of Z. officinale and 2.5% essential oil of C. verum, as a source of cinnamaldehyde
- the bioactive core 3% hydroalcoholic extract of Z. officinale and 2.5% essential oil of C. verum, as a source of cinnamaldehyde
- 7% hydroalcoholic extract of Persea americana 47.7% Aspergillus niger ferment, 17.5% soy lecithin and inert substances.
- the extract of P. americana and the fermentation product of Aspergillus and the lecithin are considered as second components.
- the elements of the bioactive core, second components, and the rest of the inert substances are carefully added in a certain order, adjusting the temperature and rotation variables of each stirrer as detailed. in Table 11.
- composition MxM5 In an example of a biopesticidal composition, the bioactive nucleus (1% of hydroalcoholic extract of Z. officinale and 0.5% of essential oil of C. verum, as a source of cinnamaldehyde) are mixed with 12.5% of citral , 20% benzyl benzoate, 17.5% soy lecithin (enhancing emulsifier) and inert substances. In this particular case, the pure compounds citral and benzyl benzoate are considered second components. Taking into account the characteristics of the reactor described in example 1, the elements of the bioactive core, the second components, and the inert substances are carefully added in a certain order, adjusting the temperature and rotation variables of each stirrer as detailed in the Table 12. Example 3. Methodology for obtaining the second components
- the plant material described in Example 2 is subjected to different extraction processes to obtain the second components, both those that make up the bioactive core and those that are used as the second component.
- Aqueous, alcoholic and / or hydroalcoholic extracts For the aqueous extraction, water is used. In the case of alcoholic extraction, an extraction with solvents is used, preferably ethanol, isopropanol or alcohol. benzylic.
- the extraction method is chosen between maceration (cold or hot, standing or stirred), infusion, percolation, decoction, reflux, ultrasound, microwave, Soxhlet and, preferably, an extraction using an advanced technology of multifunctional dispersion with a colloid mill, whose working principle is a rotor / stator system.
- the chemical profiles of the extracts are determined by Gas Chromatography coupled to Mass Spectrometry (GC-MS-MS) and Liquid Chromatography coupled to Mass Spectrometry (LC-MS-MS).
- the oils are obtained by hydrodistillation, maceration in apolar solvents (eg acetone, hexane, dichloromethane, petroleum ether), extraction using supercritical fluids and preferably by steam distillation according to the methodologies described in the European Pharmacopoeia (Ph. Eur. 8.0, 2013, ISBN: 978-92-871- 7525-0, 3513 pp.) Under the UNE EN ISO 9001: 215 certification.
- the chemical profiles of essential oils are determined by Gas Chromatography coupled to Mass Spectrometry (GC -MS). A typical diagram of the steam distillation process is shown in Figure 2.
- the solid dry citrus residues (peels, peels, pulp), the original plant material selected from those mentioned in examples 1-2 and / or residues from the extraction process of these are subjected to a fermentation process and subsequent extraction.
- the raw material in a percentage between 10-15%, is incubated in water with one of the different selected microorganisms (Bacillus sp., Pseudomonas sp., Trichoderma sp. And Aspergillus sp.) For 120h at 28 ° C. -30 ° C in a F3-100 thermistor (Bionet, Murcia, Spain).
- the mixture is pumped (by vacuum) to a sieve (42 microns) that separates the solid particles from the liquid.
- the liquid part is stored and used for new encapsulation processes and / or as water in the formulation processes.
- the solids are spread on 1 cm thick stainless steel trays and dried at a controlled temperature of 35 ° C for another 24 hours until reaching a humidity of 12%, being ready to use in the formulation process of the biopesticidal compositions.
- the preparation of the final application broth or solution is carried out by diluting the claimed biopesticidal composition in at least one solvent, preferably water.
- the amount of diluent and amount of dilution depends on the type of culture, volume of broth required, species of fly, and the level of infestation / damage at the time of application.
- the application broth will be made by following the following steps: • Condition the pH (5-7) and the hardness of the water (soft).
- premix • Perform a premix in a determined volume of solvent (eg 1/3 of the deposit) of the product (s) that make up the formulation. In the case of more than one product, the solid formulations are added first and then the liquid ones.
- the premixes will be made under agitation according to the specifications and characteristics of each tank for the preparation of the broth owned by the end user. The duration of the premix will depend on the conditions of each user and the number of elements that make up the final broth.
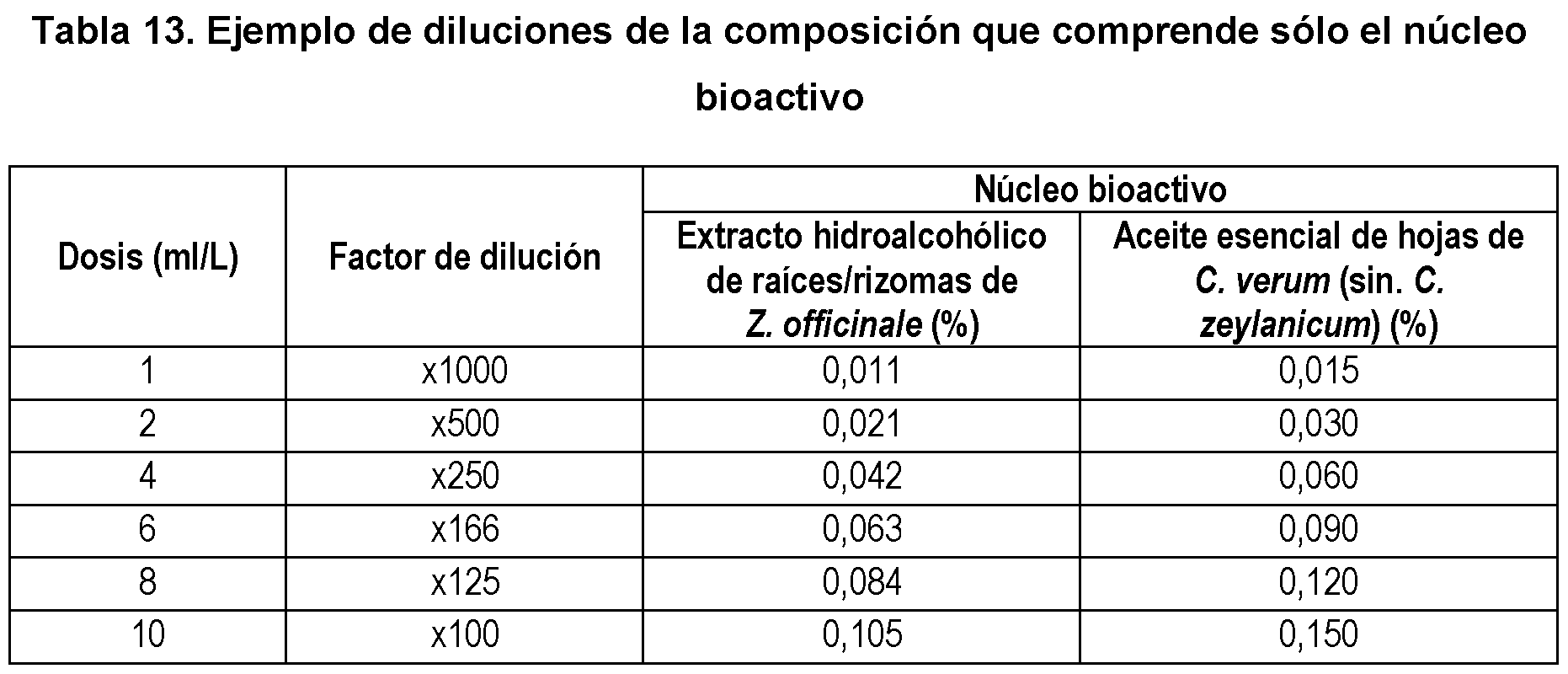
- the disclosed biopesticidal compositions are diluted in a range of 50 to 10,000 times. Examples of dilutions of the preparations shown in Examples 1 and 2 are shown below.
- Example 1 shows an example of a biopesticidal composition (see composition M0, Table 3) that only contains the bioactive core.
- Table 13 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- Example 2 shows different examples of biopesticidal compositions comprising the bloactive core.
- biopesticidal composition M1 (Table 3, Example 2.1) which contains the bloactive nucleus and the lecithin.
- Table 14 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- biopesticidal composition M2 (Table 3, Example 2.2) which contains the bloactive core and a second component.
- Table 15 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- biopesticidal composition M3 (Table 3, Example 2.3) which contains the bloactive nucleus and inert substances.
- Table 16 shows some examples of the final concentration of the elements in the final broth by applying different dilution factors.
- biopesticidal composition M4 (Table 3, Example 2.4) containing the bioactive core and two second components.
- Table 17 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- biopesticidal composition WF_F4 (Table 3, Example 2.5.1) which contains the bioactive core, soy lecithin and inert substances.
- Table 18 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- biopesticidal composition ADI-23 (Table 3, Example 2.5.2) that contains the bioactive core, three other second components, and inert substances.
- Table 19 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- biopesticidal composition PW-1.5 (Table 3, Example 2.5.3) that contains the bioactive nucleus, three other active elements (one of them is derived from a fermentation process), and inert substances.
- Table 20 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- Example of dilutions of the composition ADI-23 (bioactive core + 3 second components + inert substances) Table 20.
- Example of dilutions of the composition PW-1.5 (bioactive core + 3 second components + inert substances)
- biopesticidal composition MxM5 (Table 3, Example 2.5.4) that contains the bioactive core, two second components (pure compounds and soy lecithin) and inert substances.
- Table 21 shows some examples of the final concentration of the elements in the final broth when applying different dilution factors.
- Example 6 General protocols for laboratory tests
- the pest species that were used as biological targets to perform most of the efficacy trials and mechanisms of action are detailed in Table 22.
- the targets were selected taking into account the economic importance of their incidence on horticultural crops, the development of resistance to synthetic insecticides, their capacity transmission of viruses, as well as their widespread use as study models for the management of related pests belonging to the group of whiteflies.
- test protocols were developed in order to discriminate between the different modes and mechanisms of action of the tested substances.
- the bioactive nucleus Zingiber off ⁇ cinale + cinnamaldehyde source
- the different biopesticidal compositions object of this invention were evaluated in efficacy tests against pests selected. For them, in vitro tests were carried out in petri dishes and in vivo using reproducible plant models.
- the essays are divided into three large groups:
- Effect on the behavior of the fly They determine the effect on the control of the whitefly of a product in the medium and long term (24h-7 days) through the interaction with the receptors of taste and smell.
- Antifeedant effects (antifeedants, deterrents):
- the objective of the trial is to evaluate the effect of different doses of the substance to be tested on the mortality of adult whitefly, by topical application.
- the test is carried out in plastic jars with a screw cap 10 cm high and 5 cm in diameter.
- a 2 cm 2 hole is drilled in the center of the lid and covered with a fine cloth with a pore length of 0.77 x 0.27 mm (longitudinal: transverse).
- a leaf disk (5.7 cm 2 ) is cut from the host plant (Phaseolus vuigaris) and placed (bundle down) on the bottom of the pot previously coated with a 1 cm thick layer of agar (12 % in water p / v) that, in addition to support, provides the necessary humidity to the disc during the duration of the test (24 hours).
- Figure 5 In each boat 15 adult individuals previously captured with an entomological aspirator are introduced (Figure 5).
- the jar with the flies is incubated for one minute at 4 ° C in order to momentarily decrease the mobility of the pest and facilitate its settlement on the disk at the base of the jar.
- the substance to be treated bioactive core, biopesticide composition, reference products
- the cans are kept in a heated chamber with the same conditions described for fly breeding.
- Each adult mortality trial consists of 20 cans (replicas) for each of the treatments and 20 cans (replicas) for the control (water). In turn, each of the trials is replicated 3 times in time.
- the different combinations of the bioactive core (Table 3) are tested at an initial concentration between 0.01-0.5% of the application broth.
- the biopesticidal compositions (Table 3) and reference products are applied in the recommended dose range (between 1-5 ml of formulation / Liter of water).
- the number of live and dead flies is counted with the help of a stereoscopic magnifying glass.
- the count is carried out serially at 2, 4, 6, 8, 16 and 24 hours after applying the treatment.
- the fly is considered dead when it does not show any signs of mobility when touched with an entomological brush.
- Mortality is expressed in% with respect to the control and the data were corrected using the Abbott formula: where,
- Asphyxia is proposed as the primary mechanism of action.
- biopesticidal compositions concentrations, organisms and more specific details used for each particular experiment are explained.
- a Y-tube olfactometer with three arms (“arms”) is used as shown in Figure 7.
- Two plastic cans with a 10 cm high screw cap were prepared. and 5 cm in diameter.
- a 2 cm 2 hole is drilled in the center of the lid and covered with a fine cloth with a pore length of 0.77 x 0.27 mm (longitudinal: transverse).
- a leaf disc (5.7 cm 2 ) is cut from the host plant (Phaseolus vulgaris) and placed (bundle down) on the bottom of the pot previously coated with a 1 cm thick layer of agar (12 % in water p / v) that, in addition to support, provides the necessary humidity to the disc during the duration of the test (24 hours).
- one of the cans treated with the substance to be tested (biopesticide composition) to be tested was placed and in the other an identical can with a disc treated with water (control). Flies are released through the lower arm.
- the experiment is incubated in climate-controlled walk-in chambers under the following environmental conditions: 22 ° C ⁇ 1 ° C, 60-70% relative humidity and a photoperiod of 16: 8 hours (light: dark).
- 3 olfactometers were used that were considered as replicas. After 24h, the flies settled in the treatment and in the control were counted and the repellency index (% RI) was calculated for each substance tested using the following formula:
- T Number of live flies within the treated chamber (settled on the treated disc and / or on the walls of the pot)
- biopesticidal compositions concentrations, organisms and more specific details used for each particular experiment are explained.
- One of the plants is treated with the solution to be tested (bioactive nucleus, biopesticide composition) and the other with water (control), with a portable diffuser; ensuring good product coverage on both sides of the sheet. Both plants (treated and control) are placed in the same entomological box. Subsequently, a pot with 100 adult whitefly individuals is placed at a point equidistant between the two plants, at the base of the box. In Figure 8 you can see the experimental design.
- each repellency test consists of 5 boxes (replicas) for each of the variants analyzed. At the end of the test (24 hours) the number of living individuals settled in the treated and control plant is counted. In addition, the number of dead individuals is counted on both surfaces in the same way as in the mortality tests.
- the settlement inhibition index (% SI) is calculated according to the following formula: where,
- This test determines the effect of the different substances on the laying of adult pest eggs in treated and control host plants (Phaseolus vulgaris) placed in the same box (choice tests).
- C number of eggs deposited in the control.
- the data were analyzed using the Wilconxon multiple range nonparametric test (p ⁇ 0.05), using the IBM® SPSS Statistics® statistical package. Treatments with a percent inhibition of settlement (> 60%) were selected for dose-response studies. The dose at which 50% of the desired effect occurs (EC 50 ) was calculated using a probit regression analysis based on the log-dose pro bit.
- Table 24 shows the insecticidal (mortality) and antifeedant (repellency and oviposition inhibition) activity of the claimed bioactive nucleus and its components against whitefly.
- the efficacy results of the individual elements that make up the core are presented at two concentrations:
- synergistic effect in the control of flies belonging to the group of whiteflies memory, repellency and inhibition of oviposition
- synergy is defined from a mathematical point of view as the interaction between two or more components in a mixture in such a way that:
- compositions that have different mechanisms of action.
- the synergistic effects must be studied against a known mechanism of action assuming linearity in the response.
- there are different applications of synergistic combinations in the field of phytomedicine Physicalmedicine, Vol. 8 (5), pp. 401-409. 2001
- in pesticidal compositions Neth. J. PlantPath. 70, 1964; US005837652A, ES 2 153503 T3
- the synergistic effect that is achieved in the mixture with respect to the individual components is manifested in two ways: Significant increase in activity for each of the individual mechanisms of action: mortality-repellency-oviposition.
- E It is the expected percentage of effectiveness of the mixture of elements (A) and (B) at determined doses.
- X It is the percentage of effectiveness of the ingredient (A) at a given dose.
- Y It is the percentage of effectiveness of the ingredient (B) at a given dose.
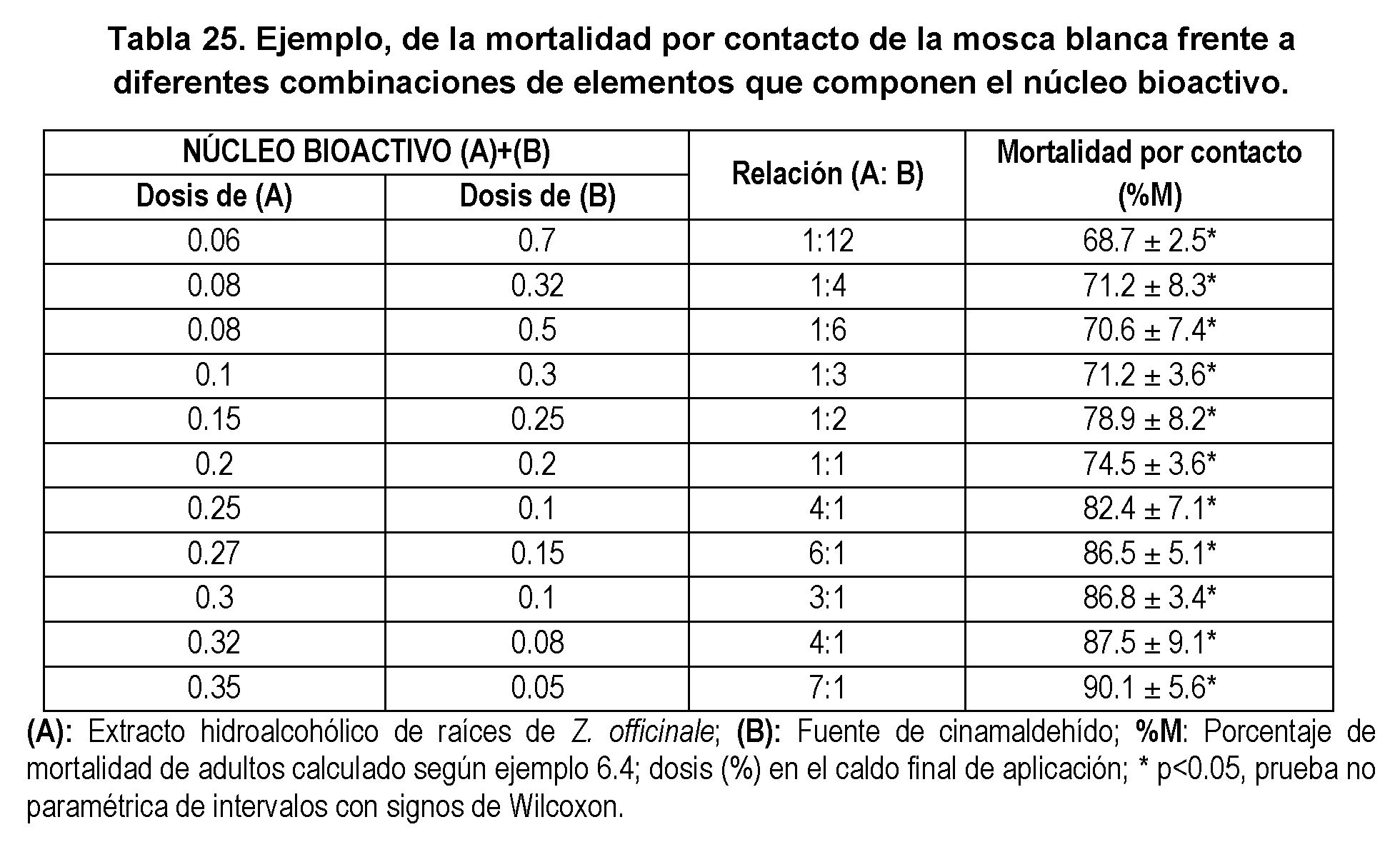
- Figure 9 shows the graph of ⁇ sobólas with the EC 50 values calculated from the observed values (dotted line) and the expected additive values (solid black line) for a series of combinations of the components that make up the synergistic core. (see values in Table 25).
- the straight line connecting the EC 50 of the individual components contains all possible combinations between them that would produce an additive effect (isobole).
- the points represent the experimental EC 50 of each of the combinations.
- the interaction profile (A + B) can be observed where a concave curve appears (characteristic of synergy), indicating that with low doses of both compounds (with respect to the effective doses of the elements separately) a high mortality is obtained.
- the observed value as represented in Table 23 is 74.3% mortality, significantly higher than the expected value, denoting the existence of a synergy.
- the repellent activity is due to the presence of volatile compounds that interact with the chemoreceptors of flies. Due to their volatile nature, these compounds have a very short-term efficacy that is lost after hours. Furthermore, its low solubility in water and its tendency to oxidation with light make its formulation complex. The formation of complexes with cyclodextrins (encapsulation) is one of the most used technologies for the protection and controlled release of this type of substances.
- biopesticidal compositions disclosed herein have at least one encapsulated component, ensuring controlled release of the active ingredient.
- encapsulation has been carried out using the coprecipitation method due to its encapsulation efficiency (> 60%) and its ease of scaling.
- b-cyclodextrin (W 7) was preferably selected as the matrix.
- the process was carried out as detailed in Example 4. An encapsulation percentage of 80% was obtained. The encapsulation efficiency from the chemical point of view was followed by gas chromatography analysis coupled to mass spectrometry (GC-MS). In Figure 10 the chromatographic monitoring (GC-MS) of the process is shown. The encapsulation process favors the retention of some bioactive components of the extract and their controlled release.
- Table 26 shows the activity of the free and encapsulated C. verum essential oil (taken as an example of cinnamaldehyde source) on the behavior (repellency and oviposition inhibition) of the whitefly (Bemisia tabaci).
- Encapsulation with b-cyclodextrin (W 7) according to the methodology proposed in Example 4 presented the best results in efficacy and controlled release.
- Example 11 Definition of the mechanisms of action attributed to the bioactive nucleus The objective of this example is to demonstrate the individual contribution of the elements to the mechanisms of action of the bioactive nucleus to achieve the final effect on the control of the whitefly.
- Table 27 shows the insecticidal activity against whiteflies of different concentrations of the individual components of the bioactive nucleus (hydroalcoholic extract of roots / rhizomes of Z. off ⁇ cinale and essential oil of leaves of C. verum as a source of cinnamaldehyde) and the OM composition (biopesticidal composition formed by the bioactive nucleus, Table 3). effect, 95% confidence (lower, upper limit); * p ⁇ 0.05, Wilcoxon paired test; MO composition as detailed in Table 3.
- Figures 11, 12 and 13 show the dose-response curves of the elements of the bioactive nucleus for contact mortality, inhibition of settlement and inhibition of oviposition, respectively.
- the hydroalcoholic extract of Z officinale has a very marked contribution to the effect of contact mortality, while the essential oil of C. verum leaves (source of cinnamaldehyde) contributes more to the antifeedant effects (inhibition of settlement and oviposition inhibition), as summarized in Table 2.
- lecithin as an activity enhancer of the biopesticidal composition and in particular of the bioactive core is disclosed.
- Table 28 shows, by way of illustration and not limitation, the efficacy against whitefly of one of the combinations of the bioactive nucleus with the soy lecithin used in the biopesticidal compositions.
- the combination "33" corresponds to the combination A + B + C in a ratio of 3: 3: 3 (see Gibbs triangle) that corresponds to the following concentrations in the application broth: A: 0.02%, B: 0.06% , C: 0.07%.
- Table 29 shows the activity against whitefly of all biopesticidal compositions (Table 3) and reference products used as positive controls for comparative purposes. All the biopesticidal compositions have a high efficacy in the control of whitefly, statistically significant when compared with the control. The compositions show similar and / or superior efficacy to the reference products (chemical and natural) that currently exist on the market for the control of whitefly.
- Table 30 shows the direct repellency effect of the bioactive core (MO composition of Table 3). The methodology used is detailed in Example 6.4. As can be seen, the bioactive nucleus shows a powerful repellent effect against whitefly adults.
- Example 15 Effect of the composition WF_F4 on the population dynamics of whitefly in a greenhouse test 15.1. Background
- Almer ⁇ a has the highest concentration of greenhouses worldwide and is one of the main horticultural suppliers in Europe.
- the cultivation of aubergine represents around 5% of the greenhouse area in Almer ⁇ a.
- Whiteflies (Bemicia tabaci and Trialeurodes vaporariorum) are considered the main pests that attack this crop.
- the area selected for the test is considered representative for carrying out an efficacy test of this type.
- Figure 15 shows a graphic representation of the design and spatial distribution of the experimental plots.
- Application scheme Table 33 details the characteristics of the application. A single application was made.
- Table 34 shows the efficacy variables and sampling times.
- the data collection dates were the following:
- DAA-1 08/07/19 (One day after application)
- each sampling 4 plants were randomly selected and 3 leaves of each plant were sampled. The number of adults was determined by counting the live flies on both surfaces (upper side and underside) of the selected leaf. In the case of the eggs, from each leaf sampled, 2 cm 2 discs were taken and the eggs were counted with the help of a stereoscopic magnifying glass.
- Ta Number of adults / eggs in treatment after application
- Tb Number of adults / eggs in the treatment before application
- Ca Number of adults / eggs in the control after application
- Cb Number of adults / eggs in the control before application.
- Tables 35 and 36 show the corrected efficacy of the WF_F4 composition and reference products on the number of adults and whitefly eggs, respectively.
- the data obtained show a clear efficacy of the product in the control of whitefly.
- the composition WF_F4 shows very significant levels of reduction in the number of whitefly adults and eggs up to 6 days after application.
- the results obtained with the WF_F4 composition were clearly superior to the efficiencies of both the chemical and natural reference products.
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Environmental Sciences (AREA)
- Plant Pathology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Dentistry (AREA)
- Agronomy & Crop Science (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Mycology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Pest Control & Pesticides (AREA)
- Insects & Arthropods (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Chemical & Material Sciences (AREA)
- Toxicology (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Medicines Containing Plant Substances (AREA)
- Cosmetics (AREA)
- Catching Or Destruction (AREA)
Abstract
Description
Claims
Priority Applications (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022544148A JP7522200B2 (ja) | 2020-01-20 | 2020-01-20 | 植物抽出物を含む生物農薬組成物およびその植物衛生的使用 |
| BR112022013069A BR112022013069A2 (pt) | 2020-01-20 | 2020-01-20 | Composição biopesticida, caldo de aplicação final contendo a mesma, procedimento para obtenção da mesma e uso da mesma |
| PCT/ES2020/070037 WO2021148684A1 (es) | 2020-01-20 | 2020-01-20 | Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario |
| MX2022008447A MX2022008447A (es) | 2020-01-20 | 2020-01-20 | Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario. |
| KR1020227028849A KR20220143042A (ko) | 2020-01-20 | 2020-01-20 | 식물 추출물을 포함하는 생물농약 조성물 및 이의 식물위생 용도 |
| AU2020424969A AU2020424969A1 (en) | 2020-01-20 | 2020-01-20 | Biopesticide compositions comprising plant extracts and phytosanitary use thereof |
| ES202290052A ES2926555B2 (es) | 2020-01-20 | 2020-01-20 | Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario |
| US17/864,268 US20220354128A1 (en) | 2020-01-20 | 2022-07-13 | Biopesticide compositions comprising plant extracts and phytosanitary use thereof |
| ZA2022/08521A ZA202208521B (en) | 2020-01-20 | 2022-07-29 | Biopesticide compositions comprising plant extracts and phytosanitary use thereof |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/ES2020/070037 WO2021148684A1 (es) | 2020-01-20 | 2020-01-20 | Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US17/864,268 Continuation US20220354128A1 (en) | 2020-01-20 | 2022-07-13 | Biopesticide compositions comprising plant extracts and phytosanitary use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2021148684A1 true WO2021148684A1 (es) | 2021-07-29 |
Family
ID=76991660
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/ES2020/070037 WO2021148684A1 (es) | 2020-01-20 | 2020-01-20 | Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US20220354128A1 (es) |
| JP (1) | JP7522200B2 (es) |
| KR (1) | KR20220143042A (es) |
| AU (1) | AU2020424969A1 (es) |
| BR (1) | BR112022013069A2 (es) |
| ES (1) | ES2926555B2 (es) |
| MX (1) | MX2022008447A (es) |
| WO (1) | WO2021148684A1 (es) |
| ZA (1) | ZA202208521B (es) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023057083A1 (fr) * | 2021-10-04 | 2023-04-13 | Xeda International | Procede de traitement phytosanitaire au moyen d'aldehyde cinnamique encapsule |
| WO2023242453A1 (es) * | 2022-05-27 | 2023-12-21 | Universidade De Vigo | Composición herbicida que comprende biomasa de eucalipto, retama, y mastranzo |
| CN117778276A (zh) * | 2024-02-23 | 2024-03-29 | 四川省农业农村厅植物保护站 | 一种防治生姜土传病害的生防菌剂及制备方法和培育方法 |
| EP4385326A1 (en) * | 2022-12-15 | 2024-06-19 | Kimitec Biogorup | Biopesticide composition and method for controlling and treating broad spectrum of pests and diseases in plants |
Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5837652A (en) | 1995-12-20 | 1998-11-17 | Rhone-Poulenc Agriculture Limited | Herbicidal compositions |
| ES2153503T3 (es) | 1994-11-18 | 2001-03-01 | Aventis Agriculture Ltd | Nuevas composiciones herbicidas sinergicas que comprenden compuestos de 4-benzoilisoxazoles y 2,6-dinitroanilinas. |
| WO2003033008A1 (en) * | 2001-06-18 | 2003-04-24 | Champon Louis S | All natural soil treatment & insecticide composition containing plant extract heat components |
| US8202557B1 (en) * | 2008-02-05 | 2012-06-19 | Sundy Aisha Doty | Bio-pesticide and methods of making and using the same |
| US20130331462A1 (en) | 2009-06-12 | 2013-12-12 | Bayer Cropscience Lp | Methods of inhibiting, preventing, killing and/or repelling insects using simulated blends of chenopodium |
| ES2444991A1 (es) | 2012-08-27 | 2014-02-27 | Seipasa S.A. | Un insecticida ecológico, procedimiento de producción del insecticida y utilización del mismo |
| CN104996500A (zh) * | 2015-06-23 | 2015-10-28 | 上海交通大学 | 一种控制植物蚜虫的复方植物杀虫剂及其制备和应用 |
| WO2016170531A1 (en) * | 2015-04-20 | 2016-10-27 | Botanocap Ltd. | Liquid and solid core microcapsules formed by interpolymeric complexation |
| CN106472611A (zh) * | 2016-10-14 | 2017-03-08 | 柳州环山科技有限公司 | 新型植物源环保生物农药 |
| CN108835137A (zh) * | 2018-04-27 | 2018-11-20 | 吴道华 | 一种生物农药 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2002255717A (ja) * | 2001-02-23 | 2002-09-11 | Yutaka Pharmacy:Kk | 植物病害防除剤および植物病害防除方法 |
| US20060165746A1 (en) * | 2005-01-24 | 2006-07-27 | Arie Markus | Formulations containing microencapsulated essential oils |
| JP2007001869A (ja) * | 2005-06-21 | 2007-01-11 | Nippon Tekuma:Kk | 天然植物素材をもとにしたユーカリオイルの薬効増強処理剤 |
| CN102340990B (zh) * | 2009-03-05 | 2015-03-04 | 关键基因股份有限公司 | 基于r-姜黄烯的植物挥发性物质 |
| JP6082514B2 (ja) * | 2010-08-24 | 2017-02-15 | 住友化学園芸株式会社 | 農園芸用殺虫組成物 |
-
2020
- 2020-01-20 KR KR1020227028849A patent/KR20220143042A/ko unknown
- 2020-01-20 AU AU2020424969A patent/AU2020424969A1/en active Pending
- 2020-01-20 BR BR112022013069A patent/BR112022013069A2/pt unknown
- 2020-01-20 MX MX2022008447A patent/MX2022008447A/es unknown
- 2020-01-20 JP JP2022544148A patent/JP7522200B2/ja active Active
- 2020-01-20 WO PCT/ES2020/070037 patent/WO2021148684A1/es active Search and Examination
- 2020-01-20 ES ES202290052A patent/ES2926555B2/es active Active
-
2022
- 2022-07-13 US US17/864,268 patent/US20220354128A1/en active Pending
- 2022-07-29 ZA ZA2022/08521A patent/ZA202208521B/en unknown
Patent Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2153503T3 (es) | 1994-11-18 | 2001-03-01 | Aventis Agriculture Ltd | Nuevas composiciones herbicidas sinergicas que comprenden compuestos de 4-benzoilisoxazoles y 2,6-dinitroanilinas. |
| US5837652A (en) | 1995-12-20 | 1998-11-17 | Rhone-Poulenc Agriculture Limited | Herbicidal compositions |
| WO2003033008A1 (en) * | 2001-06-18 | 2003-04-24 | Champon Louis S | All natural soil treatment & insecticide composition containing plant extract heat components |
| US8202557B1 (en) * | 2008-02-05 | 2012-06-19 | Sundy Aisha Doty | Bio-pesticide and methods of making and using the same |
| US20130331462A1 (en) | 2009-06-12 | 2013-12-12 | Bayer Cropscience Lp | Methods of inhibiting, preventing, killing and/or repelling insects using simulated blends of chenopodium |
| ES2444991A1 (es) | 2012-08-27 | 2014-02-27 | Seipasa S.A. | Un insecticida ecológico, procedimiento de producción del insecticida y utilización del mismo |
| WO2016170531A1 (en) * | 2015-04-20 | 2016-10-27 | Botanocap Ltd. | Liquid and solid core microcapsules formed by interpolymeric complexation |
| CN104996500A (zh) * | 2015-06-23 | 2015-10-28 | 上海交通大学 | 一种控制植物蚜虫的复方植物杀虫剂及其制备和应用 |
| CN106472611A (zh) * | 2016-10-14 | 2017-03-08 | 柳州环山科技有限公司 | 新型植物源环保生物农药 |
| CN108835137A (zh) * | 2018-04-27 | 2018-11-20 | 吴道华 | 一种生物农药 |
Non-Patent Citations (4)
| Title |
|---|
| I EPP/EPPO BULLETIN, vol. 42, no. 3, 2012, pages 367 - 381 |
| JOURNAL OF AGRICULTURAL SCIENCE AND TECHNOLOGY A, vol. 6, 2016, pages 77 - 91 |
| NETH. J. PLANTPATH., vol. 70, pages 1964 |
| PHYTOMEDICINE, vol. 8, no. 5, 2001, pages 401 - 409 |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023057083A1 (fr) * | 2021-10-04 | 2023-04-13 | Xeda International | Procede de traitement phytosanitaire au moyen d'aldehyde cinnamique encapsule |
| WO2023242453A1 (es) * | 2022-05-27 | 2023-12-21 | Universidade De Vigo | Composición herbicida que comprende biomasa de eucalipto, retama, y mastranzo |
| ES2957062A1 (es) * | 2022-05-27 | 2024-01-10 | Univ Vigo | Composición herbicida que comprende biomasa de eucalipto, retama y mastranzo |
| EP4385326A1 (en) * | 2022-12-15 | 2024-06-19 | Kimitec Biogorup | Biopesticide composition and method for controlling and treating broad spectrum of pests and diseases in plants |
| EP4385327A1 (en) * | 2022-12-15 | 2024-06-19 | Kimitec Group S.L. | Biopesticide composition and method for controlling and treating broad spectrum of pests and diseases in plants |
| WO2024126688A1 (en) * | 2022-12-15 | 2024-06-20 | Kimitec Biogroup S.L | Biopesticide composition and method for controlling and treating broad spectrum of pests and diseases in plants |
| WO2024126672A1 (en) * | 2022-12-15 | 2024-06-20 | Kimitec Biogroup S.L | Biopesticide composition and method for controlling and treating broad spectrum of pests and diseases in plants |
| CN117778276A (zh) * | 2024-02-23 | 2024-03-29 | 四川省农业农村厅植物保护站 | 一种防治生姜土传病害的生防菌剂及制备方法和培育方法 |
| CN117778276B (zh) * | 2024-02-23 | 2024-05-10 | 四川省农业农村厅植物保护站 | 一种防治生姜土传病害的生防菌剂及制备方法和培育方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| BR112022013069A2 (pt) | 2022-09-06 |
| JP7522200B2 (ja) | 2024-07-24 |
| ES2926555R1 (es) | 2023-10-23 |
| ES2926555A2 (es) | 2022-10-26 |
| ES2926555A9 (es) | 2023-10-10 |
| KR20220143042A (ko) | 2022-10-24 |
| ES2926555B2 (es) | 2024-05-16 |
| MX2022008447A (es) | 2022-08-04 |
| US20220354128A1 (en) | 2022-11-10 |
| AU2020424969A1 (en) | 2022-08-11 |
| ZA202208521B (en) | 2024-01-31 |
| JP2023519648A (ja) | 2023-05-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2926555B2 (es) | Composiciones biopesticidas que comprenden extractos vegetales y su uso fitosanitario | |
| Shahrajabian et al. | Chinese star anise ('Illicium verum') and pyrethrum ('Chrysanthemum cinerariifolium') as natural alternatives for organic farming and health care-a review | |
| Afzal et al. | Ethno-botanical studies from Northern Pakistan | |
| Hayatie et al. | Aqueous extracts of seed and peel of Carica papaya against Aedes aegypti | |
| US20060194698A1 (en) | Use of herbs as a delivery system for bioactive phytochemicals | |
| Narwal et al. | Review on chemical constituents and pharmacological action of Ocimum kilimandscharicum | |
| Ghosh | Biopesticide & integrated pest management | |
| CN102036564A (zh) | 对环境无害的植物保护剂 | |
| Mouna et al. | Insecticidal effect of two aqueous extracts from the leaves of Salvia officinalis and Eucalyptus camaldulensis against Aphis fabae | |
| Valiño et al. | Biomass from allelopathic agroforestry and invasive plant species as soil amendments for weed control—a review | |
| Singh | Association of the Aphids (Insecta: Homoptera: Aphididae) with monocots flowering plants in India | |
| Taha et al. | The first study for the Acaricidal activity of alcoholic extracts of Adiantum capillus-veneris and Funaria hygrometric against Argas persicus | |
| Ahmed et al. | A novel surface sterilization method using Artemisia dracunculus extract for tissue culturing of endangered species Sargassum fusiforme | |
| KR102509566B1 (ko) | 식물의 약성과 유황 발효를 통해 얻어지는 미생물 및 이를 이용한 살균·살충·탈취제의 제조방법 | |
| KR20130080667A (ko) | 후추 속 식물과 라반듈라 속 식물 추출물을 함유하는 살충용 조성물 | |
| Durge et al. | Vetiveria zizanioides l. Nash-a wonder plant: an industrial perspective | |
| Haryanta et al. | Repelence of Bintaro Plant Extract (Cerbera manghas) against pod-sucking insects (Riptortus linearis)(Hemiptera) | |
| Fouad et al. | Variation in essential oil composition, antioxidant and mosquito larvicidal activity during three cuts dates of five Mentha species | |
| Anvitha et al. | The importance, extraction and usage of some floral wastes | |
| Umbreen et al. | Sacred Basil | |
| Di Stefano | Toxic, repellent and antifeedant activities of Lavandula angustifolia Miller (Lamiaceae) essential oil against Sitophilus granarius (L.)(Coleoptera, Curculionidae) adults | |
| Mane et al. | Evaluation of Antibacterial Activity of Extracted Oil from Blumea lacera and Cyathocline purpurea (Asteraceae) | |
| Nisha | Phytochemical and biological investigation of Tridax procumbens leaves | |
| Mpumi | Evaluation of selected botanicals as insecticides against cabbage insect pests in Tanzania | |
| Balasankar et al. | Journal of medicinal plants studies |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 20914958 Country of ref document: EP Kind code of ref document: A1 |
|
| DPE1 | Request for preliminary examination filed after expiration of 19th month from priority date (pct application filed from 20040101) | ||
| REG | Reference to national code |
Ref country code: BR Ref legal event code: B01A Ref document number: 112022013069 Country of ref document: BR |
|
| ENP | Entry into the national phase |
Ref document number: 2022544148 Country of ref document: JP Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 2020424969 Country of ref document: AU Date of ref document: 20200120 Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 2020914958 Country of ref document: EP Effective date: 20220822 |
|
| ENP | Entry into the national phase |
Ref document number: 112022013069 Country of ref document: BR Kind code of ref document: A2 Effective date: 20220629 |