Polymerisierbare Verbindungen und ihre Verwendung in Flüssigkristallmedien und Flüssigkristallanzeigen
Die vorliegende Erfindung betrifft polymerisierbare Verbindungen, Verfahren und Zwischenprodukte zu ihrer Herstellung, ihre Verwendung für optische, elektrooptische und elektronische Zwecke, insbesondere in Flüssigkristall (FK)-Medien und FK-Anzeigen mit polymerstabilisierter blauer Phase, sowie in FK-Medien für FK-Anzeigen des PS- oder PSA- Typs ("polymer sustained" bzw. "polymer sustained alignment"), sowie diese Verbindungen enthaltende FK-Medien und FK-Anzeigen.
Im Stand der Technik sind Medien für Anzeigenelemente bekannt, die im Betrieb in der flüssigkristallinen blauen Phase (kurz: blaue Phase) arbeiten. Solche Anzeigen sind beispielsweise in WO 2004/046805 A1 und WO 2008/061606 A1 beschrieben.
Die blaue Phase wird in der Regel am Übergang vom nematischen zum optisch isotropen Zustand beobachtet. Das Medium in der
flüssigkristallinen blauen Phase kann blau sein, wie der Name andeutet, aber auch farblos. Ziel bisheriger Anstrengungen war es, den
Temperaturbereich der blauen Phase von weniger als einem Grad auf einen praktisch nutzbaren Bereich auszudehnen (vgl. H. Kikuchi et al., Nature Materials (2002), 1(1), 64-68; Kikuchi, H. et al., Polymerie Materials Science and Engineering, (2003), 89, 90-91).
Zu diesem Zweck wird im Stand der Technik vorgeschlagen, dem FK- Medium eine polymerisierbare Verbindung beizufügen, welche dann im FK-Medium in situ polymerisiert wird. Das dabei gebildete Polymer oder Polymernetzwerk soll die blaue Phase stabilisieren.
Die bisher im Stand der Technik beschriebenen polymerstabilisierten blauen Phasen verwenden beispielsweise als Monomere ein
monoreaktives nicht-mesogenes Monomer zusammen mit einem direaktiven mesogenen Monomer.
Die WO 2005/080529 A1 beschreibt beispielsweise polymerstabilisierte blaue Phasen mit mono- und multireaktiven Monomeren.
Der vorliegenden Erfindung lag als eine Aufgabe zugrunde, geeignete Monomere und entsprechende Polymere für die Stabilisierung von blauen Phasen zu finden. Das Polymer soll insbesondere folgende Effekte auf die Eigenschaften der stabilisierten FK-Phase haben:
- breiter Temperaturbereich der blauen Phase,
- schnelle Schaltzeit,
- geringe Klärpunktsdifferenz beim Polymerisieren,
- geringe Betriebsspannung (Vop),
- geringe Variation der Betriebsspannung mit der Temperatur,
- geringe Hysterese der Transmission einer Zelle bei Änderung der
Betriebsspannung zum Erzielen definierter Graustufen.
Es werden außerdem Monomere benötigt, die eine gute Voltage holding ratio' (VHR) aufweisen, hohe Klärpunkte besitzen, und stabil gegenüber Belastungen durch Licht und Temperatur sind. Weiterhin ist eine gute Löslichkeit in LC-Materialien bzw. eine gute Mischbarkeit mit dem FK- Medium notwendig, um eine gute Verteilung im FK-Medium zu erreichen.
Der vorliegenden Erfindung liegt somit die Aufgabe zugrunde, verbesserte polymerisierbare Verbindungen, sowie solche Verbindungen enthaltende FK-Medien, zur Verfügung zu stellen, insbesondere für die Verwendung in FK-Anzeigen mit einer polymerstabilisierten blauen Phase. Die
erfindungsgemäßen polymerisierbaren Verbindungen sollen die blaue Phase stabilisieren. Die erfindungsgemäßen FK-Medien sollen eine oder mehrere verbesserte Eigenschaften, insbesondere ausgewählt aus den oben genannten Eigenschaften, aufweisen. Insbesondere sollen die FK- Medien eine breite blaue Phase aufweisen, ein schnelles Schalten ermöglichen, eine gute Voltage holding ratio (VHR) aufweisen, geringe Spannungen (Vop) für den Schaltprozess benötigen und eine geringe Hysterese (AV) zeigen und einen geringen Memory Effekt (ME)
aufweisen. Die FK-Medien sollen stabil gegenüber Belastungen durch Licht- und Temperatur sein.
Weiterhin sind im Stand der Technik sogenannte PS- bzw. PSA-Anzeigen bekannt ("Polymer Sustained" bzw. "Polymer Sustained Alignment"), für die auch gelegentlich der Begriff "Polymer Stabilized" verwendet wird. In diesen Anzeigen wird dem FK-Medium eine geringe Menge (zum Beispiel 0.3 Gew.%, typischerweise <1 Gew.%) einer oder mehrerer
polymerisierbarer Verbindung(en) zugesetzt, welche nach Einfüllen in die FK-Zelle mit oder ohne angelegte elektrische Spannung zwischen den
Elektroden in situ polymerisiert bzw. vernetzt wird, üblicherweise durch UV-Photopolymerisation. Als besonders geeignet hat sich der Zusatz von polymerisierbaren mesogenen oder flüssigkristallinen Verbindungen, auch als reaktive Mesogene oder "RM"s bezeichnet, zur FK-Mischung
erwiesen.
Nachfolgend wird der Begriff "PSA", falls nicht anders angegeben,
stellvertretend für PS-Anzeigen und PSA-Anzeigen verwendet.
Mittlerweile wird das PS(A)-Prinzip in diversen klassischen FK-Anzeigen angewendet. So sind beispielsweise PSA-VA-, PSA-OCB-, PSA-IPS-, PSA- FFS- und PSA-TN-Anzeigen bekannt. Die Polymerisation der
polymerisierbaren Verbindung(en) erfolgt bei PSA-VA- und PSA-OCB-
Anzeigen vorzugsweise bei angelegter elektrischer Spannung, bei PSA-IPS- Anzeigen mit oder ohne angelegte elektrische Spannung. Wie man in
Testzellen nachweisen kann, führt das PS(A)-Verfahren zu einem pretilt in der Zelle. Bei PSA-OCB-Anzeigen beispielsweise kann man erreichen, dass die Bend-Struktur stabilisiert wird, so dass man ohne Offset-Spannung auskommt oder diese reduzieren kann. Im Falle von PSA-VA-Anzeigen wirkt sich der pretilt positiv auf die Schaltzeiten aus. Für PSA-VA-Anzeigen kann ein
Standard-MVA- bzw. -PVA Pixel- und Elektroden-Layout verwendet werden. Darüber hinaus kann man aber beispielsweise auch mit nur einer
strukturierten Elektrodenseite und ohne Protrusions auskommen, was die Herstellung wesentlich vereinfacht und gleichzeitig zu einem sehr guten Kontrast bei sehr guter Lichtdurchlässigkeit führt.
PSA-VA-Anzeigen sind beispielsweise in JP 10-036847 A, EP 1 170 626 A2, US 6,861 ,107, US 7,169,449, US 2004/0191428 A1 , US 2006/0066793 A1 und US 2006/0103804 A1 beschrieben. PSA-OCB-Anzeigen sind
beispielsweise in T.-J- Chen et al., Jpn. J. Appl. Phys. 45, 2006, 2702-2704 und S. H. Kim, L.-C- Chien, Jpn. J. Appl. Phys. 43, 2004, 7643-7647 beschrieben. PSA-I PS-Anzeigen sind zum Beispiel in US 6,177,972 und Appl. Phys. Lett. 1999, 75(21), 3264 beschrieben. PSA-TN-Anzeigen sind zum Beispiel in Optics Express 2004, 12(7), 1221 beschrieben.
PSA-Anzeigen können ebenso wie die oben beschriebenen konventionellen FK-Anzeigen als Aktivmatrix- oder Passivmatrix-Anzeigen betrieben werden. Bei Aktivmatrix-Anzeigen erfolgt die Ansteuerung einzelner Bildpunkte üblicherweise durch integrierte, nicht-lineare aktive Elemente wie
beispielsweise Transistoren (z.B. Dünnfilmtransistoren, engl, "thin film transistor" bzw. "TFT"), bei Passivmatrix-Anzeigen üblicherweise nach dem Multiplex-Verfahren, wobei beide Verfahren aus dem Stand der Technik bekannt sind.
Es sind jedoch nicht alle Kombinationen bestehend aus FK-Mischung und polymerisierbarer Komponente für PSA-Anzeigen geeignet, weil sich zum Beispiel kein oder kein ausreichender Tilt einstellt, oder weil zum Beispiel die sogenannte„Voltage Holding Ratio" (VHR oder HR) für TFT- Displayanwendungen unzureichend ist. Zudem hat sich gezeigt, dass bei Verwendung in PSA-Anzeigen die aus dem Stand der Technik bekannten FK-Mischungen und RMs noch einige Nachteile aufweisen. So eignet sich nicht jedes bekannte, in FK-Mischungen lösliche RM zur Verwendung in PSA-Anzeigen.
Darüber hinaus sollte die gewählte Kombination FK-Hostmischung/RM eine möglichst geringe Rotationsviskosität sowie möglichst gute elektrische
Eigenschaften aufweisen, insbesondere sollte sie eine möglichst hohe VHR besitzen. Bei PSA-Anzeigen ist vor allem eine hohe VHR nach Bestrahlung mit UV-Licht erforderlich, da die UV-Belichtung ein notwendiger Teil des
Herstellungsprozesses der Anzeige ist, aber auch als normale Belastung im Betrieb der fertigen Anzeige auftritt.
Insbesondere wäre es wünschenswert, neue Materialien für PSA- Anzeigen zur Verfügung zu haben, die einen besonders kleinen pretilt- Winkel erzeugen. Hierbei sind Materialien bevorzugt, die während der
Polymerisation bei gleicher Belichtungszeit einen niedrigeren pretilt- Winkel erzeugen als die bisher bekannten Materialien, und/oder durch deren Verwendung der mit den bekannten Materialien erzielbare (höhere) pretilt-Winkel bereits nach kürzerer Belichtungszeit erreicht werden kann. Dadurch könnten die Produktionszeit (engl, "tact time") der Anzeige verkürzt und die Kosten des Produktionsprozesses verringert werden.
Ein weiteres Problem bei der Herstellung von PSA-Anzeigen ist das Vorhandensein bzw. die Entfernung von Restmengen unpolymerisierter RMs insbesondere nach dem Polymerisationsschritt zur Erzeugung des pretilt-Winkels in der Anzeige. Beispielsweise können solche nicht abreagierten RMs die Eigenschaften der Anzeige nachteilig beeinflussen, indem sie z.B. nach Fertigstellung der Anzeige während des Betriebes unkontrolliert polymerisieren.
So zeigen die aus dem Stand der Technik bekannten PSA-Anzeigen oft den unerwünschten Effekt des sogenannten "image sticking" oder "image burn", d.h. dass das in der FK-Anzeige durch vorübergehende
Ansteuerung einzelner Bildpunkte (pixel) erzeugte Bild auch nach
Abschalten des elektrischen Feldes in diesen Bildpunkten, oder nach Ansteuerung anderer Bildpunkte, noch sichtbar bleibt.
Es ist deshalb wünschenswert, dass die Polymerisation der RMs bei der Herstellung der PSA-Anzeige möglichst vollständig abläuft und die
Anwesenheit von unpolymerisierten RMs in der Anzeige möglichst ausgeschlossen oder auf ein Minimum reduziert wird. Hierzu werden Materialien benötigt, die eine möglichst effektive und vollständige
Polymerisation ermöglichen. Es besteht somit immer noch ein großer Bedarf an PSA-Anzeigen sowie FK-Medien und polymerisierbaren Verbindungen zur Verwendung in solchen Anzeigen, welche die oben beschriebenen Nachteile nicht oder nur in geringem Maße zeigen und verbesserte Eigenschaften besitzen. Zudem besteht ein großer Bedarf nach PSA-Anzeigen, sowie Materialien zur Verwendung in PSA-Anzeigen, die vorteilhafte Eigenschaften aufweisen, insbesondere einen hohen spezifischen Widerstand bei
gleichzeitig großem Arbeitstemperaturbereich, kurze Schaltzeiten auch bei tiefen Temperaturen und niedriger Schwellenspannung, einen niedrigen pretilt-Winkel, eine Vielzahl von Graustufen, einen hohen Kontrast und einen weiten Blickwinkel ermöglichen, sowie hohe Werte der "voltage holding ratio" (VHR) nach UV-Belastung und der Tieftemperaturstabilität, auch als "LTS" (low temperature stability) bezeichnet, d.h. der Stabilität der FK-Mischung gegen spontane Auskristallisation einzelner
Komponenten. Der Erfindung liegt somit die weitere Aufgabe zugrunde, neue geeignete Materialien, insbesondere RMs und diese enthaltende FK-Medien, für die Verwendung in PSA-Anzeigen bereitzustellen, die die oben angegebenen Nachteile nicht oder in geringerem Maße aufweisen, möglichst schnell und vollständig polymerisieren, eine möglichst schnelle Einstellung eines niedrigen pretilt-Winkels ermöglichen, das Auftreten von "image sticking" in der Anzeige verringern oder vermeiden, und vorzugsweise gleichzeitig sehr hohe spezifische Widerstände, niedrige Schwellenspannungen und niedrige Schaltzeiten ermöglichen. Zudem sollten die FK-Medien günstige FK-Phaseneigenschaften sowie hohe VHR- und LTS-Werte aufweisen.
Die oben beschriebenen Aufgaben wurden erfindungsgemäß gelöst durch die Bereitstellung von Materialien, Verfahren und FK-Anzeigen wie in der vorliegenden Anmeldung beschrieben. Insbesondere wurde überraschend gefunden, dass die oben beschriebenen Aufgaben teilweise oder vollständig gelöst werden können, indem man zur Herstellung solcher FK- Anzeigen FK-Medien verwendet, welche eine oder mehrere
erfindungsgemäße polymerisierbare Verbindungen wie nachstehend beschrieben enthalten, bzw. indem man FK-Anzeigen mit blauer Phase bzw. PSA-Anzeigen bereitstellt, die eine oder mehrere erfindungsgemäße Verbindungen in polymerisierter Form enthalten.
Die erfindungsgemäßen polymerisierbaren Verbindungen enthalten eine zentrale mesogene Gruppe und mindestens zwei polymerisierbare
Gruppen, welche mit der mesogenen Gruppe direkt oder über
Abstandsgruppen (engl, "spacer") verknüpft sind, wobei die zentrale
mesogene Gruppe aus drei cyclischen Resten besteht, welche durch zwei Ethylenbrücken miteinander verknüpft sind.
Die Verwendung der erfindungsgemäßen polymerisierbaren
Verbindungen in erfindungsgemäßen FK-Medien für FK-Anzeigen mit polymerstabilisierter blauer Phase führt zu einer deutlichen Stabilisierung der blauen Phase. Zudem hat sich überraschend gezeigt, dass bei der Verwendung der erfindungsgemäßen polymerisierbaren Verbindungen in FK-Medien mit polymerstabilisierter blauer Phase eine deutliche
Verringerung der Hysterese (AVso) und eine Erhöhung des Kontrastes erzielt wird, im Vergleich zu polymerisierbaren Verbindungen und FK- Medien wie im Stand der Technik beschrieben.
In PSA-Anzeigen führt die Verwendung der erfindungsgemäßen
polymerisierbaren Verbindungen in erfindungsgemäßen FK-Medien zu einem besonders schnellen Erreichen des gewünschten Pretilts und zu deutlich verkürzten Zeiten bei der Herstellung der Anzeige.
Im Stand der Technik, wie beispielsweise in der US 7,440,160 (WO
2004/046805 A1 ) und den darin zitierten Dokumenten, werden FK-Medien für FK-Anzeigenelemente beschrieben, die im Betrieb in der
flüssigkristallinen blauen Phase (kurz: blaue Phase) arbeiten. Die WO 2005/080529 A1 beschreibt polymerstabilisierte blaue Phasen mit mono- und multireaktiven Monomeren. Die US 2009/0267025 A1 (WO
2006/063662 A1 ) US 2009/051855 A1 , US 2009/0059132 A1 und US 2009/0059157 A1 beschreiben die Polymerstabilisierung blauer Phasen mit flüssigkristallinen reaktiven Komponenten (auch als reaktive
Mesogene, kurz "RM"s, bezeichnet). In den vorgenannten
Veröffentlichungen werden jedoch vorzugsweise RMs mit entweder direkt oder über Estergruppen verknüpften Phenylresten verwendet, wie beispielsweise die folgenden beiden RMs:
worin x entweder beide 3 oder 6 bedeuten.
Die WO 2008/061606 A1 beschreibt RMs mit einer mesogenen Gruppe bestehend aus direkt verknüpften Cyclohexylringen, sowie ihre
Verwendung zur Polymerstabilisierung blauer Phasen. Darin wird unter anderem auch die optionale Verwendung zusätzlicher Co-Monomere erwähnt, welche unter anderem aus einer Liste ausgewählt sein können, die auch eine Formel RM27 für ein RM mit drei über Ethylbrücken verknüpften Phenylresten enthalten. In der WO 2008/061606 A1 werden jedoch keine konkreten Beispiele offenbart, worin solche Co-Monomere verwendet wurden. Auch die mit solchen Verbindungen
überraschenderweise erzielten Vorteile, wie für die FK-Medien der vorliegenden Erfindung vor- und nachstehend beschrieben, werden darin nicht nahegelegt.
Insbesondere eignen sich die in vorliegender Erfindung vorgestellten Monomere gegenüber den in WO 2008/061606 A1 vorgestellten esterverbrückten Substanzen besser dazu, den Ausgangszustand des FK- Mediums zu stabilisieren, so dass nach dem Ausschalten ein sehr guter Schwarzzustand erreicht wird. Zudem zeichnen sich die in vorliegender Erfindung vorgestellten Monomere durch eine einfachere Synthese und - abgesehen von den reaktiven Gruppen - durch eine größere chemische Stabilität aus. in der WO 93/22397 A1 wird ein elektrooptisches System mit einem PDLC-Film beschrieben. Dabei sind beispielsweise Verbindungen der folgenden generischen Formel beschrieben, welche drei über
Ethylbrücken verknüpfte Phenylreste enthalten:
wobei
Y2 H2C=CHCOO-, H2C=CMeCOO- oder CH2=CH- und
V2 O oder eine Einfachbindung und
n eine ganze Zahl zwischen 2 und 12 und
eine optinal fluorierte 1 ,4-Phenyleneinheit
bedeuten können. Ferner wird in Beispiel 1 die Synthese der folgenden Verbindung explizit beschrieben
Jedoch werden keine Eigenschaften dieser Verbindung bei Verwendung in einer FK-Anzeige offenbart. Zudem wird die Verwendung dieser solcher Verbindungen zur
Stabilisierung von blauen Phasen oder in PSA-Anzeigen in der WO 93/22397 A1 weder beschrieben noch durch sie nahegelegt.
Grundsätzlich sind PDLC-Anzeigen von den FK-Anzeigen der
vorliegenden Erfindung völlig verschieden. So bestehen PDLC-Anzeigen aus einem phasenseparierten System, wobei Tröpfchen eines
niedermolekularen FK-Mediums in einer Polymermatrix eingebettet sind. An den Phasengrenzen tritt Lichtstreuung auf. Durch Anpassung der Brechungsindizes der FK-Phase und der Polymerphase, sowie durch Umorientierung der FK-Moleküle in den Tröpfchen im elektrischen Feld kann die Anzeige zwischen einem lichtstreuenden und einem
transparenten Zustand geschaltet werden. Dies erfordert u.a. eine sorgfältige Auswahl der FK-Medien und Polymermaterialien, um eine Anpassung der Brechungsindizes zu gewährleisten, sowie die
Verwendung großer Menge an Polymermaterial, um die Polymermatrix zu bilden. Zudem besitzen PDLC-Anzeigen meist schlechtere elektrooptische Eigenschaften wie z.B. langsame Schaltzeiten und starke
Blickwinkelabhängigkeit des Kontrastes, sowie bauartbedingte Nachteile wie eine aufwendige Herstellung, geringe Langzeitstabilität und große Schichtdicke, und sind deshalb für modernere Anwendungen wie z.B. in Flachbildschirmen für TV-Geräte oder Notebooks nicht geeignet.
Im Gegensatz zu PDLC-Anzeigen werden in den erfindungsgemäßen FK- Anzeigen mit blauer Phase und PSA-Anzeigen Art und Menge der polymerisierbaren Verbindungen so gewählt, dass zwischen Polymer und FK-Medium keine makroskopisch erkennbaren Phasengrenzen mit signifikanter Lichtstreuung auftreten. Demzufolge erfolgt die Auswahl von geeigneten FK-Medien und polymerisierbaren Verbindungen für erfindungsgemäße FK-Anzeigen nach anderen Kriterien als für PDLC- Anzeigen. So sollte die polymerisierbare Komponente eine möglichst grosse Löslichkeit im FK-Medium besitzen und z.B. im Falle von PSA- Anzeigen nur in sehr geringen Mengen verwendet werden. Eine genaue Anpassung der Brechungsindices wie in PDLC-Anzeigen ist dagegen normalerweise nicht erforderlich. Auch an die
Polymerisationseigenschaften der polymerisierbaren Komponente werden, wie oben beschrieben, erheblich größere Anforderungen gestellt. Zudem müssen die FK-Medien deutlich höheren Anforderungen bzgl. der elektrooptischen Eigenschaften genügen und z.B. besonders schnelle Schaltzeiten, hohe Widerstände und niedrige Betriebs- und
Schwellenspannungen aufweisen.
In der EP 0 648 827 A1 werden reaktive Flüssigkristalle einer breiten generischen Formel beschrieben, welche u.a. eine mesogene Gruppe der folgenden Formel enthalten können:
worin L
1 und L
2 CN oder W
2-CrH
sF
2r
+s-i, W
2 eine Einfachbindung, O, S oder CO, r 1 oder 2 und s 0, 1 , 2, 3, 4 oder 5 bedeuten. Weiterhin wird darin die Verwendung solcher reaktiver Flüssigkristalle in elektrooptischen Streusystemen oder zur Herstellung von orientierten FK-Polymeren beschrieben. Konkrete Verbindungen mit einer solchen mesogenen Gruppe werden jedoch nicht konkret offenbart. Zudem wird die
Verwendung solcher oder anderer reaktiver Flüssigkristalle zur
Polymerstabilisierung blauer Phasen weder beschrieben noch nahegelegt.
In der US 7,070,838 werden polymerisierbare Verbindungen einer breiten generischen Formel beschrieben, worin die mesogene Gruppe einen durch fluoriertes Methyl substituierten Phenylrest aufweist, insbesondere zur Verwendung in optischen FK-Polymerfilmen. Darin werden auch polymerisierbare Verbindungen einer Formel BRM-15 sowie einer Formel BRM-b-5 mit drei über Ethylbrücken verknüpften Phenylresten offenbart, sowie eine Mischung polymerisierbarer Flüssigkristalle enthaltend eine solche Verbindung. Ferner wird die Verwendung solcher Verbindungen in Mischungen bestehend aus polymerisierbaren Verbindungen zusammen mit chiralen Komponenten erwähnt. Die Verwendung in
niedermolekularen FK-Medien oder FK-Medien mit blauer Phase wird jedoch weder offenbart noch nahegelegt.
In der US 2003/0203128 A1 werden polymerisierbare Verbindungen einer breiten generischen Formel beschrieben, worin die mesogene Gruppe einen zentrale Fluorenrest aufweist, insbesondere zur Verwendung in optischen FK-Polymerfilmen. Darin werden auch polymerisierbare
Verbindungen der Formel 67-70 offenbart, worin der Fluorenrest mit zwei benachbarten Phenylresten über Ethylbrücken verknüpft ist. sowie eine Mischung polymerisierbarer Flüssigkristalle enthaltend diese Verbindung. Ferner wird die Verwendung solcher Verbindungen in Mischungen bestehend aus polymerisierbaren Verbindungen zusammen mit chiralen
Komponenten erwähnt. Die Verwendung in niedermolekularen FK-Medien oder FK-Medien mit blauer Phase wird jedoch weder offenbart noch nahegelegt.
Somit werden im Stand der Technik polymerstabilisierte blaue Phasen für FK-Medien mit einer reaktiven Komponente, die vorzugsweise aus erfindungsgemäßen polymerisierbaren Verbindungen besteht, weder beschrieben noch nahegelegt.
Gegenstand der Erfindung ist die Verwendung von Verbindungen der Formel I
Pa-(Spa)si-A2-CH2CH2-A1-CH2CH2-A3-(Spb)s2-Pb I worin die einzelnen Reste folgende Bedeutung besitzen
Pa, Pb jeweils unabhängig voneinander eine polymerisierbare Gruppe,
Spa, Spb bei jedem Auftreten gleich oder verschieden eine
Abstandsgruppe, s1 , s2 jeweils unabhängig voneinander 0 oder 1 ,
A1, A2, A3 jeweils unabhängig voneinander einen Rest ausgewählt aus folgenden Gruppen a) der Gruppe bestehend aus trans-1 ,4-Cyclohexylen, 1 ,4- Cyclohexenylen und 4,4'-Bicyclohexylen, worin auch eine oder mehrere nicht benachbarte Chb-Gruppen durch -O- und/oder -S- ersetzt sein können und worin auch ein oder mehrere H-Atome durch F ersetzt sein können, b) der Gruppe bestehend aus 1 ,4-Phenylen und 1 ,3- Phenylen, worin auch eine oder zwei CH-Gruppen durch N ersetzt sein können und worin auch ein oder mehrere H-Atome durch L ersetzt sein können,
c) der Gruppe bestehend aus Tetrahydropyran-2,5-diyl, 1 ,3- Dioxan-2,5-diyl, Tetrahydrofuran-2,5-diyl, Cylcobut-1 ,3- diyl, Piperidin-1 ,4-diyl, Thiophen-2,5-diyl und Selenophen- 2,5-diyl, welche auch ein oder mehrfach durch L substituiert sein können, der Gruppe bestehend aus gesättigten, teilweise ungesättigten oder vollständig ungesättigten, und optional substituierten, polycyclischen Resten mit 5 bis 20
10 cyclischen C-Atomen, von denen auch eines oder
mehrere durch Heteroatome ersetzt sein können, vorzugsweise ausgewählt aus der Gruppe bestehend aus Bicyclo[1.1.1 ]pentan-1 ,3-diyl, Bicyclo[2.2.2]octan-1 ,4-diyl, Spiro[3.3]heptan-2,6-diyl,
35
wobei in diesen Resten auch ein oder mehrere H- Atome durch L ersetzt sein können, und/oder eine oder mehrere Doppelbindungen durch Einfachbindungen ersetzt sein können, und/oder ein oder mehrere CH-Gruppen durch N ersetzt sein können, bei jedem Auftreten gleich oder verschieden F, Cl, CN, SCN, SF
5 oder geradkettiges oder verzweigtes, jeweils optional fluoriertes, Alkyl, Alkoxy, Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy oder Alkoxycarbonyloxy mit 1 bis 12 C- Atomen,
R°, R00 jeweils unabhängig voneinander H, F oder geradkettiges oder verzweigtes Alkyl mit 1 bis 12 C-Atomen, worin auch ein oder mehrere H-Atome durch F ersetzt sein können,
-O-, -S-, -CH2-, -CHY1- oder -CY Y2-,
Y1, und Y2 jeweils unabhängig voneinander eine der oben für R°
angegebenen Bedeutungen, Cl oder CN, und vorzugsweise H, F, Cl, CN, OCF3 oder CF3, oder eines Polymers erhältlich durch Polymerisation einer oder mehrerer Verbindungen der Formel I, in FK-Anzeigen mit blauer Phase oder in FK- Anzeigen des PS- oder PSA-Typs.
Ein weiterer Gegenstand der Erfindung ist ein FK-Medium enthaltend eine oder mehrere Verbindungen der Formel I sowie gegebenenfalls zusätzlich eine oder mehrere polymerisierbare Verbindungen.
Ein weiterer Gegenstand der Erfindung ist ein FK-Medium enthaltend eine oder mehrere Verbindungen der Formel I sowie eine oder mehrere zusätzliche Verbindungen welche auch mesogen, flüssigkristallin und/oder polymerisierbar sein können.
Ein weiterer Gegenstand der Erfindung ist ein FK-Medium enthaltend ein Polymer erhältlich durch Polymerisation einer oder mehrerer
Verbindungen der Formel I, sowie optional enthaltend eine oder mehrere zusätzliche Verbindungen, welche auch mesogen, flüssigkristallin und/oder polymerisierbar sein können.
Ein weiterer Gegenstand der Erfindung ist ein FK-Medium enthaltend
- eine polymerisierbare Komponente enthaltend eine oder mehrere
polymerisierbare Verbindungen der Formel I, oder die polymerisierte Form dieser polymerisierbaren Komponente, sowie
- eine flüssigkristalline Komponente, im Folgenden auch als "FK- Hostmischung" bezeichnet, enthaltend eine oder mehrere,
vorzugsweise zwei oder mehr niedermolekulare (d.h. monomere und unpolymerisierbare) Verbindungen wie vor- und nachstehend
beschrieben, welche vorzugsweise mesogen oder flüssigkristallin sind.
Ein weiterer Gegenstand der Erfindung ist Verwendung von FK-Medien enthaltend eine oder mehrere Verbindungen der Formel I in FK-Anzeigen mit blauer Phase oder in FK-Anzeigen des PS- oder PSA-Typs.
Ein weiterer Gegenstand der Erfindung ist ein Verfahren zur Herstellung eines FK-Mediums wie vor- und nachstehend beschrieben, indem man eine oder mehrere niedermolekulare flüssigkristalline Verbindungen, oder eine FK-Hostmischung wie vor- und nachstehend beschrieben, mit einer oder mehreren Verbindungen der Formel I und gegebenenfalls mit weiteren flüssigkristallinen Verbindungen und/oder Additiven, mischt.
Ein weiterer Gegenstand der Erfindung ist die Verwendung von
Verbindungen der Formel I und diese enthaltende erfindungsgemäße FK- Medien in FK-Anzeigen zur Stabilisierung der blauen Phase,
insbesondere über einen möglichst großen Temperaturbereich.
Ein weiterer Gegenstand der Erfindung ist die Verwendung von
Verbindungen der Formel I und diese enthaltende erfindungsgemäße FK- Medien in PS- und PSA-Anzeigen zur Erzeugung eines Tiltwinkels im FK- Medium durch in situ-Polymerisation der Verbindung(en) der Formel I in der PSA-Anzeige, vorzugsweise unter Anlegen eines elektrischen oder magnetischen Feldes.
Ein weiterer Gegenstand der Erfindung ist eine FK-Anzeige enthaltend eine oder mehrere Verbindungen der Formel I oder ein
erfindungsgemäßes FK-Medium, insbesondere eine PS- oder PSA- Anzeige, besonders bevorzugt eine Anzeige mit blauer Phase, PSA-VA-, PSA-OCB-, PSA-IPS-, PSA-FFS- oder PSA-TN-Anzeige.
Ein weiterer Gegenstand der Erfindung ist eine FK-Anzeige des PS- oder PSA-Typs, enthaltend eine FK-Zelle mit zwei Substraten und zwei Elektroden, wobei mindestens ein Substrat lichtdurchlässig ist und mindestens ein Substrat eine oder zwei Elektroden aufweist, sowie einer zwischen den Substraten befindlichen Schicht eines FK-Mediums enthaltend eine polymerisierte Komponente und eine niedermolekulare Komponente, wobei die polymerisierte Komponente erhältlich ist durch Polymerisation einer oder mehrerer polymerisierbarer Verbindungen zwischen den Substraten der FK-Zelle im FK-Medium, vorzugsweise unter Anlegen einer elektrischen Spannung an die Elektroden, dadurch gekennzeichnet, dass mindestens eine der polymerisierbaren
Verbindungen aus Formel I ausgewählt ist.
Ein weiterer Gegenstand der Erfindung ist ein Verfahren zur Herstellung einer FK-Anzeige wie vor- und nachstehend beschrieben, indem man ein FK-Medium, enthaltend eine oder mehrere niedermolekulare
flüssigkristalline Verbindungen oder eine FK-Hostmischung wie vor- und nachstehend beschrieben sowie eine oder mehrere polymerisierbare Verbindungen wovon mindestens eine aus Formel I ausgewählt ist, in eine FK-Zelle mit zwei Substraten und zwei Elektroden wie vor- und
nachstehend beschrieben füllt, und die polymerisierbaren Verbindungen, vorzugsweise unter Anlegen einer elektrischen Spannung an die
Elektroden, polymerisiert.
Die erfindungsgemäßen PS- und PSA-Anzeigen weisen zwei Elektroden, vorzugsweise in Form von transparenten Schichten, auf, wobei diese auf einem oder beiden der Substrate aufgebracht sind, die die FK-Zelle bilden. Dabei ist entweder jeweils eine Elektrode auf je einem der beiden Substrate aufgebracht, wie zum Beispiel in erfindungsgemäßen PSA-VA-, PSA-OCB- oder PSA-TN-Anzeigen, oder beide Elektroden sind auf nur einem der beiden Substrate aufgebracht, während das andere Substrat keine Elektrode aufweist, wie zum Beispiel in erfindungsgemäßen PSA- IPS- oder PSA-FFS-Anzeigen.
Weiterer Gegenstand der Erfindung sind neue Verbindungen der Formel I, Verfahren zu ihrer Herstellung, sowie in diesen Verfahren verwendete oder daraus erhaltene neue Zwischenprodukte, insbesondere Verbindungen der Formel I, sowie deren Unterformeln wie vor- und nachstehend definiert, worin einer oder mehrere der Reste A1, A2 und A3 ausgewählt ist aus der Gruppe d) wie in Formel I definiert, bestehend aus optional substituierten, gesättigten oder teilweise oder vollständig ungesättigten, polycyclischen Resten mit 5 bis 20 cyclischen C-Atomen, von denen auch ein oder mehrere durch Heteroatome ersetzt sein können.
Besonders bevorzugt ist ein FK-Medium, eine FK-Anzeige, ein Verfahren oder ein Verwendung wie vor- und nachstehend beschrieben, worin das FK-Medium bzw. die darin enthaltene polymerisierbare oder
polymerisierte Komponente keine Verbindungen der folgenden Formel enthalten:
worin P
a, P
b, Sp
a, Sp , s , s2 und L r die vor- und nachstehend
angegebene Bedeutung besitzen, r 0, 1, 2, 3 oder 4 bedeutet, und Za und Zb jeweils unabhängig voneinander -COO- oder -OCO- bedeuten.
Vor- und nachstehend gelten folgende Bedeutungen:
Der Begriff "cyclisches C-Atom" bedeutet ein C-Atom, welches mit
anderen C-Atomen und/oder Heteroatomen einen carbo- oder
heterocyclischen Rest bildet.
Die Begriffe "Tilt" und "Tiltwinkel" beziehen sich auf eine gekippte oder geneigte Orientierung der FK- oleküle eines FK-Mediums relativ zu den Oberflächen der Zelle in einer FK-Anzeige (hier vorzugsweise einer PS- oder PSA-Anzeige). Der Tiltwinkel bezeichnet dabei den
durchschnittlichen Winkel (<90°) zwischen den Moleküllängsachsen der FK-Moleküle (FK-Direktor) und der Oberfläche der planparallelen
Trägerplatten, welche die FK-Zelle bilden. Ein niedriger Wert des
Tiltwinkels (d.h. eine große Abweichung vom 90°-Winkel) entspricht dabei einem großen Tilt. Eine geeignete Methode zur Messung des Tiltwinkels findet sich in den Beispielen. Soweit nicht anders angegeben, beziehen sich vor- und nachstehend offenbarte Werte des Tiltwinkels auf diese Messmethode.
Der Begriff "mesogene Gruppe" ist dem Fachmann bekannt und in der Literatur beschrieben, und bedeutet eine Gruppe, die durch die
Anisotropie ihrer anziehenden und abstoßenden Wechselwirkungen wesentlich dazu beiträgt, in niedermolekularen oder polymeren
Substanzen eine Flüssigkristall(FK-)Phase hervorzurufen. Verbindungen enthaltend mesogene Gruppen (mesogene Verbindungen) müssen nicht unbedingt selbst eine FK-Phase aufweisen. Es ist auch möglich, dass mesogene Verbindungen FK-Phasenverhalten nur nach Vermischung mit anderen Verbindungen und/oder nach Polymerisation zeigen. Typische mesogene Gruppen sind beispielsweise starre Stäbchen- oder
scheibchenförmige Einheiten. Ein Überblick über die im Zusammenhang mit mesogenen bzw. FK-Verbindungen verwendeten Begriffe und
Definitionen findet sich in Pure Appl. Chem. 73(5), 888 (2001) und C. Tschierske, G. Pelzl, S. Diele, Angew. Chem. 2004, 116, 6340-6368.
Der Begriff "Abstandsgruppe" (engl, "spacer" oder "spacer group"), vor- und nachstehend auch als "Sp" bezeichnet, ist dem Fachmann bekannt und in der Literatur beschrieben, siehe beispielsweise Pure Appl. Chem. 73(5), 888 (2001) und C. Tschierske, G. Pelzl, S. Diele, Angew. Chem. 2004, 116, 6340-6368. Falls nicht anders angegeben, bezeichnet der
Begriff "Abstandsgruppe" bzw. "Spacer" vor- und nachstehend eine flexible Gruppe, die in einer polymerisierbaren mesogenen Verbindung die mesogene Gruppe und die polymerisierbare(n) Gruppe(n) miteinander verbindet.
Der Begriff "reaktives Mesogen" oder "RM" bezeichnet eine Verbindung enthaltend eine mesogene Gruppe und eine oder mehrere funktionelle Gruppen, die zur Polymerisation geeignet sind (auch als polymerisierbare Gruppe oder Gruppe P bezeichnet).
Die Begriffe "niedermolekulare Verbindung" und "unpolymerisierbare Verbindung" bezeichnen, üblicherweise monomere, Verbindungen, die keine funktionelle Gruppe aufweisen, welche zur Polymerisation unter den üblichen dem Fachmann bekannten Bedingungen, insbesondere unter den zur Polymerisation der RMs verwendeten Bedingungen, geeignet ist.
"Halogen" bedeutet F, Cl, Br oder I.
Definitionen wie "Alkyl, Alkoxy, Alkylcarbonyl, Alkoxycarbonyl,
Alkylcarbonyloxy oder Alkoxycarbonyloxy mit 1 bis 12 C-Atomen" etc., bedeuten, dass die Reste enthaltend eine Carbonylgruppe (CO) sowie die ungesättigten Reste wie Alkenyl und Alkinyl mindestens zwei C-Atome, und die verzweigten Reste mindestens drei C-Atome aufweisen. Die polymerisierbare Gruppe Pa,b ist eine Gruppe, die für eine
Polymerisationsreaktion, wie beispielsweise die radikalische oder ionische Kettenpolymerisation, Polyaddition oder Polykondensation, oder für eine polymeranaloge Umsetzung, beispielsweise die Addition oder
Kondensation an eine Polymerhauptkette, geeignet ist. Besonders bevorzugt sind Gruppen für die Kettenpolymerisation, insbesondere solche enthaltend eine C=C-Doppelbindung oder -CsC-Dreifachbindung, sowie zur Polymerisation unter Ringöffnung geeignete Gruppen wie beispielsweise Oxetan- oder Epoxygruppen
evorzugte Gruppen Pa b sind ausgewählt aus der Gruppe bestehend aus
OCO-, (CH2=CH-CH2)2CH-OCO-, (CH2=CH)2CH-0-, (CH2=CH-CH2)2N-, (CH2=CH-CH2)2N-CO-, HO-CW2W3-, HS-CW2W3-, HW2N-, HO-CW2W3- NH-, CH2=CW1-CO-NH-, CH2=CH-(COO)ki-Phe-(O)k2-, CH2=CH-(CO)kr Phe-(0)k2-, Phe-CH=CH-, HOOC-, OCN-, und W^ /WSi-, worin W1 H, F, Cl, CN, CF3, Phenyl oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, F, Cl oder CH3 bedeutet, W2 und W3 jeweils unabhängig voneinander H oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, Methyl, Ethyl oder n-Propyl bedeuten, W4, W5 und W6 jeweils unabhängig voneinander Cl, Oxaalkyl oder Oxacarbonyialkyl mit 1 bis 5 C-Atomen bedeuten, W7 und W8 jeweils unabhängig voneinander H, Cl oder Alkyl mit 1 bis 5 C-Atomen bedeuten, Phe 1 ,4-Phenylen bedeutet, welches optional mit einem oder mehreren, von P-Sp- verschiedenen Resten L wie oben definiert substituiert ist, k^ k2 und k3 jeweils unabhängig voneinander 0 oder 1 bedeuten, kß
vorzugsweise 1 bedeutet, und k4 eine ganze Zahl von 1 bis 10 bedeutet.
Besonders bevorzugte Gruppen Pa,b sind ausgewählt aus der Gruppe bestehend aus CH2=CW1-CO-O-, CH2=CW1-CO-,
NH-, CH2=CW1-CO-NH-, (CH2=CH)2CH-OCO-, (CH2=CH-CH2)2CH-OCO-, (CH2=CH)2CH-O-, (CH2=CH-CH2)2N-, (CH2=CH-CH2)2N-CO-, CH2=CW1- CO-NH-, CH2=CH-(COO)ki-Phe-(O)k2-, CH2=CH-(CO)ki-Phe-(0)k2-, Phe-
CH=CH- und V^W^Si-, worin W1 H, F, Cl, CN, CF3, Phenyl oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, F, Cl oder CH3 bedeutet, W2 und W3 jeweils unabhängig voneinander H oder Alkyl mit 1 bis 5 C-Atomen, insbesondere H, Methyl, Ethyl oder n-Propyl bedeuten, W4, W5 und W6 jeweils unabhängig voneinander Cl, Oxaalkyl oder Oxacarbonylalkyl mit 1 bis 5 C-Atomen bedeuten, W7 und W8 jeweils unabhängig voneinander H, Cl oder Alkyl mit 1 bis 5 C-Atomen bedeuten, Phe 1,4-Phenylen bedeutet, ki, k2 und k3 jeweils unabhängig voneinander 0 oder 1 bedeuten, k3 vorzugsweise 1 bedeutet, und k* eine ganze Zahl von 1 bis 10 bedeutet.
Ganz besonders bevorzugte Gruppen Pa b sind ausgewählt aus der Gruppe bestehend aus CH2=CW1-CO-O-, insbesondere CH2=CH-CO-O-,
CH2=C(CH3)-CO-O- und CH2=CF-CO-O-, ferner CH2=CH-O-,
O
2 N
(CH
2=CH)
2CH-O-CO-, (CH
2=CH)
2CH-O-, W HC CH -
und
Weitere ganz besonders bevorzugte Gruppen Pa b sind ausgewählt aus der Gruppe bestehend aus Vinyloxy-, Acrylat-, Methacrylat-, Fluoracrylat-, Chloracrylat-, Oxetan- und Epoxygruppen, und bedeuten besonders bevorzugt eine Acrylat- oder Methacrylatgruppe.
Bevorzugte Abstandsgruppen Spa b sind ausgewählt aus der Formel Sp"- X", so dass der Rest P^-Sp3 - der Formel P^-Sp"- '- entspricht, wobei
Sp" Alkylen mit 1 bis 20, vorzugsweise 1 bis 12 C-Atomen bedeutet, welches optional durch F, Cl, Br, I oder CN ein- oder mehrfach substituiert ist, und worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander so durch -O-, -S-, -NH-, -N(R0)-, -Si(R00R000)-, -CO-, -CO-O-, -O-CO-, -O-CO-O-, -S-CO-, -CO-S-, -N(R00)-CO-O-, -O-CO-N(R00)-, -N(R00)-CO-N(R00)-, -CH=CH- oder -C^C- ersetzt sein können, dass O- und/oder S- Atome nicht direkt miteinander verknüpft sind,
X" -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O-, -CO-N(R00)-, -N(Rüü)-CO-, -N(R00)-CO-N(R00)-, -OCH2-, -CH2O-, -SCH2-, -CH2S-, -CF2O-,
-OCF2-, -CF2S-, -SCF2-, -CF2CH2-, -CH2CF2-, -CF2CF2-, -CH=N-, -N=CH-, -N=N-, -CH=CR°-, -CY2=CY3-, -C=C-, -CH=CH-CO-O-,
-O-CO-CH=CH- oder eine Einfachbindung bedeutet,
R00 und R000 jeweils unabhängig voneinander H oder Alkyl mit 1 bis 12 C- Atomen bedeuten, und Y2 und Y3 jeweils unabhängig voneinander H, F, Cl oder CN bedeuten.
X' ist vorzugsweise -O-, -S -CO-, -COO-, -OCO-, -O-COO-, -CO-NR0-, - NR°-CO-, -NR°-CO-NR°- oder eine Einfachbindung. Typische Abstandsgruppen Sp" sind beispielsweise -(CH2)pi-, -(CH2CH2O)qi - CH2CH2-, -CH2CH2-S-CH2CH2-, -CH2CH2-NH-CH2CH2- oder -(SiR00R000-O)pi- , worin p1 eine ganze Zahl von 1 bis 12 ist, q1 eine ganze Zahl von 1 bis 3 ist, und R00 und R000 die oben angegebenen Bedeutungen besitzen. Besonders bevorzugte Gruppen -Sp"-X"- sind -(Chfejpi-, -(CH2)pi-O-,
-(CH2)pi-O-CO-, -(CH2)pi-O-CO-O-, worin p1 und q1 die oben angegebene Bedeutung haben.
Besonders bevorzugte Gruppen Sp" sind beispielsweise jeweils
geradkettiges Ethylen, Propylen, Butylen, Pentylen, Hexylen, Heptylen, Octylen, Nonylen, Decylen, Undecylen, Dodecylen, Octadecylen,
Ethylenoxyethylen, Methylenoxybutylen, Ethylenthioethylen, Ethylen-N- methyl-iminoethylen, -Methylalkylen, Ethenylen, Propenylen und
Butenylen.
In einer weiteren bevorzugten Ausführungsform der Erfindung bedeuten Pa und/oder Pb in Formel I einen Rest mit zwei oder mehreren
polymerisierbaren Gruppen (multifunktionelle polymerisierbare Reste).
Geeignete Reste dieses Typs, sowie diese enthaltende polymerisierbare Verbindungen und ihre Herstellung sind beispielsweise in US 7,060,200 B1 oder US 2006/0 72090 A1 beschrieben. Besonders bevorzugt sind
multifunktionelle polymerisierbare Reste ausgewählt aus folgenden
Formeln
-X-alkyl-CHP1-CH2-CH2P2 l*a
-X-alkyl-C(CH2P1)(CH2P2)-CH2P3 l*b
-X-alkyl-CHP1CHP2-CH2P3 l*c -X-alkyl-C(CH2P1)(CH2P2)-CaaH2aa+i l*d
-X-alkyl-CHP1-CH2P2 l*e
-X-alkyl-CHP1P2 l*f
-X-a]kyl-CP1P2-CaaH2aa+i
-X-alkyl-C(CH2P1)(CH2P2)-CH2OCH2-C(CH2P3)(CH2P )CH2P5
-X-alkyl-CH((CH2)aaP1)((CH2)bbP2)
-X-alkyl-CHP1CHP -CaaH2aa+i
-X'-alkyl-C(CH3)(CH2P1)(CH2P2) worin alkyl eine Einfachbindung oder geradkettiges oder verzweigtes
Alkylen mit 1 bis 12 C-Atomen bedeutet, worin eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch -C(R00)=C(R000)-, -OC-, -N(R00)-, -O-, -S-, - CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl oder CN ersetzt sein können, wobei R00 und R000 die oben angegebene
Bedeutung haben,
aa und bb jeweils unabhängig voneinander 0, 1 , 2, 3, 4, 5 oder 6 bedeuten,
X eine der für X' angegebenen Bedeutungen besitzt, und P1"5 jeweils unabhängig voneinander eine der für Pa angegebenen
Bedeutungen besitzen.
Bevorzugte Reste A1 in Formel I sind ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
worin die einzelnen Ringe auch zusätzlich ein- oder mehrfach durch L wie vor- und nachstehend beschrieben substituiert sein können.
Ganz besonders bevorzugt bedeutet A1 eine Rest ausgewählt aus der Gruppe bestehend aus folgenden Formeln
Bevorzugte Reste A2 und A3 in Formel I sind ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
worin die einzelnen Ringe auch zusätzlich ein- oder mehrfach durch L wie vor- und nachstehend beschrieben substituiert sein können.
Besonders bevorzugte Reste A2 und A3 sind ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
Weitere besonders bevorzugte Reste A
2 und A
3 sind ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
Weitere besonders bevorzugte Verbindungen der Formel I sowie deren vor- und nachstehend angegebenen Unterformeln sind solche worin s1 und s2 jeweils 0 bedeuten
s1 und s2 jeweils 1 bedeuten,
s1 1 und s2 0 bedeutet oder s1 0 und s2 1 bedeutet.
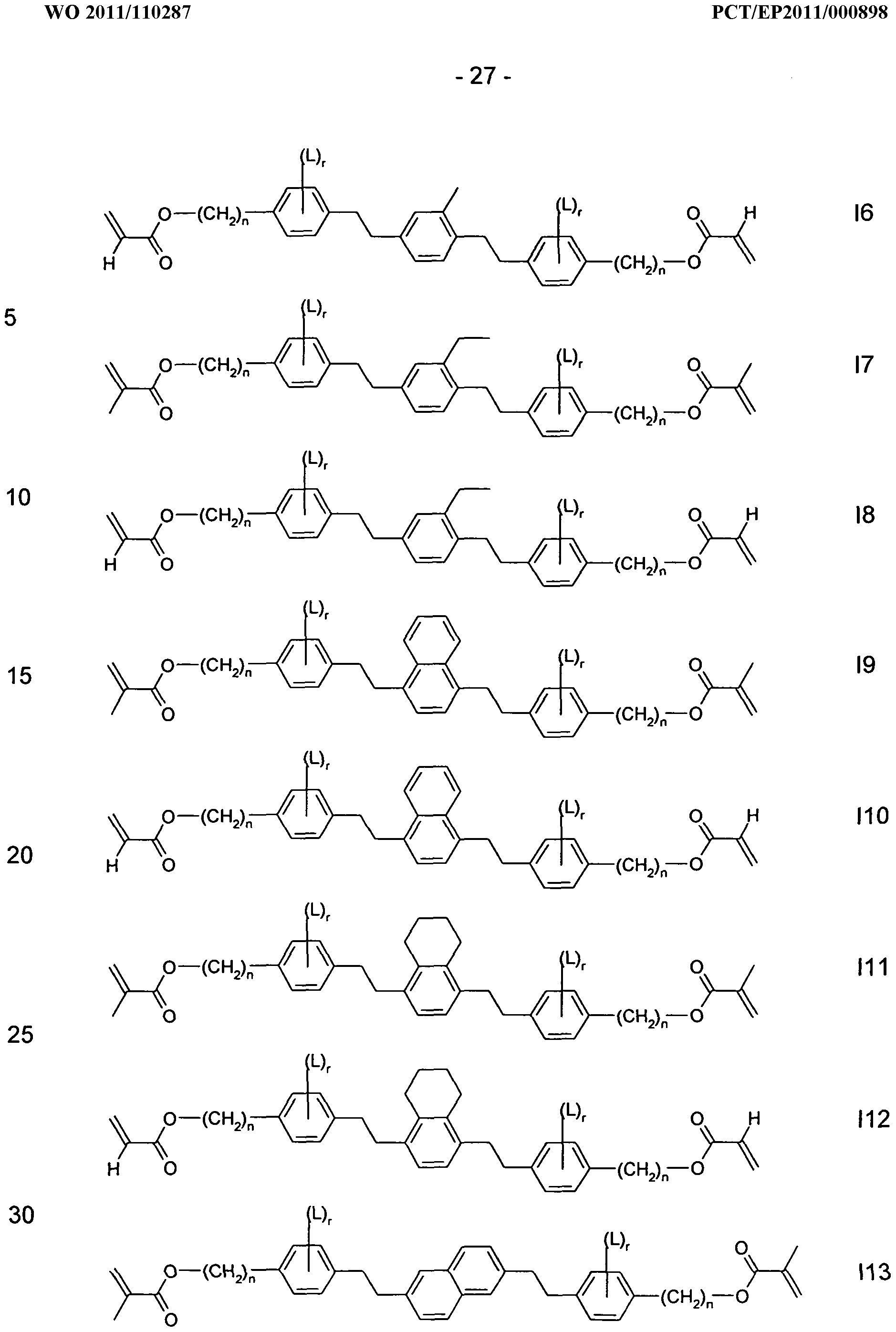
Ganz besonders bevorzugte Verbindungen der Formel I sind ausgewählt aus der Gruppe bestehend aus den folgenden Formeln:
868000/nOZd3/13d L ZOll/UOZ OAV
worin L bei jedem Auftreten gleich oder verschieden eine der vor- und nachstehend angegebenen Bedeutungen besitzt, r 0, 1 , 2, 3 oder 4 bedeutet, und n eine ganze Zahl zwischen 1 und 24, bevorzugt zwischen 1 und 12, ganz besonders bevorzugt zwischen 2 und 8 bedeutet und worin, falls ein Rest am Ende einer Einfach- bzw. Doppelbindung nicht genannt ist, es sich um eine endständige CH
3- bzw. CH
2-Gruppe handelt.
In den Formeln 11-180 bedeutet
vorzugsweise eine Gruppe ausgewählt aus der Gruppe bestehend aus folgenden Formeln
Pa und Pb bedeuten in den Verbindungen der Formel I sowie deren Unterformeln vorzugsweise Acrylat oder Methacrylat, ferner Fluoracrylat.
Spa und Spb bedeuten in den Verbindungen der Formeln I und deren Unterformeln vorzugsweise eine Rest ausgewählt aus der Gruppe bestehend aus -(CH2)Pi-, -(CH2)Pi-0-, -(CH2)pi-O-CO- oder -(CH2)p O-CO- O- und deren Spiegelbildern, worin p1 eine ganze Zahl von 1 bis 12, vorzugsweise von 1 bis 6, besonders bevorzugt 1 , 2 oder 3 bedeutet, wobei diese Gruppen so mit Pa oder Pb verknüpft sind, dass O-Atome nicht direkt benachbart sind. Weiterer Gegenstand der Erfindung sind neue Verbindungen der Formel I
Pa-(Spa)si-A2-CH2CH2-A -CH2CH2-A3-(Spb)s2-Pb I worin Pa, Pb, Spa, Spb, s1 , s2, A1, A2 und A3 die vor- und nachstehend angegebene Bedeutung besitzen, und
worin einer oder mehrere der Reste A1, A2 und A3 ausgewählt sind aus der Gruppe d) bestehend aus gesättigten, teilweise gesättigten oder vollständig ungesättigten, und optional substituierten, polycyclischen Resten mit 5 bis 20 cyclischen C-Atomen, von denen auch eines oder mehrere durch Heteroatome ersetzt sein können, vorzugsweise worin einer oder mehrere der Reste A1, A2 und A3 ausgewählt sind aus der Gruppe bestehend aus Bicyclo[1.1.1]pentan-1 ,3- diyl, Bicyclo[2.2.2]octan-1 ,4-diyl, Spiro[3.3]heptan-2,6-diyl,
wobei in diesen Resten auch ein oder mehrere H-Atome durch L ersetzt sein können, und /oder eine oder mehrere Doppelbindungen durch Einfachbindungen ersetzt sein können, und/oder ein oder mehrere CH-
Gruppen durch N ersetzt sein können, wobei L, R°, R
00, M, Y
1 und Y
2 die in Formel I angegebene Bedeutung besitzen.
Weiterer Gegenstand der Erfindung sind FK-Medien und FK-Anzeigen, insbesondere solche gemäß den Ausgestaltungen und bevorzugten Ausführungsformen sowie aller ihrer Kombinationen wie vor- und nachstehend beschrieben, welche eine oder mehrere neue Verbindungen der Formel I enthalten. Von diesen neuen Verbindungen sind solche besonders bevorzugt, worin
- die Reste der Gruppe d) ausgewählt sind aus Gruppe d1) bestehend aus
wobei in diesen Resten auch ein oder mehrere H-Atome durch L wie in Formel I definiert ersetzt sein können, wobei L besonders bevorzugt F, CN, SCN, SF
5, CH
2F, CHF
2, CF
3l OCH
2F, OCHF
2 oder OCF
3 bedeutet,
- die Reste der Gruppe d) ausgewählt sind aus Gruppe d2) bestehend aus
wobei in diesen Resten auch ein oder mehrere H-Atome durch L wie in Formel I definiert ersetzt sein können, wobei L besonders bevorzugt F, CN, SCN, SF
5, CH
2F, CHF
2, CF
3, OCH
2F, OCHF
2 oder OCF
3 bedeutet, - die Reste P
a und P
b ausgewählt sind aus der Gruppe bestehend aus
Vinyloxy-, Acrylat-, Methacrylat-, Fluoracrylat-, Chloracrylat-, Oxetan- und Epoxygruppen, besonders bevorzugt Acrylat- oder Methacrylatgruppen,
- die Reste Spa und Spb ausgewählt sind aus der Gruppe bestehend aus - (CH2)p1-, -(CH2)p1-O-, -(CH2)Pi-O-CO- und -(CH2)p1-O-CO-O- und deren
Spiegelbildern, worin p1 eine ganze Zahl von 1 bis 12, vorzugsweise von 1 bis 6, besonders bevorzugt 1, 2 oder 3 bedeutet, und wobei diese Reste so mit Pa oder Pb verknüpft sind, dass O-Atome nicht direkt benachbart sind,
- s1 und s2 jeweils 0 bedeuten,
- s1 und s2 jeweils 1 bedeuten, - s1 1 und s2 0 bedeutet oder s1 0 und s2 1 bedeutet.
Von diesen neuen Verbindungen ganz besonders bevorzugt sind solche ausgewählt aus einer oder mehreren der folgenden Gruppen:
der Gruppe bestehend aus den Formeln 19-116,
der Gruppe bestehend aus den Formeln I23-I28,
der Gruppe bestehend aus den Formeln 137-144,
der Gruppe bestehend aus den Formeln 149-154,
der Gruppe bestehend aus den Formeln 163-170 und
der Gruppe bestehend aus den Formeln 175-180,
worin L eine der vor- und nachstehend angegebenen Bedeutungen besitzt und n eine ganze Zahl zwischen 1 und 24, bevorzugt zwischen 1 und 12, ganz besonders bevorzugt zwischen 2 und 8 ist.
Ein weiterer Gegenstand der Erfindung sind neue Zwischenprodukte zur Herstellung von Verbindungen der Formel I, ausgewählt aus Formel IA
G-O-iSp^si-A^CHzCHz-A^CHzCHz-A^iSp^sa-O-G' IA worin A1, A2, A3, Spa, Spb, s1 und s2 die in Formel I oder deren
Unterformeln angegebenen Bedeutungen, oder eine der vor- und nachstehend angegebenen bevorzugten Bedeutungen, besitzen, und G und G' jeweils unabhängig voneinander ein H-Atom oder eine
Schutzgruppe bedeuten.
Geeignete Schutzgruppen G sind dem Fachmann bekannt. Bevorzugte Schutzgruppen sind Alkyl, Acyl und Alkylsilyl- oder Arylsilylgruppen, 2- Tetrahydropyranyl oder Methoxymethyl.
Die Verbindungen und Zwischenprodukte der Formel I und IA sowie deren Unterformeln können in Analogie zu dem Fachmann bekannten und in Standardwerken der organischen Chemie beschriebenen Verfahren, wie beispielsweise in Houben-Weyl, Methoden der organischen Chemie, Thieme-Verlag, Stuttgart, hergestellt werden.
Besonders geeignete und bevorzugte Verfahren zur Herstellung von Verbindungen und Zwischenprodukten der Formel I und IA sowie deren Unterformeln sind in folgenden Schemata beispielhaft dargestellt und enthalten vorzugsweise einen oder mehrere der nachfolgend
beschriebenen Schritte.
Die Verbindungen der Formel I werden bevorzugt hergestellt aus entsprechenden Dialdehyden 1. Diese werden in einer Wittigreaktion mit geeigneten Triphenyphosphoniumsalzen umgesetzt. In Schema 1 ist dies beispielhaft für die Umsetzung mit den para-Brom-benzyltriphenyl- phosphonium-salzen 2 beschrieben. Letztere sind als Reaktionspartner weiterhin besonders geeignet, um anschließend Verbindungen mit den bevorzugten Spacergruppen Sp = (CH2)pi zu liefern.
Zunächst werden aus den Dialdehyden 1 und den Benzyltriphenyl- phosphoniumsalzen 2 in einer l/tW/g-Reaktion die Verbindungen 3 erhalten. Diese werden dann direkt in einer Sonograsft/'ra-Reaktion mit beispielsweise Alkinolen 4 zu den Verbindungen 5 umgesetzt. In der anschließenden Hydrierung werden gleichzeitig die Ethylenbrücken und die Alkylspacer erhalten. Die Verbindungen 6 können dann beispielsweise mit Acrylsäurederivaten verestert werden. Auf diese Weise werden die besonders bevorzugten polymerisierbaren Verbindungen I (z.B.
Verbindungen 7) vom Acrylat- bzw. Methacrylattyp erhalten.
Schema 1 : Synthese von Verbindungen I (7 im Speziellen) ausgehend von Dialdehyden 1. Synthesebeispiel für die Verwendung von p-Brom- benzyltriphenylphosphonium-salzen 2
Der Fachmann kann die Synthese in geeigneter Weise modifizieren und so zu weiteren Verbindungen vom Typ I gelangen. Die besonders bevorzugten Verbindungen mit einem Alkoxyspacer oder direkt an den Ring gebundenen Acrylaten werden beispielsweise unter Verwendung von p-Methoxy-benzyltriphenylphosphoniumsalzen 8 erhalten (vgl. Schema 2). Nach der Wittig-Reaktion werden die Verbindungen 9 erhalten. Diese werden zu den Verbindungen 10 hydriert. Die Spaltung der
Methoxygruppen kann durch Umsetzung mit Bromwasserstoffsäure in Eisessig oder mit BBr3 erfolgen. Die Bisphenole 11 können dann direkt zu polymersierbaren Verbindungen I (z.B. Verbindungen 12) umgesetzt werden.
Schema 2: Synthese von Verbindungen I (12 im Speziellen) ausgehend von Dialdehyden 1. Svnthesebeispiel für die Verwendung von p-Methoxy- benzyltriphenyl-phosphoniumsalzen 8
1 8
Die besonders bevorzugten Verbindungen mit einem Alkoxyspacer werden aus den Verbindungen 11 durch Umsetzung mit beispielsweise Bromalkanolen 13 erhalten (vgl. Schema 3). Die erhaltenen
Verbindungen 13 werden dann z.B. mit Acrylsäurederivaten verestert.
Schema 3: Synthese von Verbindungen I (15 im Speziellen) mit Alkoxyspacern
Zur Herstellung von erfindungsgemäßen PSA-Anzeigen werden die polymerisierbaren Verbindungen im FK-Medium zwischen den Substraten der FK-Anzeige unter Anlegen einer Spannung durch in-situ- Polymerisation polymerisiert oder vernetzt (falls eine Verbindung zwei oder mehr polymerisierbare Gruppen enthält). Die Polymerisation kann in einem Schritt durchgeführt werden. Es ist auch möglich, zunächst in einem ersten Schritt die Polymerisation unter Anlegen einer Spannung durchzuführen, um einen pretilt-Winkel zu erzeugen, und anschließend in einem zweiten Polymerisationsschritt ohne anliegende Spannung die im ersten Schritt nicht abreagierten Verbindungen zu polymerisieren bzw. zu vernetzen ("end curing").
Geeignete und bevorzugte Polymerisationsmethoden sind beispielsweise die thermische oder Photopolymerisation, vorzugsweise
Photopolymerisation, insbesondere UV-Photopolymerisation. Dabei können gegebenenfalls auch ein oder mehrere Initiatoren zugesetzt werden. Geeignete Bedingungen für die Polymerisation, sowie geeignete Arten und Mengen der Initiatoren, sind dem Fachmann bekannt und in der Literatur beschrieben. Für die radikalische Polymerisation eignen sich zum Beispiel die kommerziell erhältlichen Photoinitiatoren Irgacure651®, Irgacure184®, Irgacure907®, Irgacure369®, oder Darocurel 173® (Ciba
AG). Falls ein Initiator eingesetzt wird, beträgt dessen Anteil vorzugsweise 0,001 bis 5 Gew.-%, besonders bevorzugt 0,001 bis 1 Gew.-%.
Die erfindungsgemäßen polymerisierbaren Verbindungen eignen sich auch für die Polymerisation ohne Initiator, was erhebliche Vorteile mit sich bringt, wie beispielsweise geringere Materialkosten und insbesondere eine geringere Verunreinigung des FK-Mediums durch mögliche Restmengen des Initiators oder dessen Abbauprodukte. Die Polymerisation kann somit auch ohne Zusatz eines Initiators erfolgen. Somit enthält das FK-Medium in einer bevorzugten Ausführungsform keinen Polymerisationsinitiator.
Die polymerisierbare Komponente oder das FK-Medium können auch einen oder mehrere Stabilisatoren enthalten, um eine unerwünschte spontane Polymerisation der RMs, beispielsweise während der Lagerung oder des Transports, zu verhindern. Geeignete Arten und Mengen der Stabilisatoren sind dem Fachmann bekannt und in der Literatur
beschrieben. Besonders geeignet sind zum Beispiel die kommerziell erhältlichen Stabilisatoren der Serie Irganox® (Ciba AG), wie
beispielsweise Irganox® 1076. Falls Stabilisatoren eingesetzt werden, beträgt deren Anteil, bezogen auf die Gesamtmenge der RMs
beziehungsweise der polymerisierbaren Komponente, vorzugsweise 10 - 10,000 ppm, besonders bevorzugt 50 - 500 ppm.
Die erfindungsgemäßen polymerisierbaren Verbindungen können einzeln polymerisiert werden, es können aber auch Mischungen polymerisiert werden, welche zwei oder mehr erfindungsgemäße polymerisierbare Verbindungen enthalten, oder Mischungen enthaltend eine oder mehrere erfindungsgemäße polymerisierbare Verbindungen und eine oder mehrere weitere polymerisierbare Verbindungen (Comonomere), welche
vorzugsweise mesogen oder flüssigkristallin sind. Bei Polymerisation solcher Mischungen entstehen Copolymere. Die vor- und nachstehend genannten polymerisierbaren Mischungen sind ein weiterer Gegenstand der Erfindung. Die polymerisierbaren Verbindungen und Comonomere sind mesogen oder nicht-mesogen, vorzugsweise mesogen oder flüssigkristallin.
Geeignete und bevorzugte Comonomere für die Verwendung in erfindungsgemäßen Anzeigen sind beispielsweise ausgewählt aus den folgenden Formeln:
worin die einzelnen Reste folgende Bedeutung besitzen:
P1 und P2 jeweils unabhängig voneinander eine polymerisierbare
Gruppe, vorzugsweise mit einer der vor- und nachstehend für P angegebenen Bedeutungen, besonders bevorzugt eine Acrylat-, Methacrylat-, Fluoracrylat-, Oxetan-, Vinyloxy- oder Epoxygruppe,
Sp1 und Sp2 jeweils unabhängig voneinander eine Einfachbindung oder eine Abstandsgruppe, vorzugsweise mit einer der vor- und
nachstehend für Spa angegebenen Bedeutungen, und besonders bevorzugt -(CH2)pi-, -(CH2)Pi-O-, -(CH2)Pi-CO-O- oder -(CH2)pi-0-CO-O-, worin p1 eine ganze Zahl von 1 bis 12 ist, und wobei in den letztgenannten Gruppen die
Verknüpfung zur benachbarten Ring über das O-Atom erfolgt,
wobei auch einer oder mehrere der Reste P -Sp1- und P2-Sp2- einen Rest
Raa bedeuten können, mit der Maßgabe dass mindestens einer der vorhandenen Reste P1-Sp1- und P2-Sp2- nicht Raa bedeutet,
Raa H, F, Cl, CN oder geradkettiges oder verzweigtes Alkyl mit 1 bis 25 C-Atomen, worin auch eine oder mehrere nicht benachbarte CH2-Gruppen jeweils unabhängig voneinander durch C(R°)=C(R00)-, -C=C-, -N(R0)-. -O-, -S-, -CO-, -CO-O-, -O-CO-, -O-CO-O- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, und worin auch ein oder mehrere H-Atome durch F, Cl, CN oder P1- Sp1- ersetzt sein können, besonders bevorzugt geradkettiges oder verzweigtes, optional ein- oder mehrfach fluoriertes, Alkyl, Alkoxy, Alkenyl, Alkinyl, Alkylcarbonyl, Alkoxycarbonyl, oder Alkylcarbonyloxy mit 1 bis 12 C-Atomen (wobei die Alkenyl- und Alkinylreste mindestens zwei und die verzweigten Reste mindestens drei C-Atome aufweisen),
R°, R00 jeweils unabhängig voneinander und bei jedem Auftreten gleich oder verschieden H oder Alkyl mit 1 bis 12 C-Atomen,
Ry und Rz jeweils unabhängig voneinander H, F, CH3 oder CF3,
Z1 -O-, -CO-, -C(RyRz)-,oder -CF2CF2-,
Z2 und Z3 jeweils unabhängig voneinander -CO-O-, -O-CO-, -CH2O-,
-OCH2-, -CF20-, -OCF2-, oder -(CH2)„-, wobei n 2, 3 oder 4 ist,
L bei jedem Auftreten gleich oder verschieden F, Cl, CN, SCN,
SF5 oder geradkettiges oder verzweigtes, optional ein- oder mehrfach fluoriertes, Alkyl, Alkoxy, Alkenyl, Alkinyl,
Alkylcarbonyl, Alkoxycarbonyl, Alkylcarbonyloxy oder
Alkoxycarbonyloxy mit 1 bis 12 C-Atomen vorzugsweise F,
U und L" jeweils unabhängig voneinander H, F oder Cl,
r 0, 1 , 2, 3 oder 4,
s 0, 1 , 2 oder 3,
t 0, 1 oder 2,
x 0 oder 1.
Vorzugsweise enthält das FK-Medium oder die polymerisierbare
Komponente zusätzlich zu den Verbindungen der Formel I oder IA eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus den Formeln M16-M29, besonders bevorzugt bestehend aus den Formeln M16- 21 , ganz besonders bevorzugt bestehend aus den Formeln M16, M17 und M18.
Vorzugsweise enthält das FK-Medium oder die polymerisierbare
KKoommppoonneennttee kkeeiinnee VVeerrbindungen der Formel M10, worin Z2 und Z3 -COO- oder -OCO- bedeuten.
Die FK-Medien zur Verwendung in den erfindungsgemäßen FK-Anzeigen enthalten, neben den oben beschriebenen polymerisierbaren
Verbindungen, eine FK-Mischung ("Host-Mischung") enthaltend eine oder mehr, vorzugsweise zwei oder mehr niedermolekulare (d.h. monomere bzw. unpolymerisierte) Verbindungen. Letztere sind stabil bzw. unreaktiv gegenüber einer Polymerisationsreaktion unter den zur Polymerisation der polymerisierbaren Verbindungen verwendeten Bedingungen. Prinzipiell eignet sich als Host-Mischung jede zur Verwendung in herkömmlichen VA- und OCB-Anzeigen geeignete FK-Mischung.
Geeignete FK-Mischungen sind dem Fachmann bekannt und in der Literatur beschrieben. FK-Medien für VA-Anzeigen sind in EP 1 378 557 A1 , FK-Medien für OCB-Anzeigen sind in EP 1 306 418 A1 und DE 102 24 046 A1 beschrieben. FK-Medien für FK-Anzeigen mit blauer Phase sind in WO 2006/063662 A1 sowie den darin zitierten Dokumenten beschrieben.
Besonders bevorzugte FK-Medien zur Verwendung in FK-Anzeigen mit blauer Phase werden im Folgenden beschrieben:
Vorzugsweise enthält ein erfindungsgemäßes FK-Medium mit blauer Phase eine polymerisierbare Komponente A, vorzugsweise in einer Konzentration von 1 bis 25%, besonders bevorzugt von 2 bis 20%, ganz besonders bevorzugt von 3 bis 15%, enthaltend, vorzugsweise hauptsächlich bestehend aus, ganz besonders bevorzugt
ausschließlich bestehend aus, einer oder mehrerer Verbindungen der Formel I und optional einer oder mehrerer zusätzlicher polymerisierbarer Verbindungen, und - eine flüssigkristalline Komponente B, enthaltend eine oder mehrere, vorzugsweise zwei oder mehr niedermolekulare (d.h. monomere und unpolymerisierbare) Verbindungen, vorzugsweise in einer
Konzentration von 20-100%, vorzugsweise mit einer positiven dielektrischen Anisotropie, vorzugsweise hauptsächlich bestehend aus, ganz besonders bevorzugt ausschließlich bestehend aus, einer oder mehrerer Verbindungen der Formel II
worin die einzelnen Reste folgende Bedeutung besitzen
R22 H, F, Cl, CN, NCS, SF5 , S02CF3 oder geradkettiges oder verzweigtes Alkyl mit 1 bis 20 C-Atomen, welches unsubstituiert, oder durch F, Cl oder CN ein- oder mehrfach substituiert ist, und worin auch eine oder mehrere nicht benachbarte CH2-Gruppen auch jeweils unabhängig voneinander durch -O-, -S-, -NH-, -NR01-, - SiR01R02-, -CO-, -COO-, -OCO-, -OCO-O-, -S-CO-,
-CO-S-, -CY°1=CY°1- oder -C^C- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, jeweils unabhängig voneinander F, Cl oder CN, der Reste Y01 und Y02 auch H, jeweils unabhängig voneinander H oder Alkyl mit 1 bis 12 C-Atomen,
A23 jeweils unabhängig voneinander und bei jedem
Auftreten gleich oder verschieden
Z21, Z22 jeweils unabhängig voneinander, und bei jedem Auftreten gleich oder verschieden, eine Einfachbindung, -(CH2)4-, -CH2CH2-, -CF2-CF2-, -CF2-CH2-, -CH2-CF2-, -CH=CH-, - CF=CF-, -CF=CH-, -(CH2)30-, -0(CH2)3-, -CH=CF-, -C=C-, -CH2O-, -OCH2-, -CF20-, -OCF2-, -CO-O- oder -O-CO-,
F, Cl, -CN, -NCS, -SF5, -S02CF3, oder Alkyl, Alkenyl, Alkenyloxy, Alkylalkoxy oder Alkoxy mit 1 bis 3 C-Atomen, welches durch F, Cl oder CN ein- oder mehrfach substituiert ist, jeweils unabhängig voneinander H oder F, m 0, 1 oder 2,
0, 1, 2 oder 3,
o 0, 1 oder 2, wobei m + n + o 0, 1 , 2 oder 3, vorzugsweise 0, 1 oder 2 bedeutet, optional eine flüssigkristalline Komponente C, enthaltend eine oder mehrere, vorzugsweise zwei oder mehr niedermolekulare (d.h.
monomere und unpolymerisierbare) Verbindungen, vorzugsweise in einer Konzentration von 1 bis 25 %, vorzugsweise hauptsächlich bestehend aus, ganz besonders bevorzugt ausschließlich bestehend aus, einer oder mehrerer Verbindungen der Formel III
worin a, b, c, d jeweils unabhängig voneinander 0, 1 oder 2, wobei a + b + c + d 0, 1 , 2, 3 oder 4 ist,
A31, A32, A33, A3 jeweils unabhängig voneinander, und bei jedem
Auftreten gleich oder verschieden,
Z , Z , Z , Z jeweils unabhängig voneinander, und bei jedem
Auftreten gleich oder verschieden, eine Einfachbindung, -(CH2)4)-, -CH2CH2-, -CF2-CF2-, -CF2-CH2-, -CH2-CF2-, -CH=CH-, -CF=CF-, -CF=CH-,
-(CH2)30-, -0(CH2)3-, -CH=CF-, -C=C-, -CH20-, -OCH2-,
-CF20-, -OCF2-, -CO-O- oder -O-CO-,
Alkyl oder Alkoxy mit 1 bis 15 C-Atomen, welches unsubstituiert, oder durch F, Cl oder CN ein- oder mehrfach substituiert ist, und worin auch eine oder mehrere nicht benachbarte CH2-Gruppen auch jeweils unabhängig voneinander durch -O-, -S-, -SiR Ry-, - CH=CH-, -CsC-, -CO-O- und/oder -O-CO- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, vorzugsweise ein
geradkettiger Alkyl-, Alkoxy-, Alkenyl-, Alkenyloxy- oder -O-Alkylen-O-Rest mit bis zu 10 C-Artomen, welcher unsubstituiert oder ein- oder mehrfach durch F oder Cl substituiert ist,
, L34 jeweils unabhängig voneinander H, F, Cl, CN, oder Alkyl oder Alkoxy mit 1 bis 15 C-Atomen, welches unsubstituiert, oder durch F, Cl oder CN ein- oder mehrfach substituiert ist, und worin auch eine oder mehrere nicht benachbarte CH2-Gruppen auch jeweils unabhängig voneinander durch -O-, -S-, -SiRxRy-, - CH=CH-, -C=C-, -CO-O- und/oder -O-CO- so ersetzt sein können, dass O- und/oder S-Atome nicht direkt miteinander verknüpft sind, mit der Massgabe dass mindestens einer der Reste L31, L32, L33 und L34 von H verschieden ist,
X33 F, Cl, CF3, OCF3( CN, NCS, -SF5 oder -SO2-R2
30
jeweils unabhängig voneinander H, Alkyl oder Alkoxy mit 1 bis 7 C-Atomen, vorzugsweise Methyl, Ethyl, Propyl oder Butyl, und
35
Rz Alkyl mit 1 bis 7 C-Atomen, welches unsubstituiert, oder durch F oder Cl ein- oder mehrfach substituiert ist, vorzugsweise CF3, C2F5 oder n-C4F9, - eine Komponente D, vorzugsweise in einer Konzentration von 1- 20%, enthaltend eine oder mehrere optisch aktive und/oder chirale Verbindungen, vorzugsweise mit einer HTP 20 im, vorzugsweise £ 40 pm, ganz besonders bevorzugt > 60 pm. Die chirale Komponente D enthält vorzugsweise eine oder mehrere chirale Verbindungen mit mesogener Struktur und weist vorzugsweise eine oder mehrere Mesophasen auf, besonders bevorzugt mindestens
cholesterische Phase. Bevorzugte chirale Verbindungen der Komponente D sind beispielsweise aus dem Stand der Technik bekannte und/oder kommerziell erhältliche chirale Dotierstoffe wie Cholesteryl-nonanoat
(CN), R/S-811 , R/S-10 1 , R/S-2011 , R/S-3011 , R/S-40 1 , R/S-50 1 oder CB-15 (Merck KGaA, Darmstadt). Besonders bevorzugt sind chirale Dotierstoffe mit einer oder mehreren chiralen Gruppen und einer oder mehreren mesogenen Gruppen, wie beispielsweise in DE 34 25 503, DE 35 34 777, DE 35 34 778, DE 35 34 779, DE 35 34 780,
DE 43 42 280, EP 01 038 941 und DE 195 41 820 offenbart. Ferner bevorzugt sind Sorbitole wie z.B. in WO 98/00428 A1 beschrieben, Hydrobenzoine wie z.B. in GB 2 328 207 A beschrieben, chirale
Binaphthole wie z.B. WO 02/94805 A1 beschrieben, chirale
Binaphtholacetale wie z.B. in WO 02/34739 A1 beschrieben, chirale TADDOLe wie z.B. in WO 02/06265 A1 beschrieben, oder chirale
Verbindungen mit fluorierten Brückengruppen wie z.B. in WO 02/06196 A1 oder WO 02/06195 A1 beschrieben. Der Klärpunkt des erfindungsgemäßen FK-Mediums mit blauer Phase liegt vorzugsweise im Bereich von -30°C bis 100°C.
Das FK-Medium enthält vorzugsweise eine, zwei, drei, vier oder mehr als vier chirale Verbindungen. Das FK-Medium enthält vorzugsweise chirale Verbindungen in einer Gesamtkonzentration von 0.01 bis 25%, bevorzugt 0.1-20%, besonders bevorzugt 0.5 bis 20%, ganz besonders 3-15% .
Der Anteil der Verbindungen der Formel I am Gesamtgehalt aller polymerisierbaren Verbindungen im FK-Medium, bzw. der Anteil der Verbindungen der Formel I an der polymerisierbaren Komponente A), beträgt vorzugsweise 20 bis 80%, besonders bevorzugt 40 bis 60%.
In einer weiteren bevorzugten Ausführungsform beträgt der Anteil der Verbindungen der Formel I am Gesamtgehalt aller polymerisierbaren Verbindungen im FK-Medium, bzw. der Anteil der Verbindungen der Formel I an der polymerisierbaren Komponente A), mindestens 50%, und besonders bevorzugt 60% bis 100%,.
Weitere besonders bevorzugte Ausführungsformen sind nachfolgend beschrieben: - Das FK-Medium enthält eine, zwei oder drei Verbindungen der
Formel I;
Komponente B enthält zusätzlich zu den Verbindungen der Formel II eine oder mehrere Esterverbindungen der Formel Z:
worin R
2 eine der für R
22 in Formel II angegebenen Bedeutungen hat,
Xz F, Cl, CN, NCS, OCF3, CF3 or SF5 bedeutet, und (F) F oder H bedeutet,
vorzugsweise in einer Konzentration von 5 bis 35%, besonders bevorzugt 10 bis 30%, ganz besonders bevorzugt von 10 bis 20%.
Komponente B enthält zusätzlich zu den Verbindungen der Formel II eine oder mehrere Verbindungen der Formel N:
worin R
N eine der für R
22 in Formel II angegebenen Bedeutungen hat und vorzugsweise Alkyl or Alkyl-CsC bedeutet, "Alkyl" Alkyl mit 1 bis 7 C-Atomen, welches vorzugsweise geradkettig ist, (F) F oder H, und n 0 oder 1 bedeutet.
Komponente B enthält zusätzlich zu den Verbindungen der Formel II eine oder mehrere Verbindungen der Formel E:
worin R
E eine der für R
22 in Formel II angegebenen Bedeutungen hat und vorzugsweise C1-C7-Alkyl bedeutet, und
bedeutet, vorzugsweise in einer Konzentration von 10-30%, besonders bevorzugt von 15-25%.
Das FK-Medium enthält zusätzlich eine oder mehrere Verbindungen der Formel Q1 und/oder Q2:
worin R
Q eine der für R
22 in Formel II angegebenen Bedeutungen hat, X
Q eine der für X
E in Formel E angegebenen Bedeutungen hat, und n und m jeweils unabhängig voneinander 0 oder 1 bedeuten.
Das FK-Medium enthält zusätzlich eine oder mehrere Verbindungen der Formel Dx1 und/oder Dx2:
Dx1
worin R
D eine der für R
22 in Formel II angegebenen Bedeutungen hat. Besonders bevorzugt sind FK-Medien, welche neben einer oder mehreren Verbindungen der Formel I eine oder mehrere Verbindungen der Formel II enthalten, insbesondere worin X
22 F, Cl, CN, NCS, CF
3 oder OCF
3 bedeutet. Die Verbindungen der Formeln I, II, III, Z, N, E, Q1 , Q2, Dx1 und Dx2 sind farblos, stabil und gut untereinander oder mit anderen
flüssigkristallinen Substanzen mischbar.
Die einzelnen Komponenten und Verbindungen der Formeln I, II, III, Z, N, E, Q1 , Q2, Dx1 und Dx2 der erfindungsgemäßen FK-Medien sind entweder bekannt, oder ihre Herstellungsweisen sind für den
einschlägigen Fachmann aus dem Stand der Technik ohne weiteres abzuleiten, da sie auf in der Literatur beschriebenen Standardverfahren basieren.
Die Herstellung der erfindungsgemäßen FK-Medien erfolgt in an sich üblicher Weise, beispielsweise indem man eine oder mehrere der oben genannten Verbindungen mit einer oder mehreren polymerisierbaren Verbindungen wie oben definiert, und ggf. mit weiteren flüssigkristallinen Verbindungen und/oder Additiven mischt. In der Regel wird die
gewünschte Menge der in geringerer Menge verwendeten Komponenten in der den Hauptbestandteil ausmachenden Komponenten gelöst, zweckmäßig bei erhöhter Temperatur. Es ist auch möglich Lösungen der Komponenten in einem organischen Lösungsmittel, z.B. in Aceton, Chloroform oder Methanol, zu mischen und das Lösungsmittel nach Durchmischung wieder zu entfernen, beispielsweise durch Destillation. Das Verfahren zur Herstellung der erfindungsgemäßen FK-Medien ist ein weiterer Gegenstand der Erfindung.
Die erfindungsgemäßen FK-Medien für FK-Anzeigen mit blauer Phase können auch weitere, dem Fachmann bekannte und in der Literatur beschriebene Zusätze oder Additive enthalten, wie beispielsweise Polymerisationsinitiatoren, Inhibitoren, Stabilisatoren oder
oberflächenaktive Substanzen. Diese können polymerisierbar oder unpolymerisierbar sein. Polymerisierbare Additive werden
dementsprechend der polymerisierbaren Komponente zugerechnet. Unpolymerisierbare Additive werden dementsprechend der
flüssigkristallinen Komponente zugerechnet.
Der Aufbau der erfindungsgemäßen FK-Anzeigen mit blauer Phase mit Polarisatoren, Elektrodensubstraten und oberflächenbehandelten Elektrodenschichten entspricht dem konventionellen und dem Fachmann bekannten Aufbau für Anzeigen dieses Typs, wie im Stand der Technik beschrieben, beispielsweise in DE 102 17 273 A1, DE 10241 301, DE 102 17 273 A1 , DE 102 41 301 , DE 102 536 06, DE 103 13 979^
Eine erfindungsgemäße FK-Anzeige enthält vorzugsweise folgende Komponenten
ein oder zwei Substrate,
eine Elektrodenanordnung mit zwei Elektroden auf nur einem der beiden Substrate oder mit jeweils einer Elektrode auf je einem der beiden Substrate,
ein oder zwei Polarisatoren, und
einer zwischen den beiden Substraten befindlichen Schicht eines erfindungsgemäßen FK-Mediums,
wobei die Anzeige bei einer Temperatur betrieben wird, bei der das FK- Medium im nicht-geschalteten Zustand eine optisch isotrope Phase, vorzugsweise eine blaue Phase aufweist.
Der Phasenübergang des FK-Mediums in die blaue Phase erfolgt üblicherweise ausgehend von einer bei tieferen Temperaturen als die blaue Phase existierenden cholesterischen Phase. Die
Betriebstemperatur der erfindungsgemäßen FK-Anzeige (d.h. nach Polymerstabilisierung) liegt vorzugsweise über der Temperatur des Phasenübergangs des FK-Mediums in die blaue Phase (d.h.
üblicherweise der Übergang cholesterische Phase - blaue Phase), besonders bevorzugt von 0,1 bis 50°, ganz besonders bevorzugt von 0, bis 40° über dieser Phasenübergangstemperatur. Weiterhin liegt die Betriebstemperatur der FK-Anzeige vorzugsweise unterhalb der
Temperatur des Phasenübergangs des FK-Mediums von der blauen
Phase in die isotrope Phase (auch als Klärpunkt bezeichnet). Die Anzeige kann jedoch auch in der isotropen Phase, d.h. oberhalb des Klärpunkts, betrieben werden. Die erfindungsgemäßen FK-Medien mit blauer Phase können zusätzlich zu den obengenannten Verbindungen der Formeln II und III, und zusätzlich oder alternativ zu den obengenannten Verbindungen der Formeln Z, N, E, Q1 , Q2, Dx1 und Dx2, auch weitere flüssigkristalline Verbindungen enthalten, um z.B. die physikalischen Eigenschaften anzupassen. Solche Verbindungen sind dem Fachmann bekannt. Ihre Konzentration in den FK-Medien ist vorzugsweise 0 bis 30%, besonders bevorzugt 0 bis 20%, ganz besonders bevorzugt 5 bis 15 %.
Vorzugsweise weist die flüssigkristalline Komponente eines
erfindungsgemäßen FK-Mediums (d.h. vor Polymerstabilisierung) einen Temperaturbereich der blauen Phase auf, bzw. beim Auftreten mehrerer sequentieller blauer Phasen einen kombinierten Temperaturbereich aller blauen Phasen, dessen gesamte Breite 2°C oder mehr, bevorzugt 5°C oder mehr, besonders bevorzugt 10°C oder mehr, ganz besonders bevorzugt 20°C oder mehr, beträgt.
Vorzugsweise zeigt die flüssigkristalline Komponente eines
erfindungsgemäßen FK-Mediums (d.h. vor Polymerstabilisierung) einen Temperaturbereich der blauen Phase(n) mindestens im Bereich von 10°C bis 30°C, besonders bevorzugt von 10°C bis 40°C, ganz besonders bevorzugt von 0°C bis 50°C.
Dabei bedeutet "mindestens" vor- und nachstehend, dass sich die blaue(n) Phase(n) auch unterhalb des jeweils angegebenen unteren Grenzwertes und/oder oberhalb des jeweils angegebenen oberen
Grenzwertes erstrecken können.
ln einer weiteren bevorzugten Ausführungsform zeigt die flüssigkristalline Komponente eines erfindungsgemäßen FK-Mediums (d.h. vor
Polymerstabilisierung) einen Temperaturbereich der blauen Phase(n) mindestens im Bereich von 20°C bis 40°C, besonders bevorzugt
mindestens von 30°C bis 80°C, ganz besonders bevorzugt mindestens von 30°C bis 90°C. Ferner bevorzugt sind FK-Medien mit einem
Temperaturbereich der blauen Phase(n) mindestens von -20°C bis 50°C.
Vorzugsweise zeigt ein erfindungsgemäßes FK-Medium mit der
polymerisierten Komponente (d.h. nach Polymerstabilisierung) einen
Temperaturbereich der blauen Phase(n) mindestens im Bereich von 30°C bis 70°C, bevorzugt von 20°C bis 70°C, besonders bevorzugt von 0°C bis 80°C, ganz besonders bevorzugt von -20°C bis 80°C. Die Phasenübergangstemperaturen eines erfindungsgemäßen FK- Mediums enthaltend die polymerisierbare Komponente, insbesondere der Klärpunkt und/oder die Temperatur des Übergangs von der cholesterischen Phase in die blaue Phase (T(Ch,BP), auch als T(N*,BP) bezeichnet) und/oder die Temperatur des Übergangs von der blauen Phase in die isotrope Phase (T(BP,I)), werden vorzugsweise durch die Polymerisation der polymerisierbaren Komponente nicht verringert. Das bedeutet, dass die Polymerstabilisierung die blaue(n) Phase(n) vorzugsweise so erfolgt, dass eine oder mehrere der oben angegebenen Phasenübergangstemperaturen (T(Ch,BP), T(BP,I)) nicht zu tieferen Temperaturen verschoben werden, d.h. die blaue(n) Phase(n) wird vorzugsweise mindestens zu tieferen
Temperaturen hin, und besonders bevorzugt sowohl zu tieferen als auch zu höheren Temperaturen hin verbreitert.
Besonders bevorzugte FK-Medien zur Verwendung in PSA-Anzeigen, insbesondere in PSA-VA-, PSA-OCB-, PSA-IPS-, PSA-FFS- oder PSA-TN- Anzeigen, werden im Folgenden beschrieben.
Vorzugsweise enthält ein erfindungsgemäßes FK-Medium zur
Verwendung in erfindungsgemäßen PSA-VA-, PSA-OCB-, PSA-IPS-, PSA-FFS- oder PSA-TN-Anzeigen:
< 5%, besonders bevorzugt < 1%, ganz besonders bevorzugt < 0,5 % der polymerisierbaren Komponente,
> 95%, besonders bevorzugt > 99% der flüssigkristallinen
Komponente,
< 5 Gew.-%, besonders bevorzugt < 1 Gew.-%, ganz besonders bevorzugt < 0,5 Gew.-% an polymerisierbaren Verbindungen, insbesondere polymerisierbaren Verbindungen der oben genannten Formeln I oder deren Unterformeln, eine, zwei oder drei erfindungsgemäße polymerisierbare
Verbindungen der Formel I oder deren Unterformeln, eine polymerisierbare Komponente, die ausschließlich
erfindungsgemäße polymerisierbare Verbindungen der Formel I oder deren Unterformeln enthält, eine flüssigkristalline Komponente, die eine FK-Verbindung oder eine FK-Mischung ist, die eine nematische Flüssigkristallphase aufweist, eine polymerisierbare und/oder flüssigkristalline Komponente, die ausschließlich achirale Verbindungen enthält, eine polymerisierbare Komponente, die eine oder mehrere
polymerisierbare Verbindungen mit einer polymerisierbaren Gruppe (monoreaktiv) und eine oder mehrere erfindungsgemäße
polymerisierbare Verbindungen mit zwei oder mehr, vorzugsweise zwei polymerisierbaren Gruppen (di- oder multireaktiv) enthält, vorzugsweise ausgewählt aus Verbindungen der Formel I oder deren Unterformeln, und optional aus den oben genanten Comonomeren ausgewählt aus der Liste enthaltend die Formeln M1-M29, eine polymerisierbare Komponente, die ausschließlich
erfindungsgemäße polymerisierbare Verbindungen mit zwei
polymerisierbaren Gruppen (direaktiv) enthält, vorzugsweise ausgewählt aus Verbindungen der Formel I oder deren Unterformeln, und optional zusätzlich aus den oben genanten Comonomeren der Liste enthaltend die Formeln M1-M29, außer den erfindungsgemäßen polymerisierbaren Verbindungen, insbesondere der Formel I oder deren Unterformeln, sowie den Comonomeren, keine Verbindungen, die eine endständige
Vinyloxygruppe (-0-CH=CH2) aufweisen,
1 bis 5, vorzugsweise 1 , 2 oder 3 polymerisierbare Verbindungen, vorzugsweise ausgewählt aus erfindungsgemäßen polymerisierbare Verbindungen, insbesondere der Formel I oder deren Unterformeln. Besonders bevorzugte FK-Medien zur Verwendung in PSA-VA-Anzeigen werden im Folgenden genannt: a) FK-Medium, welches eine oder mehrere Verbindungen der Formel CY und/oder PY enthält:
worin die einzelnen Reste folgende Bedeutung besitzen
1 oder 2,
R1 und R2 jeweils unabhängig voneinander Alkyl mit 1 bis 12 C- Atomen, wobei auch eine oder zwei nicht benachbarte CH2-Gruppen durch -O-, -CH=CH-, -CO-, -OCO- oder - COO- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind, vorzugsweise Alkyl oder Alkoxy mit 1 bis 6 C-Atomen,
Zx und Zy jeweils unabhängig voneinander -CH2CH2-, -CH=CH-,
-CF2O-, -OCF2-, -CH2O-, -OCH2-, -CO-O-, -O-CO-, -C2F4-, -CF=CF-, -CH=CH-CH2O-, oder eine Einfachbindung, vorzugsweise eine Einfachbindung,
L "4 jeweils unabhängig voneinander F, Cl, OCF3, CF3, CH3,
CH2F, CHF2.
Vorzugsweise bedeuten beide Reste L1 und L2 F, oder einer der Reste L1 und L2 F und der andere Cl, bzw. beide Reste L3 und L4 F, oder einer der Reste L3 und L4 F und der andere Cl.
Die Verbindungen der Formel CY sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln
Alkyl— ( H >— O V- O-Alkyl* CY2
worin a 1 oder 2, Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, und Alkenyl einen geradkettigen Alkenylrest mit 2-6 C-Atomen, und (O) ein
Sauerstoffatom oder eine Einfachbindung bedeuten. Alkenyl bedeutet vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
Die Verbindungen der Formel PY sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln:
PY2
Alkyl— ( O — O )— O-Alkyl*
worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen und Alkenyl einen geradkettigen Alkenylrest mit 2-6 C-Atomen, und (O) ein
Sauerstoffatom oder eine Einfachbindung bedeuten. Alkenyl bedeutet vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
FK-Medium, welches zusätzlich eine oder mehrere Verbindungen der folgenden Formel enthält:
worin die einzelnen Reste folgende Bedeutung besitzen
D Γ — ( H r~ oder - 0
R3 und R4 jeweils unabhängig voneinander Alkyl mit 1 bis 12 C- Atomen, worin auch eine oder zwei nicht benachbarte CH2-Gruppen durch -O-, -CH=CH-, -CO-, -O-CO- oder -CO-O- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind,
Zy -CH2CH2-, -CH=CH-, -CF2O-, -OCF2-, -CH2O-, -OCH2-,
-CO-O-, -O-CO-, -C2F4-, -CF=CF-, -CH=CH-CH2O-, oder eine Einfachbindung, vorzugsweise eine Einfachbindung.
Die Verbindungen der Formel ZK sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln:
Alkyl H >— < H V-O-Alkyl* ZK2
worin Alkyl und Alkyl
* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen bedeuten, und Alkenyl einen geradkettigen Alkenylrest mit 2-6 C-Atomen bedeuten. Alkenyl bedeutet vorzugsweise CH
2=CH-, CH
2=CHCH
2CH
2-, CH
3-CH=CH-, CH
3-CH
2-CH=CH-, CH
3-(CH
2)
2-CH=CH-, CH
3-(CH
2)
3-CH=CH- oder CH
3-CH=CH-(CH
2)
2-.
FK-Medium, welches zusätzlich eine oder mehrere Verbindungen der folgenden Formel enthält:
R5 3^CfH(°)-R6 DK worin die einzelnen Reste bei jedem Auftreten gleich oder
verschieden folgende Bedeutung haben:
R
5 und R
6 jeweils unabhängig voneinander eine der oben für R
1 angegebenen Bedeutungen,
e 1 oder 2.
Die Verbindungen der Formel DK sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln:
Alkyl— < H O O >— O-AlkyT DK8
worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, und Alkenyl und Alkenyl
* jeweils unabhängig voneinander einen geradkettigen Alkenyirest mit 2-6 C-Atomen bedeuten. Alkenyl und Alkenyl
* bedeuten
vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2- CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3- CH=CH-(CH2)2-.
FK-Medium, welches zusätzlich eine oder mehrere Verbindung der folgenden Formel enthält:
worin die einzelnen Reste folgende Bedeutung besitzen
f 0 oder 1 ,
R1 und R2 jeweils unabhängig voneinander Alkyl mit 1 bis 12 C- Atomen, wobei auch eine oder zwei nicht benachbarte CH2-Gruppen durch -O-, -CH=CH-, -CO-, -OCO- oder - COO- so ersetzt sein können, dass O-Atome nicht direkt miteinander verknüpft sind,
Zx und Zy jeweils unabhängig voneinander -CH2CH2-, -CH=CH-,
-CF2O-, -OCF2-, -CH2O-, -OCH2-, -CO-O-, -O-CO-, -C2F4-, -CF=CF-, -CH=CH-CH2O-, oder eine Einfachbindung, vorzugsweise eine Einfachbindung,
L1 und L2 jeweils unabhängig voneinander F, Cl, OCF3l CF3, CH3,
CH2F, CHF2.
Vorzugsweise bedeuten beide Reste L1 und L2 F oder einer der Reste L1 und L2 F und der andere Cl.
Die Verbindungen der Formel LY sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln
worin R
1 die oben angegebene Bedeutung hat, Alkyl einen geradkettigen Alkylrest mit 1-6 C-Atomen, (O) ein Sauerstoffatom oder eine Einfachbindung und v eine ganze Zahl von 1 bis 6 bedeuten. R
1 bedeutet vorzugsweise geradkettiges Alkyl mit 1 bis 6 C-Atomen oder geradkettiges Alkenyl mit 2 bis 6 C-Atomen,
insbesondere CH
3, C
2H
5, n-C
3H
7, n-C H
9, n-C
5H , CH
2=CH-, CH2=CHCH
2CH2-, CH
3-CH=CH-, CH
3-CH
2-CH=CH-, CH
3-(CH
2)
2- CH=CH-, CH
3-(CH
2)
3-CH=CH- oder CH
3-CH=CH-(CH
2)
2-. e) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält:
worin alkyl C
1-6-alkyl, L
x H oder F und X F, Cl, OCF
3l OCHF
2 oder OCH=CF
2 bedeutet. Besonders bevorzugt sind Verbindungen der Formel G1 , worin X F bedeutet. f) FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält:
R
5 -< H -CF
2OH( O >- (0)
d-alkyl
Y
worin R
5eine der oben für R
1 angegebenen Bedeutungen besitzt, alkyl C^-alkyl, d 0 oder 1 , und z und m jeweils unabhängig voneinander eine ganze Zahl von 1 bis 6 bedeuten. R
5 ist in diesen Verbindungen besonders bevorzugt Ci-6-alkyl oder -alkoxy oder C2J3- alkenyi, d ist vorzugsweise . Vorzugsweise enthält das
erfindungsgemäße FK-Medium eine oder mehrere Verbindungen der oben genannten Formeln in Mengen von > 5 Gew.%.
FK-Medium, welches zusätzlich eine oder mehrere
Biphenylverbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält:
Alkenyl— O )— o )— Alkenyl*
B3
worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, und Alkenyl und Alkenyl* jeweils unabhängig voneinander einen geradkettigen Alkenyirest mit 2-6 C-Atomen bedeuten. Alkenyl und Alkenyl* bedeuten
vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2- CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3- CH=CH-(CH2)2-.
Der Anteil der Biphenyle der Formeln B1 bis B3 in der FK-Mischung beträgt vorzugsweise mindestens 3 Gew.%, insbesondere > 5 Gew.%.
Die Verbindungen der Formel B2 sind besonders bevorzugt.
Die Verbindungen der Formel B1 bis B3 sind vorzugsweise
ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln
O >— Alkyl*
B1a
worin Alkyl* einen Alkylrest mit 1-6 C-Atomen bedeutet.
Insbesondere bevorzugt enthält das erfindungsgemäße Medium eine oder mehrere Verbindungen der Formeln B1a und/oder B2c.
FK-Medium, welches zusätzlich eine oder mehrere
Terphenylverbindungen der folgenden Formel enthält:
worin R
5 und R jeweils unabhängig voneinander eine der oben für R
1 angegebenen Bedeutungen besitzen und er
bedeuten, worin L
5 F oder Cl, vorzugsweise F, und L F, Cl, OCF
3, CF
3) CH
3, CH
2F oder CHF
2l vorzugsweise F, bedeuten.
Die Verbindungen der Formel T sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln
F F R \ 0 0 r~\ 0 7~ ί°)°-Η 2-ι T5
F F
R - O O O >- (0)C
mH
2m+1 T7
worin R einen geradkettigen Alkyl- oder Alkoxyrest mit 1-7 C- Atomen, R* einen geradkettigen Alkenylrest mit 2-7 C-Atomen, (O) ein Sauerstoffatom oder eine Einfachbindung, und m eine ganze
Zahl von 1 bis 6 bedeutet. R* bedeutet vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2-CH=CH-, CH3-(CH2)2- CH=CH-, CH3-(CH2)3-CH=CH- oder CH3-CH=CH-(CH2)2-.
Vorzugsweise bedeutet R Methyl, Ethyl, Propyl, Butyl, Pentyl, Hexyl Methoxy, Ethoxy, Propoxy, Butoxy oder Pentoxy.
Das erfindungsgemäße FK-Medium enthält die Terphenyle der Formeln T und deren bevorzugte Unterformeln vorzugsweise in einer Menge von 0,5-30 Gew.%, insbesondere von 1-20 Gew.%.
Besonders bevorzugt sind Verbindungen der Formeln T1 , T2, T3 und T21. In diesen Verbindungen bedeutet R vorzugsweise Alkyl, ferner Alkoxy jeweils mit 1-5 C-Atomen.
Vorzugsweise werden die Terphenyle in erfindungsgemäßen
Mischungen eingesetzt, wenn der An-Wert der Mischung > 0,1 sein soll. Bevorzugte Mischungen enthalten 2-20 Gew.% einer oder mehrerer Terphenyl-Verbindungen der Formel T, vorzugsweise ausgewählt aus der Gruppe der Verbindungen T1 bis T22.
FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält:
R
1— < H >— ( H V-COO— ( H -R
2 03
worin R1 und R2 die oben angegebenen Bedeutungen haben, und vorzugsweise jeweils unabhängig voneinander geradkettiges Alkyl mit 1 bis 6 C-Atomen oder geradkettiges Alkenyl mit 2 bis 6 C- Atomen bedeuten.
Bevorzugte Medien enthalten eine oder mehrere Verbindungen ausgewählt aus den Formeln 01 , 03 und O4.
FK-Medium, welches zusätzlich eine oder mehrere Verbindungen der folgenden Formel enthält:
R9 H, CH3l C2H5 oder n-C3H7, (F) einen optionalen Fluor- substituenten und q 1 , 2 oder 3 bedeutet, und R7 eine der für R1 angegebenen Bedeutungen hat, vorzugsweise in Mengen von > 3 Gew.%, insbesondere > 5 Gew.%, und ganz besonders bevorzugt von 5-30 Gew.%.
Besonders bevorzugte Verbindungen der Formel IF sind ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln:
FI1
worin R
7 vorzugsweise geradkettiges Alkyl bedeutet und R
9 CH
3, C
2H
5 oder n-C
3H
7 bedeutet. Besonders bevorzugt sind die Verbindungen der Formel Fl 1 , FI2 und FI3.
FK-Medium, welches zusätzlich eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält:
worin R
8 die für R angegebene Bedeutung hat und Alkyl einen geradkettigen Alkylrest mit 1-6 C-Atomen bedeutet.
FK-Medium, welches zusätzlich eine oder mehrere Verbindungen enthält, die eine Tetrahydronaphthyl- oder Naphthyl-Einheit aufweisen, wie z.B. die Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
worin R
10 und R
11 jeweils unabhängig voneinander eine der für R
1 angegebenen Bedeutungen haben, vorzugsweise geradkettiges Alkyl oder Alkoxy mit 1 bis 6 C-Atomen oder geradkettiges Alkenyl mit 2 bis 6 C-Atomen bedeuten, und Z
1 und Z
2 jeweils unabhängig voneinander -C
2H
4-, -CH=CH-, -(CH
2)
4-, -(CH
2)
30-, -0(CH
2)
3-, -CH=CH-CH
2CH
2-, -CH
2CH
2CH=CH-, -CH
20-, -OCH
2-, -CO-O-, -O-CO-, -C
2F
4-, -CF=CF-, -CF=CH-, -CH=CF-, -CH
2- oder eine Einfachbindung bedeuten.
FK-Medium, welches zusätzlich eine oder mehrere eine oder mehrere Difluordibenzochromane und/oder Chromane der folgenden Formeln enthält:
BC
worin R
1 und R
12 jeweils unabhängig voneinander die oben angegebene Bedeutung aufweisen, und c 0 oder 1 bedeutet, vorzugsweise in Mengen von 3 bis 20 Gew.%, insbesondere in Mengen von 3 bis 15 Gew.%.
Besonders bevorzugte Verbindungen der Formeln BC und CR sind ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln:
worin Alkyl und Alkyl* jeweils unabhängig voneinander einen geradkettigen Alkylrest mit 1-6 C-Atomen, und Alkenyl und Alkenyl
* jeweils unabhängig voneinander einen geradkettigen Alkenylrest mit 2-6 C-Atomen bedeuten. Alkenyl und Alkenyl
* bedeuten
vorzugsweise CH2=CH-, CH2=CHCH2CH2-, CH3-CH=CH-, CH3-CH2- CH=CH-, CH3-(CH2)2-CH=CH-, CH3-(CH2)3-CH=CH- oder CH3- CH=CH-(CH2)2-.
Ganz besonders bevorzugt sind Mischungen enthaltend eine, oder drei Verbindungen der Formel BC-2.
FK-Medium, welches zusätzlich eine oder mehrere fluorierte
Phenanthrene und/oder Dibenzofurane der folgenden Formeln enthält:
worin R
11 und R
12 jeweils unabhängig voneinander die oben angegebenen Bedeutungen besitzen, b 0 oder 1 , L F und r 1, 2 oder 3 bedeutet.
Besonders bevorzugte Verbindungen der Formeln PH und BF sind ausgewählt aus der Gruppe bestehend aus folgenden Unterformeln:
F F F F
worin R und R' jeweils unabhängig voneinander einen geradkettigen Alkyl- oder Alkoxyrest mit 1-7 C-Atomen bedeuten.
FK-Medium, welches 1 bis 8, vorzugsweise 1 bis 5 Verbindungen der Formel CY1, CY2, PY1 und/oder PY2 enthält. Der Anteil dieser Verbindungen im Gesamtgemisch beträgt vorzugsweise 5 bis 60 %, besonders bevorzugt 10 bis 35 %. Der Gehalt dieser einzelnen Verbindungen beträgt vorzugsweise jeweils 2 bis 20 %.
FK-Medium, welches 1 bis 8, vorzugsweise 1 bis 5 Verbindungen der Formel CY9, CY10, PY9 und/oder PY10 enthält. Der Anteil dieser Verbindungen im Gesamtgemisch beträgt vorzugsweise 5 bis 60 %, besonders bevorzugt 10 bis 35 %. Der Gehalt dieser einzelnen Verbindungen beträgt vorzugsweise jeweils 2 bis 20 %.
FK-Medium, welches 1 bis 10, vorzugsweise 1 bis 8 Verbindungen der Formel ZK enthält, insbesondere Verbindungen der Formel ZK1 , ZK2 und/oder ZK6. Der Anteil dieser Verbindungen im
Gesamtgemisch beträgt vorzugsweise 3 bis 25 %, besonders bevorzugt 5 bis 45 %. Der Gehalt dieser einzelnen Verbindungen beträgt vorzugsweise jeweils 2 bis 20 %.
t) FK-Medium, worin der Anteil an Verbindungen der Formel CY, PY und ZK im Gesamtgemisch mehr als 70 %, vorzugsweise mehr als 80 % beträgt, u) PSA- VA-Anzeige, worin der pretilt-Winkel vorzugsweise < 86°,
beträgt.
Besonders bevorzugte FK-Medien zur Verwendung in PSA-OCB-, PSA-TN-, PSA-IPS- oder PSA-FFS-Anzeigen werden im Folgenden genannt: a) FK-Medium, welches eine oder mehrere Verbindungen ausgewählt aus der Gruppe bestehend aus folgenden Formeln enthält:
R° bei jedem Auftreten gleich oder verschieden n-Alkyl,
Alkoxy, Oxaalkyl, Fluoralkyl oder Alkenyl mit jeweils bis zu 9 C-Atomen,
X° F, Cl oder jeweils halogeniertes Alkyl, Alkenyl, Alkenyloxy oder Alkoxy mit jeweils bis zu 6 C-Atomen,
Z° oder eine Einfachbindung, γ1-6 jeweils unabhängig voneinander H oder F, bedeuten.
X° ist vorzugsweise F, Cl, CF3, CHF2, OCF3, OCHF2, OCFHCF3, OCFHCHF2, OCFHCHF2, OCF2CH3, OCF2CHF2, OCF2CHF2,
OCF2CF2CHF2, OCF2CF2CHF2, OCFHCF2CF3, OCFHCF2CHF2, OCF2CF2CF3, OCF2CF2CCIF2, OCCIFCF2CF3 oder CH=CF2, besonders bevorzugt F oder OCF3.
Die Verbindungen der Formel AA sind vorzugsweise ausgewählt aus der Gruppe bestehend aus folgenden Formeln:
°-( O >— < O >— ( O X° AA3
R°- o o >-CF,OH O X° AA9
worin R° und X° die oben angegebene Bedeutung besitzen, und X° vorzugsweise F bedeutet. Besonders bevorzugt sind Verbindungen der Formeln AA2 und AA6.
worin R° und X° die oben angegebene Bedeutung besitzen, und X° vorzugsweise F bedeutet. Besonders bevorzugt sind Verbindungen der Formeln BB1 , BB2 und BB5.
Die Verbindungen der Formel CC sind vorzugsweise ausgewählt aus folgender Formel:
worin R° bei jedem Auftreten gleich oder verschieden die oben angegebene Bedeutung besitzt, und vorzugsweise Alkyl mit 1 bis 6
C-Atomen bedeutet.
Die Kombination von Verbindungen der oben genannten bevorzugten Ausführungsformen a)-y) mit den oben beschriebenen polymerisierten Verbindungen bewirkt in den erfindungsgemäßen FK-Medien niedrige Schwellenspannungen, niedrige Rotationsviskositäten und sehr gute Tieftemperaturstabilitäten bei gleichbleibend hohen Klärpunkten und hohen HR-Werten, und erlaubt die schnelle Einstellung eines besonders niedrigen pretilt-Winkels in PSA-Anzeigen. Insbesondere zeigen die FK- Medien in PSA-Anzeigen im Vergleich zu den Medien aus dem Stand der Technik deutlich verringerte Schaltzeiten, insbesondere auch der
Graustufenschaltzeiten.
Vorzugsweise weist die Flüssigkristallmischung einen nematischen Phasenbereich von mindestens 80 K, besonders bevorzugt von
mindestens 100 K, und eine Rotationsviskosität von nicht mehr als 250, vorzugsweise nicht mehr als 200 mPa s, bei 20°C auf.
Erfindungsgemäße FK-Medien zur Verwendung in Anzeigen des PSA-VA- Typs weisen eine negative dielektrische Anisotropie Δε auf, vorzugsweise von etwa -0,5 bis -10, insbesondere von etwa -2,5 bis -7,5 bei 20°C und 1 kHz.
In erfindungsgemäßen Anzeigen des VA-Typs sind die Moleküle in der Schicht des FK-Mediums im ausgeschalteten Zustand senkrecht zu den Elektrodenflächen (homöotrop) oder gekippt homöotrop (engl, "tilted")
orientiert. Bei Anlegen einer elektrischen Spannung an die Elektroden findet eine Umorientierung der FK-Moleküle mit den Moleküllängsachsen parallel zu den Elektrodenflächen statt. In erfindungsgemäßen Anzeigen des OCB-Typs sind die Moleküle in der Schicht des FK-Mediums eine "bend"-Orientierung auf. Bei Anlegen einer elektrischen Spannung findet eine Umorientierung der FK-Moleküle mit den Moleküllängsachsen senkrecht zu den Elektrodenflächen statt. Erfindungsgemäße FK-Medien zur Verwendung in Anzeigen des PSA-
OCB-Typs weisen vorzugsweise eine positive dielektrische Anisotropie Δε auf, vorzugsweise von etwa +4 bis +17 bei 20°C und 1 kHz.
Die Doppelbrechung An in erfindungsgemäßen FK-Medien zur
Verwendung in Anzeigen des VA-Typs liegt vorzugsweise unter 0,16, besonders bevorzugt zwischen 0,06 und 0,14, insbesondere zwischen 0,07 und 0,12.
Die Doppelbrechung Δη in erfindungsgemäßen FK-Medien zur
Verwendung in Anzeigen des OCB-Typs liegt vorzugsweise zwischen 0,14 und 0,22, insbesondere zwischen 0,16 und 0,22.
Die Doppelbrechung Δη in erfindungsgemäßen FK-Medien zur
Verwendung in Anzeigen des PSA-TN-, PSA-IPS-, oder PSA-FFS-Typs liegt vorzugsweise zwischen 0,07 und 0,15, insbesondere zwischen 0,08 und 0,13. Die dielektrische Anisotropie dieser Medien liegt vorzugsweise zwischen +2 und +17, insbesondere zwischen +3 und +15.
Die erfindungsgemäßen FK-Medien können auch weitere, dem Fachmann bekannte und in der Literatur beschriebene Zusätze oder Additive enthalten, wie beispielsweise Polymerisationsinitiatoren, Inhibitoren,
Stabilisatoren, oberflächenaktive Substanzen oder chirale Dotierstoffe.
Diese können polymerisierbar oder unpolymerisierbar sein.
Polymerisierbare Additive werden dementsprechend der
polymerisierbaren Komponente zugerechnet. Unpolymerisierbare Additive
werden dementsprechend der flüssigkristallinen Komponente
zugerechnet.
Die FK-Medien können beispielsweise einen oder mehrere chirale
Dotierstoffe enthalten, vorzugsweise solche ausgewählt aus der Gruppe bestehend aus Verbindungen der nachfolgenden Tabelle B.
Ferner können den FK-Medien beispielsweise 0 bis 15 Gew.-%
pleochroitische Farbstoffe zugesetzt werden, ferner Nanopartikel,
Leitsalze, vorzugsweise Ethyl-dimethyldodecylammonium-4-hexoxy- benzoat, Tetrabutylammoniumtetraphenylborat oder Komplexsalze von Kronenethern (vgl. z.B. Haller et al., Mol. Cryst. Liq. Cryst. 24, 249-258 (1973)) zur Verbesserung der Leitfähigkeit, oder Substanzen zur
Veränderung der dielektrischen Anisotropie, der Viskosität und/oder der Orientierung der nematischen Phasen. Derartige Substanzen sind z.B. in DE-A 22 09 127, 22 40 864, 23 21 632, 23 38 281 , 24 50 088, 26 37 430 und 28 53 728 beschrieben.
Die einzelnen Komponenten der bevorzugten Ausführungsformen a)-z) der erfindungsgemäßen FK-Medien sind entweder bekannt, oder ihre
Herstellungsweisen sind für den einschlägigen Fachmann aus dem Stand der Technik ohne weiteres abzuleiten, da sie auf in der Literatur beschriebenen Standardverfahren basieren. Entsprechende
Verbindungen der Formel CY werden beispielsweise in EP-A-0 364 538 beschrieben. Entsprechende Verbindungen der Formel ZK werden beispielsweise in DE-A-26 36 684 und DE-A-33 21 373 beschrieben.
Die Herstellung der erfindungsgemäß verwendbaren FK-Medien erfolgt in an sich üblicher Weise, beispielsweise indem man eine oder mehrere der oben genannten Verbindungen mit einer oder mehreren polymerisierbaren Verbindungen wie oben definiert, und ggf. mit weiteren flüssigkristallinen Verbindungen und/oder Additiven mischt. In der Regel wird die
gewünschte Menge der in geringerer Menge verwendeten Komponenten in der den Hauptbestandteil ausmachenden Komponenten gelöst, zweck- mäßig bei erhöhter Temperatur. Es ist auch möglich Lösungen der Komponenten in einem organischen Lösungsmittel, z.B. in Aceton,
Chloroform oder Methanol, zu mischen und das Lösungsmittel nach Durchmischung wieder zu entfernen, beispielsweise durch Destillation. Das Verfahren zur Herstellung der erfindungsgemäßen FK-Medien ist ein weiterer Gegenstand der Erfindung.
Es versteht sich für den Fachmann von selbst, daß die
erfindungsgemäßen FK-Medien auch Verbindungen enthalten können, worin beispielsweise H, N, O, Cl, F durch die entsprechenden Isotope ersetzt sind.
Der Aufbau der erfindungsgemäßen PSA-Anzeigen entspricht der für PSA-Anzeigen üblichen Geometrie, wie er im eingangs zitierten Stand der Technik beschrieben ist. Es sind Geometrien ohne Protrusions bevorzugt, insbesondere diejenigen, bei denen darüber hinaus die Elektrode auf der Colour Filter-Seite unstrukturiert ist und lediglich die Elektrode auf der TFT-Seite Schlitze aufweist. Besonders geeignete und bevorzugte
Elektrodenstrukturen für PSA-VA-Anzeigen sind beispielsweise in
US 2006/0066793 A1 beschrieben. Die folgenden Beispiele erläutern die vorliegende Erfindung ohne sie zu begrenzen. Sie zeigen dem Fachmann jedoch bevorzugte Mischungskonzepte mit bevorzugt einzusetzenden Verbindungen und deren jeweiligen Konzentrationen sowie deren Kombinationen miteinander. Außerdem illustrieren die Beispiele, welche Eigenschaften und Eigen- schftskombinationen zugänglich sind.
Folgende Abkürzungen werden verwendet:
(n, m, z: jeweils unabhängig voneinander 1 , 2, 3, 4, 5 oder 6)
CCY-n-Om
CCQY-n-(O> CCQIY-n-(0)m
CnH2„,— H O >-CF20
PGIGI-n-F PGP-n-m
YPY-n-m YPY-n-mV
CPYP-n-(0)m CPGP-n-m
CETNap-n-Om
DFDBC-n(O)-(O)m C-DFDBF-n-(O)m
AUUQGU-n-F AGUQU-n-F
PUQU-n-F PUZU-n-F In einer bevorzugten Ausführungsform der vorliegenden Erfindung enthalten die erfindungsgemäßen FK-Medien eine oder mehrere
Verbindungen ausgewählt aus der Guppe bestehend aus Verbindungen der Tabelle A. Tabelle B
In der Tabelle B werden mögliche chirale Dotierstoffe angegeben, die den erfindungsgemäßen FK-Medien zugesetzt werden können.
CM 21 R/S-811
R/S-1011
Vorzugsweise enthalten die FK-Medien 0 bis 10 Gew.%, insbesondere 0,01 bis 5 Gew.%, besonders bevorzugt 0,1 bis 3 Gew.% an Dotierstoffen. Vorzugsweise enthalten die FK-Medien einen oder mehrere Dotierstoffe ausgewählt aus der Gruppe bestehend aus Verbindungen der Tabelle B.
Tabelle C
In der Tabelle C werden mögliche Stabilisatoren angegeben, die den erfindungsgemäßen FK-Medien zugesetzt werden können,
(n bedeutet hier eine ganze Zahl von 1 bis 12, vorzugsweise 1 , 2, 3, 4, 5, 6, 7 oder 8, endständige Methylgruppen sind nicht gezeigt).
30
35
Vorzugsweise enthalten die FK-Medien 0 bis 10 Gew.%, insbesondere 1ppm bis 5 Gew.%, besonders bevorzugt 1ppm bis 1 Gew.% an Stabilisatoren. Vorzugsweise enthalten die FK-Medien einen oder mehrere Stabilisatoren ausgewählt aus der Gruppe bestehend aus Verbindungen der Tabelle C.
Tabelle D
In der Tabelle E sind Beispielverbindungen zusammengestellt, die in den FK-Medien gemäß der vorliegenden Erfindung vorzugsweise als reaktive mesogene Verbindungen verwendet werden können.
RM-19
RM-20
RM-25
RM-26
R -28
In einer bevorzugten Ausführungsform der vorliegenden Erfindung enthalten die mesogenen Medien eine oder mehrere Verbindungen ausgewählt aus der Gruppe der Verbindungen der Tabelle D.
Außerdem werden folgende Abkürzungen und Symbole verwendet:
V0 Schwellenspannung, kapazitiv [V] bei 20°C,
ne außerordentlicher Brechungsindex bei 20°C und 589 nm, n0 ordentlicher Brechungsindex bei 20°C und 589 nm,
Δη optische Anisotropie bei 20°C und 589 nm,
ε± dielektrische Permittivität senkrecht zum Direktor bei 20°C und 1 kHz,
ε ιι dielektrische Permittivität parallel zum Direktor bei 20°C und
1 kHz,
Δε dielektrische Anisotropie bei 20°C und 1 kHz,
Kp., T(N,I) Klärpunkt [°C],
γ-ι Rotationsviskosität bei 20°C [mPa s],
Ki elastische Konstante, "splay' -Deformation bei 20°C [pN],
K2 elastische Konstante, "twisf-Deformation bei 20°C [pN], K3 elastische Konstante, "bend"-Deformation bei 20°C [pN].
Soweit nicht explizit anders vermerkt, sind in der vorliegenden Anmeldung alle Konzentrationen in Gewichtsprozent angegeben und beziehen sich auf die entsprechende Gesamtmischung, enthaltend alle festen oder flüssigkristallinen Komponenten, ohne Lösungsmittel.
Soweit nicht explizit anders vermerkt, sind in der vorliegenden Anmeldung alle angegebenen Werte für Temperaturen, wie z. B. der Schmelzpunkt T(C,N), der Übergang von der smektischen (S) zur nematischen (N) Phase T(S,N) und der Klärpunkt T(N,I), in Grad Celsius (°C) angegeben. Fp. bedeutet Schmelzpunkt, Kp. = Klärpunkt. Ferner bedeuten K = kristalliner Zustand, N = nematische Phase, S = smektische Phase und I = isotrope Phase. Die Angaben zwischen diesen Symbolen stellen die Übergangstemperaturen dar.
Alle physikalischen Eigenschaften werden und wurden nach "Merck Liquid Crystals, Physical Properties of Liquid Crystals", Status Nov. 1997, Merck KGaA, Deutschland bestimmt und gelten für eine Temperatur von 20°C und Δη wird bei 589 nm und Δε bei 1 kHz bestimmt, sofern nicht jeweils explizit anders angegeben.
Der Begriff„Schwellenspannung" bezieht sich für die vorliegende
Erfindung auf die kapazitive Schwelle (V0), auch Freedericksz-Schwelle genannt, sofern nicht explizit anders angegeben. In den Beispielen kann auch, wie allgemein üblich, die optische Schwelle für 10 % relativen Kontrast (V10) angegeben werden.
Die zur Messung der kapazitiven Schwellenspannung verwendete
Anzeige besteht aus zwei planparallelen Glasträgerplatten im Abstand von 20 μπι, welche auf den Innenseiten jeweils ein Elektrodenschicht sowie eine darüberliegende, ungeriebene Orientierungsschicht aus Polyimid aufweisen, die eine homöotrope Randorientierung der
Flüssigkristallmoleküle bewirken.
Die zur Messung der Tiltwinkel verwendete Anzeige bzw. Testzelle besteht aus zwei planparallelen Glasträgerplatten im Abstand von 4 μητι, welche auf den Innenseiten jeweils eine Elektrodenschicht sowie eine darüberliegende Orientierungsschicht aus Polyimid aufweisen, wobei die beiden Polyimidschichten antiparallel zueinander gerieben werden und eine homöotrope Randorientierung der Flüssigkristallmoleküle bewirken. Die polymerisierbaren Verbindungen werden in der Anzeige bzw.
Testzelle durch Bestrahlung mit UVA-Licht (üblicherweise 365nm) einer definierten Intensität für eine vorgegebene Zeit polymerisiert, wobei gleichzeitig eine Spannung an die Anzeige angelegt wird (üblicherweise 10V bis 30V Wechselstrom, 1 kHz). In den Beispielen wird, falls nicht anders angegeben, eine Quecksilberdampflampe mit 50 mW/cm2 verwendet, die Intensität wird mit einem Standard-UV-Meter (Fabrikat Ushio UNI meter) gemessen, der mit einem Bandpassfilter bei 365nm ausgerüstet ist. Der Tiltwinkel wird per Drehkristall-Experiment (Autronic-Melchers TBA- 105) bestimmt. Ein niedriger Wert (d.h. eine große Abweichung vom 90°- Winkel) entspricht dabei einem großen Tilt.
Der VHR -Wert wird wie folgt gemessen: Zur FK-Host-Mischung werden 0.3% einer polymerisierbaren monomeren Verbindung zugesetzt, und die dadurch entstandene Mischung in TN-VHR-Testzellen gefüllt (90° gerieben, Orientierungsschicht TN-Polyimid, Schichtdicke d « 6 pm). Der HR-Wert wird nach 5 min. bei 100°C vor und nach 2h UV-Belastung (suntest) bei 1V, 60Hz, 64ps pulse bestimmt (Messgerät: Autronic- Melchers VHRM-105).
Zur Untersuchung der Tieftemperaturstabilität, auch als "LTS" (low temperature stability) bezeichnet, d.h. der Stabilität der FK-Mischung gegen spontane Auskristallisation einzelner Komponenten bei tiefen Temperaturen, werden Fläschchen mit 1g FK/RM-Mischung bei -10°C eingelagert und es wird regelmäßig überprüft, ob die Mischungen auskristallisiert waren.
Die sogenannte "HTP" ("helical twisting power") bezeichnet das helikale Verdrillungsvermögen einer optisch aktiven bzw. chiralen Substanz in einem FK-Medium (in pm). Falls nicht anders angegeben, wird die HTP in der kommerziell erhältlichen nematischen FK-Hostmischung MLD-6260 (Merck KGaA) bei einer Temperatur von 20°C gemessen.
Beispiel 1
2-Methacrylsäure-6-(4-l2-r3-methyl-4-(2-(4-f6-(2-methyl-acryloyloxyV hexyn-phenvIV-ethvD-phenvIl-ethyll-phenvD-hexylester (1 )
Die erfindungsgemäße Verbindung (1), 2-Methacrylsäure-6-(4-{2-[3- methyl-4-(2-{4-[6-(2-methyl-acryloyloxy)-hexyl]-phenyl}-ethyl)-phenyl]- ethyl}-phenyl)-hexylester (1), wird synthetisiert wie nachfolgend
beschrieben.
1.1 Herstellung von 1 ,4-Bis-[2-(4-brom-phenyl)-vinyl1-2-methyl-benzol (E/Z-Mischuna):
6,30 g (42,5 mmol) 2-Methyl-benzoldicarbaldehyd werden zusammen mit 50,0 g (97,6 mmol) 4-Brombenyzl-triphenylphosphoniumbromid und 2,50 g (9,47 mmol) 18-Krone-6 in 150 ml Dichlormethan vorgelegt. Bei -70°C werden 11 ,0 g (0,20 mol) gepulverte KOH portionsweise zugegeben. Die Mischung wird 2 h bei -70°C gerührt, und der Ansatz wird auf
Raumtemperatur erwärmt. Nach 1 h bei dieser Temperatur wird mit Wasser versetzt, und die organische Phase wird abgetrennt.
Die wässrige Phase wird mit Dichlormethan extrahiert, und die vereinigten organischen Phasen werden mit ges. Ammoniumchloridlsg. gewaschen. Die Lösung wird absorptiv (SiO2, CH2CI2) filtriert, und das Filtrat wird vollständig konzentriert. Das Rohprodukt wird säulenchromatographisch (Si02, Toluol : n-Heptan = 1 : 1) gereinigt. E/Z-1 ,4-Bis-[2-(4-brom-phenyl)- vinyl]-2-methyl-benzol wird als gelbes Öl erhalten.
1.2 Herstellung von 6- 4-f(2-(4-(2-f4-(6-Hvdroxyhex-1-inyl)-phenyll-vinylV3- methyl-phenyl)-vinyl]-phenyl}-hex-5-in-1 -ol (E/Z-Mischung):
Eine Mischung aus 18,0 g (39,6 mmol) E/Z-1 ,4-Bis-[2-(4-brom-phenyl)- vinyl]-2-methyl-benzol, 2,78 g (3,96 mmol) bis(triphenylphosphin) palladium(ll)-chlorid, 755 mg (3,96 mmol) Kupfer(l)-iodid und 28,0 ml (0,20 mol) Triethylamin in 150 ml DMF wird auf 60°C erwärmt. 15,3 ml 5- Hexin-1-ol gelöst in 50 ml DMF werden zudosiert. Nach beendeter Zugabe wird der Ansatz 18 h bei 75°C gerührt. Nach dem Abkühlen wird die
Mischung mit THF/MTBE verdünnt und mit verd. Salzsäure neutralisiert.
Die organische Phase wird abgetrennt, und die wässrige Phase wird mit MTBE extrahiert. Die vereinigte organische Phase wird mit
Natriumchloridlösung gewaschen und mit Natriumsulfat getrocknet. Die Lösung wird vollständig konzentriert, und der Rückstand wird
säulenchromatographisch (Si02, Toluol : Ethylacetat = 1 : 1) gereinigt.
1.3 Herstellung von 6 4-f2-(4-(2-f4-(6-HvdroxyhexylVphenvn-ethylV2- methyl-phenyl)-ethyll-phenyl)-hexan-1-ol:
9,5 g ( 9,4 mmol) 6-{4-[(2-(4-{2-[4-(6-Hydroxyhex-1-inyl)-phenyl]-viny^3- methyl-phenyl)-vinyl]-phenyl}-hex-5-in-1-ol (E/Z-Mischung) werden in Gegenwart von Pd/C (5 % Pd) in THF 19 h bei Raumtemperatur hydriert. Die Lösung wird filtriert und vollständig konzentriert. Der Rückstand wird aus n-Heptan/MTBE (1 : 1) umkristallisiert. Auf diese Weise wird 6-{4-[2- (4-{2-[4-(6-Hydroxyhexyl)-phenyl]-ethyl}-2-methyl-phenyl)-ethyl]-phenyl}- hexan-1-ol als farbloser Feststoff erhalten. .4 Herstellung von 2-Methacrylsäure-6-(4-l2-r3-methyl-4-(2 4-[6-(2- methvI-acryloyloxyVhexyll-phenvIVethvD-phenvn-ethylVphenvD-hexylester:
600 mg (6-{4-[2-(4-{2-[4-(6-Hydroxyhexyl)-phenyl]-ethyl}-2-methyl-phenyl)- ethyl]-phenyl}-hexan-1-ol werden zusammen mit 0,30 ml (3,54 mol) Methacrylsäure und 10 mg (0,08 mmol) DMAP in 15 ml Dichlormethan vorgelegt. 3,5 ml (3,5 mmol, 1 M Lsg. in CH2CI2) DCC in werden zudosiert, und der Ansatz wird 3 h gerührt. 100 mg (0,79 mmol) Oxalsäure-Dihydrat werden zugegeben, und die Mischung wird filtriert. Das Filtrat wird vollständig konzentriert, und der Rückstand wird
säulenchromatographisch (Si02, Pentan : MTBE = 9 : 1) gereinigt. 2- Methyacry Isä u re-6-(4-{2-[3-methy l-4-(2-{4-[6-(2-methyl-acry loyloxy)-hexy I]- phenyl}-ethyl)-phenyl]-ethyl}-phenyl)-hexylester (1) wird als farbloser Feststoff mit einem Schmelzpunkt von 38°C erhalten.
Phasensequenz: K 38 I
1H-NMR (400 MHz, CHCI3): δ = 7,15-7,07 (m, 9H, HaryL), 7,01-6,47 (m, 2H, ), 6,10-6,08 (m, 2H, CMe=CH2), 5,55-5,53 (m, 2H, CMe=CH2), 4,14 (t, 4H, J = 6,7 Hz, 2 -CH2-OC(0)CMe=CH2), 2,89-2,79 (m, 8H, Hbenzyi), 2,61-2,56 (m, 4H, Hbenzyl), 2,28 (s, 3H, Me), 1 ,95 (bs, 6H, MeAcryl), 1 ,71- 1 ,59 (m, 8H, -CH2-), 1 ,46-1 ,34 (m, 8H, -CH2-).
MS (El): m/z(%) = 636 (62, M+), 69 (100).
Beispiel 2
2- Methacrylsäure-6-(4-f2-r4-(2-l4-f6-(2-methyl-acryloyloxy)-hexyll-phenyl) ethvD-phenvn-ethviyphenvO-hexylester (2)
Die erfindungsgemäße Verbindung (2), 2- Methyacrylsäure-6-(4-{2-[4-(2- {4-[6-(2-methyl-acryloyloxy)-hexyl]-phenyl}ethyl)-phenyl]-ethyl}-phenyl) hexylester, wird analog zu Verbindung (1) aus Beispiel 1 synthetisiert.
2- Methyacrylsäure-6-(4-{2-[4-(2-{4-[6-(2-methyl-acryloyloxy)-hexyl] phenyl}ethyl)-phenyl]-ethyl}-phenyl)hexylester (2) wird als farbloser Feststoff mit einem Schmp. von 80°C erhalten.
Phasensequenz: K 80 SB (60) I
1H-NMR (400 MHz, CHCI
3): δ = 7,13-7,06 (m, 12H,
ary,X 6,09-6,08 (m, 2H, CMe=CH
2), 5,55-5,52 (m, 2H, CMe=CH
2), 4,13 (t, 4H, J = 6,7 Hz, 2 * -CH
2-OC(0)CMe=CH
2), 2,87 (s, 8H,
2,61-2,56 (m, 4H, H
benzyl),
1 ,95 (bs, 6H, Me/toy,.), 1 ,72-1 ,57 (m, 8H, -CH2-), 1 ,46-1 ,34 (m, 8H, -CH2-).
MS (El): m/z(%) = 622 (11 , M+), 104 (100). Beispiel 3
2-Methacrylsäure-6-(4-(2-r4-(2-l4-f6-(2-methyl-acryloyloxy)-hexyn-phenyl)- ethvD-naphthalin-1 -yll-ethyD-phenvO-hexylester (3) Die erfindungsgemäße Verbindung (3), 2-Methacrylsäure-6-(4-{2-[4-(2-{4- [6-(2-methyl-acryloyloxy)-hexyl]-phenyl}-ethyl)-naphthalin-1-yl]-ethyl}- phenyl)-hexylester, wird synthetisiert wie nachfolgend beschrieben.
3.1 Herstellung von Naphthalin- .4-dicarbaldehyd
80,0 g (0,28 mol) 1 ,4-Dibromnaphthalin werden in 800 ml THF bei -70°C vorgelegt und 200 ml (0,32 mmol, 15 % Lsg. in Hexan) n-BuLi werden zugegeben. Nach 1 h werden 24 ml (0,31 mol) DMF langsam zugetropft, und die Mischung wird 30 min. gerührt. Anschließend werden 500 ml (0,80 mmol, 15 % Lsg. in Hexan) π-BuLi zudosiert, und die Mischung wird 2 h bei -70°C belassen. 110 ml (1 ,4 mol) DMF werden zugegeben. Nach 30 min. wird der Ansatz langsam erwärmt und mit verdünnter Salzsäure hydrolysiert. Die Mischung wird mehrfach mit MTBE extrahiert, und die vereinigten organischen Phasen werden mit ges. Antriumchloridlösung gewaschen. Die Lösung wird mit Natriumsulfat getrocknet und vollständig konzentriert. Der Rückstand wird in MTBE digeriert und abgesaugt.
3.2 Herstellung von 1.4-Bis-r(E.Z)-2-(4-bromphenyl)-vinvn-naphthalin
20,0 g (0,11 mol) Naphthalin-1 ,4-dicarbaldehyd werden zusammen mit 125,0 g (0,24 mol) 4-Brombenyzl-triphenylphosphoniumbromid und 6,50 g (24,6 mmol) 18-Krone-6 in 500 ml Dichlormethan vorgelegt. Bei -70°C werden 30,0 g (0,53 mol) gepulverte KOH portionsweise zugegeben. Die Mischung wird 2 h bei -70°C gerührt, und der Ansatz wird auf
Raumtemperatur erwärmt. Nach 1 h bei dieser Temperatur wird mit Wasser versetzt, und die organische Phase wird abgetrennt.
Die wässrige Phase wird mit Dichlormethan extrahiert, und die vereinigten organischen Phasen werden mit ges. Ammoniumchloridlsg. gewaschen. Die Lösung wird absorptiv (Si02, CH2CI2) filtriert, und das Filtrat wird vollständig konzentriert. Das Rohprodukt wird säulenchromatographisch (Si02, Toluol : n-Heptan = 1 : 1) gereinigt. 1 ,4-Bis-[(E,Z)-2-(4-bromphenyl)- vinyl]-naphthalin wird als semikristalliner Feststoff erhalten.
3.3 Herstellung von 6-l4-f(E.Z)-2-(4-((E.Z)-2-f4-(6-Hvdroxy-hex-1-inyl)-
Eine Mischung aus 50,0 g (0,1 mol) 1 ,4-Bis-[(E,Z)-2-(4-bromphenyl)-vinyl]- naphthalin, 7,3 g (10 mmol) Bis(triphenylphosphin) palladium(ll)-chlorid, 2,0 mg (11 mmol) Kupfer(l)-iodid und 75 ml (0,54 mol) Triethylamin in 300 ml DMF wird auf 60°C erwärmt. 40,0 g (0,41 mol) 5-Hexin-1-ol gelöst in 400 ml DMF werden zudosiert. Nach beendeter Zugabe wird der Ansatz 19 h bei 75°C gerührt. Nach dem Abkühlen wird die Mischung mit
Dichlormethan verdünnt und mit verd. Salzsäure neutralisiert. Die organische Phase wird abgetrennt, und die wässrige Phase wird mit Dichlormethan extrahiert. Die vereinigte organische Phase wird mit Natriumchloridlösung gewaschen und mit Natriumsulfat getrocknet. Die Lösung wird vollständig konzentriert, und der Rückstand wird
säulenchromatographisch (S1O2, Dichlormethan : MTBE = 8 : 2 - 1 : 1) gereinigt.
3.4 Herstellung von 6-l4-f2-(4-(2-f4-(6-Hvdroxy-hexyl)-Dhenyll-ethylV- naphthalin-1 -vD-ethvn-phenvD-hexan-l -ol
25,0 g (47,7 mmol) 6-{4-[2-(4-{2-[4-(6-Hydroxy-hex-1-inyl)-phenyl]-vinyl}- naphthalin-1-yl)-vinyl]-phenyl}-hex-5-in-1-ol (E/Z-Mischung) werden in Gegenwart von Pd/C (5 % Pd) in THF 17 h bei Raumtemperatur hydriert. Die Lösung wird filtriert und vollständig konzentriert. Der Rückstand wird aus n-Heptan/MTBE (1 : 1) umkristallisiert. Auf diese Weise wird 6-{4-[2- (4-{2-[4-(6-Hydroxy-hexyl)-phenyl]-ethyl}-naphthalin-1-yl)-ethyl]-phenyl}- hexan-1-ol als farbloser Feststoff erhalten.
3.5 Herstellung von 2-Methacrylsäure-6-(4 2-r4-(2- 4-r6-(2-methyl- acryloyloxy)-hexyn-phenyl -ethyl)-naphthalin-1-yl1-ethyl}-phenyl)- hexylester:
(3)
10,0 g ( 8,6 mmol) 6-{4-[2-(4-{2-[4-(6-Hydroxy-hexyl)-phenyl]-ethyl}- naphthalin-1-yl)-ethyl]-phenyl}-hexan-1-ol werden zusammen mit 50 ml
(0,62 mol) Pyridin und 200 mg (1 ,64 mmol) DMAP in 100 ml
Dichlormethan vorgelegt. 8,0 g (51 ,6 mmol) Methacrylsäureanhydrid in 100 ml DCM werden zudosiert (Eiskühlung), und der Ansatz wird 19 h gerührt. Der Ansatz wird mit verd. Salzsäure und ges.
Natriumchloridlösung gewaschen, und die organische Phase wird mit Natriumsulfat getrocknet. Die Lösung wird vollständig konzentriert, und der Rückstand wird säulenchromatographisch (Si02, Pentan : DCM = 1 : 1
DCM) gereinigt. 2-Methacrylsäure-6-(4-{2-[4-(2-{4-[6-(2-methyl- acryloyloxy)-hexyl]-phenyl}-ethyl)-naphthal'in-1 -yl]-ethyl}-phenyl)-hexylester (3)wird als farbloser Feststoff mit einem Schmelzpunkt von 47°C erhalten.
Phasensequenz: Tg -45 K 47 I
1H-NMR (300 MHz, CHCI3): δ = 8,16-8,1 1 (m, 2H, Hafy/), 7,56-7,50 (m, 2H, Ha,y/.), 7,24-7,09 (m, 10H, Ha/y/), 6,1 1-6,08 (m, 2H, CMe=CH2), 5,54-5,52 (m, 2H, CMe=CH2), 4,14 (t, 4H, J = 6,7 Hz, 2 -CH2-OC(0)CMe=CH2), 3,38-3,31 (m, 4H, Haliph ), 3,05-2,98 (m, 4H, Haliph.), 2,64-2,56 (m, 4H, Η3φ/,.), 1 ,95 (bs, 6H, MeAcryl.), 1 ,73-1 ,57 (m, 8H, -CH2-), 1 ,47-1 ,33 (m, 8H, -CH2-).
MS (El): m/z(%) = 673 (100, M+). Beispiel 4 Acrylsäure-6-l4-f2-(4-l2-r4-(6-acryloyloxy-hexyl)-phenyll-ethylVnaphthalin- 1 -yl)-ethvn-phenyl)-hexylester (4)
Die erfindungsgemäße Verbindung (4), Acrylsäure-6-{4-[2-(4-{2-[4-(6- acryloyloxy-hexyl)-phenyl]-ethyl}-naphthalin-1-yl)-ethyl]-phenyl}-hexylester, wird analog zu den Beispielen 1 und 3 aus 6-{4-[2-(4-{2-[4-(6-Hydroxy- hexyl)-phenyl]-ethyl}-naphthalin-1 -yl)-ethyl]-phenyl}-hexan-1 -ol (s. Beispiel 3, Stufe 3.4) synthetisiert.
Phasensequenz: Tg -47 K 55 I
MS (El): m/z(%) = 644 (83, M+), 105 (100).
Anwendunqsbeispiel 1
Die folgenden Monomere werden verwendet:
Monomer (1) aus Beispiel 1
RM-CC
RM257 hat die Phasensequenz K 66 N 127 I. RM-CC hat die Phasensequenz K 14 SmB 33 I.
Die folgenden Zusatzstoffe werden verwendet: (Dp: chirales Dop
ln (Ciba Irgacure ® 651)
Tabelle 1 : Zusammensetzung der Basismischung (Host) H1 vor Zugabe der Polvmerisationskomponenten:
Beschreibung der Polymerisation
Vor der Polymerisation einer Probe werden die Phaseneigenschaften des Mediums in einer Testzelle von ca. 10 Mikrometer Dicke und einer Fläche von 2x2,5 cm2 festgestellt. Die Füllung erfolg durch Kapillarwirkung bei einer Temperatur von 75°C. Die Messung erfolgt unter einem
Polarisationsmikroskop mit Heiztisch bei einem Temperaturverlauf von 10C/min.
Die Polymerisation der Medien wird durch Bestrahlung mit einer UV- Lampe (Dymax, Bluewave 200, 365 nm Interferenzfilter) mit einer effektiven Leistung von ca. 3,0 mW/cm2 für 180 Sekunden durchgeführt. Die Polymerisation erfolgt direkt in der elektrooptischen Testzelle.
Die Polymerisation erfolgt anfangs bei einer Temperatur, in der das Medium in der blauen Phase I (BP-I) vorliegt. Die Polymerisation erfolgt in mehreren Teilschritten, die nach und nach zu einer vollständigen
Polymerisation führen. Der Temperaturbereich der blauen Phase ändert sich in der Regel während der Polymerisation. Zwischen jedem Teilschritt wird daher die Temperatur so angepasst, dass das Medium nach wie vor in der blauen Phase vorliegt. In der Praxis kann dies so erfolgen, dass nach jedem Bestrahlungsvorgang von ca. 5 s oder länger die Probe unter dem Polarisationsmikroskop beobachtet wird. Wird die Probe dunkler, so deutet dies auf einen Übergang in die isoptrope Phase hin. Die
Temperatur für den nächsten Teilschritt wird entsprechend verringert.
Die gesamte Bestrahlungszeit, die zu der maximalen Stabilisierung führt, beträgt typischerweise 180 s bei der angegebenen Bestrahlungleistung. Weitere Polymerisationen können nach einem optimierten Bestrahlungs- Temperatur-Programm durchgeführt werden.
Alternativ kann die Polymerisation auch in einem einzigen
Bestrahlungsschritt durchgeführt werden, insbesondere wenn schon vor der Polymerisation eine breite blaue Phase vorliegt. Elektrooptische Charakterisierung
Nach der oben beschriebenen Polymerisation und Stabilisierung der blauen Phase wird die Phasenbreite der blauen Phase bestimmt. Die elektrooptische Charakterisierung erfolgt anschließend bei verschiedenen Temperaturen innerhalb und ggf. auch außerhalb dieses Bereichs.
Die verwendeten Testzellen sind auf einer Seite mit Interdigitalelektroden auf der Zellenoberfläche ausgestattet. Der Zellspalt, der Elektrodenabstand und die Elektrodenbreite betragen typischerweise jeweils
10 Mikrometer. Dieses einheitliche Maß wird nachfolgend als Spaltbreite bezeichnet. Die mit Elektroden belegte Fläche beträgt ca. 0,4 cm2. Die Testzellen besitzen keine Orientierungsschicht ('alignment layer').
Die Zelle befindet sich für die elektrooptische Charakterisierung zwischen gekreuzten Polarisationsfiltern, wobei die Längsrichtung der Elektroden einen Winkel von 45° mit den Achsen des Polarisationsfilter einnimmt. Die Messung erfolgt mit einem DMS301 (Autronic-Melchers) im rechten Winkel zur Zellebene, oder mittels einer hochempfindlichen Kamera am Polarisationsmikroskop. Im spannungslosen Zustand ergibt die
beschriebene Anordnung ein im Wesentlichen dunkles Bild (Definition 0 % Transmission).
Zuerst werden die charakteristischen Betriebsspannungen und dann die Schaltzeiten an der Testzelle gemessen. Die Betriebsspannung an den Zellelektroden wird in Form von Rechteckspannung mit alternierendem Vorzeichen (Frequenz 100 Hz) und variabler Amplitude wie im Folgenden beschrieben angelegt.
Während die Betriebspannung erhöht wird, wird die Transmission gemessen. Das Erreichen des Maximalwerts der Transmission legt die charakteristische Größe der Betriebsspannung V10o fest. Gleichermaßen wird die charakteristische Spannung V10 bei 10 % der maximalen
Transmission bestimmt. Diese Werte werden bei verschiedenen
Temperaturen im Bereich der blauen Phase gemessen. Am oberen und unteren Ende des Temperaturbereichs der blauen Phase werden relativ hohe charakteristische Betriebsspannungen \ οο
beobachtet. Im Bereich der minimalen Betriebsspannung steigt V10o in der Regel nur langsam mit der Temperatur. Dieser Temperaturbereich, begrenzt durch und T2 wird als nutzbarer, flacher Temperaturbereich (FB) bezeichnet. Die Breite dieses "Flachbereichs" (FB) beträgt (T2 - Ti) und wird als Breite des Flachbereichs (BFB) (engl, 'flat ränge') bezeichnet.
Die genauen Werte von ΤΊ und T2 werden durch die Schnittpunkte von Tangenten an den flachen Kurvenabschnitt FB und die benachbarten steilen Kurvenabschnitte im V 0o-Temperatur-Diagramm ermittelt. Im zweiten Teil der Messung werden die Schaltzeiten beim Ein- und
Ausschalten ermittelt (τοη, x0ff). Die Schaltzeit τοη ist definiert durch die Zeit bis zum Erreichen von 90 % Intensität nach dem Anlegen einer Spannung der Höhe von Vi0o bei der gewählten Temperatur. Die Schaltzeit Toff ist definiert durch die Zeit bis zur Abnahme um 90 % ausgehend von maximaler Intensität bei V100 nach dem Erniedrigen der Spannung auf
0 V. Auch die Schaltzeit wird bei verschiedenen Temperaturen im Bereich der blauen Phase ermittelt.
Als weitere Charakterisierung wird bei einer Temperatur innerhalb des FB die Transmission bei kontinuierlich steigender und fallender
Betriebsspannung zwischen 0 V und V100 gemessen. Den Unterschied zwischen beiden Kurven bezeichnet man als Hysterese. Die Differenz der Transmissionen bei 0,5·\ οο bzw. die Differenz der Spannungen bei 50 % Transmission sind beispielsweise charakteristische Hysteresewerte und werden als ΔΤ50 respektive AV50 bezeichnet. Ferner unterscheidet man den Kontrast beim ersten Einschalten und beim folgenden Ausschalten als Verhältnis der jeweils maximalen und der minimalen Transmission.
Verwendunqsbeispiele M1 bis M
Verwendunqsbeispiel Mischung M1 und Verqleichbeispiele V1 und V2
Die Medien werden vor der Polymerisation wie beschrieben
charakterisiert. Darauf werden die RM-Komponenten durch einmalige Bestrahlung (180 s) in der blauen Phase polymerisiert, und die erhaltenen Medien werden erneut charakterisiert.
Das polymerstabilisierte Medium M1 , hergestellt unter Verwendung des erfindungsgemäßen Monomers (1), zeigt eine Verringerung der Hysterese
(AV50) und eine deutliche Erhöhung des Kontrastes beim Ein- und
Ausschalten gegenüber dem polymerstabilisierten Medium V1 , hergestellt unter Verwendung des Monomers RM257 aus dem Stand der Technik. Ferner zeigt sich bei dem polymerstabilisierten Medium V1 , dass der Kontrast beim Ausschalten viel geringer ist als beim Einschalten. Bei der zur Mischung V1 analogen Mischung V2, die weniger chiralen Dotierstoff enthält, ist der Kontrast beim Ein- und Ausschalten sehr ähnlich. Der geringere Kontrast im Vergleich zu M1 und V1 rührt daher, dass es sich bei V2 um eine sichtbare blaue Phase handelt. Das bedeutet, das in dieser Erfindung vorgestellte Monomergemisch eignet sich besonders gut zur Stabilisierung von blauen Phasen mit hoher Konzentration an chiralem Dotierstoff.