WO2010101121A1 - プロピレンの製造方法 - Google Patents
プロピレンの製造方法 Download PDFInfo
- Publication number
- WO2010101121A1 WO2010101121A1 PCT/JP2010/053265 JP2010053265W WO2010101121A1 WO 2010101121 A1 WO2010101121 A1 WO 2010101121A1 JP 2010053265 W JP2010053265 W JP 2010053265W WO 2010101121 A1 WO2010101121 A1 WO 2010101121A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- zeolite
- catalyst
- reaction
- hours
- water
- Prior art date
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J29/00—Catalysts comprising molecular sieves
- B01J29/90—Regeneration or reactivation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J29/00—Catalysts comprising molecular sieves
- B01J29/04—Catalysts comprising molecular sieves having base-exchange properties, e.g. crystalline zeolites
- B01J29/06—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof
- B01J29/40—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof of the pentasil type, e.g. types ZSM-5, ZSM-8 or ZSM-11, as exemplified by patent documents US3702886, GB1334243 and US3709979, respectively
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J29/00—Catalysts comprising molecular sieves
- B01J29/04—Catalysts comprising molecular sieves having base-exchange properties, e.g. crystalline zeolites
- B01J29/06—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof
- B01J29/40—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof of the pentasil type, e.g. types ZSM-5, ZSM-8 or ZSM-11, as exemplified by patent documents US3702886, GB1334243 and US3709979, respectively
- B01J29/42—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof of the pentasil type, e.g. types ZSM-5, ZSM-8 or ZSM-11, as exemplified by patent documents US3702886, GB1334243 and US3709979, respectively containing iron group metals, noble metals or copper
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J29/00—Catalysts comprising molecular sieves
- B01J29/04—Catalysts comprising molecular sieves having base-exchange properties, e.g. crystalline zeolites
- B01J29/06—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof
- B01J29/40—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof of the pentasil type, e.g. types ZSM-5, ZSM-8 or ZSM-11, as exemplified by patent documents US3702886, GB1334243 and US3709979, respectively
- B01J29/42—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof of the pentasil type, e.g. types ZSM-5, ZSM-8 or ZSM-11, as exemplified by patent documents US3702886, GB1334243 and US3709979, respectively containing iron group metals, noble metals or copper
- B01J29/44—Noble metals
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/0009—Use of binding agents; Moulding; Pressing; Powdering; Granulating; Addition of materials ameliorating the mechanical properties of the product catalyst
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/0009—Use of binding agents; Moulding; Pressing; Powdering; Granulating; Addition of materials ameliorating the mechanical properties of the product catalyst
- B01J37/0027—Powdering
- B01J37/0045—Drying a slurry, e.g. spray drying
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J38/00—Regeneration or reactivation of catalysts, in general
- B01J38/04—Gas or vapour treating; Treating by using liquids vaporisable upon contacting spent catalyst
- B01J38/12—Treating with free oxygen-containing gas
- B01J38/14—Treating with free oxygen-containing gas with control of oxygen content in oxidation gas
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C6/00—Preparation of hydrocarbons from hydrocarbons containing a different number of carbon atoms by redistribution reactions
- C07C6/02—Metathesis reactions at an unsaturated carbon-to-carbon bond
- C07C6/04—Metathesis reactions at an unsaturated carbon-to-carbon bond at a carbon-to-carbon double bond
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2229/00—Aspects of molecular sieve catalysts not covered by B01J29/00
- B01J2229/30—After treatment, characterised by the means used
- B01J2229/42—Addition of matrix or binder particles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2529/00—Catalysts comprising molecular sieves
- C07C2529/04—Catalysts comprising molecular sieves having base-exchange properties, e.g. crystalline zeolites, pillared clays
- C07C2529/06—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof
- C07C2529/70—Crystalline aluminosilicate zeolites; Isomorphous compounds thereof of types characterised by their specific structure not provided for in groups C07C2529/08 - C07C2529/65
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/584—Recycling of catalysts
Definitions
- the present invention relates to a method for producing propylene from a hydrocarbon raw material containing ethylene using a zeolite-containing catalyst.
- zeolite-containing catalyst examples include a catalyst containing Ag in an intermediate pore size zeolite substantially free of protons, and its silica / alumina (SiO 2 / Al 2 O 3 ). Catalysts having a molar ratio in the range of 200 to 5000 are known.
- olefins encompasses a broad concept, raw material “olefins” that have been put to practical use in the production of propylene are limited to those having 4 or more carbon atoms.
- Patent Document 1 states that “a hydrocarbon raw material containing one or more C 4 or more olefin components is brought into contact with a crystalline silicate catalyst to have substantially the same olefin weight content as that of the raw material. While producing a effluent having a second composition of one or more olefinic components of C 3 or higher ”(Claim 1), wherein“ preferably said ethylene is said hydrocarbon. It should be comprised between 0.1 and 50% by weight of the raw material "(paragraph 0028). Patent Document 2 describes a method for producing propylene from ethylene and methanol and / or dimethyl ether.
- ethanol that is, ethylene produced through a dehydration reaction
- H-ZSM5 zeolite into which metal ions have been introduced
- phosphate zeolite such as SAPO-34
- Patent Documents 1 and 2 described above describe that propylene can be produced from a raw material containing ethylene. Nevertheless, the reason why the catalyst has not been put into practical use is considered to be because the conventionally proposed catalyst could not achieve sufficient activity for converting stable ethylene while maintaining high selectivity. .
- Patent Document 3 discloses a method for producing propylene from ethanol as a raw material. That is, it is described that phosphate-based zeolite exhibits high selectivity in a method for producing propylene from a mixed raw material of ethylene and water produced by a dehydration reaction of ethanol.
- the conversion rate of ethylene is as low as 40% or less, and the conversion rate is remarkably lowered in only a few hours.
- a catalyst whose activity decreases in a short time cannot be said to withstand industrial use.
- a method of using ethylene obtained by steam cracking of ethane as a raw material without separation and purification, or a method of using biomass-derived ethanol as a raw material ethylene source is advantageous. That is, it can be said that it is a preferable embodiment that the ethylene source is subjected to the reaction while containing water from the viewpoint of easy availability of raw materials.
- the zeolite-containing catalyst comes into contact with water vapor at a high temperature. Deterioration due to dealumination is likely to proceed, and this degradation is so-called permanent degradation that does not recover even when regenerated by removing coke fuel, so that such a catalyst cannot withstand repeated use.
- the problem to be solved by the present invention is to produce propylene from ethylene in a high yield in a method for producing propylene from a hydrocarbon raw material containing ethylene exceeding 50% by mass in the presence of water. And providing a method for stably producing in the long term while repeating the reaction / regeneration.
- the present inventors conducted a catalytic conversion reaction of ethylene-containing hydrocarbons using a zeolite-containing catalyst containing MFI-type zeolite having a specific composition and physical properties.
- it is difficult to cause permanent deterioration of the catalyst even in the presence of water the deterioration of the catalyst due to the deposited coke can be regenerated by removing the coke combustion, and the permanent deterioration of the catalyst due to water vapor generated during the removal of the coke combustion is also suppressed.
- the inventors have found that propylene can be stably produced with high yield and long-term activity, and the present invention has been completed.
- a method for producing propylene comprising a step of catalytic conversion of a hydrocarbon raw material containing ethylene in excess of 50% by mass with a zeolite-containing catalyst while supplying water, wherein the zeolite contained in the zeolite-containing catalyst is (1 )
- MFI type zeolite MFI type zeolite
- the zeolite crystallization index determined from the X-ray diffraction spectrum is 3.3 or more
- the silica / alumina (SiO 2 / Al 2 O 3 ) molar ratio is 20 to 300.
- [2] The method for producing propylene according to the above [1], wherein 10% by mass or more of water is supplied to the hydrocarbon raw material.
- [3] The method for producing propylene according to the above [1] or [2], further comprising a step of heat-treating the zeolite-containing catalyst at a temperature of 550 ° C. or higher.
- [4] The method for producing propylene according to any one of the above [1] to [3], further comprising a step of heat-treating the zeolite-containing catalyst at a temperature of 300 ° C. or higher in the presence of water vapor.
- the crystallization index measurement result (X-ray diffraction spectrum) of the zeolite used in Example 1 is shown.
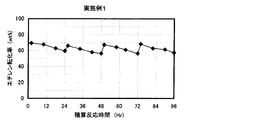
- the result of the reaction / regeneration repetition test in Example 1 is shown.
- the crystallization index measurement result (X-ray diffraction spectrum) of the zeolite used in Example 3 is shown.
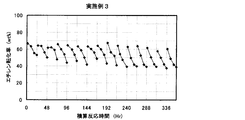
- the result of the reaction / regeneration repetition test in Example 3 is shown.
- the crystallization index measurement result (X-ray diffraction spectrum) of the zeolite used in Example 4 is shown.
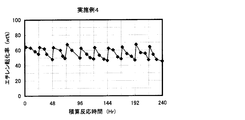
- the result of the reaction / regeneration repetition test in Example 4 is shown.
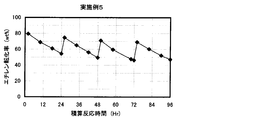
- the result of the reaction / regeneration repetition test in Example 5 is shown.
- exponent measurement result (X-ray diffraction spectrum) of the zeolite used for the comparative example 1 is shown.
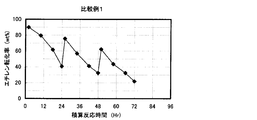
- the result of the reaction / regeneration repetition test in Comparative Example 1 is shown.
- the crystallization index measurement result (X-ray diffraction spectrum) of the zeolite used in Example 6 is shown.
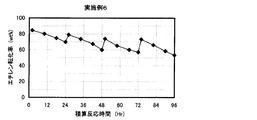
- the result of the reaction / regeneration repetition test in Example 6 is shown.
- exponent measurement result (X-ray diffraction spectrum) of the zeolite used for the comparative example 2 is shown.
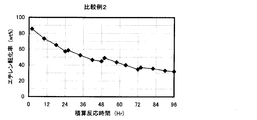
- the result of the reaction / regeneration repetition test in Comparative Example 2 is shown.
- the present embodiment a mode for carrying out the present invention (hereinafter abbreviated as “the present embodiment”) will be described in detail.
- this invention is not limited to the following embodiment, It can deform
- the method for producing propylene of the present embodiment is as follows: A method for producing propylene comprising a step of catalytic conversion of a hydrocarbon raw material containing ethylene exceeding 50% by mass with a zeolite-containing catalyst while supplying water, A method for producing propylene wherein the zeolite contained in the zeolite-containing catalyst satisfies the following (1) to (3): (1) MFI type zeolite, (2) The zeolite crystallization index determined from the X-ray diffraction spectrum is 3.3 or more, (3) The silica / alumina (SiO 2 / Al 2 O 3 ) molar ratio is 20 to 300.
- the zeolite contained in the zeolite-containing catalyst of the present embodiment is (1) MFI type zeolite. That is, the zeolite is classified into the MFI structure by the skeletal structure type according to the IUPAC recommendation, and specifically, the zeolite is ZSM-5 type.
- the zeolite contained in the zeolite-containing catalyst is an MFI-type zeolite, it exhibits high activity and selectivity in the catalytic conversion reaction of olefin, and also shows high resistance to coking deterioration.
- the MFI type zeolite is a medium pore size zeolite.
- the zeolite crystallization index obtained from the (2) X-ray diffraction spectrum of the zeolite contained in the zeolite-containing catalyst of the present embodiment is 3.3 or more.
- the crystallization index is preferably 3.5 or more, more preferably 4.0 or more.
- the peak intensity of 2 ⁇ 23 to 24 degrees is an index indicating the crystallinity of MFI-type zeolite (see JP-A-10-52646).
- the use of an internal standard sample is also widely known, and rutile titania is known to have little change in diffraction line intensity due to pulverization or grinding (Advances in X-ray analysis 5, Ikuo Kukiya) Published by Toshihiro Nakamura, published by Science and Technology Corporation (1973), pages 133-144).
- a continuous extraction / continuous regeneration method using a fluidized bed method or a fixed bed swing reactor method can be adopted industrially, and a high yield can be stably maintained over a long period of time.
- Patent Document 3 described above also describes an example in which H-ZSM5 zeolite having a silica / alumina molar ratio of 23.8 is used as a catalyst, but details of the zeolite are not described. Therefore, the crystallization index of zeolite is unknown, there is no example of repeated use of the catalyst, and the resistance to permanent deterioration is also unknown. The present inventor tried to confirm the crystallization index of this zeolite, but it was not usually available and the production method was not described, so the crystallization index could not be confirmed. Patent Document 3 describes a method for producing propylene through a dehydration reaction of ethanol.
- a zeolite having a crystallization index of 3.3 or higher is a substance that is difficult to produce unless it is intentionally synthesized. Based on the above facts, it can be predicted that the crystallization index of H-ZSM5 zeolite described in the same document is less than 3.3.
- the (3) silica / alumina (SiO 2 / Al 2 O 3 ) molar ratio of the zeolite contained in the zeolite-containing catalyst of the present embodiment is in the range of 20 to 300. From the viewpoint of stably producing the catalyst, the silica / alumina molar ratio of the zeolite is 20 or more. On the other hand, when the silica / alumina molar ratio exceeds 300, the ethylene conversion activity is low, and when a high conversion is obtained with the catalyst, the propylene selectivity is low. In particular, as described later, when the pretreatment includes a step of heat treatment at a temperature of 300 ° C. or higher in the presence of water vapor, the activity tends to further decrease.
- the silica / alumina molar ratio of zeolite can be measured by a known method.
- the zeolite can be completely dissolved in an alkaline aqueous solution, and the resulting solution can be analyzed and analyzed by plasma emission spectroscopy.
- metalloaluminosilicates in which some of the aluminum atoms constituting the zeolite skeleton are substituted with elements such as Ga, Fe, B, and Cr, and all the aluminum atoms constituting the zeolite skeleton are substituted with the above elements.
- Metallosilicates can also be used. In that case, the silica / alumina molar ratio is calculated after converting the content of the substituted element in the metalloaluminosilicate or metallosilicate to the number of moles of alumina.
- the acid amount (hereinafter referred to as TPD acid amount) determined from the high temperature desorption amount in the ammonia temperature programmed desorption (TPD) spectrum of the zeolite-containing catalyst is 50 ⁇ mol / g- It is preferable to be more than zeolite. It can be said that the TPD acid amount of 50 ⁇ mol / g-zeolite or higher is relatively high as the acid amount of the zeolite-containing catalyst.
- TPD acid amount determined from the high temperature desorption amount in the ammonia temperature programmed desorption (TPD) spectrum of the zeolite-containing catalyst is 50 ⁇ mol / g- It is preferable to be more than zeolite. It can be said that the TPD acid amount of 50 ⁇ mol / g-zeolite or higher is relatively high as the acid amount of the zeolite-containing catalyst.
- TPD acid amount the acid amount determined from the high temperature desorption amount in the ammonia temperature programmed desorption (TPD) spectrum of the zeolite
- the problem of activity deterioration due to coke formation is solved by the coexistence of water, and the problem of permanent deterioration caused by the coexistence of water is solved by increasing the crystallization index of zeolite, so that the propylene yield can be increased over a long period of time. Can be maintained. Even if coking deterioration is suppressed by the coexistence of water, if the crystallization index of the zeolite in the catalyst is 3.3 or less, the permanent deterioration proceeds at the same rate as the coking deterioration rate, and the activity activation rate after removing the coke is increased. Since the decrease is significant, high activity cannot be maintained.
- the amount of TPD acid in the present embodiment is measured by the following method.
- the sample catalyst is placed in the measurement cell of the thermal desorption spectrometer, the inside of the measurement cell is replaced with helium gas, the temperature is stabilized at 100 ° C., and the inside of the cell is once vacuum-treated, followed by ammonia gas. To a pressure of 100 Torr. This state is maintained for 30 minutes, and ammonia is adsorbed on the catalyst. Thereafter, the inside of the cell is again evacuated to remove ammonia that is not adsorbed on the catalyst, the carrier gas is switched to helium, and the inside of the cell is returned to atmospheric pressure.
- the measurement cell was connected to a quadrupole mass spectrometer, the pressure in the cell was set to 200 Torr, and the temperature in the cell was increased to 600 ° C. at a temperature increase rate of 8.33 ° C./min. The desorbed ammonia is detected. The pressure in the cell during desorption is set to be kept at about 200 Torr.
- the temperature-programmed desorption spectrum obtained was divided by waveform separation based on Gaussian distribution, and the ammonia desorption amount was obtained from the sum of the areas of the waveform having a peak top at a desorption temperature of 240 ° C or higher, and this was included in the catalyst It is expressed by the value divided by the weight of zeolite (unit: ⁇ mol / g-zeolite).
- 240 ° C.” is an index used only for determining the position of the peak top, and does not mean that the area of the portion of 240 ° C. or higher is obtained.
- the “waveform area” is the total area including portions other than 240 ° C.
- the method for synthesizing the MFI zeolite having the specific physical properties and composition described above is not particularly limited, but can be produced by optimizing various conditions of conventionally known hydrothermal synthesis methods for MFI zeolite.
- structure-directing agent SDA
- hydrothermal synthesis method by adding hydrothermally synthesized MFI zeolite as a seed crystal or as a seed slurry in a crystallization stage.
- organic SDA inorganic cations and anions are known to be involved in the structure, and zeolite synthesis depends on the combined action of each component.
- a method of synthesizing in the presence of an ammonium salt an aluminum source needs to be added as appropriate so as to obtain a desired silica-alumina molar ratio of the zeolite used in the present embodiment.
- zeolite can also be used as long as it has the above-mentioned specific physical properties and composition.
- examples of such commercially available products include MFI-27 from Zude Chemy AG, and Zeolis International. ZD03030 (MFI-42) of the company.
- the zeolite-containing catalyst of the present embodiment can be produced by molding, for example, as follows using the zeolite having the specific physical properties and composition described above.
- the molding method is not particularly limited, and may be a general method. Specifically, a method of compression molding a catalyst component, a method of extrusion molding, and a spray dry molding method optimal for a fluidized bed reaction method can be mentioned.
- a binder can be used for molding. It does not restrict
- the mass ratio of zeolite / binder is preferably in the range of 10/90 to 90/10, more preferably in the range of 20/80 to 80/20.
- the zeolite-containing catalyst of the present embodiment may contain at least one metal element selected from the group consisting of elements belonging to Group IB of the periodic table. This means that the zeolite in the catalyst contains or is supported on the catalyst in the corresponding cationic state. It is one of the preferred embodiments that the zeolite-containing catalyst contains at least one metal selected from the group consisting of metals belonging to Group IB of the Periodic Table, that is, copper, silver, and gold. More preferred group IB metals include copper and silver, and more preferably silver.
- the term "periodic table" in the present embodiment CRC Handbook of Chemistry and Physics, 75 th edition David R. Lide et al, CRC Press Inc. issued (1994- 1995), 1-15 pp Means the listed periodic table.
- ion exchange site of the zeolite contained in the zeolite-containing catalyst is exchanged with a group IB metal cation and / or proton.
- ion exchange sites other than those exchanged with group IB metal cations and / or protons may be exchanged with alkali metal cations, alkaline earth metal cations, and other metal cations.
- Examples of the method of causing the zeolite-containing catalyst to contain at least one metal element selected from the group consisting of metal elements belonging to Group IB of the Periodic Table include a method of causing zeolite to contain a Group IB metal element.
- a method of treating a zeolite or zeolite-containing catalyst not containing a group IB metal by an ion exchange method more specifically, a liquid phase ion exchange treatment method or an impregnated supported catalyst at a high temperature to treat solid phase ions.
- a method of exchanging processing is mentioned.
- group IB metal salt examples include silver nitrate, silver acetate, silver sulfate, copper chloride, copper sulfate, copper nitrate, and gold chloride. Silver nitrate and copper nitrate are preferable, and silver nitrate is more preferably used.
- the content of the group IB metal in the zeolite is preferably 0.1 to 5% by mass, more preferably 0.2 to 3% by mass.
- the content of the group IB metal in the zeolite can be determined by X-ray fluorescence analysis or the like.
- a pretreatment step may be performed on the zeolite-containing catalyst.
- a pretreatment step (A) a heat treatment step at a temperature of 550 ° C. or higher, (B) a step of heat treatment at a temperature of 300 ° C. or higher in the presence of water vapor; Is mentioned.
- the treatment is preferably performed at a temperature of 550 ° C. or higher and 1000 ° C. or lower (although the atmosphere is not particularly limited) under an inert gas flow condition such as air or nitrogen.
- a mixed gas of an inert gas such as air or nitrogen and steam (water vapor) is circulated at a temperature of 300 ° C. or higher and 900 ° C. or lower (although the atmosphere is not particularly limited). It is preferable to perform the treatment under conditions of a pressure of 0.01 atmosphere or more. In the present specification, the step (B) may be simply referred to as “steam treatment”.
- the reaction system since water coexists in the reaction system, the reaction system is in the same state as or similar to the case where the steam treatment is performed in a heated state. For this reason, prior to the reaction, (A) heat treatment at a temperature of 550 ° C. or higher and / or (B) steam treatment, that is, so-called pretreatment, is performed for the reaction and regeneration for burning and removing the deposited coke is performed. By repeating the reaction / regeneration cycle, the performance of the pretreated catalyst is gradually approached. In other words, these pretreatments can be said to be methods for obtaining the effect of improving the selectivity of the catalyst of the present embodiment over time by shortening the time. At this time, as described above, the zeolite having a crystallization index of 3.3 or higher in the present embodiment has a small decrease in activity in these pretreatments (and also in the repetition of reaction / regeneration).
- the hydrocarbon raw material contains ethylene in a range exceeding 50% by mass.
- the ethylene content in the hydrocarbon raw material is preferably 55% by mass or more, and more preferably 60% by mass or more.
- the ethylene content is 50% by mass or less as in the prior art, it may be necessary to mix a diluent gas with the hydrocarbon raw material, which is not preferable because productivity tends to decrease.
- hydrocarbon raw material containing ethylene for example, one obtained by thermal decomposition and / or oxidative dehydrogenation reaction of ethane or ethanol dehydration reaction can be used.
- ethanol may be derived from biomass.
- the hydrocarbon raw material can contain alkanes and other olefins.
- alkanes include methane, ethane, propane, butane, pentane, hexane, heptane, octane, and nonane.
- olefins include propylene, butene, pentene, hexene, heptene, octene, and nonene.
- cycloalkanes such as cyclopentane, methylcyclopentane and cyclohexane; cycloolefins such as cyclopentene, methylcyclopentene and cyclohexene; and / or dienes such as cyclohexadiene, butadiene, pentadiene and cyclopentadiene and acetylene
- acetylenes such as methylacetylene.
- oxygen-containing compounds such as t-butyl alcohol, methyl-t-butyl ether, diethyl ether, methyl ethyl ether, dimethyl ether, ethanol and methanol.
- the hydrocarbon raw material containing ethylene may contain hydrogen, nitrogen, carbon dioxide, carbon monoxide and the like.
- hydrocarbons such as unreacted ethane and acetylene and water, hydrogen, carbon dioxide, monoxide are included in the reaction product produced by the so-called steam cracking method of ethane, in which ethane is thermally decomposed in the presence of water vapor. Although carbon etc. are contained, this reaction product can be used as a raw material as it is.
- Biomass ethanol is not particularly limited as long as it is ethanol obtained from plant resources.
- Specific examples of biomass ethanol include ethanol obtained by fermentation of sugarcane and corn, and ethanol obtained from wood resources such as waste wood, thinned wood, rice straw, and crops.
- Propylene can be separated from the reaction product (propylene-containing gas) produced by contacting the hydrocarbon raw material with the zeolite-containing catalyst by a method such as distillation separation, and at least a part of the remaining can be recycled to the reactor.
- the residue obtained by removing propylene from the reaction product contains a low boiling component containing ethylene and / or a high boiling component containing butene.
- the ethylene content in the mixed raw material of the recycled component and the feedstock has a concentration exceeding 50% by mass.
- the zeolite-containing catalyst containing a zeolite having specific physical properties and composition used in the present embodiment hardly causes permanent deterioration even when water is present in the reaction system. Therefore, in recent years, the reaction product produced by the so-called steam cracking method of ethane, in which ethane, which has been attracting attention as a raw material for a new propylene production reaction, is thermally decomposed in the presence of water vapor, can be used as it is, or biomass ethanol ( This is extremely advantageous for industrial use in that ethylene and water can be used as they are by dehydration.
- the method for producing propylene of the present embodiment includes a step of catalytically converting a hydrocarbon raw material containing ethylene exceeding 50 mass% with a zeolite-containing catalyst containing the specific zeolite while supplying water.
- the “catalytic conversion” is a catalytic reaction that proceeds at an interface of a heterogeneous phase, that is, a reaction in which a reaction material in a gas phase and / or a liquid phase is brought into contact with a solid catalyst. It shows a reaction in which a substance conversion occurs.
- a heterogeneous phase that is, a reaction in which a reaction material in a gas phase and / or a liquid phase is brought into contact with a solid catalyst. It shows a reaction in which a substance conversion occurs.
- catalytic conversion of ethylene when a raw material containing ethylene is supplied to a reactor containing a zeolite-containing catalyst, the raw material comes into contact with the catalyst, and at least a part of ethylene contained in the raw material undergoes a conversion reaction to produce propylene.
- the propylene production method of the present embodiment is carried out while supplying water to the reactor together with the hydrocarbon raw material containing ethylene.
- the coexistence of water is known to be effective in improving the reaction selectivity and extending the life of the catalyst by suppressing coke formation, and also has the effect of reducing the ethylene partial pressure in the reaction system by diluting the hydrocarbon raw material. is there.
- the reduction of the olefin partial pressure is advantageous for improving the yield of propylene due to the reaction equilibrium, but if the water pressure in the reaction system is high, there is a risk of promoting permanent deterioration due to structural destruction of the zeolite.
- the amount of water supplied to the reactor is preferably 10% by mass or more, more preferably, based on the hydrocarbon raw material, from the viewpoint of reaction results, coke suppression, productivity, and permanent deterioration suppression. It is 20% by mass or more, more preferably 30 to 80% by mass.
- the reaction product obtained by the ethane steam cracking method contains water as a raw material, and when ethanol is used as a raw material, ethylene and water are produced by a dehydration reaction. It is not necessary to supply.
- the conversion rate of ethylene is preferably in the range of 45 to 85%, more preferably in the range of 50 to 80%.
- the produced olefin has thermal equilibrium, and from the viewpoint of obtaining a high propylene yield, a high reaction temperature exceeding 500 ° C. is suitable.
- the temperature is preferably in the range of 520 ° C to 600 ° C.
- catalyst deterioration is accelerated.
- the reaction pressure is preferably in the range of 0.1 to 30 atmospheres, more preferably in the range of 0.5 to 10 atmospheres.
- the feed rate of the hydrocarbon raw material is a space velocity (WHSV) based on the zeolite mass of the zeolite-containing catalyst, preferably 0.1 to 20 Hr ⁇ 1 , more preferably 0.5 to 10 Hr ⁇ 1 .
- WHSV space velocity
- the reactor for reacting the hydrocarbon raw material containing ethylene with the zeolite-containing catalyst is not particularly limited, and any reactor such as a fixed bed type, a fluidized bed type, and a moving bed type can be used.
- a zeolite-containing catalyst When a zeolite-containing catalyst is used in a propylene production reaction, a carbonaceous compound (coke) is gradually formed on the catalyst, and the catalytic activity may be lowered.
- a fixed bed reactor When a fixed bed reactor is used for propylene production reaction, temporarily stop the supply of hydrocarbon raw material, and burn the coke accumulated in the zeolite-containing catalyst using a gas containing oxygen.
- the zeolite-containing catalyst When moving bed and fluidized bed reactors are used, a part of the zeolite-containing catalyst is continuously or intermittently removed from the reactor, and the coke deposited with oxygen-containing gas is burned.
- the zeolite-containing catalyst can be regenerated.
- the regenerated zeolite-containing catalyst can be returned to the reactor.
- the regeneration of the zeolite-containing catalyst is usually carried out under conditions of 400 to 700 ° C. in air or in a mixed gas composed of air and an inert gas.
- the present embodiment will be described more specifically with reference to examples.
- the present embodiment is not limited to only these examples.
- the measuring method performed in the Example and the comparative example is as follows.
- zeolite silica / alumina (SiO 2 / Al 2 O 3 ) molar ratio 0.2 g of zeolite was added to 50 g of a 5N sodium hydroxide (NaOH) aqueous solution. This was transferred to a stainless steel micro cylinder with a Teflon (registered trademark) inner tube, and the micro cylinder was sealed. The zeolite was completely dissolved by holding the micro bomb in an oil bath for 15 to 70 hours. The resulting zeolite solution is diluted with ion-exchanged water, and the silicon and aluminum concentrations in the diluted solution are measured with the following plasma emission spectrometer (ICP device).
- ICP device plasma emission spectrometer
- silica / alumina molar ratio of the zeolite is calculated.
- Apparatus JOBIN YVON (JY138 ULTRACE) manufactured by Rigaku Denki Co., Ltd. Measurement conditions Silicon measurement wavelength: 251.60 nm Aluminum measurement wavelength: 396.152 nm Plasma power: 1.0 kW Nebulizer gas: 0.28 L / min Sheath gas: 0.3 to 0.8 L / min Coolant gas: 13L / min
- the ammonia desorption amount was calculated from the total area of waveforms having a peak top at a desorption temperature of 240 ° C. or higher, based on a separately obtained calibration curve, and converted per zeolite weight (unit: ⁇ mol / g-zeolite).
- Example 1 [Hydrothermal synthesis of raw material zeolite]
- Special No. 3 sodium silicate (Fuji Chemical Co., Ltd., SiO 2 25 mass% Na 2 O 8 mass%) 92 kg, water 95 kg, aluminum sulfate 16-hydrate 7.3 kg, and sulfuric acid (purity 97%) 3.0 kg
- FIG. 1 shows an X-ray diffraction spectrum of a sample obtained by adding 1 g of rutile type titania to 5 g of the obtained H-type ZSM-5 zeolite and collecting it with an electric mortar for 30 minutes. From the measurement result of X-ray diffraction, the crystallization index of H-type ZSM-5 zeolite was determined to be 3.73. The silica / alumina molar ratio was 40.
- Example 2 Using the zeolite obtained in Example 1, catalyst preparation, molding and pretreatment were carried out in the same manner as in Example 1. As a result of measuring the amount of TPD acid of the obtained steam-treated zeolite-containing catalyst, it was 89 ⁇ mol / g-zeolite. 50 g of the obtained steam treatment catalyst was filled in a stainless steel reaction tube having an inner diameter of 21.2 mm ⁇ , and the test was repeated three times with the reaction temperature of the first and third reactions being 520 ° C. and the reaction temperature of the second reaction being 580 ° C. A reaction evaluation experiment was conducted in the same manner as in Example 1 except that. The test results are shown in Table 2.
- Example 3 NH 4 type MFI type zeolite ZD03030 (silica / alumina molar ratio 42) manufactured by Zeolis International was kneaded with silica sol and extruded. The content of zeolite was 50% by mass. The obtained extrusion molded catalyst was dried at 120 ° C. for 6 hours and then calcined at 700 ° C. for 2 hours to obtain a columnar zeolite-containing molded catalyst having a diameter of 2 mm and a length of 3 to 5 mm. The obtained shaped catalyst was stirred and ion exchanged in a 0.5N nitric acid aqueous solution, washed with water, and dried at 120 ° C. for 5 hours. On the other hand, the crystallization index of this zeolite was 4.45. An X-ray diffraction spectrum is shown in FIG.
- H-MFI type zeolite MFI-27 (silica alumina molar ratio 27) manufactured by Sud Chemie AG was kneaded with silica sol and extruded. The content of zeolite was 50% by mass.
- the obtained extrusion molded catalyst was dried at 120 ° C. for 6 hours and then calcined at 700 ° C. for 2 hours to obtain a columnar zeolite-containing molded catalyst having a diameter of 2 mm and a length of 3 to 5 mm.
- the obtained shaped catalyst was stirred and ion exchanged in a 0.5N nitric acid aqueous solution, washed with water, and dried at 120 ° C. for 5 hours.
- the crystallization index of this zeolite was 3.37.
- An X-ray diffraction spectrum is shown in FIG.
- Example 5 Silver exchange was performed on the zeolite-containing shaped catalyst obtained in Example 1. 50 g of the zeolite-containing shaped catalyst was added to 450 g of a 0.1N silver nitrate aqueous solution and stirred at room temperature for 2 hours. Thereafter, filtration and washing were performed, and the zeolite-containing molded catalyst was dried at 120 ° C. for 5 hours to obtain a silver-supporting zeolite-containing molded catalyst. The amount of silver supported was 0.95% by mass as measured by fluorescent X-ray analysis.
- Example 6 [Hydrothermal synthesis of raw material zeolite] To a solution in which 130 g of ethyl silicate was dissolved in 278 g of ethanol, 291 g of a 10% by mass tetrapropylammonium hydroxide aqueous solution in which 1.5 g of aluminum sulfate hexahydrate was dissolved was added. This mixed solution was mixed and stirred at 5000 rpm for 10 minutes with a homogenizer to obtain a uniform transparent solution. 350 g of this solution was charged into a 1 liter autoclave and hydrothermally synthesized at 125 ° C. for 110 hours while stirring at 500 rpm for crystallization.
- FIG. 10 shows an X-ray diffraction spectrum of a sample obtained by adding 1 g of rutile type titania to 5 g of the obtained H-type ZSM-5 zeolite and performing the analysis for 30 minutes with an electric mortar. From the measurement result of X-ray diffraction, the crystallization index of H-type ZSM-5 zeolite was determined to be 4.37. The silica / alumina molar ratio was 290.
- NH 4 type MFI type zeolite CBV2802 (silica / alumina molar ratio 280) manufactured by Zeolis International was kneaded with silica sol and extruded. The content of zeolite was 50% by mass.
- the obtained extrusion molded catalyst was dried at 120 ° C. for 6 hours and then calcined at 700 ° C. for 2 hours to obtain a columnar zeolite-containing molded catalyst having a diameter of 2 mm and a length of 3 to 5 mm.
- the obtained shaped catalyst was stirred and ion exchanged in a 0.5N nitric acid aqueous solution, washed with water, and dried at 120 ° C. for 5 hours.
- water of 10% by mass or more is supplied to a hydrocarbon raw material from a hydrocarbon raw material containing ethylene exceeding 50% by mass efficiently and stably over the long term.
- it is possible to produce propylene.
- it is an industrially useful method also from the viewpoint of the diversity of propylene production raw materials.
Abstract
Description
「オレフィン類」という用語は広い概念を包含するものの、これまでプロピレンの製造に実用化されてきた原料の「オレフィン類」は、炭素数が4以上のものに限られている。ただし、一部の文献にはそれ以外の原料を使用しうることが記載されている。
例えば、特許文献1には、「C4またはそれ以上の1種以上のオレフィン成分を含有する炭化水素原料を結晶性シリケート触媒に接触させることで前記原料と実質的に同じオレフィン重量含有量を持ちながらC3またはそれ以上の1種以上のオレフィン成分をある二番目の組成で有する流出液を生じさせる」(請求項1)方法が記載されており、「好適には、前記エチレンが前記炭化水素原料の0.1から50重量%を構成するようにする」(段落0028)と記載されている。
特許文献2には、エチレンとメタノール及び/又はジメチルエーテルからプロピレンを製造する方法が記載されている。
特許文献3には、固体酸触媒として、金属イオンが導入されたH-ZSM5ゼオライトや、SAPO-34等のリン酸塩系ゼオライトを触媒として用いてエタノール(即ち、脱水反応を経て生成するエチレンと水)から、プロピレンを製造する方法が記載されている。
一方、特許文献3には、エタノールを原料にプロピレンを製造する方法が開示されている。即ち、エタノールの脱水反応により生成するエチレンと水の混合原料からプロピレンを製造する方法において、リン酸塩系ゼオライトが高い選択性を示すことが記載されている。しかしながら、リン酸塩系ゼオライトを触媒とする実施例によれば、エチレンの転化率は40%以下と低く、しかも、僅か数時間で転化率は著しく低下している。このように、短時間で活性が低下してしまう触媒は、工業的な使用に耐えるものとは言えない。
ところが、本発明者らの検討によれば、反応系内に水が共存する場合、ゼオライト含有触媒は、高温で水蒸気と接触することになるため、用いるゼオライトの種類によっては構造破壊(骨格からの脱アルミニウム)による劣化が進行し易く、しかも、この劣化はコーク燃除去による再生を施しても活性が回復しない、所謂、永久劣化であるので、かかる触媒は繰り返しの使用には耐えられないという問題が明らかとなった。
なお、ゼオライト含有触媒による高濃度エチレンの接触転化反応では触媒への炭素質の堆積による劣化、所謂、コーキング劣化は不可避である。工業的に実施しようとする場合、定期的に触媒に堆積したコークを燃焼除去することで触媒を再生し、再使用することが必須であるが、このコーク燃焼除去の際には水蒸気が発生し、やはり触媒の永久劣化を起こし易い。つまり、コーキング劣化したゼオライト含有触媒は、付着したコークを燃焼することによって活性を回復させることができるものの、その再生処理によって、回復し得ない恒久的な劣化を引き起こしてしまう。触媒を再生しながら使用する場合に生じるこのような問題点及びその解決方法については、上述の特許文献を含め、現在までに開示されていない。
[1]
50質量%を超えてエチレンを含有する炭化水素原料を、水を供給しながらゼオライト含有触媒と接触転化させる工程を含むプロピレンの製造方法であって、前記ゼオライト含有触媒に含まれるゼオライトが下記(1)~(3)を満たすプロピレンの製造方法;
(1)MFI型ゼオライトであり、
(2)X線回折スペクトルから求められるゼオライト結晶化指数が、3.3以上であり、
(3)シリカ/アルミナ(SiO2/Al2O3)モル比が、20~300である。
[2]
前記炭化水素原料に対して10質量%以上の水を供給する、上記[1]記載のプロピレンの製造方法。
[3]
前記ゼオライト含有触媒を550℃以上の温度で加熱処理する工程を更に含む、上記[1]又は[2]記載のプロピレンの製造方法。
[4]
前記ゼオライト含有触媒を、水蒸気の存在下、300℃以上の温度で加熱処理する工程を更に含む、上記[1]~[3]のいずれか記載のプロピレンの製造方法。
[5]
前記ゼオライト含有触媒が、周期律表第IB族に属する元素よりなる群から選ばれる少なくとも1種の金属元素を含有する、上記[1]~[4]のいずれか記載のプロピレンの製造方法。
[6]
前記ゼオライト含有触媒に付着したコークを燃焼させる工程を更に含む、上記[1]~[5]のいずれか記載のプロピレンの製造方法。
50質量%を超えてエチレンを含有する炭化水素原料を、水を供給しながらゼオライト含有触媒と接触転化させる工程を含むプロピレンの製造方法であって、
前記ゼオライト含有触媒に含まれるゼオライトが下記(1)~(3)を満たすプロピレンの製造方法である;
(1)MFI型ゼオライトであり、
(2)X線回折スペクトルから求められるゼオライト結晶化指数が、3.3以上であり、
(3)シリカ/アルミナ(SiO2/Al2O3)モル比が、20~300である。
(1)ゼオライト含有触媒に含まれるゼオライトの結晶化指数が3.3未満である場合には、触媒のコーク堆積による劣化と同時に、ゼオライト構造破壊による劣化(永久劣化)が起こる一方で、
(2)ゼオライト含有触媒に含まれるゼオライトの結晶化指数が3.3以上である場合には、コーク堆積は起こるが、反応系内に水を含有する反応条件下での触媒の永久劣化の進行は顕著に抑制することができることを発見した。
昇温脱離スペクトル測定装置の測定セルにサンプルの触媒を入れ、測定セル内をヘリウムガスで置換し、温度を100℃にて安定させた後、セル内を一旦真空処理し、続いてアンモニアガスを供給して圧力を100Torrとする。その状態で30分間保持し、触媒にアンモニアを吸着させる。その後、セル内を再度、真空として触媒に吸着されていないアンモニアを除去し、キャリアガスをヘリウムに切り替えてセル内を大気圧に戻す。次いで、測定セルを四重極型質量分析計に接続し、セル内の圧力を200Torrに設定し、セル内を8.33℃/分の昇温速度で600℃まで昇温させながら、触媒から脱離してくるアンモニアを検出する。脱離の間のセル内の圧力は約200Torrに保たれるように設定する。
得られた昇温脱離スペクトルをガウス分布に基づく波形分離により分割し、脱離温度が240℃以上にピークトップを持つ波形の面積の総和からアンモニア脱離量を求め、これを触媒中に含有されるゼオライト重量で除した値(単位はμmol/g-ゼオライト)で表す。なお「240℃」は、ピークトップの位置の判断のみに用いる指標であって、240℃以上の部分の面積を求めるという趣旨ではない。ピークトップが240℃以上の波である限り、当該「波形の面積」は、240℃以外の部分も含む全面積を求める。240℃以上にピークトップを持つ波形が複数ある場合は、それぞれの面積の和とする。
その成型方法は特に限定されず、一般的な方法でよい。具体的には、触媒成分を圧縮成型する方法や、押出し成型する方法、流動床反応方式に最適なスプレイドライ成型法が挙げられる。また、成型にはバインダーを用いることができる。バインダーとしては、特に制限されず、例えば、シリカ、アルミナ、カオリンを、単独又は混合して使用することができる。これらのバインダーは、市販のものを使用することができる。ゼオライト/バインダーの質量比率は、好ましくは10/90~90/10の範囲であり、より好ましくは20/80~80/20の範囲である。
(A)550℃以上の温度で加熱処理する工程、
(B)水蒸気の存在下、300℃以上の温度で加熱処理する工程、
が挙げられる。これらの前処理を行うと、触媒の劣化抑制や選択性改善の効果がより顕著となる傾向にある。
[式(1)]
エチレンの転化率=(反応器入口の供給流中のエチレン濃度-反応器出口の排出流中のエチレン濃度)/反応器入口の供給流中のエチレン濃度×100
尚、実施例及び比較例において行われた測定方法は以下の通りである。
ゼオライト0.2gを5規定の水酸化ナトリウム(NaOH)水溶液50gに加えた。これをテフロン(登録商標)製内管付きのステンレス製マイクロボンベに移し、マイクロボンベを密閉した。オイルバス中でマイクロボンベを15~70時間保持することにより、ゼオライトを完全に溶解した。得られたゼオライトの溶液をイオン交換水で希釈し、希釈液中の珪素、アルミニウム濃度を以下のプラズマ発光分光分析計(ICP装置)にて測定し、その結果からゼオライトのシリカ/アルミナモル比を計算した。
装置:JOBIN YVON(JY138 ULTRACE) 理学電気社製
測定条件
珪素測定波長 : 251.60nm
アルミニウム測定波長 : 396.152nm
プラズマパワー : 1.0kw
ネブライザーガス : 0.28L/min
シースガス : 0.3~0.8L/min
クーラントガス : 13L/min
ゼオライト5g(成型体の場合は、含有されるゼオライト量を5gとする。)に、粉砕したルチル型チタニア1gを添加し、電動乳鉢にて30分間らいかいした。得られた粉末サンプルのX線回折を以下の条件で測定した。
装置:MXP-18 マックサイエンス株式会社製
測定条件:
線源 : Cu (Kα線を用いて測定する。)
管電圧 : 40.0 KV
管電流 : 190.0 mA
データ範囲 : 20~30 deg
サンプリング間隔 : 0.02 deg
スキャン速度 : 2.00 deg/min
発散スリット : 1.00 deg
散乱スリット : 1.00 deg
受光スリット : 0.15 mm
得られたX線回折スペクトルから、MFIゼオライトに特徴的なピークである、23.06,23.22,23.70,23.90degの4本のピーク強度(単位cps)の総和(a)、ルチル型チタニア由来の27.42degのピーク強度(b)を求め、その比(a)/(b)から結晶化指数を算出した。
日本ベル株式会社製全自動昇温脱離スペクトル装置TPD-1-ATwを用いて、以下の方法により測定した。
専用硝子製セルに触媒試料100mgを充填した。(触媒試料が成型体の場合には粉末状にして充填した。)キャリアガスとしてヘリウムを50cc/分にてセルに供給しながら、前処理として、500℃まで昇温して1Hr処理した後、100℃に温度設定した。100℃で安定後、セル内を真空処理(0.01Torr)した。続いて、セル内にアンモニアガスを供給し、圧力を100Torrとした。その状態で30分間保持し、触媒にアンモニアを吸着させた。その後、セル内を再度、真空処理して、触媒に吸着されていないアンモニアを除去した。キャリアガスをヘリウムに切り替え、セル内は大気圧に戻した。次いで、セル内の圧力が200Torrに保たれるように設定し、8.33℃/分の昇温速度で600℃まで昇温させながら、セルと接続されたアネルバ株式会社製四重極型質量分析計で脱離してくるアンモニアを検出した。
得られた昇温脱離スペクトルを日本ベル株式会社製波形解析ソフト「WaveAnalysis」を使って、ガウス分布に基づく波形分離により分割した。
波形分離解析の結果、脱離温度240℃以上にピークトップを持つ波形の面積の総和から、別途求めた検量線を基にアンモニア脱離量を求め、ゼオライト重量当りに換算した(単位はμmol/g-ゼオライト)。
ガスクロマトグラフィー(GC)による反応生成物の分析は以下の装置及び測定条件で行った。
装置 :GC-17A 島津製作所社製
カラム : 米国SUPELCO社製カスタムキャピラリーカラム SPB-1(内径 0.25mm、長さ 60m、フィルム厚 3.0μm)
サンプルガス量 : 1mL(サンプリングラインは200~300℃に保温)
昇温プログラム : 40℃で12分間保持し、次いで5℃/分で200℃まで昇温した後、200℃で22分間保持した。
スプリット比 : 200:1
キャリアガス(窒素)流量 : 120mL/分
FID検出器 : エアー供給圧 50kPa(約500mL/分)、水素供給圧 60kPa(約50mL/分)
測定方法 :TCD検出器とFID検出器を直列に連結して、水素及び炭素数1及び2の炭化水素をTCD検出器で検出し、炭素数3以上の炭化水素をFID検出器で検出した。分析開始10分後に、検出の出力をTCDからFIDに切り替えた。
[原料ゼオライトの水熱合成]
特3号珪酸ソーダ(富士化学(株)製、SiO225質量%Na2O8質量%)92kgに水95kgと硫酸アルミニウム16水和物7.3kg、及び硫酸(純度97%)3.0kgと、1,3-ジメチル尿素1.15kgを水150kgに溶かした溶液を攪拌しながら加えて均質なゲルを得た。このゲルを600リットルのオートクレーブに仕込み、攪拌しながら160℃で30時間水熱合成し、Na型ZSM-5ゼオライトスラリーを得た。このスラリーの濾過、水洗を濾液pHが8以下になるまで繰り返した後、120℃で20時間乾燥し、その後、550℃で3時間、空気中で焼成してNa型ZSM-5ゼオライト粉末を得た。
特3号珪酸ソーダ92kgに水245kgと硫酸アルミニウム16水和物7.3kg、及び硫酸(純度97%)3.8kg、そして、上記で得られたNa型ZSM-5ゼオライト粉末3kgを加えて、均質なゲルを得た。このゲルを600リットルのオートクレーブに仕込み、攪拌しながら150℃で10時間水熱合成し、種スラリーを得た。
次に、特3号珪酸ソーダ92kgに水245kgと硫酸アルミニウム16水和物3.5kg、及び硫酸(純度97%)4.9kg、そして、上記で得られた種スラリー167kgを加えて、均質なゲルを得た。このゲルを600リットルのオートクレーブに仕込み、攪拌しながら160℃で45時間水熱合成し、結晶化させた。
得られたスラリーを遠心濾過しながら、pHが9以下になるまで水洗した後、120℃で20時間乾燥し、その後、550℃で3時間、空気中で焼成してNa型ZSM-5ゼオライト粉末を得た。更に、この乾燥物を1規定硝酸水溶液中に10質量%スラリーとして、室温下、3時間イオン交換した後、遠心濾過しながら、pHが4.5以上になるまで水洗した。その後、120℃で20時間乾燥し、H型ZSM―5ゼオライト粉末を得た。
得られたH型ZSM-5ゼオライト5gにルチル型チタニア1gを添加し、電動乳鉢にて30分間らいかいしたサンプルのX線回折スペクトルを図1に示す。X線回折の測定結果から、H型ZSM-5ゼオライトの結晶化指数を求めたところ3.73であった。また、そのシリカ/アルミナモル比は40であった。
得られたH型ZSM-5ゼオライトをシリカゾルと混練し、押出し成型した。ゼオライトの含有量は50質量%であった。得られた押出し成型触媒を120℃で6時間乾燥した後、700℃で2時間焼成し、直径2mm、長さ3~5mmの柱状ゼオライト含有成型体触媒を得た。得られた成型体触媒を0.5N-硝酸水溶液中で攪拌しイオン交換した後、水洗し、120℃で5時間乾燥させた。
実施例1~4では、触媒の経年活性とその劣化挙動を比較するため、予め水蒸気処理を施してからプロピレン製造反応に使用し、反応成績を評価した。
得られたゼオライト含有成型体触媒60gを内径21.2mmφのステンレス製反応管に充填し、温度650℃、スチーム流量107g/hr、窒素流量200NL/hrの条件で5時間水蒸気処理を行った。水蒸気処理後の触媒のTPD酸量を測定した結果、87μmol/g-ゼオライトであった。
得られた水蒸気処理触媒50gを内径21.2mmφのステンレス製反応管に充填して、以下の条件にて反応を行なった。
原料供給速度 :エチレン 50.77NL/hr(標準状態換算流量)
水素 50.45NL/hr
窒素 27.29NL/hr
水 31.75 g/hr
反応圧力 :0.14MPa/G
反応温度 :550℃
原料供給開始から2時間後の反応生成物を、反応器出口から直接ガスクロマトグラフィー(TCD、FID検出器)に導入して組成を分析した。
以後適宜、反応生成物の分析を実施しながら、24時間継続して反応を行なった。
24時間の反応を行った後、エチレン、水素、水の供給を停止し、窒素ガス480NL/hrを供給しながら、触媒層温度を480℃に設定した。その後、空気24NL/hrの供給を開始し、触媒上に堆積したコークの燃焼除去(再生工程)を実施した。スタート時の入口ガス酸素濃度は1%であった。反応器出口ガス中のCO,CO2濃度をGCにてモニターしながら、以下の条件にて触媒再生(堆積コークの燃焼除去)を完了した。
(1) 温度480℃ 酸素濃度1% 1時間
(2) 温度520℃ 酸素濃度1% 3時間
(3) 温度550℃ 酸素濃度1% 3時間
(4) 温度550℃ 酸素濃度5% 1時間
(5) 温度580℃ 酸素濃度5% 2時間
上記方法にて、24時間の反応と10時間の再生を1サイクルとして4サイクル繰り返した。試験結果を表1及び図2に示す。
実施例1で得られたゼオライトを用い、実施例1と同様に触媒調製、成型、前処理を行った。得られた水蒸気処理ゼオライト含有触媒のTPD酸量を測定した結果、89μmol/g-ゼオライトであった。
得られた水蒸気処理触媒50gを内径21.2mmφのステンレス製反応管に充填し、1、3回目反応の反応温度を520℃、2回目反応の反応温度を580℃として3サイクル繰り返して試験を行ったこと以外は、実施例1と同様に反応評価実験を行った。試験結果を表2に示す。
試験結果から、低温ではオレフィン平衡の制約上、プロピレン収率がやや下がる傾向が見られ、580℃では、コーキング劣化の加速挙動が見られた。しかし、580℃の高温下でも水の共存による劣化は抑制されていた。
ゼオリストインターナショナル社製のNH4型MFI型ゼオライトZD03030(シリカ/アルミナモル比42)をシリカゾルと混練し、押出し成型した。ゼオライトの含有量は50質量%であった。得られた押出し成型触媒を120℃で6時間乾燥した後、700℃で2時間焼成し、直径2mm、長さ3~5mmの柱状ゼオライト含有成型体触媒を得た。得られた成型体触媒を0.5N-硝酸水溶液中で攪拌しイオン交換した後、水洗し、120℃で5時間乾燥させた。
一方、このゼオライトの結晶化指数は4.45であった。X線回折スペクトルを図3に示す。
得られたゼオライト含有成型体触媒60gを内径21.2mmφのステンレス製反応管に充填し、温度650℃、スチーム流量107g/hr、窒素流量200NL/hrの条件で5時間水蒸気処理を行った。水蒸気処理後の触媒のTPD酸量を測定した結果、92μmol/g-ゼオライトであった。
得られた水蒸気処理触媒50gを内径21.2mmφのステンレス製反応管に充填して、実施例1と同様の条件にて反応/再生繰り返し試験を15サイクル行った。試験結果を図4に示す。
ズードケミーAG社製のH-MFI型ゼオライトMFI-27(シリカアルミナモル比27)をシリカゾルと混練し、押出し成型した。ゼオライトの含有量は50質量%であった。得られた押出し成型触媒を120℃で6時間乾燥した後、700℃で2時間焼成し、直径2mm、長さ3~5mmの柱状ゼオライト含有成型体触媒を得た。得られた成型体触媒を0.5N-硝酸水溶液中で攪拌しイオン交換した後、水洗し、120℃で5時間乾燥させた。
一方、このゼオライトの結晶化指数は3.37であった。X線回折スペクトルを図5に示す。
得られたゼオライト含有成型体触媒60gを内径21.2mmφのステンレス製反応管に充填し、温度650℃、スチーム流量107g/hr、窒素流量200NL/hrの条件で5時間水蒸気処理を行った。水蒸気処理後の触媒のTPD酸量を測定した結果、88μmol/g-ゼオライトであった。得られた水蒸気処理触媒50gを内径21.2mmφのステンレス製反応管に充填し、実施例1と同様の条件にて反応/再生繰り返し試験を10サイクル行った。試験結果を図6に示す。
実施例1で得られたゼオライト含有成型体触媒に、銀交換を施した。ゼオライト含有成型体触媒50gを、0.1N-硝酸銀水溶液450g中に加え、室温下、2時間攪拌した。その後、濾過、水洗し、ゼオライト含有成型体触媒を120℃で5時間乾燥し、銀担持型ゼオライト含有成型体触媒を得た。銀担持量は、蛍光X線分析により測定したところ0.95質量%であった。
得られた銀担持型ゼオライト含有成型体触媒50gを内径21.2mmφのステンレス製反応管に充填し、温度650℃、スチーム流量107g/hr、窒素流量200NL/hrの条件で5時間水蒸気処理を行った。水蒸気処理後の触媒のTPD酸量を測定した結果、102μmol/g-ゼオライトであった。
水蒸気処理された銀担持型ゼオライト含有成型体触媒の充填量を40gとして反応に用いたこと以外は実施例1と同様の方法により、反応/再生繰り返し試験を4サイクル行った。試験結果を表3及び図7に示す。
[原料ゼオライトの水熱合成]
珪酸ソーダ水溶液(富士化学(株)製、SiO226質量%、Na2O7質量%)8kgにNaOH0.05kgと水4.0kgを加えた溶液に、硫酸アルミニウム16水和物0.61kgと、1,3-ジメチル尿素0.1kgを水15kgに溶かした溶液を攪拌しながら加え、5質量%の硫酸10kgを加えて均質なゲルを得た。このゲルを内容積50リットルのオートクレーブに仕込み、攪拌しながら160℃で10時間水熱合成し、得られたスラリーを冷却して種スラリーを得た。
得られた種スラリー12.6kgに、上記で用いた珪酸ソーダ水溶液5.3kgとNaOH30gと水2.67kgを加えた。さらに、硫酸アルミニウム16水和物0.41kgと1,3-ジメチル尿素0.06kgを水10kgに溶かした溶液を攪拌しながら加え、5質量%の硫酸6.67kgを加え、均質なゲルを得た。このゲルを内容積50リットルのオートクレーブに仕込み、攪拌しながら150℃で30時間水熱合成し、結晶化させた。
得られたスラリーを遠心濾過しながら、pHが9以下になるまで水洗した後、120℃で20時間乾燥し、その後、550℃で3時間、空気中で焼成してNa型ZSM-5ゼオライト粉末を得た。更に、この乾燥物を1規定硝酸水溶液中に10質量%スラリーとして室温下、3時間イオン交換した後、遠心濾過しながら、pHが4.5以上になるまで水洗した。その後、120℃で20時間乾燥し、H型ZSM―5ゼオライト粉末を得た。
得られたH型ZSM-5ゼオライト5gにルチル型チタニア1gを添加し、電動乳鉢にて30分間らいかいしたサンプルのX線回折スペクトルを図8に示す。X線回折の測定結果から、得られたH型ZSM-5ゼオライトの結晶化指数を求めたところ2.84であった。また、そのシリカ/アルミナモル比は33であった。
得られたH型ZSM-5ゼオライトをシリカゾルと混練し、押出し成型した。ゼオライトの含有量は50質量%であった。得られた押出し成型触媒を120℃で6時間乾燥した後、700℃で2時間焼成し、直径2mm、長さ3~5mmの柱状ゼオライト含有成型体触媒を得た。得られた成型体触媒を0.5N-硝酸水溶液中で攪拌しイオン交換した後、水洗し、120℃で5時間乾燥させた。得られたゼオライト含有成型体触媒のTPD酸量を測定した結果、105μmol/g-ゼオライトであった。
得られたゼオライト含有成型体触媒50gを内径21.2mmφのステンレス製反応管に充填し、温度650℃、スチーム流量107g/hr、窒素流量200NL/hrの条件で5時間水蒸気処理を行った。水蒸気処理後の触媒のTPD酸量を測定した結果、23μmol/g-ゼオライトであった。水蒸気処理されたゼオライト含有成型体触媒8gを内径14.8mmφのステンレス製反応管に充填し、以下の条件にて反応を行なった。
原料供給速度 :エチレン 4.64NL/hr(標準状態換算流量)
水素 4.58NL/hr
窒素 2.46NL/hr
水 2.78g/hr
反応圧力 :0.14MPa/G
反応温度 :550℃
反応開始2時間及び6時間後の反応成績は以下の通りであった。本比較例のように結晶化指数が低いゼオライトを用いた触媒では、経年活性と劣化挙動を実施例1~4と比較するために実施した650℃、5時間の水蒸気処理により、顕著な活性低下が認められ、活性が低く、繰り返し劣化挙動を評価することができなかった。
反応時間 (Hr) 2.0 6.0
エチレン転化率(質量%) 11.6 10.3
(1) 温度480℃ 酸素濃度1% 1時間
(2) 温度520℃ 酸素濃度1% 3時間
(3) 温度550℃ 酸素濃度1% 3時間
(4) 温度550℃ 酸素濃度5% 1時間
(5) 温度580℃ 酸素濃度5% 2時間
上記方法にて、24時間の反応と10時間の再生を1サイクルとして3サイクルを繰り返した。試験結果を表4及び図9に示す。
本比較例から、ゼオライト結晶化指数が3.3未満のゼオライトを含有する触媒を用いると、触媒の劣化が顕著であり、繰り返しの使用に耐えられないことが分かる。
[原料ゼオライトの水熱合成]
珪酸エチル130gをエタノール278gに溶解させた液に、硫酸アルミニウム16水和物1.5gを溶解させた10質量%テトラプロピルアンモニウムハイドロオキサイド水溶液291gを添加した。この混合液をホモジナイザーにて5000rpmで10分間混合攪拌し、均一な透明液を得た。この溶液の350gを1リットルオートクレーブに仕込み、500rpmで攪拌しながら125℃で110時間水熱合成し、結晶化させた。
得られたスラリーを濾過しながら、pHが9以下になるまで水洗した後、120℃で20時間乾燥し、その後、550℃で3時間、空気中で焼成した。更に、この乾燥物を1規定硝酸水溶液中に10質量%スラリーとして室温下、3時間イオン交換した後、濾過水洗した。その後、120℃で10時間乾燥し、H型ZSM―5ゼオライト粉末を得た。
得られたH型ZSM-5ゼオライト5gにルチル型チタニア1gを添加し、電動乳鉢にて30分間らいかいしたサンプルのX線回折スペクトルを図10に示す。X線回折の測定結果から、H型ZSM-5ゼオライトの結晶化指数を求めたところ4.37であった。また、そのシリカ/アルミナモル比は290であった。
得られたH型ZSM-5ゼオライトをシリカゾルと混練し、押出し成型した。ゼオライトの含有量は50質量%であった。得られた押出し成型触媒を120℃で6時間乾燥した後、700℃で2時間焼成し、直径2mm、長さ3~5mmの柱状ゼオライト含有成型体触媒を得た。得られたゼオライト含有成型体触媒を0.5N-硝酸水溶液中で攪拌しイオン交換した後、水洗し、120℃で5時間乾燥させた。得られたゼオライト含有成型体触媒のTPD酸量を測定した結果、77μmol/g-ゼオライトであった。
得られたゼオライト含有成型体触媒8gを内径14.8mmφのステンレス製反応管に充填し、以下の条件にて反応を行なった。
原料供給速度 :エチレン 4.64NL/hr(標準状態換算流量)
水素 4.58NL/hr
窒素 2.46NL/hr
水 2.78g/hr
反応圧力 :0.14MPa/G
反応温度 :550℃
反応は24時間継続した。その後、エチレン、水素、水の供給を停止し、窒素ガス10NL/hrを供給しながら、触媒層温度を480℃に設定した。その後、空気0.5NL/hrの供給を開始し、触媒上に堆積したコークの燃焼除去(再生工程)を実施した。スタート時の入口ガス酸素濃度は1%であった。反応器出口ガス中のCO,CO2濃度をGCにてモニターしながら、全ガス流量は一定として、窒素、空気の流量を変えながら以下の条件にて触媒再生(堆積コークの燃焼除去)を完了した。
(1) 温度480℃ 酸素濃度1% 1時間
(2) 温度520℃ 酸素濃度1% 3時間
(3) 温度550℃ 酸素濃度1% 3時間
(4) 温度550℃ 酸素濃度5% 1時間
(5) 温度580℃ 酸素濃度5% 2時間
上記方法にて、24時間の反応と10時間の再生を1サイクルとして3サイクルを繰り返した。測定結果を表5及び図11に示す。
ゼオリストインターナショナル社製のNH4型MFI型ゼオライトCBV2802(シリカ/アルミナモル比280)をシリカゾルと混練し、押出し成型した。ゼオライトの含有量は50質量%であった。得られた押出し成型触媒を120℃で6時間乾燥した後、700℃で2時間焼成し、直径2mm、長さ3~5mmの柱状ゼオライト含有成型体触媒を得た。得られた成型体触媒を0.5N-硝酸水溶液中で攪拌しイオン交換した後、水洗し、120℃で5時間乾燥させた。得られたゼオライト含有成型体触媒のTPD酸量を測定した結果、90μmol/g-ゼオライトであった。
一方、このゼオライトの結晶化指数は、2.90であった。X線回折スペクトルを図12に示す。
得られたゼオライト含有成型体触媒を水蒸気処理(スチーミング)せずに用いたこと以外は実施例1と同様の方法により、反応/再生繰り返し試験を4サイクル行った。試験結果を表6及び図13に示す。
本比較例と実施例6との比較から、シリカ/アルミナ比が高いゼオライトであっても、結晶化指数が3.3未満のゼオライトでは、触媒の劣化が顕著であり、繰り返しの使用に耐えられないことが分かる。
Claims (6)
- 50質量%を超えてエチレンを含有する炭化水素原料を、水を供給しながらゼオライト含有触媒と接触転化させる工程を含むプロピレンの製造方法であって、
前記ゼオライト含有触媒に含まれるゼオライトが下記(1)~(3)を満たすプロピレンの製造方法;
(1)MFI型ゼオライトであり、
(2)X線回折スペクトルから求められるゼオライト結晶化指数が、3.3以上であり、
(3)シリカ/アルミナ(SiO2/Al2O3)モル比が、20~300である。 - 前記炭化水素原料に対して10質量%以上の水を供給する、請求項1記載のプロピレンの製造方法。
- 前記ゼオライト含有触媒を550℃以上の温度で加熱処理する工程を更に含む、請求項1又は2記載のプロピレンの製造方法。
- 前記ゼオライト含有触媒を、水蒸気の存在下、300℃以上の温度で加熱処理する工程を更に含む、請求項1~3のいずれか1項記載のプロピレンの製造方法。
- 前記ゼオライト含有触媒が、周期律表第IB族に属する元素よりなる群から選ばれる少なくとも1種の金属元素を含有する、請求項1~4のいずれか1項記載のプロピレンの製造方法。
- 前記ゼオライト含有触媒に付着したコークを燃焼させる工程を更に含む、請求項1~5のいずれか1項記載のプロピレンの製造方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011502746A JP5607024B2 (ja) | 2009-03-02 | 2010-03-01 | プロピレンの製造方法 |
| US13/254,373 US8450551B2 (en) | 2009-03-02 | 2010-03-01 | Method for producing propylene |
| BRPI1009564-0A BRPI1009564B1 (pt) | 2009-03-02 | 2010-03-01 | Method for producing propylene. |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009048369 | 2009-03-02 | ||
| JP2009-048369 | 2009-03-02 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2010101121A1 true WO2010101121A1 (ja) | 2010-09-10 |
Family
ID=42709678
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2010/053265 WO2010101121A1 (ja) | 2009-03-02 | 2010-03-01 | プロピレンの製造方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US8450551B2 (ja) |
| JP (1) | JP5607024B2 (ja) |
| BR (1) | BRPI1009564B1 (ja) |
| TW (1) | TWI399358B (ja) |
| WO (1) | WO2010101121A1 (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011135785A1 (en) * | 2010-04-30 | 2011-11-03 | Toyota Jidosha Kabushiki Kaisha | Propylene production method |
| WO2013099220A1 (en) * | 2011-12-28 | 2013-07-04 | Showa Denko K.K. | Method of producing catalyst and method of producing unsaturated hydrocarbon using said catalyst |
| JP2014047176A (ja) * | 2012-08-31 | 2014-03-17 | Mitsubishi Chemicals Corp | プロピレンの製造方法 |
| JPWO2016017794A1 (ja) * | 2014-08-01 | 2017-04-27 | 千代田化工建設株式会社 | 複合体触媒、複合体触媒の製造方法、低級オレフィンの製造方法および複合体触媒の再生方法 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11492264B2 (en) * | 2018-03-23 | 2022-11-08 | Ngk Insulators, Ltd. | Seed crystals, method of producing seed crystals, method of producing seed crystals attachment support, and method of producing zeolite membrane complex |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH03293031A (ja) * | 1990-04-10 | 1991-12-24 | Tosoh Corp | 高耐熱水性ゼオライト及びその製造方法 |
| JPH05147925A (ja) * | 1991-11-27 | 1993-06-15 | Tosoh Corp | ゼオライト及びその製造方法 |
| JPH07291620A (ja) * | 1994-04-22 | 1995-11-07 | Mizusawa Ind Chem Ltd | 高耐熱水性高シリカゼオライト及びその製造方法 |
| JPH1052646A (ja) * | 1996-04-18 | 1998-02-24 | Sanyo Sekiyu Kagaku Kk | 高シリカゼオライト系触媒 |
| JP2005232122A (ja) * | 2004-02-23 | 2005-09-02 | Mitsubishi Chemicals Corp | プロピレンの製造方法 |
| JP2005281254A (ja) * | 2004-03-30 | 2005-10-13 | Mitsubishi Chemicals Corp | プロピレンの製造方法 |
| JP2007191444A (ja) * | 2006-01-20 | 2007-08-02 | Tokyo Institute Of Technology | プロピレンの製造方法、触媒の再生方法、固体酸触媒 |
| WO2007114195A1 (ja) * | 2006-03-30 | 2007-10-11 | Mitsubishi Chemical Corporation | プロピレンの製造方法 |
| WO2009031445A1 (ja) * | 2007-09-06 | 2009-03-12 | Asahi Kasei Chemicals Corporation | プロピレンの製造方法 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4150062A (en) * | 1976-12-20 | 1979-04-17 | Mobil Oil Corporation | Light olefin processing |
| JPS58145616A (ja) * | 1982-02-22 | 1983-08-30 | Teijin Yuka Kk | 新規結晶性アルミノシリケ−トゼオライト及びその製造法 |
| US4845063A (en) * | 1982-10-15 | 1989-07-04 | Mobil Oil Corporation | Zeolite catalyst of improved hydrothermal stability |
| US4527001A (en) * | 1983-11-15 | 1985-07-02 | Union Carbide Corporation | Small olefin interconversions |
| US4605807A (en) * | 1984-04-27 | 1986-08-12 | Atlantic Richfield Company | Process for catalytic conversion of ethylene to higher hydrocarbons |
| JPS6168319A (ja) * | 1984-09-10 | 1986-04-08 | Asahi Chem Ind Co Ltd | 結晶性アルミノシリケ−トの合成法 |
| US4849194A (en) * | 1987-05-26 | 1989-07-18 | Mobil Oil Corporation | Measurement and control of zeolite synthesis |
| EP1061116A1 (en) | 1999-06-16 | 2000-12-20 | Fina Research S.A. | Production of olefins |
| US6894163B2 (en) | 2001-02-14 | 2005-05-17 | Asahi Kasei Kabushiki Kaisha | Process for preparation of epsilon-caprolactam |
| KR101159087B1 (ko) * | 2003-12-12 | 2012-06-25 | 미쓰비시 가가꾸 가부시키가이샤 | 프로필렌의 제조 방법 |
| JP4774813B2 (ja) | 2005-06-03 | 2011-09-14 | 三菱化学株式会社 | プロピレンの製造方法 |
| JP2009518162A (ja) * | 2005-12-01 | 2009-05-07 | ビーエーエスエフ、カタリスツ、エルエルシー | オレフィン炭化水素小分子用の熱水的に安定したAg−ゼオライト炭化水素トラップ |
-
2010
- 2010-03-01 JP JP2011502746A patent/JP5607024B2/ja active Active
- 2010-03-01 BR BRPI1009564-0A patent/BRPI1009564B1/pt active IP Right Grant
- 2010-03-01 WO PCT/JP2010/053265 patent/WO2010101121A1/ja active Application Filing
- 2010-03-01 US US13/254,373 patent/US8450551B2/en active Active
- 2010-03-02 TW TW099106014A patent/TWI399358B/zh active
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH03293031A (ja) * | 1990-04-10 | 1991-12-24 | Tosoh Corp | 高耐熱水性ゼオライト及びその製造方法 |
| JPH05147925A (ja) * | 1991-11-27 | 1993-06-15 | Tosoh Corp | ゼオライト及びその製造方法 |
| JPH07291620A (ja) * | 1994-04-22 | 1995-11-07 | Mizusawa Ind Chem Ltd | 高耐熱水性高シリカゼオライト及びその製造方法 |
| JPH1052646A (ja) * | 1996-04-18 | 1998-02-24 | Sanyo Sekiyu Kagaku Kk | 高シリカゼオライト系触媒 |
| JP2005232122A (ja) * | 2004-02-23 | 2005-09-02 | Mitsubishi Chemicals Corp | プロピレンの製造方法 |
| JP2005281254A (ja) * | 2004-03-30 | 2005-10-13 | Mitsubishi Chemicals Corp | プロピレンの製造方法 |
| JP2007191444A (ja) * | 2006-01-20 | 2007-08-02 | Tokyo Institute Of Technology | プロピレンの製造方法、触媒の再生方法、固体酸触媒 |
| WO2007114195A1 (ja) * | 2006-03-30 | 2007-10-11 | Mitsubishi Chemical Corporation | プロピレンの製造方法 |
| WO2009031445A1 (ja) * | 2007-09-06 | 2009-03-12 | Asahi Kasei Chemicals Corporation | プロピレンの製造方法 |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011135785A1 (en) * | 2010-04-30 | 2011-11-03 | Toyota Jidosha Kabushiki Kaisha | Propylene production method |
| WO2013099220A1 (en) * | 2011-12-28 | 2013-07-04 | Showa Denko K.K. | Method of producing catalyst and method of producing unsaturated hydrocarbon using said catalyst |
| JP2014047176A (ja) * | 2012-08-31 | 2014-03-17 | Mitsubishi Chemicals Corp | プロピレンの製造方法 |
| JPWO2016017794A1 (ja) * | 2014-08-01 | 2017-04-27 | 千代田化工建設株式会社 | 複合体触媒、複合体触媒の製造方法、低級オレフィンの製造方法および複合体触媒の再生方法 |
| US10556229B2 (en) | 2014-08-01 | 2020-02-11 | Chiyoda Corporation | Composite catalyst, method for producing composite catalyst, method for producing lower olefin and method for regenerating composite catalyst |
Also Published As
| Publication number | Publication date |
|---|---|
| TWI399358B (zh) | 2013-06-21 |
| JP5607024B2 (ja) | 2014-10-15 |
| TW201036939A (en) | 2010-10-16 |
| JPWO2010101121A1 (ja) | 2012-09-10 |
| US20120004490A1 (en) | 2012-01-05 |
| BRPI1009564B1 (pt) | 2017-12-26 |
| BRPI1009564A2 (ja) | 2016-03-22 |
| US8450551B2 (en) | 2013-05-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5116043B2 (ja) | プロピレンの製造方法 | |
| JP3707607B2 (ja) | エチレンおよびプロピレンの製造方法 | |
| AU2011269098B2 (en) | Dehydration of alcohols on poisoned acidic catalysts | |
| KR101217915B1 (ko) | 에탄올로부터의 올레핀의 제조 방법 | |
| KR101227221B1 (ko) | 에탄올로부터의 올레핀의 제조 방법 | |
| JP5607024B2 (ja) | プロピレンの製造方法 | |
| RU2394803C2 (ru) | Способ получения пропилена и ароматических углеводородов и установка для их получения | |
| US10773250B2 (en) | Modified crystalline aluminosilicate for dehydration of alcohols | |
| EA007767B1 (ru) | Производство олефинов | |
| US10556229B2 (en) | Composite catalyst, method for producing composite catalyst, method for producing lower olefin and method for regenerating composite catalyst | |
| JPWO2007032447A1 (ja) | エチレン及びプロピレンを製造する方法 | |
| EP3240769B1 (en) | Process for preparing olefins by dehydrating alcohols with less side effects comprising addition of sulfur containing compounds | |
| JP4921788B2 (ja) | エチレン及びプロピレンを製造する方法 | |
| CN109806909B (zh) | 一种用于甲醇和/或二甲醚制丙烯催化剂的制备方法及其应用 | |
| WO2023145941A1 (ja) | エタノールの変換方法、及びその他炭化水素の製造方法 | |
| US8168842B2 (en) | Process for the alkylation of a cycloalkene | |
| WO2024070182A1 (ja) | エタノールの変換方法、炭化水素の製造方法、プロピレンの製造方法、芳香族化合物の製造方法、及び、エタノールの変換装置 | |
| JP2023177331A (ja) | アルコールの変換方法、及び炭化水素の製造方法 | |
| CN109071378B (zh) | 低级烯烃的制造方法 | |
| US20190092706A1 (en) | Process for Preparing Olefins by Dehydrating Alcohols with Less Side Effects Comprising Addition of Organic Acids | |
| JPH06192136A (ja) | 軽質炭化水素の接触分解法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 10748716 Country of ref document: EP Kind code of ref document: A1 |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2011502746 Country of ref document: JP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 13254373 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 10748716 Country of ref document: EP Kind code of ref document: A1 |
|
| REG | Reference to national code |
Ref country code: BR Ref legal event code: B01A Ref document number: PI1009564 Country of ref document: BR |
|
| ENP | Entry into the national phase |
Ref document number: PI1009564 Country of ref document: BR Kind code of ref document: A2 Effective date: 20110902 |