RU2562583C2 - Фармацевтические композиции с уменьшенным высвобождением фенольных опиоидов - Google Patents
Фармацевтические композиции с уменьшенным высвобождением фенольных опиоидов Download PDFInfo
- Publication number
- RU2562583C2 RU2562583C2 RU2011119643/15A RU2011119643A RU2562583C2 RU 2562583 C2 RU2562583 C2 RU 2562583C2 RU 2011119643/15 A RU2011119643/15 A RU 2011119643/15A RU 2011119643 A RU2011119643 A RU 2011119643A RU 2562583 C2 RU2562583 C2 RU 2562583C2
- Authority
- RU
- Russia
- Prior art keywords
- compound
- pharmaceutical composition
- group
- composition according
- substituted
- Prior art date
Links
- 0 *C(*)C(N*1C(*)C1*)=O Chemical compound *C(*)C(N*1C(*)C1*)=O 0.000 description 7
- NTNZLJPTWSYODR-QTCDZNGVSA-N CC(C([C@@]1(C2)c3c4O[C@H]11)C=CC1=O)N(C)C2c3ccc4O Chemical compound CC(C([C@@]1(C2)c3c4O[C@H]11)C=CC1=O)N(C)C2c3ccc4O NTNZLJPTWSYODR-QTCDZNGVSA-N 0.000 description 1
- NGXKCFICKSUXTG-DVGZDSFCSA-N CC(C1[C@]23[C@H](C(C=C4)=O)O5)(C24O)N(C)C1c(cc1)c3c5c1O Chemical compound CC(C1[C@]23[C@H](C(C=C4)=O)O5)(C24O)N(C)C1c(cc1)c3c5c1O NGXKCFICKSUXTG-DVGZDSFCSA-N 0.000 description 1
- ZQXJRRHAWZMQLQ-VLALHHHYSA-N CC1C2(C3)[C@@H]1[C@H](CCCC1)[C@]31c1cc(O)ccc1C2 Chemical compound CC1C2(C3)[C@@H]1[C@H](CCCC1)[C@]31c1cc(O)ccc1C2 ZQXJRRHAWZMQLQ-VLALHHHYSA-N 0.000 description 1
- ZKLXUUYLEHCAMF-UUWFMWQGSA-N CN(CC[C@]12c(c(C3)ccc4O)c4O[C@H]11)[C@H]3C2=CC=C1OC Chemical compound CN(CC[C@]12c(c(C3)ccc4O)c4O[C@H]11)[C@H]3C2=CC=C1OC ZKLXUUYLEHCAMF-UUWFMWQGSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06104—Dipeptides with the first amino acid being acidic
- C07K5/06113—Asp- or Asn-amino acid
- C07K5/06121—Asp- or Asn-amino acid the second amino acid being aromatic or cycloaliphatic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/155—Amidines (), e.g. guanidine (H2N—C(=NH)—NH2), isourea (N=C(OH)—NH2), isothiourea (—N=C(SH)—NH2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/439—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom the ring forming part of a bridged ring system, e.g. quinuclidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/451—Non condensed piperidines, e.g. piperocaine having a carbocyclic group directly attached to the heterocyclic ring, e.g. glutethimide, meperidine, loperamide, phencyclidine, piminodine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/05—Dipeptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C215/00—Compounds containing amino and hydroxy groups bound to the same carbon skeleton
- C07C215/46—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C215/64—Compounds containing amino and hydroxy groups bound to the same carbon skeleton having hydroxy groups bound to carbon atoms of at least one six-membered aromatic ring and amino groups bound to acyclic carbon atoms or to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with rings other than six-membered aromatic rings being part of the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C257/00—Compounds containing carboxyl groups, the doubly-bound oxygen atom of a carboxyl group being replaced by a doubly-bound nitrogen atom, this nitrogen atom not being further bound to an oxygen atom, e.g. imino-ethers, amidines
- C07C257/10—Compounds containing carboxyl groups, the doubly-bound oxygen atom of a carboxyl group being replaced by a doubly-bound nitrogen atom, this nitrogen atom not being further bound to an oxygen atom, e.g. imino-ethers, amidines with replacement of the other oxygen atom of the carboxyl group by nitrogen atoms, e.g. amidines
- C07C257/18—Compounds containing carboxyl groups, the doubly-bound oxygen atom of a carboxyl group being replaced by a doubly-bound nitrogen atom, this nitrogen atom not being further bound to an oxygen atom, e.g. imino-ethers, amidines with replacement of the other oxygen atom of the carboxyl group by nitrogen atoms, e.g. amidines having carbon atoms of amidino groups bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C279/00—Derivatives of guanidine, i.e. compounds containing the group, the singly-bound nitrogen atoms not being part of nitro or nitroso groups
- C07C279/18—Derivatives of guanidine, i.e. compounds containing the group, the singly-bound nitrogen atoms not being part of nitro or nitroso groups having nitrogen atoms of guanidine groups bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D211/62—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4
- C07D211/66—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4 having a hetero atom as the second substituent in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D217/00—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems
- C07D217/02—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with only hydrogen atoms or radicals containing only carbon and hydrogen atoms, directly attached to carbon atoms of the nitrogen-containing ring; Alkylene-bis-isoquinolines
- C07D217/04—Heterocyclic compounds containing isoquinoline or hydrogenated isoquinoline ring systems with only hydrogen atoms or radicals containing only carbon and hydrogen atoms, directly attached to carbon atoms of the nitrogen-containing ring; Alkylene-bis-isoquinolines with hydrocarbon or substituted hydrocarbon radicals attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/22—Bridged ring systems
- C07D221/26—Benzomorphans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D223/00—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom
- C07D223/02—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom not condensed with other rings
- C07D223/04—Heterocyclic compounds containing seven-membered rings having one nitrogen atom as the only ring hetero atom not condensed with other rings with only hydrogen atoms, halogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/185—Radicals derived from carboxylic acids from aliphatic carboxylic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/08—Bridged systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/543—Lipids, e.g. triglycerides; Polyamines, e.g. spermine or spermidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/56—Ring systems containing bridged rings
- C07C2603/58—Ring systems containing bridged rings containing three rings
- C07C2603/76—Ring systems containing bridged rings containing three rings containing at least one ring with more than six ring members
- C07C2603/80—Ring systems containing bridged rings containing three rings containing at least one ring with more than six ring members containing eight-membered rings
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Emergency Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Pain & Pain Management (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Rheumatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Группа изобретений относится к медицине и касается фармацевтической композиции для лечения или предотвращения боли или для снижения потенциального злоупотребления фенольными опиоидами, которая содержит ингибитор трипсина и содержащее остаток фенольного опиоида соединение. Группа изобретений также касается способа лечения или предотвращения боли у пациента, нуждающегося в таком лечении, который включает введение пациенту эффективного количества указанной фармацевтической композиции; применения указанной фармацевтической композиции в изготовлении лекарственного препарата для лечения или предотвращения боли; способа снижения потенциального злоупотребления фенольным опиоидом, включающего комбинирование пролекарства фенольного опиоида, которое обеспечивает ферментативно-контролируемое высвобождение фенольного опиоида с ингибитором фермента. Группа изобретений обеспечивает лечение или предотвращение боли и снижение потенциального злоупотребления фенольными опиоидами. 5 н. и 46 з.п. ф-лы, 9 ил., 9 табл., 20 пр.
Description
Область техники, к которой относится изобретение
Изобретение относится к фармацевтическим композициям и способам их применения. Эти фармацевтические композиции содержат пролекарство фенольного опиоида, которое обеспечивает ферментативно-регулируемое высвобождение фенольного опиоида, и ингибитор фермента, который взаимодействует с ферментом(ферментами), опосредующим ферментативно-регулируемое высвобождение фенольного опиоида из пролекарства так, чтобы уменьшить ферментативное расщепление пролекарства.
Уровень техники
Существует восприимчивость к злоупотреблению фенольными опиоидами. Следовательно, необходимо контролировать доступ к этим лекарственным средствам. Контроль доступа к лекарственным средствам является дорогостоящим для управления и может привести к отказу в лечении пациентов, которые не способны к самостоятельному дозированию. Например, пациентам, страдающим от острой боли, может быть отказано в лечении опиоидом, если они не помещены в стационар.
Международная патентная заявка с номером публикации WO 2007/140272 описывает некоторые пролекарства, которые обладают возможностью контролировано высвобождать фенольные опиоиды. Пролекарства являются устойчивыми к злоупотреблению, являясь стабильными в присутствии бытовых химикатов, таких как уксус или пищевая сода, и требуют ферментной активации в кишечнике для высвобождения фенольного опиоида. Пролекарства, как полагают, высвобождают фенольный опиоид через ферментно активированный циклизационный механизм высвобождения. Таким образом, индуцированное ферментом расщепление амидной связи, как полагают, дает нуклеофильный атом азота, который затем подвергается циклизационной реакции высвобождения.
Пролекарства, описанные в WO 2007/140272, противостоят высвобождению фенольного опиоида, когда подвергаются условиям, обычно применяемым теми, кто испытывает желание злоупотребления лекарственным средством, но высвобождают фенольный опиоид, когда вводятся перорально. Это обеспечивает существенную защиту от злоупотребления. Однако бывают ситуации, в которых пероральное употребление такого пролекарства будет потенциально приводить к чрезмерному воздействию фенольного опиоида, будь то путем злоупотребления или случайного чрезмерного потребления.
Раскрытие изобретения
Данное раскрытие представляет фармацевтические композиции и способы их применения, где фармацевтические композиции содержат пролекарство фенольного опиоида, которое обеспечивает ферментативно-регулируемое высвобождение фенольного опиоида, и ингибитор фермента, который взаимодействует с ферментом(ферментами), опосредующим ферментативно-регулируемое высвобождение фенольного опиоида из пролекарства так, чтобы уменьшить ферментативное расщепление пролекарства.
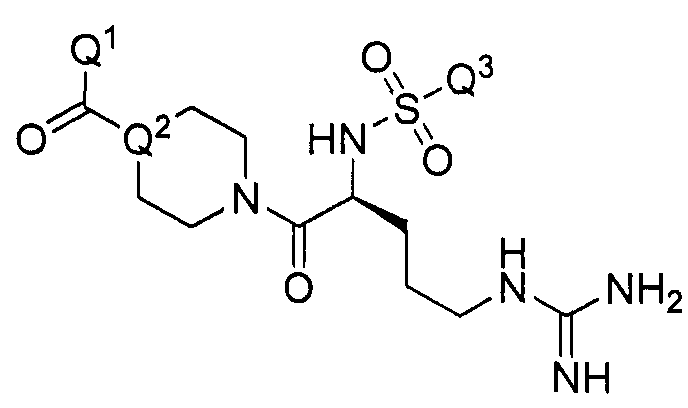
Следовательно, согласно одному аспекту, варианты осуществления данного изобретения включают фармацевтические композиции, которые содержат ингибитор трипсина и соединение общей формулы (I):
или его фармацевтически приемлемую соль, где:
Х представляет собой остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 представляет собой (1-4С)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4С)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу, или остаток аминокислоты, дипептид, или N-ацильное производное аминокислоты или дипептида.
Варианты изобретения обеспечивают фармацевтическую композицию, которая содержит ингибитор трипсина и соединение общей формулы (II):
или его фармацевтически приемлемую соль, где:
Х представляет собой остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе с углеродом, к которому они присоединены, образуют циклоалкильную и замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет собой целое число от 2 до 4;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
Варианты изобретения также обеспечивают фармацевтическую композицию, которая содержит ингибитор трипсина и соединение общей формулы (III):
или его фармацевтически приемлемую соль, где:
Х представляет собой остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 представляет собой (1-4С)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4С)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая
N-замещенное ацильное производное) аминокислоты или дипептида.
Другие варианты осуществления изобретения представляют фармацевтическую композицию, которая содержит ингибитор трипсина и соединение общей формулы (IV):
или его фармацевтически приемлемую соль, где:
Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет собой (1-4С)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4С)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу, или остаток аминокислоты, дипептид, или N-ацильное производное аминокислоты или дипептида.
Другие варианты осуществления представляют фармацевтическую композицию, которая содержит ингибитор трипсина и соединение общей формулы (V):
или его фармацевтически приемлемую соль, где:
Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе. с углеродом, к которому они присоединены, образуют циклоалкильную и замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет собой целое число от 2 до 4;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
Варианты осуществления представляют также фармацевтическую композицию, которая содержит ингибитор трипсина и соединение общей формулы (VI):
или его фармацевтически приемлемую соль, в котором:
Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет собой (1-4С)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4С)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH((C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
Краткое описание чертежей
Фигура 1 представляет собой график, который сравнивает средние концентрации в крови гидроморфона (НМ) с течением времени после перорального введения крысам соединения 1 отдельно и соединения 1 с различными количествами ингибитора трипсина из Glycine max (соя) (SBTI).
Фигура 2 представляет собой график, который сравнивает средние концентрации в плазме гидроморфона (НМ) с течением времени после перорального введения крысам соединения 1 отдельно, соединения 1 с овальбумином (OVA), и соединения 1 с овальбумином и SBTI.
Фигура 3 представляет собой график, который сравнивает индивидуальные концентрации в плазме гидроморфона (НМ) с течением времени после перорального введения крысам соединения 1 отдельно и соединения 1 с ингибитором трипсина-химотрипсина Баумана-Бирка (BBSI).
Фигура 4 представляет собой график, который сравнивает средние концентрации в плазме гидроморфона (НМ) с течением времени высвобождения после перорального введения соединения 2 отдельно и соединения 2 с SBTI крысам.
Фигура 5 представляет собой график, который сравнивает средние концентрации в плазме гидроморфона (НМ) с течением времени высвобождения после перорального введения соединения 3 отдельно и соединения 3 с SBTI крысам.
Фигура 6 представляет собой график, который сравнивает средние концентрации в плазме гидроморфона (НМ) с течением времени высвобождения после перорального введения соединения 4 отдельно и соединения 4 с SBTI крысам.
Фигуры 7А и 7В представляют собой графики, которые показывают результаты воздействия определенной комбинации соединения 4 и трипсина в отсутствие какого-либо ингибитора трипсина или в присутствии SBTI, соединения 107, соединения 108 или соединения 109. Фигура 7А изображает исчезновение соединения 4, а фигура 7В изображает появление гидроморфона с течением времени при таких условиях.
Фигура 8 представляет собой график, который сравнивает средние концентрации в плазме гидроморфона (НМ) с течением времени высвобождения после перорального введения соединения 3 отдельно и соединения 3 с соединением 101 крысам.
Фигура 9 представляет собой график, который сравнивает средние концентрации в плазме гидроморфона (НМ) с течением времени высвобождения после перорального введения соединения 4 отдельно и соединения 4 с соединением 101 крысам.
Определения
Следующие выражения имеют следующие значения, если не указано иное. Любые неопределенные выражения имеют значения, принятые в области, к которой они принадлежат.
Как используется в данном документе, выражение "алкил" само по себе или как часть другого заместителя относится к насыщенному разветвленному или с прямой цепью одновалентному углеводородному радикалу, полученному удалением одного атома водорода от отдельного атома углерода исходного алкана. Типичные алкильные группы включают, но не ограничиваясь, метил; этил, пропилы, такие как пропан-1-ил или пропан-2-ил; и бутилы, такие как бутан-1-ил, бутан-2-ил, 2-метил-пропан-1-ил или 2-метил-пропан-2-ил. В некоторых вариантах осуществления алкильная группа содержит от 1 до 20 атомов углерода. В других вариантах осуществления алкильная группа содержит от 1 до 10 атомов углерода. В некоторых других вариантах осуществления алкильная группа содержит от 1 до 6 атомов углерода, например, от 1 до 4 атомов углерода.
"Алкенил" сам по себе или как часть другого заместителя относится к ненасыщенному разветвленному, с прямой цепью или циклическому алкильному радикалу, имеющему, по меньшей мере, одну двойную связь углерод-углерод, полученную удалением одного атома водорода от отдельного атома углерода исходного алкена. Группа может иметь либо цис-, либо транс- конформацию по двойной связи(связям). Типичные алкенильные группы включают, но не ограничиваясь, этенил;
пропенилы, такие как проп-1-ен-1-ил, проп-1-ен-2-ил, проп-2-ен-1-ил (аллил), проп-2-ен-2-ил, циклопроп-1-ен-1-ил; циклопроп-2-ен-1-ил; бутенилы, такие как бут-1-ен-1-ил, бут-1-ен-2-ил, 2-метил-проп-1-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-1-ил, бут-2-ен-2-ил, бута-1,3-диен-1-ил, бута-1,3-диен-2-ил, циклобут-1-ен-1-ил, циклобут-1-ен-3-ил, циклобута-1,3-диен-1-ил и т.д.; и подобные.
"Алкинил" сам по себе или как часть другого заместителя относится к ненасыщенному разветвленному, с прямой цепью или циклическому алкильному радикалу, имеющему, по меньшей мере, одну тройную связь углерод-углерод, полученную удалением одного атома водорода от отдельного атома углерода исходного алкина. Типичные алкинильные группы включают, но не ограничиваясь, этинил;
пропинилы, такие как проп-1-ин-1-ил, проп-2-ин-1-ил и т.д.; бутинилы, такие как бут-1-ин-1-ил, бут-1-ин-3-ил, бут-3-ин-1-ил и т.д.; и подобные.
"Ацил" сам по себе или как часть другого заместителя относится к радикалу -C(O)R30, где R30 представляет собой водород, алкил, циклоалкил, циклогетероалкил, арил, арилалкил, гетероалкил, гетероарил, гетероарилалкил, как определено в данном документе. Типичные примеры включают, но не ограничиваясь, формил, ацетил, циклогексилкарбонил, циклогексилметилкарбонил, бензоил, бензилкарбонил, пиперонил и подобные. Замещенный ацил относится к замещенным вариантам ацила и включает, например, но без ограничения, сукцинил и малонил.
Выражение "аминоацил" и "амид" относится к группе -C(O)NR21R22, где R21 и R22 независимо выбирают из группы, которая включает водород, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, гетероарил, замещенный гетероарил, гетероцикл и замещенный гетероцикл, и где R21 и R22 при необходимости вместе с азотом, к которому они присоединены, образуют гетероциклическую или замещенную гетероциклическую группу, и где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероцикл и замещенный гетероцикл являются такими, как определено в данном документе.
"Алкокси-" сам по себе или как часть другого заместителя относится к радикалу -OR31, где R31 представляет алкильную или циклоалкильную группу, как определено в данном документе. Типичные примеры включают, но не ограничиваясь, метокси-, этокси-, пропокси-, бутокси-, циклогексилокси- и подобные.
"Алкоксикарбонил" сам по себе или как часть другого заместителя относится к радикалу -C(O)OR31, где R31 представляет алкильную или циклоалкильную группу, как определено в данном документе. Типичные примеры включают, но не ограничиваясь, метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, циклогексилоксикарбонил и подобные.
"Арил" сам по себе или как часть другого заместителя относится к одновалентному ароматическому углеводородному радикалу, полученному удалением одного атома водорода от отдельного атома углерода исходной ароматической кольцевой системы. Типичные арильные группы включают, но не ограничиваясь, группы, полученные из ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, бензола, хризена, коронена, флуорантена, флуорена, гексацена, гексафена, гексалена, as-индацена, s-индацена, индана, индена, нафталина, октацена, октафена, окталена, овалена, пента-2,4-диена, пентацена, пенталена, пентафена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена, рубицена, трифенилена, тринафталина и подобных. В некоторых вариантах осуществления арильная группа содержит от 6 до 20 атомов углерода. В других вариантах осуществления арильная группа содержит от 6 до 12 атомов углерода. Примерами арильной группы являются фенил и нафтил.
"Арилалкил" сам по себе или как часть другого заместителя относится к ациклическому алкильному радикалу, в котором один из атомов водорода связанный с атомом углерода, типично с концевым или sp3 атомом углерода, замещен арильной группой. Типичные арилалкильные группы включают, но не ограничиваясь, бензил, 2-фенилэт-1-ил, нафтилметил, 2-нафтилэт-1-ил, нафтобензил, 2-нафтофенилэт-1-ил и подобные. В некоторых вариантах осуществления арилалкильная группа представляет собой (С7-С30)арилалкил, например, алкильный компонент арилалкильной группы представляет собой (C1-С10), а арильный компонент представляет собой (С6-С20). В других вариантах осуществления арилалкильная группа представляет собой (С7-С20)арилалкил, например, алкильный компонент арилалкильной группы представляет собой (C1-C8), a арильный компонент представляет собой (C6-C12).
Соединения могут быть идентифицированы или по их химической структуре, и/или по химическому названию. Соединения, описанные в данном документе, могут включать один или более хиральных центров и/или двойных связей и, следовательно, могут существовать как стереоизомеры, такие как изомеры относительно двойной связи (т.е., геометрические изомеры), энантиомеры или диастереомеры. Соответственно, все возможные энантиомеры и стереоизомеры соединений, включая стереоизомерно чистую форму (например, геометрически чистую, энантиомерно чистую или диастереомерно чистую), энантиомерные и стереоизомерные смеси, включены в описание соединений в данном документе. Энантиомерные и стереоизомерные смеси могут быть разделены на их составляющие энантиомеры или стереоизомеры с использованием техник разделения или техник хирального синтеза, хорошо известных специалисту в данной области. Соединения также могут существовать в нескольких таутомерных формах, включая енольную форму, кето-форму и их смеси. Соответственно, химические структуры, описанные в данном документе, охватывают все возможные таутомерные формы иллюстрированных соединений. Описанные соединения также включают изотопно-меченные соединения, где один или более атомов имеют атомную массу, отличную от атомной массы, обычно встречающейся в природе. Примеры изотопов, которые могут быть включены в соединения, раскрытые в данном документе, включают, но не ограничиваясь, 2Н, 3Н, 11С, 13C, 14С, 15N, 18O, 17O и т.д. Соединения могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. Определенные соединения могут существовать во множественных кристаллических или аморфных формах. В основном, все физические формы являются эквивалентными для применений, предполагаемых в данном документе, и предназначены для включения в объем данного изобретения.
"Циклоалкил" сам по себе или как часть другого заместителя относится к насыщенному циклическому алкильному радикалу. Типичные циклоалкильные группы включают, но не ограничиваясь, группы, полученные из циклопропана, циклобутана, циклопентана, циклогексана и подобного. В некоторых вариантах осуществления циклоалкильная группа представляет собой (С3-С10)циклоалкил. В других вариантах осуществления циклоалкильная группа представляет собой (С3-С7)циклоалкил.
"Циклогетероалкил" сам по себе или как часть другого заместителя относится к насыщенному циклическому алкильному радикалу, в котором один или более атомов углерода (и любые связанные атомы водорода) независимо замещены таким же или отличающимся гетероатомом. Типичные гетероатомы для замещения атома углерода(атомов углерода) включают, но не ограничиваясь, N, Р, О, S, Si и т.д. Типичные циклогетероалкильные группы включают, но не ограничиваясь, группы, полученные из эпоксидов, азиринов, тииранов, имидазолидина, морфолина, пиперазина, пиперидина, пиразолидина, пирролидина,хинуклидина и подобного.
"Гетероалкил, гетероалкенил и гетероалкинил" сами по себе или как часть другого заместителя относятся к алкильной, алкенильной и алкинильной группе, соответственно, в которой один или более атомов углерода (и любые связанные атомы водорода) независимо замещены одинаковыми или различными гетероатомными группами. Типичные гетероатомные группы, которые могут быть включены в эти группы, включают, но не ограничиваясь, -О-, -S-, -O-O-, -S-S-, -O-S-, -NR37R38-,=N-N=, -N=N-, -N=N-NR39R40, -PR41-, -P(O)2-, -POR42-, -O-P(O)2-, -SO-, -SO2-, -SnR43R44- и подобные, где R37, R38, R39, R40, R41, R42, R43 и R44 представляют собой независимо водород, алкил, замещенный алкил, арил, замещенный арил, арилалкил, замещенный арилалкил, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, гетероалкил, замещенный гетероалкил, гетероарил, замещенный гетероарил, гетероарилалкил или замещенный гетероарилалкил.
"Гетероарил" сам по себе или как часть другого заместителя относится к одновалентному гетероароматическому радикалу, полученному удалением одного атома водорода от отдельного атома исходной гетероароматической кольцевой системы. Типичные гетероарильные группы включают, но не ограничиваясь, группы, полученные из акридина, арсиндола, карбазола, β-карболина, хромана, хромена, циннолина, фурана, имидазола, индазола, индола, индолина, индолизина, изобензофурана, изохромена, изоиндола, изоиндолина, изохинолина, изотиазола, изоксазола, нафтиридина, оксадиазола, оксазола, пиримидина, фенантридина, фенантролина, феназина, фталазина, птеридина, пурина, пирана, пиразина, пиразола, пиридазина, пиридина, пиримидина, пиррола, пирролизина, хиназолина, хинолина, хинолизина, хиноксалина, тетразола, тиадиазола, тиазола, тиофена, триазола, ксантена и подобных. В некоторых вариантах осуществления гетероарильная группа представляет собой 5-20-членный гетероарил. В других вариантах осуществления гетероарильная группа представляет собой 5-10-членный гетероарил. В некоторых других вариантах осуществления гетероарильные группы являются полученными из тиофена, пиррола, бензотиофена, бензофурана, индола, пиридина, хинолина, имидазола, оксазола и пиразина.
"Гетероарилалкил" сам по себе или как часть другого заместителя относится к ациклическому алкильному радикалу, в котором один из атомов водорода, связанный с атомом углерода, типично концевым или sp3 атомом углерода, замещен гетероарильной группой. В некоторых вариантах осуществления гетероарилалкильная группа представляет собой 6-30-членный гетероарилалкил, например, алкильный компонент гетероарилалкила является 1-10-членным, а гетероарильный компонент является 5-20-членным гетероарилом. В других вариантах осуществления гетероарилалкильная группа является 6-20-членным гетероарилалкилом, например, алкильный компонент гетероарилалкила является 1-8-членным, а гетероарильный компонент является 5-12-членным гетероарилом.
"Опиоид" относится к химическому веществу, которое оказывает свое фармакологическое действие путем. взаимодействия с опиоидными рецепторами. "Фенольный опиоид" относится к подгруппе опиоидов, которая содержит фенольную группу. Примеры фенольных опиоидов представлены ниже.
"Исходная ароматическая кольцевая система" само по себе или как часть другого заместителя относится к ненасыщенной циклической или полициклической кольцевой системе, имеющей сопряженную π-электронную систему. В частности, включенная в определение "исходная ароматическая кольцевая система" представляет собой слитые кольцевые системы, в которых одно или более из колец являются ароматическими, и одно или более из колец являются насыщенными или ненасыщенными, такие как, например, флуорен, индан, инден, фенален и т.д. Типичные исходные ароматические кольцевые системы включают, но не ограничиваясь, ацеантрилен, аценафтилен, ацефенантрилен, антрацен, азулен, бензол, хризен, коронен, флуорантен, флуорен, гексацен, гексафен, гексален, as-индацен, s-индацен, индан, инден, нафталин, окстацен, октафен, октален, овален, пента-2,4-диен, пентацен, пентален, пентафен, перилен, фенален, фенантрен, пицен, плеяаден, пирен, пирантрен, рубицен, трифенилен, тринафталин и подобные.
"Исходная гетероароматическая кольцевая система" сама по себе или как часть другого заместителя относится к исходной ароматической кольцевой системе, в которой один или более атомов углерода (и любые связанные атомы водорода) независимо замещены тем же или другим гетероатомом. Типичные гетероатомы, замещающие атомы углерода, включают, но не ограничиваясь, N, Р, О, S, Si и т.д. В частности, включенные в определение "исходные гетероароматические кольцевые системы" являются слитыми кольцевыми системами, в которых одно или более из колец являются ароматическими, и одно или более из колец являются насыщенными или ненасыщенными, такими как, например, арсиндол, бензодиоксан, бензофуран, хроман, хромен, индол, индолин, ксантен и т.д. Типичные исходные гетероароматические кольцевые системы включают, но не ограничиваясь, арсиндол, карбазол, β-карболин, хроман, хромен, циннолин, фуран, имидазол, индазол, индол, индолин, индолизин, изобензофуран, изохромен, изоиндол, изоиндолин, изохинолин, изотиазол, изоксазол, нафтиридин, оксадиазол, оксазол, перимидин, фенантридин, фенантролин, феназин, фталазин, птеридин, пурин, пиран, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, пирролизин, хиназолин, хинолин, хинолизин, хиноксалин, тетразол, тиадиазол, тиазол, тиофен, триазол, ксантен и подобное.
"Фармацевтическая композиция" относится к, по меньшей мере, одному соединению и фармацевтически приемлемому носителю, с которым соединение вводится пациенту.
"Фармацевтически приемлемая соль" относится к соли соединения, которое обладает желательной фармакологической активностью исходного соединения. Такие соли включают: (1) кислотные аддитивные соли, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные; или образованные органическими кислотами, такими как уксусная кислота, пропионовая кислота, капроновая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этан-дисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2,2,2]-окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и подобные; или (2) соли, образованные, когда кислотный протон, присутствующий в исходном соединении, замещен ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или координируется с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, N-метилглюкамин и подобные.
Выражение "сольват", как используется в данном документе, относится к комплексу или агрегату, образованному одной или более молекулами растворенного вещества, т.е. соединению вариантов осуществления или его фармацевтически приемлемой соли и одной или более молекул растворителя. Такие сольваты обычно являются кристаллическими твердыми веществами, имеющими в основном установленное молярное соотношение растворенного вещества и растворителя. Типичные растворители включают, в качестве примера, воду, метанол, этанол, изопропанол, уксусную кислоту и подобное. Когда растворителем является вода, образованный сольват является гидратом.
"Фармацевтически приемлемый носитель" относится к разбавителю, вспомогательному веществу, наполнителю или носителю, с которым или в котором соединение вводится.
"Пациент" включает людей, а также других млекопитающих, таких как домашний скот, зоопарковые животное и домашние животные, такие как кошка, собака или лошадь.
"Предотвращение", или "предупреждение", или "профилактика" относится к снижению риска возникновения состояния, такого как боль.
"Пролекарство" относится к производному активного средства, которое требует преобразования в организме для высвобождения активного средства. Пролекарства зачастую, хотя и необязательно, являются фармакологически неактивными до превращения в активное средство.
"Прокомпонент" относится к форме защитной группы, которая при применении для маскировки функциональной группы в активном средстве превращает активное средство в пролекарство. Типично, прокомпонент будет присоединен к лекарственному средству посредством связи(связей), которые расщепляются ферментным или неферментным средством in vivo.
"Защитная группа" относится к группировке атомов, которая, когда присоединена к реакционно-способной функциональной группе в молекуле, маскирует, снижает или предотвращает реакционную способность функциональной группы. Примеры защитных групп могут быть найдены у Green et al., "Protective Groups in Organic Chemistry," (Wiley, 2nd ed. 1991) и Harrison et al., "Compendium of Synthetic Organic Methods," Vols. 1-8 (John Wiley and Sons, 1971-1996). Типичные амино- защитные группы включают, но не ограничиваясь, формил, ацетил, трифторацетил, бензил, бензилоксикарбонил ("CBZ"), трет-бутоксикарбонил ("Boc"), триметилсилил ("TMS"), 2-триметилсилил-этансульфонил ("SES"), тритильные и замещенные тритильные группы, аллилоксикарбонил, 9-флуоренилметилоксикарбонил ("FMOC"), нитро-вератрилоксикарбонил ("NVOC") и подобные. Типичные гидрокси-защитные группы включают, но не ограничиваясь, такие, где гидрокси-группа или ацилирована, или алкилирована, например, бензил, и тритильные простые эфиры, а также алкильные простые эфиры, тетрагидропиранильные простые эфиры, триалкилсилильные простые эфиры и аллильные простые эфиры.
"Замещенный" относится к группе, в которой один или более атомы водорода являются независимо замещенными одним и тем же или другим заместителем(заместителями). Типичные заместители включают, но не ограничиваясь, алкилендиокси- (такие как метилендиокси-), М, -R60, -О-, =O, -OR60, -SR60, -S-, =S, -NR60R61,=NR60, -CF3, -CN, -OCN, -SCN, -NO, -NO2, =N2, -N3, -S(O)2O-, -S(O)2OH, -S(O)2R60, -OS(O)2O-, -OS(O)2R60, -P(O)(O-)2, -P(O)(OR60)(O-), -OP(O)(OR60)(OR61), -C(O)R60, -C(S)R60, -C(O)OR60, -C(O)NR60R61, -C(O)O-, -C(S)OR60, -NR62C(O)NR60R61, -NR62C(S)NR60R61, -NR62C(NR63)NR60R61 и -C(NR62)NR60R61, где M является галогеном; R60, R61, R62 и R63 независимо представляют собой водород, алкил, замещенный алкил, алкокси-, замещенный алкокси-, циклоалкил, замещенный циклоалкил, циклогетероалкил, замещенный циклогетероалкил, арил, замещенный арил, гетероарил или замещенный гетероарил, или необязательно R60 и R61 вместе с атомом азота, к которому они присоединены, образуют циклогетероалкильное или замещенное циклогетероалкильное кольцо.
"Терапия" или "лечение" любого состояния, такого как боль, означает в определенных вариантах осуществления улучшение состояния (т.е., купирование или снижение развития состояния). В определенных вариантах осуществления "терапия" или "лечение" относится к улучшению, по меньшей мере, одного физического параметра, который может не восприниматься пациентом. В определенных вариантах осуществления "терапия" или "лечение" относится к ингибированию состояния, либо физически (например, стабилизация заметного симптома), физиологически (например, стабилизация физического параметра), либо и тем, и другим образом. В определенных вариантах осуществления "терапия" или "лечение" относится к задерживанию появления состояния.
"Терапевтически эффективное количество" означает количество соединения, которое при введении пациенту для предотвращения или терапии состояния, такого как боль, является достаточным для эффекта такого лечения. "Терапевтически эффективное количество" будет варьировать в зависимости от соединения, состояния и его тяжести, возраста, веса и т.д. пациента.
Осуществление изобретения
Перед более подробным описанием данного изобретения следует понимать, что данное изобретение не ограничивается описанными конкретными вариантами осуществления, и, как таковое, может варьировать. Также следует понимать, что терминология, применяемая в данном документе, служит описанию только конкретных вариантов осуществления и не предназначена для ограничения, так как объем данного изобретения будет ограничен только формулой изобретения.
Следует отметить, что, как используется в описании и в приложенной формуле изобретения, единственные формы включают множественные, если контекст четко не диктует иное. Далее следует отметить, что формула изобретения может быть составлена, чтобы исключить любой необязательный элемент. В связи с этим, это изложение призвано служить предшествующей основой для применения такой исключительной терминологии, как "исключительно", "только" и подобное, в связи с перечислением заявленных элементов или применением "отрицательного" ограничения.
Следует понимать, что, как используется в данном документе, единственное число объекта подразумевает один или более таких объектов. Например, соединение означает одно или более соединения. По этой причине, выражения в единственном числе, "один или более" и "по меньшей мере, один" могут использоваться взаимозаменяемо. Подобным образом, выражения "содержащий", "включающий" и "имеющий" могут использоваться взаимозаменяемо.
Публикации, раскрытые в данном документе, представлены исключительно для раскрытия известного уровня техники до даты подачи данной заявки. Изложенное в данном документе не может быть истолковано как признание того, что данное изобретение не имеет права предшествовать таким публикациям путем преимущества предшествующего изобретения. Кроме того, даты представленной публикации могут отличаться от фактических дат публикации, которые могут потребовать независимого подтверждения.
Если не указано иное, все технические и научные выражения, применяемые в данном документе, имеют то же значение, что обычно понимается специалистом в данной области, к которой относится данное изобретение. Хотя любые способы и материалы, подобные или эквивалентные описанным в данном документе, также могут быть применены при осуществлении или тестировании данного изобретения, теперь описываются предпочтительные способы и материалы. Все публикации, упомянутые в данном- документе, включены в данный документ ссылкой на раскрытые и описанные способы и/или материалы, в связи с которыми публикации цитируются.
Если не указано иное, способы и техники данных вариантов осуществления обычно выполняются согласно общепринятым способам, хорошо известным в данном уровне техники, и как описано в различных общих и более специфических ссылках, которые цитируются и обсуждаются во всем данном описании. Смотри, например, Loudon, Organic Chemistry, Fourth Edition, New York: Oxford University Press, 2002, pp.360-361, 1084-1085; Smith and March, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, Fifth Edition, Wiley-Interscience, 2001.
Номенклатура, применяемая в данном документе для именования подлежащих соединений, проиллюстрирована в примерах в данном документе. Когда возможно, эту номенклатуру обычно получали с использованием коммерчески доступного программного обеспечения AutoNom (MDL, Сан Леандро, Калифорния).
В настоящее время установлено, что уменьшенное высвобождение фенольного опиоида может быть достигнуто введением ингибитора трипсина, полученного из сои, в комбинации с определенным пролекарством, описанным в WO 2007/140272.
Типичные варианты осуществления
Данное раскрытие представляет фармацевтические композиции и способы их применения, где фармацевтические композиции содержат пролекарство фенольного опиоида, которое обеспечивает ферментативно-регулируемое высвобождение фенольного опиоида, и ингибитор фермента, который взаимодействует с ферментом(ферментами), опосредующим ферментативно-регулируемое высвобождение фенольного опиоида из пролекарства так, чтобы уменьшить ферментативное расщепление пролекарства. Раскрытие представляет фармацевтические композиции, которые содержат ингибитор трипсина и пролекарство фенольного опиоида, содержащее трипсин-лабильный компонент, который, когда расщеплен, облегчает высвобождение фенольного опиоида. Примеры пролекарства фенольного опиоида и ингибиторов трипсина описаны ниже.
Фенольные опиоидные пролекарства
Согласно определенным вариантам осуществления представлено пролекарство фенольного опиоида, которое обеспечивает ферментативно-регулируемое высвобождение фенольного опиоида. Пролекарство фенольного опиоида является соответствующим соединением, в котором фенольный атом водорода замещен спейсерной уходящей группой, несущей азотный нуклеофил, который защищен ферментативно-расщепляемым компонентом, причем конфигурация спейсерной уходящей группы и азотного нуклеофила является такой, чтобы при ферментативном расщеплении расщепляемого компонента азотный нуклеофил был способен образовывать циклическую мочевину, освобождающую соединение от спейсерной уходящей группы так, чтобы обеспечить фенольный опиоид.
Ферментом, способным расщеплять ферментативно-расщепляемый компонент, может быть пептидаза - ферментативно-расщепляемый компонент является связанным с нуклеофильным азотом через амидную (например, пептид: -NHCO-) связь. В некоторых вариантах осуществления ферментом является пищеварительный фермент белка.
Формулы I-VI
Как показано в данном документе, формула I описывает соединения формулы II, в которой R1 является (1-4С)алкильной группой; R2 и R3 каждый независимо представляет собой атом водорода или (1-4С)алкильную группу; и R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
Формула III описывает соединения формулы II, в которой R1 является (1-4С)алкильной группой; R2 и R3 каждый независимо представляет атом водорода или (1-4С)алкильную группу; и R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
Формула IV описывает соединения формулы I, где "X" замещен структурно определенными фенольными опиоидами.
Как также показано в данном документе, формула IV описывает соединения формулы V, в которой R1 является (1-4С)алкильной группой; R2 и R3 каждый независимо представляет атом водорода или (1-4С)алкильную группу; и R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
Формула VI описывает соединения формулы V, в которой R1 является (1-4С)алкильной группой; R2 и R3 каждый независимо представляет собой атом водорода или (1-4С)алкильную группу; и R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
Для формул I-III Х представляет собой остаток фенольного опиоида, где атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5).
Как раскрыто выше, "опиоид" относится к химическому веществу, которое оказывает свое фармакологическое действие взаимодействием с опиоидными рецепторами. "Фенольный опиоид" относится к подгруппе опиоидов, которые содержат фенольную группу. Например, фенольные опиоиды включают, но не ограничиваясь, бупренорфин, дигидроэторфин, дипренорфин, эторфин, гидроморфон, леворфанол, морфин (и его метаболиты), налмефен, налоксон, N-метилналоксон, налтрексон, N-метилналтрексон, оксиморфон, орипавин, кетобемидон, дезоцин, пентазоцин, феназоцин, буторфанол, налбуфин, мептазинол, O-дезметилтрамадол, тапентадол, налорфин. Структуры вышеупомянутых фенольных опиоидов показаны ниже:
В определенных вариантах осуществления фенольный опиоид представляет собой оксиморфон, гидроморфон или морфин,
Формулы I-VI теперь описаны более детально ниже.
Формула I
Соединения формулы (I) соответствуют соединениям, раскрытым в WO 2007/140272, в которых нуклеофильный атом азота связан с остатком L-аргинина или L-лизина.
Примерами значений для фенольного опиоида, как представлено в X, являются оксиморфон, гидроморфон и морфин.
Примеры значений для R1 представляют собой метальные и этильные группы.
Примеры значений для каждого из R2 и R3 представляют собой атомы водорода.
Пример значения для n представляет собой 2.
В одном варианте осуществления R4 представляет -CH2CH2CH2NH(C=NH)NH2.
Аминокислота может быть встречающейся в природе аминокислотой. Будет учтено, что встречающиеся в природе аминокислоты обычно имеют L-конфигурацию.
В отношении R5, примерами конкретных значений являются:
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа;
для аминокислоты: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин или валин; и
для дипептида: комбинация любых двух аминокислот, выбранных независимо из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина.
Примерами конкретных значений для R5 являются:
атом водорода;
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа; и для остатка аминокислоты, дипептида или N-ацильного производного аминокислоты или дипептида: глицинил или N-ацетилглицинил.
В одном варианте осуществления R5 представляет N-ацетил, глицинил или N-ацетилглицинил, такой как N-ацетил.
Пример группы, представленной -C(O)-CH(R4)-NH(R5) представляет собой N-ацетиларгинил.
В конкретном варианте осуществления соединение формулы (I) представляет собой гидроморфон 3-(N-метил-N-(2-N'-ацетиларгиниламино))этилкарбамат или его фармацевтически приемлемую соль. Это соединение описано в примере 3 WO 2007/140272.
Формула II
Варианты осуществления представляют соединение общей формулы (II):
или его фармацевтически приемлемую соль, где:
Х представляет остаток фенольного опиоида, в котором атом водорода фенольной
гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе с углеродом, к которому они присоединены, образуют циклоалкильную и замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет целое число от 2 до 4;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
В формуле II примерами значений для фенольного опиоида, как представлено в X, являются оксиморфон, гидроморфон и морфин.
В формуле II R1 может быть выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила. В определенных случаях R1 является (1-6С)алкилом. В других случаях R1 является (1-4С)алкилом. В других случаях R1 представляет собой метил или этил. В других случаях R1 представляет собой метил. В некоторых случаях R1 является этилом.
В определенных случаях R1 является замещенным алкилом. В определенных случаях R1 является алкильной группой, замещенной карбоксилом или сложным эфиром карбоновой кислоты. В определенных случаях R1 представляет собой -(CH2)5-COOH, (СН2)5-СООСН3 или -(СН2)5-СООСН2СН3.
В определенных случаях в формуле II R1 представляет собой арилалкил или замещенный арилалкил. В определенных случаях в формуле II R1 представляет собой арилалкил. В определенных случаях R1 представляет собой замещенный арилалкил. В определенных случаях R1 представляет собой арилалкильную группу, замещенную карбоксилом или сложным эфиром карбоновой кислоты. В определенных случаях R1 представляет собой -(-(CH2)q(C6H4)-COOH, -(CH2)q(C6H4)-COOCH3 или -(CH2)q(C6H4) СООСН2СН3, где q является целым числом от одного до 10. В определенных случаях R1 представляет собой - СН2(С6Н4)-СООН, -СН2(С6Н4)-СООСН3 или -СН2(С6Н4) СООСН2СН3.
В определенных случаях в формуле II R1 является арилом. В определенных случаях R1 является замещенным арилом. В определенных случаях R1 представляет собой арильную группу, замещенную карбоксилом или сложным эфиром карбоновой кислоты. В определенных случаях R1 представляет собой -(С6Н4)-СООН, -(С6Н4)-СООСН3 или -(С6Н4)-СООСН2СН3.
В формуле II каждый R2 может быть независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила. В определенных случаях R2 представляет собой водород или алкил. В определенных случаях R2 представляет собой водород. В определенных случаях R2 представляет собой алкил. В определенных случаях R2 представляет собой ацил. В определенных случаях R2 представляет собой аминоацил.
В формуле II каждый R3 может быть независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила. В определенных случаях R3 представляет собой водород или алкил. В определенных случаях R3 представляет собой водород. В определенных случаях R3 представляет собой алкил. В определенных случаях R3 представляет собой ацил. В определенных случаях R3 представляет собой аминоацил.
В определенных случаях R2 и R3 являются водородом. В определенных случаях R2 и R3 на одном и том же углероде оба являются алкилом. В определенных случаях R2 и R3 на одном и том же углероде представляют собой метил. В определенных случаях R2 и R3 на одном и том же углероде представляют собой этил.
В формуле II R2 и R3 вместе с углеродом, к которому они присоединены, могут образовывать циклоалкильную или замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовывать циклоалкильную или замещенную циклоалкильную группу. В определенных случаях R2 и R3 вместе с углеродом, к которому они присоединены, могут образовывать циклоалкильную группу. Таким образом, в определенных случаях R2 и R3 на одном и том же углероде образуют спироцикл. В определенных случаях R2 и R3 вместе с углеродом, к которому они присоединены, могут образовывать замещенную циклоалкильную группу. В определенных случаях две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовывать циклоалкильную группу. В определенных случаях две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовывать замещенную циклоалкильную группу.
В определенных случаях один из R2 и R3 представляет собой аминоацил. В определенных случаях один из R и R3 представляет собой аминоацил, содержащий фенилендиамин. В определенных случаях один из R2 и R3 является где каждый R10 независимо выбран из водорода, алкила, замещенного алкила и ацила, и R11 представляет собой алкил или замещенный алкил. В определенных случаях, по меньшей мере, один из R10 представляет собой ацил. В определенных случаях, по меньшей мере, один из R10 представляет собой алкил или замещенный алкил. В определенных случаях, по меньшей мере, один из R10 представляет собой водород. В определенных случаях оба из R10 являются водородом.
В определенных случаях один из R2 и R3 является ; где R10 представляет собой водород, алкил, замещенный алкил или ацил. В определенных случаях R10 представляет собой ацил. В определенных случаях R10 представляет собой алкил или замещенный алкил. В определенных случаях R1 представляет собой водород.
В определенных случаях R2 или R3 могут модулировать скорость внутримолекулярной циклизации. R2 или R3 могут повышать скорость внутримолекулярной циклизации по сравнению с соответствующей молекулой, где R2 и R3 оба являются водородом. В определенных случаях R2 или R3 содержат электроноакцепторную группу или электронодонорную группу. В определенных случаях R2 или R3 содержат электроноакцепторную группу. В определенных случаях R или R содержат электронодонорную группу.
Атомы и группы, способные функционировать как электроноакцепторные заместители, хорошо известны в области органической химии. Они включают электроотрицательные атомы и группы, содержащие электроотрицательные атомы. Такие группы функционируют для понижения основности или состояния протонирования нуклеофильного азота в бета-положении через индуктивное оттягивание электронной плотности. Такие группы также могут быть расположены в других положениях вдоль алкиленовой цепи. Примеры включают атомы галогена (например, атом фтора), ацильные группы (например, алканоильная группа, ароильная группа, карбоксильная группа, алкоксикарбонильная группа, арилоксикарбонильная группа или аминокарбонильная группа (такая как, карбамоильная, алкиламинокарбонильная, диалкиламинокарбонильная или ариламинокарбонильная группа)), оксо- (=O) заместитель, нитрильную группу, нитрогруппу, группы простого эфира (например, алкокси-группа) и фенильные группы, несущие заместитель в орто-положении, пара-положении или и в орто-, и в пара-положениях, каждый заместитель независимо выбран из атома галогена, фторалкильной группы (такой как трифторметил), нитрогруппы, цианогруппы и карбоксильной группы. Каждый из электроноакцепторных заместителей независимо может быть независимо выбран из них.
В определенных случаях -[C(R2)(R3)]n- выбран из -CH(CH2F)CH(CH2F)-; -CH(CHF2)CH(CHF2)-; -CH(CF3)CH(CF3)-; -CH2CH(CF3)-; -CH2CH(CHF2)-; -CH2CH(CH2F)-; -CH2CH(F)CH2-; -CH2C(F2)CH2-; -CH2CH(C(O)NR20R21)-; -CH2CH(C(O)OR22)-; -CH2CH(C(O)OH)-; -CH(CH2F)CH2CH(CH2F)-; -CH(CHF2)CH2CH(CHF2)-; -CH(CF3)CH2CH(CF3)-; -CH2CH2CH(CF3)-; -CH2CH2CH(CHF2)-; -CH2CH2CH(CH2F)-; -CH2CH2CH(C(O) NR23R24)-; -CH2CH2CH(C(O)OR25)- и -CH2CH2CH(C(O)OH)-, в котором R20, R21, R22 и R23 каждый независимо представляет водород или (1-6С)алкил, и R24 и R25 каждый независимо представляет (1-6С)алкил, в котором R20, R21, R22 и R23 каждый независимо представляет водород или (1-6С)алкил, и R24 и R25 каждый независимо представляет (1-6С)алкил.
В формуле II n представляет целое число от 2 до 4. Пример значения для n представляет собой 2. Пример значения для n представляет собой 3. Пример значения для n представляет собой 4.
В формуле II в одном варианте осуществления R4 представляет -CH2CH2CH2NH(C=NH)NH2. В другом варианте осуществления R4 представляет -CH2CH2CH2CH2NH2.
Аминокислота может быть встречающейся в природе аминокислотой. Будет учтено, что встречающиеся в природе аминокислоты обычно имеют L-конфигурацию.
В формуле II относительно R5 примерами конкретных значений являются:
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа;
для аминокислоты: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин или валин; и
для дипептида: комбинация любых двух аминокислот, независимо выбранных из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина.
В формуле II примерами конкретных значений для R5 являются:
атом водорода;
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа; и
для остатка аминокислоты, дипептида или N-ацильного производного аминокислоты или дипептида: глицинил или N-ацетилглицинил.
В формуле II в одном варианте осуществления R5 представляет N-ацетил, глицинил или N-ацетилглицинил, например, N-ацетил.
В формуле II пример группы, представленной -С(O)-CH(R4)-NH(R5) представляет собой N-ацетиларгинил или N-ацетиллизинил.
В формуле II в определенных случаях R5 представляет замещенный ацил. В-определенных случаях R5 может быть малонилом или сукцинилом.
В формуле II в определенных случаях группа, представленная -C(O)-CH(R4)-NH(R5), представляет собой N-малониларгинил, N-малониллизинил, N-сукциниларгинил и N-сукциниллизинил.
Формула III
Варианты осуществления представляют соединение общей формулы (III):
или его фармацевтически приемлемую соль, где:
Х представляет остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 представляет (1-4С)алкильную группу;
R2 и R3 каждый независимо представляет атом водорода или (1-4С)алкильную группу;
n представляет 2 или 3;
R4 представляет CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
В формуле III примерами значений для фенольного опиоида, как представлено в X, являются оксиморфон, гидроморфон и морфин.
В формуле III примерами значений для R1 являются метальные и этильные группы.
В формуле III примерами значений для каждого из R2 и R3 являются атомы водорода.
В формуле III пример значения для n представляет собой 2.
В формуле III в одном варианте осуществления R4 представляет -CH2CH2CH2NH(C=NH)NH2. В другом варианте осуществления R4 представляет -CH2CH2CH2CH2NH2.
Аминокислота может быть встречающейся в природе аминокислотой. Будет учтено, что встречающиеся в природе аминокислоты обычно имеют L-конфигурацию.
В формуле III по отношению к R5 примерами конкретных значений являются:
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа;
для аминокислоты: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин или валин; и
для дипептида: комбинация любых двух аминокислот, независимо выбранных из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина.
В формуле III примерами конкретных значений для R5 являются:
атом водорода;
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа; и
для остатка аминокислоты, дипептида или N-ацильного производного аминокислоты или дипептида: глицинил или N-ацетилглицинил.
В формуле III в одном варианте осуществления R5 представляет N-ацетил, глицинил или N-ацетилглицинил, например, N-ацетил.
В формуле III пример группы, представленной -C(O)-CH(R4)-NH(R5), представляет собой N-ацетиларгинил или N-ацетиллизинил.
В формуле III в определенных случаях R5 представляет замещенный ацил. В определенных случаях R5 может быть малонилом или сукцинилом.
В формуле III в определенных случаях группа, представленная -C(O)-CH(R4)-NH(R5), представляет собой N-малониларгинил, N-малониллизинил, N-сукциниларгинил и N-сукциниллизинил.
Формула IV
Варианты осуществления представляют соединение общей формулы (IV):
или его фармацевтически приемлемую соль, где:
Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет (1-4С)алкильную группу;
R2 и R3 каждый независимо представляет атом водорода или (1-4С)алкильную группу;
n представляет 2 или 3;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, или остаток аминокислоты, дипептид, или N-ацильное производное аминокислоты или дипептида.
В формуле IV определенный пример Ra представляет собой водород. В формуле IV определенный пример Ra представляет собой гидроксил.
В формуле IV определенный пример Rb представляет собой оксо- (=O). В формуле IV определенный пример Rb представляет собой гидроксил;
В формуле IV определенный пример пунктирной линии представляет собой двойную связь. В формуле IV определенный пример пунктирной линии представляет собой одинарную связь.
В формуле IV примерами значений для R1 являются метальные и этильные группы.
В формуле IV примерами значений для каждого из R2 и R3 являются атомы водорода.
В формуле IV пример значения для n представляет собой 2.
В формуле IV в одном варианте осуществления R4 представляет -CH2CH2CH2NH(C=NH)NH2.
Аминокислота может быть встречающейся в природе аминокислотой. Будет учтено, что встречающиеся в природе аминокислоты обычно имеют L-конфигурацию.
В формуле IV по отношению к R5 примерами конкретных значений являются:
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа;
для аминокислоты: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин или валин; и
для дипептида: комбинация любых двух аминокислот, независимо выбранных из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина.
В формуле IV примерами конкретных значений для R5 являются:
атом водорода;
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа; и
для остатка аминокислоты, дипептида или N-ацильного производного аминокислоты или дипептида: глицинил или N-ацетилглицинил.
В формуле IV в одном варианте осуществления R5 представляет N-ацетил, глицинил или N-ацетилглицинил, например, N-ацетил.
В формуле IV пример группы, представленной -С(O)-CH(R4)-NH(R5), представляет собой N-ацетиларгинил.
Формула V
Варианты осуществления представляют соединение общей формулы (V):
или его фармацевтически приемлемую соль, в котором:
Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе с углеродом, к которому они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет целое число от 2 до 4;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
В формуле V определенный пример Ra представляет собой водород. В формуле IV определенный пример Ra представляет собой гидроксил.
В формуле V определенный пример Rb представляет собой оксо- (=O). В формуле V определенный пример Rb представляет собой гидроксил.
В формуле V определенный пример пунктирной линии представляет собой двойную связь. В формуле V определенный пример пунктирной линии представляет собой одинарную связь.
В формуле V R1 может быть выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила. В определенных случаях R1 представляет собой (1-6С)алкил. В других случаях R1 представляет собой (1-4С)алкил. В других случаях R1 представляет собой метил или этил. В других случаях R1 представляет собой метил. В некоторых случаях R1 представляет собой этил.
В определенных случаях R1 представляет собой замещенный алкил. В определенных случаях R1 представляет собой алкильную группу, замещенную карбоксилом или сложным эфиром карбоновой кислоты. В определенных случаях R1 представляет собой СН2)5-СООН, -(СН2)5-СООСН3 или -(СН2)5-СООСН2СН3.
В определенных случаях в формуле V R1 представляет собой арилалкил или замещенный арилалкил. В определенных, случаях в формуле V R1 представляет собой арилалкил. В определенных случаях R1 представляет собой замещенный арилалкил. В определенных случаях R1 представляет собой арилалкильную группу, замещенную карбоксилом или сложным эфиром карбоновой кислоты. В определенных случаях R1 представляет собой -(CH2)q(C6H4)-COOH, -(CH2)q(C6H4)-COOCH3 или -(СН2)q(С6Н4)-СООСН2СН3, где q представляет собой целое число от одного до 10. В определенных случаях R1 представляет собой -СН2(С6Н4)-СООН, -СН2(С6Н4)-СООСН3 или -СН2(С6Н4)-СООСН2СН3.
В определенных случаях в формуле V R1 представляет собой арил. В определенных случаях R1 представляет собой замещенный арил. В определенных случаях R1 представляет собой арильную группу, замещенную карбоксилом или сложным эфиром карбоновой кислоты. В определенных случаях R1 представляет собой -(С6Н4)-СООН, -(С6Н4)-СООСН3 или -(С6Н4)-СООСН2СН2.
В формуле V каждый R2 может быть независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила. В определенных случаях R2 представляет собой водород или алкил. В определенных случаях R2 представляет собой водород. В определенных случаях R1 представляет собой алкил. В определенных случаях R2 представляет собой ацил. В определенных случаях R2 представляет собой аминоацил.
В формуле V каждый R3 может быть независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила. В определенных случаях R3 представляет собой водород или алкил. В определенных случаях R3 представляет собой водород. В определенных случаях R3 представляет собой алкил. В определенных случаях R3 представляет собой ацил. В определенных случаях R3 представляет собой аминоацил.
В определенных случаях R2 и R3 являются водородом. В определенных случаях R2 и R3 на одном и том же углероде оба являются алкилом. В определенных случаях R2 и R3 на одном и том же углероде представляют собой метил. В определенных случаях R2 и R3 на одном и том же углероде представляют собой этил.
В формуле V R2 и R3 вместе с углеродом, к которому они присоединены, могут образовывать циклоалкильную и замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовывать циклоалкильную или замещенную циклоалкильную группу. В определенных случаях R2 и R3 вместе с углеродом, к которому они присоединены, могут образовывать циклоалкильную группу. Таким образом, в определенных случаях R2 и R3 на одном и том же углероде образуют спироцикл. В определенных случаях R2 и R3 вместе с углеродом, к которому они присоединены, могут образовывать замещенную циклоалкильную группу. В определенных случаях две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовывать циклоалкильную группу. В определенных случаях две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, могут образовывать замещенную циклоалкильную группу.
В определенных случаях один из R2 и R3 представляет собой аминоацил. В определенных случаях один из R2 и R3 представляет собой аминоацил, содержащий фенилендиамин. В определенных случаях один из R2 и R3 представляет собой где каждый R10 независимо выбран из водорода, алкила, замещенного алкила и ацила, и R11 представляет собой алкил или замещенный алкил. В определенных случаях, по меньшей мере, один из R10 представляет собой ацил. В определенных случаях, по меньшей мере, один из R10 представляет собой алкил или замещенный алкил. В определенных случаях, по меньшей мере, один из R10 представляет собой водород. В определенных случаях оба R10 являются водородом.
В определенных случаях один из R2 и R3 представляет собой ; где R10 представляет собой водород, алкил, замещенный алкил или ацил. В определенных случаях R10 представляет собой ацил. В определенных случаях R10 представляет собой алкил или замещенный алкил. В определенных случаях R10 представляет собой водород. В определенных случаях R2 или R3 могут модулировать скорость внутримолекулярной циклизации. R2 или R3 могут повышать скорость внутримолекулярной циклизации по сравнению с соответствующей молекулой, где R2 и R3 оба являются водородом. В определенных случаях R2 или R3 содержат электроноакцепторную группу или электронодонорную группу. В определенных случаях R2 или R3 содержат электроноакцепторную группу. В определенных случаях R2 или R3 содержат электронодонорную группу.
Атомы и группы, способные функционировать как электроноакцепторные заместители, хорошо известны в области органической химии. Они включают электроотрицательные атомы и группы, содержащие электроотрицательные атомы. Такие группы функционируют для понижения основности или состояния протонирования нуклеофильного азота в бета-положении через индуктивное оттягивание электронной плотности. Такие группы также могут быть расположены в других положениях вдоль алкиленовой цепи. Примеры включают атомы галогена (например, атом фтора), ацильные группы (например, алканоильная группа, ароильная группа, карбоксильная группа, алкоксикарбонильная группа, арилоксикарбонильная группа или аминокарбонильная группа (такая как карбамоильная, алкиламинокарбонильная, диалкиламинокарбонильная или ариламинокарбонильная группа)), оксо- (=O) заместитель, нитрильную группу, нитрогруппу, группы простого эфира (например, алкокси-группа) и фенильные группы, несущие заместитель в орто-положении, пара-положении или и в орто-, и в пара-положениях, каждый заместитель является независимо выбранным из атома галогена, фторалкильной группы (такой как трифторметил), нитрогруппы, цианогруппы и карбоксильной группы. Каждый из электроноакцепторных заместителей может быть независимо выбран из них.
В определенных случаях C(R2)(R3)]n- выбран из -CH(CH2F)CH(CH2F)-; -CH(CHF2)CH(CHF2)-; -CH(CF3)CH(CF3)-; -CH2CH(CF3)-; -CH2CH(CHF2)-; -CH2CH(CH2F)-; -CH2CH(F)CH2-; -CH2C(F2)CH2-; -CH2CH(C(O)NR20R21)-; -CH2CH(C(O)OR22)-; -CH2CH(C(O)OH)-; -CH(CH2F)CH2CH(CH2F)-; -CH(CHF2)CH2CH(CHF2)-; -CH(CF3)CH2CH(CF3)-; -CH2CH2CH(CF3)-; -CH2CH2CH(CHF2)-; -CH2CH2CH(CH2F)-; -CH2CH2CH(C(O) NR23R24)-; -CH2CH2CH(C(O)OR25)- и -CH2CH2CH(C(O)OH)-, в котором R20, R21, R22 и R23 каждый независимо представляет водород или (1-6С)алкил, и R24 и R25 каждый независимо представляет (1-6С)алкил.
В формуле V n представляет целое число от 2 до 4. Пример значения для n представляет собой 2. Пример значения для n представляет собой 3. Пример значения для n представляет собой 4.
В формуле V в одном варианте осуществления R4 представляет -CH2CH2CH2NH(C=NH)NH2. В другом варианте осуществления R4 представляет -CH2CH2CH2CH2NH2.
Аминокислота может быть встречающейся в природе аминокислотой. Будет учтено, что встречающиеся в природе аминокислоты обычно имеют L-конфигурацию.
В формуле V по отношению к R5 примерами конкретных значений являются:
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа;
для аминокислоты: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин или валин; и
для дипептида: комбинация любых двух аминокислот, независимо выбранных из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина.
В формуле V примерами конкретных значений для R5 являются:
атом водорода;
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа; и
для остатка аминокислоты, дипептида или N-ацильного производного аминокислоты или дипептида: глицинил или N-ацетилглицинил.
В формуле V в одном варианте осуществления R5 представляет N-ацетил, глицинил или N-ацетилглицинил, например, N-ацетил.
В формуле V пример группы, представленной -C(O)-CH(R4)-NH(R5), представляет собой N-ацетиларгинил или N-ацетиллизинил.
В формуле V в определенных случаях R5 представляет замещенный ацил. В определенных случаях R5 может быть малонилом или сукцинилом.
В формуле V в определенных случаях группа, представленная -C(O)-CH(R4)-NH(R5), представляет собой N-малониларгинил, N-малониллизинил, N-сукциниларгинил и N-сукциниллизинил.
Формула VI
Варианты осуществления представляют соединение общей формулы (VI):
или его фармацевтически приемлемую соль, где:
Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет (1-4С)алкильную группу;
R2 и R3 каждый независимо представляет атом водорода или (1-4С)алкильную группу;
n представляет 2 или 3;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминоки слоты; и
R5 представляет атом водорода, N-ацильную группу (включая N-замещенный ацил), остаток аминокислоты, дипептид, N-ацильное производное (включая N-замещенное ацильное производное) аминокислоты или дипептида.
В формуле VI определенный пример Ra представляет собой водород. В формуле VI определенный пример Ra представляет собой гидроксил.
В формуле VI определенный пример Rb представляет собой оксо- (=O). В формуле VI определенный пример Rb представляет собой гидроксил.
В формуле VI определенный пример пунктирной линии представляет собой двойную связь. В формуле VI определенный пример пунктирной линии представляет собой одинарную связь.
В формуле VI примеры значений для R1 представляют собой метальные и этильные группы.
В формуле VI примерами значений для каждого из R2 и R3 являются атомы водорода.
В формуле VI пример значения для n представляет собой 2.
В формуле VI в одном варианте осуществления R4 представляет -CH2CH2CH2NH(C=NH)NH2. В другом варианте осуществления R4 представляет -CH2CH2CH2CH2NH2.
Аминокислота может быть встречающейся в природе аминокислотой. Будет учтено, что встречающиеся в природе аминокислоты обычно имеют L-конфигурацию.
В формуле VI по отношению к R5 примерами конкретных значений являются:
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа;
для аминокислоты: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин или валин; и
для дипептида: комбинация любых двух аминокислот, независимо выбранных из аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, пролина, серина, треонина, триптофана, тирозина и валина.
В формуле VI примерами конкретных значений для R5 являются:
атом водорода;
для N-ацильной группы: N-(1-4С)алканоильная группа, такая как ацетил, N-ароильная группа, такая как N-бензоил, или N-пиперонильная группа; и
для остатка аминокислоты, дипептида или N-ацильного производного аминокислоты или дипептида: глицинил или N-ацетилглицинил.
В формуле VI в одном варианте осуществления R5 представляет N-ацетил, глицинил или N-ацетилглицинил, например, N-ацетил.
В формуле VI пример группы, представленной -C(O)-CH(R4)-NH(R5), представляет собой N-ацетиларгинил или N-ацетиллизинил.
В формуле VI в определенных случаях R5 представляет замещенный ацил. В определенных случаях R5 может быть малонилом или сукцинилом.
В формуле VI в определенных случаях группа, представленная -C(O)-CH(R4)-NH(R5), представляет собой N-малониларгинил, N-малониллизинил, N-сукциниларгинил и N-сукциниллизинил.
Общие процедуры синтеза
Соединения формулы I являются конкретными пролекарствами, описанными в WO 2007/140272, и там описан синтез соединений формулы I.
Схемы синтеза и методика в WO 2007/140272 также могут быть применены для синтеза соединений формул I-VI. Соединения, описанные в данном документе, могут быть получены путями, в общем показанными в схеме 1.
Прокомпоненты, описанные в данном документе, могут быть получены и присоединены к лекарственным средствам, содержащим фенолы, с помощью процедур, известных специалистам в данной области (смотри, например, Green et al., "Protective Groups in Organic Chemistry," (Wiley, 2nd ed. 1991); Harrison et al., "Compendium of Synthetic Organic Methods," Vols. 1-8 (John Wiley and Sons, 1971-1996); "Beilstein Handbook of Organic Chemistry," Beilstein Institute of Organic Chemistry, Frankfurt, Germany; Feiser et al., "Reagents for Organic Synthesis," Volumes 1-17, (Wiley Interscience); Trost et al., "Comprehensive Organic Synthesis," (Pergamon Press, 1991); "Theilheimer's Synthetic Methods of Organic Chemistry," Volumes 1-45, (Karger, 1991); March, "Advanced Organic Chemistry," (Wiley Interscience), 1991; Larock "Comprehensive Organic Transformations," (VCH Publishers, 1989); Paquette, "Encyclopedia of Reagents for Organic Synthesis," (John Wiley & Sons, 1995), Bodanzsky, "Principles of Peptide Synthesis," (Springer Verlag, 1984); Bodanzsky, "Practice of Peptide Synthesis," (Springer Verlag, 1984). Кроме того, исходные материалы могут быть получены из коммерческих источников или хорошо известными процедурами синтеза, supra.
По отношению к схеме 1 и формуле I, supra, где в иллюстративных целях Т представляет собой NH, Y представляет собой NR1, W представляет собой NH, p представляет собой один, R1, R4 и R5 являются такими, как определено ранее, Х представляет собой фенольный опиоид, Р представляет собой защитную группу, и М представляет собой уходящую группу, соединение 1-1 может быть ацилировано с соответствующей карбоновой кислотой или эквивалентом карбоновой кислоты для обеспечения соединения 1-2, с которого затем может быть снята защита для получения соединения 1-3. Соединение 1-3 затем реагирует с активированным эквивалентом угольной кислоты 1-4 для обеспечения соединения 1-5.
Для соединений формулы II-VI -(С(R2)(R3))n- соответствует части -(CH2-CH2)- между Y и Т. Таким образом, для синтеза соединений формул II-VI соединение 1-1 будет иметь соответствующие структурные единицы для -(С(R2)(R3))n-, чтобы привести к синтезу соединений формул II-VI.
Ингибиторы трипсина
Как используется в данном документе, выражение "ингибитор трипсина" относится к любому средству, способному к ингибированию действия трипсина на субстрат. Способность средства ингибировать трипсин может быть измерена с помощью анализов, хорошо известных в данном уровне техники. Например, в типичном анализе одна единица соответствует количеству ингибитора, которое снижает активность трипсина на одну единицу этилового сложного эфира бензоил-L-аргинина (BAEE-U). Одна BAEE-U представляет собой количество фермента, которое увеличивает поглощение при 253 нм на 0,001 в минуту при pH 7,6 и 25°С. Смотри, например, K.Ozawa, M.Laskowski, 1966, J. Biol. Chem. 241, 3955 и Y. Birk, 1976, Meth. Enzymol. 45, 700.
Существует много ингибиторов трипсина, известных в данном уровне техники как специфичных к трипсину, так и таких, которые ингибируют трипсин и другие протеазы, например, химотрипсин. Ингибиторы трипсина могут быть получены из разнообразных животных или растительных источников, например, соя, кукуруза, фасоль лимская и другие бобы, тыква, подсолнечник, поджелудочных желез и легкого коровы и других животных, белка куриных и индюшиных яиц, детской смеси на основе сои и крови млекопитающих. Ингибиторы трипсина также могут быть микробного происхождения, например, антипаин; смотри, например, Н. Umezawa, 1976, Meth. Enzymol. 45, 678. Ингибитор трипсина также может быть имитатором аргинина или лизина или другим синтетическим соединением, например, арилгуанидин, бензамидин, 3,4-дихлоризокумарин, диизопропилфторфосфат, габексат мезилат или фенилметансульфонилфторид. Как используется в данном документе, имитатор аргинина или лизина является соединением, которое способно связываться с Р1 "карманом" трипсина и/или мешать функционированию активного центра трипсина.
В одном варианте осуществления ингибитор трипсина получен из сои. Ингибиторы трипсина, полученные из сои (Glycine max), легкодоступны и считаются безопасными для потребления человеком. Они включают, но не ограничиваясь, SBTI, который ингибирует трипсин, и ингибитор Баумана-Бирка, который ингибирует трипсин и химотрипсин. Такие ингибиторы трипсина доступны, например, от Sigma-Aldrich, Сент-Луис, Миссури, США.
Будет учтено, что фармацевтические композиции согласно вариантам осуществления могут, кроме того, включать один или более ингибитор трипсина.
Малые молекулы-ингибиторы трипсина
Как указано выше, ингибитор трипсина может быть имитатором аргинина или лизина или другим синтетическим соединением. В определенных вариантах осуществления ингибитор трипсина представляет собой имитатор аргинина или имитатор лизина, где имитатором аргинина или имитатором лизина является синтетическое соединение.
Определенные ингибиторы трипсина включают соединения формулы:
где:
Q1 выбран из -O-Q4 или -Q4-СООН, где Q4 представляет собой C1-C4алкил;
Q2 представляет собой N или СН; и
Q3 представляет собой арил или замещенный арил.
Определенные ингибиторы трипсина включают соединения формулы:
где:
Q5 представляет собой -С(O)-СООН или -NH-Q6-Q7-SO2-C6H5, где
Q6 представляет собой -(CH2)p-СООН;
Q7 представляет собой -(CH2)r-C6H5; и
p представляет собой целое число от одного до трех; и
r представляет собой целое число от одного до трех.
Определенные ингибиторы трипсина включают следующие:
| Соединение 101 | (S)-этил-4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пипераз ин-1-карбоксилат | |
| Соединение 102 | (S)-этил-4-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперазин-1-карбоксилат |
| Соединение 103 | (S)-этил-1-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пипери дин-4-карбоксилат | |
| Соединение 104 | (S)-этил-1-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонами д)пентаноил)пиперидин-4-карбоксилат | |
| Соединение 105 | (S)-6-(4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пипераз ин-1-ил)-6-оксогексановая кислота | |
| Соединение 106 | 4-аминобензимидамид | |
| Соединение 107 | 3-(4-карбамимидоил фенил)-2-оксопропановая кислота | |
| Соединение 108 | (S)-5-(4-карбамимидоилбензиламино)-5- оксо-4-((R)-4-фенил-2-(фенилметилсульфонамид)бутан амид)пентановая кислота |
|
| Соединение 109 | 6-карбамимидоилнафталин-2-ил-4-(диаминометиленамино)бензоат | |
| Соединение 110 | 4,4'-(пентан-1,5-диилбис(окси))дибензимидамид |
В определенных вариантах осуществления ингибитором трипсина является SBTI, BBSI, соединение 101, соединение 106, соединение 108, соединение 109 или соединение 110.
Фармацевтические композиции
Как обсуждалось выше, данное раскрытие представляет фармацевтические композиции, которые содержат ингибитор трипсина и пролекарство фенольного опиоида, которое содержит трипсин-лабильный компонент, облегчающий, при расщеплении, высвобождение фенольного опиоида. Примеры композиций, содержащих пролекарство фенольного опиоида и ингибиторы трипсина, описаны ниже.
Комбинации формул I-VI и ингибитора трипсина
Варианты осуществления представляют фармацевтическую композицию, которая содержит ингибитор трипсина и соединение общей формулы (I) или его фармацевтически приемлемую соль.
Варианты осуществления представляют фармацевтическую композицию, которая содержит ингибитор трипсина и соединение общей формулы (II)-(VI) или его фармацевтически приемлемую соль.
Определенные варианты осуществления обеспечивают комбинацию соединения формулы I и ингибитора трипсина, в которой фенольный опиоид формулы I и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Оксиморфон | SBTI |
| Оксиморфон | BBSI |
| Оксиморфон | Соединение 101 |
| Оксиморфон | Соединение 106 |
| Оксиморфон | Соединение 108 |
| Оксиморфон | Соединение 109 |
| Оксиморфон | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы I и ингибитора трипсина, в которой фенольный опиоид формулы I и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Гидроморфон | SBTI |
| Гидроморфон | BBSI |
| Гидроморфон | Соединение 101 |
| Гидроморфон | Соединение 106 |
| Гидроморфон | Соединение 108 |
| Гидроморфон | Соединение 109 |
| Гидроморфон | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы I и ингибитора трипсина, в которой фенольный опиоид формулы I и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Морфин | SBTI |
| Морфин | BBSI |
| Морфин | Соединение 101 |
| Морфин | Соединение 106 |
| Морфин | Соединение 108 |
| Морфин | Соединение 109 |
| Морфин | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы I и ингибитора трипсина, в которой фенольный опиоид формулы I и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Тапентадол | SBTI |
| Тапентадол | BBSI |
| Тапентадол | Соединение 101 |
| Тапентадол | Соединение 106 |
| Тапентадол | Соединение 108 |
| Тапентадол | Соединение 109 |
| Тапентадол | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы II и ингибитора трипсина, в которой фенольный опиоид формулы II и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Оксиморфон | SBTI |
| Оксиморфон | BBSI |
| Оксиморфон | Соединение 101 |
| Оксиморфон | Соединение 106 |
| Оксиморфон | Соединение 108 |
| Оксиморфон | Соединение 109 |
| Оксиморфон | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы II и ингибитора трипсина, в которой фенольный опиоид формулы II и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Гидроморфон | SBTI |
| Гидроморфон | BBSI |
| Гидроморфон | Соединение 101 |
| Гидроморфон | Соединение 106 |
| Гидроморфон | Соединение 108 |
| Гидроморфон | Соединение 109 |
| Гидроморфон | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы II и ингибитора трипсина, в которой фенольный опиоид формулы II и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Морфин | SBTI |
| Морфин | BBSI |
| Морфин | Соединение 101 |
| Морфин | Соединение 106 |
| Морфин | Соединение 108 |
| Морфин | Соединение 109 |
| Морфин | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы II и ингибитора трипсина, в которой фенольный опиоид формулы II и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Тапентадол | SBTI |
| Тапентадол | BBSI |
| Тапентадол | Соединение 101 |
| Тапентадол | Соединение 106 |
| Тапентадол | Соединение 108 |
| Тапентадол | Соединение 109 |
| Тапентадол | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы III и ингибитора трипсина, в которой фенольный опиоид формулы III и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Оксиморфон | SBTI |
| Оксиморфон | BBSI |
| Оксиморфон | Соединение 101 |
| Оксиморфон | Соединение 106 |
| Оксиморфон | Соединение 108 |
| Оксиморфон | Соединение 109 |
| Оксиморфон | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы III и ингибитора трипсина, в которой фенольный опиоид формулы III и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Гидроморфон | SBTI |
| Гидроморфон | BBSI |
| Гидроморфон | Соединение 101 |
| Гидроморфон | Соединение 106 |
| Фенольный опиоид | Ингибитор трипсина |
| Гидроморфон | Соединение 108 |
| Гидроморфон | Соединение 109 |
| Гидроморфон | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы III и ингибитора трипсина, в которой фенольный опиоид формулы III и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Морфин | SBTI |
| Морфин | BBSI |
| Морфин | Соединение 101 |
| Морфин | Соединение 106 |
| Морфин | Соединение 108 |
| Морфин | Соединение 109 |
| Морфин | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию соединения формулы III и ингибитора трипсина, в которой фенольный опиоид формулы III и ингибитор трипсина показаны в следующей таблице.
| Фенольный опиоид | Ингибитор трипсина |
| Тапентадол | SBTI |
| Тапентадол | BBSI |
| Тапентадол | Соединение 101 |
| Тапентадол | Соединение 106 |
| Тапентадол | Соединение 108 |
| Тапентадол | Соединение 109 |
| Тапентадол | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию Соединения 1 и ингибитора трипсина, в которой ингибитор трипсина показан в следующей таблице.
| Соединение | Ингибитор трипсина |
| Соединение 1 | SBTI |
| Соединение 1 | BBSI |
| Соединение 1 | Соединение 101 |
| Соединение 1 | Соединение 106 |
| Соединение 1 | Соединение 108 |
| Соединение 1 | Соединение 109 |
| Соединение 1 | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию Соединения 2 и ингибитора трипсина, в которой ингибитор трипсина показан в следующей таблице.
| Соединение | Ингибитор трипсина |
| Соединение 2 | SBTI |
| Соединение | Ингибитор трипсина |
| Соединение 2 | BBSI |
| Соединение 2 | Соединение 101 |
| Соединение 2 | Соединение 106 |
| Соединение 2 | Соединение 108 |
| Соединение 2 | Соединение 109 |
| Соединение 2 | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию Соединения 3 и ингибитора трипсина, в которой ингибитор трипсина показан в следующей таблице.
| Соединение | Ингибитор трипсина |
| Соединение 3 | SBTI |
| Соединение 3 | BBSI |
| Соединение 3 | Соединение 101 |
| Соединение 3 | Соединение 106 |
| Соединение 3 | Соединение 108 |
| Соединение 3 | Соединение 109 |
| Соединение 3 | Соединение 110 |
Определенные варианты осуществления обеспечивают комбинацию Соединения 4 и ингибитора трипсина, в которой ингибитор трипсина показан в следующей таблице.
| Соединение | Ингибитор трипсина |
| Соединение 4 | SBTI |
| Соединение 4 | BBSI |
| Соединение 4 | Соединение 101 |
| Соединение 4 | Соединение 106 |
| Соединение 4 | Соединение 108 |
| Соединение 4 | Соединение 109 |
| Соединение 4 | Соединение 110 |
Следует отметить, что данное изобретение также включает ингибиторы других ферментов, вовлеченных в ассимиляцию белка, которые могут быть использованы в комбинации с пролекарством, имеющим формулу любую из I-VI, содержащим аминокислоту аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин или валин.
Фармацевтическая композиция согласно вариантам осуществления может дополнительно содержать фармацевтически приемлемый носитель. Композиция является удобно составленной в форму, подходящую для перорального (включая буккальное и подъязычное) введения, например, как таблетка, капсула, тонкая пленка, порошок, суспензия, раствор, сироп, дисперсия или эмульсия. Композиция может содержать компоненты, общепринятые в фармацевтических препаратах, например, один или более носителей, связующих веществ, смазочных средств, наполнителей (например, для обеспечения характеристик контролированного высвобождения), модификаторов pH, подсластителей, объемообразующих средств, красящих веществ или других активных средств.
Фармацевтическая композиция согласно вариантам осуществления применима, например, в лечении пациента, страдающего от или с риском страдания от боли.
Пациентом может быть человек или нечеловекообразное животное, например, животное-компаньон, такое как кошка, собака или лошадь.
Способы введения
Количество соединения формул (I)-(VI), подлежащего введению пациенту, чтобы быть эффективным (т.е. для обеспечения уровней фенольного опиоида в крови, достаточных для эффективного лечения или профилактики боли), будет зависеть от биодоступности конкретного соединения, чувствительности конкретного соединения к ферментной активации в кишке, количества и активности ингибитора трипсина, присутствующего в композиции, а также других факторов, таких как вид, возраст, вес, пол и состояние пациента, путь введения и назначение, прописанное доктором. В основном доза может находиться в диапазоне от 0,01 до 20 миллиграмм на килограмм (мг/кг) веса тела. Например, соединение, содержащее остаток гидроморфона, может быть введено при дозе, эквивалентной введению свободного гидроморфона в диапазоне от 0,02 до 0,5 мг/кг веса тела или от 0,01 до 10 мг/кг веса тела или от 0,01 до 2 мг/кг веса тела. В одном варианте осуществления соединение может быть введено в дозе так, чтобы уровень фенольного опиоида, достигаемый в крови, находился в диапазоне от 0,5 нг/мл до 10 нг/мл.
Количество ингибитора трипсина, подлежащего введению пациенту, чтобы быть эффективным (т.е. для уменьшенного высвобождения фенольного опиоида, когда введение соединения формул (I)-(VI) отдельно приведет к передозировке фенольного опиоида), будет зависеть от эффективной дозы конкретного соединения и активности конкретного ингибитора, а также других факторов, таких как вид, возраст, вес, пол и состояние пациента, путь введения и назначение, прописанное доктором. В основном, доза ингибитора может быть в диапазоне от 0,05 до 50 мг на мг соединения формул (I)-(VI). В определенном варианте осуществления доза ингибитора может быть в диапазоне от 0,001 до 50 мг на мг соединения формул (I)-(VI).
Терапевтические применения
В другом аспекте варианты осуществления представляют фармацевтическую композицию, как описано в данном документе выше, для применения в лечении боли.
Данное раскрытие представляет применение пролекарства фенольного опиоида и ингибитора трипсина в лечении боли.
Данное раскрытие представляет применение пролекарства фенольного опиоида и ингибитора трипсина в изготовлении лекарственного препарата для лечения боли.
В другом аспекте варианты осуществления представляют способ лечения боли у пациента, нуждающегося в таком лечении, который включает введение эффектного количества фармацевтической композиции, как описано в данном документе выше.
Препятствование опосредованному трипсином высвобождению фенольного опиоида из пролекарства
Раскрытие представляет композицию, содержащую соединение формул I-VI и ингибитор трипсина, что снижает потенциальное злоупотребление лекарственным средством. Ингибитор трипсина может препятствовать возможности потребителя применять трипсин для влияния на высвобождение фенольного опиоида из пролекарства фенольного опиоида in vitro. Например, если злоупотребляющее лицо пытается выдерживать трипсин с композицией вариантов осуществления, которая включает пролекарство фенольного опиоида и ингибитор трипсина, ингибитор трипсина может снизить действие добавленного трипсина, тем самым, препятствуя попыткам высвобождения фенольного опиоида для целей злоупотребления.
Примеры
Следующие примеры приведены для того, чтобы представить специалистам в данной области полное раскрытие и описание осуществления и применения вариантов осуществления, и не предназначены для ограничения объема того, что изобретатели считают собственным изобретением, не предназначены для представления, что эксперименты ниже являются всеми возможными или единственными выполненными экспериментами. Предприняты усилия, чтобы обеспечить точность по отношению к примененным числам (например, количества, температура и т.д.), но должны быть учтены некоторые экспериментальные ошибки и отклонения. Если не указано иное, части являются весовыми частями, молекулярный вес является средневесовым молекулярным весом, температура измеряется в градусах Цельсия, а давление соответствует или приближено к атмосферному. Могут применяться стандартные аббревиатуры.
Пример 1. Пероральное введение соединения 1 и SBTI ингибитора трипсина крысам
Гидроморфон 3-(N-метил-N-(2-N'-ацетиларгиниламино))этилкарбамат (который может быть получен, как описано в международной публикации РСТ № WO 2007/140272, опубликованной 6 декабря 2007 г., пример 3, в дальнейшем упоминается как соединение 1) и SBTI (ингибитор трипсина из Glycine max (соя) (№по каталогу 93620, -10000 единиц на мг, Sigma-Aldrich)) каждый растворили в солевом растворе.
Солевые растворы соединения 1 и SBTI дозировали как показано в таблице 1 путем перорального принудительного приема самцам крыс Спраг-Доули с канюлированием яремной вены, которых не кормили в течение 16-18 часов (ч) перед пероральным дозированием; дозу получали 4 крысы на группу. При дозировании SBTI его вводили за 5 минут (мин) до соединения 1. В определенных точках времени отбирали образцы крови, резко охлаждали в метаноле, центрифугировали при 14000 об/мин при 4°С и хранили при -80°С до анализа высокоэффективной жидкостной хроматографией/масс-спектрометрией (HPLC/MS).
Таблица 1 показывает результаты для крыс, которым вводили постоянное количество соединения 1 и изменяемые количества SBTI. Результаты представлены как максимальная концентрация гидроморфона в крови (среднее+, стандартное отклонение) для каждой группы из 4 крыс.
| Таблица 1 | ||
| Максимальная концентрация (Смакс) гидроморфона в крови крыс | ||
| Соединение 1 (мг/кг) | SBTI (мг/кг) | Смакс (нг/мл НМ) |
| 20 | 0 | 16,5+5,3 |
| 20 | 10 | 8,9+1,8 |
| 20 | 100 | 6,0+4,0 |
| 20 | 500 | <5 |
| 20 | 1000 | <5 |
Нижний предел количественного определения составлял 1 нанограмм на миллилитр (нг/мл) для первой группы и 5 нг/мл для других групп.
Результаты в таблице 1 показывают, что SBTI ослабляет способность соединения 1 высвобождать гидроморфон в зависимости от дозы, что может приводить к приблизительно 100% ослаблению при более высоких концентрациях SBTI.
Данные, полученные от крыс, представленные в таблице 1, также представлены на фигуре 1, которая сравнивает средние концентрации в крови (± стандартные отклонения) гидроморфона с течением времени после перорального введения крысам 20 мг/кг соединения 1 (а) отдельно (сплошная линия с закрашенными круглыми символами), (b) с 10 мг/кг SBTI (пунктирная линия с незакрашенными квадратными символами), (с) с 100 мг/кг SBTI (пунктирная линия с незакрашенными треугольными символами), (d) с 500 мг/кг SBTI (сплошная линия с Х-образными символами) или (е) с 1000 мг/кг SBTI (сплошная линия с закрашенными квадратными символами). Результаты на фигуре 1 показывают, что ослабление SBTI способности Соединения 1 высвобождать гидроморфон понижает Смакс и задерживает Tмакс такого высвобождения гидроморфона в крови крыс, которым ввели соединение 1 и 10, 100, 500 или 1000 мг/кг SBTI.
Пример 2. Пероральное введение крысам соединения 1 и SBTI ингибитора трипсина в присутствии овальбумина
В попытке понять роль SBTI применили овальбумин как контрольный белок, не ингибирующий трипсин. Альбумин из белка куриных яиц (овальбумин) (№ по каталогу А7641, сорт VII, лиофилизированный порошок, Sigma-Aldrich) растворили в солевом растворе.
Солевые растворы соединения 1, и SBTI (как описано в примере 1), и овальбумина объединили и дозировали, как показано в таблице 2, путем перорального принудительного приема самцам крыс Спраг-Доули с канюлированием яремной вены (4 на группу), которых не кормили в течение 16-18 часов до перорального дозирования. В определенные точки времени отбирали образцы крови, плазму собрали центрифугированием при 5400 об/мин при 4°С в течение 5 минут и 100 микролитров (мкл) плазмы перенесли из каждого образца в свежую пробирку, содержащую 1 мкл муравьиной кислоты. Пробирки перемешивали на вортекс-мешалке в течение 5-10 секунд, немедленно помещали на сухой лед, а затем хранили до анализа с помощью HPLC/MS.
Таблица 2 показывает результаты для крыс, которым ввели соединение 1 с или без различных количеств овальбумина (OVA) и/или SBTI, как указано. Результаты представлены как максимальная концентрация гидроморфона в плазме (среднее ± стандартное отклонение) для каждой группы из 4 крыс.
| Таблица 2 | |||
| Максимальная концентрация (Смакс) гидроморфона в плазме крыс | |||
| Соединение 1 (мг/кг) | OVA (мг/кг) | SBTI (мг/кг) | Смакс (нг/мл НМ) |
| 20 | 0 | 0 | 13,3±3,7 |
| 20 | 20 | 0 | 11,0±5,4 |
| 20 | 100 | 0 | 9,7±3,1 |
| 20 | 500 | 0 | 11,6±2,5 |
| 20. | 1000 | 0 | 10,3±3,5 |
| 20 | 500 | 500 | 1,9±0,9 |
Нижний предел количественного определения составлял 12,5 пикограмм/мл (пг/мл) для первой группы, 25 пг/мл для последней группы и 100 пг/мл для других групп.
Результаты в таблице 2 показывают, что овальбумин не оказывает существенного влияния на способность соединения 1 высвобождать гидроморфон или способность SBTI замедлять такое высвобождение.
Данные, полученные от крыс, представленные в строках 1, 4 и 6 таблицы 2, также представлены на фигуре 2, которая сравнивает средние концентрации гидроморфона в плазме (+стандартные отклонения) с течением времени после перорального введения крысам 20 мг/кг соединения 1 (а) отдельно (сплошная линия с круглыми символами), (b) с 500 мг/кг OVA (пунктирная линия с треугольными символами) или (с) с 500 мг/кг OVA и 500 мг/кг SBTI (пунктирная линия с квадратными символами). Результаты на фигуре 2 показывают, что ослабление SBTI способности соединения 1 высвобождать гидроморфон уменьшает Смакс и замедляет Tмакс такого гидроморфона в плазме, даже в присутствии овальбумина. Крысы, которым ввели 20 мг/кг соединения 1 с 500 мг/кг OVA и 500 мг/кг SBTI, показали Tмакс в плазме 8,0 часа, тогда как крысы, которым ввели 20 мг/кг соединения 1 отдельно, показали Tмакс в плазме 2,3 часа. Результаты в таблице 2 и фигуре 2 также показывают, что SBTI действует специфически путем ингибирования трипсина, а не неспецифическим образом.
Пример 3. Пероральное введение соединения 1 и ингибитора BBSI крысам
Соединение 1 и BBSI (ингибитор Баумана-Бирка трипсина-химотрипсина из Glycine max (соя), №по каталогу Т9777, Sigma-Aldrich) каждый растворили в солевом растворе.
Солевые растворы соединения 1 и BBSI дозировали, как показано в таблице 3. Методики дозирования, отбора образцов и анализа были такими, как описано в примере 1.
Таблица 3 показывает результаты для крыс, которым ввели соединение 1 с или без BBSI. Результаты представлены как максимальная концентрация гидроморфона в крови (среднее ± стандартное отклонение) для каждой группы из 4 крыс (n=4), а также для 3 из 4 крыс, которым ввели соединение 1 и BBSI (n=3).
| Таблица 3 | |||
| Максимальная концентрация (Cмакс) гидроморфона в крови крыс | |||
| Соединение 1(мг/кг) | BBSI(мг/кг) | Смакс (нг/мл НМ) | Число крыс (n) |
| 20 | 0 | 16,5±5,3 | n=4 |
| 20 | 100 | 10,6±5,9 | n=3 |
| 20 | 100 | 18,7±17,0 | n=4 |
Нижний предел количественного определения составлял 1 нг/мл для обеих групп. Cмакс крысы, не включенной в n=3 анализ, составила 43 нг/мл; диапазон других крыс составлял 6,8-17 нг/мл.
Результаты в таблице 3 показывают, что BBSI может ослаблять способность соединения 1 высвобождать гидроморфон.
Данные, полученные для отдельных крыс, представленные в таблице 3, строки 1 и 3 представлены на фигуре 3, которая сравнивает индивидуальные концентрации гидроморфона в плазме с течением времени после перорального введения крысам 20 мг/кг соединения 1 (а) отдельно (сплошные линии) или (b) с 100 мг/кг BBSI (пунктирные линии). Результаты на фигуре 3 показывают, что ослабление BBSI способности соединения 1 высвобождать гидроморфон уменьшает Cмакс и замедляет Tмакс такого гидроморфона в крови, по меньшей мере, для 3 из 4 крыс, которым ввели соединение 1 и BBSI.
Пример 4. Пероральное введение соединения 2 и SBTI ингибитора трипсина крысам
Солевые растворы соединения 2 (которое может быть получено как описано в примере 11) и SBTI (которое может быть получено как описано в примере 1) дозировали, как показано в таблице 4, путем перорального принудительного приема самцам крыс Спраг-Доули с канюлированием яремной вены (4 на группу), которых не кормили в течение 16-18 часов перед пероральным дозированием. Когда дозировали SBTI, его вводили за 5 минут до соединения 4. В определенные точки времени отбирали образцы крови, обрабатывали и анализировали, как описано в примере 2.
Таблица 4 и фигура 4 представляют результаты для крыс, которым вводили 20 мг/кг соединения 2 с или без 500 мг/кг SBTI, как указано. В таблице 4 представлены результаты для каждой группы из 4 крыс как (а) максимальная концентрация в плазме (Cмакс) гидроморфона (НМ) (среднее j: стандартное отклонение) и (b) время после введения соединения 2, с или без SBTI, для достижения максимальной концентрации гидроморфона (Tмакс).
| Таблица 4 | |||
| Cмакс и Tмакс гидроморфона в плазме крыс | |||
| Соединение 2 (мг/кг) | SBTI (мг/кг) | Cмакс (нг/мл НМ) | Tмакс (час) |
| 20 | 0 | 14,2±2,6 | 2,0 |
| 20 | 500 | 7,3±3,5 | 3,5 |
Нижний предел количественного определения составлял 0,0125 нг/мл для обеих групп.
Фигура 4 сравнивает средние концентрации гидроморфона в плазме (± стандартные отклонения) с течением времени высвобождения после перорального введения 20 мг/кг соединения 2 отдельно (сплошная линия) или с 500 мг/кг SBTI (пунктирная линия) крысам.
Результаты в таблице 4 и на фигуре 4 показывают, что SBTI ослабляет способность соединения 2 высвобождать гидроморфон как по отношению к уменьшению Cмакс, так и к замедлению Tмакс.
Пример 5. Пероральное введение соединения 3 и SBTI ингибитора трипсина крысам
Солевые растворы соединения 3 (которое может быть получено, как описано в примере 12) и SBTI дозировали, как показано в таблице 5. Методики дозирования, отбора образцов и анализа были такими, как описано в примере 4.
Таблица 5 и фигура 5 представляют результаты для крыс, которым вводили 20 мг/кг соединения 3 с или без 500 мг/кг SBTI, как указано. Результаты в таблице 5 представлены как Cмакс и Tмакс гидроморфона в плазме для каждой группы из 4 крыс.
| Таблица 5 | |||
| Cмакс и Tмакс гидроморфона в плазме крыс | |||
| Соединение 3 (мг/кг) | SBTI (мг/кг) | Cмакс (нг/мл НМ) | Tмакс (час) |
| 20 | 0 | 9,0±3,1 | 2,3 |
| 20 | 500 | 2,3±1,7 | 7,3 |
Нижний предел количественного определения составлял 0,100 нг/мл для обеих групп.
Фигура 5 сравнивает средние концентрации гидроморфона в плазме (+стандартные отклонения) с течением времени высвобождения после перорального введения 20 мг/кг соединения 3 отдельно (сплошная линия) или с 500 мг/кг SBTI (пунктирная линия) крысам.
Результаты в таблице 5 и на фигуре 5 показывают, что SBTI ослабляет способность соединения 3 высвобождать гидроморфон как по отношению к уменьшению Cмакс, так и к замедлению Tмакс.
Пример 6. Пероральное введение соединения 4 и SBTI ингибитора трипсина крысам
Солевые растворы соединения 4 (которое может быть получено, как описано в примере 13) и SBTI дозировали, как показано в таблице 6. Методики дозирования, отбора образцов и анализа были такими, как описано в примере 4, за исключением того, что соединение 4 без ингибитора вводили 7 крысам.
Таблица 6 и фигура 6 представляют результаты для крыс, которым вводили 20 мг/кг соединения 4 с или без 500 мг/кг SBTI, как указано. Результаты в таблице 6 представлены как Cмакс и Tмакс гидроморфона в плазме для каждой группы из 4 крыс.
| Таблица 6 | ||||
| Cмакс и Tмакс НМ в плазме крыс | ||||
| Соединение 4 (мг/кг) | SBTI (мг/кг) | Cмакс (нг/мл НМ) | Tмакс (час) | Число крыс (n) |
| 20 | 0 | 7,7+2,3 | 2,3 | 7 |
| 20 | 500 | 7,5+2,1 | 6,5 | 4 |
Нижний предел количественного определения составлял 0,500 нг/мл для обеих групп.
Фигура 6 сравнивает средние концентрации гидроморфона в плазме (± стандартные отклонения) с течением времени высвобождения после перорального введения 20 мг/кг соединения 4 отдельно (сплошная линия) или с 500 мг/кг SBTI (пунктирная линия) крысам.
Результаты в таблице 6 и на фигуре 6 показывают, что SBTI ослабляет способность соединения 4 высвобождать гидроморфон, по меньшей мере, по отношению к замедлению Tмакс.
Пример 7. Данные IC50 in vitro
Несколько кандидатов-ингибиторов трипсина, а именно соединения 101-105, 107 и 108, получили, как описано в примерах 14-18, 19 и 20, соответственно. Соединение 106 (также известное как 4-аминобензамидин), соединение 109 (также известное как нафамостат мезилат) и соединение 110 (также известное как пентамидина изетионатная соль) доступны от Sigma-Aldrich (Сент-Луис, Миссури).
Значения половины максимальной ингибиторной концентрации (IC50 или 1Сзо) каждого из соединений 101-110, а также из SBTI и BBSI, определили с использованием модифицированного анализа трипсина, как описано у Bergmeyer, HU et al, 1974, Methods of Enzymatic Analysis Volume 1, 2nd edition, 515-516, Bergmeyer, HU, ed., Academic Press, Inc. New York, NY.
Таблица 7 показывает значения IC50 для каждого из установленных ингибиторов трипсина.
| Таблица 7 | |
| Значения IC50 определенных ингибиторов трипсина | |
| Соединение | Значение IC50 |
| 101 | 2,0 Е-5 |
| 102 | 7,5 Е-5 |
| 103 | 2,3 Е-5 |
| 104 | 2,7 Е-5 |
| 105 | 4,1 Е-5 |
| 106 | 2,4 Е-5 |
| 107 | 1.9Е-6 |
| 108 | 8,8 Е-7 |
| 109 | 9,1 Е-7 |
| 110 | 1,8 Е-5 |
| SBTI | 2,7 Е-7 |
| BBSI | 3,8 Е-7 |
Результаты Таблицы 7 показывают, что каждое из соединений 101-110 проявляет ингибирующую трипсин активность.
Пример 8. Влияние ингибиторов трипсина на in vitro опосредованное трипсином трипсиновое высвобождение гидроморфона из соединения 4
Соединение 4 (которое может быть получено, как описано в примере 13) инкубировали с трипсином из поджелудочной железы коровы (№по каталогу Т8003, тип I, ~10000 ВАЕЕ единиц/мг белка, Sigma-Aldrich) в отсутствие или в присутствии одного из следующих ингибиторов трипсина: SBTI, соединение 107, соединение 108 или соединение 109. Когда ингибитор трипсина был частью инкубационной смеси, соединение 4 добавили через 5 минут после других инкубируемых компонентов. Реакции проводили при 37°С в течение 24 часов. Образцы собрали в определенные точки времени, перенесли в 0,5% муравьиную кислоту в ацетонитриле для прекращения активности трипсина и хранили при менее чем -70°С до анализа с помощью LC-MS/MS (жидкостная хроматография тандемная масс-спектрометрия).
Конечные инкубационные смеси состояли из следующих компонентов:
| Инкубационные компоненты | |||||
| Соединение | Ингибитор | Трис pH 8 | CaCl2 | Трипсин | Соединение 4 |
| Контроль | 0 | 40 ммоль | 22,5 ммоль | 0,0228 мг/мл | 0,51 мг/мл |
| 107 | 1,67 мг/мл | .20 ммоль | 22,5 ммоль | 0,0228 мг/мл | 0,51 мг/мл |
| 108 | 1,67 мг/мл | 20 ммоль | 22,5 ммоль | 0,0228 мг/мл | 0,51 мг/мл |
| 109 | 1,67 мг/мл | 20 ммоль | 22,5 ммоль | 0,0228 мг/мл | 0,51 мг/мл |
| SBTI | 10 мг/мл | 20 ммоль | 22,5 ммоль | 0,0228 мг/мл | 0,51 мг/мл |
Фигуры 7А и 7В показывают результаты воздействия 0,51 мг/мл соединения 4 на 22,8 нг/мл трипсина в отсутствие любого ингибитора трипсина (ромбические символы) или в присутствии 10 мг/мл SBTI (круглые символы), 1,67 мг/мл соединения 107 (направленные вверх треугольные символы), 1,67 мг/мл соединения 108 (квадратные символы) или 1,67 мг/мл соединения 109 (направленные вниз треугольные символы). В частности, фигура 7А изображает исчезновение соединения 4, а фигура 7 В изображает появление гидроморфона с течением времени при этих условиях.
Результаты на фигурах 7А и 7В показывают, что ингибитор трипсина вариантов осуществления может препятствовать способности потребителя применять трипсин для влияния на высвобождение гидроморфона из соединения 4.
Пример 9. Пероральное введение соединения 3 и соединения 101 ингибитора трипсина крысам
Солевые растворы соединения 3 (которое может быть получено, как описано в примере 12) и соединения 101 (полученного, как описано в примере 14) дозировали, как показано в таблице 8. Методики дозирования, отбора образцов и анализа были такими, как описано в примере 4, за исключением того, что соединение 3 и соединение 101 объединили для дозирования.
Таблица 8 и фигура 8 представляют результаты для крыс, которым вводили 20 мг/кг соединения 3 с или без 10 мг/кг соединения 101, как указано. Результаты в таблице 8 представлены как Cмакс и Tмакс гидроморфона в плазме для каждой группы из 4 крыс.
| Таблица 8 | |||
| Cмакс и Tмакс НМ в плазме крыс | |||
| Соединение 3 (мг/кг) | Соединение 101(мг/кг) | Cмакс (нг/мл НМ) | Tмакс (час) |
| 20 | 0 | 9,0±3,1 | 2,3 |
| 20 | 10 | 3,8±2,9 | 3,5 |
Нижний предел количественного определения составлял 0,100 нг/мл для первой группы и 0,500 нг/мл для второй группы.
Фигура 8 сравнивает средние концентрации гидроморфона в плазме (± стандартные отклонения) с течением времени высвобождения после перорального введения 20 мг/кг соединения 3 отдельно (сплошная линия) или с 10 мг/кг соединения 101 (пунктирная линия) крысам.
Результаты в таблице 8 и на фигуре 8 показывают, что соединение 101 ослабляет способность соединения 3 высвобождать гидроморфон как по отношению к снижению Cмакс, так и к замедлению Tмакс.
Пример 10. Пероральное введение соединения 4 и соединения 101 ингибитора трипсина крысам
Солевые растворы соединения 4 (которое может быть получено, как описано в примере 13) и соединения 101 (полученного, как описано в примере 14) дозировали, как показано в таблице 9. Методики дозирования, отбора образцов и анализа были такими, как описано в примере 4, за исключением того, что соединение 4 и соединение 101 объединили для дозирования, и соединение 4 без ингибитора вводили 7 крысам.
Таблица 9 и фигура 9 представляют результаты для крыс, которым вводили 20 мг/кг соединения 4 с или без 10 мг/кг соединения 101, как указано. Результаты в таблице 9 представлены как Cмакс и Tмакс гидроморфона в плазме для каждой группы из 4 крыс.
| Таблица 9 | ||||
| Cмакс и Tмакс НМ в плазме крыс | ||||
| Соединение 4 (мг/кг) | Соединение 101 (мг/кг) | Cмакс (нг/мл НМ) | Tмакс (час) | Число крыс (n) |
| 20 | 0 | 7,7±2,3 | 2,3 | 7 |
| 20 | 10 | 4,8±1,4 | 6,0 | 4 |
Нижний предел количественного определения составлял 0,500 нг/мл для обеих групп.
Фигура 9 сравнивает средние концентрации гидроморфона в плазме (± стандартные отклонения) с течением времени высвобождения после перорального введения 20 мг/кг соединения 4 отдельно (сплошная линия) или с 10 мг/кг соединения 101 (пунктирная линия) крысам.
Результаты в таблице 9 и на фигуре 9 показывают, что соединение 101 ослабляет способность соединения 4 высвобождать гидроморфон как по отношению к уменьшению Cмакс, так и к замедлению Tмакс.
Пример 11. Синтез гидроморфильного сложного эфира [2-((S)-2-амино-5-гуанидин-пентаноиламино)-этил]-метил-карбаминовой кислоты (соединение 2)
Приготовление 1
Синтез 2,2,2-трифтор-N-(2-метиламино-этил)-ацетамида (А) Раствор N-метилэтилендиамина (27,0 г, 364,0 ммоль) и этилтрифторацетата (96,6 мл, 838,0 ммоль) в смеси ацетонитрила (350 мл) и воды (7,8 мл, 436 ммоль) нагревали с обратным холодильником в течение ночи с перемешиванием. Затем растворители выпарили в вакууме. Остаток повторно выпарили с изопропанолом (3×100 мл). Остаток растворили в дихлорметане (500 мл) и оставили на ночь при комнатной температуре. Образованные кристаллы отфильтровали, промыли дихлорметаном и высушили в вакууме для обеспечения соединения А (96,8 г, 94%) в виде белого твердого порошка.
Приготовление 2
Синтез бензинового сложного эфира {метил-[2-(2,2,2-трифтор-ацетиламино)-этил]-карбаминовой кислоты (В)
Раствор соединения А (96,8 г, 340,7 ммоль) и DIEA (N,N-диизопропилэтиламин) (59,3 мл, 340,7 ммоль) в THF (тетрагидрофуран) (350 мл) охладили до ~5°С, с последующим добавлением раствора N-(бензилоксикарбонил)сукцинимида (84,0 г, 337,3 ммоль) в THF (150 мл) по каплям в течение периода 20 минут. Температуру реакционной смеси подняли до комнатной температуры и перемешивание продолжали еще 30 минут с последующим выпариванием растворителей. Образованный остаток растворили в EtOAc (этилацетат) (600 мл). EtOAc экстрагировали 5% водным NaHCO3 (2×150 мл) и солевым раствором (150 мл). Органический слой отделили и выпарили для обеспечения соединения B в виде желтоватого масла (103,0 г, 340,7 ммоль). LC-MS (жидкостная хроматография-масс-спектрометрия) [М+Н] 305,3 (C11H15F3N2O3+Н, рассчит.: 305,3). Соединение В применяли без дополнительной очистки.
Приготовление 3
Синтез бензинового сложного эфира (2-амино-этил)-метил-карбаминовой кислоты (С)
К раствору соединения В (103,0 г, 340,7 ммоль) в МеОН (метанол) (1200 мл) добавили раствор LiOH (16,4 г, 681,4 ммоль) в воде (120 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Растворители выпарили до 3/4 начального объема с последующим разбавлением водой (400 мл). Раствор экстрагировали с EtOAc (2×300 мл). Органический слой промыли солевым раствором (200 мл), высушили над MgSO4 и выпарили в вакууме. Образованный остаток растворили в эфире (300 мл) и обработали 2 н. HCl/эфиром (200 мл). Образованный осадок отфильтровали, промыли эфиром и высушили в вакууме для обеспечения хлористоводородной соли соединения С (54,5 г, 261,2 ммоль) в виде белого твердого вещества. LC-MS [М+Н] 209,5 (С11Н16N2O2+H, рассчит.: 209,3).
Приготовление 4
Синтез трет-бутилового сложного эфира {(S)-4-({амино-[(Е)-2,2,4,б,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-1-[2-(бензилоксикарбонил-метил-амино)-этилкарбамоил]-бутил}-карбаминовой кислоты (D)
Раствор Boc-Arg(Pbf)-OH (3,33 г, 6,32 ммоль), HATU (2,88 г, 7,58 ммоль) и DIEA (7,4 мл, 31,6 ммоль) в DMF (диметилформамид) (40 мл) выдерживали при комнатной температуре в течение 20 минут с последующим добавлением гидрохлорида соединения С (1,45 г, 6,95 ммоль). Перемешивание продолжали еще 1 час. Реакционную смесь разбавили EtOAc (500 мл) и экстрагировали водой (3×75 мл) и солевым раствором (75 мл). Органический слой высушили над MgSO4, а затем выпарили для обеспечения соединения D (4,14 г, 5,77 ммоль) в виде желтоватого твердого вещества. LC-MS [М+Н] 717,6 (C35H52N6O8S+H, рассчит.: 717,9).
Приготовление 5
Синтез (2-метиламино-этил)-амида (S)-2-амино-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-пентановой кислоты (Е)
Соединение D (4,14 г, 5,77 ммоль) и АсОН (уксусная кислота) (330 мкл, 5,77 ммоль) растворили в метаноле (40 мл) с последующим добавлением Pd/C (5 вес.%, 880 мг) суспензии в воде (5 мл). Реакционную смесь подвергли гидрированию (аппарат Парра, 75 psi (фунтов на квадратный дюйм)) при комнатной температуре в течение 2,5 часов. Катализатор отфильтровали через подушку целита на воронке из спеченного стекла и промыли метанолом. Фильтрат выпарили в вакууме для обеспечения соединения Е (1,96 г, 3,2 ммоль) в виде желтоватого твердого вещества. LC-MS [М+Н] 483,2 (C22H38N6O4S+H, рассчит.: 483,2).
Приготовление 6
Синтез трет-бутилового сложного эфира {(S)-4-({амино-[(Е)-2,2,4,б,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-1-[2-
(гидроморфилкарбонил-метил-амино)-этилкарбамоил]-бутил}-карбаминовой кислоты (F)
Суспензию гидроморфона гидрохлорида (332 мг, 1,03 ммоль) и DIEA (179 мкл, 1,03 ммоль) в хлороформе (4 мл) обработали ультразвуком в ультразвуковой ванне при комнатной температуре в течение 1 часа. После этого добавили 4-нитрофенил-хлорформиат (162 мг, 0,80 ммоль). Реакционную смесь обработали ультразвуком в ультразвуковой ванне при комнатной температуре еще 1 час с последующим добавлением раствора соединения Е (400 мг, 0,67 ммоль) и 1-гидроксибензо-триазола (154 мг, 1,14 ммоль) в DMF (4 мл). Реакционную смесь перемешивали в течение ночи (~18 часов) при комнатной температуре с последующим выпариванием растворителей в вакууме. Остаток растворили в МеОН (5 мл) и осадили добавлением эфира (500 мл). Образованный осадок отфильтровали и высушили в вакууме для обеспечения соединения F (520 мг, выход превысил количественный) в виде грязно-белого твердого вещества. LC-MS [М+Н] 894,6 (C45H63N7O10S+H, рассчит.: 894,9).
Синтез гидроморфильного сложного эфира [2-((S)-2-амино-5-гуанидин-пентаноиламино)-этил]-метил-карбаминовой кислоты (соединение 2).
Соединение F (679 мг, 0,76 ммоль) растворили в смеси 5% m-крезола/TFA (трифторуксусная кислота) (10 мл). Реакционную смесь выдерживали при комнатной температуре в течение 1 часа с последующим разбавлением эфиром (500 мл). Образованный осадок отфильтровали, промыли эфиром (100 мл) и высушили в вакууме для обеспечения неочищенного соединения 2 (441 мг, выход превысил количественный) в виде грязно-белого твердого вещества. LC-MS [М+Н] 542,4 (C27H39N7O5+Н, рассчит.: 542).
Неочищенное соединение 2 растворили в воде (10 мл) и подвергли очистке препаративной обращенно-фазовой HPLC. [Nanosyn-Pack Microsorb (100-10) С-18 колонка (50×300 мм); скорость потока = 100 мл/мин; вводимый объем 10 мл; подвижная фаза А:
100% воды, 0,1% TFA; подвижная фаза В: 100% ацетонитрила, 0,1% TFA; изократическое элюирование при 0% B в 5 мин, градиентное элюирование до 6% B в 6 мин, изократическое элюирование при 6% B в 23 мин, градиентное элюирование от 6% В до 55% B в 66 мин; детектирование при 254 нм]. Фракции, содержащие желаемое соединение объединили и концентрировали в вакууме. Остаток растворили в i-PrOH (изопропанол) (20 мл) и выпарили в вакууме (процедуру повторили дважды). Остаток растворили в i-PrOH (2 мл) и обработали 2 н. HCl/эфиром (100 мл, 200 ммоль) для обеспечения хлористоводородной соли соединения 2 (80 мг, выход 17%, чистота 98%) в виде белого твердого вещества. LC-MS [М+Н] 542,0 (C27H39N7O5+H, рассчит.: 542,9). Время удерживания*: 2,04 минуты.
* - [Chromolith SpeedRod RP-18e С 18 колонка (4,6×50 мм); скорость потока 1,5 мл/мин; подвижная фаза А: 0,1% ТРА(трифторуксусная кислота)/вода; подвижная фаза В 0,1% TFA/ACN; градиентное элюирование от 5% В до 100% В за 9,6 мин, детектирование 254 нм].
Пример 12. Синтез гидроморфонового сложного эфира (2-метиламино-этил)-амида (S)-2-ацетиламино-6-амино-капроновой кислоты (соединение 3)
Приготовление 7
Синтез 9Н-флуорен-9-илметилового сложного эфира {(S)-1-[2-(бензилоксикарбонил-метил-амино)-этилкарбамоил]-5-трет-бутоксикарбониламино-пентил}-карбаминовой кислоты (G)
К раствору Fmoc-Lys(Boc)-OH (2,0 г, 4,26 ммоль) в DMF (50 мл) добавили DIEA (2,38 мл, 13,65 ммоль) и перемешивали 15 минут при комнатной температуре. Затем реакционную смесь охладили до ~5°C с последующим добавлением HATU (1,95 г, 5,12 ммоль), добавленного порциями, и перемешивали 30 минут. Добавили CBZ-диамин (1,05 г, 4,26 ммоль) в реакционную смесь и взбалтывали при комнатной температуре в течение 2 часов. Реакционную смесь разбавили EtOAc (250 мл), промыли водой (250 мл) и солевым раствором (250 мл). Органический слой отделили, высушили над Na2SO4 и удалением растворителя в вакууме получили соединение G (2,3 г, 82%). LC-MS [М+Н] 659,6 (C37H46N4O7+H, рассчит.: 659,7).
Приготовление 8
Синтез трет-бутилового сложного эфира {(S)-5-амино-5-[2-(бензилоксикарбонил-метил-амино)-этилкарбамоил]-пентил}-карбаминовой кислоты (Н)
К раствору соединения G (2,3 г, 3,49 ммоль) в ЕЮАС (50 мл) добавили пиперидин (0,34 мл, 3,49 ммоль). Реакционную смесь перемешивали в течение 18 часов при комнатной температуре, а затем растворители удалили в вакууме. Остаток растворили в минимальном количестве EtOAc, а затем осадили Et2O (диэтиловый эфир). Осадок отфильтровали, и промыли с Et2O, и высушили для получения соединения Н (1,4 г, 94%). LC-MS [М+Н] 437,6 (C22H36H4O5+Н, рассчит.: 437,5).
Приготовление 9
Синтез изопропилового сложного эфира {(S)-5-ацетиламино-5-[2-(бензилоксикарбонил-метил-амино)-этил-карбамоил]-пентил}-карбаминовой кислоты (I)
К раствору соединения Н (1,4 г, 3,21 ммоль) в CHCl3 (10 мл) при комнатной температуре добавили DIEA (2,6 мл, 15 ммоль) с последующим Ac2O (уксусный ангидрид) (0,85 мл, 9,0 ммоль). Реакционную смесь перемешивали при комнатной температуре 2 часа. Растворители удалили в вакууме, а затем остаток растворили в дихлорметане (100 мл). Органический слой промыли 10% лимонной кислотой (75 мл), насыщенным NaHCO3 (75 мл) и солевым раствором (75 мл). Органический слой отделили, высушили над Na2SO4 и растворитель удалили в вакууме для получения соединения I (1,45 г, 99%). LC-MS [М+Н] 479,5 (C24H38H4O6+Н, рассчит.: 479,5).
Приготовление 10
Синтез трет-бутилового сложного эфира [(S)-5-ацетиламино-5-(2-метиламино-этилкарбамоил)-пентил]-карбаминовой кислоты (J)
К раствору соединения I (1,4 г, 3,00 ммоль) в МеОН (40 мл) добавили 5% Pd/C (300 мг). Эту реакционную смесь подвергли гидрированию при 70 psi в течение 2 часов. Затем реакционную смесь отфильтровали через подушку целита, МеОН удалили в ротационном выпаривателе для получения соединения J (1,02 г, 98%). LC-MS [М+Н] 344,9 (C16H32N4O4+H, рассчит.: 345,4).
Приготовление 11
[(S)-5-ацетиламино-5-(2-метиламино-этилкарбамоил)-пентил]-карбаминовой кислоты трет-бутил-гидроморфон-ди-эфир (L)
Гидроморфона HCl соль (1,24 г, 3,86 ммоль) и DIEA (0,67 мл, 3,86 ммоль) суспендировали в CHCl3 (12 мл) и обрабатывали ультразвуком в течение 1 часа при комнатной температуре. 4-Нитро-фенилхлорформиат (600 мг, 2,97 ммоль) добавили в реакционную смесь, а затем обрабатывали ультразвуком 100 минут. В активированную гидроморфоновую реакционную смесь добавили раствор соединения J (1,02 г, 2,97 ммоль) и HOBt (гидроксибензотриазол) (0,52 г, 3,86 ммоль) в DMF (12 мл) по каплям и перемешивали при комнатной температуре в течение ночи (~18 часов). Затем растворители удалили в вакууме и остаток растворили в минимальном количестве МеОН и осадили избытком EtzO. Осадок отфильтровали, промыли с Et2O и высушили в вакууме для получения соединения L. LC-MS [М+Н] 656,9 (C34H49N5O8+H, рассчит.: 656,7). Этот неочищенный продукт очистили препаративной обращенно-фазовой HPLC. [Колонка: VARIAN, LOAD & LOCK, L&L 4002-2 заполнение: Microsob 100-10 С 18, вводимый объем: ~ 15 мл, скорость введенного потока: 20 мл/мин, 100% А, (вода/О, 1% TFA), скорость потока: 100 мл/мин, фракция: 30 с (50 мл), способ: 0% В (МеСМ(ацетонитрил)/0,1% TFA)/2 мин/75% В/96 мин/100 мл/мин/ 254 нм]. Чистые фракции объединили, растворители удалили в вакууме. Остаток высушили путем совместного выпаривания с i-PrOH (4×100 мл) для получения соединения L в виде желтого масла (0,90 г, 46%).
Синтез гидроморфонового сложного эфира(2-метиламино-этил)-амида (S)-2-ацетиламино-6-амино-капроновой кислоты (соединение 3)
Соединение L (0,90 г, 1,37 ммоль) суспендировали в диоксане (~2 мл), обрабатывали ультразвуком и обработали 4,0 н HCl/диоксаном (~20 мл) при комнатной температуре. Немедленно образовался белый осадок. Затем смесь разбавили Et2O (200 мл), гексаном (20 мл) и осадок отфильтровали, и промыли Et2O (100 мл), гексаном (100 мл), и высушили под вакуумом для получения соединения 3 (0,67 г, 78% выход, 97,5% чистота). LC-MS [М+Н] 556,3 (C29H41N5O6+H, рассчит.: 556,6).
Пример 13. Синтез гидроморфонового сложного эфира [2-((S)-2-ацетиламино-5-гуанидин-пентаноиламино)-этил]-этил-карбаминовой кислоты (соединение 4)
Приготовление 12
Синтез 2,2,2-трифтор-М-(2-этиламино-этил)-ацетамида (М)
Раствор N-этилэтилендиамина (10,0 г, 113,4 ммоль) и этилтрифторацетата (32,0 мл, 261 ммоль) в смеси ацетонитрила (110 мл) и воды (2,5 мл, 139 ммоль) нагревали с обратным холодильником с перемешиванием в течение ночи (~18 часов). Растворители выпарили в вакууме. Остаток повторно выпарили с i-PrOH (3×100 мл). Остаток растворили в дихлорметане (500 мл) и оставили на ночь при комнатной температуре.
Образованные кристаллы отфильтровали, промыли дихлорметаном (100 мл) и высушили в вакууме для обеспечения соединения М (24,6 г, 82,4 ммоль) в виде белого твердого порошка.
Приготовление 13
Синтез бензинового сложного эфира {этил-[2-(2,2,2-трифтор-ацетилам.ино)-этил]-карбаминовой кислоты (N)
Раствор соединения М (24,6 г, 82,4 ммоль) и DIEA (14,3 мл, 82,4 ммоль) в THF (100 мл) охладили до ~5°C с последующим добавлением раствора N-(бензилоксикарбонил)сукцинимида (20,3 г, 81,6 ммоль) в THF (75 мл) по каплям за 20 минут. Температуру реакционной смеси повысили до комнатной температуры и перемешивание продолжали еще 30 минут. Растворители выпарили и остаток растворили в EtOAc (500 мл). Органический слой экстрагировали с 5% водным NaHCO3 (2×100 мл) и солевым раствором (100 мл). Органический слой выпарили для обеспечения соединения N (24,9 г, 78,2 ммоль) в виде желтоватого масла. LC-MS [М+Н] 319,0 (C14H17F3N2O3+H, рассчит.: 319,2). Соединение N применяли без дополнительной очистки.
Приготовление 14
Синтез бензинового сложного эфира (2-амино-этил)-этил-карбаминовой кислоты (О)
К раствору соединения N (24,9 г, 78,2 ммоль) в МеОН (300 мл) добавили раствор LiOH (3,8 г, 156 ммоль) в воде (30 мл). Реакционную смесь перемешивали при комнатной температуре 5 часов. Затем растворители выпарили до 3/4 начального объема с последующим разбавлением водой (200 мл). Раствор экстрагировали с EtOAc (200 мл × 2) и органический слой промыли с солевым раствором (100 мл), высушили над MgSO4 и выпарили в вакууме. Остаток растворили в простом эфире (200 мл) и обработали 2 н HCl/эфиром (200 мл). Образованный осадок отфильтровали, промыли эфиром и высушили в вакууме для обеспечения гидрохлоридной соли соединения О (12,1 г, 46,7 ммоль) в виде белого твердого вещества. LC-MS [М+Н] 222,9 (C12H18N2O2+H, рассчит.: 223,2).
Приготовление 15
Синтез бензинового сложного эфира {2-[Boc-Arg(Pbf)]-аминоэтил}-этил-карбаминовой кислоты (Р)
Раствор Boc-Arg(Pbf)-OH (3,0 г, 5,69 ммоль), соединение О (1,62 г, 6,26 ммоль), DIEA (3,17 мл, 18,21 ммоль) и HATU (2,59 г, 6,83 ммоль) в DMF (20 мл) перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавили EtOAc (300 мл) и экстрагировали водой (3×75 мл) и солевым раствором (75 мл). Органический слой высушили над MgSO4, отфильтровали, а затем выпарили для обеспечения соединения Р (5,97 г, выход превысил количественный) в виде желтоватого масла. LC-MS [М+Н] 731,5 (C36H54N6O8S+H, рассчит.: 731,7). Соединение Р применяли без дополнительной очистки.
Приготовление 16
Синтез бензинового сложного эфира {2-[Н-Arg(Pbf)]-аминоэтил}-этил-карбаминовой кислоты (Q)
Соединение Р (5,69 ммоль) растворили в диоксане (20 мл) и обработали 4 н. HCl/диоксаном (100 мл, 70 ммоль) при комнатной температуре в течение 1 часа. Затем растворитель удалили в вакууме с последующим суспендированием в i-PrOH (50 мл) и окончательно растворитель выпарили для удаления остаточных растворителей (процедуру повторили дважды). Неочищенную реакционную смесь высушили в вакууме для обеспечения соединения Q (5,97, выход превысил количественный) в виде желтоватого твердого вещества. LC-MS [М+Н] 631,5 (C31H46N6O6S+H, рассчит.: 631,2). Соединение Q применяли без дополнительной очистки.
Приготовление 17
Синтез бензинового сложного эфира {2-[Ас-Arg(Pbf)]-аминоэтил}-этил-карбаминовой кислоты (R).
Раствор соединения Q (5,69 ммоль), Ac2O (649 мкл, 6,83 ммоль) и DIEA (2,97 мл, 17,07 ммоль) в хлороформе (20 мл) перемешивали при комнатной температуре в течение 1 часа. Затем добавили 2 молярный EtNH2 (этиламин) /THF (1,71 мл, 3,41 ммоль). Реакционную смесь перемешивали при комнатной температуре еще 30 минут с последующим разбавлением EtOAc (300 мл). Органический слой экстрагировали водой (75 мл), 2% водной H2SO4 (75 мл), водой (3×75 мл) и солевым раствором (75 мл). Затем органический слой высушили над MgSO4 и выпарили для обеспечения соединения R (3,99 г, выход превысил количественный) в виде желтоватого твердого вещества. LC-MS [М+Н] 673,6 (C33H48H6O7S+H, рассчит.: 672,9). Соединение R применяли без дополнительной очистки.
Приготовление 18
Синтез N-[Ac-Arg(Pbf)]-N'-этил-этан-1,2-диамина (S)
Соединение R (5,69 ммоль) растворили в метаноле (50 мл) с последующим добавлением Pd/C (5 вес.%, 1 г) суспензии в воде (5 мл). Реакционную смесь подвергли гидрированию (аппарат Парра, 80 psi) при комнатной температуре в течение 1 часа. По завершении катализатор отфильтровали через подушку целита на воронке из спеченного стекла и промыли метанолом. Фильтрат выпарили в вакууме для обеспечения соединения S (3,06 г, количественный выход) в виде бесцветного масла. LC-MS [М+Н] 539,5 (C25H42N6O5S+H, рассчит.: 539,9). Соединение S применяли без дополнительной очистки.
Синтез гидроморфонового сложного эфира [2-(2-ацетиламино-5-гуанидин-пентаноиламино)-этил]-этил-карбаминовой кислоты (соединение 4).
Суспензию гидроморфона гидрохлорида (2,75 г, 8,54 ммоль) и DIEA (1,49 мл, 8,54 ммоль) в хлороформе (8 мл) обработали ультразвуком в ультразвуковой ванне при комнатной температуре в течение 1 часа с последующим добавлением 4-нитрофенил-хлорформиата (1,38 г, 6,83 ммоль). Реакционную смесь обработали ультразвуком в ультразвуковой ванне при комнатной температуре еще 1 час с последующим добавлением раствора соединения S (3,06 г, 5,69 ммоль) и 1-гидроксибензотриазола (1,31 г, 9,67 ммоль) в DMF (8 мл). Реакционную смесь перемешивали в течение ночи (~18 часов) при комнатной температуре с последующим выпариванием растворителей в вакууме. Неочищенную реакционную смесь растворили в МеОН (10 мл) и осадили эфиром (500 мл). Образованный осадок отфильтровали и высушили в вакууме для обеспечения Pbf-защищенного соединения 4 (6,96 г, выход превысил количественный) в виде грязно-белого твердого вещества. LC-MS [М+Н] 850,6 (C43H59N7O9S+Н, требует 850,2).
Pbf-зашищенное соединение 4 растворили в смеси 5% т-крезола/TFA (100 мл). Реакционную смесь выдерживали при комнатной температуре в течение 1 часа с последующим разбавлением эфиром (2 л). Образовавшийся осадок затем отфильтровали через воронку из спеченного стекла, промыли эфиром (200 мл) и высушили в вакууме для обеспечения неочищенного соединения 4 (5,2 г, 97%) в виде грязно-белого твердого вещества. Неочищенное соединение 4 (5,2 г, 5,54 ммоль) растворили в воде (50 мл) и подвергли очистке с помощью HPLC. [Nanosyn-Pack Microsorb (100-10) С-18 колонка (50×300 мм); скорость потока = 100 мл/мин; вводимый объем 50 мл; подвижная фаза А: 100% вода, 0,1% TFA; подвижная фаза В; 100% ацетонитрил, 0,1% TFA; изократическое элюирование при 0% B в 5 мин, градиентное элюирование до 6% B в 6 мин, изократическое элюирование при 6% B в 13 мин, градиентное элюирование от 6% В до 55% B в 76 мин; детектирование при 254 нм]. Фракции, содержащие желаемое соединение, объединили и концентрировали в вакууме. Остаток растворили в i-PrOH (50 мл) и выпарили в вакууме (процедуру повторили дважды). Остаток растворили в i-PrOH (50 мл) и обработали 2 н. HCl/эфиром (200 мл, 400 ммоль) для обеспечения гидрохлоридной соли соединения 4 (1,26 г, выход 32%, чистота 95,7%) в виде белого твердого вещества. LC-MS [М+Н] 598,4 (С30H43N7O6+H, рассчит.: 598,7). Время удерживания*: 2,53 минут.
* - [Chromolith SpeedRod RP-18e С18 колонка (4,6×50 мм); скорость потока 1,5 мл/мин; подвижная фаза А: 0,1%ТРА/вода; подвижная фаза В 0,1% TFA/ACN; градиентное элюирование от 5% В до 100% В за 9,6 мин, детектирование 254 нм].
Пример 14. Синтез (S)-этил-4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-карбоксилата (соединение 101)
Приготовление 19
Синтез трет-бутилового сложного эфира 4-[(S)-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-2-(9Н-флуорен-9-илметоксикарбониламино)-пентаноил]-пиперазин-1-карбоновой кислоты (Т)
К раствору Fmoc-Arg(Pbf)-OH 1 (25,0 г, 38,5 ммоль) в DMF (200 мл) при комнатной температуре добавили DIEA (13,41 мл, 77,1 ммоль). После взбалтывания при комнатной температуре в течение 10 минут реакционную смесь охладили до ~5°С. К реакционной смеси добавили HATU (16,11 г, 42,4 ммоль) порциями, перемешивали 20 минут и добавили по каплям раствор трет-бутил-1-пиперазина карбоксилата (7,18 г, 38,5 ммоль) в DMF (50 мл). Реакционную смесь взбалтывали при ~5°С 5 минут. Затем реакционной смеси позволили нагреться до комнатной температуры и перемешивали 2 часа. Растворитель удалили в вакууме и остаток растворили в EtOAc (500 мл), промыли водой (2×750 мл), 1% H2SO4 (300 мл) и солевым раствором (750 мл). Органический слой отделили, высушили над Na2SO4 и растворитель удалили в вакууме до общего объема 100 мл. Соединение Т взяли для следующего этапа как раствор в EtOAc (100 мл). LC-MS [М+Н] 817,5 (C43H56H6O8S+Н, рассчит.: 817,4).
Приготовление 20
Синтез трет-бутилового сложного эфира 4-[(S)-2-амино-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-пентаноил]-пиперазин-1-карбоновой кислоты (U)
К раствору соединения Т (46,2 ммоль) в EtOAc (175 мл) при комнатной температуре добавили пиперидин (4,57 мл, 46,2 ммоль) и реакционную смесь перемешивали 18 часов при комнатной температуре. Затем растворитель удалили в вакууме и образовавшийся остаток растворили в минимальном количестве EtOAc (~50 мл) и добавили гексан (~1 л). Осажденный неочищенный продукт отфильтровали и снова перекристаллизовали с EtOAc (~30 мл) и гексаном (~750 мл). Осадок отфильтровали, промыли гексаном и высушили в вакууме для получения соединения U (28,0 г, 46,2 ммоль). LC-MS [М+Н] 595,4 (C28H46H6O6S+Н, рассчит.: 595,3).
Приготовление 21
Синтез трет-бутилового сложного эфира 4-[(S)-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-2-(нафталин-2-сульфониламино)-пентаноил]-пиперазин-1-карбоновой кислоты (V)
К раствору соединения U (28,0 г, 46,2 ммоль) в THF (250 мл) добавили водный 1 н. NaOH (171 мл). Реакционную смесь охладили до ~5°С, раствор 2-нафталин-сульфонилхлорида (26,19 г, 115,6 ммоль) в THF (125 мл) добавили по каплям. Реакционную смесь перемешивали при ~5°С 10 минут, перемешивание продолжали при комнатной температуре 2 часа. Реакционную смесь разбавили EtOAc (1 л), промыли водным 1 н. NaOH (1 л), водой (1 л) и солевым раствором (1 л). Органический слой отделили, высушили над Na2SO4 и удалили растворитель в вакууме для получения соединения V (36,6 г, 46,2 ммоль). LC-MS [М+Н] 785,5 (C38H52H6O8S2+Н, рассчит.: 785,9).
Приготовление 22
Синтез 1-амино-1-[(S)-4-(нафталин-2-сульфониламино)-5-оксо-5-пиперазин-1-ил-пентиламино]-мет-(Е)-илиденамида 2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфоновой кислоты (W)
К раствору соединения V (36,6 г, 46,2 ммоль) в диоксане (60 мл) добавили 4 молярную НС1 в диоксане (58 мл) по каплям. Реакционную смесь перемешивали при комнатной температуре 1,5 часа. К реакционной смеси добавили Et2O (600 мл), осажденный продукт отфильтровали, промыли Et2O и окончательно высушили под вакуумом для получения соединения W (34,5 г, 46,2 ммоль). LC-MS [М+Н] 685,4 (C33H44N6O6S2+Н, рассчит.: 685,9). Соединение W применяли без дополнительной очистки.
Приготовление 23
Синтез этилового сложного эфира 4-[(S)-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-2-(нафталин-2-сульфониламино)-пентаноил]-пиперазин-1-карбоновой кислоты (X)
К раствору соединения W (8,0 г, 11,1 ммоль) в СНСl3 (50 мл) добавили DIEA (4,1 мл, 23,3 ммоль) при комнатной температуре и перемешивали 15 минут. Смесь охладили до ~5°С, по каплям добавили этилхлорформиат (1,06 мл, 11,1 ммоль). После перемешивания при комнатной температуре в течение ночи (~18 часов) растворитель удалили в вакууме. Остаток растворили в МеОН (~25 мл) и добавили Et2O (~500 мл). Осажденный неочищенный продукт отфильтровали, промыли Et20 и высушили в вакууме для получения соединения Х (8,5 г, 11,1 ммоль). LC-MS [М+Н] 757,6 (C36H48N6O8S2+H, рассчит.: 757,9). Соединение Х применяли без дополнительной очистки.
Синтез (S)-этил-4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-карбоксилата (соединение 101)
Раствор 5% т-крезола/TFA (50 мл) добавили к соединению Х (8,5 г, 11,1 ммоль) при комнатной температуре. После перемешивания в течение 1 часа реакционную смесь осадили Et2O (~500 мл). Осадок отфильтровали, промыли Et2O и высушили в вакууме для получения неочищенного продукта. Неочищенный продукт очистили препаративной обращенно-фазовой HPLC. [Колонка: VARIAN, LOAD & LOCK, L&L 4002-2, заполнение: Microsob 100-10 С 18, объем введения: ~15 мл × 2, скорость введенного потока: 20 мл/мин, 100% А, (вода/0,1% TFA), скорость потока: 100 мл/мин, фракция: 30 с (50 мл), способ: 0% В (MeCN/0,l% TFA)-60% B/60 мин/100 мл/мин/ 254 нм]. Растворители удалили из чистых фракций в вакууме. Следы воды удалили совместным выпариванием с 2 x i-PrOH (50 мл). Остаток растворили в минимальном количестве i-PrOH и продукт осадили 2 молярной HCl в Et2O. Продукт отфильтровали, промыли Et2O и высушили в вакууме для получения соединения 101 в виде НСl соли 7 (3,78 г, выход 63%, чистота 99,4%). LC-MS [М+Н] 505,4 (C38H52N6O8S2+H, рассчит.: 505,6).
Пример 15. Синтез (S)-этил-4-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперазин-1-карбоксилата (соединение 102)
Приготовление 24
Синтез этилового сложного эфира 4-[(S)-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-2-трет-бутоксикарбониламино-пентаноил]-пиперазин-1-карбоновой кислоты (Y)
К раствору Boc-Arg(Pbf)-OH (13,3 г, 25,3 ммоль) в DMF (10 мл) добавили DIEA (22,0 мл, 126,5 ммоль) при комнатной температуре и перемешивали 15 минут. Затем реакционную смесь охладили до ~5°С, порциями добавили HATU (11,5 г, 30,3 ммоль) и взбалтывали 30 минут с последующим добавлением по каплям этил-1-пиперазин-карбоксилата (4,0 г, 25,3 ммоль) в DMF (30 мл). Через 40 минут реакционную смесь разбавили EtOAc (400 мл) и влили в Н2О (1 л). Экстрагировали с EtOAc (2×400 мл) и промыли Н2О (800 мл), 2% H2SO4 (500 мл), Н2О (2×800 мл) и солевым раствором (800 мл). Органический слой отделили, высушили над MgSO4 и растворитель удалили в вакууме. Образованный маслянистый остаток высушили в вакууме для получения соединения Y (16,4 г, 24,5 ммоль) в виде пенистого твердого вещества. LC-MS [М+Н] 667,2 (C31H50N6O8S+H, рассчит.: 667,8). Соединение Y применяли без дополнительной очистки.
Приготовление 25
Синтез этилового сложного эфира 4-[(S)-2-амино-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-пентаноил]-пиперазин-1-карбоновой кислоты (Z)
Раствор соединения Y (20,2 г, 30,2 ммоль) в дихлорметане (90 мл) обработали 4,0 н. HCl в 1,4-диоксане (90 мл, 363,3 ммоль) и перемешивали при комнатной температуре 2 часа. Затем большую часть дихлорметана удалили в вакууме и добавили Et2O (~1 л). Образованный осадок отфильтровали, промыли Et2O и высушили в вакууме для получения соединения Z (17,8 г, 30,2 ммоль). LC-MS [М+Н] 567,8 (C26H42H6O6S+Н, рассчит.: 567,8).
Приготовление 26
Синтез этилового сложного эфира 4-[(S)-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-2-(2,4,6-триизопропил-бензолсулъфониламино)-пентаноил]-пиперазин-1-карбоновой кислоты (АА)
К раствору соединения Z (1,0 г, 1,8 ммоль) в THF (7 мл) добавили 3,1 н. водный NaOH (4,0 мл) и перемешивали 5 минут. Реакционную смесь охладили до ~5°С, а затем по каплям добавили раствор трипсилхлорида (2,2 г, 7,3 ммоль) в THF (5 мл) и перемешивали при комнатной температуре в течение ночи (~18 часов). Реакционную смесь разбавили H2O (130 мл), подкислили 2% H2SO4 (15 мл) и экстрагировали EtOAc (3×80 мл). Органический слой объединили и промыли H2O (2×400 мл), насыщенным NaHCO3 (100 мл), H2O (200 мл) и солевым раствором (200 мл). Органический слой отделили, высушили над MgSO4 и растворитель удалили в вакууме для получения (2,9 г) неочищенного продукта. Его очистили нормально-фазовой флэш-хроматографией (5-10% MeOH/DCM (дихлорметан)) для получения соединения АА (0,52 г, 1,0 ммоль). LC-MS [М+Н] 833,8 (C41H64H6O8S2+Н, рассчит.: 834,1).
Синтез (S)-этил-4-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперазин-1-карбоксилата (соединение 102)
Раствор 5% т-крезола/TFA (40 мл) добавили к соединению АА (3,73 г, 3,32 ммоль) при комнатной температуре. После перемешивания в течение 45 минут растворители удалили в вакууме. Остаток растворили в дихлорметане (100 мл), промыли H2O (3×200 мл) и солевым раствором (200 мл). Органический слой отделили, высушили над MgSO4, а затем растворитель удалили в вакууме. Остаток растворили в дихлорметане (~5 мл), а затем добавили гексан (~250 мл) и получили осадок. Его промыли гексаном и высушили в вакууме для получения неочищенного продукта (1,95 г). Неочищенный продукт очистили обращенно-фазовой HPLC [колонка: VARIAN, LOAD & LOCK, L&L 4002-2, заполнение: Microsob 100-10 C18, вводимый объем: ~15 мл, скорость введенного потока: 20 мл/мин, 100% А, (вода/0,1% TFA), скорость потока: 100 мл/мин, фракция: 30 с (50 мл), способ: 25% В (MeCN/0,1% TFA)/70% B/98 мин/100 мл/мин/254 нм]. Растворители удалили из чистых фракций в вакууме. Следы воды удалили совместным выпариванием с 2 x i-PrOH (50 мл). Остаток растворили в минимальном количестве i-PrOH и продукт осадили 2 молярной HCl в Et2O. Продукт отфильтровали, промыли Et2O и высушили в вакууме для получения продукта в виде HCl соли соединения 102 (0,72 г, выход 35%, чистота 99,8%). LC-MS [М+Н] 581,6 (C28H48N6O5S+H, рассчит.: 581,7).
Пример 16. Синтез HCl соли (S)-этил-1-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперидин-4-карбоксилата (соединение 103)
Приготовление 27
Синтез этилового сложного эфира 1-[Boc-Arg(Pbf)]-пиперидин-4-карбоновой кислоты (ВВ)
К раствору Boc-Arg(Pbf)-OH (3,4 г, 6,36 ммоль) и HATU (2,9 г, 7,63 ммоль) в DMF (15 мл) добавили DIEA (7,4 мл, 42,4 ммоль) и реакционную смесь перемешивали 10 минут при комнатной температуре. Раствор этилизонипекотата (1,0 г, 6,36 ммоль) в DMF (6 мл) добавили в реакционную смесь по каплям. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем разбавили этилацетатом (150 мл) и вылили в воду (500 мл). Продукт экстрагировали с этилацетатом (2×100 мл). Органический слой промыли водной 0,1 н. HCl (200 мл), 2% водным бикарбонатом натрия (200 мл), водой (200 мл) и солевым раствором (200 мл). Органический слой высушили над сульфатом натрия, отфильтровали, а затем выпарили в вакууме. Образованный маслянистый продукт высушили в вакууме в течение ночи для получения соединения ВВ (3,7 г, 5,57 ммоль) в виде вязкого твердого вещества. LC-MS [М+Н] 666,5 (C32H51O5S S+H, рассчит.: 666,7). Соединение ВВ применяли без дополнительной очистки.
Приготовление 28
Синтез HCl соли этилового сложного эфира 1-[Arg(Pbf)]-пиперидин-4-карбоновой кислоты (СС)
К раствору соединения ВВ (4,7 г, 7,07 ммоль) в дихлорметане (25 мл) добавили 4 н HCl в диоксане (25,0 мл, 84,84 ммоль) и реакционную смесь перемешивали при комнатной температуре 2 часа. Реакционную смесь концентрировали в вакууме до ~20 мл растворителя, а затем разбавили диэтиловым эфиром (250 мл) для получения белого тонкого осадка. Реакционную смесь перемешивали в течение 1 часа и твердое вещество промыли эфиром (50 мл) и высушили в высоком вакууме в течение ночи для получения соединения СС (4,3 г, 7,07 ммоль) в виде тонкого порошка. LC-MS [М+Н] 566,5 (C27H43N5O6 S+H, рассчит.: 566,7).
Приготовление 29
Синтез этилового сложного эфира 1-[5(S)-(N'-Pbf-гуанидин)-2-(нафталин-2-сульфониламино)-пентаноил]-пиперидин-4-карбоновой кислоты (DD)
К раствору соединения СС (1,1 г, 1,6 ммоль) и NaOH (260 мг, 5,9 ммоль) в смеси THF (5 мл) и воды (3 мл) добавили раствор 2-нафталосульфонилхлорида (0,91 г, 2,5 ммоль) в THF (10 мл) по каплям с перемешиванием при ~5°С. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем разбавили водой (5 мл). Добавили водную 1 н. HCl (5 мл) для получения pH ~3. Добавили дополнительную воду (20 мл) и продукт экстрагировали этилацетатом (3×50 мл). Органический слой удалили, а затем промыли 2% водным бикарбонатом натрия (50 мл), водой (50 мл) и солевым раствором (50 мл). Экстракт высушили над безводным сульфатом натрия, отфильтровали и выпарили в вакууме. Образованный маслянистый продукт высушили в вакууме в течение ночи для получения соединения DD (1,3 г, 1,6 ммоль) в виде маслянистого пенистого твердого вещества. LC-MS [М+Н] 756,5 (C37H49N5O8S2+H, рассчит.: 756,7).
Синтез HCl соли (S)-этил-1-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперидин-4-карбоксилата (соединение 103)
В колбу добавили соединение DD (1,3 г, 1,6 ммоль), а затем обработали 5% m-крезолом/TFA (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрировали в вакууме до объема 5 мл.
Затем добавили диэтиловый эфир (200 мл) к остатку и получили тонкий белый осадок. Осадок отфильтровали и промыли эфиром (2×25 мл). Образованное твердое вещество высушили в вакууме в течение ночи для получения неочищенного материала, который очистили препаративной обращенно-фазовой HPLC. [Nanosyn-Pack Microsorb (100-10) С-18 колонка (50×300 мм); скорость потока = 100 мл/мин; вводимый объем 12 мл (DMSO-вода, 1:1, объем/объем); подвижная фаза А: 100% вода, 0,1% TFA; подвижная фаза В: 100% ACN, 0,1% TFA; градиентное элюирование от 25% В до 55% B в 90 минут, детектирование при 254 нм]. Фракции, содержащие желаемое соединение, объединили и концентрировали в вакууме. Остаток растворили в i-PrOH (50 мл) и выпарили в вакууме (повторили дважды). Затем остаток растворили в i-PrOH (5 мл) и обработали 2 н. HCl/эфиром (100 мл, 200 ммоль) для получения белого осадка. Его высушили в вакууме в течение ночи для получения Соединения 103 (306 мг, выход 31%, чистота 95,7%) в виде белого твердого вещества. LC-MS [М+Н] 504,5 (C24H33N5O5S+H, рассчит.: 504,6).
Пример 17. Синтез HCl соли (S)-этил-1-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперидин-4-карбоксилата (соединение 104)
Приготовление 30
Синтез этилового сложного эфира 1-[5(S)-(N'-Pbf-гуанидин)-2-(2,4,6-триизопропил-бензолсульфониламино)-пентаноил]-пиперидин-4-карбоновой кислоты (ЕЕ) К раствору соединения СС (1,0 г, 1,6 ммоль) и NaOH (420,0 мг, 1,0,4 ммоль) в смеси THF (5 мл) и воды (4 мл) добавили по каплям раствор 2,4,6-триизопропил-бензолсульфонилхлорида (2,4 г, 8,0 ммоль) с перемешиванием и выдерживали при ~5°С. Затем реакционную смесь перемешивали при комнатной температуре в течение 1 часа, контролируя протекание реакции, затем разбавили водой (20 мл) и подкислили водной 1 н. HCl (5 мл) до pH ~3. Добавили дополнительную воду (30 мл) и продукт экстрагировали этилацетатом (3×50 мл). Органический слой промыли 2% водным бикарбонатом натрия (50 мл), водой (50 мл) и солевым раствором (50 мл). Органический слой высушили над безводным сульфатом натрия, отфильтровали и выпарили в вакууме. Образованный маслянистый остаток высушили в вакууме в течение ночи для получения соединения ЕЕ (1,0 г, 1,2 ммоль) в виде маслянистого материала. LC-MS [М+Н] 832,8 (C42H65N5O8S2+H, рассчит.: 832,7).
Синтез НС1 соли (S)-этил-1-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперидин-4-карбоксилата (соединение 104)
В колбу добавили соединение ЕЕ (2,3 г, 2,8 ммоль), а затем обработали 5% m-крезолом/TFA (16 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрировали в вакууме до объема 5 мл. Добавили гексан (200 мл) к остатку и декантировали для получения маслянистого осадка. Продукт очистили препаративной обращенно-фазовой HPLC. [Nanosyn-Pack Microsorb (100-10) С-18 колонка (50×300 мм); скорость потока = 100 мл/мин; вводимый объем 15 мл (DMSO-вода, 1:1, объем/объем); подвижная фаза А: 100% вода, 0,1% TFA; подвижная фаза В: 100% ACN, 0,1% TFA; градиентное элюирование от 35% В до 70% B в 90 мин, детектирование при 254 нм]. Фракции, содержащие желаемое соединение, объединили и концентрировали в вакууме. Остаток растворили в i-PrOH (100 мл) и выпарили в вакууме (повторили дважды). Остаток растворили в i-PrOH (5 мл) и обработали 2 н. HCl/эфиром (100 мл, 200 ммоль) для получения маслянистого остатка. Его сушили в вакууме в течение ночи для получения соединения 104 (1,08 г, 62,8%) в виде вязкого твердого вещества. LC-MS [М+Н] 580,6 (C29H49N5O5S+H, рассчит.: 580,8).
Пример 18. Синтез (S)-6-(4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-ил)-6-оксогексановой кислоты (соединение 105)
Приготовление 31
Синтез метилового сложного эфира 6-{4-[(S)-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-2-(нафталин-2-сульфониламино)-пентаноил]-пиперазин-1-ил}-6-оксо-капроновой кислоты (FF)
К раствору соединения W (1,5 г, 2,08 ммоль) в CHCl3 (50 мл) добавили DIEA (1,21 мл, 4,16 ммоль) с последующим адипоил-хлоридом (0,83 мл, 6,93 ммоль) по каплям. Реакционную смесь перемешивали при комнатной температуре в течение ночи (~18 часов). Растворители удалили в вакууме, а остаток высушили в вакууме для получения соединения FF (2,1 г, превышает количественный). LC-MS [М+Н] 827,5 (C40H54N6O9S2+H, рассчит.: 827,3). Соединение FF применяли без дополнительной очистки.
Приготовление 32
Синтез 6-{4-[(S)-5-({амино-[(Е)-2,2,4,6,7-пентаметил-2,3-дигидро-бензофуран-5-сульфонилимино]-метил}-амино)-2-(нафталин-2-сульфониламино)-пентаноил]-пиперазин-1-ил}-6-оксогексановой кислоты (GG)
К раствору соединения FF (2,1 г, 2,08 ммоль) в THF (5 мл), H2O (5 мл) добавили 2 молярный водный LiOH (6 мл). Реакционную смесь перемешивали при комнатной температуре 2 часа. Растворители удалили в вакууме, затем остаток растворили в воде (~50 мл), подкислили насыщенным водным NaHSO4 (~100 мл) и экстрагировали EtOAc (2×100 мл). Органический слой высушили над Na2SO4 и, удалив растворитель, получили соединение GG (1,72 г, 2,08 ммоль). LC-MS [М+Н] 813,5 (C39H52O9S2+Н, рассчит.: 813,3). Соединение GG применяли без дополнительной очистки.
Синтез (S)-6-(4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-ил)-6-оксогексановой кислоты (соединение 105)
Раствор 5% т-крезола/TFA (25 мл) добавили к соединению GG (1,72 г, 2,08 ммоль) при комнатной температуре. После перемешивания в течение 30 минут реакционную смесь осадили добавлением Et2O (~200 мл). Осадок отфильтровали, и промыли Et2O, и высушили в вакууме для получения неочищенного продукта. Неочищенный продукт очистили препаративной обращенно-фазовой HPLC [колонка: VARIAN, LOAD & LOCK, L&L 4002-2, заполнение: Microsob 100-10 С 18, вводимый объем: ~25 мл, скорость введенного потока: 20 мл/мин, 95% А, (вода/О, 1% TFA), скорость потока: 100 мл/мин, фракция: 30 с (50 мл), способ: 5% В (MeCN/0,1% TFA)/5 мин/ 25% В/20 мин/25% В/15 мин/50% В/25 мин/100 мл/мин/254 нм]. Растворители удалили из чистых фракций в вакууме. Следы воды удалили совместным выпариванием с i-PrOH (25 мл) (повторили дважды). Остаток растворили в минимальном количестве i-PrOH, затем добавили 2 молярную HCl в Et2O (~50 мл) и разбавили Et2O (~250 мл). Образованный осадок отфильтровали, промыли Et2O и высушили в вакууме для получения продукта в виде НС1 соли соединения 105 (0,74 г, выход 59%, чистота 98,9%). LC-MS [М+Н] 561,4 (C26H36N6O6S+Н, рассчит.: 561,2).
Пример 19. Синтез 3-(4-карбамимидоилфенил)-2-оксопропановой кислоты (соединение 107)
Соединение 107, т.е. 3-(4-карбамимидоилфенил)-2-оксопропановая кислота, может быть получено с использованием способов, известных специалистам данной области техники, таких как описанные у Richter. P et al, Pharmazie, 1977, 32, 216-220 и в содержащихся там ссылках. Чистоту соединения 107, примененного в Примере 7, оценили как 76%, оценка обусловлена низким УФ-поглощением этого соединения посредством HPLC. Данные масс-спектрометрии: LC-MS [М+Н] 207,0 (C10H10N2O3+H, рассчит.: 207,1).
Пример 20
Синтез (S)-5-(4-карбамимидоилбензиламино)-5-оксо-4-((T)-4-фенил-2-(фенилметилсульфонамид)бутанамид)пентановой кислоты (соединение 108)
Приготовление 33
Синтез бензинового сложного эфира (S)-4-трет-бутоксикарбониламино-4-(4-циано-бензилкарбамоил)-масляной кислоты (НН)
Раствор Boc-Glu(OBzl)-OH (7,08 г, 21,0 ммоль), ВОР (9,72 г, 22,0 ммоль) и DIEA (12,18 мл, 70,0 ммоль) в DMF (50 мл) выдерживали при комнатной температуре 20 минут с последующим добавлением 4-(аминометил)бензонитрила гидрохлорида (3,38 г, 20,0 ммоль). Реакционную смесь перемешивали при комнатной температуре еще 1 час и разбавили EtOAc (500 мл). Полученный раствор экстрагировали водой (100 мл), 5% водным NaHCO3 (100 мл) и водой (2×100 мл). Органический слой высушили над MgSO4, выпарили и высушили в вакууме для обеспечения соединения НН (9,65 г, выход превысил количественный) в виде желтоватого масла. LC-MS [М+Н] 452,0 (C25H29N3O5+Н, рассчит.: 452,4). Соединение НН применяли без дополнительной очистки.
Приготовление 34
Синтез бензинового сложного эфира (S)-4-трет-бутоксикарбониламино-4-[4-(N-гидроксикарбамимидоил)-бензил-карбамоил]-масляной кислоты (II)
Раствор соединения НН (9,65 г, 20,0 ммоль), гидроксиламина гидрохлорид (2,10 г, 30,0 ммоль) и DIEA (5,22 мл, 30,0 ммоль) в этаноле (абсолютный, 150 мл) нагревали с обратным холодильником 6 часов. Реакционной смеси позволили охладиться до комнатной температуры и перемешивали еще 16 часов, затем растворители выпарили в вакууме. Образованный остаток высушили в вакууме для обеспечения соединения II (14,8 г, выход превысил количественный) в виде желтоватого масла. LC-MS [М+Н] 485,5 (C25H32N4O6+Н, рассчит.: 485,8). Соединение II применяли без дополнительной очистки.
Приготовление 35
Синтез бензилового сложного эфира (S)-4-трет-бутоксикарбониламино-4-[4-(N-ацетилгидроксикарбамимидоил)-бензил-карбамоил]-масляной кислоты (JJ)
Раствор соединения II (14,8 г, 20,0 ммоль) и уксусного ангидрида (5,7 мл, 60,0 ммоль) в уксусной кислоте (100 мл) перемешивали при комнатной температуре 45 минут, а затем растворитель выпарили в вакууме. Образованный остаток растворили в EtOAc (300 мл) и экстрагировали водой (2×75 мл) и солевым раствором (75 мл). Затем органический слой высушили над MgSO4, выпарили и высушили в вакууме для обеспечения соединения JJ (9,58 г, 18,2 ммоль) в виде желтоватого твердого вещества. LC-MS [М+Н] 527,6 (C27H34N4O7+Н, рассчит.: 527,9). Соединение JJ применяли без дополнительной очистки.
Приготовление 36
Синтез бензилового сложного эфира (S)-4-[4-(N-ацетилгидроксикарбамимидоил)-бензил-карбамоил]-масляной кислоты (KK)
Соединение JJ (9,58 г, 18,2 ммоль) растворили в 1,4-диоксане (50 мл) и обрабатывали 4 н HCl/диоксаном (50 мл, 200 ммоль) при комнатной температуре в течение 1 часа. Затем растворитель выпарили в вакууме. Образованный остаток растерли с эфиром (200 мл). Полученный осадок отфильтровали, промыли эфиром (100 мл) и гексаном (50 мл) и высушили в вакууме для обеспечения соединения КК (9,64 г, выход превысил количественный) в виде грязно-белого твердого вещества. LC-MS [М+Н] 426,9 (C22H26H4O5+Н, рассчит.: 427,3). Соединение KK применяли без дополнительной очистки.
Приготовление 37
Синтез (R)-4-фенил-2-фенилметансульфониламино-масляной кислоты (LL)
Раствор D-гомо-фенилаланина (10,0 г, 55,9 ммоль) и NaOH (3,35 г, 83,8 ммоль) в смеси 1,4-диоксана (80 мл) и воды (50 мл) охладили до ~5°C с последующим периодическим добавлением α-толуолсульфонилхлорида (16,0 г, 83,8 ммоль; 5 порций по 3,2 г) и 1,12 молярный NaOH (50 мл, 55,9 ммоль; 5 порций по 10 мл), поддерживая pH>10. Реакционную смесь подкислили 2% водной H2SO4 до pH=~2. Полученный раствор экстрагировали EtOAc (2×200 мл). Органический слой промыли водой (3×75 мл), высушили над MgSO4, а затем растворитель выпарили в вакууме. Образованный остаток высушили в вакууме для обеспечения соединения LL (12,6 г, 37,5 ммоль) в виде белого твердого вещества. LC-MS [М+Н] 334,2 (C17H19NO4S+H, рассчит.: 333,4). Соединение LL применяли без дополнительной очистки.
Приготовление 38
Синтез бензинового сложного эфира (S)-4-[4-(N-ацетилгидроксикарбамимидоил)-бензилкарбамоил]-4-((R)-4-фенил-2-фенилметансульфониламино-бутириламино)-масляной кислоты (ММ)
Раствор соединения LL (5,9 г, 17,8 ммоль), дигидрохлорида соединения KK (18,0 ммоль), ВОР (8,65 г, 19,6 ммоль) и DIEA (10,96 мл, 19,6 ммоль) в DMF (250 мл) перемешивали при комнатной температуре 2 часа. Реакционную смесь разбавили EtOAc (750 мл) и экстрагировали водой (200 мл). Образованный осадок отфильтровали, промыли EtOAc (200 мл) и водой (200 мл) и высушили при комнатной температуре в течение ночи (~18 часов) для обеспечения соединения ММ (8,2 г, 11,0 ммоль) в виде грязно-белого твердого вещества. LC-MS [М+Н] 743,6 (C39H43N5O8S+Н, рассчит.: 743,9). Соединение MM применяли без дополнительной очистки.
Синтез (S)-5-(4-карбамимидоилбензиламино)-5-оксо-4-((R)-4-фенил-2-(фенилметилсульфонамид)бутанамид)пентановой кислоты (соединение 108)
Соединение ММ (8,0 г, 10,77 ммоль) растворили в уксусной кислоте (700 мл) с последующим добавлением Pd/C (5вес.%, 3,0 г) в виде суспензии в воде (50 мл). Реакционную смесь подвергли гидрированию (аппарат Парра, 5 psi) при комнатной температуре в течение 3 часов. Катализатор отфильтровали через подушку целита на фильтре из спеченного стекла и промыли метанолом. Фильтрат выпарили в вакууме для обеспечения соединения 108 в виде бесцветного масла. LC-MS [М+Н] 594,2 (C30H35N5O6S+Н, рассчит.: 594). Полученное масло растворили в воде (150 мл) и подвергли очистке с помощью HPLC. [Nanosyn-Pack YMC-ODS-A (100-10) С-18 колонка (75×300 мм); скорость потока = 250 мл/мин; вводимый объем 150 мл; подвижная фаза А: 100% вода, 0,1% TFA; подвижная фаза В: 100% ацетонитрил, 0,1% TFA; изократическое элюирование при 10% В в 4 мин, градиентное элюирование до 24% B в 18 мин, изократическое элюирование при 24% B в 20 мин, градиентное элюирование от 24% В до 58% B в 68 мин; детектирование при 254 нм]. Фракции, содержащие желаемое соединение, объединили и концентрировали в вакууме. Остаток растворили в i-PrOH (75 мл) и выпарили в вакууме (процедуру повторили дважды) для обеспечения соединения 108 (4,5 г, выход 70%, чистота 98,0%) в виде белого твердого вещества. LC-MS [М+Н] 594,2 (C30H35N5O6S+Н, рассчит.: 594). Время удерживания*: 3,55 мин.
* - [Chromolith SpeedRod RP-18e С18 колонка (4,6×50 мм); скорость потока 1,5 мл/мин; подвижная фаза А: 0,1% TFA/вода; подвижная фаза В 0,1% TFA/ацетонитрил; градиентное элюирование от 5% В до 100% В за 9,6 мин, детектирование 254 нм].
Между тем, как данное изобретение описано со ссылкой на его специфические варианты осуществления, специалисту в данном уровне техники понятно, что могут быть сделаны различные изменения, и эквиваленты могут быть замещены без отступления от истинной сущности и объема данного изобретения. К тому же, могут быть сделаны многие модификации для адаптации конкретной ситуации, материала, композиции материала, процесса, этапа или этапов процесса к цели, сущности и объему данного изобретения. Все эти модификации предназначены попадать в объем приложенной формулы изобретения.
Claims (51)
1. Фармацевтическая композиция для лечения или предотвращения боли или для снижения потенциального злоупотребления фенольными опиоидами, которая содержит ингибитор трипсина и соединение общей формулы (I)
или его фармацевтически приемлемую соль,
где X представляет собой остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 представляет собой (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4C)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу, остаток аминокислоты, дипептид или N-ацильное производное аминокислоты или дипептида.
или его фармацевтически приемлемую соль,
где X представляет собой остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 представляет собой (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4C)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу, остаток аминокислоты, дипептид или N-ацильное производное аминокислоты или дипептида.
2. Фармацевтическая композиция по п.1, где фенольный опиоид выбран из оксиморфона, гидроморфона и морфина.
3. Фармацевтическая композиция по п.1, где соединение общей формулы (I) имеет общую формулу (IV)
или его фармацевтически приемлемая соль,
где Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет собой (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4C)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу, остаток аминокислоты, дипептид или N-ацильное производное аминокислоты или дипептида.
или его фармацевтически приемлемая соль,
где Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет собой (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет собой атом водорода или (1-4C)алкильную группу;
n равно 2 или 3;
R4 представляет собой -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет собой атом водорода, N-ацильную группу, остаток аминокислоты, дипептид или N-ацильное производное аминокислоты или дипептида.
4. Фармацевтическая композиция по любому одному из пп.1-3, где R1 представляет метильную или этильную группу.
5. Фармацевтическая композиция по любому одному из пп.1-3, где каждый R2 и R3 представляет атом водорода.
6. Фармацевтическая композиция по любому одному из пп.1-3, где n представляет 2.
7. Фармацевтическая композиция по любому одному из пп.1-3, где R4 представляет-CH2CH2CH2NHC(=NH)(NH2).
8. Фармацевтическая композиция по любому одному из пп.1-3, где R5 представляет N-ацильную группу,
9. Фармацевтическая композиция по п, 8, где N-ацильная группа представляет собой N-(1-4C)алканоильную, N-бензоильную или N-пиперонильную группу.
10. Фармацевтическая композиция по любому одному из пп.1-3, где R5 представляет собой ацетильную, глицинильную или N-ацетилглицинильную группу.
11. Фармацевтическая композиция по п.10, где R5 представляет собой ацетильную группу.
12. Фармацевтическая композиция по любому одному из пп.1-3, где группа -C(O)-CH(R4)-NH(R5) представляет собой N-ацетиларгинин.
13. Фармацевтическая композиция по п.1, где X представляет собой гидроморфон; R1 представляет собой метил; каждый из R2 и R3 представляет собой атом водорода; n представляет собой 2; R4 представляет собой -CH2CH2CH2NHC(=NH)(NH2); и R5 представляет N-ацетильную группу.
14. Фармацевтическая композиция по любому одному из пп.1-3, где ингибитор трипсина получен из сои.
15. Фармацевтическая композиция по любому одному из пп.1-3, где ингибитор трипсина представляет собой миметик аргинина или миметик лизина.
16. Фармацевтическая композиция по п.15, где миметиком аргинина или миметиком лизина является синтетическое соединение.
18. Фармацевтическая композиция по любому одному из пп.1-3, где ингибитором трипсина является соединение формулы:
где Q5 представляет собой -C(O)-COOH или -NH-Q6-Q7-SO2-C6H5, где
Q6 представляет собой -(CH2)p-COOH;
Q7 представляет собой -(CH2)r-C6H5; и
p представляет собой целое число от одного до трех; и
r представляет собой целое число от одного до трех.
где Q5 представляет собой -C(O)-COOH или -NH-Q6-Q7-SO2-C6H5, где
Q6 представляет собой -(CH2)p-COOH;
Q7 представляет собой -(CH2)r-C6H5; и
p представляет собой целое число от одного до трех; и
r представляет собой целое число от одного до трех.
19. Фармацевтическая композиция по любому одному из пп.1-3, где ингибитор трипсина выбран из
(S)-этил-4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-4-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-6-(4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-ил)-6-оксогексановой кислоты;
4-аминобензимидамида;
3-(4-карбамимидоилфенил)-2-оксопропановой кислоты;
(S)-5-(4-карбамимидоилбензиламино)-5-оксо-4-((R)-4-фенил-2-(фенилметилсульфонамид)бутанамид)пентановой кислоты;
6-карбамимидоилнафталин-2-ил-4-(диаминометиленамино)бензоата; и
4,4′-(пентан-1,5-диилбис(окси))дибензимидамида.
(S)-этил-4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-4-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-6-(4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-ил)-6-оксогексановой кислоты;
4-аминобензимидамида;
3-(4-карбамимидоилфенил)-2-оксопропановой кислоты;
(S)-5-(4-карбамимидоилбензиламино)-5-оксо-4-((R)-4-фенил-2-(фенилметилсульфонамид)бутанамид)пентановой кислоты;
6-карбамимидоилнафталин-2-ил-4-(диаминометиленамино)бензоата; и
4,4′-(пентан-1,5-диилбис(окси))дибензимидамида.
20. Фармацевтическая композиция для лечения или предотвращения боли или для снижения потенциального злоупотребления фенольными опиоидами, которая содержит ингибитор трипсина и соединение общей формулы (II)
или его фармацевтически приемлемую соль,
где X представляет остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе с углеродом, к которому они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет целое число от 2 до 4;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
или его фармацевтически приемлемую соль,
где X представляет остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе с углеродом, к которому они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет целое число от 2 до 4;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
21. Фармацевтическая композиция по п.20, где соединение общей формулы (II) имеет общую формулу (V)
или его фармацевтически приемлемая соль,
где Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе с углеродом, к которому они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет целое число от 2 до 4;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
или его фармацевтически приемлемая соль,
где Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 выбран из алкила, замещенного алкила, арилалкила, замещенного арилалкила, арила и замещенного арила;
каждый R2 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
каждый R3 независимо выбран из водорода, алкила, замещенного алкила, арила, замещенного арила, ацила и аминоацила;
или R2 и R3 вместе с углеродом, к которому они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу, или две R2 или R3 группы на соседних атомах углерода вместе с атомами углерода, к которым они присоединены, образуют циклоалкильную или замещенную циклоалкильную группу;
n представляет целое число от 2 до 4;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
22. Фармацевтическая композиция по п.20, где соединение общей формулы (II) имеет общую формулу (III)
или его фармацевтически приемлемую соль,
где X представляет остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 представляет (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет атом водорода или (1-4C)алкильную группу;
n представляет 2 или 3;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
или его фармацевтически приемлемую соль,
где X представляет остаток фенольного опиоида, в котором атом водорода фенольной гидроксильной группы замещен ковалентной связью с -C(O)-NR1-(C(R2)(R3))n-NH-C(O)-CH(R4)-NH(R5);
R1 представляет (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет атом водорода или (1-4C)алкильную группу;
n представляет 2 или 3;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
23. Фармацевтическая композиция по п.22, где соединение общей формулы (III) имеет общую формулу (VI)
или его фармацевтически приемлемая соль,
где Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет атом водорода или (1-4C)алкильную группу;
n представляет 2 или 3;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
или его фармацевтически приемлемая соль,
где Ra представляет собой водород или гидроксил;
Rb представляет собой оксо- (=O) или гидроксил;
пунктирная линия представляет собой двойную связь или одинарную связь;
R1 представляет (1-4C)алкильную группу;
R2 и R3 каждый независимо представляет атом водорода или (1-4C)алкильную группу;
n представляет 2 или 3;
R4 представляет -CH2CH2CH2NH(C=NH)NH2 или -CH2CH2CH2CH2NH2, конфигурация атома углерода, к которому присоединен R4, отвечает таковой у L-аминокислоты; и
R5 представляет атом водорода, N-ацильную группу, N-замещенную ацильную группу, остаток аминокислоты, дипептид, N-ацильное производное аминокислоты или дипептида или N-замещенное ацильное производное аминокислоты или дипептида.
24. Фармацевтическая композиция по любому одному из пп.20-23, где ацил представляет собой замещенный ацил.
25. Фармацевтическая композиция по любому одному из пп.20-23, где n представляет собой 2.
26. Фармацевтическая композиция по любому одному из пп.20-23, где R1 представляет собой метил или этил.
27. Фармацевтическая композиция по любому одному из пп.20-23, где R5 представляет собой ацетил, бензоил, малонил, пиперонил, сукцинил, N-ацетиларгинин или N-ацетиллизин.
28. Фармацевтическая композиция по любому одному из пп.20-23, где R2 и R3 являются водородом.
29. Фармацевтическая композиция по любому одному из пп.20-23, где R2 и R3 на одном и том же углероде представляют собой алкил.
30. Фармацевтическая композиция по любому одному из пп.20-23, где R2 и R3 на одном и том же углероде образуют спироцикл.
31. Фармацевтическая композиция по любому одному из пп.20-23, где R2 и R3 на одном и том же углероде представляют собой метил.
32. Фармацевтическая композиция по любому одному из пп.20-23, где R2 и R3 могут модулировать скорость внутримолекулярной циклизации.
33. Фармацевтическая композиция по любому одному из пп.20-23, где R2 и R3 содержат электроноакцепторную группу или электронодонорную группу.
34. Фармацевтическая композиция по любому одному из пп.20-23, где -[C(R2)(R3)]n - выбран из -CH(CH2F)CH(CH2F)-; -CH(CHF2)CH(CHF2)-; -CH(CF3)CH(CF3)-; -CH2CH(CF3)-; -CH2CH(CHF2)-; -CH2CH(CH2F)-; -CH2CH(F)CH2-; -CH2C(F2)CH2-; -CH2CH(C(O)NR20R21)-; -CH2CH(C(O)OR22)-; -CH2CH(C(O)OH)-; -CH(CH2F)CH2CH(CH2F)-; -CH(CHF2)CH2CH(CHF2)-; -CH(CF3)CH2CH(CF3)-; -CH2CH2CH(CF3)-; -CH2CH2CH(CHF2)-; -CH2CH2CH(CH2F)-; -CH2CH2CH(C(O)NR23R24)-; -CH2CH2CH(C(O)OR25)- и CH2CH2CH(C(O)OH)-, в котором R20, R21, R22 и R23 каждый независимо представляет водород или (1-6C)алкил, и R24 и R25 каждый независимо представляет (1-6C)алкил.
35. Фармацевтическая композиция по любому одному из пп.20-23, где один из R2 и R3 представляет собой аминоацил.
38. Фармацевтическая композиция по п.37, где R10 представляет собой ацил.
39. Фармацевтическая композиция по любому одному из пп.20-23, где ингибитор трипсина получен из сои.
40. Фармацевтическая композиция по любому одному из пп.20-23, где ингибитор трипсина представляет собой миметик аргинина или миметик лизина.
41. Фармацевтическая композиция по п.40, где миметиком аргинина или миметиком лизина является синтетическое соединение.
43. Фармацевтическая композиция по любому одному из пп.20-23, где ингибитором трипсина является соединение формулы:
где Q5 представляет собой -C(O)-COOH или -NH-Q6-Q7-SO2-C6H5, где
Q6 представляет собой -(CH2)p-COOH;
Q7 представляет собой -(CH2)r-C6H5; и
p представляет собой целое число от одного до трех; и
r представляет собой целое число от одного до трех.
где Q5 представляет собой -C(O)-COOH или -NH-Q6-Q7-SO2-C6H5, где
Q6 представляет собой -(CH2)p-COOH;
Q7 представляет собой -(CH2)r-C6H5; и
p представляет собой целое число от одного до трех; и
r представляет собой целое число от одного до трех.
44. Фармацевтическая композиция по любому одному из пп.20-23, где ингибитор трипсина выбран из
(S)-этил-4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-4-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-6-(4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-ил)-6-оксогексановой кислоты;
4-аминобензимидамида;
3-(4-карбамимидоилфенил)-2-оксопропановой кислоты;
(S)-5-(4-карбамимидоилбензиламино)-5-оксо-4-((R)-4-фенил-2-(фенилметилсульфонамид)бутанамид)пентановой кислоты;
6-карбамимидоилнафталин-2-ил-4-(диаминометиленамино)бензоата; и
4,4′-(пентан-1,5-диилбис(окси))дибензимидамида.
(S)-этил-4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-4-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперазин-1-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-этил-1-(5-гуанидин-2-(2,4,6-триизопропилфенилсульфонамид)пентаноил)пиперидин-4-карбоксилата;
(S)-6-(4-(5-гуанидин-2-(нафталин-2-сульфонамид)пентаноил)пиперазин-1-ил)-6-оксогексановой кислоты;
4-аминобензимидамида;
3-(4-карбамимидоилфенил)-2-оксопропановой кислоты;
(S)-5-(4-карбамимидоилбензиламино)-5-оксо-4-((R)-4-фенил-2-(фенилметилсульфонамид)бутанамид)пентановой кислоты;
6-карбамимидоилнафталин-2-ил-4-(диаминометиленамино)бензоата; и
4,4′-(пентан-1,5-диилбис(окси))дибензимидамида.
45. Фармацевтическая композиция по п.1 для лечения или предотвращения боли или для снижения потенциального злоупотребления фенольными опиоидами, содержащая пролекарство фенольного опиоида, которое обеспечивает ферментативно-контролируемое высвобождение фенольного опиоида и ингибитор фермента, который взаимодействует с ферментом/ферментами, который опосредует ферментативно-контролируемое высвобождение фенольного опиоида из этого пролекарства путем ослабления ферментативного расщепления пролекарства.
46. Фармацевтическая композиция по п.45, в которой пролекарство фенольного опиоида содержит трипсин-лабильный участок, а указанный ингибитор фермента представляет собой ингибитор трипсина.
47. Способ лечения или предотвращения боли у пациента, нуждающегося в таком лечении, который включает введение пациенту эффективного количества фармацевтической композиции по любому одному из пп.1-3, 20-23 и 45-46.
48. Применение фармацевтической композиции по любому из пп.1-3, 20-23 и 45-46 в изготовлении лекарственного препарата для лечения или предотвращения боли.
49. Способ снижения потенциального злоупотребления фенольным опиоидом, включающий комбинирование пролекарства фенольного опиоида, которое обеспечивает ферментативно-контролируемое высвобождение фенольного опиоида с ингибитором фермента, который взаимодействует с ферментом/ферментами, который медиирует это ферментативно-контролируемое высвобождение фенольного опиоида из пролекарства для продуцирования фармацевтической композиции по п.1 и в котором ингибитор фермента снижает способность потребителя высвобождать фенольный опиоид из пролекарства фенольного опиоида путем добавления фермента.
50. Способ по п.49, в котором пролекарство фенольного опиоида содержит трипсинлабильный участок, а ингибитор фермента представляет собой ингибитор трипсина.
51. Способ по п.49, в котором пролекарство фенольного опиоида представляет собой соединение формулы I-VI, а ингибитор фермента является ингибитором трипсина.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10640008P | 2008-10-17 | 2008-10-17 | |
| US61/106,400 | 2008-10-17 | ||
| PCT/US2009/061068 WO2010045599A1 (en) | 2008-10-17 | 2009-10-16 | Pharmaceutical compositions with attenuated release of phenolic opioids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011119643A RU2011119643A (ru) | 2012-11-27 |
| RU2562583C2 true RU2562583C2 (ru) | 2015-09-10 |
Family
ID=41466912
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011119643/15A RU2562583C2 (ru) | 2008-10-17 | 2009-10-16 | Фармацевтические композиции с уменьшенным высвобождением фенольных опиоидов |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US8802681B2 (ru) |
| EP (1) | EP2349241B1 (ru) |
| JP (2) | JP5706825B2 (ru) |
| KR (1) | KR20110081852A (ru) |
| CN (1) | CN102186467B (ru) |
| AU (1) | AU2009305563C1 (ru) |
| BR (1) | BRPI0919711A2 (ru) |
| CA (1) | CA2739936C (ru) |
| IL (1) | IL212081A (ru) |
| MX (1) | MX2011004095A (ru) |
| RU (1) | RU2562583C2 (ru) |
| WO (1) | WO2010045599A1 (ru) |
| ZA (1) | ZA201102361B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2608305C2 (ru) * | 2011-03-09 | 2017-01-17 | Сигничер Терапьютикс, Инк. | Пролекарства действующих веществ гетероциклическими линкерами |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20110081852A (ko) | 2008-10-17 | 2011-07-14 | 파마코포어, 인크. | 페놀성 오피오이드를 약독화시켜 방출하는 약제학적 조성물 |
| WO2011008636A1 (en) * | 2009-07-15 | 2011-01-20 | Mallinckrodt Inc. | 3-oxy-hydromorphone derivatives |
| CN102695545B (zh) | 2009-09-08 | 2016-08-17 | 特色疗法股份有限公司 | 包括酶可剪切的酮改性的阿片样物质药物前体以及其可任选的抑制剂的组合物 |
| ES2710617T3 (es) | 2010-04-21 | 2019-04-26 | Signature Therapeutics Inc | Composiciones que comprenden profármacos de anfetamina escindibles enzimáticamente e inhibidores de los mismos |
| WO2011133149A1 (en) * | 2010-04-21 | 2011-10-27 | Pharmacofore, Inc. | Compositions comprising enzyme-cleavable opioid prodrugs and inhibitors thereof |
| WO2011133151A1 (en) * | 2010-04-21 | 2011-10-27 | Pharmacofore, Inc. | Compositions comprising enzyme-cleavable phenol-modified opioid prodrugs and inhibitors thereof |
| US20110262355A1 (en) | 2010-04-21 | 2011-10-27 | Jenkins Thomas E | Compositions comprising enzyme-cleavable opioid prodrugs and inhibitors thereof |
| US20110262359A1 (en) * | 2010-04-21 | 2011-10-27 | Jenkins Thomas E | Compositions comprising enzyme-cleavable prodrugs of active agents and inhibitors thereof |
| WO2011133178A1 (en) * | 2010-04-21 | 2011-10-27 | Pharmacofore, Inc | Compositions comprising enzyme-cleavable phenol-modified tapentadol prodrug |
| WO2012096886A1 (en) * | 2011-01-11 | 2012-07-19 | Signature Therapeutics, Inc. | Compositions comprising enzyme-cleavable oxycodone prodrug |
| EP2663187B1 (en) * | 2011-01-11 | 2016-06-01 | Signature Therapeutics, Inc. | Compositions comprising enzyme-cleavable oxycodone prodrug |
| WO2012122420A2 (en) * | 2011-03-09 | 2012-09-13 | Pharmacofore, Inc. | Opioid prodrugs with heterocyclic linkers |
| WO2016064914A1 (en) | 2014-10-20 | 2016-04-28 | Elysium Therapeutics, Inc. | Diversion-resistant opioid formulations |
| US11634384B2 (en) | 2014-11-25 | 2023-04-25 | Concentric Analgesics, Inc. | Prodrugs of phenolic TRPV1 agonists |
| US9808452B2 (en) * | 2015-10-01 | 2017-11-07 | Elysium Therapeutics, Inc. | Polysubunit opioid prodrugs resistant to overdose and abuse |
| US10335406B2 (en) | 2015-10-01 | 2019-07-02 | Elysium Therapeutics, Inc. | Opioid compositions resistant to overdose and abuse |
| EP3463576A4 (en) | 2016-05-25 | 2020-01-15 | Concentric Analgesics, Inc. | PRODRUGS BY PHENOLIC TRPV1 AGONISTS IN COMBINATION WITH LOCAL ANESTHETIC AND VASOCONSTRICTORS FOR IMPROVED LOCAL ANESTHESIA |
| AU2018234911B2 (en) | 2017-03-17 | 2024-04-18 | Elysium Therapeutics, Inc. | Polysubunit opioid prodrugs resistant to overdose and abuse |
| JP2021532183A (ja) | 2018-07-27 | 2021-11-25 | コンセントリック アナルジェジクス,インク. | フェノール性trpv1アゴニストのpeg化プロドラッグ |
| WO2022192197A1 (en) * | 2021-03-09 | 2022-09-15 | Ensysce Biosciences Inc. | Compositions comprising enzyme-cleavable prodrugs and controlled release nafamostat and methods of use thereof |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2166512C2 (ru) * | 1995-01-16 | 2001-05-10 | Коммонвелт Сайентифик Энд Индастриал Рисерч Организейшн | Конъюгаты терапевтического соединения с жирной кислотой |
| US20030035831A1 (en) * | 1998-12-21 | 2003-02-20 | Pankaj Modi | Pharmaceutical compositions for buccal delivery of pain relief medications |
| US20070123468A1 (en) * | 2005-08-19 | 2007-05-31 | Pharmacofore, Inc. | Prodrugs of active agents |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU527371B2 (en) | 1980-09-16 | 1983-03-03 | Torii & Co., Ltd. | Amidine |
| US5109118A (en) * | 1989-07-06 | 1992-04-28 | Yutaka Mizushima | Modified biologically active proteins |
| CA2032420A1 (en) | 1989-12-22 | 1991-06-23 | Akira Okuyama | Guanidinobenzene derivatives |
| US6692766B1 (en) | 1994-06-15 | 2004-02-17 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Controlled release oral drug delivery system |
| WO1997037969A1 (fr) | 1996-04-10 | 1997-10-16 | Ono Pharmaceutical Co., Ltd. | Inhibiteur de tryptase derives de guanidino |
| ATE441725T1 (de) | 1998-12-15 | 2009-09-15 | Applera Corp | Multienzym-nachweisverfahren |
| EP1161226B1 (en) | 1999-02-18 | 2004-05-26 | SuperGen, Inc. | Phosphocholine linked prodrug derivatives |
| US7060708B2 (en) | 1999-03-10 | 2006-06-13 | New River Pharmaceuticals Inc. | Active agent delivery systems and methods for protecting and administering active agents |
| US20030180352A1 (en) * | 1999-11-23 | 2003-09-25 | Patel Mahesh V. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| CA2450316A1 (en) | 2001-06-11 | 2002-12-19 | Medarex, Inc. | Cd10-activated prodrug compounds |
| US7169752B2 (en) | 2003-09-30 | 2007-01-30 | New River Pharmaceuticals Inc. | Compounds and compositions for prevention of overdose of oxycodone |
| US7375082B2 (en) | 2002-02-22 | 2008-05-20 | Shire Llc | Abuse-resistant hydrocodone compounds |
| US20100092562A1 (en) | 2002-11-26 | 2010-04-15 | Hollenbeck R Gary | Sustained-release drug delivery compositions and methods |
| AU2004251647B2 (en) | 2003-05-29 | 2010-01-14 | Takeda Pharmaceutical Company Limited | Abuse resistant amphetamine compounds |
| CA2620202C (en) * | 2005-08-26 | 2016-10-04 | The Board Of Trustees Of The Leland Stanford Junior University | Therapy procedure for drug delivery for trigeminal pain |
| EP1934201A1 (en) | 2005-10-06 | 2008-06-25 | Auspex Pharmaceuticals Inc. | Deuterated inhibitors of gastric h+, k+-atpase with enhanced therapeutic properties |
| BRPI0619425A2 (pt) | 2005-12-05 | 2011-10-04 | Xenoport Inc | mesilato de pró-fármaco de levedopa, composição farmacêutica, método de preparar (2s)-2- amino-3-(3,4-diidróxi fenil) propanoato de mesilato de (2r)-2- fenil carbonilóxi propila e uso do referido composto |
| WO2007120864A2 (en) | 2006-04-14 | 2007-10-25 | Shire Llc | Compositions and methods for enhancing analgesic potency of covalently bound compounds, attenuating its adverse side effects, and preventing their abuse |
| ES2456674T3 (es) * | 2006-05-26 | 2014-04-23 | Signature Therapeutics, Inc. | Liberación controlada de opioides fenólicos |
| TWI401237B (zh) | 2006-07-24 | 2013-07-11 | 3-〔(1r,2r)-3-(二甲基氨基)-1-乙基-2-甲基丙基〕酚之製備 | |
| WO2008101202A1 (en) | 2007-02-16 | 2008-08-21 | Pharmacofore, Inc. | N-17-alkylated prodrugs of opioids |
| US20110105381A2 (en) | 2007-02-16 | 2011-05-05 | Pharmacofore, Inc. | Prodrugs of Peripheral Phenolic Opioid Antagonists |
| EP2219633A2 (en) | 2007-11-23 | 2010-08-25 | Nectid, Inc. | Tapentadol compositions |
| US9023860B2 (en) | 2007-11-26 | 2015-05-05 | Signature Therapeutics, Inc. | Pro-drugs for controlled release of biologically active compounds |
| US20090186832A1 (en) | 2008-01-18 | 2009-07-23 | Shire Llc | Amino acid peptide pro-drugs of phenolic analgesics and uses thereof |
| ES2671897T3 (es) | 2008-02-14 | 2018-06-11 | Alkermes, Inc. | Compuestos opioides selectivos |
| KR20110081852A (ko) | 2008-10-17 | 2011-07-14 | 파마코포어, 인크. | 페놀성 오피오이드를 약독화시켜 방출하는 약제학적 조성물 |
| US20100227921A1 (en) | 2009-03-03 | 2010-09-09 | Shire Llc | Amino acid and peptide carbamate prodrugs of tapentadol and uses thereof |
| EP2413937A1 (en) | 2009-04-02 | 2012-02-08 | Shire LLC | Novel dicarboxylic acid linked amino acid and peptide prodrugs of opioids and uses thereof |
| MX2012000752A (es) | 2009-07-17 | 2012-05-08 | Shire Llc | Profármarcos novedosos de péptidos y aminoácidos de carbamato de opioides y usos de los mismos. |
| WO2011133346A1 (en) | 2010-04-21 | 2011-10-27 | Pharmacofore, Inc. | Peripheral opioid agonists and peripheral opioid antagonists |
-
2009
- 2009-10-16 KR KR1020117011102A patent/KR20110081852A/ko not_active Application Discontinuation
- 2009-10-16 US US13/121,335 patent/US8802681B2/en active Active
- 2009-10-16 JP JP2011532298A patent/JP5706825B2/ja active Active
- 2009-10-16 WO PCT/US2009/061068 patent/WO2010045599A1/en active Application Filing
- 2009-10-16 CA CA2739936A patent/CA2739936C/en active Active
- 2009-10-16 MX MX2011004095A patent/MX2011004095A/es not_active Application Discontinuation
- 2009-10-16 CN CN200980141547.0A patent/CN102186467B/zh active Active
- 2009-10-16 BR BRPI0919711A patent/BRPI0919711A2/pt not_active Application Discontinuation
- 2009-10-16 EP EP09740597.1A patent/EP2349241B1/en active Active
- 2009-10-16 RU RU2011119643/15A patent/RU2562583C2/ru active
- 2009-10-16 AU AU2009305563A patent/AU2009305563C1/en active Active
-
2011
- 2011-03-30 ZA ZA2011/02361A patent/ZA201102361B/en unknown
- 2011-04-03 IL IL212081A patent/IL212081A/en active IP Right Grant
-
2014
- 2014-06-30 US US14/320,351 patent/US9534014B2/en active Active
-
2015
- 2015-02-27 JP JP2015037724A patent/JP2015129167A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2166512C2 (ru) * | 1995-01-16 | 2001-05-10 | Коммонвелт Сайентифик Энд Индастриал Рисерч Организейшн | Конъюгаты терапевтического соединения с жирной кислотой |
| US20030035831A1 (en) * | 1998-12-21 | 2003-02-20 | Pankaj Modi | Pharmaceutical compositions for buccal delivery of pain relief medications |
| US20070123468A1 (en) * | 2005-08-19 | 2007-05-31 | Pharmacofore, Inc. | Prodrugs of active agents |
Non-Patent Citations (1)
| Title |
|---|
| TIRKKONEN T., et.al., Drug interactions with the potential to prevent prodrug activation as a common source of irrational prescribing in hospital inpatients. Clin Pharmacol Ther. 2004 Dec;76(6):639-47 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2608305C2 (ru) * | 2011-03-09 | 2017-01-17 | Сигничер Терапьютикс, Инк. | Пролекарства действующих веществ гетероциклическими линкерами |
Also Published As
| Publication number | Publication date |
|---|---|
| IL212081A0 (en) | 2011-06-30 |
| AU2009305563A1 (en) | 2010-04-22 |
| BRPI0919711A2 (pt) | 2015-12-08 |
| MX2011004095A (es) | 2011-07-28 |
| KR20110081852A (ko) | 2011-07-14 |
| EP2349241B1 (en) | 2019-06-19 |
| CA2739936A1 (en) | 2010-04-22 |
| US9534014B2 (en) | 2017-01-03 |
| JP5706825B2 (ja) | 2015-04-22 |
| CN102186467B (zh) | 2014-06-04 |
| AU2009305563B2 (en) | 2015-02-05 |
| EP2349241A1 (en) | 2011-08-03 |
| ZA201102361B (en) | 2012-09-26 |
| JP2012509846A (ja) | 2012-04-26 |
| JP2015129167A (ja) | 2015-07-16 |
| US20110281886A1 (en) | 2011-11-17 |
| CA2739936C (en) | 2017-12-12 |
| RU2011119643A (ru) | 2012-11-27 |
| AU2009305563C1 (en) | 2015-09-03 |
| US20150031635A1 (en) | 2015-01-29 |
| WO2010045599A1 (en) | 2010-04-22 |
| CN102186467A (zh) | 2011-09-14 |
| IL212081A (en) | 2016-05-31 |
| US8802681B2 (en) | 2014-08-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2562583C2 (ru) | Фармацевтические композиции с уменьшенным высвобождением фенольных опиоидов | |
| US10028945B2 (en) | Compositions comprising enzyme-cleavable ketone-modified opioid prodrugs and optional inhibitors thereof | |
| RU2608305C2 (ru) | Пролекарства действующих веществ гетероциклическими линкерами | |
| US11400062B2 (en) | Compositions comprising enzyme-cleavable amphetamine prodrugs and inhibitors thereof | |
| US9095627B2 (en) | Opioid prodrugs with heterocyclic linkers | |
| US20130210700A1 (en) | Compositions Comprising Enzyme-Cleavable Phenol-Modified Opioid Prodrugs and Inhibitors Thereof | |
| US9238020B2 (en) | Compositions comprising enzyme-cleavable phenol-modified tapentadol prodrug | |
| WO2011133151A1 (en) | Compositions comprising enzyme-cleavable phenol-modified opioid prodrugs and inhibitors thereof | |
| WO2011133347A1 (en) | Compositions comprising trypsin-cleavable amphetamine prodrugs and inhibitors thereof |