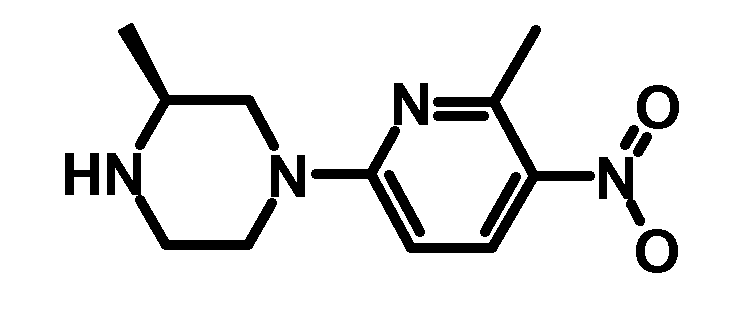
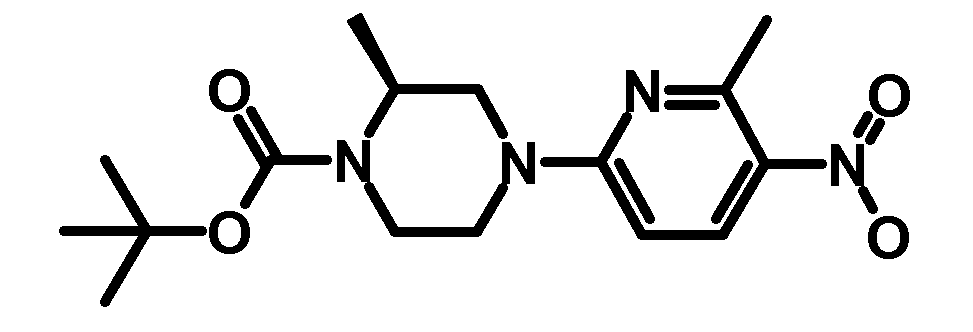
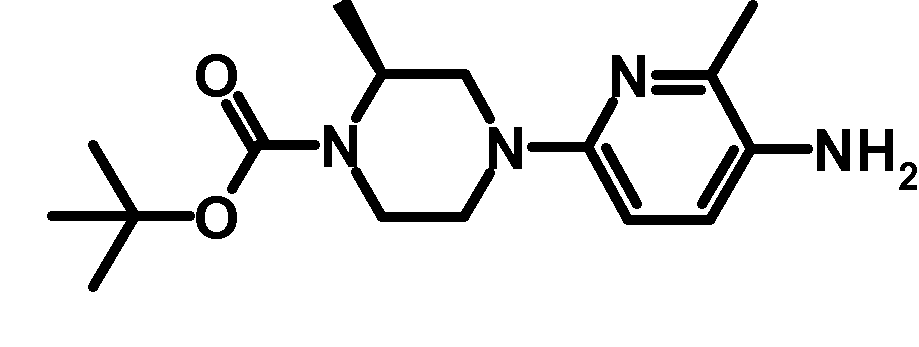
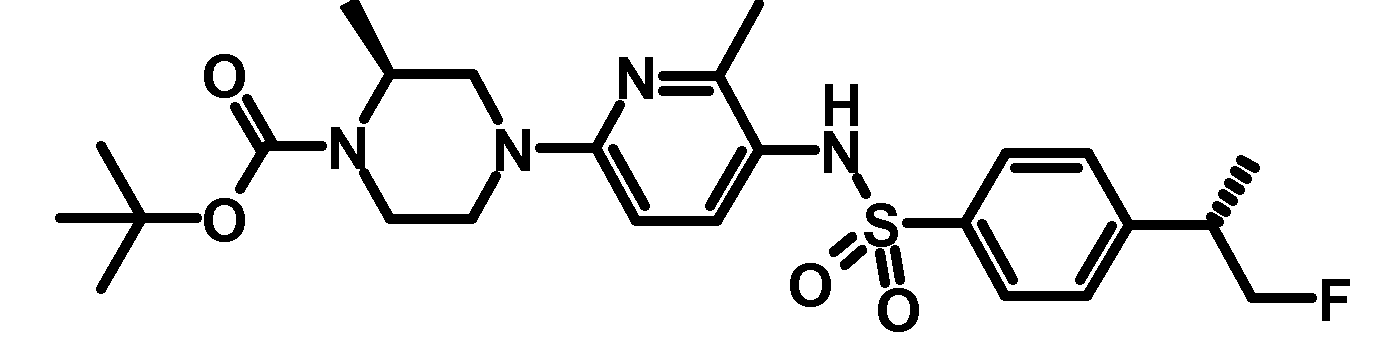
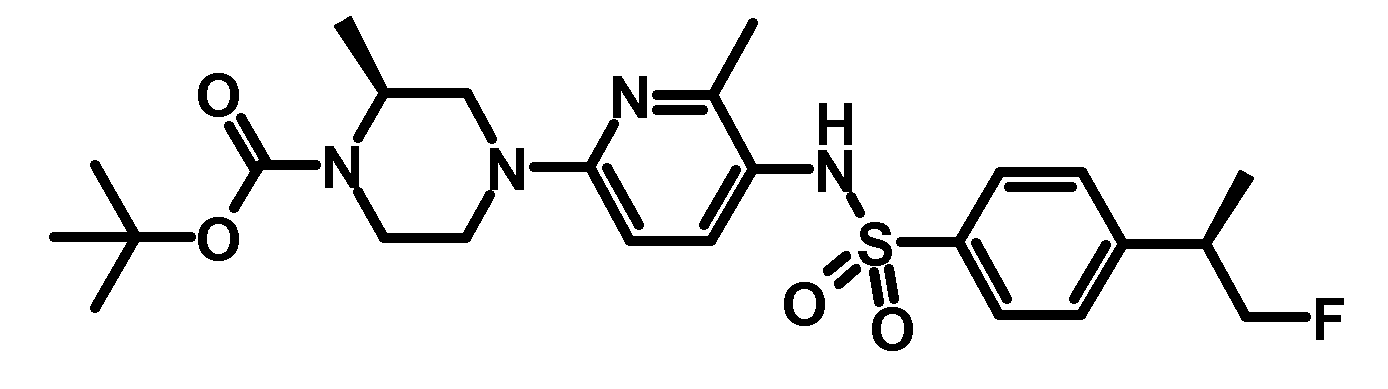
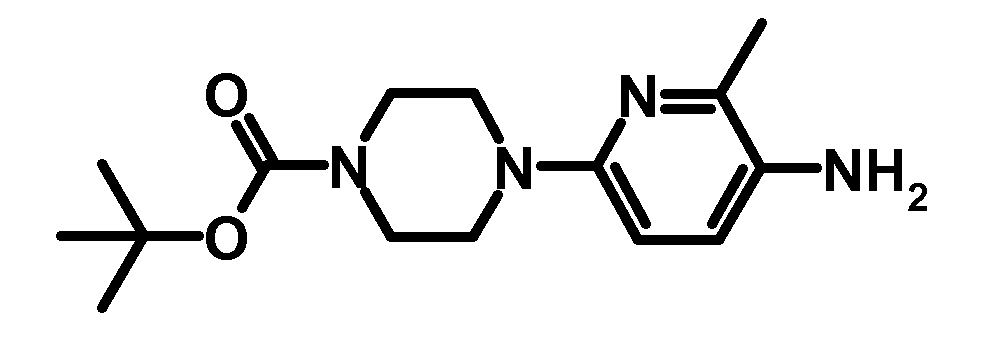
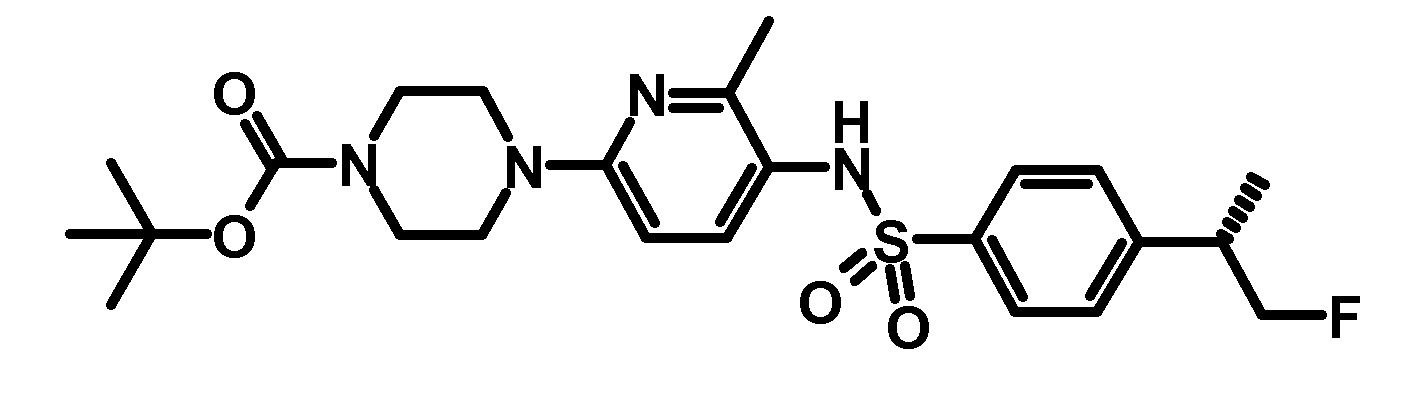
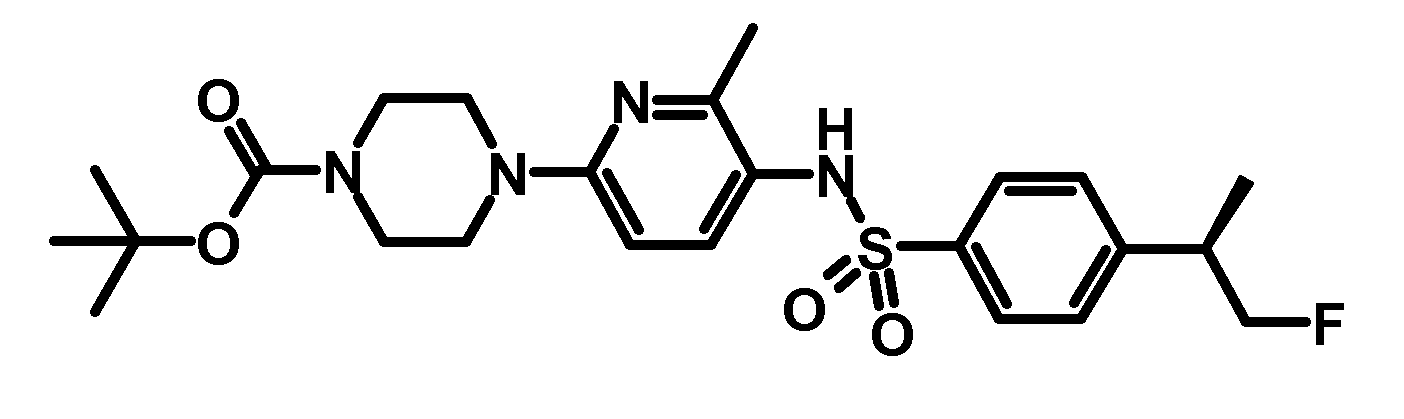
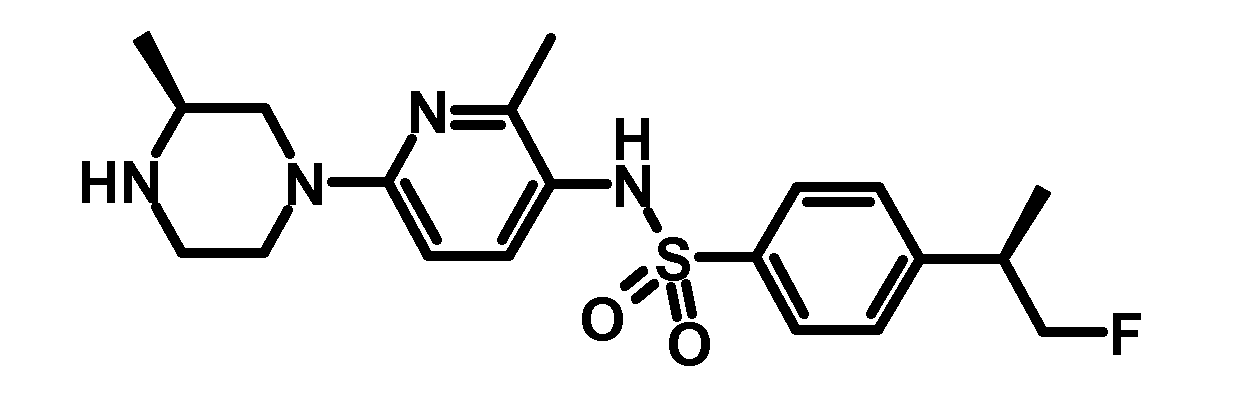
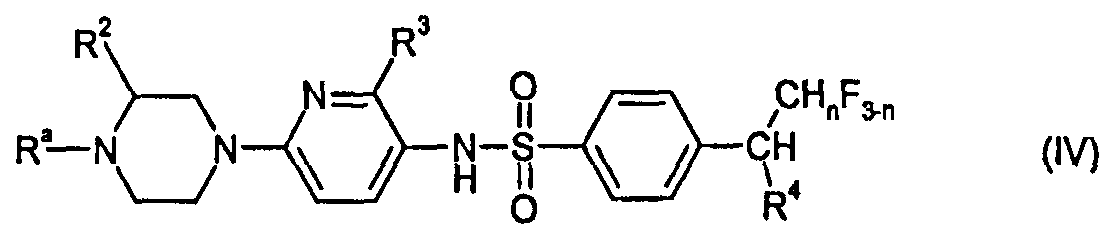
RU2485103C2 - Бензолсульфаномидные соединения, пригодные для лечения расстройств, которые восприимчивы к модуляции дофаминового рецептора d3 - Google Patents
Бензолсульфаномидные соединения, пригодные для лечения расстройств, которые восприимчивы к модуляции дофаминового рецептора d3 Download PDFInfo
- Publication number
- RU2485103C2 RU2485103C2 RU2010121830/04A RU2010121830A RU2485103C2 RU 2485103 C2 RU2485103 C2 RU 2485103C2 RU 2010121830/04 A RU2010121830/04 A RU 2010121830/04A RU 2010121830 A RU2010121830 A RU 2010121830A RU 2485103 C2 RU2485103 C2 RU 2485103C2
- Authority
- RU
- Russia
- Prior art keywords
- methyl
- methylethyl
- pyridin
- piperazin
- compounds
- Prior art date
Links
- KHBQMWCZKVMBLN-UHFFFAOYSA-N Benzenesulfonamide Chemical class NS(=O)(=O)C1=CC=CC=C1 KHBQMWCZKVMBLN-UHFFFAOYSA-N 0.000 title 1
- 102000004073 Dopamine D3 Receptors Human genes 0.000 title 1
- 108090000525 Dopamine D3 Receptors Proteins 0.000 title 1
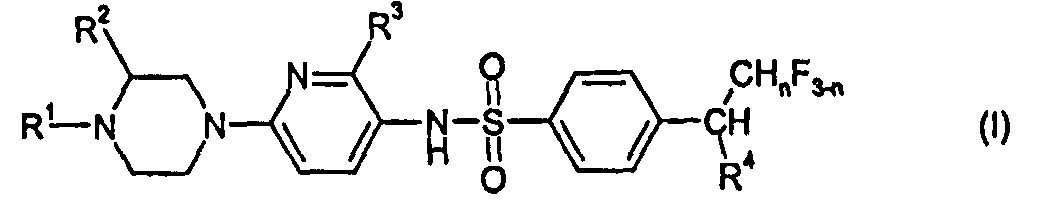
- 150000001875 compounds Chemical class 0.000 claims abstract description 174
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 56
- 150000003839 salts Chemical class 0.000 claims abstract description 49
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 claims abstract description 48
- 102000005962 receptors Human genes 0.000 claims abstract description 41
- 108020003175 receptors Proteins 0.000 claims abstract description 41
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 38
- 239000001257 hydrogen Substances 0.000 claims abstract description 29
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 29
- 201000010099 disease Diseases 0.000 claims abstract description 27
- 229960003638 dopamine Drugs 0.000 claims abstract description 24
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 22
- 230000000694 effects Effects 0.000 claims abstract description 17
- 238000000034 method Methods 0.000 claims abstract description 17
- 239000003814 drug Substances 0.000 claims abstract description 12
- 150000002431 hydrogen Chemical class 0.000 claims abstract description 6
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 6
- -1 2-fluoro-1-methylethyl Chemical group 0.000 claims description 27
- 125000004432 carbon atom Chemical group C* 0.000 claims description 25
- 229910052799 carbon Inorganic materials 0.000 claims description 20
- 238000011282 treatment Methods 0.000 claims description 20
- 102000015554 Dopamine receptor Human genes 0.000 claims description 13
- 108050004812 Dopamine receptor Proteins 0.000 claims description 13
- 125000000217 alkyl group Chemical group 0.000 claims description 13
- 238000004519 manufacturing process Methods 0.000 claims description 12
- 239000003446 ligand Substances 0.000 claims description 11
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 10
- YNNZLVJIRJLSGS-UHFFFAOYSA-N n-(6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical class C=1C=CC=CC=1S(=O)(=O)NC(C=N1)=CC=C1N1CCNCC1 YNNZLVJIRJLSGS-UHFFFAOYSA-N 0.000 claims description 6
- 208000011117 substance-related disease Diseases 0.000 claims description 6
- 201000000980 schizophrenia Diseases 0.000 claims description 5
- 208000020925 Bipolar disease Diseases 0.000 claims description 4
- 206010013663 drug dependence Diseases 0.000 claims description 4
- CXGRBCNVHFRMCP-UHFFFAOYSA-N 4-(1,1-difluoropropan-2-yl)-n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C(C(C)C(F)F)C=C1 CXGRBCNVHFRMCP-UHFFFAOYSA-N 0.000 claims description 3
- HFTXKEUJWTVRGI-UHFFFAOYSA-N 4-(1,1-difluoropropan-2-yl)-n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound C1=CC(C(C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C HFTXKEUJWTVRGI-UHFFFAOYSA-N 0.000 claims description 3
- HFTXKEUJWTVRGI-CYBMUJFWSA-N 4-[(2r)-1,1-difluoropropan-2-yl]-n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound C1=CC([C@H](C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C HFTXKEUJWTVRGI-CYBMUJFWSA-N 0.000 claims description 3
- PEOSNVHPACNWDW-AWEZNQCLSA-N 4-[(2r)-1-fluoropropan-2-yl]-n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C([C@@H](C)CF)C=C1 PEOSNVHPACNWDW-AWEZNQCLSA-N 0.000 claims description 3
- ULVSDQSELZHTLN-AWEZNQCLSA-N 4-[(2r)-1-fluoropropan-2-yl]-n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound C1=CC([C@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C ULVSDQSELZHTLN-AWEZNQCLSA-N 0.000 claims description 3
- KBAXDLPENRZPNR-GJZGRUSLSA-N 4-[(2r)-1-fluoropropan-2-yl]-n-[2-methyl-6-[(3s)-3-methylpiperazin-1-yl]pyridin-3-yl]benzenesulfonamide Chemical compound C1=CC([C@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)NCC2)N=C1C KBAXDLPENRZPNR-GJZGRUSLSA-N 0.000 claims description 3
- HFTXKEUJWTVRGI-ZDUSSCGKSA-N 4-[(2s)-1,1-difluoropropan-2-yl]-n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound C1=CC([C@@H](C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C HFTXKEUJWTVRGI-ZDUSSCGKSA-N 0.000 claims description 3
- PEOSNVHPACNWDW-CQSZACIVSA-N 4-[(2s)-1-fluoropropan-2-yl]-n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C([C@H](C)CF)C=C1 PEOSNVHPACNWDW-CQSZACIVSA-N 0.000 claims description 3
- ULVSDQSELZHTLN-CQSZACIVSA-N 4-[(2s)-1-fluoropropan-2-yl]-n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound C1=CC([C@@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C ULVSDQSELZHTLN-CQSZACIVSA-N 0.000 claims description 3
- KBAXDLPENRZPNR-CABCVRRESA-N 4-[(2s)-1-fluoropropan-2-yl]-n-[2-methyl-6-[(3s)-3-methylpiperazin-1-yl]pyridin-3-yl]benzenesulfonamide Chemical compound C1=CC([C@@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)NCC2)N=C1C KBAXDLPENRZPNR-CABCVRRESA-N 0.000 claims description 3
- 208000007342 Diabetic Nephropathies Diseases 0.000 claims description 3
- 208000033679 diabetic kidney disease Diseases 0.000 claims description 3
- LJJSAMRQOROYQX-UHFFFAOYSA-N n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)-4-(1,1,1-trifluoropropan-2-yl)benzenesulfonamide Chemical compound C1=CC(C(C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C LJJSAMRQOROYQX-UHFFFAOYSA-N 0.000 claims description 3
- LJJSAMRQOROYQX-CYBMUJFWSA-N n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)-4-[(2r)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound C1=CC([C@@H](C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C LJJSAMRQOROYQX-CYBMUJFWSA-N 0.000 claims description 3
- LJJSAMRQOROYQX-ZDUSSCGKSA-N n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)-4-[(2s)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound C1=CC([C@H](C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C LJJSAMRQOROYQX-ZDUSSCGKSA-N 0.000 claims description 3
- CXGRBCNVHFRMCP-CYBMUJFWSA-N 4-[(2r)-1,1-difluoropropan-2-yl]-n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C([C@@H](C)C(F)F)C=C1 CXGRBCNVHFRMCP-CYBMUJFWSA-N 0.000 claims description 2
- CXGRBCNVHFRMCP-ZDUSSCGKSA-N 4-[(2s)-1,1-difluoropropan-2-yl]-n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C([C@H](C)C(F)F)C=C1 CXGRBCNVHFRMCP-ZDUSSCGKSA-N 0.000 claims description 2
- 229940124530 sulfonamide Drugs 0.000 claims 3
- PEOSNVHPACNWDW-UHFFFAOYSA-N 4-(1-fluoropropan-2-yl)-n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C(C(C)CF)C=C1 PEOSNVHPACNWDW-UHFFFAOYSA-N 0.000 claims 1
- 208000015114 central nervous system disease Diseases 0.000 claims 1
- 239000000126 substance Substances 0.000 abstract description 17
- 239000002253 acid Substances 0.000 abstract description 14
- 125000004435 hydrogen atom Chemical group [H]* 0.000 abstract description 4
- 239000002464 receptor antagonist Substances 0.000 abstract description 4
- 229940044551 receptor antagonist Drugs 0.000 abstract description 4
- 239000000556 agonist Substances 0.000 abstract description 2
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 abstract 1
- 210000000653 nervous system Anatomy 0.000 abstract 1
- 239000000203 mixture Substances 0.000 description 52
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 31
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 28
- 208000035475 disorder Diseases 0.000 description 27
- 150000001204 N-oxides Chemical class 0.000 description 25
- 239000002904 solvent Substances 0.000 description 24
- 238000006243 chemical reaction Methods 0.000 description 20
- 150000002941 palladium compounds Chemical class 0.000 description 20
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 18
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 18
- 238000005160 1H NMR spectroscopy Methods 0.000 description 17
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 17
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 15
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 13
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 12
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 11
- 230000027455 binding Effects 0.000 description 11
- 239000000460 chlorine Substances 0.000 description 11
- 229910052801 chlorine Inorganic materials 0.000 description 11
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 10
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 10
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 9
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 8
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 8
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 8
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 7
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 7
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 7
- 239000002585 base Substances 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 239000003054 catalyst Substances 0.000 description 7
- 210000003169 central nervous system Anatomy 0.000 description 7
- 125000004786 difluoromethoxy group Chemical group [H]C(F)(F)O* 0.000 description 7
- 229910052731 fluorine Inorganic materials 0.000 description 7
- 239000011737 fluorine Substances 0.000 description 7
- 150000003840 hydrochlorides Chemical class 0.000 description 7
- 230000009467 reduction Effects 0.000 description 7
- 229910052938 sodium sulfate Inorganic materials 0.000 description 7
- 235000011152 sodium sulphate Nutrition 0.000 description 7
- 208000024891 symptom Diseases 0.000 description 7
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 7
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 6
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 230000004064 dysfunction Effects 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 239000012074 organic phase Substances 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 6
- 208000028017 Psychotic disease Diseases 0.000 description 5
- 239000012043 crude product Substances 0.000 description 5
- 238000011534 incubation Methods 0.000 description 5
- 230000035939 shock Effects 0.000 description 5
- 208000011580 syndromic disease Diseases 0.000 description 5
- HTSGKJQDMSTCGS-UHFFFAOYSA-N 1,4-bis(4-chlorophenyl)-2-(4-methylphenyl)sulfonylbutane-1,4-dione Chemical compound C1=CC(C)=CC=C1S(=O)(=O)C(C(=O)C=1C=CC(Cl)=CC=1)CC(=O)C1=CC=C(Cl)C=C1 HTSGKJQDMSTCGS-UHFFFAOYSA-N 0.000 description 4
- 208000019901 Anxiety disease Diseases 0.000 description 4
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 4
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- 102000018658 Myotonin-Protein Kinase Human genes 0.000 description 4
- 108010052185 Myotonin-Protein Kinase Proteins 0.000 description 4
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 4
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 4
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 4
- 206010062237 Renal impairment Diseases 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 239000012296 anti-solvent Substances 0.000 description 4
- 239000000164 antipsychotic agent Substances 0.000 description 4
- 230000036506 anxiety Effects 0.000 description 4
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 4
- 229910052794 bromium Inorganic materials 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 230000002526 effect on cardiovascular system Effects 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 229910052740 iodine Inorganic materials 0.000 description 4
- 238000011321 prophylaxis Methods 0.000 description 4
- 208000020016 psychiatric disease Diseases 0.000 description 4
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 4
- 238000010898 silica gel chromatography Methods 0.000 description 4
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 4
- 235000017557 sodium bicarbonate Nutrition 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 4
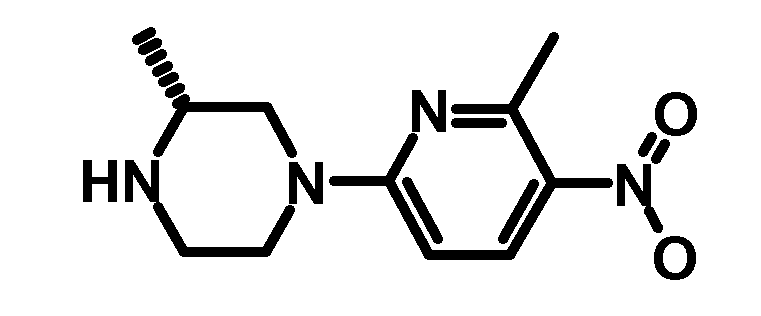
- URQTUBYVIIDIRE-MRVPVSSYSA-N (3r)-3-methyl-1-(6-methyl-5-nitropyridin-2-yl)piperazine Chemical compound C1CN[C@H](C)CN1C1=CC=C([N+]([O-])=O)C(C)=N1 URQTUBYVIIDIRE-MRVPVSSYSA-N 0.000 description 3
- 206010003805 Autism Diseases 0.000 description 3
- 208000020706 Autistic disease Diseases 0.000 description 3
- 229920002261 Corn starch Polymers 0.000 description 3
- 206010012335 Dependence Diseases 0.000 description 3
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 208000027520 Somatoform disease Diseases 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 125000003545 alkoxy group Chemical group 0.000 description 3
- 235000019270 ammonium chloride Nutrition 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 229960003920 cocaine Drugs 0.000 description 3
- 239000008120 corn starch Substances 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 239000008298 dragée Substances 0.000 description 3
- 230000002996 emotional effect Effects 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 229930195733 hydrocarbon Natural products 0.000 description 3
- 150000002430 hydrocarbons Chemical class 0.000 description 3
- 230000001771 impaired effect Effects 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 208000024714 major depressive disease Diseases 0.000 description 3
- HCKMONAVUWHQOT-JTQLQIEISA-N n-[[(2s)-1-ethylpyrrolidin-2-yl]methyl]-2-iodo-6-methoxy-3-sulfamoylbenzamide Chemical compound CCN1CCC[C@H]1CNC(=O)C1=C(I)C(S(N)(=O)=O)=CC=C1OC HCKMONAVUWHQOT-JTQLQIEISA-N 0.000 description 3
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 229910052763 palladium Inorganic materials 0.000 description 3
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical class [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 235000011181 potassium carbonates Nutrition 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 230000000506 psychotropic effect Effects 0.000 description 3
- 230000035882 stress Effects 0.000 description 3
- 201000009032 substance abuse Diseases 0.000 description 3
- 239000007940 sugar coated tablet Substances 0.000 description 3
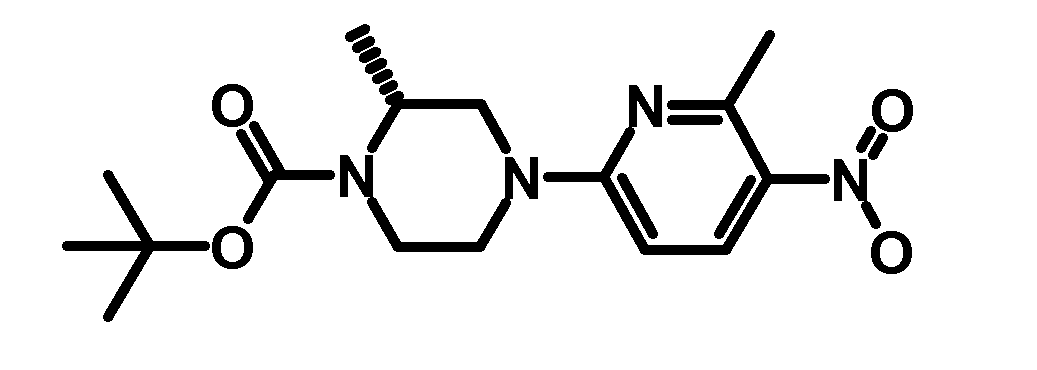
- VUXSIDQUSDOONW-NSHDSACASA-N tert-butyl (2s)-2-methyl-4-(6-methyl-5-nitropyridin-2-yl)piperazine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)[C@@H](C)CN1C1=CC=C([N+]([O-])=O)C(C)=N1 VUXSIDQUSDOONW-NSHDSACASA-N 0.000 description 3
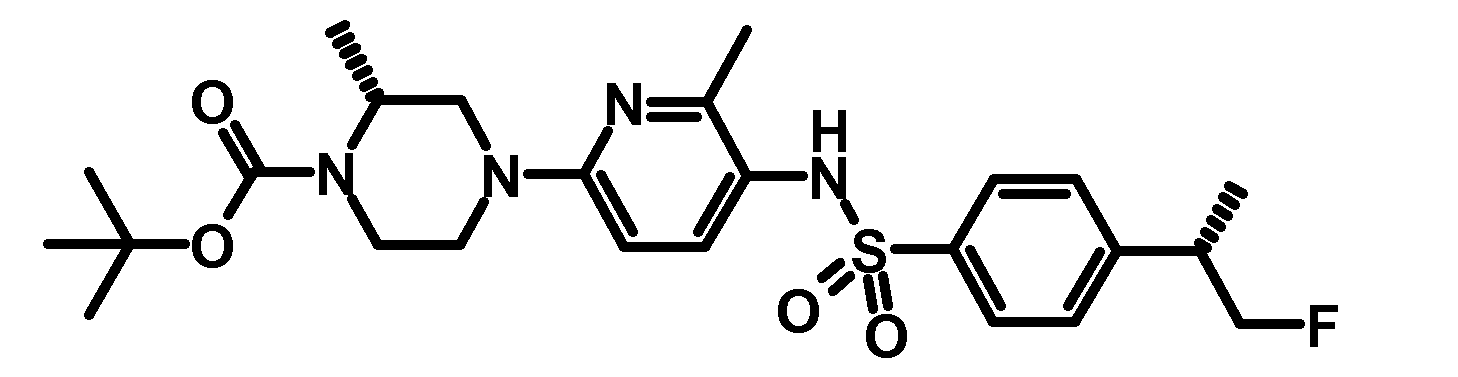
- VDQUWCZJZJXINI-QGZVFWFLSA-N tert-butyl 4-[5-[[4-[(2s)-1-fluoropropan-2-yl]phenyl]sulfonylamino]-6-methylpyridin-2-yl]piperazine-1-carboxylate Chemical compound C1=CC([C@@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCN(CC2)C(=O)OC(C)(C)C)N=C1C VDQUWCZJZJXINI-QGZVFWFLSA-N 0.000 description 3
- 229910052723 transition metal Inorganic materials 0.000 description 3
- 150000003624 transition metals Chemical class 0.000 description 3
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 description 2
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 2
- URQTUBYVIIDIRE-QMMMGPOBSA-N (3s)-3-methyl-1-(6-methyl-5-nitropyridin-2-yl)piperazine Chemical compound C1CN[C@@H](C)CN1C1=CC=C([N+]([O-])=O)C(C)=N1 URQTUBYVIIDIRE-QMMMGPOBSA-N 0.000 description 2
- 125000004454 (C1-C6) alkoxycarbonyl group Chemical group 0.000 description 2
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 description 2
- HPYNZHMRTTWQTB-UHFFFAOYSA-N 2,3-dimethylpyridine Chemical compound CC1=CC=CN=C1C HPYNZHMRTTWQTB-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- SHXWCVYOXRDMCX-UHFFFAOYSA-N 3,4-methylenedioxymethamphetamine Chemical compound CNC(C)CC1=CC=C2OCOC2=C1 SHXWCVYOXRDMCX-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 208000006096 Attention Deficit Disorder with Hyperactivity Diseases 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
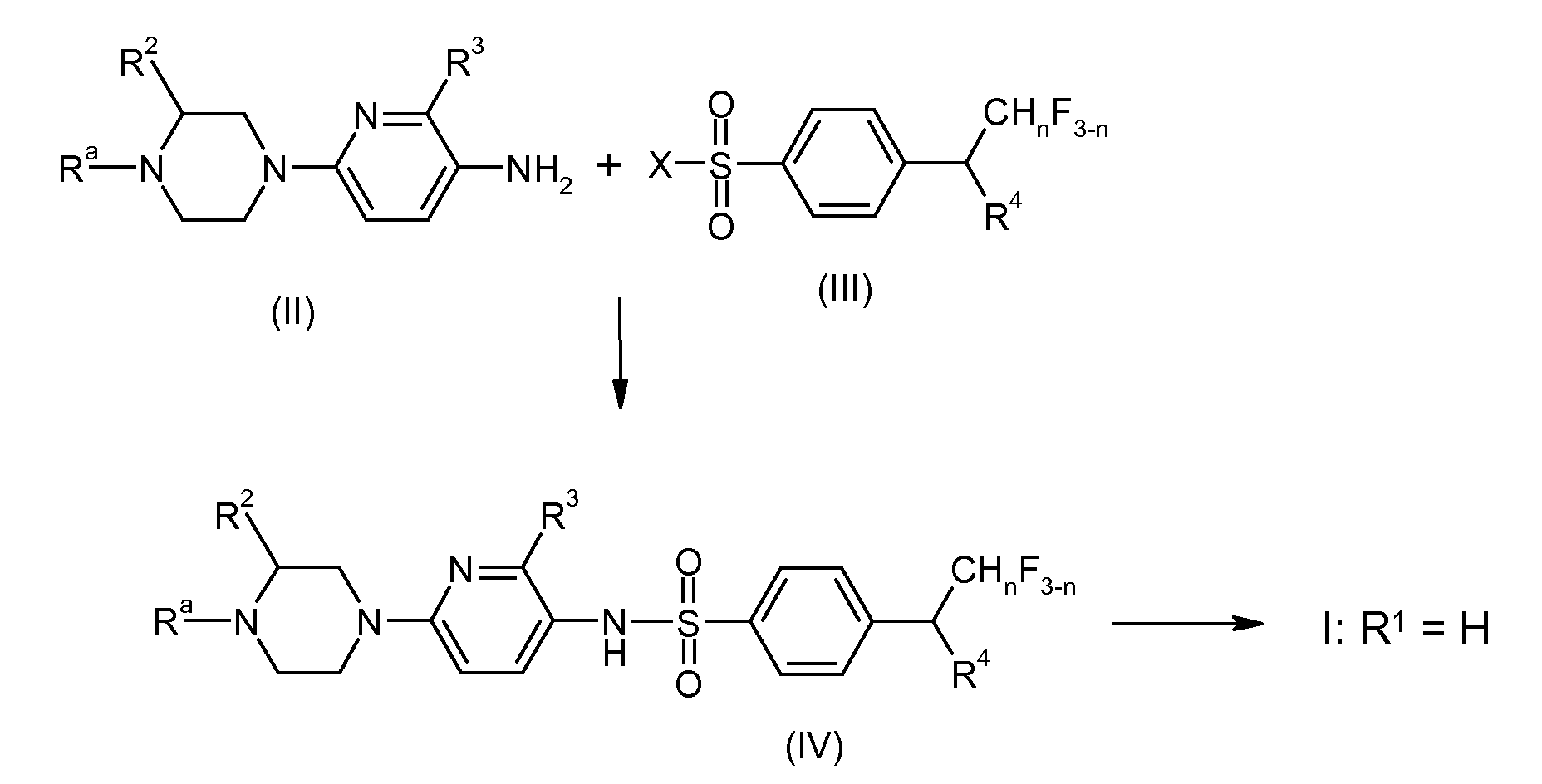
- FKLJPTJMIBLJAV-UHFFFAOYSA-N Compound IV Chemical compound O1N=C(C)C=C1CCCCCCCOC1=CC=C(C=2OCCN=2)C=C1 FKLJPTJMIBLJAV-UHFFFAOYSA-N 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- NOTFZGFABLVTIG-UHFFFAOYSA-N Cyclohexylethyl acetate Chemical compound CC(=O)OCCC1CCCCC1 NOTFZGFABLVTIG-UHFFFAOYSA-N 0.000 description 2
- 206010012289 Dementia Diseases 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 101001047090 Homo sapiens Potassium voltage-gated channel subfamily H member 2 Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 2
- FIWILGQIZHDAQG-UHFFFAOYSA-N NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F Chemical compound NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F FIWILGQIZHDAQG-UHFFFAOYSA-N 0.000 description 2
- 238000005481 NMR spectroscopy Methods 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- 208000018737 Parkinson disease Diseases 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- KFSLWBXXFJQRDL-UHFFFAOYSA-N Peracetic acid Chemical compound CC(=O)OO KFSLWBXXFJQRDL-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 102100022807 Potassium voltage-gated channel subfamily H member 2 Human genes 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 208000012886 Vertigo Diseases 0.000 description 2
- RFBUZWVPADPYJE-MRVPVSSYSA-N [(2s)-1-fluoropropan-2-yl]benzene Chemical compound FC[C@@H](C)C1=CC=CC=C1 RFBUZWVPADPYJE-MRVPVSSYSA-N 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 229940025084 amphetamine Drugs 0.000 description 2
- 229940035678 anti-parkinson drug Drugs 0.000 description 2
- 230000000561 anti-psychotic effect Effects 0.000 description 2
- 229940005529 antipsychotics Drugs 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- 230000003542 behavioural effect Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 description 2
- 229960001701 chloroform Drugs 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- RWGFKTVRMDUZSP-UHFFFAOYSA-N cumene Chemical compound CC(C)C1=CC=CC=C1 RWGFKTVRMDUZSP-UHFFFAOYSA-N 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- WBKFWQBXFREOFH-UHFFFAOYSA-N dichloromethane;ethyl acetate Chemical compound ClCCl.CCOC(C)=O WBKFWQBXFREOFH-UHFFFAOYSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 2
- NLFBCYMMUAKCPC-KQQUZDAGSA-N ethyl (e)-3-[3-amino-2-cyano-1-[(e)-3-ethoxy-3-oxoprop-1-enyl]sulfanyl-3-oxoprop-1-enyl]sulfanylprop-2-enoate Chemical compound CCOC(=O)\C=C\SC(=C(C#N)C(N)=O)S\C=C\C(=O)OCC NLFBCYMMUAKCPC-KQQUZDAGSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 125000001153 fluoro group Chemical group F* 0.000 description 2
- 239000012458 free base Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 150000008282 halocarbons Chemical class 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 125000005843 halogen group Chemical group 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 150000002576 ketones Chemical class 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 230000002503 metabolic effect Effects 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 2
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 2
- QVZYQHNIHBZDKM-UHFFFAOYSA-N n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)-4-(1,1,1-trifluoropropan-2-yl)benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C(C(C)C(F)(F)F)C=C1 QVZYQHNIHBZDKM-UHFFFAOYSA-N 0.000 description 2
- QVZYQHNIHBZDKM-ZDUSSCGKSA-N n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)-4-[(2s)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C([C@H](C)C(F)(F)F)C=C1 QVZYQHNIHBZDKM-ZDUSSCGKSA-N 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 229910052759 nickel Inorganic materials 0.000 description 2
- 229960002715 nicotine Drugs 0.000 description 2
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 230000009871 nonspecific binding Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 229940005483 opioid analgesics Drugs 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 239000006072 paste Substances 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 208000022821 personality disease Diseases 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 231100000857 poor renal function Toxicity 0.000 description 2
- 239000011736 potassium bicarbonate Substances 0.000 description 2
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 2
- 235000015497 potassium bicarbonate Nutrition 0.000 description 2
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 2
- 229940086066 potassium hydrogencarbonate Drugs 0.000 description 2
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 206010040560 shock Diseases 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 235000017550 sodium carbonate Nutrition 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- DKGZKTPJOSAWFA-UHFFFAOYSA-N spiperone Chemical compound C1=CC(F)=CC=C1C(=O)CCCN1CCC2(C(NCN2C=2C=CC=CC=2)=O)CC1 DKGZKTPJOSAWFA-UHFFFAOYSA-N 0.000 description 2
- 229950001675 spiperone Drugs 0.000 description 2
- 239000003381 stabilizer Substances 0.000 description 2
- 235000011150 stannous chloride Nutrition 0.000 description 2
- 239000000021 stimulant Substances 0.000 description 2
- 231100000736 substance abuse Toxicity 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 150000003460 sulfonic acids Chemical class 0.000 description 2
- VUXSIDQUSDOONW-LLVKDONJSA-N tert-butyl (2r)-2-methyl-4-(6-methyl-5-nitropyridin-2-yl)piperazine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)[C@H](C)CN1C1=CC=C([N+]([O-])=O)C(C)=N1 VUXSIDQUSDOONW-LLVKDONJSA-N 0.000 description 2
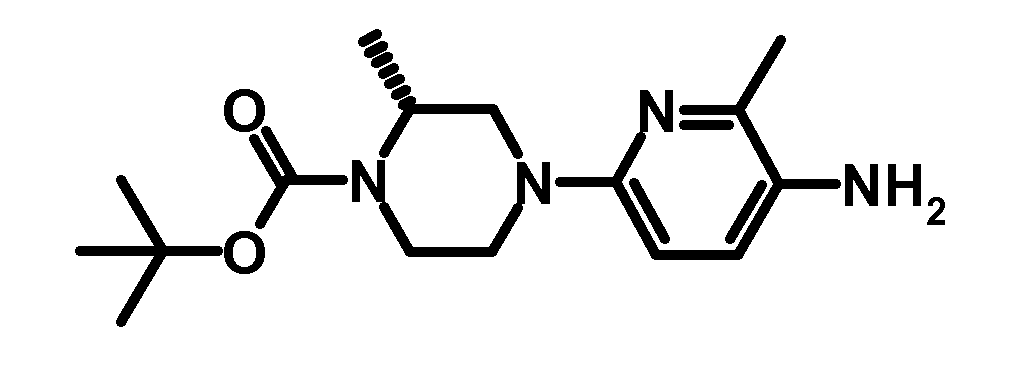
- ORLLYLGMIKFPCE-LLVKDONJSA-N tert-butyl (2r)-4-(5-amino-6-methylpyridin-2-yl)-2-methylpiperazine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)[C@H](C)CN1C1=CC=C(N)C(C)=N1 ORLLYLGMIKFPCE-LLVKDONJSA-N 0.000 description 2
- LDGONIUBTXOHBQ-MSOLQXFVSA-N tert-butyl (2s)-4-[5-[[4-[(2s)-1-fluoropropan-2-yl]phenyl]sulfonylamino]-6-methylpyridin-2-yl]-2-methylpiperazine-1-carboxylate Chemical compound C1=CC([C@@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)N(CC2)C(=O)OC(C)(C)C)N=C1C LDGONIUBTXOHBQ-MSOLQXFVSA-N 0.000 description 2
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- AXZWODMDQAVCJE-UHFFFAOYSA-L tin(II) chloride (anhydrous) Chemical compound [Cl-].[Cl-].[Sn+2] AXZWODMDQAVCJE-UHFFFAOYSA-L 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- TUQOTMZNTHZOKS-UHFFFAOYSA-N tributylphosphine Chemical compound CCCCP(CCCC)CCCC TUQOTMZNTHZOKS-UHFFFAOYSA-N 0.000 description 2
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 231100000889 vertigo Toxicity 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- JOMNTHCQHJPVAZ-RXMQYKEDSA-N (2r)-2-methylpiperazine Chemical compound C[C@@H]1CNCCN1 JOMNTHCQHJPVAZ-RXMQYKEDSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- 125000004777 2-fluoroethyl group Chemical group [H]C([H])(F)C([H])([H])* 0.000 description 1
- SMNDYUVBFMFKNZ-UHFFFAOYSA-N 2-furoic acid Chemical compound OC(=O)C1=CC=CO1 SMNDYUVBFMFKNZ-UHFFFAOYSA-N 0.000 description 1
- YNJSNEKCXVFDKW-UHFFFAOYSA-N 3-(5-amino-1h-indol-3-yl)-2-azaniumylpropanoate Chemical compound C1=C(N)C=C2C(CC(N)C(O)=O)=CNC2=C1 YNJSNEKCXVFDKW-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 1
- ULVSDQSELZHTLN-UHFFFAOYSA-N 4-(1-fluoropropan-2-yl)-n-(2-methyl-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound C1=CC(C(CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCNCC2)N=C1C ULVSDQSELZHTLN-UHFFFAOYSA-N 0.000 description 1
- IQFKEUIGEAXVJX-ZIAGYGMSSA-N 4-[(2r)-1,1-difluoropropan-2-yl]-n-[2-methyl-6-[(3r)-3-methylpiperazin-1-yl]pyridin-3-yl]benzenesulfonamide Chemical compound C1=CC([C@H](C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@@H](C)NCC2)N=C1C IQFKEUIGEAXVJX-ZIAGYGMSSA-N 0.000 description 1
- IQFKEUIGEAXVJX-UONOGXRCSA-N 4-[(2r)-1,1-difluoropropan-2-yl]-n-[2-methyl-6-[(3s)-3-methylpiperazin-1-yl]pyridin-3-yl]benzenesulfonamide Chemical compound C1=CC([C@H](C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)NCC2)N=C1C IQFKEUIGEAXVJX-UONOGXRCSA-N 0.000 description 1
- IQFKEUIGEAXVJX-KGLIPLIRSA-N 4-[(2s)-1,1-difluoropropan-2-yl]-n-[2-methyl-6-[(3r)-3-methylpiperazin-1-yl]pyridin-3-yl]benzenesulfonamide Chemical compound C1=CC([C@@H](C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@@H](C)NCC2)N=C1C IQFKEUIGEAXVJX-KGLIPLIRSA-N 0.000 description 1
- IQFKEUIGEAXVJX-KBPBESRZSA-N 4-[(2s)-1,1-difluoropropan-2-yl]-n-[2-methyl-6-[(3s)-3-methylpiperazin-1-yl]pyridin-3-yl]benzenesulfonamide Chemical compound C1=CC([C@@H](C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)NCC2)N=C1C IQFKEUIGEAXVJX-KBPBESRZSA-N 0.000 description 1
- GHSRMSJVYMITDX-UHFFFAOYSA-N 6-chloro-2-methyl-3-nitropyridine Chemical compound CC1=NC(Cl)=CC=C1[N+]([O-])=O GHSRMSJVYMITDX-UHFFFAOYSA-N 0.000 description 1
- MPEVPWUEDJNVHE-UHFFFAOYSA-N 6-piperazin-1-ylpyridin-3-amine Chemical compound N1=CC(N)=CC=C1N1CCNCC1 MPEVPWUEDJNVHE-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 229910002012 Aerosil® Inorganic materials 0.000 description 1
- 206010054196 Affect lability Diseases 0.000 description 1
- 206010002942 Apathy Diseases 0.000 description 1
- 208000036864 Attention deficit/hyperactivity disease Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 208000032841 Bulimia Diseases 0.000 description 1
- 206010006550 Bulimia nervosa Diseases 0.000 description 1
- 0 C[C@](C1)*CCN1c(cc1)nc(C)c1*(O)=O Chemical compound C[C@](C1)*CCN1c(cc1)nc(C)c1*(O)=O 0.000 description 1
- 108091006146 Channels Proteins 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- 208000028698 Cognitive impairment Diseases 0.000 description 1
- 208000022540 Consciousness disease Diseases 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- 206010012218 Delirium Diseases 0.000 description 1
- 208000032538 Depersonalisation Diseases 0.000 description 1
- 206010012374 Depressed mood Diseases 0.000 description 1
- 208000020401 Depressive disease Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- 208000012661 Dyskinesia Diseases 0.000 description 1
- 239000004097 EU approved flavor enhancer Substances 0.000 description 1
- 208000030814 Eating disease Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 208000019454 Feeding and Eating disease Diseases 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- DSLZVSRJTYRBFB-UHFFFAOYSA-N Galactaric acid Natural products OC(=O)C(O)C(O)C(O)C(O)C(O)=O DSLZVSRJTYRBFB-UHFFFAOYSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 239000001828 Gelatine Substances 0.000 description 1
- 208000004547 Hallucinations Diseases 0.000 description 1
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 1
- 102000000543 Histamine Receptors Human genes 0.000 description 1
- 108010002059 Histamine Receptors Proteins 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- 201000001916 Hypochondriasis Diseases 0.000 description 1
- 206010022998 Irritability Diseases 0.000 description 1
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 description 1
- JGFBQFKZKSSODQ-UHFFFAOYSA-N Isothiocyanatocyclopropane Chemical compound S=C=NC1CC1 JGFBQFKZKSSODQ-UHFFFAOYSA-N 0.000 description 1
- 206010026749 Mania Diseases 0.000 description 1
- DUGOZIWVEXMGBE-UHFFFAOYSA-N Methylphenidate Chemical compound C=1C=CC=CC=1C(C(=O)OC)C1CCCCN1 DUGOZIWVEXMGBE-UHFFFAOYSA-N 0.000 description 1
- 208000019022 Mood disease Diseases 0.000 description 1
- 102000014415 Muscarinic acetylcholine receptor Human genes 0.000 description 1
- 108050003473 Muscarinic acetylcholine receptor Proteins 0.000 description 1
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical class [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 1
- 125000000815 N-oxide group Chemical group 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 102000003840 Opioid Receptors Human genes 0.000 description 1
- 108090000137 Opioid Receptors Proteins 0.000 description 1
- 206010034158 Pathological gambling Diseases 0.000 description 1
- 206010062519 Poor quality sleep Diseases 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- KJTLSVCANCCWHF-UHFFFAOYSA-N Ruthenium Chemical compound [Ru] KJTLSVCANCCWHF-UHFFFAOYSA-N 0.000 description 1
- GOTMKOSCLKVOGG-UHFFFAOYSA-N SCH 23390 Chemical compound C1N(C)CCC2=CC(Cl)=C(O)C=C2C1C1=CC=CC=C1 GOTMKOSCLKVOGG-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 208000003028 Stuttering Diseases 0.000 description 1
- 208000007271 Substance Withdrawal Syndrome Diseases 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 208000000323 Tourette Syndrome Diseases 0.000 description 1
- 206010044565 Tremor Diseases 0.000 description 1
- 208000003443 Unconsciousness Diseases 0.000 description 1
- 206010048010 Withdrawal syndrome Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- 230000032683 aging Effects 0.000 description 1
- 238000013019 agitation Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229910000288 alkali metal carbonate Inorganic materials 0.000 description 1
- 150000008041 alkali metal carbonates Chemical class 0.000 description 1
- 229910000102 alkali metal hydride Inorganic materials 0.000 description 1
- 150000008046 alkali metal hydrides Chemical class 0.000 description 1
- 150000004703 alkoxides Chemical class 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 102000030619 alpha-1 Adrenergic Receptor Human genes 0.000 description 1
- 108020004102 alpha-1 Adrenergic Receptor Proteins 0.000 description 1
- 102000030484 alpha-2 Adrenergic Receptor Human genes 0.000 description 1
- 108020004101 alpha-2 Adrenergic Receptor Proteins 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 210000004727 amygdala Anatomy 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 206010003119 arrhythmia Diseases 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- PTGSSEMWFKUGOG-UHFFFAOYSA-N benzenesulfonamide;4-(1-fluoropropan-2-yl)-n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)benzenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CC=C1.COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C(C(C)CF)C=C1 PTGSSEMWFKUGOG-UHFFFAOYSA-N 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 150000008107 benzenesulfonic acids Chemical class 0.000 description 1
- 229940049706 benzodiazepine Drugs 0.000 description 1
- 150000001557 benzodiazepines Chemical class 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 208000028683 bipolar I disease Diseases 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 125000005620 boronic acid group Chemical class 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 230000005587 bubbling Effects 0.000 description 1
- PWLNAUNEAKQYLH-UHFFFAOYSA-N butyric acid octyl ester Natural products CCCCCCCCOC(=O)CCC PWLNAUNEAKQYLH-UHFFFAOYSA-N 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 229960001948 caffeine Drugs 0.000 description 1
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 229930003827 cannabinoid Natural products 0.000 description 1
- 239000003557 cannabinoid Substances 0.000 description 1
- 229940065144 cannabinoids Drugs 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical class OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- 229960004126 codeine Drugs 0.000 description 1
- 208000010877 cognitive disease Diseases 0.000 description 1
- 230000003920 cognitive function Effects 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 208000012839 conversion disease Diseases 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 238000005238 degreasing Methods 0.000 description 1
- 238000010511 deprotection reaction Methods 0.000 description 1
- 239000002274 desiccant Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 229960002069 diamorphine Drugs 0.000 description 1
- ZFTFAPZRGNKQPU-UHFFFAOYSA-N dicarbonic acid Chemical compound OC(=O)OC(O)=O ZFTFAPZRGNKQPU-UHFFFAOYSA-N 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 235000014632 disordered eating Nutrition 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 210000005069 ears Anatomy 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 230000004970 emotional disturbance Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 210000000750 endocrine system Anatomy 0.000 description 1
- 206010015037 epilepsy Diseases 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- DQYBDCGIPTYXML-UHFFFAOYSA-N ethoxyethane;hydrate Chemical compound O.CCOCC DQYBDCGIPTYXML-UHFFFAOYSA-N 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 230000008921 facial expression Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000007941 film coated tablet Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 125000004785 fluoromethoxy group Chemical group [H]C([H])(F)O* 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- 235000019264 food flavour enhancer Nutrition 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- DSLZVSRJTYRBFB-DUHBMQHGSA-N galactaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)C(O)=O DSLZVSRJTYRBFB-DUHBMQHGSA-N 0.000 description 1
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 1
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 1
- 210000004051 gastric juice Anatomy 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- 229940052308 general anesthetics halogenated hydrocarbons Drugs 0.000 description 1
- 239000003365 glass fiber Substances 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000010440 gypsum Substances 0.000 description 1
- 229910052602 gypsum Inorganic materials 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 1
- 235000003642 hunger Nutrition 0.000 description 1
- 150000004678 hydrides Chemical class 0.000 description 1
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 1
- 239000000416 hydrocolloid Substances 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 239000003326 hypnotic agent Substances 0.000 description 1
- 230000000147 hypnotic effect Effects 0.000 description 1
- 201000001881 impotence Diseases 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 208000035231 inattentive type attention deficit hyperactivity disease Diseases 0.000 description 1
- 150000002471 indium Chemical class 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 210000003715 limbic system Anatomy 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000011344 liquid material Substances 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 238000009115 maintenance therapy Methods 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 201000003995 melancholia Diseases 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 206010027175 memory impairment Diseases 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 229960001344 methylphenidate Drugs 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 230000036651 mood Effects 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- QVZYQHNIHBZDKM-CYBMUJFWSA-N n-(2-methoxy-6-piperazin-1-ylpyridin-3-yl)-4-[(2r)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound COC1=NC(N2CCNCC2)=CC=C1NS(=O)(=O)C1=CC=C([C@@H](C)C(F)(F)F)C=C1 QVZYQHNIHBZDKM-CYBMUJFWSA-N 0.000 description 1
- CXHBWOIMXTXDHG-CYBMUJFWSA-N n-(5-bromo-2-methyl-6-piperazin-1-ylpyridin-3-yl)-4-[(2s)-1-fluoropropan-2-yl]benzenesulfonamide Chemical compound C1=CC([C@@H](CF)C)=CC=C1S(=O)(=O)NC1=CC(Br)=C(N2CCNCC2)N=C1C CXHBWOIMXTXDHG-CYBMUJFWSA-N 0.000 description 1
- RCUHSZWJUXLDHZ-UHFFFAOYSA-N n-[2-methyl-6-(3-methylpiperazin-1-yl)pyridin-3-yl]-4-(1,1,1-trifluoropropan-2-yl)benzenesulfonamide Chemical compound C1=CC(C(C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2CC(C)NCC2)N=C1C RCUHSZWJUXLDHZ-UHFFFAOYSA-N 0.000 description 1
- RCUHSZWJUXLDHZ-ZIAGYGMSSA-N n-[2-methyl-6-[(3r)-3-methylpiperazin-1-yl]pyridin-3-yl]-4-[(2r)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound C1=CC([C@@H](C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@@H](C)NCC2)N=C1C RCUHSZWJUXLDHZ-ZIAGYGMSSA-N 0.000 description 1
- RCUHSZWJUXLDHZ-KGLIPLIRSA-N n-[2-methyl-6-[(3r)-3-methylpiperazin-1-yl]pyridin-3-yl]-4-[(2s)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound C1=CC([C@H](C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@@H](C)NCC2)N=C1C RCUHSZWJUXLDHZ-KGLIPLIRSA-N 0.000 description 1
- RCUHSZWJUXLDHZ-UONOGXRCSA-N n-[2-methyl-6-[(3s)-3-methylpiperazin-1-yl]pyridin-3-yl]-4-[(2r)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound C1=CC([C@@H](C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)NCC2)N=C1C RCUHSZWJUXLDHZ-UONOGXRCSA-N 0.000 description 1
- RCUHSZWJUXLDHZ-KBPBESRZSA-N n-[2-methyl-6-[(3s)-3-methylpiperazin-1-yl]pyridin-3-yl]-4-[(2s)-1,1,1-trifluoropropan-2-yl]benzenesulfonamide Chemical compound C1=CC([C@H](C)C(F)(F)F)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)NCC2)N=C1C RCUHSZWJUXLDHZ-KBPBESRZSA-N 0.000 description 1
- UUIQMZJEGPQKFD-UHFFFAOYSA-N n-butyric acid methyl ester Natural products CCCC(=O)OC UUIQMZJEGPQKFD-UHFFFAOYSA-N 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 150000002828 nitro derivatives Chemical class 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 1
- 210000001009 nucleus accumben Anatomy 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 239000003605 opacifier Substances 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 125000001477 organic nitrogen group Chemical group 0.000 description 1
- 150000001451 organic peroxides Chemical class 0.000 description 1
- 150000002902 organometallic compounds Chemical class 0.000 description 1
- 230000003534 oscillatory effect Effects 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- 208000019906 panic disease Diseases 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000008447 perception Effects 0.000 description 1
- 230000000737 periodic effect Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 208000019899 phobic disease Diseases 0.000 description 1
- 150000003003 phosphines Chemical class 0.000 description 1
- AQSJGOWTSHOLKH-UHFFFAOYSA-N phosphite(3-) Chemical class [O-]P([O-])[O-] AQSJGOWTSHOLKH-UHFFFAOYSA-N 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000011514 reflex Effects 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 239000010948 rhodium Substances 0.000 description 1
- MHOVAHRLVXNVSD-UHFFFAOYSA-N rhodium atom Chemical compound [Rh] MHOVAHRLVXNVSD-UHFFFAOYSA-N 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 239000000932 sedative agent Substances 0.000 description 1
- 229940125723 sedative agent Drugs 0.000 description 1
- 239000012056 semi-solid material Substances 0.000 description 1
- 208000012201 sexual and gender identity disease Diseases 0.000 description 1
- 208000015891 sexual disease Diseases 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 208000019116 sleep disease Diseases 0.000 description 1
- 208000022925 sleep disturbance Diseases 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 239000003206 sterilizing agent Substances 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000002511 suppository base Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000015883 synaptic transmission, dopaminergic Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- LDGONIUBTXOHBQ-QZTJIDSGSA-N tert-butyl (2r)-4-[5-[[4-[(2s)-1-fluoropropan-2-yl]phenyl]sulfonylamino]-6-methylpyridin-2-yl]-2-methylpiperazine-1-carboxylate Chemical compound C1=CC([C@@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@@H](C)N(CC2)C(=O)OC(C)(C)C)N=C1C LDGONIUBTXOHBQ-QZTJIDSGSA-N 0.000 description 1
- ORLLYLGMIKFPCE-NSHDSACASA-N tert-butyl (2s)-4-(5-amino-6-methylpyridin-2-yl)-2-methylpiperazine-1-carboxylate Chemical compound C1CN(C(=O)OC(C)(C)C)[C@@H](C)CN1C1=CC=C(N)C(C)=N1 ORLLYLGMIKFPCE-NSHDSACASA-N 0.000 description 1
- LDGONIUBTXOHBQ-ROUUACIJSA-N tert-butyl (2s)-4-[5-[[4-[(2r)-1-fluoropropan-2-yl]phenyl]sulfonylamino]-6-methylpyridin-2-yl]-2-methylpiperazine-1-carboxylate Chemical compound C1=CC([C@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2C[C@H](C)N(CC2)C(=O)OC(C)(C)C)N=C1C LDGONIUBTXOHBQ-ROUUACIJSA-N 0.000 description 1
- NZULECSKRTWAPX-UHFFFAOYSA-N tert-butyl 4-(5-amino-6-methylpyridin-2-yl)piperazine-1-carboxylate Chemical compound C1=C(N)C(C)=NC(N2CCN(CC2)C(=O)OC(C)(C)C)=C1 NZULECSKRTWAPX-UHFFFAOYSA-N 0.000 description 1
- FVMFKBGAZQXHIY-UHFFFAOYSA-N tert-butyl 4-[5-[[4-(1,1-difluoropropan-2-yl)phenyl]sulfonylamino]-6-methylpyridin-2-yl]piperazine-1-carboxylate Chemical compound C1=CC(C(C(F)F)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCN(CC2)C(=O)OC(C)(C)C)N=C1C FVMFKBGAZQXHIY-UHFFFAOYSA-N 0.000 description 1
- VDQUWCZJZJXINI-KRWDZBQOSA-N tert-butyl 4-[5-[[4-[(2r)-1-fluoropropan-2-yl]phenyl]sulfonylamino]-6-methylpyridin-2-yl]piperazine-1-carboxylate Chemical compound C1=CC([C@H](CF)C)=CC=C1S(=O)(=O)NC1=CC=C(N2CCN(CC2)C(=O)OC(C)(C)C)N=C1C VDQUWCZJZJXINI-KRWDZBQOSA-N 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 230000035922 thirst Effects 0.000 description 1
- 229910052718 tin Inorganic materials 0.000 description 1
- 239000011135 tin Substances 0.000 description 1
- 230000002110 toxicologic effect Effects 0.000 description 1
- 231100000723 toxicological property Toxicity 0.000 description 1
- 239000003204 tranquilizing agent Substances 0.000 description 1
- 230000002936 tranquilizing effect Effects 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-N trans-cinnamic acid Chemical compound OC(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-N 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 229910000314 transition metal oxide Inorganic materials 0.000 description 1
- 125000005270 trialkylamine group Chemical group 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/10—Drugs for genital or sexual disorders; Contraceptives for impotence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/76—Nitrogen atoms to which a second hetero atom is attached
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Addiction (AREA)
- Psychiatry (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Pain & Pain Management (AREA)
- Psychology (AREA)
- Gynecology & Obstetrics (AREA)
- Child & Adolescent Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Anesthesiology (AREA)
- Emergency Medicine (AREA)
- Urology & Nephrology (AREA)
- Pregnancy & Childbirth (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pyridine Compounds (AREA)
Abstract
Изобретение относится к соединениям формулы I
где R1 выбран из группы, состоящей из водорода и линейного C1-С3 алкила; R2 представляет собой водород или метил; R3 выбран из группы, состоящей из водорода, C1-C2-алкила и C1-С2-алкокси, R4 представляет собой С1-С2-алкил; n представляет собой 0, 1 или 2; и физиологически устойчивые соли этих соединений. Изобретение также относится к фармацевтической композиции, включающей, по меньшей мере, одно соединение формулы (I) и обладающей активностью и селективностью в отношении дофаминового рецептора D3, к применению соединений формулы I для лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3, и далее к способу лечения заболеваний, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3 или агонистов дофамина D3, включающему введение эффективного количества, по меньшей мере, одного соединения или физиологически устойчивой кислотно-аддитивной соли формулы I нуждающемуся в этом субъекту. Технический результат: получены и описаны новые соединения, которые могут найти свое применение в лечении заболеваний нервной системы. 7 н. и 20 з.п. ф-лы, 18 пр., 1 табл.
Description
Уровень техники
Настоящее изобретение относится к новым N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидным соединениям, в частности к соединениям формулы I, описанным в настоящем документе. Соединения обладают полезными терапевтическими свойствами и пригодны, в частности, для лечения заболеваний, которые восприимчивы к модуляции дофаминового рецептора D3.
Нейроны получают свою информацию посредством, среди прочего, рецептора, сопряженного с G-белком. Большое число веществ проявляет свое воздействие посредством этих рецепторов. Одним из них является дофамин. Существуют подтвержденные данные относительно присутствия дофамина и его физиологического назначения в качестве нейромедиатора. Расстройства в дофаминергической системе передачи приводят к заболеваниям центральной нервной системы, которые включают, например, шизофрению, депрессию и болезнь Паркинсона. Эти заболевания и другие лечат с помощью лекарственных средств, которые взаимодействуют с дофаминовыми рецепторами.
Вплоть до 1990 было четко определено фармакологически два подтипа дофаминового рецептора, названных рецепторами D1 и D2. Позднее третий подтип был найден, а именно рецептор D3, который, по-видимому, опосредует некоторые эффекты нейролептических и антипаркинсонических лекарственных средств (J. C. Schwartz et al., "The Dopamine D3 Receptor as a Target for Antipsychotics" in Novel Antipsychotic Drugs, H. Y. Meltzer, ed., Raven Press, New York 1992, pages 135-144; M. Dooley et al., Drugs and Aging 1998, 12:495-514; J.N. Joyce, Pharmacology and Therapeutics 2001, 90:231-59, "The Dopamine D3 Receptor as a Therapeutic Target for Antipsychotic and Antiparkinsonian Drugs"). После этого дофаминовые рецепторы были разделены на два семейства. С одной стороны, существует группа D2, состоящая из рецепторов D2, D3 и D4, и, с другой стороны, группа D1, состоящая из рецепторов D1 и D5.
В то время как рецепторы D1 и D2 широко распределены, рецепторы D3, по-видимому, экспрессируются региоселективно. Таким образом, эти рецепторы предпочтительно следует искать в лимбической системе и проекционных областях мезолимбической дофаминовой системы, особенно в прилежащем ядре, но также в других областях, таких как миндалевидная железа. Благодаря этой относительно региоселективной экспрессии рецепторы D3 рассматривают в качестве цели, обладающей несколькими побочными эффектами, и допускают, что, в то время когда селективный лиганд D3 обладал бы свойствами известных нейролептических лекарственных средств, он бы не имел их побочные неврологические эффекты, опосредованные дофаминовым рецептором D2 (P. Sokoloff et al., Arzneim. Forsch./Drug Res. 42(1):224 (1992), "Localization and Function of the D3 Dopamine Receptor"; P. Sokoloff et al., Nature, 347:146 (1990), "Molecular Cloning and Characterization of a Novel Dopamine Receptor (D3) as a Target for Neuroleptics").
N-(6-Пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения, обладающие аффиностью к дофаминовому рецептору D3, были описаны ранее на различных событиях, как, например, в WO2004/089905. Эти соединения обладают высокими аффиностями в отношении дофаминового рецептора D3 и, следовательно, были предложены в качестве пригодных для лечения заболеваний центральной нервной системы. К сожалению, их селективность в отношении рецептора D3 не всегда является удовлетворительной. Более того, некоторые из этих соединений имеют неудовлетворительный профиль DMPK (DMPK: метаболическая стабильность и/или фармакокинетика) и/или могут проявлять сердечно-сосудистые взаимодействия. Следовательно, существует постоянная потребность в обеспечении новыми соединениями, которые обладают улучшенной селективностью в отношении рецепторов D3 или улучшенным фармакологическим профилем, таким как профиль DMPK, и/или могут проявлять меньшие сердечно-сосудистые взаимодействия.
Сущность изобретения
Сейчас было найдено, что определенные N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения проявляют (с удивительной и неожиданной степенью) весьма селективное связывание с дофаминовым рецептором D3, а также удовлетворительный профиль DMPK, в частности относительно метаболической стабильности, и/или удовлетворительный сердечно-сосудистый профиль, т.е. соединения проявляют меньшие сердечно-сосудистые взаимодействия. Такими соединениями являются соединения, имеющие общую формулу I, их физиологически устойчивые соли и их N-оксиды:
где
R1 выбран из группы, состоящей из водорода, линейного C1-C3 алкила и фторированного линейного C1-C3 алкила;
R2 представляет собой водород или метил;
R3 выбран из группы, состоящей из водорода, галогена, C1-C2-алкила, фторированного C1-C2-алкила, C1-C2-алкокси и фторированного C1-C2-алкокси,
R4 представляет собой C1-C2-алкил или фторированный C1-C2-алкил; и
n представляет собой 0, 1 или 2.
Следовательно, настоящее изобретение относится к N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидным соединениям общей формулы I, а также к их физиологически устойчивым солям и к N-оксидам соединений I и их физиологически устойчивым солям.
Настоящее изобретение также относится к фармацевтической композиции, которая включает, по меньшей мере, одно N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидное соединение формулы I и/или, по меньшей мере, одну физиологически устойчивую соль I и/или его N-окид, где приемлемо совместно с физиологически приемлемыми носителями и/или вспомогательными веществами.
Настоящее изобретение также относится к способу лечения расстройств, которые восприимчивы к влиянию антагонистов дофаминового рецептора D3 или агонистов дофамина D3, включающему введение эффективного количества, по меньшей мере, одного N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидного соединения формулы I, и/или, по меньшей мере, одной физиологически устойчивой кислотно-аддитивной соли I, и/или его N-оксида нуждающемуся в этом субъекту.
Подробное описание настоящего изобретения
Заболевания, которые восприимчивы к воздействию антагонистов дофаминового рецептора D3 или агонистов, включают расстройства и заболевания центральной нервной системы, в частности эмоциональные потрясения, нервные потрясения, стрессовые потрясения и соматоформные нарушения и психозы, и особенно шизофрению, депрессию, биполярное расстройство, наркотическую зависимость и токсикоманию (также называемую наркоманией), слабоумие, большое депрессивное расстройство, беспокойство, аутизм, дефицитарное расстройство внимания с (или без) повышенной активностью и расстройством личности. Кроме того, D3-опосредованные заболевания могут включать нарушения функции почки, в частности нарушения функции почки, которые вызваны диабетом, таким как сахарный диабет, также называемый диабетической нефропатией (смотри WO 00/67847).
В соответствии с изобретением одно или более соединений общей формулы I, имеющие значения, упомянутые вначале, могут быть использованы для лечения вышеупомянутых показаний. В случае если соединения формулы I обладают одним или более центрами ассиметрии, также возможно использовать энантиомерные смеси, в частности рацемические, диастереомерные смеси и таутомерные смеси; предпочтительными, однако, являются соответствующие по существу чистые энантиомеры, диастереомеры и таутомеры.
Подобным образом возможно использовать физиологически устойчивые соли соединений формулы I, особенно кислотно-аддитивные соли с физиологически устойчивыми кислотами. Примерами подходящих физиологически устойчивых органических и неорганических кислот являются хлороводородная кислота, бромоводородная кислота, фосфорная кислота, азотная кислота, серная кислота, органические сульфоновые кислоты, имеющие от 1 до 12 атомов углерода, например C1-C4-алкилсульфоновые кислоты, такие как метансульфоновая кислота, циклоалифатические сульфоновые кислоты, такие как S-(+)-10-камфорсульфоновые кислоты, и ароматические сульфоновые кислоты, такие как бензолсульфоновая кислота и толуолсульфоновая кислота, ди- и трикарбоновые кислоты и гидроксикарбоновые кислоты, имеющие от 2 до 10 атомов углерода, такие как щавелевая кислота, малоновая кислота, малеиновая кислота, фумаровая кислота, муциновая кислота, молочная кислота, винная кислота, лимонная кислота, гликолиевая кислота и адипиновая кислота, а также цис- и транс-коричная кислота, фуранкарбоновая кислота и бензойная кислота. Другие используемые кислоты описаны в Fortschritte der Arzneimittelforschung [Advances in Drug Research], Volume 10, pages 224 ff., Birkhauser Verlag, Basel and Stuttgart, 1966. Физиологически устойчивые соли соединений формулы I могут присутствовать в виде моно-, бис-, трис- и тетракис-солей, то есть они могут содержать 1, 2, 3 или 4 вышеупомянутых молекул кислоты на молекулу формулы I. Молекулы кислоты могут находиться в своей кислотной форме или в виде аниона.
Используемый в настоящем описании C1-C3 алкил представляет собой разветвленную или с неразветвленной цепью алкильную группу, содержащую 1, 2 или 3 атома углерода. Примерами таких групп являются метильная, этильная, н-пропильная и изопропильная.
Используемый в настоящем описании фторированный C1-C3 алкил представляет собой разветвленную или с неразветвленной цепью алкильную группу, содержащую 1, 2 или 3 атома углерода, где, по меньшей мере, один, например 1, 2, 3, 4 или 5, атом водорода или все атомы водорода заменены атомами фтора. Примерами таких групп являются фторметильная, дифторметильная, трифторметильная, 2-фторэтильная, 2,2-дифторэтильная, 2,2,2-трифторэтильная, 1,1,2,2-тетрафторэтильная, 3,3,3-трифторпропильная, 1-метил-2-фторэтильная, 1-метил-2,2-дифторэтильная, 1-метил-2,2,2-трифторэтильная и 1,1,1,3,3,3-гексафторпропан-2-ильная.
Используемый в настоящем описании C1-C2 алкокси представляет собой алкильную группу с неразветвленной цепью, содержащую 1 или 2 атома углерода, которая присоединена к остальной молекуле через атом кислорода. Примерами таких групп являются метокси и этокси.
Используемый в настоящем описании фторированный C1-C2 алкокси представляет собой алкоксигруппу в качестве, как определено выше, где, по меньшей мере, один, например 1, 2, 3, 4 или 5 атомов водорода, заменен атомами фтора. Примерами таких групп являются фторметокси, дифторметокси, трифторметокси, 2-фторэтокси, 2,2-дифторэтокси, 2,2,2-трифторэтокси и 1,1,2,2-тетрафторэтокси.
Первый предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R1 представляет собой водород.
Другой предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R1 представляет собой этил или н-пропил.
Дополнительный предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, где R2 представляет собой метил. В соединениях, где R2 представляет собой метил, атом углерода, который несет R2, создает хиральный центр. Таким образом, конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой метил и где атом углерода, который несет R2, имеет S-конфигурацию. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой метил и где атом углерода, который несет R2, имеет R-конфигурацию.
Подобным образом предпочтительными являются смеси соединений, где атом углерода, который несет R2, имеет S-конфигурацию или R-конфигурацию соответственно. Эти смеси могут содержать равные количества или неравные количества соединения I, которое имеет R-конфигурацию относительно группы CH-R2, и соединения, которое имеет S-конфигурацию относительно CH-R2.
Предпочтительные смеси содержат S-изомер в избытке или являются энантиомерно чистыми относительно CH-R2.
Термин "энантиомерно чистый" означает, что смесь содержит соответствующее соединение в энантиомерном избытке, по меньшей мере 80%, в частности, по меньшей мере, 90% (ee).
Дополнительный предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R2 представляет собой водород.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где R3 выбран из группы, состоящей из водорода, фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси. В частности, R3 выбирают из водорода, метила или метокси. Особенно предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R3 представляет собой метил. Дополнительный особенно предпочтительный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R3 представляет собой метокси.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где n представляет собой 1.
Особенно предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где n представляет собой 2.
Предпочтение отдано соединениям формулы I, их фармакологически устойчивым солям и их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил. В соединениях по настоящему изобретению атом углерода, который несет R4, создает хиральный центр. Таким образом, конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил, и где атом углерода, который несет R4, имеет S-конфигурацию. Другой конкретный вариант осуществления настоящего изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где R4 представляет собой C1-C2-алкил, в частности метил, и где атом углерода, который несет R4, имеет R-конфигурацию.
Подобным образом предпочтительными являются смеси соединений, где атом углерода, который несет R4, имеет S-конфигурацию или R-конфигурацию соответственно. Эти смеси могут содержать равные количества или неравные количества соединения I, которое имеет R-конфигурацию относительно группы CH-R2, и соединения, которое имеет S-конфигурацию относительно CH-R4. Предпочтительные смеси содержат один S-изомер в избытке или являются энантиомерно чистыми относительно CH-R4.
Термин "энантиомерно чистый" означает, что смесь содержит соответствующее соединение в энантиомерном избытке, по меньшей мере, 80%, в частности, по меньшей мере, 90% (ee).
Особенно предпочтительный вариант осуществления Ia изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 1.
Дополнительный особенно предпочтительный вариант осуществления Ib изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 2.
Дополнительный особенно предпочтительный вариант осуществления Ic изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой метил;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 0.
Соединения вариантов осуществления Ia, Ib и Ic имеют два хиральных центра и таким образом могут существовать в четырех разных стереоизомерных формах, а именно в форме
1. RR-соединения, где оба атома: атом углерода, несущий радикал R4, и атом углерода, несущий радикал R2, имеют R-конфигурацию,
2. SS-соединения, где оба атома: атом углерода, несущий радикал R4, и атом углерода, несущий радикал R2, имеют S-конфигурацию,
3. RS-соединения, где атом углерода, несущий радикал R4, имеет R-конфигурацию, в то время как атом углерода, несущий радикал R2, имеет S-конфигурацию, и
4. SR-соединения, где атом углерода, несущий радикал R4, имеет S-конфигурацию, в то время как атом углерода, несущий радикал R2, имеет R-конфигурацию.
Соединения вариантов осуществления Ia, Ib и Ic могут присутствовать в виде диастереомерных смесей, где RR-, SS-, RS- и SR-соединения могут присутствовать в равных или неравных количествах, как энантиомерные (рацемические или нерацемические) смеси, т.е. в виде смеси RR-соединения с SS-соединением или в виде смеси RS-соединения с SR-соединением, а также в форме чистых диастереомеров. Термин "чистый диастереомер" означает, что соответствующий диастереомер состоит из, по меньшей мере, на 80% и особенно, по меньшей мере, на 90% соответствующего соединения I, т.е. другие диастереомеры присутствуют в количествах, меньших чем 20%, в частности меньших чем 10%, из расчета на общее количество соединения I.
Примеры соединений варианта осуществления Ia включают 4-(2,2-Дифтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в качестве диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в качестве смеси RS-соединения с SR-соединением.
Примеры соединений варианта осуществления Ib включают 4-(2-Фтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в виде диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в качестве смеси RS-соединения с SR-соединением.
Примеры соединений варианта осуществления Ic включают 4-(2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-(3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых стереоизомеров, а именно:
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((S)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид, или
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-[2-метил-6-((R)-3-метил-пиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид,
или в виде диастереомерных смесей RR-, SS-, RS- и SR-соединения или в виде энантиомерной (рацемической или нерацемической) смеси RR-соединения с SS-соединением или в виде смеси RS-соединения с SR-соединением.
Дополнительный особенно предпочтительный вариант осуществления Id изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 1.
Дополнительный особенно предпочтительный вариант осуществления Ie изобретения относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 2.
Дополнительный особенно предпочтительный вариант осуществления If изобретение относится к соединениям формулы I, к их фармакологически устойчивым солям и к их N-оксидам, где
R1 представляет собой водород;
R2 представляет собой водород;
R3 выбран из группы, состоящей из фтора, хлора, метила, фторированного C1-алкила, такого как трифторметил, метокси и фторированного C1-алкокси, такого как дифторметокси и трифторметокси, и где R3 представляет собой, в частности, метил;
R4 представляет собой C1-C2-алкил, в частности метил; и
где переменная n представляет собой 0.
Соединения вариантов осуществления Id, Ie и If могут присутствовать в виде рацемических или нерацемических смесей R-энантиомера с S-энантиомером, а также в форме чистого энантиомера. Термин "чистый энантиомер" означает, что соответствующий энантиомер состоит, по меньшей мере, на 80% и особенно, по меньшей мере, на 90% соответствующего соединения I, т.е. другой энантиомер присутствует в количествах, меньших чем 20%, в частности меньших чем 10%, из расчета на общее количество соединения I.
Примеры соединений варианта осуществления Id включают 4-(2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
4-((S)-2,2-Дифтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Id дополнительно включают 4-(2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Ie включают 4-(2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления Ie дополнительно включают 4-(2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления If включают 4-(2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
4-((R)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид,
4-((S)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид или в виде смеси R- и S-энантиомера.
Примеры соединений варианта осуществления If дополнительно включают N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамид и их фармакологически устойчивые соли. Это соединение может присутствовать в виде чистых энантиомеров, а именно:
N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((R)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид,
N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид.
Соединения I по изобретению получают по аналогии со способами, известными из литературы. Важный подход к соединениям по изобретению предлагается реакцией 2-(пиперазин-1-ил)-5-аминопиридинового соединения II с производным бензолсульфоновой кислоты III, как показано на схеме 1.
Схема 1:
На схеме 1 n, R2, R3 и R4 имеют ранее указанные значения. Ra представляет собой защитную группу азота или выбрана из линейного C1-C3 алкила и фторированного линейного C1-C3 алкила. Подходящие N-защитные группы описаны, например, в PJ. Kocienski "Protecting Groups", 2nd ed., Georg Thieme Verlag, Stuttgart 2000, pp 186-237 и в указанной в настоящем документе литературе. Предпочтительными примерами N-защитных групп являются, например оксикарбонильные группы, такие как C1-C6-алкоксикарбонильная, например, метоксикарбонильная, этоксикарбонильная и Boc (третбутоксикарбонильная) и другие оксикарбонильные группы, такие как бензилоксикарбонильная (Cbz), аллилоксикарбонильная, 9-флуоренилметоксикарбонильная (Fmoc) и 2-триметилсилилэтоксикарбонильная (Teoc) или 2-пропенильная (аллил). X представляет собой нуклеофильно замещаемую уходящую группу, в частности атом галогена и, особенно, хлора или брома.
Соединения формулы IV, где Ra представляет собой защитную группу азота, в частности C1-C6-алкоксикарбонильную группу, такую как метоксикарбонильную, этоксикарбонильную и Boc (третбутоксикарбонильная), являются новыми и таким образом также образуют часть настоящего изобретения.
Соединения формулы IV, где Ra представляет собой линейный C1-C3 алкил или фторированный линейный C1-C3 алкил, относятся к соединениям I, где R1 представляет собой линейный C1-C3 алкил или фторированный линейный C1-C3 алкил.
Реакция, указанная на схеме 1, проходит при условиях реакции, которые общеприняты для получения арилсульфонамидных соединений или арилсульфоновых сложных эфиров соответственно и которые описаны, например, в J. March, Advanced Organic Chemistry, 3rd edition, John Wiley & Sons, New York, 1985, p 444 и указанной в настоящем документе литературе, European J. Org. Chem. 2002 (13), pp. 2094-2108, Tetrahedron 2001, 57 (27) pp. 5885-5895, Bioorganic and Medicinal Chemistry Letters, 2000, 10(8), pp. 835-838 and Synthesis 2000 (1 ), pp. 103-108.
Реакцию обычно проводят в инертном растворителе, например в простом эфире, таком как диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран, галогеноуглеводороде, таком как дихлорметан, алифатическом или циклоалифатическом углеводороде, таком как пентан, гексан или циклогексан, или ароматическом углеводороде, таком как толуол, ксилен, кумол и подобные, или в смеси вышеупомянутых растворителей.
Реакцию соединения II с соединением III обычно проводят в присутствии вспомогательного основания. Подходящими основаниями являются неорганические основания, такие как карбонат натрия или карбонат калия или гидрокарбонат натрия или гидрокарбонат калия, и органические основания, например триалкиламины, такие как триэтиламин, или пиридиновые соединения, такие как пиридин, диметилпиридин и подобные. Последние из упомянутых соединений можно в то же время использовать в качестве растворителей. Вспомогательные основания обычно применяют, по меньшей мере, в эквимолярных количествах из расчета на соединение амина II.
Реакция соединения II с соединением III приводит к соединению IV, с которого в случае, если Ra представляет собой N-защитную группу, снимают защитную группу с получением соединения общей формулы I, где R1 представляет собой водород. Снятие защитной группы соединения IV может быть достигнуто стандартными способами, например, с помощью способов, описанных в PJ. Kocienski "Protecting Groups", 2nd ed., Georg Thieme Verlag, Stuttgart 2000, pp 186-237, и в указанной в настоящем документе литературе. Общепринятые способы могут быть затем использованы для реакции этих соединений с алкилирующим агентом R1'-Z, в котором R1' представляет собой C1-C3-алкил или фторированный C1-C3-алкил, и Z представляет собой нуклеофильно замещаемую уходящую группу (например, галоген, такой как хлор, бром или йод), с получением соединения I, в котором R1 представляет собой C1-C3-алкил или фторированный C1-C3-алкил. Условия реакции, необходимые для этого, раскрыты, например, в WO 02/83652, Tetrahedron 2000, 56(38) pp. 7553-7560 и Synlett. 2000 (4), pp. 475-480.
Соединения общей формулы II сами по себе известны или могут быть получены способом, показанным на схеме 2.
Схема 2:
На схеме 2 Ra, R2, и R3 имеют ранее указанные значения. Y представляет собой нуклеофильно замещаемую уходящую группу, в частности атом галогена, например хлор или бром, или алкилсульфонильную группу, например метилсульфонил.
Реакция, показанная на стадии a) схемы 2, проходит при условиях реакции, которые являются общепринятыми для нуклеофильного замещения на ароматический радикал и которые описаны, например, в Tetrahedron 1999, 55(33), pp. 10243-10252, J. Med. Chem. 1997, 40(22), pp. 3679-3686 и Synthetic Communications, 1993, 23(5), pp. 591-599. По необходимости, может быть выгодным преобразовать кольцевой атом азота в пиридиновом кольце в его N-оксид (смотри, например, Angew. Chem. Int. Ed. Engl., 2002 41(11), pp. 1937-1940, J. Med. Chem. 1985, 28(2), pp. 248-252 и Tetrahedron Lett. 2002 43(17) pp. 3121-3123). В связи с последующим восстановлением нитрогруппы в VII (стадия b) N-оксидная группа также восстанавливается. Для этого восстановление проводят, например, в присутствии солей индия.
Если Y в соединении VI представляет собой бром, сопряжение на стадии a) схемы 2 может также быть достигнуто при катализе на палладии в присутствии вспомогательного основания, например карбоната щелочного металла, такого как карбонат цезия. Особенно подходящими палладиевыми катализаторами в этой связи являются соединения палладия (0) или соединения палладия, которые способны образовать соединение палладия (0) при условиях реакции, например дихлорид палладия, тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0), преимущественно в комбинации с фосфиновыми лигандами, например, триарилфосфины, такие как трифенилфосфин, триалкилфосфины, такие как трибутилфосфин, и циклоалкилфосфины, такие как трициклогексилфосфин, и, особенно, используя фосфиновые хелатные лиганды, такие как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил. Условия, которые являются необходимыми для реакций этой природы, описаны, например, в Tetrahedron Lett. 2001, 42(22), p. 3681 и Tetrahedron Lett. 2002, 43(12), pp. 2171-2173.
На стадии b) нитрогруппу в соединении VII восстанавливают до NH2 группы с получением соединения II. Условия реакции, которые являются необходимыми для стадии b), относятся к общепринятым условиям для восстановления ароматических нитрогрупп, которые широко были описаны в литературе (смотри, например, J. March, Advanced Organic Chemistry, 3rd ed., J. Wiley & Sons, New-York, 1985, p. 1183 и литературу, указанную в этой ссылке). Восстановление может быть достигнуто, например, с помощью взаимодействия нитросоединения VII с помощью металла, такого как железо, цинк или олово, при кислотных условиях реакции, т.е. используя образующийся водород или используя сложный гидрид, такой как литийалюмогидрид или боргидрид натрия, предпочтительно в присутствии соединений переходного металла никеля или кобальта, таких как NiCl2(P(фенил)3)2 или CoCl2,(смотри Ono et al. Chem. Ind. (London), 1983 p.480), или используя NaBH2S3 (смотри Lalancette et al. Can. J. Chem. 49, 1971, p. 2990), делая возможным проведение этих восстановлений в зависимости от конкретного реагента в веществе или в растворителе или разбавителе. С другой стороны, восстановление VII до II может быть проведено с помощью водорода в присутствии катализатора переходного металла, например, используя водород в присутствии катализаторов, основанных на платине, палладие, никеле, рутении или родии. Катализаторы могут содержать переходный металл в элементарной форме или в форме сложного соединения, соли или оксида переходного металла, делая возможным, для цели изменения активности, использование общепринятых со-лигандов, например органических фосфиновых соединений, таких как трифенилфосфин, трициклогексилфосфин или три-н-бутилфосфины или фосфиты. Катализатор обычно применяют в количествах от 0,001 до 1 моль на моль соединения VII, рассчитанные на металл катализатора. В предпочтительном варианте восстановление осуществляют, используя хлорид олова (II) по аналогии со способами, описанными в Bioorganic and Medicinal Chemistry Letters, 2002, 12(15), pp. 1917-1919 и J. Med. Chem. 2002, 45(21), pp. 4679-4688. Реакцию VII с хлоридом олова (II) предпочтительно проводят в инертном органическом растворителе, предпочтительно спирте, таком как метанол, этанол, изопропанол или бутанол.
N-оксиды соединения формулы I могут быть получены с помощью обработки соединения формулы I окисляющим агентом, в частности неорганическим или органическим пероксидом или гидропероксидом, таким как пероксид водорода, или перкарбоновыми кислотами, такими как надуксусная кислота, надбензойная кислота или м-хлорпербензойная кислота.
Если не указано другого, вышеописанные реакции в основном проводят в растворителе при температурах между комнатной температурой и температурой кипения используемого растворителя. С другой стороны, энергия активации, которая необходима для реакции, может быть введена в реакционную смесь, используя микроволны, некоторые из которых, оказывается, имеют значение, в частности в случае, если реакции катализируются с помощью переходных металлов (относительно реакций, использующих микроволны, смотри Tetrahedron 2001, 57, p. 9199 ff. p. 9225 ff., а также, в общем случае, "Microwaves in Organic Synthesis", Andre Loupy (Ed.), Wiley-VCH 2002).
Примерами растворителей, которые могут быть использованы, являются простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, метил-трет-бутиловый эфир или тетрагидрофуран, апротонные полярные растворители, такие как диметилформамид, диметилсульфоксид, диметоксиэтан и ацетонитрил, ароматические углеводороды, такие как толуол и ксилен, кетоны, такие как ацетон или метилэтилкетон, галогенуглеводороды, такие как дихлорметан, трихлорметан и дихлорэтан, сложные эфиры, такие как этилацетат и метилбутират, карбоновые кислоты, такие как уксусная кислота или пропионовая кислота, и спирты, такие как метанол, этанол, н-пропанол, изопропанол и бутанол.
Если необходимо, возможно присутствие основания, чтобы нейтрализовать протоны, которые высвобождаются в реакциях. Подходящие основания включают неорганические основания, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия или гидрокарбонат калия, алкоксиды, такие как метоксид натрия или этоксид натрия, гидриды щелочных металлов, такие как гидрид натрия, органометаллические соединения, такие как бутиллитиевые соединения или алкилмагниевые соединения, и органические азотные основания, такие как триэтиламин или пиридин. Последние из упомянутых соединений можно в то же время использовать в качестве растворителей.
Сырой продукт выделяют общепринятым способом, как, например, с помощью фильтрования, дистилляции растворителя или экстракцией из реакционной смеси и т.д. Полученные соединения могут быть очищены общепринятым способом, как, например, с помощью перекристаллизации из растворителя, посредством хроматографии или посредством превращения в кислотно-аддитивную соль.
Кислотно-аддитивные соли получают общепринятым способом с помощью смешивания свободного основания с соответствующей кислотой, где приемлемо в растворе в органическом растворителе, как, например, низшем спирте, таком как метанол, этанол, н-пропанол или изопропанол, простом эфире, таком как метил-трет-бутиловый эфир или диизопропиловый эфир, кетоне, таком как ацетон или метилэтилкетон, или сложном эфире, таком как этилацетат. Например, свободное основание формулы I и подходящие количества соответствующей кислоты, такие как от 1 до 4 молей на моль формулы I, растворимы в подходящем растворителе, предпочтительно в низшем спирте, таком как метанол, этанол, н-пропанол или изопропанол. Нагрев может быть применен для растворения твердых веществ, если необходимо. Растворители, где кислотно-аддитивная соль I нерастворима (антирастворители), могут быть добавлены для осаждения соли. Подходящие антирастворители включают C1-C4-алкил-сложные эфиры C1-C4-алифатические кислоты, такие как этилацетат, алифатические и циклоалифатические углеводороды, такие как гексан, циклогексан, гептан, и т.д., ди-C1-C4-алкил-сложные эфиры, такие как метил-трет-бутиловый эфир или диизопропиловый эфир. Часть или весь антирастворитель может быть добавлен к горячему раствору соли, и таким образом полученный раствор охлаждают; остаток антирастворителя затем добавляют до тех пор, пока концентрация соли в маточном растворе не будет низкой, как приблизительно 10 мг/л или ниже.
Соединения по изобретению формулы I являются поразительно весьма селективными лигандами дофаминового рецептора D3. Благодаря своей низкой аффиности по отношению к другим рецепторам, таким как D1 рецепторы, D4 рецепторы, α1-адренорецептор и/или α2-адренорецептор, мускариновые рецепторы, гистаминовые рецепторы, опиатные рецепторы и, в особенности, дофаминовые рецепторы D2, можно ожидать, что соединения вызовут меньше побочных эффектов, чем классические нейролептики, которые являются антагонистами рецептора D2.
Высокая афинность соединений по изобретению в отношении рецептора D3 выражается в очень низких значениях Ki in-vitro в, как правило, меньше чем 60 нМ (нмоль/л), предпочтительно меньше чем 30 нМ и, в частности, меньше чем 20 нМ. Замещение [125I]иодосульпридом может, например, быть использовано в изучениях связывания рецептора для определения аффиности связывания для рецептора D3ов.
Селективность соединений по изобретению в отношении D2 рецептора относительно рецептора D3, выраженная как Ki(D2)/Ki(D3), равна, как правило, по меньшей мере, 20, предпочтительно, по меньшей мере, 40. Замещение [3H]SCH23390, [125I]иодосульпридом или [125I]спипероном может быть использовано, например, при проведении исследований связывания рецептора на D1, D2 и D4 рецепторах.
Благодаря своему профилю связывания настоящие соединения могут быть использованы для лечения заболеваний или расстройств, которые восприимчивы к лигандам дофамина D3, то есть можно ожидать, что они должны быть эффективными для лечения тех медицинских расстройств или заболеваний, в которых проявление воздействия (модулирование) на дофаминовые рецепторы D3 приводит к улучшению клинической картины или лечимого заболевания. Примерами этих заболеваний являются расстройства или заболевания центральной нервной системы.
Под расстройствами или заболеваниями центральной нервной системы понимаются расстройства, которые действуют на спинной мозг и, в частности, мозг. В пределах значения изобретения термин "расстройства" означает нарушения и/или аномалии, которые, как правило, рассматривают как патологические состояния или функции и которые могут обнаруживать себя в виде особых знаков, симптомов и/или дисфункций. В то время как лечение по изобретению может быть направлено на индивидуальное расстройство, то есть аномалии или патологические состояния, также возможно для некоторых аномалий, которые могут являться причиной болезни друг для друга, объединение в модели болезни или синдромы, которые могут быть вылечены в соответствии с изобретением.
Расстройствами, которые могут быть вылечены в соответствии с изобретением, являются, в частности, психиатрические и неврологические нарушения. Эти нарушения включают, в частности, органические нарушения, включая симптоматические нарушения, такие как психозы острого экзогенного типа, реакции или сопутствующие психозы органической или экзогенной причины, как, например, в связи с метаболическими нарушениями, инфекциями и патологиями эндокринной системы; экзогенные психозы, такие как шизофрения и шизотипные и иллюзорные нарушения; эмоциональные потрясения, такие как депрессии, большое депрессивное расстройство, мания и/или маниакально-депрессивные состояния; смешенные формы вышеописанных нарушений; невропатические и соматоформные нарушения и также нарушения в связи со стрессом; диссоциированные нарушения, такие как потеря сознания, помрачение сознания, раздвоение сознания и личностные нарушения; аутизм; нарушения внимания и режима бодрствования/сна, такие как поведенческие нарушения и эмоциональные нарушения, чье появление относится к детству и юности, как, например, повышенная активность у детей, умственные нарушения, такие как нарушения внимания (расстройства, связанные с дефицитом внимания с (или без) повышенной активностью), нарушения памяти и когнитивные нарушения, такие как нарушение обучения и памяти (нарушенная когнитивная функция), слабоумие, наркомания и нарушения сна, такие как синдром усталых ног; нарушение развития; состояния беспокойства; бредовое состояние; сексуальные нарушения, такие как импотенция у мужчин; нарушения питания, такие как анорексия или булемия; зависимость; биполярное расстройство и другие точно неустановленные психиатрические нарушения.
Расстройства, которые могут быть вылечены в соответствии с изобретением, также включают болезнь Паркинсона и эпилепсию и, в частности, эмоциональные потрясения, связанные с ней.
Также лечению поддаются заболевания, вызывающие зависимость (наркотическую зависимость и токсикоманию), то есть психические расстройства и поведенческие нарушения, которые вызваны злоупотреблением психотропных веществ, таких как фармацевтические препараты или наркотики, и также другие зависимые поведения, такие как игорная зависимость и/или расстройства контроля над побуждениями, не отнесенные к другим категориям. Примеры веществ, вызывающих зависимость, включают опиоиды, такие как морфин, героин и кодеин; кокаин; никотин; спирт; вещества, которые взаимодействуют с комплексом ГАМК - канал-переносчик для ионов хлора; седативные средства, снотворные средства и транквилизаторы, как, например, бензодиазепины; ЛСД; каннабиноиды; психомоторные стимуляторы, такие как 3,4-метилендиокси-N-метиламфетамин (экстази); амфетамин и амфетаминподобные вещества, такие как метилфенидат; и другие стимуляторы, включая кофеин. Вещества, вызывающие зависимость, которые особенно принимают во внимание, представляют собой опиоиды, кокаин, амфетамин или амфетаминподобные вещества, никотин и спирт.
Относительно лечения заболеваний, связанных с зависимостью, особое предпочтение отдано тем соединениям по изобретению формулы I, которые сами по себе не обладают каким-либо психотропным воздействием. Это также можно наблюдать в исследовании, используя крыс, которые, после введения им соединений, которые могут быть использованы в соответствии с изобретением, уменьшили самостоятельное потребление психотропных веществ, например кокаина.
В соответствии с другим аспектом настоящего изобретения соединения по изобретению являются пригодными для лечения расстройств, чьи причины можно, по меньшей мере частично, отнести к аномальной активности дофаминовых рецепторов D3.
В соответствии с другим аспектом настоящего изобретения лечение направлено, в частности, на те расстройства, которые могут находиться под влиянием, в смысле рационального медицинского лечения, связывания предпочтительно экзогенно вводимых партнеров (лигандов), связывающихся с дофаминовыми рецепторами D3.
Заболевания, которые могут быть вылечены с помощью соединений по изобретению, часто характеризуют с помощью прогрессивного развития, то есть вышеописанные состояния меняются с течением времени; как правило, тяжесть возрастает, и условия могут, вероятно, накладываться друг на друга, или другие условия могут появляться в дополнение к уже существующим.
Соединения по изобретению могут быть использованы для лечения большого числа явлений, симптомов и/или дисфункций, которые связаны с расстройствами центральной нервной системы и, в частности, с вышеупомянутыми состояниями. Эти явления, симптомы и/или дисфункции включают, например, нарушенные отношения к реальности, отсутствие адекватной самооценки и способности принять общепринятые общественные нормы или требования, поставленные жизнью, изменения темперамента, изменения в самоуправлении, такие как голод, сон, жажда и т.д., и в настроении, нарушения в способности наблюдать и объединять, изменения в личности, в частности эмоциональная неустойчивость, галлюцинации, нарушения эго, встревоженность, раздвоение чувств, аутизм, деперсонализация и ложное восприятие, иллюзорные идеи, бубнеж, отсутствие совместного рефлекторного движения, ходьба короткими шагами, изогнутое положение туловища и конечностей, тремор, отсутствие мимики, монотонная речь, депрессии, апатия, стесненная непосредственность и решительность, скудная ассоциативная способность, беспокойство, нервное возбуждение, заикание, общественные фобии, панические нарушения, синдромы отмены в связи с зависимостью, экспансивные синдромы, состояния возбуждения и помрачения сознания, подавленное настроение, дискинетические синдромы и тиковые расстройства, такие как хорея Гентингтона и Синдром Жиля де ла Туретта, синдромы головокружения, такие как периферическое позиционное, ротационное и осциллирующее головокружение, меланхолия, истерический невроз, ипохондрия и подобные.
В пределах значения изобретения лечение также включает профилактическое лечение (профилактику), в частности, в виде повторной профилактики или периодической профилактики, а также лечение острых или хронических явлений, симптомов и/или дисфункций. Лечение может быть сориентировано симптоматически, как, например, для подавления симптомов. Оно может иметь эффект в течение короткого периода, быть сориентировано в течение среднего срока или может представлять собой лечение в течение длительного периода, как, например, в рамках поддерживающей терапии.
Следовательно, соединения по изобретению предпочтительно пригодны для лечения заболеваний центральной нервной системы, в частности для лечения аффективных расстройств; нервных потрясений, стрессовых потрясений и соматоформных нарушений и психозов, и, в частности, для лечения шизофрении и биполярного расстройства.
Благодаря своей высокой селективности в отношении рецептора D3 соединения I по изобретению являются также пригодными для лечения нарушений функции почки, в частности нарушений функции почки, которые вызваны диабетом (смотри WO 00/67847) и, особенно, диабетической нефропатией.
Кроме того, соединения по настоящему изобретению могут обладать другими фармакологическими и/или токсикологическими свойствами, которые делают их особенно пригодными для разработки в качестве фармацевтических препаратов. В качестве примера, ожидается, что соединения формулы I, обладающие низкой аффиностью в отношении HERG рецептора, имеют пониженную вероятность стимулирования QT-пролонгации (рассматривают в качестве одного показателя риска, вызывающего аритмию сердца) (для обсуждения QT-пролонгации смотри, например, A. Cavalli et al., J. Med. Chem. 2002, 45:3844-3853 и указанную в настоящем документе литературу; анализ HERG доступен платно у GENION Forschungsgesellschaft GmbH, Hamburg, Germany).
В рамках лечения применение в соответствии с изобретением описанных соединений включает способ. В этом способе эффективное количество одного или более соединений, как правило, составленное в соответствии с фармацевтической и ветеринарной практикой, вводят индивидууму, которого необходимо лечить, предпочтительно млекопитающему, в частности человеку, продуктивному животному или домашнему животному. Показано ли такое лечение и в какой форме оно должно иметь место, зависит от индивидуального случая и представляет собой предмет медицинского обследования (диагноз), который принимает во внимание явления, симптомы и/или дисфункции, которые присутствуют, риски развития конкретных явлений, симптомов и/или дисфункций и другие факторы.
Как правило, лечение осуществляют посредством однократного или повторяющегося ежедневно введения, где приемлемо совместно или при чередовании с другими активными соединениями или препаратами, содержащими активное соединение, таким образом, чтобы ежедневную дозу предпочтительно от приблизительно 0,01 до 1000 мг/кг, более предпочтительно от 0,1 до 1000 мг/кг веса тела, в случае перорального введения, или от приблизительно 0,01 до 100 мг/кг, более предпочтительно от 0,1 до 100 мг/кг веса тела, в случае парентерального введения, вводили индивидууму, которого необходимо лечить.
Изобретение также относится к получению фармацевтических композиций для лечения индивидуума, предпочтительно млекопитающего и, в частности, человека, сельскохозяйственного животного или домашнего животного. Таким образом, соединения обычно вводят в форме фармацевтических композиций, которые включают фармацевтически приемлемый эксципиент совместно с, по меньшей мере, одним соединением по изобретению и, где приемлемо, другими активными соединениями. Эти композиции можно, например, вводить перорально, ректально, вагинально, трансдермально, подкожно, внутривенно, внутримышечно или через нос.
Примерами подходящих фармацевтических составов являются твердые медицинские формы, такие как порошки, гранулы, таблетки (в частности, таблетки, покрытые пленочной оболочкой), таблетки для рассасывания, саше, капсулы для приема лекарств, таблетки, покрытые сахаром, капсулы, такие как твердые желатиновые капсулы и мягкие желатиновые капсулы; суппозитории или вагинальные медицинские формы; полутвердые медицинские формы, такие как мази, кремы, гидрогели, пасты или гипс; и также жидкие медицинские формы, такие как растворы, эмульсии (в частности, эмульсии масло-в-воде), суспензии, такие как лосьоны, препараты для введения и препараты для инфузии, капли в нос и капли для ушей. Имплантированные спусковые устройства также могут быть использованы для введения ингибиторов по изобретению. Кроме того, также возможно использовать липосомы или микросферы.
При получении композиций соединения по изобретению обычно смешивают или разбавляют эксципиентом. Эксципиенты могут представлять собой твердые, полутвердые или жидкие материалы, которые используют в качестве средств для переноса носителей или среды для активного соединения.
Подходящие эксципиенты перечислены в медицинских монографиях специалистов. Кроме того, составы могут включать фармацевтически приемлемые носители или общепринятые вспомогательные вещества, такие как вещества, способствующие скольжению; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты; антиоксиданты; антираздражители; хелатирующие агенты; покрывающие вспомогательные вещества; стабилизаторы эмульсии; пленкообразователи; гелеобразователи; агенты, маскирующие запах; улучшители вкуса; смолу; гидроколлоиды; растворители; солюбилизаторы; нейтрализующие агенты; ускорители диффузии; пигменты; соединения четвертичного аммония; повторно обезжиривающие и пережиривающие агенты; сырые материалы для мазей, кремов или масел; силиконовые производные; распределяющиеся вспомогательные вещества; стабилизаторы; стерилизующие средства; суппозиторные основания; вспомогательные вещества для таблетки, такие как связующие вещества, наполнители, вещества, способствующие скольжению, разрыхлители или покрытия; пропелленты; осушивающие вещества; замутнители; загустители; воски; пластификаторы и белые минеральные масла. Состав в этой связи основан на знании специалиста, как описано, например, в Fiedler, H. P., Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete [Encyclopedia of auxiliary substances for pharmacy, cosmetics and related fields], 4th edition, Aulendorf: ECV-Editio-Kantor-Verlag, 1996.
Следующие примеры служат для объяснения изобретения без его ограничения.
Соединения характеризовали или через протонный ЯМР в d6-диметилсульфоксиде или d-хлороформе на ЯМР приборе (Bruker AVANCE) при 400 MHz или 500 MHz, или с помощью масс-спектрометрии, в основном записанной через ВЭЖХ-МС в быстром градиенте на C18-материале (режим электрораспылительной ионизации (ESI)), или по температуре плавления.
Спектральные свойства магнитного ядерного резонанса (ЯМР) относятся к химическим сдвигам (δ), выраженным в миллионных долях (м.д.). Относительная площадь сдвигов в 1H ЯМР спектре соответствует числу атомов водорода для конкретного функционального типа в молекуле. Природа сдвига, что касается мультиплетности, указана как синглет (с), уширенный синглет (уш.с), дублет (д), уширенный дублет (уш.д), триплет (т), уширенный триплет (уш.т), квартет (кв), квинтет (квин) и мультиплет (м).
Примеры получения:
I. Получение промежуточного соединения IV
Пример получения 1: третбутиловый эфир (R)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфонил-амино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
1.1 (R)-2-Метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин
0,72 г (R)-2-метилпиперазина (4,17 ммоль) растворяли в 10 мл N,N-диметилформамида. Добавляли 1,165 г карбоната калия (8,43 ммоль) и 0,44 г 6-хлор-2-метил-3-нитропиридина, и смесь перемешивали в течение 16 ч при комнатной температуре. Растворитель упаривали при пониженном давлении, и остаток разделяли между водой и диэтиловым эфиром. Водный слой экстрагировали с помощью диэтилового эфира, и объединенные органические фазы промывали водой, сушили над сульфатом натрия, фильтровали, и фильтрат упаривали досуха с получением 0,85 г указанного в заголовке соединения.
ESI-МС: 237,1 [M+Н]+
1.2 Третбутиловый эфир (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты
0,85 г (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазина (3,6 ммоль) растворяли в 12 мл тетрагидрофурана. Добавляли раствор 0,775 г дитретбутилдикарбоната (0,355 ммоль) в 3 мл тетрагидрофурана и 1,5 мл триэтиламина. Смесь перемешивали в течение 3 ч при комнатной температуре, растворитель упаривали, и остаток повторно растворяли в диэтиловом эфире, и раствор промывали дважды с помощью разбавленного водного раствора хлорида аммония. Органическую фазу сушили над сульфатом натрия, фильтровали, и фильтрат упаривали досуха с получением 1,2 г указанного в заголовке продукта.
ESI-МС: 337,1 [M+Н]+
1.3 третбутиловый эфир (R)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты
1,2 г третбутилового эфира (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты (3,57 ммоль) растворяли в 20 мл этилацетата. Добавляли 10% Pd на углероде и 3 мл уксусной кислоты, и смесь гидрировали в течение 4 ч при 50ºC до завершения. Катализатор отфильтровывали, и фильтрат упаривали досуха. Остаток обрабатывали водой, и pH доводили до pH 8-9 с помощью 1 N водного раствора гидроксида натрия.
Водную фазу экстрагировали дважды с помощью дихлорметана, органические экстракты сушили над сульфатом натрия, фильтровали, и фильтрат упаривали досуха. Сырой продукт очищали с помощью хроматографии на силикагеле, используя прибор ISCO CompanionTM (дихлорметан-этилацетат 0-50%) с получением 0,88 г указанного в заголовке продукта.
ESI-МС: 307,2 [M+Н]+
1.4 третбутиловый эфир (R)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
0,105 г третбутилового эфира (R)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты (0,34 ммоль) и 0,085 г ((S)-2-фтор-1-метилэтил)-бензолсульфонилхлорида (0,36 ммоль) растворяли в 5 мл пиридина, и раствор перемешивали в течение 1 ч при комнатной температуре. Растворитель упаривали при пониженном давлении, остаток обрабатывали с помощью диэтилового эфира. Органические фазы впоследствии промывали дважды с помощью разбавленного водного хлорида аммония и водой. Органическую фазу сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении. Сырой продукт очищали с помощью хроматографии на силикагеле, используя хроматографическую систему ISCO Companion (циклогексан-этилацетат 15-40%) с получением 0,162 г продукта.
ESI-МС: 507,2 [M+Н]+
Пример получения 2: третбутиловый эфир (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
2.1 (S)-2-Метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин
0,72 г (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин получали, как описано в примере получения 1,1 для синтеза (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазина.
ESI-МС: 237,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 8,2 (д, 1Н), 6,45 (д, 1Н), 4,3-4,45 (м, 2H), 3,1 (м, 1Н), 3,0 (м, 1Н), 2,7-2,95 (м, 2H), 2,75 (с, 3H), 2,65 (м, 1Н), 1,15 (с, 3H).
2.2 Третбутиловый эфир (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты
1,13 г третбутилового эфира (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты получали, как описано в примере получения 1,2 для синтеза третбутилового эфира (R)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты.
ESI-МС: 337,2 [M+Н]+
2.3 третбутиловый эфир (S)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты третбутиловый эфир
1,13 г третбутилового эфира (S)-2-метил-4-(6-метил-5-нитропиридин-2-ил)-пиперазин-1-карбоновой кислоты (3,36 ммоль) растворяли в 65 мл метанола и 5 мл этилацетата, и раствор подвергали гидрированию в H-cubeTM (Thalos Ltd.) при 40ºC (скорость потока 1 мл/мин). Растворители удаляли при пониженном давлении, и остаток очищали с помощью хроматографии на силикагеле, используя прибор ISCO CompanionTM (дихлорметан-этилацетат 0-45%) с получением 0,58 г указанного в заголовке продукта.
ESI-МС: 307,2 [M+Н]+
2.4 Третбутиловый эфир (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
0,105 г третбутилового эфира (S)-2-метил-4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты (0,34 ммоль) и 0,085 г ((S)-2-фтор-1-метилэтил)-бензолсульфонилхлорида (0,36 ммоль) растворяли в 5 мл пиридина, и раствор перемешивали в течение 1 ч при комнатной температуре. Растворитель упаривали при пониженном давлении, остаток обрабатывали с помощью диэтилового эфира. Органические фазы впоследствии промывали дважды с помощью разбавленного водного хлорида аммония и водой. Органическую фазу сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении. Сырой продукт очищали с помощью хроматографии на силикагеле, используя хроматографическую систему ISCO Companion (циклогексан-этилацетат 15-40%) с получением 0,162 г продукта.
ESI-МС: 507,2 [M+Н]+
Пример получения 3: третбутиловый эфир (S)-4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2,4 с получением 0,194 г продукта.
ESI-МС: 507,2 [M+Н]+
Пример получения 4: третбутиловый эфир 4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты
4.1 третбутиловый эфир 4-(6-метил-5-аминопиридин-2-ил)-пиперазин-1-карбоновой кислоты
Указанное в заголовке соединение получали по аналогии со способами, описанными в примерах получения с 1.1 по 1.3
4.2 третбутиловый эфир 4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2.4.
ESI-МС: 493,2 [M+Н]+
Пример получения 5: третбутиловый эфир 4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2.4.
ESI-МС: 493,2 [M+Н]+
Пример получения 6: третбутиловый эфир (R)-4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты.
Соединение получали, как описано для синтеза третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты в примере получения 2,4.
ESI-МС: 507,2 [M+Н]+
Пример получения 7: третбутиловый эфир 4-{5-[4-(2,2-дифтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты 450 мг, выход 86%.
II. Получение соединений I
Пример 1: 4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
0,162 г третбутилового эфира (S)-4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты (0,32 ммоль) растворяли в 5 мл дихлорметана. К раствору добавляли 1,5 мл 6 N хлороводородной кислоты в изопропаноле. Смесь перемешивали в течение 16 ч при комнатной температуре, и растворитель упаривали. Остаток разбавляли водой, и раствор доводили до pH 8-9 с помощью насыщенного водного бикарбоната натрия. Смесь экстрагировали три раза с помощью диэтилового эфира. Объединенные органические слои промывали водой, сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении. Сырой продукт обрабатывали с помощью 0,3 мл ацетонитрила (содержащего 0,1% трифторуксусной кислоты) и 0,3 мл ацетонитрил/вода (содержащего 0,1% трифторуксусной кислоты). Образовавшийся осадок собирали, промывали с помощью ацетонитрил/вода 1:1 и сушили с получением 0,025 г указанного в заголовке продукта.
ESI-МС: 407,2 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 7,7 (д, 2H), 7,4 (д, 2H), 7,3 d, 1Н), 6,4 (д, 1Н), 4,55 (м, 1Н), 4,4, м, 1Н), 4,1 (т, 2H), 3,15 (м, 1Н), 3,1 (м, 1Н), 2,7-2,95 (несколько м, 3H), 2,4 (т, 1Н), 2,0 (с, 3H), 1,3 (д, 3H), 1,1 (д, 3H).
Пример 2: 4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
0,194 г третбутилового эфира (S)-4-{5-[4-((R)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-2-метилпиперазин-1-карбоновой кислоты (0,38 ммоль) растворяли в 5 мл дихлорметана. К раствору добавляли 1,5 мл 6N хлороводородной кислоты в изопропаноле. Смесь перемешивали в течение 16 ч при комнатной температуре, и растворитель упаривали. Остаток разбавляли водой, и раствор доводили до pH 8-9 с помощью насыщенного водного бикарбоната натрия. Смесь экстрагировали три раза с помощью диэтилового эфира. Объединенные органические слои промывали водой, сушили над сульфатом натрия, фильтровали, и растворитель упаривали при пониженном давлении с получением 0,128 г указанного в заголовке продукта.
ESI-МС: 407,2 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 7,7 (д, 2H), 7,4 (д, 2H), 7,3 д, 1Н), 6,4 (д, 1Н), 4,55 (м, 1Н), 4,4, м, 1Н), 4,1 (т, 2H), 3,15 (м, 1Н), 3,1 (м, 1Н), 2,7-2,95 (несколько м, 3H), 2,4 (т, 1Н), 2,0 (с, 3H), 1,3 (д, 3H), 1,1 (д, 3H).
Если не указано другого, соединения следующих примеров с 3 по 18 получали с помощью по аналогии со способами, раскрытыми в примерах 1 и 2.
Пример 3: 4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
Пример 4: 4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамид
Пример 5: 4-((R)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид
100 мг, выход 99%. ESI-МС: 393,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,24 (д, 3H), 1,98 (с, 3H), 3,16 (м, 4H), 3,23 (м, 1Н), 3,67 (м, 4H), 4,48 (д, 1Н), 4,60 (д, 1Н), 6,66 (д, 1Н), 7,12 (д, 1Н), 7,50 (д, 2H), 7,60 (д, 2H), 9,00 (уш. с, 1Н), 9,43 (с, 1Н).
Пример 6: 4-((S)-2-Фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамид
460 мг, выход 99%. ESI-МС: 393,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,24 (д, 3H), 1,98 (с, 3H), 3,16 (м, 4H), 3,23 (м, 1Н), 3,67 (м, 4H), 4,48 (д, 1Н), 4,60 (д, 1Н), 6,66 (д, 1Н), 7,12 (д, 1Н), 7,50 (д, 2H), 7,60 (д,2H), 9,00 (уш. с, 1Н), 9,43 (с, 1Н).
Пример 7 (сравнительный): N-(5-Бром-2-метил-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2-фтор-1-метилэтил)-бензолсульфонамид
Третбутиловый эфир 4-{5-[4-((S)-2-фтор-1-метилэтил)-бензолсульфониламино]-6-метилпиридин-2-ил}-пиперазин-1-карбоновой кислоты (370 мг, 0,754 ммоль) разбавляли в ацетонитриле (3 мл) и добавляли N-бромсукцинимид (201 мг, 1,13 ммоль). Полученный раствор нагревали при 80ºC при микроволновом излучении в течение 35 минут. Охлажденный раствор затем разделяли между раствором NaHCO3 и дихлорметаном. Органический слой отделяли, сушили (MgSO4), фильтровали и очищали с помощью колоночной хроматографии с получением желаемого продукта. Желтое твердое вещество. Количество 135 мг. Выход 38%.
Характеризовали в виде соли HCl:
ESI-МС: 473,1, 471,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 1,24 (д, 3H), 2,02 (с, 3H), 3,18 (м, 4H), 3,25 (м, 1Н), 3,40 (м, 4H), 4,52 (дд, 2H), 7,39 (с, 1Н), 7,54 (д, 2H), 7,67 (д, 2H), 9,15 (уш. с, 2H), 9,85 (с, 1Н).
Пример 8: 4-(2,2-Дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
420 мг, выход 99%. ESI-МС: 41 1,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 2,00 (с, 3H), 3,28 (м, 5H), 3,79 (м, 4H), 5,97 (тд, 1Н), 6,63 (д, 1Н), 7,22 (д, 1Н), 7,50 (д, 2H), 7,64 (д, 2H).
Пример 9: 4-((S)-2,2-Дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
181 мг, выход 99%. ESI-МС: 411,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 2,00 (с, 3H), 3,28 (м, 5H), 3,79 (м, 4H), 5,97 (тд, 1Н), 6,63 (д, 1Н), 7,22 (д, 1Н), 7,50 (д, 2H), 7,64 (д, 2H).
Пример 10: 4-((R)-2,2-Дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
230 мг, выход 99%. ESI-МС: 41 1,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 2,00 (с, 3H), 3,28 (м, 5H), 3,79 (м, 4H), 5,97 (тд, 1Н), 6,63 (д, 1Н), 7,22 (д, 1Н), 7,50 (д, 2H), 7,64 (д, 2H).
Пример 11: 4-(2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
Характеризовали в виде соли HCl: ESI-МС: 430,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,45 (д, 3H), 1,90 (с, 3H), 3,14 (м, 4H), 3,67 (м, 4H), 4,98 (м, 1Н), 6,68 (д, 1Н), 7,12 (д, 1Н), 7,63 (д, 4H), 8,93 (с, 2H), 9,55 (с, 1Н).
Пример 12: 4-((R)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
420 мг, выход 99%. Характеризовали в виде соли HCl:
ESI-МС: 430,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,45 (д, 3H), 1,90 (с, 3H), 3,14 (м, 4H), 3,67 (м, 4H), 4,98 (м, 1Н), 6,68 (д, 1Н), 7,12 (д, 1Н), 7,63 (д, 4H), 8,93 (с, 2H), 9,55 (с, 1Н).
Пример 13: 4-((S)-2,2,2-Трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
62 мг, выход 47%. Характеризовали в виде соли HCl:
ESI-МС: 430,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,45 (д, 3H), 1,90 (с, 3H), 3,14 (м, 4H), 3,67 (м, 4H), 4,98 (м, 1Н), 6,68 (д, 1Н), 7,12 (д, 1Н), 7,63 (д, 4H), 8,93 (с, 2H), 9,55 (с, 1Н).
Пример 14: 4-((R)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
160 мг, выход 80%. Характеризовали в виде соли HCl:
ESI-МС: 409,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,23 (д, 3H), 3,12 (м, 4H), 3,18 (м, 1Н), 3,35 (с, 3H), 3,67 (м, 4H), 4,52 (дд, 2H), 6,37 (д, 1Н), 7,34 (д, 1Н), 7,45 (д, 2H), 7,59 (д, 2H), 9,28 (м, 3H).
Пример 15: 4-((S)-2-Фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
24 мг, выход 18%. Характеризовали в виде соли HCl:
ESI-МС: 409,1 [M+Н]+
1H-ЯМР (ДМСО-d6, 400 Гц): δ [м.д.] 1,23 (д, 3H), 3,12 (м, 4H), 3,18 (м, 1Н), 3,35 (с, 3H), 3,67 (м, 4H), 4,52 (дд, 2H), 6,37 (д, 1Н), 7,34 (д, 1Н), 7,45 (д, 2H), 7,59 (д, 2H), 9,28 (м, 3H).
Пример 16: 4-(2,2-Дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамид
57 мг, выход 28%. Характеризовали в виде соли HCl:
ESI-МС: 427,1 [M+Н]+
1H-ЯМР (CD3OD, 400 Гц): δ [м.д.] 1,38 (д, 3H), 3,28 (м, 4H), 3,42 (с, 3H), 3,48 (м, 1Н), 3,74 (м, 4H), 5,97 (дт, 1Н), 6,39 (д, 1Н), 7,43 (д, 2H), 7,60 (д, 1Н), 7,65 (д, 2H).
Пример 17: N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамид
42 мг, выход 31%.
ESI-МС: 445,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 1,48 (д, 3H), 3,10 (м, 4H), 3,38 (с, 3H), 3,43 (м, 1Н), 3,59 (м, 4H), 5,20 (уш. с, 2H), 6,17 (д, 1Н), 7,37 (д, 2H), 7,63 (м, 3H).
Пример 18: N-(2-Метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамид
45 мг, выход 62%.
ESI-МС: 445,1 [M+Н]+
1H-ЯМР (CDCl3, 400 Гц): δ [м.д.] 1,48 (д, 3H), 3,10 (м, 4H), 3,38 (с, 3H), 3,43 (м, 1Н), 3,59 (м, 4H), 5,20 (уш. с, 2H), 6,17 (д, 1Н), 7,37 (д, 2H), 7,63 (м, 3H).
III. Примеры форм введения, полученные обработкой растительного и животного сырья
A) Таблетки
Таблетки следующих композиций прессовали на таблеточном прессе общепринятым способом:
40 мг вещества из примера 1
120 мг кукурузного крахмала
13,5 мг желатина
45 мг лактозы
2,25 мг Aerosil® (химически чистая кремниевая кислота в ультрамикроскопической тонкой дисперсии)
6,75 мг картофельный крахмал (в виде 6% пасты)
B) Таблетки, покрытые сахаром
20 мг вещества из примера 1
60 мг основной композиции
70 мг сахарообразующей композиции
Основная композиция состоит из 9 частей кукурузного крахмала, 3 частей лактозы и 1 части сополимера винилпирролидон/винилацетат 60:40. Сахарообразующая композиция состоит из 5 частей тростникового сахара, 2 частей кукурузного крахмала, 2 частей карбоната кальция и 1 части талька. Таблетки, покрытые сахаром, которые получали этим способом, впоследствии предоставляют с покрытием, устойчивым к желудочному соку.
IV. Биологические исследования
Изучения связывания рецептора:
Вещество, которое необходимо исследовать, растворяли или в метанол/Chremophor® (BASF-AG), или в диметилсульфоксиде и затем разбавляли водой до желаемой концентрации.
a) Дофаминовый рецептор D3:
Анализируемая смесь (0,250 мл) состояла из мембран, происходящих из ~106 HEK-293 клеток, обладающих стабильно экспрессирующимися человеческими дофаминовыми рецепторами D3, 0,1 нМ [125I]-иодосульприда и инкубационного буфера (полное связывание) или, кроме того, исследоваемого вещества (кривая ингибирования) или 1 μM спиперона (неспецифическое связывание). Каждую анализируемую смесь использовали трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина, 10 μM хинолона и 0,1% аскорбиновой кислоты (получали свежую ежедневно). Буфер доводили до pH 7,4 с помощью HCl.
b) Дофаминовый рецептор D2L:
Анализируемая смесь (1 мл) состояла из мембран, происходящих из ~106 HEK-293 клеток, обладающих стабильно экспрессирующимися человеческими дофаминовыми рецепторами D2L (длинная изоформа), и 0,01 нМ [125I]иодоспиперона и инкубационного буфера (полное связывание) или, кроме того, исследуемого вещества (кривая ингибирования) или 1 μM галогенперидола (неспецифическое связывание). Каждую анализируемую смесь использовали трижды.
Инкубационный буфер содержал 50 мМ трис, 120 мМ NaCl, 5 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2 и 0,1% бычьего сывороточного альбумина. Буфер доводили до pH 7,4 с помощью HCl.
c) Измерение и анализ:
После инкубирования при 25ºC в течение 60 минут анализируемые смеси фильтровали через Whatman GF/B стекловолокнистый фильтр под вакуумом, используя устройство для сбора клеток. Фильтры переносили на сцинтилляционные виалы, используя систему для переноса фильтров. После добавления 4 мл Ultima Gold® (Packard) образцы встряхивали в течение часа и затем высчитывали радиоактивность в бета-счетчике (Packard, Tricarb 2000 или 2200CA). Значения cpm (число импульсов в минуту) переводили в dpm (число распадов в минуту), используя стандартный порядок гашения и программу, принадлежащую прибору.
Кривые ингибирования анализировали посредством циклического анализа криволинейной регрессии, используя Статистическую Анализирующую Систему (SAS), которая аналогична программе «Ligand», описанной Munson и Rodbard.
В этих исследованиях соединения по изобретению проявляют очень хорошие аффиности в отношении рецептора D3 (<100 нМ, часто <50 нМ, в частности <10 нМ) и селективность связывания с рецептором D3.
Результаты исследований на связывание представлены в Таблице 1.
+++<10 нМ, ++<100 нМ, +<1000 нМ
| Таблица 1 | ||
| Пример | Ki(D3) [нМ] | Селективность в отношении D2L |
| 1 | +++ | >50 |
| 2 | +++ | >50 |
| 5 | +++ | >50 |
| 6 | +++ | >50 |
| 7 сравнительный | + | >10 |
| 8 | +++ | >50 |
| 9 | +++ | >50 |
| 10 | +++ | >50 |
| 11 | +++ | >50 |
| 12 | +++ | >50 |
| 13 | +++ | >50 |
| 14 | +++ | >50 |
| 15 | +++ | >50 |
| 16 | +++ | >50 |
| 17 | +++ | >50 |
| 18 | +++ | >50 |
| *Ki(D2L)/Ki(D3) | ||
Claims (27)
1. N-(6-пиперазин-1-илпиридин-3-ил)бензолсульфонамидные соединения формулы I
где R1 выбран из группы, состоящей из водорода и линейного C1-С3 алкила;
R2 представляет собой водород или метил;
R3 выбран из группы, состоящей из водорода, C1-C2-алкила и С1-С2-алкокси,
R4 представляет собой С1-С2-алкил;
n представляет собой 0, 1 или 2;
и физиологически устойчивые соли этих соединений.
где R1 выбран из группы, состоящей из водорода и линейного C1-С3 алкила;
R2 представляет собой водород или метил;
R3 выбран из группы, состоящей из водорода, C1-C2-алкила и С1-С2-алкокси,
R4 представляет собой С1-С2-алкил;
n представляет собой 0, 1 или 2;
и физиологически устойчивые соли этих соединений.
2. Соединение по п.1, где R1 представляет собой водород.
3. Соединение по п.1 или 2, где R2 представляет собой метил.
4. Соединение по п.3, где атом углерода, который несет R2, имеет S-конфигурацию.
5. Соединение по п.3, где атом углерода, который несет R2, имеет R-конфигурацию.
6. Соединение по п.1 или 2, где R2 представляет собой водород.
7. Соединение по любому из пп.1, 2, 4 или 5, где R3 представляет собой метил.
8. Соединение по любому из пп.1, 2, 4 или 5, где R4 представляет собой метил.
9. Соединение по п.8, где атом углерода, который несет R4, имеет S-конфигурацию.
10. Соединение по п.8, где атом углерода, который несет R4, имеет R-конфигурацию.
11. Соединение по любому из пп.1, 2, 4, 5, 9 или 10, где n представляет собой 1.
12. Соединение по любому из пп.1, 2, 4, 5, 9 или 10, где n представляет собой 2.
13. Соединения по п.1, выбранные из группы, состоящей из:
4-(2-фтор-1-метилэтил)-N-[2-метил-6-(3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-(2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
4-(2-фтор-1-метилэтил)-N-[2-метил-6-(3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-((S)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-((R)-3-метилпиперазин-1-ил)-пиридин-3-ил]-бензолсульфонамида,
4-(2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
4-((S)-2-фтор-1-метилэтил)-N-[2-метил-6-пиперазин-1-илпиридин-3-ил]-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
14. Соединения по п.1, выбранные из группы, состоящей из:
4-(2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
4-(2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2-дифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
15. Соединения по п.1, выбранные из группы, состоящей из:
4-(2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
4-(2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2,2-трифтор-1-метилэтил)-N-(2-метил-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
16. Соединения по п.1, выбранные из группы, состоящей из:
4-(2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсуль фонамида,
4-((S)-2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-(2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-((R)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
4-(2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсуль фонамида,
4-((S)-2-фтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-(2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((S)-2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
4-((R)-2,2-дифтор-1-метилэтил)-N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-(2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-((S)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
N-(2-метокси-6-пиперазин-1-илпиридин-3-ил)-4-((R)-2,2,2-трифтор-1-метилэтил)-бензолсульфонамида,
и физиологически устойчивые соли этих соединений.
17. Фармацевтическая композиция, включающая, по меньшей мере, одно соединение, обладающее активностью и селективностью в отношении дофаминового рецептора D3, по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16, необязательно совместно с, по меньшей мере, одним физиологически приемлемым носителем или вспомогательным веществом.
18. Соединение по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 для применения в качестве лекарственного средства для лечения медицинского заболевания, поддающегося лечению с помощью лиганда дофаминового рецептора D3.
19. Применение соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 для лечения медицинского заболевания, поддающегося лечению с помощью лиганда дофаминового рецептора D3.
20. Применение соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 для получения лекарственного средства для лечения медицинского заболевания, поддающегося лечению с помощью лиганда дофаминового рецептора D3.
21. Способ лечения медицинских заболеваний, поддающихся лечению с помощью лиганда дофаминового рецептора D3, включающий введение эффективного количества, по меньшей мере, одного соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 нуждающемуся в этом субъекту.
22. Способ лечения заболевания центральной нервной системы, включающий введение эффективного количества, по меньшей мере, одного соединения по любому из пп.1, 2, 4, 5, 9, 10, 13, 14, 15 или 16 нуждающемуся в этом субъекту.
23. Способ по п.22, где медицинское заболевание представляет собой шизофрению.
24. Способ по п.22, где медицинское заболевание представляет собой наркотическую зависимость.
25. Способ по п.21, где медицинское заболевание представляет собой диабетическую нефропатию.
26. Способ по п.22, где медицинское заболевание представляет собой биполярное расстройство.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP07119788 | 2007-10-31 | ||
| EP07119788.3 | 2007-10-31 | ||
| PCT/EP2008/064732 WO2009056600A1 (en) | 2007-10-31 | 2008-10-30 | Benzenesulfonamide compounds suitable for treating disorders that respond to modulation of the dopamine d3 receptor |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010121830A RU2010121830A (ru) | 2011-12-10 |
| RU2485103C2 true RU2485103C2 (ru) | 2013-06-20 |
Family
ID=40280677
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010121830/04A RU2485103C2 (ru) | 2007-10-31 | 2008-10-30 | Бензолсульфаномидные соединения, пригодные для лечения расстройств, которые восприимчивы к модуляции дофаминового рецептора d3 |
Country Status (24)
| Country | Link |
|---|---|
| US (4) | US20100210664A1 (ru) |
| EP (1) | EP2203426B9 (ru) |
| JP (1) | JP5680416B2 (ru) |
| KR (1) | KR20100080500A (ru) |
| CN (1) | CN101687802B (ru) |
| AT (1) | ATE522505T1 (ru) |
| AU (1) | AU2008320875B2 (ru) |
| BR (1) | BRPI0812978A2 (ru) |
| CA (1) | CA2690976A1 (ru) |
| CO (1) | CO6251289A2 (ru) |
| CR (1) | CR11188A (ru) |
| DO (1) | DOP2009000295A (ru) |
| EC (1) | ECSP099832A (ru) |
| ES (1) | ES2371308T3 (ru) |
| GT (1) | GT200900332A (ru) |
| IL (1) | IL202814A (ru) |
| MX (1) | MX2009014236A (ru) |
| MY (1) | MY153300A (ru) |
| NZ (1) | NZ582095A (ru) |
| RU (1) | RU2485103C2 (ru) |
| TW (1) | TWI469782B (ru) |
| UA (1) | UA99628C2 (ru) |
| WO (1) | WO2009056600A1 (ru) |
| ZA (1) | ZA200909171B (ru) |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FI3421462T3 (fi) * | 2013-06-27 | 2023-06-26 | Pfizer | Heteroaromaattisia yhdisteitä ja niiden käyttö dopamiini-d1-ligandeina |
| JP7584757B2 (ja) * | 2021-05-18 | 2024-11-18 | テックウインド株式会社 | 顔画像データから燃え尽き症候群を検知し離職を予測するシステム |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004089905A1 (en) * | 2003-04-14 | 2004-10-21 | Abbott Gmbh & Co. Kg | N-[(piperazinyl)hetaryl]arylsulfonamide compounds with affinity for the dopamine d3 receptor |
| RU2004102389A (ru) * | 2001-07-05 | 2005-07-10 | Астразенека Аб (Se) | Ариламины для лечения состояний, ассоциированных с киназой-3 гликогенсинтазы (gsk-3) |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7320979B2 (en) * | 2003-04-14 | 2008-01-22 | Abbott Gmbh & Co. Kg. | N-[(piperazinyl)hetaryl]arylsulfonamide compounds |
-
2008
- 2008-10-30 RU RU2010121830/04A patent/RU2485103C2/ru not_active IP Right Cessation
- 2008-10-30 US US12/666,627 patent/US20100210664A1/en not_active Abandoned
- 2008-10-30 JP JP2010530492A patent/JP5680416B2/ja not_active Expired - Fee Related
- 2008-10-30 KR KR1020097027266A patent/KR20100080500A/ko not_active Abandoned
- 2008-10-30 CA CA2690976A patent/CA2690976A1/en not_active Abandoned
- 2008-10-30 NZ NZ582095A patent/NZ582095A/xx not_active IP Right Cessation
- 2008-10-30 BR BRPI0812978-9A2A patent/BRPI0812978A2/pt not_active IP Right Cessation
- 2008-10-30 AT AT08844327T patent/ATE522505T1/de not_active IP Right Cessation
- 2008-10-30 MY MYPI20095655A patent/MY153300A/en unknown
- 2008-10-30 EP EP08844327A patent/EP2203426B9/en active Active
- 2008-10-30 MX MX2009014236A patent/MX2009014236A/es active IP Right Grant
- 2008-10-30 WO PCT/EP2008/064732 patent/WO2009056600A1/en not_active Ceased
- 2008-10-30 ES ES08844327T patent/ES2371308T3/es active Active
- 2008-10-30 TW TW97141857A patent/TWI469782B/zh not_active IP Right Cessation
- 2008-10-30 UA UAA201003729A patent/UA99628C2/ru unknown
- 2008-10-30 CN CN200880023090.9A patent/CN101687802B/zh not_active Expired - Fee Related
- 2008-10-30 AU AU2008320875A patent/AU2008320875B2/en not_active Ceased
-
2009
- 2009-12-17 IL IL202814A patent/IL202814A/en not_active IP Right Cessation
- 2009-12-22 ZA ZA2009/09171A patent/ZA200909171B/en unknown
- 2009-12-29 EC EC2009009832A patent/ECSP099832A/es unknown
- 2009-12-29 CO CO09148550A patent/CO6251289A2/es not_active Application Discontinuation
- 2009-12-29 DO DO2009000295A patent/DOP2009000295A/es unknown
- 2009-12-29 GT GT200900332A patent/GT200900332A/es unknown
-
2010
- 2010-01-04 CR CR11188A patent/CR11188A/es unknown
-
2011
- 2011-07-21 US US13/187,885 patent/US20110319421A1/en not_active Abandoned
-
2013
- 2013-12-04 US US14/096,565 patent/US20140200224A1/en not_active Abandoned
-
2014
- 2014-11-25 US US14/553,923 patent/US20150175570A1/en not_active Abandoned
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2004102389A (ru) * | 2001-07-05 | 2005-07-10 | Астразенека Аб (Se) | Ариламины для лечения состояний, ассоциированных с киназой-3 гликогенсинтазы (gsk-3) |
| WO2004089905A1 (en) * | 2003-04-14 | 2004-10-21 | Abbott Gmbh & Co. Kg | N-[(piperazinyl)hetaryl]arylsulfonamide compounds with affinity for the dopamine d3 receptor |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5127448B2 (ja) | ピリジン−2−オン化合物およびそれらのドーパミンd3受容体調節剤としての使用 | |
| KR101124911B1 (ko) | 도파민 d3 수용체에 대해 친화성을 갖는 n-[(피페라지닐)헤트아릴]아릴술폰아미드 화합물 | |
| US6919342B2 (en) | Triazole compounds suitable for treating disorders that respond to modulation of the dopamine D3 receptor | |
| RU2478633C2 (ru) | Производные 1,2,4-триазин-3,5-диона для лечения нарушений, реагирующих на модулирование рецептора допамина d3 | |
| US8207160B2 (en) | Tetrahydrobenzazepines and their use in he modulation of the dopamine D3 receptor | |
| RU2485103C2 (ru) | Бензолсульфаномидные соединения, пригодные для лечения расстройств, которые восприимчивы к модуляции дофаминового рецептора d3 | |
| EP1484330B1 (en) | Triazole compouds suitable for treating disorders that respond to modulation of the dopamine D3 receptor | |
| US20050137186A1 (en) | Tetrahydrobenzazepines and their use | |
| CN101918384A (zh) | 适合治疗响应5-羟色胺5-ht6受体调节的疾病的苯磺酰苯胺化合物 | |
| HK1146628B (en) | 1,2,4,-triazin-3,5-dione compounds for treating disorders that respond to modulation of the dopamine d3 receptor |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20141128 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20160429 Effective date: 20160504 |
|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20171031 |