RU2274635C1 - Способ получения тербинафина или его гидрохлорида - Google Patents
Способ получения тербинафина или его гидрохлорида Download PDFInfo
- Publication number
- RU2274635C1 RU2274635C1 RU2004138682/04A RU2004138682A RU2274635C1 RU 2274635 C1 RU2274635 C1 RU 2274635C1 RU 2004138682/04 A RU2004138682/04 A RU 2004138682/04A RU 2004138682 A RU2004138682 A RU 2004138682A RU 2274635 C1 RU2274635 C1 RU 2274635C1
- Authority
- RU
- Russia
- Prior art keywords
- dimethylhept
- naphth
- methyl
- ine
- ene
- Prior art date
Links
- DOMXUEMWDBAQBQ-WEVVVXLNSA-N terbinafine Chemical compound C1=CC=C2C(CN(C\C=C\C#CC(C)(C)C)C)=CC=CC2=C1 DOMXUEMWDBAQBQ-WEVVVXLNSA-N 0.000 title claims abstract description 22
- 238000000034 method Methods 0.000 title claims abstract description 18
- 229960002722 terbinafine Drugs 0.000 title claims abstract description 16
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 title claims abstract description 15
- 150000007529 inorganic bases Chemical class 0.000 claims abstract description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims abstract description 8
- 239000007864 aqueous solution Substances 0.000 claims abstract description 7
- 230000003993 interaction Effects 0.000 claims abstract 3
- 239000003153 chemical reaction reagent Substances 0.000 claims abstract 2
- MQRIUFVBEVFILS-UHFFFAOYSA-N n-methyl-1-naphthalen-1-ylmethanamine Chemical compound C1=CC=C2C(CNC)=CC=CC2=C1 MQRIUFVBEVFILS-UHFFFAOYSA-N 0.000 claims description 14
- 150000001875 compounds Chemical class 0.000 abstract description 9
- 239000000126 substance Substances 0.000 abstract description 5
- 239000002168 alkylating agent Substances 0.000 abstract description 4
- 229940100198 alkylating agent Drugs 0.000 abstract description 4
- 230000000694 effects Effects 0.000 abstract description 2
- AJUXDFHPVZQOGF-UHFFFAOYSA-N n,n-dimethyl-1-naphthylamine Chemical compound C1=CC=C2C(N(C)C)=CC=CC2=C1 AJUXDFHPVZQOGF-UHFFFAOYSA-N 0.000 abstract 2
- 230000002708 enhancing effect Effects 0.000 abstract 1
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 20
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 10
- 239000000203 mixture Substances 0.000 description 8
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 229960004592 isopropanol Drugs 0.000 description 5
- 239000000243 solution Substances 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- 229960000699 terbinafine hydrochloride Drugs 0.000 description 5
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 4
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 150000001804 chlorine Chemical class 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000002244 precipitate Substances 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- 235000011121 sodium hydroxide Nutrition 0.000 description 3
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- 230000029936 alkylation Effects 0.000 description 2
- 238000005804 alkylation reaction Methods 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 229910000039 hydrogen halide Inorganic materials 0.000 description 2
- 239000012433 hydrogen halide Substances 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- 239000003444 phase transfer catalyst Substances 0.000 description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- BWMISRWJRUSYEX-SZKNIZGXSA-N terbinafine hydrochloride Chemical compound Cl.C1=CC=C2C(CN(C\C=C\C#CC(C)(C)C)C)=CC=CC2=C1 BWMISRWJRUSYEX-SZKNIZGXSA-N 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- ITSLKJVPPOREBI-GQCTYLIASA-N (e)-6,6-dimethylhept-2-en-4-ynal Chemical compound CC(C)(C)C#C\C=C\C=O ITSLKJVPPOREBI-GQCTYLIASA-N 0.000 description 1
- BOWLFAWXCUKIOE-UHFFFAOYSA-N 1-bromo-6,6-dimethylhept-2-en-4-one Chemical compound BrCC=CC(CC(C)(C)C)=O BOWLFAWXCUKIOE-UHFFFAOYSA-N 0.000 description 1
- -1 6,6-dimethylhept-2-en-4-ynyl Chemical group 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 238000007445 Chromatographic isolation Methods 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 208000031888 Mycoses Diseases 0.000 description 1
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical class [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- 150000001638 boron Chemical class 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 231100001261 hazardous Toxicity 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 1
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 125000000744 organoheteryl group Chemical group 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 235000011181 potassium carbonates Nutrition 0.000 description 1
- 235000011118 potassium hydroxide Nutrition 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 238000006268 reductive amination reaction Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 239000003799 water insoluble solvent Substances 0.000 description 1
Landscapes
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
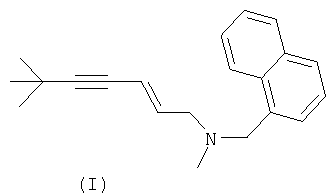
Изобретение относится к химии аллиламинов, а именно к способу получения тербинафина или его гидрохлорида. Способ включает взаимодействие избытка N-метил-нафт-1-илметиламина с 1-галоген-6,6-диметилгептен-2-ен-4-ином в воде или в водном растворе неорганического основания с последующей, при необходимости, обработкой полученного продукта соляной кислотой. Как правило, в качестве исходного реагента используют как 1-бром-6,6-диметилгепт-2-ен-4-ин, так и 1-хлор-6,6-диметилгепт-2-ен-4-ин. Обычно используют 5-50% мольный избыток N-метил-нафт-1-илметиламина в случае использования неорганического основания. Способ позволяет повысить выход целевого соединения, упростить процесс, а также расширить сырьевую базу использованием более дешевого алкилирующего агента - 1-хлор-6,6-диметилгепт-2-ен-4-ина. 2 з.п. ф-лы.
Description
Изобретение относится к химии аллиламинов, а именно к способу получения (E)-N-(6,6-диметилгепт-2-ен-4-инил)-N-метил-нафт-1-илметиламина (I) (тербинафина).
Тербинафин гидрохлорид - эффективный антимикотический препарат нового поколения, применение которого позволяет полностью излечивать грибковые заболевания без побочных явлений.
К настоящему времени известно несколько методов получения тербинафина. Так, восстановлением N-(6,6-диметил-2,4-гептадиинил)-N-метил-нафт-1-илметиламина диизобутилалюминий гидридом образуется тербинафин с выходом 46% после хроматографического выделения (Европейский патент 0024587, Chem. Abstr., 1981, v.95, 169006d; A.Stutz and G.Petranyi, J. Med. Chem., 1984, v.27, p.1539-1543, A.Stutz, and W.Granitzer, and S.Roth, Tetrahedron, 1985, v.41, p.5685-5696). Тербинафин также может быть получен восстановительным аминированием из (E)-6,6-диметил-гепт-2-ен-4-ин-1-аля и N-метил-нафт-1-илметиламина (Европейский патент 0024587, Chem. Abstr., 1981, v.95, 169006d). Однако применение пожароопасных и дорогостоящих элементоорганических восстановителей затрудняет широкое использование данных способов для получения тербинафина.
Конденсация N-метил-N-(3-галогенпроп-2-енил)-нафт-1-илметиламина (III) с элементоорганическими (олово, бор) производными трет-бутилацетилена в присутствии гомогенных палладиевых катализаторов позволяет получить тербинафин с выходом 87-98% (D.E.Radisill, and L.A.Castonguay, and J.K.Still, Tetrahedron Lett, 1988, v.29, p.1509-1512; C.H.Oh, and S.H.Jung, Tetrahedron Lett, 2000, v.41, p.8513-8516; M.Alami, and F.Ferri, and Y.Gaslain, Tetrahedron Lett, 1996, v.37, p.57-58; M.Alami, and B.Crousse, and F.Ferri, J. Organomet. Chem., 2001, v.624, p.114-123; Европейский патент 0421302; Chem. Abstr., 1991, v.115, 48409k). Практическое использование этого способа затруднено из-за высокой стоимости катализаторов и исходных элементоорганических соединений.
Известен способ получения тербинафина алкилированием N-метил-нафт-1-илметиламина 1-бром-6,6-диметилгепт-2-ен-4-ином (в виде смеси Е- и Z-изомеров, соотношение 3:1) (P.D.Croce, and R.Ferraccioli, and C.L.Rosa, Gazz. Chim. Ital., 1996, v.126, p.107-110). Конденсацию осуществляют в толуоле при комнатной температуре в течение 16-24 часов в присутствии твердого карбоната калия и катализатора межфазного переноса - тетрабутиламмоний бромида. Однако для очистки целевого соединения (в том числе и катализатора межфазного переноса) требуется колоночная хроматография.
Наиболее близким к предлагаемому является способ получения тербинафина алкилированием N-метил-нафт-1-илметиламина 1-бром-6,6-диметилгепт-2-ен-4-ином (в виде смеси Е- и Z-изомеров, соотношение 3:1) в диметилформамиде (Европейский патент 0024587; Chem. Abstr., 1981, v.95, 169006d). Выход целевого соединения составляет 43,5%.
Так, 601 г (3 моля) 1-бром-6,6-диметилгепт-2-ен-4-ина (смесь Е- и Z-изомеров, соотношение 3:1) добавляют при охлаждении льдом к смеси 536,7 г (3,13 моля) N-метил-нафт-1-илметиламина, 332 г (3,13 моля) карбоната натрия в 3 л диметилформамида (высушен над молекулярными ситами) и смесь перемешивают ночь при комнатной температуре. Растворитель отгоняют в вакууме, остаток распределяют между водой и эфиром. Органический слой промывают 2% раствором винной кислоты, насыщенным раствором бикарбоната натрия, сушат сульфатом натрия, эфир отгоняют. Остаток наносят на 1,5 кг силикагеля и промывают смесью толуол/этилацетат (4/1). Растворители отгоняют, вязкий остаток (633,4 г) растворяют в этаноле, добавляют эквимолярное количество хлороводорода, растворенного в этаноле. Растворитель отгоняют, кристаллический остаток растворяют в 1,2 л горячего изопропанола, добавляют 4 л эфира. Осадок фильтруют, промывают смесью изопропанол/эфир (1/1). После перекристаллизации из смеси изопропанол/эфир получают 427,9 г тербинафина гидрохлорида (в виде Е-изомера) (выход 43,5%).
К недостаткам известного метода можно отнести невысокий выход и необходимость в сложном выделении целевого соединения из реакционной смеси с использованием значительного количества тщательно высушенных различных растворителей и нехимических операций (отгонка, растворение, промывки и т.д.).
Настоящее изобретение направлено на повышение выхода целевого соединения, упрощение процесса (сокращение количества нехимических операций, уменьшение количества растворителей), а также на расширение сырьевой базы (использование более дешевого алкилирующего агента - 1-хлор-6,6-диметилгепт-2-ен-4-ина).
Сущность предлагаемого изобретения состоит в способе получения тербинафина взаимодействием N-метил-нафт-1-илметиламина с 1-галоген-6,6-диметилгепт-2-ен-4-ином в воде или в водном растворе неорганического основания с использованием избытка исходного N-метил-нафт-1-илметиламина, что позволяет значительно упростить выделение целевого соединения. На синтез тербинафина не оказывает заметного влияния добавление дополнительного органического водонерастворимого растворителя, в качестве которого могут выступать углеводороды, простые эфиры и др.
Для связывания выделяющегося в ходе реакции галогеноводорода используют как неорганические основания, так и соответствующий мольный избыток N-метил-нафт-1-илметиламина. В качестве неорганических оснований используют водные растворы гидроксидов натрия или калия, карбоната калия, причем концентрация неорганического основания в водных растворах не оказывает существенного влияния на процесс получения тербинафина.
При использовании неорганических оснований в качестве акцептора галогеноводорода для достижения полного расходования алкилирующего агента используют 5-50% мольный избыток N-метил-нафт-1-илметиламина, при этом достигается количественный выход N-(6,6-диметилгепт-2-ен-4-инил)-N-метил-нафт-1-илметиламина, в котором содержание E-изомера (тербинафина) соответствует количеству E-изомера в исходном 1-галоген-6,6-диметилгепт-2-ен-4-ине.
Алкилирующий агент (1-галоген-6,6-диметилгепт-2-ен-4-ин) используют в виде смеси геометрических изомеров (Е- и Z-), с содержанием E-изомера не менее 75%, при этом выделение тербинафина гидрохлорида из реакционной смеси осуществляют кристаллизацией в присутствии водного раствора соляной кислоты.
Заключительную очистку тербинафина гидрохлорида осуществляют стандартными операциями (промывка, перекристаллизация), при этом потери целевого соединения не превышают 5-10%.
Природа галогена (бром или хлор) в 1-галоген-6,6-диметилгепт-2-ен-4-ине не оказывает существенного влияния на выход целевого соединения.
Температурные параметры процесса не оказывают существенного влияния на выход целевого соединения в интервале от 0 до 100°С.
Сущность данного изобретения иллюстрируется, но не ограничивается следующими примерами.
Пример 1.
Смесь 20 мл 15% водного раствора гидроксида натрия, 14,4 г (0,084 моль) N-метил-нафт-1-илметиламина и 11,0 г (0,07 моль) (E)-1-хлор-6,6-диметил-2-гепт-2-ен-4-ина (содержит 95% E-изомера) перемешивают при 70°С 5 часов (по данным ВЭЖХ исходное хлорпроизводное отсутствует). Затем при охлаждении водой добавляют по каплям 4,0 мл соляной кислоты, осадок отделяют, моют водой, сушат. Получают 22,5 г бледно-кремового вещества (по данным ВЭЖХ - 92% (I) и 6% (II)). Перекристаллизовывают из изо-пропанола. Получают 20,6 г (E)-N-(6,6-диметилгепт-2-ен-4-инил)-N-метил-нафт-1-илметиламина гидрохлорида, выход 94,5%, т.пл. 205°С, содержание (E)-изомера более 99%.
Спектр ЯМР 1H (в виде основания, CDCl3, δ, м.д. J, Гц,): 1,32 с (9Н, С(СН3)3), 2,29 с (3Н, СН3N), 3,2 дд (J 6,4 Гц и 1,5 Гц, 2Н, NCH 2CH=), 3,96 с (2Н, NCH 2C10H7), 5,76 дт (J 15,8 Гц и 1,5 Гц, 1Н, СН=СН-С=), 6,23 дт (J 15,8 Гц и 6,4 Гц, 1Н, СН2-СН=СН), 7,44-7,61 м (4Н, аром. Н), 7,83-7,91 м (2Н, аром. Н), 8,33-8,36 м (1Н, аром. Н).
Пример 2.
Смесь 26,7 г (0,156 моль) N-метил-нафт-1-илметиламина, 10,5 г (0,067 моль) 1-хлор-6,6-диметил-2-гепт-2-ен-4-ина (содержит 85% Е-изомера) и 50 мл воды перемешивают при комнатной температуре 15-20 часов (до отсутствия по данным ВЭЖХ исходного хлорпроизводного). Добавляют 100 мл диэтилового эфира, органический слой отделяют, промывают водой. При перемешивании и охлаждении к эфирному раствору добавляют 20 мл соляной кислоты (1:3). Осадок отделяют фильтрованием, промывают эфиром, сушат, после перекристаллизации из изо-пропанола получают 16,8 г (E)-N-(6,6-диметилгепт-2-ен-4-инил)-N-метил-нафт-1-илметиламина гидрохлорида, выход 90%, содержание (E)-изомера более 99%.
Пример 3.
К раствору 13,7 г (0,08 моль) N-метил-нафт-1-илметиламина в 20 мл диэтилового эфира добавляют 13,5 г (0,067 моль) 1-бром-6,6-диметил-2-гепт-2-ен-4-ина (содержит 75% E-изомера). Перемешивают 1 час при 40°С и добавляют 20 мл 15% водного раствора гидроксида натрия. Энергично перемешивают 10-12 часов при 40°С (до отсутствия по данным ВЭЖХ исходного хлорпроизводного). Далее, как в примере 2, получают 14,8 г (E)-N-(6,6-диметилгепт-2-ен-4-инил)-N-метил-нафт-1-илметиламина гидрохлорида, выход 89%, содержание (Е)-изомера более 99%.
Спектральные параметры и физико-химические константы тербинафина в приведенных выше примерах идентичны.
Таким образом, предлагаемый способ легко реализуется в промышленных условиях и позволяет получать тербинафин гидрохлорид с высоким выходом.
Источники информации
1. Европейский патент 0024587; Chem. Abstr., 1981, v.95, 169006d.
2. A.Stutz and G.Petranyi, J. Med. Chem., 1984, v.27, p.1539-1543.
3. A.Stutz, and W.Granitzer, and S.Roth, Tetrahedron, 1985, v.41, p.5685-5696.
4. D.E.Radisill, and L.A.Castonguay, and J.K.Still, Tetrahedron Lett, 1988, v.29, p.1509-1512.
5. C.H.Oh, and S.H.Jung, Tetrahedron Lett, 2000, v.41, p.8513-8516.
6. M.Alami, and F.Ferri, and Y.Gaslain, Tetrahedron Lett, 1996, v.37, p.57-58.
7. M.Alami, and В.Crousse, and F.Ferri, J. Organomet. Chem., 2001, v.624, p.114-123.
8. Европейский патент 0421302; Chem. Abstr., 1991, v.115, 48409k.
9. P.D.Croce, and R.Ferraccioli, and C.L.Rosa, Gazz. Chim. Ital., 1996, v.126, p.107-110.
Claims (3)
1. Способ получения тербинафина или его гидрохлорида взаимодействием N-метил-нафт-1-илметиламина с 1-галоген-6,6-диметилгепт-2-ен-4-ином с последующей при необходимости обработкой полученного продукта соляной кислотой, отличающийся тем, что взаимодействие проводят в воде или в водном растворе неорганического основания с использованием избытка исходного N-метил-нафт-1-илметиламина.
2. Способ по п.1, отличающийся тем, что в качестве исходного реагента используют как 1-бром-6,6-диметилгепт-2-ен-4-ин, так и 1-хлор-6,6-диметилгепт-2-ен-4-ин.
3. Способ по п.1, отличающийся тем, что используют 5-50%-ный мольный избыток N-метил-нафт-1-илметиламина в случае использования неорганического основания.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2004138682/04A RU2274635C1 (ru) | 2004-12-29 | 2004-12-29 | Способ получения тербинафина или его гидрохлорида |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2004138682/04A RU2274635C1 (ru) | 2004-12-29 | 2004-12-29 | Способ получения тербинафина или его гидрохлорида |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2274635C1 true RU2274635C1 (ru) | 2006-04-20 |
Family
ID=36608083
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2004138682/04A RU2274635C1 (ru) | 2004-12-29 | 2004-12-29 | Способ получения тербинафина или его гидрохлорида |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2274635C1 (ru) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0024587A1 (en) * | 1979-08-22 | 1981-03-11 | Sandoz Ag | Propenylamines, processes for their production, pharmaceutical compositions containing them and their use as pharmaceuticals |
| US4680291A (en) * | 1977-08-19 | 1987-07-14 | Sandoz Ltd. | Propenylamines, processes for their production and pharmaceutical compositions containing them |
| JP2000053619A (ja) * | 1998-08-05 | 2000-02-22 | Pola Chem Ind Inc | 芳香族抗真菌剤 |
| RU2217414C1 (ru) * | 1999-10-22 | 2003-11-27 | Рихтер Гедеон Ведьесети Дьяр Рт. | Способ получения (e)-n-метил-n-(1-нафтилметил)-6,6-диметилгепт-2-ен-4-инил-1-амина или его кислотно-аддитивной соли |
-
2004
- 2004-12-29 RU RU2004138682/04A patent/RU2274635C1/ru not_active IP Right Cessation
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4680291A (en) * | 1977-08-19 | 1987-07-14 | Sandoz Ltd. | Propenylamines, processes for their production and pharmaceutical compositions containing them |
| EP0024587A1 (en) * | 1979-08-22 | 1981-03-11 | Sandoz Ag | Propenylamines, processes for their production, pharmaceutical compositions containing them and their use as pharmaceuticals |
| JP2000053619A (ja) * | 1998-08-05 | 2000-02-22 | Pola Chem Ind Inc | 芳香族抗真菌剤 |
| RU2217414C1 (ru) * | 1999-10-22 | 2003-11-27 | Рихтер Гедеон Ведьесети Дьяр Рт. | Способ получения (e)-n-метил-n-(1-нафтилметил)-6,6-диметилгепт-2-ен-4-инил-1-амина или его кислотно-аддитивной соли |
Non-Patent Citations (1)
| Title |
|---|
| P.D.CROCE ET AL, A simple procedure for N-propenylation and N-propynylation of secondary amines. Gazzetta Chimica Italiana, 1996, vol.126, №2, p.p.107-109. * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2023002679A (ja) | チトクロームp450モノオキシゲナーゼの阻害剤およびそれに関わる中間体 | |
| NO340420B1 (no) | Metode for fremstilling av 1-(3-(2-(1-benzotiofen-5-yl)-etoksy)propyl)azetidin-3-ol eller salter derav | |
| WO2008035381A2 (en) | Process for the preparation of amine derivatives as calcimimetics | |
| JP2001294559A (ja) | トリフルオロメチルベンジルアミンの製造方法 | |
| CN105392772A (zh) | 奥格列汀的关键中间体的制备方法 | |
| JP2003292476A (ja) | ジアミノレゾルシノール化合物の製造法 | |
| WO2019020508A1 (en) | PROCESS FOR THE PREPARATION OF HIGH-PURITY RUCAPARIB | |
| RU2274635C1 (ru) | Способ получения тербинафина или его гидрохлорида | |
| CN103601645A (zh) | 1-(苯乙基氨基)丙烷-2-醇类化合物或其盐的制备方法 | |
| CN102659658A (zh) | 一种高度官能化的吡咯类化合物的合成方法 | |
| JP2021509685A (ja) | クリサボロールおよびその中間体を調製するためのプロセス | |
| US6992223B2 (en) | Method for producing 2-benzylaniline | |
| CN110621660B (zh) | 盐酸罗匹尼罗的纯化方法 | |
| JP5168830B2 (ja) | テトラヒドロピラン−4−オン化合物の製法 | |
| Adimurthy et al. | A fast and highly efficient method for the synthesis of tertiary amines in aqueous medium | |
| EP2751098B1 (en) | An improved process for preparation of zolmitriptan | |
| JP4826476B2 (ja) | テトラヒドロピラン−4−カルボン酸化合物の製法 | |
| JP4538993B2 (ja) | β−ケトニトリル誘導体の製法 | |
| CA2507587A1 (en) | Process for preparing terbinafine by using platinum as catalyst | |
| JP4041281B2 (ja) | 2−ベンジルアニリンの製造法 | |
| JP4263427B2 (ja) | ハロゲノ−4−ジヒドロキシメチルピリジン、その製造法及びそれを用いたハロゲノ−4−ピリジンカルバルデヒドの製造法 | |
| JPH0987288A (ja) | 1,3−ビス(3−アミノプロピル)−1,1,3,3−テトラオルガノジシロキサンの精製方法 | |
| JP2005272417A (ja) | 2−クロロ−4−アミノメチルピリジン類の製造方法 | |
| JPH11228515A (ja) | 4,5−ジ置換アントラニルアミドの製造法 | |
| JP2003342264A (ja) | 1−置換−2−アルキルピペラジンの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20101230 |