RU2232595C2 - Композиция альфа-интерферона в форме водного раствора - Google Patents
Композиция альфа-интерферона в форме водного раствора Download PDFInfo
- Publication number
- RU2232595C2 RU2232595C2 RU2002116364/15A RU2002116364A RU2232595C2 RU 2232595 C2 RU2232595 C2 RU 2232595C2 RU 2002116364/15 A RU2002116364/15 A RU 2002116364/15A RU 2002116364 A RU2002116364 A RU 2002116364A RU 2232595 C2 RU2232595 C2 RU 2232595C2
- Authority
- RU
- Russia
- Prior art keywords
- composition
- interferon
- aqueous solution
- compositions
- biological activity
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/19—Cytokines; Lymphokines; Interferons
- A61K38/21—Interferons [IFN]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Gastroenterology & Hepatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Inorganic Chemistry (AREA)
- Zoology (AREA)
- Virology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Dermatology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
- Apparatus For Disinfection Or Sterilisation (AREA)
Abstract
Настоящее изобретение относится к композиции в форме водного раствора, не содержит человеческого сывороточного альбумина. Композиция α-интерферона в форме водного раствора включает α-интерферон; стабилизатор; агент, регулирующий осмотическое давление; антимикробные консерванты, выбранные из группы, состоящей из фенола, м-крезола или их смесей; и буферную систему. Технический результат: композиция сохраняет активность α-интерферона в течение длительного времени, устраняет потенциальную опасность для организма человека путем сведения к минимуму количества консервантов и является очень стабильной. 6 з.п. ф-лы, 13 табл., 11 ил.
Description
Настоящее изобретение относится к композиции α-интерферона (α-IFN) в форме стабильного водного раствора, которая не содержит человеческого сывороточного альбумина.
Большинство белков легко денатурируются или утрачивают биологическую активность в водном растворе. По этой причине многие фармацевтические компании разработали лиофилизированные композиции для улучшения стабильности белковых лекарственных продуктов. Однако лиофилизированная композиция белковых лекарственных средств имеет много недостатков. Поскольку процесс лиофильной сушки является дорогостоящим и требует дополнительного этапа повторного растворения перед введением лекарственного средства пациенту, он не является предпочтительным по сравнению с жидкой композицией с точки зрения экономичности или удобства. Эти вопросы также учитывались при разработке композиций α-IFN.
Интерферон (IFN) играет роль в росте, дифференцировке и функции нормальных или опухолевых клеток и представляет собой один из белковых цитокинов, которые ингибируют размножение ряда вирусов. Конкретно, IFN контролирует активность естественной клетки-киллера (NK), усиливает активность цитотоксического Т-лимфоцита и повышает фагоцитарную активность макрофага. Таким образом, IFN в конечном итоге опосредует иммунную реакцию клеток, инфицированных вирусом, и т.п. IFN бывает нескольких категорий - α, β и γ - в зависимости от вида секретирующих клеток или индуцирующих материалов. Из них формы α и β стабильны даже при рН 2, но форма γ в кислых условиях нестабильна.
Из этих трех форм α-интерферон долгое время использовали в качестве противовирусного агента, поскольку он является высокоэффективным при лечении вирусных заболеваний, включая гепатит С. Поэтому многие исследователи предпринимают постоянные попытки разработать композиции, которые могут сохранять активность α-интерферона в течение более длительного периода времени.
Патент США №4496537 относится к лиофилизированной композиции α-интерферона, содержащей аланин (или глицин) и человеческий сывороточный альбумин в качестве стабилизатора, а также буферную систему для поддержания рН в растворе на уровне 6,5-8,0. Также патент США №4847079 относится к водной композиции α-интерферона, содержащей человеческий сывороточный альбумин, глицин, тимерозал и буферную систему для поддержания рН на уровне 6,5-8,0. Интересно, что оба эти патента отличаются тем, что композиции содержат человеческий сывороточный альбумин, который эффективно сохраняет биологическую активность α-интерферона. Однако, когда композиция содержит человеческий сывороточный альбумин, высока вероятность того, что композиция потенциально контаминирована инфекционными патогенами, такими как вирус иммунодефицита человека (ВИЧ) и вирус гепатита В (HBV). В силу этого с недавних пор не рекомендуется использовать человеческий сывороточный альбумин. Кроме того, известно, что указанный альбумин может вызывать у некоторых людей иммунные реакции.
Европейский патент № 0736303А2 описывает водную композицию α-интерферона, содержащую полисорбат в качестве стабилизатора и бензиловый спирт в качестве антимикробного консерванта и имеющую буферную систему для поддержания рН в пределах 4,5-5,5. В указанном выше патенте вместо потенциально опасного человеческого сывороточного альбумина используется полисорбат, который является безопасным. Однако, известно, что антимикробная активность бензилового спирта понижается, когда его используют с неионным поверхностно-активным агентом, таким как полисорбат 80. Действительно, было установлено, что использование полисорбата 80 с бензиловым спиртом является неприемлемым (Handbook of Pharmaceutical Excipients, American Pharmaceutical Association, 1986, p18). Таким образом, для поддержания антимикробной активности нужно использовать относительно большое количество бензилового спирта (0,9-1,0%). Такое избыточное использование бензилового спирта, однако, может вызывать агрегацию пептидов (Richard L. Remmele et al., Pharmaceutical Research, Vol. 15, №2, 1998). Кроме того, согласно ускоренному испытанию композиции α-интерферона при 40°С, которое наблюдали авторы настоящего изобретения, жидкая композиция, содержащая 1,0% бензилового спирта и 0,02% полисорбата 80, обладает значительно более низкой активностью α-интерферона, чем композиция, содержащая фенол (или м-крезол) и 0,02% полисорбата 80.
WO № 96/11018 относится к композиции в форме водного раствора, содержащей полисорбат и хелирующий агент, такой как динатрий-EDTA, и консервант. Однако указанная жидкая композиция является потенциально опасной, поскольку она содержит динатрий-EDTA, которая, как известно, обладает цитотоксичностью (Paula Saarien-Savolainen et al., Pharmaceutical Research, Vol. 15, №2, 1998) и у нее есть также другая проблема, поскольку в организме человека она может образовывать хелатный комплекс с ионом кальция. Кроме того, цитрат, который упоминался в указанном выше патенте как еще один хелатирующий агент, как известно, вызывает сильную боль при введении в организм.
Для того чтобы решить упомянутые выше проблемы, авторы настоящего изобретения проводили исследования по разработке композиции α-интерферона в форме водного раствора, которая сохраняет биологическую активность α-интерферона в течение длительного периода времени и является очень стабильной и которая не содержит ни потенциально опасного человеческого сывороточного альбумина, ни хелирующего агента. Авторы осуществили настоящее изобретение путем разработки композиции α-интерферона в форме водного раствора, которая может сохранять биологическую активность α-интерферона в течение длительного периода времени и сводит к минимуму количество консерванта посредством использования полисорбата в качестве стабилизатора и фенола, м-крезола или их смеси в качестве антимикробного консерванта.
Целью настоящего изобретения является создание композиции α-интерферона в форме стабильного водного раствора, которая может сохранять биологическую активность и физико-химическую стабильность в течение длительного периода времени и может отвечать критериям приемлемости, предписанным в тесте на антимикробную эффективность, в соответствии с требованиями Европейской Фармакопеи, даже несмотря на то, что она содержит лишь очень малое количество консервантов.
Еще одной целью настоящего изобретения является создание безопасной композиции α-интерферона в форме водного раствора, которая сохраняет антимикробную активность без помощи потенциально опасных для организма человека материалов, таких как человеческий сывороточный альбумин или хелирующие агенты.
Настоящее изобретение относится к композиции α-интерферона в форме водного раствора, которая включает α-интерферон; стабилизатор; агент, регулирующий осмотическое давление; антимикробные консерванты, выбранные из группы, состоящей из фенола, м-крезола или их смесей; и буферную систему.
Согласно настоящему изобретению создана композиция α-интерферона в форме стабильного водного раствора. Также создана более безопасная композиция α-интерферона в форме водного раствора. Эти и другие признаки, особенности и преимущества настоящего изобретения будут более понятны с помощью следующего описания и прилагаемой формулы изобретения.
Фиг. 1 представляет собой график, показывающий влияние стабилизатора на биологическую активность α-интерферона (α-IFN), при хранении композиции в форме водного раствора по настоящему изобретению при 4°С в течение 4 месяцев.
Фиг. 2а представляет собой график, показывающий влияние антимикробных консервантов на стабильность композиции α-IFN (6×106 МЕ/мл) в форме водного раствора по результатам измерения биологической активности α-IFN, при хранении композиции в форме водного раствора по настоящему изобретению при 4°С в течение 36 недель.
Фиг. 2b представляет собой график, показывающий влияние антимикробного консерванта на стабильность композиции α-IFN (6×106 МЕ/мл) в форме водного раствора по результатам измерения биологической активности α-IFN, при хранении композиции в форме водного раствора по настоящему изобретению при 40°С в течение 16 недель.
Фиг. 3а представляет собой график, показывающий влияние рН на стабильность композиции α-IFN (6×106 МЕ/мл) в форме водного раствора по результатам измерения биологической активности α-IFN, при хранении композиции в форме водного раствора по настоящему изобретению при 40°С в течение 12 недель.
Фиг. 3b представляет собой фотографию, показывающую влияние рН на димеризацию α-IFN по результатам окрашивания серебром додецилсульфат натрия-полиакриламидного геля, прошедшего электрофорез, после хранения при 40°С в течение 12 недель.
Фиг. 4а, 4b и 4с представляют собой графики, показывающие различия в биологической активности между композициями, включающими смесь 0,15% фенола и 0,1% м-крезола, и композициями, включающими только 0,3% фенола, в качестве антимикробного консерванта, при хранении композиций α-IFN (6×106 МЕ/мл) в форме водного раствора в течение 12 недель, при 4, 25 и 40°С, соответственно.
Фиг. 4d, 4e и 4f представляют собой графики, показывающие различия в чистоте по результатам высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC), между композициями, включающими смесь 0,15% фенола и 0,1% м-крезола, и композициями, включающими только 0,3% фенола, в качестве антимикробного консерванта, при хранении композиций α-IFN (6×106 МЕ/мл) в форме водного раствора в течение 12 недель, при 4, 25 и 40°С, соответственно.
Для достижения указанных выше целей настоящее изобретение обеспечивает композицию α-интерферона в форме водного раствора, которая включает α-интерферон; стабилизатор; агент, регулирующий осмотическое давление; антимикробные консерванты, выбранные из группы, состоящей из фенола, м-крезола или их смесей; и буферную систему.
Термин "α-интерферон" в настоящем изобретении включает все типы α-интерферонов, которые экспрессируют, с последующим выделением из них, рекомбинантные бактерии, дрожжи и клетки животных. Иными словами, термин "α-интерферон", используемый в настоящем документе, включает натуральный и рекомбинантный α-интерферон. Кроме того, в композицию в форме водного раствора по настоящему изобретению можно включать аналоги или варианты α-интерферона, в которых аминокислоты натурального человеческого α-интерферона частично заменены, при более чем 50% сохранении активности натурального человеческого α-интерферона. Количество α-интерферона, добавляемого в композицию в форме водного раствора по настоящему изобретению, предпочтительно составляет от 1×106 МЕ/мл до 1×108 МЕ/мл.
Стабилизатором, который способствует сохранению активности α-интерферона в композиции в форме водного раствора по настоящему изобретению, предпочтительно является полисорбат 80, и концентрация полисорбата 80 предпочтительно составляет от 0,01 до 0,05% мас./об.
Помимо этого, композиция в форме водного раствора по настоящему изобретению содержит консерванты, включая фенол и/или м-крезол, для ингибирования роста микроорганизмов. Предпочтительная концентрация фенола составляет от 0,1 до 0,3% мас./об., предпочтительная концентрация м-крезола составляет от 0,1 до 0,2% мас./об. и подходящая смесь фенола и м-крезола также может быть включена в композицию в форме водного раствора по настоящему изобретению.
Буферная система в композиции в форме водного раствора по настоящему изобретению включает раствор ацетатного буфера или раствор фосфатного буфера. Более конкретно, предпочтительной является буферная система, состоящая из ацетата аммония и уксусной кислоты, или буферная система, состоящая из моногидрофосфата натрия (Na2HPO4) и дигидрофосфата натрия (NaH2PO4). Также концентрация указанной буферной системы в композиции в форме водного раствора по настоящему изобретению предпочтительно составляет от 5 до 20 мМ. рН Композиции в форме водного раствора по настоящему изобретению зависит от указанных выше буферных систем. рН Композиции в форме водного раствора по настоящему изобретению в большинстве случаев находится в пределах от 4,0 до 8,0, и, предпочтительно, в пределах от 4,5 до 6,0.
Композиция в форме водного раствора по настоящему изобретению может также включать агент, регулирующий осмотическое давление, такой как хлорид натрия. Количество агента, регулирующего осмотическое давление, зависит от других компонентов композиции. И, наконец, композицию в форме водного раствора по настоящему изобретению изготавливают в асептических условиях.
В настоящем изобретении с целью поиска предпочтительных стабилизаторов было изготовлено несколько композиций в форме водного раствора, включающих несколько наполнителей, пригодных для инъецируемых композиций, в различных концентрациях и изучалось влияние стабилизатора на биологическую активность α-интерферона. Результаты после 4 месяцев хранения при 4°С показали, что активность композиций в форме водного раствора, включающих человеческий сывороточный альбумин, полисорбат 80, полиэтиленгликоль или желатин, соответственно, в качестве стабилизатора, составляла более 90% от исходной биологической активности, определенной перед хранением, в то время как активность композиции в форме водного раствора, включающей только α-интерферон и буферную систему, составляла приблизительно 80% от исходной биологической активности, определенной перед хранением. Возможно, это происходит потому, что указанные выше стабилизаторы предотвращают адсорбцию α-интерферона на внутренней поверхности флакона. Использование человеческого сывороточного альбумина и желатина, однако, с недавних пор не рекомендуется из-за растущей озабоченности в связи с возможной контаминацией случайными вирусами, такими как ВИЧ, вирус гепатита В и т.п. Кроме того, для некоторых людей они могут быть иммуногенными. Таким образом, для настоящего изобретения как наиболее подходящий стабилизатор был выбран полисорбат 80.
Авторы настоящего изобретения изучали также влияние концентраций полисорбата 80 и антимикробных консервантов на внешний вид композиции в форме водного раствора. В результате полисорбат в пределах 0,01-0,02% не влиял на прозрачность композиций в форме водного раствора. Однако композиции в форме водного раствора становились мутными, если использовалось более 0,15% м-крезола, а степень мутности была пропорциональна концентрации м-крезола. Когда в качестве антимикробного консерванта использовался фенол, то в концентрации 0,1-0,3% он не влиял на прозрачность композиций в форме водного раствора, но композиции в форме водного раствора становились мутными, если использовалось более 0,3% фенола.
Хотя композиция в форме водного раствора, включающая фенол, имеет несколько более выраженную способность сохранять биологическую активность, чем композиция в форме водного раствора, включающая м-крезол или бензиловый спирт, разница между ними невелика. Однако в случае, когда композицию в форме водного раствора хранили при высокой температуре 40°С, биологическая активность композиции в форме водного раствора, включающей бензиловый спирт, сильно уменьшалась.
На биологическую активность, а также на димеризацию α-интерферона влияла величина рН. Биологическая активность α-интерферона является относительно стабильной при величине рН около 5,8, а димеризация чаще наблюдалась при более высоких значениях рН. Таким образом, не является предпочтительным длительное хранение композиции α-интерферона в форме водного раствора при высоких значениях рН.
Авторы настоящего изобретения изучали также эффекты антимикробной консервации композиций в форме водного раствора, включающих ряд композиций и концентраций консервантов, согласно протоколу изучения эффективности антимикробного препарата Европейской Фармакопеи (European Pharmacopoeia 1997, 5.1.3 Efficacy of Antomicrobial Preparation). Конкретный протокол изучения эффективности антимикробного препарата Европейской Фармакопеи был описан в ссылочном примере 3, и, кратко, выглядел следующим образом.
Пять видов стандартных штаммов, которые описаны для использования в этом тесте (стандартные штаммы грамположительных и грамотрицательных бактерий и рода грибов) искусственно инокулировали в концентрации от 105 до 106 клеток на 1 мл композиции в форме водного раствора. По истечении определенных интервалов времени отбирали образцы композиций и логарифмически преобразовывали степень изменений количества жизнеспособных клеток. Указанные логарифмически преобразованные величины (величины log уменьшения) сравнивали с величинами в таблице 5.1.3-1 Европейской Фармакопеи для оценки уровня антимикробной активности. Классификации между категориями А и В, описанными в Европейской Фармакопее, можно достичь по разнице величин log уменьшения количества микроорганизмов, представляющих интерес, с течением времени. В случае бактерий категория А предписывает 2 log-уменьшения в течение 6 часов и 3 log-уменьшения количества жизнеспособных микроорганизмов по сравнению с величиной, полученной для посева через 24 часа, а категория В предписывает 1 log-уменьшения в течение 24 часов и 3 log-уменьшения в течение 7 дней после инокуляции. Подобным образом, в случае грибов, категория А предписывает 2 log-уменьшения в течение 7 дней, а категория В предписывает 1 log-уменьшения в течение 14 дней. Кроме того, по истечении указанного выше времени не должно наблюдаться восстановления или увеличения количества жизнеспособных микроорганизмов. Величины log-уменьшения, описанные выше для каждой категории, применяют к композициям для инъекций и глазным каплям, и композиция α-интерферона в форме водного раствора по настоящему изобретению соответствует этому предписанию. Таким образом, путем изготовления нескольких композиций α-интерферона в форме водного раствора, включающих различные консерванты, и оценки относительной антимикробной активности с помощью теста на антимикробную эффективность в отношении 5 видов стандартных штаммов авторы настоящего изобретения попытались определить самую лучшую композицию.
В результате как композиция, содержащая 0,2% фенола и 0,1% м-крезола, так и композиция, содержащая 0,15% фенола и 0,1% м-крезола, соответствовали требованиям категорий А и В Европейской Фармакопеи в отношении Aspergillus niger, Candida albicans, Pseudomonas aeruginosa, Staphylococcus aureus и Escherichia coli. Однако в случае композиции, содержащей 0,15% фенола и 0,1% м-крезола, общее количество консервантов составило 0,25% композиции. Следовательно, композиция, содержащая 0,15% фенола и 0,1% м-крезола, является более предпочтительной композицией с точки зрения безопасности, поскольку она содержит самое маленькое количество консервантов.
Описанные ранее версии настоящего изобретения имеют много преимуществ, включая
создание композиции α-интерферона в форме стабильного водного раствора, которая может сохранять биологическую активность α-интерферона в течение более длительного периода времени путем предотвращения адсорбции α-интерферона на поверхности флакона;
создание композиции α-интерферона в форме водного раствора, в которой биологическая активность, а также антимикробная активность α-интерферона могут сохраняться путем сведения к минимуму количества консервантов;
создание более безопасной композиции α-интерферона в форме водного раствора с минимальным количеством консервантов, поскольку известно, что использование большого количества консервантов вредно для организма человека;
создание композиции α-интерферона в форме водного раствора, которая не содержит потенциально опасных для организма человека материалов, таких как человеческий сывороточный альбумин или хелатирующие агенты; и
создание композиции α-интерферона в форме водного раствора, которая является очень стабильной.
Настоящее изобретение далее проиллюстрировано следующими примерами. Специалистам будет понятно, что указанные примеры приведены только с целью проиллюстрировать настоящее изобретение более детально, но оно не ограничивается приведенными примерами.
Ссылочный пример 1: Получение очищенного рекомбинантного α-IFN
Очищенный α-интерферон для изучения композиции получали в помощью процесса получения активного вещества Intermax-α™ (interferon-α 2а, LG Chemical LTD).
После ферментирования рекомбинантных Saccharomyces cerevisiae, содержащих вставку гена человеческого α-интерферона (Saccharomyces cerevisiae pYLBC A/G af α-IFN; № депозита КСТС 0051ВР в Корейской коллекции типовых культур Korea Research Institute of Bioscience and Biotechnology; штамм помещен на хранение 2 июля 1992 г.), получали альфа-интерферон с чистотой более 95% по результатам хроматографии с обращенной фазой посредством нескольких этапов очистки, включая ионообменную хроматографию и гель-хроматографию. Подробности можно найти в патентной заявке Кореи №1992-25912, поданной 28 декабря 1992 г. и озаглавленной "Purification process of α-interferon expressed in recombinant yeast", а в настоящее время - в патенте Кореи №111251, который включен в настоящий документ в качестве ссылки.
Ссылочный пример 2: Изготовление композиции α-интерферона в форме водного раствора и оценка его биологической активности
Были изготовлены композиции α-интерферона в форме водного раствора следующего состава:
α-интерферон 1×106 ~ 100×106 МЕ/мл;
Полисорбат 80: 0,1~0,5 мг/мл;
Фенол: 1,5 мг/мл;
м-Kрезол: 1,0 мг/мл и
буферная система, включающая 10 мМ раствора ацетатного буфера или 10 мМ раствора фосфатного буфера.
Биологическую активность полученной как описано выше композиции α-интерферона в форме водного раствора оценивали в соответствии с процедурой, рекомендованной в монографии 1997: 1110 "Interferon alfa-2 concentrated solution" Европейской Фармакопеи. Иными словами, цитопротективный эффект композиции α-интерферона в форме водного раствора против инфицирования клеток вирусом измеряли для расчета международных единиц (ME) путем сравнения с указанным эффектом международного стандарта рекомбинантного человеческого интерферона α-2 (IFN α-2) или внутреннего рабочего стандарта.
При условиях культивирования 37°С и 5% CO2 клетки MDBK (клетки Madin-Derby Bovine Kidney: ATCC № CCL22) культивировали на микротитрационных планшетах до формирования клеточного монослоя. Затем более 3 различных концентраций испытуемого образца α-интерферона и рабочего стандарта α-интерферона, который был откалиброван с использованием международного стандарта человеческого α-интерферона из NIH (номер в каталоге: Gxa 01-901-535, США), добавляли в микротитрационные планшеты и культивировали. Ряд микротитрационных планшетов содержал клетки, не обработанные α-интерфероном, соответственно, и они служили отрицательными контролями. После культивирования в течение ~18-24 часов при 37°С и 5% СO2 использованный раствор α-интерферона удаляли и добавляли в лунки всех планшетов, кроме контрольных, цитопатический вирус везикулярного стоматита (АТСС № VR-158). После культивирования в течение ~24-48 часов микротитрационные планшеты окрашивали кристаллическим фиолетовым и сушили на воздухе. После добавления в каждую лунку этиленгликоля для экстрагирования красителей измеряли поглощение на 600 нм с использованием спектрофотометра для микротитрационных планшетов.
Величины поглощения стандарта и испытуемых растворов наносили на график в зависимости от дозы α-интерферона, чтобы получить линейное отношение. Затем рассчитывали титры испытуемых растворов путем сравнения с использованием методики анализа параллельных линий.
Ссылочный пример 3: Тест на антимикробную эффективность композиции α-интерферона в форме водного раствора
Пять видов стандартных штаммов, которые использовали для теста, были следующими. Использовали два вида штаммов грибов Aspergillus niger (ATCC 16404) и Candida albicans (ATCC 10231) и три вида бактериальных штаммов Pseudomonas aeruginosa (ATCC 9027), Staphylococcus aureus (ATCC 6538) и Escherichia coli (ATCC 8739).
Агар В (15 г/л казитона, 5 г/л сойтона, 5 г/л NaCl, 18 г/л агара, рН 7,3±0,2) использовали для культивирования бактерий на твердой среде, а агар С (10 г/л пептона, 40 г/л глюкозы, 15 г/л агара, рН 5,6 ± 0,2) использовали для культивирования грибов на твердой среде. Бактерии культивировали при ~30-35°С в течение ~18-24 часов, а грибы культивировали при ~20-25°С в течение ~24-48 часов в случае Candida albicans и в течение ~2-7 дней - в случае Aspergillus niger.
В случае Aspergillus черные споры, образовавшиеся после культивирования в течение приблизительно 5 дней, собирали и использовали в тесте вместо грибов.
Для того чтобы непосредственно инокулировать стандартные штаммы во флакон, содержащий испытуемую композицию α-интерферона в форме водного раствора, в концентрации от 105 до 106 клеток (в случае Aspergillus - спор)/мл стандартных штаммов, концентрацию клеток перед инокуляцией разбавляли до 107-108 клеток (или спор)/мл с помощью разбавляющего буфера, а затем разбавленную клеточную суспензию добавляли к композиции в форме водного раствора таким образом, чтобы количество добавленной клеточной суспензии составляло 1 (об./об.)% от композиции в форме водного раствора. В качестве разбавляющего буфера использовали разбавляющий буфер-А (9 г/л NaCl, 1 г/л пептона) для бактерий и Candida и разбавляющий буфер-В (9 г/л NaCl, 0,5 г/л полисорбата 80) - для Aspergillus.
После инокуляции суспензий стандартных штаммов в испытуемые композиции в форме водного раствора отбирали образцы по ~0,1-0,5 мл каждой из испытуемых композиций через 0, 6 и 24 часа, 7, 14 и 28 дней, соответственно, и отобранные растворы разводили в 1-103 раз разбавляющими буферами. Затем разбавленные образцы засевали мазком на агаровую твердую среду и культивировали при температурах культивирования, как описано выше. Количество жизнеспособных клеток в 1 мл образца рассчитывали путем подсчета количества колоний, образованных на твердой среде. Тем временем испытуемые композиции в форме водного раствора помещали на хранение в термостате при ~20-25°С немедленно после отбора образцов. В качестве методики оценки количества жизнеспособных клеток, а также сред для указанного теста использовали методики и среды, описанные в Европейской Фармакопее (Е.Р 1997, 2.6.12).
Пример 1: Поиск предпочтительных стабилизаторов
Описанный ниже эксперимент был осуществлен с целью поиска предпочтительных стабилизаторов, которые сохраняют биологическую активность α-интерферона путем предотвращения адсорбции α-интерферона на поверхности флакона.
Сначала были приготовлены композиции в форме водного раствора, содержавшие несколько наполнителей, пригодных для композиций, предназначенных для инъекций, в различных концентрациях, как описано в таблице 1, и для коррекции тоничности в них добавляли хлорид натрия. Каждую композицию в форме водного раствора хранили в течение 4 месяцев при 4°С для оценки биологической активности α-интерферона в каждой композиции согласно способу, описанному в ссылочном примере 2. Результаты представлены на фиг. 1 и в таблице 1. Фиг. 1 представляет собой график, показывающий относительную биологическую активность (%) α-интерферона по отношению с зарегистрированной биологической активности композиции в форме водного раствора, содержащей 9×106 МЕ/мл α-интерферона.
Композиции, служившие отрицательным контролем, которые включали только α-интерферон и буферную систему, сохраняли около 80% первоначальной зарегистрированной биологической активности. С другой стороны, композиция в форме водного раствора, включавшая человеческий сывороточный альбумин, полисорбат 80, полиэтиленгликоль или желатин, сохраняла более 90% первоначальной зарегистрированной биологической активности. Это произошло, вероятно, потому, что адсорбция α-интерферона на поверхности флакона была предотвращена указанными выше добавками.
Хотя указанные выше добавки вносят свой вклад в сохранение биологической активности α-интерферона, использование человеческого сывороточного альбумина и желатина в композициях для инъекций ограничено из-за возможных проблем с контаминацией случайными вирусами. Таким образом, полисорбат 80 является наиболее подходящим стабилизатором.
Пример 2: Влияние концентраций полисорбата 80 и антимикробных консервантов на внешний вид композиций в форме водного раствора
В качестве предварительного эксперимента для первоначального отбора композиции α-интерферона в форме водного раствора изучали влияние концентраций полисорбата 80 и антимикробных консервантов на внешний вид композиций в форме водного раствора. Изготавливали 100 миллилитров композиций α-интерферона в форме водного раствора, содержащих полисорбат 80 и антимикробные консерванты, включая фенол, м-крезол или их смеси, в различных концентрациях. Затем тоничность и рН каждой композиции корректировали с использование 0,8% хлорида натрия и 10 мМ буфера ацетата аммония, соответственно. рН Каждой композиции доводили до 5,3.
Цвет и мутность указанных выше композиций в форме водного раствора, содержавших полисорбат 80 и антимикробные консерванты в различных концентрациях, наблюдали визуально. Результаты представлены в таблице 2.
В случае, когда использовали более 0,15% м-крезола, композиции в форме водного раствора становились мутными и степень мутности была пропорциональная концентрации м-крезола. В случае фенола пределы концентраций, которые не приводили к помутнению композиций в форме водного раствора, составляли ~0,1-0,3%, и композиции в форме водного раствора становились мутными, когда добавляли более 0,3% фенола. Результаты теста, представленные выше, были сходными при концентрации полисорбата 80 как 0,01%, так и 0,02%.
Пример 3: Влияние антимикробных консервантов на биологическую активность α-интерферона
рН Композиции в форме водного раствора контролировали на уровне ~4,5-5,5 с помощью буфера ацетата аммония, а тоничность композиции в форме водного раствора регулировали добавлением хлорида натрия. Концентрацию α-интерферона во всех композициях в форме водного раствора доводили до 6×106 МЕ/мл. Температура хранения составляла 4 или 40°С. В течение периода хранения изменения биологической активности α-интерферона определяли с помощью способа, описанного в ссылочном примере 2. Таблица 3 и фиг. 2а, ниже, показывают результат теста на биологическую активность композиции в форме водного раствора, которую хранили при 4°С, а таблица 4 и фиг. 2b, ниже, показывают результат при 40°С.
В таблицах 3 и 4 верхняя величина представляет собой абсолютную биологическую активность α-интерферона, а нижняя величина представляет собой относительную биологическую активность (%) α-интерферона по отношению к биологической активности α-интерферона во время 0.
Как показано в таблице 3 и на фиг. 2а, хотя композиция в форме водного раствора, содержащая фенол, имела несколько более выраженную способность сохранять биологическую активность по сравнению с другими композициями в форме водного раствора, разница была невелика. Однако в случае хранения при 40°С биологическая активность композиции в форме водного раствора, содержавшей бензиловый спирт, сильно уменьшалась по сравнению с другими композициями в форме водного раствора (см. таблицу 4 и фиг. 2b).
Пример 4: Влияние рН на биологическую активность и димеризацию α-интерферона
Изготавливали композиции в форме водного раствора, содержавшие 6×106 МЕ/мл α-интерферона, 0,15% м-крезола и 10 мМ буфера ацетата аммония. рН Каждой композиции в форме водного раствора контролировали на уровне 5,3, 5,8 и 6,3, соответственно. Изготовленные композиции в форме водного раствора хранили при 40°С в течение 12 недель и биологическую активность каждой композиции в форме водного раствора определяли в через соответствующие периоды времени. Результаты представлены в таблице 5 и на фиг. 3а.
Через 12 недель наличие и степень димеризации определяли с помощью 14% SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) (дискретная буферная система, разделяющий гель; 14%, 0,375 М Tris-HCl, pH 8,8, концентрирующий гель; 5%; 0,125 М Tris-HCl, рН 6,8) при невосстанавливающих условиях, а затем - с помощью окрашивания серебром.
Сначала после приготовления 14% разделяющего геля, отвержденного между двумя стеклянными пластинами, приготавливали 5% раствор концентрирующего геля и наливали его на разделяющий гель, а затем вставляли соты. После полного затвердевания концентрирующего геля соты удаляли, а сформированные лунки промывали рабочим буфером (Tris-глициновый буфер, рН 8,3). К 100 мкл указанной выше композиции в форме водного раствора добавляли 50 мкл концентрированного в 3 раза буфера для образцов (0,186 М Tris, 3% SDS, 30% об./об.% глицерина, 0,009% бромфенолового синего, рН 6,8) и тщательно перемешивали. Затем смесь кипятили на бане с кипящей водой в течение 2 минут и охлаждали на холодной бане. 50 мкл этого образца и 10 мкл маркера молекулярной массы (Bio-Rad, низкомолекулярный MW маркер) помещали в разные лунки. После помещения образца и маркера молекулярной массы в лунки загружали гель в систему для электрофореза (Hoeffer Scientific Instruments, SE 600), а затем в систему заливали рабочий буфер. Применяя ток 10 мА к пластине геля путем подключения системы к источнику питания (Hoeffer Scientific Instruments, PS 2500), осуществляли электрофорез до тех пор, пока полоса бромфенолового синего не достигала границы между разделяющим гелем и концентрирующим гелем. Когда полоса бромфенолового синего достигала границы, ток увеличивали до 20 мА, а затем осуществляли электрофорез до тех пор, пока полоса бромфенолового синего не достигала нижнего конца стеклянной пластины. По окончании электрофореза питание отключали, гель изымали из системы и гель, содержавший белки, фиксировали в смеси метанол:уксусная кислота:вода (50:10:40) при комнатной температуре в течение ~12-16 часов. Затем гель переносили в 10% раствор глутарового альдегида на 30 минут при перемешивании и 3 раза промывали деионизированной водой по 20 мин. После приготовления раствора нитрата серебра (0,8% нитрат серебра, 0,08% NaOH и 4% нашатырного спирта) гель переносили в указанный раствор и взбалтывали в темном месте в течение 5 минут. Затем гель 3 раза промывали деионизированной водой по 1 мин. Проявительный раствор (0,005% лимонной кислоты, 0,14% формальдегида и 0,005% метанола), изготовленный непосредственно перед использованием, добавляли к гелю, и гель осторожно встряхивали до проявления окрашенных серебром белковых полос. Результаты представлены в таблице 6 и на фиг. 3b.
Как видно из таблицы 5 и фиг. 3а, биологическая активность α-интерферона была относительно стабильной при рН около 5,8. Тем временем димеризация α-интерферона наблюдалась чаще при более высоких значениях рН (см. таблицу 6 и фиг. 3b). Таким образом, высокие значения рН не являются предпочтительными для длительного хранения композиции α-интерферона в форме водного раствора.
Пример 5: Влияние двух консервантов на антимикробную активность
Тесты на антимикробную эффективность выполняли с композициями α-интерферона в форме водного раствора, содержавшими фенол и/или м-крезол в качестве консервантов, согласно методике, описанной в Европейской Фармакопее (Е.Р. 1997, 5.1.3). Сначала изготавливали композицию в форме водного раствора, содержавшую 6×106 МЕ/мл α-интерферона, 0,02% полисорбата 80 и 10 мМ буфера ацетата аммония. К композиции добавляли консерванты в различных концентрациях, как показано в таблице 7, и добавляли хлорид натрия для коррекции тоничности каждой композиции. Результаты теста на антимикробную эффективность для композиций в форме водного раствора представлены в таблице 7. Количество жизнеспособных клеток в 1 мл композиции в форме водного раствора определяли с помощью методики, описанной в ссылочном примере 3. Количество жизнеспособных клеток, определенное для каждого времени отбора образца, логарифмически преобразовывали и рассчитывали величины log уменьшения для каждого интервала времени. Полученные величины log уменьшения сравнивали с величинами критериев А или В, описанными в Европейской Фармакопее, чтобы определить, удовлетворяют ли они критериям А или В.
Как можно видеть из результатов, представленных в таблице 7, композиция в форме водного раствора, содержавшая 0,15% фенола и 0,1% м-крезола, удовлетворяла критериям А и В теста на антимикробную эффективность Европейской Фармакопеи, даже если она содержала наименьшее количество консервантов (общее количество консервантов 0,25%).
Пример 6: Сравнительный тест на стабильность композиции в форме водного раствора, содержащей смесь 0,15% фенола и 0,1% м-крезола, и композиции в форме водного раствора, содержащей только 0,3% фенола
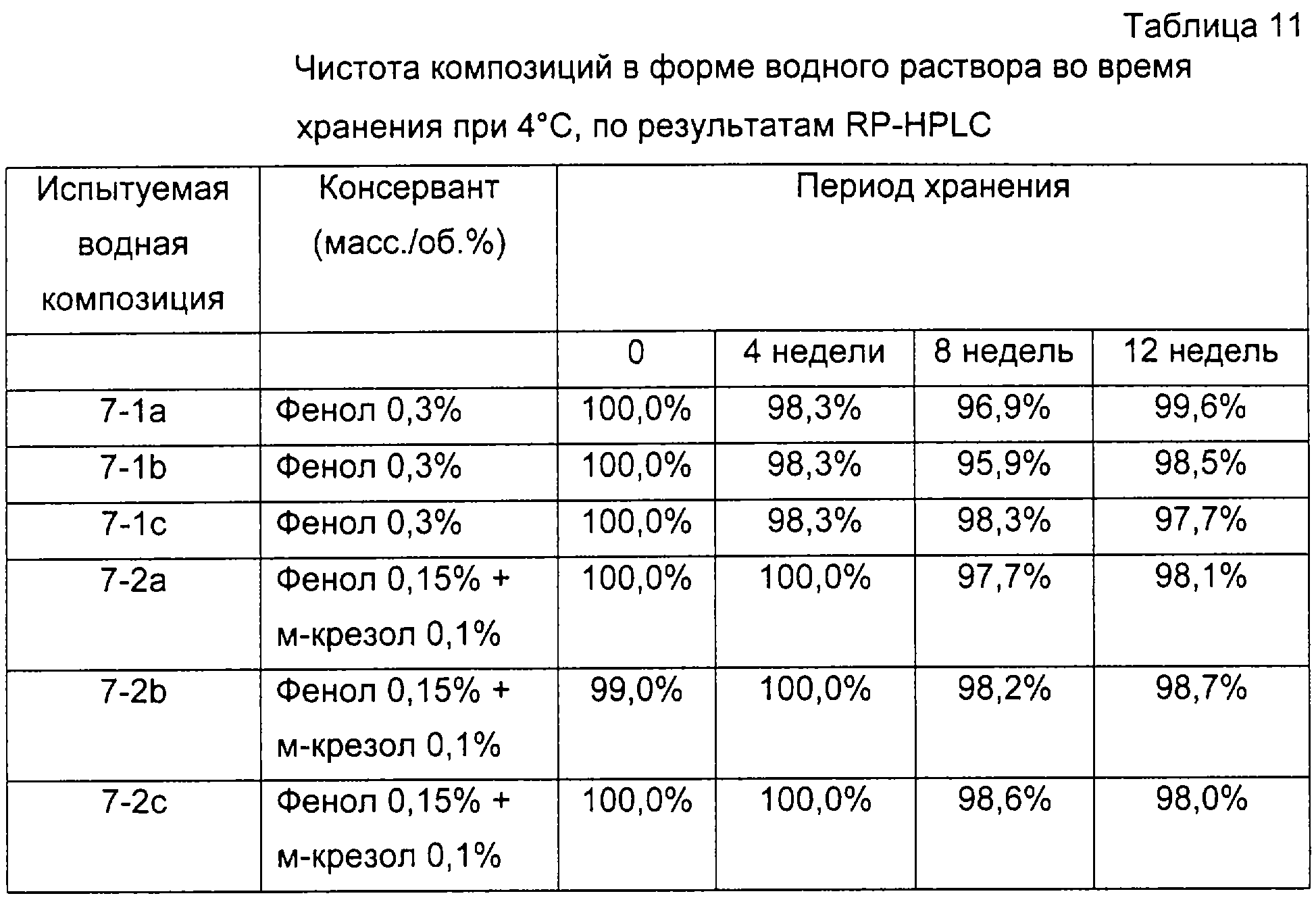
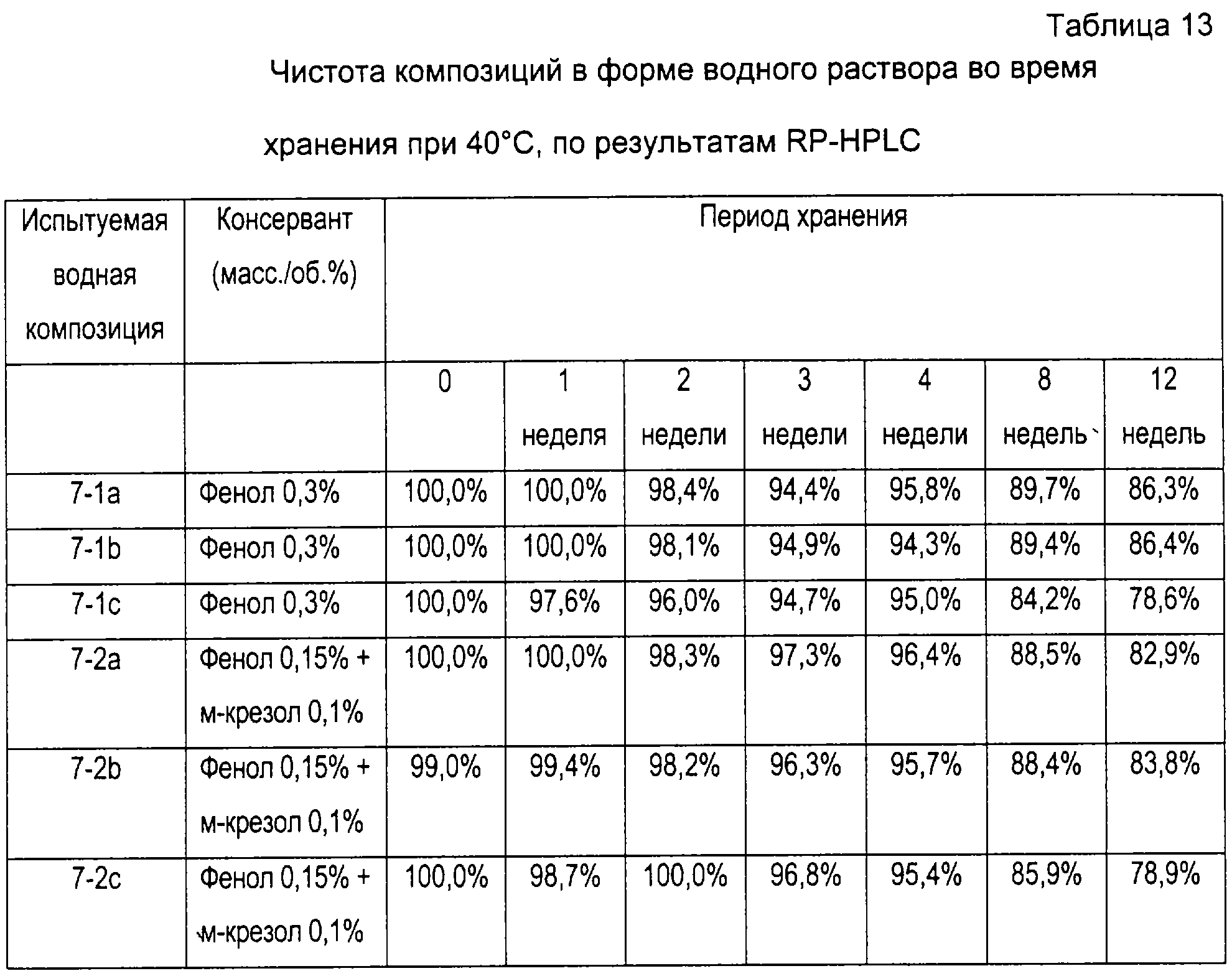
Изготавливали композицию в форме водного раствора, содержавшую 6×106 МЕ/мл α-интерферона, 0,02% полисорбата 80, 0,3% фенола и 10 мМ буфера ацетата аммония (испытуемая композиция в форме водного раствора # 7-1), и такую же композицию, как описано выше, за исключением того, что вместо 0,3% фенола использовали смесь 0,15% фенола и 0,1% м-крезола (испытуемая композиция в форме водного раствора #7-2). рН Каждой композиции в форме водного раствора доводили до 5,3, и для коррекции тоничности к композиции в форме водного раствора добавляли хлорид натрия. Два вида композиций разделяли на три группы и эти группы хранили при 4, 25 и 40°С, соответственно, в течение 12 недель. Каждая группа имела три варианта хранения. Через регулярные интервалы времени определяли биологическую активность α-интерферона. Чистоту определяли с помощью высокоэффективной жидкостной хроматографии с обращенной фазой (RP-HPLC, Water Alliance System, УФ-детектор, колонка Jupiter C18). Результаты представлены в таблицах 8-13 и на фиг. 4а-4f.
(6-1) Оценка изменений биологической активности α-интерферона
В таблицах 8-10 верхняя величина представляет собой абсолютную биологическую активность α-интерферона, а нижняя величина представляет собой относительную биологическую активность (%) α-интерферона по отношению к биологической активности α-интерферона во время 0. Единицей для каждой величины в таблицах является 106 МЕ/мл.
(6-2) Чистота α-интерферона
Фиг. 4a, 4b и 4с представляют собой графики, показывающие изменения относительной биологической активности по сравнению с биологической активностью α-интерферона во время 0. Как показано в таблицах 8-13 и на фиг. 4а-4f, композиции в форме водного раствора, содержавшие смесь 0,15% фенола и 0,1% м-крезола, показали сходную тенденцию с композициями, содержавшими только 0,3% фенола, в том, что касается активности, а также чистоты в течение всего периода тестирования. Кроме того, два вида композиций удовлетворяли антимикробным требованиям, предписанным в тесте на антимикробную эффективность Европейской Фармакопеи. Однако композиция в форме водного раствора, содержащая смесь 0,15% фенола и 0,1% м-крезола, является более безопасной для организма человека, чем композиция, содержащая только 0,3% фенола, поскольку первая содержит меньшее количество консервантов.
Claims (7)
1. Композиция α-интерферона в форме водного раствора, включающая α-интерферон; стабилизатор; агент, регулирующий осмотическое давление; антимикробные консерванты, выбранные из группы, состоящей из 0,1-0,3 мас./об.% фенола, 0,1-0,2 мас./об.% м-крезола или их смесей, и буферную систему, причем рН композиции находится в пределах от 4,5 до 6,0.
2. Композиция α-интерферона в форме водного раствора по п.1, в которой количество добавленного α-интерферона находится в пределах от 1·106 до 1·108 МЕ/мл.
3. Композиция α-интерферона в форме водного раствора по п.1, в которой стабилизатор представляет собой полисорбат 80.
4. Композиция α-интерферона в форме водного раствора по п.3, в которой концентрация полисорбата 80 находится в пределах от 0,01 до 0,05 мас./об.%.
5. Композиция α-интерферона в форме водного раствора по п.1, в которой агент, регулирующий осмотическое давление, представляет собой хлорид натрия.
6. Композиция α-интерферона в форме водного раствора по п.1, в которой буферная система представляет собой буферную систему, состоящую из ацетата аммония и уксусной кислоты; или буферную систему, состоящую из моногидрофосфата натрия (Nа2НРO4) и дигидрофосфата натрия (NaH2PO4).
7. Композиция α-интерферона в форме водного раствора по п.7, в которой концентрация буферной системы в композиции в форме водного раствора находится в пределах от 5 до 20 мМ.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1999/51481 | 1999-11-19 | ||
| KR10-1999-0051481A KR100399156B1 (ko) | 1999-11-19 | 1999-11-19 | α-인터페론의 용액제형 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2002116364A RU2002116364A (ru) | 2004-01-20 |
| RU2232595C2 true RU2232595C2 (ru) | 2004-07-20 |
Family
ID=36782398
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2002116364/15A RU2232595C2 (ru) | 1999-11-19 | 2000-11-17 | Композиция альфа-интерферона в форме водного раствора |
Country Status (23)
| Country | Link |
|---|---|
| EP (1) | EP1231933B1 (ru) |
| JP (1) | JP3893286B2 (ru) |
| KR (1) | KR100399156B1 (ru) |
| CN (1) | CN1203892C (ru) |
| AR (1) | AR026507A1 (ru) |
| AT (1) | ATE333891T1 (ru) |
| AU (1) | AU777994B2 (ru) |
| BR (1) | BR0015699A (ru) |
| CA (1) | CA2391889A1 (ru) |
| CY (1) | CY1105449T1 (ru) |
| DE (1) | DE60029614T2 (ru) |
| DK (1) | DK1231933T3 (ru) |
| ES (1) | ES2267584T3 (ru) |
| HU (1) | HUP0203706A3 (ru) |
| MX (1) | MXPA02005105A (ru) |
| PE (1) | PE20010903A1 (ru) |
| PL (1) | PL356406A1 (ru) |
| PT (1) | PT1231933E (ru) |
| RU (1) | RU2232595C2 (ru) |
| TR (1) | TR200201310T2 (ru) |
| TW (1) | TWI223596B (ru) |
| WO (1) | WO2001035987A1 (ru) |
| ZA (1) | ZA200204096B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2447897C2 (ru) * | 2009-03-26 | 2012-04-20 | Сергей Юрьевич Родионов | Цитокинсодержащая композиция для лечения вирусных заболеваний |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1245215C (zh) | 2001-02-28 | 2006-03-15 | 四川省生物工程研究中心 | 重组高效复合干扰素用作乙型肝炎表面抗原和e抗原抑制剂 |
| US8551469B2 (en) | 2001-02-28 | 2013-10-08 | Superlab Far East Limited | Treatment of tumors and viral diseases with recombinant interferon alpha |
| US6830744B2 (en) * | 2002-05-31 | 2004-12-14 | Aradigm Corporation | Compositions methods and systems for pulmonary delivery of recombinant human interferon alpha-2b |
| US7585647B2 (en) | 2003-08-28 | 2009-09-08 | Guangwen Wei | Nucleic acid encoding recombinant interferon |
| CN107496917B (zh) | 2010-02-26 | 2021-06-11 | 诺沃—诺迪斯克有限公司 | 包含稳定抗体的组合物 |
| CN105055306B (zh) | 2010-05-28 | 2019-10-01 | 诺沃—诺迪斯克有限公司 | 包含抗体和防腐剂的稳定的多剂量组合物 |
| SG11201502930XA (en) | 2012-10-26 | 2015-05-28 | Lupin Ltd | Stable pharmaceutical composition of peginterferon alpha-2b |
| CN104888196B (zh) * | 2015-06-25 | 2018-07-06 | 北京三元基因药业股份有限公司 | 一种稳定的干扰素α多剂量笔注射液 |
| CN105456186A (zh) * | 2015-12-24 | 2016-04-06 | 杭州嘉伟生物制品有限公司 | 一种生理平衡液的制备方法 |
| CN114259556B (zh) * | 2021-12-24 | 2024-05-31 | 科兴生物制药股份有限公司 | 人干扰素α2b喷雾剂及其制备方法 |
| CN114053397B (zh) * | 2022-01-17 | 2022-12-20 | 北京三元基因药业股份有限公司 | 一种稳定的干扰素多剂量注射液及其制备方法 |
| CN115068592A (zh) * | 2022-06-27 | 2022-09-20 | 长春生物制品研究所有限责任公司 | 开封后常温稳定的重组人干扰素α1b滴眼液及制备方法 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5766582A (en) * | 1994-10-11 | 1998-06-16 | Schering Corporation | Stable, aqueous alfa interferon solution formulations |
| JP2758154B2 (ja) * | 1995-04-06 | 1998-05-28 | エフ・ホフマン−ラ ロシユ アーゲー | インターフェロンを含む液体製剤 |
-
1999
- 1999-11-19 KR KR10-1999-0051481A patent/KR100399156B1/ko not_active IP Right Cessation
-
2000
- 2000-11-16 AR ARP000106058A patent/AR026507A1/es unknown
- 2000-11-17 ES ES00976435T patent/ES2267584T3/es not_active Expired - Lifetime
- 2000-11-17 DE DE60029614T patent/DE60029614T2/de not_active Expired - Fee Related
- 2000-11-17 TW TW089124326A patent/TWI223596B/zh not_active IP Right Cessation
- 2000-11-17 TR TR2002/01310T patent/TR200201310T2/xx unknown
- 2000-11-17 MX MXPA02005105A patent/MXPA02005105A/es unknown
- 2000-11-17 JP JP2001537977A patent/JP3893286B2/ja not_active Expired - Fee Related
- 2000-11-17 CA CA002391889A patent/CA2391889A1/en not_active Abandoned
- 2000-11-17 WO PCT/KR2000/001322 patent/WO2001035987A1/en active IP Right Grant
- 2000-11-17 BR BR0015699-0A patent/BR0015699A/pt not_active IP Right Cessation
- 2000-11-17 EP EP00976435A patent/EP1231933B1/en not_active Expired - Lifetime
- 2000-11-17 AU AU14216/01A patent/AU777994B2/en not_active Ceased
- 2000-11-17 RU RU2002116364/15A patent/RU2232595C2/ru not_active IP Right Cessation
- 2000-11-17 PT PT00976435T patent/PT1231933E/pt unknown
- 2000-11-17 PE PE2000001230A patent/PE20010903A1/es not_active Application Discontinuation
- 2000-11-17 DK DK00976435T patent/DK1231933T3/da active
- 2000-11-17 CN CNB00815919XA patent/CN1203892C/zh not_active Expired - Fee Related
- 2000-11-17 PL PL00356406A patent/PL356406A1/xx not_active IP Right Cessation
- 2000-11-17 HU HU0203706A patent/HUP0203706A3/hu unknown
- 2000-11-17 AT AT00976435T patent/ATE333891T1/de not_active IP Right Cessation
-
2002
- 2002-05-23 ZA ZA200204096A patent/ZA200204096B/xx unknown
-
2006
- 2006-08-30 CY CY20061101228T patent/CY1105449T1/el unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2447897C2 (ru) * | 2009-03-26 | 2012-04-20 | Сергей Юрьевич Родионов | Цитокинсодержащая композиция для лечения вирусных заболеваний |
Also Published As
| Publication number | Publication date |
|---|---|
| MXPA02005105A (es) | 2002-11-07 |
| TWI223596B (en) | 2004-11-11 |
| WO2001035987A1 (en) | 2001-05-25 |
| ZA200204096B (en) | 2003-02-26 |
| DE60029614T2 (de) | 2007-07-12 |
| DE60029614D1 (de) | 2006-09-07 |
| KR100399156B1 (ko) | 2003-09-26 |
| EP1231933A1 (en) | 2002-08-21 |
| HUP0203706A2 (hu) | 2003-03-28 |
| TR200201310T2 (tr) | 2002-09-23 |
| CY1105449T1 (el) | 2010-04-28 |
| PL356406A1 (en) | 2004-06-28 |
| JP3893286B2 (ja) | 2007-03-14 |
| AU1421601A (en) | 2001-05-30 |
| ATE333891T1 (de) | 2006-08-15 |
| PT1231933E (pt) | 2006-10-31 |
| CN1203892C (zh) | 2005-06-01 |
| HUP0203706A3 (en) | 2004-12-28 |
| DK1231933T3 (da) | 2006-10-30 |
| AR026507A1 (es) | 2003-02-12 |
| CN1391478A (zh) | 2003-01-15 |
| AU777994B2 (en) | 2004-11-11 |
| ES2267584T3 (es) | 2007-03-16 |
| JP2003514027A (ja) | 2003-04-15 |
| BR0015699A (pt) | 2002-07-23 |
| EP1231933B1 (en) | 2006-07-26 |
| PE20010903A1 (es) | 2001-08-31 |
| CA2391889A1 (en) | 2001-05-25 |
| RU2002116364A (ru) | 2004-01-20 |
| KR20010047312A (ko) | 2001-06-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US4847079A (en) | Biologically stable interferon compositions comprising thimerosal | |
| RU2232595C2 (ru) | Композиция альфа-интерферона в форме водного раствора | |
| JP3978228B2 (ja) | 安定な、水性αインターフェロン溶液処方物 | |
| EP0652766B2 (en) | Human growth hormone aqueous formulation | |
| FI112169B (fi) | Menetelmä ihmisproteiinipitoisten infuusio- tai injektointitarkoituksiin tarkoitettujen säilöttyjen lääkkeiden valmistamiseksi | |
| DE69729880T3 (de) | Stabile flüssige interferon-zubereitungen | |
| EP1250932B1 (en) | A stable aqua formulation of interferon, the preparation method and the uses thereof | |
| HU225147B1 (en) | Stabile liquide composition containing urate oxydase, and lyophilised product for its preparation | |
| US5714458A (en) | Stable pharmaceutical compositions containing a fibroblast growth factor | |
| DE69101784T2 (de) | Stabilisierte zusammensetzung enthaltend ein fibroblastwachstumsfaktor. | |
| US9023797B2 (en) | Caprylate viral deactivation | |
| CA2544432C (en) | Stable pharmaceutical composition comprising granulocyte-colony stimulating factor | |
| JP3024073B2 (ja) | タンパク質中のウイルスを不活性化する方法 | |
| NZ235153A (en) | Stabilised alpha-interferon compositions | |
| CA1295240C (en) | Biologically stable interferon compositions | |
| EP0544950B1 (en) | Chlordioxide containing agent against fishparasites | |
| KR19990085129A (ko) | 안정한 α-인터페론 용액 제제 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20091118 |