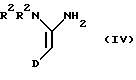RU2154635C2 - Производные 4-арил-6-амино-никотиновой кислоты и их соли - Google Patents
Производные 4-арил-6-амино-никотиновой кислоты и их соли Download PDFInfo
- Publication number
- RU2154635C2 RU2154635C2 RU95114449/04A RU95114449A RU2154635C2 RU 2154635 C2 RU2154635 C2 RU 2154635C2 RU 95114449/04 A RU95114449/04 A RU 95114449/04A RU 95114449 A RU95114449 A RU 95114449A RU 2154635 C2 RU2154635 C2 RU 2154635C2
- Authority
- RU
- Russia
- Prior art keywords
- carbon atoms
- cyano
- nitro
- group
- phenyl
- Prior art date
Links
- 0 CC(C1)=C(C(O)=O)C(*)=C(*)C1N Chemical compound CC(C1)=C(C(O)=O)C(*)=C(*)C1N 0.000 description 2
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/79—Acids; Esters
- C07D213/80—Acids; Esters in position 3
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/79—Acids; Esters
- C07D213/803—Processes of preparation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/84—Nitriles
- C07D213/85—Nitriles in position 3
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Life Sciences & Earth Sciences (AREA)
- Neurology (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Neurosurgery (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Biomedical Technology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Pyridine Compounds (AREA)
Abstract
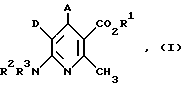
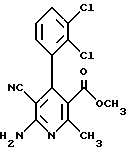
Изобретение относится к производным 4-арил-6-амино-никотиновой кислоты формулы I и их солям, где A - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фенил, галоген и трифторметил, или неразветвленной или разветвленной алкилтиогруппой с 1-6 атомами углерода или неразветвленным или разветвленным алкоксилом с 1-6 атомами углерода, D - циано или нитро, R1 - водород или C1-C8алкил, R2 и R3 -водород, C1-C6алкил, C1-C6ацил, при условии, если A означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 означают водород, то R1 не означает этил. Соединения формулы I могут быть использованы в медицине в качестве модуляторов калиевых канальцев. 2 з.п.ф-лы, 6 табл.
Description
Изобретение относится к производным пиридина, в частности к новым производным никотиновой кислоты с ценными биологическими свойствами.
Из источников Collect. Czech. Chem. Comun. 56(10), стр. 2175 - 82, 1991 г. , и Хим. гетероцикл. соедин., (11), стр. 1504 - 8, 1984 г. известны производные пиридина, представляющие собой сложные этиловые эфиры замещенной никотиновой кислоты, причем в качестве заместителей указаны метил (в положении 2), фенил (в положении 4), незамещенный или замещенный в положении 4-хлором, или метокси-, или нитрогруппой, цианогруппа (в положении 5) и аминогруппа (в положении 6).
Указанные источники не содержат данных по назначению сложных этиловых эфиров замещенной никотиновой кислоты.
Задачей изобретения является разработка новых производных замещенной никотиновой кислоты, обладающих биологической активностью, в частности проявляющих модулируещее калиевые канальцы действие.
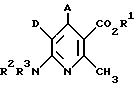
Поставленная задача решается предлагаемыми производными 4-арил-6-амино-никотиновой кислоты общей формулы (I)
где A - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фенил, галоген и трифторметил, или неразветвленной или разветвленной алкилтиогруппой с 1-6 атомами углерода или неразветвленным или разветвленным алкоксилом с 1-6 атомами углерода,
D - циано или нитро,
R1 - водород или неразветвленный или разветвленный алкил с 1 - 8 атомами углерода,
R2 и R3 одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1-6 атомами углерода или неразветвленный или разветвленный ацил с 1-6 атомами углерода,
при этом, если A означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил,
и их солями.
где A - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фенил, галоген и трифторметил, или неразветвленной или разветвленной алкилтиогруппой с 1-6 атомами углерода или неразветвленным или разветвленным алкоксилом с 1-6 атомами углерода,
D - циано или нитро,
R1 - водород или неразветвленный или разветвленный алкил с 1 - 8 атомами углерода,
R2 и R3 одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1-6 атомами углерода или неразветвленный или разветвленный ацил с 1-6 атомами углерода,
при этом, если A означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил,
и их солями.
В качестве солей предпочитают физиологически приемлемые соли. Предпочтительными являются соли с неорганическими кислотами, такими, как, например, соляная кислота, бромистоводородная кислота, фосфорная кислота или серная кислота, или соли с органическими карбоновыми кислотами или сульфокислотами, такими, как, например, уксусная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, лимонная кислота, винная кислота, молочная кислота, бензойная кислота, или метансульфокислота, этансульфокислота, фенилсульфокислота, толуолсульфокислота или нафталиндисульфокислота.
Предпочтительными являются соединения общей формулы (I),
где A - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фтор, хлор, бром, йод, фенил и трифторметил, или неразветвленной или разветвленной алкилтиогруппой с 1-4 атомами углерода или неразветвленным или разветвленным алкоксилом с 1-4 атомами углерода,
D - циано или нитро,
R1 - водород или неразветвленный или развлетвленный алкил с 1-6 атомами углерода,
R2 и R3 одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1-4 атомами углерода или неразветвленный или разветвленный ацил с 1-4 атомами углерода,
при этом, если A означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил, и их соли.
где A - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фтор, хлор, бром, йод, фенил и трифторметил, или неразветвленной или разветвленной алкилтиогруппой с 1-4 атомами углерода или неразветвленным или разветвленным алкоксилом с 1-4 атомами углерода,
D - циано или нитро,
R1 - водород или неразветвленный или развлетвленный алкил с 1-6 атомами углерода,
R2 и R3 одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1-4 атомами углерода или неразветвленный или разветвленный ацил с 1-4 атомами углерода,
при этом, если A означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил, и их соли.
Особенно предпочтительными являются соединения общей формулы (I),
где
A - фенил, незамещенный или замещенный 1 - 2 одинаковыми или различными остатками из группы, включающей нитро, циано, фтор, хлор, бром, йод, фенил, трифторметил, метокси и метилтио,
D - циано или нитро,
R1 - водород или неразветвленный или развлетвленный алкил с 1-4 атомами углерода,
R2 и R3 одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1-3 атомами углерода или неразветвленный или развлетвленный ацил с 1 - 3 атомами углерода,
при этом, если A означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил,
и их соли.
где
A - фенил, незамещенный или замещенный 1 - 2 одинаковыми или различными остатками из группы, включающей нитро, циано, фтор, хлор, бром, йод, фенил, трифторметил, метокси и метилтио,
D - циано или нитро,
R1 - водород или неразветвленный или развлетвленный алкил с 1-4 атомами углерода,
R2 и R3 одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1-3 атомами углерода или неразветвленный или развлетвленный ацил с 1 - 3 атомами углерода,
при этом, если A означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил,
и их соли.
Как уже указывалось, предлагаемые соединения общей формулы (I) обладают модулирующим калиевые канальцы действием и являются, тем самым, пригодными для применения в борьбе с церебральными заболеваниями и серповидно-клеточной анемией. В частности они представляют собой модуляторы канальцев, обладающие селективностью в отношении зависящих от кальция калиевых канальцев большой проводимости, в частности центральной нервной системы.
На основе этих фармакологических свойств они пригодны для приготовления лекарственных средств для лечения дегенеративных заболеваний центральной нервной системы, таких, как, например, деменции, как многоинфарктное слабоумие, первично дегенеративное слабоумие, пресенильное и старческое слабоумие (болезнь Альцгеймера), слабоумие в связи со СПИДом, и другие виды деменции, кроме того для лечения болезни Паркинсона, бокового амиотрофического склероза, а также множественного склероза.
Кроме того, новые соединения пригодны для лечения функциональной слабости мозга в старости, мозгоорганического психосиндрома и расстройств памяти в старости.
Они пригодны для профилактики, лечения и борьбы с последствиями нарушений мозгового кровообращения, таких, как, например, церебральные ишемии, апоплексические удары, черепно-мозговые травмы, и субарахноидальные кровоизлияния.
Кроме того, они пригодны для лечения депрессий и психозов, например шизофрении, а также для лечения расстройств невроэндокринной секреции, секреции невротрансмиттеров и связанных с ними расстройств здоровья, таких, как, например, мания, алкоголизм, злоупотребление наркотиками, болезненная страсть или болезненное отношение к еде. Дополнительными областями применения новых соединений являются лечение мигрени, расстройств сна, невропатий. К тому же они пригодны в качестве болеутоляющих средств.
Возможно применять новые соединения и для лечения расстройств иммунной системы, в частности пролиферации T-лимфоцитов, и для воздействия на гладкую мускулятуру, в частности матки, мочевого пузыря и бронхиального тракта, и для лечения связанных с этим болезней, например, астмы и недержания мочи, а также для лечения повышенного кровяного давления, аритмии, ангины и диабета.
Биологическая активность предлагаемых соединений формулы (I) иллюстрируется следующим опытом.
Выделение86 рубидия из глиомных клеток C6-BU1
Опыты проводили с незначительными изменениями по методу Тасу и др. (Neurosci. Lett. 94 стр. 279-284, (1988)). Для этого использовали выделенные из крыс глиомные клетки C6-BU1. По полученным путем жидкостной сцинтилляции данным считывали вызванное иономицином повышение выделения через базальное выделение, которое берут за 100%. Стимуляции в присутствии исследуемых веществ относили к этому значению. В этом опыте соединения примером 1, 2 проявляли стимулирующее действие в концентрациях 10-6 моль.
Опыты проводили с незначительными изменениями по методу Тасу и др. (Neurosci. Lett. 94 стр. 279-284, (1988)). Для этого использовали выделенные из крыс глиомные клетки C6-BU1. По полученным путем жидкостной сцинтилляции данным считывали вызванное иономицином повышение выделения через базальное выделение, которое берут за 100%. Стимуляции в присутствии исследуемых веществ относили к этому значению. В этом опыте соединения примером 1, 2 проявляли стимулирующее действие в концентрациях 10-6 моль.
Предлагаемые соединения формулы (I) относятся к категории малотоксичных веществ.
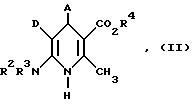
Новые соединения общей формулы (I) можно получать, например, путем окисления дигидропиридинов общей формулы (II)
где A, D, R1-R3 имеют вышеуказанное значение
R4 имеет вышеуказанное значение R1, но не означает водород,
типичным окислителем, предпочтительно двуокисью марганца, в среде инертного растворителя с последующим, при необходимости, алкилированием или ацилированием получаемого продукта, или гидролизом получаемого сложного эфира, в случае необходимости в среде органических растворителей и в присутствии основания.
где A, D, R1-R3 имеют вышеуказанное значение
R4 имеет вышеуказанное значение R1, но не означает водород,
типичным окислителем, предпочтительно двуокисью марганца, в среде инертного растворителя с последующим, при необходимости, алкилированием или ацилированием получаемого продукта, или гидролизом получаемого сложного эфира, в случае необходимости в среде органических растворителей и в присутствии основания.
Данный способ поясняется реакционной схемой, приведенной в конце описания.
В качестве растворителей пригодны любые инертные органические растворители, не меняющиеся в условиях реакции. Предпочтительными растворителями являются спирты, такие, как метанол, этанол, пропанол или изопропанол, простые эфиры, такие, как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, или диэтиленгликольдиметиловый эфир, ацетонитрил, амиды, такие, как триамид гексаметилфосфорной кислоты или диметилформамид, уксусная кислота, галогенированные углеводороды, такие, как хлористый метилен, четыреххлористый углерод, углеводороды, такие, как бензол или толуол. Можно также применять смеси приведенных растворителей. Особенно предпочтительным является хлористый метилен.
В качестве окислителей в общем пригодны 2,3-дихлор-4,5- дициан-п-бензохинон и его производные, дихромат пиридиния, элементарный бром или йод и двуокись марганца. Предпочтительной является двуокись марганца.
Окислитель в общем применяют в количестве 1 - 20 моль, предпочтительно 1 - 5 моль, в пересчете на 1 моль соединения общей формулы (II).
Температуры реакции можно варьировать в широком диапазоне. В общем работают при температурах между +10oC и +150oC, предпочтительно между +20oC и +100oC, в частности при комнатной температуре.
Реакции можно осуществлять как при атмосферном давлении, так и при повышенном или пониженном давлении (например, при 0,5 - 3 бар). В общем работают при атмосферном давлении.
В качестве растворителей для алкилирования также пригодны обычные органические растворители, не меняющиеся в условиях реакции. Предпочтительными растворителями являются простые эфиры, такие, как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, углеводороды, такие, как бензол, толуол, ксилол, гексан, циклогексан или нефтяные фракции, галогенированные углеводороды, такие, как дихлорметан, трихлорметран, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, этиловый эфир уксусной кислоты, триэтиламин, пиридин, диметилсульфоксид, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Можно также применять смеси приведенных растворителей. Предпочтительным является диметилформамид.
В качестве оснований в общем пригодны гидриды или алкоголяты щелочного металла, например, гидрид натрия или третбутилат калия, циклические амины, например пиперидин, диметиламинопиридин или алкиламины с 1 - 4 атомами углерода, например триэтиламин. Предпочтительным является гидрид натрия.
Температуры реакции можно варьировать в широком диапазоне. В общем работают при температурах между +10oC и +150oC, предпочтительно между +20oC и +100oC, в частности при комнатной температуре.
Алкилирование в среде вышеприведенных растворителей осуществляют при температурах от 0oC до +150oC, предпочтительно при комнатной температуре до +100oC.
Реакции можно осуществлять как при атмосферном давлении, так и при повышенном или пониженном давлении (например, при 0,5 - 3 бар). В общем работают при атмосферном давлении.
Основание в общем применяют в количестве 1 - 5 моль, предпочтительно 1 - 2 моль, в пересчете на 1 моль соединения, которое подвергают алкилированию.
В качестве оснований для ацилирования пригодны неорганические или органические основания. Предпочтительными основаниями являются гидроокиси щелочного металла, такие, как, например, гидроокись натрия или калия, гидроокиси щелочноземельного металла, такие, как, например, гидроокись бария, карбонаты щелочного металла, такие, как, например, карбонат натрия или калия, карбонаты щелочноземельного металла, такие, как, например, карбонат кальция, или органические амины, такие, как, например, триалкиламины с 1-6 атомами углерода в каждой алкильной части, в частности триэтиламин, или гетероциклы, такие, как пиридин, метилпиперидин, пиперидин или морфолин. Особенно предпочтительным является триэтиламин.
В качестве растворителей для ацилирования также пригодны обычные органические растворители, не меняющиеся в условиях реакции. Предпочтительными растворителями являются простые эфиры, такие, как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, углеводороды, такие, как бензол, толуол, ксилол, гексан, циклогексан или нефтяные фракции, галогенированные углеводороды, такие, как дихлорметан, трихлорметран, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, этиловый эфир уксусной кислоты, триэтиламин, пиридин, диметилсульфоксид, диметилформамид, триамид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Можно также применять смеси приведенных растворителей или же соответствующий агент ацилирования можно также применять в качестве растворителя. Предпочтительными являются ацетангидрид и пиридин.
Ацилирование в общем осуществляют в температурном диапазоне от 0oC до +120oC, предпочтительно от +30oC до +90oC, и атмосферном давлении.
Омыление сложных эфиров карбоновой кислоты осуществляют известными приемами путем обработки стандартными основаниями в среде инертных растворителей.
В качестве оснований для омыления пригодны стандартные для этой реакции неорганические основания. Предпочтительными основаниями являются гидроокиси щелочного или щелочноземельного металлов, такие, как, например, гидроокись натрия, калия или бария, или карбонаты щелочного металла как, например, карбонат натрия или калия, или бикарбонат натрия. Особенно предпочтительными являются гидроокись натрия или калия.
В качестве растворителей для омыления пригодны вода или стандартные для проведения данной реакции органические растворители. Предпочтительными растворителями являются спирты, такие, как метанол, этанол, пропанол, изопропанол или бутанол, или простые эфиры, такие, как тетрагидрофуран или диоксан, или диметилформамид или диметилсульфоксид. Особенно предпочтительными являются спирты как метанол, этанол, пропанол или изопропанол. Также возможно применение смесей приведенных растворителей,
Омыление в общем осуществляют в температурном диапазоне от 0oC до +100oC, предпочтительно от +20oC до +80oC.
Омыление в общем осуществляют в температурном диапазоне от 0oC до +100oC, предпочтительно от +20oC до +80oC.
В общем омыление осуществляют при атмосферном давлении. Можно, однако, также работать при пониженном или повышенном давлении (например, от 0,5 до 5 бар).
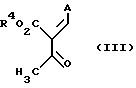
Соединения общей формулы (II) можно получать, например, путем взаимодействия соединений общей формулы (III)
где E и R4 имеют вышеуказанное значение,
с соединениями общей формулы (IV)
где R2, R3 и D имеют вышеуказанное значение,
в среде одного из вышеуказанных органических растворителей, предпочтительно в среде этанола и, в случае необходимости, в присутствии основания.
где E и R4 имеют вышеуказанное значение,
с соединениями общей формулы (IV)
где R2, R3 и D имеют вышеуказанное значение,
в среде одного из вышеуказанных органических растворителей, предпочтительно в среде этанола и, в случае необходимости, в присутствии основания.
В качестве оснований в общем пригодны гидриды или алкоголяты щелочного металла, такие, как, например, гидрид натрия или третбутилат калия, или циклические амины, такие, как, например, пиперидин, диметиламинопиридин или алкиламины с 1-4 атомами углерода, например триэтиламин. Предпочтительными являются пиперидин, диметиламинопиридин, пиридин, гидрид натрия и третбутилат калия.
Основание в общем применяют в количестве 1 - 5 моль, предпочтительно 1 - 2 моль, в пересчете на 1 моль соединения общей формулы (III).
Реакции можно осуществлять как при атмосферном давлении, так и при повышенном или пониженном давлении (например, при 0,5 - 3 бар). В общем работают при атмосферном давлении.
Температуры реакции можно варьировать в широком диапазоне. В общем работают при температурах между +10oC и +150oC, предпочтительно между +20oC и +100oC, в частности при температуре кипения соответствующего растворителя.
Соединения общих формул (III) и (IV) известны или их можно получать широкоизвестными методами.
При применении в качестве лекарственного средства предлагаемые соединения общей формулы (I) преимущественно дают в общих количествах от примерно 0,01 мг/кг до примерно 100 мг/кг, предпочтительно в общем количестве от примерно 1 мг/кг до примерно 50 мг/кг веса тела в сутки, в случае необходимости в виде нескольких отдельных доз, для достижения желаемого результата.
Однако выгодным может быть также отклонение от вышеназванных количеств, а именно в зависимости от вида и веса тела пациента, от индивидуальной реакции на лекарство, вида и серьезности заболевания, вида композиции и аппликации, а также от времени или же промежутка дачи лекарства.
Нижеследующие примеры поясняют получение соединений вышеприведенной формулы (I).
Исходные соединения
Пример I
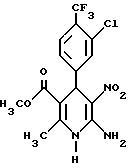
Сложный метиловый эфир 6-амино-4-(3-хлор-4-трифторметилфенил)- 1,4-дигидро-2-метил-5-нитроникотиновой кислоты
15,3 г (50 ммоль) сложного метилового эфира (3-хлор-4- трифторметилбензилиден)ацетуксусной кислоты и 5,2 г (50 ммоль) 2- нитро-1,1-этендиамина растворяют в 80 мл этанола и реакционную смесь нагревают с обратным холодильником в течение 12 часов. После охлаждения получаемое твердое вещество отсасывают и промывают этанолом. Получают 13,0 г (66% теории) целевого соединения.
Пример I
Сложный метиловый эфир 6-амино-4-(3-хлор-4-трифторметилфенил)- 1,4-дигидро-2-метил-5-нитроникотиновой кислоты
15,3 г (50 ммоль) сложного метилового эфира (3-хлор-4- трифторметилбензилиден)ацетуксусной кислоты и 5,2 г (50 ммоль) 2- нитро-1,1-этендиамина растворяют в 80 мл этанола и реакционную смесь нагревают с обратным холодильником в течение 12 часов. После охлаждения получаемое твердое вещество отсасывают и промывают этанолом. Получают 13,0 г (66% теории) целевого соединения.
Т.п.: 250oC
Пример II
Сложный метиловый эфир 6-ацетиламино-4-(3-хлор-4- трифторметилфенил)-1,4-дигидро-2-метил-5-нитроникотиновой кислоты
4,0 г (12,0 ммоль) соединения примера 1 растворяют в 40 мл ацетангидрида и нагревают с обратным холодильником в течение 12 часов. Затем ацетангидрид отгоняют при пониженном давлении, остаток растворяют в дихлорметане и промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу сушат над сульфатом магния, сгущают и остаток очищают путем хроматографии на силикагеле с применением в качестве элюента смеси толуола, этилового эфира уксусной кислоты и изопропанола в соотношении 100: 10:1. Элюат сгущают и перекристаллизуют из этанола. Получают 0,5 г (11% теории) целевого соединения.
Пример II
Сложный метиловый эфир 6-ацетиламино-4-(3-хлор-4- трифторметилфенил)-1,4-дигидро-2-метил-5-нитроникотиновой кислоты
4,0 г (12,0 ммоль) соединения примера 1 растворяют в 40 мл ацетангидрида и нагревают с обратным холодильником в течение 12 часов. Затем ацетангидрид отгоняют при пониженном давлении, остаток растворяют в дихлорметане и промывают насыщенным водным раствором бикарбоната натрия. Органическую фазу сушат над сульфатом магния, сгущают и остаток очищают путем хроматографии на силикагеле с применением в качестве элюента смеси толуола, этилового эфира уксусной кислоты и изопропанола в соотношении 100: 10:1. Элюат сгущают и перекристаллизуют из этанола. Получают 0,5 г (11% теории) целевого соединения.
Т.п.: 152oC
Пример III
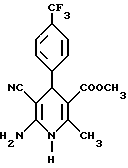
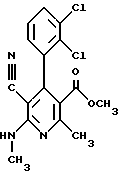
Сложный метиловый эфир 6-амино-5-циано-2-метил-4- (трифторметилфенил)-1,4-дигидропиридин-3-карбоновой кислоты
13,6 г (50 ммоль) сложного метилового эфира 2-ацетил-(4- трифторметил)фенилуксусной кислоты, 7,45 г (50 ммоль) гидрохлорида сложного этилового эфира цианацетимидной кислоты и 15 г (190 ммоль) ацетата аммония в 100 мл метанола нагревают с обратным холодильником в течение часа. После сгущения остаток распределяют между ледяной водой и этиловым эфиром уксусной кислоты. Органическую фазу два раза промывают разбавленным водным раствором бикарбоната натрия и один раз водой, сушат над карбонатом натрия и сгущают в вакууме. В результате кристаллизации остатка (18,4 г) из метанола получают 6,3 г (37% теории) бесцветных кристаллов.
Пример III
Сложный метиловый эфир 6-амино-5-циано-2-метил-4- (трифторметилфенил)-1,4-дигидропиридин-3-карбоновой кислоты
13,6 г (50 ммоль) сложного метилового эфира 2-ацетил-(4- трифторметил)фенилуксусной кислоты, 7,45 г (50 ммоль) гидрохлорида сложного этилового эфира цианацетимидной кислоты и 15 г (190 ммоль) ацетата аммония в 100 мл метанола нагревают с обратным холодильником в течение часа. После сгущения остаток распределяют между ледяной водой и этиловым эфиром уксусной кислоты. Органическую фазу два раза промывают разбавленным водным раствором бикарбоната натрия и один раз водой, сушат над карбонатом натрия и сгущают в вакууме. В результате кристаллизации остатка (18,4 г) из метанола получают 6,3 г (37% теории) бесцветных кристаллов.
Т.п.: 210 - 214oC
Пример IV
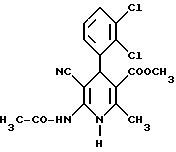
Сложный метиловый эфир 6-ацетамидо-5-циано-4-(2,3-дихлорфенил)-2- метил-1,4-дигидропиридин-3-карбоновой кислоты
6,7 г (20 ммоль) сложного метилового эфира 6-амино-5-циано-4- (2,3-дихлорфенил)-2-метил-1,4-дигидропиридин-3-карбоновой кислоты (получение аналогично примеру III) и 33,5 мл (350 ммоль) ацетангидрида нагревают с обратным холодильником в течение 30 минут. Избыточный ацетангидрид переводят в метилацетат путем взаимодействия с метанолом при перемешивании при 25oC. Реакционный раствор упаривают в вакууме и получаемый остаток дважды очищают толуолом в вакууме. Остаток кипятят вместе с 50 мл толуола, выделившиеся кристаллы фильтруют и промывают толуолом.
Пример IV
Сложный метиловый эфир 6-ацетамидо-5-циано-4-(2,3-дихлорфенил)-2- метил-1,4-дигидропиридин-3-карбоновой кислоты
6,7 г (20 ммоль) сложного метилового эфира 6-амино-5-циано-4- (2,3-дихлорфенил)-2-метил-1,4-дигидропиридин-3-карбоновой кислоты (получение аналогично примеру III) и 33,5 мл (350 ммоль) ацетангидрида нагревают с обратным холодильником в течение 30 минут. Избыточный ацетангидрид переводят в метилацетат путем взаимодействия с метанолом при перемешивании при 25oC. Реакционный раствор упаривают в вакууме и получаемый остаток дважды очищают толуолом в вакууме. Остаток кипятят вместе с 50 мл толуола, выделившиеся кристаллы фильтруют и промывают толуолом.
Выход: 3,6 г (50% теории)
Т.п.: 224oC (разл.)
Пример V
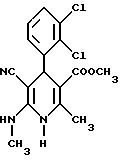
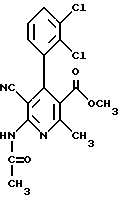
Сложный метиловый эфир 5-циано-4-(2,3-дихлорфенил)-2-метил-6- N-метиламино-1,4-дигидропиридин-3-карбоновой кислоты
2,8 г (10 ммоль) сложного метилового эфира 2-ацетил-(2,3- дихлорфенил)-уксусной кислоты и 1,5 г (10 ммоль) гидрохлорида сложного этилового эфира цианацетимидовой кислоты смешивают с 5 мл (40 ммоль) 33%-ного этанольного раствора метиламина. Смесь нагревается до 46oC. После охлаждения до 30oC к смеси добавляют 2,3 мл (40 ммоль) ледяной уксусной кислоты и затем 20 мл метанола. После нагревания с обратным холодильником в течение 5 часов реакционный раствор смешивают с ледяной водой и экстрагируют этиловым эфиром уксусной кислоты. Органическую фазу сушат над сульфатом натрия, сгущают при пониженном давлении, после чего получают 3,9 г аморфного остатка, который очищают хроматографией на 100 г силикагеля с применением в качестве элюента смеси толуола и этилового эфира уксусной кислоты (используется в качестве градиента).
Т.п.: 224oC (разл.)
Пример V
Сложный метиловый эфир 5-циано-4-(2,3-дихлорфенил)-2-метил-6- N-метиламино-1,4-дигидропиридин-3-карбоновой кислоты
2,8 г (10 ммоль) сложного метилового эфира 2-ацетил-(2,3- дихлорфенил)-уксусной кислоты и 1,5 г (10 ммоль) гидрохлорида сложного этилового эфира цианацетимидовой кислоты смешивают с 5 мл (40 ммоль) 33%-ного этанольного раствора метиламина. Смесь нагревается до 46oC. После охлаждения до 30oC к смеси добавляют 2,3 мл (40 ммоль) ледяной уксусной кислоты и затем 20 мл метанола. После нагревания с обратным холодильником в течение 5 часов реакционный раствор смешивают с ледяной водой и экстрагируют этиловым эфиром уксусной кислоты. Органическую фазу сушат над сульфатом натрия, сгущают при пониженном давлении, после чего получают 3,9 г аморфного остатка, который очищают хроматографией на 100 г силикагеля с применением в качестве элюента смеси толуола и этилового эфира уксусной кислоты (используется в качестве градиента).
Выход: 0,5 г (10% теории) кристаллов
Т.п.: 234 - 239oC
Целевые продукты
Пример 1
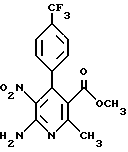
Сложный метиловый эфир 6-амино-2-метил-5-нитро-4-(4- трифторметилфенил)-никотиновой кислоты
2,0 г (5,6 ммоль) сложного метилового эфира 6-амино-2-метил- 5-нитро-4-(4-трифторметил-1,4-дигидро)-никотиновой кислоты (получение аналогично примеру 1) растворяют в 100 мл хлористого метилена и смешивают с 10,0 г осажденной, активной двуокиси марганца. Перемешивают при комнатной температуре в течение 12 часов. Затем реакционную смесь подвергают хроматографии с применением в качестве элюента хлористого метилена. Элюат сгущают и остаток перекристаллизуют из метанола. Получают 1,4 г (70% теории) целевого соединения.
Т.п.: 234 - 239oC
Целевые продукты
Пример 1
Сложный метиловый эфир 6-амино-2-метил-5-нитро-4-(4- трифторметилфенил)-никотиновой кислоты
2,0 г (5,6 ммоль) сложного метилового эфира 6-амино-2-метил- 5-нитро-4-(4-трифторметил-1,4-дигидро)-никотиновой кислоты (получение аналогично примеру 1) растворяют в 100 мл хлористого метилена и смешивают с 10,0 г осажденной, активной двуокиси марганца. Перемешивают при комнатной температуре в течение 12 часов. Затем реакционную смесь подвергают хроматографии с применением в качестве элюента хлористого метилена. Элюат сгущают и остаток перекристаллизуют из метанола. Получают 1,4 г (70% теории) целевого соединения.
Т.п.: 185 - 186oC
Аналогично примеру 1 получают приведенные в таблице 1 соединения.
Аналогично примеру 1 получают приведенные в таблице 1 соединения.
Пример 13
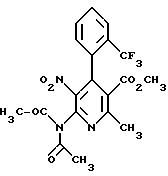
Сложный метиловый эфир 6-N,N-диацетиламино-2- метил-5-нитро-4-(2-трифторметилфенил)-никотиновой кислоты
0,8 г (2,25 ммоль) соединения примера 6 растворяют в 20 мл ацетангидрида и в течение ночи нагревают с обратным холодильником. После отгонки ацетангидрида кристаллический остаток промывают водой и перекристаллизуют из этанола. Получают 250 мг (28% теории) целевого соединения.
Сложный метиловый эфир 6-N,N-диацетиламино-2- метил-5-нитро-4-(2-трифторметилфенил)-никотиновой кислоты
0,8 г (2,25 ммоль) соединения примера 6 растворяют в 20 мл ацетангидрида и в течение ночи нагревают с обратным холодильником. После отгонки ацетангидрида кристаллический остаток промывают водой и перекристаллизуют из этанола. Получают 250 мг (28% теории) целевого соединения.
Т.п.: 113oC
Пример 14
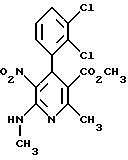
Сложный метиловый эфир 4-(2,3-дихлорфенил)-2- метил-6-N-метиламино- 5-нитро-никотиновой кислоты
0,7 г (2 моль) соединения примера 4 растворяют в 20 мл сухого диметилформамида и смешивают с 70 мг 80%-ного гидрида натрия. После перемешивания при комнатной температуре в течение 3 часов получаемую смесь смешивают с 2,5 мл 1-молярного раствора метилйодида в диметилформамиде и еще раз перемешивают в течение 18 часов при комнатной температуре. После сгущения и хроматографии на силикагеле (этиловый эфир уксусной кислоты и толуол в соотношении 1: 10) получают 0,8 г сырого продукта, который очищают колоночной хроматографией с применением в качестве элюента этилового эфира уксусной кислоты и толуола в соотношении 1: 80.
Пример 14
Сложный метиловый эфир 4-(2,3-дихлорфенил)-2- метил-6-N-метиламино- 5-нитро-никотиновой кислоты
0,7 г (2 моль) соединения примера 4 растворяют в 20 мл сухого диметилформамида и смешивают с 70 мг 80%-ного гидрида натрия. После перемешивания при комнатной температуре в течение 3 часов получаемую смесь смешивают с 2,5 мл 1-молярного раствора метилйодида в диметилформамиде и еще раз перемешивают в течение 18 часов при комнатной температуре. После сгущения и хроматографии на силикагеле (этиловый эфир уксусной кислоты и толуол в соотношении 1: 10) получают 0,8 г сырого продукта, который очищают колоночной хроматографией с применением в качестве элюента этилового эфира уксусной кислоты и толуола в соотношении 1: 80.
Выход: 65 мг (9% теории)
Аналогично примеру 14 получают приведенные в таблице 2 соединения.
Аналогично примеру 14 получают приведенные в таблице 2 соединения.
Пример 20
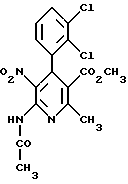
Сложный метиловый эфир 6-N-ацетиламино-4-(2,3-дихлорфенил)- 2-метил-5-нитроникотиновой кислоты
800 мг (2 ммоль) сложного метилового эфира 6-N-ацетиламино-4- (2,3-дихлорфенил)-1,4-дигидро-2-метил-5-нитроникотиновой кислоты (получение аналогично примеру II) растворяют в 80 мл хлористого метилена и смешивают с 5 г двуокиси марганца. Перемешивают 3 дня при комнатной температуре. После фильтрации на силикагеле марки целите, очистки колоночной хроматографией с применением в качестве элюента смеси этилового эфира уксусной кислоты и толуола в соотношении 4: 1 и сгущения получают остаток, который перекристаллизовывают из толуола. Получают 302 мг (38% теории) целевого соединения.
Сложный метиловый эфир 6-N-ацетиламино-4-(2,3-дихлорфенил)- 2-метил-5-нитроникотиновой кислоты
800 мг (2 ммоль) сложного метилового эфира 6-N-ацетиламино-4- (2,3-дихлорфенил)-1,4-дигидро-2-метил-5-нитроникотиновой кислоты (получение аналогично примеру II) растворяют в 80 мл хлористого метилена и смешивают с 5 г двуокиси марганца. Перемешивают 3 дня при комнатной температуре. После фильтрации на силикагеле марки целите, очистки колоночной хроматографией с применением в качестве элюента смеси этилового эфира уксусной кислоты и толуола в соотношении 4: 1 и сгущения получают остаток, который перекристаллизовывают из толуола. Получают 302 мг (38% теории) целевого соединения.
Т.п.: 195oC
Аналогично примеру 20 получают приведенные в таблице 3 соединения.
Аналогично примеру 20 получают приведенные в таблице 3 соединения.
Пример 23
Сложный метиловый эфир 6-амино-5-циано-4-(2,3-дихлорфенил)- 2-метил-никотиновой кислоты
1,0 г (3 ммоль) сложного метилового эфира 6-амино-5-циано-4- (2,3-дихлорфенил)-2-метил-1,4-дигидро-никотиновой кислоты (получение аналогично примеру III) и 2,6 г (30 ммоль) двуокиси марганца в 20 мл хлористого метилена перемешивают в течение 70 часов при комнатной температуре. Растворитель отгоняют в вакууме, остаток смешивают с этиловым эфиром уксусной кислоты и фильтруют на силикагеле. Получают 0,6 г (60% теории) целевого соединения в виде бесцветных кристаллов.
Сложный метиловый эфир 6-амино-5-циано-4-(2,3-дихлорфенил)- 2-метил-никотиновой кислоты
1,0 г (3 ммоль) сложного метилового эфира 6-амино-5-циано-4- (2,3-дихлорфенил)-2-метил-1,4-дигидро-никотиновой кислоты (получение аналогично примеру III) и 2,6 г (30 ммоль) двуокиси марганца в 20 мл хлористого метилена перемешивают в течение 70 часов при комнатной температуре. Растворитель отгоняют в вакууме, остаток смешивают с этиловым эфиром уксусной кислоты и фильтруют на силикагеле. Получают 0,6 г (60% теории) целевого соединения в виде бесцветных кристаллов.
Т.п.: 251 - 253oC
Пример 24
Сложный метиловый эфир 6-амино-5-циано-4-(3-нитрофенил)-2-метил- никотиновой кислоты
Целевое соединение получают аналогично примеру 20.
Пример 24
Сложный метиловый эфир 6-амино-5-циано-4-(3-нитрофенил)-2-метил- никотиновой кислоты
Целевое соединение получают аналогично примеру 20.
Rf: 0,19 (толуол и этиловый эфир уксусной кислоты в соотношении 3: 1)
Т.п.: 202 - 205oC
Выход: 80% теории
Аналогично примерам 23, 24 получают приведенные в таблице 4 соединения.
Т.п.: 202 - 205oC
Выход: 80% теории
Аналогично примерам 23, 24 получают приведенные в таблице 4 соединения.
Пример 30
Сложный метиловый эфир 6-ацетамидо-5-циано-4-(2,3- дихлорфенил)-2-метил-1,4-Дигидропиридин-3-карбоновой кислоты
4,3 г (11 ммоль) соединения примера IV подвергают окислению 10,7 г (120 ммоль) двуокиси марганца аналогично примеру 23. Получают 1,4 г (34% теории) целевого соединения.
Сложный метиловый эфир 6-ацетамидо-5-циано-4-(2,3- дихлорфенил)-2-метил-1,4-Дигидропиридин-3-карбоновой кислоты
4,3 г (11 ммоль) соединения примера IV подвергают окислению 10,7 г (120 ммоль) двуокиси марганца аналогично примеру 23. Получают 1,4 г (34% теории) целевого соединения.
Т.п.: 160 - 162oC (этиловый эфир уксусной кислоты)
Аналогично примеру 30 получают приведенные в таблице 5 соединения.
Аналогично примеру 30 получают приведенные в таблице 5 соединения.
Пример 34
Сложный метиловый эфир 5-циано-4-(2,3-дихлорфенил)-2-метил- 6-N-метиламинопиридин-3-карбоновой кислоты
3,5 г (10 ммоль) соединения примера V подвергают окислению 10 г (115 ммоль) двуокиси марганца аналогично примеру 20. Получают 1,7 г (49% теории) целевого соединения.
Сложный метиловый эфир 5-циано-4-(2,3-дихлорфенил)-2-метил- 6-N-метиламинопиридин-3-карбоновой кислоты
3,5 г (10 ммоль) соединения примера V подвергают окислению 10 г (115 ммоль) двуокиси марганца аналогично примеру 20. Получают 1,7 г (49% теории) целевого соединения.
Аналогично примеру 34 получают приведенные в таблице 6 соединения.
Claims (3)
1. Производные 4-арил-6-амино-никотиновой кислоты общей формулы I
где А - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фенил, галоген и трифторметил, или неразветвленной или разветвленной алкилтиогруппой с 1 - 6 атомами углерода, или неразветвленным или разветвленным алкоксилом с 1 - 6 атомами углерода;
D - циано или нитро;
R1 - водород или неразветвленный или разветвленный алкил с 1 - 8 атомами углерода;
R2 и R3 - одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, или неразветвленный или разветвленный ацил с 1 - 6 атомами углерода,
при этом, если А означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил,
и их соли.
где А - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фенил, галоген и трифторметил, или неразветвленной или разветвленной алкилтиогруппой с 1 - 6 атомами углерода, или неразветвленным или разветвленным алкоксилом с 1 - 6 атомами углерода;
D - циано или нитро;
R1 - водород или неразветвленный или разветвленный алкил с 1 - 8 атомами углерода;
R2 и R3 - одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, или неразветвленный или разветвленный ацил с 1 - 6 атомами углерода,
при этом, если А означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил,
и их соли.
2. Производные 4-арил-6-амино-никотиновой кислоты общей формулы I по п. 1, где А - фенил, незамещенный или замещенный 1 - 3 одинаковыми или различными остатками из группы, включающей нитро, циано, фтор, хлор, бром, йод, фенил и трифтометил, или неразветвленной или разветвленной алкилтиогруппой с 1 - 4 атомами углерода, или неразветвленным или разветвленным алкоксилом с 1 - 4 атомами углерода, D - циано или нитро, R1 - водород или неразветвленный или разветвленный алкил с 1 - 6 атомами углерода, R2 и R3 - одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, или неразветвленный или разветвленный ацил с 1 - 4 атомами углерода, при этом, если А означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилом или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил, и их соли.
3. Производные 4-арил-6-амино-никотиновой кислоты общей формулы I по п. 1, где А - фенил, незамещенный или замещенный 1 - 2 одинаковыми или различными остатками из группы, включающей нитро, циано, фтор, хлор, бром, йод, фенил, трифторметил, метокси и метилтио, D - циано или нитро, R1 - водород или неразветвленный или разветвленный алкил с 1 - 4 атомами углерода, R2 и R3 - одинаковы или различны и означают водород или неразветвленный или разветвленный алкил с 1 - 3 атомами углерода, или неразветвленный или разветвленный ацил с 1 - 3 атомами углерода, при этом, если А означает фенил, незамещенный или замещенный в положении 4 хлором, метоксилои или нитрогруппой, D - циано и R2 и R3 одинаковы и означают водород, то радикал R1 не означает этил, и их соли.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE4430638A DE4430638A1 (de) | 1994-08-29 | 1994-08-29 | Verwendung von substituierten 4-Phenyl-6-amino-nicotinsäurederivaten als Arzneimittel |
| DEP4430638.5 | 1994-08-29 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU95114449A RU95114449A (ru) | 1997-08-10 |
| RU2154635C2 true RU2154635C2 (ru) | 2000-08-20 |
Family
ID=6526833
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU95114449/04A RU2154635C2 (ru) | 1994-08-29 | 1995-08-28 | Производные 4-арил-6-амино-никотиновой кислоты и их соли |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US5670525A (ru) |
| EP (1) | EP0705820A1 (ru) |
| JP (1) | JPH0867670A (ru) |
| KR (1) | KR960007565A (ru) |
| CN (1) | CN1127114A (ru) |
| AU (1) | AU697552B2 (ru) |
| CA (1) | CA2156961A1 (ru) |
| CZ (1) | CZ219895A3 (ru) |
| DE (1) | DE4430638A1 (ru) |
| EE (1) | EE9500059A (ru) |
| FI (1) | FI954007A7 (ru) |
| HU (1) | HUT74618A (ru) |
| IL (1) | IL115072A (ru) |
| NO (1) | NO308287B1 (ru) |
| NZ (1) | NZ272851A (ru) |
| PL (1) | PL310145A1 (ru) |
| RU (1) | RU2154635C2 (ru) |
| SK (1) | SK106595A3 (ru) |
| TW (1) | TW419464B (ru) |
| ZA (1) | ZA957187B (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2278858C2 (ru) * | 2000-11-30 | 2006-06-27 | Санофи-Авентис Дойчланд Гмбх | Бис-арильные соединения, фармацевтическая композиция на их основе и применение |
| RU2315757C2 (ru) * | 2001-12-11 | 2008-01-27 | Байер ХельсКер АГ | Замещенные 2-тио-3,5-дициано-4-фенил-6-аминопиридины и лекарственное средство на их основе |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1999024830A1 (en) * | 1997-11-10 | 1999-05-20 | Bristol-Myers Squibb Company | Method for diagnosing alzheimer's disease |
| DE10060807A1 (de) * | 2000-12-07 | 2002-06-20 | Aventis Pharma Gmbh | Ortho, ortho-substituierte stickstoffhaltige Bisarylverbindungen, Verfahren zu ihrer Herstellung, ihre Verwendung als Medikament sowie sie enthaltende pharmazeutische Zubereitungen |
| DE10110747A1 (de) * | 2001-03-07 | 2002-09-12 | Bayer Ag | Substituierte 2,6-Diamino-3,5-dicyano-4-aryl-pyridine und ihre Verwendung |
| DE10115945A1 (de) * | 2001-03-30 | 2002-10-02 | Bayer Ag | Substituierte 2-Carba-3,5-dicyano-4-aryl-6-aminopyridine und ihre Verwendung |
| US20050075359A1 (en) * | 2003-03-14 | 2005-04-07 | Rikako Kono | Large conductance calcium-activated K channel opener |
| EP1858853A2 (en) * | 2005-02-24 | 2007-11-28 | Janssen Pharmaceutica N.V. | Novel pyridine derivatives as potassium ion channel openers |
| DE102006042143A1 (de) * | 2006-09-08 | 2008-03-27 | Bayer Healthcare Aktiengesellschaft | Neue substituierte Bipyridin-Derivate und ihre Verwendung |
| DE102006056740A1 (de) * | 2006-12-01 | 2008-06-05 | Bayer Healthcare Ag | Cyclisch substituierte 3,5-Dicyano-2-thiopyridine und ihre Verwendung |
| DE102006056739A1 (de) * | 2006-12-01 | 2008-06-05 | Bayer Healthcare Ag | Substituierte 4-Amino-3,5-dicyano-2-thiopyridine und ihre Verwendung |
| DE102007035367A1 (de) * | 2007-07-27 | 2009-01-29 | Bayer Healthcare Ag | Substituierte Aryloxazole und ihre Verwendung |
| DE102007036076A1 (de) | 2007-08-01 | 2009-02-05 | Bayer Healthcare Aktiengesellschaft | Dipeptoid-Produgs und ihre Verwendung |
| DE102007061763A1 (de) * | 2007-12-20 | 2009-06-25 | Bayer Healthcare Ag | Substituierte azabicyclische Verbindungen und ihre Verwendung |
| DE102007061764A1 (de) * | 2007-12-20 | 2009-06-25 | Bayer Healthcare Ag | Anellierte Cyanopyridine und ihre Verwendung |
| DE102008013587A1 (de) * | 2008-03-11 | 2009-09-17 | Bayer Schering Pharma Aktiengesellschaft | Heteroaryl-substituierte Dicyanopyridine und ihre Verwendung |
| CA2726020C (en) * | 2008-05-29 | 2016-08-16 | Bayer Schering Pharma Aktiengesellschaft | 2-alkoxy-substituted dicyanopyridines and use thereof |
| DE102008062567A1 (de) | 2008-12-16 | 2010-06-17 | Bayer Schering Pharma Aktiengesellschaft | Dipeptoid-Prodrugs und ihre Verwendung |
| DE102009006602A1 (de) * | 2009-01-29 | 2010-08-05 | Bayer Schering Pharma Aktiengesellschaft | Alkylamino-substituierte Dicyanopyridine und deren Aminosäureester-Prodrugs |
| DE102010030688A1 (de) | 2010-06-30 | 2012-01-05 | Bayer Schering Pharma Aktiengesellschaft | Substituierte Dicyanopyridine und ihre Verwendung |
| US20120058983A1 (en) | 2010-09-02 | 2012-03-08 | Bayer Pharma Aktiengesellschaft | Adenosine A1 agonists for the treatment of glaucoma and ocular hypertension |
| BR112013006272A2 (pt) * | 2010-09-17 | 2019-09-24 | Purdue Pharma Lp | compostos de piridina e seus usos |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0088940A1 (de) * | 1982-03-13 | 1983-09-21 | Bayer Ag | Pyridincarbonsäureester, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Arzneimittel |
| EP0282904A2 (en) * | 1987-03-13 | 1988-09-21 | Boehringer Mannheim Italia S.P.A. | 2-Thiomethyl-substituted-pyridines, a method for their preparation and pharmaceutical compositions containing them |
-
1994
- 1994-08-29 DE DE4430638A patent/DE4430638A1/de not_active Withdrawn
-
1995
- 1995-07-20 TW TW084107499A patent/TW419464B/zh active
- 1995-08-16 EP EP95112833A patent/EP0705820A1/de not_active Withdrawn
- 1995-08-22 US US08/517,873 patent/US5670525A/en not_active Expired - Fee Related
- 1995-08-23 PL PL95310145A patent/PL310145A1/xx unknown
- 1995-08-23 AU AU30205/95A patent/AU697552B2/en not_active Ceased
- 1995-08-24 JP JP7237915A patent/JPH0867670A/ja active Pending
- 1995-08-25 IL IL11507295A patent/IL115072A/xx not_active IP Right Cessation
- 1995-08-25 NZ NZ272851A patent/NZ272851A/en unknown
- 1995-08-25 CN CN95116625A patent/CN1127114A/zh active Pending
- 1995-08-25 FI FI954007A patent/FI954007A7/fi unknown
- 1995-08-25 CA CA002156961A patent/CA2156961A1/en not_active Abandoned
- 1995-08-28 NO NO953367A patent/NO308287B1/no not_active IP Right Cessation
- 1995-08-28 CZ CZ952198A patent/CZ219895A3/cs unknown
- 1995-08-28 RU RU95114449/04A patent/RU2154635C2/ru active
- 1995-08-28 KR KR1019950026840A patent/KR960007565A/ko not_active Ceased
- 1995-08-28 ZA ZA957187A patent/ZA957187B/xx unknown
- 1995-08-28 EE EE9500059A patent/EE9500059A/xx unknown
- 1995-08-28 HU HU9502520A patent/HUT74618A/hu unknown
- 1995-08-28 SK SK1065-95A patent/SK106595A3/sk unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0088940A1 (de) * | 1982-03-13 | 1983-09-21 | Bayer Ag | Pyridincarbonsäureester, Verfahren zu ihrer Herstellung sowie ihre Verwendung als Arzneimittel |
| EP0282904A2 (en) * | 1987-03-13 | 1988-09-21 | Boehringer Mannheim Italia S.P.A. | 2-Thiomethyl-substituted-pyridines, a method for their preparation and pharmaceutical compositions containing them |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2278858C2 (ru) * | 2000-11-30 | 2006-06-27 | Санофи-Авентис Дойчланд Гмбх | Бис-арильные соединения, фармацевтическая композиция на их основе и применение |
| RU2315757C2 (ru) * | 2001-12-11 | 2008-01-27 | Байер ХельсКер АГ | Замещенные 2-тио-3,5-дициано-4-фенил-6-аминопиридины и лекарственное средство на их основе |
| RU2315757C9 (ru) * | 2001-12-11 | 2008-10-27 | Байер ХельсКер АГ | Замещенные 2-тио-3,5-дициано-4-фенил-6-аминопиридины и лекарственное средство на их основе |
Also Published As
| Publication number | Publication date |
|---|---|
| CZ219895A3 (en) | 1996-03-13 |
| FI954007L (fi) | 1996-03-01 |
| IL115072A (en) | 1999-12-31 |
| KR960007565A (ko) | 1996-03-22 |
| NZ272851A (en) | 1997-07-27 |
| CA2156961A1 (en) | 1996-03-01 |
| FI954007A0 (fi) | 1995-08-25 |
| CN1127114A (zh) | 1996-07-24 |
| EE9500059A (et) | 1996-04-15 |
| SK106595A3 (en) | 1997-01-08 |
| NO308287B1 (no) | 2000-08-28 |
| NO953367L (no) | 1996-03-01 |
| AU3020595A (en) | 1996-03-14 |
| HU9502520D0 (en) | 1995-10-30 |
| NO953367D0 (no) | 1995-08-28 |
| ZA957187B (en) | 1996-04-17 |
| US5670525A (en) | 1997-09-23 |
| DE4430638A1 (de) | 1996-03-07 |
| AU697552B2 (en) | 1998-10-08 |
| JPH0867670A (ja) | 1996-03-12 |
| EP0705820A1 (de) | 1996-04-10 |
| TW419464B (en) | 2001-01-21 |
| IL115072A0 (en) | 1995-12-08 |
| HUT74618A (en) | 1997-01-28 |
| FI954007A7 (fi) | 1996-03-01 |
| PL310145A1 (en) | 1996-03-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2154635C2 (ru) | Производные 4-арил-6-амино-никотиновой кислоты и их соли | |
| JP3992666B2 (ja) | カルボン酸誘導体 | |
| DE3834204C2 (ru) | ||
| US4590189A (en) | Condensed pyrrolinone derivatives, their production and use | |
| DE69110828T2 (de) | Heterozyklische Aminderivate, deren Herstellung und deren Verwendung. | |
| HU203238B (en) | Process for producing antiinflammatory tricyclic oxindole derivatives | |
| MX2012005189A (es) | Inhibidores de ire-1-alfa. | |
| DE69103630T2 (de) | Oxazolederivate, ihre herstellung und diese enthaltende pharmazeutischen zubereitungen. | |
| RU2158259C2 (ru) | Производные 1-алкил-3,5-диацил-1,4-дигидропиридина в форме смеси их изомеров | |
| CA2437215A1 (en) | Dihydropyrazolopyridine compounds and pharmaceutical use thereof | |
| JPH033658B2 (ru) | ||
| SE466656B (sv) | Nya mellanprodukter anvaendbara foer framstaellning av 4-hydroxi-3-kinolinkarboxylsyraderivat | |
| RU2155765C2 (ru) | Производные 1,4-дигидропиридина с циклическим мостиком в положениях 1,2 в форме смеси их изомеров | |
| JPH07252260A (ja) | 新規チエノチアジン誘導体、その製造方法及びその使用方法 | |
| US4906757A (en) | Process for the preparation of dextrorotatory 3-(3-pyridyl)-1H,3H-pyrrolo [1,2-c]-7-thiazolecarboxylic acid | |
| JPH0710863B2 (ja) | エーテル化若しくはエステル化しうるジヒドロキシ基により位置2で置換された4―ohキノリンカルボン酸の新規の誘導体、その製造方法、及び医薬としてのその使用 | |
| WO2007062677A1 (en) | Thiazolyl- and pyrimidinyl-acetic acids and their use as crth2 receptor ligands | |
| US4735951A (en) | Novel 4-hydroxy-3-quinoline-carboxylates having analgesic and anti-inflammatory activity | |
| EP0511021A1 (en) | Novel thiazole derivatives | |
| JP2967231B2 (ja) | 1,4―チアジン誘導体 | |
| NO881899L (no) | Nye 2-aminoalkyl-4-benzyl-1-(2h)-ftalazino-derivater. | |
| RU2155748C2 (ru) | Производные циклогексадиена, смесь их изомеров или отдельные изомеры и их соли и фармацевтическая композиция с избирательным модулирующим действием на зависимые от кальция калиевые канальцы высокой проводимости | |
| US4124596A (en) | Thienothienylcarbonyl-phenylalkanoic acids and derivatives thereof | |
| US4183944A (en) | Thienothienylcarbonyl-phenylalkanoic acids and derivatives thereof | |
| EP0079740A1 (en) | Anthraniloyloxyalkanoates |