RU2011115077A - Пептидные антибиотики и способы их получения - Google Patents
Пептидные антибиотики и способы их получения Download PDFInfo
- Publication number
- RU2011115077A RU2011115077A RU2011115077/04A RU2011115077A RU2011115077A RU 2011115077 A RU2011115077 A RU 2011115077A RU 2011115077/04 A RU2011115077/04 A RU 2011115077/04A RU 2011115077 A RU2011115077 A RU 2011115077A RU 2011115077 A RU2011115077 A RU 2011115077A
- Authority
- RU
- Russia
- Prior art keywords
- peptide
- dab
- alkyl
- compound
- thr
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0815—Tripeptides with the first amino acid being basic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06086—Dipeptides with the first amino acid being basic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/50—Cyclic peptides containing at least one abnormal peptide link
- C07K7/54—Cyclic peptides containing at least one abnormal peptide link with at least one abnormal peptide link in the ring
- C07K7/60—Cyclic peptides containing at least one abnormal peptide link with at least one abnormal peptide link in the ring the cyclisation occurring through the 4-amino group of 2,4-diamino-butanoic acid
- C07K7/62—Polymyxins; Related peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/64—Cyclic peptides containing only normal peptide links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Abstract
1. Способ получения деацилированного защищенного пептида формулы (А2) ! ! где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; ! x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и ! Р представляет собой защитную группу; ! включающий: ! (а) обработку пептида формулы: !! реагентом для защиты аминогруппы, с образованием защищенного пептида, где: ! Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; ! Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода; ! R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и ! x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; ! и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и ! (b) обработку защищенного пептида деацилирующим реагентом с образованием защищенного деацилированного пептида А2. ! 2. Способ по п.1, в котором Y1, Y2 и Y3, каждый независимо выбирают из остатка 2,4-диаминобутановой кислоты, треонинового остатка и серинового остатка. ! 3. Способ по п.1, в котором Т выбирают из 6-метилоктаноила, 6-метилгептаноила, октаноила, гептаноила, нонаноила и 3-гидрокси-6-метилоктаноила. ! 4. Способ по п.1, в котором пептид на стадии (а) представляет собой [Ile7]-полимиксин В1. ! 5. Способ по п.1, в котором по меньшей мере один кислотный заместитель выбирают из карбокси, карбоксилата, сульфо, сульфата, фосфата, фосфоната и их солей. ! 6. Способ по п.1, в котором защитная группа включает арил или гетероарил, замещенный, по меньшей мере, о�
Claims (57)
1. Способ получения деацилированного защищенного пептида формулы (А2)
где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу;
включающий:
(а) обработку пептида формулы:
реагентом для защиты аминогруппы, с образованием защищенного пептида, где:
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и
(b) обработку защищенного пептида деацилирующим реагентом с образованием защищенного деацилированного пептида А2.
2. Способ по п.1, в котором Y1, Y2 и Y3, каждый независимо выбирают из остатка 2,4-диаминобутановой кислоты, треонинового остатка и серинового остатка.
3. Способ по п.1, в котором Т выбирают из 6-метилоктаноила, 6-метилгептаноила, октаноила, гептаноила, нонаноила и 3-гидрокси-6-метилоктаноила.
4. Способ по п.1, в котором пептид на стадии (а) представляет собой [Ile7]-полимиксин В1.
5. Способ по п.1, в котором по меньшей мере один кислотный заместитель выбирают из карбокси, карбоксилата, сульфо, сульфата, фосфата, фосфоната и их солей.
6. Способ по п.1, в котором защитная группа включает арил или гетероарил, замещенный, по меньшей мере, одним кислотным заместителем.
7. Способ по п.6, в котором по меньшей мере один кислотный заместитель выбирают из карбокси, карбоксилата, сульфо, сульфата, фосфата, фосфоната и их солей.
8. Способ по п.1, в котором защитная группа представляет собой сульфоновую кислоту 9-флуоренилметоксикарбонила.
9. Способ по п.8, в котором защитная группа представляет собой 2-сульфо-9-флуоренилметоксикарбонил.
10. Способ по п.1, в котором каждую аминогруппу пептида на стадии(а) защищают защитной группой.
11. Способ по п.1, в котором деацилирующий агент представляет собой фермент.
12. Способ по п.1, в котором источник фермента представляет собой Actinoplanes utahensis.
13. Способ по п.1, дополнительно включающий:
(с) образование из деацилированного защищенного пептида формулы А2 соединений, имеющих следующую формулу:
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу, содержащую по крайней мере один кислотный заместитель.
14. Способ по п.13, в котором образование соединений включает обработку защищенного пептида реагентом, имеющим формулу А-LG, где LG представляет собой уходящую группу.
15. Способ по п.13, в котором образование соединений включает обработку защищенного пептида реагентом, выбранным из изоцианата, тиоизоцианата, лактона, активированного гетероцикла, активированого гетероарила, имидата, кетенамина, альдегида и восстанавливающего агента и кетона и восстанавливающего агента.
16. Способ по п.13, в котором образование соединений включает обработку защищенного пептида ацилирующим реагентом, выбранным из ацилгалогенидов, ацилцианидов, сложных эфиров, лактонов и ангидридов.
17. Способ по п.13, в котором образование соединений включает обработку защищенного пептида сульфонирующим реагентом, выбранным из сульфонилхлорида и активированных сульфонамидов.
18. Способ по п.13, в котором образование соединений включает проведение реакции гидролиза N-концевой аминокислоты защищенного деацилированного пептида, так что х представляет собой 0, и каждый из y и z представляет собой 1.
19. Способ по п.18, в котором образование соединений включает проведение реакции гидролиза второй N-концевой аминокислоты защищенного деацилированного пептида, так что каждый из х и y представляет собой 0, и z представляет собой 1.
20. Способ по п.18, в котором образование соединений включает проведение реакции гидролиза третьей N-концевой аминокислоты защищенного деацилированного пептида, так что каждый из х, y и z представляет собой 0.
21. Способ получения деацилированного защищенного пептида формулы (А2)
где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу;
включающий:
(а) обработку пептида формулы:
реагентом для защиты аминогруппы, с образованием водорастворимого защищенного пептида, где:
Y1, Y2 и Y3, каждый независимо выбирают из аминокислотных остатков;
Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и
(b) обработку защищенного пептида деацилирующим реагентом с образованием защищенного деацилированного пептида А2.
22. Соединение, имеющее структуру формулы (II):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу, содержащую по крайней мере один кислотный заместитель.
23. Соединение по п.22, в котором Р представляет собой 9-флуоренилметоксикарбонильную группу, замещенную, по меньшей мере, одним кислотным заместителем.
24. Соединение по п.22, в котором Р представляет собой 2-сульфо-9-флуоренилметоксикарбонил.
28. Соединение по п.22, в котором каждый из х, y и z представляет собой 0, и А представляет собой водород.
29. Соединение по п.22, где соединение представляет собой пролекарство.
30. Водорастворимое соединение, имеющее структуру формулы (II):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу.
31. Соединение формулы (2):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1, при условии, что:
1) А не содержит по меньшей мере одного аминокислотного остатка; и
2) если каждый из x, y и z независимо представляет собой 1, Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и А представляет собой R'-(C=O), то R' не является разветвленным С8-алкилом.
32. Соединение по любому из пп.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой фенил.
33. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой н-С9-алкил.
34. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой алкил, замещенный группой, выбранной из N-(C1-10-алкил)-4-аминофенила и бензилоксигруппы.
35. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=O), и R' выбирают из н-С8-алкила, замещенного 3-индолильной группой С2-алкила, циклогексила, незамещенного фенила, бензила, 4'-бифенила и фенила, замещенного группой, выбранной из 4-С10-алкила, 4'-фенилокси и 4-хлор.
36. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=S), и R' представляет собой фенил.
37. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' выбирают из фенила, 4-пиридинила и алкила, замещенного 2-нафтилоксигруппой.
38. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-SO2-, и R' представляет собой 4-метилфенил.
39. Соединение по п.25 или 31, в котором х представляет собой 0, каждый из y и z представляет собой 1, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=O), и R' представляет собой н-C8-алкил.
40. Соединение по п.25 или 31, в котором х представляет собой 0, каждый из y и z представляет собой 1, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=S), и R' представляет собой фенил.
41. Соединение по п.25 или 31, в котором каждый из х и y представляет собой 0, z представляет собой 1, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=O), и R' представляет собой н-C9-алкил.
42. Соединение по п.25 или 31, в котором Y1 представляет собой глицин, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и где А представляет собой R'-SO2-, и R' представляет собой н-C10-алкил.
43. Соединение по п.25 или 31, в котором Y1 представляет собой лизин, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и где А представляет собой R'-(C=O), и R' представляет собой н-C9-алкил.
44. Соединение по п.25 или 31, в котором Y1 представляет собой фенилаланин, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и где А представляет собой R'-(C=O), и R' представляет собой н-C9-алкил.
45. Соединение формулы (2):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1, при условии, что если каждый их х, y и z независимо представляет собой 1, Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и А представляет собой R'-(C=O)-, то R' не является разветвленным С8-алкилом.
46. Соединение по п.25 или 45, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой Nα-(н-С9-алканоил)фенилаланин.
47. Применение соединения по любому из пп.22-46 для получения или производства лекарственного средства для лечения инфекции у субъекта.
48. Способ получения промежуточного соединения для применения при синтезе нового пептидного антибиотика, включающий стадии:
(а) защиты аминогрупп [Ile7]-полимиксина В1 с помощью (2-сульфо)-9-флуоренилметокси-карбонила или другого кислотного производного 9-флуоренилметоксикарбонила;
(b) обработки продукта реакции со стадии (а) деацилазой с получением защищенного пептидного промежуточного соединения; и
(с) использования модифицированного способа разложения Эдмана или пептидазной ферментативной реакции для получения другого защищенного промежуточного за счет уменьшения числа аминокислот в боковой цепи защищенного пептидного промежуточного соединения; и
(d) очистки защищенного пептидного промежуточного соединения с помощью хроматографии.
49. Кислотные защищенные пептидные промежуточные соединения, полученные из соответствующего защищенного [Ile7]-полимиксина В1, которые можно использовать для синтеза новых пептидных антибиотиков или их пролекарств, где защитная группа представляет собой (2-сульфо)-9-Fmoc, и защищенные пептидные промежуточные соединения имеют структуру:
50. Антибактериальное соединение или защищенное соединение, полученное из химически защищенной формы ILпептидов:
Производные ILпептида
** РАРА представляет собой п-аминофенилацетил
Все аминокислоты представляют собой L-изомеры, если не указано другого.
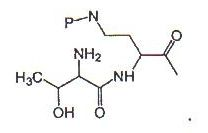
51. Антибиотик, полученный из промежуточного соединения, которое представляет собой химически защищенную форму пептида, полученного из [Ile7]-полимиксина В1, где указанный антибиотик имеет циклическое гептапептидное ядро [Ile7]-полимиксина В1, и указанный антибиотик выбирают из группы, состоящей из следующих соединений или их соответствующих солей:
где для случая 1:
А = R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, где R' представляет собой алкил, циклоалкил, алкенил, арил, гетероарил или гетероциклический остаток, и Х1 представляет собой L-Dab или другую аминокислоту; и
Х2 представляет собой L-Thr или другую аминокислоту; и
Х3 представляет собой L-Dab или другую аминокислоту;
для случая 2:
«А» является таким же, как описано для случая 1;
Х2 представляет собой L-Thr или другую аминокислоту; и
Х3 представляет собой L-Dab или другую аминокислоту;
для случая 3:
«А» является таким же, как описано для случая 1;
Х3 представляет собой L-Dab или другую аминокислоту;
для случая 4:
«А» является таким же, как описано для случая 1, при условии, что если А=R'-(C=O), то R' не является алкилом, замещенным аминогруппой, замещенной ацилом.
52. Аналоги пептидного антибиотика, имеющие следующую структуру и минимальные ингибирующие концентрации:
MIC*
** РАРА = п-аминофенилацетил
53. Соединение по п.25 или 31, в котором R' представляет собой арил.
54. Соединение по п.53, в котором R' представляет собой фенил.
55. Способ получения соединения формулы (II):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу, содержащую по крайней мере один кислотный заместитель;
включающий:
(а) обработку пептида формулы:
реагентом для защиты аминогруппы, с образованием защищенного пептида, где:
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и
(b) обработку защищенного пептида деацилирующим реагентом, где деацилирующий агент представляет собой фермент, с образованием деацилированного защищенного пептида формулы А2:
где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
(с) обработку защищенного деацилированного пептида А2 реагентом, имеющим формулу А-LG, где LG представляет собой уходящую группу, с образованием соединения формулы (II).
56. Способ по п.55, в котором защищенный пептид является водорастворимым.
57. Применение соединения по любому из пп.50-54 для получения или производства лекарственного средства для лечения инфекции у субъекта.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/881,160 | 2004-07-01 | ||
| US10/881,160 US20060004185A1 (en) | 2004-07-01 | 2004-07-01 | Peptide antibiotics and peptide intermediates for their prepartion |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007103811/04A Division RU2428429C2 (ru) | 2004-07-01 | 2005-07-01 | Пептидные антибиотики и способы их получения |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2011115077A true RU2011115077A (ru) | 2012-10-20 |
Family
ID=35514884
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007103811/04A RU2428429C2 (ru) | 2004-07-01 | 2005-07-01 | Пептидные антибиотики и способы их получения |
| RU2011115077/04A RU2011115077A (ru) | 2004-07-01 | 2011-04-15 | Пептидные антибиотики и способы их получения |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007103811/04A RU2428429C2 (ru) | 2004-07-01 | 2005-07-01 | Пептидные антибиотики и способы их получения |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US20060004185A1 (ru) |
| EP (2) | EP1761554A2 (ru) |
| JP (2) | JP2008505858A (ru) |
| KR (1) | KR20070047770A (ru) |
| CN (1) | CN101010336A (ru) |
| AU (1) | AU2005326770B2 (ru) |
| BR (1) | BRPI0512941A (ru) |
| CA (1) | CA2571944A1 (ru) |
| IL (1) | IL180458A0 (ru) |
| MX (1) | MXPA06015239A (ru) |
| NO (1) | NO20070563L (ru) |
| NZ (2) | NZ552730A (ru) |
| RU (2) | RU2428429C2 (ru) |
| WO (1) | WO2006083317A2 (ru) |
| ZA (1) | ZA200610818B (ru) |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060004185A1 (en) | 2004-07-01 | 2006-01-05 | Leese Richard A | Peptide antibiotics and peptide intermediates for their prepartion |
| SK287315B6 (sk) * | 2006-06-02 | 2010-06-07 | Biotika, A. S. | Spôsob izolácie polymyxínu B z vyfermentovanej pôdy |
| US7807637B2 (en) | 2006-08-11 | 2010-10-05 | Northern Antibiotics Oy | Polymyxin derivatives and uses thereof |
| PL2057185T3 (pl) * | 2006-08-11 | 2016-09-30 | Pochodne polimyksyny i ich zastosowania | |
| US8329645B2 (en) * | 2008-02-08 | 2012-12-11 | Northern Antibiotics Ltd. | Polymyxin derivatives and uses thereof |
| US9096649B2 (en) | 2008-02-08 | 2015-08-04 | Northern Antibiotics Ltd. | Polymyxin derivatives and uses thereof |
| US8193148B2 (en) | 2008-02-08 | 2012-06-05 | Northern Antibiotics Ltd. | Short fatty acid tail polymyxin derivatives and uses thereof |
| FI20085469A0 (fi) * | 2008-02-08 | 2008-05-16 | Northern Antibiotics Oy | Polymyksiinijohdannaiset, joissa on lyhyt rasvahappohäntä, ja niiden käyttöjä |
| PL2261238T3 (pl) * | 2008-03-14 | 2014-10-31 | Astellas Pharma Inc | Związek cykliczny i jego sól |
| CA2747995A1 (en) * | 2008-12-23 | 2010-07-01 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
| WO2010130007A1 (en) * | 2009-05-14 | 2010-11-18 | Monash University | Antimicrobial compounds |
| ES2374779B1 (es) * | 2010-03-10 | 2012-12-27 | Universidad De Barcelona | Compuestos péptidicos útiles como agentes antibacterianos. |
| US8415307B1 (en) | 2010-06-23 | 2013-04-09 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
| WO2012051663A1 (en) * | 2010-10-21 | 2012-04-26 | Monash University | Antimicrobial compounds |
| WO2012168820A1 (en) * | 2011-06-08 | 2012-12-13 | Pfizer Inc. | Polymyxin derivatives useful as antibacterial agents |
| SG11201402390PA (en) | 2011-11-18 | 2014-06-27 | Novacta Biosystems Ltd | Polymyxin derivatives |
| EP2679236A1 (de) | 2012-06-29 | 2014-01-01 | Zentrum für biomedizinische Technologie der Donau- Universität Krems | Dosierungsanleitung für endotoxinbindende Lipopeptide |
| HRP20220898T1 (hr) | 2013-05-22 | 2022-10-14 | Spero Therapeutics, Inc. | Derivati polimiksina i njihova upotreba u kombinacijskoj terapiji zajedno s različitim antibioticima |
| CN103396475B (zh) * | 2013-08-06 | 2015-08-26 | 深圳翰宇药业股份有限公司 | 一种纯固相合成多肽类抗生素Colistin的方法 |
| JP6754997B2 (ja) | 2013-08-26 | 2020-09-16 | 国立大学法人 東京大学 | 大環状ペプチド、その製造方法、及び大環状ペプチドライブラリを用いるスクリーニング方法 |
| TWI709575B (zh) * | 2014-03-11 | 2020-11-11 | 美商斯佩羅治療學股份有限公司 | 多黏菌素衍生物以及其與不同抗生素一起之組合療法的用途 |
| WO2015149131A1 (en) | 2014-04-01 | 2015-10-08 | Monash University | Polymyxin derivatives as antimicrobial compounds |
| CN103993059B (zh) * | 2014-05-28 | 2016-08-17 | 河北圣雪大成制药有限责任公司 | 优化多粘芽孢杆菌发酵液中e1和e2组分比例的方法 |
| WO2016050764A1 (en) * | 2014-09-29 | 2016-04-07 | Technische Universität Darmstadt | Method for peptide synthesis and apparatus for carrying out a method for solid phase synthesis of peptides |
| GB2530776A (en) * | 2014-10-01 | 2016-04-06 | Randox Lab Ltd | Detection of polymyxins |
| CN107257803B (zh) * | 2014-12-16 | 2021-02-05 | 上海盟科药业股份有限公司 | 用于治疗细菌感染的多粘菌素类抗菌剂 |
| JO3669B1 (ar) * | 2015-01-06 | 2020-08-27 | Ferring Bv | بيبتيدات مضَادَّة لببتيد المرتبط بجين الكالسيتونين |
| FI126143B (en) | 2015-01-15 | 2016-07-15 | Northern Antibiotics Oy | Polymyxine derivative and its uses |
| US9763996B2 (en) | 2015-01-16 | 2017-09-19 | Northern Antibiotics, Ltd. | Polymyxin derivative and uses thereof |
| JP7367950B2 (ja) * | 2015-09-29 | 2023-10-24 | モナッシュ ユニバーシティ | 抗菌性ポリミキシン誘導体化合物 |
| US10369190B2 (en) | 2016-09-13 | 2019-08-06 | Allergan, Inc. | Non-protein clostridial toxin compositions |
| EP3556769B1 (en) * | 2016-12-16 | 2023-06-14 | Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences | Polymyxin derivative, preparation method and application thereof |
| CN106868079B (zh) * | 2017-04-26 | 2020-12-08 | 山东鲁抗医药股份有限公司 | 发酵硫酸多粘菌素b用培养基及发酵生产硫酸多粘菌素b的方法 |
| CN111527100A (zh) * | 2017-11-02 | 2020-08-11 | 昆士兰大学 | 肽类抗生素 |
| US11819532B2 (en) | 2018-04-23 | 2023-11-21 | Hoffmann-La Roche Inc. | Peptide macrocycles against Acinetobacter baumannii |
| KR20210054500A (ko) | 2018-06-25 | 2021-05-13 | 스페로 테라퓨틱스, 인코퍼레이티드 | 화합물 |
| WO2021150792A1 (en) | 2020-01-21 | 2021-07-29 | Micurx Pharmaceuticals, Inc. | Novel compounds and composition for targeted therapy of kidney-associated cancers |
| CN111410682A (zh) * | 2020-04-28 | 2020-07-14 | 梯尔希(南京)药物研发有限公司 | 多粘菌素b相关化合物的环化制备方法 |
| CN113174398B (zh) * | 2021-04-22 | 2022-04-29 | 浙江工业大学 | 一种用于重组表达棘白菌素b脱酰基酶的表达盒及应用 |
| CN113215185B (zh) * | 2021-04-22 | 2022-04-29 | 浙江工业大学 | 一种用于重组表达棘白菌素b脱酰基酶的重组基因序列 |
Family Cites Families (119)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3854480A (en) | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US3753970A (en) | 1970-08-04 | 1973-08-21 | Rhone Poulenc Sa | Cyclopeptides derived from polymyxins and their preparation |
| FR2124060B1 (ru) * | 1971-02-02 | 1974-04-12 | Rhone Poulenc Sa | |
| US4091092A (en) * | 1976-09-20 | 1978-05-23 | E. R. Squibb & Sons, Inc. | Polymyxin F and process of producing polymyxin F |
| US5366734A (en) | 1981-02-16 | 1994-11-22 | Zeneca Limited | Continuous release pharmaceutical compositions |
| IE52535B1 (en) * | 1981-02-16 | 1987-12-09 | Ici Plc | Continuous release pharmaceutical compositions |
| IE55221B1 (en) * | 1982-02-27 | 1990-07-04 | Beecham Group Plc | Antibacterial 1-normon-2-yl-heterocyclic compounds |
| ATE37983T1 (de) * | 1982-04-22 | 1988-11-15 | Ici Plc | Mittel mit verzoegerter freigabe. |
| USRE32311E (en) | 1982-05-21 | 1986-12-16 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| US4537717A (en) * | 1982-05-21 | 1985-08-27 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| US4482487A (en) | 1982-05-21 | 1984-11-13 | Eli Lilly And Company | A-21978C cyclic peptides |
| US4399067A (en) * | 1982-05-21 | 1983-08-16 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| USRE32310E (en) | 1982-05-21 | 1986-12-16 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| US4524135A (en) * | 1982-05-21 | 1985-06-18 | Eli Lilly And Company | A-21978C cyclic peptides |
| GB2128617A (en) * | 1982-10-06 | 1984-05-02 | Martti Vaara | Polypeptides for use in antibacterial therapy |
| US4452775A (en) * | 1982-12-03 | 1984-06-05 | Syntex (U.S.A.) Inc. | Cholesterol matrix delivery system for sustained release of macromolecules |
| US4601893A (en) * | 1984-02-08 | 1986-07-22 | Pfizer Inc. | Laminate device for controlled and prolonged release of substances to an ambient environment and method of use |
| US4895566A (en) * | 1986-07-25 | 1990-01-23 | C. R. Bard, Inc. | Coating medical devices with cationic antibiotics |
| JPH075483B2 (ja) * | 1986-08-07 | 1995-01-25 | メディツェ・ケム−ファ−ム・ファブリク・プッタ−・ゲ−エンベ−ハ−・ウント・ツェ−オ−・ケ−ゲ− | 医薬製剤 |
| US4830860A (en) * | 1986-10-30 | 1989-05-16 | Pfizer Inc. | Stressed polymeric device for controlled release of a substance to an ambient environment |
| US5755788A (en) * | 1987-02-19 | 1998-05-26 | Rutgers, The State University | Prosthesis and implants having liposomes bound thereto and methods of preparation |
| US20010021697A1 (en) * | 1987-09-14 | 2001-09-13 | Henning Lowenstein | Methods and compositions for the treatment of mammalian infections employing medicaments comprising hymenoptera venom, proteinageous or polypeptide components thereof, or analogues of such proteinaceous or polypeptide components |
| US5028590A (en) * | 1988-04-11 | 1991-07-02 | Eli Lilly And Company | Derivatives of A54145 cyclic peptides |
| US5039789A (en) * | 1988-04-11 | 1991-08-13 | Eli Lilly And Company | A54145 cyclic peptides |
| US5254535A (en) * | 1989-04-17 | 1993-10-19 | The Children's Hospital Of Pennsylvania | Composition and treatment with biologically active peptides and antibiotic |
| US5112614A (en) * | 1989-09-14 | 1992-05-12 | Alza Corporation | Implantable delivery dispenser |
| US5459237A (en) * | 1990-02-08 | 1995-10-17 | Magainin Pharmaceuticals Inc. | Peptide compositions and uses therefor |
| JPH04167172A (ja) | 1990-10-31 | 1992-06-15 | Nec Corp | ベクトルプロセッサ |
| US5082653A (en) * | 1990-10-31 | 1992-01-21 | Warner-Lambert Company | Anti-plaque compositions comprising a combination of morpholinoamino alcohol and antibiotic |
| US5686065A (en) * | 1991-03-27 | 1997-11-11 | Special Advanced Biomaterials, Inc. | Topical siloxane sunscreen compositions having enhanced performance and safety |
| WO1992017195A1 (en) * | 1991-04-08 | 1992-10-15 | Magainin Pharmaceuticals, Inc. | Novel peptide compositions and uses therefor |
| AU665030B2 (en) | 1991-09-13 | 1995-12-14 | Magainin Pharmaceuticals, Inc. | Biologically active amphiphilic peptide compositions and uses therefor |
| TW274552B (ru) * | 1992-05-26 | 1996-04-21 | Hoechst Ag | |
| US6348445B1 (en) * | 1992-06-01 | 2002-02-19 | Magainin Pharmaceuticals, Inc. | Biologically active peptides with reduced toxicity in animals and a method for preparing same |
| US5283005A (en) * | 1992-10-08 | 1994-02-01 | Olin Corporation | Synergistic biocide combination for industrial fluids |
| US5424290A (en) * | 1992-10-26 | 1995-06-13 | Magainin Pharmaceuticals Inc. | Biologically active peptides and uses therefor |
| US5360788A (en) | 1992-11-10 | 1994-11-01 | Olin Corporation | Personal care composition containing pyrithione and a basic lipopeptide |
| US5370876A (en) * | 1993-01-08 | 1994-12-06 | Microbarriers | Antimicrobial protective skin composition and method for protecting skin from body fluids |
| US5654451B1 (en) * | 1993-01-14 | 2000-02-22 | Magainin Pharma | Amino acids and peptides having modified c-terminals and modified n-terminals |
| CA2112776C (en) * | 1993-01-21 | 2002-11-12 | Masakazu Tsuchiya | Process for inhibiting activity of endotoxin |
| US5652332A (en) | 1993-03-12 | 1997-07-29 | Xoma | Biologically active peptides from functional domains of bactericidal/permeability-increasing protein and uses thereof |
| US5733872A (en) * | 1993-03-12 | 1998-03-31 | Xoma Corporation | Biologically active peptides from functional domains of bactericidal/permeability-increasing protein and uses thereof |
| US20040023884A1 (en) * | 1993-03-12 | 2004-02-05 | Xoma Corporation | Biologically active peptides from functional domains of bactericidal/permeability-increasing protein and uses thereof |
| US6180134B1 (en) * | 1993-03-23 | 2001-01-30 | Sequus Pharmaceuticals, Inc. | Enhanced ciruclation effector composition and method |
| US5635216A (en) * | 1993-12-16 | 1997-06-03 | Eli Lilly And Company | Microparticle compositions containing peptides, and methods for the preparation thereof |
| WO1995005384A1 (en) | 1993-08-13 | 1995-02-23 | Smithkline Beecham Plc | Derivatives of monic acids a and c having antibacterial, antimycoplasmatical, antifungal and herbicidal activity |
| US5587358A (en) * | 1994-05-09 | 1996-12-24 | Asahi Kasei Kogyo Kabushiki Kaisha | Potentiators of antimicrobial activity |
| FR2735983B1 (fr) * | 1995-06-29 | 1997-12-05 | Centre Nat Rech Scient | Peptide permettant de modifier l'activite du systeme immunitaire humain ou animal |
| US5849761A (en) | 1995-09-12 | 1998-12-15 | Regents Of The University Of California | Peripherally active anti-hyperalgesic opiates |
| US20020150964A1 (en) * | 1995-12-19 | 2002-10-17 | Centre National De La Recherche Scientifique | Peptides for the activation of the immune system in humans and animals |
| US6011008A (en) * | 1997-01-08 | 2000-01-04 | Yissum Research Developement Company Of The Hebrew University Of Jerusalem | Conjugates of biologically active substances |
| US6004573A (en) | 1997-10-03 | 1999-12-21 | Macromed, Inc. | Biodegradable low molecular weight triblock poly(lactide-co-glycolide) polyethylene glycol copolymers having reverse thermal gelation properties |
| US6846478B1 (en) * | 1998-02-27 | 2005-01-25 | The Procter & Gamble Company | Promoting whole body health |
| US6350438B1 (en) * | 1998-02-27 | 2002-02-26 | The Procter & Gamble Company | Oral care compositions comprising chlorite and methods |
| US6350738B1 (en) * | 1998-03-06 | 2002-02-26 | Brigham Young University | Steroid derived antibiotics |
| US6767904B2 (en) * | 1998-03-06 | 2004-07-27 | Bringham Young University | Steroid derived antibiotics |
| JP4184607B2 (ja) * | 1998-09-25 | 2008-11-19 | キュービスト ファーマシューティカルズ, インコーポレイテッド | 抗生剤の投与方法 |
| IT1308180B1 (it) * | 1999-02-12 | 2001-12-07 | Chiesi Farma Spa | Peptidi sintetici aventi la capacita' di diminuire la tensionesuperficiale e loro impiego nella preparazione di un surfattante |
| US6964948B2 (en) * | 1999-06-25 | 2005-11-15 | Xoma Technology Ltd. | Therapeutic peptide-based constructs derived from Domain II of bactericidal/permeability-increasing protein |
| US6515104B1 (en) * | 1999-06-25 | 2003-02-04 | Xoma Technology Ltd. | Therapeutic peptide-based constructs derived from domain II of bactericidal/permeability-increasing protein |
| BR0012481A (pt) * | 1999-07-15 | 2002-04-02 | Lilly Co Eli | Processo para desacilação de lipodepsipeptìdeos |
| US6380356B1 (en) * | 1999-12-07 | 2002-04-30 | Advanced Medicine, Inc. | Multivalent polymyxin antibiotics |
| KR20020063228A (ko) | 1999-12-15 | 2002-08-01 | 큐비스트 파마슈티컬즈 인코포레이티드 | 항균제로서 리포펩티드 |
| CN1425025A (zh) | 1999-12-15 | 2003-06-18 | 卡比斯特制药公司 | 作为抗菌剂的新颖的脂肽 |
| EP1240182A2 (en) | 1999-12-15 | 2002-09-18 | Cubist Pharmaceuticals, Inc. | Daptomycin analogs and their use as antibacterial agents |
| US7074392B1 (en) * | 2000-03-27 | 2006-07-11 | Taro Pharmaceutical Industries Limited | Controllled delivery system of antifungal and keratolytic agents for local treatment of fungal infections |
| JP3292723B2 (ja) * | 2000-05-26 | 2002-06-17 | アルス電子株式会社 | 半導体パッケージ及びその製造方法 |
| AU2001267181A1 (en) * | 2000-05-30 | 2001-12-11 | Viridis Biotech Inc. | Polyubiquitin based hydrogel and uses thereof |
| CN1287803C (zh) * | 2000-06-30 | 2006-12-06 | 宝洁公司 | 促进全身健康的局部口腔组合物及其应用 |
| AU7893301A (en) * | 2000-07-17 | 2002-01-30 | Intrabiotics Pharmaceuticals | Antimicrobial sulfonamide derivatives of lipopeptide antibiotics |
| US6511962B1 (en) * | 2000-07-17 | 2003-01-28 | Micrologix Biotech Inc. | Derivatives of laspartomycin and preparation and use thereof |
| IL156942A0 (en) | 2001-01-16 | 2004-02-08 | Univ Ramot | Compounds, pharmaceutical compositions and methods for treatment of bacteremia and/or septicemia |
| KR20030072614A (ko) * | 2001-01-31 | 2003-09-15 | 화이자 프로덕츠 인크. | Pde4 이소자임 억제제로 유용한 티아졸릴-,옥사졸릴-, 피롤릴- 및 이미다졸릴-산 아미드 유도체 |
| WO2002074316A1 (en) * | 2001-03-15 | 2002-09-26 | Enteron Pharmaceuticals, Inc. | Method of treating inflammatory disorders of the gastrointestinal tract using topical active corticosteroids |
| CN100352836C (zh) | 2001-08-06 | 2007-12-05 | 卡比斯特制药公司 | 新颖的缩肽和制备它们的方法 |
| US6681765B2 (en) | 2001-12-18 | 2004-01-27 | Sheree H. Wen | Antiviral and antibacterial respirator mask |
| US7345018B2 (en) * | 2002-04-25 | 2008-03-18 | Reception Aps | Method of treating side effects induced by therapeutic agents |
| EP1360961A1 (en) | 2002-05-07 | 2003-11-12 | AM-Pharma B.V. | Use of antimicrobial peptides for potentiating the activity of antimicrobial agents |
| US6767718B2 (en) | 2002-05-10 | 2004-07-27 | Biosource Pharm, Inc. | Lipodepsipeptide antibiotics and methods of preparation |
| WO2004014322A2 (en) * | 2002-08-12 | 2004-02-19 | Dynavax Technologies Corporation | Immunomodulatory compositions, methods of making, and methods of use thereof |
| US20040037895A1 (en) * | 2002-08-23 | 2004-02-26 | Alex Zhu | Methods of treating involuntary facial spasms and facial wrinkles |
| US7871607B2 (en) | 2003-03-05 | 2011-01-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminoglycanases |
| US20060104968A1 (en) * | 2003-03-05 | 2006-05-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminogly ycanases |
| US20090123367A1 (en) * | 2003-03-05 | 2009-05-14 | Delfmems | Soluble Glycosaminoglycanases and Methods of Preparing and Using Soluble Glycosaminoglycanases |
| WO2004101017A2 (de) * | 2003-05-16 | 2004-11-25 | Blue Membranes Gmbh | Biokompatibel beschichtete medizinische implantate |
| NZ546344A (en) | 2003-09-30 | 2010-04-30 | Terry Hicks | Compositions and methods for treating burns |
| EP1691852A2 (en) | 2003-11-10 | 2006-08-23 | Angiotech International AG | Medical implants and fibrosis-inducing agents |
| US7364747B1 (en) * | 2004-02-02 | 2008-04-29 | S.S. Steiner, Inc. | Process and product for inhibiting or preventing bacterial infections |
| US20060004185A1 (en) | 2004-07-01 | 2006-01-05 | Leese Richard A | Peptide antibiotics and peptide intermediates for their prepartion |
| WO2006024741A2 (fr) * | 2004-07-30 | 2006-03-09 | Palumed S.A. | Molecules hybrides qa ou q est une aminoquinoleine et a est un residu antibiotique, leur synthese et leurs utilisations en tant qu'agent antibacterien |
| US7541046B1 (en) * | 2005-01-04 | 2009-06-02 | Gp Medical, Inc. | Nanoparticles for protein drug delivery |
| US20060195183A1 (en) * | 2005-02-18 | 2006-08-31 | The Cleveland Clinic Foundation | Apparatus and methods for replacing a cardiac valve |
| EP1893131A1 (en) | 2005-04-20 | 2008-03-05 | The Cleveland Clinic Foundation | Apparatus and method for replacing a cardiac valve |
| CA2615467A1 (en) * | 2005-07-15 | 2007-01-25 | The Cleveland Clinic Foundation | Apparatus and method for remodeling a cardiac valve annulus |
| US20070299043A1 (en) | 2005-10-03 | 2007-12-27 | Hunter William L | Anti-scarring drug combinations and use thereof |
| US20070196421A1 (en) * | 2005-10-03 | 2007-08-23 | Hunter William L | Soft tissue implants and drug combination compositions, and use thereof |
| WO2007041584A2 (en) * | 2005-10-03 | 2007-04-12 | Combinatorx, Incorporated | Implantable sensors, implantable pumps, and anti-scarring drug combinations |
| WO2007041593A2 (en) * | 2005-10-03 | 2007-04-12 | Combinatorx, Incorporated | Anti-scarring drug combinations and use thereof |
| KR100750658B1 (ko) * | 2005-12-09 | 2007-08-20 | 한국생명공학연구원 | 폴리믹신 생합성 효소 및 이를 코딩하는 유전자 군 |
| WO2007089864A2 (en) * | 2006-01-30 | 2007-08-09 | Angiotech Pharmaceuticals, Inc. | Sutures and fibrosing agents |
| US20090264342A1 (en) * | 2006-02-13 | 2009-10-22 | Trustees Of Boston University | Compositions and methods for antibiotic potentiation and drug discovery |
| US20070203080A1 (en) * | 2006-02-15 | 2007-08-30 | The Regents Of The University Of California | New Drug Delivery System for Crossing the Blood Brain Barrier |
| WO2007100663A2 (en) * | 2006-02-22 | 2007-09-07 | University Of Kansas | Polyamines and their use as antibacterial and sensitizing agents |
| US8585753B2 (en) * | 2006-03-04 | 2013-11-19 | John James Scanlon | Fibrillated biodegradable prosthesis |
| US20070243275A1 (en) * | 2006-04-13 | 2007-10-18 | Gilbard Jeffrey P | Methods and compositions for the treatment of infection or infectious colonization of the eyelid, ocular surface, skin or ear |
| US8652201B2 (en) * | 2006-04-26 | 2014-02-18 | The Cleveland Clinic Foundation | Apparatus and method for treating cardiovascular diseases |
| WO2007133944A2 (en) * | 2006-05-09 | 2007-11-22 | Emisphere Technologies, Inc. | Topical administration of acyclovir |
| JP2009545588A (ja) | 2006-08-03 | 2009-12-24 | プロセンサ テクノロジーズ ビー.ブイ. | 抗生物質組成物 |
| PL2057185T3 (pl) | 2006-08-11 | 2016-09-30 | Pochodne polimyksyny i ich zastosowania | |
| US7807637B2 (en) | 2006-08-11 | 2010-10-05 | Northern Antibiotics Oy | Polymyxin derivatives and uses thereof |
| WO2008076806A2 (en) * | 2006-12-15 | 2008-06-26 | Trustees Of Boston University | Compositions and methods to potentiate colistin activity |
| JP5559031B2 (ja) * | 2007-04-02 | 2014-07-23 | マウント シナイ スクール オブ メディスン | 抗菌薬耐性株を含む細胞外微生物により引き起こされる感染症をガリウム化合物を用いて予防または治療する方法 |
| US20090048155A1 (en) * | 2007-08-15 | 2009-02-19 | Endacea, Inc. | Methods for preventing and treating tissue injury and sepsis associated with Yersinia pestis infection |
| US20090214601A1 (en) * | 2007-09-28 | 2009-08-27 | Chappa Ralph A | Porous Drug Delivery Devices and Related Methods |
| US20090227018A1 (en) * | 2007-10-25 | 2009-09-10 | Revalesio Corporation | Compositions and methods for modulating cellular membrane-mediated intracellular signal transduction |
| US8193148B2 (en) * | 2008-02-08 | 2012-06-05 | Northern Antibiotics Ltd. | Short fatty acid tail polymyxin derivatives and uses thereof |
| US8329645B2 (en) * | 2008-02-08 | 2012-12-11 | Northern Antibiotics Ltd. | Polymyxin derivatives and uses thereof |
| CA2747995A1 (en) | 2008-12-23 | 2010-07-01 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
| US8415307B1 (en) * | 2010-06-23 | 2013-04-09 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
-
2004
- 2004-07-01 US US10/881,160 patent/US20060004185A1/en active Pending
-
2005
- 2005-07-01 JP JP2007519447A patent/JP2008505858A/ja active Pending
- 2005-07-01 AU AU2005326770A patent/AU2005326770B2/en not_active Ceased
- 2005-07-01 WO PCT/US2005/023343 patent/WO2006083317A2/en active Application Filing
- 2005-07-01 EP EP05856867A patent/EP1761554A2/en not_active Withdrawn
- 2005-07-01 EP EP10184953A patent/EP2332965A1/en not_active Withdrawn
- 2005-07-01 KR KR1020077002649A patent/KR20070047770A/ko not_active Application Discontinuation
- 2005-07-01 CA CA002571944A patent/CA2571944A1/en not_active Abandoned
- 2005-07-01 CN CNA2005800294199A patent/CN101010336A/zh active Pending
- 2005-07-01 US US11/630,847 patent/US8889826B2/en not_active Expired - Fee Related
- 2005-07-01 NZ NZ552730A patent/NZ552730A/en not_active IP Right Cessation
- 2005-07-01 RU RU2007103811/04A patent/RU2428429C2/ru not_active IP Right Cessation
- 2005-07-01 NZ NZ579261A patent/NZ579261A/en not_active IP Right Cessation
- 2005-07-01 MX MXPA06015239A patent/MXPA06015239A/es not_active Application Discontinuation
- 2005-07-01 BR BRPI0512941-9A patent/BRPI0512941A/pt not_active IP Right Cessation
-
2006
- 2006-12-21 ZA ZA200610818A patent/ZA200610818B/en unknown
- 2006-12-31 IL IL180458A patent/IL180458A0/en unknown
-
2007
- 2007-01-30 NO NO20070563A patent/NO20070563L/no not_active Application Discontinuation
-
2011
- 2011-04-15 RU RU2011115077/04A patent/RU2011115077A/ru not_active Application Discontinuation
- 2011-08-01 JP JP2011168634A patent/JP2011256189A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| KR20070047770A (ko) | 2007-05-07 |
| CA2571944A1 (en) | 2006-08-10 |
| AU2005326770B2 (en) | 2011-11-03 |
| EP1761554A2 (en) | 2007-03-14 |
| JP2011256189A (ja) | 2011-12-22 |
| CN101010336A (zh) | 2007-08-01 |
| WO2006083317A3 (en) | 2007-01-18 |
| RU2007103811A (ru) | 2008-08-10 |
| US8889826B2 (en) | 2014-11-18 |
| BRPI0512941A (pt) | 2007-10-30 |
| ZA200610818B (en) | 2008-07-30 |
| NO20070563L (no) | 2007-03-27 |
| US20060004185A1 (en) | 2006-01-05 |
| NZ579261A (en) | 2011-02-25 |
| EP2332965A1 (en) | 2011-06-15 |
| MXPA06015239A (es) | 2007-12-10 |
| WO2006083317A2 (en) | 2006-08-10 |
| JP2008505858A (ja) | 2008-02-28 |
| IL180458A0 (en) | 2007-06-03 |
| RU2428429C2 (ru) | 2011-09-10 |
| NZ552730A (en) | 2009-09-25 |
| WO2006083317A9 (en) | 2007-03-01 |
| AU2005326770A1 (en) | 2006-08-10 |
| US20080207874A1 (en) | 2008-08-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2011115077A (ru) | Пептидные антибиотики и способы их получения | |
| ES2264523T3 (es) | Inhibidores dipeptidos selectivos de calicreina. | |
| ES2576685T3 (es) | Compuestos antimicrobianos | |
| Lejczak et al. | Antibacterial activity of phosphono dipeptides related to alafosfalin | |
| CA2437983A1 (en) | Transporters comprising spaced arginine moieties | |
| JP2013511554A5 (ru) | ||
| JP2011523415A5 (ru) | ||
| CN110582506A (zh) | 新抗菌产品 | |
| CA2954653C (en) | N-(hydrophobe-substituted)vancosaminyl [.psi.[c(=nh)nh]tpg4]vancomycin and [.psi.[ch2nh]tpg4]vancomycin | |
| US6767718B2 (en) | Lipodepsipeptide antibiotics and methods of preparation | |
| ES2283107T3 (es) | Glicopeptidos modificados en n1. | |
| Dahiya et al. | First total synthesis and biological evaluation of halolitoralin A | |
| RU2184114C2 (ru) | Новые производные бензоксазиндиона и лекарственный препарат на их основе | |
| WO2013073998A2 (ru) | Новые производные гемина с антибактериальной и противовирусной активностью | |
| HRP20050242B1 (en) | Synthetic peptides containing unnatural adamantane related amino acids for use as antitumour drugs | |
| Jiménez-Andreu et al. | Synthesis and biological activity of dehydrophos derivatives | |
| CA2471723A1 (en) | Intermediates for lhrh antagonist synthesis, process for their production, and process for lhrh antagonist production | |
| JP2008100930A (ja) | エラスターゼ阻害剤 | |
| EP1049481B1 (en) | Synthetic antineoplastic agents derived from dolastatin 15 and methods of making same | |
| Green et al. | Substrate related O, O-dialkyldipeptidyly ψ carboxybenzylphosphonates, a new type of thrombin inhibitor | |
| Zhu | Design and Synthesis of 16-Membered Cyclopeptides Active Against Vancomycin-resistant Enterococci (VRE) | |
| JPH02209865A (ja) | 3―チオプロピオン酸誘導体の製造法 | |
| Li | Studies toward the synthesis of coibamide A and analogues | |
| IT201600098005A1 (it) | Analoghi e derivati di amminoacidi dicarbossilici come antibatterici | |
| JP2010270061A (ja) | ペプチド誘導体又はその塩の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| FA93 | Acknowledgement of application withdrawn (no request for examination) |
Effective date: 20140616 |