RU2011115077A - Пептидные антибиотики и способы их получения - Google Patents
Пептидные антибиотики и способы их получения Download PDFInfo
- Publication number
- RU2011115077A RU2011115077A RU2011115077/04A RU2011115077A RU2011115077A RU 2011115077 A RU2011115077 A RU 2011115077A RU 2011115077/04 A RU2011115077/04 A RU 2011115077/04A RU 2011115077 A RU2011115077 A RU 2011115077A RU 2011115077 A RU2011115077 A RU 2011115077A
- Authority
- RU
- Russia
- Prior art keywords
- peptide
- dab
- alkyl
- compound
- thr
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/08—Tripeptides
- C07K5/0815—Tripeptides with the first amino acid being basic
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K5/00—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof
- C07K5/04—Peptides containing up to four amino acids in a fully defined sequence; Derivatives thereof containing only normal peptide links
- C07K5/06—Dipeptides
- C07K5/06086—Dipeptides with the first amino acid being basic
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/50—Cyclic peptides containing at least one abnormal peptide link
- C07K7/54—Cyclic peptides containing at least one abnormal peptide link with at least one abnormal peptide link in the ring
- C07K7/60—Cyclic peptides containing at least one abnormal peptide link with at least one abnormal peptide link in the ring the cyclisation occurring through the 4-amino group of 2,4-diamino-butanoic acid
- C07K7/62—Polymyxins; Related peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/64—Cyclic peptides containing only normal peptide links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Abstract
1. Способ получения деацилированного защищенного пептида формулы (А2) ! ! где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; ! x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и ! Р представляет собой защитную группу; ! включающий: ! (а) обработку пептида формулы: !! реагентом для защиты аминогруппы, с образованием защищенного пептида, где: ! Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; ! Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода; ! R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и ! x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; ! и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и ! (b) обработку защищенного пептида деацилирующим реагентом с образованием защищенного деацилированного пептида А2. ! 2. Способ по п.1, в котором Y1, Y2 и Y3, каждый независимо выбирают из остатка 2,4-диаминобутановой кислоты, треонинового остатка и серинового остатка. ! 3. Способ по п.1, в котором Т выбирают из 6-метилоктаноила, 6-метилгептаноила, октаноила, гептаноила, нонаноила и 3-гидрокси-6-метилоктаноила. ! 4. Способ по п.1, в котором пептид на стадии (а) представляет собой [Ile7]-полимиксин В1. ! 5. Способ по п.1, в котором по меньшей мере один кислотный заместитель выбирают из карбокси, карбоксилата, сульфо, сульфата, фосфата, фосфоната и их солей. ! 6. Способ по п.1, в котором защитная группа включает арил или гетероарил, замещенный, по меньшей мере, о�
Claims (57)
1. Способ получения деацилированного защищенного пептида формулы (А2)
где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу;
включающий:
(а) обработку пептида формулы:
реагентом для защиты аминогруппы, с образованием защищенного пептида, где:
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и
(b) обработку защищенного пептида деацилирующим реагентом с образованием защищенного деацилированного пептида А2.
2. Способ по п.1, в котором Y1, Y2 и Y3, каждый независимо выбирают из остатка 2,4-диаминобутановой кислоты, треонинового остатка и серинового остатка.
3. Способ по п.1, в котором Т выбирают из 6-метилоктаноила, 6-метилгептаноила, октаноила, гептаноила, нонаноила и 3-гидрокси-6-метилоктаноила.
4. Способ по п.1, в котором пептид на стадии (а) представляет собой [Ile7]-полимиксин В1.
5. Способ по п.1, в котором по меньшей мере один кислотный заместитель выбирают из карбокси, карбоксилата, сульфо, сульфата, фосфата, фосфоната и их солей.
6. Способ по п.1, в котором защитная группа включает арил или гетероарил, замещенный, по меньшей мере, одним кислотным заместителем.
7. Способ по п.6, в котором по меньшей мере один кислотный заместитель выбирают из карбокси, карбоксилата, сульфо, сульфата, фосфата, фосфоната и их солей.
8. Способ по п.1, в котором защитная группа представляет собой сульфоновую кислоту 9-флуоренилметоксикарбонила.
9. Способ по п.8, в котором защитная группа представляет собой 2-сульфо-9-флуоренилметоксикарбонил.
10. Способ по п.1, в котором каждую аминогруппу пептида на стадии(а) защищают защитной группой.
11. Способ по п.1, в котором деацилирующий агент представляет собой фермент.
12. Способ по п.1, в котором источник фермента представляет собой Actinoplanes utahensis.
13. Способ по п.1, дополнительно включающий:
(с) образование из деацилированного защищенного пептида формулы А2 соединений, имеющих следующую формулу:
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу, содержащую по крайней мере один кислотный заместитель.
14. Способ по п.13, в котором образование соединений включает обработку защищенного пептида реагентом, имеющим формулу А-LG, где LG представляет собой уходящую группу.
15. Способ по п.13, в котором образование соединений включает обработку защищенного пептида реагентом, выбранным из изоцианата, тиоизоцианата, лактона, активированного гетероцикла, активированого гетероарила, имидата, кетенамина, альдегида и восстанавливающего агента и кетона и восстанавливающего агента.
16. Способ по п.13, в котором образование соединений включает обработку защищенного пептида ацилирующим реагентом, выбранным из ацилгалогенидов, ацилцианидов, сложных эфиров, лактонов и ангидридов.
17. Способ по п.13, в котором образование соединений включает обработку защищенного пептида сульфонирующим реагентом, выбранным из сульфонилхлорида и активированных сульфонамидов.
18. Способ по п.13, в котором образование соединений включает проведение реакции гидролиза N-концевой аминокислоты защищенного деацилированного пептида, так что х представляет собой 0, и каждый из y и z представляет собой 1.
19. Способ по п.18, в котором образование соединений включает проведение реакции гидролиза второй N-концевой аминокислоты защищенного деацилированного пептида, так что каждый из х и y представляет собой 0, и z представляет собой 1.
20. Способ по п.18, в котором образование соединений включает проведение реакции гидролиза третьей N-концевой аминокислоты защищенного деацилированного пептида, так что каждый из х, y и z представляет собой 0.
21. Способ получения деацилированного защищенного пептида формулы (А2)
где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу;
включающий:
(а) обработку пептида формулы:
реагентом для защиты аминогруппы, с образованием водорастворимого защищенного пептида, где:
Y1, Y2 и Y3, каждый независимо выбирают из аминокислотных остатков;
Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и
(b) обработку защищенного пептида деацилирующим реагентом с образованием защищенного деацилированного пептида А2.
22. Соединение, имеющее структуру формулы (II):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу, содержащую по крайней мере один кислотный заместитель.
23. Соединение по п.22, в котором Р представляет собой 9-флуоренилметоксикарбонильную группу, замещенную, по меньшей мере, одним кислотным заместителем.
24. Соединение по п.22, в котором Р представляет собой 2-сульфо-9-флуоренилметоксикарбонил.
28. Соединение по п.22, в котором каждый из х, y и z представляет собой 0, и А представляет собой водород.
29. Соединение по п.22, где соединение представляет собой пролекарство.
30. Водорастворимое соединение, имеющее структуру формулы (II):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу.
31. Соединение формулы (2):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1, при условии, что:
1) А не содержит по меньшей мере одного аминокислотного остатка; и
2) если каждый из x, y и z независимо представляет собой 1, Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и А представляет собой R'-(C=O), то R' не является разветвленным С8-алкилом.
32. Соединение по любому из пп.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой фенил.
33. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой н-С9-алкил.
34. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой алкил, замещенный группой, выбранной из N-(C1-10-алкил)-4-аминофенила и бензилоксигруппы.
35. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=O), и R' выбирают из н-С8-алкила, замещенного 3-индолильной группой С2-алкила, циклогексила, незамещенного фенила, бензила, 4'-бифенила и фенила, замещенного группой, выбранной из 4-С10-алкила, 4'-фенилокси и 4-хлор.
36. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=S), и R' представляет собой фенил.
37. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' выбирают из фенила, 4-пиридинила и алкила, замещенного 2-нафтилоксигруппой.
38. Соединение по п.25 или 31, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-SO2-, и R' представляет собой 4-метилфенил.
39. Соединение по п.25 или 31, в котором х представляет собой 0, каждый из y и z представляет собой 1, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=O), и R' представляет собой н-C8-алкил.
40. Соединение по п.25 или 31, в котором х представляет собой 0, каждый из y и z представляет собой 1, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=S), и R' представляет собой фенил.
41. Соединение по п.25 или 31, в котором каждый из х и y представляет собой 0, z представляет собой 1, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-NH-(C=O), и R' представляет собой н-C9-алкил.
42. Соединение по п.25 или 31, в котором Y1 представляет собой глицин, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и где А представляет собой R'-SO2-, и R' представляет собой н-C10-алкил.
43. Соединение по п.25 или 31, в котором Y1 представляет собой лизин, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и где А представляет собой R'-(C=O), и R' представляет собой н-C9-алкил.
44. Соединение по п.25 или 31, в котором Y1 представляет собой фенилаланин, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и где А представляет собой R'-(C=O), и R' представляет собой н-C9-алкил.
45. Соединение формулы (2):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1, при условии, что если каждый их х, y и z независимо представляет собой 1, Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и А представляет собой R'-(C=O)-, то R' не является разветвленным С8-алкилом.
46. Соединение по п.25 или 45, в котором Y1 представляет собой 2,4-диаминобутановую кислоту, Y2 представляет собой треонин, и Y3 представляет собой 2,4-диаминобутановую кислоту, и
где А представляет собой R'-(C=O), и R' представляет собой Nα-(н-С9-алканоил)фенилаланин.
47. Применение соединения по любому из пп.22-46 для получения или производства лекарственного средства для лечения инфекции у субъекта.
48. Способ получения промежуточного соединения для применения при синтезе нового пептидного антибиотика, включающий стадии:
(а) защиты аминогрупп [Ile7]-полимиксина В1 с помощью (2-сульфо)-9-флуоренилметокси-карбонила или другого кислотного производного 9-флуоренилметоксикарбонила;
(b) обработки продукта реакции со стадии (а) деацилазой с получением защищенного пептидного промежуточного соединения; и
(с) использования модифицированного способа разложения Эдмана или пептидазной ферментативной реакции для получения другого защищенного промежуточного за счет уменьшения числа аминокислот в боковой цепи защищенного пептидного промежуточного соединения; и
(d) очистки защищенного пептидного промежуточного соединения с помощью хроматографии.
49. Кислотные защищенные пептидные промежуточные соединения, полученные из соответствующего защищенного [Ile7]-полимиксина В1, которые можно использовать для синтеза новых пептидных антибиотиков или их пролекарств, где защитная группа представляет собой (2-сульфо)-9-Fmoc, и защищенные пептидные промежуточные соединения имеют структуру:
50. Антибактериальное соединение или защищенное соединение, полученное из химически защищенной формы ILпептидов:
Производные ILпептида
** РАРА представляет собой п-аминофенилацетил
Все аминокислоты представляют собой L-изомеры, если не указано другого.
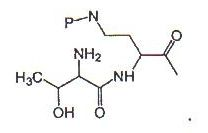
51. Антибиотик, полученный из промежуточного соединения, которое представляет собой химически защищенную форму пептида, полученного из [Ile7]-полимиксина В1, где указанный антибиотик имеет циклическое гептапептидное ядро [Ile7]-полимиксина В1, и указанный антибиотик выбирают из группы, состоящей из следующих соединений или их соответствующих солей:
где для случая 1:
А = R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, где R' представляет собой алкил, циклоалкил, алкенил, арил, гетероарил или гетероциклический остаток, и Х1 представляет собой L-Dab или другую аминокислоту; и
Х2 представляет собой L-Thr или другую аминокислоту; и
Х3 представляет собой L-Dab или другую аминокислоту;
для случая 2:
«А» является таким же, как описано для случая 1;
Х2 представляет собой L-Thr или другую аминокислоту; и
Х3 представляет собой L-Dab или другую аминокислоту;
для случая 3:
«А» является таким же, как описано для случая 1;
Х3 представляет собой L-Dab или другую аминокислоту;
для случая 4:
«А» является таким же, как описано для случая 1, при условии, что если А=R'-(C=O), то R' не является алкилом, замещенным аминогруппой, замещенной ацилом.
52. Аналоги пептидного антибиотика, имеющие следующую структуру и минимальные ингибирующие концентрации:
MIC*
** РАРА = п-аминофенилацетил
53. Соединение по п.25 или 31, в котором R' представляет собой арил.
54. Соединение по п.53, в котором R' представляет собой фенил.
55. Способ получения соединения формулы (II):
где А выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила;
Х1, Х2 и Х3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1; и
Р представляет собой защитную группу, содержащую по крайней мере один кислотный заместитель;
включающий:
(а) обработку пептида формулы:
реагентом для защиты аминогруппы, с образованием защищенного пептида, где:
Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
Т выбирают из R'-(C=O), R'-SO2-, R'-(C=NH)-, R'-NH-(C=S), R'-NH-(C=O)-, R'-NH-(C=NH)-, R'-O-(C=O)-, R'-O-(C=S)-, R'-P(O)OH-, R'-(C=S)-, R'-алкил-, R' и водорода;
R' выбирают из алкила, циклоалкила, алкенила, арила, гетероарила и гетероциклила; и
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
и где пептид включает циклический гептапептид, присоединенный к экзоциклической пептидной цепи, содержащей ацильную группу, и защитная группа содержит, по меньшей мере, один кислотный заместитель; и
(b) обработку защищенного пептида деацилирующим реагентом, где деацилирующий агент представляет собой фермент, с образованием деацилированного защищенного пептида формулы А2:
где Y1, Y2 и Y3, каждый, независимо выбирают из аминокислотных остатков;
x, y и z представляют собой целые числа, независимо выбранные из 0 и 1;
(с) обработку защищенного деацилированного пептида А2 реагентом, имеющим формулу А-LG, где LG представляет собой уходящую группу, с образованием соединения формулы (II).
56. Способ по п.55, в котором защищенный пептид является водорастворимым.
57. Применение соединения по любому из пп.50-54 для получения или производства лекарственного средства для лечения инфекции у субъекта.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/881,160 US20060004185A1 (en) | 2004-07-01 | 2004-07-01 | Peptide antibiotics and peptide intermediates for their prepartion |
| US10/881,160 | 2004-07-01 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007103811/04A Division RU2428429C2 (ru) | 2004-07-01 | 2005-07-01 | Пептидные антибиотики и способы их получения |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| RU2011115077A true RU2011115077A (ru) | 2012-10-20 |
Family
ID=35514884
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007103811/04A RU2428429C2 (ru) | 2004-07-01 | 2005-07-01 | Пептидные антибиотики и способы их получения |
| RU2011115077/04A RU2011115077A (ru) | 2004-07-01 | 2011-04-15 | Пептидные антибиотики и способы их получения |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007103811/04A RU2428429C2 (ru) | 2004-07-01 | 2005-07-01 | Пептидные антибиотики и способы их получения |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US20060004185A1 (ru) |
| EP (2) | EP2332965A1 (ru) |
| JP (2) | JP2008505858A (ru) |
| KR (1) | KR20070047770A (ru) |
| CN (1) | CN101010336A (ru) |
| AU (1) | AU2005326770B2 (ru) |
| BR (1) | BRPI0512941A (ru) |
| CA (1) | CA2571944A1 (ru) |
| IL (1) | IL180458A0 (ru) |
| MX (1) | MXPA06015239A (ru) |
| NO (1) | NO20070563L (ru) |
| NZ (2) | NZ552730A (ru) |
| RU (2) | RU2428429C2 (ru) |
| WO (1) | WO2006083317A2 (ru) |
| ZA (1) | ZA200610818B (ru) |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060004185A1 (en) | 2004-07-01 | 2006-01-05 | Leese Richard A | Peptide antibiotics and peptide intermediates for their prepartion |
| SK287315B6 (sk) * | 2006-06-02 | 2010-06-07 | Biotika, A. S. | Spôsob izolácie polymyxínu B z vyfermentovanej pôdy |
| SI2057185T1 (sl) | 2006-08-11 | 2016-10-28 | Northern Antibiotics Oy | Derivati polimiksina in njihove uporabe |
| US7807637B2 (en) * | 2006-08-11 | 2010-10-05 | Northern Antibiotics Oy | Polymyxin derivatives and uses thereof |
| FI20085469A0 (fi) * | 2008-02-08 | 2008-05-16 | Northern Antibiotics Oy | Polymyksiinijohdannaiset, joissa on lyhyt rasvahappohäntä, ja niiden käyttöjä |
| US9096649B2 (en) | 2008-02-08 | 2015-08-04 | Northern Antibiotics Ltd. | Polymyxin derivatives and uses thereof |
| US8193148B2 (en) * | 2008-02-08 | 2012-06-05 | Northern Antibiotics Ltd. | Short fatty acid tail polymyxin derivatives and uses thereof |
| US8329645B2 (en) * | 2008-02-08 | 2012-12-11 | Northern Antibiotics Ltd. | Polymyxin derivatives and uses thereof |
| PT2261238E (pt) * | 2008-03-14 | 2014-06-09 | Astellas Pharma Inc | Composto cíclico e seu sal |
| CA2747995A1 (en) | 2008-12-23 | 2010-07-01 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
| WO2010130007A1 (en) * | 2009-05-14 | 2010-11-18 | Monash University | Antimicrobial compounds |
| ES2374779B1 (es) * | 2010-03-10 | 2012-12-27 | Universidad De Barcelona | Compuestos péptidicos útiles como agentes antibacterianos. |
| US8415307B1 (en) | 2010-06-23 | 2013-04-09 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
| WO2012051663A1 (en) * | 2010-10-21 | 2012-04-26 | Monash University | Antimicrobial compounds |
| WO2012168820A1 (en) * | 2011-06-08 | 2012-12-13 | Pfizer Inc. | Polymyxin derivatives useful as antibacterial agents |
| JP6185920B2 (ja) | 2011-11-18 | 2017-08-23 | ニュー・ファーマ・ライセンス・ホールディングス・リミテッド | ポリミキシン誘導体 |
| EP2679236A1 (de) | 2012-06-29 | 2014-01-01 | Zentrum für biomedizinische Technologie der Donau- Universität Krems | Dosierungsanleitung für endotoxinbindende Lipopeptide |
| PT2999711T (pt) | 2013-05-22 | 2022-07-29 | Spero Therapeutics Inc | Derivados de polimixina e a sua utilização em terapia de combinação em conjunto com antibióticos diferentes |
| CN103396475B (zh) * | 2013-08-06 | 2015-08-26 | 深圳翰宇药业股份有限公司 | 一种纯固相合成多肽类抗生素Colistin的方法 |
| JP6754997B2 (ja) * | 2013-08-26 | 2020-09-16 | 国立大学法人 東京大学 | 大環状ペプチド、その製造方法、及び大環状ペプチドライブラリを用いるスクリーニング方法 |
| US20170073373A1 (en) * | 2014-03-11 | 2017-03-16 | New Pharma Licence Holdings Limited | Polymyxin derivatives and their use in combination therapy together with different antibiotics |
| AU2015240435B2 (en) * | 2014-04-01 | 2019-09-19 | Monash University | Polymyxin derivatives as antimicrobial compounds |
| CN103993059B (zh) * | 2014-05-28 | 2016-08-17 | 河北圣雪大成制药有限责任公司 | 优化多粘芽孢杆菌发酵液中e1和e2组分比例的方法 |
| EP3201216A1 (en) * | 2014-09-29 | 2017-08-09 | Technische Universität Darmstadt | Method for peptide synthesis and apparatus for carrying out a method for solid phase synthesis of peptides |
| GB2530776A (en) * | 2014-10-01 | 2016-04-06 | Randox Lab Ltd | Detection of polymyxins |
| EP3233889B1 (en) | 2014-12-16 | 2022-07-06 | Shanghai MicuRx Pharmaceutical Co., Ltd. | Antimicrobial polymyxins for treatment of bacterial infections |
| JO3669B1 (ar) * | 2015-01-06 | 2020-08-27 | Ferring Bv | بيبتيدات مضَادَّة لببتيد المرتبط بجين الكالسيتونين |
| FI126143B (en) * | 2015-01-15 | 2016-07-15 | Northern Antibiotics Oy | Polymyxine derivative and its uses |
| US9763996B2 (en) | 2015-01-16 | 2017-09-19 | Northern Antibiotics, Ltd. | Polymyxin derivative and uses thereof |
| CN108350034B (zh) * | 2015-09-29 | 2022-03-11 | 莫纳什大学 | 抗微生物的多黏菌素衍生的化合物 |
| IL308091A (en) | 2016-09-13 | 2023-12-01 | Allergan Inc | Stabilized Clostridium toxin preparations without protein |
| EP3556769B1 (en) * | 2016-12-16 | 2023-06-14 | Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences | Polymyxin derivative, preparation method and application thereof |
| CN106868079B (zh) * | 2017-04-26 | 2020-12-08 | 山东鲁抗医药股份有限公司 | 发酵硫酸多粘菌素b用培养基及发酵生产硫酸多粘菌素b的方法 |
| EP3704135A4 (en) * | 2017-11-02 | 2022-04-27 | The University of Queensland | PEPTIDE ANTIBIOTICS |
| US11819532B2 (en) | 2018-04-23 | 2023-11-21 | Hoffmann-La Roche Inc. | Peptide macrocycles against Acinetobacter baumannii |
| AU2019294261B2 (en) | 2018-06-25 | 2024-02-29 | Spero Therapeutics, Inc. | Compounds |
| WO2021150792A1 (en) | 2020-01-21 | 2021-07-29 | Micurx Pharmaceuticals, Inc. | Novel compounds and composition for targeted therapy of kidney-associated cancers |
| CN111410682A (zh) * | 2020-04-28 | 2020-07-14 | 梯尔希(南京)药物研发有限公司 | 多粘菌素b相关化合物的环化制备方法 |
| CN113215185B (zh) * | 2021-04-22 | 2022-04-29 | 浙江工业大学 | 一种用于重组表达棘白菌素b脱酰基酶的重组基因序列 |
| CN113174398B (zh) * | 2021-04-22 | 2022-04-29 | 浙江工业大学 | 一种用于重组表达棘白菌素b脱酰基酶的表达盒及应用 |
Family Cites Families (119)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3854480A (en) | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US3753970A (en) * | 1970-08-04 | 1973-08-21 | Rhone Poulenc Sa | Cyclopeptides derived from polymyxins and their preparation |
| FR2124060B1 (ru) * | 1971-02-02 | 1974-04-12 | Rhone Poulenc Sa | |
| US4091092A (en) * | 1976-09-20 | 1978-05-23 | E. R. Squibb & Sons, Inc. | Polymyxin F and process of producing polymyxin F |
| US5366734A (en) | 1981-02-16 | 1994-11-22 | Zeneca Limited | Continuous release pharmaceutical compositions |
| IE52535B1 (en) * | 1981-02-16 | 1987-12-09 | Ici Plc | Continuous release pharmaceutical compositions |
| ES8403890A1 (es) * | 1982-02-27 | 1984-04-01 | Beecham Group Plc | Un procedimiento para la preparacion de derivados de 1-normon-2-ilo. |
| EP0092918B1 (en) * | 1982-04-22 | 1988-10-19 | Imperial Chemical Industries Plc | Continuous release formulations |
| USRE32311E (en) | 1982-05-21 | 1986-12-16 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| US4482487A (en) | 1982-05-21 | 1984-11-13 | Eli Lilly And Company | A-21978C cyclic peptides |
| US4537717A (en) * | 1982-05-21 | 1985-08-27 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| USRE32310E (en) | 1982-05-21 | 1986-12-16 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| US4524135A (en) * | 1982-05-21 | 1985-06-18 | Eli Lilly And Company | A-21978C cyclic peptides |
| US4399067A (en) * | 1982-05-21 | 1983-08-16 | Eli Lilly And Company | Derivatives of A-21978C cyclic peptides |
| GB2128617A (en) * | 1982-10-06 | 1984-05-02 | Martti Vaara | Polypeptides for use in antibacterial therapy |
| US4452775A (en) | 1982-12-03 | 1984-06-05 | Syntex (U.S.A.) Inc. | Cholesterol matrix delivery system for sustained release of macromolecules |
| US4601893A (en) * | 1984-02-08 | 1986-07-22 | Pfizer Inc. | Laminate device for controlled and prolonged release of substances to an ambient environment and method of use |
| US4895566A (en) * | 1986-07-25 | 1990-01-23 | C. R. Bard, Inc. | Coating medical devices with cationic antibiotics |
| EP0277270B1 (de) * | 1986-08-07 | 1996-12-27 | MEDICEChem.-Pharm. Fabrik Pütter GmbH & Co. KG | N-alkylierte quartäre stickstoffhaltige Heterozyklen, Verfahren zu deren Herstellung und deren Verwendung in Arzneimitteln |
| US4830860A (en) * | 1986-10-30 | 1989-05-16 | Pfizer Inc. | Stressed polymeric device for controlled release of a substance to an ambient environment |
| US5755788A (en) * | 1987-02-19 | 1998-05-26 | Rutgers, The State University | Prosthesis and implants having liposomes bound thereto and methods of preparation |
| US20010021697A1 (en) * | 1987-09-14 | 2001-09-13 | Henning Lowenstein | Methods and compositions for the treatment of mammalian infections employing medicaments comprising hymenoptera venom, proteinageous or polypeptide components thereof, or analogues of such proteinaceous or polypeptide components |
| US5028590A (en) * | 1988-04-11 | 1991-07-02 | Eli Lilly And Company | Derivatives of A54145 cyclic peptides |
| US5039789A (en) | 1988-04-11 | 1991-08-13 | Eli Lilly And Company | A54145 cyclic peptides |
| US5254535A (en) * | 1989-04-17 | 1993-10-19 | The Children's Hospital Of Pennsylvania | Composition and treatment with biologically active peptides and antibiotic |
| US5112614A (en) * | 1989-09-14 | 1992-05-12 | Alza Corporation | Implantable delivery dispenser |
| US5459237A (en) * | 1990-02-08 | 1995-10-17 | Magainin Pharmaceuticals Inc. | Peptide compositions and uses therefor |
| JPH04167172A (ja) * | 1990-10-31 | 1992-06-15 | Nec Corp | ベクトルプロセッサ |
| US5082653A (en) * | 1990-10-31 | 1992-01-21 | Warner-Lambert Company | Anti-plaque compositions comprising a combination of morpholinoamino alcohol and antibiotic |
| US5686065A (en) | 1991-03-27 | 1997-11-11 | Special Advanced Biomaterials, Inc. | Topical siloxane sunscreen compositions having enhanced performance and safety |
| WO1992017195A1 (en) * | 1991-04-08 | 1992-10-15 | Magainin Pharmaceuticals, Inc. | Novel peptide compositions and uses therefor |
| AU665030B2 (en) | 1991-09-13 | 1995-12-14 | Magainin Pharmaceuticals, Inc. | Biologically active amphiphilic peptide compositions and uses therefor |
| TW274552B (ru) * | 1992-05-26 | 1996-04-21 | Hoechst Ag | |
| US6348445B1 (en) * | 1992-06-01 | 2002-02-19 | Magainin Pharmaceuticals, Inc. | Biologically active peptides with reduced toxicity in animals and a method for preparing same |
| US5283005A (en) * | 1992-10-08 | 1994-02-01 | Olin Corporation | Synergistic biocide combination for industrial fluids |
| US5424290A (en) * | 1992-10-26 | 1995-06-13 | Magainin Pharmaceuticals Inc. | Biologically active peptides and uses therefor |
| US5360788A (en) | 1992-11-10 | 1994-11-01 | Olin Corporation | Personal care composition containing pyrithione and a basic lipopeptide |
| US5370876A (en) * | 1993-01-08 | 1994-12-06 | Microbarriers | Antimicrobial protective skin composition and method for protecting skin from body fluids |
| US5654451B1 (en) * | 1993-01-14 | 2000-02-22 | Magainin Pharma | Amino acids and peptides having modified c-terminals and modified n-terminals |
| CA2112776C (en) * | 1993-01-21 | 2002-11-12 | Masakazu Tsuchiya | Process for inhibiting activity of endotoxin |
| US5652332A (en) | 1993-03-12 | 1997-07-29 | Xoma | Biologically active peptides from functional domains of bactericidal/permeability-increasing protein and uses thereof |
| US5733872A (en) | 1993-03-12 | 1998-03-31 | Xoma Corporation | Biologically active peptides from functional domains of bactericidal/permeability-increasing protein and uses thereof |
| US20040023884A1 (en) * | 1993-03-12 | 2004-02-05 | Xoma Corporation | Biologically active peptides from functional domains of bactericidal/permeability-increasing protein and uses thereof |
| US6180134B1 (en) * | 1993-03-23 | 2001-01-30 | Sequus Pharmaceuticals, Inc. | Enhanced ciruclation effector composition and method |
| US5635216A (en) * | 1993-12-16 | 1997-06-03 | Eli Lilly And Company | Microparticle compositions containing peptides, and methods for the preparation thereof |
| EP0712405A1 (en) | 1993-08-13 | 1996-05-22 | Smithkline Beecham Plc | Derivatives of monic acids a and c having antibacterial, antimycoplasmatical, antifungal and herbicidal activity |
| US5587358A (en) | 1994-05-09 | 1996-12-24 | Asahi Kasei Kogyo Kabushiki Kaisha | Potentiators of antimicrobial activity |
| FR2735983B1 (fr) * | 1995-06-29 | 1997-12-05 | Centre Nat Rech Scient | Peptide permettant de modifier l'activite du systeme immunitaire humain ou animal |
| US5849761A (en) | 1995-09-12 | 1998-12-15 | Regents Of The University Of California | Peripherally active anti-hyperalgesic opiates |
| US20020150964A1 (en) * | 1995-12-19 | 2002-10-17 | Centre National De La Recherche Scientifique | Peptides for the activation of the immune system in humans and animals |
| US6011008A (en) * | 1997-01-08 | 2000-01-04 | Yissum Research Developement Company Of The Hebrew University Of Jerusalem | Conjugates of biologically active substances |
| US6004573A (en) | 1997-10-03 | 1999-12-21 | Macromed, Inc. | Biodegradable low molecular weight triblock poly(lactide-co-glycolide) polyethylene glycol copolymers having reverse thermal gelation properties |
| US6846478B1 (en) * | 1998-02-27 | 2005-01-25 | The Procter & Gamble Company | Promoting whole body health |
| US6350438B1 (en) * | 1998-02-27 | 2002-02-26 | The Procter & Gamble Company | Oral care compositions comprising chlorite and methods |
| US6767904B2 (en) * | 1998-03-06 | 2004-07-27 | Bringham Young University | Steroid derived antibiotics |
| US6350738B1 (en) * | 1998-03-06 | 2002-02-26 | Brigham Young University | Steroid derived antibiotics |
| PL206091B1 (pl) * | 1998-09-25 | 2010-06-30 | Cubist Pharmaceuticals | Zastosowania daptomycyny |
| IT1308180B1 (it) * | 1999-02-12 | 2001-12-07 | Chiesi Farma Spa | Peptidi sintetici aventi la capacita' di diminuire la tensionesuperficiale e loro impiego nella preparazione di un surfattante |
| US6964948B2 (en) * | 1999-06-25 | 2005-11-15 | Xoma Technology Ltd. | Therapeutic peptide-based constructs derived from Domain II of bactericidal/permeability-increasing protein |
| US6515104B1 (en) * | 1999-06-25 | 2003-02-04 | Xoma Technology Ltd. | Therapeutic peptide-based constructs derived from domain II of bactericidal/permeability-increasing protein |
| EP1198471A1 (en) * | 1999-07-15 | 2002-04-24 | Eli Lilly And Company | Process for deacylation of lipodepsipeptides |
| US6380356B1 (en) * | 1999-12-07 | 2002-04-30 | Advanced Medicine, Inc. | Multivalent polymyxin antibiotics |
| WO2001044274A1 (en) | 1999-12-15 | 2001-06-21 | Cubist Pharmaceuticals, Inc. | Lipopeptides as antibacterial agents |
| CA2393907A1 (en) | 1999-12-15 | 2001-06-21 | Cubist Pharmaceuticals Inc. | Novel lipopeptides as antibacterial agents |
| AU784942B2 (en) | 1999-12-15 | 2006-08-03 | Cubist Pharmaceuticals, Inc. | Daptomycin analogs and their use as antibacterial agents |
| US7074392B1 (en) * | 2000-03-27 | 2006-07-11 | Taro Pharmaceutical Industries Limited | Controllled delivery system of antifungal and keratolytic agents for local treatment of fungal infections |
| JP3292723B2 (ja) * | 2000-05-26 | 2002-06-17 | アルス電子株式会社 | 半導体パッケージ及びその製造方法 |
| WO2001091814A2 (en) * | 2000-05-30 | 2001-12-06 | Viridis Biotech Inc. | Polyubiquitin based hydrogel and uses thereof |
| ATE401089T1 (de) * | 2000-06-30 | 2008-08-15 | Procter & Gamble | Orale zubereitungen, die antimikrobielle wirkstoffe enthalten zur prävention von systemischen erkrankungen |
| AU7893301A (en) * | 2000-07-17 | 2002-01-30 | Intrabiotics Pharmaceuticals | Antimicrobial sulfonamide derivatives of lipopeptide antibiotics |
| US6511962B1 (en) | 2000-07-17 | 2003-01-28 | Micrologix Biotech Inc. | Derivatives of laspartomycin and preparation and use thereof |
| CA2444637A1 (en) * | 2001-01-16 | 2002-07-18 | Ramot University Authority For Applied Research & Industrial Development Ltd. | Hybrid peptides for treatment of bacteremia and septicemia |
| KR20030072614A (ko) * | 2001-01-31 | 2003-09-15 | 화이자 프로덕츠 인크. | Pde4 이소자임 억제제로 유용한 티아졸릴-,옥사졸릴-, 피롤릴- 및 이미다졸릴-산 아미드 유도체 |
| WO2002074316A1 (en) * | 2001-03-15 | 2002-09-26 | Enteron Pharmaceuticals, Inc. | Method of treating inflammatory disorders of the gastrointestinal tract using topical active corticosteroids |
| RU2348647C2 (ru) | 2001-08-06 | 2009-03-10 | Кьюбист Фармасьютикалз, Инк | Новые депсипептиды и способы их получения |
| US6681765B2 (en) | 2001-12-18 | 2004-01-27 | Sheree H. Wen | Antiviral and antibacterial respirator mask |
| US7345018B2 (en) * | 2002-04-25 | 2008-03-18 | Reception Aps | Method of treating side effects induced by therapeutic agents |
| EP1360961A1 (en) | 2002-05-07 | 2003-11-12 | AM-Pharma B.V. | Use of antimicrobial peptides for potentiating the activity of antimicrobial agents |
| US6767718B2 (en) * | 2002-05-10 | 2004-07-27 | Biosource Pharm, Inc. | Lipodepsipeptide antibiotics and methods of preparation |
| NZ538628A (en) * | 2002-08-12 | 2008-06-30 | Dynavax Tech Corp | Immunomodulatory compositions, methods of making, and methods of use thereof |
| US20040037895A1 (en) * | 2002-08-23 | 2004-02-26 | Alex Zhu | Methods of treating involuntary facial spasms and facial wrinkles |
| US20090123367A1 (en) * | 2003-03-05 | 2009-05-14 | Delfmems | Soluble Glycosaminoglycanases and Methods of Preparing and Using Soluble Glycosaminoglycanases |
| US20060104968A1 (en) * | 2003-03-05 | 2006-05-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminogly ycanases |
| US7871607B2 (en) | 2003-03-05 | 2011-01-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminoglycanases |
| WO2004101017A2 (de) * | 2003-05-16 | 2004-11-25 | Blue Membranes Gmbh | Biokompatibel beschichtete medizinische implantate |
| EP1667648A2 (en) | 2003-09-30 | 2006-06-14 | Kohi Corporation | Compositions and methods for treating burns |
| CA2536041A1 (en) | 2003-11-10 | 2005-05-26 | Angiotech International Ag | Medical implants and fibrosis-inducing agents |
| US7364747B1 (en) * | 2004-02-02 | 2008-04-29 | S.S. Steiner, Inc. | Process and product for inhibiting or preventing bacterial infections |
| US20060004185A1 (en) | 2004-07-01 | 2006-01-05 | Leese Richard A | Peptide antibiotics and peptide intermediates for their prepartion |
| JP2008508243A (ja) * | 2004-07-30 | 2008-03-21 | パルメド・ソシエテ・アノニム | アミノキノリンをqとし、抗生物質残基をaとする混成分子qa、その合成及び抗菌剤としての使用 |
| US7541046B1 (en) * | 2005-01-04 | 2009-06-02 | Gp Medical, Inc. | Nanoparticles for protein drug delivery |
| WO2006089236A1 (en) * | 2005-02-18 | 2006-08-24 | The Cleveland Clinic Foundation | Apparatus and methods for replacing a cardiac valve |
| US20060259135A1 (en) | 2005-04-20 | 2006-11-16 | The Cleveland Clinic Foundation | Apparatus and method for replacing a cardiac valve |
| DE602006009113D1 (de) * | 2005-07-15 | 2009-10-22 | Cleveland Clinic Foundation | Vorrichtung zur Ummodellierung eines Herzklappenrings |
| US20070299043A1 (en) | 2005-10-03 | 2007-12-27 | Hunter William L | Anti-scarring drug combinations and use thereof |
| US20070197957A1 (en) * | 2005-10-03 | 2007-08-23 | Hunter William L | Implantable sensors, implantable pumps and anti-scarring drug combinations |
| US20070196421A1 (en) * | 2005-10-03 | 2007-08-23 | Hunter William L | Soft tissue implants and drug combination compositions, and use thereof |
| US20070208134A1 (en) * | 2005-10-03 | 2007-09-06 | Hunter William L | Anti-scarring drug combinations and use thereof |
| KR100750658B1 (ko) * | 2005-12-09 | 2007-08-20 | 한국생명공학연구원 | 폴리믹신 생합성 효소 및 이를 코딩하는 유전자 군 |
| WO2007089864A2 (en) * | 2006-01-30 | 2007-08-09 | Angiotech Pharmaceuticals, Inc. | Sutures and fibrosing agents |
| CA2642754A1 (en) * | 2006-02-13 | 2007-08-23 | Trustees Of Boston University | Compositions and methods for antibiotic potentiation and drug discovery |
| WO2007095631A2 (en) * | 2006-02-15 | 2007-08-23 | The Regents Of The University Of California | New drug delivery system for crossing the blood brain barrier |
| WO2007100663A2 (en) * | 2006-02-22 | 2007-09-07 | University Of Kansas | Polyamines and their use as antibacterial and sensitizing agents |
| US8585753B2 (en) * | 2006-03-04 | 2013-11-19 | John James Scanlon | Fibrillated biodegradable prosthesis |
| US20070243275A1 (en) * | 2006-04-13 | 2007-10-18 | Gilbard Jeffrey P | Methods and compositions for the treatment of infection or infectious colonization of the eyelid, ocular surface, skin or ear |
| US8652201B2 (en) * | 2006-04-26 | 2014-02-18 | The Cleveland Clinic Foundation | Apparatus and method for treating cardiovascular diseases |
| WO2007133944A2 (en) * | 2006-05-09 | 2007-11-22 | Emisphere Technologies, Inc. | Topical administration of acyclovir |
| AU2007279442A1 (en) | 2006-08-03 | 2008-02-07 | Prosensa Technologies B.V. | Antibiotic composition |
| SI2057185T1 (sl) | 2006-08-11 | 2016-10-28 | Northern Antibiotics Oy | Derivati polimiksina in njihove uporabe |
| US7807637B2 (en) | 2006-08-11 | 2010-10-05 | Northern Antibiotics Oy | Polymyxin derivatives and uses thereof |
| US20100028334A1 (en) * | 2006-12-15 | 2010-02-04 | Trustees Of Boston University | Compositions and methods to potentiate colistin activity |
| PL2141996T3 (pl) * | 2007-04-02 | 2013-05-31 | Sinai School Medicine | Sposoby zapobiegania lub leczenia chorób infekcyjnych z zastosowaniem związków galu |
| US20090048155A1 (en) * | 2007-08-15 | 2009-02-19 | Endacea, Inc. | Methods for preventing and treating tissue injury and sepsis associated with Yersinia pestis infection |
| US20090214601A1 (en) * | 2007-09-28 | 2009-08-27 | Chappa Ralph A | Porous Drug Delivery Devices and Related Methods |
| US20090227018A1 (en) * | 2007-10-25 | 2009-09-10 | Revalesio Corporation | Compositions and methods for modulating cellular membrane-mediated intracellular signal transduction |
| US8193148B2 (en) * | 2008-02-08 | 2012-06-05 | Northern Antibiotics Ltd. | Short fatty acid tail polymyxin derivatives and uses thereof |
| US8329645B2 (en) * | 2008-02-08 | 2012-12-11 | Northern Antibiotics Ltd. | Polymyxin derivatives and uses thereof |
| CA2747995A1 (en) * | 2008-12-23 | 2010-07-01 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
| US8415307B1 (en) * | 2010-06-23 | 2013-04-09 | Biosource Pharm, Inc. | Antibiotic compositions for the treatment of gram negative infections |
-
2004
- 2004-07-01 US US10/881,160 patent/US20060004185A1/en active Pending
-
2005
- 2005-07-01 EP EP10184953A patent/EP2332965A1/en not_active Withdrawn
- 2005-07-01 JP JP2007519447A patent/JP2008505858A/ja active Pending
- 2005-07-01 EP EP05856867A patent/EP1761554A2/en not_active Withdrawn
- 2005-07-01 BR BRPI0512941-9A patent/BRPI0512941A/pt not_active IP Right Cessation
- 2005-07-01 NZ NZ552730A patent/NZ552730A/en not_active IP Right Cessation
- 2005-07-01 RU RU2007103811/04A patent/RU2428429C2/ru not_active IP Right Cessation
- 2005-07-01 KR KR1020077002649A patent/KR20070047770A/ko not_active Application Discontinuation
- 2005-07-01 NZ NZ579261A patent/NZ579261A/en not_active IP Right Cessation
- 2005-07-01 US US11/630,847 patent/US8889826B2/en not_active Expired - Fee Related
- 2005-07-01 MX MXPA06015239A patent/MXPA06015239A/es not_active Application Discontinuation
- 2005-07-01 CA CA002571944A patent/CA2571944A1/en not_active Abandoned
- 2005-07-01 WO PCT/US2005/023343 patent/WO2006083317A2/en active Application Filing
- 2005-07-01 AU AU2005326770A patent/AU2005326770B2/en not_active Ceased
- 2005-07-01 CN CNA2005800294199A patent/CN101010336A/zh active Pending
-
2006
- 2006-12-21 ZA ZA200610818A patent/ZA200610818B/en unknown
- 2006-12-31 IL IL180458A patent/IL180458A0/en unknown
-
2007
- 2007-01-30 NO NO20070563A patent/NO20070563L/no not_active Application Discontinuation
-
2011
- 2011-04-15 RU RU2011115077/04A patent/RU2011115077A/ru not_active Application Discontinuation
- 2011-08-01 JP JP2011168634A patent/JP2011256189A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2011256189A (ja) | 2011-12-22 |
| EP1761554A2 (en) | 2007-03-14 |
| BRPI0512941A (pt) | 2007-10-30 |
| WO2006083317A9 (en) | 2007-03-01 |
| US20060004185A1 (en) | 2006-01-05 |
| NZ552730A (en) | 2009-09-25 |
| WO2006083317A2 (en) | 2006-08-10 |
| MXPA06015239A (es) | 2007-12-10 |
| AU2005326770B2 (en) | 2011-11-03 |
| US20080207874A1 (en) | 2008-08-28 |
| NO20070563L (no) | 2007-03-27 |
| RU2428429C2 (ru) | 2011-09-10 |
| NZ579261A (en) | 2011-02-25 |
| CA2571944A1 (en) | 2006-08-10 |
| US8889826B2 (en) | 2014-11-18 |
| CN101010336A (zh) | 2007-08-01 |
| IL180458A0 (en) | 2007-06-03 |
| RU2007103811A (ru) | 2008-08-10 |
| JP2008505858A (ja) | 2008-02-28 |
| WO2006083317A3 (en) | 2007-01-18 |
| AU2005326770A1 (en) | 2006-08-10 |
| ZA200610818B (en) | 2008-07-30 |
| EP2332965A1 (en) | 2011-06-15 |
| KR20070047770A (ko) | 2007-05-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2011115077A (ru) | Пептидные антибиотики и способы их получения | |
| ES2264523T3 (es) | Inhibidores dipeptidos selectivos de calicreina. | |
| ES2576685T3 (es) | Compuestos antimicrobianos | |
| Lejczak et al. | Antibacterial activity of phosphono dipeptides related to alafosfalin | |
| CA2437983A1 (en) | Transporters comprising spaced arginine moieties | |
| JP2013511554A5 (ru) | ||
| JP2011523415A5 (ru) | ||
| AU2006228751A1 (en) | Antibacterial amide-macrocycles V | |
| RU2004106630A (ru) | Новые депсипептиды и способы их получения | |
| Andruszkiewicz et al. | Synthesis and biological properties of N3-(4-methoxyfumaroyl)-L-2, 3-diaminopropanoic acid dipeptides. A novel group of antimicrobial agents | |
| CN110582506A (zh) | 新抗菌产品 | |
| CA2954653C (en) | N-(hydrophobe-substituted)vancosaminyl [.psi.[c(=nh)nh]tpg4]vancomycin and [.psi.[ch2nh]tpg4]vancomycin | |
| US6767718B2 (en) | Lipodepsipeptide antibiotics and methods of preparation | |
| ES2283107T3 (es) | Glicopeptidos modificados en n1. | |
| RU2184114C2 (ru) | Новые производные бензоксазиндиона и лекарственный препарат на их основе | |
| WO2013073998A2 (ru) | Новые производные гемина с антибактериальной и противовирусной активностью | |
| HRP20050242B1 (en) | Synthetic peptides containing unnatural adamantane related amino acids for use as antitumour drugs | |
| CA2471723A1 (en) | Intermediates for lhrh antagonist synthesis, process for their production, and process for lhrh antagonist production | |
| JP2008100930A (ja) | エラスターゼ阻害剤 | |
| EP1049481B1 (en) | Synthetic antineoplastic agents derived from dolastatin 15 and methods of making same | |
| Green et al. | Substrate related O, O-dialkyldipeptidyly ψ carboxybenzylphosphonates, a new type of thrombin inhibitor | |
| SONTISIRI et al. | Design, syntheses and anti-multidrug resistant bacteria analyses of derived lugdunin cyclic peptide | |
| Zhu | Design and Synthesis of 16-Membered Cyclopeptides Active Against Vancomycin-resistant Enterococci (VRE) | |
| JPH02209865A (ja) | 3―チオプロピオン酸誘導体の製造法 | |
| Li | Studies toward the synthesis of coibamide A and analogues |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| FA93 | Acknowledgement of application withdrawn (no request for examination) |
Effective date: 20140616 |