KR20200088445A - 세포 조성물 및 치료 방법 i - Google Patents
세포 조성물 및 치료 방법 i Download PDFInfo
- Publication number
- KR20200088445A KR20200088445A KR1020207017952A KR20207017952A KR20200088445A KR 20200088445 A KR20200088445 A KR 20200088445A KR 1020207017952 A KR1020207017952 A KR 1020207017952A KR 20207017952 A KR20207017952 A KR 20207017952A KR 20200088445 A KR20200088445 A KR 20200088445A
- Authority
- KR
- South Korea
- Prior art keywords
- mir
- hsa
- cells
- cell
- mesenchymal lineage
- Prior art date
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 93
- 238000000034 method Methods 0.000 title claims description 92
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 91
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 81
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 77
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 77
- 201000011510 cancer Diseases 0.000 claims abstract description 69
- 239000013598 vector Substances 0.000 claims abstract description 31
- 210000004027 cell Anatomy 0.000 claims description 521
- 239000002243 precursor Substances 0.000 claims description 310
- 210000000130 stem cell Anatomy 0.000 claims description 305
- 101001008953 Homo sapiens Kinesin-like protein KIF11 Proteins 0.000 claims description 160
- 102100027629 Kinesin-like protein KIF11 Human genes 0.000 claims description 159
- 108091034117 Oligonucleotide Proteins 0.000 claims description 151
- 230000002401 inhibitory effect Effects 0.000 claims description 68
- -1 miR-155-inh Proteins 0.000 claims description 50
- 108700023372 Glycosyltransferases Proteins 0.000 claims description 47
- 108091070501 miRNA Proteins 0.000 claims description 46
- 102000051366 Glycosyltransferases Human genes 0.000 claims description 44
- 102000010970 Connexin Human genes 0.000 claims description 42
- 108050001175 Connexin Proteins 0.000 claims description 42
- 239000002679 microRNA Substances 0.000 claims description 40
- 108010069241 Connexin 43 Proteins 0.000 claims description 38
- 102100021337 Gap junction alpha-1 protein Human genes 0.000 claims description 38
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 claims description 38
- 230000014509 gene expression Effects 0.000 claims description 36
- 125000003729 nucleotide group Chemical group 0.000 claims description 31
- 239000002773 nucleotide Substances 0.000 claims description 30
- 210000003976 gap junction Anatomy 0.000 claims description 27
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims description 25
- 230000000694 effects Effects 0.000 claims description 25
- 108010001671 galactoside 3-fucosyltransferase Proteins 0.000 claims description 22
- 102100030540 Gap junction alpha-5 protein Human genes 0.000 claims description 18
- 101710177922 Gap junction alpha-5 protein Proteins 0.000 claims description 18
- 230000035899 viability Effects 0.000 claims description 17
- 108091028043 Nucleic acid sequence Proteins 0.000 claims description 15
- 102100031463 Serine/threonine-protein kinase PLK1 Human genes 0.000 claims description 14
- 238000001727 in vivo Methods 0.000 claims description 14
- 108010056274 polo-like kinase 1 Proteins 0.000 claims description 14
- 108010019236 Fucosyltransferases Proteins 0.000 claims description 12
- 102000006471 Fucosyltransferases Human genes 0.000 claims description 12
- 230000027455 binding Effects 0.000 claims description 12
- 230000004048 modification Effects 0.000 claims description 12
- 238000012986 modification Methods 0.000 claims description 12
- 108020004459 Small interfering RNA Proteins 0.000 claims description 11
- 239000013603 viral vector Substances 0.000 claims description 11
- 201000001441 melanoma Diseases 0.000 claims description 10
- 239000004055 small Interfering RNA Substances 0.000 claims description 10
- 206010009944 Colon cancer Diseases 0.000 claims description 9
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 9
- 206010060862 Prostate cancer Diseases 0.000 claims description 9
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 9
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 9
- 108091029119 miR-34a stem-loop Proteins 0.000 claims description 9
- 201000002528 pancreatic cancer Diseases 0.000 claims description 9
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 9
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 8
- 108091027967 Small hairpin RNA Proteins 0.000 claims description 8
- 208000029742 colonic neoplasm Diseases 0.000 claims description 8
- 230000002147 killing effect Effects 0.000 claims description 8
- 201000007270 liver cancer Diseases 0.000 claims description 8
- 208000014018 liver neoplasm Diseases 0.000 claims description 8
- 201000005202 lung cancer Diseases 0.000 claims description 8
- 208000020816 lung neoplasm Diseases 0.000 claims description 8
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 7
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 7
- 201000010881 cervical cancer Diseases 0.000 claims description 7
- 230000004927 fusion Effects 0.000 claims description 6
- 201000008968 osteosarcoma Diseases 0.000 claims description 6
- 239000013612 plasmid Substances 0.000 claims description 6
- 241000701161 unidentified adenovirus Species 0.000 claims description 6
- 102100035277 4-galactosyl-N-acetylglucosaminide 3-alpha-L-fucosyltransferase FUT6 Human genes 0.000 claims description 5
- 230000000692 anti-sense effect Effects 0.000 claims description 5
- 210000002919 epithelial cell Anatomy 0.000 claims description 5
- 241000702421 Dependoparvovirus Species 0.000 claims description 4
- 101000961414 Homo sapiens Membrane cofactor protein Proteins 0.000 claims description 4
- 241000713666 Lentivirus Species 0.000 claims description 4
- 102100039373 Membrane cofactor protein Human genes 0.000 claims description 4
- 210000004413 cardiac myocyte Anatomy 0.000 claims description 4
- 230000007246 mechanism Effects 0.000 claims description 4
- 108020004999 messenger RNA Proteins 0.000 claims description 4
- 210000000329 smooth muscle myocyte Anatomy 0.000 claims description 4
- 102100040842 3-galactosyl-N-acetylglucosaminide 4-alpha-L-fucosyltransferase FUT3 Human genes 0.000 claims description 3
- 102100021335 4-galactosyl-N-acetylglucosaminide 3-alpha-L-fucosyltransferase 9 Human genes 0.000 claims description 3
- 102100035248 Alpha-(1,3)-fucosyltransferase 4 Human genes 0.000 claims description 3
- 108060003306 Galactosyltransferase Proteins 0.000 claims description 3
- 102000030902 Galactosyltransferase Human genes 0.000 claims description 3
- 108091033773 MiR-155 Proteins 0.000 claims description 3
- 108091028049 Mir-221 microRNA Proteins 0.000 claims description 3
- 108090000141 Sialyltransferases Proteins 0.000 claims description 3
- 102000003838 Sialyltransferases Human genes 0.000 claims description 3
- 210000001608 connective tissue cell Anatomy 0.000 claims description 3
- 230000002757 inflammatory effect Effects 0.000 claims description 3
- 210000000265 leukocyte Anatomy 0.000 claims description 3
- 230000014759 maintenance of location Effects 0.000 claims description 3
- 108091074057 miR-16-1 stem-loop Proteins 0.000 claims description 3
- 108091074194 miR-181b-1 stem-loop Proteins 0.000 claims description 3
- 108091062762 miR-21 stem-loop Proteins 0.000 claims description 3
- 108091041631 miR-21-1 stem-loop Proteins 0.000 claims description 3
- 108091044442 miR-21-2 stem-loop Proteins 0.000 claims description 3
- 108091061917 miR-221 stem-loop Proteins 0.000 claims description 3
- 108091063489 miR-221-1 stem-loop Proteins 0.000 claims description 3
- 108091055391 miR-221-2 stem-loop Proteins 0.000 claims description 3
- 108091031076 miR-221-3 stem-loop Proteins 0.000 claims description 3
- 108091088477 miR-29a stem-loop Proteins 0.000 claims description 3
- 108091029716 miR-29a-1 stem-loop Proteins 0.000 claims description 3
- 108091092089 miR-29a-2 stem-loop Proteins 0.000 claims description 3
- 108091066559 miR-29a-3 stem-loop Proteins 0.000 claims description 3
- 241000701447 unidentified baculovirus Species 0.000 claims description 3
- 241001430294 unidentified retrovirus Species 0.000 claims description 3
- 239000002924 silencing RNA Substances 0.000 claims 5
- 108091007423 let-7b Proteins 0.000 claims 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 13
- 201000010099 disease Diseases 0.000 abstract description 10
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 136
- 238000003501 co-culture Methods 0.000 description 35
- 108020004414 DNA Proteins 0.000 description 24
- 108090000623 proteins and genes Proteins 0.000 description 23
- 238000001890 transfection Methods 0.000 description 23
- 102100034594 Angiopoietin-1 Human genes 0.000 description 22
- 101000924552 Homo sapiens Angiopoietin-1 Proteins 0.000 description 22
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 21
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 21
- 230000010261 cell growth Effects 0.000 description 21
- 239000000243 solution Substances 0.000 description 19
- 101710151472 Neuroendocrine convertase 1 Proteins 0.000 description 18
- 102000006495 integrins Human genes 0.000 description 17
- 108010044426 integrins Proteins 0.000 description 17
- 210000004881 tumor cell Anatomy 0.000 description 17
- 230000030833 cell death Effects 0.000 description 16
- 210000001519 tissue Anatomy 0.000 description 16
- 238000005138 cryopreservation Methods 0.000 description 15
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 14
- 239000006143 cell culture medium Substances 0.000 description 14
- 239000003550 marker Substances 0.000 description 14
- 230000012010 growth Effects 0.000 description 13
- 210000001185 bone marrow Anatomy 0.000 description 12
- 102000004169 proteins and genes Human genes 0.000 description 11
- 231100000673 dose–response relationship Toxicity 0.000 description 10
- 229920001184 polypeptide Polymers 0.000 description 10
- 102000004196 processed proteins & peptides Human genes 0.000 description 10
- 108090000765 processed proteins & peptides Proteins 0.000 description 10
- 102100025683 Alkaline phosphatase, tissue-nonspecific isozyme Human genes 0.000 description 9
- 108091033409 CRISPR Proteins 0.000 description 9
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 9
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 9
- 241000282414 Homo sapiens Species 0.000 description 9
- 241000699670 Mus sp. Species 0.000 description 9
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 9
- 238000004113 cell culture Methods 0.000 description 9
- 239000005090 green fluorescent protein Substances 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 230000002829 reductive effect Effects 0.000 description 9
- JLTPSDHKZGWXTD-UHFFFAOYSA-N 2-[6-(dicyanomethylidene)naphthalen-2-ylidene]propanedinitrile Chemical compound N#CC(C#N)=C1C=CC2=CC(=C(C#N)C#N)C=CC2=C1 JLTPSDHKZGWXTD-UHFFFAOYSA-N 0.000 description 8
- 101710161969 Alkaline phosphatase, tissue-nonspecific isozyme Proteins 0.000 description 8
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 8
- 239000000758 substrate Substances 0.000 description 8
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 7
- 108091070493 Homo sapiens miR-21 stem-loop Proteins 0.000 description 7
- 108091008065 MIR21 Proteins 0.000 description 7
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 7
- 108091050724 let-7b stem-loop Proteins 0.000 description 7
- 108091030917 let-7b-1 stem-loop Proteins 0.000 description 7
- 108091082924 let-7b-2 stem-loop Proteins 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 239000000546 pharmaceutical excipient Substances 0.000 description 7
- 102100032912 CD44 antigen Human genes 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 6
- 230000004071 biological effect Effects 0.000 description 6
- 230000003833 cell viability Effects 0.000 description 6
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 6
- 150000004676 glycans Chemical class 0.000 description 6
- 230000001404 mediated effect Effects 0.000 description 6
- 239000002953 phosphate buffered saline Substances 0.000 description 6
- 241000894007 species Species 0.000 description 6
- 102100030708 GTPase KRas Human genes 0.000 description 5
- 102100039290 Gap junction gamma-1 protein Human genes 0.000 description 5
- 101710178004 Gap junction gamma-1 protein Proteins 0.000 description 5
- 108091065981 Homo sapiens miR-155 stem-loop Proteins 0.000 description 5
- 108091070491 Homo sapiens miR-16-1 stem-loop Proteins 0.000 description 5
- 108091067572 Homo sapiens miR-221 stem-loop Proteins 0.000 description 5
- 239000000427 antigen Substances 0.000 description 5
- 108091007433 antigens Proteins 0.000 description 5
- 102000036639 antigens Human genes 0.000 description 5
- 210000000988 bone and bone Anatomy 0.000 description 5
- 239000000969 carrier Substances 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 210000001808 exosome Anatomy 0.000 description 5
- 210000002950 fibroblast Anatomy 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
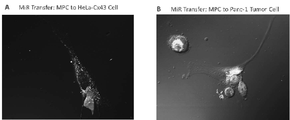
- 238000012546 transfer Methods 0.000 description 5
- 230000010304 tumor cell viability Effects 0.000 description 5
- 102100025278 Coxsackievirus and adenovirus receptor Human genes 0.000 description 4
- 101710176411 Coxsackievirus and adenovirus receptor Proteins 0.000 description 4
- 108010024212 E-Selectin Proteins 0.000 description 4
- 102100023471 E-selectin Human genes 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 108091067602 Homo sapiens miR-181b-1 stem-loop Proteins 0.000 description 4
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 108010029485 Protein Isoforms Proteins 0.000 description 4
- 102000001708 Protein Isoforms Human genes 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 210000004271 bone marrow stromal cell Anatomy 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 238000010195 expression analysis Methods 0.000 description 4
- 239000013604 expression vector Substances 0.000 description 4
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 4
- 239000001963 growth medium Substances 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 238000011068 loading method Methods 0.000 description 4
- 108091027943 miR-16 stem-loop Proteins 0.000 description 4
- 238000010369 molecular cloning Methods 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- 210000002307 prostate Anatomy 0.000 description 4
- 230000004083 survival effect Effects 0.000 description 4
- 230000003612 virological effect Effects 0.000 description 4
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 3
- 102100021333 Alpha-(1,3)-fucosyltransferase 7 Human genes 0.000 description 3
- 108020004491 Antisense DNA Proteins 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 102100030525 Gap junction alpha-4 protein Human genes 0.000 description 3
- 101710190724 Gap junction alpha-4 protein Proteins 0.000 description 3
- 102100037260 Gap junction beta-1 protein Human genes 0.000 description 3
- 101710202596 Gap junction beta-1 protein Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 3
- 108091068998 Homo sapiens miR-191 stem-loop Proteins 0.000 description 3
- 229920001612 Hydroxyethyl starch Polymers 0.000 description 3
- 239000012098 Lipofectamine RNAiMAX Substances 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 3
- 108010000134 Vascular Cell Adhesion Molecule-1 Proteins 0.000 description 3
- 102100023543 Vascular cell adhesion protein 1 Human genes 0.000 description 3
- 239000003816 antisense DNA Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 238000010835 comparative analysis Methods 0.000 description 3
- 239000002577 cryoprotective agent Substances 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- 208000035475 disorder Diseases 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000000684 flow cytometry Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 238000012239 gene modification Methods 0.000 description 3
- 230000005017 genetic modification Effects 0.000 description 3
- 235000013617 genetically modified food Nutrition 0.000 description 3
- 102000045442 glycosyltransferase activity proteins Human genes 0.000 description 3
- 108700014210 glycosyltransferase activity proteins Proteins 0.000 description 3
- 229940050526 hydroxyethylstarch Drugs 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 230000003278 mimic effect Effects 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 230000010076 replication Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 102200006539 rs121913529 Human genes 0.000 description 3
- 206010041823 squamous cell carcinoma Diseases 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- 210000002435 tendon Anatomy 0.000 description 3
- 238000010257 thawing Methods 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 238000010361 transduction Methods 0.000 description 3
- 230000026683 transduction Effects 0.000 description 3
- 239000012096 transfection reagent Substances 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- SXGZJKUKBWWHRA-UHFFFAOYSA-N 2-(N-morpholiniumyl)ethanesulfonate Chemical compound [O-]S(=O)(=O)CC[NH+]1CCOCC1 SXGZJKUKBWWHRA-UHFFFAOYSA-N 0.000 description 2
- 241001655883 Adeno-associated virus - 1 Species 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- 108020005544 Antisense RNA Proteins 0.000 description 2
- 206010005949 Bone cancer Diseases 0.000 description 2
- 208000018084 Bone neoplasm Diseases 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 2
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 2
- 201000009030 Carcinoma Diseases 0.000 description 2
- 108091026890 Coding region Proteins 0.000 description 2
- 108091033380 Coding strand Proteins 0.000 description 2
- 108020004635 Complementary DNA Proteins 0.000 description 2
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 101150018778 GDE1 gene Proteins 0.000 description 2
- 102100039397 Gap junction beta-3 protein Human genes 0.000 description 2
- 101710082451 Gap junction beta-3 protein Proteins 0.000 description 2
- 102100039416 Gap junction beta-4 protein Human genes 0.000 description 2
- 101710104113 Gap junction beta-4 protein Proteins 0.000 description 2
- 102100039417 Gap junction beta-5 protein Human genes 0.000 description 2
- 101710178161 Gap junction beta-5 protein Proteins 0.000 description 2
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 2
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 2
- 108091070521 Homo sapiens let-7a-1 stem-loop Proteins 0.000 description 2
- 108091070513 Homo sapiens let-7a-3 stem-loop Proteins 0.000 description 2
- 108091070514 Homo sapiens let-7b stem-loop Proteins 0.000 description 2
- 108091070512 Homo sapiens let-7d stem-loop Proteins 0.000 description 2
- 108091070508 Homo sapiens let-7e stem-loop Proteins 0.000 description 2
- 108091070526 Homo sapiens let-7f-2 stem-loop Proteins 0.000 description 2
- 108091069046 Homo sapiens let-7g stem-loop Proteins 0.000 description 2
- 108091069047 Homo sapiens let-7i stem-loop Proteins 0.000 description 2
- 108091068853 Homo sapiens miR-100 stem-loop Proteins 0.000 description 2
- 108091068840 Homo sapiens miR-101-1 stem-loop Proteins 0.000 description 2
- 108091068838 Homo sapiens miR-103a-2 stem-loop Proteins 0.000 description 2
- 108091068941 Homo sapiens miR-106a stem-loop Proteins 0.000 description 2
- 108091065165 Homo sapiens miR-106b stem-loop Proteins 0.000 description 2
- 108091067628 Homo sapiens miR-10a stem-loop Proteins 0.000 description 2
- 108091067631 Homo sapiens miR-10b stem-loop Proteins 0.000 description 2
- 108091069016 Homo sapiens miR-122 stem-loop Proteins 0.000 description 2
- 108091069004 Homo sapiens miR-125a stem-loop Proteins 0.000 description 2
- 108091069087 Homo sapiens miR-125b-2 stem-loop Proteins 0.000 description 2
- 108091069022 Homo sapiens miR-130a stem-loop Proteins 0.000 description 2
- 108091065455 Homo sapiens miR-130b stem-loop Proteins 0.000 description 2
- 108091069024 Homo sapiens miR-132 stem-loop Proteins 0.000 description 2
- 108091068987 Homo sapiens miR-135a-1 stem-loop Proteins 0.000 description 2
- 108091066895 Homo sapiens miR-135b stem-loop Proteins 0.000 description 2
- 108091069102 Homo sapiens miR-136 stem-loop Proteins 0.000 description 2
- 108091069015 Homo sapiens miR-138-2 stem-loop Proteins 0.000 description 2
- 108091067617 Homo sapiens miR-139 stem-loop Proteins 0.000 description 2
- 108091069017 Homo sapiens miR-140 stem-loop Proteins 0.000 description 2
- 108091068993 Homo sapiens miR-142 stem-loop Proteins 0.000 description 2
- 108091068992 Homo sapiens miR-143 stem-loop Proteins 0.000 description 2
- 108091068999 Homo sapiens miR-144 stem-loop Proteins 0.000 description 2
- 108091069002 Homo sapiens miR-145 stem-loop Proteins 0.000 description 2
- 108091092238 Homo sapiens miR-146b stem-loop Proteins 0.000 description 2
- 108091067654 Homo sapiens miR-148a stem-loop Proteins 0.000 description 2
- 108091067009 Homo sapiens miR-148b stem-loop Proteins 0.000 description 2
- 108091069090 Homo sapiens miR-149 stem-loop Proteins 0.000 description 2
- 108091069088 Homo sapiens miR-150 stem-loop Proteins 0.000 description 2
- 108091067014 Homo sapiens miR-151a stem-loop Proteins 0.000 description 2
- 108091068955 Homo sapiens miR-154 stem-loop Proteins 0.000 description 2
- 108091070507 Homo sapiens miR-15a stem-loop Proteins 0.000 description 2
- 108091069045 Homo sapiens miR-15b stem-loop Proteins 0.000 description 2
- 108091068927 Homo sapiens miR-16-2 stem-loop Proteins 0.000 description 2
- 108091070489 Homo sapiens miR-17 stem-loop Proteins 0.000 description 2
- 108091067469 Homo sapiens miR-181a-1 stem-loop Proteins 0.000 description 2
- 108091067618 Homo sapiens miR-181a-2 stem-loop Proteins 0.000 description 2
- 108091067634 Homo sapiens miR-181c stem-loop Proteins 0.000 description 2
- 108091067605 Homo sapiens miR-183 stem-loop Proteins 0.000 description 2
- 108091068954 Homo sapiens miR-185 stem-loop Proteins 0.000 description 2
- 108091068956 Homo sapiens miR-186 stem-loop Proteins 0.000 description 2
- 108091067635 Homo sapiens miR-187 stem-loop Proteins 0.000 description 2
- 108091070490 Homo sapiens miR-18a stem-loop Proteins 0.000 description 2
- 108091031921 Homo sapiens miR-18b stem-loop Proteins 0.000 description 2
- 108091067995 Homo sapiens miR-192 stem-loop Proteins 0.000 description 2
- 108091069034 Homo sapiens miR-193a stem-loop Proteins 0.000 description 2
- 108091092301 Homo sapiens miR-193b stem-loop Proteins 0.000 description 2
- 108091068960 Homo sapiens miR-195 stem-loop Proteins 0.000 description 2
- 108091067629 Homo sapiens miR-196a-2 stem-loop Proteins 0.000 description 2
- 108091067692 Homo sapiens miR-199a-1 stem-loop Proteins 0.000 description 2
- 108091067467 Homo sapiens miR-199a-2 stem-loop Proteins 0.000 description 2
- 108091067484 Homo sapiens miR-199b stem-loop Proteins 0.000 description 2
- 108091070517 Homo sapiens miR-19a stem-loop Proteins 0.000 description 2
- 108091065166 Homo sapiens miR-200a stem-loop Proteins 0.000 description 2
- 108091069457 Homo sapiens miR-200b stem-loop Proteins 0.000 description 2
- 108091066023 Homo sapiens miR-200c stem-loop Proteins 0.000 description 2
- 108091092296 Homo sapiens miR-202 stem-loop Proteins 0.000 description 2
- 108091070496 Homo sapiens miR-20a stem-loop Proteins 0.000 description 2
- 108091032024 Homo sapiens miR-20b stem-loop Proteins 0.000 description 2
- 108091067580 Homo sapiens miR-214 stem-loop Proteins 0.000 description 2
- 108091070494 Homo sapiens miR-22 stem-loop Proteins 0.000 description 2
- 108091067573 Homo sapiens miR-222 stem-loop Proteins 0.000 description 2
- 108091069527 Homo sapiens miR-223 stem-loop Proteins 0.000 description 2
- 108091069517 Homo sapiens miR-224 stem-loop Proteins 0.000 description 2
- 108091069063 Homo sapiens miR-23b stem-loop Proteins 0.000 description 2
- 108091070374 Homo sapiens miR-24-2 stem-loop Proteins 0.000 description 2
- 108091070371 Homo sapiens miR-25 stem-loop Proteins 0.000 description 2
- 108091065428 Homo sapiens miR-26a-2 stem-loop Proteins 0.000 description 2
- 108091070399 Homo sapiens miR-26b stem-loop Proteins 0.000 description 2
- 108091070400 Homo sapiens miR-27a stem-loop Proteins 0.000 description 2
- 108091069018 Homo sapiens miR-27b stem-loop Proteins 0.000 description 2
- 108091070397 Homo sapiens miR-28 stem-loop Proteins 0.000 description 2
- 108091065453 Homo sapiens miR-296 stem-loop Proteins 0.000 description 2
- 108091065449 Homo sapiens miR-299 stem-loop Proteins 0.000 description 2
- 108091070398 Homo sapiens miR-29a stem-loop Proteins 0.000 description 2
- 108091068845 Homo sapiens miR-29b-2 stem-loop Proteins 0.000 description 2
- 108091065168 Homo sapiens miR-29c stem-loop Proteins 0.000 description 2
- 108091067255 Homo sapiens miR-302d stem-loop Proteins 0.000 description 2
- 108091072656 Homo sapiens miR-3065 stem-loop Proteins 0.000 description 2
- 108091072924 Homo sapiens miR-3074 stem-loop Proteins 0.000 description 2
- 108091070365 Homo sapiens miR-30a stem-loop Proteins 0.000 description 2
- 108091069021 Homo sapiens miR-30b stem-loop Proteins 0.000 description 2
- 108091067641 Homo sapiens miR-30c-2 stem-loop Proteins 0.000 description 2
- 108091067650 Homo sapiens miR-30d stem-loop Proteins 0.000 description 2
- 108091065436 Homo sapiens miR-30e stem-loop Proteins 0.000 description 2
- 108091070395 Homo sapiens miR-31 stem-loop Proteins 0.000 description 2
- 108091072914 Homo sapiens miR-3120 stem-loop Proteins 0.000 description 2
- 108091070383 Homo sapiens miR-32 stem-loop Proteins 0.000 description 2
- 108091067007 Homo sapiens miR-324 stem-loop Proteins 0.000 description 2
- 108091066902 Homo sapiens miR-330 stem-loop Proteins 0.000 description 2
- 108091066896 Homo sapiens miR-331 stem-loop Proteins 0.000 description 2
- 108091066985 Homo sapiens miR-335 stem-loop Proteins 0.000 description 2
- 108091067013 Homo sapiens miR-337 stem-loop Proteins 0.000 description 2
- 108091067010 Homo sapiens miR-338 stem-loop Proteins 0.000 description 2
- 108091066993 Homo sapiens miR-339 stem-loop Proteins 0.000 description 2
- 108091061640 Homo sapiens miR-33b stem-loop Proteins 0.000 description 2
- 108091066899 Homo sapiens miR-340 stem-loop Proteins 0.000 description 2
- 108091067008 Homo sapiens miR-342 stem-loop Proteins 0.000 description 2
- 108091067619 Homo sapiens miR-34a stem-loop Proteins 0.000 description 2
- 108091065451 Homo sapiens miR-34b stem-loop Proteins 0.000 description 2
- 108091065456 Homo sapiens miR-34c stem-loop Proteins 0.000 description 2
- 108091067258 Homo sapiens miR-361 stem-loop Proteins 0.000 description 2
- 108091067259 Homo sapiens miR-362 stem-loop Proteins 0.000 description 2
- 108091067286 Homo sapiens miR-363 stem-loop Proteins 0.000 description 2
- 108091067254 Homo sapiens miR-367 stem-loop Proteins 0.000 description 2
- 108091067253 Homo sapiens miR-369 stem-loop Proteins 0.000 description 2
- 108091067564 Homo sapiens miR-373 stem-loop Proteins 0.000 description 2
- 108091067566 Homo sapiens miR-374a stem-loop Proteins 0.000 description 2
- 108091086479 Homo sapiens miR-374b stem-loop Proteins 0.000 description 2
- 108091067563 Homo sapiens miR-376a-1 stem-loop Proteins 0.000 description 2
- 108091063912 Homo sapiens miR-376a-2 stem-loop Proteins 0.000 description 2
- 108091067243 Homo sapiens miR-377 stem-loop Proteins 0.000 description 2
- 108091067245 Homo sapiens miR-378a stem-loop Proteins 0.000 description 2
- 108091067552 Homo sapiens miR-379 stem-loop Proteins 0.000 description 2
- 108091067557 Homo sapiens miR-380 stem-loop Proteins 0.000 description 2
- 108091067543 Homo sapiens miR-382 stem-loop Proteins 0.000 description 2
- 108091032537 Homo sapiens miR-409 stem-loop Proteins 0.000 description 2
- 108091032109 Homo sapiens miR-423 stem-loop Proteins 0.000 description 2
- 108091032108 Homo sapiens miR-424 stem-loop Proteins 0.000 description 2
- 108091032103 Homo sapiens miR-425 stem-loop Proteins 0.000 description 2
- 108091086503 Homo sapiens miR-450b stem-loop Proteins 0.000 description 2
- 108091032542 Homo sapiens miR-452 stem-loop Proteins 0.000 description 2
- 108091062137 Homo sapiens miR-454 stem-loop Proteins 0.000 description 2
- 108091063813 Homo sapiens miR-455 stem-loop Proteins 0.000 description 2
- 108091093111 Homo sapiens miR-4732 stem-loop Proteins 0.000 description 2
- 108091053841 Homo sapiens miR-483 stem-loop Proteins 0.000 description 2
- 108091053840 Homo sapiens miR-486 stem-loop Proteins 0.000 description 2
- 108091059229 Homo sapiens miR-486-2 stem-loop Proteins 0.000 description 2
- 108091092229 Homo sapiens miR-491 stem-loop Proteins 0.000 description 2
- 108091092305 Homo sapiens miR-493 stem-loop Proteins 0.000 description 2
- 108091092303 Homo sapiens miR-497 stem-loop Proteins 0.000 description 2
- 108091064508 Homo sapiens miR-501 stem-loop Proteins 0.000 description 2
- 108091064509 Homo sapiens miR-502 stem-loop Proteins 0.000 description 2
- 108091064365 Homo sapiens miR-505 stem-loop Proteins 0.000 description 2
- 108091064362 Homo sapiens miR-508 stem-loop Proteins 0.000 description 2
- 108091064366 Homo sapiens miR-513a-1 stem-loop Proteins 0.000 description 2
- 108091064370 Homo sapiens miR-513a-2 stem-loop Proteins 0.000 description 2
- 108091064368 Homo sapiens miR-514a-1 stem-loop Proteins 0.000 description 2
- 108091064369 Homo sapiens miR-514a-2 stem-loop Proteins 0.000 description 2
- 108091063558 Homo sapiens miR-514a-3 stem-loop Proteins 0.000 description 2
- 108091092284 Homo sapiens miR-515-1 stem-loop Proteins 0.000 description 2
- 108091092278 Homo sapiens miR-515-2 stem-loop Proteins 0.000 description 2
- 108091064421 Homo sapiens miR-516b-1 stem-loop Proteins 0.000 description 2
- 108091064453 Homo sapiens miR-516b-2 stem-loop Proteins 0.000 description 2
- 108091064449 Homo sapiens miR-518e stem-loop Proteins 0.000 description 2
- 108091092280 Homo sapiens miR-519c stem-loop Proteins 0.000 description 2
- 108091063565 Homo sapiens miR-532 stem-loop Proteins 0.000 description 2
- 108091061666 Homo sapiens miR-542 stem-loop Proteins 0.000 description 2
- 108091063807 Homo sapiens miR-545 stem-loop Proteins 0.000 description 2
- 108091061685 Homo sapiens miR-550a-1 stem-loop Proteins 0.000 description 2
- 108091061593 Homo sapiens miR-550a-2 stem-loop Proteins 0.000 description 2
- 108091063728 Homo sapiens miR-551b stem-loop Proteins 0.000 description 2
- 108091063808 Homo sapiens miR-574 stem-loop Proteins 0.000 description 2
- 108091063721 Homo sapiens miR-576 stem-loop Proteins 0.000 description 2
- 108091063723 Homo sapiens miR-582 stem-loop Proteins 0.000 description 2
- 108091063772 Homo sapiens miR-589 stem-loop Proteins 0.000 description 2
- 108091061594 Homo sapiens miR-590 stem-loop Proteins 0.000 description 2
- 108091061599 Homo sapiens miR-593 stem-loop Proteins 0.000 description 2
- 108091061778 Homo sapiens miR-615 stem-loop Proteins 0.000 description 2
- 108091061622 Homo sapiens miR-628 stem-loop Proteins 0.000 description 2
- 108091061631 Homo sapiens miR-629 stem-loop Proteins 0.000 description 2
- 108091061629 Homo sapiens miR-642a stem-loop Proteins 0.000 description 2
- 108091044602 Homo sapiens miR-664 stem-loop Proteins 0.000 description 2
- 108091086709 Homo sapiens miR-675 stem-loop Proteins 0.000 description 2
- 108091067630 Homo sapiens miR-7-2 stem-loop Proteins 0.000 description 2
- 108091086460 Homo sapiens miR-708 stem-loop Proteins 0.000 description 2
- 108091086454 Homo sapiens miR-744 stem-loop Proteins 0.000 description 2
- 108091062100 Homo sapiens miR-769 stem-loop Proteins 0.000 description 2
- 108091086647 Homo sapiens miR-877 stem-loop Proteins 0.000 description 2
- 108091063740 Homo sapiens miR-92b stem-loop Proteins 0.000 description 2
- 108091070377 Homo sapiens miR-93 stem-loop Proteins 0.000 description 2
- 108091070376 Homo sapiens miR-96 stem-loop Proteins 0.000 description 2
- 108091068854 Homo sapiens miR-99a stem-loop Proteins 0.000 description 2
- 108091065457 Homo sapiens miR-99b stem-loop Proteins 0.000 description 2
- 108091006905 Human Serum Albumin Proteins 0.000 description 2
- 102000008100 Human Serum Albumin Human genes 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 description 2
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 108060001084 Luciferase Proteins 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- 206010025323 Lymphomas Diseases 0.000 description 2
- 108091008060 MIR10A Proteins 0.000 description 2
- 108091008051 MIR27A Proteins 0.000 description 2
- 108091007424 MIR27B Proteins 0.000 description 2
- 108091030146 MiRBase Proteins 0.000 description 2
- 241000714177 Murine leukemia virus Species 0.000 description 2
- 229930193140 Neomycin Natural products 0.000 description 2
- 238000011529 RT qPCR Methods 0.000 description 2
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 2
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- 101150052863 THY1 gene Proteins 0.000 description 2
- 230000001464 adherent effect Effects 0.000 description 2
- 102000019997 adhesion receptor Human genes 0.000 description 2
- 108010013985 adhesion receptor Proteins 0.000 description 2
- 210000001789 adipocyte Anatomy 0.000 description 2
- 210000000577 adipose tissue Anatomy 0.000 description 2
- 230000000735 allogeneic effect Effects 0.000 description 2
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 2
- 210000001130 astrocyte Anatomy 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 2
- 238000010804 cDNA synthesis Methods 0.000 description 2
- 230000000711 cancerogenic effect Effects 0.000 description 2
- 231100000315 carcinogenic Toxicity 0.000 description 2
- 230000021164 cell adhesion Effects 0.000 description 2
- 239000002458 cell surface marker Substances 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 210000001612 chondrocyte Anatomy 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 230000003021 clonogenic effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 239000003184 complementary RNA Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 210000004700 fetal blood Anatomy 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 238000007710 freezing Methods 0.000 description 2
- 230000008014 freezing Effects 0.000 description 2
- 230000033581 fucosylation Effects 0.000 description 2
- 229930182830 galactose Natural products 0.000 description 2
- 206010017758 gastric cancer Diseases 0.000 description 2
- 210000004602 germ cell Anatomy 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 2
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 2
- 210000002216 heart Anatomy 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 210000003494 hepatocyte Anatomy 0.000 description 2
- 229920002674 hyaluronan Polymers 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 210000002510 keratinocyte Anatomy 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 208000032839 leukemia Diseases 0.000 description 2
- 210000003041 ligament Anatomy 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 239000011159 matrix material Substances 0.000 description 2
- 239000013028 medium composition Substances 0.000 description 2
- 210000005087 mononuclear cell Anatomy 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 210000004165 myocardium Anatomy 0.000 description 2
- 230000017095 negative regulation of cell growth Effects 0.000 description 2
- 229960004927 neomycin Drugs 0.000 description 2
- 230000001537 neural effect Effects 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- 108091027963 non-coding RNA Proteins 0.000 description 2
- 102000042567 non-coding RNA Human genes 0.000 description 2
- 210000004248 oligodendroglia Anatomy 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 210000003668 pericyte Anatomy 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 208000017805 post-transplant lymphoproliferative disease Diseases 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000001177 retroviral effect Effects 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 2
- 210000002027 skeletal muscle Anatomy 0.000 description 2
- 210000003491 skin Anatomy 0.000 description 2
- 201000011549 stomach cancer Diseases 0.000 description 2
- 210000002536 stromal cell Anatomy 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 102000035160 transmembrane proteins Human genes 0.000 description 2
- 108091005703 transmembrane proteins Proteins 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- WEYNBWVKOYCCQT-UHFFFAOYSA-N 1-(3-chloro-4-methylphenyl)-3-{2-[({5-[(dimethylamino)methyl]-2-furyl}methyl)thio]ethyl}urea Chemical compound O1C(CN(C)C)=CC=C1CSCCNC(=O)NC1=CC=C(C)C(Cl)=C1 WEYNBWVKOYCCQT-UHFFFAOYSA-N 0.000 description 1
- AEQDJSLRWYMAQI-UHFFFAOYSA-N 2,3,9,10-tetramethoxy-6,8,13,13a-tetrahydro-5H-isoquinolino[2,1-b]isoquinoline Chemical compound C1CN2CC(C(=C(OC)C=C3)OC)=C3CC2C2=C1C=C(OC)C(OC)=C2 AEQDJSLRWYMAQI-UHFFFAOYSA-N 0.000 description 1
- BDKLKNJTMLIAFE-UHFFFAOYSA-N 2-(3-fluorophenyl)-1,3-oxazole-4-carbaldehyde Chemical compound FC1=CC=CC(C=2OC=C(C=O)N=2)=C1 BDKLKNJTMLIAFE-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 1
- YRNWIFYIFSBPAU-UHFFFAOYSA-N 4-[4-(dimethylamino)phenyl]-n,n-dimethylaniline Chemical compound C1=CC(N(C)C)=CC=C1C1=CC=C(N(C)C)C=C1 YRNWIFYIFSBPAU-UHFFFAOYSA-N 0.000 description 1
- 102100027278 4-trimethylaminobutyraldehyde dehydrogenase Human genes 0.000 description 1
- 239000013607 AAV vector Substances 0.000 description 1
- 208000002008 AIDS-Related Lymphoma Diseases 0.000 description 1
- 102100021222 ATP-dependent Clp protease proteolytic subunit, mitochondrial Human genes 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 241000702423 Adeno-associated virus - 2 Species 0.000 description 1
- 241000202702 Adeno-associated virus - 3 Species 0.000 description 1
- 241000580270 Adeno-associated virus - 4 Species 0.000 description 1
- 241001634120 Adeno-associated virus - 5 Species 0.000 description 1
- 241000972680 Adeno-associated virus - 6 Species 0.000 description 1
- 241001164823 Adeno-associated virus - 7 Species 0.000 description 1
- 241001164825 Adeno-associated virus - 8 Species 0.000 description 1
- 241000649045 Adeno-associated virus 10 Species 0.000 description 1
- 241000649046 Adeno-associated virus 11 Species 0.000 description 1
- 241000649047 Adeno-associated virus 12 Species 0.000 description 1
- 241000300529 Adeno-associated virus 13 Species 0.000 description 1
- 101710137115 Adenylyl cyclase-associated protein 1 Proteins 0.000 description 1
- 102100027714 Alpha-(1,3)-fucosyltransferase 10 Human genes 0.000 description 1
- 102100027726 Alpha-(1,3)-fucosyltransferase 11 Human genes 0.000 description 1
- 102100023635 Alpha-fetoprotein Human genes 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 244000105975 Antidesma platyphyllum Species 0.000 description 1
- 102100035526 B melanoma antigen 1 Human genes 0.000 description 1
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 description 1
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 1
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 1
- 102100021663 Baculoviral IAP repeat-containing protein 5 Human genes 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 108091007914 CDKs Proteins 0.000 description 1
- 238000010354 CRISPR gene editing Methods 0.000 description 1
- 101100438971 Caenorhabditis elegans mat-1 gene Proteins 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 102100039510 Cancer/testis antigen 2 Human genes 0.000 description 1
- 102100026548 Caspase-8 Human genes 0.000 description 1
- 108090000538 Caspase-8 Proteins 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- VPAXJOUATWLOPR-UHFFFAOYSA-N Conferone Chemical compound C1=CC(=O)OC2=CC(OCC3C4(C)CCC(=O)C(C)(C)C4CC=C3C)=CC=C21 VPAXJOUATWLOPR-UHFFFAOYSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- HMFHBZSHGGEWLO-SOOFDHNKSA-N D-ribofuranose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H]1O HMFHBZSHGGEWLO-SOOFDHNKSA-N 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- 101100118093 Drosophila melanogaster eEF1alpha2 gene Proteins 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 101150029662 E1 gene Proteins 0.000 description 1
- 101150005585 E3 gene Proteins 0.000 description 1
- 102100021811 E3 ubiquitin-protein ligase RNF5 Human genes 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 102100023794 ETS domain-containing protein Elk-3 Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 108700039887 Essential Genes Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- 102100029378 Follistatin-related protein 1 Human genes 0.000 description 1
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 description 1
- LQEBEXMHBLQMDB-UHFFFAOYSA-N GDP-L-fucose Natural products OC1C(O)C(O)C(C)OC1OP(O)(=O)OP(O)(=O)OCC1C(O)C(O)C(N2C3=C(C(N=C(N)N3)=O)N=C2)O1 LQEBEXMHBLQMDB-UHFFFAOYSA-N 0.000 description 1
- LQEBEXMHBLQMDB-JGQUBWHWSA-N GDP-beta-L-fucose Chemical compound O[C@H]1[C@H](O)[C@H](O)[C@H](C)O[C@@H]1OP(O)(=O)OP(O)(=O)OC[C@@H]1[C@@H](O)[C@@H](O)[C@H](N2C3=C(C(NC(N)=N3)=O)N=C2)O1 LQEBEXMHBLQMDB-JGQUBWHWSA-N 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- 208000031852 Gastrointestinal stromal cancer Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 239000006173 Good's buffer Substances 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 102100032510 Heat shock protein HSP 90-beta Human genes 0.000 description 1
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 1
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 1
- 101000836407 Homo sapiens 4-trimethylaminobutyraldehyde dehydrogenase Proteins 0.000 description 1
- 101000750222 Homo sapiens ATP-dependent Clp protease proteolytic subunit, mitochondrial Proteins 0.000 description 1
- 101000756632 Homo sapiens Actin, cytoplasmic 1 Proteins 0.000 description 1
- 101000574445 Homo sapiens Alkaline phosphatase, tissue-nonspecific isozyme Proteins 0.000 description 1
- 101000874316 Homo sapiens B melanoma antigen 1 Proteins 0.000 description 1
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 1
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 1
- 101000889345 Homo sapiens Cancer/testis antigen 2 Proteins 0.000 description 1
- 101000914324 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 5 Proteins 0.000 description 1
- 101000914321 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 7 Proteins 0.000 description 1
- 101000916489 Homo sapiens Chondroitin sulfate proteoglycan 4 Proteins 0.000 description 1
- 101001107084 Homo sapiens E3 ubiquitin-protein ligase RNF5 Proteins 0.000 description 1
- 101001062535 Homo sapiens Follistatin-related protein 1 Proteins 0.000 description 1
- 101001016856 Homo sapiens Heat shock protein HSP 90-beta Proteins 0.000 description 1
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 1
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 1
- 101001078133 Homo sapiens Integrin alpha-2 Proteins 0.000 description 1
- 101000994378 Homo sapiens Integrin alpha-3 Proteins 0.000 description 1
- 101000994375 Homo sapiens Integrin alpha-4 Proteins 0.000 description 1
- 101000994369 Homo sapiens Integrin alpha-5 Proteins 0.000 description 1
- 101001046677 Homo sapiens Integrin alpha-V Proteins 0.000 description 1
- 101000935043 Homo sapiens Integrin beta-1 Proteins 0.000 description 1
- 101001015004 Homo sapiens Integrin beta-3 Proteins 0.000 description 1
- 101001015059 Homo sapiens Integrin beta-5 Proteins 0.000 description 1
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 1
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 1
- 101000579123 Homo sapiens Phosphoglycerate kinase 1 Proteins 0.000 description 1
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 description 1
- 101000617725 Homo sapiens Pregnancy-specific beta-1-glycoprotein 2 Proteins 0.000 description 1
- 101000874141 Homo sapiens Probable ATP-dependent RNA helicase DDX43 Proteins 0.000 description 1
- 101001109419 Homo sapiens RNA-binding protein NOB1 Proteins 0.000 description 1
- 101000695537 Homo sapiens Synaptophysin-like protein 1 Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 1
- 101000813738 Homo sapiens Transcription factor ETV6 Proteins 0.000 description 1
- 108091070522 Homo sapiens let-7a-2 stem-loop Proteins 0.000 description 1
- 108091070511 Homo sapiens let-7c stem-loop Proteins 0.000 description 1
- 108091070510 Homo sapiens let-7f-1 stem-loop Proteins 0.000 description 1
- 108091065458 Homo sapiens miR-101-2 stem-loop Proteins 0.000 description 1
- 108091068855 Homo sapiens miR-103a-1 stem-loop Proteins 0.000 description 1
- 108091051935 Homo sapiens miR-103b-1 stem-loop Proteins 0.000 description 1
- 108091051929 Homo sapiens miR-103b-2 stem-loop Proteins 0.000 description 1
- 108091068943 Homo sapiens miR-105-1 stem-loop Proteins 0.000 description 1
- 108091068938 Homo sapiens miR-105-2 stem-loop Proteins 0.000 description 1
- 108091068928 Homo sapiens miR-107 stem-loop Proteins 0.000 description 1
- 108091045832 Homo sapiens miR-1178 stem-loop Proteins 0.000 description 1
- 108091045833 Homo sapiens miR-1179 stem-loop Proteins 0.000 description 1
- 108091045823 Homo sapiens miR-1180 stem-loop Proteins 0.000 description 1
- 108091045825 Homo sapiens miR-1181 stem-loop Proteins 0.000 description 1
- 108091045827 Homo sapiens miR-1182 stem-loop Proteins 0.000 description 1
- 108091045829 Homo sapiens miR-1183 stem-loop Proteins 0.000 description 1
- 108091045820 Homo sapiens miR-1184-1 stem-loop Proteins 0.000 description 1
- 108091034012 Homo sapiens miR-1184-2 stem-loop Proteins 0.000 description 1
- 108091034015 Homo sapiens miR-1184-3 stem-loop Proteins 0.000 description 1
- 108091062191 Homo sapiens miR-1185-1 stem-loop Proteins 0.000 description 1
- 108091062138 Homo sapiens miR-1185-2 stem-loop Proteins 0.000 description 1
- 108091044907 Homo sapiens miR-1204 stem-loop Proteins 0.000 description 1
- 108091044803 Homo sapiens miR-1207 stem-loop Proteins 0.000 description 1
- 108091044804 Homo sapiens miR-1208 stem-loop Proteins 0.000 description 1
- 108091060466 Homo sapiens miR-1224 stem-loop Proteins 0.000 description 1
- 108091044923 Homo sapiens miR-1226 stem-loop Proteins 0.000 description 1
- 108091044926 Homo sapiens miR-1227 stem-loop Proteins 0.000 description 1
- 108091044953 Homo sapiens miR-1228 stem-loop Proteins 0.000 description 1
- 108091044954 Homo sapiens miR-1229 stem-loop Proteins 0.000 description 1
- 108091044940 Homo sapiens miR-1231 stem-loop Proteins 0.000 description 1
- 108091069019 Homo sapiens miR-124-1 stem-loop Proteins 0.000 description 1
- 108091069008 Homo sapiens miR-124-2 stem-loop Proteins 0.000 description 1
- 108091069007 Homo sapiens miR-124-3 stem-loop Proteins 0.000 description 1
- 108091044880 Homo sapiens miR-1245a stem-loop Proteins 0.000 description 1
- 108091044881 Homo sapiens miR-1246 stem-loop Proteins 0.000 description 1
- 108091044697 Homo sapiens miR-1249 stem-loop Proteins 0.000 description 1
- 108091044878 Homo sapiens miR-1251 stem-loop Proteins 0.000 description 1
- 108091044588 Homo sapiens miR-1252 stem-loop Proteins 0.000 description 1
- 108091044693 Homo sapiens miR-1253 stem-loop Proteins 0.000 description 1
- 108091044694 Homo sapiens miR-1255a stem-loop Proteins 0.000 description 1
- 108091044620 Homo sapiens miR-1255b-1 stem-loop Proteins 0.000 description 1
- 108091044621 Homo sapiens miR-1255b-2 stem-loop Proteins 0.000 description 1
- 108091069006 Homo sapiens miR-125b-1 stem-loop Proteins 0.000 description 1
- 108091069085 Homo sapiens miR-126 stem-loop Proteins 0.000 description 1
- 108091044862 Homo sapiens miR-1260a stem-loop Proteins 0.000 description 1
- 108091072927 Homo sapiens miR-1260b stem-loop Proteins 0.000 description 1
- 108091044868 Homo sapiens miR-1262 stem-loop Proteins 0.000 description 1
- 108091044860 Homo sapiens miR-1263 stem-loop Proteins 0.000 description 1
- 108091044761 Homo sapiens miR-1265 stem-loop Proteins 0.000 description 1
- 108091044759 Homo sapiens miR-1268a stem-loop Proteins 0.000 description 1
- 108091069086 Homo sapiens miR-127 stem-loop Proteins 0.000 description 1
- 108091044764 Homo sapiens miR-1270 stem-loop Proteins 0.000 description 1
- 108091044765 Homo sapiens miR-1272 stem-loop Proteins 0.000 description 1
- 108091044777 Homo sapiens miR-1275 stem-loop Proteins 0.000 description 1
- 108091044768 Homo sapiens miR-1276 stem-loop Proteins 0.000 description 1
- 108091044774 Homo sapiens miR-1277 stem-loop Proteins 0.000 description 1
- 108091044612 Homo sapiens miR-1278 stem-loop Proteins 0.000 description 1
- 108091044802 Homo sapiens miR-1285-1 stem-loop Proteins 0.000 description 1
- 108091044837 Homo sapiens miR-1285-2 stem-loop Proteins 0.000 description 1
- 108091044829 Homo sapiens miR-1286 stem-loop Proteins 0.000 description 1
- 108091044798 Homo sapiens miR-1287 stem-loop Proteins 0.000 description 1
- 108091069093 Homo sapiens miR-129-2 stem-loop Proteins 0.000 description 1
- 108091044586 Homo sapiens miR-1292 stem-loop Proteins 0.000 description 1
- 108091044790 Homo sapiens miR-1293 stem-loop Proteins 0.000 description 1
- 108091062151 Homo sapiens miR-1301 stem-loop Proteins 0.000 description 1
- 108091044964 Homo sapiens miR-1302-1 stem-loop Proteins 0.000 description 1
- 108091033925 Homo sapiens miR-1302-10 stem-loop Proteins 0.000 description 1
- 108091033832 Homo sapiens miR-1302-11 stem-loop Proteins 0.000 description 1
- 108091044965 Homo sapiens miR-1302-2 stem-loop Proteins 0.000 description 1
- 108091044966 Homo sapiens miR-1302-3 stem-loop Proteins 0.000 description 1
- 108091044969 Homo sapiens miR-1302-4 stem-loop Proteins 0.000 description 1
- 108091044970 Homo sapiens miR-1302-5 stem-loop Proteins 0.000 description 1
- 108091044961 Homo sapiens miR-1302-6 stem-loop Proteins 0.000 description 1
- 108091044962 Homo sapiens miR-1302-7 stem-loop Proteins 0.000 description 1
- 108091044968 Homo sapiens miR-1302-8 stem-loop Proteins 0.000 description 1
- 108091033923 Homo sapiens miR-1302-9 stem-loop Proteins 0.000 description 1
- 108091044974 Homo sapiens miR-1303 stem-loop Proteins 0.000 description 1
- 108091044980 Homo sapiens miR-1305 stem-loop Proteins 0.000 description 1
- 108091045232 Homo sapiens miR-1321 stem-loop Proteins 0.000 description 1
- 108091060456 Homo sapiens miR-1323 stem-loop Proteins 0.000 description 1
- 108091045230 Homo sapiens miR-1324 stem-loop Proteins 0.000 description 1
- 108091069094 Homo sapiens miR-134 stem-loop Proteins 0.000 description 1
- 108091068986 Homo sapiens miR-135a-2 stem-loop Proteins 0.000 description 1
- 108091068985 Homo sapiens miR-137 stem-loop Proteins 0.000 description 1
- 108091069092 Homo sapiens miR-138-1 stem-loop Proteins 0.000 description 1
- 108091068991 Homo sapiens miR-141 stem-loop Proteins 0.000 description 1
- 108091060454 Homo sapiens miR-1468 stem-loop Proteins 0.000 description 1
- 108091069089 Homo sapiens miR-146a stem-loop Proteins 0.000 description 1
- 108091068997 Homo sapiens miR-152 stem-loop Proteins 0.000 description 1
- 108091051957 Homo sapiens miR-1538 stem-loop Proteins 0.000 description 1
- 108091051930 Homo sapiens miR-1539 stem-loop Proteins 0.000 description 1
- 108091065989 Homo sapiens miR-181b-2 stem-loop Proteins 0.000 description 1
- 108091067627 Homo sapiens miR-182 stem-loop Proteins 0.000 description 1
- 108091078047 Homo sapiens miR-1827 stem-loop Proteins 0.000 description 1
- 108091068958 Homo sapiens miR-184 stem-loop Proteins 0.000 description 1
- 108091069033 Homo sapiens miR-188 stem-loop Proteins 0.000 description 1
- 108091079269 Homo sapiens miR-1909 stem-loop Proteins 0.000 description 1
- 108091079265 Homo sapiens miR-1915 stem-loop Proteins 0.000 description 1
- 108091068957 Homo sapiens miR-194-1 stem-loop Proteins 0.000 description 1
- 108091065167 Homo sapiens miR-194-2 stem-loop Proteins 0.000 description 1
- 108091067983 Homo sapiens miR-196a-1 stem-loop Proteins 0.000 description 1
- 108091033120 Homo sapiens miR-196b stem-loop Proteins 0.000 description 1
- 108091067982 Homo sapiens miR-197 stem-loop Proteins 0.000 description 1
- 108091067677 Homo sapiens miR-198 stem-loop Proteins 0.000 description 1
- 108091070519 Homo sapiens miR-19b-1 stem-loop Proteins 0.000 description 1
- 108091070495 Homo sapiens miR-19b-2 stem-loop Proteins 0.000 description 1
- 108091023104 Homo sapiens miR-203b stem-loop Proteins 0.000 description 1
- 108091067470 Homo sapiens miR-204 stem-loop Proteins 0.000 description 1
- 108091067482 Homo sapiens miR-205 stem-loop Proteins 0.000 description 1
- 108091069013 Homo sapiens miR-206 stem-loop Proteins 0.000 description 1
- 108091067468 Homo sapiens miR-210 stem-loop Proteins 0.000 description 1
- 108091090543 Homo sapiens miR-2110 stem-loop Proteins 0.000 description 1
- 108091067466 Homo sapiens miR-212 stem-loop Proteins 0.000 description 1
- 108091067578 Homo sapiens miR-215 stem-loop Proteins 0.000 description 1
- 108091067581 Homo sapiens miR-216a stem-loop Proteins 0.000 description 1
- 108091067465 Homo sapiens miR-217 stem-loop Proteins 0.000 description 1
- 108091035128 Homo sapiens miR-2355 stem-loop Proteins 0.000 description 1
- 108091070492 Homo sapiens miR-23a stem-loop Proteins 0.000 description 1
- 108091070373 Homo sapiens miR-24-1 stem-loop Proteins 0.000 description 1
- 108091070372 Homo sapiens miR-26a-1 stem-loop Proteins 0.000 description 1
- 108091048552 Homo sapiens miR-2909 stem-loop Proteins 0.000 description 1
- 108091086975 Homo sapiens miR-297 stem-loop Proteins 0.000 description 1
- 108091086636 Homo sapiens miR-298 stem-loop Proteins 0.000 description 1
- 108091068837 Homo sapiens miR-29b-1 stem-loop Proteins 0.000 description 1
- 108091065454 Homo sapiens miR-301a stem-loop Proteins 0.000 description 1
- 108091065459 Homo sapiens miR-302a stem-loop Proteins 0.000 description 1
- 108091067250 Homo sapiens miR-302b stem-loop Proteins 0.000 description 1
- 108091067264 Homo sapiens miR-302c stem-loop Proteins 0.000 description 1
- 108091044773 Homo sapiens miR-302f stem-loop Proteins 0.000 description 1
- 108091093174 Homo sapiens miR-3064 stem-loop Proteins 0.000 description 1
- 108091065163 Homo sapiens miR-30c-1 stem-loop Proteins 0.000 description 1
- 108091072670 Homo sapiens miR-3184 stem-loop Proteins 0.000 description 1
- 108091060457 Homo sapiens miR-320b-1 stem-loop Proteins 0.000 description 1
- 108091062096 Homo sapiens miR-320b-2 stem-loop Proteins 0.000 description 1
- 108091060471 Homo sapiens miR-320c-1 stem-loop Proteins 0.000 description 1
- 108091078079 Homo sapiens miR-320c-2 stem-loop Proteins 0.000 description 1
- 108091067006 Homo sapiens miR-323a stem-loop Proteins 0.000 description 1
- 108091072697 Homo sapiens miR-323b stem-loop Proteins 0.000 description 1
- 108091066988 Homo sapiens miR-325 stem-loop Proteins 0.000 description 1
- 108091067011 Homo sapiens miR-326 stem-loop Proteins 0.000 description 1
- 108091067005 Homo sapiens miR-328 stem-loop Proteins 0.000 description 1
- 108091070382 Homo sapiens miR-33a stem-loop Proteins 0.000 description 1
- 108091066987 Homo sapiens miR-345 stem-loop Proteins 0.000 description 1
- 108091066970 Homo sapiens miR-346 stem-loop Proteins 0.000 description 1
- 108091056757 Homo sapiens miR-3613 stem-loop Proteins 0.000 description 1
- 108091056759 Homo sapiens miR-3615 stem-loop Proteins 0.000 description 1
- 108091056758 Homo sapiens miR-3619 stem-loop Proteins 0.000 description 1
- 108091067260 Homo sapiens miR-365a stem-loop Proteins 0.000 description 1
- 108091067267 Homo sapiens miR-370 stem-loop Proteins 0.000 description 1
- 108091067269 Homo sapiens miR-371a stem-loop Proteins 0.000 description 1
- 108091067570 Homo sapiens miR-372 stem-loop Proteins 0.000 description 1
- 108091067535 Homo sapiens miR-375 stem-loop Proteins 0.000 description 1
- 108091053844 Homo sapiens miR-376b stem-loop Proteins 0.000 description 1
- 108091067272 Homo sapiens miR-376c stem-loop Proteins 0.000 description 1
- 108091035136 Homo sapiens miR-378c stem-loop Proteins 0.000 description 1
- 108091055551 Homo sapiens miR-378d-1 stem-loop Proteins 0.000 description 1
- 108091062186 Homo sapiens miR-378d-2 stem-loop Proteins 0.000 description 1
- 108091067554 Homo sapiens miR-381 stem-loop Proteins 0.000 description 1
- 108091067545 Homo sapiens miR-383 stem-loop Proteins 0.000 description 1
- 108091033149 Homo sapiens miR-384 stem-loop Proteins 0.000 description 1
- 108091056164 Homo sapiens miR-3912 stem-loop Proteins 0.000 description 1
- 108091055993 Homo sapiens miR-3928 stem-loop Proteins 0.000 description 1
- 108091053847 Homo sapiens miR-410 stem-loop Proteins 0.000 description 1
- 108091053842 Homo sapiens miR-412 stem-loop Proteins 0.000 description 1
- 108091061665 Homo sapiens miR-421 stem-loop Proteins 0.000 description 1
- 108091032093 Homo sapiens miR-422a stem-loop Proteins 0.000 description 1
- 108091032930 Homo sapiens miR-429 stem-loop Proteins 0.000 description 1
- 108091034087 Homo sapiens miR-4291 stem-loop Proteins 0.000 description 1
- 108091032638 Homo sapiens miR-431 stem-loop Proteins 0.000 description 1
- 108091092306 Homo sapiens miR-432 stem-loop Proteins 0.000 description 1
- 108091032636 Homo sapiens miR-433 stem-loop Proteins 0.000 description 1
- 108091055476 Homo sapiens miR-4421 stem-loop Proteins 0.000 description 1
- 108091032929 Homo sapiens miR-449a stem-loop Proteins 0.000 description 1
- 108091055251 Homo sapiens miR-4505 stem-loop Proteins 0.000 description 1
- 108091032793 Homo sapiens miR-450a-1 stem-loop Proteins 0.000 description 1
- 108091064510 Homo sapiens miR-450a-2 stem-loop Proteins 0.000 description 1
- 108091055174 Homo sapiens miR-4510 stem-loop Proteins 0.000 description 1
- 108091055320 Homo sapiens miR-4516 stem-loop Proteins 0.000 description 1
- 108091032683 Homo sapiens miR-451a stem-loop Proteins 0.000 description 1
- 108091054144 Homo sapiens miR-4533 stem-loop Proteins 0.000 description 1
- 108091054141 Homo sapiens miR-4539 stem-loop Proteins 0.000 description 1
- 108091023266 Homo sapiens miR-4634 stem-loop Proteins 0.000 description 1
- 108091093190 Homo sapiens miR-4747 stem-loop Proteins 0.000 description 1
- 108091053854 Homo sapiens miR-484 stem-loop Proteins 0.000 description 1
- 108091053855 Homo sapiens miR-485 stem-loop Proteins 0.000 description 1
- 108091092227 Homo sapiens miR-489 stem-loop Proteins 0.000 description 1
- 108091092228 Homo sapiens miR-490 stem-loop Proteins 0.000 description 1
- 108091092304 Homo sapiens miR-492 stem-loop Proteins 0.000 description 1
- 108091092307 Homo sapiens miR-494 stem-loop Proteins 0.000 description 1
- 108091092297 Homo sapiens miR-495 stem-loop Proteins 0.000 description 1
- 108091092298 Homo sapiens miR-496 stem-loop Proteins 0.000 description 1
- 108091092282 Homo sapiens miR-498 stem-loop Proteins 0.000 description 1
- 108091064506 Homo sapiens miR-499a stem-loop Proteins 0.000 description 1
- 108091064507 Homo sapiens miR-500a stem-loop Proteins 0.000 description 1
- 108091064515 Homo sapiens miR-503 stem-loop Proteins 0.000 description 1
- 108091064516 Homo sapiens miR-504 stem-loop Proteins 0.000 description 1
- 108091064363 Homo sapiens miR-506 stem-loop Proteins 0.000 description 1
- 108091064367 Homo sapiens miR-509-1 stem-loop Proteins 0.000 description 1
- 108091086508 Homo sapiens miR-509-2 stem-loop Proteins 0.000 description 1
- 108091087072 Homo sapiens miR-509-3 stem-loop Proteins 0.000 description 1
- 108091092230 Homo sapiens miR-511 stem-loop Proteins 0.000 description 1
- 108091092274 Homo sapiens miR-512-1 stem-loop Proteins 0.000 description 1
- 108091092275 Homo sapiens miR-512-2 stem-loop Proteins 0.000 description 1
- 108091064445 Homo sapiens miR-517a stem-loop Proteins 0.000 description 1
- 108091064420 Homo sapiens miR-518a-1 stem-loop Proteins 0.000 description 1
- 108091064422 Homo sapiens miR-518a-2 stem-loop Proteins 0.000 description 1
- 108091064470 Homo sapiens miR-518b stem-loop Proteins 0.000 description 1
- 108091064466 Homo sapiens miR-518f stem-loop Proteins 0.000 description 1
- 108091064427 Homo sapiens miR-519a-1 stem-loop Proteins 0.000 description 1
- 108091064474 Homo sapiens miR-519b stem-loop Proteins 0.000 description 1
- 108091092285 Homo sapiens miR-519e stem-loop Proteins 0.000 description 1
- 108091064467 Homo sapiens miR-520c stem-loop Proteins 0.000 description 1
- 108091064423 Homo sapiens miR-520h stem-loop Proteins 0.000 description 1
- 108091064426 Homo sapiens miR-522 stem-loop Proteins 0.000 description 1
- 108091064465 Homo sapiens miR-523 stem-loop Proteins 0.000 description 1
- 108091064471 Homo sapiens miR-525 stem-loop Proteins 0.000 description 1
- 108091063810 Homo sapiens miR-539 stem-loop Proteins 0.000 description 1
- 108091086504 Homo sapiens miR-541 stem-loop Proteins 0.000 description 1
- 108091086476 Homo sapiens miR-543 stem-loop Proteins 0.000 description 1
- 108091063773 Homo sapiens miR-548a-1 stem-loop Proteins 0.000 description 1
- 108091063768 Homo sapiens miR-548a-2 stem-loop Proteins 0.000 description 1
- 108091061687 Homo sapiens miR-548a-3 stem-loop Proteins 0.000 description 1
- 108091061614 Homo sapiens miR-548d-1 stem-loop Proteins 0.000 description 1
- 108091061568 Homo sapiens miR-548d-2 stem-loop Proteins 0.000 description 1
- 108091044615 Homo sapiens miR-548i-1 stem-loop Proteins 0.000 description 1
- 108091044616 Homo sapiens miR-548i-2 stem-loop Proteins 0.000 description 1
- 108091044617 Homo sapiens miR-548i-3 stem-loop Proteins 0.000 description 1
- 108091044611 Homo sapiens miR-548i-4 stem-loop Proteins 0.000 description 1
- 108091044760 Homo sapiens miR-548m stem-loop Proteins 0.000 description 1
- 108091060472 Homo sapiens miR-550a-3 stem-loop Proteins 0.000 description 1
- 108091063755 Homo sapiens miR-552 stem-loop Proteins 0.000 description 1
- 108091063758 Homo sapiens miR-553 stem-loop Proteins 0.000 description 1
- 108091063756 Homo sapiens miR-554 stem-loop Proteins 0.000 description 1
- 108091063735 Homo sapiens miR-557 stem-loop Proteins 0.000 description 1
- 108091063748 Homo sapiens miR-563 stem-loop Proteins 0.000 description 1
- 108091063727 Homo sapiens miR-564 stem-loop Proteins 0.000 description 1
- 108091063731 Homo sapiens miR-567 stem-loop Proteins 0.000 description 1
- 108091063732 Homo sapiens miR-569 stem-loop Proteins 0.000 description 1
- 108091063733 Homo sapiens miR-570 stem-loop Proteins 0.000 description 1
- 108091063730 Homo sapiens miR-571 stem-loop Proteins 0.000 description 1
- 108091063726 Homo sapiens miR-572 stem-loop Proteins 0.000 description 1
- 108091063720 Homo sapiens miR-575 stem-loop Proteins 0.000 description 1
- 108091063716 Homo sapiens miR-577 stem-loop Proteins 0.000 description 1
- 108091063717 Homo sapiens miR-578 stem-loop Proteins 0.000 description 1
- 108091063719 Homo sapiens miR-580 stem-loop Proteins 0.000 description 1
- 108091063764 Homo sapiens miR-583 stem-loop Proteins 0.000 description 1
- 108091063765 Homo sapiens miR-584 stem-loop Proteins 0.000 description 1
- 108091063769 Homo sapiens miR-585 stem-loop Proteins 0.000 description 1
- 108091063771 Homo sapiens miR-586 stem-loop Proteins 0.000 description 1
- 108091061597 Homo sapiens miR-595 stem-loop Proteins 0.000 description 1
- 108091061783 Homo sapiens miR-598 stem-loop Proteins 0.000 description 1
- 108091061683 Homo sapiens miR-601 stem-loop Proteins 0.000 description 1
- 108091061684 Homo sapiens miR-602 stem-loop Proteins 0.000 description 1
- 108091061789 Homo sapiens miR-603 stem-loop Proteins 0.000 description 1
- 108091061689 Homo sapiens miR-605 stem-loop Proteins 0.000 description 1
- 108091061690 Homo sapiens miR-606 stem-loop Proteins 0.000 description 1
- 108091061775 Homo sapiens miR-608 stem-loop Proteins 0.000 description 1
- 108091061772 Homo sapiens miR-609 stem-loop Proteins 0.000 description 1
- 108091061777 Homo sapiens miR-611 stem-loop Proteins 0.000 description 1
- 108091061780 Homo sapiens miR-612 stem-loop Proteins 0.000 description 1
- 108091061781 Homo sapiens miR-613 stem-loop Proteins 0.000 description 1
- 108091061779 Homo sapiens miR-616 stem-loop Proteins 0.000 description 1
- 108091061645 Homo sapiens miR-618 stem-loop Proteins 0.000 description 1
- 108091061646 Homo sapiens miR-619 stem-loop Proteins 0.000 description 1
- 108091061650 Homo sapiens miR-620 stem-loop Proteins 0.000 description 1
- 108091061653 Homo sapiens miR-623 stem-loop Proteins 0.000 description 1
- 108091061649 Homo sapiens miR-625 stem-loop Proteins 0.000 description 1
- 108091061633 Homo sapiens miR-626 stem-loop Proteins 0.000 description 1
- 108091061621 Homo sapiens miR-627 stem-loop Proteins 0.000 description 1
- 108091061636 Homo sapiens miR-630 stem-loop Proteins 0.000 description 1
- 108091061639 Homo sapiens miR-631 stem-loop Proteins 0.000 description 1
- 108091061634 Homo sapiens miR-634 stem-loop Proteins 0.000 description 1
- 108091061626 Homo sapiens miR-635 stem-loop Proteins 0.000 description 1
- 108091061623 Homo sapiens miR-636 stem-loop Proteins 0.000 description 1
- 108091061613 Homo sapiens miR-638 stem-loop Proteins 0.000 description 1
- 108091061611 Homo sapiens miR-639 stem-loop Proteins 0.000 description 1
- 108091061624 Homo sapiens miR-641 stem-loop Proteins 0.000 description 1
- 108091061630 Homo sapiens miR-643 stem-loop Proteins 0.000 description 1
- 108091061604 Homo sapiens miR-645 stem-loop Proteins 0.000 description 1
- 108091061601 Homo sapiens miR-646 stem-loop Proteins 0.000 description 1
- 108091061602 Homo sapiens miR-647 stem-loop Proteins 0.000 description 1
- 108091061610 Homo sapiens miR-649 stem-loop Proteins 0.000 description 1
- 108091061608 Homo sapiens miR-650 stem-loop Proteins 0.000 description 1
- 108091061603 Homo sapiens miR-651 stem-loop Proteins 0.000 description 1
- 108091061616 Homo sapiens miR-652 stem-loop Proteins 0.000 description 1
- 108091061679 Homo sapiens miR-653 stem-loop Proteins 0.000 description 1
- 108091061677 Homo sapiens miR-654 stem-loop Proteins 0.000 description 1
- 108091061680 Homo sapiens miR-655 stem-loop Proteins 0.000 description 1
- 108091061564 Homo sapiens miR-656 stem-loop Proteins 0.000 description 1
- 108091061671 Homo sapiens miR-657 stem-loop Proteins 0.000 description 1
- 108091061674 Homo sapiens miR-658 stem-loop Proteins 0.000 description 1
- 108091061675 Homo sapiens miR-659 stem-loop Proteins 0.000 description 1
- 108091061672 Homo sapiens miR-660 stem-loop Proteins 0.000 description 1
- 108091061569 Homo sapiens miR-663a stem-loop Proteins 0.000 description 1
- 108091044906 Homo sapiens miR-663b stem-loop Proteins 0.000 description 1
- 108091060464 Homo sapiens miR-668 stem-loop Proteins 0.000 description 1
- 108091060463 Homo sapiens miR-671 stem-loop Proteins 0.000 description 1
- 108091067625 Homo sapiens miR-7-1 stem-loop Proteins 0.000 description 1
- 108091067633 Homo sapiens miR-7-3 stem-loop Proteins 0.000 description 1
- 108091092108 Homo sapiens miR-718 stem-loop Proteins 0.000 description 1
- 108091061950 Homo sapiens miR-761 stem-loop Proteins 0.000 description 1
- 108091062099 Homo sapiens miR-766 stem-loop Proteins 0.000 description 1
- 108091060465 Homo sapiens miR-767 stem-loop Proteins 0.000 description 1
- 108091087853 Homo sapiens miR-770 stem-loop Proteins 0.000 description 1
- 108091086502 Homo sapiens miR-874 stem-loop Proteins 0.000 description 1
- 108091086462 Homo sapiens miR-875 stem-loop Proteins 0.000 description 1
- 108091086461 Homo sapiens miR-876 stem-loop Proteins 0.000 description 1
- 108091086652 Homo sapiens miR-885 stem-loop Proteins 0.000 description 1
- 108091086472 Homo sapiens miR-887 stem-loop Proteins 0.000 description 1
- 108091086506 Homo sapiens miR-888 stem-loop Proteins 0.000 description 1
- 108091086467 Homo sapiens miR-889 stem-loop Proteins 0.000 description 1
- 108091086511 Homo sapiens miR-890 stem-loop Proteins 0.000 description 1
- 108091086510 Homo sapiens miR-891b stem-loop Proteins 0.000 description 1
- 108091069003 Homo sapiens miR-9-1 stem-loop Proteins 0.000 description 1
- 108091068996 Homo sapiens miR-9-2 stem-loop Proteins 0.000 description 1
- 108091069001 Homo sapiens miR-9-3 stem-loop Proteins 0.000 description 1
- 108091087065 Homo sapiens miR-921 stem-loop Proteins 0.000 description 1
- 108091087064 Homo sapiens miR-922 stem-loop Proteins 0.000 description 1
- 108091070380 Homo sapiens miR-92a-1 stem-loop Proteins 0.000 description 1
- 108091070381 Homo sapiens miR-92a-2 stem-loop Proteins 0.000 description 1
- 108091087084 Homo sapiens miR-935 stem-loop Proteins 0.000 description 1
- 108091087110 Homo sapiens miR-940 stem-loop Proteins 0.000 description 1
- 108091087109 Homo sapiens miR-941-1 stem-loop Proteins 0.000 description 1
- 108091087114 Homo sapiens miR-941-2 stem-loop Proteins 0.000 description 1
- 108091087113 Homo sapiens miR-941-3 stem-loop Proteins 0.000 description 1
- 108091087111 Homo sapiens miR-941-4 stem-loop Proteins 0.000 description 1
- 108091045521 Homo sapiens miR-941-5 stem-loop Proteins 0.000 description 1
- 108091087115 Homo sapiens miR-942 stem-loop Proteins 0.000 description 1
- 108091070375 Homo sapiens miR-95 stem-loop Proteins 0.000 description 1
- 108091068856 Homo sapiens miR-98 stem-loop Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 101710123134 Ice-binding protein Proteins 0.000 description 1
- 101710082837 Ice-structuring protein Proteins 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 108010061833 Integrases Proteins 0.000 description 1
- 102100025305 Integrin alpha-2 Human genes 0.000 description 1
- 102100032819 Integrin alpha-3 Human genes 0.000 description 1
- 102100032818 Integrin alpha-4 Human genes 0.000 description 1
- 102100032817 Integrin alpha-5 Human genes 0.000 description 1
- 102100022337 Integrin alpha-V Human genes 0.000 description 1
- 102100025304 Integrin beta-1 Human genes 0.000 description 1
- 102100032999 Integrin beta-3 Human genes 0.000 description 1
- 102100033010 Integrin beta-5 Human genes 0.000 description 1
- SHZGCJCMOBCMKK-PQMKYFCFSA-N L-Fucose Natural products C[C@H]1O[C@H](O)[C@@H](O)[C@@H](O)[C@@H]1O SHZGCJCMOBCMKK-PQMKYFCFSA-N 0.000 description 1
- 108010092694 L-Selectin Proteins 0.000 description 1
- PNNNRSAQSRJVSB-UHFFFAOYSA-N L-rhamnose Natural products CC(O)C(O)C(O)C(O)C=O PNNNRSAQSRJVSB-UHFFFAOYSA-N 0.000 description 1
- 102100033467 L-selectin Human genes 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical group CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 101000988090 Leishmania donovani Heat shock protein 83 Proteins 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 206010025312 Lymphoma AIDS related Diseases 0.000 description 1
- 108091007774 MIR107 Proteins 0.000 description 1
- 108091007702 MIR1260B Proteins 0.000 description 1
- 108091007685 MIR541 Proteins 0.000 description 1
- 108091007772 MIRLET7C Proteins 0.000 description 1
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 1
- 208000006395 Meigs Syndrome Diseases 0.000 description 1
- 102100034216 Melanocyte-stimulating hormone receptor Human genes 0.000 description 1
- 101710161100 Melanocyte-stimulating hormone receptor Proteins 0.000 description 1
- 102000000440 Melanoma-associated antigen Human genes 0.000 description 1
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 102100034256 Mucin-1 Human genes 0.000 description 1
- 108010008707 Mucin-1 Proteins 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 101001128692 Mus musculus Neuroendocrine convertase 1 Proteins 0.000 description 1
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 206010029488 Nodular melanoma Diseases 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 108010035766 P-Selectin Proteins 0.000 description 1
- 102100023472 P-selectin Human genes 0.000 description 1
- 102100034925 P-selectin glycoprotein ligand 1 Human genes 0.000 description 1
- 101710137390 P-selectin glycoprotein ligand 1 Proteins 0.000 description 1
- KJWZYMMLVHIVSU-IYCNHOCDSA-N PGK1 Chemical compound CCCCC[C@H](O)\C=C\[C@@H]1[C@@H](CCCCCCC(O)=O)C(=O)CC1=O KJWZYMMLVHIVSU-IYCNHOCDSA-N 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 208000006735 Periostitis Diseases 0.000 description 1
- 206010048734 Phakomatosis Diseases 0.000 description 1
- 102100028251 Phosphoglycerate kinase 1 Human genes 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 101710163348 Potassium voltage-gated channel subfamily H member 8 Proteins 0.000 description 1
- 102100022019 Pregnancy-specific beta-1-glycoprotein 2 Human genes 0.000 description 1
- 102100035724 Probable ATP-dependent RNA helicase DDX43 Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 102100022491 RNA-binding protein NOB1 Human genes 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- PYMYPHUHKUWMLA-LMVFSUKVSA-N Ribose Natural products OC[C@@H](O)[C@@H](O)[C@@H](O)C=O PYMYPHUHKUWMLA-LMVFSUKVSA-N 0.000 description 1
- 206010061934 Salivary gland cancer Diseases 0.000 description 1
- 108090000184 Selectins Proteins 0.000 description 1
- 102000003800 Selectins Human genes 0.000 description 1
- 108091027548 SiDNA Proteins 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 108010002687 Survivin Proteins 0.000 description 1
- 102100028532 Synaptophysin-like protein 1 Human genes 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- 102100033082 TNF receptor-associated factor 3 Human genes 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 102100039580 Transcription factor ETV6 Human genes 0.000 description 1
- 102000004357 Transferases Human genes 0.000 description 1
- 108090000992 Transferases Proteins 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- 102000008579 Transposases Human genes 0.000 description 1
- 108010020764 Transposases Proteins 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 102000004142 Trypsin Human genes 0.000 description 1
- 108090000631 Trypsin Proteins 0.000 description 1
- 101710107540 Type-2 ice-structuring protein Proteins 0.000 description 1
- 102000003425 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- 101150109071 UBC gene Proteins 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006593 Urologic Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical group CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 206010000583 acral lentiginous melanoma Diseases 0.000 description 1
- 230000036982 action potential Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- HMFHBZSHGGEWLO-UHFFFAOYSA-N alpha-D-Furanose-Ribose Natural products OCC1OC(O)C(O)C1O HMFHBZSHGGEWLO-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- 201000007538 anal carcinoma Diseases 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000000074 antisense oligonucleotide Substances 0.000 description 1
- 238000012230 antisense oligonucleotides Methods 0.000 description 1
- 210000004507 artificial chromosome Anatomy 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 201000000053 blastoma Diseases 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000008366 buffered solution Substances 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 239000013592 cell lysate Substances 0.000 description 1
- 238000002659 cell therapy Methods 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 210000002230 centromere Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000011198 co-culture assay Methods 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- JECGPMYZUFFYJW-UHFFFAOYSA-N conferone Natural products CC1=CCC2C(C)(C)C(=O)CCC2(C)C1COc3cccc4C=CC(=O)Oc34 JECGPMYZUFFYJW-UHFFFAOYSA-N 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 230000001085 cytostatic effect Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 210000003074 dental pulp Anatomy 0.000 description 1
- 210000001968 dental pulp cell Anatomy 0.000 description 1
- 210000004268 dentin Anatomy 0.000 description 1
- 210000004207 dermis Anatomy 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 210000001755 duct epithelial cell Anatomy 0.000 description 1
- 210000003981 ectoderm Anatomy 0.000 description 1
- 210000001162 elastic cartilage Anatomy 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 201000008184 embryoma Diseases 0.000 description 1
- 210000001900 endoderm Anatomy 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 210000001339 epidermal cell Anatomy 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 235000013312 flour Nutrition 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000012921 fluorescence analysis Methods 0.000 description 1
- 201000003444 follicular lymphoma Diseases 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 230000002518 glial effect Effects 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- 230000001279 glycosylating effect Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 235000009424 haa Nutrition 0.000 description 1
- 210000002768 hair cell Anatomy 0.000 description 1
- 210000003780 hair follicle Anatomy 0.000 description 1
- 210000000442 hair follicle cell Anatomy 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- 102000055595 human KIF11 Human genes 0.000 description 1
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 description 1
- 229940099552 hyaluronan Drugs 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 210000004263 induced pluripotent stem cell Anatomy 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000035992 intercellular communication Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 210000000936 intestine Anatomy 0.000 description 1
- 238000012332 laboratory investigation Methods 0.000 description 1
- 101150066555 lacZ gene Proteins 0.000 description 1
- 206010024217 lentigo Diseases 0.000 description 1
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000021633 leukocyte mediated immunity Effects 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 208000023707 liver extraskeletal osteosarcoma Diseases 0.000 description 1
- 238000001325 log-rank test Methods 0.000 description 1
- 201000005249 lung adenocarcinoma Diseases 0.000 description 1
- 210000001165 lymph node Anatomy 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 238000013411 master cell bank Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000001704 mesoblast Anatomy 0.000 description 1
- 210000003716 mesoderm Anatomy 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 108091065212 miR-190b stem-loop Proteins 0.000 description 1
- 108091046261 miR-198 stem-loop Proteins 0.000 description 1
- 108091047268 miR-208b stem-loop Proteins 0.000 description 1
- 108091062429 miR-487b stem-loop Proteins 0.000 description 1
- 108091050453 miR-513b stem-loop Proteins 0.000 description 1
- 108091047492 miR-513b-1 stem-loop Proteins 0.000 description 1
- 108091048017 miR-513b-2 stem-loop Proteins 0.000 description 1
- 108091089992 miR-9-1 stem-loop Proteins 0.000 description 1
- 108091071572 miR-9-2 stem-loop Proteins 0.000 description 1
- 108091076838 miR-9-3 stem-loop Proteins 0.000 description 1
- 108091060187 miR-9-5 stem-loop Proteins 0.000 description 1
- 108091058972 miR-9-6 stem-loop Proteins 0.000 description 1
- 238000012737 microarray-based gene expression Methods 0.000 description 1
- 210000004088 microvessel Anatomy 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 201000000032 nodular malignant melanoma Diseases 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 239000013009 nonpyrogenic isotonic solution Substances 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 210000004416 odontoblast Anatomy 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 210000000963 osteoblast Anatomy 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 208000030940 penile carcinoma Diseases 0.000 description 1
- 201000008174 penis carcinoma Diseases 0.000 description 1
- 210000003460 periosteum Anatomy 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 201000002628 peritoneum cancer Diseases 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 238000000053 physical method Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 230000007859 posttranscriptional regulation of gene expression Effects 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000012207 quantitative assay Methods 0.000 description 1
- 239000000700 radioactive tracer Substances 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 210000001525 retina Anatomy 0.000 description 1
- 210000000844 retinal pigment epithelial cell Anatomy 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 235000002020 sage Nutrition 0.000 description 1
- 201000003804 salivary gland carcinoma Diseases 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 210000002363 skeletal muscle cell Anatomy 0.000 description 1
- 210000004927 skin cell Anatomy 0.000 description 1
- 238000010583 slow cooling Methods 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 210000002460 smooth muscle Anatomy 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 229940087562 sodium acetate trihydrate Drugs 0.000 description 1
- 239000000176 sodium gluconate Substances 0.000 description 1
- 235000012207 sodium gluconate Nutrition 0.000 description 1
- 229940005574 sodium gluconate Drugs 0.000 description 1
- RYYKJJJTJZKILX-UHFFFAOYSA-M sodium octadecanoate Chemical compound [Na+].CCCCCCCCCCCCCCCCCC([O-])=O RYYKJJJTJZKILX-UHFFFAOYSA-M 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 230000001360 synchronised effect Effects 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical compound [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 230000000451 tissue damage Effects 0.000 description 1
- 231100000827 tissue damage Toxicity 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000010415 tropism Effects 0.000 description 1
- 239000012588 trypsin Substances 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 210000003954 umbilical cord Anatomy 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 239000004474 valine Chemical group 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/28—Bone marrow; Haematopoietic stem cells; Mesenchymal stem cells of any origin, e.g. adipose-derived stem cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/45—Transferases (2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0652—Cells of skeletal and connective tissues; Mesenchyme
- C12N5/0662—Stem cells
- C12N5/0663—Bone marrow mesenchymal stem cells (BM-MSC)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0693—Tumour cells; Cancer cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y204/00—Glycosyltransferases (2.4)
- C12Y204/01—Hexosyltransferases (2.4.1)
- C12Y204/01214—Glycoprotein 3-alpha-L-fucosyltransferase (2.4.1.214)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/87—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation
- C12N15/88—Introduction of foreign genetic material using processes not otherwise provided for, e.g. co-transformation using microencapsulation, e.g. using amphiphile liposome vesicle
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
- C12N2310/141—MicroRNAs, miRNAs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/20—Type of nucleic acid involving clustered regularly interspaced short palindromic repeats [CRISPRs]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/65—MicroRNA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2502/00—Coculture with; Conditioned medium produced by
- C12N2502/13—Coculture with; Conditioned medium produced by connective tissue cells; generic mesenchyme cells, e.g. so-called "embryonic fibroblasts"
- C12N2502/1352—Mesenchymal stem cells
- C12N2502/1358—Bone marrow mesenchymal stem cells (BM-MSC)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2510/00—Genetically modified cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Biomedical Technology (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- General Health & Medical Sciences (AREA)
- General Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Microbiology (AREA)
- Developmental Biology & Embryology (AREA)
- Cell Biology (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Immunology (AREA)
- Biophysics (AREA)
- Plant Pathology (AREA)
- Physics & Mathematics (AREA)
- Epidemiology (AREA)
- Hematology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Virology (AREA)
- Rheumatology (AREA)
- Oncology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 핵산 또는 이를 발현하는 벡터를 도입하도록 변형된 세포 조성물에 관한 것이다. 이러한 조성물은 핵산을 표적세포에 전달하고 암과 같은 질병을 치료하는 데 사용될 수 있다.
Description
본 발명은 핵산 또는 이를 발현하는 벡터를 도입하도록 변형된 세포 조성물에 관한 것이다. 이러한 조성물은 핵산을 표적세포에 전달하고 암과 같은 질병을 치료하는 데 사용될 수 있다.
단일 또는 이중가닥 또는 둘 다의 핵산은 코넥신(connexin) 단백질을 발현하도록 변형된 HeLa 세포 쌍에서 코넥신 단백질에 의해 형성된 간극 연접(gap junctions)을 통과하는 것으로 나타났다. 형광-태그된 올리고뉴클레오티드의 공여세포(donor cell)로의 단일 전극 전달 및 간극 연접 매개 통신을 통해 표적세포로의 전달을 결정함으로써 전달이 입증되었다.
표적세포에 핵산을 전달하는 개선된 방법이 요구된다.
본 발명자들은 중간엽 계통 전구체 또는 줄기세포가 표적세포로 높은 비율의 핵산 전달을 지시할 수 있음을 확인하였다. 본 발명자들은 또한 중간엽 계통 전구체 또는 줄기세포가 암 세포에 핵산을 전달하여 암 세포 성장을 감소시킬 수 있음을 확인하였다. 놀랍게도, 중간엽 계통 전구체 또는 줄기세포의 이러한 능력은 세포 사이에서 핵산의 전달에 관여하는 주요 단백질의 녹아웃에도 불구하고 유지된다.
핵산을 표적세포로 전달하기 위해 중간엽 계통 전구체 또는 줄기세포를 사용하는 다른 이점은 세포가 표적조직을 향하도록 하는 능력이다. 중간엽 계통 전구체 또는 줄기세포의 이동 및 접착 능력은 그들을 이러한 목적에 특히 적합하게 만든다.
따라서, 일 실시예에서, 본 발명은 올리고뉴클레오티드를 표적세포 내로 전달하는 방법에 관한 것으로, 상기 방법은 표적세포를 α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체(mesenchymal lineage precursor) 또는 줄기세포와 접촉하는 단계를 포함하며, 여기서, 상기 세포는 올리고뉴클레오티드 또는 올리고뉴클레오티드를 발현하는 벡터를 도입하도록 변형된다. 일 실시예에서, 접촉은 중간엽 계통 전구체 또는 줄기세포가 표적세포와 간극 연접을 형성하는 것을 허용하는 조건 하에서 발생하고, 이에 의해 올리고뉴클레오티드는 간극 연접을 횡단함으로써 표적세포로 전달된다. 일 실시예에서, 간극 연접은 Cx40 또는 Cx43에 의해 형성된다. 다른 실시예에서, 간극 연접은 Cx43에 의해 형성된다. 다른 실시예에서, 올리고뉴클레오티드의 전달은 Cx43 이외의 메커니즘을 통해 이루어진다. 예를 들어, 올리고뉴클레오티드는 Cx40, Cx45, Cx30.3, Cx31 또는 Cx31.1에 의해 형성된 간극 연접을 횡단함으로써 전달될 수 있다. 다른 실시예에서, 올리고뉴클레오티드는 엑소좀의 형성을 통해 전달될 수 있다. 다른 실시예에서, 올리고뉴클레오티드의 전달은 세포 대 세포 접촉과 무관하다. 이 실시예에서, 올리고뉴클레오티드의 전달은 코넥신을 통해 발생하지 않는다.
일 실시예에서, 표적세포는 암 세포 또는 백혈구이다. 예를 들어, 암 세포는 폐암, 췌장암, 대장암, 간암, 자궁경부암, 전립선암, 골육종 또는 흑색종 세포일 수 있다. 다른 실시예에서, 표적세포는 세포융합 세포(syncytial cell)이다. 예를 들어, 세포융합 세포는 심장근육 세포, 평활근 세포, 상피 세포, 결합조직 세포 또는 세포융합 암 세포일 수 있다.
다른 실시예에서, 본 개시는 대상체에서 암을 치료하는 방법에 관한 것으로, 상기 방법은 α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체(mesenchymal lineage precursor) 또는 줄기세포를 포함하는 조성물을 대상체에게 투여하는 단계를 포함하며, 여기서, 상기 세포는 올리고뉴클레오티드 또는 올리고뉴클레오티드를 발현하는 플라스미드를 도입하도록 변형된다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 대상체의 암을 포함하는 세포에 의해 또한 발현되는 코넥신을 발현한다. 일 실시예에서, 코넥신은 Cx40 또는 Cx43이다. 일 실시예에서, 대상체의 암을 포함하는 세포는 Cx43을 발현한다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 CD46을 발현한다.
일 실시예에서, 암은 폐암, 췌장암, 대장암, 간암, 자궁경부암, 전립선암, 골육종 또는 흑색종으로 구성된 군에서 선택된다. 일 실시예에서, 상기 방법은 본 개시에 따른 조성물을 투여하는 단계를 포함한다.
일 실시예에서, 올리고뉴클레오티드는 약 12-24개의 뉴클레오티드 길이이다. 다른 실시예에서, 올리고뉴클레오티드는 RNA이다. 다른 실시예에서, 올리고뉴클레오티드는 안티센스 분자이다. 다른 실시예에서, 올리고뉴클레오티드는 shRNA이다. 다른 실시예에서, 올리고뉴클레오티드는 siRNA이다. 일 실시예에서, siRNA는 KIF11 siRNA 또는 PLK1 siRNA이다. 다른 실시예에서, siRNA는 KIF11 siRNA이다.
일 실시예에서, KIF11 siRNA는 서열번호 1(NCBI 참조번호 NM_004523.3)에 나타난 바와 같이 KIF11 mRNA의 5'말단에 결합한다. 일 실시예에서, KIF11 siRNA는 5'말단으로부터 800bp 내지 3,600bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 900bp와 3,200bp 사이의 KIF11 mRNA 전사체에 결합한다. 일 실시예에서, 올리고뉴클레오티드는 서열번호 2, 3, 4, 5, 6 또는 7 중 어느 하나에 나타난 바와 같은 핵산서열을 포함한다. 일 실시예에서, 올리고뉴클레오티드는 서열번호 2, 3, 4, 5, 6 또는 7 중 어느 하나에 나타난 바와 같은 핵산서열로 구성된다. 일 실시예에서, 올리고뉴클레오티드는 서열번호 3에 나타난 바와 같은 핵산서열을 포함한다. 다른 실시예에서, 올리고뉴클레오티드는 서열번호 3에 나타난 바와 같은 핵산서열로 구성된다. 일 실시예에서, 올리고뉴클레오티드는 서열번호 4에 나타난 바와 같은 핵산서열을 포함한다. 다른 실시예에서, 올리고뉴클레오티드는 서열번호 4에 나타난 바와 같은 핵산서열로 구성된다. 일 실시예에서, 올리고뉴클레오티드는 서열번호 7에 나타난 바와 같은 핵산서열을 포함한다. 다른 실시예에서, 올리고뉴클레오티드는 서열번호 7에 나타난 바와 같은 핵산서열로 구성된다. 일 실시예에서, 올리고뉴클레오티드는 핵산을 포함한다 서열번호 3, 4 또는 7 중 어느 하나에 나타난 바와 같은 핵산서열을 포함한다. 다른 실시예에서, 올리고뉴클레오티드는 서열번호 3, 4 또는 7 중 어느 하나에 나타난 바와 같은 핵산서열로 구성된다. 이들 실시예에서, 표적세포는 골암세포(bone cancer cell)일 수 있다. 일 실시예에서, 암은 육종일 수 있다. 다른 실시예에서, 표적세포는 췌장암 세포일 수 있다. 일 실시예에서, 암은 췌장암일 수 있다. 다른 실시예에서, 표적세포는 전립선암 세포일 수 있다. 일 실시예에서, 암은 전립선 암일 수 있다.
다른 실시예에서, 올리고뉴클레오티드는 서열번호 2, 3, 4, 5, 6, 7, 8 또는 9 중 어느 하나에 나타난 바와 같은 핵산서열을 포함한다. 일 실시예에서, 올리고뉴클레오티드는 서열번호 2, 3, 4, 5, 6, 7, 8 또는 9 중 어느 하나에 나타난 바와 같은 핵산서열로 구성된다. 일 실시예에서, 올리고뉴클레오티드는 서열번호 8 또는 9에 나타난 바와 같은 핵산서열로 구성된다.
다른 실시예에서, 올리고뉴클레오티드는 18-22개의 뉴클레오티드 길이이다. 다른 실시예에서, 올리고뉴클레오티드는 miRNA이다. 일 실시예에서, miRNAs는 miR-155, miR-155-inh, miR-181-B1, miR-15a, miR-16-1, miR-21, miR-34a, miR-221, miR-29a, let-7b로 구성된 군에서 선택될 수 있다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 표적세포를 사멸시키지만 중간엽 계통 전구체 또는 줄기세포의 생존력에 실질적으로 영향을 미치지 않는 것을 발현하는 올리고뉴클레오티드 또는 벡터를 도입하도록 변형된다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 암 세포와 같은 표적세포에 억제성 올리고뉴클레오티드를 전달하기 전에 중간엽 계통 전구체 또는 줄기세포를 사멸시키지 않는 것을 발현하는 억제성 올리고뉴클레오티드 또는 벡터를 도입하도록 변형된다.
본 발명자들은 또한 중간엽 계통 전구체 또는 줄기세포가 암 세포를 사멸 및/또는 암 세포 성장을 감소시키는 것으로 알려진 다양한 억제성 올리고뉴클레오티드를 도입하도록 변형될 수 있음을 확인하였다. 놀랍게도, 이들 변형된 중간엽 계통 전구체 또는 줄기세포는 생존 가능하며 암 세포를 사멸 및/또는 세포 성장을 감소시키기에 충분한 수준으로 억제성 올리고뉴클레오티드를 암 세포에 전달할 수 있다.
따라서, 다른 실시예에서, 본 발명은 α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체(mesenchymal lineage precursor) 또는 줄기세포를 포함하는 조성물에 관한 것이며, 상기 세포는 억제성 올리고뉴클레오티드를 도입하도록 변형되거나 억제성 올리고뉴클레오티드를 발현하는 벡터를 포함한다.
일 실시예에서, 억제성 올리고뉴클레오티드는 약 12-24개의 뉴클레오티드 길이이다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 RNA이다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 안티센스 분자이다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 shRNA이다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 siRNA이다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 18-22개의 뉴클레오티드 길이이다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 miRNA이다. 일 실시예에서, miRNAs는 miR-155, miR-155-inh, miR-181-B1, miR-15a, miR-16-1, miR-21, miR-34a, miR-221, miR-29a, let-7b로 구성된 군에서 선택될 수 있다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 또한 STRO-1을 발현한다. 따라서, 일 실시예에서, 본 발명은 올리고뉴클레오티드를 표적세포 내로 전달하는 방법에 관한 것으로, 상기 방법은 표적세포를 STRO-1 및 α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체 또는 줄기세포와 접촉시키는 단계를 포함하며, 상기 세포는 올리고뉴클레오티드 또는 올리고뉴클레오티드를 발현하는 벡터를 도입하도록 변형되었다. 다른 실시예에서, 본 개시는 대상체에서 암을 치료하는 방법에 관한 것으로, 상기 방법은 STRO-1 및 α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체 또는 줄기세포를 포함하는 조성물을 대상체에게 투여하는 단계를 포함하며, 상기 세포는 올리고뉴클레오티드 또는 올리고뉴클레오티드를 발현하는 플라스미드를 도입하도록 변형되었다. 다른 실시예에서, 본 개시는 STRO-1 및 α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체 또는 줄기세포를 포함하는 조성물에 관한 것으로, 상기 세포는 억제성 올리고뉴클레오티드를 도입하도록 변형되거나 억제성 올리고뉴클레오티드를 발현하는 벡터를 포함한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 실질적으로 STRO-1bri이다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 Cx40 또는 Cx43을 발현하도록 변형되지 않는다.
일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 예를 들어 암 세포와 같은 표적세포의 생존력을 감소시키기에 충분한 수준의 올리고뉴클레오티드를 포함한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.25 내지 5nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.5 내지 5nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.5 내지 4nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.5 내지 3.5nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 다능성 세포로부터 유래된다. 예를 들어, 중간엽 계통 전구체 또는 줄기세포는 유도만능줄기(induced pluripotent stem, iPS) 세포로부터 유래될 수 있다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 바이러스 벡터를 사용하여 올리고뉴클레오티드를 도입하도록 변형된다. 예를 들어, 바이러스 벡터는 렌티바이러스, 바쿨로바이러스, 레트로바이러스, 아데노바이러스(AdV), 아데노-관련 바이러스(AAV) 또는 이의 재조합 형태로 구성된 군에서 선택된다. 다른 실시예에서, 바이러스 벡터는 AAV이다. 다른 실시예에서, 바이러스 벡터는 재조합 AAV이다.
일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 중간엽 계통 전구체 또는 줄기세포 상에서 세포 표면 글리칸의 변형을 가져오도록 처리되었다. 일 실시예에서, 처리는 중간엽 전구체 계통 세포 또는 줄기세포 상의 세포-표면 글리칸을 변형시키는 조건 하에서 중간엽 계통 전구체 또는 줄기세포를 글리코실스트라스페라제(glycosylstrasferase)에 노출시키는 것을 포함한다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 외인성 글리코실트랜스퍼라제(glycosyltranferase)에 노출된다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 글리코실트랜스퍼라제를 발현하도록 변형되었다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 글리코실트랜스퍼라제(glycosyltransferase)를 암호화하는 핵산을 도입하도록 변형되었으며, 여기서 세포에서 글리코실트랜스퍼라제의 발현은 생체 내 염증 부위에서 세포의 보유를 향상시킨다.
일 실시예에서, 글리코실트랜스퍼라제는 푸코실트랜스퍼라제, 갈락토실트랜스퍼라제 또는 시알릴트랜스퍼라제이다. 일 실시예에서, 푸코실트랜스퍼라제는 알파 1,3 푸코실트랜스퍼라제 III, 알파 1,3 푸코실트랜스퍼라제 IV, 알파 1,3 푸코실트랜스퍼라제 VI, 알파 1,3 푸코실트랜스퍼라제 VII 또는 알파 1,3 푸코실트랜스퍼라제 IX와 같은 알파 1,3 푸코실트랜스퍼라제이다.
달리 구체적으로 언급되지 않는 한, 본원의 임의의 실시예는 다른 임의의 실시예에 필요한 부분만 약간 수정하여(mutatis mutandis) 적용되어야 한다.
본 개시는 단지 예시의 목적으로 의도되었으며, 본 명세서에 기술된 특정 실시예에 의해 범위가 제한되지 않아야 한다. 기능적으로 동등한 생성물, 조성물 및 방법은 본원에 기술된 바와 같이 본 개시의 범위 내에 명확하게 포함된다.
본 명세서 전체에서, 달리 구체적으로 언급되지 않거나 문맥상 달리 요구되지 않는 한, 단일 단계, 물질의 조성물, 단계의 군(group) 또는 물질의 조성물의 군(group)에 대한 언급은 하나 및 복수(즉, 하나 이상)의 그러한 단계들, 물질의 조성물들, 단계의 군들(groups) 또는 물질의 조성물들의 군을 포함하는 것으로 간주되어야 한다.
이하에서, 비-제한적인 실시예 및 첨부 도면을 참조하여 본 개시를 설명한다.
도 1은 MPC (a) 및 MSC (b)가 간극 연접 단백질인 코넥신 Cx43 및 Cx40을 발현하는 것을 도시한다.
도 2는 패치 클램프(Patch clamp) 기술 - 기능적 간극 연접의 MPC 발현을 도시한다.
도 3은 스크리닝 패널(Screening Panel)의 종양 라인에서 Cx43 발현을 도시한다.
도 4는 리포펙타민(1-1000nM 세포 외 농도)를 사용하여 시아닌 3 형광 표지된 siRNA로 형질주입된 MPC를 도시한다.
도 5는 (i) 간극 연접을 통한 Cy-5-MiR16의 (A) HeLa-Cx43 세포를 발현하는 GFP 및 (B) PANC-1 세포를 발현하는 GFP로의 Cy-5-MiR16의 MPCs 전달 및 (ii) PANC-1 세포를 발현하는 GFP로의 KIF11 siRNA의 MPC 전달을 도시한다.
도 6은 (a) KIF11 siRNA (100 nM) 로딩된 MPC 및 PANC-1 종양세포의 공동-배양 및 (b) KIF11 siRNA (500 nM) 로딩된 MPC 및 PANC-1 종양세포의 공동-배양을 도시한다.
도 7은 KIF11 siRNA (500 nM) 로딩된 MPC 및 SNUC2A 종양세포의 공동-배양을 도시한다.
도 8(a) 및 (b)는 KIF11 siRNA (500 nM) 로딩된 MPC 및 SAOS2 종양세포의 공동-배양을 도시한다.
도 9는 (A) Mir-16 (100 nM) 로딩된 MPC 및 PANC-1 종양세포의 공동-배양 및 (B) Mir-16 (100 nM) 로딩된 MPC 및 형질주입되지 않은 MPC의 공동-배양을 도시한다.
도 10은 (A) let7b (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양을 도시하며, let7b로 형질주입된 PANC-1 세포 및 형질주입되지 않은 PANC-1 세포의 성장을 또한 도시하고, (B) let7b로 형질주입된 MPC 및 형질주입되지 않은 MPC의 성장을 도시한다.
도 11은 (A) KIF11 siRNA (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양을 도시하며, 형질주입되지 않은 MPC와 PANC-1 (CRISP / Cas9 Cx43 KO) 세포의 성장을 또한 도시하고, (B) KIF11 siRNA (500 nM) 로딩된 MPC 및 형질주입되지 않은 MPC의 성장을 도시한다.
도 12는 KIF11 siRNA (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양, PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1과 공동-배양된 형질주입되지 않은 MPC의 성장 및 KIF11로 형질주입된 PANC-1 (CRISP / Cas9 Cx43 KO)의 성장의 조합된 데이터를 도시한다.
도 13은 (A) Mir-34a (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양을 도시하며, 형질주입되지 않은 MPC와 PANC-1 세포 및 형질주입된 세포와 PANC-1 세포의 성장을 또한 도시하고, (B) Mir-34a (500 nM) 로딩된 MPC 및 형질주입되지 않은 MPC의 성장을 도시한다.
도 14는 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 MPC의 사멸; 비표적화 siRNA, 사멸 siRNA, PLK1 siRNA 및 KIF11 siRNA로 형질주입된 MPC의 세포 수의 형광 분석, (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 MPC의 WST 분석을 도시한다.
도 15는 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PANC-1 세포의 사멸, (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PANC-1 세포의 WST 분석을 도시한다.
도 16은 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PC3 세포의 사멸(II), (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PC3 세포의 WST 분석을 도시한다.
도 17은 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 SAOS2 세포의 사멸(II), (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 SAOS2 세포의 WST 분석을 도시한다.
도 18은 세포 사멸의 비교 분석 및 WST 분석 (MPC; PANC-1)을 도시한다.
도 19는 세포 사멸의 비교 분석 및 WST 분석 (PC3; SAOS2)을 도시한다.
도 20은 PC3 전립선 이종 이식편 종양 모델을 도시한다. 마우스는 KIF11에 대해 500nM siRNA를 로딩된 0.5 million MPC로(처리된) 또는 없는(대조군) 루시페라제를 발현하는 0.5 million PC3 세포로 전립선에 정위적으로(orthotopically) 이식되었다. 일주일 후, 마우스에 루시페린을 주사하고 종양을 시각화하기 위해 영상화하였다. 패널 (A)는 대조군 마우스를 나타내고 패널 (B)는 MPC 처리된 마우스를 나타낸다. 패널 (C)는 처리 및 처리되지 않은 마우스의 생존 곡선을 나타낸다.
도 21은 500 nM KIF11 (MPC / PANC-1 세포의 1/1 비율)로 형질주입된 MPC와의 공동-배양 후 총 (패널 A) 및 살아있는 (패널 B) PANC-1 세포의 측정을 도시한다. 패널 A 및 B의 X 축은:
- PANC-1, 1 일: 배양 1 일 후 PANC-1 세포의 수 (PANC-1 세포는 단독으로 배양됨)
- PANC-1-KIF11 siRNA, 1 일: 배양 1 일 후 측정된 500 nM KIF11로 형질주입된 PANC-1의 수
- MPC-PANC-1, 1 일: MPC와의 공동-배양 1 일 후 PANC-1 세포의 수 (1/1 비율)
- MPC_KIF11- PANC-1: KIF11로 형질주입된 MPC와의 공동-배양 1 일 후 PANC-1 세포의 수(500 nM; 1/1 비율)
- PANC-1, 6 일: 배양 6 일 후의 PANC-1 세포 수 (PANC-1 세포 단독 배양)
- PANC-1-KIF11 siRNA, 6 일: 배양 6 일 후에 측정된 500 nM KIF11로 형질주입된 PANC-1의 수.
- MPC-PANC-1, 1 일: MPC와의 공동-배양 6 일 후의 PANC-1 세포의 수 (1/1 비율)
- MPC_KIF11- PANC-1: KIF11로 형질주입된 MPC와의 공동-배양 6 일 후 PANC-1 세포의 수(500 nM; 1/1 비율).
도 22는 공동-배양에서 MPC로부터 PANC-1 세포로의 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11-siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PANC-1 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 5 일째에 KIF11-siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PANC-1 세포 성장의 용량-반응 곡선을 보여준다. 패널 C는 PANC-1과의 공동-배양에서 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 성장의 시간 경과를 보여준다. 결과는 3개의 독립적 측정의 평균을 나타낸다.
도 23은 KIF11 (직접 형질주입)에 의한 PANC-1 세포 생존력의 용량 의존적 억제를 도시한다.
도 24는 PANC-1 세포 성장에 대한 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PANC1 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 6 일째에 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PANC-1 세포 성장의 용량-반응 곡선을 보여준다.
도 25는 MPC 세포 성장에 대한 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 6 일째에 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 세포 성장의 용량-반응 곡선을 보여준다.
도 26은 공동-배양에서 MPC로부터 PC3 세포로의 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PC3 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 5 일째에 KIF11-siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PC3 세포 성장의 용량-반응 곡선을 보여준다. 패널 C는 PC3 세포와의 공동-배양에서 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 성장의 시간 경과를 보여준다. 결과는 3개의 독립적 측정의 평균을 나타낸다.
도 27은 PC3 세포 성장에 대한 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PC3 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 6 일째에 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PC3 세포 성장의 용량-반응 곡선을 보여준다.
도 28은 KIF11 siRNA 로딩된 MPC 공여세포를 도시한다.
도 29는 MPC 공여세포 KIF11 siRNA가 종양세포로의 전달을 도시한다.
도 30은 KIF11 siRNA 형질주입된 세포에서 KIF11 mRNA 수준을 도시한다.
도 31은 KIF11 siRNA 로딩된 MPC와의 공동-배양 후 PANC-1 세포에서의 KIF11 mRNA 수준을 도시한다. MPC = KIF11 siRNA로 직접 형질주입된 MPC; MPC-Co = KIF11 siRNA로 직접 형질주입되고 PANC1과 공동-배양된 MPC; PANC1-Co = KIF11 siRNA로 형질주입된 MPC와 함께 24 시간 동안 공동-배양된 PANC1 세포; KIF11 발현은 형질주입 후 48 시간째에 분석되었다. qRT-PCR 데이터를 분석하기 위한 비교 Ct 방법 (ΔΔCt 방법) - 1. 샘플 KIF11 평균 Ct-GAPDH 평균 Ct = ΔCt KIF11-GAPDH; 2. ΔΔCT = ΔCt 처리 -ΔCt 미처리; 3. 미처리에 대한 KIF11의 폴드 차이 = 2-ΔΔCt.
도 32는 인간 KIF11 mRNA 서열에 대한 siRNA의 정렬을 도시한다.
도 33은 MPC 및 종양세포 생존력에 대한 KIF11 siRNA의 효과를 도시한다.
도 34는 대조군과 비교하여 MPC 및 KIF11 siRNA로 형질주입된 MSC에서의 유전자 발현 분석을 도시한다.
도 2는 패치 클램프(Patch clamp) 기술 - 기능적 간극 연접의 MPC 발현을 도시한다.
도 3은 스크리닝 패널(Screening Panel)의 종양 라인에서 Cx43 발현을 도시한다.
도 4는 리포펙타민(1-1000nM 세포 외 농도)를 사용하여 시아닌 3 형광 표지된 siRNA로 형질주입된 MPC를 도시한다.
도 5는 (i) 간극 연접을 통한 Cy-5-MiR16의 (A) HeLa-Cx43 세포를 발현하는 GFP 및 (B) PANC-1 세포를 발현하는 GFP로의 Cy-5-MiR16의 MPCs 전달 및 (ii) PANC-1 세포를 발현하는 GFP로의 KIF11 siRNA의 MPC 전달을 도시한다.
도 6은 (a) KIF11 siRNA (100 nM) 로딩된 MPC 및 PANC-1 종양세포의 공동-배양 및 (b) KIF11 siRNA (500 nM) 로딩된 MPC 및 PANC-1 종양세포의 공동-배양을 도시한다.
도 7은 KIF11 siRNA (500 nM) 로딩된 MPC 및 SNUC2A 종양세포의 공동-배양을 도시한다.
도 8(a) 및 (b)는 KIF11 siRNA (500 nM) 로딩된 MPC 및 SAOS2 종양세포의 공동-배양을 도시한다.
도 9는 (A) Mir-16 (100 nM) 로딩된 MPC 및 PANC-1 종양세포의 공동-배양 및 (B) Mir-16 (100 nM) 로딩된 MPC 및 형질주입되지 않은 MPC의 공동-배양을 도시한다.
도 10은 (A) let7b (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양을 도시하며, let7b로 형질주입된 PANC-1 세포 및 형질주입되지 않은 PANC-1 세포의 성장을 또한 도시하고, (B) let7b로 형질주입된 MPC 및 형질주입되지 않은 MPC의 성장을 도시한다.
도 11은 (A) KIF11 siRNA (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양을 도시하며, 형질주입되지 않은 MPC와 PANC-1 (CRISP / Cas9 Cx43 KO) 세포의 성장을 또한 도시하고, (B) KIF11 siRNA (500 nM) 로딩된 MPC 및 형질주입되지 않은 MPC의 성장을 도시한다.
도 12는 KIF11 siRNA (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양, PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1과 공동-배양된 형질주입되지 않은 MPC의 성장 및 KIF11로 형질주입된 PANC-1 (CRISP / Cas9 Cx43 KO)의 성장의 조합된 데이터를 도시한다.
도 13은 (A) Mir-34a (500 nM) 로딩된 MPC 및 PANC-1 (CRISP / Cas9 Cx43 KO) 또는 PANC-1의 공동-배양을 도시하며, 형질주입되지 않은 MPC와 PANC-1 세포 및 형질주입된 세포와 PANC-1 세포의 성장을 또한 도시하고, (B) Mir-34a (500 nM) 로딩된 MPC 및 형질주입되지 않은 MPC의 성장을 도시한다.
도 14는 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 MPC의 사멸; 비표적화 siRNA, 사멸 siRNA, PLK1 siRNA 및 KIF11 siRNA로 형질주입된 MPC의 세포 수의 형광 분석, (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 MPC의 WST 분석을 도시한다.
도 15는 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PANC-1 세포의 사멸, (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PANC-1 세포의 WST 분석을 도시한다.
도 16은 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PC3 세포의 사멸(II), (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 PC3 세포의 WST 분석을 도시한다.
도 17은 (a) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 SAOS2 세포의 사멸(II), (b) 5 일째에 mir-mimics, PLK1 siRNA 또는 KIF11 siRNA로 형질주입된 SAOS2 세포의 WST 분석을 도시한다.
도 18은 세포 사멸의 비교 분석 및 WST 분석 (MPC; PANC-1)을 도시한다.
도 19는 세포 사멸의 비교 분석 및 WST 분석 (PC3; SAOS2)을 도시한다.
도 20은 PC3 전립선 이종 이식편 종양 모델을 도시한다. 마우스는 KIF11에 대해 500nM siRNA를 로딩된 0.5 million MPC로(처리된) 또는 없는(대조군) 루시페라제를 발현하는 0.5 million PC3 세포로 전립선에 정위적으로(orthotopically) 이식되었다. 일주일 후, 마우스에 루시페린을 주사하고 종양을 시각화하기 위해 영상화하였다. 패널 (A)는 대조군 마우스를 나타내고 패널 (B)는 MPC 처리된 마우스를 나타낸다. 패널 (C)는 처리 및 처리되지 않은 마우스의 생존 곡선을 나타낸다.
도 21은 500 nM KIF11 (MPC / PANC-1 세포의 1/1 비율)로 형질주입된 MPC와의 공동-배양 후 총 (패널 A) 및 살아있는 (패널 B) PANC-1 세포의 측정을 도시한다. 패널 A 및 B의 X 축은:
- PANC-1, 1 일: 배양 1 일 후 PANC-1 세포의 수 (PANC-1 세포는 단독으로 배양됨)
- PANC-1-KIF11 siRNA, 1 일: 배양 1 일 후 측정된 500 nM KIF11로 형질주입된 PANC-1의 수
- MPC-PANC-1, 1 일: MPC와의 공동-배양 1 일 후 PANC-1 세포의 수 (1/1 비율)
- MPC_KIF11- PANC-1: KIF11로 형질주입된 MPC와의 공동-배양 1 일 후 PANC-1 세포의 수(500 nM; 1/1 비율)
- PANC-1, 6 일: 배양 6 일 후의 PANC-1 세포 수 (PANC-1 세포 단독 배양)
- PANC-1-KIF11 siRNA, 6 일: 배양 6 일 후에 측정된 500 nM KIF11로 형질주입된 PANC-1의 수.
- MPC-PANC-1, 1 일: MPC와의 공동-배양 6 일 후의 PANC-1 세포의 수 (1/1 비율)
- MPC_KIF11- PANC-1: KIF11로 형질주입된 MPC와의 공동-배양 6 일 후 PANC-1 세포의 수(500 nM; 1/1 비율).
도 22는 공동-배양에서 MPC로부터 PANC-1 세포로의 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11-siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PANC-1 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 5 일째에 KIF11-siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PANC-1 세포 성장의 용량-반응 곡선을 보여준다. 패널 C는 PANC-1과의 공동-배양에서 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 성장의 시간 경과를 보여준다. 결과는 3개의 독립적 측정의 평균을 나타낸다.
도 23은 KIF11 (직접 형질주입)에 의한 PANC-1 세포 생존력의 용량 의존적 억제를 도시한다.
도 24는 PANC-1 세포 성장에 대한 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PANC1 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 6 일째에 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PANC-1 세포 성장의 용량-반응 곡선을 보여준다.
도 25는 MPC 세포 성장에 대한 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 6 일째에 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 세포 성장의 용량-반응 곡선을 보여준다.
도 26은 공동-배양에서 MPC로부터 PC3 세포로의 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PC3 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 5 일째에 KIF11-siRNA (0 - 500 nM)가 로딩된 MPC와의 공동-배양에서 PC3 세포 성장의 용량-반응 곡선을 보여준다. 패널 C는 PC3 세포와의 공동-배양에서 KIF11 siRNA (0 - 500 nM)로 형질주입 후 MPC 성장의 시간 경과를 보여준다. 결과는 3개의 독립적 측정의 평균을 나타낸다.
도 27은 PC3 세포 성장에 대한 KIF11 siRNA의 효과를 도시한다. 패널 A는 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PC3 세포 성장의 시간 경과를 보여준다. 패널 B는 세포 배양 6 일째에 KIF11 siRNA (0 - 500 nM)로 형질주입 후 PC3 세포 성장의 용량-반응 곡선을 보여준다.
도 28은 KIF11 siRNA 로딩된 MPC 공여세포를 도시한다.
도 29는 MPC 공여세포 KIF11 siRNA가 종양세포로의 전달을 도시한다.
도 30은 KIF11 siRNA 형질주입된 세포에서 KIF11 mRNA 수준을 도시한다.
도 31은 KIF11 siRNA 로딩된 MPC와의 공동-배양 후 PANC-1 세포에서의 KIF11 mRNA 수준을 도시한다. MPC = KIF11 siRNA로 직접 형질주입된 MPC; MPC-Co = KIF11 siRNA로 직접 형질주입되고 PANC1과 공동-배양된 MPC; PANC1-Co = KIF11 siRNA로 형질주입된 MPC와 함께 24 시간 동안 공동-배양된 PANC1 세포; KIF11 발현은 형질주입 후 48 시간째에 분석되었다. qRT-PCR 데이터를 분석하기 위한 비교 Ct 방법 (ΔΔCt 방법) - 1. 샘플 KIF11 평균 Ct-GAPDH 평균 Ct = ΔCt KIF11-GAPDH; 2. ΔΔCT = ΔCt 처리 -ΔCt 미처리; 3. 미처리에 대한 KIF11의 폴드 차이 = 2-ΔΔCt.
도 32는 인간 KIF11 mRNA 서열에 대한 siRNA의 정렬을 도시한다.
도 33은 MPC 및 종양세포 생존력에 대한 KIF11 siRNA의 효과를 도시한다.
도 34는 대조군과 비교하여 MPC 및 KIF11 siRNA로 형질주입된 MSC에서의 유전자 발현 분석을 도시한다.
서열목록의 핵심
서열번호 1: KIF11 mRNA (NCBI 조회번호(reference number) NM_004523.3)
서열번호 2:
Hs_KIF11_8 siRNA
서열번호 3:
Hs_KIF11_9 siRNA
서열번호 4:
Hs_KIF11_6 siRNA
서열번호 5:
Hs_KIF11_12 siRNA
서열번호 6:
Hs_KIF11_7 siRNA
서열번호 7:
Hs_KIF11_4 siRNA
일반적인 기술 및 선택된 정의
달리 구체적으로 정의되지 않는 한, 본원에 사용된 모든 기술 및 과학 용어는 당업자에게 일반적으로 이해되는 것과 동일한 의미를 갖는다(예: 분자생물학, 세포 배양, 줄기세포 분화, 세포 치료법, 유전적으로 변형, 생화학, 생리학 및 임상 연구).
달리 지시되지 않는 한, 본 개시에 사용된 분자 및 통계 기술은 당업자에게 공지된 표준 절차이다. 이러한 기술은 자료(예: J. Perbal, A Practical Guide to Molecular Cloning, John Wiley and Sons (1984), J. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1989), T.A. Brown (editor), Essential Molecular Biology: A Practical Approach, Volumes 1 and 2, IRL Press (1991), D.M. Glover and B.D. Hames (editors), DNA Cloning: A Practical Approach, Volumes 1-4, IRL Press (1995 and 1996), and F.M. Ausubel et al. (editors), Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience (1988, including all updates until present), Ed Harlow and David Lane (editors) Antibodies: A Laboratory Manual, Cold Spring Harbour Laboratory, (1988), and J.E. Coligan et al. (editors) Current Protocols in Immunology, John Wiley & Sons(현재까지 모든 업데이트 포함))에 문헌 전체에 걸쳐 기재되고 설명되어 있다.
본 명세서 및 첨부된 청구범위에 사용된 바와 같이, 단수형 및 단수형태의 용어 "a", "an" 및 "the"는 예를 들어, 내용이 명확하게 달리 지시하지 않는 한 복수의 지시 대상을 임의로 포함한다. 따라서, 예를 들어, "피분석물(an analyte)"에 대한 언급은 임의로 하나 이상의 분석물을 포함한다.
본원에 사용된 용어 "약(about)"은 달리 언급되지 않는 한 지정된 값의 +/- 10%, 보다 바람직하게는 +/- 5%, 더 바람직하게는 +/- 1%를 지칭한다.
용어 "및/또는(and/or)", 예를 들어 "X 및/또는 Y(X and/or Y)"는 "X 및 Y" 또는 "X 또는 Y"를 의미하는 것으로 이해되며, 둘 다의 의미 또는 둘 중 하나의 의미에 대한 명백한 지지를 제공하기 위해 사용된다.
본 명세서에서, 용어 "포함하다(comprise)", 또는 "포함하다(comprises)" 또는 "포함하는(comprising)"과 같은 변형은 언급된 요소, 정수 또는 단계, 또는 요소, 정수 또는 단계의 그룹의 포함을 암시하는 것으로 이해될 것이며, 다른 요소, 정수 또는 단계, 또는 요소, 정수 또는 단계의 그룹의 배제를 암시하지 않는다.
본원에 사용된 용어 "코넥신(connexin)"은 세포 간 통신 및 이온 및 작은 신호 전달 분자의 전달을 허용하고 간극 연접을 형성하도록 조립되는 막관통 단백질의 패밀리를 의미한다. 코넥신은 C 및 N 세포질 말단, 세포질 루프 (CL) 및 2개의 세포 외 루프(extra cellular loops) (EL-1) 및 (EL-2)를 갖는 4 패스 막관통 단백질이다. 코넥신은 6 개의 그룹으로 조립되어 헤미채널 또는 코넥손을 형성하고, 2개의 헤미채널은 각각의 세포에 하나씩 결합된 후 결합되어 2개의 세포 사이에 간극 연접을 형성한다. 용어 "코넥신"은 Cx 및 이를 암호화하는 유전자 Cx로 약칭된다.
본원에 사용된 용어 "간극 연접(gap junction)"은 세포 유형 사이의 특수한 세포 간 연결을 의미한다. 간극 연접은 2개의 세포의 세포질을 직접 연결하여, 핵산, 이온 및 전기 자극과 같은 다양한 분자가 세포 사이의 조절된 게이트를 직접 통과하게 한다.
다양한 대상체가 본 개시내용에 따른 세포 조성물을 투여받을 수 있다. 일 실시예에서, 대상은 포유동물이다. 포유동물은 개 또는 고양이와 같은 반려동물 또는 말 또는 소와 같은 가축동물일 수 있다. 다른 실시예에서, 대상은 인간이다. 용어 "대상체(subject)", "환자(patient)" 또는 "개체(individual)"은 문맥상 본 발명에서 상호교환적으로 사용될 수 있는 용어이다.
본원에 사용된 용어 "치료(treatment)"는 임상 병리 과정 동안 치료되는 개체 또는 세포의 자연 과정을 변경하도록 설계된 임상 개입을 지칭한다. 바람직한 치료 효과는 질병 진행률 감소, 질병 상태 개선 또는 완화, 및 예후 완화 또는 개선을 포함한다. 예를 들어, 질병과 관련된 하나 이상의 증상이 완화되거나 제거되는 경우, 개체는 성공적으로 "치료"된다.
"유효량(effective amount)"은 원하는 치료적 또는 예방적 결과를 달성하기 위해 필요한 투여량 및 시간 동안 적어도 효과적인 양을 지칭한다. 유효량은 하나 이상의 투여에서 제공될 수 있다. 본 개시내용의 일부 실시예에서, 용어 "유효량"은 상기 기재된 바와 같이 질병 또는 질환의 치료에 영향을 미치는 데 필요한 양을 지칭하기 위해 사용된다. 유효량은 치료될 질병 또는 질환에 따라, 또한 체중, 연령, 인종 배경, 성별, 건강 및/또는 신체 상태 및 치료되는 포유동물과 관련된 다른 요인에 따라 달라질 수 있다. 전형적으로, 유효량은 의사의 일상적인 시험 및 실험을 통해 결정될 수 있는 비교적 넓은 범위(예: "투여량(dosage)"범위) 내에 속할 것이다. 유효량은 단일 용량으로 또는 치료 기간 동안 1회 또는 수회 반복된 용량으로 투여될 수 있다.
"치료적 유효량(therapeutically effective amount)"은 특정 장애(예: 암)의 측정가능한 개선에 영향을 미치기 위해 요구되는 최소한의 농도이다. 본원의 치료적 유효량은 환자의 질병 상태, 연령, 성별 및 체중과 같은 요인, 및 세포 조성물이 개체에서 원하는 반응을 이끌어내는 능력에 따라 달라질 수 있다. 치료적 유효량은 또한 조성물의 임의의 독성 또는 유해 효과가 치료적으로 유리한 효과 보다 작은 양이다. 암의 경우, 치료적 유효량은 암 세포의 수를 감소시킬 수 있으며; 원발성 종양 크기를 감소시키고; 말초 기관으로의 암 세포 침윤을 억제(즉, 어느 정도 느리게하고, 일부 예에서 정지)시키고; 종양 전이를 억제(즉, 어느 정도 느리게하고, 일부 예에서는 정지)시키고; 종양 성장 또는 종양 진행을 어느 정도까지 억제 또는 지연시키고; 및/또는 장애와 관련된 하나 이상의 증상을 어느 정도까지 경감시킨다. 본 개시내용에 따른 조성물이 기존 암 세포의 성장을 예방 및/또는 사멸시킬 수 있는 한, 세포증식억제(cytostatic) 및/또는 세포독성일 수 있다. 암 치료법의 경우, 생체 내 효능은 예를 들어 생존 기간, 질병 진행 시간 (TTP), 반응 속도 (RR), 반응 기간 및/또는 삶의 질을 평가함으로써 측정될 수 있다.
중간엽 계통 전구체(Mesenchymal lineage precursor, MPC) 또는 줄기세포
본원에 사용된 용어 "중간엽 계통 전구체 또는 줄기세포(mesenchymal lineage precursor or stem cells)"는 다분화능을 유지하면서 자가 재생 능력 및 중간엽 기원(예: 조골세포, 연골세포, 지방세포, 간질세포, 섬유아세포 및 힘줄) 또는 비-중배엽(non-mesodermal) 기원(예: 간세포, 신경세포 및 상피세포)의 다수의 세포 유형으로 분화하는 능력을 갖는 미분화된 다분화성 세포를 의미한다.
용어 "중간엽 계통 전구체 또는 줄기세포"는 모세포 및 그들의 미분화된 자손 둘 다를 포함한다. 이 용어는 또한 중간엽 계통 전구체 또는 줄기세포 (MPC), 다능성 간질세포, 중간엽 줄기세포, 혈관주위 중간엽 계통 전구체 또는 줄기세포 및 이들의 미분화된 자손을 포함한다.
중간엽 계통 전구체 또는 줄기세포는 자가, 동종이계, 이종, 동계(syngeneic) 또는 동계(isogeneic)일 수 있다. 자가세포는 이식될 동일한 개체로부터 분리된다. 동종이계(Allogeneic)세포는 동일한 종의 공여자로부터 분리된다. 이종세포는 다른 종의 공여자로부터 분리된다. 동계(syngeneic) 또는 동계(isogeneic) 세포는 쌍둥이, 클론 또는 고도로 교배된 연구 동물 모델과 같은 유전적으로 동일한 유기체로부터 분리된다.
중간엽 계통 전구체 또는 줄기세포는 주로 골수에 존재하지만, 예를 들어 제대혈 및 제대, 성인 말초 혈액, 지방 조직, 섬유주 및 치아 펄프를 포함한 다양한 숙주 조직에 존재하는 것으로 나타났다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 하나 이상의 인테그린을 발현한다. 인테그린은 세포-세포 및 세포-세포 외 매트릭스 부착 이벤트 둘 모두를 매개하는 세포 부착 수용체의 부류이다. 인테그린은 단일 α 사슬 폴리펩티드가 단일 β 사슬과 비공유적으로 결합하는 이종이량체 폴리펩티드로 구성된다. 인테그린 패밀리의 세포 부착 수용체를 구성하는 약 16개의 별개의 α 사슬 폴리펩티드 및 적어도 약 8개의 다른 β 사슬 폴리펩티드가 있다. 일반적으로, 상이한 결합 특이성 및 조직 분포는 α 및 β 사슬 폴리펩티드 또는 인테그린 서브유닛의 독특한 조합으로부터 유래된다. 특정 인테그린과 관련된 패밀리는 일반적으로 β 서브유닛을 특징으로 한다. 그러나, 인테그린의 리간드 결합 활성은 α 서브유닛에 의해 크게 영향을 받는다.
일 실시예에서, 본 발명에 따른 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 β1 (CD29) 사슬 폴리펩티드를 갖는 인테그린을 발현한다.
다른 실시예에서, 본 개시내용에 따른 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α1 (CD49a), α2 (CD49b), α3 (CD49c), α4 (CD49d), α5 (CD49e) 및 αv (CD51)로 구성된 군에서 선택되는 α 사슬 폴리펩티드를 갖는 인테그린을 발현한다. 따라서, 일 실시예에서, 본 개시내용에 따른 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α1을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α2를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α3을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α4를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α5를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 αv를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1, α2 및 α3을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1, α2 및 α5를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1, α3 및 α5를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1, α2, α3 및 α5를 발현한다.
다른 실시예에서, 본 발명은 STRO-1+ 및 α1 + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다. 이 실시예에서, α1 + 세포가 풍부한 집단은 적어도 약 3% 또는 4% 또는 5% α1 + 세포를 포함할 수 있다.
다른 실시예에서, 본 발명은 STRO-1+ 및 α2 + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다. 이 실시예에서, α2 + 세포가 풍부한 집단은 적어도 약 30% 또는 40% 또는 50% α2 + 세포를 포함할 수 있다.
다른 실시예에서, 본 발명은 STRO-1+ 및 α3 + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다. 이 실시예에서, α3 + 세포가 풍부한 집단은 적어도 약 40% 또는 45% 또는 50% α3 + 세포를 포함한다.
다른 실시예에서, 본 발명은 STRO-1+ 및 α4 + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다. 이 실시예에서, α4 + 세포가 풍부한 집단은 적어도 약 5% 또는 6% 또는 7% α4 + 세포를 포함한다.
다른 실시예에서, 본 발명은 STRO-1+ 및 α5 + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다. 이 실시예에서, α5 + 세포가 풍부한 집단은 적어도 약 45% 또는 50% 또는 55% α5 + 세포를 포함한다.
다른 실시예에서, 본 발명은 STRO-1+ 및 αv + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다. 이 실시예에서, αv + 세포가 풍부한 집단은 적어도 약 5% 또는 6% 또는 7% αv + 세포를 포함한다.
다른 실시예에서, 본 발명은 STRO-1, α1 +, α3 +, α4 + 및 α5 + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다.
다른 실시예에서, 본 개시내용에 따른 중간엽 계통 전구체 또는 줄기세포는 α1β1, α2β1, α3β1, α4β1 및 α5β1로 구성된 군에서 선택되는 인테그린을 발현할 수 있다. 따라서, 일 실시예에서, 본 개시내용에 따른 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α1β1을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α2β1을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α4β1을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 α5β1을 발현한다.
다른 실시예에서, 본 발명에 따른 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 β3 (CD61) 사슬 폴리펩티드를 갖는 인테그린을 발현한다. 일 실시예에서, 본 발명은 STRO-1+ 및 β3 + 세포가 풍부한 중간엽 계통 전구체 또는 줄기세포 집단을 포함한다. 이 실시예에서, β3 + 세포가 풍부한 집단은 적어도 약 8% 또는 10% 또는 15% β3 + 세포를 포함한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 αvβ3을 발현한다. 다른 실시예에서, 본 발명에 따른 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 β5 (ITGB5) 사슬 폴리펩티드를 갖는 인테그린을 발현한다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 αvβ5를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 αvβ6을 발현한다.
상기 언급된 인테그린을 발현하는 중간엽 계통 전구체 또는 줄기세포를 확인 및/또는 농축시키는 것은 당업계에 공지된 다양한 방법을 사용하여 달성될 수 있다. 일 실시예에서, 형광 활성화된 세포 분류(FACS)는 원하는 인테그린 폴리펩티드 사슬 또는 이들의 조합을 발현하는 세포를 확인하고 선택하기 위해 상업적으로 이용 가능한 항체(예: Thermofisher; Pharmingen; Abcam)를 이용하여 사용될 수 있다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 콕사키바이러스(coxsackievirus) 및 아데노바이러스 수용체를 발현한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1, 콕사키 바이러스 및 아데노바이러스 수용체 및 하나 이상의 상기 언급된 인테그린을 발현한다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1, 콕사키 바이러스 및 아데노바이러스 수용체, αvβ3 및 αvβ5를 발현한다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 그들의 세포 표면에서 하나 이상의 상기 언급된 인테그린 또는 콕사키바이러스 및 아데노바이러스 수용체를 발현하도록 유전적으로 변형된다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1 및 키메라 항원 수용체(CAR)를 발현한다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 STRO-1, CAR, αvβ3 및 αvβ5를 발현한다.
일 실시예에서, CAR를 발현하는 중간엽 계통 전구체 또는 줄기세포는 T 세포 매개 면역 반응을 유발할 수 있다. 다른 실시예에서, CAR는 중간엽 계통 전구체 또는 줄기세포를 암 세포에 부착시키는 수단으로서 작용한다. 다른 실시예에서, CAR는 중간엽 계통 전구체 또는 줄기세포의 암 세포에 대한 풍부화된 접착을 유발하는 수단으로서 작용한다.
일 실시예에서, CAR는 세포 외 항원 결합 도메인, 막관통 도메인 및 세포 내 도메인으로 구성된다. 일 실시예에서, 항원 결합 도메인은 하나 이상의 종양 항원에 대한 친화성을 갖는다. 예시적인 종양 항원은 HER2, CLPP, 707-AP, AFP, ART-4, BAGE, MAGE, GAGE, SAGE, b-catenin/m, bcr-abl, CAMEL, CAP-1, CEA, CASP-8, CDK/4, CDC-27, Cyp-B, DAM-8, DAM-10, ELV-M2, ETV6, G250, Gp100, HAGE, HER-2/neu, EPV-E6, LAGE, hTERT, survivin, iCE, MART-1, tyrosinase, MUC-1, MC1-R, TEL/AML, 및 WT-1을 포함한다.
예시적인 세포 내 도메인은 CD3-zeta, CD28 및 4- IBB를 포함한다. 일부 실시예에서, CAR는 CD3-zeta, CD28, 4- 1BB, TLR-4의 조합을 포함할 수 있다.
예시적인 막관통 도메인은 T-세포 수용체, CD28, CD3 epsilon, CD45, CD4, CD5, CDS, CD9, CD 16, CD22, CD33, CD37, CD64, CD80, CD86, CD 134, CD137, 35 CD 154의 알파, 베타 또는 제타 사슬로부터 유래될 수 있다(즉, 적어도 막관통 영역(들)을 포함함). 다른 실시예에서, 막관통 도메인은 합성될 수 있으며, 이 경우, 주로 류신 및 발린과 같은 소수성 잔기를 포함할 수 있다.
중간엽 계통 전구체 또는 줄기세포는 상기 언급되고 면역선택에 의해 풍부화된 것과 같은 숙주 조직으로부터 분리될 수 있다. 예를 들어, 대상체로부터 골수 흡인물(bone marrow aspirate)은 중간엽 계통 전구체 또는 줄기세포의 선택을 가능하게 하기 위해 STRO-1 또는 TNAP에 대한 항체로 추가로 처리될 수 있다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 Simmons & Torok-Storb, 1991에 기술된 STRO-1 항체를 사용하여 풍부화될 수있다.
STRO-1+ 세포는 골수, 혈액, 치아 펄프 세포, 지방 조직, 피부, 비장, 췌장, 뇌, 신장, 간, 심장, 망막, 뇌, 모낭, 내장, 폐, 림프절, 흉선, 뼈, 인대, 힘줄, 골격근, 진피 및 골막에서 발견되는 세포이며; 중배엽 및/또는 내배엽 및/또는 외배엽과 같은 생식선(germ line)으로 분화될 수 있다. 따라서, STRO-1+ 세포는 지방, 골, 연골, 탄성, 근육 및 섬유질 결합 조직을 포함하지만 이에 제한되지 않는 다수의 세포 유형으로 분화될 수 있다. 이들 세포가 들어가는 특정 계통-결정(lineage-commitment) 및 분화 경로는 기계적 영향 및/또는 내인성 생물 활성 인자(예: 성장 인자, 사이토카인 및/또는 숙주 조직에 의해 확립된 국소 미세환경 조건)로부터의 다양한 영향에 의존한다.
본원에 사용된 용어 "풍부한(enriched)"은 하나의 특정 세포 유형의 비율 또는 다수의 특정 세포 유형의 비율이 처리되지 않은 세포 집단(예: 천연 환경(native environment)의 세포)과 비교할 때 증가하는 세포 집단을 설명한다. 일 실시예에서, STRO-1+ 세포가 풍부한 집단은 적어도 약 0.1% 또는 0.5% 또는 1% 또는 2% 또는 5% 또는 10% 또는 15% 또는 20% 또는 25% 또는 30% 또는 50% 또는 75% STRO-1+ 세포를 포함한다. 이와 관련하여, 용어 "STRO-1+ 세포가 풍부한 세포의 집단(population of cells enriched for STRO-1+ cells)"는 용어 "X% STRO-1+ 세포를 포함하는 세포의 집단"에 대한 명백한 지지를 제공하기 위해 사용될 것이며, 여기서 X%는 본원에 언급된 백분율이다. STRO-1+ 세포는 일부 실시예에서 클론원성 집단(clonogenic colonies)을 형성할 수 있으며, 예를 들어, CFU-F (섬유아세포) 또는 그의 서브세트(예: 50% 또는 60% 또는 70% 또는 70% 또는 90% 또는 95%)가 이러한 활성을 가질 수 있다.
일 실시예에서, 세포 집단은 선택 가능한 형태로 STRO-1+ 세포를 포함하는 세포 제제로부터 풍부화된다. 이와 관련하여, 용어 "선택 가능한 형태(selectable form)"는 세포가 STRO-1+ 세포의 선택을 허용하는 마커(예: 세포 표면 마커)를 발현하는 것을 의미한다고 이해될 것이다. 마커는 STRO-1 일 수 있지만 반드시 그럴 필요는 없다. 예를 들어, 본원에 기술 및/또는 예시된 바와 같이, STRO-2 및/또는 STRO-3 (TNAP) 및/또는 STRO-4 및/또는 VCAM-1 및/또는 CD146 및/또는 3G5를 발현하는 세포(예: MPC)는 또한 STRO-1을 발현한다(STRO-1bright도 가능). 따라서, 세포가 STRO-1+라는 표시는 세포가 STRO-1 발현에 의해 선택되는 것을 의미하지는 않는다. 일 실시예에서, 세포는 적어도 STRO-3 발현에 기초하여 선택되며, 예를 들어, 이들은 STRO-3+ (TNAP +)이다.
세포 또는 이의 집단의 선택에 대한 언급이 반드시 특정 조직 공급원으로부터의 선택을 요구하는 것은 아니다. 본원에 기술된 바와 같이, STRO-1+ 세포는 매우 다양한 공급원으로부터 선택되거나 분리되거나 풍부화될 수 있다. 즉, 일부 실시예에서, 이들 용어는 STRO-1+ 세포를 포함하는 임의의 조직 또는 혈관내(vascularized) 조직 또는 주피세포(pericytes)(예: STRO-1+ 또는 3G5+ 주피세포)를 포함하는 조직 또는 본원에 언급된 임의의 하나 이상의 조직으로부터의 선택에 대한 지지를 제공한다.
일 실시예에서, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 TNAP+, VCAM-1+, THY-1+, STRO-2+, STRO-4+ (HSP-90*?*), CD45+, CD146+, 3G5+로 구성된 군에서 개별적으로 또는 집합적으로 선택되는 하나 이상의 마커를 발현한다.
"개별적으로(individually)"는 본 개시내용이 인용된 마커 또는 마커 그룹을 별도로 포함하고, 개별 마커 또는 마커 그룹이 본원에 별도로 열거되지 않을 수 있음에도 불구하고, 첨부된 청구범위는 그러한 마커 또는 마커 그룹을 별도로 및 서로 나누어져서 정의할 수 있다.
"집합적으로(collectively)"는 본 개시가 인용된 마커 또는 마커 그룹의 임의의 수 또는 조합을 포함하고, 마커 또는 마커 그룹의 이러한 수 또는 조합이 본원에 구체적으로 열거되지 않을 수 있음에도 불구하고, 첨부된 청구범위는 이러한 조합 또는 하위 조합을 마커 또는 마커 그룹의 임의의 다른 조합과 별도로 및 나누어져서 정의할 수 있다.
주어진 마커에 대해 "양성(positive)"으로 지칭되는 세포는 마커가 세포 표면에 존재하는 정도에 따라 마커의 낮은(낮음 또는 희미한 또는 둔한), 중간(중앙) 또는 높은(밝은, 브리) 수준을 발현할 수 있으며, 상기 용어는 세포의 분류 과정 또는 세포의 유동 혈구 계산 분석(flow cytometric analysis)에 사용되는 형광의 강도 또는 다른 마커와 관련이 있다. 낮은(낮음 또는 희미한 또는 둔한), 중간(중앙) 또는 높은(밝은, 브리)의 구별은 분류되거나 분석되는 특정 세포 집단에 사용되는 마커의 맥락에서 이해될 것이다. 주어진 마커에 대해 "음성(negative)"으로 지칭되는 세포가 반드시 그 세포에 완전히 존재하지는 않는다. 이 용어는 마커가 그 세포에 의해 상대적으로 매우 낮은 수준으로 발현되고, 검출가능하게 표지되거나 배경 수준, 예를 들어 이소형 대조군 항체를 사용하여 검출된 수준 이상으로 검출될 수 없을 때 매우 낮은 신호를 생성한다는 것을 의미한다.
본원에 사용된 용어 "밝은(bright)"또는 브리(bri)는 검출가능하게 표지될 때 상대적으로 높은 신호를 생성하는 세포 표면상의 마커를 지칭한다. 이론에 의해 제한되기를 원하지 않지만, "밝은"세포는 샘플에서 다른 세포보다 더 많은 표적 마커 단백질(예: STRO-1 항체에 의해 인식되는 항원)을 발현하는 것이 제안된다. 예를 들어, STRO-1bri 세포는 형광 활성화 세포 분류(FACS) 분석에 의해 결정된 바와 같이 FITC-접합된 STRO-1 항체로 표지될 때 비-밝은 세포(STRO-1낮음/희미함/둔함/중간/중앙) 보다 더 큰 형광 신호를 생성한다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 골수로부터 분리되고 STRO-1+ 세포의 선택에 의해 풍부화된다. 이 실시예에서, "밝은"세포는 출발 샘플에 함유된 가장 밝게 표지된 골수 단핵세포의 약 0.1% 이상을 구성한다. 다른 실시예에서, "밝은"세포는 출발 샘플에 함유된 가장 밝게 표지된 골수 단핵세포의 약 0.1% 이상, 약 0.5% 이상, 약 1% 이상, 약 1.5% 이상 또는 약 2% 이상을 구성한다. 일 실시예에서, STRO-1bright 세포는 "배경", 즉 STRO-1-인 세포에 비해 2log 크기 높은 STRO-1 표면 발현을 갖는다. 이에 비해, STRO-1낮음/희미함/둔함 및/또는 STRO-1중간/중앙 세포는 2log 크기 미만의 STRO-1 표면 발현 발현, 전형적으로 약 1 log 또는 "배경"미만을 갖는다.
일 실시예에서, STRO-1 + 세포는 STRO-1bright이다. 일 실시예에서, STRO-1bright 세포는 STRO-1낮음/희미함/둔함(lo/dim/dull) 또는 STRO-1 중간/중앙(intermediate/median) 세포에 비해 우선적으로 풍부화된다.
일 실시예에서, STRO-1bright 세포는 추가로 TNAP+, VCAM-1+, THY-1+, STRO-2+, STRO-4+ (HSP-90β) 및/또는 CD146+ 중 하나 이상이다. 예를 들어, 세포는 상기 마커 중 하나 이상에 대해 선택되고 및/또는 상기 마커 중 하나 이상을 발현하는 것으로 나타난다. 이와 관련하여, 마커를 발현하는 것으로 나타난 세포는 구체적으로 시험될 필요가 없고, 오히려 이전에 풍부화된 또는 분리된 세포가 시험될 수 있고, 이어서 사용되며, 분리되거나 풍부화된 세포가 또한 동일한 마커를 발현하는 것으로 합리적으로 추정될 수 있다.
일 실시예에서, STRO-1bright 세포는 혈관주위의(perivascular) 마커 3G5의 존재를 특징으로 하는 WO 2004/85630에 정의된 바와 같은 혈관주위의(perivascular) 중간엽 계통 전구체 또는 줄기세포다.
본원에 사용된 용어 "TNAP"은 조직 비특이적 알칼리성 포스파타제의 모든 이소형을 포함하는 것으로 의도된다. 예를 들어, 용어는 간 이소형(LAP), 골 이소형(BAP) 및 신장 이소형(KAP)을 포함한다. 일 실시예에서, TNAP는 BAP이다. 일 실시예에서, TNAP는 수탁번호(deposit accession number) PTA-7282 하에 부다페스트 조약의 규정에 따라 2005년 12월 19일 ATCC로 기탁된 하이브리도마 세포주에 의해 생성된 STRO-3 항체에 결합할 수 있는 분자를 의미한다.
또한, 일 실시예에서, STRO-1+ 세포는 클론원성(clonogenic) CFU-F를 일으킬 수 있다.
일 실시예에서, 상당한 비율의 STRO-1+ 세포는 적어도 2개의 상이한 생식선(germ lines)으로 분화될 수 있다. 세포가 속할(committed) 수 있는 계통의 비제한적인 예는 골 전구체 세포; 담관(bile duct) 상피 세포 및 간세포에 대해 다분화성인 간세포 전구체; 희소돌기아교세포(oligodendrocyte) 및 성상세포로 진행하는 신경교세포 전구체를 생성할 수 있는 신경 제한 세포(neural restricted cells); 뉴런으로 진행하는 뉴런 전구체; 심장 근육 및 심근세포의 전구체, 포도당-반응성 인슐린 분비 췌장 베타 세포주를 포함한다. 다른 계통은 상아질모세포(odontoblasts), 상아질 생성세포(dentin-producing cells) 및 연골세포(chondrocytes) 및 다음과 같은 전구체 세포를 포함하지만 이에 제한되지 않는다: 망막 색소 상피세포, 섬유아세포, 각질형성세포(keratinocytes)와 같은 피부세포, 수지상세포, 모낭세포, 신장 덕트(renal duct) 상피세포, 평활 및 골격근 세포, 고환 선조세포, 혈관 내피세포, 힘줄, 인대, 연골, 지방세포, 섬유아세포, 골수 기질, 심장 근육, 평활근, 골격근, 주피세포(pericyte), 혈관, 상피, 신경교, 신경, 성상세포 및 희소돌기아교세포(oligodendrocyte).
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 MSC이다. MSC는 균질한 조성물이거나 MSC가 풍부한 혼합세포 집단일 수 있다. 균질한 MSC 조성물은 부착성 골수 또는 골막세포를 배양함으로써 수득될 수 있고, MSC는 독특한 단일클론항체로 확인되는 특정 세포 표면 마커에 의해 확인될 수 있다. MSC가 풍부한 세포 집단을 수득하는 방법은 예를 들어 US 5486359에 기재되어 있다. 통상적인 플라스틱 접착 분리에 의해 제조된 MSC는 CFU-F의 비특이적 플라스틱 접착 특성에 의존한다. STRO-1에 기초한 면역선택에 의해 골수로부터 분리된 중간엽 계통 전구체 또는 줄기세포는 다른 플라스틱 부착성 골수 집단이 없는 경우 골수 집단으로부터 클론원성 중간엽 전구체를 특이적으로 분리한다. MSC의 대체 공급원은 혈액, 피부, 제대혈, 근육, 지방, 뼈 및 연골막(perichondrium)을 포함하나 이에 제한되지 않는다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 유도만능줄기세포(iPS세포)와 같은 다능성(pluripotent) 세포로부터 유래된다. 일 구현예에서 다능성 세포는 인간 다능성 세포이다. 다능성 세포로부터 중간엽 계통 전구체 또는 줄기세포의 생성에 적합한 방법은 예를 들어 US 7,615,374 및 US 2014273211, Barberi et al; Plos medicine, Vol 2(6):0554-0559 (2005), 및 Vodyanik et al. Cell Stem cell, Vol 7:718-728 (2010)에 기재되어 있다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 불멸화된다(immortalised). 불멸화된 중간엽 계통 전구체 또는 줄기세포의 생성을 위한 예시적인 공정은 예를 들어, Obinata M., Cell, Vol 2:235-244 (1997), US 9,453,203, Akimov et al. Stem Cells, Vol 23:1423-1433 및 Kabara et al. Laboratory Investigation, Vol 94: 1340-1354 (2014)에 기재되어 있다.
본 개시내용의 바람직한 실시 양태에서, 중간엽 계통 전구체 또는 줄기세포는 건강한 지원자의 골수로부터 풍부화된 중간엽 계통 전구체 또는 줄기세포로부터 유래된 마스터 세포 은행으로부터 수득된다. 이러한 공급원으로부터 유래된 중간엽 계통 전구체 또는 줄기세포의 사용은 중간엽 계통 전구체 또는 줄기세포 공여자로서 기능할 수 있는 적절한 가족 구성원이 없거나, 중간엽 계통 전구체 또는 줄기세포를 생성하는 데 걸리는 시간 동안 즉각적인 치료가 필요하고, 재발, 질병 관련 쇠퇴 또는 사망의 위험이 높은 대상체에게 특히 유리하다.
다른 실시예에서, 중간엽 계통 전구체 세포는 Cx43을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 세포는 Cx40을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 세포는 Cx43 및 Cx40을 발현한다. 다른 실시예에서, 중간엽 계통 전구체 세포는 Cx45, Cx32 및/또는 Cx37을 발현한다. 일 실시예에서, 중간엽 계통 전구체 세포는 특정 코넥신을 발현하도록 변형되지 않는다.
다른 실시예에서, 중간엽 계통 전구체 세포는 STRO-1 및 CD46을 발현한다. 이 실시예에서, 중간엽 계통 전구체 세포는 또한 상기 언급된 하나 이상의 인테그린을 발현할 수 있다.
분리 또는 풍부화된 중간엽 계통 전구체 세포는 시험관 내 배양에 의해 확장될 수 있다. 분리되거나 풍부화된 중간엽 계통 전구체 세포는 동결보존, 해동 및 후속적으로 시험관 내 배양에 의해 확장될 수 있다.
일 실시예에서, 분리되거나 풍부화된 중간엽 계통 전구체 세포는 배양 배지(무 혈청 또는 혈청-보충됨), 예를 들어 5% 소태아혈청(FBS) 및 글루타민이 보충되고 37℃ 20% O2에서 밤새 배양 용기에 부착되도록 허락된 알파 최소 필수 배지(αMEM)에서 50,000개의 생존 cells/cm2에 시딩된다. 이어서 배양 배지를 필요에 따라 교체 및/또는 변경하고 세포를 37℃, 5% O2에서 추가로 68 내지 72시간 동안 배양하였다.
당업자에 의해 이해되는 바와 같이, 배양된 중간엽 계통 전구체 세포는 생체 내에서 세포와 표현형적으로(phenotypically) 상이하다. 예를 들어, 일 현예에서 이들은 하기 마커, CD44, CD46, NG2, DC146 및 CD140b 중 하나 이상을 발현한다. 배양된 중간엽 계통 전구체 세포는 또한 생체 내에서 세포와 생물학적으로 상이하며, 생체 내에서 대부분 비-사이클링(진행이 정지된(quiescent)) 세포와 비교하여 더 높은 증식 속도를 갖는다.
Ang1 및 VEGF 수준
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 Ang1을 적어도 0.1 μg/106 cells의 양으로 발현한다. 그러나, 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 적어도 0.2 μg/106 cells, 0.3 μg/106 cells, 0.4 μg/106 cells, 0.5 μg/106 cells, 0.6 μg/106 cells, 0.7 μg/106 cells, 0.8 μg/106 cells, 0.9 μg/106 cells, 1 μg/106 cells, 1.1 μg/106 cells, 1.2 μg/106 cells, 1.3 μg/106 cells, 1.4 μg/106 cells, 1.5 μg/106 cells의 양으로 Ang1을 발현한다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 약 0.05 μg/106 cells 미만의 양으로 VEGF를 발현한다. 그러나, 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 약 0.05 μg/106 cells, 0.04 μg/106 cells, 0.03 μg/106 cells, 0.02 μg/106 cells, 0.01 μg/106 cells, 0.009 μg/106 cells, 0.008 μg/106 cells, 0.007 μg/106 cells, 0.006 μg/106 cells, 0.005 μg/106 cells, 0.004 μg/106 cells, 0.003 μg/106 cells, 0.002 μg/106 cells, 0.001 μg/106 cells 미만의 양으로 VEGF를 발현한다.
중간엽 계통 전구체 또는 줄기세포의 조성물 또는 배양에서 발현되는 세포성 Ang1 및/또는 VEGF의 양은 당업자에게 공지된 방법에 의해 결정될 수 있다. 이러한 방법은 예를 들어 정량적 ELISA 분석법과 같은 정량적 분석법을 포함하지만 이에 제한되지는 않는다. 이 실시예에서, 중간엽 계통 전구체 또는 줄기세포의 배양물로부터의 세포 용해물이 ELISA 플레이트의 웰에 첨가된다. 웰은 Ang1 또는 VEGF에 대한 1차 항체, 단일클론 또는 다클론 항체(들)로 코팅될 수 있다. 이어서, 웰을 세척한 다음, 1차 항체에 대해 2차 항체, 단일클론 또는 다클론 항체(들)와 접촉시킨다. 2차 항체는 예를 들어 겨자무과산화효소(horseradish peroxidase)와 같은 적절한 효소에 접합된다. 이어서, 웰을 배양한 후, 배양 기간 후에 세척한다. 이어서, 웰을 하나 이상의 발색체(chromogen)와 같은 2차 항체에 접합된 효소에 대한 적절한 기질과 접촉시킨다. 사용될 수 있는 발색체는 과산화수소 및 테트라메틸벤지딘을 포함하나, 이에 제한되지는 않는다. 기질(들)을 첨가한 후, 웰을 적절한 시간동안 배양한다. 배양의 완료 후, "정지"용액을 웰에 첨가하여 효소와 기질(들)의 반응을 정지시킨다. 샘플의 광학 밀도(OD)가 측정된다. 시험되는 줄기세포의 배양에 의해 발현된 Ang1 또는 VEGF의 양을 결정하기 위해 샘플의 광학 밀도는 공지된 양의 Ang1 또는 VEGF를 함유하는 샘플의 광학 밀도와 상관된다.
다른 관점에서, 중간엽 계통 전구체 또는 줄기세포는 약 2:1의 비율로 Ang1:VEGF를 발현한다. 그러나, 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 Ang1:VEGF를 적어도 약 10:1, 15:1, 20:1, 21:1, 22:1, 23:1, 24:1, 25:1, 26:1, 27:1, 28:1, 29:1, 30:1, 31:1, 32:1, 33:1, 34:1, 35:1, 50:1의 비율로 발현한다.
Ang1:VEGF 발현 비율을 결정하는 방법은 당업자에게 명백할 것이다. 예를 들어 Ang1 및 VEGF 발현 수준은 상기 논의된 바와 같이 정량적 ELISA를 통해 정량될 수 있다. Ang1 및 VEGF의 수준을 정량화한 후, Ang1 및 VEGF의 정량화된 수준에 기초한 비율은 (Ang1의 수준/VEGF의 수준) = Ang1:VEGF 비율로 나타낼 수 있다.
일 실시예에서, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 상기 예시된 수준 또는 비율로 Ang1 및/또는 VEGF를 발현하도록 유전적으로 변형되지 않는다. Ang1 및/또는 VEGF를 발현하도록 유전적으로 변형되지 않은 세포는 Ang1 및/또는 VEGF를 발현 또는 암호화하는 핵산으로 형질주입에 의해 변형되지 않았다. 의심의 여지를 피하기 위해, 본 개시의 맥락에서, Ang1 및/또는 VEGF를 암호화하는 핵산으로 형질주입된 중간엽 계통 전구체 또는 줄기세포는 유전적으로 변형된 것으로 간주될 것이다. 본 개시내용의 맥락에서, Ang1 및/또는 VEGF를 발현하도록 유전적으로 변형되지 않은 세포는 Ang1 및/또는 VEGF1을 암호화하는 핵산으로 형질주입 없이 Ang1 및/또는 VEGF를 자연적으로 어느 정도 발현한다.
핵산
본 개시내용은 다양한 핵산의 사용을 포함한다. 용어 "핵산(nucleic acid)" 및 "핵산 분자(nucleic acid molecule)"는 본 개시내용 전체에서 상호교환적으로 사용될 수 있다. 예시적인 핵산은 DNA(예: 상보적 DNA(cDNA), 게놈 DNA(gDNA)), RNA(예: 메시지 RNA(mRNA), 짧은 헤어핀 RNA(shRNA), 짧은 억제성 RNA(siRNA), 리보솜 RNA(rRNA), tRNA, 마이크로 RNA), DNA 또는 RNA 유사체(예: 염기 유사체, 당 유사체 및/또는 비천연 백본(backbone) 등을 함유함), RNA/DNA 하이브리드 및 폴리아미드 핵산(PNA)을 포함하며, 이들 모두는 단일- 또는 이중-가닥 형태일 수 있다. 일 실시예에서, 핵산은 분리된다. 본원에 사용된 용어 "분리된 핵산(isolated nucleic acid)"은 인간의 개입을 통해 자연 상태로부터 변경되거나 제거된 핵산을 의미한다.
다른 예시적인 핵산은 올리고뉴클레오티드다. 본원에 사용된 용어 "올리고뉴클레오티드(oligonucleotide)"는 짧은 DNA 또는 RNA 분자를 의미한다. 올리고뉴클레오티드는 서열-특이적 방식으로 이들의 각각의 상보적 올리고뉴클레오티드, DNA 또는 RNA에 용이하게 결합하여 이중체(duplexes)를 형성한다.
일 실시예에서, 상기 올리고뉴클레오티드는 DNA 분자일 수 있다. 다른 실시예에서, 상기 올리고뉴클레오티드는 RNA 분자일 수 있다.
다양한 실시예에서, 올리고뉴클레오티드의 길이는 약 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30개 또는 그 이상의 뉴클레오티드이다.
일 실시예에서, 본 개시내용의 올리고뉴클레오티드는 억제성 올리고뉴클레오티드다. 일 실시예에서, 용어 "억제성 올리고뉴클레오티드(inhibitory oligonucleotide)"는 하나 이상의 단백질의 생성, 발현 또는 생물학적 활성을 감소시키는 임의의 올리고뉴클레오티드를 지칭한다. 예를 들어, 억제성 올리고뉴클레오티드는 리보솜에서 단백질로의 mRNA의 번역을 방해할 수 있다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 표적 유전자(들) 또는 mRNA에 결합하여(하이브리드화) 표적 단백질의 발현 또는 생물학적 활성을 감소시키기 위해 하나 이상의 단백질을 암호화하는 유전자 또는 mRNA에 충분히 상보적일 수 있다. 다른 실시예에서, 억제성 올리고뉴클레오티드는 단백질을 암호화하지 않는 세포 내 핵산의 생물학적 활성을 억제한다. 예를 들어, 억제성 올리고뉴클레오티드는 비-코딩 RNA의 생물학적 활성을 억제할 수 있다.
예시적인 억제성 올리고뉴클레오티드는 분리 또는 합성 안티센스 RNA 또는 DNA, siRNA 또는 siDNA, miRNA, miRNA 모방체, shRNA 또는 DNA 및 키메라 안티센스 DNA 또는 RNA를 포함한다.
본원에 사용된 용어 "안티센스(antisense)"는 코딩 서열에 상보적이고 따라서 코딩 서열에 결합할 수 있는 뉴클레오티드의 서열을 의미하며, 이는 전사되는 DNA 이중 나선의 가닥 또는 메신저 RNA 분자의 것일 수 있다. 안티센스 DNA는 이중 가닥 DNA에서 코딩 가닥에 상보적인 비 코딩 가닥이다. 안티센스 가닥은 메신저 RNA(mRNA) 합성의 주형으로 사용된다.
용어 "짧은 헤어핀 RNA(short hairpin RNA)" 또는 "shRNA"는 이중(duplex) 영역 및 루프 영역을 갖는 RNA 구조를 지칭한다.
짧은 간섭 RNA 또는 침묵 RNA로도 알려진 용어 작은 간섭 RNA(siRNA)는 20-25개의 염기쌍 길이의 이중 가닥 RNA 분자의 클래스이다. 특정 단백질로의 번역을 억제 또는 방지하는 siRNA는 용어 siRNA와 결합된 단백질 이름으로 표시된다. 따라서 KIF11의 번역을 방해하는 siRNA는 "KIF11 siRNA"라는 표현으로 표시된다. 전형적으로, 다양한 구현예에서 siRNA는 2개의 뉴클레오티드 가닥을 포함하는 이중 가닥 핵산 분자이며, 각각의 가닥은 약 19 내지 약 28개의 뉴클레오티드(즉, 약 19, 20, 21, 22, 23, 24, 25, 26, 27, 또는 28개의 뉴클레오티드)를 갖는다. 본 개시내용에 포함되는 예시적인 siRNA는 KIF11 siRNA, KRAS siRNA 및 PLK1 siRNA를 포함한다.
용어 "마이크로 RNA"(약어 miRNA)는 식물, 동물 및 일부 바이러스에서 발견되는 작은 비-코딩 RNA 분자(약 22개의 뉴클레오티드 함유)이며, 유전자 발현의 RNA 침묵 및 전사 후 조절에 작용한다. 접두사 "miR" 다음에는 대시 및 숫자가 오며, 후자는 종종 명명 순서를 나타낸다. 1개 또는 2개의 뉴클레오티드를 제외하고 거의 동일한 서열을 갖는 상이한 miRNA는 추가의 소문자로 주석이 달린다. 수많은 miRNA가 당업계에 공지되어 있다(miRBase V.21 nomenclature; Kozomara et al. 2013; Griffiths-Jones, S. 2004). 인간 miRNAs의 예는 hsa-let-7d-3p, hsa-miR-101-5p, hsa-miR-106b-3p, hsa-miR-1179, hsa-miR-125a-5p, hsa-miR-141- 3p, hsa-miR-148a-3p, hsa-miR-16-5p, hsa-miR-192-5p, hsa-miR-195-5p, hsa-miR-19b-3p, hsa-miR-20a-5p, hsa-miR-200b-3p, hsa-miR-217, hsa-miR-223-3p, hsa-miR-371a-3p, hsa- miR-487b, hsa-miR-515-3p, hsa-miR-605, hsa-let-7a-3p, hsa-let-7a-5p, hsa-let-7b-3p, hsa- let-7b-5p, hsa-let-7c, hsa-let-7d-5p, hsa-let-7e-3p, hsa-let-7e-5p, hsa-let-7f-l-3p, hsa-let-7f-2- 3p, hsa-let-7f-5p, hsa-let-7g-3p, hsa-let-7g-5p, hsa-let-7i-3p, hsa-let-7i-5p, hsa-miR-1, hsa- miR-100-3p, hsa-miR-100-5p, hsa-miR-101-3p, hsa-miR-103a-2-5p, hsa-miR-103a-3p, hsa- miR-103b, hsa-miR-105-5p, hsa-miR-106a-3p, hsa-miR-106a-5p, hsa-miR-106b-5p, hsa- miR-107, hsa-miR-10a-3p, hsa-miR-10a-5p, hsa-miR-10b-3p, hsa-miR-10b-5p, hsa-miR- 1178-3p, hsa-miR-1180, hsa-miR-1181, hsa-miR-1182, hsa-miR-1183, hsa-miR-1184, hsa- miR-1185-5p, hsa-miR-1204, hsa-miR-1207, hsa-miR-1208, hsa-miR-122-3p, hsa-miR-122- 5p, hsa-miR-1224, hsa-miR-1226, hsa-miR-1227-3p, hsa-miR-1228-5p, hsa-miR-1229-3p, hsa-miR-1231, hsa-miR-124-3p, hsa-miR-1245 a, hsa-miR-1246, hsa-miR-1249, hsa-miR- 125a-3p, hsa-miR- 125b- l-3p, hsa-miR- 125b-2-3p, hsa-miR- 125b-5p, hsa-miR-1251, hsa- miR-1252, hsa-miR-1253, hsa-miR- 1255 a, hsa-miR-1255b-5p, hsa-miR- 126-3p, hsa-miR- 1260a, hsa-miR- 1260b, hsa-miR- 1262, hsa-miR- 1263, hsa-miR- 1265, hsa-miR- 1268a, hsa- miR-127-3p, hsa-miR-1270, hsa-miR-1272, hsa-miR- 1273 a, hsa-miR-1275, hsa-miR-1276, hsa-miR- 1277-3p, hsa-miR-1278, hsa-miR-128, hsa-miR-1285-3p, hsa-miR-1286, hsa-miR- 1287, hsa-miR- 129-2-3p, hsa-miR- 1292-5p, hsa-miR-1293, hsa-miR-1301, hsa-miR-1302, hsa-miR-1303, hsa-miR-1305, hsa-miR-130a-3p, hsa-miR- 130a-5p, hsa-miR-130b-3p, hsa- miR-130b-5p, hsa-miR- 132-3p, hsa-miR- 132-5p, hsa-miR-1321, hsa-miR-1323, hsa-miR- 1324, hsa-miR- 133a, hsa-miR- 133b, hsa-miR- 134, hsa-miR- 135a-3p, hsa-miR- 135a-5p, hsa- miR-135b-3p, hsa-miR- 135b-5p, hsa-miR- 136-3p, hsa-miR-136-5p, hsa-miR-137, hsa-miR- 138-l-3p, hsa-miR- 138-2-3p, hsa-miR- 138-5p, hsa-miR- 139-3p, hsa-miR-139-5p, hsa-miR- 140-3p, hsa-miR- 140-5p, hsa-miR- 142-3p, hsa-miR- 142-5p, hsa-miR-143-3p, hsa-miR-143- 5p, hsa-miR- 144-3p, hsa-miR- 144-5p, hsa-miR-145-3p, hsa-miR-145-5p, hsa-miR-1468, hsa- miR- 146a-5p, hsa-miR- 146b-3p, hsa-miR- 146b-5p, hsa-miR- 147a, hsa-miR- 147b, hsa-miR- 148a-5p, hsa-miR- 148b-3p, hsa-miR- 148b-5p, hsa-miR- 149-3p, hsa-miR- 149-5p, hsa-miR- 150-3p, hsa-miR- 150-5p, hsa-miR-151a-3p, hsa-miR-151a-5p, hsa-miR-152, hsa-miR-153, hsa-miR-1538, hsa-miR-1539, hsa-miR- 154-3p, hsa-miR- 154-5p, hsa-miR- 155-5p, hsa-miR- 15a-3p, hsa-miR- 15a-5p, hsa-miR- 15b-3p, hsa-miR- 15b-5p, hsa-miR- 16- l-3p, hsa-miR-16- 2-3p, hsa-miR- 17-3p, hsa-miR- 17-5p, hsa-miR-181a-2-3p, hsa-miR-181a-3p, hsa-miR-181a- 5p, hsa-miR-181b-5p, hsa-miR-181c-3p, hsa-miR-181c-5p, hsa-miR-181d, hsa-miR- 182-5p, hsa-miR-1827, hsa-miR- 183-3p, hsa-miR- 183-5p, hsa-miR-184, hsa-miR-185-3p, hsa-miR- 185-5p, hsa-miR- 186-3p, hsa-miR- 186-5p, hsa-miR- 187-3p, hsa-miR- 187-5p, hsa-miR-188- 5p, hsa-miR- 18a-3p, hsa-miR- 18a-5p, hsa-miR- 18b-3p, hsa-miR- 18b-5p, hsa-miR- 190a, hsa- miR- 190b, hsa-miR-191-3p, hsa-miR-191-5p, hsa-miR-1915-3p, hsa-miR- 192-3p, hsa-miR- 193a-3p, hsa-miR- 193a-5p, hsa-miR- 193b-3p, hsa-miR- 193b-5p, hsa-miR- 194-5p, hsa-miR- 195-3p, hsa-miR- 196a-3p, hsa-miR- 196a-5p, hsa-miR- 196b-5p, hsa-miR- 197-3p, hsa-miR- 198, hsa-miR- 199a-3p, hsa-miR- 199a-5p, hsa-miR- 199b-3p, hsa-miR- 199b-5p, hsa-miR-19a- 3p, hsa-miR- 19a-5p, hsa-miR- 1909-3p, hsa-miR-191 l-3p, hsa-miR-200a-3p, hsa-miR-200a- 5p, hsa-miR-200b-5p, hsa-miR-200c-3p, hsa-miR-200c-5p, hsa-miR-202-3p, hsa-miR-202- 5p, hsa-miR-203a, hsa-miR-203b-5p, hsa-miR-204-5p, hsa-miR-205-5p, hsa-miR-206, hsa- miR-208b, hsa-miR-20a-3p, hsa-miR-20b-3p, hsa-miR-20b-5p, hsa-miR-21-3p, hsa-miR-21 - 5p, hsa-miR-210, hsa-miR-21 l-5p, hsa-miR-2110, hsa-miR-212-3p, hsa-miR-214-3p, hsa- miR-214-5p, hsa-miR-215, hsa-miR-216a-5p, hsa-miR-218- l-3p, hsa-miR-218-5p, hsa-miR- 219-1 -3p, hsa-miR-219-5p, hsa-miR-22-3p, hsa-miR-22-5p, hsa-miR-221-3p, hsa-miR-221- 5p, hsa-miR-222-3p, hsa-miR-222-5p, hsa-miR-223-5p, hsa-miR-224-3p, hsa-miR-224-5p, hsa-miR-2355-3p, hsa-miR-23a-3p, hsa-miR-23a-5p, hsa-miR-23b-3p, hsa-miR-23b-5p, hsa- miR-24-l-5p, hsa-miR-24-2-5p, hsa-miR-24-3p, hsa-miR-25-3p, hsa-miR-25-5p, hsa-miR- 26a-2-3p, hsa-miR-26a-5p, hsa-miR-26b-3p, hsa-miR-26b-5p, hsa-miR-27a-3p, hsa-miR- 27a-5p, hsa-miR-27b-3p, hsa-miR-27b-5p, hsa-miR-28-3p, hsa-miR-28-5p, hsa-miR-296-3p, hsa-miR-296-5p, hsa-miR-297, hsa-miR-298, hsa-miR-299-3p, hsa-miR-299-5p, hsa-miR- 29a-3p, hsa-miR-29a-5p, hsa-miR-29b-l-5p, hsa-miR-29b-2-5p, hsa-miR-29b-3p, hsa-miR- 29c-3p, hsa-miR-29c-5p, hsa-miR-2909, hsa-miR-301a-3p, hsa-miR-301b, hsa-miR-302a-5p, hsa-miR-302b-5p, hsa-miR-302c-5p, hsa-miR-302d-3p, hsa-miR-302d-5p, hsa-miR-302f, hsa-miR-3064-5p, hsa-miR-3065-3p, hsa-miR-3065-5p, hsa-miR-3074-3p, hsa-miR-3074-5p, hsa-miR-30a-3p, hsa-miR-30a-5p, hsa-miR-30b-3p, hsa-miR-30b-5p, hsa-miR-30c-l-3p, hsa- miR-30c-2-3p, hsa-miR-30c-5p, hsa-miR-30d-3p, hsa-miR-30d-5p, hsa-miR-30e-3p, hsa- miR-30e-5p, hsa-miR-31-3p, hsa-miR-31-5p, hsa-miR-3120-3p, hsa-miR-3120-5p, hsa-miR- 3184-5p, hsa-miR-32-3p, hsa-miR-32-5p, hsa-miR-320a, hsa-miR-320b, hsa-miR-320c, hsa- miR-323a-3p, hsa-miR-323b-5p, hsa-miR-324-3p, hsa-miR-324-5p, hsa-miR-325, hsa-miR- 326, hsa-miR-328, hsa-miR-329, hsa-miR-330-3p, hsa-miR-330-5p, hsa-miR-331-3p, hsa- miR-331-5p, hsa-miR-335-3p, hsa-miR-335-5p, hsa-miR-337-3p, hsa-miR-337-5p, hsa-miR- 338-3p, hsa-miR-338-5p, hsa-miR-339-3p, hsa-miR-339-5p, hsa-miR-33a-5p, hsa-miR-33b- 3p, hsa-miR-33b-5p, hsa-miR-340-3p, hsa-miR-340-5p, hsa-miR-342-3p, hsa-miR-342-5p, hsa-miR-345-5p, hsa-miR-346, hsa-miR-34a-3p, hsa-miR-34a-5p, hsa-miR-34b-3p, hsa-miR- 34b-5p, hsa-miR-34c-3p, hsa-miR-34c-5p, hsa-miR-3591-3p, hsa-miR-361-3p, hsa-miR-361- 5p, hsa-miR-3613-5p, hsa-miR-3615, hsa-miR-3619, hsa-miR-362-3p, hsa-miR-362-5p, hsa- miR-363-3p, hsa-miR-363-5p, hsa-mir-365a-3p, hsa-mir-365a-5p, hsa-mir-3653, hsa-miR- 3656, hsa-miR-367-3p, hsa-miR-367-5p, hsa-miR-3676-3p, hsa-miR-369-3p, hsa-miR-369- 5p, hsa-miR-370, hsa-miR-372, hsa-miR-373-3p, hsa-miR-373-5p, hsa-miR-374a-3p, hsa- miR-374a-5p, hsa-miR-374b-3p, hsa-miR-374b-5p, hsa-miR-375, hsa-miR-376a-2-5p, hsa- miR-376a-3p, hsa-miR-376a-5p, hsa-miR-376b-3p, hsa-miR-376c-3p, hsa-miR-377-3p, hsa- miR-377-5p, hsa-miR-378a-3p, hsa-miR-378a-5p, hsa-miR-378c, hsa-miR-378d, hsa-miR- 379-3p, hsa-miR-379-5p, hsa-miR-380-3p, hsa-miR-380-5p, hsa-miR-381-3p, hsa-miR-382- 3p, hsa-miR-382-5p, hsa-miR-383, hsa-miR-384, hsa-miR-3912, hsa-miR-3928, hsa-miR- 409-3p, hsa-miR-409-5p, hsa-miR-410, hsa-miR-41 l-3p, hsa-miR-41 l-5p, hsa-miR-412, hsa- miR-421, hsa-miR-422a, hsa-miR-423-3p, hsa-miR-423-5p, hsa-miR-424-3p, hsa-miR-424- 5p, hsa-miR-425-3p, hsa-miR-425-5p, hsa-miR-429, hsa-miR-4291, hsa-miR-431-5p, hsa- miR-432-5p, hsa-miR-433, hsa-miR-4421, hsa-miR-449a, hsa-miR-450a-5p, hsa-miR-450b- 3p, hsa-miR-450b-5p, hsa-miR-4505, hsa-miR-4510, hsa-miR-4516, hsa-miR-451a, hsa-miR- 452-3p, hsa-miR-452-5p, hsa-miR-4533, hsa-miR-4539, hsa-miR-454-3p, hsa-miR-454-5p, hsa-miR-455-3p, hsa-miR-455-5p, hsa-miR-4634, hsa-miR-4732-3p, hsa-miR-4732-5p, hsa- miR-4747-5p, hsa-miR-4792, hsa-miR-483-3p, hsa-miR-483-5p, hsa-miR-484, hsa-miR-485- 5p, hsa-miR-486-3p, hsa-miR-486-5p, hsa-miR-489, hsa-miR-490, hsa-miR-491-3p, hsa- miR-491-5p, hsa-miR-492, hsa-miR-493-3p, hsa-miR-493-5p, hsa-miR-494, hsa-miR-495- 3p, hsa-miR-496, hsa-miR-497-3p, hsa-miR-497-5p, hsa-miR-498, hsa-miR-499a-5p, hsa- miR-500a-3p, hsa-miR-501-3p, hsa-miR-501-5p, hsa-miR-502-3p, hsa-miR-502-5p, hsa- miR-503-5p, hsa-miR-504, hsa-miR-505-3p, hsa-miR-505-5p, hsa-miR-506-3p, hsa-miR- 508-3p, hsa-miR-508-5p, hsa-miR-509-3p, hsa-miR-511 , hsa-miR-512-5p, hsa-miR-513a-3p, hsa-miR-513a-5p, hsa-miR-513b, hsa-miR-514a-3p, hsa-miR-514a-5p, hsa-miR-515-5p, hsa- miR-516b-3p, hsa-miR-516b-5p, hsa-miR-517a-3p, hsa-miR-518a-3p, hsa-miR-518b, hsa- miR-518e-3p, hsa-miR-518e-5p, hsa-miR-518f-3p, hsa-miR-519a-5p, hsa-miR-519b-5p, hsa- miR-519c-3p, hsa-miR-519c-5p, hsa-miR-519d, hsa-miR-519e-5p, hsa-miR-520c-3p, hsa- miR-520e, hsa-miR-520f, hsa-miR-520g, hsa-miR-520h, hsa-miR-521, hsa-miR-522-5p, hsa- miR-523-5p, hsa-miR-525-3p, hsa-miR-532-3p, hsa-miR-532-5p, hsa-miR-539-5p, hsa-miR- 541, hsa-miR-542-3p, hsa-miR-542-5p, hsa-miR-543, hsa-miR-545-3p, hsa-miR-545-5p, hsa- miR-548a-3p, hsa-miR-548d-3p, hsa-miR-548e, hsa-miR-548i, hsa-miR-548m, hsa-miR-549, hsa-miR-550a-3p, hsa-miR-550a-5p, hsa-miR-551b-3p, hsa-miR-551b-5p, hsa-miR-552, hsa- miR-553, hsa-miR-554, hsa-miR-557, hsa-miR-563, hsa-miR-564, hsa-miR-567, hsa-miR- 569, hsa-miR-570-3p, hsa-miR-571, hsa-miR-572, hsa-miR-574-3p, hsa-miR-574-5p, hsa- miR-575, hsa-miR-576-3p, hsa-miR-576-5p, hsa-miR-577, hsa-miR-578, hsa-miR-580, hsa- miR-582-3p, hsa-miR-582-5p, hsa-miR-583, hsa-miR-584-5p, hsa-miR-585, hsa-miR-586, hsa-miR-589-3p, hsa-miR-589-5p, hsa-miR-590-3p, hsa-miR-590-5p, hsa-miR-593-3p, hsa- miR-593-5p, hsa-miR-595, hsa-miR-598, hsa-miR-601, hsa-miR-602, hsa-miR-603, hsa- miR-606, hsa-miR-608, hsa-miR-609, hsa-miR-611, hsa-miR-612, hsa-miR-613, hsa-miR- 615-3p, hsa-miR-615-5p, hsa-miR-616-5p, hsa-miR-618, hsa-miR-619, hsa-miR-620, hsa- miR-623, hsa-miR-625-5p, hsa-miR-626, hsa-miR-627, hsa-miR-628-3p, hsa-miR-628-5p, hsa-miR-629-3p, hsa-miR-629-5p, hsa-miR-630, hsa-miR-631, hsa-miR-634, hsa-miR-635, hsa-miR-636, hsa-miR-638, hsa-miR-639, hsa-miR-641, hsa-miR-642a-3p, hsa-miR-642a- 5p, hsa-miR-643, hsa-miR-645, hsa-miR-646, hsa-miR-647, hsa-miR-649, hsa-miR-650, hsa- miR-651, hsa-miR-652-3p, hsa-miR-653, hsa-miR-654-3p, hsa-miR-655, hsa-miR-656, hsa- miR-657, hsa-miR-658, hsa-miR-659-3p, hsa-miR-660-5p, hsa-miR-663a, hsa-miR-663b, hsa-miR-664a-3p, hsa-miR-664a-5p, hsa-miR-668, hsa-miR-671-5p, hsa-miR-675-3p, hsa- miR-675-5p, hsa-miR-7-l-3p, hsa-miR-7-2-3p, hsa-miR-7-5p, hsa-miR-708-3p, hsa-miR- 708-5p, hsa-miR-718, hsa-miR-744-3p, hsa-miR-744-5p, hsa-miR-761, hsa-miR-765, hsa- miR-766, hsa-miR-767-3p, hsa-miR-769-3p, hsa-miR-769-5p, hsa-miR-770-5p, hsa-miR- 874, hsa-miR-875, hsa-miR-876, hsa-miR-877-3p, hsa-miR-877-5p, hsa-miR-885-3p, hsa- miR-887, hsa-miR-888-3p, hsa-miR-889, hsa-miR-890, hsa-miR-891a, hsa-miR-891b, hsa- miR-9-3p, hsa-miR-9-5p, hsa-miR-92a-3p, hsa-miR-92b-3p, hsa-miR-92b-5p, hsa-miR-921, hsa-miR-922, hsa-miR-93-3p, hsa-miR-93-5p, hsa-miR-935, hsa-miR-940, hsa-miR-941, hsa-miR-942, hsa-miR-95, hsa-miR-96-3p, hsa-miR-96-5p, hsa-miR-98-5p, hsa-miR-99a-3p, hsa-miR-99a-5p, hsa-miR-99b-3p, 및/또는 hsa-miR-99b-5p를 포함한다. 이들 miRNA의 서열은 관련 기술 분야에 널리 공지되어 있으며, 예를 들어 월드 와이드 웹 (world wide web)의 mirbase dot org에서 찾을 수 있다.
상기 목록으로부터의 적합한 예의 miRNA는 hsa-miR-155, hsa-miR-155-inh, hsa-miR-181-B1, hsa-miR-15a, hsa-miR-16-1, hsa-miR-21, hsa-miR-34a, hsa-miR-221 및 hsa-miR-29a를 포함한다.
일 실시예에서, "억제성 올리고뉴클레오티드"는 하나 이상의 miRNA의 활성을 모방한다. 본원에 사용된 용어 "miRNA 모방체(miRNA mimic)"는 세포 내로 도입될 때 내인성 성숙 miRNA 분자를 모방하도록 설계된 작은 이중 가닥 RNA 분자를 지칭한다. miRNA 모방체는 Sigma Aldrich 및 Thermo Fisher Scientific과 같은 다양한 공급체로부터 수득할 수 있다.
다른 실시예에서, "억제성 올리고뉴클레오티드"는 하나 이상의 miRNA의 활성을 억제한다. 다양한 miRNA 종이 이러한 목적에 적합하다. 예는 안타고미르(antagomir), 간섭 RNA, 리보자임, miRNA 스폰지 및 miR-마스크를 포함하나 제한되는 것은 아니다. 용어 "안타고미르(antagomir)"는 본 발명의 맥락에서 표적 miRNA에 결합하고 miRNA가 그의 동족 유전자 표적에 결합하는 것을 방지함으로써 miRNA 기능을 억제하는 화학적으로 변형된 안티센스 올리고뉴클레오티드를 지칭하기 위해 사용된다. 안타고미르는 당업계에 공지된 임의의 염기 변형을 포함할 수 있다. 일 실시예에서, 상기 언급된 miRNA 종의 길이는 약 10 내지 50개의 뉴클레오티드이다. 예를 들어, 안타고미르의 길이는 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 또는 50개의 뉴클레오티드이다.
일 실시예에서, miRNA 종은 각각 적어도 하나의 뉴클레오티드로 구성된 둘 이상의 화학적으로 구별되는 영역을 함유하는 키메라 올리고뉴클레오티드이다. 이들 올리고뉴클레오티드는 하나 이상의 유리한 특성(예: 증가된 뉴클레아제 내성, 증가된 세포 내로의 흡수, 증가된 표적에 대한 결합 친화성)을 부여하는 변형된 뉴클레오티드의 하나 이상의 영역 및 RNA:DNA 또는 RNA:RNA 하이브리드를 절단할 수 있는 효소의 기질인 영역을 전형적으로 함유한다.
일 실시예에서, 본 개시내용에 포함되는 핵산은 합성이다. 용어 "합성 핵산(synthetic nucleic acid)"은 핵산이 자연 발생 핵산의 화학적 구조 또는 서열을 갖지 않음을 의미한다. 합성 뉴클레오티드는 DNA 또는 RNA 분자와 같은 조작된 핵산을 포함한다. 그러나, 세포에 투여된 합성 핵산은 그 구조 또는 서열이 성숙 miRNA 서열과 같은 비합성 또는 자연 발생 핵산과 동일하도록 이후에 세포에서 변형 또는 변경될 수 있는 것으로 고려된다. 예를 들어, 합성 핵산은 전구체 miRNA의 서열과 상이한 서열을 가질 수 있지만, 그 서열은 세포에서 한번 내인성 가공된 miRNA와 동일하도록 변경될 수 있다. 결과적으로, 용어 "합성 miRNA(synthetic miRNA)"는 세포에서 또는 생리학적 조건 하에서 자연 발생 miRNA로서 기능하는 "합성 핵산"을 의미하는 것으로 이해될 것이다. 다른 실시예에서, 핵산 구조는 또한 2' 산소 및 4' 탄소 사이에 메틸렌 브릿지를 갖는 잠금 핵산(LNA)으로 변형되어 핵산의 A-유형 형태에서 3'-엔도 (North) 형태의 리보스를 고정시킬 수 있다(Lennox et al 2011; Bader et al 2011). miRNA와 관련하여, 이 변형은 분자의 표적 특이성 및 혼성화 특성 둘 모두를 유의하게 증가시킬 수 있다.
본원에 개시된 방법에 사용하기 위한 핵산은 필요에 따라 일상적인 방법을 사용하여 설계될 수 있다. 예를 들어, 억제성 올리고뉴클레오티드와 관련하여, 시드 서열 내에서 5개 이상의 연속 뉴클레오티드의 스트레치를 포함하거나 그에 바로 인접한 5, 6, 7, 8, 9, 10개 또는 그 이상의 뉴클레오티드 길이의 표적 세그먼트는 유전자를 표적으로 하기에 적합한 것으로 간주된다. 예시적인 표적 세그먼트는 시드 서열 중 하나의 5'-말단으로부터 적어도 5개의 연속 뉴클레오티드를 포함하는 서열을 포함할 수 있다(나머지 뉴클레오티드는 시드 서열의 5'- 말단의 바로 상류에서 시작하여 핵산이 약 5 내지 약 30개의 뉴클레오티드를 함유할 때까지 계속되는 동일한 RNA의 연속적인 신장이다). 다른 실시예에서, 표적 세그먼트는 시드 서열 중 하나의 3'-말단으로부터 적어도 5개의 연속적인 뉴클레오티드를 포함하는 RNA 서열로 표시된다(나머지 뉴클레오티드는 표적 세그먼트의 3'-말단의 바로 하류에서 시작하여 핵산이 약 5 내지 약 30개의 뉴클레오티드를 함유할 때까지 계속되는 동일한 RNA의 연속적인 신장이다). 용어 "시드 서열(seed sequence)"은 본 개시내용의 맥락에서 표적 특이성의 중요한 결정 요인인 miRNA의 5-말단에서 처음 8 nt 내의 6-8 뉴클레오티드(nt) 긴 서브 스트링(즉, 시드 서열)을 지칭하기 위해 사용된다. 하나 이상의 표적 영역, 세그먼트 또는 부위가 확인되면, 표적에 충분히 상보적인, 즉 원하는 효과를 제공하기에 충분히 잘 혼성화되고 충분한 특이성(즉, 다른 비-표적 핵산서열에 실질적으로 결합하지 않음)을 갖는 억제성 핵산 화합물이 선택된다.
변형
본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 상기 언급된 핵산을 도입하도록 변형될 수 있다. 용어 "도입됨(introduced)"은 본 개시내용의 맥락에서 중간엽 계통 전구체 또는 줄기세포의 핵 또는 세포질 내로 핵산의 도입을 지칭하기 위해 사용된다.
중간엽 계통 전구체 또는 줄기세포는 핵산이 임의의 적합한 인공 조작 수단에 의해 세포 내로 전달되거나, 또는 세포가 핵산을 물려받은 원래 변경된 세포의 자손인 경우 "변형된(modified)" 것으로 간주된다.
용어 "유전적으로 변경된(genetically altered)", "형질주입된(transfected)", "형질도입된(transduced)" 또는 "유전적으로 형질전환된(genetically transformed)"는 또한 변형된 중간엽 계통 전구체 또는 줄기세포를 지칭하기 위해 본 발명의 맥락에서 상호교환적으로 사용될 수 있다. 중간엽 계통 전구체 또는 줄기세포는 안정하거나 일시적인 방식으로 변형될 수 있다.
일 실시예에서, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 siRNA 또는 miRNA와 같은 적어도 1개, 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 적어도 6개, 적어도 7개, 적어도 8개, 적어도 9개, 적어도 10개, 적어도 15개, 적어도 20개의 핵산을 도입하도록 변형될 수 있다. 예를 들어, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 KIF11 siRNA, KRAS siRNA, PLK1 siRNA 또는 이들의 조합을 도입하도록 변형될 수 있다. 예를 들어, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 KIF11 siRNA를 도입하도록 변형될 수 있다. 예를 들어, 중간엽 계통 전구체 또는 줄기세포는 서열번호 1(NCBI 참조번호 NM_004523.3)에 나타낸 바와 같이 KIF11 mRNA의 5'말단에 결합하는 KIF11 siRNA를 도입하도록 변형될 수 있다. 일 실시예에서, KIF11 siRNA는 5'말단으로부터 800bp 내지 3,600bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 900bp 내지 3,200bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 900bp 내지 2,500bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 3,200bp 전에 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 3,600bp 후에 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 4,000bp 후에 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 3,600bp 내지 5101bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 4,600bp 내지 5101bp 사이의 KIF11 mRNA 전사체에 결합한다.
다른 실시예에서, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 KIF11_4 siRNA를 도입하도록 변형될 수 있다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 KIF11_6을 도입하도록 변형될 수 있다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 KIF11_9를 도입하도록 변형될 수 있다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 KIF11_8, KIF11_9, KIF11_6, KIF11_12, KIF11_7 또는 KIF11_4 중 하나 이상을 도입하도록 변형될 수 있다.
다른 실시예에서, KIF11 siRNA는 5'말단으로부터 800bp 내지 4,800bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 900bp 내지 4,800bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 KIF11_8, KIF11_9, KIF11_6, KIF11_12, KIF11_7, KIF11_4, KIF11_15 또는 KIF11_13 중 하나 이상을 도입하도록 변형될 수 있다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 KIF11_15 또는 KIF11_13을 도입하도록 변형될 수 있다.
상기 언급된 KIF11 siRNA의 서열 세부사항은 하기 표 1에 제시되어 있다.
| SEQ ID NO | KIF11 siRNA reference (#Qiagen product number) | 서열(Sequence) |
| SEQ ID NO: 2 | Hs_KIF11_8 (#SI03019793) | CTCGGGAAGCTGGAAATATAA |
| SEQ ID NO: 3 | Hs_KIF11_9 (#SI03104038) | GAGGGCGTACAAGAACATCTA |
| SEQ ID NO: 4 | Hs_KIF11_6 (#SI02653693) | ACGGAGGAGATAGAACGTTTA |
| SEQ ID NO: 5 | Hs_KIF11_12 (#SI04376358) | CAGGAATTGATTAATGTACTC |
| SEQ ID NO: 6 | Hs_KIF11_7 (#SI02653770) | GCCGATAAGATAGAAGATCAA |
| SEQ ID NO: 7 | Hs_KIF11_4 (#SI00064855) | CTAGATGGCTTTCTCAGTATA |
| SEQ ID NO: 8 | Hs_KIF11_15 (#SI05064353) | CAGCTTGAGCTTACATAGGTA |
| SEQ ID NO: 9 | Hs_KIF11_13 (#SI04435655) | TAAGCGATGGATAATACCTAA |
다른 실시예에서, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 has-miR-let7b, hsa-miR-155, hsa-miR-155-inh, hsa-miR-181-B1, hsa-miR-15a, hsa-miR-16-1, hsa-miR-21, hsa-miR-34a, hsa-miR-221, hsa-miR-29a 또는 이들의 조합을 도입하도록 변형될 수 있다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 중간엽 계통 전구체 또는 줄기세포와 비교하여 표적세포를 우선적으로 사멸시키는 것을 나타내는 올리고뉴클레오티드 또는 벡터를 도입하도록 변형된다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 표적세포를 사멸시키지만 중간엽 계통 전구체 또는 줄기세포의 생존력에 실질적으로 영향을 미치지 않는 것을 발현하는 올리고뉴클레오티드 또는 벡터를 도입하도록 변형된다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 암 세포와 같은 표적세포에 올리고뉴클레오티드를 전달하기 전에 중간엽 계통 전구체 또는 줄기세포를 사멸시키지 않는 것을 발현하는 올리고뉴클레오티드 또는 벡터를 도입하도록 변형된다.
일 실시예에서, 본 개시내용의 중간엽 계통 전구체 또는 줄기세포는 상기 언급된 핵산을 발현하는 벡터를 도입하도록 변형될 수 있다. 세포에서의 발현을 위한 수많은 벡터는 당업계에 공지되어 있다. 벡터 성분은 일반적으로 신호 서열, 올리고뉴클레오티드와 같은 핵산을 암호화하는 서열, 인핸서 요소, 프로모터 및 전사 종결 서열 중 하나 이상을 포함하지만 이에 제한되지는 않는다.
예시적인 발현 벡터는 플라스미드, 파지, 자율 복제 서열(ARS), 바이러스, 센트로미어, 인공 염색체, 염색체 또는 본 발명에 따른 중간엽 계통 전구체 또는 줄기세포에서 핵산을 발현할 수 있는 다른 구조를 포함한다.
중간엽 계통 전구체 또는 줄기세포로 형질주입 시키기에 적합한 벡터 플라스미드는 US 5,578,475; 6,020,202; 및 6,051,429에 기재된 것과 같은 지질/DNA 복합체를 포함한다. DNA-지질 복합체를 제조하기에 적합한 시약은 리포펙타민 (Gibco/Life Technologies #11668019) 및 FuGENE?? 6 (Roche Diagnostics Corp. #1814443); and LipoTAXI?? (Invitrogen Corp., #204110)를 포함한다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 바이러스 발현 벡터를 사용하여 올리고뉴클레오티드를 도입하도록 변형된다. 예시적인 바이러스 발현 벡터는 렌티바이러스, 바큘로바이러스, 레트로바이러스, 아데노바이러스(AdV), 재조합 아데노-관련 바이러스(rAAV)와 같은 재조합 형태를 포함하는 아데노-관련 바이러스(AAV) 및 자가 상보적 AAV(scAAV) 및 비-통합 AV와 같은 이의 유도체를 포함한다.
일 실시예에서, 바이러스 벡터는 복제 결함이다. 이 실시예에서, 복제 유전자는 결실되거나 높은 활성 프로모터를 갖는 발현 카세트로 대체된다. 예를 들어, AV와 관련하여, E1/E3 유전자는 결실되거나 대체될 수 있다. AAV와 관련하여, E1A 및 E1B 유전자는 결실되거나 대체될 수 있다. 예시적인 높은 활성의 프로모터는 CMV, EF1a, SV40, PGK1, Ubc, 인간 베타 액틴, CAG, TRE, UAS 및 Ac5를 포함한다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 AV 벡터 또는 이의 재조합 형태를 사용하여 올리고뉴클레오티드를 도입하도록 변형된다. 다양한 AV 혈청형(serotype)은 올리고뉴클레오티드를 도입하기 위해 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 적합할 수 있다. 일 실시예에서, AV 혈청형 1(AV1)은 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AV2는 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AV3, AV4, AV7, AV8, AV9, AV10, AV11, AV12 또는 AV13은 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AV5는 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AV6은 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 AAV 벡터 또는 이의 재조합 형태를 사용하여 올리고뉴클레오티드를 도입하도록 변형된다. 다양한 AAV 혈청형은 또한 올리고뉴클레오티드를 도입하기 위해 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 적합할 수 있다.
일 실시예에서, AAV 혈청형 1(AAV1)은 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AAV2는 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AAV3, AAV4, AAV7, AAV8, AAV9, AAV10, AAV11, AAV12 또는 AAV13은 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AAV5는 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다. 다른 실시예에서, AAV6은 중간엽 계통 전구체 또는 줄기세포를 변형시키는 데 사용된다.
최적의 벡터는 당업계에 공지된 다양한 기술을 사용하여 식별될 수 있다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 녹색 형광 단백질(GFP)을 발현하는 다양한 벡터와 접촉/형질주입될 수 있다. 이 실시예에서, 형질주입/형질도입 효율, GFP 발현 수준, 세포성 트로피즘(cellular tropism) 및/또는 GFP 발현의 지속성에 기초하여 최적 벡터가 식별될 수 있다.
바이러스 형질도입 방법은 당업계에 공지되어 있다(예: US 6,723,561; 6,627,442). Miltenyi Biotech (MACSductin), Sigma-Aldrich (ExpressMag) 및 Thermo Fisher Scientific (ViraPower)과 같은 상용 공급체로부터 다양한 바이러스 발현 벡터 시스템을 이용할 수 있다.
변형의 효율은 거의 100%가 아니며, 성공적으로 변형된 세포에 대한 집단을 풍부하게 하는 것이 일반적으로 바람직하다. 예를 들어, 변형된 세포는 새로운 유전자형의 기능적 특징을 이용함으로써 풍부화될 수 있다. 변형된 세포를 풍부하게 하는 하나의 예시적인 방법은 네오마이신과 같은 약물에 대한 내성을 사용하는 양성 선별이다.
일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 표적세포의 생존력을 감소시키기에 충분한 수준의 올리고뉴클레오티드를 포함한다. 일 실시예에서, 표적세포는 암 세포이다. 따라서, 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 암 세포의 생존력을 감소시키기에 충분한 수준의 올리고뉴클레오티드를 포함한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 적어도 0.25 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 적어도 0.3 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 적어도 0.4 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 적어도 0.5 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 적어도 1 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 적어도 3 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.25 내지 5 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.5 내지 5 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.5 내지 4 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 0.5 내지 3.5 nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함한다.
다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 100 nM 이상의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 200 nM 이상의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 300 nM 이상의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 400 nM 이상의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 500 nM 이상의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 600 nM 이상의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 700 nM 이상의 억제성 올리고뉴클레오티드를 포함한다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 1μM 이상의 억제성 올리고뉴클레오티드를 포함한다.
표적세포로의 전달
본 발명자들은 중간엽 계통 전구체 또는 줄기세포가 핵산을 표적세포로 옮길 수 있음을 확인하였다. 따라서, 일 실시예에서, 본 개시내용은 상기 참조된 핵산 또는 이를 발현하는 벡터를 도입하도록 변형된 중간엽 계통 전구체 또는 줄기세포와 접촉시킴으로써 상기 참조된 핵산을 표적세포에 전달하는 방법을 포함한다. 의심의 여지를 피하기 위해, 표적세포로 전달되는 핵산은 변형된 중간엽 계통 전구체 또는 줄기세포에 도입된 핵산이다.
용어 "접촉(contacting)"은 본 발명의 맥락에서 "직접(direct)" 또는 "간접(indirect)" 접촉을 지칭하기 위해 사용된다. "직접 접촉(Direct contact)"은 본 개시의 맥락에서 핵산의 전달을 용이하게 하는 변형된 중간엽 계통 전구체 또는 줄기세포와 표적세포 사이의 물리적 접촉을 지칭하기 위해 사용된다. 예를 들어, 표적세포 및 변형된 중간엽 계통 전구체 또는 줄기세포는 공통 코넥신(즉, 표적세포 및 변형된 중간엽 계통 전구체 또는 줄기세포 둘 다에 의해 발현되는 코넥신)을 통해 직접 접촉할 수 있다. 이 실시예에서, 공통 코넥신은 간극 연접을 통해 중간엽 계통 전구체 또는 줄기세포로부터 표적세포로 핵산의 전달을 용이하게 한다. 따라서, 일 실시예에서, 접촉은 중간엽 계통 전구체 또는 줄기세포가 표적세포와 간극 연접을 형성할 수 있게 하는 조건 하에서 발생하고, 이에 의해 핵산은 간극 연접을 횡단함으로써 표적세포로 전달된다. 일 실시예에서, 간극 연접은 Cx40에 의해 형성된다. 다른 실시예에서, 간극 연접은 Cx43에 의해 형성된다. 다른 실시예에서, 간극 연접은 Cx45, Cx32 및/또는 Cx37로 형성된다.
"간접 접촉(Indirect contact)"은 본 발명의 맥락에서 직접 접촉 없이 변형된 중간엽 계통 전구체 또는 줄기세포로부터 표적세포로 핵산의 전달을 지칭하기 위해 사용된다. 예를 들어, 표적세포에 근접한 변형된 중간엽 계통 전구체 또는 줄기세포는 표적세포와 간접적으로 접촉할 수 있다. 일 실시예에서, 표적세포와 간접적으로 접촉하는 변형된 중간엽 계통 전구체 또는 줄기세포는 엑소좀을 통해 표적세포에 핵산을 전달할 수 있다.
다른 실시예에서, 표적세포와 직접 접촉하는 변형된 중간엽 계통 전구체 또는 줄기세포는 공통 코넥신을 통해 및 간접적으로 엑소좀을 통해 표적세포에 핵산을 전달할 수 있다.
변형된 중간엽 계통 전구체 또는 줄기세포로부터 핵산을 수용하는 표적세포는 변형된 중간엽 계통 전구체 또는 줄기세포에 의해 핵산의 전달을 용이하게 하기 위해 직접 또는 간접적으로 접촉할 수 있는 한 특별히 제한되지는 않는다. 예시적인 표적세포는 세포융합(syncytial) 조직의 세포를 포함한다. 용어 "세포융합(syncytial)"은 본 발명의 맥락에서 작용 전위에서 전기적으로 동기화되는 간극 연접을 갖는 특수화된 막에 의해 상호연결된 세포로 이루어진 조직을 지칭하기 위해 사용된다. 예시적인 세포융합 세포는 심장근육 세포, 평활근 세포, 상피 세포, 결합조직 세포 또는 세포융합 암 세포를 포함한다. 일 실시예에서, 표적세포는 면역 세포이다. 예를 들어, 표적세포는 백혈구일 수 있다.
일 실시예에서, 표적세포는 암 세포이다. 예를 들어, 표적세포는 췌장암 세포일 수 있다. 다른 실시예에서, 표적세포는 폐암 세포일 수 있다. 다른 실시예에서, 표적세포는 자궁경부암 세포일 수 있다. 다른 실시예에서, 표적세포는 대장암 세포일 수 있다. 다른 실시예에서, 표적세포는 간암 세포일 수 있다. 다른 실시예에서, 표적세포는 골암 세포일 수 있다. 다른 실시예에서, 표적세포는 골육종 세포일 수 있다. 다른 실시예에서, 표적세포는 전립선암 세포일 수 있다. 다른 실시예에서, 표적세포는 흑색종 세포일 수 있다.
다른 실시예에서, 표적세포는 변형된 중간엽 계통 전구체 또는 줄기세포와 공통 코넥신을 갖는다. 일 실시예에서, 표적세포는 Cx40을 발현한다. 다른 실시예에서, 표적세포는 Cx43을 발현한다. 다른 실시예에서, 표적세포는 Cx45, Cx32 및/또는 Cx37을 발현한다.
변형된 중간엽 계통 전구체 또는 줄기세포로부터 표적세포로 핵산의 전달은 시험관 내 또는 생체 내에서 촉진될 수 있다. 예를 들어, 변형된 중간엽 계통 전구체 또는 줄기세포로부터 표적세포로 핵산의 전달은 변형된 중간엽 계통 전구체 또는 줄기세포를 표적세포와 공동-배양함으로써 시험관 내에서 촉진될 수 있다. 예를 들어, 변형된 중간엽 계통 전구체 또는 줄기세포로부터 대상 세포로의 핵산의 전달은 변형된 중간엽 계통 전구체 또는 줄기세포를 대상체에게 투여함으로써 생체 내에서 촉진될 수 있다. 예를 들어, 중간엽 계통 전구체 또는 줄기세포는 예를 들어 정맥 내, 동맥 내 또는 복강 내 투여와 같이 전신적으로 투여될 수 있다. 중간엽 계통 전구체 또는 줄기세포는 또한 비강 내, 근육 내 또는 심장 내 투여에 의해 투여될 수있다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 주변 조직과 같은 표적세포에 근접한 부위에 투여된다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 표적세포를 포함하는 조직으로 직접 투여된다.
치료방법
일 실시예에서, 본 개시내용에 따른 조성물은 암 치료를 위해 투여될 수 있다. 용어 "암(cancer)"은 일반적으로 조절되지 않은 세포 성장을 특징으로 하는 포유동물의 생리학적 상태를 지칭하거나 설명한다. 암의 예는 암종, 림프종, 모세포종, 육종 및 백혈병 또는 림프성 악성종양을 포함하지만, 이에 제한되지는 않는다. 이러한 암의 보다 구체적인 예는 편평세포 암(예: 상피 편평세포 암), 소세포 폐암을 포함한 폐암, 비소세포 폐암, 폐의 선암종(adenocarcinoma) 및 폐의 편평암종, 복막(peritoneum)암, 간세포암, 위장암 및 위장관 기질(gastrointestinal stromal)암을 포함하는 위(gastric) 또는 위(stomach)암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 요로암, 간세포암(hepatoma), 유방암, 결장암(colon cancer), 직장암, 대장암, 자궁내막암 또는 자궁암, 타액선 암종, 신장(kidney) 또는 신세포(renal)암, 전립선암, 외음부암, 갑상선암, 간암(hepatic carcinoma), 항문암종, 음경암종, 흑색종, 표면 퍼짐 흑색종, 렌티고 악성 흑색종, 낭성 흑색종(acral lentiginous melanomas), 결절 흑색종, 다발성 골수종 및 B-세포 림프종(낮은 등급/여포성 비호지킨 림프종(NHL); 소 림프종(SL) NHL; 중간 등급/소포체 NHL; 중간 등급 확산 NHL; 높은 등급 면역아세포 NHL; 높은 등급 림프모구(lymphoblastic) NHL; 고급 등급 소형 비절단 세포 NHL; 부피가 큰 질병 NHL; 맨틀 세포 림프종; 에이즈 관련 림프종; 및 발덴스트롬 마크로글로불린혈증(Waldenstrom's Macroglobulinemia) 포함); 만성 림프구성 백혈병(CLL); 급성 림프모구(lymphoblastic) 백혈병(ALL); 모발 세포 백혈병; 만성 골수아구성 백혈병; 및 이식 후 림프증식성 장애(PTLD), 및 모반증(phakomatoses), 부종(예: 뇌종양과 관련된 것), Meigs 증후군, 뇌 및 두경부암 및 관련된 전이와 관련된 비정상적인 혈관 증식을 포함하지만, 이에 제한되지는 않는다.
일 실시예에서, 암은 KRAS에서 발암성 G12D 돌연변이를 갖는다. 당업자는 G12D 돌연변이가 코돈 12에 존재하는 단일 뉴클레오티드 점 돌연변이라는 것을 이해할 것이다. 예를 들어, 암은 결장암(colon cancer), 폐암, 흑색종, 간암 및 골육종으로 구성된 군에서 선택될 수 있으며, 상기 암은 KRAS에서 발암성 G12D 돌연변이를 갖는다.
예를 들어, 암은 췌장암이다. 다른 실시예에서, 암은 폐암이다. 다른 실시예에서, 암은 자궁경부암이다. 다른 실시예에서, 암은 대장암이다. 다른 실시예에서, 암은 간암이다. 다른 실시예에서, 암은 골육종이다. 다른 실시예에서, 암은 전립선암이다. 다른 실시예에서, 암은 흑색종이다.
다른 실시예에서, 본 발명에 따라 치료된 암은 본 발명에 따른 중간엽 계통 전구체 또는 줄기세포와 공통 코넥신을 공유하는 세포를 포함한다. 이 실시예에서, 공통 코넥신은 중간엽 계통 전구체 또는 줄기세포에서 암 세포로 핵산의 이동을 용이하게 한다.
일 실시예에서, 암은 Cx40을 발현하는 세포를 포함한다. 다른 실시예에서, 암은 Cx43을 발현하는 세포를 포함한다. 다른 실시예에서, 암은 Cx40 및 Cx43을 발현하는 세포를 포함한다.
변형된 중간엽 계통 전구체 또는 줄기세포의 개선된 보존 및/또는 귀환
한 관점에서, 본원에 정의된 중간엽 계통 전구체 또는 줄기세포는 그의 세포-표면 글리칸을 변형시키기 위해 처리된다. CD44와 같은 세포 표면 단백질상의 글리칸의 변형은 염증 부위의 미세 혈관에서 생체 내 발현된 E-셀렉틴 분자에 결합할 수 있는 E-셀렉틴 리간드를 생성하는 것으로 나타났다. 이러한 방식으로, 중간엽 계통 전구체 또는 줄기세포상의 세포-표면 글리칸의 변형은 생체 내 조직 손상 부위로의 중간엽 계통 전구체 또는 줄기세포의 귀환을 개선시킨다.
본 발명자들은 또한 세포-표면 글리칸의 글리코실트랜스퍼라제 매개 변형이 동결보존 후 세포 생존력을 개선한다는 것을 확인하였다(즉, 동결-해동 사이클 후에 더 많은 세포가 생존가능함). 따라서, 일 실시예에서, 본 발명은 세포상의 세포-표면 글리칸을 변형시키는 조건 하에서 글리코실트랜스퍼라제(E.C 2.4)로 처리된 중간엽 계통 전구체 또는 줄기세포의 동결보존된 집단을 포함한다. 다른 실시예에서, 본 발명은 중간엽 계통 전구체 또는 줄기세포를 동결보존하는 방법을 포함하며, 상기 방법은 세포상의 세포-표면 글리칸을 변형시키는 조건 하에서 중간엽 계통 전구체 또는 줄기세포 집단을 글리코실트랜스퍼라제로 처리하는 단계 및 조성물에서 세포를 동결보존하는 단계를 포함한다. 다른 실시예에서, 본 발명은 치료 세포를 생산하는 방법을 포함하며, 상기 방법은 세포상의 세포-표면 글리칸의 변형시키는 조건 하에서 중간엽 계통 전구체 또는 줄기세포 집단을 글리코실트랜스퍼라제로 처리하는 단계 및 조성물에서 세포를 동결보존하는 단계를 포함한다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포 "치료(treatment)"는 글리코실트랜스퍼라제가 효소 활성을 갖는 조건 하에서 세포를 글리코실트랜스퍼라제와 접촉시키는 것을 포함한다. 이 실시예에서, 글리코실트랜스퍼라제는 중간엽 계통 전구체 또는 줄기세포상의 세포 표면 글리칸을 변형시킨다. 세포 표면 글리칸 변형의 예는 푸코실화이다. 일 실시예에서, CD44는 변형된다. 다른 실시예에서, CD14는 변형된다. 다른 실시예에서, CD44, CD14, CD3 및 CD19 중 하나 이상이 변형된다.
일 실시예에서, 표면 글리칸 변형은 유세포 분석을 사용하여 식별된다. 이 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 미처리 중간엽 계통 전구체 세포보다 푸코실화된 세포 표면 글리칸(들)의 1 로그 크기 높은 발현을 갖는다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 미처리 중간엽 계통 전구체 세포보다 푸코실화된 세포 표면 글리칸(들)의 2 로그 크기 높은 발현을 갖는다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 미처리 중간엽 계통 전구체 세포보다 푸코실화된 세포 표면 글리칸(들)의 3 로그 크기 높은 발현을 갖는다. 예를 들어, 변형된 중간엽 계통 전구체 또는 줄기세포는 미처리 중간엽 계통 전구체 세포보다 푸코실화된 CD14의 1 로그 크기 높은 발현을 가질 수 있다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 미처리 중간엽 계통 전구체 세포보다 푸코실화된 CD14의 2 log 크기 높은 발현을 갖는다. 다른 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 미처리 중간엽 계통 전구체 세포보다 푸코실화된 CD14의 발현이 3 로그 크기 높은 발현을 갖는다.
일 실시예에서, "치료(treatment)"는 뉴클레오티드 당 공여체 기질의 존재 하에 중간엽 계통 전구체 또는 줄기세포를 글리코실트랜스퍼라제와 접촉시키는 것을 포함한다. 적합한 공여체 기질은 푸코스, 갈락토스, 시알산 또는 N-아세틸 글루코사민을 포함한다. 예를 들어, 기질은 GDP-푸코스일 수 있다.
예를 들어, 치료는 중간엽 계통 전구체 또는 줄기세포 집단을 푸코실트랜스퍼라제와 같은 외인성 글리코실트랜스퍼라제와 접촉시키는 것을 포함할 수 있다. 이 실시예에서, 글리코실트랜스퍼라제는 세포 배양 배지 또는 중간엽 계통 전구체 또는 줄기세포를 포함하는 다른 생리학적으로 허용가능한 용액에 첨가될 수 있다. 예를 들어, 중간엽 계통 전구체 또는 줄기세포는 글리코실트랜스퍼라제를 포함하는 배지에서 배양될 수 있다. 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 글리코실트랜스퍼라제를 포함하는 배양 배지에 현탁된다. 예를 들어, 중간엽 계통 전구체 또는 줄기세포는 글리코실트랜스퍼라제를 포함하는 적합한 배지에서 배양 및 재현탁으로부터 해리될 수 있다. 일 실시예에서, 세포는 에틸렌디아민테트라아세트산(EDTA)을 사용하여 해리될 수 있다. 다른 실시예에서, 세포는 EDTA와 조합된 트립신 단독 oFr과 같은 프로테아제를 사용하여 해리될 수 있다.
일 실시예에서, 세포 배양 배지는 1.8 ㎍ 이상의 글리코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2.0 ㎍ 이상의 글리코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2.5㎍ 이상의 글리코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2 내지 15 ㎍의 글리코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2 내지 10 ㎍의 글리코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2 내지 5 ㎍의 글리코실트랜스퍼라제를 포함한다. 일 실시예에서, 세포 배양 배지는 1.8 μg 이상의 푸코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2.0 ㎍ 이상의 푸코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2.5 ㎍ 이상의 푸코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2 내지 15 ㎍의 푸코실트랜스퍼라제를 포함한다. 다른 실시예에서, 세포 배양 배지는 2 내지 10 ㎍의 푸코실트랜스퍼라제를 포함한다. 다른 실시예에서, 2 내지 5 ㎍의 푸코실트랜스퍼라제가 세포 배양 배지에 첨가된다. 이들 실시예에서, 글리코실트랜스퍼라제는 약 5x105 중간엽 계통 전구체 또는 줄기세포에 30㎕의 반응 부피로 제공될 수 있다.
예를 들어, 중간엽 계통 전구체 또는 줄기세포는 엑소푸코실레이션(exofucosylation)으로 알려진 과정에서 외인성 글리코실트랜스퍼라제로 처리될 수 있다. 이 구현예에서, 글리코실트랜스퍼라제는 낮은 수준의 2가 금속 보조인자를 갖는 생리학적으로 허용가능한 용액으로 제공될 수 있다. 다양한 구현예에서, 생리학적으로 허용가능한 용액은 완충된다. 생리학적으로 허용가능한 용액은, 예를 들어 Hank's Balanced Salt Solution, Dulbecco's Modified Eagle Medium, a HEPES buffer, a 2-Morpholinoethanesulfonic acid (MES) buffer, phosphate buffered saline (PBS)와 같은 a Good's buffer (N. E. Good, G. D. Winget, W. Winter, T N. Conolly, S. Izawa and R. M. M. Singh, Biochemistry 5, 467 (1966); N. E. Good, S. Izawa, Methods Enzymol. 24, 62 (1972) 참조)일 수 있다.
일 실시예에서, 생리학적으로 허용가능한 용액에는 글리세롤이 실질적으로 없다.
다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 글리코실트랜스퍼라제를 발현하도록 세포를 변형시킴으로써 글리코실트랜스퍼라제로 처리된다. 예를 들어, 글리코실트랜스퍼라제는 중간엽 계통 전구체 또는 줄기세포에 의해 세포 내에서 생성될 수 있다. 이 구현예에서, 글리코실트랜스퍼라제를 암호화하는 핵산 분자(들)가 중간엽 계통 전구체 또는 줄기세포로 도입된다. 글리코실트랜스퍼라제는 이어서 중간엽 계통 전구체 또는 줄기세포에 의해 발현되어 그의 표면 글리칸의 변형에 영향을 미친다.
글리코실트랜스퍼라제를 코딩하는 핵산이 임의의 적합한 인공 조작 수단에 의해 세포 내로 전달되거나 세포가 글리코실트랜스퍼라제를 코딩하는 핵산을 운반하는 원래 변경된 세포의 자손인 경우, 중간엽 계통 전구체 또는 줄기세포는 "글리코실트랜스퍼라제를 발현하도록 유전적으로 변형된(genetically modified to express a glycosyltransferase)"것으로 간주된다. 글리코실트랜스퍼라제를 발현하도록 세포를 안정적으로 또는 일시적으로 변형시킬 수 있다.
일 실시예에서, 유전적으로 변형된 중간엽 계통 전구체 또는 줄기세포에서 글리코실트랜스퍼라제의 발현은 생체 내 염증 부위에서 세포의 보유를 향상시킨다. 예를 들어, 유전적으로 변형된 중간엽 계통 전구체 또는 줄기세포는 종양 또는 이의 전이에 유지될 수 있다. 다른 실시예에서, 유전적으로 변형 중간엽 계통 전구체 또는 줄기세포는 장기 이식 거부 부위에 유지될 수 있다. 다른 실시예에서, 유전적으로 변형된 중간엽 계통 전구체 또는 줄기세포는 경색된 심장과 같은 손상 부위에 유지될 수 있다. 유전적으로 변형된 중간엽 계통 전구체 또는 줄기세포가 생체 내 염증 부위에 유지되는지 여부를 결정하기 위한 다양한 방법이 이용 가능하다. 일 실시예에서, 세포는 방사성추적자 또는 다른 적합한 표지를 사용하여 생체 내에서 이미지화된다.
중간엽 계통 전구체 또는 줄기세포는 당업계에 공지된 다양한 방법을 사용하여 유전적으로 변형될 수 있다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 시험관 내 바이러스 벡터로 처리된다. 유전적으로 변형된 바이러스는 핵산을 세포로 전달하기 위해 널리 적용되어왔다. 본원에 기재된 세포의 유전적 변형을 위한 예시적인 바이러스 벡터는 감마 레트로바이러스 벡터와 같은 레트로바이러스 벡터, 렌티바이러스, 뮤린 백혈병 바이러스(MLV 또는 MuLV) 및 아데노바이러스를 포함한다. 예를 들어, 바이러스는 중간엽 계통 전구체 또는 줄기세포 배양 배지에 첨가될 수 있다. 비-바이러스 방법도 사용될 수 있다. 예는 플라스미드 전달 및 인테그라제 또는 트랜스포사제 기술, 리포좀 또는 단백질 형질 도입 도메인 매개 전달 및 전기천공과 같은 물리적 방법의 사용을 통한 표적화된 유전자 통합의 적용을 포함한다.
유전적 변형의 효율은 거의 100%가 아니며, 일반적으로 성공적으로 변형된 세포 집단을 풍부하게 하는 것이 바람직하다. 예를 들어, 변형된 세포는 새로운 유전자형의 기능적 특징을 이용함으로써 풍부화될 수 있다. 변형된 세포를 풍부하게하는 하나의 예시적인 방법은 lacZ의 발현에 기초한 네오마이신과 같은 약물에 대한 내성 또는 비색(colorimetric) 선택을 이용한 양성 선택이다.
다양한 구현예에서, 중간엽 계통 전구체 또는 줄기세포는 하나 이상의 글리코실트랜스퍼라제 및 그의 적절한 공여체 기질(예: 당)과 접촉된다. 예를 들어, 세포는 2개의 글리코실트랜스퍼라제와 동시에 또는 순차적으로 접촉되며, 각각은 (확장) 코어 글리칸 구조에 적절한 결합으로 별개의 단당류를 첨가한다. 다른 실시예에서, 유전적으로 변형된 세포는 2개의 글리코실트랜스퍼라제를 발현한다.
일 구현예에서, 처리된 중간엽 계통 전구체 또는 줄기세포는 CD44, 예를 들어, 알파(2,3)시알화된 CD44를 발현한다. 다른 구현예에서, 중간엽 계통 전구체 또는 줄기세포는 CD34 또는 PSGL-1을 발현하지 않는다. 일 실시예에서, 처리된 중간엽 계통 전구체 또는 줄기세포는 E-셀렉틴 및/또는 L-셀렉틴에 결합한다. 일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 P-셀렉틴에 결합하지 않는다.
다른 실시예에서, CD14는 처리된 중간엽 계통 전구체 또는 줄기세포에서 푸코실화된다. 다른 실시예에서, CD14 및 CD3는 처리된 중간엽 계통 전구체 또는 줄기세포에서 푸코실화된다.
일 구현예에서, 글리코실트랜스퍼라제는 37℃에서 pH 6.5에서 분당 1.0mmol의 당을 전달할 수 있다.
일 실시예에서, 글리코실트랜스퍼라제는 푸코실트랜스퍼라제(L-푸코스 당의 촉매 전달)이다. 다른 실시예에서, 글리코실트랜스퍼라제는 알파 1,3 푸코실트랜스퍼라제(예: 알파 1,3 푸코실트랜스퍼라제 III, 알파 1,3 푸코실트랜스퍼라제 IV, 알파 1,3 푸코실트랜스퍼라제 VI, 알파 1,3 푸코실트랜스퍼라제 VII, 알파 1,3 푸코실트랜스퍼라제 IX, 알파 1,3 푸코실트랜스퍼라제 X, 알파 1,3 푸코실트랜스퍼라제 XI). 예를 들어, 세포는 알파 1,3 푸코실트랜스퍼라제 VII로 처리될 수 있다. 다른 실시예에서, 세포는 알파 1,3 푸코실트랜스퍼라제 VI로 처리될 수 있다. 이들 실시예에서, 중간엽 계통 전구체 또는 줄기세포의 푸코실화는 처리된 세포가 E-셀렉틴과 같은 셀렉틴에 결합하는 능력의 증가 및/또는 당업계에 HECA-452를 포함하지만 이에 제한되지 않는 sLeX에 결합한다고 공지된 항체와 처리된 세포의 반응성의 증가를 검출함으로써 확인될 수 있다.
다른 실시예에서, 글리코실트랜스퍼라제는 갈락토실트랜스퍼라제 (갈락토스의 전달을 촉매함)이다. 다른 실시예에서, 글리코실트랜스퍼라제는 시알릴트랜스퍼라제(시알산의 전달을 촉매함)이다.
세포 조성물
본 개시내용의 방법을 수행함에 있어서, 중간엽 계통 전구체 또는 줄기세포는 조성물의 형태로 투여될 수 있다.
본 개시내용에 따른 예시적인 조성물은 siRNA 또는 miRNA 또는 이를 발현하는 벡터를 도입하도록 변형된 중간엽 계통 전구체 또는 줄기세포를 포함할 수 있다. 예를 들어, 본 발명에 따른 조성물은 KIF11 siRNA, KRAS siRNA, PLK1 siRNA, 이들의 조합 또는 이를 발현하는 벡터를 도입하도록 변형된 중간엽 계통 전구체 또는 줄기세포를 포함할 수 있다.
일 실시예에서, 조성물은 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, 여기서 KIF11 siRNA는 5'말단으로부터 800bp 내지 3,600bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, 여기서 siRNA는 5'말단으로부터 900bp 내지 3,200bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, 여기서 siRNA는 5'말단으로부터 900bp 내지 2,500bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, 여기서 siRNA는 5'말단으로부터 3,200bp 전에 KIF11 mRNA 전사체에 결합한다. 이들 실시예에서, KIF11 mRNA 전사체는 서열번호 1에 나타낸 바와 같다(NCBI 참조번호 NM_004523.3).
일 실시예에서, 조성물은 KIF11_4를 도입하도록 변형된 줄기세포를 포함한다. 다른 실시예에서, 조성물은 KIF11_6을 도입하도록 변형된 줄기세포를 포함한다. 다른 실시예에서, 조성물은 KIF11_9를 도입하도록 변형된 줄기세포를 포함한다. 다른 실시예에서, 조성물은 KIF11_8, KIF11_9, KIF11_6, KIF11_12, KIF11_7 또는 KIF11_4 중 하나 이상을 도입하도록 변형된 줄기세포를 포함한다.
다른 실시예에서, 조성물은 하나 이상의 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, 여기서 siRNA는 5'말단으로부터 800bp 내지 4,800bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 하나 이상의 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, siRNA는 5'말단으로부터 900bp 내지 4,800bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 하나 이상의 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, 여기서 siRNA는 5'말단으로부터 3,600bp 전에 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 하나 이상의 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, 여기서 siRNA는 5'말단으로부터 3,600bp 후에 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 하나 이상의 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, siRNA는 5'말단으로부터 4,000bp 후에 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, KIF11 siRNA는 5'말단으로부터 3,600bp 내지 5101bp 사이의 KIF11 mRNA 전사체에 결합한다. 다른 실시예에서, 조성물은 하나 이상의 KIF11 siRNA를 도입하도록 변형된 줄기세포를 포함하고, siRNA는 5'말단으로부터 4,600bp 내지 5101bp 사이의 KIF11 mRNA 전사체에 결합한다.
다른 실시예에서, 조성물은 KIF11_8, KIF11_9, KIF11_6, KIF11_12, KIF11_7, KIF11_4, KIF11_15 또는 KIF11_13 중 하나 이상을 도입하도록 변형된 줄기세포를 포함한다. 다른 실시예에서, 조성물은 KIF11_15 또는 KIF11_13 중 하나 또는 둘 모두를 도입하도록 변형된 줄기세포를 포함한다.
상기 참조된 KIF11 siRNA의 서열 세부사항은 상기 표 1에 제시되어 있다.
다른 실시예에서, 본 개시내용에 따른 조성물은 상기 언급된 miRNA, 이들의 조합 또는 이를 발현하는 벡터를 도입하도록 변형된 중간엽 계통 전구체 또는 줄기세포를 포함할 수 있다. 예를 들어, 본 개시내용에 따른 조성물은 hsa-miR-let7b, hsa-miR-155, hsa-miR-155-inh, hsa-miR-181-B1, hsa-miR-15a, hsa-miR-16-1, hsa-miR-21, hsa-miR-34a, hsa-miR-221, hsa-miR-29, 이들의 조합 또는 이를 발현하는 벡터를 도입하도록 변형된 중간엽 계통 전구체 또는 줄기세포를 포함할 수 있다.
다른 실시예에서, 본 발명에 따른 조성물은 적어도 하나의 유형의 암 세포와 같은 표적세포에 대한 억제성 올리고뉴클레오티드가 전달하기 전에 중간엽 계통 전구체 또는 줄기세포를 사멸시키지 않는 억제성 올리고뉴클레오티드 또는 이를 발현하는 벡터를 도입하도록 변형된 중간엽 계통 전구체 또는 줄기세포를 포함할 수 있다.
일 실시예에서, 이러한 조성물은 약학적으로 허용가능한 담체 및/또는 부형제를 포함한다.
용어 "담체(carrier)" 및 "부형제(excipient)"는 활성 화합물의 저장, 투여 및/또는 생물학적 활성을 용이하게 하기 위해 당업계에 통상적으로 사용되는 물질의 조성물을 지칭한다(예: Remington's Pharmaceutical Sciences, 16th Ed., Mac Publishing Company (1980) 참조). 담체는 또한 활성 화합물의 임의의 바람직하지 않은 부작용을 감소시킬 수 있다. 적합한 담체는 예를 들어 안정한, 예를 들어 담체 중의 다른 성분과 반응할 수 없다. 일 실시예에서, 담체는 치료에 사용되는 투여량 및 농도에서 수용자에게 유의미한 국소 또는 전신 부작용을 일으키지 않는다.
본 개시내용에 적합한 담체는 통상적으로 사용되는 것(예: 물, 식염수, 수성 덱스트로스, 락토스, 링거액, 완충 용액을 포함하며, 히알루로난 및 글리콜이 특히 용액에 대한(등장성인 경우) 예시적인 액체 담체이다. 적합한 약학적 담체 및 부형제는 전분, 셀룰로오스, 글루코스, 락토오스, 수크로스, 젤라틴, 맥아, 쌀, 밀가루, 초크, 실리카 겔, 스테아르산 마그네슘, 스테아르산 나트륨, 글리세롤 모노스테아레이트, 염화나트륨, 글리세롤, 프로필렌 글리콜, 물, 에탄올, 등을 포함한다.
다른 실시예에서, 담체는 예를 들어 세포가 성장 또는 현탁되는 배지 조성물이다. 이러한 배지 조성물은 그것이 투여되는 대상체에서 어떠한 부작용도 유발하지 않는다.
예시적인 담체 및 부형제는 세포의 생존력 및/또는 질병의 치료 또는 예방 능력에 악영향을 미치지 않는다.
일 실시예에서, 담체 또는 부형제는 세포 및/또는 가용성 인자를 적합한 pH로 유지하여 생물학적 활성을 발휘하는 완충 활성을 제공하는데, 예를 들어 담체 또는 부형제는 인산 완충 식염수(PBS)이다. PBS는 세포 및 인자와 최소한으로 상호작용하고 세포 및 인자의 신속한 방출을 허용하기 때문에 매력적인 담체 또는 부형제를 나타내며, 이러한 경우, 본 개시내용의 조성물은 예를 들어 주사에 의해 혈류 또는 조직 또는 조직을 둘러싸거나 인접한 조직에 직접 적용하기위한 액체로서 제조될 수 있다.
본원에 기재된 세포 조성물은 단독으로 또는 다른 세포와의 혼합물로서 투여될 수있다. 상이한 유형의 세포는 투여 직전 또는 직후에 본 발명의 조성물과 혼합될 수 있거나, 투여 전 일정 기간 동안 함께 공동-배양될 수 있다.
일 실시예에서, 조성물은 유효량 또는 치료적 유효량의 세포를 포함한다. 예를 들어, 조성물은 약 1x105 세포 내지 약 1x109 세포 또는 약 1.25x103 세포 내지 약 1.25x107 세포를 포함한다. 투여될 세포의 정확한 양은 대상체의 연령, 체중 및 성별, 및 치료되는 장애의 정도 및 심각도를 포함한 다양한 요인에 의존한다.
예시적인 투여량은 적어도 약 1.2 x 108 내지 약 8 x 1010 세포, 예컨대 약 1.3 x 108 내지 약 8 x 109 세포, 약 1.4 x 108 내지 약 8 x 108 세포, 약 1.5 x 108 내지 약 7.2 x 108 세포, 약 1.6 x 108 내지 약 6.4 x 108 세포, 약 1.7 x 108 내지 약 5.6 x 108 세포, 약 1.8 x 108 내지 약 4.8 x 108 세포, 약 1.9 x 108 내지 약 4.0 x 108 세포, 약 2.0 x 108 약 3.2 x 108 세포, 약 2.1 x 108 내지 약 2.4 x 108 세포를 포함한다. 예를 들어, 용량(a dose)은 적어도 약 1.5 x 108 세포를 포함할 수 있다. 예를 들어, 용량은 적어도 약 2.0 x 108 세포를 포함할 수 있다.
달리 말하면, 예시적인 용량은 적어도 약 1.5 x 106 cells/kg(80kg 대상체)을 포함한다. 일 실시예에서, 용량은 적어도 약 2.5 x 106 cells/kg을 포함할 수 있다. 다른 실시예에서, 용량은 약 1.5 x 106 내지 약 1x109 cells/kg, 약 1.6 x 106 내지 약 1 x 108 cells/kg, 약 1.8 x 106 내지 약 1 x 107 cells/kg, 약 1.9 x 106 내지 약 9 x 106 cells/kg, 약 2.0 x 106 내지 약 8 x 106 cells/kg, 약 2.1 x 106 내지 약 7 x 106 cells/kg, 약 2.3 x 106 내지 약 6 x 106 cells/kg, 약 2.4 x 106 내지 약 5 x 106 cells/kg, 약 2.5 x 106 내지 약 4 x 106 cells/kg, 약 2.6 x 106 내지 약 3 x 106 cells/kg을 포함할 수 있다.
일 실시예에서, 변형된 중간엽 계통 전구체 또는 줄기세포는 약 5 % 이상, 약 10 % 이상, 약 15 % 이상, 약 20 % 이상, 약 25 % 이상, 약 30 % 이상, 약 35 % 이상, 약 40 % 이상, 약 45 % 이상, 약 50 % 이상, 약 55 % 이상, 약 60 % 이상, 약 65 % 이상, 약 70 % 이상, 약 75 % 이상 , 약 80 % 이상, 약 85 % 이상, 약 90 % 이상, 약 95 % 이상, 약 99 % 이상의 조성물의 세포 집단을 포함한다.
본 개시내용의 조성물은 동결보존될 수 있다. 중간엽 계통 전구체 또는 줄기세포의 동결보존은 당업계에 공지된 저속 냉각 방법 또는 '빠른' 동결 프로토콜을 사용하여 수행될 수 있다. 바람직하게는, 동결보존 방법은 동결되지 않은 세포와 비교하여 동결보존된 세포의 유사한 표현형, 세포 표면 마커 및 성장률을 유지한다.
동결보존된 조성물은 동결보존 용액을 포함할 수 있다. 동결보존 용액의 pH는 전형적으로 6.5 내지 8이고, 바람직하게는 7.4이다.
동결보존 용액은 멸균된 비발열성 등장성 용액, 예를 들어 PlasmaLyte ATM을 포함할 수 있다. 100mL의 PlasmaLyte ATM은 526mg의 염화나트륨, USP (NaCl); 502mg의 글루콘산 나트륨 (C6H11NaO7); 368mg의 아세트산 나트륨 삼수화물, USP (C2H3NaO2 · 3H2O); 37mg의 염화칼륨, USP (KCl); 및 30mg의 염화 마그네슘, USP (MgCl2 * 6H2O)를 포함한다. 그것은 항균제를 포함하지 않는다. 수산화 나트륨으로 pH를 조정한다. pH는 7.4(6.5 내지 8.0)이다.
동결보존 용액은 ProfreezeTM을 포함할 수 있다. 동결보존 용액은 추가로 또는 대안적으로 배양 배지, 예를 들어 αMEM을 포함할 수 있다.
동결을 용이하게하기 위해, 예를 들어, 디메틸설폭사이드(DMSO)와 같은 동결보호제(cryoprotectant)가 동결보존 용액에 첨가된다. 이상적으로, 동결보호제는 세포 및 환자에 대해 비독성이어야하고, 비항원성, 화학적으로 불활성이며 해동 후 높은 생존력을 제공하고 세척없이 이식을 허용해야 한다. 그러나 가장 일반적으로 사용되는 동결보호제인 DMSO는 세포독성을 나타낸다. 히드록실에틸전분(HES)은 동결보존 용액의 세포독성을 감소시키기 위해 DMSO와의 대체물로서 또는 함께 사용될 수 있다.
동결보존 용액은 DMSO, 히드록시에틸전분, 인간 혈청 성분 및 다른 단백질 증량제 중 하나 이상을 포함할 수 있다. 일 실시예에서, 동결보존된 용액은 약 5 % 인간 혈청 알부민 (HSA) 및 약 10 % DMSO를 포함한다. 동결보존 용액은 하나 이상의 메티셀룰로스, 폴리비닐 피롤리돈(PVP) 및 트레할로스를 추가로 포함할 수 있다.
일 구현예에서, 세포는 42.5% ProfreezeTM/50% αMEM/7.5% DMSO에 현탁되고 제어 속도 냉동고에서 냉각된다.
동결보존된 조성물은 해동되고 대상체에게 직접 투여되거나 예를 들어 히알루론산을 포함하는 다른 용액에 첨가 될 수있다. 대안적으로, 동결보존된 조성물은 해동될 수 있고 중간엽 계통 전구체 또는 줄기세포는 투여 전에 대체 담체에 재현탁될 수 있다.
일 실시예에서, 본원에 기술된 세포 조성물은 단일 용량으로 투여될 수 있다. 다른 실시예에서, 세포 조성물은 다중 용량에 걸쳐 투여된다. 예를 들어, 2회 이상, 3회 이상, 4회 이상, 5회 이상, 6회 이상, 7회 이상, 8회 이상, 9회 이상, 10회 이상의 용량이다.
일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 분리, 또는 분리 및 풍부화되고, 동결보존 전에 생체 외 또는 시험관 내에서 배양이 확장된다(culture expanded). 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 분리, 또는 분리 및 풍부화되고, 동결보존되고, 해동되고, 이어서 생체 외 또는 시험관 내에서 배양이 확장된다. 또 다른 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 냉동보존 전 및 후에 배양이 확장된다. 예를 들어, 중간엽 계통 전구체 또는 줄기세포를 해동한 후 배양을 확장시킬 수 있다. 다양한 중간엽 계통 전구체 또는 줄기세포 배양 방법이 당업계에 공지되어 있다. 일 실시예에서, 중간엽 계통 전구체 또는 줄기세포는 투여 전에 무 혈청 배지에서 배양 확장된다. 예를 들어, 중간엽 계통 전구체 또는 줄기세포는 투여 전에 적어도 1회, 2회, 3회, 4회, 5회, 6회, 7회, 8회, 9회, 10회 또는 그 이상 통과될 수 있다.
중간엽 전구체 세포는 예를 들어 정맥 내, 동맥 내 또는 복강 내 투여와 같이 전신적으로 투여될 수 있다. 중간엽 전구체 세포는 또한 비강 내, 근육 내 또는 심장 내 투여에 의해 투여될 수 있다. 예를 들어, 중간엽 전구체 세포는 대상체의 종양으로 직접 투여된다.
실시예
실시예 1 - 중간엽 전구체 세포에 의한 MiR/siRNA의 세포 전달
코넥신의 인간 중간엽 전구체 세포 (MPC) 발현을 면역조직화학(Immunohistochemistry) 및 웨스턴 블롯을 통해 평가하였다. 생성된 데이터는 MPC가 기능적 Cx43 및 Cx40을 발현하고 또한 공통 코넥신을 발현하는 표적세포 유형과 기능적 간극 연접을 생성함을 입증한다(도 1a). 코넥신의 인간 중간엽 줄기세포 (MSC) 발현은 면역조직화학 및 웨스턴 블롯을 통해 또한 평가되었다. Punctate Cx43 및 Cx40 염색은 hMSC에서 관찰되었다(도 1b). 기능적 간극 연접은 또한 패치 클램프 기술을 사용하여 MPC에서 입증되었다(도 2). 다양한 종양 세포는 또한 Cx43(도 3) 및 Cx40(데이터는 나타내지 않음)을 발현한다.
간극 연접 전달을 통한 표적세포로의 핵산의 MPC 매개 전달을 조사하였다. MPC의 지질 기반 로딩은 형광 표지된 MiR로 입증되었다. 지질 기반의 절단(LipofectamineTM; Thermo Fisher Scientific; 도 4)를 사용하여 miR 및 siRNA의 높은 수준의 세포 내 로딩을 달성했다.
Mir16의 HeLa-Cx43 및 PANC-1 종양 세포로의 전달을 나타내는 실험도 수행되었다. Cy-5 Mir16 (Red; 100nM)으로 형질주입된 MPC를 GFP 발현 HeLa-Cx43 및 GFP 발현 PANC-1 세포와 함께 24시간 동안 공동-배양하였다. 도 5a는 HeLa 세포(A) 및 PANC-1 세포(B) 둘 다로의 Cy-5-Mir16의 전달을 보여준다. 도 5b는 GFP 발현 PANC-1 세포로의 KIF11 siRNA의 전달을 보여준다.
공동-배양 분석은 이후 종양 세포주에 대한 MPC-로딩된 miR 및 siRNA의 항증식성 및 세포독성 효과를 측정하기 위해 확립되었다. PANC-1 및 KIF11 siRNA 로딩된 MPC(100 nM)의 공동-배양의 결과는 도 6a에 도시되어 있다. PANC-1 및 KIF11 siRNA 로딩된 MPC(500 nM)의 공동-배양의 결과는 도 6b에 도시되어 있다. 이러한 결과는 PANC-1 세포 사멸이 KIF11 siRNA 로딩된 MPC(100 nM)의 존재 하에 유도되고 KIF11 siRNA의 고용량(500 nM)의 존재 하에 증가됨을 보여준다.
SNUC2A 세포 및 KIF11 siRNA 로딩된 MPC(500 nM)의 공동-배양의 결과는 도 7에 도시되어 있다. 이들 결과는 KIF11의 MPC 전달이 SNUC2A 종양 세포 사멸을 유도함을 보여준다.
SAOS2 세포 및 KIF11 siRNA 로딩된 MPC(500 nM)의 공동-배양의 결과는 도 8(a) 및 (b)에 도시되어 있다. 이러한 결과는 KIF11의 MPC 전달이 SAOS2 종양 세포 사멸을 유도함을 보여준다.
PANC-1 종양 세포주 및 Mir-16 로딩된 MPC(100 nM)의 공동-배양은 또한 종양 세포 사멸을 유도하였다(도 9a). 로드되지 않은 MPC를 갖는 Mir-16 로딩된 MPC의 공동-배양은 MPC 증식을 억제했지만 로드되지 않은 MPC의 생존력에는 크게 영향을 미치지 않았다(도 9b).
Cx43의 CRISPR/CAS9 매개 녹아웃은 PANC-1 세포에서 후속적으로 수행되어 MPC로부터 표적세포로 핵산의 전달에서 간극 연접의 역할을 평가하였다.
PANC-1 세포 및 let7b 로딩된 MPC(500 nM)의 공동-배양은 PANC-1 세포 성장을 억제하였다. 그러나, let7b 로딩된 MPC와 공동-배양될 때 Cx43 녹아웃 PANC-1 세포의 성장은 유의하게 영향을 받지 않았으며, 이는 let7b의 전달이 Cx43을 통해 발생한다는 것을 시사한다(도 10a). 도 10b는 MPC에서 let7b의 직접 형질주입이 PANC-1 세포에서 관찰된 바와 같이 세포 증식은 감소시키지만 세포 사멸은 증가시키지 않음을 보여준다.
PANC-1 세포 및 KIF11 siRNA 로딩된 MPC의 공동-배양은 세포 사멸을 유도하였다. KIF11 siRNA 로딩된 MPC와 공동-배양될 때 Cx43 녹아웃 PANC-1 세포에서 감소된 수준의 세포 사멸이 관찰되었다. 그러나, 세포 성장의 MPC 지시된 억제는 놀랍게도 Cx43 녹아웃 PANC-1 세포에서 유지되었다(도 11a 및 12). 이는 siRNA의 전달이 코넥신 43뿐만 아니라 다른 코넥신(예: Cx40, Cx45, Cx30.3, Cx31 또는 Cx31.1) 또는 엑소좀 형성과 같은 다른 메커니즘을 통해서도 발생하고 있음을 시사한다. 도 11b는 MPC에서 KIF11 siRNA의 직접적인 형질주입이 PANC-1 세포에서 관찰된 바와 같이 세포 증식을 감소시키지만 세포 사멸을 증가시키지 않았음을 나타낸다.
PANC-1 세포 및 Mir-34a 로딩된 MPC의 공동-배양은 또한 세포 사멸을 유도하였다. Mir-34a 로딩된 MPC와 공동-배양될 때 Cx43 녹아웃 PANC-1 세포에서 감소된 수준의 세포 사멸이 관찰되었다. 그러나, 세포 성장의 MPC 지시된 억제는 놀랍게도 Cx43 녹아웃 PANC-1 세포에서 유지되었다(도 13a). 다시, 이것은 Mir-34a의 전달이 코넥신 43을 통해서뿐만 아니라, 예를 들어 다른 코넥신 또는 엑소좀의 형성과 같은 다른 메커니즘을 통해서도 발생하고 있음을 시사한다. 도 13b는 MPC에서 Mir-34a의 직접적인 형질주입이 PANC-1 세포에서 관찰된 바와 같이 세포 증식을 감소시키지만 세포 사멸을 증가시키지 않았음을 나타낸다.
세포 사멸 및 세포 증식에 *?*대한 miRNA 및 siRNA의 효과를 MPC, PANC-1, PC3 및 SOAS2 세포에서 평가하였다. 세포를 96-웰 또는 3.5cm 세포 배양 플레이트 상에 ~ 25% 합류(confluency)로 플레이팅하고, 형질주입 시약으로서 Lipofectamine RNAiMax를 사용하여 100 nM siRNA 또는 miR-mimic로 형질주입시켰다. hsa-miR-15A, hsa-miR-16-1, hsa-miR-34a, hsa-miR-155, hsa-let7b, hs_KIF11_4 siRNA 및 hs_PLK1_2 siRNA의 효과를 평가하였다. 형질주입 5일 후 세포 사멸 및 세포 성장에 대한 siRNA 및 miRNA의 효과를 측정하였다(도 14 내지 17). 도 18 및 19에 도시된 세포 사멸 및 WST 분석의 비교 분석. 이들 데이터는 형질주입된 miR 및 siRNA가 다양한 암 세포의 성장을 사멸 및/또는 억제할 수 있음을 보여준다.
실시예 2: siRNA의 MPC 기반 전달의 생체 내 효능
KIF 11(24시간 전)에 대해 500 nM siRNA가 로딩된 0.5 백만 MPC와 함께 또는 없이, 루시페라제를 안정적으로 발현하는 0.5 백만 PC3 세포로 6개의 마우스를 전립선에 이소성 이식하였다. 주사량은 PBS에서 60ul이었다. 일주일 후, 마우스에 루시펀을 주사한 후 IVIS 영상 시스템으로 영상화하여 종양을 시각화하였다(도 20a 및 b). 35일 후, MPC-처리된 마우스에 KIF11에 대해 500 nM siRNA가 로딩된 1 백만 MPC를 주사하였다. 대조군 마우스에 식염수를 주사하였다. 도 20c에 도시된 바와 같이, 평균 생존 시간은 대조군의 경우 38일, MPC 처리된 그룹의 경우 57일, P==0.0067(Log-Rank 테스트)이었다.
이러한 결과는 KIF11 로딩된 MPC가 마우스 PC3 전립선 이종이식(xenograft) 종양 모델에서 생존 시간을 상당히 증가시켰음을 보여준다.
실시예 3: siRNA의 MPC 기반 전달 및 세포 생존력의 용량 의존적 감소
PANC-1 세포를 KIF11 siRNA 로딩된 MPC(500 nM KIF11)와 공동-배양하였다. 6일간의 공동-배양으로 PANC-1 세포의 생존력이 77% 감소했다(도 21). 세포 성장률의 약 80 % 감소가 또한 관찰되었다(도 22).
이어서 PANC-1 세포를 증가량의 KIF11 siRNA(0 - 3.3 nM)로 직접 형질주입시켰다. 형질주입 후 6 일에 PANC-1 세포의 생존력을 측정 하였다. 직접 형질주입 후 세포 생존력의 용량 의존적 감소가 관찰되었다(도 23). 특히, 3.3 nM에서의 PANC-1 생존력의 최대 감소는 76%로, 500nM-형질주입된 MPC와의 공동-배양 후의 것과 유사하다. 도 6(a) 및 6(b)에 도시된 바와 같이, 500nM KIF11 siRNA로 형질주입된 MPC는 100nM KIF11 siRNA로 형질주입된 MPC에 비해 PANC-1 증식을 30% 이상 억제하였다. 이러한 결과는 100 내지 500nM의 KIF11 siRNA의 농도로 형질주입된 MPC에 의한 PANC-1 생존력의 단계적 억제와 일치한다. PANC-1 생존력의 직접적인 올리고뉴클레오티드 억제의 효과가 3.3에서 0.5nM로 대략 30% 감소되었기 때문에, 본 발명자들은 표적 종양 세포로의 올리고뉴클레오티드의 MPC 매개된 전달이 0.5-3.3nM의 종양 세포 내부에서 올리고뉴클레오티드의 농도를 초래하기에 충분한 수준에서 발생한다고 결론지었다.
추가 실험에서, MPC 또는 PANC-1 세포의 배양은 증가량의 KIF11 siRNA (0 - 500 nM)로 직접 형질주입되었다. PANC-1 세포에 대한 용량 반응 곡선은 도 24에, MPC는 도 25에 도시되어 있다.
PC3 세포는 또한 KIF11 siRNA 로딩된 MPC(500 nM KIF11)와 공동-배양되었다. 6일간의 공동-배양으로 세포 성장률이 약 55% 감소했다(도 26). 이어서 PC3 세포를 증가량의 KIF11 siRNA(0 - 500 nM)로 직접 형질주입시켰다. 용량 반응 곡선은 도 27에 도시되어 있다.
실시예 4: MPC 로딩 및 생존력
3개의 공여자로부터의 MPC를 리포펙타민 RNAiMax 형질주입 시약(15 ㎕/웰)을 사용하여 KIF11-FITC-siRNA(0-1000nM)로 형질주입시켰다. 형질주입 24시간 후 MPC에서 형광 표지의 축적을 유세포 분석법으로 분석하였다(도 28). MPC로의 siRNA 로딩을 위한 최적 농도는 ~ 500nM인 것으로 결정되었다.
이어서 KIF11-FITC-siRNA가 로딩된 MPC를 PANC-1 또는 PC3 세포와 공동-배양 하였다. 공동-배양 후 24시간 후에 KIF11-FITC-siRNA가 로딩된 MPC로부터 암 세포로의 siRNA의 전달을 측정하였다. 24시간 이내에, 대략 10%의 siRNA가 암 세포로 전달되어 MPC 공여체와 관련하여 생존력에 거의 변동이 없는 것으로 나타났다(도 29).
이어서 MPC 및 PANC-1 세포를 6 웰 플레이트에서 1.3 x 105 cells/well로 배양하였다. 세포는 리포펙타민 RNAiMax 형질주입 시약(15 ㎕/웰)을 사용하여 상이한 농도(0 내지 500 nM 최종)로 siRNA로 형질주입시켰다. 형질주입 2일 후 세포로부터 RNA를 수확하고 qRT-PCR(Taqman 유전자 발현 분석; Applied Biosystems; 하우스키핑 유전자 글리세르알데히드-3-포스페이트 탈수소효소(GAPDH)에 대한 s03929097_g1 및 KIF11에 대한 Hs00189698_m1)을 사용하여 유전자 발현을 평가하였다. 도 30 및 31은 KIF11 siRNA 종이 MPC 및 종양 세포에서 그의 기능을 유지함을 나타낸다(즉, 형질주입되고 MPC로부터 종양세포로 전달된 siRNA는 KIF11 mRNA를 감소시킬 수 있음).
실시예 5: MPC 및 종양 세포 생존력에 대한 KIF11 siRNA의 효과
MPC, SJSA1, PANC-1, PC3, SAOS2 및 SNUC2a 세포는 96 웰 플레이트에 25-50%의 합류로 플레이팅되었다(처리 그룹당 n=3 웰). 세포를 100 nM의 KIF11 siRNA 또는 대조군 siRNA로 형질주입시켰다(Lipofectamine; RNAiMax; 표 1에 나타낸 siRNA 서열 세부사항; 도 32에 요약된 KIF11 서열 표적). 형질주입 5일 후 세포 생존력을 측정하였고, 생존력 데이터를 대조군 세포 데이터를 사용하여 표준화하였다(도 33). 놀랍게도, KIF11 mRNA 전사체의 5'말단을 표적으로 하는 KIF11 siRNA는 특히 PANC-1 및 SAOS2 주에서 종양 세포 생존력을 감소시키는 더 큰 효과를 가졌다. 예를 들어, KIF11 mRNA 전사체의 3'말단을 표적으로 하는 KIF11_13 및 KIF11_15는 시험된 다른 KIF11 siRNA와 비교하여 종양 세포 생존력에 상대적으로 낮은 영향을 미쳤다(도 33). KIF11_4, KIF11_6 및 KIF11_9 siRNA는 MPC 생존력에 최소한의 영향을 미치면서 종양 세포 생존력을 일관되게 감소시켰다는 사실이 또한 놀라웠다(그림 33).
실시예 6: MPC 및 MSC에서의 유전자 발현에 대한 KIF11 siRNA의 효과
MPC 및 MSC를 1.25 x 106 cells/well로 6 웰 플레이트에 플레이팅하고 리포펙타민을 사용하여 KIF11 siRNA(100 nM)로 형질주입시켰다. 대조군 세포는 리포펙타민 단독으로 처리되었다. 세포 처리 48시간 후에 RNA를 수확하고 인간 Clariom S Assay (Affymetrix)를 사용하여 전체 유전자 발현을 분석하였다. 유전자 발현 분석은 MPC 및 MSC가 KIF-11 siRNA에 의해 하향조절되는 유전자와 관련하여 유사하다는 것을 나타내었다(도 34; 하향조절된 상위 10개의 유전자). KIF11 siRNA는 MPC에서 약 18배, MSC에서 약 20배인 KIF11 mRNA 수준을 감소시켰다. 상위 10개의 하향조절된 유전자를 살펴보면 FSTL1:MIR198, ALDH9A1, ELK3 & SYPL1 mRNAs도 MPC와 MSC 모두에서 감소했다. 상기 발견한 바와 함께, MPC 및 MSC 둘 다가 Cx43 및 Cx40을 발현한다는 것을 주목하는 특히 실시예 1과 함께, 유전자 발현 분석은 MPC 및 MSC 둘 다가 암 세포로의 올리고뉴클레오티드 전달을 위한 비히클로서 사용될 수 있음을 추가로 지지한다.
본 기술 분야의 통상의 지식을 가진 자라면, 광범위하게 기술된 바와 같이 본 발명의 사상 또는 범위를 벗어나지 않으면서 특정 실시예에 도시된 바와 같이 본 발명에 대한 다양한 변경 및/또는 변형이 이루어질 수 있음을 이해할 것이다. 그러므로, 본 실시예는 모든면에서 예시적이고 제한적이지 않은 것으로 간주되어야 한다.
본 출원은 2017년 11월 22일 출원된 62/589,764로부터 우선권을 주장하며, 그 개시내용은 본 명세서에 참조로 포함된다.
위에서 논의된 모든 출판물은 그 전체가 본 명세서에 포함된다.
본 명세서에 포함된 문서, 법, 물질, 장치, 기사 등의 임의의 논의는 본 개시의 맥락을 제공하기 위한 목적일 뿐이다. 이들 문제의 일부 또는 전부가 종래 기술의 일부를 형성하거나 본 출원의 각 청구항의 우선권 날짜 이전에 존재하는 바와 같이 본 개시내용과 관련된 분야에서 일반적인 일반적인 지식인 것으로 인정되지 않아야 한다.
참고문헌
Ausubel et al. (editors) (1988, including all updates until present) Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience.
Bader et al. (2011) Gene Ther. 18:1121-6.
Brown TA (editor) (1991) Essential Molecular Biology: A Practical Approach, Volumes 1 and 2, IRL Press.
Coligan et al. (editors) (including all updates until present) Current Protocols in Immunology, John Wiley & Sons.
Glover and Hames (editors) (1995 & 1996) DNA Cloning: A Practical Approach, Volumes 1-4, IRL Press.
Griffiths-Jones, S. 2004 Nucl Acids Res, 32, D109-D111.
Harlow and Lane (editors) (1988) Antibodies: A Laboratory Manual, Cold Spring Harbour Laboratory.
Kozomara et al. 2013; Nucl Acids Res, 42, D68-D73.
Lennox and Behlke (2011) Gene Ther. 18"1111-20.
Perbal J (1984) A Practical Guide to Molecular Cloning, John Wiley and Sons.
Sambrook et al., (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press.
Simmons & Torok-Storb (1991) Blood. 78:55-62.
<110> Mesoblast International Sarl
<120> CELLULAR COMPOSITIONS AND METHODS OF TREATMENT I
<130> 526519PCT
<160> 9
<170> PatentIn version 3.5
<210> 1
<211> 5101
<212> DNA
<213> Homo sapiens
<400> 1
agcgcagcca ttggtccggc tactctgtct ctttttcaaa ttgaggcgcc gagtcgttgc 60
ttagtttctg gggattcggg cggagacgag attagtgatt tggcggctcc gactggcgcg 120
ggacaaacgc cacggccaga gtaccgggta gagagcgggg acgccgacct gcgtgcgtcg 180
gtcctccagg ccacgccagc gcccgagagg gaccagggag actccggccc ctgtcggccg 240
ccaagcccct ccgcccctca cagcgcccag gtccgcggcc gggccttgat tttttggcgg 300
ggaccgtcat ggcgtcgcag ccaaattcgt ctgcgaagaa gaaagaggag aaggggaaga 360
acatccaggt ggtggtgaga tgcagaccat ttaatttggc agagcggaaa gctagcgccc 420
attcaatagt agaatgtgat cctgtacgaa aagaagttag tgtacgaact ggaggattgg 480
ctgacaagag ctcaaggaaa acatacactt ttgatatggt gtttggagca tctactaaac 540
agattgatgt ttaccgaagt gttgtttgtc caattctgga tgaagttatt atgggctata 600
attgcactat ctttgcgtat ggccaaactg gcactggaaa aacttttaca atggaaggtg 660
aaaggtcacc taatgaagag tatacctggg aagaggatcc cttggctggt ataattccac 720
gtacccttca tcaaattttt gagaaactta ctgataatgg tactgaattt tcagtcaaag 780
tgtctctgtt ggagatctat aatgaagagc tttttgatct tcttaatcca tcatctgatg 840
tttctgagag actacagatg tttgatgatc cccgtaacaa gagaggagtg ataattaaag 900
gtttagaaga aattacagta cacaacaagg atgaagtcta tcaaatttta gaaaaggggg 960
cagcaaaaag gacaactgca gctactctga tgaatgcata ctctagtcgt tcccactcag 1020
ttttctctgt tacaatacat atgaaagaaa ctacgattga tggagaagag cttgttaaaa 1080
tcggaaagtt gaacttggtt gatcttgcag gaagtgaaaa cattggccgt tctggagctg 1140
ttgataagag agctcgggaa gctggaaata taaatcaatc cctgttgact ttgggaaggg 1200
tcattactgc ccttgtagaa agaacacctc atgttcctta tcgagaatct aaactaacta 1260
gaatcctcca ggattctctt ggagggcgta caagaacatc tataattgca acaatttctc 1320
ctgcatctct caatcttgag gaaactctga gtacattgga atatgctcat agagcaaaga 1380
acatattgaa taagcctgaa gtgaatcaga aactcaccaa aaaagctctt attaaggagt 1440
atacggagga gatagaacgt ttaaaacgag atcttgctgc agcccgtgag aaaaatggag 1500
tgtatatttc tgaagaaaat tttagagtca tgagtggaaa attaactgtt caagaagagc 1560
agattgtaga attgattgaa aaaattggtg ctgttgagga ggagctgaat agggttacag 1620
agttgtttat ggataataaa aatgaacttg accagtgtaa atctgacctg caaaataaaa 1680
cacaagaact tgaaaccact caaaaacatt tgcaagaaac taaattacaa cttgttaaag 1740
aagaatatat cacatcagct ttggaaagta ctgaggagaa acttcatgat gctgccagca 1800
agctgcttaa cacagttgaa gaaactacaa aagatgtatc tggtctccat tccaaactgg 1860
atcgtaagaa ggcagttgac caacacaatg cagaagctca ggatattttt ggcaaaaacc 1920
tgaatagtct gtttaataat atggaagaat taattaagga tggcagctca aagcaaaagg 1980
ccatgctaga agtacataag accttatttg gtaatctgct gtcttccagt gtctctgcat 2040
tagataccat tactacagta gcacttggat ctctcacatc tattccagaa aatgtgtcta 2100
ctcatgtttc tcagattttt aatatgatac taaaagaaca atcattagca gcagaaagta 2160
aaactgtact acaggaattg attaatgtac tcaagactga tcttctaagt tcactggaaa 2220
tgattttatc cccaactgtg gtgtctatac tgaaaatcaa tagtcaacta aagcatattt 2280
tcaagacttc attgacagtg gccgataaga tagaagatca aaaaaaggaa ctagatggct 2340
ttctcagtat actgtgtaac aatctacatg aactacaaga aaataccatt tgttccttgg 2400
ttgagtcaca aaagcaatgt ggaaacctaa ctgaagacct gaagacaata aagcagaccc 2460
attcccagga actttgcaag ttaatgaatc tttggacaga gagattctgt gctttggagg 2520
aaaagtgtga aaatatacag aaaccactta gtagtgtcca ggaaaatata cagcagaaat 2580
ctaaggatat agtcaacaaa atgacttttc acagtcaaaa attttgtgct gattctgatg 2640
gcttctcaca ggaactcaga aattttaacc aagaaggtac aaaattggtt gaagaatctg 2700
tgaaacactc tgataaactc aatggcaacc tggaaaaaat atctcaagag actgaacaga 2760
gatgtgaatc tctgaacaca agaacagttt atttttctga acagtgggta tcttccttaa 2820
atgaaaggga acaggaactt cacaacttat tggaggttgt aagccaatgt tgtgaggctt 2880
caagttcaga catcactgag aaatcagatg gacgtaaggc agctcatgag aaacagcata 2940
acatttttct tgatcagatg actattgatg aagataaatt gatagcacaa aatctagaac 3000
ttaatgaaac cataaaaatt ggtttgacta agcttaattg ctttctggaa caggatctga 3060
aactggatat cccaacaggt acgacaccac agaggaaaag ttatttatac ccatcaacac 3120
tggtaagaac tgaaccacgt gaacatctcc ttgatcagct gaaaaggaaa cagcctgagc 3180
tgttaatgat gctaaactgt tcagaaaaca acaaagaaga gacaattccg gatgtggatg 3240
tagaagaggc agttctgggg cagtatactg aagaacctct aagtcaagag ccatctgtag 3300
atgctggtgt ggattgttca tcaattggcg gggttccatt tttccagcat aaaaaatcac 3360
atggaaaaga caaagaaaac agaggcatta acacactgga gaggtctaaa gtggaagaaa 3420
ctacagagca cttggttaca aagagcagat tacctctgcg agcccagatc aacctttaat 3480
tcacttgggg gttggcaatt ttatttttaa agaaaactta aaaataaaac ctgaaacccc 3540
agaacttgag ccttgtgtat agattttaaa agaatatata tatcagccgg gcgcggtggc 3600
tcatgcctgt aatcccagca ctttgggagg ctgaggcggg tggattgctt gagcccagga 3660
gtttgagacc agcctggcca acgtggcaaa acctcgtctc tgttaaaaat tagccgggcg 3720
tggtggcaca ctcctgtaat cccagctact ggggaggctg aggcacgaga atcacttgaa 3780
cccaggaagc ggggttgcag tgagccaaag gtacaccact acactccagc ctgggcaaca 3840
gagcaagact cggtctcaaa aacaaaattt aaaaaagata taaggcagta ctgtaaattc 3900
agttgaattt tgatatctac ccatttttct gtcatcccta tagttcactt tgtattaaat 3960
tgggtttcat ttgggatttg caatgtaaat acgtatttct agttttcata taaagtagtt 4020
cttttataac aaatgaaaag tatttttctt gtatattatt aagtaatgaa tatataagaa 4080
ctgtactctt ctcagcttga gcttacatag gtaaatatca ccaacatctg tccttagaaa 4140
ggaccatctc atgttttttt tcttgctatg acttgtgtat tttcttgcat cctccctaga 4200
cttccctatt tcgctttctc ctcggctcac tttctccctt tttatttttc accaaaccat 4260
ttgtagagct acaaaaggta tcctttctta ttttcagtag tcagaatttt atctagaaat 4320
cttttaacac ctttttagtg gttatttcta aaatcactgt caacaataaa tctaacccta 4380
gttgtatccc tcctttcagt atttttcact tgttgcccca aatgtgaaag catttcattc 4440
ctttaagagg cctaactcat tcaccctgac agagttcaca aaaagcccac ttaagagtat 4500
acattgctat tatgggagac cacccagaca tctgactaat ggctctgtgc ccacactcca 4560
agacctgtgc cttttagaga agctcacaat gatttaagga ctgtttgaaa cttccaatta 4620
tgtctataat ttatattctt ttgtttacat gatgaaactt tttgttgttg cttgtttgta 4680
tataatacaa tgtgtacatg tatctttttc tcgattcaaa tcttaaccct taggactctg 4740
gtatttttga tctggcaacc atatttctgg aagttgagat gtttcagctt gaagaaccaa 4800
aacagaagga atatgtacaa agaataaatt ttctgctcac gatgagttta gtgtgtaaag 4860
tttagagaca tctgactttg atagctaaat taaaccaaac cctattgaag aattgaatat 4920
atgctacttc aagaaactaa attgatctcg tagaattatc ttaataaaat aatggctata 4980
atttctctgc aaaatcagat gtcagcataa gcgatggata atacctaata aactgccctc 5040
agtaaatcca tggttaataa atgtggtttc tacattaaaa aaaaaaaaaa aaaaaaaaaa 5100
a 5101
<210> 2
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 2
ctcgggaagc tggaaatata a 21
<210> 3
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 3
gagggcgtac aagaacatct a 21
<210> 4
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 4
acggaggaga tagaacgttt a 21
<210> 5
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 5
caggaattga ttaatgtact c 21
<210> 6
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial Sequence
<400> 6
gccgataaga tagaagatca a 21
<210> 7
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial sequence
<400> 7
ctagatggct ttctcagtat a 21
<210> 8
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial sequence
<400> 8
cagcttgagc ttacataggt a 21
<210> 9
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Artificial sequence
<400> 9
taagcgatgg ataataccta a 21
Claims (42)
- 표적세포를 α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체(mesenchymal lineage precursor) 또는 줄기세포와 접촉하는 단계를 포함하는 올리고뉴클레오티드를 표적세포 내로 전달하는 방법으로서, 상기 세포는 올리고뉴클레오티드 또는 올리고뉴클레오티드를 발현하는 벡터를 도입하도록 변형되는 것을 특징으로 하는 방법.
- α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체(mesenchymal lineage precursor) 또는 줄기세포를 포함하는 조성물을 대상체에게 투여하는 단계를 포함하는 대상체에서 암을 치료하는 방법으로서, 상기 세포는 올리고뉴클레오티드 또는 올리고뉴클레오티드를 발현하는 플라스미드를 도입하도록 변형되는 것을 특징으로 하는 방법.
- α1, α2, α3, α4 및 α5, αv, β1 및 β3으로 구성된 군에서 선택되는 하나 이상의 마커를 발현하는 중간엽 계통 전구체(mesenchymal lineage precursor) 또는 줄기세포를 포함하는 조성물로서, 상기 세포는 억제성 올리고뉴클레오티드를 도입하도록 변형되거나 억제성 올리고뉴클레오티드를 발현하는 벡터를 포함하는 것을 특징으로 하는 조성물.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 상기 변형된 중간엽 계통 전구체 또는 줄기세포는 0.5 내지 5nM의 억제성 올리고뉴클레오티드를 표적세포로 전달하기에 충분한 수준의 억제성 올리고뉴클레오티드를 포함하는 방법 또는 조성물.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드의 길이는 약 12 내지 24개의 뉴클레오티드인 방법 또는 조성물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드는 RNA인 방법 또는 조성물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드는 안티센스 분자인 방법 또는 조성물.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드는 shRNA, siRNA 또는 miRNA인 방법 또는 조성물.
- 제8항에 있어서, 상기 siRNA는 KIF11 siRNA 또는 PLK1 siRNA인 방법 또는 조성물.
- 제7항 내지 제9항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드는 5'말단으로부터 800bp 내지 3,600bp 사이의 서열번호 1에 나타난 KIF11 mRNA 전사체에 결합하는 KIF11 siRNA인 방법 또는 조성물.
- 제7항 내지 제10항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드는 서열번호 2, 3, 4, 5, 6, 7, 8 또는 9 중 어느 하나에 나타난 핵산서열을 포함하는 방법 또는 조성물.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드의 길이는 18 내지 22개의 뉴클레오티드인 방법 또는 조성물.
- 제8항에 있어서, 상기 miRNA는 miR-155, miR-155-inh, miR-181-B1, miR-15a, miR-16-1, miR-21, miR-34a, miR-221, miR-29a 및 let-7b로 구성된 군에서 선택되는 방법 또는 조성물.
- 제1항, 제2항 또는 제4항 내지 제13항 중 어느 한 항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 표적세포를 사멸시키지만 중간엽 계통 전구체 또는 줄기세포의 생존력에 실질적으로 영향을 미치지 않는 것을 발현하는 올리고뉴클레오티드 또는 벡터를 도입하도록 변형된 방법.
- 제1항, 제2항 또는 제4항 내지 제13항 중 어느 한 항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 암 세포와 같은 표적세포에 억제성 올리고뉴클레오티드를 전달하기 전에 중간엽 계통 전구체 또는 줄기세포를 사멸시키지 않는 것을 발현하는 억제성 올리고뉴클레오티드 또는 벡터를 도입하도록 변형된 방법.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 또한 STRO-1을 발현하는 조성물 또는 방법.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 실질적으로 STRO-1bri인 조성물 또는 방법.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 다능성 세포(pluripotent cells)로부터 유래된 조성물 또는 방법.
- 제18항에 있어서, 상기 다능성 세포는 유도만능줄기(induced pluripotent stem, iPS) 세포인 조성물 또는 방법.
- 제1항에 있어서, 상기 접촉은 중간엽 계통 전구체 또는 줄기세포가 표적세포와 간극 연접(gap junction)을 형성하는 것을 허용하는 조건 하에서 발생하고, 이에 의해 올리고뉴클레오티드는 간극 연접을 횡단함으로써 표적세포로 전달되는 것을 특징으로 하는 방법.
- 제20항에 있어서, 상기 간극 연접은 Cx40 또는 Cx43에 의해 형성되는 방법.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 올리고뉴클레오티드의 전달은 Cx43 이외의 메커니즘을 통해 이루어지는 방법 또는 조성물.
- 제1항 또는 제4항 내지 제22항 중 어느 한 항에 있어서, 상기 표적세포는 암 세포 또는 백혈구 세포인 방법.
- 제23항에 있어서, 상기 암 세포는 폐암, 췌장암, 대장암, 간암, 자궁경부암, 전립선암, 골육종 또는 흑색종 세포인 방법.
- 제1항 또는 제4항 내지 제22항 중 어느 한 항에 있어서, 상기 표적세포는 세포융합 세포(syncytial cell)인 방법.
- 제25항에 있어서, 상기 세포융합 세포는 심장근육 세포, 평활근 세포, 상피 세포, 결합조직 세포 또는 세포융합 암 세포인 방법.
- 제3항 내지 제16항 또는 제22항 중 어느 한 항에 따른 조성물을 투여하는 단계를 포함하는 대상체에서 암을 치료하는 방법.
- 제27항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 대상체의 암을 포함하는 암 세포에 의해 발현되는 코넥신(connexin)을 발현하는 것을 특징으로 하는 방법.
- 제28항에 있어서, 상기 코넥신(connexin)은 Cx40 또는 Cx43인 것을 특징으로 하는 방법.
- 제28항에 있어서, 대상체의 암을 포함하는 상기 암 세포는 Cx43을 발현하는 것을 특징으로 하는 방법.
- 제2항, 제4항 내지 제16항 또는 제27항 내지 제30항 중 어느 한 항에 있어서, 상기 암은 폐암, 췌장암, 대장암, 간암, 자궁경부암, 전립선암, 골육종 또는 흑색종으로 구성된 군에서 선택되는 것을 특징으로 하는 방법.
- 제1항 내지 제31항 중 어느 한 항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 바이러스 벡터를 사용하여 올리고뉴클레오티드를 도입하도록 변형된 방법 또는 조성물.
- 제32항에 있어서, 상기 바이러스 벡터는 렌티바이러스(Lentivirus), 바쿨로바이러스(Baculovirus), 레트로바이러스(Retrovirus), 아데노바이러스(Adenovirus, AdV), 아데노-관련 바이러스(Adeno-associated virus, AAV) 또는 이의 재조합 형태로 구성된 군에서 선택되는 방법 또는 조성물.
- 제32항에 있어서, 상기 바이러스 벡터는 AAV인 것을 특징으로 하는 방법 또는 조성물.
- 제32항에 있어서, 상기 바이러스 벡터는 재조합 AAV인 것을 특징으로 하는 방법 또는 조성물.
- 제1항 내지 제35항 중 어느 한 항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 또한 CD46을 발현하는 것을 특징으로 하는 방법 또는 조성물.
- 제1항 내지 제36항 중 어느 한 항에 있어서, 상기 변형된 중간엽 계통 전구체 또는 줄기세포는 중간엽 계통 전구체 또는 줄기세포 상에서 세포 표면 글리칸의 변형을 가져오도록 처리된 방법 또는 조성물.
- 제37항에 있어서, 상기 처리는 중간엽 전구체 계통 세포 또는 줄기세포상의 세포-표면 글리칸을 변형시키는 조건 하에서 중간엽 계통 전구체 또는 줄기세포를 글리코실스트라스페라제(glycosylstrasferase)에 노출시키는 것을 포함하는 방법 또는 조성물.
- 제37항 또는 제38항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 외인성 글리코실트랜스퍼라제(glycosyltranferase)에 노출되는 방법 또는 조성물.
- 제37항 또는 제38항에 있어서, 상기 중간엽 계통 전구체 또는 줄기세포는 글리코실트랜스퍼라제(glycosyltransferase)를 암호화하는 핵산을 도입하도록 변형되었으며, 여기서 세포에서 글리코실트랜스퍼라제의 발현은 생체 내 염증 부위에서 세포의 보유를 향상시키는 방법 또는 조성물.
- 제38항 내지 제40항 중 어느 한 항에 있어서, 상기 글리코실트랜스퍼라제(glycosyltransferase)는 푸코실트랜스퍼라제(fucosyltransferase), 갈락토실트랜스퍼라제(galactosyltransferase) 또는 시알릴트랜스퍼라제(sialyltransferase )인 방법 또는 조성물.
- 제41항에 있어서, 상기 푸코실트랜스퍼라제(fucosyltransferase)는 알파 1,3 푸코실트랜스퍼라제 III, 알파 1,3 푸코실트랜스퍼라제 IV, 알파 1,3 푸코실트랜스퍼라제 VI, 알파 1,3 푸코실트랜스퍼라제 VII 또는 알파 1,3 푸코실트랜스퍼라제 IX와 같은 알파 1,3 푸코실트랜스퍼라제인 방법 또는 조성물.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762589764P | 2017-11-22 | 2017-11-22 | |
| US62/589,764 | 2017-11-22 | ||
| PCT/IB2018/001439 WO2019102268A1 (en) | 2017-11-22 | 2018-11-21 | Cellular compositions and methods of treatment i |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200088445A true KR20200088445A (ko) | 2020-07-22 |
Family
ID=65003422
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207017952A KR20200088445A (ko) | 2017-11-22 | 2018-11-21 | 세포 조성물 및 치료 방법 i |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US20210163932A1 (ko) |
| EP (1) | EP3714038A1 (ko) |
| JP (1) | JP7463275B2 (ko) |
| KR (1) | KR20200088445A (ko) |
| CN (1) | CN112004923A (ko) |
| AU (1) | AU2018372631A1 (ko) |
| BR (1) | BR112020010079A2 (ko) |
| CA (1) | CA3084575A1 (ko) |
| SG (1) | SG11202004680UA (ko) |
| WO (1) | WO2019102268A1 (ko) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007087139A2 (en) | 2006-01-13 | 2007-08-02 | Osiris Therapeutics, Inc. | MESENCHYMAL STEM CELLS EXPRESSING TNF-α RECEPTOR |
| WO2020053186A1 (en) * | 2018-09-11 | 2020-03-19 | Helmholtz Zentrum Muenchen - Deutsches Forschungszentrum Für Gesundheit Und Umwelt (Gmbh) | Microrna inhibitors for use in treating metabolic diseases |
| CN115287350A (zh) * | 2020-03-30 | 2022-11-04 | 中国医学科学院肿瘤医院 | 包括外泌体miR-106b-3p、miR-10a-3p等在肺癌诊断中的应用 |
| CN112067805B (zh) * | 2020-08-25 | 2023-08-22 | 南通大学 | 一种β-1,4-半乳糖基转移酶-IsiRNA在克服肝癌化疗耐药药物中的应用 |
| CN113025714B (zh) * | 2021-03-23 | 2022-05-24 | 华中科技大学同济医学院附属同济医院 | 用于甲状腺乳头状癌颈侧方淋巴结转移诊断的miRNA生物标志物及检测试剂盒 |
| WO2023019128A1 (en) * | 2021-08-09 | 2023-02-16 | The Trustees Of The University Of Pennyslvania | Optimizing t cell differentiation state with micrornas |
| WO2023109911A1 (en) * | 2021-12-15 | 2023-06-22 | National Institute Of Biological Sciences, Beijing | Microglia having car and use thereof |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5486359A (en) | 1990-11-16 | 1996-01-23 | Osiris Therapeutics, Inc. | Human mesenchymal stem cells |
| WO1995002698A1 (en) | 1993-07-12 | 1995-01-26 | Life Technologies, Inc. | Composition and methods for transfecting eukaryotic cells |
| US6051429A (en) | 1995-06-07 | 2000-04-18 | Life Technologies, Inc. | Peptide-enhanced cationic lipid transfections |
| GB9519776D0 (en) | 1995-09-28 | 1995-11-29 | Casimir Colin | Materials and methods relating to the transfer of nucleic acid into stem cells |
| AU2003901668A0 (en) | 2003-03-28 | 2003-05-01 | Medvet Science Pty. Ltd. | Non-haemopoietic precursor cells |
| US6627442B1 (en) | 2000-08-31 | 2003-09-30 | Virxsys Corporation | Methods for stable transduction of cells with hiv-derived viral vectors |
| JP4399533B2 (ja) | 2002-06-14 | 2010-01-20 | キシンテラ、アクチボラグ | 幹細胞のマーカーおよびその使用 |
| US7842673B2 (en) * | 2003-12-17 | 2010-11-30 | The Trustees Of Columbia University In The City Of New York | Delivery of DNA or RNA via gap junctions from host cells to target cells and a cell-based delivery system for antisense or siRNA |
| US20100047216A1 (en) * | 2006-07-21 | 2010-02-25 | Glenn Gaudette | Compositions of late passage mesenchymal stem cells (mscs) |
| WO2008073919A2 (en) * | 2006-12-08 | 2008-06-19 | Asuragen, Inc. | Mir-20 regulated genes and pathways as targets for therapeutic intervention |
| WO2008141177A1 (en) * | 2007-05-11 | 2008-11-20 | The Trustees Of Columbia University In The City Ofnew York | Methods and compositions for the treatment of sarcoma |
| US7615374B2 (en) | 2007-09-25 | 2009-11-10 | Wisconsin Alumni Research Foundation | Generation of clonal mesenchymal progenitors and mesenchymal stem cell lines under serum-free conditions |
| CA2756670A1 (en) * | 2009-03-26 | 2010-09-30 | The Regents Of The University Of California | Mesenchymal stem cells producing inhibitory rna for disease modification |
| JP6147191B2 (ja) | 2010-11-02 | 2017-06-14 | ヘルムホルツ−ツェントルム フュア インフェクツィオンスフォルシュンク ゲーエムベーハー | 細胞不死化のための方法及びベクター |
| US8748470B2 (en) * | 2011-03-17 | 2014-06-10 | The University Of Chicago | Methods for treating ovarian cancer by inhibiting fatty acid binding proteins |
| JP2015510401A (ja) * | 2012-02-22 | 2015-04-09 | ブレインステム バイオテック リミテッド | ヒト疾患のインビトロモデル化および細胞に基づく治療のための間葉系幹細胞ならびにそのバンク |
| MX366900B (es) | 2013-03-13 | 2019-07-30 | Wisconsin Alumni Res Found | Métodos y materiales para diferenciación hematoendotelial de células germinales pluripotentes humanas bajo condiciones definidas. |
| EP3142707A4 (en) * | 2014-05-13 | 2018-02-21 | Sangamo Therapeutics, Inc. | Methods and compositions for prevention or treatment of a disease |
| JP2017536127A (ja) | 2014-11-24 | 2017-12-07 | サイトストームアールエックス エルエルシー | 炎症性疾患を治療するためのカプセル化幹細胞 |
| EP3432714A4 (en) * | 2016-03-23 | 2019-11-13 | The Trustees of Columbia University in the City of New York | TREATMENT OF CANCER BASED ON THE ADMINISTRATION OF OLIGONUCLEOTIDES THROUGH LACUNAR JUNCTIONS FROM HUMAN MESENCHYMAL STEM CELLS (HMSC) |
-
2018
- 2018-11-21 CN CN201880083837.3A patent/CN112004923A/zh active Pending
- 2018-11-21 US US16/766,206 patent/US20210163932A1/en active Pending
- 2018-11-21 BR BR112020010079-0A patent/BR112020010079A2/pt unknown
- 2018-11-21 CA CA3084575A patent/CA3084575A1/en active Pending
- 2018-11-21 JP JP2020528166A patent/JP7463275B2/ja active Active
- 2018-11-21 EP EP18830515.5A patent/EP3714038A1/en active Pending
- 2018-11-21 AU AU2018372631A patent/AU2018372631A1/en active Pending
- 2018-11-21 WO PCT/IB2018/001439 patent/WO2019102268A1/en unknown
- 2018-11-21 KR KR1020207017952A patent/KR20200088445A/ko not_active Application Discontinuation
- 2018-11-21 SG SG11202004680UA patent/SG11202004680UA/en unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CA3084575A1 (en) | 2019-05-31 |
| JP7463275B2 (ja) | 2024-04-08 |
| EP3714038A1 (en) | 2020-09-30 |
| BR112020010079A2 (pt) | 2020-11-03 |
| SG11202004680UA (en) | 2020-06-29 |
| WO2019102268A1 (en) | 2019-05-31 |
| JP2021507683A (ja) | 2021-02-25 |
| US20210163932A1 (en) | 2021-06-03 |
| CN112004923A (zh) | 2020-11-27 |
| AU2018372631A1 (en) | 2020-05-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7463275B2 (ja) | 細胞組成物及び処置の方法 | |
| US9862949B2 (en) | Method for the inhibition of angiogenesis | |
| Huang et al. | Overexpression of MicroRNA-1 improves the efficacy of mesenchymal stem cell transplantation after myocardial infarction | |
| CN101821391B (zh) | 微小聚体 | |
| US9297007B2 (en) | miRNAs involved in the blood brain barrier function | |
| US20150216892A1 (en) | Cell-specific delivery of mirna modulators for the treatment of obesity and related disorders | |
| US20210147853A1 (en) | Use of Trinucleotide Repeat RNAs To Treat Cancer | |
| CN108367020B (zh) | 通过miR-200家族抑制来抑制肿瘤的方法 | |
| US20090286242A1 (en) | MicroRNA Expression Profiling and Uses Thereof | |
| CN102858376A (zh) | 使用了微小rna的心肌细胞的增殖方法 | |
| US8796238B2 (en) | Short RNA mimetics | |
| KR101286154B1 (ko) | 안티센스 올리고뉴클레오타이드를 포함하는 줄기세포로부터 연골세포 분화 촉진용 및 항암 약제학적 조성물 | |
| EP4282963A1 (en) | Nucleic acid modified biological cell with expansion-dependent gene expression | |
| Maguire et al. | Genetic correction of splice site mutation in purified and enriched myoblasts isolated from mdx 5cv mice | |
| US9273313B2 (en) | Activation of quiescent stem cells | |
| Kim | Novel Cellular Models of Human Myopathies | |
| AU2016314698A2 (en) | MicroRNAs for the treatment of heart diseases |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal |